Симбиоз с микроорганизмами — основа жизни растений [Фаня Юрьевна Гельцер] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Фаня Юрьевна Гельцер Симбиоз с микроорганизмами — основа жизни растений
 Фаня Юрьевна ГЕЛЬЦЕР
(1898—1987)
Фаня Юрьевна ГЕЛЬЦЕР
(1898—1987)
Введение
При господствующем в науке положении об автотрофном существовании растительного мира название нашего труда «Симбиоз с микроорганизмами — основа жизни растений» может звучать неубедительно. Однако только при учете симбиотрофного существования растений, т. е. обязательного участия микроорганизмов в ряде жизненно важных процессов в растительных организмах, можно решить многие нерешенные ранее вопросы, касающиеся их жизнедеятельности. Для убедительности укажем только, что ростовые вещества в растении, происхождение которых ученые безуспешно пытаются установить уже более 80 лет, синтезируют для нега симбионтные грибы. Известный ботаник академик В. Л. Комаров (1941) считал, что те растения, которые питаются самостоятельно, принадлежат к «аутотрофам», а растения, в корнях которых поселяются микроорганизмы, питающиеся их углеводами и взамен отдающие им фиксированный из воздуха азот, он назвал «гетеротрофными». На протяжении последних 100 лет ученые разных стран установили, что количество микотрофных растений составляет примерно 80% общего количества изученных, а в благоприятных для их роста условиях — все 100%. Микотрофность растений до сих пор выявляется путем просмотра препаратов корней под световым или электронным микроскопом. Получение чистых культур эндофитов более 130 лет оставалось неосуществимой мечтой многих исследователей, в том числе и В. Л. Комарова, что ограничивало возможность изучения степени их участия в жизненных процессах растений и установления их наследственной передачи. Впервые разработанный нами метод выделения чистых культур эндофитов из любых частей растений способствовал определению природы грибного симбиоза и выявлению его роли в синтезе многочисленных соединений, образование которых ранее приписывали самому растению. В настоящем труде мы предлагаем на обсуждение научной общественности первые результаты изучения деятельности симбиотрофных грибов в расчете на дальнейшее развитие этого направления в научных учреждениях различного профиля (генетика, селекция» фитопатология, не говоря уже о физиологии, биохимии и микробиологии растений), что, но нашему представлению, откроет новые возможности в повышении продуктивности и иммунитета сельскохозяйственных культур. Выражаю глубокую благодарность сотрудникам руководимой мною лаборатории микробиологии почв ВИУАА и ВНИИ микробиологических средств защиты растений и бактериальных препаратов Г. В. Кузнецовой, О. И. Громыко, Н. Г. Коваль и А. В. Сапроновой, которые в разные годы терпеливо помогали мне при разработке метода выделения чистых культур эндофитов, установлении их азотфиксирующей способности и выявлении других продуктов их синтеза, а также при создании препарата Симбионт 1. Все рисунки симбионтных грибов под микроскопом были выполнены Н. Г. Коваль. Я благодарна доценту Н. Н. Игнатьеву, который в период моей работы на общественных началах на кафедре почвоведения ТСХА включился в приготовление гормональных препаратов. На один из этих препаратов — Симбионт 2 — авторскос свидетельство мы получили совместно. Нельзя не упомянуть об участии в этой работе тех сотрудников различных организаций, которые приложили большое старание, изучая действие наших ростовых препаратов на сельскохозяйственные культуры. Особую ценность представляет тщательное изучение влияния ростовых препаратов на картофель, проводившееся в течение шести лет в Ташкентском сельскохозяйственном институте Е. Г. Лучининой под руководством заведующего кафедрой овощеводства П. Н. Балашова. Кроме того, я признательна Т. Г. Павловой за помощь в составлении списка авторов, упомянутых в настоящем труде.1. Распространенность эндотрофной микоризы в растениях
Сложность взаимоотношений между высокоорганизованными существами и микроорганизмами в их симбиотических и антагонистических взаимодействиях обусловила возникновение многих противоречивых точек зрения на сущность их совместного существования. Постепенно одностороннее представление о патогенном действии всех представителей микробного мира начинает уступать фактам, свидетельствующим о необходимости участия многих микроорганизмов в осуществлении жизненно важных функций человека, животных и растений, а также об их способности оказывать защитное действие от патогенных микробов и вирусов. Нужно отметить, что это новое представление о симбиотрофном существовании микроорганизмов с растениями еще редко учитывается наукой при изучении жизненно важных процессов у растений. Казалось бы, что умение выращивать растение в стерильных условиях служит бесспорным доказательством необязательности участия микроорганизмов в его жизнедеятельности. Ошибочность такого суждения вызвана тем, что стерильное растение всегда выращивают из природного семени, обогащенного продуктами метаболизма таких симбиотрофных микробов растений, как эндофиты, эпифитные и ризосферные бактерии. При оптимальном питании этих растений они значительно отстают в росте от нестерильных в контроле. Еще никто не доказал возможность получения нормального поколения из семян стерильного растения. Впервые обнаружили наличие грибов в корнях древесных и травянистых растений ранние исследователи их анатомического строения. Они считали, что наблюдаемые гифы являются органами самого растения. Вскоре С. Рейссек (Reissek, 1847) установил, что эти гифы принадлежат самостоятельным организмам, живущим совместно с растениями. М. Шлейден (Schleiden, 1845) показал частую встречаемость гиф в корнях орхидных растений, после чего многие исследователи обнаружили их в корнях папоротниковых, злаковых, мхов и ряда других семейств. Особый интерес вызвало открытие С. Швенденером (Schwandener, 1869) двойной природы лишайников, состоящих из гриба и водоросли. В литературе это открытие обычно связывают с именем А. де Бари (Bari de, 1879), который изучил причину необычайной жизнеспособности лишайников, растущих на камнях, древесине и коре деревьев. Оказалось, что их устойчивость к самым неблагоприятным условиям связана с наличием двух организмов — гриба и водоросли, выполняющих разные функции в процессе питания лишайников. А. де Бари назвал такой симбиоз мутуалистическим. В нашей стране в конце XIX и начале XX веков интерес к симбиотрофизму определялся изучением его значения в эволюционном развитии растительного мира. Симбиоз растений с микроорганизмами рассматривался как способ усложнения вида, что необходимо для его приспособления к изменяющимся условиям среды обитания. Обстоятельный обзор этого периода развития пауки сделан Л. Н. Хахиной (1979) в труде «Проблемы симбиогенеза», в котором критически рассмотрены работы таких ученых, как А. С. Фаминцин, К. С. Мережковский, Б. М. Козо—Полянский и др. Для нас представляет интерес разработанное К. С. Мережковским (1909) положение о наличии в природе двух плазм, сочетание которых определяет сущность симбиоза. Это положение, которое в то время воспринималось как фантазия ученого, мы рассмотрим подробнее в другом месте. В конце прошлого столетия большое внимание было уделено изучению эктотрофных микориз древесных пород. Обнаруженное Ф. М. Каменским (1883) наличие грибов на корнях бесхлорофильного подъельника (Monothropa hypopilys L.) стимулировало развитие науки о симбиозе высших растении с грибами. К сожалению, Ф. М. Каменский признавал мутуалистический характер этого симбиоза только для подъельника, считая, что у древесных пород грибы могут паразитировать, внедряясь в межклетники корня. Работы А. Франка (Frank, 1888) значительно расширили и научно обосновали представления о значении микотрофизма и его распространении в природе, в особенности у древесных пород. В противоположность взглядам Ф. М. Каменского А. Франк отстаивал полезность грибного симбиоза для деревьев, у которых он впервые установил существование двух типов симбиоза с грибами: эктотрофную микоризу с наружными чехлами грибного мицелия на копчиках корней и эндотрофную микоризу, гифы которой расположены в коровой паренхиме. Последние перевариваются растениями, обогащая их азотом. Эндотрофная микориза свойственна как древесным, кустарниковым, так и травянистым растениям. Древесные породы, обладающие обоими видами микориз, А.мФранк называл экто–эндотрофными, подчеркнув тем самым возможность симбиоза некоторых древесных пород с двумя видами грибов. Широко известные работы А. Франка и его оценка грибного симбиоза как полезного сожительства двух различных организмов вызвали большой интерес у многих исследователей, которые в основном правильно оценили физиологическое значение и полезность эктотрофной микрозы для древесных пород. У нас в стране интерес к изучению микориз древесных пород возник в 1949—1955 гг. в связи с широким развитием полезащитного лесоразведения в степных условиях. Исследованиями многочисленных ученых было доказано значение искусственного заражения семян сосны и желудей дуба чистыми культурами микоризных грибов или землей с микоризных питомников (Гельцер, 1951 и др.). На степных почвах с бедным составом грибов–микоризообразователей сосна и дуб лучше росли при заражении их перед посевом чистыми культурами белого гриба (рис. 1, 2). Рис. 1. Контрольные (слева) и микоризованные ростки сосны
Рис. 1. Контрольные (слева) и микоризованные ростки сосны
Несравненно сложней» и медленнее решался вопрос о распространенности и значении эндотрофной микоризы у травянистых растений: присущ ли данный симбиоз всем семействам и видам или его распространение, как и эктотрофной микоризы» ограничено отдельными семействами или определенными экологическими условиями?
 Рис. 2. Контрольные и микоризованные двулетние дубки
Рис. 2. Контрольные и микоризованные двулетние дубки
В конце прошлого века список растений» в корнях которых были установлены эндофиты, заметно возрос. Кроме папоротниковых и плауновых, эндофиты были обнаружены у голосемянных. Особый интерес вызывало образование у последних желваков на корнях, как у Podocarpus chinensis, которые напоминали клубеньки на корнях бобовых. Это сходство заставило некоторых исследователей заняться выяснением физиологических функций симбионтных грибов, заполняющих корневые желваки, в частности их способности к азотфиксации, о чем мы подробно расскажем в другом месте. Эндотрофная микориза, сосредоточенная в желваках, была обнаружена на корнях ольхи, облепихи, лоха, саговых пальм и других растений. Длительную дискуссию в литературе вызвали эти своеобразные образования на корнях ольхи и растений семейства лоховых, которые А. Франк (Frank, 1891) назвал микодомациями, т. е. жилищем грибов. М. С. Воронин (1866) впервые микроскопически исследовал клубеньки ольхи и выявил наличие грибов, названных им Schinzia alni. Впоследствии Ж. Пекло (Peklo, 1913) выделил из них актиомицет Actinomyces alni, но некоторые исследователи находили и бактерии. Очевидно, микодомации ольхи содержат не менее двух микроорганизмов. Во всяком случае после тщательной обработки поверхности клубеньков сулемой мы выделили из них эндофит и актиномицет. Как будет показано ниже (глава 3), клубеньки всех бобовых растений также содержат два микроорганизма — эндофит и клубеньковую бактерию (Гельцер, 1968а). Большое внимание было уделено изучению микотрофизма орхидных растений, исследования которых иногда субсидировались состоятельными коллекционерами экзотических цве тов. В. Варлих (Wahrlich, 1886) установил наличие грибных гиф у более чем 500 видов орхидных. Он ошибочно считал эти грибы паразитами орхидеи. К противоположному выводу пришел А. Франк (Frank, 1891) при изучении микотрофизма орхидных. Он установил, что у этих растений ядра в клетках, расположенных около клубков грибных гиф, бывают вдвое больше, чем в клетках, свободных от гиф гриба. Укрупнение ядер происходит в результате переваривания белковых веществ гриба в плазме клеток корня. А. Франк остроумно назвал орхидные растения грибоядными (pilzfressende). Указанное явление отмечалось А. С. Фаминциным (1907) и другими исследователями. В работе М. Маркуса (Marcusc, 1902) и широко известных работах И. Бернара (Bernard, 1911) была установлена симбиотрофная природа орхидных с эпдофитами и влияние последних на всхожесть труднопрорастающих крайне мелких семян орхидеи. Большой вклад в изучение эндомикотрофизма в тропическом климате на острове Ява внес Ж. Янзе (Janse, 1897), который изучал растительность на высоте 1400—1800 м над уровнем моря. Согласно результатам его исследований (табл. 1), из 75 изученных растений только у 6 видов трав не была обнаружена эндотрофная микориза.
Таблица 1. Эндотрофная микориза растений на Яве

В дальнейшем ученые выявили наличие микотрофности у всех исследованных растений, растущих на вулканических почвах Явы. В литературе отмечается еще одна заслуга Ж. Янзе. Он впервые правильно описал наиболее характерную морфологическую особенность эндофитов — способность образовывать везикулы. По его описанию, везикулы — это сферические или овальные расширения на концах гиф. На ранних стадиях в них можно обнаружить небольшое количество зернистой массы — продуктов синтеза гриба с капельками жировых соединений, которая постепенно заполняет везикулы. К этому можно добавить, что по мере усвоения растениями содержимого везикул они снова опорожняются. К сожалению, многие 'последующие авторы неправильно считали везикулы органами размножения гриба (Проценко, Шемаханова, 1974; Шрадер, 1963 и др.). Ученик А. Франка А. Шлихт (Schlicht, 1888) установил широкое распространение микориз у многих травянистых растений Германии, принадлежащих к различным семействам и растущих на разных почвах. Его исследования дополнили И подтвердили мнение А. Франка о широкой распространенности симбиоза у растений с грибами в данном регионе. В интересной работе В. Гевелера (Höveler, 1892) мы также находим список многих семейств микотрофных растений, за исключением водных, в Германии. Он поддержал мнение А. Франка о том, что эндофиты заменяют растениям корневые волоски. Выращивая различные растения в искусственной почве, состоящей из чередующихся слоев песка и перегнойной почвы, В. Гевелер обнаружил максимальное развитие корней и их сильную микотрофность в перегнойных слоях, что представляет интерес как первая попытка экспериментально установить связь между развитием корневой системы, ее микотрофностью и плодородием почвы. Нужно отметить появление на пороге XX в. оригинальной работы Е. Шталя (Stahl, 1900), в которой автор в отличие от других исследователей, регистрирующих лишь наличие или отсутствие эндофитов в корнях растений, впервые обратил внимание на значение этого явления: какие аналитические и физиологические особенности отличают микоризные растения от немикоризных и с чем связано возникновение такого симбиоза? Е. Шталь предложил теорию, согласно которой проявление микотрофизма определяется пониженной Транспирацией и накоплением в листьях сахара, тогда как немикотрофные растения характеризуются более высокой транспирацией и накоплением в листьях крахмала. Последние ученый назвал «амиллофиллами», а микоризные — «сахарофиллами». Теоретические положения этого автора многократно обсуждались в литературе, хотя и не получили подтверждения. Однако целенаправленность его исследований значительно обогатила науку о микотрофизме. Е. Шталь установил облигатную микотрофность у растений семейства горечавковых, которые ранее считались немикотрофными. Он отмечал, что особо сильной микотрофностыо отличаются виды, произрастающие в горах, и что только у немногих видов любого семейства в сильно увлажненных местообитаниях нет визуально обнаруживаемых эндофитов. Культурные растения Е. Шталь не изучал, но подчеркнул сильную микотрофность всех бобовых растений. Слабая микотрофность, по его данным, свойственна растениям из семейства толстянковых, маковых и крестоцветных. Последнее утверждение поддерживают и некоторые современные исследователи. Для развития рассматриваемых нами проблем в первой четверти нашего века характерно не только увеличение и уточнение списков микотрофных растений, но и изучение некоторых физиологических функций гриба (Ternetz, 1907; Rayncr, 1915, 1925 и др.). Однако вопрос о степени распространенности грибного симбиоза в растительном мире, так же как и о взаимозависимости между обоими организмами, еще не был решен, что отчетливо отражено в сводном труде, опубликованном А. А. Еленкиным (1907). Он критически оценил представление о мутуалистическом характере грибного симбиоза, заменив его теорией подвижного, или неустойчивого, равновесия. Он считал, что изменение внешних условий существования может благоприятствовать иногда грибу, иногда растению. Ошибочность этого положения заключается в том, что ни один из участников симбиоза не может преуспеть в случае снижения деятельности другого компонента, от которого он зависит. При ухудшении условий фотосинтеза гриб не получает достаточного количества углеводов И уменьшает снабжение растения продуктами своего синтеза. В грибные годы деревья в лесу не суховершинят, хорошо растут. Теория А. А. Еленкина не получила подтверждения в науке. В 30‑е годы нашего столетия в трех странах — в Советском Союзе, Японии и Чехословакии — появились обстоятельные обобщающие работы по эндомикотрофнзму. В них хорошо отразилось состояние интересующего нас раздела науки в этот период времени. В учебнике «Основы микологии» А. А. Ячевский (1933) посвятил 11 главу симбиозу микроорганизмов с насекомыми и высшими растениями. Наличие в этой главе раздета «Симбиоз» указывало на широту взглядов автора, тогда как подавляющее большинство фитопатологов того времени крайне настороженно относилось к наличию эндофитов в корнях, считая, что пребывание этих микроорганизмов внутри растений определяется их паразитарной природой. Только невозможность установить вредное влияние эндофитов на рост и развитие растений не позволила фитопатологам присвоить им термин «паразиты» и заставляла ограничиться противоречивым определением данного явления как «мутуалистический паразитизм» (Гойманн, 1954). До сих пор ботаники и фитопатологи охотно поддерживают появляющиеся в литературе недоказанные представления о «перерождении» эндофитов в паразитов, поскольку оно наиболее соответствует их ожиданию (Уранов, 1974). Обычно не учитывается, что такое перерождение микроорганизма должно сопровождаться коренным изменением его ферментативного аппарата. А. А. Ячевский (1933) привел самый обширный список растений, в корнях которых им и другими исследователями была установлена эндотрофная микориза. В списке содержалось 539 названий видов растений, принадлежащих, по нашим подсчетам, к более чем 80 семействам. В нем указаны и сельскохозяйственные культуры, которые редко упоминались другими авторами (рожь, пшеница, ячмень, лен и свекла). Среди микотрофных растений А. А. Ячевский (1933) отметил те семейства, у которых симбиоз с эндофитами установлен всеми исследователями. Это орхидные, вересковые, сложноцветные, хвойные и др. Он причислил их к облигатно микотрофным растениям. К факультативным микотрофам А. А. Ячевский отнес такие, у которых одни авторы устанавливают эндотрофную микоризу, а другие считают их немикотрофными. Сам ученый не обнаружил эндофитов в корнях 65 видов растений, однако в 24 из них микотрофность была установлена другими авторами, фамилии которых указаны А. А. Ячевским, а все остальные (41 вид), в том числе и осоки, сейчас известны как микотрофные. Мы ниже подробно остановимся на причинах отсутствия эндофитов у некоторых растений, в других случаях визуально признаваемых как микотрофные. В 1934 г. появилась обстоятельная статья японского ученого Т. Асаи (Asai, 1934), где он привел результаты своих исследований микотрофности растений, растущих в плакорных условиях, на больших высотах в горах, у кратера вулкана на вулканической почве, на морском побережье, на небольших коралловых островах и в субтропиках Японии. На основании полученных материалов Т. Асаи пришел к выводу о самом широком распространении эндотрофной микоризы у подавляющего большинства природных растений Японии. Только у водных растений пли растущих па сильно увлажненных почвах автор визуально не обнаружил эндотрофной микоризы. Изучая причины этого явления, Т. Асаи высаживал водные растения на минеральную почву и, наоборот, пересаживал сухопутные растения в воду. В первом случае у растений через некоторое время образовывалась микориза, а в последнем — растения не теряли своего симбионта на протяжении трех месяцев наблюдении. Т. Асаи считал, что водная среда неблагоприятна для заражения корней эндофитами, тогда как при их наличии в корнях избыток воды не мешает грибному симбиозу. В данном случае автор не учел многократно подчеркнутое в его статье правильное положение о том, что эндотрофная микориза развивается только в самой мелкой и тонкой корневой системе, которая у водных растений отсутствует. Пересадка на почву и изменение условий питания растений приводит к образованию мелкой корневой системы и к развитию в ней эндофитов. Так, рис, культивируемый при заливе водой, чаще всего не имеет визуально выявляемой эндотрофной микоризы, тогда как у изученных нами корней риса на Кубани, выращиваемом при периодическом затоплении, она была, о чем свидетельствуют небольшие круглые везикулы (рис. 3), которые обильно встречались в большинстве визуально изученных корней этих растений (Гельцер, 1958). Кроме того, слабая обеспеченность корней водных растений кислородом ограничивает развитие таких автотрофов, как грибы.
 Рис, 3. Везикулы на корнях риса (ув. 100 раз)
Рис, 3. Везикулы на корнях риса (ув. 100 раз)
Т. Асаи не соглашался с принятым в литературе мнением О непременном наличии гумозных почв для развития микотрофизма растений. Устанавливая микотрофность различных растений при самых разнообразных условиях и рН почвы, автор пришел к выводу об отсутствии зависимости наблюдаемого симбиоза от внешней среды, за исключением водных условий. Этот вывод можно принять с известной оговоркой, так как характер местообитания сильно влияет на проявления микотрофизма. Хорошо известна повышенная микотрофность горных растений и растений умеренно влажного и теплого климата в противоположность визуально плохой микотрофности у растений пустынь, тундры и других неблагоприятных для роста растений мест. Т. Асаи подчеркнул всеобщность микотрофизма в растительном мире Японии, достигающего 82% У изученных им растений. Чехословацкие ученые А.мКлечка и В. Вуколов (Klecka, Vukolov, 1935) детально изучили микотрофность древесных пород и кустарников в Центральной Европе. Из 111 видов они во всех случаях установили наличие эндотрофной микоризы, а у 42 древесных — дополнительно и эктотрофной. Авторы подчеркнули, что микотрофность изученных пород не зависит от типа почвы. Они особо отмстили своеобразные микоризные образования в виде желваков на корнях видов Alnus, Elaeagnus, Hippophae, Myrica. Желваки этих растений заполнены гифами грибов с септированным мицелием, который в дальнейшем распадается на круглые образования. Такое почкование свойственно многим эндофитам и в чистых культурах. Исследования чехословацких ученых подтвердили и расширили выводы А. Франка о симбиотрофном существовании всех древесных пород в центральной части Европы. Эти исследователи установили также наличие эндофитов в корнях многих галофитов, растущих на засоленных почвах Нейзадлерского озера. Среди них указывались Сагех secalina и несколько видов Aster. Salicornia, Plantago и др. Было признано неправильным утверждение о необходимости гумозных почв для проявления микотрофизма растений. Так, наличие эндотрофной микоризы у сосны и можжевельника, растущих на боровых песках, и у вереска — первого растения, поселяющегося на дюнных песках Прибалтики, с несомненностью указывает, что не гумус способствует распространению эндофитов, хотя он может несколько усилить интенсивность развития микотрофизма. При детальном изучении эндотрофных микориз, проведенном С. Р. Шварцман (1955) на песчаном массиве Большие Барсуки в Казахстане, были установлены микотрофность культурных и природных травянистых растений, полукустарников, кустарников и наличие экто–эндотрофных микориз в суровых условиях полупустыни. В предисловии к своему труду об орхидеях X. Бургефф (Burgeff, 1936) указал, что большинство природнорастущих растений живет совместно с грибами. М. Магру (1944) считал, что почти все многолетние травянистые растения и большинство древесных в природных условиях произрастают в симбиозе с грибами, тогда как однолетние растения немикотрофны. В своей монографии «Мнкотрофия у растений» А. Келли (1952, с. 27) подчеркнул, что, «несмотря на недостаточность наших сведении о деталях строения корней, мы все же знаем, что представители всех крупных систематических групп растительного мира живут в содружестве с грибами. Нет ни одной значительной группы от слоевищных растений до семенных, которая представляла бы исключение». В книге этого автора можно найти сведения о распространенности микотрофных растений на различных континентах, причем уменьшение их численности обычно зависит не от почвенно–климатических особенностей материка, а от недостатка исследований по данному вопросу. Поэтому понятно, что в Центральной Европе были составлены наиболее длинные списки микотрофных растений, тогда как для многих мест Азии это могут быть сообщения о нескольких видах. А. Келли отмечает, что иногда отдельные авторы какое–нибудь растение считают немикотрофным, тогда как другие устанавливают наличие эндофитов в его корнях. В последнее сорокалетие были значительно расширены исследования эндотрофной микоризы в различных районах Советского Союза. Еще в 1947 г. А. Н. Клечетов (1947) установил наличие эндотрофной микоризы в корнях тау–сагыза. П. M. Штеренберг (1951, 1952) обследовала на юге Одесской области корни многолетних злаков, бобовых и разнотравья, а также различных сельскохозяйственных культур и выявила их микотрофность. И. Д, Рубцова (1963) изучала микотрофность у сорговых и многочисленных растений из семейства злаковых. Она подчеркнула, что в Воронежской области не встречала немикоризиых растений в пределах этого семейства. Б. А. Тихомиров и О. С. Стрелкова (1954), работая в тундре, установили, что в этих условиях только 30% изученных растений имели визуально определяемую эндотрофную микоризу. Особо нужно отметить и более подробно рассмотреть многочисленные исследования микотрофности растений на кафедре ботаники Пермского педагогического института, руководимой И. А. Селивановым, который смог придать этой работе широкий размах. Он организовал два съезда (1968 и 1975 гг.) для обмена мнений по указанным вопросам во всесоюзном масштабе. Участники съездов получили исчерпывающую информацию о состоянии этого раздела науки в Советском Союзе, а также о нерешенных и спорных вопросах, требующих дальнейших исследований. Рефераты докладов, прочитанных на съездах, были опубликованы в специальных сборниках. Исследования Л. В. Крюгер (1968), посвященные зимнему состоянию эндотрофной микоризы, проводились в течение трех лет на многолетних растениях — клевере, кислице, черпике, грушанке и др. Кусты клевера пересаживали в гончарные горшки, которые прикапывали в почве и по мере надобности переносили зимой в лабораторию, где после оттаивания корпи фиксировали и изучали. Другие растения откапывали зимой в местах их произрастания. У всех этих растений в течение зимы отмечены нечленистый мицелий и много хорошо заполненных зернистой массой везикул, реже встречались арбускулы. Почти во всех растениях установлено наличие липидов, окрашиваемых Суданом 3 в красный цвет. Возможно, что хорошее заполнение везикул эндофитов продуктами их синтеза связано с сохранением таких продуктов растением в зимнее время. Нас интересовала указанная работа, так как мы выделяли чистые культуры эндофитов из прикопанных на зиму кустов вишни, мицелий которых в питательных средах синтезировал характерный для этого растения вишневый пигмент. Все же статья Л. В. Крюгер, снабженная многими иллюстрациями (рисунками и фотографиями препаратов под микроскопом), дает возможность установить несоответствие утверждения автора о наличии нечленистого мицелия четко изображенному на фотографиях 5 и 13 многоклеточному его строению. Такие же фотографии приводятся в статье В. Г. Логиновой (1968) о вересковых и статье II. А. Селиванова и Р. Г. Истоминой (1968) об экто–эндотрофных микоризах древесных. Что касается фотографий в статье Л. В. Крюгер, свидетельствующих о существовании наружных везикул, о чем, кстати, сообщается во многих работах, то к ним, по–нашему мнению, нужно отнестись с большой осторожностью, так как этот эффект часто достигается на столике микроскопа путем нажатия покровного стекла на предметное, в результате чего мацерированная ткань препарата разрывается и содержимое корня выходит наружу. Также механическим путем в мацерированном препарате в результате уменьшения давления плазмы происходит переход содержимого в корневой волосок. Последнее для многих исследователей служит доказательством заражения корней эндофитами в почве, хотя в данном случае наружная оболочка волоска остается ненарушенной. Микотрофность как древесных пород, кустарников, так и травянистых растений в самых разнообразных по экологическим условиям местообитаниях были изучены И. А. Селивановым с сотрудниками в Зауралье (1966), в Закавказье — в Батумском ботаническом саду (1968), в Средней Азии (1967) и многих других местах. Авторы установили самое широкое распространение эндотрофной микоризы. В Батумском ботаническом саду И. А. Селиванов и Р. Г. Истомина (1968) визуально не обнаружили микоризу только у одного растения. На склонах Эльбруса визуально немикотрофных оказалось 14% из числа всех изученных растений, принадлежащих к семействам крестоцветных, осоковых и хвощевых. В Средней Азии при сильной микотрофности растений в орошаемых и горных условиях визуально немикотрофными оказались только некоторые растения в сухой песчаной пустыне. В работе 1976 г. И. А. Селиванов приводит следующие сведения о распространении везикулярно–арбускулярных микориз в различных ландшафтно–географических зонах: в тундре насчитывается 42,2% микоризных растений, в лесах — 77,9, в степи — 85,4, в пустыне — 60,9%. Автор обобщил литературные данные о положительном действии усиления микотрофности путем заражения семян эндогоновыми грибами. Оно выражается в накоплении фосфора и повышении урожая культурных растений. Эти исследования убедили И. А. Селиванова, что основными микоризообразующими грибами являются фикомицетные из семейства Endogonaceae, хотя многие симбионтные бактерии (как эпифитные, так и ризосферные) могут стимулировать процесс микоризообразования гораздо сильнее, чем фикомицетные грибы. В своем обобщающем труде И. А. Селиванов (1981) пришел к заключению, что 78% изученных растений принадлежит к микотрофным и что поэтому «…микосимбиотрофизм высших растений является правилом, а не исключением» (с. 191). В этой же работе он отметил, что при изменении условий существования немикотрофные растения могут становиться микотрофными, и привел пример, когда Phragmites communis Trin. па солонце было сильно микотрофным растением, а на берегу озера Кукай стало немикотрофным. То же наблюдалось и у других растений. И. А. Селиванов отнес такие виды к слабо микотрофным растениям, у которых микориза установлена не у всех особей, что не совсем правильно. Даже для классически микотрофных растений, таких, как орхидеи, в редких случаях визуально не удается обнаружить эндофитов в их корнях, что» по мнению X. Бургеффа (1963), связано с неблагоприятными условиями для их роста. Слабее выражена микотрофность у орхидей, культивируемых в теплице, чем у растущих в природных условиях. Очевидно, любое растение может быть визуально микотрофным или немикотрофным и зависит это от условий их существования. В конце прошлого века все исследователи отмечали слабую микотрофность или ее отсутствие у водных растений и у растущих в избыточно увлажненных местообитаниях и поэтому обладающих слаборазветвленными толстыми корнями. Так, в Чехословакии В. Мейстржик (Mejstrik, 1965) при изучении динамики микотрофности у 16 видов растений, растущих в избыточно увлажненных местах, установил наличие эндофитов в их корнях только в конце лета, после снижения уровня грунтовых вод. Максимальное развитие микоризных гиф в корнях этих растении наблюдалось в слое 0-0,5 см. Несомненно, что у водных растений симбиоз с грибами выражен слабее, чем у сухопутных, и для его обнаружения требуется не обычный одноразовый просмотр мацерированных корней под микроскопом, а более тщательное исследование. Выше мы указали, что основным ограничивающим фактором для развития микориз в водных условиях является недостаток кислорода для таких аэробов, как грибы. Нам приходилось наблюдать, что при длительном заливе леса водой разрушалась микориза даже на корнях больших берез, в результате чего они теряли устойчивость к гнилостной микрофлоре, которая поражала корни и внутреннюю часть ствола, что приводило к гибели деревьев на большом участке леса. Эти наблюдения привели нас к мысли, что усиление микотрофности у сухопутных растений явилось основным фактором, обеспечивающим сухопутное существование растительного мира при их переходе из водной среды на сушу в давние геологические времена (Гельцер, 1976а). Нередки случаи, когда утверждение автора об отсутствии микоризы у того или иного изучаемого растения является результатом недостаточно тщательного обследования. Легко можно визуально установить наличие эндофитов в корнях сильно микотрофных растений, но немало времени нужно потратить для обнаружения грибов в корнях слабо микотрофных растений. В этих случаях лучше приготовлять продольные препараты корней, дающие возможность контролировать эндофиты на большем материале. Заканчивая наш краткий обзор о распространенности грибного симбиоза у природнорастущих растений, мы хотели отметить сильную микотрофность у лекарственных растений. Нами были изучены корни женьшеня Panax Ginseng, мать–и–мачехи Tussilago farfara, черники Myrtillus, крапивы Urtiса, облепихи Hippophae и др. Все они принадлежат к сильно микотрофным растениям (оценка их микотрофности по пятибалльной системе 5 баллов). В тонких сосущих корнях женьшеня грибные гифы с многочисленными везикулами и арбускулами заполняют значительную часть клеток эндодермы. Корни мать–и–мачехи изучались нами многократно, и обилие в них эндофитов с везикулами отражено на рис.4. На корнях облепихи имеются крупные клубеньки, заполненные гифами с везикулами, в которых накапливаются продукты синтеза гриба. Не случайно высоко ценятся лекарственные травы, выросшие в горных условиях, как, например, в Высоких Татрах в Чехословакии, где благодаря более интенсивному фотосинтезу усиливается грибной симбиоз. В нашей стране не только сборы, но и посевы лекарственных растений в горных районах на высоте от 1 до 3 тыс. м над уровнем моря могут обеспечить высокие лечебные свойства этих трав. Ниже мы сообщим, какие биологически ценные вещества синтезируют эндофиты, здесь же отметим, что, как правило, максимальное количество лекарственных веществ сосредоточено в тонких сосущих корнях, которые их синтезируют.
 Рис. 4. Эндофит из корней мать-и-мачехи
Рис. 4. Эндофит из корней мать-и-мачехи
Выявление грибного мицелия в природной растительности на протяжении последних ста лет хотя и способствовало накоплению многочисленных данных о распространении этого явления в природе, по не могло разрешить многих возникающих спорных вопросов о происхождении эндофитов в корнях растений, степени их участия в жизненных процессах растений, возможности усиления этого симбиоза и его влияния на патогенные микроорганизмы. Вначале исследователи не изучали микотрофности сельскохозяйственных культур, так как считали, что грибной симбиоз распространен только у природных многолетних растений. Однако уже в 20‑х годах нашего столетия Б. Пейронель (Peyronel, 1923, 1924) установил микотрофность пшениц, овса, ячменя, кукурузы и риса. В последующем была доказана микотрофность бобовых культур, лука, чеснока, спаржи, проса, земляники, сельдерея и других сельскохозяйственных растений. Казалось бы, что многообразие условий, в которых выращиваются культурные растения, может способствовать выяснению значения грибного симбиоза в их жизни, но неправильное представление о происхождении эндофитов (путем заражения их корней в почве) и неквалифицированная постановка полевых опытов не способствовали развитию науки в этом направлении. 13 качестве примера приведем первые неутешительные выводы, сделанные А. Винтером (Winter, 1950) на основании изучения многих сельскохозяйственных культур. Вот некоторые из них: растения, сильно зараженные микоризными грибами, чаще всего плохо развиваются; сорняки способствуют увеличению микотрофности культур; чем хуже агротехника, тем сильнее у зерновых культур развивается микориза. Эти неправильные выводы возникли в связи с сопоставлением наблюдений, выполненных в различных условиях роста растений. Только в последующих своих исследованиях А. Винтер (Winter, Peus, 1966) признал, что повышение микотрофностп соответствует повышению продуктивности культур. Он установил наличие септированного мицелия эндофитов в корнях ржи, пшеницы, ячменя и кукурузы, тогда как у овса одновременно наблюдал и несептированный мицелии, что, очевидно, относилось к более молодым гифам, перегородки у которых выражены менее отчетливо, чем у старых гиф. В противоположность Б. Пейронелю А. Винтер правильно отрицал возможность значительного развития микоризообразующих грибов в почвах и их участия в дополнительном обогащении растений питательными веществами из почвы. Академик В. Р. Вильямс (1939), придававший большое значение микотрофному типу питания растений, указывал на развитие грибного симбиоза у пшениц, возделываемых по пласту трав. Е. П. Хрущева (1956) в своей монографии о микотрофности пшениц, хотя и обнаружила способность к грибному симбиозу у непластовых пшениц, но признала значительное повышение микотрофности зерновых культур при росте их по пласту. В выводах она отметила, что одним из ведущих факторов, способствующих увеличению микотрофности культурных растений, является наличие в почве свежих растительных остатков. Очевидно, хороший травяной пласт может служить фактором воспитания более микотрофных культур, так как его разложение сопровождается значительным увеличением почвенных микроорганизмов, которые синтезируют гормональные вещества. Представляло интерес установить корреляцию между продуктивностью различных сортов пшениц и степенью их микотрофности в различных условиях возделывания. Изучение коллекций озимых пшениц, урожайность которых на окультуренных дерново–подзолистых почвах Московской области составляла около 16-20 ц/га, показало их слабую микотрофность (1-2 балла). На корнях растений редко встречались септированные гифы и мелкие круглые везикулы. Более микотрофными были плотноколосые сорта пшеницы (так называемые сверхеды). У них мы наблюдали многочисленные некрупные слабофотогеничные везикулы, что указывало на плохую заполненность последних продуктами синтеза гриба. При удобрении органомииеральными смесями отмечались более крупные везикулы с двуконтурной оболочкой, слабоокрашиваемыс анилин–бляу. Яровые пшеницы в этой зоне обычно бывают менее микотрофны, чем озимые. Резко отличался от пшениц на подзолистых почвах сорт яровой пшеницы Барнаульская 32, выращиваемый на алтайских черноземах. Урожайность его в благоприятные годы достигала 40 ц/га и была наивысшей при внесении небольших доз органических удобрений. В результате многочисленных просмотров корней этой пшеницы па протяжении трех лет была установлена ее высокая микотрофность (5 баллов). На рис.5 видны многочисленные гифы и большие скопления крупных везикул грушевидной формы, хорошо окрашенных апилии–бляу. В засушливые годы микотрофность сорта Барнаульская 32 снижалась до 3 баллов. Следует отметить, что преимущество высокопроизводительного и сильно микотрофного сорта заключается в его способности при благоприятных условиях восстанавливать свои лучшие качества.
 Рис. 5. Гифы и крупные везикулы из корней яровой пшеницы сорта Барнаульская 32 (ув. 120)
Рис. 5. Гифы и крупные везикулы из корней яровой пшеницы сорта Барнаульская 32 (ув. 120)
Два года мы изучали различные озимые сорта пшениц Всесоюзного селекционного генетического института ВСГИ: Одесскую 3 и Одесскую 16, Безостую 1, созданную П. П. Лукьяненко, а также сорта Мироновская 264 и Мироновская 808 селекции В. П. Ремесло. У Одесской 3 и Одесской 16 осенью 1961 г. и весной 1962 г. корни были сильно микотрофны. Встречались многочисленные крупные везикулы, заполненные зернистой массой с жировыми включениями, и септированные гифы с гранулированной плазмой. На рис.6 и 7 видны скопления везикул в корнях этих пшениц. Степень их микотрофности оценивалась в 4-5 баллов, урожайность составляла 40 ц/га. Очень высокой микотрофностыо отличался сорт озимой пшеницы Безостая 1 как на полях ВСГИ (г. Одесса), так и особенно на Мироновской опытной станции. В первом случае в корнях этого сорта встречались наряду с многочисленными многоклеточными гифами спорангиолы крупных везикул своеобразной формы. На Мироновской станции в корнях Безостой 1 размеры везикул в 2-3 раза превосходили размеры клеток корня (рис. 6). Можно подчеркнуть, что высокая урожайность этого сорта, достигавшая в то время 48 ц/га, находилась в полном соответствии с его микотрофностью, которую трудно оценить по пятибалльной шкале, так как насыщенность ее корней эндофитами на плодородных черноземах Мироновской станции превосходила все известные случаи.
 Рис. 6. Гифы и крупные везикулы из корней озимой пшеницы Безостая 1 (ув. 120)
Рис. 6. Гифы и крупные везикулы из корней озимой пшеницы Безостая 1 (ув. 120)
Очень высокой микотрофностыо отличались корни пшениц селекции В. П. Ремесло. В корнях этих сортов имелось большое количество крупных везикул, иногда по 10-15 шт. в поле зрения микроскопа. Еще более микотрофными были корни пшеницы сорта Мироновская 264 на черноземах ее родины. Гифы эндофитов часто образовывали петли, заполняя ими клетки корня, а везикулы по своим размерам превышали клетки корня (рис. 7). Кроме того, сильной микотрофностыо отличались сорта Мироновская 808 и Киевская 893. Очень сильная Микотрофность отмечена нами также И у яровых пшениц Народная, Артемовка и Украинка, которые использовали при создании сортов Мироновская 261, Мироновская 808 и Киевская 893.
 Рис. 7. Крупные везикулы из корней пшеницы сорта Мироновская 264
Рис. 7. Крупные везикулы из корней пшеницы сорта Мироновская 264
Имеющиеся в литературе общие указания на слабую Микотрофность пшениц не соответствуют данным, получаемым при изучении высокоурожайных сортов, в корнях которых часто интенсивность развития эндофитов значительно выше, чем у многолетних травянистых растений. Степень микотрофности любого сорта, как и его урожайность не является постоянной и неизменной величиной. При недостатке влаги или ухудшении других условий роста растений микотрофность их снижается. Так, мы установили, что для озимых пшениц, высеваемых в Одесской области по пару, микотрофность корней выше, чем у возделываемых после кукурузы. В последнем случае в корнях пшениц наблюдалось много нематод, которые, очевидно, питались эндофитами, в результате чего микотрофность этих пшениц резко снизилась. В связи с указанным мы хотели обратить внимание на популярное, но никем не доказанное утверждение, что созданный сорт не меняется, а уменьшение его продуктивности связано только с повышением активности патогенов. Не приходится сомневаться, что широкое использование сорта Мироновская 808 в подзолистой зоне сопровождается значительным снижением ее микотрофности, которое, как мы увидим ниже, влечет за собой снижение защитных свойств сорта против вирусов, микозов и бактериозов. Большой интерес представляют результаты изучения присланных нам из Института вирусологии Академии наук Узбекской ССР корней хлопчатника. Так, было установлено, что неустойчивые к вилту сорта отличались слабой микотрофностыо с оценкой в 1 балл, тогда как различные устойчивые к этой болезни сорта оказались значительно более микотрофными и наличие в их корнях эндофитов оценивалось в 3—5 баллов. Мы неоднократно убеждались в том, что корни хлопчатника, посеянного по распаханной люцерне, были несравненно сильнее микотрофны, чем в монокультурных посевах, что объясняет их высокую устойчивость к вилту. В связи с этим высев хлопчатника последовательно на протяжении двух лет по распаханной люцерне может служить хорошим приемом для повышения его вилтоустойчивости. В качестве вегетативно размножаемой культуры мы использовали для изучения картофель, о микотрофности которого в литературе имеются крайне противоречивые данные. По своей природе дикий картофель является сильно микотрофным растением, что дало основание Ж. Магру (1949) сравнивать его с орхидеями. Вместе с тем при культивировании картофеля на равнине он становится слабо микотрофным, а в сухом и жарком климате без орошения — визуально немикотрофным. Сильная микотрофность диких видов картофеля была установлена Ж. Янзе (Janse, 1897), Н. Бернар и Ж. Магру (Bernard, Magrou, 1911) и др. Даже длительно культивируемые дикие виды картофеля у нас в Союзе были значительно более микотрофными, чем растущие рядом с ними культурные сорта картофеля. Нами выявлены многочисленные везикулы в корнях Solarium demisum и дикого вида S. acaulia, выращиваемых на нолях отделения ВИРа под Москвой в Михневе. Сильной микотрофностыо отличаются и культурные сорта картофеля, возделываемые на больших высотах — 1500-2500 м над уровнем моря. Ж. Костантен и др. (Costantin е. al., 1934) установили, что прекрасные качества невосприимчивого к вирусным заболеваниям посадочного картофеля, выращенного на больших высотах, сочетаются с его сильной микотрофностью. Вначале эти авторы считали, что для образования сильно микотрофных кустов картофеля необходимо его ближайшее соседство с природнорастущим микотрофным пасленом, но, наблюдая такой картофель в горах, где в окрестностях не было паслена, они признали возможность заражения картофеля микоризными грибами от любых других растении, тем более что изучение многолетней альпийской флоры показало наличие обильного развития эндофитов в корнях представителей всех семейств на горных высотах. Л. М. Нозадзе (1968) изучала микотрофность травянистой растительности в высокогорном Казбекском районе в области Большого Кавказа на высотах 1100-3600 м над уровнем моря. Она установила сильную микотрофность у 104 видов растений субальпийского пояса и среднюю микотрофность у 68 видов. Визуально немикотрофные растения в основном встречались на высотах около 3000 м в сухих или избыточно влажных местах. Эти растения в более благоприятных условиях становились микотрофными. Мы проверили влияние горных условии на микотрофность картофеля в Южной Осетии на высоте 2200 м над уровнем моря на высокогорном стационаре АН СССР, где известный ботаник Е. А. Буш впервые успешно выращивала картофель. Присланные ею в Москву корни 11 сортов картофеля и повторно собранные нами на следующий год непосредственно на полях стационара были изучены в нашей лаборатории на содержание эндофитов. Корни сортов Эбердин, Белая и Розовая болгарские, Эпикур, Имандра, Сеянец, Альфа, Советский, Варба, Ранняя роза и Приекульский оказались необычайно для картофеля сильно микотрофными и получили максимальную оценку в 5 баллов. Помимо многочисленных гиф (см., например, гифы в корнях сорта Варба на рис.8), в них имелись многочисленные везикулы восьмигранной формы, что указывает на развитие особо симбиотрофных грибов у картофеля в горах (Гельцер, 1963а).
 Рис. 8. Везикулы зндофитов в корнях картофеля сорта Варба, выращенного на высоте 2200 м над уровнем моря
Рис. 8. Везикулы зндофитов в корнях картофеля сорта Варба, выращенного на высоте 2200 м над уровнем моря
По данным Е. А. Буш, процесс акклиматизации возделываемых ею сортов картофеля продолжался несколько лет. Очевидно, возрастание микотрофности картофеля в горах — это медленный процесс постепенного накопления симбнотрофных грибов и усиления их жизнедеятельности от поколения к поколению под влиянием особо благоприятных условии фотосинтеза, климата и высокой биогенности черноземных почв на больших высотах. Посланные нами Е. А. Буш вырожденные готические клубни картофеля сорта Коренев с визуально немикотрофных кустов были высажены па высотном стационаре. В первый год растения росли плохо и в их корнях содержалось незначительное количество эндофитов с оценкой в 2 балла. Если бы сильная микотрофность горного картофеля определялась заражением эндофитами в почве, то благоприятное действие этого фактора сказалось бы в первый же год посадки визуально немикотрофного картофеля. Во Франции уже давно по совету специалистов, изучающих микотрофность, лечат больной картофель в горах, повышая его микотрофность. Более быстрое восстановление микотрофности корней картофеля происходит при посеве его семенами. Этим приемом пользовались многие исследователи, считая, что оздоровление семенных посевов картофеля объясняется иммунностью семян по отношению к вирусным заболеваниям. Обычно в первый год посева вырастают небольшие клубни, которые используются в качестве посадочного материала на второй год, что обеспечивает получение высоких урожаев здорового картофеля (В. И. Эдельштейн, 1957). Последующие клубневые посадки приводят к постепенному уменьшению урожайности и значительному снижению микотрофности картофеля. Пять раз за лето мы отбирали и просматривали пробы корней картофеля, выращенного из семян и клубней на Овощной опытной станции Тимирязевской академии. У всех изученных сортов (Берлихинген, Смысловский, Катадин, Агрономический и Эпрон) во все сроки микотрофность семенных посевов была на 2 балла выше, чем у клубневых. При изучении корней картофеля различных сортов, посаженного клубнями на опытных полях Тимирязевской академии и Института картофельного хозяйства (Московская область), была установлена незначительная микотрофность. У сортов Берлихинген, Камераз, Лорх, Юбель, Калев, Северная роза, Смысловский, Приекульский и др. наличие эндофитов в корнях оценивалось в 1 балл, а у кустов с признаками вырождения эндофиты визуально не были обнаружены. Корни картофеля различных сортов, полученные со Львовского сортоучастка, не имели гиф эндофитов, то же отмечалось и у картофеля из южных областей. Значительно более микотрофными (3-4 балла) были различные сорта картофеля в Прибалтийских республиках, где мягкий климат обеспечивал лучший рост растений. Приведенные примеры различной степени микотрофности у картофеля указывают, до каких широких пределов может колебаться интенсивность развития грибного симбионта в корнях одного и того же вида растения в зависимости от экологических условий его произрастания или способа размножения (семенного, вегетативного). Даже если визуально не удается определить в корнях гиф грибов, везикул, арбускул или спорангиол, нельзя быть уверенным в полной стерильности картофеля по отношению к грибному симбионту, так как в случае образования цветов и семян последние всегда в той или иной степени микотрофны. Как уже отмечалось, картофельные растения из семян значительно более микотрофны по сравнению с клубневыми на одной и той же почве. Каждый новый сорт картофеля, полученный путем скрещивания через семенную репродукцию, всегда более микотрофен, чем после его длительного клубневого размножения. В этом мы могли убедиться на некоторых сортах Приекульской селекционной станции в Латвии. Привлечение для скрещивании сильно микотрофных диких и горных сортов картофеля может значительно способствовать развитию грибного симбиоза в корнях нового культурного сорта. Ниже мы подробнее остановимся на наших практических предложениях оздоровления культуры картофеля, способствующих повышению ее микотрофности. В результате изучения микотрофности картофеля, пшеницы и хлопчатника была установлена зависимость между продуктивностью этих культур и степенью их микотрофности, причем последняя устанавливалась нами уже в ранней стадии развития растений, когда об их продуктивности еще нельзя было судить. Это дает возможность предполагать, что степень, микотрофности в какой–то мере определяет урожайность растений. Указанная закономерность для культурных растений далеко не всегда приложима к природной растительности. Дикие родичи культурных растений, как правило, характеризуются большей микотрофностыо, хотя по продуктивности значительно уступают выведенным на их основе сортам. Высокая микотрофность. природной травянистой растительности часто при крайне низкой их продуктивности проявляется как защитный фактор, дающий возможность существовать в крайне неблагоприятных условиях. В качестве примера можно привести сильную микотрофность в корнях самого непроизводительного плотнокустового злака Nardus stricla L. (белоуса), который предшествует, по В. Р. Вильямсу (1939), овладению территории гипновыми мхами. Может быть впоследствии будет установлено различие в продуктах синтеза гриба диких и культурных растений. Заканчивая рассмотрение вопроса о распространении и интенсивности проявления в растительном мире эндомикотрофизма, мы должны подчеркнуть зависимость последнего от условий окружающей среды, наследственных свойств вида и способов размножения растений (вегетативного или семенного). Визуально немикотрофными оказались растения избыточно увлажненных мест, растительность тундры, сухой степи. Во всех этих случаях почвенные и климатические условия ограничивают образование мелкой корневой системы, в которой развиваются симбиотрофные грибы. При изменении условий те же растения становятся микотрофными. Несмотря на огромное количество данных о симбиотрофизме у растений, наука еще не сделала общего вывода о микотрофном существовании всего растительного мира и тезис о всеобщности и повторяемости основных законов в природе пока еще неприложим к явлению симбиоза растений с грибами. Причины такого положения труднообъяснимы, тем более что микотрофное существование растений установлено и для давних геологических эпох: на многих окаменелостях юрского периода в мельчайших деталях видны грибы в корнях растений. Их фотографии приведены в учебнике А. А. Ячевского (1933) и в работах других авторов. Непризнание микотрофного существования всего растительного мира определяется другими причинами, нежели недостаточной изученностью этого явления у всех существующих в мире растений. Ведь ни одно положение в ботанике и физиологии растений не устанавливалось при обязательной проверке его на всех растениях. Так, одно из наиболее ценных достижений физиологии растений в наше время, касающееся синтетических процессов в корневых системах растений, было установлено на единичных представителях растительного мира (Сабинин, 1949), что не мешало признать эти процессы как общие для всех растений. Так же была воспринята известная формула Ф. Вента (Went, 1928) об обязательном наличии гормональных веществ у всех растений. То, что оба указанных явления обусловлены деятельностью симбионтных грибов растений, будет показано в следующих главах нашего труда. Для того, чтобы достигнуть общего признания симбиотрофного существования растений с эндофитами, эпифнтными и ризосферными бактериями, необходим пересмотр основного давно утвердившегося тезиса науки об их автотрофном существовании. Вместе с тем усвоение указанного тезиса с самого первого знакомства с жизнью растений заставляет многих ученых придавать большее значение единичным случаям, в которых эндофиты визуально не были обнаружены, чем длинным спискам растений, у которых наличие грибного симбиоза более чем 100 лет устанавливалось на всех континентах. Микотрофность культурных растений была определена в 20‑х годах нашего столетия. Что касается указанных единичных случаев, когда у растений визуально не удается обнаружить эндофитов, то, очевидно, для окончательного решения вопроса об их микотрофности нужно обладать более точными методами исследования, тем более, что визуально невозможно установить наличие эндофитов в листьях, хвое, пыльце, семенах в связи с неспецифичностыо их морфологии при отсутствии в их гифах везикул и арбускул, что определяет отличие их от других грибов. Необходимой предпосылкой разработки таких методов является получение чистых культур эндофитов, чего не удалось добиться многим ученым. Основная трудность здесь заключалась в отсутствии роста эндофитов в стерильных питательных средах, в которых другие грибы хорошо растут. Нам уже давно удалось установить, что рост эндофитов в стерильных питательных средах возможен только при внесении нескольких капель ростовых веществ микробного или растительного происхождения, после чего они начинают сами их синтезировать. Это позволило нам разработать метод получения чистых культур эндофитов из растений (Гельцер, Коваль, Сапронова, 1965; Гельцер, Кузнецова, 1977). В следующей главе мы остановимся на нем подробнее.
Выводы
1. Литературные данные и результаты наших исследований распространенности эндомикотрофизма в растительном мире свидетельствуют о широком развитии этого симбиоза в природе, которое равнозначно утверждено о его всеобщности. 2. Устанавливаемые исследователями случаи отсутствия, а также ослабления микотрофизма у дикорастущих растений определяются или пониженной биогенностью среды их обитания (тундра, водная среда, пустыня), что ограничивает развитие мелкой корневой системы, или отсутствием гормонального воздействия продуктов метаболизма почвенных и ризосферных бактерий (стерильные опыты). 3. Наиболее сильно развит симбиоз с эндофитами у древесных, кустарниковых и многолетних травянистых растений в условиях, обеспечивающих их высокую продуктивность, в частности в горах, поймах рек, на карбонатных породах. 4. Ослабление микотрофности у однолетних сельскохозяйственных культур обычно связано с понижением их продуктивности при неправильной агротехнике выращивания. Новые высокопродуктивные сорта отечественной селекции не уступают, а часто даже превосходят по микотрофности многолетние дикорастущие растения. 5. Создание и сохранение сильно микотрофных сортов сельскохозяйственных культур должно стать очередной задачей научного земледелия.2. Происхождение симбионтных грибов и получение их чистых культур
Многие исследователи эндотрофной микоризы растений пытались выделить чистые культуры симбионтных грибов. Неожиданной оказалась невозможность их получения из корней растений, когда уже были известны составы питательных сред для культивирования почвенных грибов. Иногда выделялись грибы из семейства Fusarium или других сапрофитных грибов, которые считали эндофитами растений. К сожалению, эту ошибку повторили и некоторые современные исследователи (Хрущева, 1956; Дорохова, 1970). Ш. Тернец (Tcrnetz, 1907), применив оригинальную питательную среду с добавлением вытяжек из торфа и листьев рододендрона, выделила эндофиты из корней клюквы, брусники, подбела и вереска. Приведенные ею фотографии препаратов (рис. 9) убеждают, что под микроскопом она наблюдала прорастание характерных многоклеточных симбионтных грибов. Однако из–за ненадежной стерилизации поверхности корней 1%-иой соляной кислотой в качестве чистой культуры выделился быстрорастущий фикомицетный гриб Phoma, который Ш. Тернец и в дальнейшем М. Рейнер (Rayner, 1925) считали настоящим эндофитом, так как он способствовал заражению молодых сеянцев эндофитами и заметно усиливал рост их корней. Данные, полученные этими авторами, длительно обсуждались в научной литературе и были признаны ошибочными, но их питательные среды еще долго использовались исследователями. Рис. 9. Прорастание эндофитов из клеток эпидермиса корней различных растений (по Ternetz, 1907)
Рис. 9. Прорастание эндофитов из клеток эпидермиса корней различных растений (по Ternetz, 1907)
X. Вольф (Wolff, 1926) выделил многоклеточный мицелий грибов из корней Neottia nidus avis и некоторых других зеленых орхидей на средах с глюкозой, пептоном, вытяжками из гумуса и листьев граба. Этот исследователь впервые заметил очень важную особенность эндофитов: их лучший рост в жидких питательных средах, чем на твердом агаре, что подтверждает их адаптацию к плазме растительной клетки. У Вольфа мицелий эндофитов обычно рос глубинно и только изредка возникал воздушный мицелий со спорангиями на поверхности питательной среды, что, но нашему убеждению, указывало на загрязнение чистых культур эндофитов, которые никогда не образуют воздушного мицелия. Примененный автором метод стерилизации корней был оригинален, но ненадежен. Для освобождения от поверхностных плесневых грибов автор помещал корни в питальный раствор Кнопа и после прорастания и удаления наружных грибов промывал корни спиртом. Процедура повторялась 3 раза, что не всегда избавляло препараты от загрязнения другими грибными культурами. До сих пор выделение чистых культур эндофитов удавалось немногим исследователям, которые сами не могли установить основную причину успеха. Так, Р. Фрейслсбен (Freisleben, 1933, 1936) пытался выделить чистые культуры эндофитов из 42 растений, но ему удалось получить их только в одном случае из сильно микотрофного растения черники (Myrlillus). У этого эндофита не было спороносящих органов размножения, и он состоял из многоклеточного мицелия. При заражении эндофитом семян различных растений у них повышалась всхожесть, усиливались рост растений и развитие микоризы. Е. Поммеру (Pommer, 1959) удалось выделить многоклеточный эндофит из клубеньков ольхи (Alnus glutinosa) на обычной питательной среде, обогащенной соком из поверхностно стерильного клубенька этого растения после освобождения его от кожицы. До Поммера из клубеньков ольхи некоторые исследователи выделяли только актиномицеты, которые являются необязательными их компонентами. Автор подчеркнул медленный рост эндофитов и гранулированное строение их плазмы, а также образование везикул. При заражении стерильно выращенных проростков ольхи чистой культурой эндофитов на их корнях через 4-6 недель образовались клубеньки, тогда как у контрольных растений они не возникали. Это, по мнению автора, доказывало, что появление клубеньков у небобовых растений определяется грибами, а не актииомицетами. Однако Поммеру не удалось на основании своего метода выделить эндофиты из клубеньков других небобовых растений. А. Келли (1952) считал, что в природе не существует специальных микотрофных грибов, а имеется только «микоризное состояние» любых почвенных грибов, обладающих способностью интенсивно внедряться в ткани растений. Этим недоказанным утверждением А. Келли оказал плохую услугу науке о симбиотрофном существовании растений, поскольку многие исследователи восприняли данное ошибочное положение как аксиому. Отрицание специфичности и особой ферментативной направленности у различных микроскопических грибов противоречит успехам, достигнутым технической микробиологией в синтезе определенных органических веществ или антибиотиков. Некоторые ботаники считают возможным перерождение симбионтных грибов в паразитарных и наоборот. Однако это утверждение явно ошибочно, так как такое перерождение должно сопровождаться перестройкой их ферментативного аппарата в процессе выполнения противоположных по своему характеру действий. Также нельзя согласиться с указаниями Б. Моссе (Mosse, 1969, 1973), что симбионтными грибами являются фикомицетные эндогоновые грибы, разлагающие лесную подстилку. Если бы эти грибы действительно заразили растение, то они произвели бы в нем такую же разрушительную работу, как в подстилке. Б. Моссе в противоположность своим предшественникам Ш. Тернец (Ternetz, 1907) и М. Рейнер (Rayner, 1929) придерживалась теории заражения корней растений эндофитами в почве, так как, по ее представлениям, генеративные органы растений не содержат эндофитов, что было ошибочно подтверждено и Л. В. Крюгер (1969). Для заражения Б. Моссе предпочла использовать сапрофитный фикомицетный гриб из семейства Endogonaceae. Заражение стерильных семян различных растении спорокарпиями этого гриба приводило иногда к желаемым результатам, и в корнях опытных растений образовывалась, по ее мнению, «везикулярно–арбускулярная фикомицетная микориза». Б. Моссе (Mosse, 1969) усиливала заражаемость эндогоновыми грибами, включая ризосферную бактерию из рода Pseudomonas, после чего получила более убедительные доказательства значения поверхностного заражения стерильных семян для образования эндотрофной микоризы фикомицетного типа. Ни Б. Моссе, ни ее последователи в нашей стране Л. В. Крюгер и И. Л. Селиванов (1976), включая в процесс заражения новый фактор — ризосферные бактерии, не определили отдельно степень участия данного фактора в образовании указанных микориз. Между тем это избавило бы исследователей от необходимости проводить кропотливую работу по разработке метода получения эндогоновых грибов из лесной подстилки, так как желаемая микориза образовалась бы при действии одной ризосферной бактерии, вместе с чем отпала бы необходимость считать ее фикомицетной. Вряд ли теоретически можно допустить, что сапрофитные грибы, обладающие набором ферментов для разрушения мертвых растительных остатков лесной подстилки, способны осуществлять в корнях растений многочисленные синтетические процессы, поскольку такая универсальность несвойственна микроорганизмам. Для окончания затянувшейся на несколько десятилетий дискуссии о природе и происхождении грибных симбионтов растений назрела необходимость в разработке метода выделения чистых культур эндофитов с целью установления их морфологии, физиологии, происхождения и сущности взаимосвязи с растениями. Неудачные опыты многих исследователей, предпринимавших попытки решить этот вопрос, заставили нас искать новые пути получения таких культур. Метод выделения эндофитов. Наша работа по выделению чистых культур эндофитов из корней растений была начата с выяснения надежной стерилизации поверхности корней, не нарушающей жизнедеятельности находящихся внутри них живых организмов. Было установлено, что применение 2-3‑минутной обработки тонких корешков сулемой в концентрации 1 : 1000 и последующая отмывка сулемы спиртом и многократно стерильной водой обеспечивают стерильность поверхности корня и не нарушают жизнеспособности эндофитов. Это же достигается при короткой обработке 30%‑ной перекисью водорода. Состав питательной среды. После долгих поисков мы остановились на следующей буферной питательной среде (г на 1 л воды): глюкоза — 8; К2НРО4 — 0,3; КН2Р04— 0,9; MgS04 — 0,2; K2SО4 — 0,1; FeS04 и MnS04 — следы, аспарагин — 0,01. Нам удалось также установить основную особенность симбионтных грибов растений — их потребность в ростовых веществах в короткий период прорастания из растительной ткани в питательную среду и, как мы увидим дальше, в процессе прорастания из семени в корень, В обоих указанных случаях без наличия гормонального воздействия извне эти грибы не прорастают (Гельцер, 1973а, б). В редких случаях при сильной микотрофности растений и, очевидно, достаточной концентрации гормональных веществ в тканях их корней, а также при небольшом разведении питательной среды эндофиты прорастают без добавления ростовых веществ. Так были получены чистые культуры эндофитов из черники (Freisleben, 1936), корней зеленых орхидей (Wolff, 1926) и из ирисов в наших опытах. В качестве ростовых веществ могут быть использованы спиртовые вытяжки из различных гименомицетов и фитобактериомицета, который изготовляется из актиномицета (Actinomyces lavendulae), ризосферных бактерий или наших препаратов, изготовленных из эндофитов и получивших авторские свидетельства: Симбионт I (Гельцер, 1973а) и Симбионтм2 (Гельцер, Игнатьев, 1982). Во всех случаях количество добавляемых в питательную среду ростовых веществ должно быть минимальным при экспериментально установленной концентрации препарата. За исключением указанной особенности эндофитов, нами не выявлено каких–то их особых требований к составу питательных сред. В качестве энергетических веществ эндофиты хорошо усваивают глюкозу, сахарозу и крахмал, но неспособны использовать органические кислоты (кроме янтарной), целлюлозу и лигнин. Заканчивается подготовка к выделению чистых культур эндофитов внесением в каждую колбочку гормональных веществ (по 2-3 капли препарата Симбионтм1 или других активных веществ). После прорастания мицелия эндофитов, которое происходит через 5-12 суток, для освобождения от корней мицелий пересевают в колбы с указанной питательной средой без добавления гормональных веществ, которые грибы синтезируют сами. Так как эндофиты обладают азотфиксацией, то применение минимальных доз азота сохраняется и для их дальнейших пересевов, чтобы при многолетнем культивировании этих грибов в лаборатории не нарушать их способности использовать атмосферный азот, о чем мы подробно расскажем в главе 3. Чистые культуры эндофитов. Разработанная методика выделения эндофитов обеспечивает получение их чистых культур из любых растений, т, е. из сильно и слабо микотрофных, а также растений, считающихся не микотрофными из–за того, что визуально в их корнях под микроскопом эндофиты не были обнаружены. Мы выделили чистые культуры эндофитов из корней следующих водных растений: рдестов (Potamogeton natans L.), тростника (Phragmites communis Trin.), белокрыльника (Calla palustris L.) и рогозы (Tipha latifolia L.). Замедленный рост и слабое наращивание мицелия заметно отличают чистые культуры водных от сильно микотрофных сухопутных растений, описание которых приводится ниже. Мать–и–мачехa (Tussilago farfara L.). Эндофиты из корней этого растения ежегодно выделялись в нашей лаборатории па протяжении 9 лет и постоянно получались одинаковые результаты. Четко септированный многоклеточный мицелий, заполненный зернистой плазмой, никогда не спороносит. При старении в мицелии образуются круглые везикулярные вздутия (рис. 10), хорошо окрашиваемые анилин–бляу. Мицелий гриба в жидких средах растет погружённо, образуя студенистую массу вначале темно–зеленого цвета, а в дальнейшем — черного. Пигмент не переходит в раствор. Эндофиты, выделенные из молодых завязей этого растения, окрашены в золотисто–желтый цвет, как и его цветок.
 Рис. 10. Везикулы о старом мицелии чистой культуры эндофитов из корней мать–и–мачехи
Рис. 10. Везикулы о старом мицелии чистой культуры эндофитов из корней мать–и–мачехи
Вишня (Primus cerasus L.). Эндофит из корней вишни ежегодно выделялся в течение 8 лет. Сильно септированный мицелий с гранулированной плазмой золотистого цвета выделяет в раствор пигмент густо–вишневого цвета. Много шарообразных везикул, образующих цепочки. Спороносящие органы не обнаружены. При нагревании до 60° мицелий теряет жизнеспособность. В жидких средах растет погруженно. Облепиха (Hippophae rharnnoides L.). Чистая культура эндофита 2 года выделялась из клубеньков и корней. Многоклеточный четко септированный мицелий. иногда с веретенообразными клетками, заполненными гранулированной плазмой. Мицелий преимущественно выделяет коричнево–бурый пигмент. Клевер (Trifolium pratense L.). Отличительной особенностью эндофитов этого растения, ежегодно выделявшихся нами в течение 7 лет, является хрупкость молодого мицелия, который легко обламывается, при этом кусочки гиф накапливаются на дне колбы. Извлеченные стерильным капилляром, такие отрезки гиф в новой питательной среде образуют такой же мицелий с отпадающими отростками. Многоклеточный мицелий клевера синтезирует красный пигмент. Плодоносящие органы не наблюдались. Пшеница (Triticum vulgare Vill.). Ежегодно выделялись в течение 5 лет эндофиты из корней разных пшениц. Сильно септированный мицелий образует рыхлую массу, обычно окрашенную в красный цвет. При старении на концах гиф образуются везикулярные вздутия. Рост гриба в жидкой среде погруженный. Плодоносящие органы не наблюдались. Ирисы (Iris germanica L.). Эндофиты из корней растения ежегодно выделяли 8 -лет. Многоклеточный мицелий в начале роста с удлиненными, а в дальнейшем — с почти круглыми клетками, заполненными гранулированной плазмой, при старении образует темно–зеленую слизистую массу. Иногда мицелии был окрашен в розовый цвет, что, очевидно, зависит от сорта растения. Плодовые органы не наблюдались. При нагревании мицелия до 60° он терял свою жизнеспособность. Любка (Platanthera bifolia Rchb.). Топкие, слабо септированные гифы при старении образуют четко септированный мицелий (рис. 11). Его отличительной особенностью является белый цвет. За 7 лет выделении эндофитов только один раз мицелий был окрашен в черный цвет. При погруженном росте плодоносящие органы не наблюдались.
 Рис. 11. Мицелии чистой культуры эндофита из корней любки
Рис. 11. Мицелии чистой культуры эндофита из корней любки
Вереск (Calluna vulgaris Salisb.). Эндофит этого растения выделялся б лет. Четко септированный мицелий, заполненный гранулированной плазмой, растет погружен но. При старении гифы темнеют и приобретают, как и у всех сильно микотрофных растении, темно–зеленый или черный цвет. Эпдофит, выделенный из цветущей ветки этого растения, синтезировал фиолетовый пигмент. В остальном все так же, как у вышеописанных культур. Можно было бы представить более 100 подобных описаний чистых культур эндофитов, в которых варьировала бы окраска пигментов и их способность переходить или не переходить в раствор. Эндофиты синтезируют пигменты всех цветов. Так, гриб, выделенный из герани, всегда окрашивался в желтый цвет, но однажды оказался фиолетовым. Выяснилось, что эта герань цвела фиолетовыми цветами. Общими морфологическими показателями для всех выделенных чистых культур эндофитов были следующие: 1) отсутствие спороносящих органов размножения; 2) многоклеточный мицелий, принимающий по мере старения четко септированную форму с везикулярными расширениями; 3) гранулированная плазма, рассыпающаяся при разрыве оболочки клетки; 4) погруженный рост в жидкой среде при отсутствии поверхностного мицелия; 5) способность синтезировать пигменты разных цветов. Отличие в развитии мицелия у водных растений заключалось в крайней медлительности их роста в первый год выделения в питательных средах. Только после многих пересевов на протяжении года в богатых углеводами средах они уже ничем не отличались от симбионтных грибов сухопутных растений. Создавалось впечатление, что в корнях водных растений эндофиты голодали и понадобился год частых пересевов в богатых углеводами питательных средах для того, чтобы придать им характерную форму, обычную для эндофитов сухопутных растений. Разработанная методика получения чистых культур настоящих эндофитов открывает широкие возможности для развития науки о симбиотрофном существовании растительного мира. Ее применение способствует устранению многих спорных вопросов, обременяющих изучение грибного симбиоза растений. Во введении к разделу об эндотрофной микоризе Дж. Харли (1963, с. 134) сообщает, что «наиболее ярким признаком, позволяющим разделить все типы эндотрофной микоризы на две большие группы является членистость (септированность) их гиф. Гифы могут быть септированными, как у аскомицетов, несовершенных грибов и базидиомицетов, или, наоборот, несептированными, например, у фикомицетов». Это утверждение как бы обобщает выводы различных авторов по данному вопросу, поскольку одни твердо убеждены, что эндофиты принадлежат к фикомицетам, а другие — к несовершенным грибам гифомицетам. Никто из авторов не установил, что определенным семействам растений соответствует один из двух указанных видов грибов. Напротив, дли семейства злаковых растении одни исследователи отмечали наличие септированного мицелия, а другие — несептированного. Очевидно, это расхождение определялось тем, что авторы выделяли из корней пшениц разные грибы. Мы всегда наблюдали в корнях всех растений у хорошо развитого мицелия только многоклеточное строение эндофитов, что подтвердилось при выделении их чистых культур. При микроскопическом изучении выявление перегородок у мицелия эндофитов, растущих в тканях растений, представляет известные трудности даже после мацерации препаратов в щелочи. В молодых гифах перегородки плохо просматриваются в препаратах. В старых гифах, образующих клубки и петли, они видны отчетливо. Дж. Харли (1963) считал, что микориза у злаковых и бобовых растений относится к фикомицетному типу. Выделенные нами дополнительно для проверки его утверждения чистые культуры эндофитов из люцерны, гороха, вики, акации и бобов всегда имели многоклеточный мицелий, как и эндофиты из ржи, овса, тимофеевки, ежи, пырея и кукурузы. Многие исследователи, применив электронный микроскоп, подтвердили многоклеточную природу эндофитов. Из всего изложенного следует, что обычно принятое и уже ставшее трафаретным положение о наличии у растений «везикулярно–арбускулярной фикомицетной микоризы» не соответствует действительности и не может быть признано научно доказанным. Многоклеточное строение гиф эндофитов не дает основания причислить их к роду Rhizoctonia, от которых они отличаются как по морфологическим, так и по физиологическим свойствам. Сравнивая мицелий эндофитов с Rhizoctonia solani u R. ailcrholdii, выращенных в одинаковых по составу питательных средах, можно установить, что последние не образуют везикулярных вздутий, не имеют гранулированной плазмы, как эндофиты, и не синтезируют пигменты. Кроме того, обе культуры Rhizoctonia не обладают азотфиксирующей способностью и не синтезируют гормональных веществ. Все указанные различия заставляют отказаться от причисления эндофитов к указанному роду. Многовековая адаптация эндофитов к растительной клетке, постоянство морфологических признаков при выполнении ими определенных функций, в том числе и защитного характера (см. главу 5), исключают участие в этом сложном взаимодействии случайного сообщника при заражении корней в почве естественным путем или исследователем в эксперименте. Отсутствие спороносящих органов заставляет отнести эндофиты к классу несовершенных грибов (Fungi imperfecli), где они могут быть выделены в особый порядок симбиофитов — Symbiophytum, отличительной особенностью которых могут являться их морфология и физиологическая способность к синтезу определенных соединений. Метод получения чистых культур эндофитов из корней растений дал возможность не только составить правильное представление об их морфологии, по и обнаружить наличие эндофитов в корнях тех немногих растений, у которых из–за слабого развития симбионта он не мог быть визуально обнаружен под микроскопом. Нам предстояло использовать этот метод для решения еще одного вопроса — вопроса о наличии эндофитов в надземных частях растений, что необходимо для доказательства наследственной передачи симбионтных грибов от семени к семени. В руководимой нами лаборатории О. И. Громыко установила, что чистые культуры эндофитов хорошо выдерживают лиофильное высушивание и длительно сохраняют свою жизнеспособность в сухом состоянии. При прорастании в питательных средах с ростовым веществом они синтезируют пигменты тех же цветов, которые были им свойственны до сушки. Как известно, мицелий плесневых грибов не выдерживает лиофилизации. Наличие у эндофитов в корнях растений гиф с такими характерными образованиями, как везикулы, арбускулы и спорангиолы, в которых накапливаются белковые продукты их синтеза, хорошо окрашиваемые аиалин–бляу в фиолетовый цвет, а также расположение гиф вдоль коровой паренхимы не оставляют сомнений и их принадлежности к симбионтным грибам. В мацерированных щелочью листьях и хвое различных растений обнаруживаются слаборазвитые гифы грибов, но их признаки еще не определяют принадлежности к эндофитам. В книге, посвященной биологии микориз, Дж. Харли (1963), приводя мнение многих авторов о наличии эндофитов в надземных частях растений, подчеркивал его недостоверность, так как все авторы отмечают «ослабленное» состояние гиф в листьях. Только применяя метод выделения чистых культур эндофитов, можно решить вопрос о присутствии симбионтных грибов в надземных частях растений. Листья и хвоя растений стерилизовались сулемой, спиртом и промывались стерильной водой, после чего их помещали в стерильные чашки Петри с небольшим количеством питательного раствора и 1-2 каплями ростового препарата Симбионт I. Одновременно стерильность листьев проверяли на твердых питательных средах. Спустя 10-15 дней эндофиты из листьев прорастали, что отчетливо просматривалось в микроскопических препаратах, а еще через несколько дней стало возможным выделение их чистых культур. Последние были получены из листьев таких сильно микотрофных растений, как вереск, мать–и–мачеха, брусника, черника, дуб, ольха, липа и др., а также из слабо микотрофных растений картофеля и пшеницы. В первый период роста мицелий из листьев заметно отличался от мицелия из корней простотой своего строения, малой разветвленностью гиф и слабо очерченными перегородками. Только при длительном культивировании в лабораторных питательных средах с пересевами через каждые 2-3 месяца гифы становятся более разветвленными и широкими, с четко очерченными перегородками и гранулированной плазмой, с везикулярными вздутиями, характерными для эндофитов из корней. Скорость изменения строения гифов определяется степенью микотрофности растений. Для выделения эндофитов из листьев дуба, липы, ольхи, вереска, мать–и–мачехи и других сильно микотрофных растений достаточно было несколько месяцев, тогда как эндофиты из листьев слабо микотрофных растений нуждались в культивировании в течение 1-2 лет (рис. 12). Становится очевидным, что «ослабленное» состояние и «упрощенное» строение эндофитов определяются их неспособностью использовать для питания продукты фотосинтеза листа или отсутствием последних в листе. Возможно, упрощенность функций эндофитов в надземных частях растений связана с отсутствием у них везикул, арбускул и гранулированной плазмы, а основное их назначение сводится к наследственной передаче симбионтных грибов в пыльцу и семена.
 Рис. 12. Строение эндофитов» выделенных из листьев стерильно выращенной ольхи (1); та же культура через 1 (2) в 2 года (3)
Рис. 12. Строение эндофитов» выделенных из листьев стерильно выращенной ольхи (1); та же культура через 1 (2) в 2 года (3)
Достоверность результатов выделения чистых культур эндофитов из листьев была проверена в нескольких стерильных опытах, в которых применялись широкогорлые колбы, заполненные на одну треть силикагелем с питательной средой и закрытые ватной пробкой (в силикагеле лучше, чем в песчаной среде, развивается мелкая корневая система растений, благоприятная для развития эндофитов (Гельцер, 1966). Подопытными растениями были просо, ольха и облепиха, стерильность семян которых проверялась перед посевом на твердых питательных средах. При хорошем освещении растения выращивались 45—60 дней. Контрольные семена намачивались в стерильной воде, а в опытных вариантах — в растворе ростового препарата фитобактериомицина (ФБМ) разных концентраций. После вскрытия стерильных опытов в контрольных вариантах эндофиты не были обнаружены ни в корнях, ни в надземных частях растений, а в опытных они были выделены и из листьев, и из корней, при этом гифы эндофитов имели весьма четкие везикулярные вздутия; на корнях ольхи и облепихи образовались присущие им клубеньки (рис. 13). Очевидно, нет необходимости применять к стерильным семенам заражение какими–либо грибами. Подробнее на рассмотрении этого вопроса мы остановимся в дальнейшем.
 Рис. 13. Клубеньки на корняхоблепихи, выращенной из семян, обработанных ФБМ
Рис. 13. Клубеньки на корняхоблепихи, выращенной из семян, обработанных ФБМ
Необходимо отметить еще одну особенность эндофитов из листьев. Они при длительном культивировании в питательных средах начинают синтезировать цветные пигменты, что характерно для чистых культур эндофитов из корней (Гельцер, 1975). Так, эндофиты из листьев цветущего вереска вскоре начали синтезировать фиолетовый пигмент, из листьев липы (через год после их выделения) — желтый пигмент, характерный для ее цветов. Несколько культур эндофитов было выделено из завязей липы, яблони, вишни и золотистой смородины. В этом случае для эксперимента нужно брать молодые, недавно образовавшиеся завязи. В отличие от мицелия из листьев растений мицелий из завязей вскоре после своего разрастания синтезирует характерный для данного растения пигмент и по своей морфологии больше соответствует мицелию из корней. Так, колонии эндофитов из завязей липы и яблони были окрашены и ярко–желтый цвет. Наличие симбионтных грибов в молодых завязях определило необходимость изучения самого сложного органа растения — цветочной пыльцы, которую нельзя подвергнуть поверхностной стерилизации, так как при всех применяемых для этого приемах она теряет способность к прорастанию. Легкая стерилизация возможна только для пыльцевого мешка с последующими стерильными приемами сбора пыльцы. Способность эндофитов к анабиозу подтверждает возможность их существования в пыльцевой клетке без стадии визуально наблюдаемого мицелия. Основным условием, определяющим прорастание эндофитов из растительных клеток, является наличие в питательных средах или окружающих клетках гормональных веществ. При попадании пыльцы на рыльце пестика она получает гормональное воздействие, которое вызывает ее прорастание. Пыльцевые клетки проращивались многими генетиками, но применение ими несовершенных питательных сред, состоящих из сахара и бора, но без ростовых веществ, всегда обеспечивало развитие только первой стадии их прорастания образование пыльцевой трубки и выход плазмы, содержащей спермин. Вторая стадия — прорастание симбионтных грибов в природных условиях — происходит только при попадании пыльцы на рыльце пестика, который обладает гормональным воздействием. Для выделения эндофитов из пыльцы в лабораторных опытах мы применяли указанную выше питательную агаровую среду. После застывания этой среды в чашках Петри ее поверхность обрабатывал и янтарной кислотой для предохранения от бактериального заражения. Пыльцевые клетки наносили в нескольких местах и смачивали их гормональным препаратом Симбионт 1 и разбавлении 0,0001. В таких условиях эндофиты пыльцы прорастали. С. Г. Навашин (1951) установил, что прорастание пыльцы начинается с роста пыльцевой трубки и выделения из нее плазмы спермия во внешнюю среду. В наших опытах этот процесс всегда предшествовал развитию грибного мицелия. В тех случаях, когда пыльцевая трубка не прорастала или содержимое пыльцы не переходило наружу, мицелий гриба не развивался. При наличии водной пленки на поверхности агара в чашках Петри выделившееся из пыльцы плазменное содержимое переносится током жидкости на некоторое расстояние от клетки, создавая впечатление независимого от нее процесса развития грибного мицелия. При подсушке поверхности агара эндофиты прорастают непосредственно около выделившейся плазмы. На рис.14 и 15 видно развитие эндофитов у пыльцы лилии и крокусов.
 Рис. 14. Прорастание пыльцы лилия
Рис. 14. Прорастание пыльцы лилия
 Рис. 15. Прорастание пыльны крокуса
Рис. 15. Прорастание пыльны крокуса
Наблюдаемая последовательность в фазах развития пыльцы исключает возможность объяснения образования мицелия в результате воздушного загрязнения, не говоря уже о том, что специалист, изучающий чистые культуры эндофитов, не может принять за эндофиты плесневые спороносящие грибы. Через 1-2 дня после прорастания пыльцевой клетки образуется характерная по своему габитусу многоклеточная грибная колония эндофита. Вначале молодые гифы состоят из удлиненных клеток, заполненных зернистой плазмой с четко очерченными перегородками. При прорастании пыльцы ярко окрашенных цветков, таких как у настурции, георгина или красной лилии, мицелии эндофитов приобретает оранжевый оттенок, но уже на 3-4‑й день он становится темно–зеленым. К этому времени клетки мицелия принимают округлую септированную форму и гифы распадаются на отдельные сегменты. Такую способность к распаду гиф на отдельные клетки, а также быстрый переход удлиненных клеток в бусовидные, мы не наблюдали у других эндофитов, выделенных из других частей растений. На рис.16, 17 видны септированные гифы из пыльцы огурцов и томатов.
 Рис. 16. Септированные гифы из пыльцы огурцов
Рис. 16. Септированные гифы из пыльцы огурцов
 Рис. 17. Септиронанные гифы из пыльцы томатов
Рис. 17. Септиронанные гифы из пыльцы томатов
Участие симбионтных грибов в процессе оплодотворения растений может быть изучено под микроскопом. Нанесению пыльцы на рыльце и окраске их анилин–бляу должна предшествовать предварительная мацерация препарата в щелочи, что дает возможность отчетливо различать белок грибного происхождения по фиолетовой окраске и белок растительных клеток, окрашенных в голубой цвет. Какие наблюдения цитологов подтверждают установленный нами факт наличия эндофитов в пыльцевой клетке? При установлении двойного процесса оплодотворения яйца и вторичных клеток С. Г. Навашин (1951) отмечал проникновение спермия не только в зародышевый мешок, но и в окружающие его клетки нуцеллюса. Это явление было изучено и подтверждено Я. Е. Элленгорном и В. В. Светозаровой (1950), которые обнаружили, что полиспермия сопровождается подкисленном среды. Развитие легко распадающегося грибного мицелия при прорастании пыльны может объяснить явление полиспермии и также вызванное ростом гриба подкисление среды. В. Е. Козлов (1951), описывая цитологический процесс полиспермии у гороха, сообщает, что спермин при соприкосновении с яйцеклеткой разрыхляется и превращается в скопление множества гранул, в конце концов принимая вид длинных неправильных бусовидных нитей. В статье «Новый пример халацогамии» С. Г. Навашин (1951, С, 174) пишет: «Пыльцевые трубки грецкого ореха обладают способностью посылать боковые выросты, появляющиеся почти в любой точке пути пыльцевой трубки», В его груде представлены рисунки сильноветвящихся пыльцевых трубок в халаце. Сейчас, когда установлена способность пыльцевой клетки прорастать мицелием эндофитов, высказывание С. Г. Навашина служит подтверждением указанного процесса. Как обычно, при изучении природных явлений новые наблюдения порождают новые исследования. Вот и в данном случае предстоит изучить, в чем заключается участие эндофитов в процессе оплодотворения? Служат ли их гифы транспортирующим средством для передвижения спермия в зародышевый мешок или они обеспечивают условия, благопрнятные для слияния двух разнополых клеток, а возможно, они гарантируют наследственную передачу грибных симбионтов растений однородного происхождения? Настоящий опыт показывает, как может гриб попасть в семена. Нельзя не вспомнить раннюю работу Дж. Пекло (Peklo, 1913), который приложил много усилий, чтобы доказать наличие в семенах гиф грибов. Ему удалось слетать несколько снимков гиф в недозрелом зерне пшеницы. Он считал, что его богатый азотом алейроновый слой состоит из мицелия эндофитов, находящихся в состоянии анабиоза. Мы разработали следующие приемы для получения чистых культур эндофитов из семян растений. После стерилизации поверхности семян их обрабатывали гормональным препаратом и помещали в стерильные чашки Петри для проращивания до образования первых корешков, после чего семена слегка растирали в стерильной агатовой ступке и переносили в питательную среду. Через несколько дней эндофиты начинают прорастать и скорость этого процесса зависит от степени микотрофности изучаемого семени. В природных условиях гормональное воздействие на прорастающее семя оказывают эпифитные н ризосферные бактерии, которые обильно развиваются на прорастающем семени. Наиболее подробно эти бактерии были изучены Ю. М. Возняковской (1964), которая установила их способность синтезировать стимулирующие вещества, проникающие в ткани растении. Латвийский микробиолог Л. Л. Клинцаре (1970) создал из эпифитных бактерий препарат, стимулирующий рост растений, и получил на него в 1970 г. авторское свидетельство. При постановке стерильных опытов стерилизация семян лишает их гормонального воздействия указанных бактерий, в результате чего эндофиты из семян не переходят в корень. Таким образом, метод выделения чистых культур симбионтных грибов способствовал выяснению сложного вопроса о распространенности эндофитов в надземной части растений. Его использование позволило установить наличие таких грибов во всех органах, включая пыльцу и семена. По вызывает сомнений, что синтетическая деятельность эндофитов сосредоточена в корнях, даже в тех случаях, когда нельзя визуально установить их наличие. Наши четырехлетние исследования по выделению эндофитов из листьев, хвои, завязей, пыльцы и семян растений дают возможность установить, что источником грибной инфекции для корней и надземных органов растений служит прорастающее семя. Такая передача от семени к семени обеспечивает наследственную природу грибного симбиоза, а в ослабленном виде — и при вегетативном размножении от клубня к клубню, от луковицы к луковице и от черенка к саженцу. Для получения микотрофного растения в стерильных условиях нужно обработать семена гормональным препаратом растительного или микробного происхождения. В природных условиях процесс образования эндотрофной микоризы происходит при активном участии симбионтных бактерий, когда в процессе прорастания семени значительно увеличивается количество эпифитных бактерий и их переход на поверхность молодых корней, где эти микроорганизмы рассматривают в качестве ризосферных бактерий. Продуцируемые ими биологически активные вещества активизируют выход симбионтных грибов, находящихся в алейроновом слое семени, и активное их прорастание в корни. При изучении нами первых корешков длиной 0,5 см в прорастающем семени можно было установить, что их поверхность покрыта слоем ризосферных бактерий. Стерилизация семян исключает возможность развития на них бактерий и тем самым продуцирование гормональных веществ, необходимых для прорастания эндофитов. Нанесение на стерильное семя гормональных препаратов обеспечивает развитие в корнях везикулярно–арбускулярной микоризы. Присвоение последней названия «фикомицетной» нужно еще суметь доказать тем исследователям, которые не хотят признать многоклеточную природу мицелия эндофитов (Гельцер, Кузнецова, 1977). Вряд ли нужно увеличивать количество литературных примеров, чтобы прийти к выводу, что все значение производимых многочисленными авторами «заражений» стерильных семян различными грибами определятся добавлением некоторого количества гормональных веществ микробного происхождения, необходимых для активизации прорастания свойственных данному растению эндофитов из семян, клубней и луковиц, Вспомним, что выделение чистых культур эндофитов из любых частей растений стало возможным только после того, как была доказана необходимость наличия в питательных средах гормональных веществ. Как мы увидим дальше, эту зависимость симбионтных грибов от гормональных воздействий можно использовать для повышения их активности в корнях сельскохозяйственных культур. Занимаясь изучением проблем происхождения эндофитов, мы не применяли «заражений» различными грибами, так как всегда считали эндофиты облигатными симбионтами, имеющими большое генетическое значение в сохранении вида растений. Нас интересовал вопрос о специфичности действия различных ростовых веществ на пробуждение эндофитов при прорастании семени, а также характер их действия: стимулируют ли они активность гриба или изменяют растение, создавая более благоприятные условия для развития грибов в корнях. Хотя наши опыты не сопровождались химическим изучением состава примененных ростовых веществ, они в качестве первой разведки могут представлять интерес, в особенности для решения второго вопроса. В стерильных краткосрочных опытах по выяснению влияния различных стимулирующих веществ на развитие эндофитов из семени использовались следующие питательные среды: песок, почвенно–песчаная смесь, почвенные вытяжки с агаром при добавлении питательной среды Гельригеля. Этими средами заполнялись стаканы емкостью 200 мл, которые стерилизовались в автоклаве в зависимости от состава среды от 0,5 до 1 часа при 1 ат (0,1 МПа). Так как никто не указывал на возможное заражение эндофитами из воздуха, то в дальнейшем растения находились в обычных условиях и только иногда поверхность стаканов 'прикрывали парафинированным песком. Семена стерилизовались сулемой или перекисью водорода, но так как в контрольных вариантах эндофиты не развивались, мы в дальнейшем ограничивались промывкой их спиртом и стерильной водой. В качестве гормональных препаратов были взяты спиртовые вытяжки из различных гименомицетов, таких, как белые грибы (Boletus edulis), мухоморы (В. scaber), скрипица (Lactarius vellereus), различные сыроежки (Russula), фитобактериомицин (ФБМ), изготовляемый из актиномицета (Actinomyces lavendulae), гиббереллин, а впоследствии и наш препарат Симбионт 1, продуцентом которого был эндофит, выделенный из корней женьшеня. Семена контрольных растений замачивались в стерильной воде, а опытных — с добавлением в нее 2-3 капель указанных выше ростовых веществ. После 2-4 недель роста растений в стаканах при хорошей освещенности, их корни отмывались от среды, мацерировались в щелочи и продольные препараты изучались под микроскопом при окраске анилин–бляу. В отличие от поперечных срезов корней, обычно применяемых при изучении микотрофностн, продольные препараты дают возможность просмотреть содержание эндофитов в больших отрезках корня. В зависимости от количества полей зрения, в которых наблюдаются гифы эндофитов, арбускулы, спорангиолы и везикулы, а главное по форме и размерам последних дается оценка микотрофности растений по 5-балльной системе. Хорошим объектом для изучения влияния ростовых веществ на однолетних растениях были сильно микотрофные просо сорта Саратовское 853 и пшеница сорта Сарубра. После намачивания контрольных семян 30 мин в воде, а опытных — с добавлением 2 капель спиртовых вытяжек из указанных гименомицетов и препаратов ФБМ, гиббереллина, их высушивали и высеивали. Через месяц роста растений на стерильных агаризованных почвенных вытяжках корни в опытных вариантах, кроме варианта с гиббереллином, значительно превосходили по размерам контрольные. Если это основное и самое характерное действие ростовых веществ не проявляется при хороших условиях роста растений, даже если отмечено небольшое улучшение развития эндофитов в корнях, то у изучаемого препарата явно отсутствует способность к гормональному воздействию. В контроле эндофиты не были визуально обнаружены под микроскопом, а в опытных вариантах у проса имелись характерные для него клубки септированных гиф и крупные круглые везикулы с оценкой в 3-4 балла. Подобные результаты получены и при изучении корней менее микотрофной культуры пшеницы. Вторая серия опытов, проведенная с пшеницей сорта Сарубра, отличалась тем, что в них семена не обрабатывали вытяжками гименомицетов и препаратов, а последние вносили в стерильную среду. Результаты предыдущих опытов повторились, и микотрофность корней была установлена во всех опытных вариантах, но целесообразность использования такого приема для нестерильных почв должна быть проверена, так как в связи с их возможной минерализацией активность препаратов может снижаться. Наши опыты с применением указанных гормональных воздействий для развития эндофитов в корнях в тех случаях, когда единственным источником их образования были поверхностно стерильные семена, подтвердили мнение исследователей о наследственной передаче грибного симбиоза в растениях. Окончательное признание «циклической наследственности» было связано с доказательством наличия эндофитов в надземных частях растений. Применение методов выделения чистых культур симбионтных грибов из листьев, хвои, завязей, пыльцы, семян и тканевых культур, выращенных из одной клетки в стерильных условиях вне организма, позволило установить присутствие эндофитов в надземных частях растений, чего нельзя было убедительно доказать с помощью визуального их изучения под микроскопом. Рассмотрение вопроса о наследственной передаче грибного симбионта растений мы хотим закончить результатами изучения эндофитов у вегетативно размножаемых культур (черенками, усами) и у живородящих растений. Что касается картофеля, размножаемого в основном клубнями, то о нем подробнее будет сказано в других главах, так как наиболее важные выводы о значении микотрофизма были получены при изучении именно этой культуры. Образующиеся миниатюрные зародыши на концах листьев живородящих растений Bryophyllum degramonlianum представляют собой интересный объект для изучения миграции симбионтных грибов в надземной части растений. Снятые с листьев материнского растения ростки имели 3-5 листочков и несколько тонких корешков. После промывания стерильной водой их помещали в закрытые ватными пробками стерильные, склянки с песком, смоченным питательным раствором с уменьшенным содержанием азота. Опыт включал контроль и 2 опытных варианта: с добавлением в среду 0,5 мл гиббереллина и с прибавкой 0,5 мл спиртовой вытяжки из гриба скрипицы. При обработке гиббереллином бриофиллум сильно, вытянулся, что характерно для действия этого препарата. Вытяжка из скрипицы способствовала лучшему развитию корней и листьев, чем в контроле. Через 40 дней при тщательном изучении корней у контрольных растений гифы грибов не были визуально обнаружены. В варианте с гиббереллином наблюдались большое количество типичных везикул и гифы эндофитов с оценкой в 2 балла. Наиболее сильная микотрофность корней была установлена у растений, обработанных метаболитами гименомицета. Здесь в большом количестве встречались многоклеточные гифы и скопления круглых везикул, ярко окрашенных анилин–бляу в фиолетовый цвет, с оценкой в 5 баллов. В данном опыте мы установили (передачу симбионтного гриба через стебель и листья материнского растения своему вегетативному потомству. При образовании корней у веток ивы и тополя, помещенных в воду, в которую добавлялись питательные соли, визуально наблюдаемые эндофиты появились в короткий срок только в тех вариантах, где в среду вносили несколько капель метаболитов из гриба мухомора или подберезовика. Такие же опыты были поставлены с семенами лука, укропа и клевера. Во всех случаях ростовые вещества из гименомицетов обеспечивали развитие эндофитов из семян растений, выращиваемых в стерильной среде, тогда как в контрольных вариантах эндофиты в корнях не развивались. Приведенные результаты опытов, количество которых можно было бы значительно увеличить, не позволяют сомневаться в наследственной передаче эндофитов через прорастающее семя или вегетативные органы растений при непременном наличии в среде гормональных веществ растительного или микробного происхождения. Неясным, однако, оставался вопрос о сущности действия ростовых веществ: оказывают ли они влияние непосредственно на грибной симбионт или, создавая тонкую корневую систему растения, способствуют тем самым развитию в ней симбионта? Для ответа на него нужно было установить влияние гормональных препаратов на развитие растений в различных стерильных средах. Обычно исследователей не удовлетворяют среды, в которых приходится ставить стерильные опыты. Дело в том, что для этой цели нельзя использовать почву, в которой в процессе стерилизации накапливаются токсические для роста растений вещества. Замена почвы водой с добавлением нужных питательных солей приводит к значительному изменению всего облика корневой системы, которая в водной культуре состоит из толстых слаборазветвленных стержневых корней при полном отсутствии корешков третьего порядка, т. е. тех, где хорошо себя чувствуют эндофиты (рис. 18). Несколько лучше развиваются корневые системы в песчаных средах, но и в них растения (потребляют питательные вещества из водного раствора, что не способствует образованию мельчайшей корневой системы, которая развивается в том случае, когда элементы питания находятся в поглощенном состоянии. Микробиологи часто применяют в качестве стерильной среды жидкое стекло или агаровые среды, которые представляют собой плохо аэрируемую плотную коллоидную массу, куда корни растений проникают с трудом.
 Рис. 18. Корни кукурузы, выращенной в различных средах: в водной культуре (1), песке (2), силнкагеле (3), в почве (4)
Рис. 18. Корни кукурузы, выращенной в различных средах: в водной культуре (1), песке (2), силнкагеле (3), в почве (4)
Плохие свойства указанных питательных сред заставляли исследователей применять для стерильных культур смешанные среды, в которых почва в 2-3 раза разбавлялась песком, что несколько улучшало физические свойства среды и уменьшало концентрацию токсических веществ почвы после ее стерилизации. В поисках наиболее пригодных для наших опытов стерильных сред был испытан заводской гранулированный силикагель марки ШСК (шихта силикагель крупнопористый). Хорошие физические условия среды определяются структурой силикагеля, а его высокая поглотительная способность имитирует поглощающий комплекс почвы. Стерилизация силикагеля не меняет его свойств. После длительной очистки силикагеля от поглощенного водорода и хлора в него добавлялись питательные вещества. Лучший рост растений наблюдался при небольшом слое силикагеля — 13-15 см. При более высоком его слое не обеспечивалась равномерная влажность и избыток воды скапливался на дне колбы. Небольшие растения удобно выращивать в широкогорлых конических колбах на 0,5 л. Состав питательной среды можно менять в зависимости от цели опыта. Создание небольшой прослойки силикагеля в верхней части вегетационного сосуда, заполненного 6 кг дерново–подзолистой неплодородной почвы, способствовало значительному развитию корневой системы растений и повышению ее микотрофности. В опыте, проведенном Н. Г. Коваль, в каждый сосуд вносилось по 400 г. смеси низового торфа с перегноем, по 2 г СаС03 и 1 г К3РО4. В сосудах опытного варианта создавались 2-сантиметровые прослойки силикагеля, в контроле они отсутствовали. Повторность 3-кратная. Как видно из табл.2, урожаи зерна яровой пшеницы сорта Краснозерная в опытном варианте были на 45% выше, чем в контроле.
Таблица 2 Урожай зерна пшеницы (г/сосуд) в опыте с прослойкой силикагеля

В корнях контрольных растений эндофиты были слабо развиты с оценкой в 1 балл, нередко наблюдались гифы и единично встречались небольшие везикулы. В опытном варианте микотрофность корней достигла небывалых для яровой пшеницы размеров. Она была оценена в 5 баллов. Многочисленные гифы гриба встречались на всей протяженности тонких корней, а количество крупных везикул достигало 20-40 шт. во многих полях зрения микроскопа. Хорошо просматривалось зернистое содержимое везикул с жировыми включениями. Полученные результаты позволили высоко оценить значение силикагеля, обеспечившего развитие мелкой корневой системы растений (рис. 19).
 Рис. 19. Корни яровой пшеницы, выращенной в сосудах с прослойкой силикагеля (1) и в контроле (2).
Рис. 19. Корни яровой пшеницы, выращенной в сосудах с прослойкой силикагеля (1) и в контроле (2).
В небольшие цветочные горшки с силикагелем были высеяны стерильные семена проса Саратовское 853. В контроле семена опрыскивали водой, в опытном варианте — фитобактерномицином (ФБМ) в разведении 5 мг на 100 мл. Через 2 мес. растения в опытном варианте оказались на 7 см выше контрольных. Корневая система у последних была хорошо развита и мало отличалась от нормальной корневой системы проса. В эндофитах корней были установлены круглые и продолговатые везикулы. Корни растений опытного варианта заметно превосходили контроль по своим размерам, а также по числу везикул. До применения силикагеля мы не наблюдали появления эндофитов в корнях стерильно выращенных растений при отсутствии гормональных веществ в питательной среде или на семенах. Хорошее развитие мочковатой корневой системы в силикагеле обеспечило образование эндофитов в тонких корешках и без применения стимуляторов, что раскрывает сущность действия последних, которая сводится к изменению строения корневых систем. В многочисленных опытах со стимулирующими веществами при положительном их действии всегда наблюдалось лучшее развитие корневых систем по сравнению с контролем. Увеличение роста и продуктивности растений под влиянием ростовых препаратов является следствием более развитой и более микотрофной корневой системы? которая определяет питательный режим и способствует усилению физиологических процессов. Слабое влияние Берлингтона на продуктивность сельскохозяйственных культур связано с несоответствием замедленного роста корневых систем, что определяется действием этого препарата, и усиленного роста надземной части растений в результате увеличения растянутости клеток стебля и листьев. Вполне закономерно предположить, что гиббереллин не выполняет функций, свойственных гормональным препаратам, так как его продуцент происходит из семейства Fusarium, в котором много патогенных видов. Наросты на рисе, привлекшие внимания исследователей, оказались связанными с патогенным явлением, а не со стимуляцией самого растения. Приведем результаты еще нескольких опытов, показавшие влияние различных питательных сред на формирование корневых систем растений и степень их микотрофности. Стерильные семена яровой пшеницы проращивались и укреплялись на парафинированной сетке над широкими стерильными пробирками, заполненными водой, песком и силикагелем. Количество питательной среды во всех случаях было одинаковым. В каждом варианте имелись пробирки, в которых семена обрабатывались водой (контроль) и ФБМ. После 30 дней роста проводилась оценка степени развития эндофитов в корнях. Уже по своему виду последние резко различались по вариантам. В воде пшеница образовала прямые толстые корни с редкими разветвлениями второго порядка, тогда как в силикагеле они гофрированы, объемны и имели ответвления второго и третьего порядков. Корни из песчаной среды по своему габитусу занимали промежуточное положение, приближаясь к корням пшеницы, выросшим в водной среде. Во всех вариантах корни из семян, опрыснутых ФБМ, были развиты лучше, чем контрольные. Изучение эндофитов в корнях проводилось по отдельным отрезкам, начиная от ближайших к семени и далее до конца. Наиболее микотрофными были корни пшеницы из силикагеля, в клетках которых имелись септированные гифы, арбускулы и много клеток с продуктами грибного синтеза, окрашенными анилин–бляу в фиолетовый цвет. Особенно часто такие образования встречались в отрезках корня, прилегающих к семени. Корни пшеницы, росшей на песке, оказались слабо микотрофными, и в них изредка встречались небольшие отрезки гиф эндофитов. Корни из водной культуры были визуально немнкотрофны. Применение гормонального препарата ФБМ заметно усилило микотрофность корней в силикагеле и песке. В результате многократного повторения опытов с другими культурами установлено, что в стерильных условиях роста источником заражения корней эндофитами является семя,, для активации которого нужно гормональное воздействие,, способствующее как пробуждению эндофита из состояния анабиоза, так и образованию разветвленной корневой системы растений, благоприятной для развития симбионтных грибов. В природных условиях эту роль продуцентов гормонов выполняют всегда сопутствующие семени эпифитные и ризосферные бактерии. Образование клубеньков на корнях небобовых растений изучала в нашей лаборатории О. И. Громыко. У ольхи и облепихи мы выделили из клубеньков эндофит и актиномицет, что подтверждает их тройной симбиоз — растение, эндофит, актиномицет. Для выяснения условий образования клубеньков на корнях ольхи и облепихи было поставлено два лабораторных стерильных опыта. В первом опыте стерильные семена проращивались в чашках Петри, в одну из которых добавляли 0,1 мл препарата ФБМ в концентрации 0,005%, что способствовало повышению всхожести семян. Пророщенные семена' пересаживали в цветочные горшки со смесью дерновой почвы и силикагеля в отношении 1:3, которые были предварительно простерилизованы в автоклаве I час при 1 ат (0,1 МПа) и промыты стерильной водой для удаления токсических веществ. Применение силикагеля обеспечило образование разветвленной корневой системы, необходимой для развития эндофитов. После 2,5 мес. роста растений их корни были отмыты. Как видно из рис.20, в варианте с ФБМ клубеньки образовались и у ольхи, и у облепихи, в контроле один маленький клубенек вырос только у облепихи.
 Рис. 20. Клубеньки на корнях облепихи и ольхи в варианте с обработкой семян ФБМ (2,5 мес. роста)
Рис. 20. Клубеньки на корнях облепихи и ольхи в варианте с обработкой семян ФБМ (2,5 мес. роста)
Второй опыт с этими растениями поставлен был по более развернутой схеме. В качестве стимулятора, кроме ФБМ, использовались живые и убитые кипячением чистые культуры эндофитов, выделенные из клубеньков ольхи и облепихи.. В каждом сосуде росло по 3 растения. Через 3 мес. опыт был вскрыт. По внешнему виду лучшими оказались те растения,, семена которых обрабатывались ФБМ. Их листья были крупнее и более темного цвета, а на хорошо развитых корнях имелось по несколько крупных клубеньков. Меньше клубеньков небольшого размера образовалось на корнях растений в вариантах с обработкой семян живыми или убитыми при кипячении чистыми культурами родственных им эндофитов. На корнях контрольных растений клубеньков не удалось обнаружить, т. е. они были визуально немикотрофны. Результаты двух опытов позволяют убедиться в том, что применяемые обычно приемы «заражения» стерильных семян различными грибами (а в данном случае даже специфическими для растений) оказывают более слабое стимулирующее влияние на развитие эндофитов из семян растений, чем гормональный препарат, обладающий высоким потенциалом действующего начала. В дальнейшем мы широко использовали ростовые препараты, изготовляемые из чистых культур сильно микотрофных растений для значительного повышения микотрофности любых культур. Многие авторы (Bond, McConnell, 1956, Hewitt, Bond, 1961; Peuss, 1958 и др.), не располагая чистыми культурами эндофитов, применяли для заражения стерильных культур различных растений растертые клубеньки или отрезки корня нестерильных растений. Этим приемом нарушалась стерильность опытов, что способствовало развитию почвенных микроорганизмов, продукты метаболизма которых оказывали стимулирующее действие на развитие эндофитов из семян растений. Все изложенные результаты опытов, посвященных вопросам происхождения эндофитов и проведенных с использованием метода стерильных культур, дают возможность прийти к выводу, что в стерильных опытах эндотрофная микориза не развивается в корнях растений не из–за уничтожения эндофитов при стерилизации среды, а в связи с общим отсутствием продуктов метаболизма, и в особенности ризосферных бактерий, стимулирующее действие которых необходимо как для образования разветвленной корневой системы, так и для перехода эндофитов семени из анабиотического состояния в активное. Многие микроорганизмы в той или иной степени обладают способностью синтезировать гормональные вещества, оказывающие воздействие на развитие эндофитов из стерильного семени, что и послужило основанием для утверждения о «заражении» ими корней. Это мнение не потеряло своего значения и после того, как была доказана возможность «заражения» при использовании убитых кипячением грибов, которые благодаря термостабильности ростовых веществ сохраняли свое действие. Мы неоднократно пытались установить рост чистых культур эндофитов в почве, внося их с добавлением крахмала, торфа, навоза и без удобрений, но каждый раз убеждались в невозможности роста грибов в почве из–за лизиса их мицелия в этих условиях. Эндофиты не растут в почве, а следовательно, не могут заражать корни растений. Эти грибы тысячелетиями приспосабливались к росту в организме растения, и их физиологические функции осуществляются обменными реакциями с растениями. А. Г. Винтер (1963, с. 367), вопреки своему мнению о почвенной инфекции корней, писал: «Наши исследования не оставляют сомнений в том, что значительное развитие микоризообразующих грибов в почве исключено». Это положение противоречит данным некоторых авторов, которые непосредственно наблюдали внедрение грибов через корневые волоски. Однако Сивере (Sicvers, 1958), в своей работе подчеркивал, что, даже просмотрев огромное количество корней растений в нескольких странах, он никогда не наблюдал гиф грибов в корневых волосках. Таким образом, мы опять стоим перед противоречивыми утверждениями, которыми так богата наука о микотрофизме растений. Преимущество авторов, свидетельствующих о наличии внедрений гиф через волоски, заключается в том, что они дают фотографии этого процесса, тогда как представители другой точки зрения не могут показать «отсутствие» внедрения.
Выводы
1. Затяжной характер, который приняло решение вопроса о происхождении эндофитов в корнях растений, определил задержку развития науки о симбиотрофном существовании растительного мира. Причиной указанных трудностей явилась необычная для многих микроорганизмов зависимость симбионтных грибов от гормональных воздействий, без которых они неспособны осуществить переход от семени, в котором грибы находятся в состоянии анабиоза, в корни растений. В процессе своей жизнедеятельности в корнях они сами синтезируют гормональные вещества, обеспечивая ими ростовые процессы растений. 2. Основным аргументом при доказательстве необходимости заражения корней растений эндофитами в почве было их отсутствие в корнях стерильно выращенных растений. Результаты многочисленных опытов, в которых стерильные семена заражались различными почвенными грибами, снабжавшими их гормональными веществами, необходимыми для прорастания в семенах прирожденного эндофита, создавали видимость правдоподобия утверждения о «заражении». Такое же действие оказывают на стерильное семя вытяжки из различных гименомицетов, ризосферных бактерий и гормональные препараты без участия живых грибов. 3. В природных условиях для перехода из семян в корни эндофиты снабжаются гормональными веществами, продуцируемыми эпифитными и ризосферными бактериями, которые обильно размножаются на поверхности семени в процессе его прорастания. Установленное нами наличие эндофитов не только в корнях, по и в надземных частях растений, включая пыльцу, завязь и семя, подтверждает наличие «циклической наследственности» в передаче эндофитов. Это положение повышает генетическое значение грибного симбионта и свидетельствует о возможности его совершенствования из поколения в поколение и передачи в процессе установленного С. Г. Навашиным (1951) двойного оплодотворения. При вегетативном размножении культур переход эндофитов из клубней, луковиц и черенков заметно замедляется в связи с более слабым гормональным воздействием этих грибов. 4. Что касается микроскопических исследований, проведенных некоторыми авторами, визуально наблюдавшими процесс вторжения гиф в корневой волосок, то в этих опытах гриб попадает в корень не из почвы, а из коровой части последнего, что подтверждается ненарушенностью внешней оболочки корневого волоска. Это явление связано с приготовлением препарата и уменьшением давления плазмы, вызывающем распрямление свернутых в петли гиф гриба. Кроме того, эндофиты не могут использовать почву как среду для своего существования, так как подвергаются лизису. 5. Гормональное воздействие на семена растений как в природных условиях, так и при использовании ростовых препаратов не только стимулирует активность симбионтных грибов, но и оказывает значительное влияние на развитие разветвленной корневой системы растений, что способствует заметному увеличению микотрофности культур и повышению их продуктивности.3. Значение эндофитов для симбиотрофнои азотфиксации растений
Возможность обогащения почвы азотом за счет деятельности грибов в микоризе всегда интересовала нас. О том, что вопрос этот решается положительно, мы доложили на специальном совещании по азотфиксации в Киеве в 1968 г. (Гельцер, 1968 а). Широко распространенное прежде мнение об отсутствии эндофитов внутри клубеньков бобовых растений не соответствует действительности. При предварительной мацерации крупных розовых клубеньков клевера можно наблюдать под микроскопом их везикулы в верхней зоне клубенька. На рис.21 при увеличении в 300 и 600 раз видны хорошо окрашенные везикулы. Применявшийся в нашей лаборатории метод выделения чистых культур эндофитов дал возможность получить их из поверхностно стерильных крупных клубеньков многих бобовых растений, таких как клевер, бобы, люпин, горох, вика, что дает возможность утверждать наличие в них двух симбионтных организмов — гриба и бактерии. Рис. 21. Везикулы эндофитов в клубеньке клевера (ув, 300 и 600)
Рис. 21. Везикулы эндофитов в клубеньке клевера (ув, 300 и 600)
Отличительной особенностью чистых культур эндофитов, выделенных из клубеньков клевера, является синтез красного пигмента, который окрашивает клубенек в розовый цвет. В. Стеварт (Stevarl, 1966), изучая процесс азотфиксации а клубеньках бобовых растений с 15N, установил его только у окрашенных в розовый цвет крупных клубеньков, тогда как мелкие, белые клубеньки азотфиксацией не обладали. Правильность этого вывода была подтверждена многими микробиологами, которые выделяли из розовых клубеньков наиболее активные расы клубеньковых бактерий для приготовления нитрагина. Хотя сама по себе розовая окраска существенного значения не имеет, она служит показателем наличия в клубеньках клевера симбионтных грибов, так как эндофиты этого растения синтезируют красный пигмент. Мы уже указывали, что эндофиты из женьшеня и мать–и–мачехи, синтезирующие черный пигмент, который не переходит в раствор, также активизируют деятельность клубеньковых бактерий, как и эндофиты из облепихи, синтезирующие красно–рыжий пигмент. В лабораторных и полевых опытах при использовании чистых культур эндофитов, выделенных из сильно микотрофных женьшеня, мать–и–мачехи и облепихи, было установлено положительное действие продуктов их синтеза на размножение (табл. 3) и вирулентность клубеньковых бактерий.
Таблица 3 Масса клубеньковых бактерии клевера

В некоторых опытах, посвященных изучению стимулирующего действия эндофитов на размножение клубеньковых бактерий, было установлено увеличение их массы в 100-литровом реакторе на 20 и 40 г. Влияние симбионтных грибов на вирулентность клубеньковых бактерий было определено в стерильном опыте в широких пробирках на агаровых средах. В контрольных трех пробирках семена клевера заражались чистой культурой клубеньковых бактерий, а в опытных к ней добавлялось- несколько капель разбавленного ростового препарата эндофитов. После 2 мес. роста клевера на корнях в контроле было обнаружено по 0,45 мелких клубенька в среднем на растение, тогда как в опытных вариантах — по 4,25, т. е. в 10 раз больше. Помимо того, следует отметить и лучшее развитие последних. Краткосрочный полевой опыт на эту тему был заложен во ВНИИ кормов. Здесь контрольные семена клевера обрабатывали только клубеньковыми бактериями, а опытные — дополнительно и ростовым препаратом Симбионт 1. После 45 дней роста клевера в обоих вариантах были подсчитаны клубеньки на корнях 80 растений, взятых с двух участков поля. При этом с каждого участка брали по 20 контрольных и 20 опытных растений. На первом участке в контроле насчитывалось 445 клубеньков, в опытном варианте — 740, на втором — соответственно 677 и 1083, а в среднем 1122 и 1823 клубенька. Таким образом, применение препарата Симбионт 1 позволило увеличить количество клубеньков на 63%. На рис.22 видно более сильное, чем в контроле, развитие корневых систем у клевера, семена которого были обработаны ростовым «препаратом из эндофитов, а на рис.23 показано обилие клубеньков на корнях сои в варианте с обработкой семян растертыми клубеньками сои и очень слабое их развитие при заражении семян чистыми культурами клубеньковых бактерий сои. Приведенные результаты опытов показывают, что для активизации азотфиксации бобовых культур нужно стимулировать развитие эндофитов в корнях и клубеньках этих культур.
 Рис. 22. Корневые системы клевера в контроле (1) и из семян, обработанных ростовым препаратом (2) в возрасте 1,5 мес.
Рис. 22. Корневые системы клевера в контроле (1) и из семян, обработанных ростовым препаратом (2) в возрасте 1,5 мес.
 Рис. 23. Молодые ростки сои при заражении клубеньками (слева) и чистой культурой эндофитов (справа)
Рис. 23. Молодые ростки сои при заражении клубеньками (слева) и чистой культурой эндофитов (справа)
Какие вещества, синтезируемые эндофитами, способны оказывать стимулирующее действие на размножение и активность клубеньковых бактерий? До сих пор многие исследователи придают большое значение так называемому леггемоглобину, окрашивающему клубенек клевера в розовый цвет (Риго, 1983). Ошибочность этого направления определяется как нерезультативностью многолетних исследований этих авторов, так и материалами рассмотренных выше опытов, доказавшими стимулирующее действие эндофитов на клубеньковые бактерии и даже при отсутствии окрашенных в красный цвет пигментовэтого гриба. Как уже указывалось, кроме клеверных эндофитов, многие эндофиты из других растении синтезируют красный пигмент, окрашивая им цветы и плоды, и никто его за гемоглобин не принимает. По разработанной нами методике любой исследователь может получить чистые культуры эндофитов из корней клевера, пшеницы, томатов, ржи и других растений и убедиться в том, что продукты их жизнедеятельности не обладают признаками гемоглобина, за исключением такого, как окраска. Очевидно, основным стимулирующим свойством обладают гормональные вещества, ферменты и витамины эндофитов. Ф. В. Турчин (1959), изучая механизм азотфиксации бобовых культур с 15N, пришел к выводу, что этот процесс осуществляется в клетках клубеньковой ткани под влиянием ферментов клубеньковых бактерий, но в таком случае бактерии могли бы в чистых культурах сами фиксировать атмосферный азот. При современном состоянии науки можно утверждать, что ферменты, на которые указывал Ф. В. Турчин, синтезируют в клубеньках эндофиты, так как их наличие в развитых клубеньках можно считать установленным фактом. В дальнейшем, продолжая эти исследования с сотрудниками З. Н. Берсеневой и Г, Г. Жидких, Ф. В. Турчин (1963) пришел к выводу о способности к азотфиксации ферментов, выделенных не только из клубеньков, но и из листьев и корней как бобовых, так и небобовых растений, что указывает на возможность усвоения атмосферного азота всеми растениями, хотя и в различной степени. Для того чтобы достоверность данного вывода стала достоянием пауки, необходимо установить недостающие звенья этой цепи, т. е. тот основной микроорганизм, ферменты которого способствуют азотфиксации растений. Переходя к главной теме этой главы, мы хотели бы отметить, что выявление нами двух микроорганизмов в клубеньках бобовых растений открывает новые возможности для активизации процесса их азотфиксации. Вместо обычно рекомендуемых обработок семян бобовых культур соответствующими нитрагинами, нужно повысить вирулентность и активность клубеньковых бактерий, усиливая микотрофность этих культур путем опрыскивания семян гормональными препаратами, изготовляемыми из чистых культур эндофитов (например, Симбионтом 1 или Симбионтом 2). Добавление к ним микродоз молибдена усилит получаемый эффект, так же как и повторное применение такой обработки семян в потомстве данной культуры. В природных условиях роль бобовых растений в обогащении целинных почв азотом невелика. Даже в степной зоне, растительность которой создала самые богатые по содержанию азота черноземные почвы, количество бобовых растений не превышает, в травостое более 5% (Лаврененко и Прозоровский, 1939). Многие исследователи приходили к заключению, что не только бобовые, но и растения других семейств обладают способностью усваивать атмосферный азот. Однако, поскольку они не указывали на участие определенных микроорганизмов, ответственных за данный процесс, наука не признавала это положение доказанным. X. Шандерль (Schanderl, 1942) на основании точных учетов баланса азота в сосудах установил, что подсолнечник за вегетационный период может фиксировать из воздуха 613 мг азота на сосуд, ирисы — 539, а клевер и фасоль — только 384 и 321 мг. X. Шандерль считал, что не только бобовые, но и другие растения в симбиозе с неизвестными организмами способны усваивать азот из воздуха. Большой интерес представляет изучение баланса азота у длительно растущих многолетних растений в природных условиях. Так, Э. Рассел (1955), директор Ротемстедской опытной станции в Англии, привел данные о накоплении азота за 20 лет в залежи, которая на 86% состояла из щучки (Deschampsia caespitosa Р. В.) при почти полном отсутствии бобовых в травостое. При невысоком содержании извести в почве ежегодная прибавка азота достигала 67 кг/га, а на карбонатной почве — 103 кг/га. Ниже мы покажем, что для нового азотфиксирующего микроорганизма рН среды имеет большое значение. Рассел отметил, что «симбиотическая фиксация азота, возможно, не ограничивается одними только бобовыми растениями, хотя в сельском хозяйстве они являются единственными важными азотфиксирующими культурами» (с. 298). Очевидно, большое значение имеет длительное существование многолетних растений на одном месте. А. В. Соколов (1956) в заповедной степи установил накопление азота в слое 0-50 см черноземных почв в размере 17,5-26,5 т/га при наличии только 5% бобовых в травостое. Нами было установлено наиболее высокое содержание азота в типичном сероземе: 0,2% азота накопилось в многолетней орошаемой залежи, состоящей из чистого злакового покрова с бобовыми (Гельцер, Ласукова, 1934). Из данных, полученных с применением изотопа 15N, большой интерес представляют работы Греты Стевенсон (Stevenson, 1959) об азотфиксации у небобовых культур. Она доказала способность к азотфиксации у многих растений на бедных почвах в Новой Зеландии. В песчаных почвах, свободных от азотфиксирующих бактерий, ею наблюдалась ассимиляция l5N у сосны, зараженной микоризой, у сливы, ежи, кипрея и других растении. Доказанной азотфиксацией обладают все небобовые растения, имеющие на своих корнях клубеньки, заполненные эндофитами совместно с актиномицетами. Большинство растений, способных к азотфиксации, живет на бедных песчаных, каменистых или торфяных почвах. Несмотря на многочисленность работ, посвященных выяснению видового состава микроорганизмов, населяющих клубеньки небобовых растений, ученые еще не пришли к единому выводу. В сводных статьях по этому вопросу приводятся данные о наличии в клубеньках септированных эндофитов, актиномицетов и бактерий. Более достоверными являются работы, авторы которых применили для изучения клубеньков электронную микроскопию. Ж. Беккинг, В. Бэр и А. Хоуинк (Becking, Boer, Houwink, 1964) установили, что в клубеньках ольхи имеются эндофиты в виде септированных гиф и их многочисленных везикул, как заполненных цитоплазмой, так и лишенных се, и актиномицеты. В последние годы (1980-1982) группа авторов, возглавляемая И. II. Андреевой (Андреева и др., 1980), изучающая в электронном микроскопе развитие эндофитов в корнях облепихи, пытается доказать, что фиксация азота осуществляется везикулами, поскольку она слабо проявляется в мицелярной стадии развития эндофита и значительно увеличивается в период появления везикул. Совершенно очевидно, что это совпадение связано с общим состоянием развития эндофита, а не со способностью везикул к азотфиксации, которые являются не самостоятельными органами, а расширенной частью гифа гриба, служащей для накопления продуктов его синтеза белковой природы. Неправильным в статьях указанных авторов является определение симбионтов как «эндофит–актиномицет», тогда как это два разных организма, один из которых — актипомицет — выделяется всеми как чистая культура, а другой — эндофит — только при наличии гормональных веществ в питательной среде (Гельцер, Кузнецова, 1977). Первичный почвообразовательный процесс на свежих глинистых отложениях начинается с развития сильно микотрофной мать–и–мачехи (Tussilago farfara L.), к которой обычно через несколько лет присоединяется пырей (Triticum re–pens L.). Проходит длительный период накопления азота и зольных элементов в поверхностном горизонте почвы до появления в травостое ползучего клевера (Trifolium repens L.) или других бобовых, которые очень требовательны к условиям среды. Изучение динамики накопления азота в глине, взятой из глубокой шахты метро и заросшей в первые годы мать–и–мачехой, а затем пыреем, показало, что за 16 лет верхний горизонт этой глины превратился в темноцветную дерновую почву. Первоначальное содержание в глине азота 0,010%» а после указанного срока оно составило в слое 0-5 см 0,093%, в слое 6-25 см — 0,049, 30-35 см — 0,019%. Это накопление азота произошло без всякого участия бобовых в травостое и при незначительном количестве азотобактера в верхнем горизонте — 10-20% комочков обрастания на гелевых пластинках. Предварительный опыт по выращиванию проростков мать–и–мачехи в водной культуре с питательной смесью Гельригеля три различном содержании азота показал, что лучше всего это сильно микотрофное растение растет уже при 0,1% азота в смеси, обеспечивая себя атмосферным азотом, тогда как увеличение дозы азота до нормальной для таких растений, как пшеница или рожь, является гибельным для мать–и–мачехи. Обстоятельный вегетационный опыт, поставленный в нашей лаборатории в полулитровых сосудах с силикагелем, с несомненностью подтвердил способность к азотфиксации сильно микотрофного растения мать–и–мачехи. Опыт проведен в двукратной повторности по следующей схеме: 1 — контроль — питательная среда без азота; 2 — питательная среда + 1,4 мг азота. В каждый сосуд высаживали по 4 проростка с зачатками листьев, которые в общей сложности содержали 11,0 мг азота. Через 2 мес. в надземной части и корнях растений, освобожденных от силикагеля, было определено содержание азота (табл. 4).
Таблица 4 Азотофиксация мать–и–мачехи за 2 мес. выращивания
 Примечание. В посадочном материале содержался азот в среднем на сосуд 11,0 мг.
Примечание. В посадочном материале содержался азот в среднем на сосуд 11,0 мг.
Наибольшая азотфиксации (29,2 мг на сосуд) наблюдалась при добавлении в «питательную среду всего 1,4 мг азота. Высокая микотрофность корней у мать–и–мачехи была установлена и в варианте без азота. Как будет показано ниже, способность мать–и–мачехи к азотфиксации подтвердилась также в длительных опытах в лизиметрах. Именно благодаря данной способности это растение поселяется первым как на бедных аллювиальных песках, так и на глинистых материнских породах. Чтобы доказать азотфиксирующую способность сильно микотрофных растений, следовало установить ее наличие у чистых культур эндофитов. Изучению азотфиксирующей способности выделенных чистых культур эндофитов предшествовал длительный подбор питательных сред и условий их культивирования, необходимых для выявления продуктивности этого процесса. Обильный рост мицелия эндофитов в питательных средах можно получить при добавлении к синтетической среде с сахаром вытяжек из растений, пивного сусла или кукурузного экстракта, но в этих случаях, т. е. при хорошем азотном питании, эндофиты не фиксируют азота, что характерно для всех азотфиксирующих микроорганизмов. Способность эндофитов фиксировать азот проявляется при минимальном количестве минерального азота или азота аминокислот в среде (0,1 мг/л), что определяет длительный период роста грибов (20-30 дней) для наращивания большой массы мицелия. Еще медленнее растут эндофиты в питательной среде, без азота. Понадобилось 2-3 мес. для получения хорошо развитого мицелия у мать–и–мачехи, который фиксировал за 72 дня 0,6 мг азота, а за 118 и 127 дней — 3,2 и 4,7 мг. Эндофит из ирисов за 118 и 123 дня в среде без азота фиксировал 2,5 и 3,0 мг азота. Установив, что эндофиты используют для азотфиксации больше сахара, чем свободно живущие бактерии, мы уменьшили аэрацию путем их культивирования в широких пробирках при слое жидкости 10 см и замены минерального азота аспарагином или нуклеинатом натрия из расчета 5 мг на литр питательной среды № 22 с рН 5,8-6,6. В широкой пробирке 50 мл питательной среды заражали небольшим количеством мицелия эндофита. В начале опыта ежедневно взбалтывали пробирки для получения большого количества отрезков гиф. Затем их помещали на 30 дней в термостат при температуре 24-28° и доступе воздуха. После этого срока 5 мл среды брали для определения сахара по Бертрану, а 45 мл — для определения азота мицелии по Кьельдалю с применением перекиси водорода. Титрование проводилось с 0,01 н. растворами серной кислоты и щелочи. Было осуществлено около 500 определений содержания азота. Отмечено, что чистые культуры эндофитов зимой фиксируют немного меньше азота, чем весной и летом. Чтобы избежать изменения культуры эндофитов при длительной их адаптации к лабораторным питательным средам, мы выделяли новые чистые культуры для определения их способности к азотфиксации. Особое внимание обращалось на отсутствие загрязнения лабораторного воздуха аммиаком. При протягивании воздуха через титрованную кислоту в течение нескольких дней не было обнаружено его наличия. Полученные данные по азотфиксации чистых культур эндофитов приведены в табл.5.
Таблица 5 Азотфиксация чистых культур эндофитов

Многие авторы отмечают, что развитие эндофитов в корнях растений не зависит от степени кислотности почвы, но это еще не доказывает, что условия среды не влияют на активность их жизнедеятельности. При специальном изучении влияния кислотности питательной среды на азотфиксацию эндофитов мы получили интересные результаты (табл. 6).
Таблица 6 Азотфиксация чистых культур эндофитов (мг на 1 г сахара) при разных значениях рН среды
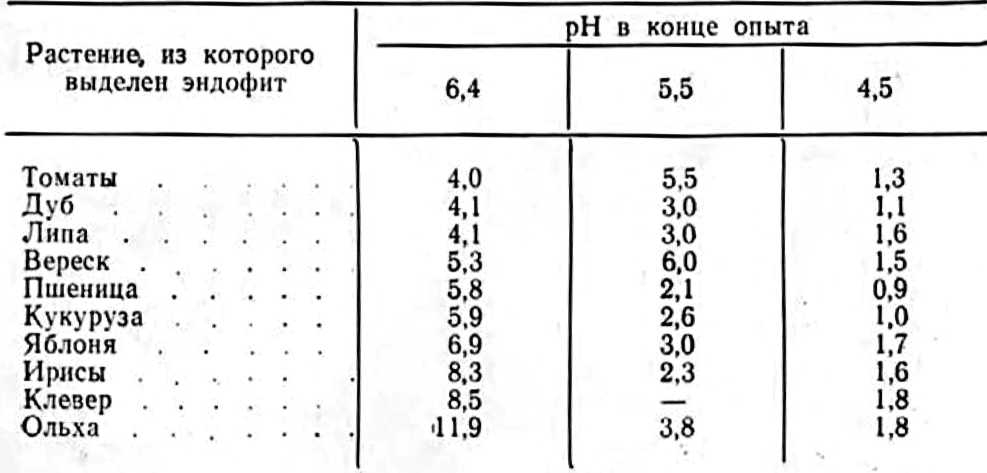
Наиболее значительно снизилась азотфиксация при увеличении кислотности среды с рН 6,4 до рН 5,5 у эндофитов» выделенных из пшеницы, кукурузы, ирисов, ольхи, в то же время эндофит из вереска не реагировал на повышение кислотности. При подкислении до pH 4,5 у всех эндофитов значительно снизилась способность к азотфиксации, что может служить объяснением более низкого содержания азота в зоне кислых подзолистых почв, чем в карбонатных черноземах. Как видно из табл.6, абсолютная азотфиксация эндофитов, так же как и относительная (на 1 г использованного сахара), довольно значительна. Чистые культуры эндофитов, выделенные из клубеньков бобовых растении, не обладали повышенной способностью к азотфиксации по сравнению с эндофитами из корней этих растений. Поскольку в клубеньках бобовых растений имеется два микроорганизма, обладающих способностью к азотфиксации — клубеньковая бактерия и эндофит, мы сделали попытку выращивать их в лабораторных питательных средах совместно, что нам не удалось. Быстрое подкисление питательной среды было неблагоприятно как для эндофита, так и для бактерий. Очевидно, их совместное существование в клубеньке обеспечено нейтрализацией избыточной кислотности. Установление азотфиксирующей способности эндофитов в питательных средах при минимальной дозе азота еще не дает права с уверенностью утверждать, что они могут осуществлять этот процесс в природных условиях, хотя эндофиты как симбиотрофные организмы более надежно обеспечены энергетическим материалом в природных условиях, чем свободноживущие азотфиксирующие бактерии. Все же для доказательства их участия в обогащении растений и почвы азотом нужно было установить, что сильно микотрофные растения фиксируют больше азота, чем слабо микотрофные. Для изучения этого вопроса были созданы на территории ВИУАА бетонные лизиметры без дна размером 0,5 м2, которые были заполнены на глубину 80 см слабосортированной глиной, взятой с глубины 3 м, ниже которой находилась местная глинистая материнская порода. Материалы подробного химического и микробиологического исследования состава глины после 3 и 7 лет проведения этого опыта уже опубликованы в наших работах (Гельцер, 1956, 1963б). Здесь мы сообщаем данные за 10 лет. Из опытов в лизиметрах академика В. Р. Вильямса было известно, что рост растений на материнской породе очень задерживается из–за недостатка зольных элементов и азота. В нашем опыте было внесено перед посевом в каждый лизиметр по 2 г Р205 в виде КН2РО4, 1,5 г азота с KN03, микроэлементы с боромагниевыми удобрениями и по 100 г. СаО. Выбор подопытных растений был обусловлен степенью их микотрофности. В парующем лизиметре незначительное накопление азота слагалось из азота осадков, поливных вод,, удобрений и азотфиксации водорослей. Помимо указанного лизиметра, имелись лизиметры, в которых ежегодно высевались слабо микотрофные однолетние зерновые и бобовые культуры, сильно микотрофные ирисы, многолетние злаки и бобово–злаковые травосмеси. Во второй серии, кроме отмеченных, были лизиметры с сильно микотрофными многолетними растениями — мать–и–мачехой, пыреем, любкой. Включение ирисов в опыт определялось имеющимися данными о быстром окультуривающем их действии на почву (Ф. Ю. Гельцер, 1955, 1960) и очень высокой степени микотрофности их корней (рис. 24). Впервые X. Шандерль (Schanderl, 1942) установил, что ирисы в сосуде накопили 539 мг азота, а клевер в тех же условиях — 384 мг.
 Рис. 24. Чистая культура эндофитов из корней ирисов. Везикулярные вздутия окрашены анилин–бляу
Рис. 24. Чистая культура эндофитов из корней ирисов. Везикулярные вздутия окрашены анилин–бляу
Изучение мать–и–мачехи представляло интерес, поскольку это растение обеспечивает первичный почвообразовательный процесс на глинистых обнажениях или песчаных аллювиальных наносах. Несмотря на свою способность к азотфиксации, бобовые растения никогда не поселяются первыми на бедных субстратах. В противоположность бобовым мать–и–мачеха не выдерживает субстратов, обогащенных минеральными солями и перегноем, и ее нельзя выращивать на материнских породах более 4-6 лет. В табл.7 дано накопление азота в глине лизиметров под влиянием роста сильно и слабо микотрофных растений. Слабо микотрофные однолетние зерновые культуры даже при наличии двухлетнего культивирования однолетних бобовых — вики и гороха — незначительно обогатили глину азотом, тогда как сильно микотрофные многолетние злаки, ирисы и мать–и–мачеха способствовали значительному увеличению азота в почве. Преимущество остается за многолетней бобово–злакововой смесью, которая в 3 и 5 раз повысила содержание азота в глине. Баланс этого элемента приведен в табл.8.
Таблица 7 Общее содержание азота и перегноя в лизиметрах в горизонте 0-15 см
 Наглядным подтверждением полученных в этом опыте (в первой серии) данных служит фотография, показывающая рост проса на почвах лизиметров разных вариантов на седьмой год (рис. 25). В лизиметре без растений урожай сухой зеленой массы проса был предельно низким — 8,9 г. Лучше выросло просо в лизиметре с однолетними культурами и ирисами — 27,9 и 30,4 г. Значительно увеличилась зеленая масса проса после 6 лет возделывания многолетних злаков и бобово–злаковой травосмеси — соответственно 98,4 и 112,5 г.
Наглядным подтверждением полученных в этом опыте (в первой серии) данных служит фотография, показывающая рост проса на почвах лизиметров разных вариантов на седьмой год (рис. 25). В лизиметре без растений урожай сухой зеленой массы проса был предельно низким — 8,9 г. Лучше выросло просо в лизиметре с однолетними культурами и ирисами — 27,9 и 30,4 г. Значительно увеличилась зеленая масса проса после 6 лет возделывания многолетних злаков и бобово–злаковой травосмеси — соответственно 98,4 и 112,5 г.
Таблица 8 Баланс азота (г) в лизиметрах за 10 лет

Опыт убедительно показывает, что сильно микотрофные многолетние злаки обладают значительной способностью к азотфиксации, так как иначе они не смогли бы способствовать заметному накоплению перегноя, достаточному для создания почти такой же зеленой массы проса, которая была получена по лучшему предшественнику — многолетней бобово–злаковой травосмеси. Ирисы и однолетние сельскохозяйственные культуры за 6 лет также заметно повысили Плодородие глины по сравнению с его уровнем в контрольном лизиметре, где глина так и не приобрела основного свойства почвы — ее плодородия. Результаты изучения азотфиксации чистых культур эндофитов в лабораторных условиях, подкрепленные данными о накоплении азота и перегноя под влиянием роста сильно микотрофных растений в лизиметрах на материнской породе» находят полное подтверждение при исследовании природных почвообразовательных процессов. В природных условиях максимальное количество перегнойных веществ и азота накапливается в почвах на богатых фосфором карбонатных материнских породах, что обеспечивает хороший рост многолетней травянистой формации с хорошо развитой корневой системой. П. А. Костычев (1886) подчеркнул, что развитие гумозного слоя черноземов определяется глубиной проникновения корневых систем травянистых растений. По данным Н. И. Болотиной (1947), в метровом слое деградированных выщелоченных и обыкновенных черноземов в расчете на 1 га содержится от 21 до 37 т азота, а в мощных черноземах — 31-43 т/га.
 Рис. 25. Рост проса на почвах с различным плодородием в лизиметрах:: слева направо — по пару; после однолетних культур; после ирисов; после многолетних злаков; после многолетних травосмесей
Рис. 25. Рост проса на почвах с различным плодородием в лизиметрах:: слева направо — по пару; после однолетних культур; после ирисов; после многолетних злаков; после многолетних травосмесей
В основном накопление азота в почвах степей, прерий и лугов связано с хорошо выраженной микотрофностыо многолетней травянистой растительности. По данным Н. М. Базилевич (1955), ежегодный опад такой растительности содержит от 94 до 193 кг азота на 1 га.
Выводы
1. Чистые культуры эндофитов, выделенные из корней различных растений, обладают значительной способностью к азотфиксации. В лабораторных условиях за 30 дней опыта они фиксируют от 3,7 до 25,2 мг азота на 1 г сахара. В природных условиях симбионтные грибы многолетних растений могут накопить большое количество азота в почве при условии нейтральной реакции среды обитания. 2. Установленное нами в хорошо развитых клубеньках всех бобовых культур присутствие эндофитов подтверждает их участие в процессе азотфиксации этих растении. 3. Тройной симбиоз у бобовых — растение — клубеньковые бактерии — эндофиты — и симбиоз у небобовых растений с хорошо развитой микоризой и клубеньками на корнях обеспечивают значительную азотфиксацию в природных условиях. 4. Стимулирующее влияние эндофитов на азотфиксацию клубеньковых бактерий определяет эффективность обработки семян бобовых культур перед посевом ростовыми препаратами (такими, как симбионты), изготовленными из чистых культур эндофитов. 5. В длительных опытах в лизиметрах было установлено, что сильно микотрофные растения накапливают в материнской породе больше азота и перегноя, чем слабо микотрофные. 6. Обоснование большого значения азотфиксации эндофитов для накопления азота в почве заставляет обратить особое внимание на создание оптимальных условий их развития в корнях возделываемых культур.4. Участие симбионтных грибов в синтетической деятельности растений
Нам предстоит коротко рассмотреть основные проблемы взаимодействия между растениями и симбионтнымн грибами, разработка которых в дальнейшем должна получить свое развитие в биохимических институтах, оснащенных современной аппаратурой, с использованием методов исследования продуктов синтеза эндофитов. Наша задача заключается только в том, чтобы доказать правильность утверждения о значительном участии эндофитов в синтетической деятельности растении, которым до сих пор неправильно приписывается автотрофность существования. Только некоторые физиологи отмечают зависимость основного процесса растений — фотосинтеза — от ростовых веществ, происхождение которых еще до недавнего времени не было известно. Так, Н. Г. Холодный и А. Г. Горбовский (1939) установили, что введение в зеленый ассимилирующий лист слабых растворов гетероауксина способно резко усилить его фотосинтез. «Таким образом, — писал Н. Г. Холодный (1939, с. 255), — и эта важнейшая функция растительного организма оказывается, по–видимому, связанной с наличием в клетке фитогормонов». Б. А. Рубин (1961, с. 138) в главе о фотосинтезе «Курса физиологии растений» отметил, что «исключительно большое влияние оказывают на ход фотосинтеза биологические (внутренние) особенности растений, которыми определяется характер реагирования организма на внешнее воздействие». По нашим представлениям, таким фактором может быть только степень микотрофности растений. Общим положением, определяющим взаимозависимость растений и симбионтных грибов, служит использование последними избытка продуктов фотосинтеза, достигающих корневых систем, так как основная синтетическая деятельность эндофитов осуществляется в корнях, поскольку лишь здесь у них образуются специальные органы для накопления продуктов синтеза — везикулы и арбускулы. Последние отсутствуют в мицелии грибов в надземных частях растений. Взамен углеводов эндофиты возвращают растению более сложные азотсодержащие вещества. Впервые такие продукты синтеза симбионтных грибов растении, как гормональные вещества, аминокислоты, ферменты, витамины, липиды и цветные пигменты, были обнаружены в пасоке корней Д. А. Сабининым (1949). В дальнейшем их наличие было установлено нами в лабораторных колбах с чистыми культурами эндофитов, выделенными из корней многочисленных растений (Гельцер, Коваль, Сапронова 1965; Гельцер, Кузнецова 1977). Гормональные вещества. В подробном обзоре литературы, посвященной исследованиям ростовых гормонов, Н. Г. Холодный (1939) отмечал, что, несмотря на огромный труд, затраченный на изучение фитогормонов и их значения в жизни растений, эта отрасль знаний все еще находится в начальной стадии развития, о чем свидетельствует обилие разнообразных, иногда противоречивых гипотез. Вместе с тем Н. Г. Холодный предугадал скорое развитие науки о фитогормонах, которые при ничтожно малых количествах обладают исключительной физиологической и биохимической активностью. В своем труде он критически рассмотрел многие аспекты проблемы: участие гормонов в клеточных делениях, в процессах роста, тропизмах, ранениях растений и цветении, — отразив тем самым всю их значимости в жизни каждого растения. Наиболее важных выводом Н. Г. Холодного (1939) является его заключение о регулирующем влиянии гормонов роста на ферментативную деятельность растений, от которой зависит характер образования различных органических соединений. Около 80 лет ученые не могли установить места образования гормональных веществ в растениях, так как при господствующем в науке представлении об автотрофности растительного мира их искали в надземных частях растений, не учитывая необходимости затрат энергии на их синтез. Длительное время признавалось правильным представление об их возникновении в точках роста, где они впервые были обнаружены (Went, 1928), однако, позднее исследователями было установлено наличие гормонов во всех частях растении. Мы находим у В. И. Кефели (1978, с. 983) следующее высказывание по этому поводу: «Несмотря на то, что в высшем растении отсутствуют специализированные органы, ответственные за образование и транспорт гормонов, определенная тканевая и органная приуроченность в биогенезе этих веществ существует». Этот автор считал, что для апикальной меристемы стебля характерна высокая концентрация ауксилов, для корней — цитокининов и абсцизовой кислоты, для листьев — гиббереллипов. Полученные нами данные об образовании гормональных веществ в корнях растений с участием эндофитов, обладающих для этого процесса нужной энергией, находятся в соответствии с данными об их синтезе гименомицетами, образующими эктотрофную микоризу (Dagus, Bluzmann, 1943). Мы использовали вытяжки из гименомицетов для получения первых чистых культур эндофитов, которые без воздействия гормональных веществ в питательных средах не прорастают из корней. Обладая высокой проницаемостью, гормональные вещества достигают точек роста надземных частей растений, стимулируя деление и рост их клеток на любом расстоянии от места их синтеза в корнях. Однородность ростовых препаратов, полученных в стерильных питательных средах путем пересевов частиц мицелия чистой культуры эндофита, обеспечивает стандартность их действия на протяжении многих лет, чего трудно достигнуть при изготовлении препаратов ростовых веществ из растущих в лесу грибов. Не случайно экто–эндотрофной микоризой обладают только такие мощные породы деревьев, как береза, сосна, дуб, ель, пальмы и др., которые нуждаются в объединенных усилиях двух видов грибов для обеспечения ростовыми веществами в течение всей жизни. Широко применяемый на практике ростовой препарат — индолилуксусную кислоту (ИУК) — получают путем применения ацетатных вытяжек из семян некоторых сортов кукурузы и последующего ряда обработок. Нами были изготовлены ростовые препараты из различных чистых культур эндофитов и назвали мы их симбионтами, поскольку продуцентами таких препаратов являются симбионтные грибы растении. Для получения препарата Симбионт 1 использовался эндофит, выделенный из корней женьшеня (Гельцер, 1973а, б), для Симбионта 2 — эндофит из облепихи (Гельцер, Игнатьев, 1982). В отличие от ИУК, которая обычно используется в небольших разведениях — в 5-10 раз, препараты Симбионт нужно разводить в 10 000 и более раз, что оправдывает их название — гормональные препараты. Замачивание черенков в препарате ИУК рекомендуется производить на 8-12 ч (Турецкая, 1947), а с препаратом Симбионт не более чем на 30 мин после 10 000 разведении (рис. 26). Рис. 26. Влияние разных концентрации препарата Симбионт 1 на рост корней и побегов картофеля: 1 — контроль; 2 — обработка препаратом в разведении 0,0001, 3 — в разведении 0,00001
Рис. 26. Влияние разных концентрации препарата Симбионт 1 на рост корней и побегов картофеля: 1 — контроль; 2 — обработка препаратом в разведении 0,0001, 3 — в разведении 0,00001
Перед высевом семена с тонкой оболочкой (например, пшеницы, ржи), клубни картофеля, луковицы и мелкие семена огородных культур нужно опрыснуть нашими препаратами в указанной концентрации и подсушить, а семена с более прочной оболочкой (у риса, гречихи, огурца, подсолнечинка и др.) замачивать в таком же растворе в течение 30 мин и тоже подсушить. Для обработки 3-4 т посадочного картофеля на 1 га потребуется 1 мл нашего препарата развести в 10 л воды. Таким же количеством можно обработать 600 кг семян зерновых культур. Первые препараты были изготовлены из продуктов метаболизма чистых культур эндофитов, выделенных из корней овса, пшеницы, картофеля и многолетних сильно микотрофных растений пырея и мать–и–мачехи. Все указанные препараты не обладали специфичностью, и их можно было использовать для обработки семян любых культур. Однако, как видно из табл.9, где приведены результаты опыта с картофелем, заложенного на песчаных почвах Новозыбковской опытной станции ВИУАА в 6-кратном повторности, эффективность их действия обусловливалась степенью развития грибного симбиоза того растения, из которого были получены продуценты. В полевом опыте с пшеницей и теми же препаратами лучший результат также был получен при обработке семян препаратом из эндофитов мать–и–мачехи. Многочисленные лабораторные опыты, выполненные с применением методов учета роста колеоптилей, измерения длины корней при прорастании семян огурцов и пшеницы, подтвердили наличие зависимости эффективности гормональных препаратов от степени микотрофности корней растений, из которых был выделен эндофит. Становится понятным, почему для изготовления гормонального препарата широкого действия мы избрали сильно микотрофное многолетнее лекарственное растение женьшень, тонкие корни которого пронизаны гифами симбионтного гриба с многочисленными везикулами и арбускулами (рис. 27). Черный мицелий этого эндофита около 20 лет размножался в лаборатории без изменения высоких качеств препарата, что обеспечивалось удачным составом питательной среды с минимальным содержанием азота. Только недавно был вторично выделен эндофит из корней женьшеня, препарат из которого незначительно превосходил старый. Такой долгий срок активности указывает на длительную стабильность свойств препарата при строгой однородности его изготовления.
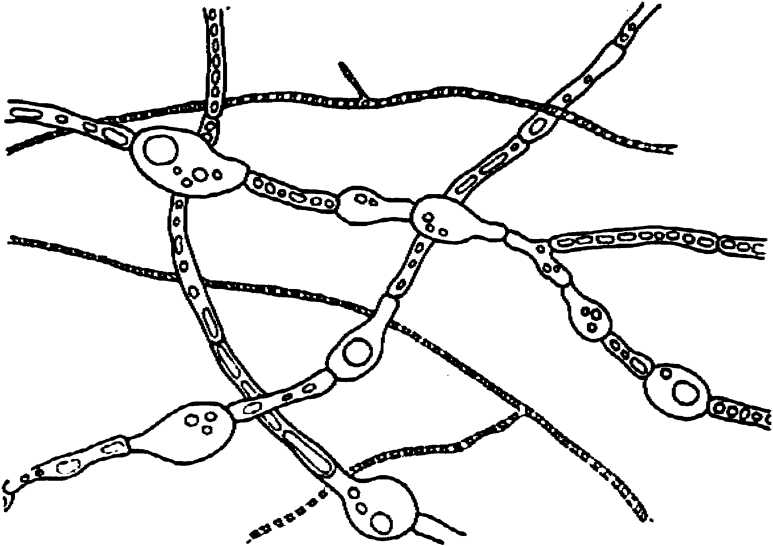 Рис. 27. Чистая культура эндофита из корней женьшеня
Рис. 27. Чистая культура эндофита из корней женьшеня
Таблица 9 Урожай картофеля (в среднем по повторностям) при обработке посадочных клубней ростовыми препаратами
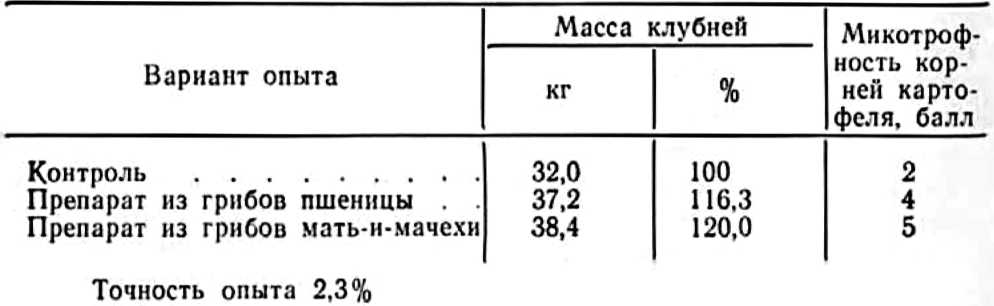
Гормональные препараты, изготовляемые из эндофитов, всегда следует применять совместно с одним из микроэлементов. К такому заключению мы пришли в результате работы по уточнению выводов физиологов о способности микроэлементов увеличивать содержание в растениях биологически активных веществ (Школьник, 1956). Так как последние синтезируются в растениях эндофитами, нужно было установить влияние микроэлементов на микотрофность растений. Вначале мы использовали вегетационные опыты с молибденом, проводимые в ВИУАА В. В. Яковлевой, которая изучала причину последействия молибдена на бобовых культурах. Нам удалось показать, что не только в год применения молибдена на бобовых культурах микотрофность их корней значительно превосходила контроль, но и на следующий год при посеве семян с обработанных вариантов развитие симбионтных грибов в их корнях было заметно лучше. Следовательно, последействие микроэлементов определяется наследственной передачей усиленной микотрофности семян в обработанных вариантах. Действие меди (здесь и в дальнейшем использовался 0,02% CuS04) на микотрофность картофеля изучалось в мелкоделяночном опыте с 3-кратной повторностью на участке ВИУАА по вспаханной дернине. Схема его была следующей: 1 — контроль; 2 — опрыскивание молодой ботвы 0,02% CuS04, 3 — внесение в лунку куста картофеля 0,05 г. меди + опрыскивание ею ботвы. Микотрофность корней определяли за лето 3 раза, Сорт картофеля Приекульский (табл. 10).
Таблица 10 Микотрофность и продуктивность картофеля при обработке растений микродоэами меди

Многократное повторение на Овощной опытной станции ТСХА наших опытов, в которых проверялось действие микроэлемента меди на микотрофность картофеля, не только подтвердило устойчивость ее влияния, но и показало, что эффективность совместного применения микроэлементов и гормональных препаратов, выражающаяся в значительном увеличении продуктивности растений и их микотрофности, заметно выше эффективности отдельных их воздействий. Первые производственные опыты, в которых изучалось влияние ростового препарата Симбионт 1 на урожайность картофеля, проводились в Брянской, Вологодской, Московской, Калининской и Воронежской областях в семеноводческих совхозах на площадях в 1 га без повторностей. Препарат рассылался в совхозы с непременным условием присылки в нашу лабораторию сухих корней с контрольного и опытного вариантов для изучения их микотрофности и сравнения степени микотрофности с урожайными данными. При хороших условиях роста картофеля опрыскивание клубней ростовым препаратом, а всходов — медью давало значительную прибавку урожая, при этом всегда уменьшалась изреженность посевов, увеличивались масса корневой системы и микотрофность, а также количество побегов (рис. 28). В тех случаях, когда проводились наблюдения за болезнями картофеля, исследователи устанавливали их уменьшение в вариантах с обработкой препаратом.
 Рис. 28. Влияние препарата на рост корней и побегов картофеля: 1 — в контроле и 2 — при обработке препаратом и медью
Рис. 28. Влияние препарата на рост корней и побегов картофеля: 1 — в контроле и 2 — при обработке препаратом и медью
Особый интерес представляет шестилетняя работа, выполненная в начале 70‑х годов на орошаемых сероземах Узбекистана Е. Г. Лучининой под руководством заведующего кафедрой овощеводства Ташкентского сельскохозяйственного института Н. Н. Балашова совместно с нами. В мелкоделяночных опытах изучалось влияние микродоз меди и ростового препарата Симбионт 1 на урожайность различных сортов картофеля. Повторность 4-6-кратная. Посадку клубней проводили в весенние и летние сроки сева. Под картофель вносили минеральные удобрения и обеспечивали оптимальный режим орошения. Согласно нашей инструкции, ростовым препаратом следовало опрыскивать клубни картофеля, а 0,02% CuS04 молодую ботву в период полных всходов. Однако уже после первого года работы Н. Н. Балашов предложил усилить действие меди путем внесения ее как в разбавленный препарат из расчета 0,02%, так и при обработке ботвы. После установления положительного действия двукратного применения меди этот прием был включен в инструкцию под названием вариант 2 меди. В табл. 11 и 12 приведены данные по урожайности картофеля сортов Лорх и Вольтман.
Таблица 11 Урожайность картофеля сорта Лорх (ц/ra) при обработках препаратом Симбионт 1 и медью

Таблица 12 Урожайность картофеля сорта Вольтман (ц/га) при обработках препаратом Симбионт 1 и медью

Можно было бы привести подобные результаты по таким сортам картофеля, как Приекульский ранний и Седов. Использование клубней, собранных с обработанных растений, для посадки на следующий год дало значительное повышение урожаев по сравнению с контролем. Повторная обработка клубней в потомстве подтвердила их способность улучшать наследственную природу растений в последующих поколениях и тем самым способствовать воспитанию более микотрофных семян и клубней картофеля высокого качества. Первая реакция растений на обработку ростовыми препаратами с микроэлементами (при оптимальных их концентрациях) семян или клубней проявляется в более дружном и раннем (на 2-4 дня) их прорастании. Положительное действие проведенной обработки хорошо определяется по степени развития корневой системы через месяц после появления всходов. В табл.13 приведены результаты действия препарата Симбионт 1 га урожай, листовую поверхность и массу корней картофеля сорта Приекульский в опыте, проведенном в Ташкентском сельскохозяйственном институте Е. Г. Лучининой и З. Иногамовым (1971). Повторность опыта 4-кратная.
Таблица 13 Развитие и урожай картофеля при обработке посадочных клубней препаратом Симбионт 1 и медью

Как видно из этой таблицы, масса корней и листовая поверхность куста картофеля при обработке клубней гормональным препаратом и медью, а затем опрыскивании ботвы медью удвоились, что способствовало повышению урожайности на 56,6%. Наряду с повышением урожаев клубней в опытных вариантах происходило увеличение количества побегов в кусте, исчезновение мозаичности листьев, снижение поражаемости готикой и вирусами. Данные о повышении иммунитета растений рассмотрены в главе 5. Препарат Симбионт 1 был испытан и на зерновых культурах. Так, в опытах, проведенных научным сотрудником Куйбышевского сельскохозяйственного института А. В. Бушевой на неорошаемых почвах Куйбышевской области в совхозе «Комсомолец», высевались ячмень сорта Одесский 36 и пшеница сорта Мироновская 808. В 1981 г. в связи с засухой (за вегетационный период выпало всего 46 мм осадков) урожай ячменя в контроле в среднем не превышал 10,6 ц/га, а прибавка в опытном варианте составила всего 2,6 ц/га. Немногим лучше были успехи в 1982 г., когда прибавка урожая ячменя от применения ростового препарата достигла 5,58 ц/га, а у пшеницы — 4,6 ц/га. Только в благополучном по осадкам 1983 г. при урожае ячменя в контроле 23,6 ц/га в опытных посевах было получено 37,2 ц/га, т. е. прибавка составила 13,6%, что свидетельствовало о высокой эффективности Симбионта 1. В 1983 г. А. В. Бушевой впервые был применен новый способ использования ростового препарата на озимой пшенице — опрыскивание весной ее всходов с самолета. Опыт проводился на площади 99 га: по 33 га в каждом из трех вариантов. На обработку 8 га посевов затрачивалось 1,2 т воды, в которую добавляли 2,4 г сернокислой меди, 4 и 6 мл препарата Симбионт 1 (0,50 и 0,75 мл/га). Надо сказать, что для обычной обработки семян зерновых культур идет 0,33 мл препарата в расчете на 1 га. Все фазы развития пшеницы в опытных вариантах, включая созревание, проходили на 3 дня раньше, а пораженность растений корневыми гнилями была на 15,9% ниже, чем в контроле. Урожайность пшеницы в контрольных посевах составила 33,8 ц/га, а в опытных была соответственно на 14,5 и 24,9 ц/га, или на 42,9 и 73,7%, выше (НСР05 1,6 ц/га). Из приведенных примеров с очевидностью следует, что эффективное применение ростовых препаратов в земледелии возможно только при хороших условиях роста растении, в частности при орошении. Мы уже давно отмечали, что с повышением урожая в контроле возрастает эффективность применения ростовых препаратов и поэтому не следует ожидать значительного увеличения продуктивности растений при низком ее уровне в контроле, а также давать оценку действия препарата в указанных условиях. При использовании ростовых препаратов в закрытом грунте на огурцах и томатах часто наблюдалось снижение их эффективности при излишней экономии на освещении и отоплении оранжерей, в особенности в первый период роста растений (Гельцер, 1973б). Вторым неблагоприятным фактором для деятельности эндофитов является применение высоких доз минерального азота (рис. 29), от которых страдают все микроорганизмы, обладающие способностью к азотфиксации. Сейчас стало очевидным, что установленное еще во времена Либиха вредное действие на растение высоких доз азота связано с морфологической деградацией строения симбионтных грибов в корневой системе. Гифы этих грибов, питающихся готовым азотом, значительно увеличиваются в размере, так же как и везикулы. Внутри последних мы не наблюдаем скопления продуктов синтеза эндофитов, что указывает на нарушение их основных функций. Отсюда следует, что при необходимости применения больших доз азота нужно вносить его дробно, в 2-3 срока.
 Рис. 29. Влияние разных доз азота на рост растения
Рис. 29. Влияние разных доз азота на рост растения
Очень важно при использовании препарата соблюдать рекомендуемые концентрации и сроки его воздействия на те или иные объекты. В процессе испытания влияния различных концентраций препарата Симбионт 1 нами было установлено, что примененный в более высокой дозировке он вместо стимулирования оказывает угнетающее действие. При более значительном сроке воздействия против оптимального также происходит торможение в развитии растении. Например, обработанные семена всходят на 2-4 дня позже, а не на столько же дней раньше, как наблюдается при оптимальной экспозиции обработки. Таким образом, стимулирующие препараты могут проявлять себя как ингибиторы. К такому же выводу пришли научные сотрудники Молдавской академии наук П. Н. Разумовский, Д. И. Атаманюк, М. А. Златоуст и Г. И. Якимова (1975). Эти авторы указывают, что при расшифровке всего комплекса биоса в нем обнаружены витамины группы В, биологически активные липиды и азотистые соединения, к рассмотрению которых мы переходим. Близкое к указанному определение биоса былодано Н. Г. Холодным (1939). Витамины и ферменты. Способность эндофитов синтезировать витамины подтверждается возможностью их многолетнего культивирования в лабораторных питательных средах без добавок витаминов извне, что указывает на их «автотрофность» по отношению к витаминам. Все же, поскольку не исключена возможность участия витаминов в стимулирующем действии продуктов метаболизма эндофитов, мы использовали разработанный Е. Н. Одинцовой (1959) микробиологический метод определения их наличия в нативной жидкости симбионтного гриба, выделенного из корней женьшеня. Тест–объектами были дрожжевые и мицелиальные грибки, реагирующие на определенные витамины. Испытывались витамины В1, В3, В5, В6, Н. В нативной жидкости установлено наличие указанных витаминов, представляющих собой продукты синтеза чистых культур эндофитов. Наиболее отчетливо качественная реакция обнаружила присутствие пиридоксина (В6), пантотеновой кислоты (В3) и биотина (Н). Количественно определяли только рибофлавин (В2) в связи с его большим значением для жизнедеятельности растений и участием в процессе их дыхания. Определение проводилось на электронном флуорометре по методу, разработанному К. Л. Поволоцкой с сотрудниками в Институте биохимии АН СССР им. Баха. В природных объектах рибофлавин встречается как в прочносвязанном с белками, так и в свободном состоянии. В первом случае необходимо проведение ферментативного и кислотного гидролиза, после чего производится осаждение и очистка растворов от посторонних примесей и по интенсивности флуоресценции определяется количество витамина с помощью шкалы гальванометра. Для количественного анализа витаминов в чистых культурах эндофитов мы использовали как мицелий гриба, так и его нативную жидкость. Раздельное определение рибофлавина в культурах эндофитов, выделенных из корней сильно микотрофных растений ольхи и ирисов, установило его наличие в обеих фракциях. Большее содержание его в нативной жидкости (табл. 14) указывает на способность симбионтного гриба выделять витамины во внешнюю среду и снабжать ими растение в процессе их совместной жизни.
Таблица 14 Количество рибофлавина в чистых культурах эндофитов (мкг на 1 л питательной среды)

Как и в предыдущих исследованиях биологически активных веществ эндофитов, в этом опыте было установлено, что синтез ими витаминов определяется интенсивностью микотрофности растений, из которых были выделены грибы. После выявления нами сильной микотрофности у картофеля на высокогорном стационаре АН СССР клубни различных сортов были направлены Е. А. Буш в Институт физиологии Грузинской академии наук для определения содержания в них витаминов. Результаты этих исследовании указывают, что картофель, выращенный в горных условиях, можно использовать как витаминный продукт (табл. 15).
Таблица 15 Содержание витаминов (мг на 100 г. сырой массы) в клубнях различных сортов картофеля в горных условиях

H. Г. Холодный (1939), присоединял витамины к группе фитогормонов, отметил их наличие в семенах и особенно в семенах злаковых растений, в которых витамины группы В находятся в зародыше и в алейроновом слое эндосперма. Не было необходимости в проверке способности эндофитов синтезировать ферменты, поскольку жизненные процессы их, как и всех мицелярных грибов, катализируются экзо– и эндоферментами. Известно, что ферменты грибов участвуют не только в реакциях расщепления, но и реакциях синтеза (Лилли, Барнетт, 1953). Представляло интерес сравнить набор ферментов симбионтных и сапрофитных грибов, но такая большая работа выходила за пределы возможностей нашей лаборатории. Б. А. Рубиным с сотрудниками (1945) было установлено, что при посеве сахарной свеклы в горах в районе Алма—Аты с увеличением высоты над уровнем моря от 1000 до 2500 м не только в 5 раз повышается содержание сахара в плодах, но значительно возрастает в клетках растении количество окислительных ферментов — пероксидаз и полифенолоксидаз. Эти ферменты обеспечивают устойчивость растений к патогенным агентам и кутинизацию тканей при их механических повреждениях. Для нас очевидно, что повышение защитного действия ферментов связано с увеличением микотрофности культур на больших высотах. Когда–то считали, что сами растения не синтезируют ферментов, которые им не нужны, но после выявления участия ферментов в процессе дыхания в науке утвердилось мнение об их синтезе растениями. Об участии в этом процессе эндофитов никто не упоминает, что, по нашему мнению, усложнило правильное решение данного вопроса. Только в теории дыхания В. И. Палладина (1950) отмечается существование в растительной ткани посредников дыхания, названных им «дыхательными хромогенами», которые при окислении превращаются в пигменты. Последнее указание автора можно отнести к симбионтным грибам растений, так как пигменты синтезируют эндофиты. Сейчас при изучении чистых культур эндофитов можно внести ясность в сложный вопрос о дыхании растений. Аминокислоты. Изучение аминокислот в богатом азотом мицелии гриба или в его нативной жидкости представляет известные трудности из–за наличия слизистых веществ, мешающих получению четкой хроматограммы. В связи с этим их изучение проводилось в 50 мл спиртовой вытяжки, очищенной от примесей стерильным углем, что соответствовало 150 мл нативной жидкости гриба, выделенного из корней женьшеня. Указанная работа проводилась в двух различных научных учреждениях: первый раз в 1968 г. С. М. Клуновой в Московском педагогическом институте, второй раз Е. Е. Колидзевой на кафедре кормления животных в Московской сельскохозяйственной академии. Использовались разные партии гормонального препарата Симбионт 1, приготовленные из одной и той же культуры симбионтного гриба. Во втором анализе было дополнительно установлено еще 3 аминокислоты: цистнн, гистидин и метионин, которые не были обнаружены в первом анализе, Всего было выявлено 15 аминокислот, синтезируемых чистыми культурами эндофитов из женьшеня (табл. 16).
Таблица 16 Синтез аминокислот (мг/л) из эндофитов женьшеня

Выявление аминокислот в чистых культурах симбионтных грибов в связи с их способностью к синтезу этих соединений по–новому освещает одну из наиболее сложных проблем образования белковых веществ в растениях. Открыт новый путь в разработке воздействий, направленных на увеличение количества аминокислот и нужного качества их состава в сельскохозяйственных растениях: накопление растительного белка можно обеспечить, стимулируя грибной симбиоз как агротехническими, так и селекционными средствами, например, подбирая родительские пары для скрещивания при учете наследственной передачи природных и приобретенных свойств эндофитов. Выше мы показали, что лучшие сорта пшениц советских селекционеров обладают сильной микотрофностыо, обеспечивающей высокую белковость зерна. Нужно подчеркнуть, что применяемые для повышения белковости культур высокие дозы минерального азота часто не достигают своей цели и губительно действуют на развитие грибных симбионтов растений. Это способствует снижению способности эндофитов к синтезу аминокислот и увеличению уязвимости растений патогенами, тогда как превалирование фосфорных и калийных удобрении, применение микроудобрений, гормональных препаратов и органических удобрений, как и посевы по пласту трав, значительно повышают активность эндофитов и продуктов их синтеза. Изменения, происходящие в морфологии эндофитов в корнях растений, растущих на почвах, обильно удобренных минеральным азотом, настолько велики, что многие исследователи, изучая их под микроскопом, отмечают вредное влияние избытка минерального азота на нормальное развитие эндофитов. Расширение гиф, не сопровождаемое накоплением хорошо окрашиваемых белковых веществ в везикулах, свидетельствует о том, что вместо снабжения растений аминокислотами эндофиты в указанных условиях превращаются в потребителей избыточного азота. Отчетливо проявляется вредность избытка азота, применяемого при выращивании одноклеточных культур. Он блокирует способность эндофитов к азотфиксации, что заставило нас снизить обычно применяемое количество азота в питательных средах при получении чистых культур эндофитов из тканевых культур. Синтез жиров. Процесс образования жиров в растениях всегда был наиболее сложным вопросом для физиологов. Е. А. Бочаров, С. Б. Климов и Д. А. Джанумов (1979) считали, что у озимой пшеницы жиры возникают в хлоропластах первичного листа, а интенсивность этого процесса зависит от уровня фотосинтеза. Авторы напомнили, что синтез липидов является наиболее энергоемким процессом, требующим на 25% больше энергии, чем синтез аминокислот, и на 46% больше, чем синтез глюкозы. В связи с этим они пришли к заключению, что наиболее подходящим местом для образования липидов являются хлоропласты. Такой способ выбора места для синтеза липидов лишний раз показывает, насколько современная физиология растений игнорирует значение многократно доказанного положения о наличии симбиотрофного существования растительного мира и об участии энергии эндофитов в процессах синтеза многих веществ, необходимых для жизни растений. Способность эндофитов синтезировать липиды не является неожиданностью, так как в науке установлена такая возможность и для многих микроскопических грибов и актиномицетов. При остром недостатке жиров в Германии после первой мировой войны ученые пытались получить их из различных культур грибов, но в ту пору их работы не увенчались успехом. Только в 40‑х годах Старке, Хессе и др. (цит. по Лилл и и Барнетт, 1953) было установлено, что для синтеза жиров грибами необходимо создать в питательных средах определенное соотношение между углеводами и азотом. Избыток азота в среде блокирует образование жира, тогда как избыток углеводов при недостатке азота обеспечивает его синтез микроорганизмами. Этот вывод наиболее соответствует разработанному нами методу выращивания чистых культур эндофитов в искусственных средах. В естественных условиях жизни эндофитов в корнях происходит постоянный отток липидов в надземную часть растения, что и освобождает клетки мицелия и везикул от избыточного их накопления. При использовании препарата Судана 3, который окрашивает липиды в оранжевый цвет, можно выявить их образование в грифах гриба и накопление в везикулах. Установленное нами хорошее соотношение между масличностью семян и степенью микотрофности корней (рис. 30) у разных сортов подсолнечника, выведенных академиком В. С. Пустовойтом, подтверждает наше утверждение о синтезе липидов эндофитами, хотя сам В. С. Пустовойт считал, что липиды не могут продвигаться по растению от корней к семенам и их образование должно происходить в местах их накопления, т. е. в семенах. Поэтому он не рекомендовал наши данные к опубликованию.
 Рис. 30. Везикулы в корнях сильно масличного подсолнечника сорта ВНИИМК-6540
Рис. 30. Везикулы в корнях сильно масличного подсолнечника сорта ВНИИМК-6540
Пигменты. В научной литературе о растениях большое место уделяется зеленому пигменту — хлорофиллу. О причинах возникновения остальных многочисленных пигментов, раскрашивающих природу, мы не находим удовлетворяющих нас данных. Почему незабудка всегда голубая, а мак — красный? После выделения чистых культур эндофитов мы с достоверностью можем утверждать, что все эндофиты синтезируют цветные пигменты, при наследственной передаче которых каждый вид растения получает свою окраску цветка и плодов. Замечательную, красочную картину представляют собой колбы с чистыми культурами эндофитов, выделенными в корнях различных растений. При повторных выделениях из разных местообитаний они в продолжение многих лет повторяют свойственную им пигментацию. Так, чистые культуры эндофитов, выделенные из корней и завязей липы и яблони (антоновки), всегда были окрашены в желтый цвет (Cel'tser, 1965, Fig. А). Такая же окраска была у эндофитов из корней герани, цветущей розовыми и красными цветами, но эндофиты из герани с фиолетовыми цветами имели фиолетовую окраску, тождественную окраске из корней крыжовника и картофеля. Красный пигмент всегда синтезируют эндофиты из корней алоэ, всех сортов пшениц, ржи, томатов, клевера, но вишневый цвет мы наблюдали только у эндофитов, выделенных из корней вишни. Черного цвета был мицелий из корней сильно микотрофных черники, брусники, ирисов, женьшеня, мексиканской аралии, вереска, мать–и–мачехи, хотя эндофиты из цветочных бутонов мать–и–мачехи были окрашены в золотисто–желтый цвет, из цветущих веток вереска — в фиолетовый, присущий цветам этого растения. Иногда пигменты эндофитов переходят в раствор и окрашивают нативную жидкость гриба, тогда как в других случаях окраска закрепляется в мицелии. Никогда мы не наблюдали у эндофитов синтеза зеленого пигмента, который создается на свету. Возможно, что какой–то пигмент эндофита на свету приобретает зеленый цвет и окрашивает хлорофилл так же, как меняется на свету окраска цветов, завязей и плодов по сравнению с их окраской в темноте. Из краткого обзора данных о продуктах синтеза чистых культур эндофитов, изучение которых должно быть продолжено соответствующими институтами, с очевидностью следует, что жизненно важные процессы растений осуществляются при сочетании двух разных по своей природе организмов — растительного и микробного происхождения. Главная задача первого заключается в создании органического вещества из углекислоты и минеральных солей при непременном участии энергии солнечного или светового луча. Второй организм — симбионтные грибы — синтезируют описанные выше необходимые для растений вещества на основе энергии, добытой ими при использовании части продуктов фотосинтеза своего партнера. Наследственная передача эндофитов гарантирует целостность этой системы. Продуктивность растений в равной степени зависит от усилий обоих членов этого созданного природой симбиоза, к сожалению, еще недостаточно изученного человеком и потому малоиспользуемого в селекции и земледелии. Необходимо напомнить, что основная идея о создании органического мира при симбиотрофном сочетании двух различных плазм была предложена К. С. Мережковским в самом начале нашего века (1909), но тогда она была воспринята как фантазия ученого. Первую плазму, из которой состоят все микроорганизмы, он назвал микоплазмой, а вторую, характерную для всех растений и животных, — амебоплазмой, но она всегда сочетается с микоплазмой. Может ли одна плазма осуществить столь различные функции растений, требующие различных источников энергии? Мы не предполагаем критически обсуждать все положения, выдвинутые К. С. Мережковским в самом начале развития таких наук, как микробиология и физиология растений, тем более что и в настоящее время эти науки не склонны рассматривать растения как симбиотрофные организмы. Ценность замечательной идеи К. С. Мережковского о симбиогепезе двух различных плазм в органическом мире заключается в предвосхищении открытия двух начал в симбиотрофном существовании растительного мира. Подробно его учение изложено в III главе книги Л. Н. Хахиной «Проблемы симбиогенеза» (1979). Нужно присоединиться к утверждению этого автора, что К. С. Мережковский обладал «редким даром научного предвидения». В 60‑х годах интересы довольно широкого круга ученых в нашей стране были сосредоточены на изучении различных химических препаратов, оказывающих стимулирующее влияние на образование белковых веществ, ДНК, РНК, углеводов, рост и продуктивность культур, неполегаемость зерновых. К таким препаратам относятся кинетин, гибберелловая кислота, гетероауксин, полифенол, хлорхолинхлорид, углекислый калий и многие другие соединения. Результаты этих исследований были доложены на конференции Прибалтийских республик по вопросам стимулирования растений, животных и микроорганизмов (лето 1969 г.) и опубликованы в книге «Стимуляторы роста организмов». В результате рассмотрения докладов, посвященных растениям, становится очевидным, что никто из их авторов не учел наличия симбиотрофной природы изучаемых культур и необходимости воздействия на стимуляцию растений через повышение их микотрофности, которая обеспечивает биологически активными веществами корни и надземную часть растений. Нетрудно доказать, что положительное действие примененных препаратов определялось их влиянием на микотрофность данного растения, в чем авторы могли бы убедиться при микроскопическом изучении тонких корней после их мацерации. Большой интерес представляли доклады о стимулирующем действии различных витаминов, которое тоже определяется воздействием на симбионтные грибы растений. Если уже сейчас не вызывает сомнений возможность значительного повышения продуктивности культур путем усиления их микотрофности, то можно рассчитывать, что дальнейшие исследования научных коллективов в указанном направлении обеспечат значительные сдвиги в практическом применении достижений этой науки.
Выводы
1. Изучение продуктов синтеза чистых культур эндофитов, выбеленных из корней растений, с достоверностью показало, что эндофиты образуют гормональные вещества, эффективность которых определяется степенью микотрофности корней, из которых они были выделены. Изготовленные из них ростовые препараты, названные нами «симбионтами», стимулируют развитие корневых систем растений, повышают микотрофность и продуктивность культур. Этими препаратами можно обрабатывать семена и клубни перед посевом, опрыскивать всходы, намачивать черенки. 2. Применение гормональных препаратов в сочетании с одним из микроэлементов способствует повышению эффективности их действия. Хорошие условия роста обработанных препаратом культур являются обязательными для положительного действия ростовых препаратов. 3. Кроме гормональных веществ, эндофиты синтезируют в растениях витамины, ферменты, липиды и пигменты разного цвета, взамен чего они получают от растения продукты его фотосинтеза, которые служат для них пищей и источником энергии. 4. Уже перечисленные факторы, число которых при дальнейшем рассмотрении результатов наших исследований будет увеличено, определяют значимость симбиотрофного существования растительного мира и невозможность наличия в природе растений вне этого симбиоза.5. Микробиологическая теория иммунитета растений
В современной медицине признано, что иммунная система человека и животных состоит из белых клеток крови двух типов — В и Т, защищающих организм от вирусов, патогенных бактерий и раковых образований. С возрастом человека клетки обоих типов ослабляют свое действие, что приводит к снижению иммунитета в старости (Курцмен и Гордон, 1982). По отношению к растениям до последнего времени наукой не была разработана общая система их иммунитета, хотя и предлагались отдельные приемы воздействия на растение, способствующие повышению их невосприимчивости к различным патогенам. Ограничивающим фактором для разработки иммунной системы являлось ошибочное представление об автотрофности растительного мира, которое не учитывало его симбиотрофное существование с микроорганизмами, снабжающими растение такими мобильными продуктами, как гормональиые вещества, перемещающиеся по всему растению. В трудах выдающегося ученого Н. И. Вавилова, для которого вопрос иммунитета растений был центральным на протяжении всей его научной деятельности, мы па шли только одно указание о симбиозе растений с эндофитами (Вавилов, 1964, с. 175): «Явление фагоцитоза у растений в случаях эндотрофной микоризы представляет большой интерес и заслуживает дальнейшего изучения, но пока, насколько нам известно, нет определенных данных о значительной роли фагоцитоза у растений в явлениях иммунитета». Основной причиной отсутствия общей системы иммунитета у растений Н. М. Вавилов (1964) считал не невозможность образования у них антител, а неспособность их передвижения в растительном организме в связи с отсутствием общего тока жидкости, подобно крови у животных. Такое предположение неправомочно не только для нашего времени, но и для первой четверти века, когда была доказана способность растений приходить на помощь каждому нанесенному ему повреждению при наличии близлежащего пучка тонких сосудов, по которому двигаются гормональные вещества, создающие защитную каллюсную ткань (Habcrlandt, 1922). Н. Г. Холодный (1939) в своем труде «Фитогормоны» подробно рассмотрел работы Г. Хаберланда и в результате своих исследовании по этому вопросу пришел к выводу, что каждый растительный организм и каждый его орган для нормального прохождения стадий в процессе развития нуждается в целом комплексе различных активных веществ, которыми его снабжает само растение. Формулировка Ф. Вента, что без ростовых веществ нет роста (Went, 1928), совпадает с выводом Н. Г. Холодного. В предыдущих главах мы показали, что все биологически активные вещества синтезируют эндофиты в корнях растения и снабжают ими надземные его части, что указывает на возможность их миграции внутри растения. Ниже мы на экспериментальных данных постараемся доказать наличие иммунной системы у растений, для чего вначале нужно установить существование общих реакций растений на применение различных приемов, обеспечивающих повышение их иммунитета. Еще Н. И. Вавилов (1964) отметил, что сложность установления природы иммунитета у растений связана с невозможностью свести ее к единой физиологической или биологической причине. Изучая в начале 60‑х годов лучшие сорта озимых пшениц советских селекционеров, такие, как Одесская 3 и 16, Безостная 1 селекции П. П. Лукьяненко, Мироновские 216 и 808 селекции В. Н. Ремесло, Киевская 839 и др., а также яровую пшеницу Барнаульская 32, которая в благоприятные годы давала урожай до 40 ц/га, мы (Гельцер, Коваль, 1965) установили в корнях этих сортов исключительно сильную микотрофность. Обильное развитие не только гиф грибов, но и многочисленных крупных везикул, часто грушевидной формы (рис. 31), указывало на активный симбиоз всех этих сортов пшениц с симбионтными грибами при их высшей оценке в 5 баллов. Наши четырехлетние исследования показали, что в каждом хорошем сорте пшеницы обеспечено прямое соотношение между тремя факторами: продуктивностью, устойчивостью к патогенам и интенсивной микотрофностью, из которых два первых были созданы путем применения различных селекционных приемов, тогда как третий, обнаруженный нами, — сильная микотрофность — появляется без специальных усилии авторов сортов и, очевидно, без их ведома. Они не проявили к этому явлению интереса даже тогда, когда ознакомились с опубликованными и присланными им результатами наших исследований микотрофности их сортов. Рис. 31. Скопление везикул о корнях пшеницы Одесская 16
Рис. 31. Скопление везикул о корнях пшеницы Одесская 16
Второй культурой, которой мы уделили большое внимание, был вегетативно размножаемый картофель. В южных областях в неорошаемых условиях часто его микотрофность нельзя визуально обнаружить под микроскопом. В указанных условиях он подвергается вырождению. В орошаемых условиях Средней Азии картофель можно культивировать только при таких сроках посадки, при которых период роста клубней не совпадает с самыми жаркими месяцами (Балашов, 1959). В сухом климате картофель не поражается фитофторозом, но страдает от вирусных заболеваний и грибов, вызывающих болезни увядания, крапчатость листьев, готику клубней и другие заболевания, приводящие к вырождению сорта и снижению его урожайности. Рекомендуемые в Узбекистане частые поливы картофеля способствуют периодическому охлаждению почвы. В совместной 6-летней работе в Узбекистане с H. Н. Балашовым и Е. Г. Лучининой было установлено, что увеличение микотрофности у картофеля различных сортов на 2-3 балла при обработке клубней перед посадкой гормональным препаратом Симбионт 1 с сернокислой медью обеспечивает повышение его устойчивости против вирусов и патогенных грибов, что видно, например, из табл.17 по сортам Вольтман и Лорх. Изучение патогенов проводилось в период цветения картофеля Е. Р. Лучининой как визуальным, так и серологическим методами. Опыты закладывались на небольших делянках в 4- и 6-кратной повторности. Подобные результаты были получены на сортах картофеля Приекульский и Седов. Повышение урожайности картофеля на 25-27 ц/га в этих опытах соответствует усилению микотрофности на 2-3 балла (см. табл.11, 12, 13). Больших успехов мы достигли, применив повторную обработку гормональным препаратом с микродозами меди в потомстве картофеля сорта Лорх. И здесь отмечено увеличение интенсивности грибного симбиоза и связанное с ним повышение устойчивости к патогенам и урожайности (табл. 18).
Таблица 17 Оздоровление картофеля (% от общего количества растений) при обработке клубней препаратом Симбионт 1 и медью

Таблица 18 Оздоровление и урожайность картофеля сорта Лорх при повторной обработке в потомстве препаратом Симбионт 1 и медью

Уменьшение вирусной инфекции при увеличении листовой поверхности, количества побегов в среднем на I куст на 2,5 и повышение урожайности картофеля на 54 ц/га указывают на правильность найденных приемов постепенного» из года в год усиления микотрофностн культур на 2-3 балла при поддержании ее па уровне 5 баллов. Указанные приемы можно рекомендовать для элитных посевов всех культур, что предотвратит вырождение хороших сортов. В данном случае, когда основной способ воздействия на растения сводился к усилению их симбиоза с эндофитами, а привел к увеличению продуктивности и устойчивости к патогенам, уже нельзя считать микотрофность случайным фактором, органически не связанным с двумя другими факторами, определяющими ценность нового сорта. Самый большой эффект от одноразового применения гормонального препарата в сочетании с микродозами меди был получен на орошаемых плодородных почвах Куйбышевской области в картофелеводческом совхозе «Кутулукский» в посадках картофеля сорта Приекульский. Опыт проводился под руководством заведующего кафедрой физиологии растений Куйбышевского сельскохозяйственного института Г. А. Зака на площади 3 га в 10-кратной повторности (табл. 19).
Таблица 19 Оздоровление и урожайность картофеля сорта Приекульский при обработке препаратом Симбионт 1 и медью

В этом опыте только путем повышения микотрофности картофеля при действии гормонального препарата и меди была значительно повышена устойчивость культуры к такому сложному заболеванию, как столбур, что способствовало повышению урожайности почти на 90%. Немалую роль сыграло здесь орошение, обеспечившее хорошие условия роста растений и периодическое снижение температуры почвы. В результате исследований микотрофности картофеля в различных зонах (Гельцер, 1963а, 1976б), а также исследований других авторов было доказано, что в северных районах и па больших высотах эта вегетативно размножаемая культура более микотрофна и устойчива к патогенам, чем на юге. Не случайно в различных странах сложилась практика использования посадочного картофеля, привезенного из более северных или вышерасположенных горных районов. Еще индейцы на родине картофеля выращивали посадочные клубни на высоте 4000 м над уровнем моря, чтобы потом высаживать их на высоте 2000 м. Ранее большинство авторов, изучающих «лечение картофеля высотой», считали, что получение здорового посадочного картофеля объясняется его заражением активными микоризными грибами в горных почвах, на которых рос дикий паслен. Однако перенос этих почв в качестве источника заражения на равнину не давал положительных результатов, так как успех «горного воспитания» заключается не только в заражении корней картофеля эндофитами, но и обилии углеводов для их питания при повышенном фотосинтезе в горных условиях (рис. 32).
 Рис. 32. Везикулы эндофитов в корнях картофеля Советский, выращенного в Южной Осетии на высоте 2200 м над уровнем моря
Рис. 32. Везикулы эндофитов в корнях картофеля Советский, выращенного в Южной Осетии на высоте 2200 м над уровнем моря
Особый интерес представляет разработанный французскими учеными Ж. Костантэном и др. (Costantin et al., 1934) метод оздоровления картофеля путем выращивания его на больших высотах для усиления его микотрофности. Этот прием был широко использован во Франции при выращивании здорового посевного картофеля для ее бывших южных колоний, в которых эта культура быстро вырождалась. Ш. Крепен с сотрудниками (Crepin, Bustarret, Chevalier, 1938) считали, что, чем легче вырождается сорт картофеля, тем в более высокорасположенных районах нужно культивировать его элитный посадочный материал. Некоторые сорта уже на уровне 600-700 м приобретают нужную устойчивость к патогенам, тогда как другие — только на высоте 1500 м над уровнем моря. Авторы считали, что полученный на указанной высоте здоровый элитный картофель можно для дальнейшего размножения выращивать на высоте 600-800 м. До сих пор этот прием повышения микотрофности и иммунитета картофеля применяется во Франции. В нашей стране высокую оценку горного картофеля дали А. М. Фаворов и В. Г. Блох (1962), которые в Закарпатской области на высоте 800-900 м над уровнем моря изучили сорт картофеля Тромбита, семена которого, выращенные в долине, обеспечивали не только получение высоких урожаев картофеля порядка 327 ц/га, но и устойчивость к фитофторе как первого, так и второго поколения. Авторы считали, что горные условия благоприятны для воспитания родительских пар, устойчивых к фитофторозу картофеля. Можно ли восстановить вырожденный и уже исключенный из списка рекомендуемых, но в прошлом хороший сорт картофеля путем повышения его микотрофности при обработке посадочного материала гормональным препаратом И медью? Для решения этого вопроса мы выбрали сорт Ранняя Роза, который уже около 100 лет успешно возделывается только в горных условиях. Мелкие вырожденные клубни этого сорта массой в 20-30 г. были обработаны перед посадкой препаратом Симбионт 1 и микродозой сернокислой меди и высажены на Овощной опытной станции Тимирязевской академии. В первый год масса выращенных клубней повысилась до 70-90 г, а в корнях растений наблюдались гифы эндофитов с оценкой микотрофности в 1 балл. Эти клубни вторично на следующий год были обработаны так же, после чего масса клубней увеличилась до 150-220 г, не выявлено было и видимых поражений патогенами. В корнях появился не только мицелий эндофитов, но и удлиненной формы везикулы, часто в скоплениях, с оценкой микотрофностн в 3 балла. В дальнейшем опыт продолжил Н. Н. Игнатьев, который при ежегодной обработке клубней этого прекрасного сорта картофеля получает клубни массой более 300 г, хотя условия их роста нельзя считать хорошими (под фруктовыми деревьями). Возможно, целесообразнее было бы восстановить прежние хорошие сорта, такие, как Лорх, Ранняя Роза или Магнум—Бонум, устойчивость которого к фитофторе была высоко оценена Н. И. Вавиловым (1964, с. 302), чем размножать слабоустойчивые новые сорта картофеля. Изучение действия наших гормональных препаратов и микродоз сернокислой меди на фитофтору многократно проводилось в различных колхозах и совхозах в средней полосе Союза. Так как эти опыты в производственных условиях обычно не сопровождались детальным исследованием всех болезней, мы не приводим их результаты в этой главе. Укажем только на совхоз «Дружба» Ярославской области, где отказались от постановки опытов, но применяли обработку нашими препаратами клубней перед их 'посадкой на больших площадях в течение нескольких лет. Это настолько освободило картофель от фитофтороза, что специальная комиссия после осмотра урожая разрешила продавать его в качестве посадочного материала. Даже одноразовое применение препарата при хороших условиях роста растений обеспечивает устойчивость к фитофторозу. На рис.33 видно, что листья картофеля, выращенного из обработанных препаратом клубней, не заражались в чашках Петри при обильном внесении спор гриба, вызывающего фитофтороз, тогда как листья в контроле сразу заразились и почернели.
 Рис. 33. Листья картофеля: 1 — заразившиеся спорами фитофторы; 2 — не заразившиеся фитофторой (от картофеля, обработанного препаратом)
Рис. 33. Листья картофеля: 1 — заразившиеся спорами фитофторы; 2 — не заразившиеся фитофторой (от картофеля, обработанного препаратом)
О широко известном приеме повышения иммунитета вегетативно размножаемого картофеля мы коротко упомянули в главе 1. Он состоит в выращивании «севка» из семян, на что уходит вегетационный сезон. Сравнительную микотрофность семенных и вегетативно размноженных 5 сортов картофеля Мы изучали 2 года в опытах В. И. Эдельштейна (1957) на Овощной опытной станции Московской сельскохозяйственной академии. Отличительной особенностью семенных вариантов было более раннее развитие эндофитов в корнях, чем у длительно вегетативно размножаемого картофеля, у которого изучение микотрофности можно начинать не ранее начала цветения. Такое запаздывание в развитии микотрофности в корнях у вегетативно размножаемых растений является основной причиной ослабления у них этого фактора. Осенью микотрофность в семенных посевах на 2 балла выше, чем при вегетативном размножении, что выражалось не только в лучшем развитии гиф, но и в больших количествах и размерах везикул (Гельцер, Чередниченко, I960), Урожай в первом случае достигал 371 и 372 ц/га, а в последнем — 262 и 230 ц/га (Эдсльштейн, 1957), Нужно отметить высокую устойчивость картофеля к патогенам в семенных посевах. Нам известна еще одна работа, в которой сравнивалась эффективность вегетативного и семенного размножения на примере лаванды в Никитском ботаническом саду (Неуструева, Маляренко, Шкурят, 1962). В этом опыте плантации лаванды при вегетативном размножении уже через 7-8 лет обнаруживали признаки старения: снижение урожая соцветий и выхода эфирного масла. Плантации, выращенные из семян, оказались более многолетними и обладали большей устойчивостью к болезням и неблагоприятным метеорологическим условиям. Изучение микотрофности в данном опыте не проводилось, но лучшая сопротивляемость к патогенам указывает на увеличение микотрофности в семенных посевах. Прием повышения устойчивости культур к патогенам путем прививки больных растений на здоровые подвои, который получил название «вегетативной гибридизации», широко используется для сельскохозяйственных культур. Нас заинтересовал вопрос, можно ли путем изучения микотрофности установить качество подвоев? Вскоре представился случай заняться этим вплотную. Дело в том, что разработанными в нашей лаборатории микотрофного типа 'питания растений методами заинтересовались сотрудники лаборатории физиологии Государственного Никитского ботанического сада и привезли нам для изучения корневые системы различных подвоев, используемых ими для вегетативной гибридизации. Исследования показали, что только немногие из привезенных объектов обладали высокой микотрофностью, но те, у которых она выявилась, считались лучшими и наиболее часто употребляемыми в Ботаническом саду. Это дало возможность рекомендовать селекционерам, применяющим вегетативную гибридизацию, подбирать подвои по степени их микотрофности. Подтверждение нашего вывода о важности применения сильно микотрофных подвоев мы обнаружили в работе Ф. С. Солодовникова (1939), который привил культурный сорт картофеля Альма на дикий картофель Solarium demisum. После заражения подвоя и привоя фитофторой автор установил, что как дикий подвой, так и культурный привой или совсем не заражались фитофторой, или иногда очень слабо заражались до степени оценки в 1 балл. Мы изучали микотрофность S. demisum, выращенного в Московском отделении ВИРа в Михневе и в отделении этого института под Ленинградом в Пушкино. В обоих случаях мы установили сильную микотрофность диких подвоев, несмотря на длительное их произрастание в наших условиях, что и предохранило как подвой, так и привой от заражения фитофторой. Б. А. Рубин (1963) подчеркнул значение прививок на иммунных видах подвоев, которые способствуют созданию менее восприимчивых к заболеваниям форм подсолнечника, хлопчатника, табака и других культур. Он объяснил это явление синтезом в клетках корней таких подвоев высокоактивных в физиологическом отношении соединений, в том числе пигментных систем и витаминов. Здесь, как и в других ценных работах этого автора, дана правильная оценка значения отмеченных выше соединений, но мы считаем, что эти биологически активные вещества синтезируют не клетки корня (Рубин, 1961), а эндофиты. Биологическая оценка взаимоотношений между симбионтными грибами и патогенами содержится в работе X. Дональда (Donald, 1969), который установил существующий антагонизм между грибами, образующими эктотрофную микоризу древесных пород, и такими патогенами, как Phylophtora cinnamomi. По его данным грибы, представляющие эктотрофную микоризу, задерживают рост у более чем 90% обследованных им патогенных грибов. К сожалению, до сих пор не были проведены тщательные исследования с чистыми культурами эндофитных микориз. Выполненные в ФРГ работы по повышению устойчивости культур к патогенам путем усиления эндофитной микоризы при заражении ее фикомицетными грибами по методу Б. Моссе нельзя считать удовлетворительными. Выше мы критически оценили прием повышения микотрофности, предложенный Б. Моссе. Отрицая облигатность симбионтных грибов растений, она 'предпочитает заражать их фикомицетными грибами. Последние при массовом выделении чистых культур более чем из 100 видов растений никогда не были выделены нами из эндотрофной микоризы. Примером подобных исследований может служить докторская диссертация X. В. Дене (Dehne, 1977). В ней автор указывает на слабое повышение микотрофности эндогоновым грибом при заражении патогенным грибом Fusarium exysporum, вызывающим болезнь увядания. Только в результате применения многочисленных методов изучения опытных растений автору удалось доказать, что эндотрофная микориза защищает корни культур от внедрения грибных и нематодных вредителей. Это наиболее эффективно можно было бы показать, обрабатывая не корни, а семена активными ростовыми препаратами с микроэлементами. Основное внимание в изучении паразитизма растений уделяется переносчикам вирусов и микозов, а не борьбе с ними самих растений. Можно напомнить интересный опыт А. И. Руденко (1958), который на крыше ВИРа на Исаакиевской площади в Ленинграде произвел посев картофеля различного происхождения под стеклянным перекрытием, исключающим наличие переносчиков. А. И. Руденко установил, что картофель из южных клубней был поражен болезнями, а из северных — оказался здоровым. Первый случай был назван автором — «климатическим типом вырождения картофеля». В переводе на современный язык это означает, что слабо микотрофный южный картофель не мог противостоять наследственно переданным заболеваниям, тогда как более микотрофный северный картофель остался здоровым. Если при господствующем ранее представлении об автотрофном существовании растительного мира нельзя было предположить, какие части растений могут выполнять функции их защиты от патогенов, то при современном состоянии науки, утвердившем обязательный симбиоз растений с эндофитами, а также с эпифитными и ризосфернымн бактериями, устанавливается возможность доказательства их участии в борьбе с патогенами растений. Необходимо подчеркнуть, что для успешного противостояния заболеваниям требуется не только наличие в корнях растений симбионтных грибов, но и их максимальное развитие, выраженное в образовании многочисленных крупных везикул с арбускулами, характеризующими напряженность их реакций обмена с растением. Со временем это неточное визуальное определение состояния эндофитов будет заменено количественным определением белковых веществ или гормональных образований и ферментов в корнях. М. В. Горленко в своем учебнике «Краткий курс иммунитета растений» (1973) выделяет главу о приобретенном иммунитете, способствующем повышению устойчивости растении к болезням и вредителям. Поскольку вредителей мы не касались, то рассмотрим несколько примеров борьбы с болезнями. М. В. Горленко привел результаты опыта Л. П. Старыгиной по обработке семян фасоли антибиотиком фитобактериомицином (ФБМ). В опытном варианте устойчивость растений к бактериозам возросла не только в год обработки семян, но и в последующий сезон, что указывает на возможность повышения иммунитета растений путем применения микробиологических воздействий на больные культуры. Кроме упомянутой работы, в сборнике «Применение антибиотиков в борьбе с бактериальными болезнями растений» (1960, т. 17) приведены данные ряда исследователей, изучавших эффективность использования разных антибиотиков, таких, как ФБМ, полимиксин, стрептомицин и др., в борьбе с гоммозом хлопчатника, бактериозом фасоли и кукурузы, суданской травы, корневой гнилью кенафа и джута. Все указанные антибиотики применялись путем заражения больных растений не живыми продуцентами, а препаратами, приготовленными из продуктов жизнедеятельности последних. Обычно такие препараты представляли собой сухие порошки, которые перед обработкой семян растений разводились иногда в несколько тысяч раз. Эти препараты изготовлялись во Всесоюзном институте антибиотиков Министерства здравоохранения СССР. Авторы установили стимулирующее действие указанныхпрепаратов на рост корней и надземной части растений, что свидетельствовало о наличии у них ростовых веществ. Особенно отчетливо это было показано У. Г. Оксентьян (1960). Она применила известный метод, разработанный P. X. Турецкой (1947), основанный на оценке активности ростовых веществ в отношении корнеобразования у черенков фасоли. Это дало возможность с несомненностью установить ростовое воздействие препаратов антибиотиков, а следовательно, и их стимулирующее действие на микотрофность культур. До того как нами был создан гормональным препарат Симбионт 1 из чистых культур симбионтных грибов, мы использовали при изучении микотрофности ряда культур препарат ФБМ, продуцентом которого был актипомицет A. lavendulae. При испытании в лизиметрах и полевых опытах, проведенных в различных местах при обеспечении хороших условий для роста растений, обработка семян перед посевом или клубней картофеля ФБМ обеспечивала повышение микотрофности корней на 1-2 балла, что способствовало увеличению урожайности иногда более чем на 20%. Приведенные выше данные о способности ФБМ оказывать стимулирующее действие на развитие симбионтных грибов, которые, в свою очередь, способствуют усилению устойчивости растений к различным заболеваниям, еще раз указывают на то, что путь к иммунитету и увеличению продуктивности сельскохозяйственных культур лежит через усиление их микотрофности. В то время, когда проводились эти исследования, общим недостатком препаратов антибиотиков была нестандартность их изготовления, что заставляло тратить много времени на ежегодное определение наиболее активных вариантов ФБМ. Кроме того, их влияние на микотрофность культур уступала действию препаратов, изготовляемых из чистых культур эндофитов, в приготовлении которых нами была достигнута достаточная однородность. При применении гормональных препаратов положительное действие на развитие грибного симбиоза в корнях различных культур оказывают различные агротехнические приемы. Возделывание по пласту и обороту пласта, применение зеленых удобрений, внесение перепревшего навоза в зону прорастания семян или клубней и другие приемы обеспечивают всходы растений продуктами жизнедеятельности микроорганизмов, содержащих ростовые вещества, необходимые для активизации развития грибного симбиоза. Многие авторы отмечают, что энергия всхожести семян часто коррелируется с устойчивостью этих растений к заражению определенными патогенами. Мы можем подтвердить значение этого ценного наблюдения, так как всходы сильно микотрофных растений всегда появляются на несколько дней раньше, чем у слабо микотрофных, так же, как и семена или клубни, обработанные ростовыми препаратами, дают всходы на 2-4 дня раньше, чем контрольные. Заканчивая раздел биологических методов воздействия на иммунитет растений, нужно подчеркнуть, что во всех приведенных опытах с вегетативно размножаемым картофелем, а также в случаях применения во Франции методов оздоровления этой культуры и земляники па больших высотах происходит повышение микотрофности растений. Установленное нами значительное усиление развития грибного симбионта в корнях всех изученных новых сортов пшениц (возникшее без ведома и старания селекционеров) не является случайным признаком, так как только симбнонтные грибы в растениях способны выполнять иммунные функции в борьбе с патогенами и тем самым способствовать повышению продуктивности культур. Выведение новых сортов зерновых культур, как правило, ведется на плодородных черноземных почвах, в которых создаются более благоприятные условия для усиления их микотрофности. Несмотря на неоднократно высказываемые в печати положения о необходимости получения новых устойчивых и продуктивных сортов различных культур для Нечерноземной зоны, осуществить их, очевидно, затруднительно. Сейчас, когда причина неудач установлена, можно повысить микотрофность создаваемых сортов путем применения гормональных препаратов и микроэлементов, что обеспечит их устойчивость к патогенам. Как видно из многих примеров, приведенных для такой культуры, как картофель, усиление микотрофности приостанавливает его вырождение, повышает устойчивость к вирусам и микозам, что обеспечивает повышение продуктивности. Обратный процесс происходит при культивировании горного картофеля на равнине, где с уменьшением микотрофности через 1-2 года снижаются и устойчивость к заболеваниям, и продуктивность, и вкус картофеля. Затормозить этот процесс пока можно только применением сильных ростовых препаратов с микроэлементами. Изложенные наблюдения дают возможность предположить, что из трех взаимосвязанных между собой основных показателей нового ценного сорта, таких, как устойчивость к патогенам, высокая продуктивность и сильная микотрофность, первенствующее значение принадлежит степени микотрофности. Для поддержания главенствующего фактора при создании новых сортов зерновых культур нужно изучить приемы, вызывающие усиление микотрофности в процессе выведения сорта, в том числе и скрещивание с сильно микотрофными растениями. До сих пор государственная комиссия, утверждая новый сорт любой культуры, не применяет оценки его микотрофности, поскольку значение этого показателя еще не признано наукой в полной мере. В дальнейшем необходимо в университетах и сельскохозяйственных институтах включать курс изучения микотрофности растений на кафедрах ботаники и селекции. Кроме описанных выше биологических методов воздействия на растения путем значительного увеличения активности их симбионтных грибов, способствующих повышению иммунитета культур, была установлена возможность подобного воздействия путем применения химических препаратов. Из них первое место занимают микроэлементы, поскольку работы многих исследователей показали их влияние на процесс фотосинтеза растений и устойчивость культур к патогенам. Так, по сообщению Ф. Е. Маленева (1956), применение меди повышает устойчивость картофеля к фитофторе, а меди и бора — к бактериозам, обыкновенной и черной парше. Н. Н. Каргаполовой (1956) было установлено, что клубни картофеля, обработанные микроэлементами, обладали мощной корневой системой, что обычно связано с повышенной микотрофностью. Как уже изложено в главе 4 настоящего труда, наши опыты по выяснению действия микроэлементов показали, что они обычно на 1 балл повышают микотрофность культур, обработанных гормональными препаратами. Второе место в борьбе с патогенами, очевидно, занимают окислительные ферменты, усиленная деятельность которых отмечена у иммунных сортов, зараженных патогенами (Рубин, 1971). Эти ферменты могут способствовать разложению ослабленных или мертвых патогенов в клетках растений. Участие самого растения в этом процессе определяется повышенным снабжением эндофитов продуктами фотосинтеза для обеспечения их питания и снабжения нужной им энергией, значение которой отмечено в работах по иммунитету. Сочетание деятельности двух организмов — растительного и микробного происхождения — обеспечивает усиление иммунной системы у растений, которая необходима для устойчивости растительного мира. Случаи нарушения этой устойчивости при возделывании сельскохозяйственных культур нужно отнести за счет недостаточной изученности природных законов. Ученые, которые не учитывают участия микробного синтеза в создании иммунитета растений, тщательными исследованиями обменных реакций у иммунных и неиммунных сортов, инфицируя их патогенами, многократно пытались установить различный характер защитных свойств растений. Мы приведем некоторые результаты, полученные коллективом сотрудников биологической и физиологической кафедр МГУ и обобщенные Б. А. Рубиным в 1971 г. Он отметил важность установления источника увеличения энергии, которая в большей мере вырабатывается в инфицированных клетках иммунных растений по сравнению с неиммунными. Б. А. Рубин считал, что увеличение энергетических возможностей у иммунных сортов связано с процессом фотосинтеза, что, однако, не объясняет причину снижения энергии у неиммунных сортов. Он подчеркнул, что отличительной особенностью иммунных сортов растений является создание более устойчивой окислительной системы: «Нам впервые удалось показать, что этим источником (энергии) является индуцируемое инфекцией усиление окислительного обмена, материальным фундаментом которого служит новообразование — синтез дополнительных количеств ферментативного белка. Наиболее отчетливо это установлено на примере пероксидазы и полифенолоксидазы — ферментов, занимающих ключевые позиции в окислительном обмене растительной клетки» (Рубин, 1971, с. 49). Осталось только определить, кто синтезирует указанные дополнительные ферменты, так как наличие последних в растениях еще не доказывает, что их синтезируют сами растения, как это было уже доказано (см. главу 4) по отношению к гормональным веществам, липидам, витаминам и другим биологически активным веществам. Способность микроорганизмов синтезировать ферменты не вызывала сомнения с начала развития микробиологии как науки, если же предположить их синтез растениями, остается неясным, почему ими снабжаются только иммунные растения. Большой квалифицированный коллектив научных работников, игнорирующий реальную действительность — симбиотрофность существования растительного мира, не смог внести полную ясность в решение вопроса о причинах существующего биологического различия между иммунными и неиммунными сортами различных культур. Теперь, когда разработана методика выделения чистых культур симбионтных грибов, можно установить, какие биологически активные вещества синтезируют эндофиты, способные оказать сопротивление паразитам. Нельзя закончить главу об иммунитете растений, не упомянув о фитоалексинах, которым приписывают защитные свойства растений. По мнению ученых, эти соединения возникают в культурах в качестве ответной реакции на внедрение в организм вредителей. При ознакомлении со многими работами о фитоалексинах, включая работу Б. Дж. Деверолла (1980), мы можем установить полное игнорирование авторами этих работ наличия симбионтных грибов во всех растениях. Независимо от любой оценки значения симбиотрофного существования растений нельзя обойти молчанием возможности взаимодействия внедрившихся патогенных микроорганизмов с живыми симбионтнымн грибами или продуктами их жизнедеятельности внутри самого растения. Трудно обвинить этих авторов в незнании самого факта существования симбионтных грибов в растениях, так как все они могли быть знакомы с классическим учебником А. А. Ячевского «Основы микологии» (1933), в котором имеются глава о симбиозе и самый большой для того времени список микотрофных растений. Не вызывает сомнений, что разработанная методика обнаружения фитоалексинов внутри зараженных растений при действии диэтилового эфира и смеси хлороформа с метиловым спиртом (Метлицкий и др., 1972) позволяет выделять только незначительное количество веществ из продуктов синтеза симбионтных грибов, поскольку полностью их можно выделить только с 60-70% этиловым спиртом. При слабой концентрации продуктов синтеза эндофитов они не могут противостоять развитию патогена. Подобное высказывание мы находим в книге Б. Дж. Деверолла (1980), где он приводит данные, что корни восприимчивых растений (по–нашему, слабо микотрофных) стимулируют инфекцию, а корни устойчивых растений (сильно микотрофных) подавляют прорастание спор патогенов.
Выводы
1. При рассмотрении растений в качестве автотрофных организмов считалось, что для выявления природы их иммунитета, затруднено создание единой физиологической или биологической концепции. При учете их симбиотрофного существования с эндофитами возникла возможность установить» что применение любых биологических, химических и селекционных приемов воздействия па растение, способствующих усилению иммунитета, всегда сопровождается значительным повышением их микотрофности. 2. Обнаружение единой реакции, неизменно сопровождающей повышение иммунитета при самых разнообразных способах воздействия на растение, с определенностью свидетельствует о ведущем значении грибного симбиоза в создании защитных свойств для всех культур. 3. Ухудшение условий выращивания устойчивых сельскохозяйственных культур приводит к снижению в потомстве микотрофности и устойчивости к патогенам. Эффективным приемом восстановления иммунных свойств растений служит обработка их семян или клубней перед посевом активными гормональными препаратами с микроэлементами. В элитных посевах такая обработка предохраняет сорт от вырождения. 4. Надежным приемом для повышения микотрофности и восстановления иммунитета служит «воспитание» культур в горных условиях на высоте от 600 до 2500 м над уровнем моря. Сочетание указанного приема с обработкой семян и клубней гормональными препаратами с микроэлементами может значительно сократить сроки повышения иммунитета культур в горных условиях. 5. Необходимым условием правильного применения указанных выше рекомендаций повышения иммунитета культур является точная оптимальная дозировка применяемых гормональных веществ и хорошие условия роста растений. Последние мы коротко определяем следующим образом: чем выше урожай в контроле, тем эффективнее рекомендуемые приемы повышения иммунитета растений.Общее заключение
Впервые разработанный автором метод получения чистых культур симбионтных грибов из корней и надземных частей растений дал возможность установить наличие этого симбиоза у всех растений. Разделение растительности на микотрофные и немикотрофные виды было связано с невозможностью визуального обнаружения симбионтных грибов под микроскопом у слабо микотрофных растений, произрастающих в избыточно влажных местах, тундре, пустыне. Но даже из этих растений можно выделить чистые культуры эндофитов. Значение продуктов грибного симбиоза для каждого растения весьма значительно, так как симбионтные грибы обеспечивают растения такими жизненно необходимыми для их роста веществами, как гормоны роста, ферменты, витамины, аминокислоты, липиды и цветные пигменты. Способность к их синтезу мы установили у всех чистых культур симбионтных грибов. Попытки выделения чистых культур эндофитов из растений на протяжении около 100 лет не были результативными. Сложность их выделения была связана с неизвестной ранее потребностью симбионтных грибов в гормональных веществах (2-3 капли) в процессе их прорастания из растительной ткани в питательную среду, так как в этот короткий период времени сами грибы не синтезируют гормонов роста. Обогащение питательных сред гормонами роста микробного или растительного происхождения обеспечивает получение чистых культур эндофитов не только из корней, но и из листьев, хвои, завязей, пыльцы, семян и одноклеточных тканевых культур, выращенных в стерильных условиях вне организма. Общими морфологическими показателями для более чем 100 выделенных чистых культур эндофитов при многократном повторении опытов были следующие: 1. Отсутствие спороносящих органов размножения. 2. Многоклеточный мицелий с везикулярными расширениями, принимающими при старении септированную форму. 3. Гранулированная плазма, рассыпающаяся при разрыве оболочки клетки. 4. Погруженный рост мицелия в жидкой среде при отсутствии воздушного мицелия. 5. Синтез цветных пигментов различных цветов — от белого до черного. Эндофиты из ржи, пшеницы, томатов, клевера, мака и некоторых других растений синтезируют красный пигмент, который многие ученые ошибочно принимают за леггемоглобин. Черный пигмент синтезируют эндофиты таких сильно микотрофных растений, как мексиканская аралия; женьшень, мать–и–мачеха, брусника, черника и др. Впервые нами была установлена способность к азотфиксации чистых культур эндофитов, что объясняет давно установленный, но не понятый наукой факт — накопление большого количества азота в целинных карбонатных почвах, заросших многолетней злаковой и разнотравной растительностью при незначительном участии в травостое бобовых растений (5%). В лабораторных условиях чистые культуры эндофитов в нейтральных питательных средах фиксируют больше азота, чем в кислых. В бетонных лизиметрах на глинистой материнской породе за 10 лет накопилось значительно больше азота при росте сильно микотрофных многолетних растений, чем при росте слабо микотрофных однолетних культур. Что касается многолетних бобовых культур, то их сильная азотфиксация выявляется только при наличии симбиоза с эндофитами в крупных клубеньках, розовый пигмент которых синтезируют симбионтные грибы. Предварительные полевые опыты подтвердили, что обработка семян клевера ростовым препаратом, повышающим микотрофность растений, эффективнее, чем предлагаемая ранее обработка их нитрагином. До сих пор дискуссионным остается вопрос о происхождении эндофитов, что значительно задерживает развитие науки о симбиотрофном существовании растительного мира. Наряду с доказательством их циклической наследственности от семени к семени и от клубня к клубню существует иная точка зрения на происхождение эндофитов — заражаемость ими корней в почве. Последний тезис лишает симбиоз генетического значения, тем более, что была доказана невозможность существования симбионтных грибов в почве на твердом субстрате при отсутствии у них спор. Было установлено, что в природных условиях эндофиты находятся в семенах в состоянии анабиоза и возможность их перехода в молодые корни осуществляется при содействии гормональных веществ, которыми их снабжают эпифитные и ризосферные бактерии, обильно развивающиеся на прорастающем семени. В стерильных опытах эти бактерии отсутствуют, и тогда эндофиты в корень не проходят, откуда и возникла идея о необходимости их заражения в почве. Применение ростовых препаратов после стерилизации семян восстанавливает способность эндофитов переходить из прорастающего семени в корень без заражения их грибами. На основе синтезированных эндофитами активных гормональных веществ были изготовлены ростовые препараты, названные нами «симбионтами». При практическом использовании препаратов их следует разводить в 10000-100000 раз. Симбионт 1 (автор Ф. Гельцер) изготовляется из чистых культур эндофитов, выделенных из корней женьшеня, а Симбионт 2 (авторы Ф. Гельцер и Н. Игнатьев) — из корней облепихи. Их действие при обработке семян выражается при благоприятных для роста растений условиях в заметном увеличении корневой системы и усилении ее микотрофности, повышении продуктивности культур и их устойчивости к болезням. Чем выше урожай в контроле, характеризующий общие условия развития растений, тем выше эффективность применения препарата, особенно при орошении. В результате изучения нами степени микотрофности новых лучших сортов зерновых и масличных культур советских селекционеров было установлено, что иммунитет растений зависит от степени микотрофности, что никогда не учитывалось авторами новых сортов различных культур. Установленная нами прямая зависимость иммунитета растений от степени развития в их корнях симбионтных грибов открывает новые возможности для создания иммунных культур и поддержания стабильности их элитных посевов. Указанные исследования легли в основу микробиологической теории иммунитета растений, которая исходит из положения о симбиотрофном существовании растительного мира и о возможности воздействия на усиление жизнедеятельности эндофитов, обеспечивающих активное передвижение продуктов своего синтеза в растениях. В связи с доказательством большой значимости развития грибного симбиоза для продуктивности и иммунитета растений необходимо включить раздел о симбиозе не только в курсы вузов биологического профиля, но и в учебник ботаники для средней школы с тем, чтобы создать у учащихся правильное представление о симбионтном существовании растительного мира.Послесловие
Монография «Симбиоз с микроорганизмами — основа жизни растений» представляет собой результат многолетней плодотворной творческой работы Фани Юрьевны Гельцер (1898-1987 гг.), успешно сочетавшей решение насущных практических вопросов и разработку оригинальных теоретических положений, которые охватывали проблемы создания плодородия почв, лесоразведения в степных районах, борьбы с вырождением картофеля, поддержания продуктивности элитных сортов пшеницы, повышения иммунитета растений на основе широкого изучения сельскохозяйственной микробиологии. Господство бактериальных процессов в дерновом типе почвообразования, пути повышения эффективности клубеньковых бактерий, микотрофное питание древесных пород в условиях степи, значение экто– и эндотрофной микоризы в питании растений и повышении их иммунитета и, наконец, создание стимулятора роста растений — препарата Симбионт — тот обширный круг вопросов, который разрабатывала Фаня Юрьевна Гельцер. Ф. Ю. Гельцер в 1917 г. поступила на Голицыиские сельскохозяйственные курсы, затем перешла в Московскую сельскохозяйственную академию, где выполнила в 1924 г. дипломную работу в лаборатории В. Р. Вильямса. В течение 1924-1926 гг. она работала агрономом–химиком в Государственном луговом институте под Москвой. В 1926 г., уехав вместе с мужем Г. И. Павловым в Ташкент, она создала лабораторию севооборотов на Ак—Кавакской опытно–оросительной станции и руководила ею до 1933 г. Затем Ф. Ю. Гельцер была приглашена на работу во Всесоюзный институт удобрений, агротехники и агропочвоведения (ВИУАА), где в 1935 г. ей была присвоена ученая степень кандидата сельскохозяйственных наук без защиты диссертации. В течение 15 лет она работала в этом институте, с 1944 г. заведуя лабораторией микробиологии, а в 1949 г. была переведена вместе с лабораторией в Московское отделение ВНИИ с. — х. микробиологии, затем преобразованное во ВНИИ микробиологических средств защиты растений и бактериальных препаратов. С 1970 г. Ф. Ю. Гельцер на общественных началах много работала над испытанием созданного ею ростового стимулирующего препарата Симбионт и в 1972 г. получила на него авторское свидетельство. Она сотрудничала с кафедрой почвоведения Московской сельскохозяйственной академии (с доцентом Н. Н. Игнатьевым), с Ташкентским сельскохозяйственным институтом (с Н. П. Балашовым и Е. Г. Лучининой), Куйбышевским сельскохозяйственным институтом (с А. В. Бушевой и Г. А. Заком), а также со многими опытными станциями и хозяйствами. В ЦЭЛХИМе, В. Г. Нахабино, она передала свой опыт изготовления препарата Симбионт[1]. Творческий путь Фани Юрьевны Гельцер протекал в условиях постоянной борьбы за утверждение выдвигаемых ею научных положений. В Узбекистане она активно пропагандировала хлопково–люцерновые севообороты, выступая против монокультуры, и в 1932 г. получила совместно с В. Полторацким высокий урожай хлопка — 40 ц/га. Она была ученицей академика В. Р. Вильямса и многие годы развивала его учение о повышении плодородия почвы на основе создания благоприятных условий для жизнедеятельности почвенных микроорганизмов. В 1982 г. она была награждена дипломом и премией имени В. Р. Вильямса за серию работ по проблеме гумуса и структурообразования почвы. Эти работы раскрыли большую роль микроорганизмов в образовании перегноя, основным источником которого является биологический процесс синтеза бактериальной микрофлорой новых органических коллоидальных соединений, ведущих к образованию прочной структуры почвы. Ею были изучены влияние многолетних трав на почвообразующнй процесс, роль клубеньковых бактерий в обогащении почвы азотом и значение микоризы растений. Активно включившись в работы по лесоразведению в степной зоне в 50‑е годы, Фаня Юрьевна разработала методику микоризации семян древесных пород и желудей дуба, а также приемы, способствующие выделению чистых культур микоризных грибов. За успешные работы по организации микотрофных питомников, сыгравших важную роль в лесоразведении лесных полос в степной зоне, Ф. Ю. Гельцер в 1954 г. была удостоена ордена Ленина. Признание практических результатов, однако, не означало признания выдвигаемых Ф. Ю. Гельцер научных положений. В острой борьбе биологического и агрохимического направлений в сельскохозяйственной науке защита ее диссертации на соискание ученой степени доктора биологических наук «Перегной, его образование и свойства» не увенчалась положительным результатом. Успешно продолжая изучение симбионтных грибов и их роли в развитии растений, Фаня Юрьевна впервые в мировой практике в 1964-1965 гг. выделила чистую культуру эндофитов из разных растений. Разработка способа выделения чистых культур открыла большие возможности для изучения их свойств, продуктов жизнедеятельности, роли в симбиозе с растениями и в воспитании иммунитета. Изготовленный на основе чистых культур эндофитов ростовой стимулирующий препарат Симбионт при многолетних испытаниях дал положительные результаты, что выразились в увеличении урожайности и усилении иммунитета растений. Еще в 1979 г. Техсовет Минсельхоза СССР (протокол № 28, от 15 марта 1979 г.) одобрил результаты, доложенные Ф. Ю. Гельцер, и принял решение о расширенной производственной проверке препарата. Научным основам симбиотрофного развития растений и результатам использования препарата посвящена монография, завершенная Фаней Юрьевной в 1985 г. и изданная посмертно. Ее работы нашли отражение еще в двух монографиях, свыше ста статьях и многочисленных докладах на совещаниях и конференциях. Работы о роли микроорганизмов в сельском хозяйстве были переведены в Болгарии, Венгрии, Румынии, Югославии и Чехословакии. Ниже приводится список основных работ Ф. Ю. Гельцер.Г. Г. Павлов, Т. Г. Павлова.
Последние комментарии
4 часов 57 минут назад
5 часов 13 минут назад
5 часов 26 минут назад
5 часов 31 минут назад
8 часов 3 минут назад
8 часов 7 минут назад