Рациональная фармакотерапия болезней нервной системы [Расул Магомедгаджиевич Атаев] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Наида Ханмурзаева, Расул Атаев, Саида Ханмурзаева Рациональная фармакотерапия болезней нервной системы
Информация
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ДАГЕСТАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»Рецензенты: Камчатнов Павел Рудольфович — д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «РНИМУ им. Н. И. Пирогова» Минздрава России; Абдуллаев Алигаджи Абдуллаевич — д.м.н., профессор, заведующий кафедрой поликлинической терапии, кардиологии и общеврачебной практики ФПК и ППС ФГБОУ ВО «ДГМУ» Минздрава России. Ханмурзаева Н. Б., Ханмурзаева С. Б., Атаев М. Г. Рациональная фармакотерапия болезней нервной системы: Учебное пособие. — Махачкала, ИПЦ ДГМУ, 2023. — 122 с. Учебное пособие предназначено для студентов медицинских вузов, клинических ординаторов, практикующих врачей, преподавателей и широкого круга читателей, интересующихся особенностями эффективного и безопасного лечения болезней нервной системы.
Список сокращений
АБР — агонисты бензодиазепиновых рецепторов АД — артериальное давление АДР — агонисты дофаминовых рецепторов АЛТ — аланинаминотрансфераза АСТ — аспартатаминотрансфераза БП — болезнь Паркинсона ВАШ — визуально-аналоговая шкала ДЭ — депрессивный эпизод ИМАО-В — ингибиторы моноаминоксидазы (тип B) ИКОМТ — ингибиторы катехол-О-метилтрансферазы ЛС — лекарственное средство НПВС — нестероидные противовоспалительные средства ПЭ — побочные эффекты РДР — рекуррентное депрессивное расстройство РККИ — рандомизированные контролируемые клинические испытания СА — старческая астения СИОЗС — селективные ингибиторы обратного захвата серотонина СИОЗСН — селективные ингибиторы обратного захвата серотонина и норадреналина ТТС — трансдермальные терапевтические системы ТЦА — трициклические антидепрессанты УДД — уровень достоверности доказательств УУР — уровень убедительности рекомендаций ЦНС — центральная нервная система START — Screening Tool to Alert to Right Treatment — Скрининговые критерии для корректного назначения лекарственных препаратов пациентам 65 лет и старше STOPP — Screening Tool of Older Persons’ Prescriptions — Скрининг препаратов, назначение которых нежелательно пациентам 65 лет и старшеШкалы доказательной медицины
Шкала оценки уровней достоверности доказательств (УДД) для профилактических, лечебных, реабилитационных вмешательств [Хроническая, 2020]
Шкала оценки уровней убедительности рекомендаций (УУР) для профилактических, диагностических, лечебных, реабилитационных вмешательств [Хроническая, 2020]

Психолептики
Психолептические средства оказывают психоседативное действие, проявляющееся в развитии "психомоторного безразличия" и "психической индифферентности". «Сила» и «качество» психолептического эффекта позволяют относить их к числу нейролептиков или транквилизаторов. Нейролептические препараты способствуют в первую очередь редукции эмоциональной насыщенности психотических расстройств (бреда, галлюцинаций). Для транквилизаторов характерно противотревожное (анксиолическое) действие [Александровский Ю. А. 2023].Нейролептики
Нейролептики (от др. — греч. νεῦρον — нерв и ληπτικός — вбирающий, втягивающий) или антипсихотики — психотропные препараты, подавляющие психическую нервную деятельность, эмоциональное состояние, поведение и способные устранять бред, галлюцинации; при этом они подавляют психомоторное возбуждение [Антипсихотические, 11.06.2022]. Основным свойством антипсихотиков является способность эффективно влиять на продуктивную симптоматику (бред, галлюцинации и псевдогаллюцинации, нарушения мышления, иллюзии, мания, расстройства поведения, психотические возбуждение и агрессивность) [Седативные, 2023]. Все антипсихотики снижают дофаминергическую иннервацию [Антипсихотические, 11.06.2022]: Мезолимбический путь. Снижение дофаминергической передачи в этом пути является необходимым условием антипсихотического действия, т. е. снятие продуктивной симптоматики (бреда, галлюцинаций). Мезокортикальный путь. Снижение уровня дофамина в этой области приводит к шизофрении с негативными расстройствами (сглаживание аффекта, апатия, бедность речи, ангедония, десоциализация) и когнитивными нарушениями (дефициты внимания, рабочей памяти, исполнительных функций). Блокада дофаминовых рецепторов в мезокортикальном пути типичными антипсихотиками приводит к усилению негативных расстройств, усилению когнитивной дисфункции, нарушению высших интегративных функций мозга. Нигростриарный путь. Блокада дофамина в этом пути приводит к экстрапирамидным расстройствам: паркинсонизму, акатизии, дистонии, тризму челюстей, слюнотечению, острой и поздней дискинезии, наблюдаемым в 60 % случаев при терапии типичными антипсихотиками. Тубероинфундибулярный путь (лимбическая система — гипоталамус — гипофиз). Блокада дофаминовых рецепторов гипофиза приводит к повышению уровня гормона пролактина (гиперпролактинемии), которая вызывает побочные эффекты: галакторею, гинекомастию, нарушения менструального цикла, половые дисфункции, депрессию, повышенный риск остеопороза, риск развития онкологической патологии, бесплодия, возникновения опухоли гипофиза. Действие на гипоталамус тормозит инкрецию кортикотропина и соматотропина. Снижение возбудимости D2-дофаминовых рецепторов триггерной зоны рвотного центра нейролептиками может ослаблять тошноту, рвоту и икоту. Для нейролептиков характерен феномен «антипсихотического порога», ниже которого антипсихотическое действие не реализуется и проявляются лишь неспецифические эффекты — снотворный, седативный и противотревожный, либо активирующий и растормаживающий, а также противорвотный. Для антипсихотического действия необходима блокада дофаминергической активности не менее чем на 60 % (в первую очередь рецепторов D2-типа); повышение пролактина возникает при блокаде 75 % рецепторов; экстрапирамидные расстройства — при блокаде 80 %. Получающийся диапазон (блокада 60–80 % дофаминовых рецепторов) составляет так называемое «терапевтическое окно», позволяющее, с одной стороны, добиться терапевтического эффекта, с другой — избежать гиперпролактинемии и экстрапирамидных расстройств. Нейролептики также блокируют альфа-адренергические рецепторы головного мозга. К нейролептикам свойственны серотонинблокирующий, м-холиноблокирующий и Н1-гистаминоблокирующий эффекты, при этом центральное действие преобладает над периферическим. В отличие от антипсихотического эффекта нейролептиков, их нейролептический (седативный) эффект обусловлен центральным α-адреноблокирующим и — в меньшей степени — м-холиноблокирующим и H1-гистаминоблокирующим действием. Нейролептический эффект проявляется угнетением реакции на внешние стимулы, ослаблением психомоторного возбуждения и аффективного напряжения, подавлением чувства страха, психической и двигательной заторможенностью, апатией, снижением агрессивности, сонливостью, ослаблением мотивации, инициативы, потерей интереса к окружающему, а также вегетативными нарушениями. Типичные антипсихотики блокируют прежде всего дофаминовые рецепторы; атипичные влияют на дофаминовые рецепторы в меньшей степени, в большей — на рецепторы серотонина и других нейротрансмиттеров. Поэтому атипичные нейролептики реже вызывают экстрапирамидные расстройства, гиперпролактинемию, нейролептическую депрессию, а также негативную симптоматику и нейрокогнитивный дефицит. Степень воздействия на различные типы рецепторов варьирует у нейролептиков, в зависимости от чего выделяют антипсихотические нейролептики (воздействующие в большей мере на дофаминовые рецепторы): галоперидол, трифтазин, сульпирид, и седативные нейролептики: дроперидол, аминазин, левомепромазин, хлорпротиксен, неулептил. Галоперидол воздействует на рецепторы следующим образом: D2 > D1 = D4 > α1 > 5НТ2, аминазин — α > 5НТ2 > D2 > D1. Разделение нейролептиков на антипсихотические и седативные возможно при назначении малых и средних доз, так как при увеличении дозы все антипсихотики оказывают угнетающее действие на психическую и двигательную активность. Блокада α1-адренорецепторов нейролептиками приводит к снижению артериального давления, ортостатической гипотонии, рефлекторной тахикардии, развитию головокружения, сонливости, задержке эякуляции; блокада α-адренергических и серотониновых рецепторов — к гипотермии; H1-гистаминовых рецепторов — к гипотензии, росту потребности в углеводах и увеличению массы тела, седации, противоаллергическому и противозудному действию. Некоторые антипсихотики блокуют ацетилхолиновые рецепторы и вызывают антихолинергические побочные эффекты: возможность когнитивных нарушений, сухость во рту, запоры, задержка мочи, тахикардия, повышение внутриглазного давления, нарушение аккомодации, расстройства терморегуляции, половые дисфункции, фармакогенный делирий, сонливость. Нейролептикам с антихолинергической активностью практически не свойственны экстрапирамидные расстройства, так как дофаминергическая и холинергическая системы находятся в антагонистических отношениях: блокада мускариновых ацетилхолиновых рецепторов I типа (M1-холинорецепторы) приводит к активизации дофаминергической передачи. Блокада серотониновых 5-НТ1А рецепторов связана с антидепрессивным и анксиолитическим (противотревожным) эффектом некоторых нейролептиков; блокада 5-НТ2А — предотвращением экстрапирамидных расстройств и снижением негативных симптомов. Антипсихотики могут снижать инкрецию гормона роста, адренокортикотропного гормона, тиреотропного гормона, окситоцина, антидиуретического гормона, повышать уровень меланостимулирующего гормона. При лечении нейролептиками возможны функциональные нарушения сердечно-сосудистой системы с изменениями на ЭКГ в виде увеличения интервала QT, снижения зубца Т или, его инверсии; кроме тахикардии, возможна брадикардия. Длительный приём типичных нейролептиков группы фенотиазинов (аминазина, трифтазина, тизерцина, тиоридазина) может сопровождаться развитием миокардиодистрофии, миокардита, дилатационной кардиомиопатии. Риск сердечно-сосудистых нарушений особенно высокий при проведении комбинированной терапии типичными и атипичными нейролептиками. Атипичные антипсихотики чаще вызывают инсульт и сахарный диабет, чем типичные, и вызывают большую прибавку массы тела по сравнению с галоперидолом [Наркотические, 2017]. Типичные нейролептики способны приводить к развитию эпилептических припадков из-за снижения порога судорожной готовности. Редко возможны кожные проявления (фотосенсибилизация, дерматиты, пигментация кожи); нарушения картины крови (лейкопения, агранулоцитоз, тромбоцитопения, апластическая анемия); офтальмологические нарушения (отложение пигмента в сетчатке, помутнение роговицы, хрусталика). Производным фенотиазина свойственно гепатотоксическое действие в виде холестатической желтухи. Применение атипичных антипсихотиков у пожилых людей повышает риск пневмонии на 60 %. Атипичные нейролептики могут приводить к развитию гипонатриемии. Назначение антипсихотических средств детям базируется на нескольких принципах [Психические, 1998]: 1) в связи с риском побочных эффектов (экстрапирамидная симптоматика) предпочтение в назначении следует отдавать антипсихотическим средствам второго поколения; 2) предпочтительной является терапия одним препаратом (монотерапия) в минимальной эффективной дозе; 3) в случае отсутствия успеха от проводимой терапии в течение 4–6 недель (при условии хорошей переносимости и назначения препарата в оптимальной терапевтической дозировке) препарат следует заменить; 4) использование дозировок препаратов выше рекомендуемых и ударных доз чревато резким повышением риска побочных эффектов; 5) перед назначением ряда препаратов следует исключить наличие сопутствующей соматической (нейроэндокринной, неврологической, кардиологической) патологии; 6) продолжительность терапии антипсихотическими средствами после купирования острого состояния в поддерживающих дозах не должна быть менее 1 года. При лечении шизофрении рекомендуются назначать [Шизофрения, 2021, Шизофрения, 2022]: производные бутирофенона: галоперидол (2В); производные фенотиазиана: хлорпромазин (1А), перициазин (3В); рисперидон (1А); тиаприд (3В); производные бензамидов: сульпирид (3В); оланзапин (1А), клозапин (1А); производные бензизоксазола: палиперидон (1А); арипипразол (2А); кветиапин (2А).Тесты для самоконтроля
1. В чем проявляется антипсихотическое действие нейролептиков? — Устранение аффективных реакций, снижение беспокойства, понижение двигательной активности — Стимуляция психической деятельности + Устранение галлюцинаций, бредовых идей, психомоторного возбуждения — Устранение тревоги, страха, беспокойства2. Какие средства применяют для коррекции экстрапирамидных нарушений, вызываемых нейролептиками? + Циклодол — Леводопа — Мидантан
3. Отметить механизмы антипсихотического действия нейролептиков — Усиление процессов торможения в коре головного мозга + Блокада адренорецепторов ствола головного мозга + Угнетение дофаминовых рецепторов мезолимбической системы + Усиление процессов метаболизации дофамина + Торможение окислительного фосфорилирования в нейронах мозга — Стимуляция бензодиазепиновых рецепторов структур головного мозга.
4. Отметить правильные утверждения для нейролептиков фенотиазинового ряда + Способны вызвать гипотермию — Обладают антипсихотическим действием, так как стимулируют дофаминергические процессы в ЦНС + Обладают антипсихотическим действием, так как тормозят дофаминергические процессы в ЦНС + Устраняют рвоту за счет блокады дофаминовых рецепторов триггер-зоны рвотного центра — Устраняют рвоту рефлекторного происхождения + Обладают в разной степени гипотензивным действием + При длительном применении развиваются экстрапирамидные расстройства.
5. С чем связано гипотензивное действие аминазина? + Угнетение центров гипоталамуса — Блокада симпатических ганглиев + Блокада периферических альфа-адренорецепторов — Симпатолитическое действие.
6. Отметить нейролептики: + Аминазин — Ниаламид + Галоперидол + Хлорпротиксен — Амитриптилин + Дроперидол
7. Какие эффекты характерны для нейролептиков? + Антипсихотический — Увеличение двигательной активности + Седативный + Уменьшение двигательной активности + Противорвотное действие
8. В каких случаях применяют нейролептики? + Для лечения психозов — Для лечения паркинсонизма + При рвоте центрального происхождения + Для нейролептанальгезии — Для купирования судорожных состояний
9. Определить нейролептик по свойствам: кратковременный эффект, незначительное α-адреноблокируюшее действие, применяется при нейролептанальгезии — Аминазин — Хлорпротиксен + Галоперидол — Трифтазин
10. Для нейролептиков характерны следующие эффекты: — антидепрессивный; + антипсихотический; + седативный; + противорвотный; — противосудорожный;
11. Характерными нежелательными лекарственными реакциями нейролептиков являются: — судорожный синдром; + эндокринные нарушения; + экстрапирамидные расстройства; — аллергические реакции; — М-холиностимулирующее действие.
12. Максимально выражено седативное действие у следующих нейролептиков: + хлорпромазин; — тиоридазин; + дроперидол; — клозапин; — рисперидон.
13. Нейролептик, при применении которого практически не возникает экстрапирамидных расстройств: — хлорпромазин; — тиоридазин; + клозапин; — дроперидол; — галоперидол.
14. Отметить препарат, применяемый только для лечения маний + Лития карбонат — Дроперидол — Аминазин — Сибазон — Амитриптилин — Ниаламид
Анксиолитики
Анксиолитики (от лат. anxietas — «тревожное состояние, страх», греч. λυτικός — «ослабляющий») — средства, снимающие тревогу, страх. Транквилизаторы (от лат. tranquillo — «успокаивать») — устаревший термин для психотропных лекарственных средств [Наркотические, 2017]. Анксиолитики обладают пятью основными компонентами фармакодинамической активности: противотревожным, седативным, снотворным, миорелаксантным и противосудорожным. Анксиолитическое действие проявляется в уменьшении беспокойства, тревоги, страха (антифобическое действие), снижении эмоциональной напряжённости. Анксиолитики способствуют снижению обсессивности (навязчивых мыслей) и ипохондрии (повышенной мнительности в отношении собственного здоровья). Однако острые галлюцинаторные, бредовые, аффективные и другие продуктивные расстройства, сопровождающиеся страхом и тревогой, анксиолитиками практически не редуцируются [Наркотические, 2017]. Седативное (успокаивающее) действие анксиолитиков выражается в уменьшении психомоторной возбудимости, дневной активности, снижении концентрации внимания, уменьшении скорости психических и двигательных реакций. Снотворный (гипнотический) эффект проявляется в облегчении засыпания, увеличении глубины сна. Миорелаксирующий эффект (расслабление скелетной мускулатуры) при применении анксиолитиков, как правило, может ограничивать при работе, где требуется быстрая психическая и физическая реакции. Миорелаксирующее действие проявляется ощущением вялости и слабости. Противосудорожное действие анксиолитиков выражается в подавлении распространения эпилептогенной активности, возникающей в эпилептогенных очагах. Противосудорожный эффект применяется для купирования приступа судорог [Наркотические, 2017]. Амнестическое действие (способность вызывать амнезию) проявляется преимущественно при парентеральном (инъекционном) применении. Механизм этого эффекта пока не ясен. Фобия — симптом, сутью которого является иррациональный неконтролируемый страх или устойчивое переживание излишней тревоги в определённых ситуациях или в присутствии (ожидании) некоего известного объекта, характерной чертой также является предметность, направленность страха на тот или иной объект, его сюжетность и фабулированность. Тревога — отрицательно окрашенная эмоция, выражающая ощущение неопределённости, ожидание негативных событий, трудноопределимые предчувствия. В отличие от причин страха, причины тревоги обычно не осознаются, но она предотвращает участие человека в потенциально вредном поведении, или побуждает его к действиям по повышению вероятности благополучного исхода [Тревожно-фобические, 2001]. Паническая атака (паника) — очерченный кратковременный эпизод интенсивной тревоги с внезапным началом, достигающий максимума в течение нескольких минут, сопровождающийся беспокойством и/или страхом смерти или потери контроля в сочетании с выраженными соматовегетативными нарушениями [Паническое, 2021]. Классификация тревожно-фобических расстройств (ТФР) [Тревожно-фобические, 2021]: 1. Агорафобия — страх перед выходом на улицу, площадь, в общественные места, магазины, транспорт, «вовне». 2. Социальные фобии — страх ситуаций, связанных с действиями в присутствии других людей и/или страх предполагаемой негативной оценки (критики, насмешки) со стороны других в относительно малых группах, но не в толпе. 3. Специфические фобии: a. Животных (страх насекомых, собак), b. Естественных природных сил (страх ураганов, воды), c. Крови, травм (страх инъекции, эндоскопии, операции), d. Ситуаций (страх самолетов, лифтов, помещений).При лечении ТФР для снижения уровня тревоги, эмоционального напряжения и интенсивности фобических переживаний рекомендуется назначать [Тревожно-фобические, 2021]: • производные бензодиазепина: клоназепам 0,5–3 мг/сут, алпразолам 0,25–10 мг/сут (1А); • прегабалин 300–600 мг/сут (1А). Пациентам с паникой рекомендуется назначать анксиолитики из группы производных бензодиазепина с целью снижения уровня тревоги и частоты панических атак коротким курсом (до 3–4 недель), клоназепам 0,254 мг/сут, доксазепам 1–6 мг/сут, алпразолам 0,75–4 мг/сут, диазепам 5–10 мг/сут (3В) [Паническое, 2021]. При неэффективности препаратов из группы селективных ингибиторов обратного захвата серотонина (СИОЗС), венлафаксина, имипрамина или кломипрамина, рекомендуется монотерапия производными бензодиазепина с целью купирования симптомов паники (1В). Оптимальные дозировки препаратов: алпразолам 0,75–6 мг/сут; клоназепам 1–4 мг/сут; лоразепам 2–7,5 мг/сут; диазепам 5–30 мг/сут; бромдигидрохлорфенилбензодиазепин 1–6 мг/сут. Способ применения — пероральный, в случае тяжелой выраженности симптомов допускаются внутримышечный и внутривенный способы введения. Длительность терапии — не более 6 месяцев. Высокий риск формирования зависимости [Паническое, 2021].
Тесты для самоконтроля
1. Указать основные эффекты анксиолитиков бензодиазепинового ряда: + Анксиолитический — Нейролептический + Миорелаксирующий + Противосудорожный + Усиление действия лекарственных средств, угнетающих ЦНС.2. Отметьте показания к применению анксиолитиков: — Психозы + Неврозы + Бессонница + Купирование эпилептического статуса
3. С чем связывают анксиолитическое действие анксиолитиков бензодиазепинового ряда: + Взаимодействуют бензодиазепиновыми рецепторами, что приводит к повышению активности ГАМК — Угнетение адренорецепторов в ЦНС + Усиливают высвобождение эндогенной ГАМК из связанного состояния + Блокируют фермент ГАМК-трансаминазу, что увеличивает содержание свободной ГАМК — Повышают активность дофаминергических процессов
4. Определить противопоказания к назначению анксиолитиков бензодиазепинового ряда: + Миастения + Нарколепсия — Стенокардия — Гипертоническая болезнь — Язвенная болезнь + Импотенция
5. Отметить наиболее сильный анксиолитик бензодиазепинового ряда по специфическим и неспецифическим эффектам: — Нозепам + Феназепам — Хлозепин — Сибазон
6. Указать осложнения при применении транквилизаторов: + Аллергические реакции + Обстипация + Сонливость + Импотенция — Повышение либидо — Повышение тонуса скелетной мускулатуры + Лекарственная зависимость + Нарушение менструального цикла
7. В каких случаях применяют седативные средства: + Для лечения неврозов и неврастений + При бессоннице + В комплексной терапии заболеваний, имеющих общеневротическую основу — Для лечения психозов — Для устранения депрессивного синдрома + Для лечения пре- и климактерических расстройств
8. Клинические формы неврозов: + Неврастения + Истерия — Астенический синдром — Психоз — Шизофрения
9. Анксиолитик (транквилизатор): + Сибазон — Амитриптилин — Коаксил — Паксил — Гептрал
10. Эффекты диазепама: + Анксиолитический + Противосудорожный — Спазмолитический — Антидепрессивный — Нейропротекторный
11. Противопоказания диазепама: + Миастения — Невроз навязчивых состояний — Бессонница — Психоз — Психопатия
12. Симптомы невроза: + тоска + раздражительность — апатия + бессонница — интеллектуальная вялость
13. Анксиолитик — производный бензодиазепина: + ативан + атаракс — зопиклон — золпидем — триазолам
14. Дневной анксиолитик: — диазепам + буспирон + мезапам — феназепам — зопиклон
15. Побочные эффекты транквилизаторов: + гиперседация + снижение памяти + миорелаксация + психическая и физическая зависимость — сухость во рту
Снотворные средства
Эпизодические нарушения сна встречаются у 33 % людей в общей популяции, а после 65 лет этот показатель возрастает до 50–65 % [Ohayon M. M. 2002]. Нарушения сна могут быть в виде парасомний: снохождение у 2 % людей, сноговорение у 4 %, ночные страхи у 2 %, бруксизм (скрежет зубами) у 8 %, энурез у 5 %, ночные кошмары (частые у 6 %, время от времени у 29 %). Наиболее часто встречающиеся расстройствами сна — это инсомния (встречается у 9–15 % людей в популяции) и расстройства дыхания во сне (1–4 %) [Сомнология, 2016]. Снотворные средства (от лат. hypnotica; син. гипнотические средства, уст.) — группа психоактивных лекарственных средств, используемых для облегчения наступления сна и обеспечения его достаточной продолжительности, а также при проведении анестезии. Инсомния (бессонница) характеризуется длительным засыпанием, частыми ночными пробуждениями, длительным бодрствованием в течение ночи, поверхностным сном, ранним утренним пробуждением, несмотря на достаточное время и подходящие условия для сна, что вызывает дневную сонливость, ухудшение памяти и внимания, снижение работоспособности, социальную дисфункцию [Пчелина П. В., 2018].Таблица 1 Средства, вызывающие бессонницу [Лиманкина И. Н., 2008]
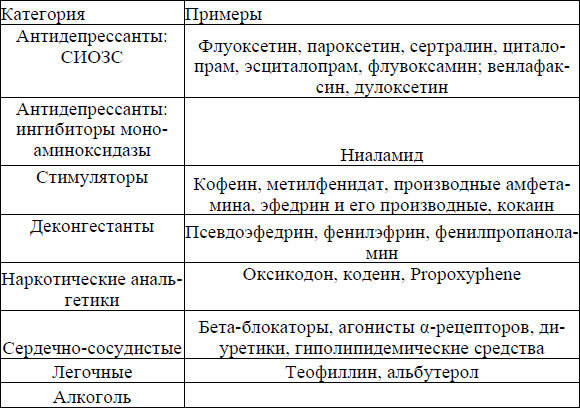
Основными ЛС для терапии инсомнии являются: Антидепрессанты Нейролептики Противоэпилептические средства При синдроме беспокойных ног рекомендованы: агонисты дофаминовых рецепторов, антиконвульсанты. Парасомнии (кошмары) при неэффективности психотерапии устраняются седативными средствами. При расстройствах поведения в быстрой фазе сна (сноговорение, крики и двигательная активность, нередко агрессивная и травмоопасная для самих пациентов и их близких, с последующим пробуждением) требуется назначение клоназепама или мелатонина. Агонисты бензодиазепиновых рецепторов (АБР) или Ramelteon: золписет, Eszopiclone, залеплон и темазепы. Седативные антидепрессанты, особенно при использовании в соединении с сопутствующей депрессией/тревогами: тразодон, амитриптилин, доксепин и миртазапины. Комбинированные АБР или Ramelteon и седативные антидепрессанты. Другие седативные агенты: антиэпилептические препараты (габапентин, тиагабина) и атипичные антипсихотики (кветиапин и оланзапин). Антигистаминные средства или наркотики обезболивающего типа, а также растительные и другие вещества (например, валериана и мелатонин) не рекомендуются для лечения хронической бессонницы из-за недостаточной эффективности и безопасности. Барбитураты, наркотики и хлоралгидрат не рекомендуются для лечения бессонницы. Краткой/средней продолжительности действия АБР или Ramelteon: залеплон, золписет, Eszopiclone, триазолы и темазепы. Zaleplon и Ramelteon имеют очень короткий период полураспада и, следовательно, могут уменьшить латентность сна, но мало влияют на пробуждение после начала сна; они также редко приводят к остаточной седации [Sateia MJ, 2017]. Eszopiclone и temazepam имеют более длительный период полураспада, позволяют добиться удлинения сна, и нередко вызывают остаточную седацию. Триазолам не считается первой линией снотворных средств. Выбор конкретного АБР может включать в себя более длительное снотворное действие, такое как от эстазолов. Flurazepam редко назначают из-за его длительного периода полураспада. Бензодиазепины (например, лоразепам, клоназепам) также могут быть рассмотрены при лечении бессонницы. Тразодон имеет малую антихолинергическую активность по сравнению с доксепином и амитриптилином, и миртазапины связаны с увеличением веса [Sateia MJ, 2017].
Таблица 2 Снотворные средства [Лиманкина И. Н. 2008]


Общие характеристики снотворных средств:
• Прием на пустой желудок рекомендуется, чтобы усиливать эффективность. • Не рекомендуется во время беременности или кормления грудным молоком. • Следует проявить осторожность, если имеются симптомы депрессии, угнетение дыхательной функции (например, астма, ХОБЛ, синдром ночного апноэ), печеночная или сердечная недостаточность. • Рекомендуется уменьшить дозу в пожилом возрасте. • Безопасность / эффективность у пациентов <18 лет не установлена. • Обратить внимание на психомоторику при одновременном приеме депрессантов ЦНС и / или употреблении алкоголя. • Быстрое снижение дозы или резкое прекращение бензодиазепинов может вызвать синдром отмены, в том числе появление бессонницы, подобно тому, что возникает от барбитуратов и алкоголя. Некоторые антидепрессанты (амитриптилин, доксепин, миртазапины, пароксетины, тразодон) используются в низких антидепрессивных дозах для лечения бессонницы. Комбинация лекарственных препаратов из двух различных классов могут повысить эффективность путем охвата нескольких механизмов сна и бодрствования при минимизации токсичности, которые могли бы иметь место с более высокими дозами одного агента. Побочные эффекты могут быть сведены к минимуму также при использовании низких доз антидепрессантов. Достаточно доказательств эффективности габапентина, тиагабина, кветиапина и оланзапина при лечении хронической первичной бессонницы. При их использовании в одиночку увеличивается риск побочных эффектов (например, припадки от тиагабина; дисметаболизм от кветиапина и оланзапина). Хлоралгидрат, барбитураты, «небарбитураты и небензодиазепины» (мепробамат) не рекомендуются для лечения бессонницы, учитывая их значительные побочные эффекты, низкий терапевтический индекс, и вероятность развития привыкания и зависимости. Антигистаминные средства и комбинация антигистамина с анальгетиком широко используются как средства от бессонницы. Доказательства их эффективности и безопасности является весьма ограниченными. Антигистаминные средства имеют серьезные побочные эффекты, связанные с их антихолинергическим свойством. Алкоголь — наиболее распространенное средство от бессонницы при самолечении — не рекомендуется использовать из-за его короткой продолжительности действия, побочных эффектов на сон, обострения обструктивного апноэ во сне, а также возможности при злоупотреблении развития зависимости. Очень немногие травяные или альтернативные методы лечения, которые были систематически оценены для лечения бессонницы. Из них наибольшее количество доказательств доступно в отношении экстрактов валерианы и мелатонина. Имеющиеся данные свидетельствуют о том, что валериана имеет небольшие, но последовательные эффекты на сон. Мета-анализ показал, что мелатонин незначительно воздействует на латентность сна. Следует отметить, что некоторые из опубликованных исследований мелатонина оценивали его эффективность в качестве хронобиотического (фазосдвигающего) агента, а не в качестве снотворного. При прекращении приема снотворного средства после использования в течение нескольких дней могут произойти возврат бессонницы (ухудшение симптомов с уменьшением дозы, как правило, длится 1–3 дня), потенциальные физические, а также психические эффекты отмены. Повторение бессонницы и снятие эффективности могут быть сведены к минимуму путем постепенного снижения как дозы, так и частоты приема. В общем, доза должна быть снижена путем увеличения длительности интервала между приемами, по крайней мере нескольких дней. Снижение частоты введения (например, каждый второй или каждой третьей ночи), чтобы свести к снижению дозы [Sateia MJ, 2017]. В целом, исследования не демонстрируют явное преимущество комбинированной фармакотерапии бессонницы над только когнитивно-поведенческой терапией. Когнитивно-поведенческая терапия бессонницы представляет собой сочетание когнитивной терапии (психотерапевтический метод) в сочетании с поведенческой терапией (контроль факторов, ограничивающих сон) с или без релаксационной терапии.Тесты для самоконтроля
Выберите два правильных ответа.1. НЕДОСТАТКИ СНОТВОРНЫХ СРЕДСТВ ИЗ ГРУППЫ БАРБИТУРАТОВ: 1) нарушают процесс засыпания *2) вызывают привыкание 3) нефротоксическое действие *4) вызывают последействия
2. МЕХАНИЗМ СНОТВОРНОГО ДЕЙСТВИЯ БАРБИТУРАТОВ ОБУСЛОВЛЕН: 1) угнетением центральных адренорецепторов *2) блокадой ГАМКА-рецепторов 3) гиперполяризацией мембран *4) конформацией мембран нервных клеток и открытием хлорных каналов
3. СНОТВОРНЫЕ СРЕДСТВА: *1) золпидем *2) сибазон 3) эуфиллин 4) леводопа
4. ФЕНАЗЕПАМ ПРИМЕНЯЮТ ПРИ: 1) тяжелых поражениях почек 2) миастении *3) бессоннице *4) неврозах
5. СНОТВОРНЫЙ ЭФФЕКТ ВЫЗЫВАЮТ: *1) зопиклон 2) леводопа *3) феназепам 4) бемегрид
6. ПРОТИВОПОКАЗАНИЯМИ К НАЗНАЧЕНИЮ СНОТВОРНЫХ СРЕДСТВ ЯВЛЯЮТСЯ: *1) нарушение дыхательной функции *2) детям школьного возраста 3) эпилепсия 4) артериальная гипотония
7. ПРИ ОТРАВЛЕНИИ СНОТВОРНЫМИ ПОМОГУТ: 1) прокаин 2) пиридостигмин *3) бемегрид *4) кофеин в терапевтических дозах
8. СНОТВОРНЫЕ ПРЕПАРАТЫ В ЗАВИСИМОСТИ ОТ ДОЗЫ ОКАЗЫВАЮТ ДЕЙСТВИЕ: *1) седативное *2) снотворное 3) нейролептическое 4) анальгезирующее
9. СНОТВОРНЫЙ ЭФФЕКТ ВЫЗЫВАЮТ: *1) зопиклон 2) леводопа *3) феназепам 4) бемегрид
10. ПРИ ЛЁГКИХ ОТРАВЛЕНИЯХ СНОТВОРНЫМИ НАЗНАЧАЮТ: 1) кислотные растворы 2) обезболивающие средства *3) адсорбируцие средства *4) диуретики
11. ЗОЛПИДЕМ: *1) снотворный препарат короткой продолжительности действия *2) улучшает способность к засыпанию 3) применяют при дыхательной недостаточности 4) используют при нарушении функции печени
12. СПОСОБСТВУЮТ ОТКРЫТИЮ ХЛОРНЫХ КАНАЛОВ: *1) золпидем 2) бемегрид *3) диазепам 4) амантадин
13. К СНОТВОРНЫМ СРЕДСТВАМ ОТНОСЯТСЯ: 1) тиопентал натрия 2) фентанил *3) зопиклон *4) нитразепам
14. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ НИТРАЗЕПАМА: *1) нарушение сна *2) эпилепсия 3) острая дыхательная недостаточность 4) усиление саливации
Психоаналептики
Эту группу психофармакологических препаратов объединяет возможность психоактивирующего ("психоэнергетического") влияния на психическую деятельность. В нее входят различные по клиническому эффекту и механизмам действия препараты из разных химических групп. По особенностям клинико-фармакологического действия различают тимоаналептики (антидепрессанты, психостимуляторы (психоактиваторы), актопротекторы и ноотропы [Александровский Ю. А., 2022].Психостимуляторы
Психостимуляторы — психотропные вещества, активизирующие психическую и, в меньшей степени — физическую активность организма. Некоторые из них стимулируют высшие психические функции, ускоряют процесс мышления, быстро снимают усталость, сонливость и вялость, повышают мотивацию и работоспособность, повышают общительность, улучшают настроение, улучшают способность к восприятию внешних раздражителей (ускоряют ответные реакции, обостряют слух и зрение, возможность цветоразличения), повышают двигательную активность и мышечный тонус, улучшают координацию движений, повышают выносливость и немного физическую силу. Многие из препаратов этой группы способны вызывать наркотическое привыкание и пристрастие. К группе психостимуляторов могут относиться как лекарственные препараты, так и общедоступные средства (кофеин, никотин), а также запрещённые во многих странах вещества (кокаин, катинон, метамфетамин, амфетамин, однако амфетамины находят ограниченное применение в медицине в западных странах) [Психостимулятор, 2023]. Препараты других фармакологических групп, например, некоторые антидепрессанты, ноотропы, адаптогены (к примеру, женьшень, пантокрин, элеутерококк, также могут оказывать психостимулирующее воздействие [Психостимулятор, 2023]. Классические психостимуляторы усиливают катехоламиновую (дофаминовую и, менее значительно, норадреналиновую) нейротрансмиссию непосредственно повышая синаптическую концентрацию нейротрансмиттеров, и по большей части делятся на две категории: ингибиторы обратного захвата и стимуляторы выброса катехоламинов. Ингибиторы обратного захвата блокируют транспортные белки, ответственные за транспорт высвобожденного нейротрансмиттера обратно в пресинаптический нейрон для устранения и переработки, тем самым повышая синаптическую концентрацию сего нейротрансмиттера. К ингибиторам обратного захвата дофамина относятся, среди прочих, наркотик кокаин, и лекарственные средства метилфенидат, модафинил, мезокарб и фепрозиднин. Стимуляторы выброса, иначе, препятствуют концентрированию нейротрансмиттеров в везикулах и способствуют фосфориляции транспортных белков, что меняет направление транспорта из клетки наружу. Таким образом нейротрансмиттер постоянно «вытекает» из нервной клетки, даже при отсутствии сигнала, необходимого для везикулярного выброса. К стимуляторам выброса дофамина относятся в первую очередь производные амфетамина, включая метамфетамин и сам амфетамин. Стимулирующее действие кофеина главным образом основано на блокировании рецепторов аденозина. Также кофеин способствует торможению активности фермента фосфодиэстеразы, разрушающего цАМФ и цГМФ, что приводит к их накоплению в клетках и вызывает адреналино-подобные эффекты. В психиатрии психостимуляторы чаще всего применяются для терапии синдрома дефицита внимания и гиперактивности. Помимо этого, они эффективны при амотивационных состояниях и нарколепсии. При адинамической депрессии, чаще всего встречаемой при шизофрении, психостимуляторы могут сочетаться с антидепрессантами. Также показанием к применению являются апатоабулические, ступорозные и субступорозные состояния; невротические расстройства с заторможенностью; астенические состояния, сопровождаемые вялостью, апатией, сонливостью. Показанием к применению психостимуляторов также является снижение способности к концентрации внимания, повышенная психическая утомляемость, снижение физической работоспособности и быстрая интеллектуальная истощаемость при нейроинфекциях, интоксикациях, черепно-мозговых травмах, нарушениях мозгового кровообращения, перенесённых соматических заболеваниях. Также психостимуляторы эффективны при астеноипохондрических и астено-депрессивных синдромах и алкогольном абстинентном синдроме после отнятия алкоголя. Могут применяться для повышения настроения и интереса к жизни у тяжёлых соматических больных с апатией и социальной отгороженностью [Психостимулятор, 2023].Список психостимуляторов [Психостимулятор, 2023]:
• Фенилэтиламины, в частности Амфетамины: Амфетамин Метамфетамин MDMA (метилендиоксиметамфетамин) Эфедрин и псевдоэфедрин Фенилпроп аноламин Пара-МетоксиамфетаминКатиноны: Катинон Меткатин (эфедрон) Мефедрон Метилон Флефедрон Амфепрамон Альфа-пирролидинофены • Альфа-Пирролидинопентиофенон (a-PVP) • 1 DPV (метилендиоксипировалерон) Фентермин • Оксазолины 4-Метиламинорекс Аминорекс Пемолин • Производные пиперазина мета-хлорфенилпиперазин Бензилпиперазин • АМПАкины • Кокаин • Модафинил • Аминептин • Норадреналин • Кофеин • Никотин
Астения характеризуется снижением физиологического резерва и функций многих систем организма, приводящий к повышенной уязвимости организма человека к воздействию эндо- и экзогенных факторов, с высоким риском развития неблагоприятных исходов для здоровья, потери автономности и смерти [Хроническая, 2020]. Развитие старческой астении (СА) сопровождается снижением физической и функциональной активности, адаптационного и восстановительного резерва организма, повышает риск развития неблагоприятных исходов — госпитализаций в 1,2–1,8 раза, развития функциональных дефицитов в 1,6–2,0 раза, смерти в 1,8–2,3 раза, физических ограничений в 1,5–2,6 раза, падений и переломов в 1,2–2,8 раза [Старческая, 2020]. По данным исследований распространенность СА среди проживающих дома людей 65 лет и старше в среднем составляет около 10,7 %, преастении — 41,6 %. Распространенность СА увеличивается с возрастом, достигая среди лиц 85 лет и старше 26,1 %. Синдром СА достоверно чаще диагностируется у женщин, чем у мужчин. В домах престарелых распространенность СА достигает 52,3 % [Старческая, 2020]. Рекомендуется прием препаратов витамина D (800–2000 ME) или его производных пациентам с синдромом старческой астении и дефицитом/недостатком витамина D <30 нг/мл (75 нмоль/л) с целью коррекции его уровня, профилактики падений и переломов и улучшения прогноза жизни (1В). Рекомендовано назначение антиостеопоротической антирезорбтивной терапии (алендроновой кислотой, золедроновой кислотой, деносумабом) пациентам с СА [Старческая, 2020]. Под утомляемостью, которая встречается в среднем у 40–60 % пациентов с болезнью Паркинсона (БП), понимают ощущение почти постоянной усталости, отсутствия энергии, физического и/или психического истощения. Рекомендуется применение ингибитора моноаминоксидазы (тип В) разагилина в дозе 1 мг/сутки, антидепрессанта СИОЗС или СИОЗСН пациентам с утомляемостью и недостаточной коррекцией двигательных симптомов БП [Болезнь Паркинсона, 2022].
Тесты для самоконтроля
1. Указать психомоторные стимуляторы: + Фенамин + Меридил — Аминолон + Сиднокарб — Пирацетам — Имизин + Кофеин2. Какие механизмы действие психомоторных стимуляторов (фенилалкиламины и их аналоги)? — Усиливают синтез норадреналина в центральных адренергических синапсах + Нарушают депонирование синтезированного медиатора + Тормозят обратныйнейрональный захват медиатора и его экстранейрональное поглощение — Повышают количество энергосубстратов в нейронах головного мозга + Ингибируют моноаминоксидазу
3. Какова реакция организма на системный прием психомоторных стимуляторов группы фенилалкиламинов? — Кумуляция — Сенсибилизация + Тахифилаксия + Лекарственная зависимость
4. Отметить основные показания к применению психомоторных стимуляторов + При остром отравлении алкоголем, наркотиками, снотворными + Нервно-психические заболевания, которые сопровождаются сонливостью, апатией и астенией — Для постоянного повышения умственной и физической работе способности + Для устранения побочных эффектов при использовании средств угнетающего типа — Для получения анорексигенного эффекта + Экстремальные условия для временного повышения умственной и физической работоспособности
5. В чем состоит механизм психостимулирующего действия кофеина? — Возбуждает адренорецепторы + Блокирует аденозиновые рецепторы + Угнетает фермент фосфодиэстеразу — Угнетает обратный нейрональный захват медиатора — Способствует высвобождению медиатора из нервных окончаний
6. Отметить свойства, присущие общетонизирующим средствам: + Для получения эффекта требуется длительное назначение — Эффект проявляется при однократном приеме + Тонизирующий эффект мягкий, без признаков возбуждения + Имеют низкую токсичность — Вызывают пристрастие + Не вызывают пристрастия и привыкания + Имеют адаптогенные свойства
7. Что характерно для группы психомоторных стимуляторов? + Повышают умственную и физическую работоспособность при однократном приеме + Длительный прием приводит к истощению резервных возможностей организма + Снижают аппетит + Повышают возбудимость жизненно важных центров + Усиливают работу сердца и повышают артериальное давление + Возможно развитие лекарственной зависимости — Лекарственную зависимость не вызывают
Антидепрессанты
Антидепрессанты — психотропные лекарственные средства, применяемые прежде всего для терапии депрессии, оказывающие влияние на уровень нейромедиаторов, в частности, серотонина, норадреналина и дофамина. У депрессивного больного они улучшают настроение, уменьшают или снимают тоску, вялость, апатию, тревогу, беспокойство, раздражительность и эмоциональное напряжение, повышают психическую активность и продолжительность сна, нормализуют аппетит (тимолептическое действие). структуру Антидепрессанты не вызывают улучшения настроения у человека, не страдающего депрессией. Депрессивный эпизод (ДЭ) — аффективное расстройство, характеризующееся в типичных случаях снижением настроения, утратой интересов и удовольствия, снижением энергичности, которое может привести к повышенной утомляемости и сниженной активности. Отмечается выраженная утомляемость даже при незначительном усилии [Депрессивный, 2021]. К другим симптомам относятся сниженная способность к сосредоточению и вниманию; сниженные самооценка и чувство уверенности в себе; идеи виновности и уничижения (даже при легком типе эпизода); мрачное и пессимистическое видение будущего; идеи или действия, направленные на самоповреждение или суицид; нарушенный сон; сниженный аппетит [Международная, 1994]. Возникновение депрессивных расстройств детерминировано сочетанием множества факторов: биологических (конституционально-генетических), психологических и социальных. Среди биологических концепций традиционной является моноаминовая теория депрессии, согласно которой основным патогенетическим механизмом ее возникновения является недостаточность синаптической активности моноаминов (серотонина, дофамина, норадреналина) головного мозга [Депрессивный, 2021]. Антидепрессанты следует назначать в минимальных эффективных дозах; при отсутствии побочных эффектов или при редукции побочных эффектов в течение нескольких дней рекомендуется производить увеличение дозы в пределах стандартных дозировок до тех пор, пока симптоматика не начнет ослабевать. В случае отсутствия динамики или недостаточного эффекта (степень редукции симптоматики от 25 % до 50 %) через 3–4 недели рекомендуется наращивание дозы до максимальной [Депрессивный, 2021]. Тимоаналептический эффект обычно возникает через 3–4 недели лечения, однако в некоторых случаях, особенно при применении СИОЗС, улучшение развивается более постепенно и достижение полноценного эффекта наблюдается на 4–6-й или даже 8-й неделе. У большинства респондеров на терапию клиническое улучшение становится заметным уже в течение первых двух недель лечения. Обычно такой ранний ответ связан с более благоприятным прогнозом курсовой эффективности проводимой терапии. Не существует доказательных данных о большей эффективности или более быстром начале действия антидепрессанта какого-либо одного класса, хотя при тяжелых, требующих госпитализации, депрессиях некоторые ТЦА (амитриптилин и кломипрамин) и венлафаксин оказываются несколько эффективнее, чем селективные ингибиторы обратного захвата серотонина (СИОЗС). В отношении антидепрессантов второго поколения сравнительный мета-анализ показал, что миртазапин, эсциталопрам, венлафаксин и сертралин были несколько более эффективны, чем дулоксетин, флуоксетин, флувоксамин и пароксетин [Депрессивный, 2021]. Антидепрессанты из классов СИОЗС, СИОЗСН, а также другие средства второго и третьего поколений в целом переносятся лучше, чем препараты первого поколения (ТЦА), что способствует уменьшению вероятности самостоятельного отказа пациентов от их приема.Таблица 3 Рекомендуемые дозы антидепрессантов [Депрессивный, 2021]

Пациентам с легким ДЭ рекомендовано назначение антидепрессанта в пероральной форме: СИОЗС, с умеренным ДЭ — назначение СИОЗС, СИОЗСН, миртазапина, агомелатина и вортиоксетина, с тяжелой формой ДЭ без психотических симптомов — назначение антидепрессанта с широким спектром нейрохимического механизма действия: СИОЗСН, миртазапин, ТЦА, обладающих несколько большей эффективностью при депрессии тяжелой степени по сравнению с СИОЗС (1А). Предпочтение в силу лучшей переносимости следует отдать СИОЗСН (венлафаксин, дулоксетин, милнаципран) либо миртазапину, а потом ТЦА (имипрамин, амитриптилин, кломипрамин). СИОЗС и гетероциклицеские препараты первого поколения (пирлиндол, пипофезин, тразодон), обладающие несколько лучшей переносимостью, но и меньшей эффективностью, являются препаратами второго выбора [Депрессивный, 2021]. Стратегия перевода на терапию неселективными ингибиторами моноаминооксидазы не используется вследствие неблагоприятного соотношения риск-польза (в частности, возможности развития гипертонического криза). Тем не менее, в ряде случаев перевод на ИМАО-А, обладающие обратимым и селективным действием (пирлиндол), может дать быстрый положительный эффект, поскольку речь идет о совершенно другом механизме действия и стимулировании выброса в синаптическую щель всех трех моноаминовых нейромедиаторов. Всем пациентам с резистентностью к антидепрессивной монотерапии рекомендована комбинированная терапия с использованием сочетаний антидепрессантов с комплементарными механизмами действия для достижения синергического тимоаналептического эффекта: комбинирование ТЦА и СИОЗС; комбинирование ингибитора обратного захвата моноаминов (СИОЗС, СИОЗСН или ТЦА) с антидепрессантами, блокирующими альфа-2-адренергические ауторецепторы (например, миртазапин, миансерин) (1А). К негативным сторонам данной стратегии следует отнести повышенный риск взаимодействий между используемыми препаратами, усиление побочных эффектов и более высокие экономические затраты. Наиболее значителен риск возникновения антигистаминовых побочных эффектов (прибавка веса и избыточная седация) и антихолинергических побочных эффектов (снижение концентрации внимания и спутанность). Следует избегать сочетания ИМАО-А с СИОЗС и другими серотонинергическими антидепрессантами (например, кломипрамин, венлафаксин) вследствие потенциальной возможности развития серотонинового синдрома [Депрессивный, 2021]. При присоединении любого антипсихотика 2 поколения возрастает общее число побочных эффектов, включая гиперпролактинемию, метаболические нарушения (увеличение массы тела, дислипидемия, нарушение углеводного обмена), лейкопению, седацию и сонливость, антихолинергические и экстрапирамидные побочные эффекты, что требует тщательной оценки отношения риск/польза при их использовании вместе с антидепрессантами. При лечении терапевтически резистентной депрессии, рекомендуемой стартовой дозой арипипразола является 5 мг/сут с возможным последующим повышением дозы до максимальной 15 мг/сут. Наиболее частыми нежелательными явлениями при применении арипипразола являются экстрапирамидные расстройства, акатизия и увеличение веса. Рекомендуемой стартовой дозой кветиапина является 50 мг/сут с возможным повышением дозы до 100–300 мг/сут. Максимальная доза не должна превышать 600 мг/сут. При этом необходимо учитывать возможность появления седации и набора веса [Депрессивный, 2021]. При применении оланзапина в целях аугментации эффекта флуоксетина рекомендуемый диапазон доз составляет 5–10 мг/сут. Наиболее часто возникают такие побочные эффекты, как увеличение веса, седация и повышение пролактина. Что касается применения рисперидона при аугментации антидепрессивной терапии, рекомендуемой стартовой дозой является 0,5 мг/сут, диапазон доз составляет 0,25–3 мг/сут. Следует учитывать возможность развития гиперпролактинемии и экстрапирамидных расстройств. Всем пациентам с резистентностью к антидепрессивной монотерапии рекомендована аугментация эффекта солями лития (лития карбонатом) в дозе >800 мг (или в дозе, достаточной для достижения концентрации лития в сыворотке >0,5 мкмоль/л) (1В). Даже небольшие дозы солей лития (концентрация лития в сыворотке 0,5–0,8 ммоль/л) в течение нескольких дней могут привести к улучшению в состоянии больного. Курс терапии не превышает 2–4 недель, однако в случае достижения эффекта терапию следует продолжить в течение нескольких месяцев. Считается, что соли лития могут изменять рецепторную чувствительность постсинаптической мембраны и усиливать действие серотонина [Депрессивный, 2021]. Комбинировать антидепрессант с солями лития нужно осторожно, поскольку повышенные дозировки могут привести к развитию нейротоксических реакций (миоклония, атаксия, возбуждение, спутанность), а при сочетании с аминокислотой L-триптофаном (биологически активная добавка) («ньюкаслский» или «серотониновый» коктейль) — к серотониновому неврологическому синдрому. Кроме того, нежелательные явления при терапии солями лития включают кардиотоксичность, нефротоксичность, тиреотоксичность и прибавку веса. По причине узкого терапевтического диапазона требуется регулярный контроль концентрации лития в крови. Пациентам с резистентностью к антидепрессивной монотерапии при наличии дополнительных симптоматических показаний (например, тревоги, фобиях, ипохондрических и психотических симптомах) рекомендована аугментация эффекта антипсихотиками 1 поколения, включая присоединение к антидепрессанту: — сульпирида (2В). Пациентам с резистентностью к антидепрессивной монотерапии рекомендована аугментация эффекта антидепрессантов противоэпилептическими препаратами: ламотриджином в начальной дозе 25 мг/сут с постепенным повышением до 200 мг/сут (1А) или карбамазепином в дозе 400–800 мг/сут (2В) [Депрессивный, 2021]. Комбинация оланзапина с флуоксетином должна применяться с осторожностью у пациентов с избыточным весом, ожирением или метаболическим синдромом. Не показана комбинация оланзапина или рисперидона с карбамазепином, в связи с их интеркуррентным действием на уровне печеночных ферментов. Период снижения дозы антидепрессанта может занимать нескольких дней, недель или даже месяцев, в зависимости от дозы, продолжительности лечения и фармакологических свойств препарата, а также особенностей состояния пациента. Необходимостьпостепенного снижения дозы обусловлена возможностью развития синдрома отмены. Риск развития синдрома отмены тем выше, чем больше выражены антихолинергические свойства препарата, выше используемая доза и чем длительнее период приема. Среди антидепрессантов новой генерации симптомы отмены наиболее характерны для венлафаксина и СИОЗС с коротким периодом полувыведения (пароксетина), и менее характерны для флуоксетина. Резкая отмена ТЦА может вызвать холинергический феномен «отдачи» (миалгия, схватывающие боли в животе) [Депрессивный, 2021].
Вопросы для самоконтроля
1. Флуоксетин: A. Блокирует нейрональный захват норадреналина Б. Блокирует нейрональный захват серотонина B. Блокирует нейрональный захват серотонина и нарадреналина Г. Ингибирует моноаминооксидазу Д. Ингибирует моноаминооксидазу и катехоламин-орто- метилтрансферазу2. Амитриптилин (все ответы верны, кроме одного): A. Блокирует обратный нейрональный захват норадреналина и серотонина Б. Относится к группе трициклических антидепрессантов B. Обладает психоседативным действием Г. Снижает концентрацию катехоламинов в синаптической щели
3. Моклобемид (все ответы верны, кроме одного): A. Блокирует обратный нейрональный захват серотонина и норадреналина Б. Обратимо ингибирует моноаминооксидазу А B. Повышает психомоторную активность Г. Тормозит метаболизм норадреналина, дофамина и серотонина Д. Применяется при депрессии с гипомоторным компонентом
4. Неизбирательный ингибитор МАО — А и В изоформ: A. Имизин Б. Флуоксетин B. Ниаламид Г. Амитриптилин
5. Показания к применению антидепрессантов: A. Неврозы и неврозоподобные состояния Б. Депрессия, субдепрессия B. Психозы с бредовым и галлюцинаторным компонентами Г. Черепно-мозговые травмы, расстройства памяти
6. Побочные эффекты антидепрессантов (все ответы верны, кроме одного) A. Гепатотоксичность, желтуха, аллергические реакции, обострение или острый приступ глаукомы Б. Экстрапирамидные расстройства, судорожный синдром B. Бессонница, тремор, судороги, тираминовый синдром, серотониновый синдром
7. Нормотимик: A. Соли лития (лития карбонат) Б. Пирацетам (ноотропил) B. Имипрамин (имизин) Г. Хлордиазепоксид (элениум)
8. Показания к применению нормотимиков: A. Депрессия, неврозы, неврозоподобные состояния Б. Маниакально-депрессивный психоз B. Шизофрения, эпилепсия
9. Побочные эффекты нормотимиков (все ответы верны, кроме одного) A. Тошнота, рвота, металлический привкус во рту, диарея, жажда, полиурия Б. Дизартрия, судорожный синдром, B. Миастения, тремор, нарушение функции щитовидной железы Г. Эйфория, лекарственная зависимость, толерантность
Ответы:
1. Б 2. Г 3. А 4. В 5. Б 6. Б 7. А 8. Б 9. ГНоотропы
Ноотропы, они же нейрометаболические стимуляторы — лекарственные средства, предназначенные для оказания специфического воздействия на высшие психические функции [Ноотропы, 2017]. В основе терапевтического действия ноотропных препаратов предположительно лежит несколько механизмов [Ноотропы, 2017]: • улучшение энергетического состояния нейронов (усиление синтеза АТФ, антигипоксический и антиоксидантный эффекты); • активация пластических процессов в ЦНС за счет усиления синтеза РНК и белков; • усиление процессов синаптической передачи в ЦНС; • улучшение утилизации глюкозы; • мембраностабилизирующее действие. Ныне основными механизмами действия ноотропных средств считаются влияние на метаболические процессы в нервной клетке и взаимодействие с нейромедиаторными системами мозга. Доказано, что ноотропы активируют аденилатциклазу, повышают её концентрацию в нейроне. Повышенный уровень серотонина через выделения цАМФ внутри сенсорного нейрона ведёт к ускоренному высвобождению медиатора (глутамата) из сенсорного нейрона. Помимо этого, активированная аденилатциклаза поддерживает стабильность выработки в клетке АТФ без участия кислорода, а в условиях гипоксии приводит метаболизм мозга в оптимально сохраняемый режим. Производители нейрометаболических стимуляторов заявляют, что их препараты хорошо проникают через ГЭБ, повышают скорость утилизации глюкозы (особенно в коре головного мозга, подкорковых ганглиях, гипоталамусе и мозжечке), улучшают обмен нуклеиновых кислот, активируют синтез АТФ, белка и РНК [Ноотропы, 2017]. Эффект ряда ноотропных средств, возможно, опосредуется через нейромедиатор головного мозга, среди которых наиважнейшие: • моноаминергическая; • холинергическая — фенотропил; • глутаматергическая (мемантин и глицин воздействуют через NMDA-рецепторы). Ноотропы, по словам производящих их фирм, оказывают также иные воздействия, среди которых [Ноотропы, 2017]: • мембраностабилизирующее: регуляция синтеза фосфолипидов и белков в нервных клетках, стабилизация и нормализация структуры клеточных мембран; • антиоксидантное: ингибирование образования свободных радикалов и перекисного окисления липидов клеточных мембран; • антигипоксическое: снижение потребности нейронов в кислороде в условиях гипоксии; • нейропротективное: повышение устойчивости нервных клеток к воздействию неблагоприятных факторов различного рода. Классификация Ныне используется классификация ноотропов по их химическому составу [Ноотропы, 2017]: • Производные пирролидона: пирацетам, этирацетам, анирацетам, оксирацетам, прамирацетам, дупрацетам, ролзирацетам и др. • Производные диафенилпирролидона: фенотропил. • Производные диметиламиноэтанола (предшественники ацетилхолина): деанола ацеглумат, меклофеноксат. • Производные пиридоксина: пиритинол, биотредин. • Производные и аналоги ГАМК: гамма-аминомасляная кислота (аминалон), никотиноил-ГАМК (пикамилон), гамма-амино-бетафенилмасляной кислоты гидрохлорид (фенибут), гопантеновая кислота, кальция гамма-гидроксибутират (натрия оксибутират). Нейропептиды и их аналоги: ноопепт, семакс, селанк. Аминокислоты и вещества, влияющие на систему возбуждающих аминокислот: глицин, биотредин. Производные 2-меркантобензимидазола: этилтиобензимидазола гидробромид (бемитил). Витаминоподобные средства: идебенон. Полипептиды и органические композиты: кортексин, церебролизин, церебрамин. Вещества других фармакологических групп с компонентом ноотропного действия [Ноотропы, 2017]: • нейромодуляторы: фенотропил; • корректоры нарушений мозгового кровообращения: ницерголин, винпоцетин, ксантинола никотинат, винкамин, нафтидрофурил, циннаризин; • общетонизирующие средства и адаптогены: ацетиламиноянтарная кислота, экстракт женьшеня, мелатонин, лецитин. • психостимуляторы: сульбутиамин; • антигипоксанты и антиоксиданты: оксиметилэтилпиридина сукцинат (мексидол); • ацефен и его производные. Признаки ноотропной активности присутствуют в фармакодинамике глутаминовой кислоты, мемантина и левокарнитина. Кроме того, в эксперименте показано ноотропное действие ряда нейропептидов и их синтетических аналогов (АКТГ и его фрагменты, соматостатин, вазопрессин, окситоцин, тиролиберин, меланостатин, холецистокинин, нейропептид Y, субстанция Р, ангиотензин II, холецистокинин-8, пептидные аналоги пирацетама и др.) [Ноотропы, 2017].Известные ноотропы [Ноотропы, 2017]
Ампакины производные пирролидона Пирацетам («Ноотропил») Анирацетам Оксирацетам Прамирацетам производные диафенилпирролидона Фенотропил производные ГАМК и ГОМК: Пикамилон Фенибут Гопантеновая кислота («Пантогам», «Пантокальцин») Пиритинол Меклофеноксат (Centrophenoxine, Lucidril) Винпоцетин Ergoloid mesylates (Hydergine) Ницерголин, производное эрголоида Нейропептиды и их аналоги: Ноопепт Семаке (синтетический аналог фрагмента адренокортикотропного гормона (АКТГ4–10)) Селанк (синтетический аналог тафтсина) Вазопрессин (антидиуретический гормон) Десмопрессин (DDAVP), синтетический аналог вазопрессина Глицин Milacemide Кофеин Никотин Амфетамин (Фенамин, Adderall, Dexedrine) Адрафинил (Olmifon) Модафинил (Provigil) DMAE — используется для лечения синдрома расстройства внимания. Ингибиторы ацетилхолинэстеразы и предшественники ацетилхолина — два класса лекарств (добавок), которые обладают ноотропным эффектом при использовании в ограниченных дозах: Холина альфосцерат (Alpha-GPC, L-alpha glycerylphosphorylcholine, Choline alfoscerate) — наиболее эффективный предшественник холина, свободно пересекающий гематоэнцефалический барьер; Huperzine А — сильный ингибитор ацетилхолинастеразы, получаемый из китайского клуб-моха; CDP-Choline (Cytidine Diphosphate Choline) — предшественник холина, более экономичная альтернатива Alpha GPC. Лецитин — природный предшественник ацетилхолина. Большие дозы ацетилхолина могут быть опасны для здоровья. Витамины и витаминподобные вещества, обладающие выраженным ноотропным эффектом: Acetyl-L–Carnitine (ALCAR) Холин с витамином В 5 НАДН Витамин С Кофермент Q Сульбутиамин Растительное сырье, обладающее ноотропным эффектом: Гинкго Withania somnifera (ashwagandha) Васора monnieri Melissa officinalis (lemon balm) Элеутерококк (сибирский женьшень) Celastrus paniculatus Gotu kola Sutherlandia frutescens Аминокислоты и их производные: фенилаланин тирозин глицин ацетил-аминоянтарная кислотаДоказательства эффективности [Ноотропы, 2017]
Винпоцетин (Кавинтон). Резюме и дополнительные сведения: 27 клинических испытаний с 1985 г. Все перечисленные показания к применению препарата имеют уровень рекомендованности не выше «С». Гопантеновая кислота (Гопантам, Кальция гопантенат, Пантогам, Пантокальцин). Резюме и дополнительные сведения: Доказательные сведения об эффективности и безопасности в Кокрейновской базе данных и других источниках доказательной информации отсутствуют. 1 клиническое испытание с 1988 г. Никотиноил гамма-аминомасляная кислота (Пикамилон). Резюме и дополнительные сведения: Клинические испытания в базах данных Кокрейновской библиотеки отсутствуют. Ни для одного из перечисленных показаний к применению не указана степень доказанности. Пирацетам (Луцетам, Ноотропил). Резюме и дополнительные сведения: Проведённые к настоящему времени систематические обзоры результатов имеющихся клинических исследований не подтвердили эффективность пирацетама. 333 клинических испытания с 1972 г. Фенибут Резюме и дополнительные сведения: клинических испытания с 1997 г. Ни для одного из перечисленных показаний к применению не указана степень доказанности. Фенотропил Резюме и дополнительные сведения: Клинические испытания не зарегистрированы в Кокрейновской базе данных. Церебролизин Резюме и дополнительные сведения: Доказательных сведений об эффективности при большинстве показаний к настоящему времени нет. 53 клинических испытания с 1976 г. Циннаризин (Стугерон). Резюме и дополнительные сведения: 137 клинических испытаний с 1966 г. Этилметилгидроксипиридина сукцинат (Мексидант, Мексидол, Мексикор). Резюме и дополнительные сведения: нет убедительных свидетельств, подтверждающих клиническую эффективность препарата. Не рекомендуется назначать пациентам ноотропные препараты в качестве терапии, основываясь только на нейропротективное, нейрорепаративное и модифицирующее действие (2В) [Болезнь Пасркинсона, 2022].Тесты для самоконтроля
1. Препаратами группы аналептиков являются (все ответы верны, кроме одного): A. Сиднокарб, кофеин, фенамин Б. Бемегрид, кордиамин, сульфокамфокаин B. Амитриптилин, имипрамин, флуоксетин2. Аналептик — антагонист снотворных барбитуратов (все ответы неверны, кроме одного): A. Кордиамин Б. Кофеин B. Бемегрид
3. Сульфокамфокаин (все ответы верны, кроме одного): A. Применяется при кардиогенном шоке Б. Вводится энтерально (внутрь, ректально) B. Обладает противовоспалительными свойствами Г. Может вызывать аллергию
4. Кофеин (все ответы верны, кроме одного): A. Является психостимулятором Б. Является аналептиком B. Расширяет сосуды скелетных мышц и почек Г. Вызывает сужение сосудов брюшной полости, расширение коронарных сосудов
5. Ноотропные средства (все ответы неверны, кроме одного): A. Кофеин-бензоат натрия, кордиамин, бемегрид, цитизин Б. Флуоксетин, имипрамин, амитриптилин B. Пирацетам, аминалон, пантогам
6. Показания к применению ноотропов (все ответы верны, кроме одного): A. Нарушение умственного развития у детей, в комплексной терапии деменции Б. Повышение скорости реакций, работоспособности, устранение усталости B. В составе лечения острых и хронических нарушений мозгового кровообращения.
Ответы:
1. Б 2. В 3. Б 4. Б 5. В 6. БРегуляторы мышечного тонуса
Противосудорожные средства
Противосудорожные препараты (также известные как противоэпилептические препараты) представляют собой разнообразную группу фармакологических агентов, используемых при лечении эпилептических припадков. Обычные противоэпилептические препараты (ПЭП) могут блокировать натриевые каналы или усиливать функцию гамма-аминомасляной кислоты (ГАМК). Дополнительные мишени включают потенциалзависимые кальциевые каналы, SV2A и а28. Блокируя натриевые или кальциевые каналы, противоэпилептические препараты уменьшают высвобождение возбуждающего глутамата, высвобождение которого считается повышенным при эпилепсии, а также ГАМК. Вероятно, это побочный эффект или даже фактический механизм действия некоторых противоэпилептических препаратов, поскольку ГАМК может сама, прямо или косвенно, действовать противосудорожно. Другой потенциальной мишенью противоэпилептических препаратов является альфа-рецептор, активируемый пролифератором пероксисом [Эпилепсия, 2020]. Примерно 60–70 % пациентов с эпилепсией достигают стойкой ремиссии или существенного урежения приступов на фоне лечения противоэпилептическими средствами. Лечение начинают с начальной (стартовой) дозы наиболее подходящего средства для данного пациента (персонализированный подход). Дозу постепенно увеличивают (титруют) до прекращения приступов или появления побочных эффектов. Каждый препарат имеет свою схему титрации [Эпилепсия, 2020]. При фокальных формах эпилепсии в режиме монотерапии разрешены к применению: бензобарбитал (1А), вальпроевая кислота (1А), габапентин (1А), зонисамид (1А), карбамазепин (1А), клоназепам (1А), лакосамид (1А), ламотриджин (1А), леветирацетам (1А), окскарбазепин (1А), примидон (2В).1 топирамат (1А), фенитоин (1А), фенобарбитал (1А), эсликарбазепин (1А) [Эпилепсия, 2020].Бензобарбитал [Эпилепсия, 2020]
Механизм действия. Усиливает тормозные ГАМК-ергические влияния в центральной нервной системе, особенно в таламусе, восходящей активирующей ретикулярной формации ствола головного мозга на уровне вставочных нейронов. Блокада натриевых каналов мембраны нервных волокон. Способ применения и дозы. Рекомендован детям старше 6 лет и взрослым. Детям 7–10 лет — по 50–100 мг на прием (150–300 мг/сут), 11–14 лет — по 100 мг на прием (300–400 мг/сут). Максимальные дозы для детей (старшего возраста): разовая — 150 мг, суточная — 450 мг. Взрослым: перорально начиная с 100 мг в вечернее время. Увеличение дозы возможно через 3 дня на 100 мг до достижения клинического эффекта. Средняя суточная доза составляет — 300–600 мг в сутки в 3 приема.Бриварацетам [Эпилепсия, 2020]
Рекомендован подросткам с 16 лет и взрослым пациентам. Механизм действия. Обратимый и селективный лиганд для синаптических пузырьков 2А (SV2A) в головном мозге. Хотя точная роль данного белка неизвестна, было показано, что он модулирует экзоцитоз нейротрансмиттеров. Имеет в 25 раз более высокую аффинность, чем левитерацетам. Способ применения и дозы. Внутрь, не разжевывая, запивая водой, независимо от приема пищи. Рекомендуемая начальная доза составляет 50 мг/сутки или 100 мг/сутки по решению лечащего врача исходя из требуемого противосудорожного эффекта и потенциального побочного действия. Суточная доза делится поровну на два приема утром и вечером. В зависимости от индивидуального ответа и переносимости, доза может быть изменена в пределах от 50 мг/сутки до 200 мг/сутки.Вальпроевая кислота [Эпилепсия, 2020]
Механизм действия. Вальпроевая кислота ингибирует вольтажзависимые натриевые каналы, блокирует кальциевые каналы Т-типа, а также воздействует на ГАМК-ергическую систему. Полагают, что вальпроевая кислота ингибирует ГАМКтрансаминазу (фермент, расщепляющий ГАМК) и повышает активность декарбоксилазы глутаминовой кислоты (фермент, участвующий в синтезе ГАМК). Вальпроевая кислота увеличивает вызванное ГАМК постсинаптическое ингибирование. Способ применения и дозы. Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Пролонгированные формы применяются 2 раза в сутки; непролонгированные формы — 3 раза в сутки. У детей, которые не могут глотать таблетки, целесообразно применение специальных лекарственных форм вальпроевой кислоты (капель, сиропа, микрогранул). У пациентов любого возраста целесообразен прием вальпроевой кислоты в виде лекарственных форм пролонгированного действия, что улучшает переносимость и дает дополнительный противосудорожный эффект. Для приема внутрь у детей с массой тела более 25 кг начальная доза составляет 10–15 мг/кг/сут. Затем дозу постепенно увеличивают на 200 мг/сут с интервалом 3–4 дня до достижения клинического эффекта. Средняя суточная доза составляет 20–30 мг/кг. Для детей с массой тела менее 25 кг и новорожденных средняя суточная доза составляет 20–30 мг/кг. Для взрослых: внутрь начиная с 300–500 мг/сутки (в два приема) с постепенным увеличением на 250–300 мг/неделю до достижения поддерживающей дозы 600–3000 мг/сутки. Терапевтическая концентрация в плазме крови — 50–150 мкг/мл. Вальпроевая кислота ингибирует микросомальные ферменты (цитохромы) печени, поэтому ее применение вызывает увеличение концентрации в крови других ПЭП (фенобарбитала, ламотриджина, карбамазепина).Габапентин [Эпилепсия, 2020]
Механизм действия. Ингибирует потенциал-зависимые кальциевые каналы связываясь с альфа-2-дельта субъединицей данного канала, вызывая снижение выброса нейротрансмиттера. Способ применения и дозы. Для взрослых и детей с 12 лет: терапию можно начинать с дозы по 300 мг 3 раза в сутки в 1-й день или увеличивать постепенно до 900 мг/сут по схеме: 300 мг 1 раз в сут. — 1 день, 300 мг × 2 раза в сут. — 2-й день, далее 300 мг × 3р в сут. Эффективная среднетерапевтическая доза 900 -2400 мг/сут. Максимальная доза 3600 мг/сут.Диазепам [Эпилепсия, 2020]
Механизм действия. Относится к группе производных бензодиазепина. Механизм действия диазепама тесно связан с тормозным эндогенным нейромедиатором гаммааминомасляной кислотой (ГАМК) и рецептором ГАМКА. Диазепам усиливает тормозное влияние ГАМК-ергических нейронов в ЦНС, стимулирует бензодиазепиновые рецепторы, усиливает пресинаптическое торможение. Диазепам (раствор ректальный) предназначен для лечения продолжительных (более 2–3 минут) острых судорожных приступов при эпилепсии у младенцев с 6 месяцев, детей грудного, дошкольного, младшего школьного возраста и подростков (до 18 лет). Способ применения и дозы. Ректально. Содержимое одной микроклизмы должно быть введено полностью за одно применение. Доза диазепама подбирается индивидуально в зависимости от состояния пациента, его возраста, массы тела, вида и тяжести заболевания. Детям с массой тела менее 15 кг назначают 5 мг; детям с массой тела более 15 кг — 10 мг. Максимальный эффект развивается через 11–23 минуты. При введении высоких доз необходим тщательный медицинский контроль и мониторинг состояния пациента. Если приступ не купировался в течение 10 минут после применения диазепама, необходимо обратиться за экстренной медицинской помощью и передать пустой тюбик врачу, чтобы предоставить ему информацию о дозе, полученной пациентом. Диазепам (раствор для внутривенного и внутримышечного введения). Взрослым при эпилептическом статусе назначают в/м или в/в по 10–20 мг. При необходимости дозу повторяют через 3–4 часа. Детям назначают после 5-й недели жизни в/в медленно по 0,1–0,3 мг/кг массы тела до максимальной дозы 5 мг. При необходимости инъекцию повторяют через 2–4 часа в зависимости от клинической ситуации. Детям от 5 лет и старше по 1 мг в/в медленно каждые 2–5 мин до максимальной дозы 10 мг. При необходимости лечение можно повторить через 4 часа.Зонисамид [Эпилепсия, 2020]
Механизм действия. Блокатор потенциал-зависимых натриевых каналов, ингибитор кальциевых каналов Т-типа, блокирует карбоангидразу. Показания: Монотерапия у взрослых пациентов с парциальными эпилептическими приступами с вторичной генерализацией или без, с впервые диагностированной эпилепсией. В составе дополнительной терапии у взрослых, подростков и детей с 6 лет с парциальными эпилептическими приступами с вторичной генерализацией или без. Способ применения и дозы. Внутрь, запивая водой, вне зависимости от приема пищи. Доза препарата подбирается с учетом лечебного эффекта. Взрослые пациенты. Эффективной является суточная доза 300–500 мг. Для монотерапии: начальная доза 100 мг/сут однократно. Увеличение на 100 мг с двухнедельным интервалом до максимальной рекомендованной дозы 500 мг. Для дополнительной терапии: начальная доза — 50 мг/сут, разделенные на два приема. На 2–3-й неделе можно увеличить дозу до 100 мг/сут. Далее увеличение не более, чем на 100 мг каждые 7 дней (для пациентов, принимающих индукторы ферментов печени) и на 100 мг каждые 2 недели (для пациентов, не принимающих индукторы ферментов печени, пациентов с почечной или печеночной недостаточностью) до максимальной рекомендованной дозы 500 мг в день. Подростки и дети с 6 лет. Начальная доза 1 мг/кг в сутки (однократно) с увеличением дозы на 1 мг/кг с недельными интервалами при сопутствующем приеме индукторов ферментов печени. И с шагом 1 мг/кг с двухнедельными интервалами при отсутствии приема индукторов ферментов печени. Доза препарата подбирается с учетом клинического эффекта.Карбамазепин [Эпилепсия, 2020]
Механизм действия. Блокатор потенциалзависимых натриевых каналов. Способ применения и дозы. Рекомендован к применению для взрослых и детей от 3 лет в виде таблеток. Для взрослых стартовая доза составляет 100–200 мг/сут внутрь в 1–2 приема с постепенным увеличением на 200 мг/неделю до достижения поддерживающей дозы 600–1200 мг/сутки. Максимальная доза — 1600 мг/сутки. Терапевтическая концентрация в плазме крови — 4–12 мкг/мл. Частота приема — 3 раза в сутки. Целесообразно применение ретардных форм 1–2 раза в сутки. Детям старше 3-х лет — начальная доза 100 мг/сут, с постепенным повышением на 100 мг каждую неделю. Поддерживающие дозы 10–20 мг/кг в сут (в несколько приемов). Детям 4–5 лет — 200–400 мг/сут. в 1–2 приема. Детям 6–10 лет — 400–600 мг/сут в 2–3 приема. Детям 11–15 лет — 600–1000 мг/сут в 2–3 приема. Подросткам старше 15 лет — 800–1200 мг/сут в 2–3 приема (как для взрослых).Клоназепам [Эпилепсия, 2020]
Механизм действия. Усиливает ингибирующее действие ГАМК. Способ применения и дозы. Рекомендован к применению для взрослых и детей от 3 лет в виде таблеток. Взрослые. Начальная доза должна быть не более 1,5 мг/сут, разделенная на 3 приема (0,5 мг 3 раза в день) внутрь. Дозу необходимо постепенно увеличивать на 0,5–1 мг через каждые 3 дня. Поддерживающая доза устанавливается индивидуально для каждого пациента в зависимости от клинического эффекта (4–8 мг/сут в 3–4 приема). Максимальная суточная доза — 20 мг/сут. Дети 3–5 лет. Начальная доза 0,25 мг/сут. Поддерживающая доза 1–3 мг/сут. Дети 6–12 лет. Начальная доза 0,5 мг/сут. Поддерживающая доза 3–6 мг/сут. Максимальная суточная доза для детей составляет 0,2 мг/кг/сут. Пациенты пожилого возраста. Начальная доза должна быть не более 0,5 мг/сут.Клобазам [Эпилепсия, 2020]
Механизм действия. Производное бензодиазепина. Усиливает ингибирующее действие ГАМК. Рекомендован в качестве дополнительной терапии для пациентов с эпилепсией, не достигших ремиссии на терапии одним или более ПЭП. Способ применения и дозы. Внутрь в виде таблеток для взрослых и детей старше 3-х лет, вне зависимости от приема пищи, целиком, либо измельчив и смешав с яблочным пюре. Таблетка 10 мг может быть разделена на равные половинки по 5 мг каждая. При лечении эпилепсии рекомендуемая начальная доза составляет 20–30 мг/сут. При необходимости дозу можно увеличить до 60 мг/сут. Детский возраст до 6 лет. У детей лечение следует начинать с минимальной дозы 5 мг/сут; поддерживающая доза составляет 0,3–1 мг/кг массы тела в сутки. На сегодняшний день не существует лекарственной формы препарата для безопасного и точного его дозирования при лечении детей младше 6 лет, в связи с чем невозможно дать рекомендации в отношении дозы препарата, которую можно применять у детей данной возрастной категории.Лакосамид [Эпилепсия, 2020]
Лекарственные формы: таблетки, раствор для приема внутрь, раствор для инфузий. Механизм действия. Избирательно усиливает медленную инактивацию потенциалзависимых натриевых каналов, что ведет к стабилизации гипервозбудимых мембран нейронов. Способ применения и дозы. Таблетки, покрытые пленочной оболочкой для приема внутрь (50 мг, 100 мг, 150 мг, 200 мг). Рекомендованы для взрослых и подростков с эпилепсией с 16 лет. Внутрь в 2 приема — утром и вечером, вне зависимости от времени приема пищи. Стартовая доза составляет 50 мг 2 раза в день. Через 1 нед дозу увеличивают до 100 мг 2 раза в день. С учетом эффективности и переносимости поддерживающую дозу можно увеличить до 150 мг 2 раза в день на 3-й неделе, до 400 мг/день (200 мг 2 раза в день) с 4-й недели. Максимальная рекомендуемая доза 600 мг/с (для монотерапии). Раствор для приема внутрь. Рекомендован для приема внутрь взрослым, подросткам и детям 4 лет и старше как в монотерапии, так и в дополнительной терапии эпилепсии. Суточную дозу делят на 2 приема — обычно утром и вечером, вне зависимости от приема пищи. Подростки и дети с массой тела 50 кг и выше, а также взрослые. Монотерапия. Рекомендуемая начальная доза составляет 50 мг 2 раза в день с последующим увеличением до начальной терапевтической дозы 100 мг 2 раза в день по истечении первой недели лечения. В зависимости от ответа и переносимости, поддерживающая доза может быть увеличена на 100 мг/сут (50 мг × 2р в день) с интервалами в неделю. Максимальная суточная поддерживающая доза 600 мг/сут (300 мг × 2р в день). Дополнительная терапия. Рекомендуемая начальная доза составляет 50 мг 2 раза в день с последующим увеличением до начальной терапевтической дозы 100 мг 2 раза в день по истечении первой недели лечения. В зависимости от ответа и переносимости, доза может быть увеличена на 100 мг/сут (50 мг × 2р в день) с интервалами в неделю. Рекомендуемая максимальная суточная поддерживающая доза 400 мг/сут (200 мг × 2р в день). Дети (старше 4 лет) и подростки с массой тела до 50 кг. Доза определяется на основании массы тела. Поэтому рекомендуется начинать лечение с раствора для приема внутрь, а затем переходить на таблетки (по желанию). При назначении раствора для приема внутрь дозу следует выражать в объемных (мл), а не в весовых единицах (мг). Монотерапия. Рекомендуемая начальная доза составляет 2 мг/кг/сут, которая должна быть увеличена до начальной терапевтической дозы 4 мг/кг/сут по истечении первой недели. В зависимости от ответа и переносимости лечения, поддерживающая доза может быть увеличена еще на 2 мг/кг/сут с интервалами в неделю. Дозу следует повышать постепенно до получения оптимального ответа. У детей с массой тела до 40 кг максимальная рекомендованная доза составляет 12 мг/кг/сут. У детей с массой тела от 40 кг до 50 кг максимальная рекомендованная доза составляет 10 мг/кг/сут. Раствор для инфузий назначают взрослым пациентам и подросткам с 16 лет с эпилепсией в тех случаях, когда временно невозможна пероральная терапия. Общая продолжительность лечения внутривенной формой лакосамида находится на усмотрении врача.Ламотриджин [Эпилепсия, 2020]
Механизм действия. Воздействует на вольтаж-зависимые натриевые каналы и блокирует выброс нейротрансмиттеров, в первую очередь глутамата. Способ применения и дозы. При приеме внутрь для взрослых и детей старше 12 лет начальная доза при монотерапии составляет 25 мг один раз в день в течение 2 недель; в последующие 2 недели — по 50 мг один раз в день. В дальнейшем, каждые одну-две недели можно повышать суточную дозу на 50 мг до тех пор, пока не будет достигнут оптимальный эффект. Обычно суточная поддерживающая доза составляет 100–200 мг. При этом положительный эффект может быть достигнут в некоторых случаях и на больших дозировках: 400–500 мг/сутки. У пациентов, принимающих вальпроевую кислоту, начальная суточная доза ламотриджина в течение двух недель должна составлять 25 мг через день; в течение следующих двух недель ежедневно принимать по 25 мг один раз в день. В последующем, каждые 1–2 недели дозу можно увеличивать на 25–50 мг, до тех пор, пока не будет достигнут оптимальный эффект. Обычно поддерживающая суточная доза составляет 100–200 мг. У взрослых, принимающих ПЭП, индуцирующие ферменты печени, лечение начинают с 50 мг в течение двух недель. В течение последующих двух недель 100 мг/сут распределенные на два приема. В дальнейшем, каждые 1–2 недели можно повышать дозу не более, чем на 100 мг до получения оптимального эффекта. Дети в возрасте от 3 до 12 лет. Монотерапия. Начальная доза препарата при монотерапии пациентов с типичными абсансами составляет 0,3 мг/кг/сут в 1 или 2 приема в течение 2-х недель с последующим повышением дозы до 0,6 мг/кг/сут в 1 или 2 приема в течение следующих 2 недель. Затем дозу препарата следуетувеличивать максимально на 0,6 мг/кг каждые 1–2 недели до достижения оптимального терапевтического эффекта. Обычная поддерживающая доза составляет от 1 до 10 мг/кг/сут в 1 или 2 приема, хотя некоторым пациентам с типичными абсансами требуются более высокие дозы. Комбинированная терапия. У пациентов, принимающих вальпроевую кислоту в сочетании с другими ПЭП или без них, начальная доза препарата составляет 0,15 мг/кг сут 1 раз в день в течение 2 недель; в дальнейшем — 0,3 мг/кг/сут — 1 раз в сутки в течение 2 недель. Затем доза может быть увеличена максимально на 0,3 мг/кг каждые 1–2 недели до достижения оптимального терапевтического эффекта. Обычная поддерживающая доза составляет 1–5 мг/кг/сут в 1 или 2 приема. Максимальная доза составляет 200 мг/сут. У пациентов, которые получают ПЭП или другие препараты, индуцирующие глюкуронизацию ламотриджина, в сочетании с другими ПЭП или без них (за исключением вальпроевой кислоты), начальная доза препарата составляет 0,6 мг/кг/сут в 2 приема в течение 2 недель. Затем дозу следует увеличивать максимально на 1,2 мг/кг каждые 1–2 недели до достижения оптимального терапевтического эффекта. Обычная поддерживающая доза составляет 5–15 мг/кг/сут в 2 приема. Максимальная доза составляет 400 мг/сут.Леветирацетам [Эпилепсия, 2020]
Механизм действия. Связывается с белком синаптических пузырьков 2А (synapticvesicle 2А, SV2A). Опосредованная модуляция выделения нейротрансмиттера через модификацию белка синаптических везикул (SV2A). Способ применения и дозы. Таблетки, покрытые пленочной оболочкой. Внутрь, независимо от приема пищи. Суточную дозу препарата делят на два приема в одинаковой дозе. Монотерапия. Взрослым и подросткам с 16 лет лечение следует начинать с суточной дозы 500 мг, разделенной на 2 приема (по 250 мг 2 раза в сутки). Через 2 недели доза может быть увеличена до начальной терапевтической — 1000 мг (по 500 мг 2 раза в сутки). Максимальная суточная доза составляет 3000 мг (по 1500 мг 2 раза в сутки). В составе дополнительной терапии. Взрослым и подросткам (от 12 до 17 лет) с массой тела более 50 кг лечение следует начинать с суточной дозы 1000 мг, разделенной на 2 приема (по 500 мг 2 раза в сутки). В зависимости от клинического ответа и переносимости суточная доза может быть увеличена до максимальной — 3000 мт (по 1500 мг 2 раза в сутки). Изменение дозы на 500 мг 2 раза в сутки может осуществляться каждые 2–4 недели. Детям с 6 лет и подросткам (от 12 до 17 лет) с массой тела менее 50 кг лечение следует начинать с суточной дозы 20 мг/кг массы тела, разделенной на 2 приема (по 10 мг/кг массы тела 2 раза в сутки). Изменение дозы на 20 мг/кг массы тела (по 10 мг/кг массы тела 2 раза в сутки) может осуществляться каждые 2 недели до достижения рекомендуемой суточной дозы — 60 мг/кг массы тела (по 30 мг/кг массы тела 2 раза в сутки). Врач должен назначить препарат в наиболее подходящей лекарственной форме и дозировке в зависимости от возраста, массы тела пациента и необходимой терапевтической дозы. В связи с отсутствием нужной дозировки таблетки не предназначены для лечения детей весом менее 25 кг, при назначении дозы менее 250 мг, а также для пациентов, имеющих трудности при глотании. В этих случаях рекомендуется начинать лечение с приема препарата в форме раствора для приема внутрь. Детям с массой тела более 50 кг дозирование осуществляют по схеме, приведенной для взрослых. Раствор для приема внутрь. Внутрь, независимо от приема пищи. Суточную дозу препарата делят на два приема в одинаковой дозе. Монотерапия. Взрослым и подросткам с 16 лет лечение следует начинать с суточной дозы 500 мг, разделенной на 2 приема (по 250 мг 2 раза в сутки). Через 2 недели доза может быть увеличена до начальной терапевтической — 1000 мг (по 500 мг 2 раза в сутки). Максимальная суточная доза составляет 3000 мг (по 1500 мг 2 раза в сутки). В составе дополнительной терапии. Взрослым с 18 лет и подросткам (от 12 до 17 лет) с массой тела более 50 кг лечение следует начинать с суточной дозы 1000 мг, разделенной на 2 приема (по 500 мг 2 раза в сутки). В зависимости от клинической реакции и переносимости препарата суточная доза может быть увеличена до максимальной — 3000 мг (по 1500 мг 2 раза в сутки). Изменение дозы на 500 мг 2 раза в сутки может осуществляться каждые 2–4 недели. Детям в возрасте от 6 месяцев до 23 месяцев, детям в возрасте от 2 лет до 11 лет и подросткам от 12 лет до 17 лет с массой тела менее 50 кг. Лечение следует начинать с дозы 20 мг/кг массы тела, разделенной на 2 приема (по 10 мг/кг массы тела 2 раза в сутки). В зависимости от клинической реакции и переносимости препарата суточная доза может быть увеличена до 30 мг/кг 2 раза в сутки. Изменение дозы на 20 мг/кг (по 10 мг/кг массы тела 2 раза в сутки) массы тела может осуществляться каждые 2 недели. Следует применять минимальную эффективную дозу. Дети в возрасте от 1 месяца до 6 месяцев. Начальная лечебная доза равна 7 мг/кг два раза в сутки. В зависимости от клинической эффективности и переносимости, доза может быть увеличена до 21 мг/кг два раза в сутки. Изменение дозы не должно превышать плюс или минус 7 мг/кг два раза в сутки каждые две недели. Следует назначать минимальную эффективную дозу.Мидазолам [Эпилепсия, 2020]
Механизм действия. Бензодиазепин короткого действия, производное группы имидобензодиазепинов. Стимулирует в мембранах нейронов бензодиазепиновые рецепторы, повышая чувствительность ГАМКА — рецепторов к ГАМК, усиливая процессы торможения в ЦНС. Способ применения и дозы. Мидазолам (раствор защечный) предназначен для лечения продолжительных (более 2–3 минут) острых судорожных приступов при эпилепсии у младенцев, детей грудного, дошкольного, младшего школьного возраста и подростков от 3 месяцев до 18 лет. Лечение младенцев в возрасте 3–6 месяцев должно проводиться в условиях стационара при возможности мониторинга состояния и наличии реанимационного оборудования. Рекомендованные дозы указаны в таблице. В возрасте от 3 до 6 месяцев рекомендована доза 2,5 мг мидазолама (Тюбик 2,5 мг/мл), от 6 месяцев до 1 года — 2,5 мг, от 1 года до 5 лет — 5,0 мг, от 5 лет до 10 лет — 7,5 мг, от 10 лет до 18 лет — 10,0 мг. Мидазолам (раствор защечный) предназначен для нанесения на слизистую оболочку полости рта. Необходимо в полном объеме медленно ввести раствор в пространство между десной и щекой. При необходимости (при больших объемах и/или у маленьких пациентов) половину дозы вводят медленно за одну щеку, а затем вторую половину — медленно за другую щеку. Мидазолам (раствор для внутривенного или внутримышечного введения 5 мг/мл) Применяется для лечения эпилептического статуса судорожных приступов у детей и взрослых. Препарат вводится в/м однократно в дозе 10 мг при массе тела более 40 кг и 5 мг при массе 13–40 кг. Мидазолам вводится внутримышечно однократно в дозе 0,2–0,3 мг/кг. Разовая доза не должна превышать: для детей до 5 лет — 5 мг (1 мл), старше 5 лет — 10 мг (2 мл); внутривенно 400 мкг/кг.Окскарбазепин [Эпилепсия, 2020]
Механизм действия. Блокада потенциалзависимых Na+ — каналов, а также модуляция К+ и Са+ — каналов. Способ применения и дозы. Принимают внутрь. Взрослые. Начальная доза составляет 600 мг/сутки в 2 приема. Дозу при необходимости увеличивают на 600 мг с интервалами в 1 неделю. Средняя терапевтическая доза — 600–2400 мг/сутки. Дети от 1 месяца и подростки. Начальная доза — 8–10 мг/кг массы тела/сут, разделенные на 2 приема. Далее дозу корректируют в зависимости от схемы лечения, возраста пациента, эффективности лечения, функции почек. У детей младше 3 лет препарат следует применять в форме сиропа в связи с трудностями применения твердых лекарственных форм у этой возрастной группы.Перампанел [Эпилепсия, 2020]
Механизм действия. Селективный неконкурентный антагонист ионотропных АМРА-глутаматных рецепторов на постсинаптических нейронах. Способ применения и дозы. Перампанел принимают внутрь 1 раз в сутки перед сном независимо от приема пищи. Таблетку проглатывают целиком (нельзя делить, разжевывать). Стартовая доза составляет 2 мг/сут. Доза может быть увеличена в зависимости от клинического ответа и переносимости с шагом 2 мг (один раз в неделю либо один раз в две недели). Средняя терапевтическая доза 4–8 мг/сутки. Максимальная доза — 12 мг/сутки. Взрослые и подростки с 12 лет. Для дополнительного лечения парциальных приступов с вторично-генерализованными приступами или без них с эпилепсией; для дополнительного лечения первично-генерализованных тоникоклонических приступов при идиопатической генерализованной эпилепсии. Дети с 4 до 11 лет для дополнительного лечения парциальных приступов с вторично-генерализованными приступами или без них с эпилепсией. Дети в возрасте от 7 до 11 лет для дополнительного лечения первично-генерализованных тоникоклонических приступов при идиопатической генерализованной эпилепсии. Противопоказание: дети с 4 до 11 лет с массой тела менее 30 кг (для данной лекарственной формы).Прегабалин [Эпилепсия, 2020]
Механизм действия. Опосредован через дополнительную субъединицу (а2-дельтапротеин) вольтаж-зависимых Са-каналов в ЦНС. Способ применения и дозы. Внутрь, независимо от приема пищи. Препарат применяют в дозе от 150 до 600 мг/сут в 2 или 3 приема. Рекомендован взрослым пациентам в качестве дополнительной терапии эпилепсии с парциальными судорожными припадками, сопровождающимися или не сопровождающимися вторичной генерализацией. Начальная доза прегабалина составляет 150 мг/сут. С учетом достигнутого эффекта и переносимости через 1 неделю дозу можно увеличить до 300 мг/сут, а еще через неделю — до 450 мг/с. Максимальная доза 600 мг/сут.Примидон [Эпилепсия, 2020]
Механизм действия. По химическому строению близок к фенобарбиталу, но отличается более сильным противосудорожным действием, не оказывая общего угнетающего влияния на центральную нервную систему. Способ применения и дозы. Таблетки примидон принимают внутрь после приема пищи. Дозы подбирают индивидуально, начиная с разовой дозы 125 мг однократно внутрь после еды, затем каждые 3 дня суточную дозу увеличивают на 125 мг до достижения 500 мг/сут. Затем каждые 3 дня дозу повышают на 250 мг для взрослых и детей старше 9 лет; на 125 мг — для детей от 3 до 9 лет, до достижения необходимого эффекта. Максимальная суточная доза для взрослых и детей с 9 лет — 1500 мг/сут; для детей 3–9 лет — 1000 мг/сут (в 2 приема).Руфинамид [Эпилепсия, 2020]
Механизм действия. Руфинамид модулирует активность натриевых каналов, пролонгируя их неактивное состояние. Способ применения и дозы. Внутрь, 2 раза в день (утром и вечером) в равных дозах, запивая водой, во время еды. Если пациенту трудно глотать, таблетки можно измельчить и принять, добавив измельченную таблетку в половину стакана воды. Применение у детей в возрасте от 1 до 4 лет. Пациенты, не принимающие вальпроевую кислоту. Лечение следует начинать с суточной дозы 10 мг/кг, разделенной на 2 приема примерно через каждые 12 часов. В соответствии с клиническим ответом и переносимостью дозу можно повышать в каждый третий день на 10 мг/кг/сутки до целевой дозы 400 мг/кг/сутки, разделенной на 2 приема примерно через каждые 12 часов. Максимальная рекомендованная доза для данной группы пациентов составляет 45 мг/кг/сутки. Пациенты, принимающие вальпроевую кислоту. Так как вальпроевая кислота значительно снижает клиренс руфинамида, то пациентам, принимающим одновременно вальпроевую кислоту, рекомендуется принимать руфинамид в меньшей максимальной дозе. Лечение следует начинать с суточной дозы 10 мг/кг, разделенной на 2 приема примерно через каждые 12 часов. В соответствии с клиническим ответом и переносимостью дозу можно повышать в каждый третий день на 10 мг/кг/сутки до целевой дозы 30 мг/кг/сутки, разделенной на 2 приема примерно через каждые 12 часов. Максимальная рекомендованная доза для данной группы пациентов составляет 30 мг/кг/сутки. Применение у детей в возрасте старше 4 лет с массой тела менее 30 кг. Пациенты с массой тела менее 30 кг, не принимающие вальпроевую кислоту. Лечение следует начинать с суточной дозы 200 мг. В соответствии с клиническим ответом и переносимостью дозу можно повышать в каждый третий день на 200 мг/сутки до максимальной рекомендованной дозы 1000 мг/сутки. Пациенты с массой тела менее 30 кг, также принимающие вальпроевую кислоту. Лечение следует начинать с суточной дозы 200 мг. В соответствии с клиническим ответом и переносимостью дозу можно повышать не ранее чем через 2 дня на 200 мг/сутки до максимальной рекомендованной дозы 600 мг/сутки. Применение у взрослых, подростков и детей в возрасте старше 4 лет с массой тела более 30 кг. Пациенты с массой тела более 30 кг, не принимающие вальпроевую кислоту: Лечение следует начинать с суточной дозы 400 мг. В соответствии с клиническим ответом и переносимостью дозу препарата можно повышать через день на 400 мг/сут до максимальной рекомендованной дозы, как указано в таблице ниже. Масса тела 30,0- 50,0 кг 50,1–70,0 кг >70,1 кг. Максимальная рекомендованная доза 1800 мг/сутки 2400 мг/сутки 3200 мг/сутки. Пациенты с массой тела более 30 кг, принимающие вальпроевую кислоту. Лечение следует начинать с суточной дозы 400 мг. В соответствии с клиническим ответом и переносимостью дозу препарата можно повышать через день на 400 мг/сутки до максимальной рекомендованной дозы, как указано в таблице ниже. Масса тела 30,0–50,0 кг 50,1–70,0 кг >70,1 кг Максимальная рекомендованная доза 1200 мг/сутки 1600 мг/сутки 2200 мг/сутки.Топирамат [Эпилепсия, 2020]
Рекомендован к применению детям старше 2 лет, подросткам и взрослым пациентам для лечения впервые диагностированной эпилепсии (монотерапия и в составе комплексной терапии), синдроме Леннокса — Гасто (в составе комплексной терапии). Механизм действия. Модуляция активности вольтаж-зависимых натриевых каналов, потенцирование вызванного ГАМК-потока ионов хлора, ингибирование кальциевых каналов, блокада каинатных рецепторов глутамата, ингибирование изоферментов карбоангидразы. Способ применения и дозы. Топирамат принимают внутрь, вне зависимости от приема пищи. При монотерапии: Дети: начальная доза — исходя из расчета 0,5–1 мг топирамата на кг веса ребёнка, один раз в сутки, перед сном, в течение недели, далее каждые одну или две недели дозу топирамата повышают на 0,5–1 мг на кг веса в сутки, разделяя её на два приема, до достижения клинического эффекта; рекомендуемая доза — 3–6 мг на кг веса ребёнка (в некоторых случаях — до 500 мг в сутки). Взрослые: начальная доза — 25 мг топирамата один раз в сутки, перед сном, в течение недели, далее каждые одну-две недели дозу топирамата поднимают на 25–50 мг в сутки, разделяя её на два приема, до достижения клинического эффекта; рекомендуемая доза — 100 мг топирамата в сутки, но не более 500 мг топирамата в сутки (иногда — до 1000 мг в сутки). В составе комплексной терапии доза топирамата назначается индивидуально, в зависимости от состояния пациента и типа лечения.Фенитоин [Эпилепсия, 2020]
Механизм действия. В основном связан с влиянием на вольтажзависимые натриевые каналы. Способ применения и дозы. Для взрослых начальная доза составляет 100 мг (1 таб.) от 2 до 4 раз в день. В последующие 7–10 дней возможно повышение дозы до максимальной 600 мг/сут. Стандартная поддерживающая доза составляет от 200 до 500 мг/сут. разделенная на несколько приемов. Детям — 5 мг/кг/сут в два приема с последующим увеличением дозы не более 300 мг/сут. Поддерживающие дозы — 4–8 мг/кг/сут.Фенобарбитал [Эпилепсия, 2020]
Механизм действия. Действие обусловлено активацией ГАМК-ергической системы, влиянием на потенциалзависимые натриевые каналы, а также подавлением активности глутамата. Способ применения и дозы. Внутрь. Режим дозирования устанавливают строго индивидуально в зависимости от показаний, течения заболевания, переносимости, возраста. Лечение необходимо начинать с наименьшей эффективной дозы. Дети: 5–8 мг/кг в сут (противопоказания: детский возраст до 3 лет для твердой лекарственной формы). Взрослые: перорально начиная с 50 мг на ночь. Увеличение дозы возможно через 3 дня на 50 мг до достижения клинического эффекта. Средняя суточная доза составляет — 100–200 мг в 2 приема.Эсликарбазепин [Эпилепсия, 2020]
Механизм действия. Медленная инактивация потенциал-зависимых Na+-каналов, дополнительный антиэпилептический эффект связан с влиянием на Са2+-каналы. Способ применения и дозы. Взрослые пациенты (старше 18 лет). Принимают внутрь независимо от приема пищи. Таблетку можно делить на две равные части. Рекомендованная начальная доза — 400 мг 1 раз в сутки, через 1–2 нед дозу повышают до 800 мг 1 раз в сутки, максимальная доза может быть повышена до 1600 мг при монотерапии и 1200 мг при дополнительной терапии, однократно в сутки.Этосуксимид [Эпилепсия, 2020]
Механизм действия. Влияние на вольтажзависимые кальциевые каналы (Т-каналы). Способ применения и дозы. Капсулы следует проглатывать целиком с достаточным количеством жидкости (например, стакан воды), во время или после еды. У детей (с 6 лет) и у взрослых лечение начинают с общей суточной дозы, находящейся в диапазоне от 5 до 10 мг/кг массы тела. Общая суточная доза этосуксимида может повышаться на 5 мг/кг с интервалом от 4 до 7 дней в зависимости от клинического ответа. Для поддерживающей терапии, как правило, достаточно суточной дозы 20 мг/кг у детей и 15 мг/кг у взрослых. Максимальная суточная доза 40 мг/кг массы тела у детей и 30 мг/кг массы тела у взрослых. Суточную дозу принимают в 2–3 приема. В связи с длительным периодом полувыведения этосуксимида при хорошей переносимости всю суточную дозу можно принимать однократно.Тесты для самоконтроля
Выберите два правильных ответа.1. ПРИ ЛЕЧЕНИИ БОЛЬШИХ ПРИПАДКОВ ЭПИЛЕПСИИ ПРИМЕНЯЮТ: *1) фенобарбитал *2) дифенин 3) аминазин 4) суксилеп
2. ДИФЕНИН ПРИМЕНЯЮТ ПРИ: *1) сердечных аритмиях 2) при бессоннице *3) больших припадках эпилепсии 4) малых припадках эпилепсии
3. ПРОТИВОЭПИЛЕПТИЧЕСКИЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ В НЕЙРОСТОМАТОЛОГИИ: 1) леводопа 2) карбамазепин *3) ламотриджин *4) дифенин
4. ДИФЕНИН: 1) применяют в качестве снотворного средства *2) снижает содержание в клетке ионов натрия *3) снижает возбудимость нейронов 4) повышает возбудимость нейронов
5. ХЛОРАЛГИДРАТ: *1) применяется для купирования приступов эпилепсии *2) обладает раздражающим действием 3) является противопаркинсоническим средством 4) является производным барбитуровой кислоты
6. ПРОТИВОЭПИЛЕПТИЧЕСКИЕ ПРЕПАРАТЫ ОТМЕНЯЮТ ПОСТЕПЕННО, ТАК КАК: *1) может развиться феномен «отдачи» *2) могут усилиться судорожные приступы 3) необходимо предотвратить лекарственную зависимость 4) это чревато недостаточностью функции надпочечников
7. КАРБАМАЗЕПИН: *1) эффективен при невралгии тройничного нерва 2) имеет синоним «триметин» 3) обладает антидепрессивным действием *4) является противоэпилептическим лекарственным средством
8. ОТМЕТЬТЕ ПРОТИВОЭПИЛЕПТИЧЕСКИЕ ПРЕПАРАТЫ: 1) леводопа *2) ламотриджин 3) кетамин *4) карбамазепин
9. ПРИ ЭПИЛЕПСИИ ЦЕЛЕСООБРАЗНО НАЗНАЧИТЬ: *1) гексамидин 2) морфин 3) антихолинэстеразные препараты *4) карбамазепин
10. ДЛЯ КУПИРОВАНИЯ РАЗВИВШЕГОСЯ СУДОРОЖНОГО ПРИПАДКА МОЖНО ПРИМЕНЯТЬ: *1) диазепам *2) хлоралгидрат 3) бромизовал 4) этосуксимид
11. КАРБАМАЗЕПИН: 1) является производным барбитуровой кислоты 2) имеет синоним «реланиум» *3) эффективен при невралгии тройничного нерва *4) эффективен при фокальной эпилепсии
12. ОТМЕТЬТЕ ПРОТИВОЭПИЛЕПТИЧЕСКИЕ СРЕДСТВА: 1) циклодол 2) леводопа *3) карбамазепин *4) ламотриджин
13. ХЛОРАЛГИДРАТ: 1) является противопаркинсоническим средством *2) имеет дозировку 0,5–1,0 3) обладает гипертензивным действием *4) применяется для купирования приступов эпилепсии
14. МЕХАНИЗМ ДЕЙСТВИЯ ПРОТИВОЭПИЛЕПТИЧЕСКИХ СРЕДСТВ СВЯЗЫВАЮТ С: 1) увеличением внутриклеточного содержания натрия *2) активацией ГАМК-ергической системы 3) уменьшением образования дофамина *4) блокадой натриевых каналов
Противопаркинсонические средства
Основное действие этих препаратов направлено на увеличение уровня дофамина в центральной нервной системе. Дофамин наряду с ацетилхолином, серотонином и норадреналином является важнейшим нейромедиатором. Его основное действие проявляется в стриатуме на преимущественно постсинаптически расположенные D1- и D2-рецепторы. Повторный захват дофамина в пресинаптические окончания и его инактивация идет путём транспортеров дофамина. В дальнейшем дофамин разрушается под воздействием ферментов моноаминоксидазы типа В (МАО-В) и катехол-О-метилтрансферазы (КОМТ). Недостаток дофамина приводит к переизбытку ацетилхолина и к недостаточности серотонина и норадреналина, следствием чего является нарушение координированных движений или возникновение непреднамеренных, непроизвольных движений. Повысить уровень дофамина можно несколькими способами: дополнительной подачей в головной мозг дофамина или веществ, действующих как дофамин (агонисты дофамина); блокадой ферментов, активирующих разрушение дофамина (КОМТ-, МАО-В-, NMDA-блокаторы), снижением повышенного уровня ацетилхолина (антихолинэргики) [Противопаркинсонические, 2017]. Паркинсонизм — синдром, проявляющийся сочетанием гипокинезии с мышечной ригидностью, тремором покоя и постуральной неустойчивостью, обычно связанный с поражением базальных ганглиев и их связей [Болезнь Паркинсона, 2022]. Около 5–7 % случаев болезни Паркинсона (БП) представлены наследственными (моногенными) формами, тогда как большинство случаев являются спорадическими и имеют мультифакториальную природу. В основе спорадических случаев БП может лежать взаимодействие генетических факторов и экзогенных воздействий, в совокупности определяющих характер процессов клеточной детоксикации и репарации, кругооборота ксенобиотиков, энергетического и нейротрансмиттерного метаболизма у конкретного индивидуума [Болезнь Паркинсона, 2021].Таблица 4 Противопаркинсонические средства [Болезнь Паркинсона, 2022]


Рекомендуется назначать дофаминергические средства пациентам с симптомами паркинсонизма, которые ограничивают повседневную активность, вызывают озабоченность больного в качестве начальной терапии (2В). Рекомендуется начинать лечение с ингибитора моноаминооксидазы (тип В) у пациентов с легкими двигательными нарушениями (2В), с агонистов дофаминовых рецепторов (АДР) — у пациентов с умеренно выраженными двигательными нарушениями и в возрасте до 70–75 лет, учитывая высокий риск развития моторных флуктуаций (1А) [Болезнь Паркинсона, 2022]. Не рекомендуются применять эрголиновые производные АДР как препараты первой линии в связи с риском развития фиброза клапанов сердца и других фиброзирующих реакций. Рекомендуется отдавать преимущество препаратам допа и ее производным в качестве начальной терапии у пациентов с выраженными двигательными и когнитивными нарушениями, серьезными преморбидными заболеваниями пожилого возраста (старше 70 лет) в связи с высоким риском нейропсихиатрических реакций [Болезнь Паркинсона, 2022]. Не рекомендуется начинать прием препаратов допа и ее производных с замедленным высвобождением или трехкомпонентного препарата леводопа+энтакапон+карбидопа у пациентов в качестве начальной терапии (1А). Рекомендуется добавление к дофаминергическим средствам антихолинергических средств или пропранолола (20, 40 и 80 мг/сут) (1А), клозапина (12,5–25 мг в сутки) (4С) для коррекции выраженного дрожания [Болезнь Паркинсона, 2022]. Рекомендуется переводить с пероральных форм препаратов допа и ее производных на леводопа+карбидопа гель для интестинального введения у пациентов на развернутой стадии для достижения контроля за двигательными симптомами и повышения качества жизни (1А). Добавление амантадина к терапии препаратом допа и ее производными в дозе 200 мг в сутки позволяет уменьшить проявления лекарственных дискинезий (1А). При выраженных когнитивных нарушениях с риском психозов терапия амантадином не рекомендована [Болезнь Паркинсона, 2022].
Тесты для самоконтроля
1. Ограничения к назначению Леводопы: 1) выраженный атеросклероз; 2) грудное вскармливание;* 3) детский возраст (до 12 лет),* 4) инфаркт миокарда в анамнезе.*2. Ограничения к назначению Ропинирола: 1) беременность;* 2) нарушение функции печени;* 3) отеки; 4) период грудного вскармливания.
3. Ограничения к назначению Селегилина: 1) выраженное недоразвитие фолликулов; 2) психоз;* 3) тиреотоксикоз;* 4) феохромоцитома.*
4. Основные проявления болезни Паркинсона: 1) гипокинезия (скованность движений);* 2) паралич; 3) ригидность (резко повышенный тонус мышц);* 4) тремор (постоянное непроизвольное дрожание).*
5. Побочные эффекты от применения Бромокриптина: 1) головокружение, сонливость;* 2) побеление пальцев рук и ног при охлаждении;* 3) почечная недостаточность; 4) снижение остроты зрения.*
6. Побочные эффекты от применения Леводопы: 1) гипертензия; 2) нарушение аппетита;* 3) ортостатическая гипотензия;* 4) тошнота, рвота.*
7. Побочные эффекты от применения Ропинирола: 1) дискинезия;* 2) запор; 3) сонливость;* 4) тошнота.*
8. Побочные эффекты ст применения Селегилина: 1) бесплодие; 2) сонливость или бессонница;* 3) супраорбитальные боли;* 4) тревожность *
9. Побочные эффекты от применения Циклодола: 1) головокружение;* 2) запор;* 3) нарушения аппетита; 4) нервозность*
10. Побочные эффекты со стороны ЖКТ от применения Мидантана: 1) диспепсические расстройства;* 2) запор; 3) нарушения аппетита;* 4) сухость во рту.*
11. Побочные эффекты со стороны мочевыделительного тракта от применения Мидантана: 1) никтурия;* 2) олигурия; 3) полиурия;* 4) протеинурия.
12. Побочные эффекты со стороны нервной системы от применения Мидантана: 1) зрительные галлюцинации;* 2) психические расстройства;* 3) психозы; 4) раздражительность *
Обезболивающие средства
Боль — это неприятное ощущение и эмоциональное переживание, возникающее в связи с настоящей или потенциальной угрозой повреждения тканей [Хроническая боль, 2020]. Ноцицептивная боль — возникает тогда, когда повреждающий ткань раздражитель действует на периферические болевые рецепторы. Причинами этой боли могут быть самые разные травматические, инфекционные, дисметаболические и другие повреждения (карциноматоз, метастазы, забрюшинные новообразования), вызывающие активацию периферических болевых рецепторов. Ноцицептивная боль — это чаще всего острая боль, со всеми присущими ей характеристиками [Хроническая боль, 2020]. Нейропатическая боль — это боль, вызванная поражением или заболеванием соматосенсорной системы. Поражение центральной или периферической соматосенсорной системы является источником центральной или периферической нейропатической боли соответственно [Хроническая боль, 2020]. Хроническая боль — изменения в системе регуляции болевой чувствительности и развитие индивидуального психологического ответа на болевые ощущения, формирующие у пациента свое собственное отношение к возникшей проблеме [Хроническая боль, 2020]. Основным, наиболее удобным, безопасным и в большинстве случаев эффективным методом лечения хронической боли является фармакотерапия [Когония Л. М., 2021].Таблица 5 Органные и системные изменения при болевом синдроме [Хроническая боль, 2020]
Эффективность анальгетиков у одного и того же пациента варьируется. В связи с этим выбор препарата и подбор дозы путем «титрования» должен осуществляться строго индивидуально, с учетом интенсивности боли и переносимости лекарственного средства. Анальгетик должен вводиться регулярно с целью предотвращения, а не устранения боли после её возникновения. Соответственно, необходимо учитывать период полувыведения и продолжительность действия анальгетика для регулярного приема. Применение анальгетика «по требованию» требует значительно больших доз лекарственных средств и имеет отрицательное психологическое действие [Когония Л. М., 2021]. Предпочтение должно отдаваться пероральному способу введения анальгетика как наиболее эффективному, простому, удобному и наименее болезненному для большинства пациентов. Альтернативой пероральным лекарственным формам являются суппозитории и трансдермальные терапевтические системы опиоидов. К инъекционному способу введения анальгетиков для постоянной терапии ХБС следует прибегать в исключительных случаях при невозможности использования неинвазивных лекарственных форм. При этом более предпочтительным является подкожный путь введения; внутривенные инъекции используются только в случае необходимости достижения быстрого эффекта; внутримышечный путь введения в силу болезненности не должен применяться для постоянного обезболивания [Когония Л. М., 2021].
 Рисунок 1. «Лестница обезболивания» хронической онкологической боли у взрослых.
Рисунок 1. «Лестница обезболивания» хронической онкологической боли у взрослых.
В некоторых случаях (при наличии интенсивного болевого синдрома и недостаточном контроле боли посредством традиционной опиоидной терапии) может рассматриваться эпидуральное или интратекальное введение опиоидов. Слабые (неопиоидные) анальгетики (парацетамол, НПВП) не должны назначаться в виде единственной терапии пациенту, страдающему от боли умеренной или сильной интенсивности. При сильных болях терапию можно начинать с назначения парацетамола/НПВП в комбинации с опиоидом (например, пероральным морфином) [Когония Л. М., 2021]. Для поддерживающей терапии онкологической боли у взрослых (в т. ч. пожилых лиц) и подростков может использоваться любой опиоид (в виде монотерапии или в комбинации с парацетамолом и/или НПВП), позволяющим достичь устойчивого, эффективного и безопасного обезболивания.
Оценка эффективности обезболивающей терапии
[Когония Л. М., 2021]: • Оценка времени начала аналгезии после разовой дозы препарата; • Продолжительность действия разовой дозы препарата; • Расчет разовых и суточных доз основного анальгетика в динамике на этапах терапии; • Расчет суточных доз дополнительных анальгетиков; • Оценка длительности терапии анальгетиком (сут).Оценка переносимости обезболивающей терапии
[Когония Л. М., 2021]: • Учет побочных эффектов (ПЭ) предшествующей терапии; • Выявление основных ПЭ, связанных с приемом анальгетика: седации, головокружения, тошноты, рвоты, повышенного потоотделения, сухости во рту, головной боли, снижения аппетита, нарушений функций пищеварительного тракта (запоров, диареи), задержки мочи, общей слабости, психических расстройств; • Степень выраженности ПЭ по четырехбалльной шкале: 0 — ПЭ отсутствуют (отличная переносимость); 1 — легкая (хорошая переносимость); 2 — умеренная (удовлетворительная переносимость); 3 — сильная степень выраженности (плохая переносимость).Тесты для самоконтроля
1. АНАЛЬГЕТИЧЕСКОЕ ДЕЙСТВИЕ НЕНАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ СВЯЗАНО С: 1) усилением антиноцицептивной активности *2) уменьшением экссудации, отека 3) возбуждением опиатных рецепторов *4) угнетением синтеза простагландинов2. ЖАРОПОНИЖАЮЩЕЕ ДЕЙСТВИЕ ПАРАЦЕТАМОЛА СВЯЗАНО С: 1) уменьшением теплоотдачи *2) увеличением теплоотдачи 3) увеличением возбудимости центра терморегуляции *4) уменьшением возбудимости центра терморегуляции
3. К ПРОИЗВОДНЫМ ПИРАЗОЛОНА ОТНОСЯТ: 1) кеторолак *2) анальгин 3) индометацин *4) бутадион
4. ПРИ ВЫСОКОЙ ТЕМПЕРАТУРЕ НЕОБХОДИМО: *1) снизить возбудимость центра терморегуляции 2) активизировать процесс теплопродукции *3) ингибировать простагландины группы Е 4) активировать синтез арахидоновой кислоты
5. НЕНАРКОТИЧЕСКИЕ ПРЕПАРАТЫ С ВЫРАЖЕННОЙ АНАЛЬГЕЗИЕЙ: *1) ибупрофен 2) фентанил *3) кеторолак 4) морфин
6. ПИРАЗОЛОНЫ И САЛИЦИЛАТЫ ПОНИЖАЮТ ГИПЕРТЕРМИЮ ЗА СЧЕТ: *1) увеличения теплоотдачи 2) увеличения теплопродукции *3) снижения возбудимости центра терморегуляции 4) прямого возбуждения центра терморегуляции
7. АНАЛЬГИН ПРИ ЗУБНОЙ БОЛИ: *1) уменьшает эмоциональную окраску боли *2) стимулирует образование эндорфинов 3) уменьшает боль в связи с ингибированием простагландина Е2 4) снижает боль из-за уменьшения воспаления
8. АЦЕТИЛСАЛИЦИЛОВУЮ КИСЛОТУ ПРИМЕНЯЮТ: *1) для снижения агрегации тромбоцитов * 2) как болеутоляющее средство * 3) как жаропонижающее средство 3) при повышенной 4) для лечения язвы желудка
9. ЖАРОПОНИЖАЮЩИМ ДЕЙСТВИЕМ ОБЛАДАЮТ ПРЕПАРАТЫ: * 1) парацетамол * 2) кислота ацетилсалициловая 3) промедол 4) атропин
10. УВЕЛИЧИВАЮТ ТЕПЛООТДАЧУ: *1) производные пиразолона 2) производные фенантрена 3) производные изохинолина *4) производные пропионовой кислоты
11. НАПРОКСЕН: * 1) назначают 2 раза в сутки *2) превосходит по болеутоляющему действию диклофенак-натрия 3) вызывает тяжелое кровотечение 4) нарушает зрение
12. ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ НЕНАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ ОПРЕДЕЛЯЕТСЯ: *1) угнетением чувствительности брадикининовых рецепторов *2) уменьшением давления экссудата на нервные проводники 3) увеличением теплоотдачи 4) подавлением теплоотдачи
13. НЕОПИОИДНЫЕ СРЕДСТВА С АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ: 1) фентанил 2) налоксон *3) парацетамол *4) анальгин
14. МЕХАНИЗМ ЖАРОПОНИЖАЮЩЕГО ДЕЙСТВИЯ ПАРАЦЕТАМОЛА: *1) уменьшение синтеза простагландинов группы Е 2) увеличение теплообразования 3) подавление теплоотдачи *4) угнетение центра терморегуляции
15. ПРИ РАДИКУЛИТЕ ИСПОЛЬЗУЮТ: 1) фентанил *2) индометацин 3) парацетамол *4) диклофенак-натрия
Нестероидные противовоспалительные средства
Нестероидные противовоспалительные препараты (НПВП) являются неселективными ингибиторами обеих изоформ фермента циклооксигеназы (ЦОГ-1 и ЦОГ-2). ЦОГ отвечает за выработку простагландинов и тромбоксана из арахидоновой кислоты, которая в свою очередь получается из фосфолипидов клеточной мембраны за счёт фермента фосфолипазы А2.Классификация НПВП
В зависимости от химической структуры и характера активности НПВП классифицируются следующим образом: 1. Кислоты • Салицилаты: ацетилсалициловая кислота (аспирин), дифлунизал, лизинмоноацетилсалицилат. • Пиразолидины: фенилбутазон, метамизол натрия. • Производные индолуксусной кислоты: индометацин, сулиндак, этодолак. • Производные фенилуксусной кислоты: диклофенак, ацеклофенак. • Оксикамы: пироксикам, теноксикам, мелоксикам. • Производные пропионовой кислоты: ибупрофен, напроксен, флурбипрофен, кетопрофен, декскетопрофен, тиапрофеновая кислота. 2. Некислотные производные • Алканоны: набуметон • Производные сульфонамида: нимесулид, целекоксиб, рофекоксиб.Рекомендуется назначение парацетамола в качестве терапии пациентам с хронической болью (1В). Следует принимать парацетамол в суточной дозе 3 грамма, а у пациентов со старческой астенией или старше 80 лет — не более 2 грамм в сутки. Рекомендуется назначение НПВС в минимально эффективных дозах короткими курсами (не более 14 дней) с учетом риска нежелательных эффектов со стороны ЖКТ и сердечно-сосудистого риска пациентам старше 60 лет с сильной ноцицептивной хронической болью в спине и/или суставах или в качестве компонента мультимодальной терапии при онкологической боли.
 Рисунок 2. Алгоритм терапии хронического болевого синдрома слабой интенсивности.
Рисунок 2. Алгоритм терапии хронического болевого синдрома слабой интенсивности.
Для лечения боли слабой интенсивности используются неопиоидные анальгетики. Данная группа препаратов представлена «чистыми» анальгетиками (парацетамол, метамизол) и НПВП (ацетилсалициловая кислота, диклофенак, кеторолак, кетопрофен, лорноксикам, нимесулид, мелоксикам, целекоксиб), ингибирующими ЦОГ и образование простагландинов в ЦНС и периферических тканях. Ненаркотические анальгетики парацетамол и метамизол, а также кеторолак оказывают практически исключительно центральное анальгетическое действие и не обладают клинически значимым противовоспалительным эффектом. В свою очередь, НПВП за счет периферического компонента действия уменьшают перифокальное воспаление, отек и сдавление тканей. НПВП являются ко-анальгетиками и препаратами выбора в терапии костно-мышечной боли, в т. ч. связанной с метастазами [Когония Л. М., 2021]. Недопустимо превышение максимальной суточной дозы препаратов, указанной в инструкции по применению, в частности: парацетамола — 4 г; ибупрофена — 1200 мг; лорноксикама — 16 мг; мелоксикама — 15 мг; диклофенака — 150 мг; целекоксиба — 400 мг. Продолжительность непрерывного применения метамизола и кеторолака рекомендуется ограничивать 5 днями или использовать интермиттирующие курсы. Максимальная суточная доза метамизола при пероральном приеме — 4 г; инъекционно 2 г (в 2–3 приема). Максимальная суточная доза кеторолака при приеме внутрь — 40 мг; при инъекционном введении — 90 мг в несколько приемов. Традиционную максимальную суточную дозу парацетамола (4 г) у пожилых и ослабленных пациентов рекомендуется снижать до 3 г в целях снижения риска гепатотоксического действия препарата [Когония Л. М., 2021]. При необходимости анальгетики первой ступени дополняются средствами адъювантной и симптоматической терапии.
Нежелательные явления неопиоидных анальгетиков
[Когония Л. М., 2021] Суточная доза парацетамола у пациентов с хроническими и декомпенсированными заболеваниями печени, хроническим алкоголизмом, кахексией и дегидратацией не должна превышать 3 г. Пациентам с множественным метастатическим поражением печени и явлениями печеночной недостаточности следует избегать назначения парацетамола. Метамизол противопоказан пациентам с лейкопенией в виду риска миелотоксического действия. Максимальная суточная доза кеторолака у пациентов старше 65 лет или с нарушенной функцией почек не должна превышать 60 мг. Курсовой прием метамизола и кеторолака следует ограничивать 5 днями. Все НПВП противопоказаны пациентам с эрозивно-язвенными заболеваниями ЖКТ в стадии обострения, выраженной печеночной или почечной недостаточностью, «аспириновой триадой», заболеваниями сердечно-сосудистой системы (ХСН II–IV функционального класса по классификации NYHA, ИБС, неконтролируемая АГ, заболевания периферических артерий, цереброваскулярные заболевания) вследствие риска тромбообразования, инфаркта миокарда и тромбоэмболических осложнений. Селективные ингибиторы ЦОГ-2 (коксибы) могут быть предпочтительнее традиционным НПВП у пациентов высокого риска по развитию осложнений со стороны верхних отделов ЖКТ, т. е. при наличии в анамнезе язвы, кровотечения или перфорации ЖКТ, а также при приеме любых антиагрегантов и/или антикоагулянтов. Дополнительным методом профилактики НПВП-гастропатий, целесообразным в т. ч. при назначении коксибов пациентам высокого риска, является прием ингибиторов протонной помпы.Тесты для самоконтроля
Выберите два правильных ответа.1. ПРОТИВОВОСПАЛИТЕЛЬНОЕ ДЕЙСТВИЕ НПВС (НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ) ОБУСЛОВЛЕНО: *1) ингибированием ЦОГ *2) снижением синтеза простагландинов 3) уменьшением проницаемости капилляров 4) усилением альтерации
2. ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ ОБЛАДАЮТ: 1) препараты опия *2) салицилаты 3) синтетические заменители морфина *4) оксикамы
3. МЕХАНИЗМ ДЕЙСТВИЯ НПВС СВЯЗАН С: *1) ингибированиен ЦОГ-1 или ЦОГ-2 2) активацией медиаторов воспаления 3) увеличением содержания арахидоновой кислоты *4) нарушением синтеза простагландинов
4. САЛИЦИЛАТЫ ОБЛАДАЮТ: *1) ульцерогенным действием 2) седативным действием *3) жаропонижающим 4) противокашлевым
5. НАРУШАЮТ ОБРАЗОВАНИЕ ПРОСТАГЛАНДИНОВ: 1) омнопон *2) кислота ацетилсалициловая 3) промедол *4) анальгин
6. ПРИ ПРИМЕНЕНИИ АСПИРИНА НАБЛЮДАЕТСЯ: *1) нарушение свертывания крови *2) ульцерогенное действие 3) брадикардия 4) остановка дыхания
7. ПРОТИВОВОСПАЛИТЕЛЬНОЕ, ЖАРОПОНИЖАЮЩЕЕ И АНАЛЬГЕЗИРУЮЩЕЕ ДЕЙСТВИЕ ВЫРАЖЕНО У: *1) индометацина *2) ибупрофена 3) кодеина 4) этилморфина
8. ИНДОМЕТАЦИН ОБЛАДАЕТ ДЕЙСТВИЕМ: 1) гипотензивным *2) противовоспалительным 3) противомикробным *4) обезболивающим
9. ПРОИЗВОДНЫЕ ПИРАЗОЛОНА ОКАЗЫВАЮТ ПРОТИВОВОСПАЛИТЕЛЬНОЕ ДЕЙСТВИЕ ЗА СЧЕТ: 1) усиления синтеза простагландинов 2) блокады фосфолипазы А2 *3) угнетения синтеза простагландинов *4) блокады циклооксигеназы
10. УЛЬЦЕРОГЕННОЕ ДЕЙСТВИЕ ПРЕПАРАТОВ САЛИЦИЛОВОЙ КИСЛОТЫ ОБУСЛОВЛЕНО: 1) уменьшением выработки соляной кислоты *2) уменьшением синтеза муцина 3) стимуляцией холинорецепторов желудка *4) нарушением синтеза гастропротекторных простагландинов
11. ОТЛИЧИТЕЛЬНЫЕ ОСОБЕННОСТИ ЦЕЛЕКОКСИБА: *1) преимущественно ингибирует ЦОГ-2 *2) хорошо всасывается 3) влияет на агрегацию тромбоцитов 4) вводится только внутривенно
12. ОТМЕТЬТЕ НПВС: *1) диклофенак-натрий 2) преднизолон *3) индометацин 4) кодеин
13. ПРОТИВОВОСПАЛИТЕЛЬНОЕ ДЕЙСТВИЕ ОКАЗЫВАЮТ: *1) ингибиторы ЦОГ-1 2) наркотические анальгетики 3) препараты опия *4) ингибиторы ЦОГ-2
14. ПРИ РЕВМАТОИДНОМ АРТРИТЕ НЕОБХОДИМО: *1) снять воспаление суставов *2) уменьшить болевую реакцию 3) назначить наркотические препараты 4) активировать энергетические процессы в очаге воспаления
15. К ОКСИКАМАМ ОТНОСЯТСЯ: *1) пироксикам 2) индометацин 3) ибупрофен *4) мелоксикам
16. ПРИ ПРИМЕНЕНИИ ИБУПРОФЕНА НАБЛЮДАЕТСЯ: 1) диуретическое действие 2) спазмолитическое действие *3) противоревматическое действие *4) противовоспалительное действие
17. ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ ОБЛАДАЮТ: *1) целекоксиб 2) дротаверин 3) омнопон *4) индометацин
18. ДИКЛОФЕНАК-НАТРИЯ ПРИМЕНЯЮТ: *1) при миалгии *2) при полиартритах 3) только в онкологии 4) при травме позвоночника
19. НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА: *1) обладают противовоспалительным действием 2) не понижают температуру *3) оказывают анальгезирующий эффект 4) вызывают стоматит
20. УЛЬЦЕРОГЕННОЕ ДЕЙСТВИЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ ОБУСЛОВЛЕНО: 1) стимуляцией гистаминовых рецепторов желудка 2) стимуляцией вагусных влияний *3) ингибированием ЦОГ-1 *4) уменьшением образования слизи в желудке
Опиоиды
Опиоиды — вещества, способные связываться с опиоидными рецепторами организма, расположенными преимущественно в центральной нервной системе и желудочно-кишечном тракте. Опиоиды, обладающие структурным сходством с морфином, называют также опиатами, их молекулы имеют фенантреновую морфиновую основу. Действие опиоидов на организм связывают с анальгетическим и седативным эффектами, угнетением дыхательного и кашлевого центров, ослаблением перистальтики кишечника. Опиоиды находят широкое применение в медицине в качестве мощных обезболивающих препаратов опиоидных анальгетиков. Способность вызывать эйфорию обусловливает рекреационное использование опиоидов, которое может привести к зависимости и абстинентному синдрому. При болях умеренной интенсивности или непереносимости ненаркотических анальгетиков и НПВП применяются слабые опиоиды или малые дозы сильных опиоидов. Из слабых опиоидов в России доступен трамадол, в т. ч. в форме фиксированной комбинации с парацетамолом. Трамадол является пролекарством. Вариабельность ответа на стартовую дозу трамадола может быть обусловлена различиями в скорости метаболизма, состоянием печени и одновременным приемов лекарственных препаратов, модифицирующих активность цитохромов. Изомеры активных метаболитов трамадола обладают различным механизмом действия — опиоидным и неопиоидным, связанным с ингибированием обратного захвата норадреналина и серотонина. Последнее обусловливает наличие дополнительных лекарственных взаимодействий трамадола с серотонинергическими средствами (антидепрессантами, антиэметиками), а также нежелательных явлений (стимуляции ЦНС, серотонинового синдрома) [Когония Л. М., 2021]. Максимальная суточная доза трамадола составляет 400 мг («потолок аналгезии»). Превышение этой дозы приводит к незначительному увеличению обезболивающего эффекта, но повышает риск развития нежелательных явлений. У пожилых и ослабленных пациентов не рекомендуется превышать суточную дозу трамадола свыше 300 мг. Согласно рекомендациям Европейской ассоциации паллиативной помощи (2012), в качестве альтернативы «слабым» опиоидам для терапии умеренной боли можно использовать «сильные» опиоиды в низких дозах. Применительно к зарегистрированным в РФ препаратам на второй ступени терапии могут использоваться: морфин перорально в дозе до 30 мг/сут, оксикодон (в составе таблеток пролонгированного действия оксикодон/налоксон) до 20 мг/сут, фентанил в форме ТТС в дозировке 12,5 мкг/ч (на 72 ч), тапентадол перорально — до 200 мг/сут. Пропионилфенилэтоксиэтилпиперидин в форме защечных таблеток, эффект которого развивается в течение 5–10 мин и продолжается 3–4 ч, может применяться для терапии умеренной боли в качестве альтернативного препарата в суточной дозе до 120 мг. Однако его наиболее целесообразно использовать для терапии прорывов боли [Когония Л. М., 2021]. Применение тримеперидина для длительной терапии хронической боли недопустимо, поскольку его метаболит нормеперидин нейротоксичен и обладает способностью к кумуляции (при недостаточной элиминации он способен вызывать тяжелые психозы и судороги). Для усиления эффекта основных анальгетиков второй ступени по показаниям (для терапии нейропатической боли) назначаются адъювантные и симптоматические средства [Когония Л. М., 2021]. Для терапии онкологической боли умеренной интенсивности показано назначение слабых опиоидов или сильных опиоидов в малых дозах, в т. ч. в комбинации с ненаркотическими анальгетиками/НПВП.Таблица 6 Перечень опиоидных анальгетиков в неинвазивных лекарственных формах [Когония Л. М., 2021]
 1 Согласно действующей инструмкцкии препарат применяется только для терапии острой боли сильной и средней интенсивности (послеоперационная, травматическая, ожоговая, при проведении диагностических процедур).
2 В настоящее время лекарственная форма недоступна для применения.
3 Не рекомендуется для курсового применения в виду риска кумуляции нейротоксического метаболита нормеперидина.
1 Согласно действующей инструмкцкии препарат применяется только для терапии острой боли сильной и средней интенсивности (послеоперационная, травматическая, ожоговая, при проведении диагностических процедур).
2 В настоящее время лекарственная форма недоступна для применения.
3 Не рекомендуется для курсового применения в виду риска кумуляции нейротоксического метаболита нормеперидина.
 Рисунок 3. Алгоритм терапии хронического болевого синдрома умеренной интенсивности.
Рисунок 3. Алгоритм терапии хронического болевого синдрома умеренной интенсивности.
Таблица 7 Перечень зарегистрированных в РФ опиоидных анальгетиков в инъекционных лекарственных формах [Когония Л. М., 2021]


Боль сильной интенсивности требует применения сильных опиоидных анальгетиков. Морфин — наиболее широко применяемый препарат для терапии ХБС онкологического генеза. Могут использоваться пероральные формы морфина с немедленным (таблетки, раствор для приема внутрь) или модифицированным (таблетки и капсулы) высвобождением. Продолжительность действия морфина в пероральных формах с немедленным высвобождением составляет 4–6 ч (аналогично инъекциям), в пролонгированных формах — 10–12 ч. Препараты морфина короткого действия наиболее удобны для титрования дозы и терапии прорывов боли. Пролонгированные формы, назначаемые дважды в сутки, наиболее удобны для контроля постоянной боли. Максимальной дозы морфина у опиоидтолерантных пациентов не существует. Каждому пациенту доза препарата титруется до наименьшей эффективной и удовлетворительно переносимой [Когония Л. М., 2021]. Фиксированная комбинация оксикодон/налоксон в форме таблеток продленного действия назначается дважды в сутки. Обезболивающее действие развивается за счет оксикодона, имеющего высокую биодоступность при пероральном приеме (около 85 %). Налоксон, обладающий низкой биодоступностью при приеме внутрь (менее 3 %), действует как антагонист опиатных рецепторов ЖКТ и уменьшает выраженность обстипационного эффекта оксикодона. Максимальная суточная доза таблеток оксикодон/налоксон составляет 160/80 мг. Пропионилфенилэтоксиэтилпиперидин (просидол) в форме защечных таблеток, обеспечивающих быстрый, но непродолжительный эффект, требует частого приема. При регулярном приеме в высоких дозах значительно повышается его наркогенный потенциал. Это ограничивает применение пропионилфенилэтоксиэтилпиперидина в качестве препарата для постоянной терапии сильного ХБС. Максимальная суточная доза препарата составляет 250 мг [Когония Л. М., 2021]. Фентанил в форме ТТС (пластыря) наиболее подходит пациентам со стабильной потребностью в опиоидах (т. е. опиоид-толерантным). Является терапией выбора у пациентов с нарушением глотания; обструкцией ЖКТ; плохой переносимостью морфина; низким комплаенсом к пероральной терапии морфином или другим опиоидам. Кроме того, в виду метаболизма фентанила до неактивных продуктов, препарат подходит для терапии сильного ХБС у пациента с нарушением функции почек, в т. ч. с хронической болезнью почек 4 и 5 стадий (СКФ<30 мл/мин). Относительный риск развития нежелательных явлений со стороны ЖКТ (тошноты, рвоты, запора), задержки мочи и сонливости при применении ТТС фентанила на 3060 % ниже, чем при использовании пероральных форм морфина [Когония Л. М., 2021]. Обезболивающий эффект трансдермальных опиоидов развивается постепенно, поэтому при первом применении ТТС в течение первых суток необходимо сохранять прежнюю обезболивающую терапию. Начальную оценку максимального обезболивающего эффекта ТТС опиоида следует проводить не ранее чем через 24 ч после аппликации, а окончательную — после достижения стационарной концентрации опиоида в крови (2 последовательные аппликации пластыря). Требуется соблюдать осторожность при применении ТТС у пациентов с кахексией и лихорадкой. Нельзя подвергать пластырь действию внешних источников тепла (грелки, одеяла с подогревом, сауна и пр.), т. к. скорость высвобождения фентанила из системы может увеличиться, и возникнет угроза передозировки. Продолжительность действия ТТС фентанила составляет 3 суток. Поскольку фентанил является чистым агонистом μ-опиатных рецепторов, он не имеет максимальной суточной дозы у опиоид-толерантных пациентов [Когония Л. М., 2021]. Тапентадол имеет двойной механизм действия — опиоидный и неопиоидный (норадренергический). В определенной степени фармакологически напоминает трамадол, однако, в отличие от последнего, имеет более высокий анальгетический потенциал (слабее перорального морфина примерно в 2,5 раза), является активным лекарством (эффект не зависит от полиморфизма цитохромов печени), не влияет на обратный захват серотонина (меньший риск лекарственных взаимодействий), метаболизируется, преимущественно до неактивных метаболитов путем глюкуронизации (низкий риск кумуляции при умеренных нарушениях функции почек). Дополнительный норадренергический механизм действия тапентадола позволяет в определенной мере воздействовать на нейропатический компонент боли. Нейропатическая боль обычно резистентна к терапии опиоидами даже высокой потенции. В случае наличия у пациента нейропатического компонента ХБС более целесообразно не эскалировать дозу основного анальгетика, а дополнять схему терапии адъювантными препаратами [Когония Л. М., 2021]. Препаратом первого выбора для терапии онкологической боли сильной интенсивности является оральный морфин, во всех случаях, когда возможен пероральный прием препарата. В качестве альтернативы можно использовать препараты других сильных опиоидов, предпочтительно в неинвазивных формах. При невозможности применения опиоидов в пероральных или трансдермальной формах подкожное введение опиоида (морфина) является альтернативой первого выбора. Внутривенное введение опиоида следует использовать при наличии противопоказаний к подкожному введению (отеки, нарушения микроциркуляции, расстройства гемостаза, необходимость введения большой дозы или объема раствора препарата). Анальгетическая активность перорального и внутривенного морфина соотносится как 1:2–1:3 [Когония Л. М., 2021]. Болеутоляющий эффект опиоидных анальгетиков реализуется через воздействие на опиатные рецепторы. Они расположены в ЦНС и являются также точками приложения эндорфинов — собственных опиоидных пептидов, выработка которых в случае продолжительных интенсивных болей недостаточна. Резкая отмена или пропуск очередной дозы длительно применяющегося опиоида (особенно, в высокой дозе) или применение антагониста (парциального агониста) опиоидных рецепторов, може спровоцировать синдром отмены с возникновением прорыва боли [Когония Л. М., 2021].
 Рисунок 4. Алгоритм терапии хронического болевого синдрома сильной интенсивности.
Рисунок 4. Алгоритм терапии хронического болевого синдрома сильной интенсивности.
Наиболее безопасным методом подбора суточной дозы сильного опиоида является назначение пероральных форм морфина короткого действия по 5 мг каждые 4 часа, при необходимости дополняя их приемом 5 мг того же препарата между основными дозами (вплоть до ежечасного). В настоящее время для титрования дозы опиоида можно использовать таблетки морфина, покрытые пленочной оболочкой, в дозировке 5 мг, либо раствор морфина для приема внутрь 2 мг/1 мл в амп. по 5 мл (0,5 мл препарата). С целью титрования дозы опиоида допустимо использовать малые дозировки перорального морфина в формах с модифицированным высвобождением вещества (10 мг дважды в сутки), также дополняя их морфином быстрого действия по потребности для купирования прорывов боли [Когония Л. М., 2021]. Инъекционный морфин также можно использовать для определения суточной дозы опиоида. В этом случае раствор морфина 1 мг/мл вводится подкожно каждые 4 ч в дозе 5 мг (0,5 мл раствора) и, при необходимости, дополнительно 5 мг того же препарата используется для купирования прорывов боли между основными инъекциями (вплоть до ежечасного введения). У пациентов с очень сильной болью рекомендуется внутривенное титрование дозы морфина (например, по 1,5 мг каждые 10 мин) для быстрого достижения обезболивания [Когония Л. М., 2021]. После титрования и определения суточной дозы морфина (включающей то количество препарата, которое потребовалось для купирования прорывов боли), целесообразно перейти на опиоид с модифицированным высвобождением вещества (пролонгированного действия) для контроля постоянной боли в течение суток (IVC). В дальнейшем подобранную дозу можно корректировать, увеличивая ее не более чем на 30 % за сутки при недостаточной эффективности, или же уменьшать дозу опиоида в случае плохой переносимости при условии сохранения адекватного обезболивания. Перевод пациента с парентерального или перорального морфина на другой опиоид, в том числе, в рамках ротации опиоидов в связи с недостаточной эффективностью и/или плохой переносимостью, осуществляется на основании таблиц эквипотенциальных (эквианальгетических) доз, приводимых в инструкции по медицинскому применению соответствующего препарата [Когония Л. М., 2021].
Принципы терапии прорывной боли
Прорывная боль — это транзиторное усиление боли, возникающее на фоне относительно стабильной и адекватно контролируемой опиоидом основной боли. Скорость развития эпизода прорывной боли колеблется от 30 секунд до 10 минут. Средняя продолжительность эпизода — около 30 минут. Для терапии прорывной боли используются опиоиды с быстрым наступлением и короткой продолжительностью эффекта, например, пероральный морфин в таблетках или растворах. Подкожное введение морфина отличается более быстрым наступлением эффекта, однако менее предпочтительно ввиду инвазивности [Когония Л. М., 2021]. Доза морфина для купирования прорывной раковой боли обычно эквивалентна 10–15 % суточной дозы опиоида. Пропионилфенилэтоксиэтилпиперидин может использоваться для терапии прорывов боли в дозе от 10 до 20–40 мг в таблетках защечно или под язык [Когония Л. М., 2021]. За рубежом для купирования прорывной боли также применяются трансмукозальные формы фентанила с немедленным высвобождением вещества (интраназальный спрей, сублингвальные таблетки, «леденцы»). Они отличаются наибольшей скоростью развития эффекта среди всех неинвазивных форм опиоидов. В РФ зарегистрирован спрей назальный дозированный фентанила в 3 дозировках: 50 мкг, 100 мкг и 200 мкг/доза. Если в течение суток пациенту требуется более 4 доз опиоида для купирования прорывов боли, необходимо скорректировать суточную дозу основного опиоида продленного действия, а также рассмотреть вопрос о целесообразности назначения адъювантных средств [Когония Л. М., 2021].Нежелательные явления опиоидных анальгетиков
К наиболее частым нежелательным явлениям опиоидных анальгетиков относятся тошнота и рвота, запоры, седация. Тошноту и рвоту можно купировать метоклопрамидом или препаратами нейролептиков. Терапия запоров предполагает применение слабительных осмотического (лактулоза, макрогол) или стимулирующего (бисакодил, препараты сенны, натрия пикосульфат) типов действия. Седативный эффект опиоидов корригируется уменьшением дозировки препарата, если это возможно, или заменой опиоида. Наиболее опасной нежелательной реакцией является угнетение дыхания, возникающее при передозировке опиоида и устраняемое внутривенным введением налоксона. Необходимо учитывать короткую продолжительность действия налоксона и необходимость повторного введения препарата через 40–60 мин при возобновлении симптомов респираторной депрессии [Когония Л. М., 2021]. При применении трамадола возможно развитие дополнительных неопиоидных побочных эффектов. Они обусловлены серотониномиметическим стимулирующим действием на ЦНС. Может отмечаться эйфоризирующий эффект, ажитация, лабильность психики, галлюцинации, нарушения сна, судороги и пр. Потенциально жизнеугрожающим состоянием является серотониновый синдром. Риск его развития повышается при одновременном приеме трамадола с другими серотонинергическими препаратами: антидепрессантами (селективными ингибиторами обратного захвата серотонина, ингибиторами обратного захвата серотонина и норадреналина, трициклическими антидепрессантами, ингибиторами моноаминоаксидазы, миртазапином), противомигренозными агонистами 5-НТ1-серотониновых рецепторов (триптанами), антиэметиками — блокаторами 5-НТЗ-серотониновых рецепторов (сетронами). Серотониновый синдром развивается обычно в течение нескольких часов или дней от начала совместного приема трамадола с вышеуказанными препаратами. Специфическим антидотом является ципрогептадин [Когония Л. М., 2021]. Следует подчеркнуть, что до настоящего времени не имеется доказательств меньшего риска развития психической зависимости от «слабых» опиоидов в сравнении с «сильными» в эквианальгетических дозах. Инъекционные опиоиды в силу кратковременности эффекта требуют частого применения, болезненны, характеризуются более быстрым развитием толерантности и лекарственной зависимости, нарушают сон и дневную активность пациента, сопряжены с риском вторичной инфекции у ослабленных больных, требуют участия медицинского персонала. По этой причине инъекционные формы опиоидов для терапии ХБС должны применяться лишь в исключительных случаях при невозможности использования неинвазивных лекарственных форм [Когония Л. М., 2021]. Лекарственные препараты в домашних условиях необходимо хранить в местах, недоступных для детей. Недопустима передача лекарственных препаратов другим людям. Согласно Федеральному закону РФ от 31.12.2014 № 501-ФЗ запрещается требовать от пациентов и их родственников «возврат первичных упаковок и вторичных (потребительских) упаковок использованных в медицинских целях наркотических лекарственных препаратов и психотропных лекарственных препаратов, в том числе в форме трансдермальных терапевтических систем, содержащих наркотические средства, при выписке новых рецептов на лекарственные препараты, содержащие назначение наркотических лекарственных препаратов и психотропных лекарственных препаратов». Не рекомендуется снижать дозу опиоида при наличии артериальной гипотензии или спутанности сознания (если они не являются следствием избыточной дозы опиоида). В случае отмены опиоидного анальгетика его дозу следует снижать постепенно, не более, чем на 1/2 за сутки во избежание синдрома отмены и прорыва боли [Когония Л. М., 2021]. Рекомендуется сохранять прием опиоидов в эффективной дозе даже при отсутствии сознания. При рефрактерном болевом синдроме целесообразно рассмотреть вопрос о проведении медикаментозной седации с помощью нейролептиков, бензодиазепинов, барбитуратов и пропофола. Возможность медикаментозной седации обсуждается с пациентом и/или его законным представителем и рассматривается на заседании врачебной комиссии [Когония Л. М., 2021].Тесты для самоконтроля
Выберите два правильных ответа.1. ОТМЕТИТЬ НАРКОТИЧЕСКИЕ (ОПИОИДНЫЕ) АНАЛЬГЕТИКИ: 1) папаверин *2) промедол 3) налоксон *4) морфин
2. ПРИ ОСТРОМ ОТРАВЛЕНИИ МОРФИНОМ: *1) ввести атропина сульфат *2) ввести налоксон 3) дать наркоз 4) назначить антидепрессант
3. МЕХАНИЗМ ДЕЙСТВИЯ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ ОБУСЛОВЛЕН: 1) блокадой болевых рецепторов в тканях и органах *2) стимуляцией опиоидных рецепторов *3) нарушением передачи болевых импульсов в таламус 4) блокадой всех звеньев антиноцицептивной системы
4. НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ: *1) морфин *2) фентанил 3) папаверин 4) диазепам
5. МОРФИН ОКАЗЫВАЕТ ЭФФЕКТЫ: 1) возбуждает дыхательный центр 2) возбуждает сосудодвигательный центр *3) угнетает кашлевой центр *4) возбуждает центры блуждающего нерва
6. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ОСТРОГО ОТРАВЛЕНИЯ НАРКОТИЧЕСКИМИ АНАЛЬГЕТИКАМИ: 1) ОМНОПОН *2) атропин 3) фенобарбитал *4) налоксон
7. МОРФИН И ПАПАВЕРИН: 1) являются прямыми синергистами *2) являются алкалоидами *3) входят в состав омнопона 4) не являются анальгетиками
8. МЕХАНИЗМ ДЕЙСТВИЯ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ: *1) возбуждают опиоидные рецепторы 2) снижают порог болевой чувствительности *3) снижают вегетативную реакцию на боль 4) блокируют брадикининовые рецепторы
9. ЛОКАЛИЗАЦИЯ ОПИОИДНЫХ РЕЦЕПТОРОВ: 1) скелетные мышцы 2) круговая мышца радужки *3) зрительные бугры головного мозга *4) спинной мозг
10. МОРФИН: *1) возбуждает центр блуждающих нервов 2) угнетает центры блуждающих нервов *3) угнетает дыхательный центр 4) угнетает центр глазодвигательного нерва
11. КАШЛЕВОЙ ЦЕНТР ПОДАВЛЯЮТ: 1) налоксон *2) кодеин *3) морфин 4) дротаверин
12. К АЛКАЛОИДАМ ОПИЯ ОТНОСЯТ: *1) кодеин *2) папаверин 3) фентанил 4) но-шпа
13. ПРИЗНАКИ ОСТРОГО ОТРАВЛЕНИЯ МОРФИНОМ: *1) дыхание Чейн-Стокса *2) миоз 3) диарея 4) повышение температуры тела
14. ФЕНТАНИЛ: 1) возбуждает центр дыхания *2) возбуждает опиоидные рецепторы 3) угнетает опиоидные рецепторы *4) обладает анальгетическим действием
15. НАРКОТИЧЕСКИМ АНАЛЬГЕТИКАМ СВОЙСТВЕННО: *1) способность вызывать лекарственную зависимость 2) стимуляция ретикулярной формации 3) угнетение центров блуждающих нервов *4) антагонизм с налоксоном
16. НАРКОТИЧЕСКИМ АНАЛЬГЕТИКАМ СВОЙСТВЕННО: *1) угнетение дыхательного центра 2) стимуляция ретикулярной фармации *3) способность вызывать гипотермию 4) угнетение центров блуждающих нервов
17. МОРФИН: *1) вызывает эйфорию *2) вызывает спазм сфинктеров 3) повышает температуру тела 4) повышает артериальное давление
18. СИНТЕТИЧЕСКИЕ ЗАМЕНИТЕЛИ МОРФИНА: 1) кодеин *2) фентанил *3) промедол 4) омнопон
Адъюванты
Необходимо учитывать патофизиологическую основу боли (ноцицептивная, нейропатическая) и ее локализацию (висцеральная и костно-суставная) и дополнять обезболивающую терапию коанальгетиками (антидепрессантами, антиконвульсантами, спазмолитиками, глюкокортикостероидами). Данные препараты могут применяться на любой ступени обезболивания нейропатического комнента ХБС [Когония Л. М., 2021]. К адъювантным средствам в терапии хронической боли относятся антиконвульсанты, антидепрессанты, спазмолитики, анксиолитики, антигистаминные средства, глюкокортикостероиды, местные анестетики. Включение адъювантных средств в схему терапии ХБС позволяет усилить эффект основного анальгетика и ограничить эскалацию его дозы, что в итоге способствует уменьшению нежелательных явлений и повышению качества жизни пациента [Когония Л. М., 2021]. Адъювантные средства из класса антиконвульсантов, антидепрессантов и местных анестетиков [Когония Л. М., 2021]: • габапентин 300–3600 мг/сут; • прегабалин 150–600 мг/сут; • карбамазепин 400–600 мг/сут; • амитриптилин 25–75 мг/сут; • венлафаксин 70–225 мг/сут • дулоксетин 60–120 мг/сут; • лидокаин в форме пластыря по 1–3 шт. на 12 часов с последующим 12-часовым перерывом при локальных невропатиях с преобладанием болевых расстройств кожной чувствительности (аллодиния, гипералгезия).Тесты для самоконтроля
1. Адъюванты — это: 1) анальгетики; 2) вспомогательные препараты, усиливающие обезболивающий эффект анальгетиков;+ 3) опиоиды; 4) простагландины; 5) стероиды.2. Вторая ступень обезболивания при онкологических болях: 1) лечение нейропатических болей адъювантами; 2) лечение прорывных болей сильными опиоидами; 3) лечение сильного болевого синдрома сильными наркотическими анальгетиками (возможно добавление ненаркотических анальгетиков и адъювантов); 4) лечение слабого болевого синдрома ненаркотическими анальгетиками (возможно добавление адъювантов); 5) лечение умеренного болевого синдрома слабыми опиоидами (добавление ненаркотических анальгетиков и адъювантов).+
3. Когда остро возникшую боль можно назвать хронической: 1) если она длится более 1 месяца;+ 2) если она длится более 5 дней; 3) только в случае, если она длится более 12 месяцев; 4) только в случае, если она длится более 3 месяцев: 5) только в случае, если она длится более 6 месяцев.
4. Определение боли: 1) боль — неприятные ощущения в ответ на повреждающее воздействие, зависящие от силы этого воздействия и не зависящие от иных факторов (психологических, социальных); 2) боль — это активность, возникающая в ноцицепторах в ответ на повреждающий стимул; 3) боль — это объективное ощущение, возникающее при воздействии повреждающих факторов; 4) боль — это ощущения, возникающие в результате возбуждения нейронов в задних рогах спинного мозга; 5) боль — это психофизиологические переживания, которые формируются в коре головного мозга в ответ на действие повреждающих факторов. Боль — это субъективное ощущение. +
5. Первая ступень обезболивания при онкологических болях по ВОЗ: 1) лечение нейропатических болей адъювантами; 2) лечение прорывных болей сильными опиоидами; 3) лечение сильного болевого синдрома сильными наркотическими анальгетиками (возможно добавление ненаркотических анальгетиков и адъювантов); 4) лечение слабого болевого синдрома ненаркотическими анальгетиками (возможно добавление адъювантов);+ 5) лечение умеренного болевого синдрома слабыми опиоидами в добавление ненаркотических анальгетиков и адъювантов.
6. Правильное суждение о природе боли: 1) боль — побочный и вредный результат эволюции человека; 2) в ответ на болевой сигнал, «сообщающий» о возникшем повреждении, организм «включает» защитные механизмы, помогающие ему бороться с повреждением, вызвавшим боль;+ 3) девочки с нечувствительностью к боли до взрослого возраста не доживают; 4) нечувствительность к боли — распространенное генетическое заболевание; 5) нечувствительность к боли — редкое заболевание, причины которого не изучены.
7. Прорывные боли — это: 1) внезапно возникшие очень сильные онкологические боли, причины которых не всегда можно определить;+ 2) острый болевой синдром; 3) указывают на наркотическую зависимость; 4) усиление болей при недостаточной дозе опиоидов; 5) усиление болей при развитии онкологического процесса.
8. Суждение о ненаркотических анальгетиках: 1) ненаркотические анальгетики имеют неограниченную противоболевую активность и устраняют сильную боль; 2) ненаркотические анальгетики имеют очень небольшой обезболивающий эффект и применяются лишь при крайне слабых болях; 3) ненаркотические анальгетики не обладают обезболивающим эффектом, а применяются исключительно как противовоспалительные средства; 4) ненаркотические анальгетики обладают обезболивающим эффектом, не вызывая наркоза и наркомании. Они имеют ограниченную противоболевую активность и не устраняют сильную боль;+ 5) ненаркотические анальгетики обладают обезболивающим эффектом, оказывая влияние на ЦНС и вызывая наркоз и наркоманию.
9. Суждение о пороге болевой чувствительности: 1) болевая чувствительность не зависит от состояния антиноцицептивной системы; 2) болевая чувствительность повышена при перевозбуждении антиноцицептивной системы; 3) болевая чувствительность понижена при пониженном тонусе антиноцицептивной системы; 4) индивидуален у каждого человека и неизменен; 5) не зависит от психоэмоционального состояния человека; 6) представляет из себя подвижную непостоянную величину, которая зависит от взаимодействия двух систем: болевой и обезболивающей.+
10. Суждение об острой боли: 1) острая боль — это болезнь; 2) острая боль — это физиологическая реакция организма на повреждение. Своевременно некупированная острая боль может перейти в хроническую;+ 3) острая боль, «просигнализировавшая» организму о повреждении и затем исчезнувшая, является патологической реакцией организма; 4) своевременно некупированная острая боль не может перейти в хроническую; 5) хроническая боль — это симптом.
11. Третья ступень обезболивания при онкологических болях по ВОЗ: 1) лечение нейропатических болей адъювантами; 2) лечение прорывных болей сильными опиоидами; 3) лечение сильного болевого синдрома сильными наркотическими анальгетиками (возможно добавление ненаркотических анальгетиков и адъювантов);+ 4) лечение слабого болевого синдрома ненаркотическими анальгетиками (возможно добавление адъювантов); 5) лечение умеренного болевого синдрома слабыми опиоидами (в добавление ненаркотических анальгетиков и адъювантов).
Регуляторы работы вегетативных центров
Дыхательные аналептики (стимуляторы дыхания) Группа лекарственных средств, возбуждающих (от греч. analeptikos — восстанавливающий, укрепляющий), в первую очередь, жизненно важные центры продолговатого мозга — сосудодвигательный и дыхательный, вследствие чего повышается их чувствительность к гуморальным и нервным раздражителям [Хлебцова Е. Б., 2020]. В настоящее время аналептики по локализации действия можно условно разделить на три подгруппы [Хлебцова Е. Б., 2020]: 1) Средства, непосредственно активирующие дыхательный центр: бемегрид, этимизол, кофеин. 2) Средства, рефлекторно стимулирующие центр дыхания: цититон, лобелин. 3) Средства смешанного типа действия, обладающие и прямым, и рефлекторным действием: кордиамин, камфора, карбоген (смесь СО2 и О2 в соотношении 5: 95 об.%). Основное действие препаратов первой группы направлено непосредственно на центры продолговатого мозга и не является избирательным; аналептики повышают уровень передачи нервных импульсов в синапсах головного мозга. Стимулирующее влияние на дыхательных центр проявляется в увеличении минутного объема и частоты дыхания. Однако восстановление внешнего дыхания аналептиками обычно неустойчиво и дает лишь короткий выигрыш во времени, необходимый для устранения причины расстройств [Хлебцова Е. Б., 2020]. При этом необходимо помнить, что повторные инъекции небезопасны и могут привести к истощению функции центра и судорогам, еще и потому, что аналептики имеют малую терапевтическую широту (превышение дозы — генерализация возбуждения ЦНС, повышение рефлекторной возбудимости). Бемегрид — является специфическим антагонистом барбитуратов и оказывает «оживляющий» эффект при интоксикации, вызванной препаратами этой группы. Препарат также стимулирует ЦНС, поэтому эффективен не только при отравлении барбитуратами, но и другими средствами, тотально угнетающими функции ЦНС. Кофеин проявляет аналептическое и психостимулирующее действие; преобладает влияние на кору головного мозга. Характерный для препарата кардиостимулирующий эффект, связанный с активацией симпатоадреналовой системы, ведет к увеличению частоты сердечных сокращений и риска возникновения аритмий. Поэтому введение кофеина опасно на фоне высокого симпатического тонуса. На сосуды препарат оказывает несильное прямое спазмолитическое действие, но при этом преобладает тоногенное влияние на сосудодвигательный центр и повышение артериального давления. Этимизол отличается более избирательным действием на дыхательный центр, устойчивостью и меньшей склонностью к истощению функций. Помимо аналептических свойств этимизол обладает: 1) стимулирующим влиянием на гипофиз-адреналовую систему, что приводит к выбросу дополнительных порций глюкокортикоидов (непрямое противовоспалительное и бронхорасширяющее действие); 2) способностью активировать синтез белка в нейронах и закреплять информацию в долговременной памяти (ноотропный эффект); 3) легким угнетающим влиянием на кору головного мозга (седативный эффект). Рефлекторными стимуляторами дыхания являются Н-холиномиметики: цититон и лобелин. Они возбуждают Н-холинорецепторы синокаротидной зоны, откуда афферентные импульсы поступают в продолговатый мозг, повышая тем самым активность нейронов дыхательного центра. Эти средства действуют кратковременно, в течение нескольких минут. Клинически происходит учащение и углубление дыхания, повышение АД [Хлебцова Е. Б., 2020]. У средств смешанного типа действия центральный эффект (непосредственное возбуждение дыхательного центра) дополняется стимулирующим влиянием на хеморецепторы каротидного клубочка (рефлекторный компонент). Это, как указано выше, кордиамин и углекислый газ. Кордиамин — неогаленовый препарат (представляет собой 25 % раствор диэтиламида никотиновой кислоты). Действие препарата реализуется стимуляцией дыхательного и сосудистого центров, что проявляется углублением дыхания и улучшением кровообращения, подъемом АД. Достоинствами препарата являются незначительное влияние на частоту сердечных сокращений и отсутствие аритмогенных свойств. Сульфокамфокаин — комплексное соединение сульфокамфорной кислоты и новокаина. Улучшает вентиляцию, легочный кровоток, функцию миокарда. Выделяют следующие показания к назначению дыхательных аналептиков [Хлебцова Е. Б., 2020]: 1) асфиксия новорожденных — этимизол (1 мг/кг в 0,6 растворе медленно в пупочную вену), цититон (в/в медленно 0,1 мл 1 % раствора) или цититон (в/в или в/м 0,1 мл 0,15 % раствора) одновременно с другими реанимационными мероприятиями; 2) гиповентиляция при отравлении средствами, угнетающими ЦНС, утоплении, в ближайшем послеоперационном периоде, у раненых и пораженных (исключая судорожные яды) — этимизол в/м или в/в (медленно) из расчета 0,6–1 мг/кг в 1–1,5 растворе; кордиамин п/к, в/м или в/в (2–5 мл); сульфокамфокаин в/в 1–2 мл 10 % раствора; при сохранении рефлекторной реакции — лобелии (в/в медленно 0,3–0,5 мл 1 % раствора) или цититон (в/в или в/м 1 мл 0,15 % раствора); 3) коллаптоидные состояния центрального генеза — кофеинбензоат натрия (п/к 1–2 мл 10 % раствора), кордиамин (п/к или в/м 1–2 мл); 4) ослабление сердечной деятельности у пожилых людей, при инфекционных заболеваниях, пневмониях — камфора (2–3 мл 20 % масляного раствора п/к, грелка на место инъекции), сульфокамфокаин (п/к или в/м по 2 мл 1–3 раза в день); 5) гипотонии и астенические состояния у пожилых людей — кордиамин в/м или внутрь (по 15–40 капель 2–3 раза в день).Вопросы для самоконтроля
1. Стимуляторы дыхания: 1. Кордиамин.+ 2. Кодеин. 3. Карбоген.+ 4. Бемегрид.+ 5. Лобелии.+ 6. Кофеин. 7. Этимизол.2. Стимуляторы дыхания, действующие непосредственно на дыхательный центр: 1. Камфора. 2. Бемегрид.+ 3. Глауцин. 4. Кофеин.+ 5. Кодеин. 6. Этимизол.+
3. Стимуляторы дыхания рефлекторного действия: 1. Этимизол. 2. Бемегрид. 3. Лобелии.+ 4. Кофеин. 5. Цититон+
4. Стимуляторы дыхания смешанного типа действия: 1. Этимизол. 2. Кордиамин.+ 3. Бемегрид 4. Карбоген.+
5. Бемегрид: 1. Стимулирует нейроны дыхательного центра.+ 2. Стимулирует н-холинорецепторы синокаротидной зоны. 3. Стимулирует дыхательный центр непосредственно и рефлекторно.
6. Лобелии: 1. Стимулирует дыхательный центр непосредственно. 2. Стимулирует дыхательный центр рефлекторно через активацию н-холинорецепторов синокаротидной зоны.+ 3. Стимулирует дыхательные мышцы.
7. Кофеин: 1. Увеличивает частоту и глубину дыхания.+ 2. Оказывает психостимулирующее действие.+ 3. Снижает артериальное давление. 4. Может вызывать тахикардию.
8. Этимизол: 1. Стимулирует дыхательный центр.+ 2. Психостимулятор. 3. Оказывает психоседативное действие + 4. Расслабляет гладкие мышцы бронхов.
9. Лобелин применяют: 1. При асфиксии новорожденных. 2. В посленаркозном периоде.+ 3. При отравлении морфином. 4. При отравлении барбитуратами.
10. Длительную стимуляцию дыхательного центра обеспечивают: 1. Лобелин. 2. Бемегрид.+ 3. Кордиамин.+
11. Кратковременно стимулирует дыхательный центр: 1. Бемегрид. 2. Лобелин. + 3. Кордиамин.
Ответы:
1. 1,3,4,5 2. 2,4,6 3. 3,5 4. 2,4 5. 1 6. 2 7. 1,2 8. 1,3 9. 2 10. 2,3 11. 2Отхаркивающие средства
Лекарственные средства, влияющие на реологические свойства мокроты и откашливание ее из дыхательных путей (экспекторанты). По механизму действия отхаркивающие средства подразделяются на следующие группы [Хлебцова Е. Б., 2020]: 1. Средства, стимулирующие отхаркивание (секретомоторные средства, усилители кашля): а) прямого резорбтивного действия: иодид натрия и калия, хлорид аммония, натрия гидрокарбонат, натрия бензоат; и содержащие эфирные масла — терпингидрат, препараты травы тимьяна, плодов аниса, листьев эвкалипта, почек сосны, кедра, фенхеля, травы богульника болотного, травы душицы, корней дягила; б) рефлекторного действия: содержащие алкалоиды — ликоринг гидрохлорид, препараты корня ипекакуаны, травы термопсиса, травы фиалки, листьев подорожника; и содержащие сапонины — препараты корня истода, корня алтея, корня солодки, корня синюхи, корня девясила, листьев плюща, листьев мать-и-мачехи, корня первоцвета, чабреца. 2. Муколитические средства (стимуляторы секреции мокроты): а) неферментные — ацетилцистеин, карбоцистеин, метилцистеин, бромгексин, амброксол, месна, гвайфенезин; б) ферментные — трипсин, химотрипсин, рибонуклеаза, дезоксирибонуклеаза. в) Мукорегуляторы: карбоцистеин, амброксол, бромгексин, гвайфенезин, М-холиноблокаторы, глюкокортикоиды. 3. Препараты легочного сурфактанта — экзосурф, куросурф, сурванта. Отхаркивающие средства прямого действия после приема внутрь всасываются, попадают в системный кровоток и доставляются к бронхам, где выделяются бронхиальными железами и увеличивают продукцию жидкого компонента мокроты. Усиливают также активность мерцательного эпителия бронхов [Хлебцова Е. Б., 2020]. Назначают внутрь и ингаляционно. Содержащиеся в растительных препаратах рефлекторного действия, алкалоиды (сапонины — эметин, ликорин) при введении внутрь вызывают раздражение рецепторов слизистой желудка и двенадцатиперстной кишки. При этом рефлекторно (по блуждающему нерву) усиливается секреция бронхиальными железами жидкого компонента мокроты (вода, электролиты), а также повышается активность ресничек мерцательного эпителия (мукоцилиарный транспорт). Мокрота становится обильной, жидкой, с меньшим содержанием белка [Хлебцова Е. Б., 2020]. Некоторые препараты частично оказывают и прямое действие — содержащиеся в них эфирные масла выделяются через дыхательные пути, вызывая усиление секреции мокроты. Эти препараты в больших дозах после резорбции стимулируют рвотный центр [Хлебцова Е. Б., 2020]. Сурфактант — это поверхностно-активное вещество, синтезирующееся в альвеолярных клетках и выстилающее внутреннюю поверхность легких, обеспечивающее стабилизацию альвеол в процессе дыхания (препятствует «спадению» альвеол во время выдоха). Нарушение биосинтеза сурфактанта отмечается при различных бронхолегочных заболеваниях [Хлебцова Е. Б., 2020]: • при респираторном дистресс-синдроме у новорожденных, • при ателектазах легких, хронических бронхитах, бронхиальной астме. Необходимость в эндотрахельном введении лекарственных средств из группы сурфактантов (экзосурф, куросурф, сурванта) наиболее часто возникает при лечении респираторного дистресс-синдрома у новорожденных.Таблица 8 Комбинированные отхаркивающие препараты [Хлебцова Е. Б., 2020, Трубников Г. А., 2022]



Вопросы для самоконтроля
1. Отхаркивающие средства: 1. Настой травы горицвета. 2. Амброксол. 3. Либексин. 4. Бромгексин. 5. Трипсин. 6. Ацетилцистеин. 7. Настой травы термопсиса. 8. Тусупрекс2. Отхаркивающие средства прямого действия: 1. Трипсин. 2. Препараты ипекакуаны. 3. Натрия гидрокарбонат. 4. Дезоксирибонуклеаза. 5. Амброксол. 6. Бромгексин.
3. Отхаркивающие средства рефлекторного действия: 1. Трипсин. 2. Препараты ипекакуаны. 3. Натрия гидрокарбонат. 4. Настой травы термопсиса. 5. Амброксол. 6. Препараты чабреца.
4. Муколитические средства: 1. Настой травы термопсиса. 2. Бромгексин. 3. Ацетилцистеин. 4. Мукалтин. 5. Трипсин. 6. Дезоксирибонуклеаза.
5. Усиливают секрецию бронхиальных желез: 1. Препараты термопсиса. 2. Препараты белладонны. 3. Препараты ипекакуаны. 4. Трипсин и химотрипсин.
6. Муколитический протеолитический эффект характеризует: 1. Препараты термопсиса. 2. Трипсин. 3. Натрия гидрокарбонат. 4. Дезоксирибонуклеаза.
7. Препараты термопсиса: 1. Стимулируют рецепторы желудка. 2. Рефлекторно усиливают секрецию бронхиальных желез. 3. Снижают вязкость мокроты за счет деполимеризации белковых молекул. 4. Рефлекторно повышают активность мерцательного эпителия бронхов. 5. Рефлекторно увеличивают сократительную активность бронхов.
8. Ацетилцистеин: 1. Рефлекторно стимулирует секрецию бронхиальных желез. 2. Оказывает прямое стимулирующее действие на бронхиальные железы. 3. Уменьшает вязкость мокроты за счет разрушения дисульфидных связей протеогликанов.
9. Препараты термопсиса: 1. Обладают муколитическим эффектом. 2. Увеличиваютсекрецию бронхиальных желез. 3. Оказывают противокашлевое действие. 4. Увеличивают активность мерцательного эпителия бронхов. 5. Усиливают сокращения мышц бронхов.
10. Ацетилцистеин: 1. Снижает вязкость бронхиального секрета. 2. Увеличивает объем бронхиального секрета. 3. Угнетает кашлевой рефлекс. 4. Расслабляет гладкие мышцы бронхов.
Ответы:
1.7 2. 3 3. 2,4 4. 2,3,5,6 5. 1,3 6. 2,4 7. 1,2 8. 3 9. 1,2 10. 1,2Противокашлевые средства
Лекарственные средства, способные угнетать кашлевой рефлекс в центральном звене или за счет воздействия на чувствительные окончания в дыхательных путях [Трубников Г. А., 2022]. Кашель — рефлекторный защитный механизм удаления содержимого из бронхов. По механизму действия выделяют следующие группы противокашлевых средств [Трубников Г. А., 2022]: 1. Средства центрального типа действия 1) наркотические — кодеин, морфин, этилморфина, декстрометорфан; 2) ненаркотические — тусупрекс, глауцин, бутамират, пентоксиверин, ледин, тусупрекс, глауцин, седотуссин. 2. Средства периферического типа действия — либексин, преноксидиазин, леводропропизин, битиодин, а также обволакивающие средства, содержащие растительные экстракты эвкалипта, липы, акации и др. Морфин — наркотический анальгетик, алкалоид опия, группа фенантрена. Сильнее кодеина по противокашлевому эффекту, но используется только по жизненным показаниям, когда кашель становится угрожающим жизни больного (инфаркт или травма легкого, операция на органах грудной клетки, нагноившаяся туберкулома). Кодеин (алкалоид опия) и этилморфин (полусинтетический аналог морфина) — производные фенантрена. Оказывают выраженный противокашлевой эффект за счет стимуляции тормозных опиатных рецепторов на нейронах кашлевого центра. Подобно морфину, проявляют сильное анальгетическое действие, оказывают угнетающее действие на функцию дыхательного центра и при длительном применении могут вызвать лекарственную зависимость. Кодеин входит в состав ряда комбинированных препаратов: микстура Бехтерева (настой горицвета, натрия бромид и кодеин), таблетки Кодтерпин, Панадеин, Солпадеин. Глауцин — алкалоид растения Glaucium flavum (мачок желтый). По сравнению с алкалоидами опия он отличается более избирательным действием на кашлевой центр. Глауцин также ослабляет спазм гладкой мускулатуры бронхов и не препятствует секреции бронхиальных желез и отхаркиванию, обладает умеренной противовоспалительной активностью. Не угнетает дыхательный центр и не вызывает привыкания и лекарственной зависимости. При его применении возможно умеренное снижение артериального давления, так как препарат обладает альфа-адреноблокирующим действием. Окселадин и бутамират — синтетические препараты, преимущественно действующий на кашлевой центр без угнетения центра дыхания. Фалиминт — оказывает слабое местноанестезирующее действие и хорошее дезинфицирующее действие на слизистую оболочку полости рта и носоглотки, уменьшая возникновение рефлексов, в том числе и кашлевых.Таблица 9 Противокашлевые средства [Трубников Г. А., 2022]

Источником кашлевого рефлекса является раздражение чувствительных окончаний вагуса слизистой трахеи и бронхов или верхнего гортанного нерва в стенке глотки. Инициирующие факторы — многочисленные биологически активные вещества (гистамин, серотонин, ацетилхолин), скопление мокроты, инородные частицы, пары химических веществ [Трубников Г. А., 2022]. Либексин — синтетический препарат. По противокашлевому эффекту уступает кодеину, но не вызывает развития лекарственной зависимости. Механизм действия либексина включает: а) местноанестезирующее влияние на слизистую верхних дыхательных путей и облегчение отделения мокроты; б) спазмолитическое миотропное действие на бронхи. Применение противокашлевых средств не показано, если оно ведет к нарушению выделения мокроты.
Вопросы для самоконтроля
1. Противокашлевые средства: 1. Кодеин. 2. Либексин. 3. Ацетилцистеин. 4. Глауцин. 5. Дионин. 6. Бромгексин.2. Противокашлевые средства центрального действия: 1. Либексин. 2. Глаувент. 3. Лазолван. 4. Тусупрекс 5.
3. Противокашлевое средство периферического действия: 1. Кодеин. 2. Либексин. 3. Глауцин. 4. Этилморфин 5. Окселадин.
4. Угнетают центральные звенья кашлевого рефлекса: 1. Кодеин. 2. Либексин. 3. Глауцин. 4. Бемегрид. 5. Окселадин
5. Кодеин: 1. Блокирует опиоидные рецепторы кашлевого центра. 2. Стимулирует опиоидные рецепторы кашлевого центра. 3. Блокирует чувствительные рецепторы дыхательных путей.
6. Противокашлевое действие либексина обусловлено: 1. Подавлением возбудимости нейронов кашлевого центра. 2. Бронхолитическим действием. 3. Уменьшением секреции бронхиальных желез. 4. Угнетением чувствительных рецепторов дыхательных путей.
7. Кодеин: 1. Угнетает кашлевой рефлекс. 2. В больших дозах угнетает дыхание. 3. Снижает тонус мышц бронхов. 4. Обладает анальгетическими свойствами. 5. Оказывает седативное действие. 6. Может вызвать лекарственную зависимость. 7. Угнетает моторику кишечника.
8. Глаувент: 1. Угнетает кашлевой рефлекс. 2. Угнетает дыхание. 3. Вызывает лекарственную зависимость.
9. Либексин: 1. Угнетает кашлевой рефлекс. 2. Вызывает лекарственную зависимость. 3. Обладает седативными свойствами. 4. Угнетает дыхание.
10. Побочные эффекты дионина и кодеина: 1. Бессонница. 2. Привыкание. 3. Лекарственная зависимость. 4. Угнетение дыхания.
11. Кодеин: 1. Расслабляет гладкие мышцы бронхов. 2. Уменьшает возбудимость кашлевого центра. 3. Вызывает привыкание и лекарственную зависимость. 4. Оказывает анальгетическое действие. 5. В больших дозах угнетает дыхательный центр.
Ответы:
1. 1,2,4,5 2. 2,4 3. 2 4. 1,3,5 5. 2 6. 1,2,4 7. 1,2,4,6,7 8. 1,3 9. 1 10. 2,3,4 11. 2,3,4,5ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВЛИЯЮЩИХ НА ФУНКЦИЮ ОРГАНОВ ДЫХАНИЯ
Амброксол [Хлебцова Е. Б., 2020]

Атропина сульфат

АЦЦ

Бромгексин

Карбоцистеин

Последние комментарии
21 часов 28 минут назад
1 день 1 час назад
1 день 4 часов назад
1 день 5 часов назад
1 день 11 часов назад
1 день 11 часов назад