Хирургические болезни [Николай Иванович Батвинков] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Николай Иванович Батвинков
Хирургические болезни
От авторов
В последние годы значительно вырос уровень оказания хирургической помощи населению. Стали выполняться сложные оперативные вмешательства, в том числе с использованием эндоскопической техники не только в клиниках, но и в других лечебных учреждениях. Поэтому будущий врач должен быть хорошо знаком с достижениями современной хирургии, в совершенстве знать как традиционные, так и новые методы лечения больных.Преподавание частной хирургии проводится на 4–м и 5–м курсах, во время прохождения субординатуры на различных кафедрах хирургического профиля. Существующие непрерывность, последовательность обучения создают возможность комплексного и целостного изучения данного предмета, отходя от схем к более сложным формам патологии и методам хирургического лечения.
Учебник "Клиническая хирургия" соответствует программе курса госпитальной хирургии. В нем изложены наиболее сложные формы патологии и методы лечения заболеваний органов грудной и брюшной полостей, магистральных сосудов, эндокринной системы.
При написании учебника авторы старались излагать материал на современном уровне, с учетом последних достижений науки и практики, находящих все более широкое применение в хирургии.
Авторы с глубокой благодарностью примут критические замечания и пожелания читателей, направленные на улучшение содержания книги.
Глава 1. Желудочно–кишечный тракт
Желудок и 12–перстная кишка
Анатомо–физиологические сведения
Желудок.
Находится в эпигастральной области, преимущественно в левом подреберье. Форма и положение его изменяются в зависимости от тонуса стенок, количества содержимого, состояния соседних органов. Проксимальная часть (⅔) желудка располагается вертикально, дистальная (⅓) – горизонтально. В желудке различают кардиальный отдел, дно, тело, антральный отдел. Первый из них представляет часть органа, непосредственно прилегающую к кардии, т.е. месту перехода пищевода в желудок. По малой кривизне это расстояние составляет 2–3 см. Не ниже 5 см от анатомической кардии находится субкардия. Желудок в брюшной полости фиксируется связочным аппаратом: печеночно–желудочной связкой, т.е. малым сальником, желудочно–ободочной связкой, являющейся начальной частью большого сальника, желудочно–селезеночной, желудочно–диафрагмальной, желудочно–поджелудочной связками.Стенка желудка состоит из слизистой оболочки, подслизистой основы, мышечной и серозной оболочек.
В зависимости от функциональной активности вся слизистая подразделяется на пять зон: кардиальных, фундальных и пилорических желез, верхнюю и нижнюю промежуточные (интермедиальные).
Кардиальные железы располагаются в месте впадения пищевода в желудок в небольшой циркулярной области шириной 0,5–J,5 см. Они содержат клетки, идентичные клеткам пилорических желез желудка и кардиальных желез пищевода. Их секрет представлен слизью, содержащей бикарбонаты.
Главные (фундальные, собственные) железы желудка занимают всю внутреннюю поверхность тела, дна, большой и малой кривизны. Они образованы четырьмя вилами клеток: главными, париетальными, добавочными, недифференцированными. Главные клетки секретируют предшественник пепсина – пепсиноген, который в присутствии соляной кислоты превращается в активную форму – пепсин. Существует мнение о возможном образовании в главных клетках химозина.
Париетальные (обкладочные) клетки секретирутот соляную кислоту и внутренний фактор Кастла, Добавочные клетки вырабатывают растворимую фракцию желудочной слизи. Недифференцированные клетки являются исходными для всех остальных клеток слизистой оболочки. Железистые трубки главных желез открываются в углублениях слизистой оболочки (криптах), покрытых однослойным цилиндрическим эпителием. Секрет эпителия представляет собой нерастворимую (видимую) фракцию желудочной слизи.
Пилорические (антральные) железы состоят из клеток, сходных со слизистыми клетками собственных желез. Продуцируемый ими секрет имеет щелочную реакцию.
Верхняя интермедиальная зона располагается дистальнее кардиальных, нижняя – собственных желез. Ширина этих зон составляет 0,5–1,5 см. Они содержат интермедиальные железы, занимающие промежуточное положение между главными и пилорическими железами.
Кроме вышеназванных, в слизистой оболочке желудка встречаются и другие клетки, играющие существенную роль в процессе пищеварения. Например, в области дна главных желез располагаются ЕС–клетки, выделяющие серотонин и мелатонин. Под влиянием серотонина повышается секреция пищеварительных ферментов и слизи, усиливается двигательная активность гастродуоденальной системы. Мелатонин является регулятором фотопериодичности функциональной деятельности,
В пилорических железах и несколько меньше в кардиальных присутствуют G–клетки, секретирующие гормон гастрин. Он стимулирует секрецию пепсиногена, соляной кислоты и моторику желудка. Кроме гастрина, G–клетки синтезируют энкефалин, который относится к группе эндогенных морфинов. В незначительном количестве в слизистой оболочке желудка присутствуют Р–, ECL–, D–, Dp, А– и Х–клетки.
Р–клетки образуют гастроинтестинальный гормон бомбезин. Бомбезин стимулирует секрецию соляной кислоты, повышает продукцию гастрина, холецистокинина, панкреатического полипептида, подавляет высвобождение вазоактивного интестинального полипептида. Под действием бомбезина усиливается секреция инсулина, глюкагона, понижаются тонус мускулатуры желчного пузыря и двигательная активность желудочно–кишечного тракта.
ECL–клетки (энтерохромаффиноподобные) находятся в фундальных железах и вырабатывают гистамин. В желудочно–кишечном тракте гистамин выступает в роли гуморального посредника в секреции слизи, соляной кислоты и пищеварительных ферментов. Физиологические эффекты гистамина опосредуются Н2–гистаминовыми рецепторами. Действуя через Н2–рецепторы, гистамин активирует аденилатциклазную систему с образованием цАМФ в париетальных клетках.
D– и Di–клетки входят в состав пилорических желез. D–клетки выделяют соматостатин, Di–клетки – вазоактивный интестинальный полипептид (ВИП). Соматостатин угнетает желудочную, панкреатическую, желчную секрецию, снижает нормальный мезентериальный кровоток, изменяет моторную активность органов желудочно–кишечного тракта, тормозит выброс гормонов гипофиза, инсулина и глюкагона. Секреция соматостатина увеличивается после приема пищи, снижения кислотности желудочной среды, под действием секретина, холецистокинина–панкреозимина, гастрина, бомбезина, ВИП и желудочного ингибирующего полипептида (ЖИП). ВИП ингибирует выделение соляной кислоты и пепсина; подавляет продукцию гастрина, расслабляет мускулатуру нижнего пищеводного сфинктера, дна желудка, желчного пузыря, толстой кишки; усиливает влияние секретина и холецистокинина–панкреозимина; активирует гликогенолиз, липолиз, выделение инсулина, глюкагона, соматостатина.
А–клетки слизистой оболочки желудка напоминают А–клетки островкового аппарата поджелудочной железы и секретируют глюкагон.
Роль X–клеток полностью не изучена.
В подслизистой основе желудка находятся артериальные, венозные и нервные сплетения, лимфатические сосуды.
Мышечная оболочка желудка содержит три слоя, образованные гладкой мышечной тканью. Наружный (продольный) и средний (циркулярный) слои являются продолжением соответствующих слоев пищевода. Средний слой дистальной части желудка образует пилорический сфинктер. Серозная оболочка желудка состоит из рыхлой волокнистой неоформленной соединительной ткани, покрытой мезотелием. Кровоснабжение желудка осуществляется за счет левой желудочной (ветвь чревного ствола), правой желудочной (ветвь общей печеночной артерии), левой желудочно–сальниковой (ветвь селезеночной артерии), правой желудочно–сальниковой (ветвь желудочно–двенадцатиперстной артерии) артерий (рис. 1). Отток венозной крови от желудка обеспечивается одноименными венами в воротную вену.
Лимфоотток происходит в регионарные лимфатические узлы, расположенные по малой и большой кривизне, вокруг кардии, над и под привратником, по ходу левой желудочной артерии.
В иннервации желудка участвуют блуждающий и симпатический нервы, интрамуральные нервные сплетения (подслизистое, межмышечное, подсерозное).
 Рис. 1. Кровоснабжение желудка:
1 – обшая печеночная артерия; 2 – пищеводная артерия; 3 – нижняя диафрагмальная артерия; 4 – чревный ствол; 5 – левая желудочная артерия; 6 – селезеночная артерия, 7 – левая желудочно–сальниковая артерия; 8 – верхняя брыжеечная артерия; 9 – нижняя передняя поджелудочно–двенадцатиперстная артерия; 10 – правая желудочно–сальниковая артерия; 11 – верхняя передняя поджелудочно–двенадцатиперстная артерия; 12 – правая желудочная артерия.
Рис. 1. Кровоснабжение желудка:
1 – обшая печеночная артерия; 2 – пищеводная артерия; 3 – нижняя диафрагмальная артерия; 4 – чревный ствол; 5 – левая желудочная артерия; 6 – селезеночная артерия, 7 – левая желудочно–сальниковая артерия; 8 – верхняя брыжеечная артерия; 9 – нижняя передняя поджелудочно–двенадцатиперстная артерия; 10 – правая желудочно–сальниковая артерия; 11 – верхняя передняя поджелудочно–двенадцатиперстная артерия; 12 – правая желудочная артерия.
Блуждающий нерв (n. vagus) – это 10–я пара черепных нервов. Содержит двигательные и чувствительные вегетативные волокна. Существует значительная вариабельность ветвления блуждающих нервов на уровне брюшной полости, куда они проникают через пищеводное, а иногда через диафрагмальное и аортальное отверстия.
 Рис. 2. Схема ветвления переднего блуждающего нерва (вид спереди):
1 – передний основной ствол; 2 – пищеводные ветви; 3 – печеночная ветвь; 4 – нерв Харкинса; 5 – нерв Латарже; 6 – желудочные ветви нерва Латарже; 7 – зона ветвления нерва Латарже ("гусиная лапка”); 8 – возвратные ветви нерва Латарже; 9 – нерв Россати.
Рис. 2. Схема ветвления переднего блуждающего нерва (вид спереди):
1 – передний основной ствол; 2 – пищеводные ветви; 3 – печеночная ветвь; 4 – нерв Харкинса; 5 – нерв Латарже; 6 – желудочные ветви нерва Латарже; 7 – зона ветвления нерва Латарже ("гусиная лапка”); 8 – возвратные ветви нерва Латарже; 9 – нерв Россати.
Левый (передний) блуждающий нерв идет по передней поверхности пищевода. В большинстве наблюдений он представлен одним или 2–4 стволами, но может иметь рассыпной тип (рис. 2). На уровне пищеводно–желудочного перехода левый блуждающий нерв делится на печеночную ветвь, проходящую в печеночно–желудочной связке, и желудочную (переднюю), направляющуюся параллельно малой кривизне к антральному отделу желудка (ветвь Латарже). В этой зоне он делится (в виде "гусиной лапки") на 2–4 конечные ветви. У некоторых больных от основного ствола левого блуждающего нерва, несколько ниже диафрагмы, отходит крупная желудочная ветвь, разветвляющаяся в области тела и фундального отдела (нерв Харкинса). От дистальных ветвей "гусиной лапки" иногда отходят восходящие ветви к телу желудка: вдоль малой кривизны проходит возвратная ветвь нерва Латарже, а вдоль большой – нерв Россати.
Правый (задний) блуждающий нерв в виде одиночного или нескольких стволов лежит на задней поверхности пищевода и реже на его правой боковой стенке. Нерв делится на чревную и желудочные ветви (рис. 3). Желудочные ветви заднего блуждающего нерва образуют верхние и нижние группы ветвей. Верхние желудочные ветви отходят от основного ствола вагуса на 1–2 см ниже диафрагмы, косо пересекают заднюю стенку пищевода и направляются ко дну желудка (криминальная ветвь Грасси). Нижние желудочные ветви представлены нервами, идущими к желудку после отхождения от заднего блуждающего нерва, его чревной ветви. Основной ствол нижней желудочной ветви (нерв Латарже) расположен вдоль малой кривизны желудка в заднем листке желудочно–печеночной связки. В антральном отделе он формирует "гусиную лапку", а также дает возвратные желудочные ветви и ветви к тонкому кишечнику.
В организме человека желудок выполняет секреторную, моторно–эвакуаторную, экскреторную, эндокринную и всасывательную функции.
 Рис. 3. Схема ветвления заднего блуждающего нерва (вид сзади):
1 – задний основной ствол; 2 – пищеводные ветви; 3 – нерв Грасси; 4 – нерв Латарже; 5 – чревная ветвь; 6 – желудочные ветви; 7 – возвратные ветви; 8 – зона ветвления нерва Латарже (“гусиная лапка”); 9 – тонкокишечные гаечные ветви.
Рис. 3. Схема ветвления заднего блуждающего нерва (вид сзади):
1 – задний основной ствол; 2 – пищеводные ветви; 3 – нерв Грасси; 4 – нерв Латарже; 5 – чревная ветвь; 6 – желудочные ветви; 7 – возвратные ветви; 8 – зона ветвления нерва Латарже (“гусиная лапка”); 9 – тонкокишечные гаечные ветви.
Секреторная функция желудка является наиболее важной. В норме в течение часа выделяется около 50 мл желудочного сока, содержащего соляную кислоту, протеолитические ферменты и слизь. Концентрация соляной кислоты в желудочном соке составляет 0,4–0,5%. Под влиянием соляной кислоты происходят денатурация и набухание белков с последующим их ферментативным расщеплением. Пепсиногены превращаются в пепсин. Желудочный сок приобретает бактерицидные свойства.
Пепсин активен при pH среды 1,5–5,5. Исходя из активности при определенном значении pH, выделяют четыре фракции фермента: пепсин, пепсин–В (паропепсин), ренин (химозин), гастриксин. 95% протеолитической активности желудочного сока обеспечивается пепсином и гастриксином. Желудочная слизь состоит из двух фракций: видимой (нерастворимой, покровно–эпителиальной) и невидимой (растворимой). Нерастворимая покровно–эпителиальная слизь образует на поверхности слизистой оболочки желудка пленку толщиной 0,5–2 мм. Растворимая слизь присутствует в просвете желудка. Водонерастворимый компонент составляет около 80% желудочной слизи, водорастворимый – 20%. Желудочная слизь содержит 95% воды, 1% электролитов, 0,5–1% белков, 0,5–1% липидов. Основным химическим компонентом слизи являются угяеводсодержащие биополимеры – гликопротеиды, состоящие из ковалентно связанных между собой пептидной и углеводной частей. Углеводный состав слизи в основном представлен биополимерами, содержащими большое количество фукозы (фукогликопротеиды). Функция слизи заключается в предохранении стенки желудка от механических повреждений пищей и кислотно–пептическим фактором, участии в обмене витамина В]2 и в пристеночном пищеварении.
Моторно–эвакуаторная функция желудка состоит в перемешивании пиши и желудочного сока, в продвижении пищевого комка в двенадцатиперстную кишку. Существуют два типа моторики: тонус и перистальтика. Под тонусом подразумевают суммарную силу давления мышечных волокон на содержимое желудка. Он обеспечивается наличием волн длительностью 12–60 с и частотой 6–7 импульсов в минуту. Перистальтическая активность желудка заключается в серии кратковременных циркулярных мышечных сокращений шириной 1–2 см и ритмом 20 с. Тонические и перистальтические волны возникают в проксимальной части желудка и распространяются к дистальному отделу.
Экскреторная функция слизистой оболочки желудка состоит в выделении через его стенку конечных продуктов обмена белка.
Эндокринная функция связана с выделением биологически активных веществ, влияющих на двигательную и секреторную активность желудочно–кишечного тракта.
Всасывательная функция желудка заключается во всасывании воды, сахаров и других веществ.
Двенадцатиперстная кишка.
Имеет длину 25–30 см, располагается преимущественно забрюшинно и состоит из четырех частей: верхней горизонтальной, нисходящей, нижней горизонтальной и восходящей.Стенка кишки образована слизистой оболочкой, подслизистой основой, мышечной и серозной оболочками. Складки слизистой оболочки имеют циркулярное направление (складки Керкринга). В нисходящем сегменте кишки по ее внутренней стенке имеется постоянная продольная складка, оканчивающаяся большим дуоденальным сосочком (фатеровым). На сосочке открывается общий желчный и главный панкреатический (вирсунгов) протоки. Добавочный панкреатический (санториниев) проток расположен на малом дуоденальном сосочке, который находится несколько проксимальнее большого. Поверхность слизистой оболочки двенадцатиперстной кишки выстлана однослойным цилиндрическим эпителием. Цилиндрический эпителий представлен каемчатыми (обеспечивающими резорбцию и транспорт веществ), бокаловидными (секретирующими слизь) и эндокринными (аргирофильными) ЕС–, А–, S–, I–, G–, D–, Dp, К–клетками.
EC–клетки секретируют серотонин и мотилин. Мотилин активирует моторику антрального и повышает тонус фундального отделов желудка. А–клетки являются источником энтероглюкагона. 1–клетки холецистокинина–панкреозимина стимулируют секрецию соляной кислоты, протеолитических, кишечных и панкреатических ферментов, бикарбонатов эндокринной части поджелудочной железы. Гормон замедляет опорожнение желудка, усиливает перистальтику тонкой кишки, тормозит всасывание воды и электролитов из тощей кишки, способствует сокращению и опорожнению желчного пузыря, расслаблению сфинктера Одди. Он повышает секрецию инсулина и глюкагона эндокринными клетками поджелудочной железы. S–клетки вырабатывают секретин, тормозящий секрецию соляной кислоты, усиливающий выделение бикарбонатов поджелудочной железой, электролитов печенью и двенадцатиперстной кишкой, пепсина. Гормон снижает двигательную активность желудка и двенадцатиперстной кишки. К–клетки продуцируют ЖИП, который ингибирует секрецию соляной кислоты и пепсина, замедляет моторику желудка и кишечника.
Подслизистая основа двенадцатиперстной кишки содержит большое количество коллагеновых и эластических волокон.
Мышечная оболочка состоит из более мощного внутреннего (циркулярного) и наружного (продольного) слоев гладкой мышечной ткани.
Строение серозной оболочки кишки идентично структуре серозной оболочки желудка.
Кровоснабжение двенадцатиперстной кишки осуществляется четырьмя поджелудочно–двенадцатиперстными артериями (верхними – задней и передней, нижними – задней и передней). Венозная кровь поступает в одноименные вены, образующие на передней и задней поверхностях головки поджелудочной железы венозные дуги.
Лимфоотток происходит в лимфоузлы, расположенные впереди и позади головки поджелудочной железы.
Парасимпатическая иннервация двенадцатиперстной кишки осуществляется блуждающими нервами, проникающими через малый сальник и стенку желудка. Симпатическая иннервация происходит за счет чревного, печеночного и верхнебрыжеечного сплетений. Интрамуральный нервный аппарат кишки включает подслизистое, межмышечное, субсерозное сплетения.
Пища, поступившая из желудка в двенадцатиперстную кишку, под влиянием содержащихся в просвете кишки ферментов подготавливается к внугриполостному, пристеночному пищеварению. Здесь же происходит всасывание кальция, магния, железа. Дуоденальный сок содержит секрет бруннеровых желез, хлориды, бикарбонаты, Na, К, Са, белки, мочевину, аминокислоты и слизь. Основными компонентами слизи являются фукогликопротеины и гликозаминогликаны, играющие защитную роль.
Язвенная болезнь
Историческая справка.
Хирургическое лечение при язвенной болезни начало проводиться в конце 1881 г., когда польский хирург Л. Ридигер произвел первую резекцию желудка при язвенном стенозе с благоприятным исходом. В дальнейшем в хирургии язвенной болезни широко стала применяться резекция, выполненная Бильрот (1881) при раке желудка с восстановлением непрерывности желудочно–кишечного тракта путем сшивания культи желудка с двенадцатиперстной кишкой. Этот вариант операции получил название резекции желудка по Бильрот–1. В 1885 г, Бильрот применил другой способ резекции, включавший ушивание культи удаленного желудка и двенадцатиперстной кишки, проведение начальной петли тощей кишки через окно в брыжейке поперечно–ободочной кишки, наложение гастроэнтероанастомоза на переднюю стенку оставшейся части желудка.
Однако до конца первой четверти XX в. резекция желудка в хирургии язвенной болезни применялась редко в связи с высокой послеоперационной летальностью. Основными видами хирургического вмешательства при язвенной болезни были технически более простые гастроэнтероанастомоз и пилоропластика. Первый гастроэнтероанастомоз с передней стенкой желудка сформировал Wolfler (1881), а с задней – Hacker (1885). Heineke (1886) и Mikulicz (1888) выполнили пилоропластику. Однако по мере увеличения количества произведенных гастроэнтеростомий и пилоропластик стали появляться сообщения об отрицательных последствиях данных операций. В 1897 г. Berg впервые сообщил о развитии после гастроэнтероанастомоза изъязвлений слизистой оболочки. Braun (1899) предложил термин "пептическая язва". В 30–е годы XX в, резекция желудка стала вытеснять гастроэнтероанастомозы при хирургическом лечении язвенной болезни.
Постепенно накапливались данные и об отрицательных последствиях резекции желудка, развитии у 20–40% больных постгастрорезекционных синдромов. Oqilvie (1935) указал, что попадание пищи в приводящую петлю сопровождается клиникой кишечного дискомфорта. Gilbert и Dunlop ввели термин "демпинг–синдром" (сброс).
Неудовлетворенность хирургов результатами операций и расширение теоретических сведений о роли блуждающих нервов в процессе пищеварения (что связано с исследованиями Brodie (1814), Bernard (1856), В. П. Павлова (1689)) привели к разработке органосохраняющего метода хирургического лечения больных при язвенной болезни – ваготомии. В 1911 г. Ехпег выполнил двустороннюю ваготомию в сочетании с гастростомией при язвенной болезни желудка. Bircher (1921), Lataije (1922), Н. А. Подолинский (1925) и другие предложили дополнять ваготомию дренированием желудка – гастроэнтеростомией или пилоропластикой. Dragstedt (1943) выполнил изолированную трансторакальную поддиафрагмальную ваготомию при язвенной болезни, осложненной кровотечением. Значительным прогрессом в хирургии язвенной болезни явилось внедрение в клиническую практику двусторонней селективной ваготомии (Francsson, 1948) и селективной проксимальной ваготомии (Holle, Hart, 1967).
По мере развития медицины в XX в. появилось множество вариантов резекций желудка, ваготомий, гастроэнтеростомий и пилоропластик.
Классификация.
Язвенная болезнь классифицируется в зависимости от локализации язвы, состояния желудочной секреции, характера течения заболевания.
По локализации различают язвы желудка и двенадцатиперстной кишки. Язвы желудка в свою очередь подразделяются на три типа (классификация Джонсона): первый – медиогастральные язвы, расположенные в области тела желудка; второй – сочетанные язвы желудка и двенадцатиперстной кишки; третий – препилорические язвы и язвы пилорического канала. К последней группе относятся язвы, локализующиеся вверх от привратника по малой кривизне не далее 3 см. Среди язв двенадцатиперстной кишки выделяют бульбарные и постбульбарные язвы.
По состоянию желудочной секреции язвенная болезнь протекает: 1. в обеих фазах с повышенной, нормальной или пониженной кислотопродукцией; 2. с нормальной секрецией в первой фазе и повышенной во второй; 3. с повышенной секрецией в первой фазе и нормальной во второй.
По характеру клинического течения выделяют: ■ неосложненные ■ осложненные язвы • кровоточащие • прободные • стенозирующие • пенетрирующие • малигнизированные.
Хирургическое лечение больных с неосложненными язвами
Хирургическое вмешательство при неосложненной язвенной болезни должно предшествовать развитию осложнений. Исходя из этого, определение показаний к операции включает решение вопроса о сроках и варианте ее выполнения, что в свою очередь зависит от локализации язвы и клинического течения болезни. Показания к хирургическому лечению лиц с дуоденальной и желудочной локализациями язв неоднозначны. Это объясняется различием их патогенеза, склонностью язв тела и препилорического отделов желудка к малигнизации. В некоторой степени решению этой проблемы способствуют сформулированные еще в 1934 г. Е. Л. Березовым абсолютные, условно–абсолютные и относительные показания к оперативному лечению больных с неосложненными и осложненными формами язвенной болезни.К абсолютным показаниям относятся прободение язв; подозрение на переход язвы в рак, профузное кровотечение, не останавливающееся консервативными способами, или кровотечение, вновь повторяющееся при наблюдении, субкомпенсированный и декомпенсированный стеноз привратника.
Условно–абсолютные показания включают пенетрирующие и каллезные язвы; повторяющиеся кровотечения, останавливающиеся под влиянием консервативного лечения, компенсированный стеноз привратника.
Относительным показанием является неэффективность консервативного лечения при отсутствии осложнений.
В настоящее время изложенные выше показания к хирургическому лечению больных с гастродуоденальными язвами значительно расширены и уточнены в основном за счет группы пациентов с неосложненной хронической язвенной болезнью. Так, вопрос об операциях у лиц с неосложненной гистологически доказанной язвенной болезнью тела желудка (I тип по Джонсону) и препилорического отдела должен быть решен в течение года с момента выявления заболевания. Это означает, что если язва, несмотря на адекватное продолжительное (до 2 месяцев) консервативное лечение, не заживает или быстро рецидивирует, то больных необходимо оперировать.
При язвенной болезни пилорического отдела желудка и двенадцатиперстной кишки сроки выполнения хирургического вмешательства выбираются индивидуально в зависимости от эффективности консервативного лечения, частоты рецидивов и риска возникновения осложнений. Так, лицам с впервые установленным диагнозом показано медикаментозное лечение. Если в последующем язва рецидивирует 3–4 раза в год, сопровождается резко выраженным болевым синдромом и медленно заживает, то операцию следует выполнять в течение первых 1–2 лет существования заболевания. При более редкой частоте рецидива вопрос о хирургическом лечении решается через 4–6 лет исходя их опасности развития осложнений язв (стеноза, пенетрации и т.д.)-
Существуют два метода хирургического лечения больных при язвенной болезни: резекция желудка и органосохраняющая (органосберегающая) операция.
При резекции желудка язва удаляется вместе с большей частью тела желудка, клетки которого продуцируют соляную кислоту и протеолитические ферменты. Удаляется и антральный отдел желудка, вырабатывающий гастрин. Кроме того, мобилизация и пересечение малой кривизны желудка неизбежно сочетаются с рассечением блуждающих нервов.
Резекции желудка подразделяются в зависимости от: 1. локализации иссекаемой части желудка – дистальные и проксимальные; 2. размеров резекции – экономные (⅓–½), обширные (⅔), субтотальные, тотально–субтотальные и тотальные; 3. формы удаляемых зон желудка – клиновидные, сегментарные, ступенчатые, циркулярные, тубулярные; 4. иссекаемых отделов желудка – пилорэктомии, антрумэктомии, кардэктомии, фундэктомии; 5. метода восстановления целостности желудочно–кишечного тракта: ■ сохраняющие гастродуоденальную непрерывность (прямой гастродуоденальный анастомоз) – резекция желудка по Бильрот–I; замещение удаленной части желудка сегментом тонкой (еюногастропластика) или толстой (кологастропластика) кишки – интестиногастропластика); ■ гастроеюнальные анастомозы с односторонним выключением двенадцатиперстной кишки (резекция желудка по Бильрот–2).
Известно более 40 модификаций резекций желудка с гастродуоденальным анастомозом, более 50 вариантов интестиногастропластики, более 60 способов резекций желудка по Бильрот–2. Однако резекция желудка сопровождается высокой послеоперационной летальностью (1–5%) и частым развитием постгастрорезекционных синдромов (10–15%). Этих недостатков во многом лишены органосохраняющие (органосберегающие) операции. Сущность последних состоит в выполнении ваготомии (пересечении стволов или веточек блуждающих нервов на различном их уровне) в сочетании с дренирующими желудок операциями или в изолированном виде. Достоинства органосберегающих вмешательств заключаются в сохранении желудка как анатомического органа, низкой частоте интра– и послеоперационных осложнений.
Разработаны три основных варианта ваготомий: стволовая, селективная и селективная проксимальная (рис. 4). При стволовой ваготомии пересекаются стволы блуждающих нервов по всей окружности пищевода над диафрагмой (наддиафрагмальная ваготомия) или под диафрагмой выше уровня отхожцения от них печеночной, чревной и желудочной ветвей (поддиафрагмальная ваготомия). Наддиафрагмальная ваготомия выполняется из трансплеврального или из трансабдоминального доступа, поддиафрагмальная – трансабдоминально. Недостатком операции является нарушение иннервации органов брюшной полости и забрюшинного пространства. Кроме того, замедляется двигательная активность желудка, что в ряде случаев проявляется гастростазом.
При селективной ваготомии производится изолированное пересечение только желудочных ветвей блуждающих нервов. Печеночная и чревная ветви заднего блуждающего нерва сохраняются, благодаря чему не нарушается иннервация печени, желчного пузыря, кишечника и поджелудочной железы. Как стволовая, так и селективная ваготомия сопровождается снижением моторики и перистальтики желудка.
 Рис. 4. Варианты пересечения блуждающих нервов:
а – стволовая ваготомия; б – селективная ваготомия; в – селективная проксимальная ваготомия (зоны пересечения нервов заштрихованы).
Рис. 4. Варианты пересечения блуждающих нервов:
а – стволовая ваготомия; б – селективная ваготомия; в – селективная проксимальная ваготомия (зоны пересечения нервов заштрихованы).
При селективной проксимальной ваготомии (суперселективная ваготомия, ультраселективная ваготомия, ваготомия париетальных клеток и т.д.) пересекаются веточки желудочных ветвей блуждающих нервов, иннервирующих тело и дно желудка. Иннервация пилороантрального отдела желудка, а вместе с этим и моторно–эвакуаторная функция желудка в послеоперационном периоде сохраняются.
Существуют и комбинированные варианты ваготомии – передняя селективная и задняя стволовая, передняя селективная проксимальная и задняя стволовая. При их выполнении в меньшей степени страдает иннервация смежных с желудком органов и не нарушается двигательная функция желудка.
Таким образом, стволовая, селективная, комбинированная, а также селективная проксимальная ваготомии при наличии признаков сужения пилородуоденального перехода и во время операции или в случае опасности его развития вследствие рубцевания язв в послеоперационном периоде должны дополняться дренирующими желудок операциями.
Все варианты дренирования желудка подразделяются на 4 группы: 1. гастродуоденоанастомозы, 2. пилоропластика 3. гастроэнтероанастомозы; 4. дуоденопластика.
Гастродуоденоанастомоз может формироваться по Джабулею, Н. Ф. Нишанову с соавторами, В. И. Белоконеву с соавторами (рис. 5). Гастродуоденостомия по Джабулею – это анастомоз по типу "бок в бок" между антральным отделом желудка и нисходящей частью двенадцатиперстной кишки вне зоны язвы. Гастродуоденостомия по Н. Ф. Нишанову с соавторами предполагает формирование соустья между начальным отделом двенадцатиперстной кишки и наиболее отвисающей частью большой кривизны желудка (применяется у больных со стенозом пилородуоденального перехода). Гастродуоденоанастомоз по В. И. Белоконеву с соавторами – это анастомоз желудка и двенадцатиперстной кишки, стенки которых рассечены в поперечном направлении (поперечный гастродуоденоанастомоз). Недостатком гастродуоденоанастомозов является возникновение в послеоперационном периоде различной интенсивности дуоденогастрального рефлюкса.
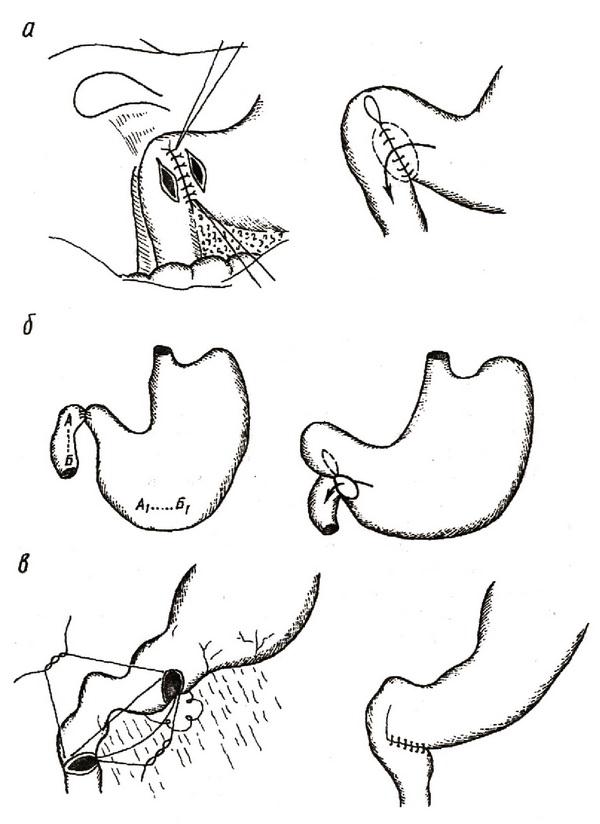 Рис. 5. Варианты гастродуоденоанастомозов:
а – по Джабулею; б – по Н. Ф. Нишанову с соавт; в – по В. И. Белоконеву с соавт.
Рис. 5. Варианты гастродуоденоанастомозов:
а – по Джабулею; б – по Н. Ф. Нишанову с соавт; в – по В. И. Белоконеву с соавт.
Пилоропластика – это пластическая операция в области пилородуоденального перехода, нередко сочетающаяся с иссечением язвы. При ее выполнении, в отличие от гастродуоденоанастомоза, сохраняется или восстанавливается замыкательная функция привратника.
Наиболее часто применяются следующие виды пилоропластики: 1. по Гейнеке–Микуличу – рассечение пилорического жома в продольном направлении со вскрытием просвета органов и ушиванием в поперечном направлении (рис. 6); 2. по Финнею – наложение серозно–мышечных швов между передними стенками антрального отдела желудка и начального отдела двенадцатиперстной кишки, дугообразное рассечение сшитых стенок через привратник, формирование передней стенки соустья (рис. 7). При выполнении пилоропластики по Финнею образуется киль задней губы анастомоза, обращенный на 1,5–2 см в просвет двенадцатиперстной кишки; 3. по Джадду–Хорслею – ромбовидное иссечение язвы передней стенки привратника или двенадцатиперстной кишки с поперечным сшиванием стенок (рис. 8)
Гастроэнтероанастомоз заключается в формировании соустья между большой кривизной желудка и петлей тощей кишки. Различают передний впередиободочный гастроэнтероанастомоз (по Бельфлеру), задний позади ободочный.
 Рис. 6. Пилоропластика по Гейнеке–Микуличу:
а – гастродуоденотомия; б – ушивание дефекта стенки желудка и двенадцатиперстной кишки серозно–мышечными и серо–серозными швами.
Рис. 6. Пилоропластика по Гейнеке–Микуличу:
а – гастродуоденотомия; б – ушивание дефекта стенки желудка и двенадцатиперстной кишки серозно–мышечными и серо–серозными швами.
При формировании гастроэнтероанастомоза по Бельфлеру петля тощей кишки проходит впереди поперечноободочной кишки и анастомозируется с передней стенкой желудка в области большой кривизны.
Гастроэнтероанастомоз по Гаккеру накладывается между задней стенкой желудка, проведенной через окно в брыжейке поперечно–ободочной кишки, и начальной петлей тощей кишки.
Дуоденопластика – это пластические операции на двенадцатиперстной кишке в области расположения язвы или рубцово–язвенной деформации с сохранением пилорического жома.
Как резекция, так и органосохраняющие операции имеют свои показания к применению в хирургии неосложненной хронической язвы.
Резекция желудка используется при язвах кардии, субкардии, тела и препилорического отделов желудка; II типе язвенной болезни по Джонсону, больших (более 1 см в диаметре) легкоудалимых язвах пилородуоденальной области. При восстановлении целостности желудочно–кишечного тракта предпочтение отдается наиболее физиологичному гастродуоденальному соустью. В случае выраженной рубцовой деформации двенадцатиперстной кишки, наличия инфильтратов, опасности развития несостоятельности швов формируется гастроеюнальный анастомоз по одному из известных вариантов.
 Рис. 7. Пилоропластика по Финнею:
а – сшивание желудка и двенадцатиперстной кишки серо–серозными швами, подковообразный разрез передней стенки пилородуоденального перехода; б – формирование второго ряда швов задней губы соустья; в – наложение первого ряда швов передней стенки анастомоза; г – серо–серозные швы.
Рис. 7. Пилоропластика по Финнею:
а – сшивание желудка и двенадцатиперстной кишки серо–серозными швами, подковообразный разрез передней стенки пилородуоденального перехода; б – формирование второго ряда швов задней губы соустья; в – наложение первого ряда швов передней стенки анастомоза; г – серо–серозные швы.
Ваготомии применяются прежде всего при язвенной болезни двенадцатиперстной кишки и пилорического отдела желудка. В плановой хирургии чаще используется селективная проксимальная ваготомия, сохраняющая иннервацию двигательного (пилородуоденального) отдела желудка.
Стволовая ваготомия показана больным пожилого и старческого возраста с тяжелым течением сопутствующих заболеваний. Быстрота ее выполнения позволяет значительно уменьшить риск операции.
Селективная ваготомия выполняется в случае отсутствия условий для выполнения селективной проксимальной ваготомии: при повреждении нервов Латарже, плохой дифференцировке нервов из–за ожирения пациентов, наличии инфильтрации или деформации малого сальника.
При выборе способа дренирования желудка целесообразно применение пилоро– и дуоденопластики в случае резко выраженного рубцового стеноза выходного отдела желудка, привратника и двенадцатиперстной кишки, при наличии их деформации и воспалительного инфильтрата используется гастродуоденоанастомоз. У больных с обширными инфильтратами и рубцовыми изменениями в двенадцатиперстной кишке, с сопутствующим язвенной болезни хроническим нарушением дуоденальной проходимости формируется гастроэнтероанастомоз.
Ваготомии (стволовая и селективная) в сочетании с дренирующей желудок операцией могут применяться как вынужденная операция из–за тяжелого состояния больных и в хирургии язв тела желудка. Они используются только при немалигнизированных, небольших язвах малой кривизны тела желудка. Язва во время операции клиновидно иссекается, дефект в стенке ушивается двухрядным швом.
 Рис. 8. Пилоропластика по Джадду–Хорслею:
а – ромбовидное иссечение язвы; б – вид раны после наложения серозно–мышечных, в – серо–серозных швов.
Рис. 8. Пилоропластика по Джадду–Хорслею:
а – ромбовидное иссечение язвы; б – вид раны после наложения серозно–мышечных, в – серо–серозных швов.
У больных со II типом язвенной болезни по Джонсону, при хронической язве пилорического отдела желудка и двенадцатиперстной кишки, протекающих с высокой (более 60 ммоль/ч) кислотопродукцией, язвенной болезни двенадцатиперстной кишки с хронической дуоденальной непроходимостью выполняется экономная резекция желудка с ваготомией (стволовой или селективной). Непрерывность желудочно–кишечного тракта при хронической дуоденальной непроходимости восстанавливается наложением гастроеюноанастомоза?
При недостаточности кардиального сфинктера пищевода ваготомии дополняются фундопликацией, чаще всего выполняемой по методу Ниссена. Сущность операции состоит в окутывании абдоминального отдела пищевода стенкой дна желудка и фиксации желудка к диафрагме вокруг пищеводного отверстия несколькими швами (рис. 9).
 Рис. 9. Эзофагофундопластика по Ру–Ниссену
Рис. 9. Эзофагофундопластика по Ру–Ниссену
Осложненная язвенная болезнь
Язвенная болезнь осложняется желудочно–кишечным кровотечением, перфорацией, стенозом выходного отдела желудка и двенадцатиперстной кишки, пенетрацией и малигнизацией.Желудочно–кишечные кровотечения
Кровотечения при язвенной болезни встречаются в 18–25% наблюдений, составляя 60–75% всех случаев желудочно–кишечных кровопотерь. Чаще всего источником кровотечения являются расположенные в области язвы аррозированные артерии, реже вены и капилляры. По характеру клинической картины кровопотеря может быть явной (ост – рой), возникающей внезапно, или скрытой, проявляющейся постепенно. В большинстве случаев кровоточат язвы малой кривизны желудка (кровотечение возникает из системы левой и правой желудочных артерий) и двенадцатиперстной кишки, пенетрирующие в головку поджелудочной железы, в печеночно–двенадцатиперстную связку (кровотечение из системы желудочно–двенадцатиперстной и верхней двенадцатиперстно–панкреатической артерий).Патогенез.
При желудочно–кишечных кровотечениях происходят существенные изменения в организме. Прежде всего кровопотеря сопровождается уменьшением объема циркулирующей крови (ОЦК) и гиповолемическим шоком. Развивающаяся гиповолемия отрицательно сказывается на кровоснабжении в первую очередь мозга и сердца. В таких условиях жизнедеятельность организма обеспечивается активацией ауторегуляторных нейрогуморальных механизмов адаптации и защиты. Так, дефицит ОЦК до 10–15% не приводит к существенным нарушениям гемодинамики и компенсируется уменьшением емкости сосудистого русла, спазмом сосудов кожи, органов брюшной полости, раскрытием артериовенозных шунтов. При кровопотере свыше 15% артериальное давление уменьшается до 90–85/45–40 мм рт. ст., т.е. на 15–30%. Компенсация недостающего ОЦК, увеличение минутного объема сердца, а в итоге нормализация артериального давления и улучшение кровоснабжения органов и тканей у такой категории больных осуществляются за счет большой напряженности адаптационно–защитных механизмов. Дефицит ОЦК восполняется генерализованным спазмом кровеносных сосудов, проникновением в общий кровоток части тканевой жидкости, крови из естественных депо, лимфы из лимфатических сосудов. Вместе с тем восполнение ОЦК сопровождается ее гемодилюцией. Повышается и частота сердечных сокращений. Одновременно под воздействием кортикостероидов, альдостерона, антидиуретического гормона увеличивается реабсорбция в почечных канальцах воды и натрия, уменьшается диурез. Однако восполнение ОЦК отрицательно сказывается на тканевой перфузии. Развивается гипоксия клеток, что неизбежно ведет к переключению обмена веществ на анаэробный тип. Постепенно возникает метаболический ацидоз. В случае истощения защитных механизмов восстановления ОЦК артериальное давление снижается до критического уровня – 50–60 мм рт. ст. Происходит необратимое расстройство микроциркуляции. Резко нарушается функция печени (печеночная недостаточность), почек (почечная недостаточность), сердца (инфаркт миокарда). На этом фоне больные нередко погибают.
Ухудшению состояния больных с желудочно–кишечньш кровотечением способствует интоксикация организма продуктами гидролиза излившейся в кишечник крови. Ведущая роль в интоксикационном процессе принадлежит аммиаку. Последний вследствие снижения функции печени из–за системной гипотонии и сопутствующей язвенной болезни не захватывается гепатоцитами, В сочетании с уменьшением диуреза это ведет к значительному повышению в крови концентрации аммиака и других токсических веществ.
Клиническая картина.
Типичными признаками желудочно–кишечных кровотечений являются кровавая рвота, дегтеобразный стул, общие симптомы. Степень их выраженности прежде всего зависит от тяжести и длительности кровотечения, степени кровопотери.
Кровавая рвота (haematemesis) встречается в большинстве случаев желудочно–кишечных кровотечений. Она может быть однократной и часто повторяющейся, незначительной и обильной, чаще типа кофейной гущи, реже – алой кровью со сгустками. Наиболее типична кровавая рвота для кровотечений из язв желудочной локализации. У лиц с язвенной болезнью двенадцатиперстной кишки онанаблюдается в случае забрасывания крови в желудок через зияющий привратник. Однако при медленном накоплении крови в желудке рвота может отсутствовать, так как излившаяся кровь успевает эвакуироваться в кишечник. Аналогичная ситуация возникает и у больных с желудочным кровотечением из–за быстрого опорожнения желудка.
Рвота алой кровью со сгустками отмечается при массивном кровотечении. Появление рвоты через короткие промежутки времени является признаком продолжающегося кровотечения, а спустя длительный период времени – его возобновления.
Кровавый дегтеобразный стул (melena) появляется через несколько часов и суток от начала кровотечения. Для массивной кровопотери характерно наличие жидкого кровавого стула, что связано с быстрым продвижением крови по кишечнику.
Общие симптомы кровопотери включают слабость, головокружение, бледность кожных покровов н слизистых оболочек, холодный пот, цианоз губ, акроцианоз, мелькание мушек перед глазами, нарушение зрения, слуха и психические расстройства (гипоксия мозга), боли в области сердца (гипоксия миокарда).
Диагностика.
При обследовании больных с желудочно–кишечным кровотечением ставятся задачи: установить его наличие, определить причину, источник, тяжесть. Большое значение для последующей тактики имеет подтверждение продолжения или остановки кровотечения.
Прежде всего обращается внимание на жалобы, данные анамнеза, объективного осмотра. Оцениваются состояние гемодинамики (пульс, АД и ЭКГ), гематологические показатели (эритроциты, гемоглобин, гематокрит и т.д.). Часто выявляются симптомы Бергманна (исчезновение боли в животе после кровотечения) и Менделя (локальная болезненность при перкуссии в пилородуоденальной зоне). Показателем снижения ОЦК является увеличение шокового индекса (отношение пульса к систолическому АД) более 0,5. Повышение шокового индекса до 1 свидетельствует о дефиците ОЦК до 30%. Шоковый индекс, равный 2, наблюдается при дефиците ОЦК до 70%.
С диагностической и лечебной целью в желудок вводят толстый зонд. Определяют количество и характер аспирированного содержимого. После промывания желудка холодной водой (3–4 л) выполняют экстренную эзофагогастро–дуоденоскопию или рентгенологическое исследование. Эзофагогастродуоденоскопия может производиться и при крайне тяжелом состоянии больных, на высоте кровотечения, так как позволяет одновременно осуществить эндоскопический гемостаз. Если с помощью инструментальных методов диагностики найти источник кровотечения не представляется возможным, а состояние больного прогрессивно ухудшается, показана экстренная лапаротомия.
Е. Л. Березов выделяет три степени тяжести желудочно–кишечных кровотечений, исходя из частоты кровавой рвоты, дегтеобразного стула, показателей АД и пульса, общего состояния больных: 1. Легкая степень тяжести: однократная рвота и дегтеобразный стул. АД и пульс в норме. Общее состояние больного удовлетворительное. 2. Средняя степень тяжести кровотечения проявляется обмороком больного, повторной кровавой рвотой, слабостью, снижением систолического АД до 90–80 мм рт. ст. Пульс учащается до 100 ударов в минуту. 3. Тяжелая степень: обильная повторная рвота, дегтеобразный стул. Систолическое АД снижается до 60–50 мм рт. ст. Пульс 120 и более ударов в минуту. Состояние больного критическое.
Более точной является классификация степеней тяжести кровотечения, в которой учитываются показатели гематокрита, плотность и ОЦК: 1. I степень – легкое кровотечение. Общее состояние пациентов ближе к удовлетворительному. Сознание не нарушено. Наблюдаются однократная рвота, легкая бледность кожных покровов. Пульс учащен до 100 ударов в минуту. Систолическое АД в норме или снижено до 100 мм рт. ст. Гематокрит – 35%. Плотность крови – 1053–1040. Дефицит ОЦК до 20% (500–1.000 мл). 2. II степень – кровотечение средней тяжести. Общее состояние больных средней тяжести. Отмечаются повторная кровавая рвота, мелена; однократная потеря сознания; значительная бледность кожных покровов. Пульс учащается до 100 ударов в минуту и более, слабого наполнения. АД снижается до 90 мм рг. ст. Гематокрит – 25–30%. Плотность крови 1050–1040. Дефицит ОЦКдо 30% (1.000–1500 мл). 3. III степень – тяжелое кровотечение. Общее состояние больного тяжелое. Наблюдаются потеря сознания, повторяющаяся обильная кровавая рвота, деггеобразный стул. Пульс нитевидный, слабого наполнения и напряжения, 130–140 ударов в минуту. Систолическое АД ниже 70 мм рт. ст. Гематокрит – 25%. Плотность крови ниже 1040. Дефицит ОЦК – 50% (1500–2500 мл).
В. И. Стручков и Э.В. Луцевич выделяют 4 степени тяжести желудочно–кишечных кровотечений: 1. I степень. Кровотечение вызывает незначительные изменения гемодинамики. Общее состояние удовлетворительное. Пульс несколько учащен. АД нормальное. Дефицит ОЦК не более 5% от должного. Содержание гемоглобина выше 100 г/л. Капилляроскопия: розовый фон, 3–4 капиллярные петли с быстрым гомогенным кровотоком. 2. II степень. Выраженное кровотечение. Общее состояние средней тяжести. Больных беспокоят вялость, головокружение, обморочное состояние. Наблюдаются однократная необильная рвота, дегтеобразный стул. Пульс значительно учащен. Систолическое АД снижено до 90 мм рт. ст. Дефицит ОЦК 15%. Гемоглобин – 80 г/л. Капилляроскопия: бледный фон, уменьшение количества капилляров, кровоток быстрый, гомогенность не нарушена. 3. III степень. Общее состояние больных тяжелое. Наблюдаются частая рвота, дегте образный стул, обмороки. Кожные покровы и видимые слизистые бледные. Больной покрыт холодным потом. Пульс учащен, нитевидный. Систолическое АД снижено до 60 мм рт. ст. Дефицит ОЦК 30%. Гемоглобин – 50 г/л. Капилляроскопия: фон бледный, 1–2 петли с плохо выраженными артериальной и венозной частями. 4. IV степень. Обильное кровотечение с длительной потерей сознания. Общее состояние крайне тяжелое, граничит с агональным. Пульс и АД не определяются. Дефицит ОЦК превышает 30%. Капилляроскопия: фон серый, открытые петли капилляров не видны.
Дифференциальная диагностика.
Известно более 70 заболеваний, сопровождающихся гастродуоденальным кровотечением. Кровотечения язвенной этиологии чаще всего дифференцируют с желудочно–кишечными кровотечениями при распадающемся раке желудка, при синдроме Маллори–Beйсса, геморрагическом эрозивном гастрите, варикозном расширении вен пищевода и желудка, болезни Рандю–Вебера–Ослера, лейкозах, гемофилии, болезни Верльгофа.
При распадающейся раковой опухоли желудка кровотечение редко бывает профузным. Обычно оно небольшое, типа кофейной гущи, не сопровождается болевыми ощущениями. Кровотечению предшествуют потеря аппетита, массы тела, прогрессирующее нарастание слабости, быстрой утомляемости, анемия. Реакция кала на скрытую кровь после исчезновения кровавой рвоты и дегтеобразного стула длительное время остается положительной. Для уточнения диагноза проводятся фиброгастроскопия с биопсией ткани опухоли и рентгенологическое исследование.
Синдром Маллори–Вейсса проявляется кровотечением из разрыва слизистой оболочки кардиоэзофагеальной области. Разрывов может быть несколько. Они располагаются продольно. Синдром встречается преимущественно в молодом возрасте. Кровотечение возникает внезапно при сильной рвоте и сопровождается появлением загрудинных болей. В большинстве случаев синдром сочетается с грыжей пищеводного отверстия диафрагмы, хроническим атрофическим гастритом, язвами пищевода и кардиального отдела желудка. При фиброгастроскопии в пищеводно–кардиальной зоне находят линейные разрывы слизистой различной длины и глубины.
Геморрагический эрозивный гастрит характеризуется различной степени интенсивности кровотечением из одиночных и множественных эрозий слизистой оболочки желудка, представляющих собой поверхностные язвы. Эрозии чаще локализуются в теле и в препилорическом отделе желудка. Развитию эрозивного гастрита способствуют ожоговая болезнь, передозировка медикаментов (аспирин, АКТГ, гормоны коры надпочечников), инфаркт миокарда, острые нарушения мозгового кровообращения, черепно–мозговая травма. Единственным методом диагностики эрозивного гастрита является фиброгастроскопия.
Кровотечению из варикозно–расширенных вен пищевода и желудка на почве портальной гипертензии способствуют портальные кризы, нарушение в свертывающей системе крови, изъязвление слизистой оболочки пищевода и желудка под действием кислотно–пептического фактора. Нередко кровотечение возникает после обильного приема пищи, а также во время сна, когда приток крови в систему v.portae значительно увеличивается. При осмотре больных находят увеличение или, наоборот, уменьшение печени, спленомегалию, нередко сочетающуюся с гиперспленизмом, асцит, расширение вен передней брюшной стенки.
При болезни Рандю–Вебера–Ослера источником кровотечения являются множественные телеангиэктазии и ангиомы слизистой оболочки. Заболевание носит наследственный характер, передается по доминантному типу. Нередко наряду с желудочно–кишечным кровотечением наблюдаются кровотечения из телеангиэктазий и ангиом, локализующихся на слизистых оболочках носа, полости рта, на губах, языке, крыльях носа, ушных мочках, мочевом пузыре, трахее и бронхах.
У больных лейкозами желудочно–кишечное кровотечение возникает из–за повышенной проницаемости стенки сосудов слизистой оболочки. Кровотечения могут быть как незначительными, так и профузными. Диагноз ставится на основании исследования мазка крови, биопсий и пунктата костного мозга.
У больных гемофилией возникновение желудочно–кишечного кровотечения связано с падением уровня антигемофильного глобулина крови ниже 30%. Заболевание передается по наследству, встречается преимущественно у мужчин. Постановке диагноза способствуют данные анамнеза о наличии повышенной кровоточивости из ран мягких тканей, внутрисуставных, подкожных и межмышечных гематом, удлинение времени свертывания крови до 10–30 мин.
Типичными признаками болезни Верлъгофа помимо желудочно–кишечного кровотечения являются повышенная кровоточивость десен, слизистой оболочки носа, почечные и маточные кровотечения, подкожные кровоподтеки и кровоизлияния в подслизистые оболочки. В крови находят тромбоцитопению, отмечают значительное увеличение продолжительности кровотечения.
Лечение.
Больные с желудочно–кишечным кровотечением подлежат экстренной госпитализации в хирургические стационары, а при возможности в реанимационные отделения, где одновременно проводятся диагностические мероприятия и активное консервативное лечение. Последнее может рассматриваться как подготовка к операции.
Консервативное лечение включает прежде всего гемостатическую терапию и восполнение ОЦК с сохранением коллоидно–осмотического давления крови, ее кислородной емкости, реологических и коагуляционных свойств.
Гемостатическая терапия подразделяется на общую и местную. При проведении общей гемостатической терапии внутривенно вводятся 10 мл 10% раствора кальция хлорида (глюконата); через каждые 4–6 ч – 5% раствор ингибитора фибринолиза аминокапроновой кислоты по 100 мл и нативная (сухая) плазма по 20–30 мл. Внутримышечно назначается 1% раствор викасола до 3 мл в сутки, а в тяжелых случаях – внутривенно трасилол (100.000 ЕД) или контрикал (25.000–30.000 ЕД). Хороший гемостатический эффект дает секретин, который вводится внутривенно капельно в дозе 100 мг на 50 мл 0,01% раствора натрия хлорида.
Местная гемостатическая терапия включает: 1. Гипотермию желудка (холод на эпигастральную область); промывание желудка ледяной водой (до + 4°С). Однако эта процедура выполняется только при продолжающемся кровотечении, так как она может привести к отрыву тромба и возобновлению кровотечения. Образование тромбов во время промывания желудка ускоряется добавлением к воде серебра нитрата и тромбина. 2. Применение средств, снижающих фибриполитическую активность слизистой оболочки желудка и раскрывающих артериовенозные шунты. Для снижения фибринолитической активности слизистой предложена смесь Уманского, состоящая из 10 г аминокапроновой кислоты, 200 мг тромбина и 100 мл воды, которую больной принимает внутрь через каждые 15 мин в течение 2 ч, а затем 3 раза в сутки. Раскрытию артериовенозных шунтов способствует введение в желудок (в том числе и через назогастральный зонд) 4 мл 0,3% раствора норадреналина в 150 мл изотонического раствора натрия хлорида. При отсутствии гемостатического эффекта норадреналин применяется повторно, но в половинной дозе. 3. Инъекции ингибиторов фибринолиза, сосудосуживающих препаратов вокруг кровоточащей язвы. 4. Диатермокоагуляцию источника кровотечения. 5. Криовоздействие на источник кровотечения, 6. Наложение аппликаций аэрозольных пленкообразователей на кровоточащую область. 7. Лазерное облучение язв. 8. Клипирование аррозированных сосудов.
Устранение волемических нарушений включает восполнение ОЦК. При легкой степени кровопотери дефицит ОЦК ликвидируется переливанием 500 мл плазмы, 5% раствора глюкозы, растворов Рингера–Локка, изотонического раствора натрия хлорида в общем объеме до 1.000 мл. Больным с кровотечением средней степени переливаются один объем эритроцитарной массы и два объема кровезаменителей (коллоидные и кристаллоидные растворы). При тяжелой степени кровотечения для возмещения глобулярного и плазменного объемов используют цельную кровь.
При кровотечении в ближайшие 24 ч переливают изотонический раствор глюкозы, натрия хлорида, что способствует восстановлению объема внеклеточной жидкости и купированию метаболического ацидоза. Из кровезаменителей предпочтение отдается среднемолекулярным их представителям (среднемолекулярный декстран, желатиноль, поливинилпирролидон и др.). Низкомолекулярные кровезаменители (гемодез, реополиглюкин и др.) назначаются при остановившемся кровотечении. В случае использования крупномолекулярных кровезаменителей (полиглюкин) предварительно вводятся низкомолекулярные кровезаменители или солевые растворы. Коррекция ОЦК осуществляется под контролем центрального венозного давления (ЦВД).
Параллельно проводится специфическая терапия язвенной болезни, включающая использование блокаторов Н2–рецепторов гистамина, в том числе внутривенно; антацидных, адсорбирующих и обволакивающих средств; репарантов; анаболиков; биогенных стимуляторов; витаминов и т.д.
После остановки кровотечения больному в течение не менее 10–12 дней назначают постельный режим и щадящую диету (диету Мейле нграхта): прием легкоусвояемой пищи с энергетической ценностью не менее 1.000–1200 ккал в сутки производится каждые 2–3 ч по 100–150 мл. Обладая буферными свойствами, пища в желудке нейтрализует соляную кислоту и протеолитические ферменты, снижает его голодную перистальтику и стимулирует процесс регенерации. Один раз в сутки ставится очистительная клизма. Если кровотечение у данной группы больных не возобновилось, то при наличии показаний им проводится плановая операция после 10–12–дневной предоперационной подготовки. Остальные пациенты лечатся консервативно по поводу язвенной болезни.
Неотложной операции подлежат больные, находящиеся в состоянии геморрагического шока; с язвами, осложненными профузным кровотечением; с калезными язвами, покрытыми свежим (красным) тромбом или содержащими сосуд с таким же тромбом; с повторяющимися кровотечениями на фоне проводимого консервативного стационарного лечения.
Во время операции после ревизии органов брюшной полости уточняют локализацию язвы. В сложных ситуациях выполняют широкую продольную гастротомию или дуоденотомию с последующим визуальным осмотром слизистой оболочки желудка и двенадцатиперстной кишки. После обнаружения источника кровотечения прибегают к временной остановке его (прошиванию, перевязке кровоточащего сосуда, прошиванию язвы) и выполняют основную операцию.
При кровотечении из язв субкардии, тела и препилорического отдела желудка показана дистальная резекция желудка. У больных пожилого возраста с высокой степенью риска операции оправдано клиновидное иссечение язвы в сочетании с пилоропластикой и ваготомией (стволовой или селективной). При язвах кардиального отдела желудка производится проксимальная резекция его или гастрэктомия.
Прикрытая перфорация.
Прикрытой перфорацией язвы называется вариант клинического течения прободной язвы в свободную брюшную полость, при котором образовавшееся отверстие в желудке и двенадцатиперстной кишке закрывается стенкой прилежащего органа, пленкой фибрина, складкой слизистой оболочки, кусочком пищи. Чаще прикрытая перфорация наблюдается при локализации язвы на передней стенки желудка и двенадцатиперстной кишки.Клиническая картина.
В течении заболевания выделяют две фазы: перфорации и угасания симптомов, В фазе перфорации желудочно–дуоденальное содержимое поступает в брюшную полость. Наблюдающаяся при этом клиническая картина ничем не отличается от таковой при типичной перфорации язвы. Фаза угасания клинических симптомов начинается после прикрытия перфорационного отверстия, что чаще происходит через 30–60 мин после наступления прободения. Постепенно уменьшаются интенсивность болей, напряжение мышц живота, выраженность симптома Щеткина–Блюмберга. В том случае, если перфорационное отверстие прикрылось достаточно прочно, а в свободную брюшную полость поступило незначительное количество желудочного или дуоденального содержимого, то при назначении больному соответствующего лечения (см. ниже) может наступить выздоровление. Однако достаточно часто прикрытие разрушается и клиническая картина прободной язвы прогрессирует (двухфазное прободение).
Диагностика.
О наличии прикрытой перфорации свидетельствуют острое начало заболевания и постепенное уменьшение возникающих симптомов. Часто во второй фазе определяют болезненность и умеренное напряжение мышц при пальпации правого верхнего квадранта живота (симптом Ратнера–Виккера), слабо выраженные признаки раздражения брюшины, субфебрильную температуру, лейкоцитоз со сдвигом формулы белой крови влево. При обзорной рентгенографии (рентгеноскопии), УЗИ органов брюшной полости и поддиафрагмальных пространств часто обнаруживается незначительное количество газа под диафрагмой. Если газ отсутствует и с момента перфорации прошло менее двух суток, выполняется пневмогастрография или рентгенологическое исследование желудка и двенадцатиперстной кишки с дачей больному 5–15 мл водорастворимого контрастного вещества. Информативна лапароскопия.
Атипичные перфорации.
Под атипичной перфорацией понимают вариант прободения гастродуоденальной язвы, при котором желудочно–кишечное содержимое изливается в ограниченное пространство или забрюшинную клетчатку. Нередко прободение сочетается с профузным кровотечением, Такой вид перфорации наблюдается в случае прободения язвы, расположенной на задней стенке двенадцатиперстной кишки, в кардиальном отделе желудка, на задней стенке желудка, а также при значительном спаечном процессе в верхнем отделе брюшной полости, когда образуются замкнутые пространства вокруг излившегося желудочно–дуоденального содержимого.Клиническая картина.
При атипичной перфорации язвы, как правило, отсутствуют наиболее характерные симптомы прободения, т.е. острое начало заболевания (кинжальная боль), доскообразное напряжение мышц передней брюшной стенки. Нет быстрого развития перитонита.
Больных беспокоят незначительные ноющие боли в верхнем этаже брюшной полости, иногда отдающие в спину. Отмечаются слабость, повышение температуры тела. Вовремя не диагностированная атипичная перфорация осложняется абсцессом сальниковой сумки, брюшной полости, забрюшинной флегмоной. При прорыве абсцесса в свободную брюшную полость развивается перитонит.
Диагностика.
При атипичной перфорации затруднена, так как печеночная тупость сохранена, свободная жидкость в брюшной полости не определяется. При рентгенологическом исследовании свободный газ под диафрагмой отсутствует. Только проведение комплексного обследования больных с применением УЗИ брюшной полости и забрюшинного пространства, рентгенологического исследования желудка и двенадцатиперстной кишки, фиброгастродуоденоскопии, наличие в животе пальпируемого образования с четко ограниченными контурами в непосредственной близости от желудка позволяют заподозрить атипичную перфорацию. В крови находят лейкоцитоз со сдвигом формулы белой крови влево. В сомнительных случаях выполняется лапаротомия. Признаком перфорации дуоденальной язвы в забрюшинное пространство является триада Лаффитэ: эмфизема, имбибиция желчью и кровью забрюшинного пространства в области нисходящего колена двенадцатиперстной кишки.
В 10–12% всех перфораций встречается вариант атипичного прободения в виде сочетания перфорации и кровотечения. Прободение и кровотечение возникают одновременно или предшествуют друг другу. Наличие кровотечения приводит к сглаживанию клинической картины перфорации. Боль, перитонеальные симптомы и напряжение мышц передней брюшной стенки у такой категории больных выражены незначительно или вообще отсутствуют. Это часто является причиной поздней диагностики данного осложнения язвенной болезни.
Лечение.
Прободная язва желудка или двенадцатиперстной кишки является абсолютным показанием к операции. Противопоказанием к хирургическому вмешательству служит агональное состояние больного.
При общем удовлетворительном состоянии больных, поступивших на 2–3–и сутки после прикрытой перфорации с отсутствием перитонеальных явлений, назначается консервативное лечение, заключающееся в постоянной аспирации желудочно–кишечного содержимого в течение 4–5 дней через назогастральный зонд, проведении комплексной антибактериальной, противовоспалительной, десенсибилизирующей, дезинтоксикационной терапии, парентерального питания, коррекции водно–солевых нарушений (метод Тейлора), назначении специфической противоязвенной терапии. Перед удалением зонда на основании рентгенологического исследования (больной принимает жидкое контрастное вещество) определяют наличие затекания контраста в свободную брюшную полость.
Кратковременная предоперационная подготовка больных включает внутривенное введение раствора глюкозы, гемодеза, реополиглюкина и т.д. в общем объеме 1,5–2,5 л. Внутримышечно назначаются анальгетики. Корригируются нарушения в функциональном состоянии сердечно–сосудистой, дыхательной и других систем.
При прободных язвах желудка и двенадцатиперстной кишки применяют следующие методы хирургического лечения: 1. ушивание перфоративной язвы; 2. резекцию желудка; 3. ваготомию с ушиванием или иссечением язвы и дренирующими желудок операциями; 4. ваготомию с экономной резекцией желудка.
Из них наибольшее распространение получило ушивание перфоративной язвы, что связано с простотой выполнения этой операции и низкой (2–3%) летальностью.
Показаниями к ушиванию язвы являются: 1. острая язва с мягкими краями у лиц без язвенного анамнеза или с коротким язвенным анамнезом; 2. тяжелое общее состояние больного вследствие сопутствующей патологии; 3. молодой возраст больных (до 25–30 лет) при перфорации нелеченной язвы; 4. пожилой возраст больных при перфорации некаллезных язв и отсутствии других осложнений (стеноза, кровотечений, малигнизации); 5. поступление больного позже 6–8 ч с момента перфорации и наличие перитонита; 6. отсутствие условий для выполнения резекции или органосохраняющей операции (опыта хирурга, ассистентов, инструментария, кровезаменителей и т.д.).
В большинстве случаев прободное отверстие ушивается наложением двух рядов швов (1–й ряд серозно–мышечный, 2–й ряд серосерозный) вдоль продольной оси желудка. При завязывании нитей линия швов располагается к этой оси поперечно. При прорезывании швов (что чаще наблюдается у больных с каллезными язвами, имеющими инфильтрированные края) используются пластические способы закрытия прободного отверстия. К ним относится укрытие перфорации: складкой из стенки желудка, подшиваемой вокруг прободного отверстия (В. Я. Корчевский); прилежащими органами; париетальной брюшиной, треугольным серозно–мышечным лоскутом, выкроенным из стенки желудка выше прободного отверстия с основанием, обращенным к язве (Л. В, Серебренников, В. П. Снежков); изолированным сальником и мышцей; сальником (Оппель–Беннет, Поликарпов–Подгорбунский). Последние способы применяются наиболее часто.
Сущность операции Оппеля–Беннета заключается во введении в прободное отверстие свернутого трубочкой сальника на ножке, который подшивают узловыми швами к стенке желудка. По методу Поликарпова–Подгорбунского сальник прошивают кетгутовой нитью. Концы нити с помощью изогнутых игл проводят через перфорационное отверстие в просвет желудка (двенадцатиперстной кишки) и прошивают стенку органа изнутри кнаружи на расстоянии 2–3 см от края отверстия и в 0,5 см друг от друга на одной стороне отверстия. При подтягивании за оба конца нити сальник инвагинирует в просвет и закрывает место перфорации. Концы нитей завязываются. Складка сальника дополнительно подшивается несколькими узловыми швами к стенке желудка.
Показаниями к резекции желудка являются: 1. Перфорация каллезныхязв желудка, подозрительных на злокачественное перерождение. 2. Длительный язвенный анамнез, свидетельствующий о неэффективности проводимого в полном объеме консервативного лечения. 3. Наличие условий для выполнения резекции желудка (поступление больных в сроки до 6–8 ч с момента перфорации, отсутствие тяжелых заболеваний жизненно важных органов, подготовленная бригада хирургов).
Чаще производят резекцию желудка по Бильрот–II в модификации Гофмейстера–Финстерера. Однако если имеются благоприятные анатомически условия, предпочтение должно отдаваться резекции желудка по Бильрот–I как наиболее физиологичному варианту.
Органосохраняющие операции в хирургии прободных язв позволяют значительно снизить летальность (до 01 %) и улучшить функциональные результаты. Ваготомия с иссечением (ушиванием) язвы и дренирующими желудок операциями показана при язвах пилорического отдела желудка и двенадцатиперстной кишки у лиц молодого и среднего возраста в случае отсутствия разлитого перитонита (поступление в сроки до 6–8 ч с момента перфорации) и выраженной воспалительной инфильтрации стенки органа.
Прободное отверстие иссекается с последующей пилоропластикой по Джадду–Хорслею или Финнею. При ушивании перфорации в качестве дренирующей желудок операции производится один из способов пилоропластики или формируется гастродуоденоанастомоз. Среди вариантов ваготомии предпочтение отдается стволовой ваготомии, так как она наиболее быстро выполняется.
Ваготомия (стволовая, селективная) с экономной резекцией желудка (пилороантрумэктомия) показана при втором типе язвенной болезни по Джонсону (прободные язвы желудка и хроническая язва двенадцатиперстной кишки или наоборот), дуоденостазе.
Пилородуоденальный стеноз
Пилородуоденальный стеноз развивается в результате рубцово–воспалительных изменений пилорического отдела желудка и двенадцатиперстной кишки, вследствие существования язвенной болезни.Как осложнение язвенной болезни пилородуоденальный стеноз встречается у 20–40% больных.
Первоначально затруднение при прохождении пищи через суженный пилородуоденальный переход компенсируется усиленным сокращением мышц стенки желудка, что приводит к ее гипертрофии. В случае прогрессирования стеноза и при длительном сроке его существования компенсаторные способности стенки желудка истощаются. Полного опорожнения желудка не происходит. Он увеличивается в объеме, желудочная стенка истончается. В ее нервно–мышечном аппарате развиваются необратимые изменения. Застой в желудке приводит к появлению рвоты, С течением времени частота и объем рвотных масс увеличиваются.
Во время рвоты из желудка выводятся электролиты, прежде всего ионы хлора и калия, а также жидкость. Необходимые для образования соляной кислоты ионы хлора поступают в желудок из крови. Освободившиеся в результате этого процесса ионы натрия соединяются с бикарбонатами крови. Постепенно развивается алкалоз. Увеличивается щелочной резерв. Одновременно происходит разрушение белков тканей с нарастанием в организме концентрации азотистых шлаков. Кальций отщепляется от тканей и связывается с фосфатами. Концентрация кальция во внеклеточной жидкости прогрессивно уменьшается.
Алкалоз, азотемия, нарушение обмена кальция клинически проявляются повышенной возбудимостью нервномышечных структур. У больных наблюдаются судороги, начиная от самопроизвольного сведения рук до судорог всего тела с опистотонусом и тризмом. При гипокалиемии (концентрация ионов калия ниже 3,5 ммоль/л) отмечаются мышечная слабость, парезы и параличи. Снижается АД, чаще диастолическое. Нарушается ритм сердечных сокращений. Расширяются границы сердца. В случае понижения уровня ионов калия в плазме до 1,5 ммоль/л развивается паралич межреберных нервов, диафрагмы с прекращением дыхания. В фазу систолы останавливается сердечная деятельность. Некоторое время алкалоз компенсируется олигурией, сопровождающейся замедлением выведения из организма кислых метаболитов. При декомпенсированном алкалозе происходит сгущение крови, появляются дистрофические, а в ряде случаев несовместимые с жизнью изменения в паренхиматозных органах с нарушением их функции.
Классификация.
В течении пилородуоденального стеноза выделяют три стадии: компенсации, субкомпенсации и декомпенсации. Последняя стадия подразделяется на фазы частичной и полной декомпенсации.
Клиническая картина и диагностика.
Наиболее типичными симптомами пилородуоденального стеноза являются: 1. рвота пищей, съеденной накануне; 2. видимая на глаз перистальтика; 3. шум плеска в желудке натощак. Каждая из стадий пилородуоденального стеноза характеризуется различной степенью их выраженности.
В компенсированной стадии пилородуоденального стеноза за счет гипертрофии мышц желудок практически полностью опорожняется от пищевых масс. Общее состояние больных удовлетворительное. Появляется чувство тяжести, полноты в эпигастрии в основном после еды. Иногда пациентов беспокоит отрыжка кислым, приносящая облегчение, эпизодическая рвота съеденной пищей. Объективно определяется видимая на глаз перистальтика. Натощак в желудке выявляется около 200–300 мл содержимого. При исследовании желудочного сока обнаруживается гиперсекреция. При фиброгастроскопии находят выраженную деформацию пилородуоденального канала с сужением его просвета до 1–0,5 см. Электрогастрографически регистрируются высокие с неравномерной частотой волны биопотенциалов стенки желудка. Во время рентгенологического исследования желудок обычных размеров или несколько расширен. Тонус обоих отделов нормальный, но чаще повышенный. Перистальтика усилена. Пилородуоденальный канал сужен. Эвакуация бариевой взвеси из желудка своевременная или замедлена на 6–12 ч.
В стадии субкомпенсации сократительная способность мышечного слоя стенки желудка истощается. Отмечаются постоянное чувство тяжести, приступообразные боли в эпигастрии, связанные с усилением перистальтики, отрыжка с запахом тухлых яиц. Рвота возникает практически каждый день. Нередко для улучшения состояния пациенты вызывают ее искусственно. Прогрессируют общая слабость, быстрая утомляемость, похудание. Объективно находят шум плеска в желудке натощак, менее выраженную, чем при компенсированном стенозе, видимую на глаз перистальтику. Из желудка натощак аспирируется 500–800 мл содержимого. Во время фиброгастроскопии желудок растянут, содержит большое количество мутной жидкости. Пилородуоденальный канал сужен до 0,5–0,3 см. Биопотенциалы желудка регистрируются в виде высоких неравномерных зубцов (гиперкинетические, тахиаритмические кривые). Рентгенологически желудок растянут, натощак содержит жидкость. Тонус нормальный или снижен. Перистальтика ослаблена. Эвакуация из желудка замедлена на 12–24 ч.
В стадии декомпенсации желудочное содержимое из–за резкого нарушения моторно–эвакуаторной функции желудка подвергается брожению и гниению. Чувство тяжести, полноты в подложечной области, отрыжка кислым, нередко со зловонным запахом, становятся постоянными. Ежедневно, часто, неоднократно возникает рвота разложившимися пищевыми массами. Нарастает общая слабость, появляются мучительная жажда, судороги. В ряде случаев развиваются запоры, что связано с недостаточным поступлением в кишечник пищи и воды. Нередко бывают поносы, обусловленные проникновением из желудка в кишечник продуктов гниения. Объективно находят значительный дефицит массы тела, сухость кожи, шум плеска натощак. Видимая на глаз перистальтика отсутствует. При фиброгастроскопии желудок больших размеров, слизистая ободочка атрофирована. Пилородуоденальный канал практически не определяется. Рентгенологически желудок значительно расширен, атоничен, натощак содержит большое количество жидкости. Контрастная масса скапливается в области нижнего отдела желудка в виде широкой чаши или полулуния с горизонтальным верхним уровнем. Над ним располагается слой жидкого содержимого желудка. Поступление бариевой взвеси в двенадцатиперстную кишку в момент исследования не наблюдается. Эвакуация контрастного вещества из желудка происходит более чем за 24 ч. Однако в первой фазе декомпенсированного стеноза в процессе рентгенологического исследования отмечается вялая, временами бурная перистальтика. Регистрируемые биопотенциалы желудка представляют собой волны очень низкой частоты и амплитуды. Во второй фазе перистальтика желудка практически не определяется. Биопотенциалы регистрируются в виде единичных волн.
Дифференциальная диагностика.
Пилоростеноз язвенной этиологии чаще всего дифференцируется со стенозом, обусловленным раком выходного отдела желудка и пилороспазмом.
У больных раком антрального отдела желудка наблюдаются анемия, выраженное похудание. Отсутствует язвенный анамнез. Часто пальпируется бугристая опухоль в подложечной области. При исследовании желудочного сока выявляется гипосекреция или анацидное состояние. Рентгенологически в выходном отделе желудка определяется дефект наполнения. Нет выраженной перистальтики. При фиброгастроскопии находят опухоль выходного отдела желудка, гистологическая структура которой подтверждается исследованием биопсийного материала.
Пилороспазм развивается при наличии эрозии, трещин, воспалительной инфильтрации слизистой оболочки пилорического отдела желудка и двенадцатиперстной кишки. Явления пилороспазма исчезают после проведения медикаментозного лечения: подкожного введения в течение 3–5 дней 1–2 мл 0,1% раствора атропина сульфата 2 раза в сутки; промывания желудка; выполнения двусторонней паранефральной новокаиновой блокады.
Лечение.
Пилородуоденальный стеноз является абсолютным показанием к операции. Однако перед операцией, в связи с имеющимися водно–электролитными нарушениями и расстройствами кислотно–щелочного равновесия (КЩР), в целях уменьшения отека и инфильтрации тканей в пилородуоденальной области, заживления язвы необходимо провести консервативное лечение. Оно включает двухтрехкратную зондовую аспирацию желудочного содержимого, противоязвенную терапию, парентеральное питание, купирование полемических нарушений. Последнее очень важно для больных с суб– и декомпенсированным стенозом. Больным вводятся растворы декстранов, белков, изотонический раствор натрия хлорида, 5–10% раствор глюкозы, растворы, содержащие ионы калия, натрия, хлора.
Эффективность консервативного лечения оценивается по показателям общего состояния больных, гемодинамики, КЩР, ОЦК, биохимического (мочевина, креатинин, белок, натрий, калий, хлор) и общего (гемоглобин, гематокрит, эритроциты) анализов крови. Длительность предоперационной подготовки при компенсированном стенозе составляет 5–7 дней. При субкомпенсированном и декомпенсированном стенозах ее продолжительность определяется по нормализации имеющихся нарушений обмена веществ.
При хирургическом лечении пилородуоденального стеноза применяют резекцию желудка и ваготомию в сочетании с дренированием желудка.
Показания для проведения резекции желудка: вторая фаза декомпенсированного стеноза; декомпенсированный пилородуоденальный стеноз при втором типе язвенной болезни по Джонсону, дуоденостаз. В стадии компенсации, субкомпенсации и в первой фазе декомпенсации выполняется селективная проксимальная ваготомия чаще в сочетании с гастродуоденоанастомозом, так как пилоропластика и дуоденопластика вследствие выраженных рубцовых или рубцово–язвенных изменений в пилородуоденальной области в большинстве случаев оказываются трудновыполнимыми. При крайне тяжелом состоянии больных с декомпенсированным стенозом в целях сокращения продолжительности операции выполняется стволовая ваготомия.
Пенетрация язвы
Пенетрация язвы – это проникновение язвы желудка или двенадцатиперстной кишки в прилежащие органы. Наблюдается в 10–15% случаев. Чаще диагностируется у мужчин в возрасте 40–50 лет с длительным язвенным анамнезом. Возникновение пенетрации связано с прогрессированием воспалительно–некротического процесса в хронической каллезной язве.Язвы желудка наиболее часто пенетрируют в малый сальник, поджелудочную железу, печень, поперечно–ободочную кишку и ее брыжейку. Реже пенетрация происходит в селезенку и диафрагму.
Язвы двенадцатиперстной кишки пенетрируют в головку поджелудочной железы, гепатодуоденальную связку, желчный пузырь.
Патоморфологические изменения, развивающиеся в брюшной полости при пенетрации, клиническая симптоматика зависят от стадии проникновения язвы в стенку желудка и двенадцатиперстной кишки или в прилежащие органы. Выделяют четыре стадии развития пенетрации язвы.
В первой стадии пенетрации в результате прогрессирования хронического воспалительно–некротического процесса на дне язвы происходит частичное разрушение стенки желудка и двенадцатиперстной кишки. Снаружи к области язвы рыхло припаиваются прилежащие органы.
Во второй стадии происходит глубокое разрушение всех слоев стенки несущего органа. Однако за его пределы язвенный процесс еще не выходит. Дефект в стенке пенетрируемого органа отсутствует. Между ним и несущим язву желудком или двенадцатиперстной кишкой образуются плотные сращения в виде воспалительного конгломерата. При их разрушении в стенке желудка или двенадцатиперстной кишки образуется сквозной дефект.
Третья стадия (поверхностной пенетрации) характеризуется полным разрушением всех слоев стенки желудка или двенадцатиперстной кишки. Язва распространяется на соседние органы или ткани с образованием в них небольшого поверхностного плоского дефекта.
При четвертой стадии в прилежащем органе или тканях образуются глубокие ниши. В месте пенетрации формируются значительных размеров воспалительные опухоли.
Клиническая картина.
Развитие пенетрирующей язвы сопровождается исчезновением суточного ритма, изменением интенсивности, иррадиации болей. Они становятся более постоянными, длительными, часто иррадиируют в спину, грудь, плечо или приобретают опоясывающий характер. Интенсивность болей не зависит от приема пищи. Светлые промежутки между болевыми приступами отсутствуют. Рвота редко приносит облегчение. Однако при голодании боль несколько уменьшается. Болевой синдром с трудом поддается консервативному лечению. Нередко отмечаются субфебрилитет, лейкоцитоз со сдвигом формулы крови влево, повышение СОЭ.
Течение пенетрирующей язвы осложняется профузным кровотечением из аррозивных сосудов прилежащих органов, перфорацией, нарушением функции органов с развитием острого панкреатита, острого холецистита. Нередко воспалительный инфильтрат сдавливает выходной отдел желудка или двенадцатиперстную кишку, что приводит к нарушению эвакуации пищи из желудка. Пенетрация язвы в полый орган сопровождается образованием патологической фистулы (сообщения) между желудком (двенадцатиперстной кишкой) и пенетрируемым органом. Чаще фистула формируется между желудком и поперечно–ободочной кишкой. У больных наблюдаются рвота с примесью кадовых масс, отрыжка с каловым запахом. После приема пищи быстро наступает дефекация. Прогрессирует похудание. Пенетрация язвы в ткани забрюшинного пространства приводит к развитию забрюшинной флегмоны. Формирующийся натечник нередко распространяется на правую поясничную и паховую области, на боковую поверхность груди.
Диагностика.
Обращают внимание на жалобы, данные анамнеза, результаты фиброгастроскопии (глубокая язва) или рентгенологического исследования желудка и двенадцатиперстной кишки (глубокая ниша, наличие ее двуслойности, быстрое попадание контраста в толстую кишку, заброс в желчные пути – признак сформировавшейся фистулы).
Лечение.
Радикальным методом лечения больных является хирургическое вмешательство. Резекция желудка выполняется при язвах I и II типов по Джонсону. При язвах III типа, а также у больных, страдающих язвенной болезнью двенадцатиперстной кишки, кроме резекции желудка, широко применяются органосохраняющие операции.
Малигнизация язвы
Малигнизация язвы – превращение язвы в рак. Встречается в 5–15% случаев. Раковому превращению подвержены исключительно язвы желудка, расположенные в пилороантральном и субкардиальном отделах на большой и малой кривизнах. Наиболее часто малигнизируют каллезные язвы диаметром более 2,5 см у лиц в возрасте 50–60 лет.Клиническая картина и диагностика.
При малигнизации язв меняется характер болей: уменьшается их интенсивность, теряется связь с приемом пищи. Нарастают общая слабость, утомляемость, снижается аппетит.
К рентгенологическим признакам малигнизации относятся неровность контуров язвы, широкий воспалительный вал с ригидностью стенки желудка и измененным рельефом слизистой оболочки в окружности язвы.
При микроскопии желудочного содержимого и промывных вод желудка находят атипичные клетки. При исследовании желудочного сока обнаруживают снижение кислотности. В крови определяются повышение СОЭ, анемия.
Диагноз подтверждается при выполнении фиброгастроскопии с гистологическим исследованием биопсийного материала из подозрительных участков язв.
Лечение.
Малигнизация язвы является абсолютным показанием к хирургическому лечению, так как представляет собой злокачественную опухоль.
При локализации процесса в нижней трети желудка выполняется субтотальная его резекция. У больных с поражением верхних отделов желудка производится гастрэктомия.
Болезни оперированного желудка
Резекция желудка и ваготомия приводят к изменению характера пищеварения. При значительной их выраженности развиваются патологические состояния – болезни оперированного желудка. Они подразделяются на патологические состояния, наблюдающиеся у больных, перенесших резекцию желудка (постгастрорезекционные синдромы, болезни резецированного желудка), и возникшие после органосберегающих операций (постваготомические синдромы, болезни ваготомированного желудка). Обе группы послеоперационных нарушений пищеварения классифицируются с учетом клинического течения, происхождения и сроков возникновения.Постгастрорезекционные синдромы
Болезни резецированного желудка отмечаются у 20–40% больных, перенесших резекцию желудка. В 1,5–2 раза чаще патологические синдромы диагностируются после резекций, сопровождающихся выключением двенадцатиперстной кишки из процесса пищеварения (по Бильрот–2, по Ру), а также у лиц, длительно страдавших язвенной болезнью, которая привела к значительным морфофункциональным изменениям в желудке, двенадцатиперстной кишке, прилежащих органах и тканях. С увеличением срока послеоперационного периода интенсивность клинических проявлений постгастрорезекционных синдромов нарастает. Это приводит к тому, что у 10–15% больных после резекции желудка определяется группа инвалидности.По характеру клинического течения постгастрорезекционные нарушения подразделяются на три основные группы: 1.Функциональные расстройства: ■ Демпинг–синдром (ранний и поздний). ■ Синдром приводящей петли (функционального происхождения). ■ Постгастрорезекционная астения. ■ Синдром малого желудка, ■ Дуоденогастральный, еюногастральный, гастроэзофагеальный рефлюкс. 2. Органические нарушения: ■ Пептическая язва желудочно–кишечного анастомоза. ■ Синдром приводящей петли (механического происхождения). ■ Анастомозит. ■ Рубцовые деформации и сужения анастомоза. ■ Желудочно–кишечный свищ, ■ Постгастрорезекционные сопутствующие заболевания (панкреатит, энтероколит, гепатит). ■ Рак культи желудка. 3. Сочетание функциональных расстройств и органических нарушений.
По происхождению различают постгастрорезекционные нарушения: 1. После резекции желудка по Бильрот–2 и ее модификаций. 2. После резекции желудка по Ру. 3. После резекции желудка по Бильрот–1.
По срокам возникновения выделяют: 1. Ранние синдромы: ■ синдром малого желудка; ■ анастомозит; ■ ранний демпинг–синдром и т.д. 2. Поздние синдромы: ■ постгастрорезекционная астения; ■ рубцовая деформация и сужение анастомоза; ■ рак культи желудка; ■ дуоденогастральный рефлюкс, желудочно–пищеводный рефлюкс, еюногастральный рефлюкс; ■ поздний демпинг–синдром; ■ постгастрорезекционные сопутствующие заболевания и т.д.
В основе каждого постгастрорезекционного синдрома лежат определенные патогенетические механизмы.
Прежде всего развитие патологических состояний после резекции желудка может быть объяснено тремя основными причинами: 1. Удалением кислотоферментопродуцирующего и гастринобразующего отделов желудка, что отрицательно сказывается на переваривании пищи и регуляции в первую очередь второй фазы пищеварения. 2. Нарушением резервуарной функции желудка, разрушением клапанного аппарата привратника. Это приводит к неполноценному перевариванию пищи, непорционному поступлению пищевого химуса в кишечник, развитию энтеродуоденогастрального рефлюкса. 3. При выполнении резекции желудка по Бильрот–2, по Ру двенадцатиперстная кишка, являющаяся важным органом гормональной регуляции, выключается из процесса пищеварения.
Наиболее часто в клинической практике встречаются демпинг–синдром (ранний и поздний), пептическая язва желудочно–кишечного анастомоза, синдром приводящей петли, еюнодуоденогастральный рефлюкс, синдром малого желудочка, постгастрорезекционная астения.
Демпинг–синдром
Ранний демпинг–синдром (демпинг–синдром, синдром сбрасывания). Встречается в 10–30% случаев.Патогенез.
Для объяснения механизма развития демпинг–синдрома разработаны механическая, нервно–рефлекторная, гуморальная, осмотическая, гипогликемическая, химическая, электролитная теории и теория функциональной недостаточности надпочечников. Общим их недостатком является односторонняя интерпретация развивающихся изменений в организме больных.
Патофизиология демпинг–синдрома связана с наличием нескольких факторов, реализующих свое влияние на фоне нарушения функционального состояния системы гипофиз – кора надпочечников и нервно–психических расстройств. Прежде всего разрушение клапанного аппарата привратника, формирование нового желудочно–кишечного соустья сопровождаются ускоренным опорожнением культи желудка от пищевых масс, стремительным их продвижением по тонкой кишке. Это приводит к быстрому ферментативному гидролизу пищеварительных веществ, повышению осмотического давления в просвете кишки. Вследствие выравнивания осмолярности во вне– и внутриклеточных пространствах внеклеточная жидкость перемещается в просвет кишки. Кишечная стенка растягивается. Одновременно выделяются вазоактивные амины: гистамин, серотонин, кинины, вазоактивный интестинальный полипептид и др. Происходит вазодилатация. Изменяется внутри– и внешнесекреторная функция поджелудочной железы. Наблюдается гипергликемия, сменяющаяся гипогликемией. В секрете поджелудочной железы снижается концентрация ферментов. Уменьшение ОЦК сопровождается тахикардией, общей слабостью, головокружением, обмороками, вначале падением, а затем повышением АД. Появляются ранние вазомоторные синдромы: тошнота, диарея. Пищевые массы подвергаются неполному перевариванию. Постепенно больные истощаются.
Клиническая картина.
У больных с демпинг–синдромом сразу же после еды (особенно после употребления сладких и молочных блюд) появляются резкая слабость, потливость, головокружение, приступы жара во всем теле, головная боль, сердцебиение, боль в области сердца, шум в ушах, ухудшение зрения, мышечная слабость. Отмечаются урчание, режущая боль в животе, часто завершающаяся профузным поносом. В зависимости от выраженности клинических синдромов выделяют три степени (формы) тяжести демпинг–синдрома: легкую, среднюю и тяжелую.
При легкой степени демпинг–синдром появляется вскоре после употребления только сладких и молочных блюд. Он продолжается 15–30 мин. Интенсивность клинических симптомов незначительная. Пульс учащается на 15 ударов в минуту. Масса тела остается нормальной, но иногда отмечается ее дефицит, не превышающий 5 кг. Трудоспособность больных не нарушается.
У больных с демпинг–синдромом средней тяжести выраженные клинические симптомы возникают после употребления любой пищи 2–4 раза в неделю. Они длятся 45–60 мин. В разгар приступа больные вынуждены ложиться. Пульс учащается на 20–25 ударов в минуту. АД имеет тенденцию к повышению в основном за счет систолического давления. Дефицит массы тела достигает 10 кг. Нарушается функция поджелудочной железы. У некоторых больных возникают нервно–психические расстройства. Трудоспособность снижается.
Демпинг–синдром тяжелой степени характеризуется появлением тяжелой реакции после употребления любой пищи. Продолжительность его составляет 1,5–3 ч. В течение этого промежутка времени больные вынуждены находиться в горизонтальном положении. В момент приступа пульс увеличивается более чем на 30 ударов в минуту. Повышается систолическое и снижается диастолическое давление. В ряде случаев отмечаются брадикардия, гипотония. Прогрессируют нервно–психические расстройства, прежде всего астенический синдром.
Для предупреждения приступов больные ограничивают количество пищи, что приводит к значительной белково–витаминной недостаточности, нарушению минерального обмена. Дефицит массы тела составляет более 10 кг. Трудоспособность утрачивается.
Диагностика.
Демпинг–синдром имеет достаточно характерные клинические проявления, которые подтверждаются провокацией его различными пищевыми нагрузками, данными рентгенологического и эндоскопического методов исследования.
Провокационный тест чаще всего проводится со 150 мл 50% раствора глюкозы, которую больной выпивает. Объективизация теста проводится по регистрации в течение последующего часа жалоб больных, динамики пульса, АД, записи на 30–й минуте ЭКГ. У больных с тяжелым демпинг–синдромом нормализация изучаемых показателей происходит спустя 1–1,5 ч после их возникновения.
Рентгенологическое исследование желудка и кишечника у лиц с подозрением на наличие демпинг–синдрома чаще проводится с водной взвесью бария сульфата. Однако более приближенные к реально существующим показатели нарушения моторно–эвакуаторной функции желудочнокишечного тракта получаются при использовании рентгеноконтрастной пищевой смеси.
К типичным рентгенологическим признакам демпинг–синдрома относятся: 1. быстрое опорожнение культи желудка от принятой бариевой взвеси; 2. значительное усиление перистальтики тонкого и толстого кишечника, сменяющееся инертностью; 3. провал первой ⅓ или ½ порции контрастной взвеси из желудка в тощую кишку в течение 1–2 мин с более длительной эвакуацией оставшейся части контраста; 4. неравномерность тонуса тонкого кишечника; 5. признаки энтерита, чаще в начальном или дистальном отделе тощей и подвздошной кишок.
Эндоскопическими признаками демпинг–синдрома являются широкое (более 2,5 см) гастроеюнальное или гастродуоденальное соустье, наличие в культе желудка повышенного количества тонкокишечного содержимого, дуоденогастральный или гастроеюнальный рефлюкс в момент выполнения фиброгастроскопии.
Лечение.
При демпинг–синдроме оно комплексное, дифференцированное с учетом тяжести демпинг–реакции. Значительное улучшение состояния больных с тяжелой или средней степенью синдрома, практически полное купирование приступов при легкой форме достигаются при консервативном лечении.
Оно включает: 1. диетотерапию; 2. проведение заместительного лечения; 3. снижение моторно–эвакуаторной функции желудочно–кишечного тракта; 4. уменьшение вегетативных реакций на поступление пищи; 5. общеукрепляющую 6. психоневрологическую терапию.
Пища должна состоять в основном из высококалорийных белковых и жировых продуктов, содержать небольшое количество углеводов. Пища принимается в прохладном виде, небольшими порциями, до 6 раз в день, в положении лежа, раздельно жидкая и плотная. При демпинг–синдроме используется и сухоедение. Заместительная терапия включает препараты, улучшающие переваривание и всасывание пищи.
Для снижения моторно–эвакуаторной функции желудочно–кишечного тракта перед употреблением пищи перорально назначаются холиноблокаторы (атропина сульфат), ганглиоблокаторы (гексоний, пипольфен и т.д.). Уменьшению интенсивности реакции после приема пищи способствуют антигистаминные вещества (димедрол, супрастин), антагонисты серотонина (резерпин), инсулин (вводимый подкожно).
Общеукрепляющее лечение включает массивную и длительную витаминотерапию (витамины группы В, С и др.); введение препаратов железа и других микроэлементов; переливание крови, плазмы, белковых гидролизатов, протеина, альбумина.
Для уменьшения болевого синдрома применяются двусторонняя паранефральная навокаиновая блокада (повторно 4–5 раз с интервалом в 3–5 дней), блокада левого чревного нерва.
Показания к хирургическому лечению возникают в случае отсутствия эффекта от консервативного лечения, что чаще всего наблюдается: 1. при тяжелой степени демпинг–реакции; 2. при сочетании демпинг–синдрома средней тяжести с синдромом приводящей петли, прогрессирующим истощением и болевой формой хронического панкреатита.
 Рис. 10. Реконструктивная гастроеюнодуоденопластика по Захарову–Хенли.
Рис. 10. Реконструктивная гастроеюнодуоденопластика по Захарову–Хенли.
Для хирургической коррекции демпинг–синдрома разработано несколько типов операций. 1. Реконструкция гастроеюнального анастомоза с включением в процесс пищеварения двенадцатиперстной кишки (редуоденизация двенадцатиперстной кишки посредством тонко– или толстокишечной вставки). Из этой группы операций наибольшее распространение получила гастроеюнодуоденопластика по Захарову–Хенли (рис. 10). Сущность операции заключается в трансплантации между культей желудка и двенадцатиперстной кишкой отводящей петли тонкого кишечника. В послеоперационном периоде вследствие замедления опорожнения желудка и восстановления порционной эвакуации желудочного содержимого в двенадцатиперстную кишку нормализуются продвижение пищи по кишечнику и ее переваривание. Меньшее распространение получили реконструкции желудочно–еюнального или желудочно–дуоденального анастомоза с применением антиперистальтическях кишечных сегментов. 2. Реконструкция желудочно–кишечных анастомозов типа Бильрот–II в анастомоз типа Бильрот–I. Операция не всегда технически осуществима. 3. Ваготомия, преимущественно стволовая, приводит к снижению двигательной активности желудка и кишечника. Применяется в сочетании с реконструктивными вариантами операции, так как восстановление пассажа пищи по двенадцатиперстной кишке сопровождается повышением кислотоферментообразующей функции желудка с последующим образованием пептической язвы. 4. Денервация начальных отделов петель тонкой кишки. Исчезновение или ослабление демпинг–реакции после хирургического лечения отмечается у 80–95% больных.
Поздний демпинг–синдром (гипогликемический синдром).
Развивается у 10–15% больных, перенесших резекцию желудка. В основном характеризуется легкой и средней степенями тяжести.Патогенез.
Развитие позднего демпинг–синдрома связывается с нарушением углеводного обмена: первоначально высокий уровень сахара в крови при ранней демпинг–реакции вызывает раздражение ядер блуждающих нервов в промежуточном мозге. В последующем происходит компенсаторное поступление в кровь инсулина, избыточное содержание которого и приводит к гипогликемии.
Клиническая картина.
Гипогликемический синдром проявляется через 1,5–3 ч после употребления пищи. У больных возникают слабость, головокружение, головная боль, иногда потеря сознания, чувство голода, ноющие боли в подложечной области. В момент приступа развивается брадикардия, снижается АД, кожные покровы бледнеют, покрываются холодным потом.
В зависимости от выраженности клинических симптомов выделяют три степени тяжести гипогликемического синдрома: легкую, среднюю и тяжелую,
В ряде случаев ранний и поздний демпинг–синдромы сочетаются.
Диагностика.
Диагностика позднего демпинг–синдрома основывается на анализе клинических симптомов, которые в отличие от ранней демпинг–реакции значительно уменьшаются или исчезают после употребления пищи, особенно сладкой. В момент приступа отмечается низкий уровень сахара в крови (меньше 4,12–2,75 мкмоль/л).
Лечение.
Больные с демпинг–синдромом подлежат консервативному лечению. Если оно неэффективно, что чаще наблюдается у больных с тяжелой формой демпинг–синдрома, выполняется один из вариантов редуоденизации, т.е. включение двенадцатиперстной кишки в процесс пищеварения.
Пептическая язва гастроэнтероанастомоза
Пептическая язва гастроэнтероанастомоза после резекции желудка возникает у 1–8% больных.Существует несколько причин ее появления. 1. Экономное удаление кислотоферментопродуцирующей зоны желудка, что приводит к сохранению или повышению в послеоперационном периоде агрессивных свойств желудочного сока. 2. Оставление над двенадцатиперстной кишкой участка антрального отдела, продуцирующего гастрин. 3. Сужение желудочно–кишечного анастомоза, что приводит к возрастанию кислотоферментопродукции во второй фазе пищеварения и тем самым способствует изъязвлению слизистой оболочки. 4. Наличие синдрома Золлингера–Эллисона. При этом синдроме возникновение пептической язвы связано с повышением кислотопродукции под влиянием гипергастринемии. Последняя в свою очередь обусловлена или гиперплазией G–клеток антрального отдела желудка (I тип синдрома) или развитием из D–клеток островкового аппарата поджелудочной железы опухоли – гастриномы (II тип синдрома). Опухоль может быть доброкачественной (30%) или злокачественной, одиночной или множественной. В 10% случаев отмечается гиперплазия клеток островкового аппарата. Иногда гастринома локализуется вне поджелудочной железы, чаще в стенке двенадцатиперстной кишки ¼ больных синдром Золлингера–Эллисона сочетается с аденоматозом других эндокринных органов, в том числе паращитовидных желез. 5. Первичный гиперпаратиреоидизм (аденома паращитовидных желез). В 90% случаев опухоль множественная. Генез язвообразования связан с продукцией опухолью паратгормона, мобилизирующего фосфор и кальций из костей скелета, тормозящего резорбцию фосфора в почечных канальцах. Гиперкальциемия приводит к непосредственной стимуляции париетальных клеток и увеличению высвобождения гастрина из G–клеток.
Клиническая картина.
Характеризуется выраженными болями в эпигастральной области, усиливающимися после еды и ночью, иррадиирующими в левую половину грудной клетки, межлопаточную область. Болевой синдром более выражен, чем до операции. Пациентов беспокоят отрыжка, изжога, тошнота, дисфункция кишечника: запоры, понос. Диарея, сопровождающаяся потерей значительного количества пищи, воды, приводит к обезвоживанию организма, потере электролитов, прежде всего калия. При гипокялиемии отмечаются мышечная слабость, парез кишечника, нефропатия, гипокалиемический алкалоз. Если пептическая язва обусловлена гиперпаратиреозом, отмечаются боли в костях, кариес, повышение АД, нефролитиаз.
Диагностика.
Проводится на основании фиброгастродуоденоеюноскопии, рентгенологического исследования, УЗИ поджелудочной железы, паращитовидных желез, анализа желудочного сока, определения в плазме крови концентрации гастрина, паратгормона, кальция, фосфора, рентгенограмм фаланг, костей черепа и позвоночника.
У больных с синдромом Золлингера–Эллисона находят выраженную гиперацидность желудочного сока. Базальная кислотопродукция превышает 15 ммоль/ч, что составляет 60% максимально стимулированной гистамином. Объем 12–часовой секреции превышает 500 мл. Уровень гастрина плазмы больше 500 пг/мл (в норме 50–200 пг гастрина в 1 мл плазмы). Наличие синдрома подтверждается проведением специальных тестов, стимулирующих выделение гастрина (с белком, кальцием, секретином). При УЗИ поджелудочной железы в зоне локализации опухоли, чаще в теле и хвосте, отмечается повышение эхогенности тканей.
Для первичного гиперпаратиреоза характерно повышение содержания в плазме крови кальция, хлоридов, паратгормона, снижение концентрации неорганического фосфора. В моче, наоборот, концентрация фосфора возрастает. Рентгенологически диагностируется остеопороз (декальцинация) фаланг, позвонков, костей черепа, а в почках – конкременты.
Течение постгастрорезекционных язв неблагоприятное, осложняется желудочно–кишечным кровотечением, прободением, пенетрацией.
Лечение.
Комплексное консервативное лечение, особенно при ульцерогенных эндокринных заболеваниях, малоэффективно и часто используется в качестве предоперационной подготовки. При хирургическом лечении пептических язв в том случае, если причинами ульцерогенеза являются экономная резекция желудка с оставлением антрального отдела, сужение анастомоза, показана ререзекция желудка в одном из ее вариантов со стволовой ваготомией.
При первичном гиперпаратиреозе удаляются паращитовидные железы, а затем проводится консервативное лечение язвы.
У больных с I типом синдрома Золлингера–Эллисона выполняется резекция желудка, со II – гастрэктомия.
Синдром приводящей петли
Синдром приводящей петли (синдром слепой кишки, синдром желчной регургитации) – это один из видов постгастрорезекционных расстройств, развивающихся после формирования гастроеюнального анастомоза. Он сопровождается нарушением эвакуации кишечного содержимого из приводящей петли и встречается в 0,8–14% случаев.Этиология.
В основе развития синдрома лежит задержка опорожнения приводящей петли, представляющей собой часть двенадцатиперстной кишки и сегмента тощей кишки между связкой Трейтца и гастроэнтероанастомозом. Факторы, приводящие к развитию синдрома, подразделяются на органические и функциональные.
Первые из них более многочисленны: 1. Ущемление приводящей петли позади гастроэнтероанастомоза или межкишечного соустья; в щелях брыжейки тонкого и толстого кишечника. 2. аворот и ротация длинной приводящей петли. 3. нвагинация приводящей петли в межкишечное соустье, в гастроэнтероанастомоз, в отводящую петлю. 4. ыпадение слизистой оболочки приводящей петли в желудочно–кишечный анастомоз. 5. давление приводящей петли периорганными сращениями. 6. Перегиб петли из–за острого угла между коротким приводящим коленом и линией гастроэнтероанастомоза. 7. Сужение приводящей петли при рубцовой послеоперационной пептической язве. 8. Артериомезентериальная компрессия приводящей петли в дистальном отделе двенадцатиперстной кишки. 9. Сдавление приводящей петли опухолевым процессом. 10. Технические погрешности формирования желудочно–кишечного соустья: образование внутреннего клапана вследствие избытка стенки желудка у малой кривизны; захват в линию швов большего объема кишечной стенки.
Патогенез.
Функциональные факторы синдрома приводящей петли обусловливают снижение тонической и двигательной активности двенадцатиперстной кишки (дуоденостаз). Дуоденостаз может существовать и до операции в виде первичной или вторичной формы, а также возникнуть после операции. Причинами послеоперационного дуоденостаза являются повреждение ветвей блуждающих нервов, травма стенки кишки.
Замедление опорожнения приводящей петли приводит к скоплению в ней большого количества желчи, секрета панкреатических и дуоденальных желез, пищи (в норме за сутки из приводящей петли в кишечник через культю желудка эвакуируется более 1,5 л пищеварительных соков). Вследствие повышения внутрикишечного давления уменьшается поступление в двенадцатиперстную кишку, а затем и в тонкий кишечник желчи, панкреатического сока. Нарушаются пищеварение и всасывание витамина ВЛ, что у некоторых пациентов сопровождается появлением железодефицитной анемии. Развивающаяся в приводящей петле бактериальная флора проникает в печеночные ходы, желчный пузырь и поджелудочную железу. Отмечаются цирротические изменения в печени, дискинезия желчных ходов, воспалительные изменения в желчном пузыре, поджелудочной железе, фатеровом сосочке (стенозирующий папиллит), дискинезия сфинктера Одди. Заброс дуоденалького содержимого в культю желудка приводит к появлению тяжелых форм гастрита, анастомозита (в том числе эрозивно–язвенных поражений слизистой), кровотечениям. Из–за частых рвот нарушается функция нижнего пищеводного сфинктера. Дуоденальное содержимое начинает поступать в пищевод, что ведет к рефлюкс–эзофагиту.
При остром развитии синдрома приводящей петли (перегиб, инвагинация) происходит нарушение кровообращения ее стенки с развитием гангрены кишки и перитонита.
Клиническая картина.
Выделяют острую и хроническую формы синдрома приводящей петли.
Острая форма синдрома сопровождается появлением интенсивных болей в правом подреберье, эпигастрии, тошнотой, рвотой без желчи. Общее состояние больных прогрессивно ухудшается, появляются тахикардия, лейкоцитоз, повышается СОЭ. В случае некроза кишки развивается перитонит.
В клинической картине хронического синдрома приводящей петли превалируют чувство тяжести, распирающая боль в правом подреберье и эпигастрии, отрыжка, рвота желчью. При забросе пиши в приводящую петлю в рвотных массах определяется частично переваренная пища.
Выделяют три степени тяжести синдрома приводящей петли: легкую, среднюю и тяжелую. При легкой степени тяжести синдрома боль непостоянна. Она возникает после обильного употребления жирной и углеводистой пищи. Наблюдается отрыжка или срыгивание желчью в объеме от 50 до 100 мл. Дефицит массы тела отсутствует или незначительный. У лиц со средней степенью тяжести синдрома боль становится более выраженной, носит распирающий, жгучий характер, появляется через 10–15 мин после еды. На высоте болей возникает рвота в объеме от 300 до 400 мл. Рвота бывает 3–4 раза в неделю. Дефицит массы тела составляет 10 кг. Трудоспособность снижается. Тяжелая форма синдрома сопровождается резкими болями, иррддиирующими за грудину, в область сердца. Боли усиливаются при присоединении перитонита, холецистита, эзофагита. Рвота появляется ежедневно, нередко после каждого употребления пищи, в объеме до 1–3 л. Больных беспокоят изжога, жажда, прогрессирующее похудание, анемия. Трудоспособность утрачивается.
Диагностика.
Объективно у больных, особенно со средней и тяжелой степенями синдрома, находят иктеричность склер, желтушноеть кожи. Живот асимметричен за счет выбухания в правом подреберье и эпигастрии. Здесь же пальпируется эластичное образование – переполненная приводящая петля, которая опорожняется после рвоты. Иногда пальпаторно определяют увеличение печени и желчного пузыря.
При рентгенологическом исследовании выявляют сочетание органических и функциональных изменений в приводящей, а нередко и в отводящей петлях. На обзорной рентгенограмме брюшной полости в проекции приводящей петли нередко виден горизонтальный уровень жидкости. Контрастное вещество забрасывается в приводящую петлю и длительно там задерживается. Наблюдается дискинезия кишки. Приводящая петля расширена до 6–7 см, нижний ее сегмент провисает. У некоторых больных отмечаются сужение приводящей петли, рубцовые и язвенные изменения в зоне анастомоза и в отводящей петле. Вместе с тем при повышении давления в приводящей петле, ее перегибе в области желудочно–кишечного соустья контрастная взвесь может не поступать в приводящую петлю.
Лечение.
Консервативное лечение включает ограничение жирных блюд, частый прием небольших порций пищи, фракционную зондовую декомпрессию желудка, назначение антацидов, спазмолитиков, средств, усиливающих двигательную активность желудка. Однако такое лечение малоэффективно.
Для хирургической коррекции синдрома применяются: 1. реконструкция гастроеюностомии по Бильрот–II в У–образный гастроеюнальный анастомоз; 2. реконструкция гастроеюноанастомоза в гастродуоденальный анастомоз; 3. формирование анастомоза между провисающей частью двенадцатиперстной кишки и отводящей петлей тонкого кишечника "бок в бок"; 4. при сочетании синдрома приводящей петли с демпинг–синдромом выполняют реконструктивную гастроеюнодуоденопластику по Захарову–Хенли со стволовой ваготомией.
Профилактика синдрома приводящей петли достигается диагностированием у больных, подлежащих резекции желудка, дуоденостаза; использованием при формировании гастроеюнального соустья петли тощей кишки длиной 8–10 см от трейтцевой связки; подшиванием приводящей петли к малой кривизне в целях создания клапана; надежной фиксацией культи желудка в окне брыжейки поперечной ободочной кишки.
Дуоденоеюногастральный и гастроэзофагеальный рефлюкс
Дуоденоеюногастральный рефлюкс возникает при формировании желудочно–кишечного соустья, лишенного клапанного аппарата. Гастроэзофагеальный рефлюкс является следствием послеоперационного нарушения функции нижнего пищеводного сфинктера. Указанные осложнения диагностируются у 40–80% больных, перенесших резекцию желудка.Патогенез.
Длительное воздействие кишечного содержимого на слизистую оболочку желудка приводит к возникновению щелочного рефлюкс–гастрита, а на слизистую пищевода – рефлюкс–эзофагита, что наблюдается в 15–35% случаев. Механизм патоморфологических изменений, появляющихся в слизистой оболочке желудка под влиянием дуоденогастрального рефлюкса, изложен при рассмотрении патогенеза язвенной болезни. Достаточно часто течение щелочного гастрита и эзофагита осложняется эрозивными изменениями слизистой оболочки, с развитием желудочно–кишечного и пищеводных кровотечений, энтеролизацией слизистой желудка, т.е. появлением в ней очагов кишечного эпителия. Исходом длительного течения щелочного рефлюкс–гастрита может явиться рак культи желудка.
Клиническая картина.
Отмечаются ноющие боли в подложечной области, горечь во рту, рвота с примесью желчи, снижение аппетита, похудание, иногда анемия. В случае присоединения рефлюкс–эзофагита больных беспокоят изжога, чувство жжения за грудиной.
Диагностика.
В желудочном соке при дуоденоеюногастралъном рефлюксе и щелочном рефлюкс–гастрите обнаруживают гипоили анацидное состояние кислотопродукщти, повышенное содержание компонентов дуоденального содержимого (билирубина, желчных кислот и т.д.). При эндоскопическом исследовании в желудке содержится желчь, отмечаются отек, гиперемия, эрозивные изменения слизистой оболочки пищевода и желудка. Гистологическое исследование биопсийного материала в слизистой желудка подтверждает атрофию желез, появление кишечной метаплазии.
Диагностика нетрудна. Симптоматика данного осложнения резекции (гастрэктомии) достаточно характерна.
Лечение.
Показано комплексное консервативное лечение. Производится сбалансированное энтеральное питание. Корригируются белковые, водно–электролитные нарушения, а также нарушения жирового и витаминного обмена. Для улучшения синтеза белка назначаются анаболические гормоны (ретаболил, нерабол, анабол и др.), проводится заместительная терапия (соляная кислота, плантаглюцид, панкреатин, фестал и др.).
Если консервативное лечение неэффективно, что чаще отмечается у больных с тяжелой степенью пострезекционной астении, показано хирургическое лечение. Оно состоит во включении двенадцатиперстной кишки в процесс пищеварения, увеличении емкости полости культи желудка, снижении скорости ее опорожнения.
Постваготомические синдромы
Применение органосберегающих операций по сравнению с резекцией желудка позволило значительно улучшить результаты хирургического лечения гастродуоденальных язв: снизить частоту интра– и послеоперационных осложнений (до 2–7%), уменьшить послеоперационную летальность (до 0–3%), сократить длительность временной нетрудоспособности пациентов (до 30–80 дней) и выход на инвалидность (в 6–8 раз).Вместе с тем и после ваготомии возможно развитие патологических состояний, объединенных термином "болезни ваготомированного желудка".
Болезни ваготомированного желудка (постваготомИ' ческие синдромы, постваготомические болезни) – это различные патологические состояния, наблюдающиеся у пациентов, перенесших ваготомию в изолированном виде или в сочетании с дренирующими желудок операциями.
По сравнению с болезнями резецированного желудка постваготомические синдромы развиваются в 2–3 раза реже. В основном они характеризуются легкой степенью тяжести. С увеличением сроков послеоперационного наблюдения их клиническое проявление сглаживается. Так же как и постгастрорезекционные синдромы, болезни ваготомированного желудка чаще развиваются у женщин, у лиц, длительно страдавших гастродуоденальной язвой, при наличии значительных морфофункциональных изменений в желудке, двенадцатиперстной кишке и смежных органах. Несомненную роль в возникновении постваготомических синдромов играют вариант органосберегающей операции и способ дренирования желудка. Сохранение иннервации пилородуоденальной зоны при селективной проксимальной ваготомии, преимущественное выполнение изолированной СП В или пилородуоденопластики снижают риск развития болезней ваготомированного желудка в 1,5–2 раза. Частота возникновения, клинические проявления постваготомических синдромов разнообразны.
Выделяют органические и функциональные синдромы; синдромы с элементами органических и функциональных нарушений; сочетание нескольких синдромов.
Органические синдромы: 1. рецидивная язва двенадцатиперстной кишки; 2. незажившая язва двенадцатиперстной кишки; 3. пептическая язва анастомоза (гастродуодено– и гастроэнтероанастомоза); 4. пептическая язва пилородуоденопластики; 5. рецидивная язва анастомоза или пилородуоденопластики; 6. вторичная язва желудка; 7. рецидивная постваготомическая язва желудка; 8. рубцевание анастомоза и пилородуоденопластики; 9. пилородуоденальный стеноз после изолированной СПВ; 10. рубцовая деформация желудка и двенадцатиперстной кишки; 11. порочный круг; 12. постфундопликационные синдромы; 13. хронический панкреатит; 14. рак желудка.
Функциональные синдромы: 1. демпинг–синдром; 2. диарея.
Синдромы с элементами органических и функциональных нарушений: 1. гастростаз; 2. дисфагия; 3. рефлюксгастрит; 4. рефлюкс–эзофагит; 5. дуоденостаз; 6. синдромы недостаточности пищеварения и всасывания; 7. камнеобразование в желчном пузыре; 8. головные боли; 9. потеря чувства голода и насыщения; 10. импотенция.
Сочетание нескольких синдромов: 1. рецидив язвы и дисфагия; 2. хронический панкреатит и рефлюкс–эзофагит ИТ. д.
Причинами развития болезней ваготомированного желудка являются тактические и технические ошибки: дооперационные, интра– и послеоперационные.
К дооперационным ошибкам относятся: 1. ошибки при установлении показаний к операции (выполнение ваготомий при значительных анатомо–физиологических изменениях в малом сальнике и в пилородуоденальной зоне; синдроме Золлингера–Эллисона); 2. ошибки при определении сроков выполнения органосберегающих операций (парасимпатическая денервация желудка при больших размерах язвы, при выраженном воспалительном процессе в окружающей язву зоне).
Интраоперационными являются: 1. ошибки техники парасимпатической денервации желудка и выполнения дренирующих желудок операций (ранение смежных органов, повреждение сосудов брюшной полости); 2. недооценка вариантов ветвления блуждающих нервов.
Развитие постваготомических синдромов в раннем послеоперационном периоде связано: 1. с ошибками техники операции (кровотечением в брюшную полость, перитонитом, отеком пищевода или сдавлением его гематомой, некрозом стенки желудка и пищевода, кровотечением из эрозированного сосуда в дне пенетрирующей язвы двенадцатиперстной кишки и т.д.); 2. с неадекватным ведением послеоперационного периода (неэффективная декомпрессия желудка и стимуляция моторики кишечника).
В ближайшие сроки после операции болезни ваготомированного желудка, как правило, обусловлены гипомоторикой желудка или двенадцатиперстной кишки (гастро– и дуоденостаз), гипермоторикой тонкой кишки (демпинг–синдромом), дискоординацией двигательной активности желудка и кишечника (диарея, дуоденогастральный рефлюкс).
В отдаленном периоде постваготомические синдромы вызываются в основном неадекватной или неполной ваготомией или их сочетаниями, дуоденогастральный рефлюксом, недостаточным дренированием желудка и т.д.
Рецидивные, незажившие и пептические постваготомические язвы. Вторичное язвообразование в желудке
Рецидивной постваготомической называется язва, которая после органосохраняющей операции зарубцевалась, а через некоторое время вновь открылась. Ряд авторов рецидивной считают язву, возникшую более чем через 6 мес. после операции, при отсутствии в течение этого периода клинических проявлений рецидива, подтвержденных эндоскопически. Частота постваготомического рецидива язв разнообразна и колеблется от 1 до 33%.Существует зависимость возврата заболевания от вида ваготомии, пола и возраста пациентов, сроков послеоперационного наблюдения, длительности язвенного анамнеза, исходного уровня кисл ото продуцирующей функции желудка. После СтВ рецидив язв составляет 4–9%, а после СПВ – 5–15%. Наиболее низкая частота рецидива отмечена после ваготомии с антрумэктомией. Вероятность повторного язвообразования зависит от техники выполнения ваготомии, особенно СПВ. При тщательной парасимпатической денервации желудка во время выполнения последней рецидив язв не превышает 10%. Наибольшая частота возврата болезни отмечена у женщин, лиц молодого возраста, при продолжительном язвенном анамнезе. В большинстве случаев рецидив наступает у лиц с высокими дооперационными показателями максимальной продукции соляной кислоты (более 25 ммоль/ч) и ночной желудочной секреции (60–70 ммоль и выше). У таких больных в раннем послеоперационном периоде и в течение первых 3 мес. после ваготомии отмечается положительный инсулиновый тест Холландера. Однако возврат заболевания иногда возникает и на фоне гипосекреции, сопровождающейся атрофическим гастритом.
Среди множества причин постваготомического рецидива язв выделяют: 1. неправильный выбор способа операции; 2. неполную ваготомию; 3. неадекватное дренирование желудка; 4. расстройство моторной функции двенадцатиперстной кишки в виде нарушения дуоденальной проходимости, дуоденогастральный рефлюкс и рефлюкс–гастрит; 5. регенерацию ветвей блуждающих нервов; 6. гиперплазию гастриновых G–клеток; 7. гиперпаратиреоз; 8. синдром Золлингера–Эллисона; 9. прием лекарственных препаратов (салицилаты, гормональные средства); 10. злоупотребление алкоголем, курением; 11. нарушение режима питания и труда. В ряде случаев причину повторного язвообразования установить невозможно, несмотря на адекватное снижение кислотности и отсутствие нарушений моторно–эвакуаторной функции желудка.
Незажившие постваготомические пилородуоденальные язвы наблюдаются у 0,9–6% пациентов, а пептические – у 0,8–3,8%. В основе их сохранения и возникновения, как при рецидивных язвах, лежат повышение кислотообразования в желудке вследствие неполной ваготомии, а также гиперпродукция гастринпродуцирующих клеток. В большинстве случаев пептические язвы образуются в первые 12 мес. после операции и обусловлены ульцерогенными эндокринными заболеваниями (синдром Золлингера–Эллисона, гиперпаратиреоз).
Вторичные язвы в желудке после ваготомии диагностируются в 0,2–10% случаев и чаще после изолированной СПВ. Существует несколько точек зрения на причины их возникновения. Прежде всего вторичное язвообразование связывается с гастростазом вследствие атонии желудка или стенозирования его выходного отдела. В этих случаях застой в желудке, пролонгируя вторую фазу пищеварения, способствует гиперсекреции гастрина, что повышает продукцию соляной кислоты ипротеолитических ферментов. Длительное воздействие кислотно–пептического фактора на слизистую оболочку приводит к эрозивно–язвенным изменениям стенки желудка. Развитию постваготомических медиогастральных язв способствует и возникновение рефлюкс–гастрита при нарушении функции клапанного аппарата привратника. Кроме того, вторичное язвообразование в желудке после СПВ связывается с ишемией его стенок в результате чрезмерного перераспределения интенсивности кровотока из желудка в двенадцатиперстную кишку.
Клиническая картина.
Симптоматика незаживших пептических и вторичных постваготомических язв обычная. Вместе с тем рецидив язвенной болезни может протекать в четырех вариантах: в виде типичной язвенной болезни, язвенной болезни, сочетающейся с рефлюкс–гастритом, стертой и бессимптомной. Типичное течение рецидива особых проявлений не имеет. При сопутствующем язвенной болезни рефлюкс–гастрите отмечается горечь во рту, периодически возникает рвота желчью. Стертая клиническая картина язвы характеризуется наличием в верхней половине живота болевого синдрома, не имеющего четкой связи с приемом пищи. В случаях бессимптомного характера заболевания язва диагностируется специальными методами исследования или первыми признаками ее существования являются острые осложнения (кровотечение, прободение).
Диагностика.
У лиц, перенесших ваготомию, она осуществляется комплексно с применением эндоскопических, рентгенологических и ультразвуковых методов исследования.
Лечение.
Все больные с рецидивными, незажившими и пептическими язвами первоначально подлежат комплексному консервативному лечению с применением препаратов группы Н2–рецепторов гистамина (циметидина, ранитидина и т.д.). Это позволяет в большинстве случаев достичь положительного результата. Если такое лечение неэффективно, показано оперативное вмешательство. Основными видами повторных операций при возврате заболевания являются резекция желудка со стволовой ваготомией и реваготомия. Однако последняя редко выполняется из–за технических сложностей поиска нервных волокон и отсутствия данных, подтверждающих возникновение рецидива вследствие неполной ваготомии. После изолированной СПВ нет особых трудностей для выполнения резекции желудка в качестве повторного вмешательства.
В том случае, если ранее СПВ сочеталась с пилоропластикой по Финнею, гастродуоденоанастамозом, то образовавшийся дефект стенки двенадцатиперстной кишки во время резекции желудка: 1. ушивается двумя рядами швов 2. закрывается серозно–мышечным лоскутом на питающей ножке, сформированной из стенки желудка 3. используется для формирования анастомоза с культей желудка.
Лечение больных с вторичными язвами желудка проводится дифференцированно. При язвах небольших размеров с коротким сроком существования, отсутствием признаков малигнизации показана консервативная терапия. Если она не дает эффекта, а также у пациентов с большими каллезными язвами наиболее радикальным методом лечения является резекция желудка.
Демпинг–синдром
Органосохраняющие операции могут приводить к развитию раннего и позднего демпинг–синдрома, занимающего второе место среди патологических состояний улиц, перенесших ваготомию. После изолированной СПВ он встречается в 0–6% случаев, а после ваготомии в сочетании с дренированием желудка – в 9–42%.Патогенез.
После органосохраняющих операций объясняется постваготомическими нарушениями секреции пищеварительных ферментов и гормонов, ускоренной желудочной эвакуацией вследствие разрушения клапанного аппарата привратника, перегрузкой кишечника и ускоренным пассажем пищевого химуса по нему, расстройством механизма кислотного пилородуоденального тормоза и нейрогуморальной регуляцией пилородуоденального перехода на фоне снижения желудочной секреции, нарушением функций поджелудочной железы.
Клиническая картина, диагностика и консервативное лечение.
Идентичны таковым при постгастрорезекционном демпинг–синдроме.
Хирургическое лечение применяется в исключительных случаях тяжелого постваготомического демпинг–синдрома, сопровождающегося истощением пациентов и нарушением трудоспособности. Характер повторной операции зависит от технических особенностей предшествующего вмешательства. Наиболее часто применяются резекция желудка по Ру и транспозиция сегмента тонкой кишки в антиперистальтическом направлении. При демпинг–синдроме, развившемся после СПВ с гастродуоденоанастомозом, в случае хорошей проходимости привратника производится снятие анастомоза с ушиванием стенки кишки и желудка (дегастродуоденостомия). У больных с демпинг–синдромом после СПВ, дополненной пилоропластикой по Гейнеке–Микуличу, выполняется резекция ⅔ желудка с пластическим восстановлением пилорического жома.
Профилактика постваготомического демпинг–синдрома заключается в определении предоперационной предрасположенности больного к демпинг–синдрому. С этой целью наиболее часто используется проба с зондовым интраеюнальным введением 150 мл 50% раствора глюкозы. У больных со стенозом зонд проводится в начальный отдел кишечника через манипуляционный канал фиброгастроскопа. При наличии предрасположенности к демпинг–синдрому показано выполнение ваготомии, преимущественно СПВ, в ранние сроки заболевания. Это исключает необходимость дополнения ее дренирующей желудок операцией. При дренировании желудка предпочтение должно отдаваться п илороду оденоп ластике.
Диарея
Диарея относится к специфическим осложнениям органосберегающих операций. Чаще она развивается после стволовой ваготомии и реже (2–10%) после СПВ.Патогенез.
Связывается с усилением в послеоперационном периоде моторики кишечника, значительным угнетением секреции соляной кислоты, протеолитических ферментов поджелудочной железы и гастроинтестинальных гормонов, кишечным дисбактериозом.
Клиническая картина и диагностика.
Различают три степени тяжести диареи. При легкой степени жидкий стул наблюдается редко – от 1 раза в месяц до двух раз в неделю. Больные не испытывают особых неудобств, трудоспособны. Средняя степень диареи характеризуется поносами до 5–6 раз в сутки. При тяжелой степени диареи поносы бывают до 10 и более раз в сутки. Средняя и тяжелая степени диареи сопровождаются нарушением трудоспособности больных.
Лечение.
При легких формах диареи специального лечения обычно не требуется, так как со временем они подвергаются обратному развитию и легко корригируются диетой. При средней и тяжелой степенях назначают препараты, нормализующие моторику желудочно–кишечного тракта (бензогексоний, церукал, ганглерон, реглан), снижающие адсорбцию желчных солей в кишечнике (холестирамин), антихолинергические средства (атропин, скополамин, препараты красавки), ферментные препараты (фестал, панзинорм). Выраженное антидиарейное действие оказывают дифеноксикислоты (реасек) и опиоиды (имодиум). Эти препараты назначают по 2–3 таблетки в сутки в течение 3–10 дней до достижения эффекта, В случае дисбактериоза проводят его коррекцию. При отсутствии эффекта от консервативного лечения выполняется оперативное вмешательство: антиперистальтическая реверсия сегмента тощей кишки вблизи связки Трейтца или восстановление пилорического жома.
Гастростаз
Гастростаз характеризуется нарушением моторно–эвакуаторной функции желудка и является специфическим постваготомическим синдромом. Он наблюдается у 2–23% пациентов, в том числе у 4–6% – в тяжелой форме.Патогенез.
В большинстве случаев гастростаз возникает у лиц, оперированных по поводу поздних стадий стеноза, так как у них уже до операции имеются нарушения двигательной функции желудка. Наиболее часто развитию гастростаза способствуют повреждение нерва Латарже во время СПВ, анастомозиты, дуоденостаз, перигастрит, высокое расположение пилородуоденального перехода вследствие особенностей анатомического развития гастродуоденальной зоны на фоне ослабления двигательной активности ваготомированного желудка, сужение или полное заращение дренирующего желудок соустья.
Классификация и клиническая картина. Приведены в табл. 1.
Таблица 1. Характеристика постваготомического гастростаза
| Клинические признаки | Степень тяжести | ||
|---|---|---|---|
| легкая | средняя | тяжелая | |
| Жалобы | Могут отсутствовать. У большинства больных определяется незначительное чувство тяжести в эпигастрии после еды | Тяжесть, распирающие боли в эпигастрии, левом подреберье после еды. Отрыжка, тошнота. Периодическая рвота съеденной пищей | Резкая боль в эпигастрии и левом подреберье после еды с иррадиацией в левое надплечье. Постоянная рвота съеденной пищей |
| Общее состояние больных | Не нарушается | Не страдает, в ряде случаев легкой степени тяжести | Средней степени тяжести, иногда тяжелое |
| Шум плеска в эпигастрии натощак | Может не определяться | Определяется | Определяется |
| Эвакуация из желудка бариевой взвеси | Замедление эвакуации до 6–12 ч | Замедление эвакуации до 13–24 ч | Замедление эвакуации на сроки более 24 ч |
| Эндоскопическое исследование через 12 ч после приема пищи | Повышенное количество желудочного сока | Повышенное количество желудочного сока, незначительное содержание пищевых масс | Скопление в желудке большого количества пищевых масс |
В зависимости от сроков возникновения выделяют ранний гастростаз (возникает в раннем послеоперационном периоде) и поздний (развивается спустя 2–3 недели с момента операции).
Диагностика.
Основывается на анализе жалоб, данных анамнеза, результатов рентгенологического, фиброгастроскопического и электрогастрографического методов исследований. Желудок при гастростазе перерастянут, атоничен, содержит большое количество слизи и пищи. Как в области тела желудка, так и в пилороантральном отделе отмечается скопление газов. Наиболее достоверную информацию о степени гастростаза дает прослеживание эвакуации бариевой взвеси из желудка через 6–12–24 ч. Инструментальный метод исследования позволяет отдифференцировать функциональный гастростаз от органического. Рентгенологически при органическом гастростазе наблюдаются усиление перистальтики и отсутствие эвакуации из желудка в любом положении больного. Функциональный гастростаз характеризуется наступлением свободного опорожнения желудка от бариевой взвеси преимущественно в положении пациента на правом боку. При фиброгастроскопии у лиц с органической гастроплегией определяются сужение области анастомоза (анастомозит) и повышенное скопление пищевого химуса в двенадцатиперстной кишке (органический дуоденостаз), а при функциональном гастростазе – атония желудочной стенки и выраженная антиперистальтика двенадцатиперстной кишки. Регистрация биоэлектрической активности желудка свидетельствует о резком снижении всех параметров электрогастрограмм в случае функциональной гастроплегии и повышении – при органической.
Лечение.
Проводится комплексно с учетом причин гастростаза. Применяется постоянная, или фракционная, временная (2–3 раза в сутки) декомпрессия желудка. Сроки декомпрессии определяются скоростью восстановления моторно–эвакуаторной функции желудка. Больным рекомендуется лежать на правом боку, что способствует "зависимому" опорожнению желудка. Назначаются церукал (1 мл внутримышечно 1–3 раза в день), бензогексоний (0,5–1 мл 2,5% раствора внутримышечно 1–3 раза в день), питуитрин (1 мл подкожно 1–3 раза в день), прозерин (1 мл 0,05% раствора 1–3 раза в день). Внутривенно вводятся полиионные растворы, соли калия, хлоридов, 10% раствора ксилита (0,5 г на 1 кг массы тела). Эффективными методами лечения являются стимуляция двигательной активности желудка диадинамическими и синусоидальными модулированными токами, ионоферез с ацетилхолином,
В случаях резкого расширения желудка, атонии и истончения его стенки при гастростазе любого генеза, а также если консервативное лечение неэффективно, показано хирургическое вмешательство. Лучшим методом операции является резекция желудка. При значительной риске операции допустимо выполнение дренирующих желудок операций: гастроеюнального соустья (после ваготомии с гастродуоденоанастомозом или пилоропластикой); гастродуоденоанастомоза; пилородуоденопластики (после изолированной СПВ).
Профилактика гастростаза заключается в правильном выполнении операции, проведении комплекса консервативных мероприятий, направленных на восстановление двигательной функции ваготомированного желудка с первого дня послеоперационного периода.
Дисфагия
Постваготомическая дисфагия отмечается у 5–27% больных, перенесших органосохраняющие операции, и наиболее часто после СПВ.По срокам возникновения дисфагия бывает ранней и поздней. Ранняя дисфагия наблюдается в течение первых 12–14 дней послеоперационного периода и купируется к моменту выписки пациентов из стационара. Эпизодически она может проявляться на протяжении нескольких последующих месяцев. Патогенез ранней дисфагии связывают с чрезмерной денервацией дистального отдела пищевода и физиологической кардии, ведущей к нарушению вагальных рефлексов, участвующих в осуществлении акта глотания. В таких случаях парасимпатическая денервация пищевода приводит к временному состоянию мышечной ригидности, затрудняющей функцию глотания. Поздняя дисфагия развивается при рубцовом сужении абдоминального отдела пищевода у лиц с язвенной болезнью, осложненной эрозивно–язвенным эзофагитом.
Клиническая картина.
Различают легкую, среднюю и тяжелую степени дисфагии. Легкая степень проявляется затрудненным глотанием твердой пищи, однако это проходит самостоятельно в ближайшие недели после выписки больного из стационара. Дисфагия средней тяжести характеризуется умеренным нарушением акта глотания жидкой пищи. При тяжелой степени дисфагии глотание затруднено при приеме любого вида пищи. Больные жалуются на боль и жжение за грудиной, тошноту, срыгивание пищей.
Диагностика.
Основана на результатах рентгенологического, эзофагогастроскопического и эзофагоманометрического методов исследования. При рентгеноскопии (графии) определяются сужение дистального отдела пищевода и супрастенотическое его расширение. У пациентов с тяжелой дисфагией фиброгастроскоп с трудом проходит (не проходит) в желудок. Эзофагоманометрия свидетельствует о повышении внутрипищеводного давления.
Лечение.
Показано консервативное лечение. Рекомендуются дробный прием пищи, спазмолитики, физиотерапия, бужирование пищевода фиброэзофагогастроскопом. Может использоваться и кардиодилатация. Если консервативное лечение не дает эффекта, проводят оперативное вмешательство. При гиперфункции фундопликационной манжеты выполняется операция – снятие манжеты и реконструкция фундопликации. Лицам с рубцовым сужением дистальной части пищевода накладывается эзофагофундоанастомоз.
Рефлюкс–гастрит
Рефлюкс–гастрит диагностируется у 1,8–12% больных чаще после ваготомии, сочетающейся с дренирующими желудок операциями.Клиническая картина.
Вследствие нарушения замыкательной функции привратника происходит заброс в желудок содержимого двенадцатиперстной кишки, оказывающего повреждающее действие на слизистую. Это сопровождается болями в надчревной области, усиливающимися после приема пищи и не устраняющимися антацидами. Больных беспокоят горечь во рту, тошнота, рвота, похудание.
Диагностика.
При постваштомическом рефлюкс – гастрите определяется существенное снижение базальной и стимулированной секреции соляной кислоты. При эндоскопическом исследовании в желудке содержится повышенное количество желчи, отмечаются отек, гиперемия и кровоточивость слизистой. Результаты лабораторного исследования свидетельствуют о наличии в желудочном соке компонентов дуоденального содержимого.
Лечение.
Консервативное лечение при постваготомическом рефлюкс–гастрите такое же, как и при рефлюксгастрите, развившемся после резекции желудка. В качестве вариантов хирургического вмешательства при тяжелом постваготомическом рефлюкс–гастрите применяют экономную резекцию желудка с клапанным анастомозом, поперечную антиперистальтическую дуоденоеюностомию с аппаратным ушиванием приводящей петли тонкой кишки, сужение привратника циркулярно наложенным швом. Выполняется изоперистальтическая интерпозиция участка тонкокишечного сегмента (длиной 15–30 см) между желудком и двенадцатиперстной кишкой (операция Henley–Soulpault). Однако основной операцией является антрумрезекция с гастроэнтероанастомозом по Ру с расстоянием между гастроэнтеро– и энтероэнтероаностомозом не менее 30 см. При высокой кислотопродукции она дополняется стволовой ваготомией.
Рефлюкс–эзофагит
Рефлюкс–эзофагит – осложнение ваготомии, обусловленное нарушением замыкательной функции кардии. Он выявляется у 2,7–37,3% пациентов. Более чем у 5,7% больных причинами его развития служат грыжа пищеводного отверстия диафрагмы и недостаточность замыкания кардии. Вследствие регургитации желудочного содержимого происходит различной степени выраженности повреждение слизистой пищевода.Клиническая картина.
Больные жалуются на боль за грудиной, изжогу, горечь во рту, срыгивание, регургитацию во время сна. В случае прогрессирования заболевания присоединяется дисфагия, которая связана со спазмом или стриктурой пищевода, воспалением окружающих тканей.
Диагностика.
Основана на данных клиники и специальных методов исследования (лабораторное, эндоскопическое, рентгенологическое).
Лечение.
В большинстве случаев проводится консервативное лечение, направленное на улучшение моторики желудочно–кишечного тракта и трофики пораженных тканей. При отсутствии эффекта, наличии грыжи пищеводного отверстия диафрагмы показана операция – восстановление замыкательной функции кардии.
Дуоденостаз
Дуоденостаз – редкое осложнение ваготомии. Причинами постваготомического дуоденостаза служат не диагностируемое до операции хроническое нарушение дуоденальной проходимости, артериомезентериальная компрессия двенадцатиперстной кишки, рубцовый процесс в области дуоденоеюнального перехода или его высокое стояние, инверсия двенадцатиперстной кишки. В отдельных случаях дуоденостаз развивается вследствие технических погрешностей операции: при повреждении кишечной стенки, чрезмерной мобилизации двенадцатиперстной кишки по Кохеру, неправильном выполнении дренирующих желудок операций.Клиническая картина.
Специфические проявления постваготомического дуоденостаза отсутствуют. Больных беспокоят чувство тяжести, полноты в эпигастрии и правом подреберье, горечь во рту, тошнота, рвота с примесью желчи.
Диагностика.
Основывается на результатах лабораторно–инструментальных методов исследования. Наиболее информативной является рентгеноскопия (графия) желудка и двенадцатиперстной кишки, при которой выявляется значительное расширение последней с длительной задержкой в ней контрастной взвеси.
Лечение.
Чаще всего консервативное. Однако оно не всегда эффективно. По строгим показаниям выполняются операции. Предпочтение отдается резекции желудка с наложением У–образного гастроэнтероанастомоза по Ру или резекции дуоденоеюнального угла (операция Робинсона).
Камнеобразование в желчном пузыре
Камнеобразование в желчном пузыре после ваготомии встречается в 0,9–1,2% случаев независимо от вида парасимпатической денервации желудка.Образование камней в желчном пузыре связывается с его постваготомической атонией и застоем в нем желчи; изменением химического состава желчи, продуцируемой депарасимпатизированной печенью; уменьшением секреции и состава желчи вследствие снижения продукции соляной кислоты, играющей сложную роль в гуморальной регуляции функции пищеварения; метаболическими нарушениями в организме при выполнении операции как таковой. Вместе с тем следует учитывать, что холецистолитиаз не всегда может быть выявлен во время интраоперационного обследования.
Клиническая картина.
У одних пациентов конкременты в желчном пузыре не проявляются и выявляются лишь при плановом обследовании, у других – приводят к развитию приступа острого холецистита или холецистопанкреатита.
Диагностика.
Наличие камней подтверждается результатами УЗИ.
Лечение.
Основным методом лечения больных желчнокаменной болезнью, в том числе и после перенесенной ваготомии, является хирургическое вмешательство – открытая или лапароскопическая холецистэктомия.
Синдром недостаточности пищеварения и всасывания
В 0,4–18,9% случаев после ваготомии, преимущественно стволовой и селективной, возникает синдром мальдигестии (недостаточности пищеварения) и мальабсорбции (недостаточности всасывания). Он обусловлен постваготомическим дефицитом пищеварительных ферментов, изменением структуры тощей, подвздошной кишок, нарушением транспортных механизмов, двигательной функции кишечника, развитием кишечной патогенной микрофлоры.Клиническая картина.
Характерны чувство тяжести в животе, его вздутие, урчание, жидкий стул, слабость, повышенная утомляемость. В редких случаях отмечаются трофические расстройства кожи, волос, ногтей.
Диагностика.
Как правило, у лиц с постваготомическим синдромом мальдигестии и мальабсорбции имеются нарушения в полостном и мембранном пищеварении, а также всасывании и в дооперационном периоде. Эти изменения выявляются по определению активности ферментов полостного и мембранного пищеварения с одновременным изучением всасывательной функции тонкой кишки (Д/ксилозным тестом). Обычно у лиц с указанными синдромами отмечается резкое угнетение полостного и всех фракций мембранного пищеварения. В 80–87% случаев всасывание веществ нарушается как в проксимальных, так и в дистальных отделах тонкого кишечника. В отличие от демпинг–синдрома и диареи синдром недостаточности пищеварения с увеличением срока наблюдения не имеет тенденции к обратному развитию.
Лечение.
Начинается с консервативных мероприятий: назначения диеты с повышенным содержанием белков, жиров и углеводов; коррекции нарушений водного и электролитного обмена, кислотно–щелочного равновесия; проведения заместительной терапии (желудочный сок, соляная кислота, фестал, панкреатин, панзинорм и др.). Неэффективность длительной терапии, тяжелая степень клинических проявлений синдромов служат показаниями к оперативному вмешательству – тонкокишечной гастродуоденопластике.
Постфундопликационные осложнения
Постфундопликационные осложнения развиваются вследствие дополнения ваготомии эзофагофундопликацией по Ниссену. К ним относятся синдром гиперфункции эзофагофундопликационной манжеты, gas–bloat–синдром, феномен телескопа, параэзофагеальная грыжа, пептическая стриктура пищевода.Клиническая картина и диагностика.
Синдром гиперфункции эзофагофундопликационной манжеты встречается в 5,2% случаев и обусловлен сдавлением абдоминального отдела пищевода. Он проявляется дисфагией. Однако постфундопликационная дисфагия может быть связана и со значительным сужением пищеводного отверстия диафрагмы, особенно при захвате ее в фундопликационный шов.
При эндоскопическом обследовании у больных с гиперфункцией манжеты аппарат с трудом проходит через место сужения. Рентгенологически определяются сужение кардиоэзофагеального перехода, расширение нижней трети пищевода с задержкой в нем контрастной массы. Для профилактики синдрома гиперфункции манжеты при выполнении эзофагофундопликации обязательным является предварительное введение в просвет пищевода толстого желудочного зонда. Обосновано дополнение фундопликации диафрагмокрурорафией.
Gas–btoat–синдром (синдром гиперфункции кардии) выявляется у 6,3–7,4% больных. Он характеризуется наличием чувства раннего насыщения, переполнения желудка, вздутия живота при невозможности или резком затруднении отрыжки после приема обычных порций пищи. Рентгенологически определяются расширение проксимального отдела желудка, увеличение газового пузыря, который нередко сдавливает участок пищевода, укутанный эзофагофундопликационной манжеткой.
В 0,5–1,1% случаев после эзофагофундопликации по Ниссену наблюдается феномен телескопа (Slipped Nissen). Феномен проявляется чувством тяжести в эпигастрии после еды. В основе его возникновения лежит выскальзывание пищевода из манжеты, образованной стенками желудка. Это происходит при отсутствии фиксации кардии к пищеводу во время операции или прорезывания швов, формирующих манжету в послеоперационном периоде. Основным методом диагностики феномена телескопа является рентгенологическое исследование, во время которого определяются провисание стенки желудка и супрастенотическое поддиафрагмальное расширение пищевода. Эндоскопически обнаруживают зияние розетки кардии.
Крайне редко после ваготомии с эзофагофундопликацией по Ниссену возникают параэзофагеальная грыжа и пептическая стриктура пищевода. Последнее постфундопликационное осложнение развивается вследствие заживления язвенных поражений слизистой пищевода при фибринозно–язвенном эзофагите.
Лечение.
Наиболее радикальный метод лечения постфундопликационных осложнений – оперативное вмешательство, заключающееся в снятии фундопликационной манжеты с ее последующей реконструкцией.
Рак желудка
Рак желудка является редким осложнением ваготомий. Он диагностируется у 0,1 % больных. Обычно эти больные длительное время страдают гипо– и анацидным гастритом, дуоденогастральным рефлюксом. Существует две точки зрения на неогенез после органосохраняющих операций. Одни авторы считают, что ваготомия не способствует развитию рака желудка, он просто вовремя не диагностируется. Другие полагают, что наступающие после ваготомии морфобиохимические изменения стенки желудка могут иметь значение у генетически предрасположенных больных. Для своевременного обнаружения этого грозного осложнения рекомендуется ежегодное контрольное обследование желудка.Хроническая дуоденальная непроходимость
Историческая справка.
Хроническое нарушение дуоденальной проходимости было известно еще в I в. до н.э. в виде отдельных клинических случаев или анатомических находок. Однако вопросы диагностики и лечения данного заболевания начали активно изучаться лишь в конце XJX в. В последующем интерес к данной проблеме пропал. В первые десятилетия нашего столетия в литературе вновь появились сообщения, в которых обсуждались различные аспекты хронической дуоденальной непроходимости. Особенно большое внимание исследователей привлекла эта проблема в 60–70–е годы, что позволило более глубоко познать сущность патологии.
Этиология и патогенез.
Имеются сообщения о различных причинах врожденного и приобретенного характера хронической дуоденальной непроходимости. Часто она обусловлена сдавлением нижнего горизонтального отдела двенадцатиперстной кишки между аортой и верхнебрыжеечными сосудами. Уменьшению угла между указанными образованиями способствуют висцероптоз и обеднение жировой клетчаткой брыжейки тонкой кишки. В последующем было отмечено, что при возникновении воспалительного процесса в области связки Трейтца, в том числе лимфаденита, в этой зоне развиваются рубцовые изменения тканей, которые вызывают сужение двенадцатиперстной кишки. К этому может также привести воспалительный перипроцесс в области указанного органа – хронический адгезивный перидуоденит, который наблюдается при язвенной болезни, холецистите, панкреатите, К возникновению заболевания приводят не только механические препятствия, нарушающие моторно–эвакуаторную функцию кишки, но и расстройство ее нейромускуляторного аппарата. Последние являются одной из причин функциональною поражения двенадцатиперстной кишки. Встречаются случаи сочетания мегадуоденума и мегаколона. Однако на практике нередко трудно провести грань между поражениями механического и функционального характера, так как они усугубляют друг друга.
Клиническая картина.
Достаточно ярка. Больные жалуются на боли в подложечной области и правом подреберье, которые обычно не зависят от принятой пищи; тошноту, отрыжку, рвоту желчью. Нередко их беспокоят горечь во рту, диспептические расстройства. Все это приводит к уменьшению массы тела. Особенно обращает на себя внимание возникновение указанных жалоб на фоне психоэмоциональных факторов (конфликтная ситуация, переживание и т.д.).
Вместе с тем имеются особенности клиники в зависимости от формы заболевания (Ю, А. Нестеренко с соавт., 1990): функциональная психопатологическая – у больных с психической патологией; функциональная соматогенная – в результате длительно протекающего соматического заболевания в органах верхнего этажа брюшной полости; механическая врожденная – обусловленная аномалией развития двенадцатиперстной кишки и брыжеечных сосудов; механическая приобретенная – при развитии сдавления двенадцатиперстной кишки вследствие осложненного течения соматических заболеваний соседних с ней органов.
Функциональная психопатологическая форма хронической дуоденальной непроходимости чаще наблюдается среди женщин. Типичными жалобами больных являются рвота (чаще желчью) и прогрессирующее похудание. Многих пациентов наряду с болями неопределенного характера и различной локализации беспокоят ощущение жара, жжения, передвижения в подложечной области. Указанная симптоматика усиливается при психоэмоциональном переживании вследствие конфликтов в семье, на работе, в быту. В клинической картине данной формы заболевания отчетливо проявляется сочетание симптомов, свойственных как соматическим, так и психическим заболеваниям.
Функциональная соматогенная форма одинаково часто поражает и мужчин и женщин, при этом развитию клиники хронической дуоденальной непроходимости длительное время предшествуют такие заболевания, как язвенная болезнь, хронический панкреатит, желчнокаменная болезнь и ее осложнения. При сочетании дуоденального стаза и язвенной болезни боли становятся постоянными, по утрам отмечается чувство горечи во рту. При фиброгастродуоденоскопии выявляются небольшие медленно эпителизирующиеся язвы, а после их заживления указанная симптоматика сохраняется. Подобная картина наблюдается и у больных желчнокаменной болезнью, сочетающейся с хронической дуоденальной непроходимостью. Выполненная в этих случаях холецистэктомия часто не приносит успеха, больные вынуждены длительное время находиться под наблюдением врача с так называемым диагнозом "постхолецистэктомический синдром". В значительной степени это касается также пациентов с хроническим панкреатитом (чаще на почве алкоголизма) – они безуспешно подвергаются оперативным вмешательствам на поджелудочной железе, которые не корригируют хроническую дуоденальную непроходимость.
При механической врожденной форме хронической дуоденальной непроходимости ведущими симптомами являются распирание и тяжесть в подложечной области, особенно после приема пищи, отрыжка, приносящая облегчение, рвота желчью. Часто больные с детства обращаются к врачам по поводу различных диспептических расстройств, из–за указанных нарушений наступает астенизация пациентов, а нередко и инвалидизация.
Клиническая картина механической приобретенной формы отличается от функциональной соматогенной тем, что при ней симптомы хронической дуоденальной непроходимости развиваются довольно быстро после перенесенного обострения основного заболевания: язвенная болезнь, деструкция желчного пузыря, панкреонекроз с образованием воспалительных инфильтратов, рубцов, кист, сдавливающих двенадцатиперстную кишку.
Диагностика.
Ведущую роль играют рентгенологические методы исследования, при этом основными признаками заболевания являются расширение диаметра двенадцатиперстной кишки, расстройство маятникообразных и перистальтических сокращений, задержка контрастной взвеси в ней более 1 мин. В некоторых случаях отмечается резкое усиление антиперистальтических движений или, наоборот, полная адинамия кишки на фоне выраженного ее расширения. Рентгенологическим симптомом хронической артериомезентериальной непроходимости является обрыв контраста по линии позвоночника при вертикальном и горизонтальном (на спине) положениях пациента. В то же время принятие пациентом коленно–локтевого положения сопровождается заполнением контрастной взвесью нижней горизонтальной ветви двенадцатиперстной кишки с последующим переходом ее в тощую. Важные сведения могут быть получены при релаксационной дуоденографии.
В последние годы вследствие широкого внедрения в практику ангиографических исследований чаще стала применяться селективная мезентерикография по Сельдингеру, позволяющая визуализировать величину угла между аортой и верхней брыжеечной артерией. Недостатком метода является его инвазивность. Развитие ультрасонографической техники дает возможность шире использовать ультразвуковые методы диагностики, которые позволяют оценить не только состояние указанных сосудов, но также выявить изменения желчевыводящей системы, поджелудочной железы и других органов. Судить о наличии хронической дуоденальной непроходимости можно на основании результатов фиброгастродуоденоскопии. Об этом будет свидетельствовать выраженный дуоденогастральный рефлюкс, определяемый по большому количеству желчи, желчных кислот в желудочном содержимом и признаков рефлюкс–гастрита.
Дифференциальная диагностика.
Хроническую дуоденальную непроходимость следует дифференцировать с заболеваниями желудка, желчевыводящих путей, поджелудочной железы, а также с различными психоэмоциональными расстройствами, что иногда делает необходимым привлечение в качестве консультанта врача–психиатра.
Лечение.
Трудность лечения больных хронической дуоденальной непроходимостью обусловлена прогрессированием взаимосвязанных функциональных и органических расстройств, которые часто сочетаются при данном заболевании. Тем не менее более оправданным является такое лечение, которое проводится с учетом формы патологического процесса. В этой связи установлено, что большая группа больных нуждается не в хирургическом вмешательстве, а в консервативном лечении в условиях терапевтического или неврологического стационара. Целесообразно проводить одновременное лечение соматических и психических нарушений.
Абсолютным показанием к хирургическому лечению является механическая врожденная форма, которая развилась вследствие тяжелого патологического процесса со стороны смежных с двенадцатиперстной кишкой органов. Операция может быть произведена также у больных с функциональной соматогенной формой вторичной хронической дуоденальной непроходимости при вовлечении в патологический процесс двух и более отделов двенадцатиперстной кишки и при наличии относительных показаний к оперативному вмешательству по поводу основного заболевания.
Интраоперационная диагностика хронической дуоденальной непроходимости заключается в тщательной ревизии двенадцатиперстной кишки, при этом могут быть выявлены различные ее изменения. При механической врожденной форме заболевания не всегда определяется причина препятствия пассажу, однако выше его диаметр кишки составляет не менее 6–8 см, она пролабирует через брыжейку поперечной ободочной кишки. Параллельно с этим отмечается значительное расширение привратника. У некоторых больных выявляется аномальное расположение двенадцатиперстной кишки. Механическая приобретенная форма заболевания характеризуется расширением просвета двенадцатиперстной кишки выше места ее стеноза, обусловленным тяжелым язвенным процессом, хроническим панкреатитом и его осложнениями или другой патологией. Одновременно могут наблюдаться увеличение в размерах желудка, рубцовый перидуоденит. Нередко выявляется также рубцовый процесс в области связки Трейтца. Операционные находки при функциональной соматической форме заболевания сводятся к обнаружению резко выраженного воспалительного процесса на большом протяжении стенки двенадцатиперстной кишки, что делает ее мобилизацию по Кохеру весьма травматичной и малоинформативной.
Выделяют два вида операций при хронической дуоденальной непроходимости. Оперативные вмешательства первой группы предусматривают дренирование двенадцатиперстной кишки, второй – выключение ее из пассажа. Самой простой и распространенной является операция Стронга, сущность которой состоит в рассечении связки Трейтца, освобождении и низведении дуоденоеюнального угла на 4–6 см (рис. 11). Нередко используется дуоденоэнтеростомия, которую впервые успешно выполнил Stavely в 1908 г. Затем было предложено много ее модификаций, среди которых можно отметить операцию Грегори–Смирнова (рис. 12) – анастомоз накладывается на изолированной по Ру петле тощей кишки; операция Я. Д. Витебского – поперечная антиперистальтическая дуоденоэнтеростомия. Важно отметить, что для наложения анастомоза необходимо использовать наиболее выбухающую нижнюю горизонтальную ветвь двенадцатиперстной кишки. При показаниях одновременно выполняются операции по поводу язвенной болезни (ваготомия) и заболеваний желчевыводящих путей.
 Рис. 11. Операция Стронга.
Рис. 11. Операция Стронга.
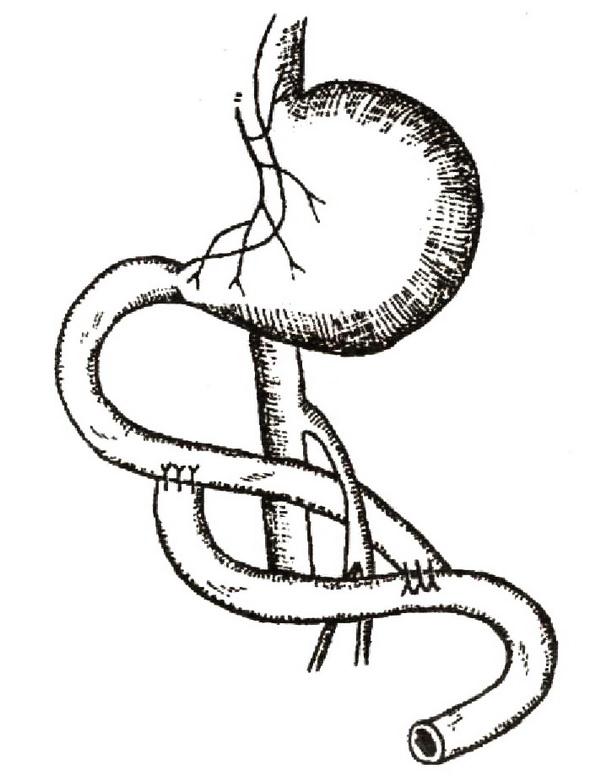 Рис. 12. Дуоденоэнтеростомия по Грегори–Смирнову.
Рис. 12. Дуоденоэнтеростомия по Грегори–Смирнову.
Среди методик второй группы, выключающих пассаж пищи по двенадцатиперстной кишке, предпочтение отдается антрумэктомии с наложением гастроэнтероанастомоза на выключенной по Ру петле, которая при наличии дуоденальной язвы дополняется стволовой или селективной ваготомией. При резком расширении двенадцатиперстной кишки, ее выраженной атонии производится антрумэктомия по типу резекции желудка по Гофмейстеру–Финстереру с формированием на отводящей петле дуоденоэнтероанастомоза, при этом с целью профилактики рефлюкс–гастрита прошивается приводящая петля. У больных с артериомезентериальной непроходимостью при относительно удовлетворительном состоянии стенки двенадцатиперстной кишки выполняется резекция дуоденоеюнального угла с наложением позадиободочного дуоденоэнтероанастомоза способом "конец в конец".
Тонкая кишка
Анатомо–физиологические сведения
Тонкая кишка начинается от двенадцатиперстно–тощекишечного изгиба (слева от II поясничного позвонка) и доходит до слепой кишки. Область илеоцекального перехода пропускает содержимое тонкой кишки в слепую, но препятствует обратному его движению. Длина тонкого кишечника у взрослых колеблется от 5 до 7 м, в среднем составляет 3–4 м. Диаметр просвета 2,5–4 см. Проксимальная часть тонкой кишки (тощая кишка) располагается преимущественно в верхнелевой области брюшной полости, которая ограничена брыжейкой поперечной ободочной кишки, селезеночным (левым) изгибом и нисходящим отделом толстой кишки. Дистальная половина (подвздошная кишка) локализуется в нижних отделах брюшной полости как слева, так и справа, при этом сверху к ней прилежит печеночный (правый) угол ободочной кишки, а справа – восходящая толстая кишка. Тонкий кишечник расположен интраперитонеально, брыжейка его представляет дубликатуру брюшины, в которой находятся кровеносные и лимфатические сосуды, лимфатические узлы, нервы. Она прикрепляется к задней стенке живота по линии, идущей от I–II поясничных позвонков до правого крестцовоподвздошного сочленения.Слизистая оболочка тонкой кишки выстлана однослойным цилиндрическим эпителием, покрыта множеством ворсин, за счет которых значительно увеличивается ее поверхность. Слизистая тощей кишки преимущественно содержит круговые или поперечные складки (Керкринга). Стенка тонкой кишки имеет выраженный мышечный слой, который обеспечивает ее двигательную функцию.
Кровоснабжение тонкой кишки осуществляется 14–15 крупными ветвями верхней брыжеечной артерии. Между соседнимиартериями образуются дугообразные анастомозы. При этом от первичных артериальных дуг тощей кишки отходят концевые артерии, которые направляются непосредственно к кишечной стенке. Кровоснабжение подвздошной кишки осуществляется через концевые артерии, которые отходят уже от вторичных и третичных дуг. Это делает дистальный отдел тонкой кишки менее приспособленным для пластических целей. Верхняя брыжеечная артерия отходит от аорты на 0,5 см ниже чревного ствола (уровень I–II поясничных позвонков). Затем она проходит позади головки поджелудочной железы, через крючковидный ее отросток, впереди нижней горизонтальной ветви двенадцатиперстной кишки, что иногда обусловливает развитие синдрома артериомезентериальной непроходимости. От верхней брыжеечной артерии ответвляется нижняя поджелудочно–двенадцатиперстная артерия, которая анастомозирует с верхней одноименной артерией, являющейся ветвью чревного ствола. Этой особенностью кровообращения является сохранение жизнеспособности нескольких сантиметров проксимального отдела тощей кишки при остром тромбозе мезентериальных сосудов, ведущего к некрозу тонкого кишечника. Наш опыт и данные литературы свидетельствуют о том, что и в этих случаях пациентам можно сохранить жизнь, если после удаления некротизированного кишечника наложить анастомоз между коротким участком тощей кишки, сохранившим питание за счет указанной выше артерии, и поперечной ободочной кишкой способом "конец в бок".
Концевые артерии снабжают кровью небольшие участки кишки, поэтому при резекции они должны перевязываться по возможности ближе к ее краю. В связи с тем что в области противобрыжеечного края концевые сосуды сужаются и ухудшается кровоснабжение, при резекции кишку следует пересекать в косом направлении под углом 45° к оси брыжейки.
Отток крови из кишечника осуществляется в систему воротной вены. Ее истоками являются венозные капилляры ворсинок. В поделизистом слое они соединяются в венулы, а затем в более крупные вены, которые сопровождают одноименные артерии. В брыжейке кишки вены образуют аркады, их продолжением являются более крупные венозные стволы (14–15), которые наряду с венами, собирающими кровь из правой половины толстой кишки, впадают в верхнюю брыжеечную вену. Последняя направляется кверху, перекрещивает двенадцатиперстную кишку и проходит позади поджелудочной железы вентральнее и правее артерии. Соединяясь затем с нижней брыжеечной веной, она образует ствол воротной вены, который располагается в печеночно–двенадцатиперстной связке позади желчных путей и печеночной артерий.
Отток лимфы из кишечника осуществляется по лимфатическим сосудам в лимфоузлы, расположенные у стенки кишки, а затем в лимфатические узлы корня брыжейки. Иннервация тонкого кишечника обеспечивается верхним брыжеечным сплетением, в состав которого входят симпатические и парасимпатические нервные волокна. Тонкая кишка выполняет различные функции: эндокринную, секреторную, моторную, выделительную и всасывательную. Слизистая ее в сутки продуцирует до 2 л кишечного сока, который содержит ряд ферментов (энтерокиназу, щелочную фосфатазу, нуклеазу, сахарозу, липазу). Благодаря их действию пищевой химус расщепляется до моносахаридов, жирных кислот, которые всасываются слизистой, наряду с водой и электролитами. Кроме того, тонкая кишка продуцирует гормоны (секретин, холедистокинин–панкреозимин, вазоактивный интестиналь – ный полипептид и др.).
Терминальный илеит (болезнь Крона)
Болезнь Крона – хроническое неспецифическое воспалительное заболевание терминального отдела подвздошной кишки, описанное впервые Кроном с соавторами в 1932 г. Установлено, что гранулематозное воспаление распространяется на все отделы желудочно–кишечного тракта – от пищевода до анального отверстия. Однако чаще всего поражаются терминальный конец подвздошной и различные участки толстой кишки.Этиология.
Не установлена. Не подтвердились предположения о бактериальном или вирусном происхождении заболевания. Не внесла ясности и аутоиммунная теория возникновения болезни Крона.
Патогенез.
Основным патогенетическим моментом считается поражение лимфатической системы, что приводит к развитию гранулематозного воспаления в кишечной стенке. Поэтому многие считают более точным название "гранулематозный илеит". При прогрессировании заболевания происходит сужение просвета кишки с развитием частичной или полной непроходимости. Воспалительный процесс может приводить к образованию язв, спаянию кишечных петель и возникновению между ними гнойников. В последующем могуг формироваться внутренние и наружные кишечные свищи.
Патологическая анатомия.
Гистологические исследования выявляют обширные гранулемы в кишечной стенке и регионарных лимфоузлах. На слизистой оболочке определяются гранулематозные разрастания и изъязвления. Макроскопически пораженный участок кишки с признаками воспаления имеет сине–багровый цвет. Отмечается увеличение периметра кишки вследствие отека и резкого утолщения кишечной стенки. Иногда пораженный сегмент настолько ригиден, что может напоминать опухоль.
Клиническая картина.
Болезнь Крона может протекать остро, особенно у лиц молодого возраста. В этих случаях она напоминает острый аппендицит. Больных беспокоят тошнота, рвота, боль в правой подвздошной области. Может определяться защитное напряжение мышц передней брюшной стенки. В крови – лейкоцитоз. Такие больные обычно подвергаются аппендэктомии, во время которой находят воспалительные изменения в червеобразном отростке, однако истинный характер заболевания устанавливается редко. Для острой формы болезни Крона типичны поносы, которые могут быть частыми, изнуряющими и приводить к потере массы тела. Иногда в правой подвздошной области определяется инфильтрат. Хроническая форма терминального илеита чаще начинается скрыто. Появляются умеренные боли в животе, поносы, субфебрильная температура. При пальпации правой половины живота определяется колбасовидное уплотнение. Сужение пораженной кишки прогрессирует и может привести к развитию кишечной непроходимости, это сопровождается усилением болей, которые затем принимают схваткообразный характер. Больных беспокоит многократная рвота, иногда с каловым запахом. Отмечаются вздутие и асимметрия живота.
Воспалительный инфильтрат брюшной полости при болезни Крона может привести к образованию гнойника. В таких случаях повышается температура тела, усиливаются боли в правой подвздошной области, при пальпации в этой зоне определяется резко болезненное образование. При вскрытии абсцесса в просвет кишечника, петли которого находятся в очагах поражения, развиваются поносы, в том числе с примесью остатков пищи. Внутренние и наружные свищи как осложнение терминального илеита могут возникать без предшествующего образования абсцесса. При перфорации пораженной кишки в свободную брюшную полость развивается клиника перитонита. При болезни Крона наблюдается анемия вследствие скрытого кишечного кровотечения, что обнаруживается реакцией Грегерсена. Нередко при этом заболевании возникают системные поражения (ирит, иридоциклит, кожная эритема, полиартрит и др.). Терминальный илеит имеет рецидивирующий характер течения, когда периоды обострения сменяются длительной ремиссией. Это приводит к нарушению функции всасывания, в результате чего развивается жировая дистрофия печени. Заболевание может осложниться склерозирующим холангитом, гепатитом, абсцессами печени.
Диагностика.
Точный диагноз можно установить только на основании гистологического исследования операционного материала. До этого можно лишь предположительно высказаться о характере паталогического процесса путем исключения других заболеваний органов брюшной полости. Тем не менее заподозрить болезнь Крона можно на основании указанной выше клиники и рентгенологического исследования кишечника с контрастом. При начальных формах болезни, когда преобладает отек пораженных тканей, на рентгенограммах отмечается сглаженность слизистой оболочки. По мере прогрессирования заболевания определяется своеобразное чередование суженных и расширенных участков кишки, а иногда она суживается в виде шнурка (симптом "шнурка"). При наличии свищей они четко выявляются на рентгенограммах. Если одновременно поражается толстая кишка, то в целях уточнения диагноза проводится эндоскопическая биопсия с гистологическим исследованием материала. Ценные сведения может дать лапароскопия.
Дифференциальная диагностика.
Проводится с регионарным энтеритом, хронической абдоминальной ишемией, инфекционным или аллергическим энтеритом. При наличии в брюшной полости опухолевидного конгломерата его следует дифференцировать с новообразованиями, а также необходимо иметь в виду туберкулез, лимфогранулематоз, актиномикоз. Острая форма терминального илеита дифференцируется прежде всего с аппендицитом.
Лечение.
При неосложненных формах заболевания обычно проводится консервативное лечение. С этой целью рекомендуются легкоусвояемая пища, антибиотикотерапия, назначаются салазопирин, иногда кортикостероидные гормоны, которые, однако, могут вызывать осложнения.
Хирургическое лечение показано при развитии осложнений заболевания (сужение просвета пораженной кишки, абсцессы, свищи, кровотечение). При хронических формах терминального илеита решение о сроках операции принимается хирургом совместно с терапевтом после обсуждения всех особенностей течения заболевания и результатов превентивного консервативного лечения. Операция выполняется экстренно у больных с перфорацией и непроходимостью кишечника. Особенностью оперативного вмешательства является широкое иссечение пораженного участка кишки, т.е. в пределах здоровых тканей. Нередко выполняется правосторонняя гемиколэктомия. При этом удаляется соответствующая часть брыжейки вместе с лимфатическими узлами, если это технически возможно. В редких случаях, когда из–за обширного инфильтрата риск одномоментной операции очень высок, вначале накладывают илеотрансверзоанастомоз, а затем вторым этапом после регрессии воспалительного процесса удаляют пораженные ткани. Число рецидивов после хирургического лечения достигает 50 % и более.
Еюнит
Еюнит – воспаление тощей кишки, нередко возникающее при заболеваниях желудка и желчевыводящих путей. Эти больные часто лечатся в терапевтических клиниках. Однако при развитии флегмоны тощей кишки они поступают в хирургические стационары. Патологические изменения в этих случаях характеризуются ярко–красным цветом серозного покрова пораженного кишечника с наличием фибринозного налета. Стенка кишки отечна, утолщена, легко травмируется. Со стороны слизистой определяются участки некрозов, язвы, которые могут перфорировать в свободную брюшную полость. Брыжейка и ее корень резко отечны, уплотнены.Клиническая картина и диагностика.
Определяется высокая температура тела. Больные жалуются на острые схваткообразные боли в животе, неукротимую рвоту, жидкий стул с примесью крови. Резко ухудшается общее состояние. Таким образом, симптоматика заболевания соответствует таковой при других острых заболеваниях органов брюшной полости (прободная язва желудка или двенадцатиперстной кишки, острый панкреатит, аппендицит и др.). Сомнения разрешает срочная лапаротомия.
Лечение.
Основным видом лечения при флегмоне тонкой кишки является консервативная терапия. Исключается прием пищи через рот, проводятся парентеральное питание, антибиотикотерапия, назначаются сердечно–сосудистые препараты. Показанием к операции служит перфорация кишки. Однако, несмотря на обширную резекцию кишки, часто наблюдается несостоятельность анастомозов, возникают новые участки некроза кишечной стенки. Поэтому прогноз оперативного вмешательства при данной патологии весьма сомнителен.
Некротический энтерит
Некротический энтерит или энтероколит носит тяжелый септический характер. Часто наблюдается у недоношенных детей, у взрослых после операций и приема большого количества антибиотиков, ослабленных больных. Причина заболевания неизвестна, но важное значение придается ишемии кишечной стенки.Клиническая картина.
Выражается в тяжелом состоянии больных, интенсивных болях в животе, признаках желудочно–кишечного кровотечения. При гангрене и перфорации кишки развивается клиника перитонита.
Диагностика.
Постановка диагноза некротического энтерита до операции практически невозможна. В этих случаях чаще всего предполагают тромбоз брыжеечных сосудов с некрозом кишечника.
Лечение.
Оперативное вмешательство состоит в резекции омертвевшей кишки или выведении ее наружу. Летальность достигает 70%.
Псевдомембранозный энтероколит
Клиническая картина.
Псевдомембранозный энтероколит – это тяжелое заболевание кишечника, которое возникает остро и характеризуется быстро прогрессирующим течением, часто заканчивающимся смертью. Его провоцируют травматичные операции, антибиотикотерапия.
Патологоанатомические изменения характеризуются резко выраженными альтеративными процессами в слизистой оболочке кишечника, а в его просвете содержится гнойная слизистая жидкость.
Диагностика.
Диагноз ставится предположительно на основании выраженной интоксикации, часто жидкого стула после перенесенной операции. Иногда возникает перфорация кишечной стенки с клиникой перитонита.
Лечение.
Проводятся детоксикационные мероприятия, исключается энтеральное питание, отменяются антибиотики. Применяются средства, улучшающие микроциркуляцию.
Неспецифические язвы тонкой кишки
Этиология и патогенез.
Не установлены.
Клиническая картина.
Предполагают, что развитию данного заболевания способствуют нарушения эвакуаторной функции и кровоснабжения кишки. Язвы локализуются преимущественно в верхнем отделе тощей и нижних сегментах подвздошной кишок.
Диагностика.
Как правило, диагноз ставится во время операции, которая предпринимается в связи с осложнением язвы (перфорация, кровотечение). О существовании таких язв следует помнить у больных с кишечными кровотечениями, причина которых не выяснена.
Лечение.
Во время операции по поводу перфорации язвы обычно производят ушивание отверстия, клиновидную или сегментарную резекцию кишки, а при разлитом гнойном перитоните перфорированный участок кишечника выводят наружу.
Пневматоз кишечника
Этиология.
Причина возникновения газовых кист в кишечной стенке не установлена. Считают, что это происходит в результате большого скопления газов в просвете кишки вследствие бактериального расщепления сахаров и последующего их проникновения через слизистую оболочку. Повышенное газообразование со снижением моторно–эвакуаторной функции кишки, возможно, и приветит к развитию заболевания.
Клиническая картина и диагностика.
Одним из частых Признаков пневматоза кишки является понос, который трудно поддается лечению. Слияние мелких пузырьков и образование большого газового пузыря может вызвать кишечную непроходимость. Иногда при рентгенологическом исследовании обнаруживаются газовые пузыри в области того или иного участка кишки, При нарушении целостности стенок пузырей развивается пневмоперитонеум.
Лечение.
Хирургическое вмешательство производят при появлении осложнений (кровотечение, кишечная непроходимость).
Туберкулез тонкой кишки
Обычно поражение тонкой кишки возникает на фоне прогрессирующего туберкулеза легких, но может иметь и первичный характер. Чаще всего патологический процесс локализуется в терминальных отделах подвздошной и слепой кишок.Патологическая анатомия.
Гранулематозный процесс захватывает все слои кишечной стенки, часто образуются глубокие язвы, которые при заживлении вызывают сужение кишки.
Клиническая картина.
При неосложненном течении заболевания больные жалуются на боль в животе, поносы, пальпаторно может определяться инфильтрат в правой подвздошной области. При развитии перитонита вследствие перфорации кишки, острой кишечной непроходимости, кровотечения появляются признаки, характерные для этих осложнений.
Диагностика.
Диагноз туберкулеза тонкой кишки основывается на клинических данных (тупые боли в правой подвздошной области, пальпируемый инфильтрат, нарастание кишечной непроходимости) и результатах рентгенологического исследования. Слепая кишка при этом имеет вид конуса, зияет илеоцекальный переход, терминальный отдел подвздошной кишки деформирован с изъеденностью контуров. Однако окончательный диагноз может быть поставлен только после операции.
Лечение.
Проводится прежде всего специфическое консервативное лечение. При выявлении опухолевидного образования в правой подвздошной области, развитии клиники кишечной непроходимости показано хирургическое вмешательство. Чаще всего выполняется правосторонняя гемиколэктомия с илеотрансверзоанастомозом. После операции также проводится специфическая терапия.
Актиномикоз тонкой кишки
Актиномикоз тонкой кишки – это редкое заболеванию, поражающее в основном илеоцекальный отдел кишечника с образованием абсцессов, внутренних и наружных свищей. Оно представляет собой третью по частоте локализацию актиномикоза после шейно–лицевой и легочной форм. Заболевание вызывается внедрением в организм лучистого грибка Actinomyces bovi, который является облигатным паразитом. Чаще всего заражение происходит эндогенным путем.Патологическая анатомия.
Отмечается резко выраженный распространенный склерозирущий процесс в области пораженных отделов кишечника с переходом на переднюю брюшную стенку и образованием наружных свищей.
Клиническая картина.
Различаютподострую и хроническую формы течения. Симптомы заболевания весьма скудны. Только после вовлечения в процесс кожи появляются свищи, гнойное отделяемое, что заставляет думать об актиномикозе.
Диагностика.
Основывается на определении плотного инфильтрата, связанного с передней брюшной стенкой, сопровождающегося образованием свищей с гнойным, а иногда и кишечным отделяемым. При микроскопическом исследовании гноя определяют друзы актиномицета.
Дифференциальная диагностика проводится с болезнью Крона, туберкулезом, опухолями.
Лечение.
В основном консервативное – назначают антибиотики, общеукрепляющие средства и специфические иммунопрепараты. Операция показана при возникновении гнойников в брюшной полости и клиники кишечной непроходимости. Иногда оперативное вмешательство производится по косметическим соображениям – иссечение кожных рубцов после консервативного лечения.
Дивертикулы тонкой кишки
Дивертикул кишки – выпячивание кишечной стенки в виде слепого мешка. Врожденные дивертикулы имеют все слои кишечной стенки и располагаются преимущественно на противобрыжеечном крае кишки. Приобретенные дивертикулы лишены мышечной оболочки и локализуются в области прикрепления брыжейки. Чаще всего они обнаруживаются в тощей кишке. Что касается меккелева дивертикула ("результат нарушения обратного развития желточного протока"), то некоторые считают, что он не имеет ничего общего с дивертикулами тонкой кишки. Однако существует также иная точка зрения, согласно которой дивертикулы тонкой кишки являются одним из вариантов меккелева дивертикула. Последний локализуется на расстоянии до 1,5 м от илеоцекального угла, имеет диаметр 0,5–1 см и длину до 12 см. Он встречается у 2 % населения.Клиническая картина.
Дивертикулы кишечника обычно протекают бессимптомно до появления осложнений. При развитии дивертикулита, который может иметь все формы воспаления, больные жалуются на боль в животе, тошноту, иногда рвоту. Повышается температура тела. Возникают перитонеальные явления. Картина заболевания может напоминать клинику острого аппендицита. При перфорации стенки дивертикула развивается симптоматика разлитого перитонита. Изъязвления дивертикула могут осложниться кишечным кровотечением с характерной для него клиникой. Длительно существующий хронический дивертикулит может вызвать развитие спаечной кишечной непроходимости.
Диагностика.
До операции весьма спорна. При рентгенологическом исследовании с контрастным веществом могут быть выявлены характерные для дивертикулов тени, связанные с кишечной стенкой. Однако дивертикулы небольших размеров на рентгенограммах обычно не определяются. Чаще всего диагноз устанавливается при лапаротомии, предпринятой в связи с кровотечением, перитонитом или кишечной непроходимостью. При отсутствии предполагаемого патологического процесса следует тщательно осмотреть тонкую кишку на предмет дивертикула.
Лечение.
Хирургическое вмешательство показано при больших дивертикулах, так как они могут вызвать осложнения. Срочное оперативное вмешательство производится при профузных кровотечениях и перфорациях изъязвленных дивертикулов, острой кишечной непроходимости. Сущность операции состоит в иссечении дивертикула и ушивании дефекта кишки, однако иногда прибегают и к резекции пораженного участка кишечника.
Опухоли тонкой кишки
Доброкачественные и злокачественные опухоли тонкой кишки встречаются относительно редко. Высказывается мнение, что это объясняется отсутствием застоя содержимого и его гниения в просвете тонкого кишечника. Признается также антиканцерогенное действие большого количества ферментов в содержимом кишки. Наиболее частая локализация – подвздошная кишка.Доброкачественные опухоли
К доброкачественным опухолям тонкой кишки относят полипы, липомы, фибромы, неврофибромы, лейомиомы, невриномы, гемангиомы. При отсутствии осложнений они редко диагностируются. Основной их опасностью является то, что, вызывая инвагинацию, они могут привести к развитию кишечной непроходимости. Другое осложнение доброкачественных опухолей – кишечное кровотечение. Чаще оно бывает при кавернозных гемангиомах, которые могут быть одиночными и множественными. Существует также возможность озлокачествления доброкачественных опухолей.Клиническая картина и диагностика.
Диагностика неосложненных опухолей трудна, так как практически отсутствует клиническая картина. При развитии указанных выше осложнений возникают симптомы кишечной непроходимости или кишечного кровотечения. При больших опухолях важные сведения получают при пальпации живота. Иногда диагноз может быть уточнен при рентгенологическом исследовании. В последнее время с этой целью применяются лапароскопия, фиброгастроэнтероскопия. При проведении дифференциальной диагностики следует иметь в виду и эндометриоз, который представляет собой развитие в ее стенке эктопированной ткани слизистой оболочки матки. Чаще заболевание возникает у женщин детородного возраста. Оно характеризуется болями в животе и признаками кишечного кровотечения, которые появляются на фоне менструации. Резекция пораженного сегмента кишки приводит к выздоровлению.
Лечение.
Сущность операции состоит в удалении опухоли путем клиновидной или циркулярной резекции кишки. Аденоматозные полипы на узких ножках могут быть удалены с помощью современных фиброэндоскопов. Однако это касается мест доступной локализации – проксимальные и дистальные отделы кишки.
Злокачественные опухоли
Злокачественные опухоли тонкой кишки встречаются значительно реже, чем доброкачественные. Обычно это аденокарциномы. Среди других злокачественных опухолей по гистологическому строению различают лейомиосаркомы, лимфосаркомы, рак. Они одинаково часто локализуются как в тощей, так и в подвздошной кишке.Клиническая картина.
Скудная. Однако при прогрессировании заболевания у больных развиваются анемия, похудание, слабость. Опухоль может определяться при пальпации живота. Злокачественные новообразования тонкой кишки вызывают два типа кишечной непроходимости – инвагинацию или обтурацию опухолью просвета кишки. Иногда они осложняются кровотечением.
Диагностика.
Важную роль в установлении диагноза играют рентгенологическое и эндоскопическое исследования. Применяются также ангиография и УЗИ. Точный диагноз устанавливается после операции.
Лечение.
Показано хирургическое вмешательство. Оно заключается в резекции пораженного участка и удалении регионарных лимфоузлов. Могут выполняться паллиативные операции (наложение обходных анастомозов), когда процесс носит распространенный характер и осложняется кишечной непроходимостью.
Карциноид тонкой кишки
Понятие "карциноидная опухоль" ввел Obemdorfer в 1907 г. для обозначения новообразований желудочно–кишечного тракта, которые характеризуются медленным ростом и поздним метастазированием. Эктопированные карциноидные опухоли встречаются в различных органах (поджелудочная железа, печень, матка, яичники, бронхи и т.д.).Клиническая картина.
Чаще всего карциноидные опухоли являются операционными находками. Однако большие опухоли могут вызвать полную или частичную непроходимость кишечника с характерной клинической картиной. При доброкачественном варианте карциноида кишечника больных иногда беспокоят боль в животе, понос, однако эти симптомы не специфичны. При злокачественном варианте карциноида, что встречается у ⅓ больных, может наблюдаться карцинадный синдром с триадой признаков: со стороны желудочно–кишечного тракта – постоянные поносы, со стороны вегетативной нервной системы – слабость, ощущение жара, головокружение и связанные с поражением клапанов сердца.
Диагностика.
Основывается на клинической картине заболевания и результатах эндоскопического и рентгенологического исследований.
Лечение.
При отсутствии отдаленных метастазов производится хирургическое вмешательство.
Повреждения тонкой кишки
Различают закрытые, открытые повреждения тонкой кишки и травмы ее изнутри инородными телами. Возможны также повреждения при выполнении эндоскопических исследований. Число таких больных увеличивается, особенно за счет дорожно–транспортных происшествий. Тяжесть состояния пациентов усугубляется в случаях повреждения не только кишки, но ее брыжейки и соседних органов (селезенки, печени, почек). Особенно подвержены повреждению фиксированные отделы тонкой кишки.Закрытые повреждения
Закрытые повреждения тонкой кишки возникают вследствие тупой травмы живота (удар, падение, сжатие). При этом в зависимости от силы удара и степени наполнения кишечника содержимым характер повреждений может быть различным: кровоизлияние в стенку кишки или брыжейку, одиночные и множественные, полные и неполные разрывы кишки, отрыв сегмента кишки от брыжейки.Клиническая картина.
При закрытом повреждении тонкой кишки определяется характером травмы. Она может быть слабо выражена при кровоизлияниях в ее стенку или брыжейку, а также при неполных разрывах. Наоборот, при перфорации быстро развивается картина перитонита, а у больных с кровотечением – анемия.
Диагностика.
До сих пор во всех странах летальность при разрыве тонкой кишки остается очень высокой (достигает 70 % и более) и зависит не только от тяжести повреждения, но и от сроков оказания помощи пострадавшим. Поэтому своевременная диагностика в этих случаях имеет исключительное значение. Диагностика основывается на данных анамнеза, клиники, результатах рентгенологических методов исследования. В сомнительных случаях обязательной является лапароскопия.
Дифференциальная диагностика проводится с повреждениями других органов брюшной полости и забрюшинного пространства.
Лечение.
При травме кишечника показано хирургическое вмешательство. Во время операции производится тщательная ревизия органов брюшной полости, дефекты в кишке ушиваются или делается резекция кишечника (при множественных повреждениях, отрыве от брыжейки).
Открытые повреждения
Открытые повреждения тонкой кишки возникают в результате проникающих ножевых или огнестрельных ранений, а также при различных катастрофах.Клиническая картина.
Особенностью этого вида повреждений является медленное нарастание болезненных симптомов, что обусловлено образованием спаек в зоне развития патологического процесса.
Диагностика.
Обычно не представляет трудностей. Дифференцировать необходимо с изолированным ранением передней брюшной стенки. В сомнительных случаях проводится лапароскопия, по результатам которой решается вопрос о необходимости лапаротомии. Объем операции зависит от характера травмы. Повреждения кишечной стенки изнутри вызывают рыбные кости, зубочистки, иглы и другие инородные тела. Этому способствуют сращения петель кишки, наличие в их просвете опухолей, что затрудняет продвижение предмета.
Лечение.
Хирургическое.
Послеоперационный период при травмах кишечника нередко осложняется прогрессирующим перитонитом, развитием динамической кишечной непроходимости, что является основной причиной высокой смертности. В этих случаях необходимо своевременно производить релапаротомию, в том числе повторную, во время которой следует санировать брюшную полость, шинировать кишечник, накладывать илеостому, иногда заканчивать операцию лапаростомией.
Осложнения грыж живота
Анатомические сведения о грыжах.
Различают наружные и внутренние грыжи живота. Наружной грыжей живота называют выхождение внутренностей через естественные или приобретенные дефекты в мышечно–апоневротическом слое под покровы тела. Наружная грыжа состоит из грыжевых ворот, грыжевого мешка, содержимого грыжи и ее оболочек.Грыжевые ворота представляют собой различные дефекты и слабые места в мышечно–апоневротическом слое брюшной стенки, через которые внутренние органы вместе с париетальной брюшиной выходят из брюшной полости. Они могут быть врожденными и приобретенными: паховый, бедренный, запирательный каналы, незаращенное или расширенное пупочное кольцо, щели в мышцах и апоневрозе брюшной стенки в области белой и полулунной линий живота, дефекты в области послеоперационных рубцов и т.д.
Грыжевой мешок – это выпячивание париетальной брюшины через грыжевые ворота. В нем различают устье, шейку, тело и дно. Устьем именуется отдел грыжевого мешка, граничащий с брюшной полостью. Шейкой называется часть грыжевого мешка, находящаяся в толще брюшной стенки. Самый большой сегмент грыжевого мешка представлен телом, а дистальный – его дном. Грыжевой мешок может быть различной величины и формы (шаровидной, грушевидной и т.д.), одно– и многокамерным. Содержимым наружной грыжи являются наиболее подвижные органы брюшной полости, чаще всего петли тонкого кишечника и сальник.
Под внутренними грыжами живота понимают грыжи, образующиеся в результате попадания органов брюшной полости в брюшные карманы и складки, отверстия в брыжейках и связках, а также при проникновении внутренностей в соседние полости через дефекты в перегородках, разделяющих их. Внутренние грыжи локализуются в местах перехода одного отдела желудочно–кишечного тракта в другой: двенадцатиперстной кишки в тощую (двенадцатиперстно–тощекишечная ямка); подвздошной кишки в слепую (верхний и нижний подвздошно–слепокишечный карманы); в кармане позади слепой и сигмовидной кишок, между пластинками брыжейки тонкой и толстой кишок; в отверстиях брыжейки червеобразного отростка, желудочно–ободочной связки, серповидной связки печени, в карманах и отверстиях широкой маточной связки, в винсловом отверстии и дугласовом кармане, в дефектах диафрагмы.
Классификация.
Различают осложнения наружных и внутренних грыж. К осложнениям наружных грыж относятся ущемление, капростаз, невправимость, воспаление. Осложнения внутренних грыж в основном представлены ущемлением.
Ущемление грыж
Ущемлением грыжи (incarceratio hernia) называется такое ее состояние, при котором наступает внезапное сдавление грыжевого содержимого в грыжевых воротах.Историческая справка.
Первую операцию грыжесечения при наружной ущемленной грыже выполнил Franco (XVII ст.). Первоначально операция при ущемленных грыжах состояла в рассечении ущемляющего кольца в случае жизнеспособности кишки или наложения кишечного свища при ее гангрене. В 1700 г. Littre произвел резекцию омертвевшей кишки и вывел оба конца ее в рану, не соединив их, Он же описал ущемление меккелева дивертикула в паховой грыже (1700). De la Peyroni (1723) удалил у больного с ущемленной грыжей гангренозно–измененную кишку и восстановил целостность желудочно–кишечного тракта наложением межкишечного анастомоза. В 1785 г. Richter описал пристеночное ущемление грыжи.
Ущемление наружных грыж.
Распространенность.
Ущемление наружных грыж встречается у 5–30% больных грыжами. В большинстве случаев ущемляются паховые, бедренные и пупочные грыжи, что связано с большей их распространенностью. У мужчин преобладает ущемление паховых грыж, у женщин – бедренных и пупочных. Наиболее часто ущемляются тонкая кишка, реже толстая кишка и большой сальник, органы, имеющие мезоперитонеальное положение: мочевой пузырь, слепая кишка и т.д.
Этиология и патогенез.
По механизму возникновения различают три вида ущемления: 1. эластическое 2. каловое 3. смешанное (сочетанное, комбинированное).
Чаще встречается эластическое ущемление, являющееся одной из форм странгуляции кишечника. Оно развивается в связи с внезапным повышением внутрибрюшного давления. Это сопровождается перерастяжением грыжевых ворот и проникновением в грыжевой мешок большего, чем в норме, количества внутренних органов. После исчезновения напряжения мышечно–апоневротического слоя брюшной стенки размеры грыжевых ворот уменьшаются и оказавшиеся в грыжевом мешке органы самостоятельно вправиться в брюшную полость не могут. Происходит их сдавление снаружи в грыжевых воротах. Возникающая при компрессии сосудов и нервов брыжейки или стенки кишки вследствие ишемии боль приводит к развитию стойкого мышечного спазма вокруг грыжевых ворот, что еще больше нарушает крово– и лимфообращение.
Каловое ущемление возникает в результате сдавления в грыжевых воротах переполненной приводящей части кишечной петли и отводящего сегмента вместе с брыжейкой. Развитию калового ущемления способствуют факторы, замедляющие моторику кишечника: преклонный возраст больных, сращение кишечника со стенкой грыжевого мешка и т.д.
При усилении давления грыжевых ворот на содержимое грыжи к каловому ущемлению присоединяется эластическое и развивается комбинированное ущемление.
Патологическая анатомия.
Происходящие в организме больных изменения зависят от вида ущемленного органа и сроков ущемления. При сдавлении в грыжевых воротах кишечной петли в области ущемления формируется странгуляционная борозда. Из–за возникающего венозного стаза форменные элементы крови и плазма пропотевают в ее стенку, полость грыжевого мешка и просвет кишки. Жидкость, скапливающаяся в грыжевом мешке (грыжевая вода), вначале бесцветная, а затем при пропотевании эритроцитов становится красно–бурой (геморрагической).
В случае внезапного одновременного сдавления в грыжевых воротах вен и артерий жидкость в грыжевом мешке не накапливается, формируется "сухая гангрена" ущемленной кишки. В просвете ущемленной кишки происходит интенсивное размножение кишечной микрофлоры с образованием большого количества токсинов. Одновременно прогрессируют некротические изменения в стенке кишечника, вначале захватывающие слизистую оболочку, а затем мышечный слой и серозу. При некрозе кишечной стенки микрофлора проникает в полость грыжевого мешка, вызывая нагноение экссудата и воспаление окружающей грыжевой мешок клетчатки. Формируется флегмона грыжевого мешка.
Ущемление кишечника сопровождается существенными изменениями в его приводящей петле, в которой накапливается большое количество кишечного содержимого. Оно растягивает кишку, сдавливает внутристеночные сосуды, нарушая крово– и лимфообращение, что вызывает повреждение слизистой оболочки. Одновременно нарушение крово– и лимфообращения происходит и в отводящей части ущемленной кишки. Разложение содержимого в приводящей петле кишки сопровождается всасыванием в кровь токсинов. Возникающая при ущемлении рефлекторная рвота способствует быстрому развитию дефицита воды и микроэлементов. Прогрессирование некроза кишки, флегмоны грыжевого мешка приводит к гнойному перитониту.
В случае изолированного ущемления неполых органов (сальник и т.д.) в ущемленных сегментах постепенно развиваются некротические изменения с образованием в более поздние сроки воспалительных инфильтратов.
В зависимости от вида ущемления помимо антеградного выделяют ретроградное, а также пристеночное ущемление (грыжа Рихтера). При ретроградном ущемлении две кишечные петли находятся в грыжевом мешке, а промежуточная, претерпевающая наибольшие изменения, в брюшной полости, т.е. кишечные петли располагаются в виде латинской буквы W. Данный вид ущемления вызывает быстрое развитие перитонита. Пристеночное ущемление характеризуется сдавлением в узком грыжевом кольце только части стенки кишки по свободному (противобрыжеечному) и реже боковому краю. Грыжа Рихтера не сопровождается клиникой острой кишечной непроходимости, но приводит к быстрому некрозу и перфорации ущемленного участка стенки.
При ущемлении в грыже меккелева дивертикула (грыжа Литтре) или червеобразного отростка могут наблюдаться: 1. Изолированное ущемление указанных органов, что сопровождается их некрозом. 2. Ущемление меккелева дивертикула и червеобразного отростка вместе с несущим участком стенки кишки (по типу грыжи Рихтера). 3. Ущемление, при котором слепой конец меккелева дивертикула и червеобразный отросток лежат в брюшной полости. 4. Ущемление меккелева дивертикула или червеобразного отростка вместе с кишечной петлей.
Клиническая картина и диагностика.
Выраженность клинической картины при ущемлении грыж зависит от механизма ущемления и вида ущемленного органа.
Типичными признаками ущемления являются: 1. Появление боли в области ранее существовавшей или остро возникшей грыжи. 2. Напряжение и резкая болезненность при пальпации грыжевого выпячивания. 3. Невозможность вправления ранее вправимой грыжи. 4. Отсутствие передачи кашлевого толчка (отрицательный симптом кашлевого толчка).
Наиболее характерная клиническая картина отмечается при эластическом ущемлении кишечника. В ее течении выделяют три периода: первый – болевой (шоковый), второй – мнимого благополучия, третий – разлитого перитонита.
Первый период сопровождается появлением сильной, постоянной боли в области грыжи. Наблюдаются бледность кожных покровов, тахикардия, падение АД. В ряде случаев развивается болевой шок. Поскольку ущемление кишки является одним из вариантов странгуляций, то вскоре возникают симптомы острой кишечной непроходимости.
Так, при ущемлении тонкой кишки больных беспокоят сильные схваткообразные боли, связанные с усилением перистальтики, многократная не приносящая облегчение рвота, вздутие живота. Не отходят газы и отсутствует стул. Для толстокишечной непроходимости характерны менее выраженный болевой синдром, нечастая рвота, тенезмы, асимметрия живота. Находят положительные симптомы Цеге–Мантейфеля (малая вместимость ампулы прямой кишки), Обуховской больницы (расширение ампулы прямой кишки и зияние заднепроходного отверстия вследствие ослабления тонуса сфинктера прямой кишки). Перкуторно у больных с ущемлением кишечной петли определяется тимпанит, а при скоплении в полости грыжевого мешка жидкости – тупой звук. При аускультации в брюшной полости выявляют непрерывные кишечные шумы, а на обзорной рентгенограмме живота – переполненные газом, перерастянутые кишечные петли с горизонтальными уровнями жидкости (чаши Клойбера).
С наступлением некроза кишечной стенки и гибели ее интрамурального нервного аппарата интенсивность боли в области грыжевого выпячивания уменьшается (период мнимого благополучия). Вместе с тем другие местные симптомы ущемленияостаются.
Прогрессирование некроза кишечной стенки, флегмоны грыжевого мешка и острой кишечной непроходимости приводит к появлению перитонита. Общее состояние значительно ухудшается. Живот увеличивается в объеме, появляется каловая рвота, снижаются показатели гемодинамики.
У большинства пациентов с грыжей Рихтера симптомы ущемления выражены незначительно: отсутствуют сильные боли, не определяются выпячивание и резистентность над ним, нет признаков кишечной непроходимости. Больных беспокоят постоянные ноющие боли в области ущемления.
В ряде случаев возникает понос. При невыраженном подкожно–жировом слое в месте ущемления пальпируется небольшое болезненное плотное образование.
При ущемлении мочевого пузыря, что чаще отмечается при скользящих грыжах, пациентов беспокоят боли над лобком, дизурические расстройства (частое и болезненное мочеиспускание).
Для ущемления придатков матки характерны сильные боли, иррадиирующие в малый таз и промежность.
Ущемление большого сальника сопровождается появлением постоянной боли в области грыж, отсутствием признаков острой кишечной непроходимости. Такая же скудная клиническая симптоматика наблюдается и при изолированном ущемлении червеобразного отростка, меккелева дивертикула, жировых привесков толстого кишечника. Часто указанные формы ущемления диагностируются только на операции.
Иногда течение ущемленной грыжи осложняется самопроизвольным вправлением. Опасность самопроизвольного вправления состоит в том, что возникшие в результате сдавления морфологические изменения стенки кишки могут подвергаться дальнейшему прогрессированию вплоть до некроза с развитием перитонита и кровотечения. При их наличии больные подлежат экстренной операции, а при отсутствии – динамическому наблюдению в условиях хирургического стационара обычно в течение 1–2 дней. В случае появления симптомов воспаления брюшины, внутривенного кровотечения выполняют экстренную операцию, а при отсутствии осложнений – плановое грыжесечение. Если больные с самопроизвольно вправившимися грыжами, протекавшими в раннем периоде заболевания без осложнений, не оперируются, то в дальнейшем у них может развиться хроническая кишечная непроходимость из–за образования спаек между ущемленными петлями кишечника, кишечником и париетальной брюшиной, смежными органами, рубцевания ущемленного сегмента кишки.
Насильственное вправление грыж часто осложняется разрывом грыжевого мешка с повреждением заключенных в нем органов, развитием перитонита или кровотечением. Нередко происходит отрыв париетальной брюшины в области шейки грыжевого мешка с последующим перемещением ущемленной петли вместе с ущемляющим кольдом в брюшную полость или в предбрюшинное пространство. Возможно перемещение ущемленного органа из одной части мешка в другую. В таких случаях типичное для ущемления грыжевое выпячивание исчезает, но сохраняется резкая боль в области грыжи. Пациенты с насильственно вправленными грыжами подлежат экстренной госпитализации в хирургические стационары и комплексному обследованию. По показаниям им выполняется экстренная операция.
Дифференциальная диагностика.
Ущемленные грыжи дифференцируются прежде всего с ложным ущемлением, капростазом, невправимостью, натечными абсцессами, тромбозом вен, локализующихся в области грыжевого мешка, метастазами опухолей в лимфоузлы, расположенные в области грыжевых выпячиваний.
Ложное ущемление (грыжа Брока) возникает при воспалении содержимого грыжевого мешка в результате проникновения в него инфекции (экссудата из брюшной полости, с соседних органов, с тканей передней брюшной стенки). Чаще причинами ложного ущемления являются острый аппендицит, острый холецистит, острый панкреатит, прободение полых органов. Грыжевое выпячивание увеличивается в размерах, становится напряженным, болезненным. Вместе с тем определяется симптом кашлевого толчка. Отсутствуют признаки острой кишечной непроходимости. На операции у больных с ложным ущемлением находят гиперемию грыжевого мешка, воспалительные изменения содержащихся в нем органов.
Натечные абсцессы на бедре и в паховой области в подавляющем большинстве случаев спускаются в lacuna musculorum, располагаясь латеральнее. При надавливании и в положении лежа они скрываются под пупартову связку. Такие абсцессы сопровождаются симптомом флюктуации.
Для тромбоза венозного узла большой подкожной вены у места ее впадения в глубокую вену бедра характерно появление болезненного плотного образования под паховой связкой. Вместе с тем отсутствует боль в животе, нет симптомов острой кишечной непроходимости. Подкожные вены на голени и в дистальном сегменте бедра варикозно расширены.
При метастазах опухолей в лимфатические узлы, расположенные в области грыжевого мешка (чаще у больных с пупочными, бедренными грыжами), находят безболезненное, плотное, не вправляющееся в брюшную полость образование. Общее состояние больных остается удовлетворительным.
У лиц с бедренным и паховым лимфаденитом определяется болезненное выпячивание плотноэластической консистенции, не вправляющееся в брюшную полость. Остается положительным симптом кашлевого толчка. Нет признаков острой кишечной непроходимости. Одновременно отмечаются повышение температуры тела, лейкоцитоз, увеличенная СОЭ.
Отличительные признаки копростаза и невправимости грыж изложены ниже.
Лечение.
Больные с ущемленными грыжами подлежат экстренной операции. Предварительно проводится предоперационная подготовка, направленная на коррекцию имеющихся нарушений функционального состояния сердечно–сосудистой, дыхательной систем, водно–электролитных нарушений. Объем хирургического вмешательства зависит от наличия флегмоны грыжевого мешка и перитонита.
При отсутствии флегмоны грыжевого мешка и перитонита операция выполняется под местной анестезией для предупреждения самопроизвольного вправления грыжевого содержимого. С этой же целью запрещается введение спазмолитиков, обезболивающих препаратов.
Операция производится в определенной последовательности: 1. I этап – послойное рассечение тканей до апоневроза и обнажение грыжевого мешка. 2. II этап – осторожное вскрытие грыжевого мешка у дна для профилактики повреждения содержащихся в нем органов. Этот этап является наиболее ответственным у больных со скользящими грыжами. При пальпации стенки грыжевого мешка у них определяют ее тестоватую консистенцию. После вскрытия мешка ассистент прочно удерживает ущемленный орган. Грыжевая вода удаляется. 3. III этап – рассечение ущемляющего кольца. Оно выполняется под контролем зрения, так как возможно ранение прилежащих к нему со стороны брюшной полости органов. Разрез грыжевых ворот у лиц с бедренными грыжами производится медиально от шейки грыжевого мешка для предупреждения повреждения лежащей латеральнее бедренной вены. При пупочной грыже ущемляющее кольцо рассекается в поперечном направлении в обе стороны, а при паховой косовертикально по ходу пахового канала кверху. 4. IV этап – определение жизнеспособности удаленных органов. Признаками жизнеспособности кишки являются быстрое исчезновение багрово–цианотичной окраски стенки с восстановлением ее обычного цвета, активные перистальтические сокращения кишки, хорошая пульсация сосудов брыжейки. При отсутствии уверенности в жизнеспособности кишки в ее брыжейку вводится 100–150 мл 0,25% раствора новокаина, ущемленная кишка орошается теплым изотоническим раствором натрия хлорида (обкладывается салфетками, смоченными в растворе). Если в течение 10–15 мин перечисленные выше признаки жизнеспособности кишки не появляются, ущемленная петля (петли) резецируется. Показаниями к резекции являются также наличие обширных субсерозных гематом, глубокая странгуляционная бороздка. У больных с ущемлением скользящих грыж для оценки жизнеспособности части органа, не покрытого париетальной брюшиной, производится срединная лапаротомия. 5. V этап – резекция нежизнеспособных органов. При нежизнеспособности кишечника удаление производится по следующим правилам: приводящая петля пересекается от видимой границы некроза со стороны слизистой не менее чем на 30–40 см, а отводящая – на 15–20 см. Целостность желудочно–кишечного тракта восстанавливается формированием энтероэнтероанастомоза по одному из известных способов. В случае некроза слепой кишки выполняется гемиколэктомия с наложением илеотрансверзоанастомоза. При нежизнеспособности стенки мочевого пузыря производится резекция мочевого пузыря с формированием эпицистостомы, а в запущенных случаях – тампонирование околопузырной клетчатки и высокая эпицистостома. Если в грыжевом мешке находят сальник, жировые привески толстой кишки, то их удаляют. Удалению подлежат ущемленный червеобразный отросток и меккелев дивертикул. 6. VI этап – перевязка шейки грыжевого мешка, иссечение избытка грыжевого мешка, пластика грыжевых ворот (определяется в зависимости от вида ущемленной грыжи). Преимущество отдают малотравматичным способам пластики.
У больных с флегмоной грыжевого мешка операцию начинают со срединной лапаротомии. Производят резекцию кишки в пределах жизнеспособных тканей. Концы удаленной части кишки прошивают аппаратом или лигируют. При отсутствии перитонита восстанавливают целостность кишечника наложением одного из вариантов межкишечных анастомозов. В случае перитонита операцию завершают илеостомией. Затем осуществляют изоляцию брюшной полости от грыжевого мешка, для чего вблизи устья грыжевого мешка рассекают париетальную брюшину и отслаивают в стороны от него на 1,5–2 см. Приводящий и отводящий сегменты резецированной кишки в непосредственной близости от грыжевых ворот прошивают двумя рядами механических швов (перевязка лигатурой) и пересекают между ними. Участок кишечной петли удаляют вместе с брыжейкой. Париетальную брюшину над слепыми концами кишки, находящимися в грыжевом мешке, сшивают. Затем ушивают рану передней брюшной стенки. Только после этого вскрывают грыжевой мешок, удаляют гнойный экссудат, рассекают ущемляющее кольцо, извлекают ущемленную кишку и ее слепые концы, отделяют устье и шейку грыжевого мешка от грыжевых ворот. Затем грыжевой мешок вместе с измененными окружающими тканями удаляют. Пластику грыжевых ворот не производят. Для профилактики послеоперационной эвентрации на края грыжевых ворот накладывают несколько швов. Рану дренируют.
В послеоперационном периоде назначаются препараты, нормализующие функциональное состояние сердечно–сосудистой и дыхательной систем, проводится дезинтоксикационная терапия. При флегмоне грыжевого мешка применяются антибиотики. Особое внимание уделяется состоянию двигательной активности кишечника. При явлениях послеоперационного пареза проводится назогастральная зондовая декомпрессия желудка, внутривенно вводится 50–60 мл 10% раствора натрия хлорида, внутримышечно – прозерин, выполняется двусторонняя новокаиновая блокада по А. В. Вишневскому.
Только у больных, находящихся в крайне тяжелом состоянии из–за тяжелых сопутствующих заболеваний, при отсутствии перитонита и сроке ущемления не более 2 ч допустима попытка осторожного вправления грыжевого содержимого в брюшную полость. До вправления подкожно вводятся спазмолитики и обезболивающие препараты, аспирируется желудочное содержимое, ставится очистительная клизма, опорожняется мочевой пузырь, больной погружается в теплую ванну. Если выполненная манипуляция неэффективна, больного укладывают на кушетку с опущенным головным концом. Он делает несколько глубоких вдохов. Хирург осуществляет равномерное давление на грыжевое выпячивание, направляя усилие перпендикулярно по отношению к грыжевым воротам, стараясь протолкнуть грыжевое содержимое без особых усилий в брюшную полость. Безуспешность попытки вправления грыжи является показанием к экстренному хирургическому вмешательству невзирая на риск операции.
Ущемление наружных грыж редкой локализации.
Поясничные грыжи.
При ущемлении поясничных грыж боль локализуется в области треугольника Пти, промежутке Гринфельта–Лесгафта. Содержимым поясничных грыж являются петли тонкой кишки, сальник, реже восходящая и слепая кишка. Во время операции после выделения и вскрытия грыжевого мешка, оценки жизнеспособности ущемленных органов, ушивания шейки грыжевого мешка и удаления его избытка на поясничные мышцы накладываются узловые швы.Грыжи спигелиевой линии.
Ущемление грыж спигелиевой линии сопровождается появлением боли в области перехода мышечной части поперечной мышцы живота в сухожильное растяжение. Чаще такие грыжи встречаются у многорожавших женщин. Они могут быть интерстициальными, предбрюшинными и подкожными. Содержимым их являются сальник, петли тонкого кишечника, реже слепая и поперечная ободочная кишка. При осмотре находят по наружной поверхности прямой мышцы живота болезненное грыжевое выпячивание эластической консистенции чаще небольших размеров. Для обнажения грыжи используют поперечный или косой доступ. Пластика грыжевого дефекта осуществляется путем создания дубликатуры апоневроза и ушивания межапоневротического пространства в месте прохождения грыжевого мешка.Седалищные грыжи.
У больных с ущемлением седалищных грыж отмечаются боли в ягодичной области. Грыжевое выпячивание пальпируется в области большой ягодичной мышцы, реже на задней поверхности бедра, по ходу седалищного нерва. Такие грыжи наблюдаются преимущественно у женщин, в ⅔ случаев локализуются справа. Объем хирургического вмешательства заключается в выделении грыжевого мешка через разрез в ягодичной области. Пластика грыжевых ворот производится послойным ушиванием мышц, иногда с применением пластики фасцией.Запирательные грыжи.
Для ущемления запирательных грыж характерно появление боли в паховой области соответственно локализации грыжи. Боль усиливается при кашле, движении и иррадиирует по внутренней поверхности бедра (симптом Ховшип–Ромберга). Нога у больных приведена и несколько согнута в тазобедренном и коленном суставах. Отведение и ротация бедра кнутри резко болезненны (симптом Тревеса). Пальпаторно находят округлое, болезненное образование эластической консистенции, располагающееся ниже горизонтальной ветви лонной кости под гребешковой и длинной приводящей мышцами. Для выделения грыжи используются позадилонный предбрюшинный и бедренный доступы, лапаротомия.Предбрюшинный доступ включает рассечение кожи и переднего листка влагалища прямой мышцы живота, отслаивание париетальной брюшины и отведение ее кверху, что позволяет выделить грыжевой мешок. После выполнения основного этапа операции внутреннее отверстие запирательного канала закрывается узловыми швами, захватывающими края ножек внутренней запирательной мышцы.
При бедренном доступе делают разрез мягких тканей длиной 8–10 см между лонным бугорком и бедренной артерией. Разделяя гребешковую и длинную приводящую мышцы, подходят к грыжевому мешку. Закрывают грыжевые ворота наложением швов на ножки наружной запирательной мышцы. Если ущемленная запирательная грыжа диагностируется после выполнения лапаротомии, кишечные петли извлекаются из запирательного канала. Для облегчения этой процедуры иногда дополнительно рассекается запирательная перепонка книзу и медиальнее от запирательной артерии, лежащей снаружи от шейки грыжевого мешка. Затем грыжевой мешок вворачивается в брюшную полость, собирается 3–4 рядами швов в складку и прошивается по окружности выходного отверстия к париетальной брюшине с захватом в швы надкостницы лобковой кости и внутренней запирательной мышцы вне ее сосудисто–нервного пучка.
Промежностные грыжи.
Различают ущемление передних и задних промежностных грыж. У мужчин преобладает ущемление передних промежностных грыж, у женщин – передних и задних. Передние промежностные грыжи сообщаются с передним дугласовым пространством и локализуются у женщин в области больших половых губ. При задних грыжах грыжевой мешок сообщается с задним дугласовым пространством и выходит на промежность в седалищно–прямокишечной впадине. Задняя промежностная грыжа иногда проходит между мышцей, поднимающей задний проход, и подвздошно–копчиковой и копчиковой мышцами, через щели в m. levator ani. Содержимым ущемленных промежностных грыж являются петли кишечника, мочевой пузырь, матка с придатками. Для хирургического лечения используют промежностные доступы соответственно локализации грыжи. После вскрытия грыжевого мешка, оценки жизнеспособности ущемленных органов производится один из вариантов пластики тазового дна.Внезапное ущемление ранее не выявлявшихся грыж.
Анатомической предпосылкой для возникновения внезапного ущемления ранее не выявлявшейся грыжи является наличие в типичных местах образования грыж выпячивания брюшины (предсуществующий грыжевой мешок). При внезапном повышении внутрикишечного давления выпячивание брюшины увеличивается и проникшие в него органы ущемляются. Во время объективного осмотра у такой категории больных находят типичные признаки ущемления. Правильной постановке диагноза помогает отсутствие в анамнезе указаний на наличие в месте ущемления грыжи. Лечение больных с внезапным ущемлением ранее не выявляющихся грыж производится по общепринятым правилам.Ущемление внутренних грыж.
Грыжи Трейтца (околодвенадцатиперстнокишечные грыжи).
Локализуются в области recessus duodenojejunal. Наблюдаются в 29–40% случаев внутрибрюшинных грыж. Подразделяются на право– и левосторонние. При правосторонних грыжах грыжевой мешок располагается в правой половине брюшной полости, ниже поперечной ободочной кишки, при левосторонних – слева от связки Трейтца, позади желудка. Грыжевой мешок грыжи Трейтца может вмещать большую часть тонкого кишечника.
Срединная грыжа.
Образуется при дефекте в брыжейке поперечной ободочной кишки. При наличии щели в mesocolon или в lig. gastrocolica петли кишечника иногда проникают в полость малого сальника.
Межсигмовидиая грыжа.
Локализуется в области recessus intersyg moideus или в дефектах брыжейки сигмовидной кишки. Грыжевой мешок располагается внутри или кнаружи от брыжейки сигмовидной кишки.
Клиническая картина и диагностика.
Типичных симптомов ущемления внутренних грыж не существует. При внутреннем ущемлении полых органов преобладают симптомы острой кишечной непроходимости, а при развитии некроза кишечной стенки – перитонита. Ущемление сальника сопровождается появлением в брюшной полости боли различной интенсивности, но постоянной локализации. Периодически возникающее ущемление кишечника в срединной грыже, грыже Трейтца симулирует картину обострения язвенной болезни, панкреатита, стеноза выходного отдела желудка и двенадцатиперстной кишки.
Наличие ущемления внутренней грыжи может быть заподозрено при неоднократном возникновении приступов острых болей в брюшной полости, самостоятельно разрешающейся кишечной непроходимости в случае отсутствия патологии со стороны органов живота, доказанной на основании результатов комплексного обследования. В момент ущемления при пальпации брюшной полости нередко находят округлое тестоватое образование в области, соответствующей ущемлению внутренних органов.
Рентгенологически наблюдаются признаки острой кишечной непроходимости, при ущемлении диафрагмальных грыж – смещение желудка или кишечника за пределы брюшной полости. Окончательно диагноз ущемления внутренней грыжи устанавливается только на операции.
Лечение.
При ущемленных внутренних грыжах проводится оперативное лечение. После устранения ущемления дефекты брыжеек, связок, сальника ушиваются. При грыжах Трейтца, сальникового отверстия осторожно накладываются швы на складки брюшины в области ущемляющего отверстия. При наличии дефектов в большом сальнике он резецируется. Нежизнеспособные ущемленные органы резецируются в пределах здоровых тканей. Целостность желудочно–кишечного тракта восстанавливается по одному из известных способов. В случае перитонита формируется илеостома.
Воспаление грыжи
Воспалением грыжи (inflammatio hemiae) называют патологическое состояние, развившееся в результате инфицирования грыжевого мешка.Оно наблюдается: 1. При остром воспалительном процессе в органах, находящихся в просвете грыжевого мешка (острый аппендицит, дивертикулит, перекрут маточной трубы, яичника). 2. Вследствие воспаления грыжи в результате проникновения экссудата из брюшной полости. 3. При распространении инфекции на грыжевой мешок со стороны кожных покровов (пиодермия, фурункул, инфицированная хроническая экзема) и органов, расположенных в непосредственной близости (лимфаденит, орхит, эпидидимит и т.д.).
Клиническая картина и диагностика.
Воспаление грыжи сопровождается появлением в области грыжевого выпячивания постоянно усиливающейся боли. Грыжевое выпячивание увеличивается в объеме. Ткани над ним становятся отечными, инфильтрированными. Постепенно появляется флюктуация. Вправление грыжевого содержимого становится невозможным. Постепенно развивается клиника острой кишечной непроходимости. Состояние больных прогрессивно ухудшается: повышается температура тела, наблюдаются озноб, рвота, неотхождение стула и газов.
Лечение.
Дифференцированное. Если причиной инфицирования грыжи являются воспалительные процессы на кожных покровах, проводится консервативное лечение. Грыжесечение выполняется после купирования воспалительных процессов на коже. В остальных случаях показана экстренная операция с удалением источника инфицирования грыжевого мешка.
Невправимость грыж
Невправимостью грыжи (hernia inreponibilis) называется такое ее состояние, при котором вправления грыжевого содержимого достичь не удается, а симптомы ущемления или воспаления грыжи отсутствуют. Невправимость развивается в результате образования сращений между содержащимися в грыжевом мешке органами, а также органами и стенкой грыжевого мешка. Формирующиеся сращения часто разделяют полость грыжевого мешка на отдельные камеры (полости), в которых происходит приращение вышедших в грыжевой мешок органов. Образованию сращений способствуют травмы грыжевого мешка, частое ущемление грыжевого содержимого. Невправимость может быть частичной и полной. В большинстве наблюдений невправимость осложняет течение больших паховых, бедренных и пупочных грыж.Клиническая картина и диагностика.
Проявления невправимых грыж зависят от содержащихся в них органов и сроков существования заболевания. При сращении со стенкой грыжи кишечника постепенно развивается картина хронической кишечной непроходимости. У больных с невправимыми паховыми грыжами отмечается учащенное мочеиспускание. Во время осмотра больных с невправимыми грыжами находят положительные симптомы кашлевого толчка, пальпируемое образование мягкой, эластической консистенции. При аускультации над ним определяется кишечная перистальтика, а при перкуссии – тимпанит (содержимое кишечника) или притупление (содержимое сальника).
Наиболее грозными осложнениями невправимых грыж являются их ущемление и спаечная кишечная непроходимость.
Лечение.
Оперативное.
Копростаз
Копростазом (каловый застой, obstructio hemiae) называется состояние, при котором просвет содержащейся в грыжевом мешке толстой кишки закупоривается каловыми массами, вызывая нарушение ее проходимости. Появлению копростаза способствует снижение двигательной активности кишечника, что чаще встречается у тучных больных, ведущих малоподвижный образ жизни, страдающих запорами, при невправимых грыжах.Клиническая картина и диагностика.
Копростаз развивается медленно. Симптомы данного осложнения проявляются по мере заполнения толстой кишки каловыми массами. Грыжевое выпячивание постепенно увеличивается в размерах, малоболезненное, тестоватой консистенции, незначительно напряжено. Симптом кашлевого толчка определяется, периодически появляется рвота. Общее состояние больных изменяется незначительно. Перекрытие просвета кишечника неполное. Прогрессирование копростаза осложняется каловым ущемлением.
Лечение.
Консервативное. Ставится сифонная клизма с глубоким проведением зонда до сигмовидной кишки, выполняется двусторонняя паранефральная новокаиновая блокада. Применение слабительных средств не рекомендуется, так как возникающее при этом перерастяжение приводящей петли способствует переходу копростаза в каловую форму ущемления.
Ободочная кишка
Анатомо–физиологические сведения
В состав ободочной кишки входят слепая, восходящая, поперечная, нисходящая и сигмовидная кишки. Длина всех ее отделов колеблется от 1 до 2 м, а диаметр просвета – от 6–7 см (слепая кишка) до 2–3 см (ректосишовидный переход). Характерной чертой ободочной кишки является наличие на ее стенке продольных тяжей (тений), которые начинаются от основания червеобразного отростка и продолжаются до ректосигмовидного перехода. Они расположены на одинаковом расстоянии друг от друга, при этом один из них называется брыжеечным (в области прикрепления брыжейки), второй – сальниковым (он тесно связан с сальником), третий – свободным (лежит свободно). Ширина их составляет около 1 см. Мышечные волокна ободочной кишки расположены циркулярно, а между ними имеются свободные промежутки, что обусловливает ее складчатость (гаустрацию). Она более выражена в правых отделах ободочной кишки. Вдоль свободной и сальниковой тений находятся жировые привески, число которых увеличивается в дистальном направлении. В их основании проходят кровеносные сосуды. Пересечение последних во время операции позволяет судить об адекватности кровоснабжения кишечной стенки.В ободочной кишке различают изгибы: правый (печеночный) и левый (селезеночный) углы.
Слепая кишка имеет тонкую стенку и широкий диаметр просвета. В месте илеоцекального перехода со стороны слизистой определяется валик. В области отхождения трех тений располагается основание червеобразного отростка. Слепая кишка, за исключением небольшого участка задней поверхности, покрыта брюшиной со всех сторон.
Восходящая ободочная кишка имеет длину от 12 до 25 см. Передняя и частично боковые ее поверхности покрыты брюшиной. Забрюшинная ее часть предлежит к жировой капсуле правой почки и нисходящему отделу двенадцатиперстной кишки. Позади нее проходит правый мочеточник.
Правый угол ободочной кишки расположен под правой долей печени. Он может быть прямым, тупым и острым. Сзади к нему предлежит почка.
Поперечная ободочная кишка, длина которой 40–50 см, фиксирована в области своего правого и левого флангов, средняя ее часть может свисать в полость малого газа. К передней стенке кишки фиксирован большой сальник. Поперечная ободочная кишка на всем протяжении покрыта брюшиной, за исключением места прикрепления брыжейки.
Левый угол ободочной кишки располагается у нижнего полюса селезенки. Диафрагмально–ободочной связкой он фиксирован к диафрагме и селезенке и покрыт со всех сторон брюшиной. Исключение составляет только небольшой участок, прилежащий к хвосту поджелудочной железы. Этот отдел ободочной кишки соприкасается с жировой капсулой левой почки и диафрагмой. В связи с указанными анатомическими особенностями мобилизацию левого угла ободочной кишки следует производить с особой осторожностью.
Нисходящая ободочная кишка имеет несколько большую длину, чем восходяшая (30 см и более). Спереди она покрыта брюшиной, а сзади ттредлежит к забрюшинному пространству, где проходит левый мочеточник. Это следует учитывать при ее мобилизации.
Непосредственным продолжением нисходящей ободочной кишки является сигмовидная кишка, длина которой варьирует от 20 до 90 см и более, Жировые привески здесь особенно многочисленны. Брюшиной не покрыта лишь задняя стенка кишки, где прикрепляется ее брыжейка. Последняя обычно хорошо развита, что способствует завороту сигмовидной кишки.
Кровоснабжение ободочной кишки осуществляется за счет верхней и нижней брыжеечных артерий. Отходящие от них магистральные сосуды образуют аркады. Те из них, которые наиболее близко расположены к стенке кишки, называются маргинальными или краевыми. Сосуду, отходящие от этих аркад, являются конечными. В области левого угла ободочной кишки образуются анастомозы между верхним и нижним брыжеечными сосудами (дуга Риолана). Кровоснабжение слепой и восходящей кишок обеспечивается конечной ветвью верхней брыжеечной артерии (подвздошно–ободочная артерия). Более проксимальные отделы восходящей и правый угол ободочной кишок получают кровоснабжение из правой артерии толстой кишки, которая отходит от верхней брыжеечной артерии. Наиболее крупным стволом верхнебрыжеечной артерии является средняя артерия толстой кишки, которая, разделяясь на левую и правую ветви, снабжает кровью правый угол толстой кишки и проксимальные ⅔ поперечной ободочной. Левый угол ободочной кишки, нисходящий ее отдел, сигмовидная кишка снабжаются кровью за счет нижней брыжеечной артерии, отходящей от аорты. Крупной ее ветвью является левая артерия толстой кишки, которая затем разделяется на восходяшую и нисходящую ветви. Последняя анастомозирует с сигмовидными артериями. Во время операции на ободочной кишке необходимо учитывать, что кровоснабжение ее имеет много вариантов.
Отток крови от ободочной кишки происходит по мельчайшим сосудам, которые, постепенно соединяясь, образуют более крупные венозные стволы, идущие в брыжейке параллельно с одноименными артериями. Венозная кровь от правой половины ободочной кишки оттекает по подвздошно–толстокишечной, правой и средней венам толстой кишки, которые вместе с сосудами тонкого кишечника образуют верхнебрыжеечную вену. Отток крови от левой половины ободочной кишки происходит по левой вене толстой кишки и по сигмовидным венозным стволам, которые, сливаясь в общий ствол, формируют нижнюю брыжеечную вену. Последняя располагается слева от нижней брыжеечной артерии. За поджелудочной железой она сливается с селезеночной, затем с верхнебрыжеечной, вследствие чего образуется ствол воротной вены.
Лимфатические узлы располагаются у самой стенки кишки (по краю брыжейки), по ходу краевых артерий и крупных артериальных стволов, а также в области устья крупных артерий (основные лимфоузлы). Отток лимфы может осуществляться не только в центральном направлении, в сторону грудного протока, но и в сторону паховой области,
Иннервация ободочной кишки происходит за счет ветвей чревного, верхнего и нижнего брыжеечных сплетений, в состав которых входят как симпатические, так и парасимпатические нервные волокна.
Функциями ободочной кишки являются всасывательная, пищеварительная, двигательная и выделительная. Обычно через 3–6 ч после еды пищевой химус поступает в толстую кишку, по которой он постепенно продвигается в течение 24–36 ч.
Всасывание и переваривание пищевых масс происходит в основном в тонком кишечнике. Тем не менее в правых отделах толстой кишки всасывается в сутки около 500 мл жидкости, а также находящиеся в ней аминокислоты, моносахариды, жиры и жирные кислоты. Здесь же происходит расщепление глюкозы и синтез витаминов группы В, витамина К, рибофлавина, тиамина, кислот {фолиевой, никотиновой). В толстой кишке образуются конечные продукты распада белков (индол, скатол, сероводород).
Выделяют четыре типа моторики ободочной кишки. Первый тип моторики характеризуется сокращением мышечной оболочки, что способствует поддержанию тонуса кишечной стенки. При втором типе моторики сокращения кишки более значительные, они имеют прямое отношение к продвижению кишечного содержимого. Третий тип моторики, для которого характерна небольшая частота движений, поддерживает внутрикишечное давление. Четвертый тип моторики заключается в возникновении редких (2–3 раза в день), но мощных пропульсивных волн, способствующих продвижению кишечного содержимого.
По данным В. Д. Федорова, в толстой кишке различают: сфинктер Варолиуса – место впадения подвздошной кишки в толстую, сфинктер Бузи – граница слепой и восходящей кишки, сфинктер Гирша – граница средней и верхней третей восходящей кишки, сфинктер Кеннона–Бема – граница правой и средней третей поперечной ободочной кишки, сфинктер Хорста – середина поперечной ободочной кишки, левый сфинктер Кеннона – в левом изгибе поперечной ободочной кишки, сфинктер Пайра–Штрауса – нижняя граница левого изгиба, сфинктер Балли – переход нисходящей кишки в сигмовидную, сфинктер Росси–Мутье – средняя треть сигмовидной кишки, сфинктер Оберна–Пирогова–Мутье – дистальная треть сигмовидной кишки.
Неспецифический язвенный колит
Неспецифический язвенный колит характеризуется хроническим воспалением ободочной и прямой кишок с язвенным поражением слизистой оболочки. Среди населения встречается с частотой 1:10 ООО. Более широко распространен в Англии, Северной Америке, Австралии, скандинавских странах.Этиология.
Несмотря на большой срок с момента описания заболевания (Wilks, Мохоп, 1875), этиология его остается неясной. Не нашли подтверждения инфекционная, аллергическая, пищевая, генетическая и другие гипотезы. В последнее время наиболее признанной является аутоиммунная теория в связи с выявлением в крови циркулирующих антител. Она согласуется с особенностями клинической картины, которая напоминает таковую при других аутоиммунных болезнях, сопровождающихся внеки шечными проявлениями, лимфоцитарной и эозинофильной инфильтрацией толстой кишки, а также получением положительных результатов при назначении стероидных гормонов.
Патогенез.
С учетом предполагаемой этиологии заболевания следует считать, что его патогенез обусловлен развитием аутоиммунных реакций. В ответ на продукцию слизистой оболочкой антигена образуются антитела, а затем комплекс антиген–антитело, которые вызывают воспалительные и некротические изменения в тканях. Кишечный дисбактериоз в этих условиях благоприятствует развитию воспалительного процесса в кишечной стенке, усиливает интоксикацию и аутосенсибилизацию организма. В патогенезе неспецифического язвенного колита важное место отводится пищевой (молоко) и лекарственной аллергии. Нередко (у ⅔ больных) обострение заболевания наступает после нервно–психического перенапряжения или стрессовых ситуаций, что подчеркивает их патогенетическое значение.
Патологическая анатомия.
Характеризуется разнообразной картиной, что зависит от формы и длительности заболевания. Воспалительный процесс начинается со слизистой оболочки. Он выражается в появлении гиперемии, отека, возникновении эрозий и поверхностных язв, которые могут сливаться в обширные поля. В тяжелых случаях язвы проникают до мышечного и серозного покровов, вызывая иногда перфорацию кишки. Кишечная стенка становится хрупкой, легкоранимой. Вследствие воспалительно–деструктивного процесса исчезают гаустры, кишечник превращается в ригидную трубку. На слизистой рядом с язвами обнаруживаются полиповидные образования (псевдополипы) различной величины и формы. Однако их никогда не бывает в прямой кишке. В отличие от болезни Крона при неспецифическом язвенном колите ободочная кишка сужается равномерно, а не сегментами. Характерной особенностью является выявление так называемых криптаабсцессов, что связывают со вторичным инфицированием слизистой оболочки. Гной из них выделяется в просвет кишки или рыхлую ткань подслизистого слоя, что сопровождается отслойкой и некрозом слизистой с образованием новых язв.
У больных с острой токсической дилатацией ободочная кишка (чаще поперечная) резко расширена, с истонченными стенками, которые могут подвергаться перфорации и вызывать развитие перитонита. При длительном течении заболевания выявляются дистрофические изменения паренхиматозных органов. При неспецифическом язвенном колите указанные выше изменения начинаются с прямой и сигмовидной кишок, а затем распространяются на другие отделы левой и правой половин ободочной кишки.
Клиническая картина.
Определяется формой заболевания и его осложнениями. У большинства больных неспецифический язвенный колит имеет хроническое течение с периодически возникающими обострениями. Периоды ремиссий могут продолжаться несколько лет. Больных беспокоят схваткообразные боли в животе, поносы с примесью крови до 10 раз в сутки. При обострении заболевания состояние пациентов ухудшается, симптоматика соответствует таковой при острой форме. Второй вариант хронической формы имеет непрерывное течение. Он представляет большую опасность, чем рецидивирующий.
Острая форма заболевания характеризуется тяжелым состоянием больных. Отмечаются сильные боли по всему животу, частота поносов достигает 30 раз в сутки и более с выделением крови, слизи и гноя. Наблюдается многократная рвота, повышается температура тела. Живот вздут и болезнен по ходу ободочной кишки. Развиваются гипотония и выраженная тахикардия, изменяется морфологический состав крови – лейкоцитоз сочетается с резким сдвигом лейкоцитарной формулы влево с выраженной токсической зернистостью нейтрофилов. Поносы вызывают обезвоживание организма, нарушаются водно–электролитный и кислотно–щелочной балансы. Постоянным признаком является прогрессирующая анемия.
Еще более тяжело протекает молниеносная форма неспецифического язвенного колита. Она продолжается несколько дней и заканчивается смертью вследствие развития острых осложнений (перфорация кишечника, кровотечение, токсическая дилатация).
Диагностика.
Основывается на клинической картине заболевания, данных ректороманоскопии, фиброколоноскопии, ирригографии. При эндоскопическом исследовании определяются отек, гиперемия и легкая кровоточивость слизистой, на поверхности которой имеются эрозии, язвы, иногда псевдоколиты. В процессе ирригографии выявляется симптом "водопроводной трубы", т.е. сужение просвета кишки и отсутствие гаустрации.
Дифференциальная диагностика.
Проводится прежде всего с болезнью Крона (гранулематозный колит), дизентерией, псевдомембранозным энтероколитом, имешическим колитом, туберкулезным колитом, раком толстой кишки. Особенности клинической картины болезни Крона изложены в соответствующих разделах. Диагноз дизентерии подтверждается бактериологическими и серологическими исследованиями. Псевдомембранозный энтероколит развивается в результате дисбактериоза из–за применения больших доз антибиотиков. Ведущую роль и грает стафилококковая инфекция, которая оказывается нечувствительной к антибактериальным препаратам. Это заболевание характеризуется тяжелым общим состоянием, поносами с примесью крови, гноя и мембранозных пленок как результат некроза слизистой толстой кишки. Ишемический колит развивается вследствие поражения висцеральных артерий (в том числе участвующих в формировании дуг Риолана) атеросклеротическим процессом или при неспецифическом аортоартериите. При амебиазе отсутствуют интоксикация, анемия, а при колоноскопии определяются глубокие язвы с подрытыми краями на фоне малоизмененной слизистой оболочки, отсутствуют псевдополипы. О туберкулезном поражении толстой кишки свидетельствуют наличие активного туберкулезного процесса в легких или указание на него в анамнезе; при колоноскопии язвы имеют подрытые края без тенденции к слиянию; рентгенологически выявляется тяжелый стеноз кишки, напоминающий раковую опухоль. Прогрессирование туберкулеза кишечника может привести к его непроходимости. Дифференциальная диагностика с раком толстой кишки основывается на результатах специальных методов исследования.
Лечение.
Комплексное. Диета должна быть высококалорийной, механически щадящей, содержать достаточное количество белков, жиров, витаминов. Из пищи исключают молоко и молочные продукты. Парентерально вводят растворы белков, глюкозы, электролитов, иногда переливают кровь. Назначают десенсибилизирующие и антишстаминные препараты (димедрол, пиполъфен, супрастин), витаминотерапию. Эффективно применение препаратов салициловой кислоты и сульфапиридина (салазопирин, сульфасалазин, салазопиридазин). При хорошей переносимости сульфасалазин назначают внутрь до 4–8 г в сутки или салазопиридазин до 2 г (курс 3–7 недель). В лечении больных язвенным колитом используется также гормонотерапия – кортикостероиды (преднизолон, гидрокортизон). Однако применять их следует с большой осторожностью, так как они часто вызывают серьезные осложнения в связи с побочным действием. В комплекс консервативного лечения целесообразно включать бактериостатические препараты (фталазол, энтеросептол).
Если такое лечение неэффективно, а также при развитии осложнений показано хирургическое вмешательство. При этом предпочтение отдается субтотальной резекции ободочной кишки с наложением илеостомы исигмостомы. Более радикальная операция – колпроктэктомия применяется реже из–за большой травматичности и невозможности в последующем создать естественный анус, хотя такие попытки предпринимались. У тяжелобольных производится отключение толстой кишки путем формирования двуствольной илеостомы. В последующем решается вопрос о возможности выполнения субтотальной резекции ободочной кишки.
Осложнения.
Перфорация ободочной кишки относится к наиболее частым осложнениям неспецифического язвенного колита. Она встречается примерно у 3 % больных. Диагностика ее не представляет особых трудностей, так как развиваются характерные признаки. Прежде всего на фоне имеющихся болей в животе появляются более выраженные боли, которые локализуются в подвздошных областях и сопровождаются напряжением мышц передней брюшной стенки. Диагноз подтверждается при наличии серповидной полоски воздуха в поддиафрагмальном пространстве во время рентгенологического исследования. Однако не всегда имеется типичная картина перфорации кишки, поэтому распознавание ее может вызывать известные затруднения. Особенно это касается тяжелых, ослабленных больных. Появление у них резкого ухудшения, выраженной тахикардии, гипотонии должно навести на мысль о возможной перфорации и развитии перитонита. Лечение при данном осложнении малоперспективно. Во–первых, такую менее травматичную операцию, как ушивание дефекта, выполнять на воспаленной кишке нецелесообразно из–за прорезывания швов. Кроме того, перфорации могут быть множественными или возникать после ушивания. Во–вторых, радикальные операции – тотальная и субтотальная колэкгомия – переносятся больными очень тяжело и дают высокий процент летальности, особенно если выполняются в поздние сроки. Поэтому при подозрении на перфорацию необходимо экстренно оперировать больных.
Массивные кровотечения как осложнение неспецифического язвенного колита встречаются редко. Обычно они требуют переливания большого количества крови (1–2 л и более) и хирургического лечения.
Синдром острой токсической дилатации толстой кишки впервые описан Madison и Bargen в 1951 г. Удельный вес этого осложнения составляет 5–10 %. Чаще оно встречается у больных с тяжелым течением язвенного колита. В основе его возникновения лежат дегенеративные изменения ауэрбаховского сплетения мышечного слоя и развитие гипокалиемии. Клиническая картина характеризуется разлитыми или локализованными болями в животе и асимметричным его вздутием. Перистальтические шумы резко ослаблены или не прослушиваются. Отмечаются симптомы выраженной интоксикации. Температура тела повышается до 39–40°С. Диагноз уточняется рентгенологическим исследованием, во время которого выявляются резко расширенные отделы ободочной кишки. На рентгенограммах определяются переполненные газом и жидкостью участки кишки, чаще всего поперечной ободочной. Консервативное лечение (дезинтоксикационная терапия, коррекция обменных процессов и др.) применяется в качестве предоперационной подготовки. Операция заключается в проведении срочной колэктомии. Однако прогноз часто неблагоприятный.
Дивертикулез толстой кишки
Дивертикулы толстой кишки представляют собой мешковидные выпячивания ее стенки. Различают врожденные (истинные) и приобретенные (ложные) дивертикулы. Первые возникают вследствие нарушения гистогенеза и стенка их включает все слои стенки кишки. Стенка приобретенных дивертикулов лишена мышечных волокон. Врожденные дивертикулы обычно встречаются в правой половине толстой кишки и бывают единичными. У взрослых чаще встречаются приобретенные дивертикулы, которые поражают левую половину толстой кишки, особенно сигмовидную. Они располагаются на боковых стенках кишки между брыжейкой и продольными мышечными лентами (тениями).Патогенез.
Дивертикулы обычно образуются в местах вхождения кровеносных сосудов в кишечную стенку. Именно здесь отмечается ее относительная слабость, что создает благоприятные условия для возникновения дивертикулов. Важным фактором является также повышение внутрикишечного давления вследствие нарушения моторики толстой кишки. Дивертикул имеет шейку и тело. Попадание через узкую шейку каловых масс в мешок может привести к образованию пролежня с развитием воспалительного процесса, который иногда переходит на соседние органы, что ведет к возникновению внутренних и наружных свищей. Прогрессирование воспалительных изменений может привести к перфорации кишечной стенки или вызвать кровотечение.
Клиническая картина.
Нередко заболевание длительное время не проявляется и обнаруживается случайно при рентгенологическом исследовании. Основными симптомами неосложненного дивертикулеза толстой кишки являются боли в животе и нарушения функции кишечника. Характер болей бывает разным – от чувства покалывания до коликообразных приступов. Однако при отсутствии осложнений чаще всего это умеренные, постоянные боли. Они локализуются преимущественно в левой подвздошной области и над лобком. Несмотря на порой сильный болевой синдром, при пальпации живот остается интактным. Это объясняется тем, что боли могут быть обусловлены спазмом кишечника, а также повышенным давлением в просвете кишки.
Для дивертикулеза характерны запоры, иногда они сменяются поносами. Могут наблюдаться тошнота, рвота. Сочетание данного заболевания с диафрагмальной грыжей и желчнокаменной болезнью носит название триады Сейнта. Нередко дивертикулез встречается также у больных язвой желудка и двенадцатиперстной кишки.
В случае развития дивертикулита клиническая картина становится более четкой – усиливаются боли в животе, повышается температура тела, изменяется морфологический состав крови (увеличиваются СОЭ и лейкоцитоз). Воспалительный процесс может распространяться на окружающие дивертикул ткани, вызывать параколит, при котором во время пальпации иногда находят инфильтраты, занимающие всю соответствующую половину живота. При абсцедировании их может произойти прорыв гноя в свободную брюшную полость с развитием клиники перитонита.
При прогрессировании дивертикулита и переходе воспаления на соседние органы между ними возникает выраженный спаечный процесс. В этих условиях гнойник может опорожниться в тонкую кишку, мочевой пузырь с образованием свищей. Если не наступает нагноения и полного рассасывания инфильтрата, в брюшной полости определяется воспалительная опухоль, которая может быть принята за новообразование.
Перфорация дивертикула бывает или на фоне полного здоровья (отсутствие симптомов), или при выраженной клинической картине заболевания. В том и другом случае развивается типичная клиника прогрессирующего перитонита. Дивертикулит может осложниться острой кишечной непроходимостью, которая, как правило, носит обтурационный характер и обусловлена образованием псевдоопухоли вследствие перфорации дивертикула не в свободную брюшную полость, а в брыжейку кишки или жировой привесок.
Профузное кишечное кровотечение при дивертикулезе обычно не встречается, однако оно бывает довольно четко выраженным. Выделяемая из заднего прохода кровь имеет алый цвет, что связано с низким расположением источника кровотечения. Если он находится в проксимальных отделах толстой кишки, то стул может быть деггеобразным. Кроме того, наблюдаются скрытые формы кровотечения, которые проявляются анемией. Проявления дивертикулеза правой половины толстой кишки могут напоминать клиническую картину острого аппендицита (боль в правой подвздошной области, болезненность и напряжение мышц при пальпации в этой зоне, лейкоцитоз при исследовании крови).
Диагностика.
Исходя из данных анамнеза и клинической картины поставить диагноз дивертикулеза толстой кишки весьма сложно. Важное значение в диагностике дивертикулеза имеет ирригоскопия (ирригография), особенно в условиях двойного контрастирования. Туго заполненные контрастным веществом дивертикулы четко видны на фоне рельефа слизистой оболочки. Основной их признак – выход бариевой взвеси за пределы контуров кишки в форме мешкообразных овальных теней с наличием шейки. Это типичная рентгенологическая картина дивертикулеза. Размеры дивертикулов и их количество, выявляемые при рентгенологическом исследовании, весьма разнообразны – от единичных до множественных, локализующихся во всех отделах толстой кишки. Диаметр их колеблется от 2–3 мм до 2–3 см. При наличии дивертикулита отмечаются спастические сокращения кишечника, беспорядочное расположение гаустр, грубые складки слизистой, медленное опорожнение дивертикулов от контрастного вещества. У больных с пара колитам и выявляются ригидность кишки и сужение ее просвета эксцентрического характера. В диагностике внутренних и наружных свищей важную роль играет рентгенологическое исследование. При кишечном кровотечении этот метод не позволяет установить его источник, однако дает возможность исключить или подтвердить дивертикулез толстой кишки.
Ценные сведения можно получить при колоноскопии, во время которой определяются единичные или множественные входные отверстия дивертикулов. Кроме того, выявляются косвенные признаки дивертикулеза (отечность слизистой, беспорядочность ее складок, деформация кишки, выделение гноя из дивертикулов). При кишечном кровотечении колоноскопия может помочь уточнить источник кровотечения, провести дифференциальную диагностику с другими заболеваниями.
Дифференциальная диагностика.
Проводится с болезнью Крона, синдромом раздраженной кишки, злокачественными образованиями, неспецифическим язвенным колитом. Она основывается на клинической картине заболевания, результатах рентгенологического и эндоскопического исследований.
Лечение.
При клинически выраженных формах дивертикулеза применяют комплекс лечебных мероприятий. Рекомендуется специальная диета, назначают противовоспалительные и спазмолитические препараты, а также средства, нормализующие стул. Предпочтение отдается продуктам, которые богаты растительной клетчаткой (картофель, яблоки, морковь, капуста). При наличии запоров увеличивают количество потребляемой жидкости, применяют оливковое или вазелиновое масло. Больным с болевым синдромом назначают папаверин, но–шпу и другие спазмолитические средства. Для борьбы с дисбактериозом применяют бактериальные препараты (колибактерин, бификол). При остром дивертикулите проводится антибактериальная терапия. Продолжительность курса лечения составляет 2–6 недель, при этом он повторяется 2–3 раза в год.
Если указанные лечебные мероприятия неэффективны, а также при возникновении осложнений проводится оперативное лечение. Экстренного оперативного вмешательства требуют перфорация дивертикулов в свободную брюшную полость, острая кишечная непроходимость, профузное кровотечение. Операция показана также при свищевых формах дивертикулеза, при наличии инфильтрата, симулирующего новообразования в брюшной полости. В случае неосложненного дивертикулеза проводится резекция сигмовидной кишки, однако при большом распространении дивертикулов объем резецируемого отдела толстой кишки увеличивается. В зависимости от качества подготовки больного решается вопрос об одновременном восстановлении пассажа. При перфорации дивертикулов или вскрытии гнойника в свободную брюшную полость с развитием перитонита после резекции кишечника формируется колостома по Микуличу. В более тяжелых случаях перфорированная кишка выводится наружу и накладывается колостома. Если это сделать невозможно (при перфорации ректосигмоидного перехода), то отверстие ушивают и формируют проксимальную колостому. При наличии хронического инфильтрата, сопровождающегося нарушением кишечной проходимости, показана резекция кишки с соблюдением онкологических принципов. От наложения анастомоза целесообразно воздержаться. У больных с профузным кишечным кровотечением производится левосторонняя гемиколэктомия, так как в этом отделе ободочной кишки чаще всего локализуются дивертикулы.
При дивертикулезе толстой кишки применяется также операция продольной серозомиотомии, устраняющая мышечный спазм как одно из звеньев патогенеза данного заболевания.
Полипоз толстой кишки
Полипы – это часто встречающиеся доброкачественные опухоли эпителиальной природы, которые склонны к малигнизации. Одиночные полипы протекают более благоприятно, реже малигнизируются. Множественные полипы располагаются по одному или группами в различных отделах кишечника. Они чаще подвергаются раковому превращению. Выделяют гиперпластические, железистые (аденоматозные), железисто–ворсинчатые, ворсинчатые полипы и опухоли.Гиперпластические полипы.
Это мелкие (диаметром 2–5 мм) образования конусовидной формы. Они возникают вследствие пролиферации эпителиальных желез и строение их соответствует строению нормальной слизистой оболочки кишечника. Малигнизации подвергаются редко.
Аденоматозные полипы.
Обычно имеют диаметр от 0,5 см до 3 см, могут достигать размеров куриного яйца, четко определяется ножка или располагаются на широком основании. Смещаются вместе со слизистой оболочкой кишки.
Железисто–ворсинчатые полипы.
Часто достигают размеров более 1 см и характеризуются бархатистой поверхностью. Могут приобретать многодольчатую форму, подвергаться эрозированию и изъязвлению.
Ворсинчатые полипы и опухоли.
Обычно имеют большие размеры (диаметр 2–6 см и более). Для этих полипов характерна толстая ножка, а ворсинчатые опухоли распластываются по слизистой оболочке без четких границ. Последние, нередко широко распространяясь, могут привести к сужению просвета кишки.
Клиническая картина.
В большинстве случаев полипы протекают бессимптомно и выявляются случайно при эндоскопических исследованиях. При увеличении их размеров и ворсинчатой трансформации появляются клинические признаки заболевания. К ним относятся тянущие боли в низу живота, патологические выделения из прямой кишки (слизь, кровь). При полипах больших размеров может развиться клиника полной или частичной кишечной непроходимости вследствие обтурации просвета кишки или инвагинации. Полипы, особенно аденоматозные, могут изъязвляться, некротизироваться при перекруте ножки и вызывать кишечное кровотечение.
Диагностика.
Основана на результатах пальцевого исследования, ректороманоскопии, колоноскопии, ирригоскопии (ирригографии). Важно уточнить возможность раковой трансформации полипов, при этом необходимо отличать истинную малигнизацию от так называемой карциномы in situ. Под последней понимают характерные отклонения эпителия от нормы, исчезновение его правильной слоистости, формы клеток, структуры ядер, возникновение клеточного полиморфизма. При неинвазивной карциноме процесс не распространяется на мышечную оболочку, кровеносные и лимфатические сосуды. Наоборот, инвазивная карцинома характеризуется прорастанием этих образований.
Лечение.
Основной метод лечения полипов толстой кишки – хирургический. Применяют эндоскопическую полипэктомию (при ректороманоскопии, колоноскопии) с электрокоагуляцией ножки, трансанальное иссечение полипов с наложением швов на рану слизистой и удаление их чрезбрюшинным доступом (колотомия или резекция кишки). Осложнениями чаще всего применяемого способа эндоскопической полипэктомии являются кровотечения и перфорация стенки кишки, требующие срочной лапарогомии.
Диффузный полипоз толстой кишки
Диффузный полипоз толстой кишки относится к числу тяжелых заболеваний желудочно–кишечного тракта, при котором происходит образование множественных полипов не только во всех отделах толстой кишки, но нередко в тонком кишечнике и желудке. Отличительным признаком этого заболевания является наследственный (семейный) характер его происхождения. Оно имеет прогрессирующее течение, которое приводит к резко выраженному нарушению обменных процессов, анемии и раковому превращению полипов.Этиология и патогенез.
Изучены недостаточно. Одни исследователи считают, что в основе этого заболевания лежат нарушения эмбрионального периода развития, другие придерживаются воспалительной теории его происхождения. Не исключается значение вирусов в этиологии диффузного полипоза. Признается также наследственный характер заболевания.
Патологическая анатомия.
Кардинальным признаком заболевания является наличие на слизистой толстого кишечника большого количества аденоматозных полипов, которые имеют различную форму и величину. Они могут располагаться на широком основании или иметь выраженную ножку. Полипы при этом заболевании характеризуются чрезмерной пролиферацией железистого эпителия. Если они не превышают размера просяного зерна, то это будет гиперпластическая (милиарная) форма полипоза. Увеличиваясь в размерах за счет роста эпителиальных клеток, полипы меняют свою структуру. Аденоматозное строение обычно характерно для небольших (диаметром 0,5–0,8 см) полипов. Эта форма носит название аденоматозного полипоза. В результате дальнейшего развития пролиферативных процессов образуются ворсины, которые могут покрывать всю поверхность полипа (железисто–ворсинчатые полипы) и иметь размеры от 1 до 4 см. Наряду с диффузным полипозом толстой кишки с преобладанием процессов пролиферации различают две другие его формы: ювенильную и синдром Пейтца–Егерса. Ювенильные полипы характеризуются гладкой поверхностью, имеют круглую форму, тонкую ножку. При микроскопическом исследовании определяется преобладение стромы над железистой тканью. При синдроме Пейтца–Егерса полипы характеризуются наличием гладкомышечных прослоек.
Клиническая картина.
Основным симптомом диффузного полипоза толстой кишки являются поносы с выделением крови. Они могут быть постоянными или периодически возобновляться. Наряду с этим больных беспокоят боли в животе и его вздутие. В процессе прогрессирования заболевания появляется анемия, снижается масса тела. У части пациентов возникают признаки интоксикации с повышением температуры, изменением морфологического состава крови. При озлокачествлении полипов соответственно меняется и клиническая картина заболевания.
Диагностика.
Основывается на клинической картине и результатах специальных методов исследования. Появление у лиц молодого возраста болей в эпигастрии, наклонности к поносам с выделением слизи и крови, прогрессирование анемии, истощение позволяют заподозрить данное заболевание. Кроме того, для синдрома Пейтца–Егерса характерна пигментация кожи лица и губ. Диффузный полипоз может сочетаться с доброкачественными опухолями мягких тканей и костей (синдром Гарднера). В диагностике заболевания важнейшее значение имеют ректороманоскопия, колоноскопия, рентгеноконтрастные методы исследования, с помощью которых выявляются описанные выше изменения толстой кишки и производится биопсия пораженных тканей, так как частота их малигнизации достигает 100%.
Дифференциальная диагностика.
Проводится с неспецифическим язвенным колитом, на фоне которого развиваются псевдополипоз, хроническая дизентерия, болезнь Крона.
Лечение.
Проводится хирургическое лечение. В редких случаях при единичных полипах используется эндоскопическая полипэктомия. Основными видами оперативного вмешательства являются тотальная колэктомия с илеоректальным анастомозом, одноэтапная или двухэтапная проктоколэктомия с илеостомией.
Осложнения острого аппендицита
Анатомо–физиологические сведения о червеобразном отростке
Червеобразный отросток (processus vermiformis, син. appendix) представляет собой часть желудочно–кишечного тракта, образующуюся из стенки слепой кишки. Формирование отростка начинается на третьем месяце эмбрионального развития. В большинстве наблюдений отросток отходит от заднемедиальной стенки слепой кишки у места слияния трех лент продольных мышц, направляется от слепой кишки книзу и медиально, Форма отростка цилиндрическая. Средняя длина его 7–8 см, толщина 0,5–0,8 см. Червеобразный отросток покрыт брюшиной со всех сторон и имеет брыжейку, благодаря которой обладает подвижностью. Существует много вариантов отхождения и локализации червеобразного отростка. Нередко он располагается ретроцекально и ретроперитонеально, прилегая к правой почке, мочеточнику, аорте. Кровоснабжение отростка происходит по a. appendicularis, являющейся ветвью a.ileocolica. Иногда питание червеобразного отростка осуществляется несколькими мелкими артериальными стволами. Венозная кровь оттекает по v.ileocolica в v.mesenterica superior и в v.portae, а лимфа – вначале в лимфатические узлы, расположенные вдоль подвздошно–ободочной, нижней брыжеечной артерии и аорты. Симпатическую иннервацию червеобразного отростка осуществляют верхнебрыжеечное и чревное сплетения, а парасимпатическую – волокна блуждающих нервов,Отросток имеет просвет треугольной или округлой формы, который может быть облитерирован. Структура стенки органа схожа со строением стенки слепой кишки и представлена слизистой, подслизистой, мышечной и наружной оболочками. Наружный (серозный) слой стенки образован висцеральной брюшиной. Собственная пластинка и подслизистая основа содержат большое количество лимфатических фолликулов и сосудов. Полагают, что червеобразный отросток играет определенную роль в иммунных реакциях.
Историческая справка.
Научно обоснованная связь между воспалением червеобразного отростка и гнойниками в брюшной полости была установлена во второй половине XIX в. благодаря исследованиям П. Ю. Немерта (1850), П. С. Платонова (1853), Р. И. Турнера (1892) и других ученых. В 80–е годы XIX в. для лечения перитонита аппендикулярного происхождения применялись вскрытие и дренирование брюшной полости. В 1884 г. Mohomed в Англии произвел первую аппендэктомию в связи с аппендикулярным абсцессом, a Kronlein в Германии – в связи с разлитым гнойным перитонитом.
Классификация.
В зависимости от возникновения осложнения острого аппендицита подразделяются на дооперационные и послеоперационные. К дооперационным осложнениям относятся аппендикулярный инфильтрат, аппендикулярный абсцесс, флегмона забрюшинной клетчатки, пилефлебит, перитонит. Послеоперационные осложнения классифицируются по клинико–анатомическому принципу.
Выделяют: 1. Осложнения со стороны операционной раны: кровотечение из раны, гематома, инфильтрат, нагноение, послеоперационные грыжи, расхождение краев раны без или с эвентрацией, келоидные рубцы, невриномы, эндометриоз рубцов. 2. Острые воспалительные процессы брюшной полости: инфильтраты и абсцессы илеоцекальной области, абсцесс дугласова пространства, межкишечные абсцессы, забрюшинные флегмоны, поддиафрагмальный абсцесс, подпеченочный абсцесс, местный перитонит, распространенный перитонит, культит. 3. Осложнения со стороны желудочно–кишечного тракта: динамическая кишечная непроходимость, острая механическая кишечная непроходимость, кишечные свищи, желудочно–кишечное кровотечение, спаечная болезнь. 4. Осложнения со стороны сердечно–сосудистой системы: сердечно–сосудистая недостаточность, тромбофлебит, пилефлебит, эмболия легочной артерии, кровотечение в брюшную полость. 5. Осложнения со стороны дыхательной системы: бронхит, пневмония, плеврит (сухой, экссудативный), абсцессы и гангрены легких, ателектаз легких. 6. Осложнения со стороны выделительной системы: задержка мочи, острый цистит, острый пиелит, острый нефрит, острый пиелоцистит. 7. Прочие осложнения: острый паротит, послеопера' ционный психоз и т. д.
По срокам развития послеоперационные осложнения подразделяются на ранние и поздние. Ранние осложнения возникают в течение первых двух недель с момента операции. В эту группу входят большинство осложнений со стороны послеоперационной раны (гнойно–воспалительные процессы, расхождение краев раны без или с эвентрацией, кровотечения из раны передней брюшной стенки) и практически все осложнения со стороны смежных органов и систем.
Поздними осложнениями острого аппендицита считаются те, которые развились по истечении двухнедельного послеоперационного периода.
Среди них чаще встречаются: 1. Из осложнений со стороны послеоперационной раны: инфильтраты, абсцессы, лигатурные свищи, послеоперационные грыжи, келлоидные рубцы, невриномы рубцов. 2. Из острых воспалительных процессов в брюшной полости: инфильтраты, абсцессы, культит. 3. Из осложнений со стороны желудочно–кишечного тракта: острая механическая кишечная непроходимость, спаечная болезнь.
Причинами возникновения осложнений острого аппендицита являются: 1. Несвоевременное обращение больных за медицинской помощью. 2. Поздняя диагностика острого аппендицита (вследствие атипичного течения заболевания, неправильной интерпретации имеющихся типичных для воспаления червеобразного отростка клинических данных и т. д.). 3. Тактические ошибки врачей (пренебрежение динамическим наблюдением за больными с сомнительным диагнозом острого аппендицита, недооценка распространенности воспалительного процесса в брюшной полости, неправильное определение показаний к дренированию брюшной полости и т. д.). 4. Ошибки техники операции (травмирование тканей, ненадежное лигирование сосудов, неполное удаление червеобразного отростка, плохое дренирование брюшной полости и т. д.) 5. Прогрессирование хронических или возникновение острых заболеваний смежных органов.
Аппендикулярный инфильтрат
Аппендикулярный инфильтрат – это конгломерат спаянных между собой вокруг деструктивно измененного червеобразного отростка петель тонкого и толстого кишечника, матки с придатками, мочевого пузыря, большого сальника, париетальной брюшины, надежно отграничивающих проникновение инфекции в свободную брюшную полость. Встречается в 0,2–3% случаев.Клиническая картина.
Аппендикулярный инфильтрат появляется на 3–4–е сутки после начала острого аппендицита. В его развитии выделяют две стадии – раннюю (прогрессирования, формирования рыхлого инфильтрата) и позднюю (ограниченную, плотного инфильтрата).
В ранней стадии происходит формирование воспалительной опухоли. У больных отмечается клиника, близкая к симптоматике острого деструктивного аппендицита, в том числе с признаками раздражения брюшины, лейкоцитозом, со сдвигом лейкоцитарной формулы влево.
В поздней стадии аппендикулярного инфильтрата явления острого воспаления стихают. Общее состояние пациентов улучшается.
Диагностика.
Решающую роль играет наличие клиники острого аппендицита в анамнезе или в момент осмотра больного в сочетании с болезненным опухолевидным образованием в правой подвздошной области. В стадии формирования пальпируемый инфильтрат мягкий, болезненный, не имеет четких границ, легко разрушается при разъединении сращения во время операции. В стадии отграничения он становится плотным, незначительно болезненным, четким.
Инфильтрат легко пальпируется при больших его размерах и типичной локализации червеобразного отростка. У больных с тазовым расположением аппендикса инфильтрат находится в тазу, а при ретроперитонеальном и ретроцекальном – позади слепой кишки, частично или полностью в забрюшинной клетчатке. Из–за глубины залегания внебрюшинные и ретроцекальные инфильтраты, а также инфильтраты у лиц с ожирением часто обнаруживаются только на операции.
При диагностике аппендикулярного инфильтрата используют пальцевое исследование через прямую кишку, вагинальное исследование, УЗИ брюшной полости, ирригографию (ирригоскопию).
Дифференциальная диагностика.
Проводится со злокачественными опухолями слепой и восходящей ободочной кишок, придатков матки, гидропиосальпинксом, т. е. заболеваниями, при которых в правой подвздошно–паховой области или в малом тазу определяется опухолевидное образование.
Рак слепой и восходящей ободочной кишок сопровождается симптомами интоксикации, анемией. Больных длительное время беспокоят боли в правой половине живота, периодические поносы. В кале присутствуют прожилки крови, слизь. По мере прогрессирования наблюдаются признаки хронической кишечной непроходимости. Больной становится адинамичным. Прогрессирует похудание. Кал приобретает зловонный характер и имеет вид мясных помоев. Ирригография и колоноскопия позволяют поставить окончательный диагноз. В пользу рака ободочной кишки свидетельствуют дефекты наполнения с неровными зазубренными контурами; плохое заполнение контрастом отдела кишечника, расположенного проксимальнее опухоли; отсутствие рельефа слизистой.
У пациенток, страдающих раком яичника, опухолевидное образование располагается глубоко в малом тазу в ректовагинальном углублении или сбоку от матки. При бимануальном исследовании оно имеет неравномерную консистенцию. Практически у всех больных отмечается нарушение функции кишечника в виде запора или учащения стула. В 40–50% случаев находят асцит. Цитологическое исследование материала, полученного посредством лапароцентеза, трансвагинальной пункции прямокишечно–маточного пространства, а также лапаро– и кольпоскопия позволяют установить характер патологического процесса и морфологическое строение опухоли.
Для гидро– и пиосальпинкса характерно наличие болей в низу живота. При влагалищном исследовании воспалительная опухоль определяется в проекции маточной трубы.
Во время проведения дифференциальной диагностики между аппендикулярным инфильтратом и вышеперечисленными заболеваниями важное значение придается изменению размеров опухоли на фоне предпринятого консервативного лечения, назначаемого при аппендикулярном инфильтрате. У больных, страдающих раком ободочной кишки, яичника они не уменьшаются.
Лечение.
Проводится комплексное консервативное лечение. Назначаются постельный режим, щадящая диета, в ранней фазе – холод на область инфильтрата, а после нормализации температуры (чаще на 3–4–й день) физиотерапевтическое лечение (УВЧ и т. д.). Проводится антибактериальная терапия, в том числе лимфотропная, выполняются двусторонняя паранефральная блокада 0,25–0,5% раствором новокаина по А. В. Вишневскому, новокаиновая блокада по Школьникову. Используются лечебные ромашковые клизмы (2 раза в сутки), УФО крови и т. д.
В случае благоприятного течения аппендикулярный инфильтрат рассасывается в сроки от 2 до 4 недель. По истечении последующего 2–3–месячного периода, в ходе которого полностью исчезают признаки воспалительного процесса в брюшной полости, выполняется плановая аппендэктомия. Это связано с опасностью рецидива заболевания. Отсутствие признаков уменьшения инфильтрата на фоне проводимого лечения является показанием к обследованию толстой кишки и органов малого таза. Возможно замещение инфильтрата соединительной тканью с образованием в брюшной полости плотной, болезненной воспалительной опухоли, нередко осложняющейся частичной кишечной непроходимостью (фибропластический инфильтрат). Вследствие этого иногда производится правосторонняя гемиколэктомия, а диагноз уточняется только после гистологического исследования опухоли.
В случае обнаружения во время операции рыхлого инфильтрата он разъединяется. Плотный, малоподвижный инфильтрат без признаков абсцедирования не разрушается, так как это сопряжено с угрозой повреждения образующих его органов. К инфильтрату подводят ограничивающие тампоны и микроирригаторы для введения антибиотиков. В послеоперационном периоде назначается медикаментозное лечение согласно изложенным выше принципам. Если консервативные мероприятия неэффективны, инфильтрат нагнаивается с образованием аппендикулярного абсцесса.
Аппендикулярный абсцесс
Аппендикулярный абсцесс встречается в 0,1–2% случаев. Он формируется в ранние сроки (до 1–3 суток) с момента развития острого аппендицита или осложняет течение существовавшего несколько дней или недель аппендикулярного инфильтрата.Клиническая картина и диагностика.
Признаками абсцесса являются симптомы интоксикации, гипертермия, нарастание лейкоцитоза со сдвигом формулы белой крови влево, повышенная СОЭ, напряжение мышц брюшной стенки, усиление болей в проекции определяемой ранее воспалительной опухоли. Иногда развивается кишечная непроходимость.
Лечение.
Абсцесс вскрывается внебрюшинным доступом по Н. И. Пирогову или по Волковичу–Дьяконову. Доступ по Н. И. Пирогову используется для опорожнения абсцесса, находящегося глубоко в правой подвздошной области, в том числе ретроперитонеальных и ретроцекальных абсцессов. Производится рассечение тканей передней брюшной стенки до париетальной брюшины длиной 10–15 см сверху вниз, справа налево на 1–1,5 см медиальнее верхней горизонтальной ости подвздошной кости или на 2–2,5 см латеральнее и параллельно разрезу Волковича–Дьяконова. Затем париетальная брюшина отслаивается от внутренней поверхности подвздошной кости, что позволяет подойти к наружной стороне абсцесса. Доступ по Волковичу–Дьяконову применяется в случае прилегания гнойника к передней брюшной стенке.
После вскрытия и санирования абсцесса при наличии в его полости червеобразного отростка он удаляется. В полость абсцесса подводятся тампон и дренажная трубка. Брюшная стенка ушивается до тампонов и дренажей.
При обнаружении поверхностно расположенного гнойника во время выполнения аппендэктомии из доступа по Волковичу–Дьяконову абсцесс опорожняется и дренируется через произведенный разрез передней брюшной стенки. Если же он располагается глубоко, рана брюшной стенки ушивается. Гнойник опорожняется и дренируется по способу Н. И. Пирогова.
Пилефлебит
Пилефлебит – гнойный тромбофлебит ветвей воротной вены, осложненный множественными абсцессами печени и пиемией. Развивается вследствие распространения воспалительного процесса с вен червеобразного отростка на подвздошно–ободочную, верхнебрыжеечную, а затем портальную вены. Чаще возникает при ретроцекальном и ретроперитонеальном расположении отростка, а также у больных с внутрибрюшинными деструктивными формами аппендицита. Заболевание обычно начинается остро. Наблюдается как в дооперационном, так и в послеоперационном периодах.Клиническая картина и диагностика.
Клиническая картина пилефлебита складывается из гектической температуры с ознобами, проливным потом, желтушным окрашиванием склер и кожных покровов. Пациентов беспокоят боли в правом подреберье, а нередко и в нижней части грудной клетки, иррадиирующие в спину, в правую ключицу. Течение пилефлебита неблагоприятное. Часто он осложняется сепсисом. Летальность составляет 85–98%. Объективно находят увеличение печени, селезенки, асцит. При рентгенологическом исследовании определяются высокое стояние правого купола диафрагмы, ограничение ее подвижности, реактивный выпот в правой плевральной полости, облитерация плеврального синуса, увеличение тени печени с повышением интенсивности в области абсцесса. УЗИ подтверждает наличие гепатомегалии и зон измененной эхогенности печеночной ткани. В крови – лейкоцитоз со сдвигом лейкоцитарной формулы влево, токсическая зернистость нейтрофилов, повышенная СОЭ, гиперфибринемия, анемия.
Лечение.
Показано выполнение аппендэктомии с последующим комплексным медикаментозным лечением: внутривенное и внутри артериальное назначение антибиотиков широкого спектра действия; проведение экстракорпоральной детоксикации (гемосорбция, плазмаферез и т. д.).
Применяется внутрипортальное введение лекарственных веществ через канюлированную пупочную вену. Ее обнажают в области, расположенной на 2–3 см выше пупка. Вена находится в клетчатке между поперечной фасцией и брюшиной. Периферический конец вены перевязывается, центральный бужируется и канюлируется. Внутрипеченочные инфузии препаратов проводятся длительно.
Единственные и множественные абсцессы печени больших размеров вскрываются и дренируются по одному из известных методов (см. Абсцессы печени).
Тазовые абсцессы
Тазовые абсцессы (абсцессы дугласова пространства) у больных, перенесших аппендэктомию, встречаются наиболее часто – в 0,03–1,5% случаев. Они локализуются в самом низком отделе брюшной полости: у мужчин в ехсаvatio retrovesicalis, а у женщин в excavatio retrouterina. Возникновение гнойников связано с плохой санацией брюшной полости во время операции, неадекватным дренированием полости малого таза, наличием в малом тазу склонного к абсцедированию инфильтрата при тазовом расположении червеобразного отростка.Клиническая картина.
Абсцесс дугласова пространства формируется через 6–30 суток после операции. Он характеризуется наличием двух групп симптомов: общих и местных. Общие симптомы сопровождаются гектической температурой, слабостью, потливостью, местные – болями в нижних отделах живота, за лоном, нарушением функций тазовых органов (дизурические расстройства, тенезмы, выделение слизи из прямой кишки).
Диагностика.
В пользу гнойно–воспалительного процесса в брюшной полости свидетельствуют лейкоцитоз, сдвиг лейкоцитарной формулы влево, токсическая зернистость нейтрофилов, повышенная СОЭ.
Per rectum находят снижение тонуса сфинктера, что связано с токсическим повреждением n.pelvicum; болезненность передней стенки прямой кишки, ее нависание. При длительно существующих абсцессах пальпируется болезненный инфильтрат по передней стенке кишки с очагами размягчения.
Per vaginam отмечаются болезненность заднего свода, интенсивные боли при смещении шейки матки. Для уточнения диагноза применяют УЗИ и диагностическую пункцию. Пункция предполагаемого гнойника у женщин выполняется через задний свод влагалища, а у мужчин и детей – через переднюю стенку прямой кишки.
Лечение.
После получения во время пункции гноя у женщин производят заднюю кольпотомию, а у мужчин и детей абсцесс вскрывают по игле. В полость гнойника на 2–3 дня вводится дренажная трубка.
Вовремя недиагностированный тазовый абсцесс осложняется прорывом: а) в свободную брюшную полость с развитием перитонита; б) в соседние полые органы (в мочевой пузырь, в прямую и слепую кишки, фаллопиеву трубу и т. д.).
Межкишечные абсцессы
Межкишечные (межпетлевые) абсцессы встречаются в 0,04–0, 5% случаев. Они возникают в основном у больных с деструктивными формами аппендицита при оставлении в брюшной полости инфицированного экссудата.Клиническая картина.
В начальной стадии формирования абсцесса симптоматика скудная. Больных беспокоит не имеющая четкой локализации боль в животе. Повышается температура тела. Постепенно нарастают явления интоксикации.
Диагностика.
При больших размерах гнойника и его расположении в непосредственной близости от брюшной стенки определяется асимметрия живота. В брюшной полости пальпируется болезненный инфильтрат. Над ним выявляется притупление, а иногда симптомы раздражения брюшины. Во время ультразвукового исследования живота находят участки повышенной эхогенности, а на обзорной рентгенограмме – очаги затемнения, в ряде случаев с горизонтальным уровнем жидкости и газа. В крови – лейкоцитоз, сдвиг лейкоцитарной формулы влево, повышенная СОЭ.
Лечение.
Межкишечные абсцессы вскрываются двумя способами. Первый используется при одиночном гнойнике, непосредственно прилежащем к париетальной брюшине, и наличии между абсцессом и брюшиной сращений. В этой ситуации разрез передней брюшной стенки производится над гнойником. Брюшная полость не вскрывается. Второй способ (лапаротомия, опорожнение и дренирование абсцессов после предварительного отграничения тампонами от свободной брюшной полости) показан при множественных абсцессах и глубоком их залегании в брюшной полости.
Поддиафрагмальные абсцессы
Подциафрагмальные абсцессы развиваются в 0,4–0,5% случаев, бывают одиночными и множественными, В зависимости от локализации поддиафрагмальные абсцессы подразделяются на право– и левосторонние (по отношению к серповидной связке печени), передние и задние (по отношению к венечной связке печени), внутрии забрюшинные. Причинами образования поддиафрагмальных гнойников являются оставление в брюшной полости экссудата, проникновение инфекции в поддиафрагмальное пространство лимфо– или гематогенно. Часто они осложняют течение пилефлебита. Первые симптомы поддиафрагмального абсцесса могут появляться как в раннем послеоперационном периоде, так и спустя 1–2 недели.Клиническая картина и диагностика.
Пациентов беспокоят боли в нижних отделах правой половины грудной клетки и верхнем этаже брюшной полости (иногда с иррадиацией в правую лопатку и плечо), слабость, потливость, гипертермия, сухой кашель. При осмотре находят вынужденное положение больных: полусидячее, на боку с приведенными к животу ногами. Грудная клетка на стороне поражения отстаетпри дыхании. Межреберные промежутки на уровне 9–11–го ребер над областью абсцесса выбухают (симптом В. Ф. Войно–Ясенецкого). Надавливание на область 9–11–го ребер болезненно (симптом М. М. Крюкова). Эпигастральная область втягивается при вдохе и выпячивается при выдохе (симптом парадоксального дыхания, симптом Дюшена). Перкуторно на стороне поражения над диафрагмой отмечается притупление перкуторного звука (в связи с наличием реактивного плеврита). При газосодержащих абсцессах в случае проведения перкуссии от верхушки легкого книзу устанавливают чередование перкуторного звука (симптом Берлоу): перкуторный легочной тон над неизмененной легочной тканью; укорочение перкуторного тона вследствие имеющегося реактивного плеврита; тимпанит над областью газового пузыря абсцесса; тупость, соответствующая уровню жидкости в абсцессе.
На обзорной рентгенограмме грудной клетки и поддиафрагмальных пространств у больных с газосодержащим абсцессом обнаруживают высокое стояние, ограничение подвижности правого купола диафрагмы, газовый пузырь с уровнем жидкости под ним, перемещающимся при изменении положения тела. В случае безгазовых гнойников рентгенологическая картина представлена высоким стоянием, малой подвижностью купола диафрагмы, реактивным плевритом.
Во время УЗИ определяется четко отграниченное скопление жидкости под куполом диафрагмы.
Диагноз заболевания уточняется после проведения диагностической пункции выявляемого поддиафрагмального образования. Информативность пункции возрастает в случае ее выполнения под контролем УЗИ или рентгеноскопии.
Лечение.
Проводится хирургическое лечение. Гнойники вскрываются, опорожняются и дренируются внеплеврально, внебрюшинно, реже чрезбрюшинно и чресплеврально.
Наиболее широко применяется внеплевральный доступ А. В. Мельникова. Его сущность состоит в резекции над областью абсцесса одного–двух ребер на протяжении 5–6 см, рассечении задней стенки ложа ребра, отслойке в spatium praediaphragmaticum плеврального синуса кверху, рассечении диафрагмы вдоль раны с подшиванием ее верхнего края к мышцам грудной клетки, опорожнении абсцесса после рассечения fascia endoabdominalis и париетальной брюшины. Поскольку spatium praediaphragmaticum определяется по всей окружности прикрепления диафрагмы к грудной клетке, доступ А. В. Мельникова применяется для вскрытия как передних, так и задних абсцессов.
Для лечения больных передним поддиафрагмальным абсцессом разработан внебрюшинный доступ ПарийскогоКлермона: в правом подреберье параллельно реберной дуге производят разрез брюшной стенки до поперечной фасции. Затем последнюю вместе с брюшиной отслаивают от диафрагмы до области абсцесса.
При чрезбрюшинном доступе поддиафрагмальные абсцессы вскрываются после тщательного отграничения места операции от свободной брюшной полости из верхнесрединного разреза передней брюшной стенки или разреза, параллельного правой реберной дуге.
Чресплевральный метод лечения используется крайне редко из–за своей травматичности и опасности развития эмпиемы плевры. Он предполагает вскрытие грудной полости после резекции двух ребер (8–го и 9, 9 и 10–го). Далее при наличии сращений плевральных листков они тупо отслаиваются книзу до диафрагмы. Диафрагма над абсцессом рассекается. Если сращения листков плевры нет, то плевральная полость изолируется от возможного проникновения гноя. С этой целью реберная плевра и все ткани реберного ложа подшиваются к диафрагме.
В связи с совершенствованием методов ультразвуковой диагностики абсцессы могут дренироваться путем проведения в их полость одно– или двухходовых трубок через троакар под контролем УЗИ.
Внутрибрюшинное кровотечение
Кровотечение в просвет брюшной полости возникает при соскальзывании лигатуры с брыжейки червеобразного отростка, плохом гемостазе его ложа, повреждении сосудов передней брюшной стенки. Определенную роль в возник новении кровотечений играет нарушение свертывающей системы крови. По характеру кровотечение может быть профузным или капиллярным.Клиническая картина и диагностика.
При значительном внутрибрюшинном кровотечении состояние больных тяжелое. Отмечаются бледность кожных покровов, холодный липкий пот, слабый частый пульс, снижение АД. Живот несколько вздут; при пальпации, особенно в нижних отделах брюшной полости и в правой подвздошной области, напряжен и болезнен. Выявляются симптомы раздражения брюшины. Перкуторно находят тупость в нижних отделах живота. При пальцевом исследовании прямой кишки определяется нависание ее передней стенки. В крови – анемия. В сложных случаях диагностики выполняются УЗИ брюшной полости, лапароскопия, лапароцентез.
Лечение.
Больным с внутрибрюшинным кровотечением после аппендэктомии показана срочная операция, как правило, лапаротомия. Во время операции производят ревизию илеоцекальной области, лигирование кровоточащего сосуда, санацию и дренирование брюшной полости. Если кровоточащий сосуд найти невозможно, дополнительно прошивается культя червеобразного отростка. Ложе отростка тампонируется. Капиллярное кровотечение останавливается с помощью гемостатической губки и тугого тампонирования области кровотечения.
Ограниченные внутрибрюшинные гематомы в правой подвздошной области опорожняются после раскрытия послеоперационной раны. Затем производятся тщательная ревизия ложа отростка, перевязка кровоточащего сосуда, дренирование брюшной полости.
Инфильтраты брюшной стенки и нагноение ран
Инфильтраты брюшной стенки (6–15% случаев) и нагноение ран (2–10%) развиваются вследствие инфицирования, чему способствуют плохой гемостаз и травмирование тканей. Эти осложнения острого аппендицита появляются на 4–6–е сутки после операции, а иногда и в более поздние сроки.Клиническая картина и диагностика.
Инфильтраты и гнойники располагаются над или под апоневрозом. Пальпаторно в области послеоперационного разреза находят болезненное с нечеткими контурами уплотнение. Кожные покровы над ним гиперемированы. Температура кожи повышена.
Лечение.
Показано консервативное лечение. Назначают антибиотики широкого спектра действия. Проводят блокады раны 0,25–0,5% раствором новокаина с антибиотиками, физиотерапевтическое лечение.
Нагноившиеся раны широко раскрывают и в дальнейшем лечат с учетом фаз течения раневого процесса. После очищения ран накладывают вторичные швы (ранние или поздние). Ранние вторичные швы накладывают на 8–15–й день после операции у лиц с гранулирующими ранами, имеющими подвижные края. Поздние вторичные швы применяют в более отдаленных сроках для ушивания медленно заживающих ран с развившейся в них рубцовой тканью. Предварительно края и дно раны экономно иссекают.
Эпифасциальная гангрена
Эпифасциальная гангрена (фагеденичная язва, тотальная ползучая флегмона передней брюшной стенки) является разновидностью гнойно–воспалительного процесса в послеоперационной ране. Она возникает при наличии супервирулентной микрофлоры на фоне резкого ослабления защитных сил организма, и встречается в 1 случае на 5 тыс. аппендэктомий.Клиническая картина и диагностика.
Заболевание проявляется на 4–5–й день после операции обычным нагноением раны. Однако спустя 1–2 дня обращает на себя внимание выделение из раны большого количества гноя с неприятным запахом. Зона гнойно–воспалительного поражения постепенно увеличивается. Одновременно прогрессивно ухудшается общее состояние больных. Наблюдаются гектическая температура, лейкоцитоз со сдвигом лейкоцитарной формулы влево. Больные погибают от присоединившегося сепсиса и истощения.
Лечение.
Проводится комплексное лечение с применением антибиотиков широкого спектра действия, гормонов, витаминов, иммунных и других средств, экстракорпоральной детоксикации. Местно назначаются протеолитические ферменты. Однако главным является хирургическое вмешательство, направленное на санирование гнойного очага.
После аппендэктомии наиболее часто наблюдается частичная эвентрация, когда дном раны в правой подвздошной области является кишка или сальник. Ее возникновение связано с выведением через рану тампонов и дренажных трубок, прогрессированием перитонита, снижением реактивных процессов в организме.
Клиническая картина и диагностика.
Частичную эвентрацию обычно устанавливают в день вскрытия гнойника в области послеоперационной раны. Хирург, обследуя полость пальцем, обнаруживает предлежание кишки. Эвентрация усиливается при кашле.
Лечение.
При частичной эвентрации после аппендэктомии проводится консервативное лечение. Оно направлено на профилактику прогрессирования эвентрации, ликвидацию гнойно–воспалительного процесса в ране. После этого накладываются вторичные швы.
Лигатурные свищи
Лигатурные свищи наблюдаются у 0,3–0,5% больных, перенесших аппендэктомию.Клиническая картина и диагностика.
Чаще всего лигатурные свищи возникают на 3–6–й неделях послеоперационного периода вследствие инфицирования шовного материала, нагноения раны и ее вторичного заживления. При благоприятном течении процесса лигатура отторгается через 2–3 недели, после чего свищевой ход закрывается самостоятельно. Однако возможно и длительное течение лигатурных свищей, их частое рецидивирование.
Лечение.
Нередко лигатуры удаляются при инструментальной ревизии свищевого хода. В ряде случаев производится иссечение всего старого послеоперационного рубца.
Келлоидные рубцы
Появление келлоидных рубцов связано с индивидуальными особенностями формирования соединительной ткани. Не исключается влияние чрезмерного травмирования тканей во время операции.Клиническая картина и диагностика.
Больных беспокоит не только наличие утолщенного послеоперационного рубца, но также его резкая болезненность при контакте с постельным бельем, пальпации.
Лечение.
В основном проводится консервативное лечение. Назначаются физиотерапевтические процедуры (электрофорез с лидазой, массаж и т. д.). Если такое лечение не дает эффекта, выполняется операция – иссечение рубца.
Невриномы
Клиническая картина и диагностика
Невриномы рубцов после аппендэктомии возникают или на крупных нервных стволах, или на мелких веточках. Могут быть одиночными и множественными. Характеризуются медленным ростом. Сопровождаются парестезиями, гиперестезиями, болью в области послеоперационного рубца, атрофией отдельных мышц передней брюшной стенки. Пальпаторно невриномы иногда определяются в виде плотной, веретенообразной опухоли, расположенной по ходу нервных стволов, хорошо смещаемой в боковых направлениях.
Лечение.
Консервативное лечение (рассасывающая терапия) малоэффективно, что служит показанием к хирургическому вмешательству – удалению этой опухоли.
Флегмона забрюшинной клетчатки
Флегмона забрюшинной клетчатки обычно развивается у больных с ретроцекальным и ретроперитонеальным расположением червеобразного отростка. Вместе с тем проникновение инфекции в забрюшинное пространство возможно через брыжейку отростка при его внутрибрюшинном расположении.Клиническая картина и диагностика.
Клиническая картина флегмоны развивается постепенно: усиливается боль в правой половине живота или поясничной области. Повышается температура, увеличивается лейкоцитоз, нарастает интоксикация. Иногда вследствие распространения процесса на поясничные мышцы наблюдается сгибательная контрактура правого бедра. Воспалительный инфильтрат при параколитах определяется по ходу восходящей ободочной кишки, при паранефритах в проекции почек, при поражении собственно забрюшинной клетчатки – над пупартовой связкой или вдоль гребня подвздошной кости.
Лечение.
Показаны аппендэктомия и вскрытие абсцессов забрюшинного пространства с учетом локализации воспалительного процесса.
Перитонит, осложняющий течение острого аппендицита, особенностей в патогенезе, диагностике и лечении не имеет. Тактика хирурга при его возникновении изложена в соответствующем разделе учебника.
Инфильтраты брюшной полости
Послеоперационные инфильтраты брюшной полости чаще локализуются в правой подвздошной области. Их образованию способствуют плохой гемостаз, неадекватное дренирование правой подвздошной области, оставление в ложе червеобразного отростка некротических тканей, а в брюшинной полости инородных тел.Клиническая картина и диагностика.
Больных беспокоят ноющие боли в месте формирования инфильтрата. Повышается температура тела. Пальпаторно в животе находят опухолевидное образование с нечеткими контурами, болезненное при пальпации.
Лечение.
Показано консервативное лечение. Проводятся антибактериальная (в том числе лимфотропная) и физиотерапия. При длительном сохранении инфильтратов, а также их абсцедировании производится вскрытие гнойников через старый послеоперационный рубец с тщательным отграничением воспалительной опухоли тампонами от свободной брюшной полости и дренированием одно– или двухпросветными трубками.
Прямая кишка
Анатомо–физиологические сведения
Прямая кишка продолжается от ректосигмоидного отдела (уровень 3–го крестцового позвонка) до аноректальной линии. Длина ее составляет в среднем 12–16 см. В прямой кишке выделяют надампулярный (ректосигмоидный) и ампулярный отделы, а ниже диафрагмы малого таза она переходит в анальный канал. Ампулярный отдел в свою очередь подразделяется на верхне–, средне– и нижнеампулярную части. Длина анального канала составляет 2–4 см, он заканчивается задним проходом. Надампулярный и верхнеампулярный отделы прямой кишки покрыты брюшиной с трех Сторон. На уровне 4–го крестцового позвонка брюшинный покров сохраняется только спереди кишки. Нижняя часть ампулы прямой кишки расположена под брюшиной и окружена клетчаткой, при этом выделяют тазово–прямокишечное и седалищно–прямокишечное пространства.Кнаружи от боковых поверхностей прямой кишки проходят подвздошные сосуды и мочеточники. Передняя поверхность ее у мужчин соприкасается с ампулами семявымосящих протоков, семенными пузырьками и предстательной железой, а у женщин – с задней стенкой влагалища. Между передней полуокружностью кишки и задней стенкой влагалища у женщин и мочеиспускательным каналом у мужчин имеется апоневроз Денонвиллье, который препятствует распространению воспалительного процесса с прямой кишки на соседние образования, но затрудняет мобилизацию ее передней стенки при оперативных вмешательствах. Слизистая оболочка кишки образует в проксимальных отделах поперечные складки, в дистальных – продольные (столбы Морганьи). Между последними находятся анальные пазухи (крипты), в которые открываются железистые ходы. Границей между цилиндрическим эпителием нижнеампулярного отдела и плоским эпителием анального канала является зигзагообразная линия, которая называется зубчатой или гребешковой.
Анальный канал по всему периметру окружен внутренним сфинктером, длина которого 3–4 см, а толщина 1 см. Основную его массу составляют волокна гладкой мускулатуры. В самой нижней части анальный канал окружен наружным сфинктером, который состоит из поперечнополосатых мышц. В верхнюю часть последнего вплетаются волокна мышцы, поднимающей задний проход. Главной функцией наружного сфинктера является активное сокращение. Внутренний сфинктер осуществляет пассивное закрытие заднего прохода.
Кровоснабжение прямой кишки обеспечивается непарной верхней прямокишечной артерией, которая является непосредственным продолжением главного ствола нижней брыжеечной артерии, двумя средними прямокишечными (стволы внутренней подвздошной или внутренней срамной артерии) и нижней прямокишечной (ветвь внутренней срамной артерии). Артерии, питающие прямую кишку, широко анастомозируют между собой. Отток венозной крови из верхней части прямой кишки происходит через верхние прямокишечные вены, которые впадают в нижнюю брыжеечную вену. Средние прямокишечные вены осуществляют отток крови от ампулы и более дистальных отделов кишки во внутреннюю подвздошную вену. Нижние прямокишечные вены собирают кровь от анального канала и наружного сфинктера, затем она оттекает во внутреннюю срамную вену. Таким образом, в области прямой кишки происходит анастомозирование двух венозных систем – воротной и нижней полой вен.
Отток лимфы из прямой кишки происходит по нескольким направлениям. От анального канала лимфа оттекает в паховые узлы, из верхних отделов прямой кишки – в крестцовые узлы, а также узлы, расположенные вдоль верхней прямокишочной артерии.
Иннервация прямой кишки осуществляется симпатическими и парасимпатическими волокнами. Первые идут от нижнего брыжеечного и аортального сплетений, Надампулярный и ампулярный отделы в основном иннервируются вегетативной нервной системой, в то время как анальный канал – преимущественно спинномозговыми нервами.
Геморрой
Геморрой – увеличение кавернозных телец прямой кишки, сопровождающееся выделением крови и неприятными ощущениями в области заднего прохода. Он относится к широко распространенным заболеваниям и встречается более чем у 10% взрослого населения, а его удельный вес среди всех заболеваний прямой кишки приближается к 40%. Геморроем чаще страдают лица мужского пола в возрасте 30–50 лет.Этиология и патогенез.
В основе развития геморроя лежит нарушение оттока крови по венулам от кавернозных телец, располагающихся в стенке дистальной части прямой кишки и анального канала. Длительное переполнение кровью из артериального русла приводит их к гипертрофии, истончению и разрыву стенок. Травмирование геморроидальных узлов способствует развитию осложнений геморроя. Важную роль в патогенезе заболевания играют врожденная слабость соединительной ткани, снижение тонуса стенок венозных сосудов, тяжелый физический труд, беременность, запоры. К неблагоприятным факторам относятся злоупотребление алкоголем, прием острой пищи. Сочетание указанных факторов способствует гиперплазии кавернозных телец и образованию в последующем геморроидальных узлов.
Патологическая анатомия.
При геморрое отмечаются гиперпластические изменения кавернозной ткани прямой кишки, которые в большинстве случаев локализуются группами и располагаются на 3, 7, 11 часах по циферблату при положении больного на спине. Реже кавернозные тельца расположены диффузно. Зрелая кавернозная ткань характеризуется наличием сообщающихся между собой лакун и сосудов венозного типа. В подслизистом слое определяется множество прямых артериовенозных анастомозов. Одна группа геморроидальных узлов располагается под слизистой прямой кишки выше гребешковой линии (внутренний геморрой), вторая локализуется под кожей ниже указанной линии (наружный геморрой). Часто они сочетаются и тогда говорят о смешанном геморрое.
Клиническая картина.
Первыми проявлениями геморроя являются неприятные ощущения и зуд в области заднего прохода, некоторое затруднение во время акта дефекации. Этот период может продолжаться несколько месяцев или лет. В последующем присоединяется кровотечение, которое является основным симптомом заболевания. Оно возникает в момент дефекации или после нее и может быть различной интенсивности. Часто это просто средства, компрессы, иногда выполняется блокада 0,25% раствором новокаина. После стихания острых воспалительных явлений производится оперативное вмешательство. При неправильном лечении, особенно при настойчивых попытках вправить воспалительно измененные узлы, могут развиться пилефлебит, абсцессы печени и легкого. Острый тромбоз наружных геморроидальных узлов с признаками инфицирования окружающих тканей подлежит указанному выше консервативному лечению.
При хроническом геморрое может применяться склерозирующая терапия внутренних узлов, однако до сих пор она не нашла широкого применения прежде всего в связи с отсутствием эффективных препаратов.
Хирургическое лечение показано при второй и третьей стадиях заболевания. Оно выполняется в случаях, когда повторяющиеся кровотечения вызывают прогрессирующую анемизацию больного. В настоящее время признано, что при острых осложнениях геморроя оперативное вмешательство должно проводиться в более ранние сроки. Предоперационная подготовка предусматривает назначение на 2 дня бесшлаковой диеты (стол № 1), вечером накануне операции ставят две очистительные клизмы (по 1 л воды) с интервалом в И, а утром эту процедуру повторяют, оставляя на 30 мин газоотводную трубку для удаления остатка промывных вод.
Предложено большое количество способов хирургического лечения геморроя, однако теперь операциями выбора являются методика Миллигана–Моргана и ее модификации, предложенные НИИ проктологии (Москва).
Как указывалось выше, прямая кишка в дистальном отделе имеет три первичных внутренних геморроидальных узла, которые располагаются соответственно цифрам 3, 7, 11 на циферблате часов. Во время операции Миллигана–Моргана эти узлы захватываются окончатыми зажимами и слегка вытягиваются наружу. По боковой поверхности их делаются разрезы слизистой оболочки и выделяется узел, ножка которого прошивается и перевязывается, после чего узел над лигатурой отсекается. Швы на рану не накладываются, она заживает вторичным натяжением в течение 2–3 недель. Недостатком этой операции является оставление открытых ран в области заднепроходного канала, что сопровождается кровотечением, инфицированием их. В связи с этим Московским НИИ проктологии была предложена 1–я модификация данной операции, которая заключалась в частичном ушивании трех раневых поверхностей заднего прохода и перианальной кожи таким образом, чтобы в шов захватывался один край раны и подшивался к середине ее дна. Однако и после этой операции остаются открытые раны с их недостатками.
Поэтому была предложена 2–я модификация операции Миллигана–Моргана, которая является более совершенной и нашла широкое применение в практике. Суть ее состоит в следующем. После девульсии сфинктера внутренние геморроидальные узлы на 3, 7, 11 часах последовательно захватывают зажимом Люэра. На основание каждого узла накладывают зажимы Бильрота (до сосудистой ножки). Над зажимом узел срезают снаружи внутрь до сосудистой ножки, которую прошивают и перевязывают хромированным кетгутом, узел отсекают. Не снимая зажим, ложе узла прошивают отдельными кетгутовыми швами, захватывая край слизистой и дно раны. Зажим снимают, швы завязывают и срезают. Кожную часть раны также зашивают кетгутовыми швами. Таким образом, происходит иссечение узлов в виде лепестков с полным восстановлением слизистой оболочки заднепроходного канала.
При смешанном геморрое следует раздельно иссекать внутренние и наружные геморроидальные узлы. Необходимо также удалять избыток слизистой, иссекая ее в виде лепестков. Если геморроидальные узлы расположены венчиками вокруг ануса, то они иссекаются поэтапно. В противном случае может развиться стриктура заднего прохода.
При остром тромбозе наружных геморроидальных узлов с отсутствием признаков инфицирования эффективна операция, сущность которой состоит в разрезе тромбированного узла и удалении тромботических масс, после чего быстро купируется воспалительный процесс.
Трещины заднего прохода
Трещина заднего прохода (анальная трещина) представляет собой дефект слизистой оболочки анального канала щелевидной или овальной формы, верхняя часть которого располагается у основания морганиевых столбиков. Это распространенное заболевание, которое после колитов и геморроя занимает третье место. Встречается оно преимущественно у женщин, локализуется чаще по задней стенке анального канала. Реже, обычно у женщин, трещины обнаруживаются в области передней спайки и очень редко выявляются на боковой стенке ануса.Этиология и патогенез.
Анальная трещина возникает вследствие механического нарушения целостности слизистой оболочки заднепроходного канала при запорах, поносах или родах у женщин. Предрасполагающими факторами являются колиты, энтероколиты, геморрой. У большинства больных одновременно наблюдаются гастриты, язвенная болезнь желудка и двенадцатиперстной кишки, холецистит. Возникновению заболевания способствуют воспаление анальных желез, невриты анального канала, спазмы мелких артериальных сосудов. Трещина с мягкими краями постепенно приобретает вид трофической язвы. Прогрессированию заболевания содействует присоединяющийся спазм сфинктера прямой кишки. Немаловажное значение имеет и тот факт, что на задней стенке анального канала морганиевы столбы имеют большую глубину с множеством расположенных у их основания анальных желез.
Патологическая анатомия.
Чаще всего, как отмечалось, трещины возникают на задней стенке анального канала в области небольшого треугольника, образующегося идущими от копчика мышечными волокнами, которые расходятся под острым углом. Так как слизистая здесь плохо соединена с окружающими тканями, она легко травмируется во время акта дефекации. Трещина имеет длину в среднем 1,5–2 см, ширину 2–5 мм, глубину – 1–2 мм. Обычно верхний край ее находится на уровне зубчатой линии, а иногда и более проксимально. Свежая трещина представлена поверхностным дефектом слизистой с мягкими краями. Ткани в области ее дна ярко–красного цвета. Длительно существующие трещины имеют подрытые и уплотненные края, их дно покрыто бледными грануляциями с фибринозным налетом. В результате развития участков избыточной ткани образуются анальные бугорки в области наружного (пограничный) и внутреннего (сторожевой) краев трещины. Нередко последний имитирует полип анального канала.
Клиническая картина.
Заболевание встречается в любом возрасте. Основным его признаком являются острейшие, жгучие боли в анальной области, которые возникают, как правило, в момент акта дефекации и продолжаются от нескольких минут до нескольких часов или суток. Из–за страха их возникновения больные стремятся задержать стул, в результате чего в прямой кишке скапливаются плотные каловые массы, эвакуация которых сопровождается новыми повреждениями тканей в области трещины. Частым симптомом являются кровотечения, при этом кровь находится на кале в виде полос или появляется каплями в конце акта дефекации. Однако эти кровотечения не такие интенсивные, как при геморрое. Нередко больных беспокоит анальный зуд. При распространении инфекции в окружающие ткани может развиться острый или хронический парапроктит.
Диагностика.
Особенностью заболевания является отсутствие возможности для исследования прямой кишки из–за резких болей. Поэтому вначале необходимо осторожно развести ягодицы и осмотреть задний проход. Обычно таким образом обнаруживают анальную трещину. Пальцевое исследование проводится с использованием обезболивающих средств, а перед ректороманоскопией необходимо обезболить место трещины введением 5 мл 1 % раствора новокаина в окружающие ее ткани.
Дифференциальная диагностика.
Проводится с геморроем, раком прямой кишки, язвенным колитом, параректальными свищами, сифилитическими и туберкулезными язвами. Подобную клиническую картину могут вызывать криптиты (воспаление морганиевой крипты) и папиллиты (воспаление гипертрофированных анальных сосочков). В первом случае обнаруживается уплотнение в области пораженной крипты и гиперемия стенки анального канала, во втором – без особого труда выявляются фиброзно–измененные анальные сосочки.
Лечение.
При свежих трещинах успешными оказываются консервативные мероприятия. Рекомендуется исключить алкогольные напитки, острые и соленые блюда. Назначаются слабительные препараты, микроклизмы, свечи с обезболивающими и антиспастическими средствами. Перед актом дефекации ставят клизму, а посла нее необходимо принять сидячую ванночку с раствором калия перманганата. Кроме того, под трещину применяются инъекции спиртновокаинового раствора по А. М. Аминеву, масляноанестезирующих растворов по А. Я. Шнее, проводится насильственное растяжение сфинктера под местной анестезией по Ракамье.
При хронических трещинах с омозолелыми краями, гипертрофией сторожевого бугорка, выраженном пектенозе (сужение заднего прохода вследствие ригидности сфинктера) показана операция. Сущность ее состоит в достаточно широком иссечении трещины вместе с рубцово–измененными краями, дном и сторожевым бугорком. Рана не зашивается.
В связи с важной ролью спазма сфинктера в патогенезе трещин предложена задняя дозированная сфинктеротомия. Однако она опасна своими осложнениями – может нарушиться функция замыкательного аппарата прямой кишки. Поэтому при выраженном спазме сфинктера и пектенозе НИИ проктологии (Москва) была предложена боковая подслизистая сфинктеротомия, которая выполняется под контролем пальца, введенного в прямую кишку. С этой целью на 3 или 9 часах по циферблату, отступив от края заднего прохода на 1,5–2 см, смещают кожу в сторону анального отверстия, прокалывают ее острием скальпеля и вводят его до верхнего края аноректального кольца. После этого рассекают боковую порцию внутреннего сфинктера по направлению к слизистой.
Выпадение прямой кишки
При выпадении прямой кишки она через задний проход выворачивается наружу. Различают выпадение слизистой оболочки прямой кишки и выпадение всех ее слоев.Этиология и патогенез.
В развитии заболевания различают предрасполагающие и производящие факторы. К первым относятся врожденная или приобретенная слабость мышц тазового дна, ампулярная форма прямой кишки, увеличение глубины дугласова пространства, ко вторым – все причины, способствующие повышению внутрибрюшного давления (упорные запоры, поносы, неукротимый кашель, тяжелый физический труд, затрудненное мочеиспускание, травмы с повреждением тканей тазового дна). При наличии указанных условий во время акта дефекации повышается внутрибрюшное давление и прямая кишка выворачивается наружу, что в свою очередь способствует ослаблению мышц диафрагмы таза. Таким образом, создается порочный круг. Этому в значительной степени способствуют геморрой, проктит, неспецифический язвенный колит, полипы толстой кишки.
Патологическая анатомия.
Определяются разной степени выраженности воспалительные изменения слизистой прямой кишки (отек, круглоклеточная инфильтрация подслизистого слоя). В мышечном слое происходит развитие соединительной ткани. Дистрофическим процессам подвергаются нервные волокна. Отмечаются гомогенизация и гиалинизация мелких сосудов брыжейки сигмовидной кишки. По мере прогрессирования заболевания усугубляются трофические расстройства и на стенке прямой кишки могут образовываться язвы. Различают выпадение слизистой анального канала, выпадение всех слоев анального канала, выпадение прямой кишки и заднего прохода.
Клиническая картина.
Основная жалоба больных – выпадение прямой кишки во время акта дефекации. Может выпадать только слизистая оболочка или все слои прямой кишки. Вначале происходит самопроизвольное ее вправление. С увеличением длительности заболевания требуется ручное вправление кишки. В более запущенных случаях больные вынуждены пользоваться удерживающими повязками. С учетом этого выделяют три стадии выпадения прямой кишки: 1–я – во время акта дефекации; 2–я – при физической нагрузке; 3–я – при ходьбе, перемене положения тела из горизонтального в вертикальное. Наконец, выпадение становится постоянным, на слизистой прямой кишки появляются изъязвления, которые могут кровоточить. Больные жалуются на недержание газа и кала. При этом выделяют три степени недостаточности сфинктера: 1–я – недержание газа; 2–я – недержание газа и жидкого кала; 3–я – недержание плотного кала.
Диагностика.
Основывается на жалобах больных и данных осмотра, который целесообразно проводить при натуживании больного в положении на корточках. Определяют размер и форму выпавшего отдела кишки, состояние слизистой оболочки. Наличие зубчатой линии свидетельствует о выпадении стенок анального канала. Это может сочетаться с геморроем. Если размер выпавшей кишки более 15 см, то можно думать о выпадении и сигмовидной кишки. Оценить тонус сфинктера позволяет пальцевое исследование. Показано также выполнение ректороманоскопии и ирригоскопии.
Дифференциальная диагностика.
Проводится с инвагинацией кишечника, когда головка инвагината выходит через задний проход. В этих случаях все сомнения разрешает следующий прием. При пальцевом исследовании пациентов с инвагинацией палец свободно проходит в ампулу прямой кишки радом со стенкой кишки, которая вышла за пределы ануса. Если же это выпадение прямой кишки, то палец упирается в перианальную переходную складку.
Лечение.
Основным методом лечения у взрослых является оперативное вмешательство. Наиболее широкое распространение получили ректопексия по Зеренину–Кюммелю и ее модификации. Суть операции состоит в подшивании задней стенки прямой кишки к передней продольной связке позвоночника в области мыса крестца, при этом париетальная брюшина не рассекается. Зудек предложил рассекать париетальную брюшину по бокам от прямой кишки, после отделения ее от крестца – подтягивать кверху и подшивать к мысу, а затем сшивать наружные листки брюшины с кишкой.
Однако более эффективной является модификация НИИ проктологии (Москва), которая применяется при I–II стадиях выпадения и при отсутствии недостаточности сфинктера II–III степеней. Разрез париетальной брюшины производят в области мыса крестца, отступив 2–3 см вправо от кишки, и продолжают вниз с переходом (1–2 см) в виде клюшки над прямой кишкой. Последнюю мобилизуют до уровня мышц, поднимающих задний проход, и обрабатывают раневую поверхность 96 % спиртом. Начиная от мыса, на переднюю поверхность крестца накладывают 3–4 шва с захватом надкостницы через 1,5–2 см, а затем, начиная с нижнего угла, этими же швами прошивают переднюю стенку прямой кишки таким образом, чтобы при завязывании швов происходила ее ротация на 180°. Рассеченную париетальную брюшину ушивают над кишкой. У больных с III стадией выпадения и II–III степенями недостаточности анального сфинктера указанная операция дополняется сфинктеролеваторопластикой. При изолированном выпадении анального канала, часто сочетающемся с геморроем, производится иссечение слизистой оболочки в виде лепестков по типу геморроидэктомии.
Парапроктиты
Парапроктит – воспаление околопрямокишечной клетчатки – является весьма распространенным заболеванием прямой кишки. В структуре проктологических заболеваний он занимает четвертое место после геморроя, анальных трещин, колитов. Парапроктит чаще встречается у лиц мужского пола.Возбудителем инфекции при парапроктите в большинстве случаев является смешанная микрофлора. Чаще всего высеваются стафилококки и стрептококки в сочетании с кишечной палочкой. Такой парапроктит называют обычным или банальным. У больных из гноя могут быть выделены анаэробы, которые не вызывают клинических проявлений. Вместе с тем анаэробная инфекция может проявляться в виде газовой флегмоны клетчатки таза, гнилостного парапроктита и анаэробного сепсиса. Специфические парапроктиты, вызываемые микобактериями туберкулеза, актиномицетами, бледной спирохетой, встречаются крайне редко.
Существует несколько путей проникновения инфекции в околопрямокишечную клетчатку: через анальные железы и поврежденную слизистую прямой кишки, с пораженных воспалительным процессом соседних органов, а также лимфо– и гематогенным путем. В анальную крипту открывается 6–8 анальных желез. Глубокие крипты являются входными воротами для инфекции. Происходит нагноение внутримышечных анальных желез, что ведет к развитию парапроктита. Другой вариант его возникновения заключается в том, что вследствие воспалительного процесса в области протока, соединяющего анальную железу с криптой, образуется нагноившаяся ретенционная киста. При ее вскрытии инфекция распространяется в перианальное и параректальное пространства. Кроме того, из нагноившихся кист микрофлора может попадать в параректальную клетчатку лимфо– и гематогенным путем.
Микротравмы слизистой прямой кишки как причина парапроктита могут вызываться комочками плотного кала, инородными телами (рыбья кость, фруктовые косточки), появляться при выполнении лечебных мероприятий, хирургических вмешательств. В значительной мере этому способствуют запоры, поносы, проктит, проктосигмоидит. В таких случаях инфекция распространяется по межтканевым щелям, лимфо– и гематогенным путем. В подслизистом слое образуются гнойнички, которые отслаивают слизистую. Гной проникает также в ишеоректальное, пельвиоректальное, подкожное параректальные клеточные пространства.
Определенную роль в возникновении парапроктита играют геморрой, анальные трещины, неспецифический язвенный колит, болезнь Крона. Воспаление околопрямокишечной клетчатки может развиться при заболеваниях предстательной железы, уретры, желез Купера, органов женской половой сферы, при остеомиелите костей таза.
Воспалительный процесс в области крипты может закончиться формированием внутреннего отверстия свища, что клинически часто ничем не проявляется. При неблагоприятных условиях (высокая вирулентность флоры, слабая реактивность организма, недостаточное дренирование гнойника) вокруг прямой кишки образуются гнойные затеки, которые могут вскрываться на кожу в различных участках тела (наружные свищевые отверстия).
Острый парапроктит
Острый парапроктит – острое гнойное воспаление околопрямокишечной клетчатки.Клиническая картина.
Заболевание характеризуется быстрым развитием воспалительного процесса. Вначале (первые три дня) больные отмечают слабость, недомогание, озноб, нарастание болей в области прямой кишки, промежности. Степень выраженности этих симптомов зависит от вида микрофлоры, реактивности организма, локализации гнойного очага. При развитии воспалительного процесса по типу флегмоны таза преобладают общие признаки, обусловленные интоксикацией. Это может сопровождаться тенезмами, задержкой стула, дизурическими расстройствами. Однако чаще всего на первый план выступают местные проявления заболевания, которые зависят от формы острого парапроктита. По мере прогрессирования воспалительного процесса, формирования гнойника ухудшается общее состояние больных, нарастает интенсивность болей, которые приобретают пульсирующий характер и часто имеют четкую локализацию. Обычно это продолжается до 10 дней. Если не проводится адекватное лечение, то гнойник вскрывается в соседние клетчаточные пространства, в прямую кишку или на кожу промежности. Это может закончиться выздоровлением (реже), формированием свища прямой кишки (хронический парапроктит) или развитием рецидивирующего парапроктита, который характеризуется сменой ремиссий новыми обострениями воспалительного процесса.
Выделяют следующие формы острого парапроктита: 1. подкожный 2. подслизистый 3. седалищно–прямокишечный 4. тазово–прямокишечный 5. позадипрямокишечный (рис. 13).
 Рис. 13. Основные виды острых парапроктитов:
1 – абсцесс дугласова пространства, 2 – седалищно–прямокишечный; 3 – подкожный; 4 – подслизистый; 5 – тазово–прямокишечный.
Рис. 13. Основные виды острых парапроктитов:
1 – абсцесс дугласова пространства, 2 – седалищно–прямокишечный; 3 – подкожный; 4 – подслизистый; 5 – тазово–прямокишечный.
Подкожный парапроктит.
Эта форма заболевания встречается наиболее часто. Ею страдают около 50 % всех больных острым парапроктитом. В этих случаях возникают острые и быстро нарастающие боли в области заднего прохода, промежности. Они носят пульсирующий характер, усиливаются при движении, напряжении брюшного пресса, кашле, акте дефекации. Могут наблюдаться дизурические явления, задержка стула. Температура тела достигает 38–39°С При осмотре отмечаются гиперемия кожи промежности на стороне поражения, сглаживание складок у заднего прохода. Последний деформируется, становится щелевидным, больные могут не удерживать газ и жидкий кал. Пальпация этой зоны резко болезненна, часто определяется флюктуация. Пальцевое исследование прямой кишки сопровождается усилением болей, при этом можно выявить размеры инфильтрата и его верхнюю границу.
Подслизистый парапроктит.
Встречается значительно реже подкожного и составляет 2–6% всех форм острого парапроктита. Клинически он протекает более легко. Основные жалобы больных – нерезко выраженные боли в области прямой кишки, которые усиливаются во время акта дефекации. Температура тела субфебрильная. При осмотре местные изменения необнаруживаются, однако если гной опустился ниже гребешковой линии и переходит на подкожную клетчатку (подкожно–подслизистый гнойник), то выявляется отек в области, соответствующей полуокружности заднего прохода. Пальцевое исследование прямой кишки позволяет определить болезненное, округлой формы и тугоэластической консистенции образование, которое располагается выше гребешковой линии в подслизистом слое. Обычно в течение 7 дней с момента заболевания гнойник вскрывается в просвет прямой кишки и наступает выздоровление.
Седалищно–прямокишечный (ишиоректальный) парапроктит.
Встречается у 35–40% больных. Вначале они жалуются на общую слабость, познабливание, расстройство сна. Затем присоединяются ощущение тяжести и боль тупого характера в области прямой кишки или таза. В последующем (к концу недели) состояние пациентов значительно ухудшается. Температура тела достигает 39–40°С, сопровождается ознобами. Боли в зоне поражения становятся острыми, пульсирующими, усиливаются при кашле, акте дефекации. Если гнойник локализуется вблизи предстательной железы и мочеиспускательного канала, наблюдаются дизурические нарушения. К концу первой недели с момента заболевания появляются припухлость и гиперемия кожи промежности в зоне расположения гнойника. При пальпации определяется тестоватость тканей без резкой их болезненности. Ценные сведения позволяет получить пальцевое исследование прямой кишки. При этом в начале заболевания выше анального канала определяется уплотнение стенки прямой кишки со сглаженностью ее складок. В процессе прогрессирования ишиоректального парапроктита воспалительный инфильтрат увеличивается и вызывает выбухание на стороне поражения стенки кишки в ее просвет.
Тазово–прямокишечный (пельвиоректальный) парапроктит.
Наиболее тяжелая форма, встречается у 2–7 % больных острым парапроктитом. Заболевание начинается с общих симптомов, обусловленных интоксикацией. Постепенно состояние пациентов ухудшается, появляются лихорадка, ознобы, головная боль, боли в суставах. Все это может напоминать клинику простудных заболеваний или гриппа. В последующем присоединяются боли в нижней половине живота, в области таза, однако в ряде случаев они могут отсутствовать, что значительно затрудняет диагностику. Поэтому больные нередко лечатся у других специалистов (урологов, гинекологов, терапевтов) в связи с ошибочно установленным диагнозом. Это может продолжаться несколько недель или месяцев, если не происходит нагноение инфильтрата пельвиоректальной клетчатки. Тем не менее исследование прямой кишки с помощью пальца и ректоскопа позволяет выявить начальные признаки пельвиоректального парапроктита. К ним относятся болезненность и тестоватая консистенция стенок верхних отделов прямой кишки, наличие инфильтрата за ее пределами, верхний полюс которого не удается определить при пальцевом исследовании. Слизистая на уровне инфильтрата гиперемирована, ее сосудистый рисунок имеет четкое сетчатое строение. При значительном выбухании очага поражения в сторону просвета прямой кишки слизистая оболочка теряет складчатость, становится гладкой, легко кровоточит от прикосновения ректороманоскопа, колоноскопа,
В случае образования гнойника в пельвиоректальной клетчатке заболевание приобретает острое течение. Быстро нарастают признаки интоксикации, появляется гектическая температура, имеют место задержка стула, тенезмы. Однако местные симптомы появляются только при распространении гнойного процесса на ишиоректальную и подкожную клетчатку. Для этого требуются 2–3 недели. За такой период времени возможен переход воспалительного процесса на противоположную сторону с формированием подковообразного парапроктита. В редких случаях гнойник может опорожниться через дефект стенки прямой кишки вследствие ее расплавления. Прорыв гноя через кожу промежности ведет к образованию свища.
При острых пельвиоректальных парапроктитах в воспалительный процесс иногда вовлекается тазовая брюшина, что сопровождается возникновением болей в нижних отделах живота и симптомов раздражения брюшины.
Позадипрямокишечный (ретроректальный) парапроктит.
Эта форма острого парапроктита встречается у 2–3 % больных. Она характеризуется выраженным болевым синдромом. При этом боли локализуются в области прямой кишки и крестца, усиливаются при акте дефекации. Внешние признаки заболевания обычно отсутствуют, они появляются лишь после прорыва гнойника на кожу промежности или в просвет прямой кишки. При пальпации крестцово–копчиковой области отмечается различной степени выраженности болезненность. Во время пальцевого исследования определяется резко болезненное выбухание задней стенки прямой кишки.
Диагностика.
Основывается на тщательном изучении анамнеза и клинической картины заболевания, результатах пальцевого исследования прямой кишки, а также данных эндоскопии.
Лечение.
При остром парапроктите проводится хирургическое лечение. Операция выполняется сразу после установления диагноза. В противном случае существует опасность распространения гнойного процесса по клетчаточным пространствам таза. Оперативное вмешательство выполняется под наркозом. Сущность операции состоит во вскрытии и дренировании гнойника, ликвидации его внутреннего отверстия как входных ворот инфекции. При подкожно–подслизистом парапроктите радиальным разрезом рассекают слизистую, гребешковую линию, пораженные анальные крипты, кожу перианальной области. После вскрытия гнойника края разреза иссекают от верхнего до нижнего угла раны вместе с пораженной криптой. В рану вводят мазевый тампон, а в просвет кишки – газоотводную трубку. Однако нередко при указанной форме парапроктита используется другой вариант операции. Гнойник вскрывают полулунным разрезом, отступив от края анального прохода не менее 3 см. После эвакуации гноя и ревизии абсцесса пуговчатым зондом проходят через внутреннее отверстие свища, который рассекают на всем протяжении. Затем кожу и слизистую оболочку иссекают в виде треугольника, вершина которого находится в анальном канале, а основание представлено разрезом на коже промежности (операция Габриэля). В этих случаях также тщательно иссекают пораженную крипту.
При ишиоректальных и пельвиоректальных парапроктитах указанные оперативные вмешательства не могут быть выполнены из–за неизбежного повреждения наружного сфинктера, В этих случаях гнойник вскрывают полулунным разрезом на глубину, достаточную для полной эвакуации гноя. С помощью пальца разъединяют перемычки, вскрывают гнойные затеки, т. е. производят тщательную ревизию полости. Указательный палец другой руки вводят в анальный канал и определяют внутреннее отверстие свища. Место сообщения гнойника с кишкой обычно находится в зоне более тесного их соприкосновения. Со стороны раны промежности через внутреннее отверстие свища проводят зонд в прямую кишку и оценивают его расположение по отношению к сфинктеру. Если зонд проходит через сфинктер, то возможно рассечение свищевого хода с клиновидным иссечением слизистой вместе с пораженной криптой и кожей. В тех случаях, когда зонд проходит кнаружи от сфинктера, операцию предлагалось заканчивать дозированной сфинктеротомией. В последние годы она почти полностью вытеснена лигатурным методом, сущность которого состоит в следующем. После опорожнения гнойника и констатации экстрасфинктерного расположения свищевого хода, который соединяет полость абсцесса с просветом прямой кишки, полулунный разрез кожи продлевают до средней линии кзади или кпереди от прямой кишки, что зависит от локализации пораженной крипты. В анальный канал вставляют ректальное зеркало и эллипсовидным разрезом иссекают внутреннее отверстие свища (пораженной крипты) до мышечного слоя. При этом нижний угол раны соединяется с медиальным углом раны промежности, а верхний располагается на 1 см выше пораженной крипты. Слизистую оболочку иссекают на всем протяжении разреза. После этого ложечкой тщательно выскабливают внутреннее отверстие свища и обрабатывают его 1 % раствором йода. Затем через рану промежности и внутреннее отверстие свища (иссеченную крипту) в прямую кишку и далее наружу проводят толстую шелковую лигатуру, которую укладывают строго по средней линии впереди или позади анального канала, и затягивают. В прямую кишку вводят мазевый тампон и газоотводную трубку, рану промежности рыхло тампонируют. В послеоперационном периоде, через каждые 3–8 дня по мере прорезывания волокон сфинктера, лигатуру снова затягивают. Этим достигается постепенное пересечение мышечных волокон сфинктера без нарушения его замыкательной функции, что предотвращает развитие хронического парапроктита.
Хронический парапроктит (свищи прямой кишки)
Хронический парапроктит является следствием острого воспаления околопрямокишечной клетчатки. Он характеризуется наличием внутреннего отверстия в кишке, наружного отверстия на коже промежности, свищевого хода в клетчаточных пространствах таза. Заболевание встречается у 30–40 % всех проктологических больных, что объясняется поздним обращением пациентов с острым парапроктитом за врачебной помощью и недостаточно эффективным его лечением из–за неверно избранной хирургической тактики – часто ограничиваются только вскрытием гнойника без ликвидации внутреннего отверстия свища.Различают полные и неполные свищи прямой кишки (рис. 14, 15, 16). Полные свищи характеризуются наличием внутреннего отверстия на стенке кишки и одного или нескольких наружных отверстий на коже промежности (иногда в области мошонки, бедра, на передней брюшной стенке). Неполный свищ (внутренний) имеет отверстие только на стенке прямой кишки. Он является следствием вскрытия гнойника в просвет кишки и встречается примерно в 10% случаев. Неполный наружный свиш встречается редко. В этих случаях просто не удается установить локализацию внутреннего отверстия на момент обследования больного. По отношению к мышечным волокнам сфинктера свищи прямой кишки подразделяют на интра–, транс– и экстрасфинктерные.
 Рис. 14. Полные свищи прямой кишки:
1 – подслизистый; 2 – седалищно–прямокишечный; 3 – подкожно–подслизистый; 4 – тазово–прямокишечный.
Рис. 14. Полные свищи прямой кишки:
1 – подслизистый; 2 – седалищно–прямокишечный; 3 – подкожно–подслизистый; 4 – тазово–прямокишечный.
Клиническая картина.
Интрасфинктерные свищи (свищевой канал проходит кнутри от сфинктера) – это под слизистые и подкожно–подслизистые свищи. Они встречаются у 25–35 % больных. При осмотре у большинства пациентов имеется одно наружное отверстие, которое локализуется в 1–3 см от края анального канала. Во время пальпации перианальной области определяется свищевой ход, который проходит в подкожном или подслизистом слое. При введении зонда в наружное отверстие свища он обычно свободно проходит в просвет прямой кишки, реже встречает препятствие в подслизистом слое, где располагается внутреннее отверстие. Проба с метиленовым синим чаще всего положительная (отмечается проникновение его в просвет кишки).
 Рис. 15. Неполные наружные свиши прямой кишки:
1 – подкожный; 2 – седалишно–прямокишечный; 3 – тазово–прямокишечный.
Рис. 15. Неполные наружные свиши прямой кишки:
1 – подкожный; 2 – седалишно–прямокишечный; 3 – тазово–прямокишечный.
Транссфинктерные (чрессфинктерные) свищи прямой кишки (свищевой канал частично проходит через сфинктер) встречаются наиболее часто (у 40–45 % больных). Пациенты жалуются на умеренное, а иногда и обильное отделяемое из свища. При осмотре в половине случаев определяется одно наружное отверстие, в 45 % – два или три и в 5 % – более трех отверстий. Пальпация позволяет выявить в подкожной клетчатке плотный тяж. При пальцевом исследовании прямой кишки обнаруживается воронкообразное углубление стенки анального канала, которое представляет собой внутреннее отверстие свища. У 60 % больных зонд, введенный через наружное отверстие свища, проникает в просвет кишки или подходит к подслизистому слою в области локализации внутреннего отверстия. Метиленовая проба, как правило, положительная. На фистулограммах у половины больных свищевой ход имеет разветвленный характер, при этом нередко выявляются также полости в параректальной клетчатке. При длительном существовании свища у больных могут появляться признаки слабости сфинктера.
 Рис. 16. Неполные внутренние свищи прямой кишки:
1 – тазово–прямокишечный; 2 – седалищно–прямокишечный; 3 – подслизистый.
Рис. 16. Неполные внутренние свищи прямой кишки:
1 – тазово–прямокишечный; 2 – седалищно–прямокишечный; 3 – подслизистый.
Экстрасфинктерные свищи (свищевой канал проходит кнаружи от сфинктера в клетчаточных пространствах таза) характеризуются наиболее четкой клинической картиной и встречаются у 15–25 % больных хроническим парапроктитом. Они являются следствием острого ишиоректального, пельвиоректального или ретроректального парапроктита. Их следует относить к сложным свищам, так как в этих случаях имеются разветвленные свищевые ходы, выраженный рубцовый процесс по ходу свища и в стенке анального канала, а также полости с гнойным содержимым в околопрямокишечной клетчатке. Больных беспокоят гнойные выделения из наружного отверстия свища. В период обострения процесса, что наблюдается несколько раз в год, усиливаются боли в анальном канале и перианальной области, появляются признаки интоксикации – общая слабость, повышение температуры тела. При осмотре перианальной области определяются выраженный рубцовый процесс и чаще несколько наружных отверстий свища. Пальпация выявляет рубцово–измененные ткани в перианальной области, а при наличии гнойных полостей – болезненность в зоне поражения. Во время пальцевого исследования прямой кишки обнаруживается воронкообразное углубление ее стенки – место локализации внутреннего отверстия свища. При зондировании свища зонд направляется параллельно прямой кишке, что свидетельствует об экстрасфинктерном расположении свищевого канала. Фистулография выявляет разветвленность свищевого хода и наличие полостей в околопрямокишечных клетчаточных пространствах.
При хроническом парапроктите общее состояние больных страдает мало. Однако пациенты с длительным анамнезом жалуются на раздражительность, снижение работоспособности, головную боль, бессонницу. Клиническое течение данного заболевания характеризуется чередованием обострений и ремиссий. Количество гнойного отделяемого зависит от объема дренируемых полостей, активности воспалительного процесса. Закрытие наружного отверстия свища ведет к обострению парапроктита (хронический рецидивирующий парапроктит), усилению болевого синдрома, который исчезает после вскрытия гнойника. Хроническому парапроктиту нередко сопутствуют проктит, проктосигмоидит. При длительном существовании свищей, особенно характеризующихся частыми обострениями, происходит замещение соединительной тканью мышечных волокон сфинктера, что делает его ригидным и может привести к сужению анального канала, недержанию газа и кала. Редким, но грозным осложнением хронического парапроктита является озлокачествление свищей.
Диагностика.
Основывается на данных анамнеза, клинической картины заболевания и результатах дополнительных методов исследования (проба с метиленовым синим, зондирование свища, фистулография, аноскопия, ректором аноскопия).
Дифференциальная диагностика.
Проводится прежде всего с заболеваниями, одним из симптомов которых является наличие свища в области промежности (эпителиальные копчиковые ходы, нагноившиеся кистозные тератоидные образования параректальной клетчатки, остеомиелит костей таза, простатит, актиномикоз, не специфический язвенный колит, болезнь Крона, туберкулез).
Лечение.
Может быть консервативным и хирургическим. Консервативное лечение предусматривает регуляцию акта дефекации, применение сидячих ванн, восходящего душа после стула, промывание свищевых ходов антисептическими растворами с последующим введением в их просвет антибиотиков, а в анальный канал свечей, назначение микроклизм, в том числе с 0,3 % раствором колларгола. Однако такое лечение редко приводит к полному выздоровлению, поэтому его целесробразно использовать в качестве предоперационной подготовки.
Основным методом лечения хронического парапроктита является хирургическое вмешательство. При этом следует учитывать отношение свищевого хода к мышечным волокнам сфинктера, степень выраженности рубцового процесса на всем протяжении свища, наличие инфильтратов и гнойных полостей в клетчаточных пространствах таза. Операцию выполняют только после ликвидации острых явлений.
Хирургическое лечение больных с интрасфинктерными свищами. 1. Рассечение свища в просвет прямой кишки. Эта операция показана больным с подслизистыми свищевыми ходами, а также с краевыми свищами. На зонде, введенном в свищ, рассекают мостик тканей между наружным и внутренним отверстиями. Дно раны выскабливают острой ложечкой, а нависающие края кожной раны иссекают таким образом, чтобы она приобрела клиновидную форму. 2. Иссечение свища в просвет прямой кишки (операция Габриэля). Это наиболее часто применяемое оперативное вмешательство у больных с интрасфинктерными свищами. После прокрашивания метиленовым синим через наружное отверстие свища проводят желобоватый зонд в просвет кишки. Над ним рассекают мостик тканей между наружным и внутренним отверстиями свища. После этого свищевой ход на всем протяжении иссекают в виде треугольника, вершина которого обращена в просвет прямой кишки. Это необходимо для того, чтобы раны прямой кишки заживали медленнее, чем раны перианальной кожи. В противном случае может сформироваться неполный внутренний свищ. 3. Иссечение свища в просвет прямой кишки со вскрытием и дренированием затека. Операция показана при наличии гнойной полости в подкожной клетчатке. В этих случаях свищевой ход рассекают по зонду, после чего последний проводят в полость гнойника и вскрывают его по зонду. Острой ложечкой выскабливают гнойную полость, затем края раны и стенки свищевого канала иссекают.
Хирургическое лечение больных с транссфинктерньши свищами. 1. Иссечение свища в просвет прямой кишки с ушиванием дна раны. Операция показана при умеренно выраженном рубцовом процессе. После введения зонда через свищ в прямую кишку рассекают мостик тканей между наружным и внутренним отверстиями, в том числе и часть волокон сфинктера. После этого осторожно иссекают стенки свищевого канала и края раны, придавая ей треугольную форму, как при операции Габриэля. Пересеченные края мышечных волокон сфинктера сшивают отдельными кетгутовыми швами без захвата слизистой и кожи. 2. Иссечение свища в просвет прямой кишки с частичным ушиванием дна раны, вскрытием и дренированием гнойной полости. Операция выполняется при наличии гнойников в околопрямокишечных клетчаточных пространствах. Суть ее состоит в том, что после рассечения свища на зонде и иссечения свищевого хода, а также кожно–слизистых краев раны вскрывают гнойную полость, стенки ее иссекают и накладывают кетгутовые швы (2–3. на края сфинктера. Рану промежности не ушивают. 3. Иссечение свища в просвет прямой кишки со вскрытием и дренированием гнойной полости. Показанием к операции является наличие выраженного рубцового процесса по ходу свищевого канала и гнойника в параректальной клетчатке. Производят рассечение на зонде свищевого хода с последующим иссечением в пределах здоровых тканей. Затем вскрывают и дренируют гнойную полость, выскабливают ее ложечкой, стенки иссекают.
Хирургическое лечение больных с жстрасфипктерными свищами прямой кишки. Экстрасфинктерные свищи прямой кишки являются наиболее сложными. Для их лечения предложены различные оперативные вмешательства, сугь которых состоит в иссечении свищевого хода и ушивании внутреннего отверстия свища, при этом рану промежности ушивают наглухо. А. Н. Рыжих предлагал дополнять операцию дозированным рассечением сфинктера, однако это не нашло широкого применения. До сих пор с успехом используется метод иссечения свища с проведением лигатуры (лигатурный метод). Сущность его состоит в рассечении сфинктера по мере затягивания лигатуры, проведенной через свищ. Мышечные волокна сфинктера вслед за лигатурой постепенно срастаются.
Глава 2. Гепатобилиарная система
Анатомо–физиологические сведения о печени и внепеченочных желчных путях
У взрослого человека масса печени составляет 1200–1500 г. Она имеет брюшинный покров на всем протяжении, за исключением задней поверхности. Различают две доли печени – правую и левую. Граница между ними проходит через ложе желчного пузыря, ворота печени и место впадения правой печеночной вены в нижнюю полую вену. В печени различают восемь сегментов, при этом I–TV сегменты составляют левую долю, а V–VIII – правую (рис. 17). Поверхность печени покрыта глиссоновой капсулой.Кровоснабжение печени осуществляется за счет собственной печеночной артерии, которая делится на две ветви – правую и левую (соответственно долям печени). Она обеспечивает примерно 25% притока крови к печени, в то время как остальные 75% – воротная вена. Последняя в воротах печени делится на правую и левую ветви. По ходу ветвей воротной вены располагаются внутрипеченочные желчные пути, которые выводят желчь в сегментарные протоки.
Отток крови из печени осуществляется через печеночные вены, которые начинаются от дольковых и сегментарных вен. Печеночные вены тремя стволами впадают в нижнюю полую вену.
Отток лимфы из печени происходит по ходу внутренней грудной артерии (в грудной лимфатический проток) и печеночно–двенадцатиперстной связки.
В иннервации печени принимают участие симпатические нервы из правого чревного ствола и парасимпатические из печеночной ветви левого блуждающего нерва.
Печень выполняет весьма разнообразные функции. Она принимает участие в обмене белков, жиров, углеводов, образовании желчи, регуляции обмена билирубина. Хорошо известна детоксикационная функция печени. Благодаря наличию ретикулоэндотелиального аппарата она играет важную роль в осуществлении защитной функции организма. Ежедневно в кишечник поступает 700–1200 мл желчи. Печень выделяет желчь непрерывно, а в двенадцатиперстную кишку она поступает с перерывами, что определяется функциональным состоянием желчного пузыря и большого дуоденального сосочка (БДС).
В воротах печени правый и левый печеночные протоки сливаются и образуют общий печеночный проток. Его длина 2–5 см, ширина 6 мм. После присоединения пузырного протока образуется общий желчный проток, длина которого колеблется в пределах 5–15 см, а ширина – 6–8 мм, Общий желчный проток имеет отделы: супрадуодепальный, ретродуоденальный, панкреатический, интрадуоденальный (интрамуральный). Он заканчивается БДС, в норме его длина составляет 3 мм, ширина – 4 мм.
Желчный пузырь имеет длину 8–10 см, ширину 3–5 см, вместимость около 50 мл. Стенка его отделена от печени фиброзной капсулой, содержащей сосуды и ходы Лушки, желчный пузырь переходит в пузырный проток, который под острым углом впадает в печеночный.
Важное значение имеют взаимоотношения желчных путей и артериальных сосудов, проходящих в печеночно–двенадцатиперстной связке. Обычно собственно печеночная артерия располагается медиально, однако встречаются различные варианты хода общей печеночной артерии и ее ветвей.
Функция желчных путей состоит в отведении желчи из печени в кишечный тракт. Этот процесс осуществляется благодаря градиенту давления. БДС регулирует ритмическое поступление желчи в кишечник. Главным регулятором моторной функции желчных путей является энтерогормон холецистокинин–панкреозимин.
 Рис. 17. Сегментарное строение печени no Coninoud.
Рис. 17. Сегментарное строение печени no Coninoud.
Историческая справка. В 1867 г. Bobs впервые выполнил одномоментную холецистостомию. Первую плановую холецистэктомию произвел Langenbuch в 1882 г. Kummel в 1884 г. сообщил о выполнении холедохотомии с одновременным удалением желчного пузыря. В 1886 г. Lins описал резекцию печени. Первую холецнстодуоденостомию выполнил Terrier в 1889 г, В 1898 г. Czerny осуществил гепатоэнтеростомию. Кег в 1902 г. выполнил гепатикодуоденостомию по поводу раковой опухоли, расположенной у устья пузырного протока. Первая гепатикосюностомия произведена Monprofit в 1904 г.
Очаговые поражения печени
Травмы печени
Различают открытые и закрытые повреждения печени. Первые возникают вследствие ранения огнестрельным или холодным оружием, иными твердыми предметами, вторые – при падении с высоты, прямом ударе в область печени или живота. Они могут быть изолированными и сочетаться с повреждениями других органов.По тяжести травмы печеночной ткани различают: 1. разрыв капсулы печени с незначительным кровотечением; 2. поверхностный разрыв печеночной ткани; 3. глубокий разрыв печени с профузным артериальным и венозным кровотечением; 4. глубокие разрывы печени с повреждением ее магистральных сосудов и нижней полой вены.
Закрытые повреждения печени
Закрытые повреждения печени встречаются относительно часто.Клиническая картина и диагностика.
Тяжесть состояния больных и клиническая картина обусловлены характером травмы печеночной ткани. При глубоких разрывах печени отмечаются травматический шок и резко выраженное внутрибрюшинное кровотечение. В таких ситуациях нет необходимости применять дополнительные методы исследования, больной подлежит срочной лапаротомии. При менее тяжелых повреждениях печени общее состояние пациентов обусловлено характером кровотечения в брюшную полость. Живот при этом часто остается мягким, но болезненным (симптом Куленкампффа). В сомнительных случаях показана пункция брюшной полости по типу шарящего катетера, однако лучше использовать лапароскопию. Особого внимания заслуживают больные с субкапсулярными гематомами, при которых состояние их в первые дни после травмы остается удовлетворительным, аналогично тому, как это наблюдается при небольших поверхностных разрывах печени. Однако после разрыва капсулы, что может произойти в любые сроки после травмы, состояние пациентов резко ухудшается в связи с возникновением внутрибрюшинного кровотечения.
Лечение.
Поверхностные разрывы печени с незначительным кровотечением могут пройти незаметно для больного и остаться недиагностированными. Если имеется надрыв капсулы печени с небольшим паренхиматозным кровотечением, что устанавливается с помощью лапароскопии, и нет повреждения других органов брюшной полости, можно использовать эндоскопические методы гемостаза (электрокоагуляция).
Основным же методом лечения при повреждении печеночной ткани является оперативное вмешательство. При этом существуют следующие способы обработки ран печени.
При поверхностных повреждениях без размозжения печеночной паренхимы рану ушивают без иссечения ее краев. С этой целью наряду с другими методами может быть использовано наложение шва Кузнецова–Пенского. Более глубокие раны с размозжением краев ушивают после иссечения поврежденных участков печеночной ткани и предварительного гемостаза путем перевязки или прошивания кровоточащих сосудов. Если этого не сделать, может образоваться внутрипеченочная гематома и развиться вторичное кровотечение или нагноение раны. При массивных повреждениях печени производится атипичная резекция – обработка пораженной зоны или типичная резекция.
При разрыве труднодоступных задних сегментов печени и тяжелом состоянии больных можно использовать метод гепатопексии по Хиари–Алферову, т.е. подшить передний и задний края печени к париетальной брюшине соответственно передней и задней стенок живота. В подобной ситуации можно прибегнуть также к тугому тампонированию раны печени. При глубоких повреждениях печени нарушается целостность внутрипеченочных желчных протоков и развивается спазм сфинктера Одди, что в послеоперационном периоде может привести к развитию желчного перитонита. Поэтому в таких случаях операцию рекомендуется заканчивать декомпрессией желчных путей (накладывается холецистостома или холедохостома).
Открытые повреждения печени
Открытые повреждения печени могут быть огнестрельные и колото–резаные. Последние характеризуются гладкой раневой поверхностью и обычно небольшой зоной повреждения печеночной паренхимы. ГГри огнестрельных ранениях возникают множественные разрывы–трещины печени со значительным разрушением ее ткани в области раневого канала. Зоны печеночной ткани, лишенные кровоснабжения в результате травмы питающих их сосудов, в последующем подвергаются некрозу.Клиническая картина и диагностика.
Клиническая картина при ранениях печени схожа с таковой при закрытых повреждениях. Тяжесть состояния больного зависит от характера травмы и степени кровотечения. Наличие раны в области печени, истечение из нее крови и желчи, развитие перитонеальных явлений свидетельствуют о травме печени, которая требует срочного оперативного вмешательства.
Лечение.
Методы обработки ран печени те же, что и при закрытых повреждениях. Однако при огнестрельных ранениях требуется особенно тщательная ревизия с полным иссечением нежизнеспособных тканей.
Кисты печени
Непаразитарные кисты
Выделяют солитарные (одиночные) и множественные (поликистоз) кисты печени, а также поликистозную болезнь, когда одновременно имеются кисты в других органах (поджелудочной железе, почках, яичниках, легких). Истинные кисты изнутри выстланы слоем кубического или цилиндрического эпителия. Такой покров отсутствует в ложных кистах, которые образуются вследствие травмы печени.Этиология и патогенез.
и патогенез. Остаются неизвестными, хотя считается, что кисты имеют врожденный характер. Кисты печени чаще встречаются в возрасте 40–60 лет преимущественно у лиц женского пола.
Клиническая картина.
Кисты печени обычно протекают бессимптомно и являются случайной находкой при УЗИ пациентов или во время лапаротомии, предпринятой по поводу другого заболевания. Кисты печени больших размеров могут вызывать болевой синдром и быть доступными пальпации. Клиническая картина становится более четкой при развитии осложнений (разрыв, нагноение кисты, кровоизлияние в ее полость и др.). В этих случаях возникают острые боли в животе, перитонеальные явления, прогрессируют признаки интоксикации, что требует срочного оперативного вмешательства. Иногда кисты печени сдавливают печеночно–двенадцатиперстную связку, что сопровождается желтухой и асцитом. При выраженном поликистозе печени может развиться печеночная недостаточность.
Диагностика.
Основывается на результатах инструментальных методов исследования (УЗИ, компьютерная томография, лапароскопия, чрескожная чреспеченочная пункция кисты с цистограммой).
Дифференциальная диагностика.
Проводится с другими очаговыми поражениями печени, в том числе паразитарными кистами.
Лечение.
Наименее травматичным методом лечения при солитарных кистах печени является чрескожная пункция их соответствующими иглами под контролем УЗИ или компьютерного томографа с оставлением микродренажа. В последующем проводится промывание полости кисты в целях ее облитерации.
При отсутствии эффекта показано хирургическое лечение.
Выполняются следующие виды операций: 1. вскрытие кисты, опорожнение ее и наружное дренирование; 2. частичное иссечение стенок кисты (выступающих над поверхностью печени) с ушиванием остаточной полости или ее дренированием; 3. марсупиализация кисты (подшивание стенок вскрытой кисты к краям раны); 4. наложение цистоэнтеро– или цистогастроанастомоза (внутреннее дренирование кисты); 5. цистэктомия; 6. резекция печени с кистой.
Паразитарные кисты
Гидатидный эхиноккоз печени.
Встречается в 50–80% всех наблюдений эхинококкоза в организме человека. Локализуется преимущественно в правой доле печени, что связано с большей развитостью в ней ветвей воротной вены. Может быть одиночным и множественным. Располагается в поверхностных слоях или в толще паренхимы печени.Этиология и патогенез.
Изложены в разделе "Паразитарные кисты селезенки". По мере увеличения эхинококкового пузыря в размерах сдавливается окружающая кисту паренхима печени. Развивается атрофия печеночных долек, разрастается соединительная и грануляционная ткань. Происходит застой в желчных капиллярах и кровеносных сосудах.
Клиническая картина.
Эхинококковые кисты растут медленно. В течении эхинококкоза печени выделяют три стадии.
Первая стадия соответствует периоду от проникновения эхиникокка в печень до развития начальных признаков заболевания. Эта стадия длится годами и десятилетиями. Больные чувствуют себя удовлетворительно. Киста обнаруживается случайно при обследовании в связи с другой патологией.
Во второй стадии появляются симптомы, связанные с давлением эхинококковой кисты на ткань печени или окружающие органы. Пациентов беспокоят чувство тяжести, распирания, ноющие боли в правом подреберье и эпигастрии, реже в грудной клетке. В случае расположения паразитарной кисты на диафрагмальной поверхности печени боль иррадиирует в спину, поясничную область, правую лопатку. Определяются правосторонний френикус–симптом, а рентгенологически высокое стояние и ограничение подвижности правого купола диафрагмы.
Третья стадия характеризуется возникновением осложнений кисты: нагноением, разрывом, сдавлением печеночных протоков и воротной вены, обызвествлением.
При нагноении эхинококковой кисты появляются интенсивные боли в области ее локализации, гектическая температура, озноб. Паразитарная киста увеличивается. Исходом нагноения могут быть развитие септического состояния, прорыв абсцесса в брюшную или плевральную полость.
Разрыв эхинококковой кисты сопровождается резкими, интенсивными или быстро купирующимися болями в правом подреберье. В ряде сдучаев наступает коллапс. Кисты опорожняются в свободную брюшную полость, в бронх, во внутрипеченочные желчные протоки, в желчный пузырь, желудок, кишечник. Попадание содержимого кисты эхинококкового пузыря в брюшную полость приводит к диссеминации процесса, возникновению крапивницы, а иногда анафилактического шока. При прорыве эхинококкового пузыря в бронх внезапно появляется сильный кашель с отхождением жидкой мокроты, содержащей множество дочерних эхинококковых пузырей. В случае опорожнения кисты во внутрипеченочные желчные протоки прогрессируют холангит, желтуха. Опорожнение кисты в плевральную полость приводит к гнойному плевриту, абсцессам легких.
В результате сдавления эхинококковым пузырем печеночных протоков и воротной вены развиваются механическая желтуха и портальная гипертензия.
Крайне редко наблюдается самопроизвольная гибель паразита с последующим обызвествлением его стенок, т.е. происходит самоизлечение организма.
Диагностика.
Печень у больных с эхинококкозом увеличена. При расположении паразитарной кисты на передне–нижней поверхности печени наблюдается выпячивание брюшной стенки, а при латеральной локализации – деформация реберной дуги и ребер. Пальпируемая киста имеет гладкую поверхность, ее консистенция зависит от характера содержимого и состояния стенки. Неосложненная киста мягкоэластической консистенции. В случае ее предлежания к передней брюшной стенке выявляют симптомы флюктуации и симптом дрожания гидатид. Для определения последнего симптома на область опухолевидного образования накладывают несколько раздвинутые указательный, средний и безымянный пальцы левой руки. Быстрыми, короткими ударами поколачивают по среднему пальцу. В этот момент два крайних пальца ощущают своеобразное дрожание или вибрацию. Появление вибрации связано с колебаниями дочерних пузырей, содержащихся в полости кисты.
Диагноз эхинококкоза печени подтверждается реакциями, в основе которых лежит появление в организме больных специфических антител в ответ на инвазию паразита. Наибольшее распространение получила внутриклеточная реакция Каццони со стерильной жидкостью эхинококкового пузыря человека или домашних животных (0,1–0,2 мл). При положительной пробе в месте инъекции антигена возникают зуд, гиперемия и отек кожи. Положительная реакция Каццони у больных с эхинококкозом наблюдается в 75–85% случаев. Через год после гибели паразита она становится отрицательной. Помимо реакции Каццони, в диагностике эхинококкоза печени используется реакция латекс–агглютинации (латекс–синтетическая смола, адсорбент антигенов). В крови больных с эхинококкозом обнаруживается эозинофилия. К рентгенологическим признакам эхиноккоза относятся высокое стояние и ограничение подвижности купола диафрагмы (при диафрагмальной локализации гнойника), увеличение тени печени, обызвествление стенки кисты. Эти симптомы выявляются на обзорной рентгенограмме брюшной полости и при пневмоперитонеографии.
Наличие объемного образования в печени подтверждается ультрасонографией, компьютерной томографией, радиоизотопным гепатосканированием, ангиографией сосудов печени, лапароскопией.
Лечение.
При гидатидозном эхинококкозе печени необходимо хирургическое вмешательство. В качестве вариантов операций применяют эхинококкэктомию, идеальную эхинококкэктомию, резекцию печени или гемигепатэктомию.
При выполнении эхинококкэктомии киста удаляется с герминативной и хитиновой оболочками. Предварительно производятся пункция и опорожнение кисты для предупреждения обсеменения брюшной полости. После удаления кисты фиброзная оболочка изнутри обрабатывается 2% раствором формалина и ушивается в этом месте отдельными швами (капитонаж). Операция показана лицам с большими кистами, локализующимися в непосредственной близости от крупных печеночных сосудов и желчных протоков.
Идеальная эхинококкэктомия предполагает удаление всей кисты вместе с ее фиброзной оболочкой без вскрытия просвета. Данный вариант операции используется редко при небольших кистах, имеющих краевое расположение.
Резекция печени производится при множественных, локализующихся в непосредственной близости друг от друга эхинококковых кистах, а гемигепатэктомия – в случае полного разрушения доли печени. Нагноившаяся эхинококковая киста печени удаляется, а остаточная полость дренируется. В качестве вынужденной меры при больших кистах, их обызвествлении стенка кисты вшивается в переднюю брюшную стенку (марсупиализация).
Альвеолярный эхинококкоз (альвеококкоз) печени.
Альвеококкоз печени представлен плотным опухолевым узлом, состоящим из воспалительно измененной и нередко некротизированной ткани, пронизанной большим количеством паразитарных пузырьков. Диаметр последних составляет 3–5 мм. Опухоль характеризуется инфильтрирующим ростом и эндогенным размножением пузырьков путем почкования. Это приводит к ее быстрому распространению на окружающие орпны В центре паразитарного узлг могут формироваться одна или несколько полостей распада, содержащих жидкость различного цвета, желчь, тканевые секвестры.Клиническая картина.
Альвеококкоз печени длительное время протекает бессимптомно. Первоначально общее состояние больных остается удовлетворительным. При значительном увеличении паразитарной опухоли появляются ощущение тяжести, ноющие боли в правом подреберье и эпигастрии. Сдавление альвеококком печеночных протоков приводит к желтухе, а воротной вены – к появлению портальной гипертензии (асцит, спленомегалия, расширение подкожных вен передней брюшной стенки). Метастазирование опухоли в головной мозг сопровождается головными болями, а в легкие – кашлем и кровохарканьем.
Диагностика.
При постановке диагноза альвеококкоза учитываются данные анамнеза – проживание больного в местах распространения паразита (Сибирь, Дальний Восток). Пальпируемая увеличенная печень плотная (каменистая), чаще с мелкобугристой поверхностью. Наличие альвеококкоза подтверждается теми же методами лабораторно–инструментальной диагностики, что и эхинококкоза.
Лечение.
Наиболее оптимальным вариантом хирургического лечения альвеококкоза является резекция печени. Однако последняя в связи с инфильтрирующим ростом паразита редко осуществима. Чаще выполняются паллиативные операции, заключающиеся в удалении большей части узла, его криодеструкции, дренировании желчных протоков при желтухе. Паллиативные операции, особенно в сочетании с местной (введение в ткань опухоли флавокридина) и общей химиотерапией, на некоторое время продлевают жизнь больных.
Абсцессы
Бактериальные абсцессы
Бактериальные абсцессы печени развиваются вследствие проникновения микрофлоры в печеночную ткань. Это может произойти билиарным путем (холангитическис абсцессы), через воротную вену (при воспалительных заболеваниях органов брюшной полости), печеночную аргерию (как следствие генерализации инфекции при остеомиелите, панариции и других гнойных очагах), а также в рс зультатеперехода воспалительного процесса с соседних органов и при повреждениях печени.Клиническая картина.
Зависит от обширности очага поражения, длительности заболевания, вирулентности микрофлоры, состояния защитных сил организма. Иногда проявления заболевания весьма скудные. Больные жалуются на общее недомогание, повышение температуры тела, снижение аппетита. Однако чаще всего при одиночных и множественных абсцессах печени имеют место высокая температура тела с колебаниями до 2–3°С, ознобы, проливной пот, боль в правом подреберье. Общее состояние больных тяжелое. При пальпации живота может определяться увеличенная и болезненная печень. Особенностью холангитических абсцессов является развитие желтухи.
Диагностика.
Основывается на тщательно собранном анамнезе, клинической картине, результатах лабораторных и инструментальных методов исследования. Важно выяснить наличие в прошлом острых воспалительных заболеваний, которые, как уже отмечалось, могут быть причиной абсцесса печени. Изменяется морфологический состав крови (растет лейкоцитоз, происходит сдвиг лейкоцитарной формулы влево, особенно увеличивается СОЭ). При рентгенологическом исследовании можно выявить ограничение подвижности диафрагмы, если гнойник близко к ней расположен. Иногда а области правого синусе обнаруживают реактивный выпот. Особенно ценные данные позволяют получить УЗИ и компьютерная томография.
С их помощью можно установить точную локализацию гнойника, его размеры, единичный он или имеются множественные абсцессы, произвести под контролем указанных методов исследования пункцию полости и определить характер содержимого в ней. Поверхностно расположенные гнойники печени диагностируются при лапароскопии.
Дифференциальная диагностика.
Проводится прежде всего с другими очаговыми поражениями печени (кисты, доброкачественные и злокачественные опухоли).
Лечение.
Основным методом лечения при абсцессах печени, как и при гнойниках других локализаций, является вскрытие их и дренирование. Это достигается двумя способами: производится чрескожная чреспеченочная пункция с установкой микродренажей или применяется оперативное вмешательство. Такое лечение возможно только при одиночных или нескольких крупных абсцессах. При этом важно подчеркнуть целесообразность дренирования абсцессов двумя катетерами, один из которых является ирригационным, а другой – аспирационным. Благодаря промыванию гнойной полости антисептическими растворами и активной аспирации содержимого лечение больных стано–вится более успешным.
При отсутствии соответствующих условий для проведения закрытого метода лечения абсцессов печени или если оно неэффективно, показана лапаротомия, во время которой производится вскрытие гнойника (или гнойников) с последующим его наружным дренированием. При локализации абсцесса печени сзади применяется внебрюшинный доступ, что предохраняет брюшную полость от распространения инфекции. Наиболее сложным является лечение мелких множественных абсцессов печени, при которых хирургическое вмешательство невозможно. В этих случаях в полном объеме используется антибактериальная терапия, в том числе введение антибиотиков в пупочную вену. Тем не менее летальность достигает 90%. При холангитических абсцессах печени проводятся коррекция желчных путей, вскрытие и дренирование гнойной полости.
Грозным осложнением абсцессов печени является разлитой гнойный перитонит.
Паразитарные абсцессы
Паразитарные абсцессы печени наиболее широко распространены в Юго–Восточной Азии, а также в Восточной и Западной Сибири. Возбудителями их являются Entamoeba hystolytica, Entamoeba disenteria и др. Тем не менее эти абсцессы следует относить к смешанным, так как они содержат и бактериальную флору.Клиническая картина.
Чаще заболевание поражает лиц мужского пола. Оно начинается с высокой температуры тела, потрясающих ознобов, могут отмечаться боли в области печени. Состояние больных прогрессивно ухудшается, однако не в такой степени, как при бактериальных абсцессах. В амебных абсцессах может содержаться несколько литров гноя, который часто остается стерильным. В этих случаях определяется увеличенная и болезненная печень.
Диагностика.
Основывается на данных серологических реакций, а также результатах УЗИ, компьютерной томографии, ангиографии.
Лечение.
При паразитарных абсцессах показано хирургическое вмешательство. Применяют также антипаразитарные препараты: эмитин, хингамин, злорохин и др., а также антибиотикотерапию.
Опухоли
Доброкачественные опухоли
Гемангиомы
Гемангиомы – наиболее часто встречающиеся доброкачественные опухоли. Они могут быть одиночными и множественными, иметь диаметр в несколько сантиметров и достигать больших размеров, поражая одновременно обе доли печени. Гемангиомы чаще развиваются из венозных сосудов печени. Поверхность опухоли гладкая, иногда мелкобугристая, консистенция эластическая. Гемангиомы легко сжимаются из–за наличия пещеристых полостей.Клиническая картина.
Хотя гемангиомы относят к врожденным опухолям, проявляются они обычно у взрослых. Больные жалуются на боли в подложечной области и правом подреберье, тошноту, слабость. Таким образом, при гемангиомах отсутствуют патогномоничные признаки. Лишь в тех случаях, когда опухоль имеет большие размеры, сопровождается гепатомегалией, при пальпации определяется мягкоэластической консистенции образование, которое при надавливании уменьшается, а после отнятия руки принимает первоначальный характер. К наиболее серьезным осложнениям заболевания относится профузное кровотечение в свободную брюшную полость. При тромбозе гемангиомы может наступить ее некроз. В ряде случаев она вызывает асцит, желтуху, печеночную недостаточность. Не исключается малигнизация гемангиом.
Диагностика.
Основывается главным образом на результатах современных методов исследования: УЗИ, компьютерной томографии, ангиогепатографии, лапароскопии.
Дифференциальная диагностика.
Проводится с другими очаговыми заболеваниями печени. Из доброкачественных опухолей печени следует иметь в виду аденому (гепатому), которая встречается относительно редко и долгое время протекает бессимптомно. Часто она выявляется случайно. Крайне редкими заболеваниями являются лимфангиомы печени, фибромы, миксомы, липомы. Когда гемангиомы поражают большую часть печеночной ткани, их необходимо дифференцировать с циррозом печени.
Лечение.
В связи с возможностью развития осложнений при гемангиомах печени рекомендуется хирургическое лечение, размеры опухоли при этом не влияют на показания к операции. Тем не менее, при опухолях, которые распространяются на ворота печени и переходят на противоположную ее долю, оперативное вмешательство по типу обширной резекции печени невозможно, В остальных случаях объем операции колеблется от краевой резекции до гемигепатэктомии.
Рак печени
Первичный рак печени в последние годы все более часто встречается в клинике. Однако из–за сложности диагностики преобладают запущенные его формы, что объясняет бесперспективность лечения данного заболевания у большинства больных.Патологическая анатомия.
Макроскопически наиболее часто встречается узловая форма, (у 60–80% больных). Она почти всегда сопровождается цирротическими изменениями печени. Обычно наряду с более крупным узлом в различных участках печени определяются многочисленные различного размера узелки – от едва различимых до нескольких сантиметров в диаметре. Относительно их происхождения существуют разные точки зрения. Одни авторы считают эти узелки метастазами одной злокачественной опухоли печени, другие предполагают, что они возникают одновременно из многочисленных аденоматозных формаций вследствие циррозной гиперплазии.
Диффузная (милиарная) форма рака печени встречается реже. В таких случаях печень не увеличена, иногда даже уменьшается. При этом на фоне атрофического цирроза развивается милиарный карциноматоз, который распространяется по всей печени. Некоторые авторы подобную картину называют раковым циррозом печени.
Выделяют также массивную форму рака печени, которая характеризуется ростом опухоли до огромных размеров (обычно поражается правая доля) на фоне почти неизмененной окружающей ее печеночной ткани. В этих случаях цирроз печени встречается редко. У некоторых больных опухоль окружена мелкими раковыми узелками. При своевременной диагностике данная форма рака печени наиболее приемлема для радикального хирургического лечения.
С микроскопической точки зрения различают гепатоцеллюлярный рак (злокачественная гепатома), развивающийся из клеток печени (гепатоцитов), и холангиоцеллюлярный, развивающийся из эпителиальных клеток внутрипеченочных желчных протоков. Отдаленные метастазы при раке печени встречаются редко. Опухолевые клетки по венозной сети могут проникать в легкое, а оттуда с артериальной кровью заноситься в различные органы, прежде всего в кости. По лимфатической системе метастазами поражаются регионарные лимфоузлы ворот печени, реже средостения и области шеи.
Клиническая картина.
Для рака печени патогномичны незаметное начало заболевания, отсутствие характерных признаков его развития, быстрое течение патологического процесса. В связи с этим большинство больных обращаются к врачу спустя несколько месяцев после возникновения заболевания. Они жалуются на боли в животе, похудание, слабость, снижение или отсутствие аппетита, иногда указывают на пальпируемую опухоль в области печени, повышение температуры тела, желтуху, тошноту, рвоту. При осмотре часто обнаруживается гепатомегалия, при этом ткань печени твердая, иногда поверхность ее гладкая, передний край заострен, однако нередко определяются узелки различных размеров. В более редких случаях печень увеличивается только за счет самой опухоли, которая четко определяется в правой или левой доле. Желтуха не является постоянным симптомом, чаще не носит выраженного характера, хотя иногда может быть достаточно интенсивной. Как правило, она обусловлена сдавлением опухолью внутрипеченочных желчных протоков. Признаки асцита обнаруживаются у 40–50% больных, при этом в асцитической жидкости обычно не содержатся раковые клетки. Весьма настораживающий признак – повышение температуры тела до 38°С, причину которой не удается объяснить. В этих случаях необходимо тщательно исследовать печень, так как выраженная гипертермия нередко наблюдается при раке печени вследствие резорбции ядовитых веществ, образующихся в результате распада опухолевой ткани, инфицирования очагов некроза, присоединившегося холангита.
Выделяют (В. С. Шапкин) следующие клинические формы рака печени: типичный рак; рак–цирроз; осложненный рак; маскированный, или метастатический, рак; бессимптомный, или скрытопротекающий, рак.
Типичный рак. Отмечаются симптомы, которые присущи вообще раковому процессу (слабость, снижение работоспособности, похудание, тошнота, рвота, анемия). Среди местных признаков определяются чувство тяжести и боль в подложечной области и правом подреберье, увеличенная и болезненная печень с бугристой поверхностью. Выявляется также спленомегалия, прогрессируют желтуха и асцит. Температура тела колеблется от субфебрильной до 38–39°С.
Рак–цирроз (диффузный рак). Характеризуется тем, что на симптоматику цирроза печени наслаиваются признаки, свойственные раковому процессу, – более быстро прогрессирует ухудшение состояния больного, чем при циррозе. Это трудная для диагностики форма рака печени, однако современные инструментальные методы исследования позволяют поставить правильный диагноз, если о нем помнить.
Осложненный рак. Проявляется распадом опухоли, что может привести к ее абсцедированию или внутрибрюшинному кровотечению. В первом случае симптоматика рака печени будет схожа с таковой при ее абсцессе, во втором – развиваются признаки внутреннего кровотечения с соот–ветствующей клиникой со стороны живота (болезненный, слегка напряженный, в отлогих местах может определяться жидкость).
Маскированный (метастатический) рак. Имеет симптоматику, обусловленную не первичным опухолевым очагом, а метастазами. Выделяют легочную форму, или "маску", которая встречается наиболее часто, мозговую, сердечную, костную и др. В этих случаях клиническая картина заболевания будет зависеть от пораженного органа.
Бессимптомный (скрыто протекающий) рак. Выявляется случайно, обычно во время лапаротомии. Однако в современных условиях, когда широко применяются УЗИ и компьютерная томография, он может быть обнаружен при обследовании больных по поводу других заболеваний или с профилактической целью.
Диагностика.
Основана на клинической картине заболевания, результатах УЗИ, компьютерной томографии, радиоизотопного сканирования печени. Верифицировать диагноз рака печени позволяет лапароскопия с прицельной биопсией.
Дифференциальная диагностика.
Проводится с другими очаговыми поражениями печени, циррозом печени, а также с заболеваниями тех органов, в которые происходит метастазирование раковых клеток.
Лечение.
При раке печени необходимо хирургическое вмешательство. Операция показана при одиночных опухолях и в случае множественных опухолей, сгруппированных таким образом, чтобы можно было провести радикальную резекцию или гемигепатэктомию. Условиями для выполнения операции являются удовлетворительное со–стояние больного; отсутствие отдаленных метастазов, инвазии опухолевого процесса в регионарные лимфоузлы, которые могут быть удалены; хорошая техническая подготовка хирурга в области гепатобилиарной хирургии; соответствующая оснащенность хирургического отделения. Из–за сложности ранней диагностики рака печени большинство больных обращаются к врачу в поздних стадиях заболевания, когда радикальная операция противопоказана, а паллиативные вмешательства нецелесообразны. Исключением могут быть только те случаи, когда во время лапаротомии устанавливается опухолевый характер генеза механической желтухи, обусловленный сдавлением внутрипеченочных протоков раковым узлом, особенно в области ворот печени. Применение транспеченочного дренирования желчных путей позволяет уменьшить степень желтухи и облегчить страдания больных.
Объем операции при раке печени может быть от клиновидной ее резекции до расширенной гемигепатэктомии, что зависит от размера опухоли и ее локализации. Оперативное вмешательство должно быть щадящим, но не в ущерб радикальности. Опухоль удаляется в пределах здоровых тканей, т.е. разрез делают, отступив не менее 2 см от опухолевой ткани. Подобные операции весьма травматичны и дают высокую летальность (20–25%). В последние годы появились сообщения о пересадке печени при развитии в ней злокачественного процесса. При раке печени возможно применение химиотерапии, в том числе с введением препаратов в печеночную артерию.
Механическая желтуха
В последние годы отмечается рост числа больных, страдающих механической желтухой, особенно опухолевого генеза. При этом большинство пациентов (около 90%) первоначально поступают в инфекционные стационары, откуда после различных сроков обследования переводятся в хирургические или онкологические отделения, где окончательно устанавливается диагноз на основании результатов современных методов инструментального исследования.Существуют разнообразные причины, которые вызывают механическую желтуху. Их можно объединить в две большие группы: желтухи неопухолевого и опухолевого генеза.
Механические желтухи неопухолевого генеза
Холангиолитиаз
Одной из наиболее частых причин возникновения механической желтухи неопухолевого генеза является гепатикохоледохолитиаз. Это обусловлено тем, что камни желчных протоков встречаются у 20–30% больных желчнокаменной болезнью, которая представляет собой широко распространенное заболевание. У части пациентов такие камни могут вызывать непроходимость желчных путей, что приводит к появлению различной степени выраженности желтухи. Первичное образование камней в желчных протоках встречается редко (1–3%). Чаще всего имеет место вторичный холангиолитиаз, когда происходит миграция камней из желчного пузыря. Это подтверждается идентичностью структуры и состава конкрементов независимо от их локализации. У большинства больных обнаруживаются множественные камни желчных протоков, при этом размеры их колеблются от 2 мм и меньше до 3–5 см. Однако крупные камни бывают преимущественно одиночными. Конкременты располагаются главным образом в области ампулы большого дуоденального сосочка, в панкреатической и ретродуоденальной частях холедоха, реже они обнаруживаются во вне– и внутри печеночных протоках одновременно.Холангиолитиаз проявляется прежде всего симптомами острого или хронического калькулезного холецистита. При длительно существующей желчной гипертензии присоединяются признаки гепатита, билиарного цирроза печени. В случае развития гнойного холангита на фоне желтухи появляются ознобы, лихорадка, симптомы интоксикации. В последующем это может привести к образованию холангитических абсцессов печени, возникновению сепсиса. Однако при непроходимости желчных путей на почве холангиолитиаза, вызывающего желтуху, указанная симптоматика нередко отсутствует, что затрудняет диагностику заболе–вания.
Стеноз большого дуоденального сосочка
Благодаря внедрению в практику современных методов исследования стеноз большого дуоденального сосочка стал диагностироваться значительно чаще, чем это было до недавнего времени. В большинстве случаев он носит вторичный характер, т.е. возникает при желчнокаменной болезни вследствие прохождения камней и песка, вызывающих его травму, а также в результате холангита. Для мор–фологической картины характерны отек и лейкоцитарная инфильтрация стенки сосочка, атрофический или гипертрофический процесс со стороны слизистой оболочки, гиперплазия железистого аппарата с образованием аденоматозных разрастаний, развитие рубцовых изменений в мышечных волокнах сфинктера. Этот процесс может распространяться на устье панкреатического протока. Указанные изменения сопровождаются прогрессированием нарушения желчеоттока, ведут к развитию желчной гипертензии и механической желтухи. Чаще это наблюдается у больных, страдающих стенозом большого дуоденального сосочка в сочетании с ущемленным конкрементом в области его ампулы.Клиническая картина заболевания мало характерна. До развития желтухи и после ее возникновения основная жалоба больных – боль в правом подреберье, которая не является патогномоничным признаком. Желтуха в этих случаях часто бывает ремиттирующей. В клинике стеноза большого дуоденального сосочка преобладает симптоматика хронического холецистита. Поэтому диагностика его основывается на результатах дооперационных инструментальных методов исследования (см. раздел "Диагностика механической желтухи") и операционных данных.
Стриктуры желчных протоков
Частой причиной нарушения желчеоттока, вызывающей желтуху, являются доброкачественные стриктуры желчных протоков, которые могут иметь травматический или воспалительный характер. В последнем случае они развиваются вследствие патологического процесса непо–средственно в гепатобилиарной системе или при распространении его со смежных органов. Нередко гепатохоледохолитиаз сопровождается холангитом, который способствует развитию сужения желчных протоков, что особенно часто наблюдается при синдроме Миризи, т.е. при образовании свища между желчным пузырем и гепатикохоледохом. Обтурация последнего конкрементами сочетается с развитием воспалительной стриктуры его, что приводит к возникновению полной непроходимости желчевыводящих путей.К стриктуре желчных протоков может привести длительно протекающий хронический холангит, хотя такая причина желтухи встречается относительно редко. Переход воспалительного процесса на внепеченочный билиарный тракт вызывает его сужение. Это наблюдается при пенетрации дуоденальных язв, дивертикулах двенадцатиперстной кишки. Подобная картина может обусловливаться также перихоледохеальным лимфаденитом и другими патологическими процессами, локализующимися вблизи печеночно–двенадцатиперстной связки.
Наиболее частой причиной образования стриктуры желчных протоков, в том числе ведущих к возникновению желтухи, является травматическое их повреждение, главным образом во время оперативных вмешательств в верхней половине брюшной полости. В большинстве случаев это происходит при выполнении холецистэктомии в условиях воспалительного инфильтрата, наличии более редко встречающихся вариантов взаимоотношений элементов гепатодуоденальной связки или по неосторожности оперирующего хирурга вследствие недостаточной его квалификации. Возможность повреждения желчных протоков осо–бенно велика при остановке внезапно развивающегося кровотечения. Повреждению подвергаются как дистальные, так и проксимальные отделы внепеченочной желчевыводящей системы. Ранения желчных протоков наблюдаются также при резекции желудка у больных с пенетрирующими язвами двенадцатиперстной кишки. В этих случаях чаще повреждается дистальный отдел холедоха или происходит его прошивание лигатурой, что в первые дни после операции проявляется прогрессирующей желтухой.
С целью профилактики посттравматических рубцовых стриктур желчных протоков крайне важно обнаружить их своевременно, т.е. до окончания операции. В этих случаях ушивают стенку протока или сшивают его концы с одновременным наружным дренированием, а при отсутствии условий для этого накладывают билиодигестивный анастомоз. Как вынужденная мера может быть перевязан дистальный конец протока, а проксимальный дренирован наружу.
Нередко интраоперационные повреждения остаются незамеченными. В таких ситуациях послеоперационный период осложняется желчным перитонитом, наружными желчными свищами или желтухой. В последующем вследствие образования рубцовой ткани в области травмы желчных путей появляются рубцовые стриктуры или полная непроходимость, что служит одной из причин возникновения механической желтухи.
Сужения желчных протоков могут развиться в результате травмирования их при зондировании, извлечении конкремента, а также в случае неправильного применения дренажа.
Клинически определить характер механической желтухи на почве травмы желчных путей весьма трудно. Можно лишь предположительно установить механизм ее развития на основании анамнестических данных. Диагноз подтверждается результатами специальных методов исследования и операционными находками.
Инородные тела желчных путей
Отток желчи может быть нарушен вследствие обтурации желчных протоков инородными телами, что наблюдается крайне редко. К этому приводят так называемые "потерянные" дренажи, которые раньше имели более широкое применение; образование конкрементов на лигатурах гепатикохоледоха; попадание кусочков пищи через ранее наложенный холедоходуоденоанастомоз; заползание аскарид в желчные протоки. Диагностика заболевания основывается на результатах специальных методов исследования, однако чаще всего указанные причины желтухи являются операционными находками.Стриктура желчеотводящих анастомозов
В ряде случаев причиной возникновения механической желтухи может быть сужение билиодигестивного анастомоза при наложении узкого соустья или вследствие его рубцевания. Профилактика подобных осложнений заключается в формировании достаточно широкого анастомоза, тщательном сопоставлении слизистых оболочек сшиваемых органов и отказе от чрезмерной мобилизации желчных протоков, что сопровождается нарушением их кровообращения.Клиническая картина указанных патологических процессов не имеет специфических признаков, однако важную роль играют тщательно собранный анамнез (установление характера перенесенной операции) и применение методик исследования, позволяющих выяснить факт наложения билиодигестивного анастомоза в прошлом.
Панкреатит и его осложнения
Воспаление поджелудочной железы часто сочетается с заболеваниями желчевыводящих путей и является причиной их непроходимости. Это может быть как при остром, так и при хроническом панкреатите. В первом случае воспалительный процесс сопровождается образованием инфильтратов, распространяющихся на печеночно–двенадцатиперстную связку и вызывающих сдавление внепеченочных желчных путей, что обусловливает возникновение желтухи. Однако следует иметь в виду, что в этих случаях желтуха может носить и токсический характер. Развитие механической желтухи при хроническом панкреатите связано с сужением общего желчного протока в результате склерозирования ткани поджелудочной железы в области ее головки (головчатый панкреатит) либо сдавления путей желчеоттока при псевдотуморозной форме заболевания или прогрессивно увеличивающейся кистой.Диагностика причин желтухи в этих случаях основывается на симптоматике той или иной формы панкреатита, данных лабораторных и специальных методов исследования.
Более редкими причинами механической желтухи неопухолевого генеза являются холестатический гепатит, первичный склерозирующий холангит, хроническая дуоденальная непроходимость, недостаточность большого дуоденального сосочка.
Механические желтухи опухолевого генеза
Наиболее частыми причинами возникновения механической желтухи опухолевого генеза являются новообразования печени, внепеченочных желчных протоков, желчного пузыря, поджелудочной железы, большого дуоденального сосочка.Опухоли печени
Механическую желтуху вызывают как первичные, так и вторичные новообразования печени (см. раздел "Очаговые поражения печени").Термин "рак ворот печени" во многом условен, однако он наиболее точно отражает особенности клиники, диагностики и лечения злокачественных образований, расположенных в области общего и долевых печеночных протоков. Опухоли указанной локализации характеризуются склонностью к инфильтрации путей желчеоттока, а затем и печеночной ткани. Они сдавливают сосуды, питающие печень, но длительное время не дают метастазов.
Клиника рака ворот печени довольно характерна. Вначале больных беспокоят боли в области печени, лихорадка. Однако главным симптомом заболевания является стойкая безболевая механическая желтуха, которая быстро нарастает и сопровождается резко выраженным кожным зудом, нередко предшествующим ей. Диагноз подтверждается результатами специальных методов исследования.
Рак общего желчного протока
Рак общего желчного протока может поражать как проксимальный отдел холедоха, распространяясь на общий печеночный проток, так и дистальный (терминальный). Ведущим клиническим симптомом заболевания является механическая желтуха, которая носит прогрессирующий характер и сопровождается кожным зудом. Иногда вследствие распада опухоли частично восстанавливается проходимость холедоха и интенсивность окрашивания кожных покровов уменьшается. При обследовании больных могут определяться гепатомегалия и увеличенный безболезненный желчный пузырь (симптом Курвуазье). Сдавление опухолью сосудов печеночно–двенадцатиперстной связки вызывает появление признаков портальной гипертензии (варикозное расширение вен пищевода и желудка, подкожных вен передней брюшной стенки, асцит и т.д.).Рак большого дуоденального сосочка
Доброкачественные опухоли данной локализации встречается редко. Основной причиной возникновения механической желтухи в этих случаях является рак большого дуоденального сосочка. Макроскопически он может быть представлен узлом, полипом или язвой. Обычно слизистая оболочка над узлом не изменена. Размеры последнего колеблются от нескольких миллиметров до 3–5 см. Полипозные формы рака большого дуоденального сосочка напоминают цветную капусту. В некоторых случаях опухоль имеет вид язвенного кратера с плотными краями и кровоточащим дном.Рак большого дуоденального сосочка чаще бывает у лиц мужского пола в среднем и пожилом возрасте. Основным симптомом заболевания является желтуха, которая встречается у 90% больных и развивается относительно рано. Кроме того, она носит нестойкий характер и имеет ремиттиругощее течение. Одновременно больных беспокоят общая слабость, диспептические расстройства и другие общие признаки, выявляемые при новообразованиях других локализаций. При обследовании пациентов отмечается симптом Курвуазье. Опухоль может прорастать в двенадцатиперстную кишку, суживая ее просвет.
Рак желчного пузыря
Обычно опухоль развивается на фоне калькулезного холецистита и встречается у 1–5% больных, которым была выполнена холецистэктомия. При локализации рака в области шейки желчного пузыря он прорастает желчные протоки и вызывает их непроходимость. Опухоль других отделов пузыря распространяется на печень, способствуя более позднему развитию желтухи. Рак желчного пузыря чаще встречается у женщин. Из анамнеза становится известно, что длительное время они страдали желчнокаменной болезнью. Однако затем симптоматика изменяется: боли становятся постоянными, более интен–сивными. Одновременно отмечаются ухудшение общего состояния, потеря аппетита, снижение массы тела, повышается температура. Желтуха носит стойкий характер. Пальпаторно в области правого подреберья определяется опухолевидное образование или увеличенный и плотный желчный пузырь.Рак двенадцатиперстной кишки
Рак двенадцатиперстной кишки встречается редко. В тех случаях, когда опухоль локализуется вблизи большого дуоденального сосочка, одним из первых признаков ее является развитие механической желтухи. Рак двенадцатиперстной кишки характеризуется быстрым течением, сопровождается дуоденальной непроходимостью и кровотечением.Рак поджелудочной железы
Рак поджелудочной железы является одной из наиболее частых причин, вызывающих механическую желтуху. Это обусловлено как распространенностью заболевания, так и особенностью локализации опухоли (преимущественно поражается головка поджелудочной железы). Клиническая картина первоначально не имеет специфических признаков. В последующем ведущими симптомами становятся боли, желтуха, диспептические расстройства на фоне ухудшения общего состояния больного. Боли локализуются в подложечной области, носят постоянный характер. Иногда желтуха является единственным признаком заболевания. Она возникает вследствие прорастания опухолью терминального отдела общего желчного протока, реже в результате распространения опухолевого процесса на печеночно–двенадцатиперстную связку или метастазирования раковых клеток в лимфоузлы ворот печени. При обследовании больных в поздних стадиях заболевания опухоль определяется пальпаторно. У 80% больных отмечается симптом Курвуазье.Специальные методы диагностики механической желтухи
На основании клинической картины, данных лабораторных методов исследования, радиоизотопного сканирования печени часто не представляется возможным поставить диагноз механической желтухи и определить причину ее возникновения. В этих случаях применяются инструментальные методы исследования инвазивного и неинвазивного характера.Ультрасонография.
Позволяет определить состояние желчевыводящих путей, наличие в них конкрементов, изменения со стороны печени и поджелудочной железы. Метод не имеет противопоказаний.
Рентгенологическое исследование.
В настоящее время в связи с широким применением УЗИ рентгенологические методы диагностики стали использоваться реже. Кроме того, при наличии желтухи проведение пероральной и внутривенной холецистохолангиографии противопоказано, так как обычно вводимые контрастные вещества не выделяются печенью. Вместе с тем следует отметить, что до сих пор не потеряли своего диагностического значения рентгеноскопия желудка и дуоденография. Прием внутрь бариевой взвеси позволяет проследить ее пассаж по желудку и двенадцатиперстной кишке, выявить опухоли, язвы, дуоденальный стаз, стриктуры билиодигестивных анастомозов, стеноз большого дуоденального сосочка, ущемленный в его ампуле конкремент. Это возможно вследствие заброса через соустье в желчные пути контраста. По времени эвакуации его и форме поданастомозного мешка судят об указанных выше патологических изменениях желчных протоков.
Компьютерная томография.
Является весьма ценным методом обследования больных с механической желтухой, однако ее применение ограничено из–за недостатка аппаратуры.
Ангиогепатография.
Применяется в клиниках, хорошо оснащенных ангиографической аппаратурой, и имеет определенное диагностическое значение в сочетании с другими методами обследования.
Эндоскопическая ретроградная панкреатохолангиография.
Метод позволяет не только осмотреть исследуемые органы, но, что особенно важно, катетеризировать холедох, ввести в его просвет контрастное вещество и получить панкреатохолангиограммы. По представленным изображениям часто можно судить о причине возникновения механической желтухи (холангиолитиаз, опухоль, стриктуры воспалительного характера, стеноз большого дуоденального сосочка и т.д.).
Чрескожная чреспеченочная холангиография.
Является весьма информативным методом прямой холангиографии. Особенно часто применяется, если невозможно использовать ретроградный путь введения контрастного вещества в желчные протоки. Методика выполнения изложена в разделе "Постхолецистэктомический синдром". Введение контрастного вещества во внутрипеченочные желчные протоки дает возможность их визуализировать и определить уровень непроходимости, а нередко и ее причину. Вместе с тем данный метод позволяет осуществить ретроградный отток желчи путем наружного дренирования внутрипеченочных желчных протоков. В свою очередь это приводит к уменьшению или исчезновению желтухи, что создает лучшие условия для оперативного вмешательства, если оно показано. При наличии противопоказаний (далеко зашедший раковый процесс) такое лечебное мероприятие избавляет больного от мучительного кожного зуда, облегчает на какой–то период страдание.
Лапароскопическая холецистохолангиография.
Лапароскопия – важный метод диагностики заболеваний органов брюшной полости. Она широко применяется у больных, страдающих желтухой неясной этиологии. В этих случаях во время лапароскопии проводятся не только диагностические, но и лечебные мероприятия. При механической желтухе, длительность которой не превышает 2–3 недели, изменения печени характеризуются наличием участков зеленого цвета на ярко–малиновом фоне печеночной ткани. Однако нередко такая же картина наблюдается и при паренхиматозной желтухе. При длительной непроходимости желчных путей печень обычно зеленого цвета и плотноватой консистенции.
В случаях хронического гепатита, цирроза или рака–цирроза печень увеличивается или уменьшается, поверхность ее имеет белесоватый цвет и покрыта узелками различного размера. При крупноузловой форме рака печени диагноз не вызывает сомнения. Изменения желчного пузыря зависят от уровня обструкции желчных протоков. При низкой локализации препятствия для желчеоттока он увеличен, напряжен, не опорожняется и, наоборот, при высокой окклюзии ("ворота" печени) находится в спавшемся состоянии.
Во время лапароскопии производится биопсия печеночной ткани для уточнения диагноза. Для выяснения уровня и характера непроходимости желчных путей выполняется холецистохолангиография. С этой целью под контролем лапароскопа производится пункция желчного пузыря через край печени, отсасывается его содержимое и вводится контрастное вещество. При проходимости пузырного протока контраст поступает в желчные протоки. Рентгенологическая картина зависит от уровня их обструкции и характера заболевания. При непроходимости терминального отдела холедоха отмечается расширение проксимальных путей желчеоттока, в том числе нередко и внутрипеченочных, а в двенадцатиперстную кишку контраст не поступает или определяются только его следы. Если препятствие оттоку желчи связано со стенозом большого дуоденального сосочка или рубцовой стриктурой терминального отдела холедоха, то на рентгенограмме определяется сужение конечного отдела общего желчного протока с супрастенотическим его расширением. При одновременном наличии конкрементов выявляется их тень, обусловленная обтеканием контраста, при этом она представлена в виде полулуния (рис. 18). В это же время при опухолевом процессе имеет место неровность контуров пораженного участка желчного протока. При непроходимости желчных путей на уровне ворот печени контрастное вещество свободно поступает в двенадцатиперстную кишку, однако не контрастируют печеночные протоки.
Если невозможно использовать желчный пузырь для введения контрастного вещества, под контролем лапароскопа проводится пункция внутрипеченочных протоков с последующим введением в них контраста. Это также позволяет судить о характере патологического процесса.
Пункцию желчного пузыря или внутрипеченочных протоков можно закончить их наружным микродренированием, используя специальные катетеры и приспособления. Это дает возможность уменьшить желтуху и при необходимости повторить в последующем рентгенологическое исследование, так как при первом исследовании может быть получена недостаточно информативная картина из–за наличия замазки в желчных путях или по другой причине.
При функционирующем пузырном протоке, особенно у больных с резко выраженной механической желтухой с дистальным уровнем не–проходимости холедоха, диагностические процедуры целесообразно закончить наложением лапароскопической цистостомии. С этой целью в проекции дна желчного пузыря делается небольшой разрез передней брюшной стенки. Под контролем лапароскопа зажимом захватывается стенка пузыря в области дна. Пузырь выводится наружу и подшивается к краям раны. Затем вскрывается просвет желчного пузыря, эвакуируется его содержимое и вводится дренажная трубка. В последующие дни через дренаж происходит отток желчи, производят промывание желчных путей, в их просвет вводят лекарственные препараты. Все это позволяет улучшить состояние больных, снять или значительно уменьшить желтуху, при необходимости повторить холецистохолангиографию, а при показаниях в более благоприятных условиях выполнить абдоминальный этап операции.
Фистулохолангиография.
Важнейший метод исследования. Выполняется в первую очередь у больных с механической желтухой, которые страдают наружными желчными свищами. Нередко на основании только результатов фисту – лохолангиографии можно судить о причине желтухи.
Следует подчеркнуть, что нет необходимости у каждого больного использовать все указанные методы исследования или отдавать предпочтение одному из них. В первом случае это травматично для пациентов, в другом могут быть допущены серьезные ошибки в постановке диагноза. При решении вопроса о применении способов диагностики надо придерживаться индивидуального подхода, учитывать особенности патологического процесса.
Хирургическое лечение больных механической желтухой
Оперативное вмешательство проводится после соответствующей предоперационной подготовки, длительность которой зависит от особенностей заболевания, причины желтухи, состояния больного. Операция выполняется не позже 7–10–го дня после установления диагноза. Однако при желтухах опухолевого генеза она нередко производится в более поздние сроки. В связи с резко выраженными морфофункциональными нарушениями в печени, которые ведут к развитию в послеоперационном периоде печеночно–почечной недостаточности, больные получают интенсивную инфузионную терапию: изотонические растворы глюкозы с инсулином, раствор Рингера, нативную плазму, раствор глютаминовой кислоты, гемодез, реополиглюкин, АТФ, сирепар, аминокислоты, альбумин, витамины, антигистаминные средства. В наиболее тяжелых случаях холемической интоксикации используют гемосорбцию, плазмаферез и другие способы экстракорпоральной детоксикации. Срок наружного дренирования желчных путей как первый этап операции обычно ограничивается 7–10 днями, поскольку длительная потеря желчи может вызвать у больного развитие ахолической болезни.
Характер оперативного вмешательства при желтухах доброкачественного генеза (гепатикохоледохолитиаз, рубцовые стриктуры желчных протоков,стеноз большого дуоденального сосочка, сужение путей желчеоттока при хроническом панкреатите и т.д.) не отличается от такового при указанных заболеваниях до развития синдрома желтухи. Они изложены в разделе "Постхолецистэктомический синдром". Дополнительно выполняется лишь холецистэктомия при наличии хронического калькулезного холецистита или бескаменного нефункционирующего желчного пузыря. Кроме того, у больных с резко выраженной желтухой и опасностью рецидива рубцового процесса в области вмешательства шире используется чреспеченочное дрени–рование желчных путей. С этой целью применяются различные способы. По Прадери (Praderi) после холедохотомии в проток вводят буж, который осторожно проталкивают в проксимальном направлении и расширяют (туннелизируют) стенозированный участок. Затем надсекают ткань печени над головкой бужа, к которой прочно фиксируют дренаж. После извлечения зонда дистальный конец трубки проталкивают в холедох ниже места стриктуры, а проксимальный выводят наружу. Если имеется препятствие для оттока желчи и в дистальном отделе общего желчного протока, дренаж может быть имплантирован в изолированную по Ру петлю тощей кишки (по Rodney–Smith). Метод Сейпла–Куриана (Saypol, Kurian) предусматривает применение сквозного управляемого транспеченочного дренажа (рис. 19). С этой целью через гепатикоеюанастомоз проводят дренаж, оба конца которого выводят наружу: один – через ткань печени (в виде гепатостомы), другой – через конец отключенной кишки (в виде еюностомы). Следует избегать оставления недренируемой доли (рис. 20).
 Рис. 19. Схема сквозного транспеченочного дренирования по Saypol–Kurian.
Рис. 19. Схема сквозного транспеченочного дренирования по Saypol–Kurian.
Особую сложность представляет лечение больных, страдающих механической желтухой на почве злокачественных новообразований. В большинстве таких случаев к моменту установления диагноза патологический процесс приобретает распространенный характер и радикальную операцию выполнить невозможно. Что же касается паллиативного вмешательства, то отношение к нему различных хирургов и онкологов противоречивое. Одни ограничиваются эксплоративной лапаротомией, другие выполняют операции, направленные на дренирование желчеотводящих путей. Предпочтение следует отдать второму варианту вмешательств, так как ликвидация желтухи в этих условиях облегчает состояние больных.
Радикальные операции.
При небольших раковых опухолях большого дуоденального сосочка производится трансдуоденальная папиллэктомия, сущность которой состоит в полном иссечении опухоли с частью слизистой оболочки кишки и устьями общего желчного и панкреатического протоков. Затем их имплантируют в образовавшийся дефект. Однако если их целостность не нарушена, этого не делают. В случае распространения рака большого дуоденального сосочка на двенадцатиперстную кишку, а также при первичном ее раковом поражении и раке головки поджелудочной железы выполняется панкреатодуоденальная резекция. Эта же операция показана при раке дистального отдела общего желчного протока. При локализации патологического процесса в супрадуоденальном отделе холедоха производится его резекция с последующим сшиванием концов протока или, при отсутствии такой возможности, накладывается билиодигестивный анастомоз.
Радикальная операция при раке желчного пузыря, осложненного желтухой, состоит в выполнении холецистэктомии с резекцией внепеченочных желчных протоков и наложением билиодигестивного анастомоза. Однако выполнить такое вмешательство можно крайне редко. Это же касается и рака ворот печени. В таких случаях чаще прибегают к паллиативным операциям.
Паллиативные операции.
При низких уровнях непроходимости желчных путей на почве распространенных форм рака (дистальный отдел холедоха, большой дуоденальный сосочек, поджелудочная железа, двенадцатиперстная кишка) оперативное вмешательство сводится к наложению обходных билиодигестивных соустьев. Имеется много вариантов их формирования с использованием для этих целей, с одной стороны, желчного пузыря, холедоха, гепатикохоледоха, с другой – желудка, двенадцатиперстной и тощей кишок. Тем не менее предпочтение чаще отдается наложению гепатикохоледоходуодено– или еюноанастомоза на выключенной петле.
 Рис. 20. Недренируемая доля печени при распространении стриктуры на внутрипеченочный долевой проток.
Рис. 20. Недренируемая доля печени при распространении стриктуры на внутрипеченочный долевой проток.
Более сложно решать вопрос о дренировании желчных путей у больных желтухой, обусловленной локализацией опухолевого процесса в области ворот печени. В этих случаях операции направлены на создание условий для ретроградного отведения желчи из внутрипеченочных протоков. Иногда для этих целей используется желчный пузырь – вскрывается его просвет, а через ложе проводится дренажная трубка в расширенный внутрипеченочный проток после его предварительной пункции. Затем накладывается холецистостома на протяжении, дренажи выводятся наружу. Однако после соединения просвета внутрипеченочного желчного протока и желчного пузыря операцию можно закончить формированием гепатохолангиохолецистоеюнанастомоза. В редких случаях для ретроградного отведения желчи применяется операция Лонгмайера – производится краевая резекция 3–го сегмента печени и накладывается анастомоз между магистральным печеночным протоком и выключенной по Ру тонкой кишкой на дренажной трубке, выведенной наружу с помощью подвесной энтеростомии (рис. 21). Иногда используется операция Дольотти – резецируется часть левой доли печени и анастомозируется крупный внутрипеченочный проток с передней стенкой желудка (рис. 22).
Кроме наложения различных видов билиодигестивных анастомозов применяются также методы туннелизации желчных путей. В таких случаях производят холедохотомию, бужируют через опухолевую ткань желчные протоки и после этого проводят в них трубку выше места обструкции. Операцию заканчивают тем или другим методом транспеченочного дренирования путей желчеоттока.
 Рис. 21. Схема операции Лонгмайера.
Рис. 21. Схема операции Лонгмайера.
В последние годы разработаны и применяются эндоскопические способы бужирования пораженных опухолью участков желчных протоков с проведением дренажных трубок в качестве каркаса.
 Рис. 22. Схема операции Дольотти.
Рис. 22. Схема операции Дольотти.
Постхолецистэктомический синдром
Историческая справка.
Первая холецистэктомия произведена в 1882 г. Уже через несколько лет после этого стали появляться больные с неудовлетворительными результатами операции. В последующем выяснилось, что число таких пациентов достигает 20–30% от всех оперированных на желчных путях, при этом клинические проявления патологического процесса носят самый разнообразный характер. По предложению американских хирургов с 30–х годов они стали называться "постхолецистэктомическим синдромом". Этим самым подчеркивалась связь с ранее выполненным вмешательством – удалением желчного пузыря. Однако изучение отдаленных результатов показало, что неудачи обусловлены прежде всего нераспознанными и некорригированными во время операции патологическими состояниями со стороны желчных протоков и других органов гепатопанкреатодуоденальной зоны. В настоящее время термин "постхолецистэктомический синдром" объединяет различные заболевания желчевыводящих путей, желудочно–кишечного тракта, воспалительные процессы в области гепатопанкреатодуональной зоны, а также поражения других органов, не имеющих отношения к билиарной системе,
Классификация.
Выделяют: 1. Заболевания желчных протоков и большого дуоденального сосочка: ■ камни желчных протоков и большого дуоденального сосочка; ■ изолированный стеноз большого дуоденального сосочка; ■ недостаточность большою дуоденального сосочка; ■ стриктуры внутри– и внепеченочных желчных протоков; ■ стриктуры билиодигестивных анастомозов; ■ длинная культя пузырного протока; ■ "остаточный" желчный пузырь; ■ кистозное расширение внутри– и внепеченочных желчных протоков; ■ опухоли желчных протоков и большого дуоденального сосочка. 2. Заболевания печени и поджелудочной железы: ■ острый и хронический гепатит; ■ билиарный цирроз печени; ■ паразитарные заболевания печени; ■ опухоли и кисты печени; ■ хронический панкреатит; ■ опухоли и кисты поджелудочной железы. 3. Заболевания желудочно–кишечного тракта: ■ язвенная болезнь желудка и двенадцатиперстной кишки; ■ гастрит, гастродуоденит; ■ хронический колит; ■ дивертикулы кишечника; ■ хроническая дуоденальная непроходимость; ■ опухоли желудка и кишечника. 4. Заболевания других органов и систем: ■ грыжи пищеводного отверстия диафрагмы; ■ почечнокаменная болезнь, нефроптоз; ■ деформирующий спондилоартроз; ■ хронический ишемический синдром брюшной полости; ■ другие заболевания.
Заболевания желчных протоков и большого дуоденального сосочка
Камни желчных протоков
Желчнокаменная болезнь относится к числу широко распространенных заболеваний, что позволило справедливо называть ее "болезнью века". Одним из часто встречающихся осложнений калькулезного холецистита является холангиолитиаз, при этом у подавляющего большинства больных камни желчных протоков имеют вторичное происхождение, т.е. мигрируют из желчного пузыря, где они образуются в результате дисхолии (уменьшения количества желчных кислот и увеличения уровня холестерина), застоя желчи и воспаления желчевыводящих путей. Поскольку холецистэктомия в настоящее время выполняется повсеместно, актуальной стала проблема оставленных камней в желчных протоках, что отмечается у 2–5% оперированных больных. Хотя ни один хирург не застрахован от этого, все же подобное осложнение значительно реже встречается там, где хброшо налажена система оперирования на желчных путях. Оставленные (резидуальные) камни по своему строению напоминают камни желчного пузыря. Они обычно плотные и характеризуются радиарной исчерченностью на распиле. Вновь образованные камни желчных протоков встречаются редко, они довольно рыхлые, легко крошатся, представлены в виде замазки или слепка протока.С целью профилактики оставления камней в желчных протоках наряду с дооперационным обследованием проводится тщательная интраоперационная их ревизия. Для этого используются осмотр и пальпация гепатобилиарной зоны, определение ширины внепеченочных протоков, операционная холангиография, холедоходебитометрия, холедохоскоггия, зондирование протоков и большого дуоденального сосочка. Важными методами исследования являются операционная холангиография и особенно рентгенотелевизионная холангиоскопия. Рентгенологическое обследование желчных путей во время операции, по мнению большинства хирургов, должно проводиться обязательно. Однако существует и иная точка зрения, согласно которой оно применяется только при наличии соответствующих показаний. Это объясняется тем, что лишь у небольшого количества больных меняется план операции после указанного исследования. Надо стремиться в каждом случае произвести зондирование внепеченочных путей, используя при необходимости дилатацию или рассечение устья пузырного протока. Оно позволяет не только определить их проходимость, но и выявить конкременты на зонде, особенно фиксированные. Показаниями к холедохотомии является наличие конкрементов в желчных протоках, расширение просвета более 10 мм, желтуха в момент операции, гнойный холангит, стеноз большого дуоденального сосочка при отсутствии возможности для выполнения эндоскопической папиллосфинктеротомии. К относительным показаниям относят наличие желтухи в анамнезе и мелких камней в желчном пузыре. Считается целесообразным выполнять холедохотомию при выделении из устья пузырного протока крошковидной массы, мутной желчи. В последние годы резко сократилось количество диагностических холедохотомий.
Клиническая картина холангиолитиаза после ранее произведенной операции обычно характеризуется приступообразными болями в правом подреберье и подложечной области, которые нередко сопровождаются желтухой и лихорадкой. Иногда боли носят тупой, постоянный характер, сочетаются с желудочно–кишечным дискомфортом. Указанные признаки возникают в различные сроки после холецистэктомии. В таких случаях одни больные обычно обращаются к хирургам, а вторые – к терапевтам, предполагая, что болевой синдром не зависит от ранее произведенной операции. Необходимо учитывать, что камень протока, который не перекрывает полностью его просвет, может не сопровождаться желтухой или она протекает скрыто, о чем свидетельствует кратковременное потемнение мочи после очередного приступа болей.
При расположении камней в области большого дуоденального сосочка клиника заболевания проявляется более четко. Боли в подложечной области часто носят опоясывающий характер и сопровождаются выраженной желтухой.
Стеноз большого дуоденального сосочка
В 1984 г. Langenbuch впервые сообщил о стенозе большого дуоденального сосочка (БДС) и описал клиническую картину его непроходимости, обусловленную вклиненным камнем. Клинические признаки и патоморфологические изменения при стенозе БДС впервые подробно описали del Valle и Donovan в 1926 г., поэтому указанное заболевание называют также болезнью дель Валле–Донована. В настоящее время стенозом БДС страдает не менее 10% больных, подвергшихся холецистэктомии. Различают первичный стеноз БДС, причина которого не совсем ясна, и вторичный, развившийся вследствие повреждений БДС при прохождении камней или нахождения их в ампуле, а также в результате патологических процессов в других отделах билиарной системы.Клиническая картина данного заболевания не имеет патогномоничных симптомов и сводится главным образом к синдрому нарушения оттока желчи. Наиболее частым признаком стеноза БДС является боль, которая у большинства больных носит постоянный ноющий характер и локализуется в области правого подреберья и надчревья. Иногда она может быть приступообразной и напоминать таковую при печеночной колике. Нередко боль усиливается при приеме пищи и сопровождается чувством горечи во рту, тошнотой и рвотой. Вторым по частоте важным признаком заболевания является желтуха, которая возникает после приступа болей и носит перемежающийся характер. В большинстве случаев интенсивность желтухи незначительная. Стеноз БДС практически никогда не сопровождается его полной непроходимостью, однако при наличии вклиненного камня желтуха непрерывно нарастает и может иметь высокие показатели (200–300 мкмоль/л). В результате присоединения холангита повышается температура тела. При вовлечении в процесс поджелудочной железы боли сопровождаются амилазурией.
Недостаточность большого дуоденального сосочка
Впервые термин "синдром недостаточности БДС" был предложен в 1941 г. Mallet–Guy и Marion. При нем наблюдается зияние устья сосочка и нарушается его запирательная функция. В основе заболевания лежат дистрофические изменения стенки БДС с атрофией слизистой, что приводит к деформации и разрушению сфинктерного аппарата. Различают первичную и вторичную недостаточность БДС. Первая встречается редко. Причины ее мало изучены, однако считается, что в основе первичной недостаточности БДС лежат пороки эмбрионального развития билиопанкреатодуоденальной зоны. Вторичная недостаточность БДС обусловлена травматизацией его при прохождении камней, перерастяжением тканей при хронической дуоденальной непроходимости, язвами двенадцатиперстной кишки, дуоденитами, панкреатитами, холециститами. Заброс дуоденального содержимого в желчные пути через зияющий БДС является причиной холангита и его последствий, особенно в условиях нарушенного оттока желчи.Клиническая картина недостаточности БДС малоинформативна. Больные жалуются на боль в подложечной области и диспептические расстройства. Диагноз устанавливается на основании результатов инструментальных методов исследования.
Стриктура внутри– и внепеченочных желчных протоков
Причиной стриктуры внутри– и внепеченочных желчных протоков может быть первичный склерозирующий холангит, или болезнь Дельбе, по имени автора Delbet, который впервые описал ее в 1924 г. Причина возникновения заболевания не выяснена, однако в основе его лежат перипортальная реакция тканей с лимфоидной инфильтрацией плазматическими клетками и перидуктальный фиброз, что приводит к утолщению стенок желчных ходов и сужению их просвета. Заболевание чаще встречается у лиц мужского пола в возрасте 25–45 лет.Клиническая картина характеризуется нарушением оттока желчи, при этом желтуха может достигать высоких цифр. Основной причиной сужения желчных протоков является их травмирование во время операций на желчевыводящих путях, желудке, двенадцатиперстной кишке. Это происходит главным образом из–за технических погрешностей, которые оперирующие хирурги склонны объяснять аномалией желчных протоков. Однако последняя встречается в 5–7% случаев, в то время как остальные анатомические особенности представляют собой различные варианты нормы. Поэтому во время операции необходимо тщательно идентифицировать образования, прежде чем их пересечь. Сужение протоков может развиться после насильственного их бужирования, проталкивания или извлечения конкрементов, а также вследствие применения грубого шовного материала.
Другой частой причиной стриктуры желчных протоков является воспалительный процесс (холангит), обусловленный длительным нахождением в их просвете конкрементов, дренажной трубки, которые могут вызвать также образование пролежней.
Сужение протоков может развиться вследствие вторичного вовлечения их в патологический процесс, развивающийся при язвенной болезни двенадцатиперстной кишки и других воспалительных явлениях в гепатопанкреатодуоденальной области.
Клиническая картина стриктуры внутри– и внепеченочных желчных протоков обусловлена степенью нарушения оттока желчи. Длительное время стриктура может проявляться зудом, который иногда носит изнуряющий характер на фоне отсутствия желтухи. Особенно это свойственно первичному склерозирующему холангиту. Такие больные вынуждены обращаться к врачам различных специальностей (инфекционистам, дерматологам, аллергологам, хирургам и др.), однако результаты лечения часто оказываются неудовлетворительными. Только инструментальные методы исследования, в том числе ретроградная эндоскопическая холангиография, позволяют поставить правильный диагноз.
В большинстве случаев стриктуры желчных протоков сопровождаются различной степени выраженности желтухой. Нередко у таких больных развивается холангит с типичной клинической картиной – желтуха, лихорадка, увеличенная болезненная печень (триада Шарко).
Стриктуры билиодигестивных анастомозов
После наложения билиодигестивного анастомоза в тканях развиваются репаративные процессы, которые приводят к его сужению, при этом формирование соустий происходит в течение различного срока – от нескольких месяцев до 2 лет. С учетом этого билиодигестивные анастомозы рекомендуется накладывать шириной 2,5–3 см. Условиями, способствующими развитию стриктур желчеотводящих анастомозов, являются воспалительная инфильтрация ткани, травматизация ее, применение грубого шовного материала, излишняя мобилизация желчных протоков. Отрицательное влияние оказывают также заброс кишечного содержимого через анастомоз и недостаточная его обратная эвакуация, агрессивное действие желчи на сшиваемые ткани при отсутствии точного сопоставления оболочек желчных протоков и кишки.Клинические признаки заболевания сходны с таковыми при стриктурах желчных протоков. Вместе с тем они отличаются большей полиморфностью, частым развитием бурного течения острого холангита с потрясающими ознобами и высокой лихорадкой. После снятия воспалительных явлений и улучшения оттока желчи снижается температура тела, уменьшается желтуха. В более тяжелых случаях процесс прогрессирует и ведет к образованию холангитических абсцессов печени с соответствующей клинической картиной (см. раздел "Абсцессы печени"). Длительно существующие стриктуры билиодигестивных анастомозов, сопровождающиеся желчной гипертензией, являются причиной развития билиарного цирроза печени.
Длина культи пузырного протока после холецистэктомии не должна превышать 0,5 см. Однако нередки случаи, когда кажущееся слияние его с общим желчным протоком не соответствует истине, а настойчивые манипуляции в области печеночно–двенадцатиперстной связки могут привести к повреждению гепатикохоледоха (частичному иссечению стенки или пересечению ее). В подобных ситуациях длина культи пузырного протока превышает указанные размеры. Тем не менее часто такие больные не предъявляют каких–либо жалоб. В этой связи следует учитывать, что наличие избыточно длинной культи пузырного протока еще не свидетельствует о рецидиве болей после холецистэктомии. Требуется тщательное обследование больных для более точной оценки состояния желчных протоков.
Клиническая картина не имеет четких признаков. Обычно больные жалуются на боль в правом подреберье. Однако избыточная культя пузырного протока может быть следствием желчной гипертензии, обусловленной сужением гепатикохоледоха, наличием в его просвете конкрементов, стенозом большого дуоденального сосочка. В этих случаях клиника заболевания выражена более четко и соответствует таковой при указанных патологических состояниях.
Остаточный желчный пузырь
При тяжелых патологоанатомических изменениях в области желчного пузыря, печеночно–двенадцатиперстной связки, обусловленных воспалительным процессом, хирурги иногда вынуждены выполнять операцию по типу резекции желчного пузыря, т.е. заведомо оставляя его остатки в области шейки. В этих случаях формируется так называемый "остаточный" желчный пузырь, который является субстратом для поддержания в данной зоне воспалительного процесса. В его просвете могут находиться конкременты.Клиническая картина "остаточного" желчного пузыря не имеет строгой очерченности. Обычно больных беспокоят боли в правом подреберье, могут наблюдаться лихорадка и желтушное окрашивание кожных покровов. Диагноз уточняется с помощью специальных методов исследования, изложенных ниже.
Клинические проявления постхолецистэктомического синдрома имеют место также при заболеваниях желудочно–кишечного тракта, особенно при язвенной болезни, хронической дуоденальной непроходимости, дивертикулах двенадцатиперстной кишки.
Постхолецистэктомический синдром может наблюдаться при различных заболеваниях других органов и систем (грыжи пищеводного отверстия диафрагмы, хронический ишемический синдром брюшной полости и др.).
Методы обследования больных в дооперационном периоде
В выявлении причины постхолецистэктомического синдрома важную роль играют биохимические изменения в крови, которые подробно изучаются в клиниках терапевтического профиля. Однако в установлении точного диагноза, определении показаний к оперативному вмешательству и выборе оптимального способа коррекции нарушений функции желчных протоков решающее значение имеют специальные методы исследования.Прежде всего выполняется обзорная рентгенография органов брюшной полости, которая позволяет определить в протоках рентгеноконтрастные камни, дренажи, а иногда и газ (при наличии желчеотводящих анастомозов и внутренних желчных свищей). При рентгенологическом исследовании желудка и двенадцатиперстной кишки оценивается состояние указанных органов, исключаются или подтверждаются их заболевания. При наличии холедоходуоденальных соустий определяется не только газ, но и заброс контрастного вещества в желчные протоки, контрастируется поданастомозный сегмент холедоха, что позволяет выявить конкременты в терминальном его отделе и диагностировать стеноз БДС. Задержка обратной эвакуации контрастного вещества в двенадцатиперстную кишку свидетельствует о стриктуре билиодигестивного анастомоза.
У больных с подозрением на заболевания поджелудочной железы и хроническую дуоденальную непроходимость целесообразно применять дуоденографию, в том числе в состоянии искусственной гипотонии (после введения метацина, аэрона, атропина). При тугом заполнении контрастной взвесью просвета двенадцатиперстной кишки можно определить изменения БДС, при его недостаточности обнаружить заброс контраста в желчные протоки. Этот метод дает возможность выявить ширину кишки, участки сужения, состояние контуров, на основании чего можно судить о характере патологического процесса.
В настоящее время, широко применяются фиброгастродуоденоскопия, ультразвуковое исследование печени и желчных путей, радиоизотопное сканирование печени, компьютерная томография, более редко используются ангиогепатография и спленопортография.
При отсутствии желтухи широко применяется одномоментная внутривенная или инфузионная холангиография, по результатам которой можно судить о состоянии желчных протоков. Однако она не всегда информативна. Весьма ценные сведения можно получить при фистулохолангиографии у больных, перенесших операцию на желчных путях с последующим их наружным дренированием. Она позволяет выявить оставленные камни в протоках, участки сужения последних, характер поступления контрастного вещества в двенадцатиперстную кишку. На основании результатов данного метода исследования можно заподозрить стеноз БДС, который проявляется резким сужением терминального отдела холедоха и нарушением оттока контрастного вещества.
Для визуализации желчных протоков, особенно при наличии у больных желтухи, в последнее десятилетие наиболее широко применяется эндоскопическая ретроградная панкреатохолангиография. Первое сообщение о ней было сделано McCune, Shove, Oi в 1968 г. Для контрастирования протоков используются водорастворимые йодсодержащие препараты (верографин, урографин, уротраст и др.). К инвазивным методам непосредственного введения контрастного вещества во внутрипеченочные желчные протоки относится чрескожная чреспеченочная холангиография.
Этот метод особенно ценен при использовании тонких и гибких игл Шиба, которые в меньшей степени травмируют печень и не вызывают тяжелых осложнений. В последние годы для этой цели применяются специальные катетеры, проксимальный конец которых остается во внутрипеченочном протоке после извлечения иглы (при пункции она находится в просвете катетера), а наружный выступает над кожей. Этот метод особенно информативен у больных с желтухами, так как дает возможность оценить характер последних, определить уровень препятствия при механической желтухе и осуществить при необходимости ретроградный отток желчи. Пункция печени производится под контролем УЗИ или компьютерной томографии.
В отдельных случаях при постхолецистэктомическом синдроме может быть применена лапароскопия, которая позволяет осмотреть печень, произвести ее биопсию, выполнить пункцию с катетеризацией внутрипеченочных протоков. Однако применение этого метода ограничено из–за развития спаечного процесса в подпеченочном пространстве после хирургического вмешательства на желчевыводящих путях.
Интраоперационные методы исследования
Несмотря на возможность получения большого объема информации в дооперационном периоде, окончательный диагноз устанавливается во время операции с использованием специальных методов исследования. Прежде всего определяется ширина холедоха, которая в норме составляет 7–8 мм. При ширине его более 10 мм необходимо уточнить, имеется ли препятствие для оттока желчи. После холециетэктомии может наблюдаться компенсаторное расширение гепатикохоледоха.Гидродинамические методы исследования (манометрия, кинезиметрия, дебитометрия) в настоящее время не находят широкого применения из–за недостаточной их информативности, особенно при повторных операциях на желчных путях. Ведущую роль в оценке состояния последних играет интраоперационная холангиография (рис. 24). С ее помощью можно выявить холангиолитиаз, стриктуру желчных протоков, стеноз БДС и другие изменения внутри– и внепеченочных протоков. Подогретые до 37°С водорастворимые контрастные вещества вводятся путем пункции гепатикохоледоха. Если его невозможно идентифицировать, производится чреспеченочная холангиография. Чтобы избежать ошибок при интерпретации рентгенограмм, необходимо делать несколько рентгеновских снимков – до введения спазмолитиков и через 3 мин после этого. Такая методика позволяет исключить возможность принятия спазма БДС за его стеноз.
Более информативной является холангиография с применением рентгенотелевизионной аппаратуры с электронно–оптическим преобразователем. Холангиолитиаз характеризуется наличием дефектов наполнения при свободно "плавающих" камнях или менискообразного изображения при вклиненных конкрементах. При стенозе БДС отмечается сужение терминального отдела холедоха или он заканчивается в виде пальца перчатки. Рубцовые стриктуры гепатикохоледоха проявляются "перетяжками" с супрастенотическим расширением. При хроническом панкреатите происходит сдавление дистального отдела холедоха на значительном протяжении (2 см и более). При полной непроходимости желчных путей отмечается их резкое расширение. Первично склерозирующий холангит характеризуется сужением желчных протоков на всем протяжении и обеднением их рисунка в области печени. Для опухолевого процесса характерна изъеденность стенок пораженных участков протоков с резким расширением их просвета выше места препятствия. При проведении холангиография возможен заброс контрастного вещества в проток поджелудочной железы, что в одних случаях носит функциональный характер, а в других свидетельствует о патологических изменениях в терминальном отделе общего желчного протока
После вскрытия гепатикохоледоха проводятся инструментальные методы исследования, которые позволяют определить проходимость желчных протоков, в том числе БДС, локализацию, протяженность и степень их сужения, наличие конкрементов. Выделение через холедохотомическое отверстие мутной желчи под давлением свидетельствует о наличие препятствия для ее оттока и о развитии халангита. При множественном халангиолитиазе в рану могут поступать конкременты и замазкообразная масса. Ведущей манипуляцией после этого является зондирование желчных протоков в дистальном и проксимальном направлениях. Это особенно необходимо для диагностики стеноза БДС. Свободное прохождение зонда диаметром 3 мм в двенадцатиперстную кишку свидетельствует об отсутствии указанной патологии. Для диагностики конкрементов при наличии соответствующей аппаратуры с успехом используется ультразвуковое сканирование. Ценным методом является фиброгепатикохоледоскопия, позволяющая непосредственно осмотреть желчные протоки и осуществить контроль за удалением камней.
Гидродинамические методы исследования (манометрия, кинезиметрия, дебитометрия) в настоящее время не находят широкого применения из–за недостаточной их информативности, особенно при повторных операциях на желчных путях. Ведущую роль в
Повторные восстановительные и реконструктивные операции на желчных путях
Повторные операции на желчных путях нередко связаны с большими техническими сложностями, которые требуют от хирурга соответствующего опыта в области гепатобилиарной хирургии. Поэтому они должны выполняться в специализированных учреждениях, имеющих необходимые условия для коррекции нарушенных функций желчных путей в самых трудных ситуациях. Допущенные во время операции технические погрешности являются одной из причин многократных повторных вмешательств.Прежде всего необходимо правильно оценить показания к хирургическому вмешательству. Оно выполняется при нарушении оттока желчи. Это может быть обусловлено оставленными или вновь образованными конкрементами, стриктурами протоков, сдавлением их извне. Оперативному вмешательству подлежат больные с острым, хроническим рецидивирующим холангитом, который не поддается консервативному лечению. Значительную опасность представляют стриктуры ранее наложенных билиодигестивных анастомозов. В этих случаях заброс кишечного содержимого в желчные протоки постоянно поддерживает воспалительный процесс в них, приводит к формированию фиброза, а затем и цирроза печени. Все это свидетельствует о необходимости своевременного хирургического лечения указанных больных. Операция показана при установлении диагноза стеноза БДС, который сопровождается желчной гипертензией. Оперативное вмешательство производится при стойких полных и неполных наружных, а также внутренних желчных свищах. Особую группу составляют больные с выраженным болевым синдромом, причину которого выяснить невозможно. При исключении заболеваний других органов и систем многие из них подвергаются оперативному вмешательству, во время которого часто диагностируют панкреатит.
Различают восстановительные и реконструктивные повторные операции на желчных путях. К первым относятся такие оперативные вмешательства, которые обеспечивают естественный пассаж желчи. При вторых отток желчи в кишечник осуществляется через билиодигестивные анастомозы.
Восстановительные операции.
При наличии единичных камней в гепатикохоледохе производятся его вскрытие и удаление конкрементов. В случае хорошей проходимости желчных протоков операция заканчивается временным наружным их дренированием или наложением глухого шва на стенку гепатикохоледоха. Последняя методика при повторных операциях применяется редко. Основным видом восстановительной операции является папиллосфинктеротомия, которая выполняется при стенозе БДС в сочетании с ущемленным камнем в его ампуле или без этого. Совершенствование техники указанной операции резко сократило число осложнений. Производится мобилизация двенадцатиперстной кишки по Кохеру. Затем через устье пузырного протока или холедохотомическое отверстие проводится зонд, кончиком которого выпячивается стенка двенадцатиперстной кишки в области БДС. После этого поперечно или продольно на протяжении 1 см рассекается передняя стенка кишки. Кончиком зонда выводится в рану БДС и производится частичная папиллосфинктеротомия длиной 10–15 мм.
При ущемленном камне в ампуле сосочка выполняется папиллотомия (длина рассечения 5–6 мм). Тотальная папиллосфинктеротомия (длина рассечения 20–25мм) используется реже. Во время данной операции необходимо избегать прошивания или повреждения устья протока поджелудочной железы. Иногда слизистые БДС и двенадцатиперстной кишки сшиваются между собой нитями на атравматической игле, т.е. выполняется папиллосфинктеропластика. При необходимости дренируется проток поджелудочной железы катетером диаметром 2–5 мм. Критерием адекватной папиллосфинктеротомии является свободное прохождение зонда диаметром 0,5 см в двенадцатиперстную кишку. Операция заканчивается ушиванием стенки кишки и наружным дренированием холедоха.
Реконструктивные операции.
Выполняются при множественных камнях в желчных протоках, стенозе терминального отдела холедоха, нарушениях моторно–эвакуаторной функции двенадцатиперстной кишки, затрудняющих отток желчи, а также если невозможно восстановить непрерывность гепатикохоледоха. Наиболее широкое распространение получила холедоходуоденостомия. Классическим ее вариантом является способ Финстерера, когда рассеченные стенки двенадцатиперстной кишки и общего желчного протока сшиваются бок в бок. По методу Флеркена продольно рассекаются проток и стенка двенадцатиперстной кишки (Т–образно), по Юрашу – холедох вскрывается продольно, а кишка – поперечным разрезом. Соустье следует формировать достаточно широким (3,5 см), так как в последующем его диаметр значительно уменьшается. Недостатками холедоходуоденостомии являются образование поданастомозного мешка за счет холедоха и неустраненный стеноз БДС, что способствует развитию панкреатита и холангита.
При сочетании стеноза БДС с множественным холедохолитиазом стриктурой терминального отдела холедоха производится двойное внутреннее дренирование желчных путей, т.е. накладывается холедоходуоденоанастомоз и выполняется папиллосфинктеротомия.
Если во время повторной операции установлено сужение ранее наложенного холедоходуоденального соустья, то необходимо вновь era сформировать. Некоторые хирурги при выполнении двойного внутреннего дренирования используют один разрез двенадцатиперстной кишки.
Особую сложность представляют операции при высоких рубцовых стриктурах печеночных протоков. В этих случаях восстановительные оперативные вмешательства выполняются редко. Они возможны при небольшой протяженности стриктуры – до 1,5 см. После иссечения рубцовой ткани производят сшивание концов протока с четкой адаптацией слизистых на дренаже, дистальный конец которого выводят наружу через разрез передней стенки холедоха. При рубцовых стриктурах печеночных протоков выполняются главным образом реконструктивные операции, т.е. создается гепатикоеноанастомоз. Имеется множество методов его наложения, при этом выключение петли тощей кишки по Ру на протяжении 60–80 см снижает до минимума заброс кишечного содержимого в желчные протоки. Для формирования указанных анастомозов одни хирурги широко применяют управляемые дренажи, в то время как другие отказались от их использования и считают, что профилактикой рубцевания анастомозов является тщательная адаптация слизистых оболочек кишки и желчных протоков.
Эндоскопические вмешательства
Основным эндоскопическим вмешательством у больных, которые ранее перенесли операции на желчных путях, является папиллосфинктеротомия. Ее методика разработана в клиниках Японии и ФРГ в 70–х годах текущего столетия. В СССР эндоскопическая папиллосфиктеротомия впервые была применена в 1976 г. Показаниями для ее выполнения у ранее оперированных больных служат холангиолитиаз, стеноз или рестеноз БДС, хронический панкреатит, обусловленный сужением устья протока поджелудочной железы. При сужении желчеотводящего анастомоза можно рассечь его с помощью папиллотома типа Демлинга, что представляет собой самостоятельную операцию или первый этап реконструктивного абдоминального оперативного вмешательства на желчных протоках.В последние годы все шире применяется неоперативное удаление камней из желчных протоков при наружном их дренировании. Это достигается путем вымывания, растворения и инструментального их извлечения. Удаление оставленных камней промыванием – простой и доступный метод. Камни вымываются наружу или в двенадцатиперстную кишку. Несмотря на заманчивость идеи, факт растворения желчных камней весьма сомнителен. Применение с этой целью препаратов хенодезоксихолевой, урсодезоксихолевой кислот и других веществ в определенной степени может быть эффективным лишь при небольших свежих холестериновых камнях. При наличии желчных свищей их можно вывести непосредственно в протоки. Pribram в 30–е годы нашего столетия для растворения забытых желчных камней применял хлороформ, эфир и спирт. В последние годы для этого чаще используется гепарин, который на протяжении нескольких дней капельно вводится через дренажи (25.000 ЕД гепарина на 250 мл изотонического раствора натрия хлорида). В настоящее время все шире применяются инструментальные методы удаления камней из желчных протоков, при этом конкремент может быть вытолкнут в кишку, раздроблен или извлечен наружу. Удаление камней через желчный свищ или дренаж производится обычно с помощью петли Дормиа.
Портальная гипертензия
Портальная гипертензия – это симптомокомплекс (синдром), развивающийся вследствие нарушения кровотока в портальной системе, ведущим признаком которого является повышение давления в воротной вене.Историческая справка.
Понятие о портальной гипертензии ввели Gilbert (1901) и Villaret (1908). Вся история хирургического лечения больных портальной гипертензией тесно связана с расширением представления о ее причинах и патогенезе, т.е. в основном с циррозом печени. Первое научное описание цирроза печени (атрофического) привел Laennec (1819). Он же предложил термин "цирроз" (от греч, kirrhos – лимонно–желтый). А. Соловьев (1873) дал характеристику билиарного цирроза. Blakemore (1945), Linton (1945, 1947) выделили вне– и внутрипеченочный блоки портального кровотока. 8 случае развивающегося при циррозе печени нарушения портального кровотока Talma (1898) предложил подшивать большой сальник к брюшине, Н. В. Экк (1877) – накладывать прямой портокавальный анастомоз, Н. А. Богораз (1912) – формировать соустье между верхней брыжеечной и нижней полой венами, a Linton (1947) – между селезеночной и левой почечной веками. В. В. Подвысоцкий (1886), В. А. Меастер (1894), Islani с соавт. (1958) теоретически обосновали целесообразность выполнения при портальной гипертензии вследствие цирроза печени частичной резекции ее, электрокоагуляции, денервации печеночной артерии. В 1955 г. Welch в эксперименте произвел первую гетеротопическую, а в 1959 г. Мооr – ортотопическую пересадку печени. Sarzl с соавт. (1963) выполнили ортотопическую трансплантацию печени в клинике.
Исходя из уровня препятствия для оттока крови по системе воротной вены и характера вызвавшего его основного заболевания выделяют четыре формы синдрома портальной гипертензии: предпеченочную (допеченочную), внутрипеченочную, надпеченочную и смешанную.
Этиология.
Причины, лежащие в основе развития синдрома портальной гипертензии, разнообразны. Они подразделяются на врожденные и приобретенные. Так, нарушение тока крови по воротной вене (предпенсионная форма синдрома) в 80% случаев возникает при врожденных аномалиях развития этой вены и ее ветвей: аплазии (врожденное отсутствие вены), гипоплазии (недоразвитие вены), атрезии (один из концов вены заканчивается слепо), протяженных или локальных заращениях просвета вены. Приобретенными причинами окклюзии являются тромбозы и флебиты воротной вены при гнойно–септических заболеваниях, сдавление ее воспалительными инфильтратами, кистами, опухолями брюшной полости и забрюшинного пространства, рубцами.
Внутрипеченочная форма синдрома обусловлена различными видами цирроза печени (портального, постнекротического, билиарного, смешанного), хроническим гепатитом, очаговыми склеротическими и рубцовыми изменениями в ткани печени (опухоли, рубцы, посттравматический, поствоспалительный, портальный фиброз печени, рак и т.д.).
Врожденными причинами надпеченочной формы портальной гипертензии являются сужение, мембранозное заращение просвета нижней полой вены на уровне или проксимальнее впадения в нее печеночных вен. К приобретенным причинам относятся тромботическая окклюзия на этом уровне нижней полой вены, ее стеноз, сдавление опухолью, рубцами (синдром Бадда–Киари) и эндофлебит печеночных вен с их частичной или полной непроходимостью (болезнь Киари), цирроз Пика сердечного происхождения.
В основе развития смешанной формы синдрома лежит сочетание различных этиологических факторов, чаще всего цирроза печени с тромбозом воротной вены.
Патогенез.
Синдром портальной гипертензии развивается, как уже отмечалось, в результате длительного повышения давления в системе воротной вены. В норме через воротную вену в печень поступает 75% крови, а 25% – через печеночную артерию. Внутрипортальное давление составляет 120–180 мм вод. ст. и определяется объемом притекающей к печени крови, величиной давления в брюшной полости, перистальтикой кишечника и т.д. При возникновении затруднения для тока крови давление в портальной системе увеличивается. У лиц с внепеченочным блоком портальная гипертензия обусловлена чисто механической причиной. При внутрипеченочном блоке повышение давления носит первоначально компенсаторный характер, направленный на поддержание адекватного кровообращения в цирротически измененной печени. Одновременно при внутрипеченочной форме портальной гипертензии для повышения артериализации крови, поступающей в печень, усиливается артериальный приток к селезенке. Внутри ее образуются артериовенозные фистулы. В свою очередь увеличение притока артериальной крови ведет к ее гиперплазии (спленомегалии), а нередко и к гиперспленизму, который проявляется анемией, лейкопенией и тромбоцитопенией.
Длительное существование препятствия для тока крови, прогрессирующее увеличение давления в системе воротной вены, часто превышающего 200–400 мм вод. ст., сопровождается изменением характера портального кровообращения. Отток крови из системы осуществляется через портокавальные анастомозы. Ретроградному току крови способствует и отсутствие в портальной вене клапанов.
Основными путями коллатерального кровообращения являются: 1. Анастомозы в области кардиального отдела желудка и абдоминального отдела пищевода. По ним кровь из воротной вены через венечную и другие вены желудка, в основном расположенные по малой кривизне, вены нижней части пищевода, по непарной и полунепарной венам поступает в верхнюю полую вену. При отсутствии анастомозов между венами желудка и пищевода происходит изолированное расширение желудочных вен вследствие возникновения портопортальных или портокавальных анастомозов. 2. Анастомозы между верхними (системой воротной вены), средними и нижними прямокишечными венами (система нижней полой вены). 3. Анастомозы между околопупочными и пупочной венами. Кровь из воротной вены через пупочную поступает в вены передней брюшной стенки, а оттуда в нижнюю и верхнюю полые вены. 4. Анастомозы между венами желудочно–кишечного тракта и венами, отводящими кровь к забрюшинным и медиастинальным венам.
Вены, участвующие в формировании портокавальных анастомозов, варикозно расширяются, истончаются и нередко являются источниками пищеводных, желудочных и прямокишечных кровотечений.
Этому способствуют: 1. наблюдающееся у больных с циррозом печени нарушение синтеза в печени и селезенке многих факторов свертывающей системы крови и ингибиторов коагуляции (протромбин, фибриноген, проконвертин, гепарин, антифибринолизин и т.д.); 2. портальные кризы, сопровождающиеся значительными колебаниями давления в портальной системе. У лиц с варикозным расширением вен пищевода и кардиального отдела желудка в изъязвлении слизистой определенную роль играет кислотно–пептический фактор.
Прогрессирующее увеличение в портальной системе давления, повышение на этом фоне диффузии белковой части крови в свободную брюшную полость с одновре – менным снижением белково–синтезирующей функции печени, затруднение оттока лимфы от органов брюшной полости, увеличение в крови содержания антидиуретического гормона альдостерона, задержка в организме натрия приводят к появлению асцита.
Клиническая картина.
Наиболее типичными признаками портальной гипертензии являются спленомегалия, варикозное расширение вен пищевода, желудка, прямой кишки и кровотечения из них, асцит, диспептические проявления, печеночные знаки (сосудистые звездочки, печеночные ладони и др.), гиперспленизм, гипокоагуляция, неврологические расстройства. Характер течения портальной гипертензии, степень выраженности указанных симптомов и синдромов зависят от варианта портального блока. Так, по сравнению с внутрипеченочной формой синдрома клинические проявления внепеченочной локализации более однотипны. Симптомы врожденной пред– и надпеченочной форм портальной гипертензии появляются в детском возрасте. При приобретенной форме портального блока в анамнезе отмечаются гнойно–септические процессы. Первыми признаками нарушения кровотока по системе портальной вены нередко является спленомегалия или пищеводно–желудочное кровотечение. После кровотечения размеры селезенки уменьшаются. Больных беспокоят общая слабость, ноющие боли в левом подреберье. Синдром протекает в основном благоприятно. Асцит возникает редко в терминальной стадии портальной гипертензии.
Острая форма внепеченочного блока сопровождается интенсивными болями в эпигастрии и правом подреберье, гипертермией. При предпеченочном блоке быстро развиваются сштеномегалия и асцит, а при надпеченочной окклюзии – и гепатомегалия. Часто возникающие пищеводно–желудочные кровотечения и печеночно–почечная недостаточность нередко приводят к летальному исходу.
У больных с внутрипеченочной формой портальной гипертензии превалируют проявления цирроза печени (алкогольного, постнекротического и т.д.). Помимо слабости, головной боли, повышенной утомляемости, чувства тяжести и болей в животе, диспептических расстройств, наблюдаются похудание, сухость и бледность кожных покровов, печеночные знаки, повышенная кровоточивость, увеличение живота (за счет гепатомегалии, спленомегалии, атонии кишечника). Пищеводно–желудочные и ректальные кровотечения, гиперспленизм приводят к анемии. В поздних стадиях появляются желтуха и асцит.
В зависимости от степени выраженности типичных признаков портальной гипертензии, состояния портопеченочного кровотока выделяют три стадии клинического течения синдрома портальной гипертензии (М. Д. Пациора): 1. компенсированную (начальную) – характеризуется умеренным повышением портального давления, компенсированным внутрипеченочным кровообращением, спленомегалией с гиперспленизмом или без него; 2. субкомпенсированную – отмечаются высокое портальное давление, спленомегалия, варикозное расширение вен пищевода и желудка с кровотечением или без кровотечения из них, значительные нарушения в портопеченочном кровообращении; 3. декомпенсированную – имеют место спленомегалия, варикозное расширение вен пищевода и желудка с кровотечением или без кровотечения из них, асцит, выраженные нарушения в портопеченочном и центральном кровообращении.
Диагностика.
При внепеченочной врожденной форме портальной гипертензии обращают на себя внимание бледность кожных покровов пациентов, увеличение и асимметрия живота за счет спленомегалии. Селезенка значительно увеличивается, имеет неровную поверхность, ограниченную подвижность из–за выраженного периспленита. Изменения в печени слабо выражены, она подвижна, с гладкой поверхностью. В крови отмечаются умеренная анемия, лейкопения и тромбоцитопения.
Для внутрипеченочной формы портального блока характерно наличие дефицита массы тела, печеночных знаков, развитой коллатеральной венозной сети на передней брюшной стенке. Состояние печени определяется этиологическим фактором портального блока. Селезенка плотная, безболезненная, в случае отсутствия периспленита смещается при пальпации. В крови выявляется гипопротеинемия, увеличиваются показатели, свидетельствующие о нарушении антитоксической функции печени, повышается активность трансаминаз. Часто возникает олигурия.
В диагностике портальной гипертензии особую роль играют лабораторно–инструментальные методы обследования.
По данным бромсульфалеиновой пробы, определения содержания в крови трансаминаз, щелочной фосфатазы, ЛДГ, пигментного и углеводного обмена устанавливают степень изменения функционального состояния печени.
При фиброгастроскопии выявляют варикозное расширение вен подслизистого слоя пищевода и кардиального отдела желудка. Расширенные вены выбухают в просвет в виде нескольких стволов, соединенных между собой более мелкими венозными сплетениями.
Рентгенологически просвет пищевода в области варикозно расширенной вены дилатирован, имеет нечеткие контуры, множественные дефекты наполнения.
Во время рекгороманоскопии выявляют варикозно расширенные геморроидальные вены.
Спленоманометрия позволяет определить уровень портального давления.
На основании спленопортографии, целиакографии, каваграфии, трансумбиликальной портогепатографии, прямой портографии получают информацию об уровне портального блока. В непораженной портальной системе на спленопортограммах определяется депо контрастного вещества в селезенке. Хорошо контрастируются селезеночная и воротная вены, вены 5–6–го порядка последней. При целиакографии наблюдается заполнение контрастом селезеночной, печеночной артерий и их внутриорганных ветвей, при каваграфии – беспрепятственное распространение контраста по нижней полой вене. На трансумбиликальной и прямой партограммах четко выявляются сосуды печени, внутри– и внепеченочные анастомозы. Типичными рентгенологическими признаками внутрипеченочной формы портальной гипертензии являются расширение v.portae и ее притоков, слабое контрастирование внутрипеченоч – ных сосудов. Нередки внутрипеченочная деформация и заполнение контрастным веществом варикозно расширенных коллатералей. При предпеченочной форме находят участки тромботической окклюзии воротной или селезеночной вены, а при надпеченочной – сужение (окклюзию) нижней полой вены в области или проксимальнее впадения в нее печеночных вен.
Причина возникновения портальной гипертензии уточняется на основании чрескожной пункционной биопсии печени в IX–X межреберье справа по средненодмышечной линии в состоянии апноэ специальной иглой (Сильвермана, Шиба) или во время лапароскопии.
Лечение.
Консервативное лечение больных портальной гипертензией малоэффективно, но оно крайне необходимо при кровотечении из варикозно расширенных вен пищевода и желудка. При пищеводно–желудочном кровотечении проводят общую и местную гемостатическую терапию. Общая гемостатическая терапия предполагает внутривенное введение 20 мл 10% раствора кальция хлорида, 100–200 мл 5 % раствора ε–аминокапроновой кислоты (для уменьшения фибринолитической активности крови), 2–4 г фибриногена, внутримышечно назначается викасол (1–3 мл 1% раствора). Исходя из показателей гемодинамики возмещают объем циркулирующей крови (цельная кровь, препараты крови, кровезаменители, кристаллоидные растворы и т.д.). Эффективно внутривенное введение питуитрина, снижающего портальное давление: 0,3 ЕД/кг препарата в 200 мл 5 % раствора глюкозы переливают внутривенно капельно за 20 мин. Через 40–60 мин вводят поддерживающую дозу – 0,1 ЕД/кг в 100 мл 5 % раствора глюкозы за 10 мин с последующей инфузией препарата в течение 6–12 ч из расчета 0,1 ЕД/кг в час.
Местное лечение включает локальную гипотермию (холод на эпигастральную область и нижнюю треть передней поверхности грудной клетки, глотание льда), введение в пищевод зонда Сенгстейкина–Блейкмора. Зонд представляет собой трехпросветную резиновую трубку с двумя баллонами (рис. 25). Круглый баллон (объемом 60–70 мл) расположен на конце зонда, цилиндрический (объемом 100–150 мл) – несколько проксимальнее. Два канала зонда используются для раздувания баллонов, а третий, сообщающийся с просветом желудка, – для контроля эффективности гемостаза. После введения зонда через нос в желудок вначале раздувается дистальный баллон. Вслед за этим зонд подтягивается кверху. При соприкосновении баллона с кардией ощущается легкое сопротивление. Нагнетанием воздуха в пищеводный баллон достигается сдавление варикозно расширенных вен. Длительность пребывания зонда в пищеводе не должна превышать 48 ч в связи с реальной опасностью развития пролежней. Эффективность сдавления кровоточащих вен контролируется при ослаблении давления в баллонах.
 Рис. 25. Остановка пищеводного кровотечения с помощью зонда Сенгстейкина–Блейкмора:
а – раздутая манжетка в желудке; б – раздутая манжетка в пищеводе.
Рис. 25. Остановка пищеводного кровотечения с помощью зонда Сенгстейкина–Блейкмора:
а – раздутая манжетка в желудке; б – раздутая манжетка в пищеводе.
Для остановки кровотечения из вен пищеводно–кардиальной области применяется и эндоскопический трансэзофагеальный гемостаз. Он достигается интравенозным (интравазальным) или паравазальным введением склерозирующих препаратов (тромбовар, варикоцид, этоксисклерол, этиловый спирт и т.д.), а также интравазальным введением эмболизирующих веществ. Последние представляют собой изначально плотные или полимеризующиеся после внутрисосудистого введения соединения (синтетические гели, препараты тромбина, желатина, цианокрилаты). Интравенозные инъекции склерозирующих препаратов вызывают выраженную деструкцию вен, способствуя быстрой облитерации просвета и остановке кровотечения. Паравазальное введение стимулирует разрастание соединительной ткани в подслизистом слое пищевода, снижая вероятность формирования новых варикозных узлов.
Хирургическое лечение показано: 1. при кровотечении из варикозно расширенных вен пищевода и желудка, не останавливающемся от проводимого консервативного лечения; 2. при варикозном расширении вен пищевода и желудка, часто осложняющемся кровотечением; 3. при спленомегалии с гиперспленизмом; 4. при асците; 5. для коррекции портального кровотока при отсутствии грубых морфофункциональных изменений в состоянии печени и селезенки; уровне билирубина в крови ниже 34 мкмоль/л, содержании альбумина выше 0,35 г/л, если нет асцита, гиперспленизма, неврологических расстройств.
Операция противопоказана: 1. при значительных морфофункциональных изменениях в печени; 2. при тяжелой сопутствующей патологии.
Хирургическое лечение в подавляющем большинстве случаев осуществляется планово, после соответствующей медикаментозной терапии. При кровотечении из варикозно расширенных вен пищевода и желудка операция нередко выполняется экстренно.
Выбор способа оперативного вмешательства определяется индивидуально, исходя из результатов прежде всего рентгенологического исследования портальной системы (уровня блока, состояния сосудистой сети), а также тяжести гиперспленизма, степени компенсации нарушенных функций печени, наличия сопутствующих заболеваний, возраста и общего состояния больных.
Многочисленные операции, используемые при портальной гипертензии, подразделяются на пять групп: 1. Направленные на предотвращение связи вен желудка и пищевода с венами портальной системы (операции разобщения). Выполняются в случае значительного коллатерального сброса, выраженного расширения вен кардиоэзофагеальной области. К ним относятся: ■ операция Пациоры – гастротомия косым разрезом от дна к малой кривизне желудка с прошиванием расширенных вен желудка и пищевода со стороны слизистой. Наиболее эффективная операция. Может сочетаться с перевязкой селезеночной артерии и пересечением ее по верхнему краю поджелудочной железы; ■ операция Таннера – поперечное пересечение желудка в кардиальном его отделе с последующим сшиванием стенок; ■ операция Крзйля – эзофаготомия и непосредственное прошивание измененных вен пищевода. При сбросе крови по венечной и коротким венам желудка производится их изолированная перевязка на протяжении. 2. Направленные на создание новых путей оттока крови из портальной системы. Эти операции подразделяются на две подгруппы: сосудистых и органоанастомозов (оментопексий и органопексий). Формирование сосудистых анастомозов (портокавальное шунтирование) – единственный радикальный способ уменьшения давления в системе v.portae. Это достаточно сложные операции. Их эффективность зависит от функционального состояния печени и селезенки к моменту хирургического вмешательства. Недостатками операций являются тромбоз анастомозов, гастродуоденальные изъязвления и рецидивы кровотечений. Кроме того, портокавальное шунтирование сопровождается уменьшением обезвреживания крови в печени. Это ведет к тому, что при формировании анастомоза между портальной и нижней полой венами в 25–50% случаев развивается токсическая энцефалопатия и печеночная кома с летальностью 20–40%. Из группы шунтирующих операций предпочтение отдается спленоренальному (операция Уиппла–Блейкмора) и кавомезентериальному анастомозам (операция Богораза). Органоанастомозы рассчитаны на улучшение оттока крови из портальной системы за счет формирования сращений между сальником и окутываемым им органом (оментопексия) или между органами вследствие существования градиента давления по разные стороны от места блока (органопексии). При органопексиях сосудистые анастомозы (сращения) образуются между органами брюшной полости или при перемещении органов брюшной полости в другие анатомические области (операции перемещения). К оментопексиям относятся оментогепатопексия, оментоспленопексия, оментонефропексия (применяются наиболее часто), оментогепатодиафрагмопексия, оментоплевропексия. Как правило, оментопексии дополняются другими вариантами хирургических вмешательств. Органопексии включают: гепатопневмопексию – иссечение части правого купола диафрагмы с подшиванием нижней поверхности правого легкого к печени; гастропексию – подшивание к декапсулированной левой доле печени серозно–мышечного лоскута малой кривизны или передней стенки желудка; кологепатопексию – подшивание к декапсулированной правой доле печени демукозированного сегмента поперечной ободочной кишки на сосудистой ножке. К операциям перемещения относятся перемещение в плевральную полость более ¾ массы правой доли печени; перемещение декапсулированной селезенки в забрюшинное пространство, в плевральную полость и т.д.; перемещение сальника в подкожно–жировую клетчатку, во влагалище прямой мышцы живота, в плевральную полость. 3. Направленные на отведение асцитической жидкости из брюшной полости: лапароцентез, операция Кальба, перитонеовенозное шунтирование, торакализация декапсулированной печени. Операция Кальба предполагает создание постоянного дренажа брюшной полости путем иссечения участков париетальной брюшины и брюшных мышц до подкожной клетчатки в области поясничных треугольников кнаружи от восходящей и нисходящей толстой кишки. При перитонеовенозном шунтировании (операция Рюотта) большая подкожная вена бедра выделяется на протяжении 10–15 см от впадения в бедренную, пересекается и вшивается над пупартовой связкой в отверстие в брюшине. Асцитическая жидкость отводится непосредственно в сосудистое русло. Операция широко не применяется из–за частой облитерации вен. Сущность тораколизации декапсулированной печени заключается в резекции правого купола диафрагмы и перемещении декапсулированной печени в плевральную полость на границе грудной и брюшной полостей. Развивающееся в раннем послеоперационном периоде вследствие брюшно–плевральной разницы в давлении усиление кровообращения в печени, а вместе с этим и ее метаболизма приводит к исчезновению асцита в ближайшие 10–15 дней. Уменьшению асцита способствуют операции, улучшающие лимфоотток из брюшной полости: а) формирование лимфовенозных анастомозов (на шее – между шейной частью лимфатического протока и яремной или подключичной веной, под диафрагмой – между брюшной частью коллектора, образующего грудной лимфатический проток, и нижней полой веной); б) наружное дренирование грудного лимфатического протока. Однако последняя операция приводит к большой потере белка, жидкости, что способствует олигурии. Для закрытия дефекта в стенке протока нередко требуется повторное вмешательство. 4. Направленные на уменьшение притока крови в портальную систему: спленэктомия, перевязка артерий и вен (левой желудочной и правой желудочно–сальниковой артерий, нижней брыжеечной вены, печеночной артерии, селезеночной и т.д.), рентгеноэндоваскулярная окклюзия печеночной артерии. Наиболее распространенной операцией данной группы является спленэктомия. Основными показаниями к ее выполнению служат гиперспленизм и изолированный тромбоз селезеночной вены. Необоснованное удаление селезенки у больных с синдромом портальной гипертензии сопровождается рецидивом кровотечений, так как снижает давление в портальной системе только на 40–100 мм рт. ст. Кроме того, разрушение в результате операций сети коллатеральных сосудов нередко способствует замедлению оттока крови с последующим венозным тромбозом в портальной системе. Не исключается и развитие в послеоперационном периоде серьезных отклонений в состоянии иммунной системы. 5. Преследующие цель – усилить регенерацию печени и улучшить внутрипеченочное артериальное кровообращение: резекция печени (10–15% массы), периартериальная неврэктомия общей печеночной артерии (операция Малле–Ги), артериопортальные анастомозы (аортопортальный, спленопортальный, силеноумбиликальный), электрокоагуляция печени и т.д. В большинстве случаев при хирургическом лечении больных портальной гипертензией выполняется несколько операций разных групп. Перспективным направлением в коррекции портального кровотока при поражении печени является ее пересадка. В послеоперационном периоде проводится комплексное консервативное лечение, преследующее цель – улучшить функциональное состояние печени, общую и местную гемодинамику и т.д. Летальность после операции у больных с синдромом портальной гипертензии колеблется от 20 до 50%.
Хронический панкреатит и его осложнения
Анатомо–физиологические сведения о поджелудочной железе
В период эмбрионального развития поджелудочная железа (pancreas) располагается внутрибрюшинно. В дальнейшем в результате внутриутробного поворота желудка и двенадцатиперстной кишки она перемещается кзади и приобретает забрюшинное положение.У взрослого человека поджелудочная железа располагается позади желудка на задней стенке брюшной полости на уровне I–II поясничных позвонков. Ее размеры варьируют в зависимости от возраста, массы тела и функционального состояния, В возрасте 25–45 лет железа имеет длину от 15 до 25 см, ширину в средней части ее тела от 2 до 8 см, толщину до 3 см. Масса поджелудочной железы у взрослого человека составляет 70–110 г. В поджелудочной железе различают головку, шейку, тело и хвост. Головка является наибольшей частью железы. Она находится справа от позвоночника в подкове двенадцатиперстной кишки. От нее отходит крючкообразный отросток, обращенный книзу и заворачивающийся под шейку. Шейка представляет собой суженную часть поджелудочной железы, соединяющую головку с телом. Тело имеет форму треугольной пирамиды с передне верхней, передненижней и задней поверхностями. Хвостом называется дистальный отдел железы. Он меньше тела, уплощен.
Поджелудочная железа тесно контактирует со многими органами и магистральными сосудами. В непосредственной близости от головки находятся двенадцатиперстная и поперечная ободочная кишки, желудок, правая почка, диафрагма, аорта, верхняя полая вена, солнечное сплетение, общий желчный проток. Последний в 15% случаев на протяжении 3–5 см лежит позади двенадцатиперстной кишки в бороздке на задней поверхности головки или залегает в толще железы. В области шейки проходят верхние брыжеечные артерия и вена. Тело поджелудочной железы находится перед верхним полюсом левой почки и надпочечником, солнечным сплетением, соприкасается с дуоденоеюнальным изгибом и петлями тощей кишки. Хвост нередко достигает ворот селезенки.
Снаружи поджелудочная железа покрыта тонкой капсулой, сращенной с висцеральным листком брюшины. Ее паренхима разделена соединительнотканными тяжами на дольки, состоящие из экзо– и эндокринной частей. В соединительнотканных перемычках залегают кровеносные и лимфатические сосуды, нервные волокна и выводные протоки железы. Структурно–функциональной единицей экзокринной части является панкреатический ацинус. Каждый ацинус содержит 8–12 экзокринных панкреатоцитов. Экзокринные панкреатоциты синтезируют пищеварительные ферменты сока поджелудочной железы. Они подразделяются на амилолитические (амилаза и ее изоферменты), протеолитические (трипсин, химотрипсин, проэластаза, калликреин), липолитические (липаза, фосфолипаза, карбоксилэластаза), нуклеотические (рибопуклеаза, дезоксирибонуклеаза). Помимо пищеварительных ферментов в соке содержатся слизистые вещества, вода, гидрокарбонат и электролиты, 95% которых составляет натрий. Секреторный процесс осуществляется циклически. За сутки образуется 1.000–1500 мл панкреатического сока, представляющего собой прозрачную жидкость с pH 7,8–8,9. По системе каналов, состоящей из вставочных (примыкают к ациноцитам), межацинозных и внутридольковых протоков, секрет поджелудочной железы поступает в главный ее проток (вирсунгов). Его длина 9–23 см, диаметр 0,5–8 мм. Проток открывается в двенадцатиперстную кишку на большом дуоденальном сосочке (papilla Fateri), образуя в 10–75% случаев вместе с холедохом общую ампулу. Общность ампулы при нарушении тонуса группы гладких мышц, расположенных циркулярно вокруг холедоха, главного панкреатического протока и ампулы, т.е. сфинктера Одни, создает предпосылки для заброса желчи в вирсунгов проток. В 80–90% случаев имеется добавочный проток поджелудочной железы (санториниев). Его длина 2–4 см, ширина 0,2–2 мм. Санториниев проток сливается с главным панкреатическим протоком в области головки поджелудочной железы или сообщается с двенадцатиперстной кишкой на малом дуоденальном сосочке. Он находится на 2–3 см выше papilla Vateri.
Эндокринный отдел поджелудочной железы представлен скоплением эндокринных клеток (А(а), B(fJ) D(A)), которые называются островками Лангерганса. Они рассеяны по всей поджелудочной железе между ацинусами, В–клетки продуцируют инсулин, А – глкжагон и липокаин, D – соматостатин. Инсулин участвует в глико– и липогенезе, понижая уровень глюкозы в крови. Глкжагон расщепляет гликоген печени и способствует глюкогенезу, что приводит к увеличению концентрации сахара в крови. Соматостатин тормозит секрецию глюкагона и инсулина.
Кроме экзо– и эндокринной функций, поджелудочная железа обладает экскреторной способностью. С панкреатическим соком выделяются мочевина, мочевая кислота, лекарственные препараты.
Кровоснабжение поджелудочной железы происходит по системе печеночной, селезеночной и верхней брыжеечной артерий. Отходящая от a.hepatica a.pancreaticoduodenalis обеспечивает приток крови к большей части головки железы. Ветви a.mesenterica sup. подходят к ее телу и хвосту. Ветви из системы a.lienalis разветвляются на передней поверхности головки и в теле поджелудочной железы.
Отток венозной крови идет по верхней брыжеечной и селезеночной венам, впадающим в воротную вену.
Лимфатическая система поджелудочной железы начинается лимфатическими щелями между отдельными ацинарными клетками. Эти щели собираются в лимфатические капилляры, оплетающие ацинарные железы совместно с кровеносными сосудами, протоковыми капиллярами и нервными волокнами. Все они располагаются в рыхлой междольковой межуточной ткани. Лимфатические капилляры собираются в лимфатические сосуды, анастомозирующие между собой. При препятствии оттоку панкреатического сока или повышенной секреторной активности железы ее секрет поступает в лимфатическую сеть, являющуюся, таким образом, для поджелудочной железы своеобразным вентилем. Лимфоотток из головки поджелудочной железы происходит в лимфоузлы, расположенные позади и вдоль ее верхнего края, от хвоста железы – в лимфоузлы ворот селезенки, от тела – в верхние панкреатические, аортальные и парааортальные, нижние брыжеечные лимфатические узлы.
Иннервацию поджелудочной железы обеспечивают парасимпатические и симпатические волокна. Основная парасимпатическая иннервация происходит в основном по блуждающим нервам. В симпатической иннервации поджелудочной железы участвуют нижние грудные и два верхних поясничных ганглия симпатического ствола.
Хронический панкреатит
Хронический панкреатит – это прогрессирующее заболевание поджелудочной железы, сопровождающееся воспалительно–дегенеративными процессами в строме и железистой ткани, исходом которых является фиброз или обызвествление железы с нарушением ее функции.Историческая справка.
Основные сведения о физиологии поджелудочной железы были получены И. П. Павловым и его учениками (конец XIX–первая четверть XX в.). В это же время было начато всестороннее изучение проблемы хирургического лечения больных хроническим панкреатитом. Так, в 1891 г. Suld удалил конкременты из вирсунгова протока. Opie впервые (1910 г.) отметил, что при хроническом панкреатите с внутридольковым поражением нарушается секреторная функция поджелудочной железы, а междольковый фиброз сопровождается изменением внутренней секреции. В 1942 г. Mallet–Gue применил левостороннюю спланхникэктомию, а в 1946 г. Clagett вымолим.! тотальную панкреатэктомию. В 1954 г. Duval произвел каудальную, а в 1958 г. Sillesby и Puestow – продольную панкреатоеюностомию. П. Н. Напалков, М. А. Трунин и И. Ф. Крутиков (1966) при хроническом болевом панкреатите использовали маргинальную невротомию.
Распространенность. Хронический панкреатит встречается в 0,01–0,4% случаев, а по данным секции, в 0,2–0,7%. Наиболее часто заболевание диагностируется у лиц в возрасте 40–60 лет, перенесших острые панкреатиты или страдающих патологией желчных путей.
Этиология и патогенез.
Хронический панкреатит, как правило, является следствием острого воспаления поджелудочной железы. Его развитию способствуют хронический алкоголизм, хронические заболевания желчного пузыря и желчных путей (особенно калькулезный холецистит), желудка и кишечника (язвенная болезнь, оддит, стеноз большого дуоденального сосочка), атеросклеротическое поражение сосудов поджелудочной железы, гиперпаратиреоидизм.
Под действием этиологических факторов происходят воспалительно–дегенеративные изменения в поджелудочной железе с реактивным развитием соединительной ткани. Это приводит к склерозу паренхимы, облитерации протоковой системы, фиброзным изменениям в парапанкреатической клетчатке. В итоге поджелудочная железа обызвествляется.
Патологическая анатомия.
Морфологические изменения при хроническом панкреатите в ранней стадии проявляются умеренным увеличением поджелудочной железы, относительно слабым неравномерным уплотнением ее ткани, имеющей на поверхности следы перенесенных острых приступов – отека, некроза и кровоизлияний с образованием кист. В поздних стадиях панкреатита железа неравномерно увеличена, плотной консистенции, покрыта множеством рубцов с псевдокистами, интимно сращена с соседними тканями. Прилегающие вены нередко тромбированы. В конечной стадии хронического панкреатита железа сморщена, уменьшена в объеме. Плотность ее доходит до хрящевой консистенции. Довольно часто наблюдаются очаги обызвествления, которые поражают ткань диффузно или откладываются в виде внутридольковых и внутрипротоковых кальцинатов. Отложение извести внутри протоков вызывает образование кист.
При гистологическом исследовании выявляются как острое воспаление, свойственное острому панкреатиту (отек, некроз), так и хронический процесс с развитием фиброза в дольках или между ними и выраженной клеточной инфильтрацией с отложением извести, гемосидерина.
В начале развития хронического панкреатита больше всего страдает железистая ткань железы, а в дальнейшем поражаются и островки Лангерганса. В конечной стадии железистая ткань полностью замещена соединительной.
Классификация.
До сих пор нет единой классификации хронического панкреатита. По происхождению его подразделяют на первичный (патологический процесс начинается непосредственно в поджелудочной железе) и вторичный (обусловленный заболеванием других органов пищеварения, классический пример – холецистопанкреатит). По патогенезу выделяют триптический и нетриптический хронический панкреатит. В первом случае возникновение панкреатита обусловлено самоперевариванием железы, во втором – ее атрофией и фибротизацией. По клиническому течению панкреатиты делят на хронический рецидивирующий, хронический болевой, хронический безболевой, хронический псевдотуморозный, хронический холецистопанкреатит, хронический псевдокистозный (хронический панкреатит с исходом в кисту), хронический калькулезный (вирсунголигиаз, кальцифицирующий панкреатит). В зависимости от интенсивности клинических проявлений хронический панкреатит протекает в мягкой, средней и тяжелой формах.
Клиническая картина.
Чрезвычайно разнообразна и зависит от формы хронического панкреатита, стадии развития, его давности, степени снижения экзо– и эндокринной функции поджелудочной железы, сопутствующих заболеваний органов пищеварения. Основными признаками хронического панкреатита являются боль, диспептические расстройства, похудание, желтуха и холангит, нарушение внутрисекреторной функции поджелудочной железы, симптомы, обусловленные заболеванием других органов пищеварения. Каждая из форм хронического панкреатита характеризуется различной выраженностью указанных признаков.
Ведущим проявлением хронического рецидивирующего панкреатита является болевой синдром. Приступы болей чаще появляются после употребления обильной жирной пищи, алкоголя. Однако нередко приступы начинаются и без всякой видимой причины. Боль имеет такой же характер, как и при остром панкреатите, продолжается от 1–2 до нескольких суток. По интенсивности боли бывают от слабых до тяжелых с коллапсом и шоком. Изредка боли носят голодный характер и появляются ночью. Боль локализуется преимущественно в эпигастральной области (45–82% случаев), в левом (22–49%) и правом подреберьях (16–29%) и иррадиирует в разные части тела. Локализация и иррадиация боли зависят от расположения патологического процесса в поджелудочной железе, а также от вовлечения в воспалительный процесс других органов пищеварения. Появление болей связано с затруднением оттока панкреатического сока и повышением внутрипротокового давления, воспалительными и рубцовыми изменениями парапанкреатической ткани с находящимися в ней нервными окончаниями.
Диспептические расстройства представлены тошнотой, рвотой, слюнотечением, снижением аппетита, метеоризмом, неустойчивым стулом. Тошнота может быть постоянной или возникает только после еды. Постоянная тошнота у некоторых больных приводит к отказу от приема пищи или значительному сокращению ее объема. Рвота, как правило, не облегчает боль. Снижение аппетита носит волнообразный характер. В фазе ремиссии аппетит улучшается, а в некоторых случаях повышается, что часто становится причиной очередного обострения. Метеоризм постоянный, мучительный. Его появление связано со снижением экзокринной функции поджелудочной железы и изменением процесса пищеварения в кишечнике в результате нарушения моторики и дисбактериоза. При выраженной экзокринной недостаточности поджелудочной железы возникает типичный панкреатический стул – обильный, пенистый, блестящий, серого цвета с гнилостным запахом. Стул бывает 1–4 раза в день, нередко сразу после еды.
Похудание больных хроническим панкреатитом обусловлено снижением аппетита или непереносимостью ряда блюд, отказом от пищи или ее значительным ограничением из–за страха перед болевым синдромом, нарушением всасывания в кишечнике. Похудание относится к обратимым процессам. В фазе ремиссии заболевания пациенты прибавляют в весе.
Желтуха может быть механической и паренхиматозной. Механическая желтуха появляется в период обострения болезни. Нередко она сопровождается холангитом, что проявляется повышением температуры тела, лейкоцитозом, увеличением СОЭ. При сдавлении холедоха железой желтуха исчезает по мере уменьшения отека. Паренхиматозная желтуха нередко возникает без усиления предшествующего болевого синдрома.
Расстройство внутрисекреторной функции поджелудочной железы у большинства пациентов проявлется нарушением толерантности к глюкозе и реже выраженным сахарным диабетом или гипогликемией. Боль при хроническом болевом панкреатите сильная, постоянная с преимущественной локализацией слева от пупка. Иногда отмечается ее атипичная локализация: в правом подреберье, нижней части живота, в других областях. Боль иррадиирует в поясницу, сердечную область, левое плечо, может быть опоясывающей. Болевой синдром усиливается после употребления жирной пищи, а также при длительном лежании на спине. С развитием склероза и выпадением функции железы появляются вздутие живота, метеоризм, поносы, чередующиеся с запорами, развивается диабет.
В клинической картине безболевой формы хронического панкреатита преобладают признаки расстройства внешне–, а затем и внутрисекреторной функции поджелудочной железы. Длительное время боль появляется в виде характерных приступов острого панкреатита или отсутствует, или ее вообще не бывает. Большинство пациентов указывают на неопределенные болезненные ощущения, главным образом в левом подреберье, обостряющиеся при употреблении обильной жирной пищи. Отмечаются прогрессирующее похудание, вздутие живота, запоры, сменяющиеся поносами, обильным зловонным стулом. Развивается авитаминоз, что проявляется глосситом, стоматитом, конъюнктивитом. В более тяжелых случаях появляются гипогликемия и диабетический синдром, тетания и желтуха.
При хроническом холецистопанкреатите превалируют постоянные тупые боли в эпигастрии, обоих подреберьях, часто опоясывающего характера. Боли усиливаются после нарушения диеты. Постепенно возникают признаки снижения экскреторной функции поджелудочной железы (обильный стул, стеаторея, креаторея, похудание).
Псевдотуморозная и псевдокистозная формы хронического панкреатита сопровождаются появлением тупой, глубоко расположенной боли, иррадиирующей в спину, фудную клетку, усиливающейся после употребления обильной жирной пищи. Как правило, имеются диспептические расстройства вследствие недостаточной экскреторной функции поджелудочной железы. В результате сдавления желчных путей в области головки железы нередко развивается механическая желтуха.
В клинической картине калькулезного панкреатита преобладает выраженный болевой синдром. Внешне– и внутрисекреторная функции поджелудочной железы практически не нарушаются.
Течение хронического панкреатита сопровождается изменениями в соседних органах: жировой дистрофией и циррозом печени, язвообразованием в двенадцатиперстной кишке и ее стенозом, сужением толстой кишки в области селезеночного угла, ретроперитонеальным фиброзом, тромбозом селезеночной вены, жировыми некрозами подкожной клетчатки, костей и суставов. Наиболее серьезными осложнениями хронического панкреатита являются кровотечения из желудочно–кишечного тракта, плеврит, асцит, формирование панкреатических свищей.
Кровотечение из желудочно–кишечного тракта при хроническом панкреатите может быть умеренным, проявляющимся анемией или профузной кровавой рвотой и дегтеобразным стулом. В большинстве наблюдений кровотечение происходит из варикозно расширенных вен пищевода, желудка и кишечника вследствие сдавления воротной и селезеночной вен. Нередко причинами кровотечения являются эрозии и изъязвления слизистой желудочно–кишечного тракта. Обусловленный хроническим панкреатитом плеврит, чаще экссудативный,локализуется в одной или двух плевральных полостях. Плевральная жидкость прозрачная или геморрагическая, содержит большое количество белка, воспалительные элементы и амилазу. Асцит появляется в результате раздражения брюшины панкреатическими ферментами или разрыва псевдокист, сопровождается отеками ног. На фоне асцита нередко возникает перитонит.
Диагностика.
Несмотря на определенные успехи, достигнутые за последние годы в исследовании поджелудочной железы, диагностика хронического панкреатита остается по–прежнему трудной. Это обусловлено многообразием клинических проявлений хронического панкреатита и отсутствием патогномоничных для него признаков. Большие трудности в диагностике панкреатита вызывает частое сочетание поражения поджелудочной железы и других органов желудочно–кишечного тракта. Это происходит вследствие развития хронического панкреатита на фоне заболеваний пищеварительной системы и вовлечения в патологический процесс органов пищеварения при существующем панкреатите. Кроме того, анатомическое расположение поджелудочной железы затрудняет получение обычными методами достоверной информации о ее функции и морфологии.
Процесс постановки диагноза хронического панкреатита условно можно разделить на три этапа. На первом этапе выявляют и анализируют признаки, на основании которых решается вопрос о наличии патологии в поджелудочной железе. Проводится дифференциальная диагностика с патологией желчного пузыря, язвенной болезнью и заболеваниями кишечника. При этом следует учитывать возможность сочетания заболеваний. На втором этапе диагноз хронического панкреатита верифицируется и проводится дифференциальная диагностика с другими заболеваниями поджелудочной железы, в первую очередь со злокачественными новообразованиями. На третьем этапе выясняется этиологический фактор хронического панкреатита.
Диагностика основывается на оценке жалоб больных (болевой синдром, нарушение внешне– и внутрисекреторной функций), данных анамнеза и объективного обследования. Последнее включает пальпацию зоны поджелудочной железы для выявления опухолевидного образования и типичных болевых точек. При хроническом панкреатите находят болезненность в зоне Шоффара–Риве (на линии, соединяющей пупок и подмышечную впадину справа), на 5 см выше пупка в точке Мейо–Робсона – в левом реберно–позвоночном углу, в точке Губергрица, соответствующей зоне Шоффара–Риве, но слева, френикус–симптом слева, атрофию подкожно–жирового слоя в области проекции поджелудочной железы (симптом Гротта), зону гиперестезии в XIII–IX сегментах слева (симптом Кача).
Проводится биохимическое исследование крови: амилаза, трипсин, липаза. Эти же ферменты определяются в моче, дуоденальном содержимом. Обязательны копрологическое исследование с выявлением креатореи (повышенное содержание в кале непереваренных мышечных волокон), стеатореи (наличие в кале неусвоенного жира в виде капелек), амилореи (присутствие в кале большого количества крахмала). Вместе с тем полученные результаты имеют относительную ценность, так как они наблюдаются и при энтеритах, колитах.
Кроме целенаправленного обследования выполняются обычные общеклинические исследования (развернутый анализ крови, мочевина в крови, уровень аминотрансфераз), а при наличии желтухи – весь комплекс исследований для установления ее сущности (паренхиматозная или механическая: билирубин (общий, связанный и свободный), ACT, AJ1T, щелочная фосфатаза и др.). Оценивается общесоматическое состояние больных: центральная и периферическая гемодинамика (ЭКГ, АД, пульс), дыхательная функция. Определяется соответствие массы тела росту больного.
Важную роль в диагностике заболеваний поджелудочной железы играет рентгенологическое исследование.
Рентгенологическими симптомами хронического панкреатита являются: 1. обызвествление в железе, которое выявляется у 7075% больных с далеко зашедшим хроническим панкреатитом. Оно может быть в виде: ■ единичных камней различной величины, расположенных в относительно крупных панкреатических протоках; ■ множественных кальцификатов, локализующихся как в железе, так и в протоках; в) диффузного обызвествления железы; 2. расширение или разворот петли двенадцатиперстной кишки; 3. сдавление двенадцатиперстной кишки увеличенной головкой поджелудочной железы наподобие стеноза; 4. изменения медиального контура двенадцатиперстной кишки и прежде всего медиальной ее стенки – бугристость, дефект заполнения; 5. появление над и под большим дуоденальным сосочком симметричных вдавлений, создающих на внутренней стенке нисходящей части двенадцатиперстной кишки картину, напоминающую перевернутую на 180" цифру 3 (симптом Фростберга); 6. выраженная гипермоторная функция двенадцатиперстной кишки; 7. деформация желудка и двенадцатиперстной кишки, смещение луковицы вверх увеличенной поджелудочной железой; 8. увеличение расстояния между желудком и позвоночником (ретрогастрального пространства), обусловленное увеличенной поджелудочной железой и определяемое при боковом просвечивании (в норме оно равняется 4–6 см); 9. нарушение эвакуации (главным образом замедленное) из желудка и двенадцатиперстной кишки, дуоденальный илеус, наличие уровня жидкости в двенадцатиперстной кишке; 10. сосочковый признак – рентгенологическое определение большого сосочка двенадцатиперстной кишки в результате перехода на него воспалительного отека с поджелудочной железы; 11. явления остеопороза костей, развивающегося в связи с недостаточным всасыванием кальция из кишечника вследствие диареи и неполноценного переваривания жира.
Более информативными являются данные УЗИ и компьютерной томографии. При ультрасонографии у больных с обострением хронического панкреатита выявляются увеличение поджелудочной железы, наличие неровных контуров и уменьшение эхоструктуры окружающей поджелудочную железу клетчатки. Вне обострения поджелудочная железа имеет нормальные, слегка увеличенные или уменьшенные размеры с неровнытетания. Поэтому с улучшением состояния больного и прекращением приступов суточное количество жира снова повышается до 70–80 г в день.
При тяжелой форме внешнесекреторной недостаточности железы наступает недостаточность переваривания белков. Из белковой пищи предпочтение следует отдать молочным продуктам, приготовленным из обезжиренного молока, в частности нежирному свежему творогу. Мясо употребляется только молодое, нежирное. Допускаются нежирная птица и рыба. Рекомендуются свежие фрукты, фрукты в виде компотов, соков, овощные протертые супы, пюре, соки.
Приведенная диета необходима лишь при умеренной недостаточности инсулярного аппарата. При наличии выраженного диабета режим питания устанавливается такой, как для больных диабетом, с учетом расстройства внешней секреции поджелудочной железы.
Для устранения внешнесекреторной недостаточности поджелудочной железы применяют панкреатин (0,5–1 г 3–4 раза в день) и др. Назначают препараты, содержащие активные желчные вещества и ферменты кишечника. Показаны спазмолитики.
При внешнесекреторной недостаточности поджелудочной железы, проявляющейся в той или иной степени диабетом, используют инсулин. Для борьбы с инфекциями применяют антибиотики широкого спектра действия.
Поскольку у больных хроническим панкреатитом нарушается всасывание витаминов в кишечнике, рекомендуется парентеральное введение витаминов А, Е, B1, B6, В12, С и препаратов железа.
Хорошим терапевтическим эффектом обладает местное применение ультразвука и лазеротерапии.
Во время обострения хронического панкреатита больной должен соблюдать такой же режим, как и при остром процессе.
Включение в комплекс медикаментозного лечения больных хроническим панкреатитом вливаний полиглюкина, донорской крови, плазмы с новокаином, антиферментных препаратов существенно повышает эффективность консервативной терапии, которая останавливает течение процесса в поджелудочной железе. Хорошими лечебными свойствами обладают внутрисосудистое лазерное облучение крови и экстракорпоральное подключение ксеноселезенки.
Абсолютными показаниями к хирургическому вмешательству являются: камни протоков, эктазия панкреатического протока, кальциноз ткани железы, сдавление и нарушение проходимости двенадцатиперстной кишки, желтуха, сегментарная портальная гипертензия, холангит, хронический гнойный панкреатит, частые рецидивы заболевания, отсутствие эффекта от проводимой терапии, наличие кист и свищей. Во время операции характер патологического процесса в поджелудочной железе и смежных органах уточняется с помощью интраоперационной холецистохолангиографии, ретроградной панкреатографии путем пункции протока через ткань поджелудочной железы или канюлирования большого дуоденального сосочка.
При хроническом панкреатите выполняют операции на вегетативной нервной системе, поджелудочной железе, желчных путях, желудке и других органах брюшной полости.
Операции на вегетативной нервной системе производят при выраженном болевом синдроме. Они направлены на купирование болевого синдрома и снижение функции поджелудочной железы. К операциям данной группы относятся левосторонняя спланхникэктомия, спланхникэктомия с резекцией левого полулунного узла (операции Малле–Ги), резекция солнечного сплетения, постганглионарная невротомия по Иошиока и Вакабаяши, маргинальная невротомия (операция П. Н. Напалкова, М. А. Трунина, И. Ф. Крутикова), селективная невротомия ветвей чревной артерии, ваготомия и др.
Хирургические вмешательства на поджелудочной железе показаны в случаях расширения и деформации главного панкреатического протока, вирсунголитиаза. Они включают внутреннее дренирование протоковой системы, рассечение и пластику устья главного панкреатического протока, резекцию железы, окклюзию ее протоков.
Для внутреннего дренирования протоков поджелудочной железы используются продольная панкреатоеюстомия (операции Пестов–1, Пестов–2 и др.) и каудальная панкреатоеюностомия (операция Дюваля и др). Сущность продольной панкреатоеюностомии по Пестов–1 заключается в продольном вскрытии от хвоста до головки железы вирсунгова протока, анастомозировании (путем погружения) дистального конца поджелудочной железы с петлей тонкого кишечника, выключенной по Ру (рис. 26). Панкреатоеюностомия по Пестов–2 предполагает формирование соустья между продольно рассеченным вирсунговым протоком и мобилизованной по Ру петлей тонкой кишки (рис. 27).
При каудальной панкреатоеюностомии по Дювалю производится резекция 3–4 см хвоста поджелудочной железы с вшиванием ее культи в конец тощей кишки, веденной в виде у–образного анастомоза по Ру (рис. 28). Разработано множество вариантов панкреатоеюностомий.
 Рис. 26. Схема продольной панкреатоеюностомия по Пестов–1.
Рис. 26. Схема продольной панкреатоеюностомия по Пестов–1.
 Рис. 27. Схема продольной панкреатоеюностомии по Пестов–2.
Рис. 27. Схема продольной панкреатоеюностомии по Пестов–2.
Рассечение и пластика устья главного панкреатического протока (вирсунгопластика) используются для восстановления нарушенного оттока секрета поджелудочной железы при наличии сужения в проксимальном отделе ее протоковой системы. Это достигается трансдуоденальным рассечением перемычки между терминальным участком общего желчного и главного панкреатического протоков или медиальной стенки выходного отдела главного панкреатического протока на протяжении до 15–25 мм. Затем выполняется пластика полученного отверстия.
Объем резекции поджелудочной железы у больных хроническим панкреатитом зависит от распространенности окклюзионно–стенотического процесса. Предложены различные ее варианты: дистальная и каудальная резекция; субтотальная резекция, при которой оставляется только незначительный участок поджелудочной железы; панкреатодуоденальная резекция, тотальная дуоденопанкреатэктомия.
Тотальная окклюзия (пломбировка) протоковой системы поджелудочной железы осуществляется введением в протоки железы препаратов на основе кремнийорганических соединений (силиконов). Это вызывает атрофию без некротических изменений экзокринной паренхимы железы с сохранением эндокринной ее паренхимы, способствуя быстрому купированию болевого синдрома.
Операции на желчных путях у больных хроническим панкреатитом применяются при сопутствующей желчнокаменной болезни, стенозе большого дуоденального сосочка, развитии синдрома механической желтухи. Наиболее широко используются холецистэктомия с дренированием общего желчного протока, билиодигистивные анастомозы, папиллосфинктеротомия и папиллосфинктеропластика.
Из операций на желудке чаще выполняются резекция желудка и гастроэнтеростомия.
 Рис. 28. Схема каудальной панкреатоеюностомии по Дювалю.
Рис. 28. Схема каудальной панкреатоеюностомии по Дювалю.
Осложнения хронического панкреатита
Псевдокисты поджелудочной железы
Псевдокисты поджелудочной железы представляют собой одиночные или множественные полости, содержащие тканевые секвестры, кровь и панкреатический секрет. Они локализуются как внутри железы, так и вне ее, чаще в сальниковой сумке или в ретроперитонеальном пространстве.?По механизму развития псевдокисты подразделяются на дегенерационные и ретенционные. Дегенерационные кисты формируются в результате воспалительно–деструктивного поражения ткани поджелудочной железы. Появление ретенционных кист обусловлено окклюзией панкреатического протока с последующим расширением его дистальной части. По строению стенки псевдокисты могут быть ложными (стенка образована грануляционной тканью) и истинными (стенка содержит эпителиальную выстилку на внутренней ее поверхности). Ложные кисты часто многокамерные. В отличие от истинных кист они имеют шейку, которой соединяются с протоком железы. По клиническому признаку псевдокисты поджелудочной железы подразделяются на острые (существуют 2–3 мес. и представляют собой несформированные кисты), подострые (существуют 3–6 мес.) и хронические (существуют более 6 мес., характеризуются наличием сформированной стенки).
Постепенно увеличиваясь, псевдокисты смещают рядом расположенные органы брюшной полости, вызывая в тяжелых случаях их сдавление. Кисты небольших размеров длительное время не сопровождаются клинической симптоматикой, В типичных случаях наблюдающиеся при псевдокистах симптомы подразделяются на местные, диспептические и общие. Большинство пациентов отмечают боль ноющего характера в эпигастрии, левом подреберье, нередко иррадиирующую в спину. Интенсивность боли усиливается при давлении кисты на солнечное и чревное сплетения. Отмечается тошнота, рвота, неустойчивый стул, похудание, слабость, снижение работоспособности. Во время объективного осмотра пациентов с большими кистами в верхней половине живота пальпируется гладкостенная, эластичная опухоль с четкими контурами. Диагноз подтверждается данными УЗИ, компьютерной томографии, эндоскопической ретроградной панкреатохолангиографии, рентгеноконтрастного исследования желудка.
Течение псевдокист осложняется инфицированием и нагноением, перфорацией в брюшную или плевральную полость, полые органы живота, в том числе с кровотечением, желтухой, кишечной непроходимостью. При кистах поджелудочной железы проводится хирургическое лечение. Наиболее часто выполняются наружное и внутреннее дренирование кист, неполное и полное их удаление.?
Наружное дренирование применяется при острых и подострых псевдокистах, нагноении кисты, разрыве кисты, осложнившемся перитонитом, а также если невозможно выполнить более радикальную операцию. В полость кисты вводятся двухпросветные дренажи при лапаротомии или лапароскопии. Реже стенка кисты подшивается к париетальней брюшине и коже (марсупиализация кисты).
Внутреннее дренирование кист используется в лечении больных со сформированными псевдокистами. Применяются различные варианты операций: цистоэнтероанастомоз, цистогастроанастомоз, цистодуоденоанастомоз (рис. 29). В случае сочетания интрапанкреатических псевдокист с вирсунголитиазом производится продольная панкреатоеюностомия.
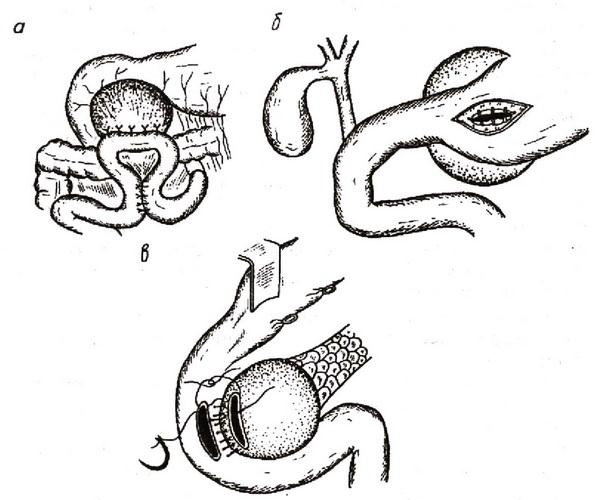 Рис. 29. Варианты панкреатоцистоэнтеростомий: а – впередиободочный цистоэнтероанастомоз с межкишечным анастомозом по Брауну; б – цистогастростомия с задней стенкой желудка (операция Юраша); в – цкстодуоденостомия.
Рис. 29. Варианты панкреатоцистоэнтеростомий: а – впередиободочный цистоэнтероанастомоз с межкишечным анастомозом по Брауну; б – цистогастростомия с задней стенкой желудка (операция Юраша); в – цкстодуоденостомия.
Полное удаление кист достигается резекцией пораженного участка поджелудочной железы или экстирпацией (цистэктомия, энуклеация) кисты. Эти операции применяются при истинных кистах, расположенных в дистальном отделе железы.
Положительные результаты хирургического лечения больных с кистами поджелудочной железы отмечаются в 85–95% случаев.
Свищи поджелудочной железы
Свищи поджелудочной железы, возникшие при хроническом панкреатите, подразделяются: 1. по характеру проявлений – наружные и внутренние. Устье наружного свищевого хода расположено на коже. Внутренний свищ открывается в полые органы живота или в плевральную полость; 2. по локализации – исходящие из головки, тела или хвоста; 3. по срокам функционирования – первичные и рецидивные (несформированные, существующие до 3 мес., и сформированные); 4. по характеру течения – неосложненные и осложненные; 5. по сообщению с внешней средой – полные, при которых весь секрет поджелудочной железы выделяется наружу, и неполные.Наружные свищи сопровождаются выделением через наружное отверстие свищевого хода секрета поджелудочной железы. У больных хроническим панкреатитом с полными свищами количество секрета может достигать 1,5 л, а при неполных свищах – всего лишь несколько миллилитров. Длительная потеря панкреатического сока сопровождается расстройством пищеварения, что находит свое отражение в нарушении всех видов обмена веществ, дефиците воды и электролитов. Больные постепенно истощаются. Течение внутренних свищей более благоприятное и не приводит к каким–либо существенным нарушениям в состоянии организма.
Для диагностики панкреатических свищей проводятся лабораторное исследование отделяемого из свищевого хода и фистулография.
Несформированные, а также неполные свищи поджелудочной железы хорошо поддаются консервативному лечению. Оно включает диетотерапию (пища содержит повышенное количество белков и мало углеводов), ферменты поджелудочной железы, спазмолитики, противовоспалительные и антиферментные препараты, блокаторы Н2–рецепторов гистамина. Несколько раз в сутки проводится активная санация свищевого хода и окружающей его кожи с последующим введением склерозирующих препаратов.
Хирургическое лечение показано в случаях, если безуспешны консервативные мероприятия у больных со свищами, сопровождающимися ежесуточной потерей около 200–500 мл панкреатического сока на протяжении 4–6 недель, а также при рецидивных свищах, самостоятельное закрытие которых вызывает появление боли. Применяются выскабливание полости свища, анастомозирование свища с полым органом брюшной полости (наложение вне– или внутрибрюшинного анастомоза свища с желудком или тощей кишкой), иссечение свища с последующим формированием панкреатоеюностомы, резекция поджелудочной железы со свищом. При панкреатических свищах, исходящих из дистального отдела поджелудочной железы, может быть выполнена окклюзия свищевого хода полимерными материалами.
Глава 3. Органы грудной клетки и диафрагмы.
Хирургия перикарда и сердца
Анатомо–физиологические сведения
Сердце расположено в передненижнем отделе средостения. Внешне оно имеет вид пирамиды, вершиной направленной вниз. Длинная ось сердца ориентирована вниз, справа налево, спереди назад. В сердце различают основание, верхушку, три поверхности, два края, две циркулярные борозды. Основание сердца образовано предсердиями и приносящими и уносящими от них кровь крупными магистральными сосудами. За счет соединения с магистральными сосудами переходных складок перикарда, расположенных в области основания, сердце надежно фиксировано в своем обычном положении.Верхушка сердца, оба желудочка, восходящий отдел аорты, легочной ствол, ушки правого и левого предсердий расположены интраперикардиально, а полые вены и оба предсердия – мезоперикардиально. Легочные вены и обе легочные артерии покрыты перикардом только в области задней стенки (экстраперикардиально).
Сердце состоит из четырех камер: двух предсердий и двух желудочков. В правое предсердие сзади и сверху впадает верхняя полая вена, а снизу – нижняя. В средней части медиальной стенки правого предсердия (межпредсердной перегородки) находится овальная ямка, имеюшая выраженный край. У 25% людей в овальной ямке определяется отверстие – овальное окно (foramen ovale). Ниже овальной ямки на межпредсердной перегородке располагается устье коронарного синуса. Посредством трехстворчатого клапана правое предсердие сообщается с правым желудочком.
Важнейшим образованием правого желудочка является наджелудочковый гребень, который отделяет трехстворчатый клапан от клапана легочного ствола. Из выходного отдела правого желудочка кровь поступает в легочной ствол, имеющий полулунный клапан.
В левом предсердии выделяют два отдела: задний с устьями легочных вен и боковой (латеральный), образованный левым ушком. Четкой границы между ними нет. Не имеет четкого края и расположенное на медиальной стенке овальное углубление. В области дна камеры левого предсердия располагается митральный клапан, через который кровь поступает в левый желудочек. В отличие от правого в левом желудочке входной (митральный) и выходной (аортальный) клапаны находятся рядом и не разделяются наджелудочковым гребнем.
Сокращение сердечной мышцы обеспечивается проводящей системой сердца. Она образована синусно–предсердным и предсердно–желудочковым узлами, прободающим предсердно–желудочковым пучком и его ножками (правой и левой).
Синусно–предсердный узел (узел Киса–Флека) расположен под эпикардом пограничной борозды на латеральной поверхности области впадения верхней полой вены в правое предсердие. Он представляет собой скопление содержащих большое количество саркоплазмы многоядерных эмбриональных волокон, находящихся в грубоволокнистой соединительнотканной сетке.
Предсердно–желудочковый узел (атриовентрикулярный узел Ашоффа–Тавара) расположен под эндокардом нижнепереднего отдела правого предсердия. В большинстве наблюдений узел находится у правой поверхности центрального фиброзного тела (в зоне соединения между собой колец аортального клапана – спереди, митрального – слева, трехстворчатого – справа). По сравнению с синусовым узлом в его структуре содержится меньше соединительнотканных и эластических элементов.
Продолжением предсердно–желудочкового узла является прободающий предсердно–желудочковый пучок (пучок Гиса), образованный проводящими импульсы волокнами. Через мембранозную часть межжелудочковой перегородки предсердно–желудочковый пучок проходит на левую сторону перегородки и делится на правую и левую ножки. Область деления пучка Гиса находится ниже комиссуры, между правой и задней полулунными заслонками клапана аорты. Правая ножка на правой стороне перегородки разветвляется на переднюю, среднюю и заднюю ветви. В результате деления левой ножки по левой стороне перегородки формируется густая сеть волокон Пуркинье.
Коронарное (венечное) кровообращение сердца осуществляется правой и левой венечными артериями, отходящими от аорты в области синусов Вальсальвы.
Венозная система сердца представлена венами, дренирующимися в венечный синус, и венами, впадающими в правое предсердие и правый желудочек.
В стенке сердца различают три оболочки: внутреннюю – эндокард, среднюю (мышечную) – миокард и наружную (серозную) – эпикард, Эндокард имеет неодинаковую в различных отделах сердца толщину. Миокард образован связанными между собой поперечнополосатыми мышечными клетками. Эпикард представляет собой тонкий (не более 3–4 мм) висцеральный листок перикарда (околосердечной сумки, сердечной сорочки).
Наружный листок перикарда выстилает ложе сердца и обозначается как собственно перикард. Узкая щель между обращенными друг к другу серозными поверхностями внутреннего и наружного листков называется полостью перикарда. Она содержит несколько миллилитров прозрачной жидкости, выполняющей роль смазки, и сохраняет отрицательное давление. В местах перехода внутреннего листка в наружный образуются два заворота (карманы, синусы) перикарда: поперечный и косой. Поперечный заворот находится между восходящей частью аорты и легочным стволом спереди и левым предсердием, легочными венами снизу и сзади. Он имеет правое и левое отверстия. Косой заворот представляет собой мешок, расположенный под сердцем. При накоплении жидкости в полости перикарда завороты значительно растягиваются.
Наружный листок околосердечной сумки имеет толщину 1 – 1,5 мм и характеризуется значительной плотностью, выдерживая давление до 2 атм. Его стенка состоит из 3 слоев: внутреннего серозного (мезотелия), фиброзного и рыхлой соединительной ткани, являющейся прослойкой между сердечной сорочкой и рядом лежащими органами.
Эпикард образован тонкой (0,3–0,4 мм) пластинкой соединительной ткани. Свободная поверхность ее покрыта мезотелием. В серозных оболочках перикарда имеется большое количество межклеточных щелей с хорошо развитой сетью лимфатических сосудов. Они играют ведущую роль в пропотевании и всасывании жидкости в полости перикарда. В наружном и внутреннем листках сердечной сорочки располагаются сплетения кровеносных сосудов. В сосудистые сплетения эпикарда кровь поступает из системы коронарных артерий. Приток крови в наружную оболочку осуществляется более чем по 11 артериям.
Оба листка сердечной сорочки содержат большое количество нервных окончаний, преимущественно чувствительного типа.
Работа сердца обеспечивает циркуляцию крови в организме человека. Это происходит ритмично, согласно фазам сердечного цикла, подразделяющегося на систолу и диастолу желудочков, в конце которых наступает систола предсердий. Обычно давление в левом желудочке и в аорте составляет около 120 мм рт. ст., а в правом желудочке и в легочной артерии – около 25 мм рт. ст. Разницы в давлениях между правым желудочком и легочной артерией, левым желудочком и аортой нет.
Перикардиты
Перикардиты представляют собой воспаление листков околосердечной сумки.Историческая справка.
В 1726 г. Aibertini описал перикардит как самостоятельное заболевание. С середины 20–х годов XIX ст. для лечения перикардитов стала применяться пункция полости перикарда. Delorm (1S98) произвел первую операцию освобождения сердца от измененного перикарда – перикардэктомию.
Распространенность.
Перикардиты, по данным аутопсий, встречаются в 3–4% случаев. Среди перикардитов инфекционного происхождения 50–70% составляют ревматические, туберкулезные и бактериальные. Острый неспецифический перикардит наблюдается в 12–67% всех перикардитов, туберкулезные в 1–3%.
Классификация.
Перикардиты подразделяются: 1. По характеру клинического течения: ■ острые ■ хронические, 2. По механизму возникновения: ■ первичные ■ вторичные, являющиеся осложнением патологических процессов в других органах. 3. По этиологии: ■ инфекционные: • бактериальные (неспецифические, кокковые и другие и специфические – брюшно–тифозные, холерные, сифилитические) • туберкулезные • ревматические • вирусные • грибковые • идиопатические; ■ асептические: • аллергические • аутоиммунные • при коллагенозах • заболеваниях крови • злокачественных опухолях • уремии • постинфарктные. 4 По характеру экссудата: ■ острые: • сухие (фибринозные) • выпотные (экссудативные – серозные, геморрагические, гнойные, гнилостные); ■ хронические: • выпотные • экссудативно–адгезивные • адгезивные.
Острые перикардиты
Этиология.
Острые перикардиты наиболее часто возникают в результате инфекционного поражения, осложнения течения ревматизма, туберкулеза, сепсиса, ранения сердца, операции на органах грудной клетки и т.д.
Патогенез.
Прогрессирующее увеличение в полости перикарда жидкости приводит к повышению внутри перикардиального давления, которое становится положительным. Сильно растянутый перикардиальный мешок сдавливает сердце и подходящие к нему сосуды – нижнюю и верхнюю полые вены. Одновременно затрудняется отток крови по печеночным венам. Постепенно уменьшается диастолический объем желудочков, что сопровождается снижением насосной функции сердца, повышением венозного давления. При дальнейшем увеличении количества жидкости в перикарде расстройство гемодинамики становится несовместимым с жизнью (тампонада сердца).
Патологическая анатомия.
Острый фибринозный сухой перикардит сопровождается ограниченным или диффузным отложением фибрина на листках перикарда. У лиц с распространенным перикардитом воспаление начинается с висцерального листка у устьев сосудов или перегиба сердечной сорочки. В результате процессов альтерации, экссудации, пролиферации в большей степени на внутреннем листке перикарда накапливается фибрин. Толщина его слоя иногда достигает 1–2 см. Нити фибрина протягиваются и между листками перикарда. Это придает сердцу своеобразный вид "волосатого сердца".
При выпотном перикардите в полости сердечной сорочки образуется воспалительный экссудат различного характера. Интенсивность его накопления зависит от степени воспалительного поражения листков перикарда, сопровождающегося резким снижением их всасывающей способности. Исходом острого экссудативного перикардита является частичная или полная организация выпота с формированием перикардиальных сращений.
Клиническая картина.
Острые перикардиты, как правило, начинаются с общего недомогания, повышения температуры тела, слабости, потливости. Гнойный и гнилостный перикардиты сопровождаются симптомами выраженной интоксикации, с гектической температурой и проливным потом. Редко заболевание, особенно сухой перикардит, протекает скрыто. Для сухого и начала выпотного острого перикардита типична боль в области сердца. Она носит тупой, давящий характер, но иногда бывает очень сильной. Болевой синдром усиливается при дыхании, движении, перемене положения тела, давлении на грудную клетку в области проекции сердца. Часто больных с острым перикардитом беспокоят кашель, одышка, затруднение глубокого вдоха. Иногда отмечается нарушение сердечного ритма – брадикардия, сменяющаяся тахикардией и экстрасистолией. Снижается АД. Интенсивность указанных признаков по мере накопления жидкости в перикарде уменьшается, что связано с ослаблением трения листков перикарда. При сдавлении увеличенной сердечной сорочкой пищевода, возвратных и диафрагмальных нервов наблюдаются затрудненное глотание, охриплость голоса, икота. Вследствие рефлекторного раздражения диафрагмального и блуждающих нервов возникают боли в животе. Давление перикардиального выпота на трахею сопровождается Появлением упорного "лающего" сухого кашля. Он усиливается при глубоком вдохе, надавливании на область надчревья. Одышка при выпотных перикардитах нарастает.
Наиболее благоприятное течение сухого перикардита. Выпотные формы воспаления сердечной сорочки осложняются тампонадой сердца. Для нее характерны снижение АД, нарастание тахикардии, появление выраженного цианоза, набухание шейных вен, увеличение печени, отек легких.
Все формы острого перикардита могут переходить в хроническую.
Диагностика.
При фибринозном перикардите и в начальных стадиях острого перикардита внешний вид больных не изменяется. Увеличение внутриперикардиального давления приводит к повышению венозного давления до 200–300 мм вод.ст. Набухают периферические вены. Их наполнение при вдохе не уменьшается. Появляется вначале локальный (губ, носа и ушей), а затем распространенный цианоз тела. Увеличивается и становится болезненной печень, особенно ее левая доля. Нарастают асцит, отеки на ногах и пояснице, лице и конечностях. Эти симптомы возникают или усиливаются после длительного лежания на спине, во время которого происходит сдавление полых вен. Иногда значительное накопление жидкости в перикарде сопровождается выпячиванием грудной клетки в области сердца и эпигастрия (следствие оттеснения книзу диафрагмы). Межреберные промежутки в проекции сердца сглаживаются, ткани грудной стенки отекают. Левая половина грудной клетки отстает при дыхании. Верхняя часть живота не участвует в дыхании (симптом Винтера). Пациенты с большим количеством жидкости в перикарде принимают характерное положение в постели: сидят с наклоненным вперед туловищем, опираясь лбом на подушку (симптом Бреймана). Верхушечный толчок при экссудативном перикардите определяется выше своего обычного положения: в четвертом межреберье по среднеключичной линии.
При выпотном перикардите границы сердечной тупости расширяются во все стороны, вправо до среднеключичной линии, образуя тупой угол перехода к печеночной тупости вместо близкого к прямому угла у здоровых (симптом Эбштейна), Внизу граница сердечной тупости занимает пространство Траубе. Перемена положения тела приводит к смещению верхушечного толчка и границ притупления. Изменяется соотношение между зоной абсолютной и относительной тупости. Полоса относительной тупости сокращается, а абсолютной увеличивается (симптом Эдиефсена).
У больных со скоплением значительного количества жидкости в перикарде вследствие коллабирования легкого отмечается притупление перкуторного звука ниже угла левой лопатки с усилением в этой области голосового дрожания и бронхофонии, ослаблением дыхания. Оно приобретает бронхиальный оттенок (синдром Эварта–Оппольцера). При наклоне вперед тупость исчезает, а ниже угла лопатки прослушиваются многочисленные крепитирующие глухие мелкопузырчатые хрипы (признак Пена). Наиболее характерным аускультативным признаком сухого перикардита являются шум трения перикарда, изменяющийся во времени и синхронный с сердечными сокращениями. Он плохо проводится, выслушивается над всей зоной абсолютной тупости сердца или локализуется только на небольшом ее участке. У больных с экссудативным перикардитом по мере увеличения количества жидкости в полости перикарда сердечные тоны ослабевают, становятся глухими. Интенсивность шума трения перикарда снижается. Он может улавливаться только на вдохе и при запрокидывании головы (симптом Герке), т.е. тогда, когда листки перикарда вновь соприкасаются.
Начальные изменения на ЭКГ при сухом и выпотном перикардитах однотипны: интервал ST приподнят во всех стандартных отведениях (наиболее выражен во II). После возвращения интервала ST (через 3–20 дней) к изоэлектрической линии зубец Т становится отрицательным. По мере накопления экссудата вольтаж зубцов снижается. Происходящие изменения на ЭКГ свидетельствуют об уменьшении диастолического расслабления сердца и нарушении питания миокарда.
На фонокардиограмме регистрируется шум трения перикарда с преобладанием высокочастотных компонентов.
При рентгенологическом исследовании в случае скопления в перикарде более 200–300 мл жидкости отмечается увеличение размеров тени сердца, которое приобретает треугольную или шаровидную форму. Сглаживаются контуры тени, ослабевает их пульсация вплоть до полного исчезновения. Пульсация аорты, наоборот, остается четкой. Для гангренозного перикардита характерно наличие в верхних отделах перикардиальной полости тонкой светлой полосы образовавшегося газа.
Эхокардиография позволяет диагностировать выпотной перикардит при накоплении в полости сердечной сорочки 50–100 мл жидкости по возникновению эхонегативного пространства между задней стенкой левого желудочка и оттесненным кзади листком перикарда (рис. 30). В случае большого количества выпота слой жидкости флотируется кпереди от передней стенки правого желудочка (феномен плавающего сердца).
Высокоэффективным диагностическим и одновременно лечебным мероприятием является пункция перикарда (см. ниже). Жидкость, извлеченная из полости сердечной сорочки, при серозно–фибринозном перикардите лимонно–желтого цвета, с относительной плотностью экссудата 1,018–1,022, содержанием белка 3 г/л, положительной реакции Ривальта. Во время микроскопии выпота находят крупные клетки мезотелия, лейкоциты, а при геморрагическом экссудате и эритроциты. У пациентов с гнойным и гнилостным перикардитом экссудат мутный, густой. Относительная плотность экссудата 1,040–1,050. Он содержит много гнойных клеток и детрит. У больных с гангренозным перикардитом при пункции получают зеленоватый зловонный гной.
Дифференциальная диагностика.
Проводится с инфарктом миокарда, тромбоэмболией легочной артерии, сухим плевритом.
Для инфаркта миокарда характерно наличие интенсивных болей в загрудинной области, иррадиирующих в левую руку, лопатку, плечо. Болевой синдром отличается волнообразным течением. Кратковременное повышение АД сменяется его снижением. Температура тела субфебрильная, появляется со 2–3–го дня заболевания и удерживается на протяжении 1–1,5 недели. Шум трения перикарда возникает только со вторых суток после начала инфаркта миокарда. В эти же сроки в крови повышается активность ферментов КФК, ACT, ЛДГ и ее изофермента ЛДГЛ Электрокардиографический контроль в динамике позволяет окончательно поставить диагноз инфаркта миокарда и уточнить его локализацию.
Тромбоэмболия легочной артерии, особенно крупной ветви, сопровождается кровохарканием, острой левожелудочковой недостаточностью с развитием у некоторых пациентов отека легких. В результате окклюзии ветвей легочной артерии возникает инфаркт легкого, часто осложняющийся инфаркт–пневмонией. На ЭКГ регистрируются признаки острого легочного сердца с перегрузкой правых отделов. Рентгенологически определяется треугольная тень в легком, обращенная основанием к плевре.
Для сухого (фибринозного) плеврита характерны субфебрильная температура тела, ознобы, ночное потение. При неизмененном перкуторном звуке выслушиваются ослабленное дыхание, различный по тембру и продолжительности шум трения плевры. Отмечаются гиперчувствительность при пальпация большой грудной и трапециевидной мышц (симптом Штенберга), боль при сдавлении грудной клетки с боков (симптом Яновского), боль при наклоне туловища в здоровую сторону (симптом Шепельмана).
Лечение.
Определяется этиологией и клиникоанатомической формой заболевания. Назначается комплексное медикаментозное лечение, которое при выпотных перикардитах сочетается с пункцией перикарда или дренированием полости сердечной сорочки по Сельдингеру.
Консервативное лечение включает применение антибиотиков (синтетические и полусинтетические), химиотерапевтических препаратов (сульфаниламиды и производные нитрофуранов), иммуномоделирующую, десенсибилизирующую, общеукрепляющую, дезинтоксикационную и симптоматическую терапию. Все формы перикардитов подлежат неспецифическому противовоспалительному лечению кортикостероидными препаратами и салицилатами. Это позволяет купировать экссудативные и пролиферативные компоненты воспаления. Эффективно введение глюкокортикоидов внутриперикардиально при пункции сердечной сорочки.
У больных с перикардитами однократные или повторные пункции перикарда выполняются: 1. для уточнения этиологии заболевания и постановки окончательного диагноза; 2. в целях аспирации экссудата, промывания полости перикарда антисептиками, внутриперикардиалъного введения лекарственных веществ, налаживания постоянного наружного дренирования перикарда; 3. при нарастающих явлениях тампонады сердца, т.е. по жизненным показаниям.
Пункция сердечной сорочки производится в операционной или перевязочной в стерильных условиях под местной анестезией. Положение больного чаще сидячее. Используют длинную иглу или тонкий троакар.
Разработано несколько способов прокола перикарда: 1. книзу от мечевидного отростка (способ Марфана) или в углу между хрящом VII ребра и мечевидным отростком слева от него (способ Ларрея, применяется наиболее часто). Иглу вводят на глубину 1,5 см, затем ее конец направляют круто вверх параллельно грудине и проводят на глубину 2–3 см. При прохождении наружного листка перикарда ощущается легкое препятствие. Положение иглы оценивается по следующим признакам: игла, находящаяся в полости перикарда, не колеблется; игле, конец которой находится в сердечной мышце, передаются толчки при каждом сокращении сердца. Для профилактики ранения сердца пункция перикарда осуществляется под контролем ЭКГ или УЗИ; 2. непосредственно вблизи грудины слева (в IV межреберье – по Пирогову, в V или VI – по Делорму–Миньону, в VI – по Войнич–Сяноженцкому); 3. на 2–3 см кнутри от левой границы абсолютной тупости в V или VI межреберье (методКуршманна); 4. трансгрудинный (после трепанации грудины): на 2–3 см вверх от мечевидного отростка (способ Риолана–Лаэннека–Дезо); 5. справа у грудины в IV или V межреберье (по Шапошникову).
При необходимости, что чаще наблюдается у больных с гнойным перикардитом, пункцией перикарда по Сельдингеру в полость сердечной сорочки проводится дренаж для повторных промываний и введения лекарственных веществ. Катетер оставляется в полости перикарда до 72 ч.
Если пункции у больных с выпотным перикардитом безуспешны, это является показанием к перикардэктомии. Объем операций заключается в резекции VII реберного хряща (или торакотомии), широком рассечении париетального листка перикарда, аспирации выпота, промывании и дренировании полости перикарда.
Хронические перикардиты
Хронический выпотной (экссудативный) перикардит.
Этиология.
Хронический выпотной перикардит чаще всего является II фазой развития острого перикардита, если его лечение не дало эффекта. У некоторых больных, особенно страдающих ревматизмом и туберкулезом, заболевание с самого начала имеет хроническое течение, развивается постепенно.
Патогенез.
У больных с хроническим экссудативным перикардитом в околосердечной сумке прогрессивно накапливается экссудат. Из–за потери листками перикарда эластических свойств полость после пункции не спадается, а вновь заполняется жидкостью. Это приводит к длительному механическому сдавлению сердца, повышению внутриперикардиального давления, уменьшению диастолического объема сердца. Постепенно прогрессирует венозный застой, прежде всего в большом круге кровообращения.
Патологическая анатомия.
Для хронического выпотного перикардита характерно утолщение прежде всего париетального листка перикарда. Он подвергается соединительнотканному перерождению, иногда частичному обызвествлению, становится ригидным, спаивается с окружающими тканями. Уплотнению подвергается и эпикард. В ряде случаев рубцовая оболочка, окружающая сердце, формируется за счет организации покрывающего его фибринного слоя. При хронических экссудативных перикардитах туберкулезной этиологии определяются типичные бугорковые высыпания, казеозные очаги, участки обызвествления перикарда.
Клиническая картина.
Заболевание может начинаться постепенно, на фоне кажущегося благополучия, или возникать по типу острого перикардита. Однако экссудат не рассасывается. У одних больных он длительное время сохраняется в одном и том же объеме, у других количество жидкости в околосердечной сумке прогрессивно увеличивается.
Пациентов беспокоят одышка, колющая боль в области сердца, приступы сердцебиения. В случае скопления в полости перикарда большого количества экссудата появляются признаки тампонады сердца. Заболевание протекает волнообразно. Периоды ухудшения самочувствия сменяются периодами относительного благополучия. Исходом хронического выпотного перикардита является прогрессирование сердечной недостаточности.
Диагностика.
У больных наблюдаются небольшой цианоз, умеренный отек лица, шеи, верхних конечностей, увеличение печени, асцит. Их выраженность, как и при остром выпотном перикардите, нарастает в лежачем положении больных (следствие сдавления полых вен).
При пальпации определяется ослабление верхушечного толчка вплоть до полного исчезновения. Перкуторно находят значительное расширение сердечной тупости. При аускультации тоны сердца глухие.
Пульс, как правило, учащен. Системное АД снижено, венозное повышено.
Электрокардиографически определяют снижение вольтажа основных зубцов, что является характерным признаком нарушения метаболизма в миокарде.
При рентгенологическом исследовании отмечаются значительное расширение контуров сердца, резкая очерченность линии контуров перикардиальной тени, участки обызвествления в наружном листке перикарда, снижение амплитуды сердечных сокращений.
Эхокардиографическая картина характеризуется наличием жидкости в околосердечной сумке, четкостью контуров наружного листка перикарда и ограничением его подвижности.
Дифференциальная диагностика.
Проводится с гидроперикардом (водянкой сердечной сорочки), микседемой, хилоперикардом.
Гидроперикард возникает под воздействием общих и местных причин. Из общих причин к гидроперикарду приводят заболевания, нарушающие осмотические свойства крови и проницаемость сосудистых мембран: болезни почек, сердечная недостаточность, кахексия. При указанных заболеваниях гидроперикард сопровождается скоплением жидкости в других серозных полостях. К местным причинам возникновения гидроперикарда относятся расстройства циркуляции в средостении, к чему чаще всего приводят опухоли средостения. Гидроперикард может возникать и вследствие резкой атрофии сердца. Клинически заболевание протекает бессимптомно. Жидкость при гидроперикарде прозрачна, бесцветна, имеет относительную плотность меньше 1,018, содержит меньше 3 г/л белка, дает отрицательную реакцию Ривальта, бедна форменными элементами крови.
Выпот в перикарде образуется и при тяжелых формах микседемы. Он отличается лимонно–желтым цветом, слизистым характером, высокой относительной плотностью, отрицательной реакцией Ривальта, но содержит 2–6 г/л белка. Часто гидроперикард при микседеме сочетается со скоплением транссудата в других серозных полостях. Лечение тиреоидными гормонами приводит к его полному рассасыванию.
Хилоперикард образуется вследствие формирования сообщения между полостью перикарда и грудным лимфатическим протоком. Это наблюдается при злокачественных опухолях, травмах средостения. В постановке правильного диагноза помогает анализ содержимого перикарда – серозной жидкости.
Лечение.
Больные с хроническим выпотным перикардитом подлежат хирургическому лечению. Выполняются два вида операций: ограниченная резекция перикарда с образованием окна над левым желудочком и широкое иссечение измененного париетального листка перикарда.
Сдавливающий перикардит.
Хронический сдавливающий (констриктивный, слипчивый) перикардит – это заболевание, сопровождающиеся нарушением сердечной деятельности в результате рубцового изменения перикарда.Этиология.
Констриктивный перикардит является чаще всего следствием ревматизма, туберкулеза, острого фибринозного выпотного перикардита, инфаркта миокарда. Он может возникнуть после закрытых и открытых травм сердца, заболеваний крови, сопровождающихся гемоперикардом.
Патологическая анатомия.
При сдавливающем перикардите происходит фиброзное изменение наружного и внутреннего листков перикарда. Стенки околосердечной сумки теряют свои эластические свойства, утолщаются, обызвествляются, срастаются между собой. Это приводит к облитерации ее полости. В ряде случаев в полости перикарда образуется третья оболочка. Она представляет собой оставшийся после рассасывания перикардиального экссудата и подвергнувшийся организации и обызвествлению фибрин, сухой детрит. В результате происходящих процессов в окружности сердца формируется соединительнотканный панцирь толщиной 1,5–2 см, который сдавливает сердце. Компрессии подвергаются все или некоторые отделы сердца. Чаще рубцовая ткань охватывает область верхушки сердца. Иногда фиброзно–известковые изменения поражают только атриовентрикулярную борозду. В таких случаях возникает симптомокомплекс, напоминающий клинику стеноза левого атриовентрикулярного отверстия. Констриктивный перикардит сопровождается миокардиофиброзом. Мышечные волокна истончаются, подвергаются атрофии и жировому перерождению. Наряду с внутриперикардиальными формируются и медиастино–перикардиальные сращения, что еще больше затрудняет работу сердца. У многих больных процесс склерозирования распространяется на поддиафрагмальную брюшину, селезеночную и печеночную капсулы. Это приводит к развитию псевдоцирроза печени с нарушением печеночной циркуляции и асциту.
Патогенез.
При хроническом сдавливающем перикардите существует два механизма сдавления сердца – первичный и вторичный.
Первичные сдавления характеризуются истинным рубцовым сморщиванием перикарда. При вторичном сдавлении листки перикарда утрачивают свою растяжимость. Исходный объем перикардиального мешка не уменьшается. Однако. если в дальнейшем возникнет необходимость в расширении сердца, например, в связи с формированием клапанного порока или рецидивирующим накоплением выпота в перикарде, компенсаторной дилатации полостей сердца или расширения полости перикарда не происходит. Непосредственное сдавление сердца сопровождается наступлением ранних расстройств гемодинамики, чаще всего через несколько недель или месяцев после начала заболевания. При вторичной констрикции расстройство кровообращения формируется в течение ряда лет.
В результате происходящих процессов нарушается расширение сердца в фазу диастолы (гиподиастолия). Прежде всего страдает функция желудочков, что сопровождается затрудненным поступлением крови к правым отделам сердца и повышением венозного давления. Однако повышение венозного давления вначале носит активный компенсаторный характер. Периферические вены в этой фазе заболевания спазмированы и нитевидны. Постепенно возникают признаки декомпенсации кровообращения. Повышается давление в грудном лимфатическом протоке и спиномозговом канале, что наряду с ухудшением аортального и печеночного кровотока способствует появлению отеков и внутриполостной транссудации.
Клиническая картина.
Формируется постепенно. В начальных стадиях заболевания пациенты отмечают слабость, одышку, чувство сдавления в области сердца при физических нагрузках, В дальнейшем указанные симптомы появляются после малейшего физического напряжения. Одышка носит стабильный характер и никогда не возникает приступообразно. Больных беспокоят боли в правом подреберье, неприятные ощущения в животе, запоры и метеоризм. Снижается аппетит. С увеличением сроков заболевания наблюдается прогрессирование сердечной недостаточности. В итоге больные погибают.
Диагностика.
При осмотре больного определяются цианоз лица, ушей, кистей рук, отек лица, шеи, конечности, асцит. Наблюдаются расширение и пульсация яремных вен, систолическое втяжение межреберных промежутков, парадоксальный пульс. На вдохе наполнение пульса уменьшается, а на выдохе увеличивается, что связано с резким снижением диастолического объема в правых отделах сердца. АД находится на нижних границах нормы. Венозное давление достигает 300–350 мм рт. ст. Верхушечный толчок в большинстве случаев не определяется. Границы относительной и абсолютной тупости сердца совпадают.
При аускультации тоны сердца приглушены, часто выслушивается трехчленный ритм. Его появление связано с формированием дополнительного тона в протодиастолической фазе (тон броска).
На ЭКГ регистрируются расширенный зубец Р, снижение вольтажа комплекса QRS, смещение интервала ST вниз от изоэлектрической линии, отрицательный зубец Т.
Рентгенологическое исследование позволяет обнаружить локальное или распространенное обызвествление перикарда, неровность контуров сердца, расширение его тени за счет увеличения предсердий, отсутствие талии сердца, сглаженность ретрокардиального и ретростернального полей. На рентгенограммах уменьшается величина зубцов сердечных сокращений, наблюдается их деформация.
При эхокардиографии находят увеличение толщины листков перикарда, облитерацию его полости, уменьшение диастолического объема левого желудочка.
Дифференциальная диагностика.
Проводится с заболеваниями, сопровождающимися декомпенсацией кровообращения в большом круге: портальной гипертензией, опухолями средостения, пороками сердца.
Лечение.
Больным со сдавливающим перикардитом абсолютно показано хирургическое лечение. В качестве предоперационной подготовки проводят комплексную медикаментозную терапию с учетом этиологии заболевания.
Положительный результат достигается только при выполнении субтотальной перикардэктомии. Измененный перикард иссекается в определенной последовательности. Это связано с опасностью перегрузки правых отделов сердца и возникновением отека легких. В начале иссекают перикард над левым желудочком, устьями легочного ствола и аорты, затем над правым желудочком и предсердием, устьями полых вен. Эффективность хирургического вмешательства подтверждается снижением венозного давления до суб– или нормальных цифр уже к концу операции.
Послеоперационная летальность составляет 1–3%. Положительные исходы операции (у 75–80% больных) определяются только при нормализации сердечной деятельности, т.е. не ранее чем через 3–6 месяцев.
Ранения сердца и перикарда
Ранения сердца и перикарда встречаются в мирное время у лиц, госпитализированных в стационары с проникающими ранениями грудной клетки, в 10,8–16,1% случаев. Более чем в половине наблюдений этот вид травмы сопровождается тяжелым шоком и терминальным состоянием. ⅔ раненых в сердце погибают на догоспитальном этапе.Историческая справка.
До конца XIX ст. в медицине господствовало представление о фатальном характере ранений сердца. Однако ряд хирургов все же предпринимали попытки к спасению пострадавших. Так, в 1649 г. Riolanus указал на возможность лечения ранения сердца аспирацией крови из перикардиального мешка. В 1829 г. Larrey впервые декомпрессировал раненое сердце с помощью дренажа. Marks (1893) добился выздоровления больного с раной сердца после ее тампонирования. Первые операции ушивания сердца выполнили Cappelen (1895) в Норвегии, Farmer (1896) в Италии, В. Шаховский (1903) в России, Е. Корчиц (1927) в Беларуси,
Патологическая анатомия.
Раны сердца и перикарда могут быть колотыми, колото–резаными и огнестрельными. Ножевые ранения, как правило, сопровождаются повреждением левых отделов сердца, что связано с более частым направлением удара слева направо. При других видах травм преобладают ранения правого желудочка и предсердия вследствие их непосредственного прилегания к передней грудной клетке. Почти у 3% пациентов отмечается и одновременное ранение межпредсердной перегородки, клапанов сердца. Встречаются случаи повреждения проводящей системы, коронарных артерий, в том числе в 5 раз чаще левой коронарной артерии. Более массивные разрушения сердца наблюдаются при огнестрельных ранениях: разрывы полостей, повреждение интракардиальных структур. В 70–90% случаев ранения сердца сопровождаются повреждением верхней или нижней доли левого легкого, диафрагмы, крупных сосудов.
Классификация.
Выделяют изолированные ранения перикарда и ранения перикарда, сочетающиеся с повреждением сердца. Последние подразделяются на изолированные и сочетанные.
Изолированные ранения сердца делятся на: 1. Непроникающие: ■ По количеству • одиночные; • множественные. ■ По характеру повреждения • с гемоперикардом; • с гемотораксом; • с гемопневмотораксом. ■ С повреждением коронарных сосудов. ■ С наружным и внутренним кровотечением. 2. Проникающие: ■ По количеству: • одиночные; • множественные. ■ По глубине ранения • сквозные; • несквозные. ■ По характеру повреждения • с гемоперикардом; • с гемотораксом; • с гемопневмотораксом, • с гематомой средостения. ■ По виду кровотечения: • с наружным кровотечением; • с внутренним кровотечением; ■ В зависимости от повреждения внутренних структур сердца: • с повреждением коронарных сосудов; • с повреждением перегородок сердца; • с повреждением проводящей системы; • с повреждением клапанного аппарата.
Сочетанные ранения сердца делятся на: 1. проникающие, 2. непроникающие. Они могут сочетаться с повреждениями: • других органов груди (легкие, бронхи, трахея, крупные сосуды, пищевод, диафрагма); • органов брюшной полости (паренхиматозные органы, полые органы, крупные сосуды); • органов другой локализации (кости черепа, головного мозга, кости и суставы, сосуды).
Патогенез.
Ранения перикарда и сердца характеризуются возникновением комплекса гемоциркуляторных нарушений. В основе их развития лежит поступление крови в полость перикарда, что сопровождается затруднением деятельности сердца. Одновременно происходит сдавление коронарных сосудов и резко нарушается питание сердечной мышцы. Скопление крови в перикарде оказывает влияние на большой и малый круги кровообращения, ограничивая приток крови в предсердия и снижая отток крови из желудочков. Кроме того, циркуляторные нарушения при ранениях сердца усугубляются продолжающимся кровотечением, скоплением воздуха и крови в плевральных полостях, смещением средостения, перегибом сосудистого пучка и т.д. Все это приводит к развитию гиповолемического, травматического и кардиогенного шоков.
Объем гемоперикарда зависит от длины раны перикарда и локализации раны сердца. При дефектах в перикарде более 1,5 см, ранениях отделов сердца и прилежащих сосудов с относительно высоким давлением (аорта, легочная артерия) кровь не задерживается в полости сердечной сорочки, а изливается в окружающие пространства, прежде всего в плевральную полость с формированием гемоторакса. В случае небольших ранений перикарда (до 1–1,5 см) кровь скапливается в его полости, вызывая в 30–50% наблюдений развитие синдрома тампонады сердца. Его возникновение связано с небольшим объемом полости перикарда, содержащим у здоровых лиц 20–50 мл серозной жидкости и крайне редко 80–100 мл. Внезапное накопление в сердечной сумке более 150 мл крови приводит к повышению внутриперикардиального давления и сдавлению сердца. Это сопровождается увеличением давления в предсердиях, падением градиента давления между легочной артерией и левым предсердием. При приближении разницы в давлениях к нулю циркуляция крови в легочной артерии прекращается. Сердечная деятельность останавливается. У лиц с быстрым накоплением крови в полости перикарда смерть от тампонады сердца наступает в течение 1–2 ч с момента ранения.
Клиническая картина.
Пострадавшие госпитализируются в лечебные учреждения в тяжелом состоянии. Вместе с тем известны случаи и стертого, бессимптомного течения ранения. Больные с сохраненным сознанием жалуются в первую очередь на слабость, головокружение, одышку, кашель, боли в области сердца. Они возбуждены, быстро теряют силу. При тяжелом шоке жалобы могут отсутствовать, а в случае сочетанной травмы нередко превалируют симптомы повреждения смежных органов. Пациенты с выраженной тампонадой сердца отмечают чувство нехватки воздуха. Повреждение коронарных артерий и множественные ранения характеризуются значительными болями в сердце.
Выделяют три клинических варианта (формы) ранений сердца: с преобладанием кардиогенного, гиповолемического шоков и их сочетаний. Проявления указанных видов шоков практически не отличаются от таковых при других заболеваниях.
Диагностика.
Решая вопросы диагностики при ранениях сердца, следует помнить о факторе времени, о том, что комплекс диагностических мероприятий должен быть направлен в первую очередь на выявление наиболее достоверных симптомов ранений сердца и основных расстройств жизненно важных функций, так как состояние больного стремительно ухудшается. Все вспомогательные методы исследований применяются строго по показаниям с минимальной потерей времени. При явлениях шока все диагностические мероприятия проводятся непосредствен – но в операционной параллельно с элементами интенсивной терапии и реанимации.
О ранении сердца свидетельствуют: 1. Расположение входного отверстия раневого канала на грудной клетке преимущественно в области сердца или в прекардиальной зоне. Поданным И. И. Грекова, область возможного ранения сердца ограничена сверху вторым ребром, снизу левым подреберьем и подложечной областью, слева средней подмышечной и справа парастернальной линиями. Ю. Ю. Джанелидзе приводит другие границы "опасной зоны": сверху – второе ребро, снизу – восьмое, слева – подмышечная и справа – среднеключичная линии. 2. Бледность кожных покровов и видимых слизистых, холодный, липкий пот – свидетельства геморрагического шока. 3. Признаки венозной гипертензии: цианоз лица и шеи, набухание вен шеи (ЦВД 140 мм вод. ст. и более). Однако у больных с преобладанием кровопотери и при тяжелой сочетанной травме ЦВД обычно снижено. Нарастание ЦВД в динамике является признаком тампонады сердца. 4. Одышка более 25–30 дыханий в 1 мин. 5. Глухость сердечных тонов или их отсутствие. При повреждении межжелудочковой перегородки определяется грубый систолический шум по левому краю грудины с эпицентром в IV межреберье. При повреждении митрального и трикуспидального клапанов может выслушиваться систолический шум в нижней трети грудины, в точке Боткина и на верхушке сердца (следует помнить о возможности повреждения сердца у лиц, ранее страдавших заболеваниями сердца). 6. Расширение перкуторных границ сердечной тупости. 7. Тахикардия. У больных в терминальном состоянии и в случае выраженной тампонады сердца отмечаются брадикардия, а также парадоксальный пульс – исчезновение или уменьшение пульсовой волны на вдохе. 8. Артериальная гипотония со сниженным систолическим и диастолическим и уменьшенным пульсовым давлением. У больных с тампонадой сердца АД в начале появления гемоперикарда может быть умеренно сниженным, но остается некоторое время стабильным. В случае нарастания явлений гемоперикарда АД резко снижается. При экстраперикардиальном кровотечении АД прогрессивно снижается.
При ранениях сердца, сопровождающихся гемоперикардом, на ЭКГ наблюдается низкий вольтаж желудочковых комплексов QRS, особенно зубца R. Возможно смещение интервала S–Т выше изоэлектрической линии в нескольких отведениях. У лиц с выраженной кровопотерей отмечаются признаки гипоксии миокарда, преимущественно диффузного характера (инверсия зубца Т, смещение сегмента ST от изоэлектрической линии вверх или вниз более 1,5 мм). Повреждение крупных коронарных артерий и желудочков сопровождается изменениями ЭКГ, идентичными таковым при острой стадии инфаркта миокарда. У лиц с ранениями проводящей системы сердца, перегородок и его клапанов отмечаются нарушение ритма и проводимости (блокада проведения импульса, диссоциация ритма и т.д.), признаки перегрузки отделов сердца. Однако ЭКГ при ранениях перикарда и сердца не позволяет точно определить локализацию раны. Это объясняется тем, что колоторезаные раны сами по себе не вызывают значительных изменений в миокарде.
При рентгенографии сердца выделяют достоверные и вероятные симптомы ранений. К достоверным симптомам повреждения сердца относятся достаточно выраженное расширение его границ, смещение дуг по правому и левому контурам сердца, ослабление пульсации контуров сердца (признак гемоперикарда).
Однако быстрое скопление крови в полости перикарда может не сопровождаться значительным расширением его границ. В то же время рентгенологическое исследование сердца в положении больного лежа на спине дает ложнопозитивные сведения о границах сердца. К вероятным признакам ранения сердца относятся средний и большой гемоторакс, гематома средостения.
Эхокардиографически при гемоперикарде выявляют наличие разрыва эхо–сигналов между стенками сердца и перикардом. Точные размеры гемоперикарда определяются при ультрасонографии.
На основании комплексного обследования больных с ранениями сердца выделяют триаду Бека – резкое снижение АД, быстрое и значительное повышение ЦВД, отсутствие пульсации сердца при рентгеноскопии грудной клетки.
Лечение.
Подозрение на ранение сердца и перикарда является абсолютным показанием к операции. Подготовка к операции ограничивается самыми необходимыми диагностическими, лабораторными и инструментальными манипуляциями, дренированием плевральных полостей при напряженном пневмотораксе, катетеризацией центральных вен.
При выборе доступа учитываются локализация входного отверстия раневого канала и его примерное направление. Чаще всего производится переднебоковая торакотомия. В случае локализации раны в нижних отделах грудной клетки целесообразно выполнить левостороннюю переднебоковую торакотомию в V межреберье, в верхних отделах в IV межреберье. Расширение раны или вскрытие плевральных полостей через раневой канал не рекомендуется. При ранении магистральных сосудов – восходящая аорта, ствол легочной артерии – производится двухсторонняя торакстомия с пересечением грудины. Ряд хирургов при ранениях сердца выполняют продольную срединную стернотомию.
После вскрытия грудной клетки продольно спереди от диафрагмального нерва рассекается перикард. В момент его вскрытия из полости перикарда выделяется большое количество крови и сгустков. Из раны сердца изливается кровь. Для проникающих ранений левых отделов сердца характерно поступление алой крови. Кровотечение из желудочков иногда пульсирующее. Вместе с тем при гипоксии и в связи с низким насыщением крови кислородом цвет крови из левых отделов может быть темным. Для временной остановки кровотечения рана сердца прикрывается пальцем. Дефект в стенке сердца ушивается нерассасывающимся шовным материалом.
Зашивание ран желудочков чаще всего производится обычными узловыми или П–образными швами на синтетических прокладках. Проколы делают через всю толщу миокарда, отступив от краев раны на 0,5–0,8 см.
При расположении раны вблизи коронарных сосудов используют П–образные швы с подведением их под сосудистые пучки. Раны стенки желудочков больших размеров ушиваются с первоначальным наложением широких П–образных швов, сближающих края раны. Раны тонкостенных предсердий ушиваются узловыми П–образными швами на синтетических прокладках, атравматической иглой, кисетными швами на прокладках, непрерывным швом после бокового отжатия стенки предсердия зажимом. Раны восходящей аорты длиной менее 1 см ушиваются наложением на адвентицию аорты двух кисетных швов. Внутренний кисетный шов проходит не ближе 8–12 мм от края раны. Перикард ушивается редкими швами.
При внезапно наступившей во время операции остановке сердца или фибрилляции производят прямой массаж сердца, внутрисердечно вводят 0,1 мл адреналина и производят дефибрилляцию.
В послеоперационном периоде проводится комплексная терапия и при необходимости топическая диагностика возникшей в результате ранения сердца патологии. У больных с выраженной тампонадой сердца на догоспитальном этапе и в стационаре при крайне тяжелом либо агональном состоянии, если невозможно провести экстренную торакотомию, показано выполнение пункции перикарда из известных точек. Ее целесообразно осуществлять под контролем ЭКГ или УЗИ. При этом появление на ЭКГ экстрасистол или нарушение ритма свидетельствует о контакте с миокардом, а увеличение вольтажа желудочковых комплексов – об эффективности декомпрессии сердца. После аспирации содержимого полости перикарда наблюдаются повышение АД, снижение ЦВД, уменьшение тахикардии. В дальнейшем выполняется операция.
У больных с крайне тяжелой сопутствующей патологией, поступивших через 12–24 ч с момента ранения и имеющих стабильные показатели гемодинамики, пункция перикарда с удалением крови из его полости может быть окончательным лечебным мероприятием.
Гнойные заболевания легких и плевры
Легкие занимают большую часть грудной клетки и находятся в правом и левом плевральных мешках. В наружном (париетальном) листке плевры различают диафрагмальную, реберную и медиастинальную части. В нижних отделах грудной клетки за счет париетальной плевры образуются пространства: реберно–диафрагмальный и реберно–медиастинальный синусы, которые меняют свою величину при дыхательных движениях. Внутренний (висцеральный) листок плевры прочно сращен с легочной тканью. Между париетальной и висцеральной плеврой имеется небольшое количество (20–25 мл) жидкости.Легкие имеют реберную, медиастинальную и диафрагмальную поверхности. Корень легкого состоит из главного бронха, легочной артерии, верхней и нижней легочных вен. Кроме того, в его состав входят бронхиальные артерии, вены, лимфатические сосуды и узлы, нервные сплетения. Элементы корня легкого обычно располагаются таким образом, что вверху находятся главный бронх и легочная артерия, а ниже – легочные вены. При этом как справа, так и слева бронхи располагаются сзади, а сосуды спереди. Необходимо также учитывать отношение к корням легких блуждающего и диафрагмального нервов. Блуждающие нервы располагаются в клетчатке позади главных бронхов Диафрагмальные нервы проходят впереди корней легких между меднастинальной плеврой и перикардом.
 Рис. 31. Сегменты легкого:
а – вид спереди; б – вид сзади; в – правое легкое (вид сбоку); г – левое легкое (вид сбоку).
Рис. 31. Сегменты легкого:
а – вид спереди; б – вид сзади; в – правое легкое (вид сбоку); г – левое легкое (вид сбоку).
Правое легкое делится па верхнюю, среднюю и нижнюю доли. В левом легком не имеется средней доли, ей соответствует язычковый сегмент верхней доли. Основной структурной единицей легких является сегмент, в состав которого входят, кроме легочной ткани, бронх, кровеносные и лимфатические сосуды, нервные волокна. По своей форме он напоминает конус, обращенный вершиной к корню легкого.
Классификация.
Проекции сегментов на грудную клетку показаны на рис. 31.
Верхушечный сегмент (С1) верхней доли правого легкого занимает всю верхушку легкого. Задний сегмент (С2) занимает дорсальную часть доли и прилежит к грудной стенке на уровне II–IV ребер. Передний сегмент (С3) проецируется на грудной стенке между хрящами I–IV ребер. Латеральный сегмент (C4) средней доли своим основанием соприкасается с грудной стенкой на уровне IV–VI ребер. Медиальный сегмент (C5) обращен к грудине и находится между хрящами IV–VI ребер. Верхушечный (верхний) сегмент (C6) занимает верхнюю часть нижней доли, прилежит к грудной клетке сзади на уровне V–VII ребер, позвоночнику и средостению. Медиальный базальный сегмент (С7) соприкасается с правым предсердием, нижней полой веной, диафрагмой. Основание переднего базального сегмента (С8) обращено к диафрагме, при этом наружная его часть находится на уровне VI–VIII ребер. Латеральный базальный сегмент (С9) проецируется на боковую поверхность грудной стенки между VII–IX ребрами. Задний базальный сегмент (С10) находится позади других, а над ним расположен C6. Он прилегает к задней стенке грудной полости на уровне VIII–X ребер, а также к средостению и позвоночнику.
Классификация бронхолегочных сегментов
Правое легкое 1. Верхняя доля: ■ Верхушечный сегмент (С1) ■ Зданий сегмент (С2) ■ Передний сегмент (С3) 2. Средняя доля: ■ Латеральный сегмент (С4) ■ Медиальный сегмент (С5) 3. Нижняя доля: ■ Верхушечный (верхний) сегмент (С6) ■ Медиальный (сердечный) базальный сегмент (С7) ■ Передний базальный сегмент (С8) ■ Латеральный батальный сегмент (С9) ■ Задний базальный сегмент (С10)
Левое легкое 1. Верхняя доля: ■ Верхушечно–задний сегмент (С1+2) ■ Передник сегмент (С3) ■ Верхний язычковый сегмент (C4) ■ Нижний язычковый сегмент (С5) 2. Нижняя доля: ■ Верхушечный (верхний) сегмент (C6) ■ Медиальный (сердечный) базальный сегмент (С7) ■ Передний базальный сегмент (С8) ■ Латеральный базальный сегмент (С9) ■ Задний базальный сегмент (С10)
Левое легкое также имеет 10 сегментов. Верхушечнозадний сегмент (С1+2) верхней доли соответствует верхушечному сегменту правого легкого. Наиболее крупным сегментом левого легкого является передний сегмент (С3). Верхний и нижний язычковые сегменты (C4 и C5) располагаются под вышеуказанными. Верхушечный (верхний) сегмент (C6) нижней доли, как и правого легкого, основанием обращен к реберной поверхности. Медиальный (сердечный) базальный сегмент (C8) является непостоянным. Топография других базальных сегментов (С8, С9, С10) соответствует таковой правого легкого.
Сегментарные бронхи делятся на субсегментарные, которые, уменьшаясь в диаметре, переходят в более мелкие бронхи, а затем в бронхиолы. Деление последних заканчивается образованием альвеол, на уровне которых осуществляется газообмен.
Кровеносные сосуды легких относятся к малому и большому кругам кровообращения. Легочные артерии и одноименные вены принадлежат к малому кругу кровообращения, выполняя в основном функцию газообмена. Бронхиальные кровеносные сосуды относятся к большому кругу кровообращения и обеспечивают питание легких.
Венозная кровь из полых вен поступает в правый желудочек, а затем через ствол легочной артерии и его ветви в легкие. Соответственно каждому бронху имеется веточка легочной артерии, которая в последующем заканчивается капиллярами, окутывающими альвеолы. Обогащенная здесь кислородом артериальная кровь поступает в вены легкого, при этом каждое из них имеет верхнюю и нижнюю легочные вены, по которым кровь направляется в левое предсердие, а затем в левый желудочек и большой круг кровообращения.
Стенки бронхов и интерстициальная легочная ткань снабжаются кровью за счет бронхиальных артерий, а отток крови осуществляется по бронхиальным венозным сосудам в непарную и полунепарную вены. Из капилляров мелких бронхов возможен отток крови в легочные вены. Между мелкими легочными артериями и венами имеются артериовенозные шунты.
Лимфатическая система легких делится на поверхностную и глубокую, при этом началом путей лимфооттока являются лимфатические капилляры. Поверхностная сеть находится в висцеральной плевре, глубокая расположена вокруг альвеол, а также сопровождает бронхи и крупные кровеносные сосуды. Между ними существует тесная связь. На путях движения потоков лимфы имеются региональные лимфатические узлы.
При этом выделяют следующие их группы (Ю. Е. Выренков, В. М. Клебанов, 1985): 1. Бронхолегочные лимфатические узлы, расположенные в глубине легких. 2. Междолевые лимфатические узлы. 3. Лимфатические узлы, расположенные в корне легкого. 4. Трахеобронхиальные лимфатические узлы, которые располагаются в правом и левом трахеобронхиальных углах. 5. Бифуркационные лимфатические узлы, расположенные в нижнем отделе бифуркационного угла трахеи. 6. Левые и правые передневерхние средостенные лимфатические узлы, которые находятся на передней поверхности артериального ствола и верхней полой вены. 7. Паратрахеальные лимфатические узлы. 8. Задние средостенные лимфатические узлы, располагающиеся между аортой и пищеводом. 9. Диафрагмальные лимфатические узлы. 10. Лимфатические узлы чревной артерии.
Отток лимфы из верхней доли правого легкого осуществляется в трахеобронхиальные лимфатические узлы, откуда часть лимфы направляется в правый лимфатический ствол, а другая часть – в нижние глубокие яремные лимфоузлы. От средней доли правого легкого лимфа оттекает в корневые бифуркационные, трахеобронхиальные узлы одноименной стороны, а затем в паратрахеальные и нижние яремные со сбросом в правый лимфатический проток. От нижней доли лимфоотток идет в направлении трахеобронхиальных лимфатических узлов и лимфоузлов, расположенных между аортой и пищеводом, а также в области малой кривизны желудка (чревные). Отток лимфы из верхней доли левого легкого происходит в трахеобронхиальные и левые паратрахеальные лимфатические узлы, а затем или в грудной проток, или в левый венозный угол. Часть лимфы направляется в медиастинальные узлы, один из которых находится в аортальном углу (ниже вогнутой поверхности дуги аорты). Он может сдавливать возвратный нерв, что сопровождается осиплостью голоса и говорит о неоперабельности.
От язычковых сегментов и нижней доли левого легкого лимфа оттекает в трех направлениях: в трахеобронхиальные, медиастинальные и забрюшинные лимфатические узлы.
Иннервация легких осуществляется за счет блуждающего и диафрагмального нервов, узлов симпатического ствола, которые образуют в воротах легкого переднее и заднее сплетения. Они находятся в тесной связи с сердечным нервным сплетением, что объясняет рефлекторую остановку сердца во время мобилизации корня легкого.
Острые гнойные заболевания легких
Согласно классификации Н. В. Путова, среди острых инфекционных деструкций легких различают: 1. острый гнойный абсцесс легкого; 2. острый гангренозный абсцесс легкого; 3. распространенную гангрену легкого.Абсцесс легкого – ограниченный гнойно–деструктивный процесс, сопровождающийся образованием одиночных или множественных гнойных полостей в легочной ткани.
Гангрена легкого – гнойно–некротический процесс в легочной ткани, который не имеет четких границ. Возможен переход абсцесса легкого в гангрену и, наоборот, гангрена может заканчиваться формированием одного или множественных абсцессов.
Этиология и патогенез.
При абсцессе и гангрене легкого микрофлора чаще всего бывает полиморфной. В очаге поражения встречаются стафилококки, стрептококки, кишечная палочка, протей, фузобактерии и др. Важное значение имеют вирусы, а также неклостридиальная анаэробная инфекция (бактерии группы Bacteroiodes). Однако главную роль в возникновении гнойного заболевания легкого играют реактивность организма и его иммунитет. При этом развитие абсцесса или гангрены зависит от того, какие процессы преобладают в очаге поражения – гнойное расплавление тканей или некротические изменения их.
Основными причинами развития абсцесса и гангрены легкого являются пневмония, аспирация инородных тел или рвотных масс. Реже эти заболевания возникают гематогенно–эмболическим, лимфогенным и травматическим путями, Постпневмонические абсцессы появляются на фоне затянувшейся пневмонии или после стихания острых ее явлений вновь наступает ухудшение состояния больного: усиливается боль в грудной клетке, а во время кашля выделяется обильная гнойная мокрота. Лишь в редких случаях после короткого недомогания процесс резко обостряется и пациент начинает откашливать мокроту "полным ртом".
Аспирационный путь развития абсцесса или гангрены легкого обусловлен попаданием в бронхи инородных тел или другого инфицированного материала. Этому способствуют алкогольное опьянение, а также тяжелое состояние после операции или вследствие других заболеваний, когда угнетен кашлевой рефлекс. В результате нарушения проходимости бронхиального дерева развивается ателектаз части легкого, на фоне которого возникает вспышка инфекции. Реже встречается гематогенно–эмболический генез гнойных заболеваний легких. В таких случаях инфекция в легкие попадает путем заноса септических эмболов с током крови, что приводит к инфицированному инфаркту легкого и гнойному расплавлению тканей. Это встречается при остром тромбофлебите глубоких вен нижних конечностей и таза, послеродовом сепсисе, септическом эндокардите, а также после операции на инфицированных тканях. Лимфогенный путь попадания инфекции в легкие может быть при ангине, медиастините, поддиафрагмальном абсцессе, однако он наблюдается редко.
Абсцессы и гангрена легкого развиваются также в результате закрытой и открытой травм грудной клетки.
Патологическая анатомия.
На фоне изменений легочной ткани, характерных для пневмонии, возникают один или несколько очагов некроза, которые под влиянием бактериальных протеолитических ферментов подвергаются расплавлению и образуется гнойная полость или множественные полости. При деструкции стенок бронхов наступает заполнение гноем бронхиального дерева. В последующем морфологические изменения зависят от состояния иммунной системы организма, степени адекватности дренирования абсцесса и его размеров. У больных с благоприятным течением заболевания полость абсцесса быстро освобождается от гноя, заполняется грануляционной тканью и постепенно превращает очаг поражения в рубец. Иногда на этом месте остается так называемая сухая полость. Если абсцесс, особенно больших размеров, плохо дренируется, заболевание принимает затяжной характер и в этих случаях формируется хронический абсцесс, стенки которого представляют плотную рубцовую ткань. Множественные абсцессы легкого образуются при распространенном воспалительном процессе вследствие некроза ткани в различных сегментах и долях легкого, причем происходит это неодновременно. При гангрене легкого отсутствуют четкие границы очага поражения.
Клиническая картина.
У большинства (75–80%) больных гнойный абсцесс бывает одиночным и чаще локализуется в верхушечном, заднем и латеральном (С1, С2, С4) сегментах правого легкого. Однако абсцессы больших размеров могут распространяться на несколько сегментов одной или разных долей. Симптоматиказависит от фазы заболевания.
Первая фаза охватывает период до прорыва абсцесса в просвет бронхиального дерева. Вначале она характеризуется признаками, которые наблюдаются при пневмонии. Больных беспокоят кашель, боль в грудной клетке, повышение температуры тела, ознобы. Во время физикального исследования выявляют ограничение дыхательных экскурсий, укорочение перкуторного звука, ослабленное дыхание, сухие и влажные хрипы. Отмечаются выраженные изменения со стороны крови: высокая СОЭ, резкий сдвиг лейкоцитарной формулы влево, токсическая зернистость нейтрофилов.
Вторая фаза течения острого абсцесса легкого начинается после вскрытия гнойной полости в бронхи. Это происходит обычно через 2–3 недели после начала заболевания. Клинически она характеризуется двумя вариантами. Первый вариант наблюдается у больных, когда гнойник опорожняется через крупный бронх. После отхождения гноя состояние пациентов быстро улучшается, снижается температура тела, уменьшаются признаки интоксикации, постепенно нормализуются показатели крови. При аускультации определяются крупнопузырчатые хрипы, иногда дыхание с амфорическим оттенком. Второй вариант течения вскрывшегося абсцесса менее благоприятный, так как гнойник плохо дренируется вследствие недостаточного опорожнения его через мелкие бронхи. Гнойно–воспалительный процесс в очаге поражения не имеет тенденции к затиханию. В результате заброса гноя в бронхиальное дерево развиваются гнойные бронхиты. Периоды некоторого улучшения состояния больных сменяются обострениями заболевания. Прогрессирующее развитие соединительной ткани в стенке полости ведет к формированию хронического абсцесса.
Острый гангренозный абсцесс развивается в результате гангрены легкого на ограниченном участке. Однако процесс имеет тенденцию к прогрессированию, поэтому интактными остаются чаще всего лишь базальные сегменты нижних долей. Обычно с самого начала состояние больных очень тяжелое. Они жалуются на боль в грудной клетке, одышку, кашель, который сопровождается выделением зловонной мокроты. При аускультации определяются влажные хрипы и дыхание с амфорическим оттенком. Вследствие всасывания продуктов распада тканей и бактериальных токсинов отмечаются признаки резко выраженной интоксикации. Температура тела достигает 40°С. СОЭ увеличивается до 70 мм/ч, выявляется резкий сдвиг формулы крови влево с выраженной зернистостью нейтрофилов. Быстро нарастают сдвиги в водно–солевом и электролитном балансах, прогрессирует диспротеинемия. Через 10–12 дней после начала заболевания наступает расплавление некротически измененных тканей и происходит их отторжение. Это сопровождается увеличением количества отделяемой мокроты, которая имеет гнилостный запах, бурый цвет и кашицеобразную консистенцию. Нередко отмечается Кровохарканье, а иногда и легочное кровотечение.
Особенностью гангренозных абсцессов является отсутствие улучшения после их опорожнения от гнойно–некротических масс. Состояние больных продолжает ухудшаться, что обусловлено прогрессированием интоксикации, так как из–за отсутствия демаркационного вала патологический процесс распространяется на соседние участки легкого. Кроме того, существование исходного очага поражения поддерживается наличием в полости абсцесса некротических секвестеров легочной ткани. При отсутствии своевременного и правильного лечения развиваются опасные для жизни больного осложнения: легочные кровотечения, гнилостный пиопневмоторакс, флегмона грудной стенки, сепсис. У ряда больных ограниченная гангрена легких протекает не по типу полостных образований, а характеризуется быстрым развитием тяжело протекающей гнилостной эмпиемы плевры.
Диагностика.
Основывается на данных клинической картины заболевания, а также результатах рентгенологических методов исследования. До прорыва абсцесса в бронх в легких выявляются различной величины и формы инфильтраты (рис. 32). При возникновении сообщения гнойника с бронхиальным деревом на месте инфильтративных теней определяются полости с горизонтальным уровнем жидкости. Кроме того, у больных с гангреной легкого они содержат секвестры.
Дифференциальная диагностика.
Абсцессы легкого необходимо дифференцировать с распространенной гангреной легочной ткани, которая протекает крайне тяжело и у большинства больных, несмотря на своевременно начатое лечение, имеет летальный исход. В отличие от абсцессов на рентгенограммах определяется сплошная тень всей пораженной половины грудной клетки.
Лечение.
Основными принципами лечения больных гнойными заболеваниями легких являются антибактериальная терапия, дренирование гнойника и повышение сопротивляемости организма. Все это используется комплексно и своевременно. Первостепенное значение придается борьбе с инфекцией, в то время как в более поздние сроки на первый план выступают адекватное дренирование и санирование гнойных полостей с удалением некротических масс. Антибиотики применяются с учетом чувствительности микрофлоры, высеянной из очага поражения (мокроты). При отсутствии таких данных назначаются антибиотики широкого спектра действия, к которым относятся аминогликозиды, цефалоспорины и др. Их целесообразно сочетать с сульфаниламидами. Поскольку в патологическом очаге возможно наличие анаэробной неклостридиальной инфекции, широко используется метронидазол (трихопол). Важно создать высокую концентрацию антибактериальных средств в зоне абсцесса. С этой целью применяют различные пути введения антибиотиков. Обычно предпочтение отдается длительной внутривенной инфузии через катетер. Непосредственно к очагу поражения антибиотики подводятся путем применения аэрозолей, во время бронхоскопии, через микротрахеостому, а также посредством трансторакальной пункции гнойника. Наиболее эффективным способом считается введение антибиотиков в бронхиальные артерии.
Дренирование абсцесса осуществляется трансбронхиально или трансторакально. Первый путь применяется при центральном расположении гнойников. Катетер проводится через бронх трансназально. При периферически расположенных абсцессах дренирование осуществляется через грудную клетку. Это могут быть повторные пункции с отсасыванием гнойного содержимого и последующим введением антисептических растворов с антибактериальными препаратами. Более современной является пункция абсцесса специальными гибкими иглами с мандренами, вмонтированными в катетер. После вхождения иглы в гнойную полость она извлекается, катетер фиксируется к коже грудной стенки, а его дистальный конец остается в полости абсцесса. Однако большие абсцессы (диаметром более 5 см) целесообразно дренировать трубками с большим просветом, которые проводятся путем пункции грудной клетки или делается торакоцентез. Для этих целей лучше использовать двухпросветный катетер или проводить в полость абсцесса два дренажа, один из которых применяется в качестве ирригационного, другой – аспирационного.
Через ирригационный катетер налаживается постепенное орошение полости абсцесса антисептическими растворами, а аспирационный катетер служит для активной аспирации содержимого гнойника. Преимуществами трансторакального дренирования катетерами являются возможность постоянного (или с небольшими перерывами) введения в очаг поражения необходимых лекарственных препаратов с аспирацией содержимого абсцесса и меньшая травматизация психики больного, чем при повторных пункциях. В то же время этот метод дренирования противопоказан при глубоко расположенных небольших абсцессах, В случае плохого оттока гнойного содержимого в антисептический раствор включают препараты, способствующие расплавлению некротических тканей вследствие усиления протеолиза.
В целях повышения сопротивляемости организма назначается рациональное питание с достаточным количеством белков и витаминов. Энергетическая ценность его должна составлять 3500–4.000 ккал. Важную роль играет парентеральное питание. Внутривенно переливают альбумин, протеин, аминокислоты. Наряду с белковыми препаратами необходимо вводить в достаточных количествах жировые эмульсии.
Назначают также метилурацил, пентоксил, калия аротат, анаболические стероиды (неробол, ретаболил). Большое значение имеет иммунокоррегирующая терапия (стафилококковый анатоксин, антистафилококковая плазма, гаммаглобулин, тимозин, тактивин, левамизол, продигиозан).
Кроме того, проводят мероприятия, направленные на нормализацию сердечно–сосудистой системы, в том числе ее микроциркуляторного русла.
Комплексное лечение при острых абсцессах легких с применением так называемого закона трех катетеров (введение соответствующих средств внутривенно, в трахеобронхиальное дерево и адекватное дренирование гнойника) позволяет получить следующие результаты: выздоровление наблюдается у 70% больных, переход острого процесса в хронический – у 20%, летальный исход – у 5%, показания к хирургическому вмешательству возникают у 5% (Ю. М. Панцырев).
Большие хирургические вмешательства по поводу острых абсцессов выполняются редко. Основными показаниями к операции являются легочные кровотечения и безуспешность настойчивого консервативного лечения, что имеет место у больных с обширными деструкциями легочной ткани и отсутствием возможности обеспечить удовлетворительные условия для дренирования пораженной зоны. При ограниченных острых гнойных процессах хирургическое вмешательство производится в крайне неблагоприятных условиях, на фоне резко выраженной интоксикации. Операцией выбора является лобили пульмонэктомия. У резко ослабленных больных при наличии секвестров легочной ткани вынужденным оперативным вмешательством может быть пневмотомия. Однако после нее часто образуются остаточные полости, бронхоплевральные свищи, хронические эмпиемы, которые требуют в свою очередь повторных операций.
Хронический абсцесс легкого
При недостаточно эффекгивном лечении острых гнойных абсцессов (что зависит от многих причин) через 1–2 месяца формируется хронический абсцесс легкого, хотя время его трансформации определить обычно сложно.Причинами образования хронического абсцесса легкого являются: 1. большие размеры полостей; 2. наличие секвестеров в них; 3. узкие просветы дренирующих бронхов и локализация гнойника в нижней доле, что затрудняет его дренирование; 4. плохая сопротивляемость организма.
Вторая группа причин обусловлена ошибками лечения: 1. несвоевременная и без учета чувствительности микрофлоры антибактериальная терапия; 2. неиспользование наиболее адекватных в каждом конкретном случае способов дренирования абсцесса; 3. недостаточная коррекция обменных процессов и иммунитета.
Патологическая анатомия.
При хронических абсцессах стенки полости образованы разрастающейся соединительной тканью, что делает их весьма ригидными. Одновременно происходит уплотнение и гнойная инфильтрация легочной ткани вокруг зоны деструкции, в том числе с образованием абсцессов вторичного характера. Последние по мере своего вскрытия в бронхиальное дерево способствуют генерализации процесса. Это приводит к развитию диффузного бронхита, перибронхита. Стенки бронхов теряют свою эластичность, просвет их обтурируется, что ведет к образованию ателектазов и вторичных бронхоэктазов.
Клиническая картина.
Заболевание обычно протекает циклично, периоды обострения чередуются с периодами ремиссий. Это обусловлено степенью проходимости дренирующих бронхов и возможностью опорожнения абсцесса. Из клинических признаков наиболее постоянным является кашель с выделением гнойной мокроты, количество которой бывает незначительным, а иногда достигает 0,5 л и более в сутки. Мокрота имеет зловонный характер, в ней может обнаруживаться примесь крови.
Больные жалуются также на слабость, бессонницу, плохой аппетит, боль в грудной клетке, одышку. При осмотре обращает на себя внимание бледность кожных покровов, неприятный запах изо рта. При длительном течении заболевания в результате прогрессирования пневмосклероза уменьшается объем грудной клетки соответствующей стороны, что выражается в ее западении и сближении ребер. Перкуторно над легкими можно выявить зоны укорочения, особенно это типично при осложнении абсцесса эмпиемой плевры. Аускультативно определяются влажные хрипы, шум трения плевры, амфорическое дыхание. В результате хронической интоксикации пальцы приобретают вид "барабанных палочек" и являются постоянным симптомом данного заболевания. Наряду с этим имеет место деформация ногтевых пластинок по типу "часовых стекол".
В период обострения заболевания изменяется морфологический состав крови, что выражается в развитии анемии, лейкоцитоза со сдвигом лейкоцитарной формулы влево. Отмечаются дис– и гипопротеинемия, дефицит калия, что клинически выражается в слабости, гипотонии, нарушении сердечного ритма. При хронических абсцессах легких в патологический процесс нередко вовлекаются почки, поэтому в моче выявляются изменения при пробе Зимницкого, альбуминурия, цилиндрурия.
Выделяют несколько типов течения данного заболевания. Так, хронический абсцесс легкого может явиться непосредственным продолжением острого гнойного процесса. Однако чаще он развивается после некоторого улучшения состояния больного или даже клинического выздоровления, т.е. трансформация острого абсцесса в хронический происходит постепенно. При этом в одних случаях периоды обострения возникают часто, в других – 1–2 раза в год. Среди осложнений следует отметить развитие вторичных бронхоэктазий, легочных кровотечений, амилоидоза паренхиматозных органов.
Диагностика.
Кроме клинической картины, лабораторных данных, важное значение имеют результаты рентгенологического исследования (см. "Острые абсцессы"). В настоящее время широко применяется фибробронхоскопия, которая позволяет не только выявить изменения со стороны бронхиального дерева, но и произвести в необходимых случаях его санацию. Несмотря на свою высокую информативность, бронхография используется реже. Она противопоказана больным с декомпенсацией сердечной деятельности, при двухстороннем поражении легких, легочных кровотечениях.
Дифференциальная диагностика.
Проводится с другими хроническими гнойными заболеваниями легких, особенно с бронхоэктатической болезнью. Она чаще всего встречается в молодом возрасте как у мужчин, так и у женщин. Из анамнеза можно установить частые воспаления легких в детстве, наличие бронхитов. Особенно ценным диагностическим признаком является увеличение количества отделяемой гнойной мокроты в период обострения бронхоэктатической болезни, чего не наблюдается при хронических абсцессах. Мокрота отходит "полным ртом", особенно по утрам. Период обострения при бронхоэктазии протекает менее тяжело, длительное время состояние больных может оставаться удовлетворительным. Поражается обычно сегмент или доля легкого, в то время как при абсцессах в процесс вовлекаются соседние участки легочной ткани. Разрешить сомнения позволяет рентгенологическое исследование. При бронхоэктатической болезни на бронхограммах четко определяются цилиндрические, мешотчатые и смешанные расширения бронхов.
Хронические абсцессы легких необходимо также дифференцировать с хронической неспецифической пневмонией, особенно когда она протекает с частыми обострениями и абсцедированием. В этих случаях важное значение имеет анамнез, а при рентгенологическом исследовании определяется сплошное затемнение доли легкого, иногда с многочисленными мелкими полостями. Весьма трудно бывает дифференцировать хронические абсцессы с туберкулезом легких, который, кроме того, может сочетаться с хроническим гнойным процессом. Необходимо также иметь в виду полостную форму рака легкого, акгиномикоз, кисты.
Лечение.
Консервативное лечение применяется чаще всего в качестве предоперационной подготовки. Однако оно может быть самостоятельным у больных с редкими легкими обострениями, на рентгенограммах грудной клетки у которых определяются сухая остаточная полость и незначительные явления пневмосклероза. Лечение должно быть направлено на ликвидацию обострения гнойного процесса в легких, коррекцию функции жизненно важных органов и повышение иммунологической сопротивляемости организма. Эти данные представлены выше, при описании острых абсцессов. Благодаря такому лечению, особенно при адекватном трансторакальном дренировании гнойника, можно получить хороший эффект при хронических абсцессах и избежать тяжелой операции. При определении показаний к операции руководствуются тяжестью состояния больных, длительностью заболевания, характером его течения и выраженностью осложнений. Прежде всего оперативное вмешательство (резекция легких) показано при одиночных и множественных абсцессах, протекающих с частыми обострениями и прогрессирующей интоксикацией. Однако выполнять его можно только после купирования острых явлений. Сложным является вопрос о выборе срока операции при легочном кровотечении. Если она производится экстренно, то отмечается высокий процент летальности. Более безопасно ее выполнение после остановки кровотечения и ликвидации его последствий.
Бронхоэктатическая болезнь
Бронхоэктазии – заболевания легкого с патологическим расширением бронхов и развитием воспалительно–деструктивных изменений всех слоев их стенки. Они могут иметь врожденный и приобретенный характер. Первые в настоящее время стали встречаться реже. Что же касается приобретенных бронхоэктазий, то они могут возникать на фоне других легочных заболеваний (опухоли, острые и хронические абсцессы, туберкулез, инородные тела бронхов, хроническая пневмония). Их называют вторичными. Однако бронхоэктазии могут быть самостоятельным патологическим процессом, развившимся на фоне бронхита. В этих случаях говорят о бронхоэктатической болезни.Этиология и патогенез.
Бронхоэктазии врожденного происхождения сочетаются с другими пороками развития. Примером может служить триада Картагенера (расширение бронхов, хронический синусит, обратное расположение внутренних органов). Основными условиями развития бронхоэктатической болезни являются нарушение вентиляции легкого и инфекция. Развитию бронхоэктазий способствуют перенесенные в детском возрасте бронхопневмонии, бронхиты, катары верхних дыхательных путей. У взрослых они также возникают после перенесенного бронхита вследствие потери эластических свойств бронхов, закупорки их просвета, нарушения крово– и лимфообращения пораженных тканей. Воспалительный процесс поражает все слои бронхиальной стенки, после чего она теряет способность к сокращению и легко поддается растяжению содержимым просвета бронха. Рецидивы обострения воспалительного процесса со стороны бронхиального дерева и ателектазированной легочной ткани содействуют формированию бронхоэктазий.
Патологическая анатомия.
Бронхоэктатическая болезнь чаще поражает левое легкое, в ⅓ случаев бронхоэктазии бывают двухсторонними. Патологический процесс локализуется преимущественно в нижней доли легкого, но может распространяться на среднюю долю и язычковые сегменты.
Различают 1. цилиндрические 2. мешотчатые 3. кистоподобные 4. смешанные бронхоэктазы.
При наличии ателектазов легкие изменены в размерах, на разрезе определяются резко расширенные бронхи, иногда заполненные гноем. Микроскопическая картина разнообразна. Слизистая оболочка бронхов бывает гипертрофированной, местами с признаками изъязвления. Атрофируются мышечные эластические волокна. При обострении воспалительного процесса имеет место лейкоцитарная инфильтрация бронхиальной стенки, а иногда гнойное расплавление и некроз ее.
Патологическая картина зависит также от стадии развития бронхоэктазии. Вначале наступает незначительное расширение мелких бронхов с нарушением оттока слизи без явных воспалительных изменений. В процессе прогрессирования заболевания увеличивается дилатация бронхов, они содержат гнойную жидкость, на слизистой образуются изъязвления, развивается фиброз тканей. В последующем патологический процесс распространяется на окружающую легочную ткань, а нередко и на все легкое. Бронхи приобретают ту или иную форму расширения, стенки их утолщены, склерозированы, местами некротически изменены, а в просвете находится гной. Со стороны легочной ткани отмечаются диффузный пневмосклероз и эмфизема. Все это сопровождается дистрофическими поражениями паренхиматозных органов.
Клиническая картина.
Основные проявления заболевания – постоянный кашель со слизисто–гнойной или гнойной мокротой и частые рецидивы инфекционного процесса с выраженной интоксикацией. В сутки больной откашливает 50–200 мл мокроты, а при обострении – 500 мл и более. Наибольшее количество ее отделяется утром ("полным ртом"). Неприятный запах изо рта делает больных нетерпимыми в обществе. Вне периода обострения мокрота может становиться слизисто–гнойной или слизистой. Важным признаком является кровохарканье, а иногда и легочное кровотечение, но не такое обильное, как при абсцессах. Некоторые больные жалуются на боль в груди соответственно стороне поражения. К постоянным жалобам следует отнести одышку, которая усиливается при физической нагрузке. Может присоединяться бронхит с астматическим компонентом (приступ одышки с затрудненным выдохом). При обострении заболевания ухудшается общее состояние больных. Температура тела редко превышает 38°С. Симптом "барабанных палочек" при бронхоэктатической болезни встречается реже, хотя раньше его относили к патогномоничным признакам.
При осмотре грудной клетки, особенно у больных с длительным анамнезом, обнаруживается ограничение ее подвижности на стороне поражения. Здесь же отмечаются укорочение перкуторного звука, наличие разнокалиберных влажных хрипов, преимущественно до откашливания. Однако у ряда больных эти признаки не выявляются. При обострении процесса изменения лабораторных данных напоминают таковые при других гнойных заболеваниях легких. По клиническому течению выделяют легкую, средней тяжести и тяжелую формы бронхоэктазий.
Диагностика.
Основана на данных анамнеза, жалобах больных и результатах рентгенологических методов исследования. Для бронхоэктатической болезни характерны периодически наступающие обострения воспалительного процесса в бронхах и легких, что сопровождается усилением кашля, изменением слизистой мокроты на гнойную, увеличением ее объема, повышением температуры тела, ухудшением общего состояния больного. При обзорной рентгеноскопии и рентгенографии можно выявить только косвенные признаки бронхоэктазии (усиление или обеднение легочного рисунка, смещение тени средостения, дыхательная деформация диафрагмы). Исключение составляют больные, у которых имеются кистозные бронхоэктазы или выраженный пневмосклероз. В первом случае будет виден ячеистый рисунок, во втором – затемнение соответственно структурной единице легкого. Поставить окончательный диагноз позволяет бронхография. Однако ей должна предшествовать бронхоскопия, во время которой не только выявляются изменения бронхов, но и производится их санирование перед бронхографией. Бронхоскопия дает возможность исключить опухолевидное образование, инородное тело, другие обструктивные процессы, а также произвести отсасывание гнойного содержимого и промыть бронхиальное дерево антисептическим раствором. В период ремиссии при бронхоскопическом исследовании определяются признаки хронического воспаления бронхиальной стенки – отек, гиперемия, явления атрофии или гипертрофии.
Бронхография выполняется под местной анестезией или наркозом. Важно получить наиболее полные сведения о состоянии бронхов всего легкого. Однако следует помнить, что это небезопасный метод исследования. Он не должен применяться у тяжелых больных, при выраженной дыхательной недостаточности, кровотечении, наличии гнойного отделяемого. Бронхография позволяет установить форму бронхоэктазов и их точную локализацию, а также выяснить состояние бронхиального дерева в других сегментах и долях легкого. Сближение бронхов на рентгенограмме свидетельствует о пневмосклерозе, ателектазе. В последние годы при наличии соответствующего технического оснащения у больных с легочным кровотечением применяется контрастная бронхиальная артериография.
Дифференциальная диагностика.
У взрослых бронхоэктатическую болезнь часто приходится дифференцировать с хроническим бронхитом. Последний встречается значительно чаще и имеет иное клиническое течение. Для него характерен постоянный кашель с небольшим количеством отделяемого, а периоды обострения напоминают таковые при пневмонии. Рентгенологически при бронхитах выявляются признаки диффузного поражения легочной ткани. Следует иметь в виду также хроническую пневмонию, при которой в зависимости от стадии на рентгенограммах определяются пневмосклероз, вторичные бронхоэктазии и абсцессы.
Бронхоэктатическую болезнь иногда трудно отличить от хронического абсцесса. Однако при нем удается установить в анамнезе острое начало, отхождение большого количества гнойной мокроты, на томограммах определяются полости, особенно в задних сегментах легкого, в то время как бронхиальное дерево при бронхографии мало изменено.
Бронхоэктазии приходится дифференцировать с локальным пневмосклерозом, прежде всего с так называемым синдромом средней доли (или язычка). Клиническая картина, течение, лечение и последствия среднедолевого синдрома соответствуют таковым при легкой форме бронхоэктазий. Другой причиной возникновения пневмосклероза являются ранее перенесенные абсцессы легкого, что устанавливается из анамнеза.
Бронхоэктазии с астматическим компонентом необходимо дифференцировать с бронхиальной астмой, при которой после приступа нет клиники бронхоэктатической болезни. Диагноз уточняется с помощью бронхографии.
При кистозных бронхоэктазиях дифференциальная диагностика проводится с кистами легкого, которые обычно на рентгенограммах имеют тонкостенную капсулу, а окружающая их легочная ткань мало изменена. В полости кисты часто определяется уровень жидкости.
Следует помнить о раке легкого, который стал весьма распространенным заболеванием. Отправными моментами для диагностики являются результаты бронхоскопии с биопсией, томографии, исследования мокроты и промывных вод бронхов.
Дифференциальная диагностика бронхоэктазий с туберкулезом легкого основывается на данных анамнеза, характере течения заболевания, результатах рентгенологического и бактериологического исследований.
Лечение.
Основной метод лечения – хирургический. Однако окончательно принять такое решение следует после длительного (2–3 года) курса интенсивной терапии, который включает как общие, так и местные лечебные мероприятия. Наряду с повышением общей сопротивляемости организма, коррекцией обменных процессов проводят тщательную санацию бронхиального дерева, методика которой изложена в разделе "Хронические абсцессы".
Оперативное вмешательство выполняется после снятия острых воспалительных явлений в зоне поражения. Типичной операцией является нижнедолевая лобэктомия, которая часто сочетается с удалением средней доли справа или язычковых сегментов слева. При двухстороннем поражении возможно выполнение билатеральной резекции легких. Успех операции во многом зависит от правильного ведения послеоперационного периода. Необходимо следить за проходимостью бронхиального дерева, рано активизировать больных, проводить массаж и дыхательную гимнастику.
Если пациенты плохо откашливают мокроту, прибегают к трансназальной катетеризации трахеи и бронхов.
Неотложные операции выполняются при осложнении бронхоэктазий легочным кровотечением, если гемостатическая терапия не дает эффекта. Среди других осложнений, требующих хирургического вмешательства, встречаются острые абсцессы, особенно гангренозные, пиопневмоторакс, рецидивирующий пневмоторакс, гемоторакс.
Кисты легких
Кисты легких представляют собой разнородную группу заболеваний, которые различаются между собой по происхождению и морфологическому строению. Общим для них является наличие тонкостенной полости, которая часто содержит жидкость, в том числе и гнойного характера. Кисты бывают врожденные (истинные) и приобретенные (ложные). Среди истинных кист чаще встречаются бронхогенные, обнаруживаемые у взрослых. В их стенке содержатся элементы бронха. Реже, обычно у детей, диагностируются альвеолярные кисты, которые происходят из тканей альвеол. Истинные кисты, как правило, имеют эпителиальный покров. Однако при их нагноении он может разрушаться и заменяться грануляционной тканью. В то же время установлено, что и ложные кисты, характерным для которых является отсутствие эпителиального покрова, при определенных условиях могут быть выстланы бронхиальным эпителием. В основе ложных кист или кистоподобных образований легких лежат другие заболевания: абсцесс, эхинококк, туберкулезная каверна, внутрилегочная гематома. Образование в этих случаях ложных кист является благоприятным исходом указанных патологических процессов. Различают кисты открытые, которые имеют сообщения с бронхом, и закрытые, т.е. "отшнуровавшиеся" от бронхиального дерева. Локализация кист бывает различной. Если они являются исходом абсцесса, то чаще встречаются в задних отделах легкого. Кисты, образующиеся на почве санированных каверн, обычно располагаются в верхней доле легкого. Кисты могут быть очень маленькими и достигать гигантских размеров, занимая долю и большую часть легкого.Клиническая картина.
Неосложненные кисты часто протекают бессимптомно. Иногда больных беспокоят неопределенные боли в груди, сухой или с выделением небольшого количества мокроты кашель. Редко отмечается одышка при физической нагрузке, что зависит от размеров кисты. При больших кистах можно отметить отставание соответствующей половины грудной клетки при дыхании, а при перкуссии – тимпанит или тупость. При аускультации дыхание ослаблено или с амфорическим оттенком. При осложненных кистах клиническая картина более выражена. В случае развития в их просвете нагноительного процесса появляются признаки, характерные для острого абсцесса: гипертермия, боль в грудной клетке, нарастание общей слабости. При прорыве содержимого кисты в бронх выделяется гнойная мокрота, иногда со зловонным запахом.
Другим осложнением является прорыв кисты в плевральную полость, что ведет к развитию эмпиемы плевры с характерной клинической картиной. Иногда могут создаваться условия для формирования так называемой "напряженной" кисты, когда вследствие клапанного механизма воздух при вдохе свободно поступает в кисту, а при выдохе полностью не выходит из–за сжатия окружающей легочной тканью устьев бронхов. Средостение смещается в здоровую сторону, что приводит к расстройству дыхания и сердечной деятельности.
Киста легкого может осложниться спонтанным пневмотораксом, проявления которого зависят от количества поступившего воздуха в плевральную полость. Определяются коробочный перкуторный звук, резко ослабленное дыхание, на рентгенограммах – смещение средостения в здоровую сторону и коллапс легкого. Легочное кровотечение относится к редким осложнениям кист. При длительном существовании возможно злокачественное перерождение кистозных образований.
Диагностика.
Ведущую роль играет рентгенологическое исследование. Закрытая врожденная киста характеризуется наличием одиночного округлого или овального образования на фоне неизмененной легочной ткани. Контуры кисты четкие, структура однородна. Приобретенные ретенционные кисты на рентгенограммах могут иметь различные формы. Они выявляются на фоне других воспалительных заболеваний легких. Стенка такой кисты может быть в той или иной мере обызвествлена. Установлению диагноза помогает томо– и бронхография.
Рентгенологически при открытых легочных кистах выявляется одиночная полость с четко очерченными тонкими стенками, которые содержат воздух и жидкость с уровнем (рис. 33). Обычно легочная ткань вокруг них интактна, однако при постпневмонических кистах она может быть очагово или диффузно склеротически изменена.
Дифференциальная диагностика.
Проводится со злокачественными и доброкачественными опухолями, одиночными метастазами, эхинококком, внутрилегочными секвестрациями, абсцессами, гамартохондромами, междолевым плевритом, буллами, а также с шаровидными образованиями средостения, диафрагмы и грудной стенки.
Лечение.
Радикальным методом лечения является хирургическое вмешательство, которое заключается в резекции легкого. Иногда излечение наступает после иссечения кисты. При осложнении ее пиопневмотораксом производятся дренирование и санация плевральной полости. У ослабленных больных, когда риск операции высок, нагноившиеся кисты можно санировать путем трансторакальнго дренирования их полостей.
Острая эмпиема плевры
Эмпиема плевры (гнойный плеврит) – воспаление висцеральной и париетальной плевры с накоплением гноя в плевральной полости. В большинстве случаев она является осложнением воспалительных процессов в легких (пневмония, абсцессы), а также следствием травм и оперативных вмешательств на органах грудной клетки.Этиология и патогенез.
Ведущим фактором являются проникновение в плевральную полость микроорганизмов, которые при благоприятных условиях получают быстрое развитие. Среди микробной флоры чаще обнаруживаются стафилококки, а также грамотрицательные бактерии: кишечная, синегнойная палочки и протей. Часто все они малочувствительны или устойчивы к большинству антибиотиков. При специальном исследовании (анаэробные условия) в содержимом из плевральной полости выявляют неклостридиальные микроорганизмы – бактероиды и др. В плевральную полость инфекция может проникать по протяжению (при пневмониях, медиастинитах, гнойно–воспалительных процессах грудной стенки), гематогенным и лимфогенным путями при наличии очагов инфекции в организме. Различают первичные и вторичные эмпиемы. Первые развиваются вследствие первичного инфицирования плевры при проникающих ранениях грудной клетки и операциях на органах груди. К первичным эмпиемам относятся также те, которые развиваются при бактериемии. При вторичных эмпиемах плевра инфицируется за счет распространения гнойного процесса с легкого, грудной стенки, средостения, поддиафрагмального пространства. Реже они являются осложнением какого–либо другого гнойно–воспалительного заболевания (острый аппендицит, холецистит, панкреатит, прободная язва желудка и др.).
Эмпиемы плевры могут сообщаться с внешней средой. Чаще всего это происходит при прорыве острого гангренозного или гнойного абсцесса легкого в плевральную полость, в которую поступает не только гной, но и воздух. В таких случаях говорят о пиопневмотораксе, который может быть клапанным, что приводит к резкому нарушению дыхания. Кроме того, эмпиемы плевры подразделяются на острые (продолжительность заболевания до 2 мес.) и хронические (более 2 мес.). По характеру экссудата они могут быть гнойные и гнилостные. По распространенности патологического процесса выделяют эмпиемы свободные, среди которых различают тотальные, субтотальные и малые, а также ограниченные (базальные, пристеночные, медиастиналъные, верхушечные, междолевые, многокамерные).
При эмпиеме плевры наступают выраженные изменения со стороны сердечно–сосудистой и дыхательной систем, печени и почек. Особенно тяжелые нарушения возникают при прорыве гнойника легкого в плевральную полость. Это сопровождается тяжелой клинической картиной вследствие раздражения большого количества рецепторов висцеральной и париетальной плевры. Значительное всасывание токсинов приводит к поражению миокарда, печени, почек. В результате освобождения кининов резко нарушается микроциркуляторное русло. Увеличивается периферическое сопротивление и уменьшается объем сердечного выброса. В организме развиваются тяжелые метаболические расстройства, приводящие к ацидозу. При накоплении в плевральной полости большого количества гноя и воздуха смещается средостение, что затрудняет приток крови к сердцу, снижается объем циркулирующей крови. Сдавление легкого приводит к нарушению газообмена, в том числе в связи с раскрытием артериоловенулярных шунтов.
У больных развиваются выраженные нарушения белкового обмена, происходит большая потеря жидкости, а вместе с ней и натрия. В этих условиях почка задерживает натрий, однако с мочой выделяется много калия. Возникающая в организме гипокалием ия нарушает сократительную способность сердечной мышцы.
Патологическая анатомия.
Воспалительный процесс приводит к исчезновению мезотелиального покрова плевры, некрозу ее клеточных элементов. Расстройства микроциркуляции сопровождаются повышенной проницаемостью капилляров, накоплением в плевральной полости экссудата. Вначале происходит всасывание последнего с отложением на висцеральном и париетальном листках плевры фибринозного налета. В последующем интенсивность всасывания экссудата падает, он скапливается в плевральной полости, вызывая сдавление легкого и смещение средостения. В местах соприкосновения листков плевры, покрытых фибрином, происходит их склеивание и образование спаек вследствие развития соединительной ткани. Значительные изменения претерпевает висцеральная и париетальная плевра, в которой интенсивно развиваются коллагеновые волокна. Все это приводит к обширным фиброзным наложениям, которые сдавливают легочную ткань. Иногда острая эмпиема может осложниться флегмоной грудной стенки с ее деструкцией и образованием плеврокожного свища. При длительном существовании гнойного процесса в плевральной полости происходят выраженные деструктивные изменения в различных органах и системах.
Клиническая картина.
При всех формах острой эмпиемы плевры отмечаются боль на стороне поражения, кашель, одышка, повышение температуры тела, признаки гнойной интоксикации. Боль в груди чаще носит постоянный ноющий характер. Она усиливается при глубоком дыхании, кашле, а также перемене положения тела.
Если эмпиема плевры явилась осложнением абсцесса легкого, то во время кашля выделяется большое количество гнойной мокроты, что свидетельствует о формировании плеврального свища. При первичных эмпиемах плевры кашель часто бывает сухим. Выраженность одышки может быть разной. Она особенно заметна у больных с большим количеством жидкости в плевральной полости, а также при ограниченных (базальных) эмпиемах из–за острых болей, возникающих в момент глубокого вдоха. При объективном исследовании отмечаются ограничение дыхательных движений пораженной стороны грудной клетки, сглаженность межреберных промежутков, иногда отек мягких тканей над зоной скопления гноя в плевральной полости. Во время перкуссии здесь определяется притупление. Если отсутствуют воздух и спайки в плевральной полости, то верхняя граница тупости соответствует линии Эллиса–Дамуазо. Выше этой линии отмечается тимпанический звук, что объясняется сдавлением легочной ткани (признак Шкоды). При ограниченных эмпиемах перкуторные данные часто имеют небольшую диагностическую ценность. При аускультации везикулярное дыхание ослаблено или может полностью отсутствовать, что свидетельствует о большом количестве жидкости в плевральной полости. В проекции поджатого легкого определяется бронхиальное дыхание с наличием разнокалиберных влажных хрипов, шума трения плевры. У больных с хорошо дренируемой полостью через бронхоплевральный свищ выслушивается амфорическое дыхание.
Степень гнойной интоксикации бывает разная, но она более выражена при гнилостной эмпиеме. Лихорадка часто носит гектический характер с разницей колебания температуры в течение суток до 2–3°С, что сопровождается ознобами, потливостью, тяжелым общим состоянием больных. В связи с этим развивается дистрофия миокарда, которая характеризуется тахикардией, сердцебиением, неприятными ощущениями в области сердца, гипотонией. Наряду с легочно–сердечной недостаточностью поражаются также органы с богатой ретикулоэндотелиальной тканью. Отмечается увеличение печени, иногда с иктеричностью склер и желтизной кожных покровов. У многих больных имеются признаки токсической нефропатии (протеинурия, микрогематурия, цилиндрурия, повышенное содержание в моче лейкоцитов). В крови изменяется лейкоцитарная формула, наблюдается лейкоцитоз, развивается лимфопения. По мере прогрессирования гнойного процесса нарастает анемия. Происходит уменьшение белка в плазме преимущественно за счет альбуминов, что способствует расстройству водно–электролитного обмена.
Клиническая картина отдельных форм эмпиемы плевры имеет дополнительные признаки. При верхушечной эмпиеме могут выявиться триада Горнера, плексит или периартрит плечевого сустава, отек тканей в надключичной области. Пристеночные эмпиемы характеризуются более выраженной местной симптоматикой (сглаженность межреберных промежутков, отек мягких тканей, а при переходе воспалительного процесса на грудную стенку – гиперемия и флюктуация в зоне поражения). При базальной эмпиеме отмечается боль в нижних отделах грудной клетки ив области подреберья. Она усиливается при дыхании и может иррадиировать в плечо, лопатку. Постгравматические эмпиемы плевры часто являются следствием нагноения гемоторакса. Наиболее тяжело протекают те из них, которые развились на фоне повреждения легкого и осложнились открыть™ пневмотораксом. В этих случаях гнойный процесс нередко распространяется на грудную стенку с развитием флегмоны, что сопровождается развитием клинической картины по типу раневого сепсиса. Проявления послеоперационных эмпием зависят от характера перенесенной операции и степени загрязнения плевральной полости.
Крайне тяжело протекают анаэробные эмпиемы плевры. Встречаются молниеносные, быстропрогрессирующие и торпидные формы. Они характеризуются резко выраженной интоксикацией. Тахикардия достигает 140–160 ударов в минуту. Даже на ранних стадиях заболевания можно обнаружить крепитацию газов в подкожной клетчатке грудной клетки. Полученный при пункции гной имеет грязно–серый цвет, иногда геморрагический оттенок, зловонный запах.
Проявления пиопневмоторакса зависят от его форм. При острой форме прорыв абсцесса легкого в плевральную полость сопровождается острыми болями в грудной клетке, резко выраженной одышкой, бледностью кожных покровов и слизистых оболочек. АД может снижаться до минимальных цифр, пульс становится нитевидным. Если к тому же развивается напряженный пиопневмоторакс, то быстро прогрессируют расстройства дыхания. Больной принимает вынужденное положение – сидит, оперевшись руками о край кровати. Мягкая форма пиопневмоторакса развивается вследствие вскрытия в полость плевры небольшого абсцесса. Так как в этих случаях нет сообщения с крупным бронхом и мало гнойного содержимого, то общее состояние больных меньше страдает (нет тяжелой интоксикации, шока, резкого нарушения дыхания). Заболевание протекает по типу ограниченного пиопневмоторакса. Стертая форма пиопневмоторакса возникает при вскрытии небольшого абсцесса (чаще хронического) в ограниченную спайками часть плевральной полости. Это может остаться для больного незамеченным, а истинный характер заболевания выявляется при рентгенологическом исследовании.
Диагностика.
Основными методами диагностики острой эмпиемы плевры являются рентгенологические: рентгеноскопия (рентгенография) в различных проекциях, фистулография, плеврография, бронхография, томография. При ограниченных эмпиемах определяются округлые, полушаровидные и треугольной формы тени, что зависит от сращений в плевральной полости и локализации гнойной жидкости. Свободные эмпиемы характеризуются треугольной тенью с косой верхней границей (прямая проекция при вертикальном положении больного). При большом количестве гноя может выявляться смещение средостения в здоровую сторону, а в медиальном отделе подключичной области – светлый участок легочной ткани на фоне затемнения всей половины грудной клетки.
Чтобы определить вертикальные размеры гнойной полости, необходимо проводить рентгенологическое исследование в латеропозиции. В этих условиях жидкость перемещается вниз и образует горизонтальный уровень (феномен Ленка). Это очень важно для проведения дифференциальной диагностики с пневмонией, плевральными спайками, облитерацией реберно–диафрагмального синуса. Размеры полости могут быть уточнены с помощью плеврографии. При наличии плеврокожных свищей выполняют фистулографию. Бронхография помогает уточнить состояние легочной ткани в процессе подготовки больного к операции. Такое же значение имеет и томография. Дополнительным методом исследования является УЗИ.
Диагноз подтверждается путем пункции плевры, которую проводят в VIII межреберье по задней подмышечной линии. При ограниченных эмпиемах в этих случаях руководствуются физикальными и рентгенологическими данными. Определяют характер полученной жидкости (цвет, запах, наличие хлопьев), проводят ее бактериологическое и цитологическое исследование. В последние годы среди методов диагностики чаще стали использоваться бронхо– и торакоскопия. Первая позволяет уточнить состояние бронхиального дерева, произвести одновременно санирование его, вторая – дать оценку поверхности гнойной плевральной полости.
Дифференциальная диагностика.
Острую эмпиему плевры необходимо дифференцировать с пневмонией. Диагноз основывается на данных анамнеза, клинической картины и результатах рентгенологических методов исследования. Следует учитывать, что возможно развитие пара– и постпневмонических эмпием плевры. Диагностические затруднения могут вызывать ателектазы легкого различного генеза. Истинная природа заболевания выясняется с помощью бронхоскопии и пункции плевральной полости. При раке легкого иногда отмечается тотальное затемнение пораженной стороны, что напоминает свободную эмпиему плевры больших размеров. Правильный диагноз устанавливается после бронхоскопии, пункции плевральной полости и легочной ткани. Дифференциальную диагностику эмпиемы плевры необходимо проводить и с другими патологическими процессами: абсцессами легкого, кистами легкого, опухолями и кистами средостения, опухолями плевры, плевральными швартами, диафрагмальными грыжами.
Лечение.
Проводятся общеукрепляющая терапия и лечение, направленные на повышение защитных сил организма, применяются антибактериальные средства, рациональное дренирование плевральной полости в целях быстрейшего санирования и расправления легкого. Наряду с усиленным энтеральным питанием показано переливание свежеконсервированной крови, плазмы, аминокислотных смесей (мориамин, полиамин и др.), белковых гидролизатов, а также жировых эмульсий (интралипид, липофундин и др.). Одновременно назначают анаболические гормоны. С учетом результатов бактериологического исследования проводят антибиотикотерапию, при этом каждые 7 дней целесообразно менять комбинацию антибиотиков. При анаэробной эмпиеме более эффективны антибиотики пенициллинового ряда, левомицин, линкомицитин, клиндомицин. В этих случаях используют также метроиидазол. тинидазол.
Большое значение имеет коррекция иммунных процессов с помощью иммуноглобулина, гипериммунной плазмы, анатоксина. При пониженной реактивности организма стимулируют Т–систему введением тактивина, тималина, декариса.
Важнейшим в лечении острой эмпиемы является удаление гноя, что достигается разными путями. Наиболее простым методом является пункция плевральной полости. При этом после удаления гноя вводят антисептический раствор, который затем аспирируют обратно. Делают это до получения чистой жидкости. В конце процедуры через иглу вводят антибиотики, иногда в сочетании с 40–50% раствором димексида. В первые дни (5–7) такая манипуляция проводится ежедневно, в дальнейшем при ее эффективности она повторяется через 1–2 дня. В последние годы с этой целью стали шире использоваться протеолитические ферменты, которые вводят в конце промывания плевральной полости. Лизис сгустков может сопровождаться временной гипертермией, которая исчезает после повторных промываний. При пункции плевральной полости могут наблюдаться осложнения в виде повреждения легочной ткани, сосудов, сердца, органов брюшной полости.
Пункционный метод имеет ограниченное применение. При отсутствии эффекта в течение 5–7 дней необходимо прибегать к активному дренированию плевральной полости. Оно обычно используется у больных с тотальными эмпиемами, при длительных сроках их существования, а также в случаях деструкции легочной ткани и при наличии бронхоплевральных свищей. Преимуществом указанного способа лечения является возможность постоянного удаления гноя из очага поражения, постоянного или фракционного промывания его антисептическими растворами с введением антибиотиков, создания отрицательного давления в плевральной полости. Дренажную трубку проводят путем торакоцентеза или с помощью троакара и налаживают дренирование плевральной полости по Бюлау или Редону. Более эффективно промывание гнойного очага через двухпросветную трубку с использованием вакуумного устройства. В результате этого происходит не только санирование инфицированной зоны – непрерывная активная аспирация способствует ликвидации остаточной полости благодаря расправлению легкого. В других случаях на месте санированной полости развивается фиброторакс. При наличии бронхиального свища указанный метод лечения не всегда приводит к выздоровлению. У таких больных выполняется временная (на 2–3 недели) окклюзия бронхов поролоновой губкой или пломбой из другого материала. Затем во время бронхоскопии пломбу удаляют и санируют бронхиальное дерево.
Существуют открытые методы дренирования плевральной полости (торакостомия). Такие операции при острой эмпиеме плевры выполняются в случаях, если пункции и закрытый способ лечения неэффективны. При этом у многих больных с большими гнойными полостями производится резекция трех ребер длиной до 10 см и мягких тканей между ними (типа операции Коннорса). Способ А. В. Вишневского заключается в резекции одного ребра и заполнении полости масляно–бальзамическими тампонами. В последние годы применение торакостомии при острой эмпиеме резко ограничено, так как открытое дренирование плевральной полости имеет ряд серьезных недостатков. У больных развиваются коллапс легкого и фиксация его спайками, что требует длительного лечения, а нередко и выполнения повторных операций.
В случае неэффективности закрытого метода лечения при острой эмпиеме плевры проводится широкая торакотомия с удалением очага инфекции и тщательным санированием плевральной полости. Она особенно показана больным многокамерной эмпиемой. Одним из важных моментов операции является декортикация легкого, которое после этого быстро расправляется. При этом в ранних сроках не требуется выполнение плеврэктомии в отличие от хронической эмпиемы.
Хроническая эмпиема плевры
Хроническая эмпиема плевры – гнойно–воспалительный процесс в остаточной плевральной полости, который характеризуется грубыми морфологическими изменениями висцеральной и париетальной плевры вследствие длительного (более 2 мес.) течения заболевания с периодическими обострениями.Этиология и патогенез.
Основными условиями перехода острой эмпиемы в хроническую являются формирование остаточной полости и продолжаюшееся инфицирование ее стенок. Этому способствует ряд факторов. К их числу прежде всего относятся бронхиальные свищи, которые препятствуют достаточному расправлению легкого и обусловливают поддержание инфекции. Кроме того, формированию хронической эмпиемы благоприятствуют секвестры легочной ткани, снижение эластичности висцеральной плевры (легкое находится как бы в панцире), наличие нескольких гнойных зон в плевральной полости. Причиной возникновения хронической эмпиемы после травм и операций могут явиться инородные тела. Иногда она поддерживается остеомиелитом или хондритом ребер.
Переходу острого процесса в хронический способствует несвоевременное и недостаточно эффективное лечение больного. Сюда можно отнести неадекватное дренирование плевральной полости, что затрудняет удаление гнойно–некротических масс и ее санирование; нерациональную антибиотикотерашпо; недостаточное проведение лечебных мероприятий, направленных на повышение реактивности организма.
Однако главным в развитии хронической эмпиемы является неустранение остаточной полости и причины, обусловившей возникновение воспалительного процесса. При длительном существовании гнойной полости происходят большие потери белка, вследствие интоксикации наступают деструктивные изменения в органах, развиваются выраженные нарушения дыхания и кровообращения.
Патологическая анатомия.
При длительном течении гнойного воспалительного процесса фиброзные наложения обогащаются соединительной тканью, что сопровождается резким утолщением и уплотнением внутренних и наружных слоев плевры.
Клиническая картина.
Определяется величиной гнойной полости, характером изменений легочной ткани, наличием свищей. Основными признаками перехода острой эмпиемы в хроническую являются снижение или нормализация температуры тела, улучшение состояния больного, уменьшение гнойного отделяемого, сохранение объема остаточной полости. Однако при неблагоприятных условиях может наступить обострение процесса, что выражается в повышении температуры тела, появлении ознобов, усилении болей в грудной клетке, нарасиглами. Иногда применяют эндоскопическую блокаду бронха. Если риск радикальной операции высок, используют методы открытого дренирования гнойной полости с резекцией ребер. В этих случаях, когда легкое не способно расправиться и заполнить остаточную полость, производят торакопластику.
Способ Шеде заключается в том, что выкраивают больших размеров кожно–мышечный лоскут, обращенный основанием кверху. Соответственно ему иссекают ребра с межреберными мышцами и париетальной плеврой. Затем указанный кожно–мышечный лоскут укладывают на место и таким образом ликвидируют остаточную полость. Этот метод травматичный и редко применяется.
Торакопластика по Линбергу предусматривает поднадкостничную резекцию ребер над эмпиемным мешком, иссечение париетальной плевры, пересечение тканей межреберных промежутков поочередно спереди и сзади и погружение их до висцеральной плевры.
Используются способы мышечной пластики для закрытия легочно–плевральных свищей.
Все виды торакопластики заканчиваются дренированием остаточной полости.
Исход оперативных вмешательств при хронической эмпиеме в значительной степени зависит от правильного ведения послеоперационного периода. Наиболее опасным осложнением является кровотечение. Если в течение 2–3 ч после операции количество геморрагического отделяемого не уменьшается, то проводится реторакотомия. Аналогично действуют при нарастании клинических признаков кровопотери независимо от характера жидкости, поступающей через дренаж. Необходимо помнить о свернувшемся гемотораксе. После операции следует проводить мероприятия, направленные на профилактику пневмонии и ателектаза легкого.
Пищевод
Анатомо–физиологические сведения
Длина пищевода колеблется у мужчин в пределах 25–30 см, у женщин – 23–24 см. Она зависит не только от пола, но также от возраста, положения головы, длины туловища. В среднем длина пищевода у взрослого человека составляет 25 см. Устье пищевода у взрослого расположено на уровне VI шейного позвонка, нижняя граница – в пределах X–XII грудных позвонков. Толщина его стенки 3–4 мм. Ширина просвета в области устья – 18 мм, в грудном отделе – 21–25 мм, в дистальной части – 22 мм.Обычно различают три отдела пищевода – шейный, грудной и брюшной. Шейный отдел расположен на уровне C6–Th2 и длина его равна 5–6 см. Спереди он соприкасается с трахеей и левой долей щитовидной железы, задней поверхностью – с позвоночником, к боковым поверхностям прилежат сонные артерии, возвратные нервы, щитовидная железа. Шейный отдел пищевода является довольно подвижным и здесь застревает большая часть инородных тел.
Грудной отдел пищевода заканчивается на уровне входа в пищеводное отверстие диафрагмы. Длина его 16–18 см. От 2 до 4–5 грудных позвонков он лежит левее трахеи, при этом на уровне Th2, перекрещивается с дугой аорты, а на высоте Th5 тесно соприкасается с бифуркацией трахеи и левым главным бронхом. Слева от пищевода на этом уровне расположены грудной лимфатический проток, дуга аорты, возвратный нерв, левый и правый блуждающие нервы. Более дистально к пищеводу прилежит перикард. На уровне 2–3 см выше диафрагмы пищевод отклоняется влево. Важно отметить, что по ходу грудного отдела пищевода в непосредственной близости от него расположены лимфатические узлы (трахеобронхиальные, бифуркационные, парааортальные, медиастинальные).
Брюшной отдел пищевода имеет длину от 1 см до 7 см. Она изменяется в зависимости от фазы дыхания, внутрибрюшинного давления, подвижности той части пищевода, которая находится на уровне диафрагмы. Диафрагмальная часть пищевода и его брюшной отдел являются физиологической кардией. Анатомическая кардия – это место впадения пищевода в желудок под острым углом Гиса.
Выделяют четыре сужения пищевода. Первое сужение расположено в области перехода глотки в пищевод (глоточно–пищеводный сфинктер). Второе сужение находится на уровне пересечения пищевода с дугой аорты. Третье сужение обусловлено давлением на стенку пищевода левого главного бронха. Некоторые авторы два последних сужения объединяют в одно. Четвертое сужение расположено на уровне пищеводного отверстия диафрагма.
Стенка пищевода состоит из слизистой, подслизистой, мышечной и наружной (соединительнотканной) оболочек. Слизистая оболочка включает 20–25 слоев плоского эпителия. Подслизистая оболочка состоит из рыхлой соединительной ткани. Здесь расположены кровеносные и лимфатические сосуды, нервные сплетения, слизистые железы пищевода. Мышечная оболочка имеет внутренний циркулярный и наружный продольный слои. При этом в верхнем отделе пищевода они представлены поперечнополосатыми мышцами, а ниже уровня дуги аорты – гладкой мышечной тканью.
Кровоснабжение пищевода осуществляется ветвями нижней щитовидной и частично левой подключичной, бронхиальных и межреберных артерий, а также за счет аорты. Брюшной отдел пищевода васкуляризируется нижней диафрагмальной и левой желудочной артериями. Вены пищевода образуют сплетения, которые располагаются преимущественно в подслизистом слое. Кровь оттекает в непарную и полунепарную вены. Через вены желудка кровь из пищевода поступает также в воротную вену.
Лимфоотток происходит по лимфатическим сплетениям слизистой и подслизистой оболочек в сторону глотки и желудка. Лимфатические сосуды могут открываться непосредственно в грудной проток. Лимфа из шейного отдела пищевода обычно оттекает а паратрахеальные узлы, из средней трети – в медиастинальные, бифуркационные и трахеобронхиальные. Из нижнего отдела она направляется вдоль пищевода в надключичные лимфатические узлы, а таюке в желудочные коллекторы.
Иннервация пищевода весьма сложна. Парасимпатическая иннервация осуществляется блуждающими нервами, которые образуют переднее и заднее периэзофагеальные сплетения. Симпатическая иннервация пищевода обеспечивается через узлы пограничного и аортального сплетений, а также чревными нервами…
Между указанными сплетениями существует множество анастомозов. Интрамуральный нервный аппарат пищевода состоит из трех тесно связанных между собой нервных сплетений – адвентициального, межмышечного (ауэрбаховского) и подслизистого (мейснеровского).
Рубцовое сужение пищевода
Своевременное и правильное консервативное лечение больных с ожогами пищевода позволяет избавить их от сложных многоэтапных оперативных вмешательств. Вместе с тем, если не проводятся адекватные консервативные мероприятия и раннее блокирование, примерно у 70% пациентов развиваются рубцовые сужения или полная непроходимость пищевода.Послеожоговые стриктуры обычно расположены в местах физиологических сужений пищевода. Различают высокие стриктуры – глоточные, шейные, бифуркационные, а также низкие, которые локализуются в дистальных отделах пищевода (от уровня диафрагмы до кардии). По протяженности они могут быть короткими и трубчатыми. Короткие стриктуры имеют длину 1–3 см. В эту же группу входят мембранозные сужения, когда пищевод перекрывается перепонкой. Трубчатые стриктуры имеют протяженность более 3 см. Сужения пищевода могут быть одиночными и множественными. Степень их выраженности бывает разная вплоть до облитерации просвета. Обычно под сужением определяется супрастенотическое расширение, при этом вход в пищевод располагается в центре или эксцентрично с образованием кармана.
Клиническая картина.
Основной симптом заболевания – дисфагия. Однако в первые 2–3 недели после ожога дисфагия может отсутствовать и период так называемого мнимого благополучия может продолжаться до нескольких месяцев. Общее состояние больных остается удовлетворительным и они не обращаются за медицинской помощью. По мере развития на месте ожога грануля пион ной рубцовой ткани сужение пищевода прогрессирует и дисфагия нарастает вплоть до непроходимости жидкости. Проявления рубцовой стриктуры пищевода разнообразны и зависят от ее локализации, протяженности, степени сужения. Вследствие травматизации пищей суженного участка пищевода развиваются эзофагит и периэзофагит, что сопровождается неприятными ощущениями и болями за грудиной. У ряда больных появляется пищеводная рвота, которая вначале возникает при приеме твердой пищи, а затем наступает срыгивание даже воды. При высоких стенозах пищевода пища может попадать в дыхательные пути, вызывая кашель и приступы удушья. Нередко вследствие этого у больных развиваются бронхиты, хроническая пневмония, абсцессы легких. Прогрессирующее истощение ведет к резкому нарушению функций паренхиматозных органов. В результате развития рубцовой ткани наступает укорочение пищевода, что может привести к образованию грыжи пищеводного отверстия диафрагмы. Одним из грозных осложнений заболевания является возникновение злокачественной опухоли в области стриктуры. Серьезную опасность может представлять застревание пищи и инородных тел в суженном месте пищевода, особенно при двойных его стриктурах.
Диагностика.
Основана на данных анамнеза, результатах рентгенологического исследования и эзофагоскопии. В качестве контрастного вещества чаще применяют мелкодисперсную бариевую взвесь. Исследование проводят обычно в вертикальном положении больного в прямой и правой косой проекциях. Рубцовому сужению пищевода свойственна различная рентгенологическая картина. При протяженной стриктуре пищевод имеет вид карандаша (рис. 34), при ахалазии кардии – "мышиного хвоста" (рис. 35), а изъеденность его стенок характеризует злокачественную опухоль (рис. 36). Вместе с тем могут определяться короткие стриктуры пищевода как одиночные, так и множественные. Просвет пищевода на уровне сужения может иметь неправильную форму. Над стриктурой нередко встречается супрастенотическое расширение. Важным рентгенологическим признаком является регургитация контрастной взвеси, когда после приема последней вслед за увеличением ширины пищевода над местом сужения происходит выброс ее кверху. Это сопровождается уменьшением просвета пищевода, что объясняется усилением его перистальтики.
Важную роль в диагностике ожоговых сужений пищевода играет эзофагоскопия, которая позволяет определить характер стриктуры, состояние слизистой оболочки, наличие карманов, рубцов. Во время исследования выявляются эзофагит, перемычки, слюна, остатки пищи.
Лечение.
Основным методом лечения больных является бужирование пищевода, в случае его неэффективности выполняется оперативное вмешательство. Однако следует проводить и консервативное лечение, направленное на ликвидацию воспалительного процесса в зоне повреждения пищевода, стимуляцию эпителизации, замедление роста грануляционной ткани, снятие эзофагоспазма. Все это способствует улучшению проходимости пищевода. Необходимо отметить, что явления эзофагита после ожога пищевода наблюдаются несколько месяцев и даже лет. Возможно также образование язв, чему способствует травмирование стенки пищевода плохо обработанной и острой пищей. Между участками сужения могут длительно задерживаться куски пищи и вызывать гниение, что требует тщательного санирования.
Лечение при эзофагите должно быть комплексным. Оно имеет большое значение в профилактике рубцовых стриктур пищевода. При этом необходимо сочетать местную противовоспалительную терапию с общеукрепляющей. Одновременно проводят раннее (профилактическое) бужирование, которое начинают через 7–15 дней после ожога пищевода. Такой подход к лечению больных позволяет получить благоприятные результаты более чем в 90% случаев. При невыполнении указанных условий у ⅔ больных развиваются различной степени выраженности рубцовые сужения пищевода, требующие позднего (лечебного) бужирования. Последнее направлено на расширение развившейся стриктуры.
С этой целью проводят: 1. "слепое" бужирование через рот; 2. бужирование под контролем эзофагоскопии; 3. бужирование пищевода пластмассовыми бужами по струне–направителю; 4. "бужирование без конца" с помощью нити; 5. ретроградное бужирование.
"Слепое" бужирование.
За 20–30 мин до него назначается премедикация: подкожно вводят 1 мл 0,1% раствора атропина сульфата и 1 мл 1% раствора димедрола. Во время бужирования больной сидит на стуле со спинкой, а врач находится спереди от него. Применяется набор бужей с четными цифрами от № 8 до № 40. Перед использованием бужи помещают под струю горячей воды, чтобы они были эластичными. Затем их смазывают вазелином или глицерином. На высоте глотательного движения буж плавно без особого усилия вводят в пищевод. Во время одной манипуляции проводят не более двух номеров бужей. Последующее бужирование начинают с бужа, которым закончено предыдущее или на один номер меньше.
Серьезным осложнением указанного способа является перфорация пищевода, поэтому его целесообразно использовать в качестве поддерживающего бужирования, когда буж проходит без особого усилия. Нередко после выписки из стационара больные нуждаются в длительном поддерживающем бужировании. К сожалению, хирурги поликлиник и центральных районных больниц часто не владеют методами бужирования пищевода. Поэтому при проведении лечебного бужирования необходимо обучать больного данной манипуляции. Это позволит ему самостоятельно выполнять поддерживающее бужирование у себя дома. При этом, конечно, необходим контроль врача.
Бужирование под контролем эзофагоскопии.
Может быть использовано при эксцентрически расположенной стриктуре, резком супрастенотеческом расширении просвета пищевода, его деформации, наличии карманов, т.е. в случаях, когда врач испытывает трудности во время проведения бужа. Однако при данном методе бужирования не всегда просто найти вход в суженный участок пищевода. Кроме того, тубус эзофагоскопа закрывается бужом, что препятствует контролю за моментом его введения в стриктуру. Отсюда возникает опасность перфорации стенки пищевода при неосторожном движении эзофагоскопа и бужа.
Форсированное бужирование по струне–направителю.
После премедикации через пищевод в желудок проводят струну–направитель с бужом наименьшего диаметра. Под наркозом больному производят форсированное бужирование. При этом во время первого сеанса используют поочередно бужи до № 30. Через 5–6 дней сеанс повторяют, применяя бужи большего диаметра. В более тяжелых случаях форсированное бужирование осуществляют в 3–4 сеанса. Однако не всегда удается провести металлический проводник через рубцовую стриктуру пищевода. У таких больных накладывают гастростому и проводят "бужирование без конца".
"Бужирование без конца" с помощью нити
Применяется при резко выраженном сужении пищевода, которое имеет извилистый характер, мешотчатую форму супрастенотического расширения, а вход в стриктуру расположен эксцентрично. Особенно это необходимо учитывать при поражении проксимального сегмента пищевода и множественных стриктурах. Гастростому целесообразно накладывать по Штамму–Сенну и Кадеру, используя трансректальный доступ в левом подреберье. В последние годы некоторые хирурги с этой целью успешно пользуются лапароскопической гастростомой. Важно правильно формировать гастростому. В противном случае она может стать причиной возникновения ряда осложнений (нагноение послеоперационной раны, флегмона передней стенки живота, дерматит, перихондрит и т.д.). Через 6–8 суток больному дают проглотить капроновую нить с дробинкой. Нить извлекают из желудка корнцангом или с помощью введенной через гастростому воды. Бужирование осуществляют резиновыми трубками различного диаметра, которые прикрепляют к нити. Растягивая, их проводят через стриктуры и оставляют в пищеводе на несколько часов. Если трубка проводится через ротоглотку, это называется ортоградным бужированим, если через гастростому – ретроградным. Последний способ предпочтителен у больных с рубцовыми стриктурами в глоточном и шейном сегментах пищевода.
При резко выраженных явлениях эзофагита проводят противовоспалительную терапию, применяют обезболивающие средства. Редким осложнением является кровотечение из пищевода, хотя следы крови на буже встречаются значительно чаще, особенно при форсированном бужировании. С профилактической целью рекомендуется принимать раствор аминокапроновой кислоты по 1 столовой ложке каждые 15 мин в течение часа, а затем 6–8 раз в сутки.
Самым грозным осложнением при бужировании является перфорация стенки пищевода. Этому способствуют эрозивный эзофагит, который наблюдается при ранних стриктурах (через 3–4 недели), супрастенотическое расширение, узкий ход канала рубцовой стриктуры. Диагностика указанного осложнения представляет определенные трудности, что обусловлено отсутствием в ранние сроки патогномоничных симптомов. Они могут напоминать таковые при обострении эзофагита. Однако для эффективного лечения важна своевременная диагностика перфорации пищевода.
Клиническая картина данного осложнения зависит от уровня повреждения пищевода и медиастинальной плевры. В случаях перфорации стенки грудного отдела пищевода и образования ложного хода в средостении больного беспокоят боли в области позвоночника (при приеме нескольких глотков жидкости они усиливаются), затем выявляется подкожная эмфизема на шее, повышается температура тела. При повреждении пищевода и медиастиналъной плевры состояние больных резко ухудшается вплоть до развития плевропульмонального шока, тяжелой легочно–сердечной недостаточности. Возникают сильные боли в грудной клетке, одышка. При аускультации дыхание ослаблено или не выслушивается. Состояние прогрессивно ухудшается. При рентгенологическом исследовании контрастное вещество (йодолипол, кардиотраст) поступает за пределы пищевода, в плевральную полость. В случае повреждения абдоминального сегмента развивается картина "острого живота".
Больные с перфорацией пищевода вследствие бужирования подлежат хирургическому лечению. Объем операции зависит от характера повреждения. При травме верхнего сегмента производится шейная медиастинотомия по Разумовскому и накладывается гастростома. Если повреждена медиастинальная плевра, дополнительно дренируется плевральная полость. При перфорации грудного отдела пищевода с повреждением плевры выполняются торакотомия, ушивание отверстия в стенке пищевода, дренирование средостения и плевральной полости, накладывается гастростома или проводится трансназально зонд в желудок. В отдельных случаях при выраженных патологических изменениях пищевода выполняется операция Добромыслова–Торека. При поздней диагностике данного осложнения, когда развилась острая эмпиема плевры, накладывается гастростома и дренируется плевральная полость.
При перфорации абдоминального отдела пищевода в первые часы отверстие может быть ушито, в том числе с дополнительным укрытием лоскутом диафрагмы по Петровскому. Однако при значительных повреждениях хирурги вынуждены прибегать к операции Добромыслова–Торека.
В случаях бурно нарастающей картины медиастинита используют чрезбрюшинную медиастинотомию по Савиных–Розанову. При заднем гнойном медиастините целесообразно также применять метод проточного промывания с аспирацией содержимого при помощи двухпросветных трубок.
Историческая справка.
Еще в середине XIX в. стали накладывать желудочный свищ при рубцовых стриктурах пищевода. Это помогало спасать больных от голодной смерти. Русский ученый В. А. Барсов в 1842 г. разработал метод гастростомии в эксперименте. Впервые наложил желудочный свищ больному Sedillot в 1849 г. Первая гастростомия по поводу рубцового сужения пищевода выполнена в России А. С. Яценко в 1880 г. В 1894 т. Birchei предложил использовать кожу для создания искусственного пищевода, однако в дальнейшем этот метод не нашел широкого применения. В 1906 г. Roux создал у больного искусственный пищевод из тонкой кишки, расположив ее впереди грудины. Указанный способ был усовершенствован П. А. Герценом (1908), С. С. Юдиным (1941) и другими русскими хирургами.
Большой вклад в развитие хирургии рубцовых сужений пищевода внес известный хирург Беларуси И. М. Стельмашонок. Однако тонкокишечная эзофагопластика имеет свои недостатки в связи с частым развитием нехроза тонкой кишки или невозможностью ее использования из–за особенностей строения сосудов брыжейки. Поэтому в начале 60–х годов стали применять толстокишечную эзофагопластику, которую предложили в 1911 г. (Celling и Vulliel. С этой целью используют левую или правую половины толстой кишки. В последнее десятилетие все шире применяются различные способы эзофагогастропластики.
По месту расположения трансплантата различают впередигрудинную, загрудинную, внутриплевральную и заднемедиастинальную эзофагопластику.
Показания к операции.
Основное показание к операции – безуспешное бужирование рубцовых стриктур пищевода. Хирургическое лечение проводится также при полной облитерации просвета пищевода. Эзофагопластика показана больным с выраженным суп расте нот им еским расширением пищевода и резким истончением его стенок. Оперативному вмешательству подлежат больные с пищеводно–трахеальными и пищеводно–бронхиальными свищами. Наиболее частое противопоказание к операции – истощение.
Виды операций.
При тяжелом истощении больного накладывают гастростому, которая используется для ретроградного бужирования пищевода или является первым этапом хирургического лечения.
Гастростомия не должна вызывать деформацию желудка, а способствовать быстрому закрытию свища после удаления трубки. Этим требованиям больше всего отвечает гастростомия по Штамму–Сеннону и Кадеру. Первый способ заключается в том, что через трансректальный доступ в левом подреберье выводят в рану переднюю стенку желудка в виде конуса, в основании которого накладывают кисет. Затем вскрывают просвет желудка, проводят трубку, фиксируют ее и погружают в кисетный шов. Концами нити последнего прошивают все слои передней стенки живота. Кроме того, желудок фиксируют к брюшине отдельными швами. Способ Кадера отличается тем, что трубку инвагинируют не кисетными швами, а двухрядными продольными серозно–мышечными. При этом нитями швов второго ряда фиксируют стенку желудка к париетальной брюшине с захватом листка влагалища прямых мышц.
В последние годы в качестве трубки, вводимой в просвет желудка, применяется катетер Пеццера. У ряда больных успешно используется лапароскопическая гастростома.
Тонкокишечная пластика пищевода по Ру (1906) заключалась в том, что из начального отдела тонкой кишки формировался трансплантат, который проводился через подкожный тоннель до яремной вырезки. При этом отводящий конец кишки анастомозировался с желудком. Питание больного осуществлялось через зонд, проведенный в верхний конец трансплантата. В последующем выделялся шейный отдел, пищевод пересекался и накладывался эзофагоэнтероанастомоз.
П. А. Герцен (1907) усовершенствовал методику Ру, стал выполнять эту операцию в три этапа. На первом этапе мобилизованную тонкую кишку проводили не впередиободочно, а через брыжейку поперечной ободочной кишки и желудочно–ободочную связку, что позволяло помещать трансплантат в подкожном тоннеле до середины шеи. На втором этапе пересекали в дистальном сегменте мобилизованную кишку и накладывали гастроэнтероанастомоз. Третий этап заключался в выделении шейного отдела пищевода, пересечении его и наложении эзофагоэнтероанасгомоза.
Существенный вклад в разработку тонкокишечной пластики пищевода внес С. С. Юдин, который выполнил более 300 таких операций с летальностью 9%. Больному накладывается гастростома и производится мобилизация тощей кишки (отступив 8–10 см от связки Трейтца) с пересечением ее и наложением энтероанастомоза конец в бок. Мобилизованная кишка проводится впереди поперечной ободочной и располагается антеторакально в подкожном тоннеле. Через 615 дней накладывается анастомоз кишки с пищеводом конец в бок. При недостаточной длине трансплантата формируются эзофагостома и еюностома, которые в последующем соединяются посредством кожной трубки.
Толстокишечная пластика пищевода применяется, если требуется создать трансплантат большой длины. При этом может быть использована правая или левая ее половина, располагать которую можно изо– и антиперистальтически.
В качестве пластического материала применяется также желудок. Его преимущество заключается в том, что в этих случаях быстро восстанавливается прием пищи через рот. Однако данный метод противопоказан при заболеваниях желудка.
Иногда агрессивная жидкость оказывает более выраженное действие на стенку желудка, а не на пищевод, вызывая некроз стенки желудка, что требует экстренного оперативного вмешательства. В зависимости от площади некроза производят ушивание перфоративного отверстия, резекцию желудка или гастрэктомию. У большинства больных с комбинированными ожогами развиваются рубцовые изменения, которые приводят к стенозу привратника и деформации желудка. В таких случаях операцией выбора является резекция желудка. Если выполнить ее невозможно, накладывается гастроэнтроанастомоз.
Ахалазия кардии (кардиоспазм)
Ахалазия кардии (кардиоспазм, идиопатическое расширение пищевода, мегаэзофагус, кардиостеноз) – отсутствие расслабления мышечного сфинктера пищевода во время глотания. Это сопровождается нарушением тонуса и моторики пищевода, что клинически характеризуется задержкой в нем пиши. Впервые об этой болезни упомянул англичанин Уиллис в 1679 г. В 1884–1885 гг. русским клиницистом С. П. Боткиным в "Клинических лекциях" подробно были описаны клиника, дифференциальная диагностика и лечение "паралитического сужения пищевода" (цит. по: Б. В. Петровский. Избранные лекции по клинической хирургии, 1968). Термин "кардиоспазм" принадлежит Mikulicz (1903), в то время как понятие "ахалазия" – Репу, хотя ввел его в практику Hurst (1914).Частота кардиоспазма среди других заболеваний пищевода составляет около 5%, однако некоторые авторы называют и более высокую цифру. Ахалазия кардии чаще наблюдается в возрасте 20–40 лет, хотя она может встречаться и у детей, и у пожилых людей.
Этиология и патогенез.
Окончательно не выяснены. Ряд авторов считают его следствием врожденного недоразвития интрамурального нервного сплетения, что нарушает моторную функцию пищевода и кардиального отдела желудка, в результате чего развивается кардиоспазм. Согласно мнению других исследователей, причиной заболевания является расстройство функции вегетативной нервной системы в связи с повреждением блуждающих нервов интрамурального нервного аппарата. Это приводит к нарушению координации в нервно–мышечном аппарате пищевода, что сопровождается расслаблением его мышечного аппарата и спазмом кардии, которая утрачивает способность к релаксации. Важное значение в развитии заболевания придается также психоневротической теории, в соответствии с которой кардиоспазм развивается вследствие психических переживаний, переутомления, что нарушает координирующую роль центральной нервной системы.
Патологическая анатомия.
При первой стадии заболевания особых патологоанатомических изменений не имеется. При второй стадии наступает заметное сужение кардии и расширение пищевода до 3 см. Микроскопически наблюдаются периваскулярная инфильтрация плазматических клеток, гипертрофия и отек мышечных волокон, дегенерация нервных волокон в интрамуральных сплетениях. Третья стадия заболевания характеризуется выраженным сужением кардии и расширением просвета пищевода до 5 см, утолщением слизистой, подслизистой и мышечного слоя. Одновременно с этим происходят изменения нервного аппарата в виде периневрального склероза, гипоганглиоза. При четвертой стадии отмечается резкое сужение дистального отдела пищевода с выраженным расширением других его сегментов (от 5 до 20 см и более). Пищевод приобретает S–образную или мешковидную форму с явлениями эзофагита. Отмечаются атрофия и дистрофия мышечных волокон кардии, склероз дистального отдела пищевода с нарушением иннервации, аганглиоз. В далеко зашедших случаях происходит сращение пищевода с медиастинальной плеврой, развиваются медиастинит, хронический бронхит, пневмония, абсцессы легкого.
Клиническая картина.
Характеризуется триадой основных симптомов: дисфагией, регургитацией и загрудинными болями. Дисфагия относится к более ранним признакам заболевания. У ⅓ больных она появляется внезапно на фоне полного здоровья, а у ⅔ развивается постепенно. Степень выраженности дисфагии зависит не от длительности заболевания, а определяется характером расстройства функции пищевода. Нередко начало дисфагии связывают с психической травмой. Затем образуется своеобразный порочный круг, когда отрицательные эмоции усиливают дисфагию, а последняя в свою очередь отрицательно влияет на нервно–психическое состояние больного. При ранней дисфагии происходит чередование нормальной проходимости пищевода, так называемых светлых промежутков, с короткими периодамизадержки пищи, т.е. дисфагия носит интермитгирующий характер. Обычно лучше проходит полужидкая, теплая пища. Однако дисфагия может иметь и парадоксальный характер, когда задерживается жидкая пища, а твердая проходит хорошо.
Типичным признаком ахалазии кардии является регургитация, т.е. срыгивание пищи полным ртом. Она может появляться во время или после еды. Нередко регургитация возникает при наклоне туловища (синдром "завязывания шнурка"). В более поздних стадиях наблюдается ночная регургитация пищи с попаданием ее в дыхательные пути (симптом "мокрой подушки", "ночного кашля").
Третий основной симптом ахалазии – боли, которые возникают за грудиной при глотании и связаны со спазмом пищевода. В поздних стадиях заболевания боли появляются независимо от приема пищи и обусловлены эзофагитом, переполнением пищевода содержимым.
По классификации Б. В. Петровского различают четыре стадии ахалазии. Первая стадия заболевания характеризуется кратковременной задержкой пищи. Может наблюдаться срыгивание мелкими порциями, что объясняется спастическими сокращениями стенок пищевода. Диаметр просвета последнего, а также кардии не изменяются. Так как эвакуация пищи полная, хотя и замедленная, то регургитация в данной стадии отсутствует. Общее состояние больных не страдает.
Во второй стадии усугубляются нарушения функции кардии, что проявляется прежде всего прогрессированием дисфагии. Больные вынуждены запивать твердую пищу водой, производить глотательные движения, запрокинув голову назад, искать удобную позу во время приема пищи.
Эвакуация из пищевода замедляется, задерживаются пищевые массы. Это сопровождается регургитацией, возникновением болей за грудиной после еды. Иногда боли иррадиируют в спину. Состояние больных улучшается после опорожнения пищевода. В данной стадии заболевания имеют место расширение просвета пищевода и утолщение его мышечной стенки.
В третьей стадии ахалазии кардии наряду с функциональными нарушениями наблюдаются органические изменения пищевода. Кардиальный отдел его сужается вследствие развития рубцовой ткани, происходит дальнейшее расширение просвета выше расположенных сегментов пищевода. В этих случаях кардия долгое время закрыта, а в период небольшого раскрытия может пропустить лишь мелкие порции пищи. Вследствие длительной задержки пищевых масс в пищеводе образуется много содержимого, которое приводит к его резкому расширению и искривлению. В результате переполнения пищевода наблюдаются обильные срыгивания полным ртом, так называемая пищеводная рвота. Больных беспокоят жжение за грудиной, одышка, сердцебиение. Облегчение наступает после срыгивания. В этой стадии заболевания страдает общее состояние больных, наступает потеря массы тела и снижается трудоспособность.
Четвертая стадия характеризуется резким сужением кардии и максимальным расширением других сегментов пищевода, он приобретает мешковидную или S–образную форму, стенки его истончаются, перистальтика отсутствует. Пищевые массы задерживаются в пищеводе не только часами, а даже сутками. Вследствие их разложения возникает воспалительный процесс, который приводит к образованию трещин, язв различной степени выраженности, медиастинитов. Наступает истощение больных.
Диагностика.
Основывается на данных анамнеза, клиники заболевания и результатах рентгенологического исследования пищевода. При опросе больного выясняют его нервно–психическое состояние, выраженность триады ведущих симптомов. Окончательным в постановке диагноза является рентгенологическое исследование. Уже на обзорной рентгенограмме при третьей–четвертой стадиях ахалазии кардии могут определяться расширение средостения вправо, отсутствие газового пузыря желудка, а также легочные осложнения в виде пневмосклероза, пневмонии, абсцессов. Контрастное исследование при первой стадии заболевания выявляет кратковременный спазм кардии за первыми глотками бариевой взвеси. Слизистая пищевода и его просвет не изменены.
При второй стадии имеет место стойкий спазм кардии, который сочетается с незначительным расширением пищевода. Тонус его сохранен. Перистальтика вначале усилена, а затем наступает ее ослабление. Раскрытие кардии происходит только благодаря повышенному гидростатистическому давлению принятой жидкости или пищи. Газовый пузырь желудка обычно отсутствует. В сомнительных случаях используют пробу Кона (больному дополнительно дают 200–500 мл жидкости), пробу Херста (тугое заполнение пищевода до уровня дуги аорты бариевой взвесью).
Наиболее характерна рентгенологическая картина при третьей–четвертой стадиях заболевания. Дистальный отдел пищевода сужен и описывается как симптом "мышиного хвоста", "заточенного карандаша", "морковки". На остальном протяжении пищевод приобретает мешковидную или S–образную форму. Тонус его и перистальтика снижены или отсутствуют. Диаметр просвета пищевода достигает 15 см и более, количество содержимого – 3–5 л, контрастное вещество определяется через 24–48 ч после начала исследования.
Дифференциальная диагностика.
Проводится с раком пищевода, рубцовой стриктурой его, дивертикулом, доброкачественными опухолями. Общим симптомом для них является дисфагия. Однако при раке, например, она развивается постепенно и носит более стойкий характер. На рубцовый характер стриктуры указывает анамнез. Основным является рентгенологическое исследование. Важное значение имеет эзофагоскопия с биопсией. При ахалазии кардии обычно удается пройти аппаратом в желудок, чего нельзя сделать при раке кардии (феномен Мельтцера).
Лечение.
Лечебные мероприятия направлены на улучшение проходимости кардии, что достигается консервативными и хирургическими способами. В первой стадии заболевания успех может быть достигнут назначением щадящей диеты (стол 1 – 1а), обеспечением больному психического комфорта, применением антиспастических препаратов при гипертензионном варианте заболевания. После курса атропинизации иногда исчезают или уменьшаются дисфагия и болезненные ощущения за грудиной. Целесообразно назначать внутрь местные анестетики (15 мл 0,5–1 % раствора новокаина). Положительный результат дает прием препаратов метоклопрамида (церукала, реглана) курсами по 3–4 недели, седативных средств и витаминов группы В. Некоторые авторы рекомендуют курс инсулинотерапии (6–10 ЕД перед обедом), что повышает тонус парасимпатической нервной системы. Иногда улучшению способствуют вагосимпатические блокады, физиотерапия и лечебная гимнастика. Однако большинство авторов отмечают лишь кратковременный эффект от консервативного лечения, поэтому не следует применять его длительно. При отсутствии успеха показана кардиодилатация.
Дилатация кардии – насильственное ее расширение с помощью кардиодилататоров различной конструкции. Является основным методом лечения данного заболевания. Впервые он применен англичанином Расселем в 1889 г. Раньше кардиодилатация проводилась металлическим лилататором Штарка. В настоящее время отдается предпочтение пневматическому кардиодилататору, так как с его помощью удается провести расширение кардии с меньшей травматичностью. За несколько дней до указанной процедуры пищевод промывают раствором фурацилина (при застое пищевых масс). Это делают за 30 мин до кардиодилатации. Вводят также подкожно промедол и атропин. Проводят обезболивание языка, глотки, гортани 0,5% раствором дикаина. Во время кардиодилатации больной сидит. Раскрытый кардиодилататор задерживают в кардии на 15–60 с.
При отсутствии стойкого эффекта после применения кардиодилатации показано хирургическое лечение, которое, поданным некоторых авторов, используется у 15–20% больных, преимущественно в четвертой стадии заболевания. С этой целью предложено большое количество операций. Наиболее распространены операции Геллера (эзофагокардиомиотомия), Гейровского (эзофагофундоанастомоз) и их модификации.
Операция Геллера впервые описана в 1913 г. Сущность ее состоит в рассечении мышечной оболочки кардии с продолжением разреза на пищевод и дно желудка на 8–10 см. Если Геллер предлагал рассекать переднюю и заднюю стенки кардии, то Цаайер (1923) ограничивался только передней кардиомиотомией. По данным Б. В. Петровского, эта операция дает положительный результат в 70 % случаев. Цаайер предложил также кардиопластику диафрагмальным лоскутом (1956). После торакотомии в VIII межреберье слева Т–образным разрезом передней стенки пищевода, кардии и желудка иссекали мышечную оболочку и образовавшийся дефект закрывали лоскутом на ножке из левого купола диафрагмы. Т. А. Суворова предложила в качестве пластического материала использовать переднюю стенку желудка. Не потеряла своего значения и операция Гейровского, которая заключается в наложении анастомоза между расширенным сегментом пищевода и дном желудка. Однако серьезным ее недостатком является развитие эзофагита вследствие забрасывания желудочного содержимого в пищевод. Может быть использована также резекция пищевода и кардии с формированием эзофагогастроанастомоза.
Повреждения пищевода
В последние годы чаще встречаются механические повреждения пишевода, что обусловлено широким распространением эндоскопических исследований и внедрением в практику различных инструментальных манипуляций.В мирное время так называемые открытые повреждения пищевода при ранениях шеи и груди встречаются редко. Чаще врачи имеют дело с травмой пищеводной стенки со стороны слизистой. При этом повреждения могут быть непроникающими (ранения слизистого и подслизистого слоев) и проникающими. Они локализуются на уровне шейного, грудного и абдоминального отделов пищевода.
Причинами повреждения шейного сегмента чаще всего являются инородные тела или попытка их извлечения. При бужировании пищевода его стенка травмируется на уровне груди, а при кардиодилатации повреждается как нижнегрудной, так и абдоминальный отделы пищевода. Наиболее часто инструментальные разрывы локализуются на задней (шейный отдел) и правой боковой (грудной отдел) стенках, пищевода. Характер травмы зависит от ее механизма. Колотые и резаные раны наблюдаются при повреждении инородными телами, в то время как рваные – при инструментальных манипуляциях. Наряду с этим следует различать повреждение здоровых тканей и патологически измененных стенок пищевода при различных его заболеваниях. Повреждения пищевода могут быть изолированными с наличием ложного хода в средостение, а также сочетаться с нарушением целостности медиастинальной плевры, трахеи, бронхов, крупных сосудов.
Патологическая анатомия.
Перфорация пищевода сопровождается развитием воспалительного процесса в средостении, куда поступают воздух, слюна, частицы пищи. Происходит смещение трахеи. Серозный экссудат в ближайшие часы после травмы превращается в гнойное отделяемое. В плевральной полости развивается реактивное воспаление, а при повреждении медиастинальной плевры быстро образуется фибринозно–гнойный выпот. Тяжелые травмы характеризуются возникновением гнилостной флегмоны средостения. В результате нарушения функции эзофагокардиального сфинктера происходит заброс желудочного содержимого в околопищеводное пространство и плевральную полость, что характерно для повреждений нижних отделов пищевода.
Клиническая картина.
Складывается из общих и местных симптомов. К общим симптомам относятся бледность кожных покровов с цианотическим оттенком, одышка, холодный пот, тахикардия, повышение температуры тела. Более характерны местные симптомы: боль за грудиной, усиливающаяся при глотании, дисфагия, подкожная эмфизема шеи и верхней половины туловища, имеющая тенденцию к прогрессированию, пневмоторакс, а также напряжение мышц живота.
В зависимости от механизма, уровня и характера повреждения пищевода выделяется несколько вариантов течения заболевания. При травмировании шейной части пищевода инородным телом наиболее частый симптом – боль в указанной области, усиливающаяся при глотании и повороте головы. Могут наблюдаться осиплость голоса и дисфагия. Подкожная эмфизема в этих случаях является поздним признаком. В последующем появляются симптомы эзофагита и медиастинита.
При травме грудного отдела пищевода отмечаются боли в межлопаточной области и за грудиной, иногда подкожная эмфизема на шее. Больные принимают вынужденное положение с наклоном туловища вперед. Вскоре присоединяются симптомы медиастинита, плеврита, перикардита.
Проникающие повреждения абдоминального отдела пищевода характеризуются наличием перитонеальных симптомов.
Клиническая картина травмы пищевода при инструментальных манипуляциях имеет свои особенности. Прежде всего боль возникает непосредственно в момент разрыва стенки пищевода. При значительных повреждениях, когда развивается эмфизема средостения и пневмоторакс, больные могут находиться в шоковом состоянии. В то же время следует отметить, что при перфорации рубцово–измененного пищевода боль иногда появляется через 30 и более минут. При разрыве пищевода в процессе фиброэзофагоскопии подкожная эмфизема обнаруживается сразу и может быть распространенной. Повреждение абдоминального отдела пищевода характеризуется резко выраженным напряжением мышц передней брюшной стенки.
Диагностика.
Основным методом диагностики повреждений пищевода является рентгенологическое исследование. При обзорной рентгеноскопии (рентгенографии) грудной клетки определяется воздух в околопищеводной клетчатке (эмфизема средостения), в случаях повреждения плевры – пневмои гидроторакс. В последующем отмечаются расширение тени средостения, смещение трахеи, сглаженность контуров дуги аорты. Более информативны рентгеноконтрастные методы исследования. С этой целью может применяться наиболее доступное контрастное вещество – свежеприготовленная взвесь бария сульфата. Опасность инфицирования ею средостения преувеличена. Однако она не должна использоваться при обтурации пищевода инородным телом. Масляные контрастные препараты из–за вязкости не всегда могут пройти через узкое перфорационное отверстие. Наиболее приемлемы водорастворимые контрастные вещества, которые способны легко проникать через небольшие дефекты и не вызывать воспалительной реакции. Их применение не противопоказано при обтурации пищевода и наличии пищеводно–трахеальных или пищеводно–бронхиальных свищей. В процессе рентгенологического исследования, которое выполняется при вертикальном и горизонтальном положениях больного в различных проекциях, обращают внимание на выхождение контрастного вещества за пределы пищевода, при этом уточняют уровень повреждения и характер затекания контраста.
Рентгенологическая картина во многом зависит также от механизма травмы пищевода. Если она нанесена инородным телом, то в средостении определяется небольшое скопление контраста. При повреждении стенки пищевода фиброэзофагоскопом выявляется заполненный контрастным веществом ложный ход. Если же это произошло в результате бужирования, то он представлен в виде более узкой полоски. У больных с повреждением нижних сегментов пищевода контраст распространяется в забрюшинное пространство, а иногда обнаруживается и в свободной брюшной полости.
Важным методом исследования является фиброэзофагоскопия, которая позволяет определить наличие инородного тела и характер повреждения стенки пищевода. Ее возможности ограничены при микроперфорациях. С диагностической целью производится также пункция плевральной полости, однако она не относится к основным методам исследования.
Дифференциальная диагностика.
Разрыв грудного отдела пищевода необходимо дифференцировать с острыми заболеваниями органов дыхания и сердечно–сосудистой системы, которые также сопровождаются сильной болью (спонтанный пневмоторакс, инфаркт миокарда, расслаивающая аневризма аорты). Диагноз устанавливается на основании данных анамнеза и результатов специальных методов исследования. При разрыве нижнего отдела пищевода клиническая картина сходна с таковой при прободной язве желудка или двенадцатиперстной кишки, остром холецистите, панкреатите, тромбозе брыжеечных сосудов. Следует помнить и о более редком заболевании – спонтанной эмфиземе средостения (синдром Хеммана), когда происходит быстрое накопление воздуха в средостении, в подкожной клетчатке шеи и верхней половине туловища.
Лечение.
Консервативное лечение оправдано при поверхностных (непроникающих) повреждениях пищевода, а также у больных с микроперфорациями. Исключается питание через рот, назначаются антибиотики. Однако основным методом лечения при разрывах пищеводной стенки является оперативное вмешательство, которое включает три обязательных момента: ушивание раны пищевода, дренирование средостения и плевральной полости, исключение питания через рот. В зависимости от уровня повреждения применяют различные доступы. При травме шейного отдела пищевода используют доступ В. И. Разумовского, т.е. разрез кожи производят продольно по переднему краю левой или правой кивательной мышцы (в зависимости от стороны повреждения).
У больных с травмой грудного отдела пищевода используют чресплевральный доступ – по VII межреберью справа или слева (при повреждении наддиафрагмальной части). В тех случаях, когда произошел разрыв абдоминального отдела пищевода, выполняют лапаротомию. Дефект в стенке пищевода ушивают атравматической иглой двумя рядами швов. После этого дренируют средостение, выводя трубки через костодиафрагмальный синус (при травме грудного отдела пищевода), а также плевральную полость с соответствующей стороны. Чтобы исключить питание через рот, накладывают гастростому или проводят трансназально зонд в желудок. В послеоперационном периоде дренажи используют для аспирации экссудата и введения лекарственных препаратов.
При позднем поступлении или недостаточности швов у больных развивается гнойный медиастинит, летальность от которого достигает 30–50% и более. Успех их лечения зависит прежде всего от эффективности дренирования очага поражения. С этой целью используют метод постоянной аспирации с промыванием, разработанный Н. И. Каншиным. Суть его состоит в том, что в зависимости от уровня повреждения пищевода чресшейным, чресплевральным или чрезбрюшным доступами в средостение проводится двухпросветная дренажная трубка, конец которой выводится в стороне от операционной раны, и обеспечивается герметичность зоны дренирования. При нарушении целостности медиастинальной плевры обязательным является дополнительное дренирование плевральной полости. После операции налаживают промывание гнойного очага с активной аспирацией. Более редко используют чреспищеводное дренирование средостения. Оно противопоказано при повреждении плевры.
При перфорации с резко выраженными рубцовыми изменениями пищевода и обширных его разрушениях у лиц молодого и среднего возраста, поступивших в первые часы после травмы, можно выполнять резекцию пищевода с эзофагопластикой.
Инородные тела пищевода
Основными причинами попадания инородных тел в пищевод являются поспешная еда, привычка держать различные предметы во рту, наличие зубных протезов. Чаще всего они проходят через просвет пищевода, а затем по желудочно–кишечному тракту выходят наружу естественным путем. Обычно инородные тела задерживаются в местах физиологических сужений пищевода. Этому способствуют различные патологические изменения его (рубцовые стриктуры, опухоли, дивертикулы и др.).Клиническая картина.
Зависит от вида инородного тела, уровня его задержки, характера повреждения пищевода. Она менее выражена, если просвет пищевода остается частично свободным. Больные жалуются на чувство стеснения за грудиной, боль в горле, дисфагию. Эти симптомы усиливаются во время употребления жидкостей. При полной обтурации просвета присоединяется регургитация (пищеводная рвота) при приеме пищи. Осо – бую опасность представляют крупные инородные тела, которые, задерживаясь у входа в пищевод, могут вызвать мгновенную смерть от асфиксии. Такие случаи встречаются при поспешной еде мясной пищи. При длительном нахождении крупного инородного тела в пищеводе образуется некроз пищеводной стенки, что сопровождается усилением болей, явлениями интоксикации в связи с присоединившимся острым медиастинитом. Инородное тело может вызвать перфорацию пищевода, клиническая картина которой описана в соответствующем разделе.
Диагностика.
Металлические инородные тела выявляют при обзорной рентгенографии, в остальных случаях необходимо выполнять многоосевое рентгеноконтрастное исследование. Важное диагностическое значение имеет фиброэзофагоскопия, которую следует выполнять с особой осторожностью, чтобы не повредить стенку пищевода.
Лечение.
Заключается в удалении инородного тела с помощью эзофагоскопа. Чаще такие больные поступают в отоларингологические стационары, где выполняются эти манипуляции. Если такое лечение неаффективно, а тем более в случае повреждения пищевода во время попытки извлечения инородного тела пациенты переводятся в хирургические стационары. Суть оперативного вмешательства состоит в проведении эзофаготомии, удалении инородного тела, ушивании стенки пищевода. При этом в зависимости от уровня локализации инородного тела используются шейный, чресплевральный или чрезбрюшинный доступы. В случае позднего обращения больных, у которых произошла перфорация пищевода с развитием гнойного медиастинита, а возможно, и гнойного плеврита после удаления инородного тела, операция заканчивается адекватным дренированием зоны повреждения, методика которого описана выше (см. Повреждения пищевода).
Дивертикулы пищевода
Дивертикулы пищевода представляют собой ограниченное выпячивание пищеводной стенки. По механизму образования их делят на пульсионные и тракционные. Пульсионные дивертикулы возникают вследствие выпячивания стенки пищевода под воздействием высокого давления в его просвете во время перистальтических движений. Причиной образования тракционных дивертикулов является воспалительный процесс в околопищеводной клетчатке, который вытягивает стенку пищевода. В дальнейшем к данному механизму присоединяются пульсирующие факторы.В зависимости от локализации различают фарингоэзофагеальные (ценкеровские), бифуркационные и эпифренальные дивертикулы. Чаще они бывают приобретенными. Врожденные дивертикулы встречаются редко. Могут наблюдаться так называемые релаксационные (функциональные) дивертикулы, которые обусловлены нарушением иннервации пищеводной стенки. Они выявляются при рентгенологическом исследовании и исчезают после прохождения глотка контрастного вещества.
Патологическая анатомия.
Глоточнопищеводные (ценкеровские) дивертикулы образуются в области треугольника Лаймера–Геккермана на задней стенке глотки (над входом в пищевод), где отсутствует или слабо выражена мышечная оболочка. При повышении давления в этом месте возникает выпячивание пищеводной стенки, что ведет к образованию дивертикула, устье которого находится на задней стенке глотки. Увеличиваясь в размере, что обычно происходит медленно, дивертикул опускается вниз между стенкой пищевода и позвоночником, а также увеличивается в поперечнике за счет смещения боковых мышц шеи. Стенка дивертикула не содержит мышечных волокон, а со стороны его просвета выстлана слизистой, которая может изъязвляться и вызывать осложнения. Бифуркационные дивертикулы локализуются на передней и боковых стенках пищевода, размеры их не превышают 2–4 см и состоят они из всех слоев пищеводной стенки. Эпифренальные дивертикулы расположены на 6–12 см выше кардии в области передней или правой боковой стенки пищевода. Как и глоточно–пищеводные дивертикулы, они могут достигать больших размеров, однако сращений с соседними органами чаще всего не отмечается.
Клиническая картина.
Зависит от размеров дивертикулов. Вначале они могут ничем себя не проявлять. Однако по мере увеличения дивертикула больных начинают беспокоить чувство першения в горле, "царапанья", неприятные ощущения при глотании. Затем появляются типичные симптомы заболевания. Одним из основных признаков глоточно–пищеводного дивертикула является дисфагия вследствие наполнения его пищей и сдавления пищевода. В целях улучшения прохождения пищевых масс больной вынужден производить наклоны головы в разные стороны, давить на шею, иногда вызывать рвотные движения. После опорожнения мешка пациенты отмечают облегчение. Нередко отмечается регургитация содержимого дивертикула в полость рта, особенно при горизонтальном положении больного. Во время сна это может приводить к аспирации рвотных масс и развитию затем легочных осложнений (бронхиты, пневмонии, абсцессы).
При фарингоэзофагеальных дивертикулах больших размеров во время отведения головы назад в области шеи определяется выпячивание мягкой консистенции, над которым при приеме жидкости выявляется шум плеска. Это может сопровождаться болью за грудиной, набуханием вен шеи и другими признаками, характерными для опухолей и кист средостения (затрудненное дыхание, осиплость голоса). В результате задержки пищи в дивертикуле, ее разложения появляется гнилостный запах изо рта. У больных развивается дивертикулит, который может привести к образованию эрозий, язв, кровотечению, перфорации стенки дивертикула с развитием медиастинита.
Бифуркационные дивертикулы характеризуются менее выраженной клинической картиной. Больных могут беспокоить боль за грудиной, явления дисфагии. Однако часто клинические проявления их наступают только тогда, когда развиваются осложнения. Это касается и эпифренальных дивертикулов, которые также вначале больных не беспокоят, но по мере их увеличения появляются загрудинные боли, тошнота, рвота, одышка, дисфагия. Заболевание усугубляется при возникновении осложнений: дивертикулита, кровотечения, гнойного медиастинита с прорывом содержимого в полостные образования средостения. В редких случаях может развиться рак в области дивертикула.
Диагностика.
Основывается на клинической картине заболевания и главным образом на результатах рентгенологического исследования, которое позволяет определить локализацию дивертикула, его размеры, ширину шейки, время задержки контрастного вещества. Кроме того, диагностика дает возможность выяснить, имеются ли признаки развития полипа, рака в области дивертикула, а также подтвердить или исключить наличие пищеводно–респираторных и пищеводно–медиастинальных свищей. Эндоскопическое исследование позволяет оценихь состояние слизистой, диагностировать полипы, опухоли. Оно должно проводиться с большой осторожностью, чтобы не перфорировать истонченную стенку дивертикула.
Дифференциальная диагностика.
Проводится с другими заболеваниями пищевода, а также с кистами и опухолями средостения, медиастинитом.
Лечение.
Консервативные мероприятия показаны при небольших дивертикулах, отсутствии осложнений или высоком риске оперативного вмешательства. Они направлены на профилактику задержки пищи в мешке дивертикула и развития дивертикулита. С этой целью рекомендуют употреблять хорошо измельченную пищу с исключением острых блюд. Она не должна быть очень холодной или горячей, что вызывает нежелательный спазм пищевода. После еды следует выпить небольшое количество воды и принять положение, при котором создаются лучшие условия для опорожнения дивертикула. Иногда прибегают к санированию мешка путем его промывания.
Хирургическое лечение показано при развитии осложнений дивертикулов, а также при больших их размерах, длительной задержке пищи. В зависимости от локализации дивертикула выбирают операционные доступы – шейный, правоили левосторонний, трансторакальный. Операцией выбора является дивертикулэктомия. При небольших дивертикулах иногда производят их инвагинацию.
Спонтанный разрыв пищевода
Спонтанный разрыв пищевода впервые описан Бурхаве в 1724 г. К развитию заболевания приводит резкое повышение давления в просвете пищевода с патологически измененными стенками. Подобное происходит вследствие того, что во время рвотных движений одновременно раскрывается эзофагокардиальный сфинктер, напрягаются мышцы брюшного пресса, сокращаются диафрагма и мышечная оболочка желудка, но остается закрытым глоточнопищеводный сфинктер. В результате этого, особенно на фоне алкогольного опьянения, возникает продольный или поперечный разрыв стенки пищевода, который иногда продолжается на кардиальный отдел желудка.Клиническая картина и диагностика.
Спонтанный разрыв пищевода обычно характеризуется выраженной клинической картиной. На фоне полного здоровья во время кашля или чихания возникает острая боль в грудной клетке и подложечной области. Появляются тахикардия, одышка, холодный пот, бледность кожных покровов с цианотичным оттенком. При обширном разрыве пищевода развиваются пневмои гидроторакс, а затем пиопневмоторакс и медиастинит. Важным симптомом является подкожная эмфизема. В случае разрыва пищевода в нижней трети клиника заболевания напоминает таковую при перфорации гастродуоденальной язвы.
Лечение.
В ранние сроки синдрома Бурхаве показано ушивание поврежденной стенки пищевода, а в более поздние (спустя 24 ч) производят дренирование средостения и плевральной полости. Операция заканчивается гастростомией.
Пищеводно–респираторные свищи
Пищеводно–респираторные свищи бывают как врожденного характера, так и приобретенного. Приобретенные пищеводно–респираторные свищи встречаются при травме пищевода, осложненной гнойником, который опорожняется в просвет дыхательных путей. Они могут наблюдаться при осложненных воспалительным процессом дивертикулах пищевода, а также при прорастании рака пищевода в трахею и бронхи. Чаще встречаются пищеводно–бронхиальные свищи. Они могут быть одиночными и множественными.Клиническая картина.
Зависит от причины, которая привела к возникновению свища. Если он травматического характера, больные жалуются на внезапную боль, сопровождающуюся сильным кашлем во время приема пищи. В мокроте обнаруживаются остатки пищевых масс. Пищеводно–респираторные свищи другой этиологии отличаются тем, что их возникновению предшествует клиническая картина соответствующего воспалительного заболевания или злокачественного новообразования.
Диагностика.
Основана на данных рентгенологического и эндоскопического исследований легких, трахеобронхиального дерева и пищевода. На обзорных рентгенограммах определяются признаки хронической пневмонии, абсцессы легких, усиление легочного рисунка. Однако достоверным признаком свища является затекание контрастного вещества из просвета пищевода в дыхательные пути. Устье свища можно обнаружить при эзофагоскопии и трахеобронхоскопии. Подводя к нему катетер, вводят через него водорастворимые контрастные вещества и получают серию снимков, на основании которых судят о характере пищеводно–респираторного свища.
Лечение.
Представляет большие трудности. Консервативные мероприятия в этих случаях безуспешны. При свищах на почве рака легкого операция, как правило, ограничивается наложением гастростомы для питания больных. Если же свищи имеют травматическую этиологию, то в ранние сроки производится разобщение органов с ушиванием дефектов. При значительном изменении легких свищ ликвидируется во время их резекции, а иногда и пульмонэктомии.
Кисты пищевода
Кисты пищевода представляют собой редкий порок развития. Слизистая их может иметь все виды эпителия пищеварительного канала. Содержимое кисты бывает серозным, слизисто–гнойным, желатинообразным, что зависит от строения слизистой оболочки. Стенка ее интимно сращена с пищеводом. Размеры кист колеблются от 2–3 до 8–10 см и более. Они обычно имеют шаровидную или овоидную форму и не сообщаются с просветом пищевода.Клиническая картина.
Зависит от величины, локализации и характера содержимого кисты. Часто кисты не беспокоят больных и случайно обнаруживаются во время рентгенологического исследования. Однако при быстром накоплении секрета они увеличиваются и сдавливают соседние органы, вызывая соответствующую симптоматику. В более тяжелых случаях, содержимое кисты нагнаивается, что может привести к перфорации ее стенки с образованием пиопневмоторакса, пищеводно–респираторных свищей.
Диагностика.
Основывается на данных анамнеза клинической картины и результатах дополнительных методов обследования, среди которых наиболее информативен рентгенологический. При этом в заднем средостении определяется шаровидной формы тень, которая оттесняет пищевод. При наличии газа в просвете кисты выявляется уровень жидкости. Используются и другие методы диагностики: фиброэзофагоскопия, компьютерная томография. Кисту пищевода необходимо дифференцировать с лейомиомой, которая имеет более округлую форму, с диафрагмальной грыжей.
Лечение.
Показано хирургическое вмешательство, при этом операция должна предшествовать развитию осложнений со стороны кисты. Производится торакотомия в IV–VI межреберьях слева или справа в зависимости от того, в какую сторону смещена тень кисты. Суть операции состоит в иссечении кисты.
Пептические язвы пищевода
Пептические язвы чаще локализуются в нижней трети пищевода. Они имеют небольшие размеры, круглую или овальную форму, подрытые края и обычно бывают одиночными. Первичные пептические язвы пищевода по своему происхождению сходны с язвами желудка и двенадцатиперстной кишки, в то время как вторичные развиваются на почве рефлюкс–эзофагита. Они могут образовываться на фоне эзофагита у больных, страдающих грыжами пищеводного отверстия диафрагмы. Не исключается также их возникновение при синдроме Золлингера–Эллисона.Клиническая картина.
Больные жалуются на боль за грудиной или в подложечной области, иррадиирующую в спину, что может симулировать стенокардию. Боли появляются во время приема пищи или спустя несколько минут. Иногда они напоминают таковые при язве желудка. Вторым важным признаком пептической язвы пищевода является дисфагия, которая может носить как спастический характер, так и обусловливаться рубцовыми изменениями. Нередко больных беспокоит изнурительная изжога, усиливающаяся ночью. Длительное течение заболевания ведет к стриктуре или полной непроходимости пищевода. Среди других осложнений следует отметить перфорацию в околопищеводную клетчатку, плевральную и брюшную полости, кровотечение, гнойные медиастиниты,' пневмонии, образование пищеводно–респираторных свищей.
Диагностика.
Основана на результатах рентгенологических и эндоскопических методов исследования. Во время рентгеноскопии определяется "ниша" в дистальном сегменте пищевода, которая может напоминать дивертикул. Диагноз уточняются с помощью фиброэзофагоскопии, когда одновременно берется биопсия, позволяющая дифференцировать природу заболевания (язва, рак и т.д.).
Лечение.
При неосложненных пептических язвах пищевода проводится такое же консервативное лечение, как при язвенной болезни желудка и двенадцатиперстной кишки. Хирургическое вмешательство выполняется при возникновении стриктуры пищевода, кровотечении, малигнизации язвы, а также при частых рецидивах заболевания до развития осложнений. В более ранние сроки операция показана больным с грыжей пищеводного отверстия диафрагмы. При рубцовых стриктурах пищевода операция производится после безуспешных попыток бужирования.
Применяются различные виды оперативных вмешательств: селективная проксимальная ваготомия, фундопликация по Ниссену, проксимальная резекция желудка, резекция пищевода с эзофагопластикой.
Диафрагма
Анатомо–физиологические сведения
Диафрагма представляет собой сухожильно–мышечное образование, которое разделяет брюшную и грудную полости. Мышечные волокна ее отделов (поясничного, реберного, грудинного), направляясь кверху и радиально, заканчиваются сухожильным центром. При этом образуются грудино–реберные пространства (треугольники Ларрея слева и Морганьи справа) и пояснично–реберные (треугольник Бохдалека). Медиальные ножки диафрагмы на уровне 1 поясничного позвонка образуют отверстие, через которое проходят аорта и грудной лимфатический проток. Правая медиальная ножка диафрагмы, а иногда и левая, принимают участие в формировании пищеводного отверстия диафрагмы. В сухожильном центре диафрагмы имеется отверстие для нижней полой вены. Со стороны брюшной полости диафрагма покрыта фасцией и брюшиной, со стороны грудной – фасцией и плеврой. Между диафрагмой и расположенными ниже ее органами (печень, желудок, селезенка) имеются связки. Высота стояния диафрагмы может меняться, однако в норме правый купол расположен выше (IV межреберье), чем левый (V межреберье). Кровоснабжение диафрагмы происходит за счет диафрагмальных и межреберных артерий. Отток крови осуществляется по одноименным венам через непарную и полунепарную вены, а также по венозной сети пищевода. Лимфатические сосуды диафрагмы отводят лимфу через медиастинальные, перикардиальные, парааорталъные и околопищеводные узлы. В иннервации диафрагмы принимают участие диафрагмальные и межреберные нервы.Диафрагма обеспечивает поддержание разницы давления в грудной и брюшной полостях, обусловливая нормальные взаимоотношения между органами. Она принимает участие в вентиляции легких, способствует оттоку венозной крови из органов брюшной полости и выполняет другие функции.
Диафрагмальные грыжи
Под диафрагмальной грыжей понимают перемещение органов брюшной полости в грудную через естественные или патологические отверстия или слабые зоны в грудобрюшной преграде. Диафрагмальные грыжи являются истинными, если содержат весь комплекс таких обязательных компонентов, как грыжевый мешок, грыжевое содержимое и грыжевые ворота. При отсутствии грыжевого мешка их называют Ложными.По происхождению грыжи диафрагмы делят на травматические, которые возникают в результате открытой или закрытой травмы, и нетравматические. Среди последних выделяют ложные врожденные грыжи, образующиеся вследствие незаращения сообщений между брюшной и грудной полостями, истинные грыжи слабых зон диафрагмы, грыжи естественных отверстий диафрагмы и грыжи атипичной локализации.
Истинные грыжи слабых зон диафрагмы возникают в результате повышения внутрибрюшинного давления и выхождения органов брюшной полости через грудинно–реберный (грыжа Ларрея–Морганьи) или пояснично–реберный (грыжа Бохдалека) треугольник. В области указанных треугольников не имеется мышц, а диафрагма представлена лишь соединительнотканной пластинкой, к которой прилегают плевра и брюшина. Грыжи могут возникать в области слаборазвитого грудинного отдела диафрагмы (ретростернальные грыжи).
Наиболее часто встречаются грыжи пищеводного отверстия диафрагмы. Они излагаются в разделе “Грыжи пищеводного отверстия диафрагмы”.
Клиническая картина.
При диафрагмальной грыже можно выделить три группы симптомов, которые обусловлены нарушением функции органов дыхания из–за сдавления легкого на стороне поражения и смещения средостения, пищеварительного тракта вследствие перемещения органов брюшной полости в плевральную и расстройством деятельности сердечно–сосудистой системы в результате смещения сердца, крупных сосудов. Наиболее частыми симптомами диафрагмальной грыжи являются боль, чувство тяжести в подложечной области, одышка^ сердцебиение, которые усиливаются после еды. Проявления заболевания зависят от степени наполнения перемещенных органов в грудную полость, их перегиба и сдавления, выраженности коллапса легкого и смещения средостения, формы и размеров грыжевых ворот. Нередко в области грудной клетки на стороне грыжи определяются бульканье и урчание. После еды может наблюдаться рвота, которая приносит облегчение. Резко ухудшается состояние больных при возникновении ущемления диафрагмальной грыжи. В этих случаях появляются резкие боли в подложечной области и соответствующей половине грудной клетки. Если ущемленным органом является желудок, наблюдается рвота “кофейной гущей”. При отсутствии своевременного оперативного вмешательства наступают некроз и перфорация стенки полого органа с развитием пиопневмоторакса.
Диагностика.
На возможность развития диафрагмальной грыжи указывают перенесенная травма, наличие рубцов в области грудной и брюшной стенок, ограничение подвижности грудной клетки на стороне поражения, сглаживание межреберных промежутков. При длительно существующих грьгжах с большим диаметром их ворот определяется западение живота в связи с перемещением в плевральную полость значительной части брюшных органов. Во время перкуссии над соответствующей стороной грудной клетки отмечается притупленно–тимпанический звук, а при аускультации на фоне ослабленного дыхания (или его отсутствия) выявляются кишечные шумы или шумплеска.
Окончательный диагноз устанавливается при рентгенологическом исследовании. При обзорной рентгеноскопии в случае перемещения желудка в плевральную полость определяется горизонтальный уровень жидкости слева, поднимающийся при приеме жидкости. Подобную картину иногда путают с таковой при гидрогемопиопневмотораксе и неоправданно производят пункцию плевральной полости, а иногда и дренирование ее. При выпадении петель тонкого кишечника на фоне диффузного затемнения легочного поля отмечаются отдельные зоны просветления. О наличии в плевральной полости кишки свидетельствует гаустрация. Перемещение печени и селезенки сопровождается затемнением соответствующего отдела легочного поля. В некоторых случаях при обзорной рентгеноскопии могут ко итерироваться купол диафрагмы и расположенные выше него органы брюшной полости. Для уточнения возможности перемещения в плевральную полость желудка производят его зондирование, при этом в случае подтверждения диагноза рентгеноконтрастный зонд определяется выше диафрагмы.
Наиболее информативно рентгеноконтрастное исследование желудочно–кишечного тракта (рентгеноскопия желудка, ирригоскопия, ирригография). Оно позволяет определить орган, который переместился в грудную полость, уточнить локализацию и размеры грыжевых ворот. Необходимо иметь в виду, что в плевральной полости могут одновременно находиться различные полые органы (желудок, тонкий и толстый кишечник). С учетом этого проводится рентгеноконтрастное исследование.
Важное диагностическое значение имеет также фиброэзофагогастроскопия при перемещении в плевральную полость желудка.
Дифференциальная диагностика.
Проводится с заболеваниями желудочно–кишечного тракта, дыхательной и сердечно–сосудистой систем. Диагностические трудности возникают при ущемленных диафрагмальных грыжах, так как симптоматика при этом может манифестировать клиническую картину "острого" живота или патологический процесс в плевральной полости. Сомнения разрешает квалифицированно проведенное рентгенологическое исследование.
Лечение.
Диафрагмальные грыжи служат показанием к операции в связи с возможностью их ущемления. Выбор доступа зависит от локализации грыжи, ее размеров, особенности оперативного вмешательства. Верхнесрединная лапаротомия применяется при парастернальных грыжах. При грыжах других локализаций используют трансторакальный доступ. В то же время при грыжах Бохдалека дефект диафрагмы можно ушить трансабдоминально. Важным моментом операции является тщательная мобилизация перемещенных органов и низведение их в брюшную полость. На этом этапе приходится разделять многочисленные сращения между выпавшими органами, грудной стенкой, грыжевыми воротами. После этого необходимо ушить дефект диафрагмы, стараясь при возможности создать дубликатуру. При больших размерах дефекта используют протезы из капрона, нейлона, тефлона и др.
При ущемленных диафрагмальных грыжах применяют трансторакальный доступ. Рассекают ущемляющее кольцо и оценивают состояние выпавшего органа. При сохранении жизнеспособности его перемещают в брюшную полость, в случае необратимых изменений производят резекцию, а при некрозе желудка – гастрэктомию. После этого восстанавливают целостность диафрагмы.
Релаксация диафрагмы
Релаксация диафрагмы впервые описана Ж. Пти в 1774 г. Она характеризуется отсутствием или резким истончением мышц купола диафрагмы или определенной ее части. Релаксация диафрагмы бывает врожденной и приобретенной. Последняя чаще развивается вследствие повреждения диафрагмального нерва, что наблюдается при травмах, воспалительных процессах, а также в результате сдавления его опухолью. Это приводит к атрофии мышц и истончению диафрагмы, которая может подниматься до III – IV межреберья. При этом органы брюшной полости перемещаются в грудную клетку, но остаются под диафрагмой, В большинстве случаев релаксация диафрагмы бывает слева.Клиническая картина.
У ряда больных отсутствуют симптомы релаксации диафрагмы. Однако часто имеют место функциональные расстройства со стороны пищеварительной, дыхательной и сердечно–сосудистой систем. Больные жалуются на дисфагию, рвоту, боль в подложечной области и левом подреберье, одышку, тахикардию. Тяжесть клинических симптомов обусловлена характером перемещения органов брюшной полости и степенью их наполнения. Это может сопровождаться выраженными признаками сдавления легкого и смещения средостения. При перкуссии над пораженной стороной грудной клетки определяется притупление или тимпанический звук, при аускультации дыхательные шумы отсутствуют или резко ослаблены, но прослушивается перистальтика кишечника, иногда выявляется шум плеска.
Диагностика.
Точный диагноз устанавливается на основании рентгенологического исследования, во время которого определяется дугообразная линия (пограничная), образованная диафрагмой. При этом медиальнее к средостению расположен газовый пузырь желудка, а латеральнее – левый угол толстой кишки. Иногда с диагностической целью накладывают пневмоперитонеум, что позволяет более четко определить пограничную линию.
Лечение.
При наличии клинических признаков заболевания проводится хирургическое лечение. Сущность операции состоит в низведении перемещенных органов брюшной полости и пластике диафрагмы за счет собственных тканей или с применением сеток из поливинилалкоголя.
Грыжи пищеводного отверстия диафрагмы
Грыжи пищеводного отверстия диафрагмы впервые были описаны французским хирургом Ambroise в 1579 г. По мнению одних авторов, данное заболевание по частоте занимает второе место после язвенной болезни, а с точки зрения других, оно находится на третьем месте после язвенной и желчнокаменной болезней. Грыжи пищеводного отверстия диафрагмы составляют 90% и более всех грыж диафрагмы. Они нередко сочетаются с язвенной и желчнокаменной болезнями.Этиология и патогенез.
У взрослых грыжи пищеводного отверстия диафрагмы чаще являются приобретенными. Они встречаются преимущественно у лиц старше 50 лет. С возрастом снижается эластичность связочного аппарата, ослабевает тонус мышц диафрагмы, что приводит к расширению пищеводного отверстия, которое может свободно пропускать 1–3 поперечных пальца.
Развитию заболевания способствует повышение внутрибрюшного давления, что имеем место при запорах, метеоризме, ожирении, поднятии тяжестей. Считают, что указанные изменения соединительной ткани являются фактором инволюции, а не самостоятельным заболеванием. Патологические изменения в пищеводе характеризуются развитием эзофагита.
При формировании скользящей грыжи пищеводного отверстия диафрагмы происходит пролабирование в заднее средостение абдоминального отдела пищевода, кардии и верхней части желудка. Реже через пищеводное отверстие пролабирует верхний отдел желудка, в то время как нижний сегмент пищевода и кардия остаются фиксированными (рис. 37). Такие грыжи называются параэзофагеальными. В редких случаях встречаются смешанные типы этих грыж.
Классификация.
Для практических целей наиболее удобна классификация Б.В. Петровского: 1. Скользящие грыжи пищеводного отверстая диафрагмы: ■ Без укорочения пищевода: • Кардиальная. • Кардиофундальная. • Субтотальная желудочная. ■ С укорочением пищевода: • Кардиальная. • Кардиофундальная. • Субтотальная желудочная. • Тотальная желудочная. 2. Параэзофагеальные грыжи пищеводного отверстия: ■ Фундальная. ■ Антральная. ■ Кишечная. ■ Кишечно–желудочная. ■ Сальниковая.
Клиническая картина.
Согласно данным литературы, нередко (3–40%) грыжи пищеводного отверстия диафрагмы остаются бессимптомными. При прогрессировании заболевания появляется ряд симптомов, которые, однако, не являются патогномоничными. Они обусловлены главным образом расстройством клапанной функции кардии, развитием рефлюкс–эзофагита. Наиболее – частый симптом – боль, одной из причин которой является эзофагит. Но боли могут быть обусловлены сдавлением нервных окончаний вследствие пролабирования в заднее средостение желудка, спастическими сокращениями пищевода. Они локализуются преимущественно в подложечной области, хотя нередко бывают за грудиной или в области сердца. Еще реже боли иррадиируют в спину и шею. По своей интенсивности они могут быть резкими, умеренными или слабыми. Боли беспокоят постоянно или возникают эпизодически, особенно после приема пищи, а также при физической нагрузке, горизонтальном положении тела. Характерно, что они уменьшаются после опорожнения желудка, перехода больного в вертикальное положение. Реже встречаются изжога, отрыжка, срыгивания пищи.
Важным симптомом грыжи пищеводного отверстия диафрагмы является дисфагия, хотя она наблюдается не у всех больных. Причинами ее могут быть воспаление слизистой оболочки, дискинезия пищевода, образование язвы и т.д. В некоторых случаях дисфагия носит, как при ахалазии, парадоксальный характер (симптом Лихтенштерна).
При данном заболевании иногда наблюдается стенокардический синдром, который проявляется болями в области сердца или за грудиной. Боли могут быть настолько сильными, что иногда врачи ставят диагноз стенокардии или инфаркта миокарда.
При грыжах пищеводного отверстия диафрагмы встречаются бронхиты, пневмонии. Больные жалуются на кашель, приступы удушья (бронхолегочный синдром).
Одним из признаков заболевания является желудочно–кишечное кровотечение, которое проявляется в виде мелены и рвоты содержимым типа кофейной гущи (геморрагический синдром). Основной причиной геморрагического синдрома является рефлюкс–эзофагит с образованием трещин, эрозий и язв слизистой оболочки пищевода. При прогрессировании заболевания развиваются рубцовые стриктуры пищевода.
Диагностика.
Основным методом диагностики грыж пищеводного отверстия диафрагмы является рентгенологическое исследование. Оно позволяет выявить заболевание еще до клинического проявления.
При бесконтрастном исследовании обнаруживаются косвенные признаки заболевания. Происходит расширение контуров средостения, иногда с наличием добавочной тени с уровнем жидкости или без него, изменяется форма желудочного пузыря, определяется газовый пузырь на фоне сердца. Контрастное исследование проводится в вертикальном положении больного и положении Тренделенбурга (таз выше головы) с компрессией живота. Рентгенологическими признаками являются уменьшение размеров газового пузыря желудка, тупой угол Гиса, укорочение абдоминального отдела пищевода. Не следует путать грыжу пищеводного отверстия диафрагмы с физиологическим расширением наддиафрагмального сегмента пищевода во время глотания. Это псевдогрыжа, имеющая размеры около 3 см.
Для диагностики грыж пищеводного отверстия диафрагмы применяется и фиброэзофагоскопия.
Дифференциальная диагностика.
Проводится с заболеваниями пищевода, панкреатитом, колитом, иногда со стенокардией, инфарктом миокарда.
Лечение.
Больные с параэзофагеальными грыжами подлежат хирургическому лечению из–за опасности ущемления. В случае скользящих грыж пищеводного отверстия диафрагмы операция производится по строгим показаниям, т.е. при выраженной клинической картине и возникновении осложнений (кровотечения, эзофагиты, изъязвления, стриктуры, анемия). Оперативное вмешательство возможно также у больных с сопутствующими заболеваниями (язвенная болезнь, холецистит и др.), требующими хирургического лечения.
Консервативное лечение носит симптоматический характер, Рекомендуется соблюдать правильный режим питания. Пищу следует принимать часто и малыми порциями, чтобы не вызывать повышения внутрижелудочного и внутрикишечного давления. Исключаются острые и соленые блюда, жиры, необходимо избегать употребления алкоголя, газированной воды, сладостей, переедания. Ужин должен быть за 2–3 ч до сна. Перед сном целесообразны прогулки. Спать надо с приподнятым изголовьем (на 15–20 см), что препятствует регургитации желудочного содержимого. Показаны физиотерапевтические процедуры, души, лечебная гимнастика.
Медикаментозное лечение включает прием антацидных, вяжущих и обволакивающих средств, спазмолитиков, анальгетиков, седативных и антигистаминных препаратов.
При хирургическом лечении чаще используется трансабдоминальный доступ как менее травматичный, чем трансторакальный. Сущность операции состоит в ликвидации грыжи и предупреждении рефлюкса содержимого желудка в пищевод. Это достигается путем сшивания позади пищевода медиальных ножек диафрагмы (крурорафия) и эзофагофундопликацией по Ниссену. При этом предварительно низводят желудок в брюшную полость.
Глава 4. Аорта и магистральные сосуды
Заболевания аорты и ее ветвей
Анатомо–физиологические сведения об артериальной системе
Артериальная система, обеспечивающая снабжение организма кислородом и питательными веществами, представлена сосудами трех типов: эластического, мышечного и смешанного (мышечно–эластического). К артериям эластического типа относятся аорта, плечеголовной ствол, подключичные, сонные, подвздошные артерии. Сосуды мышечного типа представлены артериями, по которым происходит активное продвижение крови к периферии. Такое деление артерий обусловлено преобладанием в составе их стенок тех или иных элементов.Стенка артерии состоит из трех оболочек: внутренней (интимы), средней (мышечной) и наружной (адвентиции). Интима включает эндотелий, подэндотелиальный слой и внутреннюю эластическую мембрану. Мышечная оболочка представлена несколькими слоями циркулярно ориентированных гладких мышечных волокон с расположенной между ними сетью эластических волокон. Вместе с эластическими элементами интимы и адвентиции они образуют мощный эластический каркас артериальной стенки. Адвентиция образована пучками продольно расположенных коллагеновых и эластических волокон, а также соединительнотканных клеток. По мере уменьшения диаметра артерий толщина всех оболочек уменьшается. В стенке сосудов снижается количество мышечных клеток и эластических волокон. Питание стенки артерии осуществляют ветви мелких периартериальных сосудов, образующих в средней оболочке капиллярную сеть (vaso–vasorum), а иннервацию – симпатическая и парасимпатическая нервная система.
Окклюзионные поражения ветвей дуги аорты
Окклюзионные поражения ветвей дуги аорты (синдром ветвей дуги аорты, синдром Такаясу, болезнь Такаясу, болезнь отсутствия пульса и др.) – это собирательное понятие, которое объединяет заболевания, приводящие к ишемии мозга, глаз, верхних конечностей.Историческая справка.
На окклюзии брахиоцефальных артерий обращали внимание анатомы XVII–XIX ст. Так, в 1664 г. Willis на секции описал значительное сужение просвета сонной артерии вследствие кальцификации ее стенки. Von Haller в 1749 г. привел наблюдение сочетания окклюзий сонной артерии с аневризмой аорты. Savory в 1856 г. установил, что отсутствие пульса на обеих руках, резкое ослабление пульсации левой сонной артерии могут встречаться при расслаивающей аневризме дуги аорты с окклюзией ее ветвей. В 1884 г. С. С. Яковлева опубликовала сообщение о полном заращении левой сонной и сужении левой подключичной артерий. Японский офтальмолог Takayasu в 1908 г. впервые описал характерный клинический синдром при поражении ветвей дуги аорты – отсутствие пульса на руках, усиленную пульсацию на ногах, сосудистые изменения на глазном дне. Первую успешную реконструктивную операцию при тромбозе внутренней сонной артерии произвел Carrel с соавт. (1951), тромбэндартерэктомию из внутренней сонной артерии при ее тромбозе – De Bakey (1953), пластику позвоночной артерии – Cate с соавт. (1957), грудную симпатэктомию при окклюзии подключичных артерий на почве атеросклероза и артериита – Toraii (1959).
Распространенность. Заболевания ветвей дуги аорты являются причиной смерти 10–12% больных. Они занимают третье место после сердечно–сосудистой патологии и опухолей.
Этиология.
Нарушение тока крови по ветвям дуги аорты связано с приобретенными и врожденными причинами. К приобретенным причинам относятся атеросклероз, неспецифический аортоартериит, височный артериит, посггравматический, поствоспалительный фиброз и т.д. Врожденные причины нарушения кровотока по ветвям дуги аорты обусловлены экстравазальной компрессией, аномальным развитием сосудов, их патологической извитостью и т.д,
У ⅔ больных с синдромом Такаясу, в основном у мужчин в возрасте 50–60 лет, поражение дуги аорты и ее ветвей связано с атеросклерозом. Второй по частоте причиной нарушения кровообращения по ветвям дуги аорты является неспецифический аортоартериит.
Неспецифический аортоартериит чаще наблюдается у женщин. Как правило, развивается он в первые две декады жизни, но иногда начинается и во внутриутробном периоде. В настоящее время эта патология рассматривается как самостоятельное полиэтиологичное аутоиммунное заболевание гиперчувствительного, замедленного или смешанного типа с преимущественным поражением стенки магистральных эластических артерий (аорта и ее ветви). В основе возникновения неспецифического аортоартериита лежит изменение реактивности организма к разнообразным внешним и внутренним раздражителям в связи с экологической обстановкой, контактами с бытовыми и профессиональными аллергенами. По предварительным данным, он может быть отнесен и в разряд иммунодефицитов.
Третье место среди причин нарушения проходимости брахиоцефальных артерий занимают зкстравазальные компрессии. Они возникают вследствие анатомических особенностей строения шейно–подмышечного канала, прикрепления и варианта хода лестничных, а также малой грудной мышц, врожденных аномалий костного скелета, специфики движения головы, шеи и верхних конечностей (костоклавикулярный синдром, синдром передней лестничной мышцы, синдром добавочного шейного ребра, гиперабдукционный синдром), рубцовых сдавлений после травм и воспалительных процессов, компрессии новообразованиями. Преимущественно экстравазальному сдавлению подвергается подключичная артерия, а также проходящие рядом нервы и вены. Позвоночные артерии в большинстве случаев сдавливаются остеофитами при остеохондрозе, а сонные артерии – рубцами и опухолями.
Патологическая извитость брахиоцефальных сосудов чаще диагностируется у женщин в возрасте 45–50 лет, страдающих атеросклерозом и гипертонической болезнью, в связи с потерей сосудистой стенкой эластических свойств. Вместе с тем ее появление расценивается и как функциональное приспособление организма для обеспечения равномерности тока крови и уменьшения интенсивности пульсовой волны.
Крайне редко к окклюзии или стенозу ветвей дуги аорты приводит фибромускулярная дисплазия экстракраниального сегмента внутренней сонной артерии и позвоночных артерий.
Классификация.
Окклюзионные поражения ветвей дуги аорты, помимо этиологического фактора, классифицируются по локализации и стадии нарушения мозгового кровообращения. По локализации выделяют шесть клинических синдромов поражения: подключичный, позвоночный, подключично–позвоночный, общей сонной артерии, плечеголовного ствола и их сочетания. По состоянию мозговой гемодинамики выделяют четыре стадии ее недостаточности (А. В. Покровский, 1979):
Стадия (бессимптомная, компенсированная). Характеризуется отсутствием жалоб больных и объективных неврологических признаков нарушения мозгового кровообращения. Однако при ангиографическом или ультразвуковом исследовании по поводу других заболеваний находят изолированные стенозы или окклюзии экстра краниальных отделов брахиоцефальных артерий. Над суженным участком сосуда иногда определяется систолический шум.
II стадия (преходящие неврологические нарушения мозгового кровообращения, перемежающая недостаточность). Сопровождается транзиторными ишемическими атаками различной степени тяжести каротидного или вертебрально–базилярного типов. Длительность сосудистого криза не превышает 24 ч. Кризы провоцируются физической нагрузкой или утомлением, острой дегидратацией. Между приступами больные чувствуют себя удовлетворительно. Данная стадия нарушения мозгового кровообращения появляется при значительном окклюзионно–стенотическом поражении артерии, но с компенсированным кровообращением,
III стадия (субкомпенсированная, хроническая цереброваскулярная недостаточность с очаговой симптоматикой). Наблюдаются общие симптомы медленного нарастания признаков нарушения кровообращения мозга без ишемии, ишемических атак и инсультов (головные боли, головокружение, ухудшение памяти, снижение интеллекта, работоспособности и т.д.). Морфологически выявляются изолированные окклюзии экстракраниальных артерий, а также их сочетание со стенозами.
IV стадия (декомпенсированная, стадия осложнений – ишемических инсультов и их остаточных явлений). Вследствие прогрессирующей ишемии мозга развивается ишемический инсульт со стойкой неврологической симптоматикой. Впоследствии наступает частичное восстановление, повторное нарушение мозгового кровообращения или летальный исход.
Клиническая картина.
Наиболее характерным проявлением окклюзионных поражений ветвей дуги аорты является наличие триады симптомов: ишемии головного мозга, глаз и верхних конечностей. Степень их выраженности зависит от локализации, протяженности поражения, стадии недостаточности мозгового кровообращения. Недостаточность кровотока в руках сопровождается их похолоданием, зябкостью, быстротой утомляемости конечностей. При многоэтажных окклюзиях артерий или поражении дистального сосудистого русла появляются некротические изменения тканей. Расстройство мозговой гемодинамики приводит к развитию синдрома нарушения кровообращения в бассейне сонных артерий (каротидный синдром), вертебрально–базилярной системе (вертебрально–базилярный синдром) и сочетанного синдрома мозговой недостаточности.
Синдром каротидной церебрально–базилярной недостаточности характеризуется кратковременным появлением перед глазами сетки, тумана, мушек, удвоения, нечеткости контуров предметов. У некоторых больных наблюдается синдром Горнера – птоз, миоз, энофтальм. Возможно сочетание неврологических, двигательных и чувствительных нарушений по гемипаретическому типу с расстройствами зрения на противоположном глазу (на стороне окклюзии артерии – перекрестный окулопирамидный синдром). При нарушении кровотока по наружной сонной артерии отмечаются выпадение зубов, волос, остеопороз костей лицевого черепа, атрофии мускулатуры лица (маскообразное, амимичное лицо).
Синдром вертебрально–базилярной недостаточности возникает при окклюзионно–стенотическом поражении позвоночных и непарной основной артерий мозга. Функциональная значимость вертебрально–базилярного бассейна заключается в снабжении кровью затылочной и височных долей больших полушарий, ствола мозга, мозжечка, верхних отделов спинного мозга, внутреннего уха. Синдром сопровождается головной болью, тяжестью в затылочной области на стороне пораженной артерии, головокружением, нарушением равновесия, нистагмом, атаксией, дизартрией, нарушением слуха, зрения (диплопия). Отмечаются выпадения половины поля зрения, слабость или ограничение движений конечностей по гемипаретическому типу, тетрапарез, ощущение онемения конечностей, гемигиперестезия. Пациенты могут жаловаться на тошноту, рвоту, потливость, кратковременную потерю сознания.
Комбинированный синдром каротидно–вертебральнобазилярной недостаточности обусловлен нарушением кровотока по брахиоцефальному стволу или нескольким ветвям дуги аорты. Наблюдающаяся клиническая картина складывается из симптомов ишемии мозга по каротидному и вертебрально–базилярному типам и ишемии верхних конечностей. Наиболее неблагоприятное течение заболевания отмечается при одновременном поражении внутренних сонных и позвоночных артерий.
Для синдрома подключичного обкрадывания характерно наличие симптомов вертебрально–базилярной недостаточности мозгового кровообращения и ишемии верхних конечностей. Однако первое является преобладающим. Клинические проявления ишемии мозга нарастают после нагрузки на верхнюю конечность.
Окклюзионно–стенотические поражения ветвей дуги аорты постоянно прогрессируют. При естественном течении заболевания у 60–70% больных с исходной бессимптомной окклюзией брахиоцефальных сосудов в течение ближайших 3 лет развиваются значительные мозговые нарушения. Более чем половину из них составляют тяжелые инсульты.
Диагностика.
Осуществляется на основе сочетания общеклинических и лабораторно–инструментальных методов исследования.
Пальпаторно определяется ослабление вплоть до исчезновения пульсации сонных, височных артерий и артерий верхних конечностей. При стенозе артерий пульс асимметричен. Вместе с тем у больных с синдромом подключичного обкрадывания пульсация на лучевой артерии определяется и в случае окклюзии подключичной артерии. Также за счет изменения направления кровотока усиливается пульсация на височной артерии при закупорке внутренней сонной артерии.
Измерение АД выявляет разность давления в симметричных точках.
При аускультации над стенозированными участками артерий выслушивается систолический шум.
У больных с каротидной цереброваскулярной недостаточностью I–II стадии может быть проведена проба с пальцевой компрессией сонной артерии. Как правило, сдавление основного коллатерального сосуда у них приводит к потере сознания или гемиспазму. Проба объективизируется данными ЭКГ, реои электроэнцефалографии, прямой сфигмографии общих сонных и височных артерий.
При осмотре глазного дна вокруг диска зрительного нерва видны артериовенозные анастомозы. Степень их выраженности прямо пропорциональна тяжести ишемических расстройств. В случае декомпенсации мозгового артериального кровообращения появляются зоны кровоизлияния, микроаневризмы, развивается атрофия зрительного нерва. Наиболее ранним признаком расстройства зрения является снижение давления в центральной артерии сетчатки.
Прямая сфигмография с пораженных общих сонных и височных артерий свидетельствует о снижении амплитуды кривой с контрлатеральной артерии.
При реоэнцефалографии в типичных отведениях устанавливается одностороннее поражение внутренней сонной артерии. Это подтверждается изменением формы волны, индекса, асимметрии кровенаполнения, скорости кровотока и состояния сосудистого тонуса.
Термографически находят значительное снижение интенсивности инфракрасного излучения ишемизированных участков.
При выполнении ультразвуковой допплерографии уменьшение кровотока в обшей сонной артерии более чем на 30% по сравнению с кровотоком в противоположной артерии расценивается как стеноз, а отсутствие кровотока – как окклюзия. Ультрасонография позволяет определить и характер направления кровотока в надблоковых артериях. Если в норме ток крови по надблоковой артерии направлен из черепа в бассейн наружной сонной артерии, то при сужении внутренней сонной артерии он снижается, а при значительном стенозе или окклюзии становится ретроградным. Более точную информацию об окклюзионно'стенотическом поражении ветвей дуги аорты дает метод спектрального анализа звука допплеросигнала.
Исчерпывающие сведения о локализации, протяженности окклюзионно–стенотического поражения брахиоцефальных артерий, состоянии коллатералей дает панаортография по Сельдингеру.
Лечение.
Вопрос о выборе способа лечения больных с поражением ветвей дуги аорты решается индивидуально, исходя из того, что хирургическое вмешательство должно предупреждать развитие ишемического инсульта. У больных с 1 стадией цереброваскулярной недостаточности хирургическое вмешательство производится при критическом окклюзионно–стенотическом поражении ветвей дуги аорты. II и III стадии заболевания являются абсолютными показаниями к артериальной реконструкции, так как операция полностью предупреждает повторные ишемические атаки. При IV стадии ишемии мозга (стадия необратимых морфофункциональных изменений в мозге) восстановительная операция на ветвях дуги выполняется только в случае двухсторонней окклюзии и ишемического инсульта в анамнезе как вынужденный способ профилактики повторного, часто смертельного инсульта.
Методы реконструкции ветвей дуги аорты подразделяются на прямые (тромбэндартерэктомия, протезирование) и непрямые (обходное шунтирование). Тромбэндартерэктомия показана при изолированных сегментарных окклюзиях и стенозах артерий.
В случае опасности сужения просвета сосуда тромбэндартерэктомия дополняется боковой аутовенозной пластикой.
Протезирование брахиоцефальных артерий выполняется при протяженных и множественных поражениях артерий, а также при неспецифическом аортоартериите. Анастомозы сосудов с протезом формируются по типу конец в конец.
Шунтирующие операции (обходное шунтирование) используются у лиц с множественными и протяженными поражениями артерий ветвей дуги аорты; если невозможно выполнить протезирование; в случае повторной сосудистой реконструкции. В качестве шунтов применяются аутовена (большая подкожная вена, наружная яремная вена) и эксплантаты.
Экстравазальная компрессия устраняется путем скаленотомии, резекции одного ребра, пересечения малой грудной или подключичной мышцы, удаления остеофитов и т.д.
В случае ангуляций и извитости ветвей дуги аорты производится резекция артерии с последующим анастомозированием способом конец в конец (редрессация).
При невозможности осуществления реконструкции брахиоцефальных артерий, а также как добавочное к основной операции вмешательство для улучшения коллатерального кровообращения выполняются паллиативные .операции: верхняя шейная симпатэктомия (С1–С2), удаление симпатического узла С7 (стэлэктомия), грудная симпатэктомия (Т2–Т4), периартериальная симпатэктомия, односторонняя эпинефрэктомия.
Сложность выполнения восстановительных операций на брахиоцефальных артериях заключается в необходимости сохранения жизнеспособности мозга при пережатии сонных артерий. В такой ситуации ретроградное давление не должно падать ниже 60 мм рт. ст. С этой целью для предупреждения развития необратимых изменений в тканях мозга разработано несколько методов его защиты от ишемии: краниоцеребральная гипотермия (охлаждение головы с помощью специальных аппаратов до температуры в полости рта 32–33ºС); управляемая гипертензия (создается путем внутривенного введения натрия нитропруссида, кальция хлорида, мезатона, 40% глюкозы); временное шунтирование; выполнение операции в условиях общей гипероксибаротерапии; использование фармакологической защиты мозга (антигипоксанты, антиоксиданты).
Синдром атипичной коарктации нисходящей части аорты
Синдром атипичной коарктации нисходящей части аорты (синдром атипичной коарктации аорты или средней аорты, синдром Денерэя, синдром стенозирования грудной аорты, синдром коарктации абдоминальной аорты, псевдокоарктационный синдром) – это симптомокомплекс, развивающийся в результате врожденного или приобретенного окклюзионно–стенотического поражения нисходящей части аорты на уровне VI грудного–I поясничного позвонков.Историческая справка.
Впервые гипоплазию брюшной части аорты выявил Morgagni (1733). Bahnson с соавт. дали описание ангиографической картины данного заболевания (1949). ОИгп произвел резекцию супраренального сегмента аорты и ее протезирование (1949).
Распространенность.
Частота атипично расположенных коарктаций нисходящей части аорты составляет 0,5–4% всех случаев данной патологии.
Этиология.
К окклюзионно–стенотическому поражению нисходящего сегмента аорты приводят неспецифйческий аортоартериит и нарушения эмбрионального развития. В последнем случае наблюдается сегментарная гипоплазия нисходящей части аорты.
Клиническая картина.
Проявления псевдокоарктационного синдрома складываются из симптомов основного заболевания (при неспецифическом аортоартериите) и признаков артериальной гипертензии, сочетающейся с ишемией нижних конечностей, органов брюшной полости, таза.
Диагностика.
При врожденной сегментарной гипоплазии нисходящей части аорты заметна диспропорция развития мышц верхних и нижних конечностей: гипертрофия мышц плечевого пояса и гипертрофия мышц нижних конечностей. Усилена и видима на глаз пульсация сонных, межреберных артерий, артерий спины в окружности лопатки. Пульс на артериях верхних конечностей напряжен, на нижних конечностях ослаблен или не определяется. Систолическое и пульсовое АД на верхних конечностях значительно повышено, диастолическое умеренно увеличено. Систолическое АД на ногах намного ниже, чем на верхних конечностях. Диастолическое давление в таких случаях не отличается от нормы. Пульсовое давление минимальное (около 20 мм рт. ст.).
У больных с псевдокоарктационным синдромом вследствие неспецифического аортоартериита отсутствуют гипертрофия мышц плечевого пояса и гипотрофия мышц нижних конечностей. Нет видимой пульсации межреберных артерий. Значительно повышается диастолическое давление.
Во всех случаях атипичной коарктации нисходящей части аорты отмечается смещение границ относительной тупости сердца влево с расширением границ сосудистого пучка во II межреберье с обеих сторон. При аускультации выявляются акцент II тона над аортой, систолический шум малой интенсивности над областью сердца. Он проводится на сосуды шеи и хорошо определяется в межлопаточном пространстве слева на уровне II–V грудных позвонков. Спереди систолический шум распространяется до области эпигастрия.
На ЭКГ находят отклонение ЭОС влево, гипертрофию миокарда левого желудочка сердца.
При зондировании аорты выявляется разница в уровне систолического давления проксимальнее и дистальнее зоны стеноза.
Ангиографическая картина врожденной гипоплазии характеризуется изолированным поражением аорты, плавным переходом нормального сегмента аорты в суженный. Стенки ее ровные. В зависимости от протяженности сужения различают фокальный (сегментарный – менее 3 см) и тубулярный (пролонгированный – более 3 см) варианты поражения. Последний тип встречается наиболее часто.
При неспецифическом аортоартериите рентгенологически выявляется распространенный характер сужения торакоабдоминального сегмента нисходящей части аорты вместе с ее ветвями. У ⅓ больных возможна окклюзия инфраренального сегмента аорты. Контуры аорты неровные, с дефектами наполнения. Сердце имеет аортальную конфигурацию. Расширены восходящая часть, дуга и начальный отдел нисходящей части аорты. Усилена их пульсация. По левому контуру сохранена привычная тень – "клюв" аорты. Во второй косой проекции контрастированный пищевод имеет прямолинейный ход (отсутствует Е–образное вдавление). Крайне редко определяется узурация VIII–X ребер.
Дифференциальная диагностика.
Проводится с типичной коарктацией аорты, гипертонической болезнью, аортальным пороком, дефектом перегородок сердца.
Появление симптомов при типичной коарктации аорты совпадает с периодом полового созревания. Диастолическое давление на руках повышается умеренно, на ногах соответствует норме. Сужение аорты локализуется на уровне IV–V грудных позвонков. Выражено расширение восходящего отдела грудной аорты и левой подключичной артерии. Хорошо контрастируются выполняющие роль коллатералей межреберные и нижние надчревные артерии. У больных старше 15 лет на ребрах видны узуры. По левому контуру сосудистого пучка отсутствует "клюв" аорты. При контрастировании пищевода во второй косой проекции по его левому контуру отмечается Е–образное вдавление.
Диагноз гипертонической болезни исключается на основании данных объективного осмотра, определения АД в симметричных участках верхних и нижних конечностей, анализа систолического шума при аускультации сердца, наличия симптомов общевоспалительной реакции.
Для аортального порока нетипичны перепады АД между верхними и нижними конечностями, сужение нисходящей аорты, расширение коллатералей, узурация ребер.
При дефектах перегородок сердца систолический шум редко проводится на сосуды шеи и в межлопаточное пространство. Во время объективного осмотра у больных с дефектом межпредсердной перегородки отмечаются сердечный горб, усиление и расщепление II тона легочной артерии. Для дефектов межжелудочковой перегородки характерны грубый систолический шум в III–IV межреберьях слева от грудины, диастолический шум во II межреберье по левому краю грудины.
Лечение.
Наличие синдрома атипичной коарктации аорты является показанием к операции, что объясняется неуклонным прогрессированием морфофункциональных изменений в организме, возникших вследствие неспецифического аортоартериита и врожденной гипоплазии. Исходом этих процессов является гибель больных от кровоизлияния в мозг, инфаркта миокарда, тромбозов брыжеечных сосудов и т.д.
Полноценный кровоток по суженному сегменту аорты при псевдокоарктационном синдроме, обусловленном неспецифическим аортоартериитом, восстанавливается после резекции стенозированного участка аорты с протезированием его эксплантатом, шунтирования аорты, трансаортальной эндартерэктомии. У больных с врожденной гипоплазией аорты, помимо резекции с протезированием и шунтирования, может применяться боковая пластика аорты заплатой.
Аневризмы аорты и периферических артерий
Аневризмой называют ограниченное или диффузное расширение просвета кровеносного сосуда, более чем в 2 раза превышающее нормальный его диаметр.Выделяют аневризмы аорты (грудного и брюшного отделов) и аневризмы периферических артерий.
Аневризмы грудной аорты
Историческая справка.
В 1557 г. Vesalii сообщил о мешковидной, а в 158! г. Fernelius – о сифилитической диффузной аневризме грудной части аорты. В 1761 г. Morgagni впервые описал расслоение грудной аорты. Laennec (1819) ввел термин "расслаивающая аневризма". Moor (1864) для лечения больных с аневризмами грудной аорты использовал метод тромбирования путем введения в просвет аневризматического мешка инородных тел. Tuffier (1901) произвел лигирование шейки аневризмы. Gurin (1935) для лечения расслоившейся аневризмы применил операцию дистальной фенестрации на уровне наружной подвздошной артерии. В 1944 г. Alexander и Byron выполнили резекцию мешковидной аневризмы, положив этим начало реконструктивной хирургии аневризм грудной аорты. Dc Bakey в J 953 г, сообщил о первой успешной резекции неосложненной аневризмы грудной аорты с протезированием, а в 1955 г. – о резекции расслаивающей аневризмы.
Распространенность.
Аневризмы грудной аорты встречаются в 0,7–2% случаев, составляя ⅔ всех наблюдений аневризм. Мужчины заболевают в 3–5 раз чаше, чем женщины.
Этиология.
Существует множество факторов, способствующих возникновению заболевания. Аневризмы грудной аорты подразделяются на врожденные и приобретенные. Врожденные аневризмы диагностируются до 2530–летнего возраста больных, а приобретенные – в 40–60 лет и старше.
Из врожденных заболеваний к образованию аневризм приводят болезнь Марфана (врожденное недоразвитие элементов соединительной ткани), фиброзная дисплазия, врожденная извитость дуги аорты.
Приобретенные причины подразделяются на: 1. воспалительные: неспецифические (септический эндокардит, ревматизм, послеоперационные и посттравматические инфекционные осложнения), специфические (сифилис, неспецифический аортоартериит); 2. невоспалительные (атеросклероз, дефекты протезов, шовного материала, техники выполнения операций, травмы грудной клетки); 3. идиопатические – медионекроз Эрдгейма (идиопатический кистозный медионекроз, медионекроз беременных).
Роль этиологических факторов в возникновении аневризм различных отделов грудной аорты неодинакова. Так, аневризмы дуги аорты в 65–75% случаев обусловлены сифилитическим поражением, а нисходящей части – травмами (20–42%), атеросклерозом (25–47%), врожденными заболеваниями (6–12%).
Классификация.
Аневризмы грудного отдела аорты классифицируются по: 1. этиологии – врожденные, приобретенные (воспалительные, невоспалительные, идиопатические); 2. форме – веретенообразные, мешотчатые; 3. строению аневризматического мешка – истинные, ложные; 4. локализации – синуса Вальсальвы, восходящей части, дуги, нисходящей части аорты, грудной и брюшной частей аорты, комбинированные; 5. клиническому течению – бессимптомные, неосложненные и осложненные.
Клиническая картина.
Определяется в основном локализацией и размерами аневризмы. Это приводит к тому, что в ряде случаев аневризма становится случайной находкой приобследовании больных в связи с другими заболеваниями.
Наиболее типичным симптомом аневризмы является боль. Возникновение боли обусловлено растяжением аортальной стенки и раздражением вследствие этого аортальных нервных сплетений, сдавлением рядом расположенных органов, воспалительными процессами в стенке при неспецифическом аортоартериите или сифилитическом мезоаортите. У лиц с аневризмой синуса Вальсальвы, восходящего отдела аорты боль определяется в области сердца и за грудиной. В данном случае ее появление связано и с нарушением кровотока по венечным артериям из–за сдавления аневризматическим мешком устий коронарных артерий. Одновременно пациенты отмечают наличие чувства пульсации за грудиной. При аневризме дуги аорты боль локализуется за грудиной, иррадиирует в шею, плечо и спину. Аневризма нисходящего отдела грудной аорты сопровождается и болью в спине. В некоторых случаях аневризм грудной аорты в результате раздражения периартериального симпатического сплетения наблюдается аортальноплечевой синдром, включающий боли в левой лопатке, плече и предплечье. Для торакоабдоминальных аневризм характерны боли в эпии мезогастральной областях, чувство тяжести, наличие пульсации в животе. При поражении висцеральных ветвей аорты к болевому синдрому присоединяются прогрессирующее похудание и диспептические расстройства.
Признаками аневризм грудной аорты (вторыми по частоте) являются симптомы сдавления смежных органов. Так, аневризмы восходящей части аорты нередко вызывают компрессию верхней полой вены, что сопровождается появлением головных болей, отека и цианоза лица, шеи, расширением подкожных вен груди и верхних конечностей (синдром верхней полой вены). При аневризмах дуги аорты происходит сдавление трахеи, левого главного бронха, легочной артерии, устий брахиоцефальных артерий, пищевода, нервов. Отмечаются одышка в покое в основном инспираторного типа, стридор, воспалительные процессы в левом легком (пневмония, абсцесс, ателектаз), хроническая перегрузка правого сердца с застойными явлениями в легких. Нарушение кровотока по устьям левой общей сонной и подключичной артерий и брахиоцефальному стволу обусловливает ишемию мозга, глаз, верхних конечностей. Сдавление пищевода приводит к появлению синдрома дисфагии. Компрессия возвратного нерва сопровождается осиплостью голоса, сухим кашлем; шейного симпатического узла – симптомом Горнера; блуждающего нерва – брадикардией и слюнотечением.
Аневризма нисходящей аорты может сдавливать пищевод, корень левого легкого, грудной лимфатический проток. В последнем случае наблюдается отек верхней половины туловища. Иногда развивается хилоторакс. Компрессия межреберных артерий приводит к появлению ишемии спинного мозга вплоть до развития нижних парапарезов и параплегий, а межреберных нервов – к радикулярным и межреберным невралгиям.
Из–за продолжительного давления аневризматического мешка на тела позвонков, ребра и грудину происходит их частичное разрушение с образованием кифоза. Практически у каждого второго больного с аневризмой грудной аорты отмечается артериальная гипертензия.
Течение аневризм грудной аорты неблагоприятное. В сроки от 1 до 3 лет после установления диагноза при естественном течении заболевания в живых остается 30–45% больных, а при аневризме восходящего сегмента и дуги аорты 3–4%. Это связано с развитием осложнений: расслоением и разрывом (35–45%) аневризмы, сердечно–мозговой недостаточностью, ишемией почек (25–30%), пневмониями, абсцессами легких (10–20%). Более длительное течение наблюдается при аневризме восходящей аорты, увеличивающейся кпереди, так как она длительное время не вызывает сдавления рядом расположенных органов.
Диагностика.
В пользу аневризм грудной аорты свидетельствуют данные анамнеза о перенесенном сифилисе, наличии неспецифического аортоартериита, выявление у родственников больного синдрома Марфана.
Для синдрома Марфана характерны высокий рост больных, узкий, худой лицевой скелет, "паукообразные пальцы", кифосколиоз, воронкообразная грудь, непропорциональнодлинные конечности, слабость связочного аппарата суставов. У половины пациентов с синдромом Марфана диагностируется нарушение зрения (подвывих, эктопия хрусталика).
При объективном осмотре из–за разрушения аневризматическим мешком хрящей ребер, рукоятки грудины, правой ключицы под кожей определяется опухолевидное пульсирующее образование. У пациентов с аневризмой, локализующейся в области дуги аорты, отмечаются усиление пульсации в яремной вырезке грудины и наличие симптома Оливера–Кардарелли (потягивание щитовидного хряща вверх и кпереди сопровождается смещением гортани во время каждой систолы, что связано с передаточной пульсацией на бронх, трахею, гортань).
При пальпации на верхних конечностях и сонных артериях выявляют асимметрию пульса. Возможна разница в уровнях АД. Во время перкуссии границы сосудистого пучка расширены.
В 50–60% случаев над расширенным участком аорты выслушивается систолический шум. Непостоянство его обнаружения обусловлено частым тромбированием аневризматического мешка. Появление диастолического шума во II межреберье справа и в точке Боткина на фоне снижения диастолического давления свидетельствует о недостаточности аортального клапана при диффузных аневризмах восходящей части аорты. Прорыв аневризмы синуса Вальсалъвы в одну из полостей сердца сопровождается возникновением систолодиастолического шума над точкой аортального клапана.
Наиболее ценную информацию об имеющемся заболевании получают при проведении многоосевого рентгенологического обследования. Типичными рентгенологическими признаками аневризмы аорты являются пульсация, неотделимость контуров аневризматического мешка от тени аорты, четкость и ровность контуров наружной поверхности аневризмы. Однако пульсация может не определяться при тромбозе аневризмы и кальцинозе ее стенок. К дополнительным признакам аневризмы относятся зоны кальциноза по контуру выявляемого образования, узурация тел грудных позвонков (при аневризме нисходящей части аорты), узурация грудины и ребер (при аневризме грудной аорты), смещение и сужение трахеи, бронхов, зоны ателектаза легкого.
Диагноз аневризмы грудной аорты может быть подтвержден также данными ультрасонографии, аортографии, компьютерной томографии с внутривенным введением контрастного вещества.
Дифференциальная диагностика.
Проводится с опухолями и кистами переднего и заднего средостения, перикарда, врожденной извитостью аорты.
Для злокачественных опухолей средостения характерны наличие симптомов интоксикации, метастазов в надключичную область, прорастание смежных органов и грудной клетки. При рентгенологическом исследовании определяются выбухание и расширение тени средостения, неровность и нечеткость ее контуров, острый угол между тенью опухоли и аортой.
Кисты перикарда длительное время клинически ничем не проявляются. Тень кист не пульсирует.
У больных с врожденной извитостью аорты только на правой руке отмечается умеренная гипертензия. В левой надключичной ямке определяются пульсирующее образование и симптом дрожания. Рентгенологически выявляется необычно большой "клюв" аорты со смещением влево и вверх. При аортографии находят значительное удлинение и смещение дуги и нисходящего отдела грудной аорты влево и вверх с перегибом в области дуги или ниже отхож – дения левой подключичной артерии.
Лечение.
Большая степень риска консервативного ведения больных с аневризмами грудной аорты обусловливает необходимость хирургического планового лечения.
Операции, разработанные для лечения больных с аневризмами грудной аорты, подразделяются на радикальные и паллиативные.
В качестве радикальных методов лечения применяются краевая (боковая, тангенциальная) резекция и резекция аневризмы с замещением аорты синтетическим протезом.
К паллиативным операциям относится окутывание грудной аорты протезом.
Расслаивающая аневризма грудной аорты
Расслаивающая аневризма грудной аорты характеризуется диффузным расслоением собственной стенки на различном протяжении с образованием двух каналов тока крови.Этиология.
К расслоению аневризм аорты приводят заболевания, вызывающие несоответствие между морфологическим состоянием стенки аорты и характером гемодинамики в аорте. Нарушение структуры стенки аорты, потеря ею эластических свойств обусловливаются приобретенными и врожденными заболеваниями. К приобретенным заболеваниям относятся атеросклероз; идиопатический кистозный медионекроз аорты и развивающийся в результате инфекции, интоксикации, ревматизма; сифилис; слабость эластической ткани аорты, связанная с гормональными сдвигами в последнем триместре беременности; повреждение интимы и медии аорты при травме грудной клетки; ятрогенные повреждения аорты во время ангиографических исследований, баллонной дилатации артерии. Врожденными причинами расслоения аневризмы являются фиброзная дисплазия, синдром Марфана, коарктация аорты.
Классификация.
В основу существующих многочисленных классификаций расслаивающих аневризм положены локализация проксимального разрыва внутренней оболочки аорты и протяженность расслоения аортальной стенки.
Наиболее приемлема классификация De Bakey в модификации Робискека: 1. 1 тип расслоения – разрыв внутренней оболочки локализуется в восходящей части аорты, а расслоение ее стенок распространяется до брюшной части аорты. При этом типе наблюдается два варианта расслоения: ■ расслоение стенки аорты заканчивается слепым мешком в дистальных отделах аорты; ■ имеется второй разрыв аорты (дистальная фенестрация). 2. 2 тип расслоения – разрыв внутренней оболочки локализуется в восходящей части аорты, расслоение заканчивается слепым мешком проксимальнее плечеголовного ствола. 3. 3 тип расслоения – разрыв внутренней оболочки аорты локализуется в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии. Процесс расслоения имеет четыре варианта: ■ расслоение заканчивается слепым мешком выше диафрагмы; ■ расслоение заканчивается слепым мешком в дистальных отделах брюшной части аорты; ■ расслоение направлено не только дистально, но и ретроградно на дугу и восходящую часть аорты, заканчиваясь слепым мешком; ■ расслоение аорты распространяется на брюшную часть аорты с развитием дистальной фенестрации.
Клиническая картина.
Зависит от локализации разрыва и протяженности расслоения.
Выделяют два этапа и три формы течения (острая, подострая, хроническая) расслаивающей аневризмы. Начало первого этапа соответствует разрыву интимы аорты, образованию внутристеночной гематомы и началу расслоения стенки. На втором этапе происходит полный разрыв стенки аорты с внутренним кровотечением. Формы клинического течения наблюдаются на первом этапе существования расслаивающей аневризмы. При острой форме в результате разрыва аневризмы больные погибают в течение 1–2 дней, при подострой – 2–4 недель. У лиц с хронической формой расслоение продолжается месяцы и годы.
При острой форме преобладает интенсивная боль, которая чаще всего носит нисходящий характер. При I и II типах расслоения боль локализуется за грудиной. По мере прогрессирования расслоения она меняет локализацию: смещается в межлопаточную и поясничную области, в позвоночник, в область эпигастрия и гипогастрия, нередко сопровождаясь тошнотой и рвотой. У пациентов с расслоением аневризмы III типа боль возникает в межлопаточной области, иррадиирует в левую руку, левую половину грудной клетки, затем опускается в область поясницы и живота. В случае ретроградного расслоения аневризмы дуги аорты боль определяется за грудиной и иррадиирует в шею. Болевой синдром носит волнообразный характер.
Интенсивность боли снижается при падении АД, что сопровождается замедлением процесса расслоения, и возобновляется при стабилизации давления. У некоторых пациентов расслоение аневризм протекает с незначительным болевым синдромом. Иногда первым ее признаком являются симптомы ишемии головного и спинного мозга, почек, органов брюшной полости и нижних конечностей, недостаточности аортального клапана.
Хроническая форма расслаивающей аневризмы сопровождается относительной стабилизацией процесса: исчезновением или уменьшением боли, постоянством гемодинамики.
Расслоение аневризм Г и II типов нередко сопровождается сдавлением верхней полой вены, что проявляется симптомами венозной гипертензии верхней половины туловища. Расслаивающие аневризмы I типа часто вызывают компрессию трахеи, левого бронха и возвратного нерва.
Течение расслаивающей аневризмы неблагоприятное. Только в 10% случаев продолжительность жизни от начала заболевания составляет три месяца. Больные с расслоениями аневризм I и II типов погибают в основном от тампонады сердца, III типа – от внутреннего кровотечения в левую плевральную полость или от почечной недостаточности.
Диагностика.
При объективном осмотре больных с расслоением аневризм выявляется асимметрия пульса и АД на верхних и нижних конечностях. В области грудиноключичного сочленения появляется патологическая пульсация. В большинстве случаев на левой руке определяется снижение или исчезновение пульсации. Перкуторно отмечается расширение тени средостения. При аускультации сердца выслушивается систолический шум, а в случае присоединения аортальной недостаточности – диастолический. У больных с расслоением I, II и III типов систолический шум может выслушиваться над сонными артериями, а при I и III типах – в межлопаточной или поясничной области, в эпигастрии. При таком же типе расслоения в животе определяется опухолевидное пульсирующее образование с систолическим шумом над ним.
При рентгенологическом исследовании отмечается расширение тени верхнего средостения. Для больных с I и II типами расслоения характерны увеличение восходящего отдела аорты и усиление ее пульсации. Эти признаки хорошо заметны в переднезадней и второй косой проекциях. У больных с III типом аневризм в переднезадней проекции видны расширение нисходящей аорты, ее выбухание в левое легочное поле. При исследовании во второй косой проекции вся нисходящая аорта резко расширена и имеет типичную форму надутого баллона.
Ультрасонография дает сведения о состоянии просвета восходящей аорты и аортального клапана. Створки аортального клапана, как правило, нормальные.
Компьютерная томография с одновременным контрастированием аорты позволяет точно определить проходимость аорты и ее ветвей, толщину стенок и патологические включения.
Аортография информирует о протяженности расслоения, уровне и количестве фенестраций, состоянии ветвей аорты. Поскольку при выполнении аортографии из трансфеморального доступа катетер не всегда попадает в истинный просвет аорты, эффективнее использовать правосторонний трансаксиллярный доступ.
К ангиографическим признакам расслоения аневризмы относятся: 1. Расширение и деформация тени аорты. 2. Одновременное контрастирование истинного и ложного просветов аорты (двойной контур аорты). Истинный просвет аорты всегда узкий и располагается в большинстве случаев медиально. Ложный просвет большой и неравномерно расширен. 3. Спиралевидный ход истинного просвета аорты в ее нисходящей части. 4. Наличие четкой разделительной полосы между истинным и ложным просветами (отслоенная внутренняя оболочка). 5. Отрыв ветвей дуги аорты, брюшной части аорты от истинного просвета. 6. Регургитация контрастного вещества из аорты в левый желудочек (свидетельство недостаточности аортального клапана). 7. Сброс контрастного вещества в расширенный ложный просвет.
Аортография противопоказана больным, находящимся в тяжелом состоянии.
Дифференциальная диагностика.
Проводится с инфарктом миокарда, прободной язвой желудка и двенадцатиперстной кишки, тромбозом мезентериальных сосудов и т.д.
При инфаркте миокарда на ЭКГ регистрируются признаки коронарной недостаточности, в крови отмечается нормальный уровень трансаминаз. Отсутствуют рентгенологические признаки расслаивающей аневризмы.
Более чем 80% больных с прободной язвой желудка или двенадцатиперстной кишки имеют язвенный анамнез. При объективном осмотре выявляются типичные симптомы прободения – Щеткина–Блюмберга, Жобера, Спижарного, Дзбановского, Бруннера, Гюстена. На обзорной рентгенограмме органов брюшной полости и подциафрагмальных пространств под диафрагмой определяется наличие свободного газа.
Тромбоз мезентериальных сосудов сопровождается появлением жидкого стула с примесью крови, постепенным развитием картины динамической кишечной непроходимости.
Лечение.
Основными вариантами хирургического лечения являются резекция аневризмы с протезированием сегмента аорты в условиях искусственного кровообращения, резекция аневризмы со сшиванием расслоенной аортальной стенки с последующим анастомозом способом конец в конец. По показаниям производится протезирование аортального клапана.
Аневризмы брюшной аорты
Историческая справка. Первые сведения об аневризмах брюшной аорты получены Femelius (1542). Cooper (1917) для лечения аневризм впервые применил перевязку брюшного отдела аорты. Dubost с соавт, (1952) выполнили резекцию аневризмы брюшной аорты с протезированием гомотрансплантатом. Javid с соавт. (1962) произвели удаление аневризмы с внутримешковым протезированием.Распространенность.
На долю аневризм брюшного отдела аорты приходится около 80% всех аневризм. Поданным секций, частота аневризм брюшной аорты колеблется в пределах 0,4–26%. Чаще заболевание встречается у лиц старше 55–60 лет. Соотношение числа болеющих мужчин и женщин составляет 5:1.
Этиология.
Аневризмы брюшной аорты в подавляющем большинстве случаев возникают у больных, страдающих атеросклерозом, сифилисом, неспецифическим аортоартериитом, ревматизмом, туберкулезом, сальмонеллезом. Причинами образования брюшных аневризм могут быть закрытые травмы брюшной полости, реконструктивные операции на аорте и ее ветвях, фиброзно–мышечные дисплазии. Врожденные аневризмы брюшной аорты встречаются крайне редко.
Классификация.
Аневризмы брюшной аорты классифицируются: 1. по этиологии: ■ приобретенные • невоспалительные (атеросклеротические, травматические) • воспалительные (сифилитические, вследствие неспецифического аортоартериита и т.д.); ■ врожденные; 2. по характеру клинического течения: ■ бессимптомные, ■ типичные, ■ неосложненные, ■ осложненные (разрывом, расслоением, тромбозом); 3. по локализации: ■ супраренальные – аневризмы верхнего отдела брюшной аорты с вовлечением отходящих от нее ветвей (I тип), ■ инфраренальные – без вовлечения бифуркации аорты (II тип) ■ инфраренальные – с поражением бифуркации аорты и подвздошных артерий (III тип) ■ тотальные (IV тип); 4. по форме: ■ мешковидные (боковые, распространяющиеся на подвздошные артерии – мешковидные аортоподвздошные, спускающиеся в малый таз – типа лягушки) ■ веретенообразные; 5. по морфологии: ■ истинные ■ ложные.
Клиническая картина.
Бессимптомное течение характерно для небольших (от 4 до 7 мм в диаметре) аневризм брюшной аорты. Оно наблюдается в 10–20% всех случаев аневризм данной локализации.
Проявления неосложненных брюшных аневризм подразделяются на типичные и косвенные. К типичным признакам относятся пульсирующее образование, боль в животе, систолический шум над областью аневризмы. Пульсирующее образование неподвижное, плотноэластической консистенции, имеет различные размеры, овальную, округлую форму. Пульсация передается во всех направлениях. Боль может быть различной, носить тупой характер или приступообразный, напоминающей приступ почечной или печеночной колики. Местом локализации болей является левая половина живота или область пупка. Иногда боль иррадиирует в спину, поясницу, крестец. Систолический шум выслушивается над пульсирующим образованием и проводится на бедренные артерии. Его возникновение связано с турбулентным движением крови, стенозированием аорты и ее висцеральных ветвей.
Косвенные признаки аневризм брюшного отдела аорты представлены в виде абдоминального, урологического, ишиорадикулярного синдромов и синдрома хронической ишемии нижних конечностей.
Для абдоминального синдрома характерны снижение аппетита, тошнота, рвота, боль в животе, прогрессирующее похудание. В основе развития синдрома лежат окклюзионно–стенотическое поражение висцеральных ветвей брюшной аорты, смещение или сдавление аневризмой желудка и двенадцатиперстной кишки.
Урологический синдром проявляется тупыми или приступообразными болями в поясничной области по типу покишечника, забрюшинного пространства, почек; с аномалиями развития почек; удлинением и девиацией аорты.
Опухоли органов брюшной полости, локализующиеся в непосредственной близости от брюшной аорты или над ней, иногда ошибочно принимаются за аневризму. Вместе с тем для злокачественных опухолей характерны плотная консистенция, бугристость поверхности, неподвижность, передача пульсации от аорты только в одном направлении. В том случае, если рост опухоли не сопровождается сдавлением чревной и верхней брыжеечной артерий, над пульсируемым образованием не определяется систолический шум.
Сосудистых шумов нет и над подковообразной почкой. Блуждающая почка обнаруживается при пальпации.
Удлинение и девиация аорты расцениваются как аневризма чаще при пальпаторном обследовании лиц с пониженной массой тела, страдающих гипертензией. При проведении дифференциальной диагностики в сомнительных случаях используют данные инвазивного и неинвазивного обследований.
Лечение.
Больные с аневризмами брюшной аорты подлежат обязательному хирургическому лечению. Операция выполняется пациентам любого возраста при различных вариантах локализации аневризм. Эго объясняется большой вероятностью гибели больных от осложнений заболевания. Противопоказаниями к операции являются острый инфаркт миокарда, инфаркт миокарда, перенесенный в сроки до трех месяцев при нестабильных показателях ЭКГ, недостаточность кровообращения IIБ–III стадий, острые расстройства мозгового кровообращения, инсульт в сроки от 1 до 3 мес. с выраженным неврологическим дефицитом, окклюзия глубокой и поверхностной бедренных артерий нижних конечностей. Поскольку более чем у ⅔ больных с брюшными аневризмами имеется по 2–3 сопутствующих заболевания (ИБС, артериальная гипертензия, хроническое нарушение мозгового кровообращения, синдром Лериша и т.д.), в предоперационном периоде обязательно проводится комплексная коррекция выявленных расстройств.
Для обнажения инфраренальных аневризм применяется срединная полная лапаротомия. Супраренальные, тотальные аневризмы удаляются из левостороннего торакофренолюмботомического доступа no IX межреберью.
Объем операции может заключаться: 1. в резекции аневризмы с полным удалением мешка в сочетании с протезированием только аорты или аортобедренным протезированием (шунтированием); 2. в резекции аневризмы с внутримешковым или аортобедренным протезированием.
Аортобедренное протезирование (шунтирование) выполняется ввиду частого сочетания аневризм брюшной аорты с окклюзионностенотическим поражением в подвздошных артериях, В случае проходимости почечных артерий и висцеральных ветвей брюшной аорты их имплантируют в протез на единой площадке или по отдельности (рис. 39).
Летальность после операций в связи с неосложненными аневризмами брюшной аорты колеблется от 2 до 10%, 5Летняя выживаемость составляет 47–58% против 17–36% у лиц, лечившихся консервативно.
Осложнения.
Вследствие постоянного прогрессирования аневризма брюшного отдела аорты осложняется расслоением и разрывом стенки. Частота их возникновения находится в прямо пропорциональной зависимости от размеров аневризматического мешка. Так, при диаметре аневризмы более 7 см осложнения аневризм наблюдаются практически у ⅔ больных.
Клинически расслаивающая аневризма сопровождается возникновением острых болей в животе или пояснице с иррадиацией вдоль позвоночника, в бедро. Наблюдаются небольшое снижение АД, учащение пульса при неизмененной картине красной крови. Одновременно увеличиваются размеры аневризмы, значительно усиливается ее пульсация. Как правило, исходом расслоения является истончение адвентиции аорты с последующим разрывом. Вместе с тем в случае достаточной плотности наружных слоев стенки аневризматического мешка заболевание может приобретать хронический характер течения.
 Рис. 39. Резекция аневризмы брюшной аорты с внутримешковым протезированием и имплантацией в протез ее ветвей.
Рис. 39. Резекция аневризмы брюшной аорты с внутримешковым протезированием и имплантацией в протез ее ветвей.
Диагностика расслаивающей брюшной аневризмы не представляет трудностей, если аневризма была обнаружена ранее. В сомнительных случаях наряду с проведением дифференциальной диагностики с острыми хирургическими заболеваниями органов брюшной полости (острый панкреатит, прободная язва, тромбоз мезентериальных сосудов и т.д.) применяют комплексное обследование, такое как при неосложненной аневризме брюшной аорты.
Наличие расслаивающей аневризмы является показанием к хирургическому лечению – резекции аневризмы и протезированию аорты.
Разрыв аневризмы относится к наиболее опасным ее осложнениям. У некоторых больных он является первым признаком существования заболевания. Прорыв аневризмы происходит в забрюшинное пространство (до 85%), в органы желудочно–кишечного тракта (до 30%), в свободную брюшную полость (до 20%), в систему нижней полой вены (до 2%). Наиболее типичными симптомами разрыва являются боль, наличие пульсирующего образования в животе и гипотензия. Степень их выраженности зависит от варианта прорыва аневризмы. Разрыв аневризмы в брюшную полость в большинстве случаев сопровождается мгновенной гибелью больных. При других локализациях разрыва вследствие снижения системного АД и тромбирования дефекта стенки аорты наступает период стабилизации состояния. Его продолжительность колеблется от нескольких часов до 2 недель, но неизбежно заканчивается повторным разрывом аневризмы и смертью больного. При разрыве аневризм в брюшную полость появляются острые, интенсивные боли по всему животу и симптомы массивного внутрибрюшного кровотечения (коллапс, шок, бледность кожных покровов и видимых слизистых, холодный липкий пот, тахикардия, падение АД, анемия). Пальпируемая ранее аневризма уменьшается, приобретает нечеткие контуры. По всему животу определяются симптомы раздражения брюшины, ослабевает перистальтика. В отлогих местах брюшной полости отмечается тупость. При пальцевом исследовании прямой кишки нависает передняя стенка, а при влагалищном исследовании – задний свод влагалища.
Для прорыва аневризмы в забрюшинное пространство характерно возникновение острых, интенсивных, продолжительных болей в левой половине живота, поясничной области, не снимающихся наркотиками. Часто болевой синдром сопровождается тошнотой и рвотой. Одновременно снижается АД, появляются тахикардия и анемия. Однако коллапс по сравнению с коллапсом при разрыве аневризмы в брюшную полость выражен в меньшей степени. Артериальная гипотензия, болевой шок способствуют наступлению олигурии. В левой половине брюшной полости пальпируется большое, без четких границ пульсирующее образование, постепенно увеличивающееся в размерах. При сдавлении забрюшинной гематомой подвздошных артерий развивается ишемия нижних конечностей, подвздошных вен – венозная недостаточность ног. Распространение гематомы по паранефральной и паравезикальной клетчаткам, по ходу мочеточников сопровождается дизурическими явлениями. Из–за раздражения гематомой париетальной брюшины возможно появление симптома Щеткина–Блюмберга.
Разрыв аневризмы в органы желудочно–кишечного тракта сопровождается клиникой внутреннего кровотечения. Наиболее часто аневризма прорывается в двенадцатиперстную кишку, желудок и тощую кишку, крайне редко в толстый кишечник. Кровотечение может остановиться вследствие прикрытия дефекта стенки кишки тромбами на фоне снижения АД и сокращения кишечной стенки.
Прорыв аневризмы брюшной аорты в систему нижней полой вены происходит в области ствола нижней полой вены, левой почечной и правой подвздошных вен. Клиническая картина осложнения характеризуется появлением и быстрым нарастанием признаков сердечной недостаточности по правожелудочковому типу. Симптомы внутреннего кровотечения отсутствуют. Больных беспокоят слабость, одышка, тяжесть в правом подреберье и ногах. Увеличивается печень, нарастает асцит. Иногда усиливается рисунок подкожных вен нижних конечностей и передней брюшной стенки. Над определяемым в животе пульсирующим образованием выслушивается систолодиастолическкй шум. Пальпаторно ощущается симптом дрожания.
Дифференциальная диагностика разрыва аневризмы брюшного отдела аорты проводится с инфарктом миокарда, почечнокаменной болезнью, тромбозом мезентериальных сосудов, острым панкреатитом и холециститом. Для всех вышеприведенных заболеваний характерно отсутствие основных симптомов прорыва аневризмы: болей в брюшной полости или пояснице, наличия пульсирующего образования, увеличивающегося в размерах или, наоборот, уменьшающегося, признаков внутреннего кровотечения. Если общее состояние больных позволяет, характер имеющейся патологии может быть уточнен при проведении ультрасонографии и рентгенологического исследования органов брюшной полости. У больных с забрюшинными разрывами аневризм на обзорной рентгенограмме брюшной полости отмечается исчезновение контуров большой поясничной мышцы слева. В боковой проекции выявляется смещение газов в кишечнике кпереди. При рентгеноконтрастном исследовании желудка, двенадцатиперстной кишки и тонкого кишечника может наблюдаться их отклонение от нормального положения.
Разрыв аневризмы брюшной аорты является абсолютным показанием к операции. Тяжелый шок, наблюдающийся в течение нескольких часов, и олигурия не являются абсолютными противопоказаниями к хирургическому вмешательству. Для обнажения аорты применяется тотальная лапаротомия, а при супраренальных аневризмах – широкая левосторонняя торакофренолюмботомия с продолжением разреза в параректальный. Особенность операции заключается, во–первых, в необходимости проведения интенсивных мероприятий, направленных на стабилизацию гемодинамики, профилактику почечной недостаточности и шока, а, во–вторых, в срочной остановке кровотечения. Выполнение первой задачи достигается переливанием до 3–5 л свежеконсервированной крови до нормализации ЦВД, введением диуретиков, кальция глюконата, натрия бикарбоната в целях ликвидации метаболического ацидоза и т.д. Для временной остановки кровотечений из аорты разработан ряд способов: наложение зажима на аорту выше шейки аневризматического мешка; прижатие аорты выше шейки аневризматического мешка зеркалом–компрессором, кулаком, тупфером; трансфеморальное или трансаксиллярнос введение в аорту обтурирующего баллона типа баллона Фолея; введение баллонного катетера в проксимальное русло аорты и в обе подвздошные артерии через разрез передней стенки аневризматического мешка; пережатие аорты в грудном отделе после предварительной торакотомии. Соустье с нижней полой веной разобщается путем его ушивания из просвета аневризматического мешка. Для ликвкдации сообщения аневризмы с двенадцатиперстной кишкой применяются ушивание фистулы из просвета мешка или кишки 2–3–этажными швами с дополнительным укрытием линии шва стенкой аневризматического мешка или сальником; резекция двенадцатиперстной кишки.
Каждый из указанных методов используется в зависимости от конкретной ситуации, сложившейся во время операции.
После остановки кровотечения выполняется резекция аневризмы с ее протезированием, а при необходимости – восстановление кровотока по висцеральным и почечным ветвям аорты.
Тяжесть общего состояния больных с разорвавшимися аневризмами, техническая сложность хирургического вмешательства обусловливают высокую послеоперационную летальность – от 10 до 70%.
Аневризмы периферических артерий
Приобретенные аневризмы.
Этиология.
Выделяют следующие причины возникновения приобретенных аневризм: 1. приводящие к нарушению целостности артериальной стенки: огнестрельные и ножевые ранения, тупые травмы, реконструктивные операции на сосудах; 2. снижающие эластические свойства сосудистой стенки: атеросклероз, эндартериит, сифилис и т.д.; 3. вызывающие воспалительно–деструктивные изменения в стенке артерии: эмболии инфицированными эмболами при эндокардите, распространение воспалительного процесса на стенку артерии из окружающих тканей, генерализация инфекции у больных с пневмонией, остеомиелитом, циститом.
Возникающие вследствие этого воспалительно–некротические процессы в стенке артерии напоминают таковые при остром и подостром артериите и мезоартериите с выраженным разрушением внутренней эластической мембраны.
Классификация.
Приобретенные аневризмы периферических артерий подразделяются по: 1. этиологии: посттравматические, атеросклеротические, микотические, сифилитические, эрозивные; 2. типу сформированного сообщения между сосудами: артериальные, артериовенозные, артериоартериальные, комбинированные; 3. строению аневризматического мешка: истинные, ложные; 4. локализации аневризмы: боковые, концевые (центральные, периферические, полукольцевые, бифуркационные); 5. количеству аневризм: одиночные, множественные (одной артерии и одной вены, одной артерии и нескольких вен, нескольких артерий и одной вены, нескольких артерий и нескольких вен); 6. количеству аневризматических мешков: одномешковые, двухмешковые (аневризма в аневризме); 7. форме: веретенообразные, мешковидные; 8. течению: осложненные, неосложненные (расслаивающие, разорвавшиеся, тромбированные, осложнившиеся флегмоной мягких тканей, тромбоэмболией периферических артерий).
Клиническая картина.
Классическими признаками аневризмы периферических артерий являются: боль, пульсирующая опухоль с определяемым над ней сосудистым шумом, симптомы ишемии и застойные явления в дистальных отделах конечностей.
Симптом боли при травматической артериальной аневризме встречаются у 50–70% пациентов, при артериовенозной и комбинированной – несколько реже. Происхождение боли связано с давлением аневризматического мешка на окружающие ткани, вовлечением в рубцово–воспалительный процесс лежащих рядом с аневризмой нервов и недостаточностью артериального кровоснабжения конечности. Наиболее интенсивные боли отмечаются в первые дни после травмы и во многом определяются ее видом.
Пульсирующая опухоль (припухлость) является наиболее типичным признаком артериальной аневризмы и встречается в 50% случаев при артериовенозных соустьях. Она имеет различную величину и форму и чаще определяется в виде возвышения над поверхностью тела. При артериальной аневризме опухоль напряжена, характеризуется четкой границей. Артериовенозные и комбинированные аневризмы нечеткие, менее напряжены вследствие быстрого сброса артериальной крови в венозную систему. Пульсация аневризм синхронна с пульсом, при поверхностном расположении аневризматического мешка хорошо заметна на глаз и определяется пальпаторно. Однако при тромбозе аневризматического мешка, обызвествлении и окостенении его стенок она может и не определяться. Сдавление пульсирущей опухоли приводит к ее исчезновению, но после прекращения компрессии она вновь принимает прежнюю форму. Уменьшению размеров и напряжения аневризмы, прекращению пульсации способствует также пережатие приводящей артерии. У больных с артериовенозной аневризмой сдавление приводящей артерии сопровождается урежением пульса на 15–20 ударов в минуту и повышением АД (симптом Добровольской). Возникновение этого феномена обусловлено улучшением сердечной деятельности из–за уменьшения притока крови к правым отделам сердца.
Появление сосудистого шума связано с вихревым движением крови в области аневризмы, колебаниями стенок, формирующих ее сосудов. Для артериальной аневризмы характерно наличие локального систолического, а при артериовенозной аневризме – систолодиастолического шума, распространяющегося от области соустья к приводящей и отводящей артериям на значительное расстояние. У больных с аневризмами, прилежащими к костям, шум проводится и по ним. Помимо систолодиастолического шума, характерным признаком артериовенозной аневризмы является определяемый пальпаторно симптом дрожания или "кошачьего мурлыканья" Симптом ощущается в области аневризмы и на небольшом расстоянии от нее. Интенсивность шума уменьшается к периферии.
У больных с комбинированными аневризмами в разных точках над промежуточным мешком одновременно определяются систолический, систолодиастолический шум и симптом дрожания. Это зависит от преобладания в ее строении признаков артериальной или артериовенозной аневризмы. Точка максимальной интенсивности сосудистых шумов в случае артериальной аневризмы располагается над ней, а при артериовенозном соустье соответствует точке венозного сброса (точка Гюнтера). Шум и симптом дрожания резко ослабевают у больных со значительной толщиной стенки аневризматического мешка и полностью исчезают при сдавлении приводящей артерии (феномен Терье), тромбозе аневризмы. При сдавлении вены проксимальнее артериовенозного свища непрерывный систолодиастолический шум превращается в прерывистый систолический. Пережатие периферического участка вены не приводит к изменению характера шумов. Незначительное ослабление интенсивности шума при компрессии приводящей артерии является свидетельством хорошего развития коллатерального кровообращения.
Выраженность ишемических явлений в конечности при аневризмах определяется прежде всего степенью нарушения кровообращения по травмированному сегменту артерии и сроком, прошедшим с момента травмы сосудов. В начальном периоде заболевания часто наблюдается острая артериальная недостаточность кровообращения, а в более позднем – хроническая. Это характеризуется ослаблением пульса на периферических артериях или его исчезновением. Однако пульс может определяться при окклюзии сосуда в области аневризмы за счет коллатерального кровотока.
Застойные явления в дистальных отделах конечности – наиболее характерный признак артериовенозных аневризм ввиду сброса артериальной крови в венозную систему. Это приводит к значительному повышению в ней давления, что сопровождается расширением подкожных вен, цианозом, отеком конечности. У больных с артериальными аневризмами застойные явления возникают в случае сдавления магистральных вен гематомой, аневризматическим мешком. При комбинированных аневризмах по сравнению с артериовенозными венозный стаз появляется несколько позднее и менее выражен. С увеличением сроков заболевания симптомы недостаточности венозной гемодинамики вследствие артериовенозных и комбинированных аневризм нарастают, сопровождаясь появлением в 30–40% случаев трофических изменений. При сформированной артериальной аневризме они, наоборот, иногда уменьшаются из–за хорошего развития венозных коллатералей.
Течение приобретенных аневризм осложняется разрывом аневризматического мешка с внутритканевым, внутриполостным и наружным кровотечениями. Чаще это происходит при несформированной аневризме, в области ее верхушки. Нередко аневризмы сопровождаются эмболиями, содержащимися в их просвете тромбами как периферических артерий, так и легочного ствола. У ряда больных с травматическими аневризмами вследствие активации дремлющей инфекции развивается флегмона мягких тканей, окружающих аневризматический мешок (нагноение аневризмы).
Артериовенозные и комбинированные аневризмы спустя 2–4 года после ранений приводят к возникновению постоянно прогрессирующей сердечной декомпенсации, затяжному септическому эндокардиту, тяжелым трофическим изменениям тканей в дистальных отделах конечностей. В случае расположения аневризматического мешка непосредственно на кости длительное его давление приводит к образованию в ней полости.
Диагностика.
Помимо общеклинического обследования, применяются ультрасонография, артериофлебография, обзорная рентгенография конечности.
Дифференциальная диагностика.
Проводится с посттравматической флегмоной или абсцессом, а также между сформированной и несформированной аневризмами.
Для посттравматической флегмоны или абсцесса в момент травмы характерно отсутствие признаков ранения магистральных артерий. Область воспаления имеетвид припухлости с отечной гиперемированной кожей, болезненной при пальпации. Местно находят повышение температуры или симптом флюктуации. Периферический пульс на артериях дистальнее флегмоны или абсцесса не изменяется. Сосудистый шум над ней не определяется.
Несформированная аневризма имеет вид резко болезненной без четких границ опухоли. На коже над аневризмой заметны следы воспаления и предшествующей травмы. Пульсация опухоли разлитая, видна на глаз. Сосудистый шум глухой, нечеткий из–за обилия содержащихся в полости аневризмы сгустков.
Лечение.
Основным методом лечения является хирургическое вмешательство. Консервативное лечение неэффективно и опасно, так как возможны осложнения в связи с постоянным прогрессированием заболевания.
Все операции, применяемые при лечении больных с приобретенными аневризмами, делятся на три группы: 1. операции, сохраняющие или восстанавливающие проходимость сосудов; 2. операции, ликвидирующие проходимость сосудов (лигатурные); 3. паллиативные вмешательства на сосудах.
К операциям, сохраняющим или восстанавливающим проходимость сосудов, относятся сосудистый шов, перевязка артериальной аневризмы или артериовенозного свища, операция Сапожкова, Матаса–2, Бикхама, Ратнера, Гренуэлу, Караванова, резекция аневризмы с протезированием, обходное шунтирование.
Из всего множества сосудистых швов в хирургии аневризм периферических артерий наибольшее применение получили циркулярный сосудистый шов Карреля и наружный, или пристеночный, боковой сосудистый шов (рис. 40).
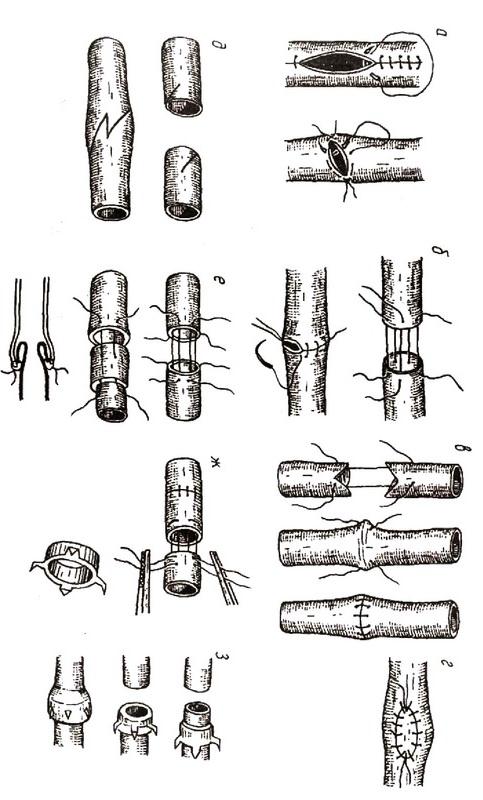 Рис. 40. Виды сосудистых швов:
а – боковой шов; б – шов Карреля; в – шов Добровольской; г – боковая пластика при помощи заплаты; д – шов Гольдмана и Гана; е – шов Соловьева; ж – выворачивающий шов; з – шов с помощью колец Донецкого.
Рис. 40. Виды сосудистых швов:
а – боковой шов; б – шов Карреля; в – шов Добровольской; г – боковая пластика при помощи заплаты; д – шов Гольдмана и Гана; е – шов Соловьева; ж – выворачивающий шов; з – шов с помощью колец Донецкого.
При артериальной аневризме и артериовенозном свище с небольшим боковым отверстием в артерии применяется операция Сапожкова в двух вариантах. У больных с артериальной аневризмой производится прошивание (перевязка) основания аневризматического мешка с последующим его отсечением. Культя мешка дополнительно ушивается вторым рядом швов через остатки стенки мешка. При артериовенозных аневризмах аневризматический мешок перевязывается у основания, после чего лигируются центральный и периферический концы вен. Аневризма удаляется (рис. 41).
 Рис. 41. Схема операции Сапожкова:
а – при артериальной, б – при артериовенозной аневризме.
Рис. 41. Схема операции Сапожкова:
а – при артериальной, б – при артериовенозной аневризме.
Операция Матаса–2 показана при артериальных травматических и атеросклеротических аневризмах с небольшим боковым дефектом в артерии. Суть операции состоит в выделении аневризмы и прилежащих сосудов, перевязке связанных с аневризматическим мешком коллатералей, вскрытии аневризмы, зашивании дефекта в стенке артерии из просвета мешка, ушивании в несколько этажей полости мешка по типу капитонажа или частичного иссечения стенки аневризмы с укрыванием линии шва мышцей или фасцией (рис. 42).
Операция Бикхама – боковой трансвенозной сосудистый шов. Показана при широком артериовенозном соустье. Предполагает мобилизацию с временным пережатием приводящих и отводящих сосудов, широкое вскрытие вены над местом соустья, наложение из ее просвета бокового шва на артерию, после чего венозная рана ушивается наружным боковым швом.
Операция Ратнера является модификацией операции Бикхама. Суть ее состоит во вскрытии вены и отсечении от артерии с оставлением на последней участка венозной стенки, ушивании дефекта артерии через венозный ободок, перевязке вены выше и ниже соустья.
Операция Гренуэлу – перевязка артериального и венозного концов свища двумя лигатурами. Показана при узком артериовенозном свище.
Операция Караванова предполагает одновременную перевязку артериовенозного свища и вены (выше и ниже его), продольное рассечение вены и окутывание ею артерии, наложение дополнительных швов над местом перевязки свщца и швов через края обворачивающей вены.
Недостатком операций Сапожкова, Ратнера, Караванова является перевязка образующих аневризму или артс риовенозный свищ вен. Более эффективна резекция аневризмы с протезированием сосудов. В тех ситуациях, когда удалить аневризму не представляется возможным, выполняется обходное шунтирование. В качестве протезов и шунтов для восстановления кровотока по артериям применяются ауто–, алло–, ксенотрансплантаты и эксплантаты. Для протезирования вен используется только аутовена.
 Рис. 42. Операция Матас–2.
Рис. 42. Операция Матас–2.
 Рис. 43. Лигатурные операции:
а – Антиллуса; б – Матас–1.
Рис. 43. Лигатурные операции:
а – Антиллуса; б – Матас–1.
При локализации аневризм на кисти, стопе, дистальной трети голени и предплечий выполнение восстановительных операций требует применения микрохирургической техники. Вместе с тем перевязка одного из магистральных сосудов на этом уровне не отражается на функциональной способности конечностей.
Сущность лигатурных операций заключается в перевязке магистральных сосудов. К этой группе относятся операция Антиллуса, Филагриуса, Матас–1.
Операция Антиллуса используется при инфицировании артериальных аневризм. Она заключается в перевязке артерии ниже и выше аневризмы (рис. 43, а), вскрытии и открытом тампонировании ее полости. В послеоперационном периоде возможно развитие кровотечения из коллатералей.
Операция Филагриуса показана при артериальных аневризмах. Она предполагает перевязку сосудов, связанных с аневризмой, и ее иссечение. Операция опасна развитием ишемии при локализации аневризмы на магистральных артериях.
Операция Матас–1 производится при сформированных артериальных аневризмах. Она заключается в прошивании и перевязке всех открывающихся в полость аневризмы сосудов внутри аневризматического мешка. Затем полость аневризмы ушивается отдельными швами в несколько этажей (рис. 43, б).
Врожденные аневризмы.
Этиология.
Возникновение врожденных аневризм обусловлено действием неблагоприятных факторов внешней и внутренней среды организма, приводящих к отклонениям в формировании сосудистой системы в течение первых 6 недель внутриутробного развития.
Классификация.
Врожденные аневризмы сосудов нижних конечностей подразделяются: 1. по виду имеющегося сообщения: ■ свищи ■ соустья ■ аневризмоподобные образования; 2. по количеству сформировавшихся сообщений: ■ одиночные ■ множественные 3. по локализации: ■ ограниченные (на каком–то одном сегменте конечности) ■ диффузные (распространяются по всей конечности) 4. по степени нарушения гемодинамики в конечности: ■ с небольшим ■ со значительным артериовенозным сбросом крови.
Клиническая картина.
Наиболее выражена при синдроме Паркса–Вебера–Рубашова.
Диагностика.
В сложных ситуациях диагноз врожденных аневризм подтверждается определением насыщения кислородом венозной крови; измерением венозного давления в пораженной конечности, которое характеризуется периодами повышения и снижения, что соответствует фазам систолы и диастолы сердечных сокращений; артериографией.
Лечение.
Предполагает ревизию сосудов, полное разобщение патологических соустий.
Термин "вазоренальная гипертензия" обозначает вторичную симптоматическую артериальную системную гипертензию, развившуюся вследствие нарушения магистрального кровотока в почках без первичного поражения паренхимы и мочевыводящих путей.
Историческая справка. В 1884 г. ученик С. П. Боткина С. В. Левашов впервые сообщил о связи между уменьшением кровотока в почечных артериях и артериальной гипертензией. Goldblatt с соавт. (1934) показали, что тяжесть вазоренальной гипертензии зависит от степени сужения почечной артерии, а устранение ее сужения приводит к нормализации давления, В 1938 г. Leadbetter при синдроме вазоренальной гипертензии произвел первую нефрэктомию, а в 1951 г. Smithwick сформировал спленоренальный анастомоз.
Распространенность.
Вазоренальная гипертензия наблюдается у 3–10% больных с повышенным АД. Чаще заболеванием страдают липа молодого и среднего возраста.
Этиология.
Нарушение артериального кровотока по почечным артериям вызывается врожденными и приобретенными заболеваниями. Среди врожденных заболеваний преобладают фибромускулярная дисплазия, гипоплазия аорты и почечной артерии, атрезия почечной артерии, артериовенозные свищи, аневризмы почечных артерий, ангиомы, множественные и добавочные почечные артерии. В последнем случае каждая добавочная артерия является сегментарной, при ее сужении или окклюзии в соответствующем сегменте почки наступают такие же изменения, способствующие развитию вазоренальной гипертензии, как и при поражении основной артерии почки.
К приобретенным заболеваниям относятся атеросклероз, неспецифический аортоартериит, инфаркт почки, отрыв устья артерии при расслоении аорты, эмболии и тромбозы почечных артерий при высокой окклюзии брюшной аорты, ятрогенные повреждения и экстравазальная компрессия артерии почек, нефроптоз.
При нефроптозе гипертензия наблюдается или только в вертикальном положении (ортостатическая гипертензия) или в горизонтальном и вертикальном положениях (стабильная гипертензия). У больных с ортостатической гипертензией АД повышается вследствие функционального стеноза почечных артерий при натяжении и деформации сосудистой ножки почки. Стабильная гипертензия обусловлена морфологическими изменениями почечных артерий из–за их длительного травмирования.
Вазоренальная гипертензия, развившаяся вследствие атеросклероза, отмечается у 30–83% больных, неспецифического аортоартериита – у 8–26%, фибромускулярной дисплазии – у 11–68%. У лиц молодого возраста причиной возникновения вазоренальной гипертензии чаще всего являются неспецифический аортоартериит и фибромускулярная дисплазия, а у пожилых – атеросклероз.
Патогенез.
Пусковым моментом в развитии вазоренальной гипертензии является ишемия почечной паренхимы или уменьшение пульсового и перфузионного давления в результате окклюзионно–стенотического поражения почечных артерий. Это сопровождается повышением продукции клетками юкстагломерулярного аппарата ренина. В организме здорового человека образование ренина необходимо для поддержания нормального тонуса сосудов. Он быстро разрушается ферментами ангиотензиназами. Соединяясь с поступающим из печени ангиотензином, ренин образует ангиотензин–I (декапептид). Ангиотензин–I не относится к прессорным веществам, а под влиянием конвертирующего фермента превращается в ангиотензин–II. Ангиотензин–II обладает сильными вазопрессорными свойствами, которые реализуются как в результате его непосредственного воздействия на системные артериолы, так и опосредованно. В последнем случае ангиотензин–II стимулирует продукцию альдостерона в коре надпочечников. Гиперальдостеронизм сопровождается снижением экскреции почками натрия, накоплением натрия в клетках в обмен на калий, увеличением объема циркулирующей жидкости и жидкости во внеклеточном пространстве. Одновременно с этим блокируется и антигипертензивный механизм: конвертирующий фермент кининаза–2 превращает лизилбрадикинин в неактивную форму. В итоге спазм периферических сосудов, гипернатриемия, гиперволемия вызывают артериальную гипертензию.
Клиническая картина.
По своим клиническим проявлениям вазоренальная гипертензия практически не отличается от гипертонической болезни.
Все наблюдающиеся при этом заболевании жалобы объединяются в 7 групп: 1. обусловленные церебральной гипертензией: чувство тяжести, боли в голове, приливы к голове, шум в ушах, ухудшение памяти, плохой сон, боли в глазных яблоках; 2. характерные для повышенной нагрузки на левые отделы сердца (относительной или истинной недостаточности коронарного кровообращения): боли в области сердца, сердцебиение, тяжесть за грудиной, одышка; 3. связанные с поражением почек: тяжесть, боли в поясничной области; 4. присущие для нарушения артериального кровообращения других сосудистых бассейнов: верхних и нижних конечностей, кишечника, головного мозга; 5. возникшие в результате вторичного гиперальдостеронизма: парестезии, мышечная слабость, тетания, изогипостенурия, полиурия и т.д.; 6. связанные с кризовым надпочечниковым течением артериальной гипертензии; 7. характерные для синдрома общевоспалительной реакции (при неспецифическом аортоартериите).
Основным симптомом вазоренальной гипертензии является значительное, стабильное повышение АД. Систолическое АД превышает 160 мм рт.ст., диастолическое – 100 мм рт. ст. Кроме того, АД плохо поддается консервативной терапии. Однако в последнее время в медикаментозном лечении больных вазоренальной гипертензией наметились положительные сдвиги в связи с появлением препаратов, обладающих выраженным антирениновым действием (каптоприл и др.).
В течении вазоренальной гипертензии выделяют три стадии: компенсации (бессимптомная, доклиническая), относительной компенсации и декомпенсации. Для стадии компенсации характерно нормальное или умеренно повышенное АД при нормальной функции почек. Гипертензия корригируется медикаментозной терапией. В бессимптомном течении заболевания выделяют истинные и ложные варианты. При истинном варианте стеноз почечной артерии не сопровождается повышением АД. У больных с ложным вариантом скрытая гипертензия обусловлена стенозом нисходящей аорты, подключичных или магистральных артерий нижних конечностей.
В стадии относительной компенсации гипертензия носит стабильный характер. Определяется умеренное снижение функции и размеров почек.
При декомпенсированной стадии гипертензия не поддается медикаментозной терапии, приобретает злокачественный характер. Значительно снижается функция почек, уменьшаются их размеры на 4 см и более.
Злокачественное течение вазоренальной гипертензии встречается в 17–20% случаев. При этом у больных отмечаются стойкое не уменьшающееся АД, астенизация, бледность кожных покровов, снижение аппетита, тошнота, рвота, прогрессирующее похудание. Наблюдаются признаки гипертонической энцефалопатии, преходящие нарушения мозгового кровообращения с очаговой неврологической симптоматикой, прогрессирующей почечной и острой левожелудочковой недостаточностью.
Диагностика.
О возможном сосудистом происхождении гипертензии свидетельствуют стабильное повышение АД у детей и подростков; устойчивость к консервативному лечению больных с повышенным АД в возрасте старше 40 лет, наличие систолического шума над почечными артериями. Однако решающее значение для диагностики вазоренальной гипертензии имеют инструментальные методы обследования: внутривенная урография, изотопная ренография, сканирование почек, ангиография.
В пользу вазоренальной гипертензии при внутривенной урографии свидетельствуют как анатомические, так и функциональные изменения в состоянии почек на стороне поражения: уменьшение продольных размеров почек на 1,5 см; снижение плотности фазы нефрограммы; запаздывание времени начального появления фазы урограммы на 3–4 мин; снижение плотности пиелограммы в первые минуты и увеличение интенсивности наполнения контрастом чашек и лоханок; замедление выведения контраста из почки на 15–20 мин. При фиброзно–мышечной дисплазии на урограммах определяется симптом "зазубренности" мочеточника (узуры) вследствие сдавления мочеточника коллатеральными артериями, идущими рядом с ним.
Изотопная ренография подчеркивает асимметрию функции почек с замедлением накопления изотопа на стороне поражения.
Сцинтиграфия выявляет снижение суммарного эффективного почечного кровотока, который у данной категории больных составляет в среднем 300–376 мл/мин (норма 1226 мл/мин).
При сканировании отмечаются равномерное уменьшение размеров почки, ровность ее наружных контуров, а при выполнении радионуклидной ангиографии – увеличение времени циркуляции препарата от аорты до почки.
Наиболее информативным способом диагностики вазоренальной гипертензии является рентгеноконтрастная ангиография. Ценность метода повышается при использовании управляемой гипотонии, рентгенокинематографии и селективной артериографии с введением в почку фармакологических вазоактивных препаратов – адреналина или ацетилхолина. Реакция на ацетилхолин хорошо выражена при фиброзно–мышечной дисплазии и снижена или отсутствует у больных атеросклерозом. Проба с адреналином наиболее эффективна при фибромускулярной дисплазии. В случае атеросклеротического поражения в почечной артерии из–за частой локализации бляшки на задней стенке артерии зона стеноза может не соответствовать истинной степени его сужения. Стеноз представлен в виде короткого конуса, иногда с перегибом артерии. Всегда определяется постстенотическое расширение. У больных с неспецифическим аортоартериитом наблюдаются одновременные изменения в брюшной аорте, устье и проксимальном отделе почечных артерий. Отсутствует постстенотическое расширение артерий. Нет выраженной сети коллатералей. Для фибромускулярной дисплазии характерны более протяженное стенозирование основной почечной артерии в средней части, четкообразный вид сосуда с микромакроаневризмами, поражения ветвей почечной артерии и внутри почечных сегментов.
Большое значение для диагностики вазоренальной гипертензии имеет определение уровня ренина в венозной крови, оттекающей от почки и в периферическом венозном русле, В почечной венозной крови он выше в 1,5–9 раз по сравнению с таковым на противоположной стороне. Отношение активности ренина в пораженной и непораженной почках равняется 1,5 и больше. При определении содержания ренина в периферической венозной крови в пользу вазоренальной гипертензии свидетельствует наличие двух пиков активности ренина в 10 и 22 г. Вместе с тем гиперренинная форма вазоренальной гипертензии встречается лишь в ⅓ случаев, а в ⅔ случаев отмечаются нормоили даже гипоренинные варианты течения.
Дифференциальная диагностика.
При ее проведении следует исходить из разработанной А. В. Покровским классификации симптоматических гипертензий, которые разделены на четыре группы: 1. 1 группа – почечная гипертензия (при гломерулонефрите, пиелонефрите, поражении почек при коллагенозах, туберкулезе, гидронефрозе); 2. 2 группа – гипертензия при поражении аорты и ее ветвей (при коарктации аорты, неспецифическом аортоартериите, вазоренальной гипертензии, поражении брахиоцефальных артерий); 3. 3 группа – надпочечниковая гипертензия (феохромо – цитома), синдром Иценко–Кушинга, первичный альдостеронизм (синдром Конна); 4. 4 группа – гипертензии, обусловленные поражением центральной нервной системы (на почве энцефалита, опухолей, при травматических повреждениях и т.д.).
Наиболее часто дифференциальная диагностика проводится с феохромоцитомой, болезнью Иценко–Кушинга, синдромом Конна, гипертензией почечного происхождения, стенозом развилки сонных артерий или опухолью каротидного тела.
Феохромоцитома – одиночная или множественная опухоль, развивающаяся из клеток мозгового слоя надпочечников или их вненадпочечниковых скоплений хромаффинной ткани (параганглии симпатической нервной системы). Отмечена чрезвычайная вариабельность локализации опухоли: по ходу трахеи, у корня языка, стенки кишки и мочевого пузыря, у бифуркации аорты. В 15–25% наблюдений место расположения феохромоцитомы определить не удается. Она одинаково часто встречается у мужчин и женщин среднего возраста.
В основе развития гипертензии при феохромоцитоме лежит продукция клетками опухоли адреналина и норадреналина. Известны четыре варианта клинического течения феохромоцитомы: бессимптомная, пароксизмальная, постоянная форма гипертонии с гипертоническими кризами, постоянная форма гипертонии без артериальных кризов. Пароксизмальная форма является наиболее типичной для феохромоцитомы и сопровождается внезапным развитием гипертонических кризов. Повышение АД может быть справоцировано пальпацией области расположения опухоли: живота, левого или правого подреберья. Во время приступа отмечаются повышение АД до 200–250 мм рт. ст. и больше, сердцебиение, обильное потоотделение, головная боль, боль в животе, рвота, одышка, дрожание рук, мерцание в глазах.
О существовании феохромоцитомы при ее типичном и атипичном течении свидетельствуют: 1. повышение, особенно в период кризов, в крови и моче уровня катехоламинов и их метаболитов, в частности ванилилминдальной кислоты; 2. гиперкалиемия; 3. патологическая кривая на сахарную нагрузку; 4. повышение основного обмена (больше + 20–50); 5. положительная обзидановая проба – снижение стойкого АД после введения обзидана (раджидана).
В пользу феохромоцитомы свидетельствуют и положительные результаты провокационных тестов: холодового, гистаминового, пальпаторного, а также постуральной пробы. При холодовом тесте гипертонический криз у больных с феохромоцитомой развивается после опускания рук в холодную (ледяную) воду. У здоровых отмечается кратковременное (до 30 с) повышение АД на 15–20 мм рт. ст. Для гистаминового теста характерно некоторое снижение АД, а затем возникновение гипертонического криза после внутривенного введения 0,25–0,05 мг гистамина в 0,250,5 мл изотонического раствора натрия хлорида. Во время проведения постуральной пробы АД в вертикальном положении всегда ниже, чем в горизонтальном. Диагноз заболевания подтверждается ультрасонографией; суперселективной аортографией (контрастирование нижней надпочечниковой артерии), в том числе на фоне ретропневмоперитонеума; сечетанием ретропневмоперитонеума с экскреторной урографией или с томографией; компьютерной томографией.
При феохромоцитоме показано хирургическое вмешательство – удаление опухоли.
При болезни Иценко–Кушинга гипертония развивается вследствие поражения промежуточного мозга, образования базофильной аденомы в передней доле гипофиза, аденомы в коре надпочечников. Это сопровождается повышенным поступлением в кровь глюкокортикоидов. У больных помимо стойкой, высокой гипертензии отмечаются общее ожирение, лунообразное, гиперемированное лицо, боли в костях, остеопороз, импотенция, аменорея, фиолетовые полосы растяжения (стрии) на груди и плечах. Возможно нарушение углеводного обмена в виде явного сахарного диабета или патологической кривой при сахарной нагрузке. О наличии болезни Иценко–Кушинга свидетельствует повышение содержания 17–оксикортикостероидов в крови. Опухоль турецкого седла выявляется при рентгенографии черепа и томографии. При болезни Иценко–Кушинга проводится хирургическое лечение – тотал ьная или субтотальная адреналэктомия.
Синдром Конна (первичный альдостеронизм) обусловлен аденомой или гиперплазией коры надпочечников с последующим выбросом в кровь большого количества минералокортикоида альдостерона. Чаще заболевание встречается у женщин в возрасте 30–45 лет. Опухоль может быть двусторонней. Ее масса составляет 1–3 г. Основными признаками синдрома являются: постоянное высокое давление, прогрессирующая мышечная слабость, парестезии, приступы тетании, полиурия. Отмечаются гиперкалиемия, гипернатриемия, гипохлоремия, повышенная экскреция калия с мочой. Для диагностики аденомы помимо ультрасонографии, компьютерной томографии, ангиографии, ретропневмоперитонеума применяется спиронолактоновая проба. Сущность последней заключается в значительном снижении АД при введении спиронолактона на фоне внутривенного капельного вливания калия. О наличии альдостеромы свидетельствует и высокий уровень альдостерона в крови при нормальных показателях 17–оксикортикостероидов и ренина.
Наиболее эффективным методом лечения при альдостероме является ее удаление.
Гипертензия почечного происхождения обусловлена различными заболеваниями почек: хроническим пиелонефритом, хроническим нефритом. В начальном периоде заболевания гипертензия обычно транзиторная, затем становится стабильной, со значительным повышением диастолического давления. О нефрогенном происхождении гипертензии свидетельствуют анамнестические данные о перенесенном воспалительном заболевании почек; частые ангины; изменения в моче в виде увеличения в 6–20 раз количества лейкоцитов, наличия белка, большого содержания выщелоченных эритроцитов; снижение концентрационной Vi выделительной функций почек. В анализе мочи по Зимницкому у больных определяются гипоизостенурия я никтурия, при ренографии – замедление выделения гипурана. На аортограммах в артериальной фазе отмечаются плохое контрастирование артерий II и III порядков, уменьшение почки на стороне поражения. Хирургическое вмешательство при гипертензии почечного происхождения показано только в том случае, если неэффективно двухтрехлетнее консервативное лечение хронического пиелонефрита. Более длительная гипертензия сопровождается поражением сосудов противоположной стороны.
Для стеноза развилки сонных артерий, опухоли каротидного тела характерно развитие гипертонических кризов при определенном положении головы, т.е. после раздражения каротидного тельца. Самым точным методом диагностики заболевания является каротидная ангиография. Лечение предполагает выполнение эндартерэктомии, удаление опухоли каротидного тела.
Лечение.
Единственным радикальным методом лечения при вазоренальной гипертензии является хирургическое вмешательство. Адекватный кровоток по почке восстанавливается путем выполнения транслюмбальной баллонной дилатации или реконструктивной операции.
Транслюмбальная баллонная дилатация стенозов почечных артерий показана при вазоренальной гипертензии у больных старше 60 лет; стенозе почечных артерий, осложнившемся почечной недостаточностью; противопоказаниях к выполнению реконструктивных операций (стеноз сонных, коронарных артерий, сердечная и легочная недостаточность); рестенозах почечных артерий после их реваскуляризации или трансплантации почек; как диагностическая процедура для уточнения зависимости между стенозом почечных артерий и артериальной гипертензией. Даже временная нормализация АД после правильно выполненной дилатации свидетельствует о ее сосудистом происхождении.
Объем реконструктивной операции при вазоренальной гипертензии зависит от количества пораженных почек и их функционального состояния; наличия сочетанного поражения аорты и ее висцеральных ветвей; общего состояний больных. Реконструктивная операция не выполняется при сморщивании обеих почек, общих хирургических противопоказаниях, терминальной стадии почечной недостаточности.
При одностороннем поражении почечных артерий реконструктивная операция производится на стороне поражения из торакофренолюмботомического или обычного люмботомического доступа. У больных с двусторонней локализацией окклюзионно–стенотического процесса операция выполняется одномоментно или в два этапа. В последнем случае сохранение гипертензии после первого этапа операции предупреждает тромбоз реконструированной артерии.
Вид и объем реконструктивной операции определяется причиной возникновения стеноза почечных артерий. Основными операциями для восстановления кровотока по почечным артериям являются резекция артерии с реплантацией в аорту; резекция с анастомозом способом конец в конец; трансаортальная эндартерэктомия; аутопластика почечных артерий свободным трансплантатом или путем спленоренального анастомоза слева; пластика эксплантатом.
В случаях атеросклеротического поражения почечной артерии можно выполнять трансаортальную эндартерэктомию, пластику аорты и протезирование почечной артерии. При фибромускулярной дисплазии чаще производится резекция артерии с последующей аутовенозной пластикой или резекция с реплантацией артерии в аорту. У больных с неспецифическим аортоартериитом показано выполнение трансаортальной эндартерэктомии или резекции с протезированием почечной артерии.
Время ишемии почек при выполнении реконструкции не должно превышать 40 мин. В целях сохранения анатомофункциональной целостности ишемизированной почки операция производится в условиях общей умеренной гипотермии (30°С). Однако если длительность операции составляет 20–25 мин, гипотермия может не применяться.
Нефрэктомия у больных с вазоренальной гипертензией показана при развитии необратимых изменений паренхимы, сморщивании, аплазии, атрофии почки на стороне пораженной артерии; протяженном поражении почечной артерии и ее ветвей; неэффективности реконструктивной операции. Одним из условий ее выполнения является удовлетворительное функциональное состояние контрлатеральной почки.
Положительные исходы операций при вазоренальной гипертензии на почве атеросклероза получены в 60–70% случаев, а при фибромускулярной дисплазии в 70–80%. Для улучшения результатов операции в течение трех последующих месяцев больные должны находиться на амбулаторном лечении и при необходимости получать гипотензивную терапию.
Хроническая абдоминальная ишемия
Стенозирующие и окклюзионные поражения висцеральных ветвей аорты приводят к дефициту кровотока в том или ином сегменте желудочно–кишечного тракта на различных этапах пищеварения. Возникающий в результате этого симптомокомплекс называют: angina abdominalis, брюшная ангина, брюшная жаба, висцеральный ишемический синдром, хроническая ишемия органов пищеварения, хроническое нарушение висцерального кровообращения, хроническая абдоминальная ишемия.Историческая справка.
В 1834 г. Despre сообщил об инфаркте кишечника у больного, длительно страдавшего хронической ишемией кишечника. Baceli (1905) предложил термин "angina abdominalis". В 1957 г. Shaw с соавт. произвели первую успешную тромбэндартерэктомию из верхней брыжеечной артерии. Morris (1962) при абдоминальной ангине выполнил аортомезентериальное шунтирование.
Этиология.
К хроническому нарушению кровотока по висцеральным ветвям брюшной аорты приводят различные внеи внутрисосудистые изменения, заболевания врожденного и приобретенного характера. Условно они подразделяются на три группы: органические, функциональные и комбинированные.
К органическим приобретенным причинам хронической абдоминальной ишемии относятся: 1. Поражение висцеральных артерий при атеросклерозе, неспецифическом аортоартериите, узелковом периартериите. 2. Посттромботические, постэмболические, посттравматические стенозы и окклюзии висцеральных артерий. 3. Экстравазальные сдавления висцеральных артерий опухолями, кистой поджелудочной железы, периартериальным и ретроперитонеальным фиброзом. 4. Аневризмы аорты, в том числе расслаивающие.
Врожденные компрессионные факторы включают аномалии развития аорты и артерий: аплазию, гипоплазию, фибромускулярную дисплазию, артериовенозные свищи, гемангиомы и др.
Функциональными причинами являются гипотензия центрального происхождения, гипогликемия, полицитемия, применение ряда лекарственных препаратов (интоксикация препаратами дигиталиса).
Наиболее часто нарушение кровотока по висцеральным ветвям брюшной аорты обусловлено атеросклерозом, неспецифическим аортоартериитом, экстравазальной компрессией. Атеросклеротическое поражение висцеральных артерий более характерно для мужчин в возрасте старше 50–60 лет. Другие заболевания наблюдаются преимущественно у женщин 20–40 лет.
В локализации окклюзионно–стенотического процесса в зависимости от причины его возникновения прослежена определенная закономерность. Так, кровообращение по чревному стволу в большинстве случаев нарушается вследствие экстравазальной компрессии, по верхней брыжеечной артерий – неспецифического аортоартериита, по нижней брыжеечной артерии – атеросклероза.
Хроническое нарушение артериального кровообращения чаще развивается при стенозе (окклюзии) двух артерий – чревной и верхнебрыжеечной или одной из них при неудовлетворительном развитии сети коллатералей.
Патогенез.
Стеноз или окклюзия висцеральных ветвей брюшной аорты приводит к нарушению артериальной гемодинамики практически во всех органах желудочнокишечного тракта. Особенно сильно недостаточное поступление артериальной крови ощущается на высоте пищеварения слизистой оболочкой и подслизистым слоем желудка и кишечника. Развивающаяся гипоксия приводит к дистрофическим и язвенно'некротическим изменениям в органах пищеварения. У больных нарушается продукция пищеварительных ферментов, страдает всасывание, прогрессируют хронические энтериты, колиты и др.
Кровообращение при хронической абдоминальной ишемии длительное время осуществляется за счет множества коллатералей между чревным стволом, верхней и нижней брыжеечными артериями. В норме наличие коллатералей способствует изменению интенсивности кровотока в артериях в зависимости от потребности органов брюшной полости в кислороде по схеме: чревная артерия – верхняя брыжеечная артерия – нижняя брыжеечная артерия, Основными анастомозами являются чревно–верхнебрыжеечный, верхненижнебрыжеечный, соустье между нижнебрыжеечной и внутренней подвздошной артериями. Чревно–верхнебрыжеечный анастомоз представлен сообщением чревной артерии с верхней брыжеечной ветвью панкреатодуоденального комплекса. Сообщение между верхней и нижней брыжеечными артериями осуществляется по дуге Риолана. Анастомозирование верхней и нижней брыжеечных артерий происходит в области селезеночного угла толстого кишечника (точка Гриффита). Здесь левая ободочная ветвь средней ободочной артерии из бассейна верхней брыжеечной артерии анастомозирует с левой ободочной артерией из системы нижней брыжеечной артерии.
У больных с хронической абдоминальной ишемией направление кровотока меняется. Так, при окклюзии верхней брыжеечной артерии приток артериальной крови к тонкому кишечнику осуществляется ветвями чревной и нижней брыжеечной артерий. В случае окклюзионно–стенотического поражения чревной и верхней брыжеечной артерий поступление артериальной крови к ишемизированным органам происходит от нижней брыжеечной артерии по дуге Риолана. Для нарушения прохождения крови по нижней брыжеечной артерии характерно наличие артериального притока по дуге Риолана, но из системы верхней брыжеечной артерии. У больных с окклюзией чревного ствола компенсация кровообращения идет за счет ветвей верхней брыжеечной артерии. Однако сообщение между висцеральными ветвями брюшной аорты наблюдаются не всегда: в 30% случаев отсутствует прямой межбрыжеечный анастомоз, в 5% – верхний брыжеечный, что создает предпосылки для развития ишемии кишечника при снижении давления перфузии.
Классификация.
Заболевание классифицируется по этиологии, локализации поражения, характеру клинических проявлений, стадии нарушения кровообращения. По локализации и характеру клинических проявлений различают чревную, брыжеечную (тонкокишечную, или проксимальную; толстокишечную, или дистальную) и смешанную формы.
По стадиям нарушения артериального кровообращения выделяют (Л. В. Поташев с соавт.): 1. 1 стадию (компенсации): ■ бессимптомное течение; ■ стадия микросимптоматики – ишемия в результате функциональной нагрузки органов пищеварения. 2. 2 стадию (субкомпенсации): ишемия вследствие функциональной нагрузки на органы пищеварения. 3. 3 стадию (декомпенсации): ишемия при функциональном покое органов пищеварения. 4. 4 стадию (язвенно–некротических изменений в органах пищеварения): язвы желудка, двенадцатиперстной кишки, тонкого кишечника, энтериты, колиты, постинфарктные стриктуры тонкой и толстой кишки.
Клиническая картина.
Основными симптомами хронической абдоминальной ишемии являются боль в животе, дисфункция кишечника, прогрессирующее похудание. Степень выраженности указанных симптомов зависит от стадии заболевания. Так, в стадии микросимптоматики клинические проявления хронической абдоминальной ишемии не выражены. Нередко они интерпретируются как свидетельства обострения хронического гастрита, дуоденита, алкогольной интоксикации. В стадии субкомпенсации болезнь не имеет четких проявлений. Диетотерапия, прием пищи малыми порциями значительно облегчают состояние пациентов. При декомпенсации кровотока по висцеральным артериям симптомы заболевания наиболее выражены.
Боль является основной жалобой при хронической абдоминальной ишемии. Ее появлению предшествует ощущение тяжести в эпигастральной, мезогастральной или левой подвздошной областях после употребления большого количества пищи. При декомпенсации артериального кровотока боль становится интенсивной, отмечается и в покое. Однако она редко сопровождается рвотой. Развитие болевого синдрома связано с накоплением в ишемизированных тканях недоокисленных продуктов обмена веществ, раздражающих внутриорганные нервные окончания. Чаще боли возникают при окклюзии одновременно трех висцеральных артерий. При чревной форме хронического нарушения артериального кровоснабжения боль обусловлена ишемией печени.
Болевой синдром появляется через 15–20 мин после еды, длится 1,5–2,5 ч, т.е. на протяжении всего периода пищеварения. Боль локализуется в эпигастрии и правом подреберье, носит интенсивный, судорожный характер. При проксимальной брыжеечной форме источником боли является тонкая кишка. Ноющие, тупые боли возникают спустя 30–40 мин после приема пищи и определяются в мезогастрии. Для дистальной брыжеечной формы характерны ноющие боли при дефекации в левой подвздошной области. Боль уменьшается при небольшом количестве употребляемой пищи, поэтому больные ограничивают себя в еде (синдром малой пищи), но аппетит у них сохранен. В случае, если компрессия чревного ствола обусловлена сокращением ножек диафрагмы с серповидной связкой, боль возникает при физической нагрузке или ходьбе и ослабевает в положении больного на боку с согнутыми коленями.
Дисфункция кишечника клинически проявляется неустойчивым, неоформленным, жидким, зловонным стулом, метеоризмом, позывами на дефекацию сразу после еды, наличием в каловых массах остатков непереваренной пищи, слизи. Однако при проксимальной форме хронической абдоминальной ишемии преобладает неустойчивый стул, а при дистальной (терминальной) – метеоризм.
В дисфункции кишечника выделяют три стадии.
Для проксимальной дисфункции кишечника характерно наличие стадии ишемической функциональной энтеропатии (усиление моторики с одновременным развитием метеоризма, нарушение адсорбции), стадии ишемического энтерита (боль, признаки паралитической кишечной непроходимости, изъязвление слизистой оболочки), стадии преходящей ишемии тонкой кишки, формирования стриктур или развития мезентериального инфаркта.
При дистальной дисфункции толстой кишки выделяют стадии функциональных ишемических расстройств (метеоризм), ишемического колита (отек, изъязвление слизистой оболочки, кровотечение), ишемических стриктур и гангрены толстой кишки.
Как при проксимальной, так и при дистальной дисфункции кишечника клиническим формам поражения кишки соответствует глубина поражения ее стенки. При ишемии только слизистой оболочки развиваются энтерит и колит. Они носят обратимый характер. Ишемия слизистой оболочки и мышечного слоя сопровождается развитием фиброза и стриктур. Нередко ишемия слизистой тонкого или толстого кишечника приводит к ее гангрене с перфорацией и перитонитом.
Прогрессирующее похудание более характерно для поражения чревной и верхней брыжеечной артерий. Оно обусловлено отказом больных от употребления обычного коли-
Хирургическое вмешательство является единственным способом восстановления адекватного кровотока по висцеральным ветвям брюшной аорты. Оно служит профилактикой острого расстройства артериального кровообращения, тяжелых морфофункциональных изменений в желудке, двенадцатиперстной кишке, тонком и толстом кишечнике, печени, способствует быстрому заживлению язвенных поражений органов желудочно–кишечного тракта.
Операция абсолютно показана при II–IV стадиях заболевания. В случае бессимптомного (I а стадия) течения хронической абдоминальной ишемии или в стадии микросимптоматики (I б стадия) хирургическое вмешательство выполняется при одновременной коррекции вазоренальной гипертензии, синдрома Лериша, аневризмы. Это обусловлено тем, что нормализация внутрисосудистого тока Крови по почечным, подвздошным и другим артериям приведет к еще большему снижению АД в висцеральных ветвях. Хроническая абдоминальная ишемия будет прогрессировать.
Операция не выполняется при наличии общехирургических противопоказаний и окклюзии дистального русла пораженной артерии. Применяемые при хроническом нарушении артериального кровотока операции делятся на три группы: реконструктивные, декомпрессионные, паллиативные.
К реконструктивным операциям относятся трансаортальная тромбэндартерэктомия, в том числе с боковой ангиопластикойзаплатой; резекция артерии с реплантацией в аорту или протезированием аутотрансплантатом либо эксплантатом; шунтирующие операции; операция переключения (аортовисцеральные и артериовисцеральные анастомозы).
Декомпрессионные операции применяют в случае сдавления артерий, главным образом чревного ствола, окружающими тканями. Для этих целей используются срединная лигаментотомия, круротомия, десоляризация и устранение различных приобретенных сдавливающих факторов (резекция поджелудочной железы, удаление опухоли, фиброзных сращений и т.д.).
Паллиативные операции выполняются при дистальных формах поражения висцеральных артерий, вторичных изменениях поджелудочной железы. К данной группе операций относятся спланхникоганглионэктомия и периартериальная симпатэктомия.
Стенозирующие и окклюзионные поражения терминального отдела брюшной аорты и подвздошных артерий
Поражения в виде окклюзии или стеноза терминального отдела брюшной аорты и подвздошных артерий вызываются рядом заболеваний, сопровождаются ишемией нижних конечностей, расстройством функций тазовых органов и обозначаются термином "синдром Лериша".Историческая справка.
Окклюзия аорты как секционная находка была описана Larcheus (1643) и Fontani (1700). Graham (1814) впервые указал на окклюзию бифуркации брюшной аорты как причину ишемии нижних конечностей. Goodison (1818) обратил внимание на хорошее развитие при этой патологии артериальных коллатералей. Начало активного хирургического лечения при окклюзиях брюшной аорты и подвздошных артерий относится к 40–50 годам XX ст. В 1946 г. Dos–Santos выполнил тромбэндартерэктомию из аортоподвздошного сегмента. Oudot (1951) произвел первую успешную реконструктивную операцию на аорте – резекцию бифуркации аорты с пластикой ее аллотрансплантатом. С начала 50–х годов для лечения больных с окклюзиями аорты и подвздошных артерий стали применять синтетические протезы.
Распространность.
Окклюзионно–стенотические поражения в аортоподвздошном сегменте встречаются у 4–30% больных с ишемией нижних конечностей. В большинстве случаев (до 90%) синдром диагностируется у мужчин в возрасте 40–65 лет. Наиболее часто отмечается сочетание нарушения прохождения артериальной крови по аорте и подвздошным артериям (98%). У 15–23% пациентов наблюдается высокая обтурация аорты. Среди закупорок подвздошных артерий одновременная окклюзия общей, наружной и подвздошных артерий определяется в 49% случаев, изолированное поражение наружной подвздошной артерии – в 44%, а обшей подвздошной артерии – в 6–8%. У 36–50% больных окклюзионно–стенотический процесс в аортоподвздошном сегменте сочетается с сужением или закупоркой артерий нижних конечностей.
Этиология.
Основными причинами возникновения окклюзий или стенозов аорты и подвздошных артерий являются атеросклероз (88,5%), неспецифический аортоартериит (910%), постэмболическая и посттравматическая закупорка (0,5–1,5%). Чрезвычайно редко синдром Лериша развивается вследствие аплазии сосудов, деформирующего ретроперитонеального фиброза, фиброзно–мышечной дисплазии.
Классификация.
Окклюзионные заболевания брюшной аорты и подвздошных артерий подразделяются по многим признакам.
По виду поражения они делятся на окклюзии (полная непроходимость сосудов) и стенозы (частичная непроходимость сосудов).
По локализации различают низкую окклюзию (окклюзия бифуркации брюшной аорты дистальнее нижней брыжеечной артерии); среднюю (при которой окклюзирована аорта и закрыта нижняя брыжеечная артерия); высокую окклюзию (обтурация на уровне почечных артерий или ниже их в пределах 2 см).
Окклюзионные заболевания подразделяются также по поражению сосудистого русла других отделов аорты: восходящего, грудного отделов и т.д.; артерий нижних конечностей, стадии расстройств артериального кровоснабжения, этиологии.
Окклюзионно–стенотический процесс в аортоподвздошной зоне сопровождается хроническим нарушением артериального кровоснабжения нижних конечностей. Для его оценки применяются классификации Фонтане, А. В. Покровского, И. Н. Гришина.
По Фонтане выделяют четыре стадии ишемии нижних конечностей: 1. 1 стадия (начальных проявлений окклюзий) – характеризуется зябкостью, чувством похолодания, парестезиями, бледностью кожных покровов, повышением потливости, утомляемостью ног. 2. 2 стадия (недостаточность кровообращения при функциональной нагрузке) – проявляется симптомом перемежающейся хромоты (claudicatio intermitens). 3. 3 стадия (недостаточность кровообращения в покое) – основным симптомом является постоянная боль в конечностях, в том числе и в ночное время. 4. 4 стадия – язвенно–некротические изменения в тканях дистальных отделов конечностей.
Согласно классификации А. В. Покровского, в основе выделения четырех стадий недостаточности артериального кровоснабжения конечностей лежит появление болей при ходьбе со скоростью 4–5 км/ч в зависимости от дистанции: 1. 1 стадия – появление болей в конечности при ходьбе на расстояние более 1 км. 2. 2 стадия: ■ появление болей при ходьбе на расстояние более 200 м; ■ появление болей при ходьбе на расстояние до 200 м. 3. 3 стадия – появление болей в конечностях в покое или при ходьбе на расстояние менее 25 м. 4. 4 стадия – наличие язвенно–некротических изменений в тканях.
И. Н. Гришин выделяет три степени хронической артериальной недостаточности: 1. 1 степень (относительной компенсации) – чувство усталости в ногах после нагрузок, превышающих обычные (бег, длительная постоянная или быстрая ходьба, велоэргометрические пробы); зябкость стоп; перемежающаяся хромота более чем через 200 м. 2. 2 степень (субкомпенсации кровообращения) – усталость в ногах, боли, судороги в икроножных мышцах при обычных нагрузках, перемежающаяся хромота через 100200 м, зябкость, парестезии стоп. 3. 3 степень (декомпенсации) – глубокий некроз тканей: сухая или влажная гангрена пальцев стопы или стоп с резкими болями и общей интоксикацией.
Клиническая картина.
Складывается из симптомов недостаточности артериального кровоснабжения нижних конечностей, органов таза и ягодичных мышц: перемежающейся хромоты, импотенции, трофических расстройств тканей дистальных отделов конечностей. Выраженность указанных симптомов зависит от степени окклюзии аорты и подвздошных артерий, состояния коллатералей. У подавляющего числа пациентов эти признаки появляются постепенно и носят волнообразный характер. Крайне редко синдром Лериша проявляется в виде эмболии или острого тромбоза аортоподвздошного сегмента.
Первыми симптомами заболевания, как правило, являются боли в икроножных мышцах при форсированной физической нагрузке (быстрая ходьба, бег, подъем по лестнице и т.д.), купирующиеся после кратковременного отдыха (в течение 1–5 мин). Это так называемая низкая перемежающаяся хромота. При окклюзиях аорты боли локализуются в ягодичных мышцах, пояснице, мышцах задней и латеральной поверхностей бедер (высокая перемежающаяся хромота).
В ряде случаев наблюдается артериальная недостаточность мышц тазового дна, что проявляется нарушением функций сфинктеров (перемежающаяся хромота сфинктера) прямой кишки в виде недержания кала, газов, а также функции мочевого пузыря в виде недержания мочи. Одновременно при высокой окклюзии аорты нередко отмечаются явления хронического колита, вазоренальной гипертензии, хронической абдоминальной ишемии.
Импотенция встречается у 50–60% больных. Ее появление обусловлено тремя причинами: недостаточностью притока крови, что исключает полноценное кровенаполнение кавернозных тел во время эрекции; хронической артериальной спинальной недостаточностью, отражающейся на функции спинальных половых центров; снижением гормональной активности, в связи с ишемией яичек, предстательной железы. Последняя продуцирует простогландины, которые оказывают специфическое сосудорасширяющее действие на гладкую мускулатуру.
Трофические нарушения кожи проявляются выпадением волос, сухостью, шелушением кожи, гиперкератозом на подошвенной поверхности стоп, замедлением роста ногтей, их утолщением и изменением цвета. Ногтевые пластинки становятся толстыми и приобретают бурую окраску. Атрофируются подкожно–жировая клетчатка и мелкие мышцы стоп. Кожа истончается, становится легкоранимой. Длительно не заживают трещины и раны. При декомпенсации кровообращения появляется отек стоп, голени. В дистальных отделах конечностей, чаще пальцев, возникают язвы. Дно их покрыто налетом грязно–серого цвета. В окружности язв определяется воспалительная инфильтрация. Часто присоединяется лимфангоит, усиливающий ишемию тканей.
Диагностика.
Правильный диагноз синдрома Лериша может быть поставлен на основании результатов объективного осмотра пациентов и инструментальных методов обследования. При осмотре определяются различной степени выраженности трофические расстройства тканей дистальных отделов конечностей, снижение тонуса сфинктера прямой кишки. При пальпации и аускультации выявляется нарушение прохождения крови по аорте и подвздошным артериям. У подавляющего числа больных выслушивается систолический шум над стенозированными бедренными артериями, а у ⅓ – над брюшной аортой. Определяется резкое снижение или отсутствие АД на ногах, а в случае одностороннего поражения подвздошных артерий – его асимметрия.
О нарушении артериального кровообращения в конечности свидетельствуют и функциональные пробы: 1. проба Оппеля (симптом плантарной ишемии) – побледнение подошвы стопы пораженной конечности, поднятой вверх под углом 45°. У практически здоровых бледность наступает в течение 3–4 мин; 2. проба Гольдфлама – появление чувства утомления, болей в поднятых ногах, при движении в голеностопных суставах; 3. проба Самюэлса – побледнение подошвенной поверхности стопы приподнятых ног, при движении в голеностопных суставах; 4. проба Панченко (коленный феномен) – появление зябкости, парестезии, болей в икроножных мышцах при закидывании больной ноги на здоровую; 5. синдром прижатия пальца – большее, чем на 5–10 с, побледнение кожи концевой фаланги первого пальца стопы при ее сдавлении в переднезаднем направлении.
Инструментальные методы исследования позволяют уточнить характер нарушения артериального кровотока. Ультразвуковое исследование дает информацию о локализации и протяженности поражения сосудов, об уменьшении давления в артериях нижних конечностей, снижении линейной скорости кровотока. Электротермометрия уже в начальной стадии синдрома Лериша выявляет асимметрию температуры ног. На реовазограммах, осциллои сфигмограммах находят снижение абсолютных показателей, сглаженность и деформацию контуров регистрируемых кривых. Для определения роли спастического компонента в развитии ишемии нижних конечностей эти методы обследования целесообразно провести до и после приема нитроглицерина (1 таблетка).
Наиболее полную информация об окклюзионно–стенотическом поражении аортоподвздошного сегмента дает аортография (рис, 44). При врожденной гипоплазии подвздошных артерий ее контуры ровные, равномерно суживаются, если отсутствуют дефекты наполнения. У больных с фиброзно–мышечными дисплазиями подвздошных артерий определяются множественные зоны сужения, из–за чего артерия имеет вид четок. Атеросклеротическому поражению аорты и подвздошных артерий свойственны краевые дефекты наполнения, изъеденность контуров сосудов с участками сегментарных стенозов и окклюзий, извитость и расширение проксимальных сегментов аорты и подвздошных артерий, хорошее развитие коллатералей. При неспецифическом аортоартериите оккдюзионно–стенотический процесс диффузно локализуется в аорте и в проксимальном сегменте подвздошных артерий, нет выраженной сети коллатералей.
Дифференциальная диагностика.
Проводится с облитерирующим эндартериитом, диабетической ангиопятией, воспалением седалищного нерва.
Облитерирующий эндартериит поражает мужчин в возрасте 20–30 лет. В анамнезе они отмечают продолжительное курение, переохлаждение, инфекцию, интоксикацию, психические и физические травмы, аллергические заболевания, тромбофлебиты. Симметрично поражаются дистальные артерии нижних конечностей – стопы и голени. Перемежающаяся хромата появляется рано, носит "низкий" характер.
Диабетическая ангиопатия наблюдается у лиц обоего пола в возрасте 50 лет и старше, страдающих сахарным диабетом. Она характеризуется симметричной локализацией в дистальных отделах артерий, сочетанным поражением артерий сетчатки глаза, почек, постоянно прогрессирует…
При воспалении седалищного нерва боли локализуются в ягодице, по заднелатеральной поверхности бедра, не зависят от физической нагрузки, в покое не исчезают, усиливаются ночью. У больных определяются неврологические симптомы воспаления седалищного нерва. Характер пульсации магистральных артерий нижних конечностей не изменяется.
Лечение.
Вопрос о тактике ведения больных с синдромом Лериша решается комплексно на основании стадии ишемии, локализации процесса и общего состояния пациентов.
При ишемии 1–2а стадий и противопоказаниях к реконструктивной операции при других стадиях показано консервативное лечение.
Основными принципами проводимых консервативных мероприятий являются: 1. Купирование болевого синдрома (анальгетики, внутриартериальные блокады 1% раствором новокаина, паравертебральные симпатические блокады, эпидуральные блокады). 2. Ликвидация сосудистого спазма с помощью спазмолитиков (но–шпа, папаверин, галидор и др.) и ганглиоблокаторов. 3. Активация обменных процессов в тканях (витамины В1, B2, B12, В15, никотиновая кислота, компламин, солкосерил, ингибиторы брадикининов – продектин, пармидин). 4. Улучшение реологических свойств крови, нормализация адгезивно–агрегационной функции тромбоцитов, состояния свертывающей системы крови (непрямые антикоагулянты, реополиглюкин, трентал, курантил). 5. Десенсибилизирующая терапия (димедрол, пиполъфен и др.). 6. Седативная терапия (седуксен, элениум и др.). 7. Физиотерапевтические и бальнеологические процедуры (токи Бернара, электрофорез, УВЧ–терапия, радоновые, сероводородные ванны). 8. Гипербаротерапия. 9. Применение методов экстракорпоральной детоксикации организма (УФО крови, гемосорбция, плазмаферез). 10. Устранение действия неблагоприятных факторов внешней и внутренней среды (отказ от курения и употребления спиртных напитков, недопущение чрезмерного охлаждения и др.). 11. Санаторно–курортное лечение.
Консервативное лечение проводится курсами по 1–2 мес. амбулаторно или стационарно в зависимости от стадии ишемии нижних конечностей 2–3 раза в год.
Наиболее эффективный метод лечения при окклюзии аортоподвздошной области – хирургическое вмешательство, так как большинство пациентов через 1–2 года после появления первых симптомов заболевания становятся нетрудоспособными. Абсолютными показаниями к реконструктивной операции являются 2б–4 стадии ишемии нижних конечностей. Операция противопоказана при инфаркте миокарда и инсульте (сроки от 1 до 3 мес.), недостаточности кровообращения III степени, циррозе печени, почечно–печеночной и выраженной легочной недостаточности. В некоторых ситуациях противопоказания к операции могут быть пересмотрены в зависимости от общего состояния больных, степени ишемии конечностей. Возраст не является прямым противопоказанием к хирургическому лечению.
В лечении больных с окклюзионно–стенотическим поражением аорты и подвздошных артерий применяются прямые, непрямые и рентген оэндоваскулярные реконструктивные операции. К группе прямых хирургических вмешательств относятся резекция с протезированием, шунтирование и тромбэндартерэктомия.
Резекция с протезированием выполняется при окклюзии и особенно кальцинозе терминального отдела брюшной аорты и подвздошных артерий с отсутствием коллатеральной сети; при аневризматическом расширении бифуркации аорты. Сущность операции заключается в полном пересечении аорты у бифуркации; формировании анастомоза протез – аорта способами "конец в конец", "конец в бок"; проведении протеза через забрюшинный канал на бедра; накладывании дистального анастомоза с общей бедренной артерией чаще по типу "конец в конец". При непроходимости поверхностной бедренной артерии соустье формируется с глубокой артерией бедра.
Шунтирование в аортоподвздошной зоне может быть выполнено линейным или бифуркационным протезом. Линейное шунтирование показано при одностороннем окклюзионно–стенотическом поражении общей и наружной подвздошной артерий с проходимыми сосудами с противоположной стороны. Бифуркационное шунтирование выполняется при двустороннем стенозе или окклюзии (и их сочетании) аортоподвздошного сегмента и хорошо развитых париетальной и висцеральной сетях коллатералей, при сочетании окклюзий подвздошных артерий одной стороны с клинически компенсированным стенозом противоположной стороны. В таких ситуациях в случае тромбирования протеза кровоснабжение конечностей осуществляется по ранее сформировавшимся сетям. Возможны различные варианты шунтирующих операций.
Тромбэндартерэктомия из аортоподвздошной области выполняется при ограниченной окклюзии дистального сегмента аорты или общей подвздошной артерии. Абсолютными противопоказаниями к данной операции являются кальциноз и аневризматическое расширение артерий.
Непрямые реконструктивные операции (внеанатомическое шунтирование) у больных с синдромом Лериша производятся при тотальном кальцинозе аорты и подвздошных артерий; проксимальном тромбозе аорты, когда ее выделение затруднено и рискованно; гнойно–воспалительных процессах в брюшной полости, забрюшинном пространстве, в коже передней брюшной стенки; при общих противопоказаниях к выполнению прямой операции. К непрямым реконструктивным операциям относятся подключично–общеглубокобедренное, подмышечно–общеглубокобедренное и различные варианты бедренно–бедренного шунтирования. При выполнении соустья между подключичной (подмышечной) и бедренными артериями протез проводится между большой и малой грудными мышцами подкожно на боковой поверхности грудной клетки и живота по средней подмышечной линии. При бедренно–бедренном шунтировании эксплантат может располагаться подкожно или в зал о б ко во м пространстве (пространство Ретциуса),
Методы рентгеноэндоваскулярной хирургии применяются при локальном поражении подвздошных артерий. К ним относятся лазерная, ротерная, ультразвуковая реканализация, рентгеноэндоваскулярное протезирование.
Лазерное и ротерное восстановление проходимости подвздошных артерий основано на разрушении атероматозных бляшек лазерным излучением и действием ротера.
Ультразвуковая реканализация артерий базируется на использовании эффекта ультразвуковых механических колебаний. При этом методе к зоне окклюзий артерий подводится волновод, представляющий собой металлический стержень из титанового сплава длиной 15–40 см с рабочей частью в форме лопаточек, полуколец и колец. После артериотомии рабочая часть волновода вводится между пораженной интимой и средним слоем артерии. При возбуждении в волноводе продольных ультразвуковых колебаний с частотой 26,5 кГц и амплитудой 35–40 мкм осуществляется эндартерэктомия. Отторгнутые атероматозные массы удаляются через ранее произведенный разрез. Применение метода значительно облегчает выполнение эндартерэктомии и уменьшает вероятность перфорации сосуда.
При интраоперационной дилатации после артериотомии в подвздошную артерию под рентгенотелевизионным контролем проводится дилатационный катетер Грюнцига диаметром 9–10 мм. Выше и ниже места сужения электроманометрически измеряется давление крови. Дилатация выполняется при наличии градиента давления 30 мм рт. ст. и более путем повышения давления в катетере до 4 атм и экспозиции 10 с. Адекватность манипуляции контролируется с помощью интраоперационной ангиографии и повторной электроманометрии.
Сущность рентгеноэндоваскулярного протезирования состоит во введении в просвет артерии вытянутой проволоки из медицинского сплава нитинола, обладающего эффектом "памяти формы". При отливе проволоки в заводских условиях ей придается форма спирали, которую она теряет при температуре 0–10°С. В случае введения проволоки в артерию, где температура равна 37°С, она восстанавливает спиралевидную форму, равномерно расширяя просвет артерии изнутри.
После восстановления кровотока в аортоподвздошной зоне больным с синдромом Лериша по показаниям выполняется коррекция кровотока на бедре и голени (эндартерэктомия, шунтирование).
В послеоперационном периоде пациенты должны постоянно принимать дезагреганты (ацетилсалициловая кислота – 0,25–0,5 г 3 раза в день, курантил – 0,025–0,05 г 3 раза в день), 1–2 раза в год проходить курсы стационарного комплексного лечения. Им рекомендуется рациональное трудоустройство.
Эмболии и тромбозы бифуркации аорты и периферических артерий
Историческая справка.
История лечения больных с тромбозами и эмболиями берет свое начало в XV–XVI ст. В трудах Vessalii, Bonnet встречаются указания о том, что образование тромбов в полостях сердца нередко сопровождается гангреной конечностей. В XVII ст. английский ученый U. Goud высказал мнение о том, что от тромбов могут отторгаться частицы, которые проникают в артериальную систему и вызывают закупорку сосудов, препятствуя притоку питающего сока. P. Virchow в 1856 г. предложил термин "эмболия", что в переводе с греческого слова "embole" означает "вторжение", "вбрасывание".Начало оперативного лечения эмболии и тромбозов связано с именем И. Ф. Сабанеева, который в 1895 г. произвел первую в мире попытку удаления эмбола из бедренной артерии. В 1897 г. Р. Вреден выполнил эмболэктомию из бифуркации аорты. Первую успешную эмболэктомию из бедренной артерии осуществил французский хирург Labey (1911). Значительным событием в хирургии артериальных тромбозов и эмболий явилась разработка в 1963 г. группой американских ученых во главе с J. Fogarty специального приспособления для эмболи тромбэктомиикатетера с раздувающейся баллонной манжеткой на конце.
Эмболии
Под эмболиями подразумевается острое нарушение артериального кровообращения, развившееся в результате перекрытия просвета неизмененной артерии или аорты эмболом, представляющим собой часть тромба либо ткани организма, оторвавшуюся от основного источника и мигрирующую с током крови по кровеносному руслу.Распространенность
Сведения о распространенности эмболий противоречивы, что объясняется бессимптомным течением эмболий ряда мелких артерий. Наиболее высокий процент эмболий отмечается у женщин в возрасте 51–60 лет, так как они более подвержены эмбологенным заболеваниям. Чаще встречаются эмболии артерий мозга, конечностей и органов брюшной полости. Среди магистральных артерий в большей степени поражаются сосуды нижних конечностей (30–60%). Это объясняется наличием острого угла отхождения подвздошных артерий от аорты, что способствует проникновению эмболов в дистальном направлении без каких–либо гемодинамических трудностей. Как правило, эмбол останавливается в местах анатомического или патологического сужения артерий. Наиболее часто это происходит в области развилки сосуда или отхождения от него крупной коллатеральной ветви.
Этиология.
По локализации первичного очага причинами эмболий являются: левая половина сердца – пристеночные тромбы, образовавшиеся на фоне нарушения ритма сердца, инфаркта миокарда, стеноза митрального клапана, эндокардита; аорта – атеросклеротическая бляшка, травма с последующим тромбозом, опухоли; правые отделы сердца – дефекты межжелудочковой и межпредсердной перегородок); вены большого круга кровообращения – незаращение внутрисердечных перегородок. К заболеваниям, часто осложняющимся эмболиями, относятся ревматические пороки с нарушением ритма сердца (45–50%); инфаркт миокарда (30%); хроническая и острая аневризма сердца (20–51%); аневризмы аорты и периферических артерий (4%); септический и фибропластический эндокардит (1–6%); инфекционные заболевания (септический тиф, токсическая форма дифтерии – 0,5–2%); тромбоз легочных вен при пневмониях и травмах (0,5–3%); инородные тела (пули, глисты, опухолевые клетки, эхинококковые пузыри – 0,5–1%).
В зависимости от количества и локализации эмболов выделяют единичные эмболии (поражение артерии на одном уровне), этажные – двойные, тройные (окклюзия одной артерии на нескольких уровнях), множественные эмболии артерий разных конечностей или сочетанные поражения артерий конечностей и внутренних органов.
Патогенез.
Схематически можно представить в виде нескольких последовательных фаз: образование эмбола в каком–либо отделе сердечно–сосудистой системы; отрыв эмбола; продвижение его по сосудистому руслу и внедрение в просвет артерии; внезапное растяжение стенки артерии выше места эмболии; возникновение спазма эмболизированной артерии и ее ветвей ниже зоны эмболии; формирование продолженного тромба; развитие морфологических изменений в стенке артерии; расстройство питания тканей; развитие гангрены конечности или восстановление кровообращения.
В результате закупорки эмболом просвета артерии ее стенка выше препятствия растягивается, раздражается интерорецептивный аппарат. Артерия ниже зоны эмболии спазмируется. В ряде случаев рефлекторно суживаются артерии и на здоровой конечности. Механизм артериоспазма связывается с кислородным голоданием сосудистой стенки, эффектом действия трансмурального давления на стенки микрососудов в условиях локальной гипотонии. После остановки эмбола в течение первых 2–3 ч от начала заболевания в проксимальном и дистальном направлениях по отношению к эмболу формируется продолженный свежий тромб. Последний блокирует по длине и ширине просвет артерии. Более интенсивно тромб распространяется к периферии. В проксимальном направлении он поднимается до места отхождения от артерии коллатералей с большой скоростью кровотока. Одновременно в дистальных участках сосудистого русла развивается вторичный тромбоз.
В течение 8–12 ч продолженный тромб обычно флотирующий, т.е. рыхло связан со стенкой артерии. Затем он плотно фиксируется к внутренней оболочке и распространяется по боковым ветвям. Одновременно в интиме и средней оболочке наступают различной степени выраженности воспалительные изменения. Через 12–24 ч очаговые инфильтраты и кровоизлияния формируются в адвентиции, паравазальной клетчатке. В воспалительный процесс вовлекаются близлежащие нервы и вены. Это ведет к развитию сопутствующих невритов и тромбофлебитов, что является крайне неблагоприятным прогностическим фактором.
Клиническая картина.
Признаками артериальной эмболии являются сильная боль, похолодание, онемение, резкая слабость пораженной конечности, бледность ее кожных покровов, ухудшение рисунка подкожных вен, изменение поверхностной и глубокой чувствительности, нарушение функций конечности, исчезновение пульсации артерий с уровня ее закупорки. Выраженность указанных признаков определяется главным образом локализацией эмбола, т.е. зоной ишемии. Так, при окклюзии бифуркации аорты область ишемии захватывает обе ноги и нижние отделы живота, подвздошных артерий – нижнюю конечность до пупартовой связки, бедренных артерий ¦ нижнюю конечность до средней трети бедра, подколенной артерии – нижнюю конечность до коленного сустава. Эмболия подключичной артерии сопровождается ишемией всей руки, подмышечной – ишемией руки до верхней трети плеча, а плечевой артерии – ишемией конечности до средней трети плеча.
Часто возникновению эмболий предшествуют различные продромальные явления: сжимающего характера боль в области сердца, сердцебиение, общая слабость, микроэмболии периферических сосудов, эмболии головного мозга, сосудов внутренних органов.
Боль при эмболиях встречается в 90–95% случаев. Болевой синдром появляется внезапно и быстро достигает значительной силы. При эмболиях бифуркации аорты часто развивается шоковое состояние. Наиболее интенсивные боли бывают при окклюзиях артерий, кровоснабжающих области с хорошо развитыми мышцами, что объясняется повышенной чувствительностью последних к недостатку кислорода. У некоторых пациентов болевой синдром вначале носит схваткообразный характер из–за рефлекторного артериального спазма. Боль может охватывать сразу всю конечность или распространяться постепенно из проксимальных ее отделов в дистальные. Однако чаще болевые ощущения носят нисходящий характер. У ослабленных пациентов и при парциальных окклюзиях сосудов эластического типа (бифуркация аорты и подвздошные артерии), в которых артериальный спазм выражен незначительно, отмечается безболевая форма эмболий при наличии ишемии ткани. Как правило, в таких случаях наблюдается несоответствие между степенью ишемии тканей и интенсивностью болей.
Слабость в пораженной конечности, ее похолодание и онемение отмечают практически все больные. В ряде случаев указанные жалобы служат первыми проявлениями заболевания и предшествуют боли.
Кожные покровы конечностей дистальнее области эмболии резко бледнеют. При прогрессировании ишемии бледность сменяется цианозом, мраморностью. Иногда в дистальных отделах конечности возникает зона особой цианотичной окраски, обычно соответствующая границе будущего некроза. Ослабевает капиллярный пульс, который оценивается по появлению белого пятна в ногтевом ложе при надавливании и исчезновению после прекращения давления.
При крайней степени ишемии ослабевает венозный рисунок, подкожные вены спадаются. У лиц с менее выраженным расстройством артериального кровообращения вены выделяются на бледном фоне кожных покровов. Кровь из них легко выдавливается пальцем, после чего вены спадаются и принимают характерный вид канавки (симптом канавки).
Для эмболий характерно резкое снижение температуры кожи с приближением ее в дистальных отделах конечное' тей к температуре окружающей среды. Степень снижения температуры находится в прямой зависимости от выраженности ишемических расстройств в тканях. Кожная температура начинает снижаться не с уровня расположения эмболии, а на 10–20 см ниже ее. В ряде случаев на границе между холодной и нормальной кожей наблюдается зона небольшой гиперемии. Обычно она сочетается с усилением пульсации артерий выше закупорки и связана с местным рефлекторным спазмом коллатералей.
Эмболия конечностей сопровождается расстройством всех видов чувствительности. Постепенно исчезает тактильная, температурная и болевая чувствительность. Затем наступает полная поверхностная и глубокая анестезия. Параллельно с расстройством чувствительности угнетаются поверхностные и глубокие рефлексы.
Нарушение функций конечностей проявляется исчезновением активных движений вначале в ее дистальных, а затем и в проксимальных отделах. Через 8–12 ч после возникновения эмболий развивается мышечная контрактура, что связано с ишемией мышечной ткани и поражением нервных стволов, при эмболии бифуркации брюшной аорты нарушается функция тазовых органов. Появляются ложные позывы на мочеиспускание и дефекацию.
Наиболее типичными признаками ишемии являются исчезновение пульсации артерий, начиная от уровня окклюзии сосуда, и усиление пульсации артерий выше этого места.
На 3–6–е сутки и после возникновения эмболий может наступить вторичный тромбоз глубоких вен конечностей (постэмболический вторичный тромбоз), что значительно ухудшает прогноз заболевания. При флеботромбозе создается впечатление об улучшении кровообращения в области ишемии: уменьшаются боли, повышается температура кожи, увеличивается объем движений в суставах. Однако затем, за счет отека и сдавления артерий, местная гемодинамика ухудшается еще в большей степени.
Диагностика и лечение.
См. тромбозы.
Тромбозы
Тромбоз – это острое нарушение артериального кровообращения, наступающее в результате перекрытия просвета артерии или аорты сгустком крови в месте поражения их стенки каким–либо патологическим процессом.Распространенность.
Острые тромбозы в 10–30% случаев осложняют течение атеросклероза и эндартериита. В 80–95% наблюдений тромбозы развиваются при травматическом повреждении артерии. Чаще заболевание встречается у мужчин в возрасте старше 50 лет. Тромботической окклюзии подвержены в основном артерии нижних конечностей.
Этиология.
Острые артериальные тромбозы развиваются вследствие заболеваний, сопровождающихся морфологическими изменениями в стенках артериальных сосудов и нарушением гомеостаза. К таким заболеваниям относятся атеросклероз (20–40%), эндартериит (10–20%), неспецифический аортоартериит (9–Т 5%), инфекционные (5–7%) и гематологические заболевания – эритроцитоз (2–6%). Образованию тромбов способствуют травмы сосудов, повреждения интимы артерии при различных диагностических и лечебных манипуляциях (1–4%), ги пер коагуляция.
Патогенез.
Острый артериальный тромбоз возникает при наличии трех причин (триады Вирхова): нарушения целостности сосудистой стенки, изменения свертывающей и противосвертывающей систем крови, замедления тока крови. Поражение стенки сосудов может быть не только морфологическое, но и чисто функциональное, например, при снижении электрического z–потенциала сосудистой стенки. Во всех случаях в ответ на повреждение эндотелия артерии происходят адгезия и агрегация тромбоцитов. Интенсивность формирования последних определяется двумя факторами – действием физиологически активных веществ, высвобождающихся из красных кровяных пластин (серотонина, тромбоксана А2, простагландинов С2 и Е2, АДФ), и способностью эндотелия продуцировать ингибиторы агрегации (простациклин). Тромбоцитарные факторы и биологически активные вещества ведут к активации свертывающей системы крови, снижению ее фибринолитической активности. Это находит отражение в организации тромбоцитарных агрегатов в кровяные сгустки (тромбы).
Эмболии и тромбозы, вызывая окклюзии артерий, приводят к развитию острой гипоксии тканей конечности с нарушением обменных процессов. Недостаточное поступление кислорода способствует переходу аэробного окисления в анаэробное с накоплением в тканях недоокисленных продуктов (молочная и пировиноградная кислоты) и мембранотоксинов (серотонин, гистамин, кинины и т.д.). Они повышают проницаемость внутриклеточных мембран, усиливают адгезию тромбоцитов, вызывают гибель миоцитов. Нарушение мембранной проницаемости приводит к появлению субфасциального отека мышц, который способствует сдавлению сосудов и еще большему ухудшению кровообращения в тканях. Формируются очаги тканевого некроза. Одновременно внутриклеточный калий, миоглобин, продукты тканевого распада проникают в межтканевое пространство, а затем в общий кровоток. Страдает функция сердечно–сосудистой системы, почек, печени. Грубые изменения центральной гемодинамики (гипотония, нарушение ритма сердечной деятельности) сопровождаются еще большим ухудшением местного кровообращения, через 10–12 ч гипоксии развиваются необратимые изменения в нервной и мышечных тканях, а через 24 ч – в коже. Зона некроза мышц всегда распространяется проксимальнее границы поврежденной кожи. Ишемические повреждения тканей в большей степени выражены в дистальных отделах конечности.
Симптоматика при острых тромбозах артерий конечностей достаточно изменчива, что объясняется многообразием причин их возникновения. Однако в течении всех форм травматических артериальных окклюзий выделяют ряд отличительных особенностей. Во–первых, ишемия при тромбозе развивается постепенно. Вначале появляются похолодание и онемение конечности, ее резкая слабость. Затем возникает и нарастает боль. Конечность бледная, ее кожная температура снижена. Нарушены поверхностная и глубокая чувствительность, функция конечности. Не определяется пульсация ранее функционировавшего сосуда, шунта или протеза. При тромбозе стенозированных артерий исчезает ранее выявляемый над ними систолический шум. Во–вторых, для острых артериальных тромбозов характерно отсутствие строгой взаимосвязи между уровнем ишемических расстройств и локализацией тромба. В–третьих, при острых тромбозах нет прямой зависимости между степенью снижения кожной температуры и выраженностью ишемии. Иногда при самом резком нарушении кровообращения с исходом в гангрену асимметрия температуры достигает всего лишь 2–УС. В–четвертых, в случае тромбоза на почве атеросклероза, эндартериита, как правило, к моменту его возникновения образуется выраженная сеть коллатералей. Это является благоприятным факторам течения ишемии, т.е. декомпенсация кровообращения у такой категории больных развивается медленно и может не достигать значительных степеней.
Выраженность указанных симптомов зависит от локализации и степени окклюзии артерии (полная или частичная), интенсивности сопутствующего нервно–рефлекторного артериального спазма, распространенности продолженного тромбоза, особенностей коллатерального кровообращения, длительности ишемии.
Классификация и клиническая картина.
Имеется несколько классификаций острой артериальной недостаточности. 1. Классификация по В. С. Савельеву. Прежде всего выделяется ишемия 2 (2а) степени, которая характеризуется появлением признаков ишемии конечности только при физической нагрузке. В покое ишемический синдром отсутствует. Ишемия I А степени проявляется онемением, похолоданием, парестезиями в конечности в покое. При ишемии I Б степени к этим симптомам присоединяется боль. У лиц с ишемией II А степени нарушается чувствительность и ограничивается объем активных движений в суставах (парез), с ишемией II Б степени активные движения становятся невозможными (плегия). Для ишемий III степени характерно развитие некробиотических изменений в тканях: субфасциального отека (III А степень), парциальных (III Б степень), тотальных (III В степень) мышечных контрактур. 2. Классификация по И. Н. Гришину с соавт. Выделяются компенсированная, субкомпенсированная и декомпенсированная степени ишемии.
При компенсированной степени ишемии после первичной болевой реакции, длящейся 1,5–3 ч, все признаки ишемии исчезают, кожные покровы принимают обычный вид. Восстанавливается капиллярный пульс, сохраняется функ ция конечности. Однако на периферических артериях он может отсутствовать. В ряде случаев наблюдается и снижение кожной температуры. Компенсация артериального кровообращения происходит при наличии адекватного коллатерального кровотока, окклюзии второстепенной артерии, миграции тромбов (эмболов) в более мелкие артерии, лизисе тромбов(эмболов).
У больных с субкомпен сированной степенью ишемии определяются постоянные в течение длительного промежутка времени признаки недостаточности артериального кровообращения. Это связано с существованием определенного остаточного артериального коллатерального притока крови. Выражен болевой синдром. Кожные покровы конечности бледные. Капиллярный пульс ослаблен. Пульс на магистральных периферических артериях отсутствует. Снижена кожная температура. Если на протяжении 8–14 ч после начала заболеваний (острый период) эмболия или тромбоз не наступают повторно, данное состояние артериальной гемодинамики расценивается как хроническая артериальная недостаточность.
Декомпенсированная степень ишемии развивается при полном прекращении поступления крови в конечность и проявляется значительным нарушением морфофункционального состояния последней. Эта степень ишемии подразделяется на фазу обратимых изменений тканей, фазу нарастания необратимых изменений и фазу необратимых изменений.
Фаза обратимых изменений длится 2–3 ч. При восстановлении артериального кровообращения в течение этих сроков функция конечности восстанавливается в полном объеме.
Для этой фазы характерны: 1. полное отсутствие болевого синдрома и жалоб после первичной болевой реакции 2. бледно–восковой цвет кожных покровов 3. исчезновение всех видов чувствительности 4. активных движений в суставах 5. капиллярного пульса и пульсации периферических артерий.
Фаза нарастания необратимых изменений характеризуется прогрессированием объективных признаков ишемии, появлением очагов деструкции в тканях. Однако восстановление кровотока приводит к их ограничению и постепенной нормализации морфофункционального состояния конечности. Продолжительность этой фазы 5–6 ч. Пациенты, как правило, жалуются на чувство онемения в конечности. При объективном осмотре отмечаются умеренная туго подвижность в суставах, похолодание конечности.
Фаза необратимых изменений по сути является фазой биологической смерти. Выражена мышечная контрактура. Невозможны движения в суставах. На коже появляются очаги некроза. Возобновление артериального кровоснабжения не только не восстанавливает функцию конечности, но сопровождается массивным поступлением продуктов тканевого распада в общий кровоток с развитием аутоинтоксикации организма.
Диагностика.
Выявление эмболий и тромбозов, оценка степени острой недостаточности артериального кровообращения в большинстве случаев не представляют трудностей. В пользу эмболий свидетельствуют внезапное появление синдрома острой артериальной ишемии на фоне существующего эмбологенного заболевания. Тромбоз возникает у лиц, страдающих облитерирующими заболеваниями аорты и артерий, – атеросклерозом, эндартериитом, неспецифическим аортоартериитом.
Локализация эмбола или тромба устанавливается путем последовательного определения пульсации магистральных артерий в типичных местах. У больных пониженного питания с эмболиями по ходу бедренных артерий иногда обнаруживается уплотнение.
Степень недостаточности артериального кровообращения оценивается на основании имеющихся объективных признаков ишемии. Данных объективного осмотра обычно достаточно для постановки диагноза эмболии или тромбоза. Однако специальные инструментальные методы исследования позволяют доказать наличие ишемического синдрома в сложных ситуациях, более точно определить уровень окклюзий, провести дифференциальную диагностику. Особенно информативна ангиография.
В ранние сроки после наступления эмболии на ангиограммах эмбол контрастируется в виде выпуклой в проксимальном направлении полусферы. Плохо заполняется коллатеральная сеть. В случае неполной закупорки артерии эмбол прослеживается в виде овального или округлого образования, обтекаемого контрастным веществом. При присоединении восходящего тромбоза верхний уровень перерыва тени контрастного вещества имеет неправильную форму и может распространяться до уровня отхождения от пораженной артерии первой крупной боковой ветви.
При тромбозе вследствие атеросклероза определяются изъеденность контуров стенок артерий, краевые дефекты наполнения, сегментарные или распространенные участки стеноза или окклюзии. Верхний уровень тромбоза представлен неровной линией. В ряде случаев наблюдается феномен постепенного исчезновения контрастного вещества в дистальном направлении. Хорошо развита коллатеральная сеть.
Ангиографическая картина тромбоза у больных эндартериитом характеризуется наличием зон окклюзии или стеноза в артериях дистальных отделов конечностей и штопорообразным обрывом коллатералей.
Дифференциальная диагностика.
Эмболии и тромбозы дифференцируют с артериальным спазмом, острой сердечной недостаточностью, расслаивающей аневризмой брюшной аорты.
Артериальный спазм развивается у лиц с повышенной реактивностью нервной системы на самые различные внешние (психоэмоциональные стрессы, травмы) и внутренние (тромбофлебит магистральных вен и т.д.) раздражители. В анамнезе у больных с динамической непроходимостью артерий, обусловленной психоэмоциональной травмой, отмечаются расстройства со стороны вегетативной нервной системы (повышенная потливость, склонность к обморокам, беспричинное похолодание конечностей). Заболевание возникает остро. Наиболее часто поражаются артерии мышечного типа. Спазм артерий может быть изолированным или протяженным. В клинической картине преобладает болевой синдром. Однако он не достигает такой интенсивности, как при эмболии. Менее выражены и ишемические проявления. У большинства пациентов сохраняются чувствительность и двигательная функция суставов. При артериоспазме, обусловленном тромбозом глубоких вен, помимо исчезновения пульса на магистральных артериях, определяются отечность конечности, повышение кожной температуры, полнокровие подкожных вен. Решающую роль в постановке диагноза играют данные ангиографического исследования.
В пользу артериоспазма свидетельствуют: 1. резкое сужение основных артериальных стволов, проходимых на всем протяжении; 2. контрастирование магистральной артерии с плавным, постепенным исчезновением контраста, одновременно отмечается плохое развитие коллатеральной сети; 3. сужение проксимального сегмента магистральной артерии с заполнением дистального сосудистого русла через коллатерали.
Острая сердечная недостаточность сопровождается ишемией ног в случае ее возникновения у больных тромбооблитерирующими заболеваниями. Правильной постановке диагноза способствуют наличие признаков хронического окклюзионно–стенотического поражения периферических артерий (отсутствие оволосения кожи, гипотрофия мышц, систолический шум над артериями), внезапное появление ишемических расстройств на фоне снижения сердечной деятельности и быстрое их купирование при возврате показателей АД к исходным величинам.
В отличие от эмболии и тромбозов бифуркации аорты боль при расслоении ее аневризмы локализуется в основном не в ногах, а в животе, поясничной области и спине. Как правило, определяются пульсация аневризмы, систолический шум над ней. В области живота пальпируется опухолевидное образование. При разрыве аневризмы появляются признаки внутреннего кровотечения. Ишемия конечности выражена умеренно. Сохраняются активные движения в суставах. Нет мраморных пятен на коже дистальных отделов ног.
Для острого поперечного миелита характерно развитие в течение нескольких часов вялого паралича нижних конечностей. Однако признаки ишемии отсутствуют. Сохраняется пульсация магистральных артерий.
Дифференциальную диагностику между эмболией и тромбозом проводят на основании данных клинической картины, анамнеза, результатов объективного осмотра и состояния свертывающей системы крови. В коагулограмме у лиц с острым тромбозом обычно отмечается резкое повышение активности свертывающей системы с депрессией противосвертывающих механизмов. При эмболиях, наобо – рот, возможна активация противосвертывающей системы.
Лечение.
Больные с эмболиями и острыми тромбозами нуждаются в экстренной квалифицированной медицинской помощи. Ее объем определяется степенью ишемии конечности, уровнем окклюзии, общим состоянием пациентов. Большинство хирургов полагают, что "нет показаний к консервативному лечению острого нарушения артериального кровообращения, есть лишь противопоказания к хирургическому"
Абсолютными противопоказаниями к хирургическому лечению эмболий и тромбозов, направленному на восстановление артериального кровотока, являются агональное состояние больных, тотальная или мышечная контрактура конечности III В степени и ее гангрена, крайне тяжелое состояние пациентов при легкой степени ишемии. Относительными противопоказаниями являются тяжелые сопутствующие заболевания (острый инфаркт миокарда, инсульт, неоперабельные опухоли) при легкой степени ишемии и отсутствии ее прогрессирования. Во всех остальных ситуациях показана экстренная операция, которая может быть вынужденно отсрочена для выполнения ангиографии, общеклинических анализов, кратковременной консервативной коррекции имеющихся гемодинамических нарушений и сопутствующей патологии.
Медикаментозное лечение при эмболиях и острых тромбозах, проводимое в качестве предоперационной подготовки, позволяет значительно улучшить гемодинамику конечностей. Это благоприятно отражается на течении послеоперационного периода. Как основной способ ведения пациентов с острым нарушением артериального кровоснабжения медикаментозная терапия достаточно эффективна при компенсации и субкомпенсации кровообращения конечностей, окклюзии дистальных отделов магистральных артерий. Консервативное лечение преследует цель – перевести более тяжелую степень острого нарушения артериального кровообращения в более легкую. Прежде всего это относится к больным с абсолютной ишемией. Поставленная цель достигается ликвидацией боли и рефлекторного спазма, нормализацией общего состояния больных, лизированием эмбола (тромба), предотвращением нарастания восходящего и нисходящего продолженного тромбоза, улучшением обменных процессов в зоне ишемии и повышением устойчивости ишемизированных тканей к гипоксии.
Для решения первой задачи больным создают максимальный покой. Назначают наркотические (промедол, морфин) и ненаркотические (анальгин) анальгетики. Допустимо сочетание наркотических анальгетиков с нейролептиками (аминазин). Выполняют паранефральную (по А. В. Вишневскому), паравертебральную, периартериальную новокаиновые блокады. Эффективна длительная перидуральная или спинномозговая анестезия с инфузией в перидуральное или спинномозговое пространство местноанестезирующих препаратов (новокаина, тримекаина). Для ликвидации артериального спазма применяют спазмолитические препараты разных групп (папаверин, но–шпа, голидор, ксантинола никотинат и др.). Медикаментозные средства в зависимости от степени ишемии конечности вводят внутримышечно или внутривенно, а в тяжелых случаях и внутриартериально. Для нормализации общего состояния больных производят коррекцию функции сердечно–сосудистой и дыхательной систем. Вводят сердечные гликозиды, витамины, антиангинальные средства, препараты калия и т.д.
Вторая задача решается назначением антикоагулянтов, тромболитиков и средств, снижающих адгезивно–агрегационные свойства тромбоцитов (см. раздел "Лечение тромбофлебитов").
Улучшение обменных процессов в зоне ишемии достигается применением стимуляторов метаболических процессов и прежде всего АТФ. Она является своеобразным источником энергии в мышцах. Кроме того, АТФ обладает сосудорасширяющим и спазмолитическим действием. Показана гипербарическая оксигенация и т.д. Повышению устойчивости ишемизированных тканей к гипоксии способствуют местная гипотермия конечности, назначение антиоксидантов.
Хирургическое лечение при эмболиях и острых тромбозах магистральных артерий является наиболее эффективным методом восстановления кровообращения в конечности.
Все способы хирургического лечения острой артериальной недостаточности при эмболиях и тромбозах делятся на радикальные и паллиативные. К радикальным операциям относятся эмболтромбинтимэктомия и различные реконструктивные операции (пластика артериальной стенки с заплатами, эндартерэктомия, шунтирующие операции, резекция артерии с протезированием – замещение ее эксплантатом, аутологичной или аллогенной веной или пуповиной, аллогенной артерией). Паллиативные методы включают операции на симпатической нервной системе и ампутацию конечности.
В большинстве случаев объем хирургического вмешательства при эмболии заключается в удалении эмбола и продолженных тромбов. При тромбозе на почве облитерирующих заболеваний методом выбора служит тромбинтимэктомия или реконструктивная операция.
В зависимости от способа выполнения эмбол(тромб)эктомии делятся на прямые и непрямые. Для выполнения прямой эмбол(тромб)эктомии артерия вскрывается поперечно или продольно над зоной окклюзии. После этого при небольших сроках заболевания эмболы(тромбы) часто выходят из сосудистого русла под действием тока крови. В случае более плотной фиксации к интиме они удаляются пинцетом, зажимом, кюретками, вакуумотсосом или методом выдавливания. Сущность способа состоит в сдавлении артерии между I и II пальцами с последующим выдавливанием окклюзирующих масс по направлению к артериотомическому отверстию. В ряде случаев эмбол (тромб) выталкиваются из артерии физиологическим раствором, новокаином после ее пункции выше или ниже места его расположения.
При непрямой эмбол(тромб)эктомии эмболы и тромбы удаляются через разрез артерии выше (антеградно) или ниже (ретроградно) места окклюзии с помощью катетера Фогарти. Это гибкий катетер диаметром 1,5–3 мм с резиновым баллончиком на конце. При использовании катетера баллончик в спавшемся состоянии проводится за область расположения эмбола (тромба), раздувается изотоническим раствором натрия хлорида (1–2 см3) и легким подтягиванием вместе с эмболом и тромбами извлекается наружу. Затем таким же образом удаляются и продолженные тромбы. Эффективность операции оценивается по интенсивности ретроградного или антеградного кровотока. Если дистальный продолженный тромб невозможно извлечь обычным способом, показаны дополнительное вскрытие артерии ниже места окклюзии и ретроградное или антеградное вымывание тромботических масс. Для профилактики вторичного тромбоза в артерию выше или ниже области ее вскрытия вводится 5.000 ЕД гепарина на 20–50 мл изотонического раствора натрия хлорида или 0,25–0,5% раствора новокаина. Артериотомическое отверстие ушивается одним из видов сосудистых швов, при угрозе его сужения производится ауто(алло)генная пластика артерии заплатами или пластика эксплантатом.
Однако при восстановлении кровотока в конечности у лиц со значительной степенью исходной ишемии большое количество содержащихся в конечности токсических веществ поступает в общий кровоток, способствуя развитию синдрома включения. Последний сопровождается нарушением функций почек, печени, сердечно–сосудистой, дыхательной и центральной нервной систем. В тяжелых случаях развивается острая почечно–печеночная недостаточность. Вымывание токсических веществ в кровоток происходит на протяжении нескольких суток волнообразно.
Для профилактики развития синдрома включения во время операции показано выполнение аппаратной или ручной регионарной перфузии конечности или регионарной (общей) гемосорбции. При проведении регионарной перфузии после удаления тромботических масс через ранее выполненный разрез в дистальное сосудистое русло вводится со скоростью 150–200 мл/мин для нижних конечностей и 70–100 мл/мин для верхних конечностей перфузат, состоящий из 3–4 л изотонического раствора натрия хлорида, 40.000–60.000 ЕД фибринолизина, 30.000–40.000 ЕД гепарина, 400 мл 4% раствора натрия бикарбоната, 4500 мл реополиглюкина. Промывная жидкость удаляется отсосом после вскрытия бедренной вены. Конечность отмывается до тех пор, пока вытекающая жидкость не приобретет розовый цвет. Затем в дистальное сосудистое русло вводится 250 мл одногруппной крови и артериотомическое отверстие ушивается.
Реконструктивные операции выполняются в том случае, если после удаления эмболов, но чаще тромбов, сохраняется опасность артериальной реокклюзии. Показаниями к их применению служат сужение неизмененной артерии при неправильном наложении сосудистого шва, а также поражение артерий тромбоблитерирующими заболеваниями. Для восстановления обычного диаметра артерии производится пластика артерии заплатой из ауто(алло)генной ткани или эксплантата. У больных с непротяженным окклюзионно–стенотическим поражением артерий (до 810 см) и при отсутствии возможности восстановить адекватный кровоток методом эмбол(тромб)эктомии показано выполнение эндартерэктомии. Сущность операции заключается в удалении измененной интимы, а иногда и медии вместе с тромботическими массами. Она бывает открытой и полузакрытой. При открытой эндартерэктомии разрез артерии производится непосредственно над местом окклюзии или стеноза. Полузакрытая эндартерэктомия сопровождается вскрытием просвета артерии выше или ниже зоны поражения с последующим удалением внутренней оболочки с помощью специальных приспособлений (кольца, зажимы и т.д.), физических факторов (лазерная, ультразвуковая, роторная реканализация, баллонная дилатация и т.д.). Возможно удаление тромба и пораженной интимы путем пересечения артерии с ее последующим выворачиванием.
Сущность шунтирующих операций заключается в создании нового пути продвижения крови в обход места окклюзии. Они производятся при протяженных (более 10 см) оккл юзи он н о – сте нотич ес ких поражениях артерий. В качестве шунтов применяются в основном реверсированная большая подкожная вена или большая подкожная вена без выделения из ее ложа (вена in situ), вена пуповины, аллогенные сосуды и эксплантаты. Однако их диаметр должен быть не менее 5 мм. При выполнении бедренно–подколенного шунтирования у лиц с выраженным сужением артерий голени, непроходимостью плантарной дуги дополнительно в зоне дистального анастомоза формируется артериовенозная фистула. В этом случае вначале накладывается анастомоз аутовенозного шунта с воспринимающей артерией по типу "бок в бок", а затем создается соустье между дистальным концом шунта и рядом расположенной подколенной или берцовой веной. Диаметр соустья должен составлять 4060% диаметра шунта (3 мм и более). Артериовенозная фистула приводит к сбросу части артериальной крови, находящейся в аутовенозном шунте, непосредственно в вену и тем самым увеличивает скорость кровотока по шунту, препятствуя его тромбозу.
После восстановления кровотока у больных с 11 б – III б степенями ишемии показано выполнение фасциотомии.
Необходимость фасциотомии при восстановлении кровообращения в конечности объясняется прогрессирующим послеоперационным набуханием мышечных волокон с повышением внутритканевого давления. Это приводит к сдавлению внутримышечных и магистральных сосудов, что еще больше затрудняет кровообращение в конечности, способствуя прогрессированию ишемических расстройств. Фасциотомия производится из небольших продольных разрезов кожи и подкожной клетчатки. Главным условием ее выполнения является вскрытие всех фасциальных влагалищ на всем протяжении сегмента конечности. На голени обязательно рассекаются фасция переднетибиального пространства и фасциальное ложе задней группы мышц, на предплечье – фасциальное пространство сгибателей и разгибателей кисти и пальцев.
Паллиативные вмешательства при острых тромбозах и эмболиях направлены на улучшение коллатерального кровообращения и микроциркуляции. Они включают операции на симпатической нервной системе (периартериальная симпатэктомия, ганглиоэктомия). Суть периартериальной симпатэктомии состоит в циркулярном удалении адвентициального слоя артерий, имеющего вид тонкой паутины (операция Джабулея), или его алкоголизации (операция В. И. Разумовского). При ганглиоэктомии удаляются внеили чрезбрюшинно II–III поясничные симпатические ганглии (операция Диеца), III грудной симпатический ганглий (операция Огнева). Как правило, операции на симпатических нервах дополняют другие варианты хирургических вмешательств. Это позволяет уменьшить частоту возникновения послеоперационных тромбозов в 3–5 раз.
В послеоперационном периоде продолжается комплексная терапия, направленная на профилактику реоклюзий, почечно–печеночной, сердечно–легочной недостаточности. При выполнении хирургического вмешательства у больных со значительными степенями острой артериальной недостаточности (IIБ–IIIБ) проводятся форсированный диурез, экстракорпоральная детоксикация (гемосорбция, плазмаферез ит.д.). Назначаются дезагреганты, спазмолитики, а лицам, перенесшим оперативное вмешательство по поводу тромбозов, – общепринятая антикоагулянтная терапия.
Острые тромбофлебиты глубоких вен нижних конечностей и их последствия
Анатомо–физиологические сведения о глубоких венах нижних конечностей
Глубокая венозная сеть нижних конечностей представлена парными венами, сопровождающими одноименные артерии. Истоками глубоких (магистральных) вен являются венозные дуги стопы, формирующиеся из парных вен. Из тыльной глубокой дуги образуются передние большеберцовые вены, а из подошвенной – задние.
В области верхней трети голени в задние большеберцовые вены впадают малоберцовые вены. На голени задние большеберцовые вены проходят позади m.soleus и m.gastrocnemius, а передние лежат на межкостной мембране. В верхнем сегменте голени передние большеберцовые вены, перегибаясь через край мембраны, под головкой малоберцовой кости соединяются со стволом задних большеберцовых вен, после чего у нижнего края подколенной мышцы образуют непарную подколенную вену. Подколенная вена идет по подколенной ямке кверху, прободает приводящую мышцу и с этого уровня, продолжаясь на бедро, называется поверхностной бедренной веной. На расстоянии 6–8 см ниже паховой складки поверхностная бедренная вена сливается с глубокой бедренной веной и образует общую бедренную вену.
В зоне между устьями глубокой бедренной и большой подкожной вен в поверхностную бедренную вену впадают медиальная и латеральная окружающие бедро вены. Общая бедренная вена продолжается в наружную подвздошную вену. Границей ее перехода является нижний край пупартовой связки. Наружная подвздошная вена проходит по краю малого таза. Достигнув передней поверхности крестцово–подвздошного сочленения, она сливается с внутренней подвздошной веной и формирует общую подвздошную вену. Притоками наружной подвздошной вены являются нижняя надчревная и глубокая окружающая подвздошную кость вены. В результате соединения правой и левой подвздошных вен в области верхнего края V поясничного позвонка несколько правее от средней линии образуется нижняя полая вена.
Посредством коммуникантов (прямых, соединяющих поверхностные и глубокие вены непосредственно, и непрямых, – осуществляющих связь через мышечные вены) глубокая венозная сеть сообщается с поверхностными веками.
На всем протяжении глубокой венозной сети нижних конечностей содержится от 80 до 100 клапанов. Последние представляют собой полулунной формы тонкие нежные складки внутренней оболочки вены.
Стенка вены состоит из трех оболочек: внутренней, средней и наружной. Внутренняя оболочка представлена эндотелием и подэндотелиальным слоем, средняя содержит циркулярно расположенные пучки гладких миоцитов, разделенных прослойками волокнистой соединительной ткани, наружная образована волокнистой соединительной тканью.
Характерными особенностями строения венозной системы являются нечеткая граница между ее слоями, слабое развитие эластических элементов в стенке и отсутствие сплошного слоя мышечных элементов.
Опитца–Раминеса – появление болей в икроножных мышцах при повышении давления в манжетке от аппарата Рива–Роччи до 45–55 мм рт. ст. Манжетка располагается выше коленного сустава;
Лусхера – боль в большеберцовой кости при постукивании пальцем по передней поверхности голени медиально от ее гребня.
Тромбофлебит подколенной вены развивается вследствие распространения процесса с берцовых вен. Он проявляется выраженным отеком стопы и голени, что обусловлено окклюзией основных путей венозного оттока от голени. Боль постоянная, локализуется в икроножной мышце, подколенной ямке, усиливается при пальпации и движениях в голеностопном суставе.
Тромбофлебит поверхностной бедренной вены может быть первичным или вторичным. В последнем случае тромбоз распространяется на поверхностную бедренную вену из общей бедренной или из подколенно–берцового сегмента. В связи с хорошо развитыми коллатералями заболевание иногда приобретает латентный характер течения. При типичной картине тромбофлебита боль локализуется в области приводящих мышц бедра, иррадиирует в пах. Отмечается отек средней и нижней третей бедра, голени. Расширяются поверхностные вены дистальных отделов конечности. Нередко возможно развитие расстройств кровообращения в коленном суставе: в его полости скапливается жидкость.
Тромбоз общей бедренной вены проявляется выраженными симптомами нарушения венозного оттока. Больных беспокоят боли в верхней трети передней поверхности бедра и паховой области. Пораженная конечность увеличивается в объеме. Кожные покровы над ней бледнеют, в дистальных отделах приобретают цианотичную окраску. В верхней трети бедра выявляется расширение поверхностных вен. В области скарповского треугольника пальпируется болезненный инфильтрат, а иногда – увеличенные лимфатические узлы.
Острый подвздошно–бедренный венозный тромбоз в 70–80% случаев начинается в венах таза, а затем спускается вниз. Он сопровождается более выраженным нарушением гемодинамики, поскольку при таком характере тромбоза коллатерали не успевают развиться. Обычное течение острого илеофеморального венозного тромбоза сопровождается болями распирающего характера в проекции глубоких вен бедра, пояснично–крестцовой, пахово–подвздошной областях. Патогенез болей объясняется воспалением чувствительных нервов, заложенных в адвентиции сосудов вследствие перифлебитического процесса, а также растяжением стенки вен за счет венозной гипертензии и вторичного блока лимфатических путей. Больных беспокоит отек конечности на всем ее протяжении от пальцев стоп до паховой складки. Возможно распространение отека и на ягодицу. В ряде случаев отек бывает настолько плотным, что не оставляет ямки после надавливания. Отек носит восходящий или нисходящий характер. Кожные покровы приобретают диффузный цианотичный цвет, более выраженный в дистальных отделах. Усиливается рисунок подкожных вен. Движения в суставах становятся болезненными. При пальпации определяются инфильтрация тканей, болезненное уплотнение по ходу магистральных сосудов в паху и на бедре. Известны две формы острого илеофеморального венозного тромбоза: белая и синяя флегмазия.
Белая флегмазия (flegmasia alba dolens) характеризуется выраженным рефлекторным артериальным спазмом и нарушением лимфоотгока из конечности. Заболевание начинается внезапно, быстро нарастает отек с одновременным похолоданием, онемением конечности, отсутствием пульсации периферических артерий. Конечность приобретает мраморный отгенок. Ограничиваются движения пальцев стоп, снижаются чувствительность и кожная температура дистальных сегментов. Общее состояние пациентов прогрессивно ухудшается: учащается пульс, снижается АД, резко повышается температура тела, затемняется сознание, развивается анемия. В случае устранения артериального спазма бледность конечности сменяется ее синюшностью.
При синей флегмазии (flegmasia coerulea doiens) происходит тотальный тромбоз глубоких, внутримышечных и подкожных вен нижних конечностей и таза. В результате этого венозный отток из пораженной конечности почти полностью прекращается. Артериальное кровообращение некоторое время сохраняется, что при затрудненном венозном оттоке приводит к превышению гидростатического давления в венозных капиллярах над коллоидно–осмотическим давлением тканей. Это сопровождается пропотеванием плазмы в интерстициальное пространство. Из–за отека тканей, переполнения кровью венозного русла конечность значительно увеличивается в объеме. Кожа напрягается, не собирается в складку, приобретает цианотичный оттенок. Скопление в ногах большого количества жидкости (до 4–5 л) сопровождается уменьшением объема циркулирующей крови с последующим гиповолемическим шоком. Происходит механическое сдавление артерий. Ослабевает, а затем исчезает пульсация периферических артерий. Одновременно прогрессивно снижается температура кожи конечности. Ограничиваются движения в пальцах стоп, голеностопном и коленном суставах. Уменьшение, а затем и полное прекращение притока артериальной крови к ногам вызывает артериальную ишемию тканей вплоть до необратимых в них изменений. Возникающие гемодинамические нарушения, нарастающая интоксикация из очага ишемии отражаются на общем состоянии больных. В 40–45% случаев венозная гангрена имеет летальный исход. При благоприятном исходе формируются очаги некроза кожи и подкожной клетчатки, гангрена пальцев стоп. В последующем наблюдается тяжелая форма постгромбофлебитического синдрома.
Для тромбоза внутренней подвздошной вены типичны интенсивные приступообразные боли в подвздошно–паховой области, над лобком, в низу живота, отек промежности, слабость, лихорадка, нарушение мочеиспускания. В моче обнаруживаются лейкоциты и эритроциты. Вдоль боковых стенок таза пальпируются болезненные инфильтраты.
Тромбоз нижней полой вены характеризуется симптомами нарушения оттока венозной крови от обеих нижних конечностей, промежности, малого таза. Наблюдаются резкий отек, синюшность обеих ног, нижней части живота, поясничной области, отмечаются боль в животе, псевдоперитонеальные симптомы. Расширяются подкожные вены передней брюшной стенки. При восходящем тромбофлебите нижней полой вены с окклюзией устьев почечных вен появляются боли в пояснице, гематурия, олигурия. Развивается острая почечная недостаточность. Тромбоз печеночных вен приводит к формированию подпеченочной формы портальной гипертензии.
Диагностика.
Помимо данных общеклинического обследования, наличие острого тромбофлебита глубоких вен подтверждается результатами специальных методов диагностики.
Наиболее информативна флебография (флебоскопия), особенно в начальном периоде острого тромбоза. В процессе исследования находят обрыв контрастирования магистральных вен на уровне тромба, дефекты наполнения, хорошо представленную сеть коллатералей. Верхняя граница тромбоза вен нижних конечностей лучше определяется при проксимальной флебографии. В случае илеофеморальной локализации процесса более ценна ретроградная илеокаваграфия в сочетании с поэтажной флебоскопией.
При ультрасонографии выявляются окклюзия магистральных вен, отек ее стенки, замедление линейной скорости кровотока.
Термография свидетельствует о снижении или асимметрии в пораженной конечности кожной температуры.
Флеботонометрия указывает на наличие венозной гипертензии в глубоких венах. Венозное давление в пораженной конечности в 2–6 раз превышает показатели нормы. У лиц с острым подвздошно–бедренным тромбозом оно колеблется от 200 до 800 мм вод. ст.
Радиоиндикация подтверждает наличие очагов избирательного накопления фибриногена в тромбах, однако не позволяет точно установить границы тромбоза.
Реофлебография свидетельствует о повышении давления и увеличении объемов крови в венозном русле.
Реовазография и осциллографическое исследование указывают на наличие выраженного артериального спазма в пораженной конечности, который развивается не только рефлекторно, но и за счет вовлечения в воспалительный процесс адвентиции одноименных артерий. Нередко осциллограммы имеют вид прямой линии.
При капилляроскопии наблюдаются мутный желтоватый фон, плохая видимость, выраженный спазм капилляров и уменьшение их количества.
Дифференциальная диагностика.
Как правило, картину острого тромбоза магистральных венозных сосудов имитируют заболевания, протекающие с болью и отеком в конечностях: острое нарушение артериального кровоснабжения, миозит, кровоизлияния в мышцы, острый тромбофлебит поверхностных вен, невриты, заболевания сердца и почек, сдавление магистральных вен опухолями, хроническая венозная недостаточность и недостаточность лимфообращения.
Острое нарушение артериального кровообращения возникает внезапно на фоне болезней сердца или аритмий. Оно сопровождается интенсивной болью в конечности, ее бледностью и похолоданием, нарушением всех видов чувствительности. Поверхностные вены спавшиеся. Отек отсутствует. Физическая нагрузка и возвышенное положение конечности усиливают боль.
Для миозита характерны болезненность и напряжение воспаленных мышц, отсутствие отека и болезненности по ходу венозных стволов.
Кровоизлияния в мышцы возникают в результате травм, болезней кровеносных сосудов и крови, мышечного перенапряжения. Отмечается боль в пораженной мышце при физической нагрузке. В покое боль значительно уменьшается или отсутствует. При осмотре находят кровоподтеки, повышение температуры кожи, отек мягких тканей.
Дифференциальная диагностика между тромбозом поверхностных и магистральных вен прежде всего основана на данных клинической картины, изложенной выше. В сложных ситуациях проводятся специальные методы диагностики и прежде всего флебография.
При невритах, особенно бедренного или седалищного нерва, боль локализуется по передней или задней поверхности конечности. Отмечаются неврологические симптомы.
Отеки вследствие заболеваний сердца или почек двусторонние и симметричные, развиваются постепенно.
Сдавление венозных сосудов опухолями, воспалительным процессом не сопровождается выраженной болью. Диагноз подтверждается результатами комплексного обследования органов брюшной полости и таза.
Клиническая картина хронической венозной недостаточности или недостаточности лимфообращения напоминает клинику острого тромбофлебита глубоких вен при присоединении дерматита, панникулита, флебита. Дифференциальная диагностика основана на данных анамнеза о перенесенных тромбозе или лимфедеме после удаления паховых, подмышечных лимфоузлов, лучевой терапии. У пациентов отсутствуют боль, инфильтраты в проекции магистральных вен. При хронической венозной недостаточности в дистальных отделах ног определяются трофические нарушения.
Лечение.
При тромбофлебитах глубоких вен должно быть комплексным. Вопрос о тактике решается исходя из этиологии заболевания, локализации тромботического процесса, выраженности клинической картины, наличия осложнений.
Большинство авторов полагают, что основным методом лечения при острых тромбофлебитах является консервативный.
В его задачи входит: 1. Снятие боли и явлений перифокального воспаления. 2. Предотвращение дальнейшего распространения воспалительного процесса и восстановление проходимости пораженных вен путем их реканализации. 3. Устранение рефлекторного сосудистого спазма. 4. Улучшение венозной гемодинамики. 5. Профилактика тромбоэмболических осложнений.
С этой целью больным в раннем периоде заболевания назначается постельный режим с возвышенным положением конечности. При тромбозе глубоких вен его длительность составляет 3–4 дня, при подвздошно–бедренном тромбозе – 10–12 дней. Одновременно предписывается комплекс специальных гимнастических упражнений, улучшающих венозный отток. На конечность накладывается компресс с гепариновой, гепароидной мазями, мазью Вишневского и т.д. Конечность бинтуется эластическим бинтом.
Проводится антикоагулянтная терапия. Вначале в течение 7–14 дней пациенты получают прямой антикоагулянт гепарин. Он является естественным противосвертывающим фактором организма и наряду с фибринолизином относится к основным компонентам физиологической антисвертывающей системы. Препарат непосредственно влияет на XII, XI, X, IX, VII и II факторы свертывающей системы. Гепарин блокирует биосинтез тромбина, снижает агрегацию тромбоцитов и незначительно активизирует фибринолитические свойства крови. Эффект от приема гепарина наступает сразу же после внутривенного и спустя 10–15 мин после внутримышечного введения. Длительность действия препарата 4–5 ч. Наиболее часто применяется следующая схема гепаринотерапии. В первые сутки больные получают 10 ООО ЕД гепарина внутривенно однократно и по 5.000 ЕД внутримышечно через 4 ч (суточная доза 40.000 ЕД), на вторые сутки – по 5.000 ЕД внутримышечно через 4 ч (суточная доза 30.000 ЕД), в дальнейшем – по 5.000 ЕД внутримышечно через 6 ч (суточная доза 20.000 ЕД).
За два дня до отмены гепарина больным назначают непрямые антикоагулянты, а суточную дозу гепарина постепенно снижают в 1,5–2 раза за счет уменьшения его разовой дозы. Эффективность терапии гепарином контролируется по показателям времени свертывания крови, которое должно увеличиться по сравнению с исходным в 2–2,5 раза. При передозировке гепарином возникает геморрагический синдром. Он купируется назначением 1% раствора протамина сульфата (1 мг нейтрализует 100 ЕД гепарина).
Непрямые антикоагулянты относятся к антагонистам витамина К, участвующего в синтезе в печени протромбина. В основе их действия лежит нарушение биосинтеза протромбина, проконвертина (фактор VII), IX и X факторов свертывания крови. Действие непрямых антикоагулянтов начинается через 18–48 ч от начала применения и сохраняется в течение 2–3 дней после отмены. Применяемые суточная и разовая дозы непрямых антикоагулянтов зависят от фармакохимических свойств препаратов: фенилина – 0,09 и 0,03 г; неодикумарина – 0,15 и 0,05 г; синкумара – 0,006 и 0,02 г. Лечение непрямыми антикоагулянтами контролируется по величине протромбинового индекса, который поддерживается в пределах 45–50%. После достижения эффекта от проводимой терапии непрямые антикоагулянты отменяются постепенно за счет уменьшения разовой дозы и увеличения интервала между приемами (до 1 раза в день или через день). При передозировке непрямых антикоагулянтов прежде всего появляется микрогематурия. Действие непрямых антикоагулянтов блокируется викасолом (1–3 мл 1% раствора внутримышечно 3 раза в день), ε–аминокапроновой кислотой (200 мл 5% раствора внутривенно), аскорбиновой кислотой (1–3 мл 5% раствора внутримышечно 2 раза в день).
Для снижения адгезивно–агрегационной функции тромбоцитов целесообразно назначение ингибиторов агрегации тромбоцитов (ацетилсалициловая кислота, дипиридамол и др.) и неспецифических антиагрегантов (декстраны,эуфиллин, папаверин, но–шпа, трентал и др.). Низкомолекулярные декстраны угнетают агрегацию тромбоцитов, увеличивают время рекальцификации, повышают фибринолитическую активность, снижают концентрацию фибриногена, замедляют образование тромбопластина и усиливают мобилизацию эндогенного гепарина.
Тромболитическая терапия позволяет лизировать тромбы и тем самым в короткие сроки восстановить проходимость магистральных вен. Она проводится при тромбозе подвздошно–бедренного, подмышечно–подключичного сегментов, верхней и нижней полых вен. В качестве тромболитиков применяются фибринолизин, стрептокиназа, урокиназа, тромболитин и т.д.
Фибринолизин – профибринолизин плазмы крови, активизированный трипсином. Эффективен в течение первых двух дней заболевания. Быстро нейтрализуется антитромбином. Суточная доза – 40.000–60.000 ЕД. Применяется в комбинации с гепарином (10.000 ЕД гепарина на 20.000 ЕД фибринолизина). Назначается 2 раза в сутки. Интервал между введением – 12 ч под контролем показателей коагулограммы или времени свертывания крови, которое должно превышать исходное в 2–2,5 раза.
Более эффективно, чем фибринолизин, действуют препараты, непосредственно активирующие профибринолизин (плазминоген), – стрептокиназа, урокиназа, тромболитин.
Стрептокиназа – продукт жизнедеятельности (3–гемолитического стрептококка. Является непрямым активатором плазминогена. Механизм ее действия связывается прежде всего с активацией экзогенного профибринолизина. Кроме того, имея плотность 45 тыс. (фибринолизин 100 тыс.), стрептокиназа значительно легче проникает в тромб и активизирует эндогенный профибринолизин, Стрептокиназа медленнее, но более стойко повышает фибринолитическую активность крови. Препарат назначается по 200.000–300.000 ЕД в 300 мл изотонического раствора натрия хлорида вместе с 10.000–15.000 ЕД гепарина в течение 3–4 ч. Суточная доза – 800.000–1.750.000 ЕД, иногда вводится несколько дней до получения клинического эффекта.
Урокиназа – прямой активатор плазминогена. Выделена из мочи. Вводится внутривенно капельно в разовой дозе 400.000–800.000 ЕД. Действие препарата усиливается при сочетанном применении небольших доз гепарина.
Тромболитическим и антикоагулянтаым эффектом обладает тромболитин. Он представляет собой соединение трипсина с гепарином. Вводится внутривенно или внутримышечно по 100 мг в 250–300 мл изотонического раствора натрия хлорида в течение 1,5–2 ч через 8 ч на протяжении 5–7 дней, иногда 2–3 недели до получения клинического эффекта. Суточная доза – 300–400 мг.
При тромбозах магистральных вен помимо общей может применяться и местная (локальная, регионарная тромболитическая) терапия. Сущность ее заключается во введении отдельных тромболитических препаратов и их смесей внутривенно (фибринолизин, фибринолизин–гепариновая смесь и т.д.), а также паравазально или интраспонгиозно (гепарин – 5.000 ЕД, гидрокортизон – 25 мг, химотрипсин – 10 мг, антибиотики, растворенные в 100 мл 0,25% раствора новокаина, и др.) к месту расположения тромба 1–2 раза в сутки в течение 5–6 дней. Эффективность регионарного тромболизиса зависит от давности тромбофлебита, протяженности поражения, особенностей клинического течения заболевания, но в большинстве случаев он сокращает сроки лечения по сравнению с традиционными в 1,5–2 раза. Механизм положительного действия локальной тромболитической терапии связан как с суммарным действием вводимых препаратов непосредственно на тромболитический процесс, так и с активацией местных тканевых факторов тромболизиса, заложенных в венозной стенке и паравазальной клетчатке.
При лечении тромболитическими препаратами, кроме незначительных побочных реакций, может развиться крайне тяжелое осложнение – фибринолиз. Для его устранения назначаются ε–аминокапроновая кислота и фибриноген. Эпсилон–аминокапроновая кислота тормозит процесс активизации профибринолизина и непосредственно инактивирует фибринолизин. Она применяется внутривенно в 5–10% растворе из расчета 1 г на 10 кг массы тела больного. Фибриноген является естественной составной частью крови. Переходя под влиянием тромбина в фибрин, он обеспечивает конечную стадию процесса свертывания крови – формирование сгустка. Назначается в средней дозе 2–4 г.
Наряду с проведением антикоагулянтной и тромболитической терапии внутримышечно или внутрь назначаются анальгетики (анальгин, промедол и др.), противовоспалительные препараты (бутадион, пирабутол и др.). Ряд авторов рекомендуют проведение и кортикостероидной терапии преднизолоном, гидрокортизоном. Однако они обладают ульцерогенным действием.
Антибактериальная терапия проводится в основном при инфекционных, особенно септических тромбофлебитах.
Для снятия вторичного спазма артерий внутримышечно или внутриартериально вводят сосудорасширяющие препараты (папаверин, но–шпа, никотиновая кислота и др.). Выполняют паранефральную, периартериальную и внутрикостную новокаиновые блокады. Блокады производят в день поступления,а затем в зависимости от выраженности воспалительного процесса с интервалом в 3–4 дня.
Нарушения венозной гемодинамики корригируются приемом эскузана, анавенола. Эскузан снижает проницаемость капилляров, повышает тонус венозных сосудов, уменьшает воспалительные явления. Анавенол тонизирует гладкую мускулатуру вен. Показаны венорутон или троксевазин. Они повышают устойчивость и снижают проницаемость капилляров, обладают противовоспалительным действием.
Улучшение результатов консервативной терапии острого тромбофлебита глубоких вен нижних конечностей после купирования явлений острого воспаления достигается наложением на больную конечность цинк–желатиновой повязки Унны сроком на 1 мес. Повязка состоит из 1 части желатина, 1 части цинка оксида, 6 частей глицерина, 2 частей воды. Она создает наружный каркас для конечности с умеренной равномерной ее компрессией. Тем самым предотвращается застой крови, лимфы и межтканевой жидкости в ногах, улучшается отток крови по магистральным венам.
Хирургическое вмешательство при тромбофлебитах глубоких вен не нашло широкого применения.
Оно выполняется лишь: 1. при опасности повторной тромбэмболии легочной артерии; 2. угрозе венозной гангрены; 3. распространении процесса на нижнюю полую вену.
Такой подход к оперативному лечению объясняется невозможностью радикального удаления тромбов из глубоких вен, особенно вен голени; частым ретромбозом в послеоперационном периоде; опасностью тромбоэмболии легочной артерии во время хирургических манипуляций. Цель хирургических вмешательств – ликвидация угрозы эмболических осложнений, освобождение венозного русла от тромботических масс, профилактика хронической венозной недостаточности.
В качестве вариантов оперативного лечения наиболее часто используются тромбэктомия, пликация нижней полой вены, перевязка вены выше тромба.
Тромбэктомия выполняется у больных с тромбозом магистральных вен среднего и крупного калибра (подколенных, бедренных, подвздошных, плечевых, подмышечных, подключичных, верхней и нижней полых) при отсутствии плотной фиксации тромботических масс к интиме сосуда, т.е. в ранней стадии заболевания (не позже 10 дней после его начала).
Тромбэктомия противопоказана при терминальном состоянии больных; в пожилом и старческом возрасте; при повторных тромбозах на фоне хронической венозной недостаточности нижних конечностей; длительности заболевания более 10–12 суток; невозможности проведения послеоперационной антикоагулянтной терапии, тромбозах вен голени.
Наиболее часто тромбы из вен извлекаются катетером Фогарти. Радикальность тромбэктомии оценивается по интенсивности ретроградного кровотока, проходимости дистального венозного русла, при интраоперационных флебографии и ультразвуковом исследовании. Вместе с тем тромбэктомия из левой общей и наружной подвздошных вен может быть неосуществима вследствие сдавления их правой подвздошной артерией, при наличии в их просвете мембран, затрудняющих удаление тромбов. Тромбоэктомия иногда осложняется тромбоэмболией легочной артерии. Для ее профилактики предварительно производится пликация нижней полой вены или в нижнюю полую вену со здоровой общей бедренной вены временно проводится баллон–обтуратор. Возможно и наложение на нижнюю полую вену провизорного турникета. В тяжелой ситуации допустима перевязка нижней полой вены ниже уровня впадения в нее почечных вен,
Пликация нижней полой вены показана при подтвержденных ангиографически эмбологенном венозном тромбозе и эмболии легочной артерии; тромбоэмболитической окклюзии 50–70% диаметра легочной артерии, что является смертельным при рецидиве тромбоэмболии; повторной тромбоэмболии на фоне консервативной терапии; невозможности выполнения тромбэктомии. Суть методики заключается в создании в вене "фильтров", сохраняющих магистральный кровоток, но препятствующих продвижению крупных эмболов (рис. 45). С этой целью F. Spenser (1959) предложил прошивание нижней полой вены в поперечном направлении 3–4 матрацными швами с интервалом 5 мм один от другого, Bavitch с соавт. (1964) осуществляли пликацию нижней полой вены механическим швом при помощи сшивающего аппарата УКБ–25, Moretz с соавт. (1959) выполняли парциальную окклюзию полой вены гладкими, a Miles с соавт, зубчатыми тефлоновыми клеммами. Adams с соавт. (1963) прошивали нижнюю полую вену с формированием в ее просвете фильтра–сетки. Pate с соавт. (1969) предложили введение в нижнюю полую вену по специальному катетеру пружины с дакроновым покрытием, которая при распрямлении придавала стенке нижней полой вены щелевидную форму.
 Рис. 45. Способы пликации нижней полой вены
а – по Spenser; б – по Bavitch с соавт.; в – по Meretz с соавт.; г – no Miles с соавт.; д – по Adams с соавт.; е – no Pate с соавт.
Рис. 45. Способы пликации нижней полой вены
а – по Spenser; б – по Bavitch с соавт.; в – по Meretz с соавт.; г – no Miles с соавт.; д – по Adams с соавт.; е – no Pate с соавт.
Для профилактики тромбоэмболии легочной артерии в настоящее время широко применяется имплантация в верхнюю полую вену зонтичного кава–фильтра. Способ впервые был предложен в 1967 г. К. Mobin–Uddin с соавт. В дальнейшем он был усовершенствован. Кава–фильтр проводится в нижнюю полую вену под рентгеновским контролем через правую внутреннюю яремную или общую бедренную вену. Имплантация фильтра производится на уровне L2–L3. У 80–95% больных пликация нижней полой вены дает хорошие результаты.
Восстановление оттока крови нередко сочетается с протяженными фасциотомиями. Во время операции или в послеоперационном периоде при тяжелой форме течения тромбоза проводится экстракорпоральная детоксикация организма.
Перевязка вены выше тромба показана при эмболоопасном тромбозе в случае, если невозможно выполнить тромбэктомию и кавапликацию.
При венозной гангрене для спасения жизни больного выполняется ампутация пораженной конечности.
После завершения стационарного консервативного или хирургического лечения больные для скорейшей нормализации микрои макроциркуляции в конечности, предупреждения развития посттромбофлебити чес кого синдрома должны продолжать амбулаторно–поликлиническую терапию. Она включает прежде всего эластическое бинтование конечности или ношение эластических чулок. Лицам, прошедшим курс консервативного лечения или подвергшимся операции, рекомендуется бинтование (ношение чулок) в течение не менее 6 мес. На протяжении 4–6 мес. они продолжают также получать поддерживающую антикоагулянтную терапию. С этой целью чаще используется фенилин (0,015–0,03 г в день). Назначаются курсами сосудорасширяющие препараты и вещества, обладающие флебодинамическим действием, проводится физиолечение. Через 68 мес. после начала заболевания показано санаторно–курортное лечение: грязелечение, радоновые, сероводородные ванны.
Посттромбофлебитический синдром
Посттромбофлебитический синдром (ПТФС, посттромботический синдром, посттромботическая болезнь) – симптомокомплекс, развивающийся у больных, перенесших острый тромбоз магистральных вен нижних конечностей.Историческая справка.
В 1916 г. Homans для обозначения симптомокомплекса, развивающегося после перенесенного тромбофлебита глубоких вен нижних конечностей, предложил термин "посттромбофлебитический синдром".
В 1904 г. Раrоn впервые у больного с ПТФС выполнил лигирование подколенной вены с хорошим клиническим результатом. В 1916 г. Homans, предположив, что исходом тромбоза глубоких вен нижних конечностей может быть как облитерация, так и реканализация магистральных сосудов, произвел резекцию бедренной вены. В 1960 г. Bransey и Russo сообщили о целесообразности замещения тромбированной вены бедра сегментом большой подкожной вены с функционирующим состоятельным клапаном. А. М. Хилькин (1966), М. Д. Пациора с соавт. (1968) заменили магистральные вены при ПТФС полубиологическими протезами. В 60–70–х годах стали разрабатываться операции по созданию искусственного экстравазального клапана.
Распространенность. ПТФС составляет от 5 до 28% всех болезней венозной системы. В 25–40% случаев постоянное прогрессирование нарушений венозной гемодинамики при данном заболевании приводит к трофическим изменениям тканей и значительному ограничению трудоспособности.
Этиология и патогенез.
ПТФС является следствием острого тромбофлебита глубоких вен. В основе его патогенеза лежит комплекс гемодинамических нарушений, развивающихся в нижних конечностях в результате частичной или полной реканализации тромбированных магистральных вен. Процесс реканализации начинается со 2–3–го дня тромбоза глубоких вен и продолжается до 3–5 лет. Исходом восстановления проходимости магистральных вен является их превращение в ригидные трубки, лишенные эластичности и тонуса, с разрушенным клапанным аппаратом. Наличие сопутствующего тромбофлебиту перифлебита приводит к формированию в окружности пораженных вен паравенозного фиброза. Он может сдавливать магистральные вены, а нередко артерии и нервы. Потеря венами эластических свойств, разрушение клапанного аппарата, окружающий фиброз приводят к замедлению скорости кровотока по глубоким венам, увеличению гидростического давления венозной крови в дистальных отделах конечностей, особенно при вертикальном положении тела.
Такое нарушение венозной гемодинамики сопровождается расширением непораженных глубоких, а затем и перфорантных вен с развитием в дальнейшем относительной недостаточности клапанов вен. Вследствие этого при сокращении мышц голени движение крови в магистральных венозных сосудах происходит в трех направлениях: проксимальном, дистальном и через несостоятельные перфоранты в подкожную венозную сеть.
Возникающие нарушения кровотока по магистральным венам в начальных стадиях ПТФС корригируются компенсаторно–приспособительной реакцией сети поверхностных, мышечных и внутрикостных вен, артерий и лимфатической системы. Так, за счет рефлюкса крови из глубоких вен в поверхностные через несостоятельные перфоранты происходит вторичное варикозное расширение последних. Значительно увеличиваются диаметр и количество функционирующих мышечных и внутрикостных вен. Неравномерно расширяется просвет лимфатических сосудов, формируется множество лимфо–лимфатических анастомозов. Одновременно происходит резкий спазм артерий, что уменьшает приток крови к дистальным отделам пораженной конечности. С увеличением продолжительности заболевания компенсаторные возможности указанных систем истощаются.
В большей степени страдает морфофункциональное состояние поверхностных вен. Наступает истончение их стенок, венозные мышечные волокна замещаются соединительнотканными, разрушаются клапана. Вследствие этого давление в венозной части микроциркуляторной системы еще больше возрастает, что затрудняет артериальный кровоток и способствует раскрытию артериовенозных и артериовенулярных анастомозов. Часть крови из артериального русла, минуя капилляры, сбрасывается в венозную систему.
Юкстакапиллярный кровоток способствует развитию тяжелой гипоксии тканей. Это связано с тем, что в норме в артериальной части капилляров гидростатическое давление крови выше осмотического давления тканей, поэтому здесь осуществляется фильтрация воды, кристаллоидов, белков в интерстициальное пространство. Резорбция продуктов тканевого обмена происходит в венозной части капиллярной сети, где гидростатическое давление составляет всего 15 мм рт. ст., а осмотическое остается неизменным – 25 мм рт. ст.
Повышение при ПТФС гидростатического давления приводит к тому, что резорбционная сила приближается к нулю или становится отрицательной. В связи с этим в тканях накапливается большое количество воды, электролитов и белковых веществ. Развивается тканевая гипоксия, приводящая к нарушению окислительно–восстановительных процессов, освобождению большого количества гистамина, гистаминоподобных веществ, кортикостероидов, катехоламинов, развитию тканевого ацидоза. Под влиянием этих процессов в тканях пораженной конечности прогрессируют тканевый склероз, бурая пигментация кожи (вследствие отложения гемосидерина), нарастает отек конечности, образуются трофические язвы. Происходит сдавление рубцово–измененными тканями рядом расположенных артерий. В стенке артерий развиваются стойкие изменения, напоминающие таковые при атеросклерозе сосудов нижних конечностей.
Венозный стаз, отек, фиброз тканей вызывают нарушение лимфооттока. Лимфатические сосуды становятся извитыми, лишаются клапанов. Просвет большинства лимфатических сосудов облитерируется. Резко замедляется скорость тока лимфы. Развивающиеся изменения в лимфатической системе носят необратимый характер и в итоге приводят к вторичной лимфедеме (слоновости).
При ПТФС наблюдаются выраженные изменения со стороны свертывающей и противосвертывающей систем крови с тенденцией к гиперкоагуляции. Наступают расстройства иммунных процессов.
Степень нарушения венозной гемодинамики при ПТФС зависит от распространенности патологического процесса, локализации и продолжительности заболевания.
Классификация.
ПТФС классифицируется по: 1. клинической форме: отечно–болевая, варикозная, язвенная, варикозно–язвенная, смешанная; 2. стадии (исходу) тромбоза: окклюзия глубоких вен (распространенная или сегментарная), реканализация глубоких вен; 3. локализации поражения: подвздошные вены, подвздошно–бедренно–подколенный сегмент, поверхностная бедренная вена, бедренно–подколенный сегмент, подколенно–берцовый сегмент, берцовые вены и т.д.; 4. степень гемодинамических нарушений: ■ субкомпенсации: наблюдается небольшой отек конечности, появляющийся к вечеру и полностью исчезающий после ночного отдыха. Болевой синдром выражен нерезко. Трофические расстройства кожи и подкожной клетчатки дистальных отделов конечности отсутствуют. Варикозное расширение поверхностных вен умеренное; ■ декомпенсации: характерны значительное увеличение конечности в объеме и стойкий болевой синдром. Отек полностью не проходит после ночного отдыха. Выражено расширение поверхностных вен. Появляются трофические расстройства.
Клиническая картина.
При ПТФС достаточно вариабельна и зависит главным образом от сроков заболевания, степени реканализации вен. Симптомокомплекс заболевания складывается из боли в ноге, отека, вторичного расширения подкожных вен, трофических расстройств кожи.
Боль появляется раньше других симптомов. Она может быть тупой или сильной, постоянной или возникать периодически. Боль усиливается после длительных физических нагрузок и ослабевает при поднятии ног или эластическом бинтовании конечности. У некоторых пациентов боль ощущается по задней поверхности ног, в результате чего развивается так называемый флебогенный ишиас. Часто боль локализуется в окружности трофических язв. Болевой симптом наиболее выражен в случае поражения магистральных вен бедра и таза. Патогенез болей связывается с раздражением нервных волокон вследствие увеличения объема конечности, с воспалением чувствительных нервов в адвентиции, с перифлебитическим процессом.
Иногда по ночам у больных ПТФС возникают судороги, сопровождающиеся острой болью.
Отек отмечается почти в 100% наблюдений. Характер отеков различен. При поражении магистральных вен голени отек локализуется в области лодыжек и на стопе, а при нарушении оттока крови через подколенную вену – в нижней трети голени и на стопе. У больных с окклюзией бедренного сегмента отек охватывает всю нижнюю конечность. В зависимости от степени гемодинамических нарушений отек исчезает или значительно уменьшается после ночного отдыха. При постоянных отеках кожа утолщается, теряет эластичность. Отек, переполнение нади подфасциального венозного русла приводят к увеличению объема пораженной ноги. Увеличение окружности голени на 2 см, а бедра на 3 см по сравнению со здоровой ногой свидетельствует о небольшом отеке пораженной конечности. Если эта разница составляет в области голени от 2 до 4 см, а на бедре – от 3 до 5 см, то говорят о средней степени выраженности отека. При значительном (большом) отеке конечности указанная разница достигает более 4 см на голени и 5 см на бедре.
Вторичное варикозное расширение поверхностных вен наблюдается не более чем у половины больных с ПТФС. У остальных выявляется усиление подкожного венозного рисунка. Наиболее характерен рассыпной тип поражения с расширением вен над лобком и на передней брюшной стенке.
К трофическим расстройствам относятся уплотнение и изменение цвета кожи, язвы. Трофические расстройства появляются поздно, спустя 2–3 и более лет после перенесенного тромбоза, на фоне существования отека или расширения поверхностных вен. Первоначально возникает гиперпигментация, а затем индурация, нередко сочетающаяся с покраснением, болью и повышением местной температуры (целлюлит). За счет развития фиброзной ткани кожа и подкожная клетчатка приобретают деревянистую плотность, не смещаются по отношению к подлежащим тканям. На границе измененных и неизмененных участков кожи определяется круговая перетяжка. У ряда больных голень приобретает форму "опрокинутой горлышком вниз бутылки" Нередко в зоне индурации возникает мокнущая экзема. Рассечение измененных при ПТФС тканей приводит к возникновению длительно не заживающих ран с выделением белой или желтоватой жидкости. Посев ее не дает роста микрофлоры. Язвы при ПТФС появляются после ушибов, расчесов, а в ряде случаев без видимых причин. Типичными местами их локализации являются передняя поверхность средней трети либо передневнутренняя поверхность задней и нижней третей голени, надлодыжечная область с внутренней поверхности.
Язвы возникают через много месяцев после начала заболевания, имеют склерозированные края, возвышающиеся над ее плоским дном. Как правило, язвенные дефекты одиночные, но иногда образуются 2–3 язвы разных диаметров. Периодически язвы уменьшаются в размерах или закрываются полностью. Чаще при ПТФС трофические расстройства охватывают голень циркулярно.
Существующие формы ПТФС характеризуются различной степенью выраженности указанных симптомов. Так, при отечно–болевой форме ПТФС в клинической картине преобладают боль и отек, при варикозной – вторичное варикозное расширение поверхностных вен. Язвенному типу свойственно появление трофических язв при отсутствии отека и варикоза поверхностных вен.
Диагностика.
Диагноз ПТФС не вызывает сомнений, если больной перенес в прошлом явный острый тромбоз глубоких вен. В остальных случаях необходимо использовать комплексный диагностический подход. О наличии ПТФС могут свидетельствовать: локализация расширенных и варикозно измененных поверхностных вен на лобке и передней брюшной стенке; циркулярные трофические расстройства на голени; отсутствие варикозного расширения подкожных вен при наличии трофических расстройств кожи; значительный отек ноги, особенно бедра; цианоз кожи стопы, не уменьшающийся во время ходьбы; боль, быстрая утомляемость и чувство распирания в нижней конечности.
В сложных ситуациях применяют функциональные и лабораторно–инструментальные методы диагностики.
При проведении функциональных проб выявляются непроходимость глубоких вен нижних конечностей, несостоятельность клапанов основного ствола большой подкожной вены или коммуникантных вен.
Флеботонометрия с пробой Вальсальвы (натуживание) и физической нагрузкой при реканализации глубоких вен сопровождается быстрым и значительным повышением венозного давления в нижних конечностях. В случае окклюзии магистральных вен оно увеличивается медленно и незначительно.
Наиболее информативными методами диагностики ПТФС являются рентгеноконтрастные флебография и флебоскопия. К рентгенологическим признакам ПТФС относятся: зоны реканализации и окклюзии магистральных вен; несостоятельные перфорантные вены на всех уровнях голени и бедра; разрушение клапанов магистральных вен; ретроградный кровоток через устья большой и малой подкожных вен; существование коллатерального кровотока; варикозное расширение поверхностных вен.
На лимфограммах в начальных стадиях ПТФС находят значительное неравномерное увеличение диаметра и количества лимфатических сосудов, лимфо–лимфатических анастомозов. Декомпенсированная стадия ПТФС характеризуется сужением и облитерацией просвета, деформацией большинства лимфатических сосудов, замедлением тока лимфы по основным коллекторам, экстравазацией контрастного вещества.
Реография свидетельствует о снижении венозного тонуса, уменьшении упругоэластичных свойств венозной стенки, повышенном скоплении в венозных сосудах крови.
При термографии артериовенозное шунтирование сопровождается четкой дифференцировкой тепловых полей, удовлетворительной реакцией на физическую нагрузку, тепловую и холодовую пробы.
Биомикроскопия выявляет уменьшение количества капилляров, их извитость, расширение, замедление кровотока при субкомпенсированной стадии гемодинамических нарушений и полный венозный стаз, мутный капилляроскопический фон при декомпенсированной.
Дифференциальная диагностика.
ПТФС необходимо отличать от заболеваний, сопровождающихся отеком, болью, трофическими расстройствами на ногах, расширением поверхностных вен нижних конечностей. Чаще всего дифференциальная диагностика проводится с варикозной болезнью и врожденными аномалиями развития (дисплазиями) венозной системы (табл. 3), болезнями сердца и почек, лимфедемой, лимфостазом, тромбоблитерирующими заболеваниями. Трофические нарушения тканей дистальных отделов ног нередко возникают при сифилисе и гипертонической болезни.
Отеки при патологии сердца и почек симметричные, распространяются на область крестца, боковую поверхность живота. Отсутствуют характерные для ПТФС трофические расстройства.
Таблица
| Симптомы | Варикозная болезнь | Венозные дисплазии |
|---|---|---|
| Отек | Возникает через несколько лет после начала заболевания. Локализуется в области лодыжек. Появляется к концу дня. Уменьшается или проходит после ночного отдыха | Может быть с рождения. Локализуется в дистальных отделах ног. Вначале проходящий, затем постоянный |
| Ощущение распирания в конечности | Редко | Часто |
| Быстрая утомляемость ног | Редко. Выражена при стоянии. Исчезает во время ходьбы | Редко |
| Варикозное расширение подкожных вен | Множественные и распространенные варикозные изменения появляются раньше отека, локализуются как на голени, так и на бедре | В 50% случаев возникает вместе с отеком или без него на латеральной поверхности бедра и голени в виде извитых вен с единичными или множественными узлами по ходу притоков |
| Трофические расстройства кожи | В 50% наблюдений располагаются по медиальной поверхности голени. Возникают через 5–10 лет после начала заболевания. Медленно прогрессируют | У 10% больных развиваются более чем через 10 лет после появления первых симптомов дисплазий. Чаще возникают по латеральной поверхности голени спустя много лет после появления варикозного расширения вен. Длительно существуют пигментации. Язвы без воспалительных изменений в коже |
Появление отека на ногах возможно и при затруднении оттока лимфы (лимфостаз) вследствие метастатического поражения паховых лимфоузлов, при опухолях забрюшинного пространства и органов брюшной полости. Только тщательное обследование позволяет установить правильный диагноз.
Боли при ПТФС следует отличать от ишемических болей, связанных с тромбоблитерирующими заболеваниями. Болевой симптом, обусловленный окклюзионно–стенотическим поражением артерий, появляется во время ходьбы и купируется после непродолжительного отдыха. Кожа нижних конечностей бледная, холодная, атрофичная. Ослаблен или отсутствует пульс на периферических артериях.
Сифилитические язвы имеют множественную локализацию, располагаются кругом или полукругом в верхней части голени, развиваются из узла, безболезненны. В крови выявляются положительные специфические реакции.
Язвы у больных гипертонической болезнью локализуются в нижней трети голени. В окружности язв отсутствуют индурация и гиперпигментация кожи. Нет патологии венозной системы.
Лечение.
Зависит от характера течения заболевания. Показаниями к хирургическому лечению служат варикозная форма ПТФС с несостоятельными коммуникантными венами, ПТФС с трофическими расстройствами на нижних конечностях, рецидив варикозного расширения поверхностных вен. Операция не выполняется у больных с отечноболевой формой ПТФС при отсутствии несостоятельности коммуникантных вен, вторичном расширении вен рассыпного характера, при общехирургических противопоказаниях.
Консервативное лечение предполагает проведение мероприятий общего и местного характера. Рекомендуются обязательное эластическое бинтование ног, свободный режим, но с исключением длительного стояния на ногах, ЛФК, массаж, плавание, физиотерапия (диадинамические токи, магнитные поля, лазеры, сероводородные ванны). Желателен отдых 2–3 раза в день с умеренно возвышенным положением нижних конечностей. При наличии отеков назначаются мочегонные средства (триампур, фуросемид и др.). Применяются флебодинамические (гливенол, эскузан, венорутон и др.), десенсибилизирующие средства, препараты, улучшающие микроциркуляцию (трентал, реополиглюкин и др.). Проводится длительная фитотерапия (толокнянка, зверобой, брусничный лист). Эффективно наложение на пораженную конечность цинк–желатиновой повязки Унны. Медикаментозное лечение проводится 2 раза в год, в различных комбинациях в течение 2–3 недель.
Существует множество методов хирургического лечения больных с ПТФС. В зависимости от целенаправленности они объединяются в 9 групп.
Некоторые из них применяются часто, другие реже, третьи представляют лишь исторический интерес. 1. Операции, устраняющие сброс крови из глубоких вен в поверхностные, являются основными при ПТФС: ■ операция Линтона – удаление варикозно расширенных большой и малой подкожных вен, субфасциальная перевязка коммуникантных вен на уровне голени путем рассечения апоневроза по ее медиальной поверхности от внутреннего мыщелка большеберцовой кости до внутренней лодыжки. Фасция ушивается в виде дубликатуры. Применяется наиболее часто; ■ операция Коккета – удаление варикозно расширенных поверхностных вен, надфасциальная перевязка коммуникантных вен из продольного разреза в нижней трети медиальной поверхности голени с обходом внутренней лодыжки. После перевязки и отсечения культя перфорантной вены уходит под фасцию. Дефект фасций ушивается; ■ операция Фельдера – удаление варикозно измененных поверхностных вен, субфасциальная перевязка перфорантных вен из разреза по задней поверхности голени от подколенной ямки до уровня лодыжек; ■ дистанционная окклюзия устьев перфорантных вен – флебэктомия в сочетании с обтурацией заднебольшеберцовых вен в пределах нижней трети или нижней половины голени путем введения в их просвет кетгутовой нити или полоски шириной 2 мм и длиной 20 см, выкроенной из большой подкожной вены. 2. Операции, улучшающие гемодинамику за счет создания дополнительных путей оттока, применяются реже: ■ операция Пальма–Эсперона – анастомоз ирование большой подкожной вены здоровой ноги с бедренной веной больной ноги дистальнее участка окклюзии. Применяется при ПТФС, обусловленном окклюзией подвздошного сегмента. Модификация этой операции состоит в использовании для обходного шунта большой подкожной вены больной ноги при несостоятельности ее клапанного аппарата; применении эксплантатов; ■ операция Уоррена–Тайра – анастомозирование дистального конца подколенной вены с большой подкожной веной бедра и перемещением последней под глубокую фасцию. Применяется при окклюзии поверхностной бедренной вены. Условием для выполнения операций Пальма–Эсперона и Уоррена–Тайра является наличие достаточно широкого просвета большой подкожной вены (не менее 0,7 см), что необходимо для предупреждения ее тромбоза; ■ операция Боровкова – анастомозирование противоположных наружных срамных вен или наружных срамных вен больной конечности с большой подкожной веной здоровой конечности. Применяется при изолированной окклюзии подвздошной вены. 3. Операции, направленные на создание искусственных клапанов: ■ экстравазальная коррекция клапанов путем наложения на глубокие вены в области несостоятельного клапана каркасной синтетической спирали – операция А. Н. Веденского; ■ реконструкция и аутотрансплантация клапанов вен с помощью микрохирургической техники; ■ замещение сегмента реканализированной бедренной вены трансплантатом большой подкожной или плечевой вены с функционирующим клапаном; ■ операция Псатакиса – создание наружного мышечного клапана за счет подшивания узкой полоски на ножке из сухожилия m.gracilis к сухожилию двуглавой мышцы бедра с проведением ее между подколенной артерией и веной; ■ аутовенозная пластика с функционирующим клапаном – операция Бранзеу–Руссо. Формирование подобия клапана при штыкообразном изгибании бедренной вены путем наложения У–образного стежка под устьем большой подкожной вены, частично пережимающего просвет бедренной; ■ формирование лепесткового венозного клапана по В. Б. Гервазиеву. Сущность операции заключается во вворачивании в просвет магистральной вены кармана, образующегося при прошивании по краям, сложенной поперек интимой внутрь продольно рассеченной культи большой подкожной вены. Затем на вену в области расположения лепесткового клапана накладывается эластическое кольцо, закрывающее отверстие в полость клапана. В просвете вены клапан занимает косое положение. Из всех операций, направленных на создание искусственных клапанов, наибольшее применение получила операция А. Н. Веденского. Одним из условий эффективности операций, направленных на создание искусственных клапанов, является одновременная коррекция нескольких клапанов на разных уровнях венозного русла. 4. Операции, снижающие гидростатическое давление на различных уровнях венозных магистралей: ■ перевязка и резекция подколенной вены (операция Бауэра); ■ перевязка и резекция бедренный вены (операция Линтона–Харди); ■ перевязка и резекция задней большеберцовой вены. 5. Операции, полностью устраняющие нарушение кровотока по магистральным венам: ■ иссечение мембранных образований в просвете магистральных вен; ■ устранение компрессионного действия правой общей подвздошной артерии; ■ восстановление проходимости сосуда при тромбинтимэктомии, протезирование участка вены. 6. Операции, направленные на улучшение кровотока по глубоким венам: ■ пластика фасции голени (операция Аскара–Зеренина) – создание более плотного фасциального футляра на голени путем формирования дубликатуры глубокой фасции по ее задней поверхности. Это суживает мышечный футляр, обеспечивает более полное сдавление вен в период мышечных сокращений; уменьшает (устраняет) относительную клапанную недостаточность глубоких вен голени; ■ флеболиз; ■ частичная тромбинтимэктомия. 7. Операции, уменьшающие артериальный приток крови к конечностям: ■ сужение артерий; ■ резекция артерий. 8. Операции на периферической нервной системе: ■ поясничная симпатэктомия – операция Диеца – через (вне) брюшинное удаление II и III поясничных симпатических ганглиев; ■ невролиз. 9. Кожно–пластические операции с лимфангиоэктомиями при трофических язвах.
Выбирая вариант операции для лечения больных с ПТФС, исходят из конкретной возможности его выполнения. В ряде случаев показана комбинация нескольких способов. При наличии трофических язв хирургическое вмешательство дополняется аутодермопластикой заранее подготовленной раневой поверхности расщепленным кожным лоскутом.
В послеоперационном периоде продолжается консервативное лечение, направленное на улучшение венозной и артериальной гемодинамики. На конечность накладывается сроком на 1 мес. цинк–желатиновая повязка Унны. После ее снятия на протяжении 3–6 мес. рекомендуется бинтование конечности эластичным бинтом от пальцев до паховой области. В последующем бинтование следует заменить ношением эластичных чулок. Целесообразно ежегодное проведение 1–2 курсов консервативной амбулаторно–стационарной терапии (см. консервативное лечение ПТФС). Все пациенты нуждаются в правильном трудоустройстве.
Глава 5. Эндокринные железы
Заболевания щитовидной железы
Анатомо–физиологические сведения
Щитовидная железа (glandula thyreoidea) по форме напоминает бабочку. Она состоит из двух боковых долей (правой и левой), соединенных между собой перешейком. У 1–2% людей перешеек отсутствует. В ⅓ случаев от перешейка поднимается отросток (пирамидальный отросток), который может образовывать самостоятельную пирамидальную долю. Перешеек охватывает спереди II–IV кольца трахеи. Нижние полюса боковых долей располагаются на уровне V–VI колец трахеи, верхние достигают середины высоты щитовидного хряща. Задние поверхности боковых долей граничат с сосудисто–нервным пучком шеи, трахеей, гортанью, глоткой и пищеводом. На задней поверхности щитовидной железы располагаются четыре (по две с каждой стороны) околощитовидные железы. С обеих сторон трахеи проходят ветви возвратных нервов. Цвет железы у лиц молодого возраста розово–красный, у пожилых – желтовато–бурый, что связано с отложением в ней жировых масс. Масса щитовидной железы у взрослого равна 25–35 г. Длина боковых долей составляет 6–8 см, ширина 2–4 см, толщина 1,5–2,5 см. Правая доля часто оказывается больше левой.Щитовидная железа покрыта висцеральным и париетальным листками IV фасции шеи. Висцеральный листок образует собственную капсулу железы. От нее внутрь отходят тонкие перемычки, разделяющие паренхиму на дольки. Париетальный листок фасции формирует поверхностную оболочку железы, которая легко от нее отделяется.
Кровоснабжение щитовидной железы осуществляется из двух парных щитовидных артерий – аа. thyreoideae sup. и аа. thyreoideae inf., а нередко и непарной a. thyreoideae ima, отходящей непосредственно от дуги аорты. Щитовидная железа – один из наиболее кровоснабжаемых органов. За 1 мин через 100 г ее ткани проходит 560 см3 крови.
Венозные сосуды образуют на передней поверхности щитовидной железы и вне ее обильные сплетения, из которых кровь поступает во внутреннюю яремную, язычную и общие лицевые вены. Вены, отходящие от боковых долей, вливаются непосредственно во внутренние яремные вены. Особенностью строения вен шеи является отсутствие в них клапанов.
Лимфатические сосуды щитовидной железы многочисленны. Отток лимфы по верхним лимфатическим сосудам происходит в глубокие лимфатические узлы шеи по ходу v. jugularis int., а по нижним – в предтрахеальные и надключичные лимфатические узлы.
Иннервация железы осуществляется ветвями симпатических, блуждающих и языкоглоточных нервов. Они проникают в щитовидную железу по ходу ее сосудов, образуя густую сеть внутри железы.
Основной структурной единицей железы являются фолликулы, представляющие собой замкнутые пузырьки, стенку которых образуют железистые клетки тироциты. Каждый фолликул окружен сетью из кровеносных, лимфатических капилляров и нервных окончаний, что способствует осуществлению обменных процессов в железистых клетках. Содержимым пузырьков являются секрет тиреоцитов – коллоид, состоящий в основном из тиреоглобулина.
Щитовидная железа продуцирует йодированные гормоны (тироксин и трийодтиронин) и нейодированный гормон тиреокальцитонин. В крови йодсодержащие гормоны связываются со специфическими белками (тироксинсвязывающим глобулином) и циркулируют в виде белковосвязанного йода.
Йодированные гормоны щитовидной железы влияют на множество физиологических функций организма. Они регулируют скорость основного обмена, повышают катаболизм углеводов, белков, жиров, оказывают экстраренальный осмотически–диуретический эффект, стимулируют действие соматотропных гормонов гипофиза, ускоряют сердечную деятельность, кровоток, усиливают моторику пищеварительного тракта, воздействуют на половые железы и кроветворную систему, надпочечники.
Тиреокальцитонин снижает уровень кальция и фосфора в крови. Это достигается угнетением резорбции кальция и белкового матрикса в кости, уменьшением мобилизации фосфора из кости и стимулированием поглощения фосфора костной тканью.
Нетоксический (эутиреоидный) зоб
Термин "нетоксический (эутиреоидный) зоб" обозначает увеличение щитовидной железы, не сопровождающееся изменениями ее функции. Он может наблюдаться у лиц, проживающих в одной местности (эндемический зоб), или возникать вне очага эндемии (спорадический зоб).Историческая справка.
В XVI ст. Paracels обратил внимание на связь эндемического зоба с кретинизмом. В XIX ст. Prevost и Chatin нашли зависимость между частотой развития эндемического зоба и недостатком йода в воде.
Распространенность.
Эутиреоидный зоб встречается у 30–60% больных с заболеваниями щитовидной железы.
Эндемическим зобом страдает 5–8% населения земли. Он встречается преимущественно у жителей высокогорных и низменных районов.
Соотношение больных мужчин и женщин составляет 1:6–8. В большинстве случаев заболевание поражает детей (5–15 лет) и лиц молодого возраста (16–30 лет).
Этиология и патогенез.
Эутиреоидный зоб развивается в результате действия экзои эндогенных факторов. Среди экзогенных факторов ведущую роль играет недостаточное поступление в организм человека йода в связи с низким его содержанием в почве, воде, продуктах питания. Кроме того, дефицит йода может возникнуть и под воздействием ингибиторов йода, т.е. веществ, затрудняющих включение йода в щитовидную железу (струмигенные вещества). К ним относятся нитраты, гуминовые кислоты. Усвояемости йода препятствуют жесткость и высокая окисляемость воды. В патогенезе заболевания не исключается роль социально–бытовых факторов: неполноценное питание, неспецифическая интоксикация, бактериальная и вирусная инфекция.
К экзогенным факторам развития зоба относятся: 1. повышенная потребность организма в гормонах щитовидной железы в период полового созревания, беременности; 2. нарушение усвояемости йода, поступившего в желудочно–кишечный тракт вследствие различных заболеваний желудка и кишечника; 3. расстройство регуляции щитовидной железы, проявляющееся в повышении чувствительности ее ткани к тиреотропной стимуляции; 4. генетические факторы. Они находят свое отражение прежде всего в дефектах ферментных систем, принимающих участие в синтезе тиреоидных гормонов; 5. аутоиммунные механизмы: в сыворотке больных зобом обнаружены иммуноглобулины (ростостимулирующая активность), которые специфически стимулируют рост паренхимы щитовидной железы, не изменяя ее функцию.
Патологическая анатомия.
Макроскопически различают три основные патоморфологические формы нетоксического зоба: диффузную, узловую (нодозную) и смешанную. По гистологическому строению его делят на коллоидный и паренхиматозный. Коллоидный зоб может быть макрофолликулярным (состоит из крупных фолликулов, заполненных коллоидом), микрофолликулярным (содержит мелкие фолликулы), макромикрофолликулярным (наряду с крупными фолликулами встречаются и мелкие). Коллоидный зоб, как правило, имеет узловое строение. В нем наблюдаются очаги обызвествления, фиброза, кровоизлияний, кистозное и злокачественное перерождение. Паренхиматозный зоб характеризуется пролиферацией эпителия фолликулов, разрастающегося в виде солидных структур.
Классификация.
В зависимости от выраженности гиперплазии выделяют пять степеней увеличения щитовидной железы (швейцарская шкала): ■ 0 степень – щитовидная железа не видна и не пальпируется. ■ 1 степень – щитовидная железа не видна, но при глотании прощупывается перешеек; ■ 2 степень – щитовидная железа видна при глотании и легко пальпируется, но форма шеи не изменена; ■ 3 степень – увеличение щитовидной железы видно на глаз и изменяет контуры шеи; ■ 4 степень – увеличенная щитовидная железа значительно изменяет конфигурацию шеи; ■ 5 степень – зоб достигает огромных размеров, сдавливает органы шеи с нарушением дыхания и глотания.
По расположению зоб может быть односторонним, двусторонним, загрудинным (5–10%), корня языка (2–9%), интратрахеальным и др.
Клиническая картина.
Проявления нетоксического зоба определяются его размерами. В случае отсутствия отклонений в функции щитовидной железы зоб длительное время протекает бессимптомно. При значительном увеличении щитовидной железы появляются симптомы сдавления смежных органов. Так, компрессия трахеи сопровождается затруднением дыхания, изменением голоса, охриплостью, сухим кашлем, приступами удушья. Повышение давления в яремных венах приводит квозникновению ощущения тяжести в голове при ее наклоне. Нарушение дыхания и кровообращения, а вслед за этим гипертензия в малом круге кровообращения способствуют гипертрофии и расширению правых отделов сердца ("зобное сердце"). В миокарде прогрессируют дистрофические изменения. У ⅔ больных наблюдаются расстройства со стороны нервной системы (неврозы, вегетососудистая дистония). Часто при эндемическом зобе возникает скрытая недостаточность надпочечников, которая проявляется только при стрессах.
Нетоксический зоб развивается медленно. Однако изменение условий жизни, психическая травма, беременность способствуют быстрому увеличению щитовидной железы.
Течение зоба осложняется его воспалением, кровоизлиянием в ткань железы, базедификацией (переход в гипертиреоз), злокачественным перерождением.
Диагностика.
Основывается на данных клинической картины и лабораторно–инструментальных методов исследования. Результаты лабораторных исследований, как правило, нормальные. При изучении функции щитовидной железы с радиоактивным йодом регистрируется высокая степень поглощения йода, но с длительной задержкой препарата в ткани (на 24–48 ч), и медленное его выведение.
Во время сцинтиграфии у больных диффузным зобом обнаруживают равномерное распределение радионуклида в щитовидной железе. При узловом и смешанном зобе отмечается негомогенная структура железы. Обнаруживаются теплые узлы (поглощающие большое количество радиоактивного йода) и холодные (не накапливающие йод). Появление последних обусловливается дегенеративно–воспалительными изменениями щитовидной железы (кисты, кальцификаты, кровоизлияния) и злокачественным перерождением.
Эхография щитовидной железы и пункционная биопсия холодных узлов позволяют уточнить характер патоморфологических изменений в органе.
Дифференциальная диагностика.
Проводится со злокачественными опухолями, туберкулезом, сифилисом, липомами щитовидной железы, срединными кистами щей, острым тиреоидитом.
Для рака щитовидной железы характерно наличие бугристого образования плотной консистенции, сросшегося с окружающими тканями. Подвижность железы значительно ограничивается. Нередко из–за прорастания опухолью возвратного нерва развивается охриплость голоса. Увеличиваются и становятся менее подвижными регионарные лимфатические узлы шеи. При сканировании в щитовидной железе находят холодные узлы, биопсия которых уточняет характер опухоли.
Туберкулез шитовидной железы чаще бывает вторичным. Он характеризуется плотной консистенцией железы, бугристой поверхностью, ограничением подвижности, медленным прогрессированием заболевания. Пальпируемые узлы неравномерного диаметра, часто абсцедируют. Диагноз уточняется биопсией, туберкулиновыми пробами.
Гумы, образующиеся в щитовидной железе при третичном сифилисе, имеют плотную консистенцию, спаяны с окружающими тканями, нередко сдавливают трахею. Серологические реакции положительные. Специфическое лечение дает положительный эффект.
Липомы шеи мягкоэластической консистенции, легко смещаемы при пальпации. В большинстве наблюдений находятся вне проекции щитовидной железы. Не привсдягг к изменению функции органов и систем организма.
Срединная киста шеи – безболезненное мягкоэластической консистенции образование. Располагается по средней линии шеи между подъязычной костью и верхним краем щитовидного хряща или в подчелюстном треугольнике. Смещается при глотании. Всегда связана с подъязычной костью. Пальпаторно между кистой и подъязычной костью часто определяется плотный тяж.
Острые тиреоидиты сопровождаются повышением температуры, равномерным увеличением щитовидной железы с сохранением ее контуров. Развиваются быстро, в течение нескольких дней или часов, чаще после перенесенного инфекционного заболевания.
Лечение.
При эутиреоидном зобе оно дифференцированное. На ранних стадиях диффузный и смешанный зоб небольших размеров, не сопровождающийся осложнениями, подлежит медикаментозной терапии. Консервативное лечение проводится и при небольших (до 2 см в диаметре) узлах щитовидной железы, доброкачественный характер которых доказан. Назначаются диета, богатая йодом, антиструмин, тиреоидин, тироксин, трийодтиронин, тиреокомб. Эффект от проводимых мероприятий наступает спустя 2–5 мес., что является основанием для его продолжения.
Хирургическое лечение показано при: 1. узловом зобе небольших размеров, подозрительном в отношении озлокачествления или природу которого установить лабораторно–инструментальными методами не представляется возможным; 2. узловом, смешанном зобе с развившимися в нем воспалительно–дегенеративными изменениями; 3. большой степени зоба (IV и V); 4. зобе, вызывающем сдавление соседних органов; 5. узловом зобе, устойчивом к консервативному лечению.
У лиц с диффузным и смешанным нетоксическим зобом выполняют двустороннюю клиновидную резекцию обеих долей щитовидной железы, оставляя культи непораженной паренхимы в достаточном объеме для сохранения нормальной функции щитовидной железы. При одиночном узле небольших размеров производится резекция доли щитовидной железы. В случае большой солидарной аденомы, а также множественного аденоматоза доли осуществляется гемиструмэктомия (удаление доли с перешейком).
Многоузловое поражение обеих долей щитовидной железы служит показанием к двусторонней субтотальной резекции щитовидной железы.
Энуклеация узла в настоящее время не применяется, так как при злокачественной природе узла опухоль рецидивирует.
Токсический зоб
Токсический зоб – заболевание, обусловленное повышением продукции тиреоидных гормонов. В зависимости от характера увеличения щитовидной железы выделяют диффузный токсический зоб, характеризующийся равномерным диффузным ее увеличением, и узловой токсический зоб – одиночный (токсическая аденома) и множественный.Диффузный токсический зоб (базедова болезнь, болезнь Грейвса, Флаяни, Парри)
Историческая справка.
В 1822 г. Ives впервые описал тиреотоксикоз. Grevs (1835) связал развитие диффузного токсического зоба с патологическими изменениями шитовидной железы. Окулист Basedof (1840) выделил три основных симптома заболевания – диффузный двусторонний зоб, тахикардия и пучеглазие. Lister (1871) произвел первую операцию при тиреотоксикозе.
Распространенность.
Токсический зоб наблюдается преимущественно у женшин в возрасте 2050 лет. Встречается повсеместно.
Этиология.
Ведущим этиологическим фактором диффузного токсического зоба является генетическая предрасположенность, обусловливающая появление антител к тиреоглобулину. Развитию тиреотоксикоза способствуют изменения в ЦНС, гипоталамических центрах, регулирующих состояние иммунной системы организма. Частота тиреотоксикоза повышается в пубертатном и климактерическом периодах, во время беременности, после перенесенных инфекционных заболеваний, интоксикаций, психических травм.
Патогенез.
До конца не изучен. Схематически его можно представить в следующем виде. Неблагоприятные этиологические факторы приводят к нарушению центральных механизмов гипоталамо–гипофизарной регуляции функции щитовидной железы с дальнейшими изменениями в иммунной системе. Развивающийся дефицит или дефект Т–супрессоров приводит к активации Т–хелперов. Они воздействуют на В–лимфоциты щитовидной железы, превращая их в плазматические клетки, синтезирующие аутоантитела – тиреостимулирующие иммуноглобулины (ТСИГ). Их действие на щитовидную железу идентично влиянию тиреотропина, т.е. сопровождается гипертрофией ее паренхимы и повышением концентрации тиреоидных гормонов в крови.
Патологическая анатомия.
У больных диффузным токсическим зобом развиваются патоморфологические изменения как в самой железе, так и в других органах и системах.
Щитовидная железа диффузно увеличена. Ее масса достигает 50–150 г. Значительно расширены сосуды, расположенные на ее поверхности. Консистенция железы колеблется от мягкоэластической до умеренно плотной. На поперечном разрезе структура органа однородная, гомогенная. Фолликулы щитовидной железы неправильной формы. Стенка фолликулов выстлана цилиндрическим, часто многослойным эпителием.
У больных с длительно существующим диффузным токсическим зобом находят гипертрофию или дилатацИю левого желудочка сердца, дистрофию миокарда. В печени обнаруживают дистрофию паренхимы, очаги жировой инфильтрации, иногда зоны некроза. Увеличены вилочковая железа и лимфатические узлы. Ретробульбарная соединительная ткань, глазные мышцы отечны, выявляются дистрофические изменения в глазном дне. Наблюдаются кровоизлияния в область дна IV желудочка, тромбоз сосудов головного мозга и т.д.
Клиническая картина.
Проявления диффузного токсического зоба разнообразны. Типичными признаками заболевания является триада К. Базеда: зоб, пучеглазие, тахикардия. Все имеющиеся симптомы тиреотоксикоза условно подразделяются на местные, обусловленные увеличением щитовидной железы, и общие (катаболический, неврологический, кардиальный, абдоминальный синдромы). Щитовидная железа увеличена у 90–97% больных диффузным токсическим зобом. Гиперплазии подвергаются все ее отделы, но преимущественно правая доля. При осмотре находят типичные глазные симптомы тиреотоксикоза: Дельримпля (широкие глазные щели), Штелльвага (редкое мигание и фиксирование глазных яблок), Краузе (блеск глаз), Грефе (отставание верхнего века от радужки при движении глазного яблока сверху вниз), Кохера (расширение участков склеры при взгляде вверх), Еллинека (гиперпигментация кожи век).
Катаболический синдром проявляется прогрессирующим похуданием больных, которое может достигать степени кахексии, с одновременным повышением аппетита, жаждой, чувством жара, потливостью, субфебрилитетом, общей слабостью, быстрым утомлением.
Неврологический синдром включает повышенную возбудимость, раздражительность, плаксивость, нарушение сна, дрожание век, пальцев, языка. Наблюдаются преходящие гемиплегия, афазия, невриты, невралгии.
Кардиальный синдром характеризуется нарушением ритма сердца в виде синусовой тахикардии (до 160–200 сокращений в I мин), мерцательной аритмией, экстрасистолиями, пароксизмальной тахикардией, иногда приступы мерцательной аритмии являются единственным клиническим проявлением тиреотоксикоза. Часто отмечаются боли в области сердца по типу стенокардических, одышка. Ее появление связано со снижением гемодинамики и возникающим вследствие этого нарушением тканевого дыхания. При прогрессировании нарушений в миокарде в 1025% случаев развивается сердечная недостаточность.
К абдоминальным проявлениям тиреотоксикоза относятся стойкая диарея (15–30%), токсический гепатит, желтуха (20–40%), нарушение функции поджелудочной железы.
Кроме указанных признаков, у больных тиреотоксикозом нередко бывают сыпь на коже, лейкодермия, выпадение волос, нарушение функции половых желез, а в 6080% случаев офтальмопатия. Она сопровождается слезотечением, припухлостью век, нарушением подвижности глазных яблок, высыханием и изъязвлением роговицы. Офтальмопатия у больных диффузным токсическим зобом рассматривается как аутоиммунный процесс, сопровождающийся накоплением большого количества кислых мукополисахаридов в ретробульбарной клетчатке и ее отеком.
Отмечаются претибиальная (локальная) микседема и акропатия. При претибиальной микседеме поражается кожа передней поверхности голени: она утолщается, отекает, с выступающими фолликулами (кожура апельсина). Для акропатии характерны изменения мягких тканей и фаланг пальцев, костей запястья.
В 0,5–19% случаев течение токсического зоба осложняется развитием тиреотоксического криза, который развивается стремительно, в течение нескольких часов или дней. Он сопровождается бурными проявлениями клинических симптомов диффузного токсического зоба: высокой температурой, рвотой, поносом и т.д. Это часто заканчивается тиреотоксической комой и гибелью больного.
В зависимости от степени выраженности клинических проявлений различают легкую, среднюю и тяжелую формы тиреотоксикоза.
Легкая форма – симптоматика заболевания выражена незначительно. Частота пульса не превышает 100–110 уд/мин. Ритм сердечных сокращений обычный. Основной обмен +30–40%. Поглощение 1311 щитовидной железой до 40% через 24 ч. Трудоспособность сохранена.
Средняя форма – частота пульса достигает 120 уд/мин. Ритм не нарушен. Основной обмен +50% и более. Поглощение 1311 щитовидной железой ускорено с первых часов исследования и может превышать 50%. Трудоспособность снижена.
Тяжелая форма – тахикардия превышает 120 уд/мин. Ритм нарушен. Основной обмен +80% и более. Накопление 1311 щитовидной железой повышено в первые 6 ч, а к 24 ч снижается. Отмечаются нарушения функции других органов, значительный дефицит массы тела. Больные нетрудоспособны и подлежат госпитализации.
Диагностика.
В крови больных диффузным токсическим зобом имеется повышение содержания тироксина, трийодтиронина, белково–связанного йода. При определении поглощения 131I щитовидной железой через 2–4 ч в ней обнаруживается 90% и более введенного препарата. На сканограммах и при ультрасонографии выявляется диффузное увеличение щитовидной железы. Значительно повышен основной обмен.
Дифференциальная диагностика.
Проводится с нейроциркуляторной дистонией, ревмокардитом, туберкулезом легких, энцефалитом и т.д.
Нейроциркуляторная дистония не сопровождается появлением типичных для токсического зоба глазных симптомов, постоянной тахикардией, увеличением пульсового давления, повышением накопления 311 в щитовидной железе и содержания тиреоидных гормонов в крови.
В анамнезе у больных ревматизмом отмечаются полиартрит, хорея. Тоны сердца глухие. В крови повышен титр антистрептолизина О, антистрептокиназы, определяется С–реактивный белок. На ЭКГ регистрируется удлинение атриовентрикулярной проводимости, снижение вольтажа всех зубцов.
Туберкулез легких проявляется ознобами, рентгенологическими изменениями в легких, положительными туберкулиновыми пробами, присутствием в мокроте микобактерий туберкулеза.
Энцефалит сопровождается повышением температуры тела до 38°С, сильной головной болью, головокружениями. Наблюдаются катаральные явления. В крови определяются умеренный полинуклеарный лейкоцитоз, увеличение СОЭ.
Лечение.
Для купирования явлений тиреотоксикоза применяют комплексную или раздельную терапию тиреостатическими препаратами, радиоактивным йодом, хирургическое вмешательство.
Консервативное лечение применяется при увеличении щитовидной железы I–II степеней и противопоказаниях к выполнению операции при других степенях тиреотоксического зоба. Из группы антитиреоидактивных веществ чаще используют производные имидазола: мерказолил. Он способствует быстрому выведению йодитов из щитовидной железы, снижает активность ее ферментных систем, блокирует выработку ТСИГ. Эффективно назначение лития карбоната и калия перхлората, препаратов неорганического йода. Проводится симптоматическая терапия. Лечение применяется в основном у больных пожилого возраста с тяжелыми сопутствующими заболеваниями.
Хирургическое лечение показано при: 1. безуспешности или невозможности проведения консервативной терапии; 2. зобе больших размеров, сдавливающем органы шеи; 3. подозрении на злокачественное перерождение зоба; 4. тиреотоксикозе у детей, беременных или планируемой беременности.
Операция выполняется при эутиреоидном состоянии больных, т.е. после консервативного предоперационного лечения с включением в комплекс проводимых мероприятий экстракорпоральной детоксикации организма – плазмафереза, гемосорбции и др. Наибольшее распространение получила субтотальная, субфасциальная резекция щитовидной железы по О. В. Николаеву (предусматривает оставление двух участков массой 1–3 г ткани щитовидной железы по заднебоковой поверхности трахеи) и Е. С. Драчинской (4–6 г ткани оставляется у одного, чаще левого, верхнего полюса железы).
Для профилактики тиреотоксического криза консервативное лечение после операции продолжается в течение 7–8 дней. При развитии криза проводимое лечение направляется на уменьшение поступления в кровь тиреоидных гормонов. С этой целью используются препараты йода, которые тормозят образование гормонов щитовидной железы. Внутривенно вводятся 5–10% растворы натрия йодида в 1 л 5% раствора глюкозы через каждые 8 ч. Перорально назначаются растворы Люголя по 30 капель 4 раза в день, мерказолил (60–100 мг). При коматозном состоянии тиреостатики вводятся через зонд в 100 мл 5% раствора глюкозы. Показаны β–блокаторы в больших дозах (20–40 мг анаприлина через 6 ч). Они снижают токсическое влияние тиреоидных гормонов и благоприятно действуют на функцию вегетативной нервной системы. При надпочечниковой недостаточности внутривенно вводят гидрокортизон (300600 мг/с) и преднизолон (200–300 мг/с). Проводятся коррекция нарушений водно–электролитного обмена, гипоксии, детоксикационная терапия и т.д.
Помимо тиреотоксического криза, ранними осложнениями операций на щитовидной железе при диффузном токсическом зобе являются кровотечение (0,3–5% случаев), в том числе с возможной асфиксией, воздушная эмболия (0,5%), парез возвратного нерва (0,3–14%), трахеомаляция. В позднем послеоперационном периоде могут наблюдаться гипотиреоз (10–15%), гипопаратиреоз, рецидив тиреотоксического зоба (3–12%).
Аутоиммунный тиреоидит
Аутоиммунный тиреоидит (зоб Хасимото) – заболевание, сопровождающееся лимфои плазмоцитарной инфильтрацией ткани щитовидной железы с последующим ее замещением соединительнотканными структурами.Историческая справка.
Заболевание впервые описал Xashimoto (1912) под названием "лимфоматозный зоб". Dcnith и Rout (1956) установили аутоиммунную природу тиреоидита.
Распространенность. Среди оперированных на щитовидной железе зоб Хасимото встречается в 0,911% случаев. Диагностируется преимущественно у женщин в возрасте старше 50 лет.
Этиология и патогенез.
Тиреоидит Хасимото развивается в результате генетически обусловленного дефекта системы иммунологического контроля. Часто он сочетается с неэндокринными аутоиммунными заболеваниями (ревматоидный артрит, миастения и др.). Дефект Т–супрессоров сопровождается выживанием "запрещенных" клонов Т–лимфоцитов, образующихся в организме вследствие случайной мутации. Они вступают во взаимодействие с антигенами рецепторного аппарата фолликулярного эпителия, повреждая тиреоидный эпителий. Это является пусковым моментом иммунной реакции по типу гиперчувствительности замедленного типа. В итоге происходит разрушение паренхимы щитовидной железы с замещением ее соединительной тканью и развитием гипотиреоза.
Патологическая анатомия.
Щитовидная железа увеличена, плотной консистенции. Наблюдается неравномерная лимфоплазмоцитарная инфильтрация стромы с преобладанием плазмоцитарной инфильтрации нал лимфоцитарной. Фолликулы щитовидной железы разрушены. Определяется оксифильно измененный тиреоидный эпителий (клетки Ашкенази–Гюртля – крупные клетки с оксифильной, зернистой цитоплазмой).
Клиническая картина.
Наиболее типичные признаки заболевания – равномерное увеличение щитовидной железы и ее деревянистая плотность. Тиреоидит больших размеров может сопровождаться сдавлением органов шеи, что проявляется соответствующей симптоматикой. По функциональному состоянию шитовидной железы зоб Хасимото протекает эутиреоидно, гипертиреоидно или гипотиреоидно. Снижение функциональной активности железы является закономерным исходом аутоиммунного тиреоидита. Заболевание медленно прогрессирует, периодически обостряясь, что проявляется симптомами слабовыраженного тиреотоксикоза. Иногда происходит злокачественное перерождение щитовидной железы.
Диагностика.
При пальпации щитовидная железа подвижна, безболезненна, с ровной или бугристой поверхностью. В крови находят высокие титры антител к тиреоглобулину или микросомальному антигену. У подавляющего числа больных уменьшено содержание Т3 и Т4. Повышен базальный уровень ТТГ. Снижен ответ щитовидной железы на стимулирование ТТГ (менее 15%). Сцинтиграфическое исследование выявляет мозаичность накопления радиоактивного изотопа (чередование участков пониженного содержания нуклида с нормальным). Неравномерность структуры щитовидной железы отмечается и при ультразвуковом исследовании. Большой диагностической ценностью обладает пункционная биопсия железы.
Дифференциальная диагностика.
Проводится с хроническим фиброзным тиреоидитом, подострым тиреоидитом (см. ниже), злокачественным поражением щитовидной железы.
Лечение.
Медикаментозное лечение предполагает назначение тиреоидных препаратов (тироксин, тиреоидин и др.), а при сочетании аутоиммунного тиреоидита с подострым – глюкокортикоидных гормонов (преднизолон). Тиреоидные препараты устраняют клинические проявления гипотиреоза, способствуют уменьшению размеров щитовидной железы, замедляют прогрессирование аутоиммунного процесса, тормозят повышенную тиреотропную стимуляцию щитовидной железы. Разработана методика лечения аутоиммунного тиреоидита интрамедуллярным введением стероидных гормонов пролонгированного действия (метипред, кеналог). Препараты инъецируются в дозе 2040 мг поочередно в каждую долю щитовидной железы с интервалом 6–10 дней. Курс лечения – 4–10 инъекций 1–2 раза в год. Положительное влияние на клеточный иммунитет оказывает назначение ε–аминокапроновой кислоты (1 г 2–3 раза в день в течение 100 дней), в том числе в сочетании с левамизолом, Т–активином. Это приводит к значительному снижению титра антитиреоидных антител или их исчезновению.
При развитии компрессионного синдрома, появлении в щитовидной железе зон пониженного поглощения радио* нуклида, зобе Хасимото, не поддающемся консервативному лечению, производится операция.
У больных с доброкачественным характером заболевания чаще выполняется субтотальная резекция щитовидной железы в сочетании с дои послеоперационной иммунодепрессивной терапией. При раке производится тиреоидэктомия.
Тиреотоксическая аденома (узловой токсический зоб)
Тиреотоксическая аденома (узловой токсический зоб) – заболевание, сопровождающееся образованием в щитовидной железе узла (узлов), секретирующего повышенное количество тиреоидного гормона.Распространенность.
Тиреотоксическая аденома чаще встречается у женщин 40–60–летнего возраста. Соотношение болеющих мужчин и женщин составляет 1:3–5.
Этиология и патогенез.
Причины возникновения токсической аденомы окончательно не выяснены. Не исключается значение местных нарушений нервной регуляции щитовидной железы. Характерной особенностью узлового токсического зоба является повышение продукции тиреоидных гормонов независимо от секреции ТТГ. Это сопровождается уменьшением его образования в гипофизе и снижением функциональной активности других участков щитовидной железы.
Патологическая анатомия.
Тиреотоксическая аденома представляет собой узел диаметром около2–2,5 см с гладкой поверхностью однородной структуры. Гистологически имеет микроили макрофолликулярное строение.
Клиническая картина и диагностика.
Клиническая картина токсической аденомы близка к проявлениям диффузного токсического зоба. Однако при ней больше выражены симптомы нарушения функционального состояния сердечно–сосудистой системы, отсутствуют офтальмопатия и претибиальная микседема. Пальпаторно находят эластический узел с четкими границами, гладкой поверхностью, смещаемый при глотании. При сцинтиграфии отмечается высокое накопление в узле радиоактивного йода (горячий узел) и пониженное в остальных участках ткани железы.
В крови определяются значительно повышенная концентрация Т3, умеренно повышенное или нормальное содержание Т4.
Лечение.
Показано хирургическое вмешательство – субтотальная резекция пораженной доли щитовидной железы вместе с аденомой. Операция выполняется при эутиреоидном состоянии больных.
Хронический фиброзный тиреоидит
Хронический фиброзный тиреоидит (тиреоидит Риделя) – зоб, характеризующийся увеличением щитовидной железы в результате замещения ее нормальной структуры фиброзной тканью.Историческая справка.
Хронический фиброзный тиреоидит описан Риделем в 1896 г.
Распространенность.
Тиреоидит Риделя встречается в 0,5% всех заболеваний щитовидной железы. Наблюдается преимущественно в зрелом возрасте, практически с одинаковой частотой у мужчин и женщин.
Этиология и патогенез.
Не изучены. Однако частое сочетание хронического фиброзного тиреоидита с ретроперитонеальным и медиастинальным фиброзом, склерозирующим холангитом, ретробульбарным фиброзом указывает на то, что фиброзные поражения органов различных систем могут быть симптомами одного заболевания. Не исключается развитие тиреоидита Риделя вследствие генерализации процесса, обусловленного поражением коллагена.
Патологическая анатомия.
Морфологически зоб Риделя проявляется развитием вокруг коллоидных узлов щитовидной железы мощной фиброзной соединительной ткани, обладающей выраженным инвазивным ростом. Она проникает в мышцы шеи, распространяется на стенку пищевода, трахеи, постепенно суживая их просвет. Иногда патологический процесс захватывает только одну долю.
Клиническая картина.
Проявления зоба Риделя связаны с компрессионным синдромом. Больные жалуются на общую слабость, ощущение сдавления в области шеи, одышку, изменение голоса, дисфагию. При поражении всей железы развивается гипотиреоз.
Диагностика.
Пальпаторно щитовидная железа каменистой плотности (большей, чем при раке). Уплотнение определяется и в области соседних структур. Регионарные лимфатические узлы не увеличены. На сканограммах находят "холодные узлы". При УЗИ отмечается повышение эхогенности щитовидной железы и прилежащих тканей. Постановка диагноза облегчается выполнением пункционной биопсии.
Лечение.
Так как стероидная терапия тиреоидита Риделя не приводит к улучшению состояния больных, выполняется хирургическое вмешательство.
Показаниями к нему служат: 1. развитие компрессионного синдрома; 2. невозможность исключения озлокачествления зоба.
Операция технически трудно осуществима из–за выраженных фиброзных сращений. При поражении обеих долей резецируется перешеек и освобождается трахея. В случае одностороннего процесса производится гемитиреоидэктомия.
Подострый тиреоидит (де Кервена тиреоидит)
Де Кервена тиреоидит встречается среди других заболеваний, являющихся причиной резекции щитовидной железы, в 0,3–1,7% случаев. В 4–6 раз чаще он диагностируется у женщин в возрасте 30–60 лет.Историческая справка.
Подострый тиреоидит впервые описан де Кервеном в 1904 г.
Этиология и патогенез.
Развитие тиреоидита де Кервена связывается с вирусной инфекцией. В пользу этого утверждения свидетельствуют частое развитие тиреоидита после респираторной вирусной инфекции или на ее фоне, а также наличие отчетливых продромальных признаков заболевания (недомогание, утомляемость, мышечные боли). В результате воспалительного процесса в щитовидной железе происходит деструкция фолликулярных клеток с разрушением их мембран и фолликулов. Это сопровождается поступлением в кровь тиреоглобулина, являющегося антигеном, с последующим образованием аутоантител. Одновременно в крови повышается концентрация Т3 и Т4. При купировании явлений воспаления и прекращении поступления в кровь тиреоглобулина аутоиммунный процесс прекращается.
Патологическая анатомия.
Щитовидная железа умеренно увеличена. Слабо выражена воспалительная реакция ткани и капсулы железы. Гистологически в участках воспаления находят десквамацию и дегенерацию тиреоидных клеток, запустение фолликулов. В строме железы и вокруг разрушенных фолликулов определяется полиморфнои круглоклеточная инфильтрация.
Клиническая картина.
В течении подострого тиреоидита выделяют четыре стадии:
Iраннюю тиреотоксическую (с клиникой гиперфункции железы);
IIпереходную (без клинических проявлений нарушения функции);
IIIвременного гипотиреоза;
IVвосстановительную (с нормализацией функции железы).
Продолжительность клинических стадий определяется степенью поражения железы и реактивностью организма. Обычно заболевание длится 2–5 мес. Как правило, тиреоидит де Кервена развивается остро и сопровождается повышением температуры тела (до 40°С), ознобом, головной болью, слабостью и т.д. Одновременно наблюдаются симптомы тиреотоксикоза: плаксивость, раздражительность, повышенная потливость, тахикардия. Щитовидная железа увеличивается, становится резко болезненной при пальпации. Боль иррадиирует в нижнюю челюсть, ухо, затылок, усиливается при глотании и кашле. Постепенно вследствие разрушения ткани железы появляются симптомы гипотиреоза, который наблюдается несколько месяцев. При значительной деструкции гипотиреоз может быть стойким.
Диагностика.
В острой стадии тиреоидита де Кервена находят значительное повышение СОЭ (до 6080 мл/ч) при нормальном лейкоцитозе и лейкоцитарной формуле. В ранней стадии заболевания концентрация в крови Т3, Т4 повышена. Накопление 1311 в щитовидной железе понижено. При стихании воспалительного процесса накопительная функция железы нормализуется. Через 23 недели после начала заболевания в крови обнаруживаются антитела к тиреоглобулину.
Дифференциальная диагностика.
Проводится с острым гнойным тиреоидитом, кровоизлияниями в узловой зоб, острым гнойным медиастинитом, токсическим зобом.
Острый гнойный тиреоидит (струмит) начинается остро, сопровождается гипертермией, выраженными симптомами гнойной интоксикации. Щитовидная железа равномерно увеличивается, пальпаторно резко болезненна. Кожа над железой гиперемирована, отечна. Постепенно появляются очаги флюктуации. Иногда сформировавшийся абсцесс опорожняется наружу.
Кровоизлияния в зоб возникают при травмах области шеи, кашле и т.д. В зобе появляются сильные боли. Ранее существовавший узел увеличивается, становится более плотным. При обширных кровоизлияниях развивается симптом компрессии органов шеи.
При остром гнойном медиастините боли локализуются за грудиной, сопровождаются выраженной интоксикацией, гипертермией. Симптом Герке положительный. На обзорной рентгенограмме грудной клетки находят расширение тени средостения и неровность его контуров, эмфизему.
Для токсического зоба характерно отсутствие признаков воспаления. Определяются глазные симптомы тиреотоксикоза. Увеличено поглощение радионуклида в щитовидной железе.
Лечение.
Проводится консервативное лечение. Назначаются противовоспалительные препараты (ацетилсалициловая кислота, индометацин, метиндол). Весьма эффективно применение глюкокортикоидов. Гормонотерапию начинают с большой дозы (преднизолон – 30–40 мг/с), которую постепенно снижают в течение месяца. При сопутствующем тиреотоксикозе используют адреноблокаторы.
Гиперпаратиреоз
Анатомо–физиологические сведения о паращитовидной железе
В организме человека присутствуют обычно четыре о коло щитовидные железы. Они имеют овальную или круглую форму. Их масса 2040 мг. Средние размеры составляют 6х3х1,5 мм, У лиц молодого возраста цвет околощитовидных желез розовый с коричневым оттенком. При старении из–за отложения жира они становятся желто–коричневыми. Околощитовидные железы располагаются на задней поверхности капсулы шитовидной железы попарно на каждой ее доле. Может наблюдаться и эктопия железы, в том числе смешение в переднее или заднее средостение. Верхние околощитовидные железы характеризуются более постоянной локализацией: задняя поверхность краниального полюса соответствующей доли щитовидной железы на уровне перстневидного хряща, выше места прохождения возвратного нерва в гортань. Нижние околощитовидные железы располагаются позади каудального полюса щитовидной железы.
Артериальное кровоснабжение нижних околощитовидных желез обеспечивается аа. thyreoideae inf. В ⅔ случаев питание нижних околощитовидных желез также осуществляется этой артерией, а в ⅓ наблюдений аа. thyreoidea sup. В паренхиме железы артерии разветвляются и заканчиваются синусами, которые непосредственно контактируют с эндокринными клетками.
Венозный отток происходит в поверхностную сеть, а оттуда – в непарную околощитовидную вену.
Лимфатические сосуды желез впадают в v. jugularis int. В иннервации околощитовидных желез участвуют шейные симпатические волокна, nn. recurentes и периваскулярная нервная сеть.
Околощитовидные железы покрыты соединительнотканной капсулой, от которой в глубь паренхимы вместе с кровеносными и нервными веточками отходят тяжи. Однако они не делят ее на дольки.
Основными компонентами паренхимы железы являются эпителиальные эндокринные клетки паратироциты – главные (светлые и темные) и оксифильные.
Околощитовидные железы продуцируют паратгормон, который является регулятором обмена кальция и фосфора в организме. При недостаточном поступлении кальция с пищей или нарушении его резорбции в кишечнике синтез паратгормона увеличивается, что сопровождается вымыванием солей кальция из костной ткани, повышением канальциевой реабсорбции кальция и уменьшением реабсорбции фосфатов.
Историческая справка
Впервые гиперпаратиреоз описал Recklinghausen (1891). Askanazy (1904) предположил о связи отмеченных клинических проявлений с изменениями в околощитовидных железах. А, В, Русаков (1924) теоретически обосновал необходимость хирургического удаления паратиреоидной аденомы, a Mandl (1925) впервые выполнил такую операцию.
Распространенность.
Гиперпаратиреоз в подавляющем числе наблюдений встречается в возрасте 20–50 лет. В 2 раза чаще болеют женщины.
Этиология.
Причинами возникновения гиперпаратиреоза являются одиночные (85%) и множественные (3–5%) аденомы околощитовидных желез, первичная гиперплазия всех четырех желез (10%), рак околощитовидной железы (1–2%).
Патогенез.
Гиперсекреция паратгормона приводит к усилению активности остеокластов, что находит отражение в выделении ими лимонной кислоты. Она вытесняет из кости фосфор и образует с ионами кальция растворимые соединения, легко проникающие в кровь. Костная ткань, утратившая кальций и фосфор, подвергается разрушениям. В измененных участках происходят кистозная дегенерация, деформация кости, возникают патологические переломы. Одновременно угнетаются реабсорбция фосфора в проксимальных и усиливается его экскреция из дистальных отделов нефрона. Это приводит к повышению концентрации фосфора в моче и уменьшению в крови. Для компенсации гипофосфатемии неорганические соли фосфора вымываются из костей в кровь. Выделение кальция из организма, наоборот, замедляется. Его концентрация в крови, а затем в моче увеличивается, что сопровождается снижением нервно–мышечной возбудимости, образованием камней в почечных лоханках (нефрокалькулез) и в интерстициальной ткани почек (нефрокальциноз). Одновременно тормозится действие антидиуретического гормона на почечные канальцы. Постепенно развиваются полиурия и полидипсия.
Патологическая анатомия.
Аденомы околощитовидных желез представляют собой овальные или округлые образования мягкой консистенции, окруженные капсулой. Длина аденом достигает 8 см, цвет коричневатооранжевый. Иногда аденомы подвергаются обызвествлению, кистозной дегенерации. Нередко в них находят очаги кровоизлияний и отложения холестерина. Микроскопически аденомы образованы всеми тремя видами клеток околощитовидной железы.
Гиперплазия захватывает все четыре железы, приводя нередко к значительному увеличению их массы.
При раке околощитовидной железы находят плотное опухолевидное образование, сращенное с окружающими тканями. Рак железы метастазирует в печень и легкие. Почти 50% метастатических опухолей являются секретирующими.
Из–за диффузной деминерализации истончается и подвергается поднадкостничному разрушению корковый слой длинных трубчатых костей. В разных частях скелета, чаще на границе между метадиафизарной и эпифизарной частями кости, образуются кисты, содержащие гемосидерин. Трубчатые кости утолщаются, искривляются, часто подвергаются патологическим переломам. Соли кальция откладываются в почках, миокарде, легких, желудочно–кишечном тракте.
Классификация.
Гиперпаратиреоз классифицируется по формам и клиническому течению.
По формам выделяют (О. В. Николаев, В. Н. Тараканова, 1974); 1. Первичный гиперпаратиреоз: ■ висцеропатическая форма (70–75%): с преимущественным поражением паренхимы почек (50–65%), желудочно–кишечного тракта (30–40%), неврологической и психической сфер (5–20%); ■ костная форма (10–12%): фиброзно–кистозный остеит; педжетоидная форма; ■ смешанная форма (15–17%). 2. Вторичный гиперпаратиреоз (обусловлен гиперплазией щитовидной железы в результате нарушения функции клубочков почек или резорбционной способностью кишечника): ■ почечная форма: почечный рахит, тубулопатия; ■ кишечная форма. 3. Третичный гиперпаратиреоз (развивается на фоне длительно существующего вторичного гиперпаратиреоза и связан с компенсаторной гиперплазией щитовидной железы). 4. Гормонально–неактивная опухоль.
По клиническому течению различают хронический и острый гиперпаратиреоз.
В практике хирургов наиболее часто встречается первичный гиперпаратиреоз.
Первичный гиперпаратиреоз (болезнь Реклингхаузена, генерализованная фиброзно–кистозная остеодистрофия) – эндокринно–метаболитное заболевание, обусловленное повышением продукции паратгормона гормонально–активной опухолью или гиперплазированной околощитовидной железой.
Клиническая картина.
Ранние признаки хронического гиперпаратиреоза неспецифичны. Больные жалуются на быструю утомляемость, слабость, отсутствие аппетита, тошноту, беспричинные рвоты, запоры или поносы, похудание. Отмечается повышенная возбудимость. Иногда рано появляются полиурия и полидипсия.
Для костной формы гиперпаратиреоза характерны боли в костях и суставах конечностей, в позвоночнике. Первоначально болевой синдром возникает только при физической нагрузке, но затем становится постоянным, волнообразным, приводя к полному обездвижению больного. Вследствие остеопороза тел позвонков, деформации длинных трубчатых костей уменьшается рост пациентов. Появляется своеобразная раскачивающаяся (утиная) походка.
Наблюдается выпадение внешне здоровых зубов. При остеопорозе с полным или частичным сплющиванием тел позвонков формируются кифоз и сколиоз. Часты длительно не заживающие переломы, нередко приводящие к образованию ложных суставов. При пальпации костей могут прощупываться кисты. Перкуссия кистозно–измененных костей черепа сопровождается тимпанитом. Ранним симптомом заболевания является расплавление дистальной части третьей фаланги.
При почечной форме гиперпаратиреоза наиболее часто наблюдаются типичные признаки мочекаменной болезни (почечные колики, гематурия, частое присоединение вторичной инфекции мочевых путей). Отличительными особенностями паратиреоидного нефролитиаза являются поражение обеих почек, упорное рецидивирование. Камни состоят из фосфата и оксалата кальция. В моче находят форменные элементы и слабую альбуминурию.
Наиболее характерным проявлением желудочнокишечной формы гиперпаратиреоза является развитие гастродуоденальных язв и панкреатита.
Язвообразование при гиперпаратиреозе отмечается у 15–18% больных, в основном у женщин. Язвенные дефекты чаще локализуются в двенадцатиперстной кишке. Это связано со щелочной реакцией секрета двенадцатиперстной кишки, способствующей отложению солей кальция в ее стенке. Обызвествленные участки кишечной стенки под влиянием ферментов поджелудочной железы и соляной кислоты легко изъязвляются. Важная роль в возникновении язв принадлежит и увеличению вследствие гиперкальциемии секреции гастрина, усиливающего кислотопродукцию. Язвы с трудом поддаются медикаментозному лечению. Назначение молочной диеты, щелочей значительно ухудшает состояние больных. После резекции желудка язвы быстро рецидивируют.
Гиперпаратиреоз, сочетающийся спанкреатитом, встречается у 7–12% больных. В одних случаях он протекает в виде острого интерстициального или геморрагического панкреатита, в других – в хронической форме (панкреатолитиаза или кальцификатов в поджелудочной железе).
Поражение нервной системы при гиперпаратиреозе проявляется симптомами сдавления спинного мозга и его корешков (боли, парезы, нарушение функции тазовых органов), расстройством психики.
Обызвествление сердечной мышцы приводит к нарушению ритма сердечной деятельности, инфаркту миокарда.
Возможны отложение солей в суставах (хондрокальциноз), в капсулу роговицы глаза (осумкованный кератит), в кожу (некроз кожи), кальцификация ушных раковин.
Течение хронического гиперпаратиреоза у 6–10% больных осложняется гиперкальциемическим кризом. Обострению заболевания способствуют инфекции, интоксикации, беременность, спонтанные переломы костей, обезвоживание, хирургические вмешательства на почках и мочевыводящих путях и т.д. Перечисленные неблагоприятные факторы приводят к избыточной продукции паратгормона, что сопровождается резким увеличением в крови концентрации кальция (до 3,5–4,25 ммоль/л). Криз развивается внезапно или постепенно и сопровождается выраженной клинической симптоматикой: гипертермией, тошнотой, неукротимой рвотой, не связанной с приемом пищи, суставными и мышечными болями, резкой мышечной слабостью, спастическими болями в животе. Нередко возникают желудочно–кишечные кровотечения, перфорации язв, острый панкреатит, острая массивная метастатическая кальцификация легких, мозга, миокарда с образованием в них очагов некроза.
Исходом происходящих процессов является развитие острой почечной и сердечно–сосудистой недостаточности, нарушение функции органов дыхания (отек легких). Наблюдаются психозы, эпиприпадки, тромбозы магистральных сосудов. Нередко гиперпаратиреозные кризы заканчиваются гибелью больных.
Диагностика.
Гиперпаратиреоз сопровождается гиперкальциемией, гипофосфатемией, увеличением активности щелочной фосфатазы, повышением концентрации паратгормона, щелочной реакцией мочи и снижением ее относительной плотности, гиперфосфатурией и гиперкальциурией. В моче находят гиалиновые и зернистые цилиндры. Диагноз уточняется определением каналъциевой реабсорбции фосфора и артериовенозной разницы в содержании кальция, проведением нагрузочной пробы с 5% раствором натрия хлорида.
При гиперпаратиреозе канальциевая реабсорбция фосфора колеблется в пределах 82–92% (у здоровых – 26–78%). Содержание кальция в артериальной крови на 3–10% превышает его концентрацию в венозной. Во время нагрузочной пробы с 5% раствором натрия хлорида препарат вводится внутривенно (0,125 мл на 1 кг массы тела в 1 мин) в течение 45 мин. До и после пробы в суточном объеме мочи определяют содержание кальция. Концентрация кальция в моче у больных гиперпаратиреозом повышена.
Типичные рентгенологические признаки заболевания находятся при рентгенографии черепа, длинных трубчатых костей. Выполняются УЗИ околощитовидных желез, пневмомедиастинография, пневмопаратиреография в сочетании с эзофагографией, сканирование околощитовидных желез с помощью 75Se, метионина, компьютерная томография, селективная артериография.
Дифференциальная диагностика.
Проводится с миеломной болезнью, болезнью Педжета, фиброзной дисплазией, кишечной остеодистрофией, почечнокаменной болезнью, гормональной спондилопатией, язвенной болезнью, панкреатитом.
У больных миеломной болезнью в пунктате костного мозга и реже в периферической крови находят миеломные клетки. В крови – гиперпротеинемия, нормальное содержание щелочной фосфатазы. В моче – белок Бенс–Джонса. При рентгенографии черепа определяются круглые отверстия в костях.
Болезнь Педжета встречается в пожилом возрасте. Характеризуется кистозными изменениями костей с гиперостозом и остеосклерозом. В сыворотке крови нормальный уровень фосфора и повышено содержание щелочной фосфатазы. Концентрационная способность почек сохранена. Нет системного остеопороза.
Фиброзная дисплазия наблюдается у детей и юношей. Часто сочетается с ранним половым созреванием и появлением пигментных пятен цвета кофе с молоком на коже. Отсутствуют изменения в содержании 17–КС, 17–ОКС, системный остеопороз, нефрокалькулез.
При кишечной остеодистрофии, сопровождающейся нарушением всасывания кальция, в анамнезе больных есть указания на перенесенные гастроэнтероколит, хронический панкреатит, спру. Содержание кальция в сыворотке крови и моче нормальное, концентрация кальция в венозной крови превышает его уровень в артериальной.
Гормональная спондилопатия относится к заболеваниям постклимактерического периода. Сопровождается локальным остеопорозом, чаще в поясничном, грудном, реже – шейном отделах позвоночника. Отсутствует гиперфосфатемия. Активность щелочной фосфатазы нормальная.
Для дифференциальной диагностики гиперпаратиреоза применяют пробы с гидрокортизоном, тиазидовыми диуретиками и ингибиторами синтеза простогландинов.
Проба с гидрокортизоном предполагает назначение препарата по 100–200 мг в сутки в течение 10 дней. При гиперпаратиреозе содержание кальция в сыворотке крови оказывается повышенным. У больных с гиперкальциемией, обусловленной миеломной болезнью, метастазами злокачественных опухолей в кости, избыточным поступлением в организм витамина D, концентрация кальция нормализуется.
Проба с тиазидовыми диуретиками: прием 1–2 г в день соответствующего диуретика приводит к подъему концентрации кальция в сыворотке крови выше 2,62 ммоль/л. У здоровых она остается в пределах нормы.
Проба с ингибиторами синтеза простогландинов: при вторичной гиперкальциемии, обусловленной метастазированием злокачественной опухоли в кости, назначение ацетилсалициловой кислоты (2–4 г в сутки) или лизолецитина (75–150 мг в сутки) в течение 7 дней приводит к нормализации содержания кальция в сыворотке крови.
Лечение.
Операция является радикальным и эффективным методом лечения при гиперпаратиреозе. Она должна выполняться до развития необратимых деструктивных изменений в почках и других органах. В предоперационном периоде проводится симптоматическое лечение гиперкальциемии (форсированный диурез, внутривенная инфузия растворов фосфатов, назначение глюкокортикоидов, санация мочевыводящих путей и т.д.). Для повышения абсорбции кальция в кишечнике за 2–3 ч до операции назначается витамин D2. Он препятствует резкому понижению содержания кальция в крови в послеоперационном периоде.
Железа обнажается из классического разреза по Кохеру. Во время операции производится тщательная ревизия всех четырех околощитовидных желез. Поиск желез облегчается интраоперационным окрашиванием ткани метиленовым синим или толуидиновым синим. Достаточно часто находят увеличение диаметра нижней щитовидной артерии на стороне аденомы, аномальные ветви артерий к эктопированным и добавочным железам. Гиперплазированная или аденоматозно–измененная железа удаляется. В случае увеличения всех четырех желез удаляют три железы, а четвертую резецируют субтотально (оставляя 70–100 мг). Допустима экстирпация всех четырех желез, но с обязательной аутотрансплантацией паратиреоидной ткани. Пересадка может проводиться в два этапа. Первоначально удаленные железы замораживаются, а затем определенная часть железы пересаживается в мышцу предплечья.
После удаления пораженных околощитовидных желез содержание кальция в сыворотке крови нормализуется в течение первых 2 суток. У прооперированных больных постоянно контролируют ЭКГ, определяют 2 раза в сутки содержание кальция в крови. При гипокальциемии назначают препараты кальция (кальция глюконат – до 1 г в день). Достаточно часто течение послеоперационного периода осложняется возникновением на 2–3–и сутки различной степени выраженности тетании. Она проявляется тоническими судорогами мышц конечностей и передней брюшной стенки, ларингоспазмом. Развитие тетании связано с быстрым поглощением кальция и фосфатов костями (синдром "голодных костей"). Для профилактики и лечения тетании назначаются препараты кальция, массивные дозы витамина D, молочная диета с высоким содержанием кальция и низким фосфора. Кроме тетании, паратиреоидэктомия может осложняться повреждением возвратных нервов, острой почечной недостаточностью, острым панкреатитом. Их лечение осуществляется по общепринятым схемам.
Состояние прооперированных больных значительно улучшается. Исчезают боли в костях. Постепенно структура кости восстанавливается. Быстро заживают гастродуоденальные язвы. Отсутствуют рецидивы камнеобразования в почках.
Феохромоцитома
Феохромоцитома – опухоль из мозгового слоя надпочечников или хромаффинной ткани в области вегетативных нервных сплетений, продуцирующая повышенное количество катехоламинов, что приводит к развитию злокачественной гипертонии.Анатомо–физиологические сведения о надпочечниках
Надпочечники – небольшие парные органы внутренней секреции, расположенные забрюшинно над верхними полюсами почек на уровне XI–XII грудных позвонков. Масса надпочечников колеблется от 4 до 8 г. Длина желез составляет 4,5 см, ширина – 3 см, толщина – 0,6 см. Форма правого надпочечника треугольная. Левый надпочечник имеет форму полумесяца. Правый надпочечник граничит с диафрагмой, печенью, нижней полой веной. Левый надпочечник соприкасается с хвостом поджелудочной железы, селезеночными сосудами. Снаружи надпочечники окружены соединительнотканной капсулой, к внутренней поверхности которой прилежит субкапсулярный слой. Железистая ткань надпочечников представлена наружным корковым веществом и внутренним мозговым. Корковое вещество состоит из трех зон: внешней клубочковой, расположенной над субкапсулярным слоем, пучковой и сетчатой, прилежащей к мозговому веществу, Мозговое вещество составляет 1/10 часть коркового слоя, образовано хромаффинными (феохромными) клетками.
Артериальное кровоснабжение надпочечников осуществляется по шести артериальным стволам, отходящим от аорты a.renalis, a.phrenica inf., a,mesenteries sup., a.capsularis renis, a supra renalis dorsalis. Выделяют два типа артериальных сосудов. Одни из них после прободения капсулы образуют в корковом слое выраженную сеть капилляров, не достигающую мозгового слоя. Другие артерии проникают через корковый слой, не разветвляясь, формируя сеть капилляров только в мозговом слое. За I мин через 1 г надпочечниковой ткани протекает 6 мл крови.
Отток венозной крови от коркового и мозговых слоев надпочечников происходит по отдельным венозным системам. Так, венозная кровь от коркового слоя поступает в поверхностную венозную сеть коры, а затем в диафрагмальные, почечные и нижнюю полую вены. Венозная кровь из мозгового слоя оттекает через центральную вену надпочечников в нижнюю полую вену и через особые вены проходит через корковое вещество в вены воротной системы. Между венозными сетями коркового и мозгового слоев существует множество анастомозов.
Лимфа истекает из надпочечников по двум отдельным сетям, сопровождающим одноименные венозные сети. Для правого надпочечника регионарными являются лимфатические узлы, расположенные по ходу нижней полой вены, а для левого надпочечника – около аорты.
Иннервацию надпочечников обеспечивают ветви n. splanchnicus major и pfexus coeltacus, которые образуют в ткани надпочечников обильную нервную сеть. Последняя более выражена в мозговом слое, чем в корковом.
В корковом веществе надпочечников образуются глкжокортикоиды (кортизол, кортикостерои), минералокортикоиды (альдостерон) и половые гормоны (тестостерон, эстрадиол). Кортизол принимает участие в регуляции углеводного, белкового и жирового обменов; обеспечивает транспорт глюкозы в скелетных мышцах, адаптацию организма к стрессу; усиливает глюконсогснез из белков и жира; обладает сильным противовоспалительным и антиаллергическим действием. Альдостерон регулирует реабсорбцию ионов натрия в почечных канальцах, усиливает выведение ионов калия. Тестостерон, эстрадиол регулируют развитие вторичных половых признаков, обеспечивают репродуктивную функцию.
Клетки мозгового вещества надпочечников продуцируют адреналин и норадреналин, дофамин (предшественник норадреналина). Адреналин оказывает сильное сосудорасширяющее действие, повышая артериальное давление в основном за счет систолического; усиливает сердечные сокращения, ускоряет пульс; вызывает расслабление гладкой мускулатуры кишечника, бронхов, сокращение мышц матки и селезенки; усиливает гликогенолиз, липолиз, продукцию А.КТГ: принимает участие в пигментном обмене; повышает чувствительность шитовидной железы к влиянию ТТГ. Норадреналин вызывает спазм артерий мышц, что приводит к повышению диастолического давления.
Историческая справка. В 1886 г. Frankel впервые описал двустороннюю опухоль мозгового вещества надпочечников у больной, страдавшей приступами гипертонии. Rick (1912) ввел термин "феохромоцитома". Vaguez и Donzelot (1926) впервые поставили диагноз фсохромоцитомы клинически, В 1926 г. Коих успешно удалил феохромоцитому.
Распространенность. Феохромоцитома встречается в 1–3% случаев. Одинаково часто заболеванием страдают мужчины и женщины в основном в возрасте 2040 лет. Описаны наблюдения феохромоцитомы у детей и пожилых людей.
Этиология.
До конца не изучена. Установлена генетическая предрасположенность к развитию опухоли: ее аутосомно–доминантный тип наследования.
Патогенез.
В основе клинических проявлений феохромоцитомы лежит продукция хромаффинными клетками опухоли катехоламинов (адреналин, норадреналин). Их образование в организме может происходить с различной интенсивностью, что приводит к преобладанию дейст вия одного гормона над другим. Так, чрезмерное повышение содержания адреналина сопровождается психоэмоциональным возбуждением, тахикардией, расширением зрачков, гипергликемией и глюкозурией, резким снижением периферического сосудистого сопротивления вплоть до развития коллапса. При гипернорадреналинемии наблюдаются потливость, брадикардия, увеличивается основной обмен. Однако главным следствием повышенного образования гормонов мозгового вещества надпочечников является развитие гипертензии. В ее генезе лежит не только непосредственное влияние катехоламинов на регуляцию сосудистого тонуса, но и повышение под действием катехоламинов активности ренинангиотензинальдостероновой системы. Не исключается и влияние снижения у больных с феохромоцитомой порога возбудимости нервной системы.
Патологическая анатомия.
В 90% случаев феохромоцитома развивается из хромаффинной ткани мозгового вещества надпочечников, в 2 раза чаще располагается в правом надпочечнике, у 9% больных возникает в обеих железах. Макроскопически опухоль имеет вид плотного или кистозного инкапсулированного, хорошо васкуляризированного образования округлой формы. Диаметр некоторых опухолей превышает 15 см. На разрезе феохромоцитома имеет коричневый цвет. Нередко отмечаются очаги кровоизлияния. Микроскопически опухоль образована полигональными, неправильной формы и разных размеров хромаффинными клетками.
В 10% случаев феохромоцитома исходит из хромаффинных клеток симпатических ганглиев и параганглиев, что является причиной ее обнаружения в области бифуркации брюшной аорты, в стенке мочевого пузыря, по верхнему краю поджелудочной железы, в хилюсе почек, в заднематочном пространстве, в грудной клетке по ходу симпатической ганглионарной цепи и в стенке пищевода, в вилочковой железе, в головном мозге. Для обозначения феохромоцитом вне надпочечниковой локализации предложен термин "параганглиома". Структура параганглиев идентична строению опухолей надпочечниковой локализации.
10% феохромоцитом, особенно двусторонней надпочечниковой и вненадпочечниковой локализации, являются злокачественными, нередко метастазируют.
Классификация.
В зависимости от характера клинического течения выделяют три формы феохромоцитом: адреналосимпатическую (пароксизмальную), постоянную (постоянно повышено АД, кризы отсутствуют) и бессимптомную.
Клиническая картина.
Пароксизмальная форма гипертоний наблюдается в 25–30% случаев. Она характеризуется быстрым повышением систолического АД до 300–350 мм рт. ст. и более. Диастолическое давление достигает 150 мм рт. ст. Развитие приступа связано с внезапным выбросом катехоламинов (преимущественно адреналина) из опухоли в кровь. Этому способствуют физические и эмоциональные нагрузки, обильная еда, пальпация опухоли, изменение положения тела.
У некоторых больных могут наблюдаться предвестники криза в виде недомогания, ползания мурашек по коже, судорог конечностей, боли в области сердца с иррадиацией в левую руку. Во время криза пациенты обычно возбуждены, испытывают чувство страха, жалуются на головные боли, боли в области сердца. Кожные покровы и видимые слизистые бледные, холодные. Зрачки расширены. Отмечаются нарушение слуха и зрения (вплоть до появления слуховой и зрительной галлюцинации), рвота, икота, слюнотечение, схваткообразные боли в животе. В тяжелых случаях расстраивается речь, появляются эпилептиформные судороги, нарушается ритм сердечной деятельности.
Во время приступа пульс учащается до 120–160 ударов в минуту, но у 20–25% больных отмечается брадикардия, обусловленная рефлекторным раздражением блуждающих нервов. Температура тела поднимается до 42°С. В основе гипертермии лежит повышение теплопродукции из–за развивающегося гиперкатаболизма и замедления выведения пота. В крови находят лейкоцитоз, эозинофилию, лимфоцитоз, глюкозурию. В моче определяют глюкозурию, альбуминурию.
В начале заболевания гипертонические кризы возникают редко, длятся 10–20 мин. Постепенно они становятся более частыми, появляются несколько раз в день.
Приступ пароксизмальной гипертонии заканчивается внезапно или постепенно, что сопровождается покраснением кожных покровов, обильным потоотделением, выделением большого количества мочи с низкой относительной плотностью. В течение ближайших 1–2 ч больные адинамичны, жалуются на слабость, утомление. Нередко течение криза осложняется кровоизлияниями в мозг, в сетчатку глаз, отеком легких, инфарктом миокарда и т.д. Иногда наблюдается состояние неуправляемой гемодинамики, характеризующееся резкой сменой гипертонии гипотонией, или сохраняется стойкая гипертензия, не купирующаяся консервативными мероприятиями.
Развитие феохромоцитомы с постоянной гипертонией связано с преимущественной секрецией опухолью норадреналина. Такая форма встречается в 60–70% случаев, в основном улиц молодого возраста. Клинически заболевание ничем не отличается от эссенсиальной гипертонической болезни, характеризуется устойчивостью к консервативному лечению, нередко осложняется сахарным диабетом, болезнями почек, сердечно–сосудистой системы. Больные бледные, пониженного питания. У них отмечаются постоянный субфебрилитет, повышенная СОЭ, тахикардия и, что особенно важно, обильное, непродолжительное (несколько минут) потоотделение после еды, психоэмоциональных нагрузок.
При бессимптомной форме феохромоцитомы опухоль не обладает гормональной активностью. Вместе с тем вследствие повышенной чувствительности больных к стрессам у них нередко развивается шок или острая надпочечниковая недостаточность.
Течение феохромоцитомы неблагоприятное. Продолжительность жизни больных без лечения колеблется от 3 до 5 лет.
Диагностика.
В пользу феохромоцитомы свидетельствует повышенное содержание катехоламинов в крови и в моче и их метаболитов (ванилилминдальной кислоты) в моче. У здоровых за сутки с мочой выделяется 10+5 мг адреналина, 40+20 мг норадреналина, 1,5–6 мг ванилилминдальной кислоты. Информативно проведение фармакологических проб, основанных на стимуляции хромаффинных клеток, т.е. провоцирующих гипертонический криз (гистаминовая, тираминовая пробы), или на ингибировании действия катехоламинов (проба с тропафеном, регитином).
Гистаминовая проба основана на способности гистамина провоцировать обильную секрецию катехоламинов феохромоцитомой, расширяя сосуды хромаффинной опухоли. Гистамин вводится в дозе 0,05 мг в изотоническом растворе натрия хлорида внутривенно или 0,5–1 мг подкожно. Затем ежеминутно определяется АД в течение 15 мин. В пользу феохромоцитомы свидетельствует повышение АД выше исходного на 60–80 мм рт. ст. Проба может осложниться развитием тяжелого гипертонического криза. Для его быстрого купирования применяется регитин. При эссенциальной гипертонии АД увеличивается незначительно (до 10 мм рт. ст.).
Проба с тирамином более безопасна для больного с феохромоцитомой. В основе теста лежит способность тирамина высвобождать норадреналин из хромаффинных клеток опухоли. Препарат вводится внутривенно в дозе 1.000 мкг. Проба считается положительной при повышении систолического АД в первые 3 мин в среднем на 40 мм рт. ст. У лиц с эссенциальной гипертонией и у здоровых АД не изменяется.
При проведении теста с тропафеном и регитином (фентоламином) происходит блокирование влияния катехоламинов, что сопровождается значительным снижением АД. Проба с тропафеном применяется в обследовании больного при исходном АД более 160/100 мм рт. ст., а с регитином – если выше 170/110 мм рт. ст. Препарат вводится быстро внутривенно или внутримышечно (тропафен – 10 мг, детям – 5 мг; регитин – 5 мг, детям – 1 мг), после чего через каждую минуту измеряется АД, а через каждые 2 мин пульс. Проба расценивается как положительная при понижении систолического АД на 2–3–й минуте более чем на 40 мм рт. ст., а диастолического – на 30 мм рт. ст.
Феохромоцитома может быть обнаружена при ультразвуковом исследовании, компьютерной томографии, селективной артериографии, нижней каваграфии, внутривенной пиелографии, сцинтиграфии с внутривенным введением метоитодбензилгуанидина, меченного 131, пробной лапаротомии. Локализация опухоли уточняется по определению показателей катехоламинов в крови, взятой на различных уровнях системы нижней и верхней полых вен
Дифференциальная диагностика.
Проводится с гипертонической болезнью, вазоренальной гипертонией, токсическим зобом и сахарным диабетом, сочетающимся с гипертонией, гипоталамическими вегетососудистыми кризами.
При гипертонической болезни кризы протекают с менее выраженной симптоматикой. В крови и моче находят нормальное содержание катехоламинов, а в моче – и их метаболитов. В пользу эссенциальной гипертонии свидетельствуют результаты фармакологической пробы с клофе – лином (прием внутрь 0,3 мг клофелина не сопровождается повышением уровня катехоламинов в плазме через 3 ч) и положительный эффект от обычной гипотензивной терапии.
У лиц с вазоренальной гипертензией при ангиографии выявляют стеноз почечных артерий.
Для токсического зоба характерны наличие триады типичных симптомов тиреотоксикоза (Дальримпля, Штелльвага, Грефе и др.); увеличение только систолического давления при нормальном или сниженном диастолическом; отсутствие гипертонических кризов; повышенное накопление 131I тканью щитовидной железы.
У больных сахарным диабетом, сопровождающимся гипертонией, находят гликемию, глюкозурию, нормальную суточную экскрецию катехоламинов и их метаболитов.
Гипоталамические вегетососудистые кризы чаще развиваются у женщин, перенесших черепно–мозговую травму, инфекции, интоксикации. Концентрация катехоламинов в крови, экскреция с мочой не изменены или незначительно повышены.
Лечение.
Единственным радикальным способом лечения больных феохромоцитомой является удаление опухоли. Медикаментозная терапия проводится для купирования кризов и в качестве предоперационной подготовки. Применяют α–адреноблокаторы (фентоламина гидрохлорид, тропафен и др.), β–адреноблокаторы (обзидан, индерал и др.), барбитураты, транквилизаторы и т.д. Назначается высококалорийная, богатая витаминами и углеводами пища.
Операция в большинстве случаев проводится в плановом порядке. Однако при некупируемом в течение 3 ч состоянии, неуправляемой гемодинамике хирургическое вмешательство выполняется экстренно. При выборе средств для наркоза учитывается их влияние на секрецию катехоламинов и функцию миокарда. Для обнажения феохромоцитомы используют люмботомию с субпериостальной резекцией X–XII ребер, внутрибрюшинный (срединный и поперечный), чрездиафрагмальный внеплевральный и чрезгрудинный чрездиафрагмальный доступы. Перед удалением феохромоцитомы перевязывается центральная надпочечниковая вена, что является профилактикой развития в ходе операции гипертонического криза, связанного с выбросом из опухоли во время манипуляций с нею катехоламинов. При небольших доброкачественных опухолях производится их энуклеация. При локализации опухоли в одном из полюсов железы выполняется частичная резекция надпочечников, при большой феохромоцитоме, поражающей весь надпочечник, показана тотальная адреналэктомия. В случае злокачественной феохромоцитомы и прорастания ею окружающих органов объем операции расширяется в зависимости от распространения процесса.
Инсулома
Инсулома – гормонсекретируюшая (гормонально–активная) опухоль, происходящая из клеток поджелудочной железы и сопровождающаяся избыточным выделением инсулина. Некоторые из указанных опухолей, помимо инсулина, продуцируют панкреатический полипептид, гастрин, глюкагон, соматостатин, 5–гидрокситриптамин, АКТГ.Историческая справка.
В 1902 г. Nichoils привел первое описание обнаруженной на аутопсии инсуломы. Valder и Wilder (1927) установили диагноз заболевания прижизненно. Grem (1929) впервые успешно удалил опухоль.
Распространенность. Инсулома составляет 70–75% всех гормонально–активных опухолей поджелудочной железы. Она наблюдается преимущественно у женщин в 50–60–летнем возрасте.
Патологическая анатомия.
Инсуломы в 80–95% случаев локализуются в поджелудочной железе или в ее эктопированных участках. Чаще они представлены солитарными узлами диаметром 1–2 см (90%), реже диффузной гиперплазией островков (6%).
Патогенез.
Избыточная продукция инсулина опухолью клеток поджелудочной железы приводит к падению интенсивности гликогенолиза, увеличению образования гликогена, белков, жиров, повышению потребления тканями глюкозы. Возникающая гипогликемия сопровождается нарушением поглощения клетками (прежде всего ЦНС, сердца, скелетных мышц) кислорода. В них развиваются гипоксия и функциональные нарушения. При снижении уровня сахара ниже 50–35% больной теряет сознание. Одновременно гипогликемия сопровождается возбуждением симпатической нервной системы, повышением синтеза адреналина, норадреналина, глюкагона, глюкокортикоидов, АКТГ, СТГ. В случае длительного существования гопоксии функциональные изменения в органах сменяются органическими.
Клиническая картина.
Выраженность проявлений инсуломы, т.е. гипогликемии, зависит от степени снижения уровня сахара в крови: от головных болей, слабости, утомляемости, расстройства зрения до потери сознания, возбуждения, судорог, афазии. В начале приступа больные бледные, возбуждены, покрыты холодным липким потом. Пульс учащен. При развитии комы появляется брадикардия, снижается АД. Дыхание становится поверхностным. Зрачки суживаются и не реагируют на свет. Роговичные рефлексы не вызываются. Снижается температура гела. Возникает гипорефлексия. Иногда гипогликемическая кома развивается без продромальных проявлений.
Диагностика.
В пользу инсуломы свидетельствует наличие триады Whipple: 1. клиническая картина гипогликемии; 2. снижение уровня сахара в крови при появлении симптомов гипогликемии до 2,77 ммоль/л; 3. купирование гипогликемии внутривенным или пероральным приемом глюкозы (20–50 мл 20–40% раствора глюкозы).
Диагноз подтверждается проведением специальных тестов. 1. При 12–24–часовом голодании (допускается прием черного кофе или чая) концентрация глюкозы в крови больных инсуломой снижается до субнормальных цифр. 2. Тест с толбутамидом: внутривенное введение в течение 2 мин 1 г толбутамида (бутамида) в 20 мл изотонического раствора натрия хлорида приводит к резкому падению уровня глюкозы в крови и развитию гипогликемии. Содержание сахара определяется через каждые 20 мин. Его уровень максимально снижен (почти 50% исходного) во 2–й пробе. 3. Определение иммунореактивного инсулина в крови и соотношения глюкоза–инсулин. При инсуломе отмечается сдвиг глюкозоинсулинового коэффициента в пользу инсулина.
Локализация опухоли, ее размеры уточняются на основании данных УЗИ и сканирования поджелудочной железы, компьютерной томографии, селективной ангиографии по Сельдингеру.
Дифференциальная диагностика.
Проводится с поздним демпинг–синдромом, опухолью или функциональной недостаточностью надпочечников, циррозом печени и гепатитом, недостаточностью питания (anorexia nervosa).
В анамнезе у больных с поздним демпинг–синдромом есть указания на перенесенную операцию на желудке по поводу язвенной болезни. Приступы гипогликемии до операции не наблюдаются.
При циррозе и гепатите гипергликемия развивается на фоне морфофункционального поражения печени, что подтверждается соответствующими методами обследования. Гипогликемия, обусловленная недостаточностью питания, исчезает после его нормализации.
Лечение.
Основным методом лечения является хирургическое удаление инсуломы. При инсуломах хвоста и тела поджелудочной железы показана левосторонняя резекция поджелудочной железы. Инсуломы головки поджелудочной железы удаляются путем энуклеации узлов или дуодено–панкреатэктомии.
Консервативное лечение малоэффективно. Оно проводится, если невозможно выполнить операцию в связи с тяжестью сопутствующих заболеваний. Комплекс консервативных мероприятий включает прежде всего диетотерапию. Пациенты получают богатую углеводами пищу, прием которой увязывается со временем суток, характером выполняемых нагрузок. Назначаются препараты, подавляющие секрецию инсулина: глюкагон, соматостатин, диазоксид, глюкокортикоиды, β–адреноблокаторы (анаприлин). При злокачественной инсуломе используются антибиотики стрептозотоцин и др. Острые кризы купируются введением глюкозы (внутривенно 100 мл или больше 25% раствора), адреналина (внутривенно 0,5 мл раствора 1:1.000), глюкагона (подкожно, внутримышечно, внутривенно в дозе 1–5 мг).
Синдром 3оллингера–Эллисона
Синдром Золлингера–Эллисона – это патологическое состояние организма, характеризующееся наличием неподдающейся медикаментозному и обычному хирургическому лечению пептической язвы; желудочной гиперсекрецией, диареей и гипергастринемией.Историческая справка.
Впервые синдром описан учеными колумбийского университета Zollinger и Ellison в 1955 г.
Распространенность.
Синдром Золлингера–Эллисона является причиной возникновения язв желудка и двенадцатиперстной кишки в 1–5% случаев, а у больных, перенесших хирургическое вмешательство по поводу язвенной болезни, – в 0,6–3%. Чаще заболевание встречается у лиц 30–50–летнего возраста, преимущественно у женщин.
Этиология и патогенез.
В основе развития синдрома лежит гиперсекреция соляной кислоты, обусловленная повышенным содержанием в крови гастрина. Гастринемия развивается вследствие продукции гормона в опухоли, развившейся из D–клеток островкового аппарата поджелудочной железы (гастринома), или в результате гиперплазии G–клеток антрального отдела желудка. Гиперплазия G–клеток связывается или с повышением образования G–клеток из герминативного эпителия, или с трансформацией других эндокринных клеток (типа D, ЕС и т.д.). Не исключается и роль генетического фактора.
Патологическая анатомия.
Гастриномы представляют собой доброкачественные или злокачественные опухоли. Доброкачественные гастриномы окружены капсулой, имеют округлую или бобовидную форму. В зависимости от степени кровоснабжения цвет гастриномы колеблется от белого до багрово–красного. Злокачественные гастриномы характеризуются прорастанием капсулы и инфильтративным распространением по ходу кровеносных и лимфатических сосудов. В 75–85% случаев опухоли локализуются в поджелудочной железе, в 15–25% – в стенке кишечника, печени, воротах селезенки, надпочечниках, паращитовидных железах. ⅔ опухолей одиночные. Солитарные интрапанкреатические гастриномы расположены в головке или хвосте поджелудочной железы. Гастриномы кишечника локализуются проксимальнее большого дуоденального сосочка, на передней и внутренней стенках двенадцатиперстной кишки. Злокачественные гастриномы рано метастазируют в печень, легкие, регионарные лимфатические узлы. У 40% больных метастазы диагностируются раньше, чем основная опухоль. Иногда размеры метастазов превышают размеры первичных опухолей.
Микроскопически гастриномы состоят из многогранных клеток округлой, овальной или вытянутой формы с центрально расположенным ядром. Протоплазма клеток содержит большое количество базофильных гранул. При прогрессировании дегенеративно–дистрофических изменений в опухоли формируются кисты.
У лиц с синдромом Золлингера–Эллисона, обусловленным гиперплазией G–клеток антрального отдела желудка, в 1 мм2 слизистой антрума содержится в среднем 102 G–клетки, в то время как у здоровых – 45, у больных язвой двенадцатиперстной кишки – 56.
Клиническая картина.
Синдром Золлингера–Эллисона характеризуется наличием устойчивой к медикаментозному лечению и быстро рецидивирующей язвы желудка, двенадцатиперстной кишки, протекающих с интенсивным болевым синдромом: рвотой, эзофагитом, диареей, стеатореей.
У 5–10% больных единственным проявлением заболевания является диарея. Частота стула при синдроме достигает 7–15 раз в сутки, диарея усиливается в ночное время, не исчезает при голодании и ослабевает только после аспирации желудочного содержимого, что подтверждает развитие диареи вследствие раздражения слизистой оболочки тонкой кишки соляной кислотой. Стеаторея обусловлена инактивацией соляной кислотой протеолитических ферментов, прежде всего липазы.
Диагностика.
У лиц с синдромом Золлингера–Эллисона за сутки выделяется 2.000–12.000 мл желудочного сока с преобладанием ночной секреции, в среднем составляющей 2500 мл. Базальная кисл ото продукция превышает 20–25 ммоль, ночная 100 ммоль, а соотношение базальной секреции и стимулированной равно 0,6.
Синдром Золлингера–Эллисона сопровождается и повышением продукции протеолитических ферментов, ослаблением слизеобразования, гипергастринемией. В норме уровень гастрина в сыворотке крови достигает 200 пг/мл, а при синдроме превышает 500 и 1200 пг/мл. В то же время характер желудочной секреции, уровень гастринемии у одних и тех же больных часто меняется, что связано с неравномерным поступлением гастрина в кровь. Иногда заболевание протекает с низким содержанием гастрина в крови. Вместе с тем гипергастринемия наблюдается при анацидности и субацидности желудка.
Диагноз уточняется проведением тестов с внутривенным введением раствора кальция хлорида, секретина, биопробами. У больных с синдромом Золлингера–Эллисона внутривенное введение 15 мг/кг кальция хлорида увеличивает выработку соляной кислоты в течение 1 ч в 2–3 раза по сравнению с базальной секрецией (у здоровых и пациентов с язвенной болезнью двенадцатиперстной кишки секреция не изменяется). После внутривенного введения секретина (3 ед/кг) в течение 1 ч уровень гастрина в отличие от такового у здоровых не снижается, а возрастает с одновременным увеличением продукции соляной кислоты.
При проведении биологической пробы кровь или сыворотка больного вводится в вену животного с последующим исследованием у него желудочной секреции. Проба считается положительной, если желудочная секреция после инъекции достигает показателей, полученных у того же животного при стимуляции гистамином, или превышает их.
К рентгенологическим признакам синдрома Золлингера–Эллисона относятся: повышенное содержание жидкости в желудке натощак, плохая импрегнация слизистой оболочки бариевой взвесью, наличие гигантских язв, окруженных большим воспалительным валом, гипертрофия слизистой оболочки желудка и его гипотония. Гастриномы могут быть обнаружены при сканировании поджелудочной железы, компьютерной томографии, ультрасонографии, селективной ангиографии.
Лечение.
Наиболее эффективным методом лечения больных с синдромом Золлингера–Эллисона является хирургическое вмешательство. При одиночных или нескольких гастриномах поджелудочной железы или других органов объем операции заключается только в их удалении. Однако это не исключает рецидива язв в случае оставления других гастрином поджелудочной железы или их метастазов. Прогноз операции может быть определен по степени уменьшения сразу же после удаления опухоли концентрации гастрина или продукции соляной кислоты.
У больных с множественными опухолями поджелудочной железы, одиночными опухолями с метастазами, рецидивом язвы после удаления опухоли производится гастрэктомия.
Гиперплазия G–клеток антрального отдела желудка служит показанием к резекции желудка и (что выполняется реже) к ваготомии с антрумэктомией.
Консервативное лечение синдрома Золлингера–Эллисона включает применение больших доз антагонистов H2–рецепторов гистамина, химиотерапию стрептозотоцином, 5–фторурацилом внутриартериально.
5–летняя выживаемость больных с синдромом Золлингера–Эллисона после гастрэктомии превышает 80%, после субтотальной резекции желудка – 20%, обычной резекции желудка – 15%.
Глава 6. Селезенка
Анатомо–физиологические сведения
Селезенка – непарный паренхиматозный орган, расположенный в брюшной полости в области левого подреберья, под левым куполом диафрагмы. У 10–35% людей имеются добавочные селезенки, находящиеся в непосредственной близости у основания или на некотором удалении от нее. Длинная ось селезенки расположена параллельно ребрам. Чаще всего селезенка залегает между IX и XI ребрами в пространстве, ограниченном спереди парастернальной линией, а сзади паравертебральной. Возможны три варианта ее расположения – высокое, среднее и низкое. При высоком стоянии она достигает VII! ребра, при низком – опускается под XII ребро.Объем селезенки составляет 210–230 см3, длина – 12–14 см, ширина – 8–9 см, толщина – 3–4 см, масса – 150–250 г. Селезенка имеет две поверхности – выпуклую верхненаружную (диафрагмальную) и вогнутую нижневнутреннюю (висцеральную). Границами между ними являются четыре края – верхний (заостренный), нижний (округленный), передний и задний. Верхний и нижний края органа называются полюсами. На переднем и заднем краях селезенки могут быть вырезки, внедряющиеся в глубь ткани. На висцеральной поверхности имеется неправильной формы щелевидное углубление, в котором проходят сосуды и нервы, – ворота селезенки.
В брюшной полости селезенка фиксируется связками, образованными складками брюшины, – желудочно–селезеночной, селезеночнодиафрагмальной, селезеночно–печеночной, селезеночно–толстокишечной.
Кровоснабжение селезенки осуществляется по самой крупной ветви чревной артерии – селезеночной артерии (a.lienalis). На расстоянии 23 см от ворот селезенки она делится на 2–4 ветви, Последние распространяются в селезенке по ее трабекулам. Венозный отток происходит по нескольким венам, которые сливаются позади хвоста поджелудочной железы и под селезеночной артерией образуют селезеночную вену. Лимфатические сосуды впадают в поджелудочно–селезеночные лимфатические узлы, расположенные вдоль селезеночной артерии. Иннервация селезенки происходит из аортально–почечного ганглия.
Снаружи селезенка со всех сторон покрыта брюшиной и соединительнотканной капсулой. Внутрь от капсулы отходят перекладины (трабекулы). Между ними находится ретикулярная соединительная ткань – красная пульпа и белая пульпа. Красная пульпа представляет собой венозные синусы, заполненные форменными элементами крови. Белая пульпа состоит из очагов лимфоидной ткани, расположенной в адвентиции артерий и лимфатических периартериальных влагалищ, У взрослых на долю белой пульпы селезенки приходится ⅓ ее массы.
Функция селезенки многогранна. Она участвует в лимфоцито–, эритро–, гранулопоэзе, регуляции функций костного мозга и ретцкулоэндотелиальной системы, образовании гуморального и клеточного иммунитета; элиминации отживших и поврежденных эритроцитов и тромбоцитов; в обмене железа, липидов, белков и углеводов.
Историческая справка. Первые сведения о строении и назначении селезенки встречаются в трудах Гиппократа, Аристотеля, Платона. Однако только в 1659 г. Malpigi изучил строение селезенки под микроскопом. Первая спленэктомия с благоприятным исходом была выполнена Zaccarelli (1549). Lucas (1882) на заседании Лондонского клинического общества обосновал возможность перевязки селезеночной артерии при иноперабельной спленомегалии. Во второй половине XIXпервой половине XX ст. появились сообщения о спленэктомиях при гематологических заболеваниях. Так, Wells (1865) выполнил спленэктомито у больного лейкозом, Schlaffer (1910) – при хронической форме болезни Верльгофа. В 1920 г. Eppinger ввел термин "гиперспленизм".
Инфаркт селезенки
Этиология и патогенез.
Инфаркт селезенки (геморрагическийили ишемический) развивается в результате эмболии или тромбоза сосудов селезенки. Это наблюдается при бактериальном, септическом эндокардите, заболеваниях сосудов, митральном стенозе, после травм, инфекционных заболеваний, особенно после тифа. При небольших инфарктах селезенки пораженный участок органа постепенно рассасывается с последующим замещением рубцовой тканью. Возможно размягчение зоны инфаркта с формированием ложной кисты. Инфицирование инфарктов осложняется абсцессами. Инфицирование может быть первичным (проникновение в селезенку изначально септического эмбола) или вторичным (гематогенный занос в зону инфаркта инфекции).
Клиническая картина.
Возникновение инфаркта сопровождается внезапным появлением боли в левом подреберье, повышением температуры тела до 39°С, тошнотой, рвотой, парезом кишечника. Небольшие инфаркты протекают бессимптомно. Нагноение инфарктов, чему часто способствуют переохлаждение и травмы, сопровождается клинической картиной абсцесса селезенки.
Диагностика.
В ряде случаев затруднена. Наиболее типично наличие напряжения передней брюшной стенки в правом подреберье, тахикардии. При УЗИ определяются зоны различной плотности ткани селезенки.
Дифференциальная диагностика.
Проводится с абсцессом селезенки, острым панкреатитом. В отличие от абсцесса боль при инфаркте стихает от применения консервативного лечения, холода на область левого подреберья, покоя. Не выражен лейкоцитоз, нет сдвига лейкоцитарной формулы влево. Размахи температур незначительные.
Для острого панкреатита характерны наличие типичных симптомов воспаления поджелудочной железы – Воскресенского и Мейо–Робсона, повышение уровня диастазы в моче, амилазы в крови.
Лечение.
Проводится консервативное лечение. Назначаются покой, холод на область левого подреберья, антибактериальная и противовоспалительная терапия в условиях динамического наблюдения. В случае нагноения показана спленэктомия, реже производятся вскрытие и дренирование абсцесса.
Кисты селезенки
Непаразитарные кисты
Этиология и патогенез.
Формирование врожденных кист связано с нарушением эмбрионального развития – отшнурованием зародышевого эндотелия брюшины.
Приобретенные кисты возникают вследствие травм, инфекционных заболеваний (малярия, возвратный, сыпной, брюшной тиф), инфаркта, туберкулеза и лейшманиоза селезенки, т.е. заболеваний, ведущих к расстройству кровоснабжения.
Патологическая анатомия.
Стенка ложной непаразитарной кисты лишена эпителиальною слоя и образована только соединительнотканной оболочкой. Полость истинной кисты выстлана эндотелиальными и эпителиальными клетками. Врожденные кисты относятся к истинным, приобретенные – к ложным.
Кисты располагаются подкапсулярно, внутриселезеночно, чаще в верхнем полюсе селезенки. Они имеют разные размеры, содержат серозную, геморрагическую, серозно–геморрагическую жидкость или жидкость темно–красного либо шоколадного цвета.
Классификация.
Не паразитарные кисты классифицируются 1. по происхождению: ■ врожденные ■ приобретенные; 2. по строению: ■ истинные ■ ложные; 3. по клиническому течению: ■ неосложненные ■ осложненные; 4. по количеству: ■ одиночные ■ множественные.
Клиническая картина.
Небольшие кисты не вызывают никаких жалоб. Большие кисты сопровождаются болями и чувством полноты в верхней части живота, общей слабостью, диспептическими явлениями. Сдавление увеличенной селезенкой кишечника приводит к кишечной непроходимости; нижней полой вены – к отекам ног; смещение почек – к дизурическим явлениям. Исходом больших кист является атрофия селезенки. Возможны нагноение, разрывы, малигнизация, обызвествление кист.
Диагностика.
Отмечается асимметрия живота за счет выбухания его левого верхнего квадранта. Пальпируется увеличенная селезенка, а при локализации кисты в нижнем полюсе – флюктуация. Окончательный диагноз ставится на основании данных ультразвукового и рентгенологического исследований. В случае необходимости выполняются спленопортография и сканирование селезенки.
Дифференциальная диагностика.
Проводится со спленомегалией при портальной гипертензии, опухолями селезенки, кистами поджелудочной железы.
Для спленомегалии при портальной гипертензии характерно наличие расширения вен пищевода и желудка, повышение давления в портальной системе более 250 мм вод. ст.
При опухолях селезенки ее поверхность бугристая.
Кисты поджелудочной железы расположены ближе к средней линии тела. Поперечная ободочная кишка располагается над опухолью или смещается наружу и вверх. Кисты селезенки смещают поперечную ободочную кишку кнутри и книзу.
Лечение.
Наиболее эффективна спленэктомия. Если эту операцию выполнить невозможно, производится дренирование кисты или ее резекция с тампонированием остаточной полости прядью большого сальника.
Паразитарные кисты
Среди паразитарных кист селезенки чаще диагностируются эхинококковые. Они составляют 3–8% всех локализаций эхинококкоза.Этиология и патогенез.
В подавляющем большинстве наблюдений встречается гидатидозная форма эхинококкоза, обусловленная личиночной стадией развития ленточного глиста – Echinococcus granulosus. Основным хозяином паразита является собака, промежуточным – человек, крупный рогатый скот, овцы. Echinococcus multilocularis, вызывающий альвеолярную форму, паразитирует в организме лисиц, песцов, собак. Из просвета желудочнокишечного тракта яйца глистов попадают в селезенку прежде всего гематогенным путем – через большой круг кровообращения, минуя печень, легкие и левое сердце. Онкосферы проникают в селезенку и ретроградно – через селезеночную вену. Этому способствуют отсутствие клапанов в селезеночной вене и перистальтика кишечника. Крайне редко селезенка поражается эхинококком через желудочные вены и сосуды толстого кишечника.
Патологическая анатомия.
Эхинококковая киста чаще локализуется в средней части селезенки. Встречается одноили многокамерный эхинококкоз. Гидатидозная форма эхинококкоза представлена узлом (узлами), заполненным бесцветной жидкостью. Стенка гидатиды состоит из двух оболочек: внутренней (герминативной, зародышевой) и наружной (хитиновой, кутикулярной). Снаружи к эхинококковому пузырю прилежит плотная фиброзная оболочка, образованная соединительной тканью. Герминативная оболочка непрерывно образует зародышевые сколексы, из которых формируются дочерние, а из них внучатые пузыри. По мере увеличения размеров эхинококка ткань селезенки атрофируется.
Альвеококк имеет вид плотного узла. Он состоит из фиброзной соединительной ткани и мелких пузырьков, содержащих бесцветную жидкость. Структура стенки паразита идентична структуре стенки гидатидозной формы эхинококка. В отличие от последнего вновь образующиеся пузырьки альвеококка инфильтрируют окружающие ткани.
Клиническая картина.
Заболевание развивается медленно (10" 15 лет), что позволяет выделить в течении эхинококкоза три периода: латентный (бессимптомный), клинических проявлений и развития осложнений (нагноение, разрыв, обызвествление).
Проявления заболевания сходны с таковыми непаразитарных кист. Больных беспокоят чувство тяжести и тупые боли в области левого подреберья, в эпигастрии, затруднение дыхания. В случае сдавления органов желудочнокишечного тракта отмечается рвота после еды. При нагноении кист появляется клиническая картина абсцесса, при перфорации – перитонита.
Диагностика.
Во время осмотра находят выбухание в верхнем левом квадранте живота. Пальпируется увеличенная, эластической консистенции селезенка. В ряде случаев возможно наличие флюктуации. Рентгенологически определяются высокое стояние левого купола диафрагмы, смещение желудка и ободочной кишки вправо и книзу. Реакция Каццони (внутрикожная реакция со стерильной жидкостью эхинококкового пузыря) положительная у 90% больных. В общем анализе крови выявляется эозинофилия.
Дифференциальная диагностика.
Проводится с непаразитарными кистами селезенки, кистами поджелудочной железы, опухолями селезенки.
Лечение.
При эхинококкозе и альвеококкозе проводится только оперативное лечение – спленэктомия. Если спленэктомию выполнить невозможно, у больных с гидатидозной формой эхинококка производятся вскрытие и опорожнение кисты, удаление хитиновой оболочки с последующей обработкой внутренней поверхности стенки кисты 10% раствором формалина. Остаточная полость частично иссекается и ушивается.
Абсцесс селезенки
Распространенность.
Абсцесс селезенки встречается у 0,5–1% больных.
Этиология и патогенез.
Абсцесс селезенки в 80–90% случаев развивается вторично в результате гематогенного проникновения в нее инфекции по венам или артериям при септических, воспалительных или нагноительных процессах других органов (послеродовом сепсисе, язвенном эндокардите, остеомиелите и т.д.), инфекционных заболеваниях (возвратном тифе, малярии, скарлатине и т.д.), нагноении гематом, эхинококкозе. Реже абсцесс возникает при переходе инфекции с соседних органов. Нередко абсцессы селезенки сочетаются с абсцессами печени и почек.
Патологическая анатомия.
Абсцессы селезенки имеют разные размеры. Они могут быть одиночными и множественными, поражать всю селезенку и локализоваться сегментарно. Множественные абсцессы имеют небольшие размеры, но, увеличиваясь, они сливаются между собой, образуя гнойник, содержащий иногда до 3 л гноя. Гистологически в гное обнаруживают клеточные элементы селезеночной пульпы, разнообразную патогенную флору. В процессе формирования абсцесса образуются сращения между капсулой селезенки и диафрагмой, а также другими органами.
Клиническая картина.
Складывается из наличия выраженной общевоспалительной реакции или, наоборот, вялотекущего инфекционного заболевания – субфебрилитета, нарастающей слабости, истощения.
Местно отмечаются боли в левом подреберье, левой половине грудной клетки. Вовремя не диагностированный абсцесс осложняется сепсисом, плевритом, разрывом гнойников с распространением гноя по свободной брюшной полости или ограничением в левом подреберье. Иногда гнойник вскрывается в плевральную полость, бронхи, желудок, кишечник, ретроперитонеальное пространство, в брюшную стенку с последующим выходом наружу.
Диагностика.
Во время осмотра больных с абсцессами селезенки наблюдается небольшое выпячивание брюшной стенки в левом подреберье. Селезенка увеличена, резко болезненна при исследовании. У некоторых пациентов в области выпячивания определяется флюктуация. Легочной звук в межлопаточном пространстве притуплен.
При рентгенологическом обследовании находят ограничение подвижности и высокое стояние левого купола диафрагмы, признаки левостороннего плеврита и нижнедолевой пневмонии, затемнение в левом поддиафрагмальпом пространстве, в том числе с горизонтальным уровнем жидкости и узкой полоской газа над ним. В крови больных выражены анемия, гипопротеинемия со сдвигом лейкоцитарной формулы влево.
Дифференциальная диагностика.
Проводится с ее инфарктом, поддиафрагмальным гнойником, периспленитом.
У больных с поддиафрагмальным абсцессом селезенка не увеличена. При перисплените симптомы общего воспаления выражены незначительно.
Лечение.
Во всех случаях абсцесса селезенки показано хирургическое лечение. Объем операции состоит в выполнении спленэктомии или вскрытии гнойника с последующим его дренированием.
Опухоли селезенки
Опухоли селезенки (первичные и вторичные – метастатические, доброкачественные и злокачественные) встречаются в 0,02–3% случаев. Такая низкая наклонность селезенки к неогенезу связывается с присутствием в ней большого количества ретикулоэндотелия, бедностью лимфатической сети. Эти факторы препятствуют как проникновению в организм человека инфекций, так и развитию опухолей.Доброкачественные опухоли селезенки
К доброкачественным опухолям селезенки относятся гемангиомы, лимфангиомы, спленомы, фибромы, хондромы и остеомы. Они диагностируются у 0,02–0,3% больных.Гемангиомы исходят из кровеносных сосудов. Состоят из пещеристых полостей различной величины. Растут в виде одиночного узла или диффузно поражают селезенку. Развиваются волнообразно, то останавливаясь, то быстро увеличиваясь в размерах. Локализуются как на поверхности, так и в глубине органа. Нередко достигают больших размеров. Осложняются разрывами с кровотечением в брюшную полость, тромбозами с последующей организацией и обызвествлением полостей.
Лимфангиомы возникают из лимфоцитов, Состоят из расширенных лимфатических сосудов или из ячеистых полостей, выстланньи эпителием. Содержат небольшое количество бесцветной или мутно–красной жидкости. Ветречаются в виде одиночного узла или диффузно растущей опухоли. Осложняются разрывами.
Спленомы (гамартомы) развиваются в глубоких слоях селезенки. Их диаметр составляет от 2 мм до 4 см. В зависимости от преобладания в структуре пульпы или фолликулов выделяют две формы опухолей: пульпозную и фолликулярную.
Фибромы, хондромы, остеомы особого клинического значения не имеют и в основном обнаруживаются на секции или лапаротомиях в связи с другими заболеваниями.
Клиническая картина.
Для доброкачественных опухолей селезенки характерно бессимптомное течение. Только при достижении опухолью больших размеров возникает чувство тяжести и боли в левом подреберье. Нередко первыми симптомами опухолей, в частности гемангиом или лимфангиом, являются их разрывы.
Диагностика.
Наличие доброкачественной опухоли селезенки уточняется по данным УЗИ, компьютерной томографии, гистологического исследования пунктата селезенки, что небезопасно при гемангиоме или лимфангиоме в связи с возможным развитием внутрибрюшного кровотечения.
Лечение.
Проводится хирургическое лечение – спленэктомия с аутотрансплантацией ткани селезенки.
Злокачественные опухоли селезенки
Злокачественные опухоли селезенки подразделяются на первичные (саркомы, лимфосаркомы, ретикулосаркомы. ангиосаркомы, фибросаркомы) и вторичные (метастазы рака и саркомы). Они встречаются в 0,8–3% случаев. Чаще возникают у мужчин в возрасте 40–50 лет.Первичные опухоли.
Саркомы селезенки растут наподобие солитарного узла или опухоли, диффузно поражающей весь орган. На разрезе они имеют вид рыбьего мяса. Для узловой формы характерна бугристость селезенки. Часто образуются сращения с окружающими органами. Иногда опухоль прорастает капсулу и переходит на соседние органы, быстро дает метастазы, распространяющиеся по лимфатическим и кровеносным пугям. В первую очередь поражаются лимфатические узлы ворот селезенки и печени, брыжеечные и забрюшинные узлы, поджелудочная железа. По гистологическому строению саркомы подразделяются на круглоклеточные, полиморфноклеточные, веретенообразные, ретикулоэндотелиальные. Прогноз неблагоприятный. Наибольшая продолжительность жизни пациентов составляет 1–2 года.Лимфосаркомы селезенки исходят из паренхимы лимфатических узлов селезенки. Опухоль плотная, безболезненная. Растет в виде узла, инфильтрирующего окружающие органы. Выделяют две фазы заболевания – изолированную (местную) и генерализованную, которая называется лимфосаркоматозом. В генерализованной фазе отмечается метастазирование опухоли практически во все органы. Гистологически различают лимфоцитарную и лимфобластную лимфосаркому. У больных с лимфобластной формой клетки опухоли напоминают малые лимфоциты. Прогноз неблагоприятный. От момента обнаружения увеличенной селезенки до летального исхода проходит 1–2 года.
Ретикулосаркома развивается из ретикулярных клеток. По фазам заболевания, характеру роста, клиническому течению схожа с лимфосаркомой. Однако при ретикулосаркоме опухолевые клетки в большом количестве выходят на периферию, повышая СОЭ. Увеличивается содержание у–глобулина крови. Генерализация процесса сопровождается лихорадкой. Прогноз неблагоприятный.
Вторичные опухоли.
Вторичные опухоли селезенки (метастазы рака и сарком) встречаются в 1–2% случаев.Клиническая картина.
В начале заболевания опухоли селезенки протекают бессимптомно. По мере увеличения размеров селезенки, как и при доброкачественных новообразованиях, появляются чувство тяжести, боль в левом подреберье. Одновременно отмечаются прогрессирующее нарастание слабости, возникают анемия, постоянный субфебрилитет. Развиваются асцит, геморрагический плеврит, клиническая картина метастатических поражений других органов. Больные истощаются.
Диагностика.
Базируется на данных комплексного обследования и прежде всего гистологического исследования пунктата селезенки.
Дифференциальная диагностика.
Проводится с опухолями почки, поджелудочной железы, эхинококкозом селезенки, спленомегалией при туберкулезе, сифилисе.
Глава 7. Брюшина
Анатомо–физиологические сведения
Брюшина – это тонкая серозная оболочка, покрывающая внутреннюю поверхность брюшной стенки (париетальная брюшина) и расположенные в полости живота органы (висцеральная брюшина). Общая площадь брюшины равняется площади поверхности тела человека и составляет 1,5–2 м2. Париетальный листок брюшины толще висцерального. Из четырех листков брюшины состоит сальник.Одни органы брюшной полости покрыты брюшиной со всех сторон, т.е. имеют интраперитонеальное расположение (желудок, поперечная ободочная и сигмовидная кишки, проксимальный отдел прямой кишки, матка с придатками, селезенка), другие располагаются мезоперитонеально, т.е. покрыты брюшиной с трех сторон (печень, восходящий и нисходящий отделы ободочной кишки), а третьи – экстраперитонеально, т.е. покрыты брюшиной с одной стороны (поджелудочная железа и большая часть двенадцатиперстной кишки).
Между листками брюшины содержится незначительное количество серозной жидкости (до 25 мл), которая постоянно обновляется в результате непрерывного протекания процессов транссудации и всасывания. Она выполняет роль смазки, тончайшим слоем покрывая серозную поверхность органов. Полость брюшины у женщин сообщается с внешней средой посредством отверстия маточных труб, а у мужчин замкнута.
Гистологически брюшина представляет собой тонкую соединительнотканную основу, в которой находятся сосуды и нервные элементы. В брюшине различают шесть слоев. Первым слоем, выстилающим поверхность серозной оболочки, является мезотелий, представляющий собой однослойные плоские полигональные клетки, неплотно соприкасающиеся одна с другой. Пространство между ними заполнено межклеточным веществом. Через эти щели осуществляется связь между полостью брюшины и лимфатическими капиллярами. Последние вместе с кровеносными и артериальными сосудами залегают в более глубоких слоях брюшины.
Иннервация париетальной брюшины (за исключением тазовой) осуществляется чувствительными соматическими нервами (ветвями межреберных нервов), а висцеральной брюшины – вегетативной нервной системой (парасимпатической и симпатической). Это приводит к тому, что любое раздражение париетальной брюшины сопровождается четко локализованной болью, а висцеральной – разлитой.
Брюшина обладает высокой всасывательной и выделительной способностью, пластическими, а сальник и электростатическими свойствами. Так, в течение суток через брюшину в норме проходит до 7080 л жидкости. Наибольшая резорбция присуща участкам висцеральной брюшины, расположенным на диафрагме, слепой кишке и сальнике. Всасывание происходит непосредственно в кровеносную, лимфатическую и капиллярную сети. Вследствие увеличения разности потенциалов между сальником и воспалительно–измененным органом сальник всегда перемещается к зоне повреждения. Благодаря способности брюшины к образованию спаек она играет важную роль в ограничении воспалительных процессов в брюшной полости.
Разлитой гнойный перитонит
Историческая справка. В III ст. до н.э. греческий врач Эрзострат для удаления гноя из брюшной полости производил разрезы в паховой области. Pti (XVIII ст.) высказал мысль о возможном наличии гнойных затеков между брюшными органами. В 1816 г. В. Шабанов дал первое достоверное описание перитонита. Samuel (1876) предложил у больных перитонитом немедленно выполнять операцию в целях устранения его причины и промывания брюшной полости. А. И. Шмидт (1881) впервые в мире произвел успешную лапаротомию при распространенном гнойном перитоните, вызванном нагноением селезенки при малярии. Более ста лет назад Mikulicz предложил использовать при перитоните метод "открытого" живота. Wear (1938) применил проточный перитонеальный диализ, a Fretheim и Selvaay (1949) – фракционный.Распространенность.
Разлитой гнойный перитонит относится к наиболее опасным осложнениям острых хирургических заболеваний и травм органов брюшной полости (летальность составляет от 20 до 60%). В большинстве случаев он осложняется острым аппендицитом, холециститом, панкреатитом, прободной язвой желудка и двенадцатиперстной кишки, ущемлением грыж и повреждением брюшной полости.
Этиология.
Гнойный перитонит в 80–90% случаев развивается в результате проникновения микробов и токсинов в брюшную полость при воспалительно–деструктивной и травматической перфорации полых органов; при расстройстве кровоснабжения органов брюшной полости и криптогенном заносе инфекции; при распространении микроорганизмов на брюшную полость по протяжению с пограничных областей; через дефекты в брюшной стенке. Гораздо реже гнойный перитонит возникает вследствие инфицирования скопившихся в полости брюшины различных неинвазивных, но агрессивных по отношению к ней агентов – желчи, крови, мочи, панкреатического сока.
Патогенез.
Представляет сложную многофакторную цепь функциональных и морфологических изменений как со стороны брюшной полости, так и всего организма. Они обусловлены общими и местными реакциями в ответ на попадание микробного агента в область брюшины. Исходом происходящих процессов является возникновение несовместимых с жизнью нарушений в функциональном состоянии всех жизненно важных органов и систем, что обозначается термином "полиорганная недостаточность". Она включает поражение сердечно–сосудистой системы – гипери гиподинамика; почек – олигурическая или полиурическая недостаточность; печени – холе цистопатические или гепатоцеллюлярные повреждения; ЦНС – расстройства сознания, дисциркуляторная энцефалопатия; легких – респираторный дистресс–синдром, шоковое легкое; кишечника – угнетение моторно–эвакуаторной, секреторной, переваривающей и всасывательной функций, образование стрессовых язв; коагулопатию; метаболические расстройства.
Развивающиеся нарушения находятся в постоянной динамической взаимосвязи, дополняя друг друга по принципу "порочного круга". Степень их выраженности зависит от характера микробного агента, тяжести стадий течения воспалительного процесса в брюшине.
Условно в течении перитонита различают три стадии (фазы): реактивную (реакцию организма на проникновение инфекции в брюшную полость); токсическую (реакцию организма на поступление в общий кровоток токсических веществ из брюшной полости); терминальную.
Первая стадия – начало и постепенное распространение воспаления по брюшине. Она наблюдается на протяжении 1–2 суток после начала заболевания, а при перфорации полых органов – в течение 12 ч. Стадия характеризуется появлением в брюшной полости содержащего небольшое количество бактерий серозного и серозно–фибринозного экссудата, резким повышением фагоцитарной активности лейкоцитов и макрофагов, усилением всасывания из брюшной полости, значительным местным и общим лейкоцитозом, выпадением вокруг очага фибрина. В этой стадии в ответ на стресс развивается неспецифическая реакция гипоталамо–гипофизарно–надпочечниковой системы, а вместе с ней и гипертензия. Последняя в результате уменьшения ОЦК сменяется гипотензией. Гипотензия и гиповолемия приводят к гипоксии тканей. Постепенно появляется парез кишечника, который в какой–то степени также способствует ограничению воспалительного очага. Недостаточности в функциональном состоянии органов и систем в этой стадии перитонита не наблюдается.
Во второй стадии (от 2–3 до 4–5 суток или от 12 до 24 ч при перитоните вследствие перфорации) формируется разлитой перитонит с диффузным поражением брюшины. Прогрессирует парез кишечника. В его просвете скапливается большое количество жидкости, а в брюшной полости – экссудат, характер которого может быть различным. Экзои эндотоксины, продукты клеточного распада (протеазы, лизосомальные ферменты) и другие токсические вещества поступают в общий кровоток, приводя к развитие эндотоксического шока. Вследствие воспалительного отека брюшины, скопления жидкости в брюшной полости и ее депонирования в просвете кишечника, падения скорости портального кровотока усиливается гиповолемия. Нарушение кровообращения в системе микроциркуляции, увеличение вязкости крови приводят к снижению перфузнойного давления, ишемии, расстройству метаболизма в легких, миокарде, почках, печени, стенке кишечника и т.д. Развивается недостаточность функции одного из органов или системы органов брюшной полости. Как защитная реакция на распространение инфекции резко снижается всасывание из брюшной полости, прогрессирует парез кишечника, сальник перемещается в очаг воспаления и окутывает его. Значительно активируется иммунная система организма.
В третьей стадии (через 5–10 суток, при перфоративном перитоните позже 24 ч) отмечаются выраженные симптомы разлитого перитонита с септическим шоком. Всасывание из брюшной полости значительно замедляется или полностью прекращается. Нарастает стойкий парез желудочно–кишечного тракта. Нарушается водно–электролитный обмен. Снижается ОЦК. Истощается иммунная система. Усугубляются нарушения гемодинамики. Прогрессируют дистрофические изменения в органах, в том числе и из–за влияния экзои эндотоксинов. Исходом терминальной стадии является развитие полиорганной недостаточности.
Классификация.
Разлитой гнойный перитонит является одной из форм перитонита, имеющего сложную классификацию.
По распространенности перитонит делится на: 1. Местный: ■ ограниченный (воспалительный инфильтрат, абсцесс). Для этой формы перитонита характерна локализация воспалительного процесса в одной анатомической области; ■ неограниченный (ограничивающих сращений нет, но процесс локализуется не более чем в 2 из 9 анатомических областей). 2. Распространенный: ■ диффузный (брюшина поражена на значительном протяжении, но процесс охватывает менее чем два этажа брюшной полости, т.е, от 2 до 5 анатомических областей); ■ разлитой (поражена брюшина более чем двух этажей брюшной полости, т.е. почти вся); ■ общий (тотальное воспаление всего серозного покрова органов и стенок брюшной полости).
По клиническому течению выделяют: 1. острый 2. подострый 3. хронический перитонит.
По характеру экссудата различают 1. серозный 2. фибринозный 3. фибринозно–гнойный 4. гнойный 5. геморрагический перитонит.
Клиническая картина.
Разнообразна и определяется этиологическим фактором, стадией течения, возрастом больных, состоянием общей реактивности организма и т.д. (клиническая картина местного перитонита изложена в разделе "Осложнения острого аппендицита").
В первой стадии разлитого перитонита общее состояние больных средней тяжести. Отмечаются боли в брюшной полости, преимущественно в области локализации первичного воспалительного очага, слабость, сухость слизистых, повышение температуры тела до 38–38,5°С, задержка стула, неотхождение газов. Пульс учащен до 100–110 ударов в минуту, но при перфорации полых органов несколько замедлен, удовлетворительного наполнения. АД за исключением случаев острого тромбоза брыжеечных сосудов и прободений чаще повышено. Участие брюшной стенки в дыхании ограничено, мышцы передней брюшной стенки, особенно над очагом воспаления, напряжены. Симптом Щеткина–Блюмберга положительный. Вследствие пареза кишечника определяется зона высокого тимпанита, а в нижних и боковых отделах брюшной полости из–за скопления экссудата – небольшое притупление. Кишечная перистальтика ослаблена. В крови выявляются лейкоцитоз, нейтрофилез, увеличение СОЭ.
Во второй стадии состояние больных тяжелое. Их беспокоят икота, жажда, тошнота, рвота. Наблюдаются выраженная бледность кожных покровов, сухость слизистой языка и полости рта, в том числе и внутренней поверхности щек. Черты лица заострены. Пульс превышает 120 ударов в минуту. АД снижено. Температура тела повышается до 38–39°С. Между частотой пульса и температурой существует несоответствие. Живот резко вздут. При пальпации выявляются меньшее, чем в предыдущей стадии, напряжение мышц передней брюшной стенки и болезненность вследствие прогрессирования необратимых изменений в нервно–мышечном аппарате кишечной стенки. Зона высокого тимпанита и размеры притупления в отлогих отделах живота, наоборот, увеличиваются. В крови выражены лейкоцитоз со сдвигом лейкоцитарной формулы влево, анэозинофилия, повышенная СОЭ. Снижены ОЦК, содержание белка, микроэлементов, прежде всего калия. КЩР сдвигается в сторону алкалоза. В моче определяются белок, сахар, эритроциты, почечный эпителий.
В третьей стадии общее состояние пациентов крайне тяжелое. Выражены нарушения со стороны ЦНС. Сознание спутано. В ряде случаев наблюдаются эйфория, адинамия, прострация. Лицо приобретает своеобразный вид (facies Hippocratica): акроцианоз, заостренные черты, частая рвота, отмечаются постоянная икота, срыгивание кишечным содержимым нередко с каловым запахом. Температура тела повышается до 39°С и выше. Пульс учащается до 130–140 ударов в минуту, слабого наполнения, нитевидный. Прогрессирует гипотония. Дыхание становится частым, поверхностным. Тоны сердца глухие. Живот равномерно увеличен в объеме, не участвует в акте дыхания. При пальпации находят разлитую болезненность, напряжение мышц передней брюшной стенки, положительный симптом Щеткина–Блюмберга. Кишечная перистальтика отсутствует. Стула нет. Газы не отходят. В крови определяются лейкоцитоз, сменяющийся лейкопенией, токсическая зернистость нейтрофилов, повышение СОЭ; увеличение гематокрита; признаки диссеминированного внугрисосудистого свертывания и дальнейшего усугубления нарушения всех видов обмена веществ. В моче увеличивается содержание белка, появляются гиалиновые цилиндры, индиканурия.
Диагностика.
Как правило, анализ жалоб, данных анамнеза, характера течения заболевания, объективного осмотра и прежде всего наличие симптома Щеткина–Блюмберга позволяют поставить диагноз разлитого гнойного перитонита. В сомнительных случаях проводятся лапароскопия, лапароцентез, ультразвуковая эхолокация брюшной полости, обзорная рентгенография органов брюшной полости и поддиафрагмальных пространств.
Во время лапароскопии при разлитом гнойном перитоните находят фибринозно–гнойный экссудат в брюшной полости, воспалительные изменения париетальной и висцеральной брюшины.
Признаком перитонита при лапароцентезе является поступление по введенному в брюшную полость катетеру перитонеального экссудата, крови, гноя, желчи. При ультрасонографии отмечают скопление жидкости в отлогих местах брюшной полости. К рентгенологическим признакам перитонита относятся уровни жидкости с газом в петлях кишечника (чаши Клойбера), раздутые газом петли кишечника, прилежащие к очагу воспаления, высокое стояние и ограничение подвижности куполов диафрагмы, свободный газ под куполом диафрагмы и др. При влагалищном исследовании определяется болезненность сводов, а при ректальном – нависание и болезненность передней стенки прямой кишки.
Дифференциальная диагностика.
В ряде случаев при постановке диагноза разлитого гнойного перитонита возникают трудности, особенно в реактивной фазе его развития. Сходная клиническая картина нередко наблюдается при остром панкреатите, острой кишечной непроходимости, остром холецистите, почечной колике, базальном плеврите, абдоминальной форме инфаркта миокарда. Однако следует иметь в виду, что при прогрессировании некоторых из этих заболеваний развивается перитонит.
Острый панкреатит начинается внезапно с резкой интенсивной боли в эпигастрии, левом подреберье, иррадиирующей в поясницу, левый реберно–позвоночный угол (симптом Мейо–Робсона), в левую лопатку и руку, шею слева. Заболеванию предшествуют погрешности в диете. Боль при остром панкреатите в отличие от боли при остром перитоните не усиливается при кашле, перемене положения тела. Одновременно с болевым симптомом появляется неоднократная, иногда неукротимая рвота, не приносящая облегчения. При объективном осмотре находят положительный симптом Воскресенского (отсутствие пульсации брюшной аорты выше пупка и наличие ее ниже пупка), Керте (зона поперечной болезненности и напряжение передней брюшной стенки в эпигастрии), желтушность кожных покровов, иктеричность склер. В моче повышена диастаза, в крови – амилаза. Отсутствует симптом Щеткина–Блюмберга.
Наиболее характерными симптомами острой кишечной непроходимости являются боль в животе, задержка газов, неотхождение кала, вздутие живота, усиление перистальтики. Боль схваткообразная, локализуется в брюшной полости в области препятствия. Усиленная перистальтика слышна на расстоянии. При объективном осмотре отмечается асимметрия живота, видны на глаз перистальтические волны. Их начало совпадает с усилением схваткообразных болей, а конец с прекращением. Положительны симптомы Валя (местный метеоризм), Склярова (шум плеска жидкости, скопившейся в просвете перистальтирующей кишечной петли), Спасокукоцкого (звук падающей капли). На обзорной рентгенограмме брюшной полости видны чаши Клойбера, поперечная исчерченность раздутой газом тонкой кишки.
Острый холецистит сопровождается внезапным появлением болей в правом подреберье, иррадиирующих в правую лопатку и надлопаточную область, тошнотой, рвотой. Для заболевания типичны симптомы Грекова–Ортнера (болезненность при поколачивании по правой реберной дуге), Мерфи (усиление болезненности на высоте вдоха при пальпации желчного пузыря), Мюсси–Георгиевского (болезненность при пальпации места прикрепления кивательной мышцы к грудине). В правом подреберье может пальпироваться увеличенный желчный пузырь. При УЗИ находят признаки воспалительных изменений в желчном пузыре, а иногда и конкременты.
У больных с приступом почечной колики боль локализуется преимущественно в поясничной области, носит приступообразный характер, иррадиирует в бедро, половые органы, не связана с изменением положения тела. Больные ведут себя беспокойно. В моче определяются гематурия, лейкоцитурия. Диагноз почечнокаменной болезни подтверждается во время УЗИ, внутривенной урографии.
Базальный плеврит помимо боли, напряжения мышц в верхнем отделе живота сопровождается болью в грудной клетке, пояснице, усиливающейся при дыхании, сухим кашлем. Объективно находят типичные болевые точки: между ножками грудино–ключично–сосцевидной мышцы, в первых межреберных промежутках у грудины, в области прикрепления диафрагмы к ребрам, на остистых отростках первых шейных позвонков. Рентгенологический контроль органов грудной клетки в динамике позволяет уточнить диагноз.
Боли в эпигастральной области, тошнота, рвота, метеоризм, болезненность во время пальпации подложечной области отмечаются при абдоминальной форме инфаркта миокарда. В отличие от разлитого гнойного перитонита заболевание сопровождается кратковременным увеличением, а затем падением АД, тахикардией, ослаблением тонов сердца, соответствующими изменениями на ЭКГ в динамике, повышением активности КФК, ЛДГ, ЛДГ1; ACT.
Лечение.
Показано срочное хирургическое вмешательство с кратковременной предоперационной подготовкой. Она включает аспирацию желудочного содержимого, катетеризацию центральной вены; установление постоянного катетера в мочевой пузырь для почасового контроля за диурезом; введение обезболивающих, сердечных, сосудистых, а при низком АД и гормональных препаратов, инфузионную терапию, направленную на восполнение ОЦК, коррекцию водно–электролитных нарушений, детоксикацию организма (полиглкжин, цельная кровь, эритроцитарная масса, солевые растворы, гемодез и т.д.).
Задачами хирургического вмешательства являются: 1. устранение источника перитонита; 2. тщательная эвакуация экссудата и промывание брюшной полости антисептиками (санация, лаваж брюшной полости); 3. декомпрессия желудочно–кишечного тракта; 4. дренирование брюшной полости.
Для адекватного обнажения органов брюшной полости применяется срединная лапаротомия.
Первая задача решается: 1. радикальным удалением источника инфицирования брюшной полости (при остром аппендиците, холецистите, перекруте кисты яичника и т.д.); 2. ушиванием перфорационных отверстий полых органов (при прободной язве желудка и двенадцатиперстной кишки, перфорации язв тонкой кишки); 3. резекцией деструктивно–измененного органа с наложением разгрузочной илеостомы или колостомы (при перфорации раковой опухоли, гангрене кишечника); 4. выведением несостоятельного межкишечного анастомоза из брюшной полости на кожу.
После ликвидации источника перитонита производится санация брюшной полости. Она может быть одномоментной, т.е. выполняться только во время операции, и продолженной – проводиться в послеоперационном периоде.
Одномоментный лаваж осуществляется уже в ранней (реактивной) стадии разлитого перитонита, характеризующегося наличием серозного и серозно–геморрагического выпота в брюшной полости. Он включает тщательное удаление экссудата, некротических тканей, фибрина электроотсосом или марлевыми тампонами, неоднократное (5–6 раз) промывание брюшной полости различными подогретыми антисептическими растворами.
Применение для лаважа брюшной полости бессолевой жидкости опасно, так как в силу осмотического градиента она вместе с токсинами будет всасываться брюшиной и поступать в общий кровоток. Промывание прекращается тогда, когда аспирируемая жидкость становится прозрачной. Обычно для полноценного лаважа брюшной полости необходимо 8–12 л диализата. Промывание брюшной полости заканчивается введением в нее антибиотиков, в основном обладающих активностью по отношению к колибациллярной микрофлоре (неомицинового ряда). Чаще всего антибиотики вводятся в конце операции под брюшину корня брыжейки тонкого кишечника в 150–250 мл 0,25% раствора новокаина.
Декомпрессия желудочно–кишечного тракта направлена на удаление из просвета прежде всего тонкого кишечника токсического содержимого и быстрейшее восстановление его двигательной функции. По срокам выполнения она может быть одномоментной (выполняться только во время операции) и продолженной (осуществляться и в послеоперационном периоде).
Существует несколько способов декомпрессии кишечника: 1. Энтеротомия с эвакуацией кишечного содержимого и ушиванием дефекта в стенке кишки. Однако при разлитом гнойном перитоните метод широко не применяется, так как декомпрессия является одномоментной и не исключает прогрессирования динамической кишечной непроходимости. Кроме того, в послеоперационном периоде наложенные в условиях перитонита швы часто оказываются несостоятельными. 2. Интубация. Производится без вскрытия или со вскрытием просвета полых органов. Сущность первого способа заключается в проведении в кишечник на всю его длину (тотальная интубация) или частично одно(двух)просветной трубки диаметром 6–8 мм с множеством перфорационных отверстий. Она выполняется чресназально (гастроинтестинальная интубация по Вангестину) или через анус. Для интубации кишечника со вскрытием его просвета наиболее широко применяются методы Житнюка и Гегечкори. 3. Наложение энтеростомы: ■ с межкишечным анастомозом по Брауну; ■ на отводящей петле с Т–образным анастомозом – способ Майдля; ■ концевой илеостомы способ Топчи башева. 4. Формирование цекостомы (способ Зауэра). 5. Формирование гастростомы (способ Дедерера). 6. Комбинация нескольких методов: сочетание энтеро(цеко)стомы с проведением через сформированное соустье в кишечник интубационной трубки и т.д. (рис. 46).
 Рис. 46. Тотальная гастроинтестинальная интубация.
Рис. 46. Тотальная гастроинтестинальная интубация.
Наиболее эффективным способом декомпрессии кишечника является интубация. При правильной интубации, адекватном ведении послеоперационного периодадвигательная функция пищеварительного тракта восстанавливается на 5–7–е сутки, что служит показанием к извлечению дренажа.
После купирования перитонита индивидуально решается вопрос о сроках закрытия гастро–, энтероцекостом.
Дренирование брюшной полости у больных перитонитом преследует цель – максимально вывести в послеоперационном периоде из брюшной полости экссудат. Оно осуществляется силиконовыми или полихлорвиниловыми толстыми трубками, биологически активными дренажами, содержащими антибиотики и протеолитические ферменты. Обычные марлевые тампоны в качестве дренажей при перитонитах не используются, так как выполняют дренажную функции только в течение одних суток, а затем начинают задерживать эвакуацию жидкости, превращаясь в дополнительный источник инфицирования брюшной полости. Поэтому для лечения больных перитонитом, сочетающимся с наличием гнойносептических полостей, имеющих выраженную пиогенную оболочку, разработан (Республика Беларусь, НПО "Фармавит") специальный детоксикационный тампон. Основным его компонентом является волокнистый сорбционный материал. Большая пористость последнего, малый диаметр образующих его волокон, расположенных по оси дренирования, создают выраженную капиллярную структуру. Это позволяет тампону выполнять Дренажную функцию рис 46 Тотальная гастроинтестиВ течение 4–7 дней.нальная интубация.
При разлитом гнойном перитоните брюшная полость дренируется четырьмя толстыми дренажами, которые проводятся через контрапертуры в правое подпеченочное и левое поддиафрагмальное пространства, в полость малого таза слева и в правый боковой канал. Вдоль срединной раны в брюшную полость проводятся 6–8 микроирригаторов для регионарной антибиотикотерапии (по 3–4 с каждой стороны).
Дренажные трубки удаляются после прекращения их функционирования, в большинстве случаев на 3–5–е сутки.
Если в послеоперационном периоде санация брюшной полости будет продолжена, характер дренирования ее несколько изменяется. Два дренажа располагают на одном из уровней верхнего этажа брюшной полости: в правом?
подпеченочном и левом подциафрагмальном пространствах. Два дренажа устанавливают в нижнем этаже брюшной полости: один в правой подвздошной ямке, другой – в малом тазу. Иногда дополнительный дренаж подводится в брюшную полость под мечевидным отростком. Брюшная полость при планируемом проведении перитонеального диализа ушивается наглухо.
Сущность послеоперационной санации брюшной полости (продолженной санации, перитонеального лаважа, брюшного диализа, перитонеального диализа) состоит в орошении ее большим количеством жидкости различного состава (содержит антисептики, антибиотики, микроэлементы и т.д.). Для большей эффективности лаважа используют диализирующие растворы с осмотическим давлением, превышающим осмотическое давление лимфы и крови. Жидкость вводится в брюшную полость через верхние дренажи, а выводится через нижние. Перитонеальный диализ показан при выполнении операции в поздние сроки (токсической и терминальной стадиях) перитонита с гнойным содержимым. Он позволяет быстро вывести экзои эндотоксины из брюшной полости и тем самым уменьшить токсические влияния на печень, почки, сердце, легкие, а также другие органы и ткани, добиться быстрого механического очищения брюшной полости, скорригировать водно–электролитные нарушения, поддержать высокую концентрацию антибиотиков в брюшной полости, в крови и лимфе.
Перитонеальный диализ проводится фракционно или проточно.
По методике фракционного перитонеального лаважа диализат вводится через верхние дренажи при закрытых нижних со скоростью 100120 капель в минуту. Заполнение брюшной полости происходит за 1–1,5 ч. Затем верхние трубки перекрываются на 1 ч. После этого открываются нижние дренажи и в течение 1–2 ч брюшная полость опорожняется от диализата. Вслед за этим нижние трубки перекрываются, а через верхние брюшная полость вновь заполняется промывным раствором. Цикл лаважа, повторяется 5–6 раз в сутки, при этом на орошение брюшной полости расходуется 8–12 л раствора.
По методике проточного перитонеального лаважа диализат поступает в брюшную полость непрерывно через верхние дренажи капельно или струйно, а оттекает через нижние. За сутки для орошения брюшной полости используется 10" 16 л раствора.
При проведении перитонеального диализа строго следят за количествами вводимого и выводимого из брюшной полости растворов, суточным диурезом, КЩР плазмы, содержанием остаточного азота, калия, натрия, общего белка и его фракций в плазме крови и в общем объеме выведенного за сутки диализата. Проводят цитологическое и бактериологическое исследования диализата. В течение первых 1–2 суток может наблюдаться дефицит вышедшего из брюшной полости раствора до 2 л в сутки. Это связано с резорбцией жидкости брюшиной на фоне имеющейся гиповолемии.
В случае значительного превышения количества введенного диализата над выведенным при хорошей проходимости дренажей к диализату добавляют 500 мл 2,5% раствора глюкозы, что увеличивает осмотическое давление промывной жидкости и уменьшает ее резорбцию. При наличии отклонений в КЩР, электролитном и белковом балансах проводят их коррекцию переливанием растворов электролитов, 4% раствора натрия гидрокарбоната (при ацидозе), калия хлорида (алкалозе), белковых растворов, крови, кровезаменителей и т.д.
Продолжительность перитонеального диализа состав' ляет 3–5 суток. Этого достаточно для достижения лечебного эффекта. Дальнейшее проведение брюшного диализа нецелесообразно из–за образования в брюшной полости сращений, препятствующих полноценному ее орошению. Вначале удаляют верхние дренажи, а через 2–3 суток и нижние.
Вместе с тем методика перитонеального диализа имеет ряд недостатков.
К ним относятся: 1. Возможное образование гидроперитонеума при плохом функционировании нижних дренажей. 2. Частое развитие несостоятельности анастомозов или ушитых перфорационных отверстий в результате снижения процессов пролиферации. 3. Осумкование промывной жидкости с последующим формированием межкишечных абсцессов.
Санация брюшной полости после операции может быть достигнута благодаря лапаростомии. Ее суть состоит в том, что после удаления гнойного очага, промывания брюшной полости и интубации кишечника, дренирования отлогих мест трубками или тампонами с мазями (левосин, левомиколь и т.д.) органы брюшной полости укрываются больигам сальником и перфорированным материалом: полиэтиленом, марлевыми салфетками. Срединная рана над ними временно закрывается путем вшивания в ее края "молниизастежки", специального лапаростомического аппарата, сведения краев раны на резиновых (полихлорвиниловых) трубках. Во время перевязок, выполняемых с интервалом 1–2 дня под общим обезболиванием, брюшная полость раскрывается, санируется, после чего вновь временно закрывается.
Более эффективным методом является формирование лапаростомы путем частичного ушивания брюшной полости, когда между краями срединной раны оставляется промежуток шириной 8–10 см. При этом под хлорвиниловые трубочки, завязываемые бантиками, подкладывается марлевая салфетка. В этих случаях создаются хорошие условия для санирования брюшной полости в послеоперационном периоде.
Лапаростомия показана при: 1. общем гнойном и каловом перитоните; 2. разлитом перитоните с выраженными явлениями эндотоксикоза; 3. наличии межкишечных абсцессов или тенденции к их образованию; 4. распространенном перитоните с множеством трудноудалимых фибринозных наложений и некротических тканей; 5. формировании анастомозов в вынужденных условиях при распространенном перитоните; 6. повторных релапаротомиях в связи с перитонитом; 7. перитоните, сочетающемся с низкими кишечными свищами, если невозможно вывести их на переднюю брюшную стенку.
Показаниями к ушиванию лапаротомной раны являются: 1. Исчезновение признаков токсикоза и локальных проявлений инфекции в брюшной полости. 2. Восстановление двигательной активности кишечника. 3. Улучшение общего состояния больных с тенденцией к нормализации различных показателей гомеостаза.
Применение лапаростомии позволило снизить летальность от перитонита по сравнению с традиционным методом в 2–4 раза.
В послеоперационном периоде осуществляется комплексная антибактериальная терапия с учетом чувствительности обнаруженной в перитонеальном экссудате микрофлоры. Эффективно введение антибактериальных препаратов внутриартериально, внутривенно, лимфогенно (эндолимфатически – через лимфатические сосуды или узлы и лимфотропно – в ткани, окружающие элементы лимфатической системы). Проводятся инфузионная коррекция водно–электролитных нарушений, симптоматическое лечение, полноценное парентеральное питание, а при появлении признаков восстановления моторно–эвакуаторной функции кишечника и энтерального – через интубационные трубки. В целях быстрейшего выведения токсинов применяются форсированный диурез, методы экстракорпоральной детоксикации в различных комбинациях (гемосорбция, плазмаферез, гемодиализ, УФО крови, экстракорпоральное подключение ксеноселезенки и т.д.). Используются гипербарическая оксигенация, внутрисосудистое лазерное облучение крови. В раннем послеоперационном периоде оправдано применение кишечного диализа (лаважа) и энтеросорбции. Эти методы позволяют быстро санировать кишечник и одновременно за счет секвестрации токсинов из сосудистого русла стенки в просвет кишки уменьшить степень токсемии.
Во время диализа кишечник промывается через интубационную трубку фракционно 2–12 раз в сутки под контролем ЦВД 400–800 мл смеси, состоящей из изотонического раствора натрия хлорида, 5–10% раствора глюкозы, фурацилина, с последующей аспирацией жидкости или ее самостоятельной эвакуацией.
Сущность энтеросорбции заключается во введении в просвет кишки специальных сорбентов. Для стимуляции двигательной функции желудочно–кишечного тракта 2–3 раза в сутки в течение первых 3–4 дней осуществляется зондовая аспирация желудочного содержимого. Назначаются ингибиторы холинэстеразы (прозерин), проводится электростимуляция кишечника (внутрипросветная, накожная).
Прогноз при перитоните определяется характером вызвавшего воспаление брюшины основного заболевания, распространенностью перитонита, объемом и эффективностью проводимого лечения. Нередко течение перитонита осложняется образованием кишечных свищей, открывающихся в брюшную полость, свищей забрюшинного отдела двенадцатиперстной кишки с обширными забрюшинньши флегмонами; пневмониями; абсцессами легких.
Последние комментарии
1 день 6 часов назад
1 день 6 часов назад
1 день 6 часов назад
1 день 6 часов назад
1 день 9 часов назад
1 день 9 часов назад