Ваниль [Эрик Оду] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Ваниль Редакторы Эрик Оду и Мишель Гризони
Эта книга посвящена памяти доктора Мигеля Анхеля Сото Аренаса (1963–2009).Фото на обложке: Слева: Обработка зрелых стручков Vanilla planifolia © Michel Grisoni, CIRAD. Справа: Vanilla planifolia в полном цвету © René Carayol, Région Réunion.
Предисловие
Ваниль – наследие Мексики, как и шоколад, один из основных мировых деликатесов. Она – компонент множества сладостей, мороженого и кола-напитков. Запах ванили ценится большинством людей во всем мире в любой концентрации. Это большой рынок, объемом почти полмиллиарда евро в год – и всего лишь несколько стран производят стручки этой тропической орхидеи. Орхидеи, с особыми требованиями к почве и климату, чувствительной к вредителям и болезням и имеющей мало генетических отличий в регионах выращивания из-за исключительно вегетативного размножения. При этом некоторые из основных регионов, такие как Мадагаскар, регулярно подвергаются тропическим штормам. Всё это делает ваниль уязвимой культурой и приводит к значительным ежегодным изменениям цен. Кроме того, зеленые стручки нуждаются в сложной процедуре обработки, в результате которой получается конечный продукт – стручки темного цвета, содержащие большое количество ванилина. Этот процесс до сих пор недостаточно изучен, хотя он имеет решающее значение для возникновения аромата ванили. Проблема с поставками привела к усилиям по запуску производства в других регионах, и даже в теплицах, а также к поиску других источников ванилина. Поскольку основные потребители – пищевая промышленность и производство напитков, предпочтительным источником является природный, а значит, ванилин произведенный другими растениями или микроорганизмами, включая микробную биоконверсию предшественников ванилина. Поэтому ванилин, как природного, так и синтетического происхождения, доступен в чистом химическом виде. Однако, чистое соединение не дает того же аромата, что стручки ванили или их экстракты. Из-за большой разницы в цене между такими товарами – фальсификация не редкость. Этот очень краткий очерк предваряет рассказ о существовании разнообразных исследований. Они включают в себя биотехнологию, направленную на поиск новых методов производства ванилина, агробиологические исследования для повышения урожайности и устойчивости растений к болезням, энтомологию для поиска возможных опылителей, необходимых в районах за пределами первоначальной среды обитания, исследования химии и биохимии процесса обработки и, к сожалению, продвинутую аналитическую химию, позволяющую идентифицировать фальсификации – стручки с добавлением ванилина и синтетический ванилин вместо натурального. Книга же дает отличный обзор по этим темам. Все главы написаны экспертами, каждый из которых имеет многолетний опыт работы в своей области. Она показывает прошлое, настоящее и будущее ванили и, без сомнения, будет долгие годы служить исчерпывающим источником сведений и стандартным справочником для тех, кто интересуется этой деликатной культурой, включая производителей, флейвористов, исследователей и потребителей. Роб Верпоорте Кафедра фармакогнозии/метаболомики Лейденского университета Лейден, НидерландыГлава 1. Ванилоидные орхидеи Систематика и эволюция
Введение
Ваниль и её родственники – выжившие представители древней линии цветковых растений. Многие из них обитают в отдаленных районах, а некоторым угрожает исчезновение. Мы, конечно, много знаем о Vanilla planifolia – о методах выращивания, болезнях, поражающих окультуренные лианы, и способах обработки стручков – но фундаментальная естественная история всего рода Vanilla и его ближайших родственников все еще плохо известна. Систематическое изучение этих растений было и остается предметом споров. По этим причинам обнадеживает тот факт, что в последние годы возрос уровень знаний об их классификации и эволюции, что произошло в первую очередь благодаря широкому использованию данных на основе ДНК в систематических исследованиях (например, см. Cameron, 2003, 2004, 2006 г.). Ванилоидные орхидеи оказалось трудно классифицировать в рамках какой-либо конкретной подтрибы, трибы или подсемейства семейства орхидные до конца двадцатого века. С одной стороны, у них есть полностью пригнутый, единственный пыльник, как у различных передовых линий орхидей. С другой стороны, они демонстрируют множество признаков, которые среди орхидей рассматриваются как примитивные. Ботаники теперь считают, что единственный пыльник на апексе колонки цветка ванили поднялся в результате эволюционного процесса, отличного от эволюционного процесса почти всех других орхидей (т.е. по этой и другим причинам, упомянутым ниже, ваниль и родственные ей орхидеи теперь классифицируются в рамках своего собственного уникального подсемейства Vanilloideae, как показано на рисунке 1.1.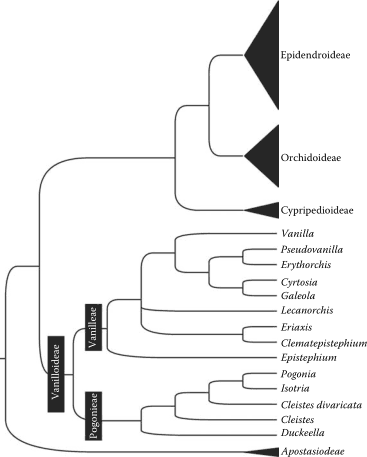 РИСУНОК 1.1. Кладограмма, изображающая филогенетические взаимоотношения между подсемействами Orchidaceae и между родами Vanilloideae, на основе комбинации данных о последовательностях ядерной, митохондриальной и пластидной ДНК. Подсемейство делится на две трибы: Pogonieae и Vanilleae. Обратите внимание, что Vanilla имеет общего предка с кладой из четырех родов, включая Galeola и Pseudovanilla.
РИСУНОК 1.1. Кладограмма, изображающая филогенетические взаимоотношения между подсемействами Orchidaceae и между родами Vanilloideae, на основе комбинации данных о последовательностях ядерной, митохондриальной и пластидной ДНК. Подсемейство делится на две трибы: Pogonieae и Vanilleae. Обратите внимание, что Vanilla имеет общего предка с кладой из четырех родов, включая Galeola и Pseudovanilla.
По мере того, как мы продвигаемся дальше в двадцать первый век и в эру геномики, нет никаких сомнений в том, что селекционеры будут стремиться улучшить ваниль как культурное растение, используя генетические модификации. При любых будущих генетических исследованиях структуры и развития цветка и/или плода ванили следует внимательно изучить другие роды Vanilloideae с общим происхождением, а не проводить прямые сравнения только с более отдаленными родственными орхидеями или другими цветущими растениями. Такие сравнения могут вводить в заблуждение предположением о гомологии. Этот момент лучше всего понять, если учесть, что за более чем 65 миллионов лет ванилоидные орхидеи адаптировались к различным специализированным средам обитания, опылителям и стратегиям распространения семян. Все они имеют общий фундаментальный геном, основанный на ныне вымершем предке, и всё же различия в экспрессии и регуляции генов в конечном итоге определяют – обитает ли данная ванилоидная орхидея в тропиках или выдерживает температуру значительно ниже нуля, растет ли она как прямостоячая трава или как лиана и даст ли она сухую безвкусную коробочку или ароматный мясистый плод. Поскольку геномная и протеомная технологии со временем применяются и к культурным растениям, имеющим меньшую экономическую ценность (по сравнению, например, с зерновыми и бобовыми), то исследования, направленные на улучшение ванили, могут также пожелать рассмотреть другие виды трибы Vanilleae или подсемейства Vanilloideae. К примеру, можно было бы создать более устойчивые к холоду и тени ванильные лианы, сначала изучив физиологию и генетический состав Cyrtosia, близкого родственника, который выживает в лиственных лесах Японии и Китая. На основе этих аргументов здесь представлен обзор систематики (научного изучения разнообразия и классификации) ванилоидных орхидей, чтобы подготовить почву для более полного понимания биологии V. planifolia и этих исключительных орхидей.
Эволюция ванилоидных орхидей
Среди биологов сохранилась необоснованная гипотеза о том, что семейство орхидей появилось сравнительно недавно по сравнению с другими цветковыми растениями. В поддержку этого мнения ботаники ссылаются на относительно низкий уровень генетического разнообразия среди родов и видов орхидей, многие из которых можно легко гибридизировать друг с другом. Они приводят в свидетельство то, что геологически молодые Анды в Южной Америке и высокогорья Новой Гвинеи являются центрами наибольшего разнообразия орхидей. Тесная связь между орхидеями и социальными пчелами, которые, как считается, эволюционировали намного позже, чем другие насекомые, также является доказательством, а тот факт, что большинство родов орхидей встречается либо в палеотропиках, либо в неотропиках, но редко в пантропиках, указывает некоторым, что Orchidaceae эволюционировала совсем недавно и определенно спустя долгое время после разделения сегодняшних континентов. Молекулярно-филогенетические исследования Vanilloideae ставят под сомнение представление о том, что все семейство орхидей появилось недавно, и новые взгляды на систематику орхидных принижают или даже противоречат некоторым фактам, упомянутым выше. Например, Vanilla – один из немногих родов орхидей с трансокеанским распространением, которое не может быть полностью связано с распространением на большие расстояния. Существующие виды обитают в Северной и Южной Америке, Африке и Азии (см. рис. 1.2). Тот факт, что ванилоидные орхидеи выживают в районе Гайанского щита в Южной Америке, в тропической Австралии и Африке, на Мадагаскаре и на острове Новая Каледония (невулканический остров в Тихом океане со своеобразной древней флорой, отделившийся от Гондваны около 65 миллионов лет назад), может также свидетельствовать об их значительном возрасте и возможном статусе древних реликтов (Cameron, 1999, 2000). РИСУНОК 1.2. Палеотропическое распространение Vanilla и оценки видового разнообразия в каждом географическом регионе.
РИСУНОК 1.2. Палеотропическое распространение Vanilla и оценки видового разнообразия в каждом географическом регионе.
Кроме того, подсемейство Vanilloideae расположено рядом с основанием генеалогического древа орхидей, а Orchidaceae является основным семейством в рамках большого отряда однодольных Asparagales (включая лук, агавы, гиацинты и семейство ирисов, среди прочего). При оценке эволюционного возраста этих растений с помощью молекулярных часов было подсчитано, что Orchidacaeae может прослеживать свое происхождение, по крайней мере, на 76–119 миллионов лет (Janssen and Bremer, 2004; Ramirez et al., 2007). Ванилоидным орхидеям, в свою очередь, не менее 62 миллионов лет. Молекулярные часы могут показывать только минимальный возраст, поэтому эти растения, вероятно, даже старше. Критическим для этого подхода является использование точки калибровки для «часов», которая, в случае Orchidaceae, была предоставлена ископаемым образцом пыльцы орхидей возрастом 15-20 миллионов лет, прикрепленным к вымершей пчеле, сохранившейся в янтаре (Ramirez et al., 2007).
Подсемейство Vanilloideae среди орхидей
Как уже упоминалось, ванилоидные орхидеи, Vanilloideae, были признаны подсемейством Orchidaceae только в последнее десятилетие, поскольку для переоценки взаимосвязей между всеми орхидеями использовались данные ДНК. Кэмерон представил подробный обзор этой ДНК-управляемой революции в систематике орхидей с 1997 по 2007 год (Cameron, 2007). Существующие системы классификации орхидей делят орхидные на пять подсемейств (например, Chase et al., 2003). Самое крупное из них, насчитывающее около 650 родов и 18 000 видов – это Epidendroidae, в котором преобладают тропические эпифиты и орхидеи, наиболее высоко ценимые как декоративные растения. Orchidoideae, второе по величине подсемейство, состоит почти исключительно из наземных видов, относящихся примерно к 200 родам. Оба подсемейства характеризуются однотычинковыми цветками (то есть имеют только один пыльник). Все виды подсемейства Vanilloideae также обладают цветками с одним пыльником, но считается, что это состояние развилось независимо от Orchidoideae и Epidendroidae и является результатом уникального способа развития цветков (Freudenstein et al., 2002). Другими словами, уменьшение количества тычинок/пыльников с нескольких (вероятно, с шести до трех и, в конечном итоге, до одного) произошло внутри Orchidaceae как минимум два раза. Считается, что в процессе эволюции цветки орхидей претерпели значительные структурные изменения, в результате которых появились цветы с выраженной двусторонней симметрией, потерей тычинок и слиянием оставшихся тычинок с пестиком, с образованием центральной колонки. Ключ к объяснению начала этого гипотетического эволюционного континуума можно найти сегодня, исследуя живых представителей четвертого подсемейства орхидей, Apostasioideae, которое включает два рода: Neuwiedia и Apostasia. Виды Neuwiedia обладают цветками с тремя пыльниками. Они лишь частично срослись с основанием пестика, а околоцветник цветка лишь слегка двусторонний по симметрии. Апостазиоидные орхидеи во многих отношениях могут рассматриваться как наиболее «примитивные» из всех орхидей, поскольку они показывают наименьшее количество модификаций по сравнению с основным планом гипотетического предка однодольного растения до орхидеи. Диандрозные цветы (то есть с двумя пыльниками) определяют пятое подсемейство орхидей Cypripedioideae. Эту группу, насчитывающую около 120 видов, обычно называют «орхидеями башмачками». По относительным размерам Cypripedioideae более разнообразно, чем Apostasioideae (15 видов), но менее разнообразно, чем Vanilloideae (200 видов), которые будут рассмотрены ниже. До того, как они были классифицированы как собственное подсемейство Orchidaceae, большинство ванилоидных орхидей считались примитивными членами моноандрозного подсемейства Epidendroidae, но это было несколько неубедительно. Фактически, в домолекулярной системе классификации орхидей Дресслера (1993) многие из ванилоидных орхидей были перечислены под категорией insertae sedis (что означает «неопределенный статус»). Одно время даже высказывалось предположение, что их лучше всего рассматривать как отдельное самобытное семейство Vanillaceae, тесно связанное с Orchidaceae, но отдельное от него (Lindley, 1835). Отчего неопределенность? Смесь ванилоидных орхидей, которые характеризуются как примитивными, так и продвинутыми признаками у цветков, может считаться источником величайшей путаницы. Их точное положение среди орхидей в конечном итоге было выяснено путем сравнения информации о последовательностях ДНК, и одним из самых неожиданных результатов первых молекулярно-филогенетических исследований орхидей было перемещение ванили и её родственников из положения среди других орхидей с единственным пыльником, к месту у основания генеалогического древа орхидей (Cameron et al., 1999). Признание Vanilloideae как монофилетического подсемейства помогло решить одну из наиболее сложных загадок систематики орхидей.Видовое разнообразие внутри Vanilla
Внутри Vanilloideae насчитывается не менее 15 родов, но Vanilla – самый разнообразный из них. Формальная монография этого рода еще не опубликована, но существует таксономическая трактовка Vanilla, в которой учитывались все виды, известные в то время (Portères, 1954). К сожалению, этот трактат был написан более 50 лет назад. Совсем недавно, посмертно, был опубликован таксономический синопсис Vanilla, основанный на работе покойного мексиканского ботаника Мигеля А. Сото Аренаса (Soto Arenas and Cribb, 2010). В рамках этой важной предварительной работы представлены ключи к видам, информация о географическом распространении и списки избранных экземпляров. Это стало значительным шагом на пути к обновлению систематической трактовки этого рода. Более подробно 15 видов мексиканских и центрально-американских видов были рассмотрены в другой посмертно опубликованной работе Сото Аренаса (Soto Arenas and Dressler, 2010). В этой статье можно найти подробные описания, иллюстрации и информацию о молекулярных характеристиках мезоамериканских видов. Текущий всемирный контрольный список всех видов орхидей сегодня включает 110 видов Vanilla (Govaerts et al., 2008). Большинство из них (61 вид) – неотропические уроженцы Южной Америки, Центральной Америки, Карибских островов и южной Флориды. В Африке зарегистрировано 23 местных вида, по крайней мере пять из которых обитают на Мадагаскаре. Остальные виды ванили встречаются на Индийском субконтиненте и по всей тропической Юго-Восточной Азии. Ни один вид ванили не является родным для Австралии. Точно так же, Полинезия и другие океанические острова Тихого океана не имеют местных видов ванили. Некоторых это сбивает с толку, поскольку «таитянская ваниль» культивируется по всему Тихому океану, а её научное название, Vanilla tahitensis, подразумевает, что она является коренным обитателем острова Таити во Французской Полинезии. Однако, то, что было описано более 75 лет назад как новый «вид» ванили (Moore, 1933), оказалось не более чем первичным гибридом между неотропическими V. planifolia (материнское растение) и V. odorata (отцовское растение) (Lubinsky et al., 2008). Что касается классификации видов в пределах рода Vanilla, они были формально разделены на две возможные секции Рольфом (Rolfe, 1896). Первая ванильная секция Aphyllae, была построена для размещения всех безлистных видов этого рода (например, V. aphylla, V. barbellata, V. roscheri и других). Виды из этого раздела растут на материковой части Африки, Мадагаскаре, Юго-Восточной Азии, а также на островах в Карибском бассейне. Хотя некоторые из этих видов дают мясистые плоды, нет никаких доказательств того, что какой-либо из них ароматный. Совместная классификация этих видов Рольфом подразумевает, что они имеют недавнего общего предка, но молекулярные исследования показали, что это не так (Cameron, 2005). Вместо этого, по-видимому, существует как минимум три независимых случая потери листьев у ванили – один раз в Африке, один раз в Карибском бассейне и, по крайней мере, один раз в Азии. Таким образом, эта секция не является монофилетической, а представляет собой искусственное объединение видов с общей вегетативной морфологией, полученной в результате конвергентной эволюции. Согласно современным правилам естественной классификации, её не следует признавать формально. Для остальных видов, не отнесенных к ванильной секции Aphyllae, Рольф создал секцию Foliosae. Как видно из названия, все они с листьями. Это большая группа видов, и поэтому Портер разделил эту секцию на подсекции (Portères, 1954). Секция Foliosae подсекция Membranaceae – небольшой кластер видов, характеризующихся тонкими стеблями, тонкими листьями, короткими воздушными корнями и цветками, у которых лабеллум не сливается с колонкой. Лабеллум также лишен сложных щетинок, волосков и чешуек, характерных для других видов Vanilla, а плоды имеют тенденцию сохнуть на лианах и расслаиваться вдоль. Примером этой секции служит Vanilla mexicana, и молекулярные систематические исследования показали, что эта группа является наиболее примитивной из всех видов Vanilla. Эти растения очень трудно культивировать, вероятно потому что они тесно связаны с микоризными грибами, и нет никаких доказательств того, что плоды производят ароматный ванилин. Другие оставшиеся виды рода, включая V. planifolia и V. pompona, были отнесены либо к Vanilla секция Foliosae, подсекция Lamellosae, либо к подсекции Papillosae. Первая группа названа так потому, что виды в этой секции характеризуются цветками со сплюснутыми чешуевидными отростками (ламеллами), волосками, щетинками и сложным орнаментом на их лабеллумах, которые всегда сливаются с колонкой по краям, образуя цветочную трубку. Последняя подсекция был предложена для тех видов, для которых характерны мясистые листья и цветы, обычно с толстыми трихомами, расположенными в центре лабеллума, но без пластинчатых чешуек. Виды в этой листовой секции имеют пантропическое распространение, но недавние молекулярные систематические исследования показали, что эта группа также является искусственной. Вместо этого виды Vanilla группируются в основном по географическому происхождению, как показано на рисунке 1.3. В частности, все виды Старого Света (из африканских и азиатских палеотропиков) имеют общего предка вместе с безлистными видами Нового Света. Вероятно, когда-то в прошлом они расселились из Африки по Карибскому бассейну. Все остальные неотропические виды, включая V. planifolia, имеют разных общих предков. Именно в этой группе находятся ароматные плоды, вырабатывающие значительное количество ванилина. Таким образом, группа была неофициально названа «неотропическими ароматными лиственными видами». Обратите внимание, что молекулярные исследования помещают V. tahitensis в эту группу неотропических родственников, тем самым подтверждая гибридное происхождение таитянской ванили Старого Света, многие особи которой являются тетраплоидами, от родителей из Нового Света. РИСУНОК 1.3. Филогенетические отношения между избранными видами ванили. Кладограмма основана на данных о молекулярных последовательностях различных генов, включая ITS ядерных рибосом, пластид rbcL, matK, rpoC1 и других. Гибридное происхождение V. tahitensis от скрещивания V. odorata и V. planifolia выделено пунктирными линиями. Неформальные клады и субклады помечены на ветви, представляющей общего предка каждой основной группы видов.
РИСУНОК 1.3. Филогенетические отношения между избранными видами ванили. Кладограмма основана на данных о молекулярных последовательностях различных генов, включая ITS ядерных рибосом, пластид rbcL, matK, rpoC1 и других. Гибридное происхождение V. tahitensis от скрещивания V. odorata и V. planifolia выделено пунктирными линиями. Неформальные клады и субклады помечены на ветви, представляющей общего предка каждой основной группы видов.
В своем недавнем синопсисе рода, Сото Аренас и Крибб классифицировали 106 видов и предложили новую внутриродовую классификацию ванили, основанную в первую очередь на молекулярных филогенетических реконструкциях (Soto Arenas and Cribb, 2010). Виды с кожистыми листьями классифицируются как Vanilla подрод Vanilla, который состоит из двух неформальных «групп». Второй подрод, Vanilla подрод Xanatha был создан для оставшейся части видов. Название основано на индейском названии ванили мексиканскими тотонаками – «ксанат». Этот подрод далее делится на пару секций: Xanatha и Tethya. Первая соответствуют преимущественно лиственным неотропическим видам и делится на шесть неформальных групп (например, группа V. palmarum и группа V. pompona). Последняя почти полностью палеотропическая по распространению, за исключением карибских безлистных видов. Эти таксоны сгруппированы в неформальную единицу (группа V. barbellata) вместе с 11 другими группами, включенными в секцию (например, группа V. phalaenopsis и группа V. africana).
Многообразие родов внутри Vanilloideae: Триба Vanilleae
Изучив отношения более высокого порядка между подсемействами Orchidaceae и отношения более низкого порядка между видами в пределах Vanilla, давайте теперь рассмотрим отношения между родами Vanilloideae. Примеры этих родов показаны на рисунке 1.4. Подсемейство делится на две трибы, первая из которых – Vanilleae. Помимо самой ванили, эта триба насчитывает восемь других тропических родов. Два из них, Eriaxis и Clematepistephium, являются эндемиками изолированного тихоокеанского острова Новая Каледония. Оба рода монотипны, то есть каждый содержит только один вид. Необычным аспектом одного из этих двух видов является то, что Clematepistphium smilacifolium растет в густой тени тропических лесов Новой Каледонии как лиана. Однако, в отличие от видов ванили, лианы Clematepistphium не производят воздушных корней. Вместо этого они взбираются, обвивая стволы небольших деревьев. На их крупных кожистых листьях видны сетчатые (решетчатые) узоры жилкования, а не исключительно параллельные, как мы видим у большинства орхидей и других однодольных растений (Cameron and Dickison, 1998). Два эндемика Новой Каледонии, описанные выше, когда-то классифицировались как виды рода Epistephium, но теперь этот род из 20 видов считается распространенным исключительно в Южной Америке. Большинство его видов представляют собой прямостоячие травы, произрастающие в открытых саваннах, и чаще всего встречаются в бедных питательными веществами районах Бразилии и Венесуэлы. Некоторые были описаны как свободно взбирающиеся по окружающей растительности, но ни один из них не является настоящим лазящим растением. Листья Epistephium имеют сетчатое жилкование, как и у их новокаледонских родственников, а потрясающие цветы в основном темно-розовые или фиолетовые. Однако, как и большинство ванилоидных орхидей, их практически невозможно выращивать. Плоды этих орхидей представляют собой коробочки, которые растрескиваются, чтобы высвободить семена с круглыми крылышками, характерными у Orchidaceae только среди Vanilloideae (Cameron and Chase, 1998). РИСУНОК 1.4. Репрезентативные роды подсемейства Vanilloideae, «ванилоидные орхидеи». (a) Pogonia ophioglossoides из США; (b) Pseudovanilla foliata из Квинсленда, Австралия; (c) Epistephium elatum из Эквадора; (d) Erythrorchis cassythoides из Нового Южного Уэльса, Австралия; e) лиана и лист Clematepistephium smilacifolium с сетчатым жилкованием из Новой Каледонии; и (f) Eriaxis rigida из Новой Каледонии.
РИСУНОК 1.4. Репрезентативные роды подсемейства Vanilloideae, «ванилоидные орхидеи». (a) Pogonia ophioglossoides из США; (b) Pseudovanilla foliata из Квинсленда, Австралия; (c) Epistephium elatum из Эквадора; (d) Erythrorchis cassythoides из Нового Южного Уэльса, Австралия; e) лиана и лист Clematepistephium smilacifolium с сетчатым жилкованием из Новой Каледонии; и (f) Eriaxis rigida из Новой Каледонии.
Крылатые семена также встречаются у трех других родов ванилоидных орхидей: Pseudovanilla, Erythrorchis и Galeola. Все они тесно связаны между собой и происходят из Юго-Восточной Азии, Северо-Восточной Австралии и нескольких островов Тихого океана. Все три этих рода – безлистные вьющиеся лианы, два из которых (Erythrorchis и Galeola) полностью лишены хлорофилла. Эти нефотосинтетические роды паразитируют исключительно на грибах, и этот образ жизни технически известен как микогетеротрофия. Безлистный род Pseudovanilla похож на два других в большинстве аспектов, но в конечном итоге развивает зеленый пигмент в своих стеблях, даже если может существовать в предположительно нефотосинтетическом состоянии на ювенильных стадиях своего жизненного цикла. Недавние исследования показали, что эти орхидеи являются ближайшими из ныне живущих родственников ванили (Cameron and Molina, 2006). Они взбираются с помощью воздушных корней, образующихся на каждом узле стебля, как ваниль, а их цветы удивительно похожи на цветы видов Vanilla. Их плоды, однако, предназначены для размещения крылатых семян, поэтому к зрелости становятся сухими, растрескивающимися и неароматными. Два других рода Vanilloideae – нефотосинтезирующие микогетеротрофы: Cyrtosia и Lecanorchis. Оба растут как прямостоячие травы в лесных районах Юго-Восточной Азии, и оба имеют ряд общих признаков с Vanilla, что затрудняет их классификацию в подсемействе. Например, плоды Cyrtosia похожи на плоды ванили тем, что они мясистые и содержат мелкие, черные, сферические, тонкокорые семена, но, как правило, эти плоды ярко-красные, чтобы привлечь птиц или млекопитающих-распространителей (Nakamura and Hamada, 1978). Маленькие цветки Lecanorchis по структуре похожи на многие виды Vanilla в том, что лабеллум сливается с колонкой по краям, образуя цветочную трубку. Также, как и у многих видов ванили, лабеллум Lecanorchis украшен характерными щетинками и волосками, но плоды Lecanorchis представляют собой сухие коробочки без запаха, содержащие многочисленные пылеподобные семена с длинными тонкими придатками. Имеет смысл дальнейшее изучение естественной истории всех этих родов.
Разнообразие родов внутри Vanilloideae: Триба Pogonieae
Вторая триба в подсемействе Vanilloideae – Pogonieae, включает тропических представителей, а также полдюжины видов умеренного климата. Триба делится на четыре или, возможно, пять родов. Pogonia – один из родов умеренного климата и необычен тем, что его виды не пересекаются между восточной частью Северной Америки (один вид, P. ophioglossoides) и восточной Азией (3-5 видов). Эти растения чаще всего встречаются в кислых болотах, по краям озер и во влажных саваннах. Род Isotria также родом из Северной Америки, в частности, восточной части Соединенных Штатов. В этом роду два вида, оба из которых характерны среди орхидей тем, что листья у них расположены по пять или шесть в мутовке. Эти растения представляют собой весенние эфемеры, обитающие в лиственных лесах, быстро отрастающие и размножающиеся до того, когда кроны деревьев полностью сомкнутся в летние месяцы. Еще один род, Cleistes, имеет представителей в Северной Америке с умеренным климатом. Большинство видов этого рода (более 30 видов) произрастают в тропиках Южной Америки, где они чаще всего встречаются в открытых саваннах, испытывающих сезонные периоды засухи. Они снабжены подземными клубнями, которые предположительно позволяют им выжить, ежегодно переходя в состояние покоя. Однако, один из видов этого рода, Cleistes divaricata, растет на юго-востоке США. Подробные систематические исследования Pogonieae и ванилоидных орхидей показывают, что этот вид лучше рассматривать как отдельный род (Cameron and Chase, 1999). Последний род Pogonieae – это Duckeella, включающий один или, возможно, два вида коренных обитателей Венесуэлы и северной Бразилии. Род отращивает длинные линейные листья и ярко-желтые цветы, которые возвышаются над влажными лугами и местами обитания в саванне. Иногда его можно найти в зарослях плавающей растительности.Последние мысли
Ванилоидные орхидеи – чрезвычайно разнообразная группа цветковых растений. Несмотря на то, что наибольшее количество исследований было сосредоточено на V. planifolia, важно осознать и оценить, что это только один вид из рода, который адаптировался к различным средам обитания, живет в больших или меньших партнерских отношениях с грибами, проявляет разнообразные привычки роста, полагается на разных опылителей и развивает цветы различной формы (см. рис. 1.5). Другими словами, V. planifolia может быть единственным видом орхидей, имеющим значительную сельскохозяйственную ценность (из более чем 25 000 встречающихся в природе видов), но он не является полностью уникальным в семействе. Скорее, это всего лишь один из примерно 110 видов рода Vanilla, похожих друг на друга и при этом друг от друга отличающихся. Кроме того, Vanilla – это только один из 15 родов, которые классифицируются в подсемействе орхидей Vanilloideae («ванилоидные орхидеи»), и некоторые из них также примечательны, как и ваниль, с точки зрения моделей роста, структуры цветка и механизмов распространения семян. К сожалению, эти орхидеи обычно не замечаются биологами и специалистами в области производства ванили, которые знают только о V. planifolia. Многие из родов и видов, обсуждаемых в этой главе, редки и находятся под большой угрозой исчезновения, прежде всего из-за разрушения среды обитания. Дальнейшее понимание и изучение их разнообразия дает надежду на их выживание и эволюцию еще на 70 миллионов лет. РИСУНОК 1.5. Представители видов Vanilla. (a) Vanilla phaeantha; (b) Vanilla kinabaluensis; (c) Vanilla aphylla; (d) Vanilla mexicana; (e) Vanilla mexicana в плодах с видимыми семенами; (f) Vanilla odorata.
РИСУНОК 1.5. Представители видов Vanilla. (a) Vanilla phaeantha; (b) Vanilla kinabaluensis; (c) Vanilla aphylla; (d) Vanilla mexicana; (e) Vanilla mexicana в плодах с видимыми семенами; (f) Vanilla odorata.
Глава 2. Эволюционные процессы и многообразие в роде Vanilla
Введение
Многообразие рода Vanilla Plumier ex Miller кажется комплексным со многих сторон. Во-первых, его систематика запутана, а разграничение видов неясно. Во-вторых, на внутривидовом уровне генетическое разнообразие часто не коррелирует с фенотипическим. На данный момент доступен значительный объем данных, позволяющих по-новому взглянуть на возможные эволюционные процессы, ответственные за эволюцию и многообразие рода. Эти процессы подробно описаны и их значение для сохранения видов и улучшения качества ванили обсуждается.Запутанная таксономия
Как показали недавние молекулярно-филогенетические исследования, Vanilla – древний род в семействе Orchidaceae, подсемействе Vanilloidae, трибе Vanilleae и подтрибе Vanillinae, (Bory et al., 2008c; Cameron, 2004, 2005; см. главу 1). Виды ванили естественным образом распространены по всей Америке, Африке и Азии и Океании между 27-й северной и южной параллелями. Портер описал 110 видов рода Vanilla (Portères, 1954), число которых сократилось до 90 (Cameron and Chase, 1999) и до 107 (Soto Arenas, 2003). Также добавились новые виды, такие как семь дополнительно предложенных американских видов (Soto Arenas, 1999, 2006, 2010) или V. shenzenica, недавно описанная в Китае (Liu et al., 2007). Всего же на сегодняшний день описано более 200 видов ванили, но остаются многочисленные синонимы (Bory et al., 2008c). Таксономическая классификация основана на морфологических вариациях (Portères, 1954), а такие вегетативные и цветочные признаки сильно зависят от окружающей среды. В частности, вегетативные признаки (листья, стебли) значительно варьируют на внутривидовом уровне, что затрудняет таксономическую идентификацию (рис. 2.1). Примером этого является отсутствие надежных сертификатов на гербарии и часто отсутствие цветов (см. главу 4). Поэтому, таксономия Vanilla значительно выиграет от развития молекулярной филогенетики, которая уже показала, что секции и подсекции, используемые в таксономическом описании видов Портером, не имеют филогенетической ценности (Bouetard, 2007; Soto Arenas, 2003). Так, на основе кладистического анализа морфологических и молекулярных данных, недавно была предложена новая внутриродовая классификация Vanilla для 106 изученных видов, разделившая род Vanilla на два подрода: Vanilla и Xanata (разделенный на секции Xanata и Tethya) (Soto Arenas and Cribb, 2010). Также предлагаются новые ключи для 15 мексиканских и центрально-американских видов (Soto Arenas and Dressler, 2010) и, в большей степени, для внутриродовой таксономической идентификации в рамках Vanilla. Эта недавняя работа представляет собой решающий и важный шаг на пути к полному таксономическому пересмотру рода. РИСУНОК 2.1. Морфологические вегетативные признаки у видов ванили из коллекции CIRAD на острове Реюньон (см. главу 3): (а) типичный образец листа для некоторых видов; (b) анализ основных компонентов вегетативных признаков (лист и стебель), измеренных у разных видов, показывающий важность внутривидовых вариаций, ведущих к перекрытию видов.
РИСУНОК 2.1. Морфологические вегетативные признаки у видов ванили из коллекции CIRAD на острове Реюньон (см. главу 3): (а) типичный образец листа для некоторых видов; (b) анализ основных компонентов вегетативных признаков (лист и стебель), измеренных у разных видов, показывающий важность внутривидовых вариаций, ведущих к перекрытию видов.
Внутривидовое разнообразие
После открытия Америки Христофором Колумбом, ароматический вид Vanilla planifolia G. Jackson, syn. V. fragrans (Salisb.) Ames – основной источник коммерческой ванили – был распространен из области её происхождения (Мексика). Плантации легко создавались черенками, но производство стручков потерпело неудачу из-за отсутствия естественных опылителей в районах интродукции. В 1841 году простой метод опыления ванили вручную был открыт рабом Эдмоном Альбиусом на острове Реюньон, и черенки ванили быстро распространились с острова Реюньон по району Индийского океана и всему миру (Bory et al., 2008c; Kahane et al., 2008; см. главу 17). Вследствие такой истории распространения, на плантациях ванили по всему миру наблюдаются чрезвычайно низкие уровни генетического разнообразия, как показали недавние молекулярно-генетические исследования (Besse et al., 2004; Bory et al., 2008b, 2008d; Lubinsky et al., 2008a; Minoo et al., 2007; Sreedhar et al., 2007), что предполагает единственное клональное происхождение культурной ванили. Этот клон мог соответствовать лектотипу, переданному маркизом Бландфордом в коллекцию Чарльза Гревилля в Паддингтоне в начале девятнадцатого века (Portères, 1954). Черенки были отправлены в ботанические сады Парижа (Франция) и Антверпена (Бельгия), откуда эти образцы распространились по всему миру (Bory et al., 2008c; Kahane et al., 2008). Поэтому удивительно наблюдать существенное морфологическое разнообразие у V. planifolia, в таких районах интродукции, как остров Реюньон, для культуры с клональным происхождением и вегетативно размножаемой черенками (Bory et al., 2008b, 2008c, 2008d). Все эти наблюдения поднимают важные вопросы относительно процессов, которые могут быть вовлечены в эволюцию и разнообразие ванили. Некоторые из ключевых процессов, которые были идентифицированы к настоящему времени, и объяснения того, как они могут обеспечить генетическую и таксономическую сложность, наблюдаемую у Vanilla, обсуждаются .Вегетативное и половое размножение
Для большинства видов Vanilla вегетативный рост, происходящий естественным образом из стеблевых черенков, является преобладающим репродуктивным способом и представляется эффективной стратегией, принятой растением для развития колоний (Portères, 1954) (рис. 2.2). Как сообщается – для видов V. bahiana Hoehne (Pignal, 1994) и V. chamissonis Klotzsch (Macedo Reis, 2000) в Бразилии, V. barbellata Reichenbach f., V. claviculata (W. Wright) Swartz и V. dilloniana Correll (Nielsen and Siegismund, 1999) в Пуэрто-Рико или V. madagascariensis Rolfe на Мадагаскаре (P. Besse, перс. комментарий) часто наблюдаются стебли, стелющиеся по земле, дающие новые корни и образующие новые растения, когда стебель обрезан. Что касается V. planifolia, в естественных условиях Мексики одна и та же особь может занимать до 0,2 га (Soto Arenas, 1999). РИСУНОК 2.2. Типичная вегетативная поросль, наблюдаемая у видов Vanilla. Слева: V. madagascariensis на Мадагаскаре. Справа: V. pompona в Гваделупе. (С любезного разрешения П. Бессе.)
РИСУНОК 2.2. Типичная вегетативная поросль, наблюдаемая у видов Vanilla. Слева: V. madagascariensis на Мадагаскаре. Справа: V. pompona в Гваделупе. (С любезного разрешения П. Бессе.)
У видов Vanilla мембрана ростеллума разделяет женскую и мужскую части цветка, поэтому опыление зависит от вмешательства внешних опылителей. Заметным исключением является вид V. palmarum (Salzm. Ex Lindl.) Lindl., который самопроизвольно самоопыляется (Bory et al., 2008c; Soto Arenas, 2006). Следовательно, половое размножение редко наблюдается в естественных условиях из-за потребности в опылителях. Для V. planifolia сообщается о частоте от 1% до 1‰ (Bory et al., 2008c; Soto Arenas, 1999), при этом возможными естественными опылителями в Америке являются орхидные пчелы из рода Euglossa и, возможно, из рода Eulaema (Lubinsky et al., 2006; Soto Arenas, 2006). Показатели полового размножения, сообщаемые для вида V. chamissonis (6% аутогамии и 15% аллогамии) , также относительно низки (Macedo Reis, 2000). Однако, даже редкие случаи полового размножения могут привести к существенному генетическому разнообразию, поскольку одно событие полового размножения способно создать множество генотипов, которые могут быстро размножиться вегетативным путем. Гетерозиготность, наблюдаемая у V. planifolia, составляла 0–0,078 при использовании изоферментов (Soto Arenas, 1999), 0,154 при использовании маркеров SSR (Bory et al., 2008b) и 0,293 при использовании AFLP (Bory et al., 2008d). Учитывая эти уровни гетерозиготности, даже самоопыление может обеспечить генетическое разнообразие, как было продемонстрировано в экспериментах по самоопылению вручную (Bory et al., 2008d), что привело к увеличению оценок разнообразия (Dmax от 0,106 до 0,140) за счет новых комбинаций аллелей (рисунок 2.3). Это хорошо видно на примере V. planifolia в районах интродукции, где отсутствуют естественные опылители. В этих районах, например на острове Реюньон, традиционные методы выращивания включают размножение лиан черенками и ручное самоопыление для получения стручков. Это привело к появлению новых сортов ванили, наблюдаемых на острове Реюньон, таких как тип «Aiguille», которые, скорее всего, возникли в результате случайного прорастания семян из забытого стручка и последующего вегетативного размножения особи (Bory et al., 2008d) (Рисунок 2.3). Такой новый тип может быстро распространиться на плантациях, учитывая вегетативное размножение, используемое для размножения лиан. Подобное должно происходить и в дикой природе. Комбинация полового и вегетативного размножения, в которой одно создает разнообразие, а другое способствует расселению, уже была предложена для видов V. pompona Schiede и V. bahiana в тропической Америке на основе моделей AFLP (Bory et al., 2008d). Таким образом, половое размножение является ключевым эволюционным процессом для большинства видов этого рода, несмотря на его низкие темпы и преимущественно вегетативного размножение. Некоторые виды Vanilla, по-видимому, для размножения полагаются исключительно на половое размножение. Так обстоит дело с V. palmarum, которая полностью эпифитна на пальме с коротким жизненным циклом (Pignal, 1994), а также с V. mexicana Mill. (син. V. inodora Shiede), у которых даже искусственное вегетативное размножение не удается (P. Feldmann, личн. ком.) (рис. 2.4).
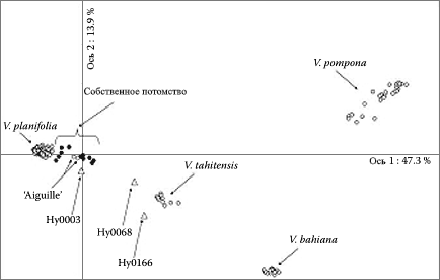 РИСУНОК 2.3. Факторный анализ маркеров AFLP различных видов американской ванили, иллюстрирующий повышенное разнообразие самоопыленных потомков V. planifolia.
РИСУНОК 2.3. Факторный анализ маркеров AFLP различных видов американской ванили, иллюстрирующий повышенное разнообразие самоопыленных потомков V. planifolia.
 РИСУНОК 2.4. Виды, размножающиеся исключительно половым путем. Слева: V. palmarum из коллекции CIRAD. Плоды были получены спонтанно в карантинной оранжерее, защищенной от насекомых. (Любезно предоставлено М. Гризони). Справа: V. mexicana в Гваделупе. (С любезного разрешения П. Бессе и П. Фельдманна).
РИСУНОК 2.4. Виды, размножающиеся исключительно половым путем. Слева: V. palmarum из коллекции CIRAD. Плоды были получены спонтанно в карантинной оранжерее, защищенной от насекомых. (Любезно предоставлено М. Гризони). Справа: V. mexicana в Гваделупе. (С любезного разрешения П. Бессе и П. Фельдманна).
Межвидовая гибридизация
Основными факторами, препятствующими межвидовой гибридизации в семействе Orchidaceae, являются механизмы предваряющие опыление, такие как специфичность опылителей, фенология цветения или механические барьеры в цветках (Dressler, 1981; Gill, 1989; Grant, 1994; Paulus and Gack, 1990; Van Der Pijl and Dodson, 1966). Напротив, генетическая несовместимость между близкородственными видами наблюдается редко (Dressler, 1993; Johansen, 1990; Sanford, 1964, 1967). То же самое и с Vanilla. Действительно, большинство межвидовых искусственных скрещиваний, предпринятых на сегодняшний день у Vanilla, оказались успешными, показывая отсутствие генетической несовместимости между вовлеченными видами. Межвидовые гибриды были успешно получены между близкородственными американскими видами (V. planifolia × V. tahitensis J.W. Moore – образец Hy0003 на рисунках 2.1 и 2.3, V. planifolia × V. pompona) в селекционных программах на Мадагаскаре (Bory et al., 2008c) и даже между отдаленно родственными видами, такими как индийская V. aphylla Blume и американская V. planifolia, в программах разведения в Индии (Minoo et al., 2006). Появляется все больше свидетельств естественной межвидовой гибридизации у Vanilla. Исследование трех местных видов ванили, V. claviculata, V. barbellata и V. dilloniana в западной части острова Пуэрто-Рико, показало возможность межвидовой гибридизации между V. claviculata и V. barbellata в симпатрических областях (Nielsen, 2000; Nielsen and Siegismund, 1999). Это было продемонстрировано с помощью изоферментных маркеров, а морфологические наблюдения за цветками подтвердили гибридный статус симпатрических популяций. С другой стороны, V. dilloniana, демонстрируя другую фенологию, не гибридизировалась с двумя другими видами. Недавняя работа с использованием маркеров AFLP и SSR также позволила предположить возможность образования межвидовых гибридов в тропической Америке с участием таких видов, как V. bahiana, V. planifolia или V. pompona (Bory, 2007; Bory et al., 2008d) (рис. 2.5.). Вид V. tahitensis также недавно был показан, с использованием ядерных последовательностей ITS и cp ДНК, как результат преднамеренной или непреднамеренной гибридизации между видами V. planifolia и V. odorata C. Presl, которая могла произойти в поздний постклассический период (1350–1500 гг.) в Мезоамерике (Lubinsky et al., 2008b). РИСУНОК 2.5. Цветки, плоды и листья образца CR0068 (a) из Коста-Рики, предположительно идентифицированные как гибридный вид, полученный от материнского вида-донора V. planifolia (b) на основе данных маркеров ДНК AFLP, SSR и cp. (С любезного разрешения М. Гризони).
РИСУНОК 2.5. Цветки, плоды и листья образца CR0068 (a) из Коста-Рики, предположительно идентифицированные как гибридный вид, полученный от материнского вида-донора V. planifolia (b) на основе данных маркеров ДНК AFLP, SSR и cp. (С любезного разрешения М. Гризони).
Полиплоидизация
Мы недавно продемонстрировали наличие событий полиплоидизации на острове Реюньон (произошедших менее чем за 200 лет с момента интродукции V. planifolia в 1822 году) (Bory et al., 2008a). Соответствующие данные (маркеры AFLP, размер генома, количество хромосом и длина устьиц) показалиформирование самостерильных аутотриплоидов (“Stérile”), а также аутотетраплоидов (“Grosse Vanille”) с размерами генома 2C = 7,5 и 10 пг соответственно, в отличие от 5 пг для традиционных сортов “Classique” (Bory et al., 2008a) (Таблица 2.1). Было высказано предположение, что наиболее вероятным образованием этих типов является ручное самоопыление, сопровождающееся образованием нередуцированных 2n гамет (Bretagnolle and Thompson, 1995), прорастанием семян из забытого стручка с последующим вегетативным размножением особей (Bory et al., 2008a) (рисунок 2.6). Полиплоидия была также зарегистрирована для культивируемого вида V. tahitensis в Полинезии с существованием диплоидных и тетраплоидных (т. е. “Хаапапе”) типов (Duval et al., 2006; см. главу 13), и этот вид мог быть результатом как полиплоидии, так и половой регенерации после его происхождения V. planifolia × V. odorata (Lubinsky et al., 2008b). РИСУНОК 2.6. Схематическое представление возможного образования аутотриплоидных и аутотетраплоидных типов V. planifolia на острове Реюньон.
РИСУНОК 2.6. Схематическое представление возможного образования аутотриплоидных и аутотетраплоидных типов V. planifolia на острове Реюньон.
Следовательно, полиплоидизация может быть важным явлением в эволюции ванили. Чтобы проверить эту гипотезу, мы провели предварительное исследование вариаций размера генома у разных видов ванили. Тридцать восемь образцов были проанализированы методом проточной цитометрии в соответствии с подробно описанным протоколом (Bory et al., 2008a), с использованием пшеницы в качестве внутреннего стандарта: Triticum aestivum L. «Китайская Весна», 2C = 30,9 пг, 43,7% GC (Marie and Brown, 1993). Эти образцы принадлежат 17 различным видам ванили, а также включают 3 искусственных гибрида (V. planifolia × V. planifolia, V. planifolia × V. tahitensis, V. planifolia × V. phaeantha Rchb. F.). Все образцы листьев были собраны с лиан, содержащихся в коллекции генетических ресурсов Vanilla CIRAD на острове Реюньон (см. главу 3 и Grisoni et al., 2007). Подробная информация по каждому образцу (вид, предполагаемый континент происхождения, место отбора образца и размер генома) представлена в таблице 2.1. Для каждого вида гистограммы флуоресценции выявили пять эндореплицированных пиков, а коэффициент маргинальной репликации все еще был нерегулярным (от 1,5 до 1,8 вместо 2), как это было у V. planifolia (Bory et al., 2008a). Содержание ядерной ДНК 2С варьировало от 4,72 (± 0,05) пг (V. tahitensis) до 12,00 (± 0,11) пг (V. phalaenopsis Reichb. F. Ex Van Houtte) для 34 дикорастущих образцов. Один образец CR0067 (Vanilla sp.) имел экстремальное значение 22,31 пг (одна мера со стандартом для пшеницы) (таблица 2.1), что было подтверждено с использованием другого стандарта (горох, данные не показаны). Коэффициенты вариации внутри сообщества не превышали 5%.
ТАБЛИЦА 2.1. Размер генома у образцов из коллекции генетических ресурсов Vanilla CIRAD острова Реюньон
| Инвентарный номер | Вид | Происхождениеa | Место взятия образца | Среднее значение 2C пг (± стандартное отклонение) |
|---|---|---|---|---|
| Group Ab | V. planifolia «Classique» | Америка | Остров Реюньон | 5.03 (±0.16) |
| Group Bb | V. planifolia «Stérile» | Америка | Остров Реюньон | 7.67 (±0.14) |
| Group Cb | V. planifolia «Grosse Vanille» | Америка | Остров Реюньон | 10.00 (±0.28) |
| CR0056 | V. planifolia × V. phaeantha | данные отсутствуют | Искусственный гибрид | 4.48 (±0.10) |
| CR0747 | V. planifolia × V. planifolia | данные отсутствуют | Искусственный гибрид | 5.24 (±0.12) |
| CR0003 | V. planifolia × V. tahitensis | данные отсутствуют | Искусственный гибрид | 10.12 (±0.10) |
| CR0062 | V. bahiana | Америка | Неизвестно | 6.70 (±0.32) |
| CR0072 | V. bahiana | Америка | Бразилия (Баия) | 6.60 |
| CR0076 | V. bahiana | Америка | Бразилия (Баия) | 6.52 |
| CR0085 | V. bahiana | Америка | Бразилия (Баия) | 7.28 |
| CR0097 | V. bahiana | Америка | Бразилия (Баия) | 7.09 |
| CR0099 | V. bahiana | Америка | Бразилия (Баия) | 6.91 |
| CR0666 | V. chamissonis | Америка | Бразилия (Сан-Паулу) | 8.22 (±0.06) |
| CR0667 | V. chamissonis | Америка | Бразилия (Сан-Паулу) | 8.14 (±0.35) |
| CR0702 | V. chamissonis | Америка | Неизвестно | 7.47 (±0.03) |
| CR0693 | V. (cf.) grandiflora Lindl. | Америка | Гайана | 9.23 (±0.25) |
| CR0109 | V. leprieuri R. Porteres | Америка | Французская Гайана | 7.74 (±0.02) |
| CR0686 | V. odorata | Америка | Неизвестно | 4.95 (±0.12) |
| CR0083 | V. palmarum | Америка | Бразилия (Баия) | 7.00 (±0.29) |
| CR0017 | V. tahitensis | Америка | Французская Полинезия | 4.72 (±0.05) |
| CR0063 | V. tahitensis | Америка | Неизвестно | 6.88 (±0.13) |
| CR0069 | V. trigonocarpa Hoehne | Америка | Бразилия (Алагоиньяс) | 8.21 (±0.07) |
| CR0103 | V. africana Lindl. | Африка | Африка | 10.25 (±0.06) |
| CR0107 | V. africana | Африка | Африка | 10.22 (±0.18) |
| CR0696 | V. crenulata Rolfe | Африка | Неизвестно | 9.88 (±0.34) |
| CR0091 | V. crenulata | Африка | Африка | 10.24 (±0.16) |
| CR0102 | V. crenulata | Африка | Африка | 9.79 (±0.37) |
| CR0106 | V. crenulata | Африка | Африка | 10.47 (±0.38) |
| CR0108 | V. humblotii Rchb. f. | Африка | Коморы | 11.81 (±0.09) |
| CR0104 | V. imperialis Kraenzl. | Африка | Африка | 6.93 |
| CR0105 | V. imperialis | Африка | Африка | 10.14 (±0.34) |
| CR0796 | V. imperialis | Африка | Неизвестно | 7.18 (±0.00) |
| CR0797 | V. imperialis | Африка | Неизвестно | 7.06 (±0.24) |
| CR0141 | V. madagascariensis | Африка | Мадагаскар | 8.06 |
| CR0142 | V. madagascariensis | Африка | Мадагаскар | 8.02 |
| CR0146 | V. phalaenopsis | Африка | Неизвестно | 12.00 (±0.11) |
| CR0067 | Vanilla sp. | Африка | Центральная Африка | 22.31 |
| CR0058 | V. albida | Азия | Неизвестно | 5.90 (±0.16) |
| CR0793 | V. albida | Азия | Таиланд | 5.15 |
| CR0059 | V. albida | Азия | Неизвестно | 8.65 (±0.08) |
| CR0145 | V. aphylla | Азия | Таиланд | 9.81 (±0.03) |
Эти результаты показывают, что у Vanilla существуют вариации размера генома, что может свидетельствовать о наличии полиплоидных видов на основе данных, обнаруженных для V. planifolia (Bory et al., 2008a). В частности, африканские образцы имели больший размер генома, чем американские образцы, с содержанием ДНК 2С в диапазоне от 6,93 до 22,31 пг и от 4,72 до 9,23 пг, соответственно. Африканские виды, следовательно, могли подвергнуться более драматическим перестройкам генома и событиям полиплоидизации, чем их американские или азиатские аналоги. Наконец, как это наблюдалось у V. planifolia на острове Реюньон (Bory et al., 2008a), у некоторых видов были обнаружены внутривидовые вариации размера генома (V. imperialis Kraenzl., V. albida Blume), что может отражать различный уровень плоидности даже внутри вида. Эти результаты необходимо дополнительно изучить с помощью подсчета хромосом для каждого вида, но они уже убедительно свидетельствуют о том, что полиплоидия может быть основным явлением в эволюции Vanilla.
Выводы
Таким образом, появляется все больше свидетельств, демонстрирующих сложность процессов, вовлеченных в эволюцию и многообразие у Vanilla. Что касается многих видов, у которых преобладает вегетативное размножение, мы наблюдали фенотипическое разнообразие на внутривидовом уровне у V. planifolia, что не соответствовало наблюдаемому низкому генетическому разнообразию этой клональной культуры. Мы продемонстрировали, что это несоответствие частично связано с возникновением редких случаев полового размножения, а также с возникновением полиплоидизации у этого вида. Учитывая, что эти изменения произошли на острове Реюньон менее чем за 200 лет, нет сомнений в том, что такие внутривидовые вариации существуют у других видов этого рода, встречающихся в дикой природе, и могут быть причиной трудностей с правильной идентификацией видов исключительно на основе морфологических наблюдений. Это усугубляется возникновением межвидовых гибридизаций, что делает четкое таксономическое распознавание еще более затруднительным. Следовательно, по мнению Энноса, Vanilla можно рассматривать как ТКГ, «таксономически комплексную группу» (Ennos et al., 2005). Действительно, она демонстрирует (1) режим однородительского размножения (вегетативное размножение), (2) межвидовую гибридизацию в симпатрических областях и (3) полиплоидию. Такие механизмы оказывают глубокое влияние на организацию биологического разнообразия и были описаны как ответственные за трудность определения дискретных, стабильных и когерентных таксонов в таких ТКГ (Ennos et al., 2005). ТКГ широко распространены у растений, и однородительское размножение может давать сложную смесь половых ауткроссингов и однородительских линий, находящихся на разных уровнях плоидности, а весь комплекс может быть вовлечен в ретикулярную эволюцию, создавая новые однородительские линии путем гибридизации (Ennos et al., 2005). Это имеет огромное значение для проведения природоохранных программ. Поскольку в таких ТКГ часто невозможно классифицировать биоразнообразие на отдельные и однозначные виды, традиционные программы сохранения видов не подходят. В соответствии с рекомендациями, сохранение in situ должно быть сосредоточено на эволюционных процессах, которые порождают таксономическое разнообразие, а не на плохо определенных таксонах, возникших в результате этой эволюции (Ennos et al., 2005). Внимание концентрируется на видах, которые могут быть широко распространены (и, следовательно, не связаны с классическими усилиями по охране), но ответственны за создание таксономического разнообразия (посредством гибридизации, интрогрессии или полиплоидизации). Следовательно, механизмы, описанные в этой главе, обеспечивают не только лучшее понимание эволюции рода Vanilla, но также имеют большое значение для будущего управления генетическими ресурсами и их сохранности (Crandall et al., 2000; Moritz, 2002). Данные механизмы также представляют большой интерес с точки зрения будущего улучшения V. planifolia. Межвидовая гибридизация V. planifolia с другими ароматическими видами уже оказалась успешной. На Мадагаскаре производство гибридного сорта “Manitra ampotony”, V. planifolia × V. tahitensis, привело к увеличению содержания ванилина (6,7% ванилина против 2,5% у V. planifolia), а “Tsy taitry”, (V. planifolia × V. pompona) × V. planifolia, проявляет повышенную устойчивость к различным заболеваниям (Dequaire, 1976; FOFIFA, 1990; Nany, 1996). В Индии были получены гибриды V. planifolia × V. aphylla для повышения устойчивости к фузариозу (Minoo et al., 2006). На внутривидовом уровне можно использовать самоопыление для увеличения разнообразия этой генетически однородной культуры (Bory et al., 2008d; Minoo et al., 2006). Кроме того, агрономическая характеристика (сила, устойчивость, выработка ванилина) аутотетраплоидных типов в настоящее время проводится на острове Реюньон в качестве первого шага для проверки потенциальных возможностей стратегии полиплоидного разведения у V. planifolia. Разгадка эволюции и получение агрономически интересных характеристик не менее важны. Такие характеристики включают аромат плодов, которому, несмотря на значительный селекционный интерес, уделялось ограниченное внимание, особенно в отношении его эволюции. Виды с ароматными стручками ограничены исключительно Америкой (Soto Arenas, 2003), и этот признак мог развиться как способствующий распространению плодов летучими мышами (Soto Arenas, 1999) или липких семян пчелами, что показано у V. grandiflora (Lubinsky et al., 2006). Вопрос недавно был рассмотрен путем изучения вариаций длины интронов в семействе генов COMT (Besse et al., 2009), кодирующих ключевые ферменты фенилпропаноидного пути, предположительно участвующих в биосинтезе ванилина. Для понимания эволюции, механизмов и генетического детерминизма спонтанного самоопыления у представителей рода (V. palmarum) – очень желательного признака, который значительно снизил бы затраты на производство стручков – также необходима дальнейшая работа. Наконец, выяснение того, как безлистные виды этого рода эволюционировали и дифференцировались, может представлять большой интерес для нашего понимания адаптации к засушливым условиям, учитывая предсказанное будущее больших климатических изменений.Глава 3. Хранение и перемещение гермоплазмы ванили
Важность генетических ресурсов растений
Сохранение генетических ресурсов растений представляет собой основную стратегическую проблему для всей деятельности, связанной с сельским хозяйством и агропродовольственной промышленностью, особенно в нынешних условиях изменения климата. В глобальном масштабе с 1950-х годов рост населения и развитие интенсивного сельского хозяйства способствовали сокращению разнообразия видов растений. Сегодня защита этих ресурсов имеет жизненно важное значение для достижения устойчивой продовольственной безопасности населения. С 1970-х годов был разработан ряд инициатив по сохранению разнообразия культивируемых видов. В 1971 году создание Консультативной группы по международным сельскохозяйственным исследованиям (CGIAR) дало первоначальный ответ на проблему утраты генетического разнообразия основных сельскохозяйственных видов. В настоящее время 11 из 15 центров CGIAR отвечают за поддержку международных генных банков для хранения и распространения генетических ресурсов растений, которые составляют основу мировой продовольственной безопасности (http://www.cgiar.org/index.html). Совсем недавно были предприняты инициативы, направленные на охрану коллекций генетических ресурсов. К ним относятся создание Центров биологических ресурсов Организации экономического сотрудничества и развития или Глобального фонда разнообразия сельскохозяйственных культур (http://www.croptrust.org/main/), который стоит за такими операционными проектами, как Глобальное хранилище семян Свальбарда, в котором в настоящее время хранится почти 660 различных родов и 3300 видов со всех континентов (http://www.croptrust.org/main/arctic.php?itemid=211). Хотя основные сельскохозяйственные виды охвачены признанными системами сохранения, было предпринято несколько крупномасштабных инициатив по сохранению малоиспользуемых и неподдерживаемых видов. Однако, для решения задач будущего, изучение и защита сельскохозяйственного биоразнообразия должны не основываться исключительно на ограниченном числе видов, а рассматриваться с широкой, открытой точки зрения, представляя каждый вид как взаимозависимого друг от друга представителя своего собственного специфического эволюционного процесса. Сегодня программа сохранения не может быть реализована без предварительного определения целей использования ресурсов и получения знаний о внутри- или межвидовом генетическом разнообразии. После определения целей, следует задать вопросы о репрезентативности генетического разнообразия (что следует сохранять и в каких количествах?), а также о стоимости создания и поддержания этих коллекций. Коллекции in situ состоят из охраняемых видов в их естественных или измененных человеком экосистемах, другими словами, в месте, в котором они развили свои отличительные характеристики. Эти коллекции в основном касаются дикорастущих видов и часто представлены национальными или региональными парками, которые защищают экосистемы в целом. Хотя этот тип охраны представляет собой идеальную модель, поскольку поддерживает давление отбора окружающей среды, его эффективность, с точки зрения сохранности, часто зависит от степени участия местного населения в управлении регионом и его ресурсами. Более того, он не обеспечивает защиты от климатических или биологических рисков (патогены, вредители растений или инвазивные виды). Коллекции ex situ состоят из генетических ресурсов, сохраняемых за пределами их естественной среды обитания. Степень защиты ресурсов и их независимости по отношению к окружающей среде сильно различается в зависимости от типа хранения. Живые растения могут храниться в виде полевых коллекций, дендрариев, в теплицах или в культуре тканей. Фрагменты растений (меристемы, зародыши, ткани), позволяющие регенерацию целого растения, можно хранить при очень низкой температуре в жидком азоте. Семена обычно хранятся в холодильнике при контролируемой влажности. Хранение пыльцы при низкой температуре означает сохранение запаса гаплоидного материала. Сохраняя больше разнообразия при меньших затратах, банки ДНК пригодны для внутри- и межвидовых генетических исследований. Внутри коллекций ex situ различают охраняемые и действующие или работающие коллекции, которые дают начало конкретной деятельности, связанной с хранящимися ресурсами, например, изучением генетического разнообразия или в области селекции растений. Тем не менее, методы хранения ex situ зависят от деятельности человека и от бесперебойного функционирования природоохранных объектов и сооружений. Наконец, гербарии (см. главу 4) – первый метод консервации видов растений (шестнадцатый век) – и коллекции в спирте необходимы, особенно для проведения таксономических исследований. Хотя экономические затраты на поддержание коллекций связаны с количеством хранимых образцов, вопрос о количестве особей, представляющих разнообразие и обеспечивающих безопасность образцов, имеет решающее значение. Принцип «основной коллекции» может дать ответ. Нуаро с коллегами разработали метод создания основной коллекции на основе количественных данных (Noirot et al., 1996). Этот метод (оценка основных компонентов) направлен на включение максимального разнообразия из базовой коллекции в выборку минимального размера, избегая при этом дублирования. Что касается генетических ресурсов растений, каждая система хранения имеет свои преимущества и недостатки, и часто только сочетание этих различных систем позволяет оптимизировать и обеспечить сохранность ресурсов. Помимо количественного аспекта (количество хранимых видов и образцов), в настоящее время, качество данных и исследовательских программ, связанных с ресурсами, является ключевым элементом при обосновании материальных и человеческих инвестиций. Ценность и точность этих данных также способствуют развитию ресурсов.Генофонд Vanilla
Род Vanilla, относящийся к семейству орхидей, включает 90–100 видов в зависимости от автора (Bory et al., 2008c). Большинство этих видов дикорастущие; только два из них, V. planifolia и V. tahitensis, выращиваются для производства товарной ванили, при этом V. planifolia обеспечивает 95% мирового производства. Таксономия ванили очень старая, неполная и все еще неточная (Portères, 1954; Rolfe, 1896; см. главу 1). Следовательно, её необходимо тщательно пересмотреть, особенно в свете результатов недавних молекулярно-генетических и цитогенетических исследований (Bory et al., 2008a, 2008b; Cameron, 2003, 2009; Schluter et al., 2007; Soto Arenas, 2003; Verma et al., 2009). Например, несколько недавних исследований происхождения V. tahitensis предполагают, что этот вид является результатом скрещивания V. planifolia и V. odorata (Besse et al., 2004; Bory et al., 2008d; Lubinsky et al., 2008b). Виды рода Vanilla в основном встречаются в естественной среде обитания в тропических и субтропических регионах американского, африканского и азиатского континентов. Большинству из видов угрожает разрушение их первоначальной среды обитания, которое усугубляется изменением климата. Вид V. planifolia находится под особой угрозой исчезновения, поскольку основной генофонд в регионе его происхождения (южная Мексика) подвергается значительному давлению, связанному с обезлесением и чрезмерной эксплуатацией природных ресурсов (Soto Arenas, 1999). Во вторичных зонах диверсификации, таких как острова Индийского океана и особенно Реюньон – точка входа вида в этот регион в девятнадцатом веке – наблюдается значительная внутривидовая однородность, что указывает на то, что культивирование может опираться на очень ограниченную генетическую основу и, вероятно, развилось от одной особи путем вегетативного размножения. Молекулярные исследования подтвердили очень низкий уровень генетического разнообразия растений ванили (V. planifolia), культивируемых во всем мире (Bory et al., 2008d; Lubinsky et al., 2008a; Minoo et al., 2008a). Процесс вегетативного размножения, преобладающий у выращиваемых видов ванили, не позволяет поддерживать и расширять генофонд. Тем не менее наблюдается интересное фенотипическое разнообразие, которое можно объяснить накоплением соматических мутаций, возможностью естественного прорастания семян в случае полового размножения, а также вариабельным уровнем плоидности, который можно найти у культурных видов ванили (см. главу 2). Однако, из-за сортовой однородности, выращивание ванили особенно уязвимо для экологических опасностей, таких как изменение климата и появление вредителей растений. Вторичный генофонд ванили включает около 100 видов, которые распространились в Америке, Африке и Азии. Эти виды обладают индивидуальными свойствами, которые могут представлять особый интерес для генетического улучшения культивируемой ванили – самоопыление, устойчивость к болезням (фузариозу, вирусам), способность приносить большое количество плодов, меньшая зависимость от фотопериода для стимуляции цветения, более высокое содержание ванилина, присутствие других ароматических или лекарственных метаболитов и устойчивость к засухе. Поэтому, создание генных банков, в форме коллекций, чрезвычайно актуально для защиты находящихся под угрозой исчезновения эндемичных генетических ресурсов рода Vanilla (Grisoni et al., 2007; Lubinsky et al., 2008a; Pandey et al., 2008; Soto Arenas, 2006). Их интересные характеристики могут быть использованы в программах генетического улучшения культуры, как это было начато в Индии (Minoo et al., 2006, 2008b; Muthuramalingam et al., 2004).Обзор охраны генетических ресурсов ванили
Наиболее эффективным средством защиты разнообразия видов ванили должна быть защита in situ в местах их происхождения. Однако, эти природные территории очень часто подвергаются сильному демографическому давлению, которое ставит под угрозу различные виды. Следовательно, этот тип охраны может быть предусмотрен только в том случае, если он связан с глобальной стратегией охраны на уровне территории (Soto Arenas, 1999). В Мексике успех и опыт Национальной комиссии по изучению и использованию биоразнообразия (CONABIO) позволяют реализовать этот метод. В Южной Африке национальный парк Исимангалисо уделяет особое внимание сохранению V. rosheri, которая занимает второе место в списке редких и находящихся под угрозой исчезновения эндемичных видов (Combrink and Kyle, 2006). Однако, разнообразие ванили, включающее более 100 видов, распространенных на трех континентах и обитающих в различных биотопах, затрудняет создание систем охраны in situ. Поэтому, создание коллекций ex situ представляется необходимой стратегией для защиты генетических ресурсов ванили. Инициативы разной степени важности в прошлом предпринимались в некоторых странах-производителях ванили (Пуэрто-Рико, Мадагаскар, Коста-Рика, Мексика). Так, с 1940-х годов на станции Маягуэс в Пуэрто-Рико проводились исследования по определению характеристик и улучшению растений ванили (Childers et al., 1959). Примерно в то же время на Мадагаскаре ванильная станция Амбохитсара около Анталахи начала собирать и гибридизировать широкий спектр растений ванили (Dequaire, 1976). Однако, эта коллекция была уничтожена повторяющимися циклонами, отсутствием обслуживания и распространением вирусов (Grisoni, 2009). В конце 1970-х годов Центр тропических сельскохозяйственных исследований и высшего образования (CATIE) в Коста-Рике собрал и сохранил около 32 образцов ванили из Центральной Америки. Часть этой коллекции была сохранена путем пассажа in vitro (Jarret and Fernandez, 1984). В Мексике, наряду с программой CONABIO, была создана коллекция клонов, представляющих разнообразие в стране, но, к сожалению, её не удалось сохранить (M.A. Soto Arenas, личн. комментарий). Сегодня наиболее важные коллекции находятся на Реюньоне (CIRAD), во Французской Полинезии (EVT), Шербурге (council/MNHN), в Индии (ICRI) и в Соединенных Штатах (таблица 3.1). Несколько ботанических садов и исследовательских институтов также содержат некоторое количество образцов ванили в своих теплицах (Оранжерейный сад Отёй, Люксембургский сад и Ботанический сад Нанси во Франции, Королевский ботанический сад Кью и Ботанический сад Копенгагена в Европе, Университет Рутгерса и Ботанический сад Нью-Йорка в США, Ботанический сад Рио-де-Жанейро в Бразилии, Секретариат Тихоокеанского сообщества на Фиджи – и это лишь некоторые из них). Частные коллекции любителей орхидей – еще один источник, иногда редких экземпляров. В целом, в этих коллекциях хранится около 50% глобального разнообразия (с точки зрения количества видов), в основном в виде целых растений in vivo или иногда in vitro.ТАБЛИЦА 3.1. Информация об основных коллекциях ванили
| Название коллекции | Центр биологических ресурсов VATEL | Коллекция американской ванили и дикорастущих родственников | Коллекция ванили в Майладампара (ICRI) | Etablissement Vanille de Tahiti (EVT) | |
|---|---|---|---|---|---|
| Расположение и адрес коллекции | Центр защиты растений, Сен-Пьер, Реюньон, Франция, 97410 | Калифорнийский университет, США | Индийский научно-исследовательский институт кардамона, Майладампара, Керала, Индия, 682 553 | Хамоа (Тапутапуатеа), Раиатеа, Французская Полинезия, 98735 | |
| Организация или компания, ответственная за сбор | Центр международного сотрудничества в области агрономических исследований для развития (CIRAD) | Д-р Песах Любинский, Калифорнийский университет, США | Индийский научно-исследовательский институт кардамона Совета по специям Правительства Индии | Etablissement Vanille de Tahiti (EVT) | |
| Куратор коллекции и email | Мишель Гризони michel.grisoni@cirad.fr | Песах Любинский plubi@hotmail.com; sdoneill@ucdavis.edu | Д-р К. Дж. Мадхусуданан dirres_spices@yahoo.com; icrimyla@eth.com; dirres_spices@rediffmail.com | Сандра Леперс-Анджеевски sandra.andrzejewski@labo-vanilledetahiti.pf | |
| Назначение коллекции | Исследования, сохранение | Сохранение, разведение, исследования | Исследования, сохранение | Улучшение ванили | |
| Дата создания коллекции | 1984 | Не официально; на основе коллекций с 2004 | 2004 | 1981 | 1999 |
| Количество видов Vanilla в коллекции | 25 (800) | 30 | 6 | 3 | |
| Количество образцов | 800 | 100 | 21 | 231 | |
| Живой материал | 400 | Все живые | 21 | 181 | |
| Гербарные и спиртовые образцы, экстракты нуклеиновых кислот | 400 | 50 | |||
| Морфологические дескрипторы | Да | Да | Да | ||
| Молекулярные дескрипторы | RAPD, AFLP, SSR, последовательности пластидной ДНК | Некоторые маркеры ITS/psBA и AFLP | Нет | AFLP, количество хромосом, содержание 2C | |
| Наличие материала на экспорт | Да, для некоторых образцов, представленных на условиях (MTA, CITES) | Нет | Только стручки или экстракт ДНК | ||
| Список видов в коллекции | V. africana, V. albida, V. aphylla, V. bahiana, V. chamissonis, V. crenulata, V. ensifolia, V. grandifl ora, V. humblotii, V. imperialis, V. insignis, V. leprieuri, V. lindmaniana, V. madagascariensis, V. odorata, V. palmarum, V. phalaenopsis, V. planifolia, V. polylepis, V. pompona, V. tahitensis, V. trigonocarpa, Vanilla spp. | Концентрация внимания на видах Нового Света | V. planifola, V. aphylla, V. pompona, V. tahitensis, V. andamanica, V. wightiana | Большинство V. tahitensis + V. planifolia, V. pompona и гибриды |
Однако, в большинстве случаев материал плохо идентифицируется с точки зрения таксономии, а используемые методы консервации не гарантируют полной безопасности ресурсов. Коллекции in vivo не защищены от рисков для здоровья растений (занесение паразитических грибов или вирусов и переносчиков вирусных заболеваний в теплицы) и климатических рисков (штормы, циклоны). Вирусное индексирование показало, что 40% растений ванили в ботанических садах, инфицированы вирусом мозаики цимбидиума (Grisoni et al., 2007). Освоены методы культивирования растений ванили in vitro (см. главу 5), обеспечивающие защиту растительного материала от контаминации. Однако, сохранение коллекций in vitro требует регулярных операций по техническому обслуживанию, что подразумевает большое количество квалифицированных рабочих. Кроме того, преемственность субкультур означает, что могут появиться сомаклональные варианты и исходные генетические ресурсы будут потеряны. По этим причинам методы защиты коллекций должны быть разработаны в срочном порядке. Вариантом на будущее может быть криоконсервация. В Индии криоконсервация пыльцы была успешно проведена в рамках исследований межвидовой гибридизации. Этот прием решает проблему синхронизации цветения у разных видов. Точно так же, протокол криоконсервации верхушки растений ванили стандартизирован для хранения генетических ресурсов (см. главу 5). Протоколы криоконсервации меристем изучаются, особенно в Мексике (Gonzalez-Arnao et al., 2009) и Франции. На острове Реюньон коллекция генетических ресурсов ванили – центральный элемент Центра биологических ресурсов VATEL, аккредитованного в 2009 году. Официальное признание подразумевает управление ресурсами, соответствующее процессу качества, аналогичному международному стандарту ISO 9001, и требует соблюдения процедур технологии консервации, интродукции биологического материала и распространения генетических ресурсов.
Правила передачи генетических ресурсов ванили
Как и остальные представители семейства орхидей, род Vanilla защищен Конвенцией о международной торговле видами дикой фауны и флоры, находящимися под угрозой исчезновения (СИТЕС), также известной как Вашингтонская конвенция (http://www.cites.org/index.html). Целью этой международной конвенции, подписанной 175 странами, является обеспечение того, чтобы международная торговля дикими животными и растениями не ставила под угрозу выживание видов, к которым они принадлежат. Действительно, хотя мы можем считать, что культивированная ваниль не находится под угрозой исчезновения, почти все виды произрастают в естественных лесах, расположенных в зонах повышенного риска. Поскольку семейство орхидей указано в Приложении 2 к конвенции СИТЕС, в которую включено более 28 000 видов растений, к ванили подлежит применению строгих правил в отношении передачи растительного материала и торговли между государствами (рис. 3.1). Эта защита касается всех частей растений и всех побочных продуктов, за некоторыми исключениями, в частности, стручков, их частей и продуктов из культивированной ванили.Статья IV Регулирование торговли образцами видов, включенных в Приложение II Полный текст конвенции см. http://www.cites.org/eng/disc/text.shtml#IV and http://www.cites.org/eng/app/appendices.shtml#hash1 (Приложения I, II and III конвенции) Основные правила 2. Для экспорта любого образца вида, включенного в Приложение II, требуется предварительная выдача и предъявление разрешения на экспорт. Разрешение выдается при выполнении следующих условий: а) научный орган экспортирующего государства вынес заключение, что такой экспорт не угрожает выживанию этого вида; b) административный орган экспортирующего государства удостоверился в том, что данный образец не был приобретен в нарушение законов государства, относящихся к охране фауны и флоры; и с) административный орган экспортирующего государства удостоверился в том, что любой живой образец будет подготовлен и отправлен т.о., чтобы свести к минимуму риск повреждения, угрозы здоровью или жестокого обращения. 4. Для импорта любого образца вида, включенного в Приложение II, требуется предварительное предъявление либо разрешения на экспорт, либо сертификата на реэкспорт. Для Orchidaceae эти правила касаются всех частей и производных, за исключением: (а) семян и пыльцы (включая поллинии); (б) рассады или культур тканей, полученных in vitro, в твердой или жидкой среде, транспортируемые в стерильных контейнерах; (в) срезанные цветы искусственно размноженных растений; а также (г) плоды, их части и производные искусственно размноженных растений рода Vanilla. Статья VII Исключения и другие специальные положения, относящиеся к торговле 6. Положения Статей III, IV и V не применяются к переданным на некоммерческой основе во временное пользование, в дар или в порядке обмена между учеными или научными учреждениями, зарегистрированными Административным органом их государства, образцам гербариев, другим законсервированным, засушенным или заспиртованным музейным образцам и живому растительному материалу, имеющим ярлык, выданный или утвержденный Административным органом.РИСУНОК 3.1. Выдержки из статей IV и VII Конвенции о международной торговле видами дикой фауны и флоры, находящимися под угрозой исчезновения (СИТЕС).
Однако, пункт 6 статьи VII конвенции («Исключения и другие специальные положения, относящиеся к торговле») способствует обмену некоммерческим растительным материалом в научных целях. Каждая страна-член СИТЕС должна внедрить законодательство, гарантирующее соблюдение конвенции на национальном уровне. Страны вправе принимать более строгие законы. Второй уровень, регулирующий доступ к генетическим ресурсам растений в целом и к ванили в частности – это Конвенция о биологическом разнообразии (КБР) или Конвенция Рио (http://www.cbd.int/). На уровне царства растений КБР охватывает все виды, не включенные в Международный договор о генетических ресурсах растений для производства продовольствия и ведения сельского хозяйства (http://www.planttreaty.org/index_en.htm). КБР вступила в силу 29 декабря 1993 года. В нее входит 191 сторона (страна-член), и её три основные цели: сохранение биологического разнообразия, устойчивое использование биологического разнообразия и справедливое и равноправное разделение благ от биологического разнообразия. Соблюдение правил обмена генетическими ресурсами растений между странами, изложенными в Конвенции, на практике выражается в разработке и подписании сторонами Соглашения о передаче материала (MTA). Этот документ по общему согласию определяет права и обязанности сторон, участвующих в передаче, особенно в отношении вопроса использования ресурсов и распределения выгод и преимуществ, возникающих в результате такого использования. В настоящее время представляется жизненно важным использовать MTA при любом обмене растительным материалом, чтобы предотвратить споры между поставщиками и пользователями генетических ресурсов. Вопреки Конвенции СИТЕС, нет никаких исключений из правил КБР для использования генетических ресурсов растений в научных целях. Генетические ресурсы, находившиеся в собственности страны до 29 декабря 1993 г., не подпадают под действие правил Конвенции. Помимо КБР и правил передачи, любой обмен растительным материалом между странами должен соответствовать обязательствам Международной конвенции по защите растений (http://www.ippc.int/IPP/En/default.jsp), особенно относительно фитосанитарного сертификата, необходимого для любой передачи растительного материала. Первоначальное руководство было составлено IBPGR, ныне Biodiversity International (Pearson et al., 1991),но знания, полученные за последние 15 лет в отношении вирусов ванили (см. главу 7), требуют обновления этого руководства.
Заключение и перспективы
Подобно многим другим видам растений, генетическим ресурсам ванили угрожает исчезновение или генетическая эрозия во многих областях происхождения и разнообразия. Следовательно, необходимо поощрять любые инициативы in situ по сохранению видов, но создание коллекций ex situ имеет важное значение для защиты разнообразия. Этот метод консервации означает, что ресурсы в большей безопасности благодаря механизмам in vitro или криоконсервации, а также упрощает перемещение ресурсов и сбор научных данных. В самом деле, несмотря на множество исследований, которые стали возможными, в частности, благодаря широкому использованию инструментов молекулярной биологии, знание генетики ванили, с точки зрения таксономии рода и свойств различных видов, все еще является неполным. Этот пробел в знаниях становится еще более разительным, когда речь идет об использовании и обычаях, связанных с ванилью, которую выращивают местные общины в регионах, где находятся генетические ресурсы. Создание глобальной сети коллекций генетических ресурсов in situ и ex situ на основе ветвей с трех континентов (Америки, Африки и Азии), на которых сосредоточена большая часть этих ресурсов, могло бы привести к значительному прогрессу с точки зрения охраны и научно-экономического усовершенствования ванили. Развитие все более эффективной геномики, связанной с методами биотехнологии, означает, что могут быть созданы программы селекции растений. Использование специфических характеристик дикорастущих видов, таких как устойчивость Vanilla aphylla к засухе, может обеспечить средства для диверсификации областей производства ванили и предвидение будущих изменений климата. Создание и распространение растений ванили, более устойчивых к болезням, более урожайных, более богатых ванилином и другими ароматическими соединениями, может улучшить условия жизни мелких производителей в районах производства ванили. Для обеспечения большей эффективности этих исследований и природоохранных инициатив следует способствовать обмену растительным материалом между коллекциями и исследовательскими программами, особенно путем смягчения правил КБР в соответствии с существующим изъятием в Конвенции СИТЕС.Глава 4. Ваниль в гербариях
Изобилующий в тропических регионах земного шара род Vanilla бросил вызов морфологам. Хотя молекулярный подход дает представление о филогенетической структуре группы, четкое определение видов сопряжено с трудностями. Эта глава открывает «Ванильный файл» и перечисляет некоторые технические аспекты, препятствующие изучению единственной орхидеи, выращиваемой для еды.Отсутствие таксономической обработки
Хотя культивированная ваниль была предметом многих исследований, дикорастущие виды, особенно те, которые не обладают агрономическими качествами (не имеют запаха или слишком капризны для выращивания), не изучались синтетически. По общему признанию, исследования многих таксонов были опубликованы в ряду членов семейства Orchidaceae. В списке Индекса Кью перечислено более 250 видов (Anonymous, 2009), но таксономический обзор отсутствуют. Первая полная таксономическая обработка рода Vanilla была проведена Рольфом в 1896 году (Rolfe, 1896). Он распознает 50 видов. Последняя редакция Портера в книге La vanille et le vanillier dans le monde включает 110 видов (Portères, 1954). Работа Портера, хотя и богата биогеографическими данными, к сожалению, не является исчерпывающей, поскольку не упоминаются несколько таксонов, опубликованных бразильским ботаником Хёне между 1941 и 1944 годами (Hoehne, 1941, 1944). Эти публикации относятся к годам Второй мировой войны, и европейские библиотеки 1950-х годов с трудом пополняли свои коллекции. Отсутствие адекватной обработки напрямую связано с состоянием гербарных образцов в коллекциях, которые являются основой любых таксономических и номенклатурных рассуждений.Коллекции по-прежнему бедны
Коллекции прошлых ботаников немногочисленны, и вместо образцов часто используются иллюстрации. Так обстоит дело с «историческими гербариями» Национального музея естественной истории в Париже. В гербарии Ламарка, например, только один рисунок изображающий ваниль, взят из Encyclopédie Méthodique. Подпись на французском языке: Petite vanille или vanille musquée (маленькая ваниль или ванильный мускус). Рисунок достаточно точен, чтобы идентифицировать Vanilla palmarum. Гербарий Жюсьё едва ли богаче, здесь имеется только один образец Vanilla aromatica. Неужели эти иллюстрации сделаны с гербарных образцов? Весьма сомнительно. Было распространено рисование с живого образца или с другой иллюстрации, что значительно способствовало путанице в отношении рода после его официальной публикации в ботанической номенклатуре (Miller, 1768), хотя ваниль уже широко культивировалась. Миллер сначала выделяет «две или три разновидности, которые различаются по окраске цветков и длине стручков» (Miller, 1768). Затем он признал их как два вида: V. mexicana и V. axillaris. Сейчас кажется, что образцы, описанные Миллером, включали, по крайней мере, наши существующие виды V. planifolia и V. pompona. Современные коллекции страдают теми же недостатками, что и их предшественники – они малочисленные, зачастую без плодов и цветков. Когда цветы присутствуют, они плохо высушены или неподготовлены, что делает определение сомнительным. Более того, виды часто представлены одним экземпляром. Некоторые крупные гербарии мира обладают образцами ванили. В Северной Америке Ботанический сад Нью-Йорка очень активен в тропических исследованиях Нового Света. В Бразилии коллекция Хёне хранится в Ботаническом саду Рио-де-Жанейро. Но есть и много прочих организаций, хранящих ваниль. По этой причине некоторые базы данных и веб-сайты позволяют удаленное сравнение с образцами. Особо следует упомянуть GBIF, Глобальный информационный фонд по биоразнообразию (http://data.gbif.org), который объединяет несколько сотен коллекций естествознания и предоставляет доступ к информации об образцах. С 2003 г. на веб-сайте Национального музея естественной истории в Париже можно найти данные и фотографии всех орхидных, включенных в его коллекции (http://www.mnhn.fr/base:sonnerat.html). Фонд «Алука» предлагает частично оплачиваемый доступ ко всем типам из Африки и Америки (http://www.aluka.org). Весьма всесторонний веб-сайт имеется у Швейцарского фонда орхидей при гербарии Яни Ренца в Базеле (http://orchid.unibas.ch/site.sof.php). Плохое состояние материала делает особенно трудным проведение морфологических исследований. Поэтому, в настоящее время по техническим и биологическим причинам, гербариев ванили недостаточно для переосмысления таксономии рода. Серьезным препятствием является сложность подготовки подходящих образцов.Советы для подготовки хорошего гербарного образца
Убейте растение быстро
Подобно многим орхидеям, ваниль особенно устойчива к обезвоживанию. Толстая кожица препятствует легкому удалению воды. Было замечено, что образцы малагасийской безлистной ванили на бумаге остаются зелеными более одного года. Поэтому необходимо быстро убить образцы. Самый распространенный метод в полевых условиях – погрузить растение в кипящую воду, затем обсушить и поместить в сушилку. Также можно использовать пары диоксида серы, с тем преимуществом, что они позволяют избежать окисления, которое ухудшает пигменты.Подготовте цветы
Цветки часто толстые и мясистые. Невыполнение подготовки для гербария обычно приводит к порче их структуры. Поэтому необходимо рассекать живые цветки и отдельно сушить околоцветник (рис. 4.1). От цветка отделяются лепестки и чашелистики; один из двух лепестков и один из двух боковых чашелистиков представляются с обратной стороны. Губа, которая всегда сливается в продольном направлении с колонкой, разрезана сбоку, чтобы можно было развернуть её и показать верхнюю сторону с её выростами и выпуклостями. Крупные соцветия обязательно нужно упростить, сохранив всего два-три цветка. РИСУНОК 4.1. Рассечение цветка и представление стебля с листьями Vanilla trigonocarpa Hoehne.
РИСУНОК 4.1. Рассечение цветка и представление стебля с листьями Vanilla trigonocarpa Hoehne.
Следите за обезвоживанием
Следует следить за высыханием и в тропических условиях часто обновлять бумагу.Приоритет коллекций в спирту
Коллекции в 70%-ном спирте – ценное дополнение к гербарию. Следует избегать более высоких концентраций, которые делают ткань хрупкой. Поскольку структуры остаются гибкими и не подвергаются сжатию, упрощается их изучение (рис. 4.2). Спирт также облегчает рассмотрение проводящих тканей. Однако, спиртовые коллекции трудно поддерживать, поскольку большие объемы спирта требуют соблюдения правил безопасности, а уровень жидкости необходимо постоянно контролировать из-за испарения. При этом, образцы в спирте не могут заменить сухие образцы, но являются очень полезным дополнением. РИСУНОК 4.2. Рассечение цветка Vanilla bahiana Hoehne, законсервированного в 70% этаноле.
РИСУНОК 4.2. Рассечение цветка Vanilla bahiana Hoehne, законсервированного в 70% этаноле.
Фотографии, сделанные в поле, и мельчайшие детали цветов также могут быть очень полезны. Однако, никакая картинка, даже самая лучшая, не может заменить коллекционный образец. Ботаники наблюдают многие мельчайшие детали, такие как волосистость на губе, структуры на колонке или проводящие пучки органов, которые фотография не может уловить. Филогенетический анализ, фенетические, а затем и кладистические методы значительно помогли в понимании групп растений. Широко распространенное сегодня использование молекулярных признаков позволило во многих случаях подтвердить морфологическую гипотезу. Сочетание молекулярной генетики и систематики – очень мощный инструмент. Поэтому коллекции гербариев ванили должны сопровождаться образцами для производства дальнейших молекулярных исследований, например, кусочками листьев, быстро дегидратированных силикагелем. Гербарии используются как инструменты для определения вида. По всем вышеупомянутым причинам, этого не всегда легко добиться. Когда существует региональная флора или если род был пересмотрен, определение вида может быть основано на определенных ключах идентификации. Но некоторые характеристики все же требуют определенных знаний группы. Образец, используемый для ссылки на название вида – это голотип (рис. 4.3). Теоретически любой экземпляр следует сравнить с этим голотипом, чтобы его можно было идентифицировать. Однако, он не отражает изменчивость вида. Голотипы используются для устойчивости имен. Но необходимо исследовать все экземпляры, чтобы иметь представление о систематике, количестве видов и морфологических отношениях.
 РИСУНОК 4.3. Vanilla ochyrae Szlach. et Olsz. (голотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
РИСУНОК 4.3. Vanilla ochyrae Szlach. et Olsz. (голотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
Дубликаты голотипов называются изотипами (рис. 4.4 и 4.5). Это разные части одного и того же объекта, собранные в один день одним и тем же ботаником. Они часто хранятся в других учреждениях. Изотипы важны для простоты сравнений и сохранности материала. Так во время Второй мировой войны гербарий Берлина был в значительной степени уничтожен, в том числе и коллекции типов. Изотипы, сохраненные в других гербариях, являются единственным справочным материалом, доступным научному сообществу. Международный кодекс ботанической номенклатуры (McNeill et al., 2006), который устанавливает правила присвоения и использования названий растений, предусматривает замену исчезнувшего голотипа изотипом. Если изотипа нет, будет использован один из других образцов (паратипов), указанных в исходной публикации. Этот образец замены называется лектотипом. Если весь исходный материал отсутствует, ботаник, изучавший вид, может выбрать образец (неотип), который лучше всего соответствует опубликованному описанию.
 РИСУНОК 4.4. Vanilla tahitiensis Moore (изотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
РИСУНОК 4.4. Vanilla tahitiensis Moore (изотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
 РИСУНОК 4.5. Vanilla humblotii Rchb.f. (изотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
РИСУНОК 4.5. Vanilla humblotii Rchb.f. (изотип). [Воспроизведено с разрешения веб-сайта Herbier National (MNHN)]
Недостаток цветов в природе
Ваниль редко наблюдается в поле в виде цветов. Во флористических описаниях гораздо чаще встречаются стебли и листья, чем соцветия или плоды. По этим причинам необходимо создавать коллекции ex situ, позволяющие отслеживать цветение и правильно препарировать образцы. Если информация о первоначальных полевых сборах будет надлежащим образом сохранена, образцы будут казаться богатыми и готовыми к изучению. Гербарные образцы сложно приготовить, дорого содержать и требуются определенные навыки для анализа. Однако, они абсолютно необходимы для пересмотра таксономии рода, пока не созданы молекулярные инструменты, в частности, на основе анализа ДНК.Глава 5. Биотехнология в приложении к Vanilla
Введение
Vanilla planifolia G. Jackson (син. V. fragrans Andrews) – тропическая вьющаяся орхидея (рис. 5.1), известная своим популярным изысканным ароматом ванили (Purseglove et al., 1981), и вторая по цене пряность, после шафрана, продаваемая на мировом рынке (Ferrão, 1992). Основными странами-производителями ванили являются Мадагаскар, Индонезия, Уганда, Индия и Коморские острова, причем Мадагаскар занимает первое место. После открытия в 1492 году Нового Света Колумбом, самый ранний отчет о распространении ванили из Мексики принадлежит отцу Лабату, импортировавшему в 1697 году три лианы V. planifolia на Мартинику. Отсутствие естественных опылителей в районах интродукции препятствовало половому размножению и производству стручков до открытия искусственного опыления в первой половине девятнадцатого века (Bory et al., 2008d). Непрерывное вегетативное размножение, отсутствие естественного набора семян и недостаточные вариации в генофонде – все это препятствует программам улучшения данной культуры. РИСУНОК 5.1. Лиана V. planifolia – в полном плодоношении.
РИСУНОК 5.1. Лиана V. planifolia – в полном плодоношении.
За короткий промежуток времени биотехнология оказала значительное влияние на характер развития и качество жизни во всем мире (Bhatia, 1996). Во второй половине двадцатого века возникли новые отрасли промышленности, основанные на открытиях, сделанных в области биологических наук, а прогресс, достигнутый за последние годы в молекулярной биологии, генной инженерии и культуре тканей растений, открыл новое измерение в улучшении сельскохозяйственных культур. Культура in vitro является одним из ключевых инструментов биотехнологии растений, в которой используется тотипотентная природа растительных клеток – концепция, предложенная Хаберландтом и впервые недвусмысленно продемонстрированная Фредериком Стюардом (Haberlandt, 1902; Steward et al., 1958). Ее можно использовать для производства здоровых клонов, массового клонирования выбранных генотипов, сохранения генофонда, отбора мутантов, выращивания гибридов нескрещиваемых таксонов, посредством соматической гибридизации, включения желаемых признаков с помощью генной инженерии и в производстве вторичных метаболитов в культивируемых клетках или тканях (Thorpe, 1990). Однако, реализация этих целей требует предварительной стандартизации и оптимизации процедур культивирования тканей.
Проблемы, на которые следует обратить внимание
Как товарная культура, ваниль играет важную роль в экономике Мадагаскара, Коморских Островов, Индонезии и Уганды. Непрерывное клональное размножение V. planifolia ведет к монокультуре, подвергая урожай серьезным потерям (Gopinath, 1994), поскольку ваниль поражается большим количеством вредителей и болезней (см. главы 7, 8, 9 и 20). Внедрение нового генетического материала в значительной степени сдерживается такими факторами как её бесполое размножение, преимущественным самоопылением цветов и опасностью, грозящей дикорастущим популяциям ванили из-за антропогенного давления (Lubinsky, 2003). Отсутствие достаточной изменчивости генофонда, угроза деструктивных заболеваний, уничтожающих плантации ванили, а также разрушение её естественной среды обитания, делают необходимым поиск альтернативных методов внесения изменчивости в генофонд. Бедный генофонд можно обогатить, используя межвидовую гибридизацию для объединения имеющегося первичного генофонда рода Vanilla со вторичным генофондом, то есть близкими родственниками V. planifolia, который является важным источником желательных признаков, таких как самоопыление, низкая зависимость стимуляции цветения от фотопериода, высокое завязывание плодов, нерастрескивание стручков и устойчивость к болезням (Lubinsky, 2003). Различные виды ванили встречаются в разных географических регионах, и их сезоны цветения не синхронизированы, что создает трудности в перемещении пыльцы к видам-рецепторам для обеспечения опыления между видами. Именно в таких случаях становится важной разработка методов хранения жизнеспособной пыльцы в течение длительных периодов времени. Переработчикам и потребителям ванили будет полезно улучшение качественных характеристик – повышенное содержание ванилина, более крупный размер стручков, улучшенный аромат и вкус и т. д. Чтобы улучшить прорастание незрелых зародышей в полноценное растение, можно использовать методы извлечения и регенерации зародышей из нежизнеспособных гибридных семян. Культура клеток или культура протопластов полезны возможностью создания соматических гибридов для переноса признаков из инородных источников. Протопласты могут использоваться в качестве органов-мишеней для преобразования, при условии их восстановления в полноценный саженец. Клональное размножение элитных линий, сохранение in vitro и международный обмен гермоплазмой возможны с использованием методов микроразмножения. Молекулярные маркеры – ДНК-маркеры [случайная амплифицированная полиморфная ДНК (RAPD), полиморфизм длины рестрикционного фрагмента (RFLP), полиморфизм длины амплифицированного фрагмента (AFLP)] и биохимические маркеры (изофермент, белок) – могут применяться для описания свойств гермоплазмы и сомаклональных вариантов.Генетическое разнообразие в Vanilla
V. planifolia – культура, мало отличающаяся от своих дикорастущих предков. Это можно объяснить недавним окультуриванием и ограниченным размножением (Bory et al., 2008c; Lubinsky et al., 2008a). В культивируемой ванили Мексики было обнаружено несколько типов, различающихся вегетативным внешним видом или способом воспроизводства (Soto Arenas, 2003). Анализ данных по изоферментам образцов с плантаций ванили на севере Веракруса, Оахаки и прочих мест в Мексике показал в целом незначительную генетическую изменчивость (Soto Arenas, 1999), хотя растения, происходящие из двух основных областей, можно было различить. Изменения нуклеотидной последовательности в интронах двух специфических генов, кодирующих белок, а именно кальмодулин и глицеральдегид-3-фосфатдегидрогеназу, были обнаружены, но не смогли быть разграничены среди мексиканских типов ванили. За пределами страны происхождения, ваниль, вероятно, имеет клональное происхождение, и здесь можно ожидать очень незначительных вариаций. Плантации ванили на Реюньоне, Мадагаскаре, Маврикии и Сейшельских островах произошли от одного черенка (Lionnet, 1958), и, согласно имеющейся информации, наблюдается мало различий в типах культивируемой V. planifolia. Однако, недавние исследования показали, что самоплодотворение, а также случаи полиплоидизации привели к фенотипическому разнообразию ванили на Реюньоне (Bory et al., 2008a, 2008b, 2008c). За последнее десятилетие, для изучения генетического разнообразия на уровне рода, были разработаны молекулярные маркеры – RAPD, AFLP и единичные повторы последовательности (SSR). RAPD использовался для оценки уровня генетического разнообразия и взаимосвязей между различными клонами V. planifolia и родственными видами. Эти данные подтвердили очень ограниченную изменчивость сообщества V. planifolia, указывающую на его узкую генетическую базу и тесную связь с V. tahitensis J.W. Moore (Besse et al., 2004; Minoo et al., 2008; Schlüter et al., 2007). В исследовании, включающем как листовые, так и безлистные видоы, такие как V. planifolia, V. tahitensis, V. andamanica Rolfe, V. pilifera Holtt. и V. aphylla Blume (рис. 5.2), наблюдалась разумная вариабельность, свидетельствующая о возможности естественного самосева в дикой природе. Несмотря на внешнее морфологическое сходство, V. andamanica не имеет близкого родства с V. planifolia или V. tahitensis, а её образцы отличаются от всех других изученных видов, образуя отдельный уникальный кластер (Minoo et al., 2008). Между восемью различными образцами V. andamanica наблюдалась значительная изменчивость, подтверждающая вероятность того, что этот вид действительно произошел с Андаманских островов, где возможно семенное размножение (Minoo et al., 2008). Ранее сообщалось о появлении естественных семян у V. wightiana в Индии (Rao et al., 2000). РИСУНОК 5.2. Цветки индийских видов ванили: (a) и (b) V. andamanica с разным цветом губы, (c) V. pilifera с указанием посещения насекомыми и d) V. aphylla.
РИСУНОК 5.2. Цветки индийских видов ванили: (a) и (b) V. andamanica с разным цветом губы, (c) V. pilifera с указанием посещения насекомыми и d) V. aphylla.
Профили AFLP были разработаны для анализа видов Vanilla, межвидовых гибридов и самоопыленных потомков (Bory et al., 2008c; Lubinsky et al., 2008a; Minoo et al., 2006b). Все эти анализы сошлись на том, что большинство образцов V. planifolia, культивируемых за пределами Мезоамерики, демонстрируют очень низкий уровень генетического разнообразия, поскольку произошли от одного образца, возможно, мексиканского сорта «Манса» из Папантлы. Также были изучены закономерности диверсификации у культурного вида и проведено сравнение с другим культурным (V. tahitensis) или дикорастущими видами (V. aphylla, V. bahiana, V. insignis, V. odorata и V. pompona). У этих родственных видов, межвидовых гибридов и самоопыленных потомков был обнаружен четкий полиморфизм. Сообщалось о разработке SSR-маркеров (микросателлитов) (Bory et al., 2008b). Описаны выделение и характеристика 14 микросателлитных локусов V. planifolia. Как и ожидалось, внутри культурных образцов они были мономорфными, исходя из вероятного единственного клонального происхождения этой культуры и предыдущих генетических исследований. Эти маркеры были переносимыми для V. tahitensis, и 11 локусов оказались полиморфными между этими двумя близкородственными видами. Кроме того, некоторые из этих маркеров были переносимыми и полиморфными среди 15 других дикорастущих американских, африканских и азиатских видов и выявили устойчивые взаимосвязи между ними, а также четкую картину дифференциации видов Старого и Нового Света внутри рода. Кроме того, использование микросателлитов позволило провести первую молекулярную оценку уровней гетерозиготности у этого вида, что было невозможно при использовании доминирующих маркеров, таких как AFLP или RAPD. Для реконструкции эволюционной истории ванилоидных орхидей, включая несколько видов Vanilla, использовалось секвенирование нейтральных генов (Cameron, 2000, 2004, 2009; Cameron and Molina, 2006; Cameron et al., 1999). Последовательности ядерной ДНК (внутренний транскрибируемый спейсер, ITS) и пластид (ген rbcL) использованы для выяснения происхождения таитянской ванили (Lubinsky et al., 2008b). Полиморфизм длины гена ненейтральной О-метилтрансферазы кофейной кислоты также недавно был использован для анализа 20 видов ванили и подтвердил сильную дифференциацию видов Старого и Нового Света в этом роде (Besse et al., 2009). На основе данных секвенирования ядерной и плазмидной ДНК Кэмерон (Cameron, 2005) предложил создать систему штрих-кода (Lahaye et al., 2008) для ванили с использованием области ITS и межгенного спейсера psbA-trnH. Эта система может позволить рутинную идентификацию образцов ванили до уровня вида и, возможно, даже до уровня образца. Для построения надежной филогении рода Vanilla необходимо задействовать эталонные гербарные образцы. С этой целью следует рассмотреть возможность создания пластидных мононуклеотидных микросателлитов для ванили (особенно при использовании образцов деградированной ДНК, извлеченных из гербарного материала), которые уже успешно применялись для биогеографических исследований орхидей (Fay and Krauss, 2003; Micheneau, 2002). Учитывая сложность использования классических фенотипических маркеров для многолетних культур, таких как ваниль, молекулярные маркеры являются мощным инструментом изучения изменчивости культивируемой ванили, выяснения взаимосвязей между видами, определения межвидовых гибридов и выявления важных генотипов (Minoo et al., 2006a). Поэтому они очень полезны для мониторинга и оценки достижений биотехнологий.
Размножение и методы разведения
Коммерческая ваниль всегда размножается стеблевыми черенками здоровых сильно-рослых растений и может быть срезана с любой части лианы. Длина черенка обычно определяется количеством доступного посадочного материала. Коротким черенкам длиной 20 см потребуется 3–4 года, чтобы зацвести и заплодоносить. Обычно предпочтительны черенки длиной 90–100 см, так как они имеют тенденцию к более раннему цветению. Когда они активны, со свободными концами свисающими с опор, то зацветут и заплодоносят через 1-2 года. Черенки обычно сразу высаживают на место, но при необходимости их первоначально подращивают на грядках. Из-за своей сочной природы черенки при необходимости можно хранить или транспортировать до двух недель. Традиционно гермоплазму ванили хранят в биорепозиториях, принадлежащих ботаническим садам и научным учреждениям. Высокая стоимость традиционных систем ограничивает количество хранимых образцов. Для уменьшения потерь биоразнообразия и сохранения исчезающих видов, были предприняты попытки сохранять виды ванили in vitro (Jarret and Fernandez, 1984; Minoo et al., 2006b). В селекционных целях ваниль можно выращивать из семян. Гибридизация и выращивание растений из семян проводились в Пуэрто-Рико и на Мадагаскаре. Семена необходимо продезинфицировать, промыть в стерильной дистиллированной воде и культивировать в питательной среде Кнудсона (Knudson, 1950). Прорастание семян ванили лучше, если культуры содержатся в темном инкубаторе при 32°C. Для прорастания семян межвидовых скрещиваний V. planifolia и V. pompona требуется более высокая температура в 34°C.Проращивание семян in vitro
Ваниль дает множество мелких семян, которые не прорастают в естественных условиях. Для успешного проращивания семян можно использовать технику культивирования тканей. Протоколы для выращивания семян и зародышей ванили стандартизированы (Gu et al., 1987; Knudson, 1950; Minoo et al., 1997; Withner, 1955). Посев семян на различных базальных средах показал, что семена ванили не имеют строгих требований к питанию для начала прорастания, в отличие от некоторых наземных орхидей умеренного климата (Minoo et al., 1997). Прорастание семян начинается в течение четырех недель после культивирования, и начальные стадии прорастания типичны для большинства орхидей, такие как набухание зародыша с последующим разрывом семенной оболочки и последующее появление протокорма (рис. 5.3). Семена прорастали непосредственно в проростки в среде, дополненной одним бензиладенином (БА) (0,5 мг/л), без какой-либо промежуточной фазы каллуса, и, таким образом, их можно было использовать для получения самоопыленных потомков/проростков. Добавление триптона имело стимулирующий рост эффект на размер и развитие протокорма, независимо от базовой среды, в которую он был добавлен. При обработке БА большинство протокормов оставались такими же, с чешуевидными примордиальными листьями и развивающимися в побеги, тогда как обработка добавками ауксина показала постепенную дезорганизацию протокорма в каллус. Среда Мурасиге и Скуга (МС), для культур ванили in vitro, давала лучший отклик, чем среда Кнудсона. Минимальная всхожесть (26%) наблюдалась в среде МС при половинной концентрации, а максимальная (85%) была зарегистрирована в среде МС полной концентрации с добавлением 2 г/л триптона (Minoo, 2002). РИСУНОК 5.3. Прорастание семян in vitro.
РИСУНОК 5.3. Прорастание семян in vitro.
Считается, что потребность в цитокинине для прорастания связана с использованием липидов, которые составляют основной запасной материал в большинстве семян орхидей, и было замечено, что, если запасной липид не используется, прорастание не продолжается (De Pauw et al., 1995). Известно, что ваниль, культура с перекрестным опылением, имеет множество мейотических и постмейотических хромосомных аномалий (Ravindran, 1979). В результате можно получить различные цитотипы в семенном потомстве. Таким образом, выращивание из семян может дать множество генетически разнообразных типов. Исследования прорастания семян ванили и полученного в результате потомства in vitro показали морфологические и биохимические вариации. На самоплодных потомках V. planifolia были изучены профили изоферментов супероксиддисмутазы (SOD) и пероксидазы (PRX). Профили четко указывают на различия между потомками, выраженные наличием или отсутствием конкретных полос. Максимальное сходство, которое продемонстрировали эти потомки, составило 47,37%, что указывает на высокую сегрегацию и уровень гетерозиготности, существующие у V. planifolia (Minoo et al., 1997). Эта гетерозиготность была дополнительно подтверждена анализом AFLP (Bory et al., 2008c). Поэтому, культуру in vitro можно использовать для проращивания семян и отбора полезных генотипов из сегрегированных потомков, которые можно было бы массово размножать для получения свободного от болезней посадочного материала.
Микроразмножение
Размножение ванили in vitro необходимо для получения однородных, свободных от болезней ростков и сохранения генетических ресурсов. Размножение in vitro с использованием апикальной меристемы стандартизовано для крупномасштабного размножения здоровых и генетически стабильных растений (Cervera and Madrigal, 1981; George and Ravishankar, 1997; Kononowicz and Janick, 1984; Minoo, 2002; Minoo et al., 1997; Philip and Nainar, 1986; Rao et al., 1993b). Стандартизовано in vitro размножение V. tahitensis (Mathew et al., 2000) и исчезающих видов ванили, таких как V. wightiana, V. andamanica, V. aphylla и V. pilifera (Minoo et al., 2006b), чтобы защитить эти виды от исчезновения. Сообщалось о методах клонального размножения для эффективного размножения V. planifolia путем индукции множественных побегов из эксплантатов пазушных зачатков (рис. 5.4) с использованием полутвердой среды МС с добавлением БА (2 мг/л) и α-нафталинуксусной кислоты (НУК, 1 мг/л) (George and Ravishankar, 1997). Множественные побеги переносили в перемешиваемую жидкую среду МС с БА в концентрации 1 мг/л и НУК в концентрации 0,5 мг/л в течение 2–3 недель, а затем культивировали на полутвердой среде. Используя этот метод, в среднем от одного эксплантата пазушной почки было получено 42 побега в течение 134 дней. Было обнаружено, что использование промежуточной жидкой среды способствует увеличению количества побегов. РИСУНОК 5.4. Микроразмножение V. planifolia.
РИСУНОК 5.4. Микроразмножение V. planifolia.
В другом исследовании (Minoo et al., 1997) оценивался перенос эксплантов на среду МС, содержащую различные уровни цитокинина (БА) и ауксина (индолмасляная кислота, ИМК), для пролиферации (таблица 5.1). Инициирование роста уже существующих почек in vitro может быть индуцировано в среде МС с низким содержанием цитокинина. Однако, комбинация цитокининов и ауксина способствовала образованию множественных побегов. Идеальной средой для размножения была МС с добавлением БА (1 мг/л) и ИМК (0,5 мг/л). В этой среде за 90 дней культивирования индуцировалось в среднем 15 множественных побегов (рис. 5.4). Узловые сегменты давали лучший ответ: в среднем 15 побегов на культуру по сравнению с кончиками побегов, которые давали в среднем семь побегов на культуру (Minoo, 2002). Питательные среды и условия, благоприятные для микроразмножения V. planifolia, подходили для других родственных видов, таких как V. andamanica, V. aphylla (рис. 5.5) и V. pilifera. Количество индуцированных побегов у разных видов варьировало (таблица 5.2). Примерно 12-15 побегов на культуру могут быть индуцированы у V. planifolia, и 8-10 побегов у V. aphylla. Среди изученных видов наименьшая скорость размножения наблюдалась у V. pilifera. Удлиненные побеги, из среды для пролиферации, укореняли на среде МС, содержащей 30 г/л сахарозы, без регулятора роста (рис. 5.6). Приживаемость проростков с хорошо развитыми корнями in vitro составила более 70%. Возникновение корней на микрочеренках начиналось между четырьмя и шестью днями после культивирования, достигая 100% культуры через две недели, что указывает на то, что оптимальные эндогенные уровни регуляторов роста растений, необходимых для укоренения, уже присутствовали в ткани/эксплантатах.
ТАБЛИЦА 5.1. Влияние регуляторов роста на индукцию множественных побегов и корней из экспланта побега V. planifolia на среде МС (среднее из 20 повторов)
| Концентрация регуляторов роста | Частота множественных побегов (%) | Среднее количество всходов/культура ± станд.откл. | Развитие корней/Культура | |||||
|---|---|---|---|---|---|---|---|---|
| Kin | BA | NAA | IBA | No. | Тип | |||
| 0.5 | 0.0 | — | — | |||||
| 1.0 | 0.0 | — | — | |||||
| 0.5 | 71 ± 3.45 | 4.18 ± 0.30 | — | — | ||||
| 1.0 | 20 ± 3.63 | 1.0 | — | — | ||||
| 0.5 | 0.0 | 1.0 | 1 | веламен | ||||
| 1.0 | 0.0 | 1.0 | 1 | веламен | ||||
| 0.5 | 0.0 | 1.0 | 1 | длинные корни | ||||
| 1.0 | 0.0 | 1.0 | 1 | длинные корни | ||||
| 0.5 | 0.5 | 0.0 | 1.0 | — | — | |||
| 1.0 | 0.5 | 0.0 | 1.0 | — | — | |||
| 0.5 | 1.0 | 0.0 | 1.0 | — | — | |||
| 0.5 | 0.5 | 0.0 | 1.0 | 1 | веламен | |||
| 1.0 | 0.5 | 0.0 | 1.0 | 1 | разветвление | |||
| 0.5 | 1.0 | 0.0 | 1.0 | 1 | веламен | |||
| 0.5 | 0.5 | 0.0 | 1.0 | 1 | — | |||
| 1.0 | 0.5 | 0.0 | 1.0 | 1 | — | |||
| 0.5 | 1.0 | 0.0 | 1.0 | 1 | — | |||
| 0.5 | 0.5 | 0.0 | 1.0 | 1 | ||||
| 1.0 | 0.5 | 97 ± 6.5 | 15.15 ± 3.63 | — | — | |||
| 0.5 | 1.0 | 65 ± 11.4 | 10.35 ± 3.45 | — | — | |||
| 0.0 | 1.0 | 1 | здоровые корни | |||||
ТАБЛИЦА 5.2. Сравнение откликов in vitro у разных видов Vanillaa
| Регулятор роста | Отклик in vitro | |||
|---|---|---|---|---|
| V. planifolia | V. andamanica | V. aphylla | V. pilifera | |
| Кин S | Одиночный побег | Одиночный побег | Одиночный побег | Одиночный побег |
| BA | Множественные побеги | Одиночный побег | Множественные побеги (3–4) | Множественные побеги (3–4) |
| NAA | Индукция корней | Индукция корней | Индукция корней | Индукция корней |
| БА + Kin | Одиночный побег | Одиночный побег | Одиночный побег | Одиночный побег |
| Кин + IBA | Одиночный побег | Одиночный побег | Одиночный побег | Одиночный побег |
| БА + ИМК (1.0 + 0.5 мг/л) | Индукция множественных побегов (12–15 шт., в 10-дневной культуре) | Индукция множественных побегов (5–7 в 90-дневной) | Индукция множественных побегов (8–10 в 90-дневной) | Индукция множественных побегов (2–4 в 120-дневной) |
| БА + NAA | Каллусирование и регенерация растений | Множественные побеги | Каллусирование и регенерация растений | Одиночный побег |
| Кин + NAA | Одиночный побег | Одиночный побег | Одиночный побег | Одиночный побег |
| Базальная среда | Удлинение одиночного побега и развитие корней | Удлинение одиночного побега и развитие корней | Удлинение одиночного побега и развитие корней | Удлинение одиночного побега и развитие корней |
 РИСУНОК 5.5. Возникновение множественных побегов in vitro у V. aphylla.
РИСУНОК 5.5. Возникновение множественных побегов in vitro у V. aphylla.
Разработаны простые и быстрые протоколы массового размножения V. planifolia (Janarthanam et al., 2005; Kalimuthu et al, 2006). Коммерчески жизнеспособный протокол массового размножения V. tahitensis, другого культивируемого вида ванили, был стандартизован с коэффициентом размножения 1:4,7 в течение периода культивирования 60–70 дней (Mathew et al., 2000). Рао (Rao et al., 2000) сообщил о случае микроразмножении V. wightiana Lindl., находящегося под угрозой исчезновения вида. Изучалось влияние других добавок, а именно,нитрата серебра, тидиазурона, зеатина, кокосового молока и т. д. на размножение побегов in vitro и образование корней у V. planifolia (Giridhar et al., 2001; Giridhar and Ravishankar, 2004). Превращение кончиков корней в побеги наблюдали у V. planifolia и V. aphylla при культивировании на среде МС с добавлением БА (1,0 мг/л) и ИМК (0,5 мг/л). Эти побеги превратились в проростки, укрепились и укоренились в почве. Ранее сообщалось о превращении корневой меристемы в побеги в культурах ванили in vitro (Philip, Nainar, 1988). Предполагается, что эти меристематические преобразования без стадии каллуса сводят к минимуму вероятность индуцированных эпигенетических изменений. Более ранние исследования (Sreedhar et al., 2007) указали на отсутствие различий в паттернах AFLP-бэндов любого из микроразмножающихся образцов для конкретного праймера, что позволяет предположить отсутствие различий между микроразмножающимися растениями.
 РИСУНОК 5.6. Укоренение in vitro в культурах V. planifolia.
РИСУНОК 5.6. Укоренение in vitro в культурах V. planifolia.
Регенерация растений через каллусные культуры
Непрерывное вегетативное размножение и отсутствие достаточных изменений в генофонде препятствуют программам улучшения сельскохозяйственных культур. Введение сомаклональной изменчивости через каллусные культуры было предпринято для расширения узкой генетической базы. Система индукции каллуса и регенерации растений in vitro оптимизирована как для вегетативных, так и для репродуктивных тканей. Наилучшие результаты были получены при использовании вегетативных тканей, и более 80% каллусий было достигнуто в среде МС с добавлением 1 мг/л БА и 0,5 мг/л НУК. Каллус дифференцировался в побеги, которые можно было успешно размножить в соотношении 1:12 в комбинации 1 мг/л БА и 0,5 мг/л ИМК при добавлении среды МС (таблица 5.3). Укоренение in vitro индуцировали с эффективностью 100% в базальной среде МС, лишенной каких-либо регуляторов роста. Эта способность дедифференцированной ткани к регенерации является важной предпосылкой для экспериментов по генетической трансформации. Протокол был успешно распространен на находящиеся под угрозой исчезновения дикорастущий вид V. aphylla, предлагая возможность применения протокола для массового размножения, а также индукции вариаций у видов Vanilla за ограниченное время.ТАБЛИЦА 5.3. Влияние регуляторов роста на индукцию каллуса и регенерацию растений в культурах семян V. planifolia на среде МС (в среднем 20 повторов)
| Регуляторы роста (мг/л) | Образование каллуса (%) | Регенерация побегов (%) | Кол-во побегов на культуру |
|---|---|---|---|
| 0 | 0 | 0 | 0 |
| НУК (0.5) | 80 | 0 | 0 |
| БА (1.0) | 0 | — | — |
| БА (1.0) + НУК (0.5) | 80 | 90 | 10 |
| БА (0.5) + НУК (1.0) | 0 | — | — |
| БА (1.0) + ИМК (0.5) | 10 | 60 | 6 |
Сообщений об изменчивости каллус-регенерированных растений ванили немного. Они касаются успешной регенерации растений из каллусов, полученных из листьев и семян (Davidonis and Knorr, 1991; Davidonis et al., 1996; Janarthanam and Seshadri, 2008; Xju et al., 1987), и исследований среди местных коллекций ванили с помощью электрофореза в полиакриламидном геле (PAGE) (Rao et al., 1993a). Исследование, включающее случайным образом отобранные каллус-регенерированные потомства, показало изменчивость морфологии и профилей RAPD (рис. 5.7) среди регенерированных из каллусов растений, по сравнению с контрольным растением V. planifolia (Minoo, 2002). Показано, что с помощью этого протокола может быть получена значительная вариабельность, которая может быть использована в программах улучшения ванили для создания вариантов с желаемыми агрономическими характеристиками.
 РИСУНОК 5.7. Профили RAPD потомков ванили, регенерированных из каллуса, с использованием праймера OPERON OPA10. 1 – лестница 1 kb, 2–23: растения, регенерированные из каллусов, 24 – контроль (V. planifolia).
РИСУНОК 5.7. Профили RAPD потомков ванили, регенерированных из каллуса, с использованием праймера OPERON OPA10. 1 – лестница 1 kb, 2–23: растения, регенерированные из каллусов, 24 – контроль (V. planifolia).
Культуры каллуса из листовых эксплантатов V. planifolia показали лучшее инициирование каллуса, чем культуры из узловых эксплантатов с максимальной продукцией биомассы каллуса при культивировании на базальной среде МС, содержащей 2,4-дихлорфеноксиуксусную кислоту и БА. Каллус, перенесенный в базальную среду МС с добавлением 3 мг/л БА и 2,5 мг/л μМ НУК, показал лучший ростовой ответ. Производство каллуса V. planifolia, экстракция ванилина и использование феруловой кислоты для увеличения содержания ванилина запатентовано (Davidonis et al. 1996). Сообщалось о наследственных сомаклональных вариациях в отношении различных признаков устойчивости, а именно: устойчивости к метионинсульфоксиму (Carlson, 1973) и Pseudomonas syringae (Thanutong et al., 1983) у табака, устойчивости к Fusarium oxysporum у томатов (Evans et al., 1984), а также устойчивости к Helminthosporium sativum (Chawla, Wenzel, 1987) у пшеницы. В будущих попытках генетически трансформировать ваниль, способность трансформированной ткани к регенерации является решающим условием. Оптимизированный протокол регенерации (Minoo, 2002) может сократить продолжительность экспериментов по генетической трансформации, вызывая высокую частоту регенерации.
Выращивание рассады ex vitro
Большинство видов растений, выращиваемых in vitro, требуют постепенной акклиматизации и закаливания для выживания и роста в естественной среде. Выживание растений in vitro зависит от их способности противостоять потере воды и осуществлять фотосинтез. Однако, у ванили выживаемость перенесенных растений в процессе закаливания в настоящее время составляет более 80% (Minoo, 2002). Проростки необходимо извлечь из культуральных сосудов (рис. 5.8), промыть, обработать фунгицидом, перенести в полиэтиленовые пакеты, содержащие почвенную смесь (песок, почву и вермикулит), и закалить в течение 30 дней в контролируемых условиях (26–28°C, 80–90% относительной влажности). Инициирование нового роста происходит за счет развития пазушной ветви. Эти растения успешно переносятся в почву после трехнедельного периода закаливания (рис. 5.9). Позже они высаживаются на участок с подходящей тенью и опорой. РИСУНОК 5.8. Закалка проростков, выращенных in vitro.
РИСУНОК 5.8. Закалка проростков, выращенных in vitro.
 РИСУНОК 5.9. Растения из культуры ткани, выращиваемые в горшках.
РИСУНОК 5.9. Растения из культуры ткани, выращиваемые в горшках.
Межвидовая гибридизация
Межвидовая гибридизация – это давний механизм, с помощью которого полезные гены диких предков и видов могут быть перенесены в культивируемые виды. Культурные типы многих видов сельскохозяйственных культур были улучшены за счет межвидовой гибридизации и обратного скрещивания. Межвидовая гибридизация очень распространена у орхидей для получения новых разновидностей цветущих растений. Нильсен и Сигзмунд (Nielsen and Siegsmund, 1999) сообщали о естественном возникновении межвидовых гибридов ванили между V. claviculata и V. barbellata в Пуэрто-Рико, в местах сосуществования. Было обнаружено потомство, имеющее промежуточные морфологические признаки между двумя родителями. Культурные вид V. planifolia был скрещен с другими американскими видами, включая V. pompona и V. phaeantha, устойчивым к Fusarium (Purseglove et al., 1981). На Яве также была проведена межвидовая гибридизация культурной и дикорастущей ванили с целью создания линий, устойчивых к стеблевой гнили, вызываемой Fusarium oxysporum (Mariska et al., 1997). В Индии V. aphylla и V. pilifera цветут синхронно, но V. aphylla естественным образом встречается в Южной Индии, а V. pilifera – в Ассаме, Северо-Восточная Индия. При культивировании в Керале цветки обоих видов раскрывались последовательно и держались один день у V. pilifera, тогда как у V. aphylla – два дня. В первом случае признаки завязывания плодов наблюдались даже без ручного опыления, тогда как цветки V. aphylla не завязывали плоды. Поскольку ростеллум присутствует у обоих видов, естественное опыление без посторонней помощи исключено. Можно предположить, что аромат цветов V. pilifera привлекает насекомых (которые, как было установлено, часто посещают цветы), чтобы посетить их и произвести эффективное опыления (Д. Миноо, неопубликованные данные). Самостоятельную и межвидовую гибридизацию между двумя видами проводили вручную и наблюдали завязывание плодов. Были предприняты успешные попытки увеличить спектр изменчивости V. planifolia путем межвидовой гибридизации с V. aphylla, устойчивой к Fusarium (Minoo, 2002). Морфологические признаки и молекулярные профили выявили истинную гибридность у межвидовых потомков. Выращенное потомство V. planifolia и межвидовые гибриды, полученные от скрещивания V. planifolia (мать) и V. aphylla (отец), оценивались с использованием ряда локусов AFLP и RAPD в качестве маркеров. Профили показали сходство между родителями, потомками от самоопыления и межвидовыми гибридами, а все протестированные потомки были разными по сравнению друг с другом, что можно использовать для улучшения культуры ванили (Minoo et al., 2006a). Таким образом, эти успешные внедрения мужских и женских признаков в гибриды (Minoo et al., 2006a) посредством межвидовой гибридизации, подтвержденные молекулярными профилями, обещают помочь преодолеть основные узкие места в селекции ванили.Хранение in vitro
Стандартизированы эффективные процедуры хранения in vitro путем медленного роста отдельных видов ванили (Minoo et al., 2006b). Добавление маннита (10-15 г/л) и снижение сахарозы до более низких уровней (15-10 г/л) вызывало медленный рост, и более 80-90% культур можно было поддерживать в течение периода 360 дней, когда культуральные сосуды были закрыты алюминиевой фольгой. Добавление маннита и сахарозы в равных пропорциях в количестве 10 или 15 г/л может помочь поддерживать культуры в течение одного года, а с ежегодным субкультивированием in vitro более семи лет. Проростки, содержащиеся в этой среде, показали пониженную скорость роста и максимальную выживаемость. Консервированный материал переносили в среду МС, обогащенную 30 г/л сахарозы и дополненную 1 мг/л БА и 0,5 мг/л ИМК для получения нормальных побегов и их размножения. Проростки небольшого размера, которые хранились в среде для консервации более одного года, показали хороший рост и превратились в растения нормального размера с хорошей степенью размножения (1:5). Эти саженцы были перенесены в почву (садовая почва:песок:перлит в равных пропорциях) и легко укоренились с успехом 80% во влажной камере в течение 20–30 дней после пересадки. Они превратились в нормальные растения без каких-либо деформаций и симптомов дефицита и проявляли очевидное морфологическое сходство с материнскими растениями. После более чем семи лет хранения с медленным ростом, включающего более пяти циклов субкультивирования, генотипическая стабильность нескольких видов была оценена с помощью молекулярных маркеров. Никаких изменений в дактилоскопии ДНК по сравнению с неконсервированными контролями в лаборатории авторов не наблюдалось. Джаррет и Фернандес (Jarret and Fernandez, 1984) сообщили о хранении верхушек побегов V. planifolia в качестве тканевых культур в течение 10 месяцев, а Филип (Philip, 1989) обсудил возможность использования корневых культур для сохранения гермоплазмы ванили для гарантированной генетической стабильности. Сообщалось о сохранении in vitro V. planifolia (Jarret and Fernandez, 1984) и V. walkeriae с использованием метода медленного роста (Agrawal et al., 1964), и было изучено влияние полиаминов на сохранность in vitro V. planifolia (Thyagi et al., 2001). Обычные и in vitro генные банки дополняют друг друга, как активная и базовая коллекции генетических ресурсов. Хотя сохранение in vitro нельзя рассматривать как метод замены сохранения in situ, были продемонстрированы преимущества сохранения in vitro как компонента, который может быть включен в общую стратегию долгосрочного сохранения ванили для безопасного и экономичного хранения гермоплазмы.Криоконсервация
Протоколы сохранения генофондов были разработаны для медленного роста, а также криоконсервации образцов ванили в виде инкапсулированных кончиков побегов, пыльцы и ДНК (Minoo, 2002). Объединение доступного генофонда поможет расширить генетическую базу и внедрить в культивируемую ваниль полезные гены из дикорастущих видов. Межвидовая гибридизация требует синхронного цветения между видами и наличия жизнеспособной пыльцы. Пыльцу двух асинхронно цветущих видов ванили, а именно культурной V. planifolia и её дикорастущего родственника V. aphylla, подвергали криоконсервации после высушивания. Предварительно обрабатывали криопротектором диметилсульфоксидом (5%) и криоконсервировали при -196°C в жидком азоте. Эта криоконсервированная пыльца была позже разморожена и протестирована на её жизнеспособность как in vitro, так и in vivo. Процент прорастания пыльцы V. planifolia и V. aphylla составил 82,1% и 75,4% соответственно, что указывает на её жизнеспособность. Эта криоконсервированная пыльца V. planifolia была успешно использована для опыления цветков V. aphylla, что привело к завязыванию плодов. Полученные таким образом семена были успешно культивированы для развития гибридных всходов (Minoo, 2002). Таким образом, оценка жизнеспособности и фертильности криоконсервированной пыльцы (рис. 5.10) видов ванили показала, что можно использовать криогенные методы для сохранения гаплоидного генофонда этого вида и управления им. Это имеет большое значение для облегчения скрещиваний в программах селекции, для распространения и обмена гермоплазмой, а также для сохранения ядерных генов гермоплазмы. РИСУНОК 5.10. Прорастание криоконсервированной пыльцы.
РИСУНОК 5.10. Прорастание криоконсервированной пыльцы.
Процедура хранения гермоплазмы ванили путем криоконсервации кончиков побегов с использованием метода инкапсуляции/дегидратации была стандартизирована (рис. 5.11). Кончики побегов, выращенных in vitro, инкапсулировали в 4% альгинате натрия. Инкапсулированные шарики подвергали предварительной обработке путем постепенного увеличения концентрации сахарозы от 0,1 до 1,0 М с последующей дегидратацией в течение 8 часов до содержания влаги 22%. Затем последовало быстрое замораживание путем погружения в жидкий азот. Криоконсервированные кончики побегов размораживали через 12 часов, выдерживая их на водяной бане при 40°C в течение 3 минут. Оттаявшим пропагулам давали возможность восстановиться на МС с 3% сахарозой, 1 мг/л БА и 0,5 мг/л ИМК в темноте в течение одной недели, а затем переносили на свет для повторного роста и размножения. Семьдесят процентов пропагул были восстановлены, выращены и размножены в полноценные растения (Ravindran et al., 2004).
 РИСУНОК 5.11. Прорастание криоконсервированных побегов.
РИСУНОК 5.11. Прорастание криоконсервированных побегов.
После полного внедрения, криоконсервация обеспечит быстрое и дешевое средство для дублирования базовой коллекции из соображений безопасности, а также для распространения наборов гермоплазмы в другие страны/континенты.
Производство синтетических семян
Технология синтетических семян была стандартизирована путем инкапсуляции на 3–5 мм регенерированных in vitro почек побегов и протокормов в 4%-ном альгинате натрия для получения жестких шариков хорошего качества, идеально подходящих для выдерживания низких температур и криоконсервации. Более высокие концентрации альгината не подходили, поскольку они давали очень твердую матрицу, которая препятствовала появлению почек побегов и тем самым влияла на скорость прорастания и восстановления, тогда как при более низких концентрациях альгината с гранулами было трудно обращаться во время криоконсервации и извлечения. Синтетические семена хранили при 5°C, 15°C и 22°C для изучения влияния температуры на их хранение и жизнеспособность. Низкие температуры (5°C и 15°C) не подходят для синтетических семян. Побеговые почки размером 0,4–0,5 см подходили для инкапсуляции, поскольку более мелкие почки не выдерживали хранения и теряли жизнеспособность в течение месяца. Однако, при температуре 22±2°C синтетические семена можно хранить в течение 10 месяцев (рис. 5.12). Растения, полученные из этих инкапсулированных почек, были явно здоровыми и превратились в нормальные растения. РИСУНОК 5.12. Синтетические семена.
РИСУНОК 5.12. Синтетические семена.
Клональное размножение V. planifolia с использованием инкапсулированных почек побегов было описано George et al. (1995). Синтетические семена идеальны для сохранения и обмена гермоплазмы, особенно у ванили, где нет естественного набора семян.
Выделение и слияние протопластов
Методы выделения и слияния протопластов важны из-за далеко идущих последствий в исследованиях улучшения растений путем модификации клеток и соматической гибридизации. была изучена Возможность протопластных систем у пряных культур, таких как кардамон, имбирь и ваниль (Triggs et al, 1995; Geetha et al., 2000). Протопласты были успешно выделены из V. planifolia и V. andamanica при инкубации в растворе фермента, содержащем мацерозим R10 (0,5%) и онозука целлюлазу R10 (2%), в течение 8 часов при 30°C в темноте (таблица 5.4). Перед ферментативным раскрытием, листья in vitro подвергали плазмолизу в растворе, содержащем промывочные соли протопластов клеток с 9% маннитом. Поскольку у ванили было трудно отшелушивать нижний эпидермис, плазмолизированную ткань листа механически мацерировали, соскребая нижнюю поверхность листа острым лезвием и инкубируя с различными концентрациями и комбинациями растворов ферментов. Периодические микроскопические наблюдения показали высвобождение кластеров клеток и отдельных клеток после 2 ч инкубации в растворе фермента.ТАБЛИЦА 5.4. Влияние концентрации фермента и условий инкубации на выход протопластов
| Вид | Раствор ферментов | Условия инкубации | Выход протопластов | Жизнеспособность (%) |
|---|---|---|---|---|
| V. planifolia | 0.5% мацерозим R10 + 2% целлюлаза онозука R10 | 8 часов при 30°C в темноте | 2.5 × 105/г листа | 72 |
| V. andamanica | 1% мацерозим R10 + 3% гемицеллюлаза + 6% целлюлаза онозука R10 | 8 часов при 30°C в темноте | 1 × 105/г листа | 55 |
Было обнаружено, что для высвобождения и поддержания жизнеспособных протопластов, необходим изолирующий раствор, содержащий 9% маннитола. Выделенные протопласты имели округлую форму и были заполнены хлоропластами. Протопласты V. planifolia были больше по размеру (0,031 мм), чем у V. andamanica (0,022 мм), и их можно было отличить по расположению хлоропластов – периферических у V. planifolia и центрально разбросанных V. andamanica. Визуально различимая природа протопласта может быть использована для идентификации генетической трансформации у этих видов. Когда они подвергаются слиянию, опосредованному полиэтиленгликолем (PEG), то протопласты сливаются, образуя гетерокарион. Продукт слияния культивировали на жидкой среде МС с 0,5 м/л БА, 0,5 мг/л ИМК с добавлением 3% сахарозы и 7% маннитола в течение 20 дней. Развитие клеточной стенки вокруг продукта слияния наблюдали через 36 часов (Minoo et al., 2008). Технология слияния протопластов может быть очень полезной для переноса генов полезных признаков, наблюдаемых у V. andamanica, в V. planifolia, особенно естественного образования семян и устойчивости к болезням.
Будущее улучшения ванили
Ориентиры, достигнутые в виде различных технологий, могут быть эффективно использованы для создания спектра генетических вариаций ванили, тем самым преодолевая основное узкое место в программах селекции и улучшения культуры. Разработанная технология выделения и слияния протопластов может быть использована для передачи полезных признаков посредством получения соматических гибридов, тем самым уступая место генетическим манипуляциям с ванилью. Характеристика видов ванили, образцов, сеянцев, сомаклонов и межвидовых гибридов доказала существование и степень генетических вариаций, которые доступны и вносятся с помощью биотехнологических инструментов. Методы сохранения in vitro с использованием синтетических семян, медленного роста и криоконсервации станут неотъемлемой и важной частью общей стратегии сохранения в управлении генетическими ресурсами гермоплазмы ванили. Кроме того, технология синтетических семян представляет собой идеальное средство для обмена незараженным посадочным материалом.Глава 6. Системы выращивания
Введение
Ваниль (Vanilla planifolia) – это редкое многолетнее полуэпифитное суккулентное растение, которое использует лесные деревья в своей естественной среде обитания для поддержки, тени и создания естественного перегноя. Леса, где встречается дикорастущая V. planifolia, классифицируются как selva alta perennifolia (высокие вечнозеленые тропические леса) – самые влажные из тропических лесов. Сегодня V. planifolia культивируется в различных производственных системах, которые в некоторой степени имитируют агроэкологические параметры, характерные для естественной среды обитания этого вида. Технологии выращивания и методы ухода за ванилью улучшались производителями ванили во всем мире, в основном, благодаря методам проб и ошибок. Напротив, эмпирические агрономические исследования ванили практически отсутствуют. В этой главе подробно описаны агроэкологические требования, системы производства, размножения, выращивания/управления, цветения/опыления и сбора V. planifolia. Эта информация основана в основном на наблюдениях, экспериментах, а также на опубликованных статьях и руководствах по выращиванию, написанных людьми, имеющими личный опыт выращивания ванили.Агроэкологические условия
Для достижения оптимальных условий роста и продуктивности, при выращивании ванили требуется соблюдение следующих агроэкологических параметров.Климат
V. planifolia хорошо растет в жарком и влажном тропическом климате.Температура
V. planifolia лучше всего растет при температуре от 20°C до 30°C (Childers and Cibes, 1948; Ranadive, 2005) и может переносить высокую температуру до 32°C (Purseglove et al., 1981; Anandaraj et al., 2005). Температура ниже 20°C подавляет рост и интенсивность цветения растений (Ranadive, 2005); температура выше 32°C вызывает пожелтение вегетативных частей и преждевременное опадение плодов (Anandaraj et al., 2005; Hernández Hernández, 2007b).Осадки
V. planifolia требует среднегодового количества осадков от 2000 до 3000 мм (Sasikumar et al., 1992; Soto Arenas, 2003), хорошо распределенных в течение года, за исключением периода цветения/опыления. Поскольку сильные дожди могут снизить эффективность опыления и завязывания плодов, лучше всего во время цветения поливать растения у основания. V. planifolia требуется 2–3 относительно засушливых месяца, чтобы стимулировать цветение. В районах, где среднегодовое количество осадков превышает 3000 мм, растения более подвержены поражению грибками (например, Fusarium sp.). С другой стороны, когда количество осадков составляет менее 2000 мм и нет системы орошения, нехватка воды значительно снижает способность растения выполнять основные физиологические функции.Высота
Наилучшие высоты для выращивания V. planifolia находятся между уровнем моря и 600 м (Childers et al., 1959), хотя в Мексике системы выращивания встречаются и на высоте 1100 м над уровнем моря (Soto, 2003). Сообщается, что в Индии V. planifolia выращивают на высоте до 1500 м (Anandaraj et al., 2005; John, 2005), а в Уганде её успешно выращивают на высотах от 800 до 1200 м над уровнем моря.Свет/тень
V. planifolia демонстрирует наиболее интенсивный рост в 50% тени. В засушливые периоды с интенсивным солнечным светом предпочтительно использовать 50–70% тень (Hernández Medina, 1943; Ranadive, 2005) для лучшего сохранения влажности почвы и воздуха. В дождливые периоды количество тени следует уменьшить до 30–50%, чтобы не создавать благоприятных условий для роста болезнетворных микроорганизмов. Избыточная тень вызывает слабый рост и плохое цветение, а избыток солнечного света приводит к ожогам листьев и стеблей, а также к раннему опадению плодов. Растения, которые страдают от слишком большого количества солнечного света или тени, являются наиболее подверженными заболеваниям.Выбор места
Первым шагом в создании успешной системы выращивания ванили является выбор места для посадки. Земля, предназначенная для выращивания ванили (вайниллал), должна иметь отличный дренаж, богатое содержание гумуса и pH от 6 до 7 (Childers et al., 1959; Soto, 2003; Ranadive, 2005). Земля должна получать утренний солнечный свет, а не интенсивные лучи днем, которые могут привести к солнечным ожогам на листьях (Sánchez Morales, 1993; Curti, 1995; Soto, 2003). Известняковые почвы на пологих склонах являются наиболее подходящими субстратами для выращивания ванили, поскольку они, как правило, менее кислые и хорошо дренированные (Childers et al., 1948; Bouriquet, 1954; Dequaire, 1980; Ranadive, 2005). Кислые почвы рекомендуются меньше всего, поскольку они способствуют распространению грибковых патогенов (Soto, 2003). Районы, где в недавнем прошлом практиковалось выращивание ванили, менее желательны, потому что они, вероятно, содержат остатки популяции Fusarium oxysporum.Подготовка земли
Самая распространенная форма выращивания ванили в Мексике – это вайниллал: вторичный лесной подрост, в котором выращивается ваниль. Первым шагом в его подготовке является прореживание леса для увеличения освещенности и пространства. Оставляют только те деревья или кусты, которые будут служить опорами. Сорные травы скашивают и, вместо сжигания, оставляют для компоста на месте. На ровной поверхности, там где почва может переувлажняться, прокладывают дренаж для удаления излишков воды. Для борьбы с эрозией, уменьшения стока органических веществ и сохранения влажности почвы, на крутых склонах выполняется террасирование,.Деревья поддержки
Основная функция дерева поддержки, обеспечение надлежащей основы и микросреды для роста и управления карабкающимся растением ванили. Опорные деревья не только обеспечивают физическую помощь, но и дают тень, а у листопадных или полулистопадных пород перераспределяют органический материал. Выбор опорного дерева должен быть из видов, которые наиболее приспособлены к данной области и имеют следующие характеристики: (1) поддерживают полог в течение года, (2) легко размножаются и легко восстанавливаются, (3) положительно реагируют на периодическую обрезку для управления формой/тенью, (4) не имеют колючек и листьев у основания, (5) достаточно сильны, чтобы выдерживать вес ванили и сильные ветра, (6) с корой, которая не осыпается, (7) достаточно устойчивые к вредителям/болезням и (8) имеют глубокую корневую систему, которая не конкурирует в мелких слоях почвы за питательные вещества и воду с растениями ванили. В мексиканских вайниллалах с низкой интенсивностью выращивания, и при выращивании совместно с другими сельскохозяйственными культурами, имеющими важное экономическое значение, в качестве опор выбираются кустарники и деревья, растущие на этой территории. Также используются плодовые деревья: апельсин (Citrus sinensis), грейпфрукт (Citrus grandis) и мандарин (Citrus reticulata). В интенсивно управляемой монокультуре ванили (рис. 6.1) сначала высаживают опорные деревья. Ниже приведены виды деревьев, наиболее часто применяемые для этой цели: Erythrina sp. (Мексика, Коста-Рика, Индия и Индонезия) Gliricidia sepium (син. G. maculata) (Мадагаскар, Тонга, Индия, Индонезия, остров Реюньон и Французская Полинезия) Leucaena leucocephala (Тонга и Индонезия) Casuarina equisetifolia (Мадагаскар, Тонга, остров Реюньон и Индия) Jatropha curcas (Мадагаскар, Уганда, Тонга, остров Реюньон и Французская Полинезия) Plumeria alba (Индия) РИСУНОК 6.1. Интенсивное выращивание ванили на живых опорах (Erythrina sp.).
РИСУНОК 6.1. Интенсивное выращивание ванили на живых опорах (Erythrina sp.).
В новейшей системе выращивания ванили используются искусственные или «мертвые» опоры (рис. 6.2). В этом случае функция опоры чисто физическая, а 50% тень обеспечивается затеняющей тканью (зеленой, красной или черной), которая натягивается над всеми растениями на высоте ок. 3–5 м с четырех сторон засаженного участка. Эти системы называются «теневыми домами». По размеру они обычно составляют порядка 25 м × 40 м (1000 м²), а некоторые – до 1 га (Hernández Hernández 2007a).
 РИСУНОК 6.2. Ваниль на бетонных опорах, интенсивно выращиваемая в теневом доме.
РИСУНОК 6.2. Ваниль на бетонных опорах, интенсивно выращиваемая в теневом доме.
Установка живых деревьев поддержки
Такие опекуны, как Erythrina sp. и Gliricidia sp. размножаются в основном черенками, хотя некоторые виды, к примеру, L. leucocephala, – семенами. В Мексике посадку и создание опор можно производить в любое время года, но наиболее успешным является проведение её в начале сезона дождей. Черенки обычно имеют длину 1,5–2 м и диаметр не менее 5 см. Их высаживают на глубину 30–40 см на время от шести месяцев до одного года до появления черенков ванили. Наиболее распространенные расстояния посадки между опорами: 1,2 × 1,50 м, 1,5 × 2,5 м, 2,0 × 2,5 м, 1,8 × 2,5 м и 2,0 × 3,0 м, или плотность примерно 1600–5000 опор/га (Childers et al.., 1948; Dequaire, 1980; Tiollier, 1980; Sasikumar et al., 1992; Soto, 2003; Anandaraj et al., 2005; Ranadive, 2005). Небольшие расстояния в посадках создают проблемы из-за недостаточной циркуляции воздуха, что приводит к заболеваниям (Childers et al., 1948; Soto, 2003; Ranadive, 2005). На каждую опору высаживают 1-2 черенка ванили. Расстояние посадки между опорами из плодовых деревьев варьирует в зависимости от вида. Для апельсина расстояния посадки обычно составляет 4 × 4 м, 5 × 5 м, 6 × 6 м и 7 × 7 м (примерно соответствует 204–625 опор/га). На каждое апельсиновое дерево высаживают 3–6 черенков ванили, что дает примерно 1224–1875 растений ванили/га. В системах поликультур, содержащих ваниль, обычно связанных с выращиванием кофе, бананов и кокосовых пальм, обычно используют Erythrina sp. или Gliricidia sp. в качестве опор ванили, высаживая их на расстоянии 1,5 × 2 м. Это меньшие плотности, чем в системах монокультуры, но их преимущество состоит в том, что они позволяют использовать по крайней мере два продукта. При использовании местных видов деревьев, они высаживаются на разных расстояниях, в зависимости от распределения выбранных насаждений, и могут составлять 500–1500 опор/га. В теневых домах опоры располагаются на расстоянии 1–1,5 м между каждым репетиром и 2–2,5 м между каждым рядом. На 1 га устанавливают 4000–5000 опор, с учетом 1–2 растения ванили на опору. Ваниль обычно растет в теневом доме. Однако, на репродуктивно зрелой стадии уход за растениями становится трудным и утомительным, циркуляция воздуха снижается, а распространение патогенов может быть очень быстрым и разрушительным (Ranadive, 2005).Размножение
Ваниль практически всегда размножают черенкованием. Черенки закупаются у другого производителя или у государственного сельскохозяйственного предприятия. Черенки получают от высокопродуктивных и сильнорослых растений, которые перед сбором урожая отбирают и маркируют. Сам черенок не должен быть цветущим побегом и должен иметь как минимум три узла с жизнеспособными пазушными почками для образования новых побегов, из которых вырастет растение. На черенках не должно быть повреждений или симптомов вредителей/болезней, чтобы избежать распространения болезни в будущем. Черенки обычно имеют длину 6–8 узлов (80–120 см в длину, 1 см в диаметре). Более длинные или толстые черенки быстрее образуют новые вегетативные и репродуктивные побеги (Ranadive, 2005), но с ними труднее справиться во время посадки, а также они более дороги. Черенки длиной менее 60 см лучше всего подращивать как саженцы, прежде чем пересаживать их на постоянное место (Anandaraj et al., 2005; Ranadive, 2005).Растения in vitro
Другой источник получения посадочного материала ванили – размножение in vitro. Такие растения привыкли получать питание из культуральной среды, поэтому перед посадкой непосредственно на площадь культивации их сначала необходимо поместить в теплицы с контролируемым климатом, где они смогут адаптироваться, обеспечивая себе пищу посредством фотосинтеза. Эти саженцы пересаживают, как только они достигают высоты около 30 см.Размножение in vitro
Вегетативный рост после укоренения происходит медленно, обычно требуется не менее одного года, прежде чем растения достигнут стадии цветения/плодоношения. Растения, полученные из побегов in vitro, фенотипически более однородны и здоровее, и, следовательно, их урожайность выше, чем у вегетативных черенков. Стоимость и уход за размноженными in vitro растениями непомерно дороги для многих фермеров, выращивающих ваниль.Подготовка и дезинфекция черенков
Перед посадкой черенки подготавливают. Три прикорневых листа удаляют вручную, скручивая черешок и стараясь не повредить стебель, где открытые раны могут способствовать распространению болезнетворных микроорганизмов. Чтобы предотвратить гниение стеблей, вызываемое в первую очередь F. oxysporum, перед посадкой стеблевые черенки дезинфицируют. Нижнюю часть черенка погружают на 2–5 мин в фунгицидный раствор. Раствор может состоять из карбендазима (2 г/л) или бордоской смеси (1 кг извести + 1 кг сульфата меди на 100 л воды). Последний менее эффективен, но разрешен для выращивания органических культур. Работать с фунгицидными растворами следует в резиновых перчатках, чтобы избежать вредного воздействия на организм человека. После дезинфекции черенки подвешивают отдельно на конструкции высотой 1–1,5 м в затененном и хорошо проветриваемом помещении на 7–15 дней. Черенки слегка обезвоживаются, что позволяет получить более гибкий материал для посадки. На участках черенков, поврежденных при удалении листьев образуются каллусы.Посадка черенков – выбор времени
Черенки высаживают тогда, когда на опорных деревьях образуется достаточно листвы, чтобы защитить молодые растения ванили от солнечных ожогов. При затенении тканью черенки высаживают сразу после установки опор. Высаживать черенки можно практически в любое время года при наличии достаточного количества воды. Зимой новые вегетативные побеги развиваются медленнее и могут «сгореть» из-за низких температур, что замедляет общее развитие растения. В сезон дождей, из-за чрезмерной влажности, до 50% черенков в той или иной степени подвержены гниению. Наилучшие условия для посадки черенков – влажный субстрат в теплые и засушливые месяцы, предшествующие началу сезона дождей (Ranadive, 2005). Это время способствует высокому проценту (> 90%) успешного укоренения черенков, поскольку высокие температуры способствуют появлению новых побегов и корней.Посадка черенков на плантацию
Высаживают черенки следующим образом: рядом с опорой выкапывается неглубокая канавка глубиной 5–10 см, в которую горизонтально укладывают черенок (но только ту часть, с которой удалены листья). Затем черенок засыпают 3–5 см органического материала и/или плодородной почвы или листьев, которые служат мульчей и источником питательных веществ. Нижний конец черенка (2–3 см) оставляют открытым, чтобы предотвратить гниение (Lepierre, 1988; Wong et al., 2003; Ranadive, 2005), особенно когда субстрат влажный. Некоторые черенки просто кладут на влажный субстрат без канав и присыпают. После посадки оставшаяся часть черенка (с листьями, примерно 4–5 узлов) помещается вертикально на опору и закрепляется биоразлагаемым материалом, таким как листья банана, кора деревьев или волокна агавы. При оптимальных условиях влажности и температуры у сильных и здоровых черенков первые корни начинают отрастать в первую неделю после посадки, а первые побеги – примерно через месяц. Такое относительно легкое укоренение исключает необходимость покупать гормоны или продукты для укоренения.Методы/практики выращивания ванили
После успешной посадки черенков необходимо выполнить некоторые действия и практики, чтобы обеспечить развитие и оптимальное производство ванили.Орошение
Вода – основной фактор роста и развития ванили. Достаточное количество воды наиболее важно во время цветения/опыления. Орошение имеет три преимущества: (1) стимулирует рост и развитие растений, (2) увеличивает урожайность и качество плодов и (3) продлевает продуктивную жизнь растения.Системы орошения
Наиболее частой формой полива в Мексике является использование микроэмиттеров для увлажнения мульчирующего слоя вайниллала.Критерии орошения
Одним из критериев полива является постоянное поддержание влажного слоя мульчи без достижения уровня насыщения. Таким образом, частота и количество поливов зависят от типа мульчи, фенологической стадии растений ванили во время полива и преобладающих климатических условий, таких как дождь и солнечная радиация, а также от количества тени, покрывающей вайниллал. Обычно в засушливый сезон полив проводят от одного до двух раз в неделю.Питание
Основным источником питания ванили при выращивании является органический материал (гумус), который возникает в результате естественного разложения растительных/животных остатков (мульча), компостирования (с помощью микроорганизмов) или вермикультуры (разрушение органического материала при помощи червей).Мульча
Помимо распределения питательных веществ, мульча имеет следующие преимущества: (1) она помогает поддерживать влажность почвы, (2) служит пористым субстратом, способствуя аэрации почвы и позволяя безудержно развиваться корням, (3) поддерживает адекватную температуру и (4) снижает зарастание сорняками. Мульчирование повышает биологическую активность микроорганизмов и способствует развитию микоризных ассоциаций (Porras Afaro and Bayman, 2007). Например, известно, что гриб Rhizoctonia sp. устанавливает микоризный симбиоз с корнями ванили, благодаря чему ваниль лучше усваивает питательные вещества и воду, в то время как гриб получает углеводы, производимые растением (Wong et al., 2003). Другие виды грибов, принадлежащие к родам Ceratobasidium, Thanatephorus и Tulasnella, также положительно влияют на прорастание семян и рост растений (Porras-Alfaro and Bayman, 2007).Типы мульчи
Самая распространенная мульча для ванили – это гниющая смесь опада из листьев, материалов обрезки деревьев и травянистых растений в вайниллале. Разложившуюся и гниющую кору деревьев также используют в виде опилок. Если в вайниллале недостаточно органического растительного материала, мульчу можно приготовить из стеблей кудзу (Pueraria phaseolides), слоновой (Pennisetum sp.) или гвинейской травы (Panicum maximum) (Bouriquet, 1954; Ranadive, 2005). Кокосовое волокно также является популярной мульчей, поскольку оно пористое, легкое и обладает отличной способностью удерживать влажность и сохранять соответствующий микроклимат для стимулирования роста корней. В свежих опилках могут содержаться токсичные для растений вещества, такие как фенолы, смолы, терпены и дубильные вещества. Свежий навоз или навоз, который плохо разложился, также может сжечь корни или вызвать корневую гниль и гибель. Важно, чтобы эти материалы компостировались перед внесением к растениям ванили.Толщина мульчи
Мульча должна быть 10–20 см в глубину и примерно 50–100 см в ширину, в зависимости от степени роста корней. В районах с высокой влажностью и недостаточным дренажем глубина меньше, чтобы уменьшить развитие грибковых патогенов, которые могут способствовать корневой гнили. Мульча укладывается по обе стороны от опоры, где будут расти корни ванили. Чтобы предотвратить потерю мульчи из-за стока в проливне дожди, который чаще всего встречается на склонах, строятся бордюры из стволов дерева, бамбука, камней или других материалов. Добавление мульчи производится, когда наблюдается рост корней из-под поверхности мульчи, как правило, 2–3 раза в год, и в основном в жаркие/засушливые месяцы, когда мульча помогает предотвратить потерю влаги.Питательные вещества
Наиболее важными питательными веществами для ванили являются кальций, калий, азот, фосфор, железо и медь (Cibes et al., 1947; Childers et al., 1959; Domínguez, 2005; Ranadive, 2005). Нормальные или оптимальные уровни питания, необходимые для ванили, подробно не изучены, и на практике потребности ванили в питательных веществах принимаются по выращиванию других видов представителей Orchidaceae (A.S. Anderson, личное сообщение).Химические удобрения
Обычно ваниль не удобряют, кроме добавления мульчи. В Индии производителям рекомендуется вносить 40–60 г азота, 20–30 г фосфора (P2O5) и 60–100 г калия (K2O) на одно растение в год. Также рекомендуется проводить опрыскивание листьев, например, 1% удобрением Triple 17 (17:17:17) один раз в месяц, чтобы стимулировать рост и цветение (Anandaraj et al., 2005).Деятельность по уходу
Борьба с сорняками
Прополка производится вручную. Между рядами используются такие инструменты, как мотыга или мачете, но у основания самих растений сорняки осторожновырываются вручную, чтобы не нарушить неглубокую структуру корней растений ванили. После прополки, сорняки, которые являются однолетними травами, можно добавить в мульчу или сначала компостировать, а затем добавить. Многолетние сорняки, такие как Commelina diffusa и Syngonium podophyllum, удаляются из вайниллала, поскольку они плохо разлагаются. С сорняками следует бороться всякий раз, когда они препятствуют доступу к растениям ванили и/или когда опорные деревья опадают в непропорционально большом количестве. Как правило, прополка проводится 3–4 раза в год.Регулировка света и тени
В вайниллалах с живыми опорными деревьями, такими как Erythrina sp. или Gliricidia sp., затенение регулируют периодической обрезкой, обычно два или три раза в год. Обрезку следует проводить в сезон дождей, чтобы избежать развития болезней ванили из-за недостаточного количества солнечного света. Уровни затенения составляют от 30% до 50% в сезон дождей. В засушливое и жаркое время года, которое совпадает с цветением/опылением и развитием стручков, опорные деревья должны создавать более плотный полог, чтобы обеспечивать тень на 70–80%, которая сохраняет влажность, предотвращает ожоги от интенсивного солнечного света и снижает опадение завязавшихся стручков. Обрезка выполняется путем удаления более толстых центральных ветвей и оставления с боковых сторон, чтобы получить крону в форме зонтика, которая к тому же максимизирует равномерное распределение побегов ванили. Ветви обрезают пилой или мачете примерно на 40 см от ствола. Самые тонкие из срезанных веток рубят на куски и кладут у основания опоры в качестве дополнительного источника органического материала. Более толстые ветви удаляются из вайниллала. Чрезмерная обрезка приводит к солнечным ожогам растений ванили, и её следует избегать. В системах выращивания с искусственными или «мертвыми» опорами 50% тени круглогодично обеспечивается затеняющей сеткой. Эта система обеспечивает однородное затенение и сводит на нет затраты на периодическую обрезку, но в жаркие месяцы 50%-ное затенение оказывается недостаточным.Управление побегом – петлеобразование
Наиболее распространенная практика управления растущим побегом «петлеобразование», то есть, перенаправление побега к земле, когда он достигает высоты первых ветвей дерева поддержки. Такая практика сохраняет высоту ванили примерно на уровне 2 м, что облегчает ручное опыление и сбор урожая. Еще одно последствие образования петель – гормональная индукция, способствующая цветению и образованию новых побегов (обычно чуть ниже высоты развилки на дереве, где побег изгибается). Побеги стараются равномерно распределить среди ветвей дерева поддержки так, чтобы один не затенял другого.Управление побегом – укоренение
Как только петля побега достигает уровня земли, его часть, обычно длиной 2–3 междоузлия, закапывают, оставляя непокрытой растущую верхушку. Эта практика способствует формированию корней в заглубленных узлах. Апекс побега крепится обратно к опорному дереву, чтобы продолжить рост. Укоренение побегов выполняется каждый раз, когда новый побег достигает уровня земли, что помогает поддерживать энергичный рост растения, которое получает больше питательных веществ и более устойчиво к F. oxysporum. Таким образом, укоренение помогает противодействовать гибели растений из-за патогенов (Hernández Hernández 2005). В качестве альтернативы, для растений, которым не менее трех лет и которые находятся вблизи или на уровне земли, производитель может выбрать обрезку верхушечного кончика (около 20 см), чтобы вызвать цветение вместо укоренения (Anonymous, 1998, 2004). Другой способ управления побегом – позволить побегу достичь высоты 1,5–2 м, после чего его прикладывают к горизонтальным опорам, таким как стволы бамбука, шланги или пластиковые трубы из ПВХ.Профилактика заболеваний/патогенов
Защита растений ванили от вредителей/болезней требует частого контроля и заключается в удалении любых частей стебля, листьев или корней, которые проявляют заболевание. Иногда требуется удаление растений целиком, чтобы остановить распространение болезни от растения к растению. Больной материал сжигают или закапывают за пределами вайниллала, чтобы устранить источники инокулята. Также удаляются листья, пораженные вредителями.Цветение и опыление
Как правило, первое цветение происходит через три года после посадки. Когда в качестве опор используются Citrus spp. или при выращивании ванили в теневых домах, цветение начинается на второй год, даже если используются мелкие черенки (80–100 см в длину), поскольку растения имеют тенденцию к энергичному росту в результате постоянного затенения и лучшего ухода. Ваниль обычно цветет один раз в год.Факторы, способствующие цветению
Физиологическим сигналом к цветению способствует климатический или механический стресс. Вот несколько примеров: а. Засуха: водный стресс вызывает цветение у репродуктивно зрелых особей ванили и многих других растений. В Уганде ваниль цветет два раза в год, что является следствием двух различных засушливых сезонов (Anonymous, 2000, 2005). б. Понижение температуры. Основным стрессом, вызывающим цветение, в Мексике являются низкие температуры осени и зимы, когда прохладные воздушные массы, известные как «норты», более или менее беспрепятственно дуют от Северного полярного круга, снижая температуру менее 10°C. Чем ниже температура, тем больше ожиданий хорошего цветения. Низкие температуры «сжигают» верхушечный кончик, убивая его, и нарушают верхушечное доминирование растения, одновременно стимулируя развитие боковых цветочных почек. c. Уход за растениями: В Индии за два месяца до цветения производителям рекомендуется выполнить ряд задач: (1) обрезку верхушечного кончика, по крайней мере, на 10-15 см, (2) временное прекращение полива, (3) обильное орошение после распускания 10% цветков, (4) обрезку кроны опорного дерева до 75% освещенности (Ranadive, 2005), но только тогда, когда интенсивность солнечного света не слишком высока, чтобы вызвать ожоги (свет является важным фактором активации цветочных бутонов; Hernández Apolinar, 1997) и (5) позволяя побегам достигать высоты 1,5 м и размещая их на горизонтальной опоре, чтобы увеличить количество цветов и воздушных корней.Соцветие
Соцветие ванили представляет собой кисть, то есть отдельные цветки расположены на стеблях вокруг центральной оси. Отдельное растение обычно дает 8-15 кистей или более (Anonymous, 1998, 2004; Ranadive, 2005), в зависимости от возраста, количества цветущих и укореняющихся побегов и преобладающих условий окружающей среды. От начального формирования соцветия до момента раскрытия первого цветка проходит 45–60 дней. Каждая кисть развивает 10–20 цветочных почек, которые открываются последовательно, начиная с основания кисти. Обычно в день открывается только один цветок на кисть. Иногда два цветка раскрываются одновременно, а иногда во время дождя или при низких температурах не раскрываются вообще. Полное раскрытие происходит рано утром и сохраняется в течении 6–8 часов до закрытия в жаркий полдень.Период цветения
В странах-производителях ванили в северном полушарии (например, в Мексике, Индии) цветение наблюдается в марте-мае, с пиком в апреле. В странах южного полушария (например, Мадагаскар, Индонезия) – сезон цветения с сентября по декабрь.Естественное опыление
Мексика – одна из немногих стран, где можно получить стручки ванили путем естественного опыления, хотя это случается редко, составляя лишь около 1% всех плодов. Идентификация естественного опылителя(ей) ванили неясна, и долгое время считалось, что ваниль опыляют пчелы (Melipona beechii), колибри (Cynniris sp.) и летучие мыши. Преобладающая часть данных свидетельствует в пользу гипотезы о том, что наиболее распространенным опылителем является блестящая зеленая орхидная пчела Euglossa viridissima (Soto, 1999a, 2003; Lubinsky et al., 2006). Было зарегистрировано, что эти пчелы посещают цветы ванили, но их посещения нерегулярны, а их потенциал для опыления еще меньше, возможно, всего 1 плод на 100 или 1000 цветов (Soto, 1999a, 1999b; Hagsater et al., 2005). При естественном опылении, как правило, бывает только один плод на кисть. Иногда наблюдается до четырех, и все они обычно крупнее и тяжелее, чем ванильные стручки, полученные путем ручного опыления, поскольку на их развитие выделяется больше ресурсов. Другие орхидные пчелы, а именно особи Eulaema sp. (жикоте) часто посещают цветы Vanilla pompona (рис. 6.3) в северном Веракрусе, Мексика. В редких случаях они также способствуют опылению цветов (5%), ища нектар внутри и у основания лабеллума. РИСУНОК 6.3. Пчела Eulaema sp. (жикоте), возможный естественный опылитель V. pompona.
РИСУНОК 6.3. Пчела Eulaema sp. (жикоте), возможный естественный опылитель V. pompona.
Ручное опыление
Внутри лабеллума, лепестка прикрепляющегося к колонке и оборачивающегося вокруг неё, цветка ванили находится мембрана, называемая ростеллум, который откидывается от колонки. Ростеллум находится точно между рыльцем (женским органом) и пыльником (мужским органом) и считается продуктом эволюции, выбранным для предотвращения самооплодотворения. При ручном опылении пыльца вручную перемещается от пыльника к рыльцу, минуя ростеллум. Соответствующие части и репродуктивные органы цветка ванили показаны на рисунке 6.4. РИСУНОК 6.4. Структуры цветка V. planifolia. (а) Целый цветок, (б) колонка (вид сбоку), (в) колонка (вид спереди) и (г) поднятый ростеллум и пыльник, обнажая рыльце.
РИСУНОК 6.4. Структуры цветка V. planifolia. (а) Целый цветок, (б) колонка (вид сбоку), (в) колонка (вид спереди) и (г) поднятый ростеллум и пыльник, обнажая рыльце.
Ручное опыление выполняется небольшой тонкой палочкой размером и формой примерно с зубочистку, которая может быть сделана из бамбука, кости, шипов или других материалов. Ручное опыление было открыто Чарльзом Морреном в 1836 году, а первым, кто применил опыление на острове Реюньон, был Эдмон Альбиус в 1841 году (Lecomte, 1901; Childers and Cibes, 1948). Этот метод ручного опыления аналогичен используемому сегодня (рис. 6.5) и состоит из следующих этапов: 1. Использовать зубочистку или аналогичный инструмент для продольного разреза в лабеллуме на стороне, противоположной колонке, чтобы обнажить репродуктивные структуры. 2. Этим же концом зубочистки приподнять ростеллум вертикально так, чтобы пыльник мог беспрепятственно свисать над лепестком рыльца. 3. Осторожно прижать пыльник к рыльцу, пока они не слипнутся, и вынуть зубочистку.
 РИСУНОК 6.5. Метод ручного опыления V. planifolia.
РИСУНОК 6.5. Метод ручного опыления V. planifolia.
Ручное опыление – Планирование
Было установлено, что пыльца V. planifolia жизнеспособна в течение периода, который начинается за 23 часа до цветения и заканчивается через 16 часов после закрытия цветка. Точно так же рыльце является восприимчивым за 41 час до раскрытия цветка и остается таковым в течении 17 часов после закрытия цветка (Shadakshari et al., 2003). Из практических соображений ручное опыление проводится с 7 часов утра до полудня или немного позже, если пасмурно, но никогда, когда цветы уже закрылись или засохли. Ручное опыление должны проводить способные и опытные люди. Женщины чаще участвуют в выполнении этой задачи. Опытный человек опыляет 1000–1500 цветков за 5–7 часов (около 4 цветков в минуту) – подразумевается, что растения находятся более или менее на одной и той же территории. Первые опыленные цветки в кисти дают более длинные и прямые плоды, в то время как последние распустившиеся цветки – обычно мелкие и изогнутые, имеющие меньшую ценность. Ручное опыление – это ежедневная задача в течение трех месяцев. Для опыления на гектар требуется 300–600 дней работы, в зависимости от обилия цветов, их расположения, эффективности опылителя и расстояния между растениями.Индикаторы успеха или неудачи ручного опыления
Оплодотворенные/опыленные цветки не отделяются и не опадают со своей цветоножки (в случае ванили цветоножка также является нижней завязью). Иногда колонка может отделяться от оплодотворенной завязи, но в идеале колонка и лепестки остаются прикрепленными к развивающемуся плоду, поскольку они снижают потерю влаги плодом и препятствуют внедрению вредителей или грибковых заболеваний. Цветы, которые не были опылены, неправильно опылены, повреждены дождем или высокими температурами, опадают сразу или через 2–3 дня после опыления. В дождливые дни до 50% случаев опыления кончается неудачно, поскольку пыльца увлажняется, теряет свои липкие свойства и не держится на рыльце.Количество плодов на кисть
Обычно опыляют 6–8 цветков на кисть, чтобы обеспечить минимальный урожай в 4–5 плодов на кисть приемлемого качества. Для получения 100–120 плодов с одного растения требуется 8–15 цветков на кисть для опыления (Anonymous, 1998). Эти приближения являются грубыми, поскольку многое зависит от условий окружающей среды, положения и силы роста растений, а также от биологических характеристик клона или сорта. Производители ванили определяют количество опыляемых цветов с учетом цен. Чрезмерное опыление приводит к появлению множества мелких стручков меньшей ценности, увеличивает стоимость опыления и требует больших затрат от растения. Чрезмерное опыление также связано с большими колебаниями объемов производства из года в год.Развитие плодов
Сразу после ручного опыления пыльцевые трубки начинают прорастать, расти и в конечном итоге оплодотворять семяпочки. Завязь начинает быстро увеличиваться в размерах и приобретает яркий темно-зеленый оттенок, свешиваясь вниз. Максимальная длина и диаметр плода достигается через 45 дней после ручного опыления (рис. 6.6). После этого рост прекращается, и плод вступает в период созревания, который длится примерно 7-8 месяцев. РИСУНОК 6.6. Данные временного ряда о развитии плода V. planifolia «манса» (длина и диаметр), наблюдавшаяся на экспериментальной станции Икстакуако (INIFAP, Мексика).
РИСУНОК 6.6. Данные временного ряда о развитии плода V. planifolia «манса» (длина и диаметр), наблюдавшаяся на экспериментальной станции Икстакуако (INIFAP, Мексика).
Сбор урожая
Индикаторы сбора урожая
Ваниль собирают по достижении товарной зрелости, когда дистальный конец плода меняет цвет с зеленого на желтый (рис. 6.7), как правило, через 8–9 месяцев после опыления. РИСУНОК 6.7. Товарная зрелость зеленых стручков (8–9 месяцев после опыления).
РИСУНОК 6.7. Товарная зрелость зеленых стручков (8–9 месяцев после опыления).
Сроки сбора урожая
Рано собранные стручки меньше весят, более восприимчивы к поражению грибками и дают меньшее количество ванилина после обработки (Tiollier, 1983). Плоды, собранные в течение последнего девятого месяца, начинают раскрываться и меняют цвет с зеленого на желтый, затем на темно-коричневый или черный. Эти плоды называются «расколотыми» и имеют меньшую ценность. В странах Северного полушария сезон сбора урожая с декабря по февраль, а в странах Южного полушария – с июня по сентябрь. Большинство производителей ванили собирают урожай за один раз и сразу все плоды, то есть зрелые и развивающиеся. Некоторые производители, например, в Уганде и Французской Полинезии, собирают урожай только тогда, когда плоды созреют, обычно один раз в неделю, продлевая сбор урожая до 2–3 месяцев.Порядок сбора урожая
В Мексике собирают весь пучок или кисть плодов вместе с центральным стеблем или рахисом. Самый лучший способ – собирать каждый зрелый стручок индивидуально. Собранные стручки помещают в корзины или пластиковые ящики, чтобы предотвратить механическое повреждение, которое может привести к заражению болезнетворными микроорганизмами. Плоды хранятся в затененных и хорошо проветриваемых местах.Обрезка отцветших побегов
После сбора урожая принято обрезать уже отцветшие побеги. Эти побеги не будут плодоносить снова (или также же), если на них нет бутонов. Обрезка выполняется ножом или лезвием, которые перед использованием дезинфицируют в растворе из 1 части отбеливателя на 6 частей воды. Удаление этих «отработанных» побегов служит для устранения непродуктивных частей растения, занимающих пространство и забирающих у растения энергоресурсы. Их удаление способствует поддержанию надлежащих условий вентиляции и освещения для растения. Некоторые из этих отработанных побегов могут служить черенками для создания новых растений, если у них сохранилась меристематическая ткань.Урожайность – Зеленая ваниль
Урожайность вайниллалов чрезвычайно различается и зависит от возраста растений, плотности посадки, метода выращивания («традиционный» или современный), источника воды (неорошаемый или орошаемый), почвы и климатических условий каждого участка и так далее. Во всем мире средняя урожайность зеленой ванили составляет менее 500 кг/га, поскольку большинство производителей используют довольно мало технологий. Те, кто пользуется орошением и удобрением или же использует теневые дома, могут получить 3–4 тонны зеленой ванили/га или примерно 500–800 кг готовой ванили/га (Ranadive, 2005). Средний вес плодов на одно растение составляет 1-2 кг и до 5,5 кг для растений, выращенных на опорах из апельсиновых деревьях (Lopez Méndez and Mata García, 2006). При любой системе выращивания ванили максимальные урожаи приходятся на четвертый или пятый год после посадки (второй или третий урожай). По истечении этого времени объем производства может быть ниже или выше, но после девяти лет урожайность будет неуклонно снижаться, пока продуктивность не прекратится почти полностью к двенадцатому году.Полезная продолжительность жизни вайниллалов
Опыт показал, что густо посаженные вайниллалы могут давать высокие урожаи, но, как правило, только один раз. Позже урожайность резко снижается и прекращается, как правило, через шесть лет после посадки из-за серьезных проблем с болезнями. Ожидается, что у ваниллалов с менее густой посадкой продуктивная продолжительность жизни составит 12 лет, поскольку существуют адекватные условия вентиляции и предотвращения болезней/вредителей. Лучшая модель для этого – ваниль, выращенная на апельсиновых деревьях поддержки.Трудозатраты
Ваниль – трудоемкая культура, требующая 172–575 рабочих дней/га в год в зависимости от системы производства и стадии развития растений (т.е. вегетативный рост по сравнению с продуктивным). Четвертый и пятый годы обычно являются самыми сложными, поскольку в этот период производительность наиболее высока. В Мексике при полуинтенсивной системе с использованием Erythrina sp. в качестве дерева поддержки, производителям требовалось максимум 575 рабочих дней в течение года (в среднем она составляет 316,2 рабочих дней). Большая часть рабочих дней, более 50%, приходится на ручное опыление, за которым следует обработка побегов (петлеобразование и укоренение, 10,4%), обрезка (7%) и борьба с сорняками, размещение органических материалов/компоста и фитосанитарное обслуживание (7%) (таблица 6.1). Требования к рабочей силе аналогичны другим системам выращивания ванили. Одна семья может выращивать максимум 1 га ванили, но ей необходим наемный труд, чтобы помочь с опылением на большей площади.ТАБЛИЦА 6.1. Трудозатраты на поддержание 1 га ванили в полуинтенсивной системе с использованием Erythrina sp. как дерева поддержки (5-й год), в регионе Мартинес-де-ла-Торре, Веракрус, Мексика
| Мероприятия | Кол-во рабочих дней | Процент от общей суммы |
|---|---|---|
| 1. Обрезка | 40 | 7.0 |
| 2. Компостирование | 20 | 3.5 |
| 3. Мульчирование | 20 | 3.5 |
| 4. Орошение | 10 | 1.7 |
| 5. Борьба с сорняками/уход за мульчей | 40 | 7.0 |
| 6. Управление побегами | 60 | 10.4 |
| 7. Борьба с вредителями/болезнями | 40 | 7.0 |
| 8. Ручное опыление | 300 | 52.1 |
| 9. Сбор урожая | 30 | 5.2 |
| 10. Осмотр/удаление больных растений | 15 | 2.6 |
| Всего | 575 | 100 |
Перспективы улучшения урожая
Грибок F. oxysporum является основной причиной экономического ущерба при выращивании ванили во всем мире. Методы возделывания и химический контроль пока не доказали свою эффективность в борьбе со вспышками фузариоза. Следует разработать стратегии для определения генетической основы устойчивости путем отбора и селекции. В этом отношении могут помочь геномные/генетические технологии, такие как селекция с помощью маркеров и генные чипы. Знания о потребностях питания ванили все еще несовершенны. Количество и типы питательных веществ, необходимых ванили на каждой фенологической стадии, следует изучить более подробно. Такую информацию можно использовать для создания мульчи и смесей удобрений, специфичных для ванили. Это, в свою очередь, положительно скажется на урожайности. Точно так же вода является незаменимым элементом при выращивании ванили, но точные потребности ванили в воде – сколько и с какими интервалами – еще предстоит изучить. С вредителями ванили легко бороться с помощью химикатов, если такие вещества используются эффективно и без промедления. Помимо получения дополнительной информации о влиянии конкретных методов возделывания, выращивание ванили стоит улучшить на основе идей о том, как можно вызвать цветение с помощью химических или гормональных средств.Глава 7. Вирусные заболевания ванили
Вирусные заболевания стали серьезной проблемой для производства ванили за последние несколько десятилетий, вероятно, в результате диверсификации площадей и интенсификации выращивания ванили. В этой главе рассматриваются данные, накопленные по вирусам, поражающим плантации ванили во всем мире, в частности вирусу мозаики цимбидиума (CymMV), потивирусам и вирусу мозаики огурца (CMV). Здесь обсуждается, как изменения окружающей среды, вызванные интенсификацией выращивания ванили, способствовали возникновению вирусных эпидемий, возможные стратегии контроля, доступные в настоящее время, и перспективы исследований по их улучшению.Введение
Вирусы – это облигатные клеточные паразиты, которые могут инфицировать бактерии, грибы, растения и животных. Вероятно, они появились и развились в своих хозяевах в начале древа жизни (Forterre, 2006). Вирусные частицы в основном состоят из одной или нескольких молекул геномной рибонуклеиновой (РНК) или дезоксирибонуклеиновой кислоты (ДНК), заключенных в белковую оболочку – капсид. В настоящее время известно более 5000 видов вирусов (Fauquet et al., 2005), из которых примерно 1000 заражают растения и были классифицированы более чем на 60 родов (Wren et al., 2006). Большинство из них становится причиной заболеваний, поскольку развитие вируса вызывает симптомы в тканях хозяина, которые могут привести к серьезным потерям урожая. Вирусы растений нечасто передаются через семена, но соматические части растений – черенки, луковицы и почки, обеспечивают распространение многих вирусов. Горизонтальная передача вирусов часто связана с животными-переносчиками (в основном насекомыми), но некоторые вирусы не имеют переносчика и заражают новых хозяев только при контакте с эпидермальными ранами. Сообщается, что орхидеи заражают более 20 видов вирусов (Gibbs and Mackenzie, 1997). Первая демонстрация заражения ванили вирусом была проведена во Французской Полинезии (Wisler et al.1987). На сегодняшний день описано 10 видов вирусов, принадлежащих к четырем семействам вирусов с положительно-полярным РНК геномом.Вирус мозаики цимбидиума (CymMV)
CymMV является наиболее распространенным и экономически опасным вирусом, поражающим орхидеи (Zettler et al., 1990). С момента первого описания CymMV Дженсеном в Калифорнии (Jensen, 1950; Jensen and Gold, 1955) сообщалось о CymMV у большинства культивируемых видов орхидей во многих странах, и теперь считается, что он присутствует во всем мире. CymMV был впервые обнаружен в ванили во время исследования во Французской Полинезии (Wisler et al., 1987). Впоследствии он был обнаружен на участках ванили многих стран: островов Кука, Фиджи, Ниуэ и Тонга (Pearson et al., 1993), Мадагаскара (Grisoni et al., 1997), острова Реюньон (Pearson, 1997), Маврикия (Rassaby, 2003), Индии (Bhat et al., 2006), а также в материалах, хранящихся в ботанических садах (Grisoni et al., 2007).Структура вируса и генетическое разнообразие
Как представитель рода Potexvirus, семейства Flexiviridae (Adams et al., 2004), CymMV имеет изогнутые частицы (~ 13 нм × 480 нм), содержащие геном однонитевой РНК(+) размером около 6,3 т.п.н. с пятью открытыми рамками считывания (ORF), фланкированных 5′- и 3′-некодирующими областями, и 3′-polyA-хвост (Francki, 1970; Wong et al., 1997). База данных GenBank содержала (на октябрь 2009 г.) полную последовательность генома для девяти изолятов CymMV и более 100 последовательностей гена белка оболочки (CP), большинство из которых имеют азиатское происхождение. Общее разнообразие изолятов низкое на уровне аминокислот, с расхождением менее 14% для CP (Ajjikuttira et al., 2002; Bhat et al., 2006; Gourdel and Leclercq-Le Quillec, 2001; Moles et al., 2007; Sherpa et al., 2006) и менее 3% расхождения для РНК-зависимой РНК-полимеразы (Moles et al., 2007). Однако, анализ нуклеотидной последовательности показал, что популяция CymMV разделяется на две расходящиеся гаплогруппы, что может отражать двойное происхождение изолятов, обнаруженных во всем мире. Однако, не наблюдается биологической разницы между двумя кластерами штаммов, которые могут сосуществовать и рекомбинировать в пределах одного хозяина (Sherpa et al., 2007; Vaughan et al., 2008). Штаммы, принадлежащие к обеим подгруппам CymMV, были обнаружены в ванили (Moles et al., 2007).Симптомы и диагностика
У декоративных орхидей CymMV вызывает хлоротичные или некротические пятна и полосы на листьях и цветах (Albouy, Devergne, 1998; Gibbs et al., 2000; Yamane et al., 2008) и замедляет рост растений (Izaguirre-Mayoral et al., 1993; Pearson, Cole, 1991; Wannakrairoj, 2008). У ванили инфекция CymMV, как правило, протекает бессимптомно, но иногда она связана с пятнами на листьях (у Vanilla planifolia и Vanilla tahitensis) и некротическими пятнами на стебле и листьях (у V. planifolia) (Grisoni et al., 1997, 2004; Leclercq Le Quillec et al., 2001) (рис. 7.1). На основании полевых наблюдений было высказано предположение, что CymMV ослабляет лиану и увеличивает влияние стрессов, возникающих в результате чрезмерной плотности посадок или заражения другим патогеном (Benezet et al., 2000), но это еще предстоит продемонстрировать. Даже при отсутствии симптомов, инфекция CymMV может быть причиной снижения роста стебля до 40% (Bartet, 2005). Влияние CymMV на содержание ароматических веществ в стручках до сих пор не исследовано. РИСУНОК 7.1. Хлоротичные (слева) и некротические (справа) пятна, индуцированные CymMV на листьях ванили.
РИСУНОК 7.1. Хлоротичные (слева) и некротические (справа) пятна, индуцированные CymMV на листьях ванили.
Наблюдения в ходе полевых исследований показали, что симптомы CymMV были более серьезными у V. planifolia (в районе Индийского океана), чем у V. tahitensis (в Тихом океане). Оценка тяжести заболевания в сопоставимых тепличных условиях с использованием штамма местной подгруппы А на острове Реюньон не показала каких-либо различий в вирусной болезни между этими двумя видами ванили. Однако, удивительно, что образец Vanilla pompona, включенный в испытание, проявил частичную резистентность к этому вирусу. Эта резистентность состояла из двух компонентов: (1) устойчивости к инокуляции (более низкий процент зараженных растений в тестах на механическую инокуляцию по сравнению с образцами V. tahitensis и V. planifolia) и (2) снижении титра вируса в инфицированных листьях, произошедшего несколькими месяцами после инокуляции с очевидной элиминацией вируса (таблица 7.1). Эта устойчивость вызывает временное подавление посттранскрипционной экспрессии генов CymMV у V. pompona, а не гиперчувствительную реакцию (Baures et al., 2008), но механизм, лежащий в основе этой резистентности, неясен и требует дальнейшего изучения.
ТАБЛИЦА 7.1. Частичная резистентность V. pompona к инфекции и репликация CymMV
(A) Скорость заражения, определенная с помощью ELISA, через 6 недель после механической инокуляции
| Вид-Инвентарный номер | Доля зараженных растений | |||
|---|---|---|---|---|
| Опыт 1 | Опыт 2 | Опыт 3 | В среднем (%) | |
| V. pompona–CR0018 | 5/12 | 4/10 | 0/20 | 21 |
| V. pompona–CR0031 | Nd | 4/10 | 6/28 | 26 |
| V. planifolia–CR0044 | 13/13 | 10/10 | 42/48 | 92 |
| V. planifolia–CR0036 | 12/12 | 10/10 | 36/40 | 93 |
| V. tahitensis–CR0017 | 10/10 | 10/10 | Nd | 100 |
| V. bahiana–CR0087 | Nd | 7/10 | Nd | 70 |
| V. crenulata–CR0091 | Nd | 10/10 | Nd | 100 |
(B) Титр вируса в инфицированных растениях, определенный с помощью SyBr Green Q-RT-PCR (log количества копий на μл экстракта РНК ± доверительный интервал при 5%)
| Вид-Инвентарный номер | Опыт 1 | Опыт 2 | |||
|---|---|---|---|---|---|
| 8 месяцев ПИ | 3 месяца ПИ | 8 месяцев ПИ | 20 месяцев ПИ | 34 месяца ПИ | |
| V. pompona–CR0018 | 4.40 ± 0.52 | 8.51 ± 0,82 | 6.26 ± 0.36 | 6.61 ± 0.98 | 3.28 ± 0.12 |
| V. pompona–CR0031 | 4.35 ± 0.49 | Н.о. | Н.о. | Н.о. | Н.о. |
| V. planifolia–CR0044 | 6.53 ± 0.04 | 8.17 ± 0.46 | 8.13 ± 0.64 | 10.4 ± 0.23 | 8.95 ± 0.46 |
| V. planifolia–CR0036 | Н.о. | 8.58 ± 0.12 | 8.31 ± 0.32 | 9.82 ± 0.70 | 7.90 ± 0.54 |
| V. tahitensis–CR0017 | Н.о. | 8.67 ± 0.14 | 8.43 ± 0.04 | 10.3 ± 0.31 | Н.о. |
| V. bahiana–CR0087 | 6.55 ± 0.08 | Н.о. | Н.о. | Н.о. | Н.о. |
| V. crenulata–CR0091 | 6.37 ± 0.15 | Н.о. | Н.о. | Н.о. | Н.о. |
CymMV нельзя надежно обнаружить в ванили на основании симптомов, и поэтому диагноз должен основываться на обнаружении вируса. Для обнаружения CymMV были описаны многочисленные инновационные молекулярные методы, такие как: ДНК-биосенсоры на основе кварцевых микровесов (Eun et al., 2002), иммуно-капиллярный зональный электрофорез (Eun and Wong, 1999), DIG-меченные зонды кРНК, (Hu and Wong, 1998), антисыворотка к рекомбинантным капсидным белкам (Lee and Chang, 2008), суперпарамагнитные шарики (Ooi et al., 2006), TD/RT-PCR (Seoh et al., 1998), бумага для быстрого иммунофильтрацинного анализа (Tanaka et al., 1997) и анализы магнитовосстановления с использованием антител без промывки (Yang et al., 2008). Поскольку частицы CymMV обладают высокой иммуногенностью (Francki, 1970) и обильно и равномерно распределены в тканях хозяина (Lawson and Hearon, 1974; Leclercq-Le Quillec and Servé, 2001), серологические методы, такие как ELISA или DIBA, дешевые и надежные, хорошо подходят для рутинной диагностики вируса. Как и следовало ожидать, исходя из низкой аминокислотной дивергенции CP, моноклональные, а также поликлональные антитела выявляли широкий спектр изолятов (Lee and Chang, 2008; Vejaratpimol et al., 1998; Wisler et al., 1982). Однако, Рид (Read et al., 2007) сообщил о штамме (Thailand 306), который не реагировал с коммерческим моноклональным антителом. Этот штамм характеризовался аспарагиновой кислотой вместо аспарагина в позиции 123 CP, уникальной для этого изолята. Более специфичное и чувствительное обнаружение вируса может быть достигнуто с использованием методов, основанных на нуклеиновых кислотах, и был разработан ряд пар праймеров и различных форматов для обнаружения CymMV с помощью ОТ-ПЦР (Barry et al., 1996; Bhat et al., 2006; Lim et al., 1993b; Martos, 2005; Ryu et al., 1995; Seoh et al., 1998; Yamane et al., 2008).
Эпидемиология
Заболеваемость CymMV на ванильных участках оценивалась в нескольких исследованиях, проведенных в различных агрономических условиях, Выявились очень разные ситуации, необъяснимые только систематической ошибкой выборки. На Коморских островах, например, весь посадочный материал кажется здоровым, поскольку недавнее расширенное обследование не обнаружило ни одной зараженной вирусом лианы (Grisoni and Abdoul-Karime, 2007). На Мадагаскаре ситуация была аналогичной в начале 2000-х годов, когда подавляющее большинство традиционных фермерских плантаций были свободны от CymMV. Однако, большая часть черенков новых сортов, размноженных в хранилище гермоплазмы в Амбохитсара (район Анталаха), были инфицированы (Grisoni et al., 1997; Leclercq-Le Quillec and Nany, 1999, 2000). На островах Реюньон и Общества относительно высокая заболеваемость CymMV была зарегистрирована после того, как в 1990-х годах были начаты интенсивные программы культивирования (Benezet et al., 2000; Grisoni et al., 2004; Leclercq Le Quillec et al., 2001), и эпидемиологический анализ мог проследить этот путь распространение вируса на ванильных участках. Благодаря высокой стабильности вириона и его повышенной концентрации в тканях хозяина, CymMV легко передается механическим путём (Jensen and Gold, 1955). Поэтому он может эффективно распространяться на участках или в теплицах в отсутствие конкретных переносчиков, исключительно в результате попадания вируса из инфицированного сока через микротравмы в эпидермальные клетки. Это было специально продемонстрировано для ванили в теневых домах на острове Реюньон (Leclercq Le Quillec et al., 2001) и ФП (Grisoni et al., 2004). Мониторинг CymMV в этих теневых домах показал быстрое распространение в больших скоплениях, в основном вдоль рядов. Эти результаты подтверждают предположение, что CymMV заносится в теневые дома через инфицированные черенки, собранные на участке, а затем распространяется с растения на растение в основном в результате процессов возделывания (искусственное опыление, петлеобразование) и, возможно, корневым анастомозом между соседними лианами. Для производителей ванили очень важно понимать, что отсутствие симптомов увеличивает вероятность как первичного, так и вторичного распространения этого вируса, и, следовательно, важность сертифицированного посадочного материала, свободного от вируса.Контроль
В отсутствие лечебных средств или устойчивых коммерческих сортов, профилактика является единственным способом избежать потерь от CymMV в посадках ванили. Поскольку основным переносчиком вируса являются люди (путем посадки инфицированных черенков или в качестве источника механической передачи), то для предотвращения болезни достаточно простой стратегии, сочетающей фитосанитарную сертификацию растений и надлежащие методы ухода. Это было успешно реализовано в программах создания новых плантаций в начале 2000-х годов на острове Реюньон и во ФП (Benezet et al., 2000; Richard et al., 2009). Основным требованием фитосанитарной сертификации является потребность в материале, свободном от вирусов, который должен быть размножен в соответствии с определенным протоколом. Здоровый исходный материал обычно можно найти в культивируемой популяции, но если требуется конкретный сорт, для которого доступна только инфицированная гермоплазма, растения необходимо излечить от вируса. Ваниль – клональная культура с высокой степенью гетерозиготности (см. главу 2), и хотя из семян вырастает ваниль, не содержащая вирусов (Jensen and Gold, 1955; Yuen et al., 1979), она не соответствуют типу. Элиминация вируса была достигнута для нескольких видов орхидей с помощью химиотерапии in vitro (Albouy et al., 1988; Lim et al., 1993a), и аналогичные стратегии должны быть перенесены на ваниль. Генетическая сопротивляемость или толерантность особенно желательны, когда профилактика не обеспечивает достаточного контроля вирусного заболевания. V. planifolia не имеет естественной устойчивости, в отличие от описанной у V. pompona. Приобретенная патогенетическая устойчивость к CymMV возникла у некоторых видов орхидей (Chang et al., 2005; Liao et al., 2004; Lim et al., 1999), и хотя эта стратегия еще не разработана для ванили, это теоретически возможно, поскольку регенерация ванильных протопластов была недавно достигнута (Minoo et al., 2008).Потивирусы
Род Potyvirus представляет собой вторую по величине группу патогенных вирусов растений (около 25% всех известных видов вирусов растений), что делает потивирусы всемирной сельскохозяйственной проблемой (Fauquet et al., 2005). Потивирус, вызывающий деформацию листьев и мозаику на лианах V. tahitensis, был идентифицирован в 1986 году во ФП (Wisler et al., 1987). Серологически, а затем генетически, было показано, что этот вирус, названный вирусом мозаики ванили (VanMV), связан с вирусом мозаики таро (DsMV) (Farreyrol et al., 2006; Wang and Pearson, 1992; Wisler et al., 1987). В то же время еще один потивирус, вызывающий некроз у V. planifolia, был идентифицирован в 1986 году в Тонге и предварительно назван вирусом ванильного некроза (VNV), прежде чем его охарактеризовали как штамм вируса мозаики арбуза (WMV-Tonga) (Pearson and Pone, 1988; Pearson et al., 1990). Биологические свойства WMV-Tonga хорошо охарактеризованы, и определена полная последовательность гена его CP (Pearson et al., 1990; Wang et al., 1993). Вонг и Пирсон (Wang and Pearson, 1992) продемонстрировали, что WMV-Tonga и DsMV-Vanilla были разными вирусами. Впоследствии DsMV-Vanilla был обнаружен серологически у V. tahitensis на Островах Кука и у V. planifolia на Фиджи и Вануату (Pearson et al., 1993), а WMV был обнаружен у V. planifolia во ФП (Grisoni et al., 2004 г.). Сообщалось также о нескольких изолятах потивируса, которые не реагировали ни с WMV, ни с DsMV-антисыворотками (Grisoni et al., 2004; Pearson, 1997; Pearson et al., 1993), что позволяет предположить, что в посадках ванили присутствовали и другие потивирусы.Вирусы
Род Potyvirus (семейство Potyviridae) включает 129 признанных видов плюс около 15 предполагаемых (Carstens and Ball, 2009; Fauquet et al., 2005). Потивирусы обнаружены во всем мире и инфицируют более 30 семейств растений, хотя отдельные вирусы часто имеют ограниченный круг хозяев. Изогнутые, непокрытые, стержнеобразные частицы (длина 680–900 нм, диаметр 12–15 нм), содержащие одноцепочечную положительно-смысловую молекулу РНК (Hull, 2002). Геном имеет размер около 10 т.п.н. и содержит одну открытую рамку считывания, которая кодирует полипротеин из 3000–3300 аминокислот. Полипротеин ко- и посттрансляционно расщепляется тремя кодируемыми вирусом протеиназами на 10 зрелых белков, большинство из которых являются многофункциональными (Adams et al., 2005a; Revers et al., 1999; Urcuqui-Inchima et al., 2001). Обширное исследование разнообразия генов в семействе Potyviridae (Adams et al., 2005b) пришло к выводу, что ген белка цитоплазматического включения (CI) лучше подходит для идентификации потивируса при использовании только части генома. Хотя ген CP менее информативен, чем CI, он тоже может эффективно разделять виды, критерий разграничения определяется этими авторами как 76–77% идентичности. Анализ гена CP из 36 образцов ванили, собранных в регионах Индийского и Тихого океана в период с 1997 по 2005 год, добавил пять видов потивирусов к двум ранее описанным вирусам, инфицирующим ваниль, а именно: вирус мозаики ванили (BCMV), вирус мозаики переносимый люцерновой тлей (CABMV), вирус мозаики жилок глицинии (WVMV), вирус желтой мозаики бобовых (BYMV) и вирус мозаики птицемлечника (OrMV) (Grisoni et al., 2006). Примечательно, что среди семи видов, инфицирующих ваниль, пять (BCMV, CABMV, DsMV, WMV и WVMV) принадлежат к подгруппе BCMV, преимущественно поражающих зернобобовые культуры и сорняки. Они были обнаружены на острове Реюньон (BCMV и CABMV), на Мадагаскаре (BCMV), на Маврикии (CABMV), во ФП (BCMV, DsMV и WMV), на Тонге (WMV) и на Самоа (WVMV). Два других вида, BYMV и OrMV, были обнаружены только на острове Реюньон. Потивирус, вызывающий мозаику, о котором сообщалось в Индии (Bhai et al., 2003; Bhat et al., 2004; Thomas et al., 2002), не был идентифицирован, но может быть связан с BYMV, что предполагается двумя образцами (GenBank, AY845011 и AY845012), происходящими из материал ванили, собранного в Карнатаке (Индия). О потивирусоподобных симптомах также сообщалось в Папуа-Новой Гвинее (Kokoa, 2000) и в Пуэрто-Рико (Childers and Cibes, 1948).Случай с DsMV-ваниль
Штаммы DsMV, инфицирующие ваниль, сначала были условнообозначены как VanMV, потому что они показали только отдаленную серологическую связь со штаммами DsMV, инфицирующими таро, и из-за невозможности перекрестной инокуляции между штаммами, происходящими от двух хозяев. Впоследствии нуклеотидный анализ 3′-конца генома двух изолятов VanMV (с Островов Кука [CI] и ФП [FP]) подтвердил, что их следует классифицировать как штаммы DsMV, поскольку они имеют более 78% идентичностей, в частности в коре CP (Farreyrol et al., 2006). Интересно, что DsMV-ваниль [CI] и DsMV-ваниль [FP] так же расходились как друг с другом, так и с опубликованными штаммами DsMV-таро (Colocasia esculenta) (Farreyrol et al., 2006). Однако, недавно полученные последовательности для изолятов таро с Островов Кука и ФП были очень похожи на изоляты ванили из той же страны (M. Pearson et al., неопубликованные данные). Поскольку таро выращивали на этих островах намного дольше, чем ваниль, это предполагает, что «скачок вируса» с таро на ваниль мог произойти независимо на двух островах Тихого океана. Кроме того, DsMV-ваниль [FP] продемонстрировал необычные особенности, которые делают его особым вирусом среди потивирусов (Farreyrol et al., 2006): мотив передачи DVG от тли (вместо более распространенного мотива DAG) выше несвойственный участок аминокислотных повторов (GTN) типичный для нативно развернутых белков, и необычный сайт протеолитического расщепления NIb/CP (Q//V).Симптомы и диагностика
У ванили потивирусы вызывают более или менее выраженную мозаику и деформацию листовых пластинок, иногда связанную с некротическими поражениями (рис. 7.2). Мозаика и некроз также могут быть видны на стебле. Эти симптомы особенно заметны на молодых листьях и значительно ослабевают на старых. На острове Реюньон симптомы потивируса были наиболее очевидны в прохладные месяцы с ремиссией симптомов, наблюдаемой в жаркое время года (Benezet et al., 2000; Leclercq Le Quillec et al., 2001). Воздействие вирусов на цветение и плодоношение ванильных лиан не было установлено, хотя о некотором замедлении роста можно судить по сильной мозаике и деформации, поражающей побеги. Полевые наблюдения показали, что вирусные частицы были неравномерно распределены в растении, а лианы с симптомами могут быть отрицательными в ELISA (Leclercq Le Quillec et al., 2001). Как следствие, визуальное наблюдение мозаики на листьях и тесты ELISA дополняют друг друга для оценки потивируса на ванильных участках, но использование методов в одиночку недостаточно надежно для диагностики. РИСУНОК 7.2. Симптомы потивируса на листьях V. planifolia (a = BYMV-Réunion, b = BCMV-Madagascar, c = некротический штамм WMV-Tonga) и V. tahitensis (d = WMV-FP, e = DsMV-FP) и на стебле (f = WMV-FP).
РИСУНОК 7.2. Симптомы потивируса на листьях V. planifolia (a = BYMV-Réunion, b = BCMV-Madagascar, c = некротический штамм WMV-Tonga) и V. tahitensis (d = WMV-FP, e = DsMV-FP) и на стебле (f = WMV-FP).
Для диагностики потивирусной инфекции ванили на общем или специфическом уровне доступно несколько молекулярных методов. Универсальные моноклональные антитела к потивирусу (Jordan and Hammond, 1991), коммерциализированные Agdia (США), доказали свою эффективность в обнаружении всех видов потивируса, идентифицированных у ванили с помощью Indirect Simple Sandwich ELISA. Аналогичным образом, несколько мотивов, консервативных в геноме потивирусов, были использованы для создания ряда вырожденных праймеров для амплификации с помощью ОТ-ПЦР соответствующей последовательности в геноме потивирусов (Chen et al., 2001; Colinet et al., 1998; Gibbs and Mackenzie, 1997; Ha et al., 2008; Langeveld et al., 1991; Marie-Jeanne et al., 2000; Pappu et al., 1993). Оба метода могут использоваться для оценки потивирусного статуса материала, но не позволяют конкретно идентифицировать обнаруженные виды потивируса. Для потивирусов специфическая идентификация с помощью серологии ненадежна из-за многочисленных перекрестных реакций между видами вирусов (Shukla et al., 1994). Чтобы преодолеть эту проблему, можно использовать простой однопробирный одностадийный анализ ОТ-ПЦР с использованием вырожденных праймеров с последующим прямым секвенированием короткого фрагмента (Grisoni et al., 2006). Поскольку технологии ОТ-ПЦР и секвенирования становятся все более простыми и дешевыми, этот метод можно использовать в эпидемиологических исследованиях, требующих высокой производительности. Технологии микрочипов, которые являются многообещающим способом получения широкого спектра, специфического и чувствительного инструмента обнаружения потивирусов, находятся в стадии разработки (Boonham et al., 2007; Wei et al., 2009).
Эпидемиология
Потивирусы несут ответственность за большие потери многих экономически важных культур, поскольку легко распространяются по полям. Некоторые из них передаются через семена, большинство – механически (хотя и неэффективно), но все они эффективно хотя и непостоянно передаются тлей (Brunt, 1992). VanMV легко передавался от V. tahitensis к V. pompona персиковой тлёй Myzus persicae (Wisler et al., 1987). Экспериментальные тесты передачи WMV-Tonga от инфицированной Nicotiana clevelandii к здоровой с использованием Aphis gossypii были успешными, но тесты передачи с участием V. planifolia в качестве растения-донора с той же тлей не увенчались успехом (Pearson and Pone, 1988; Pearson et al., 1990; Wang и Пирсон, 1992; Ван и др., 1993, 1997). Однако, несколько полевых данных о потивирусных инфекциях подтверждают роль тли в распространении потивирусов на участках ванили (Richard et al., 2009). Успешные испытания передачи тлёй соответствовали непостоянному способу передачи. При непостоянной передаче нескольких секунд или минут достаточно для приобретения вируса или инокуляции питающих проб переносчиком. Поэтому неудивительно наблюдать тяжелую потивирусную инфекцию в отсутствие на ванили колоний установленной тли (за исключением Cerataphis orchidarum, для которой описаны только бескрылые формы и которая не считается эффективным переносчиком вируса). Несколько потивирусов передаются с семенами, в частности CABMV у нескольких видов бобовых (Gillaspie, 2001), BCMV у некоторых сортов Phaseolus и Vigna и BYMV у нескольких видов стручковых (Aftab and Freeman, 2006). Кроме того, BCMV передается через пыльцу (Card et al., 2007). DsMV, WMMV и WVMV, как известно, не передаются с семенами, но было высказано предположение, что такая передача может быть более распространена, чем признано в настоящее время, особенно в подгруппе BCMV (Gibbs et al., 2008a). Передача вирусов с семенами имеет эпидемиологические последствия при наличии дополнительных культур и сорняков. В полевых условиях первичный инокулят потивируса может поступать из инфицированных черенков ванили, окружающих растений, многолетних или однолетних сорняков, в семенах которых вирус может перезимовать. Из этого первичного инокулята потивирус распространяется по участку тлями. Молекулярное сходство между изолятами, поражающими ваниль и сорняки, способствует передаче вирусов от одного вида к другому. Например, на Мадагаскаре изоляты BCMV были идентифицированы в ванили и прилегающем сорняке Senna sp. (Leguminosae), которые были на 100% идентичны по последовательностям генов CP (Grisoni et al., 2006). На острове Реюньон быстрая вспышка CABMV на недавно посаженном участке ванили с использованием безвирусных черенков взаимосвязана с межрядной Vigna unguiculata, у которой CABMV передается с семенами. Напротив, использование Gliricidia sepium, бобового дерева, часто используемого в качестве опор для участков ванили и которое из-за частой обрезки сильно заражено тлей Aphis craccivora (эффективный переносчик вирусов подгруппы BCMV), похоже, не увеличивает количество новых случаев потивируса на участках ванили, по сравнению с использованием поддерживающих деревьев без тлей, таких как Leucena glauca (Grisoni et al., 2004). Однако, при наличии других источников вируса высокие популяции тли могут стать проблемой.Контроль
Эпидемиологические данные показали, что серьезные вспышки потивируса происходят в основном в системе интенсивного выращивания ванили и могут происходить из-за разнообразия видов вирусов, включая разнообразие видов-хозяев, резервуаров вируса и, возможно, видов тлей. Таким образом, помимо универсальной рекомендации высаживать безвирусный материал, стратегию борьбы необходимо адаптировать к каждой местной ситуации. Как следствие, рекомендуется оценивать риск потивируса до начала любой программы развития на новом участке или при изменении системы выращивания. Кроме того, молекулярные инструменты, которые позволяют быстро идентифицировать потивирусы, помогают понять подходящую стратегию контроля, которую можно использовать в случае неожиданных вспышек потивируса.Вирус огуречной мозаики (CMV)
CMV – широко распространенный вирус, поражающий очень широкий круг растений. Он был обнаружен в ванили в начале 2000-х годов, что было связано с серьезными деформациями лиан во ФП (Farreyrol et al., 2001). Позднее вирус был обнаружен в ванили на острове Реюньон и в Индии (Madhubala et al., 2005).Вирусы и генетическое разнообразие Virus and Genetic Diversity
CMV является типичным представителем рода Cucumovirus в семействе Bromoviridae. Он имеет трехкомпонентный геном с позитивно-смысловой РНК, кодирующий пять белков (два компонента полимеразы на РНК1 и РНК2, белок 2b, участвующий в нарушении защиты растений и перемещении вируса в растении на РНК2, а также 30 К белок и CP на РНК3). Каждая РНК инкапсулирована в отдельную полиэдрическую частицу (диаметром 28 нм), поэтому для заражения растения требуется инокуляция трех типов вирионов. Некоторые изоляты также инкапсулируют субгеномную РНК или сателлитную (сат)РНК. Биология и экология этого вируса подробно рассмотрены (Palukaitis et al., 1992 и Gallitelli, 2000). Штаммы CMV делятся на две серологически разные подгруппы, различающиеся примерно по 25% нуклеотидов и также различающиеся по биологическим признакам. Термоустойчивые штаммы подгруппы 1 далее делятся на две клады (1A и 1B) на основе геномных последовательностей их РНК (Roossinck et al., 1999). Подгруппа 1A возникла из подгруппы 1B, и (до недавнего времени) штаммы 1A были обнаружены только в Азии. Термочувствительные штаммы подгруппы 2 ограничены зонами с прохладным климатом. Три механизма были связаны с эволюцией CMV: перегруппировка РНК между компонентами РНК, рекомбинация в некодирующих областях и мутации в кодирующих областях. Было показано, что несколько аминокислотных положений на CP положительно отобраны в отношении передачи вируса (Moury, 2004). Насколько нам известно, 65 последовательностей CMV-CP были получены для изолятов ванили, происходящих из ФП (58), острова Реюньон (6) и Индии (1) (Farreyrol, 2005; Madhubala et al., 2005; Mongredien, 2002), 53 из которых депонированы в Genbank. Большинство последовательностей были наиболее тесно связаны с изолятами подгруппы 1B и сгруппированы в несколько клад (Farreyrol et al., 2009). Деревья, полученные из 3′-UTR последовательностей РНК3 (Farreyrol, 2005) и ORF2b последовательностей РНК2 (Mongredien, 2002), соответствовали CP-анализу. Интересно, что изолят, принадлежащий к группе 2 (NZ100, AY861389), был механически инокулирован в растения ванили, что вызывало мозаику и деформацию листьев (Farreyrol et al., 2009), что позволяет предположить, что широкий спектр изолятов CMV может инфицировать ваниль. Попытки обнаружить сат-РНК CMV, ассоциированную с ванильными изолятами CMV из ФП, методом ОТ-ПЦР с использованием вырожденных праймеров (Escriu et al., 2000; Varveri and Boutsika, 1999) не увенчались успехом (M. Grisoni, неопубликованные данные). Филогенетический анализ изолятов CMV, собранных из ванили и нескольких связанных культур или сорняков, выявил кластеризацию в соответствии с географическим происхождением, а не с растением-хозяином. Например, на Подветренных островах (ФП) изоляты CMV с островов Райатеа и Хуахине находились в разных кластерах, в то время как между изолятами из ванили и из Commelina diffusa наблюдалось высокое сходство (Farreyrol et al., 2009). Эти данные подтверждают гипотезу передачи вируса от одного растения к другому, особенно от C. diffusa к V. tahitensis. Точно так же ген CP CMV из ванили, секвенированный в Керале (Индия), показал самую высокую идентичность (99%) с геном другого индийского изолята, заражающего черный перец в Карнатаке (Madhubala et al., 2005).Симптомы и диагностика
С CMV связаны различные симптомы у его многочисленных хозяевах. Наиболее распространены мозаика и задержка роста, но симптомы могут быть столь же серьезными, как и полный системный некроз. Некоторые штаммы не имеют симптомов у определенных хозяев или при повышенной температуре (штаммы подгруппы 2). Выраженность симптомов также может изменяться из-за временной ремиссии вирусной инфекции или же с ослаблением или усугублением коинфекцией сат-РНК. У ванили, описанные во ФП, изоляты CMV вызывали тяжелую деформацию листьев и побегов, а инфицированные растения часто бывают стерильными либо потому, что цветки не полностью развиваются, либо потому, что они сформированы ненормально и не содержат жизнеспособной пыльцы. На лианах V. tahitensis, механически инокулированных полевым изолятом CMV, первые симптомы проявились через два месяца после инокуляции, выпячиванием на молодых листьях, которые обычно имели тонкую и асимметричную (похожую на запятую) форму (рис. 7.3a). Впоследствии на лианах развился аномальный филлотаксис и неравномерный рост верхушек и цветков (рис. 7.3b и c), типичные для болезни. Подобные симптомы у листьев были описаны в Индии и на острове Реюньон для V. planifolia. В нескольких случаях наблюдались деформации побегов на инфицированных CMV лианах (Farreyrol, 2005), напоминающие аномальные трубчатые листья, описанные Якобом де Кордемуа (Jacob de Cordemoy,1899) (рис. 7.4), которые, возможно, являются историческим свидетельством давней инфекции CMV на острове Реюньон РИСУНОК 7.3. Симптомы, вызванные CMV-инфекцией у V. tahitensis: (а) молодые листья с выпячиванием и деформацией (здоровый лист справа); (b) распространение на инфицированных молодых побегах; и (c) аномальный цветок (справа) на лиане, инфицированной CMV.
РИСУНОК 7.3. Симптомы, вызванные CMV-инфекцией у V. tahitensis: (а) молодые листья с выпячиванием и деформацией (здоровый лист справа); (b) распространение на инфицированных молодых побегах; и (c) аномальный цветок (справа) на лиане, инфицированной CMV.
 РИСУНОК 7.4. (Слева) Аномальный трубчатый лист a, обнаруженный у V. planifolia в 1899 г. М. Х. Якоб де Кордемуа (Jacob de Cordemoy, 1899); f – нормальный лист; p, хвостовой стебель. (Справа) Симптом трубчатого листа, наблюдаемый во время исследования во ФП в 2005 году.
РИСУНОК 7.4. (Слева) Аномальный трубчатый лист a, обнаруженный у V. planifolia в 1899 г. М. Х. Якоб де Кордемуа (Jacob de Cordemoy, 1899); f – нормальный лист; p, хвостовой стебель. (Справа) Симптом трубчатого листа, наблюдаемый во время исследования во ФП в 2005 году.
Симптомы CMV на ванили очень заметны, довольно специфичны и могут быть хорошим индикатором вирусной инфекции. Однако, эти симптомы можно спутать на ранних стадиях с потивирусной инфекцией, а на более поздних стадиях – с физиологическими нарушениями. Кроме того, может наступить временная ремиссия симптомов. Следовательно, для диагностики заболевания или отбора черенков, свободных от вирусов, рекомендуются тесты, основанные на серологии (Devergne et al., 1981; Hu et al., 1995; Maeda and Inouye, 1991; Yu et al., 2005) или амплификации нуклеиновых кислот (Hu et al., 1995; Wylie et al., 1993; Yu et al., 2005).
Эпидемиология
CMV – растительный вирус, имеющий самый большой диапазон известных хозяев из более чем 1000 видов, принадлежащих более чем к 30 семействам (Douine et al., 1979). Вирус непостоянно передается более чем 80 видами тлей (Gallitelli, 2000). У некоторых хозяев CMV часто передается с семенами (Palukaitis et al., 1992). Несколько исследований указали на ключевую роль совместного присутствия резервуарных растений (в семенах которых перезимовал первичный инокулят) и тлей (которые обеспечивают вторичное распространение вируса) в эпидемиях CMV в разных культурах и странах (Hobbs et al., 2000; Kiranmai et al., 1998; Lavina et al., 1996; McKirdy, 1994; Rist and Lorbeer, 1991; Skoric et al., 2000). На ванильных участках Островов Общества (ФП) высокая распространенность CMV была зарегистрирована в начале 2000-х годов, при этом каждый третий участок был инфицирован, а частота встречаемости часто превышала 25% лиан (Farreyrol et al., 2009). Гораздо меньшая распространенность вируса наблюдалась на острове Реюньон, где было всего 2 зараженных участка со спорадическим распространением вируса из 25 (Farreyrol, 2005), а также в Индии, где вирусы мозаики наблюдались на <5% лиан (Bhat et al., 2004; Madhubala et al., 2005). На Маркизах и Австралес (ФП), Коморском архипелаге и на Мадагаскаре CMV не был обнаружен у ванили, несмотря на интенсивные исследования (Grisoni, 2003; Grisoni, 2009; Grisoni, Abdoul-Karime, 2007; Leclercq-Lequillec and Nany, 2000). Распространение CMV отслеживалось в нескольких теневых домах, засаженных безвирусными черенками, и проводилось в различных местах на Подветренных островах (Richard et al., 2009). Результаты показали, что при отсутствии защиты от насекомых и в благоприятных местах CMV может распространяться очень быстро. При этом 50% лиан были заражены всего через два года после посадки. Напротив, при использовании средств защиты от насекомых или в другом месте был зарегистрирован очень низкий уровень заболеваемости CMV. Эти результаты продемонстрировали роль тли в распространении болезни, а также важность окружающей среды, возможно, из-за наличия или отсутствия резервуара CMV среди сорняков. Было показано, что Commelina diffusa (ма’апапе на таитянском или herbe d’eau на французском, рис. 7.5) играет доминирующую роль в эпидемиях CMV во ФП (Richard et al., 2009): (1) C. diffusa был единственным видом, который демонстрировал одновременно высокую частоту заражения CMV и пораженность тлей (A. gossypii), (2) появление CMV на ванильных лианах сильно коррелировало с близостью C. diffusa, (3) Заболеваемость CMV на обследованных участках достоверно коррелировала с встречаемостью инфицированных C. diffusa на участке, но не с другими видами, инфицированными CMV, и (4) способностью A. gossypii и A. craccivora передавать CMV от C. diffusa к молодым растениям V. tahitensis была продемонстрирована в лабораторных исследованиях. Все эти данные, наряду с высоким сходством последовательностей между изолятами CMV ванили и C. diffusa (Farreyrol et al., 2009), убедительно подтверждают мнение о том, что C. diffusa является основным активным резервуаром CMV и вносит большой вклад в распространение этого вируса на участках ванили. Этот эпидемиологический сценарий напоминает сценарий, описанный для CMV на банановых плантациях (Eiras et al., 2004; Lockard, 2000; Magnaye and Valmayor, 1995). РИСУНОК 7.5. C. diffusa Burm. f., основной резервуар тлей и вирусов, участвующих в эпидемиях CMV во ФП: (а) растения, инфицированные вирусом; (b) цветок; и (c) инвазированный тлей лист.
РИСУНОК 7.5. C. diffusa Burm. f., основной резервуар тлей и вирусов, участвующих в эпидемиях CMV во ФП: (а) растения, инфицированные вирусом; (b) цветок; и (c) инвазированный тлей лист.
Контроль
Ввиду очень серьезных симптомов, вызываемых на листьях и цветках и потенциально высокой заболеваемости в полевых условиях, CMV представляет собой серьезную угрозу для плантаций ванили и должен быть приоритетом для оценки и контроля рисков при внедрении систем интенсивного выращивания. Во Французской Полинезии в 2003 г. была разработана эффективная стратегия борьбы, основанная на (1) поставке свободных от вирусов черенков, (2) покрытии теневых домов сеткой, защищающей от насекомых, (3) удалении больных растений, как только они обнаружены, (4) дезинфицированные инструменты и (5) уничтожение сорняков (особенно C. diffusa) внутри и в непосредственной близости от плантации. Обследование после внедрения в 2007 году показало, что вирусное воздействие (CMV и других вирусов) резко снизилось на новых плантациях, которые следовали рекомендациям (Richard et al., 2009). Эпидемиологические данные показывают, что распространенность CMV может сильно варьировать от одного района к другому, особенно в связи с наличием резервуаров вируса. Следовательно, стратегии борьбы должны быть адаптированы к каждому конкретному контексту выращивания.Другие вирусы
Помимо основных вирусов, уже подробно описаны другие вирусы, имеющие незначительное экономическое значение, как вирус кольцевой пятнистости одонтоглоссума (ORSV), или мало выраженные, как рабдоподобный вирус и клостероподобные вирусы (Bhat et al., 2004; Pearson et al., 1993), о которых также сообщалось у ванили.Вирус кольцевой пятнистости одонтоглоссума (ORSV)
ORSV является представителем рода Tobamovirus, членом которого является вирус табачной мозаики (Jensen and Gold, 1951). Палочковидные частицы ORSV (300 × 18 нм) содержат одноцепочечную положительно-смысловую молекулу РНК размером примерно 6,6 т.п.н., кодирующую пять белков (Ryu et al., 1995). Диапазон естественных хозяев ORSV ограничен орхидеями, у которых он может вызывать серьезные симптомы, такие как мозаика, кольцевые пятна, некроз листьев и цветов (Albouy and Devergne, 1998; Gibbs et al., 2000). Как тобамовирус, ORSV обладает высокой стабильностью в соке (температурная инактивация 90°C и конечная точка разведения 10-5-10-6) и легко передается механическими средствами. Он часто встречается у культурных декоративных видов во всем мире (Freitas et al., 1999; Khentry et al., 2006; Zettler et al., 1990). Однако, на ванили вирус имеет очень ограниченную заболеваемость и распространенность. Он был серологически обнаружен у нескольких лиан ванили на Тонге, Фиджи, островах Кука, Ниуэ, Французской Полинезии и на острове Реюньон (Farreyrol et al., 2001; Pearson and Pone, 1988; Pearson et al., 1993; Wisler et al., 1987), но никакие симптомы не были связаны с вирусом. Однако, во время карантина растений на острове Реюньон мы недавно наблюдали лиану V. pompona, происходящую из ботанического сада, с мозаикой на молодых листьях (рис. 7.6). Это растение давало положительный результат на ORSV и отрицательный на CymMV, потивирусы и CMV при помощи ELISA и RT-PCR. РИСУНОК 7.6. Мозаика на листе V. pompona, инфицированного ORSV.
РИСУНОК 7.6. Мозаика на листе V. pompona, инфицированного ORSV.
Поскольку ваниль встречается относительно нечасто, ORSV до сих пор не имел особого значения на производственных участках. Однако, из-за его возможной патогенности и отсутствия естественного переносчика стоит протестировать посадочный материал на этот вирус, чтобы избежать его размножения. Как и в случае с CymMV, был разработан ряд инновационных методов для обнаружения ORSV.
Неопознанный рабдо-подобный вирус
Во время обследования, проведенного на островах Тихого океана (Pearson et al., 1993), необычные симптомы на листьях, состоящие в виде некротических пятен, наблюдались на ванильных участках (рис. 7.7a) Вануату и Фиджи. Детальное препарирование симптоматических листьев выявили наличие оболочечных бацилловидных частиц, указывающих на возможный Rhabdovirus. РИСУНОК 7.7. (a) Образования и некроз на листьях V. planifolia, инфицированных (b) оболочечными вирусоподобными частицами, видимыми под электронным микроскопом.
РИСУНОК 7.7. (a) Образования и некроз на листьях V. planifolia, инфицированных (b) оболочечными вирусоподобными частицами, видимыми под электронным микроскопом.
Семейство Rhabdoviridae (отряд Mononegavirales) содержит вирусы, поражающие животных и растения, которые передаются членистоногими и могут размножаться в переносчике (Fauquet et al., 2005). Рабдовирусы, инфицирующие растения, относятся к двум родам (Cytorhabdovirus и Nucleorhabdovirus), но номер до сих пор не присвоен, включая предполагаемый рабдовирус пятнистости орхидей (OFV), который стал более распространенным среди орхидей за последнее десятилетие (Kitajima et al., 2001; Kondo et al., 2006). OFV был предварительно отнесен к новому роду Dichorhabdovirus, поскольку его геном, хотя и демонстрирует сходство последовательностей с нуклеорабдовирусами, является двухниточным и частицы не покрыты оболочкой (Kondo et al., 2009). Эта последняя особенность контрастирует с предполагаемыми частицами рабдовируса, обнаруженными в ванили, которые явно покрыты оболочкой (рис. 7.7b). Кроме того, неоднократные попытки амплифицировать последовательности OFV из симптоматических листьев ванили с использованием специфических праймеров (Blanchefield et al., 2001) потерпели неудачу (Mongredien, 2002). После 1993 г. о дальнейшем повреждении ванили, которое напоминает этот еще не охарактеризованный предполагаемый рабдовирус не сообщалось, и этот вирус следует рассматривать как курьез для участков ванили.
Распространение вирусов и система выращивания
Сходящиеся исследования, использующие различные подходы и патосистемы, связали раннее появление и распространение патогенов растений с изменением их окружающей среды (Stukenbrock and McDonald, 2008; Webster et al., 2007). В частности, развитие сельского хозяйства с эоцена совпадает с датами распространения РНК-потивирусов 6600 лет назад (Gibbs et al., 2008b, 2008c) и ДНК-собемовирусов 3000 лет назад (Fargette et al., 2008), по оценке филогенетических анализов. Изменения, вызванные сельским хозяйством и миграцией людей, благоприятствовали «новым встречам между растениями и вирусами», что привело к увеличению числа видов вирусов. Точно так же недавняя история потивирусных болезней ванили обычно иллюстрирует тесную взаимосвязь между агросистемами и вирусным давлением (таблица 7.2).ТАБЛИЦА 7.2. Распространенность и заболеваемость потивирусами на ванильных участках, проводимых без специальных мер контроля в различных системах возделывания
| Страна | Год обзора | Доля зараженных участков | Доля зараженных лиан | Система выращивания | Идентифицированный Potyvirus | Справка |
|---|---|---|---|---|---|---|
| Коморы | 2007 | 0/41 | 0% | Э/ПИ | Нет | Grisoni and Abdoul Karime (2007) |
| Фиджи | 1989 | 20/36 | 1–49% | ПИ/Э | НД | Pearson et al. (1993) |
| Индия | 2000/01 | 9/35 | 0.2–5% | ПИ | НД | Bhai et al. (2003) |
| Индия | 2003 | 52/65 | 0.25–10% | ПИ | НД | Bhat et al. (2004) |
| Мадагаскар | 1997 | 0/21 | 0% | Э/ПИ | Нет | Grisoni et al. (1997) |
| Мадагаскар | 2000 | 0/29 | 0% | Э/ПИ | None | Leclerq–Le Quillec (2000a, 2000b) |
| Мадагаскар | 2004 | НД | 5% | И | BCMV | Grisoni (2004) |
| Мадагаскар | 2009 | 45 | 0% | И/ПИ | Grisoni (2009) | |
| Маркизские острова (ФП) | 2003 | 5/29 | 0.5–90% | ПМ | WMV-DsMV | Grisoni (2003) |
| Майотта | 2007 | 0/ | 0% | ПИ | None | Grisoni and Abdoul Karime (2007) |
| Реюньон | 1998/99 | 14/17 | 0.3–14.4% | И | НД | Benezet et al. (2000) |
| Реюньон | 2000 | 9/25 | НД | ПИ/И | НД | Farreyrol (2005) |
| Самоа | 2005 | НД | 6% | ПИ | WVMV | Grisoni et al. (2006) |
| Острова Общества (ФП) | 2000 | 18/32 | НД | ПИ/И | НД | Farreyrol (2005) |
| Острова Общества (ФП) | 1998/99 | 27/49 | 0.6–97% | ПИ/И | DsMV, WMV, BCMV | Grisoni et al. (2004) |
| Острова Общества (ФП) | 1986 | 9/30 | 0.3–47.9% | ПИ/Э | DsMV | Wisler et al. (1987) |
| Тонга | 1989 | 19/25 | 1–21% | ПИ/Э | НД | Pearson et al. (1993) |
Мозаика и деформация листьев на побегах ванили были зарегистрированы в Пуэрто-Рико еще в 1948 году (Childers and Cibes, 1948) и могут представлять собой первое упоминание о потивирусах ванили. Тем не менее, первая подтвержденная вспышка потивирусов среди ванили была зарегистрирована во Французской Полинезии в 1986 году (Wisler et al., 1987). Это совпало с реализацией программы развития ванили, способствующей интенсификации методов выращивания, что повлекло за собой экологические изменения в агросистеме ванили (Anonymous, 1984). Аналогичным образом, в более поздних сообщениях о заражении потивирусом участков ванили, где были реализованы аналогичные программы интенсификации, таких как Тонга (Pearson and Pone, 1988), Вануату (Pearson et al., 1993), остров Реюньон (Benezet et al., 2000), Индия (Bhat et al., 2004), Мадагаскар (Grisoni et al., 2006), Маврикий (Rassaby, 2003) и Самоа (Grisoni et al., 2006). Напротив, на подлесных ванильных участках пока не было зарегистрировано инфекции потивирусом или только в исключительных случаях (Grisoni et al., 1997; Leclercq-Le Quillec and Nany, 2000).
 РИСУНОК 7.8. Упрощение агросистемы Vanilla после интенсификации: (a) Подлесок, насчитывающий более 30 адвентивных видов (деревья для тени и поддерживающие, сорняки и связанные с ними культуры); (b) полуинтенсивная система (с 10–20 адвентивными видами); и (c) интенсивная система под тенью (ваниль плюс иногда несколько сорняков).
РИСУНОК 7.8. Упрощение агросистемы Vanilla после интенсификации: (a) Подлесок, насчитывающий более 30 адвентивных видов (деревья для тени и поддерживающие, сорняки и связанные с ними культуры); (b) полуинтенсивная система (с 10–20 адвентивными видами); и (c) интенсивная система под тенью (ваниль плюс иногда несколько сорняков).
Мы предполагаем, что множественность потивирусов, поражающих ваниль (семь зарегистрированных видов), является результатом разнообразия эпидемиологических условий, в которых ваниль выращивается, и условий интенсивного культивирования, которые усиливают передачу тлей вирусов, присутствующих в сорняках или связанных с ними культурах. Распространенность потивирусов и CMV на ванильных участках сильно варьируется от одного участка к другому, хотя самые тяжелые инфекции (более 50% зараженных лиан через два года после посадки) были зарегистрированы в теневых домах, которые характеризуются очень низким разнообразием растений по сравнению с культивацией подлеске (рис. 7.8). Следовательно, вероятно, что другие оппортунистические вирусы будут заражать ваниль по мере распространения её культуры в новых средах. Это подчеркивает необходимость в быстрых, конкретных и широко применимых инструментах идентификации вирусов для понимания вспышек, поражающих плантации ванили, и реализации адаптированных стратегий борьбы.
Выводы и перспективы
Вирусные заболевания стали серьезной проблемой для производства ванили за последние несколько десятилетий, вероятно, в результате диверсификации участков выращивания и интенсификации систем выращивания. При отсутствии лечебных средств профилактика – единственный способ избежать вирусных заболеваний. Накопленные данные о вирусах, поражающих ваниль во всем мире, особенно CymMV, потивирусах и CMV, позволили ввести меры контроля, которые оказались достаточно эффективными для сохранения и расширения прибыльной индустрии ванили. Однако, вирусы обладают способностью к чрезвычайно быстрой эволюции, и может произойти появление новых патогенных изолятов на участках ванили, особенно в контексте быстрых экологических мутаций, вызванных глобальными изменениями (Canto et al., 2009; Garrett et al., 2006 г.). В последнее время был достигнут огромный прогресс в понимании биологии взаимодействий растений и вирусов, что привело к созданию мощных биотехнологий для создания устойчивых к вирусам разновидностей. Регенерация растений ванили из протопластов, которая была недавно достигнута (Minoo et al., 2008), делает такие биотехнологии доступными для производства трансгенной ванили, проявляющей высокий уровень устойчивости к РНК-вирусам. Однако, эта стратегия еще не реализована, возможно, из-за того, что вирусное давление поддерживается на приемлемом уровне обычными методами. Кроме того, потребители считают ваниль натуральным продуктом, и генетическая биоинженерия несовместима с этим представлением. Высокопроизводительные инструменты для обнаружения и идентификации нуклеиновых кислот, такие как портативные молекулярные тесты, поливалентная ПЦР, микроматрицы, секвенирование ДНК следующего поколения, в будущем будут способствовать улучшению контроля вирусов. В частности, они помогут лучше понять эпидемиологию вируса ванили и впоследствии разработать агросистему за счет снижения воздействия вируса на урожай. В глобальном масштабе эти технологии помогут производить посадочный материал с наивысшим генетическим и генетическим статусом для индустрии ванили. Несомненно, что будущее прибыльной и здоровой индустрии ванили зависит от этого элитного материала, должным образом размноженного и выращенного с соответствующими профилактическими мерами.Глава 8. Грибковые заболевания ванили
Введение
Заболевания культуры ванили, вызываемые патогенными грибами, регистрировались с тех пор, как ваниль стала коммерческой культурой. В странах-производителях ванили, таких как Индонезия, Мадагаскар, Индия, Папуа-Новая Гвинея, Мексика и Пуэрто-Рико, заболевания, вызываемые грибками, являются серьезными препятствиями для выращивания этого растения. Ваниль заражают несколько родов грибков, включая Fusarium, Phytophthora, Sclerotium и Colletotrichum. Они поражают стебли, корни, листья, побеги и плоды. Однако, болезнь, вызываемая Fusarium, является наиболее серьезной и привела к опустошению посадок на ванильных фермах или плантациях во многих странах-производителях.Фузариозная гниль ванили
Фузариозная гниль поражает корни, стебли, плоды, листья и побеги растения. Однако, инфекции стеблей и корней вызывают наибольший ущерб, что приводит к значительной потере урожая, и потому болезнь часто называют стеблевой гнилью, прикорневой гнилью или гнилью стебля и корней. В Индонезии, от питомников до продуктивных плантаций, фузариозная гниль может поражать все части растения, но поражение стебля является наиболее опасным. В свете значения, в этой главе этому заболеванию уделяется больше внимания.Исторический обзор и распространение
О фузариозной гнили, поражающей культуру ванили, сообщалось с момента начала ее коммерческого выращивания в странах-производителях, включая Индонезию, Индию, Пуэрто-Рико, Сейшельские острова, остров Реюньон, Мадагаскар и Полинезию. Заболевание ванили впервые было зарегистрировано Циммерманном в Индонезии в 1903 году (Tombe, 1994), когда была отмечена инфекция на стеблях и листьях. В 1918 году симптомы корневого заболевания впервые оказались замечены на плантациях ванили в Маягуэсе, Пуэрто-Рико (Alconero and Santiago, 1969). Такер сообщил, что корневая гниль ванили в Пуэрто-Рико вызывается почвенным патогеном под названием Fusarium batatatis var. vanillae Tucker (Tucker, 1927). В 1925 году ван Холл упомянул появление корневого грибка, который вызвал гибель саженцев ванили на Яве в Индонезии (Tucker, 1927). Однако, самое раннее упоминание, связывающее вид Fusarium с гнилью стебля ванили в Индонезии, было сделано Соетоно, который выделил вид Fusarium из инфицированных растений ванили и идентифицировал его как F. batatatis Wollenweber (Soetono, 1962). На Сейшельских островах, где ваниль раньше была важной культурой, согласно отчету Дюпона, присутствовало такое же корневое заболевание (Dupont, 1921). Описание болезни довольно близко совпадало с описанием в Пуэрто-Рико (Tucker, 1927). Мейнеке также наблюдал неописанный гриб Fusarium, поражающий нежные кончики и молодые стручки ванили (Tucker, 1927). Аверна-Сакка сообщил, что тот же вид Fusarium был выделен из больной ванили, произрастающей в Бразилии (Averna-Sacca, 1930). Однако, он заявил, что возбудитель Fusarium поражает только листья и стебли без каких-либо упоминаний о его появлении на корнях. Лили и Овино сообщали, что корневая гниль ванили, вызываемая Fusarium oxysporum (син. F. batatatis var. vanillae), была наиболее серьезным заболеванием на плантациях ванили в Уганде (Lealy, 1970; Owino, 2008). Об этом и других видах Fusarium, включая Fusarium solani, сообщалось с плантаций ванили в Индии (Balagopal et al., 1974a, 1974b; Philip, 1980; Anandaraj et al., 2005), Таиланде (Ratanachurdchai and Soytong, 2008), Тонги (Stier, 1984) и Китая (Ruan et al., 1998). Возбудитель в настоящее время обнаружен на острове Реюньон и на Мадагаскаре, но, скорее всего, там он присутствовал соответственно еще в 1871 и 1902 годах (Bouriquet, 1954).Симптомы и развитие заболеваний
Симптомы стеблевой и корневой гнили могут появиться на любой стадии роста растения ванили: на черенках, молодых и зрелых продуктивных лианах участка. Помимо стеблей и корней, болезнь поражает другие части растений, такие как побеги и стручки, в любое время года (Tombe et al., 1992a). В Индонезии большинство случаев заражения сначала происходит на стеблях, затем на корнях и побегах, а иногда и на стручках и молодых листьях. Внекорневая инфекция чаще встречается на молодых листьях. В сезон дождей более распространено поражение побегов, чем других частей растения, хотя повреждение не такое серьезное, как стеблей. При неблагоприятных условиях развития болезни симптомы проявляются в виде черных пятен на стеблях с ограниченным прогрессом и явными коричневыми краями. С другой стороны, при благоприятных условиях поражения коричневого или темно-коричневого цвета с менее четко очерченными краями увеличиваются и распространяются очень быстро по всему междоузлию стебля. Между поражением и здоровой тканью часто наблюдается хлоротичная зона (рис. 8.1a) (Soetono, 1962; Tombe, 1993a; Anandaraj et al., 2005). Как следствие, инфицированное междоузлие стебля истончается, становится коричневым или темно-коричневым и, наконец, сухим и некротическим (рис. 8.1b). Тем не менее, развитие болезни, по-видимому, сдерживается узлами на лиане (рис. 8.1c). На сгнивших и сжавшихся частях образуются желтовато-оранжево-белые споровые массы, состоящие из конидиеносцев и конидий грибов. Когда инфицированный стебель разрезан в продольном направлении, становится очевидным некроз, о чем свидетельствует коричневое изменение цвета, развивающееся от внутренней к периферической ткани. На корнях симптомы сначала проявляются в виде потемнения, за которым следует гибель (Rachmadiono et al., 1982; Tombe, 1993a; Anandaraj et al., 2005). Воздушные корни быстро отмирают после попадания в почву (рис. 8.1c), что приводит к вялости и сморщиванию стебля и, как следствие, к увяданию лианы. Она становится темно-коричневой и разлагается, а гниль становится либо мягкой и водянистой, либо несколько сухой, в зависимости от существующих условий влажности (Alconero, 1968). Фузариозную гниль надземных корней часто трудно отличить от антракноза, поскольку оба имеют очень похожие симптомы, и соответствующие патогены часто совместно выделяются, если присутствуют на одной ферме. Такер записал, что в некоторых случаях может сгнить до 3 метров нижней части лианы, в то время как верхняя часть остается зеленой и продолжает свое существование (Tucker, 1927). Однако, важно отметить, что патоген может выжить в зеленых здоровых междоузлиях без видимых внутренних или внешних симптомов. РИСУНОК 8.1. Симптомы фузариозной гнили на ванильных лианах: (а) темно-коричневое поражение на междоузлиях стебля с хлоротичной зоной; (b) развитие некроза стебля междоузлия и корня; (c) в узлах образуются многочисленные воздушные корни, но, достигнув почвы, они загнивают.
РИСУНОК 8.1. Симптомы фузариозной гнили на ванильных лианах: (а) темно-коричневое поражение на междоузлиях стебля с хлоротичной зоной; (b) развитие некроза стебля междоузлия и корня; (c) в узлах образуются многочисленные воздушные корни, но, достигнув почвы, они загнивают.
Возбудитель
Такер был первым, кто описал возбудителя корневой гнили ванили, детализировав морфологию различных типов спор и определив патоген как F. batatatis var. vanillae (Tucker, 1927). С тех пор это название претерпевало множество номенклатурных изменений. Это вместе с ассоциацией болезни с различными частями растений приводило к случайной путанице в отношении истинной этиологии болезни. Название вида, данное Такером, было основано на морфологическом сходстве с Fusarium batatis, возбудителем увядания сладкого картофеля, но не было обнаружено, что эти два патогена от соответствующих хозяев являются перекрестными патогенами, и потому для ванильного штамма было использовано название разновидности. Специализация хозяев морфологически идентичных штаммов видов Fusarium привела к концепции forma specialis (Snyder and Hansen, 1940), согласно которой многие виды Fusarium, ранее названные на основе патогенности хозяина, несмотря на морфологическое сходство с F. oxysporum Schlechtendahl, были переименованы в F. oxysporum с разными эпитетами forma specialis в зависимости от хозяев. Fusarium oxysporum Schlecht. f. sp. batatis (Wollemw.) Snyder et Hansen был синонизирован F. batatis (Snyder, Hansen, 1940), но некоторое время спустя F. batatatis var. vanillae (Tucker) был переименован в F. oxysporum Schlecht. f. sp. vanillae (Tucker) Gordon (Gordon, 1965). F. oxysporum f. sp. vanillae производит различные бесполые структуры: микроконидии, макроконидии и хламидоспоры (рис. 8.2). Мицелии погруженные, иногда разбегающиеся по поверхности очагов поражения, прозрачные, тонкие; спородохии на разлагающейся зараженной части ванили; микроконидии у ложных головок и коротких конидиеносцев, обильные, одноклеточные, овальные, 4–9 × 2–3,5 мкм; макроконидии обычно 3-сегментные, иногда 1-2-сегментные, редко 4-5-сегментные, обильные, гиалиновые, изогнутые, на ножках, 20–46 × 2,4–8 мкм; хламидоспоры присутствуют поодиночке или парами, в старом возрасте толстостенные, коричневые, 6,5–10 мкм (в среднем 7 мкм). На среде картофельного агара с декстрозой (КПК) рост колоний происходит быстро, и белый воздушный мицелий может приобретать бледно-фиолетовый оттенок. РИСУНОК 8.2. Морфология конидий F. oxysporum, выделенных из ванили нагвоздичном агаре: (а) микроконидии, продуцируемые короткими монофиалидами; (б) макроконидии, продуцируемые воздушным мицелием; (c) хламидоспоры, образованные одиночными или короткими цепочками; (d) Макроконидии и микроконидии.
РИСУНОК 8.2. Морфология конидий F. oxysporum, выделенных из ванили нагвоздичном агаре: (а) микроконидии, продуцируемые короткими монофиалидами; (б) макроконидии, продуцируемые воздушным мицелием; (c) хламидоспоры, образованные одиночными или короткими цепочками; (d) Макроконидии и микроконидии.
Общие морфологические особенности изолятов Fusarium из ванили, выделенных на сегодня в Индонезии, на острове Реюньон, на Коморских островах и в Центральной Америке, аналогичны характеристикам F. oxysporum, описанным Мессианом и Кассини (Messiaen and Cassini, 1981). Они также соответствуют основным описаниям F. oxysporum (Matuo, 1972). Морфологически эти изоляты также похожи на изоляты, выделенные из ванили в Индии (Philip, 1980). Испытания на прививку пяти растениям F. oxysporum показали, что изоляты ванили были патогенными для ванили и непатогенными для дыни, огурца, томата и цимбидиума, тогда как изоляты из томатов были непатогенными для ванили (Nurawan, 1990). В недавнем исследовании Ся-Хун (Xia-Hong, 2007) выделил 87 штаммов F. oxysporum из ванили вызывающих стеблевую гниль в семи провинциях Китая. Среди этих штаммов 81 был протестирован на патогенность, и только 43 были признаны патогенными. Группы вегетативной совместимости (VCG), иногда называемые группами совместимости с гетерокарионами, являются полезным инструментом для идентификации различных генетических группировок в популяции грибков. Каждая группа VCG уникальна в том смысле, что члены одной группы несовместимы с членами других групп. Индонезийские изоляты F. oxysporum f. sp. vanillae были сгруппированы в две группы VCG, а еще четыре группы VCG представлены отдельными изолятами (Tombe et al., 1994b). В Индонезии изоляты в одном и том же VCG не обязательно были ограничены одним и тем же регионом или местом (Tombe et al., 1994). Эти результаты были аналогичны результатам, полученным для F. oxysporum f. sp. tuberasi из картофеля (Venter et al., 1992) и Fusarium proliferatum из спаржи (Elmer, 1991). В настоящее время проводятся исследования генетического разнообразия и популяционной структуры F. oxysporum f. sp. vanillae по всей Индонезии, включая эталонные изоляты из различных частей мира. Сюда входит использование маркеров дактилоскопии на основе ПЦР, а также филогенетический анализ нескольких участков генов. Предварительные результаты указывают на наличие относительно большого количества гаплотипов, некоторые из которых образуют большие клональные группы. 87 штаммов F. oxysporum f. sp. vanillae, выделенные в Китае (Xia-Hong, 2007), принадлежали к 12 различным VCG без корреляции между VCG и вирулентностью. Выделение непатогенных штаммов F. oxysporum из корней ванили привело к исследованиям возможности использования некоторых из этих штаммов в качестве средств биологической борьбы с фузариозной гнилью ванили. Обнадеживающие результаты были получены в экспериментальных условиях, но эффективность в полевых условиях еще предстоит проверить.
Меры контроля
Хотя некоторые родственники ванили, такие как Vanilla phaeantha, Vanilla aphylla и Vanilla andamanica, продемонстрировали устойчивость к фузариозной гнили (Theis and Jiménez, 1957; Minoo et al., 2008), коммерческие сорта, устойчивые или толерантные к фузариозной гнили, еще не описаны. В связи с тем, что фузариозная гниль может поражать различные части растений на всех стадиях роста, комплексные меры борьбы с этим заболеванием имеют первостепенное значение и должны осуществляться прямо с этапа подготовки черенка, на протяжении вегетативной и продуктивной фаз, от посадки до старения (Hadisutrisno, 1996; Tombe et al., 1997; Anandaraj et al., 2005; Tombe, 2008). Некоторые компоненты сообщаемых мер контроля, среди прочего, включают применение фунгицидов – беномила, карбендазима и манкозеба (Matsumoto et al., 1992; Anandaraj et al., 2005; Bhai et al., 2006) и биологических агентов, таких как Bacillus sp., Pseudomonas fluorescens и авирулентные штаммы F. oxysporum (Tombe et al., 1992c, 1997; Hadisutrisno, 1996; Anilkumar, 2004). В Индонезии были разработаны комплексные меры контроля, которые включают использование (а) свободных от патогенов и устойчивых к болезням черенков, инокулированных непатогенным штаммом F. oxysporum 10A-M (рис. 8.3) для индукции устойчивости (черенки Bio-FOB), (b) фунгицидов, таких как беномил или манкоцеб, путем погружения черенков на 20–30 минут, (c) биологических агентов Trichoderma lactae и Bacillus pantothenticus (рис. 8.3), Bacillus firmus и T. lactae или P. fluorescens (Tombe, 2008), предварительно смешанных с органическим материалом, и (d) ботанического фунгицида эвгенола, экстрагированного из листьев или плодоножек гвоздики. В таблице 8.1 приведены рекомендации по борьбе с фузариозной гнилью ванили в различных сценариях, основанные на подходе интегрированного управления болезнями (ИУБ) в Индонезии. РИСУНОК 8.3. Биологические агенты, используемые для комплексной борьбы с фузариозной гнилью в Индонезии: (a) примерно 3-месячные черенки ванили, привитые непатогенным штаммом Fusarium oxysporum 10A-M; (b) антагонистический тест B. pantothenticus к F. oxysporum f. sp. vanillae; (c) B. pantothenticus на сахарозно-пептонном агаре; (d) Trichoderma lactae на картофельно-декстрозном агаре.
РИСУНОК 8.3. Биологические агенты, используемые для комплексной борьбы с фузариозной гнилью в Индонезии: (a) примерно 3-месячные черенки ванили, привитые непатогенным штаммом Fusarium oxysporum 10A-M; (b) антагонистический тест B. pantothenticus к F. oxysporum f. sp. vanillae; (c) B. pantothenticus на сахарозно-пептонном агаре; (d) Trichoderma lactae на картофельно-декстрозном агаре.
ТАБЛИЦА 8.1. Рекомендации ИУБ по фузариозной гнили ванили в Индонезии
| Рекомендации ИУБ | Новая плантация | Плантация без каких-либо симптомов болезни | Плантации с низкой заболеваемостью и легкой степенью тяжести | Плантации с высокой заболеваемостью и серьезностью заболевания (до пересадки) |
|---|---|---|---|---|
| Свободные от патогенов черенки растений (Bio-FOB) | + | |||
| Погружайте черенки в фунгициды (беномил или манкоцебом) | + | |||
| Используйте органические удобрения с агентами биоконтроля | + | + | + | |
| Применяйте органическую мульчу, например, сено, кокосовую шелуху, листья гвоздики | + | + | + | |
| Соблюдайте местные рекомендации по обработке земли, расстоянию между растениями, поливу и притенению деревьями | + | |||
| Регулярно следите за ранними симптомами и физически удаляйте любые пораженные ткани. Дезинфицируйте режущий инструмент | + | + | + | |
| Регулярно применяйте ботанические или синтетические фунгициды, особенно после удобрений, обрезки, прополки и сбора урожая | + | + | + | |
| Регулярно подрезайте теневые деревья, чтобы контролировать влажность и тень | + | + | + | |
| Улучшайте дренаж, особенно в сезон дождей | + | + | + | |
| Физически удалите пораженные ткани и нанесите на раны растительный или синтетический фунгицид. Продезинфицируйте режущие инструменты | + | + | ||
| Введите севооборот с другими растениями | + | |||
| Полностью удалите больные растения и примите строгие санитарные меры | + | |||
| Тщательно вспахивайте землю, чтобы улучшить соляризацию почвы | + | |||
| Выращивайте однолетние культуры, такие как кукуруза и бобы, а также культуры, которые, как считается, содержат антагонистические микроорганизмы (например, валлийский и красный лук, китайский шнитт-лук, чеснок) | + |
Антракноз ванили
Хотя сегодня считается, что антракноз ванили присутствует в большинстве регионов выращивания, включая Индонезию, Индию, Коморские Острова, Мадагаскар, Мексику, Уганду (Bouriquet, 1954; Tombe, 1993b Augstburger et al., 2000; Thomas et al., 2002).; Magala, 2008), достоверные данные о его распространении и истории обнаружения и этиологии отсутствуют.Симптомы и развитие заболеваний
Симптомы антракноза на ванили проявляются, особенно на старых листьях и стеблях, первоначально в виде небольших серых или черных пятен, которые сливаются или увеличиваются в размере, становясь темно-коричневыми или черными пятнами или поражениями разного размера (рис. 8.4a) (Taufik and Manohara, 1998). Сообщается также, что болезнь поражает молодые побеги, соцветия и стручки в Индии (Anandaraj et al., 2001; Anilkumar, 2004). На поздних стадиях заболевания эти поражения могут содержать плодовые структуры (ацервули), которые выглядят как крошечные черные точки (Tombe, 1993b). Во влажных условиях образуются инфекционные пропагулы (конидии), которые высвобождаются из плодовых структур, проявляясь в виде скоплений лососево-розовых спор на поверхности пораженной ткани (Taufik and Manohara, 1998). Эти конидии разносятся брызгами дождя или переносятся на различных частях тела насекомых, контактировавших со спорами. Заражение на листьях может произойти при проникновении спор через устьица или при прямом проникновении. Скрытая инфекция возникает, когда споры проникают всего в несколько клеток эпидермиса и не развиваются непрерывно. Только при благоприятных условиях окружающей среды грибок разовьется и образует некротические пятна. Заражение старых или стареющих листьев обычно не вызывает значительного ущерба урожаю. Лучший способ отличить фузариозную гниль от антракноза – это исследовать внутренние ткани, где наблюдаются внешние симптомы. Наличие внутреннего обесцвечивания, особенно в сосудистой ткани, указывает на фузариозную гниль. Ранние симптомы антракноза ограничиваются эпидермисом или поверхностными слоями, тогда как сосудистая ткань выглядит здоровой. РИСУНОК 8.4. Симптом (а) антракноза на листе; (b) склероциальной гнили (коричневая пропитанная водой ткань листа и белый мицелий и склероции на почве; (c) фитофторозная гниль стеблей на естественно инфицированных побегах (на вставке: симптом после искусственной инокуляции) (из Andriyani, N. et al. Jurnal Biologi) Индонезия, 5, 227–234, 2008. С разрешения.)
РИСУНОК 8.4. Симптом (а) антракноза на листе; (b) склероциальной гнили (коричневая пропитанная водой ткань листа и белый мицелий и склероции на почве; (c) фитофторозная гниль стеблей на естественно инфицированных побегах (на вставке: симптом после искусственной инокуляции) (из Andriyani, N. et al. Jurnal Biologi) Индонезия, 5, 227–234, 2008. С разрешения.)
Возбудитель
Возбудителем антракноза на ванили является Colletotrichum gloeosporioides Penzig et Saccardo (син. Colletotrichum vanillae Scalia, C. vanillae Verplancke et Claess, Gloeosporium vanillae Cooke) (Tombe, 1993b; Anilkumar, 2004; Ratanachurdchai, 2008, Soytichurdchai). Возбудитель иногда упоминается как телеоморф Glomerella cingulata (Stoneman), Spauld et Schrenk [син. G. vanillae (Stoneman) Sacc et Traverso], но у растения-хозяина половая стадия никогда не наблюдалась. Краткое морфологическое описание C. gloeosporioides включает: (1) ацервули дисковые или подушкообразные, субэпидермальные, эпифиллярные, диаметром 30–345 мкм; конидиеносцы простые, короткие, прозрачные, щетинки коричневые, у основания слегка вздутые и сужаются к вершине, на которых изредка выступают конидии 22,5–75 × 2,5–5 мкм; и (2) конидии стекловидные, одноклеточные, от овальных до продолговатых, 10–17,5 × 3–5 мкм. C. gloeosporioides имеет довольно широкий круг хозяев и обычно существует в различных условиях и местах. Однако, взаимосвязь между ванильными изолятами и изолятами от других хозяев еще предстоит исследовать.Меры контроля
До сих пор не сообщалось, что антракноз на ванили причиняет фермерам большой ущерб (Taufik and Manohara, 1998; Magala, 2008). Однако, болезнь косвенно влияет на общее состояние растений ванили и, следовательно, на производство. С этим заболеванием можно бороться используя несколько методов, примеры которых приведены ниже. 1. Регулярная обрезка теневых деревьев для контроля влажности и солнечного света. Обрезку желательно проводить в начале сезона дождей. Одновременно следует улучшить дренаж. 2. Уничтожение больных частей растений (например, путем сжигания) для предотвращения распространения болезней. 3. Применение фунгицидов (например, беномила, манкозеба и карбендазима), особенно при рецидиве заболевания (Taufik and Manohara, 1998; Bhai et al., 2006). 4. Повышение жизнеспособности растений (например, подкормка органическими веществами).Склероциальная гниль ванили
Это заболевание обычно поражает растения в сезон дождей при высокой влажности и часто встречается вместе с фузариозной гнилью. Склероциальная гниль может быть серьезной проблемой в питомнике и, если она связана с фузариозной гнилью, может привести к гибели продуктивных растений в посадках (Tombe and Sitepu, 1987; Taufik and Manohara, 1998). Заболевание зарегистрировано в Индии и Индонезии (Tombe and Sitepu, 1987; Anandaraj et al., 2005), но почти нет сведений об истории и распространении этого заболевания в других регионах произрастания, вероятно, из-за его частой ассоциации и, возможно, путаницей с более значимой фузариозной гнилью.Симптомы и повреждения
Болезнь возникает в основании стебля ванили, обычно на высоте 5 см над поверхностью почвы. Основание пораженного стебля становится пропитанным водой, приобретает цвет от коричневого до темно-коричневого, затем некротизируется и отмирает. Белый пушистый мицелий часто обнаруживается на инфицированном стебле и окружающей поверхности почвы (рис. 8.4b) (Matsumoto, 1993). Вместе с мицелием часто наблюдаются небольшие сферические структуры (склероции) светло-коричневого цвета, диаметром 0,5–2 мм. Если заболевание возникает на грядке для размножения черенков, повреждения обычно очень тяжелые (Taufik and Manohara, 1998). Склероциальная гниль иногда обнаруживается на стручках ванили, для которых характерно гниение кончиков с толстым белым покровом грибкового мицелия, который в конечном итоге покрывает весь стручок. Избыточная тень, продолжительные проливные дожди, чрезмерное загущение лиан, заболоченность и наличие инокулята патогена в посадках являются факторами, предрасполагающими к гниению ванили (Anandaraj et al., 2005).Возбудитель
Возбудитель склероциальной гнили, Sclerotium rolfsii, не образует конидий или каких-либо других репродуктивных структур. Однако, обычно образуются спящие структуры, склероции, которые сохраняются в почве в течение многих лет (Taufik and Manohara, 1998). Эти структуры выживания легко распространяются брызгами и стоками дождевой воды, зараженной почвой, животными и сельскохозяйственным инвентарём (Tombe and Sitepu, 1987), и, поэтому, также представляют собой распространяющиеся и инфекционные пропагулы заболевания. В благоприятных условиях окружающей среды склероции прорастают и образуют мицелиальные маты, которые колонизируют ткани хозяина. Характерными диагностическими симптомами и признаками заболевания являются белый мицелий вокруг пораженных частей растения и светло-коричневые склероции, образующиеся в основании стебля и окружающей поверхности почвы. Этот грибок хорошо растет на искусственной среде в лаборатории, но телеоморфа никогда не наблюдается. Через 10–14 дней на поверхности агара образуются многочисленные склероции. Эти склероции, происходящие из мицелия, изначально имеют белый цвет, а по мере созревания становятся бледно- или темно-коричневыми и образуют внешнюю меланизированную корку.Меры контроля
Ниже приводится краткое изложение рекомендуемых мер борьбы со склероциальной гнилью ванили в Индонезии. Большинство из этих мер являются общими для заболеваний, вызванных Sclerotium, и, следовательно, применимы в других регионах. 1. Регулярный мониторинг и раннее и точное выявление болезни. 2. Физическое удаление пораженной ткани, включая окружающие части растения и почву, которая может содержать склероции патогена. 3. Применение средств биологической борьбы, Trichoderma harzianum, T. lactae и B. pantothenticus (Tombe, 2007), смешанных с органической мульчей или компостом. Было показано, что внесение T. harzianum в смеси с рисовым зерном и стерилизованной почвой, разбросанной по поверхности почвы в питомнике ванили, подавляет болезнь до 54% (Kasim and Prayitno, 1993). 4. Сообщалось также об использовании эвгенола в качестве природного фунгицида для подавления болезни (Sukamto et al., 1996; Tombe et al., 1997). Измельченные листья и цветочные бутоны гвоздики рассыпали вокруг основания стеблей ванили или смешивали с почвенным субстратом в питомнике. Эвгенол (примерно 10–20% активного ингредиента) также можно вносить путем опрыскивания или погружения стеблей перед посадкой. 5. Применение синтетических фунгицидов, таких как карбендазим, манкозеб и беномил, особенно в сочетании с вышеуказанными мерами.Фитофторозная гниль побегов и стручков
Это заболевание было зарегистрировано в нескольких регионах мира, производящих ваниль, включая Индонезию, Мадагаскар, Пуэрто-Рико, Полинезию, но, как правило, не столь значимо, как фузариозная гниль и антракноз. Однако, в Полинезии гниль побегов представляет серьезную угрозу производству ванили, вызывая гибель проростков (Tsao and Mu, 1987). В Индонезии фитофторозная гниль побегов и ванили встречается в питомниках и плантациях на Бали, Суматре и Яве (Manohara, 1993), но это заболевание не стало серьезной проблемой.Симптомы и повреждения
Пораженные побеги становятся светло-желтовато-коричневыми и на более поздних стадиях полностью некротизируются (рис. 8.4c). В Индонезии болезненные поражения обычно ограничиваются молодыми частями, не прогрессируя до более старых междоузлий. Больные молодые побеги часто отмирают и опадают, после чего более старые части часто заражаются фузариозной гнилью, которая вызывает серьезные повреждения (Manohara, 1993). На побеге фитофторозная гниль обычно придаёт желтовато-коричневый цвет пораженным тканям, тогда как фузариозная гниль чаще имеет темно-коричневый цвет (Taufik and Manohara, 1998). На стручке фитофторозная гниль развивается с кончика, образуя пропитанное водой поражение, которое медленно расширяется к цветоножке, становясь более темно-зеленым. Возможный некроз распространяется на всю кисть стручков, иногда демонстрируя обильный внешний рост мицелия (Anandaraj et al., 2005). В Индии и Индонезии эта болезнь растений ванили чаще встречается в сезон дождей (Rachmadiono et al., 1982; Manohara, 1993; Bhai and Thomas, 2000).Возбудитель
Сообщается, что растения ванили поражают три вида Phytophthora, а именно, Phytophthora palmivora в Полинезии (Tsao and Mu, 1987) и Таиланде (Sangchote et al., 2004), Phytophthora capsici в Индонезии (Andriyani et al., 2008) и Phytophthora meadii в Индии (Bhai, Thomas, 2000). Морфологические характеристики P. capsici из ванили в Индонезии включают наличие спорангиев, сформированных симподиально, которые различаются по форме от яйцевидной до овальной (рис. 8.5a и b), длиной 35–125 мкм и шириной 17–58 мкм, на конце отчетливо сосочковатые. Хламидоспоры также присутствуют и образуются в середине гифы (рис. 8.5c). Морфология колоний варьирует, и вегетативный рост (рис. 8.5d) наблюдается в оптимальном диапазоне температур 25–35°C (Andriyani et al., 2008). Изоляты, обнаруженные в Индонезии, являются гетероталлическими и принадлежат к типу спаривания А1. Ооспоры образуются в оогониях с амфигенными антеридиями. Три вида Phytophthora на ванили, о которых сообщается, легче всего отличить друг от друга по длине спорангиальной ножки: P. capsici с самой длинной ножкой (10–200 мкм) (рис. 8.5a), P. meadii средней длины (10–20 мкм).) и P. palmivora самая короткая (<5 мкм) (рис. 8.5b) (Tsao, Mu, 1987; Erwin, Ribeiro, 1996). Необходимы дальнейшие исследования этиологии этого заболевания по причине систематической путаницы этого рода, основанной исключительно на морфологии.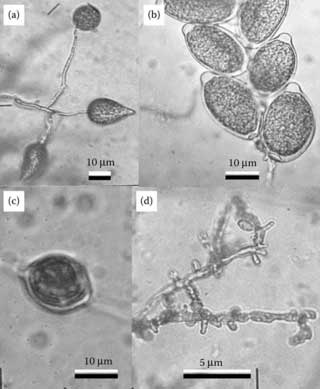 РИСУНОК 8.5. Морфология изолятов Phytophthora: (a) Спорангиальная структура длинного ветвления P. capsici; (б) спорангиальная структура с коротким ветвлением P. palmivora; (c) хламидоспора; и (d) мицелий P. capsici, образовавшийся на соковом агаре V8. (Из Andriyani, N. et al. Jurnal Biologi Indonesia, 5, 227–234, 2008. С разрешения.)
РИСУНОК 8.5. Морфология изолятов Phytophthora: (a) Спорангиальная структура длинного ветвления P. capsici; (б) спорангиальная структура с коротким ветвлением P. palmivora; (c) хламидоспора; и (d) мицелий P. capsici, образовавшийся на соковом агаре V8. (Из Andriyani, N. et al. Jurnal Biologi Indonesia, 5, 227–234, 2008. С разрешения.)
Меры контроля
Различные рекомендации по борьбе с фитофторозом побегов и стручковой гнилью ванили включают фитосанитарию (удаление инфицированных частей растений, соблюдение правил сельскохозяйственной гигиены и т. д.), контроль влажности, путем обрезки теневых деревьев, применение ботанических фунгицидов, таких как эвгенол (Tombe et al. al., 1993; Andriyani et al., 2008) и использование фосфонатных соединений – системных фунгицидов, эффективных против широкого спектра заболеваний растений, вызываемых многими видами Phytophthora (Drenth and Guest, 2004).Заключительные замечания
Сообщается о других незначительных грибковых заболеваниях ванили в различных регионах выращивания, но они плохо документированы, не подтверждены или регистрируются только в единичных случаях. Некоторые из этих болезней включают сухую гниль (вызываемую Rhizoctonia sp.) (Anandaraj et al., 2001), коричневую гниль (вызываемую Cylindrocladium quinqueseptatum) (Bhai and Anandaraj, 2006), ванильную ржавчину (вызываемую Puccinia sp. и Uredo scabies) (Correll, 1953; Augstburger et al., 2000), и другие болезни листьев, вызываемые Vermicularia vanillae, Guignardia traverse, Macrophoma vanillae, Pestalospora vanillae и Physalospora vanillae (Correll, 1953). Отчеты о болезнях ванили часто ограничиваются местными научными журналами и расширенными отчетами, которые трудно получить на международном уровне. Грибковые заболевания ванили, как правило, недостаточно изучены. Требуется большая работа для понимания биологии, распространённости, структуры и распространения патогенов, а также для управления этими заболеваниями.Глава 9. Биоэкология и борьба с появившимся вредителем ванили, червецом Conchaspis angraeci
Через несколько лет после регистрации на острове Реюньон, французском острове в юго-западной части Индийского океана, червец Conchaspis angraeci Cockerell, 1893 стал вызывать все большую озабоченность у производителей ванили на этом острове из-за ущерба нанесенного этой культуре. Поглощая сок растений-хозяев, этот бронированный червец сначала приводит к образованию хлоротичных пятен на листьях, затем к высыханию листа и, в конечном итоге, в крайних случаях, к гибели самой лианы. Поскольку в последние годы этот вредный организм получил широкое географическое распространение, мы рассматриваем его таксономическое положение, биологию, экологию, естественных врагов и меры борьбы.Таксономия и морфология
Ангрекумовый или ванильный червец, C. angraeci, принадлежит к семейству Conchaspididae (Hemiptera: Coccoidea), представители которого очень похожи на Diaspididae, с которыми их долгое время путали. Семейство Conchaspididae теперь рассматривается как отдельная группа в составе Coccoidea. Самки этого семейства имеют общую черту с представителями семейства Diaspididae – они строят панцирь, независимый от остальной части тела насекомого, а их последние брюшные сегменты сливаются, образуя пигидий, который участвует в секреции панциря. Род Conchaspis насчитывает 22 вида (BenDov, 1981). Одной из основных морфологических характеристик самок C. angraeci является внешний вид панциря – округлой и конической формы. Конус имеет 6–8 гребней, расходящихся от вершины, но не доходящих до края (Hamon, 1979). Панцирь обычно белый, но в некоторых случаях может выглядеть сероватым или желтоватым.Географическое распределение
Этот вид, распространенный в тропических и субтропических районах, впервые описан с Ямайки (Cockerell, 1893). Долгое время распространение в основном ограничивалось Неарктическим и Неотропическим регионами, когда он был известен в Мексике, США, на Бермудских островах, Барбадосе, Кубе, в Бразилии, Эквадоре, Никарагуа, Панаме, Перу, Пуэрто-Рико, Суринаме, Тринидаде и Тобаго, и Венесуэле (BenDov, 1981). Лишь в 1973 году был зарегистрирован в Афротропическом регионе, в Анголе и Камеруне, на Acalypha spp. (BenDov, 1974). С тех пор он обнаружен на Гавайях (Beardsley, 1993), в Австралии (BenDov et al., 1985), на островах Фиджи (Williams and Watson, 1990), в Малайзии (Takagi, 1992, 1997) и во Французской Полинезии (Quilici, 2002). В юго-западной части Индийского океана впервые зарегистрирован на острове Реюньон в 1997 году (Richard et al., 2003), затем на Майотте, французском острове, принадлежащем архипелагу Коморские Острова (Richard, 2003), и совсем недавно на Маврикии в 2007 году (S. Quilici и J.C. Streito, неопубликованные данные).Растения-хозяева
Вид описан на собранном материале Angraecum eburneum Bory var. virens (Orchidaceae) (Cockerell, 1893), но выглядит многоядным и встречается на многочисленных растениях-хозяевах, принадлежащих к различным семействам, среди которых наиболее распространены Euphorbiaceae и Orchidaceae (BenDov, 1981; Hamon, 1979; Mamet, 1954). Во Флориде его растения-хозяева имеют широкий ареал и включают около 30 видов древесных растений и орхидей, таких как Plumeria sp. (Apocynaceae), Stephanotis sp. (Asclepiadaceae), Rhododendron sp. (Ericaceae), Acalypha wilkesiana Müll., Codiaeum variegatum (L.), Euphorbia lactea Haw. «cristata» (Euphorbiaceae), Flacourtia indica (Burm. F.) Merrill (Flacourtiaceae), Hibiscus rosa-sinensis L. (Malvaceae), Ficus sagitata Vahl (Moraceae), Bougainvillea sp. (Nyctaginaceae), Angraecum superbum Thouars, Epidendrum secundum Jacq. (Orchidaceae), Pittosporum tobira Ait. (Pittosporaceae), Coccoloba uvifera (L.) (Polygonaceae)... (Hamon, 1979). На острове Реюньон, помимо ванили, он был также обнаружен на экзотической лиане, принадлежащей к семейству Asclepiadaceae: Hoya bella Hooker (Richard et al., 2003), на Angraecum eburneum Bory и Bulbophyllum prismaticum Thouars (Orchidaceae). На Маврикии очень большие популяции наблюдались на Euphorbia lactea Haw. (S. Quilici, неопубликованные данные). На ванили он отмечен на Vanilla planifolia (G. Jackson) на Фиджи (Williams and Watson, 1990), на острове Реюньон (Richard et al., 2003), на Маврикии (S. Quilici, неопубликованные данные) и на Майотте (Richard, 2003). Также поражает Vanilla tahitensis J.W. Moore во Французской Полинезии и на Маврикии (M. Grisoni, личн. комм.). На острове Майотта встречается также на Vanilla humblotii Rchb. Ф. (R. Gigant, личное сообщение).Симптомы и повреждения
На культуре ванили, у которой червец вызывает повреждение, он эвримерен и может развиваться на листьях, стеблях, воздушных корнях или стручках (Richard et al., 2003). С помощью присасывающего ротового аппарата червец, вероятно, вводит токсин через листья или стебли, в результате чего образуются хлоротичные пятна, переходящие в некроз и ведущие к ослаблению лианы и, в конечном итоге, к её гибели (рис. 9.1). Во Флориде было отмечено, что повреждения, приводящие к ослаблению растений, являются серьезными. РИСУНОК 9.1. Повреждения, вызванные ангрековым червецом: (а) на растении ванили; (b) детализация повреждения на листе ванили.
РИСУНОК 9.1. Повреждения, вызванные ангрековым червецом: (а) на растении ванили; (b) детализация повреждения на листе ванили.
На острове Реюньон, хотя не проводилось никаких точных экономических исследований для оценки ущерба, нанесенного этим червецом, многие производители утверждают, что они наблюдали снижение своего урожая в течение нескольких лет после его появления (Richard et al., 2003). Обследование, проведенное в 2002 г., показало сильное заражение участков ванили в восточной части острова, а в 2003 г. червец расширил ареал своего распространения и нанес ущерб до юго-восточной части. На архипелаге Коморские острова червец был обнаружен в 1999 г. на французском острове Майотта, где быстро распространился. Исследование, проведенное в 2007 году, показало высокий уровень заражения: на определенных участках было поражено до 50% лиан, в то время как червец не был обнаружен на Гранд-Коморе и Мохели, принадлежащих Исламской Республике Коморские острова (Grisoni and Abdoul-Karime, 2007). На Маврикии в 2007 году был отмечен ограниченный ущерб в коммерческих теневых домах на севере острова (Grisoni, 2007). Во Французской Полинезии ущерб, наблюдаемый в 2002 г., по-видимому, был ограничен локальными вспышками на нескольких плантациях в Муреа и Тахаа (M. Grisoni, личная переписка). Хотя обширные исследования проводились с 1998 г. в основных районах выращивания ванили на Мадагаскаре, о C. angraeci в этой стране не сообщалось (Alabouvette and Grisoni, 2009).
Жизненные особенности и экология
Данные о биологии этого вида вредителей немногочисленны. Такаги (Takagi, 1992) показал, что самки рода Conchaspis имеют только три возраста (L1, L2 и взрослый), в то время как самцы имеют пять возрастов (L1 подвижный, затем фиксированный, L2, предкуколка, куколка и взрослая особь). У C. angraeci самцы неизвестны, и этот вид, вероятно, размножается в основном путем партеногенеза. Самка откладывает под панцирем максимум 80 яиц (рис. 9.2). После вылупления подвижная личинка первого возраста (L1), которая является единственной подвижной личинкой, быстро выбирается из оболочки. После мобильной фазы L1 оседает и начинает секретировать собственную броню. После некоторого роста она трансформируется в L2, которая превращается во взрослую самку в конце периода предшествующего яйцекладке и начинает откладывать яйца. Во время испытаний по выращиванию молодых лиан ванили продолжительность преимагинального цикла оказалась большой (90 дней при T = 25°C; RH = 70%; фотопериод: L12:D12). РИСУНОК 9.2. Conchaspis angraeci разных возрастов: (а) взрослая самка; (b) самка с удаленной броней, на которой видны яйца; (c) первая возрастная стадия (L1), вторая возрастная стадия (L2) и взрослая самка.
РИСУНОК 9.2. Conchaspis angraeci разных возрастов: (а) взрослая самка; (b) самка с удаленной броней, на которой видны яйца; (c) первая возрастная стадия (L1), вторая возрастная стадия (L2) и взрослая самка.
На острове Реюньон, несмотря на то, что посадки ванили расположены в восточной, юго-восточной и южной частях острова, исследования, проведенные в 2001–2003 годах, показали, что этот вид более распространен в восточных и юго-восточных районах, которые также являются районами с большим количеством осадков. Исследование, проведенное на четырех делянках ванили в 2002–2003 гг. показало, что личиночные стадии (L1 и L2) были более многочисленными в теплое время года (с декабря по апрель). Взрослая стадия преобладала по сравнению с другими стадиями, независимо от культурного режима (интенсивная культура, посадки с сахарным тростником, под деревьями, в теневом доме) или сезона.
Природные враги
Записи о естественных врагах этого червеца недавние. Первый паразитоид был зарегистрирован на Гавайях Бердсли и Цуда (Beardsley and Tsuda, 1990), которые упоминают, что примерно через десять лет после своего появления в 1980 году червецы были сильно паразитированы афелидой Marietta pulchella Howard, личинки которой развиваются так же, как Aphytis spp. на щитовках. Хотя виды рода Marietta чаще всего являются гиперпаразитоидами, авторы показали, что M. pulchella в этом случае действительно развивается как первичный паразитоид, что является первым свидетельством для вида в роде. На острове Реюньон были обнаружены три вида паразитоидов, связанных с популяциями червеца: один эндопаразитоид, Encarsia lounsbury Berlese и Paoli (Aphelinidae), и два эктопаразитоида: Aphytis africanus Quednau (Aphelinidae) и Cephaleta sp. (Pteromalidae). В то время как первые два вида поражают L1 и L2, третий паразитирует на взрослых самках (Richard et al., 2003). В глобальном масштабе, среди изученных биотопов, уровень паразитизма оставался очень низким и зарегистрированные паразитоиды, вероятно, не являются специфичными для ванильного червеца. На острове Реюньон несколько хищных видов, в основном трипсы и клещи, также связаны с высокой численностью этого червеца. Среди пяти найденных видов трипсов три известны как пожиратели червецов: Aleurodothrips fasciapennis (Franklin), Karnyothrips flavipes (Jones) и Karnyothrips melaleucus (Bagnall), принадлежащие к Phlaeothripinae. Среди клещей были собраны два вида, которые, как известно, питаются яйцами или подвижными молодыми насекомыми-щитовками: Saniosulus nudus Summers (Eupalopsellidae) и Bdella independenta Baker and Balock (Bdellidae). Были собраны и другие виды, имеющие хищные повадки: Cheletogenes sp. и Hemicheyletia wellsi (Baker) (Cheyletidae), Bdellodes sp. и Spinibedella depressa (Ewing) (Bdellidae) и Asca sp. (Ascidae). На Гавайях хищный клещ Cheletogenes ornatus (Canestrini и Fanzago) также был обнаружен, охотящимся на C. angraeci на гибискусе-хозяине (Goff and Conant, 1985). На острове Реюньон был зарегистрирован энтомопатогенный гриб Fusarium coccidicola P. Henn, который является одним из четырех известных видов Fusarium, патогенных для щитовок (Richard et al., 2003). В глобальном масштабе уровень хищничества оказался низким (2,5–6,5%), причем более высокий уровень наблюдался на участках, расположенных под покровом леса.Методы контроля
На Гавайях биологический контроль решил проблемы, связанные с сильным заражением C. angraeci. Вскоре после открытия в 1989 г. Aphelinidae Marietta pulchella полностью контролировала червецов, которые сейчас считаются редкими (Beardsley, 1993). Имеется очень мало данных о результатах испытаний химического средств против этого червеца. Эксперименты, проведенные в 2004 г. Службой защиты растений острова Реюньон, показали высокую эффективность имидаклоприда (препараты: Confidor; Bayer CropScience) и хорошую эффективность, хотя с задержкой и уступающую имидаклоприду, минерального масла (препараты: Ovipron; Cerexagri) (SPV Réunion, 2004). Необходимы дальнейшие эксперименты использования минеральных масел, с применением в разные периоды года, чтобы определить их эффективность против червеца. Поскольку мобильные возрастные группы более чувствительны к химическим средствам, такие обработки, если они не являются фитотоксичными, должны применяться предпочтительно летом, когда первая возрастная стадия более многочисленна и активна. Ванильный червец продемонстрировал, по крайней мере в некоторых областях, свою способность наносить значительный ущерб производству ванили. Несмотря на несколько исследований, посвященных этому червецу, наши знания о биоэкологии вредителя ограничены. Дополнительные исследования были бы полезны для улучшения знаний о его естественных врагах и их влиянии, а также о возможных методах борьбы.Благодарности
Авторы выражают искреннюю благодарность систематикам, идентифицировавшим паразитоидов (G. Delvare, CIRAD, Монпелье, Франция), хищных клещей (E.A. Ueckermann, PPRI, Претория, Южная Африка) и трипсов (B. Michel, CIRAD, Монпелье, Франция).Глава 10. Анатомия и биохимия развития ванильного стручка (Vanilla planifolia G. Jackson)
Введение
Плоды ванили широко известны как «стручки», поскольку они похожи по форме на плоды бобовых, которые возникли в результате эволюции одного плодолистика. Фактически, на самом деле с ботанической точки зрения, поскольку плод является результатом эволюции трех сросшихся плодолистиков, это не стручок, а коробочка (сухой, растрескивающийся плод, образовавшийся в результате эволюции нескольких плодолистиков). В семействе орхидей, которое включает род Vanilla, коробочка состоит из трех створок, ограниченных шестью расщеплениями (по два на плодолистик), расположенными по обеим сторонам семяносца (параплацентарное раскрытие, рис. 10.1a) (Dupont and Guignard, 2007). РИСУНОК 10.1. Вскрытие коробочки: (а) общий случай коробочки семейства орхидей (шесть расщеплений раскрытия, приводящие к трем створкам); (б) конкретный случай коробочки V. planifolia (два расщепления, приводящие к двум створкам).
РИСУНОК 10.1. Вскрытие коробочки: (а) общий случай коробочки семейства орхидей (шесть расщеплений раскрытия, приводящие к трем створкам); (б) конкретный случай коробочки V. planifolia (два расщепления, приводящие к двум створкам).
Члены подсемейства Vanilloideae, однако, обладают некоторыми характеристиками, которые необычны для семейства орхидей (Cameron and Chase, 2000), в том числе относящимися к раскрытию. В случае рода Vanilla коробочка имеет только два расщепления, соответствующие центральным осям двух из трех сросшихся плодолистиков. По достижении зрелости коробочка открывается по двум трещинам раскрытия (для Vanilla planifolia и Vanilla pompona), образуя тем самым две створки (рис. 10.1b); это локулицидная коробочка. Некоторые виды могут даже быть нераскрывающимися (для Vanilla tahitensis). Ванильная коробочка однокамерная (единственная центральная полость завязи, в которой находятся все семена). Позже в этой главе мы больше не будем использовать ботаническое слово «коробочка», а будем пользоваться более часто употребляемым «боб» или «стручок». Для V. planifolia G. Jackson (которая, если не указано иное, является единственным видом, упомянутым в остальной части главы), цветки сгруппированы в соцветия (рис. 10.2), которые напоминают кисть, так как нижняя завязь имитирует отсутствующую цветоножку.
 РИСУНОК 10.2. Соцветие V. planifolia. Перед опылением завязи обращены цветком вверх, а затем изгибаются вниз.
РИСУНОК 10.2. Соцветие V. planifolia. Перед опылением завязи обращены цветком вверх, а затем изгибаются вниз.
После опыления завязь развивается очень быстро, удваиваясь в длину за несколько дней и изгибаясь вниз (рис. 10.2). Оплодотворение происходит на 1,5–2 месяца позже (Childers, Cibes, 1948; Roux, 1954). Каждая оплодотворенная завязь дает стручок. Он достигает своего полного размера и веса через 10-15 недель после опыления (рис. 10.3) (Gregory et al., 1967; Brodélius, 1994; Havkin-Frenkel et al., 1999). По мере созревания стручка, содержание влаги снижается с 90–92% до 82–85% к моменту сбора урожая (Shankaracharya and Natarajan, 1973; Brodélius, 1994; Ranadive, 1994), другими словами, примерно через 8–9 месяцев после опыления (Sreekrishna Bhat, Sudharshan, 2002).
 РИСУНОК 10.3. Незрелые стручки ванили.
РИСУНОК 10.3. Незрелые стручки ванили.
Зрелые стручки длинные, зеленые и изогнутые на конце цветоноса. Их длина составляет около 15 см, ширина может достигать 15 мм, а вес – около 10–15 г. Эти цифры имеют лишь порядки величины и могут значительно различаться в зависимости от генетических факторов, физиологии растения, агрономических или экологических условий и т. д. После этого периода созревания, независимо от того, собран он или нет, плод становится бледно-зеленым и начинает желтеть от цветочного кончика. Раскрывающиеся плоды (пропорция варьируется в зависимости от вида, а также внутри одного и того же вида) расщепляются надвое от цветочного кончика. Затем стручки темнеют, некоторые очень заметно, опять же от цветочного кончика. Затем они теряют первоначальную упругость и становятся полностью гибкими, что свидетельствует об увядании плода. Похоже, что плод выделяет этилен (Ducamp et al., 2000); однако некоторые авторы не смогли измерить это во время созревания стручков (Havkin-Frenkel et al., 2005). Однако, чувствительность плода к этилену четко наблюдалась в ходе различных научных работ; в частности, этилен увеличивает скорость раскрытия стручков (Balls and Arana, 1941; Arana, 1944; Havkin-Frenkel et al., 2005). Было бы целесообразно провести некоторые углубленные исследования, чтобы определить, является ли плод климактерическим, и если да, то на какой стадии его развития происходит респираторный климактерический период. Эти данные могут быть полезны при контроле стадии сбора урожая стручков и их обработки в лучшую сторону перед вялением. Данных о составе зрелых зеленых стручков очень мало. В таблице 10.1 представлены значения, полученные Гаррос-Патином и Ханом для стручков с Мадагаскара, которые были проанализированы в 1950 году (Garros-Patin and Hahn, 1954).
ТАБЛИЦА 10.1. Типичный состав зрелой зеленой ванили
| Сырой вес % | Сухой вес % | |||
|---|---|---|---|---|
| A | B | A | B | |
| Вода 79.6 75 | ||||
| Зола | 0.75 | 0.97 | 3.68 | 3.88 |
| Целлюлоза | 0.79 | 2.65 | 3.87 | 10.60 |
| Редуцирующие сахара | 1.42 | 1.01 | 6.96 | 4.04 |
| Невосстанавливающие сахара | 3.03 | 2.45 | 14.85 | 9.72 |
| Неазотистые вещества | 10.85 | 14.41 | 53.19 | 57.7 |
| Эфирный экстракт | 1.58 | 2.14 | 7.74 | 8.56 |
| Белки | 1.75 | 1.37 | 8.58 | 5.50 |
| Кислотность | 0.23 | 1.13 | ||
Результаты анализов, проведенных CIRAD на зрелых зеленых стручках (обычное время сбора урожая) с Мадагаскара, представлены в таблице 10.2. Эти результаты не предназначены для того, чтобы быть репрезентативными для среднего состава зрелых зеленых стручков с растения ванили, но должны восприниматься только как справочные. Более того, они относительно согласуются с результатами, полученными Гаррос-Патеном и Ханом.
ТАБЛИЦА 10.2. Типичный состав зрелой зеленой ванили (нормальная стадия сбора) (г/100 г сырой массы) (г/100 г сухой массы)
| (г/100 г сырой массы) | (г/100 г сухой массы) | Процент каждого соединения по отношению к общему количеству | |||
|---|---|---|---|---|---|
| Вода | 83.0 | ||||
| Волокна | 7.6 | 45 | Лигнин 62 | Целлюлоза 27 | Гемицеллюлоза 11 |
| Сахара | 1.7 | 10 | Сахароза 80 | Глюкоза 15 | Фруктоза 5 |
| Липидыa | 2.0 | 12 | C18:2 54 | C18:1ω9 10 | C16 10 |
| Белки | 0.5 | 3 | |||
| Органические кислоты | 0.9 | 5 | Лимонная кислота 50 | Яблочная кислота 30 | |
| Минеральные элементы | 1.7 | 10 | K 28 | Ca 10 | Mg 2 |
| Глюкованилин | 1.7 | 10 | |||
Волокна (гемицеллюлоза, целлюлоза и лигнин) составляют почти 8% от сырого веса, что является высоким показателем по сравнению с фруктами и овощами (от 1 до 4%). Сахара в основном состоят из сахарозы, и их общее содержание сопоставимо с содержанием во многих овощах (<4%) и намного меньше, чем в большинстве плодов (12%). Белки присутствуют в относительно небольших количествах, которые обычно наблюдаются в большинстве плодов и овощей (<1%). Среди этих белков мы отмечаем наличие исключительно высокой активности глюкозидазы (в среднем около 1000 нкатал/г свежих плодов), тесно связанной с ароматическим развитием ванили; это будет подробно рассмотрено в конце главы. Липиды составляют 2% от сырого веса, что является высоким показателем по сравнению со многими фруктами и овощами (за исключением масличных плодов), где обычно наблюдается содержание около 0,2–0,4%. Неудивительно, что при «умерщвлении» стручков на поверхности воды появляется значительная маслянистая фаза. Однако, по этой липидной фракции было проведено большое количество исследований (Ramaroson-Raonizafinimanana et al., 1997, 1998a, 1998b, 1999, 2000; Maestro et al., 2007). Органические кислоты в основном представлены малатом и цитратом (80% всех органических кислот), и их общее содержание аналогично содержанию в слабокислых плодах и овощах. Основные минеральные элементы – калий и кальций; их соответствующее содержание (470 мг и 170 мг) является высоким по сравнению с большинством плодов и овощей. Наконец, содержание глюкованилина составляет около 1,7% от веса свежих зеленых плодов (а иногда и больше), что является действительно исключительным и характерным для V. planifolia, и является причиной её коммерческой ценности. Более подробно о глюкованилине рассказывается в заключительной части главы. Эти разные данные об основном составе зеленых плодов были в целом подтверждены в недавней публикации (Odoux and Brillouet, 2009); тем не менее, их необходимо дополнить более систематическими исследованиями, которые в настоящее время отсутствуют.
Анатомия и морфогенез стручков ванили
Морфология, анатомия и гистология зрелых стручков ванили
Часть представленной ниже информации в значительной степени взята из следующих источников: De Lanessan, 1886; Villiers et al., 1909; Swamy, 1947; Roux, 1954; Odoux et al., 2003; and French, 2005. Зрелые зеленые стручки ванили имеют примерно треугольное поперечное сечение с центральной полостью, содержащей множество черных семян (рис. 10.4). С анатомической и гистологической точки зрения, от внешней к внутренней части плода мы находим экзокарп, мезокарп и эндокарп (рис. 10.5d). РИСУНОК 10.4. Поперечный разрез зрелых стручков ванили.
РИСУНОК 10.4. Поперечный разрез зрелых стручков ванили.
 РИСУНОК 10.5. От цветка к зрелой ванили. Поперечные срезы (3 мкм) стручка ванили, залитого в смолу Technovit 7100, на разных стадиях после окрашивания периодической кислотой Шиффа (ПКШ)–нафтоловый сине-черный: (а) через 9 дней после опыления (дпо); (b) 14 дпо; (c) 60 дпо; (d) через 8 месяцев после опыления. (Данные из Odoux et al., 2003. Annals of Botany 92: 437–444). Стенки и запасные сахара окрашены в розовый цвет; белки синего цвета. en – эндокарп; ep – экзокарп; fu – семяножка; me – мезокарп; pl – семяносец; s – семя; vb – сосудистый пучок.
РИСУНОК 10.5. От цветка к зрелой ванили. Поперечные срезы (3 мкм) стручка ванили, залитого в смолу Technovit 7100, на разных стадиях после окрашивания периодической кислотой Шиффа (ПКШ)–нафтоловый сине-черный: (а) через 9 дней после опыления (дпо); (b) 14 дпо; (c) 60 дпо; (d) через 8 месяцев после опыления. (Данные из Odoux et al., 2003. Annals of Botany 92: 437–444). Стенки и запасные сахара окрашены в розовый цвет; белки синего цвета. en – эндокарп; ep – экзокарп; fu – семяножка; me – мезокарп; pl – семяносец; s – семя; vb – сосудистый пучок.
Экзокарп состоит из слоя смежных клеток, которые различаются по длине, имеют многоугольную форму и проходят параллельно длинной оси стручка. Эти толстостенные клетки, окрашенные в интенсивный розовый цвет реактивом Шиффа (рис. 10.5d) из-за их биохимического состава (целлюлоза, гемицеллюлозы и пектиновые вещества), дифференцируются в толстую кутикулу на внешней стороне плода. Слой клеток, образующий экзокарп, обеспечивает стручку защитный слой. Мезокарп составляет большую часть объема плода (рис. 10.5d) и состоит из клеток паренхимы. Он слагается из вакуолизированных клеток, которые увеличиваются в размере от экзокарпа или эндокарпа к центральной части мезокарпа, где их размер может достигать 300 мкм. Такое значительное увеличение размера, по-видимому, сопровождается увеличением плоидности за счет эндорепликации (S. Brown, личная переписка). Мезокарп васкуляризован. Имеются три группы из трех сосудистых пучков, образующих треугольник (рис. 10.5d). Они отмечают центр каждого плодолистика и с эволюционной точки зрения представляют собой главный сосудистый пучок макрофиллы. Среди этих треугольно расположенных групп пучков мы отмечаем наличие трех дополнительных сосудистых пучков, расположенных в центре мезокарпа, на полпути между экзокарпом и эндокарпом. Сосудистые пучки стручка имеют закрытый коллатеральный тип, как и у большинства однодольных. Внутри мезокарпа, в двух из трех групп в три сосудистых пучка, на поперечных гистологических срезах стручка можно наблюдать радиальный слой специализированных клеток (рис. 10.5а). Клетки, составляющие этот слой, расположены вдоль луча стручка и содержат запасы углеводов в виде гранул крахмала. Эти два слоя, которые расходятся от внутренней к внешней части мезокарпа, отмечают расположение двух будущих линий расщепления (рис. 10.5a). Эндокарп состоит из одного или двух слоев мелких клеток, которые покрывают внутреннюю часть полости плода (рис. 10.5c). В центре плодолистика находятся специализированные клетки – сосочки. Сосочки интенсивно окрашиваются реактивом Шиффа (рис. 10.5d). В соответствии с предыдущими наблюдениями (De Lanessan, 1886) сосочки также сильно окрашиваются нильским красным (рис. 10.6), что указывает на высокую концентрацию запасных липидов. Некоторое количество белкового материала, окрашенного в зеленовато-голубой цвет с помощью нафтолового сине-черного, можно увидеть в сосочках и в центральной полости в непосредственной близости от апикальных концов сосочков (Рисунки 10.5c и d).
 РИСУНОК 10.6. Визуализация накопления липидов в сосочках зрелых стручков ванили после окрашивания нильским красным (визуализация с помощью конфокального микроскопа Zeiss 510 Meta, лазер 488 нм и 405 нм; желтый – окрашивание нильским красным, синий – автофлуоресценция стенок и сосочков).
РИСУНОК 10.6. Визуализация накопления липидов в сосочках зрелых стручков ванили после окрашивания нильским красным (визуализация с помощью конфокального микроскопа Zeiss 510 Meta, лазер 488 нм и 405 нм; желтый – окрашивание нильским красным, синий – автофлуоресценция стенок и сосочков).
Каждая сторона стручка несет семяносец, состоящий из четырех-пяти слоев паренхимных клеток и покрытый эпидермисом. Семяносец разделен на две продольные пластинчатые семяножки, состоящие из трех или четырех слоев клеток (рис. 10.5b), к которым прикреплены семена. На поперечном срезе каждая пара пластинок семяносца выглядит как лопасти в форме пальцев, согнутые внутри центральной полости (рис. 10.5d). В клетках эпидермиса пластинок семяносца содержатся многочисленные липидные везикулы, как в сосочках. При созревании в полости плода появляются многочисленные мелкие семена (в среднем 0,2 мкм) продолговатой формы с темно-окрашенным интегументом. Каждое семя прикреплено к длинной узкой семяножке. Семена содержатся в слизи, которая, как было обнаружено, по по существу своей природы является полисахаридной (Odoux and Brillouet, 2009). Остатки этой слизи, окрашенные в светло-розовый цвет, показаны на рис. 10.5d вокруг отверстий, ранее занятых семенами.
Онтогенез ванильных стручков: от цветка к зрелому стручку
Цветки ванили, группами по 10-15 штук, образуют небольшие кисти в пазухе листа. Белые, зеленоватые или бледно-желтые по цвету, они имеют типичную структуру цветков орхидей, наиболее развитых из всех цветов в царстве растений. Околоцветник этих цветов состоит из трех чашелистиков и трех лепестков. Самый нижний лепесток цветка – губа, обычно большой, со шпорами. Под околоцветником находится очень длинная завязь, которая заканчивается короткой цветоножкой, прикрепляющей цветок к оси соцветия (рис. 10.2). До опыления ванильная завязь еще далеко не полностью развита. После опыления – естественные опылители не очень хорошо известны (Lubinsky et al., 2006) – околоцветник увядает и отваливается (рис. 10.2), в то время как стенка нижней завязи постепенно разрастается, образуя околоплодник (коробочку) плода, а семяпочки внутри полости завязи превращаются в семена. Первым признаком того, что завязь развивается в плод, является резкое и быстрое увеличение её размера. С анатомической и гистоцитологической точки зрения наиболее впечатляющие изменения касаются внутренней части завязи. После оплодотворения можно наблюдать поляризованное удлинение клеток эндокарпия по направлению к полости завязи. Эти клетки разовьются в секреторные трихомы – сосочки. Через 9 или 14 дней после опыления сосочки остаются недифференцированными (рис. 10.5a и b). На этом этапе верхняя часть центральной полости опыленной завязи содержит ткань, состоящую из дегенеративных клеток, глубоко окрашиваемых в розовый цвет реагентом Шиффа (рис. 10.5b). Эта ткань может соответствовать тканям, названными Арбером (1937) «передающими тканями», паренхима обеспечивающая питательный субстрат, помогающий пыльцевой трубке прорастать через стиль и внутри полости завязи (рис. 10.5a и b). Зона дифференциации сосочков не сплошная; она расположен в центре листа плодолистика, в зоне околоплодника, под тремя треугольно-расположенными сосудистыми пучками (рис. 10.5b). Через два месяца после опыления клетки сосочка начинают свое удлинение и дифференцировку. На этом этапе их длина может достигать 20 мкм (рис. 10.5в). В зрелом состоянии сосочки имеют длину около 200 мкм (рис. 10.5d). Под ультрафиолетовым светом сосочки автофлуоресцируют белым цветом (рис. 10.7а). Клеточная стенка зрелых сосочков, которая неравномерно утолщается, подвергается лизису на её дистальном конце, облегчая секрецию содержимого в полость коробочки (рис. 10.5d). РИСУНОК 10.7. Свежие поперечные срезы (100 мкм) зрелых стручков ванили (через 8 месяцев после опыления), наблюдаемые с помощью эпифлуоресцентного микроскопа (Leica DM6000, фильтр A: возбуждение 340–380 нм, излучение 425–800). а) общий вид семяносца и сосочков; (b) семяножка, семена и «матрикс» с увеличением. en – эндокарп; fu – семяножка; pl – семяносец; vb – сосудистый пучок.
РИСУНОК 10.7. Свежие поперечные срезы (100 мкм) зрелых стручков ванили (через 8 месяцев после опыления), наблюдаемые с помощью эпифлуоресцентного микроскопа (Leica DM6000, фильтр A: возбуждение 340–380 нм, излучение 425–800). а) общий вид семяносца и сосочков; (b) семяножка, семена и «матрикс» с увеличением. en – эндокарп; fu – семяножка; pl – семяносец; vb – сосудистый пучок.
Также можно наблюдать белое флуоресцентное вещество (рис. 10.7b и 10.8), которое окружает семена и частично заполняет полость стручков. Это вещество, названное Френчем (French, 2005) «матриксом», не имеет клеточного происхождения (то есть, конечности семяножек), а скорее аморфно и отличается от полисахаридной слизи.
 РИСУНОК 10.8. Продольный вид зрелого стручка, вскрытого лезвием бритвы в одном из трех углов (в области сосочков), наблюдаемый с помощью стереомикроскопа Zeiss Lumar V12 [белая флуоресценция стенок (в мезокарпе), сосочков и «матрикса» = автофлуоресценция с УФ-возбуждением].
РИСУНОК 10.8. Продольный вид зрелого стручка, вскрытого лезвием бритвы в одном из трех углов (в области сосочков), наблюдаемый с помощью стереомикроскопа Zeiss Lumar V12 [белая флуоресценция стенок (в мезокарпе), сосочков и «матрикса» = автофлуоресценция с УФ-возбуждением].
Семяносцы (особенно край пластинки семяносца и семяножек) также автофлюоресцируют (золотисто-желтая флуоресценция, рис. 10.7a и b). В мезокарпе можно наблюдать белые флуоресцентные глобулы, которые могут соответствовать полифенолам. Одревесневшие ткани сосудистых пучков (волокна ксилемы и склеренхимы) излучают синеватую автофлуоресценцию, связанную с лигнином, содержащимся в их стенках (рис. 10.7а).
Онтогенез семяпочки: от семяпочки к семени
У растений ванили существует значительный интервал между микроспорогенезом, в результате которого образуется пыльца, и макроспорогенезом, который приводит к образованию зародышевого мешка. Удивительно, но дифференциация семяпочек на верхушке семяносцев происходит в основном после опыления. Через два дня после опыления семяпочки остаются недифференцированными (рис. 10.9 а). Пластинки семяносцев разветвляются на большое количество семяножек, которые составляют семяносцы (рис. 10.9 а). Они состоят из четырех слоев клеток, которые постепенно вакуолизируются от основания (со стороны пластинки семяносца) к вершине. Конец каждого семяносца содержит группу меристематических клеток (активно делящихся клеток, имеющих плотную цитоплазму с центральным ядром) (рис. 10.9 а). Именно этот меристематический кончик обеспечивает рост семяносца, а затем смещение семяпочек в конечное положение. Это становится ясно через 15 дней после опыления (рис. 10.9 б). Внешний интегумент и внутренний интегумент семяпочки дифференцируются почти одновременно с индивидуализацией материнской клетки споры, которая претерпевает мейоз (рис. 10.9 б). Наружный интегумент состоит из четырех слоев клеток и до восьми в его основании. Эта характеристика отличается от других орхидей, внутренний интегумент которых состоит из одного слоя клеток. Внутренний интегумент и внешний интегумент семяпочки не слившиеся, и между ними есть промежуток. Нуцеллус демонстрирует значительное значительно развитие по сравнению с другими орхидеями – он сохраняется в виде нескольких клеток в основании семян, когда они рассеиваются. Чаще всего у орхидей развитие эндосперма ограничивается в среднем 10 ядрами (максимум 12). Этот эндосперм быстро усваивается, начиная с первых делений зиготы. В отличие от эндосперма, ядрышко сохраняется до конца развития зародыша, особенно в халазе, когда семя созревает. Зигота окружена утолщенной внешней клеточной стенкой и имеет центральное звездообразное ядро с единственным ядрышком, окрашиваемым в черный цвет нафтоловым сине-черным (рис. 10.9 в). Зародыш, который прекращает развиваться очень рано (сразу после глобулярной стадии, но до стадии торпедо), накапливает запасы липидов и белков в виде алейроновых зерен, которые интенсивно окрашиваются в черный цвет нафтоловым сине-черным (рис. 10.9 d). РИСУНОК 10.9. От семяпочки до семени: поперечные срезы (3 мкм) стручков ванили на разных стадиях развития, залитые в смолу Technovit 7100 после окрашивания ПКШ-нафтоловый сине-черный. (а) 2 дпо; (б) 15 дпо; (c) 20 дпо; (г) 200 дпо. Стенки и запасные сахара окрашены в розовый цвет, белки – в синий. fu – семяножка, pl – семяносец.
РИСУНОК 10.9. От семяпочки до семени: поперечные срезы (3 мкм) стручков ванили на разных стадиях развития, залитые в смолу Technovit 7100 после окрашивания ПКШ-нафтоловый сине-черный. (а) 2 дпо; (б) 15 дпо; (c) 20 дпо; (г) 200 дпо. Стенки и запасные сахара окрашены в розовый цвет, белки – в синий. fu – семяножка, pl – семяносец.
Оболочка семян ванили – результат эволюции внешнего и внутреннего интегументов семяпочки. Самый внешний слой клеток в наружном интегументе семяпочки уплотняется (рис. 10.9d). После оплодотворения эти клетки подвергаются поляризованному удлинению по перпендикулярной оси на поверхности семяпочки. Они накапливают коричневые соединения вдоль своих стенок, которые постепенно делают их непрозрачными и придают семенной оболочке сетчатую орнаментацию. Это изменение отличается от обычно наблюдаемого у других орхидей, у которых семенная оболочка более тонкая и полупрозрачная.
Метаболизм β-глюкозидазы и глюкованилина в стручках ванили
Как отмечалось во введении, одной из наиболее важных характеристик V. planifolia является исключительно высокая активность глюкозидазы и содержание глюкозилированного предшественника (особенно содержание глюкованилина). Поскольку ароматические качества ванили тесно связаны с гидролизом этих глюкозилированных предшественников β-глюкозидазой(ами), присутствующей в стручках (см. также главы 11 и 12), были проведены различные исследования для определения мест их накопления и биосинтеза в плодах.Тканевая и клеточная локализация активности глюкозидазы и глюкованилина в зрелых стручках ванили
В конечном счете, было проведено очень мало исследований попытавшихся определить части плодов, содержщие предшественники глюкозидов, ароматических компонентов и активности глюкозидазы. Тем не менее, очень давно, Де Ланессан выдвинул в неявном виде гипотезу о том, что предшественники аромата и активность глюкозидазы происходят в центральной области семяносца, поскольку заметил, что только эта часть плода имеет характерный запах после того, как стручок нарезан тонкими продольными ломтиками от внешней части к внутренней (De Lanessan, 1886). Однако, Арана и Джонс с Висенте обнаружили, что большая часть глюкованилина (60–80%) присутствовала в мясистой части стручков (внешний мезокарп), а остальное – во внутреннем семяносце, тогда как ферментативная активность проявляется исключительно во внешней части стручка (Arana, 1943; Jones and Vicente, 1949) (рис. 10.10a). Арана делает заключение, что глюкованилин из внутренней части плода должен распространиться во внешнюю часть, где находится фермент, или наоборот, чтобы подвергнуться гидролизу во время обработки ванили или когда плод созревает на лиане. Эту гипотезу поддерживают все авторы, опубликовавшие работы о ванили за последние 60 лет. РИСУНОК 10.10. Тканевая локализация активности глюкованилина и β-глюкозидазы в стручках ванили согласно (а) Arana, 1943 и Jones and Vicente, 1949, (b) Odoux et al., 2003, (c) Joel et al., 2003 и Havkin-Frenkel et al., 2005. (Данные из Odoux, E., Fruits. 61, 171–184, 2006.)
РИСУНОК 10.10. Тканевая локализация активности глюкованилина и β-глюкозидазы в стручках ванили согласно (а) Arana, 1943 и Jones and Vicente, 1949, (b) Odoux et al., 2003, (c) Joel et al., 2003 и Havkin-Frenkel et al., 2005. (Данные из Odoux, E., Fruits. 61, 171–184, 2006.)
С другой стороны, было показано (Odoux et al., 2003), что глюкованилин обнаруживался только во внутренней части плода и, в основном, присутствовал в семяносце и, в меньшей степени, в сосочках (рис. 10.10b). В более подробном исследовании (Odoux и Brillouet, 2009) оказалось, что, с учетом массового соотношения различных тканей и соответствующего содержания, глюкованилина в семяносце 92,2%, по сравнению с 7% в сосочках и 0,8% в мезокарпе. Глюкованилина не нашлось во внутриполостном пространстве вокруг семян, за исключением следов (которые могли быть артефактами). Эти же авторы (Odoux et al., 2003) обнаружили, что активность глюкозидазы была намного выше в семяносце, чем в мезокарпе или сосочках (выраженная как общая активность на единицу массы свежей ткани). Распределение активности β-глюкозидазы, выраженное в процентах от максимального значения, оказалось следующим (Odoux and Havkin-Frenkel, 2005): 11% в мезокарпе, 100% в семяносце и 20% в сосочках (рис. 10.10b). Другими словами, существует почти идеальная суперпозиция между распределением глюкованилина и ферментативной активностью. В результате ферменту и глюкованилину не нужно распространяться в тканях плода для возникновения гидролиза (см. также главу 11). Другие исследования (Joel et al., 2003; Havkin-Frenkel et al., 2005) подтвердили, что глюкованилин присутствует в светлой, внутренней части плода (в семяносце и сосочках). Они также предположили присутствие глюкованилина во внутриполостном пространстве (рис. 10.10c) – результат, получен при окрашивании катехином-HCl, после его биосинтеза (см. ниже) и выведения сосочками. Однако, было найдено уменьшение градиента ферментативной активности (выраженной как удельная активность) от внешней части к внутренней области семяносца (Havkin-Frenkel et al. 2005). Распределение активности β-глюкозидазы, выраженное в процентах от максимального значения, было следующим (Odoux and Havkin-Frenkel, 2005): 100% в зеленой внешней ткани плода, 43% в ткани семяносца и 15% в в волосовидных клетках (рис. 10.10c). Эти результаты, которые диаметрально противоположны результатам Арана (Arana, 1943), также пришли к выводу, что глюкованилин или фермент должны распространяться через ткани стручка для его полного гидролиза. Важно отметить, что результаты относительно тканевой локализации ферментативной активности (Havkin-Frenkel et al., 2005; и Odoux et al., 2003) не обязательно противоречат друг другу. Действительно, удельная активность – это соотношение между общей активностью и содержанием белка, и это содержание белка намного выше в семяносцах, чем в мезокарпе (Odoux and Brillouet, 2009). В таком исследовании, выражать ферментативную активность как удельную активность (Havkin-Frenkel et al., 2005) – бесполезно и может привести к неправильной интерпретации. На клеточном уровне активность глюкозидазы локализована в цитоплазме или апоплазме (рис. 10.11). Однако, она не является ни вакуолярной, ни париетальной (Odoux et al., 2003). Глюкованилин не присутствовал, но различные соображения (концентрация обычно около 300 мМ и объемные соотношения клеточных компартментов) предполагают, что он может присутствовать в вакуоли (рис. 10.11), которая является предпочтительным компартментом для хранения вторичных метаболитов (Boudet et al., 1984; Wink, 1997; Beckman, 2000; Bartholomew et al., 2002). Предполагается, что он также может присутствовать во внеклеточной области вокруг семян (Joel et al., 2003), но полученные результаты (Odoux и Brillouet, 2009), противоречат этой гипотезе.
 РИСУНОК 10.11. Клеточная локализация активности глюкованилина и β-глюкозидазы согласно Odoux et al., 2003.
РИСУНОК 10.11. Клеточная локализация активности глюкованилина и β-глюкозидазы согласно Odoux et al., 2003.
Несмотря на значительные разногласия и путаницу, локализация активности глюкованилина и глюкозидазы на тканевом уровне теперь уточнена. Остается определить, присутствует ли глюкованилин во внутриполостном пространстве вокруг семян, что может иметь важное значение для подтверждения возможной тканевой специализации в биосинтезе глюкованилина (см. ниже). На клеточном и субклеточном уровнях локализацию β-глюкозидазы можно уточнить с помощью такого метода, как иммунолокализация. Аналогичным образом, еще предстоит определить клеточную локализацию глюкованилина.
Накопление глюкованилина и β-глюкозидазы во время развития стручков ванили
Другая область, в которой проводилось очень мало исследований – это эволюция глюкованилина и активности β-глюкозидазы во время развития стручков, и еще меньше исследований было проведено по их эволюции в зависимости от типа ткани. Единственная точка согласия, которая возникла в результате различных исследований эволюции глюкованилина (Ranadive et al., 1983; Sagrero-Nieves and Schwartz, 1988; Kanisawa et al., 1994; Brodélius, 1994; Havkin-Frenkel et al., 1999) заключается в том, что накопление ванилина или глюкованилина в плодах начинается с 15-й недели после опыления и продолжается примерно до 30-й недели. Однако, форма, в которой накапливается ванилин (свободная или глюкозильная форма), может привести к путанице. Ранадив (Ranadive et al., 1983), Сагреро-Ньевес и Шварц (Sagrero-Nieves and Schwartz, 1988) показывают эволюцию свободного ванилина без предварительного гидролиза. По результатам Ранадива даже показано, что свободный ванилин составляет от 50% до 90% потенциального общего количества ванилина. Броделиус считает, что большая часть ванилина находится в глюкозильной форме, причем свободная форма не превышает 15% от потенциального общего количества (Brodélius, 1994). Канисава не сообщает о присутствии ванилина в его свободной форме во время развития зеленых плодов (Kanisawa et al., 1994), а Хавкин-Френкель указывает, что ванилин накапливается только в своей глюкозильной форме (Havkin-Frenkel et al., 1999). Последнее подтверждается Леонгом, который не нашел свободной формы в зеленых стручках (Leong, 1991). Уже Арана обнаружил (Arana, 1943), что ванилин присутствует почти исключительно в глюкозильной форме. За исключением некоторых исключительных случаев, наши собственные анализы всегда показывали, что в зрелых зеленых плодах преобладает глюкозильная форма (около 95% от общего количества), если мы предотвращаем любой случайный гидролиз во время экстракции глюкованилина (например, проводя экстракцию в чистом метаноле при −18°C). Однако, более позднее исследование (неопубликованные результаты) эволюции глюкованилина во время развития плода показало, что для стручков через 3, 5, 7 и 9 месяцев развития после опыления процент свободного ванилина по отношению к общему количеству (глюкозил плюс свободные формы) составлял 33, 6, 1,5 и 0,2% соответственно. Было бы интересно получить подтверждение этой эволюции, которая поднимает вопросы о роли глюкозилирования ванилина в стручках ванили. По мнению различных исследователей, которые отслеживали эволюцию активности глюкозидазы во время развития стручков на лиане (Wild-Altamirano, 1969, Ranadive et al., 1983; Kanisawa et al., 1994), могло показаться, что эта активность соизмерима на всех стадиях роста плодов. Однако, активность фермента значительно возрастает между третьим и четвертым месяцем после опыления, достигая максимума примерно к пятому месяцу. Следовательно, эволюция активности β-глюкозидазы во время роста стручков аналогична активности глюкованилина. Анализы (неопубликованные результаты), проведенные авторами для определения активности глюкозидазы в плодах, собранных в феврале 2005 года на Мадагаскаре, на стадии развития, оцениваемой менее чем через два месяца после опыления (сильно асимметричная форма плода с более округлой частью у цветка, чем у плодоножки) показала активность глюкозидазы около 650 нкатал/г сырой массы для части у цветка по сравнению с 230 нкатал/г сырой массы для части возле плодоножки. Эти активности уже были высокими и предполагали градиент активности в фазе развития плода. Для плодов из той же кисти, которые достигли полного размера, но не развились в течение более 5 месяцев после опыления, активность глюкозидазы для частей у цветка и плодоножки была почти одинаковой, около 1100 нкатал/г сырого веса, или равной среднему значению, полученному для плодов в обычное время сбора урожая (см. ниже). Содержание глюкованилина, полученное для зеленых плодов после восьми месяцев развития, сильно различается от одного исследования к другому. Если мы переведем различные значения, приведенные в литературе, в граммы глюкованилина на 100 г сухого веса, они будут находиться в диапазоне от 2% (Sagrero-Nieves and Schwartz, 1988) до 12% (Havkin-Frenkel et al., 1999). Дальнейшие исследования подтвердили, что зрелые зеленые стручки могут содержать глюкованилин примерно 10-15% от сухого веса (Ansaldi et al., 1988; Leong, 1991; Brunerie, 1993; Odoux, 2000; Havkin-Frenkel et al., 2005). Определение глюкованилина в 70 зеленых стручках семи различных кистей в течение 2000 г. на Мадагаскаре (неопубликованные результаты) показало, что содержание глюкованилина может варьироваться от 1,5% до 12% от сухого веса в зависимости от плодов, при этом большинство отдельных стручков представляют содержание глюкованилина около 10%. Другие определения, проведенные в 2006 г. на партиях из Папуа-Новой Гвинеи, показали максимальное содержание глюкованилина даже более 20% от сухого веса для некоторых плодов, подтверждая крайнюю изменчивость, которая может существовать в содержании глюкованилина в плодах V. planifolia. Для активности β-глюкозидазы невозможно сравнить значения, приведенные в библиографии, из-за используемых средств (единиц) выражения, протоколов получения экстрактов ферментов, природы используемых буферов (pH, ионная сила и т. д.), молярности субстрата (обычно p-нитрофенил-глюкуронид) и так далее. Наш собственный опыт в этой области показал, что в зрелых зеленых стручках с физиологически здоровым внешним видом и стандартизированным точным протоколом (Odoux, 2004) эта активность также может значительно варьироваться. Для примерно 100 плодов урожая Мадагаскара 2000 года, активность β-глюкозидазы колебалась от 100 до 2000 нкатал/г свежего веса, при этом большинство отдельных стручков проявляли активность около 1000 нкатал/г свежего веса (неопубликованные результаты). Более систематические исследования эволюции глюкованилина (и других глюкозидов) и активности глюкозидазы во время развития стручков необходимы для подтверждения или опровержения уже опубликованных исследований. В случае ароматических компонентов должны быть установлены очень строгие аналитические протоколы, чтобы устранить любую двусмысленность в отношении формы, в которой они присутствуют на различных стадиях развития. Также было бы полезно стандартизировать анализы активности глюкозидазы, для которых результаты почти никогда нельзя сравнивать от одного исследования к другому. Эти изменения также следует измерять по типу ткани; в случае глюкозидов это может позволить получить дополнительную информацию о путях и местах биосинтеза этих компонентов (см. следующий раздел).Место биосинтеза и метаболический путь для глюкованилина
В своей работе по биосинтезу ванилина Лекомт пришел к выводу, что в нем участвует «кониферозид» (кониферин), производящий конифериловый спирт путем ферментативного гидролиза, который затем превращался в ванилин под действием «оксидазы» (Lecomte, 1901, 1913). Горис, который выделил «ванилозид» (глюкованилин) в 1924 году, предположил, что второй возможный путь заключался в представлении действия «оксидазы» перед действием «гидролазы» (рис. 10.12). Не имея возможности выделить ни «кониферозид», ни конифериловый спирт, он в конце концов пришел к выводу, что эти гипотезы не подтверждаются (Goris, 1947). Однако, позже они были возобновлены Анваром (Anwar, 1963). РИСУНОК 10.12. Биосинтетический путь ванилина, предложенный Лекомтом (Lecomte, 1901, 1913) и Горисом (Goris,1947).
РИСУНОК 10.12. Биосинтетический путь ванилина, предложенный Лекомтом (Lecomte, 1901, 1913) и Горисом (Goris,1947).
Сейчас принято считать, что ванилин является продуктом биосинтетического пути шикимовой кислоты через фенилаланин, который приводит к фенилпропановым соединениям посредством ферментативного дезаминирования и, прежде всего, к коричной кислоте (рис. 10.13). Последовательные ферментативные гидроксилирования и метилирования затем ведут к образованию пара-гидроксикоричных кислот и, в частности, кумаровой, кофейной, феруловой и синапиновой кислот.
 РИСУНОК 10.13. Предполагаемый путь биосинтеза соединений фенилпропана через шикимовую кислоту и l-фенилаланин. (Данные Odoux, E., Fruits, 61, 171–184, 2006.)
РИСУНОК 10.13. Предполагаемый путь биосинтеза соединений фенилпропана через шикимовую кислоту и l-фенилаланин. (Данные Odoux, E., Fruits, 61, 171–184, 2006.)
Большинство исследований, опубликованных в попытке прояснить последующие этапы пути биосинтеза ванилина, было проведено с использованием клеточных культур и показало, что различные пути могут быть активированы в зависимости от экспериментальных условий (обзор Dignum et al., 2001; Walton et al., 2003). Поэтому трудно сделать какие-либо окончательные выводы и еще труднее попытаться экстраполировать результаты, полученные в этих условиях, на растение. Что следует из исследований, проведенных на плодах, о которых имеется очень мало информации (Zenk, 1965; Kanisawa, 1993; Kanisawa et al., 1994; Negishi et al., 2009), так это то, что предполагаются два пути биосинтеза: • Первый предполагает, что прямым предшественником ванилина является феруловая кислота (соединение C6-C3). Это означает, что боковая цепь C3 молекулы позже укорачивается до ванилина (соединение C6-C1) (рис. 10.14). Это аргумент, выдвинутый Зенком (Zenk, 1965) и подтвержденный недавней работой Негиши (Negishi et al., 2009). В обоих случаях результаты были получены после внедрения помеченных 14C молекул в зеленые ванильные диски и мониторинга их превращения.
 РИСУНОК 10.14. Биосинтетический путь ванилина, предложенный Зенком (Zenk, 1965) и Негиши (Negishi et al., 2009).
РИСУНОК 10.14. Биосинтетический путь ванилина, предложенный Зенком (Zenk, 1965) и Негиши (Negishi et al., 2009).
Результаты, полученные Негиши (2009) также предполагают, что биосинтез не вызывает вмешательства глюкозилированных промежуточных соединений. Таким образом, ванилин синтезируется в форме агликона, а затем глюкозилируется после образования. • Второй вариант предполагает, что укорочение части C3 происходит выше на уровне 4-кумаровой кислоты (соединение C6-C3) с образованием 4-гидроксибензальдегида (соединение C6-C1), который затем гидроксилируется и метилируется с получением ванилина (рисунок 10.15). Этот аргумент поддерживает Канисава (Kanisawa et al., 1994) – хотя он также предлагает путь через диглюкозиды и не исключает возможности использования феруловой кислоты в качестве предшественника – на основе различных соединений, обнаруженных в плодах на разных стадиях развития. Это также аргумент, защищаемый командой из Университета Рутгерса (Принстон, США) очистившей 4-гидроксибензальдегидсинтазу (4ГБС) (из клеточных культур) и метилтрансферазу (ДОМТ) (из стручков), которые могут, соответственно, катализировать превращение 4-кумаровой кислоты в 4-гидроксибензальдегид и 3,4-дигидроксибензальдегид (протокатеховый альдегид) в ванилин (Podstolski et al., 2002; Pak et al., 2004). Существование фермента, способного гидроксилировать 4-гидроксибензальдегид до 3,4-дигидроксибензальдегида, еще предстоит доказать, и предпочтительно в плодах. Полученные результаты не показывают никакого превращения 4-гидроксибензальдегида в ванилин (Negishi et al. 2009).
 РИСУНОК 10.15. Биосинтетический путь ванилина, предложенный Канисавой (Kanisawa et al., 1994) и Подстольски (Podstolski et al., 2002). В пути, предполагаемом Канисавой, участвующие соединения гликозилируются из 4-кумаровой кислоты (не показано на рисунке).
РИСУНОК 10.15. Биосинтетический путь ванилина, предложенный Канисавой (Kanisawa et al., 1994) и Подстольски (Podstolski et al., 2002). В пути, предполагаемом Канисавой, участвующие соединения гликозилируются из 4-кумаровой кислоты (не показано на рисунке).
По пути, предложенному Канисавой (Kanisawa et al., 1994) глюкозилирование происходит, как только появляется 4-кумаровая кислота; последующие реакции, следовательно, будут включать глюкозилированные промежуточных соединений, вплоть до глюкованилина. Как обсуждалось в предыдущих разделах, глюкованилин присутствует в полностью зрелых плодах в основном в семяносце и, в меньшей степени, в сосочках. Согласно Джоэлу (Joel et al., 2003), сосочки являются местом биосинтеза глюкованилина в стручках, что основано на присутствии 4-гидроксибензальдегидсинтазы (4ГБС) в цитоплазме клеток. Присутствие 4ГБС было выявлено путем иммунолокализации, но в примечании к исследованию, которое поддерживало представление результатов, не содержится подробностей об использованной методологии. Глюкованилин (или предшественники этой молекулы) затем секретируются этими сосочками во внеклеточное пространство вокруг семян. Френч считает, что присутствие других ферментов, участвующих в биосинтезе глюкованилина, также должно быть показано, чтобы подтвердить эту гипотезу (French, 2005). Более того, если бы сосочки были единственным местом биосинтеза глюкованилина, это подняло бы вопрос о том, как он транспортируется к семяносцам (Odoux and Brillouet, 2009), которые являются основными местами накопления. Еще предстоит провести много исследований, чтобы выяснить пути биосинтеза глюкованилина в стручках ванили, а также определить вовлеченные ткани.
Глава 11. Обработка ванили
Введение
Процесс обработки ванили разработан для получения ароматно-привлекательного и микробиологически стабильного продукта из зеленых стручков, собранных до полной спелости и не имеющих особого аромата, кроме неясного «растительного» запаха. Способы обработки разнообразны, но обычно включают четыре отдельных этапа. По отношению к этим этапам в разных странах-производителях ванили, в которых говорят по-испански в Центральной Америке (Мексика), франкоязычных в регионе Индийского океана (Реюньон, Коморские острова, Мадагаскар) и англоговорящих (Индия, Уганда) используются специфические термины. Описание этих этапов на разных языках часто двусмысленное и запутанное, усложняемое тем фактом, что разделение между четырьмя этапами часто субъективное и спорное. Таким образом, важно четко определить эту терминологию, прежде чем начинать углубленное обсуждение процессов обработки и их биохимических последствий. Первая стадия обработки предназначена для остановки раскрытия стручков (особенно у Vanilla planifolia G. Jackson, которая является наиболее широко продаваемым видом) путем блокирования естественных метаболических процессов, происходящих во время созревания. Наиболее распространенные методы включают резкое состаривание стручка, то есть «убийство» плода («mortification» – умерщвление по-французски). Основная техника, используемая для этой цели, пришедшая с Реюньона, включает замачивание стручков ванили в горячей воде – это называется «ошпаривание» и «échaudage» по-французски. В Мексике стручки традиционно помещают в духовку или выставляют на солнце, и соответствующие испанские термины – «horneado» и «secado al sol». Обычный перевод слова «horneado» – «запекание», но на французском языке нет специального термина, как нет французского эквивалента для термина «secado al sol» или «убийство солнцем». Второй этап включает в себя поддержание тепла, накопленного на начальном этапе, как можно дольше, помещая контейнеры в закрытые ящики, которые максимально теплоизолированы (как правило, дерюжными мешками), чтобы создать условия, подобные тем, которые возникают в парилке. Этот шаг называется «пропаривание» или «étuvage» по-французски и «sudor de horno» (с этимологической точки зрения, этот термин вводит понятие влажного тепла) или «sudado» по-испански. Эти термины более двусмысленны, и поэтому их толкования могут заметно отличаться. Некоторые авторы (Bourriquet, 1954) сообщают, что на этом этапе стручки могут выделять черноватую жидкость, которую отдельные авторы объясняют высыханием, связанным с пропариванием стручков. Высыхание противоречит условиям, установленным на этом этапе, и такое явление не было экспериментально оценено (Odoux, 2000; Perez-Silva, 2006). Черноватая жидкость, вероятно, является результатом избыточной конденсации (смешанной с кусочками раздавленных стручков), что соответствует понятиям «пропаривание» и «étuvage». Другие авторы (Ranadive, 1994; Dignum et al., 2001) считают, что этап пропаривания также включает первые дни сушки на солнце, когда определенно происходит потеря влаги. На третьем этапе стручки ванили сушат для стабилизации продукта – это называется этапом «сушки», или «séchage» по-французски и «asolear» или «secado del sol» по-испански. Это четкие термины, описывающие явление сушки стручка, несмотря на то, что этот этап, очевидно, включает в себя нечто большее, чем просто потеря влаги – вот почему трудно четко отделить конец этапа пропаривания от начала этапа сушки. Более того, «asolear» и «secado del sol» вводят понятие пребывания на солнце как техники сушки стручков. Четвертый этап называется «кондиционирование», «conditionnement» или «affinage» по-французски и «afinado» по-испански. Эти термины объединяют два взаимодополняющих понятия, а именно: упаковка, хранение и консервация продукта в герметичной атмосфере с целью способствовать «ароматическому созреванию» в течение долгого времени. В этой главе рассказывается, как эти методы и их производные в конечном итоге позволяют поддерживать стручки ванили в условиях высокой температуры и влажности как можно дольше, чтобы подготовить почву для ряда ферментативных и химических реакций, способствующих развитию аромата, типичного для ванили, сдерживая распространение микроорганизмов (особенно плесени). Однако, как здесь обсуждается, эта обработка является довольно непрерывным процессом, поэтому его трудно разделить на четко определенные этапы.Обычные методы обработки
Этапы 1 и 2: Первоначальная тепловая обработка
У V. planifolia G. Jackson термическая обработка проводится в основном для предотвращения растрескивания стручков (например, Vanilla tahitensis не подвергается термообработке, потому что это не растрескивающийся вид, см. также главу 13), что может снизить рыночное качество стручков ванили. Стручки собирают до стадии полной спелости, на которой происходит раскрытие, но этот ранний сбор не останавливает процесс. Поэтому были разработаны различные методы, чтобы полностью его остановить. Эти методы совместимы со способом обработки ванили в местных условиях стран-производителей, то есть там, где технические ресурсы часто очень ограничены. На первом этапе наиболее распространенный метод, применяемый в регионе Индийского океана (Мадагаскар, Коморские острова, Реюньон и т. д.), включает замачивание зеленых стручков в заполненном водой резервуаре, нагретом на открытом огне (процесс ошпаривания) (рис. 11.1). Затем на втором этапе стручки сразу же помещают в закрытые ящики, чтобы избежать потери тепла (пропаривание). Теоретически ошпаривание следует проводить в течение 3 минут на водяной бане при температуре 65°C, а процесс пропаривания занимает 24 часа. В некоторых странах время и температура заваривания корректируются в зависимости от качества стручков, потому стручки иногда предварительно сортируют. РИСУНОК 11.1. Этап умерщвления: зеленые стручки замачивают в горячей воде.
РИСУНОК 11.1. Этап умерщвления: зеленые стручки замачивают в горячей воде.
На практике эти два этапа выполняются разными способами. Например, на Мадагаскаре, который является ведущей страной-производителем ванили, задействовано множество операторов, от фермеров, производящих всего несколько сотен граммов ванильных стручков, до экспортеров, которые имеют дело с сотнями тонн этого продукта, и технические ресурсы, доступные этим операторам, также заметно различаются (Odoux, 1998). У большинства фермеров нет возможности контролировать температуру и время ошпаривания, а это означает, что процесс обработки может существенно отличаться. Количество обрабатываемых стручков, которое может значительно различаться между операторами, способно существенно повлиять на качество термообработки (например, краевыми эффектами в корзинах). Процесс пропаривания также можно продлить на несколько дней, если погодные условия не подходят для начала этапа сушки. На Реюньоне, где почти весь урожай ванили обрабатывается двумя централизованными подразделениями (кооперативом и частной компанией), процессы ошпаривания и пропаривания выполняются дважды для достижения однородной термообработки (Odoux, 2000). Однако, мало что известно о фактическом влиянии этих альтернатив на конечное качество ванили. Второй метод (обычно используемый в Мексике) включает обработку стручков в дровяных печах («калорифико») в течение 24–48 часов при температуре около 60°C.Стручки заворачивают в мешковину, а затем в циновки (так называемые «малеты»). Эти «малеты» обильно поливают водой, чтобы уровень влажности оставался высоким во время процесса, затем их помещают в деревянные ящики или на полки в духовке (Bourriquet, 1954; Théodose, 1973; Perez-Silva, 2006) и, в конце, их снова обрызгивают водой. Конструкция печи, как правило, носит чисто практический характер, поэтому она оказывает существенное влияние на однородность термообработки и температуру, фактически в ней достигаемую, поэтому оператор должен соответствующим образом регулировать время обработки. В конце этого шага «малеты» вынимаются из печи, циновки удаляются, а стручки, которые все еще обернуты мешковиной, помещаются в большие ящики и накрываются на 24–48 часов (Perez-Silva, 2006 г.). Это так называемый этап «sudor de horno», который эквивалентен этапу «étuvage» на Реюньоне. Другой метод, называемый «secado al sol», который также традиционно применяют в Мексике, включает раскладывание стручков на солнце в качестве альтернативной термообработки. Этот метод редко используется в настоящее время, потому что требуются очень большие площади, а результаты с точки зрения остановки раскрытия стручков гораздо более неопределенны, чем с другими методами (Arana, 1944). С более курьёзной точки зрения следует также отметить, что раскрытие можно эффективно остановить, поцарапав стручки ванили острым предметом (Arana, 1944). Исторически этот метод был разработан в Вест-Индии и используется только для обработки стручков, произведенных из Vanilla pompona, то есть очень незначительного производства. Эти обработки ведут к состариванию стручков ванили. В результате стручок темнеет (рис. 11.2) и довольно заметно теряет первоначальную упругость. Как будет обсуждаться в последнем разделе этой главы, эти структурные модификации являются отправной точкой для образования ванильных ароматических соединений. Принимая во внимание диапазон используемых методов термообработки, цвет и текстура могут значительно отличаться между стручками в конце обработки, но последующий длительный этап сушки помогает гомогенизировать окончательный внешний вид стручков.
 РИСУНОК 11.2. Стручки ванили до (в корзине) и после этапа пропаривания.
РИСУНОК 11.2. Стручки ванили до (в корзине) и после этапа пропаривания.
Этап 3: Сушка
Следующим этапом этого процесса является намеренная медленная сушка стручков ванили. Очевидно, что сушка проводится для стабилизации стручков, чтобы избежать заражения микроорганизмами, особенно плесенью. Влажность стручка постепенно снижается примерно с 85% до максимального конечного уровня 25–38%, в зависимости от категории. На практике ваниль, предназначенная для агропродовольственной промышленности (80% рынка), сушат до влажности 18–20%. Следует отметить, что даже при влажности 18% активность воды (Aw) составляет около 0,85, что намного выше, чем 0,65 Aw, то есть уровень не следует превышать во избежание развития микроорганизмов. Однако, ваниль обычно можно хранить без каких-либо проблем такого рода. Стручки ванили обычно грубо разбрасывают на одеялах (рис. 11.3) и выставляют на решетках на солнце. После нескольких часов пребывания на солнце, ваниль завертывается в одеяла (рис. 11.4), которые, в свою очередь, складываются в тени до следующего дня (рис. 11.5). Эта процедура повторяется ежедневно в течение нескольких недель. Стручки, которые считаются достаточно сухими, отбираются, и начинается фаза сушки в тени. Это продолжается до тех пор, пока вся партия не станет достаточно сухой. Во время фазы сушки в тени стручки аккуратно выкладываются бок о бок в один слой (рис. 11.6) на деревянных стеллажах, защищенных от солнца в здании. За ними регулярно следят и переворачивают, пока они не станут достаточно сухими, чтобы начать следующий этап – кондиционирования. Степень высыхания стручка (на этапе сушки на солнце или в тени) оценивается эмпирически на ощупь, поэтому оператор должен иметь достаточно опыта в обработке ванили, чтобы правильно оценить степень сухости стручка. Скорость сушки сильно различается даже между нераскрывшимися стручками одного и того же сорта (очевидно, что раскрывшиеся стручки сохнут намного быстрее и требуют особого контроля). Весь процесс сушки длится 2–3 месяца. Эта стадия обработки проводится почти одинаково во всех странах-производителях ванили, независимо от используемых технологий. РИСУНОК 11.3. Этап сушки: стручки ванили грубо разбросаны на одеялах.
РИСУНОК 11.3. Этап сушки: стручки ванили грубо разбросаны на одеялах.
 РИСУНОК 11.4. После пребывания на солнце стручки ванили заворачиваются в одеяло.
РИСУНОК 11.4. После пребывания на солнце стручки ванили заворачиваются в одеяло.
 РИСУНОК 11.5. Одеяла с ванильными стручками сложены в тени.
РИСУНОК 11.5. Одеяла с ванильными стручками сложены в тени.
 РИСУНОК 11.6. Этап сушки в тени: стручки ванили выложены бок о бок на поддонах.
РИСУНОК 11.6. Этап сушки в тени: стручки ванили выложены бок о бок на поддонах.
Основная проблема с этой процедурой сушки заключается в том, что она сильно зависит от погодных условий, особенно во время первой фазы на открытом воздухе, когда стручки наиболее восприимчивы к заражению микроорганизмами. Этот этап совпадает с периодами обильных дождей в основных районах выращивания ванили на Мадагаскаре (Théodose, 1973), которые могут нарушить процесс сушки и иногда создать серьезные проблемы с развитием плесени. Чтобы избежать таких заражений, были предложены методы искусственной периодической сушки (Théodose, 1973), которые даже были успешно реализованы с точки зрения качества стручков в крупномасштабных промышленных условиях. Например, на Мадагаскаре и Реюньоне туннели для сушки слив использовались для сушки ванили. Однако, такие сушилки обычно не используются в странах-производителях ванили не по качественным причинам, а из-за социально-экономических ограничений. Совсем недавно были проведены исследования по сушке ванили в солнечных сушилках (Kamaruddin, 1997; Ratobison et al., 1998). Метод медленной сушки, описанный в этом разделе – это больше, чем просто стадия дегидратации, потому что реакции, вызывающие развитие типичного ванильного аромата и инициированные во время начальной термообработки, продолжаются из-за высокого Aw и нагревания во время последовательных фаз пребывания на солнце.
Этап 4: Кондиционирование
На последнем этапе стручки ванили выдерживаются в коробках в течение нескольких месяцев. Цель кондиционирования – способствовать полному раскрытию ванильного аромата. Небольшие пучки сушеных стручков (обычно после сортировки по размеру и цвету) связывают рафией, заворачивают в вощеную бумагу и помещают в металлические или деревянные ящики (рис. 11.7), максимально ограничивая потерю влаги. Эти контейнеры регулярно проверяются, чтобы убедиться в отсутствии образования плесени. Стручки ванили считаются готовыми к продаже после нескольких месяцев хранения в этих условиях. РИСУНОК 11.7. Этап кондиционирования: стручки ванили помещают в деревянные ящики с вощеной бумагой.
РИСУНОК 11.7. Этап кондиционирования: стручки ванили помещают в деревянные ящики с вощеной бумагой.
Этот этап можно сравнить со старением вина или созреванием сыра, потому что ароматические качества стручков ванили явно усиливаются в этот период. Такой процесс обработки осуществляется примерно одинаково во всех странах-производителях ванили по всему миру. Это в высшей степени эмпирическое, относительно неконтролируемое действие, во многом зависящее от преобладающих погодных условий, которые в некоторых случаях могут привести к серьезным дефектам качества стручков, но оно адаптировано к условиям, в которых живут фермеры в большинстве стран-производителей, даже на Мадагаскаре – ведущей стране-производителе ванили. На протяжении всего процесса обработки ванили требуется многократная переборка, что обеспечивает основной источник дохода многим людям.
Нетрадиционные методы
Различные недостатки уже упомянутого обычного процесса обработки, а также его продолжительность (более шести месяцев до получения товарного продукта) подвигли многих авторов попытаться разработать альтернативные методы. Более того, известно, что конечное содержание ванилина никогда не превышает 3% по отношению к сухому веществу (Bayle et al., 1982; Derbesy et al., 1982; Arnaud et al., 1983; Derbesy, 1989; Falque et al., 1992; Fayet et al., 1999; Derbesy, Charvet, 2000; Saltron et al., 2002; Gassenmeier et al., 2008), тогда как начальный потенциал обычно превышает 5% (Arana, 1943; Ansaldi et al., 1988; Leong, 1991; Brunerie, 1993; Odoux, 2000; Havkin-Frenkel et al., 2005). Эти соображения также побудили к исследованиям, направленным на повышение уровня ванилина в конечном продукте. Некоторые авторы сосредоточились на усилении контроля над основными параметрами (температура, относительная влажность, время обработки и т. д.), предположительно влияющих на конечное качество ванили, а также попытались создать условия, которые близко соответствуют обычным условиям выдержки стручков. Наконец, цель состоит в том, чтобы имитировать традиционный процесс при «индустриализации» различных этапов. Следовательно, методы, предложенные этими авторами, три из которых запатентованы, относительно похожи, но в основном различаются в отношении исходного состояния сырья, то есть в зависимости от того, целые стручки, порезанные на кусочки или измельченные. Таут (Towt, 1952) предложил измельчать стручки ванили для получения однородного пюре, основываясь на идее, что различные химические и биохимические реакции, происходящие в процессе повышения качества ванили, будут облегчены и ускорены по сравнению с использованием целых стручков. Это пюре в течение 48 часов выдерживают при температуре от 50°C до 55°C с нагнетанием воздуха в массу для ускорения реакций окисления, а затем сушат при 60°C, до тех пор, пока уровень влажности не упадет ниже 20%. Каул (Kaul, 1967) использовал целые или разрезанные на части стручки, чтобы сохранить коммерческую «идентичность» конечного продукта, при эффективном контроле процесса для сдерживания развития плесени, которая является обычной проблемой при общепринятых условиях обработки. Процесс, предложенный этим автором, включает инкубацию стручков в запечатанном контейнере при 38°C в течение одной недели или при 65°C в течение 24 часов или же в любой другой промежуточной комбинации времени/температуры, чтобы препятствовать потере влаги и способствовать химическим и биохимическим реакциям. За этой стадией обработки следует процесс сушки в условиях, не указанных в описании патента. Автор отметил, что этот этап сушки – в отличие от обычных процедур – во всех случаях, при низкой или высокой температуре, может быть проведен быстро без ущерба для качества продукта. Автор считает, что для получения конечного продукта наивысшего качества необходимо строго соблюдать описанные условия обработки. Карас (Karas et al. 1972) предложил работать над стручками, разрезанными на части и помещенными на стеллажи. Стеллажи помещают в духовку при 60°С на 72 ч. Стручки сушат при 60°C до достижения влажности 35–40%, а затем при температуре окружающей среды до тех пор, пока влажность стручков не стабилизируется на уровне 20–25%. Эти три метода были запатентованы McCormick & Company, Inc., и, насколько нам известно, один из них (Karas et al., 1972) используется в Уганде, а также промышленной группой на Мадагаскаре. Еще в 1949 г. Джонс и Висенте (Jones and Vicente, 1949a) опубликовали исследование, в котором сравнивались относительно похожие процедуры. Целые, нарезанные или измельченные стручки ванили сушили в печи при 60°C в течение 24 часов, а затем при 45°C (до тех пор, пока все стручки не стали гибкими), а окончательно досушивали и выдерживали при температуре окружающей среды. Результаты вкусовых испытаний мороженого, ароматизированного соответствующими экстрактами ванили, не выявили каких-либо существенных различий между обработками. Буррике также указал, что в 1950 году мексиканская компания уже производила очень ароматный продукт под названием «ванильный фрукт», изготавливаемого из зеленого ванильного пюре, которое нагревали в течение 48–60 часов, а затем обезвоживали в сушилке (Bourriquet, 1954). Теодоз сообщил о результатах исследований, проведенных на исследовательской станции Анталаха на Мадагаскаре в 1960-х годах, которые были направлены на упрощение процедуры обработки ванили (Théodose, 1973). Был разработан метод, который включал ошпаривание и пропаривание целых стручков обычным способом, разрезание на части размером 2–3 см, а затем сушку партиями в течение 12 дней с получением конечного продукта с содержанием влаги 20–25%. Импортеры ванили сочли результаты интересными, так как содержание ванилина было выше нормы, а аромат был сильнее. Другие авторы уделяли больше внимания оптимизации реакций гидролиза глюкованилина в ванилин эндогенной глюкозидазой (см. главу 10 и раздел «Взаимосвязь между обработкой ванили и развитием аромата» этой главы), используя при этом конкретную обработку или технологию для введения этих компонентов в контакт. Эта обработка может быть начальной стадией перед более традиционной стадией сушки или при производстве ароматического экстракта. Растительные гормоны, такие как этилен, в прошлом изучались Араной и Буррике (Arana, 1944; Bourriquet, 1954). Не было четко определено, являются ли ванильные стручки климактерическими или нет, но эти авторы ясно продемонстрировали их чувствительность к этилену как агенту, вызывающему созревание. Вызванный этиленом процесс приводит к потемнению стручков и гидролизу глюкованилина. Однако, этилен вызывает сильное раскрытие стручков, которое, согласно Арана, может затронуть до 47,5% всех стручков. Совсем недавно Хавкин-Френкель в целом подтвердил высокие показатели раскрытия стручков, обработанных этиленом в присутствии воздуха или кислорода (Havkin-Frenkel et al. 2005). Обработка этиленом, нафталин-уксусной кислотой (гормон семейства ауксинов) или биотическими элиситорами также была протестирована на стручках, подвергшихся термообработке (63°C в течение 3 минут), в сочетании или без скарификации (Sreedhar et al., 2007, 2009). По словам авторов, эти обработки положительно повлияли на образование ванилина и других ароматических фенольных соединений, а также сократили время обработки ванили. Однако, результаты этих экспериментов были несколько противоречивы, поэтому сделать однозначные выводы сложно. Кроме того, можно поставить под сомнение физиологическое воздействие, ожидаемое от этих молекул, на стручки, подвергшиеся вызывающей состаривание термообработке. Ультразвук также изучался как метод приведения в контакт ферментов и субстратов (Obolenski, 1957, 1958, 1959), и, по словам автора, метод может повысить содержание ванилина (но в целом результаты были довольно запутанными). Чернудат и Лусталот, процитированные у Буррике, протестировали использование инфракрасного излучения для начальной стадии обработки ванили и качество конечного продукта было сочтено вполне приемлемым (Cernudat and Loustalot, 1948; Bourriquet, 1954). Было также обнаружено, что сплющивание стручков ванили – без их дробления и разрушения – примерно за 10 прогонов через валки при давлении 20 кПа, усиливает гидролиз глюкованилина до ванилина (Perera and Owen, 2010). Запатентован метод замораживания/оттаивания зеленых стручков (Balls et al., 1942; Ansaldi et al., 1988), который является темой различных публикаций (Jones, Vicente, 1949a; Odoux et al., 2006). Согласно Ансалди, этот метод позволяет гидролизовать около 80% глюкованилина, присутствующего в зеленых стручках (Ansaldi et al., 1988). В аналогичных условиях наши результаты показали, что можно получить степень гидролиза даже более 90% (Odoux et al., 2006). Наконец, другие авторы предложили методы, которые радикально отличаются от общепринятых процессов. Поскольку ваниль в основном используется в агропродовольственной промышленности для производства экстрактов, стручки необходимо измельчить после выдержки. На основании этого наблюдения эти авторы предложили методы измельчения зеленых стручков и оптимизации ферментативных реакций путем добавления экзогенных ферментов к полученному пюре. В основном это касается активности глюкозидазы, но также активности полисахаридгидролазы (пектиназы, целлюлазы и т. д.) для достижения полного гидролиза глюкованилина (Graves et al., 1958; Mane and Zucca, 1992; Brunerie, 1993; Ruiz-Terán et al., 2001). Некоторые методы запатентованы. Хотя большинство из этих процессов вряд ли будет реализовано, есть очень интересные, поскольку вносят определенные улучшения. Основные недостатки связаны с тем, что они совсем не адаптированы к социально-экономическим условиям в большинстве стран-производителей (особенно на Мадагаскаре, ведущем производителе ванили) или к текущей структуре мирового рынка ванили. Потому эти методы практически нигде не были приняты или были приняты лишь в незначительной степени. Однако, рынок ванили в последние годы стал довольно нестабильным, включая введение жестких стандартов в странах-импортерах (особенно с точки зрения микробиологического качества), что в среднесрочной перспективе может стать проблемой для традиционной практики.Соотношение между обработкой ванили и развитием аромата
Как уже упоминалось выше, первоначальная термообработка в первую очередь направлена на то, чтобы остановить раскрытие стручков, но общепризнанно, что эта обработка также играет роль в инициировании фазы развития аромата, которая продолжается на протяжении всего процесса приготовления ванили. Гидролиз различных глюкозилированных предшественников – самая известная реакция в развитии ароматических качеств ванили. Здесь мы не будем вдаваться в подробное обсуждение ароматического состава ванили, поскольку эта особенность будет рассмотрена в главе 12. Однако, следует все же отметить, что многие ароматические соединения, такие как ванилин, ванильная кислота, пара-гидроксибензальдегид, пара-гидроксибензойная кислота и так далее, присутствуют в зеленых стручках ванили в форме глюкозидов без каких-либо запахов, и их гидролиз необходим для высвобождения ароматической части. Что касается ванилина, основного (количественно и качественно) ароматического компонента ванили, то было показано (Odoux, 2000; Gatfield et al., 2007), что гидролиз его предшественника инициировался во время процессов ошпаривания и пропаривания, которые затем продолжались во время медленной фазы сушки и даже кондиционирования. В целом подобное поведение наблюдалось и с другими предшественниками глюкозидов ванильного аромата (Dignum et al., 2002; Perez-Silva, 2006). Поскольку глюкованилин и глюкозидаза расположены в одних и тех же тканях, но в разных клеточных компартментах (см. предыдущую главу), были проведены исследования, чтобы определить, каким образом процесс обработки связан с контактом фермента и субстрата (Odoux et al., 2006 г.). Результаты этого исследования ясно показали, что первоначальная тепловая обработка оказывает определенное влияние на целостность клеток, но нельзя точно определить долю клеток в тканях, которые сохранили свою компартментацию или нет. Результаты световой микроскопии показали, что эффект обработки был лишь частичным. Это могло объяснить низкий уровень гидролиза глюкованилина на первых этапах обработки, то есть после ошпаривания при 60°C в течение 3 минут и пропаривания в ящиках в течение 24 часов. Однако, наблюдения во время состаривания стручков после сбора урожая и процесса замораживания/оттаивания ясно показали, что эти процедуры привели к полной деградации клеточной структуры, сопровождающейся полным (или почти полным) гидролизом глюкованилина до ванилина, несмотря на значительную потерю активности глюкозидазы. Напротив, результаты, полученные в аналогичном исследовании (Mariezcurrena et al., 2008), кажется показали, что процедура оказывала незаметное влияние на организацию клеток ткани до пятого или восьмого дня после тепловой обработки. В этом исследовании было отмечено, что процесс пропаривания проводился с небольшим количеством стручков (20), поэтому тепловая инерция была намного ниже, чем в центре ящика, что могло объяснить наблюдаемые различия в отношении целостности клеток. Более того, в этом исследовании авторы не предоставили никаких указаний на характер гидролиза глюкозидов или на уровень активности глюкозидазы во время обработки. Тем не менее, все результаты, по-видимому, указывают на то, что основным следствием начальной тепловой обработки в отношении развития аромата было приведение в контакт глюкозидазы и глюкозилированных предшественников аромата посредством разрушения клеток. Однако, процедура термобработки очень негативно влияет на активность глюкозидазы (Odoux et al., 2003; Marquez and Walizewski, 2008). Разные авторы, которые измеряли изменения этой активности во время обработки ванили, отметили почти полную потерю активности глюкозидазы после первой фазы ошпаривания (Ranadive et al., 1983; Dignum et al., 2002; Havkin-Frenkel et al., 2005; Odoux et al., 2006; Perez-Silva, 2006), что заставило их усомниться в ферментативном происхождении гидролиза предшественника аромата. Возможность химического или экзогенного ферментативного гидролиза (например, из-за микробиологического заражения во время стадии сушки) рассматривалась и проверялась несколькими авторами (Dignum et al., 2002; Havkin-Frenkel et al., 2005; Odoux et al., 2006; Перес-Сильва, 2006). Все результаты, казалось, подтверждали, что этот гидролиз на самом деле был результатом активности эндогенной глюкозидазы. Хотя эта активность была почти остановлена термообработкой и не поддается измерению с помощью ферментативных тестов, разработанных различными упомянутыми авторами, предшественники аромата продолжали гидролизоваться даже на очень продвинутых стадиях процесса. Заметные потери активности глюкозидазы (Heckel, 1910; Dignum et al., 2002; Odoux et al., 2003, 2006) также были отмечены во время замораживания стручков, несмотря на очень высокую скорость гидролиза глюкованилина (см. предыдущий абзац). Эти различные наблюдения подчеркивают, что эффективное разложение в клетках глюкозилированных предшественников и глюкозидаз(ы) более важно, чем уровень ферментативной активности, как таковой. Таким образом, тепловая обработка необходима во время обычного процесса обработки ванили. Еще одна важная особенность общепринятого процесса, которая была предметом нескольких исследований за последнее десятилетие – это заметная потеря ванилина, отмеченная после гидролиза глюкованилина. В процессе обработки систематически наблюдаются потери ванилина около 50% (Odoux, 2000; Gatfield et al., 2007). Различные исследования (Gatfield et al., 2006, 2007; Frenkel and Havkin-Frenkel, 2006; Perez-Silva, 2006) показали, что ванилин, высвобождаемый глюкозидазой, может служить отправной точкой для различных механизмов химических или даже ферментативных реакций. Некоторые из этих реакций, далеко не отрицательные, могут привести к образованию ароматических соединений, которые необходимы для определения конечного качества ванили (см. главу 12). Ясно, что имеет место множество химических и ферментативных реакций, о чем свидетельствуют изменения цвета, текстуры и запаха, наблюдаемые во время различных фаз обработки ванили. Во время переработки ванили регулярно изучались три негликозидазные ферментные системы: пероксидазы, полифенолоксидазы и протеазы (Rabak, 1916; Balls and Arana, 1941; Jones and Vicente, 1949a, 1949b; Broderick, 1956; Ranadive et al., 1983). ; Hanum, 1997; Jiang et al., 2000; Dignum et al., 2001, 2002; Dignum, 2002; Havkin-Frenkel et al., 2005; Marquez et al., 2008; Waliszewski et al., 2009). Результаты этих исследований показали, что потемнение стручков происходит из-за ферментативных реакций, и пероксидазы, полифенолоксидазы, а также, в меньшей степени, протеазы обладают высокой устойчивостью к термической обработке. Пероксидазы и полифенолоксидазы также участвуют в реакциях окисления, приводящих к образованию ароматических молекул посредством окисления липидов и т. д. Протеазы участвуют в инактивации ферментов, необходимых для образования ароматических соединений. Наконец, стоит отметить, что в образовании ароматических соединений могут участвовать микроорганизмы (Röling et al., 2001). Результаты исследований, проведенных на сегодняшний день, не выявили точной природы реакционных процессов, связанных с очень сложными явлениями, которые происходят во время приготовления ванили.Глава 12. Развитие ароматических качеств вяленых ванильных стручков (Vanilla planifolia G. Jackson)
Состав летучих соединений в вяленых ванильных стручках
Анализ летучей фракции ванили, которая, как это ни парадоксально, мало исследовалась, позволил обнаружить и идентифицировать более 150 молекул, принадлежащих к многочисленным химическим классам (Klimes and Lamparsky, 1976; Galetto and Hoffman, 1978; Schulte-Elte et al., 1978; Nakasawa et al., 1981; Vidal et al., 1989; Adedeji et al., 1993; Kiridena et al., 1994; Ramaroson-Raonizafinimanana et al., 1997; Werkhoff and Günter, 1997; Sostaric et al., 2000; Perez-Silva et al., 2006). С химической точки зрения эти различные соединения принадлежат к следующим классам: углеводороды, спирты, альдегиды, кетоны, сложные эфиры, лактоны, кислоты, терпеноиды, гетероциклические соединения и фенолы. Среди углеводородов было идентифицировано большое количество алканов (таких как н-пентакозан), метилированные и этилированные производные этих алканов, алкены (такие как 1-гентриаконтан), терпеноиды (такие как α-пинен или лимонен) и ароматические кольца (например, бензол и некоторые его производные) (рис. 12.1). Алифатические кислоты (такие как уксусная и линолевая кислоты) также представлены рядом молекул, также как ароматическими кислотами (такими как бензойная или коричная кислоты) (рис. 12.1).


 РИСУНОК 12.1. Химические структуры некоторых летучих соединений из различных химических классов, идентифицированных в вяленых стручках ванили.
РИСУНОК 12.1. Химические структуры некоторых летучих соединений из различных химических классов, идентифицированных в вяленых стручках ванили.
Также найдены алифатические и ароматические сложные эфиры (такие как этиловый эфир линолевой кислоты или метиловый эфир коричной кислоты), и даже терпеновые сложные эфиры (такие как α-терпиниловый эфир уксусной кислоты) (рис. 12.1). Были идентифицированы алифатические спирты (такие как 2,3-бутандиол), ароматические спирты (такие как бензиловый спирт) и даже терпеноиды (такие как линалол) (рис. 12.1). Также присутствуют алифатические альдегиды (такие как 2-гептеналь), терпеновые альдегиды (такие как β-циклоцитал), алифатические кетоны (такие как 3-гидрокси-2-бутанон) и ароматические кетоны (такие как ацетофенон) (рис. 12.1).). Сообщалось также, что некоторые лактоны входят в состав летучей фракции ванили (например, γ-бутиролактон) наряду с гетероциклическими соединениями (такими как фурфурол или цис-витиспиран) (рис. 12.1). Наконец, фенолы, которые являются основными представителями (как качественно, так и количественно) летучей фракции вяленой ванили и которые также могут нести альдегидные группы (такие как 3-метокси-4-гидроксибензальдегид или ванилин), кислотные группы (такие как 4-гидроксибензойная кислота), функциональные группы спирта (такие как 4-гидроксибензиловый спирт) и даже функциональные группы кетонов (такие как ацетованиллон) (рис. 12.1). Существуют многочисленные сложные эфиры (такие как метиловый эфир салициловой кислоты), также как и простые эфиры (такие как 4-гидроксибензилметиловый эфир) (рис. 12.1). Достаточно исчерпывающий список соединений, обнаруженных в ванили, можно найти в двух недавних обзорных статьях (Dignum et al., 2001 и Ranadive, 2006). Этот состав может варьироваться в зависимости от географического происхождения (понятие «терруар» в широком смысле) и ботанического происхождения образцов (Adedeji et al., 1993). Что касается ботанического аспекта, то только виды V. planifolia, Vanilla tahitensis (см. главу 13) и в меньшей степени V. pompona (Ehlers and Pfister, 1997) были предметом исследования их ароматического состава. Но даже в случае V. planifolia предстоит провести много исследований с использованием четко определенного генетического материала и стандартизированного процесса обработки. Наконец, следует помнить, что методы экстракции и анализа также могут приводить к изменчивости ароматического состава (а также в артефактах). В количественном отношении основным компонентом в вяленой ванили является ванилин (3-метокси-4-гидроксибензальдегид, рис. 12.2), концентрация которого может достигать нескольких десятков граммов на килограмм сухого веса (другими словами, нескольких десятков тысяч частей на миллион) (ISO 5565-1). Три других соединения также обычно оцениваются количественно, поскольку они считаются индикаторами качества и подлинности (см. главу 15); это пара-гидроксибензальдегид и ванильная кислота (рис. 12.2), концентрации которых обычно измеряются на уровне около 1 г/кг сухого веса (или около 1000 ppm), другими словами, примерно в 10 раз ниже, чем у ванилина, и, наконец, пара-гидроксибензойная кислота (рис. 12.2), средняя концентрация которой составляет около 100 мг/кг сухого веса (или около 100 частей на миллион), другими словами, в 100 раз ниже, чем у ванилина. Эти цифры, конечно, могут значительно варьировать в зависимости от качества продукта (Gassenmeier et al., 2008; Saltron et al., 2002). Другие соединения также были измерены при концентрациях более 100 ppm, такие как уксусная кислота или 4-гидроксибензил-метиловый эфир (Klimes and Lamparsky, 1976), а также гексадекановая кислота и линолевая кислота (Perez-Silva et al., 2006) (Рисунок 12.2). Есть даже сообщения (Adedeji et al., 1993) о большом количестве соединений с концентрацией более 1000 ppm, таких как 2-фурфурол (который на самом деле является вторым по распространенности соединением после ванилина в образце мексиканской ванили) или 3,5-дигидрокси-6-метил-2,3-дигидро-4H-пиран-4-он (рис. 12.2), который превышает 3000 ppm в большинстве проанализированных образцов, другими словами, концентрации выше, чем у пара-гидроксибензальдегида и ванильной кислоты.
 РИСУНОК 12.2. Химические структуры основных соединений (количественно), обнаруженных в летучей фракции вяленых стручков ванили.
РИСУНОК 12.2. Химические структуры основных соединений (количественно), обнаруженных в летучей фракции вяленых стручков ванили.
Тем не менее, следует отметить, что методы анализа и измерения этих соединений сильно различаются от одного автора к другому, а также сильно отличаются от стандартизированных методов (ISO 5565-2), что объясняет наблюдаемые различия. Фактически, общепризнанно, что 95% летучих соединений в выдержанной ванили обнаруживаются при концентрациях менее 10 ppm (Hoffman et al., 2005). Хотя ванилин является основным компонентом количественно, эта молекула сама по себе не объясняет качества общего аромата ванили. Трудно даже показать корреляцию между содержанием ванилина и сенсорным профилем ванильного экстракта (Gassenmeier et al., 2008). На самом деле, что довольно удивительно, было опубликовано очень мало исследований о вкладе различных ароматических соединений в качество аромата и вкуса вяленой ванили. С использованием ГХ-ольфактометрии (но без подробного описания используемой методологии), найдено, что пара-крезол, 2-фенилэтанол, гваякол и 4-креозол (рис. 12.3) оказывают значительное влияние на аромат ванили (Dignum et al. 2004). Также с помощью ГХ-ольфактометрии обнаружено 26 ароматически активных соединений в экстракте мексиканской ванили (Perez-Silva et al., 2006); из этих соединений 13 являются производными фенилпропаноидного пути (см. главу 10), некоторые из которых, такие как гваякол, 4-креозол, ацетованиллон и метиловый эфир салициловой кислоты (рис. 12.3), по интенсивности сходны с ванилином, в то время как в экстракте их концентрации в 1000 раз (а иногда и меньше) ниже. Следует отметить, что пара-крезол, метиловый эфир коричной кислоты и анизиловый спирт (рис. 12.3) имеют промежуточную интенсивность, хотя их концентрация составляет всего несколько частей на миллион. В целом, эти соединения отвечают за сладкие, древесные, бальзамические, пряные, ванильные и поджаренные ноты. Некоторые алифатические альдегиды, спирты и кислоты также имеют промежуточную интенсивность, несмотря на концентрации менее 10 ppm. В исследовании, направленном на сопоставление сенсорного анализа и химического анализа с целью классификации качества экстрактов ванили (Hoffman et al., 2005), идентифицировано 14 соединений, которые были обнаружены почти во всех исследованных экстрактах (всего 55 образцов) и положительно или отрицательно повлияли на аромат и вкус. Этиловый эфир уксусной кислоты, этиловый эфир гексановой кислоты, этиловый эфир октановой кислоты, этиловый эфир нонановой кислоты и этилгексанол (рис. 12.3) сильно коррелируют с критерием «связанный с возрастом»; 4-гидроксибензил-этиловый эфир, этилванилин и ацетальдегид этилацетат (рис. 12.3) сильно коррелируют с критерием «ромовый/смолистый»; пара-гидроксибензальдегид и ванилин (рис. 12.3) сильно коррелируют с критерием «ванильный». Все эти соединения связаны с положительными критериями, в то время как пара-гидроксибензойная кислота, ванильная кислота, гваякол и нонановая кислота (рис. 12.3) сильно коррелируют с критерием «дымный/фенольный» – другими словами, с отрицательным дескриптором.

 РИСУНОК 12.3. Химическая структура некоторых ароматически активных соединений, обнаруженных в вяленых стручках ванили.
РИСУНОК 12.3. Химическая структура некоторых ароматически активных соединений, обнаруженных в вяленых стручках ванили.
Наконец, следует упомянуть менее летучие молекулы, которые, следовательно, влияют на качество вкуса, а не на аромат, и являются предметом недавних публикаций (Gatfield et al., 2006; Schwarz and Hofmann, 2009). Семь молекул (рис. 12.4), включая диванилин, были идентифицированы в вяленой ванили и экстрактах и участвуют в создании ощущения бархатистого вкуса во рту. Диванилин, например, был обнаружен в концентрации около 170 ppm в мадагаскарской ванили (Gatfield et al., 2006). Эти молекулы в основном являются продуктами конденсации двух фенольных соединений.
 РИСУНОК 12.4. Химические структуры соединений, участвующих в ощущении бархатистого вкуса во рту, идентифицированные в ванильных стручках.
РИСУНОК 12.4. Химические структуры соединений, участвующих в ощущении бархатистого вкуса во рту, идентифицированные в ванильных стручках.
Состав глюкозилированных соединений в зеленых стручкахх ванили
Как упоминалось в предыдущем разделе, наиболее важные соединения в летучей фракции, как количественно, так и качественно, имеют ароматическое кольцо и являются производными фенилпропаноидного пути. Многие из них также содержатся в зеленых плодах в виде гликозидов – другими словами, связанных гликозидной связью (например, O-гликозидом) с одной или несколькими группами сахаров – и не влияют на обоняние. Исторически давно подозревали присутствие глюкозилированных предшественников аромата в зеленых стручках ванили. После долгих споров (Lecomte, 1901, 1913; Goris, 1924) было установлено, что «ваниллозид» (глюкованилин) был прямым предшественником ванилина и что три других предшественника также существовали, но в меньших количествах. В разных публикациях описаны попытки их выделения и идентификации (Горис, 1947; Janot, 1954). Это глюкозиды ванилинового спирта («ваниллозид»), протокатехинового альдегида (3,4-дигидроксибензальдегид) и неидентифицированного сложного эфира (рис. 12.5). Совсем недавно глюкозиды ванилина, пара-гидроксибензальдегида, пара-гидроксибензойной кислоты и ванильной кислоты (рис. 12.5) были идентифицированы в зеленой ванили (V. planifolia, происхождение Коморские острова, Реюньон, Мадагаскар, Индонезия) с использованием современных аналитических методов (Leong et al., 1989a,b; Leong, 1991). Более того, глюкоза, по-видимому, является основным сахаром, поскольку кислотный гидролиз предварительно очищенного экстракта ванильных гликозидов с последующим анализом ацетилирования позволяет получить около 20% глюкозы, 1% маннозы и следы рамнозы (процентное содержание выражено по отношению к исходному сухому веществу).


 РИСУНОК 12.5. Химические структуры различных агликонов, обнаруженных в виде глюкозидов в зеленых стручках ванили по данным разных авторов.
РИСУНОК 12.5. Химические структуры различных агликонов, обнаруженных в виде глюкозидов в зеленых стручках ванили по данным разных авторов.
Канисава (Kanisawa, 1993) идентифицировал глюкозиды 31 молекулы (рис. 12.5) в зеленых стручках ванили (V. planifolia, происхождение из Индонезии), включая ванилин, пара-гидроксибензальдегид, пара-гидроксибензойную кислоту, ванильную кислоту и ванилиновый спирт, уже идентифицированные предыдущими авторами. Такие соединения, как 2-фенилэтанол, метиловый эфир салициловой кислоты, пара-крезол и ацетованиллон – ароматически активные соединения – также были обнаружены в глюкозилированной форме. Этот автор также выделил и идентифицировал пара-гидридроксибензиловый спирт и два диглюкозида, бис[4-(β-d-глюкопиранозилокси)-бензил] 2-изопропил-тартрат (глюкозид A) и бис бис[4-(β-d-глюкопиранозилокси)-бензил] 2(1-метил-пропил)-тартрат (глюкозид B), которые, тем не менее, являются только посредниками в пути биосинтеза фенольных соединений. Однако, в более поздней публикации Канисава не подтвердили идентификацию глюкозидов 4 метиловых эфиров: метилового эфира феруловой кислоты, метилового эфира пара-гидроксибензойной кислоты, метилового эфира ванильной кислоты и метилового эфира пара-гидридроксикоричной кислоты (Kanisawa et al., 1994). Что еще более удивительно, он также не подтвердил в этой публикации присутствие глюкозидов пара-гидроксибензойной кислоты и бензилового спирта. В недавно опубликованном исследовании, в зеленой ванили (V. planifolia, происхождение Индонезия) искались различные глюкозиды (Dignum et al., 2004). Идентифицированы различные глюкозиды ванилина, ванильной кислоты, пара-гидроксибензальдегида, пара-крезола, креозола, ванилинового спирта и двух диглюкозидов A и B (рис. 12.5). В предыдущем исследовании эти авторы также обнаружили глюкозид гваякола, соединение, которое они впоследствии не смогли выделить (Dignum et al., 2002). Наконец, Перес-Силва идентифицировал 17 глюкозидов в зеленых стручках ванили из Мексики, включая глюкозид анизилового спирта (рис. 12.5), о чем было впервые сообщено (Perez-Silva, 2006). Однако, важно отметить, что присутствие многих из вышеупомянутых молекул должно быть подтверждено, поскольку, только глюкозиды ванилина, пара-гидроксибензальдегида, пара-гидроксибензойной кислоты, ванильной кислоты и глюкозиды A и B были формально изолированы и идентифицированы. Большинство других упомянутых глюкозидов сначала гидролизованы действием β-глюкозидазы, а потом идентифицированы свободные агликоны. Такой подход может привести к появлению артефактов из-за реакционной способности агликонов после их высвобождения.
Образование ароматических соединений при обработке
Глюкозиды
Как упоминалось в главе 11, наиболее известной реакцией в развитии ароматических качеств ванили во время вяления является гидролиз различных глюкозидов, являющихся предшественниками вышеупомянутых ароматических соединений. Это основная реакция в развитии аромата ванили, поскольку она позволяет агликону, который может обладать запахом, высвобождаться из глюкозида, у которого его нет. Эта реакция может осуществляться либо химически в кислых условиях, либо ферментативно с использованием β-глюкозидазы (или, в более общем смысле, с помощью гликозидазы, в зависимости от природы сахара, связанного с агликоном). В случае глюкованилина, несмотря на некоторые споры (см. главу 11), теперь признано, что этот гидролиз является результатом одной или нескольких β-глюкозидаз, эндогенных для плода. Эта идея была впервые выдвинута Миллером в 1754 г. (цитируется по Жано [Janot, 1954]). Затем Лекомт смог доказать существование ферментов гидратант и оксидант – вероятно, происхождением от термина ферментация, который до сих пор часто неправильно ассоциируется с ванильной выдержкой – и изучил их роль в развитии аромата ванили (Lecomte, 1901). После выделения глюкованилина (и других глюкозидов) и измерения активности глюкозидазы в сырых экстрактах зеленых стручках стало ясно, что основной реакцией, участвующей в ароматическом развитии ванили, является гидролиз глюкозилированных соединений. глюкозидазой (Arana, 1943): фермент гидратант Лекомта. Многие авторы впоследствии измерили эту ферментативную активность в рамках своих исследований процесса трансформации, физиологии плодов и так далее, но исследований по очистке и характеристике этой глюкозидазы опубликовано не было. Канисава упомянул о существовании двух β-глюкозидаз в зеленых стручках ванили: одна очень специфична для глюкованилина и глюкозида пара-гидроксибензальдегида, а другая имеет гораздо более широкий спектр активности (Kanisawa et al., 1994). Эти результаты были получены после осаждения с использованием сульфата аммония и катионообменной хроматографии. Однако, результаты экспериментов не включены в публикацию. Оду очистил и охарактеризовал β-глюкозидазу ванили. Был выделен фермент с нативной молекулярной массой 200 кДа, оптимальным pH 6,5, оптимальной температурой 40°C, Km 1,1 мМ с pNPG и 20 мМ с глюкованилином и Vm около 5 мккатал/мг с двумя субстратами (Odoux et al., 2003). Ханум получил значение Km 0,38 мМ с pNPG, а Дигнум – значение Km, равное 3,3 мМ из сырого ферментного экстракта зеленых стручков (Hanum, 1997; Dignum et al., 2004). Последний также изучал кинетические параметры сырого ферментного экстракта с различными глюкозидами. Полученные данные показывают, что фермент имеет большее сродство к глюкозидам ванилина, феруловой кислоты и пара-гидроксибензальдегида, чем к глюкозидам ванильной кислоты, гваякола и креозола, и не проявляет активности к глюкозидам пара-крезола и 2-фенилэтанола. Предыдущее исследование (Dignum et al., 2002), основанное на мониторинге ароматических соединений во время вяления в лабораторных условиях для партии ванили из Индонезии, тем не менее, показало снижение глюкозида гваякола (по крайней мере, глюкозида, идентифицированного как такой), которое оказалось менее очевидным для глюкозида ваниловой кислоты. Результаты, полученные для других соединений (только формы агликона), привели этих авторов к выводу, что образование второстепенных соединений, таких как пара-крезол и 2-фенилэтанол, кажется происходит посредством химического процесса, а не ферментативного, что отсутствие ферментативной активности в отношении глюкозидов этих двух соединений, по-видимому, подтверждает. В ходе исследования ароматических соединений, во время обработки ванили традиционным способом в Мексике, обнаруженочто из 17 идентифицированных глюкозидов 11 гидролизуются лишь незначительно, если вообще гидролизуются (Perez-Silva 2006), , что, по-видимому, подтверждает предыдущие выводы (Dignum et al., 2002). Эти 11 соединенийпредставляют собой глюкозиды креозола, 4-винилгваякола, метилсалицилата, пара-гидроксибензойной кислоты, пара-крезола, анизилового спирта, 2-фенилэтанола, фенилпропанола, бензилового спирта и коричного спирта (рис. 12.5). Подводя итог, можно сказать, что действие β-глюкозидазы на определенное количество глюкозидов-предшественников аромата четко установлено в развитии ванильного аромата во время вяления, но гораздо менее очевидно для некоторых других, даже если могут присутствовать их соответствующие агликоны (см. ниже). Тем не менее следует подчеркнуть, что с учетом очень низких концентраций этих соединений, естественной изменчивости и их реакционной способности (особенно свободных агликонов) и т. д., мониторинг во время вяления очень трудно осуществим и требует особого внимания к размеру образца, чтобы избежать иногда наблюдаемых беспорядочных смещений и колебаний. Это подразумевает конкретные исследования, которые часто отсутствуют. Подходы, которые заключаются в изучении кинетических параметров различных глюкозидов-предшественников аромата на очищенной β-глюкозидазе(ах), несомненно, более наглядны для установления раз и навсегда, являются ли эти глюкозиды субстратами фермента, но явно подразумевают получение глюкозидов и очищенного фермента, что само по себе представляет собой большой объем работы. Также можно работать с сырыми экстрактами ферментов, а не с очищенными ферментами, чтобы упростить задачу и убедиться, что все активности β-глюкозидазы (если их несколько) присутствуют в зеленых стручках. Тем не менее следует помнить, что фермент(ы) могут контактировать с продуктами, которые влияют на кинетические параметры (активаторы/ингибиторы), которые в противном случае не вступили бы в контакт с зеленой ванилью или во время вяления. Исходя из опыта, мы наблюдали во время разработки нашего ферментативного теста, что экстракция фермента с низким соотношением буфер/стручки (например, 4:1 об/мас) приводила к быстрой и значительной потере активности β-глюкозидазы (даже при использовании защитного агента, такого как антипротеаза, антиоксиданты и т. д.), в то время как очень высокое соотношение буфер/стручки (2000:1 об/мас) позволило достичь высокой стабильности в течение более 4 часов хранения при температуре окружающей среды без какого-либо защитного агента в буфере для экстракции (неопубликованные результаты). Эти наблюдения предполагают присутствие соединений, которые ингибируют активность β-глюкозидазы, в умеренно разбавленных экстрактах зеленой ванили.Другие соединения
В большинстве случаев механизмы реакции, которые приводят к появлению и/или исчезновению других ароматических соединений во время вяления, еще предстоит определить. Например, альдегиды не обнаруживаются в зеленых стручках ванили (Perez-Silva, 2006), но появляются на поздних стадиях обработки, когда их содержание достигает пика, а затем исчезают, оставаясь лишь следами, обнаруженными в ванили. Некоторые из этих альдегидов могут быть продуктами автоокисления олеиновой кислоты и линолевой кислоты (в больших количествах содержащихся в зеленой ванили). Напротив, алифатические кислоты, из которых линолевая кислота является основным представителем, содержатся в зеленых стручках, и их концентрация имеет тенденцию к снижению во время обработки. Только уксусная кислота не содержится в зеленых стручках, но после первой термообработки появляется в концентрации около 700 частей на миллион, затем снижается и стабилизируется на уровне около 200 частей на миллион. Образование уксусной кислоты может иметь микробное происхождение (Perez-Silva, 2006). Алифатические спирты также появляются после термообработки, тогда как сложные эфиры и углеводороды уже присутствуют в зеленых стручках, и их концентрация постепенно снижается во время выдержки. Как упоминалось ранее, среди соединений фенилпропаноидного пути присутствует определенное количество агликонов, несмотря на (очевидное) отсутствие гидролиза соответствующего глюкозида (как в случае пара-крезола), или они присутствуют в гораздо более высоких пропорциях, чем их концентрация предлагается в глюкозилированной форме (как в случае с ванильной кислотой) или даже присутствуют, когда глюкозилированная форма отсутствует (как в случае гваякола). Фактически, хотя известно, что глюкозилированные формы относительно химически неактивны, агликон, высвобождающийся после гидролиза, может, наоборот, стать субстратом для химических и/или ферментативных реакций и, таким образом, окисляться, восстанавливаться, декарбоксилироваться, метилироваться и т. д. поэтому взаимные превращения одного фенола в другой возможны и даже распространены. Например, концентрации ванильной кислоты выше ожидаемых можно объяснить окислением ванилина, а ванильная кислота сама может подвергаться декарбоксилированию до гваякола (Perez-Silva, 2006), что также может объяснить отсутствие глюкозида гваякола. Раствор ванилина, выдержанный при 80°C и pH 5 в присутствии кислорода в течение нескольких дней, также обнаруживает присутствие, помимо вышеупомянутых молекул, 2-метоксигидрохинона, в форме хинонов и семихинонов, что может приводить к димерам (Perez-Silva, 2006). Различные молекулы этого типа, включая диванилин, были обнаружены в ванили (рис. 12.4) и считаются положительно влияющими на аромат продукта (Gatfield et al., 2006; Schwarz and Hofmann, 2009). Гарфилд (Gatfield et al., 2006) предполагает, что образование диванилина является результатом действия пероксидазы, форма которой была недавно очищена (Marquez et al., 2008). Такая реакция также может привести к образованию крупных полимеров, которые, по крайней мере, частично ответственны за коричневый цвет ванили. Эти различные реакции, которые все начинаются с ванилина, частично объясняют значительные потери этого соединения во время вяления (Odoux, 2000; Gatfield et al., 2007), которые уже упоминались в главе 11. Другие реакции, не имеющие прямого отношения к образованию аромата, также могут объяснить эти потери ванилина, такие как сублимация, совместное испарение с водой (Frenkel and Havkin-Frenkel, 2006) или образование ковалентной связи с лигнином стручков (Gatfield et al. др., 2007).Глава 13. Морфологические, химические, сенсорные и генетические особенности таитянской ванили
О происхождении ванили
Таитянская ваниль, выращиваемая во Французской Полинезии с XIX века, была впервые описана как новый вид ванили в 1933 году Дж.В. Муром – Vanilla tahitensis. Эта специфичная форма ванили, найденная на деревьях в долине залива Фаароа (Райатеа, Острова Общества, Французская Полинезия), отличается от всех других культивируемых форм ванили, известных сегодня. От Vanilla planifolia G. Jacks. [син. Vanilla fragrans (Salisbury) Ames] V. tahitensis отличается, в частности, более тонкими стеблями, более узкими листьями, более длинными сегментами околоцветника, губой, которая короче чашелистиков, более длинной колонкой и более короткими стручками. Следовательно, для Дж.В. Мура V. tahitensis была новым видом ванили, эндемиком Французской Полинезии. Однако, род Vanilla, хотя и амфитропический, но как местный вид в Тихоокеанском регионе присутствует только в Индонезии и Юго-Восточной Азии и, за исключением культивируемых видов, полностью отсутствует на других островах Тихого океана (Florence and Guérin, 1996). Поэтому, его происхождение пришлось искать среди различных растений ванили, которые были завезены во Французскую Полинезию. Между 1848 и 1898 годами было по крайней мере три интродукции ванили из различных источников (Chevalier, 1946). Первый датируется 1848 годом. Адмирал Хамелин привез на Таити V. planifolia Andrews [syns. Vanilla aromatica Swartz и V. fragrans (Salisbury) Ames] из Манилы на Филиппинах (Costantin and Bois, 1915; Bouriquet, 1954; Florence and Guérin, 1996). Генри в 1924 году отметил, что на Таити проводились кое-какие садоводческие опыты в период с 1847 года по ноябрь 1849 года. Хотя никаких подробностей дано не было, он указал, что растение ванили, привезенное адмиралом Хамелином в 1848 году, действительно цвело и давало стручки. Семена этих стручков и могли быть источником таитянской ванили. Вторая интродукция ванили произошла в 1850 г. (Costantin and Bois, 1915). Французская Полинезия получила новые растения из Парижа, присланные адмиралом Бонаром. Было много растений V. planifolia из ботанического сада Парижа и V. pompona из Антильи (Florence and Guérin, 1996). Эти два вида до сих пор встречаются во Французской Полинезии. Но в действительности они не культивируются. Погодные условия не всегда позволяют V. planifolia цвести. Кроме того, V. pompona во Французской Полинезии считается исключительно декоративным растением. Третья интродукция растения ванили была осуществлена майором Пьером в 1874 году, который привез новые растения ванили из Мексики (Costantin and Bois, 1915; Florence and Guérin, 1996). Эти растения были описаны как лучшие виды ванили из Мексики и с Бурбона, с более широкими, толстыми и круглыми листьями, чем у ванили, выращиваемой во Французской Полинезии, которая обладает остроконечными и ланцетными листьями. По этим описаниям можно предположить, что третья интродукция также соответствовала V. planifolia. На основании морфологических и исторических сравнений было разработано множество гипотез о происхождении таитянской ванили. Согласно Портеру (Portères, 1951), морфология предполагает, что V. tahitensis была клональной популяцией, возникшей в результате расщепления естественных скрещиваний между V. fragrans (Salisbury) Ames (син. V. planifolia Andrews) и V. pompona Schiede, которая, вероятно, уже была гибридом с Vanilla odorata Presl. Портер полагает, что эта первоначальная гибридизация могла произойти во Французской Гвиане или на острове Реюньон между V. fragrans и сложным видом (V. pompona × V. odorata). Однако, по мнению Флоренс и Герена, V. tahitensis не проявляет каких-либо промежуточных признаков, которые должен проявлять гибрид между V. planifolia и V. pompona. Эти авторы считают V. tahitensis синонимом V. planifolia. Они действительно видят в этом расщепление, возникшее в результате небольшого числа интродукций. Сегреганты привнесли некоторые вариации, в результате чего появились черты, указывающие на полинезийскую форму (Florence, J. and M. Guérin, 1996). В настоящее время происхождение таитянской ванили все еще неизвестною. Тем не менее, среди лиан, встречающихся во Французской Полинезии, существует морфологическое разнообразие. Самыми культивируемыми сортами ванили во Французской Полинезии являются Таити и Хаапапе. Сорт Хаапапе впервые упоминается в 1914 году (Bouriquet, Hibon, 1950). Согласно К. Генри (Henry, 1924), Хаапапе, по-видимому, является инбредом Тиареи, описанного в 1900 году (Costantin and Bois, 1915). О сорте Тиареи сообщалось как о случае гигантизма (Henry, 1924). По сравнению морфологических признаков, цвету и аромату стручков, форма Тиареи не может быть результатом скрещивания таитянской ванили и лианы, происходящей из Мексики. Согласно Бурике и Хибону, сорт Тиареи возник в результате соматической мутации или является спонтанным гибридом V. planifolia и таитянской формы (Bouriquet and Hibon, 1950).Биология таитянской ванили
Размножают ваниль в основном стеблевыми черенками. Прорастание семян затруднено, потому что для этого нужен симбиотический гриб: Rhizoctonia. Для цветения требуется примерно 18 месяцев. Однако, эта задержка зависит от размера лианы. Черенки из 20 узлов могут зацвести менее чем через год после посадки. Цветение вызвано понижением температуры (18–19°C) и более сухой и солнечной погодой в прохладный сезон. В году часто бывает два периода цветения: основной – с июля по сентябрь, второй – с декабря по январь. Концы свисающих стеблей подсыхают и появляются 1–3 соцветия от 10 до 15 цветков. Цветок раскрывается на рассвете и увядает к вечеру. На одном соцветии ежедневно распускаются 1-2 цветка. Во Французской Полинезии нет насекомых-опылителей, поэтому опыление, или «свадьба», производится вручную рано утром, чтобы пыльца не стала слишком сухой и не перестала прилипать к стигме. Свадьба совершается в соответствии с общей процедурой, разработанной на острове Реюньон Эдмоном Альбиусом (Bouriquet, 1954, см. также главу 17). Стручки созревают через девять месяцев. До этого зеленая, ваниль начинает желтеть, а затем становится коричневой, начиная с кончика. Это указывает на то, что стручки можно собрать и вялить.Процесс вяления
Благодаря сохранению оригинальных сенсорных и физических свойств таитянская ваниль имеет уникальный аромат. Во Французской Полинезии таитянская ваниль в настоящее время считается подлинным источником культурной самобытности, демонстрирующим ноу-хау производителей и обработчиков. Полинезийцы разработали особый процесс обработки, основанный на том, что стручки собирают полностью созревшими и ароматными, с последующим естественным потемнением, способствующим развитию аромата. Для большинства выращиваемой во всем мире ванили, особенно для V. planifolia, спелость предполагает раскрытие стручков. Чтобы избежать этого явления, грозди стручков собирают до полного созревания; а затем созревание прерывается обработкой при высокой температуре. У стручков таитянской ванили редко появляются расщепившиеся кончики, и их собирают, когда они полностью созрели и обладают полным потенциалом аромата (рис. 13.1). Достигается естественное потемнение, что позволяет полностью преобразовать гликозилированные ароматические соединения в соответствующие агликоны, ответственные за ванильный аромат. РИСУНОК 13.1. Зрелые стручки таитянского сорта Хаапапе, все еще зеленые или превращающиеся в коричневые.
РИСУНОК 13.1. Зрелые стручки таитянского сорта Хаапапе, все еще зеленые или превращающиеся в коричневые.
Традиционная полинезийская обработка включает удаление воды, чтобы сконцентрировать аромат и обеспечить хорошую консервацию стручков. В процессе вяления в стручках ванили происходит множество биохимических реакций (ферментативных и неферментативных, подобных окислительным), которые приводят к развитию аромата (Odoux et al., 2006, более подробную информацию см. в главах 11 и 12). Эти биохимические реакции в таитянской ванили мало изучены. Таитянская обработка состоит из трех основных этапов, требующих большого терпения и тщательности (Larcher, 1989; Ranadive, 1994): 1. Потемнение в тени. После сбора урожая, зрелые стручки ванили выдерживаются в тени до тех пор, пока они не станут однородными и не приобретут сладкий запах. После их моют и сушат. 2. Сушка на солнце. Стручки подвергаются воздействию солнечных лучей на несколько часов в день, в течение нескольких недель. Содержание воды в них снижается с 80% до желаемой конечной влажности (50–55%). Когда они подвергаются воздействию тепла или солнца; вода испаряется. Затем, пока они еще теплые, ваниль заворачивают в хлопковые простыни, называемые «фараойти», и помещают на ночь в деревянные ящики, чтобы предотвратить потерю воды при пропаривании. Стручки становятся эластичными и блестящими, поскольку их эпидермис все больше покрывается маслом. При необходимости их массируют по одному для распределения и гомогенизации семян по длине. 3. Сушка на воздухе (рафинирование). Окончательно стручки сушат в тени для гомогенизации партий и стабилизации содержания воды, что обеспечивает оптимальный срок хранения. Процесс вяления позволяет развить аромат таитянской ванили. Стручки приобретают сладко-пахнущий и богатый анисовый запах. Их физические свойства также улучшаются, поскольку они демонстрируют очень привлекательную маслянистую текстуру и внешний вид. Липидные компоненты участвуют как в формировании этих свойств, так и в развитии аромата, поскольку они ограничивают потери, происходящие во время процесса.
Морфологические особенности и разнообразие
Таитянская ваниль отличается более тонким стеблем, чем V. planifolia или V. pompona, со средним диаметром стебля 8 мм и междоузлиями длиной 13 см, иногда очень длинными, до 19 см. Листья также более тонкие (рис. 13.2), узкоовальные, ланцетные, постепенно становящиеся сильно заостренными, в 3–7 раз длиннее своей ширины, темно-зеленого цвета, не очень толстые, плоские или слегка желобчатые к основанию, 16–25 см длиной и 2–5 см шириной. Черешок в среднем 15 мм длиной, выраженно-бороздчатый сверху. РИСУНОК 13.2. Сравнение размера и формы листьев V. pompona, V. planifolia и V. tahitensis сорта Хаапапе (слева направо).
РИСУНОК 13.2. Сравнение размера и формы листьев V. pompona, V. planifolia и V. tahitensis сорта Хаапапе (слева направо).
 РИСУНОК 13.3. Сравнение цветков V. pompona, V. planifolia и V. tahitensis сорта Хаапапе (слева направо).
РИСУНОК 13.3. Сравнение цветков V. pompona, V. planifolia и V. tahitensis сорта Хаапапе (слева направо).
Цветки таитянской ванили собраны в соцветие. В среднем соцветия имеют длину 9,2 см, цветы зеленоватые, с некоторыми частями более желтыми, чем у V. planifolia (рис. 13.3). Чашелистики узко-продолговатые, острые у основания, утонченно-заостренные к верху, 9–16 мм шириной, 55–77 мм длиной, без жилок с обратной стороны. Лепестки имеют длину 50–74 мм, ширину 7–13 мм, эллиптические, подострые. Лабеллум 46–49 мм в длину, воронкообразный, с небольшими оранжевыми пунктирными линиями на внутренней стороне, с отогнутым краем, бахромчато-зубчатый. Плоды таитянской ванили, ароматные, как правило, нераскрывающиеся, в отличие от V. planifolia. Сегодня основными сортами таитянской ванили являются Таити и Хаапапе. Но местные фермеры различают около 14 сортов, отличающихся формой, длиной и шириной листьев, размером цветов, а также размером и формой стручков. Пять основных культивируемых форм описаны ниже и показаны на рисунках с 13.4 по 13.6.
Таити
Стебель в среднем 8 мм в диаметре с длиной междоузлий 13 см. Листья плоские или слегка желобчатые к основанию, в длину около 18 см и в ширину 3 см, с черешком длиной 13 мм. Размер чашелистиков в среднем составляет 14 × 65 мм, а лепестков – 11 × 64 мм. Губа белая с короткими волосками и пунктирными линиями темно-оранжевого цвета. Плоды чисто-зеленого цвета, треугольные, длиной 10–19 см (в среднем 14 см) и весят в среднем 10,5 г. По мере созревания стручки мало растрескиваются.Хаапапе
Стебель больше, чем у «Таити», со средним диаметром 10 мм и длиной междоузлий 16 см. Листья желобчатые, длиной около 17 см и шириной 3 см, с черешком длиной 18 мм. Цветение менее обильное, чем у «Таити», но более крупные цветки Хаапапе легче опылять. Чашелистики и лепестки длиннее, чем у «Таити»: в среднем около 13 × 70 мм и 10 × 68 мм соответственно. РИСУНОК 13.4. Формы растений и листьев основных полинезийских сортов ванили.
РИСУНОК 13.4. Формы растений и листьев основных полинезийских сортов ванили.
 РИСУНОК 13.5. Цветовое разнообразие губы таитянской ванили: (а) сорт Реа-Реа; (b) сорт Хаапапе.
РИСУНОК 13.5. Цветовое разнообразие губы таитянской ванили: (а) сорт Реа-Реа; (b) сорт Хаапапе.
 РИСУНОК 13.6. Различия в размере, форме и цвете стручков таитянской ванили: (a) Таити, (b) Хаапапе, (c) Реа-Реа, (d) Парахураху и (e) Таити Лонг. Желтая метка длиной 10 см.
РИСУНОК 13.6. Различия в размере, форме и цвете стручков таитянской ванили: (a) Таити, (b) Хаапапе, (c) Реа-Реа, (d) Парахураху и (e) Таити Лонг. Желтая метка длиной 10 см.
Губа белая, с длинными волосками и пунктирными линиями темно-оранжевого цвета. Плоды очень темного цвета, округлые, тупые на конце, длиной 13–23 см (в среднем 18 см) и весят в среднем 16,3 г. Стручки очень редко растрескиваются по мере созревания.
Реа-Реа
Стебель утонченный, со средним диаметром 7 мм и относительно короткими междоузлиями длиной 13 см. Листья, скорее продолговатые, чем ланцетные, около 20 см длиной, 4 см шириной, с черешком 16 мм длиной. Размер чашелистиков составляет около 13 × 62 мм, а размер лепестков – 11 × 61 мм. Губа белая со светло-оранжевыми пунктирными линиями. Плоды треугольные, желтовато-зеленого цвета, длиной 11-17 см (в среднем 14 см), массой около 9,9 г. По мере созревания стручки довольно часто растрескиваются.Парахураху
Стебель также тонкий, в среднем 7 мм в диаметре с длиной междоузлий 14 см. Листья плоские или слегка желобчатые к основанию, короткоостроконечные, около 15 см в длину и 3 см в ширину, с черешком 16 мм длиной. Размер чашелистиков составляет около 12 × 63 мм, а размер лепестков – около 10 × 61 мм. Губа белая с белыми волосками и пунктирными линиями светло-оранжевого цвета. Стручки темно-зеленого цвета, имеют форму дубинки, длиной 10–18 см (в среднем 14 см) и вес около 14,1 г. Стручки очень редко растрескиваются по мере созревания.Таити Лонг
Стебель тонкий, диаметром около 7 мм с короткими междоузлиями 13 см. Листья плоские или слегка желобчатые к основанию, около 15 см в длину и 3 см в ширину, с черешком 15 мм. Цветки мельче, чем у предыдущих сортов; чашелистики в среднем имеют размер 11 × 59 мм, а лепестки – 9 × 58 мм. Губа белая, с длинными волосками и светло-желтыми пунктирными линиями. Конец губы шиповатой формы. Плоды светло-зеленого цвета, округлые, тонкие, тупые на конце, длиной 11–24 см (в среднем 17 см) и массой около 11,1 г. По мере созревания стручки редко растрескиваются. Растениеводы выделяют множество других морфологических типов, кроме описанных выше. Эти типы различаются размером и шириной листьев, а также размером, формой и цветом стручков. Эти виды ванили на самом деле не выращиваются, поскольку их плоды не соответствуют критериям, установленным нормативными актами (подробности см. в главе 24), но они демонстрируют настоящее морфологическое разнообразие. Примеры: Овири, у которого листья меньше (14 см × 3 см), чем у «Таити», и более короткие стручки (в среднем 11 см); Пуроини, имеющий листья в форме сердца; Потити и «Таити» или «Хаапапе» имеют одинаковый размер и форму листьев, но «Потити» дает очень мелкие плоды (в среднем 10 см). Наконец, «двухцветное» (вариегатное) растение ванили, на листьях которого видны светло-желтые полосы, также присутствует в сельскохозяйственных системах.Химический состав таитянской ванили
Таитянская ваниль сильно отличается от других выращиваемых в мире ванилей, особенно по сравнению с V. planifolia, своим тонким вкусом и богатым анисовым ароматом, а также глянцевым внешним видом и гибкостью своих стручков. Чтобы охарактеризовать оригинальность таитянской ванили, в лаборатории Etablissement Vanille de Tahiti были разработаны методы анализа её химического состава, особенно интересующих молекул, а именно ароматических соединений и жирных кислот.Ароматический состав таитянской ванили
Оригинальный ароматический состав
Благодаря своим сенсорным свойствам стручки ванили в основном изучаются на предмет их ароматических соединений. Первая комплексная работа по летучим компонентам ванили была проведена в 1976 году Климесом и Лампарским, которые идентифицировали с помощью газовой хроматографии (ГХ)-масс-спектрометрии (МС) 169 соединений в V. planifolia. Затем несколько исследований состава аромата таитянской ванили подчеркнули его оригинальность по сравнению с V. planifolia по наличию основных фенольных соединений, включая широко упомянутые анизильные соединения, присутствующие в более высоких количествах, и, реже, присутствие второстепенных соединений. Различные исследования таитянской ванили описывают аромат, составленный из следующих молекул (см. таблицу 13.1 для химической структуры), содержание которых отличается от V. planifolia, как подробно описано ниже. Ниже перечислены десять основных фенольных соединений: а. Ванилин, пара-гидроксибензальдегид, ванильная кислота и пара-гидроксибензойная кислота (Fayet et al., 1987; Ranadive, 1992; Langella et al., 2003) обычно количественно определяются в V. planifolia для проверки подлинности натуральной ванили. b. Четыре анизильных соединения, характерные для таитянской ванили: i. Анизиловый спирт и анисовая кислота, которые вместе с ванилином являются наиболее концентрированными соединениями таитянских стручков ванили. Они были идентифицированы с помощью ГХ-МС (Adedeji et al., 1993), подтверждая предыдущие работы (Shiota and Itoga, 1975; Lhuguenot, 1978; Tabacchi et al., 1978; Rey et al., 1980; Purseglove et al., 1981; Larcher, 1989; Hartman, 2003). ii. пара-Анисальдегид (Tabacchi et al., 1978) и метиланизат (Shiota, Itoga, 1975; Adedeji et al., 1993; Lechat-Vahirua and Bessiere, 1998; Sostaric et al., 2000), которые менее концентрированы. c. Другие фенольные соединения в незначительных количествах: протокатехуальдегид, протокатеховая кислота, сиринговая кислота и пара-гидридроксибензиловый спирт (Fayet et al., 1987). Второстепенные компоненты с различными химическими функциями: d. Ароматические сложные эфиры: анизилацетат, анизилформиат и метилциннамат (Shiota, Itoga, 1975; Adedeji et al., 1993; Sostaric et al., 2000; Hartman, 2003). е. Другие фенольные соединения (Shiota, Itoga, 1975; Scharrer, 2002). f. Альдегиды, кетоны и лактоны: 2,4-декадиеналь, 3-метилпентаналь, 2-метил-2-пентанон, 1-метокси-2-пропанон, изовальдегид и гамма-ноналактон (Adedeji et al., 1993; Lechat Vahirua and Bessiere, 1998; Scharrer, 2002). g. Монотерпены (α-пинен, β-пинен, лимонен, линалоол, терпинен-4-ол и α-терпинеол (Scharrer, 2002). h. Алифатические сложные эфиры (к примеру, этилгексаноат, этилнонаноат и этилдеканоат) (Sostaric et al., 2000). i. Гетероциклические соединения, алифатические кислоты и спирты (Fayet et al., 1987). j. Производные анизильных соединений (Da Costa and Pantini, 2006).ТАБЛИЦА 13.1. Основные молекулы аромата, идентифицированные и количественно определенные в таитянской ванили

| Семейство | Молекула | Использованное название | R1 | R2 | R3 | R4 |
|---|---|---|---|---|---|---|
| Ванилил | Ванилиновый спирт | Van_alc | CH2OH | OCH3 | OH | H |
| Ванилин | Van | COH | OCH3 | OH | H | |
| Ванильная кислота | Van_ac | COOH | OCH3 | OH | H | |
| пара-Гидроксибензил | пара-Гидроксибензиловый спирт | Phb_alc | CH2OH | H | OH | H |
| пара-Гидроксибензальдегид | Phb | COH | H | OH | H | |
| пара-Гидроксибензойная кислота | Phb_ac | COOH | H | OH | H | |
| Метил пара-гидроксибензоат | Me_paraben | COOCH3 | H | OH | H | |
| Анисил | Анисовый спирт | Anis_alc | CH2OH | H | OCH3 | H |
| Анисовый альдегид | Anis_ald | COH | H | OCH3 | H | |
| Анисовая кислота | Anis_ac | COOH | H | OCH3 | H | |
| Метиланизат | Me_anis | COOCH3 | H | OCH3 | H | |
| Протокатехил | Протокатехуальдегид | Pro_ald | COH | OH | OH | H |
| Протокатехиновая кислота | Pro_ac | COOH | OH | OH | H | |
| Изованиллил | Изованилин | Isovan | COH | OH | OCH3 | H |
| Другие | Сиринговая кислота | — | COOH | OCH3 | OH | OCH3 |
Присутствие пиперонала (гелиотропина) в качестве характерного компонента таитянской ванили долгое время было предметом споров. Окончательно показано (Joulain et al., 2007), что предполагаемым характерным пахучим компонентом таитянской ванили является пара-анисальдегид, а пиперонал присутствовал в таитянской ванили, но только как микрокомпонент, также как в V. planifolia, подтверждая предыдущие работы (Tabacchi et al., 1978; Ehlers et al., 1994; Lechat-Vahirua and Bessiere, 1998). В лаборатории Etablissement Vanille de Tahiti сильный, оригинальный и всеобъемлющий аромат таитянской ванили был проанализирован с помощью жидкостной хроматографии высокого давления (ВЭЖХ) основных ароматических фенольных соединений. Работа была сосредоточена на роли процесса выдержки в развитии уникального вкуса, а также на ароматическом составе некоторых полинезийских сортов. Было проанализировано более 300 образцов вяленых стручков ванили с Таити из трех последовательных ежегодных урожаев (2005, 2006 и 2007). Вяленые стручки таитянской ванили богаты общими ароматическими соединениями и содержат в среднем 4,6% сухого вещества по сравнению с 2,1–4,2% для V. planifolia. Более того, ароматический состав таитянской ванили более разнообразен, с меньшим вкладом ванилина в общий аромат (30% против 80% для V. planifolia). В то время как уровень ванилина оказывает меньшее влияние (1,2% против 1,7–3,5% у V. planifolia), таитянская ваниль содержит большее количество молекул анисила (2,1% при менее 0,05% у V. planifolia) и пара-гидроксибензальдегида. Наиболее концентрированными молекулами анисила являются анизиловый спирт и анисовая кислота (соответственно 1,35% и 0,75% от сухого вещества); пара-анисальдегид и метиланизат составляют около 200 частей на миллион каждый, тогда как у V. planifolia они присутствуют только в следовых количествах.
Эволюция ароматических соединений в процессе вяления
На аромат таитянской ванили влияют многие факторы – генетические, агрономические, климатические и критерии трансформации. Фактически, её ценный аромат становится все более интенсивным в процессе обработки. Тем не менее, если стручки ванили теряют воду под воздействием солнца, некоторые ароматические соединения тоже испаряются, и партии стручков приобретают приятный ванильный аромат. Исследования аромата ванили во Французской Полинезии сосредоточены на фенольных соединениях, которые способствуют общему запаху. Четырнадцать «ароматических соединений» из этанольного Сокслет-экстракта оценивали с помощью ВЭЖХ во время процесса вяления (см. таблицу 13.1). Что касается процесса сушки, происходит последующая потеря ароматических молекул. Когда стручки сушат до содержания влаги 38%, они теряют примерно треть своего ароматического потенциала, от 6,5% до 4,6% сухого веса. Однако, учитывая, что потеря воды более существенна, чем потеря ароматических соединений, их концентрация на грамм свежего веса фактически увеличивается в течение периода вяления. Различия в летучести между ароматическими соединениями и реакциями окисления, протекающими в стручках (от спирта до альдегида, а затем до кислотной функции), включают различные изменения концентраций молекул (см. рис. 13.7). Высокие концентрации ванилина и анизилового спирта подвергаются значительному снижению, тогда как концентрации ванильной кислоты и анизальдегида растут из-за их образования вследствие окисления предыдущих основных соединений (соответственно, ванилина и анизилового спирта).
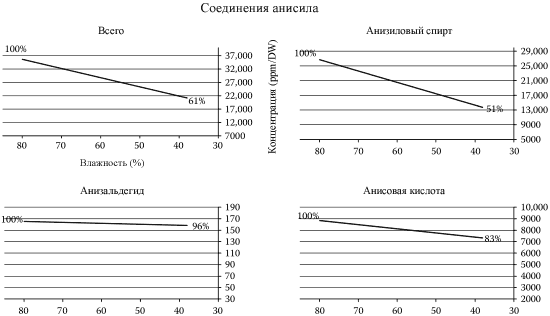 РИСУНОК 13.7. Развитие основных ароматических соединений таитянской ванили в процессе обработки. Вариация содержания соединений указывается в процентах от исходного содержания.
РИСУНОК 13.7. Развитие основных ароматических соединений таитянской ванили в процессе обработки. Вариация содержания соединений указывается в процентах от исходного содержания.
Содержание влаги влияет на ароматический состав: сушка способствует накоплению молекул кислот (анисовой и пара-гидроксибензойной кислоты) и снижению соотношения анизилового спирта и ванилина (рис. 13.8). Активный запах пара-анисальдегида является ключевым компонентом оригинального аромата таитянской ванили, так как его концентрация удваивается в процессе обработки. Поскольку содержание влаги в некоторой степени влияет на качество аромата, очень важно предоставить подробную информацию о её содержании при описании состава ванильных стручков (Collard, 2007). Процесс вяления таитянской ванили представляет собой тонкий компромисс между оптимальной сушкой и сохранением ароматических соединений. В результате получается оригинальная ароматическая композиция.
 РИСУНОК 13.8. Ароматический состав стручков таитянской ванили для разного содержания влаги (80%, 60% и 40%). Полные названия молекул см. в таблице 13.1.
РИСУНОК 13.8. Ароматический состав стручков таитянской ванили для разного содержания влаги (80%, 60% и 40%). Полные названия молекул см. в таблице 13.1.
Сорта таитянской ванили демонстрируют различные ароматические составы
Таитянская ваниль приобретает экзотический аромат по сравнению с другими видами ванили. Существует внутривидовое разнообразие с различными сортами и нюансами вкусов. У таитянской ванили есть морфологическое разнообразие, что подтверждается различным химическим составом. Исследование было проведено на основе оценки аромата необработанных стручков пяти важнейших сортов Французской Полинезии (наиболее культивируемых Таити и Хаапапе, Реа-Реа, Парахураху и Таити Лонг). Каждый сорт развивает свои ароматические характеристики. Таблица 13.2 показывает, что общее количество ароматических молекул меняется от одного сорта к другому, а концентрации некоторых молекул отличаются, внося вклад в структурные группы при статистическом анализе. Выполнение факторного дискриминантного анализа показывает очень хорошее соответствие между, полученной с переменными аромата, наблюдаемой классификацией и встречающимися в природе сортами (см. рис. 13.9) (Collard et al., 2006). РИСУНОК 13.9. Двумерный график пяти сортов необработанных стручков таитянской ванили в факторном дискриминантном анализе с использованием ароматических соединений (см. таблицу 13.2) в качестве переменных.
РИСУНОК 13.9. Двумерный график пяти сортов необработанных стручков таитянской ванили в факторном дискриминантном анализе с использованием ароматических соединений (см. таблицу 13.2) в качестве переменных.
ТАБЛИЦА 13.2. Ароматические соединения (ppm) пяти сортов таитянской ванили (необработанные стручки), определенные количественно с помощью ВЭЖХ на Etablissement Vanille de Tahiti
| Молекула* | Парахураху | Реа-Реа | Таити Лонг | Хаапапе | Таити |
|---|---|---|---|---|---|
| № образца | 18 | 13 | 15 | 23 | 110 |
| Van_alc | 243a | 909e | 407b | 514c | 614d |
| Van | 806a | 17,718c | 11,732b | 13,337b | 20,184d |
| Van_ac | 87a | 316e | 177b | 197c | 227d |
| Phb | 2504c | 352a | 4221d | 2621c | 2081b |
| Phb_ac | 7101c | 4932a | 7275c | 7202c | 6007b |
| Anis_alc | 7156a | 13,108b | 16,397c | 20,158d | 21,117d |
| Anis_ald | 46a | 65b | 71b | 82b | 65b |
| Anis_ac | 16,026c | 4896a | 8103b | 8736b | 7907b |
| Pro_ald | 1101a | 1421b | 2585c | 2758c | 2628c |
| Pro_ac | 220b | 216b | 219b | 188ab | 169a |
| Σ Van | 1137a | 18,943c | 12,316b | 14,048b | 21,025c |
| Σ Phb | 9605c | 5284a | 11,496d | 9823c | 8088b |
| Σ Anis | 23,228b | 18,069a | 24,571b | 28,976c | 29,088c |
| TOTAL | 35,290a | 43,933b | 51,186c | 55,793d | 60,998e |
Среди полинезийских сортов Парахураху очень специфичен со значительно меньшим суммарным количеством, низким содержанием молекул ванилила и более высоким уровнем анисовой кислоты. Сорт Реа-Реа демонстрирует меньшее количество пара-гидроксибензальдегида и большее количество соединений ванилила, отличаясь от группы, образованной Таити, Хаапапе и Таити Лонг, все из которых обладают очень похожими ароматическими композициями. Стручки Таити Лонг характеризуются высоким содержанием пара-гидроксибензальдегида. Таити и Хаапапе – сорта с наиболее похожими ароматическими композициями, хотя Таити богаче общим ароматом и ванилиловными соединениями, а Хаапапе содержит относительно больше пара-гидроксибензильных и анизильных компонентов. Ароматический состав может объяснить оригинальный запах таитянской ванили и показать небольшие различия между основными сортами. Как было замечено ранее, оригинальность таитянской ванили обусловлена не только запахом, но и маслянистой текстурой.
Состав жирных кислот таитянской ванили
Состав жирных кислот – интересная тема для лучшего понимания физических и сенсорных свойств более маслянистой таитянской ванили (см. раздел «Сенсорные свойства»). Некоторые предыдущие химические исследования ванильных стручков связаны с присутствием жирных кислот или производных жирных кислот. Основными идентифицированными компонентами были олеиновая или пальмовая кислота (Purseglove et al., 1981; Adedeji et al., 1993; Lechat-Vahirua and Bessiere, 1998). Всестороннее исследование липидной фракции ванильных стручков V. tahitensis, V. planifolia и Vanilla madagascariensis с помощью ГХ выявило различающиеся составы жирных кислот, с преобладанием линолевой кислоты среди 31 жирной кислоты у каждого вида (Ramaroson-Raonizafinimanana, 1988). Кроме того, были идентифицированы многие дополнительные липидные компоненты: фитостерины (Ramaroson-Raonizafinimanana et al., 1998), углеводороды (Ramaroson-Raonizafinimanana et al., 1997) и два новых семейства продуктов: длинноцепочечные γ-пироны (Ramaroson-Raonizafinimanana et al., al., 1999) и длинноцепочечные β-дикетоны (Ramaroson-Raonizafinimanana et al., 2000). На Etablissement Vanille de Tahiti работа над липидным экстрактом была направлена на определение характеристик таитянской ванили и её различных сортов по составу жирных кислот. Производные жирных кислот анализировались с помощью ВЭЖХ. Было идентифицировано около 10 жирных кислот, и идентификация некоторых из них была подтверждена ГХ (Brunschwig et al., 2007). Определены шесть распространенных жирных кислот, происходящих из первичных метаболитов, таких как триглицериды: линоленовая 18:3, линолевая 18:2, пальмитиновая 16:0, олеиновая 18:1, стеариновая 18:0 и эруковая 20:1 кислоты. В стручках ванили были идентифицированы четыре мононенасыщенные жирные кислоты с очень длинной цепью, которые редко встречаются в растениях: нервоновая (24:1), ксименовая (26:1), октакозен-19-овая кислота (28:1) и люмековая (30:1) кислоты. Эти жирные кислоты происходят из вторичных метаболитов (предполагаемых β-дикетонов), и их состав может быть гораздо более изменчивым, чем состав первичных метаболитов (Ramaroson-Raonizafinimanana, 1988). Состав жирных кислот показывает, что таитянская ваниль богаче жирными кислотами, отличающими полинезийские сорта. Вяленые стручки таитянской ванили имеют среднее содержание жирных кислот выше, чем другие сорта ванили в мире (в среднем 2,5% сухого вещества по сравнению с 1,2–2,4% у прочих), что может объяснить привлекательный глянцевый имаслянистый вид стручков (Brunschwig et al., 2007). Стручки таитянской ванили содержат в основном полиненасыщенные жирные кислоты (с преобладанием линолевой кислоты от 55% до 65%), мононенасыщенные жирные кислоты (от 20% до 30%) с заметным содержанием мононенасыщенных длинноцепочечных жирных кислот (5–13%) и немного насыщенных жирных кислот (около 15%). Это подтверждает предыдущие данные.ТАБЛИЦА 13.3. Состав жирных кислот (ЖК) (%) липидного экстракта из различных сортов таитянской ванили (необработанные стручки)
| Парахураху | Таити Лонг | Хаапапе | Таити | V. tahitensis* | |
|---|---|---|---|---|---|
| № образца | 8 | 6 | 8 | 8 | 1 |
| 16:0–пальмитиновая | 9.8a | 10.4a | 9.4a | 9.6a | 8.2 |
| 18:0 + 20:1 стеариновая + эруковая | 3.9a | 4.4b | 3.9a | 4.7b | 3.6 |
| 18:1 ω9–олеиновая | 15.7a | 17.5b | 15.2a | 15.3a | 12.9 |
| 18:2 ω6–линолевая | 53.9a | 58.1b | 63.7d | 61.2c | 67.4 |
| 18:3 ω3–линоленовая | 3.7b | 2.8a | 2.5a | 2.2a | 1.3 |
| Общее содержание ЖК | 87.0a | 93.2b | 94.7c | 93.0b | 93.3 |
| 24:1 ω9–нервоновая | 6.6c | 3.5b | 2.4a | 3.5b | 4.5 |
| 26:1 ω9–ксименовая | 2.0c | 1.3b | 0.9a | 1.3b | 1.0 |
| 28:1 ω9–октасен-19овая | 2.1b | 1.1a | 1.0a | 1.2a | 0.6 |
| 30:1 ω9–люмековая | 2.2b | 0.9a | 0.9a | 1.0a | 0.5 |
| Общие длинноцепочечные ЖК | 12.9c | 6.8b | 5.2a | 7.0b | 6.7 |
| Насыщенная ЖК | 13.7a | 14.8a | 13.3a | 14.3a | 11.8 |
| Мононенасыщенные ЖК | 28.6d | 24.3c | 20.4a | 22.3b | 19.5 |
| Полиненасыщенные ЖК | 57.6a | 60.9b | 66.2d | 63.4c | 68.6 |
| Ненасыщенные ЖК | 86.2a | 85.2a | 86.6a | 85.7a | 88.2 |
| Всего (ppm) | 9147a | 12,950b | 16,978b | 14,152b | — |
Сорта из Французской Полинезии демонстрируют совершенно различные составы жирных кислот, что иллюстрируется таблицей 13.3. Химическое внтривидовое разнообразие, выявленное факторным дискриминантным анализом, показывает, что Парахурау очень специфичен со значительно более высоким содержанием мононенасыщенных длинноцепочечных жирных кислот (особенно нервоновой кислоты) и линоленовой кислоты (рис. 13.10).
 РИСУНОК 13.10. Двумерный график четырех сортов необработанных стручков таитянской ванили, проанализированных с помощью факторного дискриминантного анализа с использованием жирных кислот в качестве переменных (см. таблицу 13.3).
РИСУНОК 13.10. Двумерный график четырех сортов необработанных стручков таитянской ванили, проанализированных с помощью факторного дискриминантного анализа с использованием жирных кислот в качестве переменных (см. таблицу 13.3).
Другие сорта имеют аналогичный состав с небольшими вариациями: Таити показывает большее количество стеариновой кислоты, Таити Лонг отличается значительно более высоким содержанием олеиновой, а Хаапапе – самый маслянистый среди полинезийских сортов. Химическое разнообразие полинезийских сортов выделяется как разнообразием ароматов, так и жирными кислотами.
Заключение
Стручки таитянской ванили обладают специфическим ароматом и составом жирных кислот. Самым оригинальным сортом является Парахурау, который содержит относительно высокий уровень анизильных молекул и небольшое количество ванилиловых соединений, а также очень высокий уровень мононенасыщенных длинноцепочечных жирных кислот. Сорта наиболее культивируемые во Французской Полинезии, а именно Таити и Хаапапе, обладают однородным ароматом и липидными характеристиками. Их ароматический состав и высокое содержание жирных кислот объясняют, соответственно, их тонкие сенсорные свойства и привлекательный внешний вид.Сенсорные свойства
Сенсорные свойства таитянской ванили уникальны. Их часто анализируют либо путем сенсорной оценки, либо с помощью ГХ-О. Эти два метода, соответственно, (i) описывают общий аромат ванили и (ii) определяют вещества, обладающие активным запахом, которые вносят вклад в общий аромат ванили.Сенсорная оценка
Сенсорные свойства ванильных стручков в первую очередь обусловлены летучими компонентами, но некоторые нелетучие соединения, такие как липиды, могут играть роль в изменении восприятия аромата (Purseglove et al., 1981). Их влияние на запах еще не изучено, но в процессе обработки они фиксируют некоторые летучие вещества и ограничивают их выделение из стручков ванили. При сенсорном анализе таитянская ваниль описывается как имеющая отчетливые цветочные, благоухающие, душистые, анисовые, миндальные и вишневые ноты. Стручки также отличаются от стручков V. planifolia неглубоким ванильным характером, также как и более слабыми фенольными, древесными, бальзамическими и дымными нотами (Ranadive, 1994, 2006; Petitdidier, 2005). Между сенсорными свойствами и количественными аналитическими параметрами (см. раздел «Химический состав таитянской ванили») четкой взаимосвязи не существует. Для V. planifolia высокое содержание ванилина, которое является показателем качества, не обязательно означает хорошие сенсорные свойства. Фактически, из-за высокого порога запаха некоторые основные соединения, количественно содержащиеся в ванильных стручках, не связаны напрямую с сенсорными свойствами экстрактов, поскольку в общем аромате ванили участвуют второстепенные соединения (Ranadive, 2006; Gassenmeier et al., 2008). Поэтому был проведен ГХ-О анализ.ГХ-О анализ
Чтобы описать общий аромат ванили, недавние исследования учитывали обонятельное воздействие соединений ГХ-О, а не только их концентрацию в стручках (Scharrer, 2002; Black, 2005; Perez-Silva et al., 2006). Такие соединения, как анисальдегид и анисиловый спирт, в значительной степени определяют характерный аромат таитянской ванили и необходимы для сладких нот аниса (www.flavornet.org). Некоторые другие соединения, такие как ароматические анизиловые эфиры (метиланизат присутствует в таитянской ванили в концентрации 200 ppm), могут оказывать обонятельное воздействие на общий аромат. Таким образом, исследование таитянской ванили позволяет идентифицировать 276 компонентов. Среди них некоторые второстепенные специфические молекулы анизила ощущаются и описываются как «анисовый, вишневый, сладкий» (Da Costa and Pantini, 2006). Было обнаружено, что некоторые фенольные соединения, идентифицированные в таитянской ванили с помощью ГХ-О, обладают ароматической активностью в стручках V. planifolia (ванилин, ванилиновый спирт, пара-гидроксибензальдегид, пара-гидридроксибензиловый спирт, анизиловый спирт и метилциннамат). Этим соединениям приписывались сладкие, древесные, бальзамические, пряные, ванильные и поджаренные ноты. Более того, было обнаружено, что второстепенные соединения, присутствующие в количестве менее 2 частей на миллион, способствуют общему аромату ванили – такие как альдегиды, которые проявляются с зелеными, масляными и похожими на травы цветочными нотами, и алифатические кислоты, описанные как имеющие кислые, жирные, и маслянистые ноты (Perez-Silva et al., 2006). Эти исследования выявили специфический анисовый аромат таитянской ванили, известной на мировом рынке как уникальная и считающейся роскошным продуктом.Генетическая специфичность
Генетическая связь между таитянской ванилью и другими культивируемыми видами ванили
Чтобы определить, отличается ли таитянская ваниль генетически от других культивируемых видов ванили, было проведено сравнительное исследование генетического разнообразия. В этом проекте участвовали Бюро генетических ресурсов (BRG), Центр международного сотрудничества в области агрономических исследований для развития (CIRAD), Etablissement Vanille de Tahiti, Университет острова Реюньон и Институт биотехнологии растений (IBP) (Andrzejewski et al., 2006; Duval et al., 2006). Культивируемые виды V. planifolia (47 образцов), V. pompona (6 образцов) и полинезийские сорта (6 образцов) с острова Реюньон, Центральной Америки и Французской Полинезии, а также 35 родственных видов из Таиланда, Бразилии, Гвианы, Камеруна и ботанических садов. Паттерн полиморфизма длины фрагмента амплификации (AFLP) каждого образца сравнивали с другими образцами, и данные использовали для расчета различий между образцами в соответствии с индексом Сокала и Миченера. Структура генетического дерева представляет разграничение видов с высокой степенью точности (бутстрапы 100%). Это исследование показало, что таитянская ваниль генетически очень отличается от других культурных или дикорастущих видов ванили. Таитянская ваниль также сравнивалась с несколькими дикорастущими или культивируемыми видами ванили из Центральной Америки в сотрудничестве с Риверсайдским университетом (Lubinsky et al., 2008). Было оценено предполагаемое происхождение таитянской ванили. Паттерны последовательностей ДНК из геномов ядерного внутреннего транскрибированного спейсера (ITS) и хлоропластов сравнивались между полинезийскими сортами и образцами, собранными в тропических лесах Центральной Америки: V. planifolia, V. odorata, V. insignis, V. pompona и несколькими другими видами. Эти данные показали, что двумя генетически наиболее близкими к таитянской ванили видами были V. planifolia и V. odorata, и, таким образом, указали, что эти два вида тесно связаны с предками таитянской ванили. Это исследование поддерживает гипотезу Портера, который предположил, что таитянская ваниль возникла в результате гибридизации между V. planifolia и другим гибридом с участием V. odorata (Porteres, 1951).Полинезийское генетическое разнообразие
В то же время было проанализировано генетическое разнообразие полинезийских сортов. Морфологическое разнообразие таитянской ванили, которое позволило местным производителям выделить 14 сортов, связано с генетическим разнообразием. Это генетическое разнообразие определяется вариациями на уровне последовательностей ДНК, выявленными при сравнении паттернов AFLP между различными сортами. Паттерны AFLP определялись присутствием или отсутствием каждого из 529 протестированных маркеров AFLP. Сравнение этих паттернов AFLP показало, что, несмотря на генетическое разнообразие, существующее в пределах таитянской ванили, все образцы собраны и образуют только одну монофилетическую группу (Andrzejewski et al., 2006; Рисунок 13.11). Генетическое разнообразие слабое (максимальное расстояние между образцами = 0,091), что связанно с размножением стеблевыми черенками, а не половым путем. Для некоторых сортов наблюдались многие образцы AFLP, указывая на то, что производители недооценили разнообразие и необходимо определить новые сорта. РИСУНОК 13.11. Структура разнообразия сообществ 42 образцов культивируемых ванилей и Vanilla bahiana и подробные взаимосвязи полинезийских сообществ, полученные из деревьев присоединения соседей с использованием матрицы расстояний Сокала и Миченера (529 переменных и 1000 бутстрапов).
РИСУНОК 13.11. Структура разнообразия сообществ 42 образцов культивируемых ванилей и Vanilla bahiana и подробные взаимосвязи полинезийских сообществ, полученные из деревьев присоединения соседей с использованием матрицы расстояний Сокала и Миченера (529 переменных и 1000 бутстрапов).
Некоторые другие сорта не различались по образцу AFLP; так было с Таити и Хаапапе. Их морфологические различия были однозначными; тем не менее, их генетическое разнообразие оказалось только следствием количества копий каждого маркера AFLP. По этой причине были разработаны цитогенетические анализы. Как было ранее описано для V. planifolia, у таитянской ванили клетки корня не имеют одинакового хромосомного набора (Nair and Ravindran, 1994). Мы также наблюдали эти вариации для образцов V. planifolia и V. pompona. У полинезийских образцов наблюдались три уровня плоидности. Количество хромосом для многочисленных метафазных пластинок кончиков корней и измерения размера генома с помощью проточной цитометрии совпадали. Выделено три группы: 1. Диплоидная группа (2 ×) с числом хромосом от 22 до 31 и размером генома от 4,87 до 5,80 пг. Эти характеристики касались большинства полинезийских сортов: Таити (рис. 13.12), Реа-Реа, Парахураху, Овири, Парааути, Потити, Пуроини, Пупа, Попоти и Пура. 2. Триплоидная группа (3 ×), у которой число хромосом варьируется от 33 до 41. Эта группа содержит два стерильных растения ванили, называемых «Хаапапе Стериле», демонстрирующих аномальную физиологию цветков (отсутствие пыльцы и аутосовместимости). 3. Тетраплоидная группа (4 ×), в которой количество хромосом и размер генома вдвое больше, чем в первой группе (43–56 хромосом и размер генома 10,10–10,89 пг). К ней относятся сорта: Хаапапе, Офе-Офе, Тиареи и Таити Лонг.
 РИСУНОК 13.12. Метафазные пластинки (а) сорта Таити с 24 хромосомами и (б) сорта Хаапапе с 52 хромосомами.
РИСУНОК 13.12. Метафазные пластинки (а) сорта Таити с 24 хромосомами и (б) сорта Хаапапе с 52 хромосомами.
Заключение
Оригинальность таитянской ванили обусловлена ее морфологией, текстурой и ароматическим содержанием стручков. Эти характеристики действительно связаны с генотипом. На них также влияют географические районы выращивания. Например, стручки таитянской ванили, выращенные и обработанные во Французской Полинезии, отличаются от стручков, произведенных в других странах. Редкая и высоко ценимая гурманами Франции полинезийская специя, является результатом сочетания факторов: почвы, климата, а также тщательности полинезийцев, выращивающих и обрабатывающих ванильные стручки.Благодарности
Авторы благодарят доктора С. Силяк-Яковлева (Университет Париж-Сакле) и доктора С.К. Брауна (CNRS, Жиф-сюр-Иветт) за их помощь в цитогенетическом анализе, а также за их интерес и поддержку таитянских исследований генома ванили, а также Дж. Фостера за его бесценные комментарии к рукописи.Глава 14. Микробиологическая безопасность вяленых стручков ванили
Введение
Натуральная ваниль – важный ингредиент пищевой промышленности во всем мире. Ваниль, плод лазящей орхидеи Vanilla planifolia, является основным источником промышленного производства ванильного ароматизатора, который состоит из смеси ванилина и многих других ароматизирующих соединений (Perez-Silva et al., 2006). Однако, развитие ванильного аромата в собранных зеленых стручках достигается только после процесса обработки, включающего четыре стадии традиционного метода; то есть убийство, пропаривание, сушку и кондиционирование. Поскольку ваниль требует влажного тропического климата, этап сушки является ключевым элементом для предотвращения развития микроорганизмов, которые могут снизить её качество. Затем процесс вяления, который занимает несколько месяцев, определит качество стручков ванили с точки зрения коммерческих стандартов и стандартов безопасности. За последние 20 лет количество стандартов стремительно выросло из-за глобализации и свободной торговли. Продукт с очень высокой добавленной стоимостью, такой как ваниль, очень зависит как от нормативных, так и от частных стандартов, ради конкурентоспособности на международных рынках. В дополнение к многочисленным техническим регламентам по безопасности пищевых продуктов, защите растений и маркировке, разработанных на национальном и международном уровнях, частный сектор все чаще устанавливает новые стандарты, охватывающие цепочку поставок от фермы до стола. Во время обработки и хранения ванильных стручков, могут происходить микробиологические заражения, разрастаясь или приводя к заражению других продуктов. Поэтому, для выявления опасностей и наиболее эффективных точек контроля их возникновения требуется подход «от фермы к столу». Поскольку специи и пищевые ингредиенты могут быть источником заражения (Scheuer and Gareis, 2002), в этой главе основное внимание уделяется микробиологическим опасностям, связанным с обработкой и хранением ванильных стручков, а также профилактическим мерам по предотвращению этих опасностей.Микробиологические опасности вяленых стручков ванили
Микробиологические заражения (в основном плесень и бактерии) ванильных стручков могут возникать во время сбора урожая и на нескольких этапах переборки и обработки. Процесс вяления, помимо включения биохимического процесса появления аромата, важен для борьбы с этими микроорганизмами, что полезно для сохранности готовых стручков. Вяление ванильных стручков – традиционно хорошо отработанный процесс в основных странах-производителях (Мадагаскар, Мексика, Коморские острова, Реюньон и Таити). Он трудоемок и занимает до шести месяцев, в зависимости от процедур обработки, принятых в разных странах-производителях. В целом, он в основном основан на следующих четырех этапах (Dignum et al., 2001):• Умерщвление зеленых стручков термической обработкой (горячая вода, духовка), чтобы остановить вегетативное развитие свежих стручков. • Пропаривание, которое происходит во время циклов солнечного нагрева, когда стручки раскладывают на солнце до тех пор, пока они не станут горячими, а затем укутывают одеялом и помещают на ночь в герметичный контейнер, чтобы сохранить их тепло и влажность. • Медленная сушка стручков для предотвращения микробной порчи и постепенной реакции развития аромата. • Кондиционирование сушёных стручков в ящиках в течение 3–4 месяцев для получения желаемого аромата и вкуса.
Первая стадия (умерщвление) снижает исходную микробную нагрузку на поверхность зеленой ванили. Во время вяления, основными грибками, обнаруживаемыми на стручках ванили, являются штаммы черной плесени Aspergillus и зеленой Penicillium (Röling et al., 2001). На зеленой ванили присутствует несколько бактериальных сообществ, но после ошпаривания (погружения в горячую воду 65–70°C на 2 мин) в этом исследовании сообщается лишь о наличии штаммов Bacillus (Bacillus subtilis, Bacillus firmus, Bacillus licheniformis, Bacillus pumilis, Bacillus smithii) вследствие их термофильной природы, как спорообразующих микроорганизмов. Для расщепленных стручков, которые не подвергались ошпариванию, были обнаружены другие роды, такие как Xanthomonas, Cellulomonas, Vibrio и Staphylococcus. B. subtilis (включая B. licheniformis) – это микроорганизмы, выделенные из разных трав и специй, вызывающие порчу пищевых продуктов и причастные к пищевым отравлениям (te Giffel et al., 1996). Буррике идентифицировал присутствие Aspergillus niger, Penicillium lividum, Penicillium vanillae и Penicillium rugulosum на ванильных стручках с Мадагаскара и Коморских островов (Bourriquet, 1954). Другое исследование показало, что основными видами плесени ванильных стручков оказались Penicillium glaucum, Trichoderma sp., Aspergillus oryzae, Aspergillus amstelodami и Xantochpinirous sp. при общей концентрации 8,4 × 104/г (Bachman et al., 1995). Вторым ключевым этапом является этап сушки, поскольку содержание влаги является основным фактором при сохранении вяленых стручков ванили, поскольку низкое содержание влаги предотвращает рост и активность микроорганизмов. Во время сушки стручки должны быть хорошо аэрированы, чтобы избежать бактериального брожения, которое приводит к нежелательному аромату, например, креозотовой ванили. При правильной сушке содержание воды в стручках должно стать достаточно низким. Фактически, сочетание низкого содержания воды с высоким содержанием фенолов, основным компонентом которых является ванилин, обеспечивает эффект ингибирования порчи вяленых стручков (Havkin-Frenkel and Frenkel, 2006). Согласно ISO 5565-1:1999 (ISO, 1999), максимальная влажность вяленых стручков составляет 38% для классов 1 и 2, 30% для класса 3 и 25% для класса 4. Содержание воды в вяленых стручках ванили соответствуют значениям активности воды (aw) соответственно 0,89, 0,86 и 0,84 (J.M. Méot, личный комментарий). Сообщалось, что присутствие соответствующего содержания воды в диапазоне от 25% до 30% приводит к желательной текстуре и внешнему виду готовых стручков (Sreedhar et al., 2007). Сообщается, что незрелые стручки более восприимчивы к заражению видами плесени Penicillium и Aspergillus (Sasikumar et al., 1992). Поскольку Aspergillus и Penicillium вместе с Fusarium являются наиболее важными родами, содержащими токсикогенные изоляты, необходимо соблюдать профилактические меры, основанные на надлежащей сельскохозяйственной и производственной практике, для снижения предуборочного и послеуборочного загрязнения микотоксинами (FDA, 2009). Микотоксины – токсичные вторичные метаболиты, вырабатываемые грибками в определенных условиях, связанных с физиологией (ростом микроорганизмов) и условиями окружающей среды (pH, температура, aw, консерванты). Токсигенные грибы могут быть удалены во время обработки, в то время как соответствующий внеклеточный микотоксин останется в пище. Наиболее важные микотоксины, представляющие риск для здоровья человека, описаны в таблице 14.1 (FAO, 2001). Среди грибов, обнаруженных в ванильных стручках, A. niger не обладает способностью продуцировать афлатоксины (Schuster et al., 2002). Однако, сообщалось, что этот вид вырабатывает охратоксин А (Blumenthal, 2004).
ТАБЛИЦА 14.1. Плесень и микотоксины всемирного значения
| Вид плесени | Продуцируемый микотоксин |
|---|---|
| Aspergillus parasiticus | Афлатоксин B1, B2, G1, G2 |
| Aspergillus flavus | Афлатоксин B1, B2 |
| Fusarium sporotrichioides | T-2 токсин |
| Fusarium graminearum | Дезоксиниваленол (или ниваленол), Зеараленон |
| Fusarium moniliforme (Fusarium verticillioides) | Фумонизин B1 |
| Penicillium verrucosum | Охратоксин A |
| Aspergillus ochraceus | Охратоксин A |
A. oryzae не продуцирует афлатоксины, несмотря на его очень близкое таксономическое родство с группой Aspergillus flavus, основной группой, продуцирующей афлатоксины в пище, но может продуцировать другой микотоксин, такой как 3-нитропропионовая кислота (Blumenthal, 2004). P. lividum продуцирует цитринин и пеницилловую кислоту (Frisvad, 1986). Однако, риск загрязнения ванильных стручков микотоксинами, если таковой имеется, требует детальной оценки (Codex Alimentarius Commission (CAC), 1999). В нескольких исследовательских работах сообщается о загрязнении ванили микотоксинами. При анализе 681 образца специй на предмет естественного присутствия охратоксина A (OTA) и охратоксина B (OTB), обнаружен один образец экстракта ванили, который был положительным на OTB при 156 нг/г (Scheuer and Gareis, 2002). Незрелость была также связана с низким выходом ванилина в готовых стручках (Saltron et al., 2002, 2003). Вяленые стручки при правильном приготовлении содержат около 2,5% ванилина. Плесень поражает ваниль с части плода, в которой концентрация ванилина наименьшая (Bourriquet, 1954). Следует подчеркнуть, что ванилин обладает антимикробными свойствами в отношении различных пищевых микроорганизмов (Nakazawa et al., 1982) и некоторых патогенных, индикаторных или микроорганизмов, вызывающих порчу: Escherichia coli, Enterobacter aerogenes, Pseudomonas aeruginosa, Salmonella enterica, Candida. albicans, Lactobacillus casei, Penicillium expansum и Saccharomyces cerevisiae (Rupasinghe et al., 2006). Исследования in vitro показали, что ванилин эффективен в подавлении роста плесени. Например, добавление 1000 ppm природного ванилина подавляло рост Aspergillus ochraceus более чем на два месяца при 25°C, в то время как рост A. flavus, A. niger и Aspergillus parasiticus подавлялся при 1500 ppm (Lopez-Malo et al., 1995, 1997). Эти авторы предложили ванилин в качестве барьерной технологии в сочетании с другими антимикробными факторами, такими как пониженный pH и aw, для предотвращения порчи плодовых пюре плесенью. Другое исследование, с использованием различных видов плесени и дрожжевых грибков, вызывающих порчу пищевых продуктов, показало, что альдегидная составляющая играет ключевую роль в противогрибковой активности ванилина (Fitzgerald et al., 2005). Эти же авторы исследовали механизм действия ванилина против Escherichia coli, Lactobacillus plantarum и Listeria innocua (Fitzgerald et al., 2004). Антимикробная активность ванилина зависела от времени воздействия, концентрации и целевого организма. Минимальные ингибирующие концентрации ванилина in vitro для трех тестируемых штаммов составляли 15, 75 и 35 ммоль/л. Ингибирующее действие оказалось скорее бактериостатическим, чем бактерицидным. При исследовании установлено, что ванилин нарушает целостность цитоплазматической мембраны, приводящую к потере ионных градиентов, гомеостазу pH и ингибированию дыхательной активности тестируемых бактерий. Таким образом, потенциальные опасности для вяленых ванильных стручков можно разделить на следующие категории:
• Микробиологическая порча из-за бактериального брожения или развития плесени. • Загрязнения микробиологическими токсинами (микотоксины из плесени) • Бактериальное инфицирование, связанное с плохими гигиеническими условиями.
Для предотвращения этой микробиологической опасности, необходимо контролировать соответствующие факторы: зрелость зеленых стручков при сборе урожая, aw вяленых стручков и общие гигиенические условия после уборки урожая. Чтобы сохранить качество стручков во время хранения, которое может длиться от нескольких месяцев до одного года, следует также учитывать другие параметры, такие как температура, влажность, состав газа и тип упаковки.
Управление и контроль за микробиологической опасностью
Меры контроля направлены на предотвращение, устранение или снижение опасности для пищевых продуктов до допустимого уровня либо путем контроля начальных уровней опасного агента, либо предотвращением повышения или снижением его уровней. Важная роль критической контрольной точки анализа опасностей (ККТАО) заключается в том, чтобы помочь производителю и переработчику пищевых продуктов обеспечить безопасность процессов, посредством определения ключевых или критических мер контроля, которые предотвращают, устраняют или снижают опасности до приемлемых уровней. Контроль микробиологической опасности вяленых стручков ванили особенно зависит от эффективной сушки и последующего предотвращения заражения и/или роста после обработки. Наиболее эффективной мерой микробиологического контроля при переработке ванильных стручков является сушка продукта таким образом, чтобы aw была недостаточной для поддержания развития микроорганизмов и, в частности, роста плесени и/или предотвращения выработки микотоксинов токсиногенными видами. aw – это мера содержания воды, доступной для микроорганизмов. Чтобы предотвратить рост большинства видов плесени, aw должно быть ≤0,70. Каждая токсикогенная плесень имеет свой собственный минимум для роста и выработки микотоксинов, что выражается в содержании влаги для каждого продукта. Это содержание влаги называется «безопасным» и может быть критическим пределом для меры контроля. Большинство бактерий порчи не могут расти при aw ≤ 0,91. Однако, было обнаружено, что золотистый стафилококк растет при значении aw всего 0,84. Поскольку плесневые грибки могут расти в широком диапазоне значений pH, влажности и более широком диапазоне температур, чем бактерии, ванильные стручки более восприимчивы к заражению ими. Критическая контрольная точка может быть установлена в конце процесса сушки, и одним критическим пределом будет содержание воды или aw стручков, что можно легко контролировать в системе ККТАО. Плохие гигиенические условия являются основным источником инфицирования стручков на протяжении всего процесса. Поскольку большинство микроорганизмов находится на поверхности стручков, приоритетом является обучение обработчиков. Руки, а также инфицированные перчатки и одеяла могут служить переносчиками микроорганизмов. Как сообщается в литературе, руки работников пищевой промышленности имеют большое значение в передаче инфицирования от человека к человеку, от человека к поверхности или наоборот и от человека к продуктам питания (Guzewich and Ross, 1999). Чтобы свести к минимуму количество насекомых и грибков в складских помещениях, требуются надлежащие процедуры уборки. Заплесневелые стручки следует немедленно выбросить, поскольку они вызывают неприятный запах и приводят к перекрестному заражению между разными партиями ванильных стручков. С этой точки зрения система ККТАО является широко признанным управлением безопасности пищевых продуктов. Это систематический подход к выявлению, оценке и контролю угроз безопасности пищевым продуктам. Он основан на превентивном подходе от первичного производства до конечного продукта, продаваемого на рынке, а не только на обычных проверках со стороны регулирующих органов. После того, как план ККТАО разработан и внедрен в производство пищевых продуктов, его необходимо поддерживать на постоянной основе. Семь принципов: (1) определение любых опасностей, которые необходимо предотвращать, устранять или снижать до приемлемых уровней; (2) определение критических контрольных точек (ККТ) на этапе (этапах), на котором контроль важен для предотвращения или устранения опасности или снижения её до приемлемого уровня; (3) установление критических пределов на ККТ, которые отделяют приемлемость от неприемлемости для предотвращения, устранения или уменьшения выявленных опасностей; (4) создание и внедрение эффективных процедур мониторинга в ККТ; (5) установление корректирующих действий, когда мониторинг показывает, что ККТ не находится под контролем; (6) установление процедур, которые должны выполняться регулярно, для проверки того, что изложенные меры работают эффективно; и (7) создание документов и записей, соответствующих характеру и размеру продовольственного бизнеса, чтобы продемонстрировать эффективное применение изложенных мер. ККТ, как определено в Продовольственном кодексе, означает точку, в которой потеря контроля может привести к неприемлемому риску для здоровья (FDA, 2009). Эти принципы получили международное признание, и их применение описано кодексом гигиены пищевых продуктов Пищевого Кодекса (CAC, 2003), Национальным консультативным комитетом по микробиологическим критериям для пищевых продуктов (NACMCF, 1992), ISO 22000 (ISO, 2005), Продовольственным кодексом Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, 2009) и Европейским постановлением № 852/2004 (JO, 2004). С 2006 года этот новый европейский регламент по гигиене пищевых продуктов также применяется к иностранным операторам производящим продукты питания, экспортируемые в Европейский Союз. В новых правилах гигиены особое внимание уделяется следующим принципам:• Основную ответственность за безопасность пищевых продуктов несет оператор пищевого бизнеса. • Безопасность пищевых продуктов обеспечивается на протяжении всей цепочки, начиная с первичного производства. • Общее внедрение процедур, основанных на принципах ККТАО. • Применение основных общих гигиенических требований, которые могут быть дополнительно уточнены для определенных категорий пищевых продуктов. • Разработка руководств по передовой практике гигиены или применения принципов ККТАО в качестве ценного инструмента, помогающего участникам хозяйственной деятельности в сфере пищевых продуктов на всех уровнях цепочки соблюдать новые правила.
Рекомендуемый международный свод правил – Общие принципы гигиены пищевых продуктов (CAC, 2003) является основой для внедрения надлежащей гигиенической практики, поскольку дает основные правила гигиенического обращения, хранения, обработки, распределения и окончательного приготовления пищи в производственной цепочке. Этот кодекс содержит приложение по системе ККТАО и руководство по её применению. Кроме того, Кодекс гигиенической практики для специй и сухих ароматических растений (CAC, 1995) более конкретен для наших целей и включает минимальные гигиенические требования при сборе урожая, послеуборочных технологиях (вяление, обесцвечивание, сушка, очистка, сортировка, упаковка, транспортировка и хранение, включая дезинфекцию и дезинсекцию), перерабатывающих предприятий, технологиях обработки, упаковки и хранения переработанных продуктов.
Заключение
Стандартные спецификации являются важными критериями, определяющими рыночную стоимость продукта с высокой добавленной стоимостью, пользующегося большим спросом на международном рынке, такого как натуральные стручки ванили. Во время послеуборочной подготовки и обработки ванильных стручков микробиологические опасности могут возникнуть на любой стадии и способны поставить под угрозу стандарты безопасности и качества ванильных стручков. Ключевые общие факторы для сохранности стручков включают (1) зрелость собранных стручков для оптимизации выхода ванилина, обладающего антимикробной активностью против плесени и бактерий, (2) этапы ошпаривания и сушки при вялении для контроля развития микроорганизмов на стручках, (3) гигиенические условия в течение всего послеуборочного процесса для контроля возникновения и передачи заражений между различными партиями стручков, и (4) этап кондиционирования и постобработки при хранении для контроля роста и активности микроорганизмов (производства микотоксинов из плесневых грибов). Чтобы помочь производителям и переработчикам внедрять эти меры контроля в производственной цепочке, необходимо создать систему ККТАО, основанную на надежной надлежащей гигиенической практике (GHP), надлежащей сельскохозяйственной практике (GAP) и надлежащей производственной практике (GMP), для обеспечения интегрированного подхода управления безопасностью продуктов питания. Тем не менее, наиболее важные ограничения для внедрения ККТАО по всей цепочке поставок при производстве ванили могут быть организационными, поскольку в цепочку участников входят фермеры, сборщики, переработчики и экспортеры, которые не обязательно соблюдают вертикальную координацию, которая, как сообщается, более эффективна для этой цели (Hobbs and Kerr, 1992). В этом контексте ККТАО может столкнуться с проблемой мелких операторов с ограниченными ресурсами в развивающихся странах.Глава 15. Аутентификация ванильных продуктов
Введение
Ваниль относится к самым ценным и самым дорогим специям в мире. Она представляет собой важнейший вкусовой ароматизатор, с многомиллионным годовым промышленным производством (Krueger and Krueger, 1983). Мировое производство ванили составляет 2000 метрических тонн в год. Экстракты ванили широко используются в шоколаде и выпечке, но чаще всего в мороженом. Главный ароматизатор экстрактов ванили – ванилин. Промышленный химический синтез ванилина начался более 130 лет назад (Tiemann and Haarmann, 1874). Это один из наиболее широко применимых ароматизирующих компонентов, применяемых в настоящее время в ароматической промышленности. Общее потребление ванилина оценивается в 12 000 метрических тонн в год (Eurofins Newsletter, 2003): около 82% в пищевых добавках, 5% для отдушек и косметики и 13% как фармацевтическое промежуточное соединение. Спрос на ваниль намного превышает естественное предложение. Бенсаид (Eurofins Newsletter, 2003) утверждает, что только 0,33% потребляемого ванилина происходит из ванильных стручков. Натуральный ванилин может быть в 100 раз дороже, чем ванилин синтетического происхождения, а в некоторые годы, в зависимости от урожая, даже больше (Eurofins Food Newsletter, 2007). Эта разница в цене в сочетании с «биотрендом» и спросом на натуральные продукты побудила индустрию ароматизаторов разработать альтернативные источники натурального ванилина, например, основанные на биотрансформации природных соединений. Следовательно, фальсификация экстрактов ванили является серьезной проблемой на коммерческом рынке для этой категории продуктов. Поэтому, существует множество правительственных постановлений, касающихся подлинности экстрактов ванили, для выявления фальсификаций и предотвращения случаев мошенничества. Чтобы защитить производителей и потребителей от фальсификации, необходимо иметь мощные аналитические инструменты, позволяющие подтвердить подлинность соответствующих ванильных продуктов. В зависимости от характера предполагаемых мошеннических действий, а также от конкретных категорий затронутых продуктов (ванильные стручки, экстракты ванили, ванильные ароматизаторы или пищевые продукты с ванилью) применяются разные стратегии для обнаружения этих фальсификаций. Известно множество возможностей того, как можно повлиять на правовой и сенсорный статус ванильного продукта:• Добавление соединений, не являющихся производными натуральной ванили, для придания аромата. Они включают: - идентичный натуральному или искусственный ванилин синтетического происхождения - искусственный этилванилин - экстракт бобов тонка - кумарин • Фальсификация ванильных стручков: добавление частиц металла, таких как гвозди, или даже металлической ртути для увеличения веса очень дорогих ванильных стручков (это было особенно актуально, когда цены на ванильные стручки были очень высокими и достигали нескольких сотен долларов за килограмм несколько лет назад). • Фальсификация неправильным ботаническим происхождением: известно более 100 различных видов ванили, и только три из них имеют коммерческое значение: Vanilla planifolia Jacks./Andrews, Vanilla tahitiensis J.W. Moore и Vanilla pompona Schiede. Например, бурбонская ваниль относится к видам V. planifolia. • Фальсификация неправильным географическим происхождением: поскольку географическое происхождение ванильных стручков имеет значение по причинам регулирования [например, пометка «бурбонская ваниль» разрешена только при использовании экстрактов, полученных из ванили, выращенной на Мадагаскаре, острове Реюньон (ранее называвшийся «остров Бурбон»), Коморских островах, Сейшельских островах или Маврикии]. • Неправильное указание концентрации x-кратных экстрактов ванили: количество ванильных стручков, используемых для производства экстрактов ванили, актуально, например, на рынке США. Это выражено в «Стандарте идентичности» (Кодекс федеральных правил FDA). Всего из 100 г ванильных стручков, использованных для производства 1 кг ванильного экстракта, получается так называемый однократный экстракт.
Аналитические методы, которые могут применяться для определения подлинного ванильного продукта, могут быть основаны на идентификации отдельных ингредиентов, а также на комбинации ингредиентов, обычно присутствующих в ванили. Например, основное ароматически активное соединение, присутствующее в ванили, ванилин, можно конкретно контролировать с помощью таких методов, как газовая хроматография (ГХ), высокоэффективная жидкостная хроматография (ВЭЖХ), масс-спектрометрия соотношения изотопов (МССИ) или специальные методы ЯМР (см. ниже). Кроме того, определяется наличие типичных побочных продуктов в ванили, таких как ванильная кислота, пара-гидроксибензальдегид или пара-гидроксибензойная кислота. По соотношению этих компонентов также судят о подлинности ванили и ванильных продуктов. Кроме того, отсутствие соединений, которые обычно не присутствуют в ванили, таких как (искусственный) этилванилин или ванилин, полученный в результате химического синтеза, может быть использовано для оценки качества. Для обнаружения указанных фальсификаций были разработаныразличные специальные аналитические методы, которые представлены в следующих разделах. Как потребители, так и производители могут быть защищены от мошенничества использованием современных комплексных аналитических методов для оценки подлинности пищевого сырья, а также продуктов питания.
ВЭЖХ анализ
В наши дни анализ ВЭЖХ является рутинно применяемым инструментальным методом для анализа вкусовых соединений в ванильных продуктах или их экстрактах. Анализ ВЭЖХ используется для идентификации и количественного определения соответствующих соединений, а также для дальнейшей оценки подлинности или фальсификации. Были опубликованы и другие методы, такие как анализ ГХ (Mosandl and Scharrer, 2001), но они не применялись для контроля качества и проверки подлинности. Была исследована проверка подлинности, основанная на энантиоселективном анализе летучей фракции экстрактов ванили (Mosandl and Hener, 2001). Среди прочего, γ-ноналактон является одним из второстепенных хиральных соединений ванили, и его экстрагировали и разделяли на R- и S-энантиомеры. Низкий энантиомерный избыток R-γ-ноналактона в 45–63% был признан незначительно высоким, чтобы предоставить однозначное доказательство фальсификации рацемическим γ-ноналактоном. Методы ВЭЖХ, разработанные для ванили, являются надежными, быстрыми и хорошо подходят для рутинного анализа. Подготовка образцов для анализа ВЭЖХ выполняется путем экстракции, в случае стручков, или просто разбавлением экстрактов. Было исследовано влияние методов подготовки проб на аналитические результаты (Ehlers et al., 1999). Эти результаты показывают, что соотношения типичных ванильных ингредиентов, таких как ванилин, ванильная кислота, пара-гидроксибензальдегид и пара-гидроксибензойная кислота, могут варьироваться в зависимости не только от сырья, но и от используемого метода подготовки образца. Были разработаны и опубликованы различные методы ВЭЖХ, которые, наконец, были приняты в качестве официальных методов (Taylor, 1993; ISO, 1999) или даже стали частью пищевого законодательства Франции (Arrêté du juin 11, 1987). Стационарные фазы представляют собой преимущественно материалы с обращенной фазой, в основном материалы RP-18, но также RP-8 и другие, такие как модифицированный алкилгалогеном силикагель (Taylor, 1993). Способы, применяющие обращенно-фазовое разделение, обычно работают с подвижными фазами метанол/вода в изократическом режиме или, чаще, с градиентным элюированием при кислых значениях pH и, наконец, с использованием УФ- или ДМД-детекции (диодно-матричный детектор). Количественное определение может быть основано на внутренних стандартах, а также на внешней калибровке, поскольку большинство обнаруженных соединений доступны в виде чистых химикатов. Время работы около 20 минут; однако с помощью специальных колонок с выбранными стационарными фазами время анализа можно сократить до менее 5 минут (Tracy et al., 2008). Типичные параметры для анализа ВЭЖХ экстрактов ванили приведены в таблице 15.1. Выявленные соединения также опубликованы и описаны в других разделах этой книги (см. главу 12). Типичными соединениями, которые обнаруживаются с помощью этих анализов, являются ванилин, ванильная кислота, пара-гидроксибензальдегид и пара-гидроксибензойная кислота. Эти аналиты рассматриваются как импактные соединения и представляют собой типичный профиль (рис. 15.1). Простая проверка подлинности может быть выполнена на основании наличия нетипичных соединений, таких как этилванилин, а также отсутствия одного или нескольких из этих импактных соединений. Другие второстепенные соединения, обнаруживаемые с помощью ВЭЖХ, такие как анисальдегид, могут служить индикаторами, позволяющими отличить V. planifolia от V. tahitiensis (Ehlers et al., 1994; Oberdieck, 1998).ТАБЛИЦА 15.1. Типичные параметры для анализа ВЭЖХ
| Прибор | Agilent 1100 |
| Колонка | Lichrospher 100 RP18 (5 μm) 124 × 4 mm |
| Объем впрыска | 2 мкл |
| Элюент/градиент | Ацетонитрил/вода соотв. фосфатный буфер |
| Обнаружение | Диодно-матричный детектор |
 РИСУНОК 15.1. ВЭЖХ-хроматограмма соединений ванильного экстракта.
РИСУНОК 15.1. ВЭЖХ-хроматограмма соединений ванильного экстракта.
Их количественное распределение типично для вида ванильного продукта и методики экстракции. Различные исследования изучали профиль, полученный в результате воздействия этих импактных соединений в экстрактах ванили, и обнаружили, что они специфичны и, следовательно, подходят для оценки подлинности экстракта ванили (Fayet et al., 1987; Juergens, 1981). Чтобы преобразовать профиль этих соединений в числовую шкалу, были рассчитаны отношения их концентраций и предложены пределы. Пять соотношений ванильных соединений были введены во французское законодательство для оценки подлинности ванильных продуктов (République Française, 1988). В 2003 г. эти коэффициенты были изменены Главным управлением по согласованию, объединению и борьбе с мошенничеством (DGCCRF), чтобы отразить результаты за более длительный период времени и дополнительную информацию о последних урожаях того времени (Note d’information, 2003 г.). Пределы показаны в таблице 15.2. Эта оценка подходит только для спиртовых экстрактов цельных ванильных стручков. Изменения в составе растворителя или использование альтернативных экстракционных агентов, таких как CO2, приводят к соотношениям, которые не обязательно соответствуют ограничениям, приведенным в таблице 15.2 (Quirin and Gerard, 1998). Источник ванильных стручков, используемых для приготовления экстрактов, также влияет на профиль и, следовательно, на соотношения. Дальнейшие исследования частично опровергли вывод о мошенничестве, когда соотношение находится за пределами указанных диапазонов (John and Jamin, 2004; Littmann-Nienstedt and Ehlers, 2005; Gassenmeier et al., 2008), и обосновывают пригодность так называемых соотношений. Международная организация производства ароматизаторов (IOFI) выразила в информационном письме свою оговорку в отношении применимости этих соотношений и переоценки их достоверности (IOFI Information Letter, 2000 г.), несмотря на то, что эти соотношения иногда ошибочно цитируются как «значения IOFI». Сомнительная достоверность соотношений применялась не только к ванильным стручкам и экстрактам, но также к ванильным ароматизаторам и даже к ароматизированной пище. Интерпретация соотношений для ароматизаторов и продуктов питания выходит далеко за рамки того, что серьезно исследовалось на научном уровне. Таким образом, так называемые соотношения являются предварительной проверкой подлинности ванильных стручков и их экстрактов в случае, если условия экстракции хорошо известны оценщику. Другие методы, такие как масс-спектрометрия стабильных изотопов (МССИ) или количественная сайт-специфическая спектроскопия ядерно-магнитного резонанса, обеспечивают гораздо более четкое указание на фальсификацию ванильных продуктов (Kempe and Kohnen, 1999).
ТАБЛИЦА 15.2. Соотношения компонентов, используемые для оценки подлинности ванильных продуктов
| Отношение | Диапазоны согласно DGCCRFa 1988 | Диапазоны согласно DGCCRFb 2003 |
|---|---|---|
| Ванилин/пара-гидроксибензальдегид | 10–20 | 10–20 |
| Ванилин/пара-гидроксибензойная кислота | 53–110 | 40–110 |
| Ванилин/ванильная кислота | 15–29 | 12–29 |
| пара-гидроксибензойная кислота/пара-гидроксибензальдегид | 0.15–0.35 | 0.15–0.35 |
| Ванильная кислота/пара-гидроксибензальдегид | 0.53–1.00 | 0.53–1.50 |
МССИ
Очень продвинутым аналитическим методом аутентификации экстрактов ванили и ванильных ароматизаторов является анализ соотношения стабильных изотопов (АССИ). Он был разработан в 1970-х годах и стал наиболее важным инструментом для проверки подлинности нехиральных соединений. Этот анализ может быть выполнен либо с помощью МССИ, в основном в сочетании с газовым хроматографическим разделением, либо путем количественного ЯМР-измерения естественного содержания на отдельных атомных позициях (Schmidt et al., 2007). В природе основные биоэлементы, такие как водород, углерод, кислород и азот, встречаются в виде смесей изотопов. Природные содержания стабильных изотопов имеют среднемировые значения. Из-за физических процессов, (био)химических реакций, таких как фотосинтез, географические параметры и климат, их относительное соотношение может варьировать. «Легкие» изотопы (1H, 12C и 16O) всегда намного преобладают по сравнению с обилием «тяжелых» (2H, 13C и 18O). Продукты, образующиеся в растениях (или животных), и ингредиенты экстрактов или пища, приготовленная из них, имеют характерное соотношение изотопов, которое позволяет соотнести его с процессами фотосинтеза, а также климатическими и географическими условиями. Соединения с ароматическим кольцом – например, ванилин – обычно синтезируются в растениях посредством пути шикимовой кислоты из эритрозо-4-фосфата и фосфоенолпирувата. Образование продуктов этого пути сопровождается соответствующим истощением 13C по сравнению с основными растительными продуктами − углеводами. Эти углеводы производятся в процессе фотосинтеза растений с использованием CO2 и воды. Первичный этап катализируется ферментативно, при этом 13CO2 реагирует несколько медленнее, чем 12CO2. Это явление получило название «кинетический изотопный эффект». Однако, дефицит 13C не одинаков для всех растений. Для растений известны три основных фотосинтетических пути фиксации CO2: C3, C4 и CAM. Так называемые растения C3 (например, пшеница, ячмень, сахарная свекла и большинство деревьев) используют реакцию рибулозабисфосфат-карбоксилазы, путь Кальвина, в то время как растения C4 (например, сахарный тростник, кукуруза, сорго и просо) используют фосфоенолпируват-карбоксилазную реакцию, путь Хетча-Слэка. CAM-растения, такие как суккуленты, орхидеи (например, V. planifolia) и некоторые тропические травы, обладают метаболизмом крассулацеиновой кислоты. Каждая группа показывает разные значения соотношений 13C/12C, 2H/1H и 18O/16O для своих метаболитов, что может быть показано с помощью МССИ (например, углеводов, жирных кислот, изопреноидов, аминокислот, фенилпропанов и т. д.). Анализируя эти соотношения, можно различать соединения, продуцируемые растениями в ходе биохимических процессов, и соединения, продуцируемые путем синтеза. Изменения в соотношении изотопов, вызванные этими эффектами, очень малы. Потому их не указывают в атомной шкале. Эти минимальные изменения сравниваются со значениями международных стандартов и выражаются в промилле (‰), как отклонение от стандартного, так называемого, дельта-значения (Schmidt, 2003):δ13C (‰) = (([ 13Csample ]/[ 12Csample ])/([ 13Cstandard ]/[ 12Cstandard ]) − 1) × 1000
Стандартным соотношением 13C/12C является δ13C: V-PDB (Vienna-PeeDee Belemnite). Анализ значений δ13C для растений C3 (так называемые «легкие растения») дает значения от −30 ‰ до −24 ‰, для растений C4 (так называемые «тяжелые растения») от −16 ‰ до −10 ‰. CAM-растения имеют значения δ13C от −10 ‰ до −30 ‰, что очень затрудняет дифференциацию от двух других типов. Подтверждение подлинности ароматизирующих веществ путем определения их среднего значения δ13C подразумевает сжигание очищенных органических образцов при температуре около 1000°C для преобразования их в CO2. Онлайн-соединение газовой хроматографии и МССИ через интерфейс сжигания уменьшило количество проб и упростило измерения. Позже была разработана интерактивная связь газовой хроматографии и МССИ через интерфейс пиролиза (около 1300°C), в первую очередь для анализа 18O, что позволило одновременно измерять в режиме онлайн значения δ18O и δ13C. Этот интерфейс также позволяет определять δ2H пиролизом при температуре около 1450°C. Хенер (Hener et al. 1998) сравнил значения δ13C различных образцов ванилина, измеренные через CO2 и CO, и показал, что значения в большинстве случаев хорошо согласуются. В настоящее время для определения используется в основном онлайн-соединение газовой хроматографии с сжиганием или восстановительным пиролизом с масс-спектрометрией соотношения изотопов (ГХ-С-МССИ или ГХ-П-МССИ) для определения значений δ углерода 13C, водорода 2H и кислорода 18O. V. planifolia принадлежит к САМ-растениям, и ванилин из стручков показывает значения δ13C в диапазоне от −16,8‰ (V. tahitiensis) до −22,0‰ (V. planifolia) (см. таблицу 15.3). Помимо экстракции из ванильных стручков, ванилин также можно получать химическим синтезом или биотехнологическими путями из различных источников (лигнин, гваякол, эвгенол, куркумин и феруловая кислота).
TABLE 15.3 δ13C-, δ2H-, and δ18O-значения ванилина различного происхождения
| Происхождение ванилина | δ13CV-PDB (‰) | δ2HV-SMOW (‰) | δ18OV-SMOW (‰) |
|---|---|---|---|
| Из стручков (Бурбон) V. planifolia | −21.5 to −19.2a | 6.7–12.4b | |
| Из стручков (Таити) V. tahitiensis | −19.7 to −15.9a | ||
| Из стручков | −20.4 to −20.2c >−21.5e −21.5 to −16.8d −22.0 to −19.0g | −115 bis −52d | 12.2–14.0c 8.1–10.7f |
| Из гваякола | −36.2 to −29.0h −26.1 to −24.9i | −23 bis −17i | −3.1 to −2.5f |
| Из эвгенола | −31.7 to −29.9h | −87j | 11.8–13.3c 0.3k |
| Из лигнина | −28.7 to −26.5d | −204 bis −170i −195 to −178b | 6.1–6.8f 6.0–9.8l |
| Из феруловой кислоты из рисовых отрубей (biotechnology) | −37 to −36m −36.4 to −33.5n | −168 to −165n | 12.4–13.2c 10.7–11.2n |
Значения δ13C ванилина, полученного из других источников, кроме ванильных стручков или его экстрактов, находятся в диапазоне от −24,9 до −37,0. Следовательно, ванилин в экстрактах ванили или полученный из ванильных стручков можно аналитически отличить от других источников по значению δ13C. Это может быть использовано для обозначения подлинности ванильных продуктов на основе ванили или её экстрактов. Согласно рекомендации IOFI, подлинность ванильных ароматизаторов оценивается путем определения значения δ13C для ванилина. Считается, что значения δ13C в районе −21,0 ‰ ± 0,5 ‰ указывают на растительное происхождение анализируемого ванилина из ванильных стручков (Информационное письмо IOFI, 1989). Различия, возникающие в результате применяемых методов выделения, в настоящее время исследуются посредством кольцевых испытаний, проводимых специальной аналитической рабочей группой Немецкого химического общества. Поскольку ванилин получают в результате биотехнологических процессов, таких как ферментация натуральной феруловой кислоты, он может считаться натуральным и впоследствии применяться в натуральных ароматизаторах. В связи с тем, что значения δ13C ванилина, полученного из натуральной феруловой кислоты путем ферментации, очень низкие, его обычно можно отличить от синтетического ванилина, не отвечающего требованиям натуральности. Чтобы обнаружить фальсификацию экстракта стручков ванили с ванилином из других источников, можно применить многоэлементную ГХ-МССИ; это означает также определение отношения 2H/1H и 18O/16O и оценить этот трехмерный набор данных. Стандарт для этих двух соотношений – это Венский стандарт средней воды в океане (V-SMOW). В недавней статье показано, что sp2 атом кислорода в альдегидном положении может химически обмениваться с водой в промышленных или лабораторных процедурах (Bensaid et al. 2002). Поэтому авторы использовали значение δ18O гваякола, которое образуется в результате разложения молекулы ванилина. Однако, они заявляют, что на практике соотношение изотопов кислорода не играет важной роли в процедурах аутентификации. Разложение молекулы ванилина стало использоваться, когда оборудование для многоэлементного МССИ еще не было хорошо разработано (Krueger and Krueger, 1983). Фальсификаторы научились имитировать значение δ13C природного ванилина, смешивая этот «идентичный натуральному» ванилин, с продуктами, искусственно обогащенными в концентрации 13C (Krueger and Krueger, 1983, 1985). МССИ измеряет среднее значение δ13C всей молекулы ванилина. Поскольку его метильную или карбонильную группу относительно просто обогатить 13C, синтетический ванилин, смешанный с фракцией, обогащенной 13C, может быть ошибочно принят за натуральный. Чтобы проверить [метил-13C]-ванилин, метильный углерод удаляют как CH3I в кипящем HI. Затем МССИ выполняется на CH3I (Krueger and Krueger, 1983). Для анализа [карбонил-13C]-ванилина, молекула должна быть окислена до ванильной кислоты. После декарбоксилирования образовавшийся СО2 анализируется с помощью МССИ (Krueger and Krueger, 1985).
ЯМР
В настоящее время проверка обогащенных частей легче анализируется с помощью количественных измерений ЯМР содержания 2H или 13C в различных положениях молекулы. Этот метод получил название сайт-специфическая спектроскопия фракционирования природных изотопов ядерно-магнитным резонансом (СФНИ-ЯМР) и основан на том факте, что распределение 2H или 13C в разных участках молекулы не является статистическим и зависит от происхождения конкретного соединения. Спектроскопия СФНИ-2H-ЯМР – мощный инструмент, позволяющий глубже понять биохимические механизмы путем определения содержания изотопов в определенных участках молекулы. В этом отношении МССИ, которая обычно требует сжигания пробы перед анализом, не подходит для измерения «внутримолекулярного» распределения изотопов. Фундаментальные исследования показали, что дейтерий далеко не случайно распределен в органических молекулах (Мартин и Мартин, 1981). Следовательно, необходимо определить отношения D/H в различных положениях молекулы. Относительная чувствительность ЯМР для 13C теоретически примерно в 100 раз выше, чем для дейтерия. Но из-за того, что кинетические изотопные эффекты для углерода намного меньше, чем для дейтерия, и из-за более короткого времени релаксации для дейтерия, количественный 2H-ЯМР стал лучшим инструментом для контроля подлинности в области ароматов. Первое применение этого метода к молекуле ванилина появилось в 1983 г. (Toulemonde et al., 1983). Теперь СФНИ-2H-ЯМР принят в качестве официального метода AOAC (№ 2006.05) для аутентификации ванилина. СФНИ-2H-ЯМР в сочетании с 13C-МССИ также позволяет характеризовать биотехнологический ванилин, полученный из феруловой кислоты, эвгенола/изоэвгенола или куркумина. В молекуле ванилина шесть монодейтерированных изотопомеров. В 2H-ЯМР-спектрах трех различных качеств ванилина на рисунке 15.2 можно увидеть пять сигналов, два дейтерия в орто-положении попадают в один сигнал. Таблица 15.4 показывает, что ванилин, синтезированный из гваякола (2-метоксифенола) путем введения альдегидной группы, четко отделен от других вариантов высокой степенью обогащения дейтерием по карбонильной функции. Ванилин из лигнина демонстрирует истощение дейтерия во всех положениях по сравнению с натуральным ванилином, полученным из стручков ванили. Экспериментальные значения для гидроксильной группы не включены в таблицу 15.4, так как они могут быть легко искажены процессами обмена H/D. РИСУНОК 15.2. 2H-ЯМР-спектры ванилина из ванильных стручков, синтетического происхождения (из лигнина, из гваякола) и ванилина биотехнологического происхождения из феруловой кислоты.
РИСУНОК 15.2. 2H-ЯМР-спектры ванилина из ванильных стручков, синтетического происхождения (из лигнина, из гваякола) и ванилина биотехнологического происхождения из феруловой кислоты.
ТАБЛИЦА 15.4. Результаты 2H-ЯМР для образцов ванилина различного происхождения (D/H) (ppm)
| Образец | Позиция в молекуле | |||
|---|---|---|---|---|
| D−C = O | Ortho | Meta | OCH2D | |
| Из стручковa | 130.8 ± 3.1 | 157.3 ± 3.0 | 196.4 ± 2.5 | 126.6 ± 1.7 |
| Из стручковb | 128.3 | 156.3 | 180.4 | 126.4 |
| Из лигнинаa | 119.9 ± 6.4 | 132.1 ± 2.6 | 168.8 ± 5.9 | 105.9 ± 1.4 |
| Из гваяколаa | 315.2 ± 56.9 | 138.8 ± 6.7 | 143.8 ± 5.3 | 139.1 ± 8.4 |
Также продолжается разработка количественного 13С-ЯМР. Уже получены первые характерные распределения 13C по качеству ванилина различного происхождения (Caer et al., 1991; Tenailleau et al., 2004a, 2004b).
Заключение
Аналитическое определение типичных ингредиентов ванили (экстракта) с помощью ВЭЖХ и расчет их соотношений можно рассматривать как предварительную проверку для оценки подлинности ванили. ВЭЖХ – мощный инструмент для подтверждения подлинности ванильных продуктов. Тем более, что с онлайн-методом обеспечения связи ГХ с ВЭЖХ, эти измерения стали доступны без громоздких шагов по изоляции. Многоэлементный анализ с наборами данных значений δ13C-, δ2H- и δ18O должен позволить выявлять случаи мошенничества. Когда можно выделить достаточное количество ванилина, количественные измерения 2H- и 13C-ЯМР особенно эффективны для определения различного происхождения ванилина.Глава 16. Использование ванили в колониальной Мексике и традиционное выращивание ванили тотонаками
Мезоамерика
Племена, живущие в северных регионах естественного ареала ванили, были первыми, кто включил ваниль в свою жизнь, возможно, еще за 2000–2500 лет до испанского завоевания Мексики в 1520 году. От Центральной Мексики до Коста-Рики существовала страсть к острым ароматическим приправам. Ваниль имела сакральную и религиозную коннотацию, как кукуруза и какао. Это были дары богов, и к ним относились с почтением. Кукуруза обеспечивала питание, какао было церемониальным напитком, а ваниль – душистым ладаном. Стручки ванили измельчали и смешивали с копалом (высушенной смолой копалового дерева с приятным сосновым запахом), как благовония для для своих храмов. Коренные народы были хорошо осведомлены о лекарственном использовании трав и вполне могли использовать молотые стручки ванили при заболеваниях легких и желудка, также как использовали жидкость из стручков ванили в качестве припарок для удаления яда насекомых и инфекций из ран. Их навыки врачевания намного превосходили навыки европейцев, ко времени их прибытия в Мексику в шестнадцатом веке. Ваниль, привезенная в Испанию в начале XVI века, ценилась как товар, а у племенных народов Америки почтительно рассматривалась как священное лекарственное растение. В доклассический период, примерно в 1500 г. до н.э., обширные торговые пути, развитые по всей Мезоамерике, и обмен товарами между группами, живущими в различных климатических и высотных условиях, привели к культурному обмену, включая обмен важными открытиями и духовными верованиями. Вероятно, это было время, когда ваниль начала использоваться и продаваться среди прибрежных племен. По мере того, как кочевой образ жизни, связанный с охотой и собирательством, постепенно заменялся аграрным и оседлым существованием, население росло, и производство соответствующих продуктов питания становилось все более важным. Больше внимания уделялось богам природы, таким как Тлалок и Шипе Тольтек, поскольку считалось, что они управляют дождем, солнцем, ветрами и урожаем. Угодность богам означала обильные запасы пищи. Именно в этот период времени возникли ольмеки, «материнская культура» Мексики. Они жили во влажных лесах и открытых саваннах вдоль побережья Мексиканского залива на юге Веракрус и Табаско. Помимо того, что они были искусными художниками и имели развитую торговлю, ольмеки внесли огромный вклад в развитие того, что стало основой мезоамериканской диеты – кукурузы. Ольмеки разработали технику, которая непреднамеренно изменила питательную ценность кукурузы, которая до того не имела особого значения, а впоследствии буквально подпитывала рост и развитие всей Мексики. Вместо того, чтобы варить початки кукурузы до мягкости или молоть зерно в муку, кукурузу готовили с белой известью или древесной золой, а затем оставляли на ночь в кулинарной жидкости. Прозрачная оболочка (околоплодник) приготовленных початков теперь легко соскальзывает, что значительно упрощает растирание зерен в мягкое тесто (известное как никстамалле на науатле и маса на испанском языке). Этот простой сдвиг в готовке, превратил кукурузу, из зерна с низким содержанием белка, в высокобелковую пищу, создав мексиканский хлеб насущный. Вполне вероятно, что ольмеки были первыми, кто также окультурил какао и, с окультуриванием какао, в какой-то момент этой ранней истории, последовало использование ванили в качестве ароматизатора. Еще они создали атоле, слабо ферментированный напиток из кукурузы, который иногда приправляли ванилью. Со временем культуру ольмеков затмили майя – блестящие художники, архитекторы и ученые, породившие ренессанс в доиспанской мексиканской культуре. Кроме того они добились больших успехов в кулинарии, в том числе, усовершенствовали приготовление какао и создали напиток, чоколатль, который позже стал популярным среди ацтеков во времена Конкисты. И именно во времена майя ваниль, скорее всего, была представлена как один из ароматизаторов для чоколатля. Однако, не всегда в этом любимом напитке использовалась ваниль. Существует как минимум 12 различных вариантов аромата чоколатля, в зависимости от мероприятия и того, что было под рукой. Это мало чем отличается от наших вкусовых вариантов для кофе, молочных коктейлей и газированной воды с сиропом. Хотя тотонаки – народ, появившийся несколько позже в истории Мезоамерики, возможно, были первыми, кто окультурил ваниль. Их предшественники, безусловно, наслаждались дикорастущими лесными плодами. Согласно тотонакской легенде и распространенному мнению, тотонаки были первыми людьми, опознавшими и окультурившими ваниль. Письменная история бросает вызов этому убеждению. Тотонаки, пришедшие из Центральной долины Мексики, вероятно, ничего не знали о ванили, пока не прибыли на побережье Мексиканского залива. Однако, в настоящее время есть веские доказательства того, что существовали также тотонаки, живущие на на побережье, и что в какой-то момент истории Мезоамерики эти группы сошлись. Что известно наверняка, так это то, что ваниль занимала центральное место в жизни тотонаков на протяжении по крайней мере сотен лет, и она настолько связана их историей и знаниями, что принадлежит им в культурном отношении (см. приложение). Майя называли ваниль Зизбич, зоке-пополоки – Тих Мойя, тотонаки – Ксанат, а, намного позже, ацтеки назвали её Тлилшочитль. Интересно, что ксанат (произносится как чанат) является общим термином для цветов на языке тотонаков, что любопытно, учитывая статус ванили в их культуре. Её также иногда называют каксиксанат (катч-е-чанат), что означает «скрытый цветок», так как эти орхидеи эффектно не выглядят и не выделяются в лесу, а живут только в течение дня. Раньше ваниль собирали, когда она полностью созрела и раскрылась, наполняя воздух своим характерным ароматом. Вместо 100–200 стручков, типичных для растений, опыляемых вручную, было восемь или девять, случайно опыленных лесными насекомыми. Конечно, при таком соблазнительным аромате понятно, почему обитатели прибрежных и низкогорных лесов будут привлечены к её семенным коробочкам и поэкспериментируют со способами наполнить свою жизнь их манящим ароматом. Если какао было пищей богов, то ваниль определенно была нектаром, который её сопровождал!Ваниль в Новой Испании
Существует несколько упоминаний о ванили в Новой Испании 1500-х годов. Ацтекский травник был составлен на науатле и записан на латыни в 1552 году Мартином де ла Крузом и Хуаном Бадиано. Рукопись под названием Libellus de Medicinalibus Indorum Herbis была окончательно переведена на английский язык и опубликована в 1939 году (Ацтекские травы: классический кодекс 1552 года, Уильям Гейтс). Это самый ранний известный документ, в котором конкретно упоминается ваниль. В книге рассказывается, что ацтеки размалывали цветы с другими ароматическими веществами и носили их на шее в качестве лечебных талисманов или амулетов. Вполне вероятно, что подобные амулеты были впервые созданы племенами побережья Мексиканского залива, которые собирали ваниль. С другой стороны, ваниль была превращена в лекарство от сифилиса. Поскольку мы знаем, что цветы ванили живут только в течение дня, они могли сначала высушиваться, а затем доставляться торговцами почтеками в долину Мексики, хотя есть любопытные пометки о том, что Монтесума выращивал ваниль в своем обширном ботаническом саду. Книга также содержит первую известную иллюстрацию растения ванили. Ацтеки были талантливыми травниками, как и большинство мезоамериканских народов. Независимо от того, определили ли они целебные свойства ванили самостоятельно или узнали о ней от торговцев почтеков, редкая и ценная ваниль имела важное значение и как лекарство, и как афродизиак в их культуре. В 1529 году францисканец – брат Бернардино де Саагун прибыл из Испании с заданием – обратить ацтеков в христианство. Просвещенный монах сначала выучил науатль, «родной язык» ацтеков, затем научил молодых людей из числа коренного населения писать свою историю на наутле, используя испанское правописание. В течение следующих трех десятилетий они коллективно записывали все аспекты ацтекской культуры. 12-томная история, написанная как на науатле, так и на испанском, была отправлена в Испанию, но католическая церковь сочла её еретической, и большая часть работы не публиковалась до 1829 года. Однако, ацтекские материалы в конечном итоге попали в Лаврентийскую библиотеку во Флоренции, где она стала известна среди ученых как Флорентийский кодекс. Брат Бернардино Саагун упомянул о широком распространении среди колонизаторов горячего шоколада. Он писал: «Он ароматный, благоухающий, драгоценный, приятный и лекарственный. Он поджаривается и смешивается в какао. Я добавляю в какао ваниль и пью как ваниль». (Это были его слова – неясно, что он имел в виду, говоря «пить, как ваниль».) Какао и ваниль можно было купить на рынке в Новой Испании, но только самые богатые люди и духовенство Новой Испании могли позволить себе их употребление.Ваниль как лекарство в Новой Испании
По словам брата Саагуна, шоколад, смешанный с ванилью и двумя другими ароматическими травами, был средством от кашля и кровохарканья. На основе комментариев Саагуна исследователи до сих пор задаются вопросом, использовалась ли ваниль для лечения заболеваний легких, таких как туберкулез, от которых коренные народы страдали с доисторических времен. Недавние медицинские открытия показали, что еще одна страшная болезнь, которая вызвала тяжелое поражение легких, также могла быть тем, что брат Саагун назвал в своих заметках коколизтли (чума на науатль), одним из самых смертоносных бедствий в истории. Доктор Франсиско Эрнандес был отправлен в Новую Испанию королем Филиппом II в 1570 году для изучения естественной истории колонии, лекарственных трав и других местных методов лечения, а также для составления антропологической истории страны. Он провел семь лет в долине Мексики, выучил науатль, изучал местную медицину и написал свои наблюдения на латыни, создав Естественную историю Новой Испании (Rerum Medicarum Novae Hispaniae Thesaurus) – сборник из шести томов, описывающий более 3000 растений. К книгам прилагались 10 томов иллюстраций мексиканских художников. В своих трудах Эрнандес называл ваниль её науатльским названием Тлилшочитль, что означает – черный стручок. Однако, он ошибочно перевел это слово как «черный цветок», что привело к столетиям путаницы по поводу все более популярной ванили. Он также классифицировал ваниль как Araco aromatico. Эрнандес писал о лечебных свойствах ванили, о которых узнал от местных врачей: «Отвар стручков ванили, пропитанных водой, заставляет мочу превосходно оттекать; смешанные с мекаксучитлем, ванильные стручки вызывают выкидыш; согревают и укрепляют живот; уменьшают метеоризм; смешивают гуморы и смягчают их; придают сил и бодрости уму; лечат женские болезни; и говорят, что они хороши против холодных ядов и укусов ядовитых животных». Сама по себе ваниль озвучена как чудодейственное средство, но Франсиско Эрнандес также говорит о трех ароматизаторах, которые «возбуждают любовный аппетит», – о Виагре шестнадцатого века. Ваниль, какао и макаксочитль (растение, родственное черному перцу и известное теперь как акуйо – Piper auritum) были тремя главными претендентами, которые добьются успеха. Фактически, столетия спустя репутация ванили как афродизиака все еще сохраняется.Традиционное выращивание ванили тотонаками
До конца 1600-х годов ваниль росла только в лесу. Через некоторое время её окультурили, срезав лианы и посадив их ближе друг к другу, чтобы облегчить сбор урожая. Выращивание ванили также облегчило насекомым-опылителям доступ к цветам, и урожайность значительно улучшилась. Только в 1875 году некоторые французы, жившие на побережье Веракрус, привезли из Франции технику искусственного опыления ванили. Первоначально они хранили эту информацию между собой и переработчиками ванили, но тотонаки обвинили их в краже стручков из-за больших урожаев, поэтому тотонаков тоже обучили этой технике. Это нововведение, конечно же, полностью изменило мексиканскую промышленность, и производители тотонаков стали богаче, хотя и никогда не такими богатыми, как евро-мексиканцы, которые покупали зеленые стручки и продавали готовую ваниль в Европу и Америку. Ниже рассказывается о традициях, использовании и духовной ценности ванили в культуре тотонаков. Тотонаки выращивают собственную ваниль в тех же условиях, как она росла в естественном лесу. Их методы и ритуалы оставались практически неизменными до 1970-х годов. Сегодня фермеры-тотонаки продолжают выращивать ваниль аналогичным образом, но большинство ритуалов, связанных с этим циклом, больше не практикуется. Перед тем, как начать какие-либо работы, с Кивигило – «лесным стариком», советовались и просили разрешения на расчистку земли. Также попросили, чтобы на плантацию ванили не заползали ядовитые змеи. Принято было при посадке давать Кивигило обещание обеспечить хороший урожай. Готовилась ритуальная еда из огненного моле с индейкой, которую приносили земле в качестве подношения за плодородие и для того, чтобы ваниль процветала. Маленькие тортильи готовили в количестве две, четыре, пять, восемь, десять и двенадцать, чтобы использовать их в качестве ритуальной пищи для богов. Это были традиционные числа, которые были синкретизированы с католицизмом для обозначения 12 апостолов. В традиционном доме тотонаков было два алтаря. Главный алтарь, который большинство людей видели при входе в дом, был католическим алтарем. Он был – и до сих пор – украшен витыми орнаментами из пальм, изображениями святых, иконами, цветами и свечами. На видном месте выкладывали еду и питье. Традиционный алтарь тотонаков находился под главным алтарем и посвящался Кивигило. Обычно его прятали за небольшими декоративными экранами из резной бумаги (папель пикадо). Алтарь был покрыт тканями, украшенными ритуальным орнаментом. Идолы и фигурки из камня или металла – подлинные археологические находки, найденные тотонаками в сельской местности во время работы на полях – украшали алтарь. Эти идолы передавались от отцов к сыновьям из поколения в поколение. Подношения состояли из местных растений и плодов, минералов, костей, шкур животных, птичьих перьев, кукурузы и семян, земли и воды. На алтарь также клали сигары, сделанные из местного табака. В католических церквях в сельской местности по всему Тотонакапану до сих пор часто можно увидеть святых-покровителей города, одетых в традиционные тотонакские платья, с небольшими подношениями воды, рефино (самогона из сахарного тростника) и кукурузных початков у ног святых. Такие дары в начале посевного сезона, должны гарантировать хороший урожай. Затем, земля вырубалась и выжигалась, чтобы расчистить лесной подлесок. Подлеску разрешали остаться, поскольку он обеспечивал необходимое затенение ванили. Быстрорастущие кусты, которые было легко размножить, сажались в качестве опекунов для ванили; традиционные кусты и небольшие деревья включали рамон, лаурел, чаку, капулин, пата-де-вака, баллетиллу (качуапакстле), кохон-де-гато и пичоко. Эти кусты выбраны из-за своих мелких листьев и круглогодичной листвы, позволяющих сохранить баланс солнца и тени. Здоровые ванильные лианы (esquejes) длиной 2–3 м нарезались в лесу и высаживались индивидуально или рядами по две рядом с опекунами. Для тотонаков каждая из многих разновидностей ванили, произрастающих в этом регионе, имела религиозное значение. Vanilla pompona, называемая Vainilla bastarda, считалась «Королевой ванили» и всегда сажалась в ключевой точке плантации. Поскольку V. pompona крупнее и выносливее, чем V. planifolia, считалось, что она защитит другие растения, и если плохое самочувствие или вред семье будут причинены болезнью или проклятиями, то сначала они затронут V. pompona и будут поглощены, оставив семью в безопасности. V. planifolia была известна как Vainilla mestiza. Vainilla rayada, также известная как Vainilla rayo или Vainilla de taro (бамбуковая ваниль), имеет полосатый лист и аромат, аналогичный planifolia. Именно ваниль всегда была посвящена важнейшему культу плодородия. Были также Vainilla de puerco (свиная ваниль), Vainilla de mono (обезьянья ваниль), Vainilla oreja de burro (ваниль ослиных ушей), Vainilla de monte alto (ваниль высокого леса) и другие, каждая со своей особой историей, большинство из которых, к сожалению, никогда не записывались и, вероятно, потеряны навсегда. Площадь традиционных насаждений составляла от 10 до 30 га. Компост из опавших листьев и прочих лесных остатков вносили под растения в феврале, августе и декабре. Первые соцветия на традиционной плантации появляются через три-четыре года. 18 марта проходила Fiesta de Fecundacion – праздник плодородия. Цветение начинается в это время и продолжается до начала мая. Во время опыления вводились ограничения в питании. Говядина и рыба, как и некоторые другие продукты, были запрещены, чтобы не лишиться цветения. В период опыления также воздерживались от секса. Когда было открыто искусственное опыление, его всегда называли «ванильной свадьбой». Поскольку опыление производилось вручную с помощью небольшой палочки, когда пыльца перемещалась с мужского пыльника и оседала на женском рыльце, это было похоже на половой акт. Поскольку для развития ванили требовалось от восьми до девяти месяцев, то весь цикл мало чем отличался от цикла размножения человека. По этой причине ваниль в тотонакском видении мира воспринималась как божественно связанная с человечеством. Согласно поверьям и практике тотонаков, ванильные орхидеи имеют как мужские, так и женские растения. Самцы производят много цветов, но стручки не завязываются и быстро опадают. Поскольку растения по сути выглядят одинаково, если растения не плодоносили в течение четырех лет, их убирали с плантации – такая практика продолжается и сегодня. Недавно было показано, что хромосомное изменение (триплоидия) является причиной стерильности некоторых лиан из-за нежизнеспособной пыльцы. Палочка, используемая для опыления, была – и остается – тщательно подготовленной. Некоторые фермеры считали, что тип древесины не имеет значения, но другие верили, что сердцевина чака – единственная древесина, которую можно использовать. Кончик строгали ножом или мачете, пока он не становился тонким, похожим надолото. Растения, расположенные высоко и вне досягаемости, обязательно опылялись, поскольку имели меньше шансов быть украденными. Чтобы добраться до цветов, применялись веревки или лестницы. Для опыления иногда использовалась V. pompona. Цветок срезали и относили к культивируемой лиане; процесс опыления был таким же, за исключением того, что цветка было два, а не один. Стручки от этого кросса были больше и тяжелее, но невысокого качества. Через день или два после опыления цветы проверяли, чтобы убедиться, что стручки завязались. В противном случае опыляли дополнительные цветы для обеспечения максимального урожая. После опыления ванили, мало что требуется делать с растениями до сбора урожая. Это давало время для ухода за семейной милпа (выращиваемыми культурами), охоты и других необходимых дел. И это было время волнения, особенно если дожди не вернулись вовремя. В Папантле всегда были очень непостоянные дожди, и, следовательно, большое беспокойство по поводу их циклов. Поскольку почва тонкая и большая часть земли находится на большом известняковом шельфе, сильные ливни быстро поглощаются землей. Если дождь не вернется к маю, это может иметь катастрофические последствия как для ванили, так и для прочих культур. Поэтому молитвы и подношения за дождь совершались постоянно. Изначально стручки собирали, когда они созрели и начали сохнуть. Позже, по мере совершенствования технологий и установления стандартов, их стали собирать, когда они становились почти спелыми. Лучшие стручки – с наибольшим количеством масла – собирали в конце января – начале февраля. Большую часть ванили привозили в casas de beneficio и продавали зеленой. В зависимости от того, где жили семьи, иногда было проще оставить стручки на ранчо и сушить их там. В домашних условиях также сушили падалицу и рано созревшую ваниль. Эти стручки не считались обладающими премиальным качеством. Некоторые из тотонаков стали бенефициадорами (beneficiadores), покупали стручки у своих соседей, а затем обрабатывали их, используя те же методы, что европейцы и метисы. Это было особенно распространено в пуэбло, спрятанных в горах, которые были труднодоступны для Папантлы, хотя некоторые из бенефициадоров объезжали ранчо в Папантле, закупая ваниль. На начальных этапах коммерческого производства счет ванили велся на тысячи. Позже она продавалась зелёной, партиями по 100 стручков. Затем – на вес, пучками по 3–5 фунтов каждый; 100 зеленых стручков считались около 5 фунтов. Сейчас её продают килограммами, как зеленые стручков, так и сухие. Папантла была известна как Качикин, или «город». Поездки в Качикин планировались для доставки стручков или на праздники и святые дни, и сочетались с закупкой припасов, которых нельзя было найти за пределами города. Ослы или мулы были основным способом перевозки товаров. Когда ваниль была наконец готова к отправке из Папантлы, её грузили в жестяные коробки, а затем в большие кедровые ящики. Ящики несли мулы либо через холмы в Теколутла, где их сплавляли на плоскодонных лодках, называемых халанами, либо их везли на мулах обратно в горы к железнодорожной станции в Тезуитлан, откуда ваниль отправлялась в порт Веракрус. Большая часть ванили шла в Соединенные Штаты, но до начала двадцатого века она также попадала в Европу. Удачный урожай и распродажа всегда отмечались местными праздниками. Успешная доставка денег домой была столь же важна, как и продажа. Грабежи, нападения и убийства всегда были проблемой, неразрывно связанной с производством ванили, точно так же, как «привязка к фирменному магазину» – проблема для мелких фермеров во всем мире. Многие из бенефициадоров имели запасы и, по сути, держали тотонаков в рабстве. Они не сообщали тотонакам цену продажи их ванили, а вместо этого выдавали кредиты, которые редко покрывали стоимость поставок. Эти две проблемы всегда были в центре внимания производителей. Однако, поскольку большинство тотонаков не говорило свободно по-испански, и даже те, кто говорил, обычно были неграмотны, то они не имели доступа к текущим ценам на ваниль, и потому были вынуждены соглашаться с оплатой или не продавать вообще. Поскольку ваниль, пока доходила до бенефициадоров в Папантле, зачастую передавалась через несколько рук, то разница в цене между тем, что получал фермер, и тем, за что ваниль в конечном итоге продавалась, была значительной. Семьи, которые сушили свою ваниль или работали в casas de beneficio, использовали ванильное масло, которое стекало на первых этапах обработки и сушки, для втирания в кожу или для блеска волос. Ваниль также использовалась как освежитель воздуха и парфюм для одежды. Сушеные стручки заправляли в ленты вместе с цветами и перьями. Агуардиенте со вкусом ванили всегда готовили к крещениям, свадьбам и другим важным семейным событиям – традиция, которая сохраняется и соблюдается сегодня, даже когда другие ритуалы ускользнули.Благодарность
Соавторы хотели бы отметить важный вклад Росио Агилеры Мадеро в подготовку этой главы посредством личного общения, в частности, о выращивании тотонаками ванили, а также посредством информации, опубликованной в информационном бюллетене La Voz del Vainillero, Union Agricola Regional de Productores de Vainilla, Papantla, Mexico.Приложение: Легенда о ванили
Это легенда тотонаков о происхождении ванили в Мезоамерике. Время появления этой легенды неизвестно. В древние времена Земля Доброй и Сияющей Луны была королевством Тотонакапан, которым управляли тотонаки. За усеянными пальмами песками, зелеными долинами, мерцающими холмами и горами в том месте, которое сейчас известно как Веракрус, наблюдали из нескольких мест. Одним из них была Папантла, место обитания папанских птиц. Другим был Эль Тажин (молния), древний город, построенный в честь божества Хуракана/Тлалока – бога бурь. Именно здесь, в этом густом тропическом лесу, впервые начали выращивать и готовить ваниль. Именно здесь аромат ванили был настолько изысканным, что Папантла позже стала известна как Город, дарящий миру благоухание. Однако, было время, до правления Теницли III, когда не было ванили. В этом городе, известном своими художниками и скульпторами, Теницли и его жена были благословлены дочерью настолько красивой, что они не могли вынести мысли, выдать её замуж за смертного. Они посвятили её жизнь культу богини урожая и пропитания Тоноакайохуа, могущественной богини, влияющей на жизнь и выживание всего народа. Их дочь, принцесса Цакопонциза (Утренняя звезда), проводила свое время в храме, принося в жертву богине еду и цветы. Именно во время её путешествия из леса с цветами для храма, молодой принц Зкатан-Оксга (Молодой Олень) впервые увидел Утреннюю Звезду и сразу же попал под её чары. Он знал, что даже позволяя своему взгляду на мгновение задержаться на ней, глядя на её невинную красоту, рискует оказаться обезглавленным, но был одержим тем, чтобы она стала его женой и соправительницей. Любовь в его сердце к Утренней звезде перевешивала опасность быть схваченным и убитым. Каждое утро, перед тем как Утренняя Звезда уходила в лес в поисках цветов и голубей для жертвы богине, Молодой Олень прятался в подлеске и ждал прибытия прекрасной принцессы. Однажды утром, когда низкие плотные облака цеплялись за холмы после дождя, Молодой Олень был настолько охвачен желанием, что решил похитить Утреннюю Звезду и бежать с ней в горы. Когда она прошла рядом, он выскочил из кустов, схватил её за руку и побежал вместе с ней вглубь леса. Хотя Утренняя Звезда была поражена внезапным появлением Молодого Оленя и его пылкой страстью, но она попала под чары их несчастливой судьбы и охотно последовала за ними. Как только они достигли первых гор, из пещеры появилось ужасное чудовище и, извергнув огонь, заставило юных влюбленных отступить к дороге. Когда они это сделали, появились жрецы Тонакайохуа и преградили им путь. Прежде чем Молодой Олень успел произнести хоть слово, священники сразили его и обезглавили. Вскоре и Утреннюю Звезду постигла та же ужасная участь. Их сердца, которые все еще бились, вырезали из тел, отнесли в храм и положили на каменный алтарь, в качестве подношения богине. А сами тела были сброшены в глубокую пропасть. Вскоре после этого, на том самом месте, где они были убиты, трава, на которую пролилась их кровь, начала сохнуть и сморщиваться, как будто их смерть была предзнаменованием перемен. Несколько месяцев спустя, настолько быстро вырос и покрылся густой листвой куст, что за несколько дней поднялся на несколько футов. А из земли появилась изумрудно-зеленая лиана. Её усики переплелись со стволом и ветвями куста куста, одновременно нежно и крепко, как в объятиях. Усики были хрупкими и элегантными, листья полными и чувственными. Все с изумлением наблюдали, как однажды утром по всей лиане расцвели нежные желто-зеленые орхидеи, похожие на отдыхающую молодую влюбленную женщину, мечтающую о своем возлюбленном. По мере того, как орхидеи умирали, развивались тонкие зеленые стручки, и, со временем, они испускали аромат более великолепный, чем лучшие благовония, предложенные богине. Именно тогда священники и приверженцы Тонакайохуа осознали, что кровь Молодого Оленя и Утренней Звезды превратилась в крепкий куст и нежную орхидею. Орхидея и лиана были обозначены как священный дар богине и с тех пор являются божественным подношением тотонаков своему божеству и миру.Глава 17. Долг ванили острову Реюньон
Ваниль пришла на остров Бурбон, ныне известный как остров Реюньон, на заре девятнадцатого века, из Центральной Америки, с другой стороны планеты. Гений 12-летнего чернокожего раба превратил бесплодную орхидею в стручковый источник богатства. Трудолюбие реюньонцев (жителей Реюньона) раскрыло всё лучшее из её аромата. К концу века её приняли новые края – прилегающие острова Индийского океана. Международное признание было получено благодаря присвоенной в 1964 году марке качества «Бурбонская ваниль». Когда, в начале девятнадцатого века, ваниль была завезена на остров Реюньон, ранее называвшийся островом Бурбон, она прошла долгий путь с другой стороны планеты и имела богатую историю (Lucas, 1990). Однако, главное произошло после её акклиматизации на Реюньоне, которая способствовала коммерческому успеху. Реюньонцы превратили эту экзотическую орхидею в прибыльный товар, прежде чем экспортировать её по всему миру. Благодаря своим техническим ноу-хау, изобретательности и природному гению, реюньонцы стали архитекторами сказочных приключений ванили. Сага, которая началась на острове Реюньон и в других регионах, куда была завезена орхидея, привела к многочисленным состояниям, но также к неизбежным спорам и трагедиям.От тлилшочитля до ванили: от Мексики до Реюньона
Первоначально орхидея была туземным растением, которое дико росло в мексиканских лесах и на отдаленных просторах Центральной Америки. Она была более известна у ацтеков как тлилшочитль (что на языке науатль означает «черный цветок»). Биографы отслеживают её с книги Бернардино де Саагуна Всеобщая история Новой Испании (Sohagun, 1801). Книга является важной вехой не только потому, что это самая старая из известных справок о тлилшочитле, но и потому, что она дает ценную информацию о том, как её использовали ацтеки. Саагун, испанский монах, высадился в Мексике через восемь лет после её завоевания испанцами. Он рассказывал, что «после каждого приема пищи подавались какао-напитки с тонким вкусом, например, приготовленные из стручков, и которые были очень вкусными; один из меда, а другой из нежного тлилшочитля». Говорят, что император Монтесума предложил эту драгоценную смесь прославленному Кортесу. История не показывает, был ли Кортес завоеван напитком из какао, приправленным тлилшочитлом, но мы знаем, что произошло потом. Множество золота и драгоценных растений было отправлено в Европу, и среди них был тлилшочитль. Испанцы попали под очарование её аромата и назвали орхидею ванилью – в переводе стручочек, уменьшительная форма слова vaina, которое означает стручок, несомненно, из-за формы плода. Помимо Испании, другие европейские страны открыли для себя ваниль, и её коммерциализация началась во Франции, где в 1692 году она продавалась исключительно через королевскую монополию. Распространенная и, в значительной степени, натурализованная, ваниль в восемнадцатом веке была предметом многих исследований (Lucas, 1990). Спустя столетие это, уже популярное растение, было завезено на Реюньон. Гористый остров площадью 2500 квадратных километров, расположенный в 800 км к востоку от Мадагаскара в центре Индийского океана, не был населён до июля 1665 года, когда сюда прибыли французские поселенцы. Их прислала Французская Ост-Индская компания, основанная в 1664 году Кольбером. Во время французского колониального периода, рабство в значительной степени способствовало развитию сельского хозяйства. Эмансипация произошла в 1848 году, когда освобожденные рабы, в основном африканского и малагасийского происхождения, были заменены на полях индийскими наемными работниками (Lucas and Serviable, 2008). Интродукция ванили соответствует давней традиции акклиматизации, проводимой учеными, администраторами, военно-морскими офицерами или непрофессионалами. Они стремились обогатить растительное наследие, тем самым способствуя экономическому развитию Реюньона. Ей мы обязаны местному военно-морскому офицеру, который первым завез на остров растения ванили. 26 июня 1819 года командор Филибер (рис. 17.1), командующий военно-морской эскадрой, останавливается на своей родине после возвращения из миссии в «южные моря», предположительно с теплых берегов Тихого океана и из Кайенны во Французской Гайане. РИСУНОК 17.1. Командор Пьер-Анри Филибер, первым привезший растения ванили (вероятно, V. pompona) на остров Реюньон в 1819 году (литография из Album de La Réunion, A. Roussin).
РИСУНОК 17.1. Командор Пьер-Анри Филибер, первым привезший растения ванили (вероятно, V. pompona) на остров Реюньон в 1819 году (литография из Album de La Réunion, A. Roussin).
Образцы различных растений, включая ваниль, были взяты из поместья Ла Габриель в Кайенне, ранее врученного генералу Лафайету в качестве подарка на память от нации в за оказанные услуги. Это короткий, толстый стручок, вероятно, Vanilla pompona. Для Филибера не возникает вопроса: введение ванили на Реюньоне может стать источником процветания. И даже больше! В письме губернатору колонии он пишет: «Это растение могло бы быть товарной культурой, продаваемой в Азии. И колонисты просто не могут не заработать большие деньги на его выращивании» (Billiard, 1822). Год спустя, вернувшись из другой миссии, на этот раз с Филиппин, командор Филибер привозит вторую партию черенков ванили. Растение было обнаружено в лесах недалеко от Манилы ботаником Перроте, членом исследовательской миссии; он также был и в предыдущей экспедиции. Ваниль отличалась от привезенной из Кайенны. Ее стебель и листья были меньше. Называемая «маленькой ванилью» по сравнению с V. pompona, она была официально завезена на остров Реюньон 6 мая 1820 г. (Thomas, 1828). Третья интродукция – заслуга местного колониального администратора Маршана. Воспользовавшись поездкой во Францию, он посетил Парижский музей и получил черенки мексиканской ванили. Этот сорт, выращиваемый в теплице, происходит от растений, привезенных маркизом Бленфордом и составляющих коллекцию Чарльза Гревилла в Паддингтоне (Англия). Данный конкретный вид был интродуцирован 25 сентября 1822 г. и отличался от двух прецедентов – фактически, это и была Vanilla planifolia. Тем не менее, все эти образцы, взятые в Кайенне или Париже, были объединены вниманием, проявленным при их выборе, и бдительной заботой, проявленной во время их перевозки. А. Дельтей, автор исследования о ванили, подробно описывает действия Перроте: «Он взял стебли длиной 4 или 5 метров, скатал их в кольца и положил горизонтально в ящики. Он поливал их умеренно, чтобы не допустить высыхания органических тканей лианы. Ящики были покрыты плотной металлической сеткой для защиты от солнечных лучей. Они прибыли на Реюньон через два с половиной месяца в идеальном состоянии, у некоторых из них даже развились почки и усики» (Delteil, 1884). На Реюньоне черенки подверглись методической обработке. Филибер, которого губернатор обвинил в том, что он не доставил ваниль непосредственно в Королевский ботанический сад Сен-Дени, оправдал свой выбор: «Поскольку эти разные виды были собраны в разных местах, удаленных друг от друга, я убежден, что для обеспечения успеха этого растения, разумно рассадить его в разных частях острова с разной температурой; так что, если оно не добьется успеха в одном регионе, то сможет найти более подходящие преобладающие условия в другом. Действительно, если все получится хорошо в одном месте – успех обеспечен. Поэтому решение, которое я принял, раздать черенки нескольким жителям, кажется лучшим для акклиматизации этого драгоценного растения. Более того, я раздавал их только тем, чьи сельскохозяйственные таланты хорошо известны, например г-ну Хьюберту: как вы видите, это дополнительная мера предосторожности, которую я принял» (Focard, 1862). Таким образом, ваниль была завезена на Реюньон три раза, в разное время, разными героями. Она происходит из трех разных областей и относится к трем разным видам. Акклиматизация будет результатом различных факторов: выбора почвенных и климатических условий, разумных советов от тех, кто привез растение, бдительности властей и непрекращающейся заботы островитян.
Гениальный раб
Ваниль, завезенная и выращиваемая на Реюньоне с 1819 года, еще не является коммерческим продуктом, так как не приносит плодов. Естественное оплодотворение цветка – случайная операция из-за его морфологии (рис. 17.2). Действительно, мужские и женские органы разделены большой мембраной, которая препятствует их контакту. Прямое опыление невозможно и требует участия насекомых или колибри. В Центральной Америке эту важную роль играют мелкие пчелы (мелипоны). Без внешнего вмешательства драгоценная орхидея обречена на бесплодие. РИСУНОК 17.2. Морфология цветка ванили. (Литография из Album de La Réunion, A. Roussin, 1872 г.).
РИСУНОК 17.2. Морфология цветка ванили. (Литография из Album de La Réunion, A. Roussin, 1872 г.).
Чтобы выйти из этого тупика, нужно было найти способ искусственно оплодотворить растение. В Европе были начаты два эксперимента: первый в Льеже в 1836 году и второй в Париже в 1838 году. Но предложенная методология, равно как и попытка, предпринятая несколькими годами позже в Гваделупе, была отвергнута как очень сложная и малоэффективная. Самый эффективный процесс опыления был обнаружен в 1841 году молодым реюньонским рабом Эдмоном – рабы не имели фамилий. Он был собственностью богатой семьи плантаторов в Сент-Сюзанне, Беллье-Бомон. Эдмон родился в 1829 году. Он потерял мать, рабыню из поселка Беллье-Бомон. Хотя Эдмон не имел школьного образования из-за своего статуса раба, он развил редкую проницательность для решения садоводческих задач от своего хозяина. Мезьер Леперванш сообщал, что Эдмон «идентифицирует все цветы по их ботаническим названиям и во многих случаях он пытался искусственно каприфицировать свои цветы, которые по той или иной причине нельзя опылить естественным путем» (Focard, 1862). Он провел такой же эксперимент с цветком ванили, объединив мужской и женский компоненты. Эдмону было всего 12 лет, и он открыл для себя процесс искусственного опыления ванили. Открытие, которое Фереоль Беллье-Бомон, учитель Эдмона, описывает так: «Прогуливаясь (с Эдмоном), я заметил на единственном растении ванили, которое у меня было – глянцевый черный стручок. Я показал свое удивление, и он сказал мне, что действительно опылил цветок. Я отказался верить ему и двинулся дальше. Но через два или три дня я увидел вторую коробочку рядом с первой. Он повторил свое утверждение. Я спросил его, как он это сделал. Он выполнял свою манипуляцию передо мной (...), и я должен был признать это, когда увидел, что операция повторяется каждый день и каждый раз с одинаковым успехом» (Focard, 1862). Год спустя, в 1842 году, Фереоль Беллье-Бомон, не желавший сохранять секретность, написал статью в местной газете Le Moniteur. Это не прошло незамеченным. Хорошая новость распространилась по всей стране, как лесной пожар, и Беллье-Бомон столкнулся с требованиями одолжить своего молодого раба. Никогда за всю историю Реюньона к рабу не снисходили так, как к юному Эдмону (рис. 17.3).
 РИСУНОК 17.3. Портрет Эдмона Альбиуса, изобретателя ручного опыления ванили. (Литография из Album de La Réunion, A. Roussin, 1863 г.).
РИСУНОК 17.3. Портрет Эдмона Альбиуса, изобретателя ручного опыления ванили. (Литография из Album de La Réunion, A. Roussin, 1863 г.).
Плантаторы обратились к нему, «правильно подумав, что гораздо проще и безопаснее иметь дело напрямую с изобретателем» (Focard, 1862). Открытие Эдмона (рис. 17.4) принесло удачу многим плантаторам; оно обеспечило новую сельскохозяйственную деятельность и способствовало развитию ванили во всем мире. Однако, изначально – это не принесло рабу ни награды, ни даже свободы. Он был освобожден семь лет спустя, в 1848 году, и получил имя Альбиус, что на латыни означает белый. Несмотря на его эпохальное открытие, любая его личная просьба оставалась без ответа – и со стороны властей, и со стороны плантаторов.
 РИСУНОК 17.4. Ручное опыление ванили. (Литография из Album de La Réunion, A. Roussin, 1872 г., любезно предоставлено Océan Editions.)
РИСУНОК 17.4. Ручное опыление ванили. (Литография из Album de La Réunion, A. Roussin, 1872 г., любезно предоставлено Océan Editions.)
Но было хуже, чем неблагодарность, и усугубляло оскорбления то, что открытие Эдмона вызвало ревность и споры. Многие сомневались в его заслуге, указывая на то, что он был «неграмотным маленьким негром», и что открытие было чистой удачей! Другие даже утверждали о своей ответственности за открытие и своих авторских правах, щеголяя своим статусом и знаниями. Третьи признавали, что Эдмон Альбиус был единственным и законным изобретателем процесса опыления ванили, добавляя, что тот был белым человеком. В ужасающей нищете, покинутый всеми, Альбиус умер в Сент-Сюзанне 9 августа 1880 года (Lucas, 1990).
Обработка: Реюньонский процесс
После натурализации и ручного опыления, еще одно реюньонское ноу-хау было использовано для преобразования стручка ванили. На самом деле, когда его собирают, стручок не имеет запаха. Его трансформация происходит только после длительной обработки, занимающей несколько месяцев. После этого он приобретает оттенок темного шоколада и восхитительный сладкий аромат, который очень ценится. Если в теплых регионах Центральной Америки существуют многочисленные методы приготовления стручков, их можно разделить на два основных типа – прямое и непрямое приготовление. Первый процесс обеспечивает естественное вызревание стручка, оставляя его выставленным попеременно на солнце и в тени. Второй процесс направлен на то, чтобы остановить естественную эволюцию стручка. Говорят, что ваниль «убита». Мексиканцы использовали оба метода (Bourriquet, 1954). На острове Реюньон ваниль готовили путем сушки в тени и на солнце. Но в начале девятнадцатого века с этими процессами получались неважные продукты, которые не могли выдержать долгое плавание на корабле. А для ванили у Реюньона были пьянящие амбиции. Вот почему целеустремленные и креативные плантаторы стремились к совершенству (Delteil, 1884). В 1851 году Эрнест Лупи, адвокат по профессии и плантатор по семейным традициям, воодушевленный острым чувством ученого любопытства, решил опробовать новый метод – бланширование в горячей воде, который он нашел в Encyclopédie méthodique (Методическая энциклопедия, издание 1787 года). Результаты были убедительными. Так родился процесс «кипячения». Давид де Флорис, отставной военно-морской служащий и плантатор в Сент-Андре усовершенствовал процесс Лупи (Floris 1857). Ваниль не была для него чем-то новым, и он не остался равнодушным к высоким ожиданиям, которые она вызывала. Сам де Флорис руководил судном, привозившим образцы Маршана в 1822 году. Новый метод, разработанный двумя плантаторами Сен-Андре, когда стручки собирались полностью созревшими со здоровых растений, дал отличные результаты. В 1857 году де Флорис издал справочник по обработке ванили, первый в истории реюньонский справочник! Книга имела большой успех и привлекла к методу внимание всех без исключения (рис. 17.5). РИСУНОК 17.5. Сушка и сортировка ванильных стручков на острове Реюньон в начале двадцатого века. (Открытка из личной коллекции автора.)
РИСУНОК 17.5. Сушка и сортировка ванильных стручков на острове Реюньон в начале двадцатого века. (Открытка из личной коллекции автора.)
Завоевание мира
Если через семь лет после открытия Эдмона, Реюньон экспортировал свою первую продукцию ванили (около 50 кг), то, после нововведений, осуществленных Лупи и де Флорисом, экспорт просто взлетел. С 267 кг в 1853 году, экспорт достиг более 3 тонн в 1858 году и 15 тонн менее чем через пять лет. В конце девятнадцатого века ваниль была почти такой же прибыльной, как сахар. Никогда ранее в экономической истории острова Реюньон товар не имел такого стремительного развития и не приносил столько богатства (рис. 17.6). В 1867 и 1900 годах «Expositions Universelles» (Международные коммерческие ярмарки) отметили успех реюньонской ванили. Местные плантаторы и обработчики увезли множество призов (Lucas, 1990). РИСУНОК 17.6. Обработка ванили на острове Реюньон. (Открытка из личной коллекции автора.)
РИСУНОК 17.6. Обработка ванили на острове Реюньон. (Открытка из личной коллекции автора.)
Для известных местных романистов, писавших под коллективным псевдонимом Мариус-Аре Леблон, креольская цивилизация могла быть приравнена к ванили. Обращаясь к истории, географии и чувственности, два автора наводили лирический глянец: «Вы все слышали о реюньонской ванили, которая выиграла первый приз на многих международных выставках. Никто не может представить, насколько трогательным и прекрасным может быть её изготовление с помощью умелой ручной работы. Некоторые слова – это полные ложки душистых духов и душ. Слова ваниль и фабрика ванили позволяют нам представить и даже почувствовать Сен-Жозеф, Винсендо, Ланжевен, все эти причудливые деревушки с благословенными именами, лелеющие, как невинный ладан, аромат ванили, чтобы приветствовать нас самым сладким образом» (Leblond, 1931). Уверенные в своем мастерстве, увенчанные лаврами, присуждаемыми на многочисленных национальных и международных мероприятиях, реюньонцы на рубеже веков были полны уверенности в себе (рис. 17.7). Имея большие планы на успех, они отправились покорять острова Индийского океана своими ароматными стручками ванили. В 1866 году они завезли на Сейшельские острова ваниль, которая имела молниеносный успех. Менее чем за 10 лет она стала главным источником процветания архипелага – на заре двадцатого века экспорт Сейшельских Островов почти равнялся экспорту Реюньона.
 РИСУНОК 17.7. Экспортеры ванили в начале двадцатого века. (Открытка из личной коллекции автора.)
РИСУНОК 17.7. Экспортеры ванили в начале двадцатого века. (Открытка из личной коллекции автора.)
В 1873 году реюньонцы отправились со своими ванильными мечтами на Коморские острова. Первоначально ваниль была завезена на Майотте, а затем распространилась на три других острова. Как и на Сейшельских островах, она была настолько успешна, что вскоре заменила сахарный тростник в первом десятилетии двадцатого века. Спектакль «Коморо» вскоре вытеснил «Реюньон». По такому же сценарию играли на Мадагаскаре, когда некоторые реюньонцы привезли ваниль в 1880 году на остров Нуси-Бе, прежде чем захватить северо-запад материковой части Мадагаскара. Реюньонская ваниль процветала в благоприятных условиях. И стартовала захватывающая гонка за ванилью. Все хотели её производить. Реюньонские колонисты и малагасийские крестьяне запускали ваниль на любой доступной земле – и земли было в изобилии. В 1929 году Мадагаскар экспортировал 1032 тонны и стал мировым производителем номер один. Он сохраняет это звание и по сей день (Lucas, 1990). Проблема опыления решена, приготовление ванили освоено, новые территории возделываются, плантаторы во главе с реюньонцами отныне приступили к решению новой задачи – реформе ванильной экономики. В 1964 году производители ванили Индийского океана, с Мадагаскара, Реюньона, Сейшельских и Коморских островов согласились создать организацию. Основными целями были: продвижение качественного продукта, стабилизация рынка и выработка общей политики. Была создана марка: Ваниль Бурбон, отдающий международную дань уважения новаторским технологическим достижениям Реюньона: Альбусу, Лупи, де Флорису и многим другим. В начале девятнадцатого века Реюньон получил первые саженцы ванили с далеких курортов, и она приветствовала его охотно. Жители не просто встречали еще одну красивую орхидею из страны пляжей и цветов. Подобно сказке о богатстве из грязи, реюньонцы превратили простое цветущее стручковое растение в мировое достояние.
Глава 18. Признание качества и происхождения ванили с острова Реюньон Создание ЗГУ «Ваниль с острова Реюньон»
Сильные исторические связи между ванилью и островом Реюньон
Хотя род Vanilla происходит из Мексики, остров Реюньон можно с полным основанием считать его вторым домом. Выращивание и переработка ванили тесно связаны с островом Реюньон (бывший остров Бурбон). Ваниль завозилась на остров три раза подряд (в 1819, 1820 и 1822 годах) из Кайенны и Манилы (Филибер и Перроте) и из Мексики через Ботанический сад в Париже (Маршан). Выращенная в разных частях острова, ваниль выжила в идеальных климатических условиях и зацвела, но не принесла плодов (поскольку на острове Реюньон не было насекомых-опылителей, встречающихся в Мексике). Лишь в 1841 году молодой раб Эдмон Альбиус в возрасте 12 лет изобрел простой и практичный метод опыления ванильных орхидей, позволивший выращиванию ванили быстро развиваться на острове (см. главу 17). С появлением первых урожаев производители столкнулись с проблемой расщепления стручков Vanilla planifolia. И снова они изобрели гениальный метод предотвращения созревания стручков, активизируя процесс возникновения аромата (Давид де Флорис в 1857). Основа современного выращивания и переработки ванили была заложена в течение нескольких лет. В настоящее время используемые методы были распространены во всем мире под влиянием производителей с Реюньона, которые экспортировали свои растения ванили и ноу-хау на Коморские острова (1873 г.), а позже на Мадагаскар (1890 г.).Всемирно известное качество
С самого начала производители острова Реюньон стремились производить высококачественные стручки, которые быстро завоевали отличную репутацию у потребителей. Эта репутация, основанная на выборе только лучших стручков и соблюдении очень строгих производственных процессов, была построена вокруг названия «Бурбонская ваниль» (от прежнего названия колонии при монархии) с самого первого экспорта в 1848 году и сохранилась до сих пор. В 1964 году, чтобы противостоять конкуренции со стороны синтетического ванилина и обеспечить продвижение натурального продукта, Мадагаскар, Коморские острова и остров Реюньон встретились в Сен-Дени, чтобы сформировать картель стран-производителей в Индийском океане (на которые в то время приходилось 85% мирового производства). Его цели заключались в организации производства, стабилизации цен путем установления импортных квот для конкретных стран, продвижении продукта в Европе и США, борьбе с подделкой (ссылки на этикетках) и разработке логотипа, идентифицирующего натуральную ваниль. Для финансирования этих инициатив с каждого экспортированного килограмма взимался взнос в размере 1,5 доллара США. Чтобы четко идентифицировать продукт, подписавшие договорились об общем наименовании «Бурбонская ваниль» (чья репутация уже в значительной степени утвердилась). Термин «бурбонская ваниль», таким образом, стал общим и перестал определять происхождение продукта только с острова Реюньон (это вызвало путаницу у жителей острова Реюньон и многих покупателей), хотя его аромат значительно отличается от одного происхождения к другому. Наконец, совсем недавно на мировом рынке появились продукты индонезийского происхождения под названием «Ваниль в стиле бурбон», но качество этих стручков несопоставимо с качеством ванили с острова Реюньон.Реюньонское производство сократилось до нишевого рынка
Из-за своей высокой себестоимости ваниль, произведенная на острове Реюньон, больше не конкурентоспособна на международном рынке стандартной ванили. Тем не менее, она по-прежнему высоко ценится некоторыми ценителями, ищущими особые продукты. Но термина «бурбонская ваниль» уже недостаточно для того, чтобы реюньонская продукция выделялась среди конкурентов. Многие розничные торговцы играют на двусмысленности этого термина, чтобы скрыть истинное происхождение своего продукта и тем самым ввести в заблуждение потребителей, которые часто ошибочно полагают, что «бурбонская ваниль» происходит с острова Реюньон. Поэтому производители задумались о способах четкой идентификации своей продукции. Чтобы гарантировать происхождение своей продукции, они могли выбрать либо ЗНМП (защищенное наименование места происхождения), либо ЗГУ (защищенное географическое указание). ЗНМП основан больше на концепции терруара (из предположения, что земля, на которой выращивается продукт, придает этому урожаю уникальное качество), чем на производственном процессе. Учитывая микроклимат, существующий на острове Реюньон, и значительные различия в почве от одного района к другому или даже от одного оврага к другому, ЗНМП следует разделить на несколько обозначений:• ЗНМП для региона Сент-Мари, Сент-Сюзанна и холмов над Сен-Андре (почвы нитиол, умбрисоль и андозоль, от 2000 до 3000 мм осадков) • ЗНМП для прибрежного региона Сен-Андре и Бра-Панон (конус выноса реки Мат и 2000 мм осадков) • ЗНМП для региона Сент-Роуз и Сен-Филипп (недавние лавовые потоки и от 3000 до 4500 мм осадков)
Также было бы необходимо рассматривать эти продукты отдельно. Учитывая низкий объем производства в настоящее время и связанные с этим ограничения, оказалось неуместным делить реюньонское производство на три части, даже если ЗНМП гораздо лучше известен потребителям, чем ЗГУ. ЗГУ, обозначение, официально признанное во всем Европейском Союзе, дает очень точное определение условий производства и обработки продукта, соответствующее исконной традиции (концепция ноу-хау) из четко определенной географической области (концепция терруара). Таким образом, это обозначение больше соответствует характеристикам производства ванили на острове Реюньон, и именно поэтому в конечном итоге был выбран ЗГУ.
ЗГУ: Предпочтение, разделяемое всеми реюньонскими производителями
Подход ЗГУ является результатом стремления, разделяемого всеми производителями и переработчиками на острове Реюньон, продвигать свой продукт с помощью однозначного обозначения (в отличие от «бурбонской ванили»). В 2000 году они сформировали Ассоциацию популяризации ванили острова Реюньон (АПВР) – организацию для защиты и управления обозначением с целью составления спецификации маркированной продукции и защиты обозначения от любых попыток имитации или подделки. В настоящее время в ассоциацию входят производители (Provanille, ассоциация фермеров из Сен-Филиппа), переработчики (UR 2) и дистрибьюторы (Réunion Agricom). Она остается открытой для всех (компаний и отдельных производителей) при соблюдении условий спецификации. В 2007 году на долю АПВР приходилось 78% всех производителей на острове Реюньон и 65% объема переработки на острове.Выбор обозначения
Ваниль, происходящая с острова Реюньон, традиционно известна как «бурбонская ваниль». Однако, это обозначение стало общим термином, используемым для всей ванили, производимой в Индийском океане (Мадагаскар, Коморские острова). Таким образом, восстановление исключительного использования этого термина было невозможным. Таким образом, АПВР решила перевернуть страницу и назвать свою продукцию ЗГУ «Ваниль острова Реюньон» (то есть «Ваниль с острова Реюньон»). Таким образом, происхождение четко указано в названии продукта, и единственная ваниль, которая теперь имеет право использовать географическое обозначение «Реюньон» – это ваниль, произведенная на острове Реюньон в рамках ЗГУ.Продукты, на которые распространяется PGI
ЗГУ «Ваниль острова Реюньон» применяется только к ванильным стручкам с растений, принадлежащих к виду V. planifolia G. Jackson и в настоящее время встречающихся на острове Реюньон. Побочные продукты, такие как ванильный порошок или экстракт, не подпадают под действие ЗГУ, как и стручки гибридных или недавно импортированных растений. Помимо других спецификаций, стручки ЗГУ должны соответствовать этим спецификациям в соответствии с категориями 1 и 2 стандарта NF ISO 5565-1 от марта 2000 г., при этом две другие категории не применимы. Стручок должен быть не менее 14 см в длину и расщеплен не более чем на 3 см. Они должны быть цельными, эластичными и насыщенными, с характерным вкусом и однородным цветом от коричневого до темно-шоколадно-коричневого. Они могут нести клеймо производителя на нижней трети. Они маслянистые, эластичные по текстуре и податливые. Маркированные стручки имеют максимальное содержание влаги 38% при продаже и содержание ванилина 2% (сырой вес). Наконец, они должны пройти созревание не менее семи месяцев, чтобы развить свой аромат.Определение географической зоны производства ЗГУ
Район, в котором производится, обрабатывается и кондиционируется ваниль, традиционно расположен на восточном побережье острова Реюньон из-за требований растений, почвенных и климатических условий, а также из-за социально-экономических факторов.Климатические факторы
Для развития ванили в благоприятных условиях требуется не менее 2000 мм осадков в год, равномерно распределенных в течение года. Ниже этого количества не гарантируется качественное производство без внешнего притока (орошения). Высота также является фактором развития растения в условиях ночных температур. Условия благоприятны на высоте ниже 600 м. Таким образом, эти два критерия были выбраны для определения зоны ЗГУ. Факторы климата влияют не только на растение, но и на условия обработки стручков. Слишком сухая атмосфера пагубно сказывается на процессе сушки ванили. Для медленного высыхания стручков необходима высокая относительная влажность, обеспечивающая их гибкость и качество. Эти условия выполняются только на восточном побережье острова.Социально-экономические факторы
Развитие выращивания сахарного тростника на острове Реюньон вытеснило ваниль обратно на земли восточного побережья, до которых трудно добраться или фермерствовать – в предгорья вулкана (государственные леса) или на края оврагов (крутые склоны). Ее выносливость означала, что ей, тем не менее, удалось адаптироваться к этим трудным условиям и тем самым помочь освоить лесные массивы и залежи, а также отпугнуть вредителей растений. Она играет важную роль на уровне окружающей среды и идеально вписывается в политику устойчивого развития. Экстенсивно возделываемая в лесах или на плантациях, она занимает площадь около 250 га и создаёт экономическую активность в регионе, который особенно сильно страдает от безработицы. Она способствует развитию социальной и экономической жизни на востоке острова Реюньон. Эти социально-экономические критерии так же важны, как и климатические факторы при выборе территории ЗГУ. Таким образом, территория ЗГУ, определенная в соответствии с вышеупомянутыми критериями, простирается вдоль всего восточного побережья острова (от Сент-Мари до Сен-Жозеф) на высоте до 600 м, за исключением западной части острова и холмов, непригодных для традиционного производства ванили (рис. 18.1). Чтобы получить выгоду от ЗГУ, стручки должны производиться и обрабатываться в пределах определенной области ЗГУ. РИСУНОК 18.1. Карта острова Реюньон, на которой светло-серым цветом показана зона ЗГУ.
РИСУНОК 18.1. Карта острова Реюньон, на которой светло-серым цветом показана зона ЗГУ.
Доказательство происхождения: вопрос прослеживаемости
Чтобы гарантировать потребителям происхождение ЗГУ продукта, была создана система отслеживания для каждого этапа производства и обработки ванили. Эти элементы прослеживаемости собраны в таблице, которая определяет записи, которые должны быть сделаны на каждом этапе, и их поддержку (Таблица 18.1).ТАБЛИЦА 18.1. Поддержка системы отслеживания на всех этапах производства и обработки ванили
| Стадия производства | Записи | Поддержка идентификации |
|---|---|---|
| Этап I: Подтверждение производителя | Номер производителя | Соглашение об обязательствах |
| Этап II: Географическая зона | Кадастровый номер | Кадастровая карта |
| Этап III: Выбор партии | Номер партии | Соглашение об обязательствах; Контрольная отметка |
| Stage IV: Плантация | Количество черенков; Происхождение черенков | Контрольная отметка |
| Этап V: Обслуживание партии | Дата операции; Коммерческая специальность; Поставляемое количество | Контрольная отметка |
| Этап VI: Удобрение ванили | Дата поставки; Тип улучшения почвы; Поставляемое количество | Контрольная отметка |
| Этап VII: Опыление | Даты начала и окончания опыления | Контрольная отметка |
| Этап VIII: Сбор урожая | Дата сбора урожая; Количество собранных стручков ванили | Контрольная отметка |
| Этап IX: Хранение на плантации | Дата сбораурожая; Дата доставки в блок обработки | Контрольная отметка; Формы поставки |
| Этап X: Идентификация единиц обработки | Номер обработчика | Соглашение об обязательствах |
| Этап XI: Приемка стручков ванили | Номер инкассового листа (номер календарной недели или номер поставщика); Форма поставки; Названия и номера производителей; Сроки поставки; Количество полученных стручков ванили, соответствующих и не соответствующих требованиям; Количество форм поставки | Лист сбора |
| Этап XII: Хранение стручков перед этапом умерщвления | Дата поставки; Дата умерщвления | Лист обработки |
| Этап XIII: Умерщвление | Дата операции; Температура выдержки для ванили; Время начала и окончания экспонирования | Лист обработки |
| Стадия XIV: Пропаривание | Сроки начала и окончания пропаривания; Температура | Лист обработки |
| Этап XV: Сушка | Сушка в печи: дата начала и окончания сушки и температура; Сушка на солнце: дата начала и окончания сушки; Сушка в тени: дата начала и окончания сушки в тени | Лист обработки |
| Этап XVI: Сортировка ванили | Номер листа обработки; Дата сортировки; Количество переданных стручков ванили, соответствующих требованиям и несоответствующим требованиям; Номер ящика созревания | Лист обработки |
| Стадия XVII: Ароматическое созревание | Номер ящика созревания; Сроки начала и окончания созревания; Сроки проверок; Количество некачественных стручков | Лист созревания |
| Этап XVIII: Разбраковка | Дата разбраковки ванили; Количество удаленного; Номер ящика хранения | Лист созревания |
| Этап XIX: Хранение стручков ванили | Номер ящика хранения; Номер ящика созревания; Дата хранения в ящике; Количество переданных стручков | Лист хранения |
| Этап XX: Упаковка | Номер производственной партии; Даты сортировки; Количество удаленных стручков ванили; Количество ящиков хранения; Количество произведенного | Упаковочный лист |
| Этап XXI: Маркировка | Юридические справки; Сертификационные ссылки; Использовать до; Количество сертифицированных стручков ванили; Номер производственной партии | Этикетка |
Запись участка идентифицирует каждый ванильный участок (привязка, дата посадки и т. д.) и детализирует различные операции, выполняемые на поле: петлеобразование, обрезка, прополка, обработки, опыление, прореживание и сбор урожая. Листы мониторинга сопровождают каждую партию ванили во время обработки, при этом партия состоит из всех стручков, собранных за одну календарную неделю, или всех стручков, собранных одним производителем.
• Лист сбора урожая с указанием производителей в происхождения партии. • Лист обработки с подробным описанием операций, применяемых к каждой партии: ошпаривание, пропарка, сушка и сортировка. • Лист созревания, контролирующий ароматическое развитие стручков. • Лист хранения, отслеживающий стабилизированные партии, ожидающие продажи. • Лист создания условий, контролирующий упаковку стручков.
Наконец, ведется учет запасов с указанием количества поступающей зеленой ванили и исходящей черной ванили для сертифицированных и несертифицируемых партий.
Метод производства ванили в соответствии с PGI
Характеристики производства
Производители должны подписать договор об обязательствах с АПВР, в котором они обязуются соблюдать спецификации ЗГУ. Разумеется, они должны находиться в географической производственной зоне ЗГУ (восточное побережье острова). Плантация должна содержать только растения V. planifolia с указанных участков или из зарегистрированных питомников. Плотность посадки не должна превышать 5000 растений/га. Разрешены три типа плантаций: лесные насаждения, поля или теневые дома без орошения. Уход за участком осуществляется механически в рядах культур и механически или химически между рядами. Ваниль можно удобрять только органическими веществами (компост, натуральные органические субстраты и т. д.); любые химические удобрения запрещены. Лианы необходимо петлевать не реже одного раза в год. Опыление цветов должно соответствовать силе растения и никогда не должно превышать 15 цветков на соцветие. Сбор урожая должен производиться, когда стручки достигли оптимальной спелости, другими словами, когда кончик стручков пожелтел. Наконец, срок хранения ванили после сбора урожая ограничен 72 часами. Ваниль, произведенная в рамках ЗГУ, должна быть не менее 14 см в длину и не должна быть расщеплена более чем на 3 см. Любые стручки, не соответствующие этим критериям, систематически понижаются в рейтинге.Характеристики обработки
Каждый блок обработки должен иметь ссылку и находиться в географической зоне ЗГУ. Первый этап обработки заключается в умерщвлении стручков по прибытии, чтобы предотвратить их расщепление (при созревании стручки растрескиваются) и тем самым потерю их качества. Эта операция включает погружение стручков в воду, нагретую до 65°C, на 3 минуты (метод, известный как «реюньонский процесс»). После слива воды, горячие стручки помещают в ящики, застеленные одеялами, на 24 часа – это фаза пропаривания, во время которой стручки теряют часть влаги. Они приобретают шоколадно-коричневый цвет. Затем следует фаза сушки, чтобы гарантировать, что стручки имеют влажность, которая позволит им храниться. Сушка делится на три этапа: сначала прерывистая сушка в печи при 65°C (что на самом деле является необязательным этапом), затем сушка на солнце от 5 до 15 дней в зависимости от стадии, на которой стручки были собраны и их консистенции, и, наконец, сушка в тени на решетке, чтобы ваниль медленно сохла, что сделает её эластичной и маслянистой. Во время этой фазы сушки, стручки через равные промежутки времени сортируются по степени сухости. Сухие стручки помещаются в ящики для ароматического созревания, а остальные возвращаются в цикл сушки. Эта фаза созревания очень важна для развития ароматических качеств. Чтобы воспользоваться этим обозначением, стручки ЗГУ должны храниться в ящиках для созревания не менее семи месяцев. Необходимо проводить регулярные осмотры, чтобы проверять состояние стручков (удаляя все заплесневелые). После завершения ароматического созревания стручки сортируются и упаковываются в связки перед окончательным хранением. Они будут упакованы по мере необходимости для продажи. Каждая упаковка должна быть герметично закрыта и иметь этикетку, на которой указаны не только ссылки, требуемые кодом потребителя (обозначение продукта, количество нетто, ссылки производителя, номер производственной партии), но также ссылки на сертификацию (ЗГУ «Ваниль острова Реуньон», название и адрес АПВР, а также название и адрес сертифицирующей организации).Строгий контроль для гарантии сертификации продукта
ЗГУ принадлежит АПВР, а не его отдельным членам, которые являются только пользователями этого обозначения. Поэтому ассоциация должна приложить все усилия, чтобы обеспечить соответствие спецификациям и тем самым защитить обозначение. Различные этапы производства и обработки изложены в спецификациях. Соблюдение этих спецификаций производителями и переработчиками, получающими выгоду от лейбла, контролируется на нескольких уровнях. Первоначальная внутренняя проверка проводится техником АПВР, который выезжает на место, чтобы встретиться с производителями и гарантировать соответствие участков и используемых методов ведения сельского хозяйства. Техник также осматривает каждую технологическую установку, проверяет параметры обработки, проводит необходимые тесты (ванилин, содержание влаги и т. д.), проверяет листы мониторинга стручков (сбор урожая, обработка, созревание, хранение и кондиционирование) и складской учёт. Эта внутренняя проверка, проводимая АПВР, контролируется внешней проверкой, проводимой официальной сертифицирующей организацией, в данном случае Organisme Certificateur Tropique Réunion Océan Indien (OCTROI), которая проводит выборочные проверки производителей, проверяет документацию и плантации, чтобы гарантировать, что внутренние проверки проводятся удовлетворительно. Это сертифицирующая организация, которая поддерживает или отклоняет сертификацию продуктов ЗГУ в зависимости от результатов своих ежегодных проверок. ЗГУ «Ваниль острова Реюньон», бесспорно, инструмент для защиты традиционного производства на острове Реюньон и гарантирует потребителям происхождение и качество продаваемых стручков. Поэтому очень важно обеспечить безопасность реюньонского производства, даже если этот процесс по-прежнему сложно реализовать.Глава 19. Производство ванили в Индонезии
Введение
Центрами производства ванили в Индонезии являются провинции Северная Суматра, Лампунг, Западная Ява, Восточная Ява, Бали, Западная Нуса Тенггара, Восточная Нуса Тенггара, Северный Сулавеси, Центральный Сулавеси и Южный Сулавеси, при этом развивающиеся районы растут, в том числе в Калимантане, Малуку и Папуа (рис. 19.1). Большинство ванильных плантаций находится в ведении мелких землевладельцев и лишь небольшая часть принадлежит предпринимателям. На международном рынке индонезийская ваниль известна как Java Vanilla Beans. РИСУНОК 19.1. Карта Индонезии с указанием основных районов производства.
РИСУНОК 19.1. Карта Индонезии с указанием основных районов производства.
Основными ограничениями в производстве ванили в Индонезии являются низкая урожайность и сравнительно низкое качество стручков (Hadipoentyanti et al., 2007). По данным Генерального директората сельскохозяйственных культур 1995 г., производство ванили колебалось от 125 до 876 кг/га, и качество всё еще не было улучшено. На производство влияют, среди прочего, условия окружающей среды, типы выращиваемой ванили, культурные обычаи и наличие вредителей и болезней. Качество ванили (содержание ванилина в стручках) обычно зависит от времени сбора урожая, длины стручков и послеуборочных процессов. В этой главе делается попытка предоставить некоторую информацию о низкой продуктивности и качестве ванильных стручков в Индонезии, а также о результатах исследований, проведенных для улучшения ситуации.
Текущая ситуация
Черенки Vanilla planifolia были завезены в Богор (Западная Ява) в 1819 году Маршалом. Растения росли хорошо, давали цветы, но не приносили плодов. Вскоре стало очевидно, что самоопыление цветов невозможно в отсутствие естественных пчел-опылителей на Яве. В 1836 году Моррену удалось вручную опылить цветы в ботаническом саду Льежа (Бельгия), а несколько лет спустя Эдмонд Альбиус на острове Реюньон усовершенствовал эту технику для повседневного сельскохозяйственного использования. В 1850 году Тейсман добился успеха, вырастить ванильные стручки на Яве (Deinum, 1949), и с тех пор плантации ванили распространились по всей Индонезии. До 1967 года выращивание ванили в Индонезии было сосредоточено на Яве, вокруг Маланга (Восточная Ява), Теманггунга (Центральная Ява) и Гарута (Западная Ява). Из-за серьезного ущерба, нанесенного вспышками болезней и длительными периодами засухи, производство ванили стало развиваться за пределами Явы, например, на Бали, Лампунге и Северной Суматре в 1970-х годах, а с 1980 года расширилось, включив Северный Сулавеси, Западную Суматру, Ачех и Восточную Нуса Тенгару (Anonymous, 1993).Производство ванили
Фермеры в Индонезии не являются специализированными производителями ванили; они также выращивают разнообразные культуры, которые и служат основным источником дохода. К таким культурам относятся – дуриан, манго, папайя, кукуруза, маниока, сладкий картофель, арахис и другие, высаживаемые в качестве вспомогательных культур в засушливый сезон. Ваниль, как товар мелких фермеров, производится на небольших площадях, разбросанных по регионам, с ограниченными агрономическими ресурсами. Обычной практикой является содержание ферм только в том случае, если цена на ваниль высока, а новые фермы часто создаются без особого внимания к пониманию технических требований выращивания ванили. Почвенно-климатические условия на производственных площадях часто не оптимальны, в частности, песчаные почвы и продолжительный засушливый сезон, в то время как растительный материал или генетический источник ванили в основном относится к худшим типам. В Индонезии выращивают много форм V. planifolia, таких как Анггрек, Гистинг, Чилаву, Маланг, Унгаран Даун Типис, Унгаран Даун Тебал, Бакан, Бандиалит и Бали. Несмотря на происхождение от одного вида, они обладают разным продуктивным потенциалом (Asnawi and Nuryani, 1995). Поэтому, объем производства сильно отличается от одной фермы к другой, особенно когда задействовано несколько факторов. Большинство ванильных хозяйств в качестве поддерживающих деревьев используют гамаль (Gliricidia maculata) или ламторо (Leucaena glauca) с шагом посадки около 1,0 м × 1,5 м и 1,5 м × 2,0 м соответственно. Культурные практики, такие как борьба с сорняками, обрезка опорных деревьев для уменьшения тени, использование удобрений и борьба с вредителями и болезнями, ограничены. Применение удобрений, инсектицидов и фунгицидов обычно игнорируется из-за высокой стоимости вкладываемых ресурсов и высокого риска производственных потерь из-за болезней. Удобрения вносятся только в периоды, когда цена на ваниль относительно высока. Это еще больше способствует несогласованности уровней производства. Рекомендуемая дозировка удобрений составляет 50–100 г NPK (1:2:2) на растение в год для растений младше двух лет и 100–200 г NPK (1:2:3) на растение в год для растения старше двух лет, вносимых 50% в начале и 50% в конце сезона дождей. Предполагается, что высокая дозировка калия по сравнению с азотом увеличивает устойчивость к стеблевой гнили (Zaubin et al., 1994). При необходимости ваниль также нуждается в опрыскивании листвы питательными веществами каждые 1-2 недели с концентрацией 5-8 г NPK (1:1:1)/л воды. Питательный раствор применяется утром с 6 до 7 часов или поздно вечером с 17 до 18 часов при высокой относительной влажности (Ernawati, 1993). Также (Gusmaini and Tarigan, 1999) предложено использование 0,4% Gandasil D (NPKMg 14:12:14:15 плюс микроэлементы) каждые четыре дня. Однако, фермеры, выращивающие ваниль, предпочитают использовать компост или навоз, нормы внесения которых, к сожалению, слишком низкие (3-5 кг/растение в год). Ваниль выращивают от уровня моря до высокогорья (до 1200 м над уровнем моря). Хотя ваниль может расти в широком диапазоне температур, от 9°C до 38°C, Чало упомянул, что оптимальная температура для ванили составляет около 25°C, которая встречается на высоте от 200 до 400 м над уровнем моря (по Deinum, 1949). Температура ниже 18,6°C считается очень низкой и влияет на активность ферментов, ответственных за аромат и развитие ванильных стручков (Zaubin and Wahid, 1995). В сухой сезон отсутствие осадков, низкая влажность воздуха и высокая температура приводят к водному стрессу, который ослабляет растения, делая их более уязвимыми для вредителей и болезней. Наиболее разрушительное заболевание – стеблевая гниль, вызываемая грибком Fusarium oxysporum f. sp. vanillae (Tombe et al., 1997) – подробно обсуждается в главе 8. Производство начинается на втором или третьем году посадки. Фермеры обычно оставляют 8–15 стручков на соцветие, а количество соцветий на растение варьируется. Сбор урожая проводится постепенно. Собираются только спелые стручки, на что указывает небольшое потускнение зеленого цвета и пожелтение кончиков. Такое состояние наступает через 8–9 месяцев после опыления. Средняя урожайность составляет 0,2 кг зрелых стручков на растение, хотя производственный потенциал составляет около 1,0 кг на растение (Hadipoentyanti et al., 2006).Обработка ванили
Фермеры обычно продают собранные стручки на местных рынках, в то время как экспортеры проводят послеуборочные процессы перед экспортом. Послеуборочные мероприятия включают подготовку, бланширование, выдержку и сушку (на солнце и в тени), а также кондиционирование (рис. 19.2). Во время подготовки свежесобранные стручки промывают водой с последующим отбором по длине, толщине, степени повреждения и физическим дефектам (Risfaheri and Rusli, 1995). Затем отобранные стручки обсушивают, помещают в проволочную или бамбуковую корзину и погружают в горячую воду (от 63°C до 65°C) на 2–2,5 мин. Целью бланширования является прекращение вегетативного роста и запуск ферментативной активности, которая вызывает образование ванилина.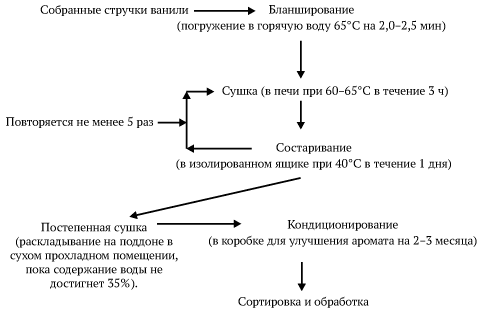 РИСУНОК 19.2. Схематическое изображение обработки стручков ванили.
РИСУНОК 19.2. Схематическое изображение обработки стручков ванили.
После слива воды стручки помещают в ящик с двойными стенками на 24 часа для состаривания. Между стенками в качестве изоляции закладывается кокосовое волокно или опилки, поддерживая температуру от 38°C до 40°C. Внутренний слой стенок покрывают сравнительно толстой тканью, которая впитывает влагу из стручков ванили. Со временем стручки приобретают коричневатый цвет с маслянистым видом. Ваниль сушат на черной ткани на сушильном бамбуковом поддоне в течение 2–2,5 ч утром, периодически переворачивая. Затем стручки накрывают черной тканью и сушат на солнце до полудня, после чего их помещают в сушильную комнату. Этот процесс повторяется ежедневно, пока содержание воды в стручках не снизится до 55–60% и не появится аромат ванилина. С этого момента стручки сушатся вдали от прямых солнечных лучей, чтобы постепенно снизить содержание воды и усилить аромат ванилина. Ванильные стручки размещают на поддонах в чистом и прохладном вентилируемом помещении на 30–45 дней и регулярно проверяют на наличие гнили или плесени. Когда содержание воды упадет примерно до 30–35%, стручки кондиционируют в духовке, поддерживающей температуру 50°C в течение 3 часов. Кондиционирование направлено на улучшение аромата ванилина. Пучки по 50–100 стручков связывают, оборачивают вощеной или парафинированной бумагой, помещают в коробку, покрытую вощеной бумагой и хранят в прохладном сухом помещении в течение 2–3 месяцев. Ваниль регулярно проверяют на предмет гнили или плесени и при необходимости очищают спиртом. Стручки со слабым ароматом подвергаются дальнейшей сушке и возвращаются в процесс кондиционирования. После кондиционирования ваниль сортируется, упаковывается и готовится к экспорту.
Коммерциализация ванили
Торговле ванилью в Индонезии не хватает структуры и организации. В регионах с относительно высоким производством, у экспортеров обычно есть местные агенты, которые покупают зеленые стручки ванили напрямую у фермеров, чтобы сократить сбытовую цепочку. Но в регионах с низким уровнем производства сбытовая цепочка длиннее. Ваниль, прежде чем попасть к экспортерам, сначала продается фермерами деревенским торговцам, затем от деревенских торговцев районным, которые продают её региональным торговцам (Board of National Export Development, 1995). Цена ванили во многом определяется качеством стручков. Каждая страна определяет свои собственные необходимые условия. Общие и особые наборы предварительных условий, определенные Национальным советом по стандартизации Индонезии (SNI), показаны в таблицах 19.1a и b. Соединенные Штаты предпочитают ваниль с низким содержанием воды (20–30%) для использования в экстракционной промышленности. В Европе ваниль обычно используется в домашней кулинарии, поэтому стручки должны быть цельными, с высоким содержанием ванилина, резким ароматом и содержанием воды 30–35% (Ruhnayat, 2005). Международная организация по стандартизации (ISO) определила обязательные требования для выхода на международный рынок (стандарт ISO 5565-1:1999).ТАБЛИЦА 19.1a. Общие условия для ванили в соответствии с SNI 01-0010-1990
| Характеристика | Спецификация | Метод тестирования |
|---|---|---|
| Аромат | Ароматная, специфическая ваниль | Сенсорный |
| Цвет | Яркий, от коричневого до темно-коричневого | Визуальный |
| Стручки | Компактные, жирные, эластичные или довольно жесткие | Сенсорный |
| Чужеродные примеси | Свободен от чужеродных примесей | Визуальный |
| Плесень | Без плесени | Визуальный |
ТАБЛИЦА 19.1b. Особые условия для ванили в соответствии с SNI 01-0010-1990
| Характеристика | Условие | Метод тестирования | |||
|---|---|---|---|---|---|
| Качество IA | Качество IB | Качество II | Качество III | ||
| Форма | Целый | Целый | Целый/обрезанный | Целый/обрезанный | Визуальный |
| Размер целого стручка | 11 | 11 | 8 | 8 | SP-SMP320-1980 SP-SMP320-1980 |
| Расщепленные и ломанные стручки | Нет | Нет | Нет | Нет | SP-SMP7-1975 |
| Содержание воды, макс. (%) | 38 | 38 | 30 | 25 | SP-SMP320-1980 |
| Содержание ванилина, макс. (%) | 2.25 | 2.25 | 1.50 | 1.00 | SP-SMP35-1975 |
| Зольность, макс. (%) | 8 | 8 | 9 | 10 |
Цена на индонезийскую ваниль, как правило, низкая, отчасти, из-за низкого качества стручков, вследствие раннего сбора урожая и неоптимальных условий обработки, а также из-за слабой позиции фермеров на переговорах. На международном рынке цена ванили из Индонезии находится в диапазоне от 15 до 48 долларов США за кг, что значительно ниже, чем на мадагаскарскую ваниль, которая колеблется от 55 до 76 долларов США за кг. Годовое производство и стоимость ванили в Индонезии значительно колеблются. В 2000 году было зарегистрировано производство 350 тонн на сумму 8,5 млн долларов США, 663 тонны в 2003 году – 18,4 млн долларов США (высшее достижение) и 499 тонн в 2006 году на сумму 5,9 млн долларов США (Ditjenbun, 2006). В 2006 г. основными странами-импортерами были США, на долю которых приходилось 67% общего экспорта, Германия (20%) и Малайзия (5%). Качество ванили, экспортируемой из Индонезии, относительно низкое: 27% сорта I, 45% сорта II и 28% сорта III (Rosman, 2005).
Результаты исследования
Для преодоления ограничений при производстве ванили необходимо учитывать три важных фактора: условия окружающей среды (климат и почва), генетический источник (разновидности или типы ванили) и заболевание стеблевой гнилью. Исследовательская деятельность сосредоточена на этих факторах, и краткое изложение результатов приводится ниже.Климатические и почвенные условия
Подходящий климат – одно из важнейших условий выращивания ванили. Оптимальное годовое количество осадков для ванили находится в диапазоне 1000–2000 мм/год и распределяется на 8–9 месяцев влажного сезона, за которым следует засушливый период (количество осадков менее 90 мм/месяц) продолжительностью 3–4 месяца. Чтобы вызвать цветение, необходим четкий период засухи одновременно с другими факторами, такими как петлеобразование стебля и удаление его верхушки во время засушливого периода. На формирование цветков в определенной степени влияет уровень стресса, испытываемый ванилью (Zaubin, 1994). Предпочтительным является сезон дождей продолжительностью 150–180 дней в году с температурой от 20°C до 39°C и относительной влажностью от 65% до 75%. Ванили требуется всего 30–50% от полного солнечного света (Deinum, 1949). Хотя ваниль хорошо растет и развивается на участках от 0 до 1200 м над уровнем моря, для практических коммерческих целей её выращивание рекомендуется на высоте до 600 м над уровнем моря. Ваниль можно выращивать на различных почвах, таких как андозоль, латосоль, регосоль, при условии хороших физических свойств. Для ванили идеально подходят почвы с мощным гумусовым горизонтом, богатые органическими веществами. Кислотность почвы (pH) должна составлять от 5,5 до 7,0. Хотя идеальная ситуация не всегда может быть доступна, эти условия используются в качестве руководящих принципов для выращивания ванили и являются полезным показателем количества необходимых ресурсов, учитывая конкретный набор существующих условий.Генетический источник
Недавно Исследовательский институт специй и лекарственных культур (RISMC) собрал 32 типа ванили со всей Индонезии. Они различаются размером и окраской листьев и цветов, а также формой листьев, количеством устьиц, индексом листовой поверхности и устойчивостью к стеблевой гнили. Среди них только четыре типа имеют многообещающие перспективы (Asnawi, Nuryani, 1995). Были идентифицированы четыре предполагаемых клона с благоприятными характеристиками, включая относительно высокий производственный потенциал, высокое содержание ванилина и относительную устойчивость к водному стрессу и стеблевой гнили (Hadipoentyanti et al., 2007). Характеристики этих клонов приведены в таблице 19.2. Эти превосходные сорта или вариететы ванили до сих пор не реализованы.ТАБЛИЦА 19.2. Характеристики четырех предполагаемых клонов ванили
| Характеристики | Клон 1 | Клон 2 | Клон 3 | Клон 4 |
|---|---|---|---|---|
| 1. Отобрано из популяций | Чилаву – Западная Ява | Гистинг – Лампунг | Маланг – Восточная Ява | Унгаран – Центральная Ява |
| 2. Лист: | ||||
| • Длина (см) | 20.54 ± 1.48 | 19.12 ± 1.56 | 18.15 ± 2.35 | 21.38 ± 1.69 |
| • Ширина (см) | 6.42 ± 0.43 | 7.03 ± 0.51 | 6.75 ± 1.24 | 7.00 ± 0.32 |
| • Толщина (мм) | 2.32 ± 0.31 | 2.13 ± 0.16 | 2.18 ± 0.25 | 1.98 ± 0.26 |
| • Цвет | Зеленый | Зеленый | Зеленый | Зеленый |
| 3. Стебель | Нет ветвей | Нет ветвей | Нет ветвей | Нет ветвей |
| 4. Диаметр стебля | 1.20 ± 0.24 | 1.17 ± 0.26 | 1.15 ± 0.38 | 1.25 ± 0.36 |
| 5. Длина междоузлия (см) | 12.69 ± 1.13 | 12.71 ± 1.12 | 15.38 | 14.78 ± 1.16 |
| 6. Цветочная кисть | Нет ветвей | Нет ветвей | Нет ветвей | 2–4 ветви |
| 7. Стручки: | ||||
| • Длина (см) | 19.03 ± 1.87 | 19.17 ± 1.08 | 18.51 ± 1.46 | 19.05 ± 1.38 |
| • Цвет | Зеленый | Зеленый | Зеленый | Зеленый |
| 8. количество кистей на растение | 5.75 ± 2.75 | 5.35 ± 2.53 | 6.50 ± 2.15 | 7.11 ± 2.32 |
| 9. Количесьво цветов на кисть | 20.15 ± 1.76 | 19.75 ± 2.76 | 21.35 ± 1.51 | 22.25 ± 1.46 |
| 10. Производство стручков (ц/га) | ||||
| • Свежие | 9.768 | 9.768 | 10.392 | 10.523 |
| • Сухие | 2.035 | 1.918 | 2.165 | 2.239 |
| 11. Содержание ванилина | 2.80–3.25 | 2.26–3.16 | 2.25–3.05 | 2.35–2.86 |
| 12. Прочее | Относительно устойчив к водному стрессу | Относительно устойчив к стеблевой гнили | — | — |
Болезни ванили
Возникновение болезней – одно из основных препятствий при выращивании ванили. Основными болезнями являются стеблевая гниль (Fusarium oxysporum f. Sp. Vanillae), гниль побегов (Phytophthora capsici), склероциальная гниль (Sclerotium rolfsii) и антракноз (Colletotrichum gloeosporioides). Стеблевая гниль – самое разрушительное заболевание. Поскольку в настоящее время отсутствует значительная степень устойчивости растения-хозяина к стеблевой гнили, потери урожая при плохом контроле очень велики. Хотя F. oxysporum f. sp. vanillae – это патоген, передающийся через почву, он также передается с брызгами воды. Продуцируется два типа распространяющихся пропагул; макроконидии и микроконидии, которые могут легко прилипать к частям растений, насекомым и сельскохозяйственным орудиям (Tombe et al., 1992). Болезнь очень заразна и способна быстро распространяться и опустошать обширные производственные площади. Болезнь может поразить все вегетативные части растения ванили, хотя чаще всего встречается на стебле. В неблагоприятных условиях окружающей среды гриб образует хламидоспоры для длительного выживания в почве и остатках хозяина. Патоген также может выжить в стебле, не проявляя никаких симптомов. Из-за общей низкой продуктивности растений и неблагоприятных условий, которые могут предрасполагать к различным заболеваниям, фермеры обычно забрасывают свои фермы через 5–7 лет. Пока отсутствуют устойчивые к болезням сорта или другие эффективные меры контроля, развитие и производство ванили в Индонезии в значительной степени остается в тупике. Недавние исследования показывают, что успешного подавления заболеваемости стеблевой гнилью можно добиться, применяя подход Bio-FOB (Tombe, 2008). Этот подход включает три компонента, которые подробно описаны в главе 8. Вкратце, методика состоит из: 1. Посадка свободных от болезней черенков, устойчивых к стеблевой гнили, таких как черенки ванили Bio-FOB (полученные с использованием непатогенных штаммов Fusarium oxysporum). 2. Использование выбранных биоконтролирующих агентов и органических веществ: было показано, что Bacillus pantothenticus и Trichoderma lactae антагонистичны F. oxysporum f. sp. vanillae. Эти микробы разлагают органические вещества, а также способствуют росту растений (Tombe, 2008). Эти два микроба рецептируются под названием Bio-TRIBA. Bio-TRIBA можно смешивать с компостом или навозом в дозировке 2–3 л Bio-TRIBA на тонну компоста или навоза и инкубировать в течение 1–2 недель перед внесением. Bio-TRIBA также можно вносить, поливом под корни ванили в дозе 5–10 мл Bio-TRIBA/л воды, предпочтительно после внесения органических удобрений. 3. Применение ботанического фунгицида Mitol 20 EC в концентрации 3–5 мл/л воды. Формула содержит активные ингредиенты эвгенола, экстрагированного из гвоздики (Tombe et al., 1993; Sukamto et al., 1996), который, как было продемонстрировано, антагонистичен нескольким патогенам растений, включая F. oxysporum f. sp. vanillae. Принимая во внимание надлежащие климатические и почвенные условия, используя лучший доступный генетический материал и внедряя стратегии борьбы с заболеванием корневой и стеблевой гнилью, ожидается, что производство и качество ванили в Индонезии увеличатся.Перспективы на будущее
Несмотря на множество проблем, которые предстоит решить в развитии и улучшении производства ванили в Индонезии, тем не менее, в стране есть преимущества и достаточный оптимизм в отношении достижения в конечном итоге статуса мирового производителя и экспортера ванили (Directorate General of Estate Crops, 2008). Индонезия богата как человеческими, так и природными ресурсами, последние с точки зрения наличия земель, подходящих для расширения культивации ванили. Доступна технология для преодоления самого серьезного ограничения производства – стеблевой гнили, на основе комплексного подхода к борьбе с болезнями, стратегии BioFOB. Однако, необходимо значительно улучшить передачу обширных знаний в области выращивания и внедрение технологий фермерами (Rosman, 2005). Следует сделать больший акцент на продвижении индонезийской ванили на международной платформе (Directorate General of Estate Crops, 2008). Это должно согласовываться с созданием интегрирующих национальных институтов для фермеров, предпринимателей, исследователей и правительства, чтобы продвигать фермерские знания, защищать их благосостояние и поддерживать связь между вовлеченными секторами.Глава 20. Производство ванили в Индии
Введение
Ваниль (Vanilla planifolia G. Jackson), уроженка юго-восточной Мексики, представляет собой орхидею, дающую высококачественную ароматическую специю, коммерчески выращиваемую на Мадагаскаре, в Индонезии, Мексике, Уганде, Коморских островах, Индии и других странах. В Индии она была интродуцирована в 1835 году. Согласно документальным свидетельствам (Anonymous, 1992), впервые она была высажена на Каллар-Бурлиарской научно-исследовательской станции садоводства, округ Нилгири в 1945 году и позднее на региональной сельскохозяйственной научно-исследовательской станции в Амбалаваяле, округ Ваянад, Керала. Некоторые предприимчивые фермеры и кофейные плантаторы Ваянада занялись её выращиванием в тени междурядьев плантаций, под техническим руководством Амбалаваяльского научно-исследовательского хозяйства. Тогдашнее правительство Кералы, с 1960 года, поощряло выращивание ванили в Амбалаваяле, как альтернативный источник доходов сельхозпроизводителей. Аналогично, тогда же занялись ванилью и некоторые растениеводы вокруг Каллар-Бурлиарской научно-исследовательской станции садоводства. Фермерами-инноваторами она постепенно распространялась по районам Кералы, Карнатаки, Тамилнада, Западной Бенгалии и Ассама. Однако, почти все первоначальные попытки не слишком удавались вследствие ненадлежащего ухода, отсутствия знаний или технической и рыночной поддержки. Тем не менее, позднее, эти плантации послужили источником посадочного материала для программ развития ванили, инициированных различными агентствами. Сообщалось об успешном производстве и маркетинге ванильных стручков с одного гектара ванильной плантации в Састхане, округ Южная Канара в Карнатаке. Производители округов Южной и Северной Канары постепенно увеличивали выращивание ванили и сейчас на штат приходится крупнейшая площадь под ванильными плантациями – 58% этой культуры в Индии.Область, производство и экспорт
Ваниль стала коммерческой культурой в Индии совсем недавно, в значительной степени из-за рекламных мероприятий, проводимых Советом по специям Индии с середины 1990-х годов. В настоящее время Индия – узнаваемый источник качественных ванильных стручков на международном рынке. Экспорт готовых стручков в течение 2008-2009 годов составлял 305,1 метрических тонн на сумму 267 млн рупий (около 5,8 млн долларов). В течение соответствующего периода экспортировалось и некоторое количество ванильного экстракта. Площади и производство ванили в Индии, а также её экспорт приведены в таблицах 20.1 и 20.2.Таблица 20.1. Оценка площади и производства ванили по штатам Индии в 2002-2007 гг.
| Штат | 2002–2003 | 2003–2004 | 2004–2005 | 2005–2006 | 2006–2007 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Общая площадь | Продуктивная площадь | Производство (готовая) | Урожайность (готовая) | Общая площадь | Продуктивная площадь | Производство (готовая) | Урожайность (готовая) | Общая площадь | Продуктивная площадь | Производство (готовая) | Урожайность (готовая) | Общая площадь | Продуктивная площадь | Производство (готовая) | Урожайность (готовая) | Общая площадь | Продуктивная площадь | Производство (готовая) | Урожайность (готовая) | |
| Керала | 812 | 239 | 19 | 79 | 1147 | 342 | 34 | 98 | 1707 | 575 | 68 | 143 | 1985 | 883 | 82 | 92 | 2206 | 1278 | 122 | 95 |
| Тамилнад | 268 | 130 | 19 | 146 | 465 | 180 | 18 | 99 | 577 | 186 | 16 | 108 | 732 | 249 | 22 | 89 | 705 | 333 | 23 | 68 |
| Карнатака | 1465 | 545 | 54 | 99 | 1931 | 732 | 82 | 113 | 3086 | 1187 | 112 | 101 | 3098 | 1751 | 84 | 48 | 2218 | 1307 | 88 | 67 |
| Вся Индия | 2545 | 914 | 92 | 101 | 3543 | 1253 | 134 | 107 | 5370 | 1948 | 196 | 113 | 5815 | 2883 | 188 | 65 | 5129 | 2918 | 233 | 80 |
Таблица 20.2. Основной экспорт ванили из Индии 2004-2009 по странам
| Страна экспорта | 2004–2005 | "top" >2005–2006 | 2006–2007 | 2007–2008(E) | 2008–2009(E) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Количество | Стоимость | Количество | Стоимость | Количество | Стоимость | Количество | Стоимость | Количество | Стоимость | |
| США | 32.8 | 248.10 | 34.5 | 55.53 | 58.7 | 110.84 | 83.3 | 58.96 | 111.2 | 84.70 |
| Нидерланды | 0.8 | 1.03 | 0.0 | 0.04 | 0.0 | 0.07 | 100.0 | 68.97 | ||
| Франция | 5.6 | 14.74 | 23.6 | 43.35 | 26.4 | 39.06 | 27.3 | 49.87 | 36.5 | 40.54 |
| Бельгия | 1.0 | 2.92 | 15.9 | 34.40 | ||||||
| Германия | 2.2 | 5.27 | 9.0 | 14.79 | 22.5 | 33.83 | 80.3 | 57.77 | 31.8 | 27.73 |
| Бразилия | 0.5 | 0.62 | 2.1 | 1.92 | 6.1 | 5.80 | ||||
| Другие | 1.5 | 18.45 | 4.5 | 8.97 | 18.4 | 21.92 | 6.0 | 5.99 | 3.7 | 4.86 |
| Вся Индия | 43.0 | 287.59 | 71.6 | 122.68 | 126.4 | 206.27 | 200.0 | 177.50 | 305.1 | 267.00 |
| Общемировое | 1259.7 | 232.38 | 1529.6 | 311.72 | 2042.5 | 426.43 | 1300.0 | 287.50 | 2155.1 | 607.47 |
Площадь под посадками постепенно увеличивается. Импульс получен за счет взлета цен в течение 2001-2002 годов, вероятно, в связи с серьезными потерями урожая из-за циклона на Мадагаскаре. По причине падения рыночной цены на натуральный ванилин с 2004-2005 годов, в сочетании с неуправляемым возникновением заболеваний, энтузиазм в выращивании ванили среди фермеров резко снизился.
Улучшение культуры ванили
Улучшение культуры ванили в Индии осуществляется Индийским научно-исследовательским институтом кардамома (ИИИК) Совета по специям, п.о. Кайласанаду, Идукки, Керала; Индийским институтом исследований специй (ИИИС), п.о. Марикунну, Каликут, Керала; Сельскохозяйственным университетом Кералы и другими учреждениями. Эти институты поддерживают хорошую коллекцию гермоплазмы ванили. Для характеристики гермоплазмы разработан минимальный дескриптор (Kuruvilla et al., 2000).Видовое разнообразие
V. planifolia G. Jackson – культивируемый вид ванили в Индии. В дополнение к нему, в Индии доступны природные виды ванили – Vanilla pilifera Holtt., Vanilla andamanica Rolfe., Vanilla aphylla Blume, Vanilla walkeriae Wight и Vanilla wightiana Lindl. Таитянская ваниль (Vanilla tahitensis J.W. Moore) в Индии также имеется.Репродуктивное поведение
Биология цветка V. planifolia адаптирована к ауткроссингу, а в Индии применяется ручное опыление, так как естественные опылители в стране отсутствуют (Sasikumar et al., 1992). О самонесовместимости или естественном скрещивании V. planifolia из Индии, как это наблюдается на островах Реюньон или в Мексике, не сообщается (Bory et al., 2008a). Однако, есть сообщения о естественном завязывании плодов у V. wightiana (Rao et al., 1994). Случайные плоды в естественных условиях наблюдаются и у V. aphylla. В репродуктивной биологии V. planifolia изучены время опыления, стигмо-рецептивность и влияние количества пыльцы на размер стручков (Shadakshari et al., 1996; Bhat и Sudarshan, 1998, 2000). Эти авторы сообщили, что идеальное время для опыления от 6 часов утра до часа дня, а рецептивность стигмы составляет до 24 часов. Они также наблюдали, что полная передача пыльцы приводит к максимальному росту плодов. Инициация цветения у ванили происходит в конце января или в начале февраля. Цветы открываются с середины февраля по апрель-май. Опыление осуществляется вручную тогда, когда цветок открывается, и процесс опыления продолжается не менее 40-60 дней. Стручок быстро развивается на начальных этапах и, в благоприятных условиях, достигает своего полного размера в течение 5-6 недель, а после – замедляется. Скорость удлинения стручков максимальна в течение первых 30 дней после оплодотворения (Kurouvilla et al., 1996). В репродуктивном режиме V. planifolia необходимо изучить полный уровень ауткроссинга, само/перекрестную несовместимость и автогамию.Разнообразие сортов
Хотя ваниль была интродуцирована в Индии около 200 лет назад, современный генопул в Индии получен из этой первоначальной интродукции. При постоянном вегетативном размножении из этой оригинальной гермоплазмы, широкая генетическая база в основном генопуле ванили очень маловероятна (Sasikumar, 2004), сродни ситуации в некоторых других странах, производящих ваниль (Soto Arenas, 1999; Lubinsky, 2003; Bory et al., 2008b). Нет подлинной записи о любых последующих интродукциях в страну. За годы окультуривания и отбора фермерами, некоторые новые варианты (субсорта) были признаны в Мексике и на Реюньоне, но о таких вариантах из Индии не сообщается, за исключением пестролистного мутанта «Маргината» (Minoo et al., 2006a, 2008b) и некоторых сообществ с разветвленными соцветиями и разнообразным размером листа. Соматический кроссинговер (Nair и Rairindran, 1994), заявленный у V. planifolia, может привести к новым вариациям, исключающим мутации, половую рекомбинацию или эпигенетическую вариацию. Анализ генетического разнообразия сообщества V. planifolia в Индии имеет смысл, поскольку может помочь подтвердить существование генетической изменчивости в гермоплазме, если таковая имеется, и помочь в программе разведения.Межвидовая гибридизация
Вариации, которые существуют среди культивируемых видов ванили или даже в некоторых близких видах, могут быть объединены для получения новых типов путем гибридизации. Вторичный генопул может содержать полезные гены самоопыления, устойчивости к корневой гнили и вирусам, крупных плодов, снижения светочувствительности, лучшего профиля аромата и нерастрескивающихся стручков для включения в культивируемую ваниль. Из-за несовместимости между некоторыми видами ванили селекционеры могут попытаться вырастить потомство от межвидовых скрещиваний через культуру семян in vitro. О межвидовых гибридах между V. planifolia × V. aphylla (Minoo et al., 2006b, 2008a) и V. planifolia × V. wightiana (Rao et al., 1992b) сообщается из Индии. Аспекты ксении/метаксении также могут быть рассмотрены, среди прочего, поскольку было замечено, что пыльца некоторых видов ванили положительно влияет на размер стручка V. planifolia (B. Sasikumar, личное наблюдение).Агрономия
Климат и почва
Ваниль является лазящей орхидеей, поэтому для промышленного производства ванильных стручков должны быть созданы благоприятные условия ее вегетативного роста и цветения. Растению требуются теплые и влажные условия влажных тропиков для нормального роста и устойчивой продуктивности. Оно хорошо растет между 10° северной и 20° южной широты, при хорошо распределенных в среднем осадках между 150 см и 300 см. Растение переносит широкий диапазон температур, но в идеале средняя минимальная температура в зимние месяцы не должна опускаться ниже 12°C и не должна превышать 35°C летом, а оптимальный диапазон температур составляет 25–32°C со средней относительной влажностью 80%. Растение не переносит длительной засухи или заболачивания, воздействия жаркого солнца или сильного ветра. Согласно Потти и Кришнакумару (Potty and Krishnakumar, 2003), ваниль может успешно выращиваться в районах ближе к экватору, где теплый и влажный климат преобладает в течение всего года, и до высоты до высоты 1100 м. Ваниль предпочитает земли с пологим уклоном и легкую пористую почву с достаточным дренажем. Предпочтительны почвы с высоким содержанием гумуса, хотя растения могут хорошо расти на супесях и даже на латеритных почвах. Богатые гумусом почвы Западных Гатов и северо-восточных штатов Индии очень подходят для её возделывания. Ваниль успешно выращивают в качестве дополнительной культуры в кокосовых и арековых садах (Sasikumar et al., 1993).Размножение
Ваниль поддается как половому, так и бесполому способам размножения. Стеблевые черенки способны выпускать корни в узлах, когда те контактируют с почвой или любой другой средой укоренения. Вегетативное размножение с помощью стеблевых черенков, в целом, является общепринятым методом, поскольку его легко и быстро внедрить. Однако, поскольку ваниль является моноподиальной орхидеей, сбор значительного количества стеблевых черенков с основных плантаций может привести к остановке вегетативного роста материнских растений (Ayyappan, 1990) и будет происходить за счет урожая последующих лет. Поэтому в условиях коммерческого земледелия прибегают к производству посадочного материала в питомниках. В районах, где свирепствуют вирусные заболевания, для возрождения плантаций рекомендуется использовать, свободные от вирусов, сертифицированные материалы микроразмножения. Первичный источник черенков для питомников может быть получен со свободных от болезней, здоровых и сильнорослых материнских растений на урожайных плантациях. Длина лианы, используемой для посадки, варьируется от места к месту, но имеет огромное влияние на дальнейший рост и время, необходимое для достижения зрелости. В ситуациях, когда маточных лиан мало, используются черенки с тремя-четырьмя узлами. Рекомендуется использовать такие черенки в питомниках для выращивания более длинных лиан, а не непосредственно на участках, потому что более короткие черенки требуют больше времени для приживаемости и получения урожая.Размножение в траншее
Была описана простая и быстрая процедура размножения для производства посадочного материала (Kuruvilla et al., 2003). Место для питомника быстрого размножения должно быть идеально расположено с точки зрения доступности, наличия источника воды, пологого склона и глубоких плодородных почв суглинистого характера с оптимальной естественной тенью. Там, где оптимальное затенение недоступно, необходимо обеспечить адекватное затенение, используя агро-сетку для затенения, обеспечивающую интенсивность света 50%. Траншеи шириной 60 см и глубиной 60 см отрываются на удобную длину, оставляя между ними 40 см. Траншеи засыпаны верхним слоем почвы, хорошо разложившимся навозом и песком в соотношении 3:1:1. Опекуны длиной 2–2,5 м для поддержки лиан высаживают на расстоянии 1 м вдоль траншей не менее чем за два месяца до посадки ванили. Предпочтительны быстрорастущие деревья с низкой ветвистостью, мелкими листьями и грубой корой. В Индии широко используются Plumeria alba, Erythrina lithosperma, Glyricidia maculata и другие. Для посадки в питомник быстрого размножения следует использовать однометровые черенки ванили не менее чем с 10 узлами. Три или четыре прикорневых листа лианы срезают, сохраняя одну треть листовых пластинок, и погружают в 1%-ную бордосскую смесь на 15 минут, а затем выдерживают в тени около одной недели для частичной потери влаги. Нижняя часть лианы укладывается на поверхность почвы вблизи опоры и покрывается тонким слоем почвы таким образом, чтобы обрезанный конец лианы был отогнут вверх над поверхностью, для избежания контакта с почвой. Остальная часть лианы привязывается к опоре так, что узлы прижаты к опоре. Основание растения должно быть замульчировано частично разложившимся древесным или листовым мусором. Лианам позволяется расти на опорах на высоту 1,5-2,0 м, а затем свободно обвиваться вокруг ветвей опекунов. По мере необходимости, растения следует поливать через короткие промежутки времени. Ваниль хорошо реагирует на удобрения. Внесение 50 г N, 25 г P2O5 и 80 г K2O на лиану, шестью отдельными дозами в год, с интервалом в два месяца, усиливает рост лиан. В качестве альтернативы, с интервалом в два месяца, можно проводить внекорневое внесение удобрений. Ухоженное растение даёт около 5–7 м прироста в год, поэтому размер питомника можно планировать с учетом годовой потребности в посадочном материале. В среднем 1 га питомника будет достаточно для выращивания около 40 000 м посадочного материала ежегодно.Саженцы в пакетах
Альтернативный метод создания посадочного материала при нехватке стандартных черенков лианы длиной 1 м состоит в том, чтобы поднять более короткие черенки с двумя или тремя узлами в полиэтиленовых пакетах и вырастить их до 8-10-узловых саженцев стандартного размера. Посадки растениями из пакетов неизменно благоприятны. Питомники должны быть расположены близко к основному участку для срочной транспортировки. Обычно, для посадки, используются черные полиэтиленовые пакеты размером 20 × 20 см и толщиной 100–150 мкм. Чтобы облегчить надлежащий дренаж, в нижней половине каждого мешка сделано от пяти до шести отверстий. Мешки заполняются почвенной смесью, приготовленной из верхнего слоя почвы джунглей, разложившегося навоза и песка в соотношении 3:1:1. Отмечено, что биогумус и разложившаяся сердцевина кокосовой пальмы являются лучшими средами для укоренения ванили (Siddagangaiah et al., 1996). Черенки с тремя узлами сажают в полиэтиленовые пакеты и привязывают к бамбуковым колышкам/опорам, вставленным в пакеты для поддержки. Было обнаружено, что длина используемых черенков оказывает сильное влияние на последующий рост. Когда использовались черенки с двумя узлами, рост лианы за шесть месяцев составил всего 32,6 см, по сравнению 51,8 см черенков с тремя узлами (Krishnakumar, 1995). Открытая почва в полиэтиленовом пакете должна быть покрыта слоем мульчи, предпочтительно разложившимися листьями, чтобы сохранить почвенную влагу и служить источником питательных веществ для растений. Частичная тень должна быть обеспечена либо с помощью теневых агро-сеток, либо с помощью сеток из койра.ИИИК Совета по специям Индии стандартизировал более удобный и экономичный метод устройства таких питомников. Черенкам ванили, посаженным в полиэтиленовые пакеты, позволяют виться по шпагату из койра, как показано на рисунке (рис. 20.1). Полностью выросшие саженцы вместе со шпагатом будут привязаны к опекуну во время посадки на участок, что обеспечит наименьшее беспокойство для лиан из пакетов. Влагоудерживающая способность и шероховатая поверхность койрового шпагата способствовали лучшему росту (ICRI, 2006).
 Рисунок 20.1. Саженцы ванили на шпагате из койра (метод ИИИК).
Рисунок 20.1. Саженцы ванили на шпагате из койра (метод ИИИК).
Растения поддерживаются регулярным опрыскиванием. Внекорневая подкормка 1% диаммонийфосфатом (ДАФ) может применяться к растущим лианам через два месяца после посадки и повторяться с ежемесячными интервалами. В качестве альтернативы, для усиления роста лиан, можно использовать вермикомпостный экстракт. Опрыскивание экстрактом один раз в две недели увеличивало длину лианы до 66 см за шесть месяцев по сравнению с 42 см, полученными в контроле (ICRI, 1999). Выращенные таким образом, черенки в полиэтиленовых пакетах будут готовы к посадке на участок через 6–7 месяцев. К этому времени они должны достичь примерно 50–70 см длины.
Поддержка для лиан
Ваниль, будучи лазящей орхидеей, требует опоры для поддержки и тени. Ряд видов деревьев может быть рекомендован в качестве подходящих опекунов для ванили. Помимо живых опор, в качестве поддержки ванильных лиан используются шпалеры, решетки, деревянные и бетонные столбы и проволоку или рейки. Деревянные столбы подвержены распаду и нападению термитов и, потому, их необходимо часто менять. В случае опоры на проволоку или рейки, нежная часть лиан может быть легко сломана. Когда используются неживые опоры, всегда необходимо обеспечить некоторую форму притенения для ванильных растений. Следовательно, живые опекуны предпочтительны для культивирования ванили. В целом, полезны виды деревьев поддержки с мелкими листьями, которые позволяют отфильтровать свет через листву. Самыми идеальными оказываются виды, которые легко размножаются длинными стволовыми черенками, быстро растут и с достаточно низким ветвлением (1,5-2,0 м от земли), чтобы лианы висели в пределах досягаемости рабочих. Деревья должны быть достаточно сильными, чтобы выдерживать вес лиан и стручков и противостоять сильному ветру и ливню. Деревья никогда не должны полностью опадать в летние месяцы, но должны выдерживать периодическую обрезку для регулирования тени. Для опорных деревьев также важно иметь глубоко проникающие корни, чтобы они не конкурировали с поверхностными корнями ванильных растений за питательные вещества. Некоторыми из вполне подходящих опорных деревьев, используемых в Индии, являются Gliricidia maculate, P. alba, Morus sp. Casuarina, либерийский кофе, коралловое дерево, альбиция Лебека, E. lithosperma, Jatropha sp. и так далее.Посадка
Лианы длиной 1 м с плантации/из траншейного питомника/из полиэтиленовых пакетов обычно предпочтительнее для посадки. Черенки сажают близко к основанию опорного дерева, укладывая 3-4 базальных узла, с которых удаляются листья, на поверхность почвы и осторожно прижимают эти узлы к почве или присыпают тонким её слоем, чтобы покрыть узлы. Во время посадки следует позаботиться о том, чтобы нижняя часть черенка оставалась чуть выше поверхности почвы, так как в противном случае возрастает вероятность гниения. Верхний конец черенка следует аккуратно привязать к основанию опорного дерева, чтобы тот в конечном итоге взобрался по нему. Частично компостированные органические материалы, такие как кокосовая шелуха, мульча, рубленная солома, опавшие листья и т. п., должны быть расположены вокруг только что посаженного черенка у основания опорного дерева слоем 10–15 см или более. Если тень от опекуна недостаточна, для притенения черенка можно использовать пальмовые или другие листья. Лучшее время для посадки ванили – когда установилась погода ни слишком дождливая, ни слишком сухая. В условиях Индии рекомендуется посадка в августе или сентябре, после юго-западного муссона. Черенкам требуется около 4-8 недель, чтобы укорениться и показать начальные признаки роста из любой пазухи листа. При условии орошения, укорененные черенки из полиэтиленовых пакетов могут быть посажены в любое время года.Последующий уход
После создания, ванильной плантации следует уделять постоянное внимание. Её необходимо часто посещать, для направления лиан к росту на удобной высоте, обрезать растущие лианы и опорные деревья и выявлять больные и пораженные вредителями растения. Выращивание других культур возле корней не рекомендуется, поскольку это может потревожить корни и почву, приводя к повреждению растений ванили. Периодическое удаление мертвых лиан или гниющих частей лиан проводится регулярно. Успех плантации будет зависеть от предотвращения серьезной вспышки заболеваний и создания благоприятных условий для цветения и роста стручков.Управление питанием
Для успешного выращивания ванили, являющейся полуназемной орхидеей, важно обеспечение правильной почвенной среды у основания растения за счет соответствующего мульчирования, а не плодородия почвы как такового. Лучший источник питательных веществ – это глубокий слой разложившейся мульчи вокруг корней ванили. Содержание питательных веществ в мульче зависит от источника и состава мульчи. Исследования по подкормке, проведенные в ИИИК Совета по специям, показали, что урожай ванили может быть увеличен внесением в почву 20:10:30 г NPK на лиану в год и листовой подкормкой карбамидом, простым суперфосфатом и хлоридом калия в пропорции 1,0%, 0,5% и 1,5% соответственно – в январе, мае и сентябре. Культура хорошо реагирует на листовую подкормку, и, следовательно, в первые годы роста ванили практикуется листовое применение неорганических удобрений. ДАФ (2%) и хлорид калия (1%) или комплекс NPK (2%) могут быть распылены на нижнюю поверхность листьев при достаточной влажности (> 60%) на плантации. Листовое применение ДАФ и микроэлементов, особенно Zn и B, повышает развитие стручков. Исследования влияния поглощения питательных веществ через воздушные корни ванили выявили, что раствор Кнопа (25%) показал улучшение роста ванили (ICRI, 2003). Культура в высокой степени поддается органическому выращиванию. В дополнение к химическим удобрениям, применяются различные органические. Разложившиеся органические вещества, костная мука, ХРН, вермикомпост и ферментированный жмых вносятся как минимум дважды в год, то есть в июне-июле и сентябре-октябре. Формирующее применение вермикомпостного экстракта (разведение 1:5) ускорило рост и развитие. Применение Вайрша аюрведических препаратов, таких как панчагавья, рыбный амино экстракт, и яичный амино экстракт, также широко практикуется в органическом выращивании ванили.Мульчирование
Мульчирование с зелеными или сухими листьями должно проводиться, по крайней мере, два раза в год. Они не только обеспечивают питание в виде богатого калием органического вещества, но и сохраняют влагу и удерживают слой мульчи в положении, создающем глубокую и богатую корневую зону, благоприятную для ванили. В исследованиях повышения эффективности роста ванили с различными материалами мульчирования, койровое волокно способствовало относительно лучшему удлинению лианы по сравнению с традиционно используемой мульчей из древесных остатков. В преимущество койрового волокна записывается лучшее сохранение влаги, поддержание благоприятного микроклимата и подачи микро- и макроэлементов для роста ванили (ICRI, 2005).Орошение
Ваниль требует влажного климата с частыми, но не чрезмерными дождями. При обильных осадках широко распространены заболевания гнилью. В условиях продолжительной засухи растения могут пострадать от физиологических повреждений, а лианы могут не восстановиться. В очень засушливых условиях полив следует проводить не реже одного раза в 4–5 дней. Было обнаружено, что мульчирование листьями манго (25 кг на лиану в год) и полив один раз в четыре дня увеличивает урожай ванили (Muraleedharan, 1975). В зависимости от обрабатываемой площади может применяться дождевание или полив из шланга. Орошение с помощью микро-разбрызгивателя/тумана рекомендуется для поддержания относительно высокого уровня влажности на плантациях и обеспечения высокого процента завязываемых стручков. Следует проявлять осторожность, чтобы избежать застаивания воды вокруг основания растения или чрезмерного водного стресса на любой стадии развития лианы или стручка. Если недостаточно тени от опорного дерева, для притенения черенков можно использовать пальмовые или другие листья,.Управление тенью
Для притенения ванильных растений очень важно аккуратно обрезать ветви опорного дерева. Ньюпорт (Newport, 1910) установил, что предпочтительнее использовать сетчатую тень, чем плотную. Ванильные лианы требуют больше солнечного света, чем тени во время цветения и во время созревания стручков. По опыту фермеров существующие теневые деревья следует обрезать так, чтобы максимально равномерно пропускать 30–50% солнечного света. Может оказаться желательным отрегулировать тень, чтобы в период цветения было больше света. Увеличение количества света помогает сдерживать вегетативный рост и способствует цветению. Следует избегать сильной тени, потому что стебель станет тонким, листья – маленькими, а цветение и плодоношение в целом уменьшатся. Напротив, при слишком большом количестве солнечного света листья не только покрываются солнечными ожогами и желтеют, но и растения в период засухи становятся слабыми и более восприимчивыми к заболеваниям корневой гнилью. Количество света, которое ваниль может выдержать, в основном зависит от подачи воды к корням, зависящей от атмосферной влажности и методов полива. При обильных дождях и высокой относительной влажности ваниль выдерживает больше солнечного света, чем в периоды низкой влажности и засухи. Таким образом, важно, чтобы поддерживающие деревья сохраняли большую часть листвы в засушливые периоды.Распределение и обрезка
Стелющаяся природа ванильных лиан оказывает эффект на цветение. Лианы обвивают вокруг нижних ветвей опорных деревьев или на шпалерной решетке, чтобы они могли свисать. Требуется осторожность, чтобы не порвать и не повредить листья, ветви или корни. Сгибание лианы, по-видимому, является важной операцией для стимулирования цветения и плодоношения за пределами изгиба, что может быть связано с накоплением углеводов и, возможно, других растительных гормонов, вызывающих цветение, в этих частях лианы. Остановка вегетативного роста ванильной лианы путем обрезки помогает вызвать цветение. Направление и обрезка предпринимаются для индукции цветения и производства стручков. При этом свисающие побеги длиной 1–1,2 м сгибают вокруг ветвей опорного дерева, слегка закручивают, кончики обрезают примерно на 45 см от почвы. Любые вегетативные побеги, появляющиеся после изгиба свисающего побега, удаляются, но побегам, появляющимся на остальной части растения до изгиба свисающего побега, дают возможность отрасти. Эти побеги составят плодоносящие ветви следующего года. В результате уменьшается сокодвижение к несущим ветвям, что способствует образованию цветов. После сбора урожая, отплодоносившую часть лианы удаляют с растения. В следующем году необходимо подготовить плодоносящие ветви путем сгибания и обрезки. Таким образом, архитектура лианы через 3–4 года представляет собой лиану с несколькими побегами, свисающими с ветвей живой опоры, без спутывания или перекрытия. Обычно в год можно подготовить от пяти до шести несущих ветвей на одно растение, в зависимости от возраста и размера лианы. Исследовалась урожайность обрезанных висячих побегов разного размера, составляющего 4, 6, 8, 10 и 12 узлов на побег. Выявлено, что формирование соцветий на висячих побегах происходит неравномерно, независимо от их размера. У 10-узловых свисающих побегов максимальное количество соцветий на побеге. Однако, качество стручков первого сорта (длиннее 15 см) составило 57% на 10-узловых побегах, 77% на 6-узловых и 88% на 4-узловых висячих побегах, соответственно, что указывает на то, что производство большего количества стручков в кисти или на продуктивной лиане происходит за счет размера стручков (Hrideek et al., 2003). Когда стручки созрели и сбор урожая завершен, отплодоносившая часть лианы удаляется, и остаются только новые побеги предыдущего года. Подрезанные и подготовленные к цветению растения нуждаются в сильном удобрении листовым перегноем, гниющими листьями, известью, золой и коровьим навозом.Болезни и их предотвращение
Грибковые и вирусные заболевания являются основными факторами, сдерживающими производство. Потери урожая из-за этих биотических стрессов различаются. Грибковые заболевания, такие как гнили Fusarium и Phytophthora, вызывают серьезные, а иногда и полные потери урожая. Вирусные заболевания, хотя и не смертельны, приводят к различной степени потерям продукции и продуктивности. Поскольку ваниль для Индии является экзотическим растением, посадочный материал мог поступить из неизвестных источников, где вирусная природа материала никогда не была установлена, и правила карантина никогда не применялись. Отсутствие соответствующих средств молекулярной диагностики, особенно вирусных заболеваний, является еще одним серьезным препятствием, ограничивающим обнаружение вирусов. Это важно ввиду вегетативного способа размножения. Генетическая изменчивость в отношении устойчивости к болезням/вредителям сравнительно низкая, что может быть причиной высокой заболеваемости и, как следствие, потери урожая. За исключением отчетности о новых заболеваниях, подробные исследования по предотвращению различных заболеваний недостаточны. Интегрированная борьба с вредителями и болезнями остается важным приоритетом для защиты культуры ванили, с большим акцентом на биологическом контроле для уменьшения использования пестицидов при выращивании. Поскольку ваниль является культурой с малой генетической изменчивостью по устойчивости к болезням, следует предпринять усилия для создания большего разнообразия, чтобы определить разумную устойчивость или толерантность к основным болезням. Недавнее сообщение о вариабельной реакции на заболевания у ванильных сеянцев и сомаклональных вариаций представляет значительный интерес и требует дальнейшего изучения (Minoo et al., 2006b). Основные заболевания, зарегистрированные у ванили в Индии, приведены в таблице 20.3.Таблица 20.3 Заболевания ванили в Индии
| Название | Патоген | Справка |
|---|---|---|
| 1. Грибковые | ||
| Основные: | ||
| 1. Стеблевая, корневая гниль, вилт | Fusarium oxysporum sp. vanillae | Philip (1980), Joseph Thomas et al. (2003) |
| 2. Фитофтороз листьев, стеблей и стручков | Phytophthora meadii | Bhai and Thomas (2000) |
| Второстепенные: | ||
| 3. Пожелтение и осыпание незрелых стручков | Colletotrichum vanillae | Thomas et al. (2003) |
| 4. Стручковая гниль | Sclerotium rolfsii | Thomas and Bhai (2000) |
| 5. Коричневая пятнистость | Cylindrocladium quinquiseptatum | Bhai et al. (2006) |
| 6. Гниль кончиков побегов | Colletotrichum gloesporides | Thomas et al. (2003) |
| 2. Вирусные | ||
| 1. Мозаика | CMV—Cucumovirus | Madhubala et al. (2005) |
| 2. Мозаика и некроз стеблей | Potexvirus, potyvirus, и closterovirus | Bhat et al. (2004) |
Грибковые заболевания
Стеблевая и корневая гниль
Это одно из самых разрушительных заболеваний, наблюдаемых во всех странах, выращивающих ваниль, и это очень серьезное заболевание в Индии. Впервые в Индии о нем было сообщено в 1980 г. (Philip, 1980). Позже было показано, что он вызывается Fusarium oxysporum sp. vanillae (Thomas et al., 2002).Симптоматика и этиология. Заболевание наблюдается в теплых влажных условиях. Грибок заселяет корень и вызывает пожелтение лианы с дегенерацией корневой системы. Оно также вызывает темно-коричневую гниль как на стебле, так и на листьях (рис. 20.2). Гниение начинается на любой части растения. Заражению подвержены все части растения, но чаще в области узлов. Позже оно распространяется вверх, вызывая гниение, приводящее к высыханию дистальной части за пределами точки заражения. Сильно пораженные сады на расстоянии кажутся засохшими, что типично для заболевания. Пораженный стебель проявляет потемнение сосудов, типичное для фузариозного увядания (Y.R. Sarma, неопубликованные данные).
 РИСУНОК 20.2. Заражение стеблей и листьев Fusarium.
РИСУНОК 20.2. Заражение стеблей и листьев Fusarium.
Эпидемиология Хотя подробные эпидемиологические исследования не проводились, температура окружающей среды около 25–28°C способствовала возникновению и распространению болезни. Заболевание протекает индивидуально и в некоторых случаях перекликается с фитофторной гнилью. Следовательно, смешанные инфекции являются обычным явлением. В пораженных тканях наблюдается обильное спороношение. Болезнь распространяется брызгами дождя внутри растения и по лиане. Требуется подробное исследование кривых прогрессирования заболевания в зависимости от условий окружающей среды. Грибок выживает на мертвых иссохших обломках, и мертвые, высохшие лианы, оставшиеся на участке, являются постоянным источником инокулята.
Предотвращение заболеваний Поскольку все доступные сорта очень восприимчивы, устойчивости к болезням не существует. Недавний отчет об изменчивости семенной рассады V. planifolia по отношению к стеблевой гнили важен и требует интенсивной полевой оценки (Minoo et al., 2008b).
Культуральная практика Регулярный мониторинг необходим для раннего выявления болезни и принятия корректирующих мер. Фитосанитация, включающая сбор и удаление зараженных лиан в саду, имеет важное значение для уменьшения инокулята патогенных микроорганизмов в почве.
Химический контроль Предлагалась фитосанитация с последующим опрыскиванием и периодическим орошением почвы 0,2% карбендазимом, в зависимости от интенсивности заболевания (Thomas et al., 2002).
Фитофтороз листьев, стебля и стручков
Заболевание впервые было зарегистрировано на плантациях ванили в поместье Маналару в Неллиампати и поместье Арнакал в Вандиперияре в 1998 году, а также на дикорастущей лиане в Дирекции по развитию бетеля и специй, Каликут (Y.R. Sarma, unpubl. data). Позже оно наблюдалось в округах Идукки и Коттаям штата Керала, особенно в районах Муваттупужа и Кутхаттукулам (Bhai and Thomas, 2000).Симптоматика и этиология Заболеваемость приходится на юго-западный сезон дождей в Керале. Заболевание протекает в виде пятен, пропитанных водой. Наблюдения в поместьях Маналару и Арнакал показали, что инфекция Phytophthora поражает листья, стебли и стручки, вызывая гниение (рис. 20.3 и 20.4). Заражению подвержены все части лианы. На листьях пропитанное водой пятно увеличивается до 0,5–1,5 см с полупрозрачным передним краем. На стеблях это обычно влажная гниль, в отличие от фузариозной гнили, пораженные части становятся мягкими и гниют полностью. В гроздях ванильных плодов заражение начинается в любой точке стручков либо на кончике, либо в области стебля. Когда инфекция начинается с кончика, она постепенно распространяется вверх, вызывая разную степень гниения. Если заражение происходит в области стебля или цветоноса, инфицированные стручки либо опадают, либо высыхают до области цветоножек (Y.R. Sarma, неопубликованные данные).
 РИСУНОК 20.3. Поражение стебля и листьев Phytophthora.
РИСУНОК 20.3. Поражение стебля и листьев Phytophthora.
 РИСУНОК 20.4. Фитофтороз стручков.
РИСУНОК 20.4. Фитофтороз стручков.
Возбудитель был идентифицирован как Phytophthora meadii. При искусственной инокуляции инфекция регистрировалась через 5–8 дней после инокуляции. Грибок на среде с морковным агаром выглядит хлопково-белым. Был зарегистрирован размер спорангиев 39,6 × 20 мкм с отношением LB 1,98. Культуры были гетероталлическими. Также наблюдались интеркалярные хламидоспоры в мицелии (Bhai and Thomas, 2000).
Эпидемиология Детальных эпидемиологических исследований не проводилось. Однако, заболевание совпадает с юго-западным муссоном с непрерывными осадками 15–20 дней в месяц с периодическими дождями в период с июля по август. На инфицированных стручках происходит рост грибка, в котором скрываются обильные спорангии. Болезнь распространяется брызгами дождя как по лиане, так и между лианами. В Керале и Карнатаке P. meadii была зарегистрирована на гевее, мелком кардамоне и ареке. Важно исследовать их патогенные отношения на молекулярном уровне и возможности скрещивания и развития новых рас/биотипов P. meadii.
Предотвращение заболеваний Культуральные практики: Как упоминалось ранее, в случае фузариозной гнили/увядания важны меры фитосанизации, заключающиеся в систематическом сборе и удалении зараженных и засохших лиан. Химический контроль: опрыскивание лиан 1%-ной бордосской смесью и орошение почвы оксихлоридом меди (0,25%) оказалось эффективным (Bhai and Thomas, 2000). Профилактическое опрыскивание лиан 4-5% фосфонатом калия (Фитофос 40), системного химического вещества, через 15-дневные интервалы действительно контролировало болезнь, но если влажный период продолжался, контроль заболевания был плохим (Y.R. Sarma, неопубл. данные).
Стручковая гниль
Об этом заболевании, вызываемом Sclerotium rolfsii, сообщалось из района Рамамангалама в Керале в ходе обследования, проведенного в 1999 году (Thomas and Bhai, 2000).Симптоматика и этиология Наблюдали гниение одного или двух стручков или всех стручков в кисти. Беловатый мицелий веерообразно разрастается по стручкам. Зараженные стручки проявляли симптомы гниения с глубокими впадинами красновато-коричневого цвета. На листьях и стеблях гриб распространяет белесые толстые мицелиальные нити, а затем образует склероидные тела кремового или коричневатого цвета, похожие на зернышки (Y.R. Sarma, неопубликованные данные).
Коричневая пятнистость
Это второстепенное заболевание, наблюдаемое в районе Чемпукадаву округа Кожикоде Кералы при смешанной системе выращивания кокоса, ареки, гвоздики и ванили. Заболевание вызывается Cylindrocladium quinquiseptatum. Оно начинается с пропитанных водой пятен на ванили, которые затем увеличиваются до углублений размером 1–10 мм. Поражения сливаются, образуя углубленные поражения красновато-коричневого цвета, напоминающие антракноз. Подвержены влиянию либо один стручок, либо все стручки в кисти. Также наблюдалась инфекция листьев с запавшими поражениями (Bhai et al., 2006).Пожелтение и преждевременное опадание ванили (YPB)
Это еще одно второстепенное заболевание ванили, наблюдаемое в районе Кожикоде штата Керала, вызываемое Colletotrichum vanillae. Заболевание характеризуется преждевременным пожелтением стручков с темно-коричневыми запавшими поражениями, которые постепенно расширяются на весь стручок (рис. 20.5). Это ведет к преждевременному опадению стручков (Bhai et al., 2006). В ходе обследования, проведенного в апреле-мае 2003 г., было зарегистрировано преждевременное опадение ванили. Сообщалось, что высокая заболеваемость была вызвана высокой температурой и низкой относительной влажностью (Bhai and Dhanesh, 2008). РИСУНОК 20.5. Colletotrichum гниль стручков.
РИСУНОК 20.5. Colletotrichum гниль стручков.
Гниль кончиков побегов
Заболевание, как правило, наблюдается на плантациях ванили в посмуссонный период сентября-декабря. Оно начинается с коричневого пятна на черешке и нижней части разворачивающегося молодого листа. Воронкообразный лист содержит дождевую воду и предрасположен к инфекции. Позже инфекция распространяется вниз к нежной части побега, вызывая гниение кончика. F. oxysporum, выделенный из пораженных побегов, признан патогенным. Также наблюдалась ассоциация Colletotrichum gloesporide. Было обнаружено, что опрыскивание листвы 0,2% карбендазимом является эффективным (Thomas et al., 2002, 2003).Другие
Rhizoctonia solani и Mucor racemosus также были зарегистрированы как патогены ванили (Bhai and Dhanesh, 2008), но их значимость требует дальнейшего изучения.Биологический контроль для предотвращения грибковых заболеваний ванили как часть интегрированного управления болезнями (ИУБ)
Эффективность агентов биоконтроля для борьбы с почвенными патогенами растений была хорошо установлена в последнее время. Его важность была четко обозначена в борьбе с болезнями сельскохозяйственных культур (Sarma, 2006a, 2006b). Ранее сообщалось об уменьшении инокулята патогенов на плантациях ванили за счет применения Trichoderma viride, Trichoderma harzianum и Pseudomonas fluorescens (Thomas et al., 2002). И Fusarium, и Phytophthora частично пересекаются в поле, и пространственная сегрегация этих патогенов на плантации при определенных экологических условиях невозможна. Крайне важно и логично идентифицировать агенты биоконтроля, которые подавляют оба этих патогена ванили. Исследования, проведенные с различными изолятами P. fluorescens и Bacillus sp.как in vitro, так и in vivo показали биоэффективность некоторых бактериальных изолятов в отношении подавления P. meadii и F. oxysporum in vitro. Они также способствовали росту ванили. Установлено подавление фузариозного увядания в крупномасштабных полевых условиях с помощью местных штаммов T. harzianum на Маврикии (Y.R. Sarma, неопубликованные данные).Вирусные заболевания
Важности вирусов ванили уделяется значительное внимание на глобальном уровне (Wisler et al., 1987; Pearson and Pone, 1988; Pearson, 1990; Benezet et al., 2000; Grisoni et al., 2004). Идентификация вирусных проблем ванили в Индии произошла недавно. Лишь в 2003 г. была выяснена частота вирусных заболеваний в штатах Керала и Карнатака (Bhai et al., 2003; Sudharshan et al., 2003). Систематическое исследование по идентификации, характеристике и молекулярной диагностике вирусных заболеваний ванили, началось недавно в ИИИС, Каликут (Bhat et al., 2004; Bhadramurthy, 2008).Симптоматика и этиология
Электронно-микроскопические исследования выявили наличие трех типов изогнутых частиц, напоминающих Potexvirus, Potyvirus и Closterovirus, а также изометрическую частицу (Bhat et al., 2004). Недавно проведенное исследование заболеваемости вирусом на ванильных участках выявило около 3–10% случаев в Карнатаке и 0,13–5% в Керале (Bhadramurthy, 2008). Эти исследования показали, что в Индии ваниль заражают вирус мозаики огурца (CMV, Cucumovirus), вирус мозаики цимбидиума (CymMV, Potexvirus), вирус общей мозаики стручков (BCMV, Potyvirus) и вирус желтой мозаики стручков (BYMV, Potyvirus), и наблюдалась смешанная инфекция. Первое достоверное исследование штаммов ванильного CMV в Индии было проведено Мадхубала (Madhubala et al., 2005). Поражение лиан проявляется искаженной листвой с мелкими кожистыми листьями (рис. 20.6). При искусственной инокуляции представители Chenopodiaceae, Cucurbitaceae и Fabaciaceae были инфицированы штаммами CMV ванили. На основе подробного электронного микроскопического исследования были найдены изометрические вирусные частицы диаметром 28 мкм. Дальнейшие исследования подтвердили, что ванильные штаммы CMV относятся к I подгруппе CMV. Легкие хлоротичные пятна и полосы на листьях – характерные симптомы CymMV (рис. 20.7). Исследование показало, что индийские изоляты CymMV тесно связаны с ванильными изолятами CymMV из Французской Полинезии (Bhat et al., 2004). Исследования потерь урожая и эпидемиологии отсутствуют, и их необходимо активизировать для разработки эффективных стратегий борьбы с болезнями. РИСУНОК 20.6. Некроз стебля, вызванный вирусом мозаики огурца.
РИСУНОК 20.6. Некроз стебля, вызванный вирусом мозаики огурца.
 РИСУНОК 20.7. Мозаика листьев, вызванная вирусом мозаики цимбидиума.
РИСУНОК 20.7. Мозаика листьев, вызванная вирусом мозаики цимбидиума.
Вирусный контроль
Ванильные лианы могут быть бессимптомными переносчиками вирусов. Текущее состояние размножения и новых посадок будет продолжаться до тех пор, пока не обнаружится снижение урожайности. С практической точки зрения, на замену растений можно пойти, когда вирусная инфекция демонстрирует стадию снижения урожайности. Желательно собрать информацию о снижении урожайности в связи с вирусной инфекцией, чтобы установить и определить точную стадию снижения урожайности. В стратегии управления это позволит знать, когда прибегать к замене. Поскольку все эти вирусы передаются через сок, необходимо регулировать обрезку, запетливание или опыление, чтобы избежать неоправданной передачи вируса, ведущей к распространению болезни. Устранение вирусов из посадочного материала посредством меристемного клонирования, производства и распространения здорового посадочного материала будет приоритетом для устойчивого производства ванили в будущем.Вредители и борьба с ними
В Индии проблемы с вредителями на ванили обычно незначительны; однако, зарегистрировано несколько насекомых, которые повреждают лианы, верхушки побегов, цветочные почки или корни – клопы, гусеницы чешуекрылых и долгоносики.Полужесткокрылые вредители
Ванильный жук
Halyomorpha picus (Pentatomidae) (рис. 20.8) вызывает серьезные повреждения, высасывая сок из верхушек побегов и соцветий. Впоследствии такие пораженные участки некротизируются и загнивают. Нимфы и взрослые особи высасывают сок из цветоноса и бутонов. Проколы, похожие на уколы, в месте кормления с последующим некрозом и гниением – типичные симптомы кормления насекомых. Пораженные вегетативные почки опадают в течение 3-5 дней, а пораженные соцветия загнивают. Пораженность вредителем выше в период появления соцветий, то есть с января по февраль. РИСУНОК 20.8. Ванильный клоп H. picus (а) некроз кончика побега, (b) нимфа и (c) имаго.
РИСУНОК 20.8. Ванильный клоп H. picus (а) некроз кончика побега, (b) нимфа и (c) имаго.
Сообщалось о появлении жука в Карнатаке, особенно там, где ваниль культивируется на плантациях арековой пальмы. Об этом также сообщают из Кутхаттукулама в районе Коттаям штата Керала. Самки клопов откладывают яйца сферической формы скоплениями на нижней поверхности листа. Яйца откладываются белыми и становятся кремовыми в течение 3-4 дней. Личинки вылупляются через 5–6 дней. Нимфы первого возраста стадны, остаются на яичной скорлупе и не питаются. Нимфы второго-пятого возрастов имеют черный цвет и активно питаются на кончике побега. Продолжительность стадии нимфы составляет около 60 дней. Вредитель наносит около 40% повреждений, питаясь на соцветиях (Prakash, Sudharshan, 2002). Борьба с H. picus включает наблюдение за клопом в течение ноября-февраля и удаление яичной массы и нимф первого возраста, которые видны на нижней поверхности листьев. Распыление монокротофоса 0,1% а.и. уничтожает нимф, если пораженность высока.
Южный зеленый вонючий жук
Nezara viridula (Pentatomidae) встречается повсюду в тропиках. Клоп откладывает яйца на листья и стебли. Нимфы сосут сок цветочных бутонов и стеблей. Сообщается, что этот вредитель встречается на ванили в Карнатаке и Керале, но его частота очень низкая (Varadarasan et al., 2002a).Riptortus pedestris (Alydidae)
Сообщалось о появлении жука на ванили в Керале и Карнатаке как незначительного вредителя. Нимфа и имаго высасывают сок из стручков и листьев (Varadarasan et al., 2002b).Червецы (Coccidae) (неопознанные)
Это насекомое, обитающее в районе Идукки, штат Керала, высасывает сок из листьев, лиан и соцветий. Установлено, что с этим сосущим насекомым связаны муравьи, и поражение вредителями происходит в период с января по февраль (Varadarasan et al., 2002b). Меры борьбы (монокротофос в концентрации 0,1% а.и.) применяются только в том случае, если вред существенный.Жесткокрылые вредители
На ванили зафиксировано три вида жесткокрылых вредителей. Среди них долгоносик Sipalus sp. в округе Идукки штата Керала наносит серьезный ущерб молодым побегам, лианам и листьям.Ванильный долгоносик, Sipalus sp. (Dryothoridae)
Долгоносик откладывает яйца поодиночке по всей длине лианы, а появляющиеся личинки питаются внутренней сердцевиной стебля, просверливая туннель; лиана по всей длине лопается, гниет и падает (Varadarasan et al., 2002a). Взрослый долгоносик имеет длину 8–10 мм, ширину 2–3 мм, цвет от светло- до темно-черного цвета с двумя волнистыми белыми поперечными полосами на надкрыльях. Он симулирует смерть при приближении или прикосновении (танатоз). Взрослая самка крупнее самца. Взрослые особи в основном питаются побегами, втыкая хоботок. Поврежденный участок некротизируется в течение суток, что приводит к гниению кончика побега/лианы. Долгоносик также питается листьями, объедая верхний или нижний эпидермис с тканью мезофилла, оставляя тонкий прозрачный эпидермис на нижней или верхней поверхности листьев (рис. 20.9). РИСУНОК 20.9. Ванильный долгоносик, Sipalus sp. (Слева: яйцо, отложенное с некрозом; справа: личинка, проходящая через лиану).
РИСУНОК 20.9. Ванильный долгоносик, Sipalus sp. (Слева: яйцо, отложенное с некрозом; справа: личинка, проходящая через лиану).
После спаривания самки откладывают яйца поодиночке на 2–4 мм ниже эпидермиса на лиане или кончике побега. Яйцо представляет собой капсулу длиной 5–6 мм, шириной 0,8–1,0 мм, белого цвета, затем перед вылуплением становится желтым. В месте отложения яиц развивается некроз. Яйца откладываются только на нежные лианы, а не на листья. Появляющиеся личинки питаются некротической тканью, прокладывая туннели в лиане. Личинка первой стадии желтая, а личинка последней стадии белая с коричневой головной капсулой. Период личинки (личинки) длится 35–40 дней. Личинки, питаясь, туннелируют лиану, и вся пораженная часть становится некротической. Зрелая личинка окукливается внутри туннеля волокнистым материалом; окукливание длится 19–21 день. Взрослый долгоносик выходит, делая небольшую щель в высохшей лиане. Обширное повреждение лианы личинками и взрослыми долгоносиками наблюдается в основном на открытых участках, где меньше тени. Взрослых долгоносиков можно увидеть в поле в течение ноября-января, и их легко найти. Долгоносики не очень активны, поэтому их можно собирать вручную и уничтожать, чтобы уменьшить повреждение культуры (Varadarasan et al., 2002a).
Saula ferriginea Gerst (Плеснееды)
Этот жук, обитающий в Винаде и Нилгирисе в Индии, прогрызает лист с нижней поверхности, поедая всю ткань листа, за исключением толстой полупрозрачной кутикулы верхнего эпидермиса. Поврежденные листья загнивают в результате заражения грибком. С вредителями можно бороться, очищая сад от сорняков, а в тяжелых случаях – путем применения 0,1% малатиона (Rai and Nayar, 1976).Белая личинка
Holotrichia (Scarabaeidae): Корни ванили повреждаются белыми личинками хруща в районах Идукки и Тируванантапурам в Керале. Обработка основания растения хлорпирифосом 0,05% а.и. в течение мая или внесение энтомопатогенных нематод позволяет бороться с вредителями.Чешуекрылые вредители
Паутинная гусеница Archips sp. (Tortricidae)
Гусеница листовертки, обитающей в Идукки, Коттаям, Эрнакулам и Триссур, округах Керала, питается вегетативными побегами. Эти бледно-зеленые гусеницы видны между почкой побега и первым листом, они образуют паутину и питаются побегом, что приводит к гниению конечной почки (рис. 20.10). Пораженность гусеницей регистрировалась в январе и феврале. Взрослая бабочка красновато-коричневая с широкой ярко-желтой полосой на передних крыльях, серыми задними крыльями и телом. При высокой пораженности, с вредителями можно бороться, распыляя монокротофос в концентрации 0,1% а.и. (ICRI, 1996). РИСУНОК 20.10. Кончики побегов, поврежденные паутинной гусеницей, Archips sp.
РИСУНОК 20.10. Кончики побегов, поврежденные паутинной гусеницей, Archips sp.
Землемер, Nemoria sp. (Geometridae)
Желтовато-пепельные гусеницы с коричневыми головами очень подвижны и при кормлении повреждают соцветия и цветочные почки (рис. 20.11). Гусеница позднего возраста светло-коричневая, окукливается на поврежденном соцветии. Вредитель был зарегистрирован в Чеманнаре в районе Идукки штата Керала в течение февраля-марта. Монокротофос 0,075% или лямбда-цигалотрин 0,004% эффективно борются с вредителями. РИСУНОК 20.11. Слева: отложенные яйца на цветочных бутонах, справа: повреждение цветочного бутона Nemoria sp.
РИСУНОК 20.11. Слева: отложенные яйца на цветочных бутонах, справа: повреждение цветочного бутона Nemoria sp.
Не насекомые вредители
Среди них значительный ущерб наносят клещи, улитки и птицы.Клещ Tyrophagus sp. (Акарина)
Установлено, что этот клещ заселяет стручки при хранении в Индии (Sasikumar et al., 1992).Моллюски-вредители
Улитки: Achatina sp.: Они были найдены поедающими хлорофилльные ткани у основания лианы. Зарегистрированы в Нагеркойле в Тамилнаду, где для мульчирования использовались листья кокосовой пальмы. Днем улитки прячутся в мульче, а ночью выходят, чтобы питаться на ванили. Также обнаружено, что улитки питаются листьями (рис. 20.12). Борьба с этим вредителем включает в себя предотвращение мульчирования кокосовыми листьями или любыми другими растительными материалами, которые быстро не разлагаются. Улиток можно собирать с мульчи и уничтожать (Varadarasan et al., 2003b). РИСУНОК 20.12. Повреждение листьев улиткой Achatina sp.
РИСУНОК 20.12. Повреждение листьев улиткой Achatina sp.
Птицы-вредители
Куры причиняют существенный вред, роясь среди мульчи, обнажая и повреждая корни.Ванильные струпья
Наблюдались продольные пробковые образования на стручках ванили, которые обычно называют «ванильными струпьями». Предполагалось, что они вызваны насекомыми, грибками или абиотическими факторами, такими как капли росы или высокая интенсивность света. Эксперименты, проведенные в ИИИС, Керала, показали, что образование струпа формируется на ванили не из-за насекомых, грибков или каких-либо других абиотических факторов. Выяснилось, что механическое повреждение ванили на ранней стадии вызвало струп. Тщательное наблюдение за стручками, листьями и междоузлиями показало, что везде, где части растения на ранней стадии соприкасаются с твердыми предметами, такими как бамбук, сухая ветка или даже зрелая листовая пластинка, в месте контакта наблюдается образование струпа. В последующих экспериментах, повреждения ногтем на завязи во время опыления превратились в струпья на стручках. Любая незначительная травма на ранних стадиях завязи растягивается в продольном направлении при удлинении стручков, и таким образом образуются струпья (Varadarasan et al., 2005).Сбор и переработка
Свежие стручки ванили темно-зеленого цвета и не издают никакого аромата, потому что ванилин и другие химические вещества недоступны в свободной форме во время сбора урожая. Стручки готовы к сбору урожая, когда они приобретают слабый желтый цвет на дистальном конце, и в зависимости от условий, для достижения стадии сбора урожая может потребоваться 8–10 месяцев. Полное созревание стручков приводит к их растрескиванию и в конечном итоге влияет на их качество. Стручки нужно собирать в нужное время, так как из незрелых производится некачественный товар. Несинхронизированное цветение и плодоношение культуры приводит к тому, что выборочная уборка урожая продлевается до 1–2 месяцев. Некоторые из важных факторов, определяющих содержание ванилина и качество стручков, – это климатические условия, стадия сбора урожая и степень пропаривания стручков во время выдержки. В процессе обработки в стручках вырабатывается свободный ванилин в результате ряда ферментативных реакций, обеспечивающих аромат. В странах, выращивающих ваниль, используется много методов обработки. Тем не менее, бурбонский метод обработки ванили, применяемый на Мадагаскаре, используется в Индии, модифицируется и стандартизируется с учетом местных условий. Этот метод прост и состоит из четырех этапов (бланширование, пропаривание, медленная сушка и ароматическое созревание, см. главу 11) (Krishnakumar et al., 2007, 2008).Упаковка
На заключительной стадии обработки стручки упаковываются в вощеную бумагу или любой подходящий материал и хранятся в закрытых ящиках в течение трех месяцев или дольше, чтобы обеспечить полное развитие желаемого аромата и вкуса. Оценка различных методов упаковки и методов сохранения качества стручков во время хранения показала, что стручки, хранящиеся в полиэтиленовых бутылках, стеклянных банках, полипропиленовых пленках (0,011 и 0,035 мм), акриловых коробках и вощеной бумаге 0,07 мм плюс жестяная банка, были на одном уровне относительно содержания ванилина и удержания влаги (ИИИК, 2006). Согласно (Purseglove et al., 1981), основным требованием к качеству вяленых стручков ванили является их аромат/вкус. Другими характеристиками, определяющими качество, являются внешний вид, гибкость, размер стручков и содержание ванилина. Стручки высшего качества длинные, мясистые, эластичные по своей природе, от темно-коричневого до черного цвета, несколько маслянистые на вид, с сильным ароматом и без шрамов и пятен. Стандарты качества, используемые в Индии, соответствуют спецификациям ISO, и нет отдельных стандартов, установленных Бюро индийских стандартов (BIS). Местные торговцы/переработчики установили свои собственные нормы в зависимости от размера стручков: стручки высшего сорта имеют размер более 20 см, чистые, без пятен; стручки сорта А (16–20 см); стручки сорта Б (12–16 см); сорта C (8–12 см); и низкосортные стручки, состоящие из более коротких стручков, стручков с трещинами, порезами и морщинами, а также стручков с рубцами/пятнами. В целом, на здоровой плантации 20-40% произведенных стручков будут иметь сорт A, включая суперсорт; 30–50% сорт B, а оставшиеся C сорт или отбраковка. Чтобы получить большую долю стручков класса А, фермеры ограничивают опыление 10 цветками на кисть и 10–12 кистями на лиане. Примерный состав цельных стручков ванили – влажность: 25–30%; белок: 2,56–4,87%; жирное масло: 4,69–6,74%; эфирное масло: 0,0–0,64%; безазотный экстракт: 30,35–32,90%; углеводы: 7,1–9,1%; клетчатка: 15,27-19,6%; зола: 4,5–4,7%; ванилин: 1,48–2,90%; смолы: 1,5–2,6%; кальций: 19,7 мг%; калий: 16,2 мг%; натрий: 6,7 мг%; фосфор: 9,5 мг%; и железо: 0,3 мг%. Анализ индийских стручков ванили, проведенный внутри страны и за её пределами, показал, что содержание ванилина неизменно превышало 2,5%, а аромат и вкус были сопоставимы с мадагаскарской ванилью.Урожайность и экономика выращивания
Урожайность ванили варьируется в зависимости от возраста и метода выращивания. Хотя ваниль начинает цвести с третьего года, урожай собирают на четвертый год. Урожайность увеличивается до седьмого-восьмого года, а затем снижается. При умеренном уходе, диапазон урожайности плантации среднего возраста составит около 400–500 кг вяленых стручков с гектара. Усеченный модельный прогноз урожайности, при точности около 93%, был разработан с помощью биометрических показателей, таких как длина лианы (см), количество листьев, длина плодоножки на лиане (см), длина нерастущей области на лиане (см), длина междоузлий (см), обхват лианы (см), лист площадь (см²), количество соцветий, количество стручков/соцветий, длина стручков (см) и количество стручков/лиан, (Priya et al., 2002). Ваниль в Индии выращивается, в основном, как дополнительная культура на плантациях и приусадебных участках, и, следовательно, стоимость производства остается конкурентоспособной. Стоимость продукции при нормальных условиях ведения сельского хозяйства варьируется от места к месту в пределах страны. Один гектар с 1600 растениями ванили требует 53000 рупий в течение первого года основания и в среднем 34000 рупий на второй и третий год посадки. Таким образом, общая стоимость создания на 1 га площади составляет около 120 000 рупий. Стоимость обслуживания будет около 37000 рупий/год. Ожидаемая урожайность вяленой ванили составляет около 400–500 кг/га.Потребности в исследованиях и разработках
Поскольку эта культура является недавним коммерческим предприятием с интенсивным выращиванием в различных системах земледелия на плантациях ареки/кокосов/кофе, новые вспышки вредителей и болезней создают проблемы. Проблемы производства и послеуборочной обработки требуют внимания с учетом местных потребностей. Крупные исследования проводятся ИИИК Совета по специям, Майладумпара, округ Идукки, штат Керала. Ввиду крупномасштабного выращивания как в Керале, так и в Карнатаке, этот институт и его региональная станция в Саклеспуре, штат Карнатака, концентрируются на разработке передовых методов ведения сельского хозяйства, борьбе с вредителями и болезнями, послеуборочной обработке и хранении. Некоторые из последних технологий обработки (Krishnakumar et al., 2007) и инициативы по комплексной борьбе с вредителями и болезнями (Thomas et al., 2002; Varadarasan et al., 2003) являются логическими стратегиями, помогающими фермерскому сообществу. Производство здорового посадочного материала является серьезной проблемой, и технологии микроразмножения были разработаны Университетом Каликута, ИИИС в Каликуте, Сельскохозяйственным университетом Кералы и ИИИК (Philip and Nainar, 1986; Rao et al., 1992a; Mary Mathew et al., 1999; Chitra et al., 2007). Распространение растений из культуры тканей и их оценка в полевых условиях были предприняты Советом по специям в сотрудничестве с Департаментом биотехнологий Правительства Индии, Нью-Дели. Усилия по распространению и популяризации ванили привели к тому, что большое количество фермеров занялись её выращиванием, особенно в Карнатаке, Керале и Тамилнаду. Научно-исследовательские и опытно-конструкторские работы Совета по специям дали необходимый импульс и поддержку развитию выращивания ванили. По оценкам, к 2009–2010 годам под ванилью будет около 3500 га. Поскольку вирусные проблемы широко распространены у ванили и передаются вертикально через посадочный материал, диагностические методы обнаружения вирусов очень важны. Исследования, проведенные в ИИИС по диагностике вирусов, заслуживают высокой оценки и могут быть использованы питомниками ванили (Bhadramurthy, 2008). Для продвижения ванили, Совет по специям предпринял несколько программ развития, которые включают программу новых посадок ванили, схему сертифицированных питомников, схему создания перерабатывающих предприятий, схему награждения за производство ванили и схему помощи производителям в продвижении экспорта органических специй (включая ваниль). Эти исследования и разработки должны поддержать выращивание и производство ванили в Индии.Выводы
В целом, ваниль – это культура мелких и маргинальных фермеров, выращиваемая в основном в междурядьях и на приусадебных участках, за исключением нескольких плантаций в корпоративном секторе. Резкий скачок цен на ваниль в 2001–2002 годах, вероятно, из-за потери урожая на Мадагаскаре из-за повреждения циклонами в 2000 году, привлек мелких фермеров к крупным инвестициям в выращивание ванили. Это привело к значительному увеличению площадей, но с крайне некачественным посадочным материалом, что серьезно отразилось на вспышках тяжелых заболеваний и, как следствие, потерей посадок. Всё еще сильнее усугублялось резкими колебаниями цен на ваниль на мировом уровне, предлагающих ухудшение ценовой структуры. В конечном итоге, именно цена и будет определять долгосрочный интерес фермеров к крупномасштабному выращиванию ванили. Учитывая нынешний низкий мировой спрос, вполне вероятно, что статус-кво выращивания ванили в Индии сохранится. Тем не менее, индийские фермеры, выращивающие ваниль, обладают достаточной пластичностью, чтобы научно выращивать, обрабатывать и поставлять стручки требуемого качества, если в воротах с фермы предлагается правильная цена.Глава 21. Производство ванили в Восточной Африке Уганда, Танзания, Кения и Восточная Демократическая Республика Конго
Введение
В этой главе рассматривается производство ванили в Восточной Африке. В Восточной Африке производство ванили сосредоточено вокруг бассейна озера Виктория и у подножия гор Рувензори в Альбертинской рифтовой долине. Страны-производители ванили включают Уганду, Кению, Танзанию и Восточную Демократическую Республику (ДР) Конго, при этом Уганда является основным производителем. Общеизвестно, что получить точную информацию и цифры о производстве ванили сложно, особенно в небольших странах-производителях в этом регионе. Кроме того, между странами продается большое количество ванили, которая позже экспортируется как угандийская ваниль. Соответственно, в этой главе основное внимание уделяется Уганде, и информация представлена в совокупности. Однако, там, где доступна информация по конкретной стране, она упоминается.История выращивания ванили в Восточной Африке
Ваниль (Vanilla planifolia) была завезена в тогдашний британский протекторат Уганда из Шри-Ланки (тогда Цейлон) в 1920-х годах. Однако, только в 1950-х годах в районе Муконо на берегу озера Виктория (рис. 21.1) были заложены первые значительные плантации. РИСУНОК 21.1. Ситуационная карта основных районов выращивания ванили в Центральной Африке.
РИСУНОК 21.1. Ситуационная карта основных районов выращивания ванили в Центральной Африке.
В 1970-х годах, во время режима Иди Амина, экономика Уганды рухнула, а вместе с ней рухнула и индустрия ванили. Хотя небольшое производство ванили сохранялось, в этом секторе не наблюдалось возрождения до середины 1990-х годов, когда Агентство США по международному развитию (АМР США) инициировало ванильный проект. Продолжавшийся с 1995 по 2004 год, проект способствовал увеличению производства ванили с нескольких тонн в год в начале 1990-х годов до примерно 200 тонн в 2006 году. Он также сыграл важную роль в расширении ареала выращивания из района озера до других регионов страны, особенно до области Рувензори, в частности в округ Бундибугио. Появление и продвижение ванили в других странах региона – явление недавнее. В Танзании ваниль выращивают на западном берегу озера Виктория, в регионе Кагера. Он возник в середине 1990-х годов и произошёл из растений ванили, выращенных в Уганде. Что касается ДР Конго, хотя есть сообщения о том, что ваниль выращивалась на западе страны в колониальные времена, сегодня невозможно проследить ни одного из этих видов деятельности. Вместо этого выращивание ванили в настоящее время сосредоточено в провинции Северное Киву, к западу от гор Рувензори, и является прямым следствием продвижения ванили в западные регионы Уганды в 1990-х годах. Выращивание ванили в Кении – явление еще более недавнее и ответ на недавнюю фазу высоких цен. Судя по всему, прогресс был незначительным.
Агрономия и переработка ванили
Для высокогорья Восточной Африки характерен мягкий экваториальный климат с бимодальным распределением осадков. Это позволяет использовать два разных сезона выращивания и сбора урожая. Это также относится к ванили и отличает этот регион от других регионов, выращивающих ваниль по всему миру. У берегов озера основной сезон сбора ванили длится с июня по август, тогда как второстепенный сезон длится с декабря по февраль. В горах Рувензори наоборот. Несмотря на то, что есть сезоны цветения и сбора урожая, из-за отчетливого микроклимата, основные сезоны цветения и сбора урожая длится 3–4 месяца, и даже после этих периодов возможно появление новых цветов. В результате, хотя и нестабильно, растения обычно несут цветы, незрелые и зрелые стручки одновременно.Агрономия
Производство во всем регионе исключительно из V. planifolia. Как правило, ваниль выращивают мелкие фермеры, и многие из них производят всего несколько килограммов зеленых стручков в год. Существуют некоторые исключения из этого, включая DML sprl. в ДР Конго, где посажены плантации площадью около 20 га. Посадочный материал обычно поступает с собственных участков или от соседей. Во время плантационного бума, вызванного высокими ценами на ваниль в 2003 и 2004 годах, посадочный материал продавался, и некоторые фермеры получили существенный доход. Помимо упомянутого проекта АМР США, этот сектор получает мало вложений от государственных институтов, и исследования остаются скудными. Таким образом, общая агрономия остаётся базовой, и плантации обычно производят ниже своего потенциала. Основные недостатки – плохой уход за почвой и борьба с сорняками.Обработка
В отличие от других регионов мира, производящих ваниль, в Восточной Африке большая часть ванили закупается специализированными переработчиками в виде зеленых стручков и вялится в централизованных условиях. В большинстве случаев обработка проводится по классическому бурбонскому методу с обработкой горячей водой, фазой солнечного нагрева и пропаривания с последующей медленной сушкой в помещении. Чтобы сохранить тепло, переработчики обычно полагаются на изолированные коробки. Чтобы разогреть стручки, их выставляют на солнце. Искусственная сушка обычно не практикуется. Классический бурбонский подход страдает двумя основными недостатками: ночью может стать довольно прохладно, а в контейнерах для вяления не хватает тепла, и ваниль становится холодной. Вторая проблема связана с гигиеной – одеяла, используемые для изоляции ванили, представляют собой скрытый риск заражения и поражения грибками. Известно, что два производителя в этом регионе используют разные методы вяления – в одном случае применяется метод быстрого созревания с предварительным измельчением стручков и искусственной сушкой, с сокращением фазы выдержки до нескольких дней. Измельченные стручки позже продаются производителям экстрактов, и с некоторыми из них существует тесное сотрудничество. Этот метод приводит к более высокому содержанию ванилина, чем классическая бурбонская обработка. Однако, утверждается, что аромат также более упрощенный – плоский и с акцентом на ванилин. Другая компания в ДР Конго использует усовершенствованный бурбонский метод вяления. Он медленнее, чем классический метод, и приводит к значительно более высокому содержанию ванилина и очень тонкому, сладкому, бальзамическому и сложному вкусу с элементами сушеной апельсиновой цедры, корицы и шоколада.Характеристики ванили
Централизованное и относительно контролируемое вяление отражается в высоком содержании ванилина. Ваниль из этого региона часто превышает 3% ванилина (в пересчете на сухой вес). Профиль аромата описывается как тонкий, сладкий и бальзамический. В аромате некоторой ванили может быть найден элемент запаха кожи. Скорее всего, это связано с ванилью, которая была выдержана при очень низких температурах. Типичная ваниль сушится до влажности 25–33%. Ваниль из Восточной Африки востребована производителями экстрактов. Репутация происхождения также постепенно проникает в премиум-сектор и выгодно конкурирует с ванилью с Мадагаскара и Коморских Островов.Продукты и основные области использования (сегменты рынка)
Большая часть продукции ванили из Восточной Африки поступает на рынок экстракции и продается оптом. Часто ваниль плохо сортируют. По крайней мере, одна компания производит ванильный порошок холодного помола, а другая – экстракты на основе растворителей. Изрядное количество изысканной ванили экспортируется, некоторая в розничной упаковке. Между тем, значительная часть ванили в этом регионе сертифицирована как органическая, и по крайней мере, три производителя имеют сертификаты органической и справедливой торговли – два в Уганде и один в ДР Конго. Подводя итог – значительная часть ванили, полученной из этого региона, нацелена на конкретную нишу на рынках, что отличает этот регион от других регионов, производящих ваниль. Основные производители ванили в этом регионе перечислены в таблице 21.1.ТАБЛИЦА 21.1. Основные производители ванили и их продукция
| Компания | Тип ванильной продукции | Контакт |
|---|---|---|
| Buiga Farm Industries Ltd. | Обработчик обычных стручков ванили; оптовый | tamale@buiga.com |
| Coetzee Natural Products (U) Ltd. | Переработчик обычных и сертифицированных органических стручков ванили; оптовый | cnp@africacentral.net |
| DML sprl | Производитель и переработчик ванильных стручков; справедливая торговля и сертифицированная органическая ваниль | lejardinbio@gmail.com |
| Empire Estates | Торговец обычными стручками ванили; оптовый | Abdul214@yahoo.com |
| ESCO Ltd. | Переработчик обычных и сертифицированных органических стручков ванили; оптовый | esco@africaonline.co.ug |
| Gourmet Gardens Ltd. | Производитель и переработчик ванильных стручков; порошок и экстракт, сертифицированная органическая и справедливая торговля; оптовые и розничные упаковки | info@gourmet-gardens.net |
| Ndali Farm | Переработчик ванильных стручков и экстракта, обычная и сертифицированная органическая и справедливая торговля; оптовые и розничные упаковки | vanilla@ndali.net |
| Sekalala | Обработчик измельченных и быстросохнущих стручков ванили, обычных; оптовый | aga@simba.fm |
| Uganda Crop Industries Ltd. | Производитель и переработчик ванильных стручков, обычных и сертифицированных органических; оптовые и розничные упаковки | Magellan@tenegra.net |
Рынки и торговые пути
Следует различать два типа торговых путей: с одной стороны, местные торговые пути, а с другой – международные торговые пути. На местном уровне, большая часть ванили из региона Кагера в Танзании и из Восточного Конго закупается зеленой и обрабатывается в Уганде, а затем продаётся как угандийская ваниль. Доля танзанийской ванили, поступающей на мировой рынок как таковая, находится в диапазоне 1–3 тонны. В настоящее время Конго экспортирует 6–8 тонн ванили, выращенной на фермах. По оценкам, по крайней мере такое же количество поступает в Уганду и продается как угандийская ваниль. Что касается международных рынков, то большая часть деликатесной ванили продается в Европу, а небольшие объемы экстрактов и высококачественные стручки отправляются в Японию. Основным рынком для экстрактов являются Соединенные Штаты. Основные рынки Европы – Великобритания и Германия. Объемы, проданные во Францию, которая в целом является крупным покупателем ванили, кажутся небольшими и могут быть объяснены предвзятым отношением французов к продукции из своих бывших заморских территорий. В течение последних нескольких лет клиенты с Мадагаскара регулярно покупали экстракт ванили для смешивания и улучшения бедной ванилином мадагаскарской ванили. Тенденция продолжается. Премиум-ваниль почти всегда транспортируется по воздуху. Экстракт ванили при высоких ценах транспортируют по воздуху. В противном случае он транспортируется через порт Момбаса в Кении по морю.Текущая ситуация
Рынок угандийской ванили полностью либерализован без какого-либо государственного вмешательства или регулирования. Аналогичная ситуация преобладает в соседних странах. Следствием этого является то, что уровни производства сильно колеблются и соответствуют спросу и предложению. Что касается фактических объемов, как упоминалось ранее, получить точную информацию и цифры по производству ванили в этом регионе крайне сложно. Представленные ниже цифры получены из разных, но обычно неподтвержденных источников и в результате прямого общения с ключевыми заинтересованными сторонами. Поэтому к отдельным цифрам следует относиться с осторожностью. Однако, нельзя отрицать, что возрождение ванильного сектора в рамках проекта, финансируемого АМР США, позволило увеличить производство ванили с практически нулевого уровня в 1995 году до примерно 150 тонн в 2004 году. Конец проекта совпал с невиданным периодом высоких цен, в результате чего гораздо больше фермеров занялись производством ванили и увеличили урожай примерно до 200 тонн в 2006 году. С тех пор, из-за обвала цен наблюдается спад производства, и к 2009 году производство упало примерно до 120 тонн (Таблица 21.2).ТАБЛИЦА 21.2. Общие тенденции производства ванили в Восточной Африке
| 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Объемы (тонн) | 0.2 | 16 | 17 | 54 | 70 | 120 | 185 | 195 | 200 | 150 | 120 | |||||
| Стоимость (‘000s USD) | 8 | 25000 | 8400 |
Вероятно, в ближайшие годы производство будет еще больше снижаться. Цены низкие, а другие культуры, такие как какао, которые выращиваются наравне с ванилью, в настоящее время переживают бум. Нередко можно увидеть, как фермеры активно искореняют ваниль, предоставляя место какао!
Перспективы
Условия для выращивания ванили в Восточной Африке очень благоприятные, и ваниль получается хорошего качества. За последние 15 лет этот регион зарекомендовал себя на мировом рынке как поставщик качественной ванили, востребованной производителями экстрактов. Премиальный сектор также развивается, и ваниль, предлагаемая в таких формах, выгодно конкурирует с ванилью с островов Индийского океана. Текущий производственный потенциал находится в диапазоне 100–150 т год. Однако, из-за постоянного падения цен производство будет продолжать снижаться, если на рынке ванили не произойдет серьезных изменений. При изменении состояния рынка и цен, наиболее вероятным сценарием будет отсроченное возвращение на рынок, что будет способствовать возобновлению цикла подъемов и спадов, как это наблюдалось ранее в этом десятилетии. Перспективы для органической и сертифицированной по справедливой торговле ванили, более многообещающие. Сертифицированные фермеры неохотно бросают свои плантации, прежде всего потому, что цены выше, а спрос более стабильный. Таким образом, в случае изменения рыночной ситуации они должны быть основными бенефициарами. Однако, по сравнению с другими регионами мира, производящими ваниль, Восточная Африка сильно отстает от выхода к морю. Это приводит к сравнительно высоким транспортным расходам и заставляет местных производителей и экспортеров бороться за сохранение конкурентоспособности. Влияние особенно велико в периоды низких цен. В результате очень маловероятно, что производство ванили в этом регионе значительно увеличится по сравнению с уровнями производства, которые наблюдались несколько лет назад. И последнее, но не менее важное: хотя Восточная Африка может производить очень хорошую ваниль, трудно конкурировать с хорошо зарекомендовавшим себя брендом Бурбон. Несмотря на то, что многие потребители на самом деле не знают, что означает бурбон, они воспринимают его как превосходящий ваниль, которая не маркируется как бурбон. Это широко распространенное явление в Европе. Французские потребители и торговцы проявляют в этом особый снобизм и невежество. В Соединенных Штатах этот вопрос решается менее жестко, и нередко ваниль, например, из Индонезии рекламируется как бурбонские стручки из Индонезии, если они были обработаны бурбонским методом.Глава 22. Производство ванили в Мексике
Введение
Основной коммерческий вид ванили («мексиканская ваниль» или «ваниль бурбон» [Vanilla planifolia G. Jackson]) – это редкая орхидея, родои из Мексики и Центральной Америки (Cameron and Soto Arenas, 2003; Lubinsky et al., 2008; Portères, 1954). Естественно-ароматные плоды V. planifolia использовались в доиспанской Мезоамерике различными культурами, в первую очередь тотонаками северного Веракруса (регион Папантла), ацтеками Центральной Мексики и майя тропических низменностей южной части Мексики, Гватемалы и Белиза (Bruman, 1948; Lubinsky, 2007; Rain, 2004). В этих культурах ваниль использовалась в качестве лекарственного (желудочного) и ароматизирующего агента, обычно в форме ингредиента для какао-напитков. Примерно с середины 1700-х до середины 1800-х годов Папантла обладала глобальной монополией на производство ванили (Bruman, 1948; Kourí, 2004), заработав репутацию «города, дарящего миру благоухание» (Rain, 2004). Папантла сохраняет свой статус основного производителя ванили в Мексике и сегодня, хотя сама страна в мире является второстепенным поставщиком. Растениеводы в регионе Папантла называют культивируемую V. planifolia «ванилла манса» (т. е. «окультуренная ваниль»), чтобы отличить её от других разновидностей и видов, до сих пор встречающихся в дикой природе (называемых «ванилла сильвестра» или «ванилла дель монте»), которые в некоторых случаях могут выращивать фермеры. Это генетическое богатство подчеркивает важность Мексики как центра окультуривания и разнообразия ванили. Выращивание ванили в Мексике расположено в прибрежной и предгорной зоне Мексиканского залива, от уровня моря до высоты 700 м. Преобладающий климат – тропический жаркий и влажный со средней температурой около 24°C, относительной влажностью 80% и количеством осадков от 1200 до 3000 мм в год. Сухой сезон длится с марта по июнь. Зимние месяцы (ноябрь-февраль) характеризуются прохладными влажными ветрами низкой интенсивности, называемыми «норте», которые беспрепятственно дуют из-за полярного круга. Эти низкие температуры имеют решающее значение для стимуляции весеннего цветения ванили. Основными производителями ванили в Мексике являются Веракрус (70%), Оахака и Пуэбла, последние два из которых отвечают за большую часть оставшихся 30%. Штаты с незначительным производством ванили, включают Сан-Луис-Потоси, Идальго,Чьяпас и Кинтана-Роо. На национальном уровне ваниль выращивают примерно 4000 семей, в основном из представителей коренных народов. В 2005 году для производства ванили было использовано около 1106,75 га, что дало 189 тонн «зеленой ванили» и 30 тонн вяленых стручков (SAGARPA, 2005; SIACON, 2005). Управление поставками осуществляется шестью частными компаниями и четырьмя фермерскими кооперативами, которые выращивают ваниль, наблюдают за её обработкой и осуществляют продажу на национальном и международном рынках (таблица 22.1).ТАБЛИЦА 22.1. Центры закупок/Предприятия обработки в Мексике
| Компания/Организация | Адрес |
|---|---|
| Santa Beatriz | Arturo Tremari No. 104, Papantla, Ver. Tel. 784-8420690 |
| Casa Larios | Gildardo Muñoz, No. 401, Papantla, Ver. Tel. 784-8420160 |
| La Alternativa | Ejido Primero de Mayo, Papantla, Ver. Tel. 728226048 |
| Consejo Nacional de Productores de Vainilla | Benito Juárez No. 202, Papantla, Ver. Tel. 784-8423905 |
| Productores Asociados de Vainilla del Totonacapan | Ejido Cuyuxquihui, Papantla, Ver. Tel. 784-8490548 |
| Gaya Vai-Mex | Av. Hidalgo No. 56, Gutiérrez Zamora, Ver. Tel. 766-8450497 |
| Vainilla del Totonacapan | Benito Juárez No. 14, Gutiérrez. Zamora, Ver. Tel. 766-8450226 |
| The Mexican Vanilla Plantation | Ejido Chacuaco, Tuxpan, Ver. Tel. 783-8346838 |
| Global Fungi | SPR de RL de CV. Xicoténcatl No. 214, Teziutlán Pue. Tel. 231-3121732 |
| Consejo Regional de Productores de Vainilla | Cerro Quemado, San Pedro Ixcatlán, Oax. Tel. 287-8779074 |
Системы выращивания ванили в Мексике
В Мексике существует четыре системы выращивания ванили (Hernández Hernández, 2005), которые классифицируются следующим образом.Традиционный или «ачауаль»
Ваниль выращивают в управляемых вторичных лесах («ачауаль») (рис. 22.1) отдельно или в сочетании с кофе (Coffea) и/или пальмами (Chamaedorea). Размер этих участков обычно составляет менее 1 га, и их использует более 80% производителей. Плотность растений на этих участках относительно низкая, как и время, которое производитель тратит для управления ростом (в частности, на петлевание и укоренение) и уход за растениями (например, на удобрение). Поэтому, урожайность низкая – в среднем 200 кг зеленой ванили с гектара. РИСУНОК 22.1. Система выращивания ванили в «ачауале».
РИСУНОК 22.1. Система выращивания ванили в «ачауале».
Разнообразные цитрусовые сады
Интенсивное выращивание цитрусовых в прибрежном Веракрусе позволило фермерам использовать эти насаждения в качестве опорных деревьев (рис. 22.2). Большинство садов состоят из апельсинов сорта Валенсия, которые обладают превосходными характеристиками в качестве опорных деревьев ванили, к примеру, имеют сильные ветви, которые растут в стороны и позволяют выращивать большое количество ванильных лиан. Цитрусовые деревья также обеспечивают полуфильтрованный солнечный свет в течение всего года, способствующий её активному росту и цветению, как правило, на второй год после посадки. Вентиляция считается хорошей, что приводит к меньшему количеству проблем с патогенами и лучшей вегетации, чем это типично для «ачуальных» систем. По сравнению с более интенсивными системами выращивания ванили, выращивание ванили в цитрусовых рощах влечет за собой более низкую стоимость производства, поскольку не требуются инвестиции для поддержки деревьев. Каждому собственнику принадлежит от 1 до 5 га, с урожайностью от 0,5 до 3,0 тонн зеленой ванили с га. РИСУНОК 22.2. Система выращивания ванили в цитрусовых садах.
РИСУНОК 22.2. Система выращивания ванили в цитрусовых садах.
Интенсивный (монокультура)
Эта система характеризуется использованием в качестве поддерживающих деревьев азотфиксирующих бобовых (Erythrina sp. и Gliricidia sp.), с плотностью посадки от 1000 до 5000 поддерживающих деревьев/га. Высокая плотность посадки позволяет получать одни из самых высоких урожаев среди всех систем, хотя в основном такой успех достигается только один раз (четвертый или пятый год после посадки). После рекордного сезона урожайность в этой системе часто резко снижается из-за загущенности, ведущей к проблемам с плохим освещением и вентиляцией, приводящим к вспышкам патогенов. Каждый фермер обрабатывает в среднем от 0,5 до 2 га, на которых 1-2 тонны зеленой ванили/га получают в богарных насаждениях, или от 2 до 4 тонн зеленой ванили/га в орошаемых посадках.Теневые дома
Это новейшая и самая интенсивная система производства ванили в Мексике. Основная особенность этой системы состоит в замене или дополнении естественного света пластиковыми сетками с 50%-ным затенением. Сетки размещают над опорными деревьями, на высоте 3–5 м, а также вдоль четырех сторон насаждений. Эти «теневые дома» обычно имеют небольшие размеры (1000 м² или 25 × 40 м) из-за высоких затрат, связанных с их строительством. Опоры для ванильных лиан искусственные или представлены живыми деревьями, но в любом случае их плотность высока (на один теневой дом высаживается 1500–2000 черенков ванили, что составляет 15–25 тыс черенков/га). Первые данные об урожайности этой системы были зарегистрированы в 2007 году. Они варьировали от 50 до 514 кг зеленой ванили на теневой дом (1000 м²). Основным фактором, вызвавшим такой разброс, скорее всего, было опадение незрелых стручков, вызванное неблагоприятными погодными условиями (например, высокими температурами и засухой) в сочетании с недостатками ухода. Максимальный урожай в 514 кг предполагает, что потенциально может быть получено 5140 кг зеленой ванили/га, что аналогично для систем затенения в других странах-производителях. Однако, до сих пор неясно, удастся ли этого добиться в Мексике, особенно с учетом необходимых крупных финансовых вложений.Основные воздействия на производство ванили в Мексике
Засуха и высокие температуры
По оценкам, 80% посадок ванили в Мексике страдают от засухи, в основном с марта по июнь, во время цветения и на ранних стадиях развития стручков. Поскольку засуха проявляется в такой критический период – общее производство, также как и качество мексиканской ванили особенно чувствительны к условиям засухи.Болезни/Патогены
Стеблевая и корневая гниль, вызванная грибком Fusarium oxysporum f. sp. vanillae – основное заболевание мексиканской ванили. Она приводит как к сокращению репродуктивной жизни, так и к гибели отдельных растений. Грибок Colletotrichum sp. ответственен за преждевременное опадение плодов, иногда до 50% для отдельной посадки.Вредители
Клоп Tenthecoris confusus Hsiao & Sailer (Hemiptera: Miridae) («чинче ройя») является основным вредителем мексиканской ванили (рис. 22.3). Он высасывает ксилему из листьев, стеблей и плодов и может вызвать полное опадение листьев растений. Неизвестный вид гусеницы («трозадорес») поедает цветочные почки, но ущерб, как правило, незначительный. РИСУНОК 22.3. Взрослая особь T. confusus Hsiao & Sailer (Hemiptera: Miridae) и повреждения ванили, которые она вызывает.
РИСУНОК 22.3. Взрослая особь T. confusus Hsiao & Sailer (Hemiptera: Miridae) и повреждения ванили, которые она вызывает.
Цветение, опыление и сбор урожая
Первое цветение ванили наступает через 2–3 года после посадки новых черенков. Сезон цветения с марта по май. Как и в других странах, опыление в Мексике осуществляется вручную. Некоторые цветы все еще опыляются естественным путем, и хотя естественный опылитель не задокументирован, скорее всего, это орхидная пчела Euglossa viridissima (Lubinsky et al., 2006; Schluter et al., 2007). Метод сбора урожая в Мексике заключается в срезании кистей целиком с помощью ножниц или ножей. Официальное открытие сбора урожая в Веракрусе 10 декабря – продолжение до января и февраля следующего года.Обработка ванили Мексике
Обработка начинается сразу после сбора урожая. В большинстве случаев она выполняется специалистами, а не производителями, и длится 3-5 месяцев, обычно с января по май. Вяление ванили в Мексике отличается от процесса во всех других странах-производителях, обеспечивая спрос на мексиканскую ваниль на мировом рынке. Этот процесс состоит из следующих этапов:1. Отделение плодов от кистей («деспезонадо») Этот этап влечет за собой ручное отделение каждого плода от рахиса («пезона»). Этап начинается с сортировки стручков по размеру и типу (например – целые, расщепленные, мелкие и т. д.). 2. Убийство в печи На этом этапе прекращается фотосинтез и клеточная активность зеленых плодов и предотвращается их растрескивание во время созревания. Стручки упаковывают в небольшие деревянные ящики или соломенные циновки («петаты»), а затем помещают в печи на 1-2 дня при 60°C. После этого стручки ванили достают из духовки и помещают в большие ящики для пропаривания. Стручки накрывают хлопчатобумажной тканью и циновками на 1-2 дня для этого первого «пропаривания». В последние годы некоторые производители в Мексике перешли с использования печей на стадии «умерщвления» к использованию горячей воды, как это происходит на Мадагаскаре. 3. Вяление на солнце и последующее пропаривание Стручки ванили достают из контейнеров для пропаривания и выставляют на циновках на солнце на 3–4 часа. Сразу после этого стручки возвращают в контейнеры для пропаривания и дополнительно накрывают тканью и соломенными циновками, чтобы продолжить пропаривание. Этот процесс повторяется до тех пор, пока содержание влаги в стручках ванили не станет около 30%, что обычно достигается, соответственно для более мелких и крупных плодов, после 11–24 циклов обработки на солнце/пропаривания. 4. Кондиционирование Стручки ванили, которые приобрели желаемое содержание влаги, помещают в ящики или деревянные шкафы, называемые «камиллас», для наблюдения в течение 30–45 дней. 5. Оценка Стручки ванили, которые не вызывают проблем во время кондиционирования, сортируются по размеру и качеству в соответствии с мексиканской системой оценки.
Коммерциализация мексиканской ванили
Большинство производителей ванили в Мексике продают свои свежие зеленые стручки посредникам или напрямую обработчикам/экспортерам. Несмотря на сложившуюся практику, многие производители в Мексике активно пытаются научиться обрабатывать собственные стручки и заключать контракты напрямую с международными покупателями или с мексиканскими обработчиками/экспортерами, стремящимися выполнять заказы. Центрами коммерциализации мексиканской ванили являются города Папантла и Гутьеррес-Самора, оба в штате Веракрус. Эти города получают зеленую ваниль от производителей и посредников из Веракруса, Пуэблы, Идальго и Сан-Луис-Потоси. Обработчики/экспортеры также находятся в Пуэбле и Оахаке.Международная торговля/экспорт
Мексиканская ваниль импортируется в другие страны через транснациональные компании. Основные поставщики мексиканской ванили – Aust & Hatchman, McCormick Co., Eurovanille, Vanipro и International Flavor and Fragrance. Головные офисы этих компаний находятся в США, Германии, Франции и Канаде. В Мексике также существует небольшой внутренний рынок ванили. Этот рынок в основном связан с закупками производителями экстракта, поставляемого как отечественным, так и зарубежным потребителям.Объемы экспорта
Почти вся ваниль, производимая в Мексике, предназначена для зарубежных рынков. Однако, в последние три года большая часть мексиканской ванили хранилась на складах, так как экспортеры ждут, пока цены не поднимутся выше 50 долларов США за килограмм. В целом Мексика ежегодно экспортирует 20–30 тонн готовой ванили. Это составляет около 1% от общего мирового производства. Основными странами-потребителями мексиканской ванили являются США, Германия, Франция, Япония и Канада. Небольшой процент (5%) ванили в Мексике используется на национальном уровне для изготовления экстрактов и кустарных продуктов. Основной спрос покупателей мексиканской ванили – на качественные стручки («экстра» или «гурмэ»). Стручки более низкого качества («пикадура») закупаются для получения экстрактов.Цены на свежую, «зеленую» ваниль
Самые низкие цены на мексиканскую «зеленую» ваниль были зафиксированы в период с 1984 по 1997 год, когда обрабатывающие компании платили менее 2,50 долларов США за килограмм. Самая высокая цена за зеленую ваниль в Мексике была в 2003 году, когда она продавалась в среднем по 45 долларов за килограмм. Несмотря на высокие цены 2003 года, в последующие годы зеленая ваниль резко упала в цене. В 2005 году зеленая ваниль в Мексике продавалась по цене 12 долларов за килограмм, а в период сбора урожая 2006 и 2007 годов подешевела до 4 долларов за килограмм (рис. 22.4). Единственным исключением в 2007 году была покупка зеленых стручков ванили длиной более 20 см по цене 12 долларов США за килограмм частной компанией, которая начала заниматься торговлей ванилью. Национальная организация производителей ванили (Consejo Nacional de Productores de Vainilla) в 2007 году платила производителям 6 долларов за килограмм зеленой ванили.Цены на готовую ваниль
Цены на готовую мексиканскую ваниль устанавливаются международным рынком и, в частности, отражают цены, предлагаемые на Мадагаскаре. Самые высокие цены на мексиканскую ваниль наблюдались в период с 2001 по 2004 год, достигнув пика в 2004 году, когда она составляла в среднем 420 долларов США за килограмм и максимум 600 долларов США за килограмм. В 2005 году цена упала более чем на 60% до 120 долларов за килограмм. С 2005 года небольшие количества высококачественной ванили («экстра» или «гурмэ») продавались по цене не более 60 долларов за килограмм (рис. 22.4). РИСУНОК 22.4. История средних цен на зеленую и готовую ваниль в Папантле, Веракрус, Мексика.
РИСУНОК 22.4. История средних цен на зеленую и готовую ваниль в Папантле, Веракрус, Мексика.
Система оценки мексиканской ванили
Вяленая ваниль в Мексике сначала подразделяется на три категории: целая («энтерас»), открытая/расщепленная («раджада») и рубленная/худшая («пикадура»). Стручки «пикадура» соответствуют частям стручков, которые могли быть получены из незрелых плодов, повреждены или плохо обработаны. Цены на ваниль в Мексике обычно делятся на эти три категории. Для целых и расщепленных стручков установлена система классификации из пяти подкатегорий: «ЭКСТРА»: стручки толстые, эластичные, блестящие, темно-коричневого шоколадного цвета («ачоколатадо»), сладкого/нежного аромата и с содержанием ванилина > 2,5%. «СУПРИОР»: похож на «extra», но менее темный и блестящий, с содержанием ванилина 2,25–2,29%. «БУЭНА»: более или менее блестящие и эластичные стручки, ароматные, темно-коричневого цвета с красной окраской в продольных бороздках и с содержанием ванилина 2–2,24%. «МЕДИАНА»: стручки с низкой эластичностью/блеском, со слабым ароматом, смешанные темно/светло-коричневые, с содержанием ванилина 1,75–1,99%. «ОРДИНАРИА»: стручки твердые/ломкие, не блестящие, со слабым ароматом, преимущественно светло-коричневого цвета с затемненными концами и с содержанием ванилина 1,5–1,74%. На практике, мексиканская ваниль может продаваться в соответствии с другими системами классификации, установленными покупателем, обычно «гурмэ», «расщепленные» и так далее.Упаковка мексиканской ванили
Мексиканская ваниль традиционно упаковывалась и распространялась оптом в вощеной бумаге и картонных коробках. Иногда высококачественные стручки («экстра/гурмэ») продавались в пучках, называемых «мазос», и фасовались по консервным банкам. В последние годы, в связи с покупательским спросом, готовая ваниль распространяется в вакуумной упаковке в полиэтиленовых пакетах по 1 кг.Ароматический профиль мексиканской ванили
Аромат мексиканской ванили описывается как интенсивный, сладкий, слегка пряный и похожий на табачный. Содержание основного ароматического соединения ванили – ванилина, в мексиканской ванили обычно составляет около 2%, но было обнаружено, что оно достигает 7% (Black, 2005). Хотя содержание ванилина имеет принципиальное значение для производителей, стремящихся обеспечить единообразный аромат для массового рынка, подлинный аромат ванили обусловлен присутствием сотен других соединений, обнаруживаемых в небольших количествах в готовых стручках. В мексиканской ванили обнаружено 65 летучих соединений, среди которых кислоты и фенолы занимают важное место (Pérez Silva et al. 2006). Одиннадцать соединений являются уникальными для мексиканской ванили: гексановая кислота, ванилметилкетон, метилэйкозаноат, 4-бутокси-3-метил-2-бутанон, метоксиметилацетат, 4-гексен-1-олацетат, 3-этил-3-метилпентан, 2,4-диметил-1-гептанол, 4-метилен-2-оксетанон, 2-метил-3-этилпентан и 2-этил-1,3-диоксолан (Hartman, 2003). Нишевый рынок, который сохраняется для мексиканской ванили, может в значительной степени быть обусловлен уникальным ароматом/соединениями, которые развиваются во время процесса обработки, используемого исключительно в Мексике.Перспективы мексиканской ванили
Интерес и мотивация к производству ванили в Мексике сильно зависит от цены. Когда международный рынок благоприятен – производители в Мексике реагируют соответствующим образом и улучшают уход/содержание своих посадок, как в 2000–2004 годах. Когда цены падают, производители быстро теряют интерес и отказываются от своих усилий, как это происходит сейчас. Эта ценовая изменчивость и международный спрос на ваниль по-прежнему будут главными определяющими факторами того, к чему будет стремиться производство ванили в Мексике.Глава 23. Производство ванили в Китае
История
Внедрение ванили и промышленное развитие
В начале 1960-х годов Vanilla planifolia Andr. была последовательно завезена из Индонезии в Фуцзянский институт субтропической ботаники и из Шри-Ланки в Даньчжоу в провинции Хайнань, а затем в регион Сишуанбаньна провинции Юньнань. С этого момента в Китае началось изучение её посадки, выращивания и обработки. В конце 1980-х – начале 1990-х годов при поддержке научно-исследовательских институтов и их достижений в исследованиях ванили, постепенно создавались компании, занимавшиеся промышленным выращиванием и производством ванили. К концу 1999 года общая площадь посадок ванили достигла около 233 га, в основном, с использованием интенсивных систем выращивания с искусственным затенением (рис. 23.1), из которых 100 га были распределены по различным частям провинции Хайнань и принадлежали разным компаниям (Chen, 2005), и 133 га распределялись по району Сишуанбаньна провинции Юньнань (рис. 23.2), включая пять плантаций, принадлежащих крупнейшему производителю ванили в Китае, компании Yunnan Vanilla Industry Ltd. РИСУНОК 23.1. Выращивание ванили в Хайнане, Китай, где показана интенсивная система выращивания в домах с искусственной тенью. (С любезного разрешения Чэн Дексина).
РИСУНОК 23.1. Выращивание ванили в Хайнане, Китай, где показана интенсивная система выращивания в домах с искусственной тенью. (С любезного разрешения Чэн Дексина).
 РИСУНОК 23.2. Карта Китая, на которой показаны районы выращивания ванили (черные кружки) в провинциях Юньнань и Хайнань.
РИСУНОК 23.2. Карта Китая, на которой показаны районы выращивания ванили (черные кружки) в провинциях Юньнань и Хайнань.
Из-за высоких затрат на ранних стадиях, длительного периода производства, плохого управления, отсутствия финансовой поддержки, нестабильного производства, стихийных бедствий и т. д. многие плантации ванили были разорены. До 2001 г. в провинции Хайнань в нормальном режиме работало лишь около 30 га плантаций ванили (Mao, 2002). В Юньнани ситуация была аналогичной. С банкротством Yunnan Vanilla Industry Ltd. в 2007 году, плантации интенсивного выращивания и фабрика по переработке в Сишуанбаньна были закрыты, и лишь несколько фермеров все еще выращивали ваниль. В прошлом, поскольку площади посадки и производства часто менялись, объем готовой ванили сильно колебался – от очень малого количества до нескольких тонн в год. На основе обобщения практического опыта Хайнань и Юньнань исследовали и разработали модель сельскохозяйственной индустриализации «Компания + фермерское хозяйство» для организации производства ванили. Производители ванили и местное правительство сформулировали преференциальную политику, чтобы побудить фермерские хозяйства развивать ориентированное на рынок выращивание ванили. Производители помогают фермерским хозяйствам создавать плантации ванили и предоставляют соответствующее техническое обучение и консультации, а фермерские хозяйства продают свои зеленые стручки производителям по фиксированным ценам. С 2002 по 2004 год, в рамках этой новой кооперативной организации и модели рассредоточенного выращивания, более 70 фермерских хозяйств на Хайнане посадили более 14 га ванили под ареками или другими деревьями, или же в сочетании с искусственными теневыми сетками (рисунки 23.3 и 23.4).
 РИСУНОК 23.3. Ваниль, растущая на Хайнане, Китай, демонстрирует систему выращивания под деревьями ареки. (Любезно предоставлено Чжоу Хенчаном).
РИСУНОК 23.3. Ваниль, растущая на Хайнане, Китай, демонстрирует систему выращивания под деревьями ареки. (Любезно предоставлено Чжоу Хенчаном).
 РИСУНОК 23.4. Ваниль, растущая на Хайнане, в фермерском хозяйстве, выращивающим ваниль. (Любезно предоставлено Чжоу Хенчаном).
РИСУНОК 23.4. Ваниль, растущая на Хайнане, в фермерском хозяйстве, выращивающим ваниль. (Любезно предоставлено Чжоу Хенчаном).
Площадь посадок и продуктивная площадь ванили на острове Хайнань (рис. 23.2) в настоящее время составляет около 34 га, которые разделены на восемь участков в Андинге, округе Тунчан, Ваньнин и городе Цюнхай и принадлежат более чем 100 фермерским хозяйствам или частным компаниям. В зависимости от системы управления и выращивания, средняя урожайность составляет около 75–300 кг вяленых стручков с гектара, а общий объем производства – около 5 тонн вяленых стручков в год, что может удовлетворить только запросы внутреннего потребления Китая. При этом мало что остается для экспорт (Chen, 2009; личное сообщение). В настоящее время, после банкротства крупнейшего предприятия по выращиванию и производству ванили Yunnan Vanilla Industry Co., Ltd., ваниль в Китае, в основном, выращивают и производят в регионе Хайнань.
Обзор исследований ванили в Китае
Общая ситуация в исследованиях
С появлением ванили в Китае и развитием её промышленного выращивания, соответствующие научно-исследовательские организации и производственные корпорации проделали большую работу во многих областях, включая посадку, производство, борьбу с вредителями, исследования биологических характеристик, а также исследования и разработки продукции. К 2008 году в различных периодических изданиях было опубликовано более 330 научных работ. Защищены 7 магистерских диссертаций и выпущено 2 монографии. В Китае было получено свыше 10 патентов и разработано 4 национальных сельскохозяйственных стандарта. Кроме того, корпорации по производству ванили устанавливают свои собственные правила, положения и стандарты по посадке, производству и производству.Основные исследовательские организации и исследовательские работы
Ученые из Академии исследований субтропических растений в провинции Фуцзянь первыми сосредоточились на исследованиях ванили в материковом Китае. Их ранние работы легли в основу исследований ванили в Китае. Именно их работы положили начало и способствовали промышленному развитию ванили. Что касается посадки – они изучили и разработали модель интенсивной посадки в домах с искусственной тенью, которая получила широкое распространение в коммерческих посадках ванили. Исследовательская группа опубликовала 36 статей, а также отредактировала и выпустила первую монографию о ванили в Китае – Vanilla Planting. Китайская академия тропических сельскохозяйственных наук (Южно-Китайская академия тропических культур до 1994 года) также была в первых рядах тех, кто сосредоточился на исследованиях ванили. Её команда ученых является основной силой в области исследований ванили в провинции Хайнань. Эта исследовательская работа напрямую способствует и поддерживает промышленное развитие ванили в этой провинции. В то же время она предоставляет ссылки на научные исследования и промышленное развитие ванили в провинции Юньнань. Опубликовано более 30 научных работ, а также организованы и отредактированы национальные сельскохозяйственные стандарты для ванили. Несколько организаций занимаются исследованиями ванили в провинции Юньнань. В основном это Научно-исследовательский институт вкусовых добавок и ароматизаторов и Колледж защиты растений при Юньнаньском сельскохозяйственном университете, Академия исследований тропических культур в провинции Юньнань, Куньминский научно-исследовательский институт ботаники Китайской академии наук и т. д. Исследовательская группа из Юньнаньского сельскохозяйственного университета проделала большую работу, особенно в области борьбы с вредителями и болезнями ванили, и опубликовала монографию о вредителях и болезнях. Некоторые корпорации, занимающиеся выращиванием и производством ванили, особенно корпорации по производству ванили в провинции Хайнань, провели свои исследования.Текущее состояние
Коммерческие сорта и генетические ресурсы
Vanilla planifolia была завезена и коммерчески выращена в Китае. Некоторые другие интродуцированные и местные дикорастущие виды ванили используются только для научных исследований. Основные коммерческие разновидности и генетические ресурсы: V. planifolia Andr. – завезена из Индонезии (1960 г.) и Шри-Ланки (1962 г.); Vanilla somai Hayata – тайваньская ваниль, распространенная на Тайване в Китае; Vanilla shenzhenica Z.J. Liu and S.C. Chen – найдена в Шэньчжэне, Южный Китай. Она сродни Vanilla somai Hayata (Liu et al., 2007); Vanilla siamensis Rolfe ex Downie – известная как «Большая ваниль», распространена в провинции Гуанси, а также в районах Сишуанбаньна и Хэкоу в провинции Юньнань. Относительная корреляция существует между V. shenzhenica Z.J. Liu & S.C. Chen и V. somai Hayata. Естественная популяция, распространенная в природоохранном районе орхидей Ячанг в округе Лей, городе Байсе на северо-западе провинции Гуанси, является самой большой из известных до сих пор дикорастущей группой этой ванили на самой высокой широте (24°48′56″ северной широты, 106°19′13″ восточной долготы) и самой большой высоте (Chen et al., 2007).Основные районы произрастания и их климатические характеристики
Провинция Хайнань и Сишуанбаньна в провинции Юньнань являются основными регионами Китая и подходят для выращивания и производства ванили. Сишуанбаньна, который включает три округа, Цзинхун, Менгла и Мэнхай, расположен в южной части Юньнани, 21°10′–22°40′ с.ш., 99°55′–101°50′ в.д., высота 475–2429 м. Это место находится на северной окраине восточного и южного-азиатского тропического региона с тропическим и субтропическим климатом, множеством типов климата и сложной местностью. Зона тропического климата в Сишуанбаньна занимает около 400 га, расположенных ниже 800 м над уровнем моря, что составляет лишь 20,4% его площади. Годовое количество осадков от 977 до 1655 мм. Среднегодовая температура в Сишуанбаньна уже много лет составляет 18,3–22,4°C, а средняя температура самого холодного месяца (январь) – 12,0–16,1°C. Остров Хайнань расположен между 18°10′ и 20°10′ северной широты, 108°37′ и 110°03′ восточной долготы. Это область океанического тропического муссонного климата, подходящего для выращивания ванили. Под влиянием местности климат на Хайнане теплый на юге и холодный на севере, сухой на востоке и влажный на западе. Среднегодовая температура воздуха составляет 23–25°C на большей части территории провинции. Средняя температура воздуха в январе 17–21°C. Среднее годовое количество осадков колеблется в разных частях острова Хайнань от 958 до 2148 мм (одно из самых высоких в регионе на той же широте). Распределение осадков неравномерное. Наивысшее – в центре, высокое – на востоке, северо-востоке и севере, низкое – на юго-западе и низшее – на западе. Тайфуны часто обрушиваются на остров Хайнань в период с июня по октябрь, а количество дней с сильным ветром в году составляет 4,7–6,8. В целом, ваниль больше подходит для выращивания на острове Хайнань, чем в провинции Юньнань.Различные системы выращивания
Кирпичные опоры в домах с искусственной тенью
При этом методе опоры для ванили изготавливаются из кирпичей размером 240 мм × 115 мм × 53 мм. Кирпичи кладут группами по три, образуя треугольник, причем каждый слой кирпичей поворачивают на определенный угол относительно предыдущего. Таким образом сооружается пустотелый столб из кирпича: заглубленная часть опоры должна быть 0,5 м, высота над землей – 1,5 м, расстояние между столбами – 2 м. Затем пустое пространство полых столбов засыпают субстратами, а вокруг них сажают саженцы ванили. Этот метод был принят на плантации площадью 1 га в Сишуанбаньна, и со 100 м² растений ванили было собрано 8,25 кг стручков. Метод оказался эффективным для выращивания ванили, но в конце концов лианы запутались, что повлияло на рост, обрезку, опыление и сбор ванили. Поэтому метод был заменен на метод, описанный в следующем разделе.Столбы и струны в домах с искусственной тенью
Для теневого дома высотой 2,5 м используется нейлоновая сетка со степенью затенения 50–70%. Столбы могут быть из цемента (15 см × 15 см × 2 м), дерева, камня или бамбука. Высота над землей для кольев должна быть 1,5 м. Поле разделено на гряды: ширина гребня 1,3 м, расстояние между грядами 0,35 м. Стойки крепятся по середине гребней с промежутком 2 м между каждой стойкой на одном гребне. Столбы на одном гребне соединяются стальными стержнями, железными струнами или другими типами струн. Затем саженцы ванили высаживают в продольном направлении по обеим сторонам каждой стойки. Все теневые дома на плантациях ванили на Хайнане и Сишуанбаньна переняли этот метод, который позволяет полностью использовать землю, а с ванилью легко и удобно обращаться. Недостаток – слишком высокая стоимость.Придомовые посадки
Этот метод можно объединить с экономической системой семейного двора и полностью использовать разбросанные земли в Сишуанбаньна. Кроме того, разные семьи могут применять разные методы посадки. Одни семьи строят простые теневые дома с кольями, другие добавляют высокие травы или листья масличных пальм на крышу теневых домов; третьи сажают ваниль прямо под деревьями, будь то манго (Mangifera indica), личи (Litchi chinensis), Baccaurea ramiflora или помело (Citrus maxima). Некоторые даже высаживают ваниль в посадках гевеи (Hevea brasiliensis), а другие – во вторичном лесу. Методы посадки во дворе требуют меньших затрат и легко осуществляются с достаточной поддержкой органическими веществами и хорошей вентиляцией. Особого внимания требует только притенение и обрезка. Площадь использования такого метода посадки достигала в Сишуанбаньна 16 га. Сейчас только несколько семей все еще сажают таким способом.Способы выращивания ванили
Производители ванили в регионах Юньнань и Хайнань применяют почти одинаковые технологии для производства ванили (Zhou, 2000). Наиболее распространенная система выращивания ванили в коммерческих целях – это интенсивная система выращивания в условиях дома с искусственным затенением. Чтобы адаптироваться к этой системе выращивания и конкретному климату в разных регионах, был разработан целый набор зрелых методов выращивания. Благодаря обмену опытом и Хайнань и Юньнань разработали аналогичные технологии выращивания. Тем не менее, некоторые различия в навыках и практическом применении методов между разными компаниями все еще существуют. В соответствии с фактическим производством ванили в условиях дома с искусственной тенью в регионах Юньнань и Хайнань, ниже приводится краткое введение в методы выращивания и обработки ванили.Размножение
Обычно ваниль размножают стеблевыми черенками или тканевой культурой. Для размножения нужно брать черенки со здоровых, крепких растений, которые еще не зацвели. Черенки обычно имеют длину 40–60 см с 4–5 узлами или 20–30 см с как минимум двумя узлами, причем длина зависит от количества имеющихся лиан. Если черенков недостаточно, ваниль можно быстро и обильно размножить путем культивирования тканей, используя в качестве эксплантатов кончики побегов и узловые сегменты. После необходимого закаливания и акклиматизации рассаду можно пересаживать в почву. Во избежание запутывания саженцев и для удобного ухода за ними саженцы следует привязать к бамбуковым палкам длиной около 50 см.Создание и посадка плантаций
Конструкция ванильной плантации на большой территории с интенсивной системой выращивания включает в себя не только создание самой плантации, но и её вспомогательной инфраструктуры, такой как ирригационные системы, жилые помещения для рабочих и т. д., которые следует рассматривать всесторонне и тщательно, планировать и распределять в соответствии с реальными ситуациями. Для оптимального роста ванили в регионе Сишуанбаньна жизненно важно разработать системы орошения и поливать растения ванили в засушливый сезон, особенно с марта по май. Работы по созданию ванильной плантации в основном включают выемку грунта на посадочные полосы (грядки) и разделение их на блоки или зоны, установку искусственных теневых сеток, опор для ванили, трубопроводов ирригационной системы и т. д. Для удобства работы, процессы следует проводить по очереди. Участку посадки ванили требуется определенный уклон, который не должен превышать 15°. Землю для посадки следует выкапывать посадочными полосами на одинаковом расстоянии друг от друга, чтобы предотвратить эрозию почвы и улучшить её плодородие и водоснабжение, а ширина каждой посадочной полосы должна составлять 1–1,5 м. Такие материалы, как стальные уголки, цементные или деревянные колонны, которые соединяются железной проволокой или стальными стержнями, обычно используются в качестве опор для искусственной теневой сетки с затенением 60–80%. Вдоль посадочной полосы с интервалом 1,8–2 м следует установить цементные или деревянные столбы, закрепить их на удобной высоте и соединить железной проволокой или другими материалами в ряд, чтобы растения ванили могли взбираться вверх по шпалере. Рекомендуемая высота шпалеры составляет около 1,5 м над землей, а высота теневой сетки – не менее 2,5 м. После того, как плантация создана, для посадки можно использовать укоренившиеся саженцы из проростков тканевых культур или черенков, выращенных на грядках. Высаживать длинные черенки можно в оптимальное время года, когда имеется много посадочного материала ванили. Рядом с каждым столбом шпалеры обычно высаживают по два черенка. В соответствии с доступностью черенков, плотность посадки может достигать 4000–9000 растений на гектар. Для сравнения, при одинаковом расстоянии между рядами, если вдоль каждой посадочной полосы высаживается больше черенков, это поможет достичь и поддержать большую вегетативную биомассу растений ванили на начальных этапах. Оптимальное время для посадки – непосредственно перед сезоном дождей, в регионе Сишуанбаньна в начале июня, хотя саженцы ванили можно высаживать в другие месяцы. Саженцы следует высаживать на 5–10 см ниже поверхности почвы, при этом их корешки должны располагаться и распределяться в центре посадочных поясов или рядом с ним, вытягиваясь по горизонтали.Забота и уход
С самого начала посадки растения ванили – особенно взрослые цветущие растения – нуждаются в тщательной заботе и кропотливом уходе. Только так можно получить высокий урожай и устойчивое производство. Регулярный уход за плантацией ванили состоит из прополки, удобрений, мульчирования, полива, обрезки и распределения ванили, а также защиты растений. Фермер обычно может взять на себя обработку 0,4–0,7 га интенсивных плантаций ванили. Разумеется, для искусственного опыления требуется больше рабочих в зависимости от количества цветов в период цветения.Искусственное опыление
Из-за необычной структуры цветка, отделения тычинок от рыльца ростеллумом, опыление должно производиться искусственно с помощью бамбуковой палочки. Есть два метода искусственного опыления. Первый – протолкнуть ростеллум под тычинки, а затем прижать пыльцевый мешок к рыльцу. Второй – непосредственно удалить ростеллум, а затем прижать пыльцевую массу, чтобы она приклеилась к рыльцу. «Метод проталкивания» обычно используется в регионе Хайнань, а «метод удаления» – в районе Сишуанбаньна в Юньнани. Искусственное опыление не должно приводить к повреждению рыльца или потере массы пыльцы как для «метода проталкивания», так и для «метода удаления».Обеспечение питательными веществами и удобрение
Ваниль, как растение с поверхностными корнями, для получения доступных питательных веществ во многом зависит от мульчирования. Мульча и разложившиеся органические материалы являются основным источником питательных веществ для растений ванили, помогают удерживать достаточное количество влаги и формировать рыхлую структуру почвенных агрегатов для распространения корней. Разумное внесение удобрений жизненно важно для получения раннего, высокого и устойчивого урожая. В зависимости от имеющихся материалов для мульчирования и подкормки растений удобрение обычно сочетается с мульчированием. Основными способами подачи питательных веществ и удобрений являются – внесение органических удобрений в сочетании с химическими удобрениями, внекорневое опрыскивание химическими удобрениями, внесение микроэлементов и т. д. Мульча, используемая и доступная в основных регионах Китая, включает слой гумуса из тропического леса, скорлупу кокосовых орехов, древесную щепу, жмых сахарного тростника и рисовую солому. Некоторые предприятия исследовали и разработали специализированные ванильные удобрения. Мульчирование следует проводить в сочетании с обрезкой посадочных полос в конце сезона дождей и завершать до начала холодного сезона.Обрезка и направление растений ванили
Обрезка и направление ванильных лиан – одни из основных агрономических мер, необходимых для регулирования вегетативного и репродуктивного роста, уменьшения числа случаев заболевания ванили, обеспечения воспроизводства черенков и так далее. В зависимости от различных целей обрезки основные части, подлежащие обрезке, могут включать инфицированную часть растения или слабые и цветущие лианы. Зараженные болезнью листья, стебли и плоды следует удалять как можно раньше, чтобы предотвратить распространение болезни. Стареющие лианы необходимо периодически обрезать, чтобы стимулировать появление побегов и стимулировать вегетативный рост. Кончики тонких лиан и молодых растений, достигающих высоты более 50 см, следует отрезать. С помощью этого метода выйдет более одного ответвления, и ветки станут более прочными. Тем не менее, следует удалить избыток ветвей или заблокировать их обрезкой, особенно в период цветения и развития стручков. Ветви, которые цветут и приносят плоды, но не имеют живых пазушных почек, можно обрезать, так как они не будут давать цветов. Специальная обрезка свисающих веток на взрослых растениях обычно проводится за 3–4 месяца до сезона цветения (в Китае примерно с ноября по декабрь), чтобы стимулировать образование соцветий в пазухах листьев на свисающих ветвях. Когда после опыления будет достигнуто желаемое количество плодов на соцветие, оставшиеся бутоны и верхушка соцветия должны быть удалены. Какими бы важными ни были меры по обрезке, направление ванильной лианы также полезно для облегчения равномерного распределения ванильной лианы на шпалере для поддержания устойчивой биомассы и урожая. Как правило, лианы первых посаженных саженцев, прикрепленные к столбу поддерживающему шпалеру или к бамбуковой палке рядом с ними, всегда растут вверх. Когда лиана или ветвь поднимется и достигнет вершины шпалеры, её следует вернуть на землю, а часть лианы с 4–5 узлами засыпать поверхностной почвой или мульчей, что побудит лиану пустить под землей корни и поддержать все растение, чтобы оно хорошо росло. Таким образом, лианы направляются вверх и вниз и равномерно распределяются по шпалере, а не накапливаются на её верхней половине. Ванильные лианы можно направлять вдоль шпалеры внутри одного ряда. Постепенно, растения ванили развиваются в ряду вдоль посадочной полосы, достигая высоты шпалеры.Прополка
Сорняки на плантациях мало вредят растениям ванили. Цель прополки – просто предотвратить конкуренцию за питательные вещества с растениями ванили. На недавно созданных плантациях растет множество различных видов сорняков, особенно в сезон дождей. Сорняки следует выпалывать перед цветением и плодоношением, их можно использовать в качестве мульчи и органических удобрений после ферментации. При ручной прополке количество и виды сорняков будут постепенно сокращаться до более низкого уровня к третьему году.Другое обслуживание
В Сишуанбаньна и некоторых регионах провинции Хайнань ежегодное чередование засушливых и дождливых сезонов приводит к уплотнению почвы, плохому росту корней и возникновению болезней. В зависимости от влажности почвы и воздуха, в сочетании с мульчированием, для хорошего роста растений ванили необходимо адекватное орошение в засушливый сезон. Отсутствие орошения приведет к гибели воздушных корней и даже к гибели растений, страдающих от недостатка воды. В течение продолжительных засушливых периодов рекомендуется поливать растения путем частого опрыскивания небольшими объемами и избегать переувлажнения, особенно в сезон дождей. Тайфуны в регионе Хайнань с июня по октябрь и особенно с августа по октябрь и муссоны в районеСишуанбаньна с февраля по июнь иногда наносят ущерб плантациям ванили. Поэтому необходимо укреплять и поддерживать плантации, чтобы предотвратить повреждение тайфунами или муссонами. Кроме того, необходимо подсадка там, где растения погибли или были уничтожены домашним скотом, птицей и т. п. Необходимо принять меры, чтобы не подпускать их к насаждениям, расположенным рядом с жилищами.Болезни, вредители ванили и борьба с ними
Болезни В различных регионах выращивания ванили в Китае заболевания, особенно корневые гнили, вызываемые Fusarium oxysporum f. sp. vanillae (Tucker) Gordon были ограничивающим фактором для производства ванили. На практике комплексные меры борьбы ставят на первое место профилактику в сочетании с лечением. Меры, рекомендуемые для предотвращения и противодействия заболеваниям ванили, следующие:• Избегайте выбора низколежащих и глинистых почв для выращивания ванили, а выбирайте пологие земли, хорошо дренированные с толстым поверхностным слоем перегноя. • Используйте для посадки здоровые саженцы. • Создайте благоприятную среду для растений ванили, особенно улучшив почвенные условия за счет органического мульчирования в ризосфере. • Не наступайте на посадочные полосы во время опыления или других операций. • Регулярно удаляйте пораженные болезнью части и в экстренных случаях применяйте необходимые медикаменты. • Разделите плантацию на разные участки, чтобы предотвратить распространение болезни после её возникновения. • Применяйте комплексные меры, такие как обрезка и направление растений, регулирование тени, дренаж воды, контроль количества цветков для опыления и т. д., чтобы омолодить растения ванили и повысить их устойчивость к стрессам и патогенам. Применяя вышеуказанные меры, можно снизить количество заболеваний до экономически приемлемого уровня и гарантировать долгосрочное производство.
Вредители Насекомые-вредители по сравнению с болезнями меньше повреждают растения ванили и их легче предотвратить. Среди прочих вредителей, кокцидии должны удаляться немедленно, как только они появятся на плантации, поскольку их крупномасштабное распространение способно уничтожить плантацию ванили. Их трудно убить, так как они покрыты и защищены восковым слоем. Кроме того, определенный ущерб нежным частям растений ванили могут нанести наземные моллюски – улитки и слизни. Размер их популяции можно эффективно контролировать с помощью аттрактантов для отлова и массового убийства вручную.
Сбор урожая После посадки ваниль обычно начинает цвести на третий год. Растения ванили, произрастающие в Китае, цветут один раз в год, достигая пика цветения в апреле. Урожай собирают в период с ноября по январь следующего года. Подходящее время для сбора урожая, в зависимости от степени зрелости стручков, когда стручки приобретают бледно-желтый цвет на своем дистальном конце. Ранний или поздний сбор отрицательно скажется на качестве обработанных стручков.
Обработка, использование и маркетинг
Обработка Собранные зеленые стручки не имеют ни аромата, ни вкуса – они будут развиваться после обработки. Тщательная обработка ванили займет 4–5 месяцев в зависимости от климатических условий. Различные компании в Китае разработали разные методы и способы обработки ванильных стручков. Хотя в разных компаниях используются разные методы, все они довольно похожи. Ниже приводится метод, использованный в бывшей компании Yunnan Vanilla Company, представленный, в качестве примера, как общее описание метода обработки в Китае, который состоит из очистки, умерщвления, ферментации, медленной сушки и кондиционирования, сортировки и упаковки. • Сортировка: В соответствии с длиной, внешним видом и степенью зрелости, зеленые стручки разделяются на четыре типа. • Очистка: с помощью специального механизированного оборудования для мойки под высоким давлением с вибрационным ситом, партии различных типов стручков очищаются и загружаются на сетчатые поддоны из нержавеющей стали. • Умерщвление: Поддоны, заполненные стручками, на несколько минут погружают в емкость с горячей водой под автоматическим контролем температуры. Температура и продолжительность стадии «умерщвления» зависят от размера различных типов стручков. • Ферментация и быстрая сушка: После умерщвления стручки переносятся в отсек сушильной камеры, в котором контролируются определенные условия температуры и влажности. Во время этой операции стручки теряют немного воды, становятся коричневатыми и эластичными с ощутимым ароматом. Это так называемое «пропаривание» традиционного метода, а не настоящая микробиологическая ферментация. • Медленная сушка и кондиционирование: Эта процедура проводится в чистой комнате при температуре окружающей среды. Это процесс, позволяющий продолжить развитие аромата и потемнение, при этом стручки постепенно теряют больше воды. Для предотвращения микробиологического заражения стручков на этом этапе используется ультрафиолетовая стерилизация. • Сортировка и упаковка: По принципу сортировки зеленых стручков, вяленые стручки сортируются по сортам в зависимости от их длины, внешнего вида, содержания ванилина и воды. На содержание ванилина или воды в основном влияет выдержка, поэтому длина вяленых стручков составляет реальную разницу между сортами. Готовые стручки разных сортов фасуются и маркируются, а затем хранятся на специальном складе для продажи или доставки. Производственная мощность полуавтоматической линии в бывшей компании Yunnan Vanilla Company составляла не менее 300 тонн зеленых стручков ванили в год. Она был построена в 1997 году и, к сожалению, разобрана, когда компания Yunnan Vanilla Company обанкротилась в 2007 году. На Хайнане несколько компаний владеют линиями по обработке ванили или оборудованием различной мощности, и они обычно обрабатывают как собственные зеленые стручки, так купленные у местных фермеров.Использование и маркетинг Ваниль в Китае выращивают компании и фермерские хозяйства. Обычно, зеленую ваниль обрабатывают несколько компаний, которые владеют оборудованием или производственной линией для обработки ванили. Эти компании продают готовые стручки непосредственным потребителям или торгуют продуктами из ванили собственной переработки. Поэтому некоторые компании не только производители ванили, но и основные потребители вяленых стручков. Ванильные стручки и их производные в основном используются в табачной и пищевой промышленности, например, в кофе, вине, соусах, выпечке и кондитерских изделиях, особенно к чаю. Кроме того, ванильные стручки непосредственно применяются в кулинарии, хотя в Китае мало людей, которые пользуются ванилью при приготовлении пищи, поскольку не знакомы с точной рецептурой и не привыкли употреблять её для китайских блюд. С развитием информационных технологий и повышением уровня жизни, все больше и больше простых людей знакомятся с ванилью и начинают учиться применять её для приготовления еды или других целей. В живописных местах региона выращивания ванили, много ванильных стручков напрямую продаётся туристам, как местные сувениры. Из-за растущего внутреннего спроса и ограниченного производства, ванильные стручки, произведенные в Китае, редко экспортируются. В прошлом только несколько партий вяленых стручков, произведенных в Юньнани, были экспортированы бывшей Yunnan Vanilla Industry Ltd в Японию и другие страны. В последние годы китайское производство всего лишь покрывает внутренний спрос на ванильные стручки.
Перспективы
Быстрое развитие ванильной индустрии в последние годы столкнулось с трудностями и проблемами во многих отношениях. Однако, промышленное развитие ванили в Китае имеет большой потенциал и множество преимуществ. За последние 49 лет исследований и разработок и за более чем 10 лет индустриализации ванили, Китай развил и сформировал рынок ванили и связанных с ней продуктов, а также разработал целый набор зрелых методов выращивания и обработки. В последние годы индустрия ванили начала демонстрировать новую тенденцию и сохранила устойчивый и здоровый рост. При поддержке ванильных компаний и местного правительства, все большее число фермеров начинают сажать ваниль в провинции Хайнань. Мы полностью уверены в перспективах развития ванили в Китае. У ванильной индустрии широкие горизонты и блестящие перспективы развития.Национальные сельскохозяйственные стандарты для ванили в Китае
Для содействия развитию ванильной промышленности, Министерство сельского хозяйства Китая в 1999 году выпустило нижеперечисленные сельскохозяйственные стандарты на ваниль. Они были разработаны Китайской академией тропических сельскохозяйственных наук. NY-T 362-1999 Саженцы ванили NY-T 483-2002 Ваниль NY-T 713-2003 Определение ванилина в стручках ванили NY-T 968-2006 Технические правила выращивания ванилиГлава 24. Производство ванили во Французской Полинезии
Выращивание и производители
Ваниль выращивают во Французской Полинезии с девятнадцатого века. Таитянская ваниль, настоящее черное золото Французской Полинезии, выращивают из-за её знаменитых стручков, которые обладают интенсивным ароматом с анисовыми нотами (см. главу 13). Плантации в основном расположены на архипелаге островов Общества (рис. 24.1). Площадь, предназначенная для выращивания ванили, составляет 306 га (SDR, 1995). Остров Тахаа еще называют «Ванильным островом». Площадь острова – 88 км², и в 2002 году на нем проживало 573 производителя ванили. На соседних островах, Райатеа и Хуахине, производителей ванили соответственно 206 и 300 (перепись SRD, 2002). Ваниль также широко распространена по всей Французской Полинезии. От Таити и родственного ему острова Муреа (10,3 га ванили) до Маркизских островов (2,4 га) жители Таити тщательно выращивают свою бесценную таитянскую ваниль. Ваниль культивируется двумя способами: первый известен как «традиционный способ», а второй – «техника теневого дома». РИСУНОК 24.1. Карта Французской Полинезии. Острова Общества (Iles de la Société), где производство ванили является наиболее важным, обведены черным кружком.
РИСУНОК 24.1. Карта Французской Полинезии. Острова Общества (Iles de la Société), где производство ванили является наиболее важным, обведены черным кружком.
Традиционный способ выращивания
В течение нескольких поколений использовался традиционный способ выращивания, при котором ванильная лиана высаживается у основания дерева. Дерево обеспечивает опору и тень для вьющейся орхидеи. Плантации ванили обычно расположены на склонах холмов в вырубленном лесу, выбранном из-за высокого содержания в нем органических веществ (Wong, 1999). Плантация наклонная, под лесными деревьями, чтобы использовать гумус, производимый деревьями сверху. Если земля ровная, почву необходимо осушить – вырыть дренажные канавы, чтобы убрать излишки воды. Выбор опекуна важен, так как он должен защищать ваниль от палящего солнца или ветра, а не конкурировать за воду и компост. Двумя любимыми опекунами являются «пити» (Gliricidia maculata) и «пиньон д’инд» (Jatropha curcas) (рис. 24.2a и c). Глирицидия – бобовое растение, не конкурирующее с ванилью за снабжение азотом. Быстро разрастается и требует частой обрезки. Ятрофа для ограничения своего роста обрезки требует меньше, поскольку её листья естественным образом опадают в сухой сезон, когда у ванили происходит цветение. Поэтому, она в обрезке не нуждается. Также используются другие естественные опоры – «пурау» (Hibiscus tiliaceus), «ауте» (Hibiscus rosa-sinensis) или «ноно» (Morinda citrifolia) (рис. 24.2b, d и e). РИСУНОК 24.2. Различные растения, используемые в качестве опор на традиционных плантациях ванили (a) «пити» (Gliricidia maculata), (b) «пурау» (Hibiscus tiliaceus), (c) «пиньон д’инд» (Jatropha curcas), (d) «ауте» (Hibiscus rosa-sinensis) и (e) «ноно» (Morinda citrifolia).
РИСУНОК 24.2. Различные растения, используемые в качестве опор на традиционных плантациях ванили (a) «пити» (Gliricidia maculata), (b) «пурау» (Hibiscus tiliaceus), (c) «пиньон д’инд» (Jatropha curcas), (d) «ауте» (Hibiscus rosa-sinensis) и (e) «ноно» (Morinda citrifolia).
В настоящее время чаще всего используется традиционный способ выращивания. В этой системе ваниль фактически ассоциируется с другими видами, такими как пищевые культуры или фрукты. В 1995 году средний размер традиционной плантации ванили составлял около 3000 м², а средний возраст производителей был старше 50 лет. Этот традиционный способ выращивания создает много ограничений для фермера. Участки вообще очень неряшливые и далеко от дома. Необходимо регулярно обрезать ветви опекуна для поддержания постоянной тени, не слишком интенсивной и не слишком слабой, чтобы сохранить развитие и цветение растений ванили. Наконец, растения ванили могут конкурировать с деревом опоры за воду и питательные вещества. Это будет препятствовать развитию плантаций ванили.
Культура в доме под тенью
В последние годы плантации ванили размещаются в теневых домах, чтобы увеличить её производство. Тень обеспечивается защищающим от насекомых полотном, что позволяет избежать передачи вируса через насекомых-переносчиков (рис. 24.3). Опора обычно делается из бетона и поэтому не конкурирует с ванильным растением за компост, внесение которого можно легко контролировать. Урожайность с гектара сильно увеличивается, а ежедневная работа менее интенсивна. Подобно традиционным плантациям, необходимо учитывать географическое расположение теневых домов. Важную роль в них играет вентиляция. Желательно строить теневой дом на берегу, на укрытой от непогоды стороне острова. Это облегчает вентиляцию и снижает риск грибковых заболеваний. Почва должна быть хорошо дренированной и иметь небольшой уклон. РИСУНОК 24.3. (а) Растения ванили в теневом доме через два года после посадки; (б) цветущие растения ванили в теневом доме, второй год плодоношения.
РИСУНОК 24.3. (а) Растения ванили в теневом доме через два года после посадки; (б) цветущие растения ванили в теневом доме, второй год плодоношения.
Этот новый метод выращивания более продуктивен и облегчает задачу фермеров. Однако, техника возделывания, традиционная или в теневом доме, мало влияет на ароматический состав ванильных стручков. Здоровые ванильные лианы дадут высококачественные стручки независимо от того, какой метод культивации использовался.
Производство и сельскохозяйственное значение
Производство
Французская Полинезия когда-то была одним из крупнейших производителей ванили. С 1900 по 1960 год производилось более 100 тонн спелых стручков ванили в год (рис. 24.4). Производство упало в 1960-х годах после открытия Центра ядерных экспериментов в Тихом океане, который привлек многих полинезийцев (Petard, 1986). С 1990-х годов производство ванили возобновляется и составляет в среднем 35 тонн сырой ванили в год. Однако, производство по-прежнему сильно зависит от погодных условий. Циклон 1998 года привел к падению производства в 1999 году до 16 тонн. Высокие температуры в 2005 году также оказали негативное влияние на производство в 2006. Чтобы увеличить производство ванили во Французской Полинезии, были приняты правительственные программы для улучшения её выращивания. РИСУНОК 24.4. Эволюция экспорта ванили с 1905 года и подробные сведения о производстве свежей и экспорте вяленой ванили за последние 18 лет.
РИСУНОК 24.4. Эволюция экспорта ванили с 1905 года и подробные сведения о производстве свежей и экспорте вяленой ванили за последние 18 лет.
Etablissement Vanille de Tahiti
Служба развития сельских районов – государственная служба, отвечающая за сельскохозяйственное производство и животноводство во Французской Полинезии, первоначально отвечавшая за «ванильную программу», разработала систему выращивания в теневом доме и методы компостирования. Чтобы популяризировать эти инновации, правительство Полинезии в 2003 году учредило Etablissement Vanille de Tahiti (EVT, рис. 24.5). Этому государственному предприятию с коммерческими интересами было поручено рестимулировать производство ванили во Французской Полинезии, на архипелаге Подветренных островов, где сохранился «традиционный способ». Кроме того, культура ванили «под тенью дома» была развита на других островах Французской Полинезии. РМСУНОК 24.5. Логотип Etablissement Vanille de Tahiti.
РМСУНОК 24.5. Логотип Etablissement Vanille de Tahiti.
Эта программа в первую очередь посвящена управлению человеческими ресурсами. Цель состоит в том, чтобы увеличить доходы фермеров и сохранить их производство. EVT помогает растениеводам, продавая и устанавливая теневые дома, поставляя сертифицированные саженцы ванили, не содержащие вирусов. Оно обеспечивает обучение и предоставляет фермерам техническую поддержку по выращиванию и санитарному контролю.
Санитарный контроль Черенки, продаваемые фермерам при установке теневых домов, сертифицированы как не содержащие вирусов. Санитарная сертификация этих лиан заключается в повторном контроле источников срезки в питомниках EVT с использованием ELISA для обнаружения трех типов вирусов (потивирусов, вируса мозаики огурца и вируса мозаики цимбидиума) (Richard et al., 2009). Черенки собирают только с лиан, на которых вирус не был обнаружен за последние 9 месяцев. При посадке создается карта новой плантации с указанием происхождения каждого черенка (питомник, название источника срезки и местоположение). Через 3–4 месяца после посадки черенков, проводится тест ELISA для обнаружения трех вирусов, чтобы проверить, не произошло ли заражение во время посадки.
Отдел исследований и разработок В качестве приоритета лаборатория EVT провела исследование по оценке традиционных ванильных лианы по их урожайности, ароматическому и липидному составу и их геному (см. главу 13); в порядке отбора лучших сорта, чтобы затем создать новые сорта, которые будут предлагаться фермерам. Цели также заключались в создании «наименования места происхождения» «Ваниль Таити». Это позволит потребителям и промышленникам лучше понимать качество таитянской ванили. После установки EVT новых плантаций в теневых домах (20 га, в том числе 16 на Подветренных островах и 4 га на Наветренных островах), несмотря на относительный упадок традиционной культуры, производство должно увеличиться в течение следующих нескольких лет, чтобы достичь уровня предполагаемого производства в 60 тонн сырой ванили.
Сельскохозяйственное значение
Сельскохозяйственное значение ванили во Французской Полинезии, а точнее стоимость продаваемых сырых ванильных стручков, сильно выросла с 2000 года – с 65 миллионов тихоокеанских франков (547 000 евро) в 2000 году до 116 миллионов в 2006 году (972 100 евро), что составляет 2% от общей стоимости полинезийской сельскохозяйственной продукции. После пика в 2004 году средняя цена килограмма сырых стручков ванили снизилась до первоначально наблюдавшегося уровня в 4000–5000 FcfP (33–42 евро/43–54 доллара США). Экспортные цены на обработанную ваниль колеблются на уровне 22 000 FcfP (184 евро/236 долларов США) (рис. 24.6). Эта цена намного выше, чем у других сортов ванили, в том числе ванили бурбон. Это связано с ароматическими качествами таитянской ванили, которая очень богата вкусом и, потому, стала продуктом высшего качества, в частности, в кондитерских изделиях и в кейтеринге. РИСУНОК 24.6. Динамика средней цены килограмма сырой ванили и экспортируемых ванильных стручков.
РИСУНОК 24.6. Динамика средней цены килограмма сырой ванили и экспортируемых ванильных стручков.
Нормы и контроль качества таитянской ванили
Сбор стручков на стадии зрелости необходим для получения вяленых стручков отличного качества и длительного хранения. Уже несколько лет действуют правила гарантирующие качество ванили профессионалам и покупателям ванильного сектора. Полинезийские правила точно определяют сбор и продажу спелой ванили (решение № 77-119 от 10.11.1977 о регулировании сбора, обработки, упаковки и экспорта ванили, произведенной во Французской Полинезии; указ № 1198 CM от 11.03.1992 о производстве и сбыте ванили, произведенной во Французской Полинезии). Начало и конец сезона сбора урожая определены так, чтобы урожай собирался только тогда, когда ванильные стручки достигли наилучшей стадии зрелости. В сезон сбора урожая организуется несколько публичных продаж. Эти продажи ванили проводятся под контролем «комитета по проверке спелой ванили», назначенного в каждом районе, производящем ваниль. Эти «комитеты по инспекции спелой ванили» контролируют степень созревания стручков, их соответствующий размер (более 14 см), проверяют отсутствие расщеплений и дефектов (рис. 24.7). Если некоторые стручки не соответствуют правилам, они будут удалены из партии и уничтожены. Производитель получает сертификат, который дает ему право продать свою ваниль обработчику или обработать её самостоятельно. РИСУНОК 24.7. Контроль за ванильными стручками при продаже ванили.
РИСУНОК 24.7. Контроль за ванильными стручками при продаже ванили.
Обработка ванили также регулируется (постановление № 1424 C от 28 декабря 1949 г.). Этот регламент гласит, что стручки должны обрабатываться строго естественным путем. Более того, обработка ванили запрещена для лиц не имеющих патента (решение № 91-120AT от 25 октября 1991 г. о создании комиссий по контролю ванили и регулировании доступа к обработке и экспертизе ванили). Патент на обработку выдается Министерством сельского хозяйства Полинезии. Он зависит от технических способностей кандидата, его теоретических знаний в области культуры и обработки ванили, а также действующих правил. На сегодняшний день существует всего 10 эффективных обработчиков стручков ванили. В зависимости от длины стручков, их внешнего вида и качества различают три категории готовой ванили. 1. Категория «Экстра» относится к ванили самого высокого качества – здоровой, цельной, нерасщепленной, эластичной и мясистой – однородного темно-коричневого цвета, маслянистой и блестящей, с прекрасным и совершенным ванильным запахом. Стручки размером не менее 16 см не должны иметь дефектов или порезов. Допускаются только несколько шрамов на ванили. 2. «Первая» категория относится к ванили хорошего товарного качества – здоровой, полной, нерасщепленной, эластичной и мясистой – однородного темно-коричневого цвета, маслянистой и блестящей, с прекрасным и совершенным запахом. Стручки размером менее 16 см и не должны иметь дефектов или порезов. Допускаются только несколько шрамов. 3. Есть еще так называемая ваниль второй категории. Эти стручки могут иметь разную длину и дефекты на поверхности. Последний контроль качества стручков ванили, предназначенных для экспорта, проводят «территориальные ванильные эксперты» (протокол № 91-120АТ от 25 октября 1991 г.). Этих экспертов назначают на два года после экзамена, проверяющего их общие знания о ванили, в частности об обработке и правилах, касающихся ванили. Они приводятся к присяге судебными органами, подразумевающей меры по борьбе с мошенничеством. «Ванильные эксперты» также входят в состав жюри, которое выдает патенты на обработку. Таким образом, все этапы – от сбора урожая до обработки и экспорта стручков таитянской ванили – регулируются и контролируются, гарантируя покупателям высококачественную ваниль.
Благодарности
Авторы выражают благодарность Е. Рева, К. Леосе-Мук-Сану за продуктивные обсуждения, Л. Панье и Дж. Сервану за бесценные комментарии к рукописи.Редакторы
Эрик Оду получил высшее образование в области биохимии и с 1988 года трудился во французском Центре сельскохозяйственных исследований для международного развития (CIRAD). Он последовательно работал над переработкой кофе, какао, ароматических растений и тропических фруктов в Камеруне (и других странах Западной Африки) и во Франции, прежде чем занялся научно-исследовательским проектом по обработке ванили на острове Реюньон и Мадагаскаре в 1996 году. Его исследования, в основном, были сфокусированы на изучении развития аромата ванили, связанном с методами обработки. Получил первую докторскую степень в области наук о еде в Университете Монпелье II (Франция) в 2004 году. Его работа привела к исследованиям в сотрудничестве с промышленностью, к консультативным отчетам и научным статьям.Мишель Гризони получил высшее образование в области агрономии и обладает первой докторской степенью в области патологии растений, полученной в Монпелье СупАгро, Франция. С 1984 года работал агровирусологом CIRAD в Колумбии, Французской Полинезии и на острове Реюньон. Его исследования были сфокусированы в первую очередь на вирусных заболеваниях ванили, а позже перешли к изучению свойств, сохранению и использованию генетических ресурсов, в частности, для повышения устойчивости растений ванили к болезням. В настоящее время он отвечает за программу генетики ванили и сертификационных исследований CIRAD и является куратором коллекции ванили в Центре биологических ресурсов (Vatel) на острове Реюньон. Он автор или соавтор множества научных статей, консультативных отчетов и сообщений на конференциях, связанных с ванилью.
Авторы
Глава 1 – Кеннет М. Кэмерон Глава 2 – Северин Бори, Спенсер Браун, Мари-Франс Дюваль и Паскаль Бессе Глава 3 – Мишель Ру-Кувелье и Мишель Гризони Глава 4 – Марк Пигналь Глава 5 – Мину Дивакаран, К. Нирмал Бабу и Мишель Гризони Глава 6 – Хуан Эрнандес Эрнандес и Песах Любинский Глава 7 – Мишель Гризони, Майкл Пирсон и Карин Фаррейрол Глава 8 – Месак Томбе и Эдвард К. Я. Лью Глава 9 – Серж Киличи, Агата Ришар и Кенни Ле Ру Глава 10 – Фабьен Лапейр-Монтес, Женевьева Конехеро, Жан-Люк Вердей и Эрик Оду Глава 11 – Эрик Оду Глава 12 – Эрик Оду Глава 13 – Сандра Леперс-Анджеевски, Кристель Бруншвиг, Франсуа-Ксавье Коллар и Мишель Дрон Глава 14 – Самира Сартер Глава 15 – Йенс-Михаэль Хильмер, Франц-Йозеф Хаммершмидт и Герд Лёзинг Глава 16 – Патриция Райн и Песах Любински Глава 17 – Рауль Лукас Глава 18 – Бертран Комо Глава 19 – Роббер Заубин, Месак Томбе и Эдвард С.Я. Лю Глава 20 – Я.Р. Сарма, Джозеф Томас, Б. Сасикумар, и С. Варадарасан Глава 21 – Клеменс Фер Глава 22 – Хуан Эрнандес Эрнандес и Песах Любински Глава 23 – Хэнцан Чжоу, Юньюэ Ван, Хуню Ван, Сюруй и Дексин Чен Глава 24 – Сандра Леперс-Анджеевски и Мишель ДронК. Нирмал Бабу Отдел улучшения сельскохозяйственных культур и биотехнологий Индийский институт исследования специй Каликут, Керала, Индия Паскаль Бессе Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Университет Реюньона Сен-Дени, Реюньон, Франция Северин Бори Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Университет Реюньона Сен-Пьер, Реюньон, Франция Спенсер Браун Институт растениеводства Национальный исследовательский центр Научный Жиф-сюр-Иветт, Франция Кристель Бруншвиг Департамент исследований и разработок Etablissement Vanille de Tahiti Утуроа, Райатеа, Французская Полинезия а также Лаборатория наземного и морского биоразнообразия Университет Французской Полинезии Таити, Французская Полинезия Хуню Ван Национальный центр сельского хозяйства Исследования и разработки в области биоразнообразия Юньнаньский сельскохозяйственный университет Куньмин, Китай Юньюэ Ван Национальный центр исследований и развития сельскохозяйственного биоразнообразия Юньнаньский сельскохозяйственный университет Куньмин, Китай С. Варадарасан Индийский научно-исследовательский институт кардамона Совет по специям Идукки, Керала, Индия Жан-Люк Вердей Совместное подразделение исследований – Разработки и усовершенствования Центр агрономических исследований по развитию Монпелье, Франция Мишель Гризони Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Центр агрономических исследований развития Сен-Пьер, Реюньон, Франция Миноо Дивакаран Кафедра ботаники Женский колледж Провиденса Каликут, Керала, Индия Мишель Дрон Институт биотехнологии растений Университет Париж-Юг Орсе, Франция Мари-Франс Дюваль Собственное исследовательское подразделение – Вегетативное размножение Центр агрономических исследований развития Монпелье, Франция Роббер Заубин Отделение эко-физиологии Индонезийский научно-исследовательский институт лекарственных и ароматических культур Богор, Индонезия Серж Киличи Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Центр агрономических исследований развития Сен-Пьер, Реюньон, Франция Франсуа-Ксавье Коллар Департамент исследований и разработок Etablissement Vanille de Tahiti Утуроа, Райатеа, Французская Полинезия Бертран Комо Provanille/La Vanilleraie Реюньон, Франция Женевьева Конехеро Объединенное исследовательское подразделение – Биохимия и молекулярная физиология растений Национальный институт агрономических исследований Монпелье, Франция Кеннет М. Кэмерон Кафедра ботаники Университет Висконсина Мэдисон, Висконсин Фабьен Лапейр-Монтес Совместное исследовательское подразделение – Разработка и совершенствование Центр агрономических исследований развития Монпелье, Франция Сандра Леперс-Анджеевски Департамент исследований и разработок Etablissement Vanille de Tahiti Утуроа, Райатеа, Французская Полинезия Кенни ле Ру Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Центр агрономических исследований развития Сен-Пьер, Реюньон, Франция Герд Лёзинг Symrise GmbH & Co Хольцминден, Германия Рауль Лукас Факультет литературы и наук Университет Реюньона Сен-Дени, Реюньон, Франция Эдвард С.Я. Лю Королевский ботанический сад Сиднея Ботанический сад Сидней, Новый Южный Уэльс, Австралия Песах Любинский Кафедра ботаники и растениеводства Калифорнийский университет Риверсайд, Калифорния Эрик Оду Совместное исследовательское подразделение – Qualisud Центр агрономических исследований развития Монпелье, Франция Марк Пигналь Совместная исследовательская группа – Происхождение, структура и эволюция биоразнообразия Национальный музей естественной истории Париж, Франция Майкл Пирсон Школа биологических наук Оклендский университет Окленд, Новая Зеландия Патрисия Рейн Ванильная компания Санта-Крус, Калифорния Агата Ричард Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Центр агрономических исследований развития Сен-Пьер, Реюньон, Франция Мишель Ру-Кувелье Совместное исследовательское подразделение – Борьба с вредителями растений в тропической среде Центр агрономических исследований развития Сен-Пьер, Реюньон, Франция Я.Р. Сарма Индийский институт исследования специй Каликут, Керала, Индия Самира Сартер Совместное исследовательское подразделение – Qualisud Центр агрономических исследований развития Антананариву, Мадагаскар Б. Сасикумар Индийский институт исследования специй Каликут, Керала, Индия Джозеф Томас Индийский научно-исследовательский институт кардамона Совет по специям Идукки, Керала, Индия Месак Томбе Отделение энтомологии и фитопатологии Индонезийский научно-исследовательский институт лекарственных и ароматических культур Богор, Индонезия Сюруй Научно-исследовательский институт вкусов и ароматов Юньнаньский сельскохозяйственный университет Куньмин, Китай Карин Фаррейрол Школа биологических наук Оклендский университет Окленд, Новая Зеландия Клеменс Фер Gourmet Gardens Ltd. Кампала, Уганда Франц-Йозеф Хаммершмидт Symrise GmbH & Co Хольцминден, Германия Йенс-Майкл Хилмер Symrise GmbH & Co Хольцминден, Германия Дексин Чен Hainan Bright Fragrance Co.Ltd. Хайкоу, Китай Хэнцан Чжоу Научно-исследовательский институт ароматизаторов и ароматизаторов Юньнаньский сельскохозяйственный университет Куньмин, Китай Хуан Эрнандес Эрнандес Национальный институт лесоводства, сельского хозяйства и животноводства Мартинес де ла Торре, Веракрус, Мексика
Последние комментарии
7 минут 24 секунд назад
4 часов 15 минут назад
4 часов 32 минут назад
4 часов 53 минут назад
7 часов 34 минут назад
14 часов 58 минут назад