Биологическая химия [Михаил Викторович Ермолаев] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
М. В. Ермолаев Биологическая химия
Введение
Биологическая химия является наукой, которая изучает химический состав органов и тканей животных и растений и химические процессы, лежащие в основе их жизнедеятельности. Биохимия изучает жизнь во всех ее проявлениях — от прорастания зерна до высшей нервной деятельности. Биохимия сравнительно недавно, около 100 лет назад, оформилась в самостоятельную науку. Она возникла в пограничной области биологии и химии. Однако за этот короткий срок и особенно в последние 20-30 лет биохимия стремительно развивалась. Именно этим объясняется тот факт, что научные исследования в области биологии, физиологии, микробиологии, клинических дисциплин и даже в некоторых областях промышленности в значительной степени развиваются благодаря использованию биохимических методов. Рис. 1. Фотоэлектроколориметр (ФЭК-М). 1 — держатели кювет; 2, 3 — узел нейтральных клиньев; 4 — щелевая диафрагма; 5 — шкала; 6 — переключатель светофильтров; 7 — переключатель чувствительности; 8 — гальванометр
Задачи, стоящие перед биохимией, можно разрешить лишь путем объединения результатов биохимии с данными биофизики, морфологии, генетики и Многих других биологических дисциплин. В последние годы развитие биохимии, в большей степени определяется достижениями физики, математики, кибернетики, механики и т. д., ибо изучение состава и структуры вещества биологического профиля невозможно без использования сложных и точных приборов и различных аппаратов. Сейчас в клинических лабораториях широко используются различные электрофотоколориметры (рис. 1), спектрофотометры (рис. 2), флюориметры и другие приборы, а биохимические лаборатории трудно представить себе без аппаратов электрофореза, аминокислотного анализатора, автоматического коллектора отбора фракций (рис. 3), колоночной хроматографии и пр. В качестве примера можно указать на изучение структуры и состава белка. Решение этого вопроса стало возможным только после того, как были разработаны такие методы исследования, как гидролиз, хроматография, электрофорез, использование меченых атомов, рентгеноструктурный анализ. Но применение этих методов потребовало создания аппаратов для хроматографии, выпрямителей для электрофореза, приборов для спектрального анализа, аминокислотных анализаторов, ультрацентрифуг, электронно-вычислительных машин. Необходимым условием для выполнения таких анализов является получение особо очищенных реактивов, синтетических смол с определенными специфическими свойствами, радиоактивных изотопов, особых видов хроматографической бумаги.
Рис. 1. Фотоэлектроколориметр (ФЭК-М). 1 — держатели кювет; 2, 3 — узел нейтральных клиньев; 4 — щелевая диафрагма; 5 — шкала; 6 — переключатель светофильтров; 7 — переключатель чувствительности; 8 — гальванометр
Задачи, стоящие перед биохимией, можно разрешить лишь путем объединения результатов биохимии с данными биофизики, морфологии, генетики и Многих других биологических дисциплин. В последние годы развитие биохимии, в большей степени определяется достижениями физики, математики, кибернетики, механики и т. д., ибо изучение состава и структуры вещества биологического профиля невозможно без использования сложных и точных приборов и различных аппаратов. Сейчас в клинических лабораториях широко используются различные электрофотоколориметры (рис. 1), спектрофотометры (рис. 2), флюориметры и другие приборы, а биохимические лаборатории трудно представить себе без аппаратов электрофореза, аминокислотного анализатора, автоматического коллектора отбора фракций (рис. 3), колоночной хроматографии и пр. В качестве примера можно указать на изучение структуры и состава белка. Решение этого вопроса стало возможным только после того, как были разработаны такие методы исследования, как гидролиз, хроматография, электрофорез, использование меченых атомов, рентгеноструктурный анализ. Но применение этих методов потребовало создания аппаратов для хроматографии, выпрямителей для электрофореза, приборов для спектрального анализа, аминокислотных анализаторов, ультрацентрифуг, электронно-вычислительных машин. Необходимым условием для выполнения таких анализов является получение особо очищенных реактивов, синтетических смол с определенными специфическими свойствами, радиоактивных изотопов, особых видов хроматографической бумаги.
 Рис. 2. Спектрофотометр (СФ-4). 1 — корпус спектрофотометра; 2 — осветитель с источником ультрафиолетового излучения (водородная лампа) или видимого света (лампа накаливания); 3 — стабилизатор; 4 — гальванометр напряжения
Рис. 2. Спектрофотометр (СФ-4). 1 — корпус спектрофотометра; 2 — осветитель с источником ультрафиолетового излучения (водородная лампа) или видимого света (лампа накаливания); 3 — стабилизатор; 4 — гальванометр напряжения
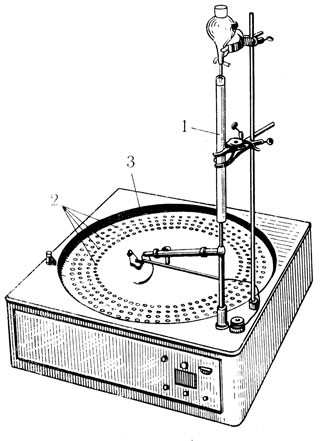 Рис. 3. Автоматический коллектор для сбора фракций. 1 — колонка, на которой происходит разделение. Вытекающие фракции растворов собираются в пробирки (2), установленные в барабане (3), автоматически передвигающемся. Передвижение барабана происходит через определенные промежутки времени (установка 'на время') или же когда в пробирки выливается определенный объем (установка 'на объем')
В свою очередь развитие целого ряда биологических дисциплин основано на достижениях биохимии. Так, физиология и гигиена труда, процессы нервной и мышечной проводимости, проблема памяти, вопросы рационального питания решаются с учетом знаний биохимии этих процессов, так же как и проблемы сельского хозяйства: повышение производительности сельскохозяйственных культур и животноводства. Современная пищевая промышленность в своей основе также базируется на биохимии, которая, детально изучив процессы хлебопечения, виноделия, переработку молока, жиров, консервирования и т. д., помогает увеличить выпуск и улучшить вкусовые качества пищевых продуктов. Есть еще одна область знаний, в которой трудно переоценить значение биохимии,- это медицина. Еще М. В. Ломоносов писал: "Медик без довольных познаний химии совершенен быть не может".
В человеческом организме постоянно протекают тысячи и тысячи различных химических реакций, которые обеспечивают его существование. И задача биохимии состоит в том, чтобы, изучив состав организма и продуктов его обмена веществ, выяснив функции различных органов и тканей, познать " существо процессов жизнедеятельности организма. В основе этих исследований лежит знание взаимодействия разнообразных физических и химических процессов, взаимозависимости между структурой и функцией веществ, регуляторных механизмов, контролирующих деятельность обмена веществ.
Таким образом, биохимия является теоретической основой медицины. Знание биохимических процессов, протекающих в нормальном здоровом организме, позволяет понять и природу различных заболеваний, которые в своей основе представляют разнообразные отклонения протекающих в организме химических реакций — патогенез заболеваний. Не менее существенным является использование данных биохимии в вопросах диагностики и лечения.
Трудно представить врача, который бы ставил диагноз без результатов тщательного биохимического анализа крови, мочи, кала, желудочного содержимого, спинномозговой жидкости и т. д. Определение широкого круга веществ в этих жидкостях позволяет врачу с большей степенью точности, своевременно и правильно поставить диагноз. Изменения концентрации многих веществ при заболеваниях являются специфическими. Например, стойкое по сравнению с нормой увеличение сахара в крови и моче является специфическим для сахарного диабета; снижение в крови γ-глобулинов характеризует понижение сопротивляемости организма к вредным воздействиям; значительное повышение цистина в моче является симптомом цистинурии, наличие в моче больших количеств мочевой кислоты является следствием подагры.
В последние годы в клинике стали широко применять определение активности ферментов как диагностических тестов. Сущность применения этих анализов заключается в том, что в определенных органах и тканях протекают специфичные для данной ткани химические процессы, которые катализируются соответственно определенными ферментами. При заболеваниях этих органов и тканей происходит нарушение структуры клеток и ферменты вымываются в кровь, что проявляется изменением их активности в крови по сравнению с нормой. Так, при инфаркте миокарда в крови увеличена активность одной из аминотрансфераз и лактатдегидрогеназы, при заболеваниях поджелудочной железы повышена активность амилазы, а при рахите — фосфатазы. Особенностью ферментной диагностики является их органная и тканевая специфичность и возможность ранней постановки диагноза, в ряде случаев в первые часы развития заболевания или еще в доклинический период, как, например, при рахите. Сейчас в клиниках начинают внедрять методы определения изоферментов, представляющих собой ферменты, катализирующие одну и ту же реакцию, но различающиеся по своим электрофоретическим и иммунологическим свойствам. Изоферменты характеризуются органной специфичностью. Так, различают 5 изоферментных форм лактатдегидрогеназы, одна из которых, наиболее электрофоретически подвижная, специфична для миокарда, другая, менее подвижная, в основном обнаруживается в печени.
Таким образом, результаты биохимических анализов с учетом данных клинического обследования больного и применением других необходимых исследований дают в руки врача те сведения, которые помогают ему своевременно и правильно поставить диагноз.
Основными средствами лечения заболеваний являются разнообразные химические вещества, влияющие определенным образом на нарушенные биохимические процессы обмена веществ и энергии в организме. Действие лекарственных препаратов включает блокировку или подавление активности различных вредных агентов (микробов или вирусов), снабжение организма недостающими веществами (витаминами, минеральными солями, гормонами и др.), активирование деятельности биохимических процессов вследствие гипофункции органов и тканей и пр. Например, использование сульфаниламидных препаратов при кокковых инфекциях, широкое применение антибиотиков, различных вакцин и сывороток при заболеваниях вирусного или микробного происхождения, введение витаминов для лечения а- и гиповитаминозов, инсулина при сахарном диабете, соляной кислоты и пепсина при пониженной кислотности в желудке и т. п.
Разработка новых высокоэффективных лекарственных веществ основана на знаниях химических процессов в органах и тканях и их соответствующих изменений при определенных заболеваниях. Все вышесказанное достаточно полно характеризует значение биохимии для медицинской науки.
История развития биохимии. История биохимии — это история происхождения жизни на земле. Поэтому именно биохимия явилась ареной ожесточенной борьбы двух противоположных мировоззрений — материализма и идеализма в науке. Именно биохимия неопровержимыми доказательствами очищала биологическую науку от идеалистической шелухи.
И первым, кто заложил основы материалистического взгляда на процессы жизнедеятельности, был великий русский ученый М. В. Ломоносов, открывший закон сохранения материи и энергии. В работах А. Лавуазье этот закон получил свое практическое подтверждение. В последующие годы трудами многих ученых всего мира были сделаны крупнейшие научные открытия, которые способствовали развитию биохимии на основе материализма.
Рис. 3. Автоматический коллектор для сбора фракций. 1 — колонка, на которой происходит разделение. Вытекающие фракции растворов собираются в пробирки (2), установленные в барабане (3), автоматически передвигающемся. Передвижение барабана происходит через определенные промежутки времени (установка 'на время') или же когда в пробирки выливается определенный объем (установка 'на объем')
В свою очередь развитие целого ряда биологических дисциплин основано на достижениях биохимии. Так, физиология и гигиена труда, процессы нервной и мышечной проводимости, проблема памяти, вопросы рационального питания решаются с учетом знаний биохимии этих процессов, так же как и проблемы сельского хозяйства: повышение производительности сельскохозяйственных культур и животноводства. Современная пищевая промышленность в своей основе также базируется на биохимии, которая, детально изучив процессы хлебопечения, виноделия, переработку молока, жиров, консервирования и т. д., помогает увеличить выпуск и улучшить вкусовые качества пищевых продуктов. Есть еще одна область знаний, в которой трудно переоценить значение биохимии,- это медицина. Еще М. В. Ломоносов писал: "Медик без довольных познаний химии совершенен быть не может".
В человеческом организме постоянно протекают тысячи и тысячи различных химических реакций, которые обеспечивают его существование. И задача биохимии состоит в том, чтобы, изучив состав организма и продуктов его обмена веществ, выяснив функции различных органов и тканей, познать " существо процессов жизнедеятельности организма. В основе этих исследований лежит знание взаимодействия разнообразных физических и химических процессов, взаимозависимости между структурой и функцией веществ, регуляторных механизмов, контролирующих деятельность обмена веществ.
Таким образом, биохимия является теоретической основой медицины. Знание биохимических процессов, протекающих в нормальном здоровом организме, позволяет понять и природу различных заболеваний, которые в своей основе представляют разнообразные отклонения протекающих в организме химических реакций — патогенез заболеваний. Не менее существенным является использование данных биохимии в вопросах диагностики и лечения.
Трудно представить врача, который бы ставил диагноз без результатов тщательного биохимического анализа крови, мочи, кала, желудочного содержимого, спинномозговой жидкости и т. д. Определение широкого круга веществ в этих жидкостях позволяет врачу с большей степенью точности, своевременно и правильно поставить диагноз. Изменения концентрации многих веществ при заболеваниях являются специфическими. Например, стойкое по сравнению с нормой увеличение сахара в крови и моче является специфическим для сахарного диабета; снижение в крови γ-глобулинов характеризует понижение сопротивляемости организма к вредным воздействиям; значительное повышение цистина в моче является симптомом цистинурии, наличие в моче больших количеств мочевой кислоты является следствием подагры.
В последние годы в клинике стали широко применять определение активности ферментов как диагностических тестов. Сущность применения этих анализов заключается в том, что в определенных органах и тканях протекают специфичные для данной ткани химические процессы, которые катализируются соответственно определенными ферментами. При заболеваниях этих органов и тканей происходит нарушение структуры клеток и ферменты вымываются в кровь, что проявляется изменением их активности в крови по сравнению с нормой. Так, при инфаркте миокарда в крови увеличена активность одной из аминотрансфераз и лактатдегидрогеназы, при заболеваниях поджелудочной железы повышена активность амилазы, а при рахите — фосфатазы. Особенностью ферментной диагностики является их органная и тканевая специфичность и возможность ранней постановки диагноза, в ряде случаев в первые часы развития заболевания или еще в доклинический период, как, например, при рахите. Сейчас в клиниках начинают внедрять методы определения изоферментов, представляющих собой ферменты, катализирующие одну и ту же реакцию, но различающиеся по своим электрофоретическим и иммунологическим свойствам. Изоферменты характеризуются органной специфичностью. Так, различают 5 изоферментных форм лактатдегидрогеназы, одна из которых, наиболее электрофоретически подвижная, специфична для миокарда, другая, менее подвижная, в основном обнаруживается в печени.
Таким образом, результаты биохимических анализов с учетом данных клинического обследования больного и применением других необходимых исследований дают в руки врача те сведения, которые помогают ему своевременно и правильно поставить диагноз.
Основными средствами лечения заболеваний являются разнообразные химические вещества, влияющие определенным образом на нарушенные биохимические процессы обмена веществ и энергии в организме. Действие лекарственных препаратов включает блокировку или подавление активности различных вредных агентов (микробов или вирусов), снабжение организма недостающими веществами (витаминами, минеральными солями, гормонами и др.), активирование деятельности биохимических процессов вследствие гипофункции органов и тканей и пр. Например, использование сульфаниламидных препаратов при кокковых инфекциях, широкое применение антибиотиков, различных вакцин и сывороток при заболеваниях вирусного или микробного происхождения, введение витаминов для лечения а- и гиповитаминозов, инсулина при сахарном диабете, соляной кислоты и пепсина при пониженной кислотности в желудке и т. п.
Разработка новых высокоэффективных лекарственных веществ основана на знаниях химических процессов в органах и тканях и их соответствующих изменений при определенных заболеваниях. Все вышесказанное достаточно полно характеризует значение биохимии для медицинской науки.
История развития биохимии. История биохимии — это история происхождения жизни на земле. Поэтому именно биохимия явилась ареной ожесточенной борьбы двух противоположных мировоззрений — материализма и идеализма в науке. Именно биохимия неопровержимыми доказательствами очищала биологическую науку от идеалистической шелухи.
И первым, кто заложил основы материалистического взгляда на процессы жизнедеятельности, был великий русский ученый М. В. Ломоносов, открывший закон сохранения материи и энергии. В работах А. Лавуазье этот закон получил свое практическое подтверждение. В последующие годы трудами многих ученых всего мира были сделаны крупнейшие научные открытия, которые способствовали развитию биохимии на основе материализма.
 Дж. Нортроп
Получением синтетической мочевины из неорганических веществ в 1828 г. Ф. Вёлер доказал возможность синтеза органических соединений без vis vitalis — "жизненной", или "божественной", силы. Его результаты послужили теоретической основой для последующего искусственного получения различных органических соединений. Так, Н. И. Зининым был получен анилин, М. Бертло — жиры, А. М. Бутлеровым — углеводы, А. Я. Данилевским и Э. Фишером — пептидоподобные вещества и пептиды и, наконец, проф. В. Ингремом — первый белок — гормон инсулин.
Дж. Нортроп
Получением синтетической мочевины из неорганических веществ в 1828 г. Ф. Вёлер доказал возможность синтеза органических соединений без vis vitalis — "жизненной", или "божественной", силы. Его результаты послужили теоретической основой для последующего искусственного получения различных органических соединений. Так, Н. И. Зининым был получен анилин, М. Бертло — жиры, А. М. Бутлеровым — углеводы, А. Я. Данилевским и Э. Фишером — пептидоподобные вещества и пептиды и, наконец, проф. В. Ингремом — первый белок — гормон инсулин.
 Н. И. Лунин (1854-1937)
В последующие годы в связи с развитием химических, физических,, математических дисциплин биохимия стала стремительно развиваться. Дж. Самнер и Дж. Нортроп впервые выделили ферменты — уреазу и пепсин. Э. Фишер открыл нуклеиновые кислоты. Н. И. Лунин и К. Функ — витамины, О. Варбург и А. Сент-Дьердьи вскрыли основу процессов получения энергии в организме, Л. Поллинг и В. Кори установили структуру простых белков, а Дж. Уотсон и Ф. Крик — структуру ДНК, С. Очао, А. Корнберг и Э. Чаргафф много сделали для открытия генетического кода и и т. д. — вот далеко не полный перечень величайших открытий в биохимии.
Н. И. Лунин (1854-1937)
В последующие годы в связи с развитием химических, физических,, математических дисциплин биохимия стала стремительно развиваться. Дж. Самнер и Дж. Нортроп впервые выделили ферменты — уреазу и пепсин. Э. Фишер открыл нуклеиновые кислоты. Н. И. Лунин и К. Функ — витамины, О. Варбург и А. Сент-Дьердьи вскрыли основу процессов получения энергии в организме, Л. Поллинг и В. Кори установили структуру простых белков, а Дж. Уотсон и Ф. Крик — структуру ДНК, С. Очао, А. Корнберг и Э. Чаргафф много сделали для открытия генетического кода и и т. д. — вот далеко не полный перечень величайших открытий в биохимии.
 А. Н. Бах (1857-1946)
Среди творцов науки отечественные ученые всегда стояли в первых рядах. А. Я. Данилевский был основоположником биохимии в России. Его стараниями в 1862 г. была впервые в мире создана кафедра медицинской химии в Казанском университете (до последних лет медицинская биохимия называлась физиологической химией). Первый учебник по физиологической химии был издан в 1847 г. А. И. Ходневым.
А. Н. Бах (1857-1946)
Среди творцов науки отечественные ученые всегда стояли в первых рядах. А. Я. Данилевский был основоположником биохимии в России. Его стараниями в 1862 г. была впервые в мире создана кафедра медицинской химии в Казанском университете (до последних лет медицинская биохимия называлась физиологической химией). Первый учебник по физиологической химии был издан в 1847 г. А. И. Ходневым.
 В. И. Палладин (1859-1922)
Работы М. М. Манассеиной, К. С. Кирхгофа, А. И. Лебедева легли в основу учения о ферментах. Трудам И. П. Павлова по ферментативным и гуморальным механизмам пищеварения, А. Н. Баха и В. И. Палладина о биологическом окислении, В. А. Энгельгарда о значении АТФ в мышечном сокращении, А. И. Опарина по созданию стройной системы происхождения жизни, С. Е. Северина по изучению обмена углеводов, А. Е. Браунштейна об аминокислотном обмене заслуженно отдается приоритет в этих вопросах биохимиками всего мира.
В. И. Палладин (1859-1922)
Работы М. М. Манассеиной, К. С. Кирхгофа, А. И. Лебедева легли в основу учения о ферментах. Трудам И. П. Павлова по ферментативным и гуморальным механизмам пищеварения, А. Н. Баха и В. И. Палладина о биологическом окислении, В. А. Энгельгарда о значении АТФ в мышечном сокращении, А. И. Опарина по созданию стройной системы происхождения жизни, С. Е. Северина по изучению обмена углеводов, А. Е. Браунштейна об аминокислотном обмене заслуженно отдается приоритет в этих вопросах биохимиками всего мира.
 В. А. Энгельгард
Настоящее развитие биохимии в России началось после Великой Октябрьской социалистической революции. Партия и правительство уделяют большое внимание биохимии. Большая армия научных сотрудников работает в биохимических институтах и лабораториях, которые возглавляются крупными учеными нашей страны, такими, как С. Е. Северин, А. И. Опарин, В. А. Энгельгард, А. Е. Браунштейн, А. В. Палладии, С. Р. Мардашов, В. Н. Орехович, А. Н. Спирин, И. И. Иванов, А. А. Покровский и др.
В. А. Энгельгард
Настоящее развитие биохимии в России началось после Великой Октябрьской социалистической революции. Партия и правительство уделяют большое внимание биохимии. Большая армия научных сотрудников работает в биохимических институтах и лабораториях, которые возглавляются крупными учеными нашей страны, такими, как С. Е. Северин, А. И. Опарин, В. А. Энгельгард, А. Е. Браунштейн, А. В. Палладии, С. Р. Мардашов, В. Н. Орехович, А. Н. Спирин, И. И. Иванов, А. А. Покровский и др.
 А. И. Опарин
Общие представления об обмене веществ. В основе всех биохимических проявлений жизни лежат два основополагающих уравнения, которые четко показывают взаимосвязь организма с окружающей средой.
Первое из них — это процесс фотосинтеза:
6СО2 + 6Н2О + энергия солнца → C6H12O6 + 6О2.
При этом процессе образуются питательные, органические вещества и кислород. Детальное изучение фотосинтеза было проведено К. А. Тимирязевым. Фотосинтез протекает в зернах хлорофилла, которые, по образному выражению Бернала, являются улавливающей системой фотосинтеза, вызывая у растений рост, у животных — движение, у человека — мысль.
Второе уравнение характеризует закон сохранения и превращения энергии в живых тканях:
С6H12О6 + 6О2 → 6СО2 + 6Н2О + энергия.
Расшифровка этого уравнения включает изучение превращений ряда веществ и энергии в организме. Эти два уравнения определяют круговорот углерода и энергии в природе. Наряду с этим между организмом и внешней средой происходит постоянный обмен азота, который поступает с продуктами питания и выделяется из организма в виде конечных продуктов, таких, как мочевина, мочевая кислота и т. д.
В изучении вопроса круговорота веществ большая заслуга принадлежит С. Н. Виноградскому. Им впервые научно доказан круговорот в природе азота, углерода, серы и многих других химических элементов.
Окружающая среда является для организма основным поставщиком питательных веществ, которые в организме подвергаются процессам распада — диссимиляции — с образованием необходимых веществ для построения клеток и тканей за счет энергии, которая при этом выделяется.
Изучение обмена веществ и энергии происходит на разных уровнях — целого организма, органа или ткани, клетки и молекулы. Изучение обмена веществ на молекулярном уровне является наиболее важным, так как позволяет вскрыть самые интимные механизмы различных видов обменов.
Основные методы, применяемые при биохимических исследованиях. Соответственно задачам исследований используются различные методы. Изучение обмена веществ на уровне целого организма является наиболее общим. Для этого применяются методы определения количества питательных веществ, полуденных организмом за определенный промежуток времени, и количества выделившихся. Таким путем, например, определяют баланс азота. Баланс энергии устанавливают методами калориметрии, когда учитываются энергетические ценности питательных веществ и энергетические траты организма. Для этих целей используют и "дыхательный коэффициент", который представляет собой отношение объема выделенного за определенный промежуток времени углекислого газа к объему поглощенного за то же время кислорода СО2/О2).
Установлено, что дыхательный коэффициент при окислении углеводов равен 1, жиров — 0,7 и белков — 0,8.
Обмен веществ органа изучают с использованием, например, метода ангиостомии, предложенного Е. С. Лондоном. Сущность этого метода заключается в том, что артерии и вены исследуемого органа выводят наружу и в оттекающей от этого органа крови определяют различные вещества, введенные в кровоток, что позволяет судить об усвоении и выделении этих веществ в органе.
Метод переживающих тканей предусматривает выделение ткани из организма и содержание ее в определенной среде, в которой ткань может нормально существовать и функционировать.
Методом тканевых срезов также изучают обмен веществ в органе или ткани. С этой целью получают тонкий срез органа, помещают его в физиологический раствор с испытуемым веществом и изучают получающиеся при этом продукты.
Методами экстрактов и гомогенатов исследуют обмен на уровне клетки. Для этого приготавливают экстракты (вытяжки) из определенных клеток или гомогенат (измельченная кашица). Затем наблюдают, какие вещества получаются из данного соединения после прибавления его к экстракту или гомогенату.
А. И. Опарин
Общие представления об обмене веществ. В основе всех биохимических проявлений жизни лежат два основополагающих уравнения, которые четко показывают взаимосвязь организма с окружающей средой.
Первое из них — это процесс фотосинтеза:
6СО2 + 6Н2О + энергия солнца → C6H12O6 + 6О2.
При этом процессе образуются питательные, органические вещества и кислород. Детальное изучение фотосинтеза было проведено К. А. Тимирязевым. Фотосинтез протекает в зернах хлорофилла, которые, по образному выражению Бернала, являются улавливающей системой фотосинтеза, вызывая у растений рост, у животных — движение, у человека — мысль.
Второе уравнение характеризует закон сохранения и превращения энергии в живых тканях:
С6H12О6 + 6О2 → 6СО2 + 6Н2О + энергия.
Расшифровка этого уравнения включает изучение превращений ряда веществ и энергии в организме. Эти два уравнения определяют круговорот углерода и энергии в природе. Наряду с этим между организмом и внешней средой происходит постоянный обмен азота, который поступает с продуктами питания и выделяется из организма в виде конечных продуктов, таких, как мочевина, мочевая кислота и т. д.
В изучении вопроса круговорота веществ большая заслуга принадлежит С. Н. Виноградскому. Им впервые научно доказан круговорот в природе азота, углерода, серы и многих других химических элементов.
Окружающая среда является для организма основным поставщиком питательных веществ, которые в организме подвергаются процессам распада — диссимиляции — с образованием необходимых веществ для построения клеток и тканей за счет энергии, которая при этом выделяется.
Изучение обмена веществ и энергии происходит на разных уровнях — целого организма, органа или ткани, клетки и молекулы. Изучение обмена веществ на молекулярном уровне является наиболее важным, так как позволяет вскрыть самые интимные механизмы различных видов обменов.
Основные методы, применяемые при биохимических исследованиях. Соответственно задачам исследований используются различные методы. Изучение обмена веществ на уровне целого организма является наиболее общим. Для этого применяются методы определения количества питательных веществ, полуденных организмом за определенный промежуток времени, и количества выделившихся. Таким путем, например, определяют баланс азота. Баланс энергии устанавливают методами калориметрии, когда учитываются энергетические ценности питательных веществ и энергетические траты организма. Для этих целей используют и "дыхательный коэффициент", который представляет собой отношение объема выделенного за определенный промежуток времени углекислого газа к объему поглощенного за то же время кислорода СО2/О2).
Установлено, что дыхательный коэффициент при окислении углеводов равен 1, жиров — 0,7 и белков — 0,8.
Обмен веществ органа изучают с использованием, например, метода ангиостомии, предложенного Е. С. Лондоном. Сущность этого метода заключается в том, что артерии и вены исследуемого органа выводят наружу и в оттекающей от этого органа крови определяют различные вещества, введенные в кровоток, что позволяет судить об усвоении и выделении этих веществ в органе.
Метод переживающих тканей предусматривает выделение ткани из организма и содержание ее в определенной среде, в которой ткань может нормально существовать и функционировать.
Методом тканевых срезов также изучают обмен веществ в органе или ткани. С этой целью получают тонкий срез органа, помещают его в физиологический раствор с испытуемым веществом и изучают получающиеся при этом продукты.
Методами экстрактов и гомогенатов исследуют обмен на уровне клетки. Для этого приготавливают экстракты (вытяжки) из определенных клеток или гомогенат (измельченная кашица). Затем наблюдают, какие вещества получаются из данного соединения после прибавления его к экстракту или гомогенату.
 Рис. 4. Структура животной клетки по данным электрон пой микроскопии
Обмен веществ изучают и в субклеточных фракциях. При детальном рассмотрении структуры клетки, например под электронным микроскопом, дающим увеличение в сотни тысяч и даже миллионы раз, были открыты различные внутриклеточные органеллы — ядра, ядрышки, микросомы, лизосомы, митохондрии, эндоплазматический ретикулум и др., представленные на рис. 4. В каждой из этих структур протекают специфические химические процессы. Разработаны методы выделения этих структур путем дифференциального центрифугирования в центрифугах с большим числом оборотов, доходящим до 10 000 — 60 000 оборотов в минуту. В связи с различными величинами этих частиц они осаждаются при разных ускорениях. Определяя различные вещества и ферменты в субклеточных фракциях, изучают тонкие механизмы обмена веществ в организме.
В последние годы нашли широкое применение и такие методы исследований, как метод изотопов. Принцип его заключается в том, что синтезируется вещество, в молекулы которого вводят атомы радиоактивных или тяжелых изотопов. При этом учитывается, что живой организм одинаково использует как природные вещества, так и их изотопы в процессах обмена. Поэтому по поведению изотопа в организме судят о судьбе вещества, в составе которого этот изотоп находится.
Рис. 4. Структура животной клетки по данным электрон пой микроскопии
Обмен веществ изучают и в субклеточных фракциях. При детальном рассмотрении структуры клетки, например под электронным микроскопом, дающим увеличение в сотни тысяч и даже миллионы раз, были открыты различные внутриклеточные органеллы — ядра, ядрышки, микросомы, лизосомы, митохондрии, эндоплазматический ретикулум и др., представленные на рис. 4. В каждой из этих структур протекают специфические химические процессы. Разработаны методы выделения этих структур путем дифференциального центрифугирования в центрифугах с большим числом оборотов, доходящим до 10 000 — 60 000 оборотов в минуту. В связи с различными величинами этих частиц они осаждаются при разных ускорениях. Определяя различные вещества и ферменты в субклеточных фракциях, изучают тонкие механизмы обмена веществ в организме.
В последние годы нашли широкое применение и такие методы исследований, как метод изотопов. Принцип его заключается в том, что синтезируется вещество, в молекулы которого вводят атомы радиоактивных или тяжелых изотопов. При этом учитывается, что живой организм одинаково использует как природные вещества, так и их изотопы в процессах обмена. Поэтому по поведению изотопа в организме судят о судьбе вещества, в составе которого этот изотоп находится.
 Рис. 5. Аппарат для электрофореза белков на бумаге (ЭФ-2). 1 — источник питания; 2 — электрофоретическая ванна
Одним из методов, позволяющим проводить детальный анализ веществ, является электрофорез. Он основан на том, что в электрическом поле молекулы вещества, обладающие электрическим зарядом, будут передвигаться к катоду или аноду. Их скорость и направление зависят от величины заряда молекулы, ее формы, размера и т. д. Этот анализ проводится в аппарате для электрофореза (рис. 5), который в принципе состоит из стабилизатора, дающего постоянный ток, и камеры. В последней имеются две ванночки для буферного раствора, к которым подведены электроды. Между ванночками располагают полоски бумаги с исследуемым веществом. При включении тока на полосках бумаги, пропитанных буферным раствором, создается электрическое поле, в котором и будут передвигаться молекулы анализируемого вещества. Этот метод успешно применяется для разделения белков на отдельные фракции (альбумины, различные типы глобулинов и т. д.), для выделения изоферментов и т. д. В клиниках метод электрофореза используется в диагностических целях, так как при различных заболеваниях изменяется количество и состав белковых фракций сыворотки крови и тканей.
Рис. 5. Аппарат для электрофореза белков на бумаге (ЭФ-2). 1 — источник питания; 2 — электрофоретическая ванна
Одним из методов, позволяющим проводить детальный анализ веществ, является электрофорез. Он основан на том, что в электрическом поле молекулы вещества, обладающие электрическим зарядом, будут передвигаться к катоду или аноду. Их скорость и направление зависят от величины заряда молекулы, ее формы, размера и т. д. Этот анализ проводится в аппарате для электрофореза (рис. 5), который в принципе состоит из стабилизатора, дающего постоянный ток, и камеры. В последней имеются две ванночки для буферного раствора, к которым подведены электроды. Между ванночками располагают полоски бумаги с исследуемым веществом. При включении тока на полосках бумаги, пропитанных буферным раствором, создается электрическое поле, в котором и будут передвигаться молекулы анализируемого вещества. Этот метод успешно применяется для разделения белков на отдельные фракции (альбумины, различные типы глобулинов и т. д.), для выделения изоферментов и т. д. В клиниках метод электрофореза используется в диагностических целях, так как при различных заболеваниях изменяется количество и состав белковых фракций сыворотки крови и тканей.
 Рис. 6. Разделение каротиноидов красного перца на колонке
Рис. 6. Разделение каротиноидов красного перца на колонке
 Рис. 7. Схема разделения смеси трех веществ на адсорбционной колонке
Хроматографические методы введены в науку и практику М. С. Цветом. Сущность метода заключается в том, что различные вещества обладают различной способностью адсорбироваться на определенных веществах — адсорбентах. Поэтому, пропуская смесь веществ через стеклянную трубку, наполненную каким-либо адсорбентом (М. С. Цвет использовал для этой цели окись алюминия), вещества распределяются на разных уровнях. На рис. 6 показано разделение каротиноидов из красного перца. Как видно из рисунка, быстрее всех передвигается а-каротин и медленнее других — ксантофилл. Чтобы собрать отдельно каждое вещество, колонку промывают растворителем. Быстрее других будет вымываться то вещество, которое было слабо связано с адсорбентом. На рис. 7 такое вещество расположено в самом конце колонки и обозначено светлыми кружочками. Вещество, прочнее соединенное с адсорбентом (обозначено на рисунке крестиками), будет вымываться последним. Разновидностью колоночной хроматографии является хроматография на бумаге. При этом смесь веществ, подлежащих разделению, наносят на полосу хроматографической бумаги, конец которой помещают в раствор с органическими растворителями (например, со смесью бутилового спирта и уксусной кислоты, фенола, пиридина и др.). В силу различной растворимости вещества смеси распределяются на разных участках полосы бумаги. Окрашивая эти вещества, можно определить состав смеси и их количества. На рис. 8 представлена хроматограмма смеси аминокислот.
Рис. 7. Схема разделения смеси трех веществ на адсорбционной колонке
Хроматографические методы введены в науку и практику М. С. Цветом. Сущность метода заключается в том, что различные вещества обладают различной способностью адсорбироваться на определенных веществах — адсорбентах. Поэтому, пропуская смесь веществ через стеклянную трубку, наполненную каким-либо адсорбентом (М. С. Цвет использовал для этой цели окись алюминия), вещества распределяются на разных уровнях. На рис. 6 показано разделение каротиноидов из красного перца. Как видно из рисунка, быстрее всех передвигается а-каротин и медленнее других — ксантофилл. Чтобы собрать отдельно каждое вещество, колонку промывают растворителем. Быстрее других будет вымываться то вещество, которое было слабо связано с адсорбентом. На рис. 7 такое вещество расположено в самом конце колонки и обозначено светлыми кружочками. Вещество, прочнее соединенное с адсорбентом (обозначено на рисунке крестиками), будет вымываться последним. Разновидностью колоночной хроматографии является хроматография на бумаге. При этом смесь веществ, подлежащих разделению, наносят на полосу хроматографической бумаги, конец которой помещают в раствор с органическими растворителями (например, со смесью бутилового спирта и уксусной кислоты, фенола, пиридина и др.). В силу различной растворимости вещества смеси распределяются на разных участках полосы бумаги. Окрашивая эти вещества, можно определить состав смеси и их количества. На рис. 8 представлена хроматограмма смеси аминокислот.
 Рис. 8. Двухмерная хроматограмма смеси аминокислот
Изучение обмена веществ и энергии на всех уровнях с применением самых различных методов исследований как в норме, так и при патологии, является существенным фактором для дальнейшего развития медицины в борьбе за здоровье человека.
Рис. 8. Двухмерная хроматограмма смеси аминокислот
Изучение обмена веществ и энергии на всех уровнях с применением самых различных методов исследований как в норме, так и при патологии, является существенным фактором для дальнейшего развития медицины в борьбе за здоровье человека.
I. Химия белков
Общая характеристика белков
Из органических веществ, входящих в состав живых организмов, наиболее важными в биологическом отношении и наиболее сложными по своей структуре являются белки. С ними мы встречаемся всюду, где имеет место проявление жизни. Еще в прошлом столетии указывалось на важное значение белков в животном организме. Термин "белки" возник впервые в связи с обнаружением в тканях животных и растений веществ, похожих по некоторым свойствам на яичный белок (при нагревании они свертывались). Эти вещества Мульдер в 1838 г. назвал протеинами (греч. proteous — первый). Оно было основано на представлении о том, что протеины являются важнейшей составной частью живой материи, без которой была бы невозможна жизнь. Теперь определение "белки" стало собирательным понятием для целого класса веществ, которые имеют много общего в составе и свойствах, присутствуют в каждой живой клетке и образуют там главную массу протоплазмы. Классическое определение роли белков как основы всего живого было дано Ф. Энгельсом[1]. Он писал, что всюду, где мы встречаем жизнь, находим, что она связана с каким-то белковым телом и повсюду, где находится белковое тело, только не в состоянии разложения, всегда без исключения встречаются и с явлениями жизни. Это представление Энгельса не утратило своего значения и до настоящего времени. Теперь, говоря о роли белков, отмечаются их многообразные функции в организме.Биологическое значение белков и их распространение в природе
Каталитическая функция. В организме протекает множество самых различных химических реакций с очень высокими скоростями, которые невозможно воспроизвести в органической химии. Это обеспечивается за счет ферментов — катализаторов белковой природы, каждый из которых с высокой степенью специфичности ускоряет химическую реакцию, протекающую в организме. Структурная функция. Анализ человеческого тела показывает, что белок составляет значительную часть организма (табл. 1). Таблица 1. Состав человеческого тела
По данным таблицы видно, что из всех органических веществ, входящих в состав тела человека, большая часть (20%) приходится — на белок. Белок входит в состав различных органов и тканей, участвует в построении оболочек клеток, составляет основную часть волос, ногтей и т. д. )
Содержание белка в коже составляет 27%, в скелете — 20%, в мышцах — 22%, в жировой ткани — 6%, в печени — 22%, в мозге — 11%.
Энергетическая функция. При распаде белков в организме выделяется значительное количество энергии, которая обеспечивает другие химические процессы, текущие с ее потреблением. При сгорании 1 г белка выделяется 4,1 ккал.
Транспортная функция. Для жизнедеятельности организма необходимо постоянное обеспечение его питательными веществами, которые переносятся по крови соединениями белковой природы. Так, снабжение клеток кислородом и удаление углекислого газа осуществляется сложным белком — гемоглобином; транспорт жирорастворимых веществ (жиров, липоидов, витаминов групп A, D, Е, К и т. д.) обеспечивается липопротеидами — сложными веществами, наружная оболочка которых представлена белками, и т. д.
Функция передачи наследственности. В основе процессов передачи наследственности, в "воспроизводстве себе подобных" лежат сложные белки — нуклеопротеиды, составными частями которых являются нуклеиновые кислоты — ДНК и РНК. ДНК является носителем наследственности, а РНК обеспечивает считывание этой информации и построение белка на этой основе.
Защитная функция. В ходе эволюции животный организм
выработал различные защитные механизмы против неблагоприятных факторов внешней и внутренней среды. Так, кожа предохраняет организм от воздействия резких колебаний температуры, солнечной радиации и т. д. На действие болезнетворных микробов организм отвечает выработкой антител, которые способствуют торможению вредного действия микроорганизмов и их разрушению. Основу этих защитных веществ составляют белки. В составе кожи обнаружен белок кератин, основу антител составляют γ-глобулины и т. д.
Эти основные функции белков достаточно четко характеризуют их значение для организма.
Таблица 1. Состав человеческого тела
По данным таблицы видно, что из всех органических веществ, входящих в состав тела человека, большая часть (20%) приходится — на белок. Белок входит в состав различных органов и тканей, участвует в построении оболочек клеток, составляет основную часть волос, ногтей и т. д. )
Содержание белка в коже составляет 27%, в скелете — 20%, в мышцах — 22%, в жировой ткани — 6%, в печени — 22%, в мозге — 11%.
Энергетическая функция. При распаде белков в организме выделяется значительное количество энергии, которая обеспечивает другие химические процессы, текущие с ее потреблением. При сгорании 1 г белка выделяется 4,1 ккал.
Транспортная функция. Для жизнедеятельности организма необходимо постоянное обеспечение его питательными веществами, которые переносятся по крови соединениями белковой природы. Так, снабжение клеток кислородом и удаление углекислого газа осуществляется сложным белком — гемоглобином; транспорт жирорастворимых веществ (жиров, липоидов, витаминов групп A, D, Е, К и т. д.) обеспечивается липопротеидами — сложными веществами, наружная оболочка которых представлена белками, и т. д.
Функция передачи наследственности. В основе процессов передачи наследственности, в "воспроизводстве себе подобных" лежат сложные белки — нуклеопротеиды, составными частями которых являются нуклеиновые кислоты — ДНК и РНК. ДНК является носителем наследственности, а РНК обеспечивает считывание этой информации и построение белка на этой основе.
Защитная функция. В ходе эволюции животный организм
выработал различные защитные механизмы против неблагоприятных факторов внешней и внутренней среды. Так, кожа предохраняет организм от воздействия резких колебаний температуры, солнечной радиации и т. д. На действие болезнетворных микробов организм отвечает выработкой антител, которые способствуют торможению вредного действия микроорганизмов и их разрушению. Основу этих защитных веществ составляют белки. В составе кожи обнаружен белок кератин, основу антител составляют γ-глобулины и т. д.
Эти основные функции белков достаточно четко характеризуют их значение для организма.
Элементарный состав белков
При химическом анализе белков были определены важнейшие элементы, входящие в их состав, и их количественные соотношения. Элементарный состав белков в процентах будет следующим: углерод — 50-54,4%, водород — 6,5-7,3%, кислород — 21,5-23,5%, азот — 15- 17%, сера — 0,3-2,5%. В составе белков обнаружены также фосфор, йод, железо и другие минеральные вещества. Как было установлено, наибольшим постоянством в составе белка отличается азот, количество которого составляет в среднем 16%, поэтому было предложено определить содержание белка по количеству входящего в него азота по следующей формуле: Кол-во азота×6,25 г = кол-во белка в %, где 6,25 г белка соответствует 1 г азота. При изучении химической структуры белка было установлено, что основной его структурной единицей — мономером — является аминокислота. Таким образом, белки определяются как высокомолекулярные органические, N-содержащие вещества, состоящие в основном из аминокислот и находящиеся в клетках в коллоидном состоянии.Свойства белков
Молекулярный вес белков
Определение молекулярного веса белков проводилось различными методами (криоскопическим, осмометрическим и др.). Наиболее точным оказался предложенный Т. Сведбергом метод седиментации, который проводится в ультрацентрифуге с ускорением до 900 000 g. Он основан на различной скорости оседания белков, в зависимости от их молекулярного веса: белки с высоким молекулярным весом оседают при меньшей скорости вращения центрифуги, а белки с малым весом — при высоких скоростях. По определенной формуле рассчитывают молекулярный вес. Изучение различных белков показало, что все они являются высокомолекулярными соединениями. Приведем молекулярный вес следующих белков: инсулина — 5700 (11 500), рибонуклеазы — 12 700, миоглобина 4 — 17 000, гемоглобина — 65 000, каталазы — 250 000, уреазы 4-480 000, гемоцианина — 5 000 000 — 6 000 000.Белки-коллоиды
Белки вследствие своего высокого молекулярного веса обладают свойствами коллоидов. Как известно, все растворы в зависимости от величины растворенных частиц подразделяются на истинные и коллоидные. К истинным относятся такие растворы, величина частиц которых меньше 1 ммк (10-7 см); величина частиц коллоидных растворов составляет от 1 мк до 1 ммк (10-4-10-7 см). Для отличия истинных от коллоидных растворов пользуются в основном двумя методами — изучением "эффекта Тиндаля" и диализом. Рис. 9. 'эффект Тиндаля'. Сосуд, ближайший к свету, содержит концентрированный раствор сахара. Второй сосуд содержит коллоидную дисперсию. Пучок света виден во втором сосуде, но проходит через первый сосуд нерассеянным
Сущность "эффекта Тиндаля" заключается в следующем: при пропускании пучка света через истинный раствор его рассеивания не происходит, т. е. частицы истинного раствора настолько малы, что они не могут стать преградой для луча света и отклонить его в сторону. Если же пучок света направить на коллоидный раствор, то произойдет его рассеивание, которое будет наблюдаться в виде светящегося конуса. Это объясняется тем, что частицы коллоидного раствора, как более крупные, будут служить препятствием на пути луча света, в результате чего последний несколько отклонится (рис. 9).
Сущность явления диализа заключается в способности частиц раствора задерживаться или проходить в зависимости от их величины через полупроницаемые перепонки — мембраны, имеющие определенный размер отверстий — поры. К полупроницаемым мембранам относятся целлофан, коллоидная пленка, стенка бычьего пузыря и т. д. Если величина частиц раствора меньше размера пор такой мембраны, то они свободно проходят через них, если же размер частицы больше, чем поры, то частица задержится" В первом случае мы имеем дело с истинными растворами, которые свободно фильтруются (проходят) через полупроницаемые мембраны. Во втором случае — частицы коллоидных растворов задерживаются и не проходят через такие же мембраны.
Это свойство широко используется в медицине и химии для получения хорошо очищенных от посторонних примесей белковых препаратов. Например, для получения лечебных сывороток, γ-глобулинов. Явление диализа лежит в основе действия аппарата "искусственная почка", который в настоящее время широко используется в клиниках при лечении острой и хронической почечной недостаточности.
Рис. 9. 'эффект Тиндаля'. Сосуд, ближайший к свету, содержит концентрированный раствор сахара. Второй сосуд содержит коллоидную дисперсию. Пучок света виден во втором сосуде, но проходит через первый сосуд нерассеянным
Сущность "эффекта Тиндаля" заключается в следующем: при пропускании пучка света через истинный раствор его рассеивания не происходит, т. е. частицы истинного раствора настолько малы, что они не могут стать преградой для луча света и отклонить его в сторону. Если же пучок света направить на коллоидный раствор, то произойдет его рассеивание, которое будет наблюдаться в виде светящегося конуса. Это объясняется тем, что частицы коллоидного раствора, как более крупные, будут служить препятствием на пути луча света, в результате чего последний несколько отклонится (рис. 9).
Сущность явления диализа заключается в способности частиц раствора задерживаться или проходить в зависимости от их величины через полупроницаемые перепонки — мембраны, имеющие определенный размер отверстий — поры. К полупроницаемым мембранам относятся целлофан, коллоидная пленка, стенка бычьего пузыря и т. д. Если величина частиц раствора меньше размера пор такой мембраны, то они свободно проходят через них, если же размер частицы больше, чем поры, то частица задержится" В первом случае мы имеем дело с истинными растворами, которые свободно фильтруются (проходят) через полупроницаемые мембраны. Во втором случае — частицы коллоидных растворов задерживаются и не проходят через такие же мембраны.
Это свойство широко используется в медицине и химии для получения хорошо очищенных от посторонних примесей белковых препаратов. Например, для получения лечебных сывороток, γ-глобулинов. Явление диализа лежит в основе действия аппарата "искусственная почка", который в настоящее время широко используется в клиниках при лечении острой и хронической почечной недостаточности.
Белки — амфотерные электролиты
При изучении химического состава белка было установлено, что в его молекуле имеются свободные аминные (NH2) и карбоксильные (СООН) группы, которые в растворе находятся в виде NH3 и СООН. Следовательно, белки в растворе обладают амфотерными свойствами (амфолит, амфион). При пропускании электрического тока белки будут передвигаться в зависимости от заряда белковой молекулы к катоду или аноду (рис. 10). Рис. 10. Белки — амфотерные соединения. а — в кислом растворе суммарный заряд белка положительный и белок становится катионом; б — изоэлектрическая точка белка; суммарный заряд белковой молекулы равен нулю; в — в щелочной среде подавлена диссоциация аминных групп. Заряд белковой молекулы становится отрицательным и белок передвигается к аноду (белок играет роль аниона)
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3:
Рис. 10. Белки — амфотерные соединения. а — в кислом растворе суммарный заряд белка положительный и белок становится катионом; б — изоэлектрическая точка белка; суммарный заряд белковой молекулы равен нулю; в — в щелочной среде подавлена диссоциация аминных групп. Заряд белковой молекулы становится отрицательным и белок передвигается к аноду (белок играет роль аниона)
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3:
 В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
 Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов, или значение рН среды. При повышении концентрации водородных ионов (среда кислая — рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение.
Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
Амфотерность белков лежит в основе белковой буферной системы, которая участвует в поддержании определенной реакции среды крови. Амфотерные свойства белков используются для разделения их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за состоянием больного.
Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов, или значение рН среды. При повышении концентрации водородных ионов (среда кислая — рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение.
Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
Амфотерность белков лежит в основе белковой буферной системы, которая участвует в поддержании определенной реакции среды крови. Амфотерные свойства белков используются для разделения их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за состоянием больного.
Белки — гидрофильные соединения
Все белки обладают гидрофильными свойствами, т. е. имеют большое сродство с водой. Стабильность белковой молекулы в растворе обусловлена наличием определенного заряда и гидратной (водной) оболочки. В случае удаления этих двух факторов устойчивости белок выпадает в осадок. Выпадение белка в осадок может быть обратимым и необратимым. Обратимое осаждение белков (высаливание) возможно при действии концентрированных растворов солей щелочных или щелочно-земельных металлов, например (NH4)2SО4, NaCl. Удаление этих веществ способствует переводу белков вновь в нативное (природное) состояние. Высаливание белков, таким образом, является обратимым процессом. В зависимости от концентрации соли в осадок будут переходить различные фракции белков. Так, глобулины крови осаждаются при полунасыщении растворов солями, а альбумины — при полном насыщении. Эта способность белков нашла широкое промышленное применение при получении различных фракций белков, например γ-глобулинов. Рис. 11. Схема денатурации. а — нативная молекула; б — развертывание; в — случайный клубок
При необратимых реакциях осаждения белки претерпевают глубокие изменения и неспособны к обратному растворению. Это наблюдается при действии на белок солей тяжелых металлов, сильных кислот и щелочей и т. д. При нагревании до 100° белок выпадает в осадок, при этом в нем происходят необратимые внутримолекулярные превращения, связанные с изменением многочисленных свойств белка, в том числе биологических. Белок, потерявший свои нативные свойства, называется денатурированным, а сам процесс — денатурацией. Схема этого процесса представлена на рис. 11.
Это свойство белков используется в клинике. При отравлении тяжелыми металлами больному вводят per os молоко или сырые яйца с тем, чтобы металлы, денатурируя белки яйца или молока, адсорбировались на их поверхности, не действовали на белки кишечника и желудка и не всасывались в кровь.
В настоящее время установлено, что при кратковременном действии денатурирующего агента денатурированные белки могут перейти обратно в нативное состояние. Этот процесс называется ренатурацией.
Рис. 11. Схема денатурации. а — нативная молекула; б — развертывание; в — случайный клубок
При необратимых реакциях осаждения белки претерпевают глубокие изменения и неспособны к обратному растворению. Это наблюдается при действии на белок солей тяжелых металлов, сильных кислот и щелочей и т. д. При нагревании до 100° белок выпадает в осадок, при этом в нем происходят необратимые внутримолекулярные превращения, связанные с изменением многочисленных свойств белка, в том числе биологических. Белок, потерявший свои нативные свойства, называется денатурированным, а сам процесс — денатурацией. Схема этого процесса представлена на рис. 11.
Это свойство белков используется в клинике. При отравлении тяжелыми металлами больному вводят per os молоко или сырые яйца с тем, чтобы металлы, денатурируя белки яйца или молока, адсорбировались на их поверхности, не действовали на белки кишечника и желудка и не всасывались в кровь.
В настоящее время установлено, что при кратковременном действии денатурирующего агента денатурированные белки могут перейти обратно в нативное состояние. Этот процесс называется ренатурацией.
Химическое строение белков
Знание свойств белков и их элементарного состава не дает еще представления об их химической структуре. Для ее изучения используют различные методы, в том числе гидролиз. Он представляет собой процесс расщепления белков на составные части при участии воды и нагревании. Гидролиз может быть 3 видов: • кислотный, • щелочной, • ферментативный. Для кислотного гидролиза применяются концентрированные растворы соляной и серной кислот и нагревание в течение 24 часов при температуре 100-110°. Щелочной гидролиз протекает при тех же условиях в присутствии 2N растворов щелочей. Ферментативный гидролиз обеспечивает расщепление белков при действии протеолитических ферментов при температуре 37-38°. Однако ни один из этих видов гидролиза не лишен недостатков. При кислотном и щелочном гидролизах частично разрушаются некоторые составные части белка, а при ферментативном происходит засорение гидролизата продуктами распада самих ферментов. Поэтому, используя данные только всех видов гидролиза, можно получить полное представление о составе белков. Конечными продуктами гидролиза белков являются аминокислоты. В результате длительных исследований было установлено, что в состав природных белков входит 20 аминокислот в различных сочетаниях. В настоящее время синтезировано около 80 новых аминокислот, которые не встречаются в составе белков организма.Аминокислоты
Аминокислоты представляют собой органические кислоты, у которых водород α-углеродного атома замещен аминогруппой — NH2, т. е. это αаминокислоты. Общая формула аминокислот следующая: Если у α-углеродного атома все валентности замещены различными функциональными группами (R-радикал не повторяет имеющиеся группы), то такой С-атом называют асимметрическим, а аминокислоту — оптически активной. Она способна вращать плоскость поляризованного луча и иметь стереоизомеры.
Например, в природе существуют 2 стереоизомера аланина.
Если у α-углеродного атома все валентности замещены различными функциональными группами (R-радикал не повторяет имеющиеся группы), то такой С-атом называют асимметрическим, а аминокислоту — оптически активной. Она способна вращать плоскость поляризованного луча и иметь стереоизомеры.
Например, в природе существуют 2 стереоизомера аланина.
 Они различаются расположением аминогруппы у α-углеродного атома. D-Аланин характеризуется тем, что мысленное направление вращения от водорода к аминогруппе через метильную группу идет по часовой стрелке; у его изомера L-аланина это направление противоположное. Вещества, содержащие два стереоизомера, называются рацематами и обозначаются как D, L-вещества. Все природные аминокислоты относятся к L-ряду.
Они различаются расположением аминогруппы у α-углеродного атома. D-Аланин характеризуется тем, что мысленное направление вращения от водорода к аминогруппе через метильную группу идет по часовой стрелке; у его изомера L-аланина это направление противоположное. Вещества, содержащие два стереоизомера, называются рацематами и обозначаются как D, L-вещества. Все природные аминокислоты относятся к L-ряду.

Свойства аминокислот
Все аминокислоты являются амфотерными электролитами и в растворе находятся в ионизированном состоянии за счет диссоциации карбоксильных и аминных групп. Аминокислоты являются электрически нейтральными. Однако в кислой среде (при подавлении диссоциации карбоксильной группы) они становятся катионами, а в щелочной среде — анионами.
Аминокислоты являются электрически нейтральными. Однако в кислой среде (при подавлении диссоциации карбоксильной группы) они становятся катионами, а в щелочной среде — анионами.
Классификация аминокислот
Все аминокислоты по структуре подразделяются на ациклические и циклические. Ациклические аминокислоты по количеству аминных или карбоксильных групп делятся на: 1. моноаминомонокарбоновые аминокислоты, имеющие в своем составе одну аминную и одну карбоксильную группу; в водном растворе они нейтральны; 2. моноаминодикарбоновые аминокислоты, имеющие в своем составе одну аминную группу и две карбоксильные; их водный раствор имеет кислую реакцию; 3. диаминомонокарбоновые аминокислоты, в которых на одну карбоксильную группу приходятся две аминные; и; реакция в растворе щелочная.Ациклические аминокислоты
Моноаминомонокарбоновые аминокислоты
К этой группе относятся следующие аминокислоты: L-Глицин, или гликокол (аминоуксусная кислота): Эта аминокислота является оптически неактивной, так как у нее отсутствует асимметричный С-атом. Гликокол принимает участие в синтезе важнейших для организма веществ: нуклеиновых кислот, глютатиона, парных желчных кислот и др. Участвует в обезвреживании бензойной кислоты.
L-Аланин (α-аминопропионовая кислота):
Эта аминокислота является оптически неактивной, так как у нее отсутствует асимметричный С-атом. Гликокол принимает участие в синтезе важнейших для организма веществ: нуклеиновых кислот, глютатиона, парных желчных кислот и др. Участвует в обезвреживании бензойной кислоты.
L-Аланин (α-аминопропионовая кислота):
 Впервые была получена в 1850 г. синтетическим путем и только в 1886 г. выделена из гидролизата шелка как природная. При ее дезаминировании образуется пировиноградная кислота. Помимо α-аланина, в организме встречается β-аланин, который входит в состав пантотеновой кислоты, коэнзима А, экстрактивных веществ мышц.
L-Серин (α-амино-β-оксипропионовая кислота):
Впервые была получена в 1850 г. синтетическим путем и только в 1886 г. выделена из гидролизата шелка как природная. При ее дезаминировании образуется пировиноградная кислота. Помимо α-аланина, в организме встречается β-аланин, который входит в состав пантотеновой кислоты, коэнзима А, экстрактивных веществ мышц.
L-Серин (α-амино-β-оксипропионовая кислота):
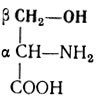 Серии входит в состав ряда белков организма, много его содержится в казеине — белке молока. В процессах обмена веществ участвует фосфорный эфир серина — фосфосерин.
L-Треонин (α-амино-β-оксимасляная кислота):
Серии входит в состав ряда белков организма, много его содержится в казеине — белке молока. В процессах обмена веществ участвует фосфорный эфир серина — фосфосерин.
L-Треонин (α-амино-β-оксимасляная кислота):
 Серии и треонин относятся к группе оксикислот, так как имеют в своем составе гидроксильный радикал.
L-Цистеин (α-амино-β-тиопропионовая кислота):
Серии и треонин относятся к группе оксикислот, так как имеют в своем составе гидроксильный радикал.
L-Цистеин (α-амино-β-тиопропионовая кислота):
 Наличие в молекуле SH-группы характеризует ее способность легко окисляться, что имеет большое значение в организме как средство защиты от веществ с высокой окислительной способностью, которые появляются при лучевом поражении, при отравлении мышьяком, фосфором и другими ядами.
Две молекулы цистеина, окисляясь, соединяются в цистин:
Наличие в молекуле SH-группы характеризует ее способность легко окисляться, что имеет большое значение в организме как средство защиты от веществ с высокой окислительной способностью, которые появляются при лучевом поражении, при отравлении мышьяком, фосфором и другими ядами.
Две молекулы цистеина, окисляясь, соединяются в цистин:
 Особенностью этого соединения является наличие дисульфидной связи (-S-S-), которая встречается в составе третичной структуры белков.
L-Метионин (α-амино-β-тиометилмасляная кислота):
Особенностью этого соединения является наличие дисульфидной связи (-S-S-), которая встречается в составе третичной структуры белков.
L-Метионин (α-амино-β-тиометилмасляная кислота):
 Особенностью этой кислоты является наличие лабильной (легкоподвижной) метильной группы, которую метионин может отдавать для синтеза других соединений, таких, как холин — липотропный фактор, предупреждающий жировую инфильтрацию печени, креатин — экстрактивное вещество мышц, ДНК и др.
L-Валин (α-аминоизовалериановая кислота):
Особенностью этой кислоты является наличие лабильной (легкоподвижной) метильной группы, которую метионин может отдавать для синтеза других соединений, таких, как холин — липотропный фактор, предупреждающий жировую инфильтрацию печени, креатин — экстрактивное вещество мышц, ДНК и др.
L-Валин (α-аминоизовалериановая кислота):
 L-Лейцин (α-аминоизокапроновая кислота):
L-Лейцин (α-аминоизокапроновая кислота):
 Эти две аминокислоты в организме не синтезируются, и поэтому их необходимо регулярно вводить с пищей.
Эти две аминокислоты в организме не синтезируются, и поэтому их необходимо регулярно вводить с пищей.
Моноаминодикарбоновые аминокислоты
L-Глютаминовая кислота (α-аминоглютаровая кислота): L-Аспарагиновая кислота (α-аминоянтарная кислота):
L-Аспарагиновая кислота (α-аминоянтарная кислота):
 Эти две аминокислоты имеют важное значение в обмене веществ в организме, участвуя в процессах биосинтеза белка, обезвреживании аммиака, в том числе в мозге, образовании других аминокислот. Производные глютаминовой и аспарагиновой кислот — α-кетоглютаровая и щавелевоуксусная кислоты — являются важными субстратами в энергетическом обмене. Другое производное глютаминовой кислоты — γ-аминомаслянаякислота — участвует в процессах торможения в нервной системе. Натриевая соль глютаминовой кислоты широко применяется в. пищевой промышленности для улучшения вкуса продуктов питания.
Эти две аминокислоты имеют важное значение в обмене веществ в организме, участвуя в процессах биосинтеза белка, обезвреживании аммиака, в том числе в мозге, образовании других аминокислот. Производные глютаминовой и аспарагиновой кислот — α-кетоглютаровая и щавелевоуксусная кислоты — являются важными субстратами в энергетическом обмене. Другое производное глютаминовой кислоты — γ-аминомаслянаякислота — участвует в процессах торможения в нервной системе. Натриевая соль глютаминовой кислоты широко применяется в. пищевой промышленности для улучшения вкуса продуктов питания.
Диаминомонокарбоновые кислоты
L-Лизин (α, ε-диаминокапроновая кислота): Эта аминокислота в организме не синтезируется, и поэтому необходимо ее регулярное поступление с пищей. Недостаток лизина в питании приводит к задержке роста, к нарушению процессов биосинтеза белка.
L-Аргинин (α-амино-δ-гуанидинвалериановая кислот)
Эта аминокислота в организме не синтезируется, и поэтому необходимо ее регулярное поступление с пищей. Недостаток лизина в питании приводит к задержке роста, к нарушению процессов биосинтеза белка.
L-Аргинин (α-амино-δ-гуанидинвалериановая кислот)
 Аргинин, кроме участия в синтезе белков, является одним из основных компонентов в процессе биосинтеза мочевины основного пути обезвреживания аммиака в организме.
Аргинин, кроме участия в синтезе белков, является одним из основных компонентов в процессе биосинтеза мочевины основного пути обезвреживания аммиака в организме.
Циклические аминокислоты
Циклические аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро. В эту группу входят: L-Фенилаланин (α-амино-β-фенилнропионовая кислота). Эта аминокислота является незаменимой для организма, так как участвует в процессах биосинтеза белка, но в организме не синтезируется. Потребность покрывается за счет пищевых продуктов животного происхождения, где фенил-аланин содержится в достаточном количестве. Под действием фермента фенилаланин-4-гидроксилазы фенилаланин превращается в другую аминокислоту — тирозин.
L-Тирозин (параоксифенилаланин):
Под действием фермента фенилаланин-4-гидроксилазы фенилаланин превращается в другую аминокислоту — тирозин.
L-Тирозин (параоксифенилаланин):
 Тирозин, помимо участия в синтезе белков, является предшественником ряда гормонов: тироксина — гормона щитовидной железы, адреналина и норадреналина — гормонов мозгового слоя надпочечников и др.
L-Триптофан (α-амино-β-индолилпропионовая кислота):
Тирозин, помимо участия в синтезе белков, является предшественником ряда гормонов: тироксина — гормона щитовидной железы, адреналина и норадреналина — гормонов мозгового слоя надпочечников и др.
L-Триптофан (α-амино-β-индолилпропионовая кислота):
 Триптофан, как и фенилаланин, является незаменимой минокислотой, в организме он не синтезируется и должен регулярно поступать с пищей. Его функции следующие: участие в биосинтезе белков, образование витамина РР (никотиновая кислота), серотонина — одного из представителей биогенных аминов, триптамина — вещества, вызывающего сужение сосудов и пр.
L-Гистидин (α-амино-β-амидазолилпропионовая кислота):
Триптофан, как и фенилаланин, является незаменимой минокислотой, в организме он не синтезируется и должен регулярно поступать с пищей. Его функции следующие: участие в биосинтезе белков, образование витамина РР (никотиновая кислота), серотонина — одного из представителей биогенных аминов, триптамина — вещества, вызывающего сужение сосудов и пр.
L-Гистидин (α-амино-β-амидазолилпропионовая кислота):
 К функциям гистидина относятся биосинтез белка, образование гистамина — биогенного амина, расширяющего сосуды, и пр.
К функциям гистидина относятся биосинтез белка, образование гистамина — биогенного амина, расширяющего сосуды, и пр.
Структура белков
Выяснение особенностей структуры белков представляет собой важную и не менее сложную задачу. Это связано с тем, что знание закономерностей строения белков позволит проникнуть в тайны живого, даст в руки людей методы и способы, с помощью которых будет осуществлен искусственный синтез белка — основного носителя жизни. Вот почему изучению структуры белка уделялось и уделяется сейчас самое большое внимание, вот почему решению этой задачи отдали свой труд, все свои силы многие ученые мира. И первым, кто внес значительный вклад в дело изучения этого вопроса, был наш отечественный ученый профессор А. Я. Данилевский. В своих работах, опубликованных в 1888 г., он высказал предположение, что аминокислоты, входящие в состав белка, соединяются между собой при помощи пептидной связи: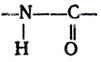 Качественной реакцией на существование такой связи является биуретовая реакция.
В дальнейшем предположение А. Я. Данилевского было подтверждено экспериментально. Эта связь образуется NH2-группой одной аминокислоты и СООН-группой другой:
Качественной реакцией на существование такой связи является биуретовая реакция.
В дальнейшем предположение А. Я. Данилевского было подтверждено экспериментально. Эта связь образуется NH2-группой одной аминокислоты и СООН-группой другой:
 Соединение, состоящее из двух аминокислот, называется дипептидом, из трех — трипептидом и т. д.
Впервые полипептид из 19 аминокислот удалось синтезировать Э. Фишеру. Некоторые из полученных им полипептидов оказались тождественными с полипептидами, получаемыми при гидролизе природных белков.
Соединение, состоящее из двух аминокислот, называется дипептидом, из трех — трипептидом и т. д.
Впервые полипептид из 19 аминокислот удалось синтезировать Э. Фишеру. Некоторые из полученных им полипептидов оказались тождественными с полипептидами, получаемыми при гидролизе природных белков.
 Рис. 12. Первичная структура инсулина
Однако дальнейшее изучение структуры белков стало возможным только в 40-50-х годах нашего столетия, когда на помощь ученым пришли новые методы исследования, такие, как рентгеноструктурный анализ, различные виды хроматографии, электрофорез, метод двойного лучепреломления и др. В результате этих исследований было установлено, что каждый белок имеет в своем составе известное количество определенных аминокислот, соединенных между собой в строго зафиксированной последовательности при помощи пептидных связей. Эта уникальная, специфичная для каждого белка последовательность аминокислот была определена как первичная структура белка. В настоящее время для ряда белков определена их первичная структура. Например, для инсулина — гормона поджелудочной железы белковой природы — установлена последовательность 51 аминокислотного остатка, входящего в его состав, что позволило получить его искусственным путем. На рис. 12 представлена первичная структура инсулина. Черные линии между молекулами цистеина — дисульфидные связи. В настоящее время выяснено, в какой последовательности соединяются 129 остатков аминокислот, входящих в состав рибонуклеазы — фермента, расщепляющего РНК.
Рис. 12. Первичная структура инсулина
Однако дальнейшее изучение структуры белков стало возможным только в 40-50-х годах нашего столетия, когда на помощь ученым пришли новые методы исследования, такие, как рентгеноструктурный анализ, различные виды хроматографии, электрофорез, метод двойного лучепреломления и др. В результате этих исследований было установлено, что каждый белок имеет в своем составе известное количество определенных аминокислот, соединенных между собой в строго зафиксированной последовательности при помощи пептидных связей. Эта уникальная, специфичная для каждого белка последовательность аминокислот была определена как первичная структура белка. В настоящее время для ряда белков определена их первичная структура. Например, для инсулина — гормона поджелудочной железы белковой природы — установлена последовательность 51 аминокислотного остатка, входящего в его состав, что позволило получить его искусственным путем. На рис. 12 представлена первичная структура инсулина. Черные линии между молекулами цистеина — дисульфидные связи. В настоящее время выяснено, в какой последовательности соединяются 129 остатков аминокислот, входящих в состав рибонуклеазы — фермента, расщепляющего РНК.
 Рис. 13. Молекулярная модель полипептидной цепи, свернутой в спираль
Дальнейшие исследования показали, что полипептидная цепь находится в молекуле белков в закрученном состоянии в виде α-спирали (рис. 13). Впервые такое предположение было выдвинуто Л. Полингом и подтверждено в последующих работах экспериментально. Спирализация полипептидной цепи обеспечивается водородными связами, которые возникают между аминными и карбоксильными группами, расположенными на противоположных витках спирали. Водородная связь представляет собой соединение за счет водорода, находящегося между двумя сильно отрицательными атомами. Это видно на примере воды (пунктирная линия обозначает водородную связь, образованную между двумя атомами кислорода):
Рис. 13. Молекулярная модель полипептидной цепи, свернутой в спираль
Дальнейшие исследования показали, что полипептидная цепь находится в молекуле белков в закрученном состоянии в виде α-спирали (рис. 13). Впервые такое предположение было выдвинуто Л. Полингом и подтверждено в последующих работах экспериментально. Спирализация полипептидной цепи обеспечивается водородными связами, которые возникают между аминными и карбоксильными группами, расположенными на противоположных витках спирали. Водородная связь представляет собой соединение за счет водорода, находящегося между двумя сильно отрицательными атомами. Это видно на примере воды (пунктирная линия обозначает водородную связь, образованную между двумя атомами кислорода):
 Во вторичной структуре белков эту связь схематично можно представить следующим образом
Во вторичной структуре белков эту связь схематично можно представить следующим образом
 Стрелками обозначены водородные связи.
Стрелками обозначены водородные связи.
 Рис. 14. Участок вторичной структуры белка. Пунктирные линии обозначают водородные связи
Такое расположение полипептидной цепи было определено как вторичная структура белка. Схематично она представлена на рис 14.
Рис. 14. Участок вторичной структуры белка. Пунктирные линии обозначают водородные связи
Такое расположение полипептидной цепи было определено как вторичная структура белка. Схематично она представлена на рис 14.
 Рис. 15. Трехмерная модель гемоглобина, иллюстрирующая третичную структуру. Темные диски — гематиновые группы (по Кендрю)
Пространственное взаиморасположение участков спиралей полипептидных цепей определяется как третичная структура (рис. 15 и 16). Основным видом связи, удерживающим спирали в определенном положении, является дисульфидная связь, которая возникает между двумя молекулами цистеина:
Рис. 15. Трехмерная модель гемоглобина, иллюстрирующая третичную структуру. Темные диски — гематиновые группы (по Кендрю)
Пространственное взаиморасположение участков спиралей полипептидных цепей определяется как третичная структура (рис. 15 и 16). Основным видом связи, удерживающим спирали в определенном положении, является дисульфидная связь, которая возникает между двумя молекулами цистеина:

 Рис. 16. Третичная структура миоглобина. Направление полипептидной цепи
Это довольно прочная связь, которая может разрываться под действием сильных факторов, таких, как высокая температура — 80-90°, сильные кислоты или щелочи, алкоголь и др. При денатурации белка происходит разрыв дисульфидных связей и раскручивание полипептидной цепи (см. рис. 16).
Следует отметить, что указанные выше типы связей являются определяющими для каждого уровня организации белковой молекулы, но они встречаются и на других структурах. В молекуле белков имеются и иные типы связей, например различные ковалентные связи, силы Ван-дер-Ваальса и т. д.
Молекулы многих белков состоят из нескольких индивидуальных полипептидных цепей, определенным образом связанных друг с другом. Каждая из них может иметь свою собственную первичную, вторичную и третичную структуры. К таким белкам относится гемоглобин, молекула которого состоит из 4 полипептидных цепей и не содержит ни одного дисульфидного мостика. О таких белках говорят, что они обладают четвертичной структурой.
В зависимости от пространственною расположения полипептидной цепи (третичная структура) молекулы белков могут быть различной формы. Если полипептидная цепь уложена в виде клубка, то молекула белка имеет в сущности шаровидную форму. Такие белки называются глобулярными (лат. globulus — шарик). В другой группе белков полипептидные цепи образуют молекулы нитевидной формы и белки называются фибриллярными (лат. fibrilla — нить). Эти белки различаются и по своим свойствам. Так, глобулярные белки хорошо растворимы в воде, фибриллярные — плохо или совсем не растворимы. Представителями глобулярных белков являются яичный белок, казеин молока, белки сыворотки крови и т. д. К фибриллярным белкам относятся белки опорных тканей: белки мышц — миозин, белки костей — оссеин, кератин, крови — фибрин и др.
Рис. 16. Третичная структура миоглобина. Направление полипептидной цепи
Это довольно прочная связь, которая может разрываться под действием сильных факторов, таких, как высокая температура — 80-90°, сильные кислоты или щелочи, алкоголь и др. При денатурации белка происходит разрыв дисульфидных связей и раскручивание полипептидной цепи (см. рис. 16).
Следует отметить, что указанные выше типы связей являются определяющими для каждого уровня организации белковой молекулы, но они встречаются и на других структурах. В молекуле белков имеются и иные типы связей, например различные ковалентные связи, силы Ван-дер-Ваальса и т. д.
Молекулы многих белков состоят из нескольких индивидуальных полипептидных цепей, определенным образом связанных друг с другом. Каждая из них может иметь свою собственную первичную, вторичную и третичную структуры. К таким белкам относится гемоглобин, молекула которого состоит из 4 полипептидных цепей и не содержит ни одного дисульфидного мостика. О таких белках говорят, что они обладают четвертичной структурой.
В зависимости от пространственною расположения полипептидной цепи (третичная структура) молекулы белков могут быть различной формы. Если полипептидная цепь уложена в виде клубка, то молекула белка имеет в сущности шаровидную форму. Такие белки называются глобулярными (лат. globulus — шарик). В другой группе белков полипептидные цепи образуют молекулы нитевидной формы и белки называются фибриллярными (лат. fibrilla — нить). Эти белки различаются и по своим свойствам. Так, глобулярные белки хорошо растворимы в воде, фибриллярные — плохо или совсем не растворимы. Представителями глобулярных белков являются яичный белок, казеин молока, белки сыворотки крови и т. д. К фибриллярным белкам относятся белки опорных тканей: белки мышц — миозин, белки костей — оссеин, кератин, крови — фибрин и др.
Видовая и тканевая специфичность белков
Каждый вид животного организма отличается по количеству и составу содержащихся в нем веществ. Это в полной мере относится и к белкам. Так, при изучении состава гемоглобина разных видов животных и человека были обнаружены определенные, строго специфические различия, например в отношении входящих в его состав аминокислот. Так, в табл. 2 показано различное содержание двух аминокислот — метионина и цистеина в гемоглобине человека, собаки и крупного рогатого скота. Таблица 2. Содержание метионина и цистеина в гемоглобине в процентах
Различия обнаружены при изучении состава инсулина и ряда других белков. Наряду с этим существуют определенные различия в составе белков в зависимости от возраста. Так, у плода человека в крови обнаружен специфический вид гемоглобина, который называется фетальным. Этот вид гемоглобина после рождения практически исчезает. При изучении его структуры также были выявлены определенные изменения аминокислотного состава по сравнению с гемоглобином взрослого человека.
Эти данные свидетельствуют о том, что структура белка внутри одного вида строится по вполне определенному плану, специфичному именно для представителей данного вида.
Важно отметить, что внутри одного и того же вида имеются и индивидуальные различия в составе белка. Показано, что одни особи обладают только одним видом гемоглобина и β-лактоглобулином молока, у других встречается смесь двух различных видов этих белков. Существуют и наследственные различия в составе белков, что в ряде случаев является причиной тяжелых наследственных заболеваний.
Приведенные примеры касались в основном гемоглобина как наиболее изученного белка, но все сказанное в полной мере относится и к другим белкам.
Вопрос тканевой специфичности белков в основе своей повторяет их видовую специфичность. Белки мышечной .ткани отличаются от белков костей или печени. Это можно подтвердить на примере ферментов. Например, и в печени, и в сердечной мышце находится фермент лактатдегидрогеназа, катализирующий синтез молочной кислоты. При детальном изучении свойств ферментов оказалось, что, несмотря на их одинаковую функцию, они различаются по некоторым свойствам Таким образом, каждый вид, каждый представитель этого вида, как и любая ткань, а возможно и клетка, характеризуется наличием строго специфичных белков, определяющих их индивидуальность.
Таблица 2. Содержание метионина и цистеина в гемоглобине в процентах
Различия обнаружены при изучении состава инсулина и ряда других белков. Наряду с этим существуют определенные различия в составе белков в зависимости от возраста. Так, у плода человека в крови обнаружен специфический вид гемоглобина, который называется фетальным. Этот вид гемоглобина после рождения практически исчезает. При изучении его структуры также были выявлены определенные изменения аминокислотного состава по сравнению с гемоглобином взрослого человека.
Эти данные свидетельствуют о том, что структура белка внутри одного вида строится по вполне определенному плану, специфичному именно для представителей данного вида.
Важно отметить, что внутри одного и того же вида имеются и индивидуальные различия в составе белка. Показано, что одни особи обладают только одним видом гемоглобина и β-лактоглобулином молока, у других встречается смесь двух различных видов этих белков. Существуют и наследственные различия в составе белков, что в ряде случаев является причиной тяжелых наследственных заболеваний.
Приведенные примеры касались в основном гемоглобина как наиболее изученного белка, но все сказанное в полной мере относится и к другим белкам.
Вопрос тканевой специфичности белков в основе своей повторяет их видовую специфичность. Белки мышечной .ткани отличаются от белков костей или печени. Это можно подтвердить на примере ферментов. Например, и в печени, и в сердечной мышце находится фермент лактатдегидрогеназа, катализирующий синтез молочной кислоты. При детальном изучении свойств ферментов оказалось, что, несмотря на их одинаковую функцию, они различаются по некоторым свойствам Таким образом, каждый вид, каждый представитель этого вида, как и любая ткань, а возможно и клетка, характеризуется наличием строго специфичных белков, определяющих их индивидуальность.
Классификация белков
Все белки в зависимости от состава и структуры делятся на простые — протеины, которые состоят только из аминокислот, и сложные — протеиды, в молекуле которых, помимо белковой части, имеется еще и небелковая часть — простетическая группа.Простые белки
Представителями простых белков являются альбумины и глобулины. Эти виды белков широко представлены в организме. Альбумины и глобулины практически встречаются во всех животных и растительных клетках и в большинстве жидкостей организма (плазма крови, сыворотка молока и др.). В сыворотке крови между альбуминами и глобулинами существует определенное отношение — альбумино-глобулиновый коэффициент (показатель А/Г). По своим свойствам альбумины отличаются от глобулинов. Альбумины растворимы в воде, а глобулины — только в разбавленных растворах нейтральных солей. Молекулярный вес альбуминов меньше, чем глобулинов. Поэтому альбумины выпадают в осадок при полном насыщении водного раствора нейтральными солями, тогда как глобулины высаливаются при полунасыщении раствора. Этим свойством пользуются для получения антитоксических сывороток (противодифтерийная, противококлюшная и др.), так как антитоксины по своей химической природе являются γ-глобулинами.Сложные белки — протеиды
Как уже было отмечено, сложные белки состоят из белковой части и небелковой — простетической группы, которая может быть представлена различными соединениями. Название протеидов зависит от названия простетической группы. К сложным белкам относятся: нуклеопротеиды, небелковая часть которых представлена нуклеиновыми кислотами; хромопротеиды — сложные белки, простетическая группа которых является окрашенным соединением, фосфопротеиды, имеющие в своем составе остатки фосфорных кислот; липопротеиды и глюкопротеиды Простетическими группами последних являются соответственно жиры и углеводы.Нуклеопротеиды
Значение этого класса протеидов трудно переоценить, потому что они входят во все клетки организма и выполняют основные жизненные функции — являются носителями генетической информации и участвуют в биосинтезе белка. Белковая часть нуклеопротеидов представлена в основном протаминами и гистонами. Небелковая часть — это рибо- и дезоксирибонуклеиновые кислоты. Строение нуклеопротеидов представлено на следующей схеме: Схема 1
Нуклеопротеиды — это соединения с высоким молекулярным весом — от 25 000 до 1 000 000 и выше, состоящие из огромного числа мономеров — мононуклеотидов. Последние состоят из азотистых оснований, пентоз и остатка фосфорной кислоты.
Из пентоз в мононуклеотидах представлены рибоза и дезоксирибоза:
Схема 1
Нуклеопротеиды — это соединения с высоким молекулярным весом — от 25 000 до 1 000 000 и выше, состоящие из огромного числа мономеров — мононуклеотидов. Последние состоят из азотистых оснований, пентоз и остатка фосфорной кислоты.
Из пентоз в мононуклеотидах представлены рибоза и дезоксирибоза:
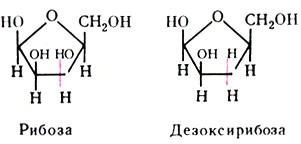 Азотистые основания являются производными пуринов или пиримидинов.
К пуриновым основаниям относятся аденин — 6-амино-пурин и гуанин — 2-амино-6-оксипурин.
Азотистые основания являются производными пуринов или пиримидинов.
К пуриновым основаниям относятся аденин — 6-амино-пурин и гуанин — 2-амино-6-оксипурин.
 Из пиримидиновых оснований в нуклеиновые кислоты входят урацил — 2,6-диоксипиримидин, тимин — 5-метилурацил и цитозин — 2-окси-6-аминопиримидин.
Из пиримидиновых оснований в нуклеиновые кислоты входят урацил — 2,6-диоксипиримидин, тимин — 5-метилурацил и цитозин — 2-окси-6-аминопиримидин.
 Эти соединения могут находиться как в кетонной, так и в энольной формах. В составе нуклеиновых кислот пиримидиновые основания представлены только кетонной формой.
Эти соединения могут находиться как в кетонной, так и в энольной формах. В составе нуклеиновых кислот пиримидиновые основания представлены только кетонной формой.
 Таким образом, мононуклеотид имеет следующую структуру:
Таким образом, мононуклеотид имеет следующую структуру:
 Адениловая кислота (аденозинмонофосфорная кислота)
Адениловая кислота (аденозинмонофосфорная кислота)
 Уридиловая кислота (урицинмонофосфорная кислота)
Мононуклеотиды могут содержать в своем составе 1, 2 или 3 остатка фосфорной кислоты. Например, аденозинмоно-, ди- и трифосфорные кислоты, которые обозначаются как АМФ, АДФ, АТФ.
Уридиловая кислота (урицинмонофосфорная кислота)
Мононуклеотиды могут содержать в своем составе 1, 2 или 3 остатка фосфорной кислоты. Например, аденозинмоно-, ди- и трифосфорные кислоты, которые обозначаются как АМФ, АДФ, АТФ.
 Аденозинтрифосфорная кислота (АТФ)
Трифосфорные кислоты этих азотистых оснований играют в организме очень большую роль, так как они являются гак называемыми макроэргическими соединениями — соединениями, богатыми энергией. Как установлено, в молекуле макроэргических соединений, например АТФ, энергия сосредоточена в химической связи между третьим остатком фосфорной кислоты и остальной частью молекулы АТФ. Эта связь называется макроэргической связью и обозначается значком ~. При распаде АТФ на АДФ и Н3РО4 выделяется энергия, которая была заключена в этой связи, примерно 8-10 ккал. Соответственно этому для синтеза АТФ, кроме АДФ и фосфорной кислоты, необходимо аналогичное количество энергии. Механизм действия других макроэргических соединений одинаков с рассмотренным
Мононуклеотиды, входящие в состав нуклеиновых кислот, соединяются между собой по типу "3-5 связи". Это означает, что соединение происходит путем образования эфирных связей между остатком фосфорной кислоты и двумя гидроксилами: одним, находящимся у 3-го углеродного атома пентозы одного мононуклеотида, и другим, расположенным у 5-го углеродного атома пентозы последующего мононуклеотида. Соединенные таким путем мононуклеотиды характеризуют первичную структуру нуклеиновых кислот.
Аденозинтрифосфорная кислота (АТФ)
Трифосфорные кислоты этих азотистых оснований играют в организме очень большую роль, так как они являются гак называемыми макроэргическими соединениями — соединениями, богатыми энергией. Как установлено, в молекуле макроэргических соединений, например АТФ, энергия сосредоточена в химической связи между третьим остатком фосфорной кислоты и остальной частью молекулы АТФ. Эта связь называется макроэргической связью и обозначается значком ~. При распаде АТФ на АДФ и Н3РО4 выделяется энергия, которая была заключена в этой связи, примерно 8-10 ккал. Соответственно этому для синтеза АТФ, кроме АДФ и фосфорной кислоты, необходимо аналогичное количество энергии. Механизм действия других макроэргических соединений одинаков с рассмотренным
Мононуклеотиды, входящие в состав нуклеиновых кислот, соединяются между собой по типу "3-5 связи". Это означает, что соединение происходит путем образования эфирных связей между остатком фосфорной кислоты и двумя гидроксилами: одним, находящимся у 3-го углеродного атома пентозы одного мононуклеотида, и другим, расположенным у 5-го углеродного атома пентозы последующего мононуклеотида. Соединенные таким путем мононуклеотиды характеризуют первичную структуру нуклеиновых кислот.
 Первичная структура ДНК
В зависимости от входящего в их состав углевода — рибозы или дезоксирибозы нуклеиновые кислоты подразделяются на рибонуклеиновые и дезоксирибонуклеиновые кислоты, или, сокращенно, РНК и ДНК. Они различаются по структуре, месту нахождения и функциям.
ДНК в основном сосредоточена в ядре (и ядрышке) клетки. Ее главная функция заключается в том, что она является носителем наследственности. Генетические особенности каждого индивидуума заключены в определенной последовательности азотистых оснований, входящих в состав первичной структуры ДНК (см. Биосинтез белка).
Первичная структура ДНК
В зависимости от входящего в их состав углевода — рибозы или дезоксирибозы нуклеиновые кислоты подразделяются на рибонуклеиновые и дезоксирибонуклеиновые кислоты, или, сокращенно, РНК и ДНК. Они различаются по структуре, месту нахождения и функциям.
ДНК в основном сосредоточена в ядре (и ядрышке) клетки. Ее главная функция заключается в том, что она является носителем наследственности. Генетические особенности каждого индивидуума заключены в определенной последовательности азотистых оснований, входящих в состав первичной структуры ДНК (см. Биосинтез белка).
 Рис. 17. Вторичная структура ДНК (двойная спираль). У — углевод (дезоксирибоза); Р — остаток фосфорной кислоты; А, Т, Г, Ц — азотистые основания
Структура ДНК имеет свои особенности. Это относится в первую очередь к азотистым основаниям. Установлено, что в молекуле ДНК встречаются следующие основания: аденин, гуанин, тимин и цитозин, которые часто обозначаются первыми буквами — А, Г, Т и Ц. При дальнейшем изучении структуры ДНК оказалось, что ее вторичная структура представляет собой двутяжную антипараллельную спираль. Схематично это напоминает винтовую лестницу (рис. 17), перила которой образованы пентозами, соединенными фосфоэфирными связями по типу "3-5 связи", а ступени — парами азотистых оснований, которые соединены между собой водородными связями. Между аденином и тимином образуются две связи, а при соединении гуанина и цитозинатри. Работами С. Очоа, Э. Чаргаффа и других были установлены определенные взаимоотношения между азотистыми основаниями, входящими в состав ДНК Они заключаются в том, что во вторичной структуре ДНК определенное пуриновое основание всегда соединяется только с вполне определенным пиримидиновым основанием. Так, аденин соединяется только с тимином, а гуанин с цитозином (или А Т и Г Ц). В основе такого соединения лежит принцип комплементарнобти дополнения (рис. 18). На рис. 17 представлен участок вторичной структуры ДНК, на котором обо значены типы связей: "3-5 связь" между отдельными мононуклеотидами и водородные связи между азотистыми основаниями.
Рис. 17. Вторичная структура ДНК (двойная спираль). У — углевод (дезоксирибоза); Р — остаток фосфорной кислоты; А, Т, Г, Ц — азотистые основания
Структура ДНК имеет свои особенности. Это относится в первую очередь к азотистым основаниям. Установлено, что в молекуле ДНК встречаются следующие основания: аденин, гуанин, тимин и цитозин, которые часто обозначаются первыми буквами — А, Г, Т и Ц. При дальнейшем изучении структуры ДНК оказалось, что ее вторичная структура представляет собой двутяжную антипараллельную спираль. Схематично это напоминает винтовую лестницу (рис. 17), перила которой образованы пентозами, соединенными фосфоэфирными связями по типу "3-5 связи", а ступени — парами азотистых оснований, которые соединены между собой водородными связями. Между аденином и тимином образуются две связи, а при соединении гуанина и цитозинатри. Работами С. Очоа, Э. Чаргаффа и других были установлены определенные взаимоотношения между азотистыми основаниями, входящими в состав ДНК Они заключаются в том, что во вторичной структуре ДНК определенное пуриновое основание всегда соединяется только с вполне определенным пиримидиновым основанием. Так, аденин соединяется только с тимином, а гуанин с цитозином (или А Т и Г Ц). В основе такого соединения лежит принцип комплементарнобти дополнения (рис. 18). На рис. 17 представлен участок вторичной структуры ДНК, на котором обо значены типы связей: "3-5 связь" между отдельными мононуклеотидами и водородные связи между азотистыми основаниями.

 Рис. 18. Двойная нить ДНК
Еще одной особенностью вторичной структуры ДНК является противоположное расположение двух цепей мононуклеотидов. На рис. 19 стрелками указано антипараллельное направление этих цепей. Рассмотренная модель вторичной структуры ДНК была впервые предложена Дж. Уотсоном и Ф. Криком.
Рис. 18. Двойная нить ДНК
Еще одной особенностью вторичной структуры ДНК является противоположное расположение двух цепей мононуклеотидов. На рис. 19 стрелками указано антипараллельное направление этих цепей. Рассмотренная модель вторичной структуры ДНК была впервые предложена Дж. Уотсоном и Ф. Криком.
 Рис. 19. Схема водородной и фосфоэфирных связей на участке вторичной структуры молекулы ДНК
Третичная структура ДНК — это расположенная в пространстве двутяжная антипараллельная спираль.
РНК обнаружена почти во всех субклеточных фракциях. Наибольшее ее количество (60-80%) сосредоточено в рибосомах, а оставшаяся часть распределена в цитоплазме и ядрышке. РНК представлена 3 видами: информационная (и-РНК), транспортная (т-РНК) и рибосомная (р-РНК), каждая из которых характеризуется специфическими свойствами и функциями. и-РНК, или матричная, является основой (матрицей) для биосинтеза белка. На и-РНК закодированы генетические особенности данного вида белка определенного органа или ткани. и-РНК строится на ДНК и, следовательно, комплементарно повторяет особенности ее структуры. т-РНК переносит активированные аминокислоты к местам биосинтеза белка — рибосомам, которые в основном построены из рибосомальной РНК (р-РНК).
Рис. 19. Схема водородной и фосфоэфирных связей на участке вторичной структуры молекулы ДНК
Третичная структура ДНК — это расположенная в пространстве двутяжная антипараллельная спираль.
РНК обнаружена почти во всех субклеточных фракциях. Наибольшее ее количество (60-80%) сосредоточено в рибосомах, а оставшаяся часть распределена в цитоплазме и ядрышке. РНК представлена 3 видами: информационная (и-РНК), транспортная (т-РНК) и рибосомная (р-РНК), каждая из которых характеризуется специфическими свойствами и функциями. и-РНК, или матричная, является основой (матрицей) для биосинтеза белка. На и-РНК закодированы генетические особенности данного вида белка определенного органа или ткани. и-РНК строится на ДНК и, следовательно, комплементарно повторяет особенности ее структуры. т-РНК переносит активированные аминокислоты к местам биосинтеза белка — рибосомам, которые в основном построены из рибосомальной РНК (р-РНК).
 Первичная структура РНК
Первичная структура РНК
 Рис. 20. Схема водородных связей на участке вторичной структуры молекулы РНК
В составе РНК обнаружены фосфорная кислота, из углеводов — рибоза вместо дезоксирибозы в ДНК и азотистые основания — аденин, гуанин, цитозин и урацил (в ДНК — тимин) — А, Г, Ц и У. Первичная структура РНК одинакова с первичной структурой ДНК и представляет собой последовательное соединение мононуклеотидов при помощи фосфоэфирных связей. Вторичная структура РНК представляет собой участки первичной структуры, перекрученные между собой в виде спирали, которые удерживаются за счет водородных связей, образованных между азотистыми основаниями по принципу комплементарное, т. е. А — У и Г — Ц. Таким образом, существует различие с ДНК, где вместо тимина к аденину присоединяется урацил (рис. 20), Третичная структура РНК — это пространственное расположение всей молекулы РНК (рис. 21).
Рис. 20. Схема водородных связей на участке вторичной структуры молекулы РНК
В составе РНК обнаружены фосфорная кислота, из углеводов — рибоза вместо дезоксирибозы в ДНК и азотистые основания — аденин, гуанин, цитозин и урацил (в ДНК — тимин) — А, Г, Ц и У. Первичная структура РНК одинакова с первичной структурой ДНК и представляет собой последовательное соединение мононуклеотидов при помощи фосфоэфирных связей. Вторичная структура РНК представляет собой участки первичной структуры, перекрученные между собой в виде спирали, которые удерживаются за счет водородных связей, образованных между азотистыми основаниями по принципу комплементарное, т. е. А — У и Г — Ц. Таким образом, существует различие с ДНК, где вместо тимина к аденину присоединяется урацил (рис. 20), Третичная структура РНК — это пространственное расположение всей молекулы РНК (рис. 21).
 Рис. 21. Участок третичной структуры молекулы РНК. 1 — участки первичной структуры, 2 — участки вторичной структуры
Рис. 21. Участок третичной структуры молекулы РНК. 1 — участки первичной структуры, 2 — участки вторичной структуры
Хромопротеиды
Небелковая часть этих сложных белков представлена окрашенными соединениями Представителями хромопротеидов в животном организме являются гемоглобин и миоглобин, а в растительных клетках — хлорофилл. К группе хромопротеидов относятся некоторые ферменты, например каталаза и пероксидаза крови. Приоритет в изучении химической природы красящего вещества гемоглобина принадлежит М. В. Ненцкому. Гемоглобин состоит из белка основного характера — глобина и небелковой части — гема, в составе которого имеется атом двухвалентного железа. В молекуле гемоглобина обнаружено 4 гема. Гемоглобин (Нb) в организме может находиться в разных формах. Оксигемоглобин — НbO2 — характеризует важнейшую биологическую функцию гемоглобина — снабжение клеток организма кислородом. Присоединение кислорода к гемоглобину происходит за счет специфических (координационных) связей с железом. При этом окисления железа не происходит и оно остается двухвалентным. Такая связь является весьма непрочной и легко разрывается при изменении парциального давления. Присоединение кислорода к гемоглобину происходит в легких, откуда кровью НbO2 разносится ко всем органам и тканям, где кислород освобождается и используется клетками. Гемоглобин же присоединяет к себе один из конечных продуктов обмена веществ, в клетках — углекислый газ — и транспортирует его к легким. Здесь СO2 отщепляется и выводится из организма при дыхании. Освободившийся гемоглобин вновь присоединяет кислород и процесс транспорта газа повторяется. Соединение гемоглобина с угарным газом — СО называется карбоксигемоглобином — НbСО. НbСО образуется при отравлении организма угарным газом и намного прочнее связывается с гемоглобином, чем кислород, и выключает таким образом гемоглобин из транспорта кислорода. Соответственно к органам и тканям поступает меньше кислорода, в результате чего возникает кислородное голодание, а снижение поступления кислорода к мозгу приводит к потере сознания. При окислении гемоглобина окислителями валентность железа изменяется и оно становится трехвалентным, а гемоглобин превращается в метгемоглобин — HbOH. Рис. 22. Спектры поглощения. 1 — солнечный спектр; 2 — оксигемоглобин; 3 — гемоглобин; 4 — карбоксигемоглобин; 5 — метгемоглобин
Одним из методов распознавания производных гемоглобина является исследование их спектров поглощения. Как установлено, при прохождении луча белого света через призму он разлагается на ряд цветных лучей, видимых на экране, от красного до фиолетового, что дает известную картину спектра, как, например, радуга. Если на пути луча между источником света и призмой поместить раствор с веществом, способным к поглощению луча с определенной длиной волны, то в определенных местах должны появиться темные, неосвещенные участки. Такой спектр называется спектром поглощения (рис. 22). Сам гемоглобин (рис. 22, 3) дает одну широкую темную полосу между линиями D и Е. НbО2 (рис. 22, 2) в этих же границах дает две темные линии, и НbCO (4) и НbОН (5) показывают свои специфические спектры поглощения.
Миоглобин — хромопротеид мышц — дыхательный пигмент мышц. Особенностью миоглобина является его более легкая способность присоединять кислород и значительно труднее по сравнению с гемоглобином его отдавать. Миоглобин создает запасы кислорода в мышцах, количество которого может достигать 14% всего кислорода организма. Это имеет важное значение, особенно для деятельности мышцы сердца. В мышцах морских животных (тюлень, морж, кашалот) высокое содержание миоглобина позволяет им длительное время находиться под водой, несмотря на отсутствие жабер.
Рис. 22. Спектры поглощения. 1 — солнечный спектр; 2 — оксигемоглобин; 3 — гемоглобин; 4 — карбоксигемоглобин; 5 — метгемоглобин
Одним из методов распознавания производных гемоглобина является исследование их спектров поглощения. Как установлено, при прохождении луча белого света через призму он разлагается на ряд цветных лучей, видимых на экране, от красного до фиолетового, что дает известную картину спектра, как, например, радуга. Если на пути луча между источником света и призмой поместить раствор с веществом, способным к поглощению луча с определенной длиной волны, то в определенных местах должны появиться темные, неосвещенные участки. Такой спектр называется спектром поглощения (рис. 22). Сам гемоглобин (рис. 22, 3) дает одну широкую темную полосу между линиями D и Е. НbО2 (рис. 22, 2) в этих же границах дает две темные линии, и НbCO (4) и НbОН (5) показывают свои специфические спектры поглощения.
Миоглобин — хромопротеид мышц — дыхательный пигмент мышц. Особенностью миоглобина является его более легкая способность присоединять кислород и значительно труднее по сравнению с гемоглобином его отдавать. Миоглобин создает запасы кислорода в мышцах, количество которого может достигать 14% всего кислорода организма. Это имеет важное значение, особенно для деятельности мышцы сердца. В мышцах морских животных (тюлень, морж, кашалот) высокое содержание миоглобина позволяет им длительное время находиться под водой, несмотря на отсутствие жабер.
Глюкопротеиды
Это сложные белки, простетическая группа которых представлена производными углеводов, среди которых встречаются аминосахара, гексуроновые кислоты и др. В составе отдельных глюкопротеидов обнаружены остатки серной и уксусной кислот Глюкопротеиды составляют основу муцинов — слизистых веществ, которые встречаются в большом количестве в секретах желудочно-кишечного тракта, подчелюстной слюнной железы.Фосфопротеиды
Соединения этого класса сложных белков характеризуются наличием фосфорной кислоты. Представителями являются казеиноген молока, вителлин — белок, выделенный из желтков яиц, ихтулин — белок рыбьей икры и др. Фосфопротеиды являются питательным материалом для растущих организмов.Липопротеиды
Липопротеиды представляют собой комплексные соединения белка и различных жиров (холестерина, нейтрального жира, фосфолипидов и др.). У растворимых липопротеидов белковая часть расположена на поверхности молекулы. В организме различные их фракции, например α- и β-липопротеиды, обнаружены в составе плазмы крови, нервной ткани, а также в яичном желтке, молоке. Одной из основных функций липопротеидов является транспорт жира. Концентрация липопротеидов в сыворотке крови меняется при отдельных заболеваниях, поэтому их определение имеет диагностическое значение, как, например; при атеросклерозе, когда увеличено содержание β-липопротеидов.Вопросы для повторения
1. Дайте определение белков. 2. Назовите основные функции белков. 3. Чем отличаются по элементарному составу белки от углеводов и жиров? 4. Каковы основные свойства белков? 5. Что такое изоэлектрическая точка белков? 6. Изоэлектрическая точка большинства природных белков рН 4,8. Какие аминокислоты преобладают в их составе (моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые)? 7. Какие факторы обеспечивают устойчивость белковой молекулы в растворе? 8. Какие изменения в белковой молекуле происходят при ее денатурации? 9. Что такое гидролиз? Какие известны виды гидролизу? 10. Сколько всего аминокислот (учитывая их повторение) содержится в белковой молекуле? 11. Как классифицируются аминокислоты? 12. Что понимают под первичной структурой белков? 13. Какая связь формирует первичную структуру белков? 14. Что такое вторичная, третичная структура белков? 15. Какие типы связей являются характерными для вторичной, третичной структуры белков? 16. Что такое видовая, тканевая специфичность белков? 17. Дайте определение простым и сложным белкам. Приведите примеры. 18. Что такое простетическая группа? Приведите примеры. 19. Что такое нуклеопротеиды? Из чего они состоят? 20. Какие известны нуклеиновые кислоты? Как они построены? 21. Назовите основные функции ДНК, РНК. 22. Что представляют собой хромопротеиды? Какие хромоирогеиды встречаются в растительных и животных организмах? 23. Какова роль гемоглобина? 24. Какова валентность железа в гемоглобине, оксигемоглобине, карбоксигемоглобине, метгемоглобине? 25. Что входит в состав простетической группы глюкопротеидон, липопротеидов, фосфопротеидов?II. Витамины
"Трудно найти такой раздел физиологии и биохимии, который бы не соприкасался с учением о витаминах: обмен веществ, деятельность органов чувств, функции нервной системы, явления роста и размножения — все эти и многие другие разнообразные и коренные по своей важности области биологической науки теснейшим образом связаны с витаминами",- так определил значение витаминов один из основоположников отечественной биохимии академик А. М. Бах.Общая характеристика витаминов
Что же такое витамины? Это низкомолекулярные органические вещества, которые у человека практически не синтезируются, но которые в минимальных дозах (в мг или даже мкг) оказывают на организм мощное биологическое влияние через участие в деятельности ферментов, в частности, входя в состав их коферментов. Основными источниками витаминов являются продукты питания и микроорганизмы, в клетках которых они синтезируются. Поэтому потребность человека в витаминах обеспечивается за счет пищи, а в последнее время и за счет синтезированных искусственным путем препаратов витаминов. Однако некоторые витамины могут быть образованы и в организме человека из своих предшественников, которые называются провитаминами. Так, витамин РР синтезируется из своего провитамина — аминокислоты триптофана, витамин D3- из 7-дегидрохолестерина. В настоящее время получены вещества, которые имеют подобную витаминам химическую структуру, но обладают прямо противоположным действием. Они названы антивитаминами. Введение антивитамина вызывает развитие тяжелой недостаточности соответствующего витамина (механизм их действия будет рассмотрен ниже). Примером может служить окситиамин — антивитамин тиамина (витамина B1). История развития учения о витаминах уходит в далекое прошлое и связана с изучением заболеваний, возникающих, как теперь установлено, в связи с недостаточностью отдельных витаминов. О таких заболеваниях было известно давно. К древним временам относятся сведения о куриной слепоте — слепоте в ночное время. Бичом мореплавателей длительных экспедиций была цинга, в странах Латинской Америки, Испании, Румынии свирепствовала пеллагра, в Японии, Индокитае, Индонезии сотни и тысячи человеческих жизней уносила болезнь бери-бери, и настоящей эпидемией, собиравшей "обильный урожай человеческих жизней", была пернициозная (злокачественная) анемия. Однако о причинах этих и ряда других аналогичных заболеваний долгое время было известно очень мало. Начало изучению витаминов было положено русским врачом Н. И. Луниным, который в 1888 г. на основании длительных опытов установил, что для нормального роста и развития животного организма, помимо белков, жиров, углеводов, минеральных веществ и воды, необходимы еще какие-то, пока неизвестные вещества. Отсутствие этих веществ приводит животный организм к гибели. Голландский врач Эйкман (1896), работая на острове Ява, обнаружил, что среди коренного населения острова процент заболевания бери-бери был выше среди лиц, питавшихся полированным, очищенным от оболочки рисом, чем среди людей, употреблявших неочищенный рис. В опытах он- установил, что при кормлении кур полированным рисом у них возникали симптомы, аналогичные проявлениям болезни у человека. Добавляя к пище водный экстракт из отрубей риса, Эйкман добился излечения этого заболевания. В 1909 г. английский ученый Степп в опытах на животных показал, что кормление мышей черным хлебом, обработанным спиртом и эфиром, приводило их к гибели. Добавление спиртовых и эфирных экстрактов, полученных из черного хлеба, к пище другой группы мышей предохраняло их от смерти. Автор сделал вывод о том, что в спиртово-эфирный экстракт вместе с жирами переходят какие-то вещества, весьма необходимые для жизни. Этот жировой фактор Степп назвал фактором А, который впоследствии получил наименование витамина А. В 1912 г. польский ученый К. Функ впервые выделил в чистом виде из отрубей риса вещество, которое имело в своем составе аминную группу и излечивало от заболевания бери-бери. Это вещество он назвал "витамин" (лат. vita — жизнь), подчеркнув этим его огромное значение. Холя это название не соответствует сущности, так как большинство витаминов не имеет в своем составе аминную группу, оно сохранилось, и теперь витаминами называют те дополнительные содержащиеся в пище факторы, недостаток которых приводит к развитию специфических заболеваний. В настоящее время известно более 20 витаминов, большинство из которых получено синтетически. При изучении их свойств было обнаружено, что все они являются жизненно важными веществами, хотя и не выполняют ни энергетических, ни пластических функций. Это связано с тем, что витамины проявляют свое действие, участвуя в построении ферментов. На это обратил внимание еще в 1921 г. акад. Н. Д. Зелинский, который писал, что "...эти вещества вызывают в клетках организма деятельность, подобную той, какая обусловливается ферментами... и далее. Связь между ферментами и витаминами, возможно, выражается в том, что последние необходимы как строительный материал для первых"[2]. Научное предвидение Зелинского в дальнейшем полностью подтвердилось. Сейчас для многих витаминов известны не только ферменты, в составе которых они обнаружены, но и детальный механизм их действия.Виды витаминной недостаточности
Полное отсутствие в организме какого-либо витамина является причиной авитаминоза — тяжелого поражения всего организма, с симптомами, характерными для каждого витамина. Чаще встречаются случаи частичной недостаточности витаминов — гиповитаминозы, которые могут быть первичными и вторичными. Первичные гиповитаминозы возникают в результате недостаточного поступления того или иного витамина с пищей. Такие состояния возникают, например, при однообразном и неполноценном питании. Примером может служить питание народов ряда стран Южной Америки и Африки кукурузой (маисом), которая является основным продуктом питания. В некоторых странах большую роль играют религиозные запреты, касающиеся источников полноценной пищи (продуктов животного происхождения). Предрасполагающими моментами в развитии гиповитаминозов являются состояния беременности и кормления, периода роста, когда возрастает потребность в регулярном снабжении витаминами. Вторичные гиповитаминозы являются следствием ряда инфекционных, хронических заболеваний, нарушений процессов всасывания. Для гиповитаминозов характерны следующие общие симптомы: легкое недомогание, понижение работоспособности, ослабление памяти, понижение резистентности организма. Гиповитаминозы у детей приводят к замедлению роста и развития ребенка. Поэтому полная обеспеченность организма всеми необходимыми витаминами является одним из важнейших условий сохранения его нормальной жизнедеятельности. Снабжение витаминами приобретает особое значение в конце зимы и весной, когда организм истощает свои запасы витаминов и значительно снижена "витаминная кладовая" продуктов питания. При избыточном потреблении витаминов развиваются, гипервитаминозы, которые специфичны для жирорастворимых витаминов. Они обладают способностью накапливаться в организме и проявлять токсическое действие.Классификация витаминов
Все витамины обозначаются буквами латинского алфавита: А, В, С, D и т. д. Наряду с этим витамины называют по производимому ими действию. Например, витамин А — антиксерофтальмический, витамин РР — антипеллагрический, витамин D — антирахитический и пр. В настоящее время принято решение называть витамины по их химической структуре: витамин В1 — тиамин, витамин В12 — цианкобаламин и т. д. По своей способности растворяться в воде или жирах все витамины делятся на 2 группы: 1. водорастворимые витамины — витамины группы В, витамины С, Р и др.; 2. жирорастворимые витамины, к которым относятся витамины группы A, D, Е, К.Водорастворимые витамины
Характерной особенностью витаминов группы В является относительно изученный механизм их действия. Почти для каждого витамина известна его активная форма, которая участвует в построении определенного фермента, входя в состав его кофермента. Витамины группы В в основном не синтезируются в организме человека.Тиамин — витамин B1
Этот витамин впервые получил в чистом виде К. Функ. Его химическая структура характеризуется наличием амин-ной группы и атома серы: Спиртовая группа витамина обусловливает его способность образовывать с кислотами сложные эфиры. Так, с двумя молекулами фосфорной кислоты тиамин образует сложный эфир — тиамин-пирофосфат, который является коферментом декарбоксилаз. Эти ферменты катализируют окислительное декарбоксилирование пировиноградной кислоты и других кетокислот. При этом пировиноградная кислота превращается в активную уксусную кислоту (ацетилКоА), которая является основным энергетическим материалом организма.
Помимо этого, тйаминпирофосфат (ТПФ) блокирует аце-тилхолинэстеразу (фермент, расщепляющий ацетилхолин, передатчик нервных импульсов), участвует в процессах образования жиров из белков и т. д.
Спиртовая группа витамина обусловливает его способность образовывать с кислотами сложные эфиры. Так, с двумя молекулами фосфорной кислоты тиамин образует сложный эфир — тиамин-пирофосфат, который является коферментом декарбоксилаз. Эти ферменты катализируют окислительное декарбоксилирование пировиноградной кислоты и других кетокислот. При этом пировиноградная кислота превращается в активную уксусную кислоту (ацетилКоА), которая является основным энергетическим материалом организма.
Помимо этого, тйаминпирофосфат (ТПФ) блокирует аце-тилхолинэстеразу (фермент, расщепляющий ацетилхолин, передатчик нервных импульсов), участвует в процессах образования жиров из белков и т. д.
 Рис. 23. Судороги у голубя при авитаминозе В1
При отсутствии витамина В1 в организме развивается болезнь — специфический полиневрит, известный под названием "бери-бери" (рис, 23, 24). Причиной этого является нарушение дальнейших превращений пировиноградной кислоты и ее накопление, особенно в миокарде, мозге, печени, почках, что приводит к различным нарушениям обмена веществ (рис. 23). Заболевание проявляется следующими клиническими симптомами: специфическим поражением нервных стволов, болезненностью в области сердца и учащением его ритма, развитием отеков на нижних конечностях, животе, ослаблением перистальтики и секреции желудка, появлением запоров, судорог, параличами мышц с последующей их атрофией (рис. 24).
Рис. 23. Судороги у голубя при авитаминозе В1
При отсутствии витамина В1 в организме развивается болезнь — специфический полиневрит, известный под названием "бери-бери" (рис, 23, 24). Причиной этого является нарушение дальнейших превращений пировиноградной кислоты и ее накопление, особенно в миокарде, мозге, печени, почках, что приводит к различным нарушениям обмена веществ (рис. 23). Заболевание проявляется следующими клиническими симптомами: специфическим поражением нервных стволов, болезненностью в области сердца и учащением его ритма, развитием отеков на нижних конечностях, животе, ослаблением перистальтики и секреции желудка, появлением запоров, судорог, параличами мышц с последующей их атрофией (рис. 24).
 Рис. 24. Атрофия мышц при бери-бери
Гиповитаминоз витамина B1 проявляется быстрой утомляемостью, повышенной раздражительностью,, снижением аппетита, мышечной слабостью и понижением резистентности организма.
В значительных количествах витамин В1 содержится в отрубях злаковых, хлебе грубого помола, дрожжах. Из продуктов животного происхождения витамином богаты печень, почки, сердце.
Суточная потребность составляет 1-3 мг.
Рис. 24. Атрофия мышц при бери-бери
Гиповитаминоз витамина B1 проявляется быстрой утомляемостью, повышенной раздражительностью,, снижением аппетита, мышечной слабостью и понижением резистентности организма.
В значительных количествах витамин В1 содержится в отрубях злаковых, хлебе грубого помола, дрожжах. Из продуктов животного происхождения витамином богаты печень, почки, сердце.
Суточная потребность составляет 1-3 мг.
Рибофлавин — витамин В2
Химическая структура витамина В2 довольно сложная. Он состоит из спирта рибитола и изоаллоксазина и обладает высокой специфичностью: Биологическое значение рибофлавина заключается в том, что он участвует в построении коферментов (флавинаденинмоно- и динуклеотидов), которые входят в состав флавиновых ферментов. Они катализируют процессы тканевого дыхания, дезаминирования аминокислот, синтеза и распада жирных кислот и т. д. Таким образом, витамин В2 контролирует важные процессы обмена веществ в организме.
Авитаминоз витамина В2 проявляется задержкой роста, дерматитом (рис. 25), васкуляризацией роговицы (прорастание роговицы глаза кровеносными сосудами), выпадением волос, атрофией сосочков языка (глоссит), урежением пульса. Со стороны нервной системы авитаминоз характеризуется параличами и судорогами.
Биологическое значение рибофлавина заключается в том, что он участвует в построении коферментов (флавинаденинмоно- и динуклеотидов), которые входят в состав флавиновых ферментов. Они катализируют процессы тканевого дыхания, дезаминирования аминокислот, синтеза и распада жирных кислот и т. д. Таким образом, витамин В2 контролирует важные процессы обмена веществ в организме.
Авитаминоз витамина В2 проявляется задержкой роста, дерматитом (рис. 25), васкуляризацией роговицы (прорастание роговицы глаза кровеносными сосудами), выпадением волос, атрофией сосочков языка (глоссит), урежением пульса. Со стороны нервной системы авитаминоз характеризуется параличами и судорогами.
 Рис. 25. Арибофлавиноз у человека. 1 — до лечения; 2 после лечения рибофлавином
Гиповитаминоз проявляется развитием аналогичных признаков в более слабой степени.
Источниками, богатыми витамином В2, являются продукты растительного происхождения, дрожжи, бобы. Много витамина в молоке, сыре, яйцах, мясе.
Потребность в сутки для взрослых людей составляет 1,5-2,5 мг.
Рис. 25. Арибофлавиноз у человека. 1 — до лечения; 2 после лечения рибофлавином
Гиповитаминоз проявляется развитием аналогичных признаков в более слабой степени.
Источниками, богатыми витамином В2, являются продукты растительного происхождения, дрожжи, бобы. Много витамина в молоке, сыре, яйцах, мясе.
Потребность в сутки для взрослых людей составляет 1,5-2,5 мг.
Никотиновая кислота — витамин РР
Никотиновая кислота была известна давно, однако о ее витаминных свойствах впервые упоминается в 20-х годах нашего столетия, когда Гольдбергер применил никотиновую кислоту для лечения пеллагроподобного заболевания у собак ("черный язык") и получил хорошие результаты. Витамин РР (антипеллагрический) представляет собой по химической структуре производное пиридина и имеет следующую структуру: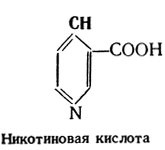 Витаминной активностью также обладает и его амид — никотинамид:
Витаминной активностью также обладает и его амид — никотинамид:
 Биологическое значение никотинамида заключается в том, что он является составной частью коферментов НАД и НАДФ (никотинамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат). Последние входят в состав дегидрогеназ — ферментов, которые катализируют реакции биологического окисления, участвуют в процессах распада углеводов, синтеза жирных кислот и фосфолипидов, обмене аминокислот и др. В организме витамин РР синтезируется из аминокислоты триптофана (провитамин РР).
Авитаминоз никотиновой кислоты проявляется пеллагрой.
Биологическое значение никотинамида заключается в том, что он является составной частью коферментов НАД и НАДФ (никотинамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат). Последние входят в состав дегидрогеназ — ферментов, которые катализируют реакции биологического окисления, участвуют в процессах распада углеводов, синтеза жирных кислот и фосфолипидов, обмене аминокислот и др. В организме витамин РР синтезируется из аминокислоты триптофана (провитамин РР).
Авитаминоз никотиновой кислоты проявляется пеллагрой.
 Рис. 26. Пеллагра. Специфический дерматит, располагающийся симметрично на не защищенных одеждой поверхностях тела (по Гаррису)
Это заболевание характеризуется появлением специфических дерматитов на открытых частях тела (лицо, шея, руки), т. е. на тех участках, которые подвергаются воздействию солнечной радиации (рис. 26). Пеллагра сопровождается диареей (сильными поносами), деменцией (кратковременной потерей памяти). Поэтому пеллагру часто называют болезнью "трех D" — понимая йод этим ее три основные симптома — дерматит,диарею, деменцию. Кроме этого, отмечаются воспаления слизистой оболочки ротовой полости, нарушения сердечно-сосудистой системы и т. д.
Витамин РР содержится в больших количествах в отрубях, пивных дрожжах, печени, мясе.
В сутки для человека необходимо 15-20-25 мг в зависимости от рода трудовой деятельности, возраста и пола.
Потребность организма в витамине РР может быть в значительной мере покрыта за счет триптофана.
Рис. 26. Пеллагра. Специфический дерматит, располагающийся симметрично на не защищенных одеждой поверхностях тела (по Гаррису)
Это заболевание характеризуется появлением специфических дерматитов на открытых частях тела (лицо, шея, руки), т. е. на тех участках, которые подвергаются воздействию солнечной радиации (рис. 26). Пеллагра сопровождается диареей (сильными поносами), деменцией (кратковременной потерей памяти). Поэтому пеллагру часто называют болезнью "трех D" — понимая йод этим ее три основные симптома — дерматит,диарею, деменцию. Кроме этого, отмечаются воспаления слизистой оболочки ротовой полости, нарушения сердечно-сосудистой системы и т. д.
Витамин РР содержится в больших количествах в отрубях, пивных дрожжах, печени, мясе.
В сутки для человека необходимо 15-20-25 мг в зависимости от рода трудовой деятельности, возраста и пола.
Потребность организма в витамине РР может быть в значительной мере покрыта за счет триптофана.
Пиридоксол витамин В6
Витамин В6 по химической природе представляет собой производное пиридоксина. Биологически активным действием обладают два его аналога — пиридоксаль и ииридоксамин: Для организма эти соединения имеют очень большое значение. Фосфорный эфир пиридоксаля — фосфопиридоксаль как кофермент принимает участие в процессах декарбоксилирования, переаминирования, пересульфирования аминокислот, синтеза пуриновых оснований, гемоглобина, креатина, обмена жира.
Для организма эти соединения имеют очень большое значение. Фосфорный эфир пиридоксаля — фосфопиридоксаль как кофермент принимает участие в процессах декарбоксилирования, переаминирования, пересульфирования аминокислот, синтеза пуриновых оснований, гемоглобина, креатина, обмена жира.
 Авитаминоз витамина В6 проявляется дерматитами, гипохромной анемией, поражением селезенки и зобной железы. У животных наблюдается отставание роста и поражение центральной нервной системы, которое проявляется в развитии судорог (рис. 27). Нарушаются процессы всасывания аминокислот и витамина В12.
Авитаминоз витамина В6 проявляется дерматитами, гипохромной анемией, поражением селезенки и зобной железы. У животных наблюдается отставание роста и поражение центральной нервной системы, которое проявляется в развитии судорог (рис. 27). Нарушаются процессы всасывания аминокислот и витамина В12.
 Рис. 27. В6-авитаминоз у хомяков. 1 хомяк в возрасте 3 [3]/2 месяцев, не получавший пиридоксина; 2 контрольный хомяк того же возраста, ежедневно получавший но 50 ммк витамина В6
Гиповитаминоз характеризуется потерей аппетита, тошнотой, слабостью, развитием дерматитов на коже, потерей памяти, воспалением нервов.
Витамин В6 содержится в больших количествах в пшеничных отрубях, пивных дрожжах, ячмене, кукурузе, печени, мясе.
Суточная потребность витамина составляет 2-3 мг.
Рис. 27. В6-авитаминоз у хомяков. 1 хомяк в возрасте 3 [3]/2 месяцев, не получавший пиридоксина; 2 контрольный хомяк того же возраста, ежедневно получавший но 50 ммк витамина В6
Гиповитаминоз характеризуется потерей аппетита, тошнотой, слабостью, развитием дерматитов на коже, потерей памяти, воспалением нервов.
Витамин В6 содержится в больших количествах в пшеничных отрубях, пивных дрожжах, ячмене, кукурузе, печени, мясе.
Суточная потребность витамина составляет 2-3 мг.
Панготеновая кислота
Биологическое значение пантотеновой кислоты для организма состоит в том, что она входит в состав коэнзима А, обеспечивающего важнейшие реакции организма — реакции апеллирования. Так, он участвует в синтезе ацетилКоА функции которого весьма широки. Последний участвует в синтезе холестерина, жирных кислот, стероидных гормонов, ацетилхолина, гемоглобина, является основным источником энергии для организма.
функции которого весьма широки. Последний участвует в синтезе холестерина, жирных кислот, стероидных гормонов, ацетилхолина, гемоглобина, является основным источником энергии для организма.
 Рис. 28. Пантотеновая недостаточность у свиней. Явление острого дерматита (по Эвансу)
Пантотеновая кислота необходима для человека и животных с целью предупреждения авитаминоза, при котором нарушается деятельность сердца, нервной системы, почек, желудочно-кишечного тракта, развиваются дерматиты, депигментация (обесцвечивание) волос, снижение аппетита и т. д. (рис. 28).
Источниками пантотеновой кислоты являются мясо, яйца, молоко, отруби, дрожжи, капуста, картофель
Потребность составляет для взрослых 10 мг в сутки, для детей — 15-20 мг.
Рис. 28. Пантотеновая недостаточность у свиней. Явление острого дерматита (по Эвансу)
Пантотеновая кислота необходима для человека и животных с целью предупреждения авитаминоза, при котором нарушается деятельность сердца, нервной системы, почек, желудочно-кишечного тракта, развиваются дерматиты, депигментация (обесцвечивание) волос, снижение аппетита и т. д. (рис. 28).
Источниками пантотеновой кислоты являются мясо, яйца, молоко, отруби, дрожжи, капуста, картофель
Потребность составляет для взрослых 10 мг в сутки, для детей — 15-20 мг.
Цианкобаламин — витамин В12
Витамин В12 был открыт только в 1948 г. Структурной основой цианкобаламина является ядро, состоящее из 4 пиррольных колец, сходное с порфириновым скелетом гема гемоглобина и соединенное с группой CN и атомом кобальта. Содержание кобальта в витамине В12 доходит до 4%. Биохимические функции витамина В12 окончательно еще не выяснены. Но то, что известно, характеризует его как витамин, который участвует во многих обменных процессах организма и обладает высокой биологической активностью. Витамин В12 относится к самым мощным антианемическим факторам, при его недостатке у человека развивается злокачественная анемия (болезнь Аддисона — Бирмера). Экспериментальные данные свидетельствуют о его участии в регуляции аминокислотного и белкового обмена. Так, наблюдалось увеличение содержания общего азота и нуклеиновых кислот в печени и снижение до нормы повышенной) уровня мочевины у животных, получавших витамин В12. По-видимому, также он играет важную роль в обмене метильной группы, участвуя в процессах ее синтеза. Витамин В12 следует рассматривать и как катализатор в синтезе пуриновых оснований. Этот витамин принимает участие в обмене углеводов и жиров. В последнем случае отмечается его действие, направленное на предупреждение развития жирового перерождения печени (липотропный фактор). Витамин В12 имеет отношение к превращению фолиевой кислоты в ее активированную форму и всасыванию каротина. Основным местом его накопления в организме является печень, где происходят многие процессы, в которых витамину В12 принадлежит первостепенная роль. Таким образом, витамин В12 имеет большое значение в процессах стимуляции и регулирования кроветворения, в обмене белков, жиров, углеводов, некоторых витаминов (фолиевая кислота и др.), принимает участие в осуществлении важнейших биохимических процессов в печени, обеспечивает обмен липидов и нуклеиновых кислот в нервной системе Витамин В12 (его также называют "внешним фактором" Кастла), поступая в желудок, соединяется с гастромукопротеидом ("внутренний фактор" Кастла) — соединение белка и сложного полисахарида — мукополисахарида. Этот белково-углеводный комплекс предохраняет В12 от использования его микробами, для которых он является существенным фактором обмена веществ. На поверхности слизистой оболочки кишечника витамин В12 освобождается от связи с гастромукопротеидом и соединяется со специфическим белком, содержащимся в слизистой оболочке кишечника, и в таком виде всасывается. Авитаминоз витамина В12 проявляется заболеванием под названием злокачественная (пернициозная) анемия или "анемия Аддисона — Бирмера". Это нервно-дистрофическое заболевание с преимущественным поражением пищеварительного тракта, органов кроветворения и нервной системы. Ведущим симптомом является резкое уменьшение количества эритроцитов, снижение уровня гемоглобина, появление незрелых форменных элементов крови, угнетение образования лейкоцитов. Заболеванию всегда сопутствуют понижение или полное отсутствие в желудке соляной кислоты. При изучении данного заболевания было установлено, что авитаминоз возникает в результате нарушения всасывания витамина В12. При этом в желудке не вырабатывается "внутренний фактор" Кастла и витамин В12 в основном используется микрофлорой желудочно-кишечного тракта. В результате витаминной недостаточности и развивается клиническая картина злокачественной анемии. При лечении необходимо вводить больному витамин В12 вместе с желудочным соком здорового человека. Источниками витамина В12 являются продукты только животного происхождения и микроорганизмы. Наиболее богаты витамином печень, молоко, яйца, почки. Суточная потребность составляет 1-3 мкг.Фолиевая кислота
Этот витамин был открыт в 1947 г как фактор роста ряда бактерий В дальнейшем было установлено, что недостаток фолиевой кислоты приводит к развитию анемии (макроцитарной) у людей, птиц, обезьян. Особенно часто анемия встречается в Индии и Африке, т. е. там, где в рационе людей содержится мало животного белка. Химическая структура витамина является сложной. В его составе обнаружен птеридин, параамннобензойная кислота и несколько остатков глютаминовой кислоты. Биологической активностью обладают аналоги фолиевой кислоты, такие, как тетрагидрофолиевая кислота и др. Их действие на организм крайне разнообразно. Они стимулируют процесс кроветворения. При витаминной недостаточности нарушаются процессы образования форменных элементов крови, тормозится синтез гемоглобина. Фолиевая кислота способствует использованию организмом глютаминовой кислоты, тирозина и всасывания витамина В12. Как и витамин В12, фолиевая кислота необходима для синтеза метальных групп. Ферменты, в составе которых предполагается участие фолиевой кислоты, катализируют перенос одноуглеродистых компонентов типа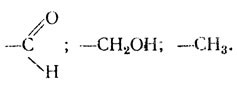 Таким образом, биологическое значение фолиевой кислоты для организма выражается в обеспечении нормального кроветворения, в участии в синтезе нуклеиновых кислот, в обмене белков, в том числе в образовании метильных групп
Авитаминоз характеризуется нарушением кроветворения с явлениями кровоточивости слизистых оболочек рта, десен и кишечника, поражением желудочно-кишечного тракта, развитием дерматитов.
Источниками фолиевой кислоты для человека является пища, в том числе дрожжи, печень, цветная капуста, фасоль, и эндогенный синтез этого витамина бактериями кишечника. Высоким содержанием отличаются зеленые листья, от которых (лат. folium — лист) этот витамин и получил свое название.
Доказательством эндогенного синтеза фолиевой кислоты у человека служит то обстоятельство, что ее выделение с калом превышает поступление с пищей в 4-6 раз. Последнее указывает на основное место синтеза фолиевой кислоты — кишечник.
Потребность составляет 0,1-0,2 мг в день.
Таким образом, биологическое значение фолиевой кислоты для организма выражается в обеспечении нормального кроветворения, в участии в синтезе нуклеиновых кислот, в обмене белков, в том числе в образовании метильных групп
Авитаминоз характеризуется нарушением кроветворения с явлениями кровоточивости слизистых оболочек рта, десен и кишечника, поражением желудочно-кишечного тракта, развитием дерматитов.
Источниками фолиевой кислоты для человека является пища, в том числе дрожжи, печень, цветная капуста, фасоль, и эндогенный синтез этого витамина бактериями кишечника. Высоким содержанием отличаются зеленые листья, от которых (лат. folium — лист) этот витамин и получил свое название.
Доказательством эндогенного синтеза фолиевой кислоты у человека служит то обстоятельство, что ее выделение с калом превышает поступление с пищей в 4-6 раз. Последнее указывает на основное место синтеза фолиевой кислоты — кишечник.
Потребность составляет 0,1-0,2 мг в день.
Аскорбиновая кислота — витамин С
Авитаминоз витамина С — цинга — был известен давно. В период средневековья эта болезнь считалась одной из самых тяжелых. Даже при исследовании ископаемых людей на территории Скандинавии у них были, обнаружены характерные для цинги изменения костей. Еще в конце прошлого столетия русский патолог В. В. Пашутин в эксперименте установил, что цинга возникает в результате отсутствия в растительной пище определенного фактора, которому Друммонд в 1919 г. дал название "витамин С" (антицинготный витамин). Структура последнего была установлена только в 1938 г. Аскорбиновая кислота является сильным восстановителем и легко может переходить в дегидроформу — дегидроаскорбиновую кислоту.
Пока не изучены ферменты, в состав которых входит данный витамин, однако хорошо известно его биологическое значение. Одной из основных функций аскорбиновой кислоты является участие в образовании соединений (коллаген), входящих в состав основного промежуточного вещества эндотелия сосудов, соединительной ткани, дентина, хряща, кости. Витамин С обладает способностью обезвреживать токсины (дифтерицный, туберкулезный, дизентерийный и др.). Этот процесс происходит в печени. Аскорбиновая кислота способствует всасыванию железа из кишечника. Она участвует в обмене нуклеиновых кислот, имеет важное значение в окислении ароматических аминокислот, связана с синтезом и обменом гормонов коры надпочечников и щитовидной железы. Витамину С принадлежит значительная роль в поддержании сопротивляемости организма инфекционным заболеваниям.
Аскорбиновая кислота является сильным восстановителем и легко может переходить в дегидроформу — дегидроаскорбиновую кислоту.
Пока не изучены ферменты, в состав которых входит данный витамин, однако хорошо известно его биологическое значение. Одной из основных функций аскорбиновой кислоты является участие в образовании соединений (коллаген), входящих в состав основного промежуточного вещества эндотелия сосудов, соединительной ткани, дентина, хряща, кости. Витамин С обладает способностью обезвреживать токсины (дифтерицный, туберкулезный, дизентерийный и др.). Этот процесс происходит в печени. Аскорбиновая кислота способствует всасыванию железа из кишечника. Она участвует в обмене нуклеиновых кислот, имеет важное значение в окислении ароматических аминокислот, связана с синтезом и обменом гормонов коры надпочечников и щитовидной железы. Витамину С принадлежит значительная роль в поддержании сопротивляемости организма инфекционным заболеваниям.
 Рис. 29. Цинготный больной. Точечные и пятнистые кровоизлияния на туловище и конечностях (по Ашоферу и Коху)
Отсутствие витамина С в пище приводит к развитию цинги, которая проявляется точечными кровоизлияниями (петехиями) на теле (рис. 29) и внутренних органах, кровоточивостью десен, выпадением зубов (рис. 30). Возникают нарушения образования костей, развивается одышка, болезненность в области сердца.
Рис. 29. Цинготный больной. Точечные и пятнистые кровоизлияния на туловище и конечностях (по Ашоферу и Коху)
Отсутствие витамина С в пище приводит к развитию цинги, которая проявляется точечными кровоизлияниями (петехиями) на теле (рис. 29) и внутренних органах, кровоточивостью десен, выпадением зубов (рис. 30). Возникают нарушения образования костей, развивается одышка, болезненность в области сердца.
 Рис. 30. Цинга. Явления гингивита (по Бикнелу и Прескотту)
Богатыми источниками витамина С являются плоды шиповника, черная смородина, цитрусовые, свежие овощи, картофель, томаты.
Потребность витамина С в сутки составляет 50-100 мг. Один стакан томатного сока обеспечивает суточную потребность организма в витамине С. Особенностью витамина С является его быстрая окисляемость. Так, в организме человека в течение 16 дней он полностью окисляется, поэтому необходимо ежедневное введение витамина С.
Рис. 30. Цинга. Явления гингивита (по Бикнелу и Прескотту)
Богатыми источниками витамина С являются плоды шиповника, черная смородина, цитрусовые, свежие овощи, картофель, томаты.
Потребность витамина С в сутки составляет 50-100 мг. Один стакан томатного сока обеспечивает суточную потребность организма в витамине С. Особенностью витамина С является его быстрая окисляемость. Так, в организме человека в течение 16 дней он полностью окисляется, поэтому необходимо ежедневное введение витамина С.
Витамин Р
Физиологическое действие витамина Р состоит в повышении устойчивости и снижении проницаемости стенки капилляров. В природе он встречается в продуктах, содержащих витамин С, таких, как черная смородина, апельсины, лимоны, шиповник, чай.Биотин
Впервые биотин был выделен из куриного желтка. Биологическое действие биотина заключается в его участии в составе ферментов, которые обеспечивают активирование СО2 и связанный с ним синтез жирных кислот, холестерина, азотистых оснований нуклеиновых кислот, обмен отдельных аминокислот и т. д. Авитаминоз биотина проявляется задержкой роста, дерматитами, выпадением волос, мышечными болями, потерей аппетита и нарушением психики. Фактически у человека авитаминоза биотина не бывает, так как последний синтезируется микрофлорой кишечника. Потребность в сутки составляет 150-300 мкг.Жирорастворимые витамины
К этой группе витаминов относятся витамины групп А, D, Е, К. Каждая группа витаминов включает ряд соединений, имеющих близкую химическую структуру и обладающих примерно одинаковым биологическим действием. Так, в группе витамина А отмечают витамины A1 и А2; в группе витамина Е — 4 витамина, а в группе витамина D их насчитывают около 10. Особенностью всех жирорастворимых витаминов является их способность всасываться в кишечнике только в присутствии жира, а также накапливаться в организме иногда в больших количествах, вызывая гипервитаминозы. Механизм действия этих витаминов пока еще не выяснен, неизвестны ферменты, в состав которых они входят. Наши знания ограничиваются только процессами, в которых они принимают участие.Витамины группы А
Витамин А (ретинол, антиксерофтальмический) был открыт в начале XX века почти одновременно с выделением из овощей и фруктов растительных пигментов-каротинов. Как было позднее установлено, каротины являются предшественниками (провитаминами) витаминов группы А. Структура витамина A1 следующая: Это ненасыщенный циклический спирт, который легко окисляется с образованием альдегида.
Витамины группы А в организме выполняют важные и разнообразные функции. Основным их действием является обеспечение нормального состояния эпителиальной ткани и предупреждение ее ороговения. Они также участвуют в обмене белка и нуклеиновых кислот, ряда гормонов, в том числе в активации инсулина — гормона поджелудочной железы, в окислительных процессах, протекающих в организме. Витамины группы А влияют на процесс зрения, механизм которого заключается в следующем.
В состав зрительного пурпура — родопсина входит белок опсин и небелковая часть — ретинен, который является альдегидом витамина А. На свету родопсин расщепляется на составные части, а ретинен окисляется в витамин А. Процесс обратной изомеризации витамина А в ретинен протекает только в печени, где имеются специфические ферменты, катализирующие этот процесс. При недостаточности витамина А нарушается весь цикл зрения, т. е. не происходит ресинтеза родопсина из ретинена и опсина.
Развитие авитаминоза сопровождается системной кератинизацией (ороговением) эпителиальной ткани с появлением симптомов, специфичных для каждого пораженного органа или ткани. В случае поражения эпителия почек развиваются симптомы нефритов и нефрозов, мочевого пузыря — циститов. Так, кератинизация эпителия слезного канальца приводит к поражению эпителия и закупорке слезного канальца, в результате чего слезная жидкость не обмывает роговицу глаза, которая высыхает (ксерофтальмия). На сухой роговице появляются трещины, куда может попадать инфекция, вызывая гнойный процесс, приводящий к размягчению роговицы (кератомаляция), следствием этого может быть потеря зрения.
Гиповитаминоз витамина А может проявиться гемералопией (куриной слепотой), когда нарушается способность глаза видеть в темноте.
Особенно часто это заболевание (куриная слепота) встречалось в царской России в период церковного поста, который приходился на конец весны. В это время людям не разрешалось употреблять в пищу продукты животного происхождения, особенно богатые витамином А (мясо, сливочное масло). За время поста (6 недель) запасы организма витамином А истощались значительно, результатом чего и являлось развитие гемералопии.
Гипервитаминоз витамина А возникает при его избыточном потреблении, так как он способен накапливаться в организме.
В последнее время гипервитаминоз часто встречается у детей в связи с передозировками синтетических препаратов витамина А. Клиническая картина проявляется тошнотой, рвотой, выпадением волос, частыми переломами костей. Предупреждением гипервитаминоза служат правильное питание и строгий контроль за потреблением витамина А.
Источниками витамина А являются сливочное масло, желток яйца, печень морских животных и рыб (кит, палтус, окунь, треска). Растительные продукты (овощи, фрукты) богаты каротинами, при распаде которых в организме образуется витамин А.
Потребность в витамине А для взрослого человека в сутки составляет 1,5-2,5 мг, а каротина — 3-5 мг. Дозировка витамина А для детей в возрасте 1-3 лет составляет 2000 ИЕ, 3-6 лет — 2500 ИЕ, 6-9 лет — 3500 ИЕ, 9-12 лет — 4500 ИЕ, 12-20 лет — 5000 ИЕ.
Это ненасыщенный циклический спирт, который легко окисляется с образованием альдегида.
Витамины группы А в организме выполняют важные и разнообразные функции. Основным их действием является обеспечение нормального состояния эпителиальной ткани и предупреждение ее ороговения. Они также участвуют в обмене белка и нуклеиновых кислот, ряда гормонов, в том числе в активации инсулина — гормона поджелудочной железы, в окислительных процессах, протекающих в организме. Витамины группы А влияют на процесс зрения, механизм которого заключается в следующем.
В состав зрительного пурпура — родопсина входит белок опсин и небелковая часть — ретинен, который является альдегидом витамина А. На свету родопсин расщепляется на составные части, а ретинен окисляется в витамин А. Процесс обратной изомеризации витамина А в ретинен протекает только в печени, где имеются специфические ферменты, катализирующие этот процесс. При недостаточности витамина А нарушается весь цикл зрения, т. е. не происходит ресинтеза родопсина из ретинена и опсина.
Развитие авитаминоза сопровождается системной кератинизацией (ороговением) эпителиальной ткани с появлением симптомов, специфичных для каждого пораженного органа или ткани. В случае поражения эпителия почек развиваются симптомы нефритов и нефрозов, мочевого пузыря — циститов. Так, кератинизация эпителия слезного канальца приводит к поражению эпителия и закупорке слезного канальца, в результате чего слезная жидкость не обмывает роговицу глаза, которая высыхает (ксерофтальмия). На сухой роговице появляются трещины, куда может попадать инфекция, вызывая гнойный процесс, приводящий к размягчению роговицы (кератомаляция), следствием этого может быть потеря зрения.
Гиповитаминоз витамина А может проявиться гемералопией (куриной слепотой), когда нарушается способность глаза видеть в темноте.
Особенно часто это заболевание (куриная слепота) встречалось в царской России в период церковного поста, который приходился на конец весны. В это время людям не разрешалось употреблять в пищу продукты животного происхождения, особенно богатые витамином А (мясо, сливочное масло). За время поста (6 недель) запасы организма витамином А истощались значительно, результатом чего и являлось развитие гемералопии.
Гипервитаминоз витамина А возникает при его избыточном потреблении, так как он способен накапливаться в организме.
В последнее время гипервитаминоз часто встречается у детей в связи с передозировками синтетических препаратов витамина А. Клиническая картина проявляется тошнотой, рвотой, выпадением волос, частыми переломами костей. Предупреждением гипервитаминоза служат правильное питание и строгий контроль за потреблением витамина А.
Источниками витамина А являются сливочное масло, желток яйца, печень морских животных и рыб (кит, палтус, окунь, треска). Растительные продукты (овощи, фрукты) богаты каротинами, при распаде которых в организме образуется витамин А.
Потребность в витамине А для взрослого человека в сутки составляет 1,5-2,5 мг, а каротина — 3-5 мг. Дозировка витамина А для детей в возрасте 1-3 лет составляет 2000 ИЕ, 3-6 лет — 2500 ИЕ, 6-9 лет — 3500 ИЕ, 9-12 лет — 4500 ИЕ, 12-20 лет — 5000 ИЕ.
Витамины группы D
В 1650 г. английский врач Глиссон впервые описал детское заболевание со специфическими нарушениями костного скелета, которое было названо английской болезнью, или рахитом. Рахит является социальной болезнью. Постоянное недоедание, темные и сырые жилища, куда редко проникает солнце, большая скученность населения — вот основные предпосылки рахита. У взрослых людей встречается остеомаляция — заболевание, связанное с декальцификацией костей и нарушением образования костной ткани. Причина рахита была выяснена только в начале XX века и ею оказалась недостаточность в организме витамина D или его предшественника — 7-дегидрохолестерина. Последний содержится в коже и под действием ультрафиолетовых лучей превращается в витамин D. Из всех веществ, входящих в группу витаминов D, наибольшей биологической активностью обладают витамины D2 и D3. По своей химической структуре они являются производными стеринов: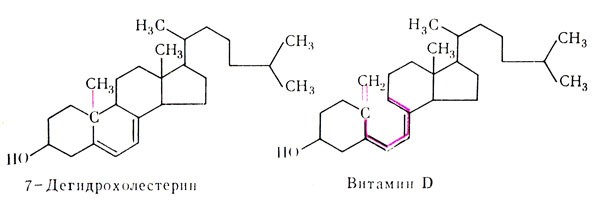 Биологическое действие витаминов группы D заключается в обеспечении всасывания кальция из кишечника, в регуляции фосфорно-кальциевого обмена и процессов окостенения, минерализации хрящевой ткани, реабсорбции (обратного всасывания) фосфора и аминокислот в почках.
Авитаминоз характеризуется снижением кальция и фосфора во всех органах и тканях. Если в норме содержание кальция в крови составляет 9-11 мг%, а фосфора — 5-7 мг%, то при рахите уровень их снижается в 2-3 раза (кальций — 5-7 мг%, фосфор — 2-3 мг%).
Механизм рахита до настоящего времени подробно не изучен, однако имеются некоторые данные об этом процессе. В основе развития рахита лежит нарушение процесса всасывания кальция из кишечника. Снижение уровня кальция в крови приводит к активизации паратгормона — гормона паращитовидных желез. Паратгормрн способствует мобилизации (выведению) кальция из костей, а также снижает процессы реабсорбции фосфора в почках. В результате этого фосфор выводится с мочой в больших количествах. Таким образом, в крови понижается уровень кальция и фосфора до критических величин. Недостаток фосфора в крови пополняется за счет вымывания последнего из костей. Этот процесс катализируется ферментом щелочной фосфатазой, активность которой повышается. Если в норме активность щелочной фосфатазы составляет 1,5-4 единицы (Боданский), то при рахите она повышается до 180 единиц. Вследствие этого кости становятся гибкими и ломкими и под тяжестью тела искривляются.
Биологическое действие витаминов группы D заключается в обеспечении всасывания кальция из кишечника, в регуляции фосфорно-кальциевого обмена и процессов окостенения, минерализации хрящевой ткани, реабсорбции (обратного всасывания) фосфора и аминокислот в почках.
Авитаминоз характеризуется снижением кальция и фосфора во всех органах и тканях. Если в норме содержание кальция в крови составляет 9-11 мг%, а фосфора — 5-7 мг%, то при рахите уровень их снижается в 2-3 раза (кальций — 5-7 мг%, фосфор — 2-3 мг%).
Механизм рахита до настоящего времени подробно не изучен, однако имеются некоторые данные об этом процессе. В основе развития рахита лежит нарушение процесса всасывания кальция из кишечника. Снижение уровня кальция в крови приводит к активизации паратгормона — гормона паращитовидных желез. Паратгормрн способствует мобилизации (выведению) кальция из костей, а также снижает процессы реабсорбции фосфора в почках. В результате этого фосфор выводится с мочой в больших количествах. Таким образом, в крови понижается уровень кальция и фосфора до критических величин. Недостаток фосфора в крови пополняется за счет вымывания последнего из костей. Этот процесс катализируется ферментом щелочной фосфатазой, активность которой повышается. Если в норме активность щелочной фосфатазы составляет 1,5-4 единицы (Боданский), то при рахите она повышается до 180 единиц. Вследствие этого кости становятся гибкими и ломкими и под тяжестью тела искривляются.
 Рис. 31 (а, б). Авитаминоз D. Рахит (по Меллэнби)
Нарушение процесса нормального окостенения приводит к развитию большой непропорциональной головы, утолщений в местах сочленения ребер с реберными хрящами, так называемых "четок" (рис. 31, а, б). Недостаток кальция вызывает изменения в мышцах, которые теряют способность к сокращению (гипотония мышц). Мышцы становятся дряблыми. У больного ребенка живот отвислый. При тяжелых формах рахита ребенок легко возбуждается, у него развиваются судороги. Введение витамина D способствует восстановлению нарушенных процессов.
Лечение рахита следует начинать как можно раньше с целью предупреждения нарушения развития ребенка. В качестве источника витамина D применяют рыбий жир, печень трески, тунца, сардин, различные формы синтетических препаратов.
Суточные дозы для детей составляют в среднем 10-15 мкг, для взрослых — 20-25 мкг.
Важное значение имеет профилактика рахита, которая включает целый комплекс различных мероприятий. Это правильное и рациональное питание, регулярное пребывание детей на воздухе, солнечные ванны, занятия спортом, систематический врачебный контроль за беременными и кормящими женщинами и детьми и др.
Гипервитаминоз наблюдается при избыточном' потреблении как витамина D, так и продуктов питания с его высоким содержанием. При этом значительно повышается всасывание кальция и фосфора из кишечника и их отложение в мышце сердца, стенке аорты, почках. При гипервитаминозах часто отмечаются тошнота и рвота, диспепсии, головные боли, анемии, угнетенное состояние. Предупреждение гипервитаминозов заключается в строгом контроле за суточным потреблением витамина.
Рис. 31 (а, б). Авитаминоз D. Рахит (по Меллэнби)
Нарушение процесса нормального окостенения приводит к развитию большой непропорциональной головы, утолщений в местах сочленения ребер с реберными хрящами, так называемых "четок" (рис. 31, а, б). Недостаток кальция вызывает изменения в мышцах, которые теряют способность к сокращению (гипотония мышц). Мышцы становятся дряблыми. У больного ребенка живот отвислый. При тяжелых формах рахита ребенок легко возбуждается, у него развиваются судороги. Введение витамина D способствует восстановлению нарушенных процессов.
Лечение рахита следует начинать как можно раньше с целью предупреждения нарушения развития ребенка. В качестве источника витамина D применяют рыбий жир, печень трески, тунца, сардин, различные формы синтетических препаратов.
Суточные дозы для детей составляют в среднем 10-15 мкг, для взрослых — 20-25 мкг.
Важное значение имеет профилактика рахита, которая включает целый комплекс различных мероприятий. Это правильное и рациональное питание, регулярное пребывание детей на воздухе, солнечные ванны, занятия спортом, систематический врачебный контроль за беременными и кормящими женщинами и детьми и др.
Гипервитаминоз наблюдается при избыточном' потреблении как витамина D, так и продуктов питания с его высоким содержанием. При этом значительно повышается всасывание кальция и фосфора из кишечника и их отложение в мышце сердца, стенке аорты, почках. При гипервитаминозах часто отмечаются тошнота и рвота, диспепсии, головные боли, анемии, угнетенное состояние. Предупреждение гипервитаминозов заключается в строгом контроле за суточным потреблением витамина.
Витамины группы Е
В 1922 г. было установлено, что для предотвращения бесплодия и нормализации процессов размножения необходим жирорастворимый витамин, который был назван витамином Е, витамином размножения и по химической структуре представлял токоферол. Е-витаминной активностью обладают α, β- и γ-токоферолы, из которых α-токоферолу присуща наибольшая биологическая активность. Основные изменения при авитаминозе Е происходят в половой системе. У самцов отмечают патологические изменения семенников и семенных канальцев с последующей дегенерацией (разрушением) семенных клеток. Постепенно прекращается спермообразование, выработка половых гормонов, наблюдается деградация вторичных половых признаков. Рис. 32. Мышечная атрофия при Е-авитаминозе
Е-авитаминозные самки при сохранении способности к зачатию теряют способность нормального вынашивания плода. Плод и плацента рассасываются, происходит самопроизвольный аборт. Развиваются мышечная слабость, параличи (рис. 32).
Практически у людей авитаминоз Е не встречается, так как витамин Е распространен весьма широко. Им богаты семена злаков, ягоды шиповника, яблоки и другие овощи и фрукты. Несколько меньше его содержится в мясе, сливочном масле, желтках яиц.
В организме основным депо витамина Е являются передняя доля гипофиза, мышцы, поджелудочная железа.
Потребность витамина в сутки для человека составляет 30 мг природных токоферолов.
Рис. 32. Мышечная атрофия при Е-авитаминозе
Е-авитаминозные самки при сохранении способности к зачатию теряют способность нормального вынашивания плода. Плод и плацента рассасываются, происходит самопроизвольный аборт. Развиваются мышечная слабость, параличи (рис. 32).
Практически у людей авитаминоз Е не встречается, так как витамин Е распространен весьма широко. Им богаты семена злаков, ягоды шиповника, яблоки и другие овощи и фрукты. Несколько меньше его содержится в мясе, сливочном масле, желтках яиц.
В организме основным депо витамина Е являются передняя доля гипофиза, мышцы, поджелудочная железа.
Потребность витамина в сутки для человека составляет 30 мг природных токоферолов.
Витамины группы К
В настоящее время известны два витамина К (антигеморрагические витамины), обладающие аналогичной биологической активностью. Один из них — витамин К1 — был выделеи из люцерны, а витамин К2 — из гниющей рыбной муки с биологической активностью в 2 раза ниже, чем витамин К1. По своей химической структуре они относятся к нафтохинонам. Самым важным биологическим свойством витаминов группы К является их участие в процессах свертывания крови. Предполагается, что их действие заключается в стабилизации одного из факторов, участвующих в свертывании крови (проконвертин). Рис. 33. Авитаминоз К. Судорожное состояние в связи с внутричерепным кровоизлиянием у новорожденного (по Бикнел и Прескотт.)
Авитаминоз проявляется понижением свертываемости крови, подкожными, внутримышечными и внутричерепными кровоизлияниями (рис. 33). Одной из причин авитаминоза
Одной из причин авитаминоза может быть нарушение всасывания витамина К в кишечнике в результате прекращения поступления в кишечник желчи, которая обеспечивает его всасывание.
У человека авитаминоз К встречается редко, так как кишечная микрофлора синтезирует этот витамин в достаточном количестве.
Витамин К и его синтетические заменители типа викасола нашли широкое применение при лечении авитаминоза К и различного рода кровотечениях (А. В. Палладин).
Богатыми источниками витамина К являются зеленые листья, ягоды рябины, печень.
Рис. 33. Авитаминоз К. Судорожное состояние в связи с внутричерепным кровоизлиянием у новорожденного (по Бикнел и Прескотт.)
Авитаминоз проявляется понижением свертываемости крови, подкожными, внутримышечными и внутричерепными кровоизлияниями (рис. 33). Одной из причин авитаминоза
Одной из причин авитаминоза может быть нарушение всасывания витамина К в кишечнике в результате прекращения поступления в кишечник желчи, которая обеспечивает его всасывание.
У человека авитаминоз К встречается редко, так как кишечная микрофлора синтезирует этот витамин в достаточном количестве.
Витамин К и его синтетические заменители типа викасола нашли широкое применение при лечении авитаминоза К и различного рода кровотечениях (А. В. Палладин).
Богатыми источниками витамина К являются зеленые листья, ягоды рябины, печень.
Антивитамины
При изучении химической структуры и биологического значения витаминов было обращено внимание на ряд веществ, которые имели примерно одинаковую с витамином структуру, но обладали прямо противоположными свойствами. При введении таких веществ в организме развивалась картина авитаминоза. Эти вещества были названы антивитаминами. Так, антивитамином витамина B1 (тиамина) является окситиамин, а фолиевой кислоты — аминоптерин и т. д. Механизм действия антивитаминов заключается в том, что они действуют по типу конкурентного торможения (см. Ферменты). Являясь структурными аналогами витаминов, они замещают витамин в составе кофермента, что вызывает блокирование фермента (фермент теряет свою активность). Последний выключается из реакций обмена веществ (развивается авитаминоз), что в ряде случаев приводит к гибели организма. Такое действие антивитаминов широко используется, когда антивитамины выступают в качестве лекарственных веществ. Например, витамин парааминобензойная кислота необходим для развития кокковых микробов, а его структурный аналог — сульфаниламид как антивитамин вызывает развитие авитаминоза и гибель этих микроорганизмов. Если витамин К способствует свертываемости крови, то его антивитамин — дикумарол — проявляет обратное действие — понижает процесс свертываемости, поэтому его применяют при лечении тромбофлебитов (закупорка кровеносных сосудов). Никотиновая кислота оказалась жизненно важным витамином для туберкулезных бацилл, а ее антивитамин — фтивазид — в настоящее время с успехом применяется для лечения туберкулеза и т. д. Дальнейшее изучение антивитаминов даст в руки врачей новые высокоэффективные лекарственные препараты для строго направленного лечения заболеваний.Вопросы для повторения
1. Что такое витамины? 2. Какие известны виды витаминной недостаточности? 3. Как классифицируются витамины? 4. Каково биологическое значение витаминов? 5. Что является источниками витаминов? 6. Какова потребность в витаминах и от чего она зависит? 7. В состав каких ферментов входят тиамин, рибофлавин, пиридоксол, никотиновая кислота, пантотеновая кислота? 8. Каковы симптомы пеллагры, бери-бери, авитаминоза пиридоксола, злокачественной анемии, цинги? 9. Почему водорастворимые витамины необходимо применять ежедневно? 10. Какова характеристика жирорастворимых витаминов? 11. Каково участие витаминов группы А в процессах обмена веществ? 12. Как участвует витамин А в цикле зрения? 13. Каковы симптомы авитаминоза А? 14. Каково биологическое участие витаминов группы D в обмене веществ? 15. Каковы биохимические основы рахита и принципы его лечения? 16. Какие мероприятия необходимы для профилактики рахита? 17. Что такое антивитамины?III. Ферменты
Общая характеристика ферментов
Материальную основу всех жизненных процессов организма составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов очень правильно и образно определил И. П. Павлов, назвав их "возбудителями жизни". Нарушение синтеза какого-либо фермента в стройной системе обменных реакций в организме приводит к развитию заболеваний, которые часто оканчиваются смертью. Например, недостаток у детей фермента, который превращает галактозу в глюкозу, является причиной галактоземии. При этом заболевании дети отравляются избытком галактозы и погибают в первые месяцы жизни. Повышение активности ксантин-оксидазы является причиной подагры. Таких примеров можно привести очень много. Вот почему ферменты представляют собой движущую силу всего того бесконечного разнообразия химических превращений, которые в своей совокупности составляют лежащий в основе жизни обмен веществ. Поэтому изучению ферментов придается такое большое значение. Наука о ферментах составляет важный раздел современной биохимии, а в медицине отчетливо выявляется направление — медицинская ферментология. Ферментология или, иначе, этимология является учением о ферментах (энзима!;) — биологических катализаторах белковой природы, образуемых любой живой клеткой и обладающих способностью активировать различные химические реакции, происходящие в организме. Ферменты нашли широкое применение во многих областях науки и промышленности. За последние годы с помощью высокоочищенных препаратов ферментов удалось расшифровать структуру сложных соединений, входящих в состав организма, в том числе некоторых белков и нуклеиновых кислот. Ферменты имеют и большое практическое значение, так как многие отрасли промышленности — виноделие, хлебопечение, сыроварение, производство спирта, чая, аминокислот, витаминов, антибиотиков — основаны на использовании различных ферментативных процессов. Поэтому изучение свойств и механизма действия ферментов позволяет химикам создать новые, более совершенные катализаторы для химической промышленности. Действие различных физиологически активных соединений, применяемых в медицине и сельском хозяйстве, — лекарственных веществ, стимуляторов роста растений и др., в конечном счете сводится к тому, что эти вещества активируют или подавляют в организме то или иное звено в обмене веществ, тот или иной ферментативный процесс. Несомненно, изучение закономерностей действия ферментов и влияния на них различных стимуляторов или парализаторов (ингибиторов) имеет первостепенное значение для медицины и сельского хозяйства. Рис. 34. Центральная роль ферментов и энзимологии в биологии
Круг вопросов, изучаемых ферментологией, весьма широк (рис. 34). Разработка методов выделения и очистки ферментов с целью установления их структуры, исследование процессов образования ферментов в живой клетке, регулирование их действия, роль ферментов в осуществлении различных физиологических функций — вот далеко не полный перечень важнейших биологических проблем, интенсивно изучаемых в настоящее время.
Рис. 34. Центральная роль ферментов и энзимологии в биологии
Круг вопросов, изучаемых ферментологией, весьма широк (рис. 34). Разработка методов выделения и очистки ферментов с целью установления их структуры, исследование процессов образования ферментов в живой клетке, регулирование их действия, роль ферментов в осуществлении различных физиологических функций — вот далеко не полный перечень важнейших биологических проблем, интенсивно изучаемых в настоящее время.
Краткая история учения о ферментах
История ферментов уходит в далекое прошлое. Еще на заре развития человеческого общества люди сталкивались с различными ферментативными процессами и использовали их в жизни. Спиртовое и молочнокислое брожение, применение заквасок при приготовлении хлеба, использование сычуга для изготовления сыров и др.- все эти ферментативные процессы хорошо известны с незапамятных времен. Одними из первых исследователей, занимавшихся изучением ферментативных процессов, были Реомюр и Спалланцани. В своих опытах по перевариванию мяса в желудке птиц они впервые поставили вопрос о необходимости изучения химического состава пищеварительных соков. Русский ученый К. С. Кирхгоф (1814) показал, что в вытяжке из проросшего ячменя содержится вещество, которое вызывает превращение крахмала в сахар. Таким образом, Кирхгофом впервые был получен ферментный препарат амилазы (фермент, расщепляющий крахмал) и эту дату мы с полным правом можем считать датой возникновения ферментологии. Изучая процессы брожения, голландский ученый Ван Гельмонт впервые ввел в науку термин "ферменты" (от лат. fermentum — закваска). Слово "энзим" происходит от древнегреческого слова "эн зюме", что означает "в дрожжах". Рис. 35. Кристаллический трипсин. Ув. 202 (по Нортропу)
К середине 50-х годов XIX века понятие о ферментах как о биологических катализаторах прочно утвердилось в науке. К этому времени и относится большой спор двух крупнейших ученых мира Луи Пастера и Ю. Либиха о месте локализации ферментов в клетке — спор, который по своему существу явился борьбой двух мировоззрений в науке — идеализма и материализма и затормозил развитие учения о ферментах без малого на 50 лет. Луи Пастер, доказывая, что деятельность ферментов неотделима от структуры клетки и с ее разрушением прекращается, прочно стоял на позициях вирховианства — одной из разновидностей идеализма в биологии. Либих утверждал, что действие ферментов не связано со структурой клетки. Этот спор практически продолжался более 100 лет и снова, в который раз, утвердил необходимость материалистического подхода к изучению биологических закономерностей. Первой подтвердила правильность точки зрения Ю. Либиха русский исследователь М. М. Манассеина в 1871 г. Растирая дрожжевые клетки с кварцевым песком, т. е. полностью разрушая структуру клетки, она доказала, что клеточный сок обладает способностью сбраживать крахмал. Однако, как это очень часто бывало в царской России, исследования М. М. Манассеиной остались без внимания и пальма первенства в этом вопросе была отдана немецким ученым братьям Бухнер, которые через 26 лет проделали аналогичный опыт (они разрушали клетки путем высокого давления) и получили такие же результаты. В последующем работами А. Н. Лебедева, И. П. Павлова, М. Дюкло, Э. Фишера, Л. Михаэлиса и многих других ученых окончательно была опровергнута точка зрения идеалистов. Именно материалистический подход в научных исследованиях дал возможность Дж. Самнеру в 1927 г. впервые получить фермент уреазу, а Дж. Нортропу в 1931 г.- кристаллические трипсин и пепсин (рис. 35, 36).
Рис. 35. Кристаллический трипсин. Ув. 202 (по Нортропу)
К середине 50-х годов XIX века понятие о ферментах как о биологических катализаторах прочно утвердилось в науке. К этому времени и относится большой спор двух крупнейших ученых мира Луи Пастера и Ю. Либиха о месте локализации ферментов в клетке — спор, который по своему существу явился борьбой двух мировоззрений в науке — идеализма и материализма и затормозил развитие учения о ферментах без малого на 50 лет. Луи Пастер, доказывая, что деятельность ферментов неотделима от структуры клетки и с ее разрушением прекращается, прочно стоял на позициях вирховианства — одной из разновидностей идеализма в биологии. Либих утверждал, что действие ферментов не связано со структурой клетки. Этот спор практически продолжался более 100 лет и снова, в который раз, утвердил необходимость материалистического подхода к изучению биологических закономерностей. Первой подтвердила правильность точки зрения Ю. Либиха русский исследователь М. М. Манассеина в 1871 г. Растирая дрожжевые клетки с кварцевым песком, т. е. полностью разрушая структуру клетки, она доказала, что клеточный сок обладает способностью сбраживать крахмал. Однако, как это очень часто бывало в царской России, исследования М. М. Манассеиной остались без внимания и пальма первенства в этом вопросе была отдана немецким ученым братьям Бухнер, которые через 26 лет проделали аналогичный опыт (они разрушали клетки путем высокого давления) и получили такие же результаты. В последующем работами А. Н. Лебедева, И. П. Павлова, М. Дюкло, Э. Фишера, Л. Михаэлиса и многих других ученых окончательно была опровергнута точка зрения идеалистов. Именно материалистический подход в научных исследованиях дал возможность Дж. Самнеру в 1927 г. впервые получить фермент уреазу, а Дж. Нортропу в 1931 г.- кристаллические трипсин и пепсин (рис. 35, 36).
 Рис. 36. Кристаллический пепсин. Ув. 90 (по Нортропу)
В настоящее время работами большой армии ученых как в нашей стране, так и за рубежом учение о ферментах успешно развивается. В настоящее время известно около 1000 ферментов. Работы академика А. Е. Браунштейна, В. А. Энгельгарда, А. И. Опарина, С. Е. Северина, В. Н. Ореховича, А. А. Покровского и многих других отечественных ученых в области изучения ферментов в человеческом организме имеют важное значение в медицине. Постановка диагноза, выбор правильного лечения и профилактики, разработка и применение различных лекарственных препаратов и т. д. основываются на изучении ферментов.
Рис. 36. Кристаллический пепсин. Ув. 90 (по Нортропу)
В настоящее время работами большой армии ученых как в нашей стране, так и за рубежом учение о ферментах успешно развивается. В настоящее время известно около 1000 ферментов. Работы академика А. Е. Браунштейна, В. А. Энгельгарда, А. И. Опарина, С. Е. Северина, В. Н. Ореховича, А. А. Покровского и многих других отечественных ученых в области изучения ферментов в человеческом организме имеют важное значение в медицине. Постановка диагноза, выбор правильного лечения и профилактики, разработка и применение различных лекарственных препаратов и т. д. основываются на изучении ферментов.
Представление о катализе
Катализ — это процесс изменения скорости химической реакции под влиянием различных веществ — катализаторов, участвующих в этом процессе и к концу реакции остающихся химически неизмененными. Если от добавления катализатора происходит ускорение химического процесса, то такое явление называют положительным катализом, а замедление реакции- отрицательным. Чаще всего приходится встречаться с положительным катализом. В зависимости от химической природы катализаторы разделяются на неорганические и органические. К последним относятся и биологические катализаторы — ферменты. Рис. 37. Схематическое изображение некатализируемой (1) и катализируемой (2) реакций (объяснение в тексте)
Для понимания действия катализаторов необходимо кратко остановиться на рассмотрении сущности катализа. Скорость любой химической реакции зависит от числа столкновений активных молекул реагирующих веществ. Активированной называется молекула, которая имеет определенный запас потенциальной энергии. Взаимодействие двух таких молекул произойдет только в том случае, если запас энергии этих молекул будет достаточным для преодоления сил отталкивания между ними — так называемого "энергетического барьера" реакции (рис. 37, F, F1, F2). Если реагирующие молекулы будут обладать большей величиной энергии, чем энергетический барьер, то реакция произойдет. Если же запаса энергии реагирующих молекул будет недостаточно для преодоления энергетического барьера, то они не будут взаимодействовать. В этом случае для протекания реакции необходимо активировать молекулы, т. е. сообщить им дополнительное количество энергии, которое в сумме с имеющейся потенциальной энергией в молекулах будет достаточным для преодоления энергетического барьера. Это дополнительное количество энергии называется "энергией активации" (см. рис. 37, а, а1, а2). Активировать молекулы можно путем нагревания, повышения давления, облучения и т. д.
Сущность действия катализаторов заключается в том, что, во-первых, они обладают способностью активировать молекулы реагирующих веществ, и, во-вторых, взаимодействие молекул (или веществ) происходит не в один, а в несколько этапов.
При этом энергетический барьер каждой из промежуточных реакций будет ниже энергетического барьера исходной реакции. Схематично это можно представить следующим образом.
Исходную реакцию некатализируемую (рис. 37,1) между веществами А и В можно записать как
А + В → АВ (1)
Энергетический барьер этой реакции можно обозначить как F, а энергию активации — а. В случае введения в эту систему катализатора (К) (см. рис. 36,2) на первом этапе (21) произойдет взаимодействие одного из веществ с катализатором:
А + К → АК (2)
Энергетический барьер этой реакции, обозначенный как F1, и энергия активации — а1 будет меньше энергетического барьера исходной реакции (1) F1<F, a1<а и соответственно энергии активации.
На втором этапе (22) произойдет образование конечного продукта исходной реакции и катализатор выделится в неизмененном виде:
АК + В → АВ + К (3)
В этой реакции, энергетический барьер которой обозначим как F2, F2<F, а энергия активации а2<а.
Суммируя 2-ю и 3-ю реакции, получим:
А + В + К → АВ + К (4)
Таким образом, в ходе реакции с катализатором образовались те же продукты, что и в исходной реакции (1), но с энергетической точки зрения эта реакция более выгодна, так как F1 + F2<F. Особенно это заметно по энергии активации (а1 + а2<а). Следовательно, катализируемая реакция, хотя и идет в 2 этапа, но при этом требуется меньше энергии и значительно снижается энергия активации по сравнению с некатализируемой реакцией.
Катализаторы являются очень активными соединениями, и химические реакции при их участии идут очень быстро, в основном за счет снижения энергии активации. Так, если, например, скорость разложения Н2О2 без катализатора принять за единицу, то в присутствии катализатора — платиновой черни (неорганический катализатор) скорость реакции увеличивается в 2*104 раза, а энергия активации снижается соответственно с 18 ккал/моль до 12 ккал/моль. Таким образом, оказывается, что катализатор не только снижает энергетические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализа относятся следующие:
• катализаторы могут ускорять (положительный катализ) только те химические реакции, которые вообще могут идти по своим термодинамическим законам,
• катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
Рис. 37. Схематическое изображение некатализируемой (1) и катализируемой (2) реакций (объяснение в тексте)
Для понимания действия катализаторов необходимо кратко остановиться на рассмотрении сущности катализа. Скорость любой химической реакции зависит от числа столкновений активных молекул реагирующих веществ. Активированной называется молекула, которая имеет определенный запас потенциальной энергии. Взаимодействие двух таких молекул произойдет только в том случае, если запас энергии этих молекул будет достаточным для преодоления сил отталкивания между ними — так называемого "энергетического барьера" реакции (рис. 37, F, F1, F2). Если реагирующие молекулы будут обладать большей величиной энергии, чем энергетический барьер, то реакция произойдет. Если же запаса энергии реагирующих молекул будет недостаточно для преодоления энергетического барьера, то они не будут взаимодействовать. В этом случае для протекания реакции необходимо активировать молекулы, т. е. сообщить им дополнительное количество энергии, которое в сумме с имеющейся потенциальной энергией в молекулах будет достаточным для преодоления энергетического барьера. Это дополнительное количество энергии называется "энергией активации" (см. рис. 37, а, а1, а2). Активировать молекулы можно путем нагревания, повышения давления, облучения и т. д.
Сущность действия катализаторов заключается в том, что, во-первых, они обладают способностью активировать молекулы реагирующих веществ, и, во-вторых, взаимодействие молекул (или веществ) происходит не в один, а в несколько этапов.
При этом энергетический барьер каждой из промежуточных реакций будет ниже энергетического барьера исходной реакции. Схематично это можно представить следующим образом.
Исходную реакцию некатализируемую (рис. 37,1) между веществами А и В можно записать как
А + В → АВ (1)
Энергетический барьер этой реакции можно обозначить как F, а энергию активации — а. В случае введения в эту систему катализатора (К) (см. рис. 36,2) на первом этапе (21) произойдет взаимодействие одного из веществ с катализатором:
А + К → АК (2)
Энергетический барьер этой реакции, обозначенный как F1, и энергия активации — а1 будет меньше энергетического барьера исходной реакции (1) F1<F, a1<а и соответственно энергии активации.
На втором этапе (22) произойдет образование конечного продукта исходной реакции и катализатор выделится в неизмененном виде:
АК + В → АВ + К (3)
В этой реакции, энергетический барьер которой обозначим как F2, F2<F, а энергия активации а2<а.
Суммируя 2-ю и 3-ю реакции, получим:
А + В + К → АВ + К (4)
Таким образом, в ходе реакции с катализатором образовались те же продукты, что и в исходной реакции (1), но с энергетической точки зрения эта реакция более выгодна, так как F1 + F2<F. Особенно это заметно по энергии активации (а1 + а2<а). Следовательно, катализируемая реакция, хотя и идет в 2 этапа, но при этом требуется меньше энергии и значительно снижается энергия активации по сравнению с некатализируемой реакцией.
Катализаторы являются очень активными соединениями, и химические реакции при их участии идут очень быстро, в основном за счет снижения энергии активации. Так, если, например, скорость разложения Н2О2 без катализатора принять за единицу, то в присутствии катализатора — платиновой черни (неорганический катализатор) скорость реакции увеличивается в 2*104 раза, а энергия активации снижается соответственно с 18 ккал/моль до 12 ккал/моль. Таким образом, оказывается, что катализатор не только снижает энергетические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализа относятся следующие:
• катализаторы могут ускорять (положительный катализ) только те химические реакции, которые вообще могут идти по своим термодинамическим законам,
• катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
Отличие ферментов от других видов катализаторов
При изучении свойств ферментов было установлено, что по своему действию они являются катализаторами, в основном обеспечивающими положительный катализ. Поэтому для них характерны все особенности процесса катализа. Наряду с этим ферменты имеют свои определенные отличия, к которым относятся "космические" скорости катализируемых ими реакций, очень сложная химическая структура, которая в ряде случаев может изменяться в ходе реакции и восстанавливаться в исходную после ее окончания, и, наконец, высокая специфичность действия. Для подтверждения высокой скорости реакций, катализируемых ферментами, снова обратимся к нашему примеру с перекисью водорода. В организме разложение Н2О2 катализируется ферментом каталазой со скоростью, в 2*1011 раз превышающей скорость некатализируемой реакции и в 107 раз в случае с платиновой чернью. Энергия активации при ферментативной реакции снижается соответственно в 9 и 6 раз. Из других примеров можно указать на следующие. В желудке человека вырабатывается фермент пепсин, который расщепляет белки. Один грамм пепсина за час способен гидролизовать 50 кг яичного белка, а 1,6 г амилазы, синтезируемой в поджелудочной и слюнных железах, за час может расщепить 175 кг крахмала. Сложность структуры ферментов обусловлена тем, что все они являются белками (см. Структура белков), т. е. высокомолекулярными соединениями с большим молекулярным весом. Высокая специфичность действия ферментов проявляется в том, что, как правило, каждый фермент катализирует только одну или несколько близких химических реакций. Действие ферментов как биологических катализаторов можно изобразить следующей формулой: S + E ES → Е + Р,
где Е — фермент; S — субстрат — вещество, на которое действует фермент; ES — фермент-субстратный комплекс, промежуточное соединение, образующееся в ходе реакции типа АК (2); Р — продукты реакции.
ES → Е + Р,
где Е — фермент; S — субстрат — вещество, на которое действует фермент; ES — фермент-субстратный комплекс, промежуточное соединение, образующееся в ходе реакции типа АК (2); Р — продукты реакции.
 Рис. 38. Схема взаимодействия фермента с субстратом (объяснение в тексте)
И в этом случае действие фермента на субстрат приводит к активированию субстрата, в результате чего снижается энергия активации и повышается скорость реакции. Основное значение в этом имеет образование промежуточного продукта — фермент-субстратного комплекса — ES, скорость образования которого определяет скорость всей реакции. Фермент-субстратный комплекс распадается на фермент и продукты реакции. На рис. 38 дано схематичное изображение хода ферментативной реакции.
Рис. 38. Схема взаимодействия фермента с субстратом (объяснение в тексте)
И в этом случае действие фермента на субстрат приводит к активированию субстрата, в результате чего снижается энергия активации и повышается скорость реакции. Основное значение в этом имеет образование промежуточного продукта — фермент-субстратного комплекса — ES, скорость образования которого определяет скорость всей реакции. Фермент-субстратный комплекс распадается на фермент и продукты реакции. На рис. 38 дано схематичное изображение хода ферментативной реакции.
Химическая природа ферментов
При изучении ферментов было установлено, что все они являются белками и поэтому обладают всеми свойствами белков. Ферменты имеют аналогичную белкам сложную структуру (рис. 39), подвергаются расщеплению под действием протеолитических ферментов, при растворении в воде образуют коллоидные растворы, при кипячении денатурируются и т. д. Молекулярный вес ферментов колеблется в пределах сотен тысяч и миллионов единиц молекулярного веса. Рис. 39.Гипотетическая модель третичной структуры молекулы химотрипсиногена (по Нейрату). Черное кольцо (обозначено стрелкой) показывает пептидную связь между 15 и 16 аминокислотными остатками. Видны 5 дисульфидных связей (изображены желтым цветом), стягивающим отдельные участки полипептидной цепи% функциональные группы активного центра показаны красным цветом
Молекулярный вес рибонуклеазы составляет 12 700, пепсина — 35 500, каталазы крови — 248 000, глютаматдегидро-геназы — 1 000 000.
По структуре все ферменты делятся на простые и сложные.
Простые ферменты — ферменты-протеины — состоят только из аминокислот, а сложные ферменты — ферменты-протеиды — в своем составе имеют белковую часть — апофермент, состоящую из одних аминокислот, и небелковую часть — кофермент, или простетическую группу. Небелковая часть может быть представлена минеральными веществами, витаминами и т. д.
К ферментам-протеинам относятся, например, гидролитические ферменты желудочно-кишечного тракта, которые расщепляют пищевые продукты с участием воды, к ферментам-протеидам принадлежит большая часть окислительно-восстановительных ферментов.
Рис. 39.Гипотетическая модель третичной структуры молекулы химотрипсиногена (по Нейрату). Черное кольцо (обозначено стрелкой) показывает пептидную связь между 15 и 16 аминокислотными остатками. Видны 5 дисульфидных связей (изображены желтым цветом), стягивающим отдельные участки полипептидной цепи% функциональные группы активного центра показаны красным цветом
Молекулярный вес рибонуклеазы составляет 12 700, пепсина — 35 500, каталазы крови — 248 000, глютаматдегидро-геназы — 1 000 000.
По структуре все ферменты делятся на простые и сложные.
Простые ферменты — ферменты-протеины — состоят только из аминокислот, а сложные ферменты — ферменты-протеиды — в своем составе имеют белковую часть — апофермент, состоящую из одних аминокислот, и небелковую часть — кофермент, или простетическую группу. Небелковая часть может быть представлена минеральными веществами, витаминами и т. д.
К ферментам-протеинам относятся, например, гидролитические ферменты желудочно-кишечного тракта, которые расщепляют пищевые продукты с участием воды, к ферментам-протеидам принадлежит большая часть окислительно-восстановительных ферментов.
Методы выделения и количественного определения активности ферментов
Для изучения свойств и клинического применения ферментов необходимы высокоочищенные препараты ферментов. Поэтому были разработаны различные методы выделения ферментов. К ним относятся разрушение клеток и получение клеточного сока, в котором содержатся ферменты; экстрагирование ферментов из высушенных тканей слабыми растворами солей, кислот и оснований. Из растворов ферменты можно осаждать добавлением солей [(NH4)2SО4, NaCl] и различных органических растворителей типа ацетона, смеси спирта и эфира и др. Выделение ферментов также осуществляется методом адсорбции. Адсорбенты типа окиси кремния, активированного угля, гидрата окиси железа, различных синтетических смол и др. обладают способностью обратимо связывать определенные ферменты. Извлечение ферментов при этом достигается промыванием адсорбентов различными специфическими растворителями, которые переводят ферменты в раствор. В настоящее время для выделения ферментов используют хроматографическое фракционирование на колонках с синтетическими смолами, разделение ферментов при помощи электрофореза и др. Получение ферментов в кристаллическом виде достигают путем высушивания очищенных ферментов при низких температурах и вакууме (лиофилизация). О присутствии ферментов в растворе судят по производимому ими действию. Так, наличие пепсина, который катализирует расщепление белка, определяют по появлению свободных аминокислот, входящих в состав этого белка, о действии каталазы узнают по выделению кислорода при разложении перекиси водорода. Активность фермента выражают количеством распавшегося под действием фермента субстрата или образовавшихся продуктов реакции за единицу времени, в расчете на г ткани или мг белка.Свойства ферментов
Обратимость действия ферментов
Ферменты в зависимости от концентрации исходных и конечных продуктов реакции могут катализировать как процессы распада, так и процессы синтеза, т. е. каталитические реакции являются обратимыми. Впервые такую способность ферментов отметил А. Я. Данилевский в 1888 г. Он показал, что ферменты желудочного сока, которые расщепляют белки на альбумозы и пептоны, в определенных условиях способны синтезировать из этих промежуточных продуктов более сложные соединения. В работах И. П. Павлова, А. И. Опарина и других авторов было также отмечено, что в организме в зависимости от условий одни и те же ферменты могут катализировать или распад, или синтез необходимых веществ. Однако на основании имеющихся в настоящее время сведений надо признать, что обратимость действия характерна не для всех ферментов. Многие процессы распада и синтеза происходят не только под влиянием различных ферментов, но и разных механизмов.Температурный оптимум действия ферментов
Ферменты являются термолабильными веществами, т. е. весьма чувствительными к изменению температуры. Установлено, что наивысшую активность ферменты проявляют в очень узком пределе температуры — 40-50°. До этого предела с повышением температуры на каждые 10° скорость катализируемой ими реакции повышается в 2 раза. Выше температурного оптимума активность ферментов снижается, а при температуре 70-80° совершенно прекращается — фермент инактивируется. Это положение относится к большинству ферментов, в том числе ко всем ферментам человеческого организма. Однако некоторые ферменты, например, рибонуклеаза, могут выдерживать кратковременное нагревание. Наряду с этим имеются ферменты некоторых микроорганизмов, которые существуют в воде горячих источников. При понижении температуры (гипотермия) активность ферментов снижается, но не исчезает. Если же создать этим ферментам оптимальные условия для их деятельности, то они снова проявят наивысшую активность. Примером может служить зимняя спячка животных. Эта особенность ферментов нашла широкое применение в хирургической практике, когда для проведения операций на грудной полости организм больного подвергают охлаждению примерно до 22°.Влияние рН среды
На активность ферментов влияет и определенная концентрация водородных ионов (рН среды). Для каждого фермента существует определенный узкий предел рН среды, который является оптимальным для проявления его наивысшей активности. Отклонение рН от оптимального вызывает понижение активности фермента и даже его инактивацию. Оптимальные значения рН среды для некоторых ферментов будут следующими: для пепсина — 1,5-2,5; трипсина — 8,0-8,5, амилазы слюны -6,8-7,4, аргиназы — 9,8, кислой фосфатазы крови — 4,5-5,0, сукцинатдегидрогеназы — 9,0.Специфичность ферментов
Одним из основных свойств ферментов, отличающих их от других катализаторов, является высокая специфичность, которая заключается в том, что каждый фермент может катализировать одну или несколько близких по своей природе химических реакций. Специфичность основана на строгом соответствии структуры субстрата и того участка фермента, с которым он. соединяется. По образному выражению Э. Фишера, фермент должен подходить к субстрату, как ключ подходит к замку. В последние годы вскрыты более тонкие механизмы взаимодействия субстрата и фермента (Кошленд и др.). Специфичность ферментов условно подразделяется на несколько видов: 1. Относительной специфичностью обладают ферменты, которые действуют на соединения, имеющие определенный тип связи. Например, протеиназы гидролизуют все соединения, имеющие в своем составе пептидную связь -СО-NH-, эстеразы расщепляют эфирную связь -О- и т. д. Ферменты, обладающие относительной специфичностью, являются ферментами широкого спектра действия. 2. Групповая специфичность характерна для ферментов, которые действуют на субстраты, имеющие одинаковый тип связи и одну из функциональных группировок. К их числу относятся: фосфомоноэстеразы, гидролизующие субстраты следующей структуры: Для их действия обязательным условием является наличие эфирной связи (-О-) и остатка фосфорной кислоты
Для их действия обязательным условием является наличие эфирной связи (-О-) и остатка фосфорной кислоты
 холинэстеразы, в субстратах которых имеются определенные группировки (эфирная связь и остаток холина):
холинэстеразы, в субстратах которых имеются определенные группировки (эфирная связь и остаток холина):
 3. Абсолютная специфичность характеризует ферменты, действующие только на один субстрат с вполне определенной структурой. Например: аргиназа расщепляет аргинин на орнитин и мочевину по следующей схеме:
3. Абсолютная специфичность характеризует ферменты, действующие только на один субстрат с вполне определенной структурой. Например: аргиназа расщепляет аргинин на орнитин и мочевину по следующей схеме:
 К ферментам, обладающим абсолютной специфичностью, относятся также уреаза, анетилхолинкгераза и др.
Следует выделить в отдельный вид специфичности и стереохимическую, при которой фермент будет действовать только на определенный сгереоиюмер субстрата.
К ферментам, обладающим абсолютной специфичностью, относятся также уреаза, анетилхолинкгераза и др.
Следует выделить в отдельный вид специфичности и стереохимическую, при которой фермент будет действовать только на определенный сгереоиюмер субстрата.
Каталитическая активность
Ферменты обладают высокой каталитической активностью, которая зависит от ряда факторов. К ним относятся температура, рН среды, концентрации фермента и субстрата, наличие веществ, активирующих и тормозящих их действие, и т. д. Зависимость активности фермента и, следовательно, скорости реакции от температуры и рН среды отмечена ранее (см. Свойства ферментов). Между концентрацией фермента и скоростью катализируемой реакции при прочих равных условиях имеется прямая пропорциональность. Так, например, при увеличении в 2 раза концентрации фермента скорость реакции также возрастет вдвое. Влияние концентрации субстрата на скорость действия фермента определяется концентрацией образующегося фермент-субстратного комплекса. Максимальная скорость реакции достигается тогда, когда концентрация субстрата будет достаточна, чтобы связать все количество фермента в фермент-субстратный комплекс.Активаторы и ингибиторы ферментов
Каталитическая функция ферментов зависит от влияния различных веществ, одни из которых повышают скорость реакций, и активность ферментов возрастает, а другие — ее затормаживают, т. е. ингибируют. Первые из них нЖываются активаторами ферментов. Например, ионы хлора активируют амилазу слюны, ионы водорода — пепсин, ионы цинка — карбангидразу. Желчные кислоты являются активаторами для кишечной липазы и т. д. Наряду с процессом активации ферментов существует и процесс самоактивации (аутоактивации). Так, в желудке вырабатывается неактивный фермент пепсиноген. Он является предшественником (проферментом) пепсина. Активация пепсиногена заключается в том, что уже имеющийся в желудке активный фермент — пепсин действует на пепсиноген и отщепляет от его молекулы полипептид с молекулярным весом 7000. Оставшаяся часть молекулы пепсиногена приобретает определенную форму, характерную для активного фермента — пепсина. Аналогичным путем происходит активирование и некоторых других ферментов (например, трипсина). Вещества, способные угнетать действие ферментов, называются парализаторами, или ингибиторами (I). Механизм действия ингибиторов в общем виде заключается в том, что ингибитор вступает в соединение с ферментом, образуя неактивный фермент-ингибиторный комплекс (EI) вместо активного фермент-субстратного (ES), что приводит к блокированию фермента. Торможение активности ферментов ингибиторами может быть обратимым и необратимым. В последнем случае ингибитор, являясь денатурирующим агентом, приводит к полному изменению структуры фермента, его инактивации. К таким ингибиторам относятся сильные кислоты и щелочи, спирт, цианистые соли и т. д. Рис. 40. Схема действия конкурентного ингибитора (объяснение в тексте)
Различают также конкурентное и неконкурентное ингибирование. Конкурентное торможение возможно в том случае, когда ингибитор имеет структуру, близкую структуре субстрата, т. е. является его структурным аналогом. В основе этого вида торможения лежит конкуренция между субстратом и ингибитором за обладание ферментом. В результате этого ингибитор обратимо взаимодействует с тем участком в молекуле фермента, с которым. обычно соединяется субстрат (рис. 40). Из рисунка видно, что между молекулами фермента и субстрата имеется структурное соответствие, которое обеспечивает образование активного фермент-субстратного комплекса. Последний затем расщепляется с образованием продуктов реакции, а фермент выделяется в неизмененном виде. В случае конкурентного торможения ингибитор (структурный аналог субстрата) присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. Если концентрация ингибитора (I) выше, чем субстрата (S), т. е. [I]>[S], образуется фермент-ингибиторный комплекс Е + S + I → EI + S и расщепления субстрата не произойдет. Но в случае избытка субстрата — [S]>[I], последний вытеснит ингибитор из фермент-ингибиторного комплекса и образуется фермент-субстратный комплекс с последующим распадом субстрата на продукты реакции:
Е + S + I → ES + I → Е + Р + I.
Таким образом, конкурентное торможение — это такое торможение, когда ингибитор обратимо соединяется с ферментом в том участке его молекулы, в котором присоединяется и субстрат (активный центр), причем между субстратом и ингибитором существует количественное взаимоотношение. Классическим примером конкурентного торможения служит конкуренция между янтарной кислотой — субстрат и малоновой- ингибитор за фермент сукцинатдегидрогеназу, которая катализирует образование фумаровой кислоты из янтарной:
Рис. 40. Схема действия конкурентного ингибитора (объяснение в тексте)
Различают также конкурентное и неконкурентное ингибирование. Конкурентное торможение возможно в том случае, когда ингибитор имеет структуру, близкую структуре субстрата, т. е. является его структурным аналогом. В основе этого вида торможения лежит конкуренция между субстратом и ингибитором за обладание ферментом. В результате этого ингибитор обратимо взаимодействует с тем участком в молекуле фермента, с которым. обычно соединяется субстрат (рис. 40). Из рисунка видно, что между молекулами фермента и субстрата имеется структурное соответствие, которое обеспечивает образование активного фермент-субстратного комплекса. Последний затем расщепляется с образованием продуктов реакции, а фермент выделяется в неизмененном виде. В случае конкурентного торможения ингибитор (структурный аналог субстрата) присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. Если концентрация ингибитора (I) выше, чем субстрата (S), т. е. [I]>[S], образуется фермент-ингибиторный комплекс Е + S + I → EI + S и расщепления субстрата не произойдет. Но в случае избытка субстрата — [S]>[I], последний вытеснит ингибитор из фермент-ингибиторного комплекса и образуется фермент-субстратный комплекс с последующим распадом субстрата на продукты реакции:
Е + S + I → ES + I → Е + Р + I.
Таким образом, конкурентное торможение — это такое торможение, когда ингибитор обратимо соединяется с ферментом в том участке его молекулы, в котором присоединяется и субстрат (активный центр), причем между субстратом и ингибитором существует количественное взаимоотношение. Классическим примером конкурентного торможения служит конкуренция между янтарной кислотой — субстрат и малоновой- ингибитор за фермент сукцинатдегидрогеназу, которая катализирует образование фумаровой кислоты из янтарной:
 При неконкурентном торможении ингибитор соединяется с ферментом не по месту присоединения с субстратом (не с активным центром), а где-то в другом участке молекулы фермента, что приводит, к значительному снижению активности фермента и даже к его ингибированию. Таким примером является действие синильной кислоты на железосодержащие ферменты, осуществляющие перенос электронов при окислительно-восстановительных реакциях.
При неконкурентном торможении ингибитор соединяется с ферментом не по месту присоединения с субстратом (не с активным центром), а где-то в другом участке молекулы фермента, что приводит, к значительному снижению активности фермента и даже к его ингибированию. Таким примером является действие синильной кислоты на железосодержащие ферменты, осуществляющие перенос электронов при окислительно-восстановительных реакциях.
Общие представления о механизме действия ферментов
Механизм действия ферментов пока изучен недостаточно, однако имеющиеся данные позволяют высказать о нем общее представление. В основе действия ферментов как биологических катализаторов лежит их способность повышать скорость реакции за счет снижения энергии активации субстрата, т. е. каким-то образом его активировать. Это достигается при взаимодействии субстрата с ферментом, который вызывает какие-либо изменения в молекуле субстрата, в результате чего он становится активным (реакционноспособным). Следовательно, необходимым условием для активации субстратов и понимания механизма действия ферментов является образование фермент-субстратного комплекса. Пути и механизмы, приводящие к активированию субстрата, могут быть самыми различными и зависят от структуры ферментов. В качестве примера можно привести предполагаемый механизм действия фумаразы — фермента-протеина, который вызывает активирование фумаровой кислоты, вследствие чего к ней присоединяется молекула воды и образуется яблочная кислота. В фумаровой кислоте имеется двойная связь, которая представлена парами электронов. Под действием фумаразы происходит их перераспределение, что приводит к появлению зарядов на молекуле субстрата (субстрат активируется). Последний становится способным присоединять ионы (Н+ и ОН-) по типу электростатической связи: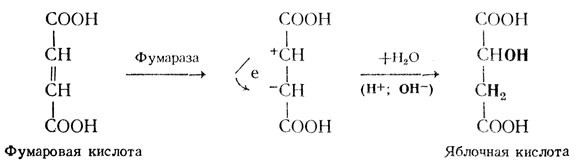 При изучении механизма действия сложных ферментов оказалось, что в процессе активации субстрата принимает участие и небелковая часть — кофермент. Кроме того, было обращено внимание на следующие обстоятельства. Одно из них заключается в том, что молекула фермента во много раз больше молекулы субстрата, и поэтому субстрат не может быть связан со всей молекулой фермента. Второе обстоятельство характеризуется тем, что при отщеплении от молекулы фермента определенного количества аминокислот фермент продолжает катализировать те же самые реакции с высокой скоростью, что и нерасщепленный фермент. Например, при удалении из молекулы папаина (фермента, катализирующего распад белков в растениях) 120 из 180 аминокислот, входящих в состав его молекулы, фермент сохранял свои каталитические способности.
При изучении механизма действия сложных ферментов оказалось, что в процессе активации субстрата принимает участие и небелковая часть — кофермент. Кроме того, было обращено внимание на следующие обстоятельства. Одно из них заключается в том, что молекула фермента во много раз больше молекулы субстрата, и поэтому субстрат не может быть связан со всей молекулой фермента. Второе обстоятельство характеризуется тем, что при отщеплении от молекулы фермента определенного количества аминокислот фермент продолжает катализировать те же самые реакции с высокой скоростью, что и нерасщепленный фермент. Например, при удалении из молекулы папаина (фермента, катализирующего распад белков в растениях) 120 из 180 аминокислот, входящих в состав его молекулы, фермент сохранял свои каталитические способности.
 Рис. 41. Модель молекулы фермента. а — схема ее гретичной структуры; б — силуэт молекулы с активным центром (обведен пунктиром) и его 'каталитически активным' центром (х)
Эти факты привели к выводу о том, что фермент взаимодействует с субстратом не всей своей молекулой, а каким-то вполне определенным участком, расположенным на поверхности фермента (на третичной структуре). Этот участок был назван активным центром (рис. 41). В составе активного центра условно выделяют несколько участков, одни из которых обеспечивают присоединение субстрата к молекуле фермента (их называют контактными, или якорными, участками), другие — каталитические — ответственны за процесс активации субстрата. В этих участках имеются различные функциональные группировки, которые находятся в строго зафиксированном положении по отношению друг к другу. Эта особенность строения активного центра объясняет специфичность действия ферментов, так как образование фермент-субстратного комплекса возможно только в случае структурного подобия субстрата и активного центра фермента.
Под действием различных факторов (высокая температура, изменение рН среды, химические вещества) нарушается структура активного центра и фермент теряет способность взаимодействовать с субстратом, т. е. фермент инактивируется.
Рис. 41. Модель молекулы фермента. а — схема ее гретичной структуры; б — силуэт молекулы с активным центром (обведен пунктиром) и его 'каталитически активным' центром (х)
Эти факты привели к выводу о том, что фермент взаимодействует с субстратом не всей своей молекулой, а каким-то вполне определенным участком, расположенным на поверхности фермента (на третичной структуре). Этот участок был назван активным центром (рис. 41). В составе активного центра условно выделяют несколько участков, одни из которых обеспечивают присоединение субстрата к молекуле фермента (их называют контактными, или якорными, участками), другие — каталитические — ответственны за процесс активации субстрата. В этих участках имеются различные функциональные группировки, которые находятся в строго зафиксированном положении по отношению друг к другу. Эта особенность строения активного центра объясняет специфичность действия ферментов, так как образование фермент-субстратного комплекса возможно только в случае структурного подобия субстрата и активного центра фермента.
Под действием различных факторов (высокая температура, изменение рН среды, химические вещества) нарушается структура активного центра и фермент теряет способность взаимодействовать с субстратом, т. е. фермент инактивируется.
Классификация ферментов
В 1961 г. в Москве на V Международном биохимическом съезде была принята новая классификация ферментов. В основу деления всех ферментов на различные группы был положен тип катализируемой данным ферментом реакции. По этому принципу все ферменты были разделены на 6 классов: • I класс — оксидоредуктазы. К этому классу относятся все ферменты, которые катализируют окислительно-восстановительные реакции. Примером могут служить дегидрогеназы — ферменты, переносящие атомы водорода. • II класс — трансферазы. Ферменты этого класса осуществляют межмолекулярный перенос отдельных функциональных групп. Например: метальные группы -СН3 — переносят метилтрансферазы, аминные — NH2 — аминотрансферазы и т. д. • III класс — гидролазы. Ферменты этого класса гидролизуют внутримолекулярные связи с участием воды. Сюда относится большая группа ферментов, в том числе почти все ферменты желудочно-кишечного тракта: эстеразы, фосфатазы, пептидазы и др. • IV класс — лиазы. В основу выделения ферментов в этот класс положена их способность расщеплять не гидролитическим путем соединения с двойными связями. К ним относятся декарбоксилазы, ферменты, отщепляющие от субстратов СО, и др. • V класс — изомеразы. Эти ферменты катализируют взаимопревращение субстратов. Например: L-изомеры превращаются в D-формы, глюкоза — во фруктозу и т. д. • VI класс — лигазы, или синтетазы. Ферменты этого класса участвуют во всех реакциях синтеза различных соединений. Каждый класс в свою очередь подразделяется на подклассы, а последние на подподклассы, в которых расположены индивидуальные ферменты. Поэтому каждый фермент зашифрован четырьмя цифрами, каждая из которых обозначает номера класса, подкласса, подподкласса и индивидуальный номер фермента. Новая классификация ферментов позволяет быстро найти нужный фермент и определить его действие. На этом же съезде была предложена новая номенклатура ферментов. Каждый фермент имеет название, в котором отражены тип катализируемой ферментом реакции, название субстрата, на который действует фермент и окончание — аза. Например, в клетках печени имеется фермент, который расщепляет глюкозо-6-фосфат на глюкозу и фосфорную кислоту по схеме: глюкозо-6-фосфат + Н2О — глюкоза + Н3РО4. Фермент, катализирующий эту реакцию, называется глюкозо-6-фосфат-фосфо-гидролаза. В названии указан тип катализируемой реакции — гидролиз, субстрат, на который действует фермент — глюкозо-6-фосфат, и, наконец, окончание аза. Наряду с новой номенклатурой ферментов ряд ферментов сохранил свои старые названия, которые прочно вошли в практику: пепсин, трипсин и др.Значение ферментов для медицины
Жизнедеятельность любого организма обусловлена постоянным и строго последовательным течением тысяч химических реакций, катализируемых ферментами.. Поэтому любые нарушения нормальных функции организма в основе своей имеют расстройство обменных процессом, нарушение деятельности ферментов (ферментопатии). С этих позиций большинство заболеваний можно характеризовать с точки зрения изменений деятельности ферментов. Механизм возникновения подобных отклонений, роль ферментов в патологии и этиологии заболеваний, в диагностике и лечении нее эти вопросы входят в самостоятельный раздел биохимии — медицинскую ферментологию. Рис. 42. Фенилпировиноградная олигофрения у мальчика в возрасте 15 месяцев (по Майстер)
При изучении заболеваний было установлено, что первопричиной ряда из них являются нарушения синтеза ферментов. К ним относятся наследственные заболевания, такие, как фенилпировиноградная олигофрения, галактоземия, различные виды гемолитических анемий, гликогенозы, разнообразные формы нарушения свертывания крови и т. д. Например, механизм развития фенилпировиноградной олигофрении (слабоумие) заключается в том, что у больных детей нарушен синтез фенилаланин-гидроксилазы — фермента, который обеспечивает синтез тирозина из фенилаланина. Следствием является накопление в организме высоких концентраций фенилаланина и продуктов его нарушенного обмена, оказывающее губительное действие на развитие организма, в том числе мозга. У такого ребенка наряду с отставанием роста развивается психическая неполноценность (рис. 42).
Гликогенозы характеризуются снижением активности ферментов, катализирующих распад и превращения в организме гликогена. В результате печень, мышцы и другие органы переполнены гликогеном, а организм испытывает недостаток в одном из основных энергетических продуктов.
Ферментопатии могут быть токсического или алиментарного происхождения. В первом случае развитие заболеваний связано с избирательным угнетением отдельных ферментных систем различными ядами или токсинами. Алиментарные ферментопатии вызываются недостаточным снабжением организма веществами, поступающими с пищей и необходимыми для синтеза ферментов. К ним относятся недостаток белка в суточном рационе, гипо- и авитаминозы, снижение уровня минеральных веществ и т. д. Изучение данных вопросов способствует пониманию механизма развития многих заболеваний.
Большое место принадлежит ферментам в диагностике заболеваний. Исследования последних лет обнаружили избирательные нарушения ферментной активности при многих болезнях. Особое значение при этом имеет изучение ферментного состава крови, который весьма постоянен в здоровом организме. Поэтому повышение или снижение активности ферментов крови, а также появление в крови ферментов, в норме в ней отсутствующих, служит убедительным диагностическим показателем определенных изменений в организме. Особенностями ферментной диагностики являются высокая специфичность и возможность определения отклонений на ранних стадиях заболеваний. Так, определенная форма щелочной фосфатазы считается органоспецифичной для костной ткани, трипсин и химотрипсин — для поджелудочной железы и т. д. Острые гепатиты характеризуются резким повышением в крови глютаматаминотрансферазы, а инфаркт миокарда — лактатдегидрогеназы.
Диагностическая роль ферментов приобретает еще большее значение в связи с применением микро- и улырамикро-методов определения активности ферментов. Эти методы позволяют в одной капле крови определить до 10-15 ферментов. Эти методы находят широкое применение в клинике и особенно в педиатрии.
Существенное значение имеет использование ферментов в качестве лечебных препаратов. Так, трипсин применяется наружно для очистки гнойных ран, при ожогах для ускорения их заживления. Внутримышечное введение трипсина дает положительный результат при тромбофлебитах, остеомиелитах, гайморитах как противовоспалительное средство. Лизоцим нашел применение при лечении послеродовых воспалений, конъюнктивитов (воспалений конъюнктивы глаза), болезней носоглотки. Пепсин, липаза, амилаза, панкреатин многие десятилетия назначаются при недостаточности секреторной функции соответствующих отделов пищеварительного тракта. Фибринолизин рекомендуется для рассасывания тромбов сосудов. Ряд коферментов: тиаминпирофосфат, коэнзим А, АТФ и другие — также нашли применение в клинике.
Развитие фармакологии на современном этапе основано также на изучении ферментов. Это связано с тем, что разработка и получение высококачественных лекарственных препаратов против определенных заболеваний имеет в своей основе создание структурных аналогов субстратов, необходимых для жизнедеятельности микроорганизмов. Введение в организм человека структурных аналогов субстратов, безвредных для него, приводит к конкурентному торможению деятельности ферментов микроорганизмов, вызывающих заболевание. Так, для жизнедеятельности кокковых форм микробов необходима парааминобензойная кислота. Ее структурный аналог — сульфаниламидные препараты — включается в обменные процессы этих микробов и способствует их гибели. Никотиновая кислота необходима для развития туберкулезных бацилл, а ее структурный аналог — гидразид изоникотиновой кислоты — фтивазид — является эффективным средством лечения туберкулеза.
При изыскании новых лекарственных препаратов для данного заболевания ученые выясняют, какие из ферментных систем микробов являются для них жизненно важными и определяют субстраты, специфичные для этих ферментов. Затем создают синтетические структурные аналоги этих субстратов, которые были бы безвредными для человека. Именно такие препараты являются наиболее эффективными.
Все изложенное выше подтверждает важность изучения ферментов и их использования для медицинской практики.
Рис. 42. Фенилпировиноградная олигофрения у мальчика в возрасте 15 месяцев (по Майстер)
При изучении заболеваний было установлено, что первопричиной ряда из них являются нарушения синтеза ферментов. К ним относятся наследственные заболевания, такие, как фенилпировиноградная олигофрения, галактоземия, различные виды гемолитических анемий, гликогенозы, разнообразные формы нарушения свертывания крови и т. д. Например, механизм развития фенилпировиноградной олигофрении (слабоумие) заключается в том, что у больных детей нарушен синтез фенилаланин-гидроксилазы — фермента, который обеспечивает синтез тирозина из фенилаланина. Следствием является накопление в организме высоких концентраций фенилаланина и продуктов его нарушенного обмена, оказывающее губительное действие на развитие организма, в том числе мозга. У такого ребенка наряду с отставанием роста развивается психическая неполноценность (рис. 42).
Гликогенозы характеризуются снижением активности ферментов, катализирующих распад и превращения в организме гликогена. В результате печень, мышцы и другие органы переполнены гликогеном, а организм испытывает недостаток в одном из основных энергетических продуктов.
Ферментопатии могут быть токсического или алиментарного происхождения. В первом случае развитие заболеваний связано с избирательным угнетением отдельных ферментных систем различными ядами или токсинами. Алиментарные ферментопатии вызываются недостаточным снабжением организма веществами, поступающими с пищей и необходимыми для синтеза ферментов. К ним относятся недостаток белка в суточном рационе, гипо- и авитаминозы, снижение уровня минеральных веществ и т. д. Изучение данных вопросов способствует пониманию механизма развития многих заболеваний.
Большое место принадлежит ферментам в диагностике заболеваний. Исследования последних лет обнаружили избирательные нарушения ферментной активности при многих болезнях. Особое значение при этом имеет изучение ферментного состава крови, который весьма постоянен в здоровом организме. Поэтому повышение или снижение активности ферментов крови, а также появление в крови ферментов, в норме в ней отсутствующих, служит убедительным диагностическим показателем определенных изменений в организме. Особенностями ферментной диагностики являются высокая специфичность и возможность определения отклонений на ранних стадиях заболеваний. Так, определенная форма щелочной фосфатазы считается органоспецифичной для костной ткани, трипсин и химотрипсин — для поджелудочной железы и т. д. Острые гепатиты характеризуются резким повышением в крови глютаматаминотрансферазы, а инфаркт миокарда — лактатдегидрогеназы.
Диагностическая роль ферментов приобретает еще большее значение в связи с применением микро- и улырамикро-методов определения активности ферментов. Эти методы позволяют в одной капле крови определить до 10-15 ферментов. Эти методы находят широкое применение в клинике и особенно в педиатрии.
Существенное значение имеет использование ферментов в качестве лечебных препаратов. Так, трипсин применяется наружно для очистки гнойных ран, при ожогах для ускорения их заживления. Внутримышечное введение трипсина дает положительный результат при тромбофлебитах, остеомиелитах, гайморитах как противовоспалительное средство. Лизоцим нашел применение при лечении послеродовых воспалений, конъюнктивитов (воспалений конъюнктивы глаза), болезней носоглотки. Пепсин, липаза, амилаза, панкреатин многие десятилетия назначаются при недостаточности секреторной функции соответствующих отделов пищеварительного тракта. Фибринолизин рекомендуется для рассасывания тромбов сосудов. Ряд коферментов: тиаминпирофосфат, коэнзим А, АТФ и другие — также нашли применение в клинике.
Развитие фармакологии на современном этапе основано также на изучении ферментов. Это связано с тем, что разработка и получение высококачественных лекарственных препаратов против определенных заболеваний имеет в своей основе создание структурных аналогов субстратов, необходимых для жизнедеятельности микроорганизмов. Введение в организм человека структурных аналогов субстратов, безвредных для него, приводит к конкурентному торможению деятельности ферментов микроорганизмов, вызывающих заболевание. Так, для жизнедеятельности кокковых форм микробов необходима парааминобензойная кислота. Ее структурный аналог — сульфаниламидные препараты — включается в обменные процессы этих микробов и способствует их гибели. Никотиновая кислота необходима для развития туберкулезных бацилл, а ее структурный аналог — гидразид изоникотиновой кислоты — фтивазид — является эффективным средством лечения туберкулеза.
При изыскании новых лекарственных препаратов для данного заболевания ученые выясняют, какие из ферментных систем микробов являются для них жизненно важными и определяют субстраты, специфичные для этих ферментов. Затем создают синтетические структурные аналоги этих субстратов, которые были бы безвредными для человека. Именно такие препараты являются наиболее эффективными.
Все изложенное выше подтверждает важность изучения ферментов и их использования для медицинской практики.
Вопросы для повторения
1. Что такое ферменты? 2. Какова химическая природа ферментов? 3. Дайте определение катализа. 4. Что такое энергетический барьер, энергия активации? 5. В чем отличия действия ферментов от других типов катализаторов? 6. Какое сходство и какие различия между витаминами и ферментами? 7. Назовите важнейшие свойства ферментов. 8. При какой температуре ферменты проявляют максимальную активность (20°, 40 или 80°)? 9. При каком значении рН проявляют оптимум активности пенсий, амилаза (рН 2,0; 5,0; 7,0; 9,0). 10. Почему при рН 3,5 трипсин неактивен? 11. Укажите виды специфичности активности ферментов. 12. Какие факторы влияют на каталитическую активность ферментов? 13. Что такое активаторы ферментов? Приведите примеры. 14. Дайте определение понятию "ингибиторы ферментов". 15. Назовите виды торможения активности ферментов. 16. Что лежит в основе механизма действия ферментов? 17. Что такое "активный" центр фермента? 18. Какие ферменты называются простыми, сложными? Приведите примеры. 19. Какие известны коферменты? 20. Что лежит в основе классификации ферментов? 21. Какое значение имеют ферменты в диагностике, патогенезе и лечении заболеваний? Приведите примеры. 22. Дайте определение наследственным заболеваниям. Какова причина их возникновения? 23. Какова сущность ферментного действия лекарственных веществ?IV. Гормоны
Общие представления о гормонах
Одной из систем, регулирующих обмен веществ в организме, является гормональная система, которая включает действие всех эндокринных желез — желез внутренней секреции. Процесс выделения вырабатываемых тканью веществ непосредственно в кровоток называется внутренней секрецией. Клетки эндокринных желез продуцируют особые вещества, называемые гормонами (гормон в переводе с греч.- возбуждаю, стимулирую). Гормоны — это биологически активные вещества различной химической природы, которые в незначительных дозах оказывают на организм очень сильное действие. Механизм действия гормонов изучен пока еще недостаточно. Имеющиеся данные указывают, что некоторые гормоны — АКТГ, глюкагон, адреналин, инсулин — проявляют свое действие путем влияния на активность ферментов. В связи с этим воздействие гормонов на организм отличается крайней разносторонностью. Процессы обмена веществ, роста, полового развития, защитные и приспособительные функции организма находятся под контролем желез внутренней секреции. Существует тесная взаимосвязь между гормональными (гуморальными) и нервными регуляторными механизмами организма. И те и другие в свою очередь контролируются корой головного мозга. Гормоны отличаются друг от друга по структуре и избирательности воздействия на организм. Так, гормоны пара щитовидных желез воздействуют преимущественно на костную ткань и почки, гормоны щитовидных желез обладают универсальным влиянием на каждую клетку организма, а гормоны гипофиза выполняют регуляторную функцию по отношению к другим эндокринным железам. Гормоны являются жизненно необходимыми для организма веществами. Заболевания, возникающие на почве нарушения функций той или иной эндокринной железы, являются следствием либо гипофункции железы (пониженная секреция гормона), либо ее гиперфункции (избыточное выделение гормона). В организме имеются следующие железы внутренней секреции: щитовидная, паращитовидная, половые, надпочечники, поджелудочная, зобная, гипофиз и др. Среди всех желез выделяется поджелудочная железа, которая является одновременно и железой внешней секреции, т. е. имеет выводные протоки, через которые в просвет кишечника поступает сок поджелудочной железы, богатый ферментами, необходимыми для процессов переваривания пищи в кишечнике. По своей химической природе все гормоны можно разделить на несколько групп. Первая группа — гормоны, имеющие белковую природу. К ним относятся, например, гормоны гипофиза, поджелудочной, щитовидной железы. В желудке вырабатывается гормон — гастрин, являющийся белком с большим молекулярным весом, который способствует образованию соляной кислоты и выделению желудочного сока. В двенадцатиперстной кишке присутствует секретин — гормон белковой природы, функция которого заключается в стимулировании секреции желчи и сока поджелудочной железы. Гормоны мозгового слоя надпочечников (адреналин и иорадреналин) являются производными аминокислоты тирозина. К гормонам, имеющим стероидную структуру, относятся мужские и женские половые гормоны, кортико-стероиды (гормоны коры надпочечников), гормоны плаценты. Достижения последних лет позволили выделить группу веществ, обладающих гормоноподобным действием. Они были названы гормонами местного действия. Эти вещества образуются отдельными клетками организма в результате процессов обмена веществ. К ним относятся гистамин, серотонин, брадикинин, калликреин, ренин и др.Гормоны щитовидной железы
Щитовидная железа состоит из двух овальных телец общим весом 25-30 г, расположенных по обе стороны нижней части гортани и трахеи. Особенностью щитовидной железы является высокое содержание в ней йода. Из 50 мг йода, содержащегося в организме, 10-15 мг приходится на долю последней, что было подтверждено опытами с радиоактивным йодом. Уже через два часа после введения в организм I131 основная масса его была обнаружена в щитовидной железе. Таким образом, щитовидную железу можно считать депо йода. Йод поступает в организм преимущественно с пищей, а также с водой и поваренной солью. Продукты, содержащие много йода (яйца, рыба, свежие овощи), способствуют отложению йода в щитовидной железе. Суточная потребность человека в йоде составляет 0,15-0,3 мг. При различных физиологических состояниях (рост, беременность) эта потребность повышается. Выделение йода происходит в основном через почки. Поглощение йода тканью щитовидной железы зависит от состояния ее активности. Поэтому о функциональном состоянии щитовидной железы можно судить по количеству введенного йода. При пониженной функции железы концентрирование в ней йода идет медленно, а при гиперфункции — быстро. Это имеет важное значение в клинике для диагностики функционального состояния железы. Йод в щитовидной железе находится в форме: 1. неорганического йода, 2. органического, гормональноактивного йода (трийодтиронин и тироксин), 3. органического, гормональнонеактивного йода (моно- и дийодтирозин). В состоянии покоя гормональноактивный йод составляет лишь 10% общего йода, который быстро увеличивается при стимуляции тиреотропным гормоном гипофиза. Секрет железы представляет йодсодержащий белок — тиреоглобулин, который является депо неактивных гормонов. Под действием протеолитических ферментов тиреоглобулин распадается на белок и небелковую группу, составные части которой и обладают гормональной активностью. К таким соединениям относятся три- и гетрайодтиронин. Последний носит название "тироксин". Биосинтез гормонов щитовидной железы протекает путем постепенного йодирования остатков тирозина в молекуле тиреоглобулина с последующим его расщеплением на гормональноактивные соединения. Гормоны щитовидной железы влияют на основной обмен, усиливая процессы биологического окисления и увеличивая потребление кислорода, регулируют обмен жира, воды, дифференцировку развития тканей.
Изменение уровня выработки гормонов приводит к развитию тяжелых заболеваний.
Гормоны щитовидной железы влияют на основной обмен, усиливая процессы биологического окисления и увеличивая потребление кислорода, регулируют обмен жира, воды, дифференцировку развития тканей.
Изменение уровня выработки гормонов приводит к развитию тяжелых заболеваний.
 Рис. 43. Группа больных кретинизмом (Швейцария, Гарроу)
Гипофункция щитовидной железы или ее атрофия в молодом возрасте характеризуется развитием кретинизма, который проявляется задержкой, а затем и остановкой роста (карликовый рост), нарушением пропорционального развития частей тела, умственной отсталостью (рис. 43).
Гипофункция, вызванная недостаточностью в организме йода и перерождением железистой ткани железы, называется эндемическим зобом. При этом заболевании размеры железы значительно увеличиваются, она выступает в области шеи в виде зоба. Это заболевание распространено в тех местностях, почвы которых бедны йодом, например в горных районах. С целью лечения и предупреждения эндемического зоба производят йодирование воды и пищевых продуктов — соли, сахара, молока и др.
Рис. 43. Группа больных кретинизмом (Швейцария, Гарроу)
Гипофункция щитовидной железы или ее атрофия в молодом возрасте характеризуется развитием кретинизма, который проявляется задержкой, а затем и остановкой роста (карликовый рост), нарушением пропорционального развития частей тела, умственной отсталостью (рис. 43).
Гипофункция, вызванная недостаточностью в организме йода и перерождением железистой ткани железы, называется эндемическим зобом. При этом заболевании размеры железы значительно увеличиваются, она выступает в области шеи в виде зоба. Это заболевание распространено в тех местностях, почвы которых бедны йодом, например в горных районах. С целью лечения и предупреждения эндемического зоба производят йодирование воды и пищевых продуктов — соли, сахара, молока и др.
 Рис. 44. Микссдема (по Н. Л. Шерешевскому)
Гипофункция или атрофия щитовидной железы у взрослых является причиной микседемы — слизистого отека (рис. 44). Для этого заболевания характерны отечность кожи, задержка воды в тканях, понижение обмена веществ, общая вялость, ожирение и старческий вид даже в молодом возрасте. Лечение предусматривает введение гормональных препаратов.
Рис. 44. Микссдема (по Н. Л. Шерешевскому)
Гипофункция или атрофия щитовидной железы у взрослых является причиной микседемы — слизистого отека (рис. 44). Для этого заболевания характерны отечность кожи, задержка воды в тканях, понижение обмена веществ, общая вялость, ожирение и старческий вид даже в молодом возрасте. Лечение предусматривает введение гормональных препаратов.
 Рис. 45. Слева больная с резко выраженной формой базедовой болезни, справа — та же больная через год после операции
Гиперфункция щитовидной железы у человека проявляется развитием базедовой болезни (рис. 45). Основными клиническими симптомами являются общее исхудание, дрожание конечностей, экзофтальм (пучеглазие), нарушение сердечной и психической деятельности. Основной обмен у больных резко повышен, увеличено поглощение кислорода, выделение углекислого газа, выведение азота с мочой, креати-нурия.
Лечение базедовой болезни направлено на снижение выработки гормонов путем блокирования поступления йода в организм, введением производных мочевины. Широкое применение находит введение в организм радиоактивного йода в небольших дозах. При этом происходит избирательная сорбция I131 тканью железы. Радиоактивный йод, распадаясь в тканях железы, выделяет гамма-лучи, которые обеспечивают локальное (ограниченное) облучение пораженной ткани.
В некоторых случаях показано хирургическое вмешательство с целью удаления части железы.
Рис. 45. Слева больная с резко выраженной формой базедовой болезни, справа — та же больная через год после операции
Гиперфункция щитовидной железы у человека проявляется развитием базедовой болезни (рис. 45). Основными клиническими симптомами являются общее исхудание, дрожание конечностей, экзофтальм (пучеглазие), нарушение сердечной и психической деятельности. Основной обмен у больных резко повышен, увеличено поглощение кислорода, выделение углекислого газа, выведение азота с мочой, креати-нурия.
Лечение базедовой болезни направлено на снижение выработки гормонов путем блокирования поступления йода в организм, введением производных мочевины. Широкое применение находит введение в организм радиоактивного йода в небольших дозах. При этом происходит избирательная сорбция I131 тканью железы. Радиоактивный йод, распадаясь в тканях железы, выделяет гамма-лучи, которые обеспечивают локальное (ограниченное) облучение пораженной ткани.
В некоторых случаях показано хирургическое вмешательство с целью удаления части железы.
Гормоны паращитовидных желез
Паращитовидные железы — или эпителиальные тельца — представляют собой 4 овальных образования весом 0,1 — 0,5 г, расположенных около щитовидных желез. На их значение в обмене веществ было обращено внимание в связи с тем, что после удаления щитовидных желез, вместе с которыми удалялись и паращитовидные железы, возникали тетанические судороги. В дальнейшем было установлено, что они являются железами внутренней секреции и продуцируют белковый гормон — паратиреоидный (паратгормон), который в своем действии тесно связан с обменом кальция и фосфора и витамина D. При гипофункции паращитовидных желез развиваются судороги, отмечаются нарушения развития кожи, ногтей, катаракта (помутнение хрусталика). В плазме крови снижаемся уровень кальция и повышается концентрация фосфора. Удаление желез приводит к смерти. При повышенной выработке гормона развиваются тяжелые общие симптомы: мышечная слабость, рвота, диарея, полиурия (повышенное выделение мочи), которые в течение нескольких дней могут привести к смерти. При этом заболевании отмечаются резкие сдвиги в обмене кальция и фосфора, что проявляется в мобилизации их из костей и повышенном выведении фосфора почками: кальций откладывается в органах, в том числе в почках.Гормоны надпочечников
В 1855 г. Аддисон указал на связь заболевания, при котором наблюдается коричневая пигментация кожи (бронзовая болезнь, или болезнь Аддисона), с поражением коры надпочечников. Этими работами впервые была отмечена важность для организма надпочечников. Надпочечники представляют два небольших тела весом в-11 г, расположенных около почек. С функциональной точки зрения надпочечники состоят из двух различных отделов: коркового и мозгового слоев. Кора составляет 9/10 всей ткани, а мозговой слой — 1/10 часть. Они продуцируют различные гормоны. Мозговое вещество надпочечников вырабатывает адреналин (около 75%) и норадреналин, которые объединяются общим названием — катехоламины, или пирокатехины. В концевых аппаратах симпатической нервной системы вырабатываются симпатины, представляющие собой, по-1 видимому, смесь адреналина и норадреналина. Предшественником этих веществ является тирозин.
Адреналин и норадреналин вызывают повышение кровяною давления в сосудах кожи, слизистых оболочек и усилие частоты сердцебиений. Однако действие их на кровообращение несколько различно. Адреналин в небольших концентрациях вызывает расширение артериол сердца и скелетных мышц, что способствует лучшему снабжению кровью этих органов при физической работе. Норадреналин, наоборот, во всех отделах кровотока вызывает сужение сосудов. Он способствует сокращению гладкой мускулатуры (мышцы беременной матки) и расслаблению мышц бронхов и кишечника.
В концевых аппаратах симпатической нервной системы вырабатываются симпатины, представляющие собой, по-1 видимому, смесь адреналина и норадреналина. Предшественником этих веществ является тирозин.
Адреналин и норадреналин вызывают повышение кровяною давления в сосудах кожи, слизистых оболочек и усилие частоты сердцебиений. Однако действие их на кровообращение несколько различно. Адреналин в небольших концентрациях вызывает расширение артериол сердца и скелетных мышц, что способствует лучшему снабжению кровью этих органов при физической работе. Норадреналин, наоборот, во всех отделах кровотока вызывает сужение сосудов. Он способствует сокращению гладкой мускулатуры (мышцы беременной матки) и расслаблению мышц бронхов и кишечника.
 Рис. 46. Активная фосфорилазы адреналином
Адреналин оказывает значительное влияние на обмен веществ, которое проявляется его участием в углеводном обмене. Он стимулирует распад гликогена в печени и мышцах, что приводит к повышению уровня сахара крови. В настоящее время изучен механизм такого действия адреналина, который заключается в том, что последний принимает участие в процессе активации фосфорилазы, фермента, катализирующего распад гликогена (рис. 46). При этом адреналин обеспечивает превращение неактивной фосфорилазы в активную.
В противоположность ему норадреналин не оказывает никакого действия на обмен веществ, являясь, таким образом, гормоном только кровообращения. Выделение гормонов мозгового слоя надпочечников осуществляется под непосредственным влиянием нервной системы. Возбуждение симпатического тонуса всякий раз вызывает увеличение выработки гормонов.
Корковое вещество надпочечников продуцирует большую группу гормонов, имеющих общую химическую структуру — стероидную. Поэтому гормоны коры надпочечников часто называют стероидными гормонами. В настоящее время выделено около 30 веществ, ряд из которых обладает гормональной активностью.
Экспериментальное удаление надпочечников быстро, в течение 1-2 дней, приводит животных к гибели. Недостаточная выработка гормонов у животных сопровождается расстройством солевого обмена и нарушением взаимосвязи обменов углеводов и белков, которое приводит к изменению и обмена жира. Эти нарушения приводят к понижению резистентности организма, мышечной слабости, расстройству функции почек, потере аппетита, снижению кровяного давления и увеличению остаточного азота, сдвигу кислотно-щелочного равновесия в сторону ацидоза, гипогликемии.
По своему действию гормоны коры надпочечников были разделены на две группы: минералокортикоиды и глюкокортикоиды.
К минералокортикоидам относятся альдостерон и дезоксикортикостерон. В группу глюкокортикоидов входят кортизол, кортизон и кортикостерон. Кроме того, в экстрактах коры надпочечников обнаружены половые гормоны, которые являются промежуточными продуктами при синтезе собственно гормонов коры.
Химическим предшественником стероидных гормонов является холестерин.
Минералокортикоиды оказывают действие на водно-солевой обмен, способствуя задержке в организме натрия и хлора и выведению калия с мочой.
При недостаточной выработке гормонов происходит повышенное выведение Na+ с мочой, это приводит к уменьшению его концентрации в плазме крови. Одновременно с натрием из организма выводятся хлориды и как следствие этого происходит повышенное выведение воды. Потеря натрия компенсаторно приводит к выходу калия из клеток и накоплению его в крови. Все это сопровождается нарушением функции почек, повышением в крови небелкового азота, развитием ацидоза, повышением возбудимости.
Избыточная продукция минералокортикоидов вызывает противоположную картину: повышение уровня натрия и снижение калия в организме.
Глюкокортикоиды оказывают значительное влияние на обмен углеводов и белков. Они усиливают процессы распада белков и аминокислот и приводят тем самым к повышенному выделению азота и развитию отрицательного азотистого баланса. Действие глюкокортикоидов на углеводный обмен проявляется повышением уровня сахара в крови. Механизм этого действия заключается в активации процесса глюко-неогенеза, т. е. обеспечения синтеза углеводов за счел жиров и безазотистых продуктов распада аминокислот. Помимо этого, глюкокортикоиды вызываютперераспределение гликогена в организме. Происходит отложение гликогена в печени за счет резервов гликогена в мышцах.
Снижение выработки глюкокортикоидов приводит к торможению процессов распада белка и глюконеогенеза, что проявляется уменьшением выделения азота с мочой и гипо-гликемическим эффектом. Результатом этого является развитие отеков.
Однако различие между этими группами корковых гормонов недостаточно отчетливо. Альдостерон может оказывать влияние на обмен углеводов, а глюкокортикоиды — на минеральный баланс организма, способствуя развитию отеков.
В печени кортикостероиды окисляются и в виде 17-кетостероидов выводятся из организма, уровень которых в моче является показателем их обмена.
Нарушение в синтезе гормонов проявляется симптомами в зависимости от вида гормона. При гиперфункции гормонов коры надпочечников развиваются ожирение, гипергликемия, нарушение минерального обмена и т. д.
Частичное выпадение функции коры надпочечников приводит к возникновению аддисоновой болезни, которая проявляется бронзовой окраской кожи, мышечной слабостью, гипергликемией, гипоазотемией, нарушением водно-солевого обмена.
Рис. 46. Активная фосфорилазы адреналином
Адреналин оказывает значительное влияние на обмен веществ, которое проявляется его участием в углеводном обмене. Он стимулирует распад гликогена в печени и мышцах, что приводит к повышению уровня сахара крови. В настоящее время изучен механизм такого действия адреналина, который заключается в том, что последний принимает участие в процессе активации фосфорилазы, фермента, катализирующего распад гликогена (рис. 46). При этом адреналин обеспечивает превращение неактивной фосфорилазы в активную.
В противоположность ему норадреналин не оказывает никакого действия на обмен веществ, являясь, таким образом, гормоном только кровообращения. Выделение гормонов мозгового слоя надпочечников осуществляется под непосредственным влиянием нервной системы. Возбуждение симпатического тонуса всякий раз вызывает увеличение выработки гормонов.
Корковое вещество надпочечников продуцирует большую группу гормонов, имеющих общую химическую структуру — стероидную. Поэтому гормоны коры надпочечников часто называют стероидными гормонами. В настоящее время выделено около 30 веществ, ряд из которых обладает гормональной активностью.
Экспериментальное удаление надпочечников быстро, в течение 1-2 дней, приводит животных к гибели. Недостаточная выработка гормонов у животных сопровождается расстройством солевого обмена и нарушением взаимосвязи обменов углеводов и белков, которое приводит к изменению и обмена жира. Эти нарушения приводят к понижению резистентности организма, мышечной слабости, расстройству функции почек, потере аппетита, снижению кровяного давления и увеличению остаточного азота, сдвигу кислотно-щелочного равновесия в сторону ацидоза, гипогликемии.
По своему действию гормоны коры надпочечников были разделены на две группы: минералокортикоиды и глюкокортикоиды.
К минералокортикоидам относятся альдостерон и дезоксикортикостерон. В группу глюкокортикоидов входят кортизол, кортизон и кортикостерон. Кроме того, в экстрактах коры надпочечников обнаружены половые гормоны, которые являются промежуточными продуктами при синтезе собственно гормонов коры.
Химическим предшественником стероидных гормонов является холестерин.
Минералокортикоиды оказывают действие на водно-солевой обмен, способствуя задержке в организме натрия и хлора и выведению калия с мочой.
При недостаточной выработке гормонов происходит повышенное выведение Na+ с мочой, это приводит к уменьшению его концентрации в плазме крови. Одновременно с натрием из организма выводятся хлориды и как следствие этого происходит повышенное выведение воды. Потеря натрия компенсаторно приводит к выходу калия из клеток и накоплению его в крови. Все это сопровождается нарушением функции почек, повышением в крови небелкового азота, развитием ацидоза, повышением возбудимости.
Избыточная продукция минералокортикоидов вызывает противоположную картину: повышение уровня натрия и снижение калия в организме.
Глюкокортикоиды оказывают значительное влияние на обмен углеводов и белков. Они усиливают процессы распада белков и аминокислот и приводят тем самым к повышенному выделению азота и развитию отрицательного азотистого баланса. Действие глюкокортикоидов на углеводный обмен проявляется повышением уровня сахара в крови. Механизм этого действия заключается в активации процесса глюко-неогенеза, т. е. обеспечения синтеза углеводов за счел жиров и безазотистых продуктов распада аминокислот. Помимо этого, глюкокортикоиды вызываютперераспределение гликогена в организме. Происходит отложение гликогена в печени за счет резервов гликогена в мышцах.
Снижение выработки глюкокортикоидов приводит к торможению процессов распада белка и глюконеогенеза, что проявляется уменьшением выделения азота с мочой и гипо-гликемическим эффектом. Результатом этого является развитие отеков.
Однако различие между этими группами корковых гормонов недостаточно отчетливо. Альдостерон может оказывать влияние на обмен углеводов, а глюкокортикоиды — на минеральный баланс организма, способствуя развитию отеков.
В печени кортикостероиды окисляются и в виде 17-кетостероидов выводятся из организма, уровень которых в моче является показателем их обмена.
Нарушение в синтезе гормонов проявляется симптомами в зависимости от вида гормона. При гиперфункции гормонов коры надпочечников развиваются ожирение, гипергликемия, нарушение минерального обмена и т. д.
Частичное выпадение функции коры надпочечников приводит к возникновению аддисоновой болезни, которая проявляется бронзовой окраской кожи, мышечной слабостью, гипергликемией, гипоазотемией, нарушением водно-солевого обмена.
Гормоны поджелудочной железы
Поджелудочная железа, как отмечено выше, является железой с двойной секрецией: внутренней и внешней. Как эндокринная железа она секретирует два гормона: инсулин и глюкагон. Первый из них вырабатывается β-клетками, а второй — α-клетками островков Лангерганса. Впервые на эндокринную функцию поджелудочной железы обратили внимание, когда при ее удалении развились симптомы сахарного диабета. Антидиабетический фактор из поджелудочной железы впервые получил Л. В. Соболев в 1902 г. Он перевязывал выводные протоки железы, достигая этим разрушения клеток, синтезирующих протеолитические ферменты типа трипсина, химотрипсина и др. Железистая ткань, продуцирующая гормоны, не изменялась. При этом предотвращалось расщепление гормонов как веществ белковой природы протеолитическими ферментами. Л. В. Соболев предложил получать этот антидиабетический препарат из поджелудочной железы новорожденных телят, у которых островковый аппарат хорошо функционирует, а ткань, выделяющая ферменты, недоразвита. Полученный препарат явился средством для лечения сахарного диабета. Впоследствии он был назван инсулином, и в 1961 г. Ингремом получен синтетическим путем. Инсулин представляет собой белок, состоящий из 51 остатка аминокислот, расположенных в виде двух полипептидных цепей. Однако при использовании такого препарата было обращено внимание на факт первоначального кратковременного гипергликемического эффекта с последующим стойким гипогликемическим действием. При изучении было установлено, что гипергликемический эффект вызывает другой гормон — глюкагон, который синтезируется α-клетками. В 1936 г. американский хирург Драгетедт, наблюдая скопление жира в печени после удаления поджелудочной железы, высказал предположение о наличии в последней еще одного гормона, действие которого направлено на обмен жира. В результате проведенных исследований было установлено, что этот гормональный препарат по химической структуре является полипептидом, вырабатывается в эпителии мелких протоков поджелудочной железы и стимулирует липотропное действие холина и метионина. В связи с этим он был назван липокаином. Получают липокаин из отходов производства инсулина и используют в качестве лечебного препарата при заболеваниях печени (болезнь Боткина, цирроз печени). В нормальной поджелудочной железе содержится в среднем около 15 мг инсулина. При этом относительное содержание гормона в железе у детей выше, чем у взрослых. При диабете его содержание снижается до У5 — Ую нормы. Секреция гормона происходит непрерывно, но его действие длится короткое время, после чего инсулин быстро подвергается разрушению инсулиназой. Действие инсулина в основном направлено на обмен углеводов и проявляется снижением уровня сахара в крови (гипогликемический эффект). Это происходит за счет того, что инсулин облегчает переход глюкозы в клетки органов и тканей, где стимулирует ее активирование путем образования глюкозо-6-фосфата. Последний, окисляясь, обеспечивает клетки энергией. Механизм действия инсулина в последнем случае заключается в активировании гексокиназы, фермента, катализирующего синтез глюкозо-6-фосфата. Таким образом, инсулин способствует периферическому окислению глюкозы. Наряду с этим инсулин тормозит распад гликогена (гликогенолиз) в печени и реакции глюконео-генеза. При этом снижаются процессы распада жиров и превращение аминокислот в глюкозу и происходит активирование синтеза жиров и белков.Половые гормоны
Половые гормоны вырабатываются половыми железами- семенниками и яичниками, а также желтым телом и плацентой. Различают мужские (андрогены) и женские (эстрогены) половые гормоны. По структуре все они относятся к стероидам, и их образование происходит через стадию прогестерона, который обнаруживается как в яичниках, так и яичках. Следует отметить, что андрогены являются промежуточными продуктами при синтезе эстрогенов. Поэтому и в мужском и женском организме находятся одновременно те и другие гормоны. Однако в мужском организме количество андрогенов значительно выше количества эстрогенов. В женском организме существует обратная зависимость. Половые гормоны обусловливают рост и полное развитие половых органов, формирование вторичных половых признаков. У женщин эстрогены определяют половой цикл организма, период беременности и лактации. Половые гормоны оказывают большое влияние и на обмен веществ. Давно было известно, что кастрация (удаление половых желез) приводит к ожирению. Поэтому этот метод широко использовали для улучшения откорма скота. Кастрация в молодом возрасте приводит к тому, что организм не достигает половой зрелости и не развиваются вторичные половые признаки, типичные для данного пола. При пересадке половых желез противоположного пола кастрированному животному можно наблюдать появление вторичных половых признаков донора. Из женских половых гормонов высокой активностью обладает эстрадиол, выделенный из фолликулов. При его расщеплении образуются эстрон и эстриол — вещества, обладающие гормональной активностью, но значительно меньшей, чем активность эстрадиола.
Биосинтез эстрогенов с большой скоростью происходит в яичниках и в малых количествах в надпочечниках и других тканях.
Биологическое действие эстрогенов весьма многообразно. Эстрогены вызывают специфические изменения матки и влагалища, рост молочных желез, формирование вторичных половых признаков (женское строение тела, тип оволосения и т. д.), а также стимулируют процессы деления клетки и окостенение. По мере созревания фолликула они стимулируют разрастание слизистой оболочки матки и сохранение желтого тела, повышают обмен веществ в ткани матки, усиливая потребление кислорода, образование нуклеиновых кислот и синтез белков.
Желтое тело, образующееся при созревании фолликула, продуцирует гормон прогестерон, который способствует прикреплению оплодотворенного яйца к слизистой оболочке матки и развитию эмбриона в первой половине беременности. В период беременности этот гормон вырабатывается плацентой, которая продуцирует и свой собственный гормон — хорионгонадотропный. Под его влиянием происходит созревание фолликула и начинается рост желтого тела.
В мужском организме, как было отмечено выше, также обнаружены небольшие количества эстрогенов, которые влияют на рост мужских половых органов и предстательной железы.
В настоящее время получены синтетические вещества, обладающие активностью эстрогенов, представителем которых является стильбэстрол.
Мужские половые гормоны стимулируют развитие половых органов и формируют вторичные половые признаки. Они оказывают значительное влияние на обмен веществ. Это выражается в стимуляции синтеза белка, особенно в мышцах, что приводит к увеличению объема мышц. У мужчин на рост костей андрогены действуют сильнее, чем эстрогены, что приводит к положительному балансу азота. На этом основано применение андрогенов для лечения старческого остеопороза (обызвествление костей). Мужские половые гормоны активируют процессы тканевого дыхания и образования энергии.
К андрогенам относятся тестостерон, андростерон и др. Тестостерон образуется в результате внутрисекреторной деятельности семенников, которая контролируется гонадотропным гормоном гипофиза. Пониженная деятельность гипофиза и без кастрации приводит к значительному уменьшению секреции мужских половых гормонов. Тестостерон применяется в клинике при сниженной эндокринной деятельности семенников, стимуляции роста у подростков, при лечении некоторых видов раковых опухолей грудных желез.
При распаде половых гормонов образуются разнообразные продукты, которые выводятся из организма в виде соединений с глюкуроновой и серной кислотами с мочой и частично через кожу. Определение продуктов выделения половых гормонов в моче имеет большое клиническое значение.
Из женских половых гормонов высокой активностью обладает эстрадиол, выделенный из фолликулов. При его расщеплении образуются эстрон и эстриол — вещества, обладающие гормональной активностью, но значительно меньшей, чем активность эстрадиола.
Биосинтез эстрогенов с большой скоростью происходит в яичниках и в малых количествах в надпочечниках и других тканях.
Биологическое действие эстрогенов весьма многообразно. Эстрогены вызывают специфические изменения матки и влагалища, рост молочных желез, формирование вторичных половых признаков (женское строение тела, тип оволосения и т. д.), а также стимулируют процессы деления клетки и окостенение. По мере созревания фолликула они стимулируют разрастание слизистой оболочки матки и сохранение желтого тела, повышают обмен веществ в ткани матки, усиливая потребление кислорода, образование нуклеиновых кислот и синтез белков.
Желтое тело, образующееся при созревании фолликула, продуцирует гормон прогестерон, который способствует прикреплению оплодотворенного яйца к слизистой оболочке матки и развитию эмбриона в первой половине беременности. В период беременности этот гормон вырабатывается плацентой, которая продуцирует и свой собственный гормон — хорионгонадотропный. Под его влиянием происходит созревание фолликула и начинается рост желтого тела.
В мужском организме, как было отмечено выше, также обнаружены небольшие количества эстрогенов, которые влияют на рост мужских половых органов и предстательной железы.
В настоящее время получены синтетические вещества, обладающие активностью эстрогенов, представителем которых является стильбэстрол.
Мужские половые гормоны стимулируют развитие половых органов и формируют вторичные половые признаки. Они оказывают значительное влияние на обмен веществ. Это выражается в стимуляции синтеза белка, особенно в мышцах, что приводит к увеличению объема мышц. У мужчин на рост костей андрогены действуют сильнее, чем эстрогены, что приводит к положительному балансу азота. На этом основано применение андрогенов для лечения старческого остеопороза (обызвествление костей). Мужские половые гормоны активируют процессы тканевого дыхания и образования энергии.
К андрогенам относятся тестостерон, андростерон и др. Тестостерон образуется в результате внутрисекреторной деятельности семенников, которая контролируется гонадотропным гормоном гипофиза. Пониженная деятельность гипофиза и без кастрации приводит к значительному уменьшению секреции мужских половых гормонов. Тестостерон применяется в клинике при сниженной эндокринной деятельности семенников, стимуляции роста у подростков, при лечении некоторых видов раковых опухолей грудных желез.
При распаде половых гормонов образуются разнообразные продукты, которые выводятся из организма в виде соединений с глюкуроновой и серной кислотами с мочой и частично через кожу. Определение продуктов выделения половых гормонов в моче имеет большое клиническое значение.
Гормоны гипофиза
Гипофиз представляет собой небольшое образование весом 0,5-1 г, расположенное в турецком седле и прикрепленное гонкой ножкой к основанию мозга. Гипофиз играет центральную роль в эндокринной системе в качестве регулятора ряда желез внутренней секреции. Помимо этого, гормоны гипофиза оказывают и непосредственное влияние на клетки организма (рис. 47). В гипофизе обнаруживаются три различных в функциональном отношении отдела: передняя, средняя и задняя доли. У человека средняя доля в значительной степени недоразвита. Рис. 47. Взаимодействие между гипофизом, промежуточным мозгом и исполнительными органами
В передней доле гипофиза продуцируется 6 гормонов: соматотропный, тиреотропный, адренокортикотропный (АКТГ), фолликулостимулирующий, лютеотропный и стимулирующий рост интерстициальных клеток.
Соматотропный гормон (гормон роста) оказывает влияние на рост в молодом возрасте, в частности на рост и развитие костей и мышц. Он способствует мобилизации жиров из жировой ткани и доставке их в печень. Его влияние на углеводный обмен характеризуется развитием гипергликемии.
Тиреотропный гормон регулирует выработку гормонов щитовидной железы.
Адренокортикотропный гормон оказывает влияние на выработку гормонов корой надпочечников, снижает содержание холестерина и аскорбиновой кислоты в организме. В свою очередь, кортикостероиды влияют на выработку АКТГ по типу обратной связи, когда избыток кортикостероидов тормозит синтез АКТГ.
Фолликулостимулирующий гормон вызывает у самок рост и созревание фолликул, а у самцов — повышение сперматогенеза.
Гормон, стимулирующий интерстициальные клетки, проявляет свое действие только совместно с фолликулостимули-рующим гормоном. У самцов он активирует секрецию андро-генов и развитие предстательной железы. На самок действует путем ускорения созревания фолликулов и желтого тела.
Лютеотропный гормон оказывает на организм самок различное влияние. В женском организме он активирует выработку гормона желтого тела (прогестерона), способствует развитию молочных желез и выработке молока.
В задней доле гипофиза находятся два гормона пептидной природы — вазопрессин и окситоцин. В настоящее время они синтезированы.
Главное действие вазопрессина направлено в основном на поддержание водного баланса и повышение кровяного давления.
Действие вазопрессина на водный обмен заключается в стимулировании процессов реабсорбции воды в почечных канальцах, что приводит к уменьшению мочеотделения (антидиуретическое действие). При повреждении задней доли гипофиза выработка вазопрессина снижается, что может привести к развитию несахарного диабета. Клиническая картина этого заболевания проявляется увеличением выделения мочи, иногда до 20 л в сутки, сильной жаждой, когда больной выпивает огромное количество воды. Введение вазопрессина в очень малых дозах (0,0001 мг) оказывает положительный эффект.
Окситоцин действует преимущественно на матку, вызывая ее сокращением стимулирует выделение молока молочными железами.
Рис. 47. Взаимодействие между гипофизом, промежуточным мозгом и исполнительными органами
В передней доле гипофиза продуцируется 6 гормонов: соматотропный, тиреотропный, адренокортикотропный (АКТГ), фолликулостимулирующий, лютеотропный и стимулирующий рост интерстициальных клеток.
Соматотропный гормон (гормон роста) оказывает влияние на рост в молодом возрасте, в частности на рост и развитие костей и мышц. Он способствует мобилизации жиров из жировой ткани и доставке их в печень. Его влияние на углеводный обмен характеризуется развитием гипергликемии.
Тиреотропный гормон регулирует выработку гормонов щитовидной железы.
Адренокортикотропный гормон оказывает влияние на выработку гормонов корой надпочечников, снижает содержание холестерина и аскорбиновой кислоты в организме. В свою очередь, кортикостероиды влияют на выработку АКТГ по типу обратной связи, когда избыток кортикостероидов тормозит синтез АКТГ.
Фолликулостимулирующий гормон вызывает у самок рост и созревание фолликул, а у самцов — повышение сперматогенеза.
Гормон, стимулирующий интерстициальные клетки, проявляет свое действие только совместно с фолликулостимули-рующим гормоном. У самцов он активирует секрецию андро-генов и развитие предстательной железы. На самок действует путем ускорения созревания фолликулов и желтого тела.
Лютеотропный гормон оказывает на организм самок различное влияние. В женском организме он активирует выработку гормона желтого тела (прогестерона), способствует развитию молочных желез и выработке молока.
В задней доле гипофиза находятся два гормона пептидной природы — вазопрессин и окситоцин. В настоящее время они синтезированы.
Главное действие вазопрессина направлено в основном на поддержание водного баланса и повышение кровяного давления.
Действие вазопрессина на водный обмен заключается в стимулировании процессов реабсорбции воды в почечных канальцах, что приводит к уменьшению мочеотделения (антидиуретическое действие). При повреждении задней доли гипофиза выработка вазопрессина снижается, что может привести к развитию несахарного диабета. Клиническая картина этого заболевания проявляется увеличением выделения мочи, иногда до 20 л в сутки, сильной жаждой, когда больной выпивает огромное количество воды. Введение вазопрессина в очень малых дозах (0,0001 мг) оказывает положительный эффект.
Окситоцин действует преимущественно на матку, вызывая ее сокращением стимулирует выделение молока молочными железами.
Зобная железа
Зобная железа сохраняется в организме до достижения половой зрелости, после чего она превращается в жировое тело. Зобная железа играет большую роль в явлениях становления и развития защитных сил организма. Удаление железы в молодом возрасте приводит к замедлению роста и раннему развитию половых желез.Местные гормоны
В последнее время было указано на существование в организме ряда веществ, действующих в какой-то степени подобно гормонам. К ним были отнесены вещества, вырабатываемые в пищеварительном тракте, так называемые местные гормоны. Гастрин, действие которого впервые обнаружил И. П. Павлов, вырабатывается в желудке и стимулирует секрецию желез дна желудка. Рис. 48. Места образования и действии гистрина и секретина
Секретин образуется в двенадцатиперстной кишке и возбуждает секрецию поджелудочной железы (рис. 48).
К местным гормонам относятся биогенные амины типа гистамина, серотонина, бра-дикинина и др. Они вырабатываются в организме и проявляют разностороннее действие, в том числе на кровеносные сосуды. Так, гистамин вызывает расширение капилляров и сужение крупных сосудов, влияет на процессы "сокращения гладкой мускулатуры и стимулирует секрецию соляной кислоты в желудке. Серотонин вызывает повышение кровяного давления и сужение бронхов, в малых дозах угнетающе действует на центральную нервную систему, а в больших количествах проявляет стимулирующее действие. Брадикинин вызывает расширение сосудов и сокращение гладкой мускулатуры.
Рис. 48. Места образования и действии гистрина и секретина
Секретин образуется в двенадцатиперстной кишке и возбуждает секрецию поджелудочной железы (рис. 48).
К местным гормонам относятся биогенные амины типа гистамина, серотонина, бра-дикинина и др. Они вырабатываются в организме и проявляют разностороннее действие, в том числе на кровеносные сосуды. Так, гистамин вызывает расширение капилляров и сужение крупных сосудов, влияет на процессы "сокращения гладкой мускулатуры и стимулирует секрецию соляной кислоты в желудке. Серотонин вызывает повышение кровяного давления и сужение бронхов, в малых дозах угнетающе действует на центральную нервную систему, а в больших количествах проявляет стимулирующее действие. Брадикинин вызывает расширение сосудов и сокращение гладкой мускулатуры.
Вопросы для повторения
1. Что такое гормоны? 2. Какую основную функцию выполняют гормоны в организме? 3. Какова химическая природа гормонов? 4. Что известно о механизме действия гормонов? 5. Назовите железы внутренней секреции и гормоны, которые они секретируют. 6. Дайте характеристику гормонов щитовидной железы. 7. При каких условиях развиваются кретинизм, эндемический зоб, микседема, базедова болезнь? 8. Как влияют гормоны щитовидной железы на обмен веществ? 9. Какое значение имеют гормоны паращитовидных желез? 10. Что представляют собой гормональноактивные вещества мозгового слоя надпочечников? 11. Какое влияние на углеводный обмен оказываем адреналин? 12. Какова природа гормонов коры надпочечников? 13. Что такое минералокортикоиды, глюкокортикоиды? Приведите примеры. 14. Как влияют на обмен веществ минералокортикоиды? 15. Какова функция глюкокортикоидов? 16. Какие гормоны вырабатываются поджелудочной железой? 17. Каково влияние инсулина на обмен веществ? 18. Что происходит в организме при недостатке инсулина? 19. Почему инсулин нельзя применять перорально? 20. В чем заключались работы Л. В. Соболева и какое они имели значение? 21. В чем проявляется действие мужских и женских половых гормонов? 22. Какие гормоны выделяет передняя доля гипофиза? 23. Каково влияние АКТГ на обмен веществ? 24. Что такое местные гормоны?V. Общие представления об обмене веществ и энергии
Жизненные процессы связаны с постоянным поглощением веществ из окружающей среды и выделением конечных продуктов распада из организма в эту среду. Совокупность этих процессов называется обменом веществ. Обмен веществ создает то единство, которое существует между живыми организмами и окружающей их средой. Марксистско-ленинская философия рассматривает жизнь как особую форму движения материи, форму существования белковых тел. Ф. Энгельс дал обобщающее представление об обмене веществ: "Жизнь — это способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней средой, причем, с прекращением этого обмена прекращается и жизнь, что приводит к разложению белка"1. Значение обмена веществ для проявления жизни неоднократно подчеркивали в своих трудах крупнейшие ученые биологи-материалисты. И. М. Сеченов в 1884 г. в "Физиологических очерках" писал: "Проследить судьбу внешнего вещества при его странствовании по телу — значит описать всю историю жизни". И. П. Павлов рассматривал обмен веществ как основу физиологических функций организма. Обмен веществ свойствен как живой, так и неживой природе. Однако между ними существует важное различие. В результате обмена веществ неживых тел последние необратимо разрушаются, тогда как обмен веществ живой ткани с окружающей средой является основным условием его существования. Обмен веществ состоит из двух процессов: ассимиляции — усвоения веществ и синтеза соединений и диссимиляции — расщепления и выведения из организма продуктов распада. Процессы биосинтеза органических соединений называют анаболизмом, а процессы распада — катаболизмом. В результате процессов диссимиляции (катаболизма) питательных веществ образуются энергия и исходные соединения, которые обеспечивают течение процессов ассимиляции (анаболизма). Взаимосвязь этих двух процессов обеспечивает существование животного организма. В основе обмена веществ лежит огромное множество химических реакций, которые протекают в определенной последовательности и теснейшим образом связаны друг с другом. Эти реакции катализируются ферментами и находятся под контролем центральной нервной системы, которая, по определению И. П. Павлова, является распорядителем всей деятельности организма. Обмен веществ можно условно подразделить на внешний обмен, который включает поступление питательных веществ в организм и выведение конечных продуктов распада, и внутренний — промежуточный, который охватывает различные превращения питательных веществ в клетках организма. Питательные вещества, поступившие в организм, расходуются на энергетические и строительные процессы. В организме эти два процесса протекают одновременно. При распаде пищевых продуктов выделяется энергия, которая расходуется на синтез специфических для организма соединений. Поэтому раздельное рассмотрение энергетического и пластического обменов связано с простотой их понимания. Главный метод изучения обмена веществ основан на определении баланса поступивших и выделившихся веществ и их энергетической ценности.Энергетический баланс организма
Баланс энергии определяется на основании данных о калорийности потребляемых питательных веществ и выводимых из организма конечных продуктов. Для получения этих данных необходимо определить величину энергии пищи и энергии, выделяющейся из организма в виде тепла и механической работы. Разность между этими величинами и составляет энергию, которая обеспечивает течение всех химических реакций организма, обеспечивает его жизнедеятельность. Потребность человека в энергии определяется опытным путем и выражается в килокалориях. Нормы энергетических затрат человека в сутки разработаны Институтом питания АМН СССР и представлены в табл. 3. Они зависят от рода трудовой деятельности, пола, возраста и т. д. Таблица 3. Энергетические потребности людей в сутки в килокалориях
Энергетические потребности человека должны полностью покрываться за счет энергетической ценности пищевых продуктов, входящих в суточный рацион человека. Энергетическая ценность пищевых продуктов приведена в табл. 4.
Таблица 3. Энергетические потребности людей в сутки в килокалориях
Энергетические потребности человека должны полностью покрываться за счет энергетической ценности пищевых продуктов, входящих в суточный рацион человека. Энергетическая ценность пищевых продуктов приведена в табл. 4.
 Таблица 4. Содержание белков, жиров, углеводов и калорийность различных пищевых продуктов
Откуда же берется эта энергия?
У растений она накапливается в ходе процесса фотосинтеза из солнечной энергии, а у домашних животных образуется в организме после потребления растительной пищи. Следовательно, вся энергия растительных и животных продуктов питания — это энергия солнца.
Водород является основным носителем энергии, которая заключена в электроне и выделяется в окружающую среду при переходе последнего с одного энергетического уровня на другой. Поэтому освобождение электрона из питательных веществ и использование его энергии для обеспечения различных химических процессов организма и составляет сущность энергетического обмена. Особенностью этого обмена в организме является постепенная выработка энергии и аккумулирование ее в макроэргических соединениях типа АТФ.
Таблица 4. Содержание белков, жиров, углеводов и калорийность различных пищевых продуктов
Откуда же берется эта энергия?
У растений она накапливается в ходе процесса фотосинтеза из солнечной энергии, а у домашних животных образуется в организме после потребления растительной пищи. Следовательно, вся энергия растительных и животных продуктов питания — это энергия солнца.
Водород является основным носителем энергии, которая заключена в электроне и выделяется в окружающую среду при переходе последнего с одного энергетического уровня на другой. Поэтому освобождение электрона из питательных веществ и использование его энергии для обеспечения различных химических процессов организма и составляет сущность энергетического обмена. Особенностью этого обмена в организме является постепенная выработка энергии и аккумулирование ее в макроэргических соединениях типа АТФ.
 Процесс освобождения энергии пищи в животном организме можно условно разделить на 3 этапа.
В результате первого этапа — подготовительного, который включает процессы переваривания и всасывания питательных веществ, происходит расщепление высокомолекулярных соединений, входящих в состав пищи, до их составных частей — мономеров. Так, белки распадаются до аминокислот, углеводы — до моносахаров типа глюкозы, фруктозы, галактозы, жиры — до глицерина и жирных кислот. На этом этапе выделяется около 0,1% всей энергии.
Второй этап выработки энергии включает различные процессы превращения мономеров в клетках и тканях организма, при которых образуются вещества, представляющие собой так называемый основной энергетический материал. К ним относится в первую очередь ацетил-КоА (СН3-СО~SKoA). Так, при окислении углеводов и жирных кислот образуется ацетил-КоА; глицерин через ряд стадий также образует этот продукт. При превращении аминокислот наряду с ацетил-КоА образуются и другие соединения этого типа — α-кетоглютаровая и щавелевоуксусная кислоты и др.
И, наконец, недостающее количество энергии (около [4]/3) дает цикл ди- и трикарбоновых кислот — цикл Кребса.
Он представляет собой систему реакций, в результате которых ацетил-КоА полностью окисляется с образованием углекислоты и водорода. Ферменты, катализирующие все реакции цикла Кребса, расположены в основном в митохондриях. Этот цикл характеризуется замкнутостью, т. е. начальным и конечным продуктом всего цикла является щавелевоуксусная кислота. Кроме того, все вещества цикла Кребса лимитируют (ограничивают) этот процесс. Это означает, что активность всего цикла зависит от минимального количества любой кислоты, участвующей в этих реакциях. Так, если одна из кислот присутствует в цикле в минимальном количестве, то и все остальные кислоты включаются в цикл именно в таком же количестве. И наконец, реакции в цикле Кребса характеризуются строгой последовательностью.
Процесс освобождения энергии пищи в животном организме можно условно разделить на 3 этапа.
В результате первого этапа — подготовительного, который включает процессы переваривания и всасывания питательных веществ, происходит расщепление высокомолекулярных соединений, входящих в состав пищи, до их составных частей — мономеров. Так, белки распадаются до аминокислот, углеводы — до моносахаров типа глюкозы, фруктозы, галактозы, жиры — до глицерина и жирных кислот. На этом этапе выделяется около 0,1% всей энергии.
Второй этап выработки энергии включает различные процессы превращения мономеров в клетках и тканях организма, при которых образуются вещества, представляющие собой так называемый основной энергетический материал. К ним относится в первую очередь ацетил-КоА (СН3-СО~SKoA). Так, при окислении углеводов и жирных кислот образуется ацетил-КоА; глицерин через ряд стадий также образует этот продукт. При превращении аминокислот наряду с ацетил-КоА образуются и другие соединения этого типа — α-кетоглютаровая и щавелевоуксусная кислоты и др.
И, наконец, недостающее количество энергии (около [4]/3) дает цикл ди- и трикарбоновых кислот — цикл Кребса.
Он представляет собой систему реакций, в результате которых ацетил-КоА полностью окисляется с образованием углекислоты и водорода. Ферменты, катализирующие все реакции цикла Кребса, расположены в основном в митохондриях. Этот цикл характеризуется замкнутостью, т. е. начальным и конечным продуктом всего цикла является щавелевоуксусная кислота. Кроме того, все вещества цикла Кребса лимитируют (ограничивают) этот процесс. Это означает, что активность всего цикла зависит от минимального количества любой кислоты, участвующей в этих реакциях. Так, если одна из кислот присутствует в цикле в минимальном количестве, то и все остальные кислоты включаются в цикл именно в таком же количестве. И наконец, реакции в цикле Кребса характеризуются строгой последовательностью.
 Освободившийся в цикле Кребса водород при помощи специфических переносчиков, которыми являются коферменты дегидрогеназ (НАД, НАДФ и ФАД), поступает в так называемую цепь биологического окисления. В этой цепи происходит окисление водорода молекулярным кислородом с образованием воды и накопление энергии. Цепь биологического окисления включает несколько этапов и представляет собой систему соединений, которые обеспечивают постепенное окисление водорода. С энергетической точки зрения этот процесс следует представлять так. Под окислением мы понимаем потерю электронов, т. е. переход электрона с одного энергетического уровня на другой, который сопровождается выделением энергии. Например, при непосредственном окислении водорода кислородом происходит образование гремучего газа, что приводит к взрыву, так как при этом освобождается большое количество энергии. В организме этого не происходит, так как в цепи биологического окисления идет поэтапный, постепенный переход электронов водорода с более высокого на более низкий энергетический уровень, что сопровождается постепенным освобождением энергии (рис. 49). В результате этого электроны водорода приходят к кислороду уже энергетически обедненными, и поэтому образование воды не сопровождается взрывом, как в случае с гремучим газом.
Освободившийся в цикле Кребса водород при помощи специфических переносчиков, которыми являются коферменты дегидрогеназ (НАД, НАДФ и ФАД), поступает в так называемую цепь биологического окисления. В этой цепи происходит окисление водорода молекулярным кислородом с образованием воды и накопление энергии. Цепь биологического окисления включает несколько этапов и представляет собой систему соединений, которые обеспечивают постепенное окисление водорода. С энергетической точки зрения этот процесс следует представлять так. Под окислением мы понимаем потерю электронов, т. е. переход электрона с одного энергетического уровня на другой, который сопровождается выделением энергии. Например, при непосредственном окислении водорода кислородом происходит образование гремучего газа, что приводит к взрыву, так как при этом освобождается большое количество энергии. В организме этого не происходит, так как в цепи биологического окисления идет поэтапный, постепенный переход электронов водорода с более высокого на более низкий энергетический уровень, что сопровождается постепенным освобождением энергии (рис. 49). В результате этого электроны водорода приходят к кислороду уже энергетически обедненными, и поэтому образование воды не сопровождается взрывом, как в случае с гремучим газом.
 Рис. 49. Освобождение энергии в ходе реакций дыхательной цепи
Цепь биологического окисления включает ряд окислительно-восстановительных реакций, которые катализируются ферментами дегидрогеназами и металлофлавопротеидами, которые и обеспечивают постепенный перенос водорода к кислороду и образование воды. Освободившаяся в цепи энергия частично расходуется в виде тепла, а частично идет на синтез АТФ, где аккумулируется. Процесс образования АТФ заключается в присоединении неорганического фосфора в виде Н3РО4 к АДФ и потреблении энергии, равной 8-10 ккал.
АДФ + Н3РО4 + 8-10 ккал = АТФ = АДФ ∼ Ф
Следовательно, в молекуле АТФ накапливается 8-10 ккал/моль, которые заключены в макроэргической фосфатной снят. Макроэргическая связь обозначается знаком ~ и характеризуется наличием в ней энергии. Соединения, имеющие такую связь, называются макроэргическими соединениями или макроэргами. К ним относится в первую очередь АТФ. Соответственно при распаде одной молекулы АТФ выделяется такое же количество энергии и образуется АДФ и Н3РО4. Именно эта энергия в основном идет на обеспечение энергетических нужд организма
Рис. 49. Освобождение энергии в ходе реакций дыхательной цепи
Цепь биологического окисления включает ряд окислительно-восстановительных реакций, которые катализируются ферментами дегидрогеназами и металлофлавопротеидами, которые и обеспечивают постепенный перенос водорода к кислороду и образование воды. Освободившаяся в цепи энергия частично расходуется в виде тепла, а частично идет на синтез АТФ, где аккумулируется. Процесс образования АТФ заключается в присоединении неорганического фосфора в виде Н3РО4 к АДФ и потреблении энергии, равной 8-10 ккал.
АДФ + Н3РО4 + 8-10 ккал = АТФ = АДФ ∼ Ф
Следовательно, в молекуле АТФ накапливается 8-10 ккал/моль, которые заключены в макроэргической фосфатной снят. Макроэргическая связь обозначается знаком ~ и характеризуется наличием в ней энергии. Соединения, имеющие такую связь, называются макроэргическими соединениями или макроэргами. К ним относится в первую очередь АТФ. Соответственно при распаде одной молекулы АТФ выделяется такое же количество энергии и образуется АДФ и Н3РО4. Именно эта энергия в основном идет на обеспечение энергетических нужд организма
 Процесс образования АТФ в результате использования энергии, выделяющейся в процессе биологического окисления, носит название окислительного фосфорилирования.
При переносе 2 атомов водорода от окисляемого субстрата по "цепи" биологического окисления выделяется около 57 ккал энергии, из которых часть выделяется в виде тепла, а другая часть обеспечивает образование 3 молекул АТФ. С этих позиций энергетическая ценность цикла Кребса составляет 12 молекул АТФ, из которых 11 образуются путем окислительного фосфорилирования, а одна молекула синтезируется путем субстратного фосфорилирования. Сущность этою процесса заключается в том, что образование АТФ идет путем переноса энергии вместе с остатком фосфата от субстрата на АДФ.
Процессы биологического окисления и окислительного фосфорилирования происходят в митохондриях, которые (называют "энергетическими станциями" организма.
Представителями макроэргических соединений, помимо АТФ, являются все нуклеотид-трифосфаты (тимидил-трифосфат, цитидил-трифосфат и др.), а также некоторые другие соединения — креатинфосфат, фосфоэнолпировиноградная кислота и т. д.
Процесс образования АТФ в результате использования энергии, выделяющейся в процессе биологического окисления, носит название окислительного фосфорилирования.
При переносе 2 атомов водорода от окисляемого субстрата по "цепи" биологического окисления выделяется около 57 ккал энергии, из которых часть выделяется в виде тепла, а другая часть обеспечивает образование 3 молекул АТФ. С этих позиций энергетическая ценность цикла Кребса составляет 12 молекул АТФ, из которых 11 образуются путем окислительного фосфорилирования, а одна молекула синтезируется путем субстратного фосфорилирования. Сущность этою процесса заключается в том, что образование АТФ идет путем переноса энергии вместе с остатком фосфата от субстрата на АДФ.
Процессы биологического окисления и окислительного фосфорилирования происходят в митохондриях, которые (называют "энергетическими станциями" организма.
Представителями макроэргических соединений, помимо АТФ, являются все нуклеотид-трифосфаты (тимидил-трифосфат, цитидил-трифосфат и др.), а также некоторые другие соединения — креатинфосфат, фосфоэнолпировиноградная кислота и т. д.
Изучение баланса энергии
Определение энергетического баланса в клинике представляет большой интерес. Этот процесс можно подразделить на два этапа. Первый этап включает определение калорийности питательных веществ, которое производится обычными калориметрическими методами. В калориметрической "бомбе" производят сжигание определенного количества питательного вещества и определяют количество выделившейся энергии. На втором этапе определяют энергетические траты организма. Для этой цели пользуются калориметрическими камерами, где у человека определяют теплопродукцию, количество выделившегося С02 и т. д. В вопросах исследования энергетического обмена много было сделано нашим отечественным ученым М. Н. Шатерниковым. Он впервые предложил замечательную модель калориметрической камеры для изучения обмена энергии. Энергетическую ценность различных тканей организма изучают по величине дыхательного коэффициента. Его определяют на основании объемного отношения между потреблением кислорода и образовавшимся при этом углекислым газом. Отношение СО2 к О2 и представляет собой дыхательный коэффициент. Так, эта величина для мозговой ткани составляет 1,0. Таким же путем можно определить дыхательный коэффициент и пищевых продуктов, который для углеводов равен 1, для жиров — 0,71, для белков — 0,8. В клинике для определения величины энергетического обмена используют понятие "основной обмен", под которым понимают выработку энергии в организме натощак в состоянии полного телесного и психического покоя за 1 час или 24 часа. Исследование проводится следующим образом: за несколько дней до измерения основной} обмена больного переводят на смешанную пищу, определенного состава и через 14 часов после последнего приема пищи у него исследуют основной обмен. Такое изучение показало, что он выше у мужчин, чем у женщин, а у детей выше, чем у взрослых. Основной обмен повышается при беременности, у спортсменов и снижается, в частности, при голодании. Он находится под действием регуляторных механизмов организма, к которым относятся нервная система, гормоны. При гиперфункции щитовидной железы он повышен, гипофункция коры надпочечников и передней доли гипофиза вызывает снижение основного обмена.Промежуточный обмен
Поступившие в желудочно-кишечный тракт пищевые продукты подвергаются распаду до своих составных частей. Так, белки, в основном, расщепляются до аминокислот, углеводы — до моносахаридов и частично до дисахаридов, жиры гидролизуются на глицерин, жирные кислоты и т. д. Эти мономеры всасываются из кишечника и разносятся кровью к различным органам и тканям. В клетках каждое из поступивших веществ подвергается различным, только ему присущим превращениям, которые определяются как промежуточный обмен (рис. 50). В понятие промежуточного обмена включаются процессы распада определенного вещества и синтеза необходимых для жизнедеятельности клеток соединений. Питательные вещества в клетках расщепляются или до конечных продуктов, которыми являются СО2 и Н2О, или их распад останавливается на стадии промежуточных а соединений. Последние, в основном, и используются для 8 синтеза специфических веществ. Например, одним из промежуточных продуктов распада глюкозы в клетке является 3-фосфоглицериновый альдегид, из которого может образоваться глицерин — один из основных компонентов жира. При окислении жирных кислот образуется ацетил-КоА — предшественник холестерина, половых гормонов, ацетил-холина и т. д. Рис. 50. Общность обмена питательных веществ
Промежуточный обмен аминокислоты триптофана включает его превращения с образованием витамина — никотиновой кислоты.
Таким образом, сущность промежуточного обмена состоит в многообразных превращениях, поступающих и возникающих в клетках веществ.
Изучение промежуточного обмена сопряжено с многими трудностями. Во-первых, промежуточный обмен протекает внутри клетки и поэтому для его изучения необходимо знать особенности структуры и функции клеток и клеточных органелл. Во-вторых, все вещества в клетке в большей части находятся в динамических отношениях, которые постоянно меняются. И, наконец, процессы обмена различных веществ тесно переплетены между собой. Все это и определяет использование особых методов изучения промежуточного обмена, среди которых важное значение имеет метод применения и изотопов. Основа этого метода заключается в том, что в организм вводится вещество, в структуре которого один из атомов заменен его радиоактивным изотопом. Чаще других используют 14С и S35. Через некоторое время по ионизирующему излучению этого атома определяют его распределение и превращения. Часто пользуются методом нагрузок, когда в результате введения в организм большого количества определенного вещества и последующего измерения его количества в теле или в выделениях изучают его участие в обменных процессах в различных клетках. Среди других методов используют метод ангиостомии, разработанный Е. С. Лондоном, метод изолированных органов, тканевых срезов, гомогенатов и т. д.
Изучение промежуточного обмена различных веществ разбирается детально в соответствующих разделах учебника. Так, промежуточный обмен аминокислот рассматривается в главе "Обмен белков", моносахаридов — "Обмен углеводов" и т. д.
Рис. 50. Общность обмена питательных веществ
Промежуточный обмен аминокислоты триптофана включает его превращения с образованием витамина — никотиновой кислоты.
Таким образом, сущность промежуточного обмена состоит в многообразных превращениях, поступающих и возникающих в клетках веществ.
Изучение промежуточного обмена сопряжено с многими трудностями. Во-первых, промежуточный обмен протекает внутри клетки и поэтому для его изучения необходимо знать особенности структуры и функции клеток и клеточных органелл. Во-вторых, все вещества в клетке в большей части находятся в динамических отношениях, которые постоянно меняются. И, наконец, процессы обмена различных веществ тесно переплетены между собой. Все это и определяет использование особых методов изучения промежуточного обмена, среди которых важное значение имеет метод применения и изотопов. Основа этого метода заключается в том, что в организм вводится вещество, в структуре которого один из атомов заменен его радиоактивным изотопом. Чаще других используют 14С и S35. Через некоторое время по ионизирующему излучению этого атома определяют его распределение и превращения. Часто пользуются методом нагрузок, когда в результате введения в организм большого количества определенного вещества и последующего измерения его количества в теле или в выделениях изучают его участие в обменных процессах в различных клетках. Среди других методов используют метод ангиостомии, разработанный Е. С. Лондоном, метод изолированных органов, тканевых срезов, гомогенатов и т. д.
Изучение промежуточного обмена различных веществ разбирается детально в соответствующих разделах учебника. Так, промежуточный обмен аминокислот рассматривается в главе "Обмен белков", моносахаридов — "Обмен углеводов" и т. д.
Вопросы для повторения
1. Какая существует взаимосвязь организма с внешней средой? 2. Дайте определение понятиям: ассимиляция, диссимиляция, анаболизм, катаболизм. 3. Что понимают под обменом веществ организма? 4. Что понимают под энергетическим балансом организма? 5. Какова потребность человека в энергии и отчего она зависит? 6. Что является основным источником энергии? 7. Как происходит освобождение энергии пищи в организме? 8. Дайте характеристику условных трех этапов освобождения энергии в организме в ходе обмена веществ? 9. Напишите формулу ацетил-КоА и укажите на его биологическое значение. 10. Каково биологическое значение цикла Кребса? 11. Что такое биологическое окисление и каково его значение? 12. Что такое окислительное фосфорилирование? 13. Что такое макроэргические соединения и какое они имеют значение? 14. Приведите примеры макроэргических соединений. 15. Напишите формулу АТФ и укажите ее значение. 16. Какими методами изучается энергетический баланс организма? 17. Что такое промежуточный обмен?VI. Химия углеводов
Общая характеристика углеводов
Углеводы очень широко распространены в природе и особенно в растительном мире, где они составляют 70-80% из расчета на сухое вещество. В животном организме содержание углеводов значительно меньше, примерно около 2% веса тела. Однако для организма их значение очень велико. Об этом свидетельствуют важные и крайне разносторонние функции, которые выполняют углеводы: 1. энергетическая функция. Углеводы на 60% обеспечивают организм энергией. При окислении 1 г углеводов выделяется 4,1 ккал энергии; 2. пластическая функция. Углеводы принимают участие в синтезе многих очень важных веществ для организма, таких, как нуклеопротеиды, липоиды, сложные ферменты^ мукополисахариды и т. д. В растениях углеводы выполняют в основном опорную функцию; 3. функция запасных питательных веществ. Углеводы обладают способностью откладываться в организме в виде гликогена, который расходуется по мере надобности. Депо гликогена являются в основном печень и мышцы. При полноценном питании в печени может содержаться до 10% гликогена от веса печени, в мышцах — до 2%. При неблагоприятных условиях, например при голодании, запасы гликогена истощаются и его количество может снизиться до 0,2%; 4. защитная функция. Вязкие секреты (слизи), выделяемые различными железами, богаты мукополисахаридами. Они предохраняют, стенки полых органов от механических повреждений, от проникновения патогенных бактерий и вирусов; 5. регуляторная функция. В пище всегда содержится значительное количество сложного углевода — клетчатки, грубая структура которого вызывает механическое раздражение желудка и кишечника, участвуя таким образом в акте перистальтики; 6. специфическая функция. Отдельные представители углеводов выполняют особые функции в организме, например, участвуют в проведении нервных импульсов, образовании антител, обеспечении специфичности групп крови, нормальной деятельности высшей нервной системы и т. д. Углеводы принимают участие и в таком "космическом" процессе, как фотосинтез. В связи с этим важное Значение имеет обеспеченность организма необходимым количеством углеводов (суточная потребность в среднем составляет 400-450 г) в основном за счет продуктов питания. Ниже приводится содержание углеводов в основных пищевых продуктах (в % от веса влажного продукта).
Элементарный состав и химическое строение углеводов
Углеводами называются органические вещества, в состав которых входят углерод, водород и кислород. Водород и кислород в углеводах находятся в основном в таком же соотношении, как и в молекуле воды: на 2 атома водорода приходится 1 атом кислорода. Поэтому эти соединения стали называть углеводами. К ним относятся: глюкоза [С6H12О6 → C6(H2О)6], рибоза [С5Н10О5 → С5(Н2O)5], сахароза [С12Н22O11 → С12(Н2O)11] и др. Однако среди углеводов имеются соединения, не отвечающие такому правилу, такие, как рамноза (С6Н12O5). С другой стороны, среди органических веществ существуют такие, в молекулах которых водород и кислород находятся в том же отношении (2:1), но они не принадлежат к углеводам, например уксусная кислота [СН4O2→С2(Н2O)2]. Таким образом, название "углеводы" не точно соответствует химической структуре веществ этого ряда. Поэтому международная комиссия дала углеводам новое название — "глюциды". Однако термин "углеводы" так широко вошел в теорию и практику, что им продолжают пользоваться и в настоящее время. По своему строению углеводы являются альдегидами и кетонами многоатомных спиртов, из которых они могут быть получены окислением первичной или вторичной спиртовой группы. Из курса органической химии известно, что спирты представляют собой производные углеводородов, в молекуле которых имеются одна или несколько гидроксильных групп — ОН. По числу этих групп спирты бывают одно-, двух-, трехатомными и т. д. Общая формула спиртов следующая: R-OH, где R — углеводородный радикал. Например, СН3-ОН — метиловый спирт, С2Н5-ОН — этиловый спирт, СН2-ОН-СН-ОН-СН2-ОН — трехатомный спирт глицерин. В зависимости от расположения гидроксильной группы различают спирты первичные и вторичные. Первичным называется спирт, у которого гидроксил находится при концевом радикале: Вторичные спирты имеют гидроксильную группу, расположенную у углеводородного радикала, который связан с двумя соседними С-радикалами:
Вторичные спирты имеют гидроксильную группу, расположенную у углеводородного радикала, который связан с двумя соседними С-радикалами:
 Если гидроксильная группа находится у С-атома, связанного с тремя углеводородными радикалами, то такой спирт называется третичным:
Если гидроксильная группа находится у С-атома, связанного с тремя углеводородными радикалами, то такой спирт называется третичным:
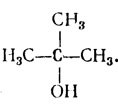 При окислении первичных спиртов образуются альдегиды:
При окислении первичных спиртов образуются альдегиды:
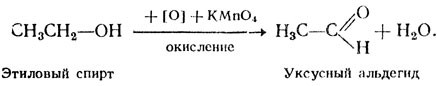 В случае окисления вторичных спиртов получаются кетоны:
В случае окисления вторичных спиртов получаются кетоны:
 Альдегидоспиртом называется соединение, в составе которого имеется и альдегидная, и спиртовая (гидроксильная) группа:
Альдегидоспиртом называется соединение, в составе которого имеется и альдегидная, и спиртовая (гидроксильная) группа:
 В структуре кетоноспирта обнаружены кетонная и гидроксильная группы:
В структуре кетоноспирта обнаружены кетонная и гидроксильная группы:

Классификация углеводов
Углеводы делятся на 3 большие группы: • моносахариды; • олигосахариды; • полисахариды. Моносахариды — это простые углеводы, которые состоят только из одной молекулы. Олигосахариды характеризуются тем, что при гидролизе распадаются на 2 и более моносахарида. Полисахариды — это высокомолекулярные углеводы, состоящие из большого числа моносахаридов. Полисахариды разделяются на гомо- и гетерополисахариды. Гомополисахариды имеют в своем составе моносахариды только одного вида. Так, крахмал и гликоген состоят из большого числа только молекул глюкозы, а инулин — из фруктозы. Гетерополисахариды представляют собой комплексы различных видов моносахаридов и их производных, соединенных с другими веществами.Моносахариды
Эти углеводы представляют собой твердые, кристаллические вещества, растворимые в воде, сладкие на вкус. При определенных условиях они легко окисляются. Так, альдегидоспирты окисляются в кислоты, а при действии восстановителей превращаются в соответствующие спирты. К моносахаридам относится группа простых углеводов, состоящих из одной молекулы с различным числом углеродных атомов (3, 4, 5, 6, 7 и более). В зависимости от числа углеродных атомов, входящих в молекулу, различают: триозы — моносахариды, состоящие из 3 углеродных атомов, тетрозы — из 4 С-атомов, пентозы — из 5 С-атомов, гексозы — из 6 С-атомов и т. д. Простые углеводы по своему строению являются альдегидами или кетонами многоатомных спиртов: например, альдегид 6-атомного спирта сорбита — глюкоза, а его кетон — фруктоза: Из триоз в организме человека имеют большое значение глицериновый альдегид и диоксиацетон, которые в процессах обмена веществ участвуют в активной форме, в виде эфиров с фосфорной кислотой:
Из триоз в организме человека имеют большое значение глицериновый альдегид и диоксиацетон, которые в процессах обмена веществ участвуют в активной форме, в виде эфиров с фосфорной кислотой:

 Пентозы широко представлены в животном мире. Они входят в состав ДНК и РНК, являются составными частями различных ферментов, обеспечивающих окисление углеводов, белков и жиров, биосинтез белка и т. д.
К пентозам относятся: рибоза, дезоксирибоза — составные части нуклеотидов; рибулеза, ксилулеза и др.
Пентозы широко представлены в животном мире. Они входят в состав ДНК и РНК, являются составными частями различных ферментов, обеспечивающих окисление углеводов, белков и жиров, биосинтез белка и т. д.
К пентозам относятся: рибоза, дезоксирибоза — составные части нуклеотидов; рибулеза, ксилулеза и др.
 Из гексоз наибольшее значение имеют глюкоза, фруктоза и галактоза. По своему химическому строению глюкоза и галактоза являются альдегидоспиртами, а фруктоза — кетоноспиртом.
Из гексоз наибольшее значение имеют глюкоза, фруктоза и галактоза. По своему химическому строению глюкоза и галактоза являются альдегидоспиртами, а фруктоза — кетоноспиртом.
 Глюкоза — виноградный сахар, чрезвычайно широко распространенный в природе. В свободном состоянии глюкоза встречается как в растительных продуктах, так и в животном организме. Она входит в состав важнейших ди- и полисахаридов (сахароза, лактоза, крахмал, гликоген и др.). В организме человека глюкоза выполняет очень важные функции, являясь одним из основных источников энергии, а для нервной ткани и мозга — единственным.
Галактоза является пространственным изомером глюкозы, отличаясь от последней только расположением гидроксильной группы и водорода у четвертого углеродного атома. Она входит в состав лактозы, некоторых полисахаридов, гликолипидов и др. Галактоза в печени под действием ряда ферментов превращается в глюкозу. В молочной железе идет процесс синтеза из глюкозы галактозы, которая необходима дляобразования молочного сахара — лактозы.
Фруктоза широко распространена в природе и в большом количестве в свободном виде встречается в плодах, в связи с чем ее иногда называют плодовым сахаром. Особенно много фруктозы во фруктах, меде, сахарном тростнике.
Различия в структура фруктозы и глюкозы (фруктоза кетоноспирт, а глюкоза — альдегидоспирт) характеризуют и отличия их свойств. Фруктоза неспособна восстанавливать металлы из их окислов, в отличие от глюкозы она хуже всасывается в кишечнике. В организме фруктоза легко изомеризуется в глюкозу, в виде фосфорных эфиров участвует в обмене веществ.
При изучении гексоз было установлено, что они могут встречаться в циклической форме, которая образуется за счет внутримолекулярных перемещений:
Глюкоза — виноградный сахар, чрезвычайно широко распространенный в природе. В свободном состоянии глюкоза встречается как в растительных продуктах, так и в животном организме. Она входит в состав важнейших ди- и полисахаридов (сахароза, лактоза, крахмал, гликоген и др.). В организме человека глюкоза выполняет очень важные функции, являясь одним из основных источников энергии, а для нервной ткани и мозга — единственным.
Галактоза является пространственным изомером глюкозы, отличаясь от последней только расположением гидроксильной группы и водорода у четвертого углеродного атома. Она входит в состав лактозы, некоторых полисахаридов, гликолипидов и др. Галактоза в печени под действием ряда ферментов превращается в глюкозу. В молочной железе идет процесс синтеза из глюкозы галактозы, которая необходима дляобразования молочного сахара — лактозы.
Фруктоза широко распространена в природе и в большом количестве в свободном виде встречается в плодах, в связи с чем ее иногда называют плодовым сахаром. Особенно много фруктозы во фруктах, меде, сахарном тростнике.
Различия в структура фруктозы и глюкозы (фруктоза кетоноспирт, а глюкоза — альдегидоспирт) характеризуют и отличия их свойств. Фруктоза неспособна восстанавливать металлы из их окислов, в отличие от глюкозы она хуже всасывается в кишечнике. В организме фруктоза легко изомеризуется в глюкозу, в виде фосфорных эфиров участвует в обмене веществ.
При изучении гексоз было установлено, что они могут встречаться в циклической форме, которая образуется за счет внутримолекулярных перемещений:
 В результате этого первый углеродный атом становится асимметрическим, он обозначается звездочкой(*). Асимметрическим называется такой атом, у которого все валентности заняты различными группировками.
В результате этого первый углеродный атом становится асимметрическим, он обозначается звездочкой(*). Асимметрическим называется такой атом, у которого все валентности заняты различными группировками.
 Наличие такого атома обусловливает явление α- и β-изомерии, т. е. различное расположение водорода и гидроксила по отношению к первому углеродному атому:
Наличие такого атома обусловливает явление α- и β-изомерии, т. е. различное расположение водорода и гидроксила по отношению к первому углеродному атому:
 В организме α- и β-формы глюкозы могут взаимопревращаться. Это явление называется мутаротацией.
В настоящее время установлено, что гексозы присутствуют в организме в виде кольцевых форм, которые впервые предложил Хеуорс:
В организме α- и β-формы глюкозы могут взаимопревращаться. Это явление называется мутаротацией.
В настоящее время установлено, что гексозы присутствуют в организме в виде кольцевых форм, которые впервые предложил Хеуорс:
 В процессах обмена веществ углеводы участвуют в организме не в свободном виде, а в активированной форме — в виде эфиров с фосфорной кислотой, которая присоединяется по месту гидроксильных группировок у первого или шестого углеродного атома (или у С1- и С6-атомов).
В процессах обмена веществ углеводы участвуют в организме не в свободном виде, а в активированной форме — в виде эфиров с фосфорной кислотой, которая присоединяется по месту гидроксильных группировок у первого или шестого углеродного атома (или у С1- и С6-атомов).
 При окислении шестого углеродного атома гексоз образуются гексуроновые кислоты (из глюкозы — глюкуроновая кислота, из галактозы — галактуроновая и т. д.).
При окислении шестого углеродного атома гексоз образуются гексуроновые кислоты (из глюкозы — глюкуроновая кислота, из галактозы — галактуроновая и т. д.).
 Глюкуроновая кислота выполняет в организме важную функцию — участвует в обезвреживании ядовитых веществ — конечных продуктов распада белков и других соединений.
При замене ОН-группы у С2 на аминогруппу NH2 в гексозах образуются аминосахара, важнейшими из которых являются глюкозамин и галактозамин.
Глюкуроновая кислота выполняет в организме важную функцию — участвует в обезвреживании ядовитых веществ — конечных продуктов распада белков и других соединений.
При замене ОН-группы у С2 на аминогруппу NH2 в гексозах образуются аминосахара, важнейшими из которых являются глюкозамин и галактозамин.
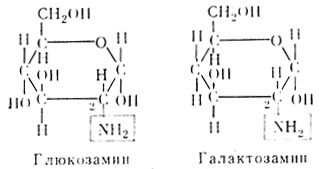 В организме аминосахара часто встречаются в виде соединений с уксусной кислотой по следующему типу:
В организме аминосахара часто встречаются в виде соединений с уксусной кислотой по следующему типу:
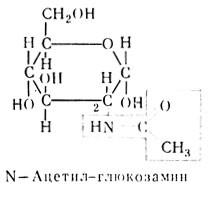
Олигосахариды
Среди олигосахаридов, имеющих важное значение в организме, следует отметить дисахариды, которые состоят только из двух моносахаридов. К ним относятся сахароза, лактоза, мальтоза, целлобиоза и др. Сахароза — свекловичный или тростниковый сахар — состоит из молекул глюкозы и фруктозы и является чисто растительным продуктом и важной составной частью питания. Лактоза — молочный сахар, имеет в своем составе глюкозу и галактозу.
Мальтоза состоит из двух молекул глюкозы и является основным структурным элементом крахмала и гликогена.
Лактоза — молочный сахар, имеет в своем составе глюкозу и галактозу.
Мальтоза состоит из двух молекул глюкозы и является основным структурным элементом крахмала и гликогена.
Полисахариды
Представителями полисахаридов являются крахмал, клетчатка или целлюлоза, и гликоген. Полисахариды имеют весьма разветвленную структуру. Эти структуры представлены двумя формами: амилозой и амилопектином. Амилоза представляет собой неразветвленную цепь, состоящую из остатков глюкозы, связанных между собой по типу связи 1-4, т. е. связи между 1-м углеродным атомом одной молекулы глюкозы и 4-м атомом другой через кислородный мостик. Амилоза имеет в своем составе 60-300 остатков глюкозы. Она растворима в горячей воде и с йодом дает синее окрашивание. Схема строения амилозы (неразветвленная цепь)
Амилопектин представляет собой весьма разветвленную структуру, также состоящую из остатков глюкозы. Развет-вленность достигается образованием связей как между 1-м и 4-м углеродным атомом, так и между 1-м и 6-м. В определенной степени по структуре к амилопектину приближается гликоген, однако он еще более разветвлен.
Схема строения амилозы (неразветвленная цепь)
Амилопектин представляет собой весьма разветвленную структуру, также состоящую из остатков глюкозы. Развет-вленность достигается образованием связей как между 1-м и 4-м углеродным атомом, так и между 1-м и 6-м. В определенной степени по структуре к амилопектину приближается гликоген, однако он еще более разветвлен.
 Схема строения амилопектита (разветвленная цепь)
Крахмал — типичный резервный полисахарид растений.
Крахмал откладывается в растениях в виде зернышек, имеющих слоистое строение, которые нерастворимы в холодной воде. В горячей воде они дают коллоидный раствор, называемый в быту крахмальным клейстером. Крахмал на 10-20% состоит из амилозы и на 80-90% — из амилопектина.
Структура крахмала представлена остатками D-глюкозы, соединенными в основном связами 1-4 и в меньшей степени связями 1-6. Количество глюкозных остатков исчисляется несколькими тысячами. Эмпирическая формула крахмала — (С6Н10О5)*х, где х — количество остатков глюкозы. Крахмал, как и белки, обладает гидрофильными свойствами.
Клетчатка, или целлюлоза,- структурный полисахарид растений, состоящий из остатков глюкозы. Клетчатка не расщепляется ферментами желудка и тонкого отдела кишечника. Однако в этих отделах клетчатка выполняет функцию активатора моторики желудка и кишечника за счет своей грубой структуры. В толстом отделе кишечника клетчатка частично расщепляется под действием микроорганизмов.
Схема строения амилопектита (разветвленная цепь)
Крахмал — типичный резервный полисахарид растений.
Крахмал откладывается в растениях в виде зернышек, имеющих слоистое строение, которые нерастворимы в холодной воде. В горячей воде они дают коллоидный раствор, называемый в быту крахмальным клейстером. Крахмал на 10-20% состоит из амилозы и на 80-90% — из амилопектина.
Структура крахмала представлена остатками D-глюкозы, соединенными в основном связами 1-4 и в меньшей степени связями 1-6. Количество глюкозных остатков исчисляется несколькими тысячами. Эмпирическая формула крахмала — (С6Н10О5)*х, где х — количество остатков глюкозы. Крахмал, как и белки, обладает гидрофильными свойствами.
Клетчатка, или целлюлоза,- структурный полисахарид растений, состоящий из остатков глюкозы. Клетчатка не расщепляется ферментами желудка и тонкого отдела кишечника. Однако в этих отделах клетчатка выполняет функцию активатора моторики желудка и кишечника за счет своей грубой структуры. В толстом отделе кишечника клетчатка частично расщепляется под действием микроорганизмов.
 Рис. 51. Схема строения молекулы гликогена. а — глюкозный остаток (1,4 связи); б — точки ветвления (1,6 связи)
Гликоген — основной запасной углевод организма человека и животных, который часто называют животным крахмалом. По своей структуре гликоген напоминает амилопектин, хотя он разветвлен сильнее (рис. 51). Он состоит примерно из 30 000 остатков глюкозы. В значительных количествах гликоген накапливается в печени, мышцах, сердце и в меньшей степени — в головном мозге.
Рис. 51. Схема строения молекулы гликогена. а — глюкозный остаток (1,4 связи); б — точки ветвления (1,6 связи)
Гликоген — основной запасной углевод организма человека и животных, который часто называют животным крахмалом. По своей структуре гликоген напоминает амилопектин, хотя он разветвлен сильнее (рис. 51). Он состоит примерно из 30 000 остатков глюкозы. В значительных количествах гликоген накапливается в печени, мышцах, сердце и в меньшей степени — в головном мозге.
Общие представления о мукополисахаридах
Мукополисахариды относятся к гетерополисахаридам, т. е. к соединениям, которые имеют в своем составе, кроме углеводов и их производных, другие вещества, например азотистые основания, органические кислоты и т. д. В организме они встречаются в комплексе с белками (мукопротеиды) и жирами (муколипиды), Мукополисахариды выполняют в организме разнообразные функции. Они участвуют в построении клеточных мембран, входят в состав хрящей, хрусталика глаза, пупочного канатика, клапанов аорты; обеспечивают групповую специфичность крови, составляют основу слизей внутренних полых органов; образуют синовиальную жидкость, являются антикоагулянтами. Мукополисахариды подразделяются на кислые и нейтральные. Кислые мукополисахариды характеризуются наличием гексуроновых кислот. К ним относятся гиалуроновая, хондроитин-серные кислоты, гепарин. В составе нейтральных мукополисахаридов имеются нейраминовая кислота, фукоза и т. д.Вопросы для повторения
1. Что такое углеводы? 2. Какие функции в организме выполняют углеводы? 3. Напишите формулы. 3-фосфоглицеринового альдегида, рибозы, глюкозо-1-фосфата, галактозо-6-фосфата, глюкуроновой кислоты, галактозамина. 4. Из каких частей построена молекула крахмала? 5. Что представляют собой амилоза и амилопектин? 6. Какова структура гликогена? 7. Назовите основные функции гликогена? 8. Что является основным депо гликогена в организме? 9. Укажите на основные функции мукополисахаридов. Приведите примеры отдельных представителей. 10. Каково строение сахарозы, мальтозы, лактозы?VII. Обмен углеводов
Переваривание и всасывание углеводов
Переваривание углеводов начинается в ротовой полости, где на них изливается слюна, содержащая ферменты амилазу и мальтазу, которые обеспечивают распад углеводов до моносахаридов, в частности, глюкозы. Однако в связи с тем что время пребывания пищи в ротовой полости очень короткое, процесс переваривания углеводов там незначительный. В полости желудка не происходит распада углеводов, потому что там отсутствуют ферменты, расщепляющие углеводы, а попавшая вместе с пищевым комком амилаза слюны не может проявить свое действие, так как в норме желудочный сок имеет сильно кислую реакцию (рН 1,5-2,5). Оптимум же рН амилазы — 6,8-7,2. Основное переваривание углеводов происходит в тонком отделе кишечника, где для этого имеются оптимальные условия: сок поджелудочной железы и кишечный сок содержат ферменты, которые обеспечивают расщепление углеводов, а наличие слабо щелочной среды в кишечнике обусловливает их высокую активность. Амилаза поджелудочной железы гидролизует крахмал вначале до декстринов, а затем до мальтозы. Последняя под действием мальтазы расщепляется до глюкозы. Если в пище содержится сахароза, то она подвергается распаду под действием сахаразы на глюкозу и фруктозу, а лактоза (молочный сахар) гидролизуется лактазой на глюкозу и галактозу. Таким образом, в тонком кишечнике углеводы типа крахмала расщепляются до моносахаридов и в таком виде всасываются в кровь. Из углеводов только клетчатка не расщепляется в тонком кишечнике. Она поступает в толстый отдел кишечника и там под действием ферментов микроорганизмов распадается до моносахаридов. Последние в основном используются для жизнедеятельности самих микроорганизмов. Часть непереваренной клетчатки принимает участие в формировании кала и выводится из организма. Рис. 52. Судьба глюкозы в организме
На рис. 52 схематично показана судьба глюкозы, поступившей из кишечника в кровь. Всосавшиеся моносахариды по воротной вене поступают в печень, где происходит процесс синтеза гликогена, осуществляются взаимопревращения углеводов, когда в зависимости от потребностей организма галактоза и фруктоза изомеризуются в глюкозу или. наоборот. Из печени углеводы кровью доставляются к различным органам и тканям, где участвуют в процессах обмена.
Рис. 52. Судьба глюкозы в организме
На рис. 52 схематично показана судьба глюкозы, поступившей из кишечника в кровь. Всосавшиеся моносахариды по воротной вене поступают в печень, где происходит процесс синтеза гликогена, осуществляются взаимопревращения углеводов, когда в зависимости от потребностей организма галактоза и фруктоза изомеризуются в глюкозу или. наоборот. Из печени углеводы кровью доставляются к различным органам и тканям, где участвуют в процессах обмена.
Промежуточный обмен углеводов
В клетках органов и тканей углеводы подвергаются различным превращениям, в результате которых образуются энергия и конечные продукты распада — молочная кислота, СО2 и Н2О. В ряде случаев процессы распада останавливаются на стадиях образования промежуточных продуктов, которые могут быть использованы для других процессов. Так, образовавшаяся пировиноградная кислота может превратиться в аминокислоту аланин; фосфоглицериновый альдегид может стать источником образования глицерина и быть использован для синтеза жиров; пентозы — рибоза и дезоксирибоза — участвуют в построении нуклеиновых кислот и т. д. Превращения углеводов в клетках происходят как при достаточном количестве кислорода и тогда такой путь называется аэробным окислением углеводов, так и при недостатке кислорода, когда углеводы распадаются по анаэробному пути. В организме разделить эти два процесса практически невозможно, так как обеспеченность клеток кислородом может меняться в течение очень короткого времени. Поэтому отдельное рассмотрение этих процессов связано с целью облегчения их изучения.Анаэробный процесс распада углеводов
Анаэробный распад углеводов может начинаться как с распада глюкозы — гликолиза, так и с распада гликогена — гликогенолиза. В основном этот путь распада характерен для мышц. Сущность анаэробного распада углеводов заключается в расщеплении активированной глюкозы (фосфоглюкозы) на 2 молекулы молочной кислоты. Образующаяся в ходе этого процесса энергия частично расходуется в виде тепла, частично накапливается (аккумулируется) в макроэргических соединениях типа АТФ.
При гликолизе образуются 2, а при гликогенолизе — 3 молекулы АТФ.
Гликогенолиз начинается с отщепления от гликогена под действием фермента фосфорилазы одной молекулы глюкозы в виде глюкозо-1-фосфата, который превращается (изомери-зуется) в глюкозо-6-фосфат.
При гликолизе глюкоза гексокиназой при участии АТФ (как источника энергии) превращается в глюкозо-6-фосфат.
Образующаяся в ходе этого процесса энергия частично расходуется в виде тепла, частично накапливается (аккумулируется) в макроэргических соединениях типа АТФ.
При гликолизе образуются 2, а при гликогенолизе — 3 молекулы АТФ.
Гликогенолиз начинается с отщепления от гликогена под действием фермента фосфорилазы одной молекулы глюкозы в виде глюкозо-1-фосфата, который превращается (изомери-зуется) в глюкозо-6-фосфат.
При гликолизе глюкоза гексокиназой при участии АТФ (как источника энергии) превращается в глюкозо-6-фосфат.
 Различия гликолиза и гликогенолиза Существуют только на начальных стадиях, до образования глюкозо-6-фосфорно-го эфира, с которого эти два процесса идут одинаково. В дальнейшем глюкозо-6-фосфат превращается во фруктозо-1,6-ди-фосфат, который под действием фермента альдолазы расщепляется на 2 молекулы триоз (моносахаридов, состоящих из 3 углеродных атомов) — фосфоглицериновый альдегид и фосфодиоксиацетон (см. стр. 134).
В организме фосфодиоксиацетон способен превратиться в фосфоглицериновый альдегид.
Таким образом, можно говорить о дальнейшем распаде 2 молекул фосфоглицеринового альдегида.
Следующий этап превращения является одним из важнейших процессов анаэробного распада углеводов — это окислительно-восстановительная реакция, в ходе которой образуются две молекулы 1,3-дифосфоглицериновой кислоты. Это соединение важно тем, что в ходе реакции оно накапливает энергию, которая идет на образование двух молекул АТФ. Существенным моментом реакции также является выделение 4 атомов водорода, которые участвуют в гликолизе на последнем этапе — восстанавливают пировиноградную кислоту до молочной (см. схему 2).
Различия гликолиза и гликогенолиза Существуют только на начальных стадиях, до образования глюкозо-6-фосфорно-го эфира, с которого эти два процесса идут одинаково. В дальнейшем глюкозо-6-фосфат превращается во фруктозо-1,6-ди-фосфат, который под действием фермента альдолазы расщепляется на 2 молекулы триоз (моносахаридов, состоящих из 3 углеродных атомов) — фосфоглицериновый альдегид и фосфодиоксиацетон (см. стр. 134).
В организме фосфодиоксиацетон способен превратиться в фосфоглицериновый альдегид.
Таким образом, можно говорить о дальнейшем распаде 2 молекул фосфоглицеринового альдегида.
Следующий этап превращения является одним из важнейших процессов анаэробного распада углеводов — это окислительно-восстановительная реакция, в ходе которой образуются две молекулы 1,3-дифосфоглицериновой кислоты. Это соединение важно тем, что в ходе реакции оно накапливает энергию, которая идет на образование двух молекул АТФ. Существенным моментом реакции также является выделение 4 атомов водорода, которые участвуют в гликолизе на последнем этапе — восстанавливают пировиноградную кислоту до молочной (см. схему 2).
 Схема 2. Анаэробный распад углеводов
1,3-Дифосфоглицериновая кислота отдает свою энергию на образование 2 молекул АТФ, а сама нревращается в 3-фосфоглицериновую кислоту.
Схема 2. Анаэробный распад углеводов
1,3-Дифосфоглицериновая кислота отдает свою энергию на образование 2 молекул АТФ, а сама нревращается в 3-фосфоглицериновую кислоту.
 3-Фосфоглицериновая кислота подвергается различным превращениям и, наконец, образует 2 молекулы пировиноградной кислоты, которая при участии фермента лактатдегидрогеназы и 4 атомов водорода, выделившихся при окислении 1,3-дифосфоглицериновой кислоты, образует молочную кислоту. Это конечный продукт анаэробного распада углеводов. Образовавшаяся молочная кислота подвергается дальнейшим превращениям. Так, 85% ее ресинтезируются в гликоген путем, обратным гликогенолизу в аэробных условиях, а оставшиеся 15% окисляются вначале до пировиноградной кислоты и затем до СО2 и Н2О.
3-Фосфоглицериновая кислота подвергается различным превращениям и, наконец, образует 2 молекулы пировиноградной кислоты, которая при участии фермента лактатдегидрогеназы и 4 атомов водорода, выделившихся при окислении 1,3-дифосфоглицериновой кислоты, образует молочную кислоту. Это конечный продукт анаэробного распада углеводов. Образовавшаяся молочная кислота подвергается дальнейшим превращениям. Так, 85% ее ресинтезируются в гликоген путем, обратным гликогенолизу в аэробных условиях, а оставшиеся 15% окисляются вначале до пировиноградной кислоты и затем до СО2 и Н2О.
Аэробное окисление углеводов
Основным путем образования энергии в организме является аэробное окисление углеводов. При этом глюкоза в присутствии кислорода окисляется до СО2 и Н2О с выделением большого количества энергии, часть которой идет на синтез 38-39 молекул АТФ. Аэробный процесс идет по следующей схеме: С6Н12О6 + 6О2 → 6СО2 + 6H2О + 680 ккал. Аэробное окисление глюкозы может происходить двумя путями — прямым и непрямым. При прямом пути окисления глюкозы (синонимы: апотомический или пентозный цикл) происходит последовательное отщепление от молекулы глюкозы каждого из ее 6 атомов углерода с образованием в течение одного цикла одной молекулы СО2 и Н2О. Распад всей молекулы глюкозы происходит в течение 6 повторяющихся циклов. Этот процесс преобладает в эритроцитах, лактирующей молочной железе, коре надпочечников, хрусталике глаза; в печени и почках он является побочным путем распада углеводов. Особенностью этого процесса является образование пентоз, которые идут на построение РНК и ДНК, выделение энергии (36 молекул АТФ) и накопление НАДФН2-кофермента дегидрогеназ, которые участвуют в синтезе холестерина, жирных кислот, активировании фолиевой кислоты и т. д. Схема 3. Аэробное окисление углеводов (непрямой путь)
В печени и почках преобладает другой путь окисления глюкозы, который называется непрямым, или дихотомическим (см. схему 3). В ходе этого процесса молекула глюкозы предварительно расщепляется на две молекулы фосфотриоз (процесс аналогичен анаэробному распаду углеводов) с последующим образованием пировиноградной кислоты. Пировиноградная кислота в результате окислительного декарбоксилирования превращается в ацетил-КоА
Схема 3. Аэробное окисление углеводов (непрямой путь)
В печени и почках преобладает другой путь окисления глюкозы, который называется непрямым, или дихотомическим (см. схему 3). В ходе этого процесса молекула глюкозы предварительно расщепляется на две молекулы фосфотриоз (процесс аналогичен анаэробному распаду углеводов) с последующим образованием пировиноградной кислоты. Пировиноградная кислота в результате окислительного декарбоксилирования превращается в ацетил-КоА
 Последний поступает в цикл Креоса, где происходит ею постепенное окисление до СО2 и Н2О и выделение большого количества энергии.
В ходе "непрямого" окисления одной молекулы глюкозы выделяется 680 ккал энергии, из которой образуется 38-39 молекул АТФ (см. схему 3).
В дрожжевых клетках и разных микроорганизмах также происходят процессы распада углеводов, однако конечные продукты различны в зависимости от вида микробов и дрожжей. Так, в дрожжевых клетках происходят процессы образования этилового спирта.
Механизм спиртового брожения глюкозы был вскрыт работами И. М. Манассеиной, Э. Бухнера, А. Н. Лебедева и других авторов. Под действием ферментов дрожжевых клеток происходит ранее рассмотренный процесс распада глюкозы или гликогена до пировиноградной кислоты. Последняя подвергается декарбоксилированию с образованием уксусного альдегида, который восстанавливается в этиловый спирт:
Последний поступает в цикл Креоса, где происходит ею постепенное окисление до СО2 и Н2О и выделение большого количества энергии.
В ходе "непрямого" окисления одной молекулы глюкозы выделяется 680 ккал энергии, из которой образуется 38-39 молекул АТФ (см. схему 3).
В дрожжевых клетках и разных микроорганизмах также происходят процессы распада углеводов, однако конечные продукты различны в зависимости от вида микробов и дрожжей. Так, в дрожжевых клетках происходят процессы образования этилового спирта.
Механизм спиртового брожения глюкозы был вскрыт работами И. М. Манассеиной, Э. Бухнера, А. Н. Лебедева и других авторов. Под действием ферментов дрожжевых клеток происходит ранее рассмотренный процесс распада глюкозы или гликогена до пировиноградной кислоты. Последняя подвергается декарбоксилированию с образованием уксусного альдегида, который восстанавливается в этиловый спирт:
 Таким образом, конечными продуктами спиртового брожения являются СО2 и этиловый спирт.
Молочнокислые бактерии превращают углеводы в молочную кислоту, маслянокислые — в масляную кислоту и т. д.
При изучении брожения Л. Пастер обратил внимание на то, что при избытке кислорода процесс гликолиза тормозится. Этот факт получил название эффекта Пастера. Объяснения ему пока еще нет. Существуют различные гипотезы, но ни одна из них не может с достаточной степенью точности его объяснить.
Исследованиями О. Варбурга было установлено, что в эмбриональной ткани и тканях злокачественных опухолей кислород не тормозит гликолиз. Образование молочной кислоты в присутствии кислорода получило название "аэробный гликолиз".
Таким образом, конечными продуктами спиртового брожения являются СО2 и этиловый спирт.
Молочнокислые бактерии превращают углеводы в молочную кислоту, маслянокислые — в масляную кислоту и т. д.
При изучении брожения Л. Пастер обратил внимание на то, что при избытке кислорода процесс гликолиза тормозится. Этот факт получил название эффекта Пастера. Объяснения ему пока еще нет. Существуют различные гипотезы, но ни одна из них не может с достаточной степенью точности его объяснить.
Исследованиями О. Варбурга было установлено, что в эмбриональной ткани и тканях злокачественных опухолей кислород не тормозит гликолиз. Образование молочной кислоты в присутствии кислорода получило название "аэробный гликолиз".
Регуляция углеводного обмена
Одной из важнейших функций углеводов является обеспечение всего организма энергией. Из всех представителей углеводов главное значение принадлежит глюкозе, которая является основным исходным продуктом почти всех превращений углеводов в организме. Ее содержание в крови в норме отличается удивительным постоянством, и по изменению уровня глюкозы судят о характере углеводного обмена в клинике. Поэтому важное значение представляет изучение регулятор-ных механизмов, ответственных за этот процесс. Регуляция углеводного обмена осуществляется многими системами организма. Главное значение принадлежит центральной нервной системе. Внешние факторы (эмоциональные состояния: чувство страха, боязни, радости и др.) и внутренние раздражители регуляторных механизмов фиксируются в центральной нервной системе, которая немедленно на них реагирует. Классическим примером регуляции углеводного обмена является так называемый "сахарный укол" — раздражение дна IV мозгового желудочка, впервые произведенный К. Бернаром. Раздражение этого участка мозга немедленно приводит к увеличению уровня сахара в крови. В организме таким раздражителем является сниженный против нормы уровень сахара в крови (гипогликемия). В этом случае импульсы из нервной системы направляются в надпочечники и стимулируют выработку их мозговым слоем гормона адреналина. Последний активирует фермент фосфорилазу, который катализирует распад гликогена. В результате этого увеличивается количество глюкозы и соответственно повышается ее концентрация в крови до нормы, что приводит к снятию такого раздражителя. Гормональная регуляция осуществляется рядом гормонов. Наибольшее значение имеют гормоны, перечисленные ниже. Инсулин — гормон поджелудочной железы, обеспечивает снижение сахара в крови путем активации ферментов, ответственных за использование глюкозы клетками организма (рис. 53).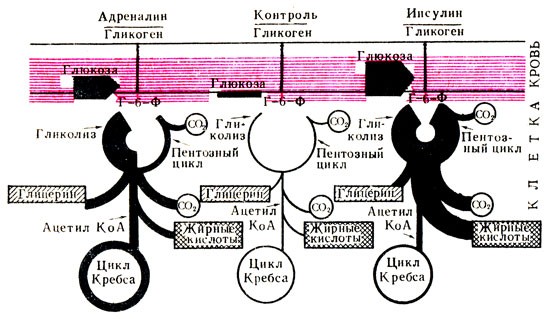 Рис. 53. Механизм действия инсулина и адреналина (объяснение в тексте)
На рис. 53 показан механизм действия инсулина. Глюкоза крови при участии инсулина поступает в клетки организма, в результате чего уровень ее в крови снижается (гипогликемический эффект). В клетках глюкоза превращается в глюкозо-6-фосфорный эфир (Г-6-Ф), который подвергается распаду или по пути гликолиза, или при аэробных условиях (пентозный цикл). При гликолизе из промежуточных продуктов может быть образован глицерин и небольшое количество ацетил-КоА, который поступает в цикл Кребса. В пентозном цикле глюкоза полностью окисляется с выделением большого количества СО2 (из одной молекулы глюкозы образуется 6 молекул СО2) и ряда промежуточных соединений, из которых могут быть синтезированы жирные кислоты.
Из других гормонов, участвующих в регуляции уровня сахара в крови, интерес представляет адреналин — гормон мозгового слоя надпочечников. Адреналин повышает уровень сахара путем активации распада гликогена (фермента фосфорилазы) до глюкозы и выброса ее в кровь. Помимо этого, адреналин умеренно активирует гликолиз. При этом происходит образование большего количества ацетил-КоА и, соответственно, большего количества энергии.
Глюкагон — гормон поджелудочной железы, действует аналогично адреналину.
Глюкокортикоиды — гормоны коры надпочечников, активируют процесс превращения жиров и белков в углеводы — глюконеогенез.
Адренокортикотропный гормон (АКТГ), вырабатываемый в гипофизе, стимулирует выработку глюкокортикоидов, т. е. опосредованно способствует повышению уровня сахара в крови путем активации глюконеогенеза. Аналогичным путем повышает сахар крови и соматотропный гормон.
Следовательно, только инсулин способствует снижению уровня сахара в крови, тогда как остальные гормоны вызывают его повышение. Эти кажущиеся на первый взгляд антагонистические отношения между инсулином, с одной стороны, и другими гормонами — с другой, являются по сути дела физиологически целесообразными в пределах всего организма. Так, адреналин и другие гормоны обеспечивают распад запасной формы углеводов — гликогена — до глюкозы и поступление ее в кровь. Инсулин же способствует использованию этой глюкозы клетками организма.
Из других регуляторных механизмов необходимо выделить печень, в клетках которой происходят процессы распада и синтеза глюкогена. Поэтому кровь, протекающая через печень, или насыщается глюкозой при ее недостатке в крови, или уровень сахара в крови снижается при ее избытке.
Таким образом, в регуляции углеводного обмена принимают участие различные факторы, совместное действие которых обеспечивает клетки необходимой энергией и питательными веществами, что характеризуется поддержанием на вполне определенном уровне сахара крови как показателя обмена углеводов всего организма.
Рис. 53. Механизм действия инсулина и адреналина (объяснение в тексте)
На рис. 53 показан механизм действия инсулина. Глюкоза крови при участии инсулина поступает в клетки организма, в результате чего уровень ее в крови снижается (гипогликемический эффект). В клетках глюкоза превращается в глюкозо-6-фосфорный эфир (Г-6-Ф), который подвергается распаду или по пути гликолиза, или при аэробных условиях (пентозный цикл). При гликолизе из промежуточных продуктов может быть образован глицерин и небольшое количество ацетил-КоА, который поступает в цикл Кребса. В пентозном цикле глюкоза полностью окисляется с выделением большого количества СО2 (из одной молекулы глюкозы образуется 6 молекул СО2) и ряда промежуточных соединений, из которых могут быть синтезированы жирные кислоты.
Из других гормонов, участвующих в регуляции уровня сахара в крови, интерес представляет адреналин — гормон мозгового слоя надпочечников. Адреналин повышает уровень сахара путем активации распада гликогена (фермента фосфорилазы) до глюкозы и выброса ее в кровь. Помимо этого, адреналин умеренно активирует гликолиз. При этом происходит образование большего количества ацетил-КоА и, соответственно, большего количества энергии.
Глюкагон — гормон поджелудочной железы, действует аналогично адреналину.
Глюкокортикоиды — гормоны коры надпочечников, активируют процесс превращения жиров и белков в углеводы — глюконеогенез.
Адренокортикотропный гормон (АКТГ), вырабатываемый в гипофизе, стимулирует выработку глюкокортикоидов, т. е. опосредованно способствует повышению уровня сахара в крови путем активации глюконеогенеза. Аналогичным путем повышает сахар крови и соматотропный гормон.
Следовательно, только инсулин способствует снижению уровня сахара в крови, тогда как остальные гормоны вызывают его повышение. Эти кажущиеся на первый взгляд антагонистические отношения между инсулином, с одной стороны, и другими гормонами — с другой, являются по сути дела физиологически целесообразными в пределах всего организма. Так, адреналин и другие гормоны обеспечивают распад запасной формы углеводов — гликогена — до глюкозы и поступление ее в кровь. Инсулин же способствует использованию этой глюкозы клетками организма.
Из других регуляторных механизмов необходимо выделить печень, в клетках которой происходят процессы распада и синтеза глюкогена. Поэтому кровь, протекающая через печень, или насыщается глюкозой при ее недостатке в крови, или уровень сахара в крови снижается при ее избытке.
Таким образом, в регуляции углеводного обмена принимают участие различные факторы, совместное действие которых обеспечивает клетки необходимой энергией и питательными веществами, что характеризуется поддержанием на вполне определенном уровне сахара крови как показателя обмена углеводов всего организма.
Патология углеводного обмена
Как уже было отмечено, уровень сахара в крови в норме отличается завидным постоянством. Содержание сахара в крови у плода составляет 35-115 мг%, у новорожденных — 20-30 мг%, у детей — 80-120 мг%, у взрослых — 70-100 мг%, у пожилых — 85-110 мг%. Поэтому изменение уровня сахара в крови характеризует определенные нарушения обмена углеводов. К таким нарушениям в первую очередь следует отнести гипер- и гипогликемии. Гипергликемия — это такое состояние организма, которое характеризуется повышением уровня сахара в крови. Гипергликемия возникает или при чрезмерном поступлении глюкозы в кровь, или при снижении ее использования клетками организма. Причинами гипергликемий могут быть как физиологические (потребление больших количеств углеводов, различные эмоциональные состояния и т. д.), так и патологические факторы (сахарный диабет, хронические инфекционные заболевания, опухоли мозга, психические заболевания). При этом уровень сахара крови может повышаться в 3-5 раз и достигать очень высоких значений (300-400 мг% и более при норме 80-120 мг%). Гипергликемии физиологического происхождения бывают кратковременными, и через 2-3 часа уровень сахара в крови снижается до нормальных величин. Очень часто гиперкликемии сопровождаются глюкозурией — появлением сахара в моче, который в норме в ней отсутствует. Это наблюдается в тех случаях, когда уровень сахара в крови превышает 160-180 мг%. Эти величины характеризуют так называемый сахарный порог почек. В почках постоянно происходит процесс фильтрации крови, в результате чего все токсические продукты выводятся из организма с мочой. В то же время другие вещества почками реабсорбируются — поступают обратно в кровь. К таким веществам относится и глюкоза. Однако способность канальцев почек всасывать глюкозу обратно в кровь ограничена. Экспериментальным путем было установлено, что почки способны реабсорбировать весь сахар обратно в кровь, если уровень его в крови не более 160 мг%. При увеличении концентрации глюкозы свыше 160-180 мг% почки не справляются с таким большим количеством сахара и последний поступает в мочу. Гипогликемические состояния характеризуются понижением сахара в крови до 50 мг% и ниже у взрослых. Гипогликемия возникает при избыточном синтезе инсулина или соответствующем снижении выработки гормонов антагонистов инсулина. При этом повышается синтез гликогена. Формой нарушения углеводного обмена является сахарный диабет. Это заболевание, как доказано в настоящее время, является наследственной патологией и клинически проявляется триадой симптомов: гипергликемией, глюкозурией и кетонемией с кегонурией (появление в крови и моче высоких концентраций ацетоново-кетоновых тел, к которым относятся ацетон, ацетоуксусная и β-оксимасляная кислоты). Основной причиной сахарного диабета является снижение выработки инсулина. Как было отмечено выше, инсулин выполняет важную роль в обмене глюкозы, обеспечивая ее фосфорилирование и поступление в клетки организма, где она при окислении выделяет энергию, необходимую для жизнедеятельности клеток. Поэтому при недостатке инсулина этот процесс снижается, что приводи с одной стороны, к увеличению концентрации свободной глюкозы в крови (развивается гипергликемия и глюкозурия), а с другой — клетки испытывают недостаток в энергии. Организм компенсирует этот недостаток путем активации процессов глюконеогенеза (повышение распада жиров и белков и превращение их в углеводы). При этом накапливаются большие количества одного из конечных продуктов распада жиров — ацетил-КоА, который поступает в цикл Кребса, где, окисляясь, выделяет энергию, необходимую для существования клеток организма. При сахарном диабете и этот процесс ограничен, так как одновременно с окислением жиров активируются процессы расщепления белков и аминокислот. Последние при своем распаде выделяют большие количества аммиака, который является для организма весьма токсичным. Его обезвреживание идет различными путями, в том числе путем взаимодействия с α-кетоглютаровой кислотой, концентрация которой в организме снижается. Данная кислота является одним из основных компонентов цикла Кребса и расходование ее на обезвреживание аммиака соответственно приводит к снижению активности всего цикла Кребса. Последний не в состоянии окислить те большие количества ацетил-КоА, которые образуются при распаде жиров и аминокислот. Избыток ацетил-КоА поступает в печень, где из него синтезируются ацетоновые или кетоновые тела. Последние поступают в кровь, в результате чего их количество значительно возрастает: если в норме в крови уровень ацетоновых тел составляет около 1 мг%, а за сутки с мочой выделяется до 40 мг, то при сахарном диабете их уровень в крови может повыситься до 100 мг% — ацегонемия (кетонемия), а с мочой выводится до 50 г — ацетонурия (кетонурия). Увеличение в крови кислых продуктов, какими являются ацетоновые тела, приводит к сдвигу рН крови в кислую сторону. Такое состояние организма называется ацидозом. При этом ацетоновые тела, особенно ацетон, выделяются не только с мочой, но и через легкие и кожу. От больного пахнет ацетоном (запах прелых фруктов). При тяжелых стадиях сахарного диабета больной теряет сознание, а в отдельных случаях возможен летальный исход. Основным средством лечения этого заболевания является введение лечебных доз инсулина вместе с глюкозой. Добавление глюкозы служит предупредительной мерой от возможного развития сильной гипогликемии после введения инсулина и лучшего использования глюкозы. Другими возможными путями лечения служит введение веществ, блокирующих действие инсулиназы,- фермента, расщепляющего инсулин. При этом сберегаются те небольшие количества инсулина, которые могут синтезироваться пораженными клетками островков Лангерганса поджелудочной железы. Диагностировать повышенный уровень сахара в крови можно различными способами, в том числе определением уровня сахара в крови методом Хагедорна-Йенсена, который основан на восстановительной способности глюкозы. Этот метод применяется в клинике. В настоящее время разработан глюкозоксидазный метод, позволяющий быстро определять уровень сахара в моче самими больными. Он заключается в следующем: на полоску бумаги наносят определенные реактивы, которые в присутствии сахара меняют свою окраску в зависимости от его количества. Поэтому достаточно смочить мочой такую бумажку, чтобы цвет ее изменился в соответствии с концентрацией сахара в моче. Имея такие бумажки, сам больной может контролировать свое состояние и принимать необходимые меры. К другим нарушениям углеводного обмена относятся некоторые наследственные заболевания, характеризующиеся отсутствием или снижением активности ферментов, участвующих в этом обмене. К ним относятся галактоземия, гликогенозы, непереносимость лактозы, сахарозы и др. При галактоземии отмечается отсутствие у детей фермента, катализирующего превращение галактозы в глюкозу. При этом в организме накапливаются большие количества галактозы, что является весьма токсичным, особенно для детей грудного возраста, Клинически заболевание проявляется поражением печени, почек, развитием желтухи, катарактой, понижением способности роста, умственной отсталостью. Чаще всего при нераспознанном заболевании дети погибают до года. Основным путем лечения являются ранняя диагностика заболевания и перевод ребенка на синтетическую диету, в которой отсутствует галактоза. Гликогенозы характеризуются нарушением распада гликогена до глюкозы в связи с отсутствием ферментов, катализирующих этот процесс. При этом заболевании органы (печень, мышцы и др.) переполнены гликогеном, в них развиваются атрофические процессы, а клетки испытывают недостаток в глюкозе и в энергии. К числу других наследственных заболеваний относятся непереносимость лактозы и сахарозы. Эти заболевания встречаются среди детей грудного возраста и возникают при отсутствии в кишечнике соответственно лактазы и сахаразы. Это приводит к переполнению кишечника нерасщепившимися дисахаридами, которые подвергаются расщеплению кишечной микрофлорой с образованием кислых продуктов (молочнокислые бактерии образуют молочную кислоту, маслянокислые — масляную и т. д.). Накопление этих веществ приводит к развитию тяжелых, длительных поносов.Исследование углеводного обмена в клинике
Диагностика заболеваний углеводного обмена в клинике осуществляется различными методами. Для изучения способности поджелудочной железы вырабатывать инсулин применяется метод сахарных нагрузок и построение по этим данным сахарных кривых. Метод заключается в том, что у больного натощак берут кровь, в которой определяют сахар. Затем больному дают 50 г глюкозы (детям.- 25 г) и определяют сахар в крови через 30, 45, 60, 120 и 180 минут. На основании полученных результатов строят график, отображающий зависимость между временем и уровнем сахара в крови. У здорового человека при этом развивается умеренная гипергликемия, которая к 3-му часу снижается до нормы. В случае же с сахарным диабетом уровень сахара в крови натощак выше контрольных цифр. После дачи сахарной нагрузки развивается гипергликемия, которая характеризуется более высокими цифрами и сохраняется наиболее длительное время. Рис. 54. Сахарные кривые крови после однократной нагрузки глюкозой
На рис. 54 представлены сахарные кривые здорового и больного сахарным диабетом. Этот метод позволяет диагностировать данное заболевание и контролировать его лечение.
Другим методом, характеризующим углеводный обмен, является определение сахара в моче.
Определение молочной кислоты в крови служит показателем обеспеченности тканей кислородом. Ее количество повышается после длительной физической нагрузки или при заболеваниях, сопровождающихся одышкой (пневмонии — воспаление легких, токсикозы, пороки сердца и т. д.).
Важное значение имеет определение пировиноградной кислоты в крови, содержание которой повышается при авитаминозе витамина B1 (бери-бери).
Еще одним показателем углеводного обмена является уровень ацетоновых (кетоновых) тел в крови и моче. Ацетонемия и ацетонурия обнаруживаются при сахарном диабете, голодании, беременности и т. д.
Диагностика наследственных заболеваний основана на определении активности ферментов, ответственных за различные этапы превращения углеводов.
Рис. 54. Сахарные кривые крови после однократной нагрузки глюкозой
На рис. 54 представлены сахарные кривые здорового и больного сахарным диабетом. Этот метод позволяет диагностировать данное заболевание и контролировать его лечение.
Другим методом, характеризующим углеводный обмен, является определение сахара в моче.
Определение молочной кислоты в крови служит показателем обеспеченности тканей кислородом. Ее количество повышается после длительной физической нагрузки или при заболеваниях, сопровождающихся одышкой (пневмонии — воспаление легких, токсикозы, пороки сердца и т. д.).
Важное значение имеет определение пировиноградной кислоты в крови, содержание которой повышается при авитаминозе витамина B1 (бери-бери).
Еще одним показателем углеводного обмена является уровень ацетоновых (кетоновых) тел в крови и моче. Ацетонемия и ацетонурия обнаруживаются при сахарном диабете, голодании, беременности и т. д.
Диагностика наследственных заболеваний основана на определении активности ферментов, ответственных за различные этапы превращения углеводов.
Вопросы для повторения
1. Что представляют собой пищевые источники углеводов? 2. В каком отделе пищеварительного тракта и под действием каких ферментов происходит переваривание углеводов? 3. В каком виде всасываются углеводы из кишечника? 4. По каким путям происходит превращение углеводов в тканях? 5. Что такое гликолиз, гликогенолиз? 6. Какое значение имеет анаэробный распад углеводов? 7. Напишите схему гликолиза. 8. Какое биологическое значение имеет аэробный распад углеводов? 9. Напишите схему аэробного распада углеводов. 10. Что является конечным продуктом окислительного декарбоксилирования пировиноградной кислоты? 11. Каково биологическое значение пентозного цикла? 12. Напишите реакции конечных этапов молочнокислого, маслянокислого и спиртового брожения. 13. Какие факторы участвуют в регуляции обмена углеводов? 14. Каков механизм действия адреналина, инсулина, глюкокортикоидов, АКТГ? 15. Что такое гипогликемия, гипергликемия, глюкозурия? 16. Каковы причины сахарного диабета? 17. Охарактеризуйте патогенез сахарного диабета с биохимических позиций. 18. Какие лекарственные средства применяются при лечении сахарного диабета? 19. Почему при лечении сахарного диабета рекомендуется введение инсулина вместе с глюкозой? 20. Какие известны наследственные заболевания углеводного обмена и какова их причина? 21. Что такое гликогенозы, галактоземия? 22. Какие методы применяются для исследования углеводного обмена в клинике?VIII. Химия липидов и липоидов
Общая характеристика
Липиды (от греч. lipos — жир) — это общее название для всех известных жиров и жироподобных веществ. В каждой клетке животного или растительного организма содержится вполне определенное количество липидов, которые выполняют жизненно важные функции. Свободный жир можно условно разделить на две большие группы: протоплазматический и запасной (резервный) жир. Протоплазматический жир (конституционный) участвует в построении каждой клетки. Он входит в состав митохондрий, микросом и других внутриклеточных структур клетки. Липиды являются составной частью оболочек (мембран) клеток, митохондрий, которые регулируют поступление в клетку и субклеточные органеллы питательных веществ и выведение конечных продуктов обмена. Количество протоплазматического жира у человека всегда постоянно и составляет около 25% от всего жира, находящегося в организме. Эта величина весьма постоянна и практически не меняется ни при голодании, ни при различных патологических состояниях. Резервный жир представляет собой очень удобную форму консервирования энергии. Это связано с тем, что жир по калорийности почти в 2 раза превышает калорийность белков и углеводов. Так, если при сгорании 1 г углеводов или белков выделяется около 4 ккал, то при полном окислении 1 г жира выделяется 9,3 ккал. Количество резервного жира может меняться в зависимости от различных условий (пол, возраст, род трудовой деятельности, режим питания и т. д.). В среднем в организме на долю резервного жира приходится примерно 7-8 кг. Депо жира являются подкожная клетчатка, сальник, околопочечная капсула и др. Из органов и тканей наиболее богаты жиром клетки мозга, спермы, яичников, где это количество составляет 7,5-30% веса органа (табл. 5). Таблица 5. Содержание липидов в различных жидкостях и тканях человека (в процентах свежей ткани)
В организме наряду со свободным жиром имеется большое количество жира, связанного с углеводами и белками. Так, соединение липидов с белками называется липопротеидами и протеолипидами. Исследования последних лет показали важное значение липопротеидов. Они представляют собой очень маленькие образования, размером 0,5-10 ммк, наружную оболочку которых составляют белки, а внутреннюю — липиды. В силу такого строения липопротеиды растворимы в воде и выполняют функцию переноса (транспорта) липидов по крови. Липопротеиды имеют важное значение в диагностике ряда заболеваний. Так, при атеросклерозе в крови повышен уровень одной из форм липопротеидов — β-липопротеидов.
Жир, окружая внутренние органы своеобразной капсулой, предохраняет их от ударов и сотрясений, а также служит термоизоляционным материалом. Входя в состав подкожной клетчатки, липиды выполняют функцию терморегуляции.
Липиды обеспечивают всасывание из кишечника жирорастворимых витаминов.
Все отмеченные функции липидов характеризуют их важное биологическое значение для организма. L
Таблица 5. Содержание липидов в различных жидкостях и тканях человека (в процентах свежей ткани)
В организме наряду со свободным жиром имеется большое количество жира, связанного с углеводами и белками. Так, соединение липидов с белками называется липопротеидами и протеолипидами. Исследования последних лет показали важное значение липопротеидов. Они представляют собой очень маленькие образования, размером 0,5-10 ммк, наружную оболочку которых составляют белки, а внутреннюю — липиды. В силу такого строения липопротеиды растворимы в воде и выполняют функцию переноса (транспорта) липидов по крови. Липопротеиды имеют важное значение в диагностике ряда заболеваний. Так, при атеросклерозе в крови повышен уровень одной из форм липопротеидов — β-липопротеидов.
Жир, окружая внутренние органы своеобразной капсулой, предохраняет их от ударов и сотрясений, а также служит термоизоляционным материалом. Входя в состав подкожной клетчатки, липиды выполняют функцию терморегуляции.
Липиды обеспечивают всасывание из кишечника жирорастворимых витаминов.
Все отмеченные функции липидов характеризуют их важное биологическое значение для организма. L
Классификация липидов и липоидов
Липиды делятся на две большие группы: 1. истинные липиды — триглицериды или нейтральные жиры; 2. липоиды жироподобные вещества, к которым относятся фосфолипиды, гликолипиды, стерины, стериды и воска.Нейтральные жиры (триглицериды)
Нейтральные жиры представляют собой по химической структуре триглицериды, т. е. сложные эфиры трехатомного спирта глицерина и высокомолекулярных жирных кислот, построенных по следующему типу: где R, R1, R2 — жирные кислоты различного состава.
В состав нейтральных жиров входят насыщенные и ненасыщенные высшие жирные кислоты. Из насыщенных высших жирных кислот в организме чаще других встречаются:
где R, R1, R2 — жирные кислоты различного состава.
В состав нейтральных жиров входят насыщенные и ненасыщенные высшие жирные кислоты. Из насыщенных высших жирных кислот в организме чаще других встречаются:
 Линолевая, линоленовая и арахидоновая кислоты содержат 2 и более двойных связей и не синтезируются в организме, поэтому их необходимо вводить в рацион как незаменимые компоненты пищи, значение которых очень велико.
Растительные жиры состоят в основном из ненасыщенных жирных кислот, содержание которых может достигать иногда 95% общего количества жира.
Линолевая, линоленовая и арахидоновая кислоты содержат 2 и более двойных связей и не синтезируются в организме, поэтому их необходимо вводить в рацион как незаменимые компоненты пищи, значение которых очень велико.
Растительные жиры состоят в основном из ненасыщенных жирных кислот, содержание которых может достигать иногда 95% общего количества жира.
Физико-химические свойства
Физические и химические свойства липидов определяются свойствами входящих в их состав жирных кислот. Насыщенные жирные кислоты имеют более высокую температуру плавления по сравнению с ненасыщенными. Температура плавления стеариновой кислоты равна 69°, пальмитиновой — 61°, олеиновой — 13°, линолевой — 5°, линоленовой — 15°. Поэтому и жир, имеющий в своем составе насыщенные жирные кислоты, представляет собой твердое вещество, тогда как растительные жиры (масла) при комнатной температуре имеют жидкую консистенцию. Соответственно этому и температура плавления разных жиров различна. Температура плавления бараньего жира равна 44-50°, говяжьего — 42-49°, свиного — 36-46°, коровьего масла — 28-33°, гусиного жира — 26-34°, температура плавления подсолнечного масла составляет — 21°, хлопковое масло плавится при 34й. Температура плавления жира человека в среднем 17,5 (0,5-40,0°). Ненасыщенные жирные кислоты, имея в своем составе одну или несколько двойных связей, являются более реакционно-способными соединениями, чем насыщенные. Они легко присоединяют различные атомы по месту двойных связей (как, например, водород), превращаясь при этом в насыщенные: Этот процесс называется гидрогенизацией. Вещества, подвергнутые гидрогенизации, меняют свои свойства. Так, если растительные масла подвергнуть гидрогенизации, то они превратятся в твердые жиры.
Кроме водорода, такие жирные кислоты могут присоединять галогены, например йод. На этом основано определение так называемого йодного числа, характеризующего степень ненасыщенности кислот. Йодное число выражается количеством граммов йода, которое может быть связано 100 г жира. Йодное число животных жиров намного ниже растительных.
При длительном стоянии на воздухе и на свету жиры разлагаются — прогоркают. Особенно легко подвергаются прогорканию жиры, имеющие в своем составе много ненасыщенных жирных кислот.
Жиры, как и все сложные эфиры, способны к омылению. Эта способность зависит от молекулярного веса жирных кислот и выражается количеством КОН (в мг), пошедшего на омыление 1 г жира. Этот показатель называется числом омыления.
При гидролизе молекулы нейтрального жира распадаются на глицерин и свободные жирные кислоты. Чем дольше протекает гидролиз, тем большее число молекул жира распадается и соответственно появляется большее число свободных жирных кислот. Следовательно, определение количества свободных жирных кислот характеризует степень гидролиза жира. С этой целью введен показатель — кислотное число, при котором определяется уровень свободных жирных кислот. Оно выражается количеством КОН (в мг), пошедшего на нейтрализацию 1 г жира.
В зависимости от состава жирных кислот нейтральный жир может быть простым, когда в его составе имеются 3 одинаковые жирные кислоты, и смешанным при наличии в молекуле жира разных кислот. Примером простого жира служит трипальмитин:
Этот процесс называется гидрогенизацией. Вещества, подвергнутые гидрогенизации, меняют свои свойства. Так, если растительные масла подвергнуть гидрогенизации, то они превратятся в твердые жиры.
Кроме водорода, такие жирные кислоты могут присоединять галогены, например йод. На этом основано определение так называемого йодного числа, характеризующего степень ненасыщенности кислот. Йодное число выражается количеством граммов йода, которое может быть связано 100 г жира. Йодное число животных жиров намного ниже растительных.
При длительном стоянии на воздухе и на свету жиры разлагаются — прогоркают. Особенно легко подвергаются прогорканию жиры, имеющие в своем составе много ненасыщенных жирных кислот.
Жиры, как и все сложные эфиры, способны к омылению. Эта способность зависит от молекулярного веса жирных кислот и выражается количеством КОН (в мг), пошедшего на омыление 1 г жира. Этот показатель называется числом омыления.
При гидролизе молекулы нейтрального жира распадаются на глицерин и свободные жирные кислоты. Чем дольше протекает гидролиз, тем большее число молекул жира распадается и соответственно появляется большее число свободных жирных кислот. Следовательно, определение количества свободных жирных кислот характеризует степень гидролиза жира. С этой целью введен показатель — кислотное число, при котором определяется уровень свободных жирных кислот. Оно выражается количеством КОН (в мг), пошедшего на нейтрализацию 1 г жира.
В зависимости от состава жирных кислот нейтральный жир может быть простым, когда в его составе имеются 3 одинаковые жирные кислоты, и смешанным при наличии в молекуле жира разных кислот. Примером простого жира служит трипальмитин:
 Смешанный жир может иметь следующийсостав:
Смешанный жир может иметь следующийсостав:
 В зависимости от возраста, пола, питания, места обитания животного организма структура нейтрального жира меняется. Так, в составе нейтральных жиров морских животных преобладают насыщенные жирные кислоты с большим числом С-атомов, например пальмитиновая кислота, и высокий процент ненасыщенных жирных кислот с С18-C22. Депо жира у них является печень.
В составе жира наземных животных в значительном количестве содержится стеариновая кислота, а ненасыщенные кислоты имеют 14-16 углеродных атомов. Депо жира являются подкожная клетчатка, околопочечная область, брыжейка, сальник.
Влияние на состав жира среды обитания можно проследить на лососях. В период их развития до полового созревания они живут в море, и состав их жира соответствует жиру морских животных. В период нереста, который проходит в пресноводных реках, он соответствует жиру пресноводных рыб.
Жир человека имеет в своем составе значительные количества стеариновой, пальмитиновой, олеиновой, линолевой, линоленовой, лауриновой, миристиновой и других кислот.
В зависимости от возраста, пола, питания, места обитания животного организма структура нейтрального жира меняется. Так, в составе нейтральных жиров морских животных преобладают насыщенные жирные кислоты с большим числом С-атомов, например пальмитиновая кислота, и высокий процент ненасыщенных жирных кислот с С18-C22. Депо жира у них является печень.
В составе жира наземных животных в значительном количестве содержится стеариновая кислота, а ненасыщенные кислоты имеют 14-16 углеродных атомов. Депо жира являются подкожная клетчатка, околопочечная область, брыжейка, сальник.
Влияние на состав жира среды обитания можно проследить на лососях. В период их развития до полового созревания они живут в море, и состав их жира соответствует жиру морских животных. В период нереста, который проходит в пресноводных реках, он соответствует жиру пресноводных рыб.
Жир человека имеет в своем составе значительные количества стеариновой, пальмитиновой, олеиновой, линолевой, линоленовой, лауриновой, миристиновой и других кислот.
Липоиды
Фосфолипиды (фосфатиды)
Биологическое значение фосфолипидов для организма весьма велико. Они принимают участие в транспорте липидов по крови, входят в состав тканей мозга, нервов, печени, сердца и т. д., являются антиоксидантами — веществами, которые предотвращают окисление других веществ, в том числе витаминов групп А и Е. Фосфолипиды состоят из глицерина, двух молекул жирных кислот, одна из которых насыщенная, а другая ненасыщенная, фосфорной кислоты и азотистого основания. Общая формула их следующая: где R — насыщенная кислота,
R1 — ненасыщенная кислота,
R2 — азотистое основание, которое может быть представлено холином
где R — насыщенная кислота,
R1 — ненасыщенная кислота,
R2 — азотистое основание, которое может быть представлено холином
 и в этом случае фосфолипид называется лецитином; если в состав фосфолипида входит этаноламин ОН-СН2*СН2-NH2, то он называется кефалином, а если фосфолипид имеет в своем составе аминокислоту серии, то он называется серинфосфатидом.
и в этом случае фосфолипид называется лецитином; если в состав фосфолипида входит этаноламин ОН-СН2*СН2-NH2, то он называется кефалином, а если фосфолипид имеет в своем составе аминокислоту серии, то он называется серинфосфатидом.
 Общая формула фосфатидов:
Общая формула фосфатидов:
 К фосфолипидам относятся также ацетальфосфатиды, которые имеют у второго углеродного атома глицерина ацетальную группировку.
Отдельную группу составляют фосфолипиды, в составе которых глицерин замещен ненасыщенным спиртом — сфингозином,- сфингомиелины.
Сфингомиелины участвуют в построении миелиновых оболочек нервов.
В составе инозитфосфатидов вместо азотистого основания присутствует витамин инозит.
К фосфолипидам относятся также ацетальфосфатиды, которые имеют у второго углеродного атома глицерина ацетальную группировку.
Отдельную группу составляют фосфолипиды, в составе которых глицерин замещен ненасыщенным спиртом — сфингозином,- сфингомиелины.
Сфингомиелины участвуют в построении миелиновых оболочек нервов.
В составе инозитфосфатидов вместо азотистого основания присутствует витамин инозит.
Стерины и стериды
По своей химической структуре стерины представляют собой высокомолекулярные циклические спирты, представителем которых является холестерин: Холестерин впервые был получен еще в XVII веке Конради из желчных камней (греч. holle — желчь). Это кристаллическое вещество, которое не растворяется в воде, но хорошо растворяется в эфире, хлороформе, горячем спирте. Холестерин в организме имеет большое значение. Он является предшественником желчных кислот, женских половых гормонов, кортикостероидов, витаминов группы D. Холестерин повышает устойчивость эритроцитов к гемолизу. Одно из важных свойств холестерина — плохая проводимость электрического заряда — позволяет высказать предположение о том, что наличие значительных количеств холестерина в мозге, помимо других его функций, является своеобразным изолятором, предохраняющим структуру мозга от изменений при прохождении нервных импульсов, несущих электрический заряд.
Холестерин образует эфиры с высшими жирными кислотами, которые называются стеридами.
В крови содержится 150-250 мг% холестерина, из которых 3/4 приходится на долю эфиросвязанного холестерина.
Холестерин впервые был получен еще в XVII веке Конради из желчных камней (греч. holle — желчь). Это кристаллическое вещество, которое не растворяется в воде, но хорошо растворяется в эфире, хлороформе, горячем спирте. Холестерин в организме имеет большое значение. Он является предшественником желчных кислот, женских половых гормонов, кортикостероидов, витаминов группы D. Холестерин повышает устойчивость эритроцитов к гемолизу. Одно из важных свойств холестерина — плохая проводимость электрического заряда — позволяет высказать предположение о том, что наличие значительных количеств холестерина в мозге, помимо других его функций, является своеобразным изолятором, предохраняющим структуру мозга от изменений при прохождении нервных импульсов, несущих электрический заряд.
Холестерин образует эфиры с высшими жирными кислотами, которые называются стеридами.
В крови содержится 150-250 мг% холестерина, из которых 3/4 приходится на долю эфиросвязанного холестерина.
Гликолипиды
Гликолипиды — это сложные соединения липидов и углеводов. Они входят в состав мозговой и нервной ткани. В группе гликолипидов выделяют цереброзиды — соединения, состоящие из сфингозина, лигноцериновой кислоты и галактозы. Ганглиозиды имеют в своем составе, помимо других компонентов, и нейраминовую кислоту — соединение, состоящее из маннозамина и пировиноградной кислоты. Соединение уксусной и нейраминовой кислот называется сиаловой кислотой. Последняя входит в состав мукополисахаридов, которые участвуют в построении клеточных оболочек.Воска
Воска объединяют большую группу веществ, состоящих из сложных эфиров высших спиртов и жирных кислот с большим числом углеродных атомов. К воскам относится ланолин — вещество, представляющее собой смесь эфиров холестерина с различными кислотами и обеспечивающее устойчивость волос и эластичность кожи, спермацет, пчелиный воск и др. Воска в большом количестве входят в состав капсулы туберкулезных бацилл.Вопросы для повторения
1. Что такое липиды, липоиды? 2. В каком виде присутствует жир в организме человека? 3. Напишите общую формулу нейтральных жиров. 4. Каковы различия между насыщенными и ненасыщенными жирными кислотами? Приведите примеры. 5. Дайте определение гидрогенизации, числа омыления, йодного числа, кислотного числа? 6. Что такое фосфолипиды? 7. Напишите общую формулу фосфолипидов? 8. Что такое стерины, гликолипиды, воска?IX. Обмен липидов и липоидов
Переваривание нейтральных жиров
Основными факторами переваривания жира являются: 1. наличие липаз — ферментов, расщепляющих жиры; 2. условий для проявления их оптимальной активности; 3. эмульгаторов — детергентов, веществ, обеспечивающих эмульгирование жиров. Липаза может воздействовать только на эмульгированные жиры. Если одно вещество, находящееся в раздробленном (диспергированном) состоянии, равномерно распределено в массе другого вещества, то такую систему называют дисперсной. Одним из видов дисперсных систем являются эмульсии. Эмульсии — дисперсные системы двух несмешивающихся жидкостей, где одна жидкость в виде капелек диспергирована (находится в раздробленном состоянии) в другой, например масло в воде или капельки жира в молоке. Чтобы получить эмульсию масла в воде, достаточно энергично взболтать эту смесь и масло разделится на мельчайшие капли. Однако при стоянии капельки масла соберутся вместе и будет четко видна граница этих двух жидкостей. Для предотвращения склеивания частиц масла в эту смесь следует добавить определенные вещества — эмульгаторы или детергенты, которые будут препятствовать такому склеиванию (рис. 55). В организме такими эмульгаторами для жира являются соли желчных кислот, сывороточный альбумин и др.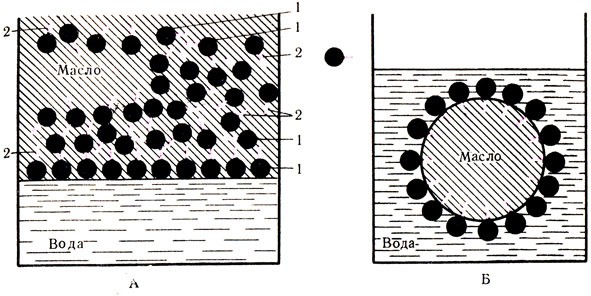 Рис. 55. Эмульгирование жира. А — слой воды, масла и молекулы эмульгатора, которые состоят из двух частей: 1 — гидрофильных групп и 2 — гидрофобных групп; Б — молекула эмульгированного жира, окруженная молекулами эмульгатора, который своими гидрофильными группами обращен к воде, а гидрофобными — к маслу
В ротовой полости отсутствуют такие условия и поэтому не происходит переваривания жиров.
В желудке присутствует липаза, однако ее активность весьма невелика. Это связано с наличием в желудке сильно кислой реакции среды (рН 1,5-2,5, а оптимум рН липазы 7,8-8,1) и отсутствием эмульгаторов. Поэтому в желудке расщепляются только эмульгированные жиры, к которым относится жир молока и яичного желтка.
У новорожденных и грудных детей в желудке происходит переваривание определенной части жира. Это связано с тем, что рН среды в желудке новорожденных равен 5,6, а в этих условиях липаза проявляет большую активность. С другой стороны, основным продуктом питания детей в этот период является материнское молоко, жир которого находится в в эмульгированном состоянии. И, наконец, в молоке, матери содержится липолитический фактор, который также участвует в переваривании жира.
В процессе переваривания жира у взрослых желудок, однако, играет определенную роль. Он регулирует поступление жира в кишечник и переваривает белки, освобождая таким образом жир из липопротеидных комплексов пищи.
Основным местом переваривания жира является тонкий отдел кишечника, где имеются все необходимые для этого процесса условия. Среда в кишечнике слабощелочная, оптимальная для активности липазы. Панкреатический и кишечный соки богаты липолитическими ферментами (липазы и лецитиназы). Диспергирование жира (раздробление жира на капельки) обеспечивается перистальтикой кишечника, и постоянно образующимся углекислым газом, который выделяется при взаимодействии кислого содержимого пищи, поступающей из желудка, с щелочной средой кишечника, где имеются углекислые соли. Образовавшийся углекислый газ "пробулькивается" через пищевые массы и участвует таким путем в раздроблении жира. Изливающаяся в просвет кишечника желчь содержит желчные кислоты, которые являются хорошими эмульгаторами. Помимо этого, желчь является активатором липаз.
Таким образом, в тонком отделе кишечника в основном нейтральные жиры расщепляются на свои составные части: глицерин и высшие жирные кислоты. Часть нейтральных жиров расщепляется до ди- и моноглицеридов (соединения глицерина с двумя или одной жирными кислотами). Непереваренный жир поступает в толстый отдел кишечника и выделяется с калом.
Рис. 55. Эмульгирование жира. А — слой воды, масла и молекулы эмульгатора, которые состоят из двух частей: 1 — гидрофильных групп и 2 — гидрофобных групп; Б — молекула эмульгированного жира, окруженная молекулами эмульгатора, который своими гидрофильными группами обращен к воде, а гидрофобными — к маслу
В ротовой полости отсутствуют такие условия и поэтому не происходит переваривания жиров.
В желудке присутствует липаза, однако ее активность весьма невелика. Это связано с наличием в желудке сильно кислой реакции среды (рН 1,5-2,5, а оптимум рН липазы 7,8-8,1) и отсутствием эмульгаторов. Поэтому в желудке расщепляются только эмульгированные жиры, к которым относится жир молока и яичного желтка.
У новорожденных и грудных детей в желудке происходит переваривание определенной части жира. Это связано с тем, что рН среды в желудке новорожденных равен 5,6, а в этих условиях липаза проявляет большую активность. С другой стороны, основным продуктом питания детей в этот период является материнское молоко, жир которого находится в в эмульгированном состоянии. И, наконец, в молоке, матери содержится липолитический фактор, который также участвует в переваривании жира.
В процессе переваривания жира у взрослых желудок, однако, играет определенную роль. Он регулирует поступление жира в кишечник и переваривает белки, освобождая таким образом жир из липопротеидных комплексов пищи.
Основным местом переваривания жира является тонкий отдел кишечника, где имеются все необходимые для этого процесса условия. Среда в кишечнике слабощелочная, оптимальная для активности липазы. Панкреатический и кишечный соки богаты липолитическими ферментами (липазы и лецитиназы). Диспергирование жира (раздробление жира на капельки) обеспечивается перистальтикой кишечника, и постоянно образующимся углекислым газом, который выделяется при взаимодействии кислого содержимого пищи, поступающей из желудка, с щелочной средой кишечника, где имеются углекислые соли. Образовавшийся углекислый газ "пробулькивается" через пищевые массы и участвует таким путем в раздроблении жира. Изливающаяся в просвет кишечника желчь содержит желчные кислоты, которые являются хорошими эмульгаторами. Помимо этого, желчь является активатором липаз.
Таким образом, в тонком отделе кишечника в основном нейтральные жиры расщепляются на свои составные части: глицерин и высшие жирные кислоты. Часть нейтральных жиров расщепляется до ди- и моноглицеридов (соединения глицерина с двумя или одной жирными кислотами). Непереваренный жир поступает в толстый отдел кишечника и выделяется с калом.
Всасывание жиров
Процесс всасывания продуктов переваривания жира является очень сложным. Это относится в основном к жирным кислотам, так как глицерин, как водорастворимое вещество свободно всасывается стенкой кишечника. Жирные кислоты как нерастворимые в воде могут всасываться только в виде водорастворимых соединений, в образовании которых принимают участие парные желчные кислоты, входящие в состав желчи и представляющие собой соединения желчных кислот с гликоколом или таурином. К желчным кислотам относятся холевая, дезоксихолевая, литохолевая и кенодезоксихолевая. Все они являются производными холестерина. В организме наибольшее значение имеют холевая и дезоксихолевая кислоты. Они присоединяют к своей карбоксильной группе аминокислоту гликокол (H2N-СН2-СООН) или таурин (H2N-СН2*СН2-О-S=О=О-OH) пептидоподобной связью и в таком виде уже называются парными желчными кислотами — глико- или таурохолевой и глико- или тауродезоксихолевой:
В организме наибольшее значение имеют холевая и дезоксихолевая кислоты. Они присоединяют к своей карбоксильной группе аминокислоту гликокол (H2N-СН2-СООН) или таурин (H2N-СН2*СН2-О-S=О=О-OH) пептидоподобной связью и в таком виде уже называются парными желчными кислотами — глико- или таурохолевой и глико- или тауродезоксихолевой:
 Соединения парных желчных кислот с жирными кислотами называются холеиновыми комплексами.
Парные желчные кислоты обволакивают молекулу жирной o кислоты и в таком виде всасываются в стенку кишечника. На каждую жирную кислоту приходится 2-4 парные желчные кислоты. Не полностью расщепившиеся или нерасщепившиеся нейтральные жиры также могут всасываться в кишечнике, если размер их капель не превышает 0,5 ммк. Всосавшиеся холеиновые комплексы в стенке кишечника распадаются на составные части и освободившиеся жирные кислоты частично вновь синтезируются в триглицериды.
Желчные кислоты поступают в систему воротной вены и попадают в печень, откуда они вновь доставляются в желчный пузырь и снова поступают в кишечник. В результате такого кругооборота небольшие количества желчи обеспечивают переваривание и всасывание значительных количеств жирных кислот.
Соединения парных желчных кислот с жирными кислотами называются холеиновыми комплексами.
Парные желчные кислоты обволакивают молекулу жирной o кислоты и в таком виде всасываются в стенку кишечника. На каждую жирную кислоту приходится 2-4 парные желчные кислоты. Не полностью расщепившиеся или нерасщепившиеся нейтральные жиры также могут всасываться в кишечнике, если размер их капель не превышает 0,5 ммк. Всосавшиеся холеиновые комплексы в стенке кишечника распадаются на составные части и освободившиеся жирные кислоты частично вновь синтезируются в триглицериды.
Желчные кислоты поступают в систему воротной вены и попадают в печень, откуда они вновь доставляются в желчный пузырь и снова поступают в кишечник. В результате такого кругооборота небольшие количества желчи обеспечивают переваривание и всасывание значительных количеств жирных кислот.
Переваривание и всасывание липоидов
Лецитины, кефалины и серинфосфатиды подвергаются расщеплению ферментами, носящими общее название "лецитиназы". Это гидролитические ферменты, которые осуществляют последовательный распад фосфолипидов. В организме обнаружены 4 лецитиназы — А, В, С и D, которые последовательно расщепляют молекулу фосфолипидов на жирные кислоты, глицерин, фосфорную кислоту и азотистое основание. Последовательность действия лецитиназ будет следующей: Действие лецитиназ Глицерин, фосфорная кислота и азотистые основания как водорастворимые вещества непосредственно всасываются в стенку кишечника. Жирные кислоты всасываются в виде холеиновых комплексов.
В пище холестерин содержится как свободным, так и связанным, в виде эфиров с высшими жирными кислотами. Последний в кишечнике расщепляется на свободный холестерин и жирные кислоты. Как жирные кислоты, так и свободный холестерин при участии парных желчных кислот всасываются в стенку кишечника, где происходит синтез специфичных для организма липоидов. Таким образом, в стенке кишечника накапливаются глицерин, жирные кислоты, моно-, ди- и триглицериды, фосфолипиды, холестерин и другие липоиды.
Глицерин, фосфорная кислота и азотистые основания как водорастворимые вещества непосредственно всасываются в стенку кишечника. Жирные кислоты всасываются в виде холеиновых комплексов.
В пище холестерин содержится как свободным, так и связанным, в виде эфиров с высшими жирными кислотами. Последний в кишечнике расщепляется на свободный холестерин и жирные кислоты. Как жирные кислоты, так и свободный холестерин при участии парных желчных кислот всасываются в стенку кишечника, где происходит синтез специфичных для организма липоидов. Таким образом, в стенке кишечника накапливаются глицерин, жирные кислоты, моно-, ди- и триглицериды, фосфолипиды, холестерин и другие липоиды.
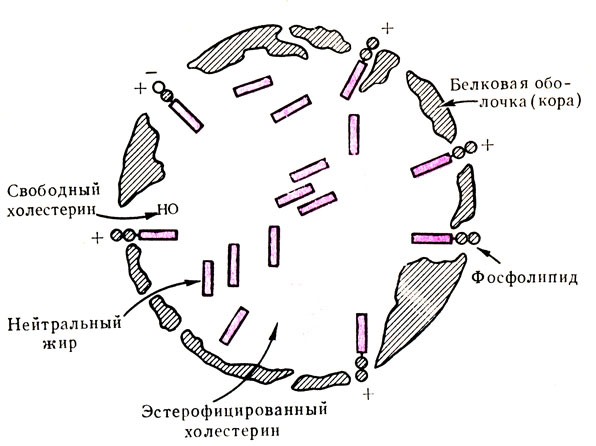 Рис. 56. Схема строения хиломикрона
Основная часть жира до 60% поступает в лимфатическую систему и через грудной проток лимфа, богатая мельчайшими капельками жира, попадает в общий круг кровообращения. Оставшиеся 40% жира формируют с белками липопро-теидные комплексы — хиломикроны (рис. 56). Последние, как и фосфолипиды, являются транспортной формой жира ив таком виде поступают в кровь воротной вены. В крови часть из них подвергается расщеплению липопротеин-липа-зой, которая активируется гепарином, на более мелкие ли-попротеидные комплексы. Из крови жиры в составе липо-протеидов и НЭЖК поступают в печень, где часть жира вновь распадается на составные части, из которых синтезируется специфический для организма жир, часть откладывается в виде запаса, часть поступает в жировые депо (сальник, подкожная и околопочечная клетчатка и т. д.), часть же жиров разносится кровью ко многим органам и тканям, где подвергается различным превращениям. В кровь поступает также и часть жирных кислот, освободившихся при распаде хиломикронов. Такие свободные жирные кислоты являются весьма токсичными для организма. Однако отравления ими не происходит, потому что жирные кислоты немедленно соединяются с альбуминами и такие комплексы называются неэстерифицированными жирными кислотами — НЭЖК. В такой форме жирные кислоты уже не проявляют своих токсических свойств. В клетках эти комплексы распадаются и жирные кислоты окисляются с освобождением большого количества энергии, в том числе в клетках сердечной мышцы, для которых они являются одним из основных источников энергии.
Рис. 56. Схема строения хиломикрона
Основная часть жира до 60% поступает в лимфатическую систему и через грудной проток лимфа, богатая мельчайшими капельками жира, попадает в общий круг кровообращения. Оставшиеся 40% жира формируют с белками липопро-теидные комплексы — хиломикроны (рис. 56). Последние, как и фосфолипиды, являются транспортной формой жира ив таком виде поступают в кровь воротной вены. В крови часть из них подвергается расщеплению липопротеин-липа-зой, которая активируется гепарином, на более мелкие ли-попротеидные комплексы. Из крови жиры в составе липо-протеидов и НЭЖК поступают в печень, где часть жира вновь распадается на составные части, из которых синтезируется специфический для организма жир, часть откладывается в виде запаса, часть поступает в жировые депо (сальник, подкожная и околопочечная клетчатка и т. д.), часть же жиров разносится кровью ко многим органам и тканям, где подвергается различным превращениям. В кровь поступает также и часть жирных кислот, освободившихся при распаде хиломикронов. Такие свободные жирные кислоты являются весьма токсичными для организма. Однако отравления ими не происходит, потому что жирные кислоты немедленно соединяются с альбуминами и такие комплексы называются неэстерифицированными жирными кислотами — НЭЖК. В такой форме жирные кислоты уже не проявляют своих токсических свойств. В клетках эти комплексы распадаются и жирные кислоты окисляются с освобождением большого количества энергии, в том числе в клетках сердечной мышцы, для которых они являются одним из основных источников энергии.
 Рис. 57. Взаимоотношения органов в обмене жира
Схематичное представление об обмене жира в организме и взаимосвязи при этом различных органов дает рис. 57.
Рис. 57. Взаимоотношения органов в обмене жира
Схематичное представление об обмене жира в организме и взаимосвязи при этом различных органов дает рис. 57.
Превращения в тканях нейтральных жиров
Поступивший в клетки нейтральный жир под действием тканевых липаз гидролизуется на глицерин и высшие жирные кислоты. Глицерин активируется в глицерофосфат и может превратиться в фосфоглицериновый альдегид, пути превращения которого аналогичны рассмотренным в обмене углеводов: распад до молочной кислоты при гликолизе, окисление до СО2 и Н2О при аэробном окислении, участие в синтезе гликогена.
Глицерин активируется в глицерофосфат и может превратиться в фосфоглицериновый альдегид, пути превращения которого аналогичны рассмотренным в обмене углеводов: распад до молочной кислоты при гликолизе, окисление до СО2 и Н2О при аэробном окислении, участие в синтезе гликогена.
Окисление жирных кислот
В основе представлений о распаде высших жирных кислот лежит предложенная Кноопом в начале нашего столетия теория β-окисления. В последующие годы она была уточнена и дополнена на основе новейших методов исследования. Сущность этой теории заключается в том, что в ходе одного цикла происходит окисление β-углеродного атома (второго от концевой карбоксильной группы кислоты), в результате чего жирная кислота укорачивается на 2 углеродных атома с образованием одной молекулы активной уксусной кислоты — ацетил-КоА. В общем виде этот процесс происходит следующим образом: β-окисление протекает в митохондриях. Этот процесс начинается с активации жирней кислоты при участии АТФ, KoA, витаминов С и В6 и катализируется ферментом тиокиназой. Приведем дальнейший ход β-окисления:
β-окисление протекает в митохондриях. Этот процесс начинается с активации жирней кислоты при участии АТФ, KoA, витаминов С и В6 и катализируется ферментом тиокиназой. Приведем дальнейший ход β-окисления:
 Таким образом, в результате одного цикла β-окисления цепь жирной кислоты укорачивается на два углеродных атома, из которых образуется одна молекула ацетил-КоА и выделяется энергия как в ходе реакции β-окисления (5 АТФ), так и при "сгорании" ацетил-КоА в цикле Кребса (12 АТФ). Оставшаяся кислота подвергается аналогичному расщеплению до образования ацетил-КоА.
Ненасыщенные жирные кислоты, как предполагают, вначале насыщаются водородом и превращаются в насыщенные, а последние уже подвергаются β-окислению (в опытах in vitro).
Процесс окисления жирных кислот протекает в основном в печени, мышцах, жировых депо, сердце и в меньшей степени в других органах. Процесс β-окисления подтверждает большое энергетическое значение жиров. Например, при полном распаде 1 молекулы 3-пальмитина образуется около 3680-4200 ккал с образованием при этом 412 молекул АТФ.
Наряду с процессами распада жиров в клетках постоянно происходит синтез специфических для каждого органа нейтральных жиров. Этот процесс называется липогенезом и включает образование глицерина, жирных кислот с последующим синтезом триглицерида.
Синтез глицерина возможен из продуктов распада углеводов и жиров.
Биосинтез жирных кислот во многом напоминает процесс х распада. И в этом случае в ходе каждого цикла происходит постепенное удлинение цепи жирной кислоты на два углеродных атома до получения специфичной для данного органа или ткани жирной кислоты с необходимым числом углеродных атомов. Однако синтез жирных кислот имеет и существенные различия. Так, он протекает в микросомах, идет с потреблением энергии за счет распада АТФ, требует для своего течения активированной углекислоты, КоА, водорода, переносчиком которого является восстановленный НАДФ-НАДФ*Н2 (последний образуется в пентозном цикле распада углеводов) и наличия "стартового" вещества малонил-КоА (малонил-КоА образуется из ацетил-КоА, активированной углекислоты и АТФ, как источника энергии).
Процесс биосинтеза жирной кислоты начинается с удлинения цепи ацетил-КоА (кислота с двумя углеродными атомами) путем взаимодействия с малонил-КоА. В ходе различных превращений молекула ацетил-КоА удлиняется на два углеродных атома и образуется кислота с четырьмя атомами углерода — бутирил-КоА. В последующем бутирил-КоА вновь взаимодействует с малонил-КоА, что приводит к удлинению цепи этой кислоты еще на два углеродных атома. И так продолжается до тех пор, пока не образуется жирная кислота с нужным числом углеродных атомов.
В результате синтетических процессов в клетке происходит образование глицерина и высших жирных кислот, которые при наличии необходимых условий (ферменты, энергия и др.) синтезируются в специфичные для данной клетки триглицериды.
Ненасыщенные жирные кислоты практически в организме синтезироваться не могут, поэтому они обязательно должны поступать с пищей.
Таким образом, в результате одного цикла β-окисления цепь жирной кислоты укорачивается на два углеродных атома, из которых образуется одна молекула ацетил-КоА и выделяется энергия как в ходе реакции β-окисления (5 АТФ), так и при "сгорании" ацетил-КоА в цикле Кребса (12 АТФ). Оставшаяся кислота подвергается аналогичному расщеплению до образования ацетил-КоА.
Ненасыщенные жирные кислоты, как предполагают, вначале насыщаются водородом и превращаются в насыщенные, а последние уже подвергаются β-окислению (в опытах in vitro).
Процесс окисления жирных кислот протекает в основном в печени, мышцах, жировых депо, сердце и в меньшей степени в других органах. Процесс β-окисления подтверждает большое энергетическое значение жиров. Например, при полном распаде 1 молекулы 3-пальмитина образуется около 3680-4200 ккал с образованием при этом 412 молекул АТФ.
Наряду с процессами распада жиров в клетках постоянно происходит синтез специфических для каждого органа нейтральных жиров. Этот процесс называется липогенезом и включает образование глицерина, жирных кислот с последующим синтезом триглицерида.
Синтез глицерина возможен из продуктов распада углеводов и жиров.
Биосинтез жирных кислот во многом напоминает процесс х распада. И в этом случае в ходе каждого цикла происходит постепенное удлинение цепи жирной кислоты на два углеродных атома до получения специфичной для данного органа или ткани жирной кислоты с необходимым числом углеродных атомов. Однако синтез жирных кислот имеет и существенные различия. Так, он протекает в микросомах, идет с потреблением энергии за счет распада АТФ, требует для своего течения активированной углекислоты, КоА, водорода, переносчиком которого является восстановленный НАДФ-НАДФ*Н2 (последний образуется в пентозном цикле распада углеводов) и наличия "стартового" вещества малонил-КоА (малонил-КоА образуется из ацетил-КоА, активированной углекислоты и АТФ, как источника энергии).
Процесс биосинтеза жирной кислоты начинается с удлинения цепи ацетил-КоА (кислота с двумя углеродными атомами) путем взаимодействия с малонил-КоА. В ходе различных превращений молекула ацетил-КоА удлиняется на два углеродных атома и образуется кислота с четырьмя атомами углерода — бутирил-КоА. В последующем бутирил-КоА вновь взаимодействует с малонил-КоА, что приводит к удлинению цепи этой кислоты еще на два углеродных атома. И так продолжается до тех пор, пока не образуется жирная кислота с нужным числом углеродных атомов.
В результате синтетических процессов в клетке происходит образование глицерина и высших жирных кислот, которые при наличии необходимых условий (ферменты, энергия и др.) синтезируются в специфичные для данной клетки триглицериды.
Ненасыщенные жирные кислоты практически в организме синтезироваться не могут, поэтому они обязательно должны поступать с пищей.
Обмен липоидов
В клетках организма под действием тканевых лецитиназ фосфолипиды гидролизуются на свои составные компоненты. Превращение глицерина и высших жирных кислот было рассмотрено выше. Фосфорная кислота используется организмом в неизмененном состоянии. Азотистые основания подвергаются различным специфическим превращениям. Так, серии, являясь заменимой аминокислотой, участвует в различных процессах белкового обмена. Особо следует остановиться на превращениях в организме холина. Он как витаминоподобное вещество незаменим для обмена веществ. С другой стороны, холин является источником для синтеза ацетилхолина — одного из медиаторов нервной системы, который обеспечивает проведение импульсов в нервно-мышечных синапсах. Холин участвует также и в синтезе фосфолипидов в тканях печени, препятствуя, таким образом, повышенному накоплению жира в печени — жировой инфильтрации. В организме постоянно осуществляется и синтез липоидов. Он представляет более сложный процесс, для течения которого необходимы глицерофосфат, активированные высшие жирные кислоты, фосфорная кислота, активированные азотистые основания и макроэргические соединения, обеспечивающие этот процесс необходимой энергией. Холестерин имеет важное значение для организма, где он находится как в свободном виде, так и в соединении с высшими жирными кислотами (эфиросвязанный холестерин). В клетках холестерин служит предшественником желчных кислот, женских половых гормонов, гормонов коры надпочечников, витамина D. В организме постоянно происходит и синтез холестерина, который достигает 0,8-1,5 г в сутки. Течение этого процесса удалось выяснить с применением метода меченых атомов. Оказалось, что синтез холестерина начинается с конденсации (последовательного соединения) трех молекул ацетил-КоА и образования промежуточного соединения — мевалоновой кислоты. В последующем происходит синтез циклического соединения — сквалена, который через ряд стадий превращается в холестерин.Регуляция жирового обмена
Процессы обмена жиров в организме регулируются нейро-гуморальным путем. Нервная система оказывает непосредственное влияние на жировую ткань, стимулируя мобилизацию (распад) жира и доставку его к органам, главным образом в печень. Одновременно центральная нервная система и ее высший отдел — кора головного мозга — осуществляют согласованность различных гормональных влияний. Так, инсулин усиливает биосинтез жирных кислот и превращение углеводов в жиры и подавляет расщепление жирных кислот. Адреналин и глюкокортикоиды активируют процессы распада жира (липолиз). Снижение выработки гормонов гипофиза и половых гормонов приводит к стимуляции процесса синтеза жира и торможению липолиза, в результате чего происходит ожирение организма. Важными регуляторными механизмами жирового обмена являются факторы внешней среды. Питание, пол, возраст, характер работы, режим дня, организация отдыха непосредственно влияют на уровень обмена жира. Избыточное, нерегулярное питание, сидячий характер работы, отсутствие физической нагрузки в период отдыха способствуют отложению жира, что может привести к нарушению обмена веществ всего организма.Патология обмена липидов и липоидов
К нарушениям жирового и липоидного обмена следует отнести: 1. Нарушение процессов переваривания и всасывания липидов, обусловленное снижением выработки липолитических ферментов в пищеварительном тракте, недостаточной секрецией желчи, что приводит к выделению нерасщепившегося жира с калом, приобретающим характерный серовато-белый цвет (ахолический стул). 2. Недостаточное поступление жира с пищей. Это нарушение служит причиной развития а- и гиповитаминозов жирорастворимых витаминов групп A, D, Е, К, для всасывания которых необходим жир. Недостаток желчи еще более усугубляет этот процесс. Не менее существенным является обеспеченность организма высшими ненасыщенными жирными кислотами, такими, как линолевая, линоленовая, арахидоновая и другие, которые не синтезируются в организме. Недостаток этих соединений приводит к развитию специфических заболеваний, которые проявляются снижением веса, потерей аппетита, развитием дерматитов и т. д. 3. Недостаток в организме липотропных веществ (холина и метионина). Последние предохраняют печень от повышенного отложения жира — жировой инфильтрации путем участия в синтезе фосфолипидов и, в частности, лецитина. 4. Кетонурия (ацетонурия) и кетонемия (ацетонемия). Эти нарушения проявляются повышенным против нормы накоплением в крови и моче кетоновых (ацетоновых) тел, к которым относятся ацетон, ацетоуксусная и β-оксимасляная кислоты. Эти вещества являются нормальными конечными продуктами распада жирных кислот.
5. Ожирение. Эта патология характеризуется повышенным отложением жира во всем организме, связанным с нарушением обмена веществ. Проблема ожирения имеет важное значение, так как люди с избыточным весом живут в среднем на 7 лет меньше, чем люди, имеющие нормальный для своего возраста и рода деятельности вес. С другой стороны, люди с ожирением примерно в 3-4 раза чаще умирают от болезней сердечно-сосудистой системы, сахарного диабета и др. Следовательно, вопрос ожирения это и вопрос долголетия. В основе ожирения лежит несколько причин. Во-первых, энергетический дисбаланс, возникающий тогда, когда количество энергии, поступающей в организм в виде пищи, много больше того, которое человек расходует; во-вторых, нарушения липидного обмена, развивающиеся в тех случаях, когда процессы синтеза жиров превышают процессы его распада (липолиза). Сюда относятся гормональные нарушения. Ожирение — это сложный процесс, патогенез которого до конца не выяснен и связан, по-видимому, с наличием сопряженных процессов превращения белков, жиров и углеводов и деятельностью гормонов. В качестве средств лечения ожирения Институтом питания АМН СССР разработана определенная методика, которая включает редуцированную диету и дозированную физическую нагрузку. Основой такой диеты является сниженная калорийность до 1750-1800 ккал/сутки вместо 2500- 2700 ккал, рекомендуемых для здоровых людей. Снижение калорийности достигается в основном за счет уменьшения количества углеводов (120 г в сутки вместо 450 г в норме). Количество белков, витаминов и минеральных солей остается нормальным. Как диету, так и степень физической нагрузки следует назначать после тщательного исследования больного врачом, который осуществляет постоянный контроль за состоянием больного в течение всего периода лечения.
6. Нарушения холестеринового обмена. Эти нарушения представляют значительный интерес в связи с некоторыми заболеваниями, возникающими на этой почве. Хроническая гиперхолестеринемия, вызванная у кроликов введением извне значительных количеств холестерина, приводит к перерождению стенок артерий, весьма напоминающему атеросклероз у человека (Н. Н. Аничков с сотр.). Эти наблюдения позволили связать вопрос об этиологии атеросклероза у человека с нарушением холестеринового обмена. Этиология и патогенез атеросклероза в настоящее время полностью не выяснены. Атеросклероз следует считать болезнью не только артерий, но прежде всего болезнью обмена веществ и нервного аппарата, регулирующего кровообращение и питание сосудистых стенок. При атеросклерозе в крови повышен уровень холестерина (до 500 мг% вместо обычных 150-250 мг%) и β-липопротеидов, которые являются его транспортной формой. Причиной гиперхолестеринемии является нарушение равновесия между количеством распавшегося и синтезированного холестерина в организме. С пищей поступает только 0,2-0,5 г холестерина в сутки, и это количество практически не может значительно повлиять на его уровень в организме. Следовательно, важное значение, вероятно, имеет эндогенный холестерин, образующийся в сутки в количестве 0,8-1,5 г. Увеличение последнего происходит при избыточном потреблении жиров и углеводов и нарушении процессов использования ацетил-КоА в организме. Лечение должно быть направлено на нормализацию энергетического обмена и торможение эндогенного синтеза холестерина в организме.
Эти вещества являются нормальными конечными продуктами распада жирных кислот.
5. Ожирение. Эта патология характеризуется повышенным отложением жира во всем организме, связанным с нарушением обмена веществ. Проблема ожирения имеет важное значение, так как люди с избыточным весом живут в среднем на 7 лет меньше, чем люди, имеющие нормальный для своего возраста и рода деятельности вес. С другой стороны, люди с ожирением примерно в 3-4 раза чаще умирают от болезней сердечно-сосудистой системы, сахарного диабета и др. Следовательно, вопрос ожирения это и вопрос долголетия. В основе ожирения лежит несколько причин. Во-первых, энергетический дисбаланс, возникающий тогда, когда количество энергии, поступающей в организм в виде пищи, много больше того, которое человек расходует; во-вторых, нарушения липидного обмена, развивающиеся в тех случаях, когда процессы синтеза жиров превышают процессы его распада (липолиза). Сюда относятся гормональные нарушения. Ожирение — это сложный процесс, патогенез которого до конца не выяснен и связан, по-видимому, с наличием сопряженных процессов превращения белков, жиров и углеводов и деятельностью гормонов. В качестве средств лечения ожирения Институтом питания АМН СССР разработана определенная методика, которая включает редуцированную диету и дозированную физическую нагрузку. Основой такой диеты является сниженная калорийность до 1750-1800 ккал/сутки вместо 2500- 2700 ккал, рекомендуемых для здоровых людей. Снижение калорийности достигается в основном за счет уменьшения количества углеводов (120 г в сутки вместо 450 г в норме). Количество белков, витаминов и минеральных солей остается нормальным. Как диету, так и степень физической нагрузки следует назначать после тщательного исследования больного врачом, который осуществляет постоянный контроль за состоянием больного в течение всего периода лечения.
6. Нарушения холестеринового обмена. Эти нарушения представляют значительный интерес в связи с некоторыми заболеваниями, возникающими на этой почве. Хроническая гиперхолестеринемия, вызванная у кроликов введением извне значительных количеств холестерина, приводит к перерождению стенок артерий, весьма напоминающему атеросклероз у человека (Н. Н. Аничков с сотр.). Эти наблюдения позволили связать вопрос об этиологии атеросклероза у человека с нарушением холестеринового обмена. Этиология и патогенез атеросклероза в настоящее время полностью не выяснены. Атеросклероз следует считать болезнью не только артерий, но прежде всего болезнью обмена веществ и нервного аппарата, регулирующего кровообращение и питание сосудистых стенок. При атеросклерозе в крови повышен уровень холестерина (до 500 мг% вместо обычных 150-250 мг%) и β-липопротеидов, которые являются его транспортной формой. Причиной гиперхолестеринемии является нарушение равновесия между количеством распавшегося и синтезированного холестерина в организме. С пищей поступает только 0,2-0,5 г холестерина в сутки, и это количество практически не может значительно повлиять на его уровень в организме. Следовательно, важное значение, вероятно, имеет эндогенный холестерин, образующийся в сутки в количестве 0,8-1,5 г. Увеличение последнего происходит при избыточном потреблении жиров и углеводов и нарушении процессов использования ацетил-КоА в организме. Лечение должно быть направлено на нормализацию энергетического обмена и торможение эндогенного синтеза холестерина в организме.
Исследование липидов и липоидов в клинике
Участие липидов в различных процессах обмена веществ в организме и изменение их количества при различных патологических состояниях определили возможность их исследования в крови с целью диагностики заболеваний. В клинике проводится определение общих жиров и жировых фракций, свободных жирных кислот, фосфатидов и холестерина. В норме количество общего жира в плазме крови составляет 559 мг%, из них нейтрального жира — 142,0 мг%. Эти количества через 1-4 часа после приема пищи могут увеличиваться соответственно до 780 и 200 мг%. Такое физиологическое состояние называется алиментарной (пищевой) гиперлипемией. Патологическая гиперлипемия обнаруживается при сахарном диабете, панкреатитах (воспаление поджелудочной железы), острых гепатитах (воспаление печени), лихорадочных состояниях и т. д. α- и β-липопротеиды, которые являются транспортной формой жиров, в плазме крови в норме содержатся в количестве соответственно 260 и 100 мг%. Увеличение β-липопротеидов обнаружено при атеросклерозе, а снижение α-липопротеидов — при циррозе печени. Общее содержание в плазме крови свободных жирных кислот у здорового человека составляет 294-341 мг%. При диабете, нефрозах (заболевания почек) их уровень может значительно повышаться. Увеличение концентрации фосфолипидов, которых в норме в плазме крови содержится 221 мг%, отмечается при диабете, нефрозах, желтухах (заболевания желчного пузыря). При пониженной функции щитовидной железы количество фосфолипидов снижено. Концентрация холестерина при атеросклерозе, диабете, микседеме (см. Гормоны) повышается, а при острых инфекционных заболеваниях, легочном туберкулезе, острых заболеваниях печени и поджелудочной железы — снижается.Вопросы для повторения
1. Какие условия необходимы для переваривания жира? 2. В каком отделе пищеварительного тракта происходит в основном распад жиров и почему? 3. Что такое парные желчные кислоты? Напишите формулу гликохолевой кислоты. 4. Какое участие принимают парные желчные кислоты в процессах всасывания жирных кислот? 5. Как происходит всасывание жиров? 6. Какие условия необходимы для переваривания и всасывания липоидов? 7. Какова судьба всосавшегося жира? 8. Напишите схему β-окисления жирных кислот. 9. Каково биологическое значение распада жиров в тканях? 10. Как происходит биосинтез жиров? 11. Какое значение имеет в организме холестерин? 12. Как осуществляется процесс регуляции обмена жира? 13. Укажите основные нарушения обмена липидов и липоидов. 14. Что относится к ацетоновым телам и когда их уровень в организме повышается? 15. Что лежит в основе ожирения? 16. Каковы основные принципы лечения ожирения? 17. Как проявляются нарушения холестеринового обмена? 18. Какое значение имеет исследование липидного обмена в клинике?X. Обмен простых белков
Значение белков в питании
В процессах жизнедеятельности организма белкам принадлежит главная роль. Однако синтез белка из неорганических веществ возможен только в растительных тканях. В животном же организме белок синтезируется из аминокислот, часть из которых образуется в самом организме, тогда как другие должны поступать с пищей. Таким образом, состояние белкового обмена в значительной степени определяется содержанием белка в продуктах питания. Ниже приводится содержание белка в некоторых пищевых продуктах. Как видно из приведенных данных, содержание белка в продуктах животного происхождения (мясо, рыба, сыр) выше, чем в растительных продуктах (хлеб, крупы, овощи). Между растительными и животными продуктами существуют и качественные различия. Именно животные продукты содержат аминокислоты, которые не синтезируются в организме.
Белки в организме выполняют разнообразные функции (см. Химия белков), основной из которых является пластическая. В течение всей жизни в организме происходит одновременно разрушение и восстановление клеток органов и тканей. Это — противоположные процессы, единство которых и составляет сущность жизни. В связи с этим в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главное место при этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в воспроизводстве основных структурных элементов органов и тканей, а также в образовании ряда важнейших веществ, например ферментов и гормонов.
Как видно из приведенных данных, содержание белка в продуктах животного происхождения (мясо, рыба, сыр) выше, чем в растительных продуктах (хлеб, крупы, овощи). Между растительными и животными продуктами существуют и качественные различия. Именно животные продукты содержат аминокислоты, которые не синтезируются в организме.
Белки в организме выполняют разнообразные функции (см. Химия белков), основной из которых является пластическая. В течение всей жизни в организме происходит одновременно разрушение и восстановление клеток органов и тканей. Это — противоположные процессы, единство которых и составляет сущность жизни. В связи с этим в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главное место при этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в воспроизводстве основных структурных элементов органов и тканей, а также в образовании ряда важнейших веществ, например ферментов и гормонов.
Норма белка в питании
Для нормальной жизнедеятельности организма необходимо поступление такого количества белка, которое полностью будет покрывать все его потребности. Эта величина не является постоянной и зависит от многих факторов, таких, как пол, возраст, род трудовой деятельности и других физиологических условий. Институтом питания АМН СССР в 1971 г. опубликованы нормы белкового питания (табл. 6). Таблица 6. Потребность в белках
Таблица 6. Потребность в белках
Азотистый баланс
Так как белки представляют собой азотсодержащие вещества, одним из методов, характеризующих состояние белкового обмена в организме и биологическую ценность продуктов питания, является определение баланса азота. Баланс азота — это разница между количеством азота, поступившего в организм, и азота, выведенного из него. Обычно у здорового человека при нормальном белковом питании имеется состояние белкового равновесия, когда поступление азота полностью покрывает его расход. При отрицательном балансе азота выводится больше, чем поступает. Такое состояние может наблюдаться при белковом голодании, нарушениях деятельности пищеварительного аппарата, рвоте и т. д. Положительный азотистый баланс наблюдается в тех случаях, когда азота вводится больше, чем выводится. Это бывает при беременности, у растущего организма, при бурном росте опухоли и других состояниях, когда в организме повышены процессы биосинтеза белка.Биологическая ценность белка
Азотистый баланс только частично может характеризовать биологическую ценность пищи и обеспеченность организма белками. Как известно, для синтеза белков организма необходимы различные аминокислоты. Ряд из них может синтезироваться в организме. Такие аминокислоты называются заменимыми. Те же, которые не синтезируются и должны поступать с пищей, называются незаменимыми. К заменимым аминокислотам относятся глицин, аланин, серии, глютаминовая кислота, аспарагиновая кислота, тирозин, аргинин, пролин и гистидин[5]. Незаменимыми аминокислотами являются треонин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и лизин. Только те белки пищи, которые имеют в своем составе все незаменимые аминокислоты, считаются полноценными. В случае отсутствия одной или нескольких незаменимых ами- .. нокислот белки являются неполноценными. Однако такое определение полноценных и неполноценных белков в настоящее время недостаточно. Это связано с тем, что использование организмом аминокислот пищи зависит еще и от соотношений последних между собой. Потребности организма будут полностью обеспечены только в том случае, если соотношение незаменимых аминокислот в пище будет примерно таким же, как и в самом организме. Таким образом, полноценными белками можно считать только такие, которые имеют в своем составе набор всех незаменимых аминокислот в соотношениях, приближающихся к таковым в организме. На этом основании А. А. Покровским рассчитана суточная потребность человека в незаменимых аминокислотах. Потребность взрослого человека в триптофане составляет 1,0 г, в треонине — 2-3 г, в лизине — 3,5 г, в метионине — 2,4 г, в фенилаланине — 2-4 г, в валине — 4,0 г, в лейцине — 4,6 г, в изолейцине — 3-4 г. Среди белков пищевых продуктов, однако, практически нет ни одного, который бы отвечал таким требованиям. С некоторым приближением к полноценным белкам можно отнести белки материнского молока, куриного яйца, икры рыб, мозга животных. Поэтому для полного обеспечения здорового организма полноценными белками в суточный рацион человека должны входить белки различных пищевых продуктов. При различных патологических состояниях потребность в белках может меняться. Так, например, при заболеваниях желудочно-кишечного тракта могут нарушаться процессы переваривания и всасывания белков, что влечет за собой изменение и белкового состава рациона. При других заболеваниях может снижаться уровень заменимых аминокислот. В этих случаях они становятся незаменимыми и должны поступать с пищей.Белковые резервы организма
Было установлено, что чем больше с пищей поступает белка, тем больше выделяется из организма конечных продуктов белкового обмена, так как белки не откладываются про запас в отличие от углеводов и жиров. Однако при голодании или длительной белковой недостаточности в течение определенного времени в организме поддерживается состояние белкового равновесия. Изучение этого вопроса позволило Б. И. Словцову впервые высказать мнение о том, что в организме существуют какие-то белковые резервы, которые используются в первую очередь при белковом голодании. Это послужило основанием для детального изучения наличия таких запасов в организме и путей их расходования. При этом было установлено, что при недостаточном поступлении белка с пищей относительно уменьшается вес ряда органов и в первую очередь печени и мышц. При определении количества белка установлено, что наиболее снижено содержание белков плазмы, особенно альбуминов, печени и мышц, в меньшей степени белков сердца и головного мозга. Потеря 1 г белков плазмы сопровождается потерей 30 г белков организма. По данным Аллисон, при голодании количество белка в печени может снизиться до 53%, а в сердце — до 48% по сравнению с нормальным уровнем. Это позволяет говорить о наличии в организме определенных белковых резервов, которые используются при неблагоприятных условиях для поддержания деятельности жизненно важных процессов. При полноценном питании происходит восстановление уровня белка в организме до нормы.Переваривание белков в пищеварительном тракте
В полости рта отсутствуют протеолитические ферменты, и поэтому белки здесь не расщепляются. Основная масса белков распадается в желудке под действием желудочного сока, которого в сутки выделяется около 2,5 л. В его составе содержится соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка и способствует набуханию белков (денатурации), облегчая тем самым гидролитическое расщепление их ферментами. Рис. 58. Структура пепсиногена. 1 — место отщепления полипептида от молекулы пепсиногена; 2 — активный пепсин
Основным протеолитическим ферментом желудочного сока является пепсин, который образуется из профермента (неактивного фермента) пепсиногена, секретируемого главными клетками слизистой оболочки желудка. Превращение пепсиногена в пепсин может происходить двумя путями: под влиянием соляной кислоты или путем аутоак-тивации. Механизм их действия одинаков. Как соляная кислота, так и имеющийся в желудочном соке пепсин отщепляют от пепсиногена полипептид с молекулярным весом 7000. При этом происходит определенная внутримолекулярная перестройка молекулы, в результате чего образуется активный пепсин, схема которого показана на рис. 58. За сутки в желудке вырабатывается около 2 г пепсина. Каталитическая активность пепсина при рН среды желудка очень высока. Пепсин катализирует расщепление пептидных связей в молекуле белка, который распадается на отдельные аминокислоты и гюлипептиды различной величины. По последним научным данным, пепсин катализирует разрыв пептидных связей, образованных, главным образом, ароматическими и дикарбоновыми аминокислотами.
Помимо пепсина, в желудке присутствует другой протеолитический фермент гастриксин, оптимум действия которого лежит в пределах рН 2,5-3,5.
В желудке хорошо перевариваются альбумины и глобулины животного и растительного происхождения, плохо расщепляются белки соединительной ткани (коллаген и эластин) и совершенно не расщепляются кератин и протамины.
Образовавшиеся в желудке полипептиды и нерасщдпленные белки поступают в двенадцатиперстную кишку и тонкий кишечник. Здесь они подвергаются воздействию большой группы протеолитических ферментов, вырабатываемых поджелудочной железой и слизистой оболочкой гонкого кишечника.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и тонкий кишечник, где смешивается с кишечным соком. Эта смесь соков содержит протеолитические ферменты, обеспечивающие расщепление белка до аминокислот. К ним относятся трипсин, химотрипсин, карбоксипептидаза, лейцинаминопептидаза и большая группа три- и дипептидаз.
Трипсин и химотрипсин вырабатываются в недеятельном состоянии в виде проферментов — трипсиногена и химотрипсиногена. Процесс их активации заключается в следующем. Трипсиноген под действием фермента энтеро-киназы превращается в трипсин. Г. К. Шлыгин установил, что энтерокиназа сама вырабатывается в недеятельном состоянии в виде кинозогена и активируется ранее образованным трипсином. Трипсиноген, так же как и пепсиноген, может активироваться уже имеющимся трипсином (процесс аутоактивации). Химотрипсиноген под действием трипсина превращается в активный фермент — химотрипсин. Оптимум действия этих ферментов лежит в слабощелочной среде (рН 7,8-8,1). Трипсин расщепляет полипептиды и белки, главным образом пептидные связи между ароматическими аминокислотами и диаминокислотами — аргинином и лизином. Химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты, а также на те пептидные связи, на которые трипсин не влияет.
Рис. 58. Структура пепсиногена. 1 — место отщепления полипептида от молекулы пепсиногена; 2 — активный пепсин
Основным протеолитическим ферментом желудочного сока является пепсин, который образуется из профермента (неактивного фермента) пепсиногена, секретируемого главными клетками слизистой оболочки желудка. Превращение пепсиногена в пепсин может происходить двумя путями: под влиянием соляной кислоты или путем аутоак-тивации. Механизм их действия одинаков. Как соляная кислота, так и имеющийся в желудочном соке пепсин отщепляют от пепсиногена полипептид с молекулярным весом 7000. При этом происходит определенная внутримолекулярная перестройка молекулы, в результате чего образуется активный пепсин, схема которого показана на рис. 58. За сутки в желудке вырабатывается около 2 г пепсина. Каталитическая активность пепсина при рН среды желудка очень высока. Пепсин катализирует расщепление пептидных связей в молекуле белка, который распадается на отдельные аминокислоты и гюлипептиды различной величины. По последним научным данным, пепсин катализирует разрыв пептидных связей, образованных, главным образом, ароматическими и дикарбоновыми аминокислотами.
Помимо пепсина, в желудке присутствует другой протеолитический фермент гастриксин, оптимум действия которого лежит в пределах рН 2,5-3,5.
В желудке хорошо перевариваются альбумины и глобулины животного и растительного происхождения, плохо расщепляются белки соединительной ткани (коллаген и эластин) и совершенно не расщепляются кератин и протамины.
Образовавшиеся в желудке полипептиды и нерасщдпленные белки поступают в двенадцатиперстную кишку и тонкий кишечник. Здесь они подвергаются воздействию большой группы протеолитических ферментов, вырабатываемых поджелудочной железой и слизистой оболочкой гонкого кишечника.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и тонкий кишечник, где смешивается с кишечным соком. Эта смесь соков содержит протеолитические ферменты, обеспечивающие расщепление белка до аминокислот. К ним относятся трипсин, химотрипсин, карбоксипептидаза, лейцинаминопептидаза и большая группа три- и дипептидаз.
Трипсин и химотрипсин вырабатываются в недеятельном состоянии в виде проферментов — трипсиногена и химотрипсиногена. Процесс их активации заключается в следующем. Трипсиноген под действием фермента энтеро-киназы превращается в трипсин. Г. К. Шлыгин установил, что энтерокиназа сама вырабатывается в недеятельном состоянии в виде кинозогена и активируется ранее образованным трипсином. Трипсиноген, так же как и пепсиноген, может активироваться уже имеющимся трипсином (процесс аутоактивации). Химотрипсиноген под действием трипсина превращается в активный фермент — химотрипсин. Оптимум действия этих ферментов лежит в слабощелочной среде (рН 7,8-8,1). Трипсин расщепляет полипептиды и белки, главным образом пептидные связи между ароматическими аминокислотами и диаминокислотами — аргинином и лизином. Химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты, а также на те пептидные связи, на которые трипсин не влияет.
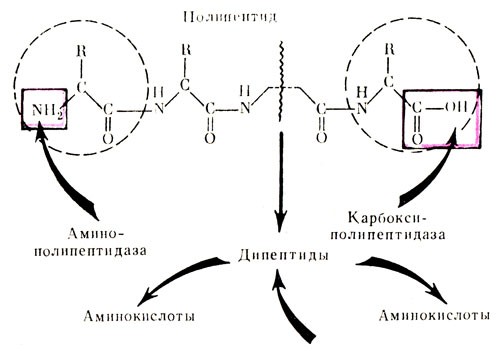 Механизм действия амино- и карбоксиполипептидаз заключается в отщеплении от полипептидов концевых аминокислот, которые имеют соответственно свободную аминную или карбоксильную группу. Оставшиеся нерасщепленными небольшие пептиды, состоящие из 3-4 аминокислотных остатков, подвергаются гидролизу специфическими ди- и трипептидазами. Таким образом, в результате пищеварения в желудке и кишечнике белки в основном расщепляются до аминокислот и небольшого количества пептидов.
Механизм действия амино- и карбоксиполипептидаз заключается в отщеплении от полипептидов концевых аминокислот, которые имеют соответственно свободную аминную или карбоксильную группу. Оставшиеся нерасщепленными небольшие пептиды, состоящие из 3-4 аминокислотных остатков, подвергаются гидролизу специфическими ди- и трипептидазами. Таким образом, в результате пищеварения в желудке и кишечнике белки в основном расщепляются до аминокислот и небольшого количества пептидов.
Гниение белков в кишечнике под влиянием бактерий
Некоторое количество не всосавшихся в тонком кишечнике аминокислот белков ? поступают в толстый кишечник, где подвергаются воздействию микроорганизмов — гниению, при котором образуются различные вещества, в том числе ядовитые. К последним относятся путресцин и кадаверин, которые образуются при декарбоксилировании орнитина и лизина. Из тирозинаобразуются фенол и крезол, а из триптофана — скатол и индол. Продукты гниения белков всасываются в кровь воротной вены, откуда попадают в печень, где обезвреживаются, вступая в соединение с активными формами серной или глюкуроновой кислот по следующей схеме:
Продукты гниения белков всасываются в кровь воротной вены, откуда попадают в печень, где обезвреживаются, вступая в соединение с активными формами серной или глюкуроновой кислот по следующей схеме:
 Калиевая соль индоксилсерной кислоты называется животным индиканом и выделяется в значительных количествах при атонии кишечника, хронических запорах, заворотах, т. е. при длительной задержке продуктов переваривания пищи в кишечнике.
Некоторые ядовитые вещества, например бензойная кислота, обезвреживаются в печени путем образования с аминокислотой глицином гиппуровой кислоты, безвредного соединения, которое выделяется с мочой.
Калиевая соль индоксилсерной кислоты называется животным индиканом и выделяется в значительных количествах при атонии кишечника, хронических запорах, заворотах, т. е. при длительной задержке продуктов переваривания пищи в кишечнике.
Некоторые ядовитые вещества, например бензойная кислота, обезвреживаются в печени путем образования с аминокислотой глицином гиппуровой кислоты, безвредного соединения, которое выделяется с мочой.
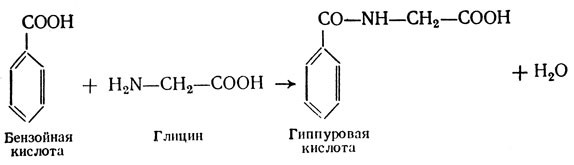 Эта реакция служит в клинике для определения антитоксической функции печени. Чем больше выделяется гиппуровой кислоты, тем выше антитоксическая функция печени.
Эта реакция служит в клинике для определения антитоксической функции печени. Чем больше выделяется гиппуровой кислоты, тем выше антитоксическая функция печени.
Судьба аминокислот после всасывания их в кишечнике
Всосавшиеся аминокислоты в кишечнике в основном поступают в кровь воротной вены. Только около 5% попадает в лимфу. По воротной вене они доставляются в печень, где часть их идет на биосинтез различных специфических для организма белков — альбуминов, глобулинов, ферментов, фибриногена крови и др. Другая часть аминокислот током крови разносится по всем органам и тканям, где они используются для биосинтеза белков или подвергаются различным превращениям. У человека в норме концентрация аминокислот в крови поддерживается на постоянном уровне и составляет в среднем 6-8 мг% из расчета на аминный азот. Основная часть белка содержится в сыворотке крови. В тканях (мышцы, печень, мозг, почки и т. д.) содержание аминокислот выше, чем в крови, и составляет 40-100 мг% аминного азота. Использование аминокислот клетками органов и тканей является активным процессом, в котором принимают участие АТФ.Промежуточный обмен аминокислот
Одним из основных путей превращения аминокислот в организме является биосинтез белка.Биосинтез белка
Изучению вопросов биосинтеза белка в организме уделяется самое большое внимание, так как это имеет важнейшее научное и клиническое значение. Пока точно не известно, как протекает этот процесс, но успехи биохимии последних двух десятилетий позволяют наметить основные этапы синтеза белка в организме. Как известно, отличие одного индивидуального белка от другого определяется прежде всего природой и последовательностью чередования аминокислот, входящих в его состав. Передача этих сведений и составляет одну из основных черт биосинтеза белка. Как было установлено, носителем информации наследственности является молекула ДНК, на которой закодированы генетические особенности организма. Они обусловлены определенной последовательностью азотистых оснований, входящих в структуру ДНК. В состав ДНК входят аденин, гуанин, тимин и цитизин, а в РНК вместо тимина представлен урацил. В ДНК и РНК каждые три последовательно соединенных азотистых основания носят название "трипилет". ДНК в основном расположена в ядре клетки, а синтез белка происходит в цитоплазме, на особых клеточных микроструктурах — рибосомах. Передача наследственных особенностей организма, закодированных на ДНК, осуществляется через информациоиную РНК (и-РНК), которая синтезируется по подобию ДНК. В основе передачи информации лежит принцип комплементарности (дополнения), т. е. каждому из 4 оснований в РНК и ДНК соответствует дополнительное, комплементарное основание, что можно записать так: Синтез и-РНК заключается в том, что молекула ДНК, как имеющая двойную спираль, в определенные моменты раскручивается и на каждой из раскрученных нитей ДНК строится молекула и-РНК по принципу комплементарное™ (рис. 59). Следовательно, каждому азотистому основанию ДНК соответствует комплементарное азотистое основание и-РНК. В результате этого молекула информационной РНК в точности повторяет последовательность азотистых оснований ДНК и, следовательно, генетическую информацию. Молекула и-РНК является матрицей, на которой строится белок, соответствующий данному организму.
Синтез и-РНК заключается в том, что молекула ДНК, как имеющая двойную спираль, в определенные моменты раскручивается и на каждой из раскрученных нитей ДНК строится молекула и-РНК по принципу комплементарное™ (рис. 59). Следовательно, каждому азотистому основанию ДНК соответствует комплементарное азотистое основание и-РНК. В результате этого молекула информационной РНК в точности повторяет последовательность азотистых оснований ДНК и, следовательно, генетическую информацию. Молекула и-РНК является матрицей, на которой строится белок, соответствующий данному организму.
 Рис. 59. Образование информационной РНК
Основная функция аминокислот — это участие в биосинтезе белка. Начинается этот процесс с активации аминокислот (при участии АТФ с образованием комплексов — аминоациладенилатов. Для каждой аминокислоты имеется своя определенная транспортная РНК (т-РНК), к которой и присоединяется вполне определенная аминокислота в виде аминоациладенилата. Этот комплекс переносится к рибосомам. Особенностью т-РНК является наличие у нее определенного триплета (антикодона), комплементарного кодону и-РНК.
Рис. 59. Образование информационной РНК
Основная функция аминокислот — это участие в биосинтезе белка. Начинается этот процесс с активации аминокислот (при участии АТФ с образованием комплексов — аминоациладенилатов. Для каждой аминокислоты имеется своя определенная транспортная РНК (т-РНК), к которой и присоединяется вполне определенная аминокислота в виде аминоациладенилата. Этот комплекс переносится к рибосомам. Особенностью т-РНК является наличие у нее определенного триплета (антикодона), комплементарного кодону и-РНК.
 Биосинтез белка заключается на последнем этапе в том, что т-РНК определенной аминокислоты своим антикодом присоединяется к кодону и-РНК. К следующему кодону и-РНК присоединяется антикодон другой т-РНК с новой аминокислотой. Две последовательно расположенные аминокислоты соединяются между собой при помощи пептидной связи. Общая схема биосинтеза белка показана на рис. 60.
Биосинтез белка заключается на последнем этапе в том, что т-РНК определенной аминокислоты своим антикодом присоединяется к кодону и-РНК. К следующему кодону и-РНК присоединяется антикодон другой т-РНК с новой аминокислотой. Две последовательно расположенные аминокислоты соединяются между собой при помощи пептидной связи. Общая схема биосинтеза белка показана на рис. 60.
 Рис. 60. Схема биосинтеза белка в рибосоме (по А. С Спирину)
Таким путём происходит образование первичной структуры белка. В дальнейшем полипептидная цепь отсоединяется от РНК, закручивается в спираль и, наконец, приобретает специфическое пространственное расположение — третичную структуру.
Процесс биосинтеза белка находится под контролем как механизмов внутри клетки, так и вне ее.
Рис. 60. Схема биосинтеза белка в рибосоме (по А. С Спирину)
Таким путём происходит образование первичной структуры белка. В дальнейшем полипептидная цепь отсоединяется от РНК, закручивается в спираль и, наконец, приобретает специфическое пространственное расположение — третичную структуру.
Процесс биосинтеза белка находится под контролем как механизмов внутри клетки, так и вне ее.
Другие пути превращения аминокислот
Дезаминирование
Этот процесс заключается в расщеплении аминокислот под действием ферментов дезаминаз или оксидаз на аммиак и безазотистый остаток. Дезаминирование может происходить несколькими путями, которые представлены в виде схем: Как установлено, у животных и человека преобладает внутримолекулярное и окислительное дезаминирование. Последний процесс происходит в два этапа через стадию образования иминокислоты:
Как установлено, у животных и человека преобладает внутримолекулярное и окислительное дезаминирование. Последний процесс происходит в два этапа через стадию образования иминокислоты:
 В организме человека наиболее активно протекает дезаминирование глютаминовой кислоты под действием фермента глютаматдегидрогеназы, обнаруженного в митохондриях всех тканей. При этом образуется α-кетоглютаровая кислота, которая принимает участие во многих процессах обмена веществ.
Ферменты, катализирующие процессы дезаминирования, могут катализировать и обратные процессы — аминирования. Синтез аминокислот из кетокислот и аммиака получил название прямого, или восстановительного, аминирования.
Активен процесс аминирования глютаминовой и аспарагиновой аминокислот, когда аммиак присоединяется по месту гидроксила карбоксильной группы с образованием их амидов — глютамина и аспарагина:
В организме человека наиболее активно протекает дезаминирование глютаминовой кислоты под действием фермента глютаматдегидрогеназы, обнаруженного в митохондриях всех тканей. При этом образуется α-кетоглютаровая кислота, которая принимает участие во многих процессах обмена веществ.
Ферменты, катализирующие процессы дезаминирования, могут катализировать и обратные процессы — аминирования. Синтез аминокислот из кетокислот и аммиака получил название прямого, или восстановительного, аминирования.
Активен процесс аминирования глютаминовой и аспарагиновой аминокислот, когда аммиак присоединяется по месту гидроксила карбоксильной группы с образованием их амидов — глютамина и аспарагина:

Переаминирование
В 1937 г. отечественными учеными акад. А. Е. Браунштейном и М. Г. Крицман впервые был установлен замечательный факт возможности непосредственного переноса аминной группы от аминокислоты на кетокислоту без освобождения при этом аммиака. Этот процесс протекает по следующей схеме: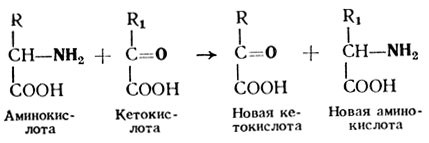 При изучении этого процесса были открыты ферменты, которые катализируют эти превращения. Они относятся к аминотрансферазам. Это сложные ферменты, простетической группой которых является фосфопиридоксаль — фосфорный эфир витамина В6.
При изучении этого процесса были открыты ферменты, которые катализируют эти превращения. Они относятся к аминотрансферазам. Это сложные ферменты, простетической группой которых является фосфопиридоксаль — фосфорный эфир витамина В6.
 А. Е. Браунштейн
Процесс переаминирования является сложным процессом и протекает в 2 этапа. На первом этапе происходит перенос NH2-группы с аминокислоты на кофермент аминотрансферазы (фосфопиридоксаль). При этом аминокислота превращается в соответствующую кетокислоту. На втором этапе аминогруппа с кофермента передается на кетокислоту, которая превращается в аминокислоту.
А. Е. Браунштейн
Процесс переаминирования является сложным процессом и протекает в 2 этапа. На первом этапе происходит перенос NH2-группы с аминокислоты на кофермент аминотрансферазы (фосфопиридоксаль). При этом аминокислота превращается в соответствующую кетокислоту. На втором этапе аминогруппа с кофермента передается на кетокислоту, которая превращается в аминокислоту.
 (1)
(1)
 (2)
Процесс переаминирования широко распространен в живой природе. Он имеет первостепенное значение в обмене аминокислот. В процессе переаминирования обязательно участвует одна из двух дикарбоновых аминокислот — глютаминовая или аспарагиновая, которые в виде соответствующих им кетокислот — α-кетоглютаровой и щавелевоуксусной — могут взаимодействовать с большинством аминокислот, за исключением лизина, треонина и аргинина. Особенностью этого процесса является его легкая обратимость.
В обмене веществ реакции переаминирования имеют важное значение, так как от них зависят такие процессы, как:
1. биосинтез многих заменимых аминокислот из соответствующих им кетокислот;
2. распад аминокислот;
3. объединение путей углеводного и аминокислотного обменов, когда из продуктов распада глюкозы, например пировиноградной кислоты, может образоваться аминокислота аланин, и наоборот.
Определение некоторых аминотрансфераз имеет важное значение в клинике. Это относится к определению в сыворотке крови глютамат-щавелевоуксусной и глютамат-пировиноградной аминотрансфераз (ГЩУТ и ГПТ). Первый из этих ферментов обеспечивает синтез аспарагиновой кислоты из щавелевоуксусной за счет NH2-группы глютаминовой кислоты, а второй — катализирует образование аланина из пировиноградной кислоты.
На основании различного распределения трансаминаз в сердце и печени установлено, что при инфаркте миокарда в сыворотке преимущественно повышается активность ГЩУТ, а при заболеваниях печени — ГПТ.
(2)
Процесс переаминирования широко распространен в живой природе. Он имеет первостепенное значение в обмене аминокислот. В процессе переаминирования обязательно участвует одна из двух дикарбоновых аминокислот — глютаминовая или аспарагиновая, которые в виде соответствующих им кетокислот — α-кетоглютаровой и щавелевоуксусной — могут взаимодействовать с большинством аминокислот, за исключением лизина, треонина и аргинина. Особенностью этого процесса является его легкая обратимость.
В обмене веществ реакции переаминирования имеют важное значение, так как от них зависят такие процессы, как:
1. биосинтез многих заменимых аминокислот из соответствующих им кетокислот;
2. распад аминокислот;
3. объединение путей углеводного и аминокислотного обменов, когда из продуктов распада глюкозы, например пировиноградной кислоты, может образоваться аминокислота аланин, и наоборот.
Определение некоторых аминотрансфераз имеет важное значение в клинике. Это относится к определению в сыворотке крови глютамат-щавелевоуксусной и глютамат-пировиноградной аминотрансфераз (ГЩУТ и ГПТ). Первый из этих ферментов обеспечивает синтез аспарагиновой кислоты из щавелевоуксусной за счет NH2-группы глютаминовой кислоты, а второй — катализирует образование аланина из пировиноградной кислоты.
На основании различного распределения трансаминаз в сердце и печени установлено, что при инфаркте миокарда в сыворотке преимущественно повышается активность ГЩУТ, а при заболеваниях печени — ГПТ.
Декарбоксилирование
Декарбоксилирование аминокислот заключается в отщеплении от аминокислот СО2 с образованием при этом аминов^ и катализируется ферментами декарбоксилазами. Процесс происходит по следующей схеме: Таким путем из триптофана образуется гриптамин и серотонин (5-оксигриптамин), из гистидина — гистамин, из глютаминовой кислоты — γ-аминомасляная кислота. Образующиеся при этом амины оказывают на организм мощный биологический эффект, в связи с чем их называют биогенными аминами.
Так, введение гистамина вызывает:
1. расширение капилляров и соответственно повышение их проницаемости;
2. сужение крупных сосудов;
3. сокращение гладкой мускулатуры различных органов и тканей;
4. возбуждение секреции соляной кислоты в желудке.
Серотонин способствует повышению кровяного, давления и сужению бронхов. Противоречиво действие серотонина на центральную нервную систему, когда малые количества подавляют, а более значительные количества, наоборот, стимулируют центральную нервную систему.
γ-Аминомасляная кислота является медиатором центральной нервной системы. В организме большие количества гистамина и серотонина находятся в неактивной, связанной форме в различных тканях. Биологическое действие проявляют только свободные формы этих веществ. Распад гистамина и серотонина и других биогенных аминов происходит при посредстве неспецифической моноаминоксидазы.
Таким путем из триптофана образуется гриптамин и серотонин (5-оксигриптамин), из гистидина — гистамин, из глютаминовой кислоты — γ-аминомасляная кислота. Образующиеся при этом амины оказывают на организм мощный биологический эффект, в связи с чем их называют биогенными аминами.
Так, введение гистамина вызывает:
1. расширение капилляров и соответственно повышение их проницаемости;
2. сужение крупных сосудов;
3. сокращение гладкой мускулатуры различных органов и тканей;
4. возбуждение секреции соляной кислоты в желудке.
Серотонин способствует повышению кровяного, давления и сужению бронхов. Противоречиво действие серотонина на центральную нервную систему, когда малые количества подавляют, а более значительные количества, наоборот, стимулируют центральную нервную систему.
γ-Аминомасляная кислота является медиатором центральной нервной системы. В организме большие количества гистамина и серотонина находятся в неактивной, связанной форме в различных тканях. Биологическое действие проявляют только свободные формы этих веществ. Распад гистамина и серотонина и других биогенных аминов происходит при посредстве неспецифической моноаминоксидазы.
Конечные продукты распада аминокислот
В результате различных превращений аминокислот в тканях организма образуются аммиак, углекислый газ и вода. Углекислый газ частично выводится из организма, а оставшаяся часть используется для синтетических процессов, например для синтеза жирных кислот, пуриновых оснований и др. Аммиак образуется в организме при дезаминировании аминокислот, при распаде некоторых веществ, таких, как пуриновые и пиримидиновые основания, глютамин и др. Например, в почках аммиак выделяется при распаде глютамина. Аммиак для организма является очень сильным токсическим веществом. Например, повышение его концентрации в крови только на 5% приводит к гибели кроликов. Поэтому организм в ходе эволюции выработал различные эффективные механизмы его обезвреживания. К основным из них относятся: образование глютамина, восстановительное аминирование, нейтрализация кислот, синтез мочевины.
Образование глютамина имеет важное значение для организма. Это связано с тем, что синтез глютамина в основном происходит в местах непосредственного образования аммиака, например в печени и мозге, где обнаружена активная глютаминсинтетаза — фермент, катализирующий этот процесс. В результате этого предотвращается проявление токсического действия аммиака. Обезвреженный таким путем NH3 может быть использован организмом в качестве источника азота, например, для синтеза пуриновых и пиримидиновых оснований, мукополисахаридов (глюкозамин). Это характеризует взаимосвязь белкового обмена с обменом нуклеиновых кислот и углеводов. Глютамин выступает в этих процессах в качестве транспортной формы аммиака.
Восстановительное аминирование представляет собой процесс, обратный дезаминированию. Он обеспечивает связывание аммиака кетокислотами с образованием соответствующих им аминокислот. В организме обнаружена активная ферментная система, которая катализирует восстановительное аминирование α-кетоглютаровой кислоты с образованием глютаминовой.
Аммиак для организма является очень сильным токсическим веществом. Например, повышение его концентрации в крови только на 5% приводит к гибели кроликов. Поэтому организм в ходе эволюции выработал различные эффективные механизмы его обезвреживания. К основным из них относятся: образование глютамина, восстановительное аминирование, нейтрализация кислот, синтез мочевины.
Образование глютамина имеет важное значение для организма. Это связано с тем, что синтез глютамина в основном происходит в местах непосредственного образования аммиака, например в печени и мозге, где обнаружена активная глютаминсинтетаза — фермент, катализирующий этот процесс. В результате этого предотвращается проявление токсического действия аммиака. Обезвреженный таким путем NH3 может быть использован организмом в качестве источника азота, например, для синтеза пуриновых и пиримидиновых оснований, мукополисахаридов (глюкозамин). Это характеризует взаимосвязь белкового обмена с обменом нуклеиновых кислот и углеводов. Глютамин выступает в этих процессах в качестве транспортной формы аммиака.
Восстановительное аминирование представляет собой процесс, обратный дезаминированию. Он обеспечивает связывание аммиака кетокислотами с образованием соответствующих им аминокислот. В организме обнаружена активная ферментная система, которая катализирует восстановительное аминирование α-кетоглютаровой кислоты с образованием глютаминовой.
 Нейтрализация неорганических и органических кислот аммиаком с образованием аммонийных солей является процессом обезвреживания аммиака в почках.
Нейтрализация неорганических и органических кислот аммиаком с образованием аммонийных солей является процессом обезвреживания аммиака в почках.
Синтез мочевины
Синтез мочевины служит основным путем детоксикации аммиака у млекопитающих и главной формой выделения белкового азота из организма. Из общего числа азотистых веществ в моче на долю азота мочевины приходится от 80 до 85%. Впервые принципиальная схема синтеза мочевины была предложена М. В. Ненцким. Ему удалось доказать, что синтез мочевины происходит из двух молекул аммиака и одной молекулы углекислого газа: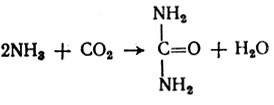 В специальных опытах И. В. Залеский и С. С. Салазкин в лаборатории И. П. Павлова установили, что если кровь воротной вены направить не в печень, а в нижнюю полую вену, т. е. миновать печень, то наступает резкое увеличение содержания аммиака в крови и отравление животного, нередко заканчивающееся его гибелью. Был сделан вывод, что печень является органом, где происходит обезвреживание аммиака.
Работами Кребса, Эмбдена, Клементи, Ратнера и других авторов было выяснено участие в этом процессе других веществ и ферментов, катализирующих реакции синтеза мочевины.
В современном представлении синтез мочевины изображен на схеме 4.
В специальных опытах И. В. Залеский и С. С. Салазкин в лаборатории И. П. Павлова установили, что если кровь воротной вены направить не в печень, а в нижнюю полую вену, т. е. миновать печень, то наступает резкое увеличение содержания аммиака в крови и отравление животного, нередко заканчивающееся его гибелью. Был сделан вывод, что печень является органом, где происходит обезвреживание аммиака.
Работами Кребса, Эмбдена, Клементи, Ратнера и других авторов было выяснено участие в этом процессе других веществ и ферментов, катализирующих реакции синтеза мочевины.
В современном представлении синтез мочевины изображен на схеме 4.
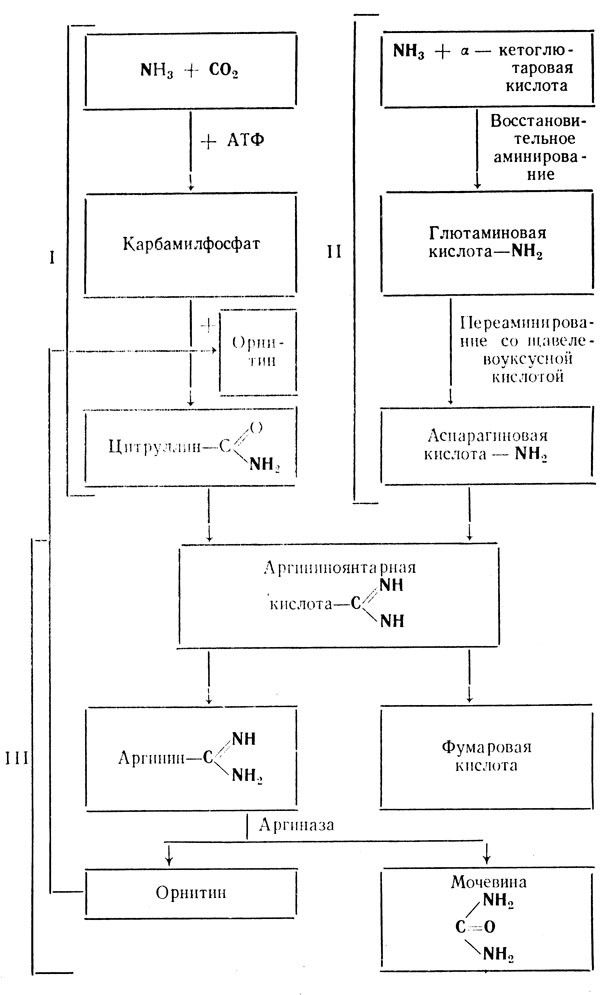 Схема 4
При детальном изучении синтез мочевины можно условно разделить на 3 этапа. На первых двух происходит связывание двух молекул аммиака в безвредные для организма соединения, а на третьем фактически происходит образование мочевины.
I этап. Молекула аммиака и углекислого газа за счет энергии, выделяемой при распаде АТФ, синтезируется в карбамилфосфат, который, соединяясь с орнитином (неприродная аминокислота), образует цитруллин.
Таким образом, в цитруллине зафиксированы одна молекула аммиака и СО2.
Схема 4
При детальном изучении синтез мочевины можно условно разделить на 3 этапа. На первых двух происходит связывание двух молекул аммиака в безвредные для организма соединения, а на третьем фактически происходит образование мочевины.
I этап. Молекула аммиака и углекислого газа за счет энергии, выделяемой при распаде АТФ, синтезируется в карбамилфосфат, который, соединяясь с орнитином (неприродная аминокислота), образует цитруллин.
Таким образом, в цитруллине зафиксированы одна молекула аммиака и СО2.
 II этап. Происходит связывание еще одной молекулы аммиака в глютаминовой кислоте путем восстановительного аминирования с α-кетоглютаровой кислотой. Глютаминовая кислота передает зафиксированную молекулу аммиака в виде NН2-группы на щавелевоуксусную кислоту, которая превращается в аспарагиновую кислоту (процесс переаминирования).
II этап. Происходит связывание еще одной молекулы аммиака в глютаминовой кислоте путем восстановительного аминирования с α-кетоглютаровой кислотой. Глютаминовая кислота передает зафиксированную молекулу аммиака в виде NН2-группы на щавелевоуксусную кислоту, которая превращается в аспарагиновую кислоту (процесс переаминирования).
 III этап. На этом этапе и происходит синтез мочевины. Цитруллин и аспарагиновая кислота при участии энергии АТФ образуют аргинин-янтарную кислоту, которая расщепляется на фумаровую кислоту и аргинин. Под действием аргиназы аргинин распадается на орнитин и мочевину. Орнитин вновь может включаться в первый этап этого процесса, а образовавшаяся мочевина выводится почками из организма.
III этап. На этом этапе и происходит синтез мочевины. Цитруллин и аспарагиновая кислота при участии энергии АТФ образуют аргинин-янтарную кислоту, которая расщепляется на фумаровую кислоту и аргинин. Под действием аргиназы аргинин распадается на орнитин и мочевину. Орнитин вновь может включаться в первый этап этого процесса, а образовавшаяся мочевина выводится почками из организма.


Обмен отдельных аминокислот
Аминокислоты, поступающие с пищей или образующиеся при распаде тканевых белков, главным образом идут на синтез белков. Однако многие аминокислоты принимают участие в образовании ряда веществ, которые имеют большое значение для жизнедеятельности организма. Так, глицин идет на синтез креатина, серина, гемоглобина, пуриновых оснований, сиаловых и парных желчных кислот. Он принимает участие в обезвреживании бензойной, фенил-уксусной кислот и других ядовитых для организма веществ. При дезаминировании аланина образуется пировиноградная кислота, которая участвует в синтезе ацетил-КоА, а также глюкозы и гликогена. Серии может явиться исходным веществом для образования 3-фосфоглицериновой кислоты, одного из субстратов обмена глюкозы и гликогена, этаноламина (азотистого основания, входящего в состав фосфолипида-кефалина), пировиноградной кислоты, цистеина. Метионин в организме имеет важное значение как один из основных поставщиков метальных групп, необходимых для синтеза холина, тимина, адреналина и креатина. Креатин играет важную роль в химических процессах, связанных с мышечным сокращением. Он относится к важнейшим азотистым небелковым соединениям. Креатин синтезируется из аргинина, глицина и метионина. В мышцах креатин находится не в свободном виде, а в соединении с фосфорной кислотой — в виде фосфокреатина. Он является макроэргическим соединением, обеспечивая энергией процесс мышечного сокращения и синтеза АТФ. При распаде фосфокреатин превращается в креатинин, который выводится с мочой из организма. За сутки в норме выделяется около 2 г креатинина. Между содержанием в крови фосфокреатина и выделением креатинина с мочой существует прямая зависимость, что позволяет по степени выделения креатинина судить о мышечном развитии тела. В случае появления в моче креатина — (креатинурия) — предполагается наличие различных заболеваний мышц и авитаминоза Е. Физиологическая креатинурия может быть у беременных женщин и у маленьких детей, но причина ее не выяснена. Цистеин участвует в синтезе цистина и таурина, необходимого компонента для образования парных желчных кислот. Значение этих серусодержащих аминокислот заключается еще и в том, что они образуют серную кислоту, которая в активированной форме, в виде фосфоаденозинфосфосульфата (ФАФС) обеспечивает обезвреживание вредных для организма веществ, таких, как крезол, фенол и др. (см. "Гниение белков") в кишечнике под влиянием бактерий. Глютаминовая и аспарагиновая кислоты в организме выполняют многие важные функции. Так, они участвуют в процессе обезвреживания аммиака путем синтеза мочевины и образования амидов — глютамина и аспарагина. В синтезе пуриновых и пиримидиновых оснований принимает участие аспарагиновая кислота. При декарбоксилировании глютаминовой кислоты образуется γ-аминомасляная кислота — медиатор в центральной нервной системе: В результате дезаминирования или переаминирования глютаминовой кислоты образуется α-кетоглютаровая кислота — один из основных субстратов цикла Кребса. Аргинин принимает участие в синтезе мочевины. При распаде лизина образуется глютаминовая кислота. Фенилаланин является предшественником тирозина. Главный путь распада тирозина проходит через стадию гомогентизиновой кислоты до образования конечных продуктов, которыми являются фумаровая и ацетоуксусная кислоты. Однако тирозин в организме подвергается и другим превращениям, в результате которых образуются важные в биологическом отношении вещества. Так, тирозин является исходным продуктом для синтеза гормонов мозгового слоя надпочечников — адреналина и норадреналина. Меланины — темные пигменты — также синтезируются из тирозина. Тирамин — представитель биогенных аминов — образуется при декарбоксилировании тирозина. Триптофан. Превращение триптофана также происходит по нескольким путям, одним из которых является эндогенный синтез никотиновой кислоты — витамина PP. Другой путь распада триптофана ведет к образованию биогенного амина — серотонина. При обмене гистидина может образоваться глютаминовая кислота, а также один из представителей биогенных аминов — гистамин.Патология белкового обмена
Одной из причин нарушения белкового обмена является его недостаточное потребление. Как установлено, человеку в зависимости от пола, возраста, рода трудовой деятельности в сутки необходимо в среднем 1 -1,5 г белка на 1 кг веса с учетом присутствия в диете всех незаменимых аминокислот в требуемом количестве и определенном соотношении. Институтом питания АМН СССР разработаны нормы суточного потребления незаменимых аминокислот (табл. 7). Таблица 7. Суточная потребность незаменимых аминокислот в граммах по отношению к триптофану
Белковое голодание может иметь в своей основе абсолютную недостаточность белка в рационе, когда суточная потребность в белке снижена на 20-30% и более.
Основным средством лечения и предупреждения заболевания является обеспеченность организма необходимым количеством белка в сутки с учетом всех незаменимых аминокислот.
Иногда белковое голодание является вторичным и развивается на основе других заболеваний, например при нарушении процессов переваривания белков в пищеварительном тракте, при кровотечениях, ожоговой болезни, глистных инвазиях, раке, поражениях печени и т. д.
Значительно чаще встречается качественное белковое голодание, связанное с нарушением соотношения аминокислот (имбаланс аминокислот), которое может иметь экзогенное происхождение при недостатке аминокислот в диете или эндогенное, связанное с нарушением обмена отдельных аминокислот внутри организма. Причинами экзогенного имбаланса аминокислот является однообразное белковое питание, с преобладанием белков растительного происхождения и ограниченным потреблением животных белков, и как следствие — недостаточность в рационе незаменимых аминокислот.
Примерами патологий, обусловленных дефицитом белка, служат такие заболевания, как квашиоркор, детский маразм и др. Эти заболевания распространены в колониальных и зависимых странах среди детского населения. Квашиоркор связан с качественным и количественным недостатком белка в питании. Типичными симптомами являются остановка роста, отечность, нарушение процессов костеобразования, мышечная слабость, потеря аппетита, поносы. Снижается резистентность (сопротивляемость) организма к инфекциям, повышается смертность. Так в голодные годы первой мировой войны смертность детей повысилась на 55%. При ква-шиоркоре снижается содержание белка, особенно в печени, а также в плазме, иногда до 50% (гипопротеинемия). Это относится к альбуминам. Глубокие изменения обнаруживаются в поджелудочной железе и печени. Изменения в поджелудочной железе уже в начальной стадии заболевания приводят к резкому нарушению экскреторной (выделительной функции этого органа. В печени происходит жировое перерождение. В этих органах нарушается синтез ферментов.
При детском маразме, или кахектической форме белковой недостаточности, наблюдается сильнейшее исхудание и отсутствие отечности. Эта форма алиментарной (пищевой) недостаточности связана с дефицитом белка в питании и с общей недостаточностью калорий. Дефицит веса у детей составляет 50-70%.
Эндогенный имбаланс аминокислот может быть следствием наследственных заболеваний, имеющих в своей основе нарушения активности ферментов, отвечающих за синтез заменимых аминокислот. Например, нарушение синтеза фенилаланин-гидроксилазы у детей приводит к развитию фенилкетонурии. При этом снижается образование тирозина, который становится уже незаменимой аминокислотой:
Таблица 7. Суточная потребность незаменимых аминокислот в граммах по отношению к триптофану
Белковое голодание может иметь в своей основе абсолютную недостаточность белка в рационе, когда суточная потребность в белке снижена на 20-30% и более.
Основным средством лечения и предупреждения заболевания является обеспеченность организма необходимым количеством белка в сутки с учетом всех незаменимых аминокислот.
Иногда белковое голодание является вторичным и развивается на основе других заболеваний, например при нарушении процессов переваривания белков в пищеварительном тракте, при кровотечениях, ожоговой болезни, глистных инвазиях, раке, поражениях печени и т. д.
Значительно чаще встречается качественное белковое голодание, связанное с нарушением соотношения аминокислот (имбаланс аминокислот), которое может иметь экзогенное происхождение при недостатке аминокислот в диете или эндогенное, связанное с нарушением обмена отдельных аминокислот внутри организма. Причинами экзогенного имбаланса аминокислот является однообразное белковое питание, с преобладанием белков растительного происхождения и ограниченным потреблением животных белков, и как следствие — недостаточность в рационе незаменимых аминокислот.
Примерами патологий, обусловленных дефицитом белка, служат такие заболевания, как квашиоркор, детский маразм и др. Эти заболевания распространены в колониальных и зависимых странах среди детского населения. Квашиоркор связан с качественным и количественным недостатком белка в питании. Типичными симптомами являются остановка роста, отечность, нарушение процессов костеобразования, мышечная слабость, потеря аппетита, поносы. Снижается резистентность (сопротивляемость) организма к инфекциям, повышается смертность. Так в голодные годы первой мировой войны смертность детей повысилась на 55%. При ква-шиоркоре снижается содержание белка, особенно в печени, а также в плазме, иногда до 50% (гипопротеинемия). Это относится к альбуминам. Глубокие изменения обнаруживаются в поджелудочной железе и печени. Изменения в поджелудочной железе уже в начальной стадии заболевания приводят к резкому нарушению экскреторной (выделительной функции этого органа. В печени происходит жировое перерождение. В этих органах нарушается синтез ферментов.
При детском маразме, или кахектической форме белковой недостаточности, наблюдается сильнейшее исхудание и отсутствие отечности. Эта форма алиментарной (пищевой) недостаточности связана с дефицитом белка в питании и с общей недостаточностью калорий. Дефицит веса у детей составляет 50-70%.
Эндогенный имбаланс аминокислот может быть следствием наследственных заболеваний, имеющих в своей основе нарушения активности ферментов, отвечающих за синтез заменимых аминокислот. Например, нарушение синтеза фенилаланин-гидроксилазы у детей приводит к развитию фенилкетонурии. При этом снижается образование тирозина, который становится уже незаменимой аминокислотой:
 К патологии белкового обмена относятся заболевания, связанные с нарушением обмена и других аминокислот. Например, при нарушении обмена тирозина развивается алкаптонурия, для которой характерно потемнение цвета мочи при стоянии на воздухе. При этом в моче обнаруживается повышенное количество гомогентизиновой кислоты — одного из промежуточных продуктов распада тирозина. На рис. 61 указаны места блокирования активности ферментов, приводящие к отмеченным заболеваниям.
К патологии белкового обмена относятся заболевания, связанные с нарушением обмена и других аминокислот. Например, при нарушении обмена тирозина развивается алкаптонурия, для которой характерно потемнение цвета мочи при стоянии на воздухе. При этом в моче обнаруживается повышенное количество гомогентизиновой кислоты — одного из промежуточных продуктов распада тирозина. На рис. 61 указаны места блокирования активности ферментов, приводящие к отмеченным заболеваниям.
 Рис. 61. Механизм нарушения обмена фенилаланина. 1 — блок ферментов при фенилкетонурии; 2 — блок энзимов при тирозинозе; 3 — блок энзимов при алкаптонурии
Недостаточность какой-либо аминокислоты приводит к развитию заболеваний с характерными для каждой аминокислоты признаками. Так, недостаток триптофана проявляется нарушением функции сердца и крови; снижение метионина приводит к поражению поджелудочной железы, а лизина — к нарушению процессов торможения в центральной нервной системе и т. д.
Рис. 61. Механизм нарушения обмена фенилаланина. 1 — блок ферментов при фенилкетонурии; 2 — блок энзимов при тирозинозе; 3 — блок энзимов при алкаптонурии
Недостаточность какой-либо аминокислоты приводит к развитию заболеваний с характерными для каждой аминокислоты признаками. Так, недостаток триптофана проявляется нарушением функции сердца и крови; снижение метионина приводит к поражению поджелудочной железы, а лизина — к нарушению процессов торможения в центральной нервной системе и т. д.
XI. Обмен сложных белков
Сложные белки в желудочно-кишечном тракте расщепляются специфическими ферментами на простые белки и простетические группы. Белки расщепляются до аминокислот и всасываются в кровь. Небелковые группы в зависимости от своей структуры распадаются под действием специфических ферментов на составные части.Обмен нуклеопротеидов
Нуклеопротеиды в кишечнике распадаются на простые белки и нуклеиновые кислоты — РНК и ДНК. В кишечнике под действием специфических нуклеаз, которые вырабатываются в поджелудочной железе, нуклеиновые кислоты расщепляются до мононуклеотидов. Последние подвергаются воздействию фосфатазы, в результате чего от мононуклеотида отщепляется фосфорная кислота. Остаток мононуклеотида — азотистое основание, соединенное с углеводом, носит название нуклеозида — может непосредственно всасываться из кишечника. Кроме этого, в кишечном соке содержатся активные нуклеазидазы, которые расщепляют нуклеозиды на азотистые основания и пентозы. Таким образом, в кишечнике происходит распад нуклеопротеидов на исходные составные части, а также мононуклеотиды и нуклеозиды, которые и всасываются в кровь. Кровь доставляет все эти продукты в печень, а также к другим органам и тканям, где они подвергаются специфическим превращениям. В тканях нуклеиновые кислоты под действием ДНК-азы и РНК-азы распадаются до мононуклеотидов, а последние — на азотистые основания, Н3РО4 и пентозы. Фосфорная кислота и пентозы подвергаются в органах и тканях различным превращениям. Пуриновые основания аденин и гуанин окисляются до мочевой кислоты, которая выводится из организма мочой. У пиримидиновых оснований в ходе превращений в тканях разрывается кольцо и образуются нециклические соединения. Например, конечными продуктами распада урацила являются β-аланин, один из компонентов коэнзима А (КоА), аммиак и углекислый газ.
У пиримидиновых оснований в ходе превращений в тканях разрывается кольцо и образуются нециклические соединения. Например, конечными продуктами распада урацила являются β-аланин, один из компонентов коэнзима А (КоА), аммиак и углекислый газ.
 Наряду с процессами распада в организме постоянно происходит и синтез нуклеиновых кислот. Необходимые для этого исходные вещества образуются в организме. Пентозы образуются при распаде углеводов (пентозный цикл). Фосфорная кислота всегда присутствует в организме. Синтез пуриновых оснований осуществляется в результате длительных превращений из глицина, глютамина, муравьиной и аспарагиновой кислот и СО2. Пиримидиновые основания образуются из карбамилфосфата, аспарагиновой кислоты и углекислого газа. Под действием ферментов вначале происходит синтез мононуклеотидов, а затем и нуклеиновых кислот РНК и ДНК.
Наряду с процессами распада в организме постоянно происходит и синтез нуклеиновых кислот. Необходимые для этого исходные вещества образуются в организме. Пентозы образуются при распаде углеводов (пентозный цикл). Фосфорная кислота всегда присутствует в организме. Синтез пуриновых оснований осуществляется в результате длительных превращений из глицина, глютамина, муравьиной и аспарагиновой кислот и СО2. Пиримидиновые основания образуются из карбамилфосфата, аспарагиновой кислоты и углекислого газа. Под действием ферментов вначале происходит синтез мононуклеотидов, а затем и нуклеиновых кислот РНК и ДНК.
Обмен хромопротеидов
Гемоглобин в пищеварительном тракте распадается на глобин и гем. Глобин как белок гидролизуется до аминокислот. Гем окисляется в, гематин и выводится с калом. Гемоглобин крови разрушается главным образом в печени, где подвергается окислению, в результате чего происходит разрыв системы порфириновых колец и окисление железа в трехвалентное. Этот первичный продукт окисления имеет зеленый цвет и называется вердоглобином. От последнего, возможно, спонтанно (самопроизвольно) отщепляется белок глобин и освобождается железо. В последующем глобин гидролизуется до аминокислот, а железо соединяется с белком, получая название ферритина, откладывается в организме как запасная форма железа. Оставшаяся небелковая часть — пигмент зеленого цвета — носит название биливердина, который восстанавливается в желто-красный билирубин. Однако принципиально распад гемоглобина может происходить везде в организме в связи с выходом крови за пределы сосудов и при клеточном распаде. Образовавшийся вне печени билирубин соединяется с альбумином и транспортируется кровью в печень. В норме его уровень в крови составляет 0,5-1,0 мг% (по Ван-ден-Бергу). В печени билирубин в значительной своей части соединяется с глюкуроновой кислотой и вместе со свободным билирубином (под названием "желчные пигменты") выделяется с желчью в кишечник. В толстом кишечнике под действием микрофлоры билирубин через стадию уробилиногена превращается в стеркобилиноген, последний спонтанно окисляется в стеркобилин и выделяется с калом, которому он придает специфический цвет. Часть уробилиногена и стеркобилиногена в толстом отделе кишечника всасывается в большой круг кровообращения и, минуя печень, поступает в мочу и выводится из организма. С мочой выделяется смесь пигментов, среди которых главное место занимает стеркобилиноген. В организме постоянно идет синтез гемоглобина. В опытах с мечеными атомами было установлено, что в синтезе гема принимают участие гликокол и янтарная кислота. В последующих стадиях включается железо. Глобин синтезируется из аминокислот. Конденсация 4 молекул гема с глобином и образует молекулу гемоглобина.
В организме постоянно идет синтез гемоглобина. В опытах с мечеными атомами было установлено, что в синтезе гема принимают участие гликокол и янтарная кислота. В последующих стадиях включается железо. Глобин синтезируется из аминокислот. Конденсация 4 молекул гема с глобином и образует молекулу гемоглобина.
Патология обмена сложных белков
При нарушении обмена нуклеопротеидов развивается подагра. Рис. 62. Подагра. Подагрические узлы в области суставов пальцев рук
Сущность этого заболевания состоит в том, что в организме откладываются большие количества солей мочевой кислоты в хрящах и других тканях. Типичным для подагры является отложение солей мочевой кислоты в суставных хрящах пальцев рук и ног. Это связано с тем, что в организме повышена активность фермента ксантиноксидазы, которая ускоряет процесс окисления ксантина — промежуточного продукта распада пуриновых оснований — в мочевую кислоту. При этом повышено содержание в крови мочевой кислоты в 2-3 и даже в 5 раз против нормы. Этот процесс сопровождается болезненностью и деформацией суставов (рис. 62). Отложение солей мочевой кислоты в почках характеризуется понижением выведения ее из организма, в результате чего уровень мочевой кислоты еще более повышается.
Одним из наследственных заболеваний обмена хромопротеидов является серповидноклеточная анемия. При этом эритроциты изменяют свою форму, в результате чего нарушается их функция переноса кислороду. Измененные эритроциты закупоривают мельчайшие сосуды, что еще более нарушает обеспеченность тканей кислородом и ведет к повреждению тканей, особенно тканей мозга. У больных наблюдается кислородная недостаточность и наступает смерть от асфиксии.
В норме в плазме содержится 0,76 (0,1-2,0) мг% билирубина. При заболеваниях, связанных с усиленным распадом эритроцитов, уровень билирубина значительно повышается. Печень не справляется с таким количеством билирубина и последний поступает в кровь, где его концентрация возрастает (гипербилирубинемия). Вследствие этого плазма приобретает темно-желтую окраску, что приводит к желтому окрашиванию слизистых оболочек кожи, склер, т. е. к развитию желтухи (иктерус).
Различают следующие виды желтух: гемолитические, механические и паренхиматозные.
Гемолитические желтухи возникают при повышенном распаде эритроцитов (гемолитическая болезнь новорожденных, токсикозы).
Механические желтухи возникают при нарушении оттока желчи (закупорка желчного протока камнями, раковой опухолью).
Паренхиматозные желтухи возникают при тяжелом нарушении печеночной функции (инфекционный гепатит, острая желтая атрофия печени). При этом в печени не происходит связывания конечных продуктов распада гемоглобина, которые поступают в мочу в большом количестве. Одновременно с этим билирубин поступает в кровь, что и приводит к развитию желтухи.
В клинической практике имеет большое значение определение билирубина как показателя пигментного обмена в организме. Билирубин в организме существует в двух формах: свободный билирубин, связанный с белком, и связанный билирубин, соединенный с глюкуроновой кислотой. Широко распространенным методом определения билирубина является его реакция с диазореактивом Эрлиха.
Связанный билирубин взаимодействует с диазореактивом непосредственно, и поэтому эта реакция называется прямой реакцией на билирубин, а определяемый этим методом билирубин — прямой. Свободный билирубин можно определить только после обработки его алкоголем или мочевиной. Такая реакция называется непрямой, а открываемый ею билирубин — непрямым. Увеличение связанного билирубина наблюдается при механических и паренхиматозных желтухах, а свободного — при гемолитических.
Из других нарушений пигментного обмена следует указать на порфирии. В основе этого заболевания лежит накопление в организме порфиринов, побочных продуктов синтеза гемоглобина. Они появляются в больших количествах при нарушении синтеза последнего. Эти вещества в норме присутствуют в кале и в моче в виде следов. При порфириях происходит отложение порфиринов во всех органах, а кал и моча приобретают красный цвет.
Порфиринурии — заболевания, охватывающие все врожденные формы патологического выделения порфиринов. Также порфиринурии встречаются при отравлениях свинцом, злокачественной анемии и т. д.
Рис. 62. Подагра. Подагрические узлы в области суставов пальцев рук
Сущность этого заболевания состоит в том, что в организме откладываются большие количества солей мочевой кислоты в хрящах и других тканях. Типичным для подагры является отложение солей мочевой кислоты в суставных хрящах пальцев рук и ног. Это связано с тем, что в организме повышена активность фермента ксантиноксидазы, которая ускоряет процесс окисления ксантина — промежуточного продукта распада пуриновых оснований — в мочевую кислоту. При этом повышено содержание в крови мочевой кислоты в 2-3 и даже в 5 раз против нормы. Этот процесс сопровождается болезненностью и деформацией суставов (рис. 62). Отложение солей мочевой кислоты в почках характеризуется понижением выведения ее из организма, в результате чего уровень мочевой кислоты еще более повышается.
Одним из наследственных заболеваний обмена хромопротеидов является серповидноклеточная анемия. При этом эритроциты изменяют свою форму, в результате чего нарушается их функция переноса кислороду. Измененные эритроциты закупоривают мельчайшие сосуды, что еще более нарушает обеспеченность тканей кислородом и ведет к повреждению тканей, особенно тканей мозга. У больных наблюдается кислородная недостаточность и наступает смерть от асфиксии.
В норме в плазме содержится 0,76 (0,1-2,0) мг% билирубина. При заболеваниях, связанных с усиленным распадом эритроцитов, уровень билирубина значительно повышается. Печень не справляется с таким количеством билирубина и последний поступает в кровь, где его концентрация возрастает (гипербилирубинемия). Вследствие этого плазма приобретает темно-желтую окраску, что приводит к желтому окрашиванию слизистых оболочек кожи, склер, т. е. к развитию желтухи (иктерус).
Различают следующие виды желтух: гемолитические, механические и паренхиматозные.
Гемолитические желтухи возникают при повышенном распаде эритроцитов (гемолитическая болезнь новорожденных, токсикозы).
Механические желтухи возникают при нарушении оттока желчи (закупорка желчного протока камнями, раковой опухолью).
Паренхиматозные желтухи возникают при тяжелом нарушении печеночной функции (инфекционный гепатит, острая желтая атрофия печени). При этом в печени не происходит связывания конечных продуктов распада гемоглобина, которые поступают в мочу в большом количестве. Одновременно с этим билирубин поступает в кровь, что и приводит к развитию желтухи.
В клинической практике имеет большое значение определение билирубина как показателя пигментного обмена в организме. Билирубин в организме существует в двух формах: свободный билирубин, связанный с белком, и связанный билирубин, соединенный с глюкуроновой кислотой. Широко распространенным методом определения билирубина является его реакция с диазореактивом Эрлиха.
Связанный билирубин взаимодействует с диазореактивом непосредственно, и поэтому эта реакция называется прямой реакцией на билирубин, а определяемый этим методом билирубин — прямой. Свободный билирубин можно определить только после обработки его алкоголем или мочевиной. Такая реакция называется непрямой, а открываемый ею билирубин — непрямым. Увеличение связанного билирубина наблюдается при механических и паренхиматозных желтухах, а свободного — при гемолитических.
Из других нарушений пигментного обмена следует указать на порфирии. В основе этого заболевания лежит накопление в организме порфиринов, побочных продуктов синтеза гемоглобина. Они появляются в больших количествах при нарушении синтеза последнего. Эти вещества в норме присутствуют в кале и в моче в виде следов. При порфириях происходит отложение порфиринов во всех органах, а кал и моча приобретают красный цвет.
Порфиринурии — заболевания, охватывающие все врожденные формы патологического выделения порфиринов. Также порфиринурии встречаются при отравлениях свинцом, злокачественной анемии и т. д.
Вопросы для повторения
1. Какое значение имеют белки в питании? 2. Почему белки в питании незаменимы? 3. Какие аминокислоты называются незаменимыми и почему? 4. Назовите незаменимые аминокислоты. 5. Чем определяется биологическая ценность белков? 6. Что представляют собой белковые резервы организма? 7. Что понимают под азотистым балансом? 8. Какова норма белка в питании? 9. Какие ферменты участвуют в расщеплении белков в желудочно-кишечном тракте? 10. Как происходит процесс активации и самоактивации пепсина и трипсина? 11. Какие продукты образуются при гниении белков в кишечнике и как они обезвреживаются? 12. Каким процессам подвергаются аминокислоты в тканях организма? 13. Как протекает биосинтез белка? 14. Какие функции в биосинтезе белка выполняют ДНК, и-РНК, т-РНК? 15. Что такое генетический код? 16. Напишите реакции процессов дезаминирования и декарбоксилирования аминокислот. 17. В чем сущность процесса переаминирования аминокислот? 18. Напиши те реакции переаминирования между пировиноградной кислотой и аланином. 19. Назовите ферменты, катализирующие дезаминирование, декарбоксилирование и переаминирование аминокислот. 20. Назовите конечные продукты распада белков в тканях. 21. Укажите основные пути образования и обезвреживания аммиака. 22. Укажите основные этапы биосинтеза мочевины. 23. Каковы причины и симптомы белкового голодания? 24. Какова причина и симптомы подагры? 25. Каким путем происходит распад гемоглобина в организме? 26. Дайте определение свободного и связанного билирубина. Какое клиническое значение имеет их определение?XII. Взаимосвязь обменов углеводов, белков и жиров
Обмен веществ в организме характеризуется тесной взаимосвязью между углеводами, белками и жирами. В организме белки, жиры и углеводы пищи в результате различных превращений теряют свои специфические свойства и часто образуют химические вещества одинаковой структуры. Углеводы, белки и жиры в пищеварительном тракте расщепляются до мономеров, которыми являются: моносахариды, аминокислоты, глицерин и жирные кислоты. В клетках организма происходит их дальнейший распад с образованием ряда конечных продуктов, в том числе CH3CO~SKoA. Последний образуется при окислении глюкозы, распаде жирных кислот, дезаминировании аминокислот. С другой стороны, ацетил-Ко А независимо от пути его образования участвует в синтезе определенных для каждого организма веществ: жирных кислот, углеводов, холестерина, желчных кислот, некоторых гормонов, витамина D. Он также служит одним из основных поставщиков энергии, главным "горючим" организма, так как при окислении его в цикле Кребса выделяется большое количество энергии, которая в виде АТФ обеспечивает жизнедеятельность всех клеток нашего тела. Поэтому, например, при недостатке в пище жиров, дефицит СН3СО ~ SKoA будет покрываться за счет повышенного распада углеводов и белков. Таким образом, нарушение любого процесса, приводящего к образованию ацетил-КоА, отразится на деятельности других видов обменов веществ, а следовательно, и организма в целом, а в ряде случаев может привести и к развитию патологии, как в случае сахарного диабета. Это — общий путь, характеризующий взаимосвязь обменов углеводов, белков и жиров в организме. Однако существуют и другие биохимические механизмы взаимосвязи между этими веществами.Взаимосвязь обмена углеводов и жиров
Многочисленными опытами над животными установлено, что углеводы пищи в организме могут превращаться в жиры. Эта особенность широко используется в сельском хозяйстве при откорме животных. Механизм такого превращения заключается в том, что при распаде углеводов в организме образуются ацетил-КоА и в качестве промежуточного продукта — фосфоглицериновый альдегид. Методом меченых атомов было показано, что из ацетил-КоА могут синтезироваться жирные кислоты, а из фосфоглицеринового альдегида — глицерин, т. е. исходные вещества для биосинтеза жира. Такой жир характеризуется низким йодным числом и твердой консистенцией. Первым ярким доказательством возможности превращения жиров в углеводы были наблюдения над зимнеспящими животными, у которых на зиму почти полностью исчезали жировые запасы, а содержание гликогена в мышцах практически не снижалось. Окончательно этот вопрос был решен с применением меченых атомов. Уксусную кислоту, являющуюся общим продуктом обмена жиров и углеводов, метили по углероду и скармливали животным. Радиоактивность была обнаружена как в углеводах, так и жирах. Это позволило высказать предположение, что в организме в зависимости от потребности клеток жиры могут превратиться в углеводы (схема). Взаимоотношение между распадом жирных кислот и углеводов
Взаимоотношение между распадом жирных кислот и углеводов
Взаимосвязь обмена углеводов и белков
При распаде белков в организме появляются аминокислоты, часть из которых может превратиться в углеводы. При дезаминировании аланина, аспарагиновой, глютаминовой кислот, серина, орнитина и т. д. образуются вещества, которые прямо или косвенно принимают участие в образовании углеводов. Этот процесс называется глюконеогенезом, регулируется глюкокортикоидами, гормонами коры надпочечников, является своеобразным компенсаторным механизмом снабжения организма энергией при недостатке углеводов. Это имеет место, например, при сахарном диабете, когда снижается процесс использования глюкозы клетками, испытывающими дефицит энергии. Распад углеводов приводит к образованию пировиноградной кислоты, которая путем восстановительного (!) аминирования или переаминирования дает начало аланину, аспарагиновой и глютаминовой аминокислотам.Взаимосвязь обмена белков и жиров
О взаимосвязи этих видов обмена известно мало. Возможно, что превращение аминокислот в жирные кислоты происходит через образование вначале углеводов, хотя некоторые аминокислоты (лейцин, фенилаланин, тирозин), дающие в качестве промежуточных продуктов ацетоуксусную кислоту, могут сразу превращаться в жирные кислоты. По-видимому, процесс синтеза аминокислот из жиров протекает ограниченно и относится к некоторым заменимым аминокислотам.Вопросы для повторения
1. Какое значение имеет ацетил-КоА в обмене жиров, белков и углеводов? 2. Какая существует взаимосвязь между обменом углеводов и жиров? 3. Как взаимосвязаны в обмене веществ белки и углеводы? 4. Укажите на взаимосвязь обмена белков и жиров.XIII. Водный и минеральный обмен
Водный обмен и его регуляция
Вода является в количественном отношении самой значительной составной частью всех клеток организма. Жизнь в ходе эволюции возникла в воде, и организмы без воды существовать не могут. Большая часть реакций обмена веществ протекает в водных растворах. Это среда, в которой существуют клетки и поддерживается связь между ними. Вода составляет основу всех жидкостей в организме: крови, лимфы, мочи, соков пищеварительного аппарата, спинномозговой жидкости и др. В целом в организме содержание воды составляет % веса тела и меняется с возрастом. Так, у четырехмесячных эмбрионов, количество воды составляет 94%, у новорожденных — 77%, а у взрослых — 50-60%. В теле мужчин содержится в среднем 60% (50-71%) воды, тогда как у женщин — 50% (40-60%). Уровень воды в разных тканях различен. Соединительные ткани, кости относительно бедны водой, а кровь, нервная ткань, мышцы, печень содержат много воды (табл. 8). Таблица 8. Содержание воды в различных тканях человека в процентах
Всю воду можно подразделить на внутриклеточную и внеклеточную. К последней относятся кровь, лимфа, межклеточная жидкость, которая образует во всем организме единую фазу. Состав лимфы имежклеточной жидкости примерно соответствует составу плазмы крови. Жидкая среда, находящаяся в различных клетках тела, имеет примерно одинаковый состав и определяется как внутриклеточная жидкость. Обе жидкости тела отличаются по количеству воды. Внутриклеточная жидкость содержит в среднем около 35-45% воды по отношению к весу тела, а внеклеточная-15%. Различаются они и по составу электролитов. Во внеклеточной жидкости преобладают ионы натрия, хлора и бикарбонатов; во внутриклеточной-ионы калия, а из анионов — белок и фосфорные эфиры.
У здорового человека наблюдается водное равновесие, что видно из табл. 9.
Таблица 8. Содержание воды в различных тканях человека в процентах
Всю воду можно подразделить на внутриклеточную и внеклеточную. К последней относятся кровь, лимфа, межклеточная жидкость, которая образует во всем организме единую фазу. Состав лимфы имежклеточной жидкости примерно соответствует составу плазмы крови. Жидкая среда, находящаяся в различных клетках тела, имеет примерно одинаковый состав и определяется как внутриклеточная жидкость. Обе жидкости тела отличаются по количеству воды. Внутриклеточная жидкость содержит в среднем около 35-45% воды по отношению к весу тела, а внеклеточная-15%. Различаются они и по составу электролитов. Во внеклеточной жидкости преобладают ионы натрия, хлора и бикарбонатов; во внутриклеточной-ионы калия, а из анионов — белок и фосфорные эфиры.
У здорового человека наблюдается водное равновесие, что видно из табл. 9.
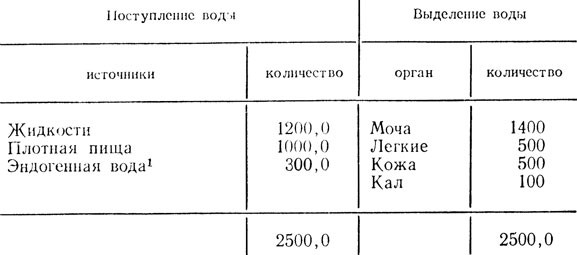 Таблица 9. Примерный водный обмен человека в миллилитрах
Потребность в воде меняется с возрастом. Взрослому человеку необходимо в сутки около 15 мл на 1 кг веса тела, а грудному ребенку — 35 мл, что зависит от интенсивного обмена веществ у ребенка и недостаточно развитой функции почек.
Таблица 9. Примерный водный обмен человека в миллилитрах
Потребность в воде меняется с возрастом. Взрослому человеку необходимо в сутки около 15 мл на 1 кг веса тела, а грудному ребенку — 35 мл, что зависит от интенсивного обмена веществ у ребенка и недостаточно развитой функции почек.
 Рис. 63. Органы водного обмена
В водном обмене принимают участие почки, легкие, кожа и желудочно-кишечный тракт (рис. 63). Почки являются главным органом регуляции водного обмена. В условиях недостатка воды выделяется мало мочи и она сильно концентрирована. При избытке воды организм способен выделять большое количество разбавленной мочи. Нарушение способности изменять концентрацию мочи отмечается при тяжелых почечных заболеваниях. Легкие выделяют воду в виде водяного пара. Это происходит в результате того, что воздух в альвеолах при температуре тела насыщается водяными парами. Количество воды, выводимой через легкие, зависит от объема дыхания, температуры тела и т. д. При усиленной мышечной деятельности, лихорадках увеличивается объем дыхания и соответственно возрастает количество выводимой воды. Через кожу потеря воды происходит путем испарения и выделения пота. Испарение воды кожей зависит от разницы температур тела и внешней среды. Пот представляет собой секрет потовых желез. Потоотделение происходит периодически и связано с повышением температуры воздуха. Способность организма выделять пот различного состава является приспособительной реакцией. При высокой температуре окружающего воздуха у человека с недостаточной акклиматизацией выделяется пот, относительно богатый ионами натрия и хлора, состав которого приближается к составу плазмы крови. У акклиматизированных же людей пот сильно разведенный.
Регуляция водного обмена осуществляется разными путями. В основе регуляции лежит поддержание постоянства осмотического давления. Важное значение принадлежит обменным взаимоотношениям между вне- и внутриклеточной жидкостями. Так, при поступлении в организм электролитов, которые распределяются в основном во внеклеточной жидкости, происходит перемещение воды из клеток в межтканевые пространства, кровь, лимфу. При избытке электролитов внутри клеток вода движется в обратном направлении. Основной регуляторной системой обмена воды в организме является система гормоны — почки. Из гормонов следует указать на вазопрессин и альдостерон.
Вазопрессин обладает антидиуретическим действием, поэтому его часто называют антидиуретическим гормоном. Секреция вазопрессина регулируется величиной осмотического давления плазмы крови. Механизм действия можно представить следующим образом. Повышение осмотического давления плазмы стимулирует выработку вазопрессина, который снижает выведение воды из организма за счет увеличения выделения концентрированной мочи. В результате этого уменьшается осмотическое давление и снижается раздражение нейрогипофиза и прекращается секреция вазопрессина.
Адреналин и различные болевые раздражения стимулируют выработку вазопрессина и уменьшают диурез, тогда как небольшие дозы алкоголя тормозят его образование и усиливают мочеотделение.
Действие на водный обмен альдостерона связано с уровнем натрия в плазме крови. Понижение осмотического давления и выделение из организма воды и, следовательно, разбавленной мочи в большом количестве может быть связано с понижением концентрации натрия в плазме крови. Это снижение натрия вызывает повышенную секрецию альдостерона, который усиливает процессы обратного всасывания натрия в почках и тем самым задержку его в организме. Повышение уровня натрия в плазме тормозит выработку этого гормона.
Таким образом, механизм действия этих двух гормонов является различным и зависит от осмотического давления плазмы, снижение которого обусловливает повышенную секрецию альдостерона и торможение выработки вазопрессина. При повышении осмотического давления возникают обратные соотношения в процессе регуляции.
Патология водного обмена может быть обусловлена либо потерями больших количеств воды (дегидратация), либо ее задержкой в организме (отеки), либо перераспределением жидкости между вне- и внутриклеточными депо. Дегидратация, или гипогидрия, развивается при нарушении деятельности желудочно-кишечного тракта, рвоте, сильном потоотделении, заболеваниях почек, избыточном поступлении в организм солей, особенно NaCl и NaHCО3.
Рис. 63. Органы водного обмена
В водном обмене принимают участие почки, легкие, кожа и желудочно-кишечный тракт (рис. 63). Почки являются главным органом регуляции водного обмена. В условиях недостатка воды выделяется мало мочи и она сильно концентрирована. При избытке воды организм способен выделять большое количество разбавленной мочи. Нарушение способности изменять концентрацию мочи отмечается при тяжелых почечных заболеваниях. Легкие выделяют воду в виде водяного пара. Это происходит в результате того, что воздух в альвеолах при температуре тела насыщается водяными парами. Количество воды, выводимой через легкие, зависит от объема дыхания, температуры тела и т. д. При усиленной мышечной деятельности, лихорадках увеличивается объем дыхания и соответственно возрастает количество выводимой воды. Через кожу потеря воды происходит путем испарения и выделения пота. Испарение воды кожей зависит от разницы температур тела и внешней среды. Пот представляет собой секрет потовых желез. Потоотделение происходит периодически и связано с повышением температуры воздуха. Способность организма выделять пот различного состава является приспособительной реакцией. При высокой температуре окружающего воздуха у человека с недостаточной акклиматизацией выделяется пот, относительно богатый ионами натрия и хлора, состав которого приближается к составу плазмы крови. У акклиматизированных же людей пот сильно разведенный.
Регуляция водного обмена осуществляется разными путями. В основе регуляции лежит поддержание постоянства осмотического давления. Важное значение принадлежит обменным взаимоотношениям между вне- и внутриклеточной жидкостями. Так, при поступлении в организм электролитов, которые распределяются в основном во внеклеточной жидкости, происходит перемещение воды из клеток в межтканевые пространства, кровь, лимфу. При избытке электролитов внутри клеток вода движется в обратном направлении. Основной регуляторной системой обмена воды в организме является система гормоны — почки. Из гормонов следует указать на вазопрессин и альдостерон.
Вазопрессин обладает антидиуретическим действием, поэтому его часто называют антидиуретическим гормоном. Секреция вазопрессина регулируется величиной осмотического давления плазмы крови. Механизм действия можно представить следующим образом. Повышение осмотического давления плазмы стимулирует выработку вазопрессина, который снижает выведение воды из организма за счет увеличения выделения концентрированной мочи. В результате этого уменьшается осмотическое давление и снижается раздражение нейрогипофиза и прекращается секреция вазопрессина.
Адреналин и различные болевые раздражения стимулируют выработку вазопрессина и уменьшают диурез, тогда как небольшие дозы алкоголя тормозят его образование и усиливают мочеотделение.
Действие на водный обмен альдостерона связано с уровнем натрия в плазме крови. Понижение осмотического давления и выделение из организма воды и, следовательно, разбавленной мочи в большом количестве может быть связано с понижением концентрации натрия в плазме крови. Это снижение натрия вызывает повышенную секрецию альдостерона, который усиливает процессы обратного всасывания натрия в почках и тем самым задержку его в организме. Повышение уровня натрия в плазме тормозит выработку этого гормона.
Таким образом, механизм действия этих двух гормонов является различным и зависит от осмотического давления плазмы, снижение которого обусловливает повышенную секрецию альдостерона и торможение выработки вазопрессина. При повышении осмотического давления возникают обратные соотношения в процессе регуляции.
Патология водного обмена может быть обусловлена либо потерями больших количеств воды (дегидратация), либо ее задержкой в организме (отеки), либо перераспределением жидкости между вне- и внутриклеточными депо. Дегидратация, или гипогидрия, развивается при нарушении деятельности желудочно-кишечного тракта, рвоте, сильном потоотделении, заболеваниях почек, избыточном поступлении в организм солей, особенно NaCl и NaHCО3.
 Рис. 64. Распределение жидкости при отеке
Увеличение количества внеклеточной жидкости (полигидрия) приводит к развитию отеков (рис. 64), когда выделение мочи снижается (олигурия) или прекращается совсем (анурия). Такое состояние наблюдается при заболеваниях почек, сердца, печени.
Рис. 64. Распределение жидкости при отеке
Увеличение количества внеклеточной жидкости (полигидрия) приводит к развитию отеков (рис. 64), когда выделение мочи снижается (олигурия) или прекращается совсем (анурия). Такое состояние наблюдается при заболеваниях почек, сердца, печени.
Исследования водного обмена в клинике
Изучение водного обмена в клинике имеет важное значение. Но непосредственное определение водного баланса затруднено и не нашло применения в лечебных учреждениях. Поэтому были разработаны непрямые методы. К ним относятся методы разведения. Они основаны на том, что ряд веществ способен весьма равномерно распределяться в жидкостях организма. Затем, определяя их конечную концентрацию, можно вычислить степень разведения этих веществ и обьем жидкости, где они распределены. Для этого существует простая формула: Общий объем = Количество введенного вещества/Конечная концентрация вещества (концентрация равновесия) Для измерения общего количества воды тела применяют тяжелую воду — D2О, которая почти не отличается от обычной воды. Определение внеклеточной жидкости производят методом разведения с использованием изотопов натрия и хлора, роданидов (CNS-), инулина, тростникового сахара и т. д. Объем плазмы изучают при введении веществ, которые распределяются только в ней. Самыми удобными оказались белки, меченные радиоактивными изотопами, например альбумины плазмы, меченные йодом.Вопросы для повторения
1. Какое значение имеет вода для организма? 2. Что такое вне- и внутриклеточная вода? 3. Какие органы принимают участие в водном обмене? 4. Как регулируется обмен воды в организме? 5. Какова функция вазопрессина и альдостерона в обмене воды? 6. Какое значение имеет исследование воды в организме? 7. Какими методами исследуют водный баланс организма? 8. Что такое дегидратация, отеки, несахарный диабет?Минеральный обмен
Минеральные элементы относятся к числу незаменимых веществ организма, хотя не обладают питательной ценностью и не являются источником энергии. Их значение определяется тем, что они входят в состав клеток органов и тканей, вместе с водой участвуют в поддержании осмотического давления, и обеспечивают постоянство рН внутри- и внеклеточной жидкости организма. Процессы мышечного сокращения, нервной проводимости в определенной степени зависят от минеральных элементов. Они включаются в различные реакции обмена веществ в организме, являясь структурным компонентом многих ферментов и витамина В12. Участие минеральных элементов в построении различных органов и тканей демонстрирует табл.10. Таблица 10. Содержание минеральных элементов в органах и тканях человека в мг %
Как видно из таблицы, Са, Mg, P в значительных количествах входят в состав костей. В мышцах, мозге, почках калия содержится больше, чем натрия. В плазме концентрация натрия превышает концентрацию калия примерно в 20 раз, тогда как в клетках органов и тканей уровень калия выше. В костях минеральные элементы находятся в нерастворимом состоянии, образуя их остов. Однако при недостатке в организме солей Р или Са последние вымываются из костей (например, при рахите).
Фосфор в значительном количестве входит в состав органических соединений типа нуклеоиротеидов, фосфопротеидов, липоидов, углеводов и др.
Таблица 10. Содержание минеральных элементов в органах и тканях человека в мг %
Как видно из таблицы, Са, Mg, P в значительных количествах входят в состав костей. В мышцах, мозге, почках калия содержится больше, чем натрия. В плазме концентрация натрия превышает концентрацию калия примерно в 20 раз, тогда как в клетках органов и тканей уровень калия выше. В костях минеральные элементы находятся в нерастворимом состоянии, образуя их остов. Однако при недостатке в организме солей Р или Са последние вымываются из костей (например, при рахите).
Фосфор в значительном количестве входит в состав органических соединений типа нуклеоиротеидов, фосфопротеидов, липоидов, углеводов и др.
Потребность в минеральных элементах
Необходимые организму минеральные элементы поступают только с пищей. Поэтому недостаток, а тем более отсутствие всех необходимых минеральных элементов отражаются на состоянии обмена веществ всего организма. Суточная потребность в минеральных элементах взрослого человека будет следующей: в натрии — 4,0-6,0 г, в калии — 2,5-5,0 г, в хлоридах — 5,0-7,0 г, в кальции — 0,8-1,0 г, в фосфоре — 1,0-1,5 г, в железе — 0,015 г. Из всех минеральных элементов только NaCl нужно вводить в рацион дополнительно, тогда как остальные минеральные вещества, входящие в состав суточного рациона, полностью покрывают потребности организма. Физиологическая потребность в хлористом натрии составляет 5 г в сутки, однако человек потребляет около 15 г, что связано с привычкой человека и вкусовыми качествами пищи. Потребность в минеральных элементах меняется в зависимости от возраста, физиологического состояния организма, рода трудовой деятельности, состава почвы, на которых произрастают растительные продукты питания. Дети, беременные и кормящие матери в большей степени нуждаются в кальции, фосфоре, магнии, железе (табл. 11). Важное значение имеют определенные отношения минеральных элементов. Наилучшее усвоение наблюдается, например, при соотношении кальция и фосфора как 1:2. Необходимым условием также является и регулярное поступление в организм минеральных элементов. Таблица 11. Потребность в отдельных минеральных элементах (в граммах в сутки)
Содержание минеральных элементов в растительных продуктах в значительной степени зависит от состава почвы. Еще давно обратили внимание, что в горных районах люди часто болеют эндемическим зобом, в отдельных местностях земного шара распространена подагра. При изучении причин таких явлений оказалось, что почвы этих районов содержат необычные количества отдельных минеральных элементов. Так, в почвах горных местностей обнаружен недостаток йода, на равнинах Австралии мало кобальта, а в других областях повышено количество молибдена. Такие местности были названы биогеохимическими провинциями. Это и является причиной заболеваний. Например, повышенное содержание в почве молибдена обусловливает его избыточное поступление в организм за счет растительных и животных продуктов. Молибден необходим для деятельности фермента ксантиноксидазы, которая катализирует синтез мочевой кислоты. При избытке в организме молибдена повышен синтез мочевой кислоты, что и является предпосылкой развития подагры.
С целью нормализации обеспеченности организма минеральными элементами в таких местностях применяются различные профилактические меры. Так, продукты питания и вода в горных областях йодируются и т. д. Поэтому при определении норм минеральных элементов необходимо учитывать и эти факторы.
Таблица 11. Потребность в отдельных минеральных элементах (в граммах в сутки)
Содержание минеральных элементов в растительных продуктах в значительной степени зависит от состава почвы. Еще давно обратили внимание, что в горных районах люди часто болеют эндемическим зобом, в отдельных местностях земного шара распространена подагра. При изучении причин таких явлений оказалось, что почвы этих районов содержат необычные количества отдельных минеральных элементов. Так, в почвах горных местностей обнаружен недостаток йода, на равнинах Австралии мало кобальта, а в других областях повышено количество молибдена. Такие местности были названы биогеохимическими провинциями. Это и является причиной заболеваний. Например, повышенное содержание в почве молибдена обусловливает его избыточное поступление в организм за счет растительных и животных продуктов. Молибден необходим для деятельности фермента ксантиноксидазы, которая катализирует синтез мочевой кислоты. При избытке в организме молибдена повышен синтез мочевой кислоты, что и является предпосылкой развития подагры.
С целью нормализации обеспеченности организма минеральными элементами в таких местностях применяются различные профилактические меры. Так, продукты питания и вода в горных областях йодируются и т. д. Поэтому при определении норм минеральных элементов необходимо учитывать и эти факторы.
Значение отдельных минеральных элементов
Основное значение натрия, калия и хлора состоит в поддержании осмотического давления. Половина всего количества натрия и большая часть хлора, содержащихся в организме, находится во внеклеточной жидкости. В костях содержится до 30% натрия, тогда как калий находится преимущественно внутри клеток. Рис. 65. Разница в развитии скелета у крыс одного помета при бедной и богатой кальцием диете
Кальций и фосфор имеют важное значение в организме. Они являются основными структурными компонентами костной ткани (рис. 65). Кальциевые соли фосфорной и угольной кислот влияют на возбуждение нервной и мышечной ткани, на проницаемость биологических мембран, участвуют в процессах свертывания крови. Кальций обладает способностью накапливаться в местах повреждений тканей различными патогенными факторами. Так, при благоприятном течении туберкулеза с рубцеванием очагов в легких обнаруживаются скопления кальция в легочной ткани и бронхиальных железах, поэтому при туберкулезе легких рекомендуется применение солей кальция. Изменения уровня кальция в крови отмечаются при различных заболеваниях. При остеомаляции, остеомиелите, костном туберкулезе его содержание в крови снижено, а при опухолях костей — повышено.
Гипокальциемия приводит к развитию тетании, которая характеризуется повышенной возбудимостью и судорогами. Наиболее богатыми источниками кальция являются материнское молоко, сыр (примерно 900 мг на 100 г свежей массы), коровье молоко, свежие овощи.
Для нормальной деятельности организма очень важен фосфор. Этот элемент содержится в биологических жидкостях и тканях в виде различных соединений фосфорной кислоты. Помимо свободного (неорганического) фосфора, он встречается в соединении с белками, жирами и углеводами. Значение фосфатной буферной системы в организме велико. Совместно с кальцием фосфор участвует в построении костной ткани. Органические фосфорные соединения типа фосфопротеидов, фосфорных эфиров углеводов и продуктов их распада, макроэргические соединения широко представлены в организме.
Особенно велика потребность в фосфоре у женщин в период беременности и кормления, у детей — в период роста. Содержание фосфора в крови в норме находится в пределах 5-7 мг%. При заболеваниях его уровень изменяется, а при рахите он может снижаться до 2-3 мг%.
Железо относится к жизненно необходимым элементам, входя в состав гемоглобина, ряда окислительно-восстановительных ферментов (каталаза, пероксидаза, цитохромы и т. д.). Большая часть железа содержится в гемоглобине эритроцитов. Часть железа находится в соединении с белками в виде ферритина, который представляет его запасную форму. Процессы окисления в тканях могут протекать только в присутствии цитохромов, необходимым компонентом которых является железо. Последнее в теле человека совершает постоянный кругооборот. В норме при распаде эритроцитов 9/10 железа остаются в организме и используются снова для синтеза гемоглобина, что обеспечивает временную независимость организма от поступления железа извне. Уровень железа в плазме крови составляет 0,105 мг%. Эта величина отражает состояние запасов и является показателем обмена железа в организме.
Недостаточность железа в организме приводит к развитию микроцитарной и гипохромной анемии, которая чаще всего встречается у беременных женщин и детей до 1 года жизни.
Магния содержится в организме около 20 г. Около половины его находится в скелете и треть — в мышцах. Магний влияет на нервно-мышечную возбудимость, на деятельность сердца, необходим для деятельности ряда ферментов. Магний является в основном внутриклеточным ионом.
Микроэлементы содержатся в организме в минимальных количествах, но имеют очень важное значение.
К ним относятся медь, цинк, марганец, йод, кобальт молибден и др. Их биологическое значение проявляется преимущественно путем участия в построении или активировании ферментных систем организма. Помимо этого, ряд из них выполняет специфические функции. Так, кобальт входит в состав витамина В12 и его недостаток приводит к развитию пернициозной (злокачественной) анемии. Кроме того, кобальт влияет на повышение всасывания железа в кишечнике и включает его в состав гемоглобина, а также способствует синтезу белков мышц. Марганец, активируя деятельность декарбоксилазы, участвует в процессах спиртного брожения и аэробного окисления углеводов, оказывает определенное влияние на половое развитие и размножение. Медь обнаружена в составе ряда окислительных ферментов, структуре эритроцитов. Депо меди является печень. Медь оказывает заметное влияние также на повышение иммунобиологической устойчивости и сопротивляемости организма к вредному влиянию факторов внешней среды. Обмен меди тесно связан с обменом железа. При ее недостатке снижается использование железа. Транспортной формой меди считают церрулоплазмин. О значении йода подробно говорилось в связи с деятельностью щитовидной железы.
Рис. 65. Разница в развитии скелета у крыс одного помета при бедной и богатой кальцием диете
Кальций и фосфор имеют важное значение в организме. Они являются основными структурными компонентами костной ткани (рис. 65). Кальциевые соли фосфорной и угольной кислот влияют на возбуждение нервной и мышечной ткани, на проницаемость биологических мембран, участвуют в процессах свертывания крови. Кальций обладает способностью накапливаться в местах повреждений тканей различными патогенными факторами. Так, при благоприятном течении туберкулеза с рубцеванием очагов в легких обнаруживаются скопления кальция в легочной ткани и бронхиальных железах, поэтому при туберкулезе легких рекомендуется применение солей кальция. Изменения уровня кальция в крови отмечаются при различных заболеваниях. При остеомаляции, остеомиелите, костном туберкулезе его содержание в крови снижено, а при опухолях костей — повышено.
Гипокальциемия приводит к развитию тетании, которая характеризуется повышенной возбудимостью и судорогами. Наиболее богатыми источниками кальция являются материнское молоко, сыр (примерно 900 мг на 100 г свежей массы), коровье молоко, свежие овощи.
Для нормальной деятельности организма очень важен фосфор. Этот элемент содержится в биологических жидкостях и тканях в виде различных соединений фосфорной кислоты. Помимо свободного (неорганического) фосфора, он встречается в соединении с белками, жирами и углеводами. Значение фосфатной буферной системы в организме велико. Совместно с кальцием фосфор участвует в построении костной ткани. Органические фосфорные соединения типа фосфопротеидов, фосфорных эфиров углеводов и продуктов их распада, макроэргические соединения широко представлены в организме.
Особенно велика потребность в фосфоре у женщин в период беременности и кормления, у детей — в период роста. Содержание фосфора в крови в норме находится в пределах 5-7 мг%. При заболеваниях его уровень изменяется, а при рахите он может снижаться до 2-3 мг%.
Железо относится к жизненно необходимым элементам, входя в состав гемоглобина, ряда окислительно-восстановительных ферментов (каталаза, пероксидаза, цитохромы и т. д.). Большая часть железа содержится в гемоглобине эритроцитов. Часть железа находится в соединении с белками в виде ферритина, который представляет его запасную форму. Процессы окисления в тканях могут протекать только в присутствии цитохромов, необходимым компонентом которых является железо. Последнее в теле человека совершает постоянный кругооборот. В норме при распаде эритроцитов 9/10 железа остаются в организме и используются снова для синтеза гемоглобина, что обеспечивает временную независимость организма от поступления железа извне. Уровень железа в плазме крови составляет 0,105 мг%. Эта величина отражает состояние запасов и является показателем обмена железа в организме.
Недостаточность железа в организме приводит к развитию микроцитарной и гипохромной анемии, которая чаще всего встречается у беременных женщин и детей до 1 года жизни.
Магния содержится в организме около 20 г. Около половины его находится в скелете и треть — в мышцах. Магний влияет на нервно-мышечную возбудимость, на деятельность сердца, необходим для деятельности ряда ферментов. Магний является в основном внутриклеточным ионом.
Микроэлементы содержатся в организме в минимальных количествах, но имеют очень важное значение.
К ним относятся медь, цинк, марганец, йод, кобальт молибден и др. Их биологическое значение проявляется преимущественно путем участия в построении или активировании ферментных систем организма. Помимо этого, ряд из них выполняет специфические функции. Так, кобальт входит в состав витамина В12 и его недостаток приводит к развитию пернициозной (злокачественной) анемии. Кроме того, кобальт влияет на повышение всасывания железа в кишечнике и включает его в состав гемоглобина, а также способствует синтезу белков мышц. Марганец, активируя деятельность декарбоксилазы, участвует в процессах спиртного брожения и аэробного окисления углеводов, оказывает определенное влияние на половое развитие и размножение. Медь обнаружена в составе ряда окислительных ферментов, структуре эритроцитов. Депо меди является печень. Медь оказывает заметное влияние также на повышение иммунобиологической устойчивости и сопротивляемости организма к вредному влиянию факторов внешней среды. Обмен меди тесно связан с обменом железа. При ее недостатке снижается использование железа. Транспортной формой меди считают церрулоплазмин. О значении йода подробно говорилось в связи с деятельностью щитовидной железы.
Изучение минерального обмена в клинике
Значение минеральных элементов для нормальной жизнедеятельности организма очень велико, поэтому изменение их количества в организме, а следовательно, в крови и моче служит хорошим диагностическим средством для определения характера и степени поражения организма. Хлориды в цельной крови в норме составляют 295 мг%, по другим данным,- 370 мг%. Организм обладает способностью поддерживать относительное постоянство содержания NaCl в крови. В моче человек за сутки выделяет 8-15 г NaCl. Это количество колеблется в зависимости от его приема с пищей. Лихорадочные состояния, рак вызывают задержку хлоридов в организме. Накопление хлора в организме возможно при болезнях почек, малокровии. Снижение его содержания отмечается при обильной рвоте, отравлении сулемой. Калий в сыворотке крови содержится в пределах 20 мг%. Основная его масса находится в эритроцитах, поэтому увеличен г калия в сыворотке характеризует распад эритроцитов, различные заболевания печени (циррозы), бронхиальную астму, алиментарную дистрофию. Кальций и фосфор имеют очень важное значение особенно в детском организме, в связи с этим их определение в крови представляет клинический Интерес. Уровень кальция и фосфора резко снижен при рахите. Помимо этого, уменьшение кальция в крови (гипокальциемия) наблюдается при судорогах, поражениях почек, желтухах. Гиперкальциемия обнаруживается при злокачественных новообразованиях, с метастазами в костях, при переломах костей, параличах, нарушении функции паращитовидных желез. Гиперфосфатемия наблюдается при некоторых видах почечной недостаточности, тетанки, кишечной непроходимости, усиленной мышечной работе и т. д.Вопросы для повторения
1. Какие минеральные элементы содержатся в организме человека? 2. Какова потребность человека в минеральных элементах? 3. Какая роль минеральных элементов в жизнедеятельности организма? 4. Укажите на значение в обмене веществ калия, натрия, кальция, фосфора, хлора, железа. 5. Что такое микроэлементы и какое они имеют значение в организме? 6. Какие функции выполняют кобальт, йод, медь? 7. Как регулируется обмен минеральных элементов в организме? 8. Какие патологические состояния связаны с нарушением обмена минеральных элементов в организме?XIV. Химия крови
Основные функции крови
Кровь является внутренней средой организма и осуществляет связь между тканями и внешней средой. Необходимыми условиями нормальной жизнедеятельности всего организма является постоянство реакции крови, ее состава и физико-химических свойств. Значение крови для организма трудно переоценить. Так, кровь выполняет питательную функцию. Она обеспечивает необходимыми продуктами питания все органы и ткани организма. Получая их из кишечника, кровь разносит эти вещества к каждой клетке. Экскреторная функция крови заключается в выведении из организма всех конечных продуктов обмена веществ. Дыхательная функция крови состоит в Переносе различных газов. Она поставляет клеткам кислород и выводит углекислый газ. В этом процессе основное значение принадлежит гемоглобину. Регуляторная функция крови играет в организме важную роль. Поддержание осмотического давления, рН среды, кислотно-щелочного равновесия, обмена воды, процессов теплообмена — вот далеко не полный перечень факторов, которые находятся под контролем крови. Защитную функцию кровь выполняет благодаря наличию лейкоцитов, иммунных белков и антител, предохраняющих организм от некоторых инфекций. Способность к свертыванию крови является одним из важнейших защитных механизмов организма от потери крови при повреждениях сосудов.Физико-химические свойства крови
Кровь состоит из жидкой части — плазмы и взвешенных частиц — форменных элементов, к которым относятся эритроциты, лейкоциты и тромбоциты. Количество крови у человека составляет примерно 1/13 веса тела, что составляет примерно 5,0-5,5 л с удельным весом 1,05-1,06. Плазма крови составляет примерно около 55%, эритроциты — 44% и 1% приходится на долю остальных клеточных элементов. Плазма крови — это соломенно-желтая жидкость с удельным весом 1,027. Химический состав плазмы крови в мг% будет следующим
Как видно, важнейшей органической частью плазмы являются белки, в состав которых входит фибриноген. Свободная от фибриногена плазма называется сывороткой.
Плазма крови во многих отношениях является посредником между различными тканями организма. Она содержит конечные продукты обмена органов и тканей, которые выделяются почками. В плазме циркулируют гормоны, в незначительном количестве ферменты и продукты промежуточного обмена. Между плазмой крови и печенью существует особенно тесная связь, что прежде всего относится к белкам, а также к фосфолипидам и холестерину, значительная часть которых синтезируется в печени.
Химический состав плазмы крови в мг% будет следующим
Как видно, важнейшей органической частью плазмы являются белки, в состав которых входит фибриноген. Свободная от фибриногена плазма называется сывороткой.
Плазма крови во многих отношениях является посредником между различными тканями организма. Она содержит конечные продукты обмена органов и тканей, которые выделяются почками. В плазме циркулируют гормоны, в незначительном количестве ферменты и продукты промежуточного обмена. Между плазмой крови и печенью существует особенно тесная связь, что прежде всего относится к белкам, а также к фосфолипидам и холестерину, значительная часть которых синтезируется в печени.
Понятие о гомеостазисе
"Гомеостазис" в переводе на русский язык обозначает понятие "внутренняя среда организма". Еще в первой половине XIX века Клод Бернар впервые обратил внимание на большое значение интерстициальной (внеклеточной) жидкости, которая омывает все клетки и ткани организма. К ней относятся кровь, лимфа, тканевые жидкости. Химический состав внутренней среды организма зависит от многих продуктов реакций обмена веществ. Важнейшей особенностью внутренней среды организма является удивительное постоянство ее основных биохимических показателей. Эта способность живого организма поддерживать одинаковый внутренний климат для клеток и органов и была названа гомеостазисом, который в значительной степени определяется составом воды и минеральных веществ. Изменение их концентраций во внеклеточной жидкости немедленно отражается на деятельности органов и тканей. Поэтому изучение свойств внеклеточной жидкости имеет важное значение. Для характеристики внутренней среды организма существует ряд показателей, в том числе осмотическое и онкотическое давление, рН, величина кислотно-щелочного равновесия и др.Осмотическое давление
Давление любой жидкости, в том числе крови и лимфы, определяется молярной концентрацией растворенных в ней веществ, которые называются осмотически активными. К ним относятся как неэлектролиты (белок, мочевина, креатин, сахар и др.), так и различные соли (NaCl, HCl, NaHCO3, Na2HPO4 и др.). Последние в большей степени, чем неэлектролиты, влияют на величину осмотического давления. Это зависит от того, что соли в воде диссоциируют на ионы, которые в свою очередь являются осмотически активными веществами. Таким образом, достаточно высокое и постоянное содержание солей, в первую очередь NaCl, в биологических жидкостях способствует сохранению осмотического давления этих жидкостей на необходимом уровне. Кровь, лимфа и другие тканевые жидкости представляют собой водные растворы молекул и ионов многих веществ. Их суммарное осмотическое давление при температуре 37° составляет 7,7-8,1 атм. Катионы и анионы создают равное друг другу осмотическое давление. Осмотическое давление имеет очень большое физиологическое значение, поскольку кровь и лимфа, омывая все клетки человеческого организма, определяют целый ряд их жизненных функций-сохранение определенной формы, способности воспринимать извне и отдавать во внешнюю среду различные вещества и др. Постоянство осмотического давления поддерживается почками и другими регуляторными механизмами организма. Изучение состава веществ, определяющих осмотическое давление внеклеточной жидкости, имеет очень важное значение. В опытах с изолированными органами было установлено, что для обеспечения их жизнедеятельности можно пользоваться растворами, содержащими определенные соли в концентрациях, приближающихся к их уровню в крови. Поэтому в клинике при обидьных кровопотерях, тяжелых ожогах больному вводят в кровь растворы, осмотическое давление которых близко к осмотическому давлению крови. Лучше всех растворов отвечает этим требованиям раствор Рингера — Локка, в 1 л которого содержатся в граммах следующие вещества: глюкоза — 1,0, NACl — 9,0, КО — 0,2, СаСl2 — 0,2, МаНСO3 — 0,1. Такой раствор называется изотоническим (от греч. "изос" — равный). Осмотическое давление этого раствора примерно одинаково с таковым крови. Изотонический раствор еще называют физиологическим. В клинике часто пользуются раствором, содержащим в 100 мл воды 0,9 г NaCl (0,9% раствор), который приравнивается к физиологическому. Растворы, отличающиеся от изотонического большей или меньшей величиной осмотического давления, называют соответственно гипер- или гипотоническими.Онкотическое давление
Коллоидно-осмотическое давление, обусловленное наличием белков, называется онкотическим давлением. Оно невелико и составляет в норме всего около 0,04 атм, но его значение в биологических жидкостях очень важно. Например, при понижении содержания белков в крови (гипопротеин-емия), при голодании, заболеваниях пищеварительного тракта, почек возникает разница в онкотическом давлении в крови и тканевых жидкостях. В результате этого вода из крови устремляется в сторону более высокого давления, т. е. в ткани, чаще всего в подкожную клетчатку, где и накапливается. Возникают отеки, которые называют голодными, или почечными.рН среды
рН — показатель концентрации водородных ионов, который характеризует реакцию среды: кислую, щелочную или нейтральную. Концентрацию водородных ионов определяют исходя из того, что в 1 л воды в диссоциированном состоянии находится 1*10-14 грамм-ионов Н2О. Так как вода диссоциирует на один ион Н+ и один ион ОН-, то, следовательно, концентрация [Н+] и [ОН-] одинакова и равна 10-7 грамм-ионов. В этом случае реакция воды является нейтральной. При уменьшении концентрации [Н+] происходит соответствующее увеличение концентрации [ОН-]. Например, если концентрация [Н+] будет равной 10-3, то концентрация [ОН-] увеличивается до 10-11 и реакция среды будет щелочной. В случае преобладания концентрации Н+ над концентрацией ОН- реакция среды будет кислой. Таким образом, количественно реакцию среды выражают через концентрацию водородных ионов. Однако в практике пользуются не этой величиной, а так называемым водородным показателем, который представляет собой отрицательный десятичный логарифм концентрации водородных ионов и обозначается рН. Поэтому концентрация водородных ионов, равная 10-3 грамм-ионов (в 1 л), соответствует рН 3, а 1*10-7 — рН 7,0 и т. д. Нейтральная среда характеризуется рН 7,0. Кислотность растворов определяется значением рН в пределах от 0 до 7,0, щелочность — от 7,0 до 14,0. Величина рН является одной из важнейших констант внутренней среды и отличается постоянством. Так, рН крови находится в пределах 7,36-7,4. В связи с тем что в кровь постоянно поступают различные кислые или щелочные вещества, представляющие собой или продукты распада, или конечные метаболиты обмена веществ, поддержание постоянства реакции среды имеет очень важное значение. Незначительное смещение рН характеризует тяжелое состояние организма. Смещение рН крови в кислую или щелочную сторону называется соответственно ацидозом или алкалозом. В организме имеются различные регуляторные механизмы, совместное действие которых обеспечивает поддержание постоянства рН среды в допустимых пределах. К ним относятся* почки, легкие, кожа, буферные системы, которые контролируются центральной нервной системой. Участие в этом процессе легких связано с тем, что они выводят избыток углекислоты из организма. В печени происходят процессы обезвреживания токсических для организма продуктов обмена веществ, через почки выводится из организма избыток кислых или щелочных продуктов.Буферные системы крови
Важнейшими буферными системами организма являются бикарбонатная, фосфатная, белковая и гемоглобиновая. Буферными системами, или буферами, называют растворы, которые обладают способностью стойко сохранять постоянство среды при добавлении кислых или щелочных веществ. Буферы состоят из слабой кислоты и ее соли, образованной сильным основанием. Например, бикарбонатный буфер состоит из Н2СО3 и NaHCО3, белковый и гемоглобиновый — из белка или гемоглобина как слабых кислот и их солей натрия или калия. Фосфатная буферная система включает NaH2PО4 и Na2HPО3. Каждый буфер характеризуется определенным значением рН, который он стремится сохранить. Механизм их действия рассмотрим на примере бикарбонатного буфера. Как известно, в плазме крови и эритроцитах содержится свободная углекислота, а также ее соли, в плазме — NaHCO3, в эритроцитах — КНСО3, количество которых примерно в 20 раз выше концентрации углекислоты. При поступлении в кровь кислоты, например НСl, часть бикарбонатов тратится на ее нейтрализацию с образованием угольной кислоты: NaHCO3 + HCl → NaCl + H2CO3 Образовавшийся избыток угольной кислоты легко диссоциирует на воду и углекислый газ по следующему уравнению: Н2СO3 → Н2O + СO2 Повышенная концентрация СO2 действует раздражающе на дыхательный центр головного мозга, который усиливает вентиляцию легких и все избыточное количество СO2 выводится легкими, a NaCl — почками. В результате изменения рН крови не происходит. В случае увеличения в крови щелочных продуктов, которые обозначены как NaOH механизм действия буферной системы будет протекать так: Н2СO3 + NaOH → NaHCO3 + H2O Избыток образовавшегося бикарбоната выводится почками или связывается с белками. Фосфатный буфер крови состоит из NaH2PO4 и Na2HPO4. Первое соединение обладает свойствами слабой кислоты, а второе — слабой щелочи. Механизм действия этой буферной системы связан с деятельностью почек. Так, при появлении в тканях избытка ионов водорода (которые условно обозначим НС1) происходит их нейтрализация: Na2HPO4 + HCl → NaH2PO4 + NaCl Образовавшийся избыток NaH2PO4 и NaCl выводится из организма почками. В случае наличия в тканях избытка щелочных продуктов (NaOH) увеличивается образование Na2HPO4, который также выводится почками: NaH2PO4 + NaOH → Na2HPO4 + H2O И в этом случае рН среды не меняется. Белковый буфер состоит из белков плазмы крови и их солей, способных как амфотерные соединения диссоциировать и как кислоты, и как основания. Важнейшей буферной системой крови является гемоглобин эритроцитов. Его буферные свойства обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина (КНb) с образованием эквивалентных количеств калиевой соли соответствующей колоты и свободного гемоглобина: КНb + НСl → КСl + ННb Способность связывать ионы водорода выражена у солей гемоглобина сильнее, чем у солей оксигемоглобина. Перенос газов крови гемоглобином также является фактором участвующим в регуляции рН среды. В капиллярах происходит отщепление кислорода от оксигемоглобина и свободный гемоглобин может в большей степени связывать углекислоту. В то же время образование оксигемоглобина в легких способствует освобождению углекислоты и выведению ее из организма. Таким образом, буферные системы крови имеют большое значение в поддержании постоянной реакции среды. В клинике важно понятие "щелочного резерва", которое означает все факторы, обеспечивающие нейтрализацию кислот, в избытке появляющихся в ходе обмена веществ. С этих позиций следует определить ацидоз как состояние, при котором снижается щелочной резерв крови. Компенсированный ацидоз определяется как снижение щелочного резерва крови, при котором не происходит изменений рН крови. Некомпенсированный ацидоз характеризуется изменением реакции крови в кислую сторону. Алкалоз — это состояние, при котором щелочные резервы крови значительно повышены, что наблюдается, например, при "горной болезни" и др.Химический состав крови
Химический состав крови довольно постоянен, несмотря на то что в крови всегда находятся различные по составу и действию вещества. Любые сдвиги в химическом составе крови характеризуют какие-либо патологические процессы в организме. Поэтому исследование состава крови представляет большой интерес в клинике и помогает врачу в установлении диагноза. Кроме того, кровь наиболее доступная для исследования ткань организма.Белки плазмы крови
Основные функции белков плазмы заключаются в поддержании коллоидно-осмотического давления, защитной деятельности организма, транспорте нерастворимых в воде веществ (липоидов, металлов, жирорастворимых витаминов, гормонов, ферментов и др.), участии в свертывании крови и т. д. В настоящее время в составе белков плазмы выделено примерно до 40 различных белков со своими специфическими свойствами, часть из которых приведена ниже. Как видно из приведенных данных, основную часть белков плазмы составляют альбумины, которые в основном определяют онкотическое давление крови и способны связывать свободные жирные кислоты, холестерин, билирубин и т. д.
Глобулины представляют большую группу белков различной структуры с важными биологическими функциями. Во фракцию γ-глобулинов входят фибриноген, большая часть антител, а также многие факторы свертывания крови. Гаптоглобины способны соединяться с гемоглобином, предупреждая тем самым потерю железа. Липопротеиды выполняют транспортную роль.
Важное значение для клиники имеет определение количества и состава белков плазмы крови. Широкое применение имеет показатель А/Г (альбумины/глобулины), который в норме равен 1,5-2,3. При многих инфекционных заболеваниях количество глобулинов повышается и показатель соответственно снижается. При воспалениях почек и печени отмечается повышение А/Г.
Как видно из приведенных данных, основную часть белков плазмы составляют альбумины, которые в основном определяют онкотическое давление крови и способны связывать свободные жирные кислоты, холестерин, билирубин и т. д.
Глобулины представляют большую группу белков различной структуры с важными биологическими функциями. Во фракцию γ-глобулинов входят фибриноген, большая часть антител, а также многие факторы свертывания крови. Гаптоглобины способны соединяться с гемоглобином, предупреждая тем самым потерю железа. Липопротеиды выполняют транспортную роль.
Важное значение для клиники имеет определение количества и состава белков плазмы крови. Широкое применение имеет показатель А/Г (альбумины/глобулины), который в норме равен 1,5-2,3. При многих инфекционных заболеваниях количество глобулинов повышается и показатель соответственно снижается. При воспалениях почек и печени отмечается повышение А/Г.
 Рис. 66. Разделение белкой плазмы по Кону. Внутри — название отдельных фракций, средний круг — значение фракций; наружный — клиническое применение
В связи с использованием современных методов биохимического анализа белков, например электрофореза, стали известны отдельные фракции белков, например: α-, β- и γ-глобулины, которые имеют важное значение в диагностике заболеваний. Так, при циррозе печени значительно снижен уровень альбуминов и повышена концентрация γ-глобулинов; нефрозы характеризуются снижением альбуминов и γ-глобулинов и увеличением α- и β-глобулинов: при ожогах, голодании уменьшается количество альбуминов; инфаркт миокарда, переломы костей приводят к увеличению уровня а-глобулинов (рис. 66, 67).
Рис. 66. Разделение белкой плазмы по Кону. Внутри — название отдельных фракций, средний круг — значение фракций; наружный — клиническое применение
В связи с использованием современных методов биохимического анализа белков, например электрофореза, стали известны отдельные фракции белков, например: α-, β- и γ-глобулины, которые имеют важное значение в диагностике заболеваний. Так, при циррозе печени значительно снижен уровень альбуминов и повышена концентрация γ-глобулинов; нефрозы характеризуются снижением альбуминов и γ-глобулинов и увеличением α- и β-глобулинов: при ожогах, голодании уменьшается количество альбуминов; инфаркт миокарда, переломы костей приводят к увеличению уровня а-глобулинов (рис. 66, 67).
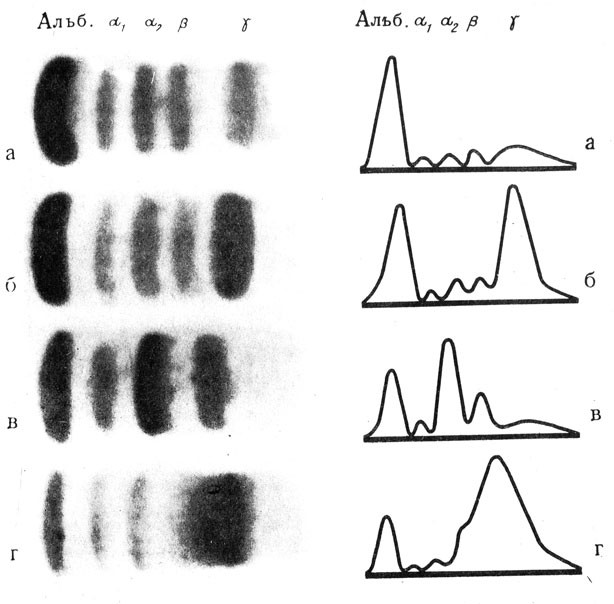 Рис. 67. Бумажная электрофореграм-ма при патологических состояниях. а — нормальная сыворотка; б — плазмоцитома; в — нефроз; г — цирроз печени
К белкам плазмы относятся и ферменты. Часть из них всегда присутствует в плазме крови, а некоторые из них появляются в крови только при патологических процессах, связанных с нарушением клеточных структур. Поэтому изучение активности ферментов при заболеваниях имеет большое диагностическое значение. В зависимости от природы органа и характера заболевания в кровь поступают специфические ферменты. Часто ферменты позволяют обнаружить начало патологии до ее клинического проявления. Так, обнаружение в крови повышенных количеств фосфомоно-эстеразы (щелочной фосфатазы) свидетельствует о развитии рахита еще в доклинический период рахита. В первые часы развития инфаркта миокарда в крови отмечается повышение активности лактатдегидрогеназы и аминотрансферазы. В нашей стране сейчас широко применяется разработанная акад. А. А. Покровским ультрамикросистема определения активности ферментов с использованием очень малых количеств материала для анализа.
Рис. 67. Бумажная электрофореграм-ма при патологических состояниях. а — нормальная сыворотка; б — плазмоцитома; в — нефроз; г — цирроз печени
К белкам плазмы относятся и ферменты. Часть из них всегда присутствует в плазме крови, а некоторые из них появляются в крови только при патологических процессах, связанных с нарушением клеточных структур. Поэтому изучение активности ферментов при заболеваниях имеет большое диагностическое значение. В зависимости от природы органа и характера заболевания в кровь поступают специфические ферменты. Часто ферменты позволяют обнаружить начало патологии до ее клинического проявления. Так, обнаружение в крови повышенных количеств фосфомоно-эстеразы (щелочной фосфатазы) свидетельствует о развитии рахита еще в доклинический период рахита. В первые часы развития инфаркта миокарда в крови отмечается повышение активности лактатдегидрогеназы и аминотрансферазы. В нашей стране сейчас широко применяется разработанная акад. А. А. Покровским ультрамикросистема определения активности ферментов с использованием очень малых количеств материала для анализа.
 Рис. 68. Изоферментные спектры лактатдегидрогеназы различных тканей ' человека. а — сердечная мышца; б — печень; в — почки: г — скелетная мускулатура
В последние годы было обнаружено, что некоторые ферменты в одном и том же организме представлены различными молекулярными формами. Ферменты, катализируя одну и ту же реакцию, отличаются между собой некоторыми физическими, химическими и иммунобиологическими свойствами. Такие формы ферментов были названы изоферментами (изоэнзимами). Различные изоформы фермента характеризуются различной органоспецифичностью. Так, одна из форм лактатдегидрогеназы наибольшую активность проявляет в печени, другая — в сердце (рис. 68). Это свойство ферментов имеет также большое значение при правильной постановке диагноза.
Рис. 68. Изоферментные спектры лактатдегидрогеназы различных тканей ' человека. а — сердечная мышца; б — печень; в — почки: г — скелетная мускулатура
В последние годы было обнаружено, что некоторые ферменты в одном и том же организме представлены различными молекулярными формами. Ферменты, катализируя одну и ту же реакцию, отличаются между собой некоторыми физическими, химическими и иммунобиологическими свойствами. Такие формы ферментов были названы изоферментами (изоэнзимами). Различные изоформы фермента характеризуются различной органоспецифичностью. Так, одна из форм лактатдегидрогеназы наибольшую активность проявляет в печени, другая — в сердце (рис. 68). Это свойство ферментов имеет также большое значение при правильной постановке диагноза.
Небелковые азотистые вещества
В крови всегда присутствуют в небольшом количестве некоторые конечные продукты азотистого обмена, к которым относятся полипептиды, аминокислоты, мочевина, мочевая кислота, креатин, креатинин, билирубин и др. Полипептиды поступают в кровь из кишечника при переваривании белков и из тканей как промежуточные продукты обмена белка. Уровень полипептидов в крови составляет 0,1-3 мг% азота. Аминокислоты всегда циркулируют в крови. Это аминокислоты, поступившие с пищей или синтезированные в организме. Их количество повышается при переваривании белков и их всасывании. Очень быстро их уровень в крови снижается в связи с тем, что клетки тканей извлекают необходимые аминокислоты из крови для построения тканевых белков и других азотсодержащих веществ. Из аминокислот почти треть приходится на долю глютаминовой кислоты и глютамина, которые являются одними из основных веществ, участвующих в связывании аммиака. Распределение аминокислот между плазмой и форменными элементами крови различно. Так, в плазме содержится 4,8-6,8 мг% азота аминокислот, а в эритроцитах — 8,8- 10,4 мг%. Отношение этих двух величин: Азот аминокислот в эритроцитах/Азот аминокислот в плазме = 1,52 — 1,82. отличается постоянством и изменяется только при тяжелых заболеваниях. Мочевина в крови содержится в количестве 20-30 мг%. При избыточном поступлении белков с пищей, повышенном потоотделении уровень мочевины в крови увеличивается. Стойкое увеличение мочевины в крови против нормы наблюдается при заболеваниях почек, злокачественных опухолях, малокровии и т. д. Мочевая кислота в норме в крови составляет 3-4 мг% и увеличивается до 6-8 мг% при подагре. Креатин в крови находится в основном в эритроцитах. Его определяют совместно с креатинином (1,0-1,5 мг% креатина и 1,0-1,2 мг% креатинина). Гиперкреатинемия наблюдается при поражениях печени, усиленном распаде мышечной ткани. Билирубин (0,25-1,5 мг%) является продуктом распада гемоглобина, уровень которого повышается при заболеваниях печени.Остаточный азот
Состояние белкового обмена в норме и при патологии можно обнаружить при исследовании ряда показателей. К ним относятся белки плазмы крови (их количественная и качественная характеристика) и небелковые азотсодержащие вещества, определяемые в крови и моче. В клинике широко используют методы определения общего и остаточного азота. Под общим азотом понимают всю сумму азотистых веществ в крови. К остаточному, или небелковому, азоту относится азот веществ, оставшихся после осаждения белков. В состав остаточного азота входит азот мочевины, мочевой кислоты, аминокислот, креатина, креатинина, полипептидов. В норме в сыворотке взрослого человека содержится 1200-1430 мг% (в среднем 1315 мг%) общего азота и 23,0-37,0 мг% (в среднем 30,0 мг%) остаточного. Разность общего и остаточного азота дает величину белкового азота, уровень которого в норме составляет 1177-1393 мг%(в среднем 1285 мг%). Повышение белка в сыворотке крови (гиперпротеинемия) наблюдается при ревматизме, а понижение (гипопротеинемия) при нефрозах, истощении, белковом голодании и раке. Из общего количества остаточного азота на долю мочевины приходится более половины азота — 19,3 мг% (13-26, мг%), на долю аминокислот — четвертая часть (3,37-4,97 мг%). При снижении уровня мочевины уменьшается и количество остаточного азота, т. е. существует прямая пропорциональность между величиной остаточного азота и уровнем мочевины. Поэтому в клинической практике часто по определению концентрации мочевины делают заключение о количестве остаточного азота. Азотемия — увеличение в крови остаточного азота наблюдается при заболеваниях почек, особенно при их недостаточности, усиленном распаде белка в организме. Снижение уровня остаточного азота обнаруживается при голодании, некоторых острых заболеваниях печени и др. Азотемия может быть абсолютной и относительной. Относительная азотемия встречается в случаях больших потерь воды организмом (рвота, поносы). Абсолютная азотемия связана с уменьшением образования белков в организме (сахарный диабет) или с усиленным распадом белков (кровотечения, тяжелые ранения, тяжелые инфекционные заболевания, поражение печени).Безазотистые вещества крови
В крови постоянно циркулирует большая группа соединений, представляющих собой питательные вещества или промежуточныепродукты их обмена. К ним относятся глюкоза, молочная кислота, триглицериды, липоиды, холестерин, свободные жирные кислоты, минеральные соли и др. Глюкоза в крови содержится в пределах 80-120 мг%. Этот уровень отличается постоянством. Гипо- или гипергликемии бывают физиологическими или патологическими. К физиологическим относятся изменения уровня глюкозы в зависимости от питания, в период беременности и т. д. Патологическое увеличение или уменьшение глюкозы возникает при различных заболеваниях (сахарный диабет, гликогенозы, галактоземия и др.). Молочная кислота присутствует в крови в небольших количествах — 5,0-15 мг на 100 мл плазмы. Она увеличивается при поражении печени и тяжелой мышечной работе. Ацетоновые тела в крови составляют 0,1-0,5 мг%. Их увеличение имеет большое клиническое значение, так как наблюдается при сахарном диабете, голодании, рвотах. Липиды в цельной крови находятся на уровне 380 мг%. В плазме их количество в несколько раз выше, чем в эритроцитах. Повышение жира в крови называется липемией. Физиологическую липемию, вызванную приемом большого количества жирной пищи, отличают от патологической, имеющей в своей основе нарушения процессов обмена жира. Туберкулез, алкоголизм характеризуются стойкой липемией, достигающей иногда 10 г на 100 мл крови. Триглицериды в основном сосредоточены в плазме и составляют 100 — 250 мг%. Общего холестерина в крови содержится 15.0- 250 мг%. Его уровень значительно повышается при атеросклерозе, подагре, ожирении, сахарном диабете. Лецитина больше в эритроцитах, чем в плазме,- соответственно 350 и 150 мг%. Минеральные элементы крови представлены в табл. 12. Таблица 12. Содержание минеральных веществ в крови (в мг на 100 мл)
В крови также присутствует большая группа микроэлементов (йод, цинк, кобальт и др.), которые участвуют в важнейших обменных процессах.
При заболеваниях наблюдаются отклонения в количествах минеральных веществ. При лихорадке уровень NaCl снижается, при болезнях почек — увеличивается. Содержание кальция и фосфора уменьшается при рахите, калия и натрия — при адиссоновой болезни, кальция — при титании.
Таблица 12. Содержание минеральных веществ в крови (в мг на 100 мл)
В крови также присутствует большая группа микроэлементов (йод, цинк, кобальт и др.), которые участвуют в важнейших обменных процессах.
При заболеваниях наблюдаются отклонения в количествах минеральных веществ. При лихорадке уровень NaCl снижается, при болезнях почек — увеличивается. Содержание кальция и фосфора уменьшается при рахите, калия и натрия — при адиссоновой болезни, кальция — при титании.
Эритроциты, лейкоциты и тромбоциты
Эритроциты — это красные кровяные клетки, которые в организме выполняют дыхательную функцию: транспортируют кислород и углекислый газ по крови, а также регулируют содержание аминокислот и полипептидов в плазме (Б. И. Збарский). В 1 мм3 крови содержится 4-5,5 млн. эритроцитов. Они представляют собой двояковогнутый диск, окруженный мембраной. Местом образования эритроцитов является в основном костный мозг, а также селезенка и печень. Продолжительность жизни эритроцитов в циркулирующей крови составляет около 100 дней. Процесс созревания эритроцитов представляет собой сложный и сравнительно длительный процесс, когда из ядросодержащих клеток через стадии нормобластов, ретикулоцитов образуются эритроциты. Из белков эритроцитов важнейшее значение принадлежит гемоглобину, содержание которого может доходить до 41%. Во всем количестве эритроцитов человека содержится примерно 800 г гемоглобина. В цельной крови количество гемоглобина составляет 13-18 г%. В настоящее время обнаружены различные формы гемоглобинов, отличающиеся по аминокислотному составу глобина — его белковой части. У эмбрионов человека на 7-12-й неделе обнаружен примитивный гемоглобин (НbР), который в дальнейшем замещается фетальным (HbF). Последний составляет 70-90% всего гемоглобина детей. У взрослого человека основную массу гемоглобина составляет гемоглобин A1 (HbA1). При некоторых заболеваниях (серповидноклеточная анемия, талассемия) в крови больных обнаруживаются патологические формы гемоглобинов, получивших обозначения С, D, S и др. Эти заболевания относятся к наследственной патологии, в основе которой лежит нарушение процесса синтеза глобина. При повреждении мембраны эритроцита под действием измененного осмотического давления, различных токсинов гемоглобин выходит в плазму. Такой процесс называется гемолизом. Уменьшение в крови гемоглобина приводит к развитию различных анемий. Снижение гемоглобина до 5% ведет к смерти. В клинике имеет большое значение определение количества гемоглобина крови. Его концентрация у взрослых людей варьируете пределах 13-18 г%, у ребенка после рождения составляет 19,5 г%, ко второму месяцу снижается до 11,5 г%.и постепенно достигает уровня взрослых людей к 12 годам. В клинике существуют различные методы определения гемоглобина, из которых наиболее распространенным является метод Сали, когда после прибавления к крови соляной кислоты гемоглобин превращается в солянокислый гематин коричневого цвета и по сравнению его окраски с окраской стандартного раствора определяют концентрацию гемоглобина. Другим показателем, применяемым для анализа красных кровяных телец, является цветной показатель. Последний позволяет получить представление о содержании гемоглобина в эритроцитах, на чем основана клиническая классификация анемий. Реакция оседания эритроцитов (РОЭ) является одной из самых важных и широко распространенных лабораторных методов исследования. Сущность ее состоит в том, что кровь, стабилизированная какими-либо веществами, оставленная в вертикальном сосуде, через некоторое время просветляется за счет оседания эритроцитов и других форменных элементов крови. Как установлено, скорость оседания эритроцитов у здоровых людей приблизительно одинакова и составляет 5-10 мм в час. При уменьшении показателя А/Г (острая стадия ревматизма, злокачественные новообразования, почечные заболевания, анемии) РОЭ ускорена. При сердечных и печеночных заболеваниях РОЭ замедлена. В клинической практике важное значение придают также методам исследования гемостаза, свертывания крови, ломкости капилляров. Лейкоциты. В 1 мм3 крови содержится 5-6 тыс. белых кровяных телец. Они подразделяются на ряд форм в зависимости от формы ядра и способа окраски. Лейкоциты участвуют в процессах фагоцитоза — захватывания и переваривания инородных тел и бактерий. В местах воспаления всегда много лейкоцитов, которые в своей массе образуют гной. Тромбоциты. Это безъядерные клетки. В 1 мм3 крови их содержится 200-300 тыс. Тромбоциты участвуют в процессах свертывания крови.Свертывание крови
Процесс свертывания крови является очень сложным и до конца не выяснен. Схематично его можно представить следующим образом: При кровотечении происходит склеивание тромбоцитов, которое приводит к их распаду, а при участии Са++, АТФ и ряда так называемых факторов — VIII, IX и др.- образуется Активный тромбопластин. Последний, действуя на протромбин плазмы, который по структуре представляет собой глюкопротеид, а по функции — профермент, переводит его в тромбин. Тромбин является протеолитическим ферментом и гидролизует фиброген — фибриллярный белок с молекулярным весом 330 000 — на молекулы полипептидов с молекулярным весом 300. Последние полимеризуются в фибрин, который и формирует сгусток. В дальнейшем под действием фибринолизина (плазмина) сгусток распадается.
К факторам, тормозящим свертывание крови, относятся гепарин, соли лимонной кислоты.
При кровотечении происходит склеивание тромбоцитов, которое приводит к их распаду, а при участии Са++, АТФ и ряда так называемых факторов — VIII, IX и др.- образуется Активный тромбопластин. Последний, действуя на протромбин плазмы, который по структуре представляет собой глюкопротеид, а по функции — профермент, переводит его в тромбин. Тромбин является протеолитическим ферментом и гидролизует фиброген — фибриллярный белок с молекулярным весом 330 000 — на молекулы полипептидов с молекулярным весом 300. Последние полимеризуются в фибрин, который и формирует сгусток. В дальнейшем под действием фибринолизина (плазмина) сгусток распадается.
К факторам, тормозящим свертывание крови, относятся гепарин, соли лимонной кислоты.
Вопросы для повторения
1. Назовите основные функции крови. 2. Каковы физико-химические свойства крови? 3. Чем отличается плазма от сыворотки? 4. Что такое гомеостазис? 5. Какими показателями характеризуется внутренняя среда организма? 6. Что такое осмотическое давление и чем оно обеспечивается? 7. Что такое изотонический, гипотонический и гипертонический растворы? 8. Что такое онкотическое давление и чем оно обеспечивается? 9. Какова величина рН крови в норме? 10. Дайте определение ацидоза и алкалоза. 11. Что называется буферными растворами? 12. Укажите основные буферные системы организма. 13. Каков механизм действия буферных систем на примере бикарбонатной системы? 14. Какой химический состав крови? 15. Какие белковые фракции входят в состав плазмы крови? 16. Какова роль различных белковых фракций крови? 17. Каково происхождение ферментов крови? 18. Какое имеет значение определение ферментов крови для диагностики заболеваний? 19. Что такое изоферменты и какое они имеют значение? 20. Назовите небелковые азотистые вещества крови. 21. Что обозначается как остаточный азот крови и каково клиническое значение его определения? 22. Чем представлены безазотистые вещества крови? 23. Каков химический состав эритроцитов, лейкоцитов и тромбоцитов? 24. Каков механизм свертывания крови? 25. Каково клиническое значение определения составных частей крови?XV. Химия мочи
Моча в организме вырабатывается почками. Последние представляют собой парный орган, основной функцией которого является выведение из организма конечных продуктов обмена и поддержание постоянства состава жидкостей тела (гомеостазиса). Все продукты метаболизма клетки вначале поступают в кровь, которая доставляет их в почки. Объем крови, протекающей через почки, составляет около 1 л в минуту, т. е. 1500 л в сутки, а выделяется мочи 1,2-1,5 л. Особенность деятельности почек заключается в том, что они не только выводят из организма подлежащие удалению вещества и обеспечивают обратное всасывание (ресорбцию) ряда важных соединений, но и сами секретируют отдельные вещества. Все это свидетельствует о том, что почки являются органом с очень интенсивным обменом. Процесс образования мочи в почках состоит из нескольких этапов. Вначале в клубочках происходит образование первичной мочи, которая содержит все компоненты плазмы крови, за исключением белков. В канальцах основное количество выделившейся воды в клубочках и часть растворенных веществ подвергаются ресорбции и образуется окончательная моча, с более высоким содержанием ряда веществ, чем в плазме. Состав нормальной мочи за сутки приводится ниже.
Физико-химические свойства мочи
Моча представляет собой прозрачную, желтоватую жидкости, цвет которой определяется присутствием почти 150 различных веществ. Свежевыпущенная моча всегда прозрачна, но при непродолжительном стоянии в ней появляется муть, которая зависит от муцина и отдельных клеток эпителия мочевыводящих путей. Реакция мочи в норме слабо кислая, однако она зависит от состава суточного рациона: при питании, в основном растительной пищей, реакция мочи становится слабо щелочной, тогда как мясная пища обусловливает слабо кислую реакцию мочи. Цвет мочи зависит от наличия многих веществ, в основном пигментов типа уробилина, урохрома и др., количество которых составляет около 70-75 мг. В сутки человек выделяет в среднем 1,2-1,5 л (мужчина — 1,5 л, женщина — 1,2 л). Количество выделяемой мочи — величина диуреза — зависит от ряда причин. К числу физиологических факторов относятся режим питания, количество выпитой воды, температура воздуха и др. Например, при жаркой погоде усиливается потоотделение, снижается количество мочи (олигурия) и повышается концентрация ее составных частей. При различных заболеваниях уровень мочи может меняться от полного прекращения выделения мочи (анурия) до выделения необычно больших количеств (полиурия). Анурия может возникнуть при сильных нервных потрясениях, отравлении почек солями ртути, сильных отеках. В этом случае организм отравляется конечными продуктами обмена веществ. Полиурия является симптомом "несахарного" диабета, который возникает при нарушении выработки гормона вазопрессина. Удельный вес мочи в норме у здоровых людей составляет 1,002-1,040. Повышение его наблюдается при олигурии и анурии.Химический состав мочи
Органические составные части мочи
Из органических веществ в моче имеются продукты азотистого обмена (мочевина, мочевая кислота, пуриновые основания, креатин, креатинин), гиппуровая кислота, производные серной и глюкуроновой кислот, ацетон, органические кислоты и др. За сутки с мочой выделяется 10-18 г общего азота, из которых 80-90% приходится на долю мочевины. При обычной пище за сутки выводится 20-35 г мочевины. При избытке белка в питании уровень мочевины повышен (гиперазотурия). Причинами гиперазотурии являются тяжелые патологические процессы, связанные с усиленным распадом тканевых белков. Гипоазотурия возникает как следствие заболеваний печени (рак, цирроз, жировое перерождение и др.). Аминокислот в норме выделяется 20-70 мг. Суточная экскреция мочевой кислоты составляет примерно ,6-0,7 г, но зависит от пуриновых оснований пищи. Выделение креатинина (производное креатина) составляет 1-1,5 г в сутки. Из других органических веществ в моче содержится индикан, количество которого увеличивается при заболеваниях желудочно-кишечного тракта, В моче также обнаруживаются некоторые гормоны, витамины группы В, витамин С, некоторые ферменты, ацетон и органические кислоты, уровень которых исчисляется миллиграммами и микрограммами.Неорганические составные части мочи
В моче содержится 15-25 г минеральных веществ, из которых на долю NaCl приходится 8-15 г. Концентрация этой соли в моче зависит от рода пищи. Калий, магний, кальций всегда содержатся в моче в небольших количествах — 0,1-0,2 г. Аммиак выводится из организма в виде аммонийных солей, в пределах 0,3-0,6 г общего азота мочи. При ацидозе это количество увеличивается. К числу наиболее важных анионов мочи относятся анионы фосфорной и серной кислот. Количество РО3-4 за сутки составляет примерно 4 г. Сульфаты мочи происходят главным образом из цистеина и метионина и составляют 2,5 г. При интенсивном распаде тканевых белков концентрация сульфатов увеличивается. При питании в основном растительной пищей в моче обнаруживаются бикарбонаты.Патологические составные части мочи
В клинике имеет большое значение определение некоторых веществ, которые в норме в моче не встречаются. К ним относятся белок, сахар, желчные и кровяные пигменты и др. Протеинурия (альбуминурия). При острых воспалительных заболеваниях почек, расстройствах сердечной деятельности, беременности в моче может появиться белок, в частности сывороточный белок в концентрации 0,2-0,5% и выше. При поражении костей в моче также может появиться белок, который выпадает в осадок при нагревании мочи до температуры 60-70°, а при 80° он вновь переходит в растворенное состояние. Этот белок называется белком Бенс-Джонса по имени врача, впервые его описавшего. Открытие этого белка в моче имеет важное диагностическое значение при поражении органического вещества костей. Гематурия и гемоглобинурия. Появление в моче форменных элементов крови носит название гематурии. Это состояние возникает при ранениях мочеточников, повреждении мочеполовых путей. Моча при гематурии имеет темно-красный цвет. При разрушении эритроцитов в моче обнаруживается гемоглобин — гемоглобинурия. Этот тяжелый симптомокомплекс появляется при ожогах, тяжелых инфекциях, отравлениях. Глюкозурия. При сильных психических потрясениях, сахарном диабете, приеме больших количеств глюкозы в моче появляется сахар, количество которого может достигать 100-200 мг. Кетонурия (ацетонурия). Это состояние характеризуется наличием в моче больших количеств ацетоновых тел (ацетон, ацетоно-уксусная и (3-оксимасляная кислоты). В норме кетоновые тела в моче в сутки выделяются в пределах 20-30 мг. При сахарном диабете их количество возрастает до 60 г. Желчные пигменты и желчные кислоты обнаруживаются в моче при закупорке желчного протока, болезни Боткина, различных видах желтух. В моче также можно обнаружить соли мочевой кислоты.Анализ мочи в клинике
При заболеваниях, связанных с нарушением деятельности органов, отмечается изменение состава крови, что в свою очередь отражается и на составе мочи. Изменения могут касаться физических, химических свойств мочи, появления веществ, которые в норме не встречаются, или нарушения соотношения нормальных составных частей мочи. Следовательно, анализ качественного и количественного состава мочи имеет в клинике важное диагностическое значение. Для анализа используют как одноразовую, так и суточную мочу. Последняя более точно отражает состояние организма.XVI. Пищеварение
 Рис. 69. Обобщение процессов пищеварения
Жизнедеятельность организма обеспечивается процессом питания. Принятые с пищей белки, жиры, углеводы обладают видовой и тканевой специфичностью, характерной для животных и растительных продуктов, и поэтому в такой форме не могут быть использованы для построения тела человека. Отсюда вытекает биологическая необходимость пищеварения. Оно заключается в том, что сложные молекулы продуктов питания расщепляются до низкомолекулярных органических веществ (так, белки распадаются до аминокислот, углеводы до моносахаридов и т. д.), которые, всосавшись в пищеварительном тракте, служат строительным материалом для органов и тканей организма человека. Переваривание пищевых продуктов является одной из главных форм взаимосвязи организма с окружающей средой. Оно происходит в желудочно-кишечном тракте, слизистая оболочка которого обеспечивает усвоение и всасывание питательных веществ. Это обеспечивается взаимодействием механических и химических процессов, которые регулируются нейро-гуморальными механизмами, условными и безусловными рефлексами, контактом пищи со слизистой оболочкой пищеварительного тракта и т. д. (рис. 69). Пищеварение осуществляется с помощью ферментов, относящихся в основном к классу гидролаз (табл. 13).
Рис. 69. Обобщение процессов пищеварения
Жизнедеятельность организма обеспечивается процессом питания. Принятые с пищей белки, жиры, углеводы обладают видовой и тканевой специфичностью, характерной для животных и растительных продуктов, и поэтому в такой форме не могут быть использованы для построения тела человека. Отсюда вытекает биологическая необходимость пищеварения. Оно заключается в том, что сложные молекулы продуктов питания расщепляются до низкомолекулярных органических веществ (так, белки распадаются до аминокислот, углеводы до моносахаридов и т. д.), которые, всосавшись в пищеварительном тракте, служат строительным материалом для органов и тканей организма человека. Переваривание пищевых продуктов является одной из главных форм взаимосвязи организма с окружающей средой. Оно происходит в желудочно-кишечном тракте, слизистая оболочка которого обеспечивает усвоение и всасывание питательных веществ. Это обеспечивается взаимодействием механических и химических процессов, которые регулируются нейро-гуморальными механизмами, условными и безусловными рефлексами, контактом пищи со слизистой оболочкой пищеварительного тракта и т. д. (рис. 69). Пищеварение осуществляется с помощью ферментов, относящихся в основном к классу гидролаз (табл. 13).
 Таблица 13. Содержание ферментов в пищеварительных соках
Пищеварительные ферменты вырабатываются особыми железами или отдельными клетками, расположенными по всей длине желудочно-кишечного тракта, на разных участках которого рН среды различный. Этим обеспечивается оптимальная активность ферментов для полного переваривания продуктов питания.
Ежедневно в пищеварительный тракт выделяется около 8 л пищеварительных секретов, которые большей частью всасываются вместе с питательными веществами. Характерным для желудочно-кишечного тракта является наличие слизи, которая служит обволакивающим и защитным средством.
Таблица 13. Содержание ферментов в пищеварительных соках
Пищеварительные ферменты вырабатываются особыми железами или отдельными клетками, расположенными по всей длине желудочно-кишечного тракта, на разных участках которого рН среды различный. Этим обеспечивается оптимальная активность ферментов для полного переваривания продуктов питания.
Ежедневно в пищеварительный тракт выделяется около 8 л пищеварительных секретов, которые большей частью всасываются вместе с питательными веществами. Характерным для желудочно-кишечного тракта является наличие слизи, которая служит обволакивающим и защитным средством.
Пищеварение в ротовой полости
Пищеварение начинается в ротовой полости, где пища подвергается механической обработке, смачивается слюной и становится доступной для продвижения по пищебоду. Слюна вырабатывается околоушной, подъязычной, подчелюстной железами. рН слюны находится в нейтральной зоне. Слюнные железы вырабатывают за сутки около 1,5 л слюны, состав и количество которой зависят от состава пищи и других факторов. Фундаментальные исследования И. П. Павлова показали, что различные раздражители вызывают неодинаковую реакцию со стороны слюнных желез. Если мясо, влажная пища вызывают небольшое слюноотделение, то сухая пища, раздражители типа кислот, перца приводят к подъему секреции слюнных желез. В слюне содержится большое количество амилазы, которая составляет около 10% всего белка слюны, причем большая ее часть (70%) выделяется околоушной железой. Указывается на возможное присутствие также мальтазы. Других ферментов здесь не обнаружено. В ротовой полости пища находится очень непродолжительное время, поэтому расщепление углеводов амилазой и мальтазой очень кратковременно. Однако этот процесс продолжается и в желудке до пропитывания пищевого комка кислым желудочным соком, который инактивирует амилазу.Пищеварение в желудке
Желудочный сок представляет собой смесь выделений различных клеток. В сутки его количество составляет примерно 2-3 л и рН равен 1,5-1,8. Важнейшими составными частями желудочного сока являются соляная кислота, слизистые вещества, "внутренний фактор Кастла", гистамин, основные протеолитические ферменты — пепсин и гастриксин и липаза. Последняя оказывает на переваривание жира незначительное действие, так как ее оптимум лежит в пределах 5,0-8,0. Желудочная слизь образуется в добавочных клетках, содержит нейтральные мукопротеиды и мукополисахариды. Ей приписывают защитную функцию от действия соляной кислоты и самопереваривания. Соляная кислота образуется в париетальных клетках желудка и стимулируется гистамином. Она выполняет две основные функции: активирует пепсиноген, превращая его в пепсин, и способствует денатурации белков, которые быстрее перевариваются протеолитическими ферментами. Важнейшим физиологическим процессом в желудке является переваривание белков, которое осуществляют пепсин и гастриксин. Оптимум действия пепсина лежит в пределах рН 1,5-2,5, а гастриксина — 3,5-5,0. Последний имеет важное значение в переваривании белков у детей, желудочный сок которых беден соляной кислотой. Изучение физиологии желудочной секции основано на классических опытах И. П. Павлова с использованием наложения фистулы для выведения секрета наружу, получения "малого" желудка с сохраненной иннервацией и кровоснабжением и метода "мнимого кормления". В клинической практике имеет важное значение анализ желудочного сока, когда определяют его количество, кислотность и переваривающую силу. Желудочный сок получают одномоментно, с использованием толстого зонда или фракционно, когда берут сок несколько раз в течение 1 1/2-2 часов (тонкий зонд). Взятие желудочного сока производится натощак или после пробного завтрака, состоящего из 30-40 г белого хлеба и 2 стаканов кипяченой воды или мясного бульона при фракционном методе. В желудочном соке определяют общую кислотность, общую, свободную и связанную соляную кислоты. Под общей кислотностью понимают все кислореагирующие вещества желудочного сока (свободная и связанная соляная кислота, органические кислоты и кислые фосфорнокислые соли). Соляную кислоту, связанную с белками и продуктами их переваривания, условно называют "связанная соляная кислота", несвязанную соляную кислоту — "свободная соляная кислота". Сумму связанной и свободной соляной кислот обозначают термином "общая соляная кислота". Их содержание выражают количеством миллилитров 0,1N NaOH, пошедшего на нейтрализацию кислоты с участием различных индикаторов. Общая кислотность выражается количеством миллилитров щелочи, пошедшей на нейтрализацию всех кислот, содержащихся в 100 мл сока. В норме их количества будут следующими: общая кислотность — 40-60 мл; НСl — свободная — 20-40 мл, связанная — 10-20 мл, общая — 30-60 мл. В характере секреции желудочного сока различают следующие патологические состояния: • гиперхлоргидрия — увеличение содержания свободной соляной кислоты и общей кислотности, что наблюдается при язвенной болезни желудка и двенадцатиперстной кишки; • гипохлоргидрия — уменьшение свободной кислоты и общей кислотности; • ахлоргидрия — полное отсутствие соляной кислоты и снижение общей кислотности; • ахилия — отсутствие секреции желудочного сока и пепсина. Уменьшение или отсутствие соляной кислоты в желудке может наблюдаться при хроническом гастрите, раке желудка, злокачественном малокровии. Особый интерес представляет использование так называемой радиопилюли, которая позволяет определить кислотность желудочного содержимого в течение всего процесса переваривания. Это — портативный электронный прибор, заключенный в стеклянную капсулу длиной около 0,5- 0,8 см. При проглатывании он попадает в желудок и оттуда передает сигналы, характеризующие степень кислотности. Переваривающую силу желудочного сока исследуют по методу Метта. Активность пепсина можно определить непрямым путем, по количеству уропепсина в моче.Пищеварение в тонком отделе кишечника
В тонком отделе кишечника содержимое Желудка подвергается воздействию соков поджелудочной железы, кишечника и желчи. Пищевая кашица здесь нейтрализуется. В этом отделе кишечника в основном заканчивается переваривание пищевых продуктов и образуются вещества, способные всасываться. Так, белки распадаются до аминокислот, жиры — до глицерина и высших жирных кислот, углеводы — до моносахаров. Поджелудочная железа выделяет 600-700 мл (рН 7,5-8,2) сока, секреция которого стимулируется пищеварительным гормоном — секретином. Особенностью этой секреции в отличие от постоянной секреции желудочного сока является ее прерывистость. Сок поджелудочной железы содержит большое количество ферментов, активных в слабощелочной среде. К ним относятся трипсин, химотрипсин, карбоксиполипептидаза, лейцинаминопептидаза, амилаза, мальтаза, лактаза, липаза, ДНК-аза и РНК-аза. Протеолитические ферменты — трипсин и химотрипсин — выделяются в неактивной форме и активируются энтерокиназой и трипсином. Они обеспечивают расщепление белков до небольших пептидов и аминокислот. Карбоксипептидаза отщепляет от конца полипептидной цепи аминокислоту со свободной карбоксильной группой, лейцинаминопептидаза действует анологично, освобождая аминокислоту со свободной аминной группой. ДНК-аза и РНК-аза гидролизу ют нуклеиновые кислоты. Амилаза, мальтаза, лактаза вырабатываются в железе в активной форме и расщепляют углеводы до моносахаров. Липаза, которая синтезируется в неактивной форме, активируется желчью. Желчь вырабатывается в печени в виде печеночной желчи и через желчные пути поступает в желчный пузырь, где и концентрируется (пузырная желчь). Выделение желчи происходит под действием раздражителей, наиболее важными из которых являются массы, поступившие в двенадцатиперстную кишку, или жир в тонкой кишке. Самыми главными составными элементами желчи являются парные желчные кислоты, которые обеспечивают всасывание жиров. За сутки в кишечник выделяется примерно 5 г желчных кислот. В составе желчи много холестерина (3-10 г/л), который при воспалительных процессах желчного пузыря участвует в образовании желчных камней. Последние на 80-90% состоят из солей холестерина. В кишечнике выделяется около 2-3 л сока. Он содержит протеолитические ферменты, расщепляющие ди- и трипептиды до аминокислот, а также ряд других ферментов (см. табл. 11), которые обеспечивают конечные этапы пищеварения.Печень
 Рис. 70. Роль печени в обмене веществ организма
Печень занимает в межуточном обмене веществ центральное место, в связи с чем ее часто называют биохимической лабораторией организма (рис. 70). Приведем химический состав печени.
Рис. 70. Роль печени в обмене веществ организма
Печень занимает в межуточном обмене веществ центральное место, в связи с чем ее часто называют биохимической лабораторией организма (рис. 70). Приведем химический состав печени.
 В ткани печени содержится очень много ферментов, катализирующих самые различные реакции.
В печени происходит выработка желчи. За сутки у человека образуется 500-1200 мл желчи.
Печень принимает участие во всех видах обмена веществ. Ее участие в белковом обмене заключается в том, что печень является депо белка. Белки печени обновляются через 7 дней. Именно в печени происходит интенсивный процесс синтеза белка. Она синтезирует все альбумины сыворотки крови, большую часть глобулинов, фибриноген, протромбин и др.
В этом органе происходят различные превращения аминокислот, синтез мочевины, образование мочевой кислоты, синтез креатина и т. д.
Функция печени в углеводном обмене многообразна. В печени депонируется гликоген, запасы которого меняются в зависимости от питания и состояния организма. При голодании через 24 часа почти весь гликоген исчезает. В печени активны ферментные системы, обеспечивающие синтез и распад гликогена и глюкозы, взаимопревращение различных моносахаридов, образование глюкуроновой кислоты, которая участвует в процессах обезвреживания токсических продуктов, превращение аминокислот в глюкозу и т. д. Печень участвует в регуляции уровня сахара в крови. Она принимает участие в синтезе гепарина, превращениях молочной кислоты и др.
В обмене липидов печень занимает ведущее место. Как установлено в последнее время, жиры в печени откладываются в большем количестве, чем углеводы. Содержание жира в печени может доходить до 30% от сухого остатка. Он состоит главным образом из ненасыщенных жирных кислот. Липиды в печени находятся в соединении с белками в виде липопротеидов. В печени происходят интенсивный синтез и распад фосфолипидов, жирных кислот, холестерина, образование желчи, желчных кислот и пигментов, ацетоновых тел, липидов из углеводов и т. д.
Гемоглобин в печени подвергается распаду с образованием билирубина и биливердина. Печень является депо каротина, витаминов групп D, К, а также витаминов РР, В12, В2. Здесь происходит синтез различных коферментов. В печени происходит распад гормонов с образованием их конечных продуктов — 17-кетостероидов. В минеральном обмене печень играет роль депо железа.
Важная функция печени — это ее выделительная способность. Она экскретирует из организма желчные пигменты, холестерин, различные лекарственные вещества, мочевую кислоту, производные обмена гормонов.
В свертывании крови печень принимает косвенное участие путем синтеза фибриногена, протромбина, гепарина и других факторов.
Важное значение печени заключается в ее тесной связи с плазмой крови. Она участвует в синтезе белков плазмы, а также влияет на кислотно-щелочное равновесие плазмы.
Одна из важнейших функций печени заключается в ее способности обезвреживать ядовитые и чужеродные организму вещества — антитоксическая функция. В печени происходит разрушение вредных веществ (алкоголь), обезвреживание аммиака путем связывания его в мочевину, конечных продуктов обмена в организме типа билирубина, крезола, фенола, индола, скатола путем образования безвредных для клеток соединений в результате взаимодействия с глюкуроновой и серной кислотами. В печени бензойная кислота обезвреживается глицином с образованием гиппуровой кислоты. Эта реакция является пробой на антитоксическую функцию печени.
Все это характеризует печень как важнейший орган, участвующий не только в процессах пищеварения, но и в обмене веществ всего организма. Поэтому любые нарушения деятельности печени приводят к заболеванию всего организма.
В ткани печени содержится очень много ферментов, катализирующих самые различные реакции.
В печени происходит выработка желчи. За сутки у человека образуется 500-1200 мл желчи.
Печень принимает участие во всех видах обмена веществ. Ее участие в белковом обмене заключается в том, что печень является депо белка. Белки печени обновляются через 7 дней. Именно в печени происходит интенсивный процесс синтеза белка. Она синтезирует все альбумины сыворотки крови, большую часть глобулинов, фибриноген, протромбин и др.
В этом органе происходят различные превращения аминокислот, синтез мочевины, образование мочевой кислоты, синтез креатина и т. д.
Функция печени в углеводном обмене многообразна. В печени депонируется гликоген, запасы которого меняются в зависимости от питания и состояния организма. При голодании через 24 часа почти весь гликоген исчезает. В печени активны ферментные системы, обеспечивающие синтез и распад гликогена и глюкозы, взаимопревращение различных моносахаридов, образование глюкуроновой кислоты, которая участвует в процессах обезвреживания токсических продуктов, превращение аминокислот в глюкозу и т. д. Печень участвует в регуляции уровня сахара в крови. Она принимает участие в синтезе гепарина, превращениях молочной кислоты и др.
В обмене липидов печень занимает ведущее место. Как установлено в последнее время, жиры в печени откладываются в большем количестве, чем углеводы. Содержание жира в печени может доходить до 30% от сухого остатка. Он состоит главным образом из ненасыщенных жирных кислот. Липиды в печени находятся в соединении с белками в виде липопротеидов. В печени происходят интенсивный синтез и распад фосфолипидов, жирных кислот, холестерина, образование желчи, желчных кислот и пигментов, ацетоновых тел, липидов из углеводов и т. д.
Гемоглобин в печени подвергается распаду с образованием билирубина и биливердина. Печень является депо каротина, витаминов групп D, К, а также витаминов РР, В12, В2. Здесь происходит синтез различных коферментов. В печени происходит распад гормонов с образованием их конечных продуктов — 17-кетостероидов. В минеральном обмене печень играет роль депо железа.
Важная функция печени — это ее выделительная способность. Она экскретирует из организма желчные пигменты, холестерин, различные лекарственные вещества, мочевую кислоту, производные обмена гормонов.
В свертывании крови печень принимает косвенное участие путем синтеза фибриногена, протромбина, гепарина и других факторов.
Важное значение печени заключается в ее тесной связи с плазмой крови. Она участвует в синтезе белков плазмы, а также влияет на кислотно-щелочное равновесие плазмы.
Одна из важнейших функций печени заключается в ее способности обезвреживать ядовитые и чужеродные организму вещества — антитоксическая функция. В печени происходит разрушение вредных веществ (алкоголь), обезвреживание аммиака путем связывания его в мочевину, конечных продуктов обмена в организме типа билирубина, крезола, фенола, индола, скатола путем образования безвредных для клеток соединений в результате взаимодействия с глюкуроновой и серной кислотами. В печени бензойная кислота обезвреживается глицином с образованием гиппуровой кислоты. Эта реакция является пробой на антитоксическую функцию печени.
Все это характеризует печень как важнейший орган, участвующий не только в процессах пищеварения, но и в обмене веществ всего организма. Поэтому любые нарушения деятельности печени приводят к заболеванию всего организма.
Последние комментарии
10 часов 34 минут назад
19 часов 26 минут назад
19 часов 29 минут назад
3 дней 1 час назад
3 дней 6 часов назад
3 дней 7 часов назад