Большая медицинская энциклопедия. Более 1500 заболеваний: описание, диагностика, лечение [Коллектив авторов] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
«БОЛЬШАЯ МЕДИЦИНСКАЯ ЭНЦИКЛОПЕДИЯ» Более 1500 заболеваний: описание, диагностика, лечение Актуализированное и дополненное издание бестселлера
Введение
«Главнейшие и существенные задачи практической медицины — предупреждение болезни, лечение болезни развившейся и, наконец, облегчение страданий больного человека», — говорит во вступлении к «Курсу клиники внутренних болезней» крупнейший отечественный врач и ученый С. П. Боткин. При решении задач практической медицины необходимо исходить из научного представления о сущности болезни. Болезнь — это реакция организма на изменившиеся условия среды, проявляющаяся в нарушении жизненных функций, нарушении конкретных форм его приспособляемости, возникающих под влиянием разнообразных причин. Болезнь вызывают не только явно вредоносные воздействия среды: физические, химические, микробные и иные, но — при измененной реакции организма больного — и обычные физиологические раздражители; последние имеют место при бронхиальной астме, аллергии и т. д. Именно взаимодействие среды и организма с его меняющейся реакцией и должно всегда учитываться при суждении о происхождении любой болезни. В структуре различных признаков болезни чрезвычайно важно учитывать как собственно патологические последствия, так и защитно-приспособительные явления, осуществляемые в значительной степени рефлекторными механизмами. В результате воздействия среды при определенных условиях могут изменяться в патологическом направлении и наследственные свойства организма, несмотря на значительную устойчивость наследственности. Корифеи отечественной медицины основывались на положениях, что наследственность в конечном итоге есть продукт воздействия среды в предшествующих поколениях. По И. М. Сеченову, «наследственность — способность передавать потомству видоизменения, приобретенные в течение индивидуальной жизни». Патологическая наследственность не предопределяет неизбежного развития болезни; она выявляется по реакциям организма в определенных условиях и, следовательно, связана с этими условиями. Особенно важно, что наследственность можно целенаправленно изменять. Среда оказывает влияние на возникновение болезней, как и вообще на жизнедеятельность высших организмов — методов воздействия на организм через нервную систему. Отечественная медицина развивалась на основе строго научных концепций. Известен ряд крупнейших отечественных ученых, которые внесли богатый вклад в учение о внутренних болезнях и положили начало самобытному направлению отечественной науки с правильным взглядом на развитие заболеваний под влиянием условий среды и на значение профилактической медицины. Основоположником медицины в России явился первый профессор медицины Московского университета Семен Герасимович Зыбелин (1735–1802), убежденно отстаивавший значение гигиенического режима с первых лет жизни, трудовых процессов, положительных эмоций как лучшего профилактического мероприятия. Основателем русской клинической науки в первой трети XIX в. был представитель московской школы Матвей Яковлевич Мудров (1776–1831); в своей научной, практической и общественной деятельности он указал путь другим деятелям отечественной медицины. Он утверждал, что «познание болезни есть половина лечения», т. е. что основу клинической медицины составляют научные данные о существе болезни, что «во врачебном искусстве нет врачей, окончивших свою науку». М. Я. Мудров рассматривал болезнь с точки зрения целостной личности. «Зная взаимные друг на друга действия души и тела, долгом считаю заметить, — учил М. Я. Мудров, — что есть и душевные лекарства, кои врачуют тело». Он всегда стремился удалить больного «от забот домашних и печалей житейских, кои сами по себе суть болезни». М. Я. Мудров выработал свое клиническое мышление, основанное на индивидуальном подходе к диагнозу, прогнозу, лечению данного больного, и никогда не рассматривал болезнь как понятие отвлеченное. Глубокий смысл сохраняют и на сегодняшний день следующие слова М. Я. Мудрова: «Не должно лечить болезнь по одному только ее имени, а должно лечить самого больного, его состав, его органы, его силы». Он считал необходимым систематическое, всестороннее и целеустремленное исследование больного, где должное место занимают анамнез и объективное исследование. М. Я. Мудров учил «после подробного опроса исследовать настоящее положение больного», для чего врачу нужно «пробежать все части тела больного, начиная с головы до ног, вглядеться в лицо его, глаза, лоб, щеки, рот и нос, на коих часто, как на картине, печатается и живописуется образ болезни, внимать звуку голоса и силе ответов, видеть и слышать дыхание груди его и вычислять соразмерность биения сердца и жил с дыханием, смотреть и осязать язык как вывеску желудка, уметь осязать живот, видеть и исследовать все извержения, кровь, мокроту, желчь и пр…» М. Я. Мудров проводил рациональную активную терапию, в которой занимал большое место общий режим и специальные лекарства. Ему было хорошо известно значение психотерапии и лечения силами природы. Так, об упомянутых выше «душевных лекарствах, кои врачуют тело», он писал: «Сим искусством сообщается больным та твердость духа, которая побеждает телесные болезни, тоску, метание и которая самые болезни иногда покоряет воле больного. Восхищение, радость и уверенность больного бывают полезней самого лекарства». И далее: «Ты достигнешь до той премудрости, что не будешь здравья полагать в одних только (аптекарских) склянках. Твоя аптека будет вся природа на службу тебе и твоим больным». На первое место М. Я. Мудров ставил медицину профилактическую. «Взять на свои руки людей здоровых, предохранять их от болезней наследственных, им угрожающих, предписать им надлежащий образ жизни есть честно и для врача покойно, ибо легче предохранить от болезней, нежели лечить их. И в сем состоит первая его (врача) обязанность». В физическом труде М. Я. Мудров видит решение основной задачи профилактики и лечения. «Первый рецепт здравия роду человеческому — в поте лица своего снеси хлеб свой». М. Я. Мудров разрабатывал и специальные противоэпидемические мероприятия, например в «Кратком наставлении о холере и способах, как предохранить себя от оной», и в области военной медицины, которой М. Я. Мудров уделял много внимания, им руководят те же профилактические идеи. В торжественном слове «О пользе и предметах военной гигиены» (1808 г.), с которым М. Я. Мудров выступил накануне Отечественной войны 1812 г., он выражает убеждение, что военная медицина должна состоять из четырех частей: — военной гигиены; — военной терапии, или армейской клиники; — военной, или полковой, хирургии; — полевой фармакопеи. М. Я. Мудров учил, как предупреждать болезни, особенно свойственные различным родам войск (скорбут — у матросов, геморрой — у кавалеристов и т. д.). «Задачи полковых врачей не столько лечить болезни, сколько предупреждать их, а наиболее — учить солдат беречь свое здоровье». Григорий Антонович Захарьин (1829–1897), знаменитый русский ученый, снискал себе славу блестящего клинициста, диагноста и терапевта. Им написаны широко известные «Клинические лекции», в которых он проводит индивидуальный разбор больного по оригинальной схеме обследования, позволявшей путем тщательного опроса устанавливать развитие болезни, вероятные причины ее, функциональное состояние органов и назначать нужный режим, лекарства и другие лечебные мероприятия. Г. А. Захарьин уделял большое внимание патологии целостного организма с его нервно-эндокринными регуляциями. Ему принадлежит описание зон кожной гиперестезии при заболеваниях внутренних органов (так называемые зоны Захарьина-Геда), оригинальные теории об ангионевротической природе геморроя, о роли эндокринных нарушений в происхождении хлороза. Г. А. Захарьин учил, целеустремленно идя к диагнозу, избегать поверхностного и беспорядочного, а также излишне подробного исследования, подчеркивая, что не все то, что представляет интерес для семиотики, нужно для диагностики. Основоположником петербургской школы терапевтов был профессор Военно-медицинской академии Сергей Петрович Боткин (1832–1889), крупнейший отечественный ученый-клиницист, научное наследие которого до сих пор имеет огромное значение. Все вопросы клиники С. П. Боткин решал на высоком теоретическом уровне «приемами естествоиспытателя», будучи убежден, что «практическая медицина должна быть поставлена в ряд естественных наук» и что «значение врачебного искусства будет уменьшаться по мере увеличения точности и положительности наших сведений». С. П. Боткин хорошо видел недочеты западноевропейской «госпитальной», т. е. чисто эмпирической, медицины. В прогрессивном представлении С. П. Боткина понятие о болезни неразрывно связывается с ее причиной, которая всегда обусловливается только внешней средой. Благодаря правильным широким взглядам С. П. Боткина на сущность болезни ему ясны были отрицательные стороны переживавшегося в то время медицинской наукой периода увлечения микробами, «из-за которых начинают забывать не только клинику, но и патологическую анатомию тканей, забывают значение реакции организма на микробы». Через всю научную деятельность С. П. Боткина в его лекциях красной нитью проходит борьба за научную гипотезу, органически связанную с клинической практикой. Он увлекательно и строго логично раскрывает патогенез болезни, патогенез отдельных ее симптомов. Многие концепции С. П. Боткина опережали взгляды современников и только в настоящее время стали доступны правильной оценке, свидетельствуя о гениальных предвидениях С. П. Боткина. Мнение о руководящем для врача значении физиологии четко высказывалось русскими учеными и ранее. Однако только С. П. Боткин открыл физиологическому эксперименту широкую дорогу в клинику. В лаборатории, организованной С. П. Боткиным при клинике, работал первые годы великий русский физиолог И. П. Павлов, на научную деятельность которого С. П. Боткин оказал большое влияние. На важность изучения функционального состояния органов для клиники С. П. Боткин указывал неоднократно, подчеркивая несоответствие между патолого-анатомическими изменениями и степенью функциональных нарушений, например при болезнях сердца. С. П. Боткин был врачом-рационалистом. Он дал медицине строго научную основу, возглавив функциональное, физиологическое направление и проводя в клинике чрезвычайно широко идеи «нервизма» (боткинско-павловское направление русской медицины). С. П. Боткин учил, что необходимо проводить углубленное исследование больного в клинике со строго индивидуальным подходом, диагностировать и лечить не болезнь, а больного. Большое значение он придавал объективному методу, с которого часто и рекомендовал начинать исследование больного. В то же время он детальнейшим образом знакомился с субъективной картиной болезни, умея мастерски использовать для диагноза тонкие ощущения больного со стороны внутренних органов. Тщательное изучение клиники позволило С. П. Боткину еще в до-рентгеновский период при слабо развитой лабораторной технике ставить диагноз туберкулезного прикорневого сморщивания легкого с параличом возвратного нерва, диагноз малых аневризм аорты, тромбоза воротной вены и т. д. На основе клинического анализа и гениальных обобщений С. П. Боткин пришел к убеждению о значении инфекции в развитии желчнокаменной болезни и о том, что так называемая катаральная желтуха (болезнь Боткина) представляет собой специфическую общую инфекционную болезнь, при которой поражение печени, желудочно-кишечного тракта, селезенки, почек есть следствие этой общей инфекции, а не местного кишечного процесса. С. П. Боткин чрезвычайно расширил изучение клиники инфекционных болезней, проведя глубоко научный разбор поражения нервной системы, систем кровообращения и кроветворения при крупозной пневмонии, тифах и указав новые пути научного патогенетического лечения инфекционных болезней. Лечение внутренних болезней С. П. Боткин обогатил рядом новых средств, в значительной степени заимствованных из народной медицины, предварительно подвергнув их глубокому экспериментальному фармакологическому исследованию в лаборатории клиники. Именно в клинике С. П. Боткина ландыш, горицвет стали достоянием научной терапии; в той же клинике В. А. Манассеиным, учеником С. П. Боткина, были открыты еще в 1871 г. противомикробные свойства зеленого кистевика, известного теперь всему миру под названием пенициллина. Таковы целеустремленные научные достижения С. П. Боткина и его школы в области лекарственной терапии. Идеи боткинского учения внедрялись в отечественную медицину учеником С. П. Боткина В. А. Манассеиным (1841–1901), талантливым разносторонним клиницистом, придерживавшимся физиологического направления (работы о голодании, лихорадке и многие др.). Особенно созвучна интересам современной клиники монография В. А. Манассеина об этиологии и терапевтическом значении психических явлений, в которой он убедительно показывает на ярких примерах, что «между психической и растительной жизнью организма существует теснейшая связь и всякое изменение в остальных органах тела отражается непременно и на мозговой деятельности» и что, с другой стороны, ни одна мысль, «ни одно ощущение, ни одно чувство не могут явиться без того, чтобы не отразиться на различных частях животного организма». Передовым ученым-клиницистом являлся и представитель московской школы Алексей Александрович Остроумов (1844–1908), ученик Г. А. Захарьина, продолжавший разработку экспериментально-физиологического направления С. П. Боткина и придавший ему оригинальный клинико-биологический уклон. Экспериментальные исследования А. А. Остроумова по иннервации сосудов, механизму образования тонов сердца и другие вошли в сокровищницу мировой физиологической науки. Наиболее интересная сторона его клинической деятельности — это функциональные методы исследования, изучение компенсации нарушенной функции органов. В то же время А. А. Остроумов возражал против безоговорочного переноса в клинику данных экспериментальной физиологии. Хорошо известны блестящие клинические лекции А. А. Остроумова, в которых он уделял особенно много места принципам нервизма. При исследовании больного остроумовская клиника уделяла много внимания личному и семейному анамнезу, стремясь подкрепить общую идею А. А. Остроумова — естественную историю развития семейной патологии вследствие резко изменившихся условий внешней среды, к которым организм не может надлежащим образом приспособиться. В учении А. А. Остроумова правильна концепция о связи болезни со средой и о возможности наследования приобретенных признаков. Современная медицинская наука неразрывно связана с достижениями медицины прошлых лет, представляя в то же время коренные отличия. Теоретической основой современной медицины и ее профилактического направления являются не только естественные науки, но и учение о взаимосвязи социальных, психологических и биологических факторов, определяющих здоровье человека. При постановке диагноза нужно учитывать не только основные жалобы, основную болезнь, но и все другие отклонения от нормы, выявленные у данного больного наряду с указаниями на функциональные нарушения, степень компенсации процесса и т. д. Такой развернутый уточненный диагноз составляет основу предсказания и лечения каждого больного. Обследование больного начинается с расспроса о жалобах и развитии болезни, а также о всех предшествующих заболеваниях и условиях жизни больного. Тщательно собранный анамнез имеет особенно большое значение с точки зрения современной медицины, поскольку всякое воздействие на организм в прошлом не проходит бесследно для нервной системы, для высшей нервной деятельности и, следовательно, может определять течение дальнейших заболеваний, возникающих без явной связи с заболеваниями в прошлом. Данные специальных диагностических исследований (химических, микробиологических, рентгенологических, электрокардиографических и т. д.) имеют при постановке диагноза только подсобное значение, подчиненное общему клиническому изучению больного. При лечении больного режимом в сочетании с лекарственными и другими методами так же, как при определении трудоспособности, следует учитывать особенности типа высшей нервной деятельности больного, хотя клиника еще не располагает достаточно простыми и точными методами индивидуальной типологической характеристики. Профилактика должна основываться на знаниях природы заболевания и возможности целенаправленного изменения как условий среды, так и индивидуальных особенностей организма. Комплексные оздоровительные мероприятия направляются главным образом на условия труда и быта, на снижение заболеваемости и травматизма, особенно промышленного. Эти мероприятия осуществляются при обязательном повышении санитарной грамотности населения. На основе истинно научного познания всех причин болезней облегчается задача превращения медицины настоящего времени «в медицину будущего, т. е. в гигиену в широком смысле слова» (И. П. Павлов).♦ А ♦
АБОРТ
ОпределениеАборт — искусственное или самопроизвольное прерывание беременности на сроке до 28 недель. Различают искусственный аборт, к которому относятся криминальный и медикаментозный, а также спонтанный (выкидыш) аборт.
Искусственный аборт Искусственный аборт — преднамеренное прерывание беременности в срок до 28 недель. Криминальный аборт — прерывание беременности самой женщиной или другим лицом вне лечебного учреждения, но лицом без должного медицинского образования, лицензии или на сроке свыше 28 недель. Лицо, выполнившее такой аборт, ждет уголовное наказание. Обычно криминальные аборты проводятся тогда, когда женщина не желает раскрывать свою беременность при официальном обращении к врачу. Из-за того, что криминальные аборты проводятся в несоответствующих условиях, могут возникнуть различные осложнения, такие, как кровотечение, тяжелейшие гнойно-септические процессы, инфекционно-токсический шок (см.), ДВС-синдром, почечная и печеночная недостаточность (см.). Впоследствии женщине грозит бесплодие и невынашивание беременности. Медицинский искусственный аборт выполняется в условиях лечебного учреждения (родильный дом, гинекологическое отделение, женская консультация) акушером-гинекологом, когда женщина решает прервать беременность либо по собственному желанию, либо при соответствующих медицинских (реже — социальных) показаниях. Если срок беременности не превышает 12 недель, обычно медицинский аборт проводится методом выскабливания. При задержке менструации не более чем на 20 дней можно выполнять аборт методом вакуум-экскохлеации (мини-аборт). В том случае, когда срок беременности более 12–14 недель, возможность проведения аборта определяется медицинскими показаниями. Противопоказаниями к проведению искусственного медицинского аборта являются острые и подострые воспалительные заболевания генитальной сферы, гнойная инфекция независимо от места ее локализации, срок менее 6 месяцев после предшествующего аборта, острые инфекционные заболевания. При поздних сроках, когда проведение аборта имеет большую опасность для здоровья и жизни женщины, чем беременность и последующие роды, аборт противопоказан. Перед проведением аборта проводится необходимый минимум лабораторных методов исследования. Он включает клинические анализы крови и мочи, бактериоскопию мазка из влагалища, реакцию Вассермана, определение группы крови и резус-фактора. На поздних сроках также дополнительно определяется коагулограмма и проводится исследование тех систем или органов, патология которых послужила непосредственной причиной аборта. После проведения медицинского искусственного аборта возможны осложнения. Например, перфорация стенки матки с последующим кровотечением и оставление остатков плодного яйца в полости матки, как наиболее часто встречающиеся. Чтобы предотвратить последнее, сразу же после аборта выполняется УЗИ. Если обнаруживаются остатки плодного яйца, проводится ревизия полости матки. Как отдаленные осложнения аборта можно назвать воспалительные заболевания генитальной сферы, невынашивание беременности, дисфункцию яичников и надпочечников, бесплодие (см.). Чтобы снизить возможность осложнения, используется метод вакуум-экскохлеации, так как в этом случае шейка и стенки полости матки травмируются меньше, а длительность вмешательства уменьшается. При прерывании беременности на поздних сроках, как правило, выполняется метод малого кесарева сечения и интраамниальное введение гипертонического раствора хлорида натрия или простагландинов. При различной экстрагенитальной патологии малое кесарево сечение является методом выбора.
Классификация абортов: 1 — угрожающий аборт; 2 — начинающийся аборт; 3 — неполный аборт; — полный аборт
Спонтанный аборт Спонтанный аборт подразделяют в зависимости от сроков на ранний (до 12 недель) и поздний (13–28 недель). Повторение спонтанных абортов более чем два раза подряд считают привычным невынашиванием беременности (привычным выкидышем). Стадии течения спонтанного аборта: — угрожающий аборт (угроза прерывания беременности); — начавшийся аборт; — аборт в ходу; — неполный аборт; — полный аборт; — несостоявшийся аборт; — инфицированный аборт (неосложненный и осложненный).
Этиология Спонтанный аборт Спонтанный аборт (выкидыш) — один из основных видов акушерской патологии. Его причины нередко могут оставаться неясными, тогда как возможные патогенетические факторы весьма обширны. К ним относятся инфекции, передающиеся половым путем (ИППП) (см.), эндокринные дисфункции (яичников, щитовидной железы, надпочечников, гипофиза), острые и хронические инфекционные заболевания и интоксикации, половой инфантилизм, аномалии развития матки, истмико-цервикальная недостаточность, миомы и другие опухоли половой сферы, резус-конфликт крови матери и плода и пр. Могут сказаться и такие физические факторы, как ушибы, подъем значительных тяжестей, если имелись предрасполагающие моменты. Плоды, родившиеся до 28 недель, имеют массу до 1000 г и длину тела менее 35 см. Как правило, они нежизнеспособны. Однако известны случаи выхаживания плодов, родившихся в срок от 22 недель (преимущественно в экономически развитых странах).
Чрезмерное растяжение передней цервикальной стенки и ущемление губы зева при плоскорахитическом тазе: 1 — внутренний зев; 2 — чрезмерно растянутый нижний сегмент матки; 3 — отечная передняя губа; 4 — ущемленная влагалищная губа
Патогенез Спонтанный аборт В течении аборта могут быть задействованы различные механизмы. В одних случаях сокращение матки приводит к тому, что плодное яйцо отслаивается и погибает. В других же (при инфекционной патологии беременной и плода, токсикозах), наоборот, сначала происходит гибель плодного яйца. Бывает и так, что оба этих фактора сочетаются и случаются одновременно.
Клиническая картина Угрожающий аборт При угрожающем аборте беременная жалуется на несильную боль внизу живота и в поясничной области. Кровянистых выделений нет, величина матки соответствует сроку беременности, однако пальпаторно или на УЗИ определяется гипертонус матки. Это состояние обратимо, и при своевременной терапии дальнейшее протекание беременности возможно.
Начавшийся аборт Определить начавшийся аборт можно по усилению болей, появлению скудных мажущих кровянистых выделений из половых путей при наличии выраженного гипертонуса матки. Величина матки соответствует сроку, наружный зев закрыт или слегка приоткрыт. Иногда удается сохранить и такую беременность, но прогноз хуже, чем при угрожающем аборте.
Аборт в ходу Аборт в ходу является дальнейшей стадией спонтанного аборта. При этом плодное яйцо отслаивается от стенки матки и изгоняется через цервикальный канал. В связи с этим возникают схваткообразные боли внизу живота, кровотечение (иногда значительное). Размеры матки зависят от стадии изгнания плодного яйца. Они соответствуют данному сроку беременности или несколько меньше положенных. При вагинальном исследовании шейка сглажена или раскрыта, в ее просвете прощупывается губчатая ткань (сгустки крови или плодное яйцо). Сохранить такую беременность невозможно.
Неполный аборт В полости матки задерживаются части плодного яйца. Клинически проявляется длительным кровотечением. Цервикальный канал приоткрыт, из него выделяются сгустки крови и части плодного яйца, величина матки не соответствует сроку беременности.
Полный аборт Чаще всего наблюдается в ранние сроки беременности. При этом матка полностью освобождается от плодного яйца, самопроизвольно сокращается, цервикальный канал закрывается, кровотечение прекращается.
Инфицированный (лихорадочный) аборт Если спонтанный аборт происходит достаточно длительное время, возможно развитие восходящей инфекции из влагалища (стафилококк, хламидии, эшерихии и пр.). Впоследствии происходит инфицирование эндометрия и плодного яйца — инфицированный аборт. Из матки патогенная флора распространяется лимфогенным и гематогенным путями по трубам, яичникам, брюшине, околоматочной клетчатке. Это приводит к развитию различных осложнений вплоть до генерализации инфекции. Поэтому условно выделяют неосложненный лихорадочный выкидыш и септический аборт. При неосложненном лихорадочном аборте наблюдаются повышение температуры тела, тахикардия (см.), лейкоцитоз, умеренно выраженная интоксикация. Это характеризуется слабостью, головной болью. При пальпации матки болезненных ощущений не возникает, придатки и околоматочная клетчатка не изменены, признаков пельвиоперитонита нет. При осложненном лихорадочном аборте наблюдаются признаки выраженной интоксикации, боли внизу живота, лихорадка с ознобом, высоким лейкоцитозом и СОЭ. Матка чувствительна при пальпации, придатки увеличены, определяются симптомы параметрита (реже) и пельвиоперитонита. При септическом аборте состояние женщины можно определить как тяжелое. Оно характеризуется лихорадкой с потрясающим ознобом, бледностью, желтушностью склер, адинамией. Также отмечаются токсические поражения паренхиматозных органов. При резком снижении иммунитета развиваются септическая пневмония, перитонит, тромбофлебиты, острая почечная недостаточность.
Несостоявшийся аборт Бывают случаи, когда плодное яйцо после гибели остается в полости матки. Со временем оно пропитывается кровью, возможно образование кальцинатов. В какой-то момент прекращается рост матки, возникает несоответствие ее величины сроку беременности, периодически появляются незначительные мажущие кровянистые выделения и незначительные схваткообразные боли. Нередко такое состояние расценивается как угроза прерывания беременности, при этом выполняется сохраняющая терапия. Но если провести в этот момент биологические или иммунологические пробы на беременность, результат будет отрицательным. При УЗИ плодное яйцо в матке не просматривается.
Лечение Лечение спонтанных абортов зависит от стадии процесса. Если беременность сохранить возможно, то женщину срочно госпитализируют в отделение патологии беременности. Дальнейшая терапия включает в себя лечебно-охранительные мероприятия (строгий постельный режим, полноценный сон, седативные средства, психотерапия), создание благоприятного гормонального фона (прогестерон), спазмолитическую терапию (генипрал, дуфастон, но-шпа). При инфантилизме и гипофункции яичников эстрогены и гестагены назначаются одновременно. При гиперандрогенемии назначают преднизолон по 10 мг в сутки в течение 10 дней (или дексаметозон в соответствующей дозировке). После выписки из стационара беременная должна продолжать прием генипрала, пока полностью не исчезнут признаки гипертонуса матки. Если же развивается тахикардия, назначают анаприлин. Если дальнейшее продолжение беременности невозможно, выполняют инструментальное удаление плодного яйца или его частей. При больших сроках выскабливание проводят только при задержке в полости матки плаценты. При угрожающем или начавшемся аборте, обусловленном истмико-цервикальной недостаточностью, на шейку матки накладывают двойной П-образный шов или полностью зашивают наружный маточный зев. После операции беременная выписывается из стационара и до родов (при неосложненном течении) наблюдается амбулаторно. При неосложненном лихорадочном аборте выскабливание выполняется сразу же или после купирования острого воспаления эндометрия. Во всех остальных случаях сначала купируется воспаление, а затем выполняется выскабливание. Наиболее предпочтительным является метод вакуум-экстракции. При этом также назначаются массивный курс антибиотиков и препараты фторхинолонового ряда, десенсибилизирующие средства, инфузионная дезинтоксикационная терапия. Остатки плодного яйца удаляют сразу только по витальным показаниям (сильное кровотечение). Лечение несостоявшегося аборта заключается в том, что плодное яйцо удаляется искусственно. При помощи фолликулина или эстрадиола дипропионата 10 000 ЕД 2 раза в день в течение 3 дней у женщины создается эстрогенный фон. Затем вводятся сокращающие средства. Когда остатки плодного яйца частично изгнаны, выполняется выскабливание. Если срок беременности не более 12 недель, то выскабливание выполняется без предварительной подготовки. После спонтанного аборта, который закончился прерыванием беременности, женщина должна применять средства контрацепции в течение 6—12 месяцев. В этот период необходимо использовать следующие средства реабилитации: коррекцию гормонального фона, профилактику воспалительных заболеваний женской половой сферы или лечение при их наличии, лечение ИППП (см.) одновременно у женщины и ее полового партнера, курсы витаминов и биостимуляторов, лечение экстрагенитальной патологии.
АБСЦЕСС
ОпределениеАбсцесс (от лат. abscessus — «нарыв», «гнойник») — ограниченное гнойное воспаление жировой клетчатки в различных органах и тканях, скопление гноя в осумкованной полости. Локализация абсцессов может быть весьма различной, что и определяет их особенности. Например, флегмона (разлитое гнойное воспаление) отличается от эмпиемы (скопления гноя в полостях тела и полых органах).
Этиология Как правило, причиной возникновения абсцессов является гноеродная флора: стафилококки, стрептококки, кишечная палочка, протей, синегнойная палочка в сочетании с фузоспириллезной флорой, анаэробными бактериями, бациллой Фридлендера. Причиной возникновения абсцесса легкого являются вирусно-бактериальные ассоциации. Введение в ткани некоторых концентрированных химических веществ, в том числе лекарств (например, 25 %-ного раствора сернокислой магнезии), может вызывать асептический некроз с последующим формированием абсцесса. У детей причиной развития абсцессов кожи и подкожной клетчатки может стать введение дифтерийного, скарлатинозного анатоксинов, вакцин и даже антибиотиков.
Патогенез В патогенезе абсцессов выделяют пути поступления инфекционного агента — экзо- или эндогенные. Особую роль играет эндогенное инфицирование, которое происходит при посредстве крови или лимфы. Инфекция может распространяться как от соседних органов, так и отдаленных. Гнойное воспаление — общий патогенетический механизм абсцессов любой локализации. Оно приводит к расплавлению тканей, а в ряде случаев — к некрозу с последующим отторжением некротических масс. Для всех абсцессов также характерно наличие оболочки, вырабатывающей гной. Ее формируют ткани, которые окружают воспалительный очаг. Внутренняя стенка обращена к полости абсцесса и представлена грануляционной тканью, которая продуцирует экссудат и отграничивает гнойно-некротический процесс. При дальнейшем течении абсцессов различной локализации возможно, что произойдет спонтанное вскрытие с прорывом наружу (абсцесс подкожной клетчатки, мышечный абсцесс, мастит (см.), парапроктит (см.); прорыв и опорожнение в закрытые полости (брюшную, плевральную, в полость суставов); прорыв гнойника в полость органов, сообщающихся с внешней средой (в полость кишки, желудка, мочевого пузыря, бронхов). В благоприятных условиях опорожнившаяся полость абсцесса спадается и подвергается фиброзу (см.). Если опорожнение и дренирование полости абсцесса произошли не полностью, процесс может перейти в хронический. При этом образуется длительно не заживающий свищ. Из-за прорыва гноя в закрытые полости начинается развитие распространенных гнойных процессов (перитонит (см.), плеврит (см.), перикардит (см.), менингит (см.), артрит (см.) и т. д.) с тяжелым течением и прогнозом. Абсцесс легкого чаще всего имеет постпневмоническое или реже — аспирационное происхождение, значительно реже — гематогенно-эмболический, травматический, лимфогенный генез. Важная роль принадлежит гриппозным пневмониям (см.), при которых развиваются деструктивные изменения, разрушающие бронхиальную стенку. Нарушается также дренажная функция бронхов, происходит тромбоз мелких легочных сосудов. Одна из причин развития постпневмонических абсцессов легкого — постоянное увеличение количества штаммов антибиотикоустойчивых возбудителей. Аспирационный механизм абсцедирования легкого может возникнуть по нескольким причинам. Например, попадание инородного тела, аспирация рвотных масс, крови, желудочного содержимого с последующим развитием инфекции в соответствующем сегменте или доле легкого. Как правило, этот механизм абсцедирования связан с такими ситуациями, как алкогольное опьянение, диабетическая кома (см.), приступэпилепсии (см.). Оказывает влияние также наличие травм, ранений и хирургических вмешательств, особенно на голове и шее. Гораздо реже встречается гематогенно-эмболический механизм абсцедирования легкого. Он возникает, если в организме присутствует распространенный гнойный процесс, например септический эндокардит (см.), тромбофлебит (см.) глубоких вен голеней и таза, остеомиелит (см.), послеродовой сепсис (см.) и пр. Септический эмбол из первичного очага током крови заносится в одну из ветвей легочной артерии и закупоривает ее. Далее развивается инфицированный инфаркт легкого, а затем — гнойное расплавление соответствующего участка легочной ткани, т. е. абсцесс. В патогенезе пиогенного абсцесса печени основную роль играет метастазирование инфекции по сосудам воротной вены из воспалительных очагов в органы брюшной полости (язвенный колит (см.), аппендицит (см.), перитонит (см.) либо по желчным путям (холангит (см.), паразитарные поражения желчных путей). Патогенез абсцесса головного мозга может происходить по следующим путям: отогенный — проникновение инфекции в мозг при гнойных процессах среднего и внутреннего уха, риногенный — при гнойных процессах полости носа и придаточных пазух, а также гематогенный путь при остеомиелите (см.) костей черепа, тромбофлебите (см.) лицевых вен, гнойных процессах мягких тканей головы. При открытых черепно-мозговых травмах инфекция проникает через инфицированную раневую поверхность. Метастатические абсцессы головного мозга развиваются при наличии отдаленных очагов гнойной инфекции (чаще в легких — бронхоэктазы, эмпиема (см.) плевры, абсцесс легкого).
Клиническая картина Гнойно-воспалительные процессы любого происхождения и локализации характеризуются общими клиническими симптомами. К ним относятся повышение температуры тела от средних цифр до 41 °C в тяжелых случаях, общее недомогание, слабость, потеря аппетита, головная боль. Тяжесть симптомов интоксикации зависит от размеров и локализации гнойно-некротического очага. Эти же факторы влияют и на прочие составляющие клинической картины.
Абсцесс Броди (внутрикостный) Абсцесс Броди (внутрикостный) — отграниченный некроз губчатого вещества кости, при котором происходит последующее ее расплавление и образование полости. Преимущественная локализация — проксимальный отдел большеберцовой кости. Возбудитель, как правило, стафилококк. Клиническая картина не всегда одинакова. Обычно чувствительность к надавливанию ограниченная. Нередко очаги ничем не проявляются и боль возникает лишь временами, чаще ночью, после физического напряжения или при перемене погоды. Повышение температуры, озноб и другие общие симптомы обычно отсутствуют. Встречаются, однако, и формы с периодическим обострением, повышением температуры тела, покраснением кожи, болезненностью при надавливании. Процесс может длиться годами, с временным улучшением. Как правило, в метафизе большеберцовой кости образуется полость диаметром 2–2,5 см. Полость заполнена гнойной, серозной или кровянистой жидкостью, иногда в ней находят тканевый детрит.

Абсцесс Броди (остеомиелит)
Абсцесс брюшной полости Абсцессы брюшной полости встречаются при перитонитах (см.) (30–35 % случаев), деструктивных аппендицитах (см.), холециститах (см.), панкреонекрозе, травмах живота. В клинической картине выделяют два основных этапа: формирования и собственно клинических проявлений. В первой стадии наблюдаются признаки заболевания, которое и послужило причиной абсцедирования (аппендицита (см.), холецистита (см.), травмы и пр.). Затем наступает незначительный «светлый промежуток». После этого снова отмечается усиление болей в животе, появление лихорадки, воспалительного сдвига в анализе крови. При этом в соответствующем отделе брюшной полости нередко удается прощупать воспалительный инфильтрат. Исключением является поддиафрагмальный абсцесс. При типичной картине гнойного воспаления признаки формирования гнойника в брюшной полости не отмечаются.
Абсцесс головного мозга Абсцессы головного мозга могут быть одиночными и множественными. Отогенные абсцессы локализуются преимущественно в височной доле или в полушариях мозжечка. Метастатические абсцессы чаще поражают лобные доли. В острой стадии характерно наличие общеинфекционных симптомов, затем присоединяются общемозговые и очаговые. Начало заболевания острое, с выраженной головной болью, рвотой, повышенной температурой, оглушенностью. Характерны брадикардия (см.), менингеальные знаки. Для последних возможна диссоциация с наличием ригидности затылочных мышц при отсутствии симптома Кернига. На глазном дне нередко выявляются застойные явления разной степени выраженности. Для скрытой стадии характерно улучшение состояния больного. При этом сохраняются незначительная головная боль, недомогание, умеренная или субфебрильная лихорадка. Спустя некоторое время присоединяются очаговые симптомы. Они возникают при определенной локализации гнойного процесса. Их появление свидетельствует о начале явной стадии заболевания.

Схема расположения поддиафрагмальных нарывов: 1 — поддиафрагмальный абсцесс, расположенный вправо от lig suspensorium hepatis; 2 — подпеченочный абсцесс; 3 — поддиафрагмальный абсцесс, расположенный влево от lig suspensorium hepatis; 4 — левосторонний поддиафрагмальный нарыв
Абсцессы височной доли встречаются чаще всего. Для этой локализации характерны амнестическая и, реже, сенсорная афазия (см.), а также гемианопсия, эпилептические припадки, расстройства слуха. Реже наблюдаются нарушения вкуса и обоняния, расстройства координации. Помимо очаговых симптомов может выявляться синдром Вебера (см.) (частичное поражение глазодвигательного нерва со стороны очага и разной степени выраженности признаки пирамидной недостаточности с противоположной стороны). Это связано со сдавлением либо смещением среднего мозга. Абсцессы мозжечка проявляются различными расстройствами координации: гомолатеральной гемиатаксией и снижением мышечного тонуса, диадохокинезом, падением больных в сторону очага поражения или назад, горизонтальным крупноразмашистым нистагмом в сторону поражения, дизартрией. Может отмечаться вынужденное положение головы с поворотом в сторону, противоположную локализации абсцесса, наклоном вперед и вниз. Реже отмечаются парез взора и девиация глазных яблок (в здоровую сторону), геми- и монопарезы, тонические судороги, поражение VII, IX, X, XII пар черепных нервов. Абсцессы лобной доли мозга занимают 3-е место по частоте локализации. Симптоматика неспецифична: могут наблюдаться джексоновские припадки, моно- или гемипарезы, моторная афазия, дизартрия, апраксия конечностей, нарушения в психике, атаксия (см.), каталепсия, нистагм. Абсцессы затылочной и теменной долей встречаются значительно реже, они характеризуются очаговой симптоматикой.
Абсцесс легкого Различают острый гнойный, гангренозный и хронический абсцесс легкого. Острый гнойный абсцесс легкого в 75–80 % случаев бывает одиночным и локализуется в сегментах правого легкого. В его течении выделяют 3 стадии. Первая, так называемая стадия инфильтрации, характеризуется острым гнойным воспалением и разрушением легочной ткани. При этом прорыв гнойно-некротических масс в просвет бронхиального дерева не наблюдается. Отмечаются жалобы на боль в груди, кашель, слабость, потливость, озноб, одышку, отсутствие аппетита, жажду. Имеет место ремиттирующая или интермиттирующая лихорадка, адинамия (уменьшение двигательной активности), отставание пораженной стороны грудной клетки в акте дыхания. Перкуторно (методом выстукивания) определяются притупление звука, ослаблениеголосового дрожания, аускультативно (методом выслушивания) отмечаются жесткое дыхание, иногда бронхиальное, небольшое количество сухих и влажных мелкопузырчатых хрипов. Прорыв гнойного содержимого в просвет бронха означает, что началась вторая фаза течения острого абсцесса легкого. Обычно это происходит на 2—3-й неделе от начала заболевания. Температура и другие симптомы интоксикации уменьшаются. Начинает также отходить мокрота — как правило, «полным ртом». В зависимости от размеров полости абсцесса количество мокроты в сутки (при хорошем дренировании) может достигать 1–1,5 л. Физикальные данные в этот период могут быть малоспецифичны. Хотя у небольшой части больных четко выслушивается гулкое дыхание со свистом. При прощупывании определяется тимпанит. Третья стадия, называемая стадией исхода, обычно наступает на 15—20-й день заболевания. Как правило, это происходит при раннем прорыве и хорошем опорожнении (при абсцессах верхних долей и интенсивном лечении). Кашель становится редким, количество мокроты значительно снижается, состояние больного нормализуется. Полость абсцесса замещается соединительной тканью. Иногда на месте абсцесса остается ложная киста (см.), т. е. тонкостенная полость без признаков воспаления. При этом состояние больного удовлетворительное. При плохом или недостаточном дренаже гнойно-некротическое воспаление может затянуться. Чаще всего это встречается при локализации абсцесса в средней и нижних долях. Спустя 2–3 месяца от начала заболевания такой абсцесс становится хроническим. Хронический абсцесс легкого протекает циклично. Стадия обострения сменяется стадией ремиссии. Длительность стадий зависит от того, насколько сохранились функции дренирующего бронха и опорожняемости полости абсцесса. Заболевание характеризуется длительным кашлем с выделением мокроты. При этом также сохраняются симптомы интоксикации, субфебрильной температуры. С течением времени развиваются изменения концевых фаланг пальцев рук («барабанные палочки») и ногтей («часовые стекла»). В период обострения кашель усиливается. Выделяется больше мокроты, она приобретает гнилостный запах. Нередко в ней присутствуют прожилки крови. Над пораженным участком легкого выявляются укорочение перкуторного звука, ослабление дыхания, разнокалиберные влажные хрипы, может выслушиваться гулкое дыхание.
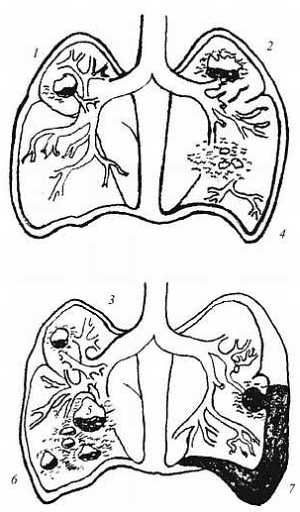
Наиболее частая локализация легочных нагноений: 1 — абсцесс; 2 — путридный абсцесс; 3 — хронический абсцесс; 4 — гангренозный абсцесс; 5 — пристеночный абсцесс; 6 — множественный абсцесс; 7 — пиопневматический абсцесс
При длительном течении могут возникнуть некоторые осложнения. Например, бронхоэктаз (расширение бронхов в связи с воспалением), пневмосклероз (разрастание рубцовой соединительной ткани), эмфизема легких (повышенная воздушность легочной ткани), легочные кровотечения, дыхательная недостаточность, амилоидоз (отложение белка амилоида) (см.) внутренних органов.
Абсцесс печени (пиогенный) Абсцесс печени (пиогенный) — ограниченное нагноение печени с некрозом (омертвением клеток) и расплавлением паренхимы органа, т. е. совокупности именно тех клеток, которые выполняют специфическую функцию. Абсцесс печени может быть как единичным, так и множественным. Патогномоничные признаки отсутствуют. Отмечаются высокая лихорадка с ознобом, боль в области печени, чувство тяжести. Размеры печени увеличиваются, а при прощупывании ощущается болезненность. При множественных абсцессах, заболевании желчных путей, выраженной интоксикации может развиться желтуха.
Поверхностно расположенные абсцессы При поверхностно расположенных абсцессах возникают все признаки воспаления: краснота, припухлость, боль, нарушение функции, местное повышение температуры. Как решающий фактор служит выявление флюктуации, которая возникает при наличии в полости абсцесса жидкости. Гнойно-деструктивные изменения могут занимать различную площадь и глубину. Это зависит от размера абсцесса и его локализации. Вид инфекции определяет характер гноя, который содержится в полости абсцесса (консистенция, цвет, запах).
Абсцесс предстательной железы Абсцесс предстательной железы является следствием нелеченого острого простатита. Происходит гнойное расплавление фолликулов предстательной железы, и в результате слияния нескольких мелких очагов формируется абсцесс. Общее состояние больного тяжелое: высокая температура наряду с ознобом, явления интоксикации, резкая боль в промежности и прямой кишке. Мочеиспускание и дефекация затруднены и болезненны. Возможна задержка мочеиспускания. Абсцесс предстательной железы может самопроизвольно вскрыться в мочеиспускательный канал, мочевой пузырь, прямую кишку, реже — в брюшную полость.
Диагностика Абсцессы диагностируются в зависимости от их локализации. При поверхностном расположении диагноз не представляет затруднений. Однако если гнойно-некротический очаг расположен глубоко в тканях или внутренних органах, ряд признаков (гиперемия, флюктуация) может отсутствовать. Это делает необходимым подключение всех доступных методов исследования, в том числе диагностической пункции. При этом в крови отмечается типичная для воспаления реакция: лейкоцитоз до 20 г/л и нейтрофильный сдвиг лейкоцитарной формулы влево, повышение СОЭ. Степень этих изменений зависит от тяжести патологического процесса. При переходе абсцесса в хроническую форму признаки острого воспаления почти полностью исчезают. В этом случае для диагностики должны быть использованы такие признаки, как припухлость, небольшая болезненность при пальпации, симптом флюктуации, а также данные пункции. Абсцесс Броди (внутрикостный) характеризуется изменениями в области метафиза. При прощупывании утолщение обнаруживается редко. На рентгеновских снимках в губчатой части метафиза просматривается полость диаметром 2–2,5 см округлой или овальной формы, окруженная хорошо выраженной зоной склероза в виде узкой или широкой каймы. Абсцессы брюшной полости диагностируются на основании данных исследования и типичных данных опроса. Исключение составляет поддиафрагмальный абсцесс, который диагностируется путем рентгенологического исследования и компьютерной томографии. В диагностике абсцессов головного мозга используют эхоэнцефалографию, электроэнцефалографию, пневмоэнцефало- и вентрикулографию, ангиографию, компьютерную томографию и люмбальную пункцию. При проведении последней определяется повышенное давление цереброспинальной жидкости, количество клеток варьирует от нормального до высокого (тысячи). При этом максимальный цитоз характеризует начальную стадию заболевания, когда преобладают полинуклеары, а уровень белка не превышает 1 г/л. Уровень сахара может быть слегка понижен. Его резкое снижение свидетельствует об осложнении абсцесса менингитом. На рентгенограммах черепа могут выявляться признаки внутричерепной гипертензии. С опухолями, энцефалитом (см.), синус-тромбозом, гнойным менингитом (см.) необходим различный диагноз. Опухолям головного мозга свойственно более длительное течение. При этом оболочечные симптомы, воспалительные изменения в крови и цереброспинальной жидкости отсутствуют. При синустромбозе характерны выраженные менингеальные симптомы, повышение внутричерепного давления, очаговые симптомы, поражение черепно-мозговых нервов. В диагностике абсцессов легкого ведущее значение принадлежит рентгенологическому и особенно томографическому методам исследования. При выявлении острого абсцесса в фазе инфильтрации рентгенологически определяется участок затемнения с нечеткими краями (с локализацией чаще в базальных сегментах нижних долей и верхушечных сегментах средней доли). Затем, во второй фазе, на уровне уменьшения инфильтрации определяются одна или множественные полости, нередко с горизонтальным уровнем жидкости. При хроническом абсцессе легкого на рентгеновском снимке можно увидеть полость с горизонтальным уровнем жидкости. Далее этот уровень не уменьшается. Возможно также обнаружение секвестров и плевральных сращений. Дифференциальный диагноз необходимо проводить с абсцедирующей полостной формой рака (см.) легкого, туберкулезным инфильтратом, бронхоэктазами. Решающими будут являться рентгенологические исследования и характерная клиническая картина, т. е. четко выраженные симптомы заболевания до и после прорыва абсцесса. Диагностика абсцессов печени несколько затруднена. Это связано с тем, что заболевание можно заподозрить только после того, как клиническая картина абсцесса приобретает четкие формы. При этом отмечаются яркие прогрессирующие общие признаки гнойного процесса. Рентгенологически определяется выпот, иногда высокое стояние диафрагмы и ее малая подвижность. Однако ведущая роль в диагностике принадлежит компьютерной томографии и ультразвуковому исследованию. Реже применяются ангиогепатография, сканирование, лапароскопия. Дифференциальный диагноз необходим с раком печени, эхинококкозом (см.), альвеококкозом (см.) печени. Поверхностно расположенные абсцессы необходимо различать с «холодными» натечными абсцессами, которые возникают притуберкулезе (см.) костей и суставов. В отличие от обычных «холодные» абсцессы развиваются скрыто и медленно, признаки острого воспаления отсутствуют. Дифференциальную диагностику поверхностных абсцессов следует проводить с учетом возможного наличия гематом, кист и распадающихся опухолевых образований. В этих целях также используется диагностическая пункция. Для того чтобы сделать оптимальный подбор антибактериальных средств терапии, важно провести бактериологическое исследование при получении гноя. В процессе газообразования в полости абсцесса образуется газообразующая флора. При выстукивании над полостью абсцесса можно отметить нетипичный звук. На рентгеновских снимках в полости абсцесса определяются пузырек газа и горизонтальный уровень гноя под ним. Чаще всего это наблюдается в абсцессе вокруг инородных тел и в огнестрельных ранах, осложненных гнилостной инфекцией. Другие рентгенологические признаки абсцесса — патологическое затемнение, а также смещение или деформация соседних анатомических образований. Могут возникнуть трудности при выявлении причин тяжелого состояния больного с абсцессом, когда в клинической картине преобладают явления интоксикации. Причиной тяжести состояния может быть как генерализация инфекции, так и резорбция токсинов из гнойного очага. В таких случаях необходимо сопоставить местные явления с общими. При гнойно-резорбтивной лихорадке температурная реакция и гематологические сдвиги соответствуют местному гнойно-некротическому процессу. При этом общие расстройства исчезают с устранением очага инфекции. В отличие от этого при сепсисе тяжелая интоксикация и изменения со стороны внутренних органов неадекватны местным изменениям. При их устранении тяжесть состояния и гематологические сдвиги сохраняются.
Лечение Диагноз абсцесса — это показание к хирургическому вмешательству. Оно включает в себя вскрытие, опорожнение и дренирование гнойной полости вне зависимости от ее локализации. Если лечение применяется относительно небольших поверхностно расположенных абсцессов подкожной клетчатки, то оно проводится в амбулаторных условиях под местной анестезией. Во всех других случаях, особенно при выявлении абсцессов внутренних органов или подозрении на них, больные подлежат срочной госпитализации в хирургическое отделение. Особенности лечения зависят от локализации абсцесса. При абсцессе Броди (внутрикостном) выполняют трепанацию полости, выскабливают внутреннюю стенку. Рану зашивают наглухо. При больших полостях применяют мышечную пластику. Абсцесс брюшной полости вскрывается, гной удаляется. Полость дренируется в наилучшем для оттока гноя положении. Обязательно введение антибиотиков. При этом учитывается чувствительность к ним возбудителя. При лечении таких абсцессов также существуют прямые показания к интенсивной инфузионной терапии с целью коррекции метаболических процессов. Вмешательство при абсцессе головного мозга будет наиболее эффективным, если абсцесс удаляется полностью, вместе с капсулой. При пункционном методе лечения производят повторное отсасывание гноя из полости абсцесса, а затем промывают ее антисептическими растворами и вводят антибиотики. При открытом способе лечения полость абсцесса вскрывают, промывают и дренируют до очищения раны и ее заполнения свежими грануляциями. До и после операции необходима массивная антибиотикотерапия. Учитывается также чувствительность к ней бактериальной флоры, дегидратационная терапия. При абсцессе легкого также необходимо терапевтическое воздействие. Оно заключается в обязательном восстановлении дренажа и ликвидации гноя в очаге поражения, воздействии на микрофлору, борьбе с интоксикацией, стимуляции защитных сил больного. На микрофлору воздействуют массивными дозами антибиотиков с учетом чувствительности к ним возбудителя. Предпочтительнее вводить их в комбинации из 2–3 совместимых препаратов, используя различные пути (парентерально, интратрахеально и т. д.). Широко используются лечебные бронхоскопии, которые после лаважа заканчивают введением в бронхиальное дерево протеолитических ферментов, бронхолитиков, антибиотиков. Дренирование абсцесса легкого возможно двумя способами — через бронх и через грудную стенку. В последнем случае используются трансторакальные пункции. Чтобы дренажная функция бронхов осуществлялась более эффективно, используются постуральный дренаж, аэрозольная терапия и лечебная физкультура. Дезинтоксикационная терапия включает внутривенное введение жидкостей (гемодез, полиглюкин), витаминов, переливание плазмы. Вводят также 40 %-ный раствор глюкозы с добавлением 8—14 ЕД инсулина и препаратов, содержащих калий. При необходимости добавляют 25–30 мл гидрокортизона. Стимуляция защитных сил предусматривает переливание крови, белоксодержащих препаратов, иммуностимуляторов (пентоксила, метилурацила, оротата калия), анаболических стероидов. Применяется также иммунотерапия. Если в течение 1,5–2 месяцев консервативная терапия не дает эффекта, следует приступать к хирургическому лечению. Хронический абсцесс легкого тоже возможно вылечить. Этого можно достигнуть только путем радикальной операции. Производится резекция сегмента или доли легкого вместе с полостью абсцесса. Желательно оперировать во время ремиссии, т. е. при стабильном улучшении состояния больного. В случаях противопоказаний к хирургическому лечению нужно периодически очищать полость абсцесса от очагов инфекции. При абсцессах печени лечение в основном хирургическое — дренирование абсцесса. Возможна также пункция абсцесса с отсасыванием содержимого полости. Затем туда вводятся антибиотики. При абсцессе предстательной железы необходимо экстренное оперативное вмешательство. Перед ним целесообразно применить пункцию участка флюктуации, чтобы подтвердить наличие гноя. Далее продолжают антибактериальную и дезинтоксикационную терапию. В целом ведение больных после вскрытия абсцессов любой локализации такое же, как при лечении гнойных ран. Больным необходимы полноценное сбалансированное питание, соответствующий их состоянию режим, мероприятия по повышению специфической и неспецифической резистентности организма. Если лечение начато своевременно и течение поверхностных и глубоких абсцессов благоприятно, то возможен хороший прогноз. При поздно выполненных операциях и отсутствии полноценного дренирования абсцесса он может перейти в хроническую форму. Возможно также распространение инфекции (см. Сепсис).
АДЕНОВИРУСНАЯ ИНФЕКЦИЯ
ОпределениеАденовирусная инфекция — острая вирусная болезнь, поражающая преимущественно детей и лиц молодого возраста, протекающая с поражением слизистых оболочек респираторного тракта, глаз, кишечника, а также лимфоидной ткани.
Этиология Аденовирус принадлежит к ДНК-содержащим вирусам. Его диаметр — от 7 до 90 нм. В настоящее время известен 41 вид вируса. Он устойчив во внешней среде и к действию органических растворителей. В антигенной структуре выделяют антигены А (общий группоспецифический), В (отвечает за токсигенность) и С (типоспецифический). Аденовирусы обладают способностью склеивать эритроциты.
Эпидемиология Источник инфекции — больной любой формой аденовирусной инфекции или здоровый вирусоноситель. Существует большая опасность заражения от больных в начале заболевания, т. е. в течение первых двух недель. Однако бывает и так, что вирус продолжает выделяться в последующие 3–4 недели в период выздоровления. Инфекция передается воздушно-капельным и фекально-оральным путем. Наиболее восприимчивы к нему дети в возрасте от 6 месяцев до 5 лет. Дети до 6 месяцев невосприимчивы к инфекции в связи с наличием трансплацентарного иммунитета, т. е. полученного от матери. После перенесенного заболевания возникает типоспецифический иммунитет. Эпидемические вспышки заболевания регистрируются на протяжении всего года, особенно часто зимой, и в виде спорадических случаев в теплое время года. Инфицированию способствует тесное общение детей.
Патогенез В организм инфекция попадает через слизистые оболочки верхних дыхательных путей, реже — кишечник либо конъюнктиву. Вирус проникает в эпителиальные клетки и клетки лимфоидной ткани, поражает цитоплазму и ядро, где происходит репликация вирусной ДНК. Пораженные клетки прекращают деление и погибают. Вирусы проникают в другие клетки слизистых оболочек и лимфатических узлов, а также в кровь. Клинически это сопровождается массивным экссудативным воспалением со стороны слизистых, т. е. накоплением в них жидкости. Появляется конъюнктивит (см.). Далее в патологический процесс вовлекаются внутренние органы (легкие, бронхи, кишечник, почки, печень, селезенка), а также головной мозг, мезентериальные лимфоузлы.
Клиническая картина Аденовирусная инфекция отличается разнообразием форм течения, однако у всех ее проявлений имеется ряд общих черт. Отличительной особенностью является наличие экссудативного компонента. В связи с тропностью аденовирусов к лимфоидной ткани с первых дней болезни появляется затрудненное носовое дыхание, одутловатость лица и обильный серозно-слизистый ринит. А также увеличиваются шейные, поднижнечелюстные, медиастенальные и мезентериальные лимфатические узлы. Длительность инкубационного периода составляет от 2 до 12 дней. Заболевание начинается остро с появления симптомов интоксикации (слабость, вялость, снижение аппетита, головная боль, иногда тошнота и рвота) и повышения температуры. Максимальная температура тела — 39–40 °C за 2–3 дня. Лихорадка при аденовирусной инфекции сохраняется длительно — от 2 до 4 недель. Поражение слизистых оболочек дыхательных путей проявляется как заложенность носа и ринорея, т. е. выделение жидкого секрета из полости носа. Вначале отделяемое — слизистого характера, а затем — слизисто-гнойного. Увеличивается кровенаполнение зева, а также отмечается инфильтрация передних дужек и миндалин, гиперемия и гиперплазия фолликулов задней стенки глотки («гранулезный фарингит»). На них иногда можно видеть белесоватые наложения и густую слизь. С первых дней заболевания возникает влажный кашель. У детей раннего возраста он отличается упорным характером. При прослушивании выявляют рассеянные влажные и сухие хрипы, которые связаны с экссудативным характером воспаления. Сразу или на 3—4-й день присоединяется вирусный конъюнктивит. Сначала он поражает конъюнктиву одного глаза, а спустя 2–3 дня переходит и на другой. Отмечаются жжение конъюнктив, отек и гиперемия век, сужение глазной щели, слезотечение, светобоязнь, ощущение инородного тела в глазу. Конъюнктивиты (см.) бывают катаральные, фолликулярные (7—10 дней) и пленчатые (2–3 недели). Для аденовирусной инфекции типично развитие полиаденита, а в тяжелых случаях — гепатолиенального синдрома (см.). На пике клинических проявлений у детей раннего возраста возможны кишечные расстройства: жидкий стул с частотой до 4–5 раз в сутки без слизи и патологических примесей. Среди различных форм течения аденовирусной инфекции принято выделять основной клинический синдром: фарингоконъюнктивальная лихорадка, ринофарингит, острый катаральный и пленчатый конъюнктивит (см.), кератоконъюнктивит, тонзиллофарингит, диарея (см.), мезентериальный лимфаденит (см.) и д.р. Для фарингоконъюнктивальной лихорадки (см.) характерен длительный период повышенной температуры (не менее 1–2 недель), «гранулезный» фарингит (см.), тонзиллит (см.), поражение конъюнктив, увеличение шейных лимфоузлов, гепатоспленомегалия. Болезнь протекает длительный период. При развитии тонзиллофарингита ведущим признаком в клинической картине являются изменения в ротоглотке: налеты на миндалинах, боль в горле при глотании, увеличение регионарных лимфоузлов. Ангина носит вирусно-бактериальный характер. Мезентериальный лимфаденит (мезаденит)(см.) проявляется внезапно возникающими приступами болей в области пупка, рвотой и лихорадкой. Могут быть симптомы раздражения брюшины. При этом язык влажный, в крови отсутствуют признаки гнойного воспаления. При хирургическом вмешательстве обнаруживаются увеличенные, отечные лимфатические узлы брыжейки. Ринофарингит и ринофарингобронхит протекают наиболее легко: температура повышается незначительно и держится 3–4 дня. При этом отмечаются обильное слизистое отделяемое из носовых ходов, явления катарального фарингита, влажный кашель. У детей младшего возраста могут наблюдаться признаки развития крупа и бронхита. Шейные лимфоузлы увеличены. Диарея (см.) наблюдается, как правило, у детей от 6 до 12 месяцев. На высоте катаральных явлений отмечается появление разжиженного стула с примесью слизи. Его частота увеличивается до 3–4 и даже 5–7 раз в сутки. Спустя 3–4 дня признаки воспаления в верхних дыхательных путях уменьшаются, а диарея исчезает. У детей в возрасте до года развитие аденовирусной инфекции сопровождается появлением субфебрильной температуры. Кератоконъюнктивит характеризуется острым началом, высокой лихорадкой, головной болью, болями в глазах, светобоязнью, признаками конъюнктивита. На 2-й неделе болезни присоединяется помутнение роговицы. Течение доброкачественное. На 3—4-й неделе наступает полное выздоровление. Изъязвлений роговицы не наблюдается.
Диагностика Диагноз аденовирусной инфекции достоверен при наличии лихорадки, катара верхних дыхательных путей, лимфаденопатии, явлений тонзиллофарингита и конъюнктивита (см.). В периферической крови количество лейкоцитов обычно в норме; лишь в первые дни болезни возможен небольшой лейкоцитоз с нейтрофилезом. Характерно снижение количества лимфоцитов в крови. СОЭ незначительно увеличена. Аденовирусы выделяются из носоглоточных смывов, фекалий и крови больного. С целью экспресс-диагностики применяют метод флюоресценции антител. При этом в эпителии дыхательных путей идентифицируется аденовирусный антиген. Из методов серодиагностики используются реакция связывания комплемента и реакция задержки гемагглютинации. Диагноз подтверждается нарастанием титра антител в парных сыворотках в 4 и более раз. Дифференциальный диагноз требуется проводить с инфекционным мононуклеозом (см.). Для последнего характерны значительное увеличение шейных лимфоузлов, отсутствие выраженных катаральных проявлений, выраженный гепатолиенальный синдром. Отмечается также наличие в крови лимфоцитарного лейкоцитоза и атипичных мононуклеаров. Для микоплазменной инфекции (см.) характерно отсутствие экссудативного компонента и наличие упорных катаральных проявлений, увеличения СОЭ.
Лечение Лечение, как правило, осуществляется в домашних условиях. В лихорадочном периоде необходимы постельный режим, полноценное питание, обогащенное витаминами, дополнительное введение жидкости. В терапии аденовирусной инфекции широко используются препараты интерферона: лейкоцитарный интерферон (не позднее конца первых суток заболевания) по 5 капель 5 раз в день в нос; реаферон или гаммаферон в виде ингаляций по 1 млн ЕД; гриппферон (рекомбинантный интерферон альфа-2) в виде капель в нос по 2–3 капли 3–4 раза в день в течение первых 3–4 дней. Применяют также препараты из группы иммуномодуляторов: арбидол по 200 мг 4 раза в день в течение 3 дней, детям его назначают из расчета 10 мг/кг в сутки. Афлубин (комплексный гомеопатический препарат с противовоспалительным и иммуномодулирующим действием): детям до 1 года — по 1 капле, от 1 года до 12 лет — 6–7 капель 3 раза в сутки, взрослым — по 10–15 капель 3 раза в сутки в течение 7—10 дней. Деринат (капли в нос) назначают по 2–3 капли 4–5 раз в день. ИРС-19 (спрей): по 2–3 впрыскивания в сутки в каждую ноздрю до исчезновения симптомов инфекции. Применяется у детей с 6-месячного возраста и у взрослых. В нос можно закладывать противовирусные мази: оксолиновую, бонафтон, теброфен, флореналь. При поражении глаз рекомендуется вводить 0,5 %-ный раствор дезоксирибонуклеазы в конъюнктивальный мешок по 1–2 капли каждые 2 ч, свежеприготовленный 0,2 %-ный раствор оксолина по 1–2 капли 3 раза в день или закладывать за край века 0,25 %-ную оксолиновую мазь 3 раза в день. Можно закапывать интерферон по 2 капли каждые 2–3 ч. Назначается десенсибилизирующая и витаминотерапия в возрастных дозировках, а также симптоматические средства. Антибиотики показаны только при наличии осложнений, хронических очагов инфекции и микст-инфекции. Специфическая профилактика аденовирусной инфекции не разработана. Неспецифическая профилактика заключается в том, что заболевших нужно как можно скорее выявить, изолировать в течение 10 дней и применить соответствующее лечение. С профилактической целью применяется также интерферон по 2–3 капли в каждую ноздрю 2–3 раза в день, арбидол по 100 мг 1 раз в сутки в течение 5 дней, афлубин по 10–15 капель 1 раз в день в течение 1–2 недель.
АДЕНОИДИТ
ОпределениеАденоидит — воспаление патологически разращенной (гиперплазированной, гипертрофированной) глоточной (носоглоточной) миндалины. Может встречаться изолированно или в сочетании с воспалением увеличенных небных миндалин.
Этиология и патогенез Носоглоточная миндалина (аденоиды) хорошо развита в детском возрасте; приблизительно с 12 лет она становится меньше, а у взрослых нередко полностью атрофируется. Аденоиды чаще всего наблюдаются у детей 3—10 лет, но могут быть и в первые годы жизни, и после периода полового созревания. Развитию аденоидов способствуют детские инфекционные заболевания (корь, скарлатина, дифтерия), часто повторяющиеся вирусные и микробные воспалительные заболевания верхних дыхательных путей, иммунодефицитные состояния, склонность к аллергии, наследственный фактор. По величине аденоиды делят на три степени: — I степень — аденоиды малого размера, прикрывают верхнюю треть сошника; — II степень — аденоиды среднего размера, закрывают две трети сошника; — III степень — аденоиды большого размера, прикрывают весь или почти весь сошник.
Клиническая картина Острый аденоидит При остром аденоидите отмечается нарушение носового дыхания, обильное выделение слизистого секрета, заполняющего носовые ходы и стекающего в носоглотку, хроническое набухание и воспаление слизистой оболочки носа. Из-за затрудненного носового дыхания дети спят с открытым ртом, сон часто бывает беспокойным и сопровождается громким храпом; дети встают вялыми, апатичными. У школьников часто снижается успеваемость из-за ослабления памяти и внимания. Аденоиды, закрывая глоточные отверстия евстахиевых (слуховых) труб и нарушая нормальную вентиляцию среднего уха, могут вызвать понижение слуха, иногда значительное. Искажается речь, голос теряет звучность и принимает гнусавый оттенок. Дети раннего возраста с трудом овладевают речью. Часты жалобы на упорную головную боль как результат затрудненного оттока крови и лимфы от головного мозга, обусловленного застойными явлениями в полости носа. Постоянные выделения слизистого секрета из носа вызывают мацерацию и припухание кожи верхней губы, а иногда экзему. Рот постоянно открыт, нижняя челюсть отвисает, носогубные складки сглаживаются, выражение лица в поздних стадиях малоосмысленное, из углов рта вытекает слюна, что придает лицу ребенка особое выражение, получившее название «аденоидное лицо», или «внешний аденоидизм». Постоянное дыхание через рот приводит к деформации лицевого черепа. У таких детей может наблюдаться неправильный прикус, высокое нёбо. В результате длительного затрудненного носового дыхания деформируется грудная клетка, становясь уплощенной и впалой. Нарушается вентиляция легких, снижается оксигенация крови, уменьшается количество эритроцитов и содержание гемоглобина. При аденоидах нарушается деятельность желудочно-кишечного тракта, развиваются анемия, ночное недержание мочи, хореоподобные движения мышц лица, ларингоспазм, астматические приступы, приступы кашля. Преимущественно в детском возрасте может возникать самостоятельно или чаще в сочетании с острым воспалением небных миндалин (см. Ангина) острый аденоидит (ангина глоточной миндалины), при котором температура тела может повышаться до 39 °C и выше, появляется ощущение сухости, саднения, жжения в носоглотке. Наряду с насморком, заложенностью носа у больных отмечается закладывание, а иногда и боль в ушах, приступообразный кашель по ночам. Регионарные лимфатические узлы (подчелюстные, шейные и затылочные) увеличены и болезненны при пальпации. У детей раннего возраста могут появиться признаки общей интоксикации, диспепсия. Заболевание длится 3–5 дней. Нередкое осложнение острого аденоидита — евстахиит (см.), отит (см.).
Хронический аденоидит Вследствие частых респираторных заболеваний, острых аденоидитов, особенно при выраженной аллергии, возникает хронический аденоидит. При этом характерно нарушение общего состояния больного, ребенок становится вялым, теряет аппетит, во время приема пищи нередко возникает рвота. Затекание из носоглотки в нижележащие дыхательные пути слизисто-гнойного отделяемого вызывает упорный рефлекторный кашель, особенно по ночам. Температура тела нередко субфебрильная, регионарные лимфатические узлы увеличены. Воспалительный процесс из носоглотки легко распространяется на придаточные пазухи носа, глотку, гортань, нижележащие дыхательные пути, в результате чего дети часто страдают бронхолегочными заболеваниями. Для распознавания применяют заднюю риноскопию, пальцевое исследование носоглотки и рентгенологическое исследование. Размеры аденоидов не всегда соответствуют вызванным ими патологическим изменениям в организме. Иногда аденоиды I–II степени вызывают резкое затруднение дыхания через нос, снижение слуха и другие патологические изменения. Аденоиды дифференцируют с юношеской фибромой носоглотки и другими опухолями этой области. Затрудненное дыхание через нос бывает не только при аденоидах, но и при искривлении носовой перегородки, гипертрофическом рините, новообразованиях полости носа.
Диагностика На основании жалоб, объективного осмотра, риноскопии, фарингоскопии.
Лечение Лечение, как правило, хирургическое. Показаниями к операции служат не столько величина аденоидов, сколько возникшие расстройства в организме. У детей с аллергическим диатезом, склонных к аллергии, аденоиды после хирургического лечения нередко рецидивируют. В таких случаях операцию проводят на фоне десенсибилизирующей терапии. При аденоидах I степени без выраженных нарушений дыхания можно рекомендовать консервативное лечение — закапывание в нос 2 %-ного раствора протаргола. Из общеукрепляющих средств назначают рыбий жир, препараты кальция внутрь, витамины Си D, климатическое лечение.
АДЕНОМА
Определение Аденома — доброкачественная опухоль, происходящая из железистого эпителия. Может возникать в любом органе, где представлен железистый эпителий. Течение и клиника процесса зависят от особенностей локализации, темпа роста и размеров аденомы.Аденома гипофиза, например, представляет собой опухоль из клеток аденогипофиза (передней доли) и локализуется в области турецкого седла. Аденома предстательной железы — доброкачественная опухоль предстательной железы. Клинически эти заболевания проявляются совершенно различно. Аденома представляет собой четко очерченный и отграниченный капсулой узел, расположенный в толще органа. Реже она имеет форму полипа на тонкой ножке или широком основании (аденоматозный полип). Гистологически аденомы имеют соединительнотканную строму и эпителиальную паренхиму. Последняя может сохранять способность к продукции секрета (например, коллоид в аденоме щитовидной железы, нейтральный жир в аденоме сальных желез и прочее). Секрет аденом может накапливаться, в результате чего в них образуются кисты. Такие опухоли носят название цистаденом или аденокистом. Характер соотношения в аденоме эпителиальных и соединительнотканных структур, а также форма и локализация железистого эпителия в опухоли являются основанием для тканевой классификации аденом. Трабекулярная, или солидная, аденома характеризуется наличием компактных тяжей железистых клеток, которые разделены очень тонкими прослойками соединительной ткани. Тубулярная аденома состоит из узких каналов, выстланных кубическим или призматическим эпителием, в центре которых обнаруживается секрет. Альвеолярная, или ацинозная, аденома возникает за счет концевых отделов ветвящихся желез. Аденома с преобладанием соединительнотканной стромы называется фиброаденомой.
Патогенез Механизм развития аденом в целом изучен недостаточно. Однако в большинстве случаев удается проследить первичные нарушения в балансе гормонов — регуляторов функции железистого эпителия.
Аденомы гипофиза Возможно развитие аденом, связанное с первичным поражением гипоталамуса и вторичным вовлечением в процесс тканей аденогипофиза. Далее последовательно возникают гиперплазия, аденоматоз и аденома. Ряд аденом (гонадотропинома, тиреотропинома) развиваются в результате гипоталамической гиперстимуляции гипофиза вследствие первичного снижения активности периферических желез внутренней секреции — гонад и щитовидной — при гипогонадизме и гипотиреозе (см.).
Аденома предстательной железы В связи с непосредственной связью развития аденомы простаты (доброкачественная гиперплазия предстательной железы) с возрастом (старше 45 лет) можно сделать вывод в пользу дисгормональной природы аденомы простаты. Это подтверждает и экспериментальное воспроизведение ее у животных. Рост ткани предстательной железы и последующее развитие ее гиперплазии связаны с превращением тестостерона в его более активный аналог дегидротестостерон в железистых клетках простаты. Возрастное угнетение синтеза тестостерона в яичках и коре надпочечников приводит к повышенной секреции гонадотропного гормона аденогипофиза. Наряду с этим активизируется превращение тестостерона с низкой активностью в его более активный метаболит. Симптомы нарушения проходимости мочевыводящих путей при аденоме простаты развиваются благодаря нарушениям уродинамики. Их происхождение связано с тем, что аденома растет и, увеличиваясь в размерах, начинает сдавливать простатическую часть мочеиспускательного канала. Последний становится более узким, длинным и искривленным, что обусловливает нарушение акта мочеиспускания. Как компенсирующее явление увеличиваются в размерах мышцы мочевого пузыря (детрузора). При последующем росте аденомы приподнимается шейка мочевого пузыря. Кроме того, могут сдавливаться устья мочеточников, что приводит к расширению вышележащих отделов мочевыводящих путей. Вследствие нарушений мочеиспускания в мочевом пузыре возникает повышенное давление. Это в свою очередь в сочетании с его неполным опорожнением приводит к перерастяжению и последующей атонии пузыря. В результате атонии и дилатации верхних отделов развиваются пузырно-мочеточниково-лоханочные рефлюксы (см.). Их следствием являются восходящий пиелонефрит (см.) и хроническая почечная недостаточность (см.).
Клиническая картина
Аденома гипофиза Различают гормонально-активные и гормонально-неактивные аденомы гипофиза. Гормонально-активную опухоль подтверждают ярко выраженные симптомы или синдромы, характерные для гиперсекреции того или иного гормона. Кроме того — повышенная концентрация этого гормона в сыворотке крови. Встречаются пролактиномы, соматотропиномы, кортикотропиномы, тиреотропиномы, гонадотропиномы и смешанные формы. Гормонально-неактивные аденомы гипофиза клинически проявляются только по достижении ими больших размеров, которые обусловливают сдавление окружающих структур мозга. При этом появляются соответствующие симптомы. В зависимости от размера различают микроаденомы (диаметром менее 10 мм) и макроаденомы. Клинические проявления гормонально-активных аденом гипофиза складываются из совокупности эндокринно-обменных нарушений, офтальмоневрологических и рентгенологических симптомов. Эндокринно-обменные нарушения чаще бывают связаны с гиперстимуляцией органа-мишени, например гиперкортицизмом или тиреотоксикозом (см.). Также влияет степень повреждения окружающих опухоль тканей аденогипофиза. Пролактинома у женщин характеризуется развитиемсиндрома галактореи (см.) иаменореи (см.). В ряде случаев пролактинома проявляется одним из симптомов — например, только галактореей или нарушениями менструального цикла. Однако чаще отмечается сочетание этих симптомов, ведущих к бесплодию. Около трети женщин с пролактиномами страдают также отнерезко выраженного гипертрихоза (см.), умеренного ожирения, акне, себореи (см.), нарушений в сексуальной сфере: аноргазмии (см.), снижения либидо. Мужчины с пролактиномами, как правило, жалуются на снижение либидо, импотенцию (см.). Отмечается мужское бесплодие (см.), тогда как галакторея игинекомастия (см.) встречаются у них редко. Офтальмоневрологические нарушения встречаются у женщин с пролактиномами в 25 % случаев, тогда как у мужчин в клинике они доминируют. Это связано с более ранним выявлением опухоли у женщин (еще на стадии микроаденом). У мужчин же постепенное нарастание неспецифических симптомов (половая слабость и др.) приводит к тому, что опухоль, как правило, выявляется уже больших размеров. Соматотропиномы, продуцирующие соматотропин, клинически проявляются синдромами акромегалии (см.), или гигантизма (у детей). Помимо типичных изменений скелета и мягких тканей при акромегалии могут отмечаться другие эндокринные нарушения — повышение артериального давления, ожирение и сахарный диабет, эутиреоидная гиперплазия щитовидной железы. Кроме того, выявляются гирсутизм, появление папиллом, невусов, бородавок на коже, повышенные сальность и потоотделение. Снижается работоспособность. Офтальмоневрологическая симптоматика развивается по достижении опухолью определенных размеров. Отмечаются периферические полинейропатии со снижением чувствительности в дистальных отделах конечностей, парестезий и болей. Кортикотропиномы встречаются реже, чем аденомы гипофиза. Основным клиническим проявлением кортикотропиномы считают болезнь Иценко-Кушинга (см.), при которой данную опухоль находят практически в 100 % случаев. Помимо гиперкортицизма и гиперсекреции АКТГ отмечается повышенный уровень меланоцитостимулирующего гормона, который обусловливает усиленную пигментацию кожных покровов. После двусторонней адреналэктомии по поводу болезни Иценко-Кушинга (см.) отмечается ускоренный рост кортикотропиномы, что получило название синдрома Нельсона. Данный вид аденом по сравнению с другими доброкачественными опухолями аденогипофиза более склонен к озлокачествлению и метастазированию. Выявляются они, как правило, рано, поэтому офтальмоневрологические проявления могут еще отсутствовать. Кортикотропиномы приводят к развитию эндокринных психических нарушений. Гонадотропиномы и тиреотропиномы также относятся к редким формам аденом гипофиза. Эндокринологические нарушения при этих формах зависят главным образом от того, первично или вторично по отношению к патологии органов-мишеней развились аденомы. При первично существующей тиреотропиноме патология органа-мишени (щитовидной железы) будет выражаться в гипертиреозе (см.). Если же опухоль возникла вторично в качестве элемента компенсации первичной недостаточности щитовидной железы, клинически будет отмечаться гипотиреоз (см.). При гонадотропиномах, как правило, отмечается гипогонадизм. Значительно реже ему сопутствует галакторея (см.) в связи с тем, что повышается секреция пролактина тканью аденогипофиза, окружающей опухоль. Симптоматика гонадотропиномы малоспецифична, поэтому выявление опухоли происходит на поздних стадиях. Для развивающейся аденомы гипофиза характерны офтальмоневрологические симптомы. К ним относят первичную атрофию зрительных нервов и изменение полей зрения по типу битемпоральной гемианопсии или гипопсии. Это связано со сдавлением области перекреста зрительных нервов. Дальнейший рост опухоли вверх приводит к повреждению структур гипоталамуса. Характерна головная боль, возникающая из-за давления аденомы на диафрагму турецкого седла. Места локализации — лобная, височная и позадиглазничная области. Боль тупая, не сопровождаетсятошнотой и не всегда снимается при приеме анальгетиков. При латеральном росте опухоли повреждаются III, IV, VI и ветви V пары черепно-мозговых нервов с возникновением офтальмоплегии и диплопии. Направление роста — преимущественно вниз с распространением процесса в пазуху клиновидной кости и решетчатые пазухи. Это может сопровождаться чувством заложенности носа и ликвореей (истечением спинномозговой жидкости из носовых ходов). Ускорение роста аденомы гипофиза (например, при беременности) влияет на внезапное усиление головной боли и офтальмо-неврологической симптоматики. Причиной также может быть кровоизлияние в области аденомы. Последнее считают тяжелым, но не фатальным осложнением. При беременности отмечается рост опухоли, однако после родоразрешения у большинства больных ее размеры сокращаются.
Аденома предстательной железы (доброкачественная гиперплазия предстательной железы) Клиническая картина аденомы предстательной железы развивается у мужчин старше 40 лет. Особенности симптоматики зависят от размеров и преимущественного роста аденомы. Встречаются формы с преимущественным ростом в сторону прямой кишки (подпузырные), реже внутрипузырные, растущие внутрь мочевого пузыря, при которых расстройства мочеиспускания выражены более значительно. При исследовании через прямую кишку опухоль не определяется. В ряде случаев аденома может быть локализована непосредственно под мочепузырным треугольником (ретротригональная форма). Выделяют 3 стадии течения аденомы предстательной железы, связанные со степенью расстройств мочеиспускания и нарушения функции почек. Первая стадия (компенсации) характеризуется тем, что мочевой пузырь опорожняется полностью, а признаки нарушения функции верхних отделов мочевыводящих путей и почек отсутствуют. Клинически на этой стадии определяются «вялая» струя мочи, затруднения в начале и большая длительность акта мочеиспускания, учащенные позывы на него, особенно в ночное время. После мочеиспускания в пузыре может остаться до 50 мл мочи. Вторая стадия (субкомпенсации) характеризуется появлением «остаточной» мочи, которая сохраняется в мочевом пузыре. Это происходит вследствие того, что нарушается баланс функций детрузора в количестве 100 мл после естественного акта мочеиспускания. Постепенно это количество увеличивается вплоть до возникновения пузырно-мочеточникового рефлюкса (см.) и дилатации верхних отделов мочевыводящих путей, что приводит к развитию хронической почечной недостаточности. Возможны недержание мочи и острая задержка мочеиспускания. В третьей (декомпенсированной) стадии аденомы предстательной железы развивается атония детрузора и внутреннего сфинктера мочевого пузыря. Это приводит к появлению сочетания «задержание и недержание» мочи, когда при переполненном мочевом пузыре моча выделяется по каплям, что получило название парадоксальной задержки мочи. Развивается азотемическая интоксикация, нарастает картина почечной недостаточности, что в конечном итоге может привести к летальному исходу. Нарастающие явления почечной недостаточности характеризуются жаждой, полиурией, аммиачным запахом изо рта, снижением аппетита, изменениями со стороны внутренних органов. При осмотре, прощупывании и прослушивании уже на ранних стадиях можно выявить выбухающий над лонным сочленением переполненный мочевой пузырь. При ректальном исследовании простата имеет четкие границы, гладкую поверхность, равномерную тугоэластическую консистенцию и сглаженную междолевую борозду. Стенка прямой кишки над предстательной железой полностью сохраняет свою подвижность. В первой и второй стадиях аденомы простаты возможны случаи острой задержки мочеиспускания, которые могут быть связаны с переохлаждением, приемом алкоголя, ситуационным перезадержанием мочеиспускания. Аденома может осложниться развитием гематурии из расширенных вен шейки мочевого пузыря, иногда довольно обильной — вплоть до заполнения пузыря кровяными сгустками. Длительный уростаз создает благоприятные условия для восходящей инфекции — особенно опасен пиелонефрит (см.), а также камнеобразования в мочевом пузыре. В последнем случае присоединяются характерные симптомы: учащение мочеиспускания, а также боли со смещением в головку полового члена и симптом «закладывания» струи мочи.
Диагностика Рентгенологическими симптомами опухолей аденогипофиза являются изменения формы и размеров турецкого седла, истончение и разрушение его костных структур. При компьютерной томографии просматривается и сама опухоль. Клинико-биохимические и радиоиммунологические методы исследования позволяют точно установить тип эндокринно-обменных нарушений и концентрацию гормонов гипофиза в сыворотке крови. Следует различать аденомы гипофиза с опухолями внегипофизарной локализации, гипоталамо-гипофизарной недостаточностью неопухолевого генеза, синдромом «пустого» турецкого седла. Для последнего характерно развитие офтальмоневрологических нарушений. В диагностике аденом предстательной железы широко применяется урофлоуметрия для распознавания аденомы и количественной оценки функции мочевого пузыря. Размеры простаты, ее структура, наличие камней в мочевом пузыре и уровень остаточной мочи хорошо просматриваются при помощи УЗИ. Экскреторная урография позволяет раздельно оценить функциональное состояние почек и верхних отделов мочевыводящих путей. При этом на цистограммах отчетливо виден овальный (холмовидный) дефект наполнения и наличие (или отсутствие) камней. При невозможности выполнения нисходящей цистографии (при выраженной почечной недостаточности, например) используется ретроградная цисто- или уретроцистография. Радионуклидные исследования позволяют определить функцию почек, состояние уродинамики, количество остаточной мочи. Для исключения рака простаты выполняют трансперинеальную или трансректальную пункционную биопсию. Дифференциальный диагноз при аденомах простаты необходим с заболеваниями, которые сопровождаются сходной клинической симптоматикой: стриктурами уретры, склерозом предстательной железы и шейки мочевого пузыря, новообразованиями уретры и мочевого пузыря, раком (см.) предстательной железы.
Лечение Аденомы гипофиза Характер терапии аденом гипофиза зависит от конкретного вида аденомы, ее размеров, выраженности и тяжести клинических проявлений. Применяют медикаментозное лечение, оперативные вмешательства, дистанционную и внутритканевую лучевую терапию. Их эффективность зависит от стадии развития и выраженности клинической симптоматики. Пролактиномы вне зависимости от их размеров начинают лечить консервативно с применением антагонистов дофаминовых рецепторов (парлодела и др.). На фоне длительной терапии женщинам разрешают беременеть. Если эффект от консервативного лечения отсутствует, выполняется оперативное вмешательство, предпочтительно методами микрохирургии. При больших размерах аденом выполняется нейрохирургическое вмешательство с последующей послеоперационной лучевой терапией. При больших размерах соматотропином и пролактосоматотропином и невозможности радикального их удаления из-за прорастания в глазницу или решетчатые пазухи требуется проведение дистанционной гамматерапии в послеоперационном периоде. Применяются также лекарственные средства — антагонисты дофаминовых рецепторов. Кортикотропиномы в молодом возрасте при сочетании с синдромом Нельсона или болезнью Иценко-Кушинга (см.) легкой и средней тяжести лучше поддаются дистанционной лучевой терапии. При аденомах небольших размеров предпочтительнее использовать протонное облучение. Если болезнь протекает тяжело, на первом этапе терапии требуется снизить степень гиперкортицизма или устранить его с использованием одно- или двусторонней адренэктомии и химиотерапии, а уже затем проводить дистанционное протонное облучение. Тиреотропиномы и гонадотропиномы обычно лечатся с первичной коррекцией гормонального фона (заместительная терапия), после чего в зависимости от размеров и распространенности опухоли назначаются оперативное вмешательство или лучевая терапия. Гормонально-неактивные опухоли аденогипофиза нуждаются в комплексном лечении — оперативном вмешательстве и лучевой терапии, после которых пациентам необходима корригирующая гормональная терапия.
Аденома предстательной железы Лечение больных с первой стадией аденомы обычно консервативное. Его проводят, чтобы нормализовать кровообращение в малом тазу, улучшить питание мочевого пузыря, ликвидировать воспалительные процессы в простате, а также с целью уменьшения размеров аденомы. Широко используются неспецифические методы терапии — оптимизация режима дня, борьба с гиподинамией, прогулки на свежем воздухе не реже 2 раз в день, лечебная физкультура для мышц тазового дна и бедер. Для снижения ночного диуреза ограничивают прием жидкости на ночь, полностью исключают из рациона алкоголь, острые приправы и пряности, ограничивают количество острой и консервированной пищи. Необходимо проводить лечение сопутствующих заболеваний, способных приводить к развитию никтурии, особенно сердечно-сосудистых. Улучшению функции детрузора способствует назначение андрогенов: метил-тестостерон по 0,005 г 3 раза в день в течение 1 месяца (перед повторным курсом необходим месячный перерыв); 1 %-ный раствор тестостерона пропионата внутримышечно в течение 2–3 недель, но не более 3 курсов с перерывами в 2–3 недели; сустанон-250 по 2 мл внутримышечно 1 раз в месяц. Чтобы уменьшить размеры простаты и как следствие улучшить отток мочи, можно применять ингибитор стероидной 5-альфа редуктазы — финастрида (проскара, финаста) по 5 мг 1 раз в день. Одновременно проводят лечебные мероприятия, направленные на устранение инфекции. Проводится лечение цистита, уретрита и простатита, которые нередко осложняют течение основного заболевания. Облегчению обструктивных симптомов способствует назначение альфа-1А-адреноблокаторов (омник) и альфа-1-адреноблокаторов (дальфаз, корнам, кардура и другие), которые блокируют альфа-1-адренорецепторы, расположенные в мочепузырном треугольнике, гладких мышцах предстательной железы и простатической части уретры. Благодаря этому снижается их тонус и улучшается отток мочи. Больные с острой задержкой мочеиспускания нуждаются в оказании экстренной помощи (выведение мочи катетером, надлобковая пункция мочевого пузыря, срочная операция). Чтобы улучшить функциональные возможности мочевого пузыря, допускается его дренирование в течение 1–3 суток тонким уретральным или мочеточниковым катетером. Экстренная помощь требуется и при развитии полной гематурии. Показаниями к оперативному лечению являются отсутствие эффекта от консервативной терапии, декомпенсация детрузора и возрастающий объем остаточной мочи, нарушение уродинамики верхних отделов мочевыводящих путей с развитием почечной недостаточности. Оперативные вмешательства при аденомах простаты подразделяются на паллиативные и радикальные. К паллиативным мерам относят наложение надлобкового мочепузырного свища в качестве окончательной помощи и трансуретральную электрорезекцию аденомы, которая выполняется при объеме узлов не более 60 см3. Это на какое-то время восстанавливает нормальное мочеиспускание. При необходимости электрорезекцию можно провести повторно. К радикальным операциям относят одно- и двухмоментную аденомэктомию. Наибольшее распространение имеет трансвезикальный доступ. При проведении двухмоментной аденомэктомии (при осложненном течении заболевания) вначале проводится наложение эпицистостомы, а после восстановления тонуса верхних отделов мочевыводящих путей и нормализации общего состояния пациента — радикальная трансвезикальная аденомэктомия.
АДИНАМИЯ
Адинамия (от греч. adynamia — «бессилие») — резкая мышечная слабость, сопровождающаяся существенным снижением либо полным прекращением двигательной активности. Может быть результатом атрофии мышечной системы, возникающей при продолжительной неподвижности, голодании, истощающих инфекционных болезнях, хронических интоксикациях, кахексии различного происхождения (например, при злокачественных опухолях, тяжелом тиреотоксикозе, поражениях гипофиза), при перерождении мышц вследствие патологических процессов в спинном мозге, периферических нервах, при некоторых миопатиях, а также при старческих изменениях организма.Другая причина адинамии — нарушения специфических биохимических и биофизических процессов, лежащих в основе сокращения мышечных волокон. Часто появление адинамии характеризуется комплексным действием нескольких патогенных факторов. Наряду с общей адинамией возможна адинамия отдельных органов, возникающая в результате их повреждения разнообразными патогенными факторами, функционального истощения на почве гиперфункции либо расстройства регуляторных механизмов (например, адинамия желчного пузыря при снижении выделения холецистокинина в двенадцатиперстной кишке). В зависимости от причины адинамия может быть полностью обратима без вмешательства извне (например, адинамия при резком мышечном утомлении) или требует специального лечения. При наличии далеко зашедших структурных изменений адинамия может стать необратимой.
АДИПОЗОГЕНИТАЛЬНАЯ ДИСТРОФИЯ
ОпределениеАдипозогенитальная дистрофия (синдром Пехкранца-Бабинского-Фрелиха) — нейроэндокринный синдром, характеризующийся прогрессирующим ожирением с преимущественным отложением жира в плечевом поясе, молочных железах, на животе, ягодицах, бедрах. Он сопровождается недоразвитием (недостаточным функционированием) половых органов.Этиология Как правило, факторами развития адипозогенитальной дистрофии являются поражения гипоталамуса или гипофиза в результате нейроинфекции, травмы, воспалительного или опухолевого процесса. В ряде случаев причину заболевания уточнить не удается.
Патогенез Данные факторы приводят к снижению секреции гонадотропного гормона аденогипофиза, в связи с чем развивается гипогонадотропный гипогонадизм. В ряде случаев отмечается снижение секреции антидиуретического и тиреотропного гормонов. На механизм развития ожирения влияют гипоталамические и гипофизарные нарушения, а также наличие повышенного аппетита (вплоть до приступов булимии (см.).
Клиническая картина В клинической картине доминируют обменные нарушения и снижение активности половых желез. Чаще синдром выявляется у мальчиков в возрасте 10–12 лет. Характерны общее ожирение, ложная гинекомастия (см.), слабое развитие вторичных половых признаков. В ряде случаев может наблюдаться снижение темпов роста. Яички и мошонка недоразвиты, может отмечаться одно- или двусторонний крипторхизм (см.). У девочек на фоне ожирения отсутствуют месячные. Умственное развитие не страдает. При развитии заболевания у взрослых наблюдается снижение либидо и потенции, развитие гипо- или аменореи (см.), бесплодия (см.) на фоне ановуляторных циклов. Нередко встречается повышение температуры. Жировые отложения локализуются в области плечевого пояса, рук, молочных желез, живота, ягодиц и бедер. Если причиной развития синдрома стала аденома гипофиза или краниофарингиома области турецкого седла, к описанным нарушениям присоединяются офтальмоневрологические симптомы. Они связаны со сдавлением области перекреста зрительных нервов (чаще встречается битемпоральная гемианопсия). Прогноз в отношении жизни благоприятный. В отношении трудовой деятельности — ограниченный.
Диагностика В диагностике важная роль принадлежит биохимическим и рентгенологическим методам исследования. У мужчин снижается секреция с мочой, в крови понижается концентрация тестостерона. У женщин снижается секреция с мочой эстрогенов. У всех больных отмечается снижение концентрации лютеинизирующего и фолликулостимулирующего гормонов гипофиза в сыворотке крови. Дифференциальный диагноз адипозогенитальной дистрофии необходим в детском возрасте с задержкой полового развития конституционально-наследственного характера в сочетании с ожирением, а также с синдромом Лоренса-Муна-Бидля. При нем, помимо ожирения и гипогонадизма, выявляются задержка умственного развития, полидактилия и пигментный ретинит (см.).
Лечение Опухолевая природа заболевания лечится оперативным вмешательством в сочетании с лучевой терапией (преимущественно протонным пучком). При наличии воспаления проводят комплексную антибактериальную терапию на фоне низкокалорийной сбалансированной по основным ингредиентам диеты (1500–1600 ккал); в ряде случаев показаны аноректики. В дальнейшем назначается заместительная терапия хорионическим гонадотропином: детям до 12 лет — по 500—1000 ЕД 2 раза в неделю, старше 12 лет и взрослым — по 1500–3000 ЕД 2 раза в неделю в течение 3–4 недель. Курсы повторяют с интервалом в 2–3 месяца. При отсутствии эффекта проводят заместительную терапию половыми гормонами. Лечение сопутствующих гормональных нарушений при гипотиреозе и несахарном диабете проводится по общим схемам (см. Гипотиреоз, Диабет несахарный).
АКИНЕТИКО-РИГИДНЫЙ СИНДРОМ
ОпределениеАкинетико-ригидный синдром (амиостатический симптомокомплекс, гипокинетико-гипертонический синдром) — совокупность двигательных расстройств, выражающихся снижением двигательной активности, замедлением произвольных движений и повышением тонуса мышц по пластическому типу.Акинетико-ригидный синдром встречается при дрожательном параличе, после перенесенного энцефалита (эпидемического, летаргического, японского, энцефалита Сент-Луис), вследствие атеросклероза сосудов головного мозга, острых и хронических интоксикаций, гепатоцеребральной дистрофии, черепно-мозговых травм. Данный синдром может быть также следствием побочного эффекта при лечении препаратами фенотиазинового ряда, раувольфии, метилдофа и др.
Этиология и патогенез Развитие акинетико-ригидного синдрома непосредственно связано с поражением экстрапирамидной системы, в частности черного вещества и базальных ядер (нигральный синдром). При этом играет роль и наследственно обусловленный дефект механизмов контроля за обменом катехоламинов в головном мозге, что характеризуется снижением уровня дофамина в базальных ядрах и черном веществе. Таким образом, приведенные выше факторы являются лишь провоцирующими для развития подкорковых нарушений.
Клиническая картина В клинике акинетико-ригидного синдрома основные признаки могут характеризоваться различной степенью проявления. Замедление произвольных движений, например, может варьировать от брадикинезии до полной акинезии. Понижение двигательной активности (гипокинезия) сочетается с ригидностью мышц и отсутствием синкинетических движений (например, сочетанных движений рук при ходьбе, жестикуляции, мимике). Речь больных становится монотонной и невнятной. У многих больных отмечаются признаки паркинсонизма — мелкоразмашистый ритмичный тремор, исчезающий при попытке целенаправленного движения. Когда достигается мышечный тонус степени ригидности, больные лишаются возможности двигаться. Если придать какой-либо конечности определенное положение, она сохраняет его в течение длительного времени. Прогноз определяется основным заболеванием.
Диагностика Диагностика основывается на данных клинических наблюдений, однако необходимо учитывать, что развернутая клиническая картина выявляется не всегда. Например, при лечении нервно-психических больных препаратами фенотиазинового ряда или после хирургического лечения паркинсонизма может отмечаться гипокинезия, а также скованность без повышения тонуса мышц по экстрапирамидному типу.
Лечение Лечение направлено в первую очередь на коррекцию первичных нарушений вследствие основного заболевания. Параллельно используются препараты, направленные на снижение мышечного тонуса (миорелаксанты), противопаркинсонические средства. При развитии акинетико-ригидного синдрома вследствие приема препаратов фенотиазинового ряда их отмена приводит к полному исчезновению симптомов отравления.
АКРОМЕГАЛИЯ
ОпределениеАкромегалия (от греч. akros — «крайний», megas — «большой») относится к группе нейроэндокринных заболеваний, обусловленных патологическим повышением ростовой активности. В детском и юношеском возрасте (до окончания окостенения эпифизарных хрящей) при чрезмерной ростовой активности развивается гигантизм. После закрытия ростовых зон он переходит в акромегалию. Гигантизм характеризуется сравнительно пропорциональным эпифизарным и периостальным увеличением костей, мягких тканей и внутренних органов. При акромегалии, напротив, увеличение костей скелета в периостальной зоне и внутренних органов отличается диспропорциональностью; кроме того, развивается ряд обменных нарушений.Акромегалия является редким заболеванием и развивается преимущественно у взрослых.
Этиология и патогенез Основную роль в развитии акромегалии играет увеличение секреции соматотропного гормона гипофиза — гормона роста. Наиболее частой причиной гиперпродукции соматотропина является гормонально-активная аденома (см.) гипофиза — соматотропинома. Несколько реже встречается первичное поражение гипоталамуса или вышерасположенных отделов мозга. К нему могут приводить травмы черепа с сотрясением мозга, психоэмоциональные нагрузки, внегипофизарные опухоли головного мозга, влияние на центральную нервную систему специфических и неспецифических инфекционных процессов. При этом увеличивается синтез соматолиберина, а уже вслед за тем опосредованно — синтез соматотропина. К возникновению акромегалии может приводить повышенная активность соматомединов, которые вырабатываются печенью и периферическими тканями в ответ на воздействие соматотропина, а также повышенная чувствительность тканей к ним. Это связано с тем, что соматомедины оказывают непосредственное влияние на рост костно-суставного аппарата. Кроме того, акромегалия как синдром может развиваться при наличии эктопической продукции соматотропина или соматолиберина опухолями неэндокринной локализации (легкие, желудок, кишечник и др.). На возникновение акромегалии способны также влиять резкие колебания гормонального фона, что особенно характерно для женского организма: роды (см.), аборты (см.), климактерический (см.) и посткастрационный периоды.
Клиническая картина В течении акромегалии выделяют ряд стадий. Заболевание развивается годами. В связи с этим наиболее ранняя стадия — преакромегалическая — выявляется достаточно редко, поскольку симптоматика не столь отчетлива, как на гипертрофической стадии. Гипертрофическая стадия характеризуется развернутой клиникой заболевания. Типичны жалобы на головную боль, изменение внешности, увеличение в размерах кистей и стоп. Кроме того, пациентов беспокоят онемение в руках, слабость, сухость во рту, жажда, боль в суставах, ограничение и болезненность движений. У большинства женщин развиваются нарушения менструального цикла вплоть до аменореи (см.), у трети больных (мужчин) развивается импотенция (см.). При сочетании гиперпродукции соматотропина и пролактина отмечается синдром галактореи (см.). Головные боли беспокоят преимущественно при опухолевой природе акромегалии. Их связывают с повышением внутричерепного давления и (или) компрессией растущей аденомой диафрагмы турецкого седла. К изменениям внешности приводит огрубение черт лица, связанное с увеличением надбровных дуг, скуловых костей, нижней челюсти. Расширяются межзубные промежутки (диастема). Кроме того, характерна гипертрофия мягких тканей лица — носа, губ, ушей. Увеличивается язык (макроглоссия), на котором сохраняются отпечатки зубов.
Кисть больного акромегалией
Кисть больного акромегалией Довольно часто при акромегалии отмечаются изменения со стороны кожных покровов: гиперпигментация (чаще в области кожных складок и мест трения одеждой), повышенная жирность и влажность благодаря увеличению количества и размеров потовых и сальных желез, лихенизация (см.) и складчатость (более выражены на волосистой части головы). Отмечается также гипертрихоз (см.). Изменения со стороны мышц заключаются не столько в гипертрофии мышечной ткани, сколько в разрастании соединительнотканных структур. В начале заболевания отмечается повышение мышечной силы и работоспособности пациентов, однако по мере его прогрессирования мышечные волокна подвергаются склерозированию, развивается проксимальная миопатия. Гипертрофия хрящевой ткани в суставах приводит к появлению акромегалической артропатии. В результате пролиферации хрящей гортани голос у больных становится низким и сиплым. На начальных этапах заболевания увеличенные внутренние органы функционируют нормально. Но вследствие прогрессирования болезни присоединяются признаки сердечной, легочной и печеночной недостаточности. Быстрее, чем в норме, возникают атеросклеротические изменения сосудов, развивается повышение артериального давления. Сердце увеличивается в размерах за счет разрастания соединительной ткани и гипертрофии мышечных волокон, однако клапанный аппарат при этом не изменяется, что приводит к развитию недостаточности кровообращения. На стадии развернутых клинических проявлений характерна миокардиодистрофия(см.), возможно нарушение внутрисердечной проводимости. У трети всех больных отмечаются акропарестезии разной степени выраженности, которые появляются в результате сдавления нервов разросшимися костными структурами или мягкими тканями. Обменные нарушения связаны с патологическим влиянием гиперпродукции соматотропина. Для них характерны активация процессов липолиза, увеличение окисления жиров в периферических тканях, повышение содержания в сыворотке крови холестерина, кетоновых тел, бета-липопротеидов, лецитина, неэстерифицированных жирных кислот (причем чем больше последних, тем активнее течение заболевания). У 50–60 % пациентов наблюдаются нарушения устойчивости к глюкозе, а явный сахарный диабет(см.) развивается у 1/5 больных. Соматотропин является контринсулярным гормоном. Его биологическое влияние на углеводный обмен сводится к стимуляции глюконеогенеза, снижению утилизации глюкозы мышечной тканью. Он также обладает способностью угнетать активность гликолитических ферментов периферических тканей за счет липолитического действия гормона и высокого уровня свободных жирных кислот. Нарушения минерального обмена связаны с воздействием соматотропина на функциональную активность почек. Он усиливает экскрецию с мочой кальция, калия, натрия, хлоридов. Характерны для акромегалии нарушения фосфорно-кальциевого баланса. При акромегалии, связанной с развитием аденомы гипофиза(см.), наступает период появления офтальмоневрологической симптоматики, связанной с ростом опухоли за пределы турецкого седла. Сдавление области перекреста зрительных нервов проявляется битемпоральной гемианопсией, снижением остроты и сужением полей зрения. На глазном дне отмечается последовательная смена отека, стаза и атрофии зрительных нервов. При отсутствии лечения это приводит к слепоте. Рост опухоли преимущественно в сторону гипоталамуса вызывает у больных сонливость, жажду, полиурию, резкие подъемы температуры. Преимущественно фронтальный рост приводит к возникновению эпилепсии, поражение обонятельного тракта — к аносмии. Врастание опухоли в области кавернозных синусов характеризуется поражением III, IV, V и VI пар черепно-мозговых нервов. Клинически это проявляется в птозе, офтальмоплегии, диплопии, лицевой анальгезии, снижении остроты слуха. Кроме того, возникают или усиливаются признаки внутричерепной гипертензии(см.). Исходом заболевания является кахексия. При отсутствии соответствующего лечения, при неблагоприятном течении и раннем начале (в молодом возрасте) продолжительность жизни больных составляет 3–4 года. При медленном развитии и благоприятном течении человек может прожить от 10 до 30 лет. При своевременном лечении прогноз для жизни благоприятный, возможно выздоровление. Трудоспособность ограничена.
Диагностика В диагностике, помимо физикального, обследования и анамнестических данных доминирующее значение придается рентгенологическим и биохимическим методам. При рентгенографии костей скелета отмечаются явления периостального гиперостоза с признаками остеопороза(см.). На рентгенограммах черепа просматривается истинный прогнатизм, расхождение зубов, увеличение затылочного бугра и утолщение свода черепа. Нередко отмечается кальцификация твердой мозговой оболочки. В 70–90 % случаев увеличены размеры турецкого седла. С помощью компьютерной или ЯМР-томографии можно увидеть и саму аденому. Среди лабораторных методов достаточно информативным является определение концентрации соматотропина в крови радиоиммунологическим методом. При этом о гиперсекреции свидетельствует стойкое превышение нормального уровня гормона (7—10 мкг/л). Кроме того, при акромегалии отмечается изменение физиологической секреции соматотропина в ответ на стандартный глюкозотолерантный тест, внутривенное введение тиреолиберина — парадоксальное повышение концентрации гормона роста. В начальной стадии сна, напротив, уровень соматотропина не изменяется. При проведении тестов с инсулиновой гипогликемией(см.), L-Допа, допамином и бромокриптином, а также при физической нагрузке отмечается парадоксальное снижение концентрации гормона. Акромегалию следует дифференцировать с пахидермопериостозом, болезнью Реджета и синдромом Мари-Бамбергера.
Лечение Лечение акромегалии включает в себя комплекс мер, направленных на снижение концентрации соматотропина в сыворотке крови. При опухолевой природе заболевания у молодых больных предпочтительнее оперативное вмешательство с последующей лучевой терапией. Если позволяют размеры аденомы (не выходит за пределы турецкого седла), операцию проводят с использованием транссфеноидального доступа для минимальной травматизации окружающих тканей. При значительных размерах аденомы проводится трансфронтальная аденомэктомия. Показаниями к такому оперативному вмешательству являются прогрессирующее сужение полей зрения, неврологические нарушения, упорные головные боли, подозрение на злокачественное новообразование. Дистанционное лучевое воздействие на промежуточно-гипофизарную область проводят рентгеновскими и гамма-лучами, а также направленным протонным пучком. Последний способ предпочтительнее в связи с большей эффективностью. Используются дозы от 4,5 до 15 тыс. рад в зависимости от размеров опухоли. Если оперативное лечение невозможно, эффект от изолированно применяемой лучевой терапии наступает спустя 1–2 года после облучения. Признаками стабилизации процесса являются исчезновение потливости, снижение отечности, нормализация показателей артериального давления и углеводного обмена. Объективным критерием является снижение уровня концентрации соматотропина в сыворотке крови. У пожилых пациентов при невозможности хирургического и лучевого лечения применяются медикаментозные препараты группы стимуляторов допаминергических рецепторов (бромокриптин, лисенил-форте), которые способны тормозить секрецию соматотропина. На размеры аденомы они влияния не оказывают. Суточная дозировка бромокриптина составляет от 10 до 20 мг. Эффект наступает спустя 2–3 недели после начала лечения и сохраняется только в период приема препарата. В комплексной терапии в связи с многочисленными обменными нарушениями и осложнениями следует использовать симптоматические средства. Больные нуждаются в соответствующей диете с ограничением поваренной соли (не более 5 г в сутки), жиров и легкоусвояемых углеводов. При развитии сахарного диабета следует принимать сахароснижающие средства или использовать инсулин. После аденомэктомии или лучевого лечения больные могут нуждаться в назначении заместительной терапии гормонами надпочечников или щитовидной железы.
АКТИНОМИКОЗ
ОпределениеАктиномикоз (лучисто-грибковая болезнь) — хроническое заболевание, вызываемое различными видами актиномицетов. Это самый распространенный тип псевдомикозов, характеризующийся поражением различных органов и тканей. При этом образуются плотные инфильтраты с последующим нагноением, появлением свищей и поражением кожи. Заболевание встречается повсеместно.
Этиология Возбудители актиномикоза — актиномицеты — анаэробные бактерии, внешне крайне напоминающие грибы. Выделяют Actinomyces Israeli, Actinomyces bovis, Actinomyces albus, Actinomyces violaceus. Актиномицеты хорошо растут на питательных средах, образуя колонии неправильной формы, нередко с лучистыми краями. В патологическом материале колонии грибов встречаются в виде друз, которые представляют собой желтоватые комочки диаметром 1–2 мм. Чувствительны к бензилпенициллину, тетрациклину, эритромицину и левомицетину. Актиномицеты часто обнаруживают у здоровых людей в ротовой полости, зубном налете, лакунах миндалин, на слизистой оболочке желудочно-кишечного тракта. Они широко распространены в природе (почва, сено, злаки и др.). Вызывают заболевание у людей и сельскохозяйственных животных.
Патогенез Источником инфекции может являться как внешняя среда, так и очаги хронической инфекции в самом организме. Наиболее часто инфекция попадает в организм из внешней среды. Хотя актиномицеты могут с растениями (злаками) попадать на слизистые оболочки (в частности, ротовой полости), они находятся там в форме сапрофитов. Чтобы они превратились в патогенные формы, необходимо развитие воспалительного процесса на слизистых (стоматит, колит, бронхит и др.). При внедрении актиномицетов образуется инфекционная гранулема, которая затем прорастает в окружающие ткани. В центре гранулемы происходят некроз клеток и их распад, возникают абсцессы, которые, прорываясь, образуют свищи. Поражение кожи имеет вторичный характер. В развитии нагноений играет роль и вторичная, преимущественно стафилококковая флора. При благоприятном течении исходом актиномикотической гранулемы является образование фиброзной, а затем плотной рубцовой ткани.
Клиническая картина Актиномикоз является первично-хронической инфекцией с длительным прогрессирующим течением. Длительность инкубационного периода неизвестна. Выделяют следующие формы актиномикоза: актиномикоз головы, языка и шеи; торакальный актиномикоз; абдоминальный актиномикоз; актиномикоз мочеполовых органов; актиномикоз кожи; мицетома (мадурская стопа); актиномикоз центральной нервной системы. Практически при любой из клинических форм заболевания отмечаются типичные вторичные поражения кожи. Первоначально определяется очень плотный и почти безболезненный очаг воспаления, кожа становится багрово-синюшной, затем возникает флюктуация, а после прорыва гнойника формируются длительно не заживающие свищи. В гнойном отделяемом просматриваются комочки.
Актиномикоз головы, языка и шеи Встречается наиболее часто. Выделяют глубокую (мышечную) форму, при которой процесс локализован в межмышечной клетчатке, а также подкожную и кожную формы. Мышечная форма поражает преимущественно жевательную мускулатуру. При этом образуется инфильтрат хрящевой плотности в области угла нижней челюсти. Возникают асимметрия лицевой области, тризм разной степени выраженности, нарушения жевания. Температура повышается до 38 °C, отмечаются симптомы интоксикации (головная боль, недомогание и пр.).
Актиномикоз шеи
Спустя некоторое время в инфильтрате появляются очаги размягчения, которые самопроизвольно вскрываются, образуя свищи, отделяющие гнойную или кровянисто-гнойную жидкость, иногда с примесью комочков. Синюшная окраска кожи вокруг свищей является патогномоничным признаком актиномикоза. Подкожная форма актиномикоза характеризуется наличием шаровидных или полушаровидных инфильтратов, локализующихся в подкожной клетчатке. Тризм и нарушения акта жевания отсутствуют. Кожная форма является редкой. Актиномикозный процесс может захватывать щеки, губы, язык, миндалины, трахею, глазницы, гортань, околоушные слюнные железы. Течение относительно благоприятное. Состояние больного удовлетворительное, может отмечаться температура.
Торакальный актиномикоз Торакальный актиномикоз (актиномикоз легких или грудной клетки и органов грудной полости) занимает второе место по частоте встречаемости. Начало заболевания постепенное. Пациенты предъявляют жалобы на слабость, мучительный кашель, вначале сухой, затем с мокротой слизисто-гнойного характера, иногда в ней определяются прожилки крови. Температура слегка повышена. При прослушивании определяются сухие хрипы и жесткое дыхание. При распространении очага воспаления на ткань легких развивается клиника пневмонии(см.) с высокой температурой, болью в груди на стороне поражения, кашлем. Над областью поражения прослушиваются ослабленное дыхание, сухие и влажные хрипы. В ряде случаев процесс в легких принимает характер вялотекущей пневмонии. Он распространяется от центра к периферии, постепенно вовлекая в процесс плевру, грудную стенку и кожу над ней. Образуется болезненное уплотнение багрово-синюшного цвета. Исходом является абсцедирование и прорыв гнойника с образованием свищей, которые сообщаются с бронхами и могут открываться не только на грудной клетке, но и на пояснице и даже на бедре. В гнойном отделяемом свищей обнаруживаются комочки актиномицетов. Течение тяжелое. При отсутствии лечения больного ждет летальный исход.
Абдоминальный актиномикоз Абдоминальный актиномикоз по частоте занимает третье место. Первичный очаг локализуется обычно в илеоцекальной зоне (более 60 %), реже — в слизистой толстого кишечника и крайне редко — в пищеводе, желудке и тонком кишечнике. Инфильтрат с локализацией в илеоцекальной области нередко имитирует клиническую картину острого живота. Характерны боли, повышение температуры, диспепсические явления, симптомы раздражения брюшины. В правой подвздошной области прощупывается плотный болезненный инфильтрат. Распространяясь, процесс захватывает близлежащие органы и ткани, в том числе переднюю брюшную стенку. Это проявляется характерными изменениями кожи, образованием свищей, сообщающихся с кишечником, расположенных чаще в паховой области. При актиномикозе прямой кишки вследствие наличия инфильтратов развиваются специфические парапроктиты(см.); свищи вскрываются в перианальной области. Без соответствующей терапии смертность достигает 50 %. Актиномикоз мочеполовых органов встречается редко, обычно при распространении на органы мочеполовой системы инфильтрата при абдоминальном актиномикозе.
Актиномикоз костей и суставов Встречается редко, преимущественно при переходе процесса с соседних пораженных тканей или, реже, при гематогенном заносе инфекции. Нередко этому предшествует травма. При остеомиелите(см.) происходит разрушение костей и образование секвестров, однако больные сохраняют способность передвигаться. При поражении суставов их функция сохраняется. С образованием свищей возникают характерные изменения кожи.
Мицетома Мицетома (мадуроматоз, мадурская стопа) — своеобразный вариант актиномикоза, который часто встречается в странах тропического пояса. Заболевание начинается с появления на стопе (обычно на подошве) одного или нескольких плотных отграниченных узлов величиной от горошины и более. Сначала они покрыты неизмененной кожей. В дальнейшем над уплотнениями кожа становится красно-фиолетовой или буроватой. По соседству с первоначальными узлами появляются новые, кожа отекает, стопа увеличивается в объеме, меняет свою форму. В дальнейшем узлы размягчаются, вскрываются, возникают глубокие свищи, выделяющие гнойную или серозногнойную (иногда кровянистую) жидкость. В отделяемом просматриваются друзы. Узлы почти безболезненны. Процесс медленно прогрессирует, инфильтрация захватывает всю подошву, узлы и свищевые ходы появляются и на тыле стопы. Вся стопа превращается в деформированную и пигментированную субстанцию, пронизанную свищами и полостями. Процесс может переходить на мышцы, сухожилия и кости. Иногда наблюдается атрофия мышц голени. Обычно процесс односторонний. Заболевание продолжается до 10–20 лет. Прогноз серьезный, но при проведении своевременных и в полном объеме лечебных мероприятий — благоприятный.
Диагностика Диагностика актиномикоза на поздних стадиях при образовании типичных кожных изменений несложна. На ранних стадиях используют внутрикожную пробу с актинолизатом. Однако полученные результаты сложно объяснить однозначно. Во внимание следует принимать только положительные и резкоположительные результаты, так как слабоположительные встречаются практически у всех лиц, страдающих пародонтозом и другими заболеваниями зубов. Отрицательный ответ также не всегда является показателем отсутствия заболевания, так как при тяжелых его формах возможно развитие анергии. У ВИЧ-инфицированных всегда отмечается отрицательная реакция. Выделение культур актиномицетов имеет диагностическое значение при заборе материала из свищевых ходов, биоптатов пораженных тканей, друз, так как на слизистых оболочках полости рта, дыхательных путей они обнаруживаются и у здоровых лиц. Реакция связываниякомплемента с актинолизатом положительна у 80 % больных, поэтому ее результат можно считать достоверным. Актиномикоз легких следует отличать от опухолевых процессов в легких, абсцессов(см.), глубоких микозов(см.), аспергиллеза(см.), нокардиоза, гистоплазмоза, а также от туберкулеза (см.) легких. Абдоминальный актиномикоз необходимо отличать от хирургических заболеваний, сопровождающихся клиникой острого живота (аппендицит(см.), перитонит(см.) и пр.).
Лечение Подозрение на актиномикоз — показание для госпитализации. Лечение должно сочетать хирургические и терапевтические методы: обработку очага, выскабливание грануляций. В ряде случаев выполняется иссечение пораженных тканей, при актиномикозе легких — лобэктомия. Также применяется сочетание этиотропной терапии (тетрациклин, бензилпенициллин, эритромицин, левомицетин) и иммунотерапии актинолизатом (подкожно или внутримышечно по 3 мл 2 раза в неделю, 20–30 инъекций на курс). При актиномикозе головы, языка и шеи назначают внутрь феноксиметилпенициллин по 2 г в сутки в течение не менее 6 недель либо тетрациклин по 0,75 г 4 раза в день в течение 4 недель, а также эритромицин по 0,3 г 4 раза в сутки в течение 6 недель. При абдоминальном и торакальном актиномикозе назначают большие дозы бензилпенициллина (10 млн ЕД в сутки и более) внутривенно в течение 1–1,5 месяца. Далее переходят на феноксиметилпенициллин в суточной дозе 2–5 г в течение 2–5 месяцев. При наслоении вторичной инфекции (стафилококки, анаэробная микрофлора) назначают длительные курсы диклоксациллина или других антибиотиков с учетом чувствительности к ним, при анаэробной инфекции — метронидазол. В тяжелых случаях — трансфузия крови 150–200 мл 1 раз в неделю. Хирургическое лечение — вскрытие флюктуирующих очагов, выскабливание свищевых грануляций. Из физиотерапевтических методов применяются УФО зоны поражения, электрофорез йода на зону поражения. В связи с возможностью рецидивов выздоравливающие должны находиться под длительным наблюдением (не меньше года). Профилактическими мерами являются гигиена полости рта, своевременное лечение заболеваний зубов и десен, миндалин.
АЛКОГОЛИЗМ
ОпределениеАлкоголизм — это неумеренное употребление спиртных напитков, приводящее к нарушению норм поведения в быту, обществе, сфере трудовой деятельности. Алкоголизм — болезнь, относящаяся к токсикомании, сопровождающаяся суммой определенных болезненных изменений в организме под влиянием алкоголя.Алкоголизм — хроническое заболевание, характеризующееся совокупностью внутренних и психических нарушений. Типичными признаками алкоголизма являются изменение устойчивости к алкоголю, патологическое влечение к опьянению, развитие синдрома лишения. Единой классификации алкогольной зависимости не существует. В течении болезни выделяют ряд стадий (А. Г. Гофман, 1985 г.). I стадия диагностируется при наличии патологического влечения к алкоголю и утрате количественного контроля. II стадия диагностируется при наличии алкогольного абстинентного синдрома (ААС): — постоянно возникающий ААС (только после употребления средних или больших доз алкоголя); — постоянно возникающий ААС, не сопровождающийся появлением обманов восприятия или выраженных аффективных расстройств; — постоянно возникающий ААС, сопровождающийся появлением обманов восприятия или тяжелых аффективных расстройств; — развернутый синдром похмелья, сочетающийся с выраженными изменениями нервной системы или внутренних органов, а также психики, обусловленными алкоголизмом. III стадия диагностируется при падении устойчивости к алкоголю: — снижение устойчивости к концу запоя; — постоянное снижение устойчивости; — «истинные» запои; — наличие выраженных изменений нервной системы, внутренних органов или психики (вплоть до слабоумия). IV стадия диагностируется в пожилом возрасте при снижении интенсивности влечения к алкоголю, урежении периодов злоупотребления алкоголем: — уменьшение длительности периодов потребления алкоголя, более редкое их возникновение; — переход на эпизодическое употребление алкоголя с резким ослаблением или исчезновением влечения к нему; — отказ от употребления алкоголя.
Этиология Главными факторами вероятности формирования алкогольной зависимости являются частота употребления спиртных напитков и их объем. Большое значение имеет наследственная предрасположенность. Играет роль и определенный склад личности (психопатии, повышенная внушаемость, отсутствие серьезных жизненных интересов, трудности в установлении межличностных контактов), индивидуальные особенности нейромедиаторных и окислительных систем.
Патогенез В развитии алкоголизма ведущая роль принадлежит изменению функциональной активности нейромедиаторных систем головного мозга. Преобладают нарушения обмена эндогенных опиатов, а также катехоламиновых образований. Результатом являются возникновение влечения к алкоголю, изменение реакций на его введение, а также развитие синдрома лишения (абстиненции). Поражение внутренних органов и нервной системы при алкоголизме связано с токсическим влиянием ацетальдегида (производного этилового спирта), дефицитом витаминов (особенно группы В), изменением функциональных возможностей ферментных и окислительных систем, нарушением синтеза белка, снижением иммунобиологической реактивности организма.
Клиническая картина В клинике алкоголизма выделяют ряд синдромов. Их совокупность определяет стадию заболевания. На разных стадиях изменяется (повышается или снижается) выносливость к алкоголю, исчезают защитные реакции при передозировке, отмечается способность к систематическому употреблению спиртного и извращение его действия, амнезия на период опьянения. Психическая зависимость проявляется навязчивым влечением к опьянению, психическим дискомфортом в трезвом состоянии и улучшением психических функций в состоянии опьянения. При развитии физической зависимости возникают физическая (неудержимая) потребность в опьянении, потеря контроля за количеством выпитого, явления абстиненции(см.), улучшение физических функций в состоянии опьянения. Последствия хронической интоксикации проявляются как на неврологическом, внутреннем и личностном уровнях, так и в социальной деятельности. К неврологическим последствиям относят острые мозговые, так называемые дисциркуляторно-токсические синдромы (эпилептиформный, Гайе-Вернике, мозжечковый, стриопаллидарной недостаточности, периферические невриты(см.), атрофия зрительного и слухового нервов, особенно при употреблении суррогатов). Последствиями алкоголизма для организма являются поражение сердечно-сосудистой системы, органов дыхания, желудка, печени и поджелудочной железы, почек, полигландулярная недостаточность эндокринной системы, снижение иммунологической реактивности. Среди психических последствий выделяют астению, психопатизацию личности, аффективные расстройства (колебания настроения, депрессии и дисфории(см.) с агрессивностью и тенденциями к самоубийству, в далеко зашедших случаях — деменцию (слабоумие). Характерным проявлением является так называемый алкогольный юмор — плоский, грубый, бестактный. Могут возникать психотические состояния — острые (делириозный, галлюцинаторно-параноидный синдромы) и хронические (галлюциноз, бред(см.) ревности, корсаковский психоз(см.)) состояния. Продолжительность жизни больных алкоголизмом укорачивается на 15–20 лет в связи с повышенной заболеваемостью внутренних органов (особенно сердечно-сосудистой патологией), а также травматизмом. Трудоспособность прогрессивно падает. Сроки появления последствий хронической алкогольной интоксикации зависят не только от продолжительности заболевания, но и от компенсаторных возможностей организма. Развитию алкоголизма обычно предшествует многолетнее бытовое пьянство. Повышается устойчивость к алкоголю, страдают сон и аппетит, половая сфера. Снижается седативный эффект алкоголя: и в опьянении, и в трезвом состоянии сохраняются повышенные жизненный тонус и двигательная активность, приподнятое настроение. При этом еще сохраняются чувство насыщения опьянением и рвота при передозировке, однако в последнем случае уже нет отвращения при мысли о спиртном. Появляются первые признаки дисфории (см.), когда повышенное настроение внезапно сменяется периодами раздражительности, конфликтности, которые исчезают при приеме алкоголя. Желание выпить возникает без видимого повода, а критическое отношение к пьянству отсутствует.
Течение алкоголизма В развитии алкоголизма наблюдается несколько стадий. На первой стадии устойчивость к алкоголю продолжает усиливаться. Иногда она возрастает в 4–5 раз. Периодически возникает желание привести себя в состояние опьянения. При этом желание опьянения больные не воспринимают как неестественное. Оно расценивается ими на одном уровне с чувством голода или жажды. В связи с повышенной устойчивостью развивается способность к ежедневному приему высоких доз. Однако при невозможности употребления алкоголя влечение к нему временно преодолевается. При приеме малых доз, напротив, влечение к алкоголю резко повышается и становится неконтролируемым. Чувства насыщения опьянением не наступает. Характерны также исчезновение рвоты при передозировке, забывание отдельных эпизодов периода опьянения (палимпсесты), отсутствие критики к своему состоянию. Физическая зависимость в этот период отсутствует, синдром последствий интоксикации может ограничиваться астеническими проявлениями, временными нарушениями функций внутренних органов и нервной системы. Продолжительность первой стадии колеблется от 1 года до 4–5 лет, после чего заболевание переходит во вторую стадию. Она характеризуется максимальным повышением устойчивости к алкоголю. За сутки больные способны выпивать от 0,5 до 2 л водки. Седативный эффект алкоголя исчезает, наблюдается только активирующий. Несмотря на то что внешне поведение упорядоченное, вместо забывания отдельных эпизодов опьянения наблюдается полная амнезия. В первое время амнезии наблюдаются только при приеме высоких доз. Психическая зависимость проявляется нарушением организации психической деятельности в трезвом состоянии, резким снижением настроения из-за невозможности выпить (раздражительность, агрессивность, вспыльчивость). Способность к умственному труду падает. Развивается физическая зависимость с неудержимым влечением к алкоголю. После употребления небольших количеств спиртного влечение к алкоголю неконтролируемо усиливается, что приводит к развитию тяжелых стадий опьянения. Поведение становится непредсказуемым. Развитие абстинентного синдрома, характерного для второй стадии алкоголизма, является важнейшим критерием наступившей физической зависимости. Сначала он возникает только после употребления высоких доз алкоголя, а в дальнейшем — после употребления средних и небольших доз. Время развития абстиненции (см.) индивидуально, в среднем она развивается через 8—12 ч после последнего употребления алкоголя. Абстинентный синдром характеризуется развитием гипертонуса, перевозбуждения и гиперфункций в различных внутренних органах, психической и неврологической сферах: экзофтальм, мидриаз, гиперемия верхней части туловища, пастозность, крупный горячий пот, тремор пальцев, кистей рук, языка и век, серо-коричневый, густой налет на языке, тошнота, рвота, послабление стула, задержка мочи, отсутствие аппетита, бессонница, подъем артериального давления, головокружение и головная боль, боль в области сердца и печени. Нарастание тревоги, ночное беспокойство, судорожный припадок могут быть предвестниками острого психоза. Абстинентный синдром максимальной степени тяжести сопровождается обильным потом, бессонницей, дрожанием всего тела, хореиформными гиперкинезами (см.), клонусом коленных чашечек и стоп, тяжелой атаксией (см.), судорогами мышц рук и ног, судорожными припадками с утратой сознания. Могут возникать гипногогические слуховые, зрительные и тактильные галлюцинации (см.), иногда эпизодические галлюцинации при открытых глазах. Настроение тревожно-пугливое или тоскливо-тревожное с оттенком раздражительности. Внимание неустойчиво. Больные путаются в числах и датах, не способны воспроизвести правильную последовательность событий. В этот период чрезвычайно велико влечение к опьянению. Продолжительность абстинентного синдрома не более 2 суток свидетельствует о его легком течении, тяжелая абстиненция длится до 5 и более суток. Дальнейшее развитие заболевания быстро приводит к появлению запоев. Прием малых доз алкоголя вызывает безудержное влечение к опьянению: спиртное употребляется многократно в течение дня, абстиненция утяжеляется и сопровождается интенсивным влечением к алкоголю. Во время запоя тяга к алкоголю заставляет больных употреблять его суррогаты (при отсутствии этилового спирта). Длительность подобных периодов по мере развития алкоголизма нарастает, время воздержания между ними сокращается. После снятия абстиненции влечение к спиртному на некоторое время может стихать вплоть до следующего запоя. Длительность периодов воздержания индивидуальна — от нескольких дней до нескольких месяцев (в среднем — около 2–3 недель). Начало очередного запоя может быть связано как со случайным употреблением спиртного, так и с появлением тяги к опьянению. Последствия интоксикации со стороны нервной системы представлены невритами, появлением слепых пятен на сетчатке глаза, сужением полей зрения, снижением слуха на определенные частоты, атактическими расстройствами, нистагмом, нарушением точности и координации движений, возможны и мозговые острые синдромы. При исследовании внутренних органов отмечаются поражения сердечно-сосудистой системы, печени и др. Любое заболевание, затрагивающее нервную систему, а также травма, оперативное вмешательство могут осложниться острым алкогольным психозом. В психической сфере преобладают личностные нарушения: потеря творческих возможностей, ослабление интеллекта, психопатизация, аффективные расстройства. Одной из главных причин изменений личности является перестройка шкалы ценностей. На первое место выходит влечение к алкоголю. Другой причиной является токсическое воздействие алкоголя и его производных на головной мозг. Характерно появление следующих особенностей: легкость возникновения аффектов, ослабленный контроль за эмоциями, неустойчивость реакций. Отмечается истощаемость мотивации и побуждений, быстрая утрата интереса к любому делу. Однако в личностных нарушениях преобладают изменения в морально-этической сфере. Такие качества, как чувство долга, честность, привязанности, исчезают. Они сменяются лживостью, эгоистичностью, беззастенчивостью, легкомыслием, утратой интереса к своему внешнему виду. Довольно скоро мышление становится вялым и пассивным, суждения — поверхностными, в разговорах преобладает алкогольная тематика. Страдают внимание и волевая сфера. Возникают и доминируют раздражительность, сварливость, потеря симпатии даже к близким людям. У ряда больных отмечаются повышенная возбудимость, гневливость, склонность к агрессии. У других преобладает постоянно приподнятое настроение, склонность к балагурству, хвастовству, бесцеремонности. В некоторых случаях характерна нестойкость интересов, склонность к антисоциальному поведению. Иногда преобладают истерические проявления с демонстративным поведением и псевдопопытками самоубийства. Длительность второй стадии индивидуальна и может составлять от 5 до 15 лет. Затем наступает третья стадия заболевания, которая характеризуется снижением устойчивости к алкоголю. Вначале она развивается только к концу алкогольного эксцесса, однако затем сильное опьянение достигается от приема совсем небольших доз, сопровождаясь оглушенностью или злобностью и агрессией. Многодневные запои заканчиваются психофизическим истощением с последующим воздержанием от нескольких дней до нескольких месяцев, запоям могут предшествовать расстройства настроения (см.) с нарушением сна и неудержимым влечением к алкоголю, возможно сохранение систематического (ежедневного) пьянства в малых дозах. Другим проявлением изменения ответа организма на этой стадии считается снижение активирующего влияния алкоголя, который теперь лишь умеренно выравнивает тонус, а также амнезию (см.), завершающую практически каждое опьянение. Симптомы психической зависимости выражены слабо ввиду наличия описанных выше грубых психических изменений. Физическая зависимость характеризуется неудержимым влечением, определяющим жизнь больного. Отсутствие количественного контроля в сочетании со снизившейся переносимостью нередко приводит к смертельным передозировкам. Интенсивное влечение проявляется и утратой ситуационного контроля (безразличие к времени и месту приема спиртного, компании собутыльников и пр.). Абстинентный синдром протекает длительно и тяжело, он представлен в основном вегетативными расстройствами: вялостью, обездвиженностью, падением сердечно-сосудистого тонуса, бледностью, синюшностью, холодным потом, запавшими глазами, заострившимися чертами лица, мышечной гипотонией, атактическими нарушениями (вплоть до невозможности самостоятельно передвигаться). Нередко развиваются необратимые нарушения памяти и интеллекта. Следующим этапом является возникновение алкогольной деградации. Наблюдаются опустошение психики, утрата эмоциональной гаммы, примитивные аффекты (жестокость, злоба), проявление которых смягчается лишь падением возбудимости и волевым обеднением. Колебания эмоционального фона чаще выглядят как дисфории, а не как депрессии. На фоне интеллектуально-амнестических расстройств формируются психопатоподобные проявления с явлениями истеричности либо аспонтанности, пассивности, утратой интересов. Последствия интоксикации представлены не только функциональными, но и органическими поражениями жизненно важных систем. В механизме их развития играет роль не только токсическое воздействие, но и нарушения обмена и питания, нервной регуляции, ферментопатии и пр. Неврологические нарушения приобретают необратимый характер. Обычно отмечаются энцефалопатии (см.) и полиневриты; примерно 1/5 больных алкоголизмом в третьей стадии страдают эпилептическим синдромом, в ряде случаев возможен острый синдром Гайе-Вернике, опасный для жизни. Алкогольная деменция может проявляться псевдопаралитическими расстройствами. Возможны хронический галлюциноз, алкогольная парафрения и бред ревности. Больной не способен к самостоятельной продуктивной деятельности и нуждается в постоянном контроле. На этой стадии алкоголизма поражены практически все органы и системы, наиболее часто обнаруживается сочетание патологии печени и миокардиодистрофии (см.). Течение алкоголизма характеризуется различной скоростью прогрессирования. Тяжело протекающий прогрессирующий алкоголизм формируется в течение 2–3 лет. При этом личностные изменения глубокие, порой необратимые, улучшения состояния отсутствуют, выражена социальная дезадаптация. Среднепрогрессирующий алкоголизм развивается на протяжении 8—10 лет, личностные изменения могут быть умеренными. Возможны длительные периоды улучшения состояния. Малопрогрессирующий алкоголизм развивается медленно, третья стадия заболевания вообще не наступает. Изменения личности при этом малозаметны, ремиссии могут продолжаться много лет, возможно полное сохранение социальной адаптации. Большей скоростью развития обладает алкоголизм у женщин (ранняя семейная и трудовая дезадаптация), подростков (возможно злокачественное течение), пожилых лиц (при начале заболевания после 60 лет). При алкоголизме могут наблюдаться улучшения состояния (ремиссии) не только в результате лечения, но и спонтанно. Их наступление и длительность во многом зависят от актуальности воздержания от алкоголя, личностных особенностей больного, течения заболевания. Рецидивы связаны с актуализацией влечения к алкоголю, психическими травмами, стремлением больного проверить эффективность лечения. Перейти на умеренное употребление спиртного больным не удается, хотя после длительной ремиссии рецидив может наступить не сразу после первого употребления спиртного.
Поражение внутренних органов при алкоголизме Для первой и особенно второй стадии алкоголизма характерно умеренно высокое артериальное давление. Отмечается подъем артериального давления до 160–180/90— 110 мм рт. ст. обычно на 1—5-е сутки после злоупотребления спиртными напитками. Более высокий уровень артериального давления — 200–220/110—130 мм рт. ст. — характерен для предделириозного периода. Кроме повышения артериального давления, у больных отмечаются тахикардия до 100–110 уд./мин, гиперемия лица, гипергидроз, дрожание рук, век, языка, неустойчивость в позе Ромберга, нарушения координации при проведении пальце-носовой и коленнопяточной проб. Классическая форма алкогольной миокардиодистрофии проявляется болью в области сердца (см.), особенно по ночам, одышкой, сердцебиением, перебоями в работе сердца. Обычно ухудшение состояния развивается после выхода из запоя и сочетается с явлениями абстинентного синдрома. Псевдоишемическая форма характеризуется выраженным болевым синдромом, развитием увеличения сердца, легким повышением температуры, частыми нарушениями ритма, развитием недостаточности кровообращения. При аритмической форме на первый план выходят нарушения ритма: мерцательная аритмия, экстрасистолия, пароксизмальная тахикардия (см.); кроме того, отмечаются одышка и увеличение размеров сердца. Боли в области сердца возникают ночью или под утро и не связаны с физической нагрузкой, с приемом нитроглицерина не исчезают. Сами больные отмечают связь между приемом алкоголя и усилением болей. При объективном исследовании отмечаются расширение границ сердца влево, приглушение тонов сердца, систолический шум на верхушке. При тяжелом поражении сердца развиваются явления застойной сердечной недостаточности (одышка, акроцианоз, ортопноэ, увеличение печени, отеки). Поражение органов дыхания при алкоголизме проявляется развитием ларингитов (см.), трахеобронхитов (см.), пневмосклероза, эмфиземы (см.). Больные чаще всего предъявляют жалобы на мучительный утренний кашель со скудной мокротой, особенно после алкогольных эксцессов. Кашель сочетается с одышкой, не соответствующей степени физической нагрузки. При исследовании функции внешнего дыхания отмечаются обструктивные нарушения. Частота пневмоний у лиц, страдающих алкоголизмом, выше в 4–5 раз по сравнению с остальными людьми. При этом воспалительный процесс в легких протекает обычно тяжело, со склонностью к абсцедированию. Наиболее обычный исход заболевания — пневмосклероз. Патология органов желудочно-кишечного тракта при алкоголизме заключается в развитии хронических гастритов и энтероколитов. Хронический алкогольный гастрит (см.) характеризуется развитием болевого синдрома разной степени выраженности, расстройством пищеварения. По утрам характерна рвота, довольно скудная и не приносящая облегчения. Она сочетается с чувством распирания в подложечной области, отрыжкой и потерей аппетита при сильной жажде. Нередко встречается полное поражение всего желудочно-кишечного тракта, когда симптомы гастрита сочетаются с изменениями стула (чередование запоров и поносов). Повреждающее действие алкоголя и его производных сказывается и на внешнесекреторной функции поджелудочной железы. Среди причин развития панкреатитов у мужчин (при отсутствии первичного поражения желчевыводящих путей) алкоголизм стоит на первом месте. Острый алкогольный панкреатит (см.) проявляется приступом резчайших болей в верхней части живота непосредственно после употребления спиртных напитков. Боль настолько интенсивна, что сопровождается двигательным возбуждением и может быстро приобретать характер опоясывающей. Обычно ее сопровождает многократная рвота, не приносящая облегчения. Живот при прощупывании мягкий, болезненный в верхней половине. Хронический алкогольный панкреатит характеризуется наличием постоянных болей в верхней части живота и околопупочной области, расстройством пищеварения. Боли усиливаются после приема алкоголя и еды, сочетаются с чувством распирания в животе, неустойчивым стулом, иногда может отмечаться и рвота. Рецидивы и обострения по клинике напоминают острый алкогольный панкреатит. В ряде случаев может сформироваться сахарный диабет второго типа.
Жировая дистрофия печени при алкогольном циррозе (прижизненная пункция)
Алкогольное поражение печени в начальных стадиях заболевания характеризуется белковым и жировым истощением. Затем развивается алкогольный гепатит, исходом которого может стать цирроз. Алкогольная дистрофия печени проявляется умеренной гепатомегалией (увеличением печени). Иногда после приема алкоголя возникает ощущение дискомфорта в правом подреберье. Этот процесс полностью обратим: полный отказ от спиртного приводит к нормализации размеров и функции печени. Алкогольный гепатит (см.) может протекать по типу острого алкогольного гепатита или хронического гепатита. Острый алкогольный гепатит развивается при многолетнем злоупотреблении алкоголем. После приема больших доз спиртного у больного исчезает аппетит, появляются тошнота и рвота, боль в эпигастрии и правом подреберье. Отмечаются умеренная лихорадка, боли в суставах, мышцах, ломота во всем теле. Спустя 2–3 дня возникает печеночная желтуха (см.). При прощупывании отмечаются гепатомегалия и болезненность в правом подреберье. В ряде случаев острый алкогольный гепатит приводит к развитию острой печеночной недостаточности. Хронический гепатит при алкоголизме характеризуется гепатомегалией, периодической гипербилирубинемией, особенно после приема больших доз, диспротеинемией. Исходом хронического гепатита является алкогольный цирроз печени (см.). Его течение крайне неблагоприятно при продолжающемся приеме спиртного и может быстро приводить к развитию печеночной недостаточности. Характерно при алкоголизме поражение почек — алкогольная нефропатия. В острой форме она проявляется нефронекрозом после употребления значительных количеств спиртного. При развитии рецидивирующей формы у больного возникает преходящая гематурия и протеинурия. При присоединении восходящей инфекции состояние может осложниться пиелонефритом. У больных алкоголизмом отмечается снижение половой функции («алкогольная импотенция» у мужчин, раннее начало климакса у женщин). Прежде всего это связывают с алкогольным повреждением эндокринных желез, в первую очередь гонад (половых желез).
Алкогольная миопатия Различают острую, подострую и хроническую алкогольную миопатию (см.). При всех формах встречаются мышечные боли, отечность, болезненность самой разнообразной локализации, в процесс вовлекаются многочисленные скелетные мышцы. При тяжелом течении наблюдаются распространенные некрозы мышечных волокон, миоглобинурия с поражением почек.
Поражение периферической нервной системы Среди поражений периферической нервной системы отмечают паралич лучевого нерва с развитием «свисающей кисти», возникающий после очередного алкогольного эксцесса. В ряде случаев наблюдается клиника плечевой плексопатии с полным параличом руки и анестезией, болевой синдром возникает на стадии восстановления. Природа этих повреждений связана с длительной ишемией в результате компрессии («паралич садовой скамейки» — больной в состоянии опьянения глубоко засыпает, закинув руки на спинку скамейки). Алкогольная полиневропатия обычно чаще поражает нижние конечности, может иметь рецидивирующее течение. В начальных стадиях отмечаются боли в стопах и икроножных мышцах, чувство онемения в стопах и кистях. В дальнейшем развивается снижение чувствительности конечностей в виде «перчаток» и «носков», иногда сильнее страдает глубокая чувствительность. В последнем случае быстрее выпадают сухожильные рефлексы, нарушается координация движений, наблюдается клиника псевдотабеса. В отличие от спинной сухотки характерна болезненность при сдавлении икроножных мышц. У части больных могут отмечаться симптомы поражения периферической нервной системы по типу смешанных полиневропатий с присоединением атрофических парезов. При хроническом алкоголизме может отмечаться так называемая табачно-алкогольная амблиопия — атрофия зрительных нервов с резким падением остроты зрения по типу ретробульбарного неврита.
Алкогольное поражение центральной нервной системы Клинические проявления алкогольного поражения центральной нервной системы многообразны. Среди них выделяют алкогольные энцефалопатии (см.), алкогольные психозы (делирий (см.), галлюциноз, алкогольные бредовые психозы, алкогольную депрессию, алкогольную эпилепсию (см.)), дипсоманию. Однако при некоторых исследованиях мозга не обнаруживается его атрофия при сколько-нибудь длительном алкогольном анамнезе. Алкогольная деменция (алкогольный псевдопаралич) развивается у больных в возрасте старше 40–50 лет, преимущественно у мужчин. Течение алкогольной деменции в целом соответствует таковому при любых формах деменции. Развиваются и прогрессируют интеллектуальные и амнестические расстройства (памяти и мышления), эмоциональная нестабильность, личностная деградация, неопрятность и нечистоплотность. На этом фоне нередко отмечается наличие бредовых психозов (чаще — бред ревности). Алкогольная деменция может протекать с развитием поражения суставов, дрожания, ослабления зрачковых реакций, нистагма и алкогольной миопатии. Иногда встречается сочетание слабоумия и алкогольной полиневропатии, но даже и без последней сухожильные рефлексы на ногах могут не вызываться. Течение алкогольной деменции может имитировать прогрессивный паралич. Исключить его позволяет только классическая серологическая реакция. Алкогольные психозы (см.) относятся к группе внешних психозов, обусловленных хронической алкогольной интоксикацией. Алкогольный делирий (белая горячка, delirium tremens) возникает остро, через несколько часов или суток после прекращения приема алкоголя. Начальный период характеризуется бессонницей, слабостью, развитием отдельных иллюзий, эпизодов бредового восприятия реальности на фоне тревожности, возбуждения, боязливости больных. Затем отмечаются желтушность склер, гиперемия и отечность лица, тахикардия, колебания артериального давления, увеличиваются размеры печени. Наблюдается повышенная температура. Наиболее постоянным симптомом является дрожание рук, головы или всего тела. Нередко встречаются повышенное потоотделение и нистагм, появление патологических рефлексов, общая гиперрефлексия, атаксия (см.), мышечная гипотония. Типичный делирий продолжается обычно от 2 до 5 дней. При этом наблюдаются ложная ориентировка в месте и окружающих лицах, неточная ориентировка по времени. Галлюцинации (см.) усиливаются. Они могут быть как простыми по содержанию, чисто зрительными, так и сложными — сценическими, комбинированными. Зрительные галлюцинации часто объединены общим содержанием, обычно имеющим устрашающий характер. Они изменчивы и переплетаются с иллюзиями, расстройствами схемы тела (метаморфопсиями). Они могут носить макроманический (огромные лица, животные, чудовища) и микроманический (мелкие существа — классические «зеленые чертенята») характер. Больные высказывают бессистемные бредовые идеи физического уничтожения, преследования, обвинения, выражающие содержание их зрительных галлюцинаций — так называемый галлюцинаторный бред. Доминирует страх, может быть недоумение, иногда встречается эйфория. Поведение больного соответствует содержанию его галлюцинаций и бреда: он защищается, стремится убежать, кого-то гонит и стряхивает с себя и окружающих его предметов. Типичны бессонница, усиление симптомов к вечеру и в ночное время. Днем, напротив, возможно некоторое ослабление проявления симптомов. Если удается отвлечь больных от болезненных переживаний, можно получить некоторые анамнестические сведения (обычно неполные). Выход из состояния психоза, как правило, критический — после глубокого сна через фазу астении. Выздоровление может наступать и постепенно, с развитием бреда или депрессии. Впоследствии у больных сохраняются более полные воспоминания о болезненных переживаниях, чем о реальных событиях. Атипичные формы делирия могут включать в себя онейроидные компоненты, отдельные психические автоматизмы. При этом бредовые идеи могут быть в значительной степени систематизированы, а галлюцинации могут носить преимущественно слуховой характер. Атипичные формы более продолжительны. Могут встречаться и редуцированные формы, которые длятся около суток (абортивный делирий). Иногда течение делирия утяжеляется с присоединением стадий профессионального и мусситирующего делирия. Профессиональный делирий протекает на фоне тяжелого соматического состояния. При этом больные выполняют однообразные разрозненные движения, напоминающие профессиональные. Они сопровождают их отрывочными комментариями профессионального характера, нередко отмечаются ложные узнавания. Воспоминания об этой стадии практически не сохраняются. Развитие мусситирующего делирия характеризуется отсутствием реакции на окружающих и на обращенную к больному речь. На фоне общего крайне тяжелого состояния отмечаются едва слышное бессвязное бормотание, слабые, неуверенные, иногда судорожные движения рук (больные ощупывают, перебирают край одеяла, что-то стряхивают с себя). Отмечаются повышенная температура, усугубление имевшихся в предделириозном периоде нарушений, присоединение пневмонии. Состояние может осложниться сопором и комой. Смертельный исход при делирии в условиях стационара, по разным данным, колеблется от 1 до 16 %. Алкогольный галлюциноз может быть острым, подострым и хроническим. Он характеризуется наличием множественных слуховых галлюцинаций и бредовых идей преследования, физического уничтожения, обвинения и прочего на фоне тревоги и страха. Содержание бреда тесно связано с содержанием галлюцинаций. Сознание не помрачено. Острый алкогольный галлюциноз продолжается от нескольких часов до 1 месяца. Слуховые галлюцинации исходят от одного или нескольких «голосов», которые угрожают, порицают, приказывают больному, дразнят его или обсуждают неблаговидные поступки, совершенные им в прошлом. Слуховые галлюцинации довольно часто носят сценический характер. Бредовые идеи мало систематизированы, расплывчаты. В начальном периоде острого галлюциноза может отмечаться значительное двигательное возбуждение. Острый галлюциноз может протекать в стертых формах (острый гипнагогический слуховой галлюциноз, острый прервавшийся галлюциноз, которые длятся около суток), в атипичных (с депрессией, кратковременным субступором, отдельными психическими автоматизмами, бредом величия или онейроидными включениями), а также смешанных формах — с выраженным бредом или делириозными эпизодами. Подострый алкогольный галлюциноз может длиться от 1 до 6 месяцев. От острого он отличается меньшей выраженностью страха и возбуждения. При этом преобладают слуховые галлюцинации, бред преследования и депрессивный аффект. Выход из острого и подострого алкогольного галлюциноза может быть критическим или постепенным. Хронический галлюциноз протекает длительно — от полугода до нескольких лет — и характеризуется наличием стереотипных слуховых галлюцинаций. Высказывания «голосов» могут быть нейтральными, комментирующими, типа «эха мыслей». Больные до некоторой степени привыкают к ним. Однако в период усиления галлюцинаций заметен страх. Возбуждение встречается редко, при этом возможно непредсказуемое поведение. Иногда бред может отсутствовать или, наоборот, преобладать. В ряде случаев истинные галлюцинации заменяются псевдогаллюцинациями. Прогрессирование заболевания приводит к переходу в парафрению и псевдопаралич. Алкогольные бредовые психозы могут протекать в качестве острого или хронического параноида, алкогольного бреда ревности. Острый параноид характеризуется ярко выраженным страхом, образным бредом преследования или отношения. Лиц, находящихся с ним в контакте, больной принимает за преследователей, любые предметы в их руках — за оружие. В реальных разговорах он находит намеки на собственную скорую насильственную смерть. Действия больного при этом направлены на то, чтобы убежать от опасности, приготовиться к обороне или нападению. Продолжительность острого параноида составляет от нескольких дней до нескольких недель, хотя встречается и абортивное течение — до суток. Хронический алкогольный параноид характеризуется более сглаженно проявляющимися симптомами. Отмечается усиление существовавших ранее бредовых идей преследования либо появление бреда воздействия и других психических автоматизмов. Алкогольный бред ревности (алкогольная паранойя) начинается постепенно. На фоне подавленного или озлобленного эмоционального состояния возникают и систематизируются бредовые идеи ревности. Они часто скрываются больным от окружающих и впервые высказываются в пылу ссоры или во время опьянения. Со временем болезненные высказывания утрачивают правдоподобность. Деятельность больного имеет своей целью добыть доказательства «неверности» супруги и наказать «обидчиков». Нередко она выливается в жестокую агрессию с исходом в убийство. Течение алкогольной паранойи длительное, многолетнее. Наблюдаются периоды затухания и возобновления симптоматики, которые связаны с интенсивностью алкоголизации и условиями жизни больного. Алкогольная депрессия характеризуется тревогой, слезливостью, раздражительностью, ипохондрией, стремлениями к самоубийству, чувством неполноценности, ухудшением настроения во второй половине дня. Депрессия может быть различной длительности и интенсивности. Алкогольная эпилепсия клинически не отличается от эпилепсии (см.) идиопатической. Припадки могут отмечаться на высоте запоя или во время абстиненции. При длительном воздержании от алкоголя они не возобновляются. Дипсомания, так называемый истинный запой, встречается на 3-й стадии алкоголизма, нередко на фоне хронической стертой психической патологии. Началом служит появление тревожно-депрессивного аффекта, дисфорий, нарушений сна и аппетита, головных болей. На протяжении индивидуально-вариабельного срока (от дней до недель) больные испытывают интенсивную тягу к алкоголю, ежедневно употребляют его. Запой прерывается внезапно в связи с исчезновением влечения к спиртному или возникновением отвращения к нему. Алкогольные энцефалопатии характеризуются наличием психических и соматоневрологических расстройств, причем последние могут преобладать. Выделяют острые (синдром Гайе-Вернике) и хронические (корсаковский психоз) энцефалопатии. Для всех форм энцефалопатий (см.) характерен период предболезни разной продолжительности: от нескольких недель до года и более, наиболее коротким он бывает при сверхострой форме — 2–3 недели. Этот период характеризуется развитием астении с преобладанием адинамии, снижением аппетита вплоть до полной анорексии (см.), отвращением к жирной и белоксодержащей пище. Частый симптом — рвота, преимущественно в утренние часы. Нередко отмечаются изжога, отрыжка, боли в животе, неустойчивый стул. Физическое истощение усиливается. Для состояния продрома типичны нарушения сна — трудности засыпания, неглубокий поверхностный сон с яркими кошмарами, частыми пробуждениями, ранним просыпанием. Может отмечаться извращенный цикл «сон — бодрствование»: сонливость днем и бессонница ночью. Часто возникают ощущения озноба или жара, которые сопровождаются потливостью, сердцебиениями, болью в области сердца, чувством нехватки воздуха, обычно по ночам. В различных областях тела, как правило в конечностях, нарушается кожная чувствительность, в мышцах икр, пальцах рук или ног отмечаются судороги. Синдром Гайе-Вернике встречается обычно у мужчин в возрасте 35–45 лет. Началом, как правило, служит делирий со скудными, отрывочными, однообразными галлюцинациями и иллюзиями. Доминируют тревога и страх. Двигательное возбуждение наблюдается преимущественно в виде стереотипных действий (как при обыденных или профессиональных занятиях). Периодически возможно развитие кратковременных состояний обездвиженности с повышенным тонусом мышц. Больные могут что-либо бормотать, выкрикивать однообразные слова, при этом речевой контакт с ними невозможен. Через несколько дней развивается состояние оглушенности, которое затем может перейти в ступор, а при неблагоприятном течении — в кому. В более редких случаях сопорозному состоянию предшествует апатический ступор. Ухудшению психического состояния способствует усугубление соматических и неврологических нарушений. Последние отличаются большим разнообразием. Часто наблюдаются фибриллярные подергивания языка, губ и мышц лица. Постоянно отмечаются сложные непроизвольные движения (см.), среди которых дрожание перемежается с подергиваниями, хореиформными, атетоидными и прочими видами движений. Мышечный тонус может быть как повышен, так и понижен. Вскоре развивается атаксия. Определяются нистагм, птоз, страбизм, неподвижность взора, а также зрачковые расстройства (анизокория, миоз, ослабление реакции на свет вплоть до ее полного исчезновения) и нарушения конвергенции. Довольно часто отмечаются полиневриты, легкие парезы, наличие пирамидных знаков, из менингеальных симптомов может определяться ригидность затылочных мышц. Больные физически истощены, выглядят старше своих лет. Лицоотечное. Язык малинового цвета, его сосочки сглажены. Отмечается повышенная температура. Постоянны тахикардия и аритмия, артериальное давление при усугублении состояния снижается, имеется склонность к гипотонии (коллапсу). Отмечается гепатомегалия, нередко встречается диарея (см.). Сверхострое течение алкогольной энцефалопатии характеризуется тем, что сначала развиваются тяжелые формы делирия (профессионального или мусситирующего). Вегетативная и неврологическая симптоматика продромального периода резко усиливается. Температура тела достигает 40–41 °C. Спустя один или несколько дней развивается состояние оглушенности с переходом в коматозное. Смерть наступает чаще на 3—6-й день. В исходе острых алкогольных энцефалопатий возможно развитие органического психосиндрома. При синдроме Гайе-Вернике летальность чаще бывает связана с присоединением сопутствующих заболеваний, обычно пневмонии. Корсаковский психоз (алкогольный паралич, полиневритический психоз) имеет хронический характер. Довольно часто встречается у женщин, страдающих алкоголизмом. Клинически это характеризуется нарушениями памяти и внимания, что приводит к дезориентации больных в пространстве. Третьим типичным признаком является заполнение провалов в памяти вымышленными событиями. Амнестические нарушения характеризуются полным или частичным отсутствием памяти на текущие события (фиксационная амнезия), а также памяти на события, которые предшествовали заболеванию (ретроградная амнезия продолжительностью от нескольких недель до нескольких лет). При этом сохраняется память на отдаленные события. Содержание конфабуляций, возникающих в ответ на заданные вопросы, соответствует фактам обыденной жизни. Неврологическими нарушениями, характерными для корсаковского психоза (см.), являются полиневропатии конечностей. Они сопровождаются нарушениями чувствительности, различной степенью атрофии мышц, снижением сухожильных рефлексов. Неврологические нарушения проходят быстрее психических. У лиц молодого и среднего возраста, особенно у женщин, наблюдается значительная положительная динамика в ответ на лечение. Алкогольная мозжечковая дегенерация характеризуется атаксией (см.) стояния и ходьбы, атаксией в ногах с отсутствием или минимальным вовлечением рук. Нистагма и дизартрии в большинстве случаев не наблюдается. Заболевание прогрессирует на протяжении нескольких недель или месяцев с последующим длительным стабильным течением.
Диагностика В диагностике используют данные о злоупотреблении алкоголем, наличии патологического влечения к опьянению, измененной устойчивости к алкоголю, наличии абстинентного синдрома, изменений личности. Имеют значение характерные нарушения нервной системы, типичные повреждения внутренних органов. Полисистемный характер поражения позволяет диагностировать алкоголизм врачам любой специализации. На поздних стадиях диагноз затруднений не вызывает. В начальных стадиях можно использовать лабораторные методы — биологические маркеры хронического употребления алкоголя: повышение активности алкогольдегидрогеназы (АДГ) и микросомальной этанолокисляющей системы; снижение активности альдегидрогеназы (АльДГ); обнаружение гиперлипидемии, общей гиперхолестеринемии, гипертриглицеридемии; повышение уровня холестерина в составе липопротеидов высокой плотности (ХЛВП). Факт хронической алкогольной интоксикации подтверждают высокая и колеблющаяся при 2—3-кратном исследовании (в течение 7—10 дней) активность комплекса ферментов глутамилтрансферазы (ГГТ), аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), щелочной фосфатазы (наиболее часто и значительно повышается активность ГГТ в сочетании с ACT). Колебания активности свидетельствуют в пользу интоксикационной природы отклонений и позволяют отличить их от ферментопатий патологии внутренних органов. При воздержании в раннем периоде заболевания активность ферментов возвращается к норме. Сформированная патология удерживает высокую активность ГГТ, АЛТ и ACT до полугода. Алкогольная миокардиодистрофия (см.) характеризуется следующими изменениями на ЭКГ: синусовой тахикардией (см.), суправентрикулярной экстрасистолией, мерцательной аритмией (см.), изменениями зубца Т и интервала S-Т. В первой — начале второй стадии алкоголизма характерно укорочение интервала Р-Q, косовосходящее смещение сегмента S-Т, высокий заостренный зубец Т в отведениях V2—V5. Со второй стадии (при алкогольном анамнезе более 10 лет) помимо описанных изменений регистрируются увеличение левого желудочка, нарушения внутрижелудочковой проводимости в виде расщепления и уширения комплекса QRS, возможно появление отрицательного зубца Т. Эхокардиография выявляет распространенные изменения миокарда, увеличение полостей сердца. Исследование кровообращения на первой стадии выявляет изменения по гиперкинетическому типу с увеличением минутного объема и понижением периферического сопротивления; при прогрессировании заболевания отмечается гипокинетический тип кровообращения со стойким снижением сердечного выброса. При развитии острого алкогольного панкреатита (см.) помимо типичных клинических проявлений характерны изменения со стороны клеток крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и ускорение СОЭ. В моче повышен уровень альфаамилазы. Биохимическое исследование крови также выявляет повышение уровня альфа-амилазы, липазы, трипсина, гаммаглобулинов, сиаловых кислот и серомукоида. При хроническом панкреатите описанные изменения характерны для развития обострений. Кроме того, отмечается снижение устойчивости к глюкозе. Острый алкогольный гепатит (см.) приводит к воспалительной реакции белой крови: лейкоцитозу со сдвигом формулы влево, повышению СОЭ. Содержание билирубина в сыворотке крови, АСТ и АЛТ многократно превышают нормальные показатели. Хронический алкогольный гепатит характеризуется преходящей гипербилирубинемией, диспротеинемией-гипоальбуминемией и гипергаммаглобулинемией. Алкогольные психозы (см.) диагностируют при наличии хронического алкоголизма и клиники психоза, в том числе динамики симптомов. Алкоголизм может наслаиваться или провоцировать развитие многих психических заболеваний (см.), поэтому в каждом отдельном случае необходимо тщательное психиатрическое обследование. Диагноз алкогольных энцефалопатий (см.) устанавливают преимущественно на основании клинической картины и данных анамнеза. Дифференцировать их необходимо с делирием (см.), опухолями головного мозга, шизофренией (см.), острыми симптоматическими психозами.
Лечение Лечение больных должно быть поэтапным и комплексным. Схема лечения включает три этапа, каждый из которых преследует собственные цели. В задачи I этапа входят устранение последствий массивной интоксикации алкоголем и прекращение абстинентного синдрома. На II этапе необходимо добиться подавления патологического влечения к алкоголю и коррекции психологических и внутренних нарушений. III этап — профилактическая терапия. Для прекращения абстинентного синдрома в сочетании с дезинтоксикационной терапией (гипертонические, изотонические, плазмозамещающие растворы, тиоловые производные) широко применяются витамины группы В, а также С, РР и др., сердечно-сосудистые средства; препараты, нормализующие сон и снижающие вторичное влечение к алкоголю, — транквилизаторы бензодиазепинового ряда (лоразепам, клоназепам, феназепам, грандаксин, диазепам), натрия оксибутират, хлорпротиксен. В первые дни лишения алкоголя возможно развитие психоза. Поэтому применяют парентеральное введение нейролептиков — фенотиазинов и бутирофенонов. Широко используются антиконвульсанты — карбамазепин (тегретол, финлепсин), вальпроат натрия. Среди ноотропных средств наибольшее применение имеет ороцетам. Его следует использовать, если в клинике абстинентного синдрома преобладают соматовегетативные расстройства. Для прекращения абстинентного синдрома можно использовать специальные схемы иглорефлексотерапии, краниоцеребральную гипотермию, гемосорбцию. На втором и третьем этапах терапии продолжают применяться сенсибилизирующие средства — преимущественно дисульфирам (антабус, тетурам, аверсан, эспераль). Эффект препарата связан с подавлением активности альдегидрогеназы (АльДГ), что ведет к накоплению ацетальдегида. Этот процесс начинается не ранее чем через 12 ч после приема дисульфирама и продолжается несколько дней. В результате развивается выраженное расстройство функций внутренних органов и нервной системы, так называемая антабус-алкогольная реакция (ААР). Она приводит к невозможности совместного приема дисульфирама и спиртного. Однако в последнее время отмечается относительно низкая эффективность сенсибилизирующей терапии как препаратами дисульфирама, обладающего большим количеством побочных эффектов, так и другими средствами (трихополом, циамидом, фуразолидоном, никотиновой кислотой). Наиболее широко для лечения больных алкоголизмом на втором этапе применяются препараты тимонейролептического действия (терален, труксал, тиоридазин, неулептил). Для лечения расстройств депрессивного спектра широко используются антидепрессанты (триптизол, пиразидол, азафен), сочетающие антидепрессивный и успокаивающий эффекты. На втором этапе терапии продолжается применение транквилизаторов бензодиазепинового ряда. Однако следует помнить, что у больных алкоголизмом легко формируется перекрестная зависимость, в том числе и к этой группе препаратов. На втором этапе после прекращения абстиненции основной задачей лечения является формирование стабильного улучшения состояния больного. Это достигается только при совместном применении фармако- и психотерапии. Вначале применяется индивидуальная, а затем и групповая психотерапия, которая обладает наибольшим лечебным потенциалом. Она позволяет больным сформировать критическое отношение к заболеванию, а также получить поддержку не только от врача, но и от других членов группы. На этапе сформировавшейся ремиссии в межприступном периоде может потребоваться курсовая терапия психотропными средствами в случаях спонтанного ухудшения состояния или под влиянием неблагоприятных внешних факторов, приводящих к возобновлению на то или иное время патологического влечения к алкоголю. Желателен продолжительный контакт с психотерапевтом (наркологом).
АЛОПЕЦИЯ
ОпределениеАлопеция (лат. alopecia — «облысение», «плешивость») — патологическое выпадение волос. Выделяют врожденную, симптоматическую, себорейную, рубцовую и преждевременную алопецию. По степени выраженности облысения алопеция бывает полной или гнездной.
Этиология и патогенез Причины алопеции многообразны. Считают, что преждевременное облысение запрограммировано генетически, а его степень определяется выраженностью проявления соответствующих генов. При этом волосяные фолликулы уменьшаются в размерах под влиянием мужских гормонов после завершения полового созревания. Их количество при этом не уменьшается вплоть до поздних стадий облысения, но волосы столь малы, что не видны невооруженным глазом. У женщин причиной алопеции может являться повышенная чувствительность к мужским гормонам или их повышенное содержание в организме при следующих заболеваниях: поликистоз яичников, поздноразвивающаяся врожденная дисфункция коры надпочечников, синдром Кушинга, опухоли надпочечников и яичников. Симптоматическая алопеция может сопровождать многие тяжело протекающие острые и хронические заболевания и бывает связана с интоксикацией, обменными нарушениями, дисгормонозами. Алопеция встречается при сифилисе (см.), заболеваниях системы крови, авитаминозах (особенно А, С и В), длительной лихорадке (малярия (см.), у раковых больных при проведении химио- и лучевой терапии, гипотиреозе (см.) и других эндокринных заболеваниях, после проведения обширных хирургических вмешательств, при тяжело протекающих родах (см.). Ряд лекарственных препаратов может вызывать повышенное выпадение волос. К ним относятся противоопухолевые препараты, колхицин, противоэпилептические препараты (вальпроевая кислота, карбамазепин), антитиреоидные средства, тяжелые металлы, противосвертывающие препараты (гепарин, кумарин). Причиной рубцовой алопеции может быть красная волчанка, глубокие гнойничковые (фурункулы (см.), карбункулы) или грибковые (фавус (см.), трихофития (см.)) поражения кожи волосистой части головы. В процессе развития выделяют два основных механизма: выпадение волос в фазу анагена (активного роста волосяного фолликула) и выпадение волос в период телогена, когда рост фолликула прекращается. Продолжительность этой фазы в среднем составляет 3 месяца, после чего волосы выпадают «физиологически». Первый тип выпадения волос отмечается при непосредственном повреждении крайне чувствительных ростовых клеток фолликула, например ионизирующим излучением при лучевой терапии. В результате луковица волоса производит истонченный стержень, который постепенно заостряется, становится хрупким, выпадает или разрушается при малейшем воздействии.
Клиническая картина Врожденная алопеция встречается редко. Она характеризуется полным отсутствием или резким поредением волос, что может сочетаться с другими нарушениями: истощением ногтей, зубов и др. Преждевременная, или пресенильная, алопеция чаще встречается у мужчин молодого и среднего возраста и развивается постепенно. У женщин обычно процесс ограничивается поредением волос. Выпадение волос начинается в лобной и теменной областях. Затем процесс захватывает другие участки, вследствие чего волосы часто сохраняются только по границам своего роста. Кожа на облысевших участках истончается, становится гладкой и блестящей, отверстия волосяных фолликулов незаметны. Себорейная алопеция развивается на фоне себореи. Отмечается некоторое поредение волос на всей поверхности волосистой части головы на фоне нарушения салоотделения, шелушения кожи, повышенной сальности волос и других симптомов себореи (см.). Под рубцовой алопецией подразумевается постоянное разрушение волосяного фолликула и его замещение соединительной тканью. Рубцы не так заметны, как при заживлении ран, и приводят к исчезновению устьев волосяных фолликулов; в результате скальп становится гладким и блестящим. Кожа может оставаться мягкой и эластичной, хотя иногда при прощупывании отмечается уплотнение. Гнездная алопеция характеризуется выпадением волос на одном или нескольких небольших участках волосистой части головы, в области подмышечных впадин, лобка, бороды, ресниц или бровей. Очаги имеют чаще всего округлые очертания, они могут увеличиваться и сливаться между собой, образуя крупные участки. Кожа в свежих очагах слегка гиперемирована и отечна. В дальнейшем она становится гладкой и приобретает цвет слоновой кости. В очагах сохраняются отдельные, длиной до нескольких миллиметров, легко удаляемые «пеньки» с незначительно отечным корнем и истонченной верхушкой в форме вопросительного знака. Заболевание может протекать на фоне эозинофилии, лимфоцитоза, регионарного лимфаденита (см.), истощения ногтей, сопровождаться головными болями. В ряде случаев отмечается полное выпадение волос на голове, а также ресниц, бровей, пушковых волос на всем теле (полная злокачественная, или универсальная, алопеция). Течение может отличаться длительностью — волосы выпадают на протяжении нескольких лет. У детей иногда наблюдается алопеция в виде мелкоочаговых «просветов» волос или змеевидного венчика, распространяющегося лентообразно от затылка к ушным раковинам.
Диагностика В диагностике большое значение принадлежит клинической картине и данным анамнеза. Дифференциальный диагноз необходимо проводить между гнездной алопецией и сифилитической алопецией, а также трихофитией (см.). Сифилитическая алопеция развивается во вторичном периоде сифилиса. Ее характеризует появление на волосистой части головы, особенно в области висков и затылка, множества мелких очажков облысения. Поскольку не все волосы в очаге выпадают, данная картина приобретает сходство с мехом, изъеденным молью. Выпадение волос не сопровождается субъективными ощущениями. Как правило, имеются и другие клинические симптомы вторичного периода сифилиса (см.). Классические серологические реакции обычно резко положительны. В отличие от гнездной алопеции при поверхностной трихофитии (см.) волосистой части головы в очагах поражения имеется шелушение. В этих участках волосы не выпадают, а обламываются. Исследование чешуек и волос выявляет наличие спор гриба.
Лечение Терапия преждевременной алопеции чаще всего заключается в интенсивном общеукрепляющем лечении. Оно не может привести к восстановлению волосяного покрова, но способно заметно уменьшить прогрессирование процесса. В настоящее время разработаны методики оперативного лечения алопеции. Например, пересадка волосяных фолликулов на кожу в облысевших участках, а также пересадка кожного лоскута (скальпа) вместе с волосами. Эти операции дорогостоящие и выполняются в специализированных клиниках. У женщин при гиперандрогенемии лечение направлено на устранение причин последней. При повышенной чувствительности к андрогенам (мужским гормонам) проводится неспецифическая терапия, подавляющая их продукцию яичниками или блокирующая их периферические эффекты. С этой целью применяются оральные контрацептивы и спиронолактон. Лечение симптоматических алопеций должно быть направлено на основное заболевание, при благоприятном исходе которого волосы со временем восстанавливаются. Лечение себорейной алопеции должно быть профилактическим. В этих целях помимо общеукрепляющей терапии и коррекции обменных процессов используется интенсивное местное лечение. Комплексное лечение способно предупредить или приостановить выпадение волос. Лечение проводят врачи-дерматологи и косметологи. При гнездной алопеции лечение проводится амбулаторно или в дерматологическом стационаре (при обширном процессе и упорном течении). Используются витамины А, Е, С, Н, никотиновая, пантотеновая и фолиевая кислоты; препараты фурокумарина (бероксан, псорален, аммифурин, меладинин); седативные средства; гормоны АКТГ и глюкокортикоиды. Последние используются также наружно в виде мазей. Местно применяют пасту Розенталя, алкогольные и эфирные растворы с добавлением серы, салициловой кислоты, настойки стручкового перца; также применяют аммифурин и меламидин с последующим облучением УФ-лучами или фотохимиотерапией (ПУВА-терапией). Из физиотерапевтических средств используют дарсонвализацию, криотерапию снегом угольной кислоты, криомассаж и массаж электрощеткой.
АЛЬБИНИЗМ
ОпределениеАльбинизм (от лат. albus — «белый») представляет собой врожденное отсутствие кожного пигмента (меланина), приводящее к отсутствию нормальной пигментации кожи, волос, радужной оболочки.
Этиология и патогенез Этиология и патогенез изучены недостаточно. Известно, что вследствие нарушения синтеза ферментов тирозиназы, дофаоксидазы прекращается образование меланина из тирозина, диоксифенилаланина. О сложности механизмов происхождения альбинизма часто говорят сопутствующие ему такие аномалии, как врожденная глухота, нарушения интеллекта, патология глаз и др.
Клиническая картина Выделяют тотальный, неполный и частичный альбинизм. Тотальный альбинизм. Депигментация кожи и придатков отмечается с рождения, сопровождается сухостью кожи, нарушением потоотделения, иногда гипо- или гипертрихозом, особенно на открытых участках. У больных легко появляются солнечные ожоги, актинический хейлит. Они предрасположены к развитию кератом, эпителиом, телеангиэктазий. Из-за отсутствия пигмента в тканях глаза зрачки кажутся красными. Типичными являются горизонтальный нистагм и выраженная светобоязнь. Часто наблюдаются сходящееся косоглазие, снижение остроты зрения вследствие нарушений рефракции, катаракты, возможна микрофтальмия. Нередко могут быть бесплодие, иммунодефицит, пороки развития, сокращение продолжительности жизни, олигофрения. Неполный альбинизм (или альбиноидизм). Наблюдается гипопигментация кожи, волос, радужки, иногда фотофобия. Других дефектов и аномалий не регистрируется. Частичный альбинизм (или пиебалдизм). Признаки выявляются при рождении. Обусловлен появлением участков ахромии на коже живота, лица, нижних конечностей, прядей седых волос. Депигментированные пятна неправильной формы с резкими границами, на их поверхности имеются мелкие темно-коричневые пятнышки. Вокруг ахромичных пятен кожа может быть пигментированной. Поражений других органов обычно не бывает.
Лечение Эффективных методов лечения нет. Показано применение фотозащитных средств, декоративной косметики. Для придания коже желтоватого оттенка при тотальном и неполном альбинизме рекомендуют назначать бета-каротин (90—180 мг/сут.). Проводится косметическая коррекция внешности (окраска волос, ношение контактных линз и т. д.).
АЛЬВЕОЛИТЫ
ОпределениеАльвеолиты — группа распространенных воспалительных процессов в респираторном отделе легкого с тенденцией к замещению легочной ткани соединительной.Альвеолит может возникать как проявление ряда заболеваний: ДБСТ (системной красной волчанки (см.), ревматоидного артрита (см.), системной склеродермии (см.), синдрома Шегрена (см.)), хронического активного гепатита (см.), первичного билиарного цирроза (см.), аутоиммунного тиреоидита, саркоидоза (см.), СПИДа (см.) и некоторых других; к самостоятельным нозологическим формам относят экзогенные аллергические альвеолиты, токсические альвеолиты, идиопатический фиброзирующий альвеолит. Идиопатический фиброзирующий альвеолит (синдром Хаммена-Рича, интерстициальная пневмония, диффузный интерстициальный фиброз легких) проявляется прогрессирующим пневмофиброзом с развитием дыхательной недостаточности, высокого артериального давления малого круга кровообращения и легочного сердца. Частота встречаемости — 3—10 случаев на 100 тыс. населения. Чаще заболевают женщины, возраст может быть различным. Внешние аллергические альвеолиты (экзогенные аллергические альвеолиты, гиперчувствительные интерстициальные пневмониты, экзогенные бронхиолоальвеолиты) возникают благодаря реакции иммунной системы на внешние аллергены. Распространенность этой патологии нарастает в связи с увеличением объема промышленных и сельскохозяйственных отраслей, при работе в которых человек непосредственно соприкасается с веществами, способными вызвать аллергические реакции. Причиной возникновения патологии может быть широкое и подчас бесконтрольное использование лекарственных препаратов. Токсические альвеолиты развиваются благодаря непосредственному токсическому воздействию на легочную ткань различных химических соединений.
Этиология и патогенез Идиопатический фиброзирующий альвеолит Большинство исследователей склоняются к тому, что вирусная инфекция является причинным фактором и дальнейшее поражение легкого имеет аутоиммунный механизм развития. В ряде случаев нельзя отрицать наследственную предрасположенность к развитию заболевания, так как встречаются семейные его формы. Аутоиммунный характер заболевания подтверждается тем, что в крови больных нередко выявляются ревматоидные факторы, повышенное содержание иммунных белков и циркулирующих иммунных комплексов, а в ткани легких обнаруживается инфильтрация лимфоцитами. Иммунологические реакции, ведущие к накоплению в альвеолярных структурах нейтрофилов (развитие нейтрофильного альвеолита), протекают с участием иммунных комплексов, альвеолярных макрофагов. Следствием разрушения нейтрофилов является высвобождение большого количества протеолитических ферментов, в том числе коллагеназы, ведущей к нарушению обмена коллагена в легочной ткани и развитию прогрессирующего легочного фиброза. Этому способствует и активный рост фибробластов, обусловленный воздействием макрофагов. Основным структурным субстратом идиопатического фиброзирующего альвеолита является альвеолярно-капиллярный блок вследствие реакции, приводящей к нарушению газообменной функции легких. Характерны серозно-фибринозное пропитывание альвеолярных перегородок, накопление в альвеолах богатого фибрином и макрофагами экссудата, выраженное разрастание соединительной ткани и ее склерозирование, гиалиновые мембраны в альвеолах. При прогрессировании заболевания продолжается слипание и деформация альвеол с вовлечением в процесс мелких бронхиол. В результате в легких формируются гладкостенные полости небольших размеров — так называемое «сотовое» легкое. Макроскопически наблюдаются легкие повышенной плотности, имеющие краснобурый цвет с сетью сероватых полосок и очагами буллезной эмфиземы.
Экзогенные аллергические альвеолиты Аллерген, вызывающий заболевание, попадает в организм ингаляционным, реже — иным путем. Как правило, аллергеном является мельчайшая (1–5 мкм), сложная по составу пыль — частицы растений и животных, бактерий, актиномицетов, сапрофитных грибов. Обычно аллергенами являются споры грибков, находящиеся на прелом сене, сахарном тростнике и других растительных производных. Значительно реже ими становятся растительная пыль, белковые антигены, антигены домашней пыли, лекарственные средства. Виды аллергенов, вызывающие ЭАА: амбарная болезнь — пшеничная пыль, мука; багассоз — плесневая пыль сахарного тростника; болезнь молольщиков кофе — кофейная пыль; болезнь моющихся в сауне — мокрая древесина; болезнь сыроваров — некоторые сорта сыра; биссиноз — хлопковая и льняная пыль; легкое птицевода (голубевода) — перья и помет голубей, цыплят, волнистых попугайчиков; легкое скорняка — каракуль и мех лис; легкое обрабатывающих грибы — заплесневелый грибной компост; легкое работающих с солодом — прелый ячмень, солодовая пыль; легкое фермера — прелое сено; ликопердоноз — споры гриба-дождевика (в народной медицине используется как средство от носовых кровотечений); секвойоз — заплесневелые опилки красного дерева; субероз — пробковая пыль; болезни легких, вызываемые увлажнителями воздуха и использованием кондиционеров, — загрязненные вода и воздух; альвеолиты, вызываемые лекарственными средствами, — ряд антибиотиков (например, пенициллины), сульфаниламиды, нитрофураны, белковые препараты, соли золота и др. Основным механизмом развития повреждения легких при экзогенных аллергических альвеолитах является образование иммунных комплексов. Они откладываются в стенках альвеол и мельчайших дыхательных бронхиол, вызывая их воспаление. Этому способствует повышенная проницаемость сосудистой стенки, возникающая при развитии аллергических реакций немедленного типа. Последние характеризуются массивным высвобождением биологически активных веществ (в первую очередь гистамина и серотонина) из клеток крови, благодаря которым и повышается сосудистая проницаемость. Кроме того, биологически активные вещества активизируют нейтрофилы и эозинофилы, которые также задействуются в развитии воспалительных реакций. Кроме реакций немедленного типа, в механизме развития экзогенных аллергических альвеолитов могут участвовать и реакции замедленного типа, приводящие к образованию в легких гранулем. Это связано с особенностями аллергена — чаще спорами грибков или их частицами. Образованию гранулем могут способствовать и нерастворимые иммунные комплексы. Результатом развития гранулем является рубцевание (развития некроза при этом, как правило, не бывает), вследствие чего формируется замещение легочной ткани (см.). При исследовании ткани бронхолегочных структур помимо гранулем в стенках альвеол и концевых бронхиол отмечается инфильтрация мононуклеарами и плазматическими клетками. В альвеолах возможно скопление экссудата. Отмечается формирование васкулитов (см.) с околососудистым отложением иммуноглобулинов. При прогрессировании заболевания развивается диффузный легочный фиброз с очагами более обширного разрастания соединительной ткани. Структура легкого нарушается, возникает неравномерное разрушение альвеол, расширение бронхиол и эмфизема легких (см.).
Токсические альвеолиты В качестве факторов, способствующих возникновению токсических альвеолитов, чаще всего выступают лекарственные препараты и токсические промышленные вещества. Среди первых необходимо отметить цитостатики и иммунодепрессанты (хлорбутин, сарколизин, циклофосфан, метотрексат, миелосан, меркаптопурин и пр.), противоопухолевые антибиотики (блеомицетин, митомицин С и др.), цитостатики растительного происхождения (винбластин, винкристин и др.), ряд противоопухолевых препаратов (прокарбазин, нитрозометил-мочевина). Частота развития токсических альвеолитов при использовании противоопухолевых средств и цитостатиков достигает 40 %. Токсическим действием на ткани легких обладают производные нитрофурана, сульфаниламиды, нейроактивные и вазоактивные средства (бензогексоний, анаприлин, апрессин), пероральные сахароснижающие средства (хлорпропамид), L-аспарагиназа. При продолжительных ингаляциях кислорода последний также может оказывать токсическое воздействие на легочную ткань. Риск возникновения токсических альвеолитов зависит от срока приема и дозировок токсических препаратов. Он усиливается при одновременном использовании нескольких таких препаратов. Среди производственных провоцирующих факторов токсических альвеолитов выделяют раздражающие газы (сероводород, хлор, аммиак, тетрахлорметан и др.), ряд металлов (марганец, ртуть, цинк, бериллий, кадмий, никель) и их соединения, некоторые пластмассы (полиуретан, политетрафлюороэтилен), некоторые гербициды и др. Развитие токсических альвеолитов характеризуется непосредственным токсическим воздействием на стенки легочных капилляров. Это приводит к нарушениям микроциркуляции, внутритканевому отеку и инфильтрации с последующим исходом в пневмофиброз. Ряд токсических соединений (например, бериллий) помимо прямого токсического эффекта на легкие оказывает воздействие и на развитие функций иммунной системы. Альвеолит (помимо респираторной патологии) — воспаление лунки, которая остается после удаления зуба. Начало заболевания характеризуется появлением резкой боли в области травмированной или вторично инфицированной лунки, через некоторое время у пациента повышается температура тела, возникает отек вокруг пораженной области. Края лунки становятся ярко-красными, припухшими. Лечение альвеолита выполняют комплексными методами. Сначала под местной анестезией производят очистку с удалением омертвевших тканей, затем обрабатывают рану антисептиком и останавливают кровотечение. Далее в лунку вводят антибактериальные и противовоспалительные вещества, среди которых большую роль отводят препарату коллапан, способствующему росту костной ткани. Осложнения: при отсутствии своевременно принятых мер возможно развитие тяжелых осложнений, например остеомиелита.
Клиническая картина Идиопатический фиброзирующий альвеолит Первыми клиническими проявлениями заболевания могут служить одышка, снижение устойчивости к физическим нагрузкам и сухой кашель, не поддающийся терапии. Одышка и покашливание могут сопровождаться общими жалобами (повышенная утомляемость, анорексия (см.), похудение). Иногда начало идиопатического фиброзирующего альвеолита может протекать по типу банального ОРВИ — с лихорадкой, влажным продуктивным кашлем и быстро нарастающей одышкой. При прослушивании по задней поверхности легких наблюдается распространенное характерное похрустывание, иногда — притупление звука. С течением времени могут присоединиться симптомы сухого плеврита (см.), возможен спонтанный пневмоторакс (см.). Нарастает дыхательная недостаточность, появляются синюшность, признаки гипертензии (см.) малого круга кровообращения и легочного сердца. В исходе заболевания развиваются типичные пальцы в виде «барабанных палочек» и ногти в форме «часовых стекол». Прогноз неблагоприятный. Длительность жизни больных после выявления ИФА составляет в среднем 4–6 лет. Однако при проведении всех соответствующих лечебных мероприятий можно не только продлить жизнь, но и сохранить трудоспособность пациентов.
Экзогенные аллергические альвеолиты Экзогенные аллергические альвеолиты характеризуются острым, подострым и хроническим течением. Развитие той или иной формы заболевания связано с особенностями аллергена, частотой контакта с ним и его дозой при поступлении в организм, а также с реактивностью самого организма. Например, у голубеводов заболевание проявляется в острой форме чаще всего после чистки голубятни, т. е. когда в дыхательные пути попадает большая доза аллергена. У любителей, содержащих птиц в квартирах, заболевание протекает чаще в хронической форме: хотя контакт с аллергеном постоянный, последний проникает в организм в значительно меньших дозах. Острая форма в типичных случаях развивается спустя 4–6 ч после контакта с аллергеном. Отмечаются жалобы на лихорадку с ознобом, недомогание, головную боль, боли в конечностях, а также одышку, кашель и чувство «заложенности» (стеснения) в груди. При выслушивании в легких определяются хрустящие хрипы. У лиц, страдающих атопическими аллергическими заболеваниями (см.), в первые 10–15 мин после контакта с аллергеном развивается синдром бронхоспазма с клиникой приступа бронхиальной астмы (см.). При этом в легких при прослушивании определяются свистящие хрипы. Выздоровление при острой форме экзогенных аллергических альвеолитов наступает, когда контакт с аллергеном прекращается. В некоторых случаях через 3–4 дня от начала заболевания вследствие нарушения отхождения мокроты из бронхиального дерева могут присоединиться инфекционно-воспалительные изменения с клиникой острой пневмонии (см.) или острого бронхита (см.). В таких случаях выздоровление затягивается до прекращения присоединившегося воспалительного процесса. При подострой форме симптомы проявляются не так ярко. В большинстве случаев прямая связь заболевания с вдыханием определенного сорта пыли может отсутствовать. Отмечаются жалобы на одышку, кашель, повышенную утомляемость, потерю веса. Данные обследования свидетельствуют о наличии признаков бронхита. Выздоровление при этой форме наступает более медленно. Когда в организм в течение длительного времени регулярно проникают небольшие количества аллергена или его большие дозы, развивается хроническая форма экзогенных аллергических альвеолитов. Пациенты предъявляют жалобы на одышку, даже при небольших физических нагрузках, постоянный кашель с мокротой слизистого характера, слабость, боли в мышцах и снижение веса. При прослушивании в легких наблюдаются ослабленное дыхание, хрустящие хрипы; при длительном течении заболевания с развившейся эмфиземой (см.) при выстукивании отмечается коробочный звук. Если полностью прекратить контакт человека с аллергеном в начале заболевания, его исход благоприятен. В далеко зашедших случаях при развившемся пневмофиброзе возможно формирование легочного сердца.
Токсические альвеолиты Выделяют острые, подострые и хронические токсические альвеолиты. Острые токсические альвеолиты обычно возникают после массивного воздействия промышленных токсических агентов. Причиной также может быть длительный прием препаратов нитрофуранового ряда. Хронические токсические альвеолиты развиваются постепенно, при регулярном поступлении токсического вещества в организм в небольших или умеренных дозах, т. е. при продолжении контакта с пневмотоксическим средством. Симптомы усиливаются постепенно. В клинике преобладают жалобы на одышку, сухой кашель, лихорадку. При выслушивании выявляются хрустящие хрипы и жесткое дыхание. Прогноз зависит от своевременности диагностики и лечения. При своевременно проведенной терапии наблюдается благоприятный эффект; в противном случае при развившемся пневмофиброзе — неблагоприятный. При назначении препаратов, которые могут вызвать токсический эффект, следует избегать использования максимальных доз и сочетания нескольких препаратов с подобными свойствами. При длительном лечении такими препаратами необходим постоянный контроль за функцией легких, чтобы выявить ранние признаки альвеолита.
Диагностика Идиопатический фиброзирующий альвеолит Диагноз устанавливается на основании данных обследования, результатов рентгенологических, функциональных и лабораторных методов исследования. Ранними рентгенологическими признаками ИФА являются: двустороннее усиление и деформация легочного рисунка, преимущественно в области нижних отделов легочных полей; понижение прозрачности по типу «матового стекла»; распространенная двусторонняя мелкоочаговая инфильтрация полей легких. В дальнейшем рентгенологические симптомы прогрессируют: легочный рисунок все больше деформируется и распространяется на все отделы легочного поля, уменьшается подвижность диафрагмы; в исходе заболевания по периферии полей легких возникают мелкие кистовидные полости — «сотовое легкое». Функциональные пробы выявляют нарушения вентиляции по рестриктивному типу, прогрессирующее снижение газообменной способности легких, артериальную гипоксемию. В активной фазе заболевания в крови отмечаются повышение СОЭ, полицитемия, гипергаммаглобулинемия (преимущественно за счет фракций G и А), ревматоидные факторы, увеличение количества циркулирующих иммунных комплексов. Для уточнения характера изменений структуры легочной ткани показано проведение чрезбронхиальной или чрезторакальной биопсии. Исследование жидкости, полученной путем бронхоальвеолярного лаважа, позволяет получить клетки, выстилающие дыхательные пути (альвеолярные макрофаги, лимфоциты, нейтрофилы, эозинофилы), отражающие характер альвеолярного воспаления. Дифференциальная диагностика идиопатического фиброзирующего альвеолита необходима с многофокусной очаговой бронхопневмонией (см.), диссеминированным туберкулезом (см.) легких, пневмокониозами, бронхоальвеолярным раком (см.).
Экзогенные аллергические альвеолиты В диагностике следует опираться на преимущественное развитие заболевания у лиц, которым не свойственны атопические реакции, возникновение жалоб после длительного контакта с аллергеном, характерную клиническую картину, данные рентгенологического исследования. При острой форме экзогенных аллергических альвеолитов рентгенологически определяют усиление легочного рисунка, а также мелкоочаговые тени — от малозаметных до более очерченных. При подострой форме на рентгенограмме отмечаются распространенные узелковые тени и интерстициальный фиброз. При хронической форме выявляется распространенный пневмофиброз. Исследования крови определяют наличие лейкоцитоза, С-реактивного белка, повышенной СОЭ. Серологические исследования позволяют выявить различные виды антител к предполагаемым аллергенам. Это особенно важно при подострых и хронических формах, когда контакт с аллергеном не ясен. Применяют иммуноферментный, радиоиммунологический, иммунофлюоресцентный методы. Используются также аллергические диагностические пробы — обычно внутрикожные, реже — ингаляционные. Наилучший результат получается с антигенами птиц (сывороткой крови или пометом), менее четкий — с грибковыми антигенами вследствие возможных неспецифических реакций. Дифференцировать экзогенные аллергические альвеолиты обычно приходится с идиопатическим фиброзирующим альвеолитом, саркоидозом (см.), пневмониями (см.) инфекционной природы, диссеминированным туберкулезом (см.) легких.
Токсические альвеолиты Токсическая природа альвеолитов диагностируется главным образом на основании опроса пациента. Изменения на рентгенограмме не являются специфичными: на ранней стадии отмечаются признаки интерстициального отека и распространенных очаговоподобных теней. Развитие пневмофиброза характеризуется диффузной двусторонней ячеистой деформацией легочного рисунка, уменьшением воздушности легких, расширением и нечеткостью корней. Изменения в формуле крови и биохимических тестах могут быть вызваны различной сопутствующей патологией. Для токсических альвеолитов характерно отсутствие иммунологических нарушений. Исследования взятых образцов ткани легких и бронхоальвеолярных смывов (лаважа) выявляют наличие и степень активности патологического процесса, но не его природу. Все диагностические тесты (кроме иммунологических) и данные клиники не отличаются при развившемся фиброзе от идиопатического фиброзирующего альвеолита.
Лечение Идиопатический фиброзирующий альвеолит При подозрении на идиопатический фиброзирующий альвеолит больных следует госпитализировать в специализированные пульмонологические отделения. На начальных стадиях назначают глюкокортикостероидные препараты, цитостатики, пеницилламин (купренил). Максимальные дозы ГКС (50–60 мг в сутки в пересчете на преднизолон) применяются при остром начале заболевания. В остальных случаях суточная доза преднизолона не должна превышать 40 мг. Наличие положительной динамики позволяет постепенно снижать дозировку ГКС. В стадии выраженного легочного фиброза («сотового легкого») назначают преднизолон в дозе 10–15 мг в сутки. Терапия ГКС проводится длительно — до года, а затем — по показаниям. При наличии выраженных признаков аутоиммунного поражения используют цитостатики (азатиоприн по 2,5 мг/кг в сутки в течение 2 месяцев, а затем по 1,5 мг/кг в суткициклофосфан) на протяжении 1–2 лет. Пеницилламин (купренил), препятствующий переходу коллагена из растворимого в нерастворимый, назначают на всех стадиях заболевания, кроме острой. Терапия проводится длительно, в течение 1–2 лет по схеме: первоначально 300 мг в сутки препарата, затем постепенно дозу увеличивают до 1,8 г в сутки с последующим уменьшением до поддерживающей — 300 мг в сутки. При прогрессирующем течении заболевания и большом количестве циркулирующих иммунных комплексов терапия дополняется плазмаферезом.
Экзогенные аллергические альвеолиты Лечение заключается в прекращении и дальнейшем предотвращении контактов больного с аллергеном. При острой форме обычно используют короткий курс лечения глюкокортикостероидами, чтобы как можно быстрее восстановить нарушенные функции. При подострой и хронической формах эффект ГКС менее заметен. Используются антигистаминные средства, симптоматическая и общеукрепляющая терапия.
Токсические альвеолиты Лечение токсических альвеолитов может быть эффективным только в том случае, если полностью исключить возможность контакта больного с аллергеном. Иногда рекомендуется сменить работу. На начальных стадиях заболевания эффективны глюкокортикостероиды. В остальном используется симптоматическое лечение, как при идиопатическом фиброзирующем альвеолите или экзогенных аллергических альвеолитах.
АЛЬВЕОКОККОЗ
ОпределениеАльвеококкоз (альвеолярный эхинококкоз) — тяжелое хроническое паразитарное заболевание из группы тениидозов (см.). Характеризуется прогрессирующим течением и образованием в печени одиночных или (чаще) множественных паразитарных кистозных очагов. Имеет склонность к метастазированию.
Этиология Возбудителем альвеококкоза является личиночная стадия цепня альвеококка. Половозрелая форма представляет собой цестоду длиной 1–4,5 мм, в которой выделяют головку, шейку и 2–6 члеников. Человек является промежуточным хозяином паразита. Личиночная стадия альвеококка представлена скоплением мелких пузырьков (лавроцист) диаметром 0,1–0,3 мм, которые состоят из оболочки и зародышевого слоя. Полость пузырьков заполнена вязкой жидкостью, в которой иногда обнаруживают сколексы. Пузырьки способны к внешнему делению, благодаря чему происходит инфильтрация тканей пораженного органа.
Эпидемиология, патогенез и патанатомия Заболеваемость альвеококкозом имеет очаговый характер. Природными очагами являются Центральная Европа (Германия), Аляска, Северная Канада. В России заболевание встречается в Западной Сибири, на Дальнем Востоке, в Кировской области, Татарстане, из стран СНГ — в республиках Средней Азии и Закавказье. Окончательным хозяином цепня альвеококка являются лисицы, песцы, собаки и кошки. Половозрелые формы гельминта паразитируют в тонкой кишке этих мелких хищников. Зрелые яйца и членики, заполненные яйцами, выделяются во внешнюю среду с фекалиями животных. Человек заражается при охоте, обработке шкур убитых животных, уходе за собаками, сборе и употреблении дикорастущих ягод и трав. В желудочно-кишечном тракте человека пузыри альвеококка освобождаются от оболочки, а выделившиеся личинки внедряются в кровеносные сосуды и разносятся током крови. Большая часть личинок задерживается в печени. При этом первичное поражение других органов (легких, мозга и пр.) наблюдается крайне редко. Обычно поражается правая доля печени, где формируется узел диаметром от 0,5 до 30 см. Узлы бывают одиночными и множественными. Они могут прорастать в желчные протоки, диафрагму, почку. В пораженном органе развиваются дистрофические и атрофические изменения, фиброз (см.) стромы. Компенсация функции печени достигается за счет увеличения здоровых участков органа. Развивается механическая желтуха (см.), в поздних стадиях — билиарный цирроз (см.). В развитии заболевания большую роль играют помимо механических факторов и нарушения функций иммунной системы. Если происходит омертвение клеток паразитарного узла, в его центральных отделах формируются полости с мутным или гнойным содержимым.
Клиническая картина Альвеококкоз диагностируется преимущественно у лиц молодого и среднего возраста (30–50 лет). Довольно длительное время (доклиническая стадия) симптомы могут не проявляться. Это связывают с медленным ростом паразита, а также генетическими особенностями иммунитета коренного населения в очагах заболевания. В клинически выраженной стадии симптоматика малоспецифична и определяется объемом поражения, его локализацией и наличием осложнений. Выделяют раннюю неосложненную стадию, стадию осложнений и терминальную стадию заболевания. В ранней стадии наблюдаются периодические ноющие боли в печени, чувство тяжести в правом подреберье и в верхней части живота. При поверхностном расположении паразитарный узел прощупывается в виде плотного участка, печень на 2–3 см выступает из-под края правой реберной дуги. Общее состояние больного удовлетворительное, трудоспособность сохранена. В неосложненной стадии альвеококкоза болевой синдром медленно прогрессирует, присоединяются расстройства пищеварения. Печень значительно увеличена и имеет плотноэластическую консистенцию. При прощупывании могут определяться участки каменистой плотности (симптом Любимова). Нередко наблюдаются геморрагические проявления по типу капилляротоксикоза. В стадии осложнений чаще всего развивается механическая желтуха (см.), несколько реже (при прорастании узла в портальные сосуды или нижнюю полую вену) — портальная или кавальная гипертензия (см.). При образовании в узле полостей распада появляются ознобы, лихорадка, могут развиться абсцесс печени (см.), гнойный холангит (см.). При вскрытии полости могут образовываться бронхо-печеночные и плевро-печеночные свищи, развиваться перитонит (см.), плеврит (см.), перикардит (см.). В далеко зашедших случаях и при злокачественном течении в легких и головном мозге обнаруживаются опухолевые образования (метастазы), реже — в почках и костях. Больше половины больных страдают от поражения почек даже при отсутствии в них метастазов. Для них характерно развитие мочевого синдрома с протеинурией, гематурией, пиурией, цилиндрурией. Почки страдают от сдавления извне или за счет роста метастазов, что приводит к нарушению почечного кровотока и выведению мочи. При этом развиваются инфекции мочевыводящих путей. Присоединение иммунопатологических процессов характеризуется формированием хронического гломерулонефрита (см.), системного амилоидоза (см.) с формированием хронической почечной недостаточности. В терминальной стадии болезни развиваются необратимые обменные нарушения и кахексия (см.). Выделяют медленно прогрессирующую, активно прогрессирующую и злокачественную формы болезни. Более прогрессирующее течение заболевания наблюдается у приезжих в очагах заболевания, у лиц с иммунодефицитами (первичным и вторичным), в период беременности и при ее прерывании, при тяжелой сопутствующей патологии.
Диагностика При диагностике важную роль играет опрос больного о периоде его проживания на территориях очагов заболевания, наличие характерных симптомов, а также данные лабораторных и инструментальных исследований. Достаточно ранним признаком является диспротеинемия с гипергаммаглобулинемией, а также ускорение СОЭ. С течением времени присоединяется непостоянная эозинофилия (до 15 %), в развернутой клинической стадии — резкое повышение СОЭ. Увеличиваются показатели тимоловой пробы, С-реактивного белка, выражена диспротеинемия: гиперпротеинемия (до 100–110 г/л), гипоальбуминемия, гипергаммаглобулинемия до 35–60 %. Специфическими тестами являются реакция латекс-агглютинации, ИФА и внутрикожная проба Касони. Последняя используется осторожно, так как при повторном проведении возможен анафилактический шок. При обзорной рентгенограмме области печени просматривается обызвествление в зоне паразитарного узла в виде «известковых брызг». Ультразвуковые методы, компьютерная томография, ЯМР-томография позволяют оценить степень поражения органов. Состояние паренхимы оценивается с помощью радиоизотопных методов исследования. Лапароскопия может быть использована для прицельной биопсии узла альвеококка. Реже применяется ангиогепатография. Дифференциальный диагноз проводят с эхинококкозом (см.), поликистозом печени, новообразованиями, циррозом (см.), гемангиомой (см.).
Лечение Лечение альвеококкоза хирургическое, при его невозможности — симптоматическое. Радикальное удаление области паразитарного узла удается осуществить в редких случаях, так как орган бывает поражен в значительной степени. В таких случаях (при прорастании узлов в область ворот печени, нижнюю полую вену, соседние органы) проводят частичное удаление, а оставшиеся ткани гельминта подвергаются криодеструкции (разрушению при помощи низких температур) или обработке химическими противопаразитарными средствами. При далеко зашедшем процессе выполняют дренирование полости распада узла, желчеотводящие операции. Больные альвеококкозом наблюдаются пожизненно. Появление клинических признаков рецидива или нарастание количества серологических реакций является показанием для госпитализации в стационар. Больные неоперабельными формами заболевания нетрудоспособны и подлежат представлению на медико-социальную экспертизу. В целях профилактики следует тщательно соблюдать правила личной гигиены при уходе за животными, сборе ягод. Важно проводить регулярные профилактические осмотры лиц, наиболее подверженных заболеванию (охотники, пастухи, животноводы, люди, занимающиеся разделкой туш убитых животных).
АЛЬПОРТА СИНДРОМ
ОпределениеАльпорта синдром (нефрит наследственный) — наследственное заболевание, характеризующееся ранним развитием почечной недостаточности, невритом слухового нерва, снижением остроты зрения. Неполная форма характеризуется только развитием поражения почек.Этиология и патогенез Синдром Альпорта наследуется по ауто-сомно-доминантному типу, частично сцеплен с полом. Больные мужчины-гетерозиготы способны передавать дефектный ген только дочерям, больные женщины — большей части дочерей и сыновей. Предполагается, что поражение почек связано с наследственно обусловленным дефектом мочеобразующей системы почек или с врожденным дефектом в почечных ферментных системах с последующим развитием нефрита и снижением почечных функций. На ранних стадиях болезни в образцах почечной ткани отсутствуют изменения клубочков. В дальнейшем происходит параллельное повреждение почечных структур. При этом отложения иммунных комплексов не выявляются. Помимо поражения слухового нерва при синдроме Альпорта описаны поражения глаз (пигментный ретинит (см.), сферофакия и др.), аномалии развития костного скелета.
Клиническая картина Клиника обнаруживается на 1-м или (чаще) 3—5-м годах жизни ребенка. В ряде случаев отмечается, что начало почечных проявлений связано с инфекцией (фактор провокации). Однако, как правило, заболевание выявляется случайно. Течение наследственного нефрита может характеризоваться признаками гломерулонефрита (см.) гематурической формы, реже он протекает с нефротическим синдромом либо по пиелонефротическому типу. В начальной стадии функции почек сохранены и заболевание проявляется только гематурией с небольшой протеинурией, иногда с лейкоцитурией. Между приступами макрогематурии наблюдается микрогематурия, последняя может встречаться изолированно. При выраженном мочевом синдроме возможно развитие гипертензии (см.), иногда — нефротического синдрома, что свидетельствует о прогрессировании нефрита. У отдельных больных отмечается расширение чашечно-лоханочной системы. Иногда выявляется аминоацидурия. При синдроме Альпорта глухота имеет неврогенный характер. Чаще наблюдается у мальчиков и появляется в возрасте 8—10 лет. Иногда глухота является первым признаком заболевания и нарастает при его прогрессировании. У отдельных членов семей с синдромом Альпорта может встречаться глухота без поражения почек. Течение и исход заболевания зависят от пола больных. У мальчиков рано (с 10–15 лет) развиваются гипертензия и хроническая почечная недостаточность. Смерть наступает в возрасте 15–30 лет. У девочек заболевание протекает чаще скрыто в виде гематурического синдрома. Иногда это сочетается с нарушением слуха. Сопутствующие заболевания и переутомление могут быть причиной декомпенсации и прогрессирования болезни.
Диагностика В диагностике преобладают сведения семейного опроса: наличие прогрессирующего течения почечного заболевания у мужчин и более доброкачественное его течение у родственниц-женщин; наличие у членов семьи неврита слухового нерва, в основном у мужчин и некоторых женщин с заболеваниями почек. Клинико-лабораторные данные позволяют установить наличие мочевого синдрома, преимущественно гематурии, которая иногда бывает преходящей. Нефрит наследственного характера необходимо отличать от приобретенных форм гломерулонефрита (см.) и пиелонефрита (см.), для которых не характерны семейные формы заболевания, глухота и поражение органа зрения; от врожденных болезней почек: синдрома де Тони-Дебре-Фанкони (см.), поликистоза почек (см.), заканчивающихся ХПН; от доброкачественной семейной гематурии. Последняя клинически проявляется только микрогематурией и может рецидивировать или быть постоянной в течение многих лет. При этом почки функционируют нормально, изменения структуры ткани отсутствуют.
Лечение Лечение синдрома Альпорта проводится в соответствии с проявляющимися симптомами. При присоединении пиелонефрита применяют антибактериальные и другие препараты, при развитии ХПН используют перитонеальный диализ и гемодиализ, проводят трансплантацию почек.
АЛЬТЕРНИРУЮЩИЕ СИНДРОМЫ
ОпределениеАльтернирующие синдромы (лат. alterno — «чередоваться»; синонимы: альтернирующие параличи, перекрестные параличи) — синдромы, которые сочетают в себе поражение черепно-мозговых нервов на стороне очага с проводниковыми расстройствами двигательной и чувствительной функций на противоположной стороне.
Этиология и патогенез Альтернирующие синдромы возникают при поражении одной половины ствола головного мозга, спинного мозга (см. Броун-Секара синдром), а также при одностороннем комбинированном поражении структур головного мозга и органов чувств. Различные альтернирующие синдромы могут быть вызваны нарушениями кровообращения в системе спинного мозга и ствола головного мозга опухолевыми процессами с локализацией в стволе мозга, черепно-мозговыми травмами. Стволовые симптомокомплексы характеризуются поражением на стороне очага одного или нескольких черепно-мозговых нервов по периферическому типу (вследствие повреждения их ядер или корешков), а также проводниковыми нарушениями на противоположной стороне (гемипарезы, гемиплегии (см.), гемианестезии, гемиатаксии и др.) благодаря повреждениям волокон пирамидного пути, медиальной петли, мозжечковых связей и пр. Выделяют бульбарные, понтинные, педункулярные и смешанные альтернирующие синдромы в зависимости от места расположения очага (что важно для уточнения локализации повреждения).
Клиническая картина Бульбарные альтернирующие синдромы Синдром Джексона (медиальный медуллярный синдром, синдром Дежерина) возникает при поражении ядра подъязычного нерва и волокон пирамидного пути. Характеризуется паралитическим поражением половины языка со стороны очага и центральной гемиплегией (см.) или гемипарезом конечностей. Синдром Авеллиса (палатофарингеальный паралич) развивается при поражении ядер языкоглоточного и блуждающего нервов и пирамидного пути. Характеризуется со стороны очага параличом мягкого нёба и глотки, с противоположной стороны — гемипарезом и гемигипестезией. Синдром Шмидта характеризуется сочетанным поражением двигательных ядер или волокон языкоглоточного, блуждающего, добавочного нервов и пирамидного пути. Проявляется со стороны очага параличом мягкого нёба, глотки, голосовой связки, половины языка, грудино-ключично-сосцевидной и верхней части трапециевидной мышц, с противоположной стороны — гемипарезом и гемигипестезией. Синдром Валленберга-Захарченко (дорсолатеральный медуллярный синдром) возникает при поражении двигательных ядер блуждающего, тройничного и языкоглоточного нервов, симпатических волокон, нижней мозжечковой ножки, спиноталамического тракта, иногда — пирамидного пути. На стороне очага отмечаются паралич мягкого неба, глотки, голосовой связки, синдром Горнера, мозжечковая атаксия (см.), нистагм, утрата болевой и температурной чувствительности половины лица; с противоположной стороны — выпадение болевой и температурной чувствительности на туловище и конечностях. Синдром Бабинского-Нажотта возникает при сочетанном поражении нижней мозжечковой ножки, оливомозжечкового пути, симпатических волокон, пирамидного, спиноталамического трактов и медиальной петли. Характеризуется со стороны очага развитием мозжечковых нарушений, синдромом Горнера, с противоположной стороны — гемипарезом, выпадением чувствительности.
Понтинные альтернирующие синдромы Синдром Мийяра-Гублера (медиальный мостовой синдром) возникает при поражении ядра или корешка лицевого нерва и пирамидного пути. Проявляется со стороны очага параличом лицевого нерва, с противоположной стороны — гемипарезом. Синдром Фовилля (латеральный мостовой синдром) наблюдается при сочетанном поражении ядер (корешков) отводящего и лицевого нервов, медиальной петли, пирамидного пути. Характеризуется со стороны очага параличом отводящего нерва и параличом взора в сторону очага, иногда параличом лицевого нерва; с противоположной стороны — гемипарезом и гемигипестезией. Синдром Раймона-Сестана отмечается при поражении заднего продольного пучка, средней мозжечковой ножки, медиальной петли, пирамидного пути. Характеризуется параличом взора в сторону очага, с противоположной стороны — гемигипестезией, иногда гемипарезом. Синдром Бриссо возникает при раздражении ядра лицевого нерва и поражении пирамидного пути. Характеризуется лицевым гемиспазмом со стороны очага и гемипарезом с противоположной стороны.
Педункулярные альтернирующие синдромы Синдром Вебера (вентральный мезэнцефальный синдром) наблюдается при поражении ядра (корешка) глазодвигательного нерва и волокон пирамидного пути. На стороне поражения отмечаются птоз, мидриаз, расходящееся косоглазие, на противоположной стороне — гемипарез. Синдром Клода (дорсальный мезэнцефальный синдром, нижний синдром красного ядра) возникает при поражении ядра глазодвигательного нерва, верхней мозжечковой ножки, красного ядра. Характеризуется со стороны поражения птозом, расходящимся косоглазием, мидриазом, с противоположной стороны — гемипарезом, гемиатаксией или гемиасинергией. Синдром Бенедикта (верхний синдром красного ядра) отмечается при поражении ядер глазодвигательного нерва, красного ядра, красноядерно-зубчатых волокон, иногда медиальной петли. На стороне очага возникают птоз, расходящееся косоглазие, мидриаз, на противоположной стороне — гемиатаксия, дрожание века, гемипарез (без симптома Бабинского). Синдром Нотнагеля возникает при сочетанном поражении ядер глазодвигательных нервов, верхней мозжечковой ножки, латеральной петли, красного ядра, пирамидного пути. На стороне очага отмечаются птоз, расходящееся косоглазие, мидриаз, с противоположной стороны — хореатетоидный гиперкинез (см.), гемиплегия (см.), паралич мышц лица и языка.
Диагностика Диагностическое значение альтернирующих синдромов заключается в возможности локализовать очаг поражения и определить его границы. Например, синдром Джексона возникает при тромбозе передней спинномозговой артерии или ее ветвей, синдромы Авеллиса и Шмидта развиваются при нарушении кровообращения в ветвях артерии, питающей продолговатый мозг, а синдромы Валленберга-Захарченко и Бабинского-Нажотта — в бассейне нижней задней мозжечковой или позвоночной артерии. Понтинные синдромы Фовилля, Бриссо, Раймона-Сестана возникают при поражении ветвей базилярной артерии, педункулярные синдромы — глубоких ветвей задней мозговой артерии, синдром Клода — передней и задней артериол красного ядра, синдром Бенедикта — межножковых или центральных артерий и пр. Изменение симптомов характеризует причину патологического процесса. Ишемическое поражение ствола мозга, например, в результате тромбоза ветвей позвоночных, базилярной или задней мозговой артерии приводит к постепенному развитию альтернирующих синдромов, даже не сопровождающихся утратой сознания. Границы очага при этом соответствуют зоне нарушения кровоснабжения, гемиплегия или гемипарез имеют спастический характер. Кровоизлияния в ствол мозга могут приводить к возникновению атипичных альтернирующих синдромов. Это происходит в связи с тем, что кроме участка поврежденного сосудистого бассейна в процесс вовлекаются и окружающие ткани мозга за счет развития периферического отека. Острое развитие очага в понтинной зоне сопровождается нарушениями дыхания, сердечной деятельности, рвотой. В остром периоде определяется снижение мышечного тонуса на стороне гемиплегии.
АЛЬЦГЕЙМЕРА БОЛЕЗНЬ
ОпределениеБолезнь Альцгеймера — разновидность старческого слабоумия, проявляющаяся полным слабоумием с прогрессирующим распадом памяти и корковыми очаговыми расстройствами (см. Деменция). Относится к группе пресенильных деменций, в 3–8 раз чаще встречается у женщин.
Этиология и патогенез Этиология заболевания изучена не до конца. Считают, что в его основе лежит распространенная атрофия коры головного мозга. 10 % всех больных страдают семейной формой болезни Альцгеймера, которую связывают с генами, локализованными в 4-й и (реже) в 21-й хромосоме. При этом отмечаются склерозирующие отложения в нейронах и образование старческих бляшек, наиболее часто — в гиппокампе и ассоциативной зоне коры головного мозга. Сходные невропатологические нарушения имеются и при болезни Дауна (см.). Старческая бляшка имеет внеклеточное амилоидное ядро, образованное из белка — предшественника амилоида (БПА), который закодирован геном 21-й хромосомы. БПА является белком клеточной мембраны и при болезни Альцгеймера синтезируется в избытке. Это сопровождается его патологическим отложением. Изменения БПА служат причиной раннего начала семейных форм заболевания. У женщин также отмечена связь развития болезни Альцгеймера с развитием постклимактерического гормонального дисбаланса. Об этом свидетельствуют успехи рано начатой заместительной терапии женскими половыми гормонами.
Клиническая картина Начало заболевания приходится на возраст 54–56 лет, реже — ранее. Иногда первые признаки отмечаются в возрасте 60–70 лет. Начинают резко прогрессировать расстройства памяти — сначала на текущие события, затем общие нарушения. На этом фоне выступают явления апатии, чувственной тупости, ослабления внимания. В дальнейшем нарушаются другие мыслительные функции с проявлениями афазии (см.), апраксии (см.) или трудностью оценки окружающей действительности. Личность пациента сохранена, и поверхностное обследование может не выявить признаков развития слабоумия. Симптомы заболевания обычно первыми замечают члены семьи. Больной часто не подозревает о серьезности степени потери памяти. Заболевание быстро прогрессирует. Его особенностью является смутное осознание больными своей болезни даже при развившемся полном слабоумии. Вскоре возникают нарушения координации движений и параличи (см.) с ограниченной подвижностью, эпилептические припадки. Слабоумие достигает высокой степени очень быстро, в исходной стадии появляются насильственный смех и плач, патологические рефлексы, больные лежат в позе эмбриона, отмечается прогрессирующая кахексия (см.). Чем позже началось заболевание, тем более длительно оно протекает. Смерть наступает через 8—10 лет при полном распаде психической деятельности.
Диагностика Основанием для постановки диагноза являются опрос пациента и клиника заболевания. Его следует дифференцировать с болезнью Пика, а также с простой формой старческого слабоумия.
Лечение Появление ранних признаков заболевания у женщин в постклимактерическом периоде служит показанием для назначения заместительной терапии женскими половыми гормонами. Наиболее эффективна она при назначении в первые 5 лет после менопаузы. Оптимальным способом профилактики заболевания является назначение заместительной терапии в первые 2 года после менопаузы. Оптимальных средств лечения и профилактики заболевания у мужчин пока не разработано. Доказано, что защитным эффектом обладает аполипопротеид Е2. Повышенный риск развития болезни Альцгеймера наличествует у пациентов в старческом возрасте, при отягощенной наследственности.
АМЕБИАЗ
ОпределениеАмебиаз — заболевание, вызванное простейшим организмом. Оно характеризуется язвенным поражением толстого кишечника, возможностью образования абсцессов (см.) в различных органах и склонностью к затяжному и хроническому течению.
Этиология Возбудителем болезни является Entamoeba histolytica. Различают две формы дизентерийных амеб — вегетативную и инцистированную, которые могут переходить одна в другую на протяжении жизненного цикла. Вегетативная форма подразделяется на просветную, обитающую в верхних отделах толстого кишечника и являющуюся основной стадией жизненного цикла дизентерийной амебы, и тканевую, которая паразитирует в слизистом и подслизистом слоях стенки толстой кишки больных амебиазом, вызывая глубокие язвенные поражения. У больных острым амебиазом слизистокровянистые испражнения содержат тканевые и просветные формы. При затухании процесса, а также у здоровых паразитоносителей в кале обнаруживаются просветные формы, в которые превращаются тканевые формы, и цисты, в которые в свою очередь переходят просветные формы. Средний размер тканевой формы амебы — 23–24 мкм. Она содержит поглощенные эритроциты, которыми питается в стенке толстой кишки. Размеры просветной формы амебы, обитающей преимущественно в содержимом слепой кишки у больных амебиазом и паразитоносителей, составляют от 12 до 25 мкм. Амеба обладает округлым ядром с равномерно распределенными в нем глыбками хроматина. Находясь в просветной форме, она размножается путем простого деления. Просветная форма способна совершать поступательные движения, используя для этого псевдоподии (ложноножки). Она способна вызывать растворение тканей в связи с образованием ферментов. Внедряясь в слизистые оболочки и подслизистый слой стенки толстой кишки, она переходит в тканевую форму и может увеличиваться до 30–50 мкм в диаметре. Вегетативные формы амеб неустойчивы в условиях окружающей среды и гибнут в обычных фекалиях через 20–30 мин. Споры амеб образуются при неблагоприятных условиях (изменение рН фекалий и развитие гнилостных процессов). Диаметр спор колеблется в пределах от 8 до 16 мкм. Они имеют правильную округлую форму и окружены бесцветной оболочкой. Споры амеб отличаются высокой устойчивостью к факторам внешней среды. Во влажных фекалиях при температуре 17–20 °C и в воде они не утрачивают жизнеспособности около 1 месяца, а в почве сохраняются до 8 дней. В охлажденных пищевых продуктах, на фруктах, овощах, предметах домашнего обихода, игрушках споры способны сохраняться несколько дней. Воздействие низких температур (-20 °C) споры переносят в течение нескольких месяцев. Высушивание и кипячение губят споры почти мгновенно. Споры устойчивы к 5 %-ному раствору формалина и 1 %-ному раствору хлорамина, а в растворе сулемы (1:1000) они погибают в течение 4 ч. Особую опасность в распространении заболевания (типичного кишечного антропоноза (см.)) представляют споровыделители, среди которых на первом месте находятся паразитоносители, затем выздоравливающие с острым кишечным амебиазом и больные хроническим рецидивирующим амебиазом в стадии улучшения состояния. Механизм заражения — фекально-оральный. Возможны различные пути распространения — пищевой, водный, контактно-бытовой. Разносчиками спор являются мухи и тараканы. Заболеванию подвержены все возрастные группы населения обоего пола, но болеют преимущественно мужчины в возрасте 20–58 лет. Повышенная восприимчивость отмечается у беременных и женщин в послеродовом периоде. Заболевание регистрируется круглогодично, но его вспышки отмечаются преимущественно в жаркие месяцы. Амебиаз встречается во всех странах мира, но пик заболеваемости приходится на районы тропического и субтропического климата. В виде единичных случаев амебиаз регистрируется в Средней Азии, Закавказье и Нижнем Поволжье. Единичные случаи можно выявить и в средней полосе, преимущественно у лиц, приехавших из эндемичных очагов. Носительство дизентерийной амебы повсеместно значительно превышает заболеваемость амебиазом. Соотношение между заболеваемостью и носительством в очаговых районах составляет 1:7, в остальных — 1:23.
Патогенез Зрелые споры дизентерийной амебы минуют желудочный барьер и в нижнем отделе тонкого кишечника превращаются в вегетативные просветные формы. Последние обильно размножаются в слепой кишке, где условия для существования более благоприятны. Большинство инфицированных становятся носителями просветной амебы и споровыделителями, так как возбудитель способен длительно обитать в кишечнике, не вызывая заболевания. При неблагоприятных условиях (снижение сопротивляемости организма, дефицит пищевого белка, дисбактериоз (см.) и др.) амебы внедряются в стенку кишки, где размножаются и вызывают клинические формы заболевания. В механизме развития амебиаза большое значение имеет выраженность способности заражения возбудителя. Существенное значение принадлежит также микрофлоре кишечника. После внедрения амеб в стенку кишки там происходит разрушение клеток и омертвение тканей с образованием язв. Патологический процесс при кишечном амебиазе в основном локализуется в слепой и восходящей ободочной кишке, реже — в прямой кишке и других отделах кишечника. В стенке кишки образуются глубокие язвы с подрытыми краями, дно покрыто гноем и тканевым детритом, содержащим амебы, по периферии язвы отмечаются гиперемия и отек слизистой. Поскольку целостность кишечной стенки нарушена, появляются кишечные кровотечения. Распространение с током крови амеб вызывает развитие внекишечного амебиаза с формированием абсцессов в печени, легких, головном мозге. Иммунитет после перенесенного заболевания кратковременный и малонапряженный.
Клиническая картина Кишечный амебиаз, или амебная дизентерия, может протекать в тяжелой, среднетяжелой и легкой формах. Длительность инкубационного периода составляет от 1–2 недель до 3 месяцев и более. При остром кишечном амебиазе самочувствие больных длительное время остается удовлетворительным, интоксикация не выражена, температура нормальная или слегка повышена. В клинике кишечного амебиаза преобладают расстройства стула. Вначале он обильный, калового характера, с примесью слизи и частотой до 4–6 раз в сутки, имеет резкий запах. Затем количество дефекаций нарастает до 10–20 раз в сутки, стул теряет каловый характер, представляет собой стекловидную слизь, позже примешивается кровь («малиновое желе»). В острый период возможны постоянные или схваткообразные боли в животе, усиливающиеся при дефекации. При поражении прямой кишки отмечаются мучительные тенезмы. Живот мягкий или слегка вздут, болезненный при прощупывании по ходу толстого кишечника. Острый характер симптоматики кишечного амебиаза сохраняется обычно не более 4–6 недель. Затем даже без специфического лечения происходит улучшение самочувствия и прекращение воспалительного синдрома. Ремиссия (улучшение состояния) может продолжаться от нескольких недель до нескольких месяцев, но затем наступает возврат симптомов амебиаза. Заболевание принимает хронический характер и без специфического лечения продолжается многие годы.
Анатомические изменения нижнего отдела толстой кишки при амебиазе: 1 — некротические очаги в складках слизистой оболочки, местами; 2 — с глубоким распадом
У детей младшего возраста острые формы амебиаза протекают на фоне тяжелой общей симптоматики: лихорадки, рвоты, поноса, дегидратации. У беременных и кормящих грудью женщин возможно молниеносное течение амебиаза с выраженным токсикозом, парезом (см.) кишечника, частой перфорацией (см.) язв и перитонитом (см.). Состояние быстро усугубляется, без экстренной терапии наступает смерть. Для хронического течения кишечного амебиаза характерно развитие астенического синдрома, гипопротеинемии, авитаминоза, кахексии (см.). При обострении частота дефекаций достигает 20–30 и более раз в сутки. Болевой синдром (см.), напротив, не выражен или отсутствует совсем. Выделяют рецидивирующее и монотонное течение хронического кишечного амебиаза. При рецидивирующей форме заболевания периоды обострения чередуются с периодами ремиссии. При монотонном течении периоды ремиссии отсутствуют, клинические проявления периодически усиливаются или ослабевают. Осложнениями амебиаза являются: со стороны кишечника — перфорация кишечной стенки с развитием гнойного перитонита (см.), кишечные кровотечения (см.), опухолевидный воспалительный инфильтрат в толще кишечной стенки (амебома), амебный аппендицит (см.), сужение и непроходимость кишечника (см.), выпадение прямой кишки (см.); внекишечные — абсцессы (см.) печени, легких, головного мозга, амебные язвы на коже. Последние принято обозначать как внекишечные формы амебиаза. Наиболее часто встречается амебиаз печени, который может протекать остро и хронически. Печень увеличена, нередко отмечаются боли в правом подреберье, лихорадка различных типов. Выражены явления интоксикации. Характерен вид больных: исхудание, заостренные черты лица, кожные покровы приобретают землистый оттенок. Иногда развивается желтуха (см.). Хроническое течение амебного абсцесса печени характеризуется лихорадкой неправильного типа, нарастанием слабости, истощения, постоянными болями в правом подреберье. Печень увеличена, болезненна. При локализации абсцесса (см.) на передней поверхности при прощупывании определяется опухолевое образование. Абсцессы бывают одиночные или множественные, чаще локализуются в правой доле печени. Течение может осложниться перигепатитом, поддиафрагмальным абсцессом, а при его прорыве — гнойным перитонитом (см.), плевритом (см.), перикардитом (см.). Смертельный исход при амебных абсцессах печени без специфического лечения достигает 25 % и выше. Амебиаз легких развивается при заносе амеб с кровью в легкие или при прорыве абсцесса печени в плевральную полость. Клинически он протекает как специфическая плевропневмония или абсцесс легкого (см.). Амебы из кишечника могут также с кровью проникать в головной мозг, где возможно возникновение амебных абсцессов с развитием очаговых и общемозговых симптомов. Описаны редко встречающиеся амебные абсцессы селезенки, почек, женских половых органов с соответствующей симптоматикой. Кожные поражения при амебиазе носят вторичный характер и отмечаются преимущественно на коже в области ануса, промежности и ягодиц. Они имеют вид глубоких малоболезненных язв с почерневшими краями и неприятным запахом. В соскобе из язв обнаруживаются вегетативные формы амеб. Прогноз заболевания при отсутствии специфической терапии серьезный. Если своевременно не распознать внекишечный амебиаз, исход болезни неблагоприятный. При раннем распознавании и правильной терапии амебиаза прогноз благоприятный.
Диагностика Распознавание болезни основывается на эпидемиологических и клинико-лабораторных данных с использованием ректороманоскопии. При острой форме амебиаза при исследовании крови наблюдаются анемия, эозинофилия, моноцитоз, лимфоцитоз, увеличение СОЭ. При эндоскопическом исследовании толстой кишки обнаруживаются язвы величиной от 2 до 10–20 мм в диаметре, чаще всего — на вершинах складок. Язвы с подрытыми краями, дно может достигать подслизистой основы, покрыто гноем и скоплением омертвевших клеток. Слизистая, свободная от язв, выглядит малоизмененной, практически нормальной. Однако иногда могут отмечаться небольшая отечность и гиперемия. Ирригоскопия выявляет неравномерное заполнение отделов толстой кишки, наличие спазма и быстрого опорожнения кишечника. При хроническом кишечном амебиазе эндоскопически помимо язв можно обнаружить кисты, полипы, амебомы. Разграничить их при осмотре затруднительно. При рентгенологическом обследовании выявляются те же изменения, что и в острой фазе болезни, а также отсутствие складок стенки кишки, иногда — рубцовые изменения с сужением кишечника. Амебомы дают дефекты наполнения и имитируют опухолевый процесс. При поражении печени рентгенологическое обследование выявляет высокое стояние диафрагмы с уменьшением подвижности правого купола. При поддиафрагмальной локализации абсцесса может определяться выпот в правом плевральном синусе. В формуле крови при амебном абсцессе печени находят нейтрофильный лейкоцитоз, СОЭ повышена. При длительном течении развивается гипохромная анемия. С диагностической целью прибегают к радиоизотопному сканированию, УЗИ, лапароскопии, лапаротомии с пункцией абсцесса. Диагноз подтверждается, если при микроскопии обнаруживаются тканевые формы амеб в патологическом материале из дна язв, полости абсцессов, обнаружение большой вегетативной формы амебы в испражнениях. Выявление просветных форм и спор амеб в кале недостаточно для окончательного диагноза. Исследуют свежевыделенный кал, т. е. не позднее 10–15 мин после дефекации. Основной метод — микроскопия препаратов, окрашенных раствором Люголя и железным гематоксилином по Гейденгайну, которые могут храниться неограниченное время. Применяется также выращивание амеб на искусственных питательных средах с бактериями (среда Робинсона). Для распознавания всех форм амебиаза, особенно внекишечных и амебом, используются серологические реакции: РНГА, ИФМ, ВИЭФ, меньшей чувствительностью обладают РНИФ и РСК. Дифференциальный диагноз кишечного амебиаза проводится с другими паразитарными инфекциями: балантидиазом (см.), бактериальной дизентерией (см.), неспецифическим язвенным колитом (см.), полипозом (см.), раком (см.) кишечника, а при амебном абсцессе печени — с гнойными ангиохолитами, раком желчных путей, эхинококкозом (см.), иногда — с малярией (см.), висцеральным лейшманиозом (см.). При абсцессах в легких следует иметь в виду туберкулез (см.) и абсцедирующие пневмонии (см.) с различным происхождением.
Лечение Лечение осуществляется в условиях стационара. До нормализации стула показана диета № 4. По показаниям используют регидратирующую и дезинтоксикационную терапию, переливание компонентов крови, витамины. Для специфической терапии амебиаза применяются 3 группы препаратов. Группа I — препараты прямого контактного действия, к которым относятся хиниофон (ятрен) и дийодохин, действующие на просветные формы возбудителей. Применяются для лечения носителей амеб и терапии хронического кишечного амебиаза при стабильном улучшении состояния. Ятрен назначают по 0,5 г 3 раза в день в течение 10 дней. Параллельно можно использовать клизмы с ятреном (по 1–2 г препарата на стакан теплой воды). Дийодохин также применяется в течение 10 дней по 0,25—0,3 г 3–4 раза в день. Группа II — препараты, действующие на амеб в слизистой оболочке (тканевые амебоциды). Они эффективны против тканевых и просветных форм амеб, используются в терапии острого кишечного и иногда внекишечного амебиаза: эметина гидрохлорид в суточной дозе 1 мг/кг (максимальная суточная доза — 60 мг) внутримышечно или подкожно; дигидроэметин внутримышечно, подкожно или внутрь по 1,5 мг/кг в сутки (максимальная суточная доза — 90 мг) в течение 5 дней (при амебном абсцессе печени — 10 дней); амбильгар внутрь по 25 мг/кг в сутки (но не более 1,5 г в сутки) в течение 7—10 дней; делагил применяется для лечения больных с амебными абсцессами печени трехнедельным курсом: в первые два дня лечения по 1,0 г, а в последующие 19 дней — по 0,5 г в день. Группа III — препараты универсального действия, применяющиеся при всех формах амебиаза: метронидазол по 0,4–0,8 г 3 раза в день в течение 5–8 дней; тинидазол (фазижин) по 2 г в сутки в течение 3 дней; фурамид по 2 таблетки 3 раза в день в течение 5 дней (он также используется и для профилактики амебиаза в очагах); тиберал по 2 таблетки в течение 2 дней. Антибиотики широкого спектра действия используют как вспомогательные средства, чтобы устранить микробы из кишечника. Абсцессы печени, легких, мозга и других органов лечат хирургическим путем в сочетании с противоамебными препаратами. При амебиазе кожи используют мазь с ятреном. Необходима терапия в широком объеме в соответствии с механизмом развития заболевания и проявляющимися симптомами.
Профилактика Меры профилактики амебиаза включают выявление и оздоровление источников заражения и воздействие на пути его распространения. Мероприятия, направленные на источник инфекции, включают выявление и лечение споровыделителейи носителей амеб, а также раннее выявление и лечение больных с острыми формами амебиаза. Выздоравливающие носители не допускаются к работе в системе общественного питания. Важное значение принадлежит санитарной охране внешней среды от фекальных загрязнений, строгому надзору за состоянием канализации, туалетов, выгребных ям, источников водоснабжения. Выздоравливающие подлежат наблюдению в течение 1 года при систематическом обследовании их в кабинетах инфекционных заболеваний. В профилактике амебиаза имеет значение широкая пропаганда гигиенических знаний среди населения.
АМИЛОИДОЗ
ОпределениеАмилоидоз — разнородные по происхождению нарушения белкового обмена, при которых внеклеточно в тканях разных органов откладывается гликопротеид амилоид, специфический белково-сахаридный комплекс. Различают системный и локальный амилоидоз. При последнем отложения амилоида локализуются только в определенном органе.
Этиология и патогенез Природа и механизмы развития амилоидоза до конца не ясны. Считают, что в основе развития заболевания лежит продукция белка — предшественника амилоида. Это происходит под влиянием специфического амилоидвысвобождающего фактора, выработка которого осуществляется клетками крови вследствие генетического дефекта или под воздействием провоцирующих агентов. Накопление в крови белка-предшественника совместно с нарушениями его катаболизма и (или) рассасывания приводит к выработке амилоидного белка, из которого на 96–98 % состоит амилоид. По распространению различают: — локальный амилоидоз; — системный амилоидоз (поражает большинство органов и тканей). Из-за недостатка знаний о факторах, влияющих на развитие системного амилоидоза, и механизма его развития заболевание принято разделять на генетический (наследственный), первичный, вторичный и старческий. Генетический амилоидоз развивается в результате наследственных дефектов ферментных систем, участвующих в синтезе белка. Он встречается в нескольких формах (семейные, нейропатические и пр.), среди которых на территории стран СНГ наибольшее значение имеет амилоидоз при периодической болезни. Первичный амилоидоз встречается единично, причина его не установлена. Предшественник амилоида и амилоидные фибриллы являются производными легких цепей иммуноглобулинов. Вторичный амилоидоз возникает на фоне выраженных нарушений белкового обмена, чаще — в результате хронических инфекций: туберкулез (см.), сифилис (см.), малярия (см.), длительные нагноительные процессы в легких, остеомиелит (см.). Реже наблюдается развитие амилоидоза при ревматоидном полиартрите, лимфогранулематозе (см.), актиномикозе (см.), миеломной болезни (см.). При вторичном амилоидозе амилоидный белок представлен аномальным протеином, амилоидвысвобождающий фактор — интерлейкин-1. Особое место занимает так называемый старческий амилоидоз, который характеризуется поражением сердца, головного мозга и поджелудочной железы. Большинство локальных форм амилоидоза не имеют установленного причинного фактора и обозначаются как идиопатический амилоидоз. Первичный амилоидоз характеризуется отложением амилоида вокруг коллагеновых волокон, вторичный — околососудистой локализацией. Вследствие этого первичный амилоидоз чаще поражает пищеварительный тракт, миндалины, кожу, поперечно-полосатую мускулатуру, сердце, нервы и крупные сосуды, а вторичный — внутренние органы, а в них прежде всего мелкие сосуды. При этом амилоидная субстанция сначала откладывается в стенке, а затем распространяется на периферию сосуда, переходя в дальнейшем на соседнюю соединительную ткань. По частоте отложения амилоида органы и системы можно расположить в следующем порядке: селезенка, почки, надпочечники, печень, желудочно-кишечный тракт, лимфатические узлы, поджелудочная железа, предстательная железа, сердце, головной мозг, кожа и пр.
Клиническая картина Клинические симптомы амилоидоза зависят от преимущественной локализации амилоидных отложений и степени нарушения функции пораженного органа. Амилоидоз сердца чаще бывает первичным. Он характеризуется симптомами прогрессирующей сердечной недостаточности, параллельно с которыми (или чуть раньше) наблюдаются различные нарушения проводимости и ритма сердца. Амилоидоз желудочно-кишечного тракта обычно проявляется диарейным синдромом, реже развивается синдром мальабсорбции. При поражении пищевода характерна дисфагия (см.). В целом нарушения всасывания приводят к развитию полигиповитаминоза и похудения вплоть до кахексии (см.). Нередко выявляется увеличение размеров языка, что приводит к мысли о первичном амилоидозе. Типично увеличение размеров печени и селезенки, не сопровождающееся у трети больных нарушениями их функций. Изолированный амилоидоз печени наблюдается крайне редко; обычно встречаются сочетанные поражения, особенно при вторичном амилоидозе. В клинике преобладает увеличение печени, которое, впрочем, может развиться на поздних стадиях заболевания. Печень при прощупывании плотная, малоболезненная. Желтуха (см.) наблюдается редко и носит неинтенсивный характер. Возможна внутрипеченочная обструктивная желтуха на фоне первичного амилоидоза печени. В отдельных случаях может развиться геморрагический синдром. Амилоидоз почек — поражение при вторичном амилоидозе, имеющее наиболее неблагоприятный прогноз. Клинически он подразделяется на 3 стадии: протеинурическую, нефротическую и азотемическую. Клиническая симптоматика протеинурической стадии вторичного амилоидоза малоспецифична и во многом зависит от основного заболевания: туберкулеза (см.), сифилиса (см.), бронхоэктатической болезни (см.) и т. д., а также от отложения амилоида в других органах. Протеинурическая стадия может продолжаться от 6 месяцев до 5 лет. Она имеет более длительное течение, если основной процесс имеет гнойный характер, а при туберкулезе, наоборот, укорачивается. Изменения выявляются только при тщательном исследовании мочевого осадка. В нефротической стадии симптомы основного заболевания отходят на второй план. Характерна триада симптомов — протеинурия, отеки, гипо- и диспротеинемия, гиперлипидемия. Развиваются олигурия (см.) и никтурия. Распространены отеки. Артериальное давление снижено, что обусловлено поражением надпочечников. Очевидно, в связи с этим снижается фильтрационная функция почек. Вследствие присоединения липоидного нефроза повышается реабсорбционная функция. Белково-углеводная функция печени нарушена. Развиваются желудочно-кишечные нарушения. Селезенка плотная. Азотемическая стадия вторичного амилоидоза почек характеризуется развитием хронической почечной недостаточности в результате сморщивания клубочков (амилоидно-сморщенная почка). Толчком к развитию уремии (см.) могут явиться перекрестные заболевания, травмы, тромбоз почечных сосудов и др. Снижаются мочеобразовательная, мочевыделительная функции почек. Наблюдаются полиурия, гипоизостенурия. Остаточный азот не превышает 100 мг/%. Артериальное давление в пределах нормы или незначительно повышено. Отеки остаются только на ногах и лодыжках. Уровень холестерина снижается до нормы. Усиливается анемия (см.). В этой стадии болезни может наступить смерть больного вследствие азотемической уремии (см.) или других осложнений (гнойно-септический процесс, пневмония (см.), гнойный перитонит (см.), тромбоз почечных вен, рожистое воспаление, абсцесс легкого (см.) и т. д.). Амилоидоз половых органов бывает как первичным, так и вторичным. Первичный амилоидоз чаще характеризуется нарушенной функцией половых желез: импотенцией (см.) у мужчин и нарушениями менструального цикла у женщин. Симптомы возникают на 2—5-м году болезни в возрасте 20–45 лет. Продукция половых гормонов и образование сперматозоидов не нарушаются. Значительно реже выявляются поражения мочевого пузыря, матки, предстательной железы. При этом отмечаются кровотечения (маточные, макрогематурия), олигоспермия, затрудненное мочеиспускание. Симптомы амилоидоза матки и мочевого пузыря сходны с симптомами при опухолевом поражении этих органов. Амилоидоз кожи встречается при системном амилоидозе. При этом на фоне бледной («фарфоровой») кожи (чаще лица) отмечаются желтоватые узелки или бляшки (обычно на коже конечностей), лихенизация (см.), реже — узлы и бородавчатые разрастания в районах кожных складок, возможны мелкие кровоизлияния. Первичный локализованный амилоидоз кожи характеризуется наличием множественных мелких зудящих узелков на разгибательных поверхностях конечностей с лихенизацией кожи в области расчесов (амилоидный лихен) или округлыми розовато-коричневыми пятнами с непостоянным зудом, реже — опухолевидными образованиями в коже (на лице, груди, в области гениталий). Собственно кожа истончается, легко собирается в складки над этими образованиями. Встречается также вторичный локализованный амилоидоз кожи на фоне предшествующих дерматозов. Генетический (наследственный, семейный) амилоидоз наиболее распространен в странах Средиземноморского бассейна. У нас в стране наблюдаются единичные случаи заболевания. Генетический амилоидоз начинается в первые два-три десятилетия жизни больного. В клинической картине выделяют 3 основных синдрома: нефропатический, протекающий с поражением почек; нейропатический, характеризующийся преимущественным поражением нервной системы; кардиопатический, проявляющийся изменениями со стороны сердца. Клиническая картина генетического амилоидоза характеризуется лихорадкой, отеками, протеинурией, анемией (см.), суставными и кожными изменениями, миалгиями, поражением желудочно-кишечного тракта (боли, расстройства пищеварения). Мочевой синдром может предшествовать перечисленным проявлениям заболевания или, наоборот, появляться значительно позже. У больных выявляются нарушения белкового состава крови, ускорение СОЭ. Кровяное давление обычно нормальное и нередко не повышается даже в стадии хронической почечной недостаточности. Изменения глазного дна отсутствуют или выражены слабо. Отмечается относительно раннее снижение почечного кровотока и фильтрации. У многих больных отмечается увеличение печени и селезенки за счет отложения амилоидного вещества в этих органах. Функции печени нарушены. Старческий амилоидоз характеризуется развитием в преклонном возрасте симптомов сахарного диабета (см.) на фоне диабета. Это сочетается с быстро прогрессирующим атеросклерозом. При этом в бляшках на стенках сосуда при исследовании выявляется амилоид. Прогноз зависит от локализации и выраженности амилоидоза, а при вторичной форме — и от течения основного заболевания. Трудоспособность больных с амилоидозом почек сохраняется только на протеинурической стадии. Затем они нуждаются в медикосоциальной экспертизе и установлении группы инвалидности. Хроническая почечная недостаточность при амилоидозе быстро прогрессирует и приводит к смерти больного. То же относится и к амилоидозу желудочно-кишечного тракта с синдромом мальабсорбции.
Диагностика Диагностика первичного амилоидоза сложна и требует использования всех возможных методов. Вторичный амилоидоз органов распознается несколько легче, поскольку известно заболевание, способное привести к его развитию. Специфических лабораторных изменений при амилоидозе нет. Однако для больных характерно наличие значительно повышенной СОЭ (50–70 мм/ч) и анемии (в ряде случаев отмечаются тромбоцитоз, гиперфибриногенемия). Применяют также специальные пробы на амилоид (с конго-рот, метиленовой синью, которые в норме изменяют окраску мочи, тогда как у больных они фиксируются амилоидом и выводятся с мочой в минимальных количествах), и электрофоретическое исследование белков мочи. При амилоидозе сердца на ЭКГ регистрируется низкий вольтаж комплекса QRS. При проведении эхокардиографии отмечается сочетание повышенной эхогенности (проницаемости) миокарда и утолщения стенок предсердий, что в 60–90 % случаев указывает на амилоидоз. В протеинурической стадии амилоидоза почек выявляется незначительное количество белка в моче и периодическое появление эритроцитов, которое иногда обнаруживается лишь при исследовании осадка мочи по методу Каковского-Аддиса. В моче определяются единичные цилиндры (гиалиновые, зернистые, восковидные) и лейкоциты. В ряде случаев незначительно снижаются почечный кровоток и фильтрация. В нефротической стадии нарастает количество альбумина, среди белков мочи преобладают глобулины, особенно их крупные частицы. Отмечается высокое содержание гамма-гликопротеидов и альфа-липопротеидов в моче. В осадке мочи обнаруживают небольшое количество эритроцитов, цилиндров и нередко лейкоцитов. Наблюдается снижение уровня белков крови с нарушением их соотношения (альбуминоглобулиновый коэффициент уменьшается до 1,0 и ниже), среди глобулинов преобладают альфа-2 и гамма-фракции. Может наблюдаться повышенный уровень холестерина крови. Иногда в крови обнаруживается умеренное повышение содержания креатинина, мочевины и остаточного азота. Могут наблюдаться небольшие изменения глазного дна. Большое значение в диагностике принадлежит биопсии почек. Кроме того, уточнить диагноз помогают результаты рентгенологических и радиоиндикационных методов исследования. При амилоидозе печени лабораторное исследование выявляет характерные белковые сдвиги, особенно альфа-2-глобулинемию, иммунные нарушения, часто повышена активность щелочной фосфатазы сыворотки, другие функциональные пробы мало изменены. Наибольшее диагностическое значение имеет пункционная биопсия печени.
Лечение Лечение первичного амилоидоза сопряжено с большими трудностями. На успех в лечении вторичного амилоидоза можно рассчитывать лишь в том случае, если в органах отсутствуют грубые изменения, а также если устранить вызвавшие его развитие причины. Лечение включает диету, щадящий режим, по возможности — радикальное устранение основного заболевания (остеомиелит, опухоль), назначение патогенетических и симптоматических средств. К патогенетической терапии относят назначение хингамина по 0,25 г в сутки, 5 %-ного унитиола по 5—10 мл внутримышечно курсами по 20–30 инъекций, колхицина (эффективен при наследственных формах) по 2 мг в сутки, иммунодепрессантов при амилоидозе, обусловленном миеломной болезнью, и первичных формах заболевания. Симптоматические средства используются по показаниям (гипотензивные, диуретические, десенсибилизирующие средства, препараты железа, витамины группы В, сердечные гликозиды, переливание цельной крови и ее компонентов, гепатопротекторы и т. д.). При развитии хронической почечной недостаточности должен решаться вопрос о гемодиализе и трансплантации почки.
АМИОТРОФИИ
ОпределениеАмиотрофия — нарушение питания мышц, сопровождающееся дегенеративнодистрофическими изменениями, истончением волокон и нарушением сократительной функции. Из-за поражения тел нейронов, расположенных в передних ногах спинного мозга, развивается спинальная амиотрофия. При положении их аксонов, проходящих в составе периферической нервной системы, возникает невральная амиотрофия.Выделяют неоднородную группу наследственно обусловленных амиотрофий (спинальные и невральные), а также симптоматические амиотрофии. Последние развиваются при поражении мышечной ткани при заболеваниях соединительной ткани, хронических интоксикациях, инфекционных и паразитарных заболеваниях, эндокринных нарушениях.
Этиология и патогенез Причины возникновения и механизмы развития наследственных амиотрофий изучены не до конца. В целом амиотрофии обусловлены повреждением нервных клеток спинного мозга, их отростков и спинномозговых нервов. В результате прогрессирования процесса постепенно развиваются параличи, нарушаются функции соответствующих мышц, снижение их электровозбудимости. Атрофические процессы затрагивают все структуры мышечного волокна.
Клиническая картина Спинальные амиотрофии Спинальные амиотрофии характеризуются прогрессирующими атрофическими парезами, обусловленными поражением нервных клеток спинного мозга. К этой группе относят болезнь Верднига-Гоффмана, доброкачественную спинальную амиотрофию Кугельберга-Веландер, болезнь Арана-Дюшена и ряд более редких форм. Для всех форм спинальных амиотрофий характерны сходные симптомы. Клинически это выражается в том, что постепенно развиваются вялые периферические параличи (см.) и атрофия (см.) мышц, асимметрия поражения, отсутствие сухожильных рефлексов. Чувствительность и тазовые функции не страдают. Амиотрофия прогрессирующая спинальная Верднига-Гоффмана (синоним: семейная спинальная амиотрофия детского возраста) характеризуется прогрессирующей слабостью и атрофией мышц преимущественно туловища и близких к нему отделов конечностей. Среди родителей больных отмечен высокий процент кровного родства. Заболевание передается по аутосомно-рецессивному типу. Прогноз неблагоприятный, большинство погибают до 15 лет. Различают врожденную, раннюю детскую и позднюю формы заболевания. Врожденная форма развивается в первые месяцы жизни ребенка. Отмечаются вялые парезы, распространенное снижение мышечного тонуса, сухожильные рефлексы отсутствуют. Возможно сочетание с различными пороками развития. Течение прогрессирующее, основная причина смерти — дыхательная и сердечно-сосудистая недостаточность из-за слабости дыхательных мышц и нарушений в коре головного мозга. Ранняя детская форма развивается обычно в интервале от 6 месяцев до 1 года. Первыми поражаются мышцы туловища и ног, позднее в процесс вовлекаются все мышечные группы, включая мышцы, иннервируемые черепными нервами. Ребенок перестает опираться на ножки, утрачивает способность сидеть, захватывать игрушки. В положении сидя возникает выраженный кифоз вследствие слабости мышц спины. Отмечается раннее симметричное выпадение сухожильных и надкостничных рефлексов. Характерны подергивания мышц, особенно мышц языка. В поздней стадии болезни развиваются полная мышечная гипотония и бульбарный паралич (см.). Дети доживают до 14–15 лет. Поздняя форма заболевания характеризуется постепенным началом в возрасте 1,5–2,5 года. В движениях и походке ребенка нарастает неуверенность, дети часто падают. Затем присоединяются вялые параличи (см.) и атрофии мышц близких к туловищу (проксимальных) отделов конечностей. Снижаются сухожильные рефлексы. Помимо подергивания мышц языка отмечается снижение глоточного и небного рефлексов. Постепенно формируется дисфагия (см.). Двигательные навыки медленно исчезают, и к 10–12 годам дети перестают передвигаться и обслуживать себя. При поздней форме они доживают до 20–30 лет. Доброкачественная спинальная амиотрофия Кугельберга-Веландер (синонимы: псевдомиопатическая, или юношеская, амиотрофия, амиотрофия спинальная прогрессирующая ювенильная) характеризуется медленно прогрессирующим течением с развитием слабости, атрофии, подергиваний мышц туловища и проксимальных отделов конечностей. Ряд авторов рассматривает заболевание как доброкачественный вариант болезни Верднига — Гоффмана. Заболевание может начаться в возрасте от 3 до 17 лет. Атрофические парезы и подергивания мышц появляются преимущественно в проксимальных отделах конечностей. Нередко у больных отмечается избыточное развитие подкожно-жировой клетчатки, маскирующей развитие атрофий и подергивания мышц. Постепенно процесс распространяется, но больные на протяжении многих лет (вплоть до старческого возраста) могут сохранять способность к самостоятельному передвижению. Болезнь Арана-Дюшена (спинальная амиотрофия взрослых) начинается в возрасте 40–60 лет. Постепенно возникает прогрессирующая атрофия мышц дистальных (удаленных от туловища) отделов конечностей (преимущественно кистей). Далее в процесс могут вовлекаться и проксимальные отделы конечностей, мышцы тазового и плечевого пояса. В пораженных мышцах отмечаются подергивание, в мышцах языка — дрожание. Течение медленно прогрессирующее. Смерть обычно наступает от бронхопневмонии. Ряд авторов не признают болезнь Арана-Дюшена спинальной амиотрофией.
Невральные амиотрофии Невральная амиотрофия связана с поражением двигательных волокон или корешков периферических нервов. Основной формой невральных амиотрофий является болезнь Шарко-Мари-Тута, а также некоторые более редкие заболевания, принадлежность которых к невральным амиотрофиям не вполне доказана (например, интерстициальная гипертрофическая невропатия Дежерина-Сотта, клинически очень напоминающая амиотрофию Шарко-Мари-Тута). Невральная амиотрофия Шарко-Мари-Тута (синоним: перонеальная мышечная атрофия) характеризуется развитием параличей (см.) в дистальных отделах конечностей и расстройствами чувствительности по полиневритическому типу. Подергивания в мышцах отсутствуют. Начало заболевания чаще приходится на возрастной интервал от 10 до 20 лет. Ранними симптомами являются слабость и атрофия перонеальных мышц с постепенным развитием так называемой «петушиной» походки. Атрофический парез нарастает очень медленно; в поздних стадиях в процесс вовлекаются и кисти. Исчезают сухожильные рефлексы. Нередки боль, а также легкое снижение кожной чувствительности в ногах. Координация движений и тазовые функции не нарушены. Течение медленно прогрессирующее. Нередко больные доживают до глубокой старости, сохраняя возможность самообслуживания и даже трудоспособность.
Диагностика В диагностике важную роль играют клинические особенности течения заболевания, семейный опрос, а также специальные электрофизиологические и морфологические методы исследования. Спинальные амиотрофии характеризуются поражением нервных клеток спинного мозга. Для них типичны атрофия и реакция перерождения мышц при исследовании электровозбудимости, подергивания, асимметрия поражения. Дифференцировать следует с прогрессирующими мышечными дистрофиями (см.), нейроинфекциями (полиомиелит (см.)) и боковым амиотрофическим склерозом (см.). Невральные амиотрофии возникают при поражении двигательных волокон или корешков периферических нервов. Диагностика сложна. Существует множество редких форм невральных амиотрофий, различить которые возможно только с использованием специальных исследований (биопсия кожного нерва, определение скорости передачи возбуждения по нерву, уточнение данных обследований членов семьи больного и пр.). Амиотрофию Шарко-Мари-Тута дифференцируют с полиневропатиями (последние развиваются значительно быстрее, даже при хроническом характере поражения), миопатиями (см.) (электромиография и исследование скорости проведения нервного импульса свидетельствуют о нейрогенном механизме развития амиотрофии), инфекционными полиневритами и нейроинфекциями (состав цереброспинальной жидкости при амиотрофии нормальный).
Лечение Лечение нейрогенных амиотрофий симптоматическое, комплексное и пожизненное. Применяют витамины группы В, Е, глутаминовую кислоту, аминалон, прозерин, дибазол. Периодически проводят курсы анаболических стероидов. Помимо фармакотерапии используются регулярные курсы массажа, ЛФК, различные виды физиотерапии, бальнеолечения. При нарушенной подвижности в суставах, деформациях скелета больным необходима ортопедическая коррекция.
АНГИНА (ОСТРЫЙ ТОНЗИЛЛИТ)
ОпределениеАнгина (острый тонзиллит (см.)) — острое инфекционно-аллергическое заболевание с преимущественным поражением небных миндалин, лимфоидной ткани. При локализации воспалительного процесса в других лимфоидных тканях глотки (язычных, гортанных, носоглоточных миндалинах) развиваются соответственно язычные, гортанные и ретроназальные (носоглоточные) ангины.Выделяют катаральную, фолликулярную, лакунарную, флегмонозную ангину. Кроме того, при осмотре слизистой глотки различают фибринозную, герпетическую, язвенно-некротическую и смешанную формы.
Этиология и эпидемиология Возбудителями могут быть различные микроорганизмы: стафилококки, стрептококки (бета-гемолитический стрептококк группы А, пневмококк и ряд других), бактерии (моракселла, ацинетобактерии, клебсиелла, листерия и др.). Среди ангин вирусной природы преобладают аденовирусные и герпесвирусные, встречаются и смешанные бактериально-вирусные формы. Причина возникновения ангины Симановского-Плаута-Венсана (ангина Венсана) — воздействие условно-патогенной флоры полости рта. Ангина может возникать вследствие грибкового поражения — кандидоза, лептотрихоза, возбудителями паразитарных ангин являются амебы ротовой полости. Проникновение инфекции в организм происходит как извне, так и в результате самозаражения. В первом случае инфицирование происходит, как правило, воздушно-капельным путем при тесном контакте с больным, несколько реже — с употреблением пищи (описаны вспышки при употреблении молока от коров со стрептококковым поражением вымени). Во втором случае инфицирование происходит при наличии в полости рта или глотки очагов хронического воспаления (кариозные зубы, гнойные воспаления придаточных пазух носа и т. д.). Чаще болеют дети дошкольного и школьного возраста, а также взрослые до 35–40 лет. Характерны сезонные подъемы заболеваемости в весенний и осенний периоды. Ангины подразделяются на первичные и вторичные при острых инфекционных заболеваниях — кори (см.), скарлатине (см.), дифтерии (см.), сифилисе (см.), инфекционном мононуклеозе (см.) и т. д., а также при заболеваниях системы крови (гемобластозах).
Клиническая картина Катаральная ангина Заболевание начинается с першения, саднения и сухости в горле. Затем в течение суток присоединяется боль при глотании. Отмечаются жалобы на общее недомогание, слабость, головную боль. Температура у взрослых обычно слегка повышена. У детей лихорадочная реакция более выражена (до 38–39 °C). Осмотр глотки выявляет умеренно увеличенные и гиперемированные небные миндалины и гиперемию прилегающих участков слизистой оболочки дужек. Мягкое небо и задняя стенка глотки не изменены в отличие от острого фарингита (см.). Могут отмечаться незначительное увеличение и болезненность при прощупывании подчелюстных лимфоузлов. Фолликулярная и лакунарная ангины Эти формы протекает более тяжело с низко выраженной интоксикацией. Обычно эти формы сочетаются у одного больного, изолированно встречаются редко. Характерно острое начало с повышением температуры. У детей возможны температура до 40–41 °C, озноб, общая слабость, головная боль. Подчелюстные лимфоузлы увеличены и болезненны при прощупывании. При осмотре слизистой отмечаются выраженная гиперемия и увеличение небных миндалин, прилежащих участков мягкого неба и дужек. При фолликулярной ангине просматриваются нагноившиеся фолликулы, просвечивающие через слизистую в виде мелких желтоватых пузырьков. При лакунарной ангине желтовато-белые налеты локализуются в устьях складок миндалин. Они могут сливаться между собой, покрывая всю поверхность или только часть миндалин; налеты легко снимаются шпателем, слизистая под ними не кровоточит.
Фибринозная ангина Фибринозная ангина характеризуется образованием единого сплошного налета беловато-желтого цвета, который может выходить за пределы миндалин. Такой тип ангины может развиться из лакунарной либо протекать самостоятельно с наличием сплошной пленки уже в первые часы заболевания. В последнем случае характерно острое начало с высокой лихорадкой, ознобом, тяжелыми явлениями общей интоксикации, иногда с признаками поражения головного мозга.
Флегмонозная ангина Это острое гнойное воспаление околоминдальной клетчатки. В этом случае воспаление распространяется из глубоких лакун, фолликулов или интратонзиллярного абсцесса. Флегмонозная ангина чаще развивается на фоне одной из форм ангины при наличии предшествующего хронического тонзиллита. Процесс чаще односторонний. Отмечаются резкие боли при глотании, гнусавость голоса, спазм жевательных мышц. Болезнь может протекать с незначительными общими симптомами. При осмотре слизистой отмечается резкая гиперемия и отечность тканей мягкого неба с одной стороны, осмотреть саму миндалину вследствие этого не удается. Подчелюстные лимфоузлы увеличены, при прощупывании резко болезненны. Созревший абсцесс может прорываться в полость рта или клетчатку вокруг миндалины с образованием абсцесса. Паратонзиллярный абсцесс локализуется обычно кпереди и кверху от небной миндалины. При созревшем абсцессе помимо состояния слизистой, свойственного флегмонозной ангине, выявляется бело-желтый участок слизистой оболочки — истонченная стенка абсцесса. После его вскрытия (самостоятельного или оперативного) состояние больного быстро нормализуется.
Ангина Венсана Возбудителями ангины Венсана являются веретенообразная палочка и спирохеты. Ангина язвенно-пленчатая (ангина Симановского-Плаута-Венсана) характеризуется жалобами на умеренную болезненность в горле и лихорадку. Остальные симптомы интоксикации выражены слабее, чем при других формах ангин. При осмотре гиперемированных миндалин на них просматривается серовато-зеленый налет разной толщины. При попытке его снятия подлежащая ткань кровоточит. В дальнейшем места, покрытые налетом, изъязвляются, для язв характерна кратерообразная форма с неровными краями. Регионарные лимфоузлы незначительно увеличены и болезненны.
Грибковая ангина (кандидоз) Симптомы интоксикации выражены слабо, отмечаются небольшое недомогание и слегка повышенная температура. При осмотре на миндалинах на фоне незначительных катаральных явлений виден серовато-белый или белый творожистый налет, который легко снимается, подлежащая ткань не кровоточит.
Вторичные ангины Ангина агранулоцитарная начинается остро, с озноба и высокой температуры тела; миндалины и окружающие ткани подвергаются обширному изъязвлению и некрозу, отека нет. Отмечается неприятный гнилостный запах изо рта. Характерна резкая болезненность в горле при глотании. Лимфатические узлы не увеличены. Ангина при инфекционном мононуклеозе (ангина моноцитарная) при осмотре слизистой глотки напоминает фолликулярную. В дальнейшем на миндалинах появляется налет в виде тонкой пленки и увеличиваются лимфатические узлы. При прощупывании определяется увеличение селезенки и печени.
Диагностика Катаральная ангина В диагностике ведущая роль принадлежит клинике и осмотру слизистой зева. Изменения в крови могут отсутствовать или быть незначительными: небольшой лейкоцитоз, умеренное повышение СОЭ.
Фолликулярная, лакунарная, фибринозная ангины Общий анализ крови: лейкоцитоз до 20–25 г/л с нейтрофильным сдвигом формулы влево, повышение СОЭ до 40–45 мм/ч. Ведущий диагностический метод — осмотр слизистой глотки. Дифференцировать следует с дифтерией ротоглотки и вторичными ангинами.
Флегмонозная ангина Диагностируется на основании типичной фарингоскопической картины. Дифференцировать необходимо с токсической дифтерией (см.) ротоглотки.
Ангина Венсана В диагностике используются данные клиники, фарингоскопии, а также в качестве подтверждения — бактериоскопии окрашенного мазка-отпечатка с небных миндалин.
Грибковая ангина (кандидоз) В диагностике используются данные клиники, фарингоскопии, а также исследования мазка — выделяются грибы рода Candida.
Вторичные ангины Вторичные ангины (агранулоцитарные) развиваются на фоне имеющихся заболеваний крови, сопровождающихся агранулоцитозом, диагностируются при соответствующей клинике и картине крови. При инфекционном мононуклеозе (см.) типичны полилимфаденит, гепатолиенальный синдром (см.), характерная картина периферической крови с лейкоцитозом до 20 г/л, лимфоцитозом и наличием атипичных мононуклеаров.
Лечение Лечение больных ангиной осуществляется, как правило, на дому. Оно должно быть индивидуально подобранным с учетом формы ангины и состояния организма больного. При катаральной ангине можно применять комбинированные сульфаниламидные препараты (триметоприм и аналоги) по 2 таблетки 2–3 раза в день (детям — в возрастных дозировках). При прочих формах бактериальных ангин используются антибиотики с учетом типа возбудителя и его чувствительности к антибиотикам. В экстренных случаях применяют антибиотики широкого спектра действия (макролиды, тетрациклины), а также пенициллины, поскольку гемолитический стрептококк группы А все еще сохраняет чувствительность к ним. Бензилпенициллина натриевую соль назначают по 250–500 тыс. ЕД 4 раза в день внутримышечно, оксациллина или ампициллина натриевую соль — по 0,25—0,5 г в 3 мл воды для инъекций 4 раза в день внутримышечно. При стафилококковых ангинах применяется амоксиклав по 375 мг 3 раза в день (детям — в возрастных дозировках). Лечение антибактериальными средствами проводят в течение 5–7 дней. Из симптоматических средств применяют ацетилсалициловую кислоту по 0,5 г 3–4 раза в день. Местно используют для полосканий и орошений зева 3 %-ный раствор перекиси водорода, 0,1 %-ный раствор перманганата калия, 2–4 %-ный раствор борной кислоты, раствор бикарминта, 0,05—0,1 %-ный раствор риванола, настойку календулы, а также настои шалфея или ромашки. Назначают паровые ингаляции. Лечение паратонзиллярного абсцесса хирургическое — вскрытие после его созревания. Антибактериальная и симптоматическая терапия проводится по общепринятой схеме лечения ангин. При вирусных ангинах антибиотики малоэффективны, рекомендуется орошение интерфероном, спреем ИРС-19. При смешанной вирусно-бактериальной форме ангин применяют как антибактериальные средства, так и противовирусные.
Ангина Венсана Лечение язвенно-пленчатых ангин заключается в смазывании язвы раствором новарсенола в глицерине (10 %-ный раствор) или нитрата серебра (10 %-ный раствор) 2 раза в день. Назначают антибактериальные препараты, аскорбиновую и никотиновую кислоты в возрастной дозировке. Для полоскания рта используют раствор калия перманганата или перекись водорода.
Грибковая ангина (кандидоз) Лечение сводится к отмене антибиотиков, снижению дозы кортикостероидов, назначению противогрибковых средств (нистатин, леворин, низорал), поливитаминов, смазыванию пораженных участков 2 %-ным раствором метиленового синего или 1 %-ным раствором бриллиантового зеленого.
Вторичные ангины Лечение вторичных ангин при агранулоцитозе осуществляется гематологом. Лечение ангины при инфекционном мононуклеозе симптоматическое (см. также Инфекционный мононуклеоз).
АНГИОМЫ
ОпределениеАнгиома — доброкачественная опухоль, развивающаяся из кровеносных (гемангиомы) или лимфатических (лимфангиомы) сосудов. Гемангиомы составляют около 25 % всех доброкачественных опухолей и 45 % всех опухолей мягких тканей. По строению различают доброкачественную гемангиоэндотелиому, капиллярную (ювенильную), кавернозную и рацемическую гемангиомы, а также гемангиоматоз.Доброкачественная гемангиоэндотелиома встречается редко, как правило, в раннем детском возрасте. Преимущественная локализация — кожа и подкожная клетчатка. Капиллярная (ювенильная) гемангиома также преобладает в детском возрасте. Преимущественная локализация — в коже, реже — в слизистой оболочке полости рта, языка, органов желудочно-кишечного тракта и в печени. Встречаются формы, склонные к прорастанию в окружающие ткани. Кавернозная гемангиома представляет собой скопление сосудистых полостей различной формы и величины, сообщающихся между собой. Чаще всего располагается в печени, реже — в губчатых костях, мышцах, желудочно-кишечном тракте. Рацемическая гемангиома может быть венозной, артериальной, артериовенозной. Это сосудистое образование встречается в области головы и шеи. Гемангиоматоз — распространенное поражение сосудистой системы, при котором в процесс вовлекается обширная ее часть, например вся конечность или ее периферический отдел. Лимфангиомы встречаются реже, по строению бывают бородавчатыми, диффузными, кавернозными, капиллярными, кистозными и системными. Они обладают ограниченным ростом. Микроскопически опухоль представляет собой полости разных форм и размеров, стенки которых представлены слоем соединительной ткани и эндотелия. Нередко встречается сочетание гемангиомы и лимфангиомы.
Этиология и патогенез Факторы возникновения и механизмы развития не ясны. В большинстве случаев источником развития ангиом являются избыточные сосудистые зачатки, которые в эмбриональном периоде или вскоре после рождения начинают расти.
Клиническая картина Гемангиомы Гемангиома — доброкачественная опухоль, развивающаяся из кровеносных сосудов у детей в возрасте до 1 года. В зависимости от локализации различают гемангиомы покровных тканей (кожа, подкожная клетчатка, слизистые оболочки), опорно-двигательного аппарата (мышцы и кости), паренхиматозных органов (печень). Чаще всего встречаются гемангиомы покровных тканей с преобладающей локализацией на коже лица. Внешне гемангиома представляет собой розовое или багрово-синюшное безболезненное пятно, которое немного приподнимается над уровнем кожи. Пальцевое надавливание приводит к уплощению этого пятна, интенсивность его окраски снижается. После прекращения надавливания вновь происходит заполнение образования кровью, в результате чего внешний вид его восстанавливается. Типичной особенностью такой гемангиомы является быстрый прогрессирующий рост. За несколько месяцев опухоль, размеры которой при рождении ребенка составляли 1 х 1 мм, может достигать значительных размеров. Это приводит к косметическим дефектам и различным функциональным нарушениям даже таких жизненно важных функций, как зрение, дыхание, питание, дефекация или мочеиспускание — в зависимости от локализации. Особенно интенсивный рост гемангиомы отмечается на первом году жизни ребенка. В последующем начинается ее обратное развитие, которое полностью завершается к 5 годам у 50 % пациентов, однако оно необязательно означает возвращение кожи к нормальному состоянию. Осложнениями гемангиом наружных покровов (помимо нарушений жизненно важных функций) являются: изъязвление с последующим кровотечением и развитием инфекции, сердечная недостаточность и задержка тромбоцитов (синдром Казабаха-Мерритта). Чаще всего встречается изъязвление, развивающееся в месте прилегания пленки. Гемангиомы подкожной клетчатки и мышц чаще обнаруживаются на конечностях, преимущественно нижних. В этом случае поверхность кожи над опухолью может сохраниться неизменной. Однако, если гемангиома носит пещеристый характер, она имеет вид узловатых образований темно-синего цвета, покрытых истонченной кожей. Если ангиома сообщается с крупной артерией, можно прощупать ее пульсацию. При выслушивании над этой областью отмечается шум. При развитии тромбозов и флебитов, а также при проникающем росте и повреждении окружающих тканей отмечается болевой синдром. При продолжительном сроке развития опухоли ее осложнениями могут стать атрофия мышц, нарушение функции конечности. Гемангиомы с локализацией в костях встречаются редко и составляют 0,5–1 % всех доброкачественных новообразований костей. По строению эти опухоли кавернозные. Они могут возникать в любом возрасте с одинаковой частотой у мужчин и женщин. Преимущественная локализация — позвоночник, кости черепа, таза, реже — длинные трубчатые кости конечностей. Очень часто встречаются множественные кавернозные гемангиомы. Длительное время симптомы могут не проявляться. В дальнейшем начинаются боли, деформируется скелет, возникают патологические переломы. В каждом конкретном случае симптомы зависят от локализации. При поражении позвонков, например, отмечаются корешковый синдром, другие спинальные синдромы.
Лимфангиомы Лимфангиома — опухоль, исходящая из лимфатических сосудов. Наблюдается у новорожденных часто в подмышечной области, на шее, на дне полости рта. Лимфангиома чаще встречается у детей первого года жизни. Преимущественная локализация — кожа и подкожная клетчатка. С возрастом довольно часто опухоль подвергается обратному развитию благодаря склерозу и запустеванию лимфатических сосудов. Капиллярная лимфангиома чаще всего локализуется в коже, выглядит как участок диаметром 1–2 см, возвышающийся над уровнем кожной поверхности, обычного для кожи цвета с плотными темно-красными вкраплениями. При прощупывании такой лимфангиомы болезненных ощущений не наблюдается. Кавернозные и кистозные лимфангиомы чаще всего локализуются в области лица, шеи, подмышечных впадин и груди. В ряде случаев они определяются как безболезненные кожные припухлости синевато-розового цвета мягкой консистенции. Иногда могут достигать значительных размеров. Рост лимфангиом, как правило, медленный. Из осложнений встречается нагноение.
Диагностика Диагностика гемангиом кожных покровов и мышц не представляет собой затруднений. Характерный цвет и способность сокращаться при надавливании являются типичными признаками. Гемангиомы костей диагностируются в результате рентгенологического исследования. Для поражения позвонков характерно вздутие их тела, костная структура представлена грубыми, вертикально направленными балками, на фоне которых просматриваются отдельные просветления округлой формы. Такая же рентгенологическая картина может наблюдаться в дужках и поперечных отростках позвонков. При наличиипатологического перелома структура позвонка изменяется за счет клиновидной деформации, и тогда при отсутствии специфичных изменений в дужках и поперечных отростках диагноз гемангиомы становится трудным. При гемангиомах длинных трубчатых костей отмечается булавовидная деформация кости с нарушением ее обычной структуры, которая приобретает ячеистый рисунок. В подобных случаях особую ценность приобретает ангиографическое исследование, выявляющее полости в пораженном отделе кости. Диагностика лимфангиом также не представляет затруднений при наличии типичной локализации. При проведении диагностической пункции получают из опухоли прозрачную желтоватую жидкость.
Лечение Лечение ангиом, как правило, хирургическое. Применяют также склерозирующую и лучевую терапию, криодеструкцию. Оперативное иссечение ангиом является основным и наиболее радикальным методом лечения. Однако в ряде случаев радикальная операция невозможна из-за наличия множественных полостей и каверн, особенно в случае лимфангиом. Поэтому после удаления части опухоли применяют склеротерапию при помощи 70 %-ного этилового спирта. Наилучший эффект как в косметическом плане, так и в отношении дальнейшего прогноза операция будет иметь при проведении ее в возрасте 6—12 месяцев. Лучевая терапия используется при кавернозных и капиллярных гемангиомах наружных покровов и опорно-двигательного аппарата. При лимфангиомах она не эффективна. При гемангиомах кости лучевую терапию проводят только при наличии клинических проявлений (болевой синдром, нарушение функции и др.). Доза облучения, величина и число полей зависят от локализации опухоли и ее размеров. Криодеструкция используется преимущественно при небольших с локализацией в коже. Прогноз при своевременном и полном лечении благоприятный. При больших ангиомах, располагающихся в труднодоступных областях (внутренние органы, локализация крупных сосудов), прогноз менее оптимистичен.
АНГИОНЕВРОЗЫ
ОпределениеАнгионеврозы (вегетативно-сосудистые неврозы, сосудисто-трофические невропатии) — заболевания, развивающиеся вследствие динамических расстройств сосудодвигательной и питательной иннервации органов и тканей.
Этиология и патогенез В качестве причин развития ангионеврозов выделяют наследственную предрасположенность, неполноценность сосудодвигательной иннервации, а также ряд провоцирующих внешних факторов: инфекции, привычные интоксикации, воздействие холода. Кроме того, отмечают роль обменных и эндокринных нарушений, а также сосудисто-трофических расстройств аллергического происхождения, травм центральной и периферической нервной системы, травм психического характера. Механизм развития ангионеврозов сложен. Сосудодвигательная и питательная иннервация может нарушаться на разных уровнях нервной системы (кора головного мозга, гипоталамус, ствол мозга, спинной мозг, периферические нервные сплетения).
Клиническая картина Наиболее частым проявлением ангионеврозов являются спазмы сосудов, реже встречаются двухфазные нарушения по типу спазм — расширение, еще реже — только расширение сосудов. К спастическим формам ангионеврозов относят акропарестезии, акроцианоз, начальные формы болезни Рейно (см.), синдром Рейно при системной склеродермии (см.), мигрень (см.), болезнь Меньера (см.). В результате локального расширения сосудов развиваются эритромелалгия и акроэритрозы; последние выражаются в безболезненном покраснении дистальных отделов конечностей (чаще рук) вследствие резкого расширения артериол и капилляров. Практически у всех больных отмечаются симптомы нарушения кровоснабжения конечностей. При этом отмечаются побледнение и похолодание (или покраснение) поврежденных конечностей, боль, регионарное повышение (снижение) артериального давления. У ряда больных помимо сосудистых расстройств выявляются и преобладают расстройства питания ткани. Они характеризуются стойким изменением окраски конечностей, нарушением кожного пото- и салоотделения, роста волос и ногтей, отеками, атрофией кожи, образованием трофических язв. Описаны холодовые ангионеврозы, например холодовой эритроцианоз, встречающийся, как правило, у девушек в возрасте 16–19 лет. Типичные симптомы: холодные ноги, мраморная окраска кожи как в холодное, так и в теплое время года. К этой же группе относят и профессиональное заболевание — «стопу шахтера», при которой отмечаются сосудодвигательные расстройства на стопах, связанные с длительным вынужденным положением рабочих в шахте стоя с согнутыми ногами.
Диагностика Диагноз ангионевроза устанавливают на основании данных полного исследования, методов термографии, осциллографии, исследования кожно-гальванического рефлекса, капилляроскопии и артериографии периферических сосудов.
Лечение При спастических формах ангионеврозов используют спазмолитики (платифиллин, никотиновую кислоту, папаверин, дибазол), ганглиоблокаторы (пахикарпин, ганглерон, пентамин), витамин В^. Применяют гальванизацию по Щербаку, электросон, сероводородные и радоновые ванны, ультрафиолетовое облучение. Показана курортотерапия на курортах с сероводородными водами (Мацеста, Пятигорск), радоновыми водами (Цхалтубо, Белокуриха), грязелечением (Одесса, Саки, Евпатория). Если отсутствует эффект от консервативной терапии, применяют симпатэктомию с прерыванием связи узлов, иннервирующих пораженные органы и ткани с центральной нервной системой. При акропарестезиях рекомендуют метод чередования горячих и холодных ванн для кистей и стоп — своеобразную гимнастику для сосудов. При ангионеврозах с преобладанием расширения сосудов рекомендуют препараты сосудосуживающего действия (эфедрин, кофеин), препараты кальция, аскорбиновую кислоту, витамин В6. Иногда положительный эффект достигается от использования новокаиновых блокад симпатических узлов. Лечение ангионеврозов, сопровождающих начальные формы склеродермии, вибрационной болезни, см. в соответствующих разделах.
АНЕВРИЗМЫ
ОпределениеАневризма — ограниченное расширение просвета кровеносного сосуда (полости сердца) в результате врожденных аномалий строения или патологического изменения их стенок.Различают артериальные, артериовенозные, венозные аневризмы. Истинная аневризма представлена ограниченным выпячиванием сосудистой стенки (мешковидная аневризма) или распространенным увеличением просвета сосуда на определенном его участке (цилиндрическая и веретенообразная аневризмы). Аневризма, расположенная между слоями сосудистой стенки, называется расслаивающей. Ложная аневризма представляет собой полость, сообщающуюся с просветом сосуда через дефект в его стенке и отграниченную соединительной тканью. Последняя обычно образуется вокруг излившейся из просвета сосуда крови. Патологическое сообщение просветов артерий и прилежащих вен называется артериовенозной аневризмой.
Этиология и патогенез Врожденными бывают аневризмы сосудов головного и спинного мозга (артериовенозные аневризмы), аорты (например, сочетающаяся с коарктацией аорты (см.), а также аневризмы при синдроме Марфана (см.). Причины развития приобретенных аневризм подразделяют на воспалительные, невоспалительные и травматические. К первым относят аневризмы при наличии аортита (см.), а также микотические аневризмы артерий головного мозга. Основной причиной невоспалительных аневризм считают атеросклероз (см.), причиной их расслоения — артериальную гипертензию (см.), а при аневризме сердца — инфаркт миокарда (см.). Травматические аневризмы аорты чаще возникают при тупой травме грудной клетки (специфической, локальной) или закрытой черепно-мозговой травме и представляют собой, как правило, осумкованную гематому (см.).
Аневризма аорты (набухание)
Механизм развития приобретенных аневризм связан с разрушающими или атрофическими процессами в сосудистой стенке, связанными с замещением или разрушением эластических и мышечных волокон. В возникновении мешковидных аневризм значение придают врожденным особенностям строения стенок артерий. Травматическая аневризма чаще возникает при механическом повреждении сосуда. Расслаивающая аневризма характеризуется наличием дефекта в стенке артерии (чаще — аорты), через который кровь поступает в средний слой сосудистой стенки и под давлением распространяется там параллельно магистральному направлению кровотока, расслаивая стенку аорты. По ходу сосуда такая аневризма может вновь прорываться в его просвет, что приводит к образованию двух параллельных каналов для кровотока. При развитии аневризмы сердца преобладающим фактором является локальная слабость сердечной стенки, обусловленная чаще всего трансмуральным инфарктом миокарда (см.).
Клиническая картина Аневризма аорты По месту локализации выделяют аневризмы восходящей части аорты, поперечной дуги аорты, нисходящей грудной аорты, торакоабдоминальную, а также травматическую с типичной локализацией в зонах наибольшей фиксации аорты дистальнее левой подключичной артерии. Клиническая симптоматика характерна только при больших размерах аневризмы, обусловливающей сдавление окружающих тканей и органов. При аневризмах грудной части аорты нарушается бронхиальная и трахеальная проходимость, отмечается также венозный застой в верхних конечностях и шее из-за сдавления верхней полой и безымянной вен, боли от сдавления спинномозговых нервов и позвоночника. Вследствие сдавления ветвей возвратного нерва возникает осиплость голоса.
Ложная аневризма нисходящей части аорты, развивающаяся на месте атеросклеротической бляшки (вид со стороны просвета аорты)
Расслаивающая аневризма; заштрихованы места разрыва и расслоения аорты
Схема расслаивающей аневризмы
Аневризма восходящей части аорты приводит к появлению признаков аортального порока сердца. При аневризмах брюшной части аорты возможно развитие «брюшной жабы», нарушение функции органов желудочно-кишечного тракта. Клиника расслоения аорты также зависит от места его локализации. Характерно возникновение внезапной интенсивной боли в груди или же в области спины со смещением по ходу аорты. Боль не снимается даже наркотическими анальгетиками. О дальнейшем расслаивании аорты свидетельствует постепенное изменение ее локализации, а также смещение. Состояние больных тяжелое, напоминающее шок (см.), однако артериальное давление первоначально повышено. При распространении расслаивания возможны попадание крови в перикард с тампонадой сердца, аортальная недостаточность из-за отрыва аортальных клапанов, ишемии различных органов. Нередко отмечается асимметрия пульса и артериального давления на верхних и нижних конечностях. По течению расслаивающая аневризма аорты может быть острой (часы), подострой (дни, редко 2–4 недели), хронической (месяцы). Без лечения в первые 2 недели погибают 70 % больных, 50 % выживших умирают в течение года. Самая частая причина смерти — разрыв аорты.
Аневризма дуги аорты со смещением трахеи
Аневризма сердца Постинфарктные аневризмы делят на острые (1–2 недели от возникновения инфаркта), подострые (3–6 недель) и хронические. Для острых и подострых аневризм типично наличие в истории болезни обширного трансмурального инфаркта миокарда (см.), расширения сердца, прекардиальной пульсации, прогрессирующей сердечной недостаточности, обычные средства на которую действуют слабо. Прослушивание выявляет ослабление I тона на верхушке, акцент II тона над легочной артерией, систолический шум на верхушке и в точке Боткина, нередко разного тембра, иногда определяется шум трения перикарда. При хронической аневризме проявляющиеся симптомы зависят от ее размеров и локализации. При этом постинфарктные аневризмы чаще локализуются на переднебоковой стенке и верхушке, могут распространяться на область передних перегородок. При небольших аневризмах больные при отсутствии тяжелых физических нагрузок могут жаловаться на перебои в работе сердца, сердцебиения. В остальных случаях развиваются одышка и боли в области сердца или за грудиной. Прекардиальная пульсация определяется у половины больных. Иногда она видна на глаз, но чаще определяется прощупыванием с усилением в положении больного на левом боку.

Аневризма левого желудочка
Аневризмы сосудов головного и спинного мозга Аневризмы сосудов центральной нервной системы делят на артериальные и артериовенозные. Первые встречаются преимущественно в головном мозге, вторые могут образовываться и в головном, и в спинном мозге. Различают две формы клинического течения артериальных аневризм — апоплексическую и опухолеподобную. Наиболее часто встречается первая из них. Она характеризуется внезапным развитием кровоизлияния под оболочку мозга, обычно без предшествующих симптомов. Иногда больных до кровоизлияния может беспокоить боль в лобно-глазничной области, в редких случаях наблюдаются парезы черепных нервов. Ведущий симптом разрыва аневризмы — выраженная головная боль, которая быстро распространяется. Одновременно возникают тошнота, многократная рвота. На различное время может утрачиваться сознание. Затем присоединяется менингеальный синдром, могут отмечаться эпилептиформные припадки. В остром периоде возможно повышение температуры, в крови отмечается немного повышенное содержание лейкоцитов, в спинномозговой жидкости — примесь крови. Разрыв аневризм у основания черепа сопровождается поражением глазодвигательного нерва. Помимо подоболочечного кровоизлияния (см.) при разрыве аневризм может произойти кровоизлияние в вещество мозга, что сопровождается появлением очаговой симптоматики, а также в желудочки мозга; последнее протекает наиболее тяжело и быстро приводит к гибели больного. В некоторых случаях артериальные аневризмы при медленном увеличении сдавливают мозг и имитируют течение доброкачественных опухолей. Преимущественно они образуются в кавернозном синусе и хиазмальной области. Артериовенозные аневризмы (артериовенозные ангиомы, артериовенозные мальформации) являются врожденной аномалией строения сосудов и характеризуются отсутствием в них капилляров. Это приводит к прямому сбросу артериальной крови в венозную сеть. При этом возникает феномен «обкрадывания» мозговой ткани. Сосудистые новообразования представляют собой клубки переплетенных между собой артерий и вен разного размера. В головном мозге они могут занимать большую часть полушария, локализуясь преимущественно в лобно-теменных отделах. Симптомы артериовенозных аневризм головного мозга — внутримозговые кровоизлияния и эпилептиформные припадки. Артериовенозные аневризмы спинного мозга до первого кровоизлияния могут проявляться преходящими расстройствами в двигательной и чувствительной сферах зон иннервации спинномозговых нервов, которые близко расположены к аневризме. В зависимости от уровня поражения кровоизлияние характеризуется развитием парезов от одной до всех конечностей, параличей с чувствительными и тазовыми нарушениями. После таких инсультов восстановление функций происходит в редких случаях, сохраняются стойкие неврологические нарушения.
Диагностика Аневризма аорты В диагностике аневризмы аорты значение имеют данные объективного исследования: систолический шум над аневризмой при прослушивании, прощупывание пульсирующего опухолевидного образования в верхней части живота при торакоабдоминальной аневризме; данные инструментальных методов обследования: обзорная рентгенография грудной и брюшной полости (локальное расширение тени аорты различной величины), эхокардиография с определением диаметра аорты в месте предполагаемого расширения, компьютерная и магнитно-резонансная томография; «золотым стандартом» является аортография. Подтвердить диагноз расслаивающей аневризмы аорты позволяют динамическая рентгенография (расширение тени аорты, двойной контур), компьютерная томография, магнитно-резонансная томография, эхокардиография, доплерография, аортография. При расслаивании грудного отдела при диагностике особенно велика роль чреспищеводной эхокардиографии. Чувствительность и специфичность метода достигают 90 %. Дифференцировать аневризмы грудной аорты следует с объемными образованиями легких и средостения, брюшной аорты — с объемными образованиями органов брюшной полости, поражениями тонкокишечных лимфоузлов, почечной патологией, опухолями забрюшинного пространства.
Аневризма сердца У больных с острой и подострой аневризмой могут отмечаться длительный лейкоцитоз и увеличение СОЭ. На ЭКГ отмечается «застывшая» картина острого трансмурального инфаркта миокарда (см.). Для диагностики хронических аневризм используется ЭКГ: характерно наличие желудочкового комплекса типа QS в сочетании с приподнятым над изолинией сегментом ST. При локализации аневризмы в передней стенке левого желудочка такие изменения обнаруживают не менее чем в 3 грудных отведениях. При рентгенографии выявляется изменение контура левого желудочка с мешковидным выпячиванием (у половины больных). Эхокардиография позволяет выявить аневризму задней стенки левого желудочка. Решающее значение принадлежит рентгеноконтрастной коронаровентрикулографии, при которой четко выявляются участки с нарушением сократительной деятельности стенки желудочка.
Аневризмы сосудов головного и спинного мозга Диагностика как артериальных, так и артериовенозных аневризм клинически представляет большие трудности. Основой является только церебральная артериография, которую при наличии показаний выполняют даже в остром периоде инсульта. В ряде случаев информативна компьютерная томография головы с контрастным усилением.
Лечение Аневризма аорты Лечение больного аневризмой аорты в целом включает наблюдение, операцию, извлечение тромбов, вшивание искусственного сосудистого протеза, закрытие протеза снаружи стенкой аневризмы. При расслаивающей аневризме в первую очередь необходим контроль за повышенным артериальным давлением и сократимостью миокарда, что имеет очень важное значение. Экстренная операция показана при расслоении восходящей аорты с целью ее осмотра и удаления с последующим протезированием. Первоначально расслоение нисходящей аорты лечат соответствующими медикаментами, так как в этом случае риск разрыва меньше. Позже проводится ее восстановление, хотя признаки продолжающегося расслоения сохраняются. В послеоперационном периоде необходимы длительное наблюдение за состоянием пациента, коррекция артериальной гипертензии, повторные исследования при помощи компьютерной томографии.
Аневризма сердца Лечение преимущественно хирургическое. Показаниями к операции являются прогрессирующая сердечная недостаточность, учащение приступов стенокардии, угрожающие формы желудочковой аритмии, тромбоэмболии вследствие образования тромбов в аневризматическом мешке. Если оперативное вмешательство противопоказано, проводится симптоматическая консервативная терапия. Применяются кардиотоники, антикоагулянты, дыхательные аналептики.
Аневризмы сосудов головного и спинного мозга Консервативная терапия при разрыве аневризм такая же, как при кровоизлиянии в мозг (см. Инсульт). Единственным радикальным средством лечения аневризм является хирургическое вмешательство. Прогноз более благоприятен при проведении операции в плановом порядке.
АНЕМИИ
ОпределениеАнемия (малокровие) — уменьшение количества эритроцитов и (или) снижение содержания гемоглобина в единице объема крови. Анемия может быть как самостоятельным заболеванием, так и синдромом, сопровождающим течение другого патологического процесса. В практических целях анемии характеризуют по степени снижения концентрации гемоглобина (в г/л): для детей от 6 месяцев до 6 лет и беременных женщин — ниже 110, от 6 до 14 лет — 120, взрослых женщин — 120, взрослых мужчин — 130.При анемии наблюдаются не только количественные, но и качественные изменения эритроцитов: их размера (анизоцитоз), формы (пойкилоцитоз), окраски (гипо- и гиперхромия, полихроматофилия). Классификация анемий сложна. В ее основе согласно причинам возникновения и механизмам развития заболевания лежит распределение анемий на три группы: анемии вследствие кровопотери (постгеморрагические анемии); анемии вследствие нарушений процесса образования гемоглобина или процессов кроветворения; анемии, вызванные усиленным распадом эритроцитов в организме (гемолитические). С учетом конкретных механизмов развития, лежащих в основе развития анемического синдрома, выделяют острую постгеморрагическую анемию, железодефицитную анемию, сидероахрестическую анемию (нарушение синтеза и утилизации порфиринов), мегалобластную анемию (нарушение синтеза ДНК и РНК), гемолитическую анемию, гипо- и апластические (связанные с угнетением роста клеток костного мозга) анемии, полидефицитные анемии, обусловленные сочетанным недостатком различных кровообразующих факторов и действием ряда патологических механизмов (гемолиза, метаплазии, аутоиммунных конфликтов, кровопотери, сепсиса (см.) и др.). По объему кровопотери различают 3 степени, определяющие тяжесть: — I степень — до 15 %; — II степень — от 15 до 50 % (тяжелая); — III степень — свыше 50 %.
Этиология и патогенез Постгеморрагическая анемия Острая постгеморрагическая анемия возникает вследствие быстрой и массивной кровопотери. Причины — травмы (ранения) кровеносных сосудов с развитием внешнего кровотечения и внутренние кровотечения (желудочно-кишечные, кровотечения в брюшную полость, почечные, легочные, маточные, а также кровотечения из различных органов при геморрагических диатезах, внутренних заболеваниях). Механизм развития связан с резким сокращением общего объема крови в сосудах. Хроническая постгеморрагическая анемия развивается благодаря повторным незначительным кровопотерям, которые истощают запасы железа в организме. Причиной таких кровопотерь могут быть кровотечения из язвенных дефектов в желудочно-кишечный тракт, обильные менструации, у детей — заражение кровососущими гельминтами и пр.
Железодефицитные анемии Причины железодефицитных анемий могут быть как внешними, так и внутренними. Основными факторами возникновения первых являются хронические кровопотери (вместе с эритроцитами теряется железо), повышенное расходование запасов железа (беременность, кормление, период роста детей). Вторые связаны с общим недостаточным питанием или длительным соблюдением диеты (особенно молочной) с ограниченным содержанием железа. Кроме того, отмечают нарушение всасывания железа при удалении желудка и кишечника, хроническом энтерите. При дефиците железа нарушается синтез гемоглобина, что приводит к задержке созревания клеток красной крови и выхода их в кровеносное русло.
Сидероахрестические анемии Сидероахрестические (железонасыщенные) анемии бывают наследственными и приобретенными. Наследственная форма связана с нарушением синтеза порфиринов, в частности протопорфирина, что ведет к снижению в эритроците количества гемоглобина и накоплению в организме несвязанного железа. Болеют чаще мужчины. В синтезе порфирина участвует витамин В6. В связи с этим выделяют В6-чувствительные и устойчивые формы этой анемии. В первом случае витамин В6 эффективен, во втором — нет. Приобретенные формы встречаются у лиц, имеющих контакт с рядом металлов (свинец, кадмий, никель), токсичных для человека. Длительный контакт приводит к связыванию групп ферментов аминокислоты, предшественницы протопорфирина и гемсинтетазы, в результате чего происходит накопление в эритроцитах железа, протопорфирина и его предшественников.
Мегалобластная (витаминодефицитная) анемия Мегалобластные анемии возникают при недостаточном поступлении в организм витаминов В12 и (или) фолиевой кислоты. Дефицит этих витаминов приводит к нарушению в клетках синтеза ДНК и РНК, что вызывает нарушения созревания и насыщения гемоглобином эритроцитов. В костном мозге появляются крупные клетки — мегалобласты, а в периферической крови — крупные эритроциты (мегалоциты и макроциты). Процесс кроворазрушения преобладает над кроветворением. Неполноценные эритроциты менее устойчивы, чем нормальные, и гибнут быстрее. У взрослых людей распространена В12-дефицитная (пернициозная) анемия Аддисона-Бирмера, связанная с атрофией слизистой оболочки желудка. При этом происходит прекращение выработки слизистой оболочкой внутреннего фактора Кастла, который способствует всасыванию витамина В12, поступающего с пищей. Пернициозоподобные В12-дефицитные анемии бывают при раке (см.), лимфогранулематозе (см.), сифилисе (см.), полипозе (см.) и других патологических процессах в желудке, а также при удалении последнего. Подобные состояния встречаются при глистных заражениях широким лентецом, спру (см.), после удаления тонкой кишки, при лечении некоторыми лекарственными препаратами. Дефицит фолиевой кислоты у взрослых развивается при удалении тощей кишки, целиакии (см.), тропической спру (см.), после длительного приема противосудорожных препаратов типа фенобарбитала, у страдающих хроническим алкоголизмом (см.). У детей грудного и младшего возраста эта анемия возникает при недоношенности, при вскармливании козьим молоком и продуктами, бедными фолиевой кислотой.
Гемолитические анемии Гемолитические анемии представлены большой группой разнородных по механизму и происхождению анемических состояний. Их объединяющим признаком является преобладание процессов кроворазрушения над процессами кровеобразования. Кроворазрушение может происходить преимущественно внутри сосудов или вне их. Причины внутрисосудистого гемолиза: гемолитические яды, тяжелые ожоги (см.), малярия (см.), сепсис (см.), переливание несовместимой крови, нарушения в работе иммунной системы, вирусные инфекции, хронический лимфолейкоз, системная красная волчанка (см.). Внутриклеточный гемолиз происходит в некоторых внутренних органах, преимущественно в селезенке, и сопровождается увеличением селезенки. Вследствие повышенного разрушения эритроцитов в крови нарастает количество непрямого билирубина. У больных появляется желтушное окрашивание кожи и слизистых оболочек. При этом желчь и кал интенсивно окрашены вследствие значительного количества желчных пигментов билирубина и стеркобилиногена, моча темная за счет повышенного количества уробилина. Кроверазрушение сопровождается уменьшением общего количества эритроцитов и повышением количества ретикулоцитов в крови, а также увеличением количества эритробластов в костном мозге. Уровень железа сыворотки крови повышается. При ряде нарушений характерно снижение стойкости эритроцитов, что способствует их быстрому разрушению. Наследственный микросфероцитоз (хроническая семейная желтуха, болезнь Минковского-Шоффара). В результате дефекта структуры мембран эритроцитов они утрачивают свою нормальную форму двояковогнутого диска и приобретают форму сферы. Подобные клетки быстро разрушаются в селезенке. Вследствие ранней гибели эритроцитов уменьшается их количество.
Периферическая кровь при гемолитической анемии. Микросфероцитоз
Злокачественная пернициозная анемия (болезнь Аддисона-Бирмера) развивается, как правило, в пожилом возрасте, в среднем около 60 лет. До 30 лет она наблюдается редко, но все же встречается даже у детей младше 10 лет. Анемия связана с атрофией слизистой оболочки желудка. При этом происходит прекращение выработки слизистой оболочкой внутреннего фактора Кастла, который способствует всасыванию витамина В12, поступающего с пищей. Пернициозоподобные В12-дефицитные анемии бывают при раке, лимфогранулематозе, сифилисе, полипозе и других патологических процессах в желудке, а также при удалении последнего. Подобные состояния встречаются при глистных заражениях широким лентецом, спру, после удаления тонкой кишки, при лечении некоторыми лекарственными препаратами. Дефицит фолиевой кислоты у взрослых развивается при удалении тощей кишки, целиакии, тропической спру, после длительного приема противосудорожных препаратов типа фенобарбитала, у страдающих хроническим алкоголизмом. У детей грудного и младшего возраста эта анемия возникает при недоношенности, при вскармливании козьим молоком и продуктами, бедными фолиевой кислотой. Пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы-Микели) обусловлена приобретенным дефектом мембраны эритроцитов и связана с появлением мутировавших клеток. Поражаются не только эритроциты, но и лейкоциты и тромбоциты. Возможен врожденный изолированный дефект активности ряда ферментов эритроцитов (ферментопатии). Недостаток активности ферментов эритроцитов нарушает состав эритроцитов и укорачивает продолжительность их жизни. Гемоглобинопатии (гемоглобинозы) обусловлены наследственным нарушением строения белковой (глобиновой) части гемоглобина. Гемоглобин здорового человека состоит из фракций А — 96 %, А2 — 2,5 %, F (фетальная) — 1,5 %. Они различаются по строению глобиновых цепей. Структура цепи при замене одной аминокислоты на другую нарушается, возникает аномальный гемоглобин. Он отличается от обычного снижением способности к захвату кислорода, устойчивости к давлению и травме. При серповидноклеточной анемии отмечается замещение аминокислотной структуры цепей глобина с появлением HbS. HbS обладает низкой растворимостью при пониженном давлении кислорода в бедной кислородом венозной крови; такой гемоглобин выпадает в виде полукристаллических овальных тел. В результате эритроциты приобретают форму серпа, веретена, иглы. При этом вязкость крови значительно увеличивается, скорость кровотока уменьшена, происходит закупорка мелких капилляров, сопровождающаяся тромбозами и инфарктами (см.) внутренних органов и тканей. При попадании серповидных эритроцитов в артериальную кровь форма их восстанавливается. Однако механическая устойчивость эритроцитов снижена, что приводит к их усиленному разрушению. Талассемия представляет собой целую группу гемоглобинопатий, определяемых различными генами. При этом заболевании гемоглобин А, свойственный взрослым, на 50–90 % заменен на фетальный гемоглобин HbF. Он не способен продуктивно снабжать ткани кислородом, в результате чего развивается гипоксия (см.), которая и приводит к резкому возрастанию производства эритроцитов. Усиление кровообразования может вызвать усиление всасывания железа, что приводит к сидерозу (отложению железа) органов. У аномальных эритроцитов сокращается продолжительность жизни, следовательно, увеличивается интенсивность распада крови. При иммунных анемиях кроворазрушение обусловлено воздействием антиэритроцитарных антител и может протекать внутрисосудисто и внутриклеточно. Антитела могут быть как аутоиммунными, так и чужеродными. Причиной гемолитической болезни новорожденных является несовместимость крови матери и плода по резус-фактору или группе крови. При беременности эритроциты плода попадают в организм матери, вызывая выработку у нее антител против эритроцитов плода. Антитела матери в крови плода приводят к разрушению эритроцитов как до, так и после рождения, стимулируя массивное кроворазрушение. Незрелая печень ребенка не может вывести из организма продукты распада эритроцитов. Интоксикация приводит к гибели печеночных клеток, клеток подкорки и коры головного мозга (см. Ядерная желтуха). В основе аутоиммунных гемолитических анемий лежит агрессия иммунной системы к собственному антигену эритроцитов, как неизмененному, так и измененному воздействием вирусной инфекции, лекарственных препаратов, в результате хронического лимфолейкоза, системной красной волчанки (см.), рака (см.), неспецифического язвенного колита (см.) и т. д. Иногда причину установить не удается. Провоцирующим фактором в последнем случае служат беременность, роды (см.), острые инфекции, травмы. Антитела могут повреждать эритроциты периферической крови или их предшественников в костном мозге. Наиболее часто встречаются аутоиммунные гемолитические анемии с антителами против эритроцитов периферической крови.
Гипо- и апластические анемии Это большая группа анемических состояний, связанных с нарушением кровообразования. Для них характерно истощение костного мозга (аплазия) с панмиелопатией. Среди причин выделяют наследственные факторы, антитела против родоначальников клеток крови, лекарственные препараты гемотоксического действия (амидопирин, барбитураты), токсические вещества, яды, лучевую энергию. Развивается поражение всех трех групп кроветворения: эритроидной, миелоидной и тромбоцитарной, что обусловливает клинические проявления не только анемии, но и панцитопении. Костный мозг утрачивает способность к восстановлению.
Клиническая картина Острая постгеморрагическая анемия У больного прежде всего появляются симптомы коллапса: резкая слабость, головокружение, бледность, сухость во рту, холодный пот, рвота, падает артериальное и венозное давление, уменьшается сердечный выброс, резко учащается пульс, наполнение пульса становится слабым. Клиническая картина определяется количеством потерянной крови и скоростью ее истечения.
Железодефицитная анемия Больных беспокоят слабость, головокружение, головная боль, одышка при небольшой физической нагрузке, снижение аппетита, бледность кожных покровов (иногда с зеленоватым оттенком — хлороз). Среди типичных железодефицитных симптомов отмечают изменение вкуса (пристрастие к мелу, ластику, глине, земле, сырому мясу), ломкость и выпадение волос, исчерченность ногтей, затруднение при глотании сухой и твердой пищи, запоры, ангулярный стоматит (см.). В ряде случаев отмечаются слегка повышенная температура, небольшое смещение границ сердца влево, систолический шум на верхушке, глухость сердечных тонов.

Койлонихия (вогнутые, ложкообразные ногти) при хлорозе
Сидероахрестические анемии При наследственной форме заболевание начинается с детства или юности. Жалобы могут отсутствовать, иногда больные жалуются на небольшую слабость, головокружение, одышку, сердцебиение. Печень увеличена, иногда увеличена и селезенка. При выраженных отложениях железа в тех или иных органах развивается клиника гемосидероза. Страдают печень, поджелудочная железа, миокард, половые железы. При свинцовой интоксикации наблюдаются общая астенизация, полиневротический синдром, приступы болей в животе, иногда тяжелые двигательные расстройства.
Мегалобластная (витаминодефицитная) анемия В12-дефицитная анемия характеризуется симптомами поражения кроветворной ткани, пищеварительной и нервной системы. Отмечаются жалобы на слабость, снижение работоспособности, головокружение, одышку, сердцебиение, жжение и боли в языке, парестезии, боли в ногах, пошатывание при ходьбе. Объективно кожа имеет желтушный оттенок, определяются явления глоссита («полированный» язык), небольшое увеличение печени и селезенки, тахикардия (см.), глухость тонов, негромкий систолический шум на верхушке. У части больных диагностируется фуникулярный миелоз: нарушение чувствительности, атрофия мышц, полиневрит, в наиболее тяжелых случаях — параличи (см.) нижних конечностей. При фолиеводефицитной анемии отмечаются жалобы на общую слабость, головокружение, изредка боли в языке. Оболочки глаз желтушные. Течение циклическое (рецидивы и ремиссии). Прогноз хороший при профилактике рецидивов.
Гемолитические анемии При наследственном микросфероцитозе отмечаются жалобы на слабость, головокружение, одышку, сердцебиения, боли в левом подреберье, периодически наблюдаются потемнение мочи и желтушность кожи. У больных развивается желтуха (см.) различной интенсивности, увеличение печени и селезенки, большая или меньшая степень анемии, склонность к образованию камней в желчном пузыре. Если болезнь развивается в раннем детстве, типичны башенная форма черепа, микрофтальмия, высокое «готическое» нёбо, синдактилия, полидактилия. Гемолитические кризы чаще всего провоцируются инфекцией. В период криза отмечаются интенсивные боли в области печени, селезенки, озноб, лихорадка с высокой температурой, рвота, усиление желтухи (см.) и анемии. При злокачественной пернициозной анемии (болезнь Аддисона-Бирмера) клиническая картина складывается преимущественно из признаков дефицита витамина В12. Заболевание начинается постепенно и прогрессирует медленно. При лабораторном обследовании выявляют гипергастринемию и абсолютную ахлоргидрию (соляная кислота не вырабатывается даже в ответ на введение пентагастрина), а также изменения картины крови и других лабораторных показателей. Атрофия слизистой желудка, охватывающая те его отделы, где происходит секреция соляной кислоты и пепсина, и не затрагивающая антральный отдел, другие изменения обусловлены дефицитом витамина В12 и затрагивают желудочный и кишечный эпителий и нервную ткань. Измененные клетки желудочного эпителия при цитологическом исследовании выглядят как атипичные, поэтому необходима дифференциальная диагностика с раком желудка. При пароксизмальной ночной гемоглобинурии больные предъявляют жалобы на слабость, одышку, сердцебиения, головокружения, в период криза — боли в поясничной области, озноб, лихорадку, черный цвет мочи. Кожные покровы бледные с желтоватым оттенком, отмечается увеличение печени и селезенки, возможна миокардиодистрофия (см.). По ночам возникают гемолитические кризы с выделением мочи темного цвета. Примерно у четверти больных развивается гипоплазия костного мозга. Течение заболевания может осложниться тромбозами: тромбоз почек приводит к необратимой почечной недостаточности, тромбоз портальной вены — к портальной гипертензии (см.) и т. д. При ферментопатиях симптомы могут существенно различаться — от клинически скрытых до тяжелых форм. При дефиците одного из ферментов гемолитический криз провоцирует прием противомалярийных препаратов (хинин, акрихин), сульфаниламидов (норсульфазол, сульфадиметоксин, сульфадимезин, противодиабетические сульфаниламидные препараты), нитрофуранов (фурагин, фурадонин, фуразолидон), 5-НОК, невиграмона, тубазида, фтивазида, ПАСК, антипирина, фенацетина, викасола, а также употребление с пищей конских бобов или попадание в легкие пыльцы этого растения (фавизм). Характерная триада симптомов: анемия, желтуха (см.), увеличение селезенки. Во время кризов моча приобретает черный цвет. Гомозиготная талассемия проявляется выраженной гипохромной анемией, анизоцитозом (мишеневидные эритроциты). Постоянное кроверазрушение приводит к переразвитию костного мозга. К концу первого или второго года жизни ребенка появляются значительное увеличение селезенки, желтушность кожи (грязно-желтый цвет) и слизистых оболочек, выраженная бледность. Череп почти четырехугольной формы, переносица уплощена, скулы выступают, глазные щели сужены, нарушены прикус и расположение зубов. Дети отстают в физическом и психическом развитии. Гетерозиготная форма протекает легче. Гомозиготная форма серповидноклеточной анемии проявляется с раннего детства тяжелыми гемолитическими кризами, приводящими к глубокой нормо- или гиперхромной анемии, физической и психической отсталости, нарушению скелета (удлиненные конечности, высокий и узкий с утолщенным швом лобных костей в виде гребня череп); частыми тромбозами сосудов костей и брюшной полости, которые сопровождаются болевым синдромом и асептическим некрозом головок бедренной и плечевой костей, а нередко — язвами голени, увеличением печени и селезенки. Гетерозиготная форма проявляется гемолитическим кризом при дефиците кислорода (тяжелой пневмонии (см.), наркозе, полете в самолете без достаточной герметизации кабины и т. д.). При гемолитической болезни новорожденных выделяют 3 формы течения заболевания: отечную, желтушную и анемическую. Отечная форма встречается сравнительно редко, но протекает особенно тяжело и приводит обычно к внутриутробной гибели плода. Часто наступают преждевременные роды (см.). Родившиеся живыми дети погибают в первые минуты или часы жизни. Желтушная форма проявляется на 1—2-й день жизни ребенка и характеризуется желтухой (см.), увеличением печени и селезенки, анемией. Отмечается небольшая отечность тканей. Дети малоподвижны, плохо сосут, рефлексы снижены. Интоксикация желчными пигментами может достигать степени «ядерной желтухи». Улучшение состояния можно наблюдать спустя 2–3 недели, но прогноз для дальнейшего развития ребенка неблагоприятен. Самой легкой является анемическая форма. Анемия развивается на первой или второй неделе жизни. Характерны бледность, плохой аппетит, вялость, увеличение печени и селезенки, уровень билирубина повышен умеренно. Аутоиммунными гемолитическими анемиями обычно страдают люди пожилого возраста. Отмечаются жалобы на одышку, резкую слабость,бывают боли в пояснице и в области сердца, часто отмечается лихорадка, быстро развивается желтуха. В других случаях болезнь наступает постепенно, сопровождаясь болью в суставах, болями в животе, слегка повышенной температурой. Одышки и сердцебиения в этом случае не бывает. В ряде случаев возможно выделение черной мочи.
Гипо- и апластические анемии При истощении костного мозга развиваются анемический, геморрагический и лейкопенический синдромы: наряду с анемией, свойственной нарушению эритропоэза, отмечаются инфекционные заболевания из-за снижения числа лейкоцитов и моноцитов, носовые, маточные кровотечения (см.) и кровоизлияния в серозные и слизистые оболочки из-за недостатка тромбоцитов.
Диагностика Острая постгеморрагическая анемия В диагностике учитывают сведения о произошедшей острой потере большого количества крови при внешнем кровотечении. В случае массивного внутреннего кровотечения диагноз основывается на клинических признаках в сочетании с лабораторными пробами (Грегерсена, Вебера), повышении уровня остаточного азота при кровотечении из верхних отделов желудочно-кишечного тракта. При анализе крови сразу после кровотечения цифровые показатели эритроцитов и гемоглобина мало отличаются от исходных. Анемия выявляется через 1–2 дня. К этому времени объем крови восполняется за счет поступления в сосуды тканевой жидкости, увеличивается количество ретикулоцитов и юных эритроцитов (нормобластов). Из-за дефицита железа уровень гемоглобина снижен.
Железодефицитная анемия В анализе крови отмечается снижение количества эритроцитов и гемоглобина, хотя иногда показатель эритроцитов в норме, содержание в них гемоглобина снижается. Иногда повышается содержание в них клеток предшественников эритроцитов. Биохимический анализ крови: снижаются содержание сывороточного железа менее 11 мкмоль/л при норме для женщин 11–21,5, мужчин — 14,3—25 мкмоль/л, страдает общая способность плазмы связывания железа, повышается уровень свободного железа.
Сидероахрестические анемии При наследственной форме диагностика основывается на клинических симптомах и устойчивости больного к терапии. Показатели крови такие же, как при железодефицитной анемии, однако уровень сывороточного железа повышен. Для хронической интоксикации свинцом типичны мишеневидные эритроциты, высокое содержание сывороточного железа, повышенное разрушение эритроцитов с выделением их в плазму крови, боли в животе, симптомы полиневрита. Характерным признаком является увеличение в моче аминокислоты при отсутствии или небольшом увеличении содержания белков. Наиболее показательно определение свинца в моче после введения комплексона. При В12-дефицитной анемии в общем анализе крови наблюдаются гиперхромная (или нормохромная) анемия, резко выраженные нарушения клеточного состава крови. Количество ретикулоцитов чаще снижено, отмечаются снижение содержания лейкоцитов, иногда тромбоцитов. Характерны деформации нейтрофилов, гигантизм клеток белого и красного ряда. В биохимическом анализе крови повышен уровень билирубина. Основное значение в постановке диагноза принадлежит исследованию костного мозга. В мазке обнаруживается увеличение количества клеток красной крови за счет мегалобластов (иногда до 80–90 %) различной степени зрелости. Пункцию костного мозга следует делать до назначения витамина В12, так как мегалобласты могут исчезнуть из костного мозга уже после первых его инъекций. При фолиеводефицитной анемии состав крови и костного мозга такой же, как при В12-дефицитной анемии.
Гемолитические анемии При наследственном микросфероцитозе в периферической крови увеличено число клеток предшественников эритроцитов до 10 %, иногда до 50–60 %. В мазке крови — аномальные эритроциты в виде маленьких клеток с интенсивной окраской без обычной для нормальных эритроцитов бледности в центре. Среднее число их — 20–30 %. Характерно развитие спонтанного разрушения эритроцитов после двухсуточной инкубации, снижение их устойчивости, возрастание интенсивности кроветворения в 10–15 раз. Биохимический анализ крови: билирубинемия за счет связанного билирубина. Наблюдается усиленное выделение желчных пигментов. Пароксизмальная ночная гемоглобинурия: общий анализ крови — нормохромная, затем гипохромная анемия, уровень сывороточного железа снижен, свободного гемоглобина — повышен. Биохимия крови: повышенный уровень билирубина преимущественно за счет свободной фракции. В моче — появление гемоглобина и гемосидерина. Миелограмма: увеличение количества эритро- и нормобластов. Тест Хэма положительный, проба Кумбса отрицательная. При ферментопатиях диагностика во многих случаях сложна. Существуют экспресс-методы для определения активности лишь некоторых ферментов эритроцитов. Ориентировочное значение имеет метод определения телец Гейнца. Общий анализ крови: уровень гемоглобина и эритроцитов может быть нормальным либо имеет место выраженная анемия. Цветовой показатель близок к единице. Характерны изменения количества и размера кровяных клеток. Типична та или иная форма ретикулоцитоза. При талассемии в крови снижены количество эритроцитов и уровень гемоглобина. Цветовой показатель 0,5 и менее. Среди эритроцитов встречаются мишеневидные. Отмечаются микроцитоз, ретикулоцитоз, повышенный или нормальный уровень сывороточного железа. В цитоплазме эритроцитов — зернистость. При серповидноклеточной анемии в мазках крови отмечаются анизоцитоз, пойкилоцитоз, мишеневидные эритроциты, зернистость эритроцитов, повышение уровня ретикулоцитов. Серповидность может быть выявлена в пробе с метабисульфитом натрия или после наложения жгута на основание пальца. В моче определяется гемосидерин. В случае гемолитической болезни новорожденных диагностика основывается на данных клиники, исследовании антигенной принадлежности эритроцитов матери и плода. При желтушной форме в крови выявляются выраженная анемия, ретикулоцитоз, эритро- и нормобластоз. Повышение уровня билирубина за счет непрямой фракции от 100 до 342 мкмоль/л, в дальнейшем присоединяется и прямая фракция. При анемической форме повышение уровня билирубина умеренное, в анализе крови — анемия, ретикулоцитоз, нормобластоз. В диагностике аутоиммунных гемолитических анемий используют серологические реакции (прямая и непрямая пробы Кумбса, сахарная проба, хранение сыворотки и донорских эритроцитов при различных температурных условиях). В крови отмечаются признаки анемии, ретикулоцитоз, нейтрофильный лейкоцитоз. Биохимия крови: повышение уровня билирубина за счет связанной фракции. В моче — желчные пигменты.
Гипо- и апластические анемии Диагноз ставится на основании клинической картины болезни, картины крови (панцитопения, ускорение СОЭ) и костного мозга (опустошение — резкое уменьшение количества клеток всех ростков кроветворения). При пункции отмечается жировой костный мозг, малоклеточные очаги кроветворения.
Лечение Острая постгеморрагическая анемия Лечение острой постгеморрагической анемии начинается с остановки кровотечения и с противошоковых мероприятий. Показанием к началу терапии является продолжение кровотечения, существенное падение артериального давления в желудочках сердца (ниже 90 мм рт. ст.), учащение пульса на 20 и больше ударов в минуту. В качестве средств заместительной терапии используют заменители плазмы (при потере до 1 л крови): полиглюкин, желатиноль, альбумин, растворы Рингера и физиологический. Целесообразно пользоваться эритроцитарной массой, переливая ее с полиглюкином в соотношении 1:2. При большой потере крови (1 л и более) показано введение донорской цитратной крови, хранившейся не более 5 дней. Недопустимо восполнять всю кровопотерю кровью во избежание развития «синдрома массивных трансфузий».
Железодефицитная анемия Лечение включает устранение источника кровопотери и дефицита железа, длительное применение в достаточной дозе одного из препаратов железа (ферроплекс, ферроградумет, сорбифер, тардиферон и другие в соответствующих дозах), диету с включением значительного количества блюд из мяса и печени, а также свежих фруктов и овощей, богатых железом и аскорбиновой кислотой. Переливания крови должны применяться по жизненным показаниям. Прием препаратов железа надо проводить в течение двух-трех месяцев. При нарушении кишечного всасывания препараты железа применяют в инъекциях (внутривенно или внутримышечно): фербитол, феррум лек. При этом возможно развитие аллергических реакций, очагов воспаления в месте введения. Критерием эффективности терапии является нормализация не уровня гемоглобина и эритроцитов, а главным образом ферритина и сывороточного железа.
Сидероахрестические анемии Наследственная форма: витамин В6, десферал внутримышечно. В случае пиридоксин-устойчивых форм эти препараты малоэффективны. Сидероахрестическая анемия при свинцовой интоксикации: выведение свинца (см. Отравления). Наибольшее применение нашел тетацин калия.
Мегалобластная (витаминодефицитная анемия) В12-дефицитная анемия: витамин В12 вводится ежедневно подкожно в дозе 200–400 мкг, курс — 4–6 недель, после нормализации гемограммы — 1 раз в неделю в течение 2–3 месяцев, затем на протяжении полугода 2 раза в месяц по 200–400 мкг. В последующем для предотвращения рецидива витамин B12 вводится 1–2 раза в год по 5–6 инъекций. При глубокой анемии, симптомах прекоматозного или коматозного состояния делают переливание эритроцитарной массы по 250–300 мл (до 5–6 трансфузий на курс). Фолиеводефицитная анемия: фолиевая кислота назначается в дозе 5—15 мг в сутки внутрь, обычно в сочетании с витамином В12.
Гемолитические анемии При наследственном микросфероцитозе рекомендуется хирургическое лечение. Показания к спленэктомии: частые и тяжелые гемолитические кризы, холангиты, желчнокаменная болезнь. У детей спленэктомию не рекомендуется выполнять раньше 10–11 лет. Пароксизмальная ночная гемоглобинурия: при развитии тяжелой анемии (гемоглобин крови — 70 г/л и менее) переливается 150–200 мл отмытых эритроцитов. При недостаточности кроветворения применяются анаболические гормоны, при тромбозах — подкожное введение гепарина (10–15 тыс. МЕ в сутки), антиагреганты (реополиглюкин, курантил) и дезинтоксикационная терапия (гемодез). Ферментопатии: устранение фактора, спровоцировавшего гемолитический криз. Для профилактики почечной недостаточности внутривенно вводятся 5 %-ный раствор натрия гидрокарбоната, лазикс (фуросемид) по 40–60 мг. Если развилось невыделение мочи, проводится гемодиализ; при анемической коме — переливание отмытых эритроцитов. При талассемии лечение сводится к коррекции анемии эритроцитарной массой, курсовому введению десферала, при частых кризах — к спленэктомии. В период гемолитического криза при серповидноклеточной анемии больной госпитализируется. Его согревают, назначают плазму, ацетилсалициловую кислоту в качестве антиагреганта, при глубокой анемии применяют переливания эритроцитарной массы. При гемолитической болезни новорожденных абсолютным показанием к заменному переливанию крови является уровень билирубина свыше 342 мкмоль/л, его нарастание свыше 6 мкмоль/л в час. Консервативное лечение заключается во внутривенном назначении 5 %-ной глюкозы, фенобарбитала по 10 мг/кг в сутки, фототерапии. При аутоиммунных гемолитических анемиях назначается терапия глюкокортикоидами (преднизолон по 1–1,5 мг/кг, при тяжелом кризе 2–3 мг/кг). В последующем, если гемолиз не удается устранить, назначаются иммунодепрессанты (циклофосфан, азатиоприн, метотрексат и др.). При глубокой анемии (уровень гемоглобина менее 60–70 г/л) переливается подобранная по непрямой пробе Кумбса кровь или отмытые (лучше размороженные) эритроциты. При неэффективности — спленэктомия.
Гипо- и апластические анемии Лечение зависит от причины болезни и должно проводиться в условиях гематологических отделений. Назначаются анаболические гормоны (ретаболил по 1 мл 1 раз в 7 дней, на курс — 4 инъекции, неробол по 10–15 мг внутрь в течение 2–3 недель), глюкокортикоиды (преднизолон по 1–2 мг/кг массы), витамины С, Р, группы В; трансфузии эритроцитарной массы (150–200 мл 1–2 раза в неделю). При неэффективности лечения применяют спленэктомию. Показана трансплантация костного мозга.
АНКИЛОСТОМИДОЗЫ
ОпределениеАнкилостомидозы — кишечные геогельминтозы из группы нематодозов (см.). Включают 2 вида — анкилостомоз и некатороз.
Этиология Возбудители — нематоды (анкилостома и некатор). Оба вида имеют сходное строение. Яйца обоих видов овальные, с тонкой прозрачной оболочкой, трудноразличимы. Продолжительность жизни анкилостомы — 4–5 лет, некатора — 14–15 лет.
Эпидемиология, патогенез и патанатомия Анкилостомидозы широко распространены в зонах тропического и субтропического поясов. В России очаги анкилостомидозов имеются в южных районах. Регистрируются и завозные случаи, особенно часто — некатороза. Источником заражения является зараженный человек, в верхних отделах тонкой кишки которого паразитируют взрослые гельминты, откладывающие яйца. Последние с фекалиями попадают в почву, где при температуре 14–26 °C и достаточной влажности через 2–3 дня они созревают, а затем из них вылупливаются личинки, достигающие через 7—15 дней способности к заражению. Личинка, способная к заражению, жизнеспособна в почве от 7–8 недель до 1,5 года. Заражение происходит при активном внедрении личинок через неповрежденную кожу (слизистые оболочки) при контакте с почвой и растениями (преимущественно при некаторозе) и при проглатывании их с загрязненными овощами, фруктами, водой (преимущественно при анкилостомозе). Личинки совершают миграцию по большому и малому кругам кровообращения, длящуюся 7— 10 дней. В тонком кишечнике личинки превращаются в половозрелые особи и спустя 4–6 недель начинают откладывать яйца. Продолжительность жизни анкилостомид составляет от нескольких месяцев до 20 лет. В период миграции личинки вызывают токсико-аллергические явления. Взрослые гельминты — гематофаги. При фиксации на слизистой оболочке кишки они травмируют ткани, приводят к образованию геморрагий и эрозий, вызывают кровотечения, развитие анемии, поддерживают состояние аллергии, дискинезию желудочно-кишечного тракта и диспепсию. Восприимчивость всеобщая. Наибольшему риску заражения подвержены сельскохозяйственные рабочие, шахтеры, лица, занятые на земляных работах, а также дети. Если источник заражения попал в организм через рот, личинки проникают в тонкий кишечник, где через 4–5 или 8—10 недель они превращаются в половозрелых гельминтов, выделяющих яйца. Чрескожный механизм заражения заключается в миграции личинок по кровеносной системе в легкие, затем в носоглотку, откуда, заглатываясь, они попадают в желудок и кишечник. Анкилостомы — истинные гематофаги, питаются только кровью, прикрепляясь к слизистой оболочке на 1–3 мин и затем меняя место прикрепления. В механизме развития в ранней фазе источника заражения главным является токсико-аллергическое воздействие паразитарных образований, а также разрушение тканей и кровеносных сосудов при перемещении личинок гельминтов. В хронической фазе повреждается слизистая оболочка тонкого кишечника с развитием длительных кровотечений (см.) и железодефицитной анемии (см.). Возможно присоединение микробной флоры с возникновением энтеритов, а также нервнорефлекторное влияние на другие отделы желудочно-кишечного тракта.
Клиническая картина Чрескожный механизм заражения вызывает в месте проникновения личинок местные сыпи эритематозного или экссудативного характера и зуд, что более выражено при повторных заражениях. Попав в кровяное русло, личинки передвигаются по сосудам, достигают легочных капилляров, затем выходят в бронхи и через верхние дыхательные пути попадают в рот, затем заглатываются, и процесс повторяется. Спустя 3–5 дней развиваются симптомы поражения легких: кашель, одышка, при массивном заражении в легких отмечаются нестойкие эозинофильные скопления, бронхит (см.), ларингит (см.). Часто возникает лихорадка. Симптомы, связанные с перемещением личинок, могут наблюдаться в течение 2–3 недель, затем исчезают. В случае заражения через рот данные симптомы не отмечаются. Хроническая фаза заражения характеризуется комплексом симптомов дуоденита (см.), перидуоденита и еюнита. Преобладают жалобы на боли в верхней части живота, нередко сильные, сходные с таковыми при язвенной болезни (см.) желудка и двенадцатиперстной кишки. При длительном либо массивном заражении присоединяются тошнота, рвота, ощущение дискомфорта, метеоризм, послабление стула. Иногда отмечается стул с примесью слизи и крови. В дальнейшем преобладают симптомы гипохромной анемии (см.): слабость, быстрая утомляемость, одышка, головокружение, шум в ушах. Кожа и слизистые бледные. При выраженной анемии страдают внутренние органы, развиваются отеки, глоссит (см.). Анемии наиболее подвержены дети раннего возраста и беременные женщины, а также больные с белково-витаминной недостаточностью. Прогноз в большинстве случаев благоприятный. Отмечается снижение трудоспособности среди взрослого населения; кроме того, анкилостомидозы отрицательно сказываются на развитии детей.
Диагностика При исследовании крови на ранних стадиях отмечается выраженная эозинофилия (до 30–60 %). В хронической фазе заражения определяются гипохромия, умеренная эозинофилия, увеличение СОЭ. Количество ретикулоцитов обычно повышено. Диагноз подтверждается обнаружением в свежем кале яиц анкилостомид, при невозможности быстрой доставки материала он хранится в холодильнике или консервируется. Используется серодиагностика. Больной считается вылеченным, если при контрольной овоскопии через 2–3 недели яйца гельминтов отсутствуют.
Лечение В терапии используются средства, направленные на устранение причин заболевания и нарушений. Из противогельминтных препаратов используются: вермокс — взрослым по 100 мг 2 раза в день, курс — 3 дня; детям до 7 лет препарат назначают по 25 мг 2 раза в день, 7–9 лет — 50 мг 2 раза в день, старше 9 лет — 100 мг 2 раза в день однократно курсом 3 дня (принимать через 1 ч после еды); эффективность — 80–90 %; комбактрин назначают и взрослым, и детям по 10 мг/кг массы в сутки в 2–3 приема курсом 3 дня (принимать через 1 ч после еды); эффективность — 60–80 %; нафтамон назначают в разовой и курсовой дозе по 5 г натощак. При глубокой анемии предварительно применяют препараты железа, белково-витаминную диету. При нарушении белкового обмена больные нуждаются в параллельном проведении белковозаместительной терапии и срочной терапии, направленной на устранение гельминтов.
АНОРЕКСИЯ НЕРВНАЯ
ОпределениеАнорексия нервная (анорексия неврогенная, нервно-психическая) — патологическое состояние, характеризующееся ненормальным пищевым поведением и отсутствием аппетита. Оно возникает вследствие стремления к коррекции внешности и приводит к выраженным нарушениям эндокринной системы и внутренних органов. Заболевание встречается главным образом среди девочек-подростков и молодых девушек.
Больная нервной анорексией
Этиология и патогенез Факторы возникновения и механизм развития заболевания изучены недостаточно. Отмечается важная роль нарушения регуляции со стороны эндокринной системы в период полового созревания, психических особенностей личности (упрямство, стремление к повышенному контролю над собой, самоутверждению), особенностей внутрисемейных отношений (чрезмерная опека со стороны матери). Голодание, приводящее к истощению, вызывает вторичные нейроэндокринные и обменные изменения, оказывающие воздействие на функцию мозговых структур, что вызывает изменения в психике. Формируется замкнутый круг нарушений в психике и физиологии человека.
Клиническая картина В основе патологического стремления к похудению лежит недовольство излишней полнотой, стремление к коррекции фигуры. С этой целью вначале полностью исключается любая высококалорийная пища, затем сознательно все более и более ограничивается объем дневного рациона. Параллельно девушки занимаются интенсивными физическими тренировками, принимают слабительные и мочегонные средства, регулярно делают клизмы. По мере потери массы тела (как правило, значительной — до 25–50 %) развиваются вторичные нарушения в работе внутренних органов, изменения в эндокринной системе. В первую очередь наступает аменорея (см.), которая может явиться поводом для обращения к врачу. Развиваются гипотония (см.), брадикардия (см.); несмотря на высокую двигательную активность, отмечаются зябкость, повышенная температура, сухость кожи, запоры. Около половины больных не выдерживают длительного голодания и прибегают к вызыванию рвоты после приема сколько-нибудь значительного количества пищи. Нередко у них развивается булимия (см.), и рвота часто бывает связана с ней. Очень скоро неприятные проявления при рвоте притупляются, напротив, возникает приятное чувство «очищенности» организма. Потеря массы более 50 % от исходной приводит к развитию кахексии. Больные полностью утрачивают критику к своему состоянию, подкожно-жировая клетчатка у них совершенно отсутствует, отмечаются гипертрихоз (см.), сухость кожи, отеки, выраженные нарушения состава крови. Без терапевтического вмешательства это состояние приводит к смерти. В целом при нервной анорексии смертельный исход составляет 20 % (по данным Американской ассоциации психиатров).
Диагностика Диагноз нервной анорексии на ранних стадиях затруднен, да и в последующем больные тщательно скрывают причину своего похудения, в связи с чем длительное время лечатся и обследуются у врачей разных специальностей. При нарастающей потере массы, особенно у молодых девушек и женщин, кроме других методов исследования, необходимо наблюдение за их пищевым поведением. Как правило, диагноз ставится в поздних стадиях заболевания, когда степень потери массы тела становится угрожающей. Дифференцировать нервную анорексию следует с болезнью Симмондса (гипофизарной кахексией (см.), надпочечниковой недостаточностью, неврозами с аноректическим синдромом, депрессиями и шизофренией (см.).
Лечение Человека, страдающего анорексией, необходимо обязательно госпитализировать в психиатрический стационар, чтобы изолировать от семьи, а также для надзора за надлежащим питанием. В стадии кахексии следует начинать с введения внутрь элементных смесей. Затем следует терапия психотропными средствами, после чего наступает этап социальной адаптации. После выписки из стационара больным необходим длительный контакт с психотерапевтом. У 1/3 девушек после восстановления массы тела не наступают менструации, вследствие чего им необходимо лечение у гинеколога-эндокринолога.
АНТРИТ
ОпределениеАнтрит (отоантрит) — воспаление слизистой оболочки пещеры сосцевидного отростка (антрума).
Этиология и патогенез Антрит является осложнением острого гнойного отита (см.). У детей до 1 года сосцевидный отросток еще не развит. В толще сосцевидной части височной кости располагается сосцевидная пещера, сообщающаяся с барабанной полостью. Инфекция проникает через зубной канал. Заболевание развивается у детей грудного возраста, чаще у недоношенных, а также при пониженном питании и у ослабленных различными заболеваниями.
Клиническая картина Заболевание может протекать явно или латентно. Катаральный антрит протекает без значительных нарушений в общем состоянии ребенка. При гнойном антрите, напротив, наблюдается повышение температуры до 38–38,5 °C, нарушение общего состояния. Ребенок сонлив или, наоборот, беспокоен, часто плачет, плохо сосет грудь, худеет, кожа становится бледно-серой или синюшной, тоны сердца приглушены, пульс учащен, стул жидкий. Отмечается увеличение регионарных лимфоузлов. Отоскопически барабанная перепонка серого цвета, тусклая, заметно ее выпячивание. Состояние ребенка значительно ухудшается, когда в процесс вовлекается костная ткань сосцевидного отростка. Антрит может протекать и латентно. Он встречается у детей-гипотоников, страдающих рахитом, пневмонией и др. Латентный антрит наблюдается: — при сохранении у ребенка токсикоза; — при быстром падении веса; — при субфебрилитете. У ребенка меняется тургор тканей, цвет кожи становится бледно-серый, определяется «немой Вебер» — поворот глаз ребенка в сторону больного уха при установке камертона на темени ребенка.
Диагностика Диагноз основывается на данных клиники и отоскопической картине. В крови отмечается повышение СОЭ, лейкоцитоз с нейтрофильным сдвигом влево. Поставить точный диагноз позволяют тимпанопункция, пробный парацентез, антропункция, рентгенологическое исследование височной кости.
Лечение Лечение должно быть направлено на основное заболевание (см. Отит), включать в себя антибактериальную терапию, предпочтительнее с определением чувствительности микрофлоры к антибиотикам либо препаратам широкого спектра действия. Хороший эффект оказывают инъекции антибиотика в область задне-верхней стенки наружного слухового прохода. При токсикозе применяют гамма-глобулин, переливание сухой плазмы, внутривенные вливания раствора глюкозы. Если консервативная терапия не дает ожидаемого эффекта, выполняют пункцию с введением в полость антибактериального препарата либо антротомию под местной анестезией.
АОРТИТ
ОпределениеАортит — воспалительное поражение стенок аорты.
Этиология и патогенез Воспаление стенок аорты может возникать в результате инфекции и аллергии. К аллергическим формам поражения относят аутоиммунные, инфекционно-аллергические и токсико-аллергические. Развитию инфекционного аортита способствует проникновение инфекционного агента в стенку аорты с кровью или лимфой, а также переход воспалительного процесса на аорту с прилежащими к ней внутренними органами. Воспаление всей толщи стенки аорты называют панаортитом, при изолированном поражении одной из оболочек говорят о периаортите, мезаортите и эндаортите. Аортит обычно развивается при системных сосудистых поражениях — например, при ревматизме (см.), а также таких инфекциях, как туберкулез (см.) и сифилис (см.), редко он встречается изолированно.
Патанатомия Изменения макро- и микроструктуры аорты зависят от природы аортита. Сифилитический аортит приводит к формированию на внутренней поверхности аорты структуры коры дерева или шагреневой кожи. В результате распространения патологического процесса на основания заслонок аортального клапана возникает его недостаточность. В ряде случаев в стенке аорты обнаруживают опухоли. Растягиваясь вследствие гибели эластических волокон, аорта нередко достигает размеров большой аневризмы. При гнойном аортите характерно флегмонозное или абсцедирующее воспаление стенок аорты, их расслаивание, в ряде случаев — перфорация (см.). Некротический язвенный аортит, причиной которого является переход воспалительного процесса на эндотелий аорты при подостром септическом эндокардите (см.), вызывает сморщивание внутренней поверхности аорты. Иногда на ней просматриваются вегетации и участки изъязвления, некоторые из них прикрыты кровяными наслоениями. Возможны перфорация и расслаивание аортальной стенки. Туберкулезный аортит обычно наблюдается совместно с туберкулезным поражением прилежащих к аорте органов: легких, лимфоузлов средостения, позвоночника. В стенке аорты отмечаются специфические образования и небольшие очаги некроза. Формируются изъязвления эндотелия, кальциноз, участки аневризм (см.). Иногда на внутренней поверхности аорты выявляют милиарные бугорки. Ревматический панаортит характеризуется мукоидным отеком, фибриноидным набуханием тканей, развитием специфических гранулем и склероза. Как правило, гранулемы располагаются в срединной оболочке. Неспецифический аортоартериит (болезнь Такаясу) характеризуется признаками продуктивного воспаления с повышенным замещением соединительной ткани. Гранулемы при этом не образуются.
Клиническая картина Течение аортита может быть острым (при гнойном или некротическом характере воспаления), подострым (при поражении эндотелия аорты бактериальными агентами) и хроническим, что чаще встречается при продуктивном или абактериальном характере воспаления. Симптоматика складывается из проявлений основного заболевания — сепсиса (см.), туберкулеза (см.), сифилиса (см.), ревматизма (см.) и др. — и поражения собственно аорты. Для аортита характерно развитие аорталгии, стеноза, аневризмы (см.) или расширения пораженного участка; также наблюдаются признаки нарушения кровотока в отходящих от аорты артериях. Аорталгия характеризуется давящим или жгучим характером, боли смещаются в обе руки, шею, межлопаточную область, верхнюю часть живота. В отличие от стенокардии (см.) боль не приступообразная, а длительная, может продолжаться часами и сутками, с периодической сменой интенсивности, не прекращается нитратами. Вследствие сдавления аортой трахеи и блуждающего нерва при попытке больного поднять руки вверх у него могут возникать приступы одышки и приступообразный кашель. На фоне этих проявлений может возникать аорталгия. Однако симптоматику аортита может давать и истинная стенокардия, возникающая при коронарной недостаточности (поражении устьев венечных артерий). При поражении брюшной аорты боль может локализоваться в спине или животе. Возможно развитие «брюшной жабы», а также сосудопочечной гипертензии (см.), нарушений кровоснабжения конечностей (чаще при неспецифическом аортоартериите). При прощупывании (при аортите в брюшном отделе), при прослушивании (при поражении восходящей аорты), а также рентгенологически в большинстве случаев выявляется расширение аорты, доходящее до размеров аневризмы (см.). Над аневризмой часто удается выслушать систолический шум. Обнаружение кальциноза стенок аорты у молодых людей может свидетельствовать либо о сифилитическом характере поражения, либо о развитии болезни Такаясу. Прогноз серьезен при бактериальном аортите с острым и подострым течением. Если болезнь осложняется сифилисом или туберкулезом, прогноз более благоприятен при рано начатом лечении. В остальных случаях прогноз зависит от основного заболевания.
Диагностика В диагностике аортитов применяют клинико-лабораторные и инструментальные методы исследования. Диагноз аортита правомочен при наличии типичных аорталгий, симптомов ишемии (см.) органов, признаков значительного расширения аорты, а также наличии признаков воспаления (лихорадка, потливость, нейтрофильный лейкоцитоз, повышение СОЭ белка) или иммунных нарушений. Для подтверждения сифилитической природы аортита используют классические серологические реакции, исследование спинно-мозговой жидкости. Для выявления причины бактериальных аортитов во всех случаях используются посевы артериальной крови. Уточнить диагноз позволяют данные аортографии, компьютерной томографии.
Лечение Лечение может увенчаться успехом только при своевременной и соответствующей терапии основного заболевания. В начале лечения при висцеральном сифилисе (см.) возможно обострение симптомов аортита. При аллергических и аутоиммунных поражениях используют глюкокортикостероиды, аминохинолиновые производные (делагил), иммунодепрессанты. При наличии аневризмы, особенно при появлении признаков ее расслаивания, показано хирургическое лечение (удаление пораженного сегмента с последующим его протезированием).
АПОПЛЕКСИЯ ЯИЧНИКА
ОпределениеАпоплексия яичника (гематома (см.) яичника, инфаркт (см.) яичника, разрыв желтого тела) — внезапно наступившее кровоизлияние в яичник, сопровождающееся нарушением его целостности и кровотечением (см.) в брюшную полость. Чаще встречается апоплексия правого яичника.
Этиология и патогенез Как правило, основной причиной апоплексии яичника является разрыв желтого тела, образующегося после овуляции. Разрыв желтого тела возможен и при наступившей беременности. Провоцирующим фактором могут быть: травма брюшной полости, сильное физическое напряжение, бурное и прерванное половое сношение. Обычно апоплексия развивается на фоне патологических изменений сосудов и ткани яичника вследствие хронических воспалительных процессов — аднексита (см.), аппендицита (см.) и др.
Клиническая картина Чаще апоплексия отмечается у женщин в возрасте 20–36 лет, в середине или второй половине менструального цикла. Внезапно возникает острая боль внизу живота, как правило, со стороны поражения, возникают признаки внутрибрюшного кровотечения: головокружение, слабость, холодный пот, тошнота, рвота, бледность кожи и видимых слизистых, учащение пульса, снижение артериального давления, обморочное состояние. В ряде случаев из половых путей отмечаются скудные кровянистые выделения. При прощупывании определяются напряжение мышц передней брюшной стенки, нередко — симптомы раздражения брюшины. При прослушивании отмечается скопление жидкости (крови) в отлогих частях живота. Отмечаются сглаженность и легкая отечность заднего свода влагалища, увеличенный и резко болезненный яичник мягкой консистенции. При значительном объеме кровоизлияния в брюшную полость прощупывание матки и ее придатков может быть затруднено. Воспалительных изменений не отмечается. Прогноз при своевременном лечении благоприятный.
Диагностика Диагноз основывается на данных опроса и полного исследования. Если преобладающими являются симптомы внутрибрюшного кровотечения, апоплексию яичника дифференцируют с нарушенной внематочной беременностью (см.), при преобладании болевого синдрома — с аппендицитом (см.). Окончательный диагноз в ряде случаев позволяет установить лишь лапаротомия (лапароскопия).
Лечение Осуществляется в условиях стационара, куда женщина должна быть экстренно доставлена (транспортировка на носилках с приподнятым ножным концом). Выполняется лапаротомия с последующим ушиванием разрыва или удалением яичника. В случае массивного продолжающегося кровотечения яичник удаляют. Разрыв желтого тела у беременной ушивают, беременность продолжают. В некоторых случаях при общем удовлетворительном состоянии больной (нормальном пульсе и артериальном давлении) и незначительном характере внутрибрюшного кровотечения, а также полной уверенности врача в диагнозе возможно проведение консервативной терапии — холод на живот, покой, противовоспалительные средства.
АППЕНДИЦИТ
ОпределениеАппендицит — воспаление червеобразного отростка слепой кишки; одно из наиболее распространенных хирургических заболеваний брюшной полости. Чаще отмечается в возрасте от 10 до 30 лет, но может развиться в любом возрасте.
Этиология и патогенез В качестве инфекционного агента выступает, как правило, смешанная флора (кишечные палочки, стафилококки, стрептококки, анаэробы). Возбудители внедряются в стенку червеобразного отростка энтерогенным путем (т. е. непосредственно из его просвета). Этому способствует застой содержимого в отростке, связанный, как правило, с закупоркой просвета каловыми конкрементами либо инородными телами, лимфоидной гиперплазией, а также при кишечных заражениях. При этом давление в полости отростка повышается, возникает застой в сосудах его стенки, что приводит к усиленному размножению бактерий и снижению защитных свойств слизистой оболочки. Существенная роль принадлежит предрасполагающим факторам, например характеру питания с повышенным количеством мясной пищи, ведущей к запорам и интоксикации продуктами распада белка, что в то же время является идеальной питательной средой для размножения бактерий.
Патанатомия Различаются острый и хронический аппендицит. Острый аппендицит можно разделить на простой и деструктивный, т. е. с разрушением стенки (флегмонозный, апостематозный, флегмонозно-язвенный, гангренозный). При простом аппендиците в первые часы отмечаются признаки расстройства крово- и лимфообращения в дистальных отделах отростка, отек и кровоизлияния; в последующие часы возникают первичные аффекты гнойного воспаления слизистой оболочки в виде конусовидных фокусов. Вершиной они обращены в сторону слизистой, на поверхности которой отмечаются дефекты. Отросток набухший, его поверхность полнокровная и тусклая. В дальнейшем на этой стадии может наступить обратное развитие процесса либо переход в разрушающие формы. К концу первых суток инфильтрат распространяется на все слои стенки отростка (флегмонозный аппендицит). Стенка утолщена, из просвета выделяется гной. Брыжейка отростка отечна, гиперемирована. При появлении на фоне распространенного гнойного воспаления отростка мелких абсцессов аппендицит считают апостематозным. Присоединение к флегмонозному воспалению изъязвлений слизистой оболочки характеризуется развитием флегмонозно-язвенного аппендицита. Дальнейшее прогрессирование процесса приводит к гангренозному аппендициту. Переход гнойного воспаления с отростка на окружающие ткани характеризуется развитием периаппендицита, на брыжейку — мезентериолитом. Перфорация стенки отростка, которая может возникнуть при флегмонозно-язвенном аппендиците, ведет к прорыву его содержимого в брюшную полость и развитию гнойного перитонита (см.) отграниченного или разлитого.
Прободение отростка при гангренозном аппендиците: А — прободное отверстие
Хронический аппендицит развивается после перенесенного острого и характеризуется процессами склерозирования и атрофии (см.), на фоне которых могут возникать воспалительно-разрушающие изменения. Обычно воспаление и разрушение сменяются разрастанием грануляционной ткани в стенке и просвете отростка, между серозной оболочкой которого и окружающими тканями образуются спайки. Иногда в просвете накапливается серозная жидкость, а отросток превращается в кисту.
Дивертикул отростка при хроническом аппендиците
Клиническая картина Часто встречаются чрезвычайно разнообразные клинические проявления. Это во многом зависит от топографического расположения червеобразного отростка. Типично он располагается лишь в половине случаев. Он при этом располагается свободно в правой подвздошной области. В других случаях он может располагаться позади слепой кишки, может свисать в полость малого таза или смещаться верхушкой в сторону позвоночника, может располагаться высоко над печенью. Типичная клиническая картина острого аппендицита характеризуется приступом боли в правой подвздошной области, выраженной местной и общей реакцией организма. Характерна анорексия (см.). Первоначально отмечается тупая боль без четкой локализации в верхней половине живота или области пупка. Через 4–6 ч (с колебаниями от 1 до 12 ч) боль перемещается в правую подвздошную область. Изменение локализации болей с возникновением болезненности в правой подвздошной области указывает на раздражение висцеральной брюшины. Локализация боли зависит от расположения червеобразного отростка: при типичном положении боль ощущается в правой подвздошной области, при высоком положении — в области правого подреберья, при ретроцекальном положении — на боковой поверхности живота или в поясничной области, при тазовом положении — над лобком. Тошнота — частый симптом острого аппендицита, иногда (особенно в начале заболевания) возможна рвота. Стул в большинстве случаев не нарушен, у детей чаще отмечается запор, иногда может быть диарея (см.) — редко, обычно при выраженной интоксикации. Язык в начале заболевания влажный, часто обложен белым налетом, но быстро становится сухим. Больной лежит на спине или правом боку; изменение положения тела, кашель, смех, чиханье резко усиливают боль в животе. Осмотр живота может выявлять отставание правого нижнего квадранта брюшной стенки при дыхании. При прощупывании обнаруживают напряжение мышц и резкую болезненность в правой подвздошной области. Здесь же могут определяться положительные симптомы раздражения брюшины. Боль может усиливаться при положении больного на левом боку, особенно при прощупывании. При ретроцекальном расположении отростка может отмечаться усиление болезненности при поднимании выпрямленной правой ноги; проверять осторожно, при грубом давлении на брюшную стенку возможна перфорация (см.) отростка. При ректальном и вагинальном исследовании отмечается болезненность при прощупывании правой стенки таза (особенно при тазовом положении отростка). К общим симптомам аппендицита относится слегка повышенная (у детей — высокая) температура. Пульс в первые сутки может учащаться до 100 уд./мин, артериальное давление снижается при выраженной интоксикации. В начальном периоде заболевания, когда процесс ограничен только самим отростком, возможно благоприятное течение с обратным развитием симптомов на 3—4-е сутки (нормализация температуры, исчезновение болей в животе, восстановлениеаппетита). В других случаях возможно образование аппендикулярного инфильтрата (также на 3—4-е сутки). Он формируется при отграничении воспаления с участием большого сальника, брыжейки и петель тонкой кишки. Обычно состояние больного улучшается, снижается интенсивность болей в правой подвздошной области. Температура слегка повышена. При осмотре живот мягкий, определяется ригидность мышц и умеренная болезненность в правой подвздошной области, здесь же прощупывается малоболезненное, плотное, малоподвижное образование без четких границ. В дальнейшем инфильтрат может рассосаться или привести к развитию аппендикулярного абсцесса (см.). В первом случае инфильтрат вначале уплотняется, границы его становятся четкими, затем постепенно происходит его рассасывание (в среднем — за 4–6 недель), состояние больного прогрессивно улучшается. Во втором случае состояние больного ухудшается, возрастает амплитуда колебания температуры, инфильтрат увеличивается в размерах, становится резко болезненным, в его центре отмечается размягчение. Без операции абсцесс (см.) может прорваться в брюшную полость с развитием перитонита (см.) либо в просвет слепой кишки. В этом случае у больного отмечаются жидкий зловонный стул и быстрое улучшение общего состояния. К осложнениям острого аппендицита относят формирование абсцессов (см.) различной локализации (поддиафрагмальных, тазовых, межпетлевых), тромбофлебита (см.) тазовых или подвздошных вен, пилефлебита, перфорацию отростка с развитием гнойного перитонита (см. перитонит).
Тазовый аппендикулярный абсцесс
Схема расположения наиболее частых периаппендикулярных абсцессов: 1 — ретроцекальный абсцесс; 2 — илеоцекальный абсцесс; 3 — абсцесс дугласова пространства
Перфорация (см.) отростка характеризуется внезапным резким усилением боли при характерных клинических проявлениях острого аппендицита и распространением ее по всему животу. Общее состояние больного быстро ухудшается. Нарастает интоксикация, постепенно развивается прогрессирующий парез желудочно-кишечного тракта, проявляющийся вздутием живота, срыгиванием и рвотой застойным желудочным содержимым. Другие симптомы — сухой обложенный язык и тахикардия (см.), не соответствующая уровню лихорадки. При физикальном исследовании определяются разлитое напряжение мышц и болезненность по всему животу с положительными симптомами раздражения брюшины, полное отсутствие перистальтических шумов кишечника.
Перфорированный отросток
Течение острого аппендицита у детей, стариков и беременных женщин отличается своими особенностями. У детей в начальной стадии заболевания отмечаются тошнота, многократная рвота, высокая температура, разлитая боль в животе, в связи с чем нередко допускаются диагностические ошибки. У стариков снижение реактивности организма обусловливает стертость клинических симптомов заболевания. В результате заболевание диагностируется позже. Отсюда преобладание разрушающих форм острого аппендицита и нередко — аппендикулярных инфильтратов. У беременных начиная с 18–20 недель смещение купола слепой кишки и червеобразного отростка маткой приводит к изменению типичной локализации болей, а расположение отростка за маткой — к снижению выраженности перитонеальных симптомов. Хронический аппендицит обычно проявляется периодически усиливающейся болезненностью в правой половине живота. Отмечаются упорные запоры, иногда сменяющиеся поносами. Для хронического аппендицита характерна локальная болезненность в определенных точках: на границе наружной и средней трети линии, соединяющей правую верхнюю подвздошную ость и пупок; на границе правой и средней трети линии, соединяющей правую и левую верхние передние подвздошные ости; на 1–2 см ниже и вправо от пупка.
Диагностика В диагностике острого аппендицита важнейшая роль принадлежит полному исследованию. В типичных случаях диагноз не сложен, однако атипичность расположения и особенности течения воспалительного процесса иногда чрезвычайно затрудняют его. Симптомы Щеткина-Блюмберга, Раздольского, Ровзинга (появление боли в правом нижнем квадранте при прощупывании левого нижнего квадранта) указывают на раздражение брюшины. При атипичном расположении отростка используют симптомы Образцова, запирающей мышцы (болезненность при пассивном внутреннем вращении согнутого правого бедра при положении больного лежа на спине). При тазовом аппендиците могут отмечаться боль при исследовании прямой кишки и повышение давления в дугласовом пространстве. В крови отмечается умеренный лейкоцитоз (10–12 г/л) с незначительным нейтрофильным сдвигом. В моче может отмечаться повышенное количество лейкоцитов при локализации воспаленного червеобразного отростка около мочеточника или мочевого пузыря. При развитии осложнений (перфорации, перитонита) уровень количества лейкоцитов значительно возрастает. Для диагностики хронического аппендицита используют обычно контрастное рентгенологическое исследование отростка, слепой кишки и терминальной петли подвздошной кишки. Рентгенологическими признаками хронического аппендицита являются необычное положение отростка, фиксация его спайками, длительная (до 2–3 суток) задержка бариевой массы в отростке, наличие камней в просвете отростка, деформация слепой кишки. В целях дифференциальной диагностики с объемными образованиями проводят колоноскопию слепой кишки. Дифференциальный диагноз проводят с почечной коликой (см.), острым аднекситом (см.), внематочной беременностью (см.), острым энтеритом (см.), мезаденитом (см.), дивертикулитом (см.), острым холециститом (см.), острым панкреатитом (см.), прободной язвой желудка и двенадцатиперстной кишки (см.), правосторонней пневмонией (см.) и др.
Лечение Лечение аппендицита — хирургическое. Общепринятая тактика заключается в ранней операции, хотя при установлении диагноза острого аппендицита оперируют больного вне зависимости от того, сколько времени прошло от начала заболевания. На догоспитальном этапе больному назначают строгий постельный режим, запрещают прием пищи и питья. Транспортировка больного в стационар осуществляется строго в положении лежа. Запрещается использовать грелки, слабительные и анальгетики. Лечение аппендикулярного образования, когда он плотен и отграничен, консервативное. Назначают механически щадящую диету, холод на живот, антибиотики широкого спектра действия, метронидазол. Спустя несколько дней переходят к тепловым процедурам. Благодаря такому комплексу в большинстве случаев удается добиться полного рассасывания образования. Если в ответ на консервативную терапию инфильтрат увеличивается в размерах, а состояние больного ухудшается (развитие аппендикулярного абсцесса), это является показанием к экстренной лапаротомии. Больным острым аппендицитом без признаков перитонита операцию удаления аппендикса проводят немедленно, без подготовки. У худощавых пациентов молодого возраста удаление аппендикса, как правило, проводят под местной анестезией 0,25—0,5 %-ным раствором новокаина. При выраженном болевом синдроме у больных с неустойчивой психикой, детей, беременных, больных пожилого и старческого возраста следует отдать предпочтение общему обезболиванию. При развитии распространенного и разлитого перитонита больные нуждаются в предоперационной подготовке, которую в течение 2–3 ч проводят совместно хирург и анестезиолог. Оперативное вмешательство состоит в удалении аппендикса, промывании брюшной полости, ее дренировании. При разлитом перитоните после операции проводят перитонеальный лаваж. Прогноз серьезный. Оперативное лечение при хроническом аппендиците показано при упорном болевом синдроме, нарушающем трудоспособность больного. В остальных случаях проводят консервативную терапию (физиотерапия, борьба с запорами, спазмолитики и пр.).
АРИТМИИ
ОпределениеАритмии сердца — любой сердечный ритм, не являющийся регулярным синусовым ритмом нормальной частоты, а также нарушение проводимости электрического импульса по разным отделам проводящей системы сердца.Аритмии подразделяются преимущественно на нарушения функций автоматизма, возбудимости и проводимости. Классификация аритмий: 1. Нарушение образования импульса: а) номотопные аритмии — нарушение образования импульса в синусовом узле. К ним относятся: синусовая тахикардия, синусовая брадикардия, синусовая аритмия, отказ синусового узла; б) гетеротопные (эктопические) аритмии — импульс зарождается вне синусового узла. К ним относятся: — активные гетеротопные нарушения ритма. Могут выражаться экстрасистолией, пароксизмальной тахикардией, непароксизмальной тахикардией, фибрилляцией предсердий, трепетанием и мерцанием желудочков; — пассивные эктопические нарушения ритма. К ним относятся: медленный сердечный ритм, внутрипредсердная блокада, мигрирующий ритм, желудочковый ритм, замещающие систолии. 2. Нарушение проведения импульса: а) синоатриальная блокада; б) внутрипредсердная блокада; в) атриовентрикулярная блокада; г) внутрижелудочковая блокада. 3. Состояния нарушения образования и проведения импульса (комбинированные аритмии): а) синдром слабости синусового узла; б) атриовентрикулярная диссоциация; в) парасистолия; г) синдром преждевременного возбуждения желудочков.
Нарушения функции автоматизма Синусовая тахикардия — учащение сердечных сокращений до 90—160 уд./мин в состоянии покоя при сохраненном правильном синусовом ритме. Синусовая брадикардия — урежение частоты сердечных сокращений до 60 уд./мин и менее при сохраненном правильном синусовом ритме. Синусовая аритмия — неправильный синусовый ритм, характеризующийся периодами постепенного учащения и урежения ритма вследствие образования импульсов в синусовом узле с периодически меняющейся частотой. Синдром слабости синусового узла — ослабление или потеря синусовым узлом функции автоматизма.
Эктопические комплексы или ритмы При появлении эктопических комплексов или ритмов импульсы исходят из очага, расположенного вне синусового узла. Они бывают активными (экстрасистолия, парасистолия, пароксизмальная тахикардия) и пассивными. Экстрасистолия — нарушение сердечного ритма, характеризующееся преждевременным сокращением всего сердца или отдельных его частей. Парасистолия — эктопический ритм с активным разнородным очагом, характеризующийся ответом миокарда в виде возбуждения предсердий, желудочков или всего сердца на каждый из импульсов. Пароксизмальная тахикардия — нарушение сердечного ритма в виде приступов сердцебиений с частотой сокращений 140–220 уд./мин. Предсердные эктопические ритмы характеризуются установкой ритма для всего сердца эктопическим очагом, расположенным в левом или правом предсердии.
Мерцание и трепетание Мерцание предсердий (мерцательная аритмия) — нарушение сердечного ритма, при котором на протяжении всего сердечного цикла отмечаются частые сокращения отдельных мышечных волокон предсердий, а согласованное их сокращение отсутствует. Трепетание предсердий — учащение сокращений предсердий при сохранении правильного предсердного ритма. Трепетание и фибрилляция желудочков — частое ритмичное сокращение желудочков, обусловленное устойчивым круговым движением импульса, вырабатываемого в желудочках.
Нарушения функций проводимости Синоаурикулярная блокада — нарушение проведения импульса от синусового узла к предсердиям. Внутрипредсердная блокада — нарушение проведения импульсов внутри проводящей системы предсердий. Атриовентрикулярная блокада — нарушение проведения импульса от предсердий к желудочкам. Асистолия желудочков — прекращение электрической и механической активности желудочков — остановка сердца. Блокада ножек пучка Гиса — нарушение проведения наджелудочковых импульсов по одной из ножек пучка Гиса. Синдром Вольфа-Паркинсона-Уайта обусловлен наличием дополнительного пути проведения между предсердиями и желудочками. Синдром CLC обусловлен наличием дополнительного пути проведения между предсердиями и пучком Гиса (пучок Джеймса).
Этиология На возникновение аритмии могут влиять различные факторы развития. Среди них отмечают функциональные расстройства и органические поражения центральной нервной системы: стрессы, неврозы (см.), опухоли (см.), травмы черепа, нарушения мозгового кровообращения и пр.; нервно-рефлекторные факторы (нарушения позвоночника и др.); поражения миокарда и сердечно-сосудистой системы: ишемическая болезнь сердца (см.) и инфаркт миокарда (см.), миокардиты (см.), кардиомиопатии (см.), пороки сердца, нарушения крупных сосудов, гипертоническая болезнь (см.), перикардиты (см.), опухоли сердца; нарушения электролитного баланса, особенно калиевого, кальциевого и магниевого; влияние токсинов — бактериальных и промышленных; привычные интоксикации (алкоголь, никотин); интоксикации лекарственными препаратами — сердечными гликозидами, бета-блокаторами, мочегонными и др.; кислородная недостаточность; эндокринопатии (тиреотоксикоз (см.), феохромоцитома (см.) и др.
Патогенез Среди механизмов развития аритмий большая роль принадлежит изменению соотношения содержания ионов калия, магния и кальция внутри клеток миокарда и во внеклеточной среде. Это приводит к изменениям возбудимости, резкому ее снижению, изменению проводимости синусового узла, проводящей системы и сократительности миокарда.
Клиническая картина Нарушения функции автоматизма Синусовая тахикардия субъективно проявляется сердцебиением, чувством тяжести, иногда болью в области сердца. Частота сердечных сокращений может достигать 160 уд./мин. При прослушивании тон на верхушке усилен, может отмечаться маятниковый ритм. Существующие ранее шумы могут ослабевать или исчезать. Синусовая брадикардия клинически часто не проявляется. Иногда больные жалуются на редкий ритм сердца, слабость, чувство замирания сердца, головокружение. Однако в ответ на физическую нагрузку появляется учащение пульса, что отличает брадикардию от полной атриовентрикулярной блокады с брадикардией. Нередко отмечается сочетание с синусовой аритмией. Синусовую аритмию подразделяют на дыхательную аритмию и аритмию, не зависящую от дыхания. Жалобы больных обычно незначительны и проявляются сердцебиением или замиранием сердца. Пульс и частота сердечных сокращений то ускоряются, то замедляются. При дыхательной аритмии имеется четкая связь с фазами дыхания, после задержки дыхания она исчезает. Сила и звучность сердечных тонов не изменены. Синдром слабости синусового узла. Скрытая форма клинически ничем не проявляется. В других случаях проявляется выраженной брадикардией, болями в области сердца, нарушениями кровотока в головном мозге в виде головокружений, обмороков, снижения памяти, головной боли, временного снижения двигательных функций, расстройств речи, приступов Морганьи. При синдроме Шорта увеличивается риск образования внутрисердечных тромбов и некоторых осложнений, среди которых нередки ишемические инсульты. Состояния, обусловленные приступами Морганьи, характеризуются внезапностью, отсутствием предобморочных реакций, выраженной бледностью в момент потери сознания и быстрым возвращением нормального цвета кожных покровов вследствие расширения кровеносных сосудов после приступа быстрым восстановлением исходного самочувствия. Потеря сознания наступает при внезапном урежении частоты сердечных сокращений до величины менее 20 уд./мин или во время асистолии продолжительностью более 5—10 с.
Эктопические комплексы и ритмы При экстрасистолии больные жалуются на ощущение перебоев в работе сердца, толчков и замираний за грудиной. В некоторых случаях такие жалобы нередко отсутствуют. У части больных более выражены повышенная утомляемость, одышка, головокружение, общая слабость. При обследовании экстрасистолия определяется как преждевременный удар с последующей компенсаторной паузой. Пароксизмальная тахикардия. Во время пароксизма больные ощущают частое сердцебиение, нередко начинающееся с резкого толчка за грудиной. Во многих случаях сердцебиение сопровождается одышкой, болью в области сердца или за грудиной, головокружением, слабостью. Приступ предсердной пароксизмальной тахикардии может сопровождаться тошнотой, рвотой, метеоризмом, потливостью. В конце приступа беспокоит частое обильное мочеиспускание с выделением большого количества светлой мочи низкого удельного веса (1001–1003). Пульс ритмичен, резко учащен, систолическое артериальное давление снижается. При прослушивании обнаруживается выравнивание интенсивности I и II тонов сердца, паузы между тонами становятся одинаковыми, маятникообразный ритм. При предсердных эктопических ритмах специфических жалоб и симптомов нет. В клинике преобладают симптомы основного заболевания. Диагностируется по электрокардиограмме. Клинические проявления ритма атриовентрикулярного соединения зависят от тяжести основного заболевания. При выраженной брадикардии возможны обмороки, головокружения, боли в области сердца. Определяется брадикардия. Возможно набухание шейных вен. Миграция суправентрикулярного водителя ритма характерных клинических признаков не дает. Объективно обнаруживается незначительная аритмия, сходная с синусовой. Желудочковый ритм клинически отмечается брадикардией до 30–40 уд./мин, ритм правильный, учащается при физической нагрузке, под воздействием атропина. Типичны головокружения, частое возникновение приступов с потерей сознания и судорогами. Выражена склонность к желудочковой тахикардии, трепетанию и фибрилляции желудочков, асистолии и внезапной смерти.
Мерцание и трепетание Мерцание предсердий (мерцательная аритмия) по частоте желудочковых сокращений делится на тахисистолическую (частота сердечных сокращений 90 и более уд./мин), нормосистолическую (частота сердечных сокращений 60–90 уд./мин) и брадисистолическую (частота сердечных сокращений менее 60 уд./мин). При тахисистолической форме мерцательной аритмии больные жалуются на сильное сердцебиение, слабость, нарастает сердечнососудистая недостаточность. При прослушивании отмечаются аритмия, беспорядочное появление тонов. Пульс ритмичный, пульсовые волны разной амплитуды, определяется дефицит пульса. Трепетание предсердий может быть пароксизмальным либо отмечаться длительно (до 2 недель и более). Больные жалуются на сердцебиения, иногда одышку и боли в области сердца. При прослушивании отмечается тахикардия. В остальном симптоматика зависит от основного заболевания. Клинически трепетание и фибрилляция желудочков равносильны остановке кровообращения. В первую секунду появляются слабость и головокружение, спустя 18–20 с — потеря сознания, через 40–50 с наступают судороги и непроизвольное мочеиспускание. Пульс и артериальное давление не определяются, сердечные тоны не выслушиваются. Дыхание урежается и прекращается. Зрачки расширяются. Наступает клиническая смерть.
Нарушения функции проводимости При синоаурикулярной блокаде во время сердечной паузы больные отмечают головокружение, шум в голове, возможна потеря сознания. В это время не прослушиваются тоны сердца, а пульс при прощупывании лучевых артерий отсутствует. Атриовентрикулярная блокада (АВ-блокада) I степени проявляется в замедлении атриовентрикулярной проводимости. Клинически не распознается. Атриовентрикулярная блокада II степени — неполная атриовентрикулярная блокада. Больные жалуются на перебои в работе сердца, иногда легкое головокружение. При прослушивании правильный ритм прерывается длинными паузами (выпадение сокращений желудочков). Различаются 3 вида атриовентрикулярной блокады II степени. Атриовентрикулярная блокада III степени — полная атриовентрикулярная блокада. Больные жалуются на слабость, головокружение, потемнение в глазах, кратковременные обмороки, боли в области сердца, которые особенно характерны при урежении частоты сердечных сокращений до величины менее 40 уд./мин. Пульс редкий, при прослушивании отмечаются брадикардия, правильный сердечный ритм. В некоторых случаях удается прослушать во время пауз доносящиеся как будто издалека глухие тоны сокращений предсердий (эхо-симптом). Систолическое артериальное давление может быть повышено. Привнутрижелудочковой блокаде ножек пучка Гиса происходят нарушения проводимости в ножках пучка Гиса и их разветвлениях. Если импульс проведения по одной из ножек прерван, то волна возбуждения проходит до обоих желудочков через неповрежденную ножку — происходит неодновременное возбуждение желудочков. Клинически это проявляется расщеплением или раздвоением тонов сердца. Синдром Вольфа-Паркинсона-Уайта встречается у 0,15—0,20 % людей, причем у 40–80 % из них наблюдаются различные нарушения сердечного ритма, чаще наджелудочковые тахикардии. Могут возникать пароксизмы мерцания или трепетания предсердий (примерно у 10 % больных). У 1/4 лиц отмечается экстрасистолия, преимущественно суправентрикулярная. Это нарушение чаще наблюдается у мужчин и может проявиться в любом возрасте.
Диагностика В диагностике играют роль главным образом ЭКГ и характерные симптомы. Проводятся также суточное мониторирование ЭКГ, пробы с физической нагрузкой ЭХО КГ, электрофизиологическое исследование.
Нарушения функции автоматизма При синусовой тахикардии частота сердечных сокращений 90—160 уд./мин. При синусовой брадикардии происходит урежение частоты сердечных сокращений до 59 уд./мин и меньше, правильный синусовый ритм. При синусовой аритмии сохраняются все ЭКГ признаки синусового ритма. При синдроме слабости синусового узла отмечаются стойкая синусовая брадикардия до 45–50 уд./мин, перемежающаяся синоаурикулярная блокада; периодически — полная остановка синусового узла; в период полной остановки синусового узла могут отмечаться выскальзывающие сокращения из атриовентрикулярного соединения. При синдроме Шорта (брадитахикардии) отмечается смена выраженной брадикардии пароксизмами суправентрикулярной тахикардии, мерцанием и трепетанием предсердий.
Эктопические комплексы и ритмы Экстрасистолы при экстрасистолии могут быть предсердными, из атриовентрикулярного соединения и желудочковыми. Преждевременное появление экстрасистолического комплекса. Для наджелудочковых экстрасистол характерны неизменная форма желудочкового комплекса и неполная компенсаторная пауза. Желудочковые экстрасистолы изменены. Интерполированные (вставочные) желудочковые экстрасистолы возникают между двумя нормальными сокращениями; при этом экстрасистола появляется очень рано. Появление на ЭКГ экстрасистол с различной формой желудочкового комплекса (политопных) указывает на несколько эктопических очагов. Политопные и множественные экстрасистолы присущи органическому повреждению миокарда и прогностически неблагоприятны. Парасистолия. Регистрируются 2 независимых друг от друга ритма, эктопический ритм напоминает экстрасистолу, но интервал сцепления (расстояние от предыдущего нормального комплекса до экстрасистолы) все время меняется. Расстояния между отдельными парасистолическими сокращениями кратны наименьшему расстоянию между парасистолами. Для диагностики парасистолии необходима длительная запись ЭКГ с измерением расстояния между отдельными эктопическими комплексами. При пароксизмальной тахикардии отмечается внезапное начало и окончание приступа тахикардии свыше 160 уд./мин при сохранении правильного ритма. При предсердных эктопических ритмах отмечаются ЭКГ-признаки правопредсердного эктопического ритма. Ритм атриовентрикулярного соединения: ЭКГ-признаки ритма атриовентрикулярного соединения с предшествующим возбуждением желудочков, ритм предсердий и желудочков одинаков. ЭКГ при эктопическом ритме из атриовентрикулярного соединения и пароксизмальной тахикардии, исходящей из атриовентрикулярного соединения, одинаковы. Диагностика осуществляется по частоте ритма: если ритм имеет частоту в пределах 30–60 уд./мин, то это эктопический атриовентрикулярный ритм; если частота более 140 уд./мин, то это пароксизмальная тахикардия. Желудочковый ритм: брадикардия 30–40 уд./мин (иногда — менее) с правильным сердечным ритмом.
Мерцание и трепетание Мерцание предсердий. Имеются волны мерцания разной амплитуды и продолжительности, аритмия желудочков. Различают крупноволнистые (волны по амплитуде больше 1 мм) и мелковолнистые (амплитуда волн меньше 1 мм) формы мерцательной аритмии. Трепетание предсердий. На желудочки (вследствие функциональной атриовентрикулярной блокады) проводится каждый второй, третий или четвертый импульс: число желудочковых комплексов обычно не превышает 120–150 уд./мин; желудочки сокращаются в правильном ритме. Иногда отмечается чередование трепетаний и мерцаний предсердий.
Лечение Нарушения функции автоматизма Лечение синусовой тахикардии направлено на лечение основного заболевания. При неврозах показана успокаивающая терапия (валериана, транквилизаторы). При лечении синусовой тахикардии без явлений сердечной недостаточности — бета-адреноблокаторы (анаприлин, обзидан, карданум), которые уменьшают потребление кислорода миокардом, понижают ритм и возбудимость нервномышечного аппарата миокарда. При явлениях сердечной недостаточности при тахикардии оправдано назначение сердечных гликозидов (дигоксин, изоланид). Синусовая брадикардия у практически здоровых людей лечения не требует. В остальных случаях лечение направлено на устранение причины, вызывающей брадикардию, и лечение основного заболевания. При вагусной синусовой брадикардии, сопровождающейся дыхательной аритмией, хороший эффект оказывают малые дозы атропина. При брадикардии, связанной с нейроциркуляторной дистонией, сопровождающейся признаками нарушения кровоснабжения, симптоматический эффект дают эуфиллин, алупент, беллоид. В тяжелых случаях может потребоваться электрокардиостимуляция. Синусовая аритмия в ее дыхательной форме лечения не требует. В остальных случаях проводится терапия основного заболевания. На ранних этапах развития синдрома слабости синусового узла удается достичь кратковременного нестойкого учащения ритма отменой препаратов, которые замедляют сердечный ритм, и назначением холинолитических (атропина в каплях) или симпатолитических средств (изадрин по 5 мг начиная с 1/4—1/2 таблетки, дозы постепенно повышаются, чтобы предотвратить возникновение эктопических аритмий). В ряде случаев временный эффект можно получить назначением препаратов белладонны. У некоторых больных отмечен эффект при применении нифедипина, никотиновой кислоты, а при сердечной недостаточности — ингибиторов АПФ. Основной метод лечения синдрома слабости синусового узла — постоянная электростимуляция сердца.
Эктопические комплексы и ритмы Лечение экстрасистолий зависит от основного заболевания. При вегетососудистых расстройствах лечения, как правило, не проводят, иногда назначают седативные средства (транквилизаторы), при плохом сне — снотворные средства. При усилении вагуса показаны препараты атропина и белладонны. При склонности к тахикардии эффективны бета-адреноблокаторы (анаприлин, обзидан, пропранолол). Хорошее действие оказывают изоптин и кордарон. При экстрасистолах органического происхождения назначают хлорид калия, панангин. В исключительных случаях прибегают к противоаритмическим средствам, таким как новокаинамид и аймалин. При инфаркте миокарда с экстрасистолией эффективно применение лидокаина (1 %-ного раствора) с панангином внутривенно капельно. Политопные экстрасистолы, возникающие из-за интоксикации наперстянкой, могут привести к фибрилляции желудочков и требуют срочной отмены препарата. Применяют для лечения лидокаин, индерал, препараты калия. Для снятия интоксикации, связанной с кумуляцией сердечных гликозидов, применяют унитиол, назначают калийсберегающие диуретики (верошпирон). У части больных приступы пароксизмальной тахикардии прекращаются спонтанно. При наджелудочковой форме показаны массаж каротидного синуса справа и слева по 15–20 с, надавливание на глазные яблоки и брюшной пресс. При отсутствии эффекта из медикаментозных средств назначают бета-адреноблокаторы: пропранолол (обзидан, анаприлин) по 40–60 мг, верапамил по 2–4 мл 0,25 %-ного раствора или новокаинамид по 5—10 мл 10 %-ного раствора. Вводят препараты медленно, под контролем артериального давления и пульса. Опасно (из-за чрезмерной брадикардии или асистолии) попеременно внутривенно вводить верапамил и пропранолол. Лечение наперстянкой (дигоксин) возможно, если больной не получал ее в ближайшие дни перед приступом. Если приступ не прекращается и состояние больного ухудшается, используют электроимпульсную терапию (которая противопоказана при интоксикации сердечными гликозидами). При частых и плохо прекращаемых приступах целесообразна временная или постоянная электрокардиостимуляция. Если приступ связан с интоксикацией наперстянкой или слабостью синусного узла, больного следует немедленно госпитализировать. При желудочковой тахикардии больного госпитализируют, назначают противоаритмические средства (лидокаин по 80 мг) под контролем ЭКГ и артериального давления, повторяя введение по 50 мг через каждые 10 мин до общей дозы 200–300 мг. Если приступ возник при инфаркте миокарда и состояние больного ухудшается, то используют электроимпульсную терапию. После приступа проводят противорецидивное лечение (используют новокаинамид, лидокаин и другие препараты в течение нескольких дней и более длительно). Пассивные эктопические ритмы — лечение основного заболевания.
Мерцание и трепетание Лечение мерцания предсердий зависит от основного заболевания и его обострения (борьба с миокардитом, компенсация тиреотоксикоза, оперативное устранение пороков). При стойком мерцании предсердий восстанавливают синусовый ритм противоаритмическими препаратами или электроимпульсной терапией. Применяют сердечные гликозиды, бета-блокаторы, новокаинамид, верапамил (финоптин, изоптин), этмозин, этацизин, аймалин, хинидин. В случае нормо- и брадисистолической форм мерцательной аритмии, а также при отсутствии сердечной декомпенсации антиаримические препараты не применяются. Лечение направлено на основное заболевание. Лечение трепетания предсердий проводится по тем же принципам, что и мерцательной аритмии. Для прекращения пароксизма трепетаний может быть использована частая внутрипредсердная или чреспищеводная электростимуляция предсердий. При частых пароксизмах необходим постоянный прием противоаритмических препаратов с профилактической целью (например, дигоксина, способного в ряде случаев перевести пароксизмальную форму в постоянную, что лучше переносится больными). Лечение трепетания и фибрилляции желудочков сводится к немедленному началу непрямого массажа сердца и искусственного дыхания на протяжении времени, необходимого для подготовки к электроимпульсной терапии, а также других реанимационных мероприятий.
Нарушения функции проводимости Лечение синоаурикулярной блокады сводится к терапии основного заболевания. При выраженных гемодинамических нарушениях применяют атропин, белладонну, эфедрин, алупент. Появление частых обморочных состояний служит показанием для электрокардиостимуляции сердца. Атриовентрикулярная блокада: при АВ-блокаде I степени и II степени типа Мобитц I без клинических проявлений лечения не требуется. При нарушениях кровообращения назначают атропин по 0,5–2,0 мг внутривенно, а затем электрокардиостимуляцию. Если атриовентрикулярная блокада вызвана ишемией миокарда (в тканях повышается уровень аденозина), то назначается антагонист аденозина аминофиллин. При атриовентрикулярной блокаде II степени типа Мобитц II и III и полной атриовентрикулярной блокаде независимо от клинических проявлений показаны временная, а затем постоянная электрокардиостимуляция. Блокады ножек пучка Гиса сами по себе не требуют лечения, однако их следует учитывать при назначении лекарственных препаратов, замедляющих проведение импульса в системе проводящих путей. Синдром Вольфа-Паркинсона-Уайта, не сопровождающийся приступами тахикардии, не требует лечения. При возникновении нарушений сердечного ритма, а это чаще всего пароксизмы суправентрикулярной тахикардии, принципы лечения такие же, как при подобных тахиаритмиях другого генеза (сердечные гликозиды, бета-блокаторы, изоптин, новокаинамид и др.). Если эффект от фармакотерапии отсутствует, проводится электрическая дефибрилляция. При частых пароксизмах тахиаритмии, не поддающихся лечению медикаментами, проводится хирургическое лечение: пресечение дополнительных путей проведения.
АРТРИТЫ
ОпределениеАртриты — разнообразные по происхождению заболевания суставов, поражающие синовиальные (внутренние) оболочки, суставной хрящ, капсулу и другие суставные элементы, проявляющиеся болью, припухлостью и ограничением объема в суставах. Сложность и многообразие суставных нарушений характеризуются отсутствием единой классификации. В целом все артриты подразделяют на собственно заболевания суставов и артриты, связанные с другими заболеваниями.В качестве самостоятельных форм рассматриваются ревматоидный артрит (см.), ревматический полиартрит (болезнь Сокольского-Буйо) (см. Ревматизм), анкилозирующий спондилоартрит (см. Болезнь Бехтерева), инфекционные специфические артриты (гонорейный, туберкулезный, дизентерийный, вирусный и др.), инфекционно-аллергический полиартрит (включая полисиндромный ревматизм и сопутствующий гидрартроз), псориатический полиартрит, болезнь Рейтера (см.). К артритам при других заболеваниях отнесены артриты при аллергических заболеваниях, распространенных заболеваниях соединительной ткани, нарушениях обмена веществ, заболеваниях легких, крови, пищеварительного тракта, саркоидозе (см.), злокачественных опухолях (см.) и некоторых синдромных заболеваниях. Отдельно рассматриваются травматические артриты (вследствие особенностей их возникновения и лечения). По течению различают острый, подострый и хронический артриты, по степени распространенности — моноартрит (поражение одного сустава), олигоартрит (поражение двух-трех суставов) и полиартрит (поражение более трех суставов).
Этиология Причины развития артритов включают в себя инфекцию, иммунные и обменные нарушения, опухоли, местные травмы. В ряде случаев факторы возникновения и механизмы развития выяснены не до конца. Воспалительные изменения синовиальной оболочки суставов могут возникать под воздействием развития нарушений в костных элементах сустава (при остеомиелите, туберкулезном остите) либо в околосуставных тканях (реже). Факторами, способствующими развитию артритов, являются переохлаждения, физическая перегрузка сустава и др.
Патогенез Механизм развития артритов сложен и многообразен. Общей особенностью является способность суставов быстро отвечать воспалительной реакцией на любые отрицательные воздействия вследствие большого количества кровеносных сосудов и нервных окончаний синовиальной оболочки. Острые артриты различаются по характеру выпота: экссудат может быть серозным, серозно-фибринозным и гнойным. Серозный экссудат образуется при синовите; более тяжело протекают артриты при серозно-фибринозном выпоте и наиболее тяжело — при гнойном. В последнем случае процесс с синовиальной оболочки распространяется на всю суставную капсулу с окружающими мягкими тканями. При подостром и хроническом артрите отмечается увеличение ворсин синовиальной оболочки, рост слоя поверхностных клеток, выход из кровяного русла лимфоцитов и плазмоцитов. В дальнейшем возникает замещение синовиальной оболочки соединительной тканью. В результате длительного воспалительного процесса по краям покрывающего суставные поверхности хряща развивается рубцовая ткань. В дальнейшем она постепенно наползает на хрящ, разрушая его и подлежащую кость. Возникают костно-хрящевые эрозии. Со временем грануляционная ткань замещается соединительной, которая затем подвергается костеобразованию. Этот процесс характеризуется появлением фиброзных либо костных анкилозов (см.). Вовлечение в процесс суставной капсулы, сумки, связки, сухожилий, мышц может приводить к изменениям суставов, подвывихам, потере подвижности в суставах. Если причиной возникновения артрита является инфекционный процесс, механизмы развития могут быть собственно инфекционными, возникающими после инфекции, и быть ответом организма. Это деление достаточно условно, поскольку на современном этапе специальные тесты не позволяют с точностью диагностировать наличие и характер инфекционного агента. Инфекционные артриты характеризуются прямым попаданием (при травме) либо заносом инфекции с кровью или лимфой непосредственно в полость сустава с последующим обнаружением ее в синовиальной жидкости. Это наблюдается при туберкулезных, острых гнойных, гонорейных и других специфических артритах. Как правило, воспалительный процесс носит при этом прогрессирующий характер, а суставные ткани подвергаются разрушению. Постинфекционные артриты возникают при образовании и отложении в суставных тканях иммунных комплексов, что характерно для артритов при вирусном гепатите В (см.), хламидийной (см.) и менингококковой инфекции (см.). Механизм развития третьей группы артритов не вполне ясен, хотя связь их с инфекцией несомненна. Считают, что преобладающую роль при этом играет токсико-аллергический механизм, который приводит к развитию аллергического воспаления синовиальной оболочки сустава, а также особенности иммунной системы, для которой характерен чрезмерный ответ на внедрение чужеродных антигенов. Микроорганизмы и их антигены в полости сустава отсутствуют (так называемый «стерильный» артрит). Травматический артрит развивается главным образом в результате травматизации суставных тканей при ушибе сустава либо чрезмерных насильственных движениях в нем. Аллергический артрит развивается благодаря повышенной чувствительности организма к чужеродному белку (вакцины, сыворотки). В основе механизма развития артрита лежит образование иммунных комплексов вследствие иммунизации антигенами сывороток или лекарственными веществами. Механизм развития так называемых неспецифических артритов, к числу которых относятся ревматоидный артрит (см.), анкилозирующий спондилоартрит (см.), псориатический полиартрит, требует дальнейшего изучения. Наиболее важную роль в их развитии играют изменения общей и тканевой реактивности организма, аллергические и иммунные механизмы. Общим механизмом повреждения суставных тканей при обменных заболеваниях (подагре (см.), пирофосфатной артропатии, дислипидемиях) является поглощение кристаллов, выпадающих в синовиальную жидкость и окружающие ткани из суставного хряща, в котором они откладываются. Этот процесс сопровождается интенсивным выходом ферментов, повреждающих суставные структуры. Механизм развития суставных поражений при системных заболеваниях соединительной ткани до конца не изучен; то же самое можно сказать и о механизмах развития артритов при терминальном илеите, болезни Крона (см.) и ряде других заболеваний.
Клиническая картина Течение артритов протекает разнообразно. Наблюдаются острые непродолжительные и полностью обратимые формы (аллергические, ревматические артриты), а также длительно текущие прогрессирующие хронические. Исходом последних может быть полная утрата функции суставов (костный или фиброзный анкилоз при ревматоидном или инфекционном артрите). Клинически артриты могут выражаться рядом общих признаков, характеризующих воспалительные процессы любой локализации. К ним относятся боль в суставах, припухлость и выпот (деформация сустава), нарушение функции, повышение местной температуры и гиперемия кожных покровов. Боль при артрите носит спонтанный характер, наиболее интенсивна она во вторую половину ночи и утром, уменьшается после движения (воспалительный тип боли). При прощупывании определяется болезненность над всей областью сустава, особенно вдоль суставной щели. Нарушение функции сустава может быть различным — от легкой степени до полной его неподвижности вследствие фиброзного или костного анкилоза (см.), что характерно для прогрессирующего ограничения подвижности при хронически протекающих артритах. При острых артритах ограничение подвижности носит обратимый характер. В редких случаях вследствие разрушения костных структур и подвывихов может возникнуть нарушение подвижности сустава. Повышение температуры может отмечаться при острых, подострых артритах и обострении хронических. Возможна сопутствующая гиперемия кожи, хотя этот признак определяется не всегда.

Деформирующий артрит
При остром артрите боль в суставе обычно очень сильная и постоянная. Могут наблюдаться гиперемия кожных покровов, увеличение сустава в размере и его деформация. Подвижность резко ограничена. При подостром артрите все вышеперечисленные показатели выражены в меньшей степени. При хроническом артрите боль возникает в основном при движении в суставе. Прощупывание показывает наличие плотной болезненной припухлости мягких тканей.
Острый гнойный артрит Чаще поражаются коленные, тазобедренные, плечевые, локтевые, лучезапястные, голеностопные суставы. Как правило, развивается моноартрит, реже поражаются два сустава. Клинические проявления острого гнойного артрита включают и общие, и местные симптомы. К общим симптомам относятся лихорадка, ознобы, проливные поты, слабость, малоподвижность, другие признаки интоксикации вплоть до угнетения сознания. Среди местных симптомов наблюдаются боль в суставе постоянного характера и резкая болезненность при попытке движения в нем; покраснение и значительное повышение местной температуры, опухание сустава вследствие накопления экссудата в полости сустава и отечности околосуставных тканей, что характеризуется изменением контуров сустава; нарушение функции конечности, принимающей вынужденное положение. Скопление в полости сустава большого количества экссудата приводит к появлению симптома флюктуации, а при развившемся гоните — к подвижности надколенника. С переходом воспаления на окружающие мягкие ткани развиваются симптомы, характерные для капсульной флегмоны. Процесс быстро прогрессирует с развитием разрушения всех суставных элементов, особенно синовиальной оболочки и костно-хрящевой ткани; возникает остеоартрит (см.). В результате разрушения эпифизов костей наблюдаются смещения и подвывихи. Прорыв суставной сумки сопровождается распространением гноя по межсвязочным пространствам с образованием затеков, которые могут вскрываться самостоятельно.
Лайм-боррелиоз Заболевание характеризуется сочетанием рецидивирующего моно- или олигоартрита с перемещающимися участками гиперемии кожи. Поражение суставов развивается спустя 2 месяца или 2 года после инфицирования. Артрит характеризуется острым и внезапным началом. Отмечаются умеренная болезненность и припухлость коленных (реже — других крупных) суставов, в ряде случаев наблюдается симметричный полиартрит. Суставной синдром отличается кратковременностью (не более недели) и склонностью к рецидивированию. Стойкая деформация суставов не типична за исключением 10 % случаев хронизации артрита.
Туберкулезный артрит Туберкулезный артрит характеризуется распространением туберкулезного процесса с кости на синовиальную оболочку сустава. В настоящее время встречается редко. Обычно инфекции подвержены крупные суставы: тазобедренные, коленные и особенно часто — позвоночник. Клинически характерно постепенное развитие артрита. Боли отмечаются как в покое, так и при движении. Припухлость возникает как вследствие появления экссудата в полости сустава, так и в результате поражения околосуставных тканей. Цвет кожи мало изменяется. При прощупывании определяются болезненность и умеренное повышение местной температуры. Постепенно происходит атрофия регионарных мышц. В отсутствие лечения может развиться свищ, сформироваться натечный абсцесс.
Артрит при болезни Рейтера Болезнь Рейтера (см.) (синдром Рейтера, уретроокулосиновиальный синдром) в типичных случаях характеризуется триадой симптомов: уретрит (см.), конъюнктивит (см.) и артрит. Заболевание поражает преимущественно молодых мужчин. Обычно в процесс вовлекаются голеностопные суставы, а также суставы предплюсны и плюсны. В типичных случаях сначала возникает припухлость одного сустава (чаще голеностопного), затем в процесс вовлекается один или два коленных сустава, затем — тазобедренные. В дальнейшем могут припухать крупные суставы рук, суставы кистей и стоп. Экссудативные явления в суставах выражены умеренно, в большей степени наблюдается отек околосуставных тканей, возможна гиперемия кожи. Поражения суставов нередко асимметричны. Типично наличие бурситов (см.), ахиллобурситов, фасцитов, фиброоститов. В это же время нередки боли в поясничнокрестцовом отделе позвоночника. У многих больных отмечается поражение глаз в виде легкого конъюнктивита (см.), продолжающегося 3–5 дней. Артриту в типичных случаях предшествует острый уретрит (см.), опережающий поражение суставов на несколько дней. Помимо уретрита могут встречаться явления цистита (см.), простатита (см.), баланита (см.). Около 10 % больных отмечают диарею (см.), предшествующую заболеванию.
Реактивные артриты Реактивные артриты возникают после инфекционных заболеваний. Включают в себя артриты при шигеллезе, иерсиниозе, сальмонеллезе (см.), кампилобактериозе, а также после ОРВИ, вирусного гепатита В и др. Отмечается тесная связь с предшествующей инфекцией (особенно при наличии синдрома энтероколита (см.)). Поражаются преимущественно суставы нижних конечностей — коленные, голеностопные, плюснефаланговые и межфаланговые с сосискообразной дефигурацией пальцев стопы, а также ахиллово и подошвенное сухожилие. Процесс протекает в виде олигоартрита с асимметричным характером поражения. Заболевание протекает благоприятно, склонно к обратному развитию на протяжении 1–6 месяцев, хотя в ряде случаев может рецидивировать. Реже болезнь приобретает хронический характер с вовлечением все большего количества суставов.
Аллергический артрит Развивается либо сразу после повторного введения сыворотки или лекарственного средства, либо спустя 4—12 дней. Поражение локализуется чаще на крупных суставах. Помимо него характерны другие проявления аллергического характера: отек Квинке (см.), крапивница (см.), бронхоспазм, а также тахикардия (см.), тошнота и рвота. Аллергический артрит отличается доброкачественным течением и спустя некоторое время полностью исчезает.
Травматический артрит Как правило, травматический артрит поражает крупные суставы, несущие большую нагрузку: коленные, голеностопные, локтевые, плечевые. Отмечаются боль, припухлость, нередко — кровоизлияние в полость сустава. При отсасывании экссудата, который имеет кровянистый характер, сгустки крови обнаруживают редко, обычно лишь при крайне тяжелых повреждениях суставных поверхностей.
Псориатический артрит Псориатический артрит (артропатия) встречается у 5–7 % больных псориазом. В большинстве случаев поражение суставов возникает в различное время от начала кожных проявлений и не совпадает с кожным поражением (см. Псориаз). Типично для псориатического артрита поражение дистальных межфаланговых суставов кистей и стоп, особенно больших пальцев стоп. При этом отмечаются болезненность и припухлость в области сустава, кожа над ним синюшная или багрово-синюшная. Параллельно развивается поражение пястнофалангового или плюснефаланговых проксимального и дистального межфаланговых суставов, что вызывает полную припухлость пальца — сосискообразную деконфигурацию. Характерно для псориатического артрита наличие болей в пяточном бугре — талалгия. Позже или одновременно с поражением пальцев стоп в процесс вовлекаются позвоночник и крестцово-подвздошные сочленения (спондилит (см.) и сакроилеит). В настоящее время чаще встречается псориатический моно- или олигоартрит крупных суставов, а также полиартрит, сходный по клинике с ревматоидным полиартритом. В ряде случаев развивается особо тяжелый обезображивающий артрит, обусловленный разрушением костной ткани фаланг пальцев и сопровождающийся их укорочением и подвывихами.
Подагрический артрит Подагрический артрит связан с отложением солей в суставах. Развитию приступа подагрического артрита всегда предшествуют провоцирующие факторы: охлаждение, физическое напряжение, нервное потрясение, прием избыточного количества пищи, богатой пуринами, алкоголя. Характерны значительная припухлость, покраснение, повышение местной температуры и резкая болезненность в суставе. Артрит длится от нескольких дней до месяца и может закончиться полным выздоровлением, в ряде случаев развиваются рецидивы или хроническая форма артрита.
Подагрический артрит
Артриты при дислипидемиях Такие артриты характерны для гиперлипопротеинемий ПА и IV типов. Могут поражаться как крупные, так и мелкие суставы. Типичны артралгии разной степени выраженности, припухлость суставов, иногда гиперемия кожи над ними; у части больных может отмечаться утренняя скованность. Продолжительность суставного синдрома составляет от нескольких дней до месяца, встречается перемещающийся тип поражения, частое сочетание артритов с тендинитами.
Интермиттирующий гидрартроз Заболевание связано с периодическим появлением в полости сустава выпота. Клинически в течение быстрого времени (12–24 ч) в одном из крупных суставов (чаще коленном) появляется значительное количество выпота, отмечаются незначительная болезненность и ограничение подвижности сустава из-за скопления в нем жидкости. Общее состояние не страдает. Выпот имеет характер транссудата. Лабораторные и рентгенологические нарушения отсутствуют. Спустя 2–5 дней наступает полное улучшение состояния, но через некоторое время (постоянное и индивидуальное для каждого больного) проявления повторяются в том же суставе. Иногда заболевание самопроизвольно излечивается. В ряде случаев так может протекать начало ревматоидного артрита.
Артриты при диффузных болезнях соединительной ткани Поражение суставов при диффузных болезнях соединительной ткани, особенно таких, как системная красная волчанка (СКВ) (см.), болезнь Шегрена (см.), дерматомиозит (см.), системная склеродермия (см.), а также при системных васкулитах (см.), является характерным клиническим проявлением. Как правило, отмечаются нестойкие мигрирующие артриты, не сопровождающиеся рентгенологическими признаками разрушения суставов.
Артрит при язвенном колите Артрит при язвенном колите (см.) чаще возникает на фоне обострения, а также при осложненных формах заболевания. Характерно параллельное течение артрита и колита; поражаются преимущественно крупные суставы (плечевые, тазобедренные). При экссудативных изменениях отмечаются небольшое повышение местной температуры и болезненность, цвет кожных покровов над пораженным суставом практически не изменен. Воспалительный процесс в суставе имеет стойкий характер, но не приводит к замещению соединительной тканью и ограничению подвижности в суставах. Периферический артрит при язвенном колите схож с болезнью Бехтерева (см.). При успешном хирургическом лечении язвенного колита наступает стойкое выздоровление.
Артрит при болезни Крона При болезни Крона (см.) чаще поражаются крупные суставы верхних конечностей. Артрит имеет рецидивирующий характер, течение его сравнительно доброкачественное. Рецидивы возникают в период обострения энтероколита.
Диагностика В диагностике артритов применяется комплексное обследование больного с использованием всех доступных клинико-лабораторных и инструментальных методов. Основанием для постановки диагноза служат данные опроса, который устанавливает связь поражения суставов с инфекционными заболеваниями, очаговой инфекцией, травмой, аллергией или другими патологическими процессами; характерная клиническая картина («воспалительный» тип болей, деформация суставов, прогрессирующее ограничение функции); лабораторные показатели воспалительного процесса; характерные рентгенологические данные (сужение суставной щели, эпифизарный остеопороз, анкилозы); результаты исследования синовиальной жидкости. В целях более точной диагностики применяется артроскопия, дающая возможность наглядного осмотра и фотографирования синовиальной оболочки. Ценным диагностическим приемом, позволяющим установить наличие и активность процесса в суставе, является пунктирование сустава с извлечением и исследованием синовиальной жидкости. Рентгенологическое исследование при артритах проводится в двух стандартных проекциях, при наличии показаний — в ряде дополнительных. Хорошие результаты удается получить при электрорентгенографии пораженных суставов. В ряде случаев для уточнения характера изменений в глубоко расположенных участках эпифизов, невидимых или недостаточно хорошо различимых при обычной рентгенографии, применяют томографию. Рентгенологическая симптоматика артрита характеризуется остеопорозом (см.) во всех его разновидностях, иногда — расширением суставной щели, но чаще — ее сужением (полным или частичным); краевыми костными дефектами; изменением рельефа суставных поверхностей костей и краевыми костными разрастаниями на костях, образующих сустав; вывихами (см.) и подвывихами, возникающими в результате деформации суставов при некоторых формах артрита.
Острый гнойный артрит Общий анализ крови: лейкоцитоз, повышение СОЭ. При бактериологическом исследовании синовиального материала обнаруживается возбудитель. Синовиальная жидкость мутная. В 1 мл ее содержится более 100 000 лейкоцитов. Рентгенологически в ранней стадии выявляется сужение суставной щели; контуры сустава неровные, бахромчатые; наблюдается симптом «щипка». Возможно омертвение одного из эпифизов. Встречаются подвывихи, вывихи и смещение костей.
Лайм-боррелиоз Общий анализ крови: лимфоцитарный лейкоцитоз, эозинофилия до 30 %, повышение СОЭ. Исследование синовиальной жидкости: высокие показатели количества иммунных комплексов. Серологические реакции становятся положительными только через 2–4 недели после появления хронической мигрирующей эритемы. В диагностике ведущая роль принадлежит опросу больного и клиническим наблюдениям.
Туберкулезный артрит Рентгенологически в ранней стадии процесса наблюдаются сужение суставной щели, разрушение костной ткани. В кости образуются щели и отверстия, происходит отторжение омертвевших участков костной ткани.
Артрит при болезни Рейтера Общий анализ крови: повышение СОЭ, умеренный лейкоцитоз. Биохимия крови: положительная проба на С-реактивный белок, увеличение содержания серомукоида, диспротеинемия. В сыворотке крови обнаруживают антихламидийные антитела, выявляется положительная РСК. Диагноз достоверен при обнаружении хламидий в материале, взятом из уретры или конъюнктивы. Рентгенологическое исследование периферических суставов выявляет лишь отечность мягких тканей. При рецидивирующем течении и хронизации заболевания возможны признаки эрозивного артрита, чаще в мелких суставах стоп. Нередко в зоне поражений выявляются периоститы, эрозии пяточной кости и пяточные «шпоры».
Реактивные артриты Общий анализ крови: увеличение СОЭ до 25–30 (реже 40–50) мм/ч, лейкоцитоз. Биохимия крови: положительный С-реактивный белок, увеличение содержания белков глобулинов. Специфическая рентгенологическая картина реактивным артритам не свойственна, после прекращения клинических проявлений изменений суставов не наблюдается.
Аллергический артрит Диагностируют на основании четкой связи артрита с введением аллергена, характерной общей клинической картины и быстрого обратного развития всех изменений. Анализ крови: умеренное повышение СОЭ (20–25 мм/ч), лейкоцитоз, эозинофилия.
Травматический артрит Диагностируют на основании жалоб и опроса (травма). Исследование синовиальной жидкости: вязкость незначительно снижена, слизистый сгусток плотный, микроскопия выявляет эритроциты.
Псориатический артрит Общий анализ крови: повышение СОЭ, незначительный лейкоцитоз, в тяжелых случаях анемия. Биохимия крови: увеличение содержания активности биологически активных веществ, вызывающих воспаление. На рентгенограммах кистей и стоп обнаруживаются субхондральный остеопороз (см.), умеренный или выраженный склероз, субхондральные кисты (см.) различных размеров. Щели, отверстия в кости и замещение соединительной тканью наблюдаются на более поздней стадии. В ряде случаев обнаруживаются неровность и зазубренность верхней части эпифиза плюсневых костей. При тяжелой распространенной форме заболевания может иметь место разрушение эпифизов плюсневых костей. Изменения крестцово-подвздошных суставов: мало выраженный остеопороз в виде отдельных очагов, сочетание участков остеопороза и остеосклероза с преобладанием последнего. Биопсия синовиальной оболочки: в начальной стадии определяются очаги мукоидного набухания, васкулит (см.), кровоизлияния, фиброзные изменения. Затем возникают некротические изменения синовиоцитов. При хроническом течении — продуктивновоспалительная реакция с незначительной ворсинчатой гиперплазией синовиальной оболочки, кольцевидным склерозом стенок сосудов, скудным околососудистым пропитыванием плазмоцитами и лимфоцитами.
Подагрический артрит (см. Подагра)
Лечение Терапия, направленная на устранение причин возникновения заболевания, в основном применима при артритах, преимущественно связанных с инфекцией (антибактериальные средства), аллергических артритах (антигистаминные и кортикостероидные средства), а также при заболеваниях обмена веществ (подагра, дислипидемия). Напротив, терапия, обусловленная воздействием на механизмы развития заболевания, применяется чрезвычайно широко. Она предусматривает воздействие на общую и иммунологическую реактивность больного (применение десенсибилизирующих, иммунодепрессивных средств, воздействие на очаг хронической инфекции, нормализация обмена, витаминного баланса и т. д.); снижение общих и местных воспалительных реакций (применение медикаментозных, гормональных, физиотерапевтических средств, курортного лечения); восстановление нарушенной функции сустава (лечебная гимнастика, массаж, физиобальнеотерапия, трудотерапия); лечение основного заболевания. Важным принципом терапии хронического артрита является длительное этапное лечение (стационар — поликлиника — курорт), различное в зависимости от природы артрита, его формы и т. д.
Острый гнойный артрит Терапия осуществляется в условиях стационара. В комплекс мер входят иммобилизация пораженного сустава, пункция с удалением экссудата и введением в полость сустава антибиотиков, внутривенное применение антибиотиков с учетом чувствительности к ним возбудителя, общая противовоспалительная терапия, симптоматические средства. При отсутствии эффекта от комплексной терапии устанавливается длительное проточное дренирование полости сустава растворами антибактериальных средств (с учетом чувствительности возбудителя). В случае прогрессирования процесса прибегают к вскрытию сустава с удалением омертвевших масс, по жизненным показаниям производится ампутация.
Лайм-боррелиоз Антибактериальные средства в больших дозах. Обычно назначают пенициллин по 20 млн ЕД внутривенно или тетрациклин по 1,2 млн ЕД в сутки в течение 10–12 дней. При хроническом течении и поражении суставов и мышц назначают нестероидные противовоспалительные средства в обычных дозировках.
Туберкулезный артрит Специфическая противотуберкулезная терапия (стрептомицин, этамбутол, рифампицин, изониазид, ПАСК и др.). Комплекс мероприятий предусматривает соответствующую диету, курортное лечение. Применяются ортопедические методы — иммобилизация пораженного сустава (гипсовая лонгета, специальные шины). В поздней стадии показано оперативное вмешательство.
Артрит при болезни Рейтера В начальном периоде используют антибактериальные средства, активные в отношении хламидий (тетрациклины, макролиды, фторхинолоны) в индивидуально подобранных дозировках и курсами, нестероидные противовоспалительные средства, десенсибилизирующие препараты, фонофорез гидрокортизона на пораженные суставы и отделы позвоночника, внутрисуставное введение глюкокортикоидов с одновременным удалением экссудата. При отсутствии эффекта от нестероидных противовоспалительных средств и высокой активности процесса используют кортикостероиды внутрь по 20–40 мг в сутки в пересчете на преднизолон. При хронической форме, когда имеются стойкие изменения в суставах и позвоночнике, целесообразно, кроме симптоматических и антибактериальных средств, назначать делагил (плаквенил).
Реактивные артриты На ранних этапах используют антибактериальные препараты широкого спектра действия, нестероидные противовоспалительные средства, симптоматические средства. В дальнейшем необходимы массаж, ЛФК, физиотерапевтическое и бальнеологическое лечение.
Аллергический артрит Применяются антигистаминные средства в индивидуальных дозировках, хлорид кальция, нестероидные противовоспалительные средства, реже (по показаниям) — глюкокортикоиды.
Травматический артрит Лечение зависит от характера и локализации поражения сустава.
Псориатический артрит В терапии используют нестероидные противовоспалительные средства, в тяжелых случаях при устойчивости резистентности к ним больного — иммунодепрессанты (метотрексат). Показаны внутрисуставные введения глюкокортикоидов. Из средств неспецифической терапии широко применяют витаминные средства, физиотерапию, курортное лечение по назначению дерматолога (см. Псориаз).
Подагрический артрит (см. Подагра)
АРТРОЗ
ОпределениеАртрозы — дегенеративные поражения хряща и суставов.Артрозы (остеоартрозы) — группа медленно-прогрессирующих заболеваний опорно-двигательного аппарата дистрофически-воспалительного характера. Типичный представитель — деформирующий остеоартроз. Чаще всего поражаются суставы кистей рук, позвоночника (см. Остеохондроз), нижних конечностей, несущих большую нагрузку весом тела (тазобедренные, коленные, голеностопные).
Этиология Выделяют 2 большие группы факторов возникновения: к первой относят чрезмерную механическую и функциональную нагрузку на неповрежденный (здоровый) суставной хрящ профессионального, бытового или спортивного характера; избыточный вес; дисплазию (см.) и нарушения статики, ведущие к изменениям суставных поверхностей; травмы сустава. Ко второй группе относят снижение устойчивости хряща к обычной нагрузке при наличии существующих изменений в нем (артритов (см.), гемартрозов (см.) при гемофилии (см.), хондрокальциноза, остеодистрофии (см.), нервных нарушений с потерей чувствительности, эндокринных нарушений, наследственной предрасположенности).
Костный дефект при гемофильном артрите
Патогенез Под влиянием фактора возникновения происходят более быстрое и раннее старение суставного хряща, изменения в синовиальной жидкости, ведущие к нарушению обменных процессов в хряще. Отмечается нарушение структуры основного вещества и гибель части клеток хряща. Хрящ теряет эластичность, разволокняется, в нем образуются трещины, обнажается подлежащая кость. Отсутствие амортизации при давлении на суставную поверхность костей приводит к их уплотнению с образованием участков ишемии (см.), склероза, кист (см.). По краям суставных поверхностей хрящ компенсаторно разрастается, затем подвергается окостенению — возникают краевые разрастания. Наличие в суставной полости отломков хряща и поглощение их лейкоцитами с развитием аутоиммунных реакций приводит к высвобождению внутриклеточных ферментов (активаторов воспаления) с дальнейшим развитием синовита; при неоднократных рецидивах отмечается фиброз синовии и капсулы.
Клиническая картина Характерны боли в суставах механического типа, возникающие при нагрузке. Более интенсивными они бывают к вечеру. При развитии венозных застоев в околосуставном отделе возможны тупые «сосудистые» боли, развивающиеся ночью и исчезающие при утренней активности. Часто встречаются жалобы на «стартовые» боли в суставах, возникающие при первых шагах, а затем исчезающие и вновь появляющиеся после нагрузки. Развитие синовита сопровождается усилением боли и припуханием сустава. Периодически отмечается «заклинивающая» боль в суставе при малейшем движении, что бывает вызвано ущемлением в полости сустава омертвевшего хряща. Боль исчезает при движении, устраняющем кусочек хряща с суставной поверхности. При движениях в суставе характерно похрустывание. При поражении дистальных межфаланговых суставов отмечаются узелки Гебердена, что часто сочетается с поражением коленных (гонартроз) или тазобедренных (коксартроз) суставов. Геберденовские узелки представляют собой симметричные, плотные, узловатые образования размером с горошину на тыльно-боковой поверхности суставов, развившиеся за счет краевых остеофитов. Могут отмечаться узелки Бушара — остеоартроз средних межфаланговых суставов. Со временем развивается стойкая деформация суставов, обусловленная костными изменениями. При этом ограничения подвижности сравнительно невелики (за исключением тазобедренного сустава при коксартрозе).
Изменения шейки бедра при деформирующем артрозе
По течению деформирующие остеоартрозы подразделяются на явные и малосимптомные формы. Первые, в свою очередь, бывают медленно и быстро прогрессирующими. При медленном течении процесса существенные клинико-рентгенологические изменения в суставах появляются спустя 5 лет и более после начала заболевания. Рентгенологические изменения преимущественно I–II стадий. При быстром прогрессировании выраженные нарушения суставной функции и деформация суставов отмечаются в срок до 5 лет от начала заболевания, рентгенологические изменения — преимущественно во II–III стадии. Коксартроз является одной из наиболее частых и тяжелых форм деформирующих остеоартрозов. На ранних стадиях отмечаются жалобы на боли при ходьбе и хромоту только к концу рабочего дня, позднее они держатся весь день, а в тяжелых случаях боль смещается в коленный сустав, седалищную и паховую область. Относительно рано возникает гипотрофия мышц бедра и ягодичных мышц, позже развивается ограничение подвижности в суставах при сгибании. Походка становится щадящей. Вследствие нарушения статики или укорочения конечности появляется хромота. При двустороннем поражении походка становится «утиной». Ограничение подвижности сначала затрагивает поворот бедра кнаружи и отведение, затем присоединяются ограничения наружной ротации, приведения бедра, его сгибания и разгибания. Гонартроз чаще бывает вторичным, вследствие травмы коленного сустава или нарушений статики. Протекает более благоприятно, чем коксартроз. Основные жалобы на боли с передней или внутренней стороны сустава при ходьбе (особенно по лестнице), которые проходят в покое. Отмечается нестабильность сустава.
Диагностика Кровь без существенных изменений. При реактивном синовите может быть повышение СОЭ до 20–25 мм/ч, повышение уровня серомукоида, сиаловых кислот. Рентгенологически выделяют 3 стадии артроза: I стадия — незначительное неравномерное сужение суставной щели, легкое заострение краев суставных поверхностей (начальные разрастания) сочетается с небольшим ограничением движений; II стадия — выраженное сужение суставной щели, значительные костные выросты, околохрящевой остеосклероз и кистоидные просветления в эпифизах, клинически сочетающиеся с ограничением подвижности, грубым хрустом при движениях, умеренной амиотрофией (см.); III стадия — полное отсутствие суставной щели, деформация и уплотнение суставных поверхностей эпифизов, обширные костные разрастания, кисты, клинически сочетающиеся с деформацией сустава и значительным ограничением его подвижности. При биопсии синовиальной оболочки отмечаются атрофия ворсин, расположение в один ряд покровных клеток, малое количество сосудов, участки замещения соединительной тканью, участки жирового перерождения. Синовиальная жидкость прозрачная или слегка мутная, высокой или средней вязкости, слизистый сгусток плотный. Цитоз составляет от 500 до 5000 в 1 мкл, нейтрофилов менее 50 %, могут обнаруживаться фрагменты хрящевой ткани.
Лечение Лечение артрозов — симптоматическое, так как обратного развития дистрофических процессов в хряще на сегодняшний день добиться не удается. Применяют комплекс фармакотерапии, физиотерапевтических процедур, оказывающих сосудорасширяющее и обезболивающее действие, санаторно-курортное лечение с использованием благоприятных климатических условий, минеральных вод и грязей. Из медикаментозных препаратов на первом месте находятся нестероидные противовоспалительные средства, однако их не следует использовать постоянно в связи с большим количеством побочных эффектов. При стойком реактивном синовите нестероидные противовоспалительные средства рекомендуется применять в течение 1 месяца. В отдельных случаях возможно внутрисуставное введение кортикостероидов (кеналог, гидрокортизон). Из средств физиотерапии широко используют электрофорез лекарственных растворов, импульсные токи, ультразвук, индуктотермию, магнитотерапию, парафиновые и грязевые аппликации. Проведение регулярных курсов массажа и ЛФК.
АСКАРИДОЗ
ОпределениеАскаридоз — пероральный геогельминтоз (см. Гельминтозы) из группы нематодозов (см.), характеризуется аллергическим синдромом в ранней стадии и абдоминальным — в позднем.
Этиология Возбудитель — аскарида, круглый червь веретенообразной формы, белого или розового цвета. Размеры самца составляют 15–25 см, самки — 25–40 см. Хвостовой конец самца заострен и загнут крючком в брюшную сторону. Яйца аскарид имеют размеры 0,05—0,07 х 0,04—0,05, слегка овальной формы, покрыты плотной шероховатой оболочкой. Аскарида — крупная раздельнополая нематода.
Эпидемиология, патогенез и патанатомия Источником заражения и окончательным хозяином паразита может быть только человек, в тонкой кишке которого паразитируют половозрелые аскариды. Яйца выделяются с фекалиями и созревают до стадии способности заражения в почве при высоком содержании кислорода и влажности; оптимальная температура для развития яиц в почве — 24 °C. Механизм заражения фекально-оральный, факторы передачи — овощи, ягоды, другие пищевые продукты, вода, грязные руки, обсемененные яйцами аскарид. Восприимчивость к гельминту всеобщая, дети поражаются чаще, чем взрослые. Встречается повсеместно, кроме зон вечной мерзлоты, пустынь и полупустынь. Максимальная распространенность отмечается в тропическом поясе. Вследствие повторных заражений формируется относительный иммунитет. В тонком кишечнике из яиц выходят личинки аскарид, проникают сквозь его стенку в сосуды бассейна воротной вены и с кровью перемещаются в печень (к 5—6-му дню заражения, затем в легкие (к 8—10-му дню), где переходят из капилляров в респираторные бронхиолы и совершают две линьки. Из легких при помощи движений ресничек они поступают в ротоглотку, заглатываются со слюной и к 14—15-му дню достигают тонкой кишки, где после двух линек становятся половозрелыми. Общая продолжительность цикла от момента заражения до первой кладки яиц составляет 10–12 дней. Продолжительность жизни аскариды — около 1 года. В ранней фазе перемещений аскаридоза развивается интоксикация организма человека продуктами обмена личинок, а также разрушение тканей перемещающимися гельминтами. В меньшей степени интоксикация выражена в хронической фазе заражения. Большое место в механизме развития занимают механические травмы кишечной стенки (вплоть до ее перфорации) зрелыми гельминтами, которые затем способны перемещаться в организме человека, что приводит к крайне неблагоприятным последствиям.
Клиническая картина В стадии миграции личинок отмечаются слабость, лихорадка, потливость, боли в мышцах и суставах, зудящие экзантемы, отечный синдром, легкая отечность лица, обструктивный бронхит (см.), воспалительные образования в легких, увеличение печени и селезенки. Эти симптомы могут встречаться как вместе, так и по отдельности. В хронической стадии могут наблюдаться понижение или повышение аппетита, слюнотечение, тошнота, боли в животе, неустойчивый стул, головные боли, плохой сон. Отмечается отхождение гельминтов во время дефекации. При массивном заражении у детей раннего возраста имеют место бледность кожных покровов, понижение аппетита, задержка физического развития. Осложнениями аскаридоза при заползании гельминтов в желчные пути являются желчная колика (см.), желтуха (см.); при их попадании в протоки поджелудочной железы развивается гнойный панкреатит (см.); возможно развитие аппендицита (см.), перитонита (см.), абсцессов (см.), непроходимости кишечника (см.).
Диагностика В ранней фазе заподозрить аскаридоз позволяют симптомы со стороны легких в сочетании с высоким уровнем эозинофилов крови. В мокроте на этой стадии можно обнаружить личинки аскарид. В хронической фазе заражения при исследовании крови отмечается умеренное повышение количества эозинофилов, иногда — гипохромная анемия и тромбоцитопения. У детей эозинофилия может быть значительной, СОЭ повышается. Решающим моментом диагностики является обнаружение в кале яиц аскарид. Диагноз облегчается при отхождении гельминтов при дефекации. Используется серодиагностика — РСК, РНГА, ИФА. Иногда применяется рентгенологический метод — определяются летучие образования в легких и удлиненные просветления шириной 4–6 мм в кишечнике.
Лечение При аскаридозе широко используются противогельминтные препараты в качестве этиотропной терапии: медамин, декарис (левамизол), комбактрин, вермокс (мебендазол), тиабендазол (минтезол). Из них в ранней стадии используют вермокс и минтезол. Применяют симптоматические средства по показаниям.
АСПЕРГИЛЛЕЗ
ОпределениеАспергиллез — заболевание, вызываемое различными видами плесневых грибов. Чаще протекает с преимущественным поражением легких, на фоне подавленной иммунной системы принимает тяжелое септическое (полное) течение.
Этиология Возбудители — различные виды грибков рода аспергиллы. Аспергиллы — гетеротрофы и аэробы. При посеве на среду Сабуро отмечается быстрый рост с образованием плоских колоний: сначала белых, слегка пушистых или бархатистых, затем синеватых, коричневых, желтоватых или другой окраски (в зависимости от вида). Аспергиллы широко распространены во внешней среде, устойчивы к замораживанию и высушиванию. Из дезинфицирующих средств на аспергиллы наиболее активно действуют растворы карболовой кислоты и формалин, их рост подавляют перманганат калия и гидрокарбонат натрия. Благодаря широкому распространению в природе аспергиллы обнаруживаются в почве, зерне, муке, сене (особенно заплесневелом), в пыли помещений, в том числе в пыли лечебных учреждений, что может приводить к внутрибольничному инфицированию. Возбудитель проникает в организм, как правило, воздушно-пылевым путем. Возможен внутренний путь инфицирования, так как аспергиллы могут обитать на слизистой оболочке зева здоровых людей. Этот путь характерен для лиц с различными иммунодефицитными состояниями. Случаев заражения человека от больных людей не наблюдается.
Патогенез Ведущую роль в развитии аспергиллеза играет снижение иммунитета. Аспергиллез в качестве вторичного процесса возникает при различных заболеваниях кожи, слизистых оболочек, внутренних органов. Отмечено, что легочные формы аспергиллеза часто развиваются на фоне бронхоэктатической болезни (см.), абсцессов легкого (см.), туберкулеза (см.) легких, хронического бронхита (см.) и др. Настоящую проблему представляет собой аспергиллез у лиц с подавленной иммунной системой (врожденные иммунодефициты, лица, получающие противоопухолевую химиотерапию, иммунодепрессанты, а также ВИЧ-инфицированные). Аспергиллез при этом встречается значительно чаще, чем другие глубокие микозы (см.). Сначала в процесс вовлекаются легкие, затем плевра, лимфатические узлы, дальнейшее распространение гриба происходит путем гематогенной диссеминации. Распространенные (септические) формы характеризуются высокой смертностью (свыше 50 %). При массивной ингаляции спор аспергилл у лиц с нормальной иммунной системой может возникнуть острая распространенная пневмония, заканчивающаяся самовыздоровлением. В качестве профессионального заболевания аспергиллез встречается у работников таких предприятий, где аспергиллы используют для ферментации ряда химических веществ (производство лимонной кислоты, органических кислот, этиленгликоля), а также у работников пивоваренных заводов, хлопкоочистительных и ткацких фабрик, зернохранилищ, где они соприкасаются с обсемененным аспергиллами сырьем. Клеточные изменения при аспергиллезе характеризуются омертвением тканей в месте внедрения гриба. Его элементы можно обнаружить среди омертвевших масс. Возможно дальнейшее абсцедирование. При длительном течении процесса по периферии очага выявляют грануляционную ткань. Мицелий гриба прорастает сквозь стенки кровеносных сосудов.
Клиническая картина Клинические проявления аспергиллеза зависят от локализации процесса. Выделяют бронхолегочный аспергиллез, генерализованный (септический) аспергиллез, аспергиллез ЛОР-органов, аспергиллез глаз, аспергиллез кожи, аспергиллез костей, прочие формы аспергиллеза (поражение слизистых оболочек рта, гениталий и пр.). Бронхолегочный аспергиллез сначала может проявляться симптомами бронхита (см.) или трахеобронхита (см.). Заболевание характеризуется хроническим течением, больные жалуются на общую слабость, кашель с выделением мокроты серого цвета, иногда с прожилками крови. Усугубление процесса с переходом на легкие характеризуется картиной пневмонии (см.). Отмечается лихорадка (чаще неправильного типа), нередко наблюдаются повторные ознобы, кашель с обильной вязкой слизисто-гнойной или кровянистой мокротой. У некоторых больных мокрота содержит зеленовато-серые комочки, в которых при микроскопии обнаруживаются скопления мицелия и спор гриба. Появляются одышка, боли в груди, ночные поты, нарастают слабость, похудение. При прослушивании отмечаются мелкопузырчатые влажные хрипы. При развитии вторичных форм аспергиллеза на фоне уже существующих легочных нарушений наблюдаются симптомы, свойственные первичному процессу, и признаки аспергиллеза. В ряде случаев это может быть появление запаха плесени изо рта, зеленоватые комочки в мокроте, состоящие из скоплений гриба. Смертность при легочном аспергиллезе колеблется от 20 до 37 %. Септические (генерализованные) формы аспергиллеза развиваются на фоне различных нарушений иммунной системы (в том числе у больных СПИДом). Эта форма характеризуется распространением аспергилл с кровью. При этом в различных органах и тканях образуются метастазы. Поражения желудочно-кишечного тракта могут проявляться в виде тошноты, рвоты, запаха плесени изо рта, жидкого пенистого стула с большим количеством аспергилл). Возможно появление абсцессов головного мозга, специфических воспалений сосудистого тракта глаза, множественных поражений кожи в виде своеобразных узлов. Наблюдаются и изменения органов дыхания, с которых обычно и начинается аспергиллезный сепсис. У больных СПИДом (см.) признаки аспергиллеза сочетаются с проявлениями основного заболевания и других СПИД-ассоциированных инфекций. На этом фоне распространенный аспергиллез приводит к летальному исходу. Аспергиллез ЛОР-органов характеризуется развитием наружного и среднего отита, поражениями слизистой оболочки носа и придаточных полостей, гортани. Встречается аспергиллезное поражение кожи и ногтей. Профессиональный аспергиллез чаще протекает в виде хронического бронхита, иногда с симптомами бронхоспазма.
Диагностика В диагностике аспергиллеза большое значение придается данным опроса, в том числе профессионального. При бронхолегочном аспергиллезе используются клинико-лабораторные методы, а также рентгеновская диагностика. При исследовании крови отмечаются лейкоцитоз (при остром течении до 20 г/л), эозинофилия, СОЭ увеличена. Микроскопия мокроты иногда выявляет аспергиллы. При рентгенологическом исследовании обнаруживаются воспалительные образования в виде овальных или округлых инфильтратов, склонных к распаду. Вокруг образующихся полостей виден широкий инфильтративный вал. При вторичном характере аспергиллеза легких рентгенологически выявляется заполнение полостей, возникающих в результате основного заболевания, своеобразной тенью в виде шара с воздушной прослойкой между последней и стенками полости. Эта прослойка газа имеет вид своеобразной серповидной полости («ореола»). Подтверждением диагноза служит выделение возбудителя (из мокроты, материала, взятого из бронхов, образцов ткани пораженных органов). Используются серологические реакции (РСК и др.). Кожные пробы со специфическим аспергиллезным антигеном можно использовать лишь при относительно доброкачественном течении у лиц без иммунодефицитов. Аспергиллез необходимо дифференцировать с другими глубокими микозами (гистоплазмоз, кандидоз (см.)), а также с туберкулезом (см.) легких, абсцессами легких (см.), новообразованиями, хроническим бронхитом (см.).
Лечение Лечение легочного и генерализованного аспергиллеза должно проводиться в условиях стационара. Для терапии легочного аспергиллеза с ограниченным инфильтратом в последние годы успешно применяют хирургические методы (лобэктомию с резекцией пораженных участков легкого). У большинства больныхоперация протекает без осложнений и дает хорошие результаты (рецидивов не наблюдается). При распространении процесса на многие органы хирургические методы используются в комплексе с консервативным лечением. Используют низорал, амфоглюкамин, амфотерицин В. В тяжелых случаях назначают внутривенные вливания по 50 тыс. ЕД амфотерицина В в 450 мл 5 %-ного раствора глюкозы капельно в течение 4–6 ч. Суточную дозу назначают из расчета 250 ЕД/кг. Препарат вводят 2–3 раза в неделю. Длительность курса зависит от клинической формы аспергиллеза: в среднем от 4 до 8 недель (у ВИЧ-инфицированных — дольше). При легочных формах аспергиллеза показаны ингаляции амфотерицина В по 25 000 ЕД на ингаляцию. При наслоении вторичной инфекции (обычно стафилококковой) можно применять оксациллин (по 1 г 4 раза в день) или эритромицин (по 0,25 г 4 раза в день). Антибиотики тетрациклиновой группы и левомицетин противопоказаны. При кожных поражениях и аспергиллезе слизистых оболочек используют местно противовоспалительные и противомикозные препараты.
АСТИГМАТИЗМ
ОпределениеАстигматизм — нарушение преломляющей силы глаза, при котором в одном глазу сочетаются разные виды аметропии или различные степени одного вида аметропии.
Этиология и патогенез В основе развития астигматизма лежит неодинаковое преломление световых лучей в разных меридианах глаза, что связано с различиями в радиусе кривизны роговицы (реже — хрусталика). На двух главных взаимно перпендикулярных меридианах наиболее сильная и наиболее слабая преломляющая способность. Вследствие этой особенности изображение на сетчатке всегда оказывается нечетким, искаженным. Как правило, причиной является нарушение строения глаза. Однако подобные изменения могут возникать после операций, ранений глаз, заболеваний роговицы. Астигматизм подразделяется на прямой, обратный, простой, сложный, смешанный, правильный, неправильный. Простой астигматизм характеризуется тем, что в одном из главных меридианов отмечается эмметропия, а в другом — аметропия (миопия или гиперметропия); сложный астигматизм, когда в обоих главных меридианах глаза отмечается аметропия одного вида, но разной степени; смешанный астигматизм, при котором в одном из главных меридианов отмечается миопия, а в другом — гиперметропия. При остром астигматизме по горизонтальному меридиану роговицы преломляющая сила больше, чем по вертикальному. При правильном астигматизме преломляющая сила одинакова по всему меридиану роговицы. При неправильном астигматизме преломляющая сила меняется по ходу меридиана роговицы.
Клиническая картина и диагностика Больные предъявляют жалобы на снижение остроты зрения, быструю утомляемость глаз во время работы, головную боль, иногда — на видение предметов искривленными. Сферические выпуклые и вогнутые стекла не улучшают зрения. Исследование преломляющей силы выявляет разницу в преломляющей силе глаза в разных меридианах. Диагноз основывается на определении рефракции в главных преломляющих меридианах.
Лечение Назначаются очки с цилиндрическими или сфероцилиндрическими линзами (астигматическими линзами). Постоянное ношение таких очков сохраняет высокую остроту зрения и хорошую работоспособность.
АСТМА СЕРДЕЧНАЯ
ОпределениеСердечная астма — синдром левожелудочковой недостаточности, возникающей внезапно в виде приступа инспираторной одышки с сухим отрывистым кашлем, чаще в первой половине ночи. Другими словами, это — пароксизмальные формы тяжелого затруднения дыхания, обусловленного выпотеванием в легочную ткань серозной жидкости с образованием (усилением) интерстициального отека.
Этиология и патогенез Сердечная астма может возникать при гипертонической болезни (см.), симптоматических артериальных гипертензиях (см.), инфаркте миокарда (см.), кардиосклерозе (см.), артериальных пороках, остром миокардите (см.), митральном стенозе, остром нефрите, острой левожелудочковой недостаточности у больных с миокардиопатией и др. либо при острых проявлениях хронической левожелудочковой недостаточности (митральный или аортальный порок, хроническая аневризма сердца и др.). Ведущим звеном острой левожелудочковой недостаточности является резкое снижение сократительной динамики миокарда с уменьшением ударного объема сердца и застоем в левом предсердии и легочных венах. В результате затруднения венозного оттока из легких нарушается кровообращение в малом круге. Оно ведет к рефлекторной гипертензии (см.) малого круга, повышению проницаемости сосудистых стенок, усилению транссудации (пропотевания) жидкости из капилляров в интерстициальную (межклеточную) ткань и альвеолы. Все это приводит к нарушению функции внешнего и тканевого дыхания, респираторному и метаболическому ацидозу (см.). Клинически это проявляется развитием сердечной астмы. К основному патогенетическому фактору — повышению гидростатического давления в легочных капиллярах — обычно присоединяются провоцирующие приступ дополнительные: физическое или эмоциональное напряжение, гиперволемия (гипергидратация, задержка жидкости), увеличение притока крови в систему малого круга при переходе в горизонтальное положение и нарушение центральной регуляции во время сна и другие факторы. Сопровождающие приступ возбуждение, подъем артериального давления, тахикардия, тахипноэ, усиленная работа дыхательной и вспомогательной мускулатуры повышают нагрузку на сердце и снижают эффективность его работы. Присасывающее действие форсированного вдоха ведет к дополнительному увеличению кровенаполнения легких. Гипоксия и ацидоз сопровождаются дальнейшим ухудшением работы сердца, нарушением центральной регуляции, повышением проницаемости альвеолярной мембраны и снижают эффективность медикаментозной терапии.
Клиническая картина Прежде всего это приступ тяжелой одышки, появляющийся обычно в первую половину ночи, во время сна. Просыпаясь, больной ощущает затрудненное дыхание, которое вынуждает его сесть. Иногда приступ прекращается через несколько минут. В других случаях он продолжается дольше, появляются кашель с отделением небольших количеств слизистой мокроты, синюшность, учащение пульса, больному приходится спустить ноги с постели или пересесть в кресло. Обычно в этих случаях прослушиваются сухие или влажные хрипы, нередко к приступу сердечной астмы присоединяются признаки отека легкого (см.). Сердечная астма наблюдается у больных, страдающих гипертонией и атеросклерозом (см.) почек, сифилитическим аортитом (см.), атеросклерозом (см.) венечных артерий, то есть у таких больных, у которых развивается сначала недостаточность левого желудочка. Приступы сердечной астмы в этих случаях нередко появляются в ранний период развития сердечной недостаточности, когда больные находятся еще на ногах и даже работают, а кроме одышки напряжения, у них нет никаких более тяжелых проявлений сердечной недостаточности. Появлению приступов в этих случаях часто способствуют сильное переутомление или волнение в течение предыдущего дня, обильный прием пищи на ночь или прием значительного количества алкоголя. Приступы сердечной астмы часто сопровождаются отеком легких, наблюдаются чаще, чем принято считать, и в той стадии митрального стеноза, когда относительная компенсация осуществляется усиленной работой правого желудочка посредством повышения давления в малом круге. В этих случаях, а иногда и при недостаточности левого сердца вследствие гипертонии, нефросклероза, сифилитического аортита (см.) приступы сердечной астмы возникают нередко и днем при чрезмерном волнении. При митральном стенозе приступы сердечной астмы чаще всего возникают в связи с усиленными физическими движениями.
Лечение и профилактика При сердечной астме исход зависит от быстрой и эффективной лечебной помощи. Если она недостаточна, то быстро может присоединиться отек легких и наступит смерть. При выборе лекарственных средств необходимо иметь в виду, что механизм развития сердечно-астматического приступа сложен. Если есть основания предполагать в качестве первопричины нервно-рефлекторные влияния, то уместно введение морфина или пантопона, оказывающих успокаивающее действие, уменьшающих симпатический тонус и связанное с ним сужение артериол и вен. Однако при наличии симптомов нарушения мозгового кровообращения, сопровождающихся формой удушья, напоминающего сердечную астму, в основе которой лежит нарушение кровоснабжения дыхательного центра, введение морфина может спровоцировать резкое понижение возбудимости дыхательного центра. В последующем проводится воздействие на основные патогенетические факторы — уменьшение преднагрузки и посленагрузки и усиление сократимости миокарда. Чтобы уменьшить нагрузку на сердце, следует ограничить физическую активность пациента, включая временное соблюдение постельного и полупостельного режима. Питание должно включать ограничение соли. Целью лекарственной терапии является предупреждение или замедление прогрессирования нарушений функций сердца. Используются периферические вазодилататоры — ингибиторы ангиотензинпревращающего фермента, нитраты. Повышение сократимости миокарда и увеличение сердечного выброса достигается применением сердечных гликозидов. Контроль количества натрия и воды в организме достигается с помощью диуретиков. Последовательность терапевтических мероприятий во многом определяется их доступностью, временем, которое потребуется для их осуществления. 1. Купирование эмоционального напряжения. Значительная при этой патологии роль эмоционального фактора определяет повышенные требования к образу действий врача. При появлении предвестников попытки успокоить больного, оценивая его состояние как относительно безобидное, приводят порой к обратному результату. Больной должен убедиться, что врач со всей серьезностью относится к его жалобам и состоянию, действует решительно и уверенно. 2. Необходимо усадить больного (со спущенными ногами). 3. Нитроглицерин 1–1,5 мг (2–3 таблетки или 5—10 капель) под язык каждые 5—10 мин под контролем артериального давления до наступления заметного улучшения (хрипы становятся менее обильными и перестают выслушиваться у рта больного, субъективное облегчение) или до снижения артериального давления. Возможно внутривенное введение нитроглицерина со скоростью 5 мг в минуту. В ряде случаев монотерапия нитроглицерином оказывается достаточной, заметное улучшение наступает через 5—15 мин. При недостаточной эффективности нитроглицерина или невозможности его применения лечение проводится по приведенной ниже схеме. 4. 1 %-ный раствор морфина от 1 до 2 мл вводят под кожу или в вену (медленно, в изотоническом растворе глюкозы или хлорида натрия). При противопоказаниях к назначению морфина (угнетение дыхания, бронхоспазм, отек мозга) или относительных противопоказаниях у пожилых больных вводят 2 мл дроперидола внутримышечно или внутривенно под контролем артериального давления. 5. Фуросемид — от 2 до 8 мл внутривенно (не применять при низком артериальном давлении, гиповолемии); при низком диурезе — контроль эффективности с помощью мочевого катетера. 6. Применяют ингаляцию кислорода (носовые катетеры или маска, но не подушка). 7. Растворы дигоксина 0,025 % в дозе 1–2 мл или строфантина 0,05 % в дозе 0,5–1 мл вводят в вену одномоментно или капельно в изотоническом растворе натрия хлорида или глюкозы. По показаниям производят их повторное введение в половинной дозе через 1 и 2 ч. Ограниченные показания при острых формах ИБС. 8. При поражении альвеолярной мембраны (пневмония, аллергический компонент) и при гипотонии применяют преднизолон или гидрокортизон. 9. При смешанной астме с бронхоспастическим компонентом вводят преднизолон или гидрокортизон; возможно медленное введение в вену 10 мл 2,4 %-ного раствора эуфиллина (иметь в виду возможную угрозу возникновения тахикардии, экстрасистолии). Лечение проводят под постоянным (с интервалом 1–2—3 мин) контролем систолического артериального давления, которое не должно снижаться более чем на 1/3 от исходного или ниже 100–110 мм рт. ст. Особая осторожность требуется при сочетанном применении препаратов, а также у лиц пожилого возраста и при высокой артериальной гипертензии в анамнезе. При резком снижении систолического артериального давления необходимы экстренные мероприятия (опустить голову, поднять ноги, начать введение мезатона с помощью заранее подготовленной резервной системы для капельной инфузии). Венозные жгуты на конечности (попеременно по 15 мин) или венозное кровопускание (200–300 мл) могут быть рекомендованы в качестве вынужденной замены «внутреннего кровопускания», перераспределения кровенаполнения, проводимого с помощью нитроглицерина, фуросемида или (и) ганглиоблокаторов. Ингаляция паров этилового спирта малоэффективна и сопровождается нежелательным раздражением слизистой дыхательных путей. Объем инфузионной терапии и введения солей натрия должны ограничиваться необходимым минимумом. Показания к госпитализации могут возникать в стадии предвестников и после выведения из приступа сердечной астмы. Прогноз серьезный во всех стадиях и во многом определяется тяжестью основного заболевания и адекватностью лечебных мероприятий. Профилактика заключается в лечении основного заболевания, установлении бытового и трудового режима, соответствующего состоянию больного.
АСФИКСИЯ У ДЕТЕЙ
ОпределениеАсфиксия — это острое нарушение газообмена в организме. Чаще всего она происходит вследствие прекращения доступа кислорода или накопления в нем углекислого газа. В обоих случаях развивается кислородное голодание организма, приводящее в конечном итоге к смерти. Причинами асфиксии могут быть заболевания, отравления (токсическая) и механические препятствия для поступления воздуха в организм (механическая).Различают следующие виды асфиксии: — дислокационная: закрытие рта и носа, закрытие дыхательных путей собственно тканями организма (язык); — обтурационная: закрытие рта и носа, закрытие дыхательных путей инородными предметами; — странгуляционная: повешение, удавление петлей, удавление руками; — компрессионная: сдавление груди и живота; — аспирационная: аспирация сыпучих веществ, жидкостей.
Этиология и патогенез Существуют различные причины ее развития. Это болезни матери, при которых имеется недостаток кислорода или избыток углекислоты в ее организме: сердечно-сосудистые патологии, тяжелые поражения легких, выраженная анемия, при которой количество эритроцитов, т. е. клеток крови, переносящих кислород к различным органам и тканям, уменьшается или они не в полной мере выполняют свои функции; большая кровопотеря, шок — состояние, при котором наступают резкие расстройства кровообращения и, как результат этого, недостаточное снабжение кислородом органов и тканей; тяжелые отравления. Факторами, ведущими к развитию асфиксии, являются также: узел пуповины, тугое обвитие пуповины вокруг шеи и сдавление ею головки плода, перенашивание беременности, преждевременное излитие вод, атипичное течение родовой деятельности, полная или частичная закупорка дыхательных путей, например слизью, меконием.
Клиническая картина, диагностика и дифдиагностика В зависимости от степени выраженности заболевания различают легкую и тяжелую асфиксию. При легкой форме новорожденный делает вдох в течение первой минуты после своего рождения, дыхание ослаблено, крик тихий, отмечаются нарушения сердечной деятельности (как урежение, так и учащение ритма), рефлексы и тонус мышц снижены, кожа синюшная, пуповина пульсирует. Во многих случаях это состояние длительного лечения не требует. Ребенку удаляют слизь из верхних дыхательных путей, проводят ингаляцию кислородом с помощью кислородной маски и вводят в вену пуповины 10 %-ный раствор глюкозы с витамином С (аскорбиновой кислотой). При тяжелой форме асфиксии дыхание нерегулярное или отсутствует, ребенок не кричит, иногда стонет, сердцебиение замедленное, тонус мышц резко снижен или отсутствует, рефлексы не вызываются, кожа бледная, пуповина не пульсирует. В этом случае осуществляют реанимационные мероприятия, направленные на восстановление дыхания и сердечной деятельности (искусственное дыхание, массаж сердца, вводят при необходимости 0,1 %-ный раствор адреналина, обязательно 5 %-ный раствор гидрокарбоната натрия, 10 %-ный раствор глюкозы, аскорбиновой кислоты, кокарбоксилаза); для предотвращения отека мозга проводят местное охлаждение головки, а также капельное вливание растворов: респолиглюкина (10 %), глюкозы (20 %), маннитола (10 %), в конце процедуры в капельницу добавляют лазикс — мочегонное. Дифференциальный диагноз асфиксии новорожденных проводят с внутриутробной инфекцией, родовой травмой — внутричерепной, спинного мозга, печени, почек, селезенки, острой надпочечниковой недостаточностью, грыжей диафрагмы, врожденным пороком сердца, анемией (малокровием) после большой потери крови.
Лечение и профилактика За детьми, родившимися в асфиксии, устанавливается тщательный уход с первого дня жизни. Им обеспечивают покой, придают головке возвышенное положение, следят за своевременным опорожнением мочевого пузыря и кишечника, назначают ингаляции кислородом; кормят их через зонд или из бутылочки, потому что вначале, даже если асфиксия была легкой степени, ребенку трудно сосать. После выписки из роддома обязательно регулярное наблюдение педиатра и невропатолога в течение первого года жизни, так как не исключена возможность осложнений со стороны центральной нервной системы. Прогноз зависит от тяжести асфиксии, проведенных лечебных мероприятий. Профилактика заключается в своевременном выявлении и лечении болезней женщины, патологии беременности и родов, предупреждении внутриутробной гипоксии (недостаточности кислорода) плода и правильном уходе за ребенком после родов.
АСЦИТ
ОпределениеАсцит (брюшная водянка, водянка живота) — скопление жидкости (транссудата) в брюшной полости.
Этиология и патогенез Наиболее распространенными факторами возникновения и механизмами развития асцита являются портальная гипертензия (см.) различного происхождения с над-, внутри- или подпеченочной блокадой портального кровотока; отечный синдром при хронической недостаточности сердца, заболеваниях почек, алиментарной дистрофии (см.); нарушение оттока лимфы по грудному протоку (его ранение, сдавление); поражение брюшины опухолевым или туберкулезным процессом (так называемый асцит-перитонит). В механизме развития асцита нередко сочетаются несколько факторов возникновения. Кроме того, развитию асцита способствуют нарушения регуляции водно-солевого обмена. Накопление больших количеств транссудата в брюшной полости ведет к повышению внутрибрюшного давления, подвижность диафрагмы значительно снижается, давление оттесняет ее в грудную полость. В результате дыхательные движения легких могут ограничиваться вплоть до развития дыхательной недостаточности, нарушается сердечная деятельность, сопротивление кровотоку в органах брюшной полости значительно возрастает. При этом чем больше объем транссудата, тем больше страдает функция последних. Характер транссудата, как правило, серозный, реже — с кровью либо жирами. Иногда в полости брюшины накапливается от 8 до 30 л жидкости и более. Содержание белка в серозной асцитической жидкости обычно незначительно, но общие потери при массивном асците могут быть высоки, особенно в тех случаях, когда больному проводят частые повторные пункции. Вследствие этого развивается белковая недостаточность.
Клиническая картина Физикальное обследование выявляет асцит только при наличии в полости брюшины не менее 1 л жидкости. Чаще всего накопление транссудата протекает постепенно на протяжении нескольких месяцев. Оно может сопровождаться метеоризмом, который вначале может быть преобладающим симптомом. Однако в ряде случаев, например при тромбозе воротной вены, асцит может развиться остро. При осмотре определяется увеличенная окружность живота. Он имеет шаровидную форму с выступающей вперед или отвисающей нижней половиной. В горизонтальном положении больного живот распластан, наблюдается выбухание боковых отделов — так называемый «лягушачий живот». Отмечается напряжение брюшной стенки, кожа при этом истончена, натянута, сглажена. При большом объеме транссудата пупок выпячивается, кожа живота чрезмерно растягивается, нередко в области пупка отмечается симптом «головы медузы» (извитые и расширенные подкожные вены при наличии портальной гипертензии (см.)). При выстукивании обнаруживается тупой звук над отлогой или боковой частью живота. Отмечается симптом флюктуации, когда ладонью руки, приложенной к одной из боковых стенок живота, ощущаются толчки, производимые второй ладонью с другой стороны. Повышение внутрибрюшного давления способствует возникновению грыж (см.) — пупочной и бедренной. Осложнением асцита является разрыв пупочного кольца с последующим развитием перитонита (см.), иногда наблюдаются выпадение прямой кишки (см.); при наличии застойной сердечной недостаточности, помимо асцита, могут отмечаться гидроторакс (см.) и дыхательная недостаточность. Прогноз зависит от основного заболевания. Его следует считать серьезным, если, несмотря на лечение, жидкость продолжает быстро накапливаться.
Диагностика Ранней диагностике асцита способствует определение жидкости в дугласовом пространстве при исследовании больных ректальным или вагинальным методом. При неизвестной природе асцита полезным подспорьем может оказаться лабораторное исследование асцитической жидкости, забор которой осуществляется путем пункции. При сердечной недостаточности и циррозе печени жидкость чаще прозрачна, нейтральной или слабощелочной реакции. Преимущественно в ней содержатся эндотелиальные клетки, хотя раздражение брюшины повторными пункциями способствует появлению лейкоцитов; ее удельный вес не более 1,015, а концентрация белка не выше 2,5 %. В случаях злокачественного обсеменения брюшины в асцитической жидкости могут выявляться опухолевые клетки. При асцит-перитоните туберкулезного происхождения асцитическая жидкость имеет чаще геморрагический характер и содержит лимфоциты. При соответствующих исследованиях там можно найти микобактерии туберкулеза.
Лечение Лечение определяется характером основного заболевания (см. Сердечная недостаточность, цирроз печени). Задачами терапии обычно являются уменьшение задержки хлорида натрия (бессолевая диета, диуретические средства) и устранение нарушений кровообращения (сердечные гликозиды при декомпенсации сердца, кислородная терапия при гипоксии и т. д.). При неэффективности фармакотерапии транссудат удаляется путем пунктирования. Манипуляция проводится преимущественно в стационарных условиях с соблюдением всех правил асептики и антисептики. После предварительного опорожнения мочевого пузыря больного усаживают (при тяжелом состоянии — укладывают набок) и после проведения местной анестезии выполняют прокол брюшной стенки троакаром по средней линии живота между лобком и пупком либо на уровне гребней подвздошных костей. Жидкость выпускают медленно, не более 5–6 л за одну пункцию. В тяжелых случаях (обычно при значительных степенях портальной гипертензии) производится хирургическое вмешательство.
АТЕЛЕКТАЗ ЛЕГКИХ
ОпределениеАтелектаз легких — патологическое состояние целого или части легкого, при котором отмечается его спадение и безвоздушность.
Этиология и патогенез Частичные ателектазы легких нередко встречаются и у здоровых новорожденных, особенно недоношенных, в первые дни жизни. Причинами возникновения данного состояния являются: недостаточное поступление воздуха в отдельные участки легкого, неполное расправление сети его сосудов, сниженное содержание сурфактанта — вещества, препятствующего спадению легочной ткани. В большинстве случаев «физиологические» ателектазы самостоятельно ликвидируются у доношенных в течение 2 суток, у недоношенных — в более поздние сроки. При родовой травме, воспалительных заболеваниях, когда легкие не расправляются в указанные сроки, это приводит к их заболеванию, чаще — к тяжелой дыхательной недостаточности и (или) пневмонии. Возникновение ателектазов может вызвать и вдыхание небольшого количества околоплодных вод (часто это происходит при гипоксии) или молока во время кормления. Иногда причиной служит небольшое воспаление дыхательных путей, слизистая оболочка которых в этом возрасте очень рыхлая и в случае даже ее незначительного набухания закрывается просвет бронхов. Длительно существующие ателектазы всегда инфицируются, впоследствии в зоне спадения легочной ткани могут возникнуть необратимые изменения.
Клиническая картина, диагностика и дифдиагностика Чем большая площадь легочной ткани поражена, тем более выражены расстройства дыхания. Отмечаются одышка, бледность, даже синюшность кожи, дыхание на стороне пораженного легкого резко ослаблено. Окончательный диагноз устанавливается при помощи рентгенологического исследования, при этом тень сердца смещена в сторону пораженного легкого (так как оно не расправлено и участок грудной полости в этом месте свободен). Дифференцируют ателектаз со скоплением жидкости в полости плевры — оболочки, покрывающей легкие и выстилающей грудную полость. В этом случае сердце смещено в сторону здорового легкого (так как в полости пораженной стороны имеется жидкость). В некоторых случаях на рентгенограмме можно обнаружить врожденное отсутствие одного из легких. При этом, как правило, не наблюдается острой кислородной недостаточности.
Лечение Обычно не требуется, если ателектазы являются «физиологическими» и расправляются самостоятельно в указанные выше сроки. В противном случае назначают противовоспалительную терапию (антибиотики, витамины, обильное питье, ингаляции кислородом). Рекомендуется поместить ребенка в хирургический стационар для проведения подробного обследования и выбора лечения.
АТЕРОСКЛЕРОЗ
ОпределениеАтеросклероз — хроническое заболевание артерий крупного и среднего калибра (эластического и мышечно-эластического типа), характеризующееся отложением и накоплением в стенке плазменных атерогенных липопротеинов с последующим разрастанием соединительной ткани и образованием атеросклеротических бляшек в артериальной стенке.В зависимости от преимущественной локализации атеросклеротических процессов в сосудистой системе развиваются определенные клинические проявления, некоторые из которых выделены в отдельные нозологические формы (ишемическая болезнь сердца (см.)).
Этиология Факторы, способствующие возникновению атеросклероза, изучены не до конца. Из них преобладающими являются частые и длительные стрессы, злоупотребление жирной и богатой легкоусвояемыми углеводами пищей, эндокринные и обменные заболевания: сахарный диабет (см.), гипотиреоз (см.), желчнокаменная болезнь (см.). Основными факторами риска развития атеросклероза считаются артериальная гипертензия (см.), повышение вязкости и свертываемости крови, дислипопротеинемия с повышением содержания в сыворотке крови липопротеинов очень низкой и низкой плотности (II–IV тип гиперлипопротеинемии по классификации ВОЗ) и снижением содержания липопротеинов высокой плотности, курение, ожирение, генетическая предрасположенность к преждевременному атеросклерозу, гиподинамия (см.), возраст старше 40 лет. Как одни из факторов, способствующих возникновению заболевания, изучаются вирусный и герпес-вирусный. Установлено, что вирус Эпштейна-Барра, вирусы Коксаки и другие приводят к повреждению мембран эндотелиальных клеток, нарушениям жирового обмена и иммунным нарушениям, свойственным атеросклеротическому процессу.
Патогенез В механизме развития атеросклероза принимает участие множество факторов, что находит различное объяснение в рамках существующих на сегодняшний день теорий. Наиболее популярны две основные гипотезы: липидная и эндотелиальная. Липидная гипотеза первичным считает повышение уровня плазменных липопротеинов низкой плотности, богатых холестерином, что способствует поступлению последних в сосудистую стенку. Липопротеины высокой плотности, напротив, обладают защитным действием, поэтому риск развития атеросклероза тем выше, чем больше различается их соотношение. Кроме того, липопротеины низкой плотности способны вызывать переразвитие мышечных клеток сосудов и влиять на изменения в клеточном росте стенок сосудов. Имеются сообщения и о воздействии липопротеинов низкой плотности на образование стволовых клеток, активацию фактора роста и в конечном итоге на образование локального фиброза (см.). Эндотелиальная гипотеза в качестве первичного фактора рассматривает повреждение эндотелиального слоя сосудов, которое запускает целый каскад клеточно-иммунологических реакций. Они, в свою очередь, приводят к формированию фиброзной бляшки в месте повреждения. Клеточная трансформация и образование гигантских (многоядерных) эндотелиальных клеток приводят к развитию аутоиммунных реакций, сопровождающихся фазой воспаления, что завершается формированием бляшки. Обе гипотезы скорее дополняют одна другую, чем исключают.
Атеросклеротическая бляшка, суживающая просвет артерии; в просвете красный тромб
Атеросклеротическая бляшка медленно растет на протяжении многих лет, проходя в своем развитии стадии рыхлой и обызвествленной атеросклеротической бляшки. При этом условия кровотока в пораженной артерии все более ухудшаются. На любой из стадий бляшка может спонтанно или при резком повышении артериального давления повреждаться в результате трещины или разрыва, что приводит к образованию тромба и к еще большему ухудшению кровотока.
Клиническая картина В течении атеросклероза выделяются два периода. В первом, так называемом доклиническом, периоде доступными методами диагностики можно выявить дислипидемию и гиперхолестеринемию, а также начальные неспецифические сосудистые реакции. Во втором — периоде клинических проявлений — в пораженных атеросклеротическим процессом органах развиваются преходящие ишемические нарушения и хроническая недостаточность кровоснабжения органов. В этом периоде проявляющиеся симптомы зависят от преимущественной локализации атероматоза. Наиболее часто поражаются грудная и нисходящая часть аорты, венечные, общие сонные, мозговые, почечные, мезентериальные и бедренные артерии. При развитии клиники множественных атероматозных очагов говорят о распространенном атеросклерозе.
Атеросклеротический нефроцирроз. Грубые западения на поверхности почек
Атероматоз аорты. Внутренняя поверхность аорты обезображена атероматозными бляшками и язвами

Атерома в атеросклеротической бляшке аорты
Кроме того, в течении заболевания выделяют фазы прогрессирования, стабилизации и регрессирования атеросклероза.
Атеросклероз аорты Атеросклероз аорты развивается раньше, чем в других сосудистых зонах, более выражен, встречается чаще, однако диагностируется намного позже вследствие длительного периода скрытого течения. Ясные клинические симптомы обычно выявляются у больных в возрасте 60 лет и старше. Одними из ранних признаков являются повышение систолического и пульсового давления при нормальном, а затем снижающемся диастолическом, а также увеличение скорости распространения пульсовой волны. В ряде случаев возникает загрудинная боль (аорталгия) — редкий, но типичный симптом. Боль имеет давящий или жгучий характер, смещается в обе руки, шею, межлопаточную область, верхнюю часть живота. В отличие от стенокардии, боль не приступообразная, длительная, может продолжаться часами и сутками, с периодической сменой интенсивности.

Отчетливая видимость грудной аорты при атеросклерозе (первое косое положение)
При атрофии мышечного слоя в пораженных атеросклерозом участках аорты формируется аневризма с образованием мешковидных или распространенных расширений. В этом случае, а также при значительном расширении дуги аорты могут отмечаться осиплость голоса, кашель, одышка, дисфагия (см.) (из-за сдавления возвратного нерва и давления на трахею). Возможны головокружения, обморочные состояния и судороги при резком повороте головы. При преимущественном поражении брюшной аорты (оно бывает более выраженным, чем в грудном отделе) отмечается неравномерное повышение ее плотности при прощупывании. При прослушивании над ней может прослушиваться систолический шум по средней линии выше или на уровне пупка. Отмечаются боли в животе различной локализации, запоры вследствие недостаточного кровоснабжения разных участков желудочно-кишечного тракта. Атеросклероз области раздвоения аорты (бифуркации) приводит к развитию синдрома Лериша — хронической закупорке аорты (перемежающаяся хромота, похолодание и онемение ног, атрофия мышц голеней, импотенция, язвы и некрозы в области пальцев стоп, отсутствие пульсации в артериях стоп, подколенных, а нередко и в бедренных, систолический шум над бедренной артерией в области пахового сгиба).
Развернутая аорта при атеросклерозе (второе косое положение). Восходящая аорта заметно расширена. Увеличение «аортального окна» вследствие большего расхождения восходящей и нисходящей аорты
Атеросклероз венечных артерий сердца (см. Ишемическая болезнь сердца)
Атеросклероз сосудов головного мозга (см. Мозговой криз, Инсульт)
Атеросклероз мезентериальных артерий Атеросклероз мезентериальных артерий проявляется симптомами «брюшной жабы» и нарушения пищеварительной функции желудочно-кишечного тракта. «Брюшная жаба» характеризуется появлением резких приступообразных болей в верхней части живота на высоте пищеварения, которая держится 1–3 ч и напоминает стенокардические боли. Иногда боли кратковременные, прекращаются нитроглицерином. Боль сопровождается вздутием живота, отрыжкой, запорами. В дальнейшем могут присоединяться зловонные поносы 2–3 раза в сутки с остатками непереваренной пищи и невсосавшихся жиров. При исследовании живота определяются высокое стояние диафрагмы, снижение или отсутствие перистальтики, систолический сосудистый шум в верхней области живота.
Атеросклероз почечных артерий Основным синдромом при атеросклерозе почечных артерий является почечная симптоматическая артериальная гипертензия, которая при вовлечении в атеросклеротический процесс обеих почечных артерий принимает злокачественный характер. В моче определяются белок, эритроциты, цилиндры. Над местом сужения почечной артерии иногда выслушивается систолический шум.
Облитерирующий атеросклероз артерий нижних конечностей Клинически проявляется слабостью и повышенной утомляемостью мышц голеней, зябкостью и онемением ног, синдромом перемежающейся хромоты (сильной болью в ногах при ходьбе, которая проходит во время отдыха). При обследовании отмечаются уменьшение кожной температуры конечностей, бледность, трофические нарушения (сухость, шелушение кожи, трофические язвы, гангрена), а также ослабление или отсутствие пульса на тыльной стороне стопы. В результате прогрессирования поражения сосудов расстояние, которое больной может пройти без боли в ногах, сокращается.
Диагностика В диагностике используются клинико-лабораторные и инструментальные методы. При биохимическом исследовании крови отмечаются повышение содержания холестерина, триглицеридов, липопротеидов, увеличение коэффициента атерогенности. При рентгенологическом исследовании выявляются уплотнение, удлинение и расширение аорты в грудном и брюшном отделах. Данные ультразвуковой флуометрии, реовазо-, осцилло-, плетизмо- и сфигмографии демонстрируют снижение и запаздывание основного магистрального кровотока в артериях нижних конечностей. При ангиографии артерий нижних конечностей и почек отмечается сужение их просвета. С помощью изотопной рентгенографии можно сделать вывод о нарушении секреторно-экскреторной функции почек при атеросклерозе почечных артерий.

Рентгенограмма при атеросклерозе аорты: 1 — контур восходящей аорты расположен на большем расстоянии от средней линии и имеет большее закругление; 2 — безымянная артерия видна от ее ответвления до аорты; 3 — верхняя полая вена; 4 — левая подключичная артерия становится видимой; 5 — контур дуги аорты более сильно выступает влево («клюв»); 6 — тень нисходящей аорты становится видимой — ее левая граница расположена от средней линии на большем расстоянии; 7 — контур левого желудочка закруглен вследствие гипертрофии
Лечение Лечение атеросклероза и его профилактика включают общие мероприятия по оздоровлению организма: рациональное питание, борьбу с малоподвижностью, отказ от курения, снижение избыточного веса. Тактика лечебного воздействия должна быть направлена на механизмы развития заболевания и в первую очередь — на нормализацию холестеринового обмена: уменьшение поступления холестерина с пищей, снижение его синтеза в клетках организма и увеличение выведения из организма, а также на предотвращение повреждения эндотелия сосудов (гипотензивная терапия и пр.). Диета больных атеросклерозом должна быть низкокалорийной. Уменьшение поступления холестерина в организм достигается с помощью снижения в пище жиров животного происхождения, включения в рацион жиров растительного происхождения, овощей, фруктов, витаминов и т. д. Воздействовать на синтез холестерина и нарушения жирового обмена возможно с помощью липидонормализующих препаратов. С этой целью используются холестирамин, колестипол, квестран, действующие только на уровне кишечника; производные никотиновой кислоты (ниацин, эндурацин), снижающие уровень общего холестерина, триглицеридов и повышающие уровень липопротеинов высокой плотности; их назначают по 1,5–3,0 г в сутки в 3 приема. Клофибрат, мисклерон, безафибрат назначают в дозе 200 мг 2—3 раза в сутки; ловастатин, флювастатин, правастатин, симвастатин непосредственно влияют на синтез холестерина, хорошо переносятся, назначаются 1 раз в сутки по 20–40 мг во время ужина. Благоприятное действие на сосудистую стенку выявлено у ингибиторов ангиотензинпревращающего фермента, антагонистов кальция и эстрогенов. При семейнонаследственных формах гиперлипидемии применяются плазмаферез, иммуносорбция, угольные сорбенты.
АХАЛАЗИЯ КАРДИИ
ОпределениеАхалазия кардии(хиатоспазм, идиопатическое расширение пищевода, мегаэзофагус, функциональная непроходимость кардии) — заболевание пищевода, характеризующееся нарушением рефлекторного раскрытия кардиального отверстия (место впадения пищевода в желудок) при глотании, нарушениями перистальтики и прогрессирующим снижением тонуса гладких мышц тубулярного отдела пищевода. Термин «кардиоспазм» (см.), который также иногда встречается при описании заболевания, не точен, так как истинного спазма кардии при ахалазии не происходит. Частота встречаемости ахалазии кардии составляет 7 случаев на 100 тыс. населения.Ахалазия чаще проявляется в возрасте 20–40 лет, одинаково часто среди женщин и мужчин.
Этиология и патогенез Считают, что главная причина развития ахалазии — повреждение парасимпатической нервной системы и непосредственно межмышечных пучков ауэрбаховского сплетения, что предположительно зависит от врожденной недостаточности или инфекции, локализованной непосредственно в стенке пищевода. Выделяют также вторичную — симптоматическую — форму ахалазии кардии, возникающую при инфильтрации волокон пучка Ауэрбаха клетками злокачественных новообразований. Симпатическая иннервация пищевода при ахалазии кардии нарушается в значительно меньшей степени и лишь на поздних стадиях заболевания. Нервная дегенерация приводит к гипертензии нижнего сфинктера пищевода, повышению пищеводного давления, последующей потере перистальтики в теле пищевода и потере тонуса гладких мышц. Поступление пищи в желудок продолжается лишь благодаря механическому раскрытию кардиального отверстия под давлением скопившейся в пищеводе жидкой пищи. Длительная задержка пищи вкупе с мышечной атонией приводят к расширению отделов пищевода, находящихся выше кардиального отдела. Морфологическая картина зависит от длительности заболевания. В начальной стадии процесса морфологические изменения отсутствуют. В дальнейшем возникает и прогрессирует расширение верхнего (до 5 см и более) и сужение нижнего отделов. При микроскопии отмечаются увеличение пучков гладкомышечных клеток, разрастание соединительной ткани, изменения в межмышечном нервном сплетении. Макроскопически отмечается удлинение и S-образная извилистость пищевода. В поздних стадиях заболевания в стенке пищевода полностью отсутствуют нервные сплетения, слизистаяоболочка грубая, складки на ней отсутствуют.
Клиническая картина В клинике преобладает дисфагия (см.), регургитация и боли за грудиной. На ранних стадиях заболевания дисфагия повторяется эпизодами, возникая или усиливаясь при волнении. В поздних стадиях наблюдается при каждом приеме пищи, особенно сухой или плохо прожеванной, хотя может носить и парадоксальный характер: твердая пища проходит в желудок лучше жидкой. Для облегчения состояния больные пьют воду или молоко, делают глубокие вдохи, выгибают туловище назад, что в ряде случаев помогает. Регургитация проявляется либо срыгиванием скопившихся в пищеводе слюны, слизи и пищевых остатков, либо в виде пищеводной рвоты, которая развивается спустя 3–4 ч после еды, что свидетельствует о значительном расширении пищевода. Она появляется в том случае, если больной принимает горизонтальное положение или наклоняется вперед (так называемый симптом «шнурка»). Регургитация может возникнуть и в ночное время во сне. При этом нередко отмечается затекание пищеводного содержимого в дыхательные пути, что сопровождается симптомами «ночного кашля», «мокрой подушки», «ночной рвоты» и др. Следствием попадания в дыхательные пути пищеводного содержимого становятся хронический (часто рецидивирующий) бронхит либо аспирационная пневмония. Помимо пищеводной рвоты съеденной пищей с примесью слизи и слюны, чаще при наклоне вперед (например, при мытье полов), пациенты предъявляют жалобы на загрудинные боли. Боли за грудиной возникают при глотании или вне приема пищи. Они напоминают таковые при стенокардии со смещением в шею, челюсть, межлопаточную область, исчезают при приеме нитроглицерина (а также после срыгивания или прохождения пищи в желудок), но никогда не связаны с физической нагрузкой. В дальнейшем дисфагия (см.) прогрессирует, недостаток питания приводит к снижению массы тела в течение нескольких месяцев или лет. Заболевание может протекать волнообразно, с периодами обострений и улучшений состояния. Среди осложнений на первом месте находятся повторные аспирационные пневмонии (см.) и хронические бронхиты (см.). В 3–8 % случаев на фоне ахалазии кардии развивается злокачественное новообразование.
Диагностика В диагностике важнейшее значение имеют клинические данные и результаты инструментальных исследований. При рентгенологическом исследовании отмечается отсутствие воздушного пузыря желудка. При контрастировании сульфатом бария просматривается расширение пищевода с дистальным клювоподобным сужением и уровнем жидкости. Подтверждение диагноза и исключение опухолевой природы (вторичной ахалазии, особенно в начале заболевания у больных старше 50 лет) осуществляется эзофагоскопическим методом. Данные манометрии: нормальный или увеличенный уровень давления нижнего сфинктера пищевода, снижение его расслабления, отсутствие перистальтики. Дифференцировать заболевание следует с истинным кардиоспазмом (см.), рубцовыми сужениями и новообразованиями пищевода.
Лечение Назначается диета (стол № 1). Питание частое и необильное. Противопоказаны алкоголь и курение. На первом этапе лечения применяют пробную терапию антагонистами кальция (нифедипин по 10–20 мг или изосорбида динитрат по 5—10 мг внутрь). Местно применяют алмагель А. Однако фармакотерапия чаще всего оказывается безрезультатной. Основным методом лечения является пневматическая баллонная дилатация под местной анестезией, 4–6 процедур на курс. Ее эффективность составляет 85 %, отмечен риск перфорации (3–5 %) или кровотечения. Миотомия нижнего пищеводного сфинктера (процедура Геллера) имеет такую же эффективность, риск рефлюкс-эзофагита составляет 10–30 %. Полного выздоровления не происходит, однако на фоне рано начатого лечения основные симптомы исчезают. Частота рецидивов составляет 30–60 %.
♦ Б ♦
БАЛАНТИДИАЗ
ОпределениеБалантидиаз — паразитарная болезнь, характеризующаяся язвенным поражением толстой кишки, тяжелым течением и высокой смертностью при поздно начатой терапии.
Этиология и патогенез Возбудитель — балантидия — относится к классу инфузорий, встречается в активной форме и в виде цист, устойчивых во внешней среде. Естественными носителями балантидий являются свиньи. Заражение человека происходит при попадании балантидий в пищеварительный тракт, где они могут длительно существовать (в тонком кишечнике), не вызывая болезни. У некоторых инфицированных лиц балантидии проникают в ткани, вызывая кровоизлияния, очаги некроза и язвы. Они имеют неправильные очертания, изрезанные и утолщенные края, неровное дно, покрытое кровянисто-гнойным налетом. Может наступить прободение язв, перитонит (см.).
Балантидия
Клиническая картина Острый балантидиаз Острые формы болезни характеризуются лихорадкой, симптомами общей интоксикации и признаками поражения кишечника (боль в животе, понос, метеоризм, возможны тенезмы — ложные позывы к дефекации). В испражнениях отмечается примесь слизи и крови. Характерны спазм и болезненность толстого кишечника, увеличение печени. При ректороманоскопии выявляется очаговый инфильтративно-язвенный процесс. При тяжелом течении отмечаются общая интоксикация, высокая лихорадка, стул до 20 раз в сутки с примесью слизи и крови с гнилостным запахом. Больные быстро худеют, иногда появляются симптомы раздражения брюшины. При ректороманоскопии устанавливают обширные язвенные поражения.
Хронический балантидиаз При хроническом балантидиазе симптомы интоксикации выражены слабо, температура тела нормальная, стул до 2–3 раз в сутки, жидкий, со слизью, иногда с примесью крови. При прощупывании отмечается болезненность преимущественно в области слепой и восходящей кишки. При ректороманоскопии могут быть типичные язвенные изменения. Подтверждением диагноза служит обнаружение паразитов в кале.
Диагностика и дифдиагностика Диагноз ставится на основании клинической картины и обязательного подтверждения обнаружением паразита — балантидии. Обязательным условием микроскопической диагностики является многократное исследование испражнений (обследование ежедневно в течение 10 дней). При запущенных формах заболевания, сопровождающихся истощением, прогноз сомнительный. В случаях раннего распознавания лечение успешное.
Лечение и профилактика Препараты, направленные на устранение паразитов, применяют в виде 2–3 пятидневных циклов. Назначают мономицин по 0,15 г 4 раза в сутки, окситетрациклин по 0,4 г 4 раза в сутки, метронидазол по 0,5 г 3 раза в сутки. Интервал между циклами составляет 5 дней. Прогноз при современной терапии благоприятный. Без применения антипаразитарной терапии смертность достигала 10–12 %. Для предупреждения заболевания необходимо соблюдение гигиенических мер при уходе за свиньями, а также своевременное выявление и лечение больных балантидиазом людей. Общие меры профилактики те же, что при дизентерии.
БАРТОЛИНИТ
ОпределениеБартолинит — воспаление большой железы преддверия влагалища.
Этиология и патогенез Возбудителями являются различные микробы: стафилококки, эшерихии, гонококки и др. Инфекция проникает через выводной проток железы — каналикулит (см.), затем воспалительный процесс захватывает всю окружающую ткань, в результате чего возникает серозное или гнойное воспаление. Гнойное содержимое заполняет дольки железы с образованием ложного абсцесса, который может самостоятельно вскрыться.
Клиническая картина В острой стадии наблюдаются недомогание, слабость, ощущение припухлости в области наружных половых органов, повышение температуры тела. При объективном исследовании отмечают припухлость и прилив крови в области бартолиновой железы; ее прощупывание резко болезненно. При образовании псевдоабсцесса температура резко повышена, ознобы. При прорыве гнойника улучшается общее состояние больной, снижается температура. В хронической стадии заболевания возможно развитие кисты. Заболевание имеет склонность к рецидивам.
Диагностика и лечение Диагноз ставится на основании характерных жалоб больной, данных объективного обследования и основных симптомов заболевания. В острой стадии показаны покой, антибиотики, сульфаниламиды, сидячие теплые ванночки с раствором перманганата калия (1:6000), при образовании псевдоабсцесса — хирургическое лечение. В случае рецидивирующего бартолинита показано удаление железы.
БАУГИНИТ
ОпределениеБаугинит — воспалительное поражение баугиниевой заслонки (илеоцекального клапана, расположенного в месте перехода подвздошной кишки в слепую). Обычно наблюдается при энтеритах (см.) и колитах (см.).
Этиология и патогенез Причиной возникновения заболевания становятся болезнетворные микроорганизмы, поступающие вместе с пищей, неполноценное питание, особенно при недостатке белка, витаминов, и индивидуальная непереносимость отдельных продуктов. В результате воздействия неблагоприятных факторов нарушается регенерация слизистой оболочки кишечника, развиваются местное воспаление и отек. Кроме того, значительную роль в развитии баугинита играет нарушение моторики кишечника и нервно-эндокринный фактор.
Клиническая картина Боль в правой подвздошной области, метеоризм, нарушение стула. Прощупывание живота в правой подвздошной области болезненно, нередко возникает урчание. Признаки воспаления баугиниевой заслонки могут быть выявлены при рентгенологическом исследовании кишечника и при колоноскопии. Иногда выявляется недостаточность баугиниевой заслонки.
Диагностика и дифдиагностика Заподозрить развитие баугинита позволяют основные клинические проявления — приступы схваткообразных болей в правой подвздошной области, нарушения стула, урчание в животе, метеоризм, тошнота, отрыжка. При прощупывании обнаруживается болезненность в области подвздошной кишки, вздутие живота. Лабораторные микроскопические и бактериологические исследования выявляют значительные нарушения пищеварительной функции кишечника и бактериальной флоры. При рентгенологическом исследовании — признаки энтерита или колита. Эндоскопически обнаруживается отек, зоны покраснения и атрофических изменений слизистой оболочки.
Лечение и профилактика Больные нуждаются в госпитализации, при подозрении на инфекционную природу заболевания — в инфекционные больницы. Назначают антибактериальную или противопаразитарную терапию, при токсических колитах — солевые слабительные. В первый день разрешают только обильное питье (несладкий или полусладкий чай), затем, на 2— 5-й день, диету № 4, потом № 4б и 4 в. При обезвоживании капельно подкожно или внутривенно вводят 0,9 %-ный раствор натрия хлорида, 5 %-ный раствор глюкозы или гемодез. Внутрь назначают обволакивающие и вяжущие средства (висмута нитрат основной по 1 г 4–6 раз в день, танальбин, каолин и др.), препараты пищеварительных ферментов (абомин, полизим и др.), холинолитические средства. Для нормализации кишечной флоры назначают энтеросептол, интестопан, колибактерин, бификол и др. Больные подлежат последующему наблюдению в течение 6 месяцев. Показано частое дробное питание (4–6 раз в сутки), диета — механически щадящая (слизистые супы, пюре, фрикадельки, паровые мясные и рыбные котлеты и т. д.). Пища должна содержать 100–120 г белка, 100–120 г легко усвояемых жиров (сливочное, растительное масла), около 400–500 г углеводов. В период наибольшей остроты процесса временно ограничивают поступление в организм углеводистых продуктов (до 350 и даже 250 г) и жиров. Жиры переносятся и усваиваются больными хроническими заболеваниями кишечника лучше, если они поступают в организм не в чистом виде, а в связи с другими пищевыми веществами (в процессе кулинарной обработки пищи). Переносимость углеводов и растительной клетчатки значительно повышается при их соответствующей кулинарной обработке (протирание, варка на пару, в наиболее тяжелых случаях — хорошо измельченные овощные пюре и пр.). Витамины назначают внутрь в виде поливитаминов или парентерально (С, В2, В6, В12 и др.). Фрукты используют в виде киселей, соков, пюре, в печеном виде (яблоки), а в период улучшения состояния — и в натуральном виде, за исключением тех, которые способствуют усилению процессов брожения в кишечнике (виноград) или обладают послабляющим действием, что нежелательно при поносах (чернослив, инжир и др.). Холодная пища и напитки, низкомолекулярные сахара, молочнокислые продукты усиливают перистальтику кишечника, поэтому их при обострениях и поносах назначать не следует. Исключают острые приправы, пряности, тугоплавкие жиры, черный хлеб, свежие хлебные продукты из сдобного или дрожжевого теста, капусту, свеклу, кислые сорта ягод и фруктов, ограничивают поваренную соль. Основная диета в период обострения — № 2 и 4а (при преобладании бродильных процессов), по мере стихания воспалительного процесса назначают диету № 4б и более расширенную, приближающуюся к нормальной, диету № 4в (пищу дают в непротертом виде). Полезно ацидофильное молоко (150–200 г 3 раза в день). При наличии сопутствующих заболеваний (холецистит, панкреатит, атеросклероз) в соответствии с надлежащими требованиями изменяют диету. В период обострений назначают на короткое время антибиотики широкого спектра действия (тетрациклины, левомицетин, аминогликозиды и др.) или сульфаниламидные препараты (сульгин, фталазол) в обычных дозах. Наиболее эффективным во многих случаях является назначение энтеросептола (по 0,25—0,5 г 3 раза в день), мексаформа, интестопана, которые оказывают угнетающее действие в первую очередь на патогенную флору кишечника, уменьшают бродильные и гнилостные процессы. Полезны колибактерин, бифидумбактерин, бификол, лактобактерин, которые назначают по 5—10 доз в день (в зависимости от тяжести заболевания). С целью повышения реактивности организма назначают подкожно экстракт алоэ (по 1 мл 1 раз в сутки, 10–15 инъекций), пеллоидин (внутрь по 40–50 мл 2 раза в день за 1–2 ч до еды или в виде клизм по 100 мл 2 раза в день в течение 10–15 дней), проводят аутогемотерапию. При проктосигмоидите назначают микроклизмы (ромашковые, таниновые, протарголовые, из взвеси висмута нитрата), а при проктите — вяжущие средства (ксероформ, дерматол, цинка окись и др.) в свечах, нередко в комбинации с белладонной и анестезином («Анестезол», «Анузол» и «Неоанузол» и др.). При поносе рекомендуются вяжущие и обволакивающие средства (танальбин, тансал, висмута нитрат основной, белая глина и др.), настои и отвары растений, содержащие дубильные вещества (отвары 15:2000 корневищ змеевика, лапчатки или кровохлебки по 1 ст. л. 3–6 раз в день, настой или отвар плодов черемухи, плодов черники, соплодий ольхи, травы зверобоя и др.), холинолитики (препараты белладонны, атропина сульфат, метацин и др.). Холино- и спазмолитики назначают при спастическом колите. При выраженном метеоризме рекомендуется уголь активированный (по 0,25—0,5 г 3–4 раза в день), настой листа мяты перечной (5:200 по 1 ст. л. несколько раз в день), цветков ромашки (10:200 по 1–2 ст. л. несколько раз в день) и другие средства. Если причиной поноса является в первую очередь секреторная недостаточность желудка, поджелудочной железы, сопутствующий энтерит, полезны препараты пищеварительных ферментов — панкреатин, фестал и др. Большое место в терапии обострений занимают физиотерапевтические методы (кишечные орошения, грязевые аппликации, диатермия и др.) и санаторно-курортное лечение (Ессентуки, Железноводск, Друскининкай, местные санатории для больных с заболеваниями кишечного тракта).
БЕРЕМЕННОСТЬ ВНЕМАТОЧНАЯ
ОпределениеБеременность внематочная — патология беременности, при которой имплантация и развитие плодного яйца происходят вне матки, чаще всего в маточной трубе (99 % случаев), реже в яичнике и брюшной полости.Инфантилизм трубы, сопровождающийся недоразвитием мускулатуры ее, как причина трубной беременности: 1–4 — недостаточная канализация просвета трубы на небольшом протяжении ампулы и перешейка; 2–3 — отсутствие складок в среднем участке и перешейке трубы; 3 — отсутствие кольцевого слоя мускулатуры в среднем участке трубы — причина трубной беременности
Возможная локализация внематочной беременности: 1 — беременность маточная; 2 — внематочная в перешейке; 3 — интерстициальная; 4 — трубная; 5 — яичниковая; 6 — брюшная
Резкое сужение просвета в ампуле трубы как причина ампулярной беременности: 1—2 — аденомиоз в перешейке трубы; 3 — грубая недоразвитая складчатость и перегородки в среднем участке трубы возле перешейка; 4 — сеткообразное расположение складок в ампуле трубы
Этиология и патогенез Внематочная беременность обнаруживается у 1–4 % от общего числа гинекологических больных. Чаще всего причиной внематочной беременности служат воспалительные изменения маточных труб. Наряду с этим большую роль играют инфантилизм и различные эндокринные расстройства, изменяющие перистальтику труб. Ворсины плодной оболочки глубоко прорастают всю толщу маточной трубы, не встречая на своем пути воздействия фермента другой оболочки, так как в трубе она выражена слабо.
Инфантилизм трубы, сопровождающийся недоразвитием мускулатуры ее, как причина трубной беременности: 1-4 — недостаточная канализация просвета трубы на небольшом протяжении ампулы и перешейка; 2-3 — отсутствие складок в среднем участке и перешейке трубы; 3 — отсутствие кольцевого слоя мускулатуры в среднем участке трубы — причина трубной беременности
Внематочная беременность может окончиться или трубным абортом (см.), когда плодное яйцо выталкивается через ампулярный конец трубы, или разрывом трубы вследствие ее прорастания ворсинами. И в том, и в другом случае возникает внутрибрюшинное кровотечение, в результате которого образуются скопление крови в трубе, околотрубная или заматочная гематома. При разрыве трубы кровотечение бывает особенно сильным.
Исходы внематочной беременности: 1 — трубный аборт; 2 — разрыв трубы
Клиническая картина Различают прогрессирующую и прервавшуюся внематочную беременность. Прогрессирующая внематочная беременность сопровождается такими же симптомами, как и маточная (задержка менструации, тошнота и рвота по утрам, синюшность влагалища и шейки матки, увеличение и размягчение матки и др.). Обычно на этой стадии развития внематочная беременность не диагностируется, и ее принимают за маточную. Изменения маточной трубы выражены незначительно.
Различные виды расщепления просвета трубы, обнаруженные при внематочной беременности: 1 — добавочное отверстие и слепой добавочный ход; 2 — срез через средний участок трубы в начале отщепления слепого добавочного хода; 3 — срез через перешеек, видно врастание слизистой и возникновение аденомиоза
Прерывание трубной беременности в результате разрыва трубы чаще всего происходит на 6—8-й неделе. Внезапно появляются резкая боль в животе со смещением вверх (френикус-симптом) или вниз, в область наружных половых органов и прямую кишку, головокружение, обморочное состояние, снижение артериального давления, учащение пульса и нарастающие симптомы внутреннего кровотечения. Кровянистые выделения из половых путей могут отсутствовать, так как плодная оболочка еще не успевает отслоиться от стенок матки. Нарушение по типу трубного аборта может протекать длительно и иметь разнообразную картину. Обычно на фоне небольшой задержки менструации у больной возникают схваткообразная боль в животе, чувство общей слабости, головокружение, дурнота. Через несколько дней появляются темно-кровянистые мажущие выделения из половых путей. Эти симптомы носят периодический характер. Температура тела нормальная или немного повышенная (реже). При значительном внутреннем кровотечении симптомы аналогичны таковым при разрыве трубы.
Диагностика и дифдиагностика Правильный диагноз прогрессирующей трубной беременности ставят редко. Диагноз нарушенной внематочной беременности устанавливают с учетом данных опроса (сальпингоофорит, инфантилизм, гормональные нарушения), характерной задержки менструаций, клинической картины. При разрыве маточной трубы как характерные клинические проявления отмечаются боли, внутреннее кровотечение и нарастающая анемия больной. Прощупывание живота болезненно, особенно в нижних отделах, на стороне расположения измененной трубы. Имеются симптомы перитонита. При значительном кровотечении обнаруживают притупление звука при выстукивании в боковых отделах живота. При перемещении больной с боку на бок границы притупления соответственно перемещаются. При влагалищном исследовании отмечают синюшность слизистых оболочек, небольшое увеличение размеров матки (она меньше, чем должна быть по предполагаемому сроку беременности), ее размягчение. Прощупывание придатков матки на стороне поражения вызывает резкую боль и защитную реакцию мышц живота, вследствие чего увеличенные придатки прощупать часто не удается. Задний свод влагалища выбухает, болезнен при обследовании. При пункции заднего свода получают темную кровь с мелкими сгустками (не всегда). Нарушенная внематочная беременность, протекающая по типу трубного аборта, требует для распознавания более длительного времени, так как сходные признаки наблюдаются и при других заболеваниях: начавшемся маточном аборте, воспалении придатков матки, остром аппендиците и т. д. Поэтому для диагностики наряду с вышеописанными симптомами немалое значение имеют дополнительные тесты (биологические или иммунологические реакции на беременность, пункция заднего влагалищного свода, лапароскопия, исследование с помощью ультразвука и др.).
Лечение и профилактика При подозрении на внематочную беременность больную экстренно госпитализируют. После установления диагноза показана срочная операция с одновременным применением средств борьбы с анемией и шоком (если они имеются). После операции проводят восстановительное лечение, которое является профилактикой повторной внематочной беременности (5 % случаев), и лечение воспалительного процесса придатков матки противоположной стороны: назначают сеансы гидротубации в сочетании с ультразвуком.
Пятерня. Однояйцевая тройня и двуяйцевая двойня
Однояйцевая двойня: 1 — раздельная водная оболочка. Децидуальная и ворсистая оболочки — общие; 2 — децидуальная, ворсистая и водные оболочки — общие
БЕРЕМЕННОСТЬ МНОГОПЛОДНАЯ
ОпределениеБеременность многоплодная — одновременное развитие двух и более плодов. Частота — 1 % всех беременностей.
Этиология Причины многоплодной беременности изучены недостаточно. Имеется определенная наследственная предрасположенность. Различают одно- и двуяйцевые двойни (в первом случае была оплодотворена одна яйцеклетка, во втором — две). Однояйцевые близнецы всегда однополы и имеют одинаковые группы крови; двуяйцевые близнецы могут быть как однополыми, так и разнополыми и иметь как одинаковые, так и различные группы крови.
Клиническая картина Женщины в конце беременности жалуются на одышку, тяжесть в животе, часто наблюдаются поздние токсикозы. В ранние сроки беременности диагностика затруднена. В поздние сроки диагноз двойни ставят на основании большой окружности живота, прощупывания трех крупных частей плода, выслушивания двух сердцебиений с зоной затухания и разницей в частоте более 10 уд./мин.
Диагностика Диагноз уточняют с помощью ультразвукового исследования, регистрации ЭКГ плодов и обзорной рентгенограммы. Одно- и двуяйцевость двойни диагностируют после рождения и осмотра последа. Возможны следующие осложнения: слабость родовой деятельности, преждевременные роды, дородовое излитие околоплодных вод, преждевременная отслойка плаценты второго плода (после рождения первого), запоздалый разрыв оболочек второго плода, аномалии положения или предлежание плода, гипотоническое кровотечение. Роды ведут выжидательно. После рождения первого плода и перевязывания пуповины через 10 мин обычно вскрывают плодный пузырь второго плода. В третьем периоде родов проводят профилактику гипотонического кровотечения.
Двуяйцевая двойня: 1 — раздельные водная и ворсистая оболочки, плаценты соприкасаются; 2 — раздельные водная и ворсистая оболочки, плацента на расстоянии
БЕРЕМЕННОСТЬ ПЕРЕНОШЕННАЯ
ОпределениеБеременность переношенная — продолжение беременности более 41–42 недель. Различают истинное перенашивание (патологическое состояние) и мнимое перенашивание. В акушерской практике наибольшее значение имеет истинное перенашивание, частота которого составляет 10 %.
Окаменелый плод, пробывший в брюшной полости 14 лет: 1 — известковая скорлупа; 2 — дно матки; 3 — кости черепа плода
Этиология Причины перенашивания изучены недостаточно. К ним относят функциональные изменения нервной системы, эндокринные нарушения, снижение возбудимости матки, патологические изменения плода.
Клиническая картина Переношенная беременность характеризуется отсутствием родовой деятельности после истечения предполагаемого срока родов, отсутствием нарастания массы тела беременной, уменьшением окружности живота на 5—10 см вследствие рассасывания околоплодных вод, крупными размерами плода, плотными костями черепа у него, изменениями сердечной деятельности плода (состояние хронической кислородной недостаточности по данным фетальной ЭКГ). При амниоскопии находят примесь мекония в околоплодных водах. При исследовании околоплодных вод, полученных при амниоцентезе, обнаруживают снижение концентрации глюкозы до 0,1 г/л и менее (при норме 0,2–0,5 г/л). Содержание в моче эстриола снижено. При цитологическом исследовании влагалищного мазка определяются большое количество промежуточных клеток и отсутствие ороговевающих клеток. Плод при перенашивании находится в угрожаемом состоянии (часто наблюдаются внутриутробная гипоксия (кислородная недостаточность) и гибель плода). В родах возникает опасность внутричерепных кровоизлияний и удушья.
Диагностика и лечение Диагноз ставится на основании клинической картины — отсутствие родовой деятельности после предполагаемого срока, характерные изменения в организме беременной женщины и плода, данных ультразвукового исследования и амниоскопии. Лечение заключается в возбуждении родовой деятельности медикаментозными средствами после предварительного создания глюкозо-кальциево-гормонального фона. С этой целью вводят окситоцин внутривенно капельно — 5 ЕД в 500 мл 5 %-ного раствора глюкозы, начиная с 6–8 капель и доводя до 40 капель в минуту, либо 5 мг простагландина (в 500 мл изотонического раствора хлорида натрия), либо 2,5 мг простагландина и 2,5 ЕД окситоцина в этом же растворе. Скорость введения — от 6 до 20–30 капель в минуту. Переношенная беременность в сочетании с другими осложнениями (пожилой возраст первородящей, узкий таз, тазовое предлежание плода и др.) может служить показанием к кесареву сечению.
БЕСПЛОДИЕ
ОпределениеБесплодие — отсутствие на протяжении 2 лет и более беременности у женщины, регулярно живущей половой жизнью и не применяющей противозачаточных средств (женское бесплодие), и отсутствие способности к оплодотворению у мужчин (мужское бесплодие).
Этиология Причинами бесплодия могут быть: — трубно-перитонеальный генез (непроходимость маточных труб) после перенесенного воспалительного процесса (30–35 %); — олиго- или азооспермия (30–35 %); — эндокринные факторы (нарушение овуляции) (15 %); — иммунологические причины (20 %); — неустановленные причины (30 %). У половины бесплодных женщин отмечается сочетание от 2 до 5 факторов нарушения репродуктивной функции. Особенно выделяется эндокринный фактор бесплодия. I группа — гипоталамо-гипофизарная недостаточность. К ней относятся гипогонадотропный гипогонадизм гипоталамического генеза, гипогонадотропный гипогонадизм гипофизарного генеза; гипогонадизм, обусловленный гиперпролактинемией. II группа — гипоталамо-гипофизарная дисфункция, включающая нормогонадотропную аменорею, олигоменорею, недостаточность функции желтого тела, синдром поликистозных яичников, центрального генеза. III группа — яичниковая недостаточность. В нее входят: синдром преждевременного истощения яичников, синдром резистентных яичников, дисгенезия гонад, синдром постоварноэктомии, лучевого поражения яичников, поликистоз. IV группа — дисфункция коры надпочечников при поликистозе яичников. V группа — гипотиреоз с нарушением менструального цикла. Различают абсолютное бесплодие, когда в организме женщины имеются необратимые патологические изменения, препятствующие зачатию (отсутствие матки, маточных труб, яичников), и относительное бесплодие, при котором причины, вызывающие бесплодие, могут быть устранены. Кроме того, различают первичное бесплодие, когда у женщины, живущей половой жизнью, никогда не было беременности, и вторичное бесплодие, когда зачатие не наступает, хотя в прошлом беременности были. Мужское бесплодие, как и женское, является не заболеванием, а симптомом различных болезней. Различают секреторное и экскреторное мужское бесплодие. Секреторное бесплодие развивается в результате нарушения образования сперматозоидов, а экскреторное — в результате нарушения выделения спермы. Кроме того, возможно появление бесплодия в результате нарушения подвижности сперматозоидов или нарушения их способности к проникновению через оболочку яйцеклетки.
Клиническая картина В первый год замужества беременность наступает у 80–90 % женщин. Отсутствие беременности после трех лет замужества указывает на то, что шансы ее наступления снижаются с каждым годом. Брак считается бесплодным, если беременность не наступает в течение более двух лет половой жизни без применения контрацептивных мер. Частота бесплодных браков составляет 10–15 %. В 60 % случаев причиной бесплодия являются нарушения в организме женщины, в 40 % — в организме мужчины (неполноценность спермы, нарушения эякуляции, импотенция). Наиболее частой причиной бесплодия женщины служат анатомические и функциональные изменения в половых органах: инфантилизм; воспалительные заболевания маточных труб, яичников, матки, шейки матки, влагалища; нарушения функции яичников, гипофиза, надпочечников, щитовидной железы; опухоли матки (миома); эндометриоз; опухоли яичников; травматические повреждения шейки матки во время родов и абортов и др.
Диагностика и дифдиагностика Важная причина вторичного бесплодия — аборты. Обследование женщины, страдающей бесплодием, должно проводиться только после соответствующего обследования мужа, при котором исключают возможные причины мужского бесплодия. При гинекологическом исследовании обращают внимание на состояние внутренних половых органов (матки, придатков, шейки). Важно определить кислотность влагалищного содержимого, вязкость шеечного секрета (повышенная кислотность губительно действует на сперматозоиды, а повышенная вязкость цервикальной слизи препятствует их продвижению). Необходимо провести пробу на совместимость шеечной слизи и спермы (проба Шуварского-Симса-Хунера). Для этого через 30–45 мин после полового сношения в капле слизи, взятой из шеечного канала, определяют количество и состояние сперматозоидов. В норме в каждом поле зрения должно быть 10–15 сперматозоидов, пересекающих поле зрения за 8—10 с. Отсутствие сперматозоидов или их подвижности в шеечной слизи указывает на отрицательный результат пробы. Для выявления спаечного процесса после воспаления в матке, шейке, маточных трубах и вокруг них применяют пертубацию, метросальпингографию, биконтрастную гинекографию, кимографическую гидротубацию. Эти методы исследования используют с учетом противопоказаний (подозрение на беременность, острые воспалительные процессы половых органов, острые и подострые экстрагенитальные заболевания). У женщин с эндокринными формами бесплодия определяют функцию яичников при помощи тестов функциональной диагностики, производят биопсию эндометрия. Для диагностики бесплодия, обусловленного патологией маточных труб и матки, применяют лапароскопию.
Лечение и профилактика Лечение определяется локализацией и характером патологического процесса. При непроходимости маточных труб на почве хронического воспаления (исключить туберкулез половых органов) наиболее эффективен ультразвук в непрерывном или импульсном режиме. Вместо ультразвука можно использовать индуктотермию, электрофорез йода, лечебные гидротубации с растворами антибиотиков, лидазой и гидрокортизоном. При недоразвитии половых органов показаны электростимуляция шейки матки, индуктотермия, грязелечение, гинекологический массаж. Гормонотерапию применяют в зависимости от характера гормональных нарушений. При синдроме Штейна-Левенталя производят клиновидное удаление яичников. Миомы матки в сочетании с бесплодием у молодых женщин требуют оперативного лечения. Эндометриоз подлежит консервативному (комбинированные эстрогено-гестагенные препараты) или оперативному лечению. Хирургическое лечение трубного бесплодия (сальпинголизис, сальпингостомия, сальпингопластика) показано при безуспешности консервативной терапии. При отсутствии эффекта от консервативного лечения рекомендуется экстракорпоральное оплодотворение (ЭКО), а также инструментальное введение сперматозоида непосредственно в яйцеклетку (ИКСИ). В тяжелых случаях используется суррогатное материнство.
БЕШЕНСТВО
ОпределениеБешенство (водобоязнь) — вирусная нейроинфекция, характеризующаяся развитием тяжелого энцефалита.
Этиология Возбудителем бешенства является вирус рода Рабдовирус. Известно два варианта вируса: уличный (или дикий), циркулирующий в естественных условиях среди диких животных, и фиксированный, применяемый для получения антирабических сывороток. Вирус бешенства нестоек во внешней среде. Кипячение убивает его в течение 2 мин, он быстро погибает в 2–3 %-ном растворе лизола и хлорамина, 70 %-ном спирте. Бешенство — острая вирусная болезнь теплокровных животных и человека, характеризуется поражением центральной нервной системы, смертельным для человека.
Эпидемиология Бешенство — зоонозная инфекция, т. е. основными носителями вируса бешенства являются животные. Заражение животных и человека происходит при укусе или ослюнении бешеным животным поврежденных кожных покровов и, более редко, слизистых оболочек. От человека вирус, как правило, не передается. Человек менее восприимчив к вирусу бешенства, чем многие виды животных. Наибольшая заболеваемость бешенством наблюдается в осенне-летний период.
Патогенез В организм инфекция проникает через повреждения (раны, ссадины) на коже, реже на слизистых оболочках. Обладая выраженным сродством к нервной ткани, возбудитель продвигается по нервным волокнам и околоневральным пространствам и достигает центральной нервной системы. Предполагается распространение возбудителя с кровью и лимфой. Из центральной нервной системы вирус распространяется в различные органы: слюнные железы, надпочечники, почки, легкие, печень, сердце, скелетные мышцы, кожу. Воспалительный процесс поражает оболочки и вещество мозга, нервные ганглии, надпочечники, слюнные железы, появляются дистрофические изменения миокарда, кровоизлияния в слизистых оболочках. Характерные для бешенства судороги дыхательной и глотательной мускулатуры связаны с поражением блуждающего, языкоглоточного и подъязычного нервов. Раздражение симпатического отдела нервной системы ведет к повышенному слюнотечению и потоотделению. Поражения блуждающего нерва, а также различных узлов симпатической нервной системы определяют нарушения деятельности сердечно-сосудистой системы. Из центральной нервной системы вирус распространяется по нервным стволам и, достигнув нервных окончаний слюнных желез, проникает в слюну больного.
Клиническая картина Инкубационный период продолжается от 12 до 90 дней, в редких случаях — до 1 года и более. Вариабельность инкубационного периода при бешенстве связывают с различными факторами: возрастом укушенного, реактивностью организма, наличием условий, ослабляющих нервную систему (переутомление, неполноценное питание), локализацией укуса, размером и глубиной раны, количеством вируса, попавшего в организм. В течении заболевания выделяют три стадии: стадию предвестников, стадию возбуждения, стадию параличей.
Стадия предвестников В стадии предвестников наряду с общим недомоганием и головной болью могут наблюдаться диспепсические явления (тошнота, рвота), температура становится повышенной. Обостряются воспалительные явления в месте укуса, рубец вновь становится красным, припухает, появляются ноющие боли в области раны. Одновременно возникают первые симптомы нарушения психики: необъяснимый страх, тоска, тревога, мрачные мысли. Больной подавлен, замкнут, апатичен, отказывается от еды, плохо спит, сон у него сопровождается устрашающими сновидениями. Стадия предвестников длится 2–3 дня. Затем апатия и депрессия сменяются беспокойством, сопровождающимся учащением пульса и дыхания. Появляется затрудненное глотание, возникает чувство стеснения в груди как первый признак последующего расстройства дыхания.
Стадия возбуждения Стадия возбуждения характеризуется повышенной возбудимостью и развитием приступов болезни. Классическими для бешенства являются приступы водобоязни, развивающейся при попытке пить воду, а вскоре и при виде воды, журчании ее, плеске, словесном упоминании или даже при мысли о воде. Приступы могут быть спровоцированы движением воздуха (аэрофобия), ярким светом (фотофобия) или громким звуком (акустикофобия). Приступ начинается с тревожного беспокойства и страха, затем присоединяется двигательное возбуждение (внезапное вздрагивание тела) с чрезвычайно болезненным спазмом мышц глотки и гортани, расстройством дыхания (резкое затруднение вдоха, в котором участвует вспомогательная мускулатура, дыхание становится шумным). Во время приступа вид больного весьма характерен: он с громким криком откидывает назад голову и туловище, выбрасывает вперед дрожащие руки, отталкивает сосуд с водой. Шея больного вытягивается, мучительные судороги искажают лицо, которое становится синюшным и выражает ужас, возникает экзофтальм (выпучивание глаз), зрачки расширяются, взгляд устремляется в одну точку. Развивается затрудненный вдох. Больной со свистом вдыхает воздух, умоляет о помощи, иногда наблюдается рвота. На высоте приступа возможна остановка сердца и дыхания. Продолжительность приступа — несколько секунд, после чего спазмы мышц проходят. В этой стадии на высоте развития болезни у больных возникают приступы бурного психического и двигательного возбуждения, которые и послужили основанием для названия болезни. Больные становятся агрессивными, царапают и кусают себя и окружающих, плюются, кричат и мечутся в яростном отчаянии, рвут одежду, ломают мебель, окна, двери, обнаруживая нечеловеческую силу. Приступы сопровождаются помрачением сознания с развитием слуховых и зрительных галлюцинаций устрашающего характера. В межприступный период сознание обычно проясняется, больные рассказывают о своих переживаниях, нередко призывают персонал осторожно обращаться с ними. Через 1–2 дня появляется обильное мучительное слюнотечение (сиалорея). Больные не в состоянии проглотить слюну, которая постоянно вытекает изо рта, пропитывает одежду больного, разбрызгивается во все стороны. Наблюдается жар, нарастает частота сердечных сокращений, появляются дыхательные и сердечно-сосудистые расстройства. В результате обезвоживания организма и нарушения обмена веществ катастрофически снижается масса тела, черты лица заостряются. Продолжительность стадии возбуждения — 2–3 дня, редко до 6 дней. Если в период одного из приступов не наступает смерть от остановки сердца или дыхания, болезнь переходит в третью стадию.
Паралитическая стадия Паралитическая стадия характеризуется психическим успокоением. Исчезают страх и тревожно-тоскливое настроение, прекращаются приступы водобоязни и психического возбуждения, появляется возможность пить, употреблять пищу, а с ними и надежда на выздоровление. Сознание становится ясным. Наряду с этим нарастают вялость, апатия, слюнотечение, появляются различные по локализации параличи конечностей (иногда — пара- и гемиплегии) и черепных нервов, нарушается функция тазовых органов, температура тела повышается до 42 °C. Характерны нарастающая частота сердечных сокращений и понижение давления. Длительностьэтой стадии — 18–20 ч, исход обычно смертельный. Смерть наступает от паралича дыхательного центра. Общая продолжительность болезни — 3–7 дней, в редких случаях — 2 недели и более. Возможны атипичные формы бешенства, развивающиеся на фоне неполноценной вакцинации, при хроническом алкоголизме. К ним относятся паралитические, бульбарные, менингоэнцефалитические, мозжечковые и другие формы, при которых кардинальные симптомы болезни (возбуждение, гидрофобия) отсутствуют или выражены слабо. Прогноз крайне неблагоприятный. Имеются описания единичных случаев выздоровления, достоверность которых сомнительна.
Диагностика и дифдиагностика В периоде, предшествующем заболеванию, диагноз основывается на данных опроса больного (укус или ослюнение бешеным животным), а также на диспептических явлениях и наличии галлюцинаций. Диагноз становится ясным с появлением основных клинических симптомов, таких, как возбуждение, галлюцинации, агрессивность и бредовое состояние больного, судороги глотательной мускулатуры и водобоязнь, общая повышенная чувствительность с повышением рефлекторной возбудимости, потливости и обильное слюноотделение. В паралитической стадии, т. е. в позднем периоде болезни, диагноз основывается на данных опроса, общей последовательности развития симптомов и наличии параличей. Необходимо при постановке диагноза принимать во внимание описанные выше варианты клинического течения болезни. В сравнительно редких случаях спазмы глотательной мускулатуры могут отсутствовать.
Лечение Специфическая терапия бешенства не разработана. Проводят симптоматическое лечение, направленное на уменьшение страданий больного. Больной бешенством нуждается в покое и защите от внешних раздражителей — шума, яркого света, резких движений воздуха. Его помещают в тихую, затемненную, теплую палату, назначают индивидуальный пост. Для снижения повышенной возбудимости центральной нервной системы используют снотворные, противосудорожные и болеутоляющие средства (морфин, аминазин). Быстро наступающее обезвоживание и резкое похудение являются показаниями к инфузионной терапии. В паралитической стадии назначают средства, стимулирующие дыхание и сердечно-сосудистую деятельность, используют искусственную вентиляцию легких.
Профилактика Профилактика бешенства включает борьбу с источниками инфекции и предупреждение заболевания человека. Более радикальным мероприятием является ликвидация бешенства среди животных. С этой целью проводят комплекс санитарно-ветеринарных мероприятий: соблюдение режима содержания собак, поголовная профилактическая вакцинация домашних и служебных собак, своевременная лабораторная диагностика. Предупреждение бешенства у человека осуществляют с помощью антирабических вакцин. При укусе бешеного или подозрительного на бешенство животного проводят первичную обработку раны (промывание перекисью водорода и обработку спиртовыми растворами краев раны) с целью уменьшить инфицирующую дозу вируса, что может удлинить инкубационный период и повысить успех вакцинации. Хирургическое иссечение краев раны с наложением швов противопоказано, так как приводит к дополнительной травматизации нервных стволов и укорочению периода инкубации. После оказания первой помощи укушенного незамедлительно направляют к рабиологу для проведения антирабических прививок. Известны живые и ослабленные антирабические вакцины. Наибольшее распространение получили ослабленные вакцины. Специфическая профилактика бешенства представляет собой комбинацию пассивной и активной иммунизации и осуществляется антирабическим гамма-глобулином и антирабической вакциной. Дозу вакцины, величину курса вакцинации определяют в зависимости от локализации, характера и давности укуса, состояния напавшего животного (наличие у животного признаков бешенства по результатам наблюдения). Вакцина вводится ежедневно в подкожную клетчатку живота. Средняя продолжительность курса — 20–25 дней. В последующем проводят 2–3 ревакцинации с интервалом в 10 дней. В случае укусов в область головы, кончиков пальцев рук и множественных укусах — однократно вводится антирабический иммуноглобулин в дозе 0,5 мл/кг.
БОЛЕВОЙ СИНДРОМ
ОпределениеБоль — наиболее частый симптом болезни. Лечение зависит от выяснения ее причин, облегчающих, пусковых и усиливающих факторов.Боль — неприятное, порой нестерпимое ощущение, возникающее при раздражении (травма, воспаление) чувствительных окончаний, заложенных в органах и тканях.
Этиология и патогенез Болевые (ноцицептивные) чувствительные рецепторы в коже и внутренних органах активируют нервные окончания нервных клеток спинного или головного мозга. После соединения с нервной клеткой в спинном или продолговатом мозге перекрещенные восходящие нервные пути достигают подкорковых образований и проецируются в коре. Передача боли регулируется на уровне сегментов спинного мозга через нисходящие проводящие нервные пути, содержащие серотонин, норадреналин и некоторые нейропептиды. Биологически активные вещества, снижающие восприятие боли, могут также уменьшать тканевое воспаление (глюкокортикоиды, нестероидные противовоспалительные средства, ингибиторы синтеза простагландинов), препятствовать передаче боли (наркотики) или увеличивать нисходящую модуляцию (трициклические антидепрессанты). Противосудорожные средства (фенитоин, карбамазепин) способны изменять патологическую болевую чувствительность неврогенного происхождения, например при повреждении оболочки периферических нервов. Боль может быть соматического (кожа, глубокие ткани, суставы, мышцы) или невропатического (повреждение нервов, спинномозговых проводящих путей или таламуса) происхождения.
Клиническая картина Соматическая боль Болевой раздражитель очевиден. Боль обычно четко локализована. Боль внутренних органов может смещаться, напоминать другую внутреннюю боль, перенесенную ранее. Уменьшается под влиянием противовоспалительных и наркотических средств.
Невропатическая боль Нет очевидного болевого стимула. Часто нечетко локализуется. Необычная, непохожая на соматическую боль. Лишь частично облегчается наркотиками. Сенсорные признаки невропатической боли можно описать следующими терминами: — невралгия — боль, распространяющаяся по единичному нерву (например, невралгия тройничного нерва); — дизестезия — спонтанное ощущение постоянной или жгучей боли; — гипералгезия, или гиперестезия, — усиленная реакция на болевой стимул или прикосновение; — аллодиния — восприятие неболевого стимула как болезненного: например, вибрация вызывает болезненное ощущение; — гипалгезия — сниженная болевая чувствительность; — аналгезия — отсутствие болевой чувствительности; — каузалгия — сильная длительная жгучая боль с нечеткими границами, сопровождающаяся расстройством функций симпатической нервной системы (нарушение потоотделения, а также кожи, сосудов, волос — симпатическая дистрофия) после повреждения периферического нерва.
Хроническая боль Больные могут испытывать эмоциональное смятение. Психотерапия в специализированном многопрофильном центре по лечению боли может дать эффект. Некоторые факторы могут вызвать, сохранить и усилить хроническую боль: — патологические состояния, трудно поддающиеся лечению (артрит, рак, мигрень, диабетическая невропатия); — нервные факторы, вызванные соматическим заболеванием, сохраняющимся после выздоровления (повреждение чувствительных или симпатических нервов); — психологические факторы. Следует обратить особое внимание на анамнез заболевания и сопутствующую депрессию. Многие депрессивные больные склонны к попыткам самоубийства.
Лечение Острая соматическая боль Обычно хорошо поддается лечению ненаркотическими анальгетиками. Наркотические анальгетики необходимы для устранения очень выраженной боли.
Невропатическая боль Часто бывает хронической, лечение весьма затруднительно. Следующие препараты в сочетании с анализом факторов, усиливающих боль (депрессия, невроз), могут быть эффективными. I. Антиконвульсанты у больных с невропатической болью и невыраженным нарушением периферической нервной системы, а также при диабетической невралгии тройничного нерва (болевой тик). II. Симпатолитики; у больных с каузалгией и истощением периферической нервной системы можно применить хирургическую или химическую симпатэктомию. III. Трициклические антидепрессанты: их фармакологическое действие снижает активность нервных клеток путем торможения от них повторной информации. Применяются в лечении хронической боли, постгерпетической невралгии, атипичной боли с локализацией на лице, хронической боли в поясничном отделе.
Хроническая боль После оценки состояния больного следует предложить ему четкий план лечения, включающий конкретные и реалистичные задачи: добиться полноценного ночного сна, обрести способность ходить за покупками, возобновить работу. Для улучшения качества жизни больного может потребоваться комплексный подход: советы, медикаменты, физиотерапия, блокада периферических нервов и даже хирургическое вмешательство. Некоторым больным требуется госпитализация, другим помогает медикаментозное лечение.
БОЛЬ В БРЮШНОЙ ПОЛОСТИ
Этиология Боль в брюшной полости может быть вызвана разнообразными причинами. Их диапазон колеблется от острых, угрожающих жизни катастроф до функциональных расстройств и поражения нескольких систем организма. При острой боли надо быстро определить ее причины и немедленно начать лечение. Более обстоятельный подход к диагностике уместен в менее острых ситуациях. Данные о течении заболевания и особенностях жизни больного очень важны. Физикальное исследование может дезориентировать, а лабораторные и радиологические исследования не всегда доступны. Наиболее частыми причинами абдоминальных болей являются: воспаление слизистой оболочки или мускулатуры полых внутренних органов: заболевания, обусловленные кислотно-пептическим фактором (язвы, эрозии, воспаление), геморрагический гастрит, желудочно-пищеводный рефлюкс, аппендицит, дивертикулит, холецистит, холангит, воспалительные процессы в толстой кишке (болезнь Крона, неспецифический язвенный колит, синдром Бехчета), инфекционный гастроэнтерит, мезентериальный лимфаденит, колит, цистит, пиелонефрит. Висцеральный спазм или растяжение: непроходимость кишечника (спайки, опухоль, инвагинация), аппендикулярная обструкция (в результате воспаления червеобразного отростка), ущемление грыжи, синдром раздражения толстой кишки (мышечная гипертрофия и спазм), острая непроходимость желчных путей, закупорка протока поджелудочной железы (хронический панкреатит, камень), закупорка мочеточника (камень, тромб), трубная беременность. Сосудистые расстройства: брыжеечная тромбоэмболия (артериальная и венозная), расслаивание или разрыв стенки артерии (например, аневризма аорты), закупорка вследствие наружного сдавления или перекручивания (заворот, грыжа, опухоль), гемоглобинопатия (особенно серповидноклеточная анемия). Растяжение или воспаление серозных оболочек внутренних органов: капсулы печени (гепатит, кровотечение, опухоль, синдром Бадда-Киари, синдром Фитца-Хью-Куртиса — гонококковый перигепатит), растяжение капсулы почки (опухоль, инфекция, инфаркт, венозный тромбоз), капсулы селезенки (кровотечение, абсцесс, инфаркт), поджелудочной железы (панкреатит, псевдокиста, абсцесс), яичника (кровотечение в кисту, внематочная беременность, абсцесс). Перитонит: бактериальная инфекция (воспаление органов малого таза, инфицированный асцит), инфаркт кишки, химическое раздражение, панкреатит, перфорация полого органа (особенно желудка или двенадцатиперстной кишки), реактивное воспаление (прилежащий абсцесс, дивертикулит, плевропульмональная инфекция), серозит (ДБСТ, семейная средиземноморская лихорадка). Поражения передней брюшной стенки: травмы, грыжи, инфекция и воспаление мышечной ткани, гематома (травма, противосвертывающая терапия), спаечный процесс. Токсины: свинцовое отравление, укус паука «Черная вдова». Метаболические расстройства: уремия, кетоацидоз (диабетический, алкогольный), криз при недостаточности надпочечников, порфирия, ангионевротический отек (дефицит С-эстеразы), наркотическая «ломка». Неврологические патологические состояния: герпетическое поражение, каузалгия, сдавление или воспаление корешков спинного мозга (артрит, грыжа Шморля, опухоль, абсцесс), психогении. Распространяющаяся боль: из сердца, легких, пищевода, гениталий (например, ишемия миокарда, пневмония, пневмоторакс, тромбоэмболия легочной артерии, эзофагит, спазм или разрыв пищевода).Клиническая картина Длительность и характер боли позволяют судить о ее происхождении и серьезности, хотя острая внутрибрюшная катастрофа может разыграться и внезапно или на фоне хронической боли. Тип и локализация боли дают возможность ориентироваться в природе болезни. Висцеральная боль (в результате растяжения полых органов) обычно нечетко локализована и ощущается в центре живота. Кишечная боль имеет спастический характер; если она возникает в тонком кишечнике, то ощущается над пупком или вокруг него. Боль из толстой кишки проецируется в нижние отделы живота. Боли, вызванные непроходимостью желчных путей или мочеточников, обычно заставляют пациентов мучительно корчиться, настолько они интенсивны. Внутренняя боль (при перитоните) обычно более острая и точнее привязана к пораженной зоне (острый аппендицит, растяжение капсулы печени, почки или селезенки), усиливается при движениях, что заставляет больного избегать их. Смещение боли диагностически значимо: правое плечо (печень, желчный пузырь), левое плечо (селезенка), середина спины (поджелудочная железа), боковые отделы живота (верхние отделы мочевыделительной системы), паховая область (гениталии или нижние отделы мочевых путей).
Факторы, усиливающие или облегчающие боль Связь с приемом пищи (поражение верхних отделов желудочно-кишечного тракта, желчевыводящей системы, поджелудочной железы, ишемия толстой кишки), дефекацией, мочеиспусканием (мочеполовая), дыханием (легочно-плевральная, печеночно-желчная зоны), положением больного (поджелудочная железа, желудочно-пищеводный рефлюкс, скелетные мышцы), менструацией, физической активностью (ишемия коронарных артерий, скелетная мускулатура), приемом медикаментов или особой пищи (нарушение моторики, непереносимость пищи, желудочно-пищеводный рефлюкс, недостаточность надпочечников, кетоацидоз, токсины), стрессом (нарушение моторики).
Связанные с болью симптомы Лихорадка или озноб (инфекция, воспалительные заболевания, инфаркт), истощение (опухоль, воспалительные заболевания, нарушения всасывания, ишемия), тошнота или рвота (непроходимость, инфекция, воспалительные заболевания, нарушения обмена), нарушения глотания (пищевод), быстрое насыщение (желудок), кровавая рвота (пищевод, желудок, двенадцатиперстная кишка), запор (прямокишечная, околоанальная, мочеполовая области), желтуха (печеночно-пузырная зона, гемолиз), понос (воспалительные заболевания, инфекция, ишемия, мочеполовая область), нарушения мочеиспускания или гематурия, выделения из влагалища или уретры (мочеполовая зона), поражение кожи, суставов и (или) глаз (воспалительные заболевания, бактериальная или вирусная инфекция).
Предрасполагающие факторы Наследственность (воспалительные заболевания, опухоли, панкреатит), артериальная гипертензия (ишемия), сахарный диабет (нарушения моторики, кетоацидоз), ДБСТ (серозит, нарушения моторики), депрессия (опухоли, нарушения моторики), курение (ишемия), недавнее прекращение курения (воспалительные заболевания), алкоголь (поражение печени и желчевыводящих путей, панкреатит, заболевания, вызванные кислотно-пептическим фактором).
Диагностика и дифдиагностика Осмотр живота в связи с перенесенными травмой или оперативным вмешательством; вздутие, наличие жидкости или воздуха; боль непосредственная, отраженная и перемещающаяся; размеры печени и селезенки; шумы, в том числе патологические кишечные шумы; грыжи. Прямокишечное исследование для поиска патологических изменений, боли при осмотре, кровь (в явной или скрытой форме). Очень важно исследовать тазовые органы у женщин. Выявление признаков нестабильности кровообращения, расстройств электролитного баланса, нарушений питания и свертывающей системы крови, нарушений артериального кровообращения и функций сердца, поражения печени, лимфаденопатии, поражений кожи. Выбор исследования определяется клинической ситуацией (интенсивность боли, внезапность начала). Включает клинический анализ крови, определение электролитов сыворотки, сахара крови, биохимических показателей функции печени, почек, поджелудочной железы, коагулограмму; рентгенологическое исследование органов грудной клетки для выявления поражения сердца, средостения, плевры; ЭКГ для исключения поражения сердца, сопровождающегося перемещением боли; рентгенограмму брюшной полости для оценки смещения толстой кишки, растяжения тонкой кишки, наличия жидкости и газа, свободного газа в брюшной полости, размеров печени, камней (билиарные, почечные камни, хронический панкреатит). Специальные исследования могут включать УЗИ брюшной полости (оно наиболее информативно при оценке желчных путей, желчного пузыря, печени, почек); желудочно-кишечное рентгеноконтрастное исследование с бария сульфатом (пассаж контраста по пищеводу, желудку, двенадцатиперстной и тонкой кишке, клизма с бария сульфатом для контрастирования толстой кишки); гастродуоденоскопию, колоноскопию, ректороманоскопию; компьютерную томографию, магнитно-резонансную томографию, холангиографию, ангиографию, сканирование с радионуклидами. В отдельных случаях требуется взятие образцов ткани печени, поджелудочной железы, тканей в брюшной полости; лапароскопия и иногда диагностическая лапаротомия.
БОЛЬ В БРЮШНОЙ ПОЛОСТИ ОСТРАЯ КАТАСТРОФИЧЕСКАЯ
Этиология и патогенез Интенсивная боль в животе, начавшаяся внезапно, или боль, возникшая на фоне обморока, признаков снижения артериального давления, симптомов интоксикации, требуют быстрой оценки, проводимой в определенном порядке. Надо иметь в виду следующие патологические состояния: непроходимость, перфорация или разрыв полого органа, расслоение или разрыв крупного кровеносного сосуда (особенно аневризмы аорты), язвенный процесс, абдоминальный сепсис, кетоацидоз, надпочечниковый криз.Клиническая картина Обращают внимание на наличие пониженной температуры, гипервентиляции, синюшности, непосредственной или отраженной боли в животе, пульсирующих образований в брюшной полости, кишечных шумов, асцита, крови в прямой кишке, болезненности при исследовании органов малого таза и прямой кишки, признаков нарушения свертываемости крови.
Диагностика и дифдиагностика Показаны следующие лабораторные исследования: определение гематокрита (может быть нормален при остром кровотечении и повышен при обезвоживании), число лейкоцитов, электролиты крови, азот мочевины, креатинин, сахар крови, липаза и амилаза, общий анализ мочи. Рентгенологическое исследование включает рентгенограммы брюшной полости в горизонтальном и вертикальном положениях (левая боковая горизонтальная позиция, если правая невозможна) для оценки поперечника толстой кишки и наличия свободного газа в брюшной полости, а также горизонтальный боковой снимок для оценки диаметра аорты. Лапароцентез или перитонеальный лаваж при травме позволяют исключить кровотечение или перитонит. УЗИ брюшной полости проводят для подтверждения диагноза абсцесса, холецистита, гематомы, определения диаметра аорты.
Лечение Неотложная терапия включает внутривенное введение жидкости, коррекцию расстройств кислотно-основного состояния, угрожающих жизни, и принятие решения о необходимости экстренного оперативного вмешательства. Через некоторое время важно повторно проанализировать ситуацию, причем желательно, чтобы это сделал тот же врач. До установления диагноза и принятия плана лечения наркотические анальгетики применять нельзя, так как они маскируют симптоматику, что может отсрочить необходимое вмешательство.
БОЛЬ В ГРУДИ
Между выраженностью боли в груди и серьезностью вызвавшей ее причины отмечена лишь слабая зависимость. Боль в груди может быть симптомом многих заболеваний, очень разных по течению, прогнозу и лечению.Этиология и клиническая картина Потенциально серьезные причины Ишемия миокарда (angina pectoris). Чувство давления за грудиной с типичной иррадиацией в левую руку, обычно при физическом напряжении, часто после еды или в связи с эмоциональным стрессом. Диагностически значим эффект от нитроглицерина и отдыха. Острый инфаркт миокарда. Ощущения близки к описанным при ишемии миокарда, но интенсивнее и длительнее (приблизительно 30 мин), отдых или нитроглицерин не избавляют от них. Часто возникают III и IV сердечные тоны. Тромбоэмболия легочной артерии. Боль может ощущаться за грудиной или в боковых отделах грудной клетки. Клиническая картина отчасти напоминает плеврит, включает кровохарканье, сердцебиение на фоне дефицита кислорода. Расслаивающая аневризма аорты. Очень острая боль в центре грудной клетки пульсирующего характера, иррадиирующая в спину; изменение положения тела не влияет на характер боли. Периферический пульс слабый и даже может отсутствовать. Эмфизема средостения. Острая интенсивная боль за грудиной, часто сопровождается отчетливым звуком «хруста». Острый перикардит. Боль обычно постоянная, давящая, ощущается за грудиной, часто усиливается при кашле, глубоком вдохе, в горизонтальном положении, изменяется при переходе в положение сидя, при этом может выслушиваться одно-, двух- или трехкомпонентный шум трения перикарда. Плеврит. Боль воспалительного происхождения, реже провоцируется опухолью или пневмотораксом. Обычно она односторонняя, «кинжальная», поверхностная, усиливается при кашле и чихании.
Менее важные причины Боль в ребрах или хрящах. Боль в передней поверхности грудной клетки, обычно четко локализована, кратковременная и стреляющая или постоянная и тупая. Воспроизводится при надавливании на реберно-хрящевое и грудино-хрящевое сочленение. При синдроме Титце (воспаление реберно-хрящевого сочленения) пораженные суставы отечны, болезненны, отмечается их покраснение. Боль в грудной клетке. Обусловлена напряжением мышц или связок при непривычной физической нагрузке или переломом ребра, всегда локализована. Боль, связанная с пищеводом. Воспринимается как чувство дискомфорта в грудной клетке, может сопровождаться нарушением глотания и отрыжкой. Эмоциональные расстройства. Могут сопровождаться продолжительной или кратковременной колющей болью, вызванной переутомлением и эмоциональным напряжением. К другим причинам болевого синдрома могут относиться поражение межпозвоночного диска в шейном отделе, остеоартроз шейного или грудного отделов позвоночника, патологический процесс в брюшной полости (язва, грыжа пищеводного отверстия диафрагмы, панкреатит, желчная колика), трахеобронхит и пневмония, заболевания молочной железы (опухоль, воспаление), межреберная невралгия.
Диагностика и дифдиагностика Диагностика болей в груди проводится с учетом анатомического расположения органа: грудная клетка, сердце, перикард, аорта, пищевод. Скрупулезное изучение обстоятельств появления и развития боли, факторов, усиливающих и облегчающих ее, помогает установить диагноз при рецидивирующей боли в грудной клетке. При подозрении на ишемию миокарда следует также исключить поражение клапанов аорты и гипертрофическую обструктивную кардиомиопатию, если зафиксирован систолический шум.
БОЛЬ В ПОЯСНИЧНОЙ ОБЛАСТИ
Боль в поясничной области встречается часто. Она может быть острой и хронической, а причинами служат поражения позвоночника или корешков нервов. Возможно перемещение боли из более глубоких структур (почки, поджелудочная железа, толстая кишка, тазовые органы или забрюшинные опухоли).Этиология и клиническая картина Острая боль в поясничной области Острое растяжение. В прошлом указание на травму. Боль локализуется в области длинных мышц спины при их спазме, что вызывает ограничения в движениях. Смещения боли в паховую область или в нижние конечности нет. Переломы позвонков. Обычно это следствие травмы при сгибании или падении на ноги, но такой же результат может быть и при минимальной травматизации, если у больного поражена костная система, имеются остеопороз, синдром Кушинга, гиперпаратиреоз, миеломная болезнь, метастазы злокачественных опухолей в кости, болезнь Педжета. Смещение межпозвоночных дисков в поясничном отделе. Чаще всего поражен участок LV-SP затем — LIV–LV, реже — LIII–LIV или выше. Симптомы включают боль в поясничной области, вынужденное положение тела, ограничение подвижности. На участие в патологическом процессе нервных корешков указывают: корешковая боль, обычно односторонняя; расстройства чувствительности (парестезия, гиперестезия или гипалгезия); снижение или отсутствие ахиллова (корешок S или S2) или коленного рефлекса (L3—L4). Выпячивание межпозвоночного диска обычно воздействует на корешок, расположенный ниже уровня диска, иными словами, диск LIV–LV воздействует на корешок L5. Нарушение функций мочевого пузыря или прямой кишки свидетельствует о поражении конского хвоста, но может возникнуть и при выпячивании значительной части диска. Фасеточный синдром. Сдавление корешка в месте его выхода из позвоночного канала вызывает корешковую боль, не обусловленную поражением диска. Односторонний фасеточный синдром, который чаще всего связан с корешком L5, проявляется при увеличении верхней и нижней фасеток межпозвоночного сустава, что влечет за собой сужение межпозвоночного канала или отверстия. Эпидуральный абсцесс. Чаще всего встречается в грудном отделе позвоночника, может сопровождаться острой болью в спине при прощупывании или простукивании пораженной зоны. Требует быстрой диагностики и хирургического вмешательства, если есть признаки сдавления спинного мозга. Патологические процессы в области тазобедренного сустава могут сопровождаться болями, отдающими в ягодичную область и нижние конечности до уровня коленного сустава.
Хроническая боль в поясничной области Деформирующий спондилез. Деформирующий спондилез представляет собой дегенеративные изменения поясничных позвонков с формированием костных выростов, суживающих позвоночный канал и оказывающих давление на корешки. При появлении пояснично-крестцовой боли с неврологической симптоматикой при ходьбе (потеря чувствительности, нарушения чувствительности или слабость в обеих нижних конечностях) есть подозрения на синдром перемежающейся хромоты, связанный с позвоночником и возникающий при сужении позвоночного канала. Диагноз подтверждается при обследовании. Анкилозирующий спондилоартроз. Его следует заподозрить у молодых людей с болями в нижних отделах спины, смещающимися в бедра. Сперва возникают ограничение подвижности и утренняя скованность, уменьшение дыхательных движений грудной клетки, прогрессирующее искривление и сгибание грудного отдела позвоночника. Рентгенологические признаки: разрушение и перестройка крестцово-подвздошных сочленений, формирование так называемого «бамбукового» позвоночника. Сходная симптоматика с ограничением движений в нижних отделах позвоночника может иметь место при псориатическом артрите, синдроме Рейтера и хроническом колите. Опухоли и их метастазы, болезни обмена. С помощью рентгенографии и миелографии необходимо исключить следующие патологические состояния: метастатическая карцинома (молочная железа, легкие, предстательная железа, щитовидная железа, почки, желудочно-кишечный тракт), миеломная болезнь, лимфома. Остеомиелит. Вызывается гноеродными бактериями (чаще стафилококками) или микобактерией туберкулеза; возможность указанных инфекций необходимо подтвердить или исключить с помощью определения СОЭ, рентгенографии костей, кожной пробы с туберкулином. Интрадуральные опухоли — нейрофиброма, менингиома и липома — могут вызывать хроническую боль еще до появления других неврологических симптомов.
Перемещающиеся боли при заболеваниях внутренних органов При поражении тазовых органов боль смещается в крестцовый отдел, органов нижних отделов брюшной полости — в поясничные сегменты L3—L5, верхних отделов брюшной полости — в нижние грудные и верхние поясничные сегменты T10—L2. Характерно отсутствие локальных симптомов и скованности в спине, движения спины в полном объеме не усиливают боль. I. Пептическая язва и опухоли желудка, двенадцатиперстной кишки и поджелудочной железы, в особенности с забрюшинным распространением, могут вызывать боль в спине в сегментах T10—L2. II. Язвенный колит, дивертикулит, опухоли толстой кишки вызывают боль в нижних отделах спины. III. Хронические заболевания органов малого таза, эндометриоз, карцинома яичников или матки сопровождаются болью в поясничной области. У мужчин необходимо исключить хронический простатит и карциному предстательной железы. IV. Заболевания почек вызывают боли в реберно-позвоночном углу. V. Расслаивающая аневризма аорты вызывает боль в грудном и поясничном отделах.
Лечение Большое внимание следует уделить началу, длительности и локализации болей, а также факторам, которые их усиливают или ослабляют. Проводят исследование органов брюшной полости и таза (в том числе малого), оценку движений позвоночника и выявление признаков неврологической дисфункции. При острой боли обычная рентгенография дает мало данных, если не было травмы. Компьютерную томографию, магнитно-резонансную томографию и поясничную миелографию используют для выявления спондилеза, острой грыжи диска или опухоли. При хронической боли нужно исследовать СОЭ, активность кислой фосфатазы сыворотки, альфа-фетопротеин и другие опухолеспецифические эмбриональные антигены, а также применять рентгенографию.
БОЛЬ ГОЛОВНАЯ И БОЛИ В ОБЛАСТИ ЛИЦА
Этиология Головная боль, часто хроническая или рецидивирующая, — обычная жалоба, имеющая у большинства больных сосудистое происхождение (мигрень) или зависящая от напряжения (мышечный спазм). Повторные боли бывают односторонними или охватывают всю голову. Проявления мигрени, как правило, стереотипны у конкретного больного (классическая, обычная или кластерная). Причинами головной боли могут быть: растяжение, натяжение или расширение внутричерепных или внечерепных артерий; натяжение, смещение внутричерепных вен или соответствующих участков твердой мозговой оболочки; сдавление, натяжение, воспаление черепных нервов или верхних ветвей спинномозговых нервов; спазм, воспаление, травма черепных или шейных мышц; раздражение мозговых оболочек (инфекция или субарахноидальное кровоизлияние); инфекция или отек слизистой оболочки придаточных пазух носа; поражение костей черепа (инфекция или опухоли); повышение или снижение внутричерепного давления.Классификация I. Мигрень A. Обычная мигрень. Б. Классическая мигрень. B. Кластерная мигрень.
II. Головная боль при напряжении
III. Сосудистые заболевания головного мозга A. Артериальная гипертензия. Б. Субарахноидальное кровоизлияние. B. Артериовенозная мальформация. Г. Височный артериит.
IV. Раздражение мозговых оболочек А. Менингит (бактериальный или вирусный). Б. Энцефалит.
V. Изменение внутричерепного давления А. Снижение внутричерепного давления (после люмбальной пункции). Б. Повышение внутричерепного давления: — опухоль головного мозга; — тромбоз венозных синусов; — доброкачественная внутричерепная гипертензия (псевдоопухоль головного мозга).
VI. Посттравматическая головная боль
VII. Боли разного происхождения A. Во время полового сношения. Б. Посталкогольный синдром (похмелье). B. Поражение синусов (синусит) или глаз (глаукома). Г. Кашель.
Клиническая картина Мигрень Для мигрени характерно периодическое возникновение приступов умеренно выраженной или тяжелой головной боли, которая продолжается 4—72 ч и нередко сочетается с тошнотой, реже — рвотой, а также с повышенной чувствительностью к световым, звуковым и другим раздражителям. Мигрень распространена до 25 % среди женщин и до 10 % у мужчин. Классическая мигрень. Начинается заболевание обычно в детском, подростковом возрасте или у взрослых; описаны случаи начала заболевания в возрасте старше 50 лет. Типичны следующие факторы: четкое семейное наследование и частое возникновение болезни у женщин. Классическая клиническая триада состоит из зрительных расстройств, головной боли (односторонняя пульсирующая), тошноты и рвоты. Обычно приступ длится 2–6 ч, после сна симптомы смягчаются. Приступы провоцируются употреблением вина, сыра, шоколада, применением контрацептивов, физической нагрузкой, прогулкой или любым стрессом. Обычная мигрень. Односторонняя или двусторонняя головная боль с тошнотой, реже рвотой или зрительными расстройствами, чаще у женщин. Начало более постепенное, чем при классической мигрени, боль носит более распространенный характер, может длиться несколько часов или дней. Обычно сочетается с типичной болью напряжения или переходит в нее. Кластерная мигрень. Боль рецидивирующая, односторонняя, возникает ночью, имеет непульсирующий характер, локализуется в глазнице или над ней. В типичном случае молодой мужчина (90 % случаев) пробуждается спустя 2–4 ч после засыпания от интенсивной боли, сопровождающейся односторонним отеком слизистой оболочки носа и слезотечением. Зрительные расстройства или тошнота (рвота) отмечаются редко. Боль длится 20–60 мин и потом проходит, но повторяется в одно и то же время несколько ночей подряд, иногда с перерывом в несколько недель (кластер — серия). В течение месяцев или лет болезнь не беспокоит, а затем возобновляется с прежней симптоматикой и периодичностью. Внутричерепная аневризма также проявляется заглазничной болью.
Головная боль, обусловленная мышечным напряжением Начало болезни обычно относится к подростковому или молодому возрасту. Боль двусторонняя, распространенная, локализуется в височных областях или в нижних частях затылка, воспринимается как сдавление или тугая лента на голове, но может быть и пульсирующей. Тошнота и рвота бывают редко, нет отека слизистой оболочки носа или слезотечения. Чаще начинается к ночи, связана со стрессом. Боль может длиться несколько часов или дней.
Другие виды головной боли и болей в области лица При головной боли, сопровождающей инфекцию головного мозга, обычно отмечаются лихорадка и ограничение движений в области шеи. Диагноз височного артериита ставят при одно- или двусторонней боли у пожилых (редко у молодых) лиц в сочетании с потерей зрения, болезненностью и отечностью височных артерий, повышением СОЭ. Быстрая диагностика и соответствующее лечение (уменьшение ишемии зрительного нерва) важны для сохранения зрения. Боль после люмбальной пункции вызвана снижением внутричерепного давления и обычно исчезает без лечения спустя 5–7 дней. Артериальная гипертензия редко сопровождается сильной головной болью. Увеличение внутричерепного давления любого происхождения может сопровождаться интенсивной головной болью, обычно с тошнотой и рвотой. Головная боль при половом сношении обычно неинтенсивна, имеет тенденцию к быстрому прекращению, однако надо исключить субарахноидальное кровоизлияние.
Доброкачественная внутричерепная гипертензия Обычно наблюдается у тучных женщин моложе 40 лет; характерно повышение давления ликвора при спинномозговой пункции без локальных неврологических симптомов. При лабораторном исследовании патологических изменений не отмечается. Лечение: диакарб, повторные люмбальные пункции.
Головные боли, начинающиеся в возрасте старше 50 лет Следует заподозрить височный артериит, опухоль головного мозга (психические отклонения, рвота, отек диска зрительного нерва, локальные неврологические симптомы), подоболочечную гематому (недавнее падение, нарушение сознания).
Невралгия тройничного нерва Пульсирующая или стреляющая односторонняя боль, длящаяся 10–30 с, чаще всего захватывает нижнюю, реже — верхнюю челюсть. Характерен возраст старше 50 лет. Боль в десне или щеке может затруднять прием пищи. Неврологических изменений не выявляется. Аналогичная боль в более молодом возрасте позволяет заподозрить рассеянный склероз, аневризму или другую сосудистую аномалию, а также невриному тройничного нерва. Первоначальный эффект от карбамазепина в дозе 600—1400 мг в сутки отмечен у 2/3 больных. При рецидивирующем течении или безуспешном медикаментозном лечении показана невротомия.
Невралгия после герпетической инфекции Боль возникает после появления герпетической сыпи по ходу глазной, верхнечелюстной или (реже) нижнечелюстной ветвей тройничного нерва. Может сопровождаться потерей чувствительности. Лечение недостаточно эффективно, боль обычно уменьшается через 4–8 недель.
Атипичные боли в области лица Они не могут быть объяснены поражением черепных нервов, носят распространенный характер, иногда сочетаются с поражением височно-нижнечелюстного сустава.
Затылочная невралгия Поражение большого затылочного нерва на выходе из черепа сопровождается односторонней стреляющей болью в затылочной области. В зоне выхода данного нерва из полости черепа можно обнаружить локальную боль и точку, давление на которую провоцирует эту боль.
Диагностика и дифдиагностика Следует оценить характер, локализацию, длительность, периодичность возникновения головной боли, а также обстоятельства, которые порождают, усиливают или облегчают ее. За исключением боли при височном артериите и затылочной невралгии.
Лечение I. Установление клинического диагноза. II. После установления диагноза лечение строится исходя из периодичности возникновения, выраженности боли и степени потери трудоспособности. Лечение направлено на уменьшение выраженности приступа или на его предупреждение, если приступы частые и тяжелые.
Мигрень При остром приступе назначают эрготамин или его комбинации с кофеином или анальгетиками (аспирин, парацетамол, ибупрофен). Начальная терапия включает эрготамина тартрат по 1–3 мг внутрь повторно через 30 мин до 4–6 таблеток. Кафэргот или виграин содержат 1 мг эрготамина тартрата и 100 мг кофеина. Две таблетки принимают в начале приступа или в ауре (если она имеет место), в дальнейшем — по 1 таблетки каждые 30 мин, максимально до 6 таблеток. Можно применять ректальные свечи с эрготамином (1–2 мг). Вторую свечу вводят через 15–30 мин после первой, это может прервать приступ. Если тошнота и рвота весьма выражены, применяют церукал по 10 мг с последующим назначением эрготамина. Также эффективен суматриптан по 100 мг внутрь или 6 мг подкожно. При необходимости препарат вводят повторно через 2–4 ч.
Кластерная головная боль Эффективна профилактика препаратами лития (600–900 мг в сутки) или преднизолоном (начальная доза — 60 мг, с постепенным снижением и отменой через 7 дней). Профилактический прием эрготамина — 1 мг за 1–2 ч до ожидаемого приступа — может дать эффект.
Головные боли от напряжения Обычно эффективны парацетамол, аспирин или ибупрофен.
Височный артериит Преднизолон в дозе, достаточной для нормализации СОЭ (обычно 60—120 мг в сутки в течение 2–4 недель, затем постепенное снижение дозы). Лечение может длиться месяцы и годы.
Профилактика Возможны различные варианты; часто препараты назначают в качестве пробной терапии для определения наиболее эффективного варианта. Лечение показано в случае, когда у больного больше двух-трех выраженных приступов в месяц. Препараты: пропранолол по 60—240 мг в сутки, амитриптилин по 30—100 мг в сутки (вводить дробно), вальпроат по 500—2000 мг в сутки, антикальциевые препараты (нифедипин по 10–40 мг в сутки или верапамил по 120–480 мг в сутки) и метисергид по 4—12 мг в сутки.
БОЛЬ И ПРИПУХЛОСТЬ СУСТАВОВ
Этиология и клиническая картина Боли в суставах, их припухлость и другие жалобы на костно-мышечную боль часто встречаются в амбулаторной практике и являются ведущими причинами нетрудоспособности и инвалидности. Жалобы следует анализировать тщательно, чтобы создать предпосылки к постановке правильного диагноза и спланировать обследование и лечение. Боли и припухлость суставов могут быть проявлением первичного поражения костномышечной системы, а могут отражать наличие системных заболеваний.Диагностика и лечение При постановке диагноза большое значение имеют следующие данные анамнеза: — возраст, пол, раса, наследственность; — начало болезни: острое более характерно для инфекции или подагры, хроническое — для остеоартроза или ревматоидного артрита; — длительность существования отдельных симптомов; — важные эпизоды: травма, приеммедикаментов, сопутствующие заболевания; — число и тип вовлеченных в процесс тканей: симметричность, поражение одного или нескольких суставов, миграция симптоматики, характер боли (постоянная или повторяющаяся); — сопутствующие признаки: лихорадка, сыпь, утренняя скованность, вовлечение других систем.
Физикальное обследование Особое внимание уделяют состоянию глаз, кожи, слизистых оболочек, сердца, легких, ногтей (можно обнаружить характерные вдавления при псориазе), нервной системы. Тщательное обследование вовлеченных в процесс и незатронутых суставов и окружающих тканей необходимо провести в определенной последовательности: от головы до ног и от конечностей до головы и туловища. Обращают внимание на отсутствие или наличие следующих признаков: отек, эритема, местный жар; выпот в суставы и суставные сумки; подвывих, смещение, деформация суставов; утолщение синовиальной оболочки; неустойчивость суставов; ограничение амплитуды пассивных и активных движений; хруст; изменения в тканях, окружающих сустав; поражение мышц.
Особенности обследования пожилых больных При оценке патологических изменений суставов и костно-мышечных тканей в преклонном возрасте следует учитывать, что эти поражения начинаются постепенно и часто протекают первично хронически. Характерно отсутствие определенности в клинической картине, а понятие нормы при толковании результатов диагностических исследований весьма широко. Хотя в пожилом возрасте встречаются любые костно-мышечные патологические изменения, определенные нарушения отмечаются особенно часто. Особое внимание следует обратить на возможные ревматологические последствия перекрестных заболеваний (и их лечения) при обследовании пожилых больных.
Дополнительные исследования Клинический анализ крови, СОЭ, С-реактивный белок, мочевая кислота сыворотки крови. Рентгенограмма суставов, количество антистрептолизина-О, показатели системы комплемента. Отсасывание и исследование синовиальной жидкости особенно важны при остром моноартрите и подозрении на подагрический или септический артрит. Необходимо исследовать внешний вид и вязкость синовиальной жидкости; определить количество клеток, содержание сахара и белка; установить наличие кристаллов (поляризующая микроскопия); произвести окраску по Граму и посев на культуру. Дополнительные процедуры, включающие УЗИ, радионуклидную сцинтиграфию, компьютерную томографию, магнитно-резонансную томографию, целесообразны, если обычное рентгенографическое исследование не дает необходимой информации. Терапия при возникновении болей в суставах должна быть направлена на устранение причины, вызвавшей развитие заболевания.
БОТУЛИЗМ
ОпределениеБотулизм — тяжелое токсико-инфекционное заболевание, характеризующееся поражением ботулотоксином преимущественно продолговатого и спинного мозга и протекающее с преобладанием поражения нервной системы, с преобладанием офтальмологического и бульбарного синдромов.
Этиология Возбудители ботулизма обитают в почве и из нее попадают в воду, овощи, фрукты, другие пищевые продукты. Размножающиеся формы клостридии ботулинум малоустойчивы во внешней среде и быстро погибают при нагревании свыше 60 °C. В отсутствие кислорода, например при консервировании, споры превращаются в активные формы, продуцирующие токсины. Ботулотоксин — наиболее сильно действующий бактериальный яд: в 1 мл токсина может содержаться до 1–3 млн смертельных доз для белых мышей. Смертельная для человека доза — 0,3 мкг. Ботулотоксин распадается при нагревании. Нагревание до 80 °C в течение 30 мин разрушает токсин частично, а кипячение в течение 5—10 мин полностью нейтрализует его.
Эпидемиология Основными носителями возбудителей ботулизма являются теплокровные травоядные животные, поглощающие споры с водой или кормом. Плотоядные животные обычно устойчивы к данному возбудителю. Человек заражается при употреблении в пищу зараженных спорами продуктов, реже — при заглатывании пыли, содержащей споры или токсин. Большая часть случаев ботулизма (более 90 %) связана с употреблением продуктов домашнего консервирования — грибов, овощей, рыбы, окороков. Наибольшую опасность представляют грибы, плохо отмытые от частиц почвы перед герметизацией их в банках.
Патогенез При употреблении зараженных продуктов в организм человека попадают активные формы возбудителя и ботулотоксин, который затем из кишечника проникает в кровеносное русло. Проникновение ботулотоксина вызывает резкое сужение кровеносных сосудов с последующим их параличом и повышением ломкости капилляров. Из крови токсин попадает во внутренние органы. Особой чувствительностью к ботулотоксину обладают нервные клетки спинного и продолговатого мозга. Ботулотоксин нарушает передачу импульса в некоторых отделах нервной системы в результате подавления выработки биологически активных веществ в нервно-мышечных соединениях, что обусловливает развитие периферических параличей. В большой дозе ботулотоксин угнетает тканевое дыхание головного мозга. Поражение окончаний двигательных нервов и нарушение функций скелетной мускулатуры грудной клетки, диафрагмы, глотки, гортани влекут за собой расстройство внешнего дыхания или развитие аспирационной пневмонии. В патогенезе ботулизма ведущую роль играет гипоксия — гипоксическая, гистотоксическая, гемическая и циркуляторная. Развитие прогрессирующей острой двигательной недостаточности связано с угнетением больших мотонейронов, интервирующих двигательную мускулатуру. Механизм раневого ботулизма и ботулизма младенцев отличается тем, что заражение происходит спорами, которые прорастают в анаэробных условиях раны или в условиях флоры или ферментов кишечника грудных детей в вегетативной форме продуцирующих токсинов. Патологоанатомические изменения в тканях и органах людей, умерших от ботулизма, неспецифичны. При вскрытии выявляют резкое кровенаполнение внутренних органов, множественные мелкие кровоизлияния и дегенеративные изменения в легких, печени, почках, селезенке, желудочно-кишечном тракте. Характерно полнокровие оболочек мозга. В сосудах мозга обнаруживаются некротические изменения ткани сосудов и тромбы. В мышцах, особенно грудной клетки, брюшной стенки и конечностей, а также в миокарде набухают мышечные волокна. Перенесенное заболевание иммунитета не оставляет, возможны повторные заболевания.
Клиническая картина Клиника ботулизма, вызванного различными типами возбудителей, одинакова. Инкубационный период колеблется от 2—12 ч до 8—10 дней. Продолжительность инкубации зависит от дозы токсина, проникшей в организм: чем больше доза, тем короче период инкубации и тяжелее клиника болезни. Различают ряд синдромов: инфекционнотоксический, диспепсический, офтальмоплегический, бульбарный и миастенический. Начало болезни внезапное. Больных беспокоят боли в подложечной области, чувство тяжести и распирания в области желудка, тошнота. Рвота и понос непродолжительны и прекращаются при развитии максимального эффекта ботулотоксина. Температура тела остается нормальной, реже повышается. Многие больные жалуются на головную боль, головокружение, замирание сердца, сухость во рту. Рано отмечаются быстрая утомляемость, прогрессирующая мышечная слабость, иногда вплоть до шаткой походки. В ряде случаев наблюдается локальная слабость в конечностях. Спустя 3–4 ч от начала болезни развиваются симптомы поражения черепных нервов и паралитические нарушения иннервации различных органов. Офтальмоплегические симптомы нередко являются первыми типичными признаками ботулизма. Больные жалуются на ослабление зрения, отмечают туман или сетку перед глазами, двоение предметов. При попытке читать они замечают, что строчки и буквы разбегаются. В дальнейшем исчезает реакция приспособления глаза, обнаруживаются разница в размерах зрачков, подергивание глазных яблок. Позднее развивается опущение века. Наряду с глазными симптомами рано появляются нарушения глотания и речи, обусловленные поражением черепных нервов. У больных отмечается осиплость голоса при длительном разговоре (грубый голос), затем речь становится гнусавой, нечленораздельной, смазанной, нередко пропадает звучность голоса. Больные жалуются на затруднения при глотании и поперхивание. В более тяжелых случаях вследствие пареза мягкого неба жидкая пища выливается через нос. Нарушение функции пищеварительной системы проявляется сухостью слизистых оболочек рта, мучительной жаждой. Вследствие спазма отмечаются боли в подложечной области, сменяющиеся в дальнейшем чувством распирания в области желудка и метеоризмом ввиду полного расслабления некоторых мышц. Наблюдаются тошнота, рвота, вздутие живота, запор. Ботулизм сопровождается функциональными нарушениями сердечно-сосудистой системы. Определяются расширение границ сердечной тупости и значительное приглушение тонов сердца с акцентом II тона на легочной артерии, возможна экстрасистолия. В начале болезни отмечается замедление сердечных сокращений, впоследствии сменяющееся сердцебиением. Ввиду сосудосуживающего эффекта ботулотоксина часто повышается артериальное давление. В заключительной фазе болезни преобладают нарушения функции дыхания, что связано со слабостью мышц диафрагмы и других дыхательных мышц. Вдох совершается с большим трудом, больной жалуется на чувство сдавления и сжатия в грудной клетке, принимает вынужденное положение, способствующее деятельности вспомогательной дыхательной мускулатуры. Частота дыхания достигает 30–40 в минуту, отмечается западение межреберных промежутков, в поздние сроки — дыхание типа Чейна-Стокса. Дыхательная недостаточность усиливается в связи с частым развитием пневмонии. В конечном периоде скелетная мускулатура расслабляется, становится тестообразной. Движения крайне ограниченны, больные не могут удерживать голову. В дальнейшем отмечается полная неподвижность при сохранении ясного сознания. Смертный исход наступает от паралича дыхания. У многих больных уменьшается отделение мочи. В моче определяются белок и цилиндрические клетки, возможна азотемия. В крови повышается количество нейтрофилов и лейкоцитов, особенно при тяжелом течении болезни. Выздоровление наступает медленно. Вначале восстанавливаются дыхание и глотание. Головная боль, гнусавость, нарушения речи и глазные нарушения сохраняются длительно. Медленно восстанавливается сердечная деятельность. Нередко спустя 3–4 месяца после выписки из стационара у больных еще наблюдаются одышка и сердцебиение. Нетрудоспособность может сохраняться 6—12 месяцев. В некоторых случаях в связи с поражением почек и нервной системы развивается стойкая инвалидность. Наряду с типичными формами болезни наблюдаются стертые формы ботулизма с постепенным развитием лишь некоторых симптомов, сохранением функции дыхания. Прогноз неблагоприятный. При отсутствии адекватной терапии летальность колеблется от 15 до 70 %.
Диагностика и дифдиагностика Данные опроса (заболевание после употребления в пищу консервов), а также наличие таких опорных симптомов, как головокружение и офтальмоплегия (расширение зрачков, отсутствие реакции на аккомодацию и свет), птоз, брадикардия, являются достаточными данными для постановки диагноза. Не следует смешивать ботулизм с пищевым сальмонеллезом и другими пищевыми отравлениями, для которых характерен понос и отсутствие параличей глазных мышц. При ботулизме в начальном периоде понос — довольно редкое явление, хотя тошнота, рвота и боли в животе выражены ясно. Особенно характерно для ботулизма сочетание этих признаков с запором и метеоризмом при нормальной температуре. Отравление грибами сопровождается поносом (слизь, кровь), обильным слюноотделением и потоотделением, нарушением психики. При отравлении метиловым алкоголем наблюдается токсическое поражение зрительного нерва, параличи же глазных мышц часто отсутствуют; на первый план выступает сильная одышка, цианоз и быстро развивающееся коматозное состояние. При отсутствии в анамнезе указаний на причину заболевания ботулизм можно смешать с острым полиомиелитом (см.), энцефалитом (см.). При энцефалите не наблюдается сильного метеоризма, часто имеет место слюнотечение, повышение температуры, сонливость. При дальнейшем течении отмечаются параличи и парез различных мышц, изменения спинномозговой жидкости. В сомнительных случаях нужно прибегать к лабораторным методам исследования.
Лечение Все больные с предполагаемым диагнозом ботулизма подлежат обязательной госпитализации в инфекционный стационар. Для удаления остатков инфицированной пищи, возбудителей и токсинов из желудочно-кишечного тракта назначают промывание желудка, высокие сифонные клизмы с 2–5 %-ным раствором гидрокарбоната натрия и солевое слабительное. С целью нейтрализации ботулотоксина применяют лечебные противоботулинические сыворотки, наибольший эффект которых отмечается при их введении в первые часы болезни. До установления типа возбудителя болезни вводят поливалентные сыворотки. Лечебные сыворотки вводят по Безредке. В случае развития аллергических явлений больным назначают димедрол, промедол, эфедрин и гидрокортизон. Для предупреждения образования активных форм бактерий класса клостридий в кишечнике человека применяют левомицетин или тетрациклин в обычных дозах на протяжении 7–8 дней. Наряду с этиотропным лечением осуществляют неспецифические дезинтоксикационные мероприятия, включающие введение кристаллоидов и коллоидов, диуретических препаратов, назначают сердечно-сосудистые средства, по показаниям — глюкокортикоиды. В тяжелых случаях, когда болезнь сопровождается нарушением дыхания, парезом глотки, гортани, при снижении вентиляции легких до 30 % применяют искусственную вентиляцию легких. Питание осуществляется через зонд, который сохраняют до восстановления глотания. Для создания активного иммунитета больным вводится анатоксин.
Профилактика Соблюдение санитарно-гигиенических правил при обработке, транспортировке, хранении и приготовлении пищевых продуктов предохраняет от заболевания ботулизмом. Необходим строгий контроль при заготовках консервированных продуктов, особенно в процессе их стерилизации и хранения.
БРОНХИАЛЬНАЯ АСТМА
ОпределениеБронхиальная астма представляет собой хроническое заболевание дыхательных путей, сопровождающееся гиперреактивностью бронхов к различным раздражителям и генерализованной их обструкцией, обратимыми спонтанно или под воздействием лечения. У предрасположенных лиц этот процесс приводит к развитию распространенных нарушений бронхиальной проходимости разной степени выраженности, полностью или частично обратимых спонтанно или под влиянием лечения. Воспалительный процесс вызывает также содружественное усиление ответа дыхательных путей в виде нарушения бронхиальной проходимости на различные внешние и внутренние стимулы (определение экспертов ВОЗ).Появление этого определения бронхиальной астмы стало возможным в связи с тем, что за последние 10 лет существенно изменилось представление о бронхиальной астме, ее причинах, процессе развития, клинике, лечении и профилактике. Таким образом, в основе бронхиальной астмы (независимо от степени тяжести) лежит хронический инфекционный воспалительный процесс в дыхательных путях. Повышенная активность бронхов, изменяющееся со временем нарушение бронхиальной проходимости и тесно связанные с ними клинические симптомы бронхиальной астмы являются следствием постоянного воспаления в бронхах.
Этиология За последние 30–40 лет бронхиальная астма стала очень распространенным заболеванием. Распространенность бронхиальной астмы колеблется от 3 до 8 %. В возникновении бронхиальной астмы имеет значение наследственная предрасположенность. Выявлена связь некоторых антигенов с тяжестью течения бронхиальной астмы; нарастание тяжести заболевания особенно часто отмечается у носителей некоторых антигенов. В развитии болезни играют роль внутренние и внешние факторы. Внутренние факторы — это биологические дефекты иммунной и эндокринной систем, периферической нервной системы, чувствительности и реактивности бронхов, слизеобразования и слизеотделения, сосудов легких, системы быстрого реагирования (тучные клетки), обмена арахидоновой кислоты. Внешние факторы, способствующие клинической реализации биологических дефектов, включают аллергены (пыльцевые, пылевые, пищевые, лекарственные, производственные, аллергены клещей, насекомых и животных), инфекцию (вирусы, грибы, некоторые виды бактерий), механические и химические раздражители (металлическая, древесная, силикатная, хлопковая пыль; пары кислот и щелочей), метеорологические и физико-химические факторы (изменение температуры и влажности воздуха, колебания барометрического давления, магнитного поля Земли), стрессовые нервно-психические воздействия и физическую нагрузку, фармакологические воздействия (бета-адреноблокаторы, нестероидные противовоспалительные препараты). Инфекционные агенты, помимо их аллергизирующего действия, могут играть также иную роль: снижать порог чувствительности организма к неинфекционным (атопическим) аллергенам, повышать проницаемость для них слизистой оболочки органов дыхания, формировать неиммунологическим путем изменение реактивности клеток-мишеней (тучные клетки, базофилы, моноциты). Известно, что некоторые вирусы и бактерии оказывают бронхоспастическое действие. При бронхиальной астме у одного и того же больного можно заподозрить или выявить сочетание нескольких провоцирующих факторов. Чем продолжительнее течение болезни, тем большее значение приобретают различные неспецифические раздражения и психогенные факторы.
Патогенез Центральным звеном развития бронхиальной астмы является неинфекционный воспалительный процесс в бронхах, который вызывается воздействием различных воспалительных клеток и выделяемых ими биологически активных веществ. В свою очередь, воспаление бронхов ведет к развитию их повышенной чувствительности и гиперреактивности. В большинстве случаев бронхиальная астма является аллергической болезнью, поэтому главный механизм формирования этого процесса — иммунный. У значительной части больных бронхиальной астмой нарушения иммунной системы протекают по типу реакции гиперчувствительности. Чаще других главную роль играют механизмы повышенной чувствительности (анафилактического или атопического типа). К этому типу аллергии относятся немедленные реакции, развивающиеся вследствие взаимодействия аллергена (антигена) со специфическим иммунным белком. Более отдаленным последствием активации тучных клеток является запуск продукции производных арахидоновой кислоты, тромбоксанов и цитокинов, которые также вырабатываются тучными клетками и участвуют в поддержании воспалительной реакции в тканях. Под влиянием этих процессов повышается проницаемость капилляров, развиваются отек, бронхоспазм и прочие проявления неинфекционного воспаления дыхательных путей. Клинически это выражается острым нарушением проходимости бронхов и развитием приступа бронхиальной астмы. Иммунокомплексная реакция развивается под воздействием чужеродных аллергенов (микроорганизмы, ферменты, пыль, антибиотики) и внутренних аллергенов (инфекционное и (или) аллергическое воспаление). Различные раздражители и другие факторы могут приводить к разрушению белков бронхиол с последующим формированием внутренних аллергенов — аутоаллергенов. В развитии бронхиальной астмы определенная роль принадлежит местной поломке иммунной защиты: отмечается уменьшение вырабатываемого иммунного белка, нарушается система удаления чужеродных частиц, которая в органах дыхания обеспечивается в основном макрофагами. При нарушении их функции резко снижается противовирусная защита организма. Воспаление приобретает постоянный характер. Известно также, что существует большое количество неспецифических факторов (токсины, ферменты, лекарства, различные макромолекулы), вызывающих распад тучных клеток. Различные физические, механические и химические раздражители (например, дым, двуокись серы, пыль, холодный воздух), инфекционные факторы провоцируют рефлекторный бронхоспазм путем стимуляции рецепторов в дыхательных путях. Ранее считалось, что такая реакция осуществляется путем повышенной активности парасимпатической нервной системы. В настоящее время этот механизм не считается основным. Обнаружена распространенная сеть нервных волокон регуляции бронхов, содержащих мощные нейрохимические вещества, которые имеют отношение к развитию большинства признаков обострения бронхиальной астмы. Предполагают также, что в формировании нестабильности тучных клеток играют роль гормональные нарушения — глюкокортикоидная недостаточность, дизовариальные расстройства (гиперэстрогенемия и гипопрогестеронемия) и нервно-психические нарушения. Недостаточность глюкокортикостероидов способствует развитию повышенной реактивности тучных клеток, снижению синтеза катехоламинов, а также нарушению иммунной системы (комплексное участие в развитии бронхиальной астмы и иммунологических и неиммунологических механизмов). При нарушении бронхиальной проходимости, обусловленной любыми другими механизмами, также отмечается гормональный дисбаланс, выражающийся в преобладании системы одних гормонов над другими. Кроме того, изменяется содержание внутриклеточного фермента фосфодиэстеразы, усиливается поступление ионов кальция в клетку.
Классификация В последние годы в нашей стране с учетом принятого определения бронхиальной астмы используется классификация, предложенная Г. Б. Федосеевым. Она не отменяет классификацию, разработанную А. Д. Адо и П. К. Булатовым, но развивает ее с учетом результатов новых исследований. Этапы развития бронхиальной астмы: состояние предастмы; клинически оформленная бронхиальная астма. К предастме относят все состояния, представляющие угрозу возникновения бронхиальной астмы (острый и хронический бронхит, а также острая и хроническая пневмония с элементами бронхоспазма в сочетании с сосудодвигательным ринитом, крапивницей и другими состояниями, при которых выявляются эозинофилия крови и увеличенное содержание эозинофилов в мокроте). После первого приступа или сразу возникшего астматического статуса бронхиальная астма считается клинически оформленной. Формы бронхиальной астмы: иммунологическая; неиммунологическая (в формулировку клинического диагноза не включается). Механизмы развития бронхиальной астмы и варианты их клинических форм: атопический; инфекционно-зависимый; аутоиммунный; дисгормональный; нервно-психический дисбаланс; адренергический дисбаланс; первично измененная реактивность бронхов. Разделение бронхиальной астмы по механизмам развития и выделение основного из них представляет трудную и часто неразрешимую задачу. Однако во всех случаях такая попытка оправдана, так как каждый из механизмов предполагает определенный, свойственный только ему характер лекарственной терапии. У одного больного возможно сочетание нескольких вариантов клинических проявлений и механизмов развития. Поэтому необходимо на момент обследования выделить основной для данного больного вариант, так как это важно для проведения соответствующей терапии. В процессе длительного течения бронхиальной астмы возможна смена механизма развития. Тяжесть течения бронхиальной астмы: легкое течение; течение средней тяжести; тяжелое течение. При легком течении бронхиальной астмы обострения недлительные, возникают 2–3 раза в год. Приступы удушья устраняются, как правило, приемом различных бронхорасширяющих препаратов внутрь. В межприступный период признаки бронхоспазма, как правило, не выявляются. Среднетяжелое течение характеризуется более частыми обострениями — 3–4 раза в год. Приступы удушья протекают тяжелее и снимаются инъекциями лекарственных препаратов. При тяжелом течении бронхиальной астмы обострения возникают часто (5 раз и более в год), отличаются длительностью. Приступы тяжелые, нередко переходят в астматическое состояние. В ряде случаев разделение бронхиальной астмы по тяжести течения бывает условным. Так, при легком течении бронхиальной астмы больной может погибнуть от внезапно развившегося астматического статуса. В то же время возможно спонтанное прекращение обострения при довольно тяжелом течении болезни. Фазы течения бронхиальной астмы: обострение, стихающее обострение, ремиссия. Фаза обострения характеризуется наличием выраженных признаков заболевания, прежде всего — повторно возникающих приступов бронхиальной астмы или астматического состояния. В фазе стихающего обострения приступы становятся более редкими и нетяжелыми. Клинические признаки заболевания выражены меньше, чем в фазу обострения. В фазу ремиссии исчезают типичные проявления бронхиальной астмы: приступы удушья не возникают; полностью или частично восстанавливается проходимость бронхов. Осложнения: легочные — эмфизема легких, легочная недостаточность, ателектаз, пневмоторакс, астматический статус; внелегочные — легочное сердце (компенсированное и декомпенсированное с развитием правосердечной недостаточности), дистрофия миокарда. Настоящая классификация еще не утверждена, но позволяет более эффективно проводить лечение больных бронхиальной астмой. Экспертами ВОЗ даны новые критерии тяжести бронхиальной астмы, определяемой выраженностью клинических симптомов, объемом быстрого выдоха за первую секунду и пиковой скоростью выдоха — наиболее значимыми показателями выраженности нарушения проходимости дыхательных путей. Оценка по этим показателям тяжести бронхиальной астмы позволяет осуществить так называемый ступенчатый подход к лечению больных: объем терапии должен повышаться при увеличении степени тяжести болезни. Классификация бронхиальной астмы, основанная на степени тяжести, наиболее важна, когда нужно принять решение о выборе терапии. Кроме того, предложение экспертов ВОЗ классифицировать бронхиальную астму по степени тяжести базируется на том, что нередко другие рубрики вышеприведенной классификации невозможно с достоверностью определить у всех больных.
Клиническая картина Наиболее характерный признак бронхиальной астмы — наличие приступов удушья. Однако клинический диагноз бронхиальной астмы может быть поставлен с учетом оценки результатов всех трех этапов диагностического поиска, так как удушье встречается как симптом и при других заболеваниях. В связи с этим возникает на каждом из трех этапов необходимость ее дифференциации с заболеваниями, составной частью которых является бронхоспастический синдром с развитием приступов удушья. Больные жалуются на приступы удушья (затрудненное дыхание, преимущественно на выдохе), одышку и кашель. Характер кашля может быть различным: чаще кашель сухой, надсадный, приступообразный или с выделением вязкой, трудноотделяемой мокроты. При развитии легочной недостаточности одышка беспокоит и в межприступный период. Повышение температуры тела может свидетельствовать об активизации бронхолегочной инфекции. Затрудненное носовое дыхание, как правило, служит проявлением аллергической риносинусопатии (насморк, полипы) — частого спутника или предшественника бронхиальной астмы (предастма). При расспросе больного необходимо уточнить частоту возникновения симптомов бронхиальной астмы в неделю, обратив особое внимание на ночные симптомы. Эти данные особенно важны для оценки тяжести течения болезни на момент обследования больного. Данные расспроса помогают установить связь развития приступов с воздействием определенных аллергенов и других факторов. Наиболее частой причиной обострения и развития бронхиальной астмы является инфекция дыхательных путей; особенно велика ее роль в обострении болезни. Из расспроса узнают о влиянии физических усилий (быстрая ходьба, смех), метеорологических факторов (холод, повышенная влажность), нарушений функции яичников на возникновение приступов удушья. Знакомство с условиями работы помогает обнаружить профессиональную астму. Изучение аллергологического прошлого способствует диагностике атопического варианта бронхиальной астмы. В подобных случаях можно получить сведения о поллинозе (аллергия на пыльцу): обострения болезни имеют сезонный характер (чаще весной и летом), сопровождаются насморком, конъюнктивитом. У таких больных бывают крапивница, отек Квинке; выявляется непереносимость пищевых продуктов, ряда лекарственных веществ; отмечается наследственная предрасположенность к аллергическим заболеваниям. Ориентируясь на данные расспроса, можно предположительно, а в ряде случаев и с уверенностью высказать предположение о так называемой аспириновой астме. Эти больные не страдают наследственной формой аллергических заболеваний. Их беспокоит нарушенное носовое дыхание (полипозные разрастания). Наиболее характерный симптом у таких больных — непереносимость нестероидных противовоспалительных препаратов (ацетилсалициловая кислота, индометацин), вызывающих астматические приступы. Указание в прошлом на прием кортикостероидных препаратов свидетельствует о тяжести болезни, а эффективность приема — об иммунной форме бронхиальной астмы или кортикостероидозависимом ее варианте. Отсутствие эффекта от приема гормональных препаратов, особенно у больных с тяжелым течением бронхиальной астмы, делает предположение об аллергическом происхождении бронхиальной астмы менее достоверным и практически исключает наличие у больного гормональной недостаточности. Глюкокортикоиды неэффективны также при астме физического усилия. Данные о развитии в прошлом астматического статуса свидетельствуют о тяжести течения заболевания и указывают на необходимость проведения терапии кортикостероидами. Бронхиальная астма может протекать монотонно, с постоянно нарушенным дыханием и потребностью принимать ежедневно противоастматические средства. Другой тип течения бронхиальной астмы характеризуется периодическими обострениями с заметно усиливающимися признаками нарушения бронхиальной проходимости и ремиссиями, когда нарушения бронхиальной проходимости резко уменьшаются или исчезают. Такое течение бронхиальной астмы наиболее характерно для атопического варианта заболевания. При обследовании кожных покровов иногда можно выявить изменения, характерные для аллергических проявлений: крапивницу, пузырьковые (папулезные) и пятнистые (эритематозные) высыпания. Эти изменения могут свидетельствовать об иммунологическом варианте бронхиальной астмы. При аллергических формах бронхиальной астмы могут быть конъюнктивиты (особенно часто у больных поллинозами). Сочетание бронхиальной астмы с экземой, нейродермитом, псориазом предрасполагает к тяжелому течению астмы. Грибковое поражение кожи, ногтевых лож может сопровождаться гиперчувствительностью к грибковым аллергенам. Часто можно выявить нарушение носового дыхания. Риниты и полипоз рассматриваются как предастма. Гаймориты и другие синуситы служат очагом инфекции, который может провоцировать удушье. При исследовании легких могут быть выявлены признаки эмфиземы. Появлению эмфиземы легких, а затем хронической дыхательной недостаточности и легочного сердца часто способствует хронический бронхит. Он может присоединиться к бронхиальной астме, если она затяжная, а также может служить фоном, на котором развивается инфекционно-зависимая бронхиальная астма. Выслушивание легких помогает обнаружить признаки бронхиальной непроходимости, для которой характерны изменения дыхания (удлиненный выдох), сухие (преимущественно свистящие) хрипы. Иногда при обследовании вне приступа удушья сухих хрипов может быть немного или они не прослушиваются. Ускоренный выдох позволяет выявить скрытый бронхоспазм (появление или нарастание сухих хрипов). Обязательно проводят выслушивание легких в положении больного лежа: количество сухих хрипов может увеличиться. Постоянно выслушиваемые на определенном участке влажные звонкие (трескучие) мелкопузырчатые хрипы могут свидетельствовать о развившемся пневмосклерозе. В случае астматического статуса отмечается уменьшение количества сухих хрипов при выслушивании вплоть до развития немого легкого, несмотря на резкое нарастание удушья и одышки. Объективное обследование больного помогает выявить симптомы других заболеваний («бабочка» на коже лица, лимфаденопатия в сочетании с увеличением печени и селезенки, стойкое повышение артериального давления, упорная лихорадка), при которых возникают приступы бронхоспазма, проявляющиеся удушьем (системная красная волчанка, узелковый периартериит, реже — другие распространенные заболевания соединительной ткани). В таких случаях предполагаемый диагноз бронхиальной астмы становится маловероятным. Течение бронхиальной астмы может иметь четыре стадии: — I стадия (легкая интермиттирующая), которая характеризуется приступами удушья, носящими кратковременный характер. Они возникают не чаще 1–2 раз в месяц. Показатели скорости выдоха и объема форсированного выдоха составляют не менее 85 % от стандартных значений; — II стадия характеризуется легким персистирующим течением, при котором приступы удушья возникают 1 раз в неделю. Показатели скорости выдоха и объема форсированного выдоха составляют не менее 80 % от суточных колебаний; — III стадия — средне тяжелое течение, характеризующееся приступами в периоде обострения до 2–3 раз в неделю в ночное время. Показатели скорости выдоха составляют 60–80 % от должных величин, а их суточное колебание составляет 20–30 %; — IV стадия — тяжелое течение, характеризуется ежедневными приступами. Физическая активность больных ограничена, скорость выдоха составляет 60 %, их суточные колебания более 30 %.
Астматический статус Факторы, предрасполагающие к его развитию, почти всегда являются результатом неадекватной терапии. Чаще всего причинами его служат бесконтрольный прием бронхорасширяющих и гормональных препаратов; резкое прерывание длительно проводимой гормональной терапии; обострение хронического или возникновение острого воспалительного процесса в бронхолегочном аппарате, неэффективно леченного; неудачно проведенное специфическое лечение; злоупотребление снотворными и успокаивающими средствами. Критерии астматического статуса: прогрессирующее нарушение дренажной функции бронхов и клиническая картина удушья, которое может осложняться легочной дыхательной недостаточностью, кислорододефицитной комой, острым легочным сердцем, невосприимчивостью к бронхорасширяющим препаратам, гипоксией тканей. Классификация астматического статуса: — I стадия — затянувшийся приступ удушья, сформировавшаяся устойчивость к бронхорасширяющим препаратам; — II стадия — нарастание дыхательной недостаточности по обструктивному типу; — III стадия — гипоксемическая (кислорододефицитная) кома. Стадия I характеризуется затянувшимся приступом удушья, вынужденным положением больного, учащенным дыханием, приступообразным кашлем со скудной и трудноотделяемой мокротой, сердцебиением, часто — повышением артериального давления. Из типичных симптомов отмечают несоответствие между интенсивностью дыхательных шумов, выслушиваемых дистанционно, и данными выслушивания легких (скудность хрипов, участки ослабленного дыхания). Для II стадии характерно очень тяжелое состояние больного: бледно-серые влажные кожные покровы, учащенное поверхностное дыхание, при выслушивании — немое легкое (хрипы почти не слышны), частый пульс малого наполнения, нарушения сердечного ритма, снижение артериального давления. Периоды безразличия у больного сменяются возбуждением. В III стадии сознание отсутствует, дыхание учащенное, часто отмечаются разлитой красный цианоз, нередко — сосудистые нарушения. Смертность на высоте астматического статуса достигает 5—20 %. Наиболее частые причины смерти — асфиксия (прекращение дыхания) вследствие позднего проведения реанимационных мероприятий, невозможность восстановления эффективной вентиляции легких. При своевременно начатой интенсивной терапии прогноз астматического статуса может быть благоприятным. Все вышеизложенное касалось так называемого медленно развивающегося астматического статуса. Кроме того, существует немедленно развивающийся (анафилактический) астматический статус, обусловленный развитием молниеносной аллергической реакции немедленного типа с мгновенным высвобождением веществ аллергии и воспаления, что приводит к полному бронхоспазму и удушью в момент контакта с аллергеном.
Диагностика и дифдиагностика Дифдиагноз проводится обычно между инфекционно-зависимой бронхиальной астмой и хроническим обструктивным бронхитом, клинические проявления которых довольно похожи. Для бронхиальной астмы наиболее типичны повышение уровня эозинофилов в крови и мокроте, наличие риносинусита (аллергического или полипозного), положительные результаты теста на выявление скрытого бронхоспазма и хороший лечебный эффект от применения антигистаминных препаратов. Подобные критерии используются для дифференциальной диагностики бронхиальной астмы и астмоподобного бронхоспазма при раке легких, попадании в дыхательные пути инородного тела, сдавлении их опухолью или увеличенными лимфоузлами, при системном мастоцитозе. Диагноз подтверждается результатами аллергологического обследования. Удушье при приступе бронхиальной астмы необходимо дифференцировать с сердечной астмой (левожелудочковой недостаточностью). При сердечной астме характерными признаками являются наличие в прошлом нарушений деятельности сердца, затруднений выдоха, при прослушивании влажные хрипы в легких (преимущественно в нижних отделах). Кроме того, имеются отеки на нижних конечностях и увеличение печени, терапевтический эффект от применения кардиотоников и мочегонных средств.
Лечение и профилактика Основные принципы лечения включают неотложную терапию приступа бронхиальной астмы, интенсивную терапию при развитии астматического статуса, лечение в фазе обострения и лечение в фазе ремиссии. Лечение приступа бронхиальной астмы проводят с учетом возраста пациента и тяжести приступа. Легкий приступ больные, как правило, снимают самостоятельно. Используются лекарственные вещества в таблетках (эуфиллин) или ингаляторах (сальбутамол, вентолин, фенотерол или беротек, беродуал). При отсутствии ингаляторов приступ снимают подкожными инъекциями адреналина (0,3 мл 0,1 %-ного раствора; рекомендуется молодым пациентам) или эфедрина (0,5 мл 5 %-ного раствора) в сочетании с папаверином (1 мл) и антигистаминным препаратом (1 мл димедрола или супрастина). Приступы средней тяжести у молодых пациентов с немедленным развитием прекращают ингаляциями симпатомиметических средств или подкожным введением адреналина; при отсутствии эффекта внутривенно вводят эуфиллин. В случае сочетания приступа бронхиальной астмы с повышением артериального давления молодым пациентам одновременно с эуфиллином можно вводить ганглиоблокаторы (пентамин, бензогексоний), пожилым — дроперидол. Иногда приступ проходит только после внутривенного введения преднизолона (60 мг). Пожилым больным при среднетяжелом и тяжелом приступе, особенно при длительном его течении, внутривенно вводят эуфиллин, а при отсутствии эффекта — преднизолон. При тяжелых приступах, помимо внутривенного введения преднизолона, существенное значение имеет выравнивание измененного кислотно-основного состояния; проводится инфузионная терапия натрия гидрокарбонатом, изотоническим раствором хлорида натрия, особенно в тех случаях, когда приступ затягивается и очень плохо отходит мокрота. Прибегают к повторному введению эуфиллина и преднизолона. Больного обязательно госпитализируют. При затянувшихся тяжелых приступах бронхиальной астмы возрастает угроза развития астматического статуса. Лечение астматического статуса заключается в проведении интенсивной терапии, которую необходимо начинать в максимально ранние сроки. Она включает оксигенотерапию, терапию в виде непрерывной подачи кислородно-воздушной смеси с относительно небольшим содержанием О2 (35–40 %); инфузионную терапию, при которой внутривенно вводят декстраны, глюкозу, инсулин, 20 тыс. ЕД гепарина, натрия гидрокарбонат (под контролем показателей кислотно-основного состояния) в общем количестве не менее 3–3,5 л в первые сутки с целью восполнения дефицита жидкости, устранения сгущения крови, разжижения бронхиального содержимого; обязательное внутривенное введение кортикостероидов — гидрокортизона по 1 мг/ч на 1 кг массы тела, преднизолона по 60–90 мг каждые 2–4 ч. После выведения из астматического статуса дозу стероидов ежесуточно уменьшают на 25 % до минимальной. Лечение астматического статуса исключает использование спазмолитических средств, если он развился в результате их передозировки. В качестве бронхорасширяющего средства используют эуфиллин. Для разжижения мокроты используют щелочное питье, парокислородные ингаляции. Мочегонные средства показаны лишь при возрастании центрального венозного давления до 150 мм вод. ст. и выше. При сопутствующей гипертензии в небольших дозах назначают ганглиоблокаторы (пентамин, бензогексоний), они же улучшают легочное кровообращение. Активно используют перкуссионный и вибрационный массаж грудной клетки для улучшения отделения содержимого бронхов. Прогрессирующее нарушение легочной вентиляции, не поддающееся консервативной терапии, является показанием для применения искусственной вентиляции легких, лечебной бронхоскопии и проведения бронхоальвеолярного лаважа сотмыванием и удалением бронхиального содержимого. Лечение анафилактического варианта астматического статуса требует проведения немедленной парентеральной лекарственной терапии: внутривенного введения 0,3–0,5 мл 0,1 %-ного раствора адреналина на 20 мл изотонического раствора хлорида натрия и струйного внутривенного введения 120 мг преднизолона с последующим переходом на внутривенное капельное введение этих же препаратов. Одновременно можно добавить 0,5–1 мл 0,1 %-ного раствора атропина, вводя его струйно на 10 мл изотонического раствора. При отсутствии эффекта от перечисленных мероприятий проводят фторотановый наркоз и переводят больного на ИВЛ. Лечение больного бронхиальной астмой в период обострения помимо прекращения приступа включает ряд различных мероприятий: устранение контакта с выявленным аллергеном, лекарственная противовоспалительная терапия. Глюкокортикоидные препараты в настоящее время являются наиболее эффективными противовоспалительными средствами при лечении бронхиальной астмы. Их можно применять местно (ингаляционно) или системно (внутрь или внутривенно). Ингаляционное введение кортикостероидных препаратов оказывает местный эффект и снижает до минимума их побочное действие на организм. К числу короткодействующих препаратов относятся бекотид и бекломет, их следует применять 4 раза в день. Такие препараты, как игакорт, фликсотид и пульмикорт турбухалер, характеризуются большей продолжительностью действия, что позволяет использовать их для надежного контроля за течением бронхиальной астмы 2 раза в сутки. Если высокие дозы ингалируемых кортикостероидных препаратов не обеспечивают надежный контроль за течением бронхиальной астмы, добавляют кортикостероиды внутрь. При тяжелом течении бронхиальной астмы кортикостероиды назначают постоянно, начиная с максимальной для больного дозы (30–40 мг преднизолона), затем постепенно дозу снижают и переходят на поддерживающую терапию. Противовоспалительным действием обладает также натрия кромогликат, который эффективен при лечении большинства больных атопической (аллергической) бронхиальной астмой; кроме того, он иногда дает положительный эффект у больных аспириновой астмой и астмой физического усилия. Препарат вводят ингаляционно в виде сухого порошка или в виде распыляемого раствора. Лечение следует начинать с двух ингаляций препарата 4 раза в сутки; при достижении эффекта переходят на поддерживающую терапию. В последние годы появился новый противовоспалительный препарат, также вводимый ингаляционно, — тайлед (натрия недокромил). Он дает возможность контролировать легкое течение бронхиальной астмы. У части больных со среднетяжелым, а иногда и тяжелым течением бронхиальной астмы его назначение позволяет уменьшить дозу применяемых кортикостероидов. При затрудненном дыхании за 15 мин до ингаляции противовоспалительного препарата больной должен сделать 1–2 вдоха бронхолитика. Комбинированным препаратом, содержащим в одном аэрозоле полную дозу интала и уменьшающую дозу бронхолитического препарата (50 мкг беротека), является дитек.
Бронхолитическая терапия Бронхолитические препараты применяются внутривенно, в свечах или перорально. Препаратами выбора остаются эуфиллин или теофиллин. Применяют препараты эуфиллина продолжительного действия (теопек, теодур). Эти препараты являются основными и назначаются всем больным (при условии хорошей переносимости). Симпатомиметические или холинолитические препараты назначаются в дозированном аэрозоле, как правило, при появлении предвестников приступа удушья. Постоянное применение этих препаратов в ингаляциях не рекомендуется во избежание побочных эффектов. В настоящее время наряду с ингаляционными препаратами короткого действия — фенотеролом (беротек), сальбутамолом, длительность бронхолитического действия которых составляет 4–6 ч, применяют пролонгированные препараты с продолжительностью действия более 12 ч, в частности сальметерол (серевент). Применяют препараты длительного действия в форме таблеток (вольмакс). Они показаны для приема внутрь на ночь при ночных приступах.
БРОНХИОЛИТ
ОпределениеБронхиолит — острое воспаление бронхиол (самых мелких бронхов); рассматривается как тяжелая форма острого бронхита.
Этиология и патогенез Возбудители — обычно вирусы (гриппозные, респираторно-синцитиальные) или вирусы и бактерии (вирусно-бактериальные инфекции). Может развиться после вдыхания раздражающих газов, очень холодного воздуха. Воспаление бронхиол с нарушением их проходимости приводит к тяжелым нарушениям газообмена и кровообращения.
Клиническая картина Начало болезни острое или на фоне трахеобронхита. Лихорадка (38–39 °C), выраженная одышка (до 40 и более дыхательных движений в минуту), дыхание поверхностное с участием вспомогательной мускулатуры. Грудная клетка фиксирована в положении вдоха с приподнятым плечевым поясом. Лицо одутловатое, синюшное. Мучительный кашель со скудной слизистой мокротой, боль в груди вследствие перенапряжения мышц и сокращения диафрагмы при кашле. При выстукивании — звук с коробочным оттенком, дыхание ослабленное или жесткое, обильные мелкопузырчатые незвучные хрипы, свистящие хрипы на выдохе. Нарастают симптомы обструктивной эмфиземы. К выраженной дыхательной недостаточности присоединяются расстройства легочного и внутрисердечного кровообращения.
Диагностика и дифдиагностика Рентгенологически определяется усиление легочного рисунка в нижних отделах и в области корней легких. Отмечаются увеличенное количество лейкоцитов, повышение СОЭ. Течение очень тяжелое, длительность болезни до 5–6 недель. Возможен летальный исход. Дифференцируют с милиарным туберкулезом (см.), пневмониями (см.).
Лечение Внутривенное введение антибиотиков по принципу лечения острой пневмонии. Кислородотерапия. Аналептические средства (кордиамин, сульфокамфокаин), эуфиллин (5 мл 2,4 %-ного раствора внутривенно 2–3 раза в день). Симптоматическая терапия: в период мучительного непродуктивного кашля — противокашлевые средства (кодеин, этилморфина гидрохлорид); затем — отхаркивающие и разжижающие; анальгетики при боли; банки, горчичники, спиртовые компрессы на грудную клетку, растирания (например, скипидарной мазью). При необходимости — интенсивная терапия в условиях реанимационного отделения.
БРОНХИТЫ
ОпределениеБронхит — воспалительное поражение бронхиального дерева, обусловленное длительным раздражением бронхов различными вредными факторами, имеющее прогрессирующее течение и характеризующееся нарушением слизеобразования и функции бронхиального дерева, что проявляется кашлем, отделением мокроты и одышкой.Согласно рекомендациям ВОЗ, бронхит можно считать хроническим, если больной откашливает мокроту на протяжении большинства дней не менее 3 месяцев в течение более 2 лет подряд.
Классификация хронического бронхита Хронический бронхит подразделяется на первичный и вторичный. Первичный хронический бронхит является самостоятельным заболеванием, не связанным с какими-то иными бронхолегочными процессами или поражением других органов и систем. Наблюдается распространенное поражение бронхиального дерева. Вторичный хронический бронхит развивается на фоне других заболеваний, как легочных (туберкулез, бронхоэктатическая болезнь, хроническая пневмония), так и внелегочных (уремия, застойная сердечная недостаточность). Чаще всего вторичный хронический бронхит сегментарный, т. е. носит локальный характер. Принципиально важным является разделение хронического бронхита на обструктивный (при котором развиваются сужения бронхов) и необструктивный (без изменения структуры бронхов) варианты. При каждом из этих вариантов в бронхах может развиться катаральный (слизистый), катарально-гнойный или гнойный воспалительный процесс. Таким образом, выделяют несколько вариантов течения бронхита. В классификацию включены редко встречающиеся формы: геморрагический и фибринозный бронхиты.
Этиология и патогенез Острый бронхит Заболевание вызывают вирусы (вирусы гриппа, парагриппозные, аденовирусы, респираторно-синцитиальные, коревые, коклюшные и др.), бактерии (стафилококки, стрептококки, пневмококки и др.), физические и химические факторы (сухой, холодный, горячий воздух, окислы азота, сернистый газ и др.). Предрасполагают к заболеванию охлаждение, курение табака, употребление алкоголя, хроническая очаговая инфекция в полости носа и глотки, нарушение носового дыхания, деформация грудной клетки. Повреждающий фактор проникает в трахею и бронхи с вдыхаемым воздухом, кровью или лимфой (уремический бронхит). Острое воспаление бронхиального дерева может сопровождаться нарушением бронхиальной проходимости отечно-воспалительного или бронхоспастического механизма. Характерны кровенаполнение и набухание слизистой оболочки; на стенках бронхов в их просвете определяются слизистый, слизисто-гнойный или гнойный секрет и дегенеративные изменения внутреннего реснитчатого слоя. При тяжелых формах воспалительный процесс захватывает глубокие ткани стенки бронхов.
Хронический бронхит Развитие хронического бронхита в значительной степени определяется внешними воздействиями — экзогенными факторами: табачный дым (при активном и пассивном курении); загрязнение воздушного бассейна; неблагоприятные условия профессиональной деятельности; климатические факторы; инфекционные факторы (вирусная инфекция). В связи с тем, что заболевание возникает не у всех подвергающихся неблагоприятным воздействиям, выделяют также внутренние причины, обусловливающие развитие бронхита, — эндогенные факторы: патология носоглотки, нарушение дыхания через нос и очищения вдыхаемого воздуха, повторные острые респираторные заболевания (ОРЗ), очаговая инфекция верхних дыхательных путей, наследственная предрасположенность (нарушение ферментных систем), нарушение обмена веществ (ожирение). Среди внешних факторов главная роль в возникновении хронического бронхита принадлежит поллютантам — примесям различной природы, содержащимся во вдыхаемом воздухе. Под воздействием внешних и внутренних факторов развиваются нарушения в трахее и бронхах. Изменяются структурно-функциональные свойства слизистой оболочки и подслизистого слоя. Развивается воспаление слизистой оболочки. Нарушаются проходимость и дренажная функция бронхов. Изменения структурно-функциональных свойств слизистой оболочки и подслизистого слоя выражаются в переразвитии бронхиальных желез, повышенной выработке слизи и изменении ее свойств (слизистый секрет становится густым и вязким). Снижается выработка белков и ферментов иммунной системой. Развивается отек слизистой оболочки, а затем — атрофия и перерождение ее внутреннего слоя. Усилению слизеобразования и изменению состава слизистого секрета способствуют также наследственная предрасположенность (дефицит некоторых ферментов, отчетливо проявляющийся в условиях повышенной потребности в них) и воздействие бактериальной и вирусной инфекции. Воспаление слизистой оболочки вызывают различные раздражающие вещества в сочетании с инфекцией (вирусной и бактериальной). Химические вещества, содержащиеся в воздухе, вызывают повреждение в дыхательных путях, сопровождающееся отеком слизистой оболочки и торможением активности внутренней реснитчатой оболочки. Это приводит к нарушению эвакуаторной и снижению барьерной функции слизистой оболочки бронхов. Катаральное содержимое сменяется катарально-гнойным, а затем гнойным. Распространение воспалительного процесса на периферические отделы бронхиального дерева нарушает выработку вещества, препятствующего слипанию легочной ткани, и снижает активность иммунных клеток, которые осуществляют удаление бактерий и других чужеродных частиц. Если спазм бронхов (как проявление воспаления) выражен резко, то говорят о наличии бронхоспастического (неаллергического) компонента. Вместе с тем инфекция при обострении воспаления может способствовать присоединению астматического (аллергического) компонента — одного из осложнений хронического бронхита, позволяющего отнести такой бронхит к предастматическому состоянию. Исходом воспалительного процесса могут быть спадение мелких бронхов и закупорка бронхиол. Нарушение проходимости и дренажной функции (обструктивный синдром) бронхов развивается как следствие сочетания ряда факторов: спазма гладких мышц бронхов, возникающего в результате непосредственного раздражающего воздействия внешних факторов и воспалительных изменений слизистой оболочки; повышенной выработки слизи, изменения ее свойств, приводящего к нарушению эвакуации и закупорке бронхов вязким секретом; перерождения внутреннего эпителия и его переразвития; нарушения выработки сурфактанта; воспалительного отека слизистой оболочки; спадения мелких бронхов и закупоривания бронхиол; аллергических изменений слизистой оболочки. При вовлечении в процесс бронхов преимущественно крупного калибра (проксимальный бронхит) нарушения бронхиальной проходимости не выражены. Поражение мелких бронхов и бронхов среднего калибра протекает часто с нарушением бронхиальной проходимости. При изолированном поражении мелких бронхов (дистальный бронхит), лишенных кашлевых рецепторов, одышка может быть единственным симптомом. Кашель появляется позже, при вовлечении в процесс более крупных бронхов. Различные соотношения изменений слизистой оболочки, проявляющиеся в ее воспалении и (или) нарушениях проходимости, обусловливают формирование той или иной клинической формы болезни: при катаральном необструктивном бронхите преобладают поверхностные изменения свойств слизистой оболочки; при слизисто-гнойном (или гнойном) бронхите преобладают процессы инфекционного воспаления. Возможен переход одной клинической формы бронхита в другую. Если нет нарушений проходимости бронхов, то и дыхательные нарушения выражены, как правило, незначительно. Нарушения проходимости при хроническом бронхите могут вначале появляться только на фоне обострения заболевания и быть обусловлены воспалительными изменениями бронхов, бронхоспазмом (обратимыми спастическими компонентами), но затем сохраняются постоянно. Чаще отмечается медленное и постепенное нарастание спастического синдрома. При обструктивном (спастическом) варианте хронического бронхита преобладает утолщение слизистой оболочки и подслизистого слоя, сочетающееся с отеком и повышением продукции слизи при развитии его на фоне катарального бронхита или с большим количеством гнойного бронхиального содержимого. Для обструктивной формы хронического бронхита характерны стойкие нарушения дыхания. Развившееся нарушение проходимости мелких бронхов приводит к эмфиземе легких. Прямой зависимости между выраженностью бронхиальной обструкции и эмфиземы не существует. В своем развитии хронический бронхит претерпевает определенные изменения. В результате развития эмфиземы и пневмосклероза отмечается неравномерная вентиляция легких, образуются участки с повышенной и пониженной вентиляцией. В сочетании с местными воспалительными изменениями это приводит к нарушению газообмена, дыхательной недостаточности, снижению содержания кислорода в артериальной крови и повышению внутрилегочного давления с последующим развитием правожелудочковой недостаточности — основной причины смерти больных хроническим бронхитом.
Клиническая картина Острый бронхит Бронхит, вызванный инфекцией, нередко начинается на фоне острого ринита, ларингита. При легком течении заболевания возникают саднение за грудиной, сухой, реже влажный кашель, чувство разбитости, слабость. При обследовании какие-либо изменения отсутствуют или над легкими определяются жесткое дыхание и сухие хрипы. Температура тела незначительно повышена или нормальная. Состав крови не меняется. Такое течение наблюдается чаще при поражении трахеи и крупных бронхов. При среднетяжелом течении значительно выражены общее недомогание, слабость, характерны сильный сухой кашель с затруднением дыхания и одышкой, боль в нижних отделах грудной клетки и брюшной стенки, связанная с перенапряжением мышц при кашле. Кашель постепенно становится влажным, мокрота приобретает слизисто-гнойный или гнойный характер. Над поверхностью легких выслушиваются жесткое дыхание, сухие и влажные мелкопузырчатые хрипы. Температура тела остается повышенной в течение нескольких дней. Выраженных изменений состава крови нет. Тяжелое течение болезни наблюдается, как правило, при преимущественном поражении бронхиол (см. Бронхиолит). Острые симптомы болезни стихают к 4-му дню и при благоприятном исходе полностью исчезают к 7-му дню. Острый бронхит с нарушением бронхиальной проходимости имеет тенденцию к затяжному течению и переходу в хронический бронхит. Тяжело протекают острые бронхиты токсико-химической этиологии. Болезнь начинается с мучительного кашля с выделением слизистой или кровянистой мокроты, быстро присоединяется бронхоспазм (на фоне удлиненного выдоха выслушиваются сухие свистящие хрипы) и прогрессирует одышка (вплоть до удушья), нарастают дыхательная и кислородная недостаточность. Рентгенологически могут определяться симптомы острой эмфиземы легких. Тяжелое течение могут принимать и острые пылевые бронхиты. Кроме кашля (вначале сухого, а затем влажного), отмечаются выраженная одышка, синюшность слизистых оболочек. Определяются коробочный оттенок при выстукивании, жесткое дыхание, сухие хрипы. Возможно увеличение количества эритроцитов. Рентгенологически выявляется повышенная прозрачность легочных полей и умеренное расширение корней легких.
Хронический бронхит Выделяют следующие основные симптомы хронического бронхита: кашель, выделение мокроты, одышка. Также выявляют симптомы общего характера (потливость, слабость, повышение температуры тела, быстрая утомляемость, снижение трудоспособности), которые могут появляться при обострении болезни либо как проявление гипоксии при развитии легочной недостаточности и других осложнениях. Кашель является наиболее типичным проявлением болезни. По характеру кашля и мокроты можно предположить тот или иной вариант течения заболевания. При необструктивном варианте катарального бронхита кашель сопровождается выделением небольшого количества слизистой водянистой мокроты, чаще по утрам, после физических упражнений или в связи с учащением дыхания. Количество мокроты может увеличиваться при обострении бронхита. В начале болезни кашель не беспокоит больного; если в дальнейшем он становится приступообразным, это указывает на развитие нарушения проходимости дыхательных путей. Кашель приобретает оттенок лающего и носит судорожный характер при выраженном спазме трахеи и крупных бронхов. При гнойном и слизисто-гнойном бронхите больных больше беспокоит выделение мокроты, однако иногда они не замечают, что она выделяется при кашле. В случае обострения болезни мокрота приобретает гнойный характер, количество ее может увеличиваться (преобладание воспалительного синдрома); иногда мокрота выделяется с трудом (возникновение бронхиального спазма при обострении). При обструктивном варианте бронхита (любой его форме) кашель малопродуктивный и надсадный, сопровождается одышкой, мокрота (даже гнойная) выделяется в небольшом количестве. Если бронхит начинается с поражения мелких бронхов, то кашля может не быть, а единственным симптомом заболевания является одышка. Одышка возникает у всех больных хроническим бронхитом в различные сроки от начала болезни. Появление у длительно кашляющих больных одышки первоначально свидетельствует о присоединении нарушения проходимости бронхов. С увеличением продолжительности болезни одышка становится более выраженной и постоянной, свидетельствуя о развитии дыхательной (легочной) недостаточности. Иногда только появление одышки заставляет больных впервые обратиться к врачу. В типичных случаях хронический бронхит при необструктивном варианте прогрессирует медленно, одышка появляется обычно через 20–30 лет от начала болезни. Такие больные начало болезни почти никогда не фиксируют (утренний кашель с мокротой связывают с курением и не считают проявлением болезни). Они считают началом болезни период, когда появляются осложнения или частые обострения. В прошлом можно выявить повышенную чувствительность к охлаждению, а у подавляющего числа больных — указание на длительное курение. У ряда больных заболевание связано с профессиональными вредностями на производстве. При анализе развития кашля необходимо убедиться в отсутствии у больного другой патологии бронхолегочного аппарата (туберкулез, опухоль, бронхоэктазы, пневмокониозы, системные заболевания соединительной ткани), сопровождающейся теми же симптомами. Это непременное условие для отнесения указанных жалоб к проявлениям хронического бронхита. У части больных в прошлом имеются указания на кровохарканье, что связано с легкой ранимостью слизистой оболочки бронхов. Повторяющееся кровохарканье является указанием на геморрагическую форму бронхита. Кроме того, кровохарканье при хроническом и длительно протекающем бронхите может быть первым симптомом рака легкого, развивающегося у мужчин, длительно и много куривших. Кровохарканьем могут проявляться и бронхоэктазы. В начальном периоде болезни какие-либо симптомы могут отсутствовать. В дальнейшем появляются изменения при выслушивании: жесткое дыхание (при развитии эмфиземы может стать ослабленным) и сухие хрипы рассеянного характера, тембр которых зависит от калибра пораженных бронхов. Свистящие хрипы, особенно хорошо слышимые на выдохе, характерны для поражения мелких бронхов. Если при обычном дыхании хрипы не выслушиваются, то следует проводить выслушивание в положении больного лежа и обязательно при усиленном дыхании. Изменения данных выслушивания будут минимальными при хроническом необструктивном бронхите вне обострения и наиболее выражены при обострении процесса, когда можно прослушать и влажные хрипы, характер которых также зависит от уровня поражения бронхиального дерева. Влажные хрипы при хроническом бронхите могут исчезать после откашливания и выделения мокроты. При обострении обструктивного бронхита одышка усиливается, нарастают явления дыхательной недостаточности. Гнойный вязкий секрет затрудняет проходимость бронхов. Обструктивный компонент может присоединяться к катаральной и слизисто-гнойной формам бронхита в период обострения или в процессе их развития. Нарушение проходимости бронхов значительно утяжеляет течение бронхита. При обследовании больного выявляются признаки нарушения закупорки дыхательных путей: удлинение выдоха при спокойном и особенно при усиленном дыхании; свистящие хрипы на выдохе, которые хорошо слышны при усиленном дыхании и в положении лежа; симптомы обструктивной эмфиземы легких.
Осложнения хронического бронхита Все осложнения можно разделить на две группы: непосредственно обусловленные инфекцией — пневмония, бронхоэктазы, бронхоспастический (неаллергический) и астматический (аллергический) компоненты; обусловленные развитием бронхита — кровохарканье, эмфизема легких, диффузный пневмосклероз, легочная недостаточность, легочное сердце (компенсированное и декомпенсированное с развитием правожелудочковой сердечной недостаточности). Тяжелейшим осложнением обструктивного бронхита является острая дыхательная недостаточность с быстро прогрессирующими нарушениями газообмена и развитием острых дыхательных нарушений и обмена веществ.
Диагностика и дифдиагностика Дифференциальный диагноз острого бронхита следует проводить сбронхопневмонией (см.), остро начинающимся туберкулезом легких (см.), брюшным тифом (см.) и коклюшем (см.). Хронический бронхит приходится дифференцировать с затяжной пневмонией (см.), бронхиальной астмой и раком легкого (см.).
Лечение Острый бронхит Постельный режим, обильное теплое питье с медом, малиной, липовым цветом; подогретая щелочная минеральная вода; ацетилсалициловая кислота по 0,5 г 3 раза в день, аскорбиновая кислота до 1 г в день, витамин А по 3 мг 3 раза в день; горчичники, банки на грудную клетку. При выраженном сухом кашле назначают кодеин (0,015 г) с гидрокарбонатом натрия (0,3 г) 2–3 раза в день. Препаратом выбора может быть либексин по 2 таблетки 3–4 раза в день. Из отхаркивающих средств эффективны настой термопсиса (0,8 г на 200 мл по 1 ст. л. 6–8 раз в день), 3 %-ный раствор йодида калия (по 1 ст. л. 6 раз в день), бромгексин по 8 мг 3–4 раза в день в течение 7 дней и др. Показаны ингаляции отхаркивающих средств, муколитиков, подогретой минеральной щелочной воды, 2 %-ного раствора гидрокарбоната натрия, эвкалиптового, анисового масла с помощью парового или карманного ингалятора. Ингаляции проводят по 5 мин 3–4 раза в день в течение 3–5 дней. Бронхоспазм прекращают назначением эуфиллина (0,15 г 3 раза в день). Показаны антигистаминные препараты. При неэффективности симптоматической терапии в течение 2–3 дней, а также среднетяжелом и тяжелом течении болезни назначают антибиотики и сульфаниламиды в тех же дозах, что и при пневмониях.
Хронический бронхит Цель лечения — снижение темпов прогрессирования распространенного повреждения бронхов, ведущего к нарастающей дыхательной недостаточности, снижение частоты обострений, сокращение периода выздоровления, повышение устойчивости к физической нагрузке, улучшение качества жизни. Основным направлением лечения и профилактики прогрессирования хронического бронхита является устранение воздействия вредных примесей во вдыхаемом воздухе (запрещение курения, устранение воздействия пассивного курения, рациональное трудоустройство). Само же лечение хронического бронхита должно быть дифференцированным и зависеть от формы болезни и наличия тех или иных осложнений. Лечение хронического бронхита состоит из комплекса мероприятий, несколько различающихся в периодах обострения и ремиссии болезни. Выделяется два основных направления лечения в период обострения: этиотропное (направленное на устранение причин заболевания) и патогенетическое (направленное на прекращение развития заболевания). Этиотропное лечение проводится с целью ликвидации воспалительного процесса в бронхах и включает терапию антибиотиками, антисептиками, фитонцидами. Антибиотики назначают с учетом чувствительности бактерий, выделенных из мокроты или бронхиального содержимого. Если чувствительность определить невозможно, то следует начинать лечение с антибиотиков пенициллинового ряда (пенициллин, ампициллин). В случае их непереносимости вводят антибиотики группы цефалоспоринов (цефамезин, цепорин). В последние годы назначают макролиды новых генераций (сумамед, рулид), обладающие особой эффективностью. К ним чувствительны основные возбудители обострений катарального или гнойного бронхита (палочка инфлюэнцы, пневмококки, марокселла). Эти препараты применяют внутрь. При отсутствии эффекта назначают антибиотики группы резерва (гентамицин). Наиболее предпочтительный способ введения — интратрахеальный (заливка гортанным шприцом или через бронхоскоп). При выраженной активности воспалительного процесса в бронхах и гнойном его характере местное (интратрахеальное) введение антибиотиков должно сочетаться с внутривенным. При простом (катаральном) хроническом бронхите основным, а в большинстве случаев и единственным методом лечения является использование отхаркивающих препаратов, направленных на нормализацию слизеотделения и профилактику присоединения гнойного воспаления. Патогенетическое лечение направлено на улучшение легочной вентиляции; восстановление бронхиальной проходимости; борьбу с повышенным внутрилегочным давлением и правожелудочковой недостаточностью. Улучшению (восстановлению) нарушенной легочной вентиляции, помимо ликвидации воспалительного процесса в бронхах, способствуют кислородотерапия и занятия лечебной физкультурой. Основное в терапии хронического бронхита — восстановление проходимости бронхов, что достигается путем улучшения их дренажа и ликвидации бронхоспазма. Для улучшения бронхиального дренажа назначают отхаркивающие (горячее щелочное питье, отвары трав, мукалтин) и разжижающие препараты — ацетилцистеин, бромгексин, амбраксол (лазолван, ласольван). Недопустимо практиковавшееся ранее применение в качестве разжижающих средств протеолитических ферментов. С успехом используется лечебная бронхоскопия. Перспективно применение низкочастотной ультразвуковой бронхоскопической обработки. С целью ликвидации бронхоспазма применяют бронхорасширяющие препараты. Бронхорасширяющая терапия является основной (базисной) в лечении больных хроническим обструктивным бронхитом. Используют антихолинергические препараты (атровент, тровентол), комбинацию атровента и фенотерола (беродуал) и метилксантины (эуфиллин и его производные). Наиболее предпочтителен и безопасен ингаляционный путь введения лекарственных средств. Эффективны также препараты продленного эуфиллина (теопэк, теодур, теобиолонг), которые назначают внутрь всего 2 раза в сутки. При отсутствии эффекта от такой терапии вводят небольшие дозы кортикостероидов внутрь (10–15 мг преднизолона в сутки) или интратрахеально (суспензия гидрокортизона — 50 мг), назначают ингаляции ингакорта по 500 мкг 2 раза в сутки. Для борьбы с повышением внутрилегочного давления используют длительные (несколько часов) ингаляции кислорода, по показаниям — блокаторы кальциевых каналов: верапамил (финоптин, кордафен) и продленные нитраты (нитросорбид, нитронг). Лечение правожелудочковой недостаточности проводят по общим принципам лечения сердечной недостаточности (сердечные гликозиды, мочегонные средства и пр.). В качестве дополнительной терапии назначают лекарственные средства, подавляющие кашлевой рефлекс: при малопродуктивном кашле — либексин, тусупрекс, бромгексин, при надсадном кашле — кодеин, дионин, стоптуссин; лекарственные средства, повышающие сопротивляемость организма: витамины А, С, группы В, биогенные стимуляторы. В настоящее время при лечении хронического бронхита (особенно затяжных обострений, часто рецидивирующих и гнойных форм) все шире применяют препараты, влияющие на иммунную систему: Т-активин или тималин (по 11 мг подкожно в течение 3 дней); внутрь с успехом применяют бактериальные иммунокорректоры: рибомунил, бронхомунал, бронховаксон. Назначают физиотерапевтическое лечение: диатермию, электрофорез хлорида кальция, кварц на область грудной клетки, массаж грудной клетки и занятия дыхательной гимнастикой. Вне периода обострения при бронхите легкого течения ликвидируют очаги инфекции (удаляют аденоиды); начинают проводить закаливание организма. Занятия ЛФК (дыхательная гимнастика) проводятся постоянно. При бронхите средней тяжести и тяжелом наряду с противорецидивным и санаторно-курортным лечением многие больные вынуждены постоянно получать поддерживающее медикаментозное лечение. В среднетяжелых случаях хронического бронхита обязательны постоянные занятия дыхательной гимнастикой. Поддерживающая терапия направлена на улучшение проходимости бронхов, снижение внутрилегочного давления и борьбу с правожелудочковой недостаточностью. Назначают те же препараты, что и в период обострения, только в меньших дозах и курсами.
Профилактика Устранение возможного фактора возникновения бронхита (запыленность и загазованность рабочих помещений, переохлаждение, курение, злоупотребление алкоголем, хроническая и очаговая инфекция в дыхательных путях и др.), а также меры, направленные на повышение сопротивляемости организма к инфекции.
БРОНХОЭКТАТИЧЕСКАЯ БОЛЕЗНЬ
ОпределениеБронхоэктатическая болезнь — приобретенное (в ряде случаев — врожденное) заболевание, характеризующееся хроническим нагноительным процессом в необратимо измененных (расширенных, деформированных) и функционально неполноценных бронхах, преимущественно нижних отделов легких. Основой этого патологического процесса являются первичные бронхоэктазы (мешотчатые расширения бронхов), которые и обусловливают возникновение характерного симптомокомплекса.Так называемые первичные бронхоэктазы, по существу, первичными не являются и обычно развиваются как следствие перенесенных в детском возрасте инфекций бронхолегочной системы, преимущественно вызванных вирусами. Вместе с тем при первичных бронхоэктазах имеются признаки, позволяющие выделить бронхоэктатическую болезнь как самостоятельное заболевание, так как существенного вовлечения в процесс развития нарушения легочной ткани при них не отмечается, а обострения бронхоэктатической болезни протекают преимущественно по типу обострения гнойного бронхита без поражения ткани легких. Выделяют также вторичные бронхоэктазы, возникающие как осложнение или проявление другого заболевания (чаще всего — хронической пневмонии); их не относят к бронхоэктатической болезни. Самостоятельность бронхоэктатической болезни как отдельной формы до последних лет оспаривается.
Этиология Причины развития бронхоэктазов до настоящего времени нельзя считать достаточно выясненными. Вероятно, решающую роль в их возникновении играет сочетанное воздействие возбудителя и врожденной неполноценности бронхов. Микроорганизмы, вызывающие острые воспалительные процессы в дыхательных путях (пневмония, корь, коклюш) у детей, могут считаться лишь условно провоцирующим фактором, так как у подавляющего большинства больных эти процессы полностью подавляются. Инфекционные возбудители, вызывающие нагноительный процесс в уже измененных бронхах (пневмококк, стафилококк, гемофильная палочка), могут рассматриваться как причина обострений бронхоэктазов. Существенную роль в формировании бронхоэктазов играет наследственно обусловленная неполноценность бронхиального дерева, приводящая к нарушению механических свойств стенок бронхов при их инфицировании, особенно в раннем детском возрасте. Имеется связь между развитием бронхоэктазов и заболеваниями верхних дыхательных путей: возможно, в основе их развития имеет значение недостаточность одних и тех же защитных механизмов дыхательного тракта; происходит постоянное взаимное инфицирование верхних и нижних дыхательных путей.
Патогенез Важная роль в развитии бронхоэктатической болезни отводится бронхоэктазам и их нагноению. К развитию бронхоэктазов приводит возникающее при нарушении проходимости бронхов слипание воздушной ткани легкого (ателектаз). Развитию такого слипания может способствовать снижение активности вещества, препятствующего слипанию легочной ткани — сурфактанта (врожденное или приобретенное, обусловленное местными воспалительными процессами). У детей причинами нарушения проходимости крупных бронхов могут быть сдавление податливых, а возможно, и врожденно неполноценных бронхов переразвитыми прикорневыми лимфатическими узлами и длительная закупорка бронхов плотной слизистой пробкой при острых респираторных инфекциях. Снижение устойчивости стенок бронхов к действию так называемых бронхорасширяющих сил (повышение внутрибронхиального давления при кашле, растяжение бронхов скапливающимся секретом) способствует стойкому расширению просвета бронхов. Расширение бронхов и задержка бронхиального секрета приводят к развитию воспаления. В дальнейшем при прогрессировании последнего происходят необратимые изменения в стенках бронхов (перестройка слизистой оболочки с полной или частичной гибелью выстилающей ткани и нарушением очистительной функции бронхов; дегенерация хрящевых пластинок и гладкой мышечной ткани с заменой ее соединительной тканью, что сопровождается снижением ее устойчивости и способности выполнять основные функции), в результате чего и развиваются бронхоэктазы. Бронхоэктазия приводит к нарушению механизма откашливания, застою и инфицированию секрета в расширенных бронхах. Развивается хронически текущий, периодически обостряющийся нагноительный процесс, что является вторым важнейшим фактором развития бронхоэктатической болезни. Нагноение сформировавшихся бронхоэктазов представляет собой самую суть бронхоэктатической болезни. Измененный секрет скапливается обычно в нижних отделах бронхиального дерева (из верхних отделов он стекает свободно под действием силы тяжести). Этим объясняется преимущественно нижнедолевая локализация процесса. В зависимости от характера расширения бронхов выделяют цилиндрические, мешотчатые, веретенообразные и смешанные бронхоэктазы. По распространенности процесса целесообразно различать одно- и двусторонние бронхоэктазы (с указанием точного их расположения по сегментам).
Клиническая картина Обращает на себя внимание своеобразие жалоб и степень их выраженности — появление кашля с мокротой после перенесенных в детстве пневмонии, кори, коклюша или тяжелой формы гриппа. Количество выделяемой мокроты велико (за сутки — 200–300 мл), она отходит полным ртом, иногда приобретает гнилостный характер, часто наблюдается кровохарканье. Больных беспокоят выраженное похудение, отсутствие аппетита, значительно выражены симптомы интоксикации. Клинические симптомы отчетливо выражены: снижение массы тела, изменение ногтей (они приобретают вид часовых стекол) и пальцев в виде барабанных палочек. Практически всегда (и вне обострения) при выслушивании легких выявляются очаги стойко удерживающихся влажных и звонких мелкопузырчатых хрипов. Часто встречаются осложнения бронхоэктатической болезни: кровохарканье, амилоидоз почек (реже — селезенки и печени), астматический компонент, очаговая пневмония, абсцесс легкого, плеврит (эмпиема плевры), вторичный хронический бронхит. Последний является самым частым и обычно прогрессирующим осложнением, ведущим к дыхательной и легочно-сердечной недостаточности, нередко оказывающейся непосредственной причиной смерти больных. Причиной смерти может быть легочное кровотечение или хроническая почечная недостаточность как следствие вторичного амилоидоза почек.
Диагностика и дифдиагностика Дифференциальный диагноз бронхоэктатической болезни обычно приходится проводить с хроническим бронхитом (см.), абсцессом легкого (см.), туберкулезом (см.) и раком легкого (см.). Помимо рентгенологического, бактериологического и цитологического исследования мокроты, наибольшее значение в диагностике заболевания придается бронхографическому исследованию и компьютерной томографии, выявляющим характерные поражения бронхов.
Лечение и профилактика Возможно медикаментозное и оперативное лечение. Медикаментозное лечение показано больным с незначительными или клинически мало проявляющимися изменениями в бронхах; с распространенным и недостаточно четко локализованным процессом (когда невозможно оперативное лечение); при подготовке к бронхографии и радикальной операции. Главным звеном медикаментозного лечения является обработка бронхиального дерева: воздействие на гноеродных микробов (введение антимикробных средств через носовой катетер или бронхоскоп); выведение гнойного бронхиального содержимого и мокроты (дыхательная гимнастика, массаж грудной клетки, бронхоскопический дренаж, применение разжижающих мокроту средств). Следует обрабатывать верхние дыхательные пути, проводить общеукрепляющие мероприятия, обеспечить полноценное питание.
Веретенообразные бронхоэктазы
Кистоподобные бронхоэктазы
Оперативное лечение лучше проводить в молодом возрасте. Лиц старше 45 лет оперируют реже, так как к этому периоду жизни у них уже имеются осложнения, препятствующие операции. Удаление доли легкого или отдельных сегментов проводится при односторонних бронхоэктазах. При двусторонних бронхоэктазах удаляют наиболее пораженную часть легкого (с одной стороны).
БРУКСИЗМ
ОпределениеБруксизм — периодически появляющиеся во сне приступообразные сокращения жевательных мышц, сопровождающиеся сжатием челюстей и скрежетом зубов. По некоторым данным, бруксизм наблюдается у 1–3 % людей. Заболевание может возникать как в младенчестве, так и в зрелом возрасте.
Этиология До настоящего времени не выявлены точные причины развития бруксизма. Существует распространенная немедицинская точка зрения, что бруксизм вызывается глистами, однако она не имеет доказательств. Бруксизм нередко отмечается у пациентов с дефектами строения лицевого скелета, нарушением прикуса и патологией суставов, соединяющих нижнюю челюсть с височной костью. Предполагается также связь бруксизма с двигательными либо неврологическими нарушениями, как орофасциальная дискинезия, нижнечелюстная дистония или тремор. Если бруксизм внезапно развивается у взрослого человека, следует провести обследование на предмет выявления эпилепсии.
Клиническая картина Достаточно специфична. Во время сна неожиданно раздается скрежет зубов, который может продолжаться в течение нескольких секунд или минут. Подобные приступы нередко повторяются много раз за ночь.
Диагностика Диагноз, как правило, ставится на основе анамнеза. Помимо непосредственного скрежета зубов, пациент может жаловаться на мышечные и суставные боли в области нижней челюсти. При осмотре можно не выявить каких-либо патологий, но при тяжелой форме заболевания нередко отмечается стирание дентина, кариес и воспаление периодонтальных тканей.Это связано с сильной травмой зубов во время спастических сокращений нижней челюсти. Диагноз можно подтвердить с помощью специального полисомнографического исследования, при котором регистрируется весьма специфическая картина спастического сокращения жевательных мышц. Кроме этого, полисомнография имеет важное значение для исключения эпилепсии как причинного фактора бруксизма.
Лечение Лечение заболевания до настоящего времени остается сложной проблемой. В большей степени оно зависит от времени развития, причин и характера течения заболевания. Бруксизм, развивающийся в младенчестве, не требует лечения и самостоятельно прекращается к 6–7 годам. Если бруксизм сохраняется у взрослого человека, то, во-первых, нужно, по возможности, ликвидировать все имеющиеся стоматологические проблемы или дефекты прикуса и, во-вторых, рассмотреть вопрос о целесообразности использования внутриротовых защитных аппликаторов из резины или мягкого пластика, которые фиксируются между зубами и предотвращают их травмирование. В качестве дополнительного лечения можно применять препараты магния, кальция и витамины группы В. Насыщение организма такими микроэлементами и витаминами может снизить судорожную активность жевательных мышц во сне. Если бруксизм внезапно появился у взрослого человека, то следует исключить ночную эпилепсию и заболевания головного мозга.
БРУЦЕЛЛЕЗ
ОпределениеБруцеллез — инфекционно-аллергическое заболевание, имеющее наклонность к хроническому течению. Характеризуется длительной лихорадкой, поражением опорно-двигательной, нервной, сердечно-сосудистой, урогенитальной и других систем организма.
Этиология В настоящее время известны шесть основных видов возбудителей бруцеллеза. Каждый из видов бруцелл подразделяется на биотипы с различно выраженной способностью к поражению организма. В клеточном отношении виды бруцелл не отличаются друг от друга. Они шаровидной формы, неподвижны, спор не образуют. Являются анаэробами, т. е. могут обходиться без воздуха. Бруцеллы неустойчивы к высокой температуре, при низких температурах могут сохраняться длительное время. Бруцеллез характеризуется высокой способностью к инвазии и внутриклеточному паразитированию.
Эпидемиология Источниками бруцеллезной инфекции людей являются мелкий и крупный рогатый скот, свиньи, а в некоторых местах северные олени. Заболевание бруцеллезом животных в период беременности в большинстве случаев влечет за собой аборт. В абортированном плоде возбудитель содержится в большом количестве. Кроме того, возбудитель передается с молоком зараженных животных в течение нескольких лет. В передаче инфекции от животных к человеку большое значение имеют мясо и сырые молочные продукты. Заражение человека бруцеллезом происходит с пищей или контактным путем, возможен и воздушный путь заражения. Микробы, взвешенные в пылевых частицах, попадают в организм человека и через слизистую оболочку глаз. Связь заболеваний бруцеллезом с больными животными и продуктами животноводства обусловливает выраженный профессиональный характер этой инфекции. Основной контингент больных — это работники животноводства и предприятий, обрабатывающих продукты от животных. Больной человек не является источником бруцеллезной инфекции для окружающих лиц, что подтверждается многими прямыми эпидемиологическими наблюдениями. Иммунитет при бруцеллезе развивается медленно, двухфазно. При инфицировании организм приобретает устойчивость к бруцеллам (инфекционная фаза иммунитета), благодаря чему освобождается от возбудителя, и иммунитет переходит во вторую фазу (стерильная фаза). Иммунитет при бруцеллезе ненапряженный и непродолжительный, в среднем — 6–9 месяцев. Иммунитет не является строго специфическим, что дает возможность вакцинировать людей ослабленными микробами, создавая иммунитет к более болезнетворным возбудителям.
Патогенез Бруцеллы проникают в организм через кожу или слизистые оболочки, захватываются иммунными клетками тканей, размножаются в них и током лимфы заносятся в регионарные лимфатические узлы, а из последних по лимфатическим и кровеносным сосудам распространяются по всему организму. Схема развития бруцеллеза включает пять фаз течения инфекции: лимфогенную, гематогенную, фазу полиочаговых локализаций, фазу экзоочаговых обсеменений и фазу метаморфоза. Степень проявления отдельных фаз и последовательность их развития зависят от индивидуальных особенностей организма, входных ворот инфекции, вида и дозы возбудителя, условий заражения.
Бруцеллезная гранулома, состоящая из эпителиоидных клеток. В центре — гигантская клетка
Поступление инфекции по лимфатическим путям в регионарные лимфатические узлы соответствует инкубационному периоду. Он длится от 2 до 4 недель. Дальнейшее развитие патологического процесса определяется инфицирующей дозой и состоянием защитных сил организма. Бруцеллы могут длительно сохраняться в лимфатических узлах, обусловливая иммунологическую перестройку организма без каких-либо клинических проявлений. При значительном накоплении возбудителя лимфатические узлы становятся очагами инфекции, откуда бруцеллы могут поступать в кровь и распространяться по всему организму. Из крови возбудитель захватывается иммунными клетками с формированием отдаленных очагов инфекции в печени, селезенке, костном мозге и других органах. С началом распространения инфекции и формированием ее отдаленных очагов происходит аллергическая перестройка организма, определяющая особенности развития заболевания. Бруцеллез относится к таким инфекционным заболеваниям, при которых у значительной части больных иммунная система не обеспечивает бактериологического очищения организма. Бруцеллы длительно сохраняются в метастатических очагах, откуда происходит повторное распространение возбудителя с переходом заболевания в хроническую форму.
Бруцеллезный продуктивно-деструктивный васкулит в головном мозге
Суперинфекция, нередко имеющая место в очагах распространения возбудителя, является дополнительным фактором, способствующим развитию обострений и хроническому течению болезни. Длительное воздействие продуктов жизнедеятельности возбудителя на органы и ткани обусловливает аллергический комплекс проявлений, характерный для подострого и хронического бруцеллеза. Наряду с симптомами, присущими острому бруцеллезу, возникают очаговые поражения различной локализации. Уменьшается процент высева бруцелл из крови, выявляются положительные аллергические пробы.
Клиническая картина Инкубационный период при бруцеллезе длится от 7 до 30 дней и более. Клиническая картина заболевания весьма разнообразна и может варьировать как по длительности течения, так и по разнообразию симптомов. Нередко в очагах болезни встречается скрытый бруцеллез, при котором в организме зараженных людей бруцеллы находятся в виде дремлющей инфекции, вызывая его аллергическую и иммунную перестройку. Однако при тщательном клиническом обследовании у части лиц обнаруживаются такие симптомы бруцеллеза, как увеличение лимфатических узлов, функциональные расстройства нервной системы, увеличение печени и селезенки. Серологические пробы и кожная проба Бюрне у этих лиц положительны. Клинически выраженные формы бруцеллеза проявляются длительной лихорадкой, ознобами, повышенной потливостью, увеличением печени и селезенки, поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, урогенитальной и других систем организма. Известно несколько клинических классификаций бруцеллеза, основанных на учете особенностей проявления этой инфекции. Согласно классификации Руднева различают острую, подострую, хроническую и резидуальную формы бруцеллеза. В данной классификации учитывается не только длительность течения, но и степень тяжести инфекции (легкая, средняя и тяжелая формы), а также ее фазы — компенсация, субкомпенсация и декомпенсация процесса.
Двусторонний гонит с контрактурой правого коленного сустава при бруцеллезе
Острая и подострая формы бруцеллеза Началу заболевания предшествует продромальный период длительностью 3–5 дней, в ходе которого наблюдаются недомогание, слабость, подавленность настроения, легкая головная боль, утомляемость, понижение аппетита. К концу продромального периода признаки интоксикации нарастают и наступает разгар заболевания с преобладанием четырех кардинальных симптомов: повышения температуры, озноба, проливного пота, увеличения печени и селезенки. Лихорадка длительная, в разгар заболевания температура скачкообразно изменяется. Несмотря на длительность и высоту лихорадки, состояние больных не нарушается; часто отмечаются словоохотливость и эйфория. При осмотре в первые дни болезни лицо больного багровое. В дальнейшем кожные покровы становятся бледными и влажными. Изредка на коже появляются высыпания в виде крапивницы, эритем или розеол. Отмечаются носовые кровотечения.
Бруцеллез кожи
Лимфатические узлы, особенно шейные и подмышечные, увеличены до размеров фасоли, безболезненны и не спаяны с окружающей тканью. Иногда в процесс вовлекаются межкишечные лимфатические узлы. В подкожной клетчатке и в области сухожилий и мышц образуются плотные болезненные узелки — фиброзиты и целлюлиты. При обследовании обнаруживаются умеренное расширение границ сердца, приглушенность тонов, систолический шум на верхушке. В тяжелых случаях могут развиться миокардит, эндокардит и перикардит. Артериальное и венозное давление понижено. Частота пульса соответствует температуре тела. У ряда больных отмечается нарушение пульса, иногда нарушения ритма по типу экстрасистолии. Повышается ломкость капилляров, их проницаемость увеличена. При острой форме болезни по мере развития септического процесса выявляются изменения органов дыхания: катар верхних дыхательных путей, бронхиты, бронхопневмонии, бронхоадениты. Печень и селезенка увеличены, мягкие и болезненные при прощупывании. В патологический процесс вовлекается система желчных путей, развиваются гипомоторная дискинезия, гипотония желчного пузыря и гипертонус сфинктера Одди. Возможно и поражение поджелудочной железы. Типичны головные боли, раздражительность, эмоциональная неустойчивость, чрезмерно быстрая утомляемость, нарушение сна. В тяжелых случаях отмечаются расстройства психики, явления менингизма и менингита. Течение менингита обычно вялое, без четко выраженных общемозговых и менингеальных симптомов. Спинномозговая жидкость серозная. Опорно-двигательная система при остром бруцеллезе поражается примерно у 14 % больных. Боли в суставах кратковременны, исчезают по мере уменьшения признаков интоксикации. В поздние сроки появляются аллергические изменения. При бруцеллезе определяются все виды аллергических реакций. В связи с этим бруцеллез может быть назван полиаллергическим заболеванием. На измененном фоне ответная реакция отдельных органов и систем сопровождается септическим состоянием в сочетании с реактивноаллергическими проявлениями. Несвоевременная диагностика и поздно начатое лечение при ослаблении реактивности организма приводят к затяжному течению болезни с переходом ее в подострую и хроническую формы. Даже после эффективно проведенной терапии у части больных при полном отсутствии клинических симптомов могут сохраняться бруцеллы. Они располагаются внутриклеточно — в костном мозге и ретикулоэндотелиальной системе. Длительное пребывание бруцелл, фиксирующихся в клетках, при наличии факторов, ослабляющих организм, приводит к вторичному распространению инфекции с развитием клинических симптомов рецидива заболевания. Рецидивы могут возникать через 1–2 месяца после выздоровления и в более поздние сроки. Обычно они протекают с ознобом, повышением температуры тела, усилением потоотделения. В первые же дни рецидива развивается очаговое поражение отдельных органов и систем. Чаще всего поражается опорно-двигательная система. Продолжительность рецидивов зависит от специфической аллергической перестройки органов и тканей. При определении продолжительности бруцеллезной инфекции следует учитывать возможность супер- и реинфекции, возникающей в очагах распространения возбудителя и значительно увеличивающей продолжительность заболевания. Больные при своевременном и правильно назначенном лечении выздоравливают спустя 1–2 года от начала заболевания. Однако нередко болезненный процесс принимает хроническое течение.
Хронический бруцеллез Хронический бруцеллез развивается чаще всего вследствие ранее перенесенных острой и подострой форм инфекции и ее рецидивов. Клинические симптомы хронического бруцеллеза проявляются на фоне предшествующей иммунологической и аллергической перестройки органов и тканей. Эта форма отличается разнообразием и нестойкостью клинических симптомов, рецидивирующим течением, слабой выраженностью интоксикации, преобладанием очагового поражения систем и органов. Наиболее часто при хронической форме бруцеллеза наблюдаются поражения опорнодвигательного аппарата в виде артритов, бурситов, тендовагинитов, периоститов, перихондритов. Характерны многочисленные поражения суставов, при которых в процесс разрушения вовлекаются крупные суставы. Поражение суставов проявляется краснотой, припухлостью, ограничением движений, обусловленным воспалением околосуставных тканей. Могут развиваться воспалительные изменения в суставах, сопровождающиеся накоплением выпота. При повторных поражениях суставов изменению подвергаются внутрисуставные поверхности, мениски и хрящи с сужением и заращением внутрисуставных щелей. Эти изменения приводят к артрозам, спондилоартрозам, анкилозу. Больные предъявляют жалобы на общую слабость, утомляемость, повышенную раздражительность, нарушение сна, что свидетельствует о функциональном расстройстве нервной системы, протекающем по типу неврастении. Поражение периферической нервной системы при хроническом бруцеллезе проявляется радикулитами, ишиорадикулитами, плекситами, межреберными и другими видами невралгий, расстройствами чувствительности, парезами, невритами слухового и зрительного нервов со значительным снижением слуха и зрения. Менингиты и менингоэнцефалиты при хронической форме бруцеллеза отличаются вялым течением и слабо выраженными клиническими симптомами. Хроническая интоксикация центральной нервной системы, особенно коры головного мозга, в случаях длительного течения инфекции приводит к глубоким неврозам, реактивным состояниям, ипохондрии, психозам. При вовлечении в инфекционный процесс периферической нервной системы нарушается тонус сосудов, возникают синюшность, неподвижность, обильное потоотделение, кожные поражения. Закономерно поражается сердечно-сосудистая система, в первую очередь кровеносные сосуды. Развиваются эндо-, пери- и панваскулиты, повышенная проницаемость капилляров, нередко отмечаются эндокардиты, миокардиты, панкардиты. Печень и селезенка увеличены, уплотнены, функции их нарушены. Известны случаи развития асцита на почве портальной гипертензии. Иногда наблюдается панкреатит. При висцеральной форме хронического бруцеллеза может поражаться урогенитальная система (отек мошонки, орхит, эпидидимит у мужчин; оофорит, сальпингит, эндометрит, нарушение менструального цикла и прерывание беременности у женщин). При хронических формах бруцеллеза выявляются функциональные нарушения щитовидной железы и надпочечников. Описаны тиреотоксикозы, гипотиреозы, гиперфункция и гипофункция надпочечников. Картина крови изменена. Хронический бруцеллез протекает с рецидивами и ремиссиями. Больные надолго утрачивают работоспособность и могут становиться инвалидами. У вакцинированных лиц заболевание протекает легче и менее продолжительно, с небольшой температурной реакцией и умеренными суставными болями.
Резидуальный бруцеллез У лиц, перенесших бруцеллез, нередко имеются те или иные остаточные явления, в основном функционального характера, обусловленные аллергической перестройкой организма и расстройствами вегетативной нервной системы. Отмечаются повышенная потливость, раздражительность, изменения со стороны нервно-психической сферы, боли в суставах, чаще непостоянного характера; при этом видимых изменений в суставах нет. Такие боли усиливаются при выполнении физической работы и в связи с переменой погоды. Температура тела обычно нормальная, реже слегка повышена. У перенесших бруцеллез могут быть органические изменения опорно-двигательного аппарата с деформацией суставов за счет разрастания околосуставной ткани, что обнаруживается при рентгенологическом и клиническом обследовании. Стойкие и необратимые изменения опорно-двигательной системы в ряде случаев требуют оперативного вмешательства.
Диагностика и дифдиагностика Чаще всего бруцеллез приходится дифференцировать с малярией (см.), ревматизмом (см.), эндокардитом (см.), сепсисом (см.), туберкулезом (см.), лейшманиозом (см.), брюшным тифом (см.) и туляремией (см.). Довольно часто у больных бруцеллезом на ранней или поздней стадии заболевания подозревают малярию. Неправильно ремиттирующая температура, гепатолиенальный синдром (увеличение печени и селезенки), потливость, лейкопения с нейтропенией (изменение количества клеток крови) составляют сходные черты этих заболеваний. Отличительными признаками являются следующие: озноб при малярии выражен более резко, потливость при ней связана с падением температуры, тогда как при бруцеллезе усиленное потоотделение у больных не зависит от колебаний температуры. Анемия, часто сопровождаемая желтушностью, свойственная малярии, при бруцеллезе встречается редко. Отрицательные результаты повторных исследований крови на паразитов малярии и отсутствие эффекта от лечения противомалярийными препаратами довершают исключение малярии, а болевые ощущения в опорно-двигательном аппарате, не характерные для малярии, требуют в таких случаях проверки подозрений постановкой серологической реакции и реакции Бюрне. При этом нужно помнить, что наблюдаются смешанные заболевания малярией и бруцеллезом.
Техника внутрикожного введения бруцеллина (мелитина) при постановке пробы Бюрне
Эндокардит и сепсис отличаются от бруцеллеза наличием выраженной анемии, лейкоцитоза и отрицательными реакциями Райта, Хеддльсона и Бюрне. Во время первых атак бруцеллез можно смешать с брюшным тифом. Брюшной тиф, протекающий с рецидивами, может давать волнообразную температурную кривую, весьма напоминающую таковую при бруцеллезе. Увеличение селезенки и наличие со стороны крови лейкопении довершают сходство. Дифференциально-диагностическими признаками являются болевые ощущения (суставы, мышцы, периферические нервы). Бруцеллезу обычно не свойственны тифозные состояния и та степень метеоризма, которой сопровождаются тифо-паратифозные заболевания. В некоторых случаях, особенно когда имеет место поражение легких или позвоночника (спондилит), бруцеллез может напоминать туберкулез. Не следует упускать из вида, что и параллельное течение обоих заболеваний не представляет редкости. О бруцеллезе говорят болевые ощущения в различных частях тела, увеличение селезенки и печени, отсутствие в мокроте палочек Коха, значительно большая доброкачественность самого течения процесса. Наличие поражений нервной системы вызывает необходимость проводить дифференциальную диагностику со множеством аналогичных поражений другой этиологии. Туберкулезный менингит (см.) можно исключить на основании исследования спинномозговой жидкости. Установленный диагноз нужно стремиться дополнить определением фазы заболевания и диагнозом поражений отдельных органов. Диагноз «бруцеллез» недостаточен: он не отображает направления процесса, является слишком общим. Требуется не только знать, что у больного бруцеллез, но и хорошо понимать, в какой форме и как у него развивается это заболевание, что имеет громадное значение и для прогноза, и для выбора того или иного метода лечения.
Лечение Главными задачами лечения бруцеллеза являются прекращение болезненного процесса, ликвидация его последствий и восстановление трудоспособности больного. Терапия бруцеллеза зависит от фазы болезни, степени компенсации патологического процесса и аллергической перестройки организма. Лечение острых и подострых форм бруцеллеза начинают с применения антибиотиков, которые оказывают антибактериальное действие, приводят к снижению температуры тела, уменьшению интоксикации и потоотделения. Наиболее эффективен при бруцеллезе левомицетин, который назначают по схеме: 0,5 г каждые 4 ч, т. е. 3 г в сутки в течение всего периода повышения температуры. Затем дозу снижают до 0,25 г 6 раз в сутки в течение 10 дней. Курс повторяют 2–3 раза с интервалом в 10–15 дней. По такой же схеме может быть назначен тетрациклин в дозе 3 г каждые 6 ч до снижения температуры тела. Эффективен тетрациклин в сочетании со стрептомицином. После прекращения острых проявлений заболевания проводят вакцинотерапию. При хроническом течении заболевания вакцинотерапия является основным методом лечения. Вакцинирование проводят различными способами, используя внутрикожное, подкожное, внутримышечное и внутривенное введение вакцины. Разработаны соответствующие схемы введения вакцины. Наиболее эффективно внутривенное введение, но оно должно проводиться осторожно из-за возможных осложнений вакцинотерапии. С целью симптоматического лечения назначают противовоспалительные средства: аспирин, бруфен, вольтарен, индометацин, анальгин, бутадион, реопирин. Длительность лечения противовоспалительными нестероидными средствами составляет примерно 4 недели, чаще всего назначают в течение 14 дней один препарат, а затем заменяют его. Кортикостероидные гормоны показаны при тяжелом течении подострого и хронического бруцеллеза с преимущественным поражением центральной и периферической нервной системы и в некоторых случаях тяжелых поражений опорно-двигательной системы.
Профилактика Для успешной профилактики бруцеллеза очень важны согласованные действия медицинских и ветеринарных работников. Необходимо взаимное осведомление ветеринаров и медицинских работников о выявленных случаях и очагах бруцеллеза. О всех случаях выявления больных бруцеллезом надлежит сообщать администрации пораженного хозяйства, районному отделу здравоохранения, областной бруцеллезной станции, областному ветеринарному управлению. Основные мероприятия по борьбе с бруцеллезом сводятся к следующему: планомерное оздоровление животноводческих хозяйств, пораженных бруцеллезом; систематическое обследование всех лиц, работающих в хозяйствах, подозрительных по заражению бруцеллезом; запрещение переброски скота из одного хозяйства в другое без выдерживания в карантине и повторного обследования; запрещение продажи животных, не обследованных на бруцеллез и больных бруцеллезом. Охрана труда персонала, ухаживающего за больными бруцеллезом животными, а также работников боен и других рабочих, соприкасающихся с животным сырьем. Эти лица должны быть обеспечены соответствующей спецодеждой, в их рабочем помещении должны быть дезинфицирующие растворы, мыло, рукомойники, полотенца. Установление тщательного контроля за изготовлением молочных продуктов, особенно брынзы. Молоко из хозяйств, пораженных бруцеллезом, до продажи или изготовления из него пищевых продуктов подлежит пастеризации. Санитарно-просветительная работа среди населения по вопросам борьбы с бруцеллезом. Очень важны ранняя диагностика и госпитализация больных бруцеллезом. В первую очередь должны быть госпитализированы больные с острым течением заболевания. В отделениях, где находятся больные бруцеллезом, необходимо проводить обычную текущую дезинфекцию. При хроническом течении, не сопровождающемся высокой температурой, больные могут подвергаться амбулаторному лечению при условии специального инструктажа их и соблюдения ими правил личной гигиены. Активная иммунизация живой сухой вакциной по эпидемиологическим показаниям. Вакцина вводится однократно под кожу в объеме 1 мл.
♦ В ♦
ВАГИНИЗМ
ОпределениеВагинизм — это судорожное сокращение мышц влагалища и тазового дна (главным образом — мышцы, сжимающей влагалище, и мышцы, поднимающей задний проход), препятствующее проведению полового акта.
Этиология Вагинизм нередко служит причиной виргогамии (девственного брака), длящейся иногда годами. В некоторых случаях вагинизм возникает как результат насилия, болезненной дефлорации, грубого поведения партнера при попытке дефлорации. Однако чаще вагинизм возникает при нерешительном поведении мужа и определенных чертах характера у жены (мнительность, обидчивость, тревожность, эмоциональная неустойчивость). Кроме того, в прошлом у большинства пациенток с детского возраста отмечались различные страхи (страх боли, темноты, воды, высоты и т. п.). Страх боли часто становится навязчивым и сочетается с эмоциональной напряженностью. У отдельных больных наряду с обычными для вагинизма жалобами отмечаются нарушения сна, дисморфофобии, периодические депрессии.
Клиническая картина У большинства пациенток отмечается нарушение психосексуального развития с более или менее выраженной трансформацией половой роли. Заключению брака при вагинизме часто предшествуют дружба «со школьной скамьи», затянувшиеся товарищеские отношения, а нередко и длительный петтинг. Часто жена характеризует своего мужа как «идеального»: любящего, заботливого, тактичного, мягкого, уступчивого, подчиняемого. Иногда с самого начала муж играет роль избалованного ребенка, желания и капризы которого исполняются беспрекословно. Длительное отсутствие дефлорации в браке при этом не только не ухудшает межличностных отношений, но даже ставит жену в привилегированное положение человека, требующего к себе повышенной чуткости, что способствует «бегству в болезнь». Вагинизм обычно возникает с началом половой жизни. Судорожному сокращению мышц предшествует страх боли при дефлорации, однако в отдельных случаях он возникает внезапно и неожиданно для пациентки в момент болезненной дефлорации. Мягкие и тактичные мужья не настаивают на коитусе. При последующих попытках все повторяется. В дальнейшем вагинизм проявляется и при гинекологическом исследовании. Можно выделить три степени выраженности вагинизма: I степень — реакция наступает при введении во влагалище полового члена или инструмента при гинекологическом исследовании; II степень — реакция наступает при прикосновении к половым органам или ожидании прикосновения к ним; III степень — реакция наступает при одном представлении полового акта или гинекологического исследования. Отсутствие дефлорации в браке тяжело переживается супругами, хотя во многих случаях не ухудшает межличностных отношений, а сексуальная адаптация пары происходит на уровне петтинга или (при возможности) вестибулярного коитуса. Женщины с вагинизмом при этом нередко могут испытывать оргазм, но обращаться к врачу их заставляет чувство неполноценности или желание иметь ребенка.
Диагностика и дифдиагностика Вагинизм следует дифференцировать с псевдовагинизмом, когда боль при попытке интроинъекции, судорожный спазм и оборонительная реакция женщины вторичны и обусловлены заболеваниями половых органов (дефекты развития, кольпиты, спаечный процесс и другие гинекологические заболевания, делающие коитус резко болезненным). Кроме того, вагинизм необходимо дифференцировать с коитофобией — боязнью боли при половом акте, препятствующей его осуществлению и не сопровождающейся судорожным сокращением мышц влагалища. Сходные с вагинизмом явления могут быть вызваны и неправильными действиями, обусловленными незнанием обоими партнерами анатомии половых органов. В этом случае достаточно однократной коррекции, чтобы восстановилась сексуальная функция.
Лечение и профилактика Лечение вагинизма требует от врача настойчивости и терпения. Недопустима примитивная «психотерапия» в виде упреков, насмешек и угроз. Основным методом лечения является рациональная и суггестивная психотерапия, а также специальная тренировка, направленная на устранение страха перед половым актом и связанного с этим непроизвольного сокращения мышц и сведения бедер. Для облегчения исследования и проведения сеансов тренировки больной предлагают напрягать мышцы брюшного пресса (тужиться), что ведет к расслаблению мышц таза. Во время сеансов больную убеждают в безболезненности введения во влагалище сначала одного пальца, потом — двух или расширителя Гегара; постепенно вводят все более толстые расширители. Эффективны также конические расширители и набор расширителей Свядоща. При этом с целью уменьшения чувства страха больной могут быть рекомендованы транквилизаторы (феназепам, тазепам). В отдельных случаях, при резко выраженном вагинизме и коитофобии и сохраненной девственной плеве, может быть показана хирургическая дефлорация. При наличии симптомов нарушений в психической деятельности применяют нейролептические средства (терален, френолон) и антидепрессанты (азафен, амитриптилин) в течение 2–3 недель, постепенно снижая дозу. Назначение обезболивающих средств (анестезин, новокаин) осуществляется в виде мазей или микроклизм. С мужем, если за период брака у него не развились сексуальные нарушения, обычно проводят одну психотерапевтическую беседу. Прогноз обычно благоприятный, однако он утяжеляется, если вагинизм сочетается с психическим заболеванием.
ВАГИНИТ
ОпределениеВагинит (кольпит) — воспаление слизистой оболочки влагалища с выделениями и ощущением дискомфорта. Возбудителями являются стрепто- и стафилококки, эшерихии, трихомонады, грибы (кандиды).
Этиология и патогенез Воспалительные заболевания женских половых органов инфекционного происхождения в гинекологической практике встречаются особенно часто. В огромном большинстве случаев возбудителями вагинитов являются следующие: стрептококк, стафилококк, гонококк, кишечная и туберкулезная палочки. Указанные микробы могут попасть в половые органы из воздуха, с белья, из кишечника вследствие близости заднего прохода; они заносятся при половом сношении и, наконец, случайно могут быть занесены при исследовании и различных манипуляциях на половых органах. Предрасполагающие факторы: общие заболевания, пониженная функция яичников, несоблюдение правил личной гигиены, процессы обратного развития в пожилом возрасте.
Клиническая картина и диагностика Различают острое, подострое и хроническое течение болезни. При остром воспалении предъявляются жалобы на ощущение тяжести во влагалище, жжение и зуд в области наружных половых органов, обильные серозногнойные бели. При исследовании с помощью влагалищных зеркал находят покраснение слизистой оболочки влагалища с точечными кровоизлияниями и обильные бели. В хронической стадии больные жалоб не предъявляют. Диагноз основывается на характерном течении болезни и жалобах больной, данных гинекологического исследования и бактериоскопии белей.
Лечение и профилактика Лечение зависит от причины вагинита. При остром воспалении производят орошения слизистой оболочки влагалища настоем ромашки или раствором молочной кислоты (2 ч. л. на 1 л воды), назначают влагалищные ванночки (2 %-ный раствор нитрата серебра, 3–5 %-ный раствор протаргола), влагалищные тампоны с синтомициновой эмульсией. При трихомонадном вагините применяют трихопол внутрь по 0,25 г 2 раза в день в течение 7—10 дней (обязательно одновременное лечение мужа). Противопоказания: беременность (ранние сроки), нарушения гемопоэза, поражения центральной нервной системы. Местно применяют октилин в виде 1 %-ного или 3 %-ного раствора или в виде вагинальных шариков. При кандидозном вагините (молочнице) обрабатывают влагалище 3 %-ным раствором натрия тетрабората (бура). Вагиниты, вызванные грибами типа Candida, лечат нистатином и леворином (свечи и глобулы, содержащие по 250 тыс. и 500 тыс. ЕД нистатина, или свечи, содержащие 250 тыс. ЕД леворина), а также назначают противогрибковый препарат клотримазол (2 таблетки вводят во влагалище на ночь, курс лечения — 2 недели). При старческом вагините показаны влагалищные спринцевания раствором молочной кислоты (1 ч. л. на стакан) с последующим введением тампонов с синтомициновой эмульсией или масляными растворами эстрогенов.
ВАРИКОЗНОЕ РАСШИРЕНИЕ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ
ОпределениеВарикозное расширение вен нижних конечностей — это расширение поверхностных вен, сопровождающееся несостоятельностью клапанов и нарушением кровотока. Первичное варикозное расширение связано со слабостью или функциональными нарушениями венозной стенки.
Этиология Способствуют развитию заболевания беременность, ожирение, длительное пребывание в положении стоя, врожденная слабость соединительной ткани, ношение чулок с тугими резинками. Вторичное варикозное расширение возникает в результате нарушения венозного оттока, например при посттромбофлебитическом синдроме, несостоятельности клапанов глубоких вен, опухолях и травмах.
Патогенез Ток венозной крови к сердцу обеспечивается сокращением мышц голени и бедра (мышечная помпа) и пульсацией артерий. При сокращении мышц голени и бедра происходит сдавление глубоких вен конечности, и кровь из них поступает в проксимальные (удаленные от туловища) отделы конечностей и вены таза. Функционирующие клапаны коммуникантных вен не позволяют крови проникать в поверхностную венозную систему. При расслаблении мышц при условии состоятельности клапанов глубоких вен возврата крови из вен таза не происходит, в глубокие вены поступает кровь из поверхностной системы через вены и из системы мышц голени. При варикозном расширении повышение давления в венах приводит к недостаточности клапанов коммуникантных вен. В результате этого при мышечных сокращениях кровь под большим давлением поступает из глубокой системы в поверхностную. Возникает местная венозная гипертензия, более выраженная в нижней трети голени, где коммуникантные вены наиболее мощные. Повышение давления в поверхностных венах приводит к их расширению. В то же время повышение давления в венозном отделе микроциркуляции приводит к появлению отеков и выходу эритроцитов из сосудов (при длительном повышении давления возникает пигментация кожи), а также открытию артериовенозных сбросов. Это вызывает значительное снижение кровотока в капиллярах, кислородную недостаточность тканей и возникновение язв.
Клиническая картина Основной симптом в начале заболевания — варикозное расширение вен; при компенсации венозного кровообращения других жалоб может и не быть. По мере прогрессирования заболевания появляются утомляемость, чувство тяжести в ногах, распирание, судороги в икроножных мышцах, особенно к вечеру, а иногда и по ночам. Отмечается нарушение кожной чувствительности. Отеки обычно возникают к вечеру, особенно после длительного стояния; после ночного отдыха отеки полностью исчезают. Со временем наряду с прогрессированием варикозного расширения вен появляются нарушения питания кожного покрова, чаще локализованные на внутренней поверхности нижней трети голени: пигментация, воспаление кожи; затем развивается трофическая язва, плохо поддающаяся лечению.
Диагностика и дифдиагностика Диагноз ставят на основании жалоб, характерного течения заболевания, осмотра конечности и проведения функциональных проб. Цель функционального исследования — исключить вторичный варикоз, выявить несостоятельность клапанного аппарата большой подкожной вены, определить функциональное состояние коммуникантных вен, определить проходимость глубокой венозной системы. О состоянии клапанного аппарата поверхностной системы можно судить по пробам Троянова-Тренделенбурга и Гаккенбруха. Симптом Троянова-Тренделенбурга: больной, находящийся в горизонтальном положении, поднимает больную ногу. После запустевания поверхностной венозной системы хирург передавливает большую подкожную вену у места впадения ее в глубокую. Больной встает. Если венозный клапан не функционирует, после отпускания руки отмечается выраженная обратная волна крови. Симптом Гаккенбруха: в вертикальном положении больного хирург кладет руку на варикозные узлы и просит больного покашлять — при несостоятельности клапанов рука ощущает толчок крови. Состояние коммуникантных вен и их клапанов оценивают с помощью пробы Пратта и трехжгутовой пробы Шейниса. Проба Пратта: больной лежит; после опорожнения поверхностных вен больному накладывают эластический бинт на голень и нижнюю треть бедра. Ниже пупартовой связки (на 5–6 см выше уже наложенного тура бинтов) накладывают тур второго эластического бинта. Больной встает. Отпуская тур первого бинта, сразу накладывают тур второго, расстояние между бинтами остается постоянным (5–6 см). На месте локализации коммуникантных вен с нефункционирующими клапанами после снятия слоя первого бинта сразу появляются варикозно расширенные вены. Трехжгутовая проба Шейниса производится почти аналогично, но с тремя жгутами, уровень наложения которых можно менять. После вставания больного зона нефункционирующих клапанов коммуникантных вен определяется по появлению варикозных узлов. Локализацию коммуникантных вен можно определить прощупыванием. Если клапаны не способны функционировать, коммуникантная вена расширена и растягивает поверхностную оболочку, в которой иногда удается обнаружить дефект. Проходимость глубоких вен определяют с помощью пробы Дельбе — Пертеса: больному в вертикальном положении накладывают на бедро жгут, после чего больной ходит на месте в течение 30 с. При проходимости глубоких вен отмечается спадение или уменьшение напряжения варикозных узлов. При клиническом и функциональном исследовании даже у опытных специалистов возможна ошибочная диагностика проходимости глубоких вен (почти 15 %). Поэтому при сомнениях в проходимости глубоких вен, особенно наличии нарушений питания тканей, показана флебография.
Осложнения Осложнения варикозного расширения вен: острый тромбофлебит, разрыв варикозного узла с кровотечением, хроническая венозная недостаточность с развитием трофических язв. Стадии варикозного расширения вен: I стадия — жалоб нет, только косметические нарушения; II стадия — чувство тяжести, распирания, судороги по ночам, нарушение кожной чувствительности; III стадия — отеки, чувство распирания, пигментация; IV стадия — образование язв.
Лечение и профилактика Консервативное лечение заключается в ношении эластических чулок или бинтов. Оно показано при варикозном расширении вен у беременных, поскольку после родов оно может исчезнуть или уменьшиться. Консервативное лечение проводят также при отказе больного от операции. По показаниям к нему можно добавить препараты, улучшающие микроциркуляцию (венорутон), повышающие прочность капилляров (витамин С), дезагреганты (препараты салициловой кислоты), мочегонные средства. Склеротерапия в качестве самостоятельного метода лечения применяется редко, так как часто дает рецидив заболевания. Проведение склеротерапии показано для блокады боковых ветвей подкожной вены, а также при сетчатых формах варикоза. Осложнения склеротерапии: тромбофлебит глубоких вен конечности, омертвение кожи и подкожной клетчатки после околовенозного введения препарата. Оперативное лечение заключается в перевязке большой подкожной вены у места впадения ее в глубокую (операция Троянова-Тренделенбурга), иссечении варикозно расширенных вен и перевязке нефункционирующих коммуникантных вен. После операции в течение 4–6 недель производят бинтование конечности эластичным бинтом. При частичном варикозном расширении вен допустимо частичное удаление вен. Прогноз благоприятный.
ВАРИКОЗНОЕ РАСШИРЕНИЕ ВЕН СЕМЕННОГО КАНАТИКА
ОпределениеВарикозное расширение вен семенного канатика — это расширение вен семенного канатика, приводящее к нарушению кровообращения.
Этиология и патогенез Заболевание встречается у мужчин в возрасте 20–30 лет, как правило, слева. Слева яичковая вена впадает в почечную под прямым углом (справа она впадает в нижнюю полую вену). Имеет значение и более низкое расположение левого яичка. Вторичное (симптоматическое) варикоцеле может быть следствием сужения почечной вены опухолью почки. Двустороннее поражение обусловлено первичной нефункциональностью клапанов яичковой вены и (или) наличием несоединения артерии с веной.
Варикоз вен семенного канатика
Клиническая картина и диагностика Чувство тяжести, боль в яичке, мошонке и по ходу семенного канатика, усиливающаяся при физической нагрузке и длительном стоянии. При прощупывании мошонки определяются извитые вены семенного канатика («клубок червей»), иногда отмечается небольшое гидроцеле на стороне поражения. Течение заболевания постепенно прогрессирующее. С нормализацией половой жизни отмечается обратное развитие симптомов. Появление варикоцеле в пожилом возрасте более характерно вкачестве осложнения какого-либо другого заболевания. Стадии заболевания: I стадия — каких-либо ощущений нет, расширенные вены локализованы в пределах семенного канатика; II стадия — вены расширены до нижнего полюса яичка, тяжесть и боль в области яичка, семенной канатик утолщен; III стадия — расширенные вены на дне мошонки ниже яичка, которое может быть уменьшено в размерах, а функции его нарушены; боль в яичке, промежности, поясничной области и крестце. Диагноз варикоцеле основывается на жалобах больного, развитии типичных клинических проявлений и данных опроса.
Лечение При выраженном болевом синдроме показано оперативное лечение. При этом осуществляется внебрюшинное выделение разреза параллельно паховому каналу и перевязывание яичковой вены (операция Иванисевича). В качестве консервативных мероприятий показано ношение суспензория, тугих трусов или плавок, рекомендуется нормализация половой жизни. Прогноз благоприятный.
ВАСКУЛИТ ГЕМОРРАГИЧЕСКИЙ
ОпределениеВаскулит геморрагический (анафилактическая пурпура, капилляротоксикоз, болезнь Шенлейцна-Геноха) — иммуноаллергическое заболевание, в основе которого лежит множественный микроваскулит с преимущественным поражением сосудов кожи, брыжейки, слизистой оболочки кишечника, почек. Заболевание проявляется развитием геморрагии на фоне гиперкоагуляции.
Этиология Факторы возникновения не вполне ясны. Причинное значение имеют острые и хронические инфекции, токсико-аллергические факторы (яйца, рыба, молоко, прививки, некоторые лекарства, гельминты). Заболевание возникает обычно у детей и подростков, реже у взрослых обоего пола после перенесенной инфекции — стрептококковой ангины или обострения тонзиллита (см.), фарингита (см.), а также после введения вакцин и сывороток, в связи с лекарственной непереносимостью, охлаждением и другими неблагоприятными воздействиями внешней среды.
Патогенез Это классическое заболевание с иммунокомплексным генезом. Механизм развития сложен. Придается значение образованию токсических масс, влияющих на стенки кровеносных сосудов и увеличивающих их проницаемость. Определенную роль отводят иммунным поражениям сосудистой стенки (обнаружение в коже и стенке сосудов иммуноглобулинов А, М, G, фибриногена) и иммунодефицитному состоянию (дефицит С2-комплемента), что приводит к повышению проницаемости сосудов, отеку и пурпуре различной локализации. Признаки кровоточивости: геморрагическая сыпь, кишечные кровотечения появляются в результате дезорганизации сосудистой стенки, некротических изменений в ней на фоне гиперкоагуляции при отсутствии коагулопатии потребления.
Клиническая картина Болезнь чаще начинается внезапно. Реже ей предшествует короткий продромальный период, во время которого могут наблюдаться познабливание, головная боль, недомогание, обычно после перенесенной инфекции (грипп, ангина). Важным симптомом являются поражения кожи в виде пузырьков с кровянистой жидкостью, иногда буллезной сыпи. Начальные кожные высыпания располагаются на разгибательных поверхностях конечностей, иногда на туловище, заканчиваются остаточной пигментацией, которая может оставаться длительное время. Чаще поражаются нижние конечности. Кожные высыпания могут быть единственным проявлением болезни. Кожные высыпания симметричны, локализуются в основном на ногах вокруг суставов, хотя могут быть и на туловище, ягодицах, лице (щеки, нос, уши), руках; характерно дистальное их расположение. Часто наблюдаются кожный зуд и нарушение кожной чувствительности. Нередко наряду с пурпурой у детей имеется отечность кистей, стоп, голеней по типу отека Квинке. Температура тела у большинства больных бывает слегка повышенной. Наличие гематурии свидетельствует о присоединении геморрагического нефрита. Частый симптом при пурпуре — боли в животе, возможны рвота с примесью крови и черный стул. Отмечаются боль в суставах и их припухлость. При лабораторных исследованиях отмечают нейтрофильный лейкоцитоз со сдвигом влево и эозинофилию; альбумино-глобулиновый показатель снижен тем сильнее, чем тяжелее заболевание, количество протромбина понижено, повышена проницаемость капилляров. Чаще болеют дети дошкольного возраста. Длительность заболевания — от 2–3 недель до нескольких лет. Различают острое (до 30–40 дней), подострое (в течение 2 месяцев и более), хроническое (клинические симптомы сохраняются до 1,5–5 лет и более) и рецидивирующее течение (рецидивы до 3–4 раз на протяжении 3–5 и более лет). Различают также три степени активности: I степень (минимальная), II степень, при которой симптомы выражены наиболее отчетливо, и III степень (обильная экссудативно-геморрагическая сыпь, нередко с пузырьковыми некротическими элементами; полиартрит; меняющие свою локализацию рецидивирующие ангионевротические отеки; тяжелый абдоминальный синдром с кровавой рвотой и кровавым стулом; поражение почек, сосудов печени, оболочек глаза, нервной и сердечно-сосудистой систем). Необходимо дифференцировать с болезнью Верльгофа и гемофилией. Заболевание нередко проявляется триадой симптомов: мелкоточечные красные, иногда сливающиеся геморрагические высыпания на коже (пурпура), преходящие артралгии (или артрит), преимущественно крупных суставов, и абдоминальный синдром. Мигрирующие симметричные полиартриты, обычно крупных суставов, наблюдаются более чем у 2/3 больных. Они сопровождаются болью различного характера — от кратковременной ломоты до острейшей боли, приводящей больных к обездвиженности. Артрит нередко совпадает по времени с появлением и локализацией пурпуры. Абдоминальный синдром (брюшная пурпура) характеризуется внезапно развивающейся кишечной коликой. Боль обычно локализуется вокруг пупка, но нередко регистрируется и в других отделах живота (в правой подвздошной области, правом подреберье, верхней части живота), симулируя аппендицит, холецистит, панкреатит. Боль усиливается при прощупывании. Одновременно у больных наблюдается типичная картина абдоминального синдрома — бледность кожных покровов, осунувшееся лицо, запавшие глаза, заостренные черты лица, сухой язык, признаки раздражения брюшины. Больные обычно лежат на боку, прижав ноги к животу, мечутся. Одновременно с коликой появляются кровавая рвота, жидкий стул, нередко с прожилками крови. Все разнообразие брюшной пурпуры можно уложить в следующие варианты: типичная колика; абдоминальный синдром, симулирующий аппендицит или прободение кишечника; абдоминальный синдром с инвагинацией. Этот перечень вариантов определяет тактику совместного наблюдения терапевтами и хирургами, необходимость своевременного оперативного вмешательства (прободение кишечника, инвагинация). Нередко в процесс развития заболевания вовлекаются почки в виде гломерулонефрита за счет поражения капилляров клубочков. Однако при исходе гломерулонефрита в хронический почечные нарушения могут быть разнообразными — от мочевого синдрома до распространенного гломерулонефрита гипертонического или смешанного типа. При общем благоприятном течении нефрита возможны исходы в хронический прогрессирующий нефрит с почечной недостаточностью. Другие клинические признаки (поражение центральной нервной системы, геморрагические пневмонии, миокардиты и серозиты) наблюдаются редко и распознаются при специальных исследованиях. Лабораторные данные малохарактерны: обычно наблюдается лейкоцитоз, наиболее выраженный при абдоминальном синдроме, со сдвигом формулы влево, СОЭ обычно повышена, особенно при абдоминальном синдроме и полиартритах. При остром течении заболевание начинается внезапно и протекает бурно с многочисленными симптомами, часто осложняясь нефритом. При хроническом течении большей частью речь идет о рецидивирующем кожно-суставном синдроме (ортостатическая пурпура пожилых).
Диагностика Диагноз при наличии характерной триады или только геморрагических высыпаний на коже затруднений не вызывает. Однако синдром геморрагического васкулита может наблюдаться при инфекционном эндокардите (см.), различных васкулитах, распространенных болезнях соединительной ткани и др. У пожилых лиц необходимо исключить макроглобулинемическую пурпуру Вальденстрема.
Лечение и профилактика Важно соблюдать постельный режим не только в остром периоде болезни, но и в течение 1–2 недель после исчезновения сыпи. В тех случаях, когда установлена связь с инфекцией, применяют антибиотики широкого спектра действия. С целью гипосенсибилизации назначают димедрол, супрастин и другие антигистаминные препараты. В качестве противовоспалительных препаратов назначают салицилаты, амидопирин, анальгин. Карболен используют как средство, всасывающее гистаминоподобные вещества в кишечнике. Для уменьшения проницаемости сосудистой стенки применяют 10 %-ный раствор хлорида кальция, витамин С, рутин. В тяжелых случаях при абдоминальном, почечном и церебральном синдромах хороший эффект дает гормонотерапия (преднизолон). При абдоминальном синдроме показано внутривенное введение больших доз метилпреднизолона (до 1 г в сутки в течение 3 дней). Прогноз в целом благоприятен, но становится серьезным при развитии абдоминального, почечного или церебрального синдрома. В тяжелых случаях назначают гепарин в дозе 100–200 ЕД/кг/сут. 2 раза подкожно в область живота до ликвидации признаков повышенной свертываемости крови. При хроническом течении могут быть рекомендованы аминохинолиновые препараты и большие дозы аскорбиновой кислоты (до 3 г в сутки). При очаговой инфекции показано удаление — консервативное или хирургическое. Некоторым больным с хроническим рецидивирующим течением кожной пурпуры или гломерулонефрита может быть рекомендовано сменить климат (юг Украины, Южный берег Крыма, Северный Кавказ).
ВАСКУЛИТ ГИГАНТОКЛЕТОЧНЫЙ
ОпределениеГигантоклеточный васкулит (височный артериит, гигантоклеточный артериит) — системное заболевание, характеризующееся гранулематозным воспалением средней оболочки сосудов, преимущественно бассейна сонных артерий (височных, черепных и др.); нередко сочетается с ревматическими симптомами.
Этиология и патогенез Предполагается, что заболевание имеет вирусное происхождение. Иммунное поражение артерий подтверждается обнаружением в стенке пораженных артерий фиксированных иммунных комплексов. Гранулематозный тип клеточных образований также характерен для поражения иммунной системы.
Клиническая картина Заболевают люди пожилого возраста, мужчины и женщины поражаются с одинаковой частотой. При наиболее частом височном артериите заболевание начинается остро, с высокой лихорадки, головных болей в зоне локализации патологии. Отмечается утолщение пораженной височной артерии, болезненность при прощупывании, в ряде случаев — покраснение кожных покровов. При поздней диагностике возможно поражение сосудов глаза с развитием частичной или полной слепоты. Общее состояние страдает с первых дней болезни. Наблюдаются повышенная утомляемость, отсутствие аппетита, похудение, нарушение сна, депрессия. При развитии ревматических симптомов появляется боль и скованность в мышцах плечевого и тазового пояса, в шее. Лабораторные данные свидетельствуют о высокой воспалительной активности: повышение СОЭ, увеличение количества нейтрофильных лейкоцитов. Течение прогрессирующее, однако рано начатое лечение может привести к полному выздоровлению.
Лечение Лечение проводят кортикостероидами (преднизолон по 40–60 мг в сутки) с постепенным медленным снижением и длительным приемом поддерживающих доз (10–50 мг в день); при уменьшении дозы преднизолона показаны аминохинолиновые производные (плаквенил по 0,2 г или хингамин по 0,25 г 1 раз в день в течение нескольких месяцев). При быстром нарастании глазных симптомов или тяжелых сосудистых проявлениях других локализаций показана пульс-терапия метилпреднизолоном внутривенно по 1 г в сутки в течение 2–3 дней с последующим переводом на прием препарата внутрь.
ВАСКУЛИТЫ КОЖИ
ОпределениеВаскулиты кожи (ангииты кожи) — это группа воспалительно-аллергических дерматозов, основным проявлением которых служит поражение кожных кровеносных сосудов разного калибра. Факторы, вызывающие заболевание, неизвестны.
Патогенез Механизм развития в большинстве случаев связан с иммунной системой (поражение сосудистых стенок иммунными комплексами с инфекционными, медикаментозными и другими антигенами). Основное значение придается очаговой (реже общей) хронической инфекции (стрептококки, стафилококки, туберкулезная палочка, дрожжевые и другие грибы), которая может локализоваться в любом органе (чаще в миндалинах, зубах). Определенное значение в развитии ангиитов имеют хронические интоксикации (алкоголизм, курение), эндокринопатии (сахарный диабет), обменные нарушения (ожирение), переохлаждение, общие и местные сосудистые заболевания: гипертоническая болезнь (см.), облитерирующий тромбангиит (см.), распространенные болезни соединительной ткани (см.). Отличительные общие признаки ангиитов кожи: воспалительно-аллергический характер высыпаний с наклонностью к отеку, кровоизлияниям и омертвению клеток; разнообразие высыпных элементов; симметричность высыпаний; преимущественная или первичная локализация на нижних конечностях; острое или периодически обостряющееся течение; частое наличие сопутствующих сосудистых или аллергических заболеваний других органов.
Клиническая картина В зависимости от калибра пораженных сосудов различают глубокие (гиподермальные) ангииты, при которых поражаются артерии и вены мышечного типа (узелковый периартериит, узловатый ангиит), и поверхностные (дермальные), обусловленные поражением артериол, венул и капилляров кожи (полиморфный дермальный ангиит, хроническая пигментная пурпура). Описано около 50 клинических форм ангиитов кожи.
Узелковый периартериит. Деструктивный васкулит
Узелковый периартериит (кожная форма). Наиболее характерны немногочисленные, величиной от горошины до грецкого ореха, узловатые высыпания, появляющиеся приступообразно по ходу сосудов нижних конечностей. Кожа над ними позднее может становиться синюшно-розовой. Высыпания болезненны, могут изъязвляться, существуют несколько недель или месяцев. Полиморфный дермальный ангиит (болезнь Гужеро-Рюитера) имеет несколько клинических типов: уртикарный (стойкие волдыри), геморрагический (идентичен геморрагическому васкулиту, проявляющемуся преимущественно геморрагической сыпью в виде точечных кровоизлияний, пурпуры, экхимозов, пузырей с последующим образованием эрозий или язв), папулонекротический (воспалительные узелки с центральным омертвением клеток, оставляющие вдавленные рубчики), пустулезно-язвенный (идентичен гангренозной пиодермии), некротически-язвенный (образование геморрагических некрозов с трансформацией в язвы), разнообразный (сочетание волдырей, узелков, пурпуры и других элементов). Хроническая пигментная пурпура (прогрессирующая пигментная пурпура Шамберга, гемосидероз кожи) проявляется повторными множественными точечными кровоизлияниями с исходом в буровато-коричневые пятна гемосидероза.
Диагностика и дифдиагностика Диагностика ангиитов кожи основана на характерных клинических проявлениях заболевания. В затруднительных случаях проводится клеточное исследование. Оно обычно бывает необходимым и при дифференциальном диагнозе с туберкулезными поражениями кожи (индуративная эритема и папулонекротический туберкулез). При этом учитывают молодой возраст больных кожным туберкулезом, зимние обострения процесса, положительные кожные пробы с разведенным туберкулином, наличие туберкулеза других органов.
Лечение и профилактика Проводится удаление очагов инфекции, коррекция эндокринно-обменных нарушений. Применяются антигистаминные препараты, витамины (С, Р, В12), препараты кальция, нестероидные противовоспалительные средства (индометацин, бутадион). При четкой связи с инфекцией — антибиотики. В тяжелых случаях — очищение крови от токсинов, плазмаферез, длительно — соответствующие дозы кортикостероидов с постепенной отменой. При хронических формах — хинолины (делагил по 1 таблетке в день несколько месяцев). Местно при пятнистых, узелковых и узловатых высыпаниях — плотные повязки с кортикостероидными мазями (флуцинар, фторокорт), линимент «Дибунол»; при некротических и язвенных поражениях — примочки с химопсином, мазь «Ируксол», мазь Вишневского, мазь «Солкосерил», 10 %-ная метилурациловая мазь. В тяжелых случаях необходимы постельный режим, госпитализация. Прогноз при изолированном поражении кожи для жизни благоприятный, для полного излечения — часто сомнительный. При удалении очаговой инфекции следует избегать длительной нагрузки на ноги, переохлаждения, ушибов ног. Необходимы щадящие условия труда.
ВАСКУЛИТЫ СИСТЕМНЫЕ
ОпределениеВаскулиты системные (СВ) — группа заболеваний, характеризующихся системным поражением сосудов с воспалительной реакцией сосудистой стенки. Различают первичные васкулиты, при которых системное поражение сосудов является самостоятельным заболеванием, и вторичные, которые развиваются на фоне какого-либо инфекционного, аллергического или другого заболевания. В ряде случаев вторичные системные васкулиты могут приобретать важнейшее значение в клинической картине болезни, например при ревматоидном артрите (см.), системной красной волчанке (см.), системной склеродермии (см.).Основные формы первичных системных васкулитов: геморрагический васкулит, гигантоклеточный височный артериит, гранулематоз Вегенера, облитерирующий тромбангиит, синдромы Гудпасчера, Такаясу, узелковый периартериит.
Этиология и патогенез Процесс развития заболевания характеризуется воспалением и повреждением кровеносных сосудов, сужением их просвета и ишемией. Клинические проявления ишемии зависят от величины и локализации сосуда. Может быть первичным и единственным проявлением заболевания или вторичным, т. е. проявлением другой болезни. Большинство синдромов васкулита обусловлены в целом или частично иммунными механизмами.
Клиническая картина Классический узелковый полиартериит: в процесс вовлечены мелкие и среднего размера мышечные артерии, особенно их окончания. В процесс также обычно вовлекаются почки, сердце, печень, желудочно-кишечный тракт, периферические нервы и кожа. Легкие, как правило, не затронуты. Аллергический ангиит и гранулематоз (болезнь Хурга-Штраусса): гранулематозный васкулит различных систем внутренних органов, особенно часто поражает легкие. Напоминает узелковый полиартериит, но отличается от него большей частотой вовлечения легких и сосудов различных размеров и типов; характеризуется увеличением в крови эозинофильных лейкоцитов и сочетанием с тяжелой бронхиальной астмой (см.). Синдром перекрестного полиангиита объединяет признаки узелкового полиартериита, аллергического ангиита и гранулематоза, проявляется мелкососудистым гиперчувствительным васкулитом. Аллергический васкулит — неоднородная группа нарушений. Для данного заболевания характерно вовлечение в процесс мелких сосудов. Обычно преобладают поражения кожи. Гранулематоз Вегенера — гранулематозный васкулит верхних и нижних дыхательных путей, сочетающийся с гломерулонефритом (см.). Заболевание характеризуется застоем в околоносовых пазухах и болью, гнойными или кровянистыми выделениями из носа. Изъязвление слизистой оболочки, перфорация носовой перегородки и разрушение хрящевой ткани ведут к тому, что нос приобретает седлообразную форму. Поражение легких может протекать бессимптомно или проявляться кашлем, кровохарканьем или одышкой. Кроме того, могут быть затронуты глазные яблоки. Поражение почек часто заканчивается смертельным исходом. Височный артериит — это воспаление средних и крупных артерий; обычно вовлечена височная артерия, но может развиться и системное поражение. Главные проявления: лихорадка, высокая СОЭ, анемия, мышечно-скелетные симптомы (ревматическая полимиалгия), внезапная слепота; для предотвращения глазных осложнений необходима терапия глюкокортикоидами. Артериит Такаясу (болезнь отсутствия пульса) — васкулит средних и крупных артерий с поражением дуги аорты и ее ветвей, наиболее типичен для молодых женщин. Проявляется воспалительными или ишемическими симптомами в области рук и шеи, характерны системные воспалительные проявления и аортальная регургитация.
Диагностика Диагноз ставится на основании характерного течения болезни, физикального обследования, специального изучения ишемических и системных воспалительных проявлений. Проводится также общий анализ крови, СОЭ, биохимическое исследование сыворотки крови, общий анализ мочи, ЭКГ, количественный анализ иммуноглобулинов в сыворотке крови; пробы на сифилис, определение антигена гепатита В; антител, иммунных комплексов, комплемента. Антинейтрофильные цитоплазматические аутоантитела могут быть обнаружены у больных гранулематозом Вегенера. Рентгенологическое исследование включает при необходимости ангиографию пораженных органов. Берется также образец ткани пораженного органа для его исследования.
Лечение Как только установлен диагноз, может возникнуть необходимость лечения глюкокортикоидами и (или) цитостатиками. Тактика лечения больного васкулитом I. Необходимо классифицировать синдром (специфичен ли он, т. е. гранулематоз Вегенера, темпоральный артериит и т. д.). II. Если синдром вызван каким-либо заболеванием или известным антигеном, лечат находящееся в основе заболевание или по возможности устраняют антиген. III. Определяют активность заболевания. IV. Назначают лечение соответствующими препаратами (например, глюкокортикоиды и циклофосфамид при гранулематозе Вегенера). V. По возможности избегают иммуносупрессивной терапии (глюкокортикоиды или цитостатики) при заболеваниях, редко вызывающих необратимое нарушение функций внутренних органов (например, при хроническом изолированном кожном васкулите). VI. Назначают глюкокортикоиды больным системным васкулитом. При отсутствии должной реакции организма или если выявлена гистологическая реакция только на цитостатики (как при гранулематозе Вегенера), последние добавляют (циклофосфамид). VII. Следует знать токсические и побочные эффекты применяемых препаратов. VIII. Необходимо постоянно пытаться перевести лечение глюкокортикоидами на периодический режим и прекратить их прием, когда представится такая возможность. При использовании цитостатиков уменьшают дозу и прекращают прием препарата настолько быстро, насколько это возможно, а также при выздоровлении. IX. Применяют альтернативные препараты в случаях, определяемых клинической ситуацией, при отсутствии реакции на медикаменты или возникновении нежелательных побочных эффектов. Монотерапия глюкокортикоидами может быть эффективна при височном артериите и артериите Такаясу. Некоторые синдромы с вовлечением в процесс мелких сосудов могут быть особенно невосприимчивы к лечению.
Эффективные препараты Преднизолон по 1 мг/кг в день с последующим снижением дозы. Циклофосфамид по 2 мг/кг в день, дозу регулируют так, чтобы избежать тяжелой лейкопении. Пульс-терапия циклофосфамидом (1 г/кг в месяц) может быть полезной у больных, не переносящих длительного приема препарата. Азатиоприн по 2 мг/кг в день, дозу регулируют так, чтобы избежать недопустимого снижения лейкоцитов в периферической крови. Этот препарат применяют тогда, когда побочные эффекты вынуждают прекратить прием циклофосфамида. Метотрексат до 25 мг в неделю больным гранулематозом Вегенера, которые не переносят циклофосфамид. Плазмаферез играет вспомогательную роль в лечении, когда проявления заболевания не устраняются перечисленными средствами.
ВЕСЕННИЙ КАТАР
ОпределениеВесенний катар (весенний конъюнктивит) — это хроническое воспаление внутренней поверхности век и глазного яблока, обостряющееся в весенне-летний период.Поражаются преимущественно лица мужского пола в возрасте 4—10 лет. Заболевание длится 6–8 лет до периода полового созревания. Часто встречается в регионах с жарким климатом.
Этиология Полагают, что в происхождении заболевания основную роль играют аллергические факторы, эндокринные расстройства и ультрафиолетовая радиация.
Клиническая картина Наблюдаются светобоязнь, слезотечение, зуд в глазах. Различают конъюнктивальную, роговичную и смешанную формы заболевания. При конъюнктивальной форме соединительная оболочка хряща верхнего века имеет молочный оттенок и покрыта крупными уплощенными бледно-розовыми сосочковыми разрастаниями, напоминающими булыжную мостовую. На поверхности переходной складки и нижнего века они очень редки. Роговичная форма заболевания характеризуется появлением серовато-бледных стекловидных утолщений области перехода роговицы глаза в непрозрачную оболочку глаза. Кнутри от утолщений изредка встречаются нежные помутнения роговицы. Отделяемое незначительное или отсутствует. Течение длительное, с периодическими обострениями, преимущественно весной и летом. Заболевание, как правило, возникает в юношеском возрасте и спустя много лет затихает.
Диагностика и дифдиагностика Диагностика конъюнктивитов сравнительно проста и общедоступна. Для того чтобы установить наличие признаков конъюнктивита, прежде всего необходимо знать, что конъюнктива в норме гладкая, блестящая, влажная, розовая и высокочувствительная. При отсутствии в ней воспаления не наблюдается светобоязни, слезотечения, спазма век, слизисто-гнойного или другого отделяемого. Следовательно, обычный общий осмотр области глаз, а затем и при раскрытой глазной щели поможет раньше выявить перечисленные признаки воспаления. При малейшем подозрении на конъюнктивит следует взять мазок с коньюнктивы и сделать посев для определения флоры и ее чувствительности.
Лечение Облегчение приносят введения в конъюнктивальный мешок слабого раствора уксусной кислоты (2–3 капли разведенной уксусной кислоты на 10 мл дистиллированной воды несколько раз в день), 0,25 %-ного раствора сульфата цинка с добавлением 10 капель раствора адреналина в разведении 1:1000, 0,25 %-го раствора дикаина (по 1–2 капли 3 раза в день). Эффективно местное применение слабых растворов кортикостероидов в виде глазных капель: 0,5–1—1,5–2,5 %-ного раствора гидрокортизона, 0,5 %-ного раствора преднизолона, 0,01—0,05—1 %-ного раствора дексаметазона 3–4 раза в день; гидрокортизоновой мази (без хлорамфеникола!) на ночь. Рекомендуется принимать внутрь 10 %-ный раствор хлорида кальция по 1 ст. л. 3 раза в день или глюконат кальция по 0,5 г 3 раза в день перед едой, рибофлавин по 0,02 г 2–3 раза в день, димедрол по 0,05 г 2 раза в день, фенкарол по 0,025 г 2–3 раза в день. С целью общетерапевтического воздействия назначают гистоглобулин подкожно 2 раза в неделю (детям — по 1 мл, 6 инъекций на курс; взрослым — по 2 мл, 8 инъекций). В некоторых случаях наблюдается улучшение от рентгенотерапии. Прижигающие средства противопоказаны. Целесообразно ношение светозащитных очков. Иногда приносит пользу перемена климата.
Профилактика Профилактика конъюнктивита прежде всего предполагает соблюдение гигиенических правил: чистота, свежий воздух и оптимальная температура в помещении, правильный режим дня, обработка посуды кварцевой лампой, чистота одежды и рук, срочная изоляция заболевшего и оказание ему первой медицинской помощи.
ВИРИЛЬНЫЙ СИНДРОМ
ОпределениеВирильный синдром — появление у женщин вторичных мужских половых признаков, обусловленное повышенным содержанием в организме женщины мужских половых гормонов.
Этиология Является следствием нарушения функции коры надпочечников, яичников, длительного лечения женщин большими дозами мужских половых гормонов.
Клиническая картина Рост волос на лице, конечностях, спине, груди, животе, выпадение волос на голове по мужскому типу, изменение тембра голоса (голос становится низким), развитие мужского типа телосложения, атрофия молочных желез, нарушение менструального цикла от недостаточного кровоотделения до полного его отсутствия, увеличение клитора и его вирилизация, уменьшение матки, истощение и утончение ее слизистой оболочки и слизистой оболочки влагалища. В крови повышается уровень тестостерона, увеличивается выделение с мочой тестостерона и 17-кетостероидов.
Диагностика Постановка диагноза не представляет особых сложностей. Диагноз ставится на основании характерных клинических проявлений, таких, как изменение внешности, голоса, нарушения менструального цикла, а также жалоб больной. Подтверждается диагноз результатом анализа крови на гормоны.
Лечение При опухоли яичников или коры надпочечников проводится хирургическое лечение. При нарушении гормонального баланса проводится соответствующая заместительная коррекция.
ВИТАМИННАЯ НЕДОСТАТОЧНОСТЬ
ОпределениеВитаминной недостаточности болезни (авитаминозы, гиповитаминозы) — это группа заболеваний, вызванных недостаточностью в организме одного или многих витаминов.Витамины — незаменимые биологически активные вещества, активирующие деятельность различных ферментных систем или входящие в состав многих ферментов. Витамины необходимы для нормального обмена веществ, роста и обновления тканей, биохимического обеспечения всех функций организма. Недостаточное поступление витаминов ведет к нарушению ферментативных реакций, гипо- и авитаминозу с соответствующей картиной заболевания. Значительный дефицит тех или иных витаминов в организме (авитаминоз) в настоящее время довольно редок. Значительно чаще встречается субнормальная обеспеченность витаминами, что не сопровождается яркой клинической картиной авитаминоза, но все же отрицательно сказывается на общем состоянии: ухудшается самочувствие, уменьшается сопротивляемость организма инфекционным заболеваниям, снижается работоспособность. Субнормальная обеспеченность витаминами, выявляемая специальными ферментными и радиоизотопными методами исследования, отражается на общем физическом развитии ребенка или подростка. Доказано, что сбалансированное питание не во всех случаях обеспечивает должное поступление витаминов в организм человека; нередко требуется периодическое дополнительное их введение в виде поливитаминных препаратов («Гексавит», «Ундевит» и др.).
Этиология и патогенез Различают гиповитаминозы первичные (внешние, обусловленные дефицитом поступления витаминов в организм с пищей) и вторичные (внутренние, связанные с нарушением всасывания витаминов в желудочнокишечном тракте или их усвоением, избыточной потребностью в витаминах при лечении некоторыми антибиотиками). Способствуют возникновению витаминной недостаточности чрезмерно низкая или высокая температура окружающей среды, длительное физическое или нервно-психическое напряжение, заболевание эндокринных желез, некоторые профессиональные вредности и другие факторы. Особое значение имеют ограниченность рациона питания (при недостаточном содержании витаминов в продуктах, например консервах), некоторые гельминтозы (см.) (потребление большого количества витаминов гельминтами), беременность и период кормления у женщин (повышенная потребность в витаминах у плода и грудного ребенка). Полигиповитаминозы часто наблюдались в различных странах в период социальных и стихийных бедствий (войны, неурожаи), при нерациональном (несбалансированном) питании как групп людей (во время длительных походов, путешествий и т. д.), так и отдельных лиц (питание консервами, сушеными продуктами, длительное однообразное питание). В некоторых развивающихся странах болезни витаминной недостаточности все еще встречаются очень часто. Многие заболевания желудочно-кишечного тракта, сопровождающиеся синдромами недостаточности пищеварения и недостаточности всасывания, ведут к витаминной недостаточности. Заболевания печени и нарушение проходимости внепеченочных желчных ходов (опухоль, закупорка камнем и др.), сопровождающихся прекращением поступления желчи в кишечник, приводят к нарушению всасывания жирорастворимых витаминов. Кишечный дисбактериоз (см.) (при острых и хронических заболеваниях кишечника, длительном лечении антибиотиками) нарушает синтез некоторых витаминов бактериальной флорой кишечника (особенно В1, В2, B6 и РР). В детском возрасте (вследствие повышенной потребности растущего организма) и старческом возрасте (вследствие нарушения усвоения) витаминная недостаточность встречается чаще и имеет свои особенности. При тяжелых инфекционных заболеваниях повышается потребность в некоторых витаминах. Следует учитывать взаимноусиливающее действие ряда витаминов, задерживающее развитие витаминной недостаточности (аскорбиновой кислоты с тиамином, фолиевой кислотой, тиамина — с рибофлавином и пиридоксином и др.), а также их антагонизм (токоферола с пиридоксином, никотиновой кислоты с тиамином, холином и т. д.).
Витамина А недостаточность Недостаточность витамина А (ксерофтальмия, недостаточность ретинола) возникает при недостатке витамина А и каротина в пище, нарушении всасывания в кишечнике и синтеза витамина из каротина в организме. Витамин А содержится во многих продуктах животного происхождения (сливочное масло, яичный желток, печень, особенно некоторые рыбы и морские животные); в растительных пищевых продуктах содержится каротин, являющийся провитамином А, из которого в организме человека синтезируется этот витамин. Витамин А жирорастворимый. Суточная потребность для взрослого человека — 1,5 мг (5000 ME). Витамин способствует нормальному обмену веществ, росту и развитию организма, обеспечивает физиологические функции эпителия кожных покровов и слизистых оболочек, потовых, сальных и слезных желез, органа зрения.
Витамина В1 недостаточность Недостаток в организме витамина В1 приводит к нарушению окисления углеводов и накоплению в крови и моче недоокисленных продуктов. Это приводит к нарушению функции нервной, сердечно-сосудистой и других систем организма. Гиповитаминоз и авитаминоз В1 (недостаточность тиамина, бери-бери, алиментарный полиневрит) возникают при недостатке в пище этого витамина (преимущественное питание полированным рисом в странах Восточной и Юго-Восточной Азии), нарушении его всасывания в кишечнике и усвоения (при тяжелых поражениях кишечника, протекающих с нарушением всасывания, упорной рвоте, длительном поносе и т. д.). Предрасполагают к развитию заболевания беременность и кормление, тяжелый физический труд, лихорадочные заболевания, тиреотоксикоз (см.), сахарный диабет (см.). Суточная потребность взрослого человека в витамине В1 составляет около 2 мг. Витамин В1 входит в состав ряда ферментов, участвующих в углеводном обмене. В развитии полной клинической картины авитаминоза В1 имеет значение также сопутствующий дефицит других витаминов группы В.
Витамина В2 недостаточность Гипо- или арибофлавиноз возникает при недостатке витамина В2 в пище, нарушении его всасывания в кишечнике или при повышенном разрушении его в организме. Рибофлавин содержится во многих продуктах животного и растительного происхождения. Суточная потребность взрослого человека составляет 2–3 мг. В организме рибофлавин образует некоторые белки, участвующие в регулировании окислительно-восстановительных процессов. При арибофлавинозе возникает клеточная кислородная недостаточность. Рибофлавин принимает участие в осуществлении зрительной функции глаза и синтезе гемоглобина. В механизме развития арибофлавиноза имеет значение и недостаток других витаминов группы В.
Витамина В3, РР недостаточность Витамина В3, РР (никотиновой кислоты) недостаточность чаще всего обусловлена недостаточным поступлением этого витамина с пищей (например, при преимущественном питании кукурузой), недостаточным всасыванием его в кишечнике (различные заболевания желудка и тонкой кишки, сопровождающиеся синдромом недостаточности всасывания) или повышенной потребностью в нем (беременность, тяжелая физическая работа и др.). Тяжелая степень недостаточности никотиновой кислоты проявляется клиническими симптомами пеллагры, которая встречается в некоторых странах Африки и Азии. Никотиновая кислота и ее амид являются действенными антипеллагрическими средствами, участвуют в клеточном дыхании. При их дефиците в организме возникают значительные нарушения обмена веществ и функций многих органов, изменения в органах и тканях, ведущие к истощению и разрушению. Они бывают наиболее выраженными в коже, нервной и пищеварительной системах. Обычно при пеллагре наблюдаются признаки дефицита других витаминов группы В, а также аминокислоты триптофана, содержащейся в полноценных белках. Во многих продуктах питания животного и растительного происхождения никотиновая кислота имеется в достаточном количестве. Суточная потребность взрослых в никотиновой кислоте и ее амиде составляет 20–25 мг.
Витамина В6 недостаточность У взрослых наблюдается только внутренняя форма при подавлении бактериальной флоры кишечника (синтезирующей пиридоксин в достаточном для организма количестве) длительным приемом антибиотиков, сульфаниламидных и противотуберкулезных препаратов, особенно при одновременной повышенной потребности в этом витамине (значительные физические нагрузки, беременность и т. д.). Витамин В6 в достаточном количестве содержится во многих продуктах растительного и животного происхождения, особенно в дрожжах. В организме он подвергается превращению и входит в состав ферментов, участвующих в различных обменных процессах. Суточная потребность в пиридоксине для взрослых равна 2–2,5 мг. При недостаточности витамина B6 возникают дистрофические изменения в клетках различных органов, особенно пищеварительной и нервной систем, кожи; у детей раннего возраста наблюдается задержка роста.
Витамина С недостаточность Недостаточность витамина С — это недостаточность аскорбиновой кислоты (скорбут или цинга). Витамин С играет большую роль в окислительно-восстановительных процессах, углеводном обмене, синтезе коллагена и проколлагена, нормализации проницаемости сосудов.
Витамина D недостаточность Наибольшее значение имеет недостаточность витаминов D2 и D3. Основное количество витамина D образуется в коже при действии на нее света (ультрафиолетовых лучей), меньшая часть поступает с продуктами питания. Витамин D жирорастворимый, содержится в небольших количествах в сливочном масле, молоке, яичном желтке; особенно высокое содержание его отмечается в печени и жировой ткани трески, некоторых других рыб и морских животных. В организме участвует в регуляции кальциевого и фосфорного обмена. При недостатке в пище продуктов, содержащих витамин D, а также недостаточном действии солнечных лучей на кожу возникает клиническая картина дефицита этого витамина. Дополнительные факторы: недоношенность ребенка, сдвиг кислотно-щелочного состояния в сторону повышения кислотности (в частности, при некоторых инфекционных заболеваниях). Суточная потребность взрослого человека в витамине D составляет 100 ME, ребенка — 500—1000 ME.
Витамина К недостаточность Недостаточность витамина К встречается у взрослых редко. Обусловлена прекращением поступления в кишечник желчи, необходимой для всасывания витамина К (при закупорке и сдавлении желчных путей), а также хроническими заболеваниями кишечника, сопровождающимися синдромом недостаточности всасывания. Наблюдается также при передозировке дикумарина. Витамин К поступает в организм с пищей и частично образуется микрофлорой кишечника.
Гипополивитаминозы Гипополивитаминозы, полиавитаминозы встречаются чаще, чем изолированная относительная или полная недостаточность одного из витаминов. В механизме развития гиповитаминозов и полиавитаминозов следует учитывать взаимное влияние некоторых витаминов, их синергизм и антагонизм.
Клиническая картина и диагностика Клинические проявления болезней витаминной недостаточности возникают постепенно, по мере расходования витаминов, хранящихся в различных органах и тканях (запасы большинства витаминов, за исключением А и В12, в организме невелики). Различают 3 стадии развития болезней витаминной недостаточности. Стадия I — прегиповитаминоз (субнормальная обеспеченность витаминами) — проявляется малоспецифическими общими изменениями некоторых функций внутренних органов, снижением тонуса, общей сопротивляемости организма и работоспособности. Наличие витаминной недостаточности на этой стадии подтверждается лишь специальными лабораторными исследованиями. Стадия II — гиповитаминоз — является следствием относительного дефицита витамина (витаминов). Характеризуется явными клиническими проявлениями, зависящими от преимущественного дефицита того или иного витамина. Последнее подтверждается лабораторными исследованиями (определением содержания витамина в сыворотке крови,выделением его или продуктов обмена веществ с мочой и др.). Стадия III — авитаминоз — крайняя степень витаминной недостаточности вследствие полного (или почти полного) отсутствия поступления витаминов в организм. Проявляется характерной яркой клинической картиной и значительным снижением содержания витаминов в организме (при лабораторных исследованиях). Различают также моногипо- и моноавитаминоз, развивающийся при недостаточности в организме какого-то одного витамина, и полигипо- и полиавитаминоз, развивающийся при недостаточности нескольких или многих витаминов. Следует особо отметить, что стертые внутренние формы гиповитаминозов, особенно наблюдающиеся при хронических заболеваниях органов пищеварения и нарушениях процессов всасывания кишечной стенкой, встречаются достаточно часто и представляют известные трудности для ранней диагностики. Ниже рассмотрены наиболее часто встречающиеся болезни витаминной недостаточности.
Витамина А недостаточность Характерны гемералопия (ночная, или «куриная», слепота вследствие истощения сетчатки и зрительных нервов), ксерофтальмия (сухость конъюнктивы, образование на ней белесоватых непрозрачных бляшек), кератомаляция (изъязвление роговицы), гиперкератоз (изменения эпителия кожи, слизистых оболочек и кожных желез — сухость, шелушение и бледность кожи, ороговение волосяных фолликулов, атрофия потовых и сальных желез и др.), наклонность к гнойничковым заболеваниям кожи, инфекционным поражениям системы дыхания, мочеотделения, пищеварительного тракта, общее недомогание, слабость; у детей — задержка роста и развития, неврологические нарушения. Диагноз устанавливают на основании данных опроса и характерной клинической картины. При биохимическом исследовании сыворотки крови содержание ретинола при недостаточности витамина А ниже 100 мкг/л, каротина — ниже 200 мкг/л.
Витамина В1 недостаточность Заболевание характеризуется распространенным поражением периферических нервов (полиневрит (см.)), сердечно-сосудистой системы и отеками. Первыми жалобами являются общая слабость, быстрая утомляемость, головная боль, одышка и сердцебиение при физической нагрузке. Затем присоединяются явления полиневрита: понижение кожной чувствительности нижних конечностей, а позднее и других участков тела, ощущение тяжести и слабости в ногах, быстрая утомляемость при ходьбе, хромота. Икроножные мышцы становятся твердыми и болезненными при прощупывании. Характерна походка больных бери-бери: они наступают на пятку и затем наружный край стопы, щадя пальцы. Далее угасают сухожильные рефлексы, возникают мышечные атрофии. Нарушение деятельности сердечно-сосудистой системы проявляется учащением сердцебиения, дистрофическими изменениями в сердечной мышце с недостаточностью кровообращения, понижением артериального давления, в основном диастолического. Наблюдаются также симптомы дистрофических поражений и нарушения функций органов пищеварительной системы, расстройства зрения, нарушения психики. Соответственно преобладающим симптомам выделяют отечную форму (с более выраженными поражениями сердечно-сосудистой системы и отеками) и сухую (с преобладающим поражением нервной системы), а также острую злокачественную «молниеносную» форму, часто заканчивающуюся смертью. Трудно распознать бери-бери у детей раннего детского возраста. Диагноз устанавливают на основании данных опроса (характер питания, наличие заболеваний, способствующих проявлению тиаминной недостаточности), характерных изменений сердечно-сосудистой и нервной систем. Диагноз подтверждается биохимическими исследованиями: доказательно снижение содержания тиамина в суточной моче ниже 100 мкг, в часовой (натощак) — ниже 10 мкг; содержание кокарбоксилазы в эритроцитах бывает ниже 20–40 мкг/л. Характерно повышение содержания пировиноградной кислоты в плазме (выше 0,01 г/л) и повышенное выделение ее с мочой (более 25 мг в сутки). В последнее время с этой целью используют также ряд более сложных современных методов. Дифференциальный диагноз с инфекционными (при полиомиелите (см.), дифтерии (см.) и др.) и токсическими полиневритами (см.) (отравления ртутью, метиловым спиртом, фосфором и т. д.) основывается на учете эпидемической обстановки, характерного течения заболевания, а также на результатах биохимических исследований обмена тиамина. Дифференциальный диагноз отечной формы бери-бери с миокардитами (см.), миокардиодистрофиями (см.) облегчается наличием симптомов полиневрита.
Витамина В2 недостаточность Характерны понижение аппетита, похудение, слабость, головная боль, нарушение сумеречного зрения, дистрофические изменения кожи и слизистых оболочек, ощущение жжения кожи, резь в глазах, появление конъюнктивита, ангулярного стоматита (трещин и мацерации эпителия с появлением корочек в углах рта), афтозного стоматита, глоссита (язык ярко-красный и сухой), себорейного дерматита, особенно выраженного в области носогубных складок, на крыльях носа и ушах, сухого зудящего дерматита на кистях рук. При длительном течении наблюдаются нарушения нервной системы: нарушения кожной чувствительности, повышение сухожильных рефлексов, нарушение координации движений и др., а также гипохромная анемия. Течение хроническое, с обострениями в весенне-летние месяцы. Диагноз основан на характерных клинических признаках, биохимических исследованиях (доказательно снижение содержания рибофлавина в суточной моче ниже 100 мкг, часовой моче — ниже 10 мкг, содержания в сыворотке крови — ниже 3 мкг/л, эритроцитах — ниже 100 мкг/л). Дифференциальный диагноз проводят с пеллагрой (см.), авитаминозом А (см.), рассеянным склерозом (см.). В сомнительных случаях наиболее доказательны результаты исследований содержания витаминов в крови и моче.
Витамина В3, РР недостаточность Клиническая картина обусловлена преимущественным поражением пищеварительной, нервной систем и кожи. Появляются потеря аппетита, сухость и жжение во рту, рвота, понос, чередующийся с запором, общая прогрессирующая слабость. Язык ярко-красный, отечный, позднее — лаковый. На нем также возникают болезненные изъязвления. Атрофические и эрозивные изменения обнаруживаются и в других отделах пищеварительного тракта, подавляется секреция пищеварительных желез, возникает ахилия. Поражение нервной системы проявляется общей раздражительностью, симптомами полиневрита, иногда признаками поражения спинного мозга. В тяжелых случаях возникают судороги, нарушается координация движений, иногда развивается слабоумие. Поражение кожи проявляется пеллагрической эритемой, сопровождающейся кожным зудом, повышенной пигментацией (преимущественно на открытых участках тела и конечностях), шелушением кожи, появлением кожных высыпаний — папул. Нарушаются функции эндокринной системы, а также снижается количество белков в плазме крови. Диагноз основан на характерных клинических проявлениях заболевания, данных биохимических исследований: характерно содержание N1-метилникотинамида в суточной моче ниже 4 мг, в часовой моче — ниже 0,3 мг; содержание никотиновой кислоты ниже 0,2 мг. Снижается содержание в крови и моче других витаминов группы В.
Витамина В6 недостаточность Раздражительность либо заторможенность, бессонница, полиневриты верхних и нижних конечностей, нарушение кожной чувствительности, расстройства пищеварения, анорексия, стоматит, глоссит, себорейный и десквамативный дерматит лица, волосистой части головы, шеи, гипохромная анемия. Диагноз устанавливается на основании клинических симптомов и данных биохимических исследований (содержание Н-пиридоксиновой кислоты в суточной моче ниже 0,5 мг, часовой — ниже 30 мкг, содержание пиридоксина в цельной крови ниже 50 мкг/л). После приема 10 г триптофана выделение ксантуреновой кислоты превышает 50 мг.
Витамина С недостаточность Заболевание характеризуется общей слабостью, повышенной ломкостью капилляров с образованием мелких кровоизлияний под кожу, кровотечений из десен, кровоизлияний в суставы и плевру, дистрофическими изменениями слизистых оболочек, развитием анемии, нарушениями нервной системы.
Скорбут. Кровоизлияния в кожу нижних конечностей
Скорбут. Западение грудины вследствие разъединения хрящевидных и костных частей ребер
Для первой стадии заболевания характерно наличие боли в ногах во время движений, появляется бледность кожи. Десны становятся рыхлыми, приобретая красный, а затем фиолетовый цвет. Во второй стадии геморрагические высыпания распространяются на туловище. Появляются гематомы, кровоизлияния в мышцах при ушибах. Кроме этого, кровоизлияния могут быть в перикард, плевру. Зубы выпадают. В третьей стадии при присоединении инфекции развиваются некрозы десен и остеомиелиты альвеолярных отростков. Появляются обширные кровоизлияния, нарастает гипохромная анемия.
Витамина D недостаточность Симптомы у детей такие же, как и при рахите (см.), у взрослых наблюдаются необоснованная слабость, утомляемость, быстрое прогрессирование кариеса (особенно у беременных женщин), разрежение костей, боли в области костей и в мышцах, нарушения кожной чувствительности. Для диагноза у взрослых основное значение имеют данные биохимических лабораторных исследований (снижение содержания неорганического фосфора в крови ниже 30 мг/л; повышение активности щелочной фосфатазы).
Витамина К недостаточность Геморрагический синдром (кровотечения из носа, десен, желудочно-кишечные, внутрикожные и подкожные кровоизлияния). Диагноз подтверждается данными клинического наблюдения (заболевания, способствующие возникновению недостаточности витамина К), а также лабораторного биохимического исследования: характерны гипопротромбинемия ниже 30–35 %, дефицит проконвертина, а также IX и Х факторов свертываемости.
Гипополивитаминозы Клиническая картина многообразна, но в основном проявляется симптомами недостаточности тех витаминов, поступление и утилизация которых наиболее нарушены. Особенно часты слабость, снижение памяти, трудоспособности, нарушения сна, понижение аппетита, одышка при обычной физической нагрузке.
Лечение и профилактика Витамина А недостаточность Лечение заключается в полноценном питании с включением продуктов, богатых ретинолом и каротином, препаратов ретинола в суточной дозе взрослому от 10 тыс. до 100 тыс. МЕ в сутки в зависимости от степени тяжести витаминной недостаточности в течение 2–4 недель под тщательным врачебным контролем (большие дозы и бесконтрольное лечение могут вызвать гипервитаминоз А). При гемералопии, ксерофтальмии и пигментном ретините одновременно назначают рибофлавин. Разнообразное питание с включением в пищу продуктов, богатых ретинолом и каротином; в условиях вынужденного однообразного питания — дополнительное назначение ретинола по 1–2 драже (3300–6600 ME).
Витамина В1 недостаточность Лечение в тяжелых и средней тяжести случаях стационарное. Режим постельный. Назначают витамин В1 по 30–50 мг внутримышечно или подкожно с последующим переходом на прием внутрь; одновременно назначают никотиновую кислоту (25 мг), рибофлавин (10–20 мг), витамин В6. Симптоматическая терапия: сердечно-сосудистые средства, диуретики, для повышения тонуса нервной системы — инъекции стрихнина в разведении 1:1000 по 1–1,5 мг. При внутренней недостаточности витамина В1, вызванной хроническими заболеваниями кишечника, проводят их лечение. Полноценное, богатое витамином В1 питание, своевременная диагностика и лечение заболеваний, при которых нарушается всасывание витамина В1.
Витамина В2 недостаточность Лечение заключается в полноценном питании. Также назначают рибофлавин внутрь по 10–30 мг в течение 2–4 недель, а также другие витамины группы В. При внутренней недостаточности — лечение заболеваний кишечника, сопровождающихся нарушениями всасывания.
Витамина В3, РР недостаточность Лечение в среднетяжелых и тяжелых случаях стационарное: полноценное дробное питание с постепенным увеличением калорийности, никотиновая кислота или никотинамид внутрь по 25—100 мг в сутки в течение 2–3 недель в сочетании с другими витаминами группы В. При внутренних формах — внутривенно введение никотиновой кислоты и ее амида. Разнообразное сбалансированное питание с достаточным содержанием в пищевом рационе продуктов, богатых никотиновой кислотой. При внутренней форме — своевременная диагностика и лечение заболеваний кишечника, профилактическое введение никотиновой кислоты и ее амида; дополнительное введение витамина РР лицам с повышенной потребностью в нем.
Витамина В6 недостаточность Препараты пиридоксина по 10–50—100 мг в день в течение 2–3 недель внутрь, при хронических заболеваниях желудочно-кишечного тракта — внутривенно; устранение факторов возникновения. При длительном лечении антибиотиками, сульфаниламидами и противотуберкулезными препаратами, а также при состояниях, сопровождающихся повышенной потребностью в пиридоксине (беременность, резко повышенная физическая нагрузка и т. д.), проводится профилактическое назначение пиридоксина.
Витамина С недостаточность Аскорбиновая кислота и препараты, содержащие витамин С (настой, сироп из плодов шиповника, чай витаминный). Полноценное сбалансированное питание, содержащее достаточное количество овощей, ягод, фруктов; профилактический прием аскорбиновой кислоты в условиях возможного возникновения ее недостаточности (в длительных походах с преимущественным питанием консервированными и высушенными продуктами, женщинам в период беременности и кормления и т. д.); правильное приготовление пищи, предотвращающее значительные потери аскорбиновой кислоты при кулинарной обработке продуктов.
Витамина D недостаточность Препараты витаминов D2 и D3 в комбинации с препаратами кальция и ультрафиолетовым облучением. В дальнейшем — диспансерное наблюдение и повторные курсы лечения (передозировка витамина D может вызвать интоксикацию). При недостаточности витамина D у взрослых, вызванной заболеваниями пищеварительного тракта и нарушением желчеотделения, помимо назначения препаратов витамина D, проводят лечение основного заболевания. Лечебная доза составляет 0,25—0,5 мл в день. Курсовая доза — 1 тыс. МЕ.
Витамина К недостаточность Терапию проводят в стационаре витамином К (викасолом) под контролем уровня протромбина и коагулограммы.
Гипополивитаминозы Проводят лечение основного заболевания, ведущего к синдрому нарушения всасывания; назначают витаминные препараты, парентеральное введение витамина. Профилактика: своевременная диагностика и лечение заболеваний желудочно-кишечного тракта, при которых нарушается всасывание пищевых веществ и витаминов; включение витаминотерапии в курс лечения хронических заболеваний пищеварительного тракта.
ВИТИЛИГО
ОпределениеВитилиго — относительно редкое заболевание кожи, характеризующееся развитием депигментированных участков на коже, волосах, сетчатке глаза.
Этиология Заболевание обусловлено потерей отдельными участками кожи способности к выработке пигмента вследствие отсутствия в пигментных клетках фермента, активирующего процесс пигментообразования. В развитии болезни определенную роль могут играть наследственные и нейроэндокринные факторы (психические травмы, нарушение функций надпочечников, щитовидной и половых желез).
Клиническая картина Отмечается постепенное появление на разных участках кожи пятен, лишенных пигментации и склонных к росту и слиянию. Волосы на пораженных местах также лишены пигмента. Какие-либо ощущения отсутствуют. Участки, лишенные пигмента, обладают повышенной чувствительностью к солнечным и искусственным ультрафиолетовым лучам. Заболевание наблюдается в любом возрасте. Течение крайне упорное, обычно прогрессирующее. Случаи выздоровления редки.
Диагностика и дифдиагностика Диагноз основан на характерной клинической картине. В отличие от лепрозных ахромий пятна витилиго не имеют нарушений чувствительности. Лейкодерма, возникающая после обратного развития отрубевидного лишая, псориаза, экзематоидов, всегда вторична, не дает полного избавления от нарушенной пигментации и быстро исчезает. В депигментированных участках кожи меланоциты не обнаруживаются, в гипопигментированных участках — число их значительно меньше. В базальном слое кожи, окружающем депигментированную зону, количество меланина увеличено.
Лечение и профилактика Лечение обычно малоэффективно. Повторные курсы фотосенсибилизаторов (аммифурин, бероксан) в сочетании с ультрафиолетовым облучением, в том числе ПУВА-терапия. Витамины группы В. Нанесение кортикостероидных мазей. Коррекция выявленных расстройств нервной и эндокринной систем. Хороший косметический эффект дают декоративные кремы. Прогноз в плане излечения неблагоприятный. Для профилактики солнечных ожогов рекомендуется не подвергаться длительному воздействию ультрафиолетового облучения.
ВНУТРИБОЛЬНИЧНЫЕ ИНФЕКЦИИ
ОпределениеВнутрибольничные (госпитальные, нозокомиальные) инфекции — это инфекции, возникающие в период пребывания пациента в больнице. Обычно проявления инфекции отмечаются через 48 ч после госпитализации.
Эпидемиология Считается, что 3–5 % больных, экстренно поступающих в стационары, приобретают там новую инфекцию. За год регистрируется около 2 млн случаев внутригоспитальной инфекции, что вызывает расходы в размере 2 млрд рублей. Среди госпитальных инфекций первое место занимает инфекция мочевых путей (40–45 %), затем идут раневые инфекции (25–30 %), пневмония (15–20 %) и бактериемия (5–7 %).
Этиология и патогенез Факторы риска инфицирования мочевых путей: женский пол, длительная катетеризация уретры, отсутствие антибактериального лечения, неправильное обращение с катетером. Факторы риска развития хирургической раневой инфекции: тип раны, дренирование, длительность предоперационного периода, предоперационная подготовка операционного поля, длительность операции, наличие нелеченой трудно обнаруживаемой инфекции (синусит), асептика хирурга. Критерии, по которым оценивается риск развития раневой инфекции, включают операцию на брюшной полости, длительность операции свыше 2 ч, наличие зараженной или грязной раны по стандартной классификации ран, а также три и более заболеваний у одного больного. Факторы риска пневмонии: пребывание в палате интенсивной терапии, искусственная вентиляция трахеи, нарушение сознания (в особенности в сочетании с введенным зондом), преклонный возраст, хроническое заболевание легких, послеоперационный период, применение Н2-гистаминоблокаторов или антацидов. Главный фактор риска первичной бактериемии — наличие постоянного внутрисосудистого катетера и ожирение. Учреждения или отделения больниц, изучающие инфекции, разрабатывают общие и специальные меры по контролю за ними. Смешанная инфекция особо значима, наиболее действенный метод ее профилактики в стационаре — мытье рук. Ранжированные по категориям меры включают: строгую изоляцию (ветряная оспа), пресечение контактов (стафилококковые раневые инфекции), прекращение воздушных потоков (при туберкулезе), профилактика кишечной (бактериальная диарея) и раневой (дренаж, секреция) передачи инфекции (при неяркой инфекции раны). Общие меры профилактики имеют большее значение, чем лишь профилактические меры, касающиеся крови и жидкостей организма.
Клиническая картина Инфекция мочевых путей Лихорадка, дизурия, поллакиурия, лейкоцитоз, болезненность в боковых отделах живота или реберно-позвоночного угла — эти симптомы взаимосвязаны с инфекцией мочевого пузыря или пиeлoнeфритом у больного, у которого ранее стоял мочевой катетер. У больных с лихорадкой наличие лейкоцитов без клеток слизистой в моче или наличие нитритов в анализе мочи свидетельствует об инфекции мочевых путей. Выделения какой-либо одной культуры в посеве мочи у стационарного больного без симптомов каких-либо нарушений недостаточно для диагностики инфекции мочевых путей.
Хирургическая раневая инфекция О наличии раневой инфекции свидетельствуют покраснение вокруг краев раны более 2 см, боль при прощупывании, флюктуация, отделение гнойного содержимого и прорезывание швов. При ране в области грудины лихорадка, нестабильность кости могут быть показанием к осмотру раны.
Пневмония У больных, не находящихся в палате интенсивной терапии, следует заподозрить пневмонию при появлении кашля, лихорадки, лейкоцитоза, мокроты и свежей инфильтрации на рентгенограмме. У больного в палате интенсивной терапии, особенно с искусственной вентиляцией трахеи, признаки могут быть менее яркими, но обычно появляется гнойная мокрота, а заболевание обнаруживается при рентгенографии. Для диагноза существенно изменение количества или качества мокроты у больного на фоне лихорадки. В развитии госпитальной пневмонии обычно участвуют грамотрицательные аэробы. Также значимы вирусы, в особенности респираторно-синцитиальные и аденовирусы.
Бактериемия Лихорадка может быть единственным ее симптомом. Место размещения венозного катетера необходимо исследовать на наличие покраснения и болезненности и (или) выделений гноя.
Диагностика и дифдиагностика Важными источниками лихорадки служат связанная с антибиотиками диарея, пролежни и синуситы. В качестве неинфекционных причин следует иметь в виду прием некоторых лекарств и флебит. Обследование стационарного больного, у которого возникла лихорадка, включает тщательное изучение течения болезни, а также таких симптомов, как головная боль, кашель, диарея, боли в боковых отделах живота, дизурия, поллакиурия и боли в ногах. Также важны внутривенные и мочевые катетеры, хирургические процедуры, применение новых лекарственных средств. Следует обратить особое внимание на состояние кожи, легких, живота (особенно правый верхний квадрант), реберно-позвоночного угла, хирургических ран, голеней. В стационаре лабораторные исследования у всех лихорадящих больных должны включать полный клинический анализ крови, рентгенограмму грудной клетки, посевы крови и мочи. Дополнительные исследования: функциональные пробы печени, исследование мокроты на аэробы, исследование кала и биологических жидкостей, посевы кала на микрофлору.
Лечение Все терапевтические и профилактические мероприятия должны быть направлены на устранение наиболее вероятной причины инфекции.
ВОДЯНКА ЯИЧКА И СЕМЕННОГО КАНАТИКА
ОпределениеПод водянкой яичка и семенного канатика понимают скопление экссудата или транссудата между листками брюшины.
Этиология Яички на 4-м месяце внутриутробного развития находятся внутрибрюшинно в поясничной области. К моменту рождения ребенка они опускаются в мошонку, увлекая за собой пристеночную брюшину в виде слепого мешка (влагалищный отросток). В норме он к рождению зарастает, но иногда этого не происходит. Брюшная полость сообщается узким отверстием с полостью, в которой находится яичко. При повышении внутрибрюшного давления серозная жидкость проходит в полость влагалищной оболочки. Возникает в результате травмы, воспаления яичка (туберкулез (см.), неспецифический эпидидимит (см.), свинка (см.), опухолей яичка, иногда при варикоцеле (см.)). Если причину выявить не удается, говорят об идиопатическом гидроцеле. Острое гидроцеле иногда возникает при опухолях яичка — после пункции и отсасывания жидкости с помощью прощупывания устанавливают причину заболевания.
Клиническая картина и диагностика Плотноэластическое безболезненное образование иногда больших размеров с гладкой поверхностью. Процесс может быть одно- и двусторонним. Яичко четко контурировать не удается. Верхний полюс образования обычно четко отделяется от передней брюшной стенки (отличие от грыжи). Более точно дифференциальный диагноз с паховой грыжей проводят с помощью диафаноскопии. Некоторые трудности возникают при сообщающейся водянке: часть водяночного мешка расположена в брюшной полости, поэтому при горизонтальном положении больного образование уменьшается в размерах. В этом случае диагностике помогает диафаноскопия. При изолированных кистах семенного канатика диагноз обычно затруднений не вызывает. Связь с семенным канатиком установить очень просто — при легком потягивании за яичко смещается и образование в семенном канатике.
Лечение Лечение у взрослых оперативное: производят иссечение водяночного мешка (операция Бергманна) или обертывание его вокруг семенного канатика (операция Винкельманна). Обычно обе методики сочетаются. У взрослых оперативное вмешательство является последним этапом диагностики с целью исключения симптоматического гидроцеле. У новорожденных водянка обычно самопроизвольно рассасывается. Маленьким детям достаточно однократной пункции и процедуры отсасывания содержимого водяночного мешка. У взрослых же подобные действия эффекта обычно не дают, возникает рецидив заболевания. Прогноз благоприятный, при симптоматической водянке зависит от основного заболевания.
ВОЛЧАНКА КРАСНАЯ СИСТЕМНАЯ
ОпределениеСистемная красная волчанка — это хроническое многосиндромное заболевание соединительной ткани и сосудов, развивающееся в связи с генетически обусловленным несовершенством иммунорегуляторных процессов. Оно вызывает разнородные нарушения, имеющие определенные общие черты, включая воспалительные процессы в коже, суставах и других структурах, богатых соединительной тканью, а также общие черты нарушения иммунной регуляции с образованием антител к собственным тканям (аутоантител), нарушением клеточно-опосредованного иммунитета.
Этиология и патогенез Системная красная волчанка характеризуется генетическим детерминированным аутоиммунитетом, основной особенностью которого является обнаружение широкого спектра антиядерных аутоантител, включая аутоантитела к нативной ДНК. Страдают чаще женщины молодого возраста и подростки. В качестве факторов, способствующих возникновению заболевания, выступают факторы окружающей среды. Существует мнение, что вирусы, токсические вещества и лекарственные средства могут быть причиной развития системной красной волчанки, однако убедительных доказательств этого до сих пор нет. В ряде случаев у больных системной красной волчанкой обнаруживают антитела к вирусу Эпштейна-Барра и другим РНК-содержащим вирусам. Предрасполагающими факторами являются: I. Генетические особенности организма. Роль наследственности подтверждается высокой частотой возникновения болезни у однояйцевых близнецов, в отличие от обычных родных братьев и сестер. Отмечена связь заболевания с наследственным дефектом некоторых генов. II. Гормональные влияния. Системная красная волчанка развивается в основном у женщин детородного возраста, но предполагается, что гормональные факторы больше влияют на проявления заболевания, чем на его возникновение. Для системной красной волчанки характерны разнообразные нарушения иммунорегуляции. Образуются так называемые иммунные комплексы, которые циркулируют по сосудистому руслу и поражают клетки внутренней оболочки сосудов не только в том месте, где образовались, а по всему организму. Откладываясь на базальных мембранах различных органов, вызывают их повреждение и воспаление.
Клиническая картина Принято выделять острое, подострое и хроническое течение системной красной волчанки. Острое течение характеризуется внезапным началом с резким повышением температуры тела, быстрым поражением внутренних органов, включая почки, а также высоким уровнем антител. Подострое течение характеризуется периодически возникающими обострениями заболевания, выраженными не в такой степени, как при остром течении, и развитием поражения почек в течение первого года болезни. Хроническое течение характеризуется длительным преобладанием одного или нескольких симптомов (поражения кожи, множественные поражения суставов, снижение количества тромбоцитов в крови, снижение количества белка в моче и др.).
Язвенные образования в виде бугорков
Язвенная форма волчанки.
Мощные, образовавшиеся от слияния бугорковых элементов мягкие диффузные инфильтраты
В России традиционно применяется деление болезни на три степени активности. I степень: температура тела нормальная, незначительное похудение, волчаночные очаги на коже, кардиосклероз (см.), небольшое количество белка в моче, гемоглобин 120 г/л и более, небольшие сдвиги лабораторных показателей. II степень: температура тела менее 38 °C, умеренное похудение, покраснения на коже, умеренный миокардит (см.), гемоглобин 110–120 г/л, умеренные сдвиги лабораторных показателей. III степень: температура тела 38 °C и выше, выраженное похудение, «бабочка» на лице, гемоглобин 100 г/л и менее, значительные сдвиги лабораторных показателей. В процесс развития нарушений могут быть вовлечены различные системы и органы. Заболевание протекает с чередованием периодов обострения и относительного покоя. Общие проявления включают утомляемость, лихорадку, недомогание, снижение массы тела, кожную сыпь (особенно «бабочку» в области щек), фоточувствительность, артрит (см.), миозит (см.), язвы в полости рта, васкулит (см.), выпадение волос, анемию (см.) (часто гемолитическую), нейтропению, тромбоцитопению, лимфаденопатию (см.), увеличение селезенки, органические синдромы головного мозга, судороги, психозы (см.), плеврит (см.), перикардит (см.), миокардит (см.), пневмонит (см.), нефрит (см.), венозный или артериальный тромбоз (см.), мезентериальный васкулит (см.). Начинается болезнь постепенно, с рецидивирующего полиартрита и астении. Реже бывает острое начало (высокая лихорадка, дерматит, острый полиартрит). В дальнейшем отмечаются рецидивирующее течение и характерная многосиндромность. Полиартрит, полиартралгии — наиболее частый и ранний симптом заболевания. Поражаются преимущественно мелкие суставы кистей рук, лучезапястные, голеностопные, реже коленные суставы. Характерен неэрозивный (без образования дефектов суставной ткани) тип полиартрита, даже при наличии деформации межфаланговых суставов, которая развивается у 10–15 % больных с хроническим течением. Красные пятна на коже лица в виде «бабочки», в верхней половине грудной клетки в виде «декольте» и на конечностях — также частый признак системной красной волчанки. Полисерозит (множественное воспаление серозных оболочек) считается компонентом диагностической триады наряду с дерматитом и полиартритом. Наблюдается он практически у всех больных в виде двустороннего плеврита и (или) перикардита, реже перигепатита и (или) периспленита. Характерно поражение сердечно-сосудистой системы. Обычно развивается перикардит, к которому присоединяется миокардит. Сравнительно часто наблюдается бородавчатый эндокардит Либмана-Сакса с поражением митральных, аортальных и трикуспидальных клапанов сердца. Признаки поражения сосудов входят в картину поражения отдельных органов. Тем не менее следует отметить возможность развития синдрома Рейно (задолго до типичной картины болезни), поражение как мелких, так и крупных сосудов с соответствующей клинической симптоматикой. Поражения легких могут быть связаны с основным заболеванием в виде волчаночного пневмонита, характеризующегося кашлем, одышкой, незвонкими влажными хрипами в нижних отделах легких. Рентгенологическое исследование у таких больных выявляет усиление и изменение легочного рисунка в нижних отделах легких; временами можно обнаружить очаговоподобные тоны. Поскольку пневмонит обычно развивается на фоне текущего полисерозита, описанная рентгенологическая симптоматика дополняется высоким стоянием диафрагмы с признаками плевродиафрагмальных и плевроперикардиальных сращений и дисковидными ателектазами (линейные тени, параллельные диафрагме). При исследовании желудочно-кишечного тракта отмечаются афтозный стоматит, диспепсический синдром и анорексия. Болевой абдоминальный синдром может быть связан как с вовлечением в патологический процесс брюшины, так и с собственно васкулитом — мезентериальным, селезеночным. Реже развиваются очаговые илеиты. Поражение ретикулоэндотелиальной системы выражается в увеличении всех групп лимфатических узлов (весьма частый и ранний признак системности болезни), а также увеличении печени и селезенки. Собственно волчаночный гепатит развивается крайне редко. Однако увеличение печени может быть обусловлено сердечной недостаточностью при панкардите или выраженном выпотном перикардите, а также развитием жирового истощения печени. Волчаночный диффузный гломерулонефрит (люпус-нефрит) развивается у половины больных обычно в период распространения процесса. Встречаются различные варианты поражения почек — мочевой, нефритический и нефротический синдромы. Для распознавания люпус-нефрита большое значение имеет прижизненная пункционная биопсия с исследованием образца ткани почки. Развитие почечных нарушений у больных с рецидивирующим суставным синдромом, лихорадкой и стойко повышенной СОЭ требует исключения волчаночного происхождения нефрита. Следует помнить, что почти у каждого пятого больного с нефротическим синдромом имеет место системная красная волчанка.
Волчаночный нефрит
Поражение нервно-психической сферы встречается у многих больных во всех фазах болезни. В начале болезни наблюдается астеновегетативный синдром, в последующем развиваются признаки поражения всех отделов центральной и периферической нервной системы в виде энцефалита, миелита, полиневрита. Характерно поражение нервной системы. Реже наблюдаются эпилептиформные припадки. Возможны галлюцинации (слуховые или зрительные), бредовые состояния.
Дискоидная красная волчанка
Лабораторные данные, имеющие диагностическое значение: определение большого числа LЕ-клеток и высокого количества антител к ДНК. При остром течении уже через 3–6 месяцев выявляется люпус-нефрит, нередко по типу нефротического синдрома. При подостром течении отчетливо наблюдается волнообразное развитие заболевания с вовлечением в патологический процесс различных органов и систем и характерной многосиндромностью. Хроническое течение заболевания длительное время характеризуется рецидивами полиартрита и (или) полисерозита, синдромами дискоидной волчанки, Рейно; лишь на 5—10-м году постепенно развивается характерная полисиндромность. В соответствии с клинико-лабораторной характеристикой выделяют три степени активности процесса: высокую, умеренную и минимальную.
Диагностика Включает опрос и физикальное обследование, рентгенологическое исследование, ЭКГ, общий анализ мочи, общий анализ крови, СОЭ, определение в сыворотке крови уровней иммунных белков, антител к гладким мышцам, а также пробу на сифилис. Диагноз достоверен при наличии четырех или более критериев.
Лечение и профилактика Направлено на ограничение воспалительного процесса. Применяют салицилаты (особенно аспирин, покрытый оболочкой, растворимой в кишечнике, по 2–4 г в день в нескольких дозах), нестероидные противовоспалительные средства (ибупрофен по 400–800 мг 3–4 раза в день) и гидроксихлорохин по 400 мг в день; глюкокортикоиды (преднизон по 1— 2 мг/кг массы или его эквиваленты необходимы при состояниях, угрожающих жизни, или при тяжелых проявлениях заболевания); цитостатические препараты (циклофосфамид по 1,5–2,5 мг/кг или азатиоприн по 2–3 мг/кг) применяют в случаях, когда стероиды не обеспечивают подавление симптомов заболевания); внутривенное введение пульс-доз циклофосфамида (10–15 мг/кг каждые 4 недели) — альтернатива ежедневному приему цитостатических средств. Больные нуждаются в непрерывном, многолетнем и комплексном лечении. Лучшие результаты с развитием стойкой клинической ремиссии достигаются при рано начатом лечении. При хроническом и подостром течении и минимальной степени активности показаны нестероидные противовоспалительные препараты и аминохинолиновые производные. Первые рекомендуются при суставном синдроме. Важен подбор препарата с учетом его индивидуальной эффективности и переносимости: вольтарен (ортофен) по 50 мг 2–3 раза в день, индометацин по 25–50 мг 2–3 раза в день, бруфен по 400 мг 3 раза в день, хингамин (хлорохин, делагил) по 0,25—0,5 г в сутки в течение 10–14 дней, а затем по 0,25 г в сутки в течение нескольких месяцев. При развитии распространенного люпус-нефрита с успехом применяют плаквенил по 0,2 г 4–5 раз в день, длительно, под контролем динамики мочевого синдрома. При остром течении с самого начала, а при подостром и хроническом течении при III и II степени активности патологического процесса показаны глюкокортикостероиды. Начальная доза этих препаратов должна быть достаточной, чтобы надежно подавить активность патологического процесса. Преднизолон в дозе 40–60 мг в сутки назначают при остром и подостром течении со средней степенью активности и наличием нефротического синдрома или менингоэнцефалита. При этих же вариантах течения со II степенью активности, а также при хроническом течении с III и II степенью активности подавляющая доза должна быть 30–40 мг, а при I степени активности — 15–20 мг в сутки. Лечение преднизолоном в подавляющей дозе проводят до наступления выраженного клинического эффекта (по данным снижения клинико-лабораторных показателей активности). По достижении эффекта дозу преднизолона медленно снижают. Одной из важнейших задач и залогом эффективности терапии является подбор наименьшей дозы, которая позволяет поддерживать клинико-лабораторную ремиссию. Преднизолон в поддерживающей дозе 5—10 мг в сутки назначают в течение нескольких лет. Для уменьшения побочного эффекта глюкокортикоидов рекомендуется сочетать эту терапию с препаратами калия, анаболическими стероидами, мочегонными и гипотензивными препаратами, транквилизаторами, противоязвенными мероприятиями. Наиболее серьезные осложнения: стероидная язва, септические инфекции, туберкулез, кандидоз, психозы. При агрессивном течении болезни, высоком количестве аутоантител, иммунных комплексов с успехом используется плазмаферез. При неэффективности глюкокортикоидов назначают иммунодепрессанты (алкилирующего ряда или азатиоприн). Показания к назначению цитотоксических препаратов (обычно в комбинации с умеренными дозами кортикостероидов) следующие: высокая степень активности у подростков и в климактерическом периоде; нефротический и нефритический синдромы; необходимость быстро уменьшить подавляющую дозу преднизолона из-за выраженности побочного действия (быстрая и значительная прибавка массы тела, высокое артериальное давление, стероидный диабет, выраженный остеопороз с признаками спондилопатии); необходимость снизить поддерживающую дозу преднизолона, если она превышает 15–20 мг в сутки. Наиболее часто применяют азатиоприн (имуран) и циклофосфан (циклофосфамид) в дозе 1–3 мг/кг (100–200 мг в сутки) в сочетании с 30 мг преднизолона. В этой дозе препарат назначают в течение 2–2,5 месяца (обычно в стационаре), затем рекомендуют поддерживающую дозу (50— 100 мг в день), которую дают в течение нескольких месяцев и даже года и более. Чтобы обеспечить безопасность лечения, требуется тщательный контроль анализа крови для предотвращения серьезных нарушений кроветворения; необходимо избегать присоединения инфекционных осложнений, расстройств пищеварения; при приеме циклофосфана опасность развития геморрагического цистита можно уменьшить путем назначения обильного питья (2 л жидкости и более в сутки). Поскольку больные нуждаются в многолетнем лечении после выписки из стационара, они должны находиться под наблюдением терапевта или ревматолога в поликлинике. С целью улучшения переносимости многолетней кортикостероидной терапии в поликлинических условиях рекомендуется делагил по 0,25 г в сутки и витамины группы В, аскорбиновая кислота в виде весенне-осеннего курса. Больным показано лечение в санаториях местного типа (кардиологических, ревматологических). Климатобальнеологическое, физиотерапевтическое лечение противопоказано, так как ультрафиолетовое облучение и гидротерапия могут вызвать обострение болезни.
ВУЛЬВОВАГИНИТ
ОпределениеВульвовагинит — воспаление влагалища и наружных половых органов. Наблюдается в основном в детском возрасте.
Этиология Возбудители: гноеродная и кишечная флора, гельминтозы (см.) (острицы). Предрасполагающие факторы: экссудативный диатез (см.); изменения в организме, обусловленные хронической интоксикацией; несоблюдение правил гигиены; механические факторы (введение инородных тел во влагалище).
Клиническая картина и лечение Отмечаются зуд и обильные бели; вульва отечна и кровенаполнена, слизистая оболочка влагалища также кровенаполнена, с точечными кровоизлияниями. Бели обильные,гноевидные, иногда с примесью крови (при введении во влагалище инородных тел). Лечение такое же, как при вульвите и вагините.
ВУЛЬВИТ
ОпределениеВульвит — воспаление наружных половых органов; часто сочетается свагинитом (см.).
Этиология и клиническая картина Возникает вследствие механических, химических воздействий, развития инфекций. Боль и зуд в области половых органов, при наружном осмотре в острой стадии — кровенаполнение и отечность тканей вульвы с серозно-гнойными выделениями; возможны изъязвления и образование налетов.
Лечение Проводят лечение воспалительных заболеваний влагалища и матки (см. Вагинит). Устраняют механические и другие раздражители. В острой стадии — постельный режим, обмывание наружных половых органов 2–3 раза в день теплым раствором перманганата калия (1:10 000), настоем ромашки, 2 %-ным раствором борной кислоты. Теплые сидячие ванны со слабым раствором перманганата натрия.
ВЫВИХ ЗУБА
ОпределениеПод вывихом зуба понимают насильственное смещение зуба с повреждением периодонта.
Этиология Наиболее частой причиной вывиха бывают механическое повреждение, травма. Вывихи подразделяются на неполные и полные, когда зуб утратил связь с лункой, а также вколоченные вывихи.
Клиническая картина Сильная боль, смещение зуба из зубного ряда, его патологическая подвижность. Позднее возникают воспаление пародонта и омертвение мягких тканей зуба.
Диагностика и лечение Диагностика не представляет каких-либо сложностей. Вывих определяется при обследовании ротовой полости по изменению зубного ряда, кровоточивости десны и патологической подвижности зуба. При неполном вывихе зуб вправляют в лунку и фиксируют к смежным зубам. При появлении признаков некроза пульпы показаны трепанация коронки зуба и эндодонтическое лечение. При полном вывихе зуб удаляют либо реплантируют. При вколоченном вывихе проводят наблюдение. Прогноз при неполном вывихе благоприятный. При вколоченном вывихе зуб может со временем занять свое место в зубном ряду.
ВЫВИХИ
ОпределениеВывих — выхождение суставной части кости из полости сустава, вызывающее нарушение функции сустава. Неполное смещение называют подвывихом. Различают травматические, привычные, патологические вывихи, врожденные вывихи.
Этиология и патогенез Вывих бедра врожденный Наиболее частой причиной врожденных вывихов является родовая травма, реже — внутриутробные нарушения. При этом пороке развития страдают все элементы сустава: вертлужная впадина, головка и конец бедренной кости со стороны туловища, сухожильно-связочный аппарат, окружающие мышцы. Чаще встречается левосторонний вывих.
Вывих травматический Травматический вывих возникает при сильной механической травме сустава. Наблюдаются закрытые и более тяжелые по течению и прогнозу открытые вывихи, при которых имеется рана в области сустава.
Вывих бедра
Подвздошный вывих бедра: 1 — положение костей; 2 — положение конечности
Вывих привычный Привычный вывих нередко бывает при преждевременном прекращении неподвижности после вправления первого вывиха и выражается в часто возникающих вывихах в суставе даже при небольшой травме. Самая частая локализация — плечевой сустав.
Седалищный вывих бедра: 1 — положение костей; 2 — положение конечности
Вывих патологический Патологический вывих наступает в результате разрушения сустава каким-либо патологическим процессом: туберкулез (см.), остеомиелит (см.). Чаще наблюдается у детей.
Вывих височно-нижнечелюстного сустава Вывих височно-нижнечелюстного сустава — это смещение суставной головки нижней челюсти. Этому способствуют: сильное раскрывание рта (при еде, крике, зевоте, некоторых вмешательствах — удалении зуба, зондировании желудка, при искусственной вентиляции легких и т. д.), травма.
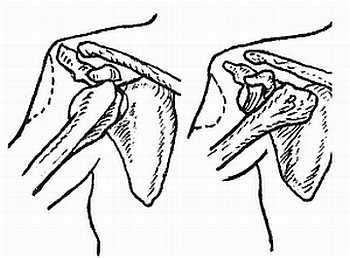
Виды передних вывихов плеча

Надлобковый вывих бедра: 1 — положение костей; 2 — положение конечности
Механизм развития связан с растяжением либо разрывом суставной капсулы. Имеет значение врожденная слабость связочного аппарата. Различают вывихи полный и неполный (подвывих), передний, задний, односторонний и двусторонний.

Вывих костей предплечья кзади
Клиническая картина, диагностика и дифдиагностика Вывих бедра врожденный Наиболее частыми симптомами врожденного вывиха у новорожденного являются симптом «щелчка» при разведении бедер, асимметрия кожных складок на бедрах, укорочение конечности и наружное ее вращение. Указанные симптомы непостоянны и позволяют лишь заподозрить заболевание. Окончательный диагноз ставится на основании рентгенологического исследования, которое обнаруживает выраженное недоразвитие суставной впадины и смещение конца бедренной кости кнаружи и кверху. Этим врожденный вывих бедра отличается от дисплазии тазобедренного сустава, при которой смещения бедер не отмечается. Дифференцировать врожденный вывих следует с врожденной деформацией бедер, травматическим эпифизеолизом проксимального отдела бедренной кости в родах.
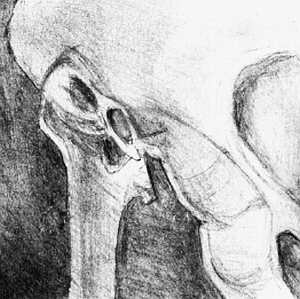
Патологический вывих бедра при остеомиелите головки бедра
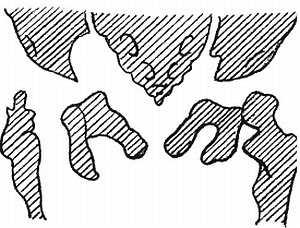
Схема рентгеновского снимка при врожденном вывихе в правом тазобедренном суставе
Вывих травматический Боль в суставе, невозможность активных и пассивных движений в нем и нарушение его конфигурации. Тяжелым осложнением вывиха может быть повреждение близлежащих кровеносных сосудов или нервов. Если вывих не вправлен в течение первых 2 ч после травмы, его называют застарелым. Лечение его (особенно вправление) может представлять трудную задачу. Открытый вывих может осложниться гнойным артритом. Диагноз ставят на основании клинических симптомов с обязательной рентгенографией сустава, так как вывихи иногда сочетаются с околосуставными переломами. Этот метод важен также для диагностики подвывиха, симптомы которого выражаются менее ярко.
Вывих привычный При осмотре области повреждения отмечаются изменение формы сустава, отечность, невозможность движений в полном объеме, резкая боль при попытке сместить конечность. Диагноз ставят только на основании характерного течения болезни и рентгенографии сустава.
Вывих патологический Конечность отстает в росте, атрофична. Характерна чрезмерная подвижность (разболтанность) в суставе. Помимо этого, отмечаются симптомы основного заболевания, приведшего к патологическому вывиху.
Вывих височно-нижнечелюстного сустава Типичен передний вывих, характеризующийся болью, невозможностью закрыть рот, затруднением речи, слюнотечением. При двустороннем вывихе рот раскрыт широко, при одностороннем подбородок смещен в здоровую сторону. Во время прощупывания выявляется суставная головка впереди суставного бугорка. При заднем вывихе головка находится кзади от суставной ямки. Диагноз ставится при осмотре больного. Типичными признаками вывиха являются изменение области рта, невозможность движений в височно-нижнечелюстном суставе, слюнотечение.
Лечение и профилактика Вывих бедра врожденный Лечение начинают сразу после установления диагноза. Оно заключается в применении различных шин (шина-распорка, шина Виленского, шина ЦИТО и т. д.), позволяющих фиксировать нижние конечности в состоянии разведения. При своевременно начатом функциональном лечении в течение 5–6 месяцев удается добиться нормального дальнейшего развития сустава. Позднее выявление вывиха может вызвать такие осложнения, как сосудистый некроз головки бедренной кости и контрактуры; кроме того, это усложняет методы лечения и удлиняет их сроки. Легкие формы дисплазии тазобедренного сустава, как правило, излечивают с помощью так называемого широкого пеленания, ЛФК, массажа. Дети с врожденной патологией тазобедренного сустава подлежат диспансерному наблюдению ортопеда в течение всего периода роста.
Вывих травматический При вывихах в крупных суставах необходимо обеспечить их неподвижность и срочно госпитализировать человека в хирургический стационар, где производят вправление вывиха и иммобилизацию сустава на срок не менее 3 недель с последующей лечебной гимнастикой и физиотерапией. Вывихи в мелких суставах, например кисти и нижней челюсти, устраняют амбулаторно. При застарелых вывихах нередко показано оперативное лечение. Прогноз при раннем вправлении вывиха и отсутствии осложнений благоприятный.
Вывих привычный Лечение, как правило, оперативное. Профилактика — строгое соблюдение сроков иммобилизации при травматическом вывихе.
Вывих патологический Лечение оперативное. Применяют также ортопедические аппараты.
Вывих височно-нижнечелюстного сустава Вывих вправляют под анестезией в положении больного сидя. Врач большими пальцами, обернутыми марлевыми салфетками, надавливает на нижние зубы и без резких движений оттягивает нижнюю челюсть книзу. Суставные головки в положении ниже суставных бугорков устанавливаются в суставные ямки. Вправленную нижнюю челюсть фиксируют пращевидной повязкой на 2 недели. Привычные вывихи лечат ортопедически. Прогноз благоприятный. Профилактика заключается в фиксации подбородка при вмешательствах.
ВЫВИХ ХРУСТАЛИКА
ОпределениеПод вывихом хрусталика понимают полное (вывих) или частичное (подвывих) смещение хрусталика.
Этиология и патогенез Врожденное недоразвитие, слабость или частичное отсутствие связок хрусталика; разрыв их вследствие травмы или дегенерации.

Вывих хрусталика
Клиническая картина При подвывихе хрусталика определяются неравномерная передняя камера, более мелкая в стороне смещения, дрожание радужки, сдвиг преломления света в сторону близорукости, понижение зрения. При офтальмоскопии видны край хрусталика и удвоенное изображение глазного дна. Вывих хрусталика в стекловидное тело сопровождается признаками его отсутствия и может быть причиной иридоциклита или вторичной глаукомы. При вывихе хрусталика в переднюю камеру после травмы он виден в очень глубокой передней камере в виде золотисто-маслянистой капли. Как правило, развивается вторичная глаукома.
Диагностика Вначале необходимо исследовать зрительные функции, центральное зрение, поле зрения. При наружном осмотре прежде всего обращают внимание на состояние придаточного аппарата глаза — положение век, размеры глазной щели, роговицы, объем движений глазных яблок. Особое внимание уделяют осмотру области зрачка. Важное значение имеет исследование реакции зрачков на свет.
Лечение При подвывихе и неосложненном вывихе — назначение корригирующих линз, если они улучшают зрение. При осложненном вывихе производится удаление хрусталика. При смещении хрусталика без осложнений коррекция значительно и стойко улучшает зрение. При осложненном вывихе прогноз определяется успешностью лечения и степенью изменений в глазу.
ВЫВОРОТ ВЕК
ОпределениеПод выворотом век понимают состояние, при котором в силу каких-либо патологических изменений край века заворачивается, обнажая роговицу.
Этиология и патогенез Рубцовый выворот образуется вследствие стягивания кожи век после ранений, ожогов (см.), системной красной волчанки (см.) и других патологических процессов. Спастический выворот возникает в результате сокращения орбитальной части круговой мышцы глаза. Старческий выворот — следствие слабости этой мышцы. Паралитический выворот бывает только на нижнем веке и возникает при параличе лицевого нерва.
Клиническая картина Край века отстает от глаза или отвернут вниз, вследствие чего слизистая оболочка вывернута наружу. Она постепенно сохнет и увеличивается в размерах. Вместе с веком от глаза отходит слезная точка, что ведет к слезотечению и мацерации кожи. В результате несмыкания глазной щели может развиться кератит с последующим помутнением роговицы.
Диагностика Диагностика заболеваний век несложна и доступна не только врачу, но и самому больному. При внешнем осмотре можно обнаружить изменения век. При более детальном осмотре с помощью бокового освещения можно обнаружить и более тонкие изменения со стороны век.
Лечение При спастическом вывороте — терапия, направленная на устранение его причины. При других видах выворота век показана операция. Прогноз в отношении зрения благоприятный. Косметический дефект и восстановление слезоотведения зависят от вида и степени выворота, а также своевременности и правильности операции.
ВЫПАДЕНИЕ ПРЯМОЙ КИШКИ
ОпределениеЭто заболевание, при котором прямая кишка выворачивается через задний проход наружу. Различают выпадение слизистой оболочки и полное выпадение всех слоев стенки прямой кишки. В 1/3 случаев встречается у детей раннего возраста, у взрослых 21–50 лет. Различают предрасполагающие и производящие факторы выпадения.
Этиология К первым относятся анатомические особенности расположения и строения таза, прямой кишки, ее фиксирующего аппарата, дистрофические нарушения. Во втором случае отмечается резкое повышение внутрибрюшного давления, усиление перистальтики кишки при поносе, повышение внутрибрюшного давления при физическом напряжении и запоре, ослабление эластичности, тонуса, травматические и дистрофические поражения мышечно-апоневротических образований диафрагмы таза и связочного аппарата прямой кишки.
Клиническая картина У детей при расстройстве пищеварения или запоре во время акта дефекации может сразу выпадать значительная часть прямой кишки, и тогда отчетливо виден цилиндр выпавшей кишки, покрытый слизистой оболочкой. Повторные выпадения во время дефекации могут превратиться в привычные и сохраниться во взрослом состоянии. У детей вправление кишки и устранение причинных факторов (понос или запор) могут привести к излечению. У взрослых выпадение склонно только к прогрессированию, сопровождается ощущением инородного тела в заднем проходе, болью, выделениями слизи и крови в результате раздражения и травмы слизистой оболочки выпавшей кишки, недержанием газов и кала (нарастающая слабость сфинктера). Выпадение прямой кишки у взрослых чаще развивается постепенно, начинаясь выпадением только слизистой оболочки прямой кишки, а затем становится полным. Выпадение значительной части прямой и сигмовидной кишок может сопровождаться нарушением кровообращения и омертвением стенки кишки.
Диагностика Диагноз не представляет трудностей при осмотре области заднего прохода, особенно при натуживании в положении больного на корточках. Степень недостаточности сфинктера, сопровождающая выпадение прямой кишки, определяется при пальцевом исследовании через задний проход и путем сфинктерометрии.
Лечение Лечение у детей преимущественно консервативное — вправление выпавшей кишки в положении лежа с приподнятыми ногами. После этого назначают постельный режим на 1–3 дня. Опорожнение кишечника в этот период должно происходить в положении лежа. У взрослых при отсутствии самопроизвольного вправления после акта дефекации рекомендуется коленно-локтевое положение с опущенной головой, сочетающееся с глубоким дыханием. При этом возможно легкое пальцевое пособие после смазывания вазелином. При прогрессировании заболевания и у взрослых лечение хирургическое. Прогноз у большинства детей благоприятный. У взрослых имеется склонность к рецидивам, даже после хирургической коррекции
♦ Г ♦
ГАЙМОРИТ
ОпределениеГайморит — это воспаление верхнечелюстной гайморовой пазухи. Различают гаймориты острый и хронический (в результате затяжного течения или частого повторения острого процесса под влиянием различных факторов).Этиология и патогенез Воспаление в гайморовой пазухе обусловлено тем, что отток содержимого пазухи затруднен в связи с расположением соустья с полостью носа в верхней трети ее средней стенки, а также тем, что воспаление корней четырех задних верхних зубов может переходить на пазуху; кроме того, верхнечелюстные пазухи самые большие и расположены ниже других. Причинами острого воспаления пазух чаще всего являются острое респираторное заболевание (см.), грипп (см.), переохлаждение, простуда, общие острые микробные инфекции, травмы. В причине возникновения и процессе развития воспалений придаточных пазух носа существенную роль играют болезнетворные микробы, хотя в ряде случаев отмечаются асептические синуситы. Гнойные формы заболевания чаще всего вызываются стрептококками и стафилококками, иногда пневмококками, грибами и др. При одонтогенных гайморитах (см.) патологическое отделяемое из пазухи, как правило, содержит микрофлору, в то время как аллергические, вазомоторные, гиперпластические, серозные формы обычно имеют асептическое отделяемое. В зависимости от этого различают катаральную (см.) и гнойную (см.) формы гайморита.
Патанатомия Патологоанатомические изменения при катаральном воспалении характеризуются отеком слизистой оболочки. При этом эпителий сохраняется. Соединительнотканные волокна собственного слоя слизистой оболочки раздвигаются экссудатом, образуя небольшие псевдокисты. Вокруг расширенных сосудов и слизистых желез возникает клеточная инфильтрация. Надкостница при катаральном воспалении в процесс не вовлекается. При остром гнойном гайморите больше выражена инфильтрация слизистой оболочки, отечность ее невелика, утолщенность выражена, поверхность покрыта гнойным отделяемым. В слоях слизистой оболочки интенсивно скапливаются круглоклеточные элементы, в основном лейкоциты. Воспалительный процесс чаще всего распространяется на надкостницу, в тяжелых случаях — и на кость. Патологоанатомические изменения при хроническом гайморите разнообразны. Различают экссудативные, продуктивные, альтеративные и смешанные типы морфологических изменений. Продуктивные процессы характерны для гиперпластической, полипозной форм и в значительной степени — для аллергической формы заболевания. В частности, при хроническом процессе чаще встречается скопление круглоклеточных элементов и псевдокист, в процесс вовлекается нижний слой слизистой оболочки — надкостница.
Клиническая картина Острый гайморит Субъективные и объективные признаки острого гайморита могут быть местными и общими. К местным симптомам часто относятся боль в области пораженной пазухи, лба, корня носа, скуловой кости. Она может быть различной интенсивности, усиливаться при прощупывании, смещаться в висок или на всю половину лица. Иногда возникает разлитая головная боль. Обычным местным симптомом является нарушение носового дыхания на стороне пораженной пазухи или (редко) с обеих сторон. Оно наступает вследствие набухания слизистой оболочки носа и резкого сужения носовых ходов. Иногда возникает слезотечение вследствие закупорки слезноносового канала. Выделения из носа обычно также односторонние; вначале бывают жидкими, серозными, затем становятся мутными, вязкими и гнойными; иногда они сразу бывают гнойными. Обоняние, как правило, нарушается, однако тяжесть других симптомов отодвигает эту жалобу на задний план. Общими симптомами являются повышение температуры тела до средних и высоких цифр, плохое общее самочувствие, которое еще больше ухудшается, если дыхание нарушается через обе половины носа и больной вынужден дышать ртом. Температурная реакция в одних случаях может начинаться с озноба и быть интенсивной в течение первых дней; иногда температура тела остается нормальной.
Хронический гайморит Гайморит хронический — это воспаление в гайморовой пазухе, возникающее в результате затяжного течения (более 6 недель) или частого повторения острого процесса под влиянием различных общих и местных факторов. Хроническое воспаление пазух, как правило, является продолжением острого процесса. Наиболее часто встречаются гнойная, гнойно-полипозная и полипозная формы хронического гайморита, несколько реже — катаральная аллергическая и пристеночногиперпластическая формы, редко — холестеатомная, казеозная, некротическая и озеозная формы заболевания. Характерным признаком экссудативных форм хронического процесса является различного вида и качества отделяемое, чаще из одной половины носа, которое может быть обильным в период обострения и незначительным — в период улучшения состояния больного. При гайморите гнойное отделяемое может быть густым или жидким, часто с запахом; слизисто-гнойное отделяемое плохо отсмаркивается, насыхает корками. Катаральный гайморит сопровождается обильными слизистыми тягучими выделениями, которые часто задерживаются в полости носа, подсыхают и образуют корки. При серозном аллергическом гайморите обычно бывает жидкое и серозное отделяемое, которое часто отходит порциями; скапливаясь в пазухе, оно быстро стекает в полость носа при определенных положениях головы. Иногда преобладающей жалобой является неприятный запах, ощущаемый самим больным. На стороне пораженной пазухи, как правило, отмечается нарушение обоняния вплоть до его потери, обычно респираторного характера. При двухсторонних хронических процессах в верхнечелюстных пазухах больные всегда жалуются на понижение обоняния. Головная боль, ограниченная или распространенная, появляется обычно лишь в период обострения процесса или при затруднении оттока содержимого из пазухи. В период ремиссии общее состояние и самочувствие больного остаются обычно удовлетворительными, наступает определенное привыкание к патологическим явлениям и нарушениям функции носа; в этот период больные редко обращаются за помощью. Обострение хронического процесса может сопровождаться повышением температуры тела, ухудшением самочувствия, появлением болезненной припухлости щеки и отека век, локальной или разлитой головной боли. Нередко в преддверии носа в связи с постоянными выделениями возникают повреждения кожи в виде трещин, мацерации (размягчения), припухлости, мокнутия; иногда здесь развивается экзематозное поражение.
Диагностика и дифдиагностика Острый гайморит Объективным симптомом острого гнойного гайморита является поступление гноя из верхнечелюстной пазухи в виде полоски в средний носовой ход. Если после удаления его из среднего носового хода он вновь появляется после наклона головы в противоположную сторону, можно сделать вывод, что гной поступает именно из верхнечелюстной пазухи. Нужно учитывать, что отделяемое может стекать из лобной пазухи — в этом случае оно появляется в среднем носовом ходе ближе кпереди при наклоне головы вниз. По данным опроса, жалоб и объективного осмотра не всегда можно отличить острый гайморит от фронтита и этмоидита, тем более — установить форму заболевания. Поэтому необходимо провести ряд дополнительных исследований: рентгенографию придаточных пазух носа, диагностическую пункцию и промывание верхнечелюстной пазухи. Показаниями к диагностической пункции верхнечелюстной пазухи являются субъективные и объективные признаки синусита и данные рентгенографии, с помощью которых выявляются не только патологические изменения в пазухе, но и особенности ее анатомии и топографии. Перед пункцией производят предотвращение кровотечения и анестезию слизистой оболочки нижнего и среднего носовых ходов двукратным смазыванием ее 5 %-ным раствором кокаина или 2 %-ным раствором дикаина с адреналином. Для пункции используется игла Куликовского, но могут быть применены и другие иглы, например игла для спинномозговой пункции. Осложнения гайморита могут быть местными и общими. К ним относятся абсцесс орбиты, внутричерепной абсцесс, менингит, сепсис.
Хронический гайморит При хроническом воспалении верхнечелюстной пазухи основываются на данных анамнеза, жалоб, осмотра и таких методах, как рентгенография придаточных пазух носа, диагностический прокол пазухи, а при неясной картине заболевания проводится контрастная рентгенография верхнечелюстной пазухи. Патологическое отделяемое из носа и пазухи направляют на исследование микрофлоры и ее чувствительности к антибиотикам. Дифференцировать хронический гайморит нужно с этмоидитом и фронтитом, в очень редких случаях — со сфеноидитом (см.). У взрослых необходимо исключить одонтогенную природу заболевания. Осложнениями болезни могут быть флегмона глазницы (см.), внутричерепной абсцесс (см.), менингит (см.) и сепсис (см.).
Лечение и профилактика Острый гайморит При остром гайморите местно применяют сосудосуживающие средства, физиотерапию и общую антибактериальную терапию. При отсутствии достаточно быстрого эффекта производят через день или два пункции пазухи с промыванием и введением смеси растворов пенициллина (300 тыс. ЕД) и стрептомицина (250 тыс. ЕД) (чаще всего). В детском, особенно младшем, возрасте при остром гнойном гайморите лучше избегать пункции пазухи в связи с небольшим ее объемом. Применяют самые разнообразные сосудосуживающие капли в нос, что обеспечивает раскрытие соустья пазухи с носом и лучший дренаж содержимого (галазолин, отривин, 1–3 %-ный раствор эфедрина). Вливание производят 3 раза в день по 5 капель в каждую половину носа или в одну половину носа (при одностороннем процессе). В первые же дни заболевания показано назначение на область верхнечелюстных пазух УВЧ или СВЧ ежедневно, всего 8—12 сеансов, а при тяжелом течении заболевания — одновременно ультрафиолетовое облучение, как местное, так и общее. Хорошее действие, особенно у детей, оказывает согревающий компресс на щеку. Антибактериальная терапия чаще проводится пенициллином по 1,5–2 млн ЕД в сутки, однако и другие антибиотики (линкомицин, эритромицин, тетрациклин и др.) дают хороший терапевтический эффект. Из общих средств применяются нестероидные противовоспалительные средства (аспирин) в период повышенной температуры, витаминотерапия, по показаниям — сердечно-сосудистые препараты. Больной нуждается в постельном режиме, а в тяжелых случаях — в стационарном лечении. Показаниями к срочному хирургическому вмешательству являются местные или общие осложнения: абсцесс (флегмона) орбиты, внутричерепной абсцесс, менингит, сепсис. В этих случаях производят радикальную операцию на верхнечелюстной пазухе; обычно через нее вскрывают решетчатый лабиринт, удаляют гнойный очаг, затем проводят антибактериальную терапию. Нередко хирургическое лечение показано при остром одонтогенном гайморите, когда он протекает с остеомиелитом верхнечелюстной кости.
Хронический гайморит Лечение хронического воспаления верхнечелюстных пазух следует начинать с устранения причин заболевания. В последующем применяют консервативную терапию, которая, как правило, предшествует хирургическим вмешательствам. При одонтогенных гайморитах следует вначале провести лечение зубов, после чего консервативное лечение часто оказывается эффективным. Следует иметь в виду, что радикальная операция на пазухе не приведет к излечению, если не устранена причина заболевания. При полипах в носу сначала производят удаление полипов, а затем приступают к лечению гайморита. Различные формы хронического гайморита требуют индивидуального лечебного подхода. Как правило, вне обострения общая антибактериальная терапия не показана, в период обострения она назначается соответственно чувствительности микрофлоры и в комбинации с другими лечебными мерами. При хроническом гнойном гайморите лечение следует начинать с применения консервативных методов, среди которых наиболее эффективна пункция пазухи с промыванием одним из дезинфицирующих растворов и введением в пазуху раствора антибиотика. Пункции проводятся через день, а при небольшом количестве гноя — через 2–3 дня. Общее количество пункций на курс лечения— 7—10. Одновременно с применением лечения пункциями назначают курс УВЧ или СВЧ-терапии на область пораженной пазухи; общее количество сеансов — 15; они назначаются в дни, когда пункция не производится. Одновременно с указанным лечением назначаются сосудосуживающие препараты по 5 капель в каждую половину носа 3 раза в день. Курс лечения сосудосуживающими каплями равен 7—10 дням. При катаральной, серозной и вазомоторной формах гайморита основой лечения также являются пункции и промывания пазухи, однако вводить в нее нужно не антибактериальные препараты, а вяжущие вещества (3 %-ный раствор колларгола или стероидные препараты вместе с антигистаминными средствами, например димедролом). Нередко приходится прибегать к относительно небольшому хирургическому вмешательству — вскрытию через носовой ход верхнечелюстной пазухи. При полипозной и гнойно-полипозной формах гайморита необходимо радикальное хирургическое вмешательство, после которого показана консервативная терапия для предупреждения рецидива полипоза. Холеастеатомные, казеозные и некротические гаймориты требуют хирургического лечения, при котором патологические ткани полностью удаляют. Профилактическими методами являются общеукрепляющая терапия, профилактика ОРВИ, санация полости рта и хронических очагов инфекции, своевременное обращение за специализированной помощью.
ГАЛАКТОЗЕМИЯ
ОпределениеГалактоземия — наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу.
Этиология и патогенез Галактоза, поступающая с пищей в составе молочного сахара — лактозы, подвергается превращению, но реакция превращения не завершается в связи с наследственным дефектом ключевого фермента. Галактоза и ее производная накапливаются в крови и тканях, оказывая токсическое действие на центральную нервную систему, печень и хрусталик глаза, что определяет клинические проявления болезни. Тип наследования галактоземии аутосомно-рецессивный.
Клиническая картина Заболевание проявляется в первые дни и недели жизни выраженной желтухой, увеличением печени, неврологической симптоматикой (судороги, нистагм, гипотония мышц), рвотой; в дальнейшем обнаруживается отставание в физическом и нервно-психическом развитии, возникает катаракта. Тяжесть заболевания может значительно варьировать; иногда единственным проявлением галактоземии бывают лишь катаракта или непереносимость молока. Один из вариантов болезни — форма Дюарте — протекает бессимптомно, хотя отмечена склонность таких лиц к хроническим заболеваниям печени. При лабораторном исследовании в крови определяется галактоза, содержание которой может достигать 0,8 г/л; специальными методами (хроматография) удается обнаружить галактозу в моче. Активность ферментов в эритроцитах резко снижена или не определяется, содержание ферментов увеличено в 10–20 раз по сравнению с нормой. При наличии желтухи нарастает содержание как прямого (диглюкуронида), так и непрямого (свободного) билирубина. Характерны и другие биохимические признаки поражения печени (гипопротеинемия, гипоальбуминемия, положительные пробы на нарушение коллоидоустойчивости белков). Значительно снижается сопротивляемость по отношению к инфекции.
Диагностика и дифдиагностика Позитивные пробы на сахар и обнаружение галактозы в моче в первые дни жизни, а также уровень ее в крови более 0,2 г/л требуют специального обследования ребенка на галактоземию. Существуют специальные методы определения активности ферментов, превращающихся в галактозу, которые выполняются в централизованных биохимических лабораториях. Дифференциальный диагноз проводится обычно с сахарным диабетом (см.). Тяжелые формы заканчиваются летально в первые месяцы жизни, при затяжном течении на первый план могут выступать явления хронической недостаточности печени или поражения центральной нервной системы.
Лечение и профилактика При подтверждении диагноза необходим перевод ребенка на питание с исключением главным образом женского молока. Для этого разработаны специальные продукты: сояваль, нутрамиген, безлактозный энпит. Рекомендуются заменные переливания крови, дробные гемотрансфузии, вливания плазмы. Из лекарственных препаратов показано назначение оротата калия, АТФ, кокарбоксилазы, комплекс витаминов. Показана высокая эффективность раннего выявления беременных в семьях высокого риска и внутриутробной профилактики, состоящей в исключении молока из диеты беременных. Учет семей риска позволяет рано, т. е. еще в доклинической стадии, подвергнуть специальному обследованию новорожденного и при положительных результатах перевести его на безлактозное вскармливание. Для раннего выявления предложены также специальные скрининг-программы массового обследования новорожденных.
ГАЛЛЮЦИНАТОРНЫЙ СИНДРОМ (ГАЛЛЮЦИНОЗ)
ОпределениеГаллюцинаторный синдром — синдром, который проявляется в течение достаточно продолжительного времени почти исключительно обильными галлюцинациями и протекает без нарушения сознания.
Этиология и клиническая картина Возникает при шизофрении, органических и сосудистых заболеваниях центральной нервной системы, симптоматических психозах, интоксикациях, эпилепсии. Различают слуховой, зрительный и тактильный (ощущение ползания под кожей червей, насекомых, микробов) галлюцинозы. При слуховом (наиболее часто встречающемся) галлюцинозе вербальные галлюцинации возникают в виде монолога или диалога; обманы восприятия носят комментирующий или приказной характер. В последнем случае возможны тенденции к самоповреждению или даже попытки самоубийства, а также акты агрессии по отношению к окружающим. В процессе развития заболевания нередко присоединяется обонятельный галлюциноз (дурные запахи, как представляется больному, исходят не только от собственного тела, но и от окружающих предметов); наблюдается также трансформация галлюцинаторного синдрома в параноидный. Диагноз устанавливается на основании клинических проявлений. Лечение направлено на основное заболевание, вызвавшее развитие галлюцинаторного синдрома (шизофрения и др.).
ГАНГРЕНА ГАЗОВАЯ
ОпределениеГазовая гангрена представляет грозную раневую инфекцию, вызываемую чаще патогенными клостридиальными анаэробами, характеризующуюся быстронарастающим и распространяющимся некрозом тканей, их распадом с образованием газов, тяжелой интоксикацией при отсутствии выраженного воспаления.
Этиология и патогенез Заболевание вызывается бактериями рода клостридии, которые обитают в почве и уличной пыли. Раны, загрязненные землей, имеющие раневые карманы и участки омертвевшей ткани, а также плохо кровоснабжаемые ткани и не подвергшиеся первичной хирургической обработке, предрасположены к газовой гангрене. Возбудитель быстро приобретает способность к заражению, выделяя газообразующие и растворяющие ткани экзо- и эндотоксины, которые способствуют быстрому распространению инфекции.
Газовая гангрена после огнестрельного ранения
Клиническая картина Уже через 6 ч после приобретения микробом способности к заражению возникают нарушения общего состояния с тахикардией и лихорадкой. Кожные покровы серо-синего цвета. Рана резко болезненна, края ее бледные, отечные, безжизненные, дно раны сухое. Окраска видимых в ране мышц напоминает вареное мясо. При надавливании на края раны из тканей выделяются пузырьки газа с неприятным сладковато-гнилостным запахом. При прощупывании определяется типичное похрустывание. Состояние больного быстро ухудшается, наступает шок. По особенностям клинического течения газовая гангрена подразделяется на ряд форм. 1. В зависимости от топографии процесса различают следующие формы: поверхностную, глубокую с поражением мышц. 2. В зависимости от быстроты прогрессирования различают молниеносную, быстро распространяющуюся и медленно распространяющуюся формы. 3. В зависимости от клинических проявлений различают: отечную, эмфизематозную, гнилостно-гнойную, смешанную формы.
Диагностика и дифдиагностика Диагноз ставится на основании характерной раны, общей интоксикации. Диагноз подтверждается рентгенологически (определяется «пористость» мышечных тканей) и микроскопически (обнаружение клостридий в раневом отделяемом). Дифференциальный диагноз проводят с фасциальной газообразующей флегмоной (нет поражения мышц) и путридной (гнилостной) инфекцией.
Лечение и профилактика «Лампасные» разрезы кожи, мышц, оболочек с иссечением омертвевших тканей и подозрительных на некроз участков. Налаживание оттока гноя из раны с промыванием раствором перекиси водорода и антибиотиков; рану оставляют открытой. Абсолютный покой конечности. Пенициллин до 20–40 млн ЕД в сутки (2–3 раза в день внутривенно) в течение 10–14 дней, тетрациклин. Противогангренозная сыворотка и анатоксин неэффективны как при лечении, так и при проведении профилактики газовой гангрены. При быстром нарастании интоксикации — гильотинная ампутация конечности. Эффективно воздействие кислорода под давлением, однако не исключено хирургическое удаление очага инфекции из раны, показаниями к которому являются клинические и рентгенологические признаки газовой гангрены с микроскопически доказанным наличием клостридий в ране. В настоящее время применяется гипербарическая оксигенация тканей в специальных барокамерах. Профилактика заключается в своевременной квалифицированной первичной хирургической обработке всех загрязненных ран.
ГАСТРИТ
ОпределениеГастрит — воспаление слизистой оболочки (в ряде случаев и более глубоких слоев) стенки желудка.Выделяют острый и хронический гастрит. Острый гастрит — острое воспаление слизистой оболочки желудка. Хронический гастрит проявляется хроническим воспалением слизистой оболочки (в ряде случаев и более глубоких слоев) стенки желудка.
Этиология и патогенез Острый гастрит Острый гастрит — воспалительный процесс, поражающий преимущественно слизистую оболочку желудка. Данное заболевание может развиться в результате воздействия различных факторов. Острый гастрит встречается в любом возрасте, и, как правило, можно проследить его связь с определенным провоцирующим фактором. Особенностью данной нозологической формы является сочетание ранимости слизистой оболочки желудка и чрезвычайно большого количества факторов, приводящих к ее повреждению. Несмотря на множественность и разнообразие, причины, вызывающие воспаление желудка, можно объединить в две большие группы: — экзогенные, или ирритативные (гастрит развивается в ответ на действие внешних факторов); — эндогенные, или гематогенные, связанные с внутренним воздействием на слизистую оболочку желудка патологических агентов, исходящих из самого организма (острые инфекции, нарушения обмена веществ, распад белков организма при ожогах и облучении, нарушения психики и т. д.). К числу основных экзогенных причин гастритов относятся: прием недоброкачественной пищи, переедание, употребление очень острых, жирных, слишком горячих или чрезмерно холодных, трудноперевариваемых пищевых продуктов, крепких спиртных напитков и т. п. (алиментарный гастрит). Следует отметить, что развитие воспалительного процесса в слизистой оболочке желудка может быть спровоцировано таким банальным фактором, как плохое пережевывание пищи. Каждому из нас известно выражение «набить желудок» и то неприятное ощущение тяжести и дискомфорта в подложечной области, которое возникает после быстрой, торопливой еды. Вот вам и одна из причин гастрита. С этой точки зрения понятна мудрость тибетских лам, поражающих нас долголетием и чрезвычайно длительной молодостью, — ведь они «пережевывают» даже обычную питьевую воду! Девиз йогов: пить твердую пищу и жевать жидкую. Еще наш великий русский физиолог И. П. Павлов доказал, что процесс жевания рефлекторно подготавливает весь желудочно-кишечный тракт к пищеварению: усиливается перистальтика желудка и кишечника, активно выделяются пищеварительные соки и ферменты, что улучшает пищеварение, способствуя извлечению максимальной пользы из пищи. Для хорошего пережевывания пищи нужны крепкие, здоровые зубы. Отсюда следует необходимость тщательного ухода за ними. Причиной гастрита может явиться нарушение режима питания (переедание, особенно после длительного перерыва между приемами пищи) и сухоядение.Злоупотребление алкогольными напитками и курение также могут стать причиной воспаления желудка. В ряду факторов, провоцирующих развитие гастрита, следует отметить прием недоброкачественной, инфицированной пищи, так называемые пищевые токсикоинфекции: коли-инфекции, сальмонеллезы, ботулизм, стафилококковые токсикоинфекции и др. Широкое применение фармакологических препаратов в клинической практике, длительный, а иногда и пожизненный прием различных лекарств не могут не вызвать повреждения слизистой оболочки типа острого гастрита. Известна роль салицилатов, нестероидных противовоспалительных препаратов, вызывающих острый гастрит с эрозиями слизистой оболочки желудка, осложняющимися иногда тяжелыми кровотечениями. Тяжелые диффузные повреждения слизистой оболочки желудка могут быть спровоцированы длительным приемом ряда лекарственных средств. В ряду подобных провокаторов следует назвать салициловые препараты, хинин, дигиталис, атофан, мышьяк, сульфаниламиды, антибиотики, йод, бром, стероидные гормоны, бутадион, инсулин и др. Тяжелые аллергические гастриты возникают при индивидуальной повышенной чувствительности к некоторым медикаментозным средствам. Индивидуальная устойчивость слизистой оболочки желудка играет важную роль в происхождении гастритов. Известен факт существования так называемых «луженых» желудков, способных переварить любую пищу. Наряду с ними есть желудки, чувствительные к самым обычным блюдам, например молоку, яйцам, клубнике, ракам, дыням, томатам, икре, грибам и т. д. Все вышеперечисленные экзогенные причины вызывают гастрит при непосредственном контакте со слизистой оболочкой желудка или при гематогенном воздействии на нее. В последнем случае происходит предварительное попадание этиологического агента в кровь, в составе которой, т. е. гематогенно, он доставляется к слизистой оболочке желудка и вызывает ее воспаление. При эндогенных гастритах как бактериальные токсины, так и патологические продукты нарушенного обмена веществ оказывают повреждающее действие при гематогенном воздействии на слизистую оболочку желудка. У здоровых людей устойчивость слизистой оболочки желудка к действию токсических факторов весьма высока. Она даже превышает сопротивляемость кожи. Под воздействием ряда предрасполагающих факторов, изменяющих иммунный статус макроорганизма, устойчивость слизистой оболочки желудка к действию болезнетворных агентов значительно снижается. К числу подобных факторов следует отнести нервно-психическое и физическое переутомление, отсутствие полноценного отдыха, профессиональные вредности, конституциональные и наследственные особенности организма и перенесенные заболевания. К внутренним причинам развития гастритов относятся острые и хронические инфекционные заболевания (корь, скарлатина, дифтерия, брюшной тиф, грипп, сыпной тиф, абсцесс легких, туберкулез и т. д.). В возникновении этой группы гастритов ведущую роль играет гематогенный занос (с кровотоком) в стенку желудка болезнетворных микробов и выделяемых ими токсических веществ. Кроме того, при инфекционных заболеваниях образуется значительное количество токсических продуктов белкового распада, которые вместе с бактериальными токсинами попадают гематогенно в стенку желудка и вызывают ее воспаление. Причиной гастрита могут явиться ожоги, отморожения. Эти патологические состояния сопровождаются циркуляторными расстройствами, гипоксией (дефицитом кислорода) слизистой оболочки желудка и поступлением в кровяное русло токсических веществ, что составляет предрасполагающую основу развития гастрита при данных заболеваниях. Среди внешних факторов развития воспаления желудка видное место занимают заболевания желез внутренней секреции и нарушения обмена веществ: сахарный диабет, подагра, тиреотоксикоз и др., при которых также имеет место гематогенное патологическое воздействие токсических веществ (продуктов нарушенного обмена веществ) на слизистую оболочку желудка. В механизме развития гастритов, возникающих под влиянием психогенных факторов, отрицательных эмоций и аффективных состояний, ведущую роль играют нарушение кровообращения в желудке, циркуляторная гипоксия его слизистой оболочки и функциональные расстройства, т. е. нарушение секреторной и моторной функций желудка. Среди внешних причин, вызывающих тяжелейшие коррозивные гастриты, следует особо отметить отравления некоторыми ядовитыми веществами: крепкими кислотами (серной, соляной, азотной, хромовой, уксусной, фосфорной, карболовой, муравьиной и др.), едкими щелочами (нашатырным спиртом, каустической содой, едким калием, едким натром), сулемой, цианистым калием, мышьяком, хлороформом, лизолом, высокими концентрациями алкоголя и большими дозами медикаментов. Эти вещества могут быть приняты по ошибке или с целью суицида. Вышеперечисленные ядовитые вещества не только вызывают сильное раздражение слизистой оболочки желудка, но в определенной концентрации обладают выраженным некрозирующим действием. При воздействии концентрированных кислот развивается коагуляционный (сухой) некроз слизистой оболочки желудка; при контакте с едкими щелочами возникает некроз колликвационного (мокнущий, с образованием пузырей) вида. Степень и распространенность поражения при этом зависят от концентрации и времени пребывания отравляющего вещества в желудке. В легких случаях слизистая оболочка может восстанавливаться, в тяжелых случаях развиваются грубые рубцовые изменения. В группе острых гастритов следует выделять следующие клинические формы: — острый простой, экзогенный и эндогенный гастрит; — флегмонозный гастрит; — коррозивный гастрит. Морфологически выделяют следующие разновидности острых гастритов: — катаральный гастрит; — фибринозный гастрит; — некротический гастрит; — гнойный гастрит. Представляет интерес рассмотрение механизмов возникновения отдельных клинических симптомов гастритов. Снижение аппетита, наблюдаемое у ряда больных, чаще всего бывает обусловлено гипотонией мышц желудка и снижением его секреторной функции. Недостаточная секреция пепсина и соляной кислоты в железистом аппарате желудка, а также чрезмерная эвакуаторная функция, обусловленная усилением его моторики, лежат в основе развития патологического симптомокомплекса нарушения желудочных функций, характерного для воспалений желудка. Недостаточность кардии приводит к рефлюксу (забросу) в пищевод кислого содержимого желудка, вызывающего раздражение нервных окончаний преимущественно дистального отдела пищевода. Вследствие этого у больного возникает изжога, т. е. ощущение жжения за грудиной. Гастриты часто сопровождаются таким клиническим симптомом, как отрыжка — внезапное, непроизвольное выхождение через рот газов из желудка в пищевод. Ее возникновение связано с тем, что функциональные или органические поражения стенки желудка приводят к напряжению и легким антиперистальтическим движениям пищевода и желудка параллельно с кратковременным или длительным открытием кардии. Эвакуаторная недостаточность желудка, являющаяся следствием его воспаления, может привести к появлению срыгиваний — забросу в глотку или полость рта небольшого количества пищеводного или желудочного содержимого. В основе поносов, часто наблюдающихся при гастритах, лежит нарушение процессов секреции желудочных желез. Частый симптом гастритов — тошнота (неприятное ощущение в верхней части живота, которое может сопровождаться дурнотой, слюнотечением, бледностью кожных покровов, потоотделением, головокружением и даже полуобморочным состоянием), часто предшествующая рвоте. Ее возникновение вызвано раздражением блуждающего и чревного нервов с последующей передачей импульсов в рвотный центр и обратной патологической импульсацией, вызывающей дискинезию верхних отделов пищеварительного тракта. Рвота при гастритах представляет собой сложнорефлекторный акт, связанный с раздражением расположенного в продолговатом мозге рвотного центра патологическими импульсами, исходящими с рецепторного аппарата слизистой оболочки воспаленного желудка, и токсическими веществами, поступившими в кровяное русло. Раздражение рвотного центра вызывает обратную импульсацию, обусловливающую развитие ряда последовательных процессов: опущение диафрагмы, закрытие голосовой щели, сокращение пилорической части желудка, расслабление тела желудка и его кардиального сфинктера, возникновение антиперистальтических волн. Вследствие сокращения диафрагмы и мышц брюшного пресса повышается внутрибрюшное и внутрижелудочное давление. Результатом перечисленных процессов является быстрый выброс содержимого желудка в рот через пищевод. Возникновение болей при острых гастритах связано с механическим раздражением содержимым растянутого желудка патологически чувствительных внутренних рецепторов, расположенных в его слизистой оболочке.
Хронический гастрит Хронический гастрит представляет собой длительно протекающее заболевание, характеризующееся развитием ряда морфологических изменений слизистой оболочки желудка: увеличением ее круглоклеточной инфильтрации, нарушением восстановления эпителия желез с последующей постепенной атрофией эпителиальных клеток, замещением нормальных желез соединительной тканью и их перестройкой по кишечному или пилорическому типу. Прогрессирующие структурные изменения слизистой оболочки желудка сопровождаются нарушениями основных его функций, отражаясь в первую очередь на характере секреции соляной кислоты и пепсина. Хронические гастриты бывают двух видов: — гастриты как основное первичное заболевание; — вторичные гастриты. Общепринятой классификацией хронических гастритов в настоящее время является классификация хронических гастритов по С. М. Рыссу (1995 г.), в которой учитываются этиологические факторы и морфологические особенности хронического гастрита, функциональное состояние желудка, клинические проявления и течение заболевания. Выделяют: I. По этиологическому признаку: 1. Экзогенные гастриты, в основе которых лежат: — длительные нарушения ритма и режима питания, качественного и количественного состава пищи; — злоупотребление алкоголем и никотином; — действие термических, химических, механических и других агентов; — влияние профессиональных вредностей — систематическое употребление густо приправленного пряностями мяса (консервированных продуктов), заглатывание щелочных паров и жирных кислот (на мыловаренных, маргариновых и свечных заводах), хлопковой, угольной, металлической пыли; работа в горячих цехах и др. 2. Эндогенные гастриты: — нервно-рефлекторный (патологическое рефлекторное воздействие других пораженных органов — кишечника, желчного пузыря, поджелудочной железы); — гастрит, связанный с нарушениями вегетативной нервной системы и патологией эндокринных органов (гипофиз, надпочечники, щитовидная железа); — гематогенный гастрит (при хронических инфекциях, нарушениях обмена веществ); — гипоксемический гастрит (хроническая недостаточность кровообращения, пневмосклероз, эмфизема легких, легочное сердце); — аллергический гастрит. II. По морфологическому признаку: — поверхностный гастрит; — гастрит с поражением желез без атрофии эпителия; — атрофический гастрит: а) умеренный; б) выраженный; в) с признаками перестройки эпителия; г) атрофически-гиперпластический; д) прочие редкие формы атрофического гастрита (с явлениями жировой дегенерации, без основы подслизистого слоя с образованием кист); — гипертрофический гастрит; — антральный гастрит; — эрозивный гастрит. III. По функциональному признаку: — гастрит с нормальной секреторной функцией; — гастрит с умеренно выраженной секреторной недостаточностью: отсутствие свободной соляной кислоты натощак, снижение ее концентрации после пробного раздражителя ниже 20 титр. ед.; уменьшение концентрации пепсина после пробного раздражителя от 25 до 10 г/л, концентрация мукопротеина ниже 23 %, положительная ответная реакция на гистамин после первого или повторного введения; нормальное содержание уропепсиногена; — гастрит с резко выраженной секреторной недостаточностью: отсутствие свободной соляной кислоты во всех порциях желудочного сока, снижение концентрации пепсина как до, так и после введения пробного раздражителя ниже 10 г/л или полное его отсутствие; отсутствие или следы мукопротеина; гистамин-рефрактерная реакция после первого и повторного введения гистамина; снижение содержания уропепсиногена. IV. По клиническому течению: — компенсированный гастрит (или фаза ремиссии): отсутствие клинических симптомов, нормальная секреторная функция или умеренно выраженная секреторная недостаточность; — декомпенсированный гастрит (или фаза обострения): отчетливые клинические симптомы (с тенденцией к прогрессированию) стойкие, трудно поддающиеся терапии, резко выраженная секреторная недостаточность. V. Специальные формы хронических гастритов: — ригидный гастрит; — гигантский гипертрофический гастрит (болезнь Менетрие); — полипозный гастрит. VI. Хронический гастрит, сопутствующий другим заболеваниям: — хронический гастрит при анемии Аддисона-Бирмера; — хронический гастрит при язве желудка; — хронический гастрит при злокачественных новообразованиях. Одновременно с воспалением желудка при хроническом гастрите поражаются и другие внутренние органы. Хронические гастриты являются многофакторными заболеваниями. Аналогично острым воспалениям желудка, хронический процесс могут вызвать как внешние, так и внутренние факторы. В ряде случаев хронический гастрит развивается после перенесенного острого воспаления желудка. В других случаях он является самостоятельным заболеванием и развивается в ответ на длительное воздействие раздражающих факторов. Среди них важную роль играет переедание, употребление грубой, острой, трудноперевариваемой пищи, злоупотребление пряностями, копченостями, жирной пищей, еда всухомятку, поспешная еда с плохим пережевыванием пищи, нарушение ритма и режима питания, систематический прием крепких алкогольных напитков, курение. В возникновении хронического гастрита имеет значение качество употребляемой пищи: ее низкая калорийность, несбалансированность, недостаточный белковый и витаминный состав, недостаток аскорбиновой и никотиновой кислот, тиамина, рибофлавина, пиридоксина, витамина А. Отсутствие в пищевом рационе полноценных белков приводит к атрофическим процессам в слизистой оболочке желудка. Имеет значение температура пищи и принимаемой жидкости. Установлено, что горячая вода вызывает повреждения слизистой оболочки желудка. К важным внешним факторам относятся профессиональные вредности. Заболевание часто развивается у рабочих горячих цехов, а также у работников мыловаренных, маргариновых, свечных заводов в результате постоянного раздражающего действия на слизистую оболочку желудка паров щелочей и жирных кислот. Хроническое воспаление желудка может быть следствием хронического свинцового отравления, заглатывания металлической, хлопковой, силикатной и угольной пыли. Профессиональные хронические гастриты часто встречаются у работников пищевой промышленности, у рабочих консервных заводов. Развитие хронического воспаления желудка у этих категорий рабочих связано с употреблением большого количества приправленного пряностями мяса, рыбы и т. д. Длительный прием ряда лекарственных препаратов (салицилаты, двууглекислый натрий, дигиталис, эуфиллин, слабительные средства, сульфаниламиды, препараты ртути и др.) может провоцировать развитие хронического гастрита в результате их раздражающего действия на слизистую оболочку желудка и изменение его секреторной функции. В развитии обострений хронического гастрита существенная роль принадлежит так называемым пищевым аллергенам (нутритивная аллергия), а также дефектам в нейрогуморальной регуляции желудочных функций. Патологические процессы в нейрогормональной системе относятся к группе внутренних причин, вызывающих хронический воспалительный процесс в стенке желудка. Доказано, что невроз желудка может являться причиной его «катара» в результате вегетативных нарушений желудочной секреции, которые, в свою очередь, приводят к морфологическим изменениям в слизистой оболочке желудка. Немаловажную роль в происхождении хронических гастритов играют рефлекторные влияния, исходящие с патологически измененных внутренних органов. Известны случаи хронических гастритов, обусловленных заболеваниями поджелудочной железы, желчного пузыря, кишечника и пр., а также глистными инвазиями. Хронические гастриты могут развиться вследствие расстройства кровообращения, нарушения кровоснабжения тканей желудка при заболеваниях сердечно-сосудистой системы, пневмосклерозе, эмфиземе легких, болезнях почек, печени, системы крови, органов внутренней секреции и обмена веществ (ожирение, подагра, сахарный диабет, дефицит железа в организме). Секреторная деятельность желудка нарушается и при заболеваниях надпочечников и щитовидной железы. К группе внутренних причин развития хронических гастритов следует отнести хронические инфекции: тонзиллиты, гаймориты, аднекситы, холециститы, кариозные зубы, хронический аппендицит, сифилис, туберкулез, малярию. Меньшую роль играют острые инфекции: грипп, дифтерия, паратифы, энтероколиты и т. д. К группе внешних провокаторов развития хронических гастритов относятся аллергические заболевания, приводящие к желудочной гиперсекреции. Таким образом, хронический гастрит вызывается многими факторами, каждый из которых обусловливает те или иные особенности механизма развития заболевания. Однако, несмотря на различия в механизмах развития патологического процесса, в основе всех форм хронического воспаления желудка лежит структурное повреждение его слизистой оболочки. Повреждающий агент может действовать на нее непосредственно, или его действие опосредовано поступлением через ток крови. Структурные нарушения в слизистой оболочке желудка, спровоцированные нарушениями нейроэндокринной регуляции, следуют за стадией функциональных изменений в желудке, вызванных этими нарушениями. Структурная перестройка в стенке желудка, вызванная нарушениями режима и ритма приема пищи, следует за стадией функциональных нарушений желудочной секреции. Токсические вещества, поступая в желудок, разрушают его защитный слизистый барьер и далее вызывают структурные повреждения слизистой оболочки. Дисбаланс нервно-рефлекторной регуляции желудочной секреции, имеющий место при ряде гормональных и нервных заболеваний, приводит первоначально к желудочной гиперсекреции, которая впоследствии сменяется истощением главных желез желудка. Одновременно происходит структурная перестройка слизистой оболочки желудка, развитие хронического гастрита с секреторной недостаточностью. В механизме развития хронических гастритов, развивающихся при инфекционных заболеваниях и нарушениях обмена веществ, ведущая роль принадлежит повреждающему действию, оказываемому на слизистую оболочку желудка токсическими веществами, поступившими гематогенным путем. В основе механизма развития хронического гастрита при заболеваниях, сопровождающихся гипоксией тканей (недостаточность кровообращения, железодефицитная анемия, пневмосклероз и др.), лежит атрофия слизистой оболочки желудка, вызванная нарушением тканевого дыхания и кислородным голоданием клеточных элементов железистого аппарата желудка. Следствием нарушения секреторной и всасывающей функций желудка и дисбактериоза, наблюдающихся при хронических гастритах, являются полигиповитаминоз и авитаминоз (А, В, С и др.). Возникновению последнего способствуют также длительная щадящая диета и применение ряда медикаментозных препаратов, в частности сульфаниламидов, разрушающих витамины. Ахилия (отсутствие желудочного сока) приводит к нарушению процесса всасывания поступившего с пищей железа, что обусловливает развитие анемии. При локализации патологического процесса в фундальном отделе желудка происходит гибель клеток, продуцирующих гастромукопротеин, что приводит к развитию гипохромной анемии. Наиболее распространенной за рубежом является классификация хронического гастрита, предусматривающая выделение двух форм заболевания: хронического гастрита типа А и хронического гастрита типа В. Хронический гастрит типа А, обусловленный иммунными (аутоиммунными) нарушениями, характеризуется первичными атрофическими изменениями слизистой оболочки фундального отдела желудка, тогда как слизистая оболочка антрального отдела длительное время остается незатронутой. Хронический гастрит А характерен для В12-дефицитной анемии (классическое аутоиммунное заболевание с появлением аутоантител к слизистой оболочке желудка, обкладочным париетальным клеткам). Однако аутоиммунный гастрит А может быть и не связан с В12-дефицитной анемией. При гастрите А увеличивается количество П-клеток, продуцирующих гастрин. Повышение содержания гастрина в желудочном содержимом и в крови обусловлено тем, что слизистая оболочка желудка атрофирована, соляной кислоты в желудочном содержимом нет и по принципу обратной связи возрастает продукция гастрина. Хронический гастрит типа В, который обнаруживается у подавляющего числа больных, патогенетически не связан с иммунными механизмами и представляет собой хронический гастрит антрального отдела желудка с последующим постепенным распространением («антрокардиальная экспансия») на фундальный отдел. Хронический гастрит типа В связан с инфицированием пилорическими кампилобактериями (хеликобактер пилори). В последние годы у части больных хроническим гастритом типа В обнаружены аутоантитела против гастринобразующих клеток, в антральном отделе выявляется уменьшение популяции G-клеток, снижение концентрации гастрина в ткани желудка. В отличие от аутоиммунного гастрита А антитела против париетальных клеток при гастрите В отсутствуют. В дальнейшем была описана промежуточная форма хронического гастрита (тип АВ), которая включает в себя сочетанное поражение слизистой оболочки антрального и фундального отделов желудка и является, по мнению некоторых авторов, наиболее распространенной формой заболевания. Данная классификация впоследствии была дополнена еще одной формой хронического гастрита (тип С), представляющей собой поверхностный гастрит фундального отдела желудка у больных с грыжами пищеводного отверстия диафрагмы. По другим данным, гастритом С обозначается хронический гастрит, развивающийся в пилорическом отделе желудка в результате дуаденогастрального рефлюкса желчи (такая форма гастрита встречается, в частности, у больных, перенесших операцию резекции желудка). Согласно «Сиднейской классификации», при формулировке диагноза хронического гастрита учитываются топография поражения (антральный или фундальный гастрит, пангастрит), причина гастрита (гастрит, ассоциированный с хеликобактериальной инфекцией; аутоиммунный гастрит, идиопатический гастрит, медикаментозный гастрит), а также его морфологический вариант (острый гастрит, хронический гастрит или особые формы гастрита). К особым формам гастрита отнесены гранулематозный гастрит (в том числе при болезни Крона, туберкулезе, саркоидозе), эозинофильный, лимфоцитарный и реактивный гастрит. В последнюю форму включаются, в частности, и рефлюкс-гастрит.
Клиническая картина Острый простой гастрит Признаки заболевания появляются спустя 6—12 ч после приема пищи (недоброкачественные пищевые продукты, крепкие алкогольные напитки; обильная, жирная пища, чрезмерно горячие или слишком холодные продукты и т. д.). Заболевание развивается бурно или постепенно в зависимости от характера, степени и длительности воздействия причинного фактора, а также от уровня индивидуальной чувствительности организма больного. Появляются нарастающая общая слабость, неприятный, горький вкус во рту, тошнота, отрыжка застоявшейся, разложившейся пищей. Беспокоят чувство тяжести, распирание и боль в подложечной области, головная боль. Иногда в результате гастроспазма появляются схваткообразные боли в животе. Аппетит отсутствует. Может возникать избирательная потребность в соленой, кислой или холодной (вода, кусочки льда) пище. Вскоре присоединяется рвота съеденной пищей. Часто рвота носит повторный характер, сопровождается болями в животе и приносит временное облегчение. Рвотные массы имеют неприятный кисловатый запах. Они содержат непереваренные пищевые частицы, примеси слизи и желчи. Иногда в рвотных массах присутствует кровь. После многократной рвоты и освобождения желудка от содержимого в рвотных массах появляется перемешанная с желчью тягучая слизь. Рвота обычно сопровождается бледностью кожных покровов, повышенным потоотделением, резкой слабостью, снижением артериального давления. У некоторых больных общее состояние страдает мало, у других наблюдается тяжелое общее состояние, вплоть до развития коллапса. Отмечается бледность кожных покровов, кожа влажная. Язык обложен серым или серовато-желтым налетом. Ощущается неприятный запах изо рта больного. Живот вздут, при пальпации болезнен, особенно в эпигастральной области, отмечается метеоризм. У ряда больных повышается температура тела (от субфебрильных до фебрильных цифр). Может появиться понос. Отмечается отвращение к пище, одно упоминание о которой может вызывать у больного приступ тошноты и рвоты. В ряде случаев, особенно при аллергической природе заболевания, гастрит приобретает тяжелое течение, часто сопровождающееся образованием множественных поверхностных эрозий. При этом к диспепсическим расстройствам присоединяются симптомы интоксикации: головная боль, головокружение, сокращение подвижности, высокая температура. Отмечаются тахикардия, глухость сердечных тонов. Артериальное давление снижается. Может развиться коллапс. Обильная многократная рвота вызывает гипохлоремию из-за потери жидкости и солей. При этом появляются судороги в икроножных мышцах. Значительная потеря жидкости (за счет рвоты и поноса) приводит к так называемому «сгущению» крови, что проявляется повышенным содержанием гемоглобина и эритроцитов. Кроме того, при остром гастрите в крови отмечается нейтрофильный лейкоцитоз, ускорение СОЭ, снижение уровня хлоридов и бикарбонатов. Количество мочи понижено. Может отмечаться небольшое количество белка в моче. Иногда появляется уробилинурия, свидетельствующая о токсическом поражении печени. Если причиной заболевания послужила пищевая токсикоинфекция, значительное место в его клинической картине занимает энтерит, т. е. воспаление тонких кишок, сопровождающееся поносом. В начале течения острого гастрита отмечается повышение желудочной секреции и кислотности содержимого желудка. Далее гиперсекреторная активность сменяется угнетением функций желудочных желез. Двигательная и эвакуаторная функции желудка резко замедлены из-за его гипотонии и атонии, а также вследствие спазма привратника. Острый алиментарный гастрит имеет непродолжительное, благоприятное течение. Его длительность редко превышает 4–5 дней. При своевременном лечении симптоматика заболевания быстро стихает, и наступает клиническое выздоровление. В среднем острый простой гастрит длится 5 дней. Однако патоморфологические изменения в стенке желудка сохраняются на протяжении более длительного времени. Иногда после наступившего выздоровления больного долго беспокоит повышенная чувствительность к грубой пище. Нередко происходит переход заболевания в хроническую форму. Острый простой гастрит часто развивается как осложнение инфекционных заболеваний, а также при распаде собственных белков организма, спровоцированном обширными ожогами и действием ультрафиолетового и рентгеновского облучений. В этом случае воспаление желудка является ответом на гематогенный занос в его стенку болезнетворных микробов и ядовитых продуктов разрушения белка. При этой форме эндогенного гастрита в клинической картине на первый план выступает симптоматика того заболевания, которое послужило причиной его развития. Аналогичное превалирование в клинической картине признаков основного заболевания наблюдается при эндогенных гастритах, спровоцированных нарушением обмена веществ (сахарный диабет, подагра, тиреотоксикоз, уремия, холемия и т. д.).
Острый эрозивный гастрит Одной из разновидностей острых экзогенных гастритов является острый эрозивный гастрит. Возникновение эрозивного острого гастрита связано с приемом недоброкачественных пищевых продуктов или лекарственных препаратов, например больших доз салицилатов. Заболевание начинается с появления диспепсических расстройств (тошнота, рвота), болей в подложечной области и желудочного кровотечения. Иногда начало заболевания знаменуется желудочным кровотечением без других симптомов гастрита. Кровотечение обусловлено наличием на слизистой оболочке желудка множественных эрозий, а также пропотеванием крови из воспаленной слизистой оболочки в просвет желудка. Склонность к желудочному кровотечению отличает эрозивный гастрит от других разновидностей острого гастрита.
Флегмонозный гастрит (флегмона желудка) Эта редкая форма острого гастрита отличается чрезвычайной тяжестью течения и высокой летальностью. Чаще встречается у страдающих алкоголизмом мужчин. Первичный флегмонозный гастрит имеет место в случае внедрения инфекции через дефект в слизистой оболочке желудка, что может наблюдаться при язве, раке желудка, его травматическом повреждении, дивертикуле и т. п. При вторичной флегмоне желудка болезнетворные бактерии проникают в его стенку с соседних органов или заносятся с током крови, т. е. гематогенным путем. Вторичный флегмонозный гастрит встречается при таких септических заболеваниях, как рожа, эндокардит, сепсис, а также при фурункулезе, брюшном тифе, оспе, после удаления инфицированного зуба и хирургических вмешательств на желудке. Важную роль в возникновении этой формы гастрита играют предрасполагающие факторы: алкоголизм, длительное недоедание, травмы, перенесенные острые инфекционные заболевания, очаги хронических инфекций в организме, хронический гастрит с секреторной недостаточностью. Флегмонозный гастрит характеризуется развитием бактериального абсцесса стенки желудка. При этом имеет место преимущественное распространение гноя в подслизистой оболочке. Бактериальными агентами, вызывающими гнойный процесс в желудке, являются гемолитический стрептококк, стафилококк, кишечная палочка, протей, пневмококк, возбудитель газовой гангрены и другие болезнетворные микроорганизмы. Процесс может развиваться постепенно, но чаще имеет бурное течение и черты септического заболевания. Отмечается лихорадка с ознобом, температурная кривая носит ремиттирующий, или гектический, характер. Больного беспокоят тошнота, рвота. В рвотных массах содержится примесь желчи, реже — крови и гноя. Может развиться желудочное кровотечение. Больной беспокоен или находится в прострации. Состояние его тяжелое, с тенденцией к прогрессивному ухудшению. Наблюдаются жажда, интенсивные разлитые боли в животе, понос. Отмечается вздутие живота, его пальпация вызывает боль. В подложечной области пальпаторно определяется мышечное напряжение. В дальнейшем присоединяются явления перитонита и сепсиса. Развивается токсическая сердечно-сосудистая недостаточность. В ряде случаев флегмона желудка осложняется развитием гнойного флебита вен портальной системы, образованием множественных абсцессов печени, желудочным кровотечением. В крови больного определяется резкий нейтрофильный лейкоцитоз со сдвигом влево и токсической зернистостью лейкоцитов. Диагностика заболевания трудна. Часто ошибочно ставят диагноз панкреатита, абсцесса печени, перфоративной язвы желудка или двенадцатиперстной кишки или других острых заболеваний органов брюшной полости, характеризующихся клинической картиной «брюшной катастрофы».
Острый коррозивный гастрит При попадании в желудок крепких кислот, едких щелочей и других ядовитых веществ у больного сразу же после их проглатывания возникает явление острого фарингоэзофагита. Появляются боли и чувство жжения во рту, разлитая боль по ходу пищевода, затруднение глотания, обильное слюнотечение. К симптомам острого фарингоэзофагита быстро присоединяются признаки тяжелого поражения желудка. Возникают сильные, мучительные боли в желудке, сочетающиеся с резкой жаждой и невозможностью проглотить жидкость. Больного беспокоят тошнота и многократная рвота кровянистыми массами, содержащими большое количество слизи и остатки пищи. Запах рвотных масс может помочь определить вид принятого больным ядовитого вещества. Установить качество яда помогает также появление характерных пятен на слизистой оболочке губ, углов рта, щек, языка, зева, мягкого неба, гортани. На слизистой оболочке рта, пищевода, желудка наблюдаются обширные участки ожогов и воспалительные изменения различной степени выраженности: гиперемия, отек, эрозии, изъязвления; в тяжелых случаях — перфорации. Наблюдается отек гортани, вследствие чего голос исчезает или становится хриплым. Пальпация живота вызывает резкую боль, особенно выраженную в подложечной области. Отравление в одних случаях сопровождается угнетенным психогенным состоянием и адинамией, в других — признаками возбуждения нервной системы. В тяжелых случаях быстро развивается состояние глубокого шока, вызванного резкой болью, аутоинтоксикацией ядовитыми продуктами белкового распада, потерей крови и жидкости. Наблюдается коллаптоидное состояние, сопровождающееся резким падением артериального и венозного давления и изменением объема циркулирующей крови. Количество суточной мочи уменьшается. В моче обнаруживают белок, эритроциты, цилиндры, уробилиноген, уробилин. В ряде случаев развиваются диффузные поражения почек. В кале определяется скрытая кровь. Иногда наблюдается черный дегтеобразный неоформленный стул со зловонным запахом (мелена), что обусловлено кровотечением из пораженного отравляющим веществом желудка или пищевода. Тяжелые коррозивные гастриты сопровождаются глубокими поражениями стенки желудка и разрушением его железистого аппарата, в результате чего секреторная функция желудка полностью прекращается. В тяжелых случаях больные умирают в ближайшие часы и дни. Критическими считаются первые 2–3 дня от начала болезни. Смерть может наступить от шока, острого пищеводного или желудочного кровотечения, отека гортани, аспирационной пневмонии; медиастинита, развившегося вследствие перфорации пищевода, а также перитонита, обусловленного перфоративным процессом в желудке. Прогноз острого коррозивного гастрита всегда очень серьезен. Он в большой степени зависит от своевременной и правильной терапии. Полное выздоровление возможно только в легких случаях. Восстановление морфологической структуры и функций слизистой оболочки желудка происходит редко. Заболевание приводит к обширным рубцовым изменениям в пищеводе и желудке, вследствие которых развиваются стеноз пищевода, расстройства глотания (дисфагия), стеноз пилорического и кардиального отделов желудка, рубцовое сморщивание желудка, микрогастрия, двигательная и секреторная недостаточность желудка, хронический атрофический гастрит, ахилия.
Хронические гастриты Вопросы, касающиеся клинических проявлений хронического гастрита, до сих пор дискутабельны. Одни специалисты полагают, что каждой из форм этого заболевания присуща своя характерная клиническая картина. В последние годы, однако, широкое распространение получила точка зрения, согласно которой хронический гастрит не имеет каких-либо клинических проявлений и те или иные жалобы больных хроническим гастритом совершенно не соответствуют данным эндоскопического и гистологического исследований образцов слизистой оболочки желудка. Вполне справедлива точка зрения, что диагноз хронического гастрита ни в коей мере не должен основываться на субъективных симптомах заболевания, тем более что хронический гастрит нередко протекает без каких-либо заметных клинических проявлений, прежде всего без болевого синдрома. Многими специалистами отмечено, что больные, страдающие хроническим гастритом, особенно при обострении заболевания, часто предъявляют разнообразные жалобы: на болевые ощущения, тошноту, отрыжку, изжогу, метеоризм, нарушение аппетита, расстройство стула и т. д. Эти жалобы входят в состав так называемой желудочной и кишечной диспепсии. Диспепсические симптомы могут иметь различную степень выраженности. Их возникновение связано со снижением уровня желудочной секреции и выпадением бактерицидных свойств желудочного сока. После приема пищи больной испытывает дискомфорт в эпигастральной области в виде тяжести и давления. Во рту ощущается неприятный металлический вкус. Отрыжка может иметь запах съеденной пищи. Изжога бывает разной степени интенсивности, чаще она проявляется чувством жжения в эпигастрии. Частый симптом хронического гастрита — тошнота, возникающая после еды. Рвота не носит постоянного характера, она наблюдается эпизодически, чаще при нарушениях диеты. Если морфологические изменения при гастрите поверхностные, аппетит сохранен. При выраженных атрофических поражениях слизистой оболочки желудка аппетит понижен или отсутствует вовсе. У многих больных наблюдаются явления кишечной диспепсии. Чаще она проявляется в виде поносов, реже — запоров. Поносы обусловлены нарушением секреторной функции желудка, в результате которого страдает процесс желудочного пищеварения, снижается бактерицидная активность желудочного сока, развивается кишечный дисбактериоз, стимулируются процессы гниения в кишечнике. В основе запоров лежит нарушение моторики кишечника и склонность к спазмам. Боли при хроническом гастрите имеют разную степень выраженности: от чувства давления и распирания в эпигастральной области до выраженного болевого синдрома. Боли обычно появляются сразу после еды и держатся в течение нескольких часов. При этом они могут усиливаться или уменьшаться. Боли могут носить постоянный характер. Они обычно тупые, ноющие, умеренной силы, но иногда становятся интенсивными. Боли в эпигастральной области связаны с раздражением воспаленных интерорецепторов слизистой оболочки желудка при его растяжении. Общее состояние больных чаще всего не нарушается. Если желудочная секреция сохранена или уменьшена незначительно, процессы желудочного пищеварения и усвоения пищи не нарушаются, больной не худеет. При значительных морфологических (атрофических) изменениях в слизистой оболочке развивается резко выраженная секреторная недостаточность (вплоть до ахилии). В результате этих патологических изменений больной теряет аппетит, вплоть до анорексии, развиваются вялость, адинамия, гипотония. Из-за недостаточной секреторной функции желудка развивается гипопротеинемия, больной теряет в весе. Иногда наблюдается прогрессирующее снижение массы тела больного. При хронических гастритах часто наблюдаются симптомы полигиповитаминозов и авитаминозов, механизмы развития которых были описаны выше. Клинически они проявляются сухостью кожных покровов, покраснением, рыхлостью и кровоточивостью десен, изменениями языка (утолщен, с отпечатками зубов, может стать гладким, атрофичным, блестящим). У ряда больных наблюдаются явления хейлита, т. е. воспаления губ: их побледнение, наличие покрытых корочками трещин, мацерации в углах рта (ангулярный стоматит). У больных хроническим гастритом часто развивается гипохромная анемия, сопровождающаяся появлением соответствующей клинической симптоматики. При хроническом гастрите в патологический процесс часто вовлекаются печень и желчевыводящая система. При этом развитие холецистита и гепатита обусловлено поступлением микробных агентов и ядовитых продуктов их распада в систему воротной вены с последующим гематогенным заносом бактерий и распространением процесса по желчным путям. Если хронический гастрит осложняется развитием вышеназванных осложнений, пальпация живота нередко выявляет болезненность области желчного пузыря и плотный безболезненный край печени. К объективным симптомам хронического гастрита относится изменение показателей кислотности и объема желудочной секреции, а также количественного содержания в желудочном соке пепсина, гастромукопротеина и белков, а также пепсиногена (или уропепсина) в моче. Изменение этих показателей зависит от степени нарушения процесса желудочной секреции и будет рассмотрено в соответствующих разделах энциклопедии. Объективные симптомы хронического воспаления желудка устанавливаются также при его фиброгастроскопическом, рентгенологическом, цитологическом исследовании и будут рассмотрены ниже. Между секреторной функцией желудка и степенью морфологических изменений его слизистой, а следовательно, и клиническими проявлениями хронического гастрита существует определенная коррелятивная связь. Этот факт положен в основу классификации хронических гастритов по функциональному признаку. Каждая из приведенных в этой классификации форм имеет свои характерные клинические, морфологические и функциональные особенности, которые целесообразно рассмотреть отдельно. Хронический гастрит с секреторной недостаточностью. Заболевание чаще наблюдается у людей зрелого и пожилого возраста. В одних случаях болезнь с самого начала развивается как гастрит с пониженной кислотностью и отсутствием свободной соляной кислоты. В других случаях она является конечной стадией гастрита с повышенной кислотностью. Наиболее выраженная клиническая симптоматика наблюдается у больных, страдающих ахилией. У таких больных на первый план выступают диспепсические явления. Ихбеспокоит отрыжка воздухом или тухлым яйцом. Часто наблюдаются тошнота и тяжесть в эпигастральной области. Боль не является характерным симптомом. Иногда через 0,5–1 ч после еды возникают несильные ноющие боли, зависящие от количества и качества принятой пищи (острая, пряная, консервированная и др.). При локализации процесса в антральном отделе желудка, а также при гастродуодените болевой симптом выражен значительнее. Аппетит понижен, вплоть до анорексии. Часто беспокоят глоссит и гингивит. При ахилическом гастрите больные ощущают неприятный вкус во рту. В некоторых случаях отмечается рвота натощак. Частый симптом заболевания — диарея, связанная с выпадением секреторной функции желудочных желез и созданием благоприятных условий для развития дисбактериоза с преобладанием в кишечнике микрофлоры, вызывающей процессы гниения и брожения. Это так называемые ахилические поносы. В их развитии определенное значение приобретает также функциональная недостаточность поджелудочной железы, которая в ряде случаев осложняет течение хронического ахилического гастрита. Расстройство функциональной активности кишечника, характерное для данной формы гастрита, проявляется чередованием поноса и запора, метеоризмом, нарушением переваривания пищи. Заболевание, как правило, осложняется развитием поражений двенадцатиперстной кишки (дуодениты), печени (хронический мезенхимальный или эпителиальный гепатит), кишечных путей (ангиохолецистит), поджелудочной железы (функциональная недостаточность), белковой и витаминной недостаточностью (полигиповитаминозы А, В, С, РР), нарушениями процессов кроветворения (железодефицитная и В12-дефицитная анемии). Часто развивается нутритивная аллергия (энтерогенная сенсибилизация). У больных могут наблюдаться нервно-психические расстройства. Хронический гастрит с секреторной недостаточностью относится к группе предраковых заболеваний желудка. Он протекает в нескольких вариантах, каждый из которых имеет характерные особенности симптоматики: — хронический ригидный (антральный) гастрит; — хронический гипертрофический органический гастрит, болезнь Менентрие; — полипозный гастрит, полипоз желудка. Хронический ригидный (антральный) гастрит. При данном заболевании имеет место локальный дистрофический процесс в антральном отделе желудка, сопровождающийся повышением мышечного тонуса, спазмами с последующим развитием склеротического процесса в стенке желудка и ее ригидности. Примерно у половины больных имеют место явления перигастрита. Антральный отдел желудка деформируется и приобретает вид узкой ригидной трубки. Ригидный гастрит протекает как тяжелая форма хронического гастрита с секреторной недостаточностью. Заболевание характеризуется выраженным болевым синдромом, многолетней упорной диспепсией, ахлоргидрией и частым озлокачествлением. Переход в раковый процесс наблюдается примерно у 10–40 % больных. Заболевание имеет характерную морфологическую и рентгенологическую картину. Микроскопически обнаруживают дегенерацию и атрофию главных желез желудка, разрастание покровного эпителия слизистой оболочки, увеличение мышечных волокон и разрастание соединительной ткани. Рентгенологически определяются изменения рельефа слизистой оболочки желудка, деформация его антрального отдела, частичное или полное отсутствие перистальтики. Хронический гипертрофический органический гастрит, болезнь Менентрие, гигантский гипертрофический гастрит. Редкий вариант хронического гастрита с секреторной недостаточностью. Известны две формы гигантского гипертрофического гастрита: — отдельные плоские полиаденомы гипертрофированной слизистой оболочки желудка; — множественные полипозные полиаденомы слизистой оболочки желудка. Заболевание характеризуется местной гиперплазией слизистой оболочки, локализующейся в теле, синусе или субкардиальном от деле желудка. Мужчины и женщины болеют с одинаковой частотой. Обычно возраст больных — от 30 до 70 лет, но иногда заболевают дети. Клиническая картина многообразна, не имеет характерных черт. Заболевание протекает как хронический гастрит, иногда напоминает рак желудка. Больных беспокоят явления желудочнокишечной диспепсии, ощущение дискомфорта, давления, спазма и болей в эпигастральной области. Иногда боли отсутствуют. Но чаще болевой синдром напоминает таковой при язвенной болезни. Приступ болей облегчается после рвоты, приема пищи и щелочных растворов. Желудочная диспепсия проявляется в виде тошноты и рвоты. Рвотные массы могут содержать примесь крови. Иногда наблюдаются кровавая рвота и мелена. Очень часто больные теряют в весе. У них развиваются железодефицитная анемия и гипопротеинемия. Часто наблюдается отечность кистей и стоп. Диагноз ставится на основе данных гастроскопического и рентгенологического исследований. Фиброгастроскопия выявляет наличие гипертрофированных, извилистых, отечных складок слизистой оболочки желудка, поверхность которых покрыта слизью. Иногда обнаруживаются эрозии. У ряда больных на поверхности слизистой оболочки желудка видны бородавчатые или сосочковые разрастания (вид «булыжной мостовой» или «извилины мозга»). При гистологическом исследовании выявляются структурные изменения желудочных желез, их гипертрофия; метаплазия главных и обкладочных клеток, множественные слизистые кисты; иногда типичные эпителиальные разрастания, напоминающие злокачественный рост. Полипозный гастрит, полипоз желудка. Полипы желудка состоят из соединительнотканной основы покровного (папиллома) или железистого (аденома) эпителия. Они имеют ножку или широкое основание. По форме полипы напоминают ягоду или цветную капусту. Их консистенция может быть различной. Полипы чаще располагаются на передней и задней стенках антрального отдела желудка. Полипозный гастрит, как правило, является осложнением хронического гастрита с секреторной недостаточностью. Возраст больных чаще составляет от 40 до 50 лет. Клиническая картина полипозного гастрита существенно не отличается от обычного атрофического гастрита с секреторной недостаточностью. Заболевание часто сочетается с ригидным гастритом. Отмечается склонность больных к кровотечениям. Процесс имеет выраженную склонность к малигнизации (примерно у 1/3 больных наблюдается переход полипоза в раковую опухоль). При локализации полипа на ножке в препилорической области возможно его выпадение в двенадцатиперстную кишку, в результате которого развивается стеноз привратника. При раковом перерождении или выпадении полипа в двенадцатиперстную кишку наблюдается кровотечение. Рентгенологически полипы дают дефекты наполнения с ровным краем. Хронический гастрит с нормальной и повышенной секрецией наблюдается обычно у лиц молодого и среднего возраста, причем у мужчин чаще, чем у женщин. Воспалительные изменения слизистой оболочки желудка имеют поверхностный характер (иногда с элементами атрофического гастрита в антральном отделе) и нередко сочетаются с воспалением слизистой оболочки двенадцатиперстной кишки (гастродуоденит). Нередко эта разновидность гастрита предшествует развитию язвенной болезни желудка и двенадцатиперстной кишки. При этой форме хронического гастрита боли являются частым, но не обязательным симптомом; они нередко носят «язвенноподобный» характер, возникают натощак (голодные боли): спустя 1,5–2 ч после приема пищи, ночью. Отличить их от болевого синдрома при язвенной болезни иногда достаточно трудно. Гастрит с нормальной или повышенной секрецией соляной кислоты проявляется в двух формах: — диспепсической; — болевой (антральный гастрит). Характерные симптомы диспепсической формы: изжога, кислая отрыжка, срыгивание кислым, чувство тяжести, жжения и распирания в эпигастральной области, запоры. Аппетит сохранен или повышен. При этой форме заболевания боли возникают после еды и снимаются приемом двууглекислого натрия. Диспепсические явления часто появляются после приема жирной, углеводистой пищи, а также алкогольных напитков. Болевая форма заболевания (антральный гастрит) характеризуется выраженным болевым синдромом, чередующимся с диспепсическими явлениями. Больного беспокоят умеренно выраженные поздние и голодные, тупые, ноющие боли в эпигастральной области, возникающие через 2 ч после еды, а также ночные и утренние боли. Болевой синдром уменьшается после приема пищи. Боли не имеют выраженной иррадиации. Болевой синдром обусловлен спазмом привратника, усиленной перистальтикой желудка и повышением его секреторной активности. Иногда в происхождении болей играют роль перигастрит и перидуоденит. В этом случае болевой синдром усиливается при тряской езде и при ходьбе. Сезонность болей выражена не столь ярко, как при язвенной болезни. Иногда при антральном гастрите образуются эрозии на слизистой оболочке желудка с развитием эрозивного гастрита. Как при диспепсической, так и при болевой формах хронического гастрита с нормальной и повышенной секрецией наблюдается спастический дискинетический запор; часто в воспалительный процесс вовлекаются печень, желчные пути; развиваются гиповитаминозы, нарушения вегетативной нервной системы, неврастенический синдром. Характерным осложнением этих форм гастрита является развитие рубцовых изменений в пилорическом отделе желудка или в луковице двенадцатиперстной кишки. Часто возникает спазм привратника. Могут наблюдаться гипогликемические состояния, проявляющиеся резкой слабостью больного, дрожанием рук, побледнением лица, чувством голода и холодным липким потом. Такое состояние может сопровождаться возникновением болей в эпигастральной области. У больных хроническим гастритом с сохраненной и повышенной секрецией рентгенологически выявляются утолщение складок слизистой оболочки желудка, повышенный тонус его стенки и усиленная перистальтика привратника. При фиброгастроскопии обнаруживаются воспалительные явления в слизистой оболочке желудка в виде ее гиперемии и отека. Хронический геморрагический (эрозивный) гастрит. Развитию геморрагического (эрозивного) гастрита могут способствовать прием нестероидных противовоспалительных препаратов и алкоголя. Клиническая картина заболевания обычно соответствует клинике хронического гастрита с нормальной или повышенной секрецией соляной кислоты, однако часто дополняется признаками желудочного кровотечения (рвота типа «кофейной гущи» или мелена), анемией (слабость, утомляемость, головокружение, сердцебиение). Желудочное кислотообразование у больных с эрозивным гастритом может быть нормальным, повышенным и слегка сниженным. Основным методом диагностики эрозивного гастрита является эндоскопическое исследование, при котором выявляются отек, гиперемия и легкая контактная кровоточивость слизистой оболочки желудка, множественные плоские дефекты (эрозии) и петехии. Клинические проявления, свойственные хроническому гастриту, могут наблюдаться и при других заболеваниях желудка (функциональных расстройствах двигательной и секреторной функции, язвенной болезни, опухолях желудка), поэтому установление диагноза хронического гастрита предполагает обязательное исключение вышеперечисленных заболеваний. Данное обстоятельство требует проведения комплексного обследования больных с подозрением на хронический гастрит с тщательным анализом субъективных симптомов заболевания, исследованием кислотообразующей функции желудка, проведением рентгенологического, эндоскопического, а в необходимых случаях и гистологического исследования слизистой оболочки желудка. При этом следует помнить, что обнаружение у больного той или иной формы хронического гастрита не исключает у него и более серьезного заболевания желудка.
Лечение и профилактика Лечение различных форм острого гастрита имеет общие черты и в то же время характеризуется некоторыми особенностями. Поэтому целесообразно рассмотреть отдельно лечение каждой из этих форм.
Острый неспецифический гастрит Как было отмечено, причиной возникновения острого неспецифического гастрита является так называемый «алиментарный» фактор: переедание, употребление трудноперевариваемой, плохо пережеванной, недоброкачественной, инфицированной пищи, очень жирных и слишком острых пищевых продуктов, крепких растворов алкоголя, чрезмерно горячих или холодных продуктов, а также прием ряда лекарственных веществ. Учитывая вышеперечисленные этиологические факторы, лечение острого неспецифического гастрита следует начинать с освобождения желудка от его содержимого. Это достигается промыванием желудка. Если состояние больного нетяжелое, промывание осуществляется путем вызывания искусственной рвоты надавливанием пальцами или шпателем на корень языка. Предварительно больному дают выпить не менее 2 л жидкости (0,5–1 %-ный раствор гидрокарбоната натрия — 1–2 ст. л. чайной соды на 1 л воды; физиологический раствор; слабый раствор марганцовокислого калия — 1:10 000; минеральная или обычная питьевая теплая вода). Если не удается провести промывание желудка таким образом, оно осуществляется через толстый зонд с применением перечисленных выше растворов или теплой питьевой воды. Промывать желудок следует до так называемой «чистой воды», т. е. до тех пор, пока промывные воды не станут прозрачными, без остатков пищи и примеси слизи. Давать обильное питье необходимо и при наличии у больного самостоятельной рвоты. Если промыть желудок не удается, больному вводят подкожно 0,5 мл 1 %-ного раствора апоморфина и дают выпить несколько стаканов теплой щелочной воды (лучше боржоми, ессентуки). При этом у больного возникает рвота. Удаление желудочного содержимого прекращает его раздражающее действие на слизистую оболочку желудка. Кроме того, во время промывания из желудка удаляются токсические продукты, действие которых вызывает клиническую симптоматику интоксикации. Чтобы связать оставшиеся токсические вещества и прекратить их всасывание в кишечник, больному дают адсорбирующие средства (активированный уголь — 4–6 таблеток после предварительного их измельчения, полифепан, энтеросгель или любые другие сорбенты). Кроме того, для окончательного удаления токсических продуктов из кишечника назначают солевое слабительное (20–30 г сульфата магния или 20–30 г сернокислого натрия в 400–500 мл воды) или 30 мл касторового масла. После опорожнения желудка больного укладывают в постель и обеспечивают ему полный покой. Показаны горячий чай или кофе и согревание: грелки к рукам и ногам. При болях в желудке на область живота накладывают согревающий компресс или ставят грелку. По показаниям (артериальная гипотония, коллаптоидное состояние) назначают подкожные введения кофеина (1 мл 10 %-ного или 20 %-ного раствора), камфоры (1–2 мл 20 %-ного раствора); внутривенно капельно вводят норадреналин (2–4 мл 0,2 %-ного раствора в 1 л 5 %-ного раствора глюкозы). Обильная рвота может вызвать обезвоживание больного. Для его устранения прибегают к внутривенному капельному введению изотонического раствора натрия хлорида или 5 %-ного раствора глюкозы (0,5–1 л) с аскорбиновой кислотой (500 мг). Кроме того, следствием обильной рвоты может стать развитие хлоропении. Для борьбы с ней внутривенно вводят 10 мл 10 %-ного раствора хлористого натрия. При болях в животе назначают спазмолитические и болеутоляющие средства: препараты белладонны (бесалол, бепасал, беллалгин, белластезин, павестезин, таблетки желудочные с экстрактом красавки — по 1 таблетке 2–3 раза в день); папаверина гидрохлорид (по 0,04 г 3–4 раза в день) и его комбинированные препараты (люпаверин — папаверина гидрохлорид с фенобарбиталом; пафиллин — папаверина гидрохлорид с платифиллина гидротартратом, келлатрин — папаверина гидрохлорид с келлином и атропина сульфатом; никоверин — папаверина гидрохлорид с никотиновой кислотой) — по 1 таблетке 2–3 раза в день. Для снятия болевого синдрома можно применять атропин (0,25—0,5 мл 0,1 %-ного раствора подкожно или по 5–7 капель 1 %-ного раствора внутрь). Для устранения болевого синдрома, а также диспепсических расстройств больному можно назначить антацидный препарат актал (по 1–2 таблетке держать во рту до полного рассасывания; в день принимать не более 16 таблеток). Следует обратить внимание на то, что применение препарата противопоказано для детей в возрасте до 12 лет. В качестве антацидного, обволакивающего и адсорбирующего средства назначают гелюсил (принимается неразведенным по 12 мл — 1 пакетик или 2 ч. л. — несколько раз в день). Препарат устраняет боли в желудке и диспепсические явления. Вместо него можно применять гелюсил-лак (по 1–2 таблетке несколько раз в день), обладающий аналогичным действием. Кроме того, хороший терапевтический эффект при остром гастрите оказывает маалокс, обладающий антацидным и обволакивающим действием. Препарат следует применять при возникновении болей по 1–2 таблетке (разжевывать или держать во рту до полного рассасывания) или по 15 мл суспензии. Аналогичным действием обладает маалокс-70. Он назначается по 2 ч. л. 4 раза в день. Болевые ощущения и диспепсические явления достаточно быстро устраняет препарат эндрюс ливер солт. Перед употреблением 1 ч. л. порошка растворяют в 1 стакане воды. Препарат принимается внутрь, при необходимости до 4 раз в сутки. Для снятия болей в желудке и диспепсических симптомов можно назначить ренни: по 1–2 таблетки держать во рту до рассасывания; при необходимости прием повторить через 2 ч. Принимать не более 16 таблеток за сутки. Оправдано назначение мексазы, обладающей одновременно ферментативным и антибактериальным действием. Препарат назначается по 1–2 драже 3 раза в день в течение 2–5 дней. При инфекционной природе заболевания больной нуждается в назначении антибактериальной терапии (антибиотики, сульфаниламиды). Следует учесть, что при остром гастрите назначение медикаментов перорально может спровоцировать тошноту и рвоту, поэтому к пероральному введению лекарственных препаратов нужно относиться с осторожностью и при необходимости переходить на внутривенное их введение. Больной острым гастритом нуждается в достаточном количестве витаминов. Они вводятся внутримышечно или внутрь. Из витаминных препаратов следует назначать аскорбиновую кислоту, тиамин, биофлавоноиды. В тяжелых случаях, сопровождающихся обильной многократной рвотой, витамины вводят внутривенно капельно в 5 %-ном растворе глюкозы. Их дозы при этом составляют: 500 мг аскорбиновой кислоты, 50–60 мг тиамина, 50 мг никотиновой кислоты, 10–12 мг рибофлавина, 50 мг пиридоксина.
Аллергический и эрозивный гастрит Следует отметить, что не существует специального лечения аллергического гастрита. При этой форме заболевания проводятся те же терапевтические мероприятия, что и при остром неспецифическом гастрите. Однако лечение таких больных требует дополнительного введения ряда лекарственных средств, что обусловлено этиологическими и патогенетическими особенностями данной формы гастрита. В лечение больного следует включить подкожное введение адреналина (1 мл 0,1 %-ного раствора), внутривенные введения глюконата кальция (10 мл 10 %-ного раствора) или хлористого кальция (10 мл 10 %-ного раствора). Кроме того, терапевтические мероприятия дополняют парентеральным введением антигистаминных препаратов: димедрол (1 мл 1 %-ного раствора внутримышечно 2 раза в день); супрастин (1 мл 2 %-ного раствора внутримышечно) и др. Позднее переходят на пероральное введение антигистаминных средств (димедрол по 0,025—0,05 г 2 раза в день, супрастин по 0,025 г 2–3 раза в день, тавегил по 0,001 г 2 раза в день; фенкарол по 0,025—0,05 г 3–4 раза в день и др.). Длительность курса десенсибилизирующей терапии зависит от течения заболевания. В среднем она составляет 10 дней. Хороший терапевтический эффект при эрозивных гастритах вызывает назначение беломета (циметидин). Препарат оказывает антигистаминное, противоэрозивное действие, ингибирует секрецию желудочной кислоты и пепсина. Дозу препарата подбирают индивидуально; назначают внутрь (по 1 таблетке 3 раза в день и 2 таблетки перед сном или по 2 таблетке утром и вечером), внутривенно струйно или капельно (по 200 мг). При эрозивном гастрите показано применение пирегексала (в первые 2–3 дня по 50 мг 3 раза в день, затем по 50 мг 2 раза в день; курс лечения — 4–6 недель). Аллергический гастрит может осложниться развитием эрозивных поражений слизистой оболочки желудка. При этом в рвотных массах появляется примесь крови. В таких случаях следует назначить больному пузырь со льдом на подложечную область. Эрозивный гастрит может стать причиной желудочного кровотечения, которое требует оказания больному неотложной помощи. Лечение обычно сводится к консервативной терапии, хирургическое вмешательство возможно в качестве исключения. Больного следует немедленно госпитализировать в хирургический стационар. Транспортировка больного осуществляется в положении лежа, при выраженных признаках кровопотери головной конец носилок опускают. В стационаре больному обеспечивают полный покой и проводят экстренные терапевтические мероприятия по остановке кровотечения и устранению шока. Внутривенно капельно вводят 100 мл 5 %-ного раствора аминокапроновой кислоты; внутримышечно или внутривенно — 10 мл 10 %-ного хлористого кальция; внутримышечно — 1–2 мл 1 %-ного раствора викасола. При желудочном кровотечении показано внутривенное медленное введение (в течение 2 мин) 20 мг кваматела в 5—10 мл 0,9 %-ного раствора натрия хлорида. Через 12 ч инъекцию можно повторить. Остановке кровотечения из желудочно-кишечного тракта способствуют внутривенные или внутримышечные введения реместила (по 200 мг — 2 мл раствора). Гемостатическое действие оказывает внутривенное введение экзацила (по 2–4 г в сутки за 2–3 приема). При массивном желудочном кровотечении подкожно вводят 500 мл 10 %-ного раствора желатина, предварительно подогрев его до 36–37 °C. Больному на область желудка помещают пузырь со льдом и дают глотать маленькие кусочки льда. При тяжелом кровотечении проводят гемостатическую и заместительную терапию. Внутривенно струйно или капельно вводят коллоидные растворы, обладающие выраженным эффектом замещения и эффективно ликвидирующие гиповолемию. Больному в зависимости от тяжести состояния вводят от 400 до 1200 мл полиглюкина, реополиглюкина, рондекса, реоглюмана и т. п. Далее переходят к введению кристаллоидов, среди которых предпочтительнее назначение многокомпонентных солевых растворов (лактасол и т. п.).
Острый коррозивный гастрит Если больной не находится в состоянии шока и нет признаков перфорации пищевода, приступают к немедленному промыванию желудка с целью удаления яда. Чтобы связать ядовитое вещество, к раствору, используемому для промывания в случае отравления кислотами, добавляют молоко, яичный белок, магнезиальное молоко, известковую воду, жженую магнезию. При поражении щелочами промывание желудка осуществляют с применением разведенных органических кислот — лимонной или уксусной. Промывание желудка следует провести как можно раньше, так как спустя 1 ч после приема концентрированных кислот или щелочей эта манипуляция становится бесполезной. Промывание желудка проводят с помощью толстого зонда, хорошо смазанного маслом. При отравлении уксусной кислотой для промывания используют не менее 10–15 л 1–2 %-ного раствора бикарбоната. Предварительно больному следует внутривенно ввести димедрол (1–2 мл 1 %-ного раствора), атропин (1 мл 0,1 %-ного раствора), промедол (1–2 мл 2 %-ного раствора), хлористый кальций (10 мл 10 %-ного раствора), преднизолон (30–60 мг). Кроме того, больному дают 1 г анестезина. Если после этого сохраняется выраженная болевая реакция, производят левостороннюю вагосимпатическую новокаиновую блокаду. При шоковом состоянии назначают повторные инъекции наркотических веществ, кофеина, кордиамина, мезатона и других аналептиков; проводят переливание кровезамещающих растворов, плазмы крови и цельной крови. В первые дни после отравления больной нуждается во внутривенном введении жидкости (не менее 3 л в первые сутки). Для этого используют физиологический раствор, 5 %-ный раствор глюкозы с аскорбиновой кислотой и тиамином и др. Для снятия болевого синдрома назначают морфин, препараты опия и другие наркотические средства. В случае развития желудочного кровотечения принимают меры для его остановки. При перфорации желудка производят хирургическое вмешательство. Компенсация плазмопотери, поддержание функций печени, борьба с анемией достигаются переливанием крови, назначением препаратов, улучшающих кроветворение, глюкозы с инсулином, витаминных препаратов. В первые дни после отравления необходимо полное голодание; питание больного осуществляется парентерально. Далее назначают механически и химически щадящую диету: сливки, молоко, мороженое, кисели, фруктовые соки и т. п. Через рот периодически вводят подсолнечное масло с анестезином или новокаином. В целях профилактики инфекционных осложнений назначают антибиотики и сульфаниламиды. Через 10–20 дней от момента отравления начинают бужирование пищевода для предотвращения его рубцового сужения.
Хронический гастрит Лечение больных хроническими гастритами должно быть комплексным, дифференцированным и индивидуализированным в зависимости от формы заболеваний, типа желудочной секреции, стадии заболевания (обострения или ремиссии) и наличия у больного сопутствующих патологических процессов. Прежде всего следует устранить причину, вызвавшую заболевание (запретить курение, употребление алкоголя, организовать рациональное питание и т. д.). Диетотерапия, или лечебное питание, — это лечение питанием. Проводимое лечебное питание должно быть направлено на коррекцию нарушений обмена веществ, на восстановление нормальной работы измененного состояния органов и систем организма, возникающих у больных с той или иной патологией. Научное обоснование организации лечебного питания базируется на ряде положений: — соответствии энергоемкости назначаемого рациона суточной энергетической потребности конкретного больного с конкретной патологией; — назначении диеты со сбалансированным соотношением основных питательных веществ (белков, жиров и углеводов); — подборе, основываясь на вышеперечисленном, соответствующего ассортимента продуктов; — соблюдении строгого режима питания; — правильном выборе определенных технологических приемов обработки пищевых продуктов. Другими словами, лечебное питание должно удовлетворить потребности больного организма в энергии, питательных веществах, а сама пища должна быть легко перевариваемой и усваиваемой организмом. Лечебное питание необходимо проводить не только в условиях больниц, профилакториев, но и в быту, домашних условиях. Это связано с тем, что диетическое питание, являясь наиболее физиологичным способом лечения, может проводиться длительное время, тем самым замедляя прогрессирование болезни и предупреждая ее обострение. Особую важность этот тезис приобретает при назначении диетического питания у больных с хроническими заболеваниями, прежде всего заболеваниями желудочно-кишечного тракта. Говоря о лечебном питании, следует не забывать об использовании в рационах больных так называемых специализированных диетических продуктов, отличающихся химическим составом и физическими свойствами от запрещенных по медицинским показаниям традиционных. Диетическое питание должно проводиться дифференцированно на различных стадиях болезни и оказывать целебное действие на основные патогенетические звенья заболевания. Лечебное питание должно также стимулировать защитно-приспособительные функции организма. Наряду с вышесказанным лечебные диеты должны снижать возможное побочное действие лекарств и не вызывать при этом блокирующего воздействия на фармакокинетику препарата. Тактика лечебного питания, направленная на коррекцию нарушенных функций органов и систем больного организма, заключается прежде всего в проведении щадящей диеты. Сильное механическое воздействие на желудочно-кишечный тракт оказывают твердая, жареная пища (жилистое мясо, хрящи, кожа птиц, рыб, жареный картофель, гренки и т. д.), изделия из муки грубого помола, пшено и другие крупы без специальной кулинарной обработки, большинство сырых овощей, фасоль, горох, неочищенные незрелые фрукты. Интенсивность механического воздействия зависит от количества пищевых волокон, главным образом целлюлозы и пектиновых веществ пищевых продуктов растительного происхождения, а также мышечных волокон и соединительной ткани продуктов животного происхождения. Сильное химическое воздействие на желудочно-кишечный тракт оказывают продукты, содержащие эфирные масла (чеснок, лук, редька и др.), экстрактивные вещества бульонов, а также продукты, возбуждающие секрецию (пряности, алкоголь и т. д.). Щадящее воздействие на организм будет оказывать диета, содержащая растительные продукты, представленные хлебобулочными изделиями из муки высшего помола, очищенным рисом, отварным картофелем, манной крупой, кабачками, и животные продукты — сливки, натуральное молоко, свежий творог, яйца всмятку, молодая телятина, цыплята и т. д. Для щадящего воздействия пищи на организм больного важно учитывать способ ее приготовления, консистенцию, температуру горячих и холодных блюд. Щадящими свойствами обладают отварные, кашице- и пюреобразные блюда (при температуре не более 60 °C для горячих и не менее 15 °C для холодных блюд). Последнее связано с тем, что горячие блюда усиливают секрецию и ослабляют моторику, а холодные, наоборот, снижают секрецию, но усиливают моторику. Для уменьшения содержания экстрактивных веществ, содержащихся в бульонах, в них при изготовлении увеличивают массовую долю воды. При этом вкусовые свойства бессолевых отварных блюд улучшают использованием укропа, сельдерея, мяты и т. п. Для создания у больного чувства удовлетворения, положительных эмоций большое значение имеет привлекательный вид блюд, их разноообразие и красивое оформление. Не менее важным в лечебном питании является подбор блюд, содержащих необходимые компоненты, оказывающие фармакотерапевтический эффект. Данный эффект прежде всего основан на принципах рационального, сбалансированного питания и поступления в организм эссенциальных (не синтезируемых в организме) компонентов основных питательных веществ. К ним будут относиться полиненасыщенные жирные кислоты, незаменимые аминокислоты, большинство витаминов и минеральных веществ. В России при назначении лечебного питания (диеты) применяют групповую номерную систему. Лечебные диеты обозначаются соответственно номерами с № 0 до № 15. Дополнительно, в зависимости от характера и стадии заболевания, выделяют варианты диет, обозначаемые буквенными индексами — а, б, в. Лечение обычно проводится амбулаторно. В неясных случаях и при наличии осложнений показана госпитализация. Кроме того, в фазе обострения процесса в ряде случаев также показано стационарное лечение. Основу терапевтического лечения больных хроническими гастритами составляет диетический режим, который зависит от секреторной функции желудка, общего состояния больного и фазы заболевания. При этом следует помнить, что лечебное питание при хронических гастритах — это прежде всего питание больного человека, обеспечивающее его физиологическую потребность в пищевых ингредиентах. Вместе с тем специально подобранный и особым образом обработанный комплекс продуктов является методом лечения, влияющим на различные патогенетические механизмы заболевания. Следовательно, любая диета, назначенная больному, должна покрывать его физиологическую потребность в разнообразных пищевых продуктах и, кроме того, удовлетворять повышенную потребность в ряде питательных веществ, возникающую вследствие заболевания (например, в витаминах, минеральных веществах, белках, железе и т. д.). На короткий срок допустимо назначение физиологически неполноценных диет, необходимость которых может быть обусловлена резким нарушением функций пищеварительного тракта (например, обострение хронического гастрита). Диета подбирается по качественному составу (содержит определенный набор продуктов), по способу кулинарной обработки пищевых продуктов (вид тепловой обработки — поджаривание, варка, приготовление на пару, запекание в духовом шкафу; степень измельчения). В диетическом питании при хронических гастритах имеет значение температура пищи и степень ее механического и химического воздействия на слизистую оболочку и железистый аппарат желудка. Следует помнить, что блюда, имеющие температуру ниже 15 °C и выше 57–62 °C, оказывают раздражающее действие, а принятые натощак холодные блюда усиливают кишечную перистальтику за счет рефлекторного воздействия с терморецепторов желудка. Наиболее индифферентными в этом отношении являются блюда, температура которых близка к 37–38 °C. Механическое действие пищи определяется ее объемом, степенью измельчения, консистенцией, способом тепловой обработки. При составлении диет рационального питания необходимо учитывать, что весь суточный рацион должен составлять около 3 кг. При этом 25–30 % общей калорийности приходится на 1-й завтрак; 10–15 % — на 2-й завтрак; 35–40 % — на обед и 15–20 % — на ужин. Если состояние больного требует механического щажения пищеварительного тракта, весь суточный рацион делят на 5–6—8 порций. В некоторых случаях прибегают к уменьшению веса суточного рациона и назначению на некоторый срок жидкой и кашицеобразной пищи, оказывающей меньшее механическое действие на желудок. Больным хроническими гастритами необходимо знать, что жареные блюда обладают наибольшим механическим воздействием на слизистую оболочку желудка. В меньшей степени такое действие оказывают блюда, запеченные в духовом шкафу. Наименьшим механическим воздействием обладают блюда, отваренные в воде, и паровые блюда. Механически щадящая диета не должна содержать соединительнотканных волокон. Поэтому мясо следует очистить от сухожилий и оболочек, а птицу — от кожи. Кроме того, в механически щадящих диетах не должно содержаться продуктов, богатых клеточными оболочками (отруби, мука грубого помола, крупа полтавская и «Артек», бобовые, пшено, свекла, морковь, зеленый горошек), или их количество в рационе уменьшается. Эти продукты даются только в вареном и протертом виде. Химическое действие, которое пища оказывает на желудочно-кишечный тракт, определяется содержанием в ней органических кислот, эфирных масел, экстрактивных веществ, поваренной соли, углекислоты, водорастворимых сахаров. Диетотерапия является одним из основных патогенетических методов лечения хронических гастритов. При этом выбор необходимой диеты и длительность ее применения определяются состоянием больного, а также тем, как он переносит выбранный пищевой рацион. Особенности диетотерапии при хронических гастритах с сохраненной и повышенной cекрецией. Диетический режим больных хроническими гастритами с сохраненной и повышенной секрецией во многом совпадает с тем, который назначают при язвенной болезни желудка и двенадцатиперстной кишки. Диетотерапия при этой форме хронического гастрита должна быть направлена на уменьшение раздражения гастродуоденальной зоны, при одновременном сохранении физиологической полноценности пищевого рациона. Основная цель назначения диеты — максимальное уменьшение отрицательного воздействия на слизистую оболочку желудка кислотнопептического фактора (устранение сильной стимуляции секреции желудочного сока, назначение механически щадящей диеты; увеличение кратности приема пищи, в результате чего обеспечивается более длительное ее антацидное действие). В период обострения назначается диета № 1а, которую далее заменяют диетой № 1б, позже диетой № 1 и диетой № 5. Сроки применения той или иной диеты подбираются индивидуально и зависят от течения заболевания. Даже после стихания процесса обострения и наступления стойкой ремиссии из пищевого рациона больного на длительный срок следует исключить химические возбудители желудочной секреции: эфирные масла, органические кислоты, экстрактивные вещества мяса и рыбы. Следует избегать приема алкогольных напитков, потребления жирной пищи, окрошки, жирных супов, рассольника, солянки, свинины, жирной баранины, гуся, жирных и копченых колбасных и рыбных изделий, консервов, маринадов, грибов, тушенки, изделий из слоеного и песочного теста, ледяных и газированных напитков, заварного крема. В рацион больного целесообразно включать свежеприготовленный картофельный и капустный соки. Наряду с диетотерапией комплексное лечение хронических гастритов должно включать назначение медикаментозных средств, физиопроцедур, лечебной физкультуры, санаторно-курортного лечения, а в ряде случаев хирургическое вмешательство (полипозный гастрит и др.). Медикаментозная терапия хронических гастритов, так же как лечебное питание, зависит от функционального состояния желудочных желез (субацидный, ахилический гастрит или гастрит с сохраненной и повышенной секреторной активностью), фазы заболевания (обострение, ремиссия) и его формы, а также от степени выраженности патологических изменений в желудке и сопутствующего поражения органов и систем. Лечение больных хроническими гастритами с сохраненной и повышенной секрецией во многом сходно с лечением язвенной болезни желудка и двенадцатиперстной кишки. В период обострения больному назначаются постельный режим и лечебное питание. Виды диет, их характеристика, сроки назначения и перечень входящих в них блюд подробно описаны в разделе «Особенности диетотерапии при хронических гастритах с сохраненной и повышенной секрецией». Больному следует обеспечить физический и психический покой. С целью нейтрализации повышенной кислотности желудочного сока назначают антацидные препараты: жженую магнезию (по 1–2 г за 30 мин до еды 3–4 раза в день), углекислый магний (по 1–2 г за 30 мин до еды 3–4 раза в день), альмагель и альмагель А (по 1–2 ч. л. за 30 мин до еды 4 раза в день — утром, днем, вечером и перед сном); викалин (по 1–2 таблетки 3 раза в день после еды, предварительно измельчив и запивая половиной стакана теплой воды); викаир (по 1 таблетке через 1–1,5 ч после еды 3 раза в день, запивая четвертью стакана воды); гелюсил (по 12 мл несколько раз в день); гелю-сил-лак (по 1–2 таблетки несколько раз в день); маалокс (по 1–2 таблетки через 1–1,5 ч после еды); маалокс-70 (по 10 мл внутрь через 1–2 ч после еды и непосредственно перед сном); квамател (по 20 мг 2 раза в день); актал (по 1–2 таблетки держать во рту до полного рассасывания; применять не более 16 таблеток в сутки); алюгастрин (по 1–2 таблетки между приемами пищи или по 1–2 ч. л. или 1–2 пакетика смешать с одной четвертью стакана воды — принимать внутрь между приемами пищи и перед сном); алюмаг (по 3–4 таблетки 3–4 раза в день принимать через 1–2 ч после еды); анацид (внутрь 5—10 мл между частыми приемами пищи — 6–8 раз в день; содержимое пакетика предварительно размять между пальцами); ренни (по 1–2 таблетки держите во рту до полного рассасывания; прием повторяют каждые 2 ч; принимать не более 16 таблеток в сутки); эндрюс антацид (по 1–2 таблетки); эндрюс ливер солт (1 ч. л. порошка растворить перед употреблением в стакане воды, принимать внутрь, при необходимости до 4 раз в сутки); эндрюс ансвер (содержимое пакетика растворить в одном стакане воды, принимать внутрь не более 4 пакетиков в сутки с минимальным интервалом между приемами — 4 ч); Пее-Хоо (внутрь по 10–15 мл суспензии до 6 раз в сутки); мегалак или алмасилат (внутрь по 10 мл 4 раза в день после еды); милкоф магнезия (по 2–4 таблетки или по 1–2 ч. л. суспензии); натрия гидрокарбонат (по 0,5–1 г несколько раз в сутки). В механизме развития хронических гастритов с сохраненной и повышенной секреторной активностью желудочных желез важная роль принадлежит нервно-рефлекторному фактору. Поэтому оправдано назначение холинолитических средств и других препаратов, оказывающих воздействие на нервную систему. Холинолитические препараты блокируют холинореактивные системы. По механизму действия холинолитики можно разделить на следующие группы: — препараты, обладающие атропиноподобным действием, т. е. блокирующие периферические синапсы постганглионарных парасимпатических нервов; — препараты, блокирующие синапсы вегетативных ганглиев; — препараты, оказывающие курареподобное действие, т. е. блокирующие периферические нервномышечные синапсы двигательных нервов. Препараты этой группы холинолитиков не используются в терапии хронических гастритов; — холинолитики центрального действия, блокирующее действие которых оказывается на уровне межнейронных синапсов центральной нервной системы. Кроме того, в соответствии с делением холинорецепторов на М-холинорецепторы (мускариночувствительные) и Н-холинорецепторы (никотиночувствительные) все холинолитические препараты подразделяют на вещества с преимущественным М- или Н-холинолитическим действием. Блокируя холинорецепторы, препараты холинолитического действия делают их нечувствительными к действию ацетилхолина. Одним из следствий подобной блокады является снижение секреторной активности желудочных желез. Кроме того, ряд холинолитических препаратов оказывает спазмолитическое действие. Этим объясняется широкое применение холинолитиков в комплексной терапии хронических гиперацидных гастритов. Из препаратов холинолитического действия назначают: атропин (внутрь 0,1 %-ный раствор атропина сульфата по 5–8 капель 2–3 раза в день за 30–40 мин до еды или через час после еды; под кожу по 0,5–1 мл 0,1 %-ного раствора 1–2 раза в день за 30–40 мин до еды). Препараты белладонны: экстракт белладонны густой — по 0,01—0,015 г 3 раза в день; настойка красавки — по 5—10 капель 3 раза в день; бекарбон — по 1 таблетке 2–3 раза в день; бепасал — по 1 таблетке по 2–3 раза в день; беллалгин — по 1 таблетке 2–3 раза в день после еды; белластезин — по 1 таблетке 2–3 раза в день; павестезин — по 1 таблетке 2–3 раза в день; таблетки желудочные с экстрактом красавки — по 1 таблетке 2–3раза в день и др. Препараты платифиллина: платифиллина гидротартрат — внутрь по 1 таблетке 2–3 раза в день, по 10 капель 0,5 %-ного раствора 2 раза в день или подкожно по 1–2 мл 0,2 %-ного раствора 2–3 раза в день; палюфин — по 1 таблетке 2–3 раза в день и др. Хороший эффект при гастралгии оказывает Н-холинолитик ганглерон, который, наряду с болеутоляющим эффектом, повышает содержание в желудочном соке мукопротеида и у ряда больных усиливает моторную функцию желудка. Ганглерон принимают внутрь в капсулах по 0,04 г 3–4 раза в день до еды или прибегают к его внутривенному введению (подкожно или внутривенно по 2 мл 1,5 %-ного раствора 3 раза в день). Из препаратов ганглиоблокирующей группы можно назначить кватерон. Его принимают внутрь по 0,03 г 3–4 раза в день. Следует отметить, что существует определенная зависимость между степенью морфологических изменений в слизистой оболочке желудка, наблюдаемых при хроническом гастрите, и эффективностью применения холинолитических препаратов. Отмечено, что назначение этой группы лекарственных веществ приносит лучшие результаты при поверхностном гастрите. Эффективность применения препаратов, обладающих холинолитическим действием, значительно ниже у больных с атрофическими процессами в слизистой оболочке желудка. Перечень холинолитических препаратов, применяемых при хронических гиперацидных гастритах, можно продолжить. Хорошим эффектом снижения кислотопродуцирующей активности желудочных желез обладает М-холинолитик — гастрозем. Препарат принимается внутрь по 25 мг перед едой утром и вечером, в течение 2–3 недель. Назначение гастрозема противопоказано в первом триместре беременности. Снижение кислотопродукции желудочных желез за счет блокады Н-холинорецепторов вызывает гистодил. Препарат назначается внутрь по 200 мг 3 раза в день во время еды и дополнительно на ночь 400 мг в течение 4–6 недель. При недостаточной эффективности суточную дозу препарата можно увеличить до 400 мг 4 раза в день. Блокаду Н-холинорецепторов с последующим снижением кислотности желудочного сока вызывает холинолитик фамосан. Препарат назначается внутрь по 40 мг на ночь в течение 4–6 недель, затем по 20 мг на ночь. Н-холинолитический эффект оказывает препарат ранисан. Он назначается для снижения гиперсекреторной активности желудочных желез. Рекомендуется принимать ранисан внутрь по 1 таблетке 2 раза в день (утром и вечером). Курс лечения продолжается от 4 до 6 недель. Препарат можно назначать в качестве профилактического средства, предупреждающего возникновение обострений хронического процесса. С этой целью ранисан следует назначать по 1 таблетке 1 раз в день — на ночь. Ингибирование базальной и стимулированной секреции соляной кислоты в желудке за счет блокады Н-холинорецепторов вызывает препарат гистак. При гиперацидных гастритах он назначается внутрь по 300 мг перед сном или по 150 мг 2 раза в день (утром и вечером). Курс лечения продолжается в течение 4–8 недель. Предусматривается применение препарата для профилактики обострений. В этом случае он назначается по 150 мг 1 раз в день перед сном. Из группы препаратов, обладающих Н-холинолитическим действием, для борьбы с гиперацидностью желудочного сока можно также назначать следующие лекарственные средства: зоран (внутрь после еды по 1 таблетке 2 раза в день); квамалел (внутрь по 40 мг перед сном или по 20 мг 2 раза в день — утром и вечером в течение 4–8 недель; далее поддерживающая доза 20 мг принимается на ночь в течение 4 недель); либракс (внутрь по 1 драже 3–4 раза в день за 30 мин до еды, запивая жидкостью); нейтронорм (внутрь в начальной дозе 0,2 г 3 раза в день во время еды и 0,4 г перед сном; при необходимости дозу можно увеличить до 0,4 г 3 раза в день и по 0,4 г перед сном); ранигаст (внутрь вне зависимости от приема пищи по 150 мг 2 раза в день в течение 4–8 недель); рэнкс (внутрь по 150 мг 2 раза в день, в течение 4–6 недель); симесан (внутрь по 200 мг 3 раза в день и 400 мг перед сном). Можно рекомендовать назначение М-холинолитика пирегексала (внутрь в первые 2–3 дня назначают по 50 мг 3 раза в день за 30 мин до еды, затем 2 раза в день по 50 мг; курс лечения длится 4–6 недель). Так как в развитии хронических гастритов важную роль играет патология нервной системы больного, помимо холинолитиков, в комплекс терапевтических средств следует включать препараты, способствующие нормализации нарушенной нервной регуляции: бромиды, кофеин, беллоид, белласпон и др. Понижению повышенной возбудимости коры головного мозга и подкорковых центров, а также подавлению патологических рефлексов со слизистой оболочки желудка способствует назначение следующих препаратов: фенобарбитала (внутрь по 0,03 г 1–3 раза в день); бромистого натрия — внутривенное введение 10 мл 10 %-ного раствора. На курс 10–15 вливаний; новокаина — внутривенное введение 10 мл 0,5 %-ного раствора. На курс 15–20 вливаний. Назначаются препараты, оказывающие седативный и снотворный эффект: валериана (в виде настоя по 1–2 ст. л. 3–4 раза в день или настойки — по 20–30 капель 3–4 раза в день); успокоительный чай; ноксирон — по 0,1–0,2 г; этаминал-натрий — по 0,1 г; фанодорм — по 0,1 г. Хороший эффект оказывает назначение транквилизаторов: седуксен — по 0,005 — 0,01 г 2 раза в день; мепротан — по 0,1 г 2 раза в день; эуноктин — по 0,005—0,01 г за полчаса до сна; триоксазин — по 0,3 г; метамизил — по 0,001 г; амизил — по 0,001 г; элениум — по 0,005 г 2 раза в день. В комплексную терапию включается назначение противоспастических средств: папаверина гидрохлорид — по 0,05 г 2–3 раза в день внутрь или 1 мл 3 %-ного раствора подкожно; но-шпа — по 1–2 таблетке 2–3 раза в день внутрь или по 2–4 мл 2 %-ного раствора внутримышечно; ганглиоблокаторы и т. д. Следует назначать препараты, нормализующие метаболические процессы: витамины, белковые гидролизаты, гормональные препараты, метилурацил. Из витаминных препаратов особенно важную роль в терапии хронических гастритов играют витамины группы В, витамины А и U. Наиболее обоснованным является комплексное назначение витаминов разных групп в течение 25–30 дней с повторением курса витаминотерапии 1 раз в 3–4 месяца. Из белковых гидролизатов назначают аминопептид или гидролизин Л-103. Препараты назначаются внутривенно по 200–250 мл. На курс предусматривается 4–5 вливаний. Метилурацил назначают по 1 г 3–4 раза в день. Курс лечения длится от 30 до 40 дней. В ряде случаев показано назначение гормональных препаратов: неробол (по 10 мг в сутки в течение 2–3 недель), ретаболил (0,025—0,05 г внутримышечно 1–2 раза в неделю), метиландростендиол (0,025 г под язык 2–3 раза в день) и др. Лечение хронических гастритов с секреторной недостаточностью должно быть комплексным. Оно включает диетотерапию, назначение медикаментозных средств, фитотерапию, физио- и бальнеологические процедуры. При назначении лечения следует учитывать стадию заболевания (обострение, ремиссия) и наличие сопутствующих заболеваний. В стадии обострения больному назначаются постельный режим и лечебное питание, подробно описанное в разделе «Особенности диетотерапии гастритов с секреторной недостаточностью». Щадящий пищевой режим назначается на короткое время. Далее переходят к следующей стадии диетического лечения — сокогонной диете. Чрезвычайно важным является прием пищи в определенные часы дня, в спокойной обстановке. Большое значение имеет запрещение курения и приема алкогольных напитков. Назначается заместительная терапия: натуральный желудочный сок (по 1–2 ст. л. 2–3 раза в день во время или после еды), ферментные препараты. Из ферментных препаратов применяют пепсин (по 1–2 ст. л. 2–3 раза в день во время еды), ацидин-пепсин (по 0,5 г 3–4 раза в день во время или после еды; таблетку перед приемом растворить в 1/4—1/2 стакана воды); пепсидил (по 1–2 ст. л. 3 раза в день во время еды); абомин (по 1 таблетке 3 раза в день во время еды; курс лечения 1–2 месяца. При необходимости разовую дозу увеличивают до 3 таблеток, а курс — до 3 месяцев). При ахилии хороший терапевтический эффект наблюдается при назначении панкреатина (по 0,5–1 г от 3 до 6 раз в день перед приемом пищи; запивать боржоми или водой с гидрокарбонатом натрия). При анацидных и гипоацидных хронических гастритах назначают оразу (препарат содержит комплекс аминолитических и протеолитических ферментов, получаемых из культуры гриба Аспергиллус) — по 1/2—1 ч. л. гранул 3 раза в день, во время или после еды. Длительность курса — 2–4 недели. К средствам заместительной терапии, применяемой при гипоацидных и анацидных гастритах, относятся также солизим (липолитический ферментный препарат, гидролизующий животные и растительные жиры; назначается по 40 тыс. ЛЕ — 2 таблетки 3 раза в день во время или после еды в течение 3–4 недель); панзинорм (комплексный ферментный препарат, назначается по 1 драже во время еды 3 раза в день, запивается небольшим количеством жидкости; при недостаточной эффективности дозу увеличивают до 2 драже 3 раза в день). Хороший терапевтический эффект наблюдается при назначении фестала (по 1–2—3 драже во время или сразу после еды), дигестала (по 1–2 драже 3 раза в день во время или после еды), котазим-форте (по 1 таблетке 3 раза в день во время или после еды); мезим-форте (по 1–3 драже перед приемом пищи). Рекомендуется назначение мексазы (препарат обладает ферментативным и антибактериальным действием; назначается во время или непосредственно после еды с небольшим количеством воды по 1–2 драже 3 раза в день; курс лечения при обострениях — 2–5 дней, во время ремиссии — 2–3 недели), холензима (после еды по 1 таблетке 1–3 раза в день); витогепата (внутримышечно по 1–2 мл в день, курс 15–20 дней). Заживлению пораженной слизистой оболочки желудка и устранению боли в желудке способствует применение метилметионинсульфония хлорида (витамин U). Препарат назначают по 0,1 г (2 таблетки) 3–5 раз в день после еды. Курс лечения продолжается от 30 до 40 дней. При необходимости курс повторяют. Рекомендуется назначение следующих витаминных препаратов: цианокобаламина (витамин В12; назначается по 30–60 мкг в день или по 100 мкг через день в течение 20–30 дней); никотиновой кислоты (витамин РР; назначается по 0,02—0,05—0,1 г 2–3 раза в день в течение 15–20 дней), никотинамида (по 1 таблетке — 0,025 г 2 раза в день, или парентерально — по 1–2 мл 1 %-ного раствора или 2,5 %-ного раствора внутримышечно или подкожно). Применение никотиновой кислоты у больных гипоацидным и анацидным гастритами способствует повышению количества свободной соляной кислоты в желудочном соке. Стимулирующим действием на кислотообразующую функцию желудка обладает также пиридоксин (витамин В6), причем это действие выражено сильнее при непосредственном поступлении препарата в желудок, чем при его парентеральном введении. Суточная доза витамина В6 составляет 25— 100 мг. У больных ахилическим гастритом наблюдается значительный недостаток аскорбиновой кислоты, так как в бескислотном желудочном содержимом она разрушается. Дневная потребность в аскорбиновой кислоте при ахилическом гастрите повышается в 2 раза по сравнению с нормой и составляет около 100 мкг. Поэтому в комплекс терапевтических назначений следует обязательно включать внутривенное или пероральное введение аскорбиновой кислоты. Целесообразно перед приемом развести аскорбиновую кислоту в лимонном соке, который повышает ее резорбцию. Препарат назначается в следующих дозах: внутрь по 1–2 таблетке (0,005— 0,01 г) 2–3 раза в день или внутримышечно по 1 мл 5 %-ного раствора. Витаминные препараты целесообразно назначать в комплексе друг с другом в течение 25–30 дней с повторением курса витаминотерапии один раз в 3–4 месяца. При гастралгиях следует прибегать к назначению холинолитических препаратов: платифиллина (по 1–2 мл 0,2 %-ного раствора подкожно, по 0,003—0,005 г или по 10–15 капель 0,5 %-ного раствора внутрь 2–3 раза в день; курс лечения длится от 10 до 20 дней); атропина (по 6—15 капель 0,1 %-ного раствора внутрь 2–3 раза в день за 30–40 мин до еды или через час после еды; 1 мл 0,1 %-ного раствора внутримышечно до 3 раз в день); ганглерона (по 1 мл 1,5 %-ного раствора внутримышечно до 3 раз в день или внутрь по 1 капсуле — 0,04 г 3–4 раза в день); бензогексония (по 1 мл 2,5 %-ного раствора подкожно 1 раз в день или по 1 таблетке — 0,1 г 3 раза в день за 1 ч до еды) и др. Снятию болевого симптома способствует назначение спазмолитиков: папаверина гидрохлорида (по 1 таблетке — 0,04 г 3–4 раза в день); но-шпы (по 0,04—0,08 г — 1–2 таблетке 2–3 раза в день или по 2–4 мл 2 %-ного раствора внутримышечно) и др. Так как в патогенезе заболевания важное место занимают нарушения процессов нервной регуляции, оправдано назначение бромидов, кофеина, белладонны, беллоида, белласпона, валерианы, пустырника, триоксазина и других средств, направленных на коррекцию патологических процессов в нервной системе. При бессоннице оправдано назначение перед сном димедрола (по 0,05 г), ноксирона (по 1 таблетке), фенобарбитала (по 0,1–0,2 г), родедорма (по 0,01 г) и других снотворных средств. Больным с декомпенсированными формами хронического гастрита с выраженной секреторной недостаточностью показано назначение гормональной терапии. Стероидные гормоны обладают выраженным противовоспалительным действием. Кроме того, их назначение положительно влияет на функциональную способность главных желез желудка, что проявляется в увеличении продукции пепсиногена, соляной кислоты, гастромукопротеина и других белковых фракций, вырабатываемых желудочными железами. Из гормональных препаратов назначают АКТГ (по 10 ЕД 2 раза в день внутримышечно в течение 12–15 дней), преднизон (внутрь по 5 мг 3 раза в день, курс лечения составляет 12–15 дней). Лечение стероидными гормонами быстро устраняет боли и диспепсический синдром. Кроме того, применение стероидной терапии способствует появлению в желудочном соке ранее отсутствовавшего пепсина. Это происходит в результате воздействия гормонов на белковые фракции желудочного сока. В качестве профилактических средств используют бальнео- и курортотерапевтические средства, фитотерапию и др. Курортное лечение показано больным хроническим гастритом с пониженной и нормальной секреторной и моторно-эвакуаторной функцией желудка вне фазы обострения. Основная задача при лечении больного хроническим гастритом с секреторной недостаточностью — предотвращение прогрессирования изменений слизистой оболочки желудка и восстановление ее структуры, улучшение тем самым ее функции, воздействие на воспалительный процесс в слизистой оболочке желудка, а также на функцию других органов пищеварения, как правило вовлеченных в патологический процесс при этом заболевании. Это достигается применением питьевых минеральных вод, бальнеогрязелечения, физиотерапевтических факторов, диетического питания, лечебной гимнастики и т. д. Назначение питьевых минеральных вод направлено на стимуляцию секреторной функции желудка, нормализацию ее моторики, улучшение функций печени, поджелудочной железы, кишечника. В наибольшей степени этому способствуют средне- и высокоминерализованные хлоридные натриевые, гидрокарбонатные натриевые воды, особенно содержащие углекислоту.
ГАСТРОПТОЗ
ОпределениеГастроптоз — опущение желудка вплоть до малого таза.
Этиология и патогенез Обычно гастроптоз сочетается с хронической гипотонией желудка или является ее следствием. Выделяют врожденный и приобретенный гастроптоз. Врожденный гастроптоз в первую очередь обусловлен конституциональной астенией, приобретенный гастроптоз наблюдается при резком ослаблении мышц брюшной стенки вследствие значительного похудения, после родов, устранения асцита или удаления крупных опухолей брюшной полости. Он объясняется растяжением связочного аппарата, фиксирующего положение желудка. В большинстве случаев встречается антропилороптоз, сочетающийся с удлинением и гипотонией желудка; тотальный гастроптоз наблюдается лишь при одновременном опущении диафрагмы (вследствие эмфиземы легких, массивного плеврального выпота и т. д.), смещающей вниз дно желудка.
Клиническая картина Чаще всего различают три степени опущения желудка, при этом ориентируются не на положение большой кривизны и нижнего полюса желудка, которое довольно неустойчиво и зависит от наполнения желудка и кишечника, напряжения брюшной стенки и некоторых других факторов, а на положение малой кривизны, которая менее подвижна, так как фиксирована в области кардии и привратника. При 1-й степени малая кривизна определяется на 2–3 см выше линии желчного пузыря, при 2-й степени — на ее уровне и при 3-й степени — ниже ее. Выделяют также тотальный гастроптоз и частичный, т. е. антропилороптоз. Гастроптоз чаще встречается у лиц женского пола, обычно в возрасте 15–45 лет и старше. В большинстве случаев гастроптоз 1—2-й степени протекает бессимптомно. Небольшая часть больных предъявляет жалобы на ощущение тяжести, распирания, полноты в подложечной области, особенно после обильной еды, тупые ноющие боли в эпигастрии, реже в пояснице, которые облегчаются в лежачем положении и объясняются растяжением фиксирующих желудок связок и раздражением заложенных в них нервных окончаний. Иногда отмечаются сердечные боли, возникают кратковременные боли в животе во время бега или прыжков, проходящие самостоятельно. Нередко больные жалуются на подташнивание, снижение аппетита. Часто при гастроптозе наблюдаются запоры, одной из причин которых являются значительное опущение и гипотония не только желудка, но также и поперечной ободочной кишки, что ведет к заострению ее селезеночного угла и задержке продвижения в ней содержимого. Вообще гастроптоз обычно сочетается с птозом и других органов: печени, почек и т. д., что может давать дополнительные симптомы. При осмотре больного с приобретенным гастроптозом определяется отвислость живота; при подтягивании его кверху боли нередко уменьшаются или исчезают. В ряде случаев при гастроптозе удается видеть очертания желудка. Методом глубокой скользящей пальпации можно определить опущение привратника и большой кривизны желудка.
Лечение При гастроптозе 1—2-й степени, протекающем бессимптомно, можно ограничиться рекомендацией заниматься физкультурой, выполнять упражнения, направленные на укрепление брюшного пресса. При гастроптозе 3-й степени назначают специальные курсы лечебной физкультуры под руководством опытного методиста, массаж живота, водолечение. Во всех случаях следует рекомендовать частое дробное питание, пища должна быть калорийной и легкоусвояемой, особенно при резком похудении больного. Если у больного снижен аппетит, назначают средства, стимулирующие его, в частности небольшие дозы — 4–6 ЕД инсулина за 20 мин до еды подкожно; при ахилии дают желудочный сок и его заменители. В тяжелых случаях гастроптоза, связанных с резкой дряблостью передней брюшной стенки, рекомендуют в течение 1–1,5 ч после еды лежать и назначают лечебный бандаж; его накладывают в положении больного лежа так, чтобы верхний край бандажа не был выше наиболее выступающей вперед точки живота.
Диагностика При наличии вышеперечисленных симптомов в диагностике гастроптоза помогает рентгенологическое исследование, при котором обращает внимание вытянутая вертикально форма желудка, вследствие чего большая и малая кривизны в области его тела сближены, антропилорическая часть и особенно нижний полюс желудка опущены, в отдельных случаях уходят в малый таз. При преобладании атонии выпитая контрастная масса, не встречая сопротивления стенок желудка, быстро «проваливается», скапливаясь в самой нижней его части, синус желудка расширен, перистальтика вялая, эвакуация контрастной взвеси из желудка замедлена. При исследовании желудочного сока часто обнаруживают ахлоргидрию. Дифдиагностику проводят с другими заболеваниями желудка: хроническим гастритом с секреторной недостаточностью, опухолями желудка.
Профилактика К профилактическим мерам при гастроптозе и гипотонии желудка в первую очередь относятся правильное физическое воспитание детей и подростков, систематические занятия физкультурой и спортом. Большое значение имеет укрепление брюшной стенки у женщин в период беременности и в первые месяцы после родов, применение лечебной гимнастики.
ГАСТРОЭНТЕРИТ
ОпределениеГастроэнтерит — воспалительное заболевание слизистой оболочки тонкой кишки и желудка.При остром гастроэнтерите в патологический процесс одновременно вовлекаются желудок (гастроэнтерит) и толстая кишка (гастроэнтероколит).
Этиология и патогенез Выделяют острые гастроэнтериты: — инфекционного и вирусного происхождения (с клинической картиной тяжелого гастроэнтерита протекают холера, брюшной тиф, сальмонеллезы, иногда грипп и т. д.); — алиментарные (обусловленные перееданием с приемом большого количества острой либо слишком грубой пищи, раздражающих слизистую оболочку приправ, крепких алкогольных напитков); — токсические (при отравлениях соединениями мышьяка, сулемой и другими ядами; отравлениях грибами — бледной поганкой, мухоморами, ложными опятами, другими ядовитыми веществами небактериальной природы, которые могут содержаться в пищевых продуктах — косточковых плодах, некоторых рыбных продуктах — печень налима, щуки, икра скумбрии и т. д.); — аллергические (при идиосинкразии к некоторым пищевым продуктам — землянике, яйцам, крабам и т. д. или при аллергической реакции на медикаменты — препараты йода, брома, некоторые сульфаниламиды, антибиотики и т. п.). Патогенез обусловлен либо непосредственным действием патологического начала на слизистую оболочку тонкой кишки, либо его гематогенным заносом (микробы, токсины) в кишечные сосуды, а затем повреждающим действием при выделении слизистой оболочкой в просвет кишечника, либо вследствие аутоиммунных механизмов. Предрасполагающими моментами к возникновению острого гастроэнтерита являются холодное питье, общее охлаждение организма, полигиповитаминозы, злоупотребление продуктами, богатыми грубой клетчаткой.
Хронический гастроэнтерит Основные факторы, ведущие к развитию хронических гастроэнтеритов: — систематические алиментарные нарушения, злоупотребление острой пищей и приправами, безрежимное питание; — алкоголизм, особенно прием крепких алкогольных напитков и их суррогатов; — производственные интоксикации при нарушениях техники безопасности и хронических отравлениях соединениями свинца, ртути, фосфора, мышьяка и др.; бытовые интоксикации, в частности лекарственные (при злоупотреблении солевыми слабительными, длительном бесконтрольном применении антибиотиков широкого спектра действия, способных вызвать кишечный дисбактериоз и др.) и эндогенные (при уремии); — пищевая аллергия; — паразитарные инвазии (лямблиоз и др.), некоторые кишечные гельминтозы; — радиационные поражения (производственные при нарушении техники безопасности и в результате лучевого лечения злокачественных новообразований живота); — «сопутствующие» гастроэнтериты при длительно протекающих гастритах с секреторной недостаточностью желудка, хронических панкреатитах, колитах. Наиболее изученные механизмы развития заболевания: — непосредственное хроническое повреждающее воздействие этиологического фактора на стенку тонкой кишки (токсическое, раздражающее); — длительно существующий дисбактериоз, сопровождающийся раздражением и токсическим действием продуктов ненормального расщепления пищевых веществ под влиянием ферментов необычной кишечной флоры (органические кислоты, альдегиды, индол, скатол, метан, сероводород и др.), а также бактериальных токсинов на слизистую оболочку кишечной стенки; — иммунологические механизмы. В некоторых случаях преимущественно поражается тощая (еюнит) или подвздошная (илеит) кишка.
Клиническая картина Острый гастроэнтерит Заболевание может начинаться с местных симптомов: тошноты, рвоты, диареи, выраженного урчания в животе, иногда спастических болей. Затем к ним присоединяются слабость, общее недомогание, холодный пот, лихорадка (температура может достигать 38–39 °C и выше), явления общей интоксикации, симптомы сосудистого коллапса. В других случаях общие симптомы появляются первыми, а спустя некоторое время (от получаса до нескольких часов) к ним присоединяются признаки воспалительного поражения тонкой кишки. При пальпации живота отмечается болезненность в эпигастральной области, иногда сильное урчание при пальпации слепой кишки. Отмечается умеренный, реже выраженный лейкоцитоз, повышение СОЭ.
Хронический гастроэнтерит Боль (если имеет место) носит тупой, редко спастический характер, локализуется в околопупочной области; здесь же нередко отмечается болезненность при пальпации живота и сильном давлении (несколько левее и выше пупка — симптом Поргеса), болезненность по ходу брыжейки тонкой кишки (по направлению от пупка к правому крестцово-подвздошному сочленению — симптом Штернберга). Боль при сотрясении тела, ходьбе может быть признаком перивисцерита. Урчание и плеск при пальпации слепой кишки — важный признак гастроэнтерита (симптом Образцова). Синдром кишечной диспепсии проявляется малохарактерными диспепсическими жалобами: ощущением давления, распирания и вздутия живота, особенно после еды, тошнотой, ощущением урчания, переливания в животе и др., которые возникают в результате нарушения переваривания пищевых веществ в кишечнике, ускорения их пассажа по тонкой кишке, а также нарушения всасывания в кишечнике. Иногда при тяжелом гастроэнтерите вскоре после еды возникают слабость, головокружение и другие общие явления, напоминающие демпинг-синдром. Гастроэнтеритный копрологический синдром: частый (до 15–20 раз в сутки) кашицеобразный, с непереваренными частицами пищи, но без видимой слизи, часто зловонный, с пузырьками газа стул. Характерна полифекалия: общее количество каловых масс за сутки может достигать 1,5–2 кг. Иногда возникают резкие позывы к дефекации вскоре после еды, а после дефекации возникает резкая слабость, сопровождаемая холодным потом, дрожанием рук (еюнальная диарея). В нетяжелых случаях и при отсутствии сопутствующего колита понос может отсутствовать и даже наблюдаться запор. Характерна непереносимость молока: после его приема усиливаются метеоризм, понос. Обострение заболевания вызывают прием острой пищи, содержащей большое количество жиров и углеводов, переедание. Часто имеет место своеобразный желтоватый (золотистый) цвет каловых масс вследствие наличия невосстановленного билирубина и большого количества жира, придающего каловым массам глинистый вид. При микроскопическом исследовании: большое количество остатков непереваренной пищи (лиентерея), капли нейтрального жира (стеаторея), капельки, глыбки и кристаллы жирных кислот и нерастворимых мыл, мышечные волокна (китаринорея), свободный внеклеточный крахмал (амилорея), большое количество слизи, равномерно перемешанной с каловыми массами.
Диагностика и дифдиагностика Острый гастроэнтерит Дифференциальный диагноз неинфекционных гастроэнтеритов прежде всего проводят с острыми кишечными инфекциями (холерой, брюшным тифом, пищевыми интоксикациями), а также с общими инфекционными и вирусными заболеваниями, которые могут протекать с энтеритным синдромом. Большое значение имеет эпидемиологический анамнез. Бактериологическое исследование испражнений часто позволяет выделить патогенного возбудителя (при инфекционных острых гастроэнтеритах). Детальный расспрос больного облегчает дифференциальную диагностику алиментарных, токсических, аллергических гастроэнтеритов. В легких и среднетяжелых случаях заболевание заканчивается выздоровлением через несколько дней. Тяжелые формы могут осложняться кишечными кровотечениями, некрозом и перфорацией тонкой кишки. При токсических и аллергических гастроэнтеритах могут иметь место сопутствующие поражения других органов — сердца, печени и т. д.
Хронический гастроэнтерит При дифференциальном диагнозе в первую очередь следует исключить алиментарные диспепсии, возникающие вследствие систематического нерационального питания (бродильную, гнилостную, жировую). В этих случаях специальные исследования не показывают нарушений процессов всасывания кишечной стенкой, при аспирационной биопсии не обнаруживается воспалительных изменений в слизистой оболочке кишки, а перевод больного на рациональное питание без дополнительных лечебных мероприятий обычно быстро устраняет патологические симптомы и нормализует функцию кишечника. В случаях тяжелого гастроэнтерита нужно проводить дифференциальную диагностику со спру. Сравнительно редкой формой гастроэнтерита является регионарный гастроэнтерит (болезнь Крона), который протекает чаще всего с преимущественным поражением подвздошной кишки, лихорадочным состоянием, гиперглобулинемией, прогрессирующим течением. Следует исключить возможность врожденных энзимодефицитных энтеропатий (глютеновой, дисахаридазной и т. д.), в первую очередь назначением соответствующей диеты, а также пробами с нагрузками различными дисахарами, глиадином и т. д.
Лечение и профилактика Острый гастроэнтерит Больных с тяжелым гастроэнтеритом, а также гастроэнтеритом токсического происхождения (дальнейшее течение которого определить в первые часы болезни трудно) обязательно госпитализируют. Больных с инфекционными гастроэнтеритами госпитализируют в инфекционные больницы. Во всех случаях острого гастроэнтерита с целью удаления из желудочно-кишечного тракта токсинов желудок промывают (зондовым или беззондовым способом) слабым раствором натрия гидрокарбоната, дают внутрь слабительное (30 мл касторового масла или 25 г магния сульфата в 100 мл воды). В первые 12–24 ч назначают голод, рекомендуют обильное питье (кипяченая вода, несладкий чай). При выраженной общей интоксикации назначают подкожно или внутривенно капельные вливания изотонического раствора натрия хлорида или 5 %-ного раствора глюкозы, кордиамин, сульфокамфокаин, кофеин. Внутрь назначают препараты пищеварительных ферментов (абомин, фестал и др.), а в дальнейшем с целью нормализации кишечной флоры — энтеросептол, интестопан или же колибактерин, бифидумбактерин, бификол, лактобактерин. Со 2-го дня заболевания больным разрешают нежирный бульон, протертые каши на воде, сухари; в последующие дни диету расширяют. Профилактика острых гастроэнтеритов заключается в строгом соблюдении правил личной гигиены, употреблении в пищу только тщательно вымытых овощей и фруктов, рациональном питании. Для профилактики токсических гастроэнтеритов из пищи исключают продукты, которые могут оказать токсическое действие на организм (неизвестные грибы и т. д.).
Хронический гастроэнтерит Лечение в период обострения проводится в стационаре. Назначают диету № 4—4а, 4б, 4 в. Пищевой рацион должен содержать достаточное количество белка (130–150 г) в основном животного происхождения (телятина, нежирное говяжье или куриное мясо, рыба, яйца, творог) и легко усвояемых жиров (100–110 г). Исключают тугоплавкие жиры животного происхождения (бараний, свиной); в период обострения процесса количество жиров временно уменьшают до 60–70 г. Количество углеводов в дневном рационе обычное — как при легкой и средней физической нагрузке (около 450–500 г), однако ограничивают продукты, содержащие большое количество клетчатки. Последнее достигается, помимо подбора продуктов, тщательной механической обработкой пищи (протертые овощи и фрукты, пюре). При поносах исключают из пищевого рациона чернослив, инжир, капусту, виноград, черный хлеб, свежевыпеченные мучные продукты, орехи, бродильные напитки — пиво, квас. Режим частого (5–6 раз в день) дробного питания; вся пища принимается в теплом виде. В период обострения процесса пища назначается в механически щадящем виде — в виде слизистых отваров, супов, протертых каш, пюре, паровых котлет, суфле и т. д. При поносах хороший эффект оказывает систематический прием ацидофильного молока (по 100–200 г 3–4 раза в день) и несладких соков и киселей из фруктов и ягод, содержащих дубильные вещества (черника, черная смородина, гранаты, груша и др.). При явлениях авитаминоза назначают витамины, в первую очередь В, В2, В6, B12, фолиевую кислоту, витамин А, при геморрагических явлениях — витамин К (викасол). Особенно полезны комплексные витаминные препараты: пангексавит, декамевит, ундевит и др. Антибиотики широкого спектра действия при хроническом гастроэнтерите не находят большого применения из-за опасности дисбактериоза. Чаще назначают колибактерин, бифидумбактерин, бификол и особенно производные оксихинолина: энтеросептол, интестопан, мексаформ, мексазу. Препараты пищеварительных ферментов (желудочный сок и аналогичные лекарственные средства, панкреатин, фестал, холензим, абомин и др.) показаны при преимущественном нарушении полостного внутрикишечного пищеварения. В период обострения процесса, особенно сопровождающегося поносом, показано пероральное применение вяжущих и обволакивающих средств (нитрат висмута основного, танальбин, теальбин, отвары корневища или корней змеевика, кровохлебки, лапчатки — 4,0—15,0: 200,0 или настоев цветов пижмы, травы зверобоя, шишек ольхи и др. — 10,0—30,0:200,0 по 1 ст. л. 5–6 раз в день). При тяжелых гастроэнтеритах с явлениями недостаточности всасывания назначают повторно внутривенно вливания плазмы, белковых гидролизатов (аминопептид, гидролизат казеина, аминокровин и др.) — 1 л/сут.; в более легких случаях их вводят через интрагастральный зонд капельно. Полезно назначение анаболических стероидных гормонов (метандростенолона по 0,005— 0,01 г 1–2 раза в день перорально или ретаболила 0,025—0,05 г 1 раз в 1–3 недели внутримышечно). Лечение сопутствующего малокровия (см. Анемии). Из физиотерапевтических процедур наиболее эффективны согревающие компрессы, парафиновые аппликации, озокерит, диатермия, индуктотермия и т. д. Курортное лечение в санаториях Желез новодска, Ессентуков, Пятигорска, Миргорода, Боржоми. В тяжелых случаях хронического гастроэнтерита показано трудоустройство больных и перевод на инвалидность. Профилактика заключается в предотвращении действия тех факторов, которые способны вызвать хронический гастроэнтерит. Необходимо своевременное лечение острых и подострых гастроэнтеритов и диспансеризация больных хроническим гастроэнтеритом с целью профилактики рецидивов болезни и возникновения возможных осложнений.
ГЕЛЬМИНТОЗЫ
ОпределениеГельминтозы — заболевания, вызываемые поселившимися в организме паразитическими червями — гельминтами и их личинками. У человека описано более 250 видов гельминтов, из них наибольшее значение имеют представители класса круглых червей: возбудители аскаридоза (см.), анкилостомидозов (см.), стронгилоидоза (см.), трихинеллеза (см.), энтеробиоза (см.), трихоцефалеза (см.); класса ленточных червей (цестод): возбудители альвеококкоза (см.), тениаринхоза (см.), тениоза (см.), гименолепидоза (см.), дифиллоботриоза (см.), цистицеркоза (см.), эхинококкозов (см.); плоских червей класса сосальщиков (трематод): возбудители шистосомоза (японского, мочеполового, кишечного) (см.), фасциолеза (см.), фасциолопсидоза (см.), описторхоза (см.), клонорхоза (см.), метагонимоза (см.), парагонимозов (см.).К группе кишечных гельминтов относятся аскаридоз (см.), анкилостомидоз, стронгилоидоз, трихинеллез, тениаринхоз, тениоз, гименолепидоз, дифиллоботриоз, метагонимоз, энтеробиоз и трихоцефалез. К группе внекишечных гельминтозов относятся фасциолезы, описторхоз, клонорхоз. Различают также три типа гельминтозов человека: биогельминтозы, геогельминтозы и контагиозные (контактные) гельминтозы. Возбудители биогельминтозов в организме человека проходят только часть своего развития, прежде чем приобретают способность к заражению другого человека. Остальная часть развития происходит в организмах одного или нескольких промежуточных хозяев. К биогельминтозам относятся все трематодозы, цестодозы и некоторые нематодозы (шистосомозы, альвеококкоз, описторхоз, парагонимоз, тениаринхоз, тениоз, эхинококкоз, дифиллоботриоз, трихинеллез, онхоцеркоз, лоаоз и др.). Возбудители геогельминтозов некоторый период своего развития проводят в организме человека. Остальная часть их развития проходит на каком-нибудь неживом субстрате, чаще всего в почве. Промежуточные хозяева отсутствуют. К геогельминтозам относятся аскаридоз, трихоцефалез, анкилостомидозы, стронгилоидоз и др. При контагиозных, или контактных, гельминтозах из организма человека выделяются зрелые (или почти зрелые) возбудители, способные к заражению. К контагиозным гельминтозам относят гименолепидоз и энтеробиоз.
Этиология Нематодозы Нематодозы вызываются представителями класса круглых червей (нематод): возбудителями филяриозов (лоаоза и др.), аскаридоза, анкилостомидозов, стронгилоидоза, трихинеллеза, энтеробиоза, трихоцефалеза. Нематоды имеют удлиненную, нитевидную или веретенообразную форму, длиной от 1 мм до 1 м и более. На поперечном срезе тело округлое. У одних нематод наружная оболочка (кутикула) поперечно исчерчена, у других имеет различные приспособления для фиксации червей в организме хозяина (продольные гребни, шипики, щитки). Нематоды являются раздельнополыми животными. Яйца разнообразны по форме и величине, снабжены плотной оболочкой.
Цестодозы Цестодозы — гельминтозы, вызываемые представителями класса ленточных червей (цестод): альвеококкоз, тениаринхоз, тениоз, гименолепидоз, дифиллоботриоз, цистицеркоз, эхинококкоз, спарганоз. Цестоды имеют плоское лентовидное тело — стробилу, состоящую из головки (сколекса), шейки и члеников (проглоттид). На головке имеются различные приспособления для прикрепления к стенке кишечника хозяина (присоски, ямки-ботрии, крючки).
Трематодозы Трематодозы — гельминтозы, вызываемые представителями класса трематод. Наиболее распространенными из них являются: возбудители шистосомоза, фасциолеза, фасциолопсидоза, описторхоза, клонорхоза, метагонимоза, парагонимозов. Представители класса трематод имеют листовидную или ланцетовидную форму тела, длина которого варьирует от 1 мм до нескольких сантиметров. Органы фиксации представлены мускулистыми присосками и нередко хитиновыми шипами. Паразитические трематоды имеют примитивную нервную и пищеварительную системы. Половая система у большинства видов гермафродитная; шистосомы являются раздельнополыми червями с выраженным половым диморфизмом. Яйца многих трематод имеют плотную оболочку и снабжены крышечкой, кроме яиц шистосом. Возбудителем нанофиетоза является нанофиетус, паразитирующий в кишечнике человека, собаки, кошки, норки, барсука. Возбудитель парагонимоза имеет тело яйцевидной формы, покрытое чешуевидными шипиками, а яйца овальные, золотистокоричневого цвета, с крышечкой и толстой оболочкой.
Эпидемиология, патогенез и патанатомия Нематодозы и цестодозы Большинство паразитических видов нематод развиваются без промежуточных хозяев (аскарида, власоглав, анкилостома и др.) — геогельминты, у некоторых происходит смена хозяев (филярии) — биогельминты. Для трихинелл окончательным и промежуточным хозяином является один и тот же организм. Цестодозы являются биогельминтами. Промежуточными хозяевами могут быть дикие животные, грызуны (при альвеококкозе), домашние животные, а также человек. Заражение происходит при несоблюдении правил личной гигиены, при употреблении зараженного мяса, рыбы, а также немытых сырых овощей и ягод. Кроме того, заражение возможно при контакте с больными животными (альвеококкоз).
Трематодозы Все трематоды являются биогельминтами. Жизненные циклы трематод разнообразны и нередко очень сложны. Для них характерно последовательное развитие двух или трех поколений паразита в организме двух или трех хозяев — первый промежуточный, второй промежуточный (дополнительный) и окончательный. Первым промежуточным хозяином трематод всегда являются моллюски, вторым промежуточным хозяином — рыбы, крабы и раки, окончательным — человек и некоторые позвоночные животные. Находящиеся в организме окончательного хозяина гельминты выделяют яйца, которые, попадая в окружающую среду, развиваются с выходом из них мирацидий — личинок с ресничным покровом. При внедрении в организм первого промежуточного хозяина (моллюска) ресничный покров сбрасывается (у трематод некоторых видов мирацидий выходит из яйца в кишечнике моллюска). В организме моллюска развивается материнская спороциста, а затем дочерние, в которых формируются церкарии — личинки, выходящие из моллюска и живущие в воде. Они имеют овальное тело и хвост, способствующий свободному передвижению. При внедрении церкария в организм дополнительного хозяина формируется покоящаяся инвазионная (заразная) стадия — метацеркарий (описторхоз, клонорхоз). У шистосом стадия редии (спороцисты) выпадает, а церкарии являются инвазионными личинками, способными проникать через неповрежденную кожу человека. Для ряда трематод характерно инцистирование церкарий в окружающей среде (на водяных растениях в стоячих водоемах) и превращение их в адолескариев. Заражение окончательного хозяина происходит либо при употреблении в пищу рыбы, крабов и раков — дополнительных хозяев (при описторхозе, клонорхозе, парагонимозе и др.), либо при заглатывании адолескариев с водой или съедобными растениями (салат, укроп, петрушка), которые поливали водой из открытых водоемов (при фасциолезе, фасциолопсидозе и др.). Церкарии шистосом активно проникают через кожу или слизистые оболочки хозяина с формированием в его организме половозрелых гельминтов — мариты. Половозрелые трематоды поражают многие органы и ткани: желчевыделительную систему (описторхисы, клонорхисы, фасциолы, дикроцелии), протоки поджелудочной железы (описторхисы, клонорхисы), кишечник (фасциолопсисы), легкие(парагонимы), венозную систему брюшной полости (шистосомы). Возбудители нанофиетоза оказывают механическое и токсико-аллергическое воздействие на ткани кишечника. Ареал обитания различных трематод неодинаков. Он определяется комплексом природных факторов (климат, наличие водоемов, популяции промежуточных хозяев, их численность) и социальных факторов (особенности быта, профессия, санитарное состояние населенных пунктов, уровень организации здравоохранения).
Клиническая картина и диагностика Нематодозы и цестодозы Различные гельминты класса нематод и цестод вызывают различные болезненные состояния, клинические проявления которых зависят от вида паразита. В их основе лежит развитие аллергических реакций, интоксикация продуктами обмена веществ живых червей или продуктами распада погибших особей, механическое воздействие на органы и ткани. Последнее выражается травмированием в результате прикрепления к ним паразитов, а также сдавливанием и нарушением целостности при перемещении личинок. В клиническом течении различают три стадии: острую, латентную (скрытую) и хроническую. Острая стадия характеризуется развитием аллергического симптомокомплекса в связи с перемещением личинок гельминта по кровеносной системе и тканям человека. Латентная стадия клинически не проявляется. В этот период в организме человека паразитируют незрелые гельминты. С момента первой яйцекладки самкой паразита наступает хроническая стадия. Именно в начале данной стадии клинические проявления выражаются наиболее ярко. При отсутствии выявления паразита и соответствующего лечения в организме человека наступают необратимые изменения. Это так называемая стадия исхода. Выраженность симптомов снижена, поскольку к этому времени паразит, как правило, отмирает.
Трематодозы Механизм развития и клиническая картина трематодозов определяются видовой принадлежностью паразита, стадией его развития, локализацией в организме хозяина, интенсивностью инвазии, путями миграции личиночных стадий. Например, нанофиетоз проявляется болью и урчанием в животе, поносами, запорами, слюнотечением и тошнотой по ночам. Основными факторами механизма развития являются сенсибилизация (состояние повышенной чувствительности) организма хозяина продуктами обмена и распада паразитов и механическое воздействие на него трематод. Диагностика трематодозов основывается на клинико-эпидемиологических и лабораторных данных (анализ крови с целью выявления эозинофилии, исследование кала, желчи, мокроты с целью обнаружения яиц гельминтов). В диагностике миграционной стадии важное значение приобретают иммунологические методы исследования: РСК, РНГА, иммуноферментный анализ. Применяется внутрикожная проба.
Лечение и профилактика При различных видах гельминтозов применяется соответствующее лечение. Меры профилактики схожи. Необходимо исключить употребление непроваренного мяса, рыбы (сырой, недостаточно просоленной или термически обработанной), раков, крабов, немытых овощей и ягод. Важно своевременное выявление и лечение зараженных лиц, а иногда и животных, охрана водоемов и почвы от загрязнения фекалиями.
ГЕМАНГИОМА
ОпределениеГемангиома представляет собой доброкачественную опухоль, происходящую из сосудов, преимущественно у детей в возрасте до 1 года.
Этиология и патанатомия Заболевание возникает на основе врожденных аномалий сосудов. В зависимости от строения и распространенности подразделяется на капиллярную (гипертрофическую), кавернозную и ангиоматоз. В капиллярной опухоли сосудистая ткань значительно увеличена в объеме, часть клеток находится в спавшемся состоянии. Этот вид ангиом склонен к инфильтрирующему росту. Кавернозная опухоль представляет собой множество полостей различной формы и величины, заполненных кровью. Ангиоматоз занимает значительные участки конечности (чаще всего) и является доброкачественным разрастанием различных сосудов (артерий, вен, капилляров).
Клиническая картина Гемангиома не вызывает каких-либо субъективных ощущений. Она поражает чаще всего кожу лица и имеет вид розового или фиолетово-розового пятна, несколько выступающего над кожей. При поражении подкожной клетчатки и мышц образование характеризуется распространенной формой, цвет кожи над гемангиомой может быть не изменен. Возможны осложнения в виде кровотечения, тромбофлебита, тромбоза. Диагноз устанавливается на основании характерных объективных данных.
Лечение Для лечения гемангиом применяются оперативные вмешательства, склерозирующие вещества, электрокоагуляция, криотерапия и облучение. Наиболее радикальным и основным методом является хирургический. Лучевая терапия применяется при кавернозных гемангиомах. Лечение рекомендуется начинать со 2 месяца жизни, в связи с возможностью роста опухоли.
ГЕМАРТРОЗ
ОпределениеГемартроз — кровоизлияние в полость сустава.
Этиология Возникает при ушибах, чаще при внутрисуставных повреждениях (разрывы капсулы, мениска, вывихи, подвывихи, переломы). Самая частая локализация — коленный сустав.
Клиническая картина Кровь заполняет полость сустава и его завороты, вызывая боль, увеличение объема сустава, ограничение и болезненность движений. Диагноз устанавливается на основании жалоб, объективных данных, пункции. Для исключения травмы костей необходима рентгенография сустава. К числу осложнений относятся переход в хроническое течение с развитиемсиновита (см.); при инфицировании содержимого сустава может развиться гнойный артрит (см.).
Лечение и профилактика Транспортировка в стационар с обеспечением покоя сустава, пункция сустава в асептических условиях, удаление крови, давящая повязка на коленный сустав в виде кольца, задняя гипсовая лонгета на 2–3 недели. После этого назначают лечебную гимнастику и физиотерапию. Профилактика заключается в применении защитных приспособлений при игре в футбол, баскетбол, волейбол, хоккей.
ГЕМАТОМА НОСОВОЙ ПЕРЕГОРОДКИ
ОпределениеГематома носовой перегородки — кровоизлияние под слизистую оболочку носовой перегородки с образованием гематомы. В дальнейшем при инфицировании гематомы может образоваться абсцесс. Причиной развития гематомы носовой перегородки часто являются травмы.
Клиническая картина Резкое затруднение носового дыхания; при развитии абсцесса носовой перегородки — повышение температуры тела, головная боль. При передней риноскопии видны мягкие мешковидные выпячивания ярко-красного цвета. При гнойном расплавлении хряща носовой перегородки отмечается западение спинки носа.
Лечение При гематоме — отсасывание крови и тугая тампонада носа, при абсцессе — широкое вскрытие его и тампонада полости носа, антибиотикотерапия; западение спинки носа исправляют хирургическим путем (пластические операции — пересадка хряща и др.).
ГЕМАТУРИЯ
ОпределениеЭто кровь в моче, один из синдромов, развивающийся при различных почечных патологиях, при этом отмечается появление в моче эритроцитов, которые могут быть свежими или измененными, в зависимости от уровня поражения, от места попадания эритроцитов в мочевую систему. При развитии патологии в почках эритроциты под действием щелочной среды изменяются, такие эритроциты называются выщелоченными, при патологии мочеточников, мочевого пузыря, уретры эритроциты не успевают измениться, такие эритроциты неизмененные — свежие.В зависимости от количества эритроцитов в моче выделяют макрогематурию (большое содержание эритроцитов в моче), микрогематурию (незначительное количество эритроцитов в моче), при незначительной примеси моча не меняет своего цвета или незначительно изменяется, такую патологию диагностируют лабораторными методами диагностики: общий анализ мочи, проба Нечипоренко и др. При интенсивной гематурии моча цвета крепкого чая, мясных помоев.
Этиология и патогенез Повышение эритроцитов в моче встречается при следующих заболеваниях: геморрагический диабет, артериальная гипертензия с вовлечением сосудов почек, инфекции мочевого тракта, камни мочевыводящих путей, опухоли мочеполовой системы, отравления различными ядами (бензол, анилин, грибы, змеиный яд), травма почек, системная красная волчанка.
Лечение Лечение необходимо проводить в специализированных отделениях, производят устранение основного заболевания.
ГЕМОФИЛИЯ
ОпределениеГемофилия — генетически детерминированные нарушения синтеза или аномалии VIII и IX факторов свертывания крови, гены которых локализуются в разных частях Х-хромосомы и являются рецессивными. Очень редко гемофилия обусловлена дефицитом факторов VII, X, V и XI.
Этиология и патогенез Гемофилия представляет собой генетическое заболевание, сцепленное с полом. Ген, ответственный за синтез VIII и IX факторов, локализуется в Y-хромосоме, вследствие чего гемофилией заболевают почти исключительно мужчины. Заболевание гемофилией женщины возможно при браке между больным гемофилией и женщиной-носителем. Основной механизм кровоточивости при гемофилии заключается в нарушении внутреннего механизма свертывания вследствие дефицита или недостаточной активности VI–II или IX фактора. Заболевание, связанное с недостатком VIII фактора, обозначают как гемофилию А, с дефицитом IX фактора — как гемофилию В. Частота гемофилии А составляет 85–90 %, а гемофилии В — 10–15 %. Известна также гемофилия С, связанная с дефицитом XI фактора.
Клиническая картина Клинически гемофилии А и В не отличаются друг от друга и могут различаться только по лабораторным данным. Основным клиническим признаком заболевания является склонность к кровоточивости. Характерны кровоизлияния в крупные суставы, внутримышечные гематомы, обильные и длительные кровотечения при травмах, гематурия (наличие крови в моче). Реже возникают желудочно-кишечные и легочные кровотечения, забрюшинные гематомы, внутричерепные кровоизлияния. В зависимости от уровня антигемофилических факторов VIII или IX различают гемофилии различной тяжести: от 0 до 1 % нормального содержания — крайне тяжелая форма; от 1 до 2 % — тяжелая форма; от 2 до 5 % — форма средней тяжести; выше 5 % — легкая форма, при которой, однако, у всех больных имеется опасность тяжелых и даже смертельных кровотечений после травм и хирургических вмешательств. Проявления гемофилий меняются в зависимости от возраста. При рождении могут наблюдаться гематомы в области черепа. Когда ребенок учится ходить, то при падениях возникают носовые кровотечения, гематомы в области черепа и мягких тканей. В более старшем возрасте на первый план выступают кровоизлияния в суставы, появляющиеся тем раньше, чем тяжелее гемофилия. У каждого больного в зависимости от возраста и тяжести заболевания поражается от 1–2 до 8—10 суставов. Клинически различают три разновидности поражения суставов при гемофилии: острые гемартрозы; хронические геморрагически-деструктивные остеоартрозы; вторичный ревматоидный синдром (воспалительный процесс в мелких суставах, не поражавшихся ранее кровоизлияниями, с развитием деформации и прогрессированием суставного процесса, отсутствием связи между болевым синдромом и свежими кровоизлияниями в суставы при наличии лабораторных признаков, характерных для ревматоидного артрита). Типичными для гемофилии являются кровотечения после травм и операций, возникающие обычно через 1–5 ч. Особенно опасны удаления миндалин и зубов, которые могут сопровождаться длительными кровотечениями. Осложнения при гемофилии включают постгеморрагическую анемию, сдавление и разрушение тканей гематомами, инфицирование гематом, почечную колику, отсутствие выделения мочи.
Диагностика и дифдиагностика Гемофилию диагностируют на основании наличия гематомного типа кровоточивости (поздние кровотечения при операциях, подкожные гематомы, гемартрозы), семейных случаев заболевания по мужской линии, данных лабораторных исследований. Важнейшим лабораторным признаком является выявление пониженной свертываемости в общих тестах (время свертывания цельной крови). Форму гемофилии устанавливают, добавляя к плазме больных компоненты нормальной крови. Отсутствие нормализации свертывания в одной из пробирок указывает на дефицит того же фактора в обеих смешиваемых порциях плазмы, т. е. на дефицит его у больного. Необходимо дифференцировать гемофилию и болезнь Виллебранда, которая представляет собой наследственное заболевание, обусловленное нарушением синтеза фактора свертываемости крови, обозначаемого как фактор Виллебранда. От гемофилии болезнь Виллебранда отличается типом наследования и кровоточивости, нарушением функции тромбоцитов.
Лечение и профилактика Основным методом лечения кровоточивости при гемофилии является заместительная терапия в виде применения гемопрепаратов, содержащих фактор свертываемости. Применяются рекомбинированные препараты фактора VIII при гемофилии типа А, фактора IX при гемофилии типа В по схеме. При длительной терапии гемофилии возможно появление в крови веществ, подавляющих фактор свертываемости, в связи с чем трансфузионная терапия утрачивает свою эффективность. В такой ситуации показан плазмофорез с целью удаления из кровотока веществ, подавляющих свертываемость крови. В экстренных случаях допустимо производить массивные прямые гемотрансфузии не реже трех раз в сутки. Местно применяют обработку кровоточащих участков тромбопластином, тромбином, аминокапроновой кислотой. При острых гемартрозах производят временное обеспечение покоя суставов (3–5 дней), отсасывание крови с последующим введением в сустав гидрокортизона. Профилактика и лечение хронических гемофилических гемартрозов включают предупреждение травм конечностей, ЛФК, физиотерапию, рентгенотерапию, синовэктомию. При ревматоидном синдроме назначают глюкокортикоиды — преднизолон в дозе 20–40 мг. Профилактика кровотечений при гемофилии включает предупреждение травм, трансфузионную терапию перед оперативным вмешательством, систематическое внутривенное введение препаратов, содержащих фактор свертываемости.
ГЕМЕРАЛОПИЯ
ОпределениеГемералопия (ночная слепота, куриная слепота) — расстройство сумеречного зрения.
Этиология и патогенез Причины врожденной гемералопии недостаточно выяснены. Причиной гемералопии являются авитаминоз или гиповитаминоз А, а также В, иPP (см.). Симптоматическая гемералопия наблюдается при заболеваниях сетчатки и зрительного нерва. В развитии заболевания играет роль процесс восстановления зрительного пурпура.
Клиническая картина Ослабление зрения и пространственной ориентации в сумерках. Понижение световой чувствительности, нарушение процесса темновой адаптации, сужение полей зрения, особенно на цвета. Диагноз ставят на основании жалоб, клинической картины и данных лабораторных исследований. При врожденной гемералопии отмечается стойкое понижение зрения. В случае первичной гемералопии прогноз благоприятный, при симптоматической гемералопии он зависит от течения и исхода основного заболевания.
Лечение и профилактика Врожденная гемералопия лечению не поддается. При симптоматической гемералопии лечат основное заболевание. При первичной гемералопии показано назначение внутрь витамина А: взрослым — по 50—100 тыс. МЕ в сутки, детям — 1–5 тыс. МЕ в сутки; одновременно назначают рибофлавин (до 0,02 г в сутки). Профилактикой первичной гемералопии является достаточное потребление витамина А.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ
ОпределениеГемолитическая болезнь новорожденных — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между организмами матери и плода из-за несовместимости по резус-фактору.
Этиология и патогенез Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус-факторам (С, Е, с, d, e) или М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в ее организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Клиническая картина Различают три формы гемолитической анемии: отечную, желтушную и анемическую. Отечная протекает наиболее тяжело и характеризуется общим отеком при рождении, накоплением жидкости в полостях (плевральной, сердечной сумке, брюшной), резкой бледностью с желтизной, увеличением печени и селезенки. В анализах крови отмечаются резкая анемия и изменения клеточного состава крови. Сочетание резкой анемии и снижения уровня белков в крови способствует развитию сердечной недостаточности, которая и приводит к смерти (внутриутробно или сразу после рождения). Желтушная форма — самая частая клиническая форма; она проявляется на 1—2-й день жизни ребенка. Отмечается желтуха, увеличиваются печень и селезенка, наблюдается небольшая отечность тканей. Дети вялые, неподвижные, плохо сосут. Рефлексы снижены. Выражена анемия (уровень гемоглобина ниже 160 г/л), псевдолейкоцитоз, ретикулоцитоз, эритро- и нормобластоз. Ярким признаком является увеличенное содержание непрямого билирубина в крови. Моча темная, кал обычной окраски. В дальнейшем может наблюдаться повышенное содержание и прямого билирубина. Билирубиновая интоксикация характеризуется вялостью, срыгиваниями, рвотой, патологическим зеванием, снижением мышечного тонуса. Затем появляются классические признаки ядерной желтухи: повышение тонуса мышц, симптомы нарушения мозговой деятельности, подергивание мышц, судороги, положительный симптом «заходящего солнца», нистагм и полная остановка дыхания. Через 2–3 недели состояние больных улучшается, однако в последующем выявляются признаки детского церебрального паралича (атетоз, хореоатетоз, параличи, парезы, задержка психофизического развития, глухота, дизартрия и др.). Анемическая форма — наиболее доброкачественная, встречается в 10–15 % случаев и проявляется бледностью, плохим аппетитом, вялостью, увеличением печени и селезенки, анемией, ретикулоцитозом, нормобластозом, умеренным повышением билирубина. Осложнения заболевания зависят от его формы. При уровне билирубина 257–342 мкмоль/л и более, даже если не развилась ядерная желтуха, почти у 1/3 детей имеют место отклонения в нервно-психическом статусе. Если проведено заместительное переливание крови, то в течение 1–2 месяцев наблюдается анемия.
Диагностика и дифдиагностика Диагноз строится на данных о больном и клинических симптомах, определении группы крови и резус-принадлежности матери и ребенка, анализе крови ребенка, определении уровня билирубина в крови. С целью дородовой диагностики определяют уровень билирубина и резус-антител в околоплодных водах. При диагностике необходимо различать наследственные гемолитические желтухи (см.), кровоизлияния (см.), полицитемии (см.), желтухи (см.).
Лечение Может быть как консервативным, так и оперативным (по показаниям). Консервативное лечение: внутривенное вливание 5 %-ного раствора глюкозы; АТФ, эривит, фенобарбитал по 10 мг/кг массы тела в сутки, агар-агар по 0,1 г 3 раза в день, 12,5 %-ный раствор ксилита или сульфата магния по 1 ч. л. 3 раза в день, фототерапия (лампы синего или голубого цвета, сеансы по 3 ч с интервалами в 2 ч, всего в сутки время облучения составляет 12–16 ч). Оперативное лечение: абсолютным показанием к заменному переливанию крови является повышенное содержание билирубина в крови — выше 342 мкмоль/л с темпом нарастания билирубина свыше 6 мкмоль/л в час и при уровне его в пуповинной крови выше 60 мкмоль/л. В большинстве случаев заменное переливание крови проводят по способу Даймонда через пуповинную вену с помощью полиэтиленового или металлического катетера. Для этих целей используют свежеконсервированную одногруппную кровь (лучше резус-отрицательную). Расчет: 120–170 мл крови на 1 кг массы тела.
Профилактика В целях профилактики всех беременных женщин обследуют на резус-принадлежность. При резус-отрицательной крови у беременной женщины каждые 1–1,5 месяца определяют количество антител к резус-фактору. При нарастании количества антител показано введение антиглобулина. Рекомендуется сохранение первой беременности и перерыв на 4–5 лет перед последующей. Дети, перенесшие гемолитическую болезнь новорожденных, находятся на диспансерном учете с ежемесячным осмотром невропатологом, ортопедом, окулистом. Дается отвод от прививок продолжительностью до 1 года.
ГЕМОРРОЙ
ОпределениеГеморрой — болезнь эректильных (кавернозных) тел подслизистого слоя концевого отдела прямой кишки. Им страдает около 10 % населения.
Этиология и патогенез Факторами, определяющими широкое распространение геморроя в современном обществе, являются вертикальное положение человека, особенности пищевого режима и рациона, прием алкоголя, сидячий труд, малоподвижность, обильная еда с использованием значительного количества пряностей и острых приправ, беспорядочность половой жизни. Определенное значение в возникновении заболевания имеют систематические нарушения правил гигиенического ухода за анальной областью; замечено, что в странах, где уход за этой областью возведен в ранг предписываемых религией манипуляций, частота геморроя значительно ниже.
Наружные и внутренние геморройные узлы: 1 — связка Моргани; 2 — внутренний жом; 3 — морганьевы крипты; 4 — внутренние геморройные узлы; 5 — наружные геморройные узлы
Воспаление наружных геморройных узлов
Данные исследований свидетельствуют о том, что геморроидальные узлы образуются в результате гиперплазии (увеличенного развития) кавернозных телец дистальной части прямой кишки, в которых функционируют артериовенозные анастомозы. В связи с этим геморроидальные узлы заполняются не венозной, а артериальной кровью. В результате влияния неблагопритных факторов, способствующих увеличению внутрибрюшного давления, пещеристая ткань подвергается гиперплазии, увеличивается количество артериовенозных анастомозов и начинает формироваться внутренний геморроидальный узел. К факторам, способстующим развитию геморроя, также относят хронические запоры, двухмоментную дефекацию и некоторые заболевания органов малого таза (гинекологические заболевания, аденома предстательной железы и др.). Из многообразия классификаций наиболее простой является деление геморроя на острую и хроническую формы, каждая из них подразделяется на наружный, внутренний и смешанный геморрой.
Острый геморрой Острый геморрой подразделяется по тяжести течения на легкую, среднюю и тяжелую степени: — легкая степень — характеризуется умеренным воспалением, явлениями тромбоза, появляющимися иногда кровотечениями; боли достаточно выражены, стул не нарушен, хотя и болезненный, выпавшие узлы самостоятельно вправляются; общесоматические проявления заболевания отсутствуют; — средняя степень — выраженный отек и воспаление узлов перианальной кожи, выпавшие отечные узлы самостоятельно не вправляются; признаки выраженного тромбоза и кровотечения из наружных или внутренних узлов; запоры, резко болезненный акт дефекации; общее повышение температуры, слабость, недомогание, снижение аппетита; — тяжелая степень — связывается с ущемлением выпавших внутренних узлов, некрозами или острым гнойным воспалением их, резким отеком перианальной кожи и ануса; выраженными общесоматическими нарушениями с высокой лихорадкой, ознобами, болями не только в области ануса и прямой кишке, но и в животе; самостоятельный стул невозможен.
Хронический геморрой По мере прогрессирования хронического геморроя выделяют три стадии. На первой стадии в области ануса определяются спавшиеся геморроидальные узлы, которые при натуживании во время акта дефекации увеличиваются, напоминая «тутовую ягоду». Кровотечения из прямой кишки не обильные, чаще в виде прожилок алой крови, анальный зуд, эпизоды воспаления возникают относительно редко (2–3 раза в году). Замыкательная функция анального сфинктера прямой кишки хорошо сохранена. При второй стадии во время стула появляется выпячивание легкокровоточащих геморроидальных узлов, нередко с признаками перенесенного тромбоза. Выпавшие геморроидальные узлы самостоятельно не вправляются, и для их вправления необходимо ручное пособие. Кровотечение из узлов регулярное, нередко довольно интенсивное, хотя выраженного малокровия нет. Обострения часты, почти ежемесячно, анальный зуд выражен и, как правило, предшестует эпизодам анальных кровотечений. Тонус сфинктера прямой кишки снижен, но удержание кишечного содержимого достаточное. В третьей стадии происходит выпадение узлов и участков слизистой при легком натуживании, физическом труде, вертикальном положении тела. Выпавшие узлы самостоятельно не вправляются, и имеются постоянные кровотечения. Нередки тяжелая анемизация и многолетний анамнез, в котором наряду с частым воспалением или ущемлением узлов прослеживается прогрессирующее снижение замыкательной функции наружного сфинктера, имеется недостаточное удержание газов и кишечного содержимого, угнетение и деформация эмоционально-психической сферы. Острый и хронический геморрой подразделяются также на первичный и вторичный. В возникновении и механизме развития последнего большое значение придается портальной гипертензии, опухолям и флеботромбозу в области малого таза.
Клиническая картина Больные жалуются на выделение алой крови, боли при акте дефекации или выпадение узлов. Заболевание развивается постепенно, вначале чувство дискомфорта сменяется неприятным ощущением в прямой кишке, появляется зуд в заднем проходе. Эти явления обычно проходят самостоятельно, и больные не обращаются к врачу. Лишь после того как начинается кровотечение, происходит выпадение узлов и появляется боль, большинство больных обращается за помощью. Незначительное кровотечение существенно влияет на общее самочувствие больного. Обильные кровотечения могут сопровождаться выраженной постгеморрагической анемией, нередко являются причиной временной нетрудоспособности больного. При осмотре видны наружные геморроидальные узлы, которые контурируются изолированно под кожей; нередко они связаны с внутренними узлами, образуя геморроидальные комплексы. Выпавшие в просвет прямой кишки внутренние геморроидальные узлы отечны, увеличены в размерах, приобретают синюшную или сине-багровую окраску. Вначале они могут вправляться самостоятельно, несколько позже при прогрессировании заболевания больной вынужден вправлять их руками. Длительно продолжающееся выпадение ведет к мацерации (раздражению) кожи, возникновению перифокального отека, и через определенное время выпавшие геморроидальные узлы не вправляются даже при определенных усилиях больного. При воспалении геморроидальных узлов кожа над ними гиперемирована, отечна; отмечается повышение температуры тела до 37–38 °C. Больные жалуются на боль и чувство жжения в заднем проходе. При пальцевом исследовании наблюдается отек внутренних геморроидальных узлов и спазм сфинктера. Инструментальное исследование болезненно.
Осложнения К осложнениям геморроя относят тромбоз и ущемление геморроидальных узлов. Тромбоз наружного геморроидального узла чаще возникает после погрешности в диете, физической нагрузки. Появляются резкие боли в области заднего прохода, усиливающиеся при любой физической нагрузке, кашле, ощущение инородного тела. При осмотре в области анального отверстия виден синюшного цвета узел, очень болезненный при пальпации. Ректальное исследование болезненно и не дает дополнительной существенной информации. Ущемление внутренних геморроидальных узлов провоцируется обычно погрешностями в диете, физическими нагрузками, запорами. Внутренние геморроидальные узлы выпадают и ущемляются в анальном отверстии, вследствие чего могут возникнуть тромбоз ущемленных узлов и их некроз. У больных появляются резкие распирающие боли в области заднего прохода и ощущение инородного тела. При осмотре по всему периметру анального канала видны выпавшие темно-вишневого, вплоть до черного цвета геморроидальные узлы, при некрозе слизистой оболочки возможно кровотечение, впоследствии — парапроктит. Ректальное исследование в остром периоде невозможно.
Диагностика и дифдиагностика Диагноз обычно не представляет значительных трудностей. При формулировании его следует указать характер процесса (первичный, вторичный), степень поражения прямой кишки, тяжесть, вид и стадию заболевания. Дифдиагноз геморроя проводится прежде всего с выпадением прямой кишки, при котором выпячивание из ануса носит всегда циркулярный характер, в то время как при геморрое выпячивается или выпадает только один или несколько участков слизистой прямой кишки. В острой стадии дифдиагноз следует проводить с анальными трещинами, парапроктитом и раком прямой кишки, имея в виду, что прямокишечные кровотечения при раке никогда не бывают алой артериальной кровью. Следует также помнить о возможности сочетания нескольких заболеваний, когда на фоне длительно существующего геморроя возникают другие конкурирующие заболевания (проктит, полипы, рак).
Лечение Лечение геморроя проводят в амбулаторных условиях и в стационаре в зависимости от клинического течения и возникших осложнений. Консервативное лечение геморроя применяется в острой фазе болезни. Оно включает щадящую диету, запрещается прием алкоголя, острой, жирной и жареной пищи; местное применение тепла (сидячие теплые ванночки с антисептиками); местно мази и свечи, обладающие гемостатическим, противовоспалительным, бактериальным и анальгезирующим действием (например, «Анестезол», «Бетиол», «Неоанузол»), общее противовоспалительное, антибактериальное, болеутоляющее лечение в сочетании с приемом седативных средств. Применение наркотических средств при геморрое нежелательно, поскольку препараты этой группы способствуют усилению запоров. Из физиотерапевтических процедур при воспалении геморроидальных узлов целесообразно применять УВЧ, электрофорез с левомицетином. Физметоды лечения способствуют уменьшению отека, стиханию воспалительных явлений, уменьшению боли; их с успехом можно применять в амбулаторных условиях. Оперативное лечение в этих случаях целесообразно не ранее чем после 5–6 дней консервативной терапии. Оперативное лечение геморроя показано при отчетливых клинических симптомах заболевания, частом воспалении, интенсивных и упорных кровотечениях, выпадении и ущемлении узлов. Объем и содержание оперативного вмешательства определяется в каждом конкретном случае в зависимости от наличия осложнений, возраста больных и сопутствующих заболеваний. Возможен еще один неоперативный способ лечения геморроя (он применим и у больных с высокой степенью операционного риска в связи с тяжелыми сопутствующими заболеваниями внутренних органов) — лигирование (вправление) узлов резиновыми или латексными кольцами. По сравнению с хирургическим методом этот метод менее радикален и дает большее число рецидивов. Хирургическое лечение геморроя противопоказано при выраженной портальной гипертензии и гипертонической болезни 3-й стадии. При тромбозе наружного геморроидального узла лечение чаще консервативное — диета с ограничением острых блюд, алкоголя; целесообразны послабляющие средства, противовоспалительные препараты (бутадион, реопирин, ацетилсалициловая кислота, местно — свинцовые примочки). С 3—4-го дня — сидячие теплые ванночки со слабым раствором перманганата калия. Более целесообразно хирургическое лечение — рассечение тромбированного узла, удаление тромботических масс. Подобное лечение позволяет сократить продолжительность нетрудоспособности больного, ликвидировать болевой синдром. При ущемлении внутренних узлов также показана послабляющая диета, противовоспалительные средства, свинцовые примочки, хороший эффект оказывает пресакральная блокада 0,25 %-ным раствором новокаина, после чего больного укладывают в постель с приподнятым ножным концом. В таком положении у ряда больных выпавшие узлы могут вправиться. После ликвидации острых явлений больным показано хирургическое лечение в плановом порядке.
ГЕМОТОРАКС
ОпределениеГемоторакс — скопление крови в плевральной полости.
Этиология, патогенез и клиническая картина Гемоторакс развивается вследствие ранения плевры, легкого. Источником гемоторакса, кроме легкого, могут быть межреберные артерии, внутренняя грудная артерия, которые травмируются при переломах ребер. При небольших кровоизлияниях больные жалуются на кашель, одышку, боли в груди, головокружение. Основные признаки прогрессирующего гемоторакса, сопровождающегося массивным кровотечением в плевральную полость, скрытыми симптомами острого кровотечения: слабость, падение артериального давления, тахикардия и др. При аускультации легких выслушивается так называемое «немое» легкое, при перкуссии определяется притупление перкуторного звука. Инфицирование скопившейся в плевральной полости крови может привести к развитию эмпиемы плевры (см.).
Диагностика и дифдиагностика Диагноз ставится на основании анамнеза, объективных данных и подтверждается рентгенологическим обследованием (горизонтальный уровень жидкости), анализом пунктата. Дифференциальную диагностику проводят с плевритами (см.) и раком легкого (см.).
Схема гемоторакса и травматической эмфиземы: 1 — подкожная эмфизема; 2 — медиастинальная эмфизема
Лечение Больные госпитализируются в хирургический стационар, где решается вопрос о выборе метода лечения (пункция плевральной полости, налаживание оттока гноя и секрета или оперативное вмешательство). Лечение заключается в проведении противошоковых мероприятий, гемостатической терапии и восполнении кровопотери. Плевральная пункция выполняется лишь после проведения противошоковой терапии.
ГЕМОХРОМАТОЗ
ОпределениеГемохроматоз (пигментный цирроз печени, бронзовый диабет, гидрофилия) — наследственное заболевание, характеризующееся повышением всасывания железа в кишечнике и отложением в органах и тканях железосодержащих пигментов (преимущественно в виде гемосидерина) с развитием фиброза.Встречается сравнительно редко (3–8 на 100 тыс. населения), преимущественно у мужчин. Но в последние годы в результате улучшения диагностики отмечается ее рост.
Классификация 1. Наследственный (идиопатический, первичный) гемохроматоз. 2. Вторичный гемохроматоз, формы: — посттрансфузионный (при хронической анемии, в лечении которой длительно применялись переливания крови); — алиментарный (гемохроматоз африканского племени банту вследствие избыточного употребления железа с пищей и водой; алкогольный цирроз печени; вероятно, болезнь Кашина — Бека и др.); — метаболический (нарушение превращения железа при промежуточной В-талассемии, у больных циррозом печени при развитии или наложении портокавального анастомоза, при закупорке протока поджелудочной железы, кожной порфирии и др.); — смешанного происхождения (большая талассемия, некоторые виды дизэритропоэтической анемии — железорефракторная, сидероахрестическая, сидеробластная).
Этиология В настоящее время роль генетического фактора в развитии идиопатического гемохроматоза несомненна. Распространенность гена наследственного гемохроматоза составляет 0,03—0,07 %. Установлена связь между наследственным гемохроматозом — врожденным ферментным дефектом, приводящим к накоплению железа во внутренних органах, и антигенами гистосовместимости системы НЛА-А3, В7, В14, А11. Вторичный гемохроматоз возникает при избыточном поступлении в организм железа: при длительном внутривенном введении препаратов железа (без показаний), при повторных частых переливаниях крови. Последнее имеет место, например, при тяжелых апластических анемиях, когда на протяжении сравнительно небольшого отрезка времени больному переливают огромное количество крови.
Патогенез При первичном гемохроматозе первичным функциональным дефектом является нарушение регуляции захвата железа клетками слизистой оболочки желудочно-кишечного тракта, что приводит к неограниченному всасыванию железа с последующим чрезмерным отложением железосодержащего пигмента гемосидерина в печени, поджелудочной железе, сердце, яичках и других органах (отсутствие «ограничения всасывания»). Это обусловливает гибель функционально активных элементов и развитие склеротического процесса. Возникает клиническая симптоматика цирроза печени, сахарного диабета, метаболической кардиомиопатии. Основные клинические признаки гемохроматоза появляются приблизительно через 7—10 лет от начала заболевания, так как ежедневно у больного всасывается около 7,5 мг железа, в то время как у здорового человека 1,5 мг. Таким образом, за год в организме больного накапливается около 3 г избыточного железа. Вторичный гемохроматоз наиболее часто развивается при циррозе печени, злоупотреблении алкоголем, неполноценном белковом питании. При циррозе печени снижается синтез трансферрина, который связывает железо в крови и доставляет его в костный мозг (для образования эритроцитов), в ткани (для деятельности ферментов тканевого дыхания) и в депо железа. При недостатке трансферрина происходит накопление не используемого для обмена веществ железа. Кроме того, при циррозе печени нарушается синтез ферритина, который является формой депо железа. Злоупотребление алкоголем приводит к усилению всасывания железа в кишечнике, что способствует более быстрому появлению симптоматики наследственного гемохроматоза или поражению печени и развитию вторичной формы заболевания. Наличие анастомозов в портальной системе усиливает депонирование железа в печени. При железорефракторной (сидероахрестической) анемии и большой талассемии всосавшееся железо не используется, оказывается избыточным и откладывается в печени, миокарде и других органах и тканях.
Патанатомия Отмечается увеличение печени, повышенное отложение гемосидерина в виде глыбок в клетках печени, разрастание соединительной ткани, в основном по ходу капилляров, без выраженной тенденции к сморщивающим склеротическим изменениям ее. Аналогичные изменения наблюдаются в миокарде, поджелудочной железе, эндокринных железах, коже и других тканях и органах.
Клиническая картина Наиболее характерными симптомами гемохроматоза являются гиперпигментация кожи, принимающей серо-бурый или коричневый цвет, увеличенная плотная печень и диабет. Окраска кожи обусловлена отложением в эпидермисе не содержащих железа пигментов (меланина, липофусцина) и гемосидерина. Выраженность пигментации зависит от давности заболевания. Гиперпигментация наиболее заметна на открытых участках тела (лице, руках), на ранее пигментированных местах, в подмышечных впадинах, в области половых органов. Увеличение печени наблюдается у 97 % больных в развернутой стадии болезни, печень плотная, нередко болезненная. В дальнейшем развивается клиническая картина цирроза печени с асцитом, портальной гипертензией, увеличением селезенки. Диабет при этом заболевании возникает вследствие поражения инсулярного аппарата поджелудочной железы в результате интерстициального воспалительно-склерозирующего процесса, возникающего в ответ на избыточное отложение гемосидерина в поджелудочной железе, проявляется жаждой, повышенным мочевыделением, гипергликемией, глюкозурией. Редко осложняется ацидозом и комой. При гемохроматозе нередко выявляется также симптомокомплекс недостаточности и других эндокринных желез, в первую очередь — половых (гипогонадизм, снижение потенции, атрофия яичек, исчезновение вторичных половых признаков, феминизация, у женщин — аменорея, бесплодие; гипокортицизм, резкая слабость, снижение артериального давления, выраженное похудение). Гемосидероз миокарда проявляется электрокардиографическими признаками дистрофии миокарда, увеличением сердца, аритмиями, сердечной недостаточностью, резистентной к лечению сердечными гликозидами. От застойной сердечной недостаточности умирают 35 % больных гемохроматозом. Также у больных наблюдается синдром мальабсорбции, который обусловлен нарушением функции тонкого кишечника и поджелудочной железы вследствие отложения железосодержащего пигмента в этих органах. Течение первичного гемохроматоза длительное (15 лет и более), при развитии цирроза печени продолжительность жизни не превышает 10 лет. При вторичном гемохроматозе продолжительность жизни меньшая.
Диагностика В типичных случаях диагноз устанавливается на основании характерной клинической картины и подтверждается пункционной биопсией печени или кожи,повышенным содержанием железа в сыворотке крови (более 37 мкмоль/л). В образцах ткани кожи — избыточное отложение меланина, в образцах ткани печени — отложение гемосидерина, липофусцина, картина микронодулярного цирроза печени. Содержание железа в печени при первичном гемохроматозе увеличивается по сравнению с нормой почти в 40 раз, при вторичном в 3–5 раз. Характерна положительная десфералевая проба, которая основана на способности десфераля связывать железо ферритина и гемосидерина и выводить его из организма. Проба считается положительной, если после внутримышечного введения 0,5–1 г десфераля в сутки с мочой выделяется более 2 мг железа. При стернальной пункции в пунктате выявляется высокое содержание железа. Изменение ферментов печени зависит от объема поражения печени.
Дифдиагностика Дифференциальный диагноз проводится в первую очередь с циррозом печени (основное значение имеет пункционная биопсия), реже — с сахарным диабетом.
Лечение Проводят основную терапию с исключением из диеты продуктов, содержащих железо, а также водорастворимых углеводов с учетом сахарного диабета. Средством выбора являются кровопускания до гематокрита менее 0,5 и общей железосвязующей способности сыворотки крови менее 50 ммоль/л. Рекомендуется начинать с кровопускания 1 раз в неделю по 500 мл, затем по 500 мл 1 раз в 2 недели под контролем гемоглобина и железа сыворотка крови. Если лечение кровопусканиями проводится в амбулаторных условиях, то переносимость их и эффективность контролируются динамикой субъективных (слабость, состояние голоса, болей в суставах) и объективных (размеры печени, селезенки) данных, а также результатами лабораторных исследований (печеночные ферменты, сывороточное железо, железосвязующая способность, гемоглобин и другими тестами, в том числе с учетом диабета). Повышение уровня печеночных ферментов, несмотря на нормализацию содержания сывороточного железа и железосвязывающей способности сыворотки крови, дает основание предполагать развитие гематомы и определять в связи с этим содержание альфафетопротеина в крови.
Вторичная профилактика С целью более раннего выявления гемохроматоза у гомозиготных родственников больного необходимо проводить биопсию печени, и даже, если у них при этом отсутствуют данные за гемохроматоз, они все равно нуждаются в наблюдении с определением каждые 6—12 месяцев железосвязывающей способности сыворотки крови. Кровопускания с лечебной целью показаны, если железосвязывающая способность менее 40 %. Гетерозиготным родственникам больного гемохроматозом биопсия печени проводится только тогда, когда у них имеется измененный уровень ферментов печени или железосвязывающая способность сыворотки крови менее 40 %. Если же эти тесты оказались нормальными, то дальнейшее наблюдение за ними проводить не следует.
ГЕПАТИТ
ОпределениеГепатит — воспалительное заболевание печени, которое может протекать остро или хронически.
Этиология и патогенез Гепатит острый Гепатит острый — воспалительное заболевание печени чаще инфекционного или токсического происхождения. Наиболее частая причина острого поражения печени у человека — вирусный гепатит. Острый гепатит может быть вызван также энтеровирусами, возбудителями кишечных инфекций, вирусами инфекционного мононуклеоза, лептоспирой, некоторыми тропическими паразитами, септической бактериальной инфекцией (см.). Существуют также острые токсические гепатиты, вызываемые лекарственными препаратами, промышленными ядами (фосфор, фосфорорганические инсектициды, тринитротолуол и др.), грибными ядами бледной поганки и сморчков (мускарин, афлатоксин и др.). Острый гепатит может возникнуть как следствие лучевого (радиационного) поражения, при обширных ожогах тела, тяжелых инфекционных заболеваниях, токсикозах беременных. Употребление алкоголя нередко предрасполагает к развитию острого гепатита. Развитие острого гепатита заключается либо в непосредственном действии повреждающего фактора на печеночную паренхиму, либо в иммунологических нарушениях, возникающих в ответ на первичное поражение печени, с последующим разрушением пораженных и незатронутых клеток печени. В некоторых случаях дополнительное значение имеют нарушение микроциркуляции в печени и внутрипеченочный холестаз.
Хронические гепатиты Хронические гепатиты — хронические (длительностью более 6 месяцев) поражения печени воспалительно-дистрофического характера с преимущественно сохраненной структурой печени, вызываемые множеством причин. Хронический гепатит представляет собой хронический процесс с различной степенью прогрессирования, проявляющийся астеновегетативным, холестатическим, диспепсическим синдромами или их сочетанием. Среди хронических заболеваний печени хронический гепатит является наиболее частым. Наибольшее значение имеет вирусное, токсическое и токсико-аллергическое поражение печени при вирусных гепатитах, промышленных, бытовых, лекарственных хронических интоксикациях (алкоголь, хлороформ, соединения свинца, тринитротолуол, атофан, аминазин, изониазид, метилдофа и др.), реже — вирусы инфекционного мононуклеоза, герпеса, цитомегаловирус. Хронический гепатит часто наблюдается при затяжном септическом эндокардите, висцеральном лейшманиозе, малярии. Хронический холестатический гепатит может быть обусловлен длительным подпеченочным холестазом (вследствие закупорки камнем или рубцового сдавления общего желчного протока, рака головки поджелудочной железы и т. д.) в сочетании с обычно присоединяющимся воспалительным процессом в желчных протоках и ходах, преимущественным первично-токсическим или токсико-аллергическим поражением холангиол. Он также может быть вызван некоторыми медикаментами или возникать после перенесенного вирусного гепатита. Помимо хронических гепатитов, представляющих собой самостоятельное заболевание (первичные гепатиты), встречаются также хронические неспецифического характера гепатиты, возникающие на фоне хронических инфекций (туберкулеза, бруцеллеза, различных хронических заболеваний пищеварительного тракта, системных заболеваний соединительной ткани и т. д. — вторичные, или реактивные, гепатиты). Наконец, во многих случаях причина возникновения хронического гепатита остается невыясненной. Процесс развития хронических гепатитов связан с непосредственным действием причины возникновения (вируса или яда, оказывающего на печень токсическое действие) на печеночную ткань, вызывающим дистрофию и отмирание печеночных клеток и замещение соединительной ткани. Одним из механизмов перехода острого вирусного и токсического гепатита в хронический и дальнейшего прогрессирования последнего являются специфические иммунологические нарушения.
Клиническая картина и осложнения Гепатит острый В легких случаях острый гепатит протекает практически бессимптомно, выявляясь лишь при случайном или целенаправленном обследовании (например, на производстве среди лиц, контактирующих с гепатотропными ядами (они оказывают токсическое действие на печень), при бытовых групповых отравлениях грибами и т. д.). В более тяжелых случаях (например, при токсическом гепатите) клинические симптомы заболевания развиваются быстро, часто в сочетании с признаками общей интоксикации и токсического поражения других органов и систем. В разгар болезни характерны желтушное окрашивание кожи и слизистых оболочек, беловато-глинистого цвета стул, насыщенно-темного цвета («цвета пива») моча, геморрагические явления. Цвет кожных покровов бывает оранжевым или шафранным. Однако в легких случаях желтуха видна только при дневном освещении, наиболее рано появляется желтушное окрашивание склер и слизистой оболочки мягкого нёба. Нередки носовые кровотечения и мелкие кровоизлияния под кожу; больных беспокоит кожный зуд, отмечаются брадикардия, угнетенное психическое состояние, повышенная раздражительность, бессонница и другие признаки поражения центральной нервной системы. Печень и селезенка несколько увеличены и болезненны. При особо тяжелых поражениях и преобладании некротических изменений в печени (острой дистрофии) ее размеры могут уменьшаться. При своевременном лечении часто наступает полное выздоровление. В части случаев острый гепатит переходит в хронический, а затем вцирроз печени (см.). В отдельных случаях развивается острая дистрофия печени (см. Гепатоз) с клиникой острой печеночной (см.) или печеночно-почечной недостаточности, от которой больные могут погибнуть.
Хронические гепатиты Характерны увеличение печени, боль или чувство тяжести и полноты в правом подреберье, расстройства пищеварения; реже выявляются желтуха, кожный зуд и постоянное повышение температуры тела. Увеличение печени встречается приблизительно у 95 % больных, однако в большинстве случаев оно умеренное. Увеличение селезенки отсутствует или она увеличена незначительно. Боль в области печени тупого характера, постоянная. Часты снижение аппетита, отрыжка, тошнота, плохая переносимость жиров, алкоголя, метеоризм, неустойчивый стул, общая слабость, снижение трудоспособности, повышение потоотделения. У трети больных выявляется нерезко выраженная (желтушность склер и неба) или умеренная желтуха. Часты, но неспецифичны увеличение СОЭ, диспротеинемия за счет снижения концентрации альбуминов и повышения глобулинов. В сыворотке крови больных увеличено содержание печеночных ферментов. Приблизительно у 50 % больных находят незначительное или умеренное повышение билирубина крови, преимущественно за счет повышения содержания в сыворотке крови связанного (прямого) билирубина. При холестатическом гепатите обычно наблюдаются более выраженная стойкая желтуха и лабораторный синдром холестаза: в сыворотке крови повышено содержание щелочной фосфатазы, холестерина, желчных кислот, связанного билирубина, меди. Выделяют малоактивный (неактивный) доброкачественный и активный агрессивный прогрессирующий и рецидивирующий гепатит. Малоактивный (персистирующий) гепатит протекает бессимптомно или с незначительными симптомами, изменения лабораторных показателей также незначительны. Обострения процесса нехарактерны. Хронический активный рецидивирующий (агрессивный) гепатит характеризуется выраженными жалобами и яркими объективными клиническими и лабораторными признаками. У некоторых больных наблюдаются системные аллергические проявления заболевания (полиартралгия, кожные высыпания, гломерулонефрит и т. д.). Характерны частые рецидивы болезни, иногда наступающие под воздействием даже незначительных факторов (погрешность в диете, переутомление и т. д.). Частые обострения при хроническом гепатите приводят к значительным морфологическим изменениям печени и развитию цирроза.
Диагностика и дифдиагностика Гепатит острый Лабораторные исследования обнаруживают повышенное содержание билирубина в крови (100–300 мкмоль/л и более), повышение активности ряда сывороточных ферментов, снижение уровня белков крови. Отклонены от нормы показатели белково-осадочных проб (тимоловая, сулемовая и др.). Нарушена выработка печенью белков, вследствие чего возникают геморрагические явления. В дифференциальной диагностике большое значение имеют тщательно собранные данные опроса, установление возможности профессиональных или бытовых интоксикаций, учет эпидемиологической обстановки в выявлении характера и причины заболевания. В неясных случаях прежде всего следует подумать о вирусном гепатите. Выявление так называемого австралийского антигена характерно для сывороточного гепатита В (он выявляется также у вирусоносителей, редко — при других заболеваниях). Механическая (подпеченочная) желтуха возникает остро обычно лишь при закупорке общего желчного протока камнем при желчнокаменной болезни. Но в этом случае появлению желтухи предшествует приступ желчной колики; билирубин в крови в основном прямой, стул обесцвеченный. При гемолитической надпеченочной желтухе в крови определяется свободный (непрямой) билирубин, стул интенсивно окрашен. В случае ложной желтухи (вследствие окрашивания кожи каротином при длительном и обильном употреблении в пищу апельсинов, моркови, тыквы) склеры обычно не окрашены, повышенное содержание билирубина в крови отсутствует.
Хронические гепатиты Пункционная биопсия печени и лапароскопия позволяют более точно различить эти две формы гепатита, а также провести дифференциальную диагностику с другими заболеваниями печени. Сканирование печени позволяет определить ее размеры. Дифференциальный диагноз в случаях яркой клинической картины распространенного поражения печени в первую очередь нужно проводить с циррозом печени. При циррозе более выражены симптомы заболевания, печень обычно значительно плотнее, чем при гепатите; она может быть увеличенной, но нередко и уменьшенной в размерах. Как правило, наблюдается увеличение селезенки, часто выявляются печеночные признаки (сосудистые звездочки, печеночный язык, печеночные ладони), могут иметь место симптомы портальной гипертензии. Лабораторные исследования показывают значительные отклонения от нормы результатов так называемых печеночных проб; при пункционной биопсии выявляются дезорганизация структуры печени и значительное разрастание соединительной ткани. Фиброз печени (см.), в отличие от гепатита, обычно не сопровождается клиническими симптомами и изменением функциональных печеночных проб. Опрос (наличие в прошлом заболевания, которое могло вызвать фиброз печени), длительное наблюдение за больным и пункционная биопсия печени (в необходимых случаях) позволяют отличить его от хронического персистирующего гепатита. При жировом гепатозе (см.) печень обычно более мягкая, чем при хроническом гепатите, селезенка не увеличена, решающее значение в диагностике имеет пункционная биопсия печени. Отличительный диагноз с функциональным билирубином основывается на особенностях их клинической картины (легкая желтуха с билирубином без ярких проявлений и изменений данных лабораторных печеночных проб и пункционной биопсии печени). Амилоидозу (см.) с преимущественной печеночной локализацией, в отличие от хронического гепатита, свойственны симптомы и других органных локализаций процесса, положительная проба с Конго красным или метиленовым синим; диагноз подтверждается пункционной биопсией печени. При очаговых поражениях (опухоль (см.), киста (см.), туберкулома (см.) и др.) печень неравномерно увеличена, а сканирование определяет очаг разрушения печеночной паренхимы.
Лечение и профилактика Гепатит острый Больных острым вирусным гепатитом (и с подозрением на таковой), а также инфекционными гепатитами другой причины возникновения обязательно госпитализируют в специализированные отделения инфекционных больниц, а в очаге инфекции проводят санитарно-противоэпидемические мероприятия. Больных с токсическими гепатитами госпитализируют в центры отравлений, где им проводят мероприятия по удалению яда из организма (промывания желудка и т. д.), дезинтоксикационную терапию. Больным острым гепатитом назначают постельный режим, щадящую диету с ограничением жиров и увеличением содержания углеводов, большое количество фруктовых соков. В тяжелых случаях, особенно при выраженной анорексии и рвоте, внутривенно капельным способом вводят 5—10 %-ный раствор глюкозы (до 500 мл). При появлении признаков загруженности или комы по показаниям проводят массивный плазмаферез. С помощью центрифуги либо сепаратора удаляют 1,5–2 л плазмы и вводят внутривенно 2 л свежезамороженной плазмы. Если нет стойкого улучшения (прояснение сознания), на следующий день и далее процедуру повторяют. Ежедневно в течение 2–3 дней и более до стойкого исчезновения признаков комы необходимо вводить 1–2 л свежезамороженной плазмы до нормализации системы свертывания крови. Профилактика острых гепатитов, учитывая многообразие их факторов возникновения, заключается в четком проведении санитарнопротивоэпидемических мероприятий, соблюдении правил личной гигиены, обеспечении соответствующего санитарно-гигиенического надзора на предприятиях, предотвращающего возможность производственных отравлений ядами, оказывающими токсическое воздействие на печень. Не следует употреблять в пищу заведомо несъедобные или неизвестные грибы, а также съедобные, но старые (которые тоже могут вызвать тяжелое отравление).
Хронические гепатиты Больные хроническим персистирующим и агрессивным гепатитом вне обострения должны соблюдать диету с исключением острых и пряных блюд, тугоплавких животных жиров, жареной пищи. Рекомендуются творог (ежедневно до 100–150 г), неострые сорта сыра, нежирные сорта рыбы в отварном виде (треска и др.). При токсических и токсико-аллергических гепатитах чрезвычайно важно полное прекращение контакта с соответствующим токсическим веществом, при алкогольных гепатитах — приема алкоголя. При обострении гепатита показаны госпитализация, постельный режим, более строгая щадящая диета с достаточным количеством белков и витаминов. Назначают глюкозу по 25–30 г внутрь, витаминотерапию (особенно витамины В1, В2, B6, B12, никотиновую, фолиевую и аскорбиновую кислоты). С целью улучшения способности стимулировать синтез белка в организме применяют препараты, усиливающие синтез белка (метандростенолон внутрь по 15–20 мг в сутки с постепенным снижением дозы или ретаболил по 20–50 мг 1 раз в 2 недели внутримышечно). В более острых случаях, особенно с признаками значительной активации иммунокомпетентной системы, показаны в небольших дозах кортикостероидные гормоны (по 20–40 мг преднизолона в сутки) и (или) иммунодепрессанты (также в небольших дозах, но длительно). Проводят лечение экстрактами и гидролизатами печени (витогепат, сирепар и др.), но осторожно, так как при острых гепатитах введение печеночных гидролизатов может усилить аллергические процессы и способствовать еще большему обострению процесса. При хроническом холестатическом гепатите основное внимание должно быть направлено на выявление и устранение причины холестаза; в этом случае можно ожидать успеха от лечебных мероприятий. Больные хроническим гепатитом нуждаются в трудоустройстве (ограничение тяжелой физической нагрузки, освобождение от работ, связанных с частыми командировками и не позволяющих соблюдать режим питания). Больных агрессивным гепатитом с быстрым прогрессированием процесса переводят на инвалидность III, а в отдельных случаях — и II группы. Профилактика хронических гепатитов сводится к профилактике инфекционного и сывороточного гепатитов, борьбе с алкоголизмом, исключению производственных и бытовых интоксикаций гепатотропными веществами, оказывающих влияние на печень, а также к своевременному выявлению и лечению острого и подострого гепатита.
ГЕПАТОЛЕНТИКУЛЯРНАЯ ДЕГЕНЕРАЦИЯ
ОпределениеГепатолентикулярная дегенерация (гепатолентикулярная дистрофия, гепатоцеребральная дегенерация, семейный юношеский гепатит с дегенерацией полосатого тела, болезнь Вестфаля-Вильсона-Коновалова) — общее заболевание, характеризующееся нарушением обмена меди, поражением печени по типу цирроза и деструктивными (разрушительными) процессами в головном мозге.
Этиология и патогенез Причина накопления меди остается неизвестной. Заболевание встречается чаще всего в юношеском возрасте и, по-видимому, относится к генетически обусловленным ферментопатиям, передающимся наследственно. Болезнь встречается редко — 30 случаев на 1 млн. В сыворотке крови больных снижено содержание вещества, связывающего медь, и значительно усилено поглощение меди в кишечнике. Вследствие этого происходит повышенное отложение меди в печени (что ведет к развитию цирроза), нервных узлах нервной системы (вызывая их токсическое поражение), в коже, по периферии роговицы и в других тканях. В 5—10 раз усиливается выделение меди с мочой.
Клиническая картина Нередко заболевание начинается с признаков поражения печени и диагностируется как хронический гепатит (см.) или цирроз печени (см.), а затем присоединяются неврологические расстройства: дрожание конечностей, скандированная речь, отсутствие мимики (амимия) лица. Далее развиваются повышенный тонус мышц конечностей и нарушения мышления. В других случаях поражение нервной системы развивается раньше, а затем у больных выявляется цирроз печени (см.), по своим клиническим проявлениям в основном не отличающийся от циррозов с другой причиной возникновения. Отложение меди в почках ведет к гипераминоацидурии, а в ряде случаев — почечной глюкозурии (т. е. к наличию глюкозы в моче).
Диагностика и дифдиагностика Диагностическое значение имеет гиперпигментация кожи — от темно-серого до коричневого цвета и наличие на периферии роговиц больного характерного зеленовато-коричневого ободка — так называемых колец Кайзера-Флейшера. Как правило, обнаруживается умеренное увеличение селезенки. Дифференциальная диагностика проводится с циррозом печени и хроническими активными гепатитами (см.). Диагноз подтверждается пункционной биопсией печени и лабораторными тестами, в частности концентрации меди в крови и суточной моче. При отсутствии лечения болезнь прогрессирует с возникновением риска развития печеночной недостаточности (см.) и часто заканчивается гибелью больных.
Лечение и профилактика Рекомендуется специальная диета с низким содержанием меди. Хорошие результаты отмечены при назначении D-пеницилламина (20–40 мг/кг ежедневно пожизненно), который увеличивает выделение меди с мочой. Члены семьи должны в обязательном порядке обследоваться. Всем родственникам следует пройти генетическую консультацию.
ГЕПАТОЗЫ
ОпределениеГепатозы — поражения печени дистрофического характера, проявляющиеся нарушением внутрипеченочного обмена билирубина и хронической или перемежающейся желтухой. Различают наследственные пигментные гепатозы и приобретенные гепатозы.Гепатозы наследственные пигментные — поражения печени дистрофического характера, развивающиеся на почве генетически обусловленных энзимопатий, проявляющиеся нарушением внутрипеченочного обмена билирубина и хронической или перемежающейся желтухой. Приобретенные гепатозы — общее название болезней печени, характеризующихся дистрофическими изменениями ее ткани без выраженных структурных изменений.
Этиология и патогенез Гепатозы наследственные пигментные Возникновение врожденных функциональных негемолитических гипербилирубинемий обусловлено нарушением одного из этапов перемещения билирубина из крови в клетки печени, связывания его с глюкуроновой кислотой и последующего выделения в желчь вследствие генетически детерминированного дефицита соответствующих ферментов. В настоящее время различают 3 типа врожденных функциональных негемолитических гипербилирубинемий. В основе врожденной негемолитической желтухи I типа (синдром Криглера-Найяра) лежит полное отсутствие в клетках печени (гепатоцитах) фермента, отвечающего за связывание билирубина. В связи с этим в крови резко повышается содержание свободного (неконъюгированного) билирубина, который оказывает токсическое действие на центральную нервную систему, поражаются подкорковые узлы (ядерная желтуха). Обнаруживаются также значительные дистрофические изменения в миокарде, скелетных мышцах и других органах как проявление токсического воздействия билирубина. При врожденной негемолитической желтухе II типа (синдром Ариаса) фермент, связывающий билирубин, видимо, существует, хотя имеющимися в настоящее время методами не определяется. Процесс развития синдрома Жильбера недостаточно ясен, большинство авторов считают, что повышенное содержание билирубина в крови возникает в результате нарушений ферментных реакций, обеспечивающих проникновение молекул билирубина в печеночную клетку и их перемещение до внутриклеточных структур, где происходит соединение билирубина с глюкуроновой кислотой. Отмечено, что нередко синдром Жильбера сочетается с гемолитическим синдромом, у некоторых больных выявлено умеренное снижение содержания связывающего фермента в клетках печени. В основе синдрома Дабина-Джонсона (семейной хронической идиопатической желтухи с неидентифицированным пигментом в печеночных клетках) лежит врожденный дефект нарушения выделительной функции клеток печени. При этом нарушается выделение билирубина из клеток печени, развивается повышенное содержание билирубина крови. Наряду с дефектом выделения билирубина отмечается нарушение выделения контрастных веществ, используемых при исследовании. Выделение желчных кислот не нарушается. Процесс развития синдрома Дабина-Джонсона недостаточно изучен. По-видимому, основное значение имеет дефект ферментных систем, транспортирующих свободный билирубин из клеток печени в желчь. Процесс развития синдрома Ротора аналогичен развитию синдрома Дабина-Джонсона, но дефект выделения билирубина выражен меньше.
Гепатозы приобретенные Различают острые и хронические приобретенные гепатозы. Острый гепатоз (острая токсическая дистрофия печени) развивается при токсических поражениях печени — тяжелых отравлениях фосфором, мышьяком, большими дозами алкоголя, некоторыми лекарствами (при бесконтрольном применении тетрациклина, экстракта папоротника мужского и др.), несъедобными грибами. Иногда острой дистрофией осложняются вирусный гепатит (в основном вызванный вирусом гепатита В) и сепсис. Хронический гепатоз чаще всего является следствием алкоголизма. Его причиной могут быть также эндокринный и внешний (несбалансированное питание) дефицит белка и витаминов, хронические интоксикации четыреххлористым углеродом, фосфорорганическими соединениями, этанолом, другими ядовитыми веществами, обладающими токсическим действием на печень. Различные нарушения обмена веществ, в том числе сахарный диабет, тиреотоксикоз и др., обычно сопровождаются нарушениями обменных процессов и в печени. Процесс развития поражения печени в этих случаях в основном сводится к нарушению обмена жиров и их образованию в клетках печени (отсюда и название — «гепатоз жировой»). Некоторые внешние вещества, в том числе лекарственные средства (аминазин, аналоги тестостерона, гестагены), при длительном неконтролируемом применении могут вызвать развитие особой формы поражения печени — холестатический гепатоз. Поражение печени в этих случаях сводится к нарушению обмена, преимущественно холестерина и желчных кислот в клетках печени, нарушению желчеобразования и оттока желчи по внутридольковым канальцам. В прогрессировании дистрофических и некробиотических изменений имеет значение не только непосредственное действие повреждающего начала на печеночную клетку, но и токсикоаллергический фактор.
Патанатомия Гепатозы наследственные пигментные При исследовании биоптатов печени, при синдроме Криглера-Найяра, как правило, морфологических изменений не обнаруживается, иногда бывают небольшой жировой гепатоз и незначительный перипортальный фиброз. Макроскопически печень при синдроме Жильбера не изменена. При исследовании тканей печени обнаруживаются отложение пигмента золотисто-коричневого цвета, ожирение, белковая дистрофия гепатоцитов, фиброз портальных полей. Характерным для синдрома Дабина-Джонсона является отложение в клетках печени значительного количества пигмента темно-коричневого цвета. Макроскопически печень имеет цвет от голубовато-зеленого до почти черного. Природа пигмента окончательно не установлена. А. Ф. Блюгер (1984 г.) предполагает, что основой его является меланин. При синдроме Ротора отмечается нормальная структура печени, накопления пигмента не выявляется.
Гепатозы приобретенные При остром жировом гепатозе печень имеет желтый цвет, вначале несколько увеличена, затем резко уменьшается в размерах, становится красноватой. При гистологическом исследовании обнаруживается жировая дистрофия гепатоцитов, преимущественно в центральных частях долек, вплоть до их некроза. При хроническом гепатозе печень увеличена, обычно имеется жировая дистрофия клеток печени. При холестатическом гепатозе желчный пигмент накапливается в клетках печени, в клетках, участвующих в процессах кроветворения и кроверазрушения, и внутрипеченочных желчных канальцах. Одновременно отмечаются дистрофические изменения клеток печени (преимущественно белковая дистрофия).
Клиническая картина Гепатозы наследственные пигментные Обычно наследственные пигментные гепатозы протекают вполне доброкачественно, как правило, почти не сказываясь на общем самочувствии и трудоспособности больных, и не являются причиной преждевременной смерти больных (за исключением синдрома Криглера-Найяра, характеризующегося крайне высоким уровнем билирубина крови). Интенсивность желтухи при многих функциональных гипербилирубинемиях незначительна, но со временем может колебаться, усиливаясь после переутомления, приема алкоголя, на фоне острых респираторных инфекций. Наблюдаются во многих случаях и длительные периоды безжелтушного течения, и первое появление желтухи после действия указанных выше факторов. Врожденные функциональные гипербилирубинемии встречаются нередко, и врач должен уметь их отличать от гипербилирубинемий, обусловленных приобретенными поражениями печени. Врожденная негемолитическая желтуха I типа (синдром Криглера-Найяра) впервые описана в 1952 г. Криглером и Найяром. К настоящему времени известно немногим более 90 случаев этого заболевания. Характеризуется выраженной желтухой с высоким содержанием в крови непрямого билирубина (свыше 350 мкмоль/л), который при такой концентрации токсически действует на базальные и стволовые ядра головного мозга. Желтуха развивается в течение первых дней после рождения и продолжается всю жизнь. Поражение центральной нервной системы появляется уже в младенческом возрасте и проявляется судорогами, опистотонусом, атетозом, нистагмом, мышечной гипертонией, отставанием в физическом и умственном развитии. В результате этого большинство больных, как правило, умирают в раннем детстве от тяжелых неврологических поражений. Желчь таких больных обесцвечена (обнаруживаются лишь следы билирубина). Количество желчных пигментов в моче и кале невелико; возможны ахолия (прекращение поступления желчи в кишечник) кала, небольшое повышение активности в крови ферментов, отражающих функцию печени; фенобарбитал не уменьшает содержания в крови свободного билирубина. Врожденная негемолитическая желтуха II типа (синдром Ариаса) описана впервые Ариасом. Желтуха при таком процессе развития обычно не столь выражена. В крови определяется несвязанный билирубин, но его концентрация в сыворотке колеблется в пределах 100–340 мкмоль/л (редко он бывает выше), поэтому поражений нервной системы вследствие билирубиновой интоксикации не наблюдается. Иногда желтуха впервые проявляется уже во взрослом возрасте. Неврологические нарушения редки и слабо выражены, могут отсутствовать совсем. Желчь окрашена, в кале выявляется значительное количество желчных пигментов; в моче желчные пигменты отсутствуют; применение фенобарбитала приводит к уменьшению содержания билирубина в сыворотке крови. Конституциональная дисфункция печени (синдром Жильбера) описана Гилбертом и соавт. в 1990 г. Заболевание характеризуется легкой, а в части случаев — непостоянной желтухой с содержанием в крови несвязанного билирубина, редко превышающим 50 мкмоль/л. Раньше заболевание считалось редким, но в последние годы в связи с более широким распространением биохимических методов исследования в клинической практике легкое повышенное содержание билирубина в крови, обусловленное синдромом Жильбера, встречается довольно часто: до 5 % среди обследуемых лиц и в 10 раз чаще у мужчин, чем у женщин. Заболевание выявляется обычно в юношеском и молодом возрасте (наиболее часто с 11–30 лет) и продолжается всю жизнь. У многих больных синдром Жильбера впервые выявляется после перенесенного острого вирусного гепатита. Общее состояние больных, как правило, удовлетворительное. Основные жалобы — появление желтухи, неинтенсивная боль и чувство тяжести в правом подреберье, диспепсические явления (тошнота, горечь во рту, снижение аппетита, отрыжка), вздутие живота, нередко выявляются нарушения стула и астеновегетативные проявления (подавленное настроение, утомляемость, плохой сон, головокружение). Указанные жалобы, а также появление желтухи провоцируются стрессовыми ситуациями (эмоциональный стресс, тяжелая физическая нагрузка), эпизодами инфекции в носоглотке или желчевыводящих путях. Желтуха является основным симптомом заболевания и имеет следующие характерные особенности: — бывает интермиттирующей (возникает периодически) или хронической; — степень выраженности желтухи различная: у многих пациентов она проявляется только желтушностью склер, у ряда больных возможно достаточно выраженное диффузное матово-желтушное окрашивание кожи и видимых слизистых оболочек или только частичное окрашивание ладоней, стоп и подмышечных впадин; — в отдельных случаях наблюдаются ксантелазмы век, пигментация лица, рассеянные пигментные пятна на коже. В некоторых случаях желтуха может отсутствовать, хотя уровень билирубина в крови повышен (85—100 мкмоль/л). Под влиянием лечения фенобарбиталом наступает нормализация уровня билирубина. Увеличение печени наблюдается, по данным С. Д. Подымовой (1993 г.), у 25 % больных, при этом печень выступает из-под реберной дуги на 1–4 см, консистенция ее обычная, прощупывание безболезненное. Увеличение селезенки может обнаруживаться у 10 % больных. Содержание билирубина в крови увеличено за счет неконъюгированной (непрямой) фракции. У некоторых больных возможно небольшое преходящее увеличение активности печеночных ферментов, небольшое снижение уровня белков крови. Однако следует заметить, что изменения функциональных проб печени наблюдаются обычно при длительном течении заболевания и развитии хронического персистирующего (портального) гепатита. Течение синдрома Жильбера обычно волнообразное, с периодами обострения и улучшения. У некоторых больных возможно присоединение воспалительного процесса в желчевыводящих путях. Первые клинические признаки синдрома Дабина-Джонсона обнаруживаются в период от рождения и до 25 лет. Чаще болеют мужчины. Основной признак заболевания — хроническая или периодическая желтуха, нерезко выраженная. Желтуха сопровождается утомляемостью, тошнотой, снижением аппетита, иногда болями в животе; редко — неинтенсивным кожным зудом. Содержание в крови билирубина повышено до 20–50 мкмоль/л (редко до 80–90 мкмоль/л за счет преимущественного увеличения прямого билирубина). Наблюдаются билирубинурия и темный цвет мочи. Печень у большинства больных не увеличена, изредка отмечается ее увеличение на 1–2 см. Бромсульфалеиновая проба, а также радиоизотопная гепатография выявляют резкое нарушение экскреторной функции печени, другие функциональные пробы печени существенно не изменены. При рентгенологическом исследовании желчевыводящих путей характерно отсутствие контрастирования или позднее и слабое заполнение желчных путей и пузыря контрастным веществом. Изменений показателей крови нет. Синдром цитолиза (разрушения) клеток печени нехарактерен. Течение синдрома Дабина — Джонсона хроническое, благоприятное. Обострения заболевания связаны с острыми респираторными инфекциями, физическим перенапряжением, психоэмоциональным стрессом, приемом алкоголя или средств, усиливающих синтез белка в организме (анаболические стероиды), операциями. Нередко синдром Дабина-Джонсона осложняется развитием желчнокаменной болезни. Первые клинические признаки синдрома Ротора появляются в детском возрасте. Болеют одинаково часто мальчики и девочки. Основным клиническим признаком этого синдрома является нерезко выраженная хроническая желтуха; субъективные признаки (утомляемость, боли в правом подреберье, горечь во рту, снижение аппетита) неотчетливы. Печень нормальных размеров, лишь у некоторых больных она несколько увеличена. Содержание билирубина в крови повышено преимущественно за счет свободного билирубина. Наблюдается появление желчных пигментов в моче, периодически возникает повышенное выведение уробилина с мочой, наблюдается потемнение мочи. Общий анализ крови и функциональные пробы печени не изменены. Течение синдрома Ротора благоприятное, многолетнее, без существенных нарушений общего состояния. Периодически возможны обострения заболевания под влиянием тех же факторов, которые вызывают обострение синдрома Дабина-Джонсона. Возможно развитие желчнокаменной болезни.
Гепатозы приобретенные Острый жировой гепатоз (токсическая дистрофия печени) развивается бурно, его клинические проявления характеризуются расстройством пищеварения, признаками общей интоксикации, желтухой. Печень вначале несколько увеличена, мягкая, в дальнейшем не прощупывается, а ее размеры уменьшены. Лабораторные исследования обнаруживают значительное повышение содержания в крови печеночных ферментов. В тяжелых случаях обычно имеет место снижение уровня калия в крови, может увеличиваться СОЭ. Изменения печеночных проб незакономерны. При хроническом жировом гепатозе наблюдаются расстройства пищеварения, общая слабость, тупые боли в правом подреберье. Печень умеренно увеличена, с гладкой поверхностью, болезненная при прощупывании, в отличие от цирроза она никогда не бывает плотной и не имеет заостренного края. Увеличение селезенки, часто сопровождающее гепатиты и, как правило, циррозы печени, для жирового гепатоза нехарактерно. Содержание печеночных ферментов в сыворотке крови умеренно или незначительно повышено, нередко также увеличено содержание холестерина, жирных кислот. Характерны результаты бромсульфалеиновой и вофавердиновой проб: задержка выделения печенью этих препаратов наблюдается в большинстве случаев. Другие лабораторные тесты дают малохарактерные результаты. Решающее значение в диагностике имеют данные пункционной биопсии печени. Холестатический гепатоз может быть острым или иметь затяжное хроническое течение. Основные клинические проявления болезни — желтуха, кожный зуд, обесцвечивание кала, темный цвет мочи, нередко лихорадка — обусловлены синдромом холестаза. При лабораторном исследовании выявляются повышение уровня билирубина и холестерина крови, повышенная активность некоторых ферментов в сыворотке крови, нередко — повышение СОЭ. Острый жировой гепатоз может сопровождаться тяжелой печеночной недостаточностью (см.) и привести к смерти больного от печеночной комы (см.), вторичных геморрагических явлений. В более легких случаях, если причина возникновения продолжает действовать, заболевание переходит в хроническую форму. Для хронического жирового гепатоза характерно относительно благоприятное течение. Во многих случаях, особенно при исключении действия повреждающего агента и своевременном лечении, возможно выздоровление. Однако он может трансформироваться в хронический гепатит и цирроз печени. Холестатический гепатоз сравнительно быстро трансформируется в гепатит вследствие возникающей реакции в ткани печени и вторичного холангита.
Диагностика и дифдиагностика Гепатозы наследственные пигментные В типичных случаях диагноз устанавливают на основании жалоб больного на постоянную или перемежающуюся желтуху, как правило, незначительную, отмечаемую нередко с детства или впервые возникшую в подростковом или юношеском возрасте. При этом среди родственников больного также отмечаются аналогичные случаи. Характерными являются отсутствие увеличения печени и нормальные, кроме гипербилирубинемии (повышенного содержания билирубина в крови), показатели биохимических исследований крови (в частности, тех, которые изменяются при поражении печени). В более сложных или нетипичных случаях диагноз нередко связан с большими трудностями. Тщательный анализ родословной, составление генеалогической схемы, наблюдение за больными, данные лабораторных исследований, наконец, результаты пункционной биопсии печени позволяют поставить диагноз наследственного пигментного гепатоза. Врожденное функциональное повышенное содержание билирубина в крови отличают от острого гепатита (см.), жирового гепатоза (см.) и других приобретенных хронических заболеваний печени, протекающих с синдромом желтухи. Установив, что у больного имеется врожденная гипербилирубинемия (повышенное содержание билирубина в крови), а не приобретенное заболевание печени, необходимо решить, какой из наследственных пигментных гепатозов имеет место в данном случае. Диагностике помогают некоторые функциональные тесты с фенобарбиталом и бромсульфалеином, данные инструментальных исследований желчного пузыря (особенности заполнения желчного пузыря контрастом при синдромах Дабина-Джонсона и Ротора) и некоторые другие признаки. Синдром Криглера-Найяра, поскольку он встречается почти исключительно в раннем детском возрасте, нужно отличать в первую очередь от желтух новорожденных.
Гепатозы приобретенные Острый жировой гепатоз необходимо отличать от острых вирусных и токсических гепатитов. В отличие от вирусного гепатита, при гепатозах нет характерного периода от начала заболевания до появления развернутойклинической картины. Следует учитывать также данные опроса и эпидемиологические данные. При острых гепатозах селезенка не увеличена. Этот же признак позволяет с известной степенью уверенности различать хронические гепатозы, гепатиты и циррозы печени. При циррозах печени обычно имеются печеночные стигматы, чего не наблюдается при гепатозах. При гепатозах отсутствуют признаки портальной гипертензии, характерные для портальных циррозов. Иногда затруднителен различительный диагноз приобретенных хронических гепатозов и так называемых врожденных (негемолитических) функциональных повышений уровня билирубина. Отличительным признаком является то, что при этих заболеваниях наблюдаются почти постоянные, но в большинстве случаев незначительные, повышение билирубина и желтуха, однако функциональные печеночные пробы, как правило, не изменены; морфология печени (по данным пункционной биопсии) не нарушена. Большое значение для диагностики и дифференциальной диагностики гепатозов имеет биопсия печени.
Лечение и профилактика Гепатозы наследственные пигментные Терапия врожденных функциональных гипербилирубинемий пока неэффективна. Больных с наследственными гепатозами следует предупредить о необходимости полностью исключить из употребления алкогольные напитки, придерживаться разумной щадящей диеты, избегать острых блюд и физического переутомления; им не следует назначать лекарства, обладающие токсическим действием на печень. Учитывая наследственный характер врожденных функциональных билирубинемий, в их профилактике большое место занимают медико-генетические консультации, так как специалисты-генетики могут оценить риск возникновения этих заболеваний у потомства и не рекомендовать родителям, страдающим функциональными повышениями уровня билирубина в крови, иметь детей, если риск передачи заболевания детям достаточно высок.
Гепатозы приобретенные При остром токсическом гепатозе (при отравлениях) больных госпитализируют, принимают срочные меры для прекращения поступления в организм токсического фактора и выведения его из организма. Проводят борьбу с геморрагическим синдромом, общим токсикозом, снижение уровня калия в крови. В особо тяжелых случаях вводят кортикостероидные гормоны. Проводят лечение печеночной недостаточности. При хроническом гепатозе необходимо также стремиться к прекращению воздействия фактора, послужившего причиной начала заболевания, категорически запрещается прием алкогольных напитков. Назначают диету № 5 с повышенным содержанием полноценных белков животного происхождения (до 100–129 г/с). Ограничивают поступление в организм жиров, особенно тугоплавких и животного происхождения. Назначают липотропные факторы: холинхлорид, липоевую и фолиевую кислоты, витамин В12, препараты, содержащие экстракты печени (сирепар по 5 мл внутримышечно ежедневно и др.), эссенциале или эссливер-форте, легалон, катерген. При холестатическом гепатозе назначают кортикостероидные гормоны. Санаторно-курортное лечение не рекомендуется. Профилактика гепатозов состоит в устранении причины, вызывающей это заболевание, обеспечении сбалансированного рационального питания, своевременном лечении заболеваний пищеварительной системы. Больные должны находиться под диспансерным наблюдением.
ГЕПАТОМА
ОпределениеГепатома — первичный гепатоцеллюлярный рак печени, является наиболее частой злокачественной опухолью в мире, но реже встречается в Европе.
Этиология и патогенез Предраспологают к развитию гепатомы все виды цирроза, но наиболее часто она диагностируется у больных вирусным (вирус гепатита В) циррозом печени. Гепатит В в 100 раз увеличивает риск развития гепатомы. Имеются данные о роли в развитии первичного рака печени афлотоксина — продукта обмена желтого плесневого гриба, широко распространенного в экваториальной Азии и Африке. Особенно часто канцерогенное вещество обнаруживается в рисе, горохе, сое, пшенице и некоторых других пищевых продуктах. На возникновение первичного рака печени могут оказывать влияние хроническая алкогольная интоксикация, инфекционные и паразитарные болезни, протекающие с поражением печени. Из глистных заражений ведущее место в возникновении рака печени занимает описторхоз, шистосомоз. На образование гепатом влияет длительное применение андрогенов. Первичный рак печени занимает 7—8-е место по частоте среди злокачественных опухолей человека. По ориентировочным данным ВОЗ, этой опухолью в мире ежегодно заболевают около 250 тыс. человек. Рак печени особенно широко распространен в развивающихся странах, в которых на его долю приходится более 8 % от общего числа злокачественных опухолей у мужчин и 3,5 % — у женщин.
Патанатомия По гистологическому строению гепатома — гепатоцеллюлярный рак, возникающий из эпителия ткани печени; по макроскопической картине — опухоли в виде единичного или множественных (уницентрический и мультицентрический рост) узлов, а также диффузный рак с инфильтративным ростом.
Клиническая картина Типичными симптомами для гепатомы являются боль в правом подреберье или надчревной области, иногда иррадиирующая в спину и правую лопатку, увеличение печени, лихорадка, снижение аппетита, общая слабость, асцит, желтуха. Боль вначале нерезкая, в виде чувства тяжести, распирания или давления в подреберье, в дальнейшем тупая, постоянная, ноющая боль, которая не зависит от приема пищи, но может усиливаться к концу дня, а иногда и ночью. Интенсивность ее нарастает, и со временем она становится нестерпимой. Такая динамика болевых ощущений связана с растяжением капсулы печени растущей опухолью и зависит от скорости роста новообразования. Увеличение печени является важным объективным признаком первичного рака печени. К моменту установления диагноза печень достигает значительной величины. Особенно показательно неравномерное увеличение органа. Консистенция органа плотная. Более чем у половины больных поверхность печени бугристая. Другим важным признаком служит болезненность при пальпации печени. Лихорадка наблюдается у большинства больных, но каких-либо закономерностей в характере температурной кривой не обнаружено. У некоторых больных бывают кратковременные единичные незначительные подъемы температуры, в других случаях температура держится на высоких цифрах в течение длительного времени и является ведущим признаком рака. Снижение аппетита, похудение, общая слабость относятся к числу частых жалоб при раке печени. Вначале эти симптомы мало выражены, с течением времени они прогрессируют. В относительно короткий срок исчезает аппетит, потеря массы тела становится ощутимой, резко усиливается общая слабость. Асцит (геморрагический) при гепатоме встречается почти у половины больных. Иногда накопление асцитической жидкости зависит от степени распространенности опухолевых клеток по брюшине, в других случаях от нарушения белкового баланса, сдавления или тромбоза воротной вены. Желтуха обнаруживается реже, примерно у 1/3 заболевших. Она зависит от степени поражения внепеченочных протоков метастазами или от механической закупорки внутрипеченочных желчных протоков опухолью. Желтуха возникает в поздних стадиях заболевания, но в отдельных случаях является первым наиболее характерным симптомом. Важно отметить, что кожный зуд у больных желтухой, обусловленной раком печени, наблюдается редко.
Диагностика Диагноз в типичных случаях устанавливают на основании характерной клинической симптоматики. Лабораторные исследования крови часто показывают повышение СОЭ, реже невысокий лейкоцитоз с относительной лимфопенией, в отдельных случаях анемию. Биохимические исследования крови могут выявить снижение уровня альбуминов и повышение бета- и гамма-глобулинов, повышение активности щелочной фосфатазы и отклонение других показателей от нормальных цифр. Однако обнаружить какие-либо диагностически значимые закономерности не удается. У 80 % больных выявляется увеличение в сыворотке крови альфа-фетопротеина (более 4 нг/мл) (иммуно-химическая реакция Абелева-Татаринова). УЗИ печени позволяет выявить признаки очагового поражения печени у 75 % больных гепатомой. Радиоизотопное сканирование нередко используется при амбулаторном обследовании больных, что позволяет обнаружить очаговые поражения печени небольшого размера. Компьютерная томография проводится только тогда, когда диагноз сомнителен или УЗИ не дает четкого представления. Биопсия печени, проводимая под ультразвуковым контролем, является безопасной и обязательной для подтверждения диагноза на гистологическом уровне.
Дифдиагностика Дифдиагноз на основании клинических данных проводится с широким кругом заболеваниий в зависимости от клинической формы рака печени. При увеличении печени в амбулаторных условиях прежде всего исключают диффузные поражения печени на почве безжелтушного вирусного гепатита, острой жировой дистрофии, хронического гепатита и цирроза. Решающими диагностическими критериями являются большая величина и неравномерное увеличение печени, плотная консистенция, бугристая поверхность и болезненность при пальпации, а также быстрое прогрессирование заболевания. Кисты печени чаще встречаются у женщин, прощупываются в виде округлого упругого образования с гладкой поверхностью, медленно прогрессируют и не сопровождаются нарушением общего состояния. Гемангиомы печени имеют мягкую или эластическую консистенцию, малоболезненны, прогрессируют медленно, не сопровождаются симптомами интоксикации. Эхинококковая киста чаще обнаруживается у лиц, проживающих в очаговых районах, имеет эластическую консистенцию, сопровождается аллергическими реакциями, развивается медленно. При альвеококкозе размеры печени увеличиваются медленно, общее состояние больного долго остается удовлетворительным, часто наблюдается эозинофилия, положительны диагностические тесты на наличие эхинококковых антигенов. Желтушную форму рака печени дифференцируют с широким кругом заболеваний, сопровождающихся желтухой.
Лечение Радикальным методом лечения гепатомы является оперативное вмешательство. Операция — анатомическая резекция, проводится в специализированных центрах. Но хирургическое вмешательство возможно только у 20–30 % больных, с массивной формой или узловой, если узлы расположены в пределах одной доли или на небольшом расстоянии друг от друга. Трансплантация печени при гепатоме не является оправданной за исключением локализованных опухолей фиброламеллярного типа. С паллиативной целью проводят лучевое или химиотерапевтическое лечение, а также хирургические вмешательства, уменьшающие кровоснабжение опухоли. Лучевая терапия широкого распространения не получила из-за малой устойчивости печени к ионизирующему излучению. Существенного продления жизни больных получить не удается. Химиотерапевтическое лечение столь же малоэффективно. Из изученных препаратов наиболее эффективным оказался адриамицин, с помощью которого удается получить кратковременную и частичную ремиссию у 10–44 % больных. Не увенчались успехом попытки замедлить развитие опухоли путем перевязки печеночной артерии. Средняя выживаемость больных с момента диагностики гепатомы составляет 12 недель, а 5-летняя выживаемость после радикальной операции по поводу опухоли равняется 15 %.
Профилактика Профилактика рака печени заключается в исключении факторов, способствующих возникновению опухоли, а также диспансеризации лиц, имеющих призводственный контакт с веществами, характеризующимися гепатоканцерогенным действием. Очевидно, в будущем может оказать позитивное влияние на распространение гепатомы вакцинация против вируса гепатита В.
ГЕПАТОРЕНАЛЬНЫЙ СИНДРОМ
ОпределениеГепаторенальный синдром — прогрессирующая функциональная почечная недостаточность, возникающая у больных с тяжелой патологией печени, в том числе и билиарной (желчевыводящей) системы.
Этиология и патогенез Клиническими предвестниками (причинами) гепаторенального синдрома являются: — почечная недостаточность (см.), развивающаяся на фоне острого или хронического прогрессирующего заболевания печени (часто, но необязательно проявляющаяся холестатической желтухой); — эпизоды артериальной гипотонии во время операции; чрезмерная диуретическая терапия, абдоминальный парацентез, сепсис (см.); — гипонатриемия — снижение выделения натрия с мочой (менее 10 ммоль/л); повышенный уровень мочевины в крови; рефрактерный к терапии асцит (скопление жидкости в брюшной полости); парадоксально функционирующие почечные канальцы (возрастает реабсорбция натрия, а воды — падает); внутривенное введение жидкости и электролитов не влияет на содержание натрия и мочевины в крови. Механизм развития гепаторенального синдрома неизвестен, но выделяют несколько факторов: — вазоконстрикция мелких почечных сосудов; — сброс крови из коры в мозговую часть почки; — снижение скорости почечной фильтрации; — снижение почечного кровотока.
Клиническая картина Гепаторенальный синдром развивается, как правило, по типу острой почечной недостаточности (см.), которая утяжеляет картину основного заболевания. Нарушается концентрирование мочи, развиваются патологические изменения плотности мочи, ряд нарушений состава крови, ранний ацидоз. Этот комплекс симптомов, если пережить критический момент, имеет тенденцию к обратному развитию.
Лечение Единственная форма борьбы с гепаторенальным синдромом — это нормализация процессов движения крови в организме (гемодинамика) и коррекция печеночной недостаточности. Целесообразно применять прессорные вещества, повышающие артериальное давление. Препаратом выбора здесь является дофамин, применение которого может улучшить и почечный, и печеночный кровотоки. Вторым мероприятием после восстановления кровообращения должна быть активная десенсибилизирующая терапия. Лечебные мероприятия могут оказаться недостаточно эффективными, если не поддается лечению основное заболевание, явившееся причиной развития гепаторенального синдрома.
Профилактика К профилактическим мерам относят: — предупреждение развития артериальной гипотензии; — отмену нефротоксичных препаратов; — отмену чрезмерной мочегонной терапии и удаление скопившейся в брюшной полости жидкости при помощи пункции; — перед операцией и во время нее для поддержания диуреза (выделения определенного количества мочи за какой-либо установленный срок) рекомендуется внутривенное введение 10 %-ного раствора маннитола по 20 мл в час; — ограничение введения жидкости (1000 мл в сутки) и соли (менее 50 ммоль/день); — внутривенное введение альбумина (100 мл 20 %-ного раствора в течение 3 дней), что может увеличить объем циркулирующей крови, повысить уровень артериального давления и почечный кровоток и способствовать обратному развитию гепаторенального синдрома.
ГЕРМАФРОДИТИЗМ
ОпределениеГермафродитизм (синонимы: врожденные нарушения половой дифференцировки) — заболевания, обусловленные хромосомными нарушениями.
Патогенез Половая принадлежность гонады (половой железы) определяется генетически и зависит от сочетания половых хромосом; две Х-хромосомы определяют женский, а сочетание Х- и Y-хромосом — мужской пол. Для нормальной функции половых желез необходим не только набор хромосом XX и XY, но и полный набор генов. Нарушения в наборе хромосом, возникшие при нерасхождении половых хромосом, потеря одной хромосомы либо изменения структуры хромосом приводят к заболеваниям, характеризующимся нарушением половой дифференцировки. В этих случаях ткань половой железы не способна к нормальной секреции половых гормонов, и развитие мужских или женских начал определяется элементами половой ткани, формирующими гонаду.
Клиническая картина Как клиническое проявление гермафродитизма наблюдаются агонадизм (врожденное отсутствие половых желез), дисгенезии гонад (могут быть обнаружены отдельные структурные элементы половых желез). Симптоматика различных клинических форм дисгенезии половых желез разнообразна. По внешним признакам легко диагностируется синдром Шерешевского-Тернера: отсутствие вторичных половых признаков, недоразвитие молочных желез, наружных половых органов, низкорослость, короткая шея с крыловидными складками, часто аномалии скелета — вальгусная девиация локтевых и коленных суставов, синдактилия, деформация позвонков, птоз, высокое небо, нарушения со стороны сердечно-сосудистой системы — пороки сердца и крупных сосудов. Половой хроматин отрицательный, кариотип чаще 46, XY. Труднее диагностируется «чистая дисгенезия гонад», при которой отсутствуют соматические аномалии, характерные для синдрома Шерешевского — Тернера. Большое значение имеют результаты исследования внутренних половых органов: гонады отсутствуют; рудиментарные матка, трубы, влагалище. Половой хроматин отрицательный, набор хромосом 46, XY. При синдроме Шерешевского — Тернера и «чистой дисгенезии гонад» в некоторых случаях могут наблюдаться признаки маскулинизации: увеличение клитора, вирильное оволосение. Одной из форм дисгенезии гонад является дисгенезия яичников. Основные симптомы: отсутствие менструаций, недоразвитие вторичных половых признаков. Дисгенезия тестикул: наличие внутренних женских половых органов при отсутствии элементов яичника, наружные половые органы бисексуальны. Отрицательный половой хроматин, кариотип 46, XY. Тестикулярная феминизация (ложный мужской гермафродитизм) — развитие наружных половых органов и вторичных половых признаков по женскому типу, наличие мужских половых желез, отсутствие матки, половой хроматин отрицательный, кариотип 46, XY. В некоторых случаях (при неполной форме) могут выявляться признаки маскулинизации: недостаточное развитие молочных желез, грубоватый голос, увеличение клитора. Синдром Клайнфелтера — гинекомастия, евнухоидные пропорции тела, недоразвитие вторичных половых признаков, недоразвитие яичек при нормальных размерах полового члена, азооспермия, снижение потенции. Половой хроматин положительный, кариотип 47, XXY. Истинный гермафродитизм — наличие у индивидуума функционирующей гонадной ткани обоего пола и вследствие этого женских и мужских половых признаков. При изучении кариотипа он наиболее часто определяется как XX/XY
Лечение При необходимости проводят коррекцию пола с учетом психосексуальной ориентации и анатомических и функциональных возможностей половой сферы. Проводится заместительная терапия половыми гормонами в зависимости от избранного пола: для усиления феминизации применяют эстрадиоладипропионат, микрофоллин, для маскулинизации — тестостерона пропинат, тестэнат, сустанон-250, омнадрен.
ГЕРПЕТИЧЕСКАЯ ИНФЕКЦИЯ
ОпределениеГерпетические инфекции — группа широко распространенных антропонозных инфекционных болезней, вызываемых вирусами семейства Herpesviridae и характеризующихся хроническим рецидивирующим течением и пожизненным персистированием возбудителя в организме.
Этиология и патогенез Возбудитель относится к семейству вирусов герпеса и подразделяется на 6 антигенных групп. Наиболее распространен I тип; с вирусом II типа связывают возникновение генитального герпеса и распространенной инфекции новорожденных. Вирус проникает в организм человека чаще всего через травмированную кожу и слизистые оболочки при прямом контакте с больными или вирусоносителями. Немаловажное значение имеет передача вируса половым путем. Возможно также заражение при опосредованном контакте с инфекционным материалом и воздушно-капельным путем. Известны случаи трансплацентарного заражения плода. Вирусоносителями являются примерно 90 % населения земного шара. Начальный период заболевания составляет 2—14 дней (чаще 4 дня). После внедрения вирус герпеса сохраняется в организме человека пожизненно в виде скрытой инфекции, которая может переходить в клинически выраженные формы под влиянием ослабляющих организм факторов (грипп и другие болезни, лечение иммунодепрессантами, СПИД и др.).
Клиническая картина Первичная инфекция обычно протекает незаметно, лишь у 10–20 % больных возникают различные клинические (ярко выраженные) проявления. Выделяют следующие клинические формы: герпетические поражения кожи (локализованные и распространенные); герпетические поражения полости рта/ ОРЗ/ генитальный герпес/ герпетическое поражение глаз (поверхностное и глубокое)/ энцефалиты и менингоэнцефалиты/ висцеральные формы (гепатит, пневмония)/ генерализованный герпес новорожденных. Локализованные герпетические поражения кожи являются наиболее частыми, они обычно сопровождают какое-либо другое заболевание (ОРЗ, малярия (см.), менингококковая инфекция и др.). Общие симптомы отсутствуют или маскируются проявлениями основного заболевания. Пузырьки локализуются вокруг рта, на губах, крыльях носа. В некоторых случаях бывает распространенная герпетическая сыпь. Поражение слизистых оболочек полости рта обычно протекает в виде афтозного герпетического стоматита. Вирусы герпеса обусловливают 5–7 % всех ОРЗ; клинически они мало отличаются от ОРЗ, имеющего другую причину возникновения.
Опоясывающий герпес. Типичная везикулезная сыпь
Опоясывающий герпес. Высыпания на спине с образованием корочек
Генитальный герпес, передающийся половым путем, протекает чаще в виде некротического цервицита, герпетических поражений влагалища и наружных половых органов. Эта форма способствует возникновению рака шейки матки (см.), у беременных представляет опасность для плода (может возникнуть тяжелый генерализованный герпес новорожденных). Герпетическое поражение глаз чаще протекает в виде поверхностных и глубоких поражений роговицы. Заболевание склонно к длительному рецидивирующему течению и может обусловить стойкое помутнение роговицы. Тяжело протекают герпетические энцефалиты, они нередко заканчиваются летально. Поражение внутренних органов при герпесе обычно возникает на фоне массивного лечения различными иммунодепрессантами, а также у больных СПИДом, чаще проявляются в виде гепатита, пневмонии, энцефалитов. Генерализованный герпес новорожденных протекает с энцефалитом, поражением кожи и внутренних органов; без лечения противовирусными препаратами обычно заканчивается летально. Прогноз сомнительный при генерализованном герпесе, герпетических энцефалитах. При поражениях глаз может быть длительное рецидивирующее течение, что ведет к нарушению трудоспособности.
Диагностика Диагностика герпетической инфекции облегчается наличием характерных поражений кожи или слизистых оболочек. Для подтверждения диагноза используется выделение вируса из различного материала (содержимое пузырьков, соскобы с роговицы, спинномозговая жидкость, материал биопсии шейки матки и др.).
Лечение и профилактика Наиболее эффективны препараты специфического противовирусного действия, особенно на начальных этапах процесса. Необходимо учитывать, что при тяжелом течении болезни их назначают либо внутрь, либо внутривенно, а при обычном течении — только местно: ацикловир (зовиракс, виролекс) — по 200 мг 5 раз в день в течение 5 дней; хелепин — по 0,1 г 4 раза в день в течение 5–7 дней; изопринозин (модимунал) — по 0,8 г 4 раза в день; бонафтон — по 0,1 г 3–5 раз в день; алпизарин — по 1 г 4 раза в день; метисазон — по 0,6 г 2 раза в день, а также инъекции дезоксирибонуклеазы по 25 мг 4 раза в день и человеческий лейкоцитарный интерферон по 5 тыс. МЕ 3 раза в день. При локализованных неосложненных формах герпетической инфекции проводят лечение основного заболевания: местно элементы сыпи смазывают 1 %-ным раствором метиленового синего или бриллиантового зеленого, используют мази флореналь, мегосин, теброфеновую, зовиракс, риодоксоль. При появлении корок применяют тетрациклиновую и эритромициновую мази. При высыпаниях в полости рта целесообразны полоскания растворами фурацилина, риванола, отваром ромашки. Для предупреждения распространения инфекции по всему организму внутримышечно вводят 6 мл нормального человеческого иммуноглобулина. При нагноении элементов сыпи назначают антибиотики: оксациллин по 1 г через 6 ч, эритромицин по 0,5 г 4 раза в день. Для профилактики поражений глаз можно закапывать в глаза 0,1 %-ный раствор керецида. Этот же раствор хорошо помогает при герпетических поражениях слизистых оболочек. При часто рецидивирующем герпесе необходимы обработка очагов инфекции, коррекция нарушений функций пищеварительного тракта и нервной системы, назначение общеукрепляющих средств. Из средств, оказывающих противорецидивный эффект, наиболее эффективна специфическая герпетическая поливакцина. Лечение вакциной целесообразно начинать в межрецидивном периоде. Препарат вводят в дозе 0,1–0,2 мл внутрикожно 2 раза в неделю. Курс лечения состоит из 5 инъекций. Интервал между первыми двумя курсами составляет 2 недели, между последующими — 3–4 месяца. Общее число курсов может достигать 6–8. При появлении герпетической сыпи на фоне вакцинотерапии лечения не прекращают, но дозу препарата, вводимого при последующей инъекции, сокращают вдвое, а интервал между инъекциями увеличивают до 5–6 дней. Местно применяют противовирусные мази. После стихания рецидива вакцину назначают в исходной дозе. Перспективным является сочетанное применение вакцины и внутривенного введения активаторов интерферона, в частности ридостина по 8 мг каждые 3 дня, всего 4 инъекции, а также одновременное применение ридостина и виферона в виде ректальных свечей (по 1 свече в день на протяжении 16 дней). Используют также изопринозин по 0,8 г 2 раза в день в течение недели. Курс лечения состоит из трех таких циклов с интервалом 7—10 дней; специфический иммуноглобулин назначают по 3 мл через день в течение 8—10 дней. Для профилактики распространения инфекции вводят нормальный человеческий иммуноглобулин (по 6 мл через каждые 3 недели). Для предупреждения рецидивов эффективна убитая вакцина из вируса герпеса (схема описана в лечении). Мероприятий в очаге не проводят.
ГИДРАДЕНИТ
ОпределениеГидраденит — гнойное воспаление потовых желез.
Этиология и патогенез Чаще всего развивается в подмышечных впадинах, где имеется много потовых желез. Возбудитель заболевания — золотистый или гемолитический стафилококк — проникает в потовые железы через выводной проток или лимфогенным путем. К предрасполагающим факторам относят гипергидроз, инфицирование кожи подмышечной впадины, микротравмы при бритье волос в этой области, потертости одеждой, эндокринные нарушения.
Клиническая картина Заболевание начинается с появления в подмышечной области болезненного уплотнения округлой или овальной формы. При гидрадените, в отличие от фурункула, не образуется некротический стержень. Уплотнение увеличивается в объеме, становится еще более болезненным, кожа над ним приобретает багрово-красный цвет, спаяна с нестойкими эозинофильными скоплениями. Через некоторое время уплотнение размягчается, и на его месте образуется нестойкое эозинофильное скопление с явлениями флюктуации, после вскрытия которого выделяется гной. Наблюдается недомогание, движения в плечевом суставе болезненны.
Гидраденит
Диагноз ставится на основании жалоб и данных объективного осмотра. Дифференциальную диагностику проводят с лимфаденитом (см.) и фурункулом (см.).
Лечение и профилактика После стрижки волос в подмышечной впадине конечность фиксируют косынкой. На область нестойких эозинофильных скоплений накладывают мазевые повязки, пропитанные антибиотиками и ферментами. В отдельных случаях при обширных поражениях подмышечной впадины показано применение короткого блока с использованием 20–30 мл 0,5 %-ного раствора новокаина с антибиотиками (канамицином). Хорошее действие в начальной стадии оказывают ультрафиолетовое облучение, УВЧ, электрофорез антибиотиков. При явлениях общей интоксикации организма назначают антибактериальные препараты в виде внутримышечных инъекций (тетрациклин, рондомицин и др.). При наличии флюктуации в центре нестойких эозинофильных скоплений (инфильтрата) показано оперативное лечение — удаление гнойного детрита и некротизированных тканей. При рецидиве заболевания и вялотекущем гидрадените применяют стафилококковый анатоксин, антистафилококковый гамма-глобулин, гемотрансфузии. Профилактика гидраденита заключается в соблюдении правил личной гигиены, уходе за кожей в подмышечных впадинах, лечении гипергидроза, опрелостей, эндокринных нарушений, применении дезодорантов.
ГИДРОНЕФРОЗ
ОпределениеГидронефроз — заболевание почки, развивающееся вследствие нарушения оттока мочи и характеризующееся расширением чашечнолоханочной системы, патологическими изменениями ткани почки и ее атрофией. Гидронефроз правой или левой почки встречается одинаково часто, двусторонний наблюдается лишь в 5–9 % случаев этого заболевания.
Этиология, патогенез и классификация С практической точки зрения и исходя из современных теоретических представлений о гидронефрозе, наиболее приемлемо деление заболевания на два вида. I. Гидронефроз врожденный, или первичный. Причинами врожденного гидронефроза служат дискинезия мочевых путей; врожденная аномалия расположения почечной артерии (или ее ветви), сдавливающей мочеточник; врожденные клапаны и стриктуры мочеточника; ретрокавальное расположение мочеточника; уретероцеле; врожденная обструкция нижних мочевых путей. II. Гидронефроз приобретенный. Причинами приобретенного гидронефроза являются некоторые урологические заболевания: мочекаменная болезнь (см.), воспалительные изменения мочевой системы, травматические сужения мочевых путей, опухоли мочевых путей, опухоли предстательной железы (см.), а также ретроперитонеальной клетчатки, опухоли шейки матки, проникновение клеток опухоли в забрюшинную клетчатку и клетчатку малого таза, метастазы опухоли в забрюшинные лимфатические узлы, различные травматические и другие повреждения спинного мозга, ведущие к нарушениям оттока мочи. В тех случаях, когда препятствие оттоку мочи расположено ниже лоханочно-мочеточникового сегмента и расширяется не только лоханка, но и мочеточник, имеет место гидроуретеронефроз. Гидронефроз бывает асептическим и инфицированным. В первом случае почечные изменения зависят от степени сужения просвета полого органа (обструкции) и длительности заболевания, во втором — как от степени обструкции и длительности заболевания, так и от способности инфекции к заражению. В начальных стадиях заболевания почка внешне мало отличается от здорового органа, обнаруживается лишь расширение лоханки и чашечек. Повышенное внутрилоханочное давление нарушает функцию почек, но эти нарушения еще обратимы, и после устранения непроходимости функция почки полностью восстанавливается. При более длительном нарушении оттока мочи в почке развиваются органические изменения, которые рассматриваются как обструктивный интерстициальный нефрит. При этом после устранения обструкции функция почки восстанавливается лишь частично. Если происходит инфицирование гидронефроза, то интерстициальный нефрит переходит в обструктивный пиелонефрит.
Патанатомия При гидронефрозе патологоанатомическая картина в значительной степени зависит от анатомического поражения органа и стадии болезни. В начальной стадии почка мало отличается от здорового органа. Основные изменения в начале болезни происходят в лоханке и чашечках. Под действием повышенного внутрилоханочного давления увеличивается вместимость чашечек и в значительной степени изменяется их конфигурация; они становятся круглыми, шейки их укорачиваются и расширяются. Стенка лоханки постепенно истончается в связи с прогрессирующей атрофией гладких мышечных волокон и заменой их соединительной тканью; атрофируются нервные окончания, нарушается проходимость как кровеносных, так и лимфатических сосудов лоханки. В конечной стадии гидронефроза лоханка представляет собой тонкостенный мешок, состоящий в основном из грубоволокнистой соединительной ткани.
Клиническая картина Гидронефроз может длительно развиваться бессимптомно, и лишь присоединение таких осложнений, как инфекция, образование камня в лоханке или травматическое повреждение пораженной почки, обусловливают первые симптомы заболевания, дающие основание для исследования мочевой системы. В большинстве случаев гидронефроз проявляется болями в поясничной области. Боли носят характер почечной колики с типичной локализацией и смещением боли по ходу мочеточника в паховую область, яичко у мужчин и наружные половые органы у женщин, а также бедро или промежность. Приступы почечной колики более характерны для начальной стадии гидронефроза. В дальнейшем, когда стенка лоханки и чашечек частично замещается соединительной тканью, лоханка и чашечки теряют способность активно сокращаться, а гидронефроз проявляется тупыми болями в поясничной области. Боли при гидронефрозе, как и при нефролитиазе, могут возникать и днем, и ночью, независимо от того, на каком боку спит больной. Последний симптом важен для дифференциальной диагностики гидронефроза с нефроптозом (см.), при котором больные предпочитают спать на больном боку. При сужении верхних мочевых путей нарушения мочеиспускания обычно не бывает или оно возникает лишь во время приступа болей. Другой важный симптом гидронефроза — наличие крови в моче (гематурия). Макроскопическая гематурия, т. е. видимая простым глазом, наблюдается у 20 % больных гидронефрозом, а видимая при помощи микроскопа (микрогематурия) встречается значительно чаще. Повышение температуры во время усиления болей в поясничной области свидетельствует о присоединении инфекции. Прощупать увеличенную почку удается лишь при очень большом гидронефрозе. Течение асептического одностороннего гидронефроза может быть скрытым (латентным), больные длительное время считают себя здоровыми, несмотря на наличие у них прогрессирующего процесса. Даже при далеко зашедшем одностороннем гидронефрозе явлений почечной недостаточности не наблюдается, так как противоположная почка компенсирует функцию пораженной. Из осложнений при гидронефрозе нужно отметить острый и хронический пиелонефрит, образование вторичных камней и разрывы гидронефротического мешка при травмах, а также развитие хронической почечной недостаточности.
Диагностика и дифдиагностика Диагностика основывается прежде всего на анамнезе, свидетельствующем об имевшихся почечных коликах, или тупых болях в области почек. При прощупывании удается выявить гидронефроз в поздних стадиях, когда почка значительно увеличена и хорошо прощупывается. Простукивание передней стенки живота позволяет определить вне- или внутрибрюшинное расположение прощупываемого образования. Более информативным методом исследования при гидронефрозе является хромоцистоскопия, при которой обнаруживается значительное запаздывание или отсутствие выделения контрастного вещества со стороны пораженной почки. Рентгенологическое исследование почки — основной метод диагностики гидронефроза. Обзорная рентгенограмма дает возможность определить размеры почек и обнаружить камни, если они имеются. На серии внутривенных урограмм можно отметить замедленное накопление контрастного раствора в расширенных лоханке (лоханках) и чашечках. На урограммах видны расширенная, округлой формы лоханка и расширенные чашечки. При значительном нарушении функции почки контрастный раствор может накопиться в достаточной концентрации лишь через 1–2 ч или вовсе не выделиться больной почкой. Таким образом, внутривенная урография позволяет диагностировать и стадию заболевания — от расширения почечных лоханок до гигантского гидронефроза с утратой функции почки. Дополнительными методами диагностики, существенно уточняющими данные клиникорентгенологических методов, являются радионуклидная ренография и сканирование почек, устанавливающие степень нарушения функции почек; ультразвуковое сканирование выявляет при гидронефрозе полость с однородной жидкой средой. Вследствие сходства симптомов гидронефроз следует отличать от почечнокаменной болезни (не осложненной развитием гидронефроза), при которой рентгенологически обнаруживается только камень почки; нефроптоза, при котором боли возникают при движении, а больные предпочитают спать на больном боку. Смещающаяся почка прощупывается в этом случае в положении стоя, а на рентгенограммах, выполненных в положении лежа и стоя, выявляется значительная подвижность почки. При опухоли почки, в отличие от гидронефроза, прощупываемая почка плотная и бугристая. При поликистозе (см.) бугристые почки прощупываются с обеих сторон. Во всех этих случаях в дифференциальной диагностике ведущая роль принадлежит рентгенологическим методам исследования.
Лечение Лечение гидронефроза хирургическое. Его важно провести в ранний период, когда устранение непроходимости (обструкции) мочевых путей не только предотвращает дальнейшие анатомические изменения, но и приводит к улучшению функции почек. При одностороннем заболевании и потере функции почки показана нефрэктомия, при двустороннем — органосохраняющая операция. В лечении инфицированного гидронефроза важное место занимает антибактериальная терапия под контролем посевов мочи и исследования микрофлоры на чувствительность к антибактериальным препаратам.
ГИДРОЦЕФАЛИЯ
ОпределениеГидроцефалия — патологическое состояние, при котором происходит увеличение ликворных пространств головного мозга вследствие избыточного количества спинномозговой жидкости в полости черепа.
Этиология и патогенез Возникновение гидроцефалии у новорожденного обусловлено перенесенными матерью во время беременности инфекционными заболеваниями (цитомегаловирусная инфекция), приводящими к нарушению работы желудочковой системы головного мозга плода. Это приводит к затруднению циркуляции ликвора и (или) его избыточной продукции. Помимо врожденной гидроцефалии, может развиться (чаще всего в первые месяцы жизни новорожденного) и приобретенная гидроцефалия после перенесенных менингитов, менингоэнцефалитов, травм головы, интоксикаций и т. д. Нарушение циркуляции цереброспинальной жидкости ведет к повышению внутричерепного давления и так называемому гипертензионно-гидроцефальному синдрому. Различают: — внутреннюю гидроцефалию — увеличение желудочков мозга; — наружно-внутреннюю — расширение желудочков мозга в подпаутинном пространстве; — наружную — расширение только подпаутинного пространства; — активную — с прогрессирующим накоплением церебральной жидкости, создающую повышенное давление и нарастающую атрофию ткани мозга; — пассивную — расширение ликворной системы без повышенного давления; — компенсированную — состояние, при котором давление церебральной жидкости нормализовалось.
Клиническая картина При гидроцефалии новорожденных наиболее характерны увеличение головы, подчеркнутость венозной сети покровов черепа и опускание глаз (симптом заходящего солнца); объем головы, постепенно увеличиваясь, может достигать гигантских размеров (окружность черепа до 60 см и более). Черепные швы расширены, передний родничок резко увеличен. Из-за податливости черепа детей симптомы гипертензии наблюдаются редко. Часто встречаются параличи черепных нервов, в частности снижение остроты зрения в связи с атрофией зрительных нервов. В ногах обычно отмечаются спастические нарушения. В тяжелых случаях неизбежна умственная отсталость. Гидроцефалия у взрослых характеризуется признаками повышения внутричерепного давления: головная боль, рвота, застойные диски зрительных нервов, головокружение. Заболевание, возникшее в возрасте после 17–18 лет, увеличением размеров головы не сопровождается.
Диагностика и дифдиагностика Диагноз ставится на основании клинических проявлений данных нейросонографии и компьютерной томографии. Рентгенограммы черепа изменены в зависимости от возраста, в котором развилась гидроцефалия: у взрослых отмечается разрушение турецкого седла, усиление пальцевых вдавлений по своду черепа. Компьютерная томография и вентрикулография обнаруживают резко увеличенные желудочки мозга, атрофию мозгового вещества. Отличают гидроцефалию новорожденных прежде всего от рахитического увеличения головы, для которого характерны разрастание костной ткани черепа и типичные для рахита изменения скелета. При гидроцефалии взрослых необходимо выяснить причину нарушения циркуляции спинномозговой жидкости, в первую очередь — своевременно распознать опухоль мозга.
Лечение Для снижения внутричерепного давления назначают диуретики, глюкокортикоидные гормоны, глицерин. Хирургическое лечение гидроцефалии новорожденных состоит в создании дополнительных путей оттока спинномозговой жидкости из полости черепа (шунтирование); при гидроцефалии взрослых вбольшинстве случаев необходима ликвидация причины непроходимости путей оттока спинномозговой жидкости (например, удаление опухоли, рассечение спаек). Прогноз при гидроцефалии новорожденных малоблагоприятен; исход гидроцефалии взрослых определяется возможностью хирургической коррекции причин, вызвавших болезнь.
ГИМЕНОЛЕПИДОЗ
ОпределениеГименолепидоз — заболевание, вызываемое кишечным гельминтом — карликовым цепнем.
Этиология Возбудитель — карликовый цепень, относящийся к классу цестод, длиной 15–30 мм и шириной 0,5–0,7 мм с очень маленькой головкой (сколексом), снабженной четырьмя присосками и коротким хоботком с венчиком из 20–24 мелких крючьев. Тело цепня состоит из тонкой шейки и большого числа (до 200) члеников.
Эпидемиология, патогенез и патанатомия Гименолепидоз — заболевание, распространенное исключительно среди людей. Гименолепидоз имеет повсеместное распространение. Механизм развития заболевания во многом определяется циклом развития паразита. Цикл развития карликового цепня характеризуется последовательным развитием личиночной и взрослой стадий в организме человека. Таким образом, человек для этого гельминта является и промежуточным, и основным хозяином. Источник заражения — зараженный человек, в тонкой кишке которого паразитируют взрослые цестоды. Терминальные членики червей, наполненные яйцами, выделяются с фекалиями во внешнюю среду. Яйца, выделившиеся из членика, содержат сформированный зародыш, являются инвазионными и не нуждаются в дозревании во внешней среде. Из яйца, попавшего в рот, а затем в кишечник человека, освобождается онкосфера, которая активно внедряется в ворсинку тонкого кишечника. Спустя 5–7 дней из онкосферы развивается личинка — цистицеркоид, которая разрушает ворсинку, выходит в просвет тонкой кишки, прикрепляется к ее слизистой оболочке и через 14–15 дней вырастает до взрослого цепня. Заражение происходит при заглатывании яиц паразита, попавших на руки при контакте с больным и загрязненными фекалиями предметами домашнего обихода (ночными горшками, стульчаками и пр.) и стенами уборных. Местное воздействие личинок и взрослых форм на слизистую оболочку кишечника выражается в разрушении ворсинок, разрастании воспалений (иногда с изъязвлением) слизистой оболочки с обильным выделением слизи. Наблюдается и токсико-аллергическое действие. Резервуар возбудителей: окончательные хозяева гельминта — грызуны, промежуточные хозяева — личинки блох, тараканы и др.
Клиническая картина и диагностика Гименолепидоз иногда протекает бессимптомно (почти у трети зараженных паразитирование гельминтов клинически не проявляется), но чаще больных беспокоят тошнота, рвота, изжога, изменения аппетита, а также тупые боли в животе. Боли бывают в виде ежедневных приступов или с перерывами в несколько дней. Характерным для заболевания является неустойчивый жидкий и учащенный стул с примесью слизи. В случае заражения основные симптомы болезни связаны с поражением кишечника, нервной системы и проявлениями снижения чувствительности организма. Отмечаются снижение аппетита, тошнота, боль в животе, понос или запор, головокружение, головная боль, раздражительность, повышенная утомляемость, беспокойный сон. Иногда наблюдаются похудение, умеренная анемия, эозинофилия. В результате длительного поноса и потери аппетита наблюдается похудение. У детей гименолепидоз протекает в более выраженной и тяжелой форме. Поносы, истощение, нервные подергивания и даже эпилептиформные припадки у детей могут быть следствием гименолепидоза. Выраженных и характерных изменений крови при гименолепидозе обычно не отмечается. Диагноз устанавливается на основании обнаружения яиц карликового цепня в кале.
Лечение и профилактика Для изгнания применяют фенасал. Лечение проводят циклами с промежутками в 4–7 дней. Через месяц после основного курса проводят один цикл противорецидивного лечения. В промежутках между циклами изгнания проводят общеукрепляющее лечение (витамины, глицерофосфат кальция). В период лечения необходимо соблюдать санитарно-гигиенические правила (дезинфекция горшков, стульчаков, смена белья, личная гигиена). Фенасал назначают в суточной дозе (2–3 г). Проводят 2–3 цикла лечения по 4 дня с интервалом между ними в 4 дня или 5–7 циклов по 2 дня с интервалом в 5 дней. Но возможно применение фенасала по следующим схемам: по первой схеме фенасал назначают в 4 приема через каждые 2 ч 4 дня подряд. В дни лечения прием пищи рекомендуется в 8, 13 и 18 ч, а прием фенасала — в 10, 12, 14 и 16 ч; по второй схеме фенасал назначают в один прием натощак за 1,5–2 ч до еды 2 дня подряд. Накануне и в дни лечения больные получают бесшлаковую диету. В первые дни первых двух циклов днем после приема фенасала назначают слабительное, а на ночь — очистительную клизму. Во время лечения и в течение 3–4 дней после его окончания больной должен ежедневно принимать душ и менять белье. Все лица, лечившиеся от гименолепидоза, при отсутствии яиц цепней в кале остаются на диспансерном учете в течение года. Профилактика сводится к соблюдению гигиены тела, одежды, жилища, общественной гигиене. Необходимо обследование на гельминтов всех членов семьи больного и одновременное лечение всех зараженных.
ГИНГИВИТ
ОпределениеГингивит — воспаление десны, обусловленное неблагоприятным воздействием местных и общих факторов, протекающее без нарушения целостности зубодесневого прикрепления.
Этиология Из причин общего характера следует отметить изменение реактивности (неспецифической сопротивляемости) организма вследствие нарушения функции эндокринной, сердечно-сосудистой, кровеносной систем; поражение разных тканей и нарушение функций желудочно-кишечного тракта; гиповитаминозы, аллергические, инфекционные заболевания, токсикоз беременных и др. Нарушения в организме общего характера поддерживаются и усугубляются неблагоприятными местными факторами: плохая гигиена рта и накопление микрофлоры в нем; образование зубной бляшки, зубного камня, аномалии и деформации зубочелюстной системы, механическое повреждение, химическое, лучевое поражение и др. Местные травматические факторы могут быть непосредственной причиной гингивита. Местными причинами ограниченного поражения 1–2 межзубных сосочков являются зубные отложения, кариозные полости на контактных поверхностях, дефекты пломб, погрешности пломбирования, подвижный молочный зуб, который острыми краями частично резорбированного корня травмирует прилегающую слизистую оболочку, вызывая воспаление десен на ограниченном участке.
Патанатомия Патоморфологические изменения выражаются в нарушении ороговения эпителия, в результате чего развивается паракератоз. Часто обнаруживаются явления акантоза и вакуольной дистрофии. В соединительной ткани отек и гиперемия наиболее выражены субэпителиально и в области эпителиального прикрепления. Очаговые инфильтраты, состоящие преимущественно из лимфоидных клеток и гистиоцитов, а также сегментоядерных лейкоцитов, располагаются в области десневой борозды. Коллагеновые волокна дистрофически изменены, утолщаются, сливаются в грубые пучки.
Клиническая картина Различают различные формы гингивита: — катаральный гингивит: острый и хронический; — гипертрофический гингивит: локализованный, генерализованный, отечный, фиброзный; — язвенный гингивит: острый и хронический; — десквамативный гингивит: эритематозный, эрозивный, буллезный; — атрофический гингивит: ограниченный и диффузный. Тяжесть гингивита проявляется комплексом общих изменений организма, а также распространенностью воспалительного процесса в слизистой оболочке. Для гингивита легкой степени характерно поражение преимущественно межзубных сосочков; процесс средней тяжести распространяется и на свободную (краевую) десну. Гингивит тяжелой степени характеризуется воспалением всей десны, включая прикрепленную (альвеолярную) часть. При гингивите не нарушается целостность зубодесневого соединения, однако за счет отечности межзубных сосочков, увеличения их объема создается кажущееся углубление десневой борозды. При локализованном процессе воспаление десны определяется в области группы зубов. Для генерализованного процесса характерно распространение воспалительного процесса на слизистую оболочку альвеолярного отростка в области всех зубов верхней челюсти и альвеолярную часть всех зубов нижней челюсти. В остальных случаях заболевание ограничивается одной челюстью, чаще нижней, а воспаление десны протекает с преобладанием экссудативного компонента.
Катаральный гингивит Больные жалуются на неприятные ощущения в деснах, чувство зуда, неприятный запах изо рта, извращение вкуса, кровоточивость десен во время приема пищи или чистки зубов, может быть окрашивание ротовой жидкости в розовый цвет. При остром течении или обострении хронического течения боли усиливаются во время приема пищи в результате влияния механических и химических раздражителей. Общее состояние страдает мало, однако периоды обострения могут сопровождаться недомоганием, повышенной температурой. Острый катаральный гингивит характерен для периода прорезывания и смены зубов. Наблюдается при острых инфекционных и других общесоматических заболеваниях Хронический катаральный гингивит отличается длительным вялым течением; жалобы слабо выражены. Воспалительный процесс может ограничиваться межзубными сосочками и краевой десной или распространяется на всю альвеолярную часть десны, бывает ограниченный — локализованный или генерализованный — разлитой. При обследовании отмечаются отек, гиперемия, цианоз десны, утолщение ее, ограниченные очаги десквамации, единичные эрозии, преимущественно в области вершин межзубных сосочков; механическое раздражение сопровождается кровотечением. Вследствие отека десны иногда можно предположить наличие пародонтальных карманов, однако их нет, так как сохраняется целостность зубодесневого соединения. На зубах — повышенное содержание мягкого зубного налета (больные избегают чистить зубы вследствие болезненности и кровоточивости десен), иногда налет окрашивается пигментами крови или красящими веществами пищи, табачного дыма. Нередко наблюдается наличие твердого окрашенного (зеленого) налета на зубах в пришеечной области. Увеличивается количество десневой жидкости, определяются также положительная проба Шиллера-Писарева, повышенная эмиграция лейкоцитов по Ясиновскому; пониженная стойкость капилляров при вакуумной пробе по Кулаженко и др. Напряжение кислорода в десне (полярографический метод) понижено, при обострении воспалительного процесса — повышено. Общее состояние больных, как правило, не нарушено, изменения в периферической крови не выявляются. При длительном течении могут наблюдаться остеопороз в межальвеолярных перегородках и расширение периодонтальной щели.
Гипертрофический гингивит Гипертрофический гингивит — это хронический воспалительный процесс десны, сопровождающийся пролиферативными явлениями. В клиническом течении возможны обострения, ремиссии. Характер жалоб определяется степенью выраженности заболевания (легкая, средняя, тяжелая). При отечной форме больные жалуются на разрастание десны, зуд, кровоточивость и боли, усиливающиеся во время приема пищи и значительно нарушающие акт жевания, неприятный запах изо рта. Вследствие значительного разрастания десны определяются ложные десневые карманы, часто из них выделяется воспалительная жидкость, но зубодесневое соединение не нарушено. В пришеечной области зубов, в участках увеличения десен обнаруживается большое количество мягкого или пигментированного налета, прочно связанного с твердыми тканями зуба. Вершины гипертрофированных (увеличенных) десневых сосочков иногда некротизируются. Фиброзная форма гипертрофического гингивита протекает доброкачественно. Больные не предъявляют жалоб (при легкой степени) или жалуются на необычный вид и форму десны (при средней и тяжелой степени). При легкой степени гипертрофического гингивита десневые сосочки нормального цвета или бледнее здоровых участков десны, плотно прилежат к зубу, хотя деформированы и увеличены в размере, не кровоточат, так как ложные карманы неглубокие, выделений из них нет. Для средней и тяжелой степени (особенно если процесс генерализованный) характерны значительные разрастания десен, одинаково выраженные как с вестибулярной, так и с язычной поверхностей зубов.
Язвенный гингивит Для данной формы воспалительного процесса десны характерны некроз и изъязвление, развивающиеся при снижении реактивности организма как гиперергическая реакция на сенсибилизацию тканей фузоспириллярным симбиозом. Наличие язвенного гингивита свидетельствует о серьезных нарушениях реактивности организма вследствие общих заболеваний или снижении устойчивости тканей десны. Клинически различают острое и хроническое течение, а по степени тяжести — легкую, среднюю и тяжелую. При остром язвенном гингивите больные жалуются на недомогание, головную боль, потерю аппетита, повышение температуры тела, снижение работоспособности, гнилостный запах изо рта, боли в деснах, кровоточивость, затруднение приема пищи, иногда боль при глотании, тризм и др. При общем осмотре эти лица производят впечатление тяжелобольных, они малоподвижны, вследствие затрудненного глотания наблюдается слюнотечение, особенно у детей; резко выраженный запах изо рта со сладковатым привкусом. Характерны системность поражения десневого края, иногда ангина, поражения слизистой оболочки щек, губ, языка, увеличение и болезненность регионарных лимфатических узлов, в крови — повышение уровня лейкоцитов, увеличение СОЭ и др. Тяжесть язвенного гингивита определяется не только распространенностью воспалительного процесса, но и выраженностью явлений интоксикации организма. При легкой степени локализованного процесса выраженные общие нарушения организма отсутствуют. Выявляются только некротизированные десневые сосочки и часть краевой десны, между здоровой и пораженной деснами определяется четкая демаркационная линия, некротизированная часть маркая, бесструктурная, после удаления ее инструментом обнажается кровоточащая поверхность. При поражении средней тяжести в патологический процесс вовлекаются не только межзубной сосочек и краевая десна, но и часть альвеолярной десны. Усугубляются все симптомы, ухудшается общее состояние больного. Наиболее выражены все симптомы заболевания при генерализованном процессе, особенно тяжелой степени: больной вялый, потливый, цвет лица приобретает землистый оттенок, усиливаются боли даже вне приема пищи. Увеличены и болезненны регионарные лимфатические узлы, повышена температура тела до 38–39 °C и др. Слизистая оболочка резко отечна, гиперемирована, межзубные сосочки некротизированы на всем протяжении верхней и нижней челюстей. Сохранившаяся десна покрыта грязносерым фибриновым налетом, после снятия которого обнажается язвенная кровоточащая поверхность. После отторжения некротизированных участков нередко обнажаются шейки зубов. Язык обложенный вследствие нарушения процессов самоочищения, наблюдается мягкий налет на зубах, иногда с одновременным наличием зубных отложений. Хронический язвенный гингивит чаще развивается как исход острого процесса и характеризуется вялым течением. Больные жалуются на постоянную кровоточивость, незначительную болезненность десен и непрятный запах изо рта. Десна застойно гиперемирована, отечна, изъязвленный край валикообразно утолщен. Нередко в результате некроза десневых сосочков утрачивается фестончатость десневого края, межзубные промежутки открыты, зияют. Протекает хронический язвенный гингивит, как правило, в легкой форме, реже — средней тяжести.
Десквамативный гингивит Заболевание впервые описано в 1932 г. Встречается чаще у взрослых. У подростков десквамативный гингивит наблюдают в период полового созревания. Заболевание характеризуется повышенной десквамацией (слущиванием) эпителия, вследствие чего отдельные участки десен приобретают яркокрасный (полированный) вид. Нередко отторжение десквамированных клеток эпителия задерживается, тогда на фоне измененной десны образуются пленки белесоватого цвета, которые снимаются с трудом, при этом обнажается тусклая, кровоточащая эрозивная поверхность. Иногда такие эрозии появляются на неизмененной слизистой оболочке. В подобных случаях десна имеет «пестрый» вид. Поражение десен при десквамативном гингивите бывает ограниченным и диффузным. В зависимости от клинической картины описаны эритематозная, эрозивная и буллезная формы. При эритематозной форме больные жалуются на изменение внешнего вида десен, боль, жжение от химических, физических раздражителей (прием острой, горячей, пряной пищи и др.). При объективном обследовании обнаруживают зоны повышенной десквамации эпителия в области краевой и прикрепленной частей десны. По мере развития заболевания отдельные очаги поражения сливаются, образуя полосы неравномерной ширины у края десны и неправильной формы десквамированные поверхности. Десна приобретает ярко-красную окраску. В отдельных случаях сохраняется целостность эпителиального слоя. При эрозивной форме жалобы больных варьируют от незначительных болевых ощущений в результате действия механических, химических, физических факторов до появления постоянной боли, жжения в области очагов поражения. При объективном исследовании обнаруживают чаще множественные эрозии по краю десны, у вершин десневых сосочков. Вначале очаги поражения отличаются от здоровых цветом, потерей блеска. Пораженная десна становится тусклой, мутной, постепенно приобретает белесоватый вид, затем четко отграничивается от здоровой ткани. После снятия таких пленок, представляющих собой некрозированный эпителий, обнажается эрозивная поверхность, гладкая, блестящая, кровоточащая при механическом раздражении. При буллезной форме больные жалуются на появление пузырей на десне и образование эрозий, болезненных при еде, разговоре, Эта форма гингивита встречается редко. Часто эту форму рассматривают как предвестник развития обыкновенной (вульгарной) пузырчатки.
Атрофический гингивит Заболевание характеризуется атрофией десневых сосочков, десневого края при слабо выраженном хроническом воспалении. Атрофия десневых сосочков наблюдается у пожилых людей. Атрофический гингивит является одним из симптомов пародонтоза. Различают ограниченную атрофию десны и диффузный атрофический гингивит. Ограниченная атрофия десны возникает в области одного зуба, нередко симметрично, чаще в области клыков, премоляров. Вследствие атрофии исчезает десневой край, постепенно оголяются шейка и корень зуба. Иногда атрофический процесс приводит к образованию V-образного дефекта. Окружающая дефект десна утолщена в виде валика, нередко имеет признаки хронического катарального воспаления. Вследствие обнажения шейки и корня зуба иногда повышена чувствительность к механическим, химическим, температурным раздражителям. Значительно реже встречается диффузный атрофический гингивит (воспаление десен), при котором отмечают ретракцию (размягчение) десен, чаще с вестибулярной (слуховой) поверхности челюсти. Постепенно обнажаются шейки зубов. Десна теряет присущую ей фестончатость, межзубные промежутки зияют. Заболевание протекает субъективно бессимптомно, лишь при обнажении шеек зубов могут появиться признаки гиперестезии.
Диагностика Диагноз устанавливается на основании вышеописанных объективных данных. Воспалительные изменения оцениваются по следующим признакам: гиперемия, отечность, кровоточивость, изъязвление, гипертрофия, локализованный или генерализованный характер поражения, острое или хроническое течение.
Лечение Лечение гингивита предусматривает устранение причинного фактора, противовоспалительную терапию и комплекс реабилитационных мероприятий. Лечение оказывается более рациональным, если в одно посещение больного проводится максимальный объем манипуляций и при этом используются различные комбинации методов и средств. При остром катаральном гингивите для местной терапии после обезболивания и снятия зубных отложений используют противовоспалительные средства в виде орошений, полосканий, ванночек, нанесений лечебных повязок. В домашних условиях рекомендуют содовые полоскания, прием витаминов С, Р, А. С целью повышения защитных свойств слизистой оболочки назначают полоскания искусственным лизоцимом (1 л воды + 1 ч. л. соли + 1 белок куриного яйца) 5–6 раз в день в течение 2–3 дней, аэрозоли, нанесение противовоспалительных и кератопластических мазей (солкосерил, метилурацил, пропоцеум и др.). Лечение хронического катарального гингивита начинают со снятия зубных отложений. В процессе их удаления полость рта периодически орошают антисептическими препаратами. При необходимости проводят лечение зубов, избирательное пришлифовывание зубов, наложение лечебных повязок, физиотерапевтические процедуры. Местная терапия отечной формы гипертрофического гингивита после устранения раздражающих причинных факторов предусматривает использование противовоспалительных и противоотечных препаратов: официнальный раствор гепарина или гепариновая мазь, 10 %-ный раствор хлорида кальция, гидрокортизон, галаскорбин, сок каланхоэ, подорожника, отвар дубовой коры и др. Эти же препараты можно вводить с помощью ультразвука. Склерозирующая терапия применяется только при упорном течении. При фиброзной форме гингивита используют различные виды склерозирующего воздействия или иссечение гипертрофированных участков десны. Эффективны криодеструкция, диатермокоагуляция. После лечения применяют лечебные повязки с гепариновой мазью, гидрокортизоном и другими препаратами. При склерозирующей терапии (после обезболивания) в каждый разросшийся десневой сосочек вводят 0,1–0,2 мл 40 %-ного раствора глюкозы, 25 %-ного раствора сульфата магния, 10 %-ного раствора хлорида кальция или 70 %-ного этилового спирта 3–4 раза с перерывом в 1–2 дня. Склерозирующим свойством обладают также «Мараславин» и «Полиминерол», которые применяют в виде аппликаций. Для лечения язвенного гингивита оптимальными являются комбинации обезболивающих, противовоспалительных, некрозирующих и кератопластических препаратов. Важным является удаление зубных отложений. Их необходимо удалять поочередно: в первый сеанс наддесневой зубной камень, затем поддесневой. Эти операции надо проводить максимально атравматично, исключая возможное распространение инфекции в глубь пародонта. Для успеха лечения существенное значение имеет удаление некротического распада десны и десневых сосочков. Оно проводится механическими инструментами до обнажения раневой поверхности. Последнюю обрабатывают растворами трипсина, химотрипсина. Успешно применяются, кроме общепринятых антисептиков, ферменты, димексид, хлоргексидин, трихопол, стероидные и кератопластические препараты. В ряду лечебно-профилактичеких мероприятий при заболеваниях пародонта большое значение имеют физиотерапевтические процедуры. Они показаны почти при всех формах и стадиях заболевания и широко применяются на различных этапах диагностики с целью воздействия на отдельные патогенетические звенья процесса и для симптоматического лечения (электрофорез 10 %-ного раствора кальция хлорида попеременно с анода и катода, диадинамические токи, флюктуаризация, дарсонвализация, ультразвуковая терапия, светолечение и др.).
Профилактика Согласно рекомендациям ВОЗ (1980 г.) мероприятия профилактики принято подразделять на первичные, вторичные и третичные. Методы первичной профилактики включают мероприятия, направленные на устранение факторов, вызывающих заболевания зубов и пародонта или способствующих им. Первичная профилактика предусматривает профилактику общих заболеваний, устранение вредных привычек, рациональное питание, воспитание гигиенических навыков, регулярное посещение стоматолога для контроля гигиенического состояния полости рта. Вторичная профилактика представляет собой комплекс методов диагностики и устранения кариеса и его осложнений, заболеваний пародонта, зубочелюстных аномалий и деформаций. Третичная профилактика в стоматологии — это восстановление утраченной функции зубочелюстной системы в результате потери зубов или заболевания. Индивидуальная профилактика связана с непосредственным участием стоматолога: это устранение травматических факторов в полости рта, диспансеризация лиц с факторами риска, санитарно-просветительная работа. Не менее важным в индивидуальной профилактике является строгое соблюдение правил личной гигиены полости рта, применение индивидуально подобранных по рекомендации врача зубных щеток, аутомассаж, гидромассаж десен.
ГИНЕКОМАСТИЯ
ОпределениеГинекомастия — увеличение молочной железы у мужчин с гипертрофией желез и жировой ткани. В период полового созревания часто возникает болезненное уплотнение молочных желез, которое затем самопроизвольно исчезает.
Этиология Причиной гинекомастии могут быть различные эндокринопатии: синдром Клайнфельтера (см.), тестикулярная феминизация (см.), синдром Райфенштейна (см.), кастрация (см.) и гипотиреоз (см.), опухоли яичек (см.) (появление клеток Лейдига), хориокарцинома (см.), опухоли гипофиза (см.) и надпочечников (см.). Гинекомастия может быть опухолевым синдромом при раке бронха (см.). Она возникает также при циррозе печени (см.), дистрофии от голодания, лепре (см.). Ряд лекарственных препаратов при длительном применении может привести к гинекомастии: спиронолактон, дигиталис, метилдопа, резерпин, мепробамат, фенотиазин, марихуана, гормонотерапия эстрогенами, тестостероном или гонадотропином.
Клиническая картина Отмечаются чувство тяжести, распирания и неприятные ощущения в области молочной железы. При прощупывании определяется плотноэластическое подвижное образование с четкими контурами, безболезненное. Регионарные лимфатические узлы не увеличены.
Диагностика, дифдиагностика и лечение Для исключения рака молочной железы (см.) производят пункцию образования с последующим исследованием клеточного состава. Для диагностики важно найти причину заболевания (медикаментозный опрос, исследование яичек). По показаниям проводят также рентгенологическое исследование черепа, грудной клетки, исследование гормонального профиля (эстрогены, тестостерон, пролактин, гормоны надпочечников), исследуют функции печени. Лечение оперативное: удаление молочной железы. Гинекомастия у новорожденных и в периоде полового созревания оперативного лечения не требует.
ГИПЕРВИТАМИНОЗ D
ОпределениеГипервитаминоз D — состояние, возникающее при передозировке витамина D или повышенной индивидуальной чувствительности к нему с развитием симптомокомплекса D-витаминной интоксикации.
Этиология Причиной гипервитаминоза D является применение больших доз витамина D для лечения или профилактики; обычно суммарная доза выше 1 млн ME. Иногда гипервитаминоз вызывают и небольшие дозы (4–8 тыс. ME), что объясняют повышенной чувствительностью к витамину D.
Патогенез Основным является токсическое действие витамина D на клеточные мембраны, нарушение обмена веществ с развитием гиперкальциемии и гиперкальциурии, гиперфосфатурии, ацидоза, кальциноза тканей и внутренних органов.
Клиническая картина Основными симптомами являются: отсутствие аппетита, рвота, сочетающаяся с запорами, задержка физического развития, жажда, увеличение объема мочевыделения. Ребенок возбужден, затем становится вялым, могут наблюдаться судороги, повышение артериального давления, замедление пульса. Ведущими биохимическими признаками являются гиперкальциемия, гиперкальциурия. Моча содержит белок, цилиндры.
Диагностика и дифдиагностика Диагноз основывается на данных опроса, клинических симптомах, положительной пробе Сулковича, выявлении гиперкальциемии и гиперкальциурии, снижении активности щелочной фосфатазы. Дифференциальный диагноз необходимо проводить с гиперпаратиреозом, идиопатическим кальцинозом.
Лечение Прекращение приема витамина D приводит к улучшению состояния. В тяжелых случаях, особенно у детей первых месяцев жизни, показаны внутривенное введение изотонического раствора хлорида натрия и глюкозы, сердечные средства, аскорбиновая кислота, витамины А, В, преднизолон 1 мг/кг 5–7 дней. Прогноз зависит от степени поражения внутренних органов.
Профилактика В каждом случае лечения рахита витамином D целесообразно контролировать выведение кальция с мочой с помощью пробы Сулковича (реактив Сулковича — 2,5 г щавелевой кислоты, 2,5 г сульфата аммония и 5 мл ледяной уксусной кислоты растворяют в дистиллированной воде и объем доводят до 150 мл; к 10 каплям мочи прибавляют 10 капель реактива Сулковича; при гиперкальциурии появляется значительное помутнение). Избегать назначения витамина В ударными дозами.
ГИПЕРГИДРОЗ
ОпределениеГипергидроз — повышенное потоотделение.
Этиология Различают общий и локализованный гипергидроз. Общий гипергидроз наблюдается при воздействии высокой температуры окружающей среды, физических и эмоциональных напряжениях (физиологический гипергидроз), а также при ряде болезней (туберкулез (см.), поражения нервной системы). Наиболее частые формы локализованного гипергидроза — ладонно-подошвенный гипергидроз и гипергидроз крупных складок. Нередко эти формы являются проявлением вегетососудистой дистонии (см.), а также результатом несоблюдения личной гигиены, плоскостопия (см.), использования тесной, резиновой обуви, одежды из синтетических тканей и т. д. Гипергидроз создает условия для развития грибковой и гноеродной флоры в результате мацерации (поражения) кожи и изменения ее кислотности.
Клиническая картина Гипергидроз может сопровождаться неприятным зловонным запахом, пот часто обладает окрашивающими свойствами, доставляя больному неприятные ощущения. Диагноз устанавливается на основании жалоб и данных объективного осмотра.
Лечение Выявление и устранение факторов, способствующих развитию гипергидроза. Назначают седативные средства, наружно используют общие теплые ванны с травами (шалфей, череда, ромашка); для ладоней и подошв — поочередно горячие и холодные ванночки с отварами буквицы лекарственной, листьев грецкого ореха, шалфея, дубовой коры. В носки полезно засыпать пудру следующего состава: тальк — 50 г, окись цинка — 25 г, жженые квасцы — 2 г, лимонная эссенция — 25 г. Кожу рук и стоп протирают 1—10 %-ным спиртовым раствором формалина, используют для ног присыпки с уротропином. Необходимо тщательное соблюдение правил личной гигиены, соблюдение питьевого режима.
ГИПЕРИНСУЛИНИЗМ
ОпределениеГиперинсулинизм — патологическое состояние организма, связанное с избытком инсулина и приводящее к значительному снижению содержания сахара в крови.
Этиология и патогенез Избыток инсулина может быть абсолютным, связанным с патологией клеток поджелудочной железы, вырабатывающих инсулин, а также относительным, т. е. независимым от подобной патологии. Последний обычно является следствием повышения чувствительности организма к выделяемому в обычных количествах инсулину бета-клеток панкреатических островков. Гиперинсулинизм может быстро приводить к гипогликемическому состоянию, что в первую очередь сказывается на функции головного мозга. По классификации Э. Г. Вейнсберга все гипогликемии подразделяются следующим образом. I. Панкреатические гипогликемии, которые вызываются чаще всего гиперинсулинизмом, обусловленным аденомой (инсулиномой), чаще доброкачественной, реже — злокачественной и совсем редко — диффузной аденоматозной гиперплазией бета-клеток панкреатических островков. II. Внепанкретические гипогликемии, развивающиеся вследствие заболеваний печени, желчных путей, эндокринной системы, нарушения обмена веществ, расстройств центральной и вегетативной нервной системы.
Клиническая картина Клинические симптомы обусловлены гипогликемическим состоянием. Гипогликемическая болезнь (инсулинома) характеризуется триадой Уиппла: возникновением приступов спонтанной гипогликемии натощак, после мышечной работы или через 2–3 ч после еды; падением содержания сахара в крови во время приступа ниже 1,7–1,9 ммоль/л; прекращением (купированием) приступа введением глюкозы или сахара. Приступы гипогликемии возникают обычно внезапно. Они проявляются резкой слабостью, сердцебиением, головной болью, потливостью, чувством сильного голода, иногда возбуждением. В более тяжелых случаях возбуждение может сменяться потерей сознания с развитием комы. При хронической гипогликемии отмечаются апатия, снижение умственных способностей, слабость, импотенция. Осложнением гипогликемических состояний является развитие комы (в тяжелых случаях).
Диагностика и дифдиагностика Для диагностики гиперинсулинизма определяют содержание сахара в крови натощак, во время приступа, исследуют уровень сахара в течение суток; проводят пробы с голоданием, белковой диетой. Для определения местонахождения инсулиномы используют висцеральную артериографию и компьютерную томографию. Инсулиномы отличают от внепанкреатических гипогликемий на основании характерной клинической картины, данных анамнеза, лабораторных проб, неуклонного прогрессирования заболевания. Внепанкреатические гипогликемии характеризуются более легким течением, во время приступов сознание обычно сохраняется, приступы короткие, прекращаются обычно самостоятельно, неврологическая симптоматика отсутствует.
Лечение Лечение гиперинсулинизма оперативное. При внепанкреатических гипогликемиях лечению подлежит в первую очередь основное заболевание. Рекомендуется частое, дробное, богатое углеводами питание (не менее 5–6 раз в день). Во время приступов гипогликемии углеводы можно давать внутрь или при необходимости вводить их внутривенно (40—100 мл 40 %-ного раствора глюкозы).
ГИПЕРКЕРАТОЗ ПРЕДРАКОВЫЙ ОГРАНИЧЕННЫЙ
ОпределениеГиперкератоз предраковый ограниченный — состояние, предшествующее раку красной каймы губ.
Этиология Неблагоприятные факторы окружающей среды, снижение общей устойчивости организма.
Клиническая картина и лечение Проявляется в виде ограниченного участка ороговения, покрытого тонкими и плотно сидящими чешуйками. Очаг поражения не возвышается над уровнем эпителия, безболезненный. Лечение сводится к хирургическому вмешательству или криогенному воздействию.
ГИПЕРСЕКСУАЛЬНОСТЬ
ОпределениеГиперсексуальность — повышенная половая возбудимость.
Этиология и патогенез Гиперсексуальность в умеренной степени свойственна определенным возрастным периодам (пубертатная гиперсексуальность, парадоксальная гиперсексуальность в начальной фазе климакса); гиперсексуальность наблюдается при неврологических очагах диэнцефальной локализации, некоторых эндокринных синдромах, психических заболеваниях (маниакальная фаза маниакально-депрессивного психоза, шизофрения и др.). Некоторые разновидности гиперсексуальности (нимфомания у женщин и сатириаз у мужчин) нередко обусловлены эндогенным психическим заболеванием: повышение полового влечения определяется несоответствием между биологическим и психическим компонентами либидо за счет гипертрофии последнего; возбуждение при этом субъективное, не сопровождается специфическими реакциями половых органов, наступление оргазма затруднено.
Клиническая картина Свойственная периоду юношеской гиперсексуальности чрезмерная фиксация психики на сексуально-эротических впечатлениях и фантазиях, сопровождаемых спонтанными эрекциями и частыми поллюциями, порождая некоторую невротизацию, в то же время способствует формированию условно-рефлекторных комплексов половой сферы, обеспечивающих нормальное протекание половых функций в период зрелости. Наблюдающаяся при этой форме мастурбация имеет четкую суррогатно-защитную направленность на избавление от избыточного полового возбуждения. В противоположность этому нимфомания и сатириаз часто сопровождаются психотическими проявлениями, а мастурбация носит навязчивый характер.
Лечение Гиперсексуальность в период полового созревания требует психогигиенических рекомендаций (организация режима, интенсивность трудовых и спортивных нагрузок, коррекция направленности интересов), в некоторых случаях — применения медикаментозных и физиотерапевтических воздействий для снятия общей невротической симптоматики; при климактерических формах могут потребоваться медикаментозные (в том числе гормональные) средства. Диэнцефальные и психотические формы (в том числе сатириазис и нимфомания) требуют установления характера основного заболевания и лечения в соответствующем стационаре.
ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ
ОпределениеГипертоническая болезнь — это хронически протекающее заболевание, основным проявлением которого является синдром артериальной гипертензии, не связанный с наличием патологических процессов, при которых повышение артериального давления обусловлено известными причинами (симптоматические артериальные гипертензии).Термин «гипертоническая болезнь», предложенный Г. Ф. Лангом, соответствует употребляемому в других странах понятию «эссенциальная артериальная гипертензия».
Этиология и патогенез Согласно неврогенной теории гипертонической болезни, выдвинутой Г. Ф. Лангом в 1948 г. и получившей дальнейшее развитие в трудах А. Л. Мясникова, главным фактором возникновения является нервно-психическое перенапряжение, возникающее как после острых, так и после длительных эмоциональных перегрузок, особенно если это сочетается с малоподвижным образом жизни. Другим важным причинным фактором является возрастная перестройка структур мозга, так как хорошо известно, что у многих женщин гипертоническая болезнь возникает в климактерический период. Несомненно, что большое значение как фактор, предрасполагающий к развитию гипертонической болезни, имеет наследственность. При развитии гипертонической болезни можно выделить три звена: центральное — нарушение соотношения процессов возбуждения и торможения центральной нервной системы; повышенная продукция прессорных веществ (норадреналин, альдостерон, ренин, ангиотензин) и уменьшение депрессорных влияний; тоническое сокращение артерий с наклонностью к спазму и ишемии органов. Следовательно, перенапряжение в коре головного мозга и особенно в подкорковых центрах реализуется через нейроэндокринную систему и проявляется повышением артериального давления.
Патанатомия Патологоанатомическая картина определяется стадиями гипертонической болезни и характером ее течения и осложнений. Основным анатомическим признаком гипертонической болезни являются гипертрофия миокарда левого желудочка и увеличение мышечной массы преимущественно мелких артерий с внешним диаметром 100 мкм и меньше. В основном отмечают три вида изменений артерий: артериальный гиалиноз, артериосклероз, фибриноидный некроз. Основным поражением артерий эластического типа является атеросклероз. При макроскопическом исследовании почки плотные, уменьшены в размере, составляют до 0,25 % своей нормальной массы, имеют зернистую поверхность. При микроскопическом исследовании обнаруживают склеротические изменения артериол почек, сердца, мозга.
Схематическое изображение патологических процессов в почках, мочевых путях и в надпочечниках, приводящих к артериальной гипертензии
Клиническая картина Ранним и постоянным признаком гипертонической болезни служит повышение артериального давления. В I стадии гипертонической болезни у всех больных отмечается только периодическое повышение артериального давления, а во II стадии показатели артериального давления и их стабильность чрезвычайно изменчивы. Некоторые клиницисты выделяют в этой группе изменчивое (лабильное) и неизменчивое (стабильное) течение гипертонической болезни. При первом варианте артериальное давление может колебаться в течение суток от высоких цифр до нормального уровня. Субъективно это проявляется многочисленными жалобами, имеющими эмоциональную окраску. У больных со стабильным течением заболевания уровень артериального давления остается высоким, мало колеблется в течение суток. В большинстве своем они хорошо его переносят, не предъявляют подчас никаких жалоб. В ряде случаев только при диспансерном наблюдении выявляются высокие цифры артериального давления, что указывает на необходимость проведения более интенсивной терапии. Степень повышения артериального давления, особенно диастолического, в известной мере соответствует тяжести заболевания. Высокий постоянный уровень артериального давления обычно сочетается с органическими изменениями в сосудистой системе, особенно в почках. Кратковременные высокие подъемы давления —кризы — наблюдаются во всех стадиях заболевания и в большинстве случаев протекают благоприятно, однако иногда они (когда гипертоническая болезнь сочетается с атеросклерозом) могут окончиться тяжелыми осложнениями со стороны сосудов мозга (инсульт) и коронарной системы (инфаркт миокарда). В момент обострения болезни больные жалуются на головные боли, которые часто носят характер мигрени, развиваются в виде приступа, продолжаются в течение многих часов и могут заканчиваться рвотой. Изредка наблюдаются головные боли в виде тяжелых кризов с затемнением сознания. Частыми при гипертонической болезни являются головокружения и шум в ушах, мелькание темных мушек или блесток в глазах, наклонность к сердцебиению, быстрая утомляемость, физическая слабость. При гипертонической болезни отмечается увеличение левого желудочка вследствие его гипертрофии. В результате верхушечный толчок смещается влево, а в поздних стадиях и вниз. При его выслушивании в начале заболевания отклонений от нормы не выявляется, только при стабилизации гипертонии определяется высокий акцент сердечного тона над аортой. Появление ритма галопа может свидетельствовать о наличии у больных тяжелого дистрофического поражения миокарда. Иногда над верхушкой прослушивается систолический шум (т. е. шум, выслушиваемый во время сокращения желудочков сердца), что указывает на относительную недостаточность митрального клапана. При рентгенологическом исследовании сердца и крупных сосудов в I стадии гипертонической болезни не определяется отчетливых изменений. В поздних стадиях выявляются характерные изменения конфигурации сердца, типичные для гипертрофии левого желудочка. Верхушка сердца закругляется, отделяясь больше обычного от купола диафрагмы, сокращения сердца становятся более мощными. Аорта несколько расширена, удлинена, изогнута, а восходящая ее часть больше выступает вправо, дуга поднимается кверху и сдвигается несколько влево. Увеличивается аортальное окно, рентгенологически часто обнаруживаются признаки атеросклероза аорты. По данным эхокардиографии при гиперкинетическом типе нарушения кровообращения в организме у больных с гипертонической болезнью отмечаются увеличение скорости сокращения стенок левого желудочка, увеличение ударного объема, высокая сократимость миокарда при нормальных размерах полостей сердца и нормальной толщине стенок. Прогрессирование процесса и появление стойкой гипертонии сопровождаются развитием гипертрофии миокарда, в дальнейшем — расширением левого желудочка, а затем снижением его сократимости.
Гипертрофия левого желудочка сердца на поперечном разрезе
Одним из объективных признаков, указывающих на изменение сосудов при гипертонической болезни, является динамика сосудов глазного дна. В ранних стадиях обнаруживаются лишь сосудистые изменения: сужение и извилистость артерий сетчатки, расширение вен. Одним из проявлений гипертонического поражения глазного дна служат кровоизлияния. Позже возникают дегенеративные очаги в сетчатке в области соска зрительного нерва в виде белых пятен, а иногда развиваются отслойка сетчатки и атрофия зрительного нерва с потерей зрения.
Отслойка сетчатки глаза и кровоизлияние при гипертонической болезни
Поражение центральной нервной системы при гипертонической болезни проявляется разнообразными симптомами в зависимости от стадии болезни и степени поражения мозговых сосудов атеросклерозом. Упорные головные боли и плохой сон свойственны большинству больных уже в более раннем периоде. Нарушения мозгового кровообращения возникают или в период гипертонических кризов, или в поздних стадиях болезни. Они проявляются малыми и большими инсультами с расстройствами двигательной и чувствительной функции определенных органов (обычно конечностей), нарушением речи, потерей сознания, мозговой рвотой и другими симптомами. Изменения функции почек в начале болезни отсутствуют, отмечается только некоторое уменьшение почечного кровотока. Периодически в моче могут появляться единичные эритроциты и немного белка в результате некоторого нарушения проницаемости почечных сосудов. В позднем периоде в связи с развитием почечного артериосклероза возникают уже заметные симптомы поражения почек: появление в моче крови, белков, снижение концентрационной способности почек, которые могут привести к азотемии. В Российской Федерации по-прежнему актуально, особенно при формулировке диагностического заключения, использование трехстадийной классификации болезни (ВОЗ, 1993 г.). Гипертоническая болезнь I стадии предполагает отсутствие изменений в органах-мишенях, выявляемых при вышеперечисленных методах обследования. Гипертоническая болезнь II стадии предполагает наличие одного или нескольких изменений со стороны органов-мишеней (табл. 1). Гипертоническая болезнь III стадии устанавливается при наличии одного или нескольких ассоциированных (сопутствующих) состояний (табл. 1).
В современную классификацию введено разделение больных в зависимости от степени риска. Чтобы оценить суммарное влияние нескольких факторов риска относительно абсолютного риска тяжелых сердечно-сосудистых поражений, экспертами ВОЗ предложено разделение риска по четырем категориям (низкий, средний, высокий и очень высокий — табл. 1, 2). Риск в каждой категории рассчитывают исходя из данных об усредненном за 10 лет риске смерти от сердечно-сосудистых заболеваний, а также риске инсульта и инфаркта миокарда.
Лечение Основной целью лечения является достижение максимальной степени снижения общего риска сердечно-сосудистой заболеваемости и смертности. Терапия должна включать мероприятия по изменению образа жизни: отказ от курения, снижение и нормализация массы тела, снижение потребления алкогольных напитков, увеличение физических нагрузок (по 30–40 мин не менее 4 раз в неделю), снижение потребления поваренной соли до 5 г в сутки, комплексное изменение режима питания (увеличение употребления растительной пищи, уменьшение употребления насыщенных жиров, увеличение в рационе калия, кальция, содержащихся в овощах, фруктах и зерновых, и магния, содержащегося в молочных продуктах). В лечении гипертонической болезни сегодня применяют препараты следующих групп: — диуретики; — бета-блокаторы; — ингибиторы АПФ; — антагонисты кальция; — альфа-адреноблокаторы; — антагонисты рецепторов к ангиотензину II; — агонисты имидазолиновых рецепторов. В случае неосложненной гипертонической болезни предпочтение следует отдавать диуретикам и адреноблокаторам (при наличии показаний в качестве первой линии препаратов из всех основных современных классов антигипертензивных препаратов). На выбор препарата оказывают влияние многие факторы, среди которых наиболее важными являются следующие: — наличие фактора риска у данного больного; — наличие поражений органов-мишеней, клинических проявлений сердечно-сосудистых заболеваний, болезней почек и сахарного диабета; — наличие сопутствующих заболеваний, которые могут способствовать или ограничивать использование антигипертензивного препарата того или иного класса; — индивидуальные реакции больных на препараты различных классов; — вероятность взаимодействия с препаратами, которые пациент принимает по другим поводам; — социально-экономический фактор, включая стоимость лечения. Для выбора стартовой терапии, для достижения целевого уровня артериального давления определяется степень сердечно-сосудистого риска. При высоком артериальном давлении, артериальной гипертонии I степени начинают с низкодозовой монотерапии. В случае, если целевое артериальное давление не достигнуто, увеличивают дозу назначенного препарата или переходят к другому препарату в низкой дозе. При отсутствии эффекта начинается комбинация 2–3 препаратов в полной дозе. При артериальной гипертонии II–III степени при высоком риске назначается комбинация 2 препаратов в низкой дозе. Если целевое артериальное давление не достигнуто, назначается эта же комбинация препаратов в полной дозе или комбинация из трех препаратов в низкой дозе. В случае отсутствия эффекта эти 3 препарата назначаются в полной дозе.
ГИПЕРТОНИЧЕСКИЕ КРИЗЫ
ОпределениеГипертонический криз — это кратковременное резкое повышение артериального давления при гипертонической болезни с появлением ряда общих нарушений.Гипертонический криз представляет собой резкое обострение гипертонической болезни в течение короткого периода времени.
Этиология и патогенез При гипертонической болезни причины и механизмы гипертонического криза обусловлены теми же факторами, которые имеют отношение к возникновению и механизму развития заболевания. Спровоцировать криз могут как экзогенные, так и эндогенные факторы. Среди экзогенных ведущее место занимают психоэмоциональные стрессы, метеорологические влияния, избыточное потребление соли и воды, алкоголя и др. Из эндогенных причин большую роль играют: увеличение выделения ренина, связанное с преходящим ухудшением почечного кровообращения; временами усиливающиеся процессы вторичного гиперальдостеронизма с задержкой натрия и воды, особенно в момент гормональной перестройки у женщин; гиперсекреция антидиуретического гормона; острая гипоксия (кислородная недостаточность) мозга; рефлекторные влияния со стороны внутренних органов, а также повышение чувствительности со стороны альфа-адренорецепторов артериол к катехоламинам при длительном лечении симпатолитиками (допегит) и синдром отмены гипотензивных препаратов (клофелин, бета-блокаторы и др.). Во многих случаях эти причины и механизмы комбинируются. Достаточно часто и закономерно гипертонический криз развивается у больных гипертонической болезнью с неконтролируемой или неадекватно корректируемой артериальной гипертензией. Об истинном гипертоническом кризе можно говорить только в том случае, если у пациента внезапно отмечается значительное для него повышение артериального давления и оно сопровождается появлением или углублением уже имеющейся симптоматики кардиального, церебрального или вегетативного характера. Принято различать: — гипертонические кризы первого типа. Они связаны с выбросом в кровь адреналина и характерны для ранних стадий болезни; — гипертонические кризы второго типа. В развитии этого вида кризов лежит гиперпродукция норадреналина, поэтому они называются «норадреналовые». Иногда не представляется возможным установить тот или иной тип криза. В этом случае допустимо говорить о третьем типе криза — смешанном, когда присутствуют элементы обоих типов, но в разных соотношениях. Такая картина указывает на прогрессирование гипертонической болезни, когда наряду с признаками криза первого типа проявляются симптомы второго типа. Кроме описанного выше деления гипертонических кризов, различают кризы по гемодинамическому признаку. 1. Гиперкинетический тип криза: высокий сердечный выброс при нормальном или сниженном общем периферическом сопротивлении сосудов. Чаще регистрируется на ранней стадии гипертонической болезни, когда сократительная способность миокарда не снижена. 2. Эукинетический тип криза: уровень сердечного выброса аналогичен таковому при гиперкинетическом типе. Высокое артериальное давление в этих случаях обусловлено умеренным повышением общего периферического сопротивления сосудов. 3. Гипокинетический тип криза: низкий сердечный выброс при еще большем, чем при эукинетическом, общем периферическом сопротивлении сосудов. Этот тип криза чаще встречается у больных с поздними стадиями гипертонической болезни, страдающих коронарным атеросклерозом. Одной из наиболее современных классификаций гипертонических кризов является предложенная профессором В. П. Жмуркиным (1992 г.). Автор дифференцирует пять их вариантов, из них наиболее часто встречаются три: — гипертензивный кардиальный криз; — церебральный ангиогипотонический криз; — церебральный ишемический криз. К более редким относятся: — церебральный сложный криз; — генерализованный сосудистый криз. 1. Гипертонический кардиальный криз характеризуется острой левожелудочковой сердечной при резком повышении артертиального давления (обычно выше 220 и 120 мм рт. ст.) недостаточностью. 2. Церебральный ангиогипотонический криз — в основе криза лежит недостаточная тоническая реакция артерий мозга в ответ на повышение артериального давления, обусловливающая «прорыв» избыточного притока крови к мозгу под высоким давлением, а также гипотония церебральных вен, препятствующих своевременному оттоку. 3. Церебральный ишемический криз обусловливается избыточной тонической реакцией мозговых артерий в ответ на чрезвычайный прирост артериального давления. 4. Церебральный сложный криз. В механизме развития этого криза ведущим является патологическое открытие артериовенозных анастомозов в мозгу, что способствует перерастяжению вен и приводит к очаговой ишемии за счет феномена «обкрадывания» капилляров. 5. Генерализованный сосудистый криз характеризуется чрезвычайным приростом артериального давления с выраженным диастолическим давлением, полирегиональными ангиодистониями с признаками нарушения кровоснабжения одновременно нескольких органов: мозга, сердца, почек. Нередко развивается острая левожелудочковая недостаточность.
Клиническая картина Клинические проявления гипертонического криза зависят от типа криза. 1. Гипертонические кризы I типа. Клинически они проявляются покраснением лица, сердцебиением, головной болью, дрожью, общим возбуждением. Продолжительность таких состояний — минуты, часы. После прекращения криза нередко отделяется большое количество светлой мочи с низким удельным весом. 2. Гипертонические кризы II типа. Они проявляются бледностью, сильной головной болью, тошнотой, рвотой, нарушением зрения (темные пятна перед глазами, мелькание мушек, иногда непродолжительная слепота). Все эти проявления принято называть синдромом гипертонической энцефалопатии. Во время криза может развиться преходящее нарушение мозгового кровообращения с преходящей очаговой симптоматикой, или истинный мозговой инсульт. Могут возникнуть приступ стенокардии, инфаркт миокарда, отек легких и т. д. Такие кризы продолжаются от нескольких часов до нескольких суток, их трудно купировать, они чаще дают осложнения. Гипертонический кардиальный криз характеризуется острой левожелудочковой сердечной при резком повышении артериального давления (обычно выше 220 и 120 мм рт. ст.) недостаточностью. К ранним признакам криза относятся жалобы на беспокойство, позже обнаруживается тенденция к тахикардии, появление одышки. В дальнейшем развивается интерстициальный, переходящий в альвеолярный отек легких.
Церебральный ангиогипотонический криз Основным отличительным симптомом данного варианта является типичная головная боль, иррадиирующая в ретроорбитальные пространства (чувство давления над глазами, позади глаз), затем становится диффузной; усиливается в ситуациях, затрудняющих отток крови из вен головы (горизонтальное положение, натуживание, кашель и прочее), уменьшается (в ранних стадиях развития) при вертикальном положении тела, а также после приема напитков, содержащих кофеин. В поздней стадии появляются различные вегетативные расстройства, чаще всего тошнота, повторные приступы рвоты. Выявляются инъекция сосудов склер и конъюнктив, иногда цианотичная гиперемия (покраснение лица с синюшным оттенком) лица; определяются «общемозговые» неврологические нарушения (заторможенность, нистагм, диссоциация рефлексов на верхних и нижних конечностях). Криз часто начинается при умеренном повышении артериального давления, например до 170 и 100 мм рт. ст., с нарастанием артериального по мере развития криза до 220 и 120 мм рт. ст. и более. Значительное острое повышение артериального давления от исходного уровня — главный компонент криза. Однако нет четкой зависимости выраженности клинических проявлений от величины артериальной гипертензии. Вторым компонентом криза является острая энцефалопатия, на фоне которой клинически может проявляться левожелудочковая недостаточность, поражение сосудов почек, нейроретинопатия. С практической точки зрения выделяют три клинические формы криза: — нейровегетативная форма; — водно-солевая форма; — судорожная форма. При нейровегетативной форме больной возбужден, беспокоен, проявляется дрожание конечностей, кожные покровы гиперемированы, усилено потоотделение, тахикардия, повышение преимущественно систолического артериального давления, мочеиспускание учащено, моча низкой плотности. При водно-солевой форме больной скован, беспокоит сонливость, кожа бледная, лицо одутловатое, отечность конечностей, мышечный тонус снижен, мочевыделение снижено. Данная форма криза чаще наблюдается у женщин. Обе клинические формы возникают на фоне удовлетворительного самочувствия больных. Длительность от нескольких минут до нескольких часов. При обеих формах проявляются общемозговые симптомы: головные боли, головокружение, шум в голове, тошнота, рвота, может ухудшаться зрение, появляется пелена перед глазами, мелькание мушек. Обычно эти формы протекают без очаговой мозговой симптоматики. Судорожная форма гипертонического криза встречается реже. Она наблюдается у больных в поздних стадиях гипертонической болезни либо при злокачественном течении гипертонической болезни. Данная форма протекает с потерей сознания, тоническими или клоническими судорогами, обычно выражены проявления отека мозга. Продолжительность криза от нескольких часов до нескольких суток. После окончания криза больные некоторое время дезориентированы, медленно проходят нарушение зрения, расстройство памяти. Криз может повториться, что зачастую приводит к осложнениям: возникают паренхиматозное или субарахноидальное кровоизлияние, мозговая кома, некроз почечных сосудов, резкое снижение мочевыделения, гематурия, уремия. Гипертонический криз диагностируется по наличию триады признаков: внезапное начало, высокий подъем артериального давления, наличие жалоб церебрального, кардиального или общевегетативного характера.
Церебральный ишемический криз Отличительные клинические симптомы (очаговые неврологические расстройства) этого криза зависимы от зоны церебральной ишемии и появляются в поздней фазе. Им часто предшествуют признаки диффузной ишемии. Наблюдаются эйфория, раздражительность, которая сменяется угнетенностью, слезливостью, порой появляется агрессивность в поведении. Церебральный сложный криз характеризуется появлением очаговых неврологических расстройств в разгар клинических проявлений ангиогипотонического криза, реже в начальной фазе его развития.
Генерализованный сосудистый криз Симптоматика последнего проявляется мозговыми расстройствами (головная боль), зрительными расстройствами с выпадением полей зрения, могут быть признаки стенокардии, аритмии; выделение с мочой белков, клеток крови. При осмотре больного, чтобы не пропустить начинающегося отека легких, следует обращать внимание на внешний вид больного: появление синюшности губ, затрудненного вдоха, связанного с данным ухудшением состояния, немотивированного беспокойства, дискомфорта, гипергидроза. В нижних отделах легких могут появиться и нарастать влажные хрипы, что, в свою очередь, приведет к увеличению числа дыхательных движений.
Диагностика и дифдиагностика Диагноз ставится с учетом следующих данных. 1. Относительно внезапное начало приступа — от минут до нескольких часов. 2. Индивидуально высокий подъем артериального давления — с учетом привычных для данного больного цифр. 3. Наличие жалоб: кардиальных, церебральных, общевегетативных (описанных выше). Необходимо тщательное проведение дифференциального диагноза с острой коронарной недостаточностью для исключения инфаркта миокарда (больной должен быть обследован электрокардиографически), с острым нарушением мозгового кровообращения (осмотр невропатолога, окулиста).
Осложнения Осложнениями гипертонических кризов могут быть развитие острого нарушения мозгового кровообращения, острой недостаточности коронарного кровообращения (стенокардия, инфаркт), синдрома сердечной астмы, острой недостаточности кровообращения в соответствующем органе или бассейне.
Лечение С учетом типа развития кризов выделяют два варианта их купирования: — тактика быстрого купирования — применяется у больных с отеком легких при гиперкинетическом и эукинетическом типах кризов; — тактика замедленного (контролируемого) снижения артериального давления — целесообразна при гипокинетическом типе криза, особенно в поздних стадиях гипертонической болезни, с выраженными церебральными и коронарными проявлениями. В связи с этим препараты, применяемые для купирования кризов, можно разделить на две группы. I. Препараты с высокой скоростью наступления эффекта: пентамин, бета-блокаторы, аминазин, дроперидол, клофелин. В этих случаях хороший результат дает сочетанное применение указанных препаратов с фуросемидом в дозе 40–80 мг и более, для устранения явлений отека мозга, определяющего тяжесть криза. II. Препараты с относительно малой скоростью наступления эффекта: дибазол, сернокислая магнезия, диуретики. Ниже приводится примерная схема купирования основных вариантов криза (табл. 2). После купирования криза необходимо динамическое наблюдение за больным, во избежание «шлейфовой» реакции рекомендуется использование препаратов, обладающих цереброангиорегулирующими и дезагрегантными свойствами (кавинтон, нимотоп S, тиклид, сермион). Вопрос о госпитализации больного после купирования гипертонического криза решается индивидуально в каждом конкретном случае, следует обращать внимание на кризы II типа. Общепринято назначать мочегонные препараты — лазикс (40–60—80 мг) внутривенно, седативные — реланиум, седуксен (10–30 мг) внутримышечно или внутривенно медленно на 5 %-ном растворе глюкозы (20 мл). Внутривенное введение 1,0 мл 0,01 %-ного раствора клофелина медленно. Введение ганглиоблокаторов (арфонад, пентамин) предпочтительно внутривенное капельное со скоростью 10–15 капель в минуту. При дальнейшем лечении водно-солевой и вегетативной форм криза после его купирования госпитализации не требуется, лечение гипертонической болезни проводится амбулаторно на дому либо в дневном стационаре. Возникновение у больного судорожной формы гипертонического криза требует обязательного дальнейшего лечения в условиях стационара. Профилактикой гипертензивных кризов служит своевременное и адекватное лечение гипертонической болезни.
ГИПЕРТРОФИЯ НЕБНЫХ МИНДАЛИН
ОпределениеГипертрофия небных миндалин — гиперплазия лимфоидной ткани миндалин, нередко сочетается с аденоидами.
Этиология и патогенез Причиной возникновения гипертрофии лимфоидной ткани являются частые острые воспаления, на степень их увеличения влияют многие факторы: состояние белкового обмена, эндокринных функций, общая реактивность организма, перенесенные заболевания, условия внешней среды. Встречается чаще в детском возрасте как проявление гипертрофии лимфаденоидной ткани глотки. С возрастом гипертрофированные миндалины могут подвергаться обратному развитию.
Патанатомия Миндалины имеют гладкую поверхность, а при гистологическом исследовании обнаруживается большое количество фолликулов с многочисленными митозами.
Клиническая картина Гипертрофированные небные миндалины без воспалительных явлений имеют бледножелтоватый цвет. Если они занимают 1/3 расстояния от небной дужки до средней линии зева, их принято считать I степенью увеличения; если они занимают 2/3 этого расстояния — II степенью; если миндалины соприкасаются друг с другом — III степенью увеличения. Заболевание проявляется нарушениями дыхания, речи и прохождения пищи. В результате наличия механического препятствия могут возникать рефлекторный кашель по ночам, особенно у детей. Эти дети тяжело переносят скарлатину, дифтерию.
Осложнения При длительно существующей гипертрофии может быть изменение лицевого скелета, развитие явлений нервной и психической дистонии.
Диагностика и дифдиагностика При фарингоскопии небные миндалины резко увеличены, бледно-розового цвета, мягкие при надавливании шпателем, выступают из-за небных дужек, при рвотных движениях, соприкасаясь, закрывают вход в глотку. Простую гипертрофию небных миндалин необходимо дифференцировать с хроническим гипертрофическим тонзиллитом. Характерно, что воспалительных явлений в таких миндалинах у детей, как правило, нет.
Лечение Полоскания с щелочными или вяжущими средствами, смазывание йодглицерином; общеукрепляющее лечение — витаминотерапия, климатическое лечение (пребывание в горах или на берегу моря). При неэффективности консервативного лечения и отсутствии противопоказаний производят тонзиллотомию (частичное удаление небных миндалин).
ГИПОАЛЬДОСТЕРОНИЗМ
ОпределениеГипоальдостеронизм — недостаточность альдостерона в организме.
Этиология и патогенез Недостаточность альдостерона в организме может быть: — изолированной, — сочетаться с дефицитом других кортикостероидов — вызываться снижением рецепторной чувствительности эффекторных органов к действию альдостерона, синтез которого не нарушен. Существует ряд гипотез о природе изолированного гипоальдостеронизма, механизм развития которого может быть связан с дефектом биосинтеза альдостерона (первичный изолированный гипоальдостеронизм) или нарушением отдельных звеньев его регуляции (вторичный изолированный гипоальдостеронизм). Первичный изолированный гипоальдостеронизм, вероятнее всего, вызывается дефицитом ферментных систем, контролирующих синтез альдостерона на последних этапах: 18-гидроксилазы (блокируется превращение кортикостерона в 18-оксикортикостерон) и (или) 18-дегидрогеназы (блок перехода 18-оксикортикостерона в альдостерон). Указанное нарушение биосинтеза чаще носит врожденный характер, проявляясь у грудных детей или в раннем детстве. Дефект биосинтеза альдостерона может быть индуцирован рядом фармакологических средств при их длительном использовании: гепарином, индометацином, препаратами лакрицы, содержащей ДОК-подобные субстанции, бета-блокаторами, верошпироном. Вторичный гипоальдостеронизм связан с недостаточной продукцией ренина почками или выходом неактивного ренина. Эта форма часто сопутствует и осложняет течение таких заболеваний, как сахарный диабет, хронический нефрит с почечным канальцевым ацидозом. Гипоальдостеронизм в сочетании с недостаточностью продукции кортизола наблюдается при болезни Аддисона (см.), после двусторонней адреналэктомии, при врожденном нарушении биосинтеза кортикостероидов у больных с адреногенитальным синдромом. Недостаточность альдостерона способствует повышению реабсорбции, снижению секреции и экскреции калия в почечных канальцах. Его задержка обычно преобладающая над потерей натрия, ведет к универсальной гиперкалиемии (увеличение калия в крови).
Клиническая картина Изолированный гипоренинемический гипоальдостеронизм как самостоятельный клинический синдром впервые описал Хадсон (1957 г.). Это редкое заболевание наблюдается преимущественно у мужчин. Для него характерны общая и мышечная слабость, гипотония, головокружения, склонность к обморокам, брадикардия, временами достигающая степени атриовентрикулярной блокады, нарушения ритма дыхания вплоть до приступов Адамса — Стокса с помрачением сознания и судорогами. Течение заболевания хроническое и волнообразное. Периоды обострения с циркуляторными коллапсами чередуются со спонтанными ремиссиями.
Диагностика и дифдиагностика Лабораторная диагностика основывается на низком уровне альдостерона, гиперкалиемии (6–8 мэкв/л), иногда гипонатриемии, повышении коэффициента натрий/калий в моче и слюне, нормальном или повышенном уровне кортизола, 17-оксикортикостероидов и катехоламинов в крови и моче. На ЭКГ регистрируются признаки гиперкалиемии: удлинение интервала PQ, брадикардия, та или иная степень поперечной блокады, высокий остроконечный зубец в грудных отведениях. Дифдиагностика изолированного гипоальдостеронизма как самостоятельного клинического синдрома проводится с гипоальдостеронизмом, развившимся на фоне сахарного диабета, хронического нефрита, врожденной гиперплазии коры надпочечников с дефектом 11-гидроксилазы, с синдромом ортостатической гипотонии на основе поражения вегетативной нервной системы; с гипоальдостеронизмом при синдроме отмены после длительного приема минералокортикоидов; с гиперкалиемией в связи с гемолизом (разрушением эритроцитов).
Лечение Повышенное введение хлорида натрия и жидкости, препараты минералокортикоидного ряда (инъекции 0,5 %-ного ДОКСА по 1 мл 1 раз в 2 недели, флоринефа по 0,5–2 мг в сутки, кортинефа по 0,1 мг, ДОКСА в таблетках по 0,005 1–3 раза в сутки). Глюкокортикоиды даже в очень больших дозировках неэффективны, особенно в периоды обострения. Лечение псевдогипоальдостеронизма включает только введение хлорида натрия, так как почки «ускользают» от минералокортикоидного влияния соответствующих препаратов.
ГИПОГАЛАКТИЯ
ОпределениеГипогалактия — недостаточное образование молока вследствие дисфункции молочных желез.
Этиология Причинами гипогалактии являются: общие тяжелые экстрагенитальные заболевания, токсикозы беременных, психогенные факторы, послеродовая недостаточность гипофиза (синдром Шихена).
Клиническая картина Признаки гипогалактии: беспокойство и крик ребенка сразу или во время кормления, длительное сосание при редких глотательных движениях у ребенка, редкий стул беспокойный сон, частый плач. К достоверным признакам гипогалактии относятся: низкая прибавка массы тела, редкое мочеиспускание у ребенка. Гипогалактия может быть транзиторная, проявляясь в виде лактационных кризов, в основе которых лежат особенности регуляции лактации, которая регистрируется на 3—6-й неделе, 3, 4, 7, 8-х месяцах лактации.
Лечение Коррекция гипогалактии включает воздействие на психологический настрой матери, более частые прикладывания к груди, сохранение ночных кормлений, обеспечение правильного режима дня к питанию матери с использованием специализированных продуктов питания (соков, напитков и т. д.). Рекомендуются лактогенные чаи (с экстрактом аниса, фенхеля, галеги, тмина, крапивы, душицы). Правильная техника кормления ребенка грудью, высококалорийное питание с повышенным содержанием витаминов, пивные дрожжи, общее ультрафиолетовое облучение, дарсонвализация молочных желез, внутримышечное введение пролактина по 5 ЕД 2 раза в день в течение 7 дней.
ГИПОГОНАДИЗМ (МУЖСКОЙ)
ОпределениеГипогонадизм (мужской) — патологическое состояние, обусловленное недостаточной секрецией андрогенов.
Этиология Причинами возникновения гипогонадизма являются врожденное недоразвитие половых желез, токсическое, инфекционное, лучевое их поражение, нарушение функции гипоталамо-гипофизарной системы.
Патогенез Звеном механизма развития является снижение секреции половых гормонов яичками. При первичном гипогонадизме поражается непосредственно тестикулярная ткань, при вторичном — снижение функции половых желез возникает вследствие поражения гипоталамо-гипофизарной системы со снижением гонадотропной функции гипофиза.
Клиническая картина Клинические проявления зависят от возраста, в котором возникло заболевание, и степени андрогенной недостаточности. Различают допубертатные и постпубертатные формы гипогонадизма. При поражении яичек до полового созревания развивается типичный евнухоидный синдром, отмечаются высокий непропорциональный рост вследствие запаздывания окостенения эпифизарных зон роста, удлинение конечностей, недоразвитие грудной клетки и плечевого пояса. При первичном гипогонадизме скелетная мускулатура развита слабо, подкожная жировая клетчатка распределена по женскому типу. Нередка истинная гинекомастия. Кожные покровы бледные. Слабое развитие вторичных половых признаков: отсутствие оволосения на лице и теле (на лобке — по женскому типу), недоразвитие гортани, высокий голос. Половые органы недоразвиты: половой член малых размеров, мошонка сформирована, но депигментирована, без складчатости, яички гипоплазированы, предстательная железа недоразвита, нередко пальпаторно не определяется. При вторичном гипогонадизме, кроме симптомов андрогенной недостаточности, часто наблюдается ожирение, нередки симптомы пониженной функции других желез внутренней секреции — щитовидной, коры надпочечников (результат выпадения тропных гормонов гипофиза). Может наблюдаться симптоматика пангипопитуитризма. Половое влечение и потенция отсутствуют. Если выпадение функции яичек произошло после полового созревания, когда половое развитие и формирование костно-мышечной системы уже закончены, симптомы заболевания выражены меньше. Характерны уменьшение яичек, снижение оволосения лица и тела, истончение кожи и утрата ее эластичности, развитие ожирения по женскому типу, нарушение половых функций, бесплодие, вегетативно-сосудистые расстройства.
Диагностика В диагностике используются данные рентгенологического и лабораторного исследования. При гипогонадизме, развившемся до периода полового созревания, отмечается отставание «костного» возраста от паспортного на несколько лет. Содержание в крови тестостерона ниже нормы. При первичном гипогонадизме — повышение уровня гонадотропинов в крови, при вторичном — его снижение, в некоторых случаях их содержание может быть в пределах нормы. Выделение с мочой 17-КС может быть в пределах нормы или ниже ее. При анализе эякулята — азоо- или олигоспермия; в некоторых случаях эякулят получить не удается. Прогноз для жизни благоприятный. Заболевание хроническое, в процессе лечения удается уменьшить симптомы андрогенной недостаточности.
Лечение Проводится заместительная терапия препаратами тестостерона (тестостерона пропионат, тестэнат, тетрастерон, сустанон-250, омнадрен-250). Ввиду заместительного характера лечения оно проводится постоянно. При вторичном гипогонадизме назначают стимулирующую терапию хорионическим гонадотропином по 1,5–3 тыс. ЕД 2–3 раза в неделю курсами по месяцу с месячными перерывами или терапию хорионическим гонадотропином в сочетании с андрогенами. Показаны общеукрепляющая терапия, лечебная физкультура.
ГИПОПАРАТИРЕОЗ
ОпределениеГипопаратиреоз, или недостаточность околощитовидных желез, — заболевание, связанное с изменением секреции паратиреоидного гормона, характеризующееся выраженными нарушениями фосфорно-кальциевого обмена, повышенной нервной возбудимостью и судорожным синдромом.
Этиология и патогенез Основными причинными формами гипопаратиреоза являются: послеоперационный; связанный с лучевым, сосудистым, инфекционным повреждениями околощитовидных желез; идиопатический (при врожденном недоразвитии, отсутствии околощитовидных желез или аутоиммунного генеза). В механизме развития заболевания главную роль играет абсолютный или относительный дефицит паратиреоидного гормона с гиперфосфатемией и гипокальциемией, развитие которых связано с нарушением всасывания кальция в кишечнике, понижением его мобилизации из костей и относительным уменьшением его канальцевой реабсорбции в почках. Недостаток паратиреоидного гормона приводит к снижению уровня кальция в крови и самостоятельно, и опосредованно — в связи с уменьшением синтеза в почках активной формы витамина D3. Отрицательный кальциевый и положительный фосфорный баланс нарушает электролитное равновесие, изменяются соотношения кальций — фосфор — натрий — калий. Это ведет к универсальному нарушению проницаемости клеточных мембран, в частности, и в нервных клетках, к изменению процессов поляризации в области синапсов. Возникающее в результате этого повышение нервно-мышечной возбудимости и общей вегетативной реактивности приводит к повышению судорожной готовности и тетаническим кризам. В развитии тетании значительная роль принадлежит нарушению превращения магния и развитию гипомагнезиемии (снижение магния в крови). Это способствует проникновению ионов натрия в клетку и выходу из клетки ионов калия, что тоже способствует повышению нервно-мышечной возбудимости. Такое же действие вызывает и возникающий при этом сдвиг кислотно-щелочного состояния в сторону алкалоза.
Патанатомия Анатомическим субстратом гипопаратиреоза является отсутствие околощитовидных желез. Во внутренних органах и стенках крупных сосудов при гипопаратиреозе возможно отложение солей кальция.
Клиническая картина Больного гипопаратиреозом беспокоят парестезии, похолодание и чувство ползания мурашек во всем теле, особенно в конечностях, судорожные подергивания в мышцах, приступы болезненных тонических судорог, нервозность. В поздних стадиях заболевания появляются изменения кожи, катаракта, кальцинаты в различных органах и в подкожной клетчатке. По течению и характеру клинических особенностей гипопаратиреоза выделяют его формы: явную (манифестную), с острыми и хроническими проявлениями и скрытую (латентную). Клиническая симптоматика складывается из нескольких групп симптомов: повышения нервно-мышечной проводимости и судорожной готовности, висцеро-вегетативных и нервно-психических нарушений. Наиболее типичны для гипопаратиреоза приступы тетании, начинающиеся с парестезий, фибриллярных подергиваний мышц, переходящих в тонические судороги, вовлекающие преимущественно симметричные группы сгибателей конечностей (чаще верхних), при тяжелых формах — также мышцы лица. Во время приступа руки согнуты в суставах, кисть — в форме «руки акушера»; ноги вытянуты, сжаты между собой, стопа находится в состоянии резкого подошвенного сгибания с согнутыми пальцами («педальный спазм»). Судороги лицевой мускулатуры вызывают «сардоническую» форму рта, наступает спазм жевательной мускулатуры (тризм), судороги век. Судороги дыхательных мышц и диафрагмы могут вызывать затруднение дыхания. Особенно опасен нередко наблюдающийся у детей ларингоспазм и бронхоспазм. Из-за спазмов гладкой мускулатуры пищевода нарушается глотание. В связи с пилороспазмом появляется рвота. Из-за изменения тонуса мускулатуры кишечника и мочевого пузыря — поносы или запоры, дизурия (нарушение мочеиспускания), боли в животе. Судороги при гипопаратиреозе очень болезненны. Сознание при тетании обычно сохранено и нарушается редко, лишь при особенно тяжелых приступах. Приступы бывают разной длительности: от нескольких минут до нескольких часов, возникают с разной частотой. При преобладании во время приступа тонуса симпатической нервной системы приступ протекает с бледностью из-за спазма периферических сосудов, с тахикардией, повышением артериального давления. При преобладании тонуса парасимпатической вегетативной нервной системы типичны рвота, поносы, повышенное мочевыделение, брадикардия (урежение частоты сердечных сокращений), гипотония. Вне приступов тетании вегетативные нарушения у больных проявляются ощущением похолодания или жара, потливостью, стойким дермографизмом, головокружением, обмороками, нарушениями зрительной аккомодации, косоглазием, диплопией, мигренью, звоном в ушах, ощущением «закладывания» ушей, неприятными ощущениями в области сердца с картиной коронароспазма и нарушениями ритма. При длительной гипокальциемии развиваются изменения психики, неврозы, эмоциональные нарушения (депрессия, приступы тоски), бессонница. Наиболее тяжелые неврологические изменения наблюдаются у больных с внутричерепной кальцификацией, в частности в области базальных ганглиев, а также над турецким седлом, иногда в области мозжечка, что вызывает явления эпилептиформного типа и паркинсонизм. При длительном течении гипопаратиреоза может возникнуть катаракта, обычно подкапсульная, двусторонняя, иногда наблюдается отек соска зрительного нерва. Возникают изменения зубочелюстной системы: у детей — нарушения формирования зубов; у больных всех возрастных групп — кариес, дефекты эмали. Характерны нарушения роста волос, раннее поседение и поредение волос, ломкость ногтей, изменения кожи: сухость, шелушение, экзема, эксфолиативный дерматит. Очень часто развивается кандидамикоз. Острая форма заболевания протекает с частыми и тяжелыми приступами тетании и трудно компенсируется. Хроническая форма течет мягче, при адекватной терапии можно добиться длительных (многолетних) бесприступных периодов. Латентная форма протекает без видимых внешних симптомов и выявляется только на фоне провоцирующих факторов или при специальном обследовании. Провоцирующими факторами при латентном гипопаратиреозе могут быть волнения, уменьшение поступления с пищей кальция и увеличение поступления фосфатов, физическая нагрузка,предменструальный период, инфекции, интоксикации, переохлаждение или перегревание, беременность, лактация. Как правило, судорожные явления и развернутая картина гипопаратиреоидного криза возникают при снижении содержания кальция в крови до 1,9–2,0 ммоль/л.
Диагностика и дифдиагностика Диагностика явных форм гипопаратиреоза нетрудна. Она основана на данных анамнеза (операция на щитовидной или околощитовидной железах); наличии нервно-мышечной возбудимости с приступами тонических судорог или готовностью к судорогам; наличии гипокальциемии и гипокальцурии; гиперфосфатемии и гипофосфатурии; на снижении уровня паратиреоидного гормона сыворотки; на снижении выделении цАМФ с мочой, достигающей нормального значения после введения препаратов паратиреоидного гормона; на наличии кальцификации тканей, на изменениях эктодермальных производных — кожи, волос, ногтей, эмали зубов. При гипопаратиреозе содержание общего кальция крови снижается ниже 2,25 ммоль/л, при уровне менее 4,75 ммоль/л кальций перестает определяться в моче (в пробе Сулковича). Для выявления скрытой недостаточности околощитовидных желез используют пробы, характеризующие повышение механической и электрической возбудимости нервно-мышечного аппарата. С их помощью выявляются следующие симптомы. Симптом Хвостека — сокращение мышц лица при постукивании в месте выхода лицевого нерва впереди наружного слухового прохода. Симптом Труссо — судороги в области кисти через 2–3 мин после перетягивания плеча жгутом или манжеткой аппарата для измерения артериального давления. Симптом Вейса — сокращение круглой мышцы век и лобной мышцы при поколачивании у наружного края глазницы. Симптом Гофмана — появление парестезий при надавливании в участках разветвления нервов. Симптом Шлезингера — судороги в разгибательных мышцах бедра и стопы при быстром пассивном сгибании ноги в тазобедренном суставе при выпрямленном коленном суставе. Симптом Эрба — повышенная электровозбудимость нервов конечностей при раздражении слабым гальваническим током. Проба с гипервентиляцией является причиной усиления судорожной готовности или развития приступа тетании при глубоком форсированном дыхании. Следует помнить, что все эти пробы неспецифичны и выявляют не гипопаратиреоз как таковой, а повышенную судорожную готовность. При наличии судорожного симптомокомплекса требуется дифференциальная диагностика с заболеваниями, сопровождающимися судорогами и гипокальциемией. Это метаболические тетании (при неполном всасывании (синдром мальабсорбции, поносы) или потеря кальция (рахит, гиповитаминоз В, остеомаляция (размягчение костей), лактация); при повышенной потребности в кальции (беременность), хронической почечной недостаточности; при алкалозе (гипервентиляционная, гастрогенная — при рвоте, гипокальциемическая — при гиперальдостеронизме); при органических поражениях центральной нервной системы (сосудистые поражения, энцефалопатии, менингиты). Помимо метаболических тетаний, гипопаратиреоз необходимо дифференцировать с гипомагнезиемией и судорожными проявлениями при гипогликемиях. От судорожных припадков надо отличать генноинженерную эпилепсию как таковую, столбняк, бешенство, отравления и интоксикации. В отличие от гипопаратиреоза и псевдогипопаратиреоза при большинстве видов тетании нет нарушений фосфорно-кальциевого обмена. Гипопаратиреоз может быть компонентом синдрома множественной эндокринной недостаточности аутоиммунного происхождения, в сочетании с кандидозом — генетического синдрома с картиной недостаточности околощитовидных желез, коры надпочечников и грибкового поражения кожи и слизистых с частым развитием кератоконъюнктивита. Гипопаратиреоз необходимо отличать от псевдогипопаратиреоза и псевдогипопсевдопаратиреоза (неистинного снижения функции паращитовидных желез и заболеваний с неистинным, подобным снижением функции паращитовидных желез, встречающимся при других патологических состояниях). Псевдогипопаратиреоз — редкий наследственный синдром с клинико-лабораторными признаками недостаточности околощитовидных желез с повышенным или нормальным содержанием в крови паратиреоидного гормона, с низкорослостью, особенностями развития скелета (остеодистрофия, укорочение трубчатых костей конечностей, дефекты зубочелюстной системы), метастатической кальцинацией мягких тканей, нарушениями психики.
Лечение Для лечения гипопаратиреозного криза внутривенно вводят 10 %-ный раствор хлорида или глюконата кальция. Доза определяется тяжестью приступа и составляет от 10 до 50 мл (чаще 10–20 мл). Эффект должен наступить в конце вливания. В связи с возможностью интоксикации вводить препарат следует медленно. Инъекции целесообразно повторять 2–3 раза в сутки. В межприступный период его препараты (глюконат, лактат, хлорид) применяют перорально в дозе 1–2 г в сутки после еды. При кризе применяют также паратиреоидин — экстракт околощитовидных желез крупного рогатого скота в дозе 40—100 ЕД (2–5 мл) внутримышечно. Эффект наступает через 2–3 ч и длится сутки с максимумом действия через 18 ч. Паратиреоидин для поддерживающей терапии применяют ограниченно из-за возможности развития резистентности и возникновения аллергии. При необходимости проводят курсы лечения по 1,5–2 месяца с перерывами по 3–6 месяцев. Важное значение имеют препараты витамина D, которые усиливают кишечную абсорбцию и реабсорбцию кальция в почечных канальцах, стимулируют его мобилизацию из костей. Наиболее эффективны препараты витамина D в масляном растворе в дозах 1,0,5 и 0,25 мкг в капсулах для перорального применения. В остром периоде суточная доза может составлять 2–4 мкг на 2 приема, поддерживающая — 0,5–1 мкг в сутки. Сохраняет определенное значение лечение витаминами: D2 (эргокальциферол), в спиртовом (200 тыс. МЕ/мл) и масляном (200, 50, 25 тыс. МЕ/мл) растворах. В остром периоде назначают по 200–400 тыс. МЕ/мл, поддерживающая доза — 25–50 тыс. МЕ/мл. Широко используется лечение 0,1 %-ным масляным раствором дигидротахистерола (тахистин, АТ10 в капсулах), 1 мл которого содержит 1 мг дигидротахистерола. В остром периоде назначают по 1–2 мг каждые 6 ч, поддерживающая доза — 0,5–2 мл в день (подбирается индивидуально). Лечение проводят под контролем исследования уровня кальция в крови во избежание передозировки и развития гиперкальциемии, которая сопровождается повышенным мочевыделением, сухостью во рту, жаждой, слабостью, головной болью, тошнотой, болями в животе, запорами. В данном случае следует отменить прием препаратов кальция и провести лечение как при гиперкальциемическом кризе. Для лечения гипопаратиреоза применяется диета, богатая солями кальция и магния (молоко, молочные продукты, овощи, фрукты) с ограничением фосфора (мясо). Отказ от мясных продуктов необходим особенно в период тетании. Желательно введение с пищей эргокальциферола, который содержится в рыбьем жире, сельди, печени, яичном желтке. Для устранения гипомагнезиемии при гипопаратиреозе назначают сульфат магния в 25 %-ном растворе по 10–20 мл внутримышечно, при алкалозе — хлорид аммония до 3–7 г в сутки. Используют с целью симптоматической терапии седативные и пртивосудорожные препараты (люминал, бромиды). При наличии ларингоспазма прибегают к интубации или трахеотомии. Для создания депо кальция в организме делают подсадку в мышцу консервированной кости. Предпринимались попытки подсадки околощитовидных желез, хотя эффективность этих методов сомнительна. При псевдогипопаратиреозе лечение паратиреидином неэффективно из-за нечувствительности к нему тканей-мишеней. Гипокальциемию приходится у таких больных компенсировать введением препаратов кальция и витамина D.
ГИПОПОЛИВИТАМИНОЗЫ
ОпределениеГипополивитаминозы — состояние, характеризующееся недостаточностью ряда витаминов.
Этиология и патогенез Причиной гипополивитаминозов чаще всего являются заболевания пищеварительного тракта, при которых нарушена всасываемость витаминов, в меньшей степени алиментарная. Полиавитаминозы встречаются чаще, чем изолированная относительная или полная недостаточность одного из витаминов. В развитии гиповитаминозов и полиавитаминозов следует учитывать взаимное влияние некоторых витаминов, их синергизм и антагонизм.
Клиническая картина Клиническая картина многообразна, но в основном проявляется симптомами недостаточности тех витаминов, поступление которых в организм и утилизация наиболее нарушены. Особенно часты слабость, снижение памяти, трудоспособности, нарушения сна, понижение аппетита, одышка при обычной физической нагрузке.
Лечение Проводят лечение основного заболевания, ведущего к синдрому нарушения всасывания; назначают витаминные препараты, внутривенное введение витамина.
Профилактика Своевременная диагностика и лечение заболеваний желудочно-кишечного тракта, при которых нарушается всасывание пищевых веществ и витаминов; включение витаминотерапии в курс лечения хронических заболеваний пищеварительного тракта.
ГИПОТИРЕОЗ
ОпределениеГипотиреоз — заболевание, вызванное недостаточным уровнем тиреоидных гормонов (гормонов щитовидной железы). Впервые описано В. Галлом в 1873 г.
Этиология В подавляющем большинстве случаев (90–95 %) заболевание обусловлено патологическим процессом в самой щитовидной железе, снижающим уровень продукции гормонов (первичный гипотиреоз). Нарушение регулирующего и стимулирующего эффекта гипофизарного тиреотропина или гипоталамического рилизинг-фактора (тиролиберина) ведет к вторичному гипотиреозу, по частоте значительно уступающему первичному. Вопрос о периферическом гипотиреозе, возникающем либо в связи с нарушением превращения тиреоидных гормонов на периферии, либо в результате снижения чувствительности ядерных рецепторов органов и тканей к тиреоидным гормонам, во многом еще не решен. В настоящее время у взрослых наиболее распространен первичный гипотиреоз, возникающий на основе хронического аутоиммунного тиреоидита. Первичный гипотиреоз возникает по ряду причин: 1) осложнения лечебных мероприятий после: — оперативного лечения различных заболеваний щитовидной железы; — лечения токсического зоба радиоактивным йодом; — лучевой терапии при злокачественных заболеваниях органов, расположенных на шее (лимфома, карцинома гортани); — плохо контролируемого лечения тиреотоксическими средствами (мерказолил, литий); — использования йодсодержащих лекарственных препаратов, в том числе рентгеноконтрастных веществ; — приема глюкокортикоидов, эстрогенов, андрогенов, сульфаниламидных препаратов; 2) деструктивные поражения щитовидной железы: опухоли, острые и хронические инфекции (тиреоидит, абсцесс, туберкулез, актиномикоз и крайне редко амилоидоз, саркоидоз, цистиноз); 3) дисгенезия (аплазия или гипоплазия) щитовидной железы вследствие дефектов внутриутробного развития обычно у новорожденных и детей 1–2 лет, нередко сочетающаяся с глухотой и кретинизмом. Иногда остаток тиреоидной ткани находится в подъязычнотиреоидной области у корня языка. Порок развития щитовидной железы может быть вызван йодной недостаточностью в окружающей среде, нелеченым гипотиреозом матери, наследственной предрасположенностью. Вторичный гипотиреоз развивается при воспалительных, деструктивных или травматических поражениях гипофиза и (или) гипоталамуса (опухоль, кровоизлияние, некроз, хирургическая и лучевая гипофизэктомия) с недостаточным выделением гормонов и последующим снижением функциональной активности щитовидной железы. Чаще вторичный гипотиреоз возникает в рамках общей гипофизарной патологии (преимущественно передней доли) и сочетается с гипогонадизмом, избытком соматотропного гормона.
Патогенез Механизм развития (особенно первичного) гипотиреоза определяется снижением уровня тиреоидных гормонов, имеющих спектр влияния на физиологические функции и обменные процессы в организме. В результате угнетаются все виды обменов, утилизация кислорода тканями, тормозятся окислительные реакции и снижается активность различных ферментных систем, газообмен и основной обмен. Замедление синтеза и катаболизма белка и белковых фракций, а также процесса их выведения из организма ведет к значительному увеличению продуктов белкового распада во внесосудистых пространствах органов и тканей, в коже, в скелетной и гладкой мускулатуре. В частности, в миокарде и в других мышечных группах накапливается креатинфосфат. Одновременно снижается содержание нуклеиновых кислот, меняется белковый спектр крови в сторону повышения глобулиновых фракций, а в интерстиции (межклеточной жидкости) концентрируется значительное количество альбумина, изменяется структура гемоглобина. В сердце, легких, почках, серозных полостях и прежде всего во всех слоях кожи избыточно депонируются кислые гликозаминогликаны, преимущественно глюкуроновая кислота и в меньшей степени — хондроитинсерная. Уровень гликозаминогликанов в фибробластах крови, находящийся под прямым влиянием тиреоидных гормонов, резко возрастает. В исследованиях, проведенных авторами совместно с А. Н. Назаровым, показано, что уровень гликозаминогликанов нарастает по мере длительности заболевания. Избыток меняет коллоидную структуру соединительной ткани, усиливает ее гидрофильность (чувствительность к воде) и связывает натрий, что в условиях затрудненного лимфооттока формирует микседему. На механизм задержки в тканях натрия и воды может также влиять избыток вазопрессина, продукция которого тормозится тиреоидными гормонами, а также снижение уровня предсердного натрийуретического фактора. Наряду с тенденцией к повышению уровня внутриклеточного и интерстициального натрия имеется склонность к гипонатриемии и снижению степени концентрации внутриклеточного калия. Уменьшается также насыщенность тканей свободными ионами кальция. Замедляются утилизация и выведение продуктов липолиза, повышается уровень холестерина, триглицеридов, липопротеидов. Дефицит тиреоидных гормонов тормозит развитие ткани мозга и угнетает высшую нервную деятельность, что особенно ощутимо в детском возрасте. Но и у взрослых развивается гипотиреоидная энцефалопатия, которая характеризуется снижением психической активности и интеллекта, ослаблением условной и безусловной рефлекторной деятельности. Ограничивается физиологическая активность других эндокринных желез, и в первую очередь коры надпочечников, быстро снижающих свою функцию в условиях низкой температуры. Нарушается также периферическое превращение кортикостероидов и половых гормонов. Снижение уровня тиреоидных гормонов в крови по механизму отрицательной обратной связи усиливает секрецию тиреотропного гормона и нередко пролактина. Тиреотропный гормон стимулирует компенсаторное разрастание тиреоидной ткани, образование кист, аденом. В основе гипотиреоидной комы лежат угнетение дыхательного центра и прогрессирующее снижение сердечного выброса, нарастающая кислородная недостаточность мозга и пониженная температура как результат общего понижения обмена веществ в результате падения скорости основных обменных реакций и использования кислорода. Наряду с угнетением дыхательного центра легочная вентиляция затрудняется из-за накопления бронхиального секрета и снижения кашлевого рефлекса. Важнейшим звеном механизма развития, определяющим тяжесть и прогноз, является гипокортицизм. Потере сознания предшествует обычно предкоматозный период, когда концентрируются и утяжеляются основные симптомы гипотиреоза. В условиях выраженной низкой температуры тела (30 °C и даже ниже) снижаются функции всех внутренних органов, и прежде всего надпочечников. Однако температура при гипотиреоидной коме в редких случаях может быть и нормальной.
Патанатомия При тяжелой атрофии щитовидная железа весит не более 3–6 г и представлена утолщенной капсулой с хорошо развитыми соединительнотканными прослойками и сосудами, между которыми располагаются немногочисленные островки тиреоидной ткани из мелких фолликулов с густым коллоидом и плоскими фолликулярными клетками. В строме имеются немногочисленные лимфоидные инфильтраты с примесью макрофагов и других клеток. Иногда отмечается выраженная жировая инфильтрация. Такого рода изменения обычно имеют место при гипотиреозе, обусловленном нарушением тиреотропной функции гипоталамуса и (или) гипофиза. При врожденном гипотиреозе отмечается формирование зоба. Железа при этом увеличивается за счет переразвития и увеличения тиреоидного эпителия, формирующего тяжи, солидные скопления, тубулярные и редко — фолликулярные структуры практически без содержимого. В скелетной мускулатуре при гипотиреозе отмечается увеличение части мышечных волокон с исчезновением в них поперечной исчерченности, разрыв миофибрилл, нарушение целостности сарколеммы (мышечной оболочки), отек отдельных волокон. Все эти изменения характерны для микседемы и рассматриваются как микседематозная миопатия. В сердце этих больных часто обнаруживается перикардиальный отек, а в коронарных артериях — множественные атеромы. Базальная мембрана капилляров миокарда обычно резко утолщена. Гипофиз нередко увеличен, в нем могут обнаруживаться разнообразные изменения. Кора надпочечников атрофирована. Аутоиммунный гипотиреоз может сочетаться с аутоиммунным поражением коры надпочечников. Гипотиреоидная полинейропатия обусловлена прежде всего нейроаксональной дегенерацией, которая в свою очередь усугубляет микседематозную миопатию.
Клиническая картина Первичный гипотиреоз, представленный преимущественно его «идиопатической» формой, чаще наблюдается у женщин 40–60 лет. В последние десятилетия отмечен рост всех аутоиммунных заболеваний, в том числе и гипотиреоза. В этой связи возрастные рамки значительно расширились (заболевание наблюдается и у детей, и у подростков, и у пожилых людей), а половая принадлежность стала стираться. Клиническая картина выраженного гипотиреоза очень многообразна, и больные предъявляют массу жалоб: на вялость, медлительность, быструю утомляемость и снижение работоспособности, сонливость днем и нарушение ночного сна, ухудшение памяти, сухость кожи, отечность лица и конечностей, ломкость и исчерченность ногтей, выпадение волос, увеличение веса, парестезию, нередко обильные или скудные менструации, иногда их отсутствие. Многие отмечают упорные боли в пояснице, однако этот симптом исчезает в результате эффективной тиреоидной терапии. Начальные проявления заболевания характеризуются скудной и неспецифической симптоматикой (слабость, быстрая утомляемость, снижение работоспособности; боли в сердце и др.), и больные могут длительно безуспешно наблюдаться по поводу различных заболеваний. При выраженном гипотиреозе вид больных весьма характерен: периорбитальный отек, бледное, одутловатое и маскообразное лицо. Отечные и укрупненные черты лица иногда напоминают акромегалоидные. Больные зябнут и кутаются в теплую одежду и при высокой окружающей температуре, так как низкий основной обмен, нарушение терморегуляции с преобладанием теплоотдачи над теплопродукцией снижают устойчивость к холоду. Замедление периферического кровотока, нередко сопутствующая анемия и специфический отек делают кожу бледной, тугоподвижной, холодной на ощупь. Наряду с этим у отдельных больных на фоне общей бледности появляется яркий, ограниченный румянец на щеках. Кожа сухая, шелушащаяся, с участками ороговения, особенно на стопах, передней поверхности голеней, коленях, локтях. Отечность голосовых связок и языка приводит к замедленной, нечеткой речи, тембр голоса снижается и грубеет. Язык увеличивается в объеме, на его боковых поверхностях видны следы, вмятины от зубов. Увеличение языка и голосовых связок вызывает эпизоды апноэ во сне. Из-за отека среднего уха нередко снижается слух. Отмечаются сухость и ломкость волос, их поредение на голове, в подмышечных впадинах, лобке, в наружной трети бровей. Снижается секреция сальных и потовых желез, нередко наблюдается желтушность кожных покровов, чаще в виде пятен на ладонной поверхности кистей из-за избытка циркулирующего каротина, замедленно трансформирующегося в печени в витамин А. Отмечаются головные боли, уменьшение мышечной силы и повышение мышечной утомляемости, особенно в верхних группах. Мышечные боли, судороги и замедленная релаксация — наиболее общие проявления гипотиреоидной миопатии, а ее выраженность пропорциональна тяжести гипотиреоза. Мышечная масса увеличивается, мышцы становятся плотными, тугоподвижными, хорошо контурируются. Возникает так называемая псевдогипертрофия (ложное увеличение) мышц. Костные поражения нехарактерны для гипотиреоза взрослых. Умеренный остеопороз развивается лишь при длительном и тяжелом течении. В юношеском возрасте и у больных гипотиреозом с детских лет, но плохо леченных, может быть дефект эпифизарного окостенения, отставание «костного» возраста от хронологического, замедление линейного роста и укорочение конечностей. Нередко наблюдаются боли в суставах, артропатии, синовиты и артрозы. Поражение миокарда с последующим развитием гипотиреоидного сердца появляется уже на ранних стадиях заболевания. Больных беспокоит одышка, усиливающаяся даже при незначительном физическом напряжении, неприятные ощущения и боли в области сердца и за грудиной. Поражение миокарда, перикарда и тоногенная дилатация (расширение) полостей увеличивают объем сердца, что клинически характеризуется перкуторными и рентгенологическими признаками расширения его границ. Ослабляется сердечная пульсация, приглушается звучность тонов. Брадикардия с малым и мягким пульсом — типичный симптом гипотиреоза. Она наблюдается в 30–60 % случаев. У значительной части больных частота пульса в пределах нормы, а приблизительно у 10 % отмечается тахикардия. Артериальное давление может быть низким, нормальным и повышенным. Артериальная гипертензия, по данным разных авторов, отмечена у 10–50 % больных. Она может снижаться и даже исчезать под влиянием эффективной тиреоидной терапии. Широкие статистические исследования показали, что связанное с возрастом постепенное повышение артериального давления более выражено у гипотиреоидных пациентов, чем у лиц с нормальной функцией щитовидной железы. В этой связи гипотиреоз может быть отнесен к факторам риска для развития гипертензии. Одним из характерных симптомов у 30–80 % больных является наличие жидкости в перикарде. Объем перикардиального выпота может быть незначительным (15–20 мл) и значительным (100–150 мл). Жидкость накапливается медленно и постепенно, и такой грозный симптом, как тампонада сердца, наблюдается крайне редко. Перикардит может сочетаться с другими проявлениями гипотиреоидного полисерозита — гидротораксом, асцитом, характерным для аутоиммунного поражения с тяжелой аутоагрессией. Отклонения со стороны дыхательной системы характеризуются мышечной дискоординацией, центральными нарушениями, снижением вентиляции в альвеолах, недостатком кислорода, повышенным содержанием углекислого газа и отеком слизистой дыхательных путей. Больные склонны к бронхиту, пневмонии, которые отличаются вялым, затяжным течением, иногда без температурных реакций. Имееется ряд желудочно-кишечных расстройств: снижение аппетита, тошнота, метеоризм, запоры. Снижение тонуса мускулатуры кишечника и желчных путей ведет к застою желчи в пузыре и способствует образованию камней, развитию мегаколона и иногда кишечной непроходимости с картиной острого живота. Выделение жидкости почками уменьшено за счет низкого периферического кровообращения и в результате повышенного уровня вазопрессина; атония мочевыводящих путей благоприятствует развитию инфекции. Иногда может быть легкая протеинурия (появление белка в моче), снижение фильтрации и почечного кровотока. Тяжелых нарушений почечного кровообращения обычно не бывает. Расстройства периферической нервной системы проявляются парестезиями (нарушениями чувствительности), невралгиями, замедлением сухожильных рефлексов. Та или иная степень психических расстройств наблюдается у всех больных, а иногда они доминируют в клинической симптоматике. Характерны вялость, апатичность, ухудшение памяти, безразличие к окружающему; снижаются способность концентрировать внимание, острота восприятия и реакции. Извращается сон, больных беспокоит сонливость днем и бессонница ночью. Наряду с психической индифферентностью может быть повышенная раздражительность и нервозность. При длительно не леченном заболевании развивается тяжелый гипотиреоидный хронический психосиндром, вплоть до психозов. Гипотиреозу могут сопутствовать те или иные проявления офтальмопатии, однако они встречаются значительно реже, чем при тиреотоксикозе, и не имеют тенденции к прогрессированию. Обычно наблюдаются периорбитальный отек, птоз, аномалии рефракции. Нарушения в крови в той или иной степени обнаружены у 60–70 % больных. В основе «тиреогенных» анемий лежит ахлоргидрия (отсутствие образования хлорной кислоты в желудке), уменьшение всасывания железа в желудочно-кишечном тракте, витамина В12 и фолиевой кислоты, угнетение обменных процессов в костном мозге. Содержание сахара в крови натощак обычно нормальное или несколько сниженное в связи с медленным всасыванием глюкозы в кишечнике. Гипотиреоз сопровождается повышением синтеза холестерина и снижением его катаболизма. Вместе с тем липидный спектр существенно не нарушается и содержание холестерина в крови остается нормальным.
Осложнения Наиболее тяжелым, нередко смертельным осложнением гипотиреоза является гипотиреоидная кома. Это осложнение возникает обычно у пожилых женщин с недиагностированным или длительно не леченным, а также плохо леченным гипотиреозом. Провоцирующие моменты: охлаждение, особенно в сочетании с малоподвижностью, сердечно-сосудистая недостаточность, инфаркт миокарда, острые инфекции, психоэмоциональные и мышечные перегрузки, различные заболевания и состояния, способствующие понижению температуры, интоксикация (алкоголь, транквилизаторы). Важнейшие клинические ориентиры: сухая, бледно-желтушная, холодная кожа, иногда с геморрагическими высыпаниями, брадикардия (урежение частоты сердечных сокращений), гипотония (снижение артериального давления), редкое дыхание, уменьшение мочевыделения, снижение и даже исчезновение сухожильных рефлексов. Лабораторные исследования выявляют кислородную недостаточность, увеличение содержания углекислого газа в крови, гипогликемию (уменьшение глюкозы в крови), гипонатриемию (уменьшение натрия в крови), ацидоз, высокий уровень холестерина и нарушение липидного спектра, увеличение гематокрита и вязкости крови.
Диагностика и дифдиагностика Диагностика выраженных форм гипотиреоза, тем более у лиц, перенесших операции на щитовидной железе, получавших лечение радиоактивным йодом, не вызывает особых затруднений. Сложнее выявление легких форм со скудной, не всегда типичной клинической симптоматикой, особенно у больных пожилого возраста, где легко заподозрить сердечно-сосудистую недостаточность, заболевания почек и др. У молодых и среднего возраста женщин ряд сходных с гипотиреозом симптомов наблюдается при синдроме «идиопатических» отеков. Диагноз первичного гипотиреоза уточняется рядом диагностических лабораторных исследований. Функциональная недостаточность щитовидной железы характеризуется снижением йода, связанного с белком. В последние годы появилась возможность прямого определения в крови тиреотропного гормона, а также Т3, Т4, радиоиммунным методом с использованием коммерческих наборов. Наибольшую диагностическую ценность при гипотиреозе имеет определение тиреотропного гормона, уровень которого значительно возрастает, и вычисление индекса свободного тироксина. При вторичном гипотиреозе содержание йодсвязывающего белка снижено, однако результаты пробы с внутримышечным введением тиреотропного гормона показывают, что они в отличие от первичного гипотиреоза увеличиваются. Исходное содержание данного гормона снижено, а при пробе с ним у больных с гипофизарным происхождением заболевания эффекта не наблюдается. Для практических целей используются такие дополнительные методы, как определение времени ахиллова рефлекса, холестерина и липопротеидов крови, электрокардиографическое исследование.
Лечение Основным методом лечения всех форм гипотиреоза является заместительная терапия препаратами щитовидной железы. Препараты тиреотропного гормона обладают аллергизирующими свойствами и не используются в качестве лечебного средства при вторичном (гипофизарном) гипотиреозе. В последнее время появились работы об эффективности интраназального (400–800— 1000 мг) или внутривенного (200–400 мг), введения тиреотропного гормона в течение 25–30 дней у больных с вторичным гипотиреозом, вызванным дефектом внутренней стимуляции и секрецией биологически малоактивного тиреотропного гормона. Наиболее распространенным отечественным препаратом является тиреоидин, получаемый из высушенной щитовидной железы крупного рогатого скота в виде драже по 0,1 или 0,05 г. Ориентировочно 0,1 г тиреоидина содержит 8—10 мкг Т3 и 30–40 мкг Т4. Нестабильный состав препарата затрудняет его использование и оценку его эффективности, особенно на первых этапах лечения, когда нужны точные минимальные дозы. Действенность препарата снижается, а иногда и полностью прекращается также из-за плохой его всасываемости слизистой желудочно-кишечного тракта. Помимо тиреоидина, применяют таблетки тироксина по 100 мкг Т4, трийодтиронина — по 20 и 50 мкг, а также комбинированные препараты: тиреокомб (70 мкг Т, 20 мкг Т3 и 150 мг йодида калия), тиреотом (40 мкг Т4, 10 мкг Т3) и тиреотом форте (120 мкг Т4, 30 мкг Т3). Комбинированные препараты эффективнее подавляют секрецию тиреотропного гормона. Заместительная терапия проводится в течение всей жизни, исключая преходящие формы заболевания, например при передозировке тиреостатических препаратов во время лечения токсического зоба или в раннем послеоперационном периоде после хирургического удаления щитовидной железы. Основной принцип лечения гипотиреоза основывается на осторожном и постепенном, особенно в начале лечения, подборе дозы с учетом возраста больных, тяжести гипотиреоза, наличия сопутствующих заболеваний и характеристики препарата. Ошибочным является представление о том, что молодой возраст больных позволяет уже в самом начале лечения активно использовать тиреоидные препараты. Определяющим и ограничивающим врачебную тактику является не столько возраст, сколько тяжесть и длительность заболевания без лечения. Чем тяжелее гипотиреоз и чем дольше больные любого возраста были без заместительной терапии, тем выше их общая чувствительность, особенно восприимчивость миокарда к тиреоидным препаратам, и тем более постепенным должен быть процесс адаптации. Исключение составляют коматозные состояния, когда необходимы срочные меры.
ГИПОТОНИЧЕСКАЯ БОЛЕЗНЬ
ОпределениеГипотоническая болезнь (артериальная гипотония) — это клиническое снижение артериального давления ниже 100/60 мм рт. ст. у лиц в возрасте до 25 лет и ниже 105/65 мм рт. ст. у лиц старше 30 лет.
Этиология и патогенез В современной клинической практике различают гипотонии физиологические и патологические. Физиологическая артериальная гипотония, обусловленная в основном особенностями телосложения и наследственными факторами, встречается нередко у совершенно здоровых людей, выполняющих обычную физическую и умственную работу, и не сопровождается какими-либо жалобами и патологическими изменениями в организме. Известна физиологическая гипотония спортсменов. К физиологическим относят также артериальные гипотонии, развивающиеся в процессе акклиматизации и адаптации организма человека в условиях высокогорья, Заполярья, субтропического или тропического климата. Резкое снижение артериального давления в этих условиях объясняется прежде всего уменьшением содержания кислорода в атмосферном воздухе, постоянным ветром, очень низкой или очень высокой температурой, сухостью воздуха, интенсивной солнечной радиацией и т. д. Патологическая гипотония подразделяется на первичную и вторичную, в каждой из которых выделяют острые и хронические формы. В основе первичной артериальной гипотонии лежат повышение тонуса парасимпатического отдела периферической нервной системы, нарушение периферической нервной регуляции, ведущее к стойкому уменьшению общего периферического сопротивления току крови. Компенсаторное увеличение сердечного выброса в этих случаях оказывается недостаточным для нормализации артериального давления. Скорость кровотока при первичной хронической артериальной гипотонии обычно не изменена. Объем циркулирующей крови находится в пределах нормы или несколько снижен. Указанные сдвиги обусловлены, скорее всего, отчетливым уменьшением гормональной активности коры надпочечников при неизмененной активности их мозгового вещества. Экскреция с мочой адреналина достоверно снижена, а дофамина — повышена. При ортостатической гипотонии (падение артериального давления при резком изменении положения тела из горизонтального в вертикальное) обнаруживается стабильное снижение активности ренина (вещества, способствующего повышению давления) и уровня циркулирующих катехоламинов в плазме крови. Определенное значение в развитии ортостатической гипотонии имеют электролитные сдвиги (тенденция к повышению уровня натрия и калия крови при несколько увеличенном выведении с мочой ионов натрия и уменьшенной — ионов калия). Основное значение в возникновении гипотонической болезни, по-видимому, принадлежит длительному психоэмоциональному напряжению, в отдельных случаях — психической травме. По современным представлениям, первичная гипотония является особой формой невроза высших сосудодвигательных центров с нарушением регуляции сосудистого тонуса. Таким образом, не вызывает сомнений тот факт, что в процессе развития гипотонической болезни ведущую роль играют нарушения центральной и вегетативной нервных систем.
Клиническая картина Жалобы больных разнообразны и многочисленны (вялость, апатия, ощущение резкой слабости и утомляемости по утрам, ухудшение памяти, пониженная работоспособность). Часто отмечаются ощущение нехватки воздуха в покое и выраженная одышка при умеренной физической нагрузке, незначительная отечность или отеки голеней и стоп к вечеру. У большинства больных отмечаются раздражительная эмоциональная неустойчивость, нарушения сна (сонливость днем и бессонница ночью), потенции и либидо у мужчин и менструального цикла у женщин. К этому нередко присоединяются ощущения тяжести в эпигастральной области и горечи во рту, снижение аппетита, отрыжка воздухом, изжога, метеоризм, запоры. На основании преобладания болей в области сердца или головных болей различают преимущественно кардиальную или церебральную форму первичной артериальной гипотонии. В отличие от приступа стенокардии, при первичной артериальной гипотонии тупая, колющая или ноющая (значительно реже — давящая или сжимающая) боль локализуется в основном в области верхушки сердца; она не смещается, появляется обычно в покое или утром после сна (изредка возникает при чрезмерной физической нагрузке). Боль продолжается в течение нескольких часов, не прекращается антиангиальными средствами (нитроглицерин ухудшает состояние больного) и снимается иногда после легких физических упражнений. Для многих больных характерна ипохондрическая сосредоточенность на неприятных ощущениях в области сердца с тревогой и страхом за свою жизнь. Привычная головная боль иногда является единственной жалобой больного, возникает обычно после сна (особенно дневного), физической или умственной работы (иногда на фоне крайней усталости, неадекватной проделанной работе, вплоть до ощущения изнеможения). Развитию ее способствуют также резкие колебания атмосферного давления, обильный прием пищи и длительное неподвижное пребывание в вертикальном положении. Тупая, стягивающая, распирающая или пульсирующая головная боль захватывает чаще лобно-височную или лобно-теменную область (но может и не иметь четкой локализации) и продолжается от нескольких часов до 2 суток. В ряде случаев она протекает по типу мигрени, сопровождаясь тошнотой и рвотой, и исчезает от применения холода, после прогулки на свежем воздухе или физических упражнений. Не менее характерны периодические головокружения с повышенной чувствительностью к яркому свету, шуму, громкой речи и тактильным раздражениям, пошатыванием при ходьбе и обморочными состояниями (в душном помещении, при езде в транспорте). Отмечаются непостоянные боли в суставах (артралгии) и мышцах (миалгии), тупая тянущая или ноющая боль в суставах и мышцах конечностей при отсутствии каких-либо объективных изменений. При объективном обследовании у большинства больных выявляются те или иные нарушения в периферических нервных центрах: переувлажнение голеней и стоп, дрожание век и пальцев рук, бледность кожи с легкой синюшной окраской, стойкий красный дермографизм и расстройства терморегуляции с выраженными суточными колебаниями температуры тела и падением ее по утрам ниже 36 °C. Артериальное давление и пульс очень изменчивы и зависят от положения тела, времени суток и состояния больного. Данные лабораторных исследований не выходят, как правило, за пределы нормы. Лишь у небольшой части больных имеется склонность к умеренной анемии и лейкопении с лимфоцитозом и замедлением СОЭ. Первичная артериальная гипотония отличается волнообразным течением. Патологический процесс обостряется в основном весной и летом, а также после острых инфекционных заболеваний.
Диагностика и дифдиагностика Диагноз ставится на основании жалоб больного и клинических проявлений артериальной гипотонии. Первичную и вторичную артериальную гипотонию различают (дифференцируют) путем исключения различных патологических процессов (прежде всего профессиональных вредностей), ведущих к стойкому снижению артериального давления. Так, нормализация последнего после выявления и удаления очагов хронической инфекции подтверждает симптоматический характер артериальной гипотонии. При отсутствии указаний на патологические изменения внутренних органов целесообразно тщательное обследование больного у эндокринолога и психиатра.
Лечение Лечение артериальной гипотонии предполагает выполнение ряда гигиенических мероприятий. К ним относятся: четкий режим дня (ночной сон не менее 8 ч, утренняя и производственная гимнастика, водные тонизирующие процедуры после гимнастических упражнений, систематическое чередование труда и отдыха с пешими походами на небольшие расстояния, лыжные и велосипедные прогулки, плавание); правильная организация труда; полноценное и разнообразное четырехразовое питание (с увеличением в рационе белков животного происхождения, витаминов и поваренной соли, крепкий чай и кофе по утрам и в середине дня). Большое распространение в лечении гипотонической болезни получили растительные и биологические нейростимуляторы, к которым относятся пантокрин, экстракт элеутерококка, настойка лимонника, экстракт родиолы, настойка аралии, настойка заманихи. Их рекомендуют назначать вместе с настойкой из корня валерианы. Отмечена эффективность от приема элеутерококка по 30 капель за 30 мин до еды 3 раза в день с витамином С по 0,2 г 3 раза в день. Положительный эффект дает применение сапарала, кофеина (по 0,05—0,1 г 2–3 раза в день), этимизола по 0,1 г 2–3 раза в день в течение 2–3 недель (способствует нормализации сосудистого тонуса). Рекомендуются физиотерапевтические процедуры, оказывающие общее тонизирующее действие и повышающие артериальное давление (электрофорез с 5 %-ным раствором кальция хлорида, 1 %-ным раствором кофеина, эфедрина или мезатона, диадинамотерапия области шейных симпатических узлов, дождевой или циркулярный душ, общее ультрафиолетовое облучение). Бальнеотерапия оказывает выраженное положительное влияние на состояние больных артериальной гипотензией. Рекомендуются ванны из минеральных вод (кислородные, жемчужные и углекислые) с постепенным снижением температуры воды с 36 до 32 °C. Успешно применяются тонизирующий массаж, массаж околопозвоночных зон, точечный массаж, а также иглоукалывание. В резистентных случаях используют фетанол по 1 г 1 %-ного раствора подкожно или внутрь по 0,005 г 2–3 раза в день; секуринин по 1 г 0,25 %-ного раствора подкожно или внутрь по 0,002 г 2–3 раза в день в течение 20–30 дней. Рекомендуется санаторно-курортное лечение.
ГИПОТРОФИЯ
ОпределениеГипотрофия — хроническое расстройство питания, характеризующееся различной степенью потери массы тела. Как правило, гипотрофией страдают дети раннего возраста.
Этиология и патогенез Заболевание может возникнуть в результате ряда причинных факторов. Различают врожденную (пренатальную) и приобретенную (постнатальную) гипотрофию. Врожденная гипотрофия чаще всего обусловлена заболеваниями матери или связана с внутриутробной кислородной недостаточностью, инфекцией плода, геномными и хромосомными мутациями. Среди причин приобретенной гипотрофии выделяют экзогенные (факторы внешней среды) и эндогенные (факторы внутренней среды организма). К первым относят алиментарные (пищевые) факторы (гипогалактия у матери, неправильно рассчитанный рацион при искусственном вскармливании, одностороннее кормление и др.), пилоростеноз и пилороспазм, лекарственные отравления (гипервитаминоз D и др.), инфекциижелудочно-кишечного тракта, недостатки ухода, режима, воспитания и т. д. Эндогенными причинами гипотрофии могут быть пороки развития желудочно-кишечного тракта и других органов, поражения центральной нервной системы, наследственные аномалии обмена веществ и иммунодефицитные состояния, эндокринные заболевания и т. д. В основе механизма развития гипотрофии лежит снижение утилизации пищевых веществ с нарушением процессов переваривания, всасывания и усвоение их под воздействием различных факторов.
Клиническая картина Различают I, II, III степени тяжести гипотрофии. Гипотрофия I степени характеризуется потерей массы тела не более чем на 20 % от долженствующей по возрасту. При этом истончается подкожный жировой слой на животе, понижается упругость тканей. Кривая нарастания массы тела уплощена. Другие показатели, как правило, в пределах нормы или слегка снижены. При гипотрофии II степени потеря массы тела составляет 25–30 % по сравнению с возрастной нормой. Подкожный слой сохраняется только на лице, особенно истончен он на животе и конечностях. Кожа сухая, легко собирается в складки, кое-где свисает. Наблюдается отставание в росте, снижается аппетит, ребенок становится раздражительным, утрачивает приобретенные ранее навыки, нарушается терморегуляция. Стул неустойчивый: «голодный» стул (скудный, сухой, обесцвеченный, с резким и неприятным запахом) сменяется диспепсическим (зеленого цвета, непереваренные частицы пищи, со слизью). При гипотрофии III степени потеря массы тела составляет более 30 % от долженствующей до возрасту. Нарастание массы тела отсутствует, ребенок значительно отстает в росте. Внешне — крайняя степень истощения, кожные покровы бледно-серого цвета, полностью отсутствует подкожный жировой слой. Слизистые оболочки бледные, сухие, во рту элементы кандидозного стоматита (молочницы). Дыхание поверхностное, тоны сердца приглушены, артериальное давление снижено. Температура тела понижена, отмечаются периодические незначительные ее повышения, отсутствует разница между подмышечной и ректальной температурой. Инфекционные процессы протекают малосимптомно. Нередко имеются признаки подостро текущего рахита.
Осложнения При первичной гипотрофии III степени прогноз всегда серьезен; летальность составляет до 30 %.
Диагностика Установление диагноза гипотрофии обычно не представляет трудностей. Значительно труднее выяснить причины гипотрофии.
Лечение Лечение больных должно быть комплексным и включает мероприятия, направленные на устранение или коррекцию причинно-значимых факторов, диетотерапию, назначение общеукрепляющих процедур, ферментов и симптоматических средств, ликвидацию очагов инфекции, витаминотерапию. Во всех случаях при назначении диеты необходимо выяснить устойчивость к пище. В период усиленной пищевой нагрузки нужен копрологический контроль. При гипотрофии I степени бывает достаточно устранить выявленные дефекты вскармливания, наладить питание и общий режим ребенка. При гипотрофии I степени количество белков и углеводов обычно рассчитывают на 1 кг массы тела, долженствующей по возрасту, а жиров — на 1 кг существующей массы тела. При гипотрофии II степени установление устойчивости к пище проводят в течение 3–5 дней. Назначают, как правило, грудное молоко или кислые смеси (кефир, ацидофильная «Малютка», биолакт и др.). Расчет вначале ведут на существующую массу тела ребенка, затем на приблизительно долженствующую (существующая +20) и лишь потом на долженствующую. С 3—4-го дня постепенно увеличивают белковую нагрузку, затем углеводную и в последнюю очередь жировую. При гипотрофии III степени предпочтительно диетотерапию начинать с введения грудного молока каждые 2 ч по 20–30 мл. Доведя количество пищи до 50 мл, уменьшают число кормлений. Порядок увеличения нагрузки белками, углеводами и жирами такой же, как и при гипотрофии II степени, но более постепенный. Устойчивость к пище выясняется в течение 2 недель. При гипотрофии II и III степени недостающее количество жидкости, питательных веществ и электролитов вводят внутривенно капельно: 5—10 %-ный раствор глюкозы, изотонический раствор хлорида натрия, раствор Рингера, белковые гидролизаты, альбумин, протеин и др. (альбумин 3–5 мл/кг; гемодез до 15 мл/кг, но не более 200 мл; реополиглюкин 3–8 мл/кг). Показано проведение инсулинглюкозотерапии (п/к 1 ЕД инсулина на 5 г вводимой глюкозы). Лечение гипотрофии IV степени необходимо проводить в стационаре. При наличии очагов инфекции назначают антибиотики (избегать нефро-, гепато- и ототоксичных препаратов), при необходимости проводят хирургическое вмешательство. Широко используют ферментотерапию, витаминотерапию. Из стимулирующих средств назначают апилак, гаммаглобулин, альбумин, плазму, переливания крови. В ряде случаев целесообразно применять анаболические гормоны (ретаболил 1 мг/кг 1 раз в 2 недели и др.). Показаны массаж и ЛФК, пребывание на свежем воздухе.
Профилактика По возможности обеспечение естественного вскармливания, лечение гипогалактии, рациональное вскармливание, ранняя диагностика заболеваний новорожденных и детей грудного возраста.
ГИПОФИЗАРНЫЙ НАНИЗМ
ОпределениеГипофизарный нанизм (карликовость) — заболевание, характеризующееся задержкой роста и физического развития, связанное с нарушением секреции гормона роста — передней долей гипофиза. Карликовым считают рост взрослого мужчины ниже 130 см, взрослой женщины — ниже 120 см.
Этиология Большинство форм гипофизарного нанизма относится к генетическим заболеваниям. Наиболее распространенной является пангипопитуитарная карликовость. Большую группу больных нанизмом (первично-церебральным, церебрально-гипофизарным) составляют больные с различными видами органической патологии центральной нервной системы, возникшими внутриутробно или в раннем детском возрасте. Анатомическим субстратом, вызывающим эту патологию, могут являться недоразвитие или отсутствие гипофиза, его дистопия (другое место развития) при патологии формирования турецкого седла, кистозная дегенерация гипофиза, его атрофия вследствие сдавливания опухолью. Нанизм может быть вызван травматическими повреждениями гипоталамо-гипофизарной области, что часто возникает при многоплодной беременности. Имеют значение инфекционные и токсические повреждения (внутриутробные вирусные инфекции, туберкулез, сифилис, малярия, токсоплазмоз; заболевания в раннем возрасте, сепсис, менингоэнцефалит и пр.). Эти процессы могут повреждать сам гипофиз, регулирующие его функцию гипоталамические центры, нарушать нормальные функциональные связи в центральной нервной системе. Дополнительными факторами, усугубляющими нарушение физического развития при нанизме, могут быть неполноценное, не сбалансированное по основным ингредиентам и микроэлементам (дефицит цинка) питание и неблагоприятные условия внешней среды, а также различные хронические заболевания, например гломерулонефрит, при котором азотемия воздействует на активность рецепторов печени или прямо влияет на обмен веществ печеночных клеток, вызывая снижение синтеза соматомедина или цирроз печени, когда нарушено образование соматомедина. Таким образом, основными звеньями механизма развития являются снижение или выпадение соматотропной функции гипофиза, биологическая неактивность гормона роста или нарушение чувствительности к нему периферических тканей.
Патанатомия При изолированной недостаточности соматотропного гормона морфологические изменения в гипофизе изучены мало. В исследованных случаях патологические нарушения обнаруживают редко. При этом типе нанизма может наблюдаться врожденное недоразвитие пептидэргических клеток или дефект системы нейротрансмиттеров в гипоталамусе. В таких случаях возможно сочетание нанизма с дисплазией или гипоплазией (с нарушением или недоразвитием) зрительных нервов. К недостаточности соматотропного гормона ведут интранелярные кисты, опухоли гипофиза и гипоталамуса, вызывающие сдавление гипофизарной ткани, в частности соматотрофов. При карликовости отмечаются истончение костей за счет кортикального слоя, задержка дифференцировки и окостенения скелета. Внутренние органы недоразвиты, иногда атрофичны, мышцы развиты слабо.
Клиническая картина Задержка роста выявляется в первые месяцы жизни ребенка, реже — в период полового созревания (учитывают не только рост и массу тела, но и динамику этих показателей). Тело сохраняет пропорции, свойственные детскому возрасту. Отмечаются отставание дифференцировки и синостозирования скелета от возраста, задержка смены зубов. Кожа сухая, бледная, морщинистая; слабое развитие подкожной жировой клетчатки, иногда избыточное отложение жира на груди, животе, бедрах. Слаборазвита мышечная система. Выпадение гонадотропной функции гипофиза проявляется признаками недостаточности полового развития. У больных мужского пола половые железы и половой член уменьшены по сравнению с возрастными нормами, мошонка недоразвита, отсутствуют вторичные половые признаки. У большинства больных женского пола также выражены явления гипогонадизма: отсутствуют менструации, недоразвиты молочные железы, вторичные половые признаки. Умственное развитие нормальное, с некоторыми ювенильными чертами. При неврологическом обследовании могут быть выявлены признаки органического поражения нервной системы. Характерно уменьшение размеров внутренних органов, нередки гипотензия (пониженное артериальное давление), брадикардия (урежение частоты сердечных сокращений). Возможны явления вторичного гипотиреоза и вторичного гипокортицизма.
Диагностика Турецкое седло, как правило, уменьшено, нередко имеется обызвествление его диафрагмы; при наличии опухоли гипофиза выявляются увеличение турецкого седла, разрушение его стенок. При рентгенологическом исследовании кистей и лучезапястных суставов отмечается задержка дифференцировки и окостенения скелета. Базальная концентрация гормона роста в сыворотке крови снижена или в пределах нормы, введение инсулина (инсулиновый тест) или аргинина не сопровождается повышением секреции гормона роста, в некоторых случаях может быть кратковременное и незначительное повышение его секреции.
Лечение С целью стимуляции роста применяют прерывистые курсы терапии анаболическими стероидами (метиландростендиол — 1–1,5 мг/кг в сутки под язык, метандростенолол — 0,1–0,15 мг/кг в сутки, феноболин — 1 мг/кг в месяц, месячную дозу вводят за 2–3 приема, ретаболил — 1 мг/кг в месяц). Соматотропин человека (при низком уровне эндогенного соматотропина) по 4 ЕД внутримышечно 3 раза в неделю курсами по 2 месяца с перерывами 2 месяца. Больным с клиническими проявлениями гипотиреоза назначают тиреоидин, тиреогом, тиреокомб, тироксин. Для стимуляции полового развития после закрытия зон роста назначают половые гормоны: женщинам — эстрогены и препараты желтого тела (синэстрол, микрофоллин, эстрадиоладипропионат, прегнин, прогестерон, инфекундин), хорионический гонадотропин; мужчинам — хорионический гонадотропин и препараты тестостерона (тестостерона пропионат, тестэнат, сустанон-250, омнадрен), при гипофункции коры надпочечников — преднизолон, кортизон, дезоксикортикостерона ацетат. При нарушении функции центральной нервной системы назначают глутаминовую кислоту, церебролизин, аминалон. В некоторых случаях проводят дегидратационную (фуросемид, верошпирон, гипотиазид), рассасывающую (бийохинол, алоэ) терапию. Диета с увеличенным содержанием белка, витаминов.
ГЛАУКОМА
ОпределениеГлаукома — это хроническое заболевание глаз, характеризующееся постоянным или периодическим повышением внутриглазного давления, особой формой атрофии зрительного нерва и характерными изменениями поля зрения. Различают первичную, вторичную и врожденную глаукому.Врожденная глаукома бывает наследственной (около 15 % случаев) и внутриутробной (около 85 % случаев). Глаукома ювенильная (юношеская) развивается в молодом возрасте вследствие врожденных дефектов структуры радужно-роговичного угла радужки; наблюдается наследственная передача этих дефектов. При вторичной глаукоме повышение внутриглазного давления является следствием другого заболевания глаза (или всего организма) или повреждения глаза.
Этиология и патогенез Первичная глаукома В развитии первичной глаукомы имеют значения как местные, так и общие факторы. К местным факторам относятся изменения дренажной системы и микрососудов глаза, к общим — наследственная предрасположенность, нейроэндокринные и гемодинамические нарушения. Повышению внутриглазного давления предшествуют трофические изменения в дренажной системе глаза, что приводит к нарушению циркуляции водянистой влаги и повышению внутриглазного давления. В классификации первичной глаукомы учитываются форма и стадия заболевания, уровень внутриглазного давления и динамика зрительных функций. Форма глаукомы определяется состоянием радужно-роговичного угла передней камеры и местом нарушения основного сопротивления оттока водянистой влаги. Различают открытоугольную и закрытоугольную формы глаукомы.
Первичная открытоугольная глаукома Открытоугольная глаукома характеризуется дистрофическими изменениями сетчатой ткани и каналов различной степени выраженности, блокадой шлеммова канала. К разновидностям открытоугольной глаукомы относятся пигментная, псевдоэксфолиативная и глаукома с невысоким внутриглазным давлением. При пигментной открытоугольной глаукоме пигмент полностью закрывает сетчатую зону, что приводит к нарушению оттока водянистой влаги и повышению внутриглазного давления. При псевдоэксфолиативной глаукоме псевдоразрастания откладываются на задней поверхности роговицы, радужке, ресничном теле и в радужно-роговичном углу передней камеры. Псевдоэксфолиативная глаукома часто сочетается с катарактой. Для глаукомы с невысоким внутриглазным давлением характерны типичные симптомы первичной глаукомы: изменение поля зрения, частичная атрофия зрительного нерва с глаукоматозным перерождением диска зрительного нерва. Поражение зрительного нерва нередко связано с низкой устойчивостью его к внутриглазному давлению, а также с выраженным склерозом сосудов, питающих зрительный нерв. Глаукома с невысоким внутриглазным давлением нередко сочетается со стойкой вегетососудистой дистонией, протекающей по гипотензивному типу.
Первичная закрытоугольная глаукома Закрытоугольная глаукома характеризуется блокадой радужно-роговичного угла передней камеры корнем радужки, а также развитием спаек. Разновидностями закрытоугольной глаукомы являются глаукома со зрачковым блоком, с укорочением радужно-роговичного угла передней камеры, с плоской радужкой и витреохрусталиковым блоком. При смешанной форме глаукомы сочетаются признаки открытоугольной и закрытоугольной глаукомы. Выделяют четыре стадии болезни: начальную, развитую, далеко зашедшую и терминальную, а также острый приступ закрытоугольной глаукомы. Стадии глаукомы определяются по состоянию поля зрения и диска зрительного нерва. В начальной стадии нет краевой экскавации диска и изменений периферических границ поля зрения. Развитая и далеко зашедшая стадии глаукомы характеризуются наличием краевой экскавации, сужением периферических границ поля зрения и появлением центральных и парацентральных ограниченных участков зрения. При развитой стадии заболевания поля зрения сужены не менее чем на 5° с внутренней стороны, при далеко зашедшей стадии поле зрения хотя бы в одном меридиане сужено, не выходит за пределы 15° от точки фиксации. По состоянию внутриглазного давления различают нормальное, умеренно повышенное и высокое внутриглазное давление.
Врожденная глаукома Внутриутробная глаукома возникает в результате воздействия различных патологических факторов на глаз плода, что приводит к порокам развития переднего отдела глаза. Повышение внутриглазного давления возникает из-за нарушения оттока внутриглазной жидкости вследствие закрытия радужно-роговичного угла передней камеры нерассосавшейся эмбриональной мезодермальной тканью. Реже причиной ретенции (образования закупорки) водянистой влаги могут быть переднее прикрепление радужки, а также внутрисклеральные изменения.
Вторичная глаукома при иридоциклитах и увеитах Причинами этого заболевания являются передние увеиты (см.), протекающие в остром периоде с накоплением жидкости в переднюю камеру глаза. Накопленная жидкость закрывает фильтрующую зону угла передней камеры и ухудшает отток внутриглазной жидкости. Имеют значение также изменения сосудов сосудистого тракта, связанные с воспалительным процессом (расширение капилляров, стаз крови). При хронических увеитах вторичная глаукома развивается вследствие образования задней круговой спайки зрачка, сращиваний, нарушающих нормальный отток водянистой влаги, что приводит к резкому повышению внутриглазного давления.
Вторичная глаукома при нарушениях кровообращения в сосудах глаза, глазницы и внутриглазных кровоизлияниях Причинами являются чаще всего тромбоз центральной вены сетчатки, реже — нарушения венозного кровообращения в орбите, нарушения венозного оттока в вортикозных и передних ресничных венах, внутриглазные кровоизлияния. Вторичная глаукома при тромбозе центральной вены сетчатки возникает вследствие патологических изменений на путях оттока водянистой влаги. При гемофтальме причиной повышения внутриглазного давления являются отложения продуктов распада крови вследствие внутриглазных геморрагий, заполняющие фильтрующую систему. В дальнейшем в углу передней камеры формируется соединительная ткань с новообразованными сосудами. Эти изменения увеличивают сопротивление оттоку водянистой влаги и ведут к стойкому повышению внутриглазного давления. Вторичная глаукома может развиться также при ретинопатиях различной причины возникновения.
Клиническая картина Первичная открытоугольная глаукома Открытоугольная глаукома обычно возникает после 40 лет. Начало заболевания нередко бессимптомное. Жалобы на появление радужных кругов вокруг источника света, периодическое затуманивание зрения отмечаются только у 15–20 % больных. Нередко наблюдается раннее, не соответствующее возрасту ослабление аккомодации. Изменения в переднем отделе глаза обычно незначительны. Иногда имеется расширение цилиарных артерий и эписклеральных вен. Глубина передней камеры при открытоугольной глаукоме обычно не изменена. Рано появляются изменения в радужке в виде сегментарных атрофий ресничной зоны или диффузной атрофии зрачковой зоны с разрушением ее пигментной каймы. Особенностью клинической картины открытоугольной глаукомы является также развитие глаукоматозной атрофии зрительного нерва в виде краевой экскавации. При этом около диска зрительного нерва возможно появление кольца беловатого или желтоватого цвета (гало). При исследовании радужно-роговичный угол передней камеры всегда открыт. Как правило, он бывает достаточно широким и лишь в редких случаях несколько суженным. Отмечается пигментация радужно-роговичного угла передней камеры. Внутриглазное давление при открытоугольной глаукоме повышается медленно и постепенно по мере нарастания сопротивления оттоку водянистой влаги. Установлены следующие средние цифры коэффициента легкости оттока, соответствующие стадиям развития открытоугольной глаукомы: в начальной стадии — 0,14, в развитой и далеко зашедшей — 0,08, в терминальной — 0,04 мм3/мин на 1 мм рт. ст. С нарастающими явлениями глаукоматозной атрофии диска зрительного нерва связано ухудшение зрительных функций. Ранние изменения поля зрения проявляются расширением слепого пятна и появлением небольших ограниченных слепых участков (скотома) в парацентральной области, переходящих позднее в дуговую скотому Бьеррума. При дальнейшем развитии глаукоматозного процесса выявляются дефекты периферического поля зрения. Сужение поля зрения происходит преимущественно с носовой стороны (в верхненосовом секторе). В поздних стадиях заболевания поле зрения суживается концентрически. Острота зрения обычно снижается только в поздних стадиях заболевания. Первичной открытоугольной глаукомой страдают люди среднего и пожилого возраста. В их организме нередко выявляются изменения, свойственные этой возрастной группе. Ряд факторов отрицательно влияют на течение и прогноз первичной открытоугольной глаукомы: пониженное артериальное давление, наличие шейного остеохондроза, склеротические изменения черепных сосудов. Перечисленные факторы приводят к ухудшению кровоснабжения мозга и глаза. Это способствует нарушению нормального обмена веществ в тканях глаза и зрительного нерва, снижению зрительных функций. К местным факторам, отрицательно влияющим на течение и прогноз открытоугольной глаукомы, относятся снижение устойчивости диска зрительного нерва к сдавлению, ухудшение тонографических показателей, неустойчивое, с частыми подъемами, внутриглазное давление (выше 28 мм рт. ст. при тонометрии с грузом 10 г), возрастающее соотношение диаметров экскавации и диска зрительного нерва.
Первичная закрытоугольная глаукома Закрытоугольная глаукома составляет 20 % случаев первичной глаукомы и развивается обычно в возрасте старше 40 лет. Она значительно чаще встречается у лиц с дальнозоркостью, так как анатомические особенности глаз с такой рефракцией (мелкая передняя камера и большой хрусталик) предрасполагают к ее развитию. Закрытоугольная глаукома протекает с периодами обострений и улучшений. На механизм повышения внутриглазного давления влияют два основных фактора: продвижение вперед хрусталиковой диафрагмы (или образование складки радужки у ее корня при расширении зрачка) и функциональный зрачковый блок. Радужка при этом принимает выбухающую конфигурацию (бомбаж) и вызывает блокаду угла передней камеры. Болезнь течет волнообразно — с повышениями внутриглазного давления (приступы) и межприступными периодами. Острый приступ закрытоугольной глаукомы провоцируется эмоциональным возбуждением, расширением зрачка, обильным приемом жидкости, перееданием, охлаждением, положением тела, вызывающим венозный застой в области глаз (при длительном наклоне головы вниз, сдавливании шеи и др.), приемом алкоголя в значительном количестве. Больные жалуются на боль в глазу, отдающую по ходу тройничного нерва в область лба и висков, затуманивание зрения, появление радужных кругов при взгляде на источник света. Отмечаются замедление пульса, тошнота, иногда рвота. Перечисленные симптомы наблюдаются все вместе или каждый в отдельности. При остром приступе глаукомы понижается острота зрения. Выявляются расширение передних эписклеральных сосудов (застойная инъекция), помутнение роговицы из-за отека, мелкая передняя камера, расширение зрачка с резко сниженной реакцией на свет. Иногда влага передней камеры мутнеет вследствие увеличения содержания в ней белка. Радужка покрасневшая, ткань ее отечна. В хрусталике нередко появляются помутнения в виде белых пятен, расположенных внутри капсулы. Отек роговицы затрудняет осмотр глазного дна. Если удается уменьшить отек роговицы, то становится видно, что диск зрительного нерва отечен, а вены сетчатки расширены. Во время острого приступа глаукомы внутриглазное давление достигает максимальной величины, радужно-роговичный угол передней камеры полностью закрыт. Внутриглазное давление быстро повышается, а давление в шлеммовом канале снижается. Корень радужки нередко прижимается к корнеосклеральной зоне с такой силой, что сдавливает сосуды радужки; это вызывает острое локальное нарушение кровообращения и очаговый некроз радужки, затем возникают зоны ее атрофии и деформация зрачка. Этот же процесс приводит к развитию асептического воспаления, появлению задних сращений и распылению клеток пигментного эпителия радужки, спаек и внутрикапсулярной катаракты. Может пострадать и зрительный нерв. Подострый приступ закрытоугольной глаукомы протекает более легко. При этом угол передней камеры глаза закрывается не на всем протяжении или недостаточно плотно, что и определяет клиническую картину заболевания. В легких случаях отмечается затуманивание зрения и появление радужных кругов при взгляде на источник света. Поверхностные сосуды глазного яблока расширены, роговица слегка отечна, несколько расширен зрачок. При гониоскопии отмечается блокада угла передней камеры глаза, но не на всем протяжении, а особенно внизу. Внутриглазное давление повышается до 40 мм рт. ст., коэффициент легкости оттока значительно снижается. При повышении внутриглазного давления до 60 мм рт. ст. симптомы более выражены: появляются боль в глазу и надбровной дуге. После подострого приступа, в отличие от острого, не бывает деформации и смещения зрачка, сегментарных атрофий и грубых спаек.
Врожденная глаукома Врожденная глаукома проявляется в трех формах: простая (собственно гидрофтальм) с изменениями в углу передней камеры глаза (наиболее часто встречающаяся); врожденная глаукома с аномалиями в переднем отделе глаза или всего глаза (аниридия, эктопия хрусталика, микрофтальм и др.); врожденная глаукома при факоматозах (ангиоматоз, нейрофиброматоз). В большинстве случаев врожденная глаукома проявляется у новорожденных или в первые 6 месяцев жизни ребенка, а также на первом году жизни. Врожденная глаукома характеризуется прогрессирующим течением. Различают пять стадий заболевания: начальную, развитую, далеко зашедшую, почти абсолютную и абсолютную. По состоянию внутриглазного давления выделяют компенсированную, некомпенсированную и декомпенсированную врожденную глаукому. В начальной стадии болезни отмечаются светобоязнь, слезотечение, тусклость роговицы; длина сагиттальной (идущей спереди назад) оси глаза и диаметр роговицы нормальные или слегка увеличены. В развитой стадии вследствие дальнейшего растяжения оболочек глазного яблока длина сагиттальной оси глаза и диаметр роговицы увеличиваются и нарастает отек роговицы. Возникают разрывы оболочки и помутнения роговицы. Передняя камера становится глубже. Наступают изменения в радужке в виде атрофии и гипоплазии, обесцвечивание. Зрачок расширен. Наблюдается экскавация диска зрительного нерва. Острота зрения снижена, поле зрения сужено с носовой стороны до 45–35 °C (если возраст ребенка позволяет их исследовать). Далеко зашедшая стадия болезни характеризуется резким увеличением длины сагиттальной оси глаза и диаметра роговицы. Место перехода роговицы глаза в склеру (лимб) растянуто. Склера истончается, через нее просвечивает синевато-голубоватым цветом сосудистая оболочка. Передняя камера глубокая. Имеются дегенеративные изменения роговицы. Зрачок широкий. Диск зрительного нерва сероватого цвета, экскавация его увеличивается. Острота зрения резко снижается, поле зрения концентрически сужается, преимущественно с носовой стороны (до 15 °C). В стадии почти абсолютной и абсолютной глаукомы все эти явления нарастают, нередко развиваются осложнения (подвывих и вывих хрусталика, внутриглазные кровоизлияния, осложненная катаракта, отслойка сетчатки и др.), зрение снижено до светоощущения с неправильной проекцией, в абсолютной стадии наблюдается полная слепота.
Ювенильная глаукома Ювенильная (юношеская) глаукома развивается в молодом возрасте. Наблюдается наследственная передача. Обычно болеют лица не старше 30 лет. У одних больных отмечаются изменения в радужке, у других первые симптомы проявляются на втором десятилетии жизни, прогрессируют медленно, роговица нормальной величины, передняя камера глубокая. Первичная ювенильная глаукома (ПЮГ) Возникает в возрасте от 11 до 35 лет, наследственность связана с нарушениями в хромосоме 1 и TIGR, патомеханизмы трабекулопатия и (или) гониодисгенез, ВГД повышено, изменения ДЗН и зрительных функций по глаукомному типу.
Вторичная глаукома Глаукома может развиваться в различные сроки после удаления катаракты (см.). Повышение внутриглазного давления в ранние сроки после удаления катаракты связано со зрачковым блоком в результате закрытия зрачка стекловидным телом, остаточными хрусталиковыми массами или введенным в глаз воздухом. Повышение внутриглазного давления в поздние сроки после удаления катаракты может быть обусловлено зрачковой или ангулярной блокадой, развившейся вследствие послеоперационных осложнений (иридоциклит (см.), образование сращений). Иногда глаукома может быть проявлением первичной открытоугольной глаукомы, не выявленной до удаления катаракты.
Вторичная глаукома при иридоциклитах и увеитах При вторичной глаукоме, являющейся осложнением хронического увеита, в свете щелевой лампы обнаруживаются единичные отложения на задней поверхности роговицы, в углу передней камеры накопившейся жидкости, сращений.
Вторичная глаукома при нарушениях кровообращения в сосудах глаза, глазницы и внутриглазных кровоизлияниях Клиника определяется основным заболеванием. Вторичная геморрагическая глаукома при тромбозе центральной вены сетчатки развивается через 3–8 месяцев после начала заболевания и протекает тяжело. При различных процессах в глазнице внутриглазное давление может повышаться весьма значительно — вплоть до развития приступа глаукомы.
Диагностика Первичная глаукома Ранняя диагностика первичной глаукомы имеет исключительно важное значение. Она основывается на учете жалоб больного, сведений о заболевании, клинической картины, результатов исследования функций глаза, особенно центральной области поля зрения, состояния внутриглазного давления и данных тонографии. Ведущее значение для диагностики глаукомы имеет определение уровня и регуляции внутриглазного давления с помощью тонометрии и тонографии, а также при исследовании центральной части поля зрения. Необходимость периодических и многократных измерений внутриглазного давления больным глаукомой приводит к тому, что у некоторых из них развивается аллергическая реакция на дикаин. Таким больным перед измерением внутриглазного давления для анестезии роговицы вместо раствора дикаина необходимо применять 3–5 %-ный раствор тримекаина. Тонометрия — основной метод определения внутриглазного давления. Измерение давления производится больному в положении лежа тонометром с грузом 10 г, при этом определяется тонометрическое давление, которое в норме не должно превышать 27 мм рт. ст. Разница внутриглазного давления в правом и левом глазу в норме не превышает 5 мм рт. ст. Весьма важной для диагностики глаукомы следует считать суточную тонометрию. Внутриглазное давление измеряют обычно в 6–8 ч утра и в 6–8 ч вечера; желательно измерять его и в середине дня. Суточные изменения внутриглазного давления (офтальмотонуса) определяют в стационаре или глаукомном диспансере: утреннее измерение внутриглазного давления проводят у пациента, еще находящегося в постели. Оптимальная длительность исследования — 7—10 дней, минимальная — 3–4 дня. Высчитывают средний утренний и вечерний показатели уровня внутриглазного давления и его амплитуду. В норме размах колебаний внутриглазного давления в течение суток не должен превышать 5 мм рт. ст. Размах колебаний более 5 мм рт. ст. является основанием для подозрения на глаукому. Большое значение имеет абсолютная величина подъемов офтальмотонуса (более 27 мм рт. ст.). Если они возникают неоднократно, то это служит достоверным признаком глаукомы. Эластотонометрия — метод определения внутриглазного давления при его измерении тонометрами различной массы. Для эластотонометрии применяют набор тонометров Маклакова массой 5; 7,5; 10 и 15 г, при помощи которых в порядке возрастания их массы 4 раза измеряют внутриглазное давление. Показания тонометров разной массы наносят на график: на оси абсцисс откладывается масса тонометров в граммах, на оси ординат — значения тонометрического внутриглазного давления. Высокое начало эластокривой (внутриглазное давление более 21 мм рт. ст. при тонометрии с грузом 5 г), укороченный или удлиненный тип эластокривых (размах менее 7 и более 12 мм рт. ст.) являются основанием для подозрения на глаукому. Более точные данные о гидродинамике глаза получают с помощью электронных тонографов. Тонография — метод исследования динамики водянистой влаги с графической регистрацией внутриглазного давления. Сущность метода заключается в продленной тонометрии с последующим вычислением основных показателей гидродинамики глаза — коэффициента легкости оттока и минутного объема водянистой влаги. Тонографические исследования проводят при помощи электронных тонографов. Коэффициент легкости оттока характеризует состояние путей оттока водянистой влаги из глаза в целом. Зная его, можно рассчитать минутный объем водянистой влаги. Наиболее убедительным для диагноза является сочетание результатов тонографии, суточной тонометрии и периметрии центральной части поля зрения. Если коэффициент легкости оттока меньше 0,15, а суточная кривая имеет патологический характер и имеются ограниченные слепые участки в центральной части поля зрения, диагноз глаукомы не вызывает сомнений. Подозрение на глаукому возникает в следующих случаях: внутриглазное давление, равное 27 мм рт. ст. и выше; жалобы, характерные для глаукомы; мелкая передняя камера; побледнение диска зрительного нерва (или его части) или начинающееся развитие глаукоматозной экскавации; асимметрия в состоянии двух глаз (уровень внутриглазного давления, глубина передней камеры, состояние дисков зрительного нерва); наличие мелких парацентральных относительных и абсолютных ограниченных слепых участков в поле зрения. Если при первом измерении внутриглазного давления по Маклакову (с грузом массой 10 г) тонометрическое давление оказывается равным 27 мм рт. ст. и выше, необходимо повторить измерение через 20–30 мин (строго соблюдая правила тонометрии), чтобы убедиться в наличии повышенного внутриглазного давления, исключив ошибку измерения. Дифдиагностику глаукомы проводят с офтальмогипертензией (см.).
Ювенильная глаукома В диагностике стертых форм имеют значение гонископические и тонографические исследования. У большинства больных юношеской глаукомой обнаруживаются остатки зародышевой ткани в углу передней камеры.
Вторичная глаукома Дифференциальный диагноз основывается на данных тонометрических, тонографических исследований и гонископии обоих глаз.
Вторичная глаукома при иридоциклитах и увеитах Диагноз основывается на данных тонометрии, эластометрии, тонографии, биомикроскопии и гониоскопии. Наличие отложений на задней поверхности роговицы отличает вторичную сосудистую глаукому от первичной. Вторичная глаукома при нарушениях кровообращения в сосудах глаза, глазницы и внутриглазных кровоизлияниях Диагноз основывается на клинической картине основного заболевания и данных тонометрических, тонографических исследований и гониоскопии.
Лечение Первичная открытоугольная глаукома В настоящее время медикаментозное лечение глаукомы проводят по трем основным направлениям: офтальмогипотензивная терапия (местная и общая) в целях нормализации внутриглазного давления; терапия, способствующая улучшению кровоснабжения внутренних оболочек глаза и внутриглазной части зрительного нерва; терапия, направленная на нормализацию обмена веществ в тканях глаза с целью воздействия на дистрофические процессы, характерные для глаукомы. При подборе лекарственных препаратов местного гипотензивного действия для лечения больных первичной глаукомой необходимо учитывать многие обстоятельства. Внутриглазное давление обычно снижается после однократного закапывания. На этом основано проведение медикаментозной пробы до систематического назначения препарата. При последующих закапываниях эффект снижения давления регулярно повторяется. Однако действие препарата проявляется не сразу, сначала оно может быть слабо выражено и усиливается в последующие дни лечения. Гипотензивный эффект при продолжительном применении уменьшается вплоть до полной устойчивости к данному препарату. В связи с этим при длительном лечении больного глаукомой целесообразна замена одного препарата другим. Нередко имеется устойчивость к препарату с самого начала (данный препарат не снижает внутриглазного давления, следовательно, назначение его нецелесообразно). Иногда после введения лекарственного средства внутриглазное давление повышается (парадоксальный эффект). В таких случаях назначение данного средства противопоказано. При выработке режима медикаментозного лечения за больным глаукомой устанавливается срок наблюдения (не менее 2–3 недель), в течение которого применяется препарат. В дальнейшем контроль за эффективностью лечения осуществляется 1 раз в 1–3 месяца. Лечение больных первичной глаукомой начинают с назначения закапываний растворов холиномиметических средств, чаще всего 1 %-ного раствора пилокарпина гидрохлорида 2–3 раза в день. Пилокарпин улучшает отток водянистой влаги из глаза, что приводит к понижению внутриглазного давления. Если лечение 1 %-ным раствором пилокарпина гидрохлорида не приводит к нормализации внутриглазного давления, назначают инстилляции 2 %-ного раствора пилокарпина 3 раза в день. При недостаточности 3-кратных закапываний используют растворы пилокарпина продленного действия. Эти препараты применяют 3 раза в день. Используются также пилокарпина гидрохлорид в глазной лекарственной пленке по 1–2 раза в сутки и 2 %-ная пилокарпиновая мазь на ночь. Значительно реже применяют другие холиномиметические средства (1–3 %-ные растворы карбахолина или 2–5 %-ные растворы ацеклидина). При недостаточной эффективности холиномиметических препаратов дополнительно назначают прозерин, фосфакол, армин или тосмилен; частота введения этих препаратов составляет не более 2 раз в сутки. Их действие направлено также на улучшение оттока водянистой влаги из глаза. Больным открытоугольной глаукомой с пониженным или нормальным артериальным давлением при недостаточной эффективности пилокарпина гидрохлорида добавляют введение 1–2 %-ных растворов адреналина гидротартрата, дипивалила эпинефрина, изоптоэпинала или назначают адренопилокарпин 2–3 раза в день. Гипотензивное действие адреналина обусловлено уменьшением продукции водянистой влаги и отчасти улучшением ее оттока. Для лечения больных открытоугольной глаукомой наряду с пилокарпином используют 3 %-ный и 5 %-ный растворы фетанола. В сравнении с адреналином фетанол обладает более длительным и мягким действием на кровеносные сосуды, поэтому показан больным глаукомой, сочетающейся с начальной стадией гипертонической болезни. Гипотензивный эффект фетанола обусловлен главным образом уменьшением секреции водянистой влаги. Возможно применение инстилляций 0,5 %-ного раствора клофелина (гемитон). Гипотензивное действие клофелина объясняется угнетением секреции водянистой влаги, а также улучшением ее оттока. Контроль эффективности лечения следует проводить 2–3 раза в месяц. Используют и в виде глазных капель 1 %-ный анаприлин, 1 %-ный пропранолол, 0,25—0,5 %-ный оптимол. Гипотензивное действие этих препаратов обусловлено уменьшением секреции водянистой влаги; они не изменяют величину зрачка и не влияют на артериальное давление. При недостаточной эффективности местной гипотензивной терапии открытоугольной глаукомы ее дополняют кратковременным назначением гипотензивных средств общего действия: ингибиторов карбоангидразы (диамокс, диакарб), осмотических (глицерол) и нейролептических средств (аминазин). Ингибиторы карбоангидразы уменьшают продукцию внуртриглазной жидкости, что приводит к снижению внутриглазного давления. Эти препараты особенно эффективны при гиперсекреторной глаукоме. Диакарб назначают внутрь по 0,125— 0,25 г от 1 до 3 раз в сутки. После 3 дней приема диакарба рекомендуют делать перерыв на 1–2 дня. Глицерол и аминазин назначают однократно при острых повышениях внутриглазного давления. Вопрос о хирургическом лечении открытоугольной глаукомы решается индивидуально с учетом формы глаукомы, уровня внутриглазного давления, коэффициента легкости оттока, состояния угла передней камеры, поля зрения и общего статуса больного. Основными показаниями для операции являются: стойкое и значительное повышение внутриглазного давления, несмотря на применение различных гипотензивных средств; прогрессирующее ухудшение поля зрения; отрицательная динамика клинических данных (состояние радужки, угла передней камеры, зрительного нерва), т. е. нестабилизированный характер течения глаукоматозного процесса. В последние годы используются лазерные методы лечения первичной глаукомы. При открытоугольной глаукоме применяют лазерную гониопунктуру и трабекулоспазис при помощи аргоновых или рубиновых лазеров. При медикаментозном лечении закрытоугольной глаукомы наибольшее значение имеют пилокарпин, карбахолин, ацеклидин. Возможно назначение также 0,25—0,5 %-ного раствора тимолола. Армин, фосфакол, тосмилен, способствуя резкому сужению зрачка, могут вызвать зрачковый блок, поэтому при закрытоугольной глаукоме их обычно не назначают. Адреномиметические препараты (адреналин, фетанол, клофелин) при этой форме глаукомы также противопоказаны из-за их свойств (расширение зрачка) и возможности блокады радужно-роговичного угла передней камеры. Из средств общего действия для снижения внутриглазного давления применяют внутрь диакарб и глицерол. При недостаточной медикаментозной терапии также применяют хирургическое и лазерное лечение. Лазерное лечение заключается в проведении лазерной иридэктомии ииридопластики.
Острый приступ глаукомы При остром приступе глаукомы требуется неотложная специализированная помощь. Основная цель неотложной помощи — снизить внутриглазное давление и таким образом нормализовать нарушенное кровообращение в глазу, восстановить обмен веществ в тканях глаза и зрительном нерве. В амбулаторных условиях лечение начинают с введения 1 %-ного раствора пилокарпина гидрохлорида через каждые 15 мин в течение 1 ч, затем — через каждые 30 мин в последующие 2 ч и далее через каждый час. Вместо пилокарпина можно вводить 1,5–3 %-ный раствор карбохолина. Закапывают 0,5 %-ный раствор оптимола. Одновременно с миотиками внутрь назначают 0,5 г (2 таблетки) диакарба или глицерол (50 %-ный раствор глицерина) из расчета 1–1,5 г глицерина на 1 кг массы тела. Внутриглазное давление после приема глицерина начинает снижаться примерно через 30 мин, а через 1–1,5 ч достигается его максимальное снижение. После проведения неотложных мероприятий больного направляют на стационарное лечение. В стационаре при недостаточном эффекте от проведенного ранее лечения спустя 2–3 ч и при отсутствии артериальной гипотензии показано введение аминазина, который оказывает выраженный успокаивающий эффект. Препарат снижает артериальное и внутриглазное давление. Снижение внутриглазного давления под влиянием аминазина обусловлено уменьшением продукции водянистой влаги. Аминазин вводят в составе смеси, содержащей 2,5 %-ный раствор аминазина (1 мл), 1 %-ный раствор димедрола (2 мл) и 2 %-ный раствор промедола (1 мл). Растворы этих лекарств набирают в один шприц и вводят внутримышечно. После введения этой смеси больные должны находиться 3–4 ч в постели в горизонтальном положении во избежание резкого снижения давления. При выраженном отеке роговицы показаны глазные ванночки с 20–40 %-ным раствором глюкозы. Если описанное медикаментозное лечение не прекращает острого приступа глаукомы в течение 8—10 ч, проводят антиглаукомную операцию. Общее медикаментозное лечение при первичной глаукоме включает назначение препаратов, улучшающих процессы обмена веществ в сетчатке и зрительном нерве. Для стабилизации зрительных функций у больных глаукомой с нормальным внутриглазным давлением применяют сосудорасширяющие препараты и средства, воздействующие на процессы тканевого обмена. Из этих препаратов наиболее широко используются внутрь никотиновая кислота (по 0,05 г 2–3 раза в день в течение 2–3 недель), никошпан (по 1 таблетке 2–3 раза в день в течение 2–3 недель), но-шпа (по 0,04 г 2–3 раза в день), нигексин (по 0,25 г 3–4 раза в день первые 2–3 недели и 2 раза в день еще в течение 2 недель), аминалон (по 0,5 г 3 раза в день в течение месяца и более), кавинтон (по 0,005 г 2–3 раза в день), компламин (по 0,15 г 2–3 раза в день), трентал (по 0,1 г 2–3 раза в день), рибоксин (по 0,2 г 2–3 раза в день), глио-6, или пиридоксилат, по 0,1 г 2–3 раза в день; биогенные стимуляторы (ФиБС под кожу по 0,5 мл, 15–20 инъекций на курс); 1 %-ный раствор натриевой соли АТФ (по 1 мл внутримышечно ежедневно по 3 инъекции на курс), 0,25 %-ный раствор цитохрома С (по 4 мл внутримышечно через день, 10–15 инъекций на курс), витамины группы В. Целесообразно сочетание лекарственных средств. Больным глаукомой для стабилизации зрительных функций назначают лекарственный комплекс, включающий элеутерококк (по 30 капель 3 раза в день в течение месяца), цитохром С (0,25 %-ный раствор по 4 мл внутримышечно через день, 10–15 инъекций на курс) и аскорбиновую кислоту (внутрь по 0, 1 г 3 раза в день в течение 1 месяца). Указанное медикаментозное лечение больным глаукомой проводят курсами продолжительностью 1 месяц 2 раза в год с учетом необходимости нормализации внутриглазного давления.
Врожденная глаукома Лечение врожденной глаукомы хирургическое. Наиболее эффективными являются операции в области угла передней камеры с целью устранения эмбриональной ткани и улучшения оттока внутриглазной жидкости в шлеммов канал. Операцию необходимо проводить незамедлительно, независимо от возраста ребенка. Медикаментозное лечение является дополнительным к хирургическому (до и после операции). Из медикаментозных средств местно назначают 1–2 %-ный раствор пилокарпина гидрохлорида, 0,055 %-ный раствор армина, 0,013 %-ный раствор фосфакола и 2–3 %-ный — ацеклидина, 0,25 %-ный раствор оптимола. Внутрь — диакарб или глицерол (в дозах, соответствующих массе тела и возрасту ребенка). Проводят общеукрепляющую и снижающую чувствительность (десенсибилизирующую) терапию.
Ювенильная глаукома Местное применение различных средств, снимающих мышечный спазм (пилокарпин, карбахолин, ацеклидин, фосфакол, армин), а также клофелина и оптимола; внутрь назначают диакарб. При отсутствии компенсации глаукоматозного процесса и ухудшении зрительных функций показана операция.
Вторичная глаукома Лечение состоит в расширении зрачка, снижении внутриглазного давления, уменьшении продукции внутриглазной жидкости, устранении воспалительной реакции, а также зависит от причины, вызвавшей повышение внутриглазного давления. Вводят 1–2 %-ный раствор пилокарпина гидрохлорида, препараты тимолола малеата (0,25—0,5 %-ный тимоптик, 0,25 %—0,5 %-ный офтан тимолол, 0,25 %—0,5 %-ный проксодолол и др.); комбинированные препараты (фотил, тимпило); внутрь назначают диакарб по 0,125—0,25 г 2–3 раза в день. При неэффективности показано хирургическое вмешательство.
Вторичная глаукома при иридоциклитах и увеитах В первую очередь проводят лечение основного заболевания. В острой стадии, особенно при образовании задних сращиваний, больным назначают аппликации с 0,1 %-ным раствором адреналина гидрохлорида или вводят раствор адреналина под конъюнктиву по 0,25 мл 1 раз в день. Применяют мидриатические (расширяющие зрачок) средства — 1 %-ный раствор гоматропина гидробромида, 0,25 %-ный раствор скополамина гидробромида, 1 %-ный раствор мезатона. Местно используют кортикостероидные препараты: 0,5–2,5 %-ную суспензию гидрокортизона, 0,3 %-ный раствор преднизолона, 0,1 %-ный раствор дексаметазона, капли «Софрадекс». Для снижения внутриглазного давления внутрь назначают диакарб по 0,125—0,25 г 2–3 раза в сутки. При стойком повышении внутриглазного давления и неэффективности медикаментозного лечения показано хирургическое лечение. Вторичная глаукома при нарушениях кровообращения в сосудах глаза, глазницы и внутриглазных кровоизлияниях Прежде всего лечат основное заболевание. Миотические средства назначают при отсутствии в радужке новообразованных сосудов. При их наличии рекомендуют введение растворов адреналина, клофелина, оптимола, а также кортикостероидов. Применяют средства, способствующие рассасыванию кровоизлияний (геморрагий): местно — введение 3 %-ного раствора калия йодида, 0,1 %-ного раствора лидазы, внутримышечно назначают лидазу и стекловидное тело.
ГЛОМЕРУЛОНЕФРИТ
ОпределениеГломерулонефрит — приобретенное полиэтиологическое заболевание почек, характеризующееся иммунным восполнением с преимущественным поражением клубочков с возможным вовлечением в процесс любого компонента почечной ткани.Диффузный гломерулонефрит — иммуно-комплексное заболевание почек с преимущественным поражением сосудов клубочков — является одним из наиболее частых заболеваний почек. Оно протекает в виде острого или хронического процесса с повторными обострениями и ремиссиями. Острый гломерулонефрит может развиться в любом возрасте, однако большинство больных составляют лица до 40 лет. В более редких случаях наблюдается подострый гломерулонефрит, для которого характерно бурное прогрессирующее течение, быстро приводящее к почечной недостаточности. Хронический диффузный гломерулонефрит — длительно (не менее года) протекающее иммунологическое двустороннее заболевание почек. Это заболевание заканчивается (иногда спустя многие годы) сморщиванием почек и смертью больных от хронической почечной недостаточности. Хронический гломерулонефрит может быть как исходом острого гломерулонефрита, так и первично-хроническим, без предшествующей острой атаки.
Этиология и патогенез Острый диффузный гломерулонефрит Чаще всего заболевание возникает после ангин, тонзиллитов, инфекций верхних дыхательных путей, скарлатины и др. Важную роль в возникновении гломерулонефрита играет стрептококк, особенно тип 12 бета-гемолитического стрептококка группы А. В странах с жарким климатом чаще других острому гломерулонефриту предшествуют стрептококковые кожные заболевания. Он может также развиваться после пневмоний (в том числе стафилококковых), дифтерии, сыпного и брюшного тифа, бруцеллеза, малярии и некоторых других инфекций. Возможно возникновение гломерулонефрита под влиянием вирусной инфекции, после введения вакцин и сывороток (сывороточный, вакцинный нефрит). К числу причинных факторов относится и охлаждение организма во влажной среде («окопный» нефрит). Охлаждение вызывает рефлекторные расстройства кровоснабжения почек и влияет на течение иммунологических реакций. В настоящее время общепринятым является представление об остром гломерулонефрите как об иммунокомплексной патологии, появлению симптомов гломерулонефрита после перенесенной инфекции предшествует длительный скрытый период, во время которого изменяется реактивность организма, образуются антитела к микробам или вирусам. Комплексы антиген — антитело, взаимодействуя с комплементом, откладываются на поверхности базальной мембраны капилляров преимущественно клубочков. Развивается генерализованный васкулит с поражением главным образом почек.
Хронический диффузный гломерулонефрит См. Острый гломерулонефрит.
Мембранозно-фибропластический гломерулонефрит
Клиническая картина Заболевание, как правило, возникает через 7—20 дней после стрептококковой инфекции.
Острый гломерулонефрит Острый гломерулонефрит характеризуется основными симптомами: уменьшением объема мочевыделения, отечным, гипертоническим и мочевым признаками. Заболевание чаще всего развивается остро. Больные отмечают слабость, отечность, головную боль, снижение мочевыделения, что связано с понижением фильтрации в почках. Мочевой синдром характеризуется появлением в моче белков (протеинурия), цилиндров, макро- или микрогематурией (появлением в моче клеток крови). Количество белка в моче обычно колеблется от 1 до 10 г/л, но нередко достигает 20 г/л и более. Однако высокое содержание белка в моче отмечается лишь в первые 7—10 дней, поэтому при позднем исследовании мочи протеинурия чаще оказывается невысокой (менее 1 г/л). Небольшая протеинурия в ряде случаев может быть с самого начала болезни, а в некоторые периоды она даже может отсутствовать. Небольшие количества белка в моче у больных, перенесших острый нефрит, наблюдаются долго и исчезают только через 3–6, а в ряде случаев даже 9—12 месяцев от начала заболевания. Гематурия — обязательный и постоянный признак острого гломерулонефрита; в 13–15 % случаев бывает макрогематурия, в остальных случаях — микрогематурия, иногда количество эритроцитов может не превышать 10–15 в поле зрения. Цилиндрурия — не обязательный симптом острого гломерулонефрита. В 75 % случаев находят единичные гиалиновые и зернистые цилиндры, иногда встречаются эпителиальные цилиндры. Лейкоцитурия (лейкоциты в моче), как правило, бывает незначительной, однако иногда обнаруживают 20–30 лейкоцитов и более в поле зрения. При этом всегда все же отмечается количественное преобладание эритроцитов над лейкоцитами, что лучше выявляется при подсчете фирменных элементов осадка мочи с помощью методик Каковского-Аддиса, де Альмейда-Нечипоренко. Олигурия (400–700 мл мочи в сутки) — один из первых симптомов острого нефрита. В некоторых случаях в течение нескольких дней наблюдается анурия (острая почечная недостаточность). У многих больных в течение первых нескольких дней заболевания отмечается незначительная или умеренная азотемия. Часто при остром гломерулонефрите уменьшаются содержание гемоглобина и число эритроцитов в периферической крови. Это связано с гидремией (повышенным содержанием воды в крови), а также может быть обусловлено истинной анемией в результате влияния инфекции, приведшей к развитию гломерулонефрита (например, при септическом эндокардите). Повышение СОЭ наблюдается часто и является показателем активности нефрита. Количество лейкоцитов в крови, как и температурная реакция, определяются начальной или сопутствующей инфекцией (чаще температура нормальная и нет лейкоцитоза).
Интракапиллярный гломерулонефрит Большое значение в клинической картине острого гломерулонефрита имеют отеки, которые служат ранним признаком заболевания у 80–90 % больных. Располагаются они преимущественно на лице и вместе с бледностью кожи создают характерное «лицо нефритика». Часто жидкость накапливается в полостях (плевральной, брюшной, полости перикарда). Прибавка массы тела за короткое время может достигать 15–20 кг и более, но через 2–3 недели отеки обычно исчезают. Одним из кардинальных симптомов острого диффузного гломерулонефрита является артериальная гипертензия, наблюдавшаяся у 70–90 % больных. В большинстве случаев артериальное давление не достигает высоких уровней (180/120 мм рт. ст.). У детей и подростков повышение артериального давления бывает реже, чем у взрослых. Остро возникшая артериальная гипертензия может привести к развитию острой сердечной недостаточности, особенно левожелудочковой. Позднее возможно развитие гипертрофии (увеличения) левого желудочка сердца. При обследовании определяется расширение границ сердечной тупости, что может быть обусловлено накоплением транссудата в полости перикарда и гипертрофией миокарда. Нередко выслушиваются функциональный систолический шум на верхушке, акцент II тона на аорте, иногда ритм галопа: в легких — сухие и влажные хрипы. На ЭКГ могут наблюдаться изменения зубцов R и Т в стандартных отведениях, нередко глубокий зубец Q и несколько сниженный вольтаж комплекса ORS. Артериальная гипертензия при остром гломерулонефрите может сопровождаться развитием эклампсии, но уремии при этом нет. Эклампсию правильнее считать острой энцефалопатией, так как она обусловлена артериальной гипертензией и отеками (гиперволемический отек мозга). Несмотря на тяжелую клиническую картину экламптических припадков, они редко кончаются смертью и проходят большей частью бесследно. Различают две наиболее характерные формы острого гломерулонефрита. Циклическая форма начинается бурно. Появляются отеки, одышка, головная боль, боль в поясничной области, уменьшается количество мочи. В анализах мочи — высокие цифры протеинурии и гематурии. Повышается артериальное давление. Отеки держатся 2–3 недели. Затем в течении болезни наступает перелом: развивается полиурия (увеличение объема выделяемой мочи) и снижение артериального давления. Период выздоровления может сопровождаться гипостенурией. Однако нередко при хорошем самочувствии больных и практически полном восстановлении работоспособности могут длительно, месяцами, наблюдаться небольшая протеинурия (0,03—0,1 г/л) и остаточная гематурия. Латентная форма встречается нередко, и диагностика ее имеет большое значение, так как часто при этой форме заболевание становится хроническим. Эта форма гломерулонефрита характеризуется постепенным началом без каких-либо выраженных субъективных симптомов и проявляется лишь небольшой одышкой или отеками на ногах. В таких случаях гломерулонефрит удается диагностировать только при систематическом исследовании мочи. Длительность относительно активного периода при скрытой форме заболевания может быть значительной (2–6 месяцев и более). Острый гломерулонефрит может сопровождаться нефротическим синдромом. Всякий острый гломерулонефрит, не закончившийся бесследно в течение года, нужно считать перешедшим в хронический. Следует помнить, что в ряде случаев остро начавшийся диффузный гломерулонефрит может принять характер подострого злокачественного экстракапиллярного гломерулонефрита с бурно прогрессирующим течением.
Подострый диффузный гломерулонефрит Подострый диффузный гломерулонефрит имеет злокачественное течение и, как правило, заканчивается смертью больных через 0,5–2 года от начала заболевания. Решающее значение для возникновения злокачественного течения подострого гломерулонефрита, по-видимому, имеет активность иммунологических реакций. Болезнь начинается обычно как острый гломерулонефрит (чаще бурно), но может вначале протекать скрыто. Характерны большие упорные отеки, выраженная альбуминурия (до 10–30 г/л), а также резко выраженные гипопротеинемия (45–35 г/л) и гиперхолестеринемия (до 6—10 г/л), т. е. признаки липоидно-нефротического синдрома. Одновременно наблюдается выраженная гематурия с олигурией. При последней относительная плотность мочи высокая только вначале, а затем она становится низкой. Прогрессивно снижается фильтрационная функция почек.
Экстракапиллярный продуктивный гломерулонефрит
Уже с первых недель заболевания может нарастать азотемия, что ведет к развитию уремии. Артериальная гипертензия при этой форме нефрита бывает очень высокой и сопровождается тяжелыми изменениями на глазном дне (кровоизлияния в сетчатку, отек дисков зрительных нервов, образование экссудативных белых ретинальных пятен).
Подострый гломерулонефрит с нефротическим компонентом («большая пестрая почка»)
Хронический диффузный гломерулонефрит Клинические проявления такие же, что и при остром гломерулонефрите: отеки, артериальная гипертензия, мочевой синдром и нарушение функций почек. В течении хронического гломерулонефрита выделяют две стадии: — почечной компенсации, т. е. достаточной азотовыделительной функции почек (эта стадия может сопровождаться выраженным мочевым синдромом, но иногда долго протекает латентно, проявляясь лишь небольшой альбуминурией или гематурией); — почечной декомпенсации, характеризующейся недостаточностью азотовыделительной функции почек (мочевые симптомы могут быть менее значительными; как правило, наблюдается высокая артериальная гипертензия, отеки чаще умеренные; в этой стадии выражены гипоизостенурия и полиурия, которые заканчиваются развитием азотемической уремии). Выделяют следующие клинические формы хронического гломерулонефрита. 1. Нефротическая форма — наиболее частая форма первичного нефротического синдрома. Этой форме в отличие от чистого липоидного нефроза свойственно сочетание нефротического синдрома с признаками воспалительного поражения почек. Клиническая картина заболевания может долго определяться нефротическим синдромом, и только в дальнейшем наступает прогрессирование собственно гломерулонефрита с нарушением азотовыделительной функции почек и артериальной гипертензией. 2. Гипертоническая форма. Длительное время среди симптомов преобладает артериальная гипертензия, тогда как мочевой синдром мало выражен. Изредка хронический гломерулонефрит развивается по гипертоническому типу после первой бурной атаки гломерулонефрита, но чаще бывает результатом возникновения скрытой формы острого гломерулонефрита. Артериальное давление достигает 180/100—200/120 мм рт. ст. и может подвергаться большим колебаниям в течение суток под влиянием различных факторов. Развивается гипертрофия левого желудочка сердца, выслушивается акцент II тона над аортой. Как правило, гипертензия все же не приобретает злокачественного характера. Артериальное давление, особенно диастолическое, не достигает высоких уровней. Наблюдаются изменения глазного дна в виде нейроретинита. 3. Смешанная форма. При этой форме одновременно имеются нефротический и гипертонический синдромы. 4. Латентная (скрытая) форма. Это довольно часто возникающая форма, проявляющаяся обычно лишь слабо выраженным мочевым синдромом баз артериальной гипертензии и отеков. Она может иметь длительное течение (10–20 лет и более), позднее все же приводит к развитию уремии. Следует также выделять и гематурическую форму, так как в ряде случаев хронический гломерулонефрит может проявляться гематурией без значительной протеинурии и общих симптомов (гипертензия, отеки). Все формы хронического гломерулонефрита могут периодически давать рецидивы, весьма напоминающие или полностью повторяющие картину первой острой атаки диффузного гломерулонефрита. Особенно часто обострения наблюдаются осенью и весной и возникают через 1–2 суток после воздействия раздражителя, чаще всего стрептококковой инфекции. При любом течении хронический диффузный гломерулонефрит переходит в свою конечную стадию — вторично-сморщенную почку. Для вторично-сморщенной почки характерна картина хронической азотемической уремии.
Осложнения и прогноз Острый диффузный гломерулонефрит Смертельный исход в остром периоде заболевания бывает редко. Переход острого гломерулонефрита в хроническое заболевание наблюдается приблизительно в 1/3 случаев. Прогноз подострого гломерулонефрита плохой. Это заболевание, как правило, заканчивается летально через 6 месяцев, но не позже чем через 2 года. Смерть наступает от хронической почечной недостаточности и уремии, реже — от кровоизлияния в мозг.
Хронический диффузный гломерулонефрит Исходом хронического гломерулонефрита является сморщивание почек с развитием хронической почечной недостаточности — хронической уремии. Иммунодепрессивная терапия значительно изменила течение болезни. Наблюдаются случаи полной ремиссии болезни с исчезновением как общих, так и мочевых симптомов.
Диагностика и дифдиагностика Острый диффузный гломерулонефрит Диагноз острого диффузного гломерулонефрита не представляет больших трудностей при выраженной клинической картине, особенно у лиц молодого возраста. Важно, что часто ведущими в картине заболевания являются симптомы сердечной недостаточности (одышка, отеки, сердечная астма и др.). Для установления диагноза в этих случаях существенную роль играет то, что острое развитие заболевания происходит у больных без предшествующей патологии сердца и что при этом обнаруживаются выраженный мочевой синдром, особенно гематурия, а также склонность к брадикардии (урежению частоты сердечных сокращений). Труден дифференциальный диагноз между острым гломерулонефритом и обострением хронического. Здесь имеет значение уточнение срока от начала инфекционного заболевания до острых проявлений нефрита. При остром гломерулонефрите этот срок составляет 1–3 недели, а при обострении хронического процесса — всего несколько дней (1–2 дня). Мочевой синдром может быть одинаковым по выраженности, но стойкое уменьшение относительной плотности мочи ниже 1,015 и снижение фильтрационной функции почек более характерно для обострения хронического процесса. Трудно диагностировать латентную (скрытую) форму острого гломерулонефрита. Преобладание в осадке мочи эритроцитов над лейкоцитами, отсутствие активных и бледных лейкоцитов (при окраске по Штернгеймеру-Мальбину), отсутствие в прошлом дизурических явлений помогают его отличить от хронического, латентно протекающего пиелонефрита. Данные рентгеноурологических исследований могут иметь значение для дифференциальной диагностики с пиелонефритом, почечнокаменной болезнью, туберкулезом почек и другими заболеваниями, протекающими с малым мочевым синдромом.
Хронический диффузный гломерулонефрит При латентной форме, а также при гипертонической и гематурической формах заболевания его распознавание иногда бывает весьма трудным. Если в анамнезе нет определенных указаний на перенесенный острый гломерулонефрит, то при умеренно выраженном мочевом синдроме приходится проводить дифференциальную диагностику с одним из многих одно- или двусторонних заболеваний почек. Следует также помнить о возможности ортостатической альбуминурии. При дифференцировании гипертонической и смешанной форм хронического гломерулонефрита с гипертонической болезнью имеет значение определение времени появления мочевого синдрома по отношению к возникновению артериальной гипертензии. При хроническом гломерулонефрите мочевой синдром может задолго предшествовать артериальной гипертензии или возникать одновременно с ней. Для хронического гломерулонефрита характерны также меньшая выраженность гипертрофии сердца, меньшая склонность к гипертоническим кризам (за исключением обострений, протекающих с эклампсией) и более редкое или менее интенсивное развитие атеросклероза, в том числе коронарных артерий. В пользу наличия хронического гломерулонефрита при дифференциальной диагностике с хроническим пиелонефритом свидетельствуют преобладание в осадке мочи эритроцитов над лейкоцитами, отсутствие активных и бледных (при окраске по Штернгеймеру-Мальбину) лейкоцитов, а также одинаковая величина и форма двух почек и нормальная структура лоханок и чашечек, что обнаруживается при рентгеноурологическом исследовании. Нефротическую форму хронического гломерулонефрита следует отличать от липоидного нефроза, амилоидоза и диабетического гломерулосклероза. При дифференциальной диагностике амилоидоза почек имеет значение наличие в организме очагов хронической инфекции и амилоидной дегенерации другой локализации. Так называемая застойная почка иногда дает повод к неправильной диагностике, ибо может протекать со значительной протеинурией при умеренной гематурии и высокой относительной плотностью мочи. Застойная почка часто проявляется отеками, иногда артериальной гипертензией. О застойной почке говорят наличие самостоятельного первичного заболевания сердца, увеличение печени, расположение отеков преимущественно на нижних конечностях, меньшая выраженность гиперхолестеринемии и мочевого синдрома, а также исчезновение его при уменьшении сердечной декомпенсации.
Лечение Острый диффузный гломерулонефрит Назначаются постельный режим и диета. Резкое ограничение поваренной соли в пище (не более 1,5–2 г/сут.) уже само по себе может приводить к усиленному выделению воды и ликвидации отечного и гипертонического синдромов. В первое время назначают сахарные дни (по 400–500 г сахара в сутки с 500–600 мл чая или фруктовых соков). В дальнейшем дают арбузы, тыкву, апельсины, картофель, которые обеспечивают почти полностью безнатриевое питание. Длительное ограничение потребления белков при остром гломерулонефрите недостаточно обосновано, так как задержки азотистых шлаков, как правило, не наблюдается, а предполагаемое иногда повышение артериального давления под влиянием белкового питания не доказано. Из белковых продуктов лучше употреблять творог, а также яичный белок. Жиры разрешаются в количестве 50–80 г/сут. Для обеспечения суточной калорийности добавляют углеводы. Жидкости можно потреблять до 600— 1000 мл/сут. Антибактериальная терапия показана при явной связи гломерулонефрита с имеющейся инфекцией, например при затяжном септическом эндокардите, хроническом тонзиллите. При хроническом тонзиллите показана тонзиллэктомия через 2–3 месяца после стихания острых явлений гломерулонефрита. Целесообразно применение стероидных гормонов — преднизолона (преднизона), триамцинолона, дексаметазона. Лечение преднизолоном назначают не раньше чем через 3–4 недели от начала заболевания, когда общие симптомы (в частности, артериальная гипертензия) менее выражены. Особенно показаны кортикостероидные гормоны при нефротической форме или затянувшемся течении острого гломерулонефрита, а также при так называемом остаточном мочевом синдроме, в том числе и гематурии. Преднизолон применяют начиная с дозы 10–20 мг/сут., быстро (в течение 7—10 дней) доводят суточную дозу до 60 мг. Эту дозу продолжают давать в течение 2–3 недель, затем ее постепенно уменьшают. Курс лечения длится 5–6 недель. Общее количество преднизолона на курс 1,5–2 тыс. мг. Если за это время не достигается достаточный лечебный эффект, можно продолжить лечение поддерживающими дозами преднизолона (по 10–15 мг/сут.) длительно под врачебным контролем. Кортикостероидная терапия влияет как на отечный, так и на мочевой синдром. Она может способствовать выздоровлению и предупреждению перехода острого гломерулонефрита в хронический. При наличии артериальной гипертензии и особенно при возникновении эклампсии показана комплексная гипотензивная терапия периферическими вазодилататорами (верапамил, гидралазин, нитропруссид натрия, диазоксид) или симпатолитиками (резерпин, клофелин в сочетании с салуретиками (фуросемид, этакриновая кислота) и транквилизаторами (диазепам и др.). Могут применяться ганглиоблокаторы и 3-адреноблокаторы. Для уменьшения отека мозга используют осмотические диуретики (40 %-ный раствор глюкозы, маннитол). При судорогах (на этапе) дают эфирно-кислородный наркоз. При непрекращающихся судорогах проводят кровопускание. Лечение стероидными гормонами подострой формы гломерулонефрита менее эффективно, а в ряде случаев не показано из-за высокой и прогрессирующей артериальной гипертензии (артериальное давление выше 200/140 мм рт. ст.). В последнее время рекомендуют применять антиметаболиты и иммунодепрессанты (6-меркаптопурин, азатиоприн, а также циклофосфан) при тщательном контроле за морфологическим составом крови. Лечение иммунодепрессантами более эффективно в сочетании с кортикостероидными гормонами, которые при этом назначают в меньших дозах (25–30 мг/сут.). Такое сочетание не только способствует эффективности лечения, но и уменьшает опасность развития осложнений как от кортикостероидов, так и от иммунодепрессантов (в частности, тяжелой лейкопении). При нарастании почечной недостаточности и повышенном содержании в крови азотистых шлаков необходимо уменьшить потребление с пищей белков и вводить большие количества концентрированной глюкозы (80—100 мл 20 %-ного раствора внутривенно), а также 5 %-ный раствор глюкозы по 300–500 мл внутривенно капельно. При отсутствии отеков следует капельно вводить 100–200 мл 5 %-ного раствора гидрокарбоната натрия. В случае появления признаков сердечной недостаточности назначают препараты наперстянки, диуретики. Применение диализа (перитонеального или искусственной почки) менее эффективно, чем при хроническом гломерулонефрите, из-за высокой активности и быстроты прогрессирования основного почечного процесса. Пересадка почки не показана.
Хронический диффузный гломерулонефрит Необходимо устранение очагов инфекции (удаление миндалин, санация полости рта и т. д.). Больные хроническим нефритом должны избегать охлаждения, особенно воздействия влажного холода. Им рекомендуется сухой и теплый климат. При удовлетворительном общем состоянии и отсутствии осложнений показано санаторно-курортное лечение в Средней Азии (Байрам-Али) или на Южном берегу Крыма (Ялта). Постельный режим необходим только в период появления значительных отеков или развития сердечной недостаточности, а также при уремии. Для лечения больных хроническим гломерулонефритом существенное значение имеет диета, которую назначают в зависимости от формы и стадии заболевания. При нефротической и смешанной формах (отеки) поступление хлорида натрия с пищей не должно превышать 1,5–2,5 г/сут., для чего прекращают солить пищу. При достаточной выделительной функции почек (нет отеков) пища должна содержать достаточное количество (1–1,5 г/кг) животного белка. Это нормализует азотистый баланс и компенсирует белковые потери. При гипертонической форме рекомендуется умеренно ограничивать потребление хлорида натрия до 3–4 г/сут. при нормальном содержании в диете белков и углеводов. Особенно большое значение имеет кортикостероидная терапия, являющаяся основой патогенетической терапии при этом заболевании. На курс лечения применяют 1500–2000 мг преднизолона (преднизона) или 1200–1500 мг триамцинолона. Начинают лечение обычно с 10–20 мг преднизолона и доводят дозу до 60–80 мг/сут. (дозу триамцинолона увеличивают с 8 до 48–64 мг), а затем постепенно снижают ее. Рекомендуется проводить повторные полные курсы лечения (при обострениях) или поддерживающие небольшие курсы. На фоне приема кортикостероидных гормонов возможно обострение скрытых очагов инфекции. В связи с этим лечение кортикостероидами лучше проводить, назначая одновременно антибиотики или после удаления очагов инфекции (например, тонзиллэктомии). Противопоказанием к назначению кортикостероидов у больных хроническим гломерулонефритом является прогрессирующая азотемия. При умеренной артериальной гипертензии (артериальное давление 180/110 мм рт. ст.) лечение кортикостероидными гормонами можно проводить, одновременно применяя гипотензивные средства. При высокой артериальной гипертензии требуется предварительное снижение артериального давления. При противопоказаниях к кортикостероидной терапии или при ее неэффективности рекомендуется применение негормональных иммунодепрессантов: аэатиоприна (имуран), 6-меркаптопурина, циклофосфана. Эти препараты более эффективны, и лечение ими лучше переносится больными при одновременном приеме преднизолона в умеренных дозах (по 10–30 мг/сут.), что предупреждает токсические влияния иммунодепрессантов на лейкопоэз. В поздних стадиях — при склерозе клубочков и их атрофии с наличием высокой гипертензии — иммунодепрессанты и кортикостероиды противопоказаны, так как иммунологической активности в клубочках уже нет, а продолжение такого лечения только усугубляет артериальную гипертензию. Иммунодепрессивным свойством обладают также препараты 4-аминохинолинового ряда — хингамин (делагил, резохин, хлорохин), гидроксихлорохин (плаквенил). Резохин (или хлорохин) применяют по 0,25 г 1–2—3 раза в день в течение 2–3—8 месяцев. Индометацин (метиндол, индоцид) воздействует на медиаторы иммунологического повреждения. Под влиянием индометацина снижается протеинурия. Назначают его внутрь по 25 мг 2–3 раза в день, затем в зависимости от переносимости увеличивают дозу до 100–150 мг/сут. Лечение проводится длительно, в течение нескольких месяцев. Одновременное применение стероидных гормонов и индометацина позволяет значительно снизить дозу кортикостероидов с постепенной полной их отменой. Обоснованным считается проведение антикоагулянтной терапии, назначается гепарин: снижает протеинурию (выделение белка с мочой), уменьшает диспротеинемию (нарушение белков в крови), улучшает фильтрационную функцию почек. Назначаемый подкожно по 20 тыс. ЕД в день в течение 2–3 недель с последующим постепенным снижением дозы в течение недели или внутривенно капельно (1000 ЕД в час) гепарин может применяться в сочетании с кортикостероидами и цитостатиками. При смешанной форме хронического гломерулонефрита (отечный и выраженный гипертонический синдромы) показано применение натрийуретиков, так как они оказывают выраженное диуретическое и гипотензивное действие. Гипотиазид назначают по 50—100 мг 2 раза в день, лазикс по 40— 120 мг/сут., этакриновую кислоту (урегит) по 150–200 мг/сут. Салуретики целесообразно комбинировать и конкурентным антагонистом альдостерона альдактоном (верошпирон) — по 50 мг 4 раза в день. Мочегонный эффект гипотиазида (и других салуретиков) сопровождается выделением с мочой калия, поэтому следует одновременно назначать раствор хлорида калия. При упорных отеках на фоне гипопротеинемии можно рекомендовать применение полиглюкина (декстрана) в виде капельного внутривенного введения 500 мл 6 %-ного раствора, что способствует перемещению жидкости из тканей в кровь и вызывает диурез. Полиглюкин лучше действует на фоне лечения преднизолоном или диуретиками. При лечении гипертонической формы хронического гломерулонефрита могут быть назначены гипотензивные средства, резерпин с гипотиазидом, адельфан, трирезид, кристепин, допегит. Однако следует избегать резких колебаний артериального давления и его ортостатического падения, которые могут ухудшить почечный кровоток и фильтрационную функцию почек. В преэклампсическом периоде и при лечении эклампсии больным может быть назначен сульфат магния; при внутривенном и внутримышечном введении он в виде 25 %-ного раствора может снизить артериальное давление и улучшить функцию почек с диуретическим эффектом, а также способствует уменьшению отека мозга. Лечение в конечной стадии хронического нефрита (см. Почечная недостаточность хроническая).
Профилактика Острый диффузный гломерулонефрит Профилактика сводится к предупреждению и раннему интенсивному лечению острых инфекционных болезней, устранению очаговой инфекции, особенно в миндалинах. Профилактическое значение имеет и предупреждение резких охлаждений тела. Лицам, страдающим аллергическими заболеваниями (крапивница, бронхиальная астма, сенная лихорадка), противопоказаны профилактические вакцинации. Хронический диффузный гломерулонефрит См. Острый гломерулонефрит.
ГЛОССАЛГИЯ
ОпределениеГлоссалгия — гиперестезия и парестезия языка.
Этиология и патогенез Возникновение связано с хроническими заболеваниями желудочно-кишечного тракта, гормональными сдвигами и изменениями в психоэмоциональной сфере. Имеют значение раздражения языка острым краем кариозной полости, корня зуба, зубным протезом и т. д. Встречается и как проявление контактной аллергии к пломбировочным и зубопротезным материалам.
Клиническая картина Неприятные ощущения, чувство жжения, пощипывание, главным образом в области кончика либо корня языка, чаще одной половины. Эти ощущения в языке возникают независимо от приема пищи, обычно к вечеру. Нередко сухость во рту. Иногда отмечается парестезия губы и других участков слизистой оболочки рта и кожи лица. Заболевание может сопровождаться канцерофобией. Отчетливых изменений слизистой оболочки языка нет. Начало заболевания часто ассоциируется с вмешательством в полости рта (удаление зуба, пломбирование, протезирование и т. д.). Иногда жалобы возникают после выявления больным каких-либо анатомических особенностей языка. При обследовании проводят кожные аллергические пробы с 1 %-ным раствором хромата калия у носителей зубных протезов из стали, 1 %-ным раствором хлористого золота при зубных протезах или пломбах из золота. При пользовании зубными протезами из пластмассы необходимо исключить сенсибилизацию к акриловым пластмассам.
Лечение Лечение строго индивидуализированное на основании данных обследования больного, нередко с участием эндокринолога, невропатолога, гинеколога и других специалистов. Непременное условие — устранение вредных факторов, раздражающих язык, удаление из полости рта аллергенов в виде зубных протезов и пломб. Назначают препараты, усиливающие слюновыделение (1 %-ный раствор пилокарпина по 4–5 капель 1–2 раза в день), психотропные средства — андаксин, диазепам (седуксен) и т. д. Важна психотерапия. При локализованности ощущений повторная новокаиновая блокада. Полезны витамины С, В1, В2, В12, A, PP. Физические методы: синусоидальные модулированные токи на шейные симпатические узлы, гальванический воротник по Щербаку.
Профилактика Соблюдение лечебно-гигиенических мероприятий в отношении полости рта, своевременное обращение к специалисту при нарушениях в психоэмоциональной сфере.
ГЛОССИТ
ОпределениеГлоссит — поверхностное или глубокое воспаление тканей языка.При локальных инфекциях глоссит вызывают бактерии и вирусы (включая вирус герпеса), причем развитию инфекционного процесса особенно способствуют ожоги, механические травмы языка и ротовой полости. Факторами риска, провоцирующими развитие глоссита, являются никотин, алкоголь, горячая пища, острые специи, а также аллергические реакции на зубную пасту, полоскатели, освежители полости рта, карамель. Глоссит проявляется и при некоторых системных заболеваниях, таких как железодефицитная анемия, красный плоский лишай, В-витаминодефицитные состояния, эритемы, афтоз, сифилис и др. В редких случаях точную причину, вызвавшую заболевание, установить не удается.
Этиология Причинными факторами являются местнораздражающие факторы, укол косточкой, укус и другие травмы, приводящие к воспалению тканей языка.
Клиническая картина При катаральном глоссите чувство жжения в языке, боль при попадании острой пищи. Язык гиперемирован, отечен, сосочки языка сохранены. При абсцессе языка нарастающая боль, усиливающаяся от прикосновения; речь невнятна, слюнотечение, язык увеличен неравномерно, границы припухлости нечеткие, развитие медленное. При флегмоне языка — боль, нарушение глотания, речи, дыхания, слюнотечение. Отек дна полости рта и шеи, интоксикация, повышение температуры тела.
Диагностика Диагноз устанавливается на основании жалоб и характерных изменений языка. Симптомы глоссита: — жжение, воспаление языка; — язык приобретает ярко-красный или бордовый цвет; — при анемии язык покрывается бледным налетом; — язык может увеличиваться в размерах и становиться мягким; — наблюдаются трудности при жевании, глотании, речи.
Лечение Лечение включает в себя: — устранение травмирующих факторов: сглаживание острых краев зубов и протезов; — повышение местного иммунитета путем назначения препарата имудон; — полоскание полости рта 2 %-ным раствором гидрокарбоната натрия. Абсцесс и флегмона требуют хирургического лечения, при флегмоне — неотложного.
Профилактика Рекомендовано при повреждениях языка своевременно обращаться за медицинской помощью.
ГЛУХОТА
ОпределениеГлухота — это состояние, при котором человек не воспринимает громкую речь, произнесенную около его уха.
Этиология и патогенез Наиболее частыми причинами, ведущими к тугоухости и глухоте, являются: — болезни центральной нервной системы (эпидемический церебральный менингит и др.); — острые инфекционные заболевания, преимущественно скарлатина; — местные нагноительные процессы и сухие катары среднего уха, как самостоятельные, так и в сочетании с ринитом, дистрофическимим процессами в слизистой оболочке носа, аденоидами и другими патологическими состояниями верхних дыхательных путей; — дистрофические расстройства внутреннего уха. К группе с дистрофическими расстройствами относится прогрессирующая нервная тугоухость и отосклероз; — травма (производственная, бытовая, лучевая, химикотоксическая, акустическая, психическая).
Диагностика Уточнение функции слухового анализатора предусматривает главным образом осуществление топической диагностики. Основной вопрос топической диагностики — различение поражений системы звукопроведения от поражений системы звуковой перцепции. Такая диагностика основывается на длительном опыте использования способов и тестов, например надпороговые методы исследования, анализ речевой аудиометрии. В дифдиагностике поражений слухового анализатора особое значение приобретает распознавание центральных форм тугоухости. В этих случаях наблюдается расхождение между порогами тонального и речевого слуха. Центральные поражения чаще бывают двусторонними, нередко отмечается повышенная утомляемость к звукам, поражение вкуса и обоняния, часто нарушается речь. При центральных поражениях наблюдается нарушение бинаурального слуха, уменьшение альфа волн на ЭЭГ.
Лечение При лечении глухоты используется весь арсенал медикаментозных и физиотерапевтических средств, включая реэдукацию (тренировка слуха частыми тембровыми звуками). Особое внимание при лечении глухоты заслуживает комплекс мероприятий, объединенных понятием «слухопротезирование». Оно предусматривает подбор слухового аппарата, усиливающего звук, лицам, не поддающимся консервативным и хирургическим методам лечения. Аппарат считается тем более совершенным, чем меньше искажается передаваемый звук или речь. Известно, что пользование слуховыми аппаратами ни в коей мере не влияет на регресс патологического процесса во внутреннем ухе, однако аппарат, улучшая слух, позволяет больному корригировать свою речь. Слухопротезирование детей способствует нормальному развитию речи и психики.
Профилактика Профилактика расстройств слуха является одним из главных мероприятий сурдологии. Она предусматривает не только предупреждение острых воспалительных заболеваний носа, придаточных пазух, среднего уха, детских инфекций, но и детальное изучение профессиональных и бытовых условий населения. В этом отношении громадная роль отводится диспансеризации детей и подростков с пониженным слухом.
ГОЛОВОКРУЖЕНИЕ
ОпределениеГоловокружение — ощущение больным вращения его самого или окружающих его предметов или чувство проваливания, падения, неустойчивости пола, уходящего из-под ног. Головокружение является базисным обозначением для потери ориентации в пространстве, а также одним из подтипов патологии, характеризующейся иллюзией движения.
Этиология и патогенез Подобное системное головокружение характерно для поражения вестибулярных рецепторов, вестибулярного нерва или его ядер в стволе мозга. Различают специфическое истинное головокружение, причины которого связаны с нарушением функции вестибулярного аппарата, и неспецифическое — невестибулярное головокружение, которое может иметь форму потери равновесия.
Клиническая картина Как правило, системное головокружение сопровождается тошнотой, рвотой, повышенной потливостью, изменением частоты пульса, колебаниями артериального давления. Приступы системного головокружения продолжаются от нескольких минут до многих часов. Помимо субъективных расстройств и вегетативных нарушений, нередко обнаруживается нистагм. При ирритации вестибулярных структур нистагм направлен в сторону очага поражения, а при деструктивных процессах — в противоположную. Звон в ухе или снижение слуха указывает на зависимость головокружения от повреждения периферических элементов вестибулярной системы. Вращательное головокружение особенно резко выражено при непосредственном поражении лабиринта — воспалении, травме, ишемии, отеке. Головокружение, обусловленное органическим поражением головного мозга, нередко сочетается с диплопией (удвоением), парезами глазодвигательных мышц, бульбарными знаками. Нистагм при этом бывает постоянным и может быть горизонтальным, вертикальным, ротаторным или диагональным. Особенно резко головокружение выражено при болезни Меньера. Для вестибулярного нейронита характерны длящиеся несколько дней головокружение, рвота и нарушение равновесия без расстройств слуха; процесс при этом заболевании локализуется в периферических отделах вестибулярного анализатора (воспаление преддверного ганглия); наблюдаются эпидемические вспышки вестибулярного нейронита с высокой температурой, болью в животе, иногда с плеоцитозом в цереброспинальной жидкости. Головокружение и рвота характерны для опухолей задней черепной ямки; сочетание их с пароксизмом жестокой головной боли вслед за поворотом головы носит название синдрома Брунса. Наиболее частой причиной меньероформных атак у пожилых больных является недостаточность кровообращения в вертебробазилярной системе, обычно при сочетании атеросклеротического стеноза и шейного остеохондроза. Изредка головокружение может быть эквивалентом эпилептического припадка. Головокружения характерны также для невротических состояний. Подобные психогенные головокружения описываются больными весьма неопределенно: ощущение пошатывания при стоянии и ходьбе, чувство опьянения, тяжесть в голове. Как правило, этому сопутствуют и другие невротические симптомы, а объективное обследование не обнаруживает органических изменений.
Лечение Применяются антигистамины (циннаризин, дипразин (пипольфен), торекан, метеразин, фенобарбитал, беллоид, диазепины, вазодилататоры (тионикол, никотиновая кислота), диуретики. При рвоте, нередко сопутствующей головокружению, назначают инъекции седуксена или хлордиазепоксида (элениума). При тяжелых затяжных головокружениях показаны нейролептики (галоперидол). Ряд нейролептиков обладает и выраженным противорвотным эффектом, их можно вводить внутривенно. Так как головокружение представляет мультисерийный синдром, применение препаратов, направленных на купирование симптомов, не представляется перспективным, возможен только комплексный подход. Средства обычной медицины имеют побочный эффект, это ограничивает их долгосрочное применение. В этих случаях рекомендуется назначение гомеопатических препаратов. Таким препаратом является вертигохель.
ГОНОРЕЯ
ОпределениеГонорея — инфекционное заболевание, вызываемое гонококками рода нейссерий и передающееся половым путем.
Этиология и патогенез Возбудители — грамотрицательные диплококки. В настоящее время идентифицируется до 60—100 штаммов гонококка. Внеполовой путь заражения встречается редко (у детей при пользовании общими с больной матерью полотенцем и бельем). Возбудитель инфекции поражает преимущественно отделы мочеполовой системы, выстланные однослойным эпителием: слизистую оболочку уретры, выводные протоки бартолиниевых желез, канал шейки матки, тело матки, маточную трубу. Нередко в процесс вовлекаются парауретральные ходы, покровный эпителий яичников, слизистая оболочка прямой кишки, брюшина малого таза. Воспаление слизистой оболочки влагалища (гонорейный кольпит) возможно при особых состояниях женского организма: в детском возрасте, во время беременности и в период менопаузы. Воспалительная жидкость содержит большое количество фибриногена, быстро выпадающего в фибрин и способствующего тем самым отграничению воспалительного процесса с образованием многочисленных спаек. Распространение инфекции происходит в основном по предсуществующим каналам. Начальный период болезни составляет 3–4 дня. Иммунитет к гонококку практически не вырабатывается.
Клиническая картина Различают свежую гонорею (острая, подострая и торпидная), хроническую и латентную. Торпидная (асимптомная) форма характеризуется незначительными клиническими проявлениями при обнаружении у больных возбудителя. Для латентной гонореи типично такое состояние, когда гонококки в мазках и посевах не обнаруживаются, симптомы заболевания практически отсутствуют, а женщина является тем не менее явным источником заражения. Гонорейный уретрит. В острой стадии больные жалуются на боль и резь при мочеиспускании, в хронической стадии жалобы отсутствуют. При гинекологическом исследовании отмечаются покраснение и отечность в области наружного отверстия уретры и слизисто-гнойные выделения из уретры. В воспалительный процесс часто вовлекаются парауретральные ходы. При хроническом уретрите отмечается только утолщение стенок уретры (при прощупывании через переднюю стенку влагалища). Гонорейный эндоцервицит наряду с уретритом — самая частая локализация заболевания. В острой стадии наблюдаются слизисто-гнойные бели и небольшая боль внизу живота. При осмотре шейки матки с помощью влагалищных зеркал обнаруживают покраснение и разрыхление слизистой оболочки в области наружного маточного зева, шеечные слизисто-гнойные бели, свисающие в виде ленты. В хронической стадии выделения становятся слизистыми, жалоб больные не предъявляют. Вокруг наружного зева матки нередко бывает эрозия. Гонорейный бартолинит. Воспаление всегда начинается с выводного протока железы (каналикулит); оно выражается гиперемией в области наружных отверстий выводных протоков (гонорейные пятна). При присоединении вторичной инфекции возникает псевдоабсцесс железы с характерной клинической картиной. Гонорейный проктит наблюдается сравнительно редко, при затекании инфицированных выделений из половых органов. Острая стадия характеризуется чувством жжения в прямой кишке и тенезмами (болезненными позывами на дефекацию); в хронической стадии эти симптомы не выражены. Гонорейный эндометрит. Восхождению инфекции (ее проникновению за область внутреннего маточного зева) способствуют менструация, аборты, роды, внутриматочные вмешательства (диагностическое выскабливание, гистеросальпингография и др.). В воспалительный процесс при гонорейном эндометрите вовлечены как базальный, так и функциональный слои эндометрия. Во время очередной менструации отторжение слизистой оболочки затягивается, что проявляется типичной гиперполименореей (меноррагия). Острая стадия болезни характеризуется болью внизу живота, повышенной температурой, серозно-гнойными выделениями. При влагалищном исследовании матка слегка болезненная при прощупывании. Для хронического гонорейного эндометрита типичен только симптом меноррагии. Гонорейный сальпингоофорит обычно бывает двусторонним, в то время как при сальпингоофорите, вызванном другими микробами, воспалительный процесс чаще бывает односторонним. В острой стадии процесса больных беспокоят боль в животе, повышение температуры, нарушения мочеиспускания, нарушения менструального цикла. При влагалищном исследовании обнаруживают увеличенные и отечные придатки матки, резко болезненные при прощупывании. Часто присоединяются явления тазового перитонита. В хронической стадии больные предъявляют жалобы на периодически возникающую боль внизу живота, часто — ее рецидивы под влиянием неспецифических факторов (переохлаждение, грипп и др.). Типично бесплодие (первичное или вторичное). Гонорейный пельвиоперитонит является результатом перехода воспалительного процесса с придатков матки на брюшину малого таза. Воспаление имеет выраженную тенденцию к отграничению. Начало заболевания чаще острое. Характерны резкая боль в животе, расстройства пищеварения, тахикардия, повышение температуры, симптомы раздражения брюшины в нижних отделах живота. Отграничение процесса наступает быстро, о чем свидетельствует борозда, расположенная выше области таза (скопления петель кишечника и сальника). При влагалищном исследовании определяются явления двустороннего сальпингоофорита и выбухание заднего свода влагалища, резко болезненного при прощупывании. При пункции заднего свода в острой стадии процесса получают серозный выпот. В хронической стадии возникает боль, обусловленная рубцово-спаечными изменениями тазовых органов; часто развивается бесплодие за счет эндо- и перисальпингита. Осложнениями гонореи могут стать хронические заболевания органов малого таза (хронический простатит (см.), сальпингоофорит (см.), бесплодие (см.).
Диагностика и дифдиагностика Распознаванию способствует опрос: возникновение заболевания вскоре после начала половой жизни, случайные половые связи. При обследовании обнаруживают уретрит, эндоцервицит у первично бесплодной женщины, двусторонний сальпингоофорит, проктит (см.). Применяется бактериологическая и бактериоскопическая диагностика — мазки и посевы из уретры, канала шейки матки, влагалища (до начала применения антибиотиков!). В хронических стадиях показана провокация: смазывание слизистой оболочки уретры и цервикального канала раствором нитрата серебра (для уретры — 0,5 %-ный раствор, для шейки матки — 2 %-ный); внутримышечное введение гоновакцины (500 млн микробных тел); физиотерапевтические процедуры (диатермия и др.). Отличительную диагностику проводят с другими инфекционными заболеваниями, передающимися половым путем. В уточнении диагноза помогает бактериологическое и бактериоскопическое исследование, которое проводят на 3-й день после провокации. Менструация является провокацией, поэтому можно взять мазки и сделать посев на 2—3-й день менструации. Серологические реакции с антителами и антигеном большого диагностического значения не имеют. При цитобактериологическом исследовании мазков различают следующие картины: К1 — в мазке большое количество лейкоцитов, флоры нет, виден внутри- и внеклеточно расположенный гонококк (грамотрицательный); К2 — большое количество лейкоцитов, флоры нет, гонококки отсутствуют (мазок подозрителен на гонорею); К3 — небольшое количество лейкоцитов и разнообразная микробная флора (мазок не характерен для гонореи).
Лечение и профилактика При свежей и восходящей гонорее лечение проводят в условиях стационара. Постельный режим, антибактериальное и симптоматическое лечение. Назначают антибактериальную терапию, при этом курс лечения зависит от стадии и локализации воспалительного процесса. Курсовые дозы антибиотиков при гонорее нижнего отдела мочеполовых органов должны быть в 2 раза ниже, чем при восходящей гонорее (при восходящей гонорее антибактериальную терапию проводят в течение 5–7 суток). Пенициллин и полусинтетические пенициллины назначают в следующих дозах: бензилпенициллин или калиевая его соль (разовая доза от 500 тыс. до 2 млн ЕД внутримышечно, суточная — 2—20 млн ЕД внутримышечно; оксациллин по 0,5 г 4 раза в сутки внутримышечно; ампициллин по 0,4 г 6 раз в сутки внутримышечно; ампиокс по 1 г 3–4 раза в сутки внутримышечно). Из других антибиотиков применяют цефалоспорины (кефзол по 0,5–1 г 2–4 раза в сутки внутримышечно), тетрациклин по 0,25 г 4 раза в сутки внутрь, эритромицин по 0,5 г 3–4 раза в сутки внутрь. Сульфаниламиды назначают при непереносимости антибиотиков (по 1 г 5 раз в день в течение 4 дней). Вакцинотерапию проводят при хроническом течении заболевания (внутримышечно по 200–300 млн микробных тел через 2–3 дня или в очаг поражения по 50—100 млн микробных тел — только в стационаре). Местное лечение применяют при хронической гонорее нижнего отдела половых органов (в острой стадии эти процедуры противопоказаны). При уретрите: промывание уретры раствором перманганата калия в разведении 1:5000—1:10 000; введение 1–2 %-ного раствора протаргола, смазывание слизистой оболочки уретры 1 %-ным раствором нитрата серебра. При цервиците: смазывание канала шейки матки 2 %-ным раствором нитрата серебра, влагалищные ванночки с 3–5 %-ным раствором протаргола. При бартолините: в острой стадии — сидячие ванночки и УВЧ; при нагноении — вскрытие гнойника; в хронической стадии — удаление железы (в случае образования псевдоабсцесса). После окончания лечения проводят гинекологическое исследование больной и берут мазки в течение 3 месяцев. Мазки из уретры, шейки и влагалища берут после медикаментозной и физиологической (менструация) провокации (см. выше). Отсутствие гонококков в течение этого периода позволяет считать женщину излеченной от гонореи. Профилактика заключается в активном выявлении больных, их полноценном лечении, тщательном контроле за качеством и полнотой излечения, выявлении и отлучении половых партнеров больных, проведении санитарно-просветительной работы среди населения.
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА
ОпределениеГранулематоз Вегенера — это системный некротический гранулематозный артериит с преимущественным поражением верхних дыхательных путей, легких, почек, а также других органов, в том числе кожи.Это редкое тяжелое аутоиммунное заболевание возникает в возрасте 25–55 лет, у мужчин в 2 раза чаще.
Этиология и патогенез Факторы возникновения заболевания неизвестны. Провоцирующим фактором могут быть распираторные заболевания, охлаждения, травма, лекарственная непереносимость. Предполагается аутоиммунный механизм развития васкулита. Маркерами заболевания являются антигены HLA-B7, B8, DR2, DQ-W7. Патогенетически определенную роль играют нейтрофильные цитоплазматические антитела, которые реагируют с протеиназой-3 цитоплазмы нейтрофилов. Механизм развития заболевания связан с иммунными нарушениями, приводящими к гиперергичекой сосудистой реакции с образованием иммунных комплексов; нарушение антибактериальной защиты — с дефектом нейтрофилов.
Патанатомия Гистологически обнаруживают изменения типа гранулемы и некротического васкулита. Гранулема представляет собой очаг некроза, окруженный инфильтратом, содержащим нейтрофилы, лимфоциты и плазматические клетки, реже эозинофилы.
Клиническая картина Различают генерализованную и локализованную формы. При генерализованной форме наблюдаются очаги гранулематозного воспаления слизистых оболочек носа и его пазух, а также глотки, трахеи, которые приводят к язвеннонекротическим поражениям. Данная форма сопровождается фебрильным (с увеличением температуры тела) септическим состоянием с тяжелыми изменениями в легких, почках, органах зрения, сердце, нервной системе, печени и других органах. При локализованной форме тяжелые легочные и внелегочные изменения протекают без выраженных поражений почек, но в 50 % случаев сопровождаются высыпаниями на коже. К ранним проявлениям, иногда на месяцы предшествующим другим системным симптомам болезни, относятся папулонекротические (узелково-некротические), везикулезные, реже уртикарные, пятнисто-узелковые или пятнистые высыпания. Могут возникать подкожные узлы и очаги глубоких пиогенных поражений. В терминальном (конечном) периоде, протекающем с явлениями уремии, возникают генерализованная эритема, пурпура, везикулы десен, некроз альвеолярных отростков. Болезнь обычно заканчивается летальным исходом спустя несколько недель и месяцев после развития кахексии и почечной недостаточности стадии.
Диагностика Диагноз устанавливают на основании клинической картины, результатов гистологического и лабораторного исследований. Диагноз устанавливается при наличии двух и более перечисленных признаков: — воспаление слизистой оболочки носа или ротовой полости с появлением болезненных и безболезненных язв на слизистой рта или гнойно-кровянистых выделений из носа; — определение при рентгенологическом исследовании легких узелков, инфильтратов, полостей; — выявление при микроскопии мочевого осадка микрогематурии и эритроцитарных цилиндров; — определение при биопсии стенки артерий или артерии гранулематозного воспаления. Дифференциальный диагноз проводят с узелковым периартериитом кожи, системной красной волчанкой и др.
Лечение Длительное применение больших доз кортикостероидных гормонов (преднизолон по 40–60 мг в сутки с препаратами калия, кальция, антибиотиками широкого спектра действия, витаминами) в комбинации с цитостатиками (циклофосфамидом или метотрексатом, хлорамбуцилом). Сообщается о высокой эффективности бактрима.
ГРИПП
ОпределениеГрипп — острое вирусное заболевание, характеризующееся коротким инкубационным периодом, выраженной общей интоксикацией, катаральными изменениями дыхательных путей и склонностью к бактериальным суперинфекциям.
Этиология Возбудителем гриппа является РНК-содержащий вирус. Их вирионы имеют округлую или овальную форму с диаметром частиц 80—100 нм. Известно 3 серологических варианта вирусов гриппа — А, В, С. Наиболее характерной особенностью вируса гриппа является уникальная изменчивость его поверхностных антигенов — гемагглютинина и нейраминидазы. В последние годы установлено, что причиной повторных заболеваний и повторных эпидемий является указанная изменчивость вируса. В естественных условиях она присуща вирусу гриппа типа А и происходит с определенной последовательностью. Точные механизмы данного процесса неясны. Наиболее доказательной является антропонозная теория происхождения пандемических штаммов вируса, согласно которой антигенная изменчивость вируса гриппа А небезгранична, происходит спиралеобразно и зависит от состояния коллективного иммунитета. Анитигены вируса типа В изменяются в значительно меньшей степени и не систематически, изменчивость антигенов для вируса С не зарегистрирована. Вирусы гриппа малоустойчивы во внешней среде. Они лучше переносят низкие, отрицательные температуры и быстро погибают при нагревании и кипячении. Отмечается высокая чувствительность вирусов гриппа к ультрафиолетовым лучам и воздействию обычных дезинфицирующих средств.
Эпидемиология Источником инфекции является больной человек. Максимальная зараженность наблюдается в первые дни болезни, когда при кашле и чихании с капельками слизи вирусы интенсивно выделяются во внешнюю среду. Большая часть больных теряет заразительность спустя 5–9 дней. Путь передачи — воздушно-капельный. Вирусы гриппа постоянно циркулируют среди населения и вызывают подъем заболеваемости ежегодно в зимнее время. Наряду с этим каждые 1–3 года отмечаются эпидемические вспышки, вызванные различными серологическими вариантами вируса гриппа типа А. Каждые 10–30 лет имеют место пандемии гриппа, обусловленные появлением новых серотипов вируса А. За последние годы большинство эпидемий в нашей стране были не завозного, а эндогенного характера. Повсеместно регистрируется коциркуляция обоих эпидемических вариантов вирусов гриппа А (H3N2), A (H1N1), с некоторым преимуществом вируса гриппа А (H3N2). Претерпевает изменение эпидемический процесс при гриппе В, эпидемии которого стали чередоваться с интервалом в 2 года. Периодичность эпидемий и уровень заболеваемости зависят от длительности приобретенного типоспецифического иммунитета у населения и изменчивости антигенных свойств вируса. Существовавшее ранее мнение о кратковременности и слабости постгриппозного иммунитета подверглось пересмотру. Выяснилось, что штамм специфический, постинфекционный иммунитет к гриппу у большинства людей сохраняется практически до конца жизни. Существенная роль в невосприимчивости к гриппу принадлежит иммунной памяти. В число неспецифических гуморальных факторов невосприимчивости к вирусу гриппа входят термолабильные бетаингибиторы, кофактор и интерферон. К ним же относят тепловое воздействие человеческого организма, значительно усиливающееся при высокой температуре, на внеклеточно расположенные вирусы. Постинфекционный иммунитет при гриппе А сохраняется 1–3 года, при гриппе В в течение 3–6 лет, поэтому вспышки гриппа А и В иногда наслаиваются и возникают длительные двухволновые эпидемии.
Патогенез Вирусы гриппа обладают тропностью к эпителию дыхательных путей. Здесь он внедряется в цилиндрический эпителий и альвеолярные клетки, где находит наиболее благоприятные условия для развития. В этот период вирус можно обнаружить в крови. Клиническому проявлению симптомов предшествует фаза скрытого взаимодействия вируса с восприимчивой клеткой, в которой происходит воспроизведение и накопление заразного начала. Вследствие существенных нарушений обмена веществ инфицированные клетки гибнут с высвобождением как вирусных частиц, так и неспецифических токсических субстанций (гистамина, серотонина и др.). Освободившийся вирус частично выбрасывается во внешнюю среду во время кашля, чихания и разговора, часть его внедряется в еще нетронутые клетки, но значительное количество проникает в кровь, создавая, с одной стороны, вирусемию, с другой — обеспечивая развитие синдрома общей интоксикации. В отличие от других респираторных вирусных инфекций воспроизведение возбудителя при гриппе происходит значительно быстрее. Отсюда короткий инкубационный период и внезапность возникновения болезни. В основе механизма развития общей интоксикации лежит воздействие вируса и неспецифических токсических субстанций, поступающих в кровь из очага первичной фиксации вируса, на важные центры, осуществляющие нейровегетативную, нейроэндокринную и нейрогуморальную регуляцию в организме, расположенные в зоне промежуточного мозга, где создается высокая концентрация токсических продуктов. В результате воздействия токсических субстанций на чувствительные рецепторы мозговых оболочек, сосудов коры и промежуточного мозга возникают головная боль и другие симптомы выраженной общей интоксикации: головокружение, общая слабость. Непосредственное и рефлекторное влияние вируса и токсических продуктов на центральную нервную систему влечет за собой изменение проницаемости капилляров, это нарушает обменные процессы, образование и движение спинномозговой жидкости, микроциркуляцию и кровообращение в целом. В настоящее время наличие вирусемии, токсемии и их значение в механизме развития гриппа не вызывает сомнений, но вирус не только находится в крови и заносится ею в различные органы и ткани, он накапливается в них (в мозге, почках, печени), являясь подчас причиной воспалительных реакций (менингит, менингоэнцефалит). Тяжесть поражения нервной системы зависит как от особенностей возбудителя, так и от исходного состояния макроорганизма, его нервной системы, общей устойчивости, наличия или отсутствия сенсибилизации, очагов хронической инфекции. Проникновение в верхние дыхательные пути и альвеолы и первичная фиксация вируса гриппа в них обусловливают постоянное развитие катаральных изменений дыхательных путей.
Патанатомия Патоморфологические изменения в слизистых оболочках дыхательных путей характеризуются дегенеративными явлениями в эпителиоцитах, исчезновением ворсинок из них, гибелью, слущиванием пластов эпителия. Железы расширены и находятся в состоянии гиперсекреции. В слизистых оболочках отмечаются сосудистые нарушения в виде полнокровия, отека, иногда кровоизлияний.
Клиническая картина Различают типичное и атипичное течение гриппа, а по тяжести клинических проявлений — легкую, средней тяжести и тяжелую формы болезни. Некоторые авторы выделяют еще очень тяжелую — молниеносную (гипертоксическую) форму болезни. Инкубационный период при гриппе составляет обычно 1–2 дня, но может укорачиваться до нескольких часов и удлиняться до 3 дней. В клинической картине заболевания выделяют два основных синдрома — интоксикацию и поражение дыхательных путей (катаральный синдром). В типичных случаях грипп начинается остро. Возникают озноб или познабливание, головная боль. Уже через несколько часов температура тела достигает максимальных цифр (38,5—40 °C). Развиваются слабость, ощущение разбитости, ноющие боли в мышцах, костях и крупных суставах. Головная боль усиливается и локализуется в лобной или лобно-височной области, надбровных дугах и глазных яблоках; иногда отмечается светобоязнь. Выраженная интоксикация сопровождается головокружением, в некоторых случаях обморочным состоянием, анорексией, рвотой, геморрагическим синдромом, проявляющимся чаще всего в виде носового кровотечения. В первые сутки болезни больные жалуются на сухость и саднение в носоглотке, «заложенность» носа. На 2—3-й день у большинства из них возникает кашель, часто сопровождающийся саднением и болями за грудиной, а также небольшой насморк. Спустя 3–4 дня кашель становится влажным.
Грипп. Изменения в зеве
Грипп. Инъекция сосудов склер
В неосложненных случаях продолжительность лихорадки при гриппе А составляет 1–6 дней, чаще до 4 дней, при гриппе В — несколько больше. Снижение температуры происходит критически либо постепенно, сопровождаясь потоотделением. Двухволновая лихорадка встречается редко; ее развитие зависит от появления осложнений. При осмотре больного в первые дни заболевания отмечаются гиперемия и одутловатость лица, инъекция сосудов склер, иногда герпетические высыпания на губах с 3—4-го дня. При тяжелом течении болезни наблюдается бледность кожных покровов с синюшным оттенком (проявление недостатка кислорода). Зев синюшно-багровый. Гиперемия носит разлитой характер, более яркой она бывает в области дужек, распространяется на мягкое небо и заднюю стенку глотки. У ряда больных отмечается мелкая зернистость неба, реже язычка и дужек. Задняя стенка глотки суховата на вид и имеет увеличенные лимфатические фолликулы. К 3—4-му дню гиперемия слизистых оболочек уменьшается и остается лишь инъекция сосудов. На этом фоне более заметной становится зернистость мягкого неба и нередко видны точечные кровоизлияния. Слизистая оболочка носа гиперемирована, с синюшным оттенком, набухшая. На 2—3-й день заболевания могут появиться необильные серозные, затем слизистые выделения из носа. В случае присоединения бактериальной флоры выделения приобретают слизистогнойный характер. У многих больных отмечается приглушенность тонов сердца, особенно при тяжелых формах заболевания. Поражение органов дыхания закономерно. В лихорадочном периоде может наблюдаться одышка. При простукивании легких нередко выявляется коробочный звук, прослушивание определяет жестковатое дыхание, могут прослушиваться кратковременные сухие хрипы.
Грипп. Фолликулярная ангина слева
При рентгенологическом исследовании в ранние сроки находят усиление легочного рисунка и расширение корней легких. Пищеварительная система поражается в меньшей степени. При тяжелых формах гриппа аппетит снижен вплоть до анорексии, язык влажный, обложен белым налетом, у кончика — ярко-красный с обнаженными сосочками, иногда болезненный. Отмечается склонность к запорам. В периферической крови наблюдаются снижение уровня лейкоцитов, нейтроцитов, эозинофилов, незначительное повышение уровня моноцитов; СОЭ нормальная или снижена. Со стороны мочевыделительной системы отмечается умеренное снижение объема выделяемой мочи, сменяющееся повышением его после нормализации температуры. Нередко имеют место выделение с мочой белков, небольшое количество клеток крови и цилиндров. Особенно ярко выражены функциональные нарушения вегетативной нервной системы в виде покраснения лица, потливости, неустойчивости пульса. Поражение центральной нервной системы проявляется клинически симптомами интоксикации, а при тяжелом течении болезни — менингеальными симптомами, судорогами и явлениями энцефалопатии, обусловленными циркуляторными расстройствами. Страдает и периферическая нервная система. Бывают локальные нарушения чувствительности кожных покровов, невралгии тройничного, межреберных и других нервов. Период выздоровления продолжается 1–2 недели и характеризуется наличием астеновегетативного синдрома (повышенная утомляемость, раздражительность, нарушение сна, потливость, неустойчивость пульса), наклонностью к осложнениям и обострению хронических заболеваний. При легкой форме гриппа интоксикация выражена слабо. Температура тела повышенная, длительность ее не превышает 2–3 дня. В некоторых случаях в клинической картине доминируют симптомы поражения верхних дыхательных путей. Длительность лихорадочного периода составляет в среднем 4–5 дней. Форма средней тяжести является наиболее частым вариантом течения инфекции. Заболевание сопровождается отчетливо выраженной интоксикацией организма и симптомами поражения верхних дыхательных путей. Длительность лихорадочного периода составляет в среднем 4–5 дней. Тяжелая форма гриппа характеризуется острейшим началом, высокой и более длительной лихорадкой с резко выраженной интоксикацией. Болезнь проявляется снижением подвижности, головокружением, обморочным состоянием, бессонницей или сонливостью, анорексией, рвотой, судорогами, потерей сознания, менингеальными симптомами, энцефалическим синдромом, сердечно-сосудистыми нарушениями. Чаще встречаются геморрагические проявления. Со стороны органов дыхания, как правило, наблюдаются осложнения, наиболее часто вирусно-бактериальные пневмонии. Продолжительность заболевания во многом зависит от характера и течения возникших осложнений. Молниеносная (гипертоксическая) форма гриппа, по мнению многих авторов, не является строго очерченным в клиническом отношении вариантом заболевания. В клинической картине доминируют тяжелейший нейротоксикоз с развитием отека мозга, сердечно-сосудистая недостаточность, дыхательная недостаточность (острый геморрагический отек легких), бронхиолит, сужение гортани. Нередко наблюдается сочетание этих синдромов, так что выделить из них ведущий не представляется возможным. Отличительными особенностями данной формы являются крайняя тяжесть и быстротечность заболевания, часто заканчивающегося летально. Атипичные формы гриппа встречаются сравнительно редко и характеризуются отсутствием одного из кардинальных синдромов. Заболевание может протекать без температурной реакции и других проявлений интоксикации или при отсутствии симптомов поражения дыхательных путей. Существенных отличий в течении гриппа, вызванного разными серотипами вируса гриппа А, не отмечается. Однако пандемии, обусловленные появлением нового серологического варианта вируса гриппа, характеризуются увеличением числа больных с тяжелыми формами болезни. Грипп типа В отличают более длительные инкубационный период и катаральные явления на фоне менее выраженной по сравнению с гриппом А интоксикацией. В период эпидемии регистрируются все формы заболевания, а в межэпидемический период («спорадический грипп») преобладают легкие и средней степени тяжести формы.
Осложнения Наиболее частым и серьезным осложнением гриппа является пневмония. Она может развиваться в любой период болезни в случае присоединения бактериальной флоры (пневмококки, стафилококки). Наличие первично-вирусных пневмоний в последние годы отвергается. Особенно часто пневмонии возникают у детей, лиц пожилого возраста и при наличии хронических заболеваний дыхательной системы. Второе место по частоте занимают осложнения со стороны лор-органов. Присоединение микробной флоры при гриппе способствует возникновению ринита, фарингита, ларингита, трахеобронхита, а также поражению миндалин (лакунарная и фолликулярная ангина), придаточных полостей носа (гайморит, фронтит, этмоидит), слухового аппарата (отит, тубоотит) и т. д. При гриппе могут развиваться осложнения со стороны нервной системы: менингоэнцефалит, арахноидит, полиневрит, радикулит и др. Для гриппа закономерны обострения любого хронического процесса, и в первую очередь хронических заболеваний сердечно-сосудистой, дыхательной, мочевыделительной и нервной систем.
Диагностика и дифдиагностика Ведущие клинические признаки гриппа: острое начало с развитием симптомов интоксикации в 1-е сутки, высокая лихорадка, головная боль с типичной локализацией в области лба, надбровных дуг, глазных яблок, ноющие боли в костях, в мышцах вялость, «разбитость», возникновение на 2—3-и сутки умеренно выраженных катаральных явлений (насморк, сухой кашель, разлитая гиперемия зева и задней стенки глотки). Материалом для вирусологических исследований служит отделяемое носа и глотки, а также кровь. Вирус можно выделить на разных этапах гриппозной инфекции, но чаще в начале болезни. Культивируют вирус на куриных эмбрионах. Для быстрой диагностики гриппа в ранние сроки применяется метод флюоресцирующих антител. Наибольшее значение в подтверждении гриппа имеют серологические исследования. Применяют РТГА, РСК, реже реакцию нейтрализации. Диагностическое значение имеет нарастание титра антител в 4 раза и более. В последние годы стали использовать высокочувствительные методы (экспрессивные) иммуноферментного анализа и молекулярной гибридизации. Интоксикация и поражение дыхательных путей встречаются при многих заболеваниях. Наибольшие затруднения возникают в дифференциальной диагностике гриппа от других острых респираторных заболеваний, пневмоний различного генеза, обострений хронических заболеваний дыхательных путей. Определенные сложности встречаются при разграничении гриппа с другими инфекциями (тифы, малярия, некоторые детские инфекции, орнитоз и др.).
Лечение Лечение большинства больных гриппом проводят на дому. Госпитализации подлежат лица с тяжелыми и осложненными формами гриппа, а также с тяжелой сопутствующей патологией. В ряде случаев госпитализацию осуществляют по эпидемиологическим показаниям. В течение всего лихорадочного периода больному предписываются молочно-растительная диета, обогащенная витаминами, обильное питье. Из этиотропных средств применяют био- и химиопрепараты: биологические средства включают иммуноглобулины и интерферон. Противогриппозный гамма-глобулин вводят при тяжелых формах взрослым в дозе 3 мл, детям 1 мл. Указанную дозу назначают повторно при выраженных симптомах интоксикации. При отсутствии противогриппозного глобулина применяют противокоревой (он также содержит противогриппозные антитела). Специфическое действие этих препаратов отмечается лишь при введении их в первые 3 дня болезни. Лейкоцитарный интерферон используют в начальный период гриппа. Препарат в виде раствора вводят в носовые ходы каждые 1–2 ч на протяжении первых 2–3 дней заболевания. Из химиопрепаратов в настоящее время используют ремантадин; назначенный в ранние сроки болезни, особенно в первые сутки, он дает выраженный эффект и применяется в течение первых трех дней болезни. В 1-й день суточная доза составляет 300 мг (по 100 мг 3 раза в день), во 2-й и 3-й день по 200 мг (по 100 мг 2 раза в день). Показан также оксолин, который выпускается в виде 0,25 %-ной мази. Его назначают 3–4 раза в день (в полость носа). Оксолиновая мазь смягчает катаральные явления и сокращает их длительность. Оказывает эффект лишь в первые дни болезни. Широко используют патогенетические и симптоматические средства, обязательны десенсибилизирующая терапия и витаминотерапия. При высокой температуре тела показаны жаропонижающие средства. Для устранения сухости и першения в горле рекомендуют теплое молоко с минеральной водой, инжиром, гидрокарбонатом натрия. Для облегчения кашля используют пектусин, глаувент, либексин, тусупрекс, щелочные ингаляции, позже — отхаркивающие средства, горчичники. При остром рините показан 2–3 %-ный раствор эфедрина. В последние годы с успехом применяют комплекс препаратов: ремантадин 3 дня и антигриппин (анальгина 0,5 г, аскорбиновой кислоты 0,3 г, димедрола 0,02 г, рутина 0,02 г, лактата кальция 0,1 г) в течение 5 дней. Антибиотики и сульфаниламидные препараты назначают при наличии бактериальных осложнений, с профилактической целью их следует давать больным туберкулезом и некоторыми хроническими заболеваниями дыхательной системы. В лихорадочный период гриппа рекомендуется обильное питье, а при тяжелых формах заболевания — внутривенное введение жидкости (от 500 до 2000 мл) в сочетании с мочегонными средствами. Больных с молниеносными (гипертоксическими) формами гриппа лечат в палатах интенсивной терапии. Лечение осложнений со стороны лор-органов, нервной, мочевыделительной и других систем проводится под наблюдением соответствующих специалистов.
Профилактика Для активной иммунизации против гриппа используют инактивированнные и живые вакцины. Новые типы инактивированных очищенных вакцин включают: цельновирусные (вирионные), из расщепленных вирионов (спливирусные вакцины), субъединичные препараты наивысшей степени очистки. Для профилактики сейчас используют два первых типа инактивированных вакцин. Вирионные вакцины вводят внутрикожно струйным методом с помощью безыгольного инъектора, что позволяет использовать их для иммунизации больших контингентов населения. Вакцина из расщепленных вирионов-АГХ (адсорбированнная гриппозная химическая вакцина) вводится подкожно и используется главным образом для иммунизации людей, которым противопоказаны прививки вирионными и живыми вакцинами. К живымгриппозным вакцинам относятся аллантоисная (яичная) и тканевая. Иммунизация живой аллантоисной вакциной осуществляется интраназально (в полость носа) двукратно с интервалом 20–30 дней. Она применяется в основном для вакцинации ограниченных контингентов населения. Живая тканевая вакцина для перорального применения, как правило, не вызывает побочных реакций и используется для иммунизации детей. Для профилактики гриппа перед началом эпидемии и во время ее следует назначать стимуляторы интерферона, лишенные инфекционных и антигенных свойств (нуклеиновые кислоты, полисахариды). В период эпидемии для экстренной профилактики применяют оксолиновую мазь, лейкоцитарный интерферон, ремантадин. С этой же целью у лиц группы риска используют донорский и плацентарный гамма-глобулин. Для снижения заболеваемости в период эпидемии гриппа проводят комплекс противоэпидемических мероприятий. Больных надо изолировать. Помещение, где находится больной, необходимо проветривать. Следует производить влажную уборку, используя 0,5 %-ный раствор хлорамина. В медицинских учреждениях, аптеках, магазинах и других сферах обслуживания персонал должен работать в масках из четырехслойной марли. В палатах лечебных учреждений, врачебных кабинетах и коридорах в поликлиниках следует систематически включать ультрафиолетовые лампы. Для выздоравливающих в поликлиниках организуются изолированные отсеки с отдельным входом с улицы и гардеробом.
ГУДПАСЧЕРА СИНДРОМ
ОпределениеСиндром Гудпасчера — системный капиллярит с преимущественным поражением легких и почек по типу геморрагических пневмонита и гломерулонефрита. Заболевают чаще мужчины в возрасте 20–30 лет.
Этиология и патогенез Факторы возникновения заболевания неизвестны, однако отмечается связь с вирусной и бактериальной инфекцией, переохлаждением. Первое описание болезни сделано во время эпидемии гриппа в 1919 г. Обсуждается аутоиммунный механизм развития, поскольку обнаружены циркулирующие и фиксированные антитела к базальным мембранам почек, перекрестно реагирующие с антигенами базальных мембран легких.
Клиническая картина Начало острое, с высокой лихорадкой, кровохарканьем или легочным кровотечением, одышкой. При прослушивании отмечаются обилие звонких влажных хрипов в средних и нижних отделах легких, рентгенологически — множественные очаговые или сливные затемнения в обоих легочных полях. Тяжелый, прогрессирующий гломерулонефрит развивается почти одновременно, быстро приводя к почечной недостаточности. Повторные кровохарканье и потеря крови с мочой ведут, как правило, к анемии, усугубляющейся при почечной недостаточности. Диагноз легочно-ренального синдрома подтверждается прогрессирующей почечной недостаточностью на фоне геморрагического гломерулонефрита в сочетании с пневмонией у молодых мужчин. При лабораторном исследовании: анемия, увеличение количества лейкоцитов в крови и повышенная СОЭ. Характерным иммунологическим признаком болезни являются антитела к базальным мембранам почки. Прогноз обычно неблагоприятен — смерть наступает в течение 12 месяцев от начала болезни при явлениях легочно-сердечной или почечной недостаточности.
Лечение Кортикостероиды в больших дозах (преднизолон до 100 мг/сут.) в сочетании с цитотоксическими препаратами (азатиоприн по 150–200 мг/сут.) при условии рано начатого лечения могут замедлить прогрессирование болезни. Описано успешное применение плазмафереза в сочетании с иммуносупрессивной терапией.
ГРЫЖА БРЮШНОЙ СТЕНКИ
ОпределениеРазличают наружные и внутренние грыжи живота. Наружные грыжи живота — это выхождение внутренних органов брюшной полости, покрытых париетальным листком брюшины, через естественные и приобретенные дефекты мышечно-апоневротического слоя брюшной стенки.От наружных грыж живота следует отличать эвентрацию и выпадение (пролапс) внутренних органов. Эвентрация — это выхождение внутренних органов через дефект в брюшной стенке и париетальном листке брюшины. Эвентрация обычно связана с острой травмой в брюшной стенке и наиболее часто возникает после ранений, травм и оперативных вмешательств. Выпадением (пролапсом) называют выпячивание наружу отдельных внутренних органов или их частей через естественные отверстия путем выворота наружу их внутренней стенки (выпадения влагалища, матки, прямой кишки). Внутренние грыжи живота — это выпячивание органов брюшной полости в различные складки и карманы брюшины, брыжейки кишки, а также в грудную полость через естественные или приобретенные отверстия и щели диафрагмы. Внутренние грыжи живота относятся к редким видам патологии. В ряде случаев они могут явиться причиной развития кишечной непроходимости и, как правило, распознаются во время оперативного вмешательства. Наружные грыжи живота являются одними из самых частых хирургических заболеваний. Среди заболеваний, подлежащих хирургическому лечению, они составляют 8—20 %, или около 3–4 % всего населения имеют брюшные грыжи. У мужчин наружные грыжи живота встречаются чаще, чем у женщин. Однако это преобладание не столь велико, как считалось раньше, и по материалам современных статистических исследований составляет 1,12—1,3 раза. У мужчин чаще развиваются паховые грыжи, другие локализации наружных грыж живота встречаются преимущественно у женщин. Грыжи живота наблюдаются в любом возрасте, но наибольшая частота заболеваемости отмечается в дошкольном возрасте и после 50 лет. Около 40 % заболевает в наиболее работоспособном возрасте — от 20 до 50 лет. Грыжи бедренные — это грыжи, которые выходят под паховой связкой в области бедренного треугольника, ограниченного сверху пупартовой связкой, медиально-длинной приводящей мышцей бедра, латеральнопортняжной мышцей. Подавляющее большинство бедренных грыж выходят через бедренный канал. По частоте образования они составляют 5–6 % от всех грыж живота и встречаются преимущественно у женщин.
Схема бедренной грыжи: 1 — кожа и подкожная клетчатка; 2 — мышцы; 3 — брюшина; 4 — паховая связка; 5 — лобковая кость; 6 — большая подкожная вена
Белая линия живота образуется за счет перекрещивающихся сухожильных пучков трех пар широких мышц живота. Она тянется от мечевидного отростка грудины до симфиза, более широкая над пупком. В белой линии живота имеются щелевидные промежутки, через которые проходят сосуды и нервы, связывающие предбрюшинную клетчатку с подкожной. Эти щели и являются местами выхода грыж.
Этиология, патогенез и патанатомия Возникновение грыж живота является сложным патологическим процессом, который происходит в результате взаимодействия целого ряда причинных факторов и патогенетических механизмов. Основным условием возникновения грыж живота следует считать длительно существующее несоответствие между силой внутрибрюшного давления и сопротивлением ему определенных участков брюшной стенки. Под влиянием часто повторяющегося значительного повышения внутрибрюшного давления в этих местах возникает растяжение тканей и образуются грыжевые ворота, происходит расслабление париетального листка брюшины и его выпячивание — соответственно расположению грыжевых ворот формируется воронка, которая с наружной стороны представляет выпячивание париетальной брюшины и в последующем преобразуется в грыжевой мешок — элемент наружной грыжи передней брюшной стенки. Причины, способствующие образованию грыж, можно разделить на местные и общие. Местные причины, предрасполагающие к возникновению наружных грыж живота, связаны с анатомическими особенностями строения брюшной стенки, особенно в «слабых» ее местах. К таким местам, или «грыжевым точкам», брюшной стенки относятся следующие: зона пахового канала, зона овальной ямки на бедре, апоневроз белой линии живота, пупочная область, зоны спигиевой линии, треугольника Пти, четырехугольники Грюнфельда-Лесгафта, запирательного канала и некоторые другие. К общим причинам могут быть отнесены следующие. 1. Предрасполагающие причины — это особенности конституционального характера (общее недостаточное развитие, слабое телосложение, недостаточное физическое развитие), наследственность, пол, возраст, патология коллагеновой системы (диспропорция синтеза, трансформации и дезинтеграции коллагена, его качественные изменения) и др. 2. Производящие причины: — повышение внутрибрюшного давления; — снижение биомеханических свойств брюшной стенки. В настоящее время роль наследственной предрасположенности в образовании грыж не вызывает сомнения и отмечается у 20–25 % больных. Речь идет не только о наследственной передаче особенностей анатомического строения брюшной стенки, но и об истинной, конституциональной предрасположенности к образованию грыж, в основе которой лежит врожденная слабость соединительной ткани, носящая характер системной патологии, которая проявляется в виде множественных грыж, например сочетанием грыжи пищеводного отверстия с паховой грыжей и т. д. У таких больных часто наблюдаются недоразвитие скелетной мускулатуры, плоскостопие, варикозная болезнь, атонические запоры и др. Важным причинным фактором, обусловливающим ослабление брюшной стенки у женщин, является беременность, при которой происходит значительное истончение и расширение пупочного кольца, перерастяжение мышц. Эти изменения носят физиологический характер, и после родов происходит почти полная реституция первоначальных свойств тканей, однако достаточно полное восстановление биомеханических свойств брюшной стенки наблюдается далеко не во всех случаях. Важной причиной развития грыж брюшной стенки является значительное и стойкое повышение внутрибрюшного давления: тяжелый физический труд, особенно при отсутствии трудовых навыков; частый плач и крик в младенческом и детском возрасте; острые и хронические заболевания органов дыхания, сопровождающиеся изнурительным кашлем; длительные запоры и поносы; заболевания, затрудняющие мочеиспускание (аденома предстательной железы); частые рвоты; игра на духовых инструментах и др. Грыжи живота классифицируют по анатомическим, этиологическим и клиническим признакам. По локализации грыжевых ворот различают паховые, бедренные, пупочные грыжи, грыжи белой линии живота, спигелевой линии, а также поясничные, седалищные и промежностные грыжи.
Пупочная грыжа
По этиологическим признакам все грыжи в зависимости от их происхождения делятся на две группы: врожденные и приобретенные. Подавляющее большинство наружных врожденных грыж живота — это паховые и пупочные грыжи. Они могут проявиться сразу же после рождения ребенка или значительно позже. Приобретенные грыжи делят в зависимости от причин, которые привели к возникновению дефекта брюшной стенки. Наиболее часто из всех приобретенных наружных грыж живота встречаются грыжи, возникающие в типичных «слабых» местах брюшной стенки. Эти грыжи называют предуготовленными. Большую группу составляют послеоперационные вентральные грыжи.
Скользящая грыжа
В строении каждой наружной грыжи живота следует различать следующие ее элементы: грыжевые ворота, грыжевой мешок, грыжевые оболочки и грыжевое содержимое. Грыжевые ворота — это дефект в мышечно-апоневротическом слое брюшной стенки, через который происходит выхождение наружу внутренних органов и париетального листка брюшины. Грыжевые ворота могут возникать во всяком врожденно или приобретенно ослабленном месте брюшной стенки. Врожденно ослабленные места обусловлены особенностями расположения мышц, оболочек, апоневрозов брюшной стенки, способствующими возникновению между их краями щелей, промежутков, которые являются исходным пунктом для формирования грыжевых ворот. Мышечно-апоневротические ткани, образующие края грыжевых ворот, в начальной стадии образования грыжи податливы и эластичны, но вследствие давления увеличивающимся грыжевым выпячиванием могут подвергаться атрофии и фиброзному перерождению, становясь малоподатливыми, ригидными. Форма грыжевых ворот может быть круглая, овальная, треугольная, щелевидная или неопределенная. Величина их также очень вариабельна — от 1–2 см при пупочных грыжах и грыжах белой линии живота до 20–30 см и более при послеоперационных грыжах. Грыжевой мешок образован выпячиванием через грыжевые ворота париетального листка брюшины. Различают устье, шейку, тело и дно грыжевого мешка. Устьем грыжевого мешка называют место, где его полость соединяется с полостью брюшины. Шейкой грыжевого мешка является его верхний отдел, находящийся в грыжевых воротах. Обычно она имеет несколько вытянутую, узкую, трубчатую форму; стенки ее утолщены по сравнению с остальной частью грыжевого мешка и менее податливы. Шейка грыжевого мешка переходит в тело, наиболее широкую его часть. Самая нижняя часть грыжевого мешка называется дном. Иногда через грыжевые ворота одновременно с грыжевым мешком выпячивается и орган, лишь частично покрытый брюшиной или расположенный в забрюшинной клетчатке, например мочевой пузырь, восходящая ободочная кишка и т. д. В этих случаях одну из стенок грыжевого мешка составляет частично покрытый брюшиной «соскользнувший орган». Такие грыжи называются скользящими. Грыжевой мешок может быть врожденным (врожденные выпячивания, или эмбриологические остатки бывших карманов, брюшины) и приобретенным. Так, например, в случае задержки облитерации (заращения) влагалищного отростка брюшины в паховом канале он может стать грыжевым мешком врожденной паховой грыжи. Грыжевые оболочки — это ткани, покрывающие снаружи грыжевой мешок и располагающиеся между ним и кожей. К ним относятся: предбрюшинная клетчатка, растянутые и истонченные пластинки фасций, волокна мышц, элементы семенного канатика. Внутренние органы брюшной полости, постоянно или периодически перемещающиеся через грыжевые ворота в грыжевой мешок, составляют грыжевое содержимое. Содержимым грыжи может быть любой орган брюшной полости, но чаще им бывают органы, ближе расположенные к месту грыжевых ворот и обладающие большей подвижностью. По частоте участия в составе грыжевого содержимого их можно разложить в следующем порядке: петли тонкой кишки; сальник; отделы ободочной кишки, снабженные брыжейкой; червеобразный отросток и жировые подвески толстой кишки; маточные трубы и яичник, иногда и матка, даже беременная; складки брыжейки кишки; органы, расположенные забрюшинно или частично покрытые брюшиной, в виде так называемой скользящей грыжи (мочевой пузырь, слепая кишка, восходящий и нисходящий отделы толстой кишки, мочеточник, почка, поджелудочная железа); наконец, желудок, селезенка, желчный пузырь, дивертикул Меккеля. Описаны грыжи, содержимым которых были все органы брюшной полости.
Клиническая картина и диагностика Согласно клинической классификации, грыжи бывают одиночными или множественными. Неосложненные грыжи подразделяются на вправимые, или свободные, и невправимые. Наиболее типичными жалобами больных являются боли и наличие выпячивания в области брюшной стенки. Боли, обусловленные грыжей брюшной стенки, возникают преимущественно в области грыжевых ворот, но могут иметь и иную локализацию в эпигастрии, поясничной области, соответственно проекции локализации корня брыжейки тонкой кишки, или носить характер разлитых болей в животе без определенной локализации. Характер болевых ощущений и их острота весьма индивидуальны и разнообразны, причем степень выраженности болевых ощущений непропорциональна увеличению размеров грыжевого выпячивания. Типичным является усиление болей при ходьбе, после физической нагрузки, поднятия тяжестей, натуживания больного. Болевые ощущения могут быть единственными жалобами в начальных периодах формирования грыжи. При больших грыжах, особенно невправимых, иногда возникают жалобы на дизурические и диспепсические расстройства (мочевыделения и пищеварения), запоры. Осложнениями грыж являются ущемление, копростаз, воспаление как содержимого грыжи, так и грыжевых оболочек, повреждения и новообразования. Диагноз устанавливается на основании жалоб, данных объективного осмотра. Осмотр больного необходимо осуществлять в вертикальном и горизонтальном положениях, в покое и при натуживании. В вертикальном положении грыжевое выпячивание увеличивается, в горизонтальном уменьшается или исчезает. Увеличение грыжевого выпячивания наблюдается при кашле, натуживании, что зависит от перемещения содержимого грыж из брюшной полости в грыжевой мешок и обратно. При введении пальца по ходу выпячивания грыжи к месту расположения грыжевых ворот в случае кашля отмечается «кашлевой толчок» (ощущается толчкообразное давление на подушечку пальца, обусловленное резким кратковременным повышением внутрибрюшного давления). Характерным объективным признаком наружной грыжи живота является наличие выпячивания передней брюшной стенки в области грыжевых ворот. В начальных стадиях грыжевое выпячивание может отсутствовать, и тогда в распознавании грыжи большое значение приобретают данные опроса.
Схема механизма ущемления грыжи
Мнимое вправление ущемленной грыжи: 1 — обычное ущемление; 2 — вправление в брюшную полость через разрыв мешка; 3 — вправление вместе с грыжевым мешком и кольцом; 4 — вправление с ущемляющим кольцом
Бедренные грыжи чаще возникают в пожилом возрасте, справа они нередко бывают скользящими. Бедренные грыжи склонны к ущемлению. Часто развивается невправимость грыжи. Грыжевая припухлость при этих грыжах, как правило, небольших размеров, овальной или шаровидной формы, расположена ниже пупартовой связки. Бедренные грыжи могут проявляться болями в животе с иррадиацией в ногу, сопровождаться расстройствами пищеварения. При ущемлении может возникать острая режущая боль в ноге с пораженной стороны — симптом Хаушипа. При небольших размерах выпячивания установление точного диагноза может быть сложным. В редких случаях при бедренной грыже может развиться отек нижней конечности в результате сдавления грыжевым выпячиванием бедренной вены. Дифдиагностика должна проводиться с лимфаденитом, метастазами злокачественной опухоли в лимфатические узлы, натечным абсцессом при туберкулезе позвоночника, варикозным расширением вены в овальной ямке, аневризмой бедренных сосудов, паховыми грыжами. Встречаются грыжи надпупочного отдела белой линии живота, так называемые эпигастральные или надчревные, но могут возникать и околопупочные и подчревные, расположенные ниже пупка. Грыжи белой линии живота редко бывают больших размеров, пальпация их обычно безболезненна. При вправимой грыже можно определить дефект белой линии живота. При напряжении мышц брюшного пресса определяется наличие диастаза прямых мышц живота, часто встречающегося при эпигастральных грыжах. Определение величины расхождения мышц производят на середине расстояния между мечевидным отростком и пупком. Различают три стадии диастаза прямых мышц живота: 1-я стадия — до 5–7 см, 2-я стадия — более 5–7 см, 3-я стадия — большой диастаз, сочетающийся с отвислым животом. Дифдиагностику проводят с заболеваниями внутренних органов, которые могут иметь сходную клиническую картину.
Лечение Самоизлечение грыж практически не наблюдается, поэтому наличие грыжи является показанием к операции. Ношение бандажа можно назначить больному лишь в случае, когда имеются абсолютные противопоказания для операции. Задачами оперативного лечения являются устранение грыжевого мешка и закрытие дефекта брюшной стенки. Лечение бедренных грыж оперативное. Предложено около 100 способов, использующих преимущественно два оперативных доступа для закрытия грыжевых ворот: бедренный и паховый. Лечение грыж белой линии живота оперативное. Закрытие грыжевых ворот производят, создавая дупликатуру апоневроза (способ Юхельсона), или производят перестройку белой линии от мечевидного отростка до пупка по способу Н. И. Напалкова или А. В. Мартынова, создающих более благоприятные условия противодействия прямых мышц живота тракции (движению) широкими (боковыми) мышцами.
ГРЫЖА ПИЩЕВОДНОГО ОТВЕРСТИЯ ДИАФРАГМЫ
ОпределениеГрыжа пищеводного отверстия диафрагмы (диафрагмальная грыжа) — хроническое рецидивирующее заболевание, связанное со смещением через пищеводное отверстие диафрагмы в грудную полость абдоминального отдела пищевода, кардии, верхнего отдела желудка, а иногда и петель кишечника.Грыжа пищеводного отверстия диафрагмы является очень распространенным заболеванием. Она встречается у 5 % всего взрослого населения, причем у 50 % больных она не дает никаких клинических проявлений и, следовательно, не диагностируется.
Этиология и патогенез В развитии грыжи пищеводного отверстия диафрагмы решающую роль играют три группы факторов: — слабость соединительнотканных структур, укрепляющих пищевод в отверстии диафрагмы; — повышение внутрибрюшного давления; — тракция пищевода кверху при дискинезиях (нарушение моторики) пищеварительного тракта и заболеваниях пищевода. Слабость связочного аппарата пищеводного отверстия диафрагмы развивается с увеличением возраста человека в связи с инволютивными (обратного развития) процессами, поэтому грыжа пищеводного отверстия диафрагмы наблюдается преимущественно у пациентов старше 60 лет. В соединительных структурах, укрепляющих пищевод в отверстии диафрагмы, происходят дистрофические изменения, они теряют эластичность, атрофируются. Такая же ситуация может сложиться у нетренированных, астенизированных людей, а также у лиц, имеющих врожденную слабость соединительнотканных структур (например, плоскостопие, синдром Марфана, и др.). Вследствие дистрофических инволютивных процессов в связочном аппарате и тканей пищеводного отверстия диафрагмы происходит значительное его расширение и образуются «грыжевые ворота», через которые абдоминальный отдел пищевода или прилегающая часть желудка могут проникать в грудную полость. Повышение внутрибрюшного давления играет огромную роль в развитии грыжи пищеводного отверстия и может рассматриваться в ряде случаев как непосредственная причина заболевания. Высокое внутрибрюшное давление способствует реализации слабости связочного аппарата и тканей пищеводного отверстия диафрагмы и проникновению абдоминального отдела пищевода через грыжевые ворота в грудную полость. Повышение внутрибрюшного давления наблюдается при резко выраженном метеоризме, беременности, неукротимой рвоте, сильном и упорном кашле, асците, наличии в брюшной полости больших опухолей, резком и продолжительном напряжении мышц передней брюшной стенки, тяжелых степенях ожирения. Дискинезии пищеварительного тракта, в частности пищевода, широко распространены среди населения. При гипермоторных дискинезиях пищевода продольные его сокращения вызывают тракцию пищевода кверху и могут таким образом способствовать развитию грыжи пищеводного отверстия диафрагмы, особенно при наличии слабости его тканей. Функциональные заболевания пищевода наблюдаются очень часто при язвенной болезни желудка и двенадцатиперстной кишки, хроническом холецистите, хроническом панкреатите и других заболеваниях системы пищеварения. Возможно, поэтому при названных заболеваниях часто наблюдаются грыжи пищеводного отверстия диафрагмы. Известны триада Кастена (грыжа пищеводного отверстия диафрагмы, хронический холецистит, язвенная болезнь двенадцатиперстной кишки) и триада Сайнта (грыжа пищеводного отверстия диафрагмы, хронический холецистит, дивертикулез толстой кишки). Тракционный механизм образования грыжи пищеводного отверстия диафрагмы имеет значение при таких заболеваниях пищевода, как химические и термические язвы пищевода, пептическая эзофагеальная язва, рефлюкс-эзофагит и др. При этом происходит укорочение пищевода в результате рубцово-воспалительного процесса и тракция его кверху. В процессе развития грыжи пищеводного отверстия диафрагмы отмечается последовательность проникновения в грудную полость различных отделов пищевода и желудка — вначале абдоминального отдела пищевода, затем кардии и далее верхнего отдела желудка. В начальных стадиях грыжа пищеводного отверстия диафрагмы бывает скользящей (временной), т. е. переход абдоминальной части пищевода в грудную полость происходит периодически, как правило, в момент резкого повышения внутрибрюшного давления. Как, правило, смещение абдоминального отдела пищевода в грудную полость способствует развитию слабости нижнего пищеводного сфинктера и, следовательно, гастроэзофагеального рефлюкса и рефлюксэзофагита. Единой классификации грыж пищеводного отверстия диафрагмы не существует. Наиболее актуальными являются следующие: Классификация, основанная на анатомических особенностях грыжи пищеводного отверстия диафрагмы. Различают следующие три варианта: — скользящая (аксиальная, осевая) грыжа. Она характеризуется тем, что абдоминальная часть пищевода, кардия и фундальная часть желудка могут через расширенное пищеводное отверстие диафрагмы свободно проникать в грудную полость и возвращаться обратно в брюшную полость (при перемене положения больного); — параэзофагеальная грыжа. При таком варианте конечная часть пищевода и кардия остаются под диафрагмой, но часть фундального отдела желудка проникает в грудную полость и располагается рядом с грудным отделом пищевода (параэзофагеально); — смешанный вариант грыжи. При смешанном варианте грыжи наблюдается сочетание аксиальной и параэзофагеальной грыж. Существует также классификация грыжи пищеводного отверстия диафрагмы (ГПОД) в зависимости от объема проникновения желудка в грудную полость (И. Л. Тегер, А. А. Липко, 1965 г.). В основе этой классификации лежат рентгенологические проявления заболевания. Выделяют три степени грыжи: — ГПОД I степени — в грудной полости (над диафрагмой) находится абдоминальный отдел пищевода, а кардия — на уровне диафрагмы, желудок приподнят и непосредственно прилежит к диафрагме; — ГПОД II степени — в грудной полости располагается абдоминальный отдел пищевода, а непосредственно в области пищеводного отверстия диафрагмы — уже часть желудка; — ГПОД III степени — над диафрагмой находятся абдоминальный отдел пищевода, кардия и часть желудка (дно и тело, а в тяжелых случаях даже и антральный отдел). Клиническая классификация В. Х. Василенко и А. Л. Гребенева (1978 г.): 1. Тип грыжи: — фиксированные или нефиксированные (для аксиальных и параэзофагеальных грыж); — аксиальная — пищеводная, кардиофундальная, субтотально- и тотальножелудочная; — параэзофагеальная (фундальная, антральная); — врожденный короткий пищевод с «грудным желудком» (аномалия развития); — грыжи другого типа (тонкокишечные, сальниковые и др.). 2. Осложнения: — рефлюкс-эзофагит (морфологическая характеристика — катаральный, эрозивный, язвенный); — пептическая язва пищевода; — воспалительно-рубцовое стенозирование и (или) укорочение пищевода (приобретенное укорочение пищевода), степень их выраженности; — острое или хроническое пищеводное (пищеводно-желудочное) кровотечение; — ретроградный пролапс слизистой оболочки желудка в пищевод; — инвагинация пищевода в грыжевую часть; — перфорация пищевода; — рефлекторная стенокардия; — ущемление грыжи (при параэзофагеальных грыжах). 3. Предполагаемая причина: — дискинезия пищеварительного тракта; — повышение внутрибрюшного давления; — возрастное ослабление соединительнотканных структур и др. 4. Механизм возникновения грыжи: — пульсионный; — тракционный; — смешанный. 5. Сопутствующие заболевания. 6. Степени тяжести рефлюкс-эзофагита: — легкая форма (слабая выраженность симптоматики, иногда ее отсутствие (в этом случае наличие эзофагита констатируется на основании данных рентгенографии пищевода, эзофагоскопии и прицельной биопсии); — средняя степень тяжести (симптоматика заболевания выражена отчетливо, имеется ухудшение общего самочувствия и снижение трудоспособности); — тяжелая степень (выраженная симптоматика эзофагита и присоединение осложнений — в первую очередь пептических структур и рубцовых укорочений пищевода).
Клиническая картина Приблизительно в 50 % случаев ГПОД может протекать скрыто с очень незначительными клиническими проявлениями и просто оказаться случайной находкой при рентгенологическом или эндоскопическом исследовании пищевода и желудка. Достаточно часто (у 30–35 % больных) на первый план в клинической картине выступают нарушения сердечного ритма (экстрасистолия, пароксизмальная тахикардия) или боли в области сердца (некоронарные кардиалгии), что служит причиной диагностических ошибок и безуспешного лечения у кардиолога. Наиболее характерным клиническим симптомом ГПОД является болевой синдром. Чаще всего боль локализуется в подложечной области и распространяется по ходу пищевода, реже наблюдается иррадиация боли в спину и межлопаточную область. Иногда наблюдается боль опоясывающего характера, что приводит к ошибочной диагностике панкреатита. Приблизительно у 15–20 % больных боль локализуется в области сердца и принимается за стенокардию или даже инфаркт миокарда. Следует также учесть, что возможно сочетание ГПОД и ишемической болезни сердца. Очень важным в дифдиагностике болей, возникающих при ГПОД, является учет следующих обстоятельств: — боль чаще всего появляется после еды, особенно обильной, при физической нагрузке, подъеме тяжестей, при кашле, метеоризме, в горизонтальном положении; — боль исчезает или уменьшается после отрыжки, рвоты, глубокого вдоха, перехода в вертикальное положение, а также приема щелочей, воды; — боль редко бывает чрезвычайно сильной, чаще всего она умеренная, тупая; — боль усиливается при наклоне вперед. Происхождение болей при ГПОД обусловлено следующими основными механизмами: — сдавление нервных и сосудистых окончаний кардии и фундального отдела желудка в области пищеводного отверстия диафрагмы при проникновении их в грудную полость; — кислотно-пептическая агрессия желудочного и дуоденального содержимого; — растяжение стенок пищевода при гастроэзофагеальном рефлюксе; — гипермоторная дискинезия пищевода, развитие кардиоспазма; — в некоторых случаях развивается пилороспазм.
Пристеночное ущемление грыжи
Ретроградное ущемление грыжи
В случае присоединения осложнений характер болей при ГПОД меняется. Так, например, при развитии солярита боли в эпигастрии становятся упорными, интенсивными, приобретают жгучий характер, усиливаются при надавливании на зону проекции солнечного сплетения, ослабевают в коленно-локтевом положении и при наклоне вперед. После приема пищи существенного изменения болевого синдрома не происходит. При развитии перивисцерита боли становятся тупыми, ноющими, постоянными, они локализуются высоко в эпигастрии и области мечевидного отростка грудины. При ущемлении грыжевого мешка в грыжевых воротах характерны постоянные интенсивные боли за грудиной, иногда покалывающего характера, иррадиирующие в межлопаточную область. Также характерна группа симптомов, обусловленных недостаточностью кардии, гастроэзофагеальным рефлюксом, рефлюкс-эзофагитом. При ГПОД закономерно развивается гастроэзофагеальная рефлюксная болезнь, к этой группе симптомов относятся: — отрыжка кислым желудочным содержимым, нередко с примесью желчи, что создает вкус горечи во рту; возникает вскоре после еды и часто бывает очень выражена (при кардиофундальной фиксированной грыже — значительно, при нефиксированной кардиофундальной или фиксированной кардиальной грыже — менее выражена); возможна отрыжка воздухом; — регургитация (срыгивание) — появляется после еды, обычно в горизонтальном положении, часто ночью («симптом мокрой подушки»), чаще всего происходит пищей, принятой недавно, или кислым желудочным содержимым, наиболее характерна для кардиофундальных и кардиальных ГПОД, обусловлена собственными сокращениями пищевода, ей не предшествует тошнота; — дисфагия — затруднение при прохождении пищи по пищеводу, может появляться и исчезать; характерным для ГПОД является то, что дисфагия чаще всего наблюдается при употреблении жидкой или полужидкой пищи и провоцируется приемом слишком горячей или слишком холодной воды, поспешной едой или психотравмирующими факторами; — загрудинная боль при глотании пищи — появляется в том случае, когда ГПОД осложняется рефлюкс-эзофагитом; по мере устранения эзофагита боль уменьшается; — изжога — один из наиболее частых симптомов ГПОД, прежде всего аксиальных грыж, наблюдается после еды, в горизонтальном положении и особенно часто возникает ночью; — икота — может иметь место у 3–4 % больных с ГПОД, преимущественно при аксиальных грыжах, характерной особенностью икоты является ее продолжительность и зависимость от приема пищи; происхождение икоты объясняется раздражением диафрагмального нерва грыжевым мешком и воспалением диафрагмы; — жжение и боли в языке — нечастый симптом при ГПОД, который может быть обусловлен забросом желудочного или дуоденального содержимого в ротовую полость, а иногда даже в гортань (своего рода «пептический ожог» языка и гортани), что вызывает появление боли в языке и часто охриплость голоса; — частое сочетание ГПОД с патологией органов дыхания — трахеобронхитом, бронхиальной астмой, аспирационными пневмониями (бронхопищеводный синдром). Среди указанных проявлений особенно важным является попадание желудочного содержимого в дыхательные пути. Как правило, это наблюдается ночью, во время сна, если незадолго до сна больной обильно поужинал. Возникает приступ упорного кашля, нередко он сопровождается удушьем и болями за грудиной. При объективном исследовании больного можно также выявить еще один характерный симптом. Так, при расположении свода желудка с имеющимся в нем воздушным пузырем в грудной полости можно обнаружить при перкуссии тимпанический звук в околопозвоночном пространстве слева. Как важнейший в клинической картине целесообразно выделить анемический синдром, так как нередко он выступает на первый план и маскирует остальные проявления ГПОД. Как правило, анемия связана с повторными скрытыми кровотечениями из нижнего отдела пищевода и желудка, обусловленными рефлюкс-эзофагитом, эрозивным гастритом, а иногда пептическими язвами нижнего отдела пищевода.
Осложнения 1. Хронический гастрит и язва грыжевой части желудка развиваются при длительно существующей ГПОД. Симптоматика этих осложнений маскируется проявлениями самой грыжи. Известен синдром Кея — грыжа пищеводного отверстия диафрагмы, гастрит и язва в той же части желудка, которая находится в грудной полости. 2. Кровотечения и анемия. Выраженные острые желудочные кровотечения наблюдаются в 12–18 %, скрытые — в 22–23 % случаев. Причиной кровотечений являются пептические язвы, эрозии пищевода и желудка. 3. Ущемление грыжи пищеводного отверстия диафрагмы — наиболее серьезное осложнение. Клиническая картина ущемления ГПОД имеет следующую симптоматику: сильные схваткообразные боли в эпигастрии и левом подреберье (боли несколько ослабевают в положении на левом боку); тошнота, рвота с примесью крови; одышка, цианоз, тахикардия, падение артериального давления; выбухание нижней части грудной клетки, отставание ее при дыхании; коробочный звук или тимпанит и резкое ослабление или отсутствие дыхания в нижних отделах легких на стороне поражения; иногда определяется шум перистальтики кишечника; рентгенологически можно обнаружить смещение средостения в здоровую сторону. 4. Рефлюкс-эзофагит является закономерным и частым осложнением ГПОД. Остальные осложнения ГПОД — ретроградный пролапс слизистой оболочки желудка в пищевод, инвагинация пищевода в грыжевую часть наблюдаются редко и диагностируются при рентгеноскопии и эндоскопии пищевода и желудка.
Диагностика и дифдиагностика Грыжи пищеводного отверстия диафрагмы обычно хорошо обнаруживаются при рентгенологическом исследовании. В то же время выявление аксиальных грыж небольших размеров требует обязательного проведения исследования в положении лежа. К признакам аксиальной грыжи относятся: необычно высокая локализация нижнего пищеводного сфинктера, расположение кардии выше пищеводного отверстия диафрагмы, отсутствие поддиафрагмального сегмента пищевода, наличие в наддиафрагмальном образовании складок слизистой оболочки желудка, задержка взвеси бария в грыже, расширение пищеводного отверстия диафрагмы, уменьшение газового пузыря желудка. При параэзофагеальной грыже кардия проецируется под диафрагмой, а заполнение грыжевого мешка взвесью контрастного вещества происходит не из пищевода, как при аксиальной грыже, а из желудка. При эндоскопическом исследовании аксиальные грыжи распознаются на основании смещения пищеводно-желудочной линии и слизистой оболочки желудка выше диафрагмы. ГПОД приходится дифференцировать со всеми заболеваниями органов пищеварения, проявляющимися болями в эпигастрии и за грудиной, изжогой, отрыжкой, рвотой, дисфагией — с хроническим гастритом, язвенной болезнью, хроническим панкреатитом, холециститом. Довольно часто ГПОД приходится дифференцировать с ишемической болезнью сердца (при наличии загрудинных болей, аритмий сердца). Однако не следует забывать о том, что возможно сочетание ишемической болезни сердца и ГПОД и что ГПОД может вызывать ее обострение.
Лечение Бессимптомно протекающие аксиальные грыжи пищеводного отверстия диафрагмы лечения не требуют. При наличии клинических симптомов желудочно-пищеводного рефлюкса лечение проводится в соответствии с установками, принятыми при лечении гастроэзофагеальной рефлюксной болезни (диета, нормализация массы тела, сон с высоким изголовьем, антацидные и антисекреторные препараты, прокинетики). Оперативное лечение аксиальных грыж обычно проводится в тех случаях, когда возникают показания к хирургическому лечению гастроэзофагеальной рефлюксной болезни. С учетом возможного развития осложнений (кровотечение, ущемление) параэзофагеальные грыжи подлежат оперативному лечению.
ГРЫЖИ ПАХОВЫЕ
ОпределениеПаховые грыжи — это такие грыжи, которые выходят из брюшной полости в паховой области. Это самая частая локализация наружных брюшных грыж и встречается преимущественно у мужчин.
Этиология и патогенез Местные предрасполагающие причины возникновения паховых грыж связаны с индивидуальными особенностями строения паховой области. Особенно важным в развитии паховых грыж является состояние задней стенки пахового канала, т. е. поперечной фасции (оболочки), и расширение внутреннего пахового кольца. Ослабление задней стенки пахового кольца является предрасполагающим фактором развития не только прямой, но и косой паховых грыж. Увеличение грыжевого выпячивания в процессе формирования и развития косой паховой грыжи приводит иногда к значительному расширению глубокого пахового кольца, его сближению с поверхностным и формированию грыжи с выпрямленным каналом. Выделяют следующие паховые грыжи. I. По локализации: 1) односторонние паховые грыжи; 2) двусторонние паховые грыжи. II. По типу: 1) прямые паховые грыжи; 2) косые паховые грыжи. III. По происхождению: 1) врожденные паховые грыжи; 2) приобретенные паховые грыжи. IV. По стадиям развития: 1) начинающаяся паховая грыжа; 2) грыжа пахового канала, или канальная грыжа; 3) полная косая паховая грыжа; 4) пахово-мошоночная грыжа; 5) гигантская грыжа. V. По течению: 1) неосложненные паховые грыжи: — вправимые; — невправимые; 2) осложненные (ущемленные, копростаз, воспаление и др.). VI. По сложности: 1) простые паховые грыжи; 2) переходные; 3) сложные.
Клиническая картина Косые грыжи встречаются значительно чаще прямых. Прямые паховые грыжи составляют только 5—10 %. Косые грыжи обычно возникают у людей молодого и среднего возраста, прямые — у пожилых. Прямые грыжи чаще бывают двусторонними. Характерным объективным признаком паховых грыж является выпячивание передней брюшной стенки в паховой области. При косой паховой грыже оно имеет продолговатую форму, располагается по ходу пахового канала, часто опускается в мошонку. При больших грыжах у мужчин половина мошонки со стороны выпячивания резко увеличивается, кожа ее становится растянутой, половой член отклоняется в противоположную сторону, а при гигантских грыжах скрывается в складках кожи. При прямой паховой грыже выпячивание имеет округлую или овальную форму, расположено у медиальной части паховой связки, рядом с наружным краем лона. В тех случаях, когда грыжевое выпячивание расположено выше проекции наружного отверстия пахового канала, следует заподозрить наличие околопаховой или интерстициальной грыжи.
Диагностика и дифдиагностика Диагноз ставится на основании жалоб на выпячивание в паховой области, ноющие боли в животе, объективных данных. При пальпации необходимо оценить отношение грыжевого выпячивания к лонному бугорку. Прощупывание производитсяуказательным пальцем, который вводится в наружное отверстие пахового канала, будучи обращенным подушечкой медиально. При паховых грыжах бугорок легко прощупывается кнутри от выпячивания, при бедренных прощупать его не удается (симптом Купера). После пальпации выпячивания при свободных грыжах его вправляют в брюшную полость. Пальпация подвздошно-паховой области производится непосредственно после вправления грыжевого выпячивания. Определяются наличие или отсутствие в мошонке яичек, их величина и форма, наличие варикозного расширения вен семенного канатика. Одновременно исследуют лимфатические узлы паховой области и области скарповского треугольника. Затем приступают к исследованиям пахового канала. У мужчин с этой целью средним и указательным пальцем инвагинируют кожную складку мошонки. У женщин введение пальца в паховый канал не всегда бывает возможным и удается лишь при дряблой коже и значительном расширении наружного отверстия. Поэтому приходится ограничиться осмотром и пальпацией грыжевого выпячивания, которое при прямой грыже располагается над паховой связкой, а при косой опускается в большую половую губу. Исследование пахового канала проводится как в вертикальном, так и горизонтальном положении и расчленяется на ряд последовательных моментов. Вначале пальпируют лонный бугорок, затем продвигают палец вперед и кнаружи по направлению к наружному отверстию пахового канала. В норме наружное отверстие пропускает кончик пальца. При грыже, в зависимости от ее величины, диаметр отверстия увеличивается до 2–3 см и более, пропуская до двух-трех пальцев, а иногда, при гигантских грыжах, всю кисть. При прямой паховой грыже пальцем, введенным в грыжевой канал по нижнему краю канала, в его начальной части отчетливо прощупывается верхняя поверхность или бугорок лонной кости. Этого нет при косой паховой грыже: палец не ощупывает наличия кости при продвижении его по паховому каналу, так как этому мешают мышечно-апоневротические элементы латерального отдела пахового треугольника. Затем, не извлекая пальца, просят больного потужиться или покашлять — определяют симптом кашлевого толчка. Дифдиагностику следует проводить с бедренными грыжами, водянкой яичка, периорхитом, кистой семенного канатика и нукова канала, варикозным расширением вен семенного канатика, липомами семенного канатика и области наружного пахового кольца, паховым лимфаденитом, опухолями корня мошонки, большой половой губы и брюшной стенки в зоне пахового канала, натечным абсцессом.
Лечение Лечение паховых грыж оперативное. Общие принципы и последовательность этапов операции не отличаются от таковых при других локализациях грыж.
Осложнения Наиболее частым осложнением паховых грыж является ущемление, а также копростаз и воспаление грыжи.
ГРЫЖИ ПУПОЧНЫЕ
ОпределениеПупочные грыжи — это такие грыжи, при которых грыжевыми воротами является пупочное кольцо.Под этим кольцом понимают отверстие, окаймленное апоневротическими волокнами белой линии живота, через которое в период внутриутробного развития проходят две пупочные артерии, пупочная вена и мочевой проток. В дальнейшем сосуды и проток запустевают и превращаются в связки. После отпадения пуповины пупочное кольцо затягивается рубцовой тканью. Слои, образующие пупок, состоят из кожи, сращенной с рубцовой тканью пупочной оболочки, брюшины. Здесь нет ни подкожной клетчатки, ни предбрюшинной клетчатки.
Этиология и патогенез Различают: — эмбриональные пупочные грыжи; — пупочные грыжи у детей; — пупочные грыжи у взрослых. Эмбриональные пупочные грыжи являются следствием задержки формирования передней брюшной стенки плода. В этих случаях грыжевой мешок представляет собой амниотическую оболочку пуповины с покрывающей ее изнутри недоразвитой внутренней оболочкой. Эмбриональные пупочные грыжи относятся к врожденным порокам развития. Пупочные грыжи у детей — результат недостаточного закрытия пупочного кольца в процессе его рубцевания, т. е. ребенок рождается с дефектом передней брюшной стенки, в области которого, как правило, развивается грыжевое выпячивание. Пупочные грыжи у взрослых составляют 3–5 % от всех наружных грыж живота. Они возникают преимущественно у женщин старше 30 лет, имеющих гиперстенический тип телосложения. Важными причинными факторами возникновения пупочных грыж являются беременности, особенно многократные, и ожирение.
Клиническая картина Размеры пупочных грыж могут быть самыми различными — от нескольких сантиметров в диаметре до гигантских. Грыжевые ворота могут быть узкими, даже при больших размерах грыжи, или достигать значительных размеров. Пупочные грыжи часто бывают многокамерными, они склонны к ущемлению. При больших грыжах появляются боли в области выпячивания, запоры, иногда тошнота и даже рвота. Особенно выражены болевой синдром и расстройства пищеварения при невправляемых грыжах.
Лечение Лечение грыж оперативное. При грыжах больших размеров необходимо помнить, что быстрая репозиция (восстановление) содержимого в брюшную полость может привести к значительному повышению внутрибрюшного давления и вызвать расстройства дыхания и сердечно-сосудистой деятельности. В этих случаях необходима предварительная специальная подготовка к операции путем бинтования живота и постепенного увеличения внутрибрюшного давления. Закрытие грыжевых ворот осуществляется путем создания дупликатуры апоневроза в поперечном направлении (способ Мейо-Стоуна) или в продольном направлении (способ Сапежко), или при небольшом дефекте ушиванием его кисетным швом (способ Лексера), что в меньшей степени предотвращает рецидив. При больших дефектах применяются методы алло-, гомо- или аутопластики.
♦ Д ♦
ДАКРИОЦИСТИТ
ОпределениеДакриоцистит — это гнойное воспаление слезного мешка, обычно хроническое. В отдельную форму выделяют дакриоцистит новорожденных.
Этиология и патогенез Вследствие воспалительных процессов в полости носа, его придаточных пазухах, в костях, окружающих слезный мешок, возникает сужение или закупорка носослезного канала. Это способствует задержке и развитию в нем болезнетворных микробов и приводит к воспалению его слизистой оболочки. Дакриоцистит у новорожденных обычно возникает из-за сохранения зародышевой пленки, закрывающей нижний отдел носослезного канала. Причиной развития хронического дакриоцистита является сужение носослезного протока, приводящее к застою слезы и отделяемого слизистой оболочки слезного мешка. Стенка мешка постепенно растягивается. Скапливающееся в нем содержимое является благоприятной средой для развития болезнетворной микрофлоры (стрептококк, пневмококк и т. д.). Создаются условия для развития вялотекущего воспалительного процесса. Прозрачный секрет полости слезного мешка становится слизисто-гнойным. Наиболее часто встречаются повреждения слезных точек и канальцев при ранениях век. В происхождении и механизме развития дакриоциститов у детей играет роль комплекс факторов — особенности расположения и строения слезоотводящих путей, патология носа, нарушение носового дыхания.
Клиническая картина В области слезного мешка припухлость без воспалительных явлений. При надавливании на нее из слезных точек появляется слизисто-гнойное или гнойное отделяемое. Промывная жидкость в нос не проходит. Длительно текущий дакриоцистит может привести к растяжению (эктазии) слезного мешка, хронический дакриоцистит иногда осложняется острым воспалением слезного мешка в виде абсцесса или флегмоны. При остром дакриоцистите имеется болезненное образование в области слезного мешка. При дакриоцистите новорожденных наблюдаются слизисто-гнойное отделяемое, слезотечение, покраснение конъюнктивы, припухание в области слезного мешка. Определяющим признаком становится выделение слизисто-гнойного содержимого через слезные точки при надавливании на область слезного мешка.
Диагностика Для диагностики используют биомикроскопию, канальцевую и носовую пробы. В случае недостаточной четкости результатов проб делают промывание и бужирование слезоотводящих путей, которое позволяет уточнить уровень и протяженность поражения. В последующем проводят контрастную рентгенографию слезоотводящих путей.
Лечение Лечение хронического дакриоцистита хирургическое — дакриоцисториностомия. При остром дакриоцистите — противовоспалительная терапия, после стихания воспалительных процессов — операция. При дакриоцистите новорожденных показаны нисходящий массаж, промывание слезных путей, при отсутствии эффекта — зондирование слезноносового канала. Прогноз, как правило, благоприятный. Лечение дакриоцистита новорожденных проводится поэтапно и последовательно: — точечный массаж слезного мешка — 2–3 недели; — промывание слезоотводящих путей — 1–2 недели; — ретроградное зондирование носослезного канала — до 2–3 недель; — зондирование носослезных путей сверху (до 2–3 недель); — эндоназальная дакриоцисториностомия (с 2–3 лет).
ДЕРМАТИТЫ
ОпределениеДерматиты — это воспалительные реакции кожи в ответ на воздействие раздражителей внешней среды.Атопический дерматит (диффузный нейродермит) — это заболевание кожи, характеризующееся зудом, лихеноидными папулами, лихенификациями и хроническим рецидивирующим течением. Различают контактные дерматиты и токсидермии. Контактные дерматиты возникают под влиянием непосредственного воздействия внешних факторов на кожу. При токсидермиях последние первоначально проникают во внутреннюю среду организма.
Дерматит
Дерматит периоральный
Атопический дерматит имеет четкую сезонную зависимость: зимой — обострения и рецидивы, летом — частичные или полные ремиссии. Характерен белый дермографизм. Провоцирующую роль играют пищевые продукты (цитрусовые, сладости, копчености, острые блюда, спиртные напитки), медикаменты (антибиотики, витамины, сульфаниламиды, производные пиразолона), прививки и другие факторы.
Этиология и патогенез Раздражители, обусловливающие дерматиты, имеют физическую, химическую или биологическую природу. Так называемые облигатные (обязательные) раздражители вызывают простой (искусственный, артефициальный) дерматит у каждого человека. К ним относятся трение, давление, лучевые и температурные воздействия (см. Ожоги и Отморожения), кислоты и щелочи, некоторые растения (крапива, ясенец, едкий лютик, молочай и др.). Другие раздражители вызывают воспаление кожи лишь у лиц, имеющих к ним повышенную чувствительность: возникает аллергический (сенсибилизационный) дерматит. Количество таких раздражителей (сенсибилизаторов) огромно и непрерывно увеличивается. Наибольшее практическое значение из них имеют соли хрома, никеля, кобальта, формалин, скипидар, полимеры, медикаменты, стиральные порошки, косметические средства, предметы парфюмерии, инсектициды, некоторые растения (примула, алоэ, табак, подснежник, герань, чеснок и др.). Механизм развития простого дерматита сводится к непосредственному повреждению тканей кожи. Поэтому клинические проявления простого дерматита и его течение определяются силой (концентрацией), длительностью воздействия и природой раздражителя, причем поражение кожи возникает немедленно или вскоре после первого же контакта с раздражителем, а площадь поражения строго соответствует площади этого контакта. Огромную роль в механизме сенсибилизации играют индивидуальные особенности организма: состояние нервной системы (включая вегетативную), наследственная предрасположенность, перенесенные и сопутствующие заболевания (в том числе микозы стоп), состояние всех структур кожи, а также функции сальных и потовых желез. Сенсибилизация определяет особенности клиники и течения аллергического дерматита: четкую специфичность (дерматит развивается под влиянием строго определенного раздражителя); наличие скрытого (сенсибилизационного) периода между первым контактом с раздражителем и возникновением дерматита (от 5 дней до 4 недель), необычную интенсивную воспалительную реакцию кожи, не соответствующую концентрации раздражителя и времени его воздействия; обширность поражения, далеко выходящего за пределы площади воздействия раздражителя.
Клиническая картина Простой дерматит протекает остро или хронически. Различают три стадии острого дерматита: эритематозную (покраснение и отечность различной степени выраженности), везикулезную или буллезную (на эритематозно-отечном фоне формируются пузырьки и пузыри, подсыхающие в корки или вскрывающиеся с образованием мокнущих эрозий), некротическую (распад тканей с образованием изъязвлений и последующим рубцеванием). Острые дерматиты сопровождаются зудом, жжением или болью, что зависит от степени поражения. Хронические дерматиты, причиной которых служит длительное воздействие слабых раздражителей, характеризуются застойным кровенаполнением, воспалительным уплотнением, лихенификацией, трещинами, усиленным ороговением, иногда атрофией кожи. Одной из наиболее частых разновидностей острого дерматита является потертость, возникающая обычно на ладонях, особенно у лиц, не имеющих навыка к физическому труду, и стопах при ходьбе в неудобной обуви. Клинически характеризуется резко очерченной отечной гиперемией, на фоне которой при продолжающемся воздействии раздражающего фактора возникают крупные пузыри — «водяные мозоли»; возможно присоединение пиококковой инфекции. Омозолелость — хроническая форма механического дерматита — развивается вследствие длительного и систематического давления и трения на кистях при выполнении ручных операций (профессиональная примета), а на стопах — при ношении тесной обуви. Потертость может возникать также в складках при трении соприкасающихся поверхностей, особенно у тучных лиц. Солнечные дерматиты, клинически протекающие по эритематозному или везикулобуллезному типу, отличаются наличием небольшого (до нескольких часов) скрытого периода, обширностью поражения и исходом в пигментацию (загар); возможны общие явления. Подобные изменения могут дать также источники искусственного ультрафиолетового излучения. В результате длительного облучения, которому подвергаются лица, вынужденные по условиям своей профессии длительное время находиться на открытом воздухе (геологи, пастухи, рыбаки), развивается хронический дерматит. Лучевые дерматиты протекают однотипно независимо от вида ионизирующего излучения. Острый лучевой дерматит, возникающий от однократного облучения, реже при лучевом лечении (радиоэпидермит), может быть пятнистым, крупно- и мелкопузырчатым или некротическим, что зависит от дозы излучения. Скрытый период имеет прогностическое значение: чем он короче, тем тяжелее протекает дерматит. Язвы отличаются длительным течением (многие месяцы, даже годы) и мучительной болью. Отмечаются общие явления с изменениями состава крови. Хронический лучевой дерматит развивается как результат длительного воздействия ионизирующей радиации в небольших, но превышающих предельно допустимые дозах: сухая, атрофичная кожа покрывается чешуйками, сосудистыми звездочками, пятнами пониженной и повышенной пигментации, гиперкератозами, трофическими язвами, склонными к озлокачествлению. Острый дерматит, вызываемый кислотами и щелочами, протекает по типу химического ожога: эритематозного, везикулобуллезного или некротического. Слабые их растворы при длительном воздействии вызывают хронический дерматит в виде очагов воспалительного уплотнения и лихенификации различной степени выраженности. Атопический дерматит впервые может проявиться в одной из трех возрастных фаз — младенческой, детской и взрослой, приобретая, как правило, упорное течение. Клинические проявления определяются возрастом больного независимо от момента начала заболевания. Фазы характеризуются постепенной сменой локализации клинических проявлений, ослаблением острого воспаления и формированием лихеноидных папул и очагов лихенификации. Во всех фазах беспокоит сильный, подчас мучительный зуд. Младенческая фаза охватывает период с 7—8-й недели жизни ребенка до 1,5–2 лет. Заболевание носит в этот период острый, экземоподобный характер с преимущественным поражением кожи лица (щеки, лоб), хотя может распространиться и на другие участки кожи. В детской фазе (до возраста полового созревания) начинают преобладать лихеноидные папулы и очаги лихенификации, локализующиеся в основном на боковых поверхностях шеи, верхней части груди, локтевых и подколенных сгибах и кистях. Взрослая фаза начинается с возраста полового созревания и по клиническим проявлениям приближается к высыпаниям в позднем детстве. В зависимости от степени вовлечения кожного покрова различают ограниченные, распространенные и универсальные (эритродермия) формы.
Диагностика и дифдиагностика Диагноз простого дерматита основывается на четкой связи с воздействием раздражителя, быстром возникновении после контакта с ним, резких границах поражения, быстрой инволюции (обратном развитии) после устранения раздражителя. Клиническая картина аллергического дерматита характеризуется яркой эритемой с резко выраженным отеком. На этом фоне могут появляться многочисленные пузырьки и пузыри, дающие при вскрытии мокнущие эрозии. При стихании воспаления образуются корки и чешуйки, по отпадении которых некоторое время сохраняются синюшно-розовые пятна. Для подтверждения диагноза используют аллергические пробы.
Лечение Прежде всего необходимо устранение раздражителя. При эритематозной стадии применяются присыпки и водно-взбалтываемые взвеси. Пузыри, особенно при потертостях, следует вскрыть и обработать анилиновыми красками. В везикуло-буллезной стадии — холодные примочки. При всех формах и стадиях, за исключением язвенных, показаны кортикостероидные мази, при пиококковых осложнениях — с дезинфицирующими компонентами. При химических ожогах первая помощь заключается в немедленном обильном и продолжительном смывании водой. Лечение язвенно-некротических поражений проводят в условиях стационара. Лечение атопического дерматита предусматривает устранение провоцирующих факторов, диету, регулирование стула, антигистаминные, седативные и иммунокорригирующие препараты, рефлексотерапию, ультрафиолетовое облучение, селективную фототерапию, фотохимиотерапию, местные средства (примочки, кортикостероидные мази, горячие припарки, парафиновые аппликации). При тяжелых обострениях показана госпитализация с использованием инфузионной терапии (гемодез, реополиглюкин), гемосорбции, плазмафереза. Наиболее эффективна по стойкости результатов длительная климатотерапия (пребывание в течение 2–3 лет в теплой климатической зоне, например в Крыму).
Профилактика Соблюдение техники безопасности на производстве и в быту; своевременное устранение инфекции и микозов стоп; применение антибиотиков и других сенсибилизирующих медикаментов строго по показаниям с учетом их переносимости в прошлом. Прогноз обычно благоприятный, за исключением некротического дерматита химического и особенно лучевого происхождения. Профилактика атопического дерматита предусматривает рациональное ведение беременности и родов, диету кормящей матери и новорожденного, устранение сопутствующих нарушений, длительный прием задитена. Особое внимание уделяется психотерапии, социально-бытовой адаптации, профессиональной ориентации, рациональному питанию и другим факторам.
ДЕРМАТОМИОЗИТ
ОпределениеДерматомиозит (полимиозит) — это системное заболевание скелетной и гладкой мускулатуры и кожи, сопровождающееся воспалительным процессом без нагноения с преобладанием лимфоцитарной клеточной инфильтрации. Преимущественно болеют женщины 30–50 лет и девочки 5—15 лет.
Этиология и патогенез Применяется следующая классификация. Форма заболевания: — полимиозит идиопатический; — дерматомиозит идиопатический; — полимиозит, связанный с опухолями; — полимиозит, связанный с васкулитом; — overlap-синдром; — антисинтетазный синдром. Причины, способствующие развитию дерматомиозита, неизвестны. Предполагается роль вирусной инфекции и генетических факторов. Вирусы длительно сохраняются в мышцах, вызывают образование антител к ним и развитие иммунного воспаления. Предрасполагающими факторами являются переохлаждение, перегревание, обострение очаговой инфекции, физические и психические травмы, вакцинация, лекарственная аллергия (см.). В механизме развития заболевания играют роль разнообразные иммунопатологические нарушения. Преобладание женщин (2:1), два возрастных пика болезни (переходный и климактерический периоды) указывают на значение нейроэндокринной реактивности. Возможно семейно-генетическое предрасположение.
Клиническая картина и диагностика Течение заболевания может быть острым, подострым и хроническим. Заболевание начинается остро или подостро с мышечного синдрома (миастения, боли в мышцах), артралгии (боли в суставах), лихорадки, поражения кожи, плотных распространенных отеков. Начало заболевания постепенное. Появляется неуклонно прогрессирующая слабость в верхних отделах мышц рук и ног. В некоторых случаях мышечная слабость нарастает в течение 5—10 лет. Менее характерно острое начало, когда в течение 2–4 недель появляются резкие боли и слабость в мышцах, повышается температура тела и быстро развивается тяжелое состояние. Иногда первыми симптомами болезни бывают кожные сыпи, боли в суставах, чувство онемения и покалывания в кончиках пальцев кистей, сопровождающееся мраморным окрашиванием кожи, сменяющееся чувством жжения и покраснением. В дальнейшем болезнь приобретает рецидивирующее течение. Поражение скелетных мышц наблюдается у всех больных в виде мышечной боли при движении и даже в покое, при надавливании и нарастающей мышечной слабости. Особенно характерна резко выраженная слабость мышц верхних отделов рук и ног, а также мышц шеи. Больному трудно подняться с постели, умыться, причесаться, одеться, войти в транспорт, так как трудно поднять ногу на подножку. В очень тяжелых случаях больные не могут приподнять голову с подушки и удержать ее (голова падает на грудь), не могут ходить без посторонней помощи, удерживать в руках даже нетяжелые предметы. При поражении глотки, пищевода, гортани нарушается речь, появляются приступы кашля, затруднения при глотании пищи, поперхивание. При исследовании мышц отмечаются их болезненность и отечность, при длительном течении болезни возможна мышечная атрофия (см.). Распространение патологического процесса на мимические мышцы ведет к маскообразности лица, поражение глоточных мышц — к нарушению глотания, а интеркостальных и диафрагмы — к нарушению дыхания, снижению жизненной емкости легких, их пониженной вентиляции и частым пневмониям. Может поражаться глазодвигательная мускулатура с развитием диплопии, страбизма, двустороннего птоза век и т. п. На ранних этапах болезни мышцы болезненные и нередко отечные, позже на месте подвергшихся дистрофии и миолизу мышечных волокон развиваются миофиброз, атрофия, контрактуры, реже — кальциноз. Кальциноз может также наблюдаться в подкожной клетчатке, особенно часто у молодых людей, и легко обнаруживается при рентгенологическом исследовании. При электромиографии изменения неспецифичны. Поражения кожи — характерный признак дерматомиозита. Они довольно разнообразны (эритематозные, папулезные, буллезные высыпания, пурпура, телеангиэктазии, гиперкератоз, гипер-и депигментация и т. п.). В ряде случаев высыпания сопровождаются зудом. Весьма характерно наличие периорбитального отека с пурпурно-лиловой (гелиотроповой) эритемой — так называемые дерматомиозитные очки. Может наблюдаться красная пятнистая сыпь в области верхних век, скул, носа, носогубной складки, в области верхних отделов грудины, спины, локтевых, коленных суставов и суставов кисти. В области суставов кисти образуются красноватые шелушащиеся пятна. Кожа ладоней краснеет и шелушится. Ногти становятся ломкими и исчерченными. Поражение слизистых оболочек проявляется конъюнктивитом (см.), стоматитом (см.), покраснением и отеком (см.) неба, задней стенки глотки. Полиартралгии при движении и ограничение подвижности суставов вплоть до развития анкилозов большей частью обусловлены поражением мышц. Наблюдается поражение миокарда воспалительного или дистрофического характера, что проявляется стойкой тахикардией и неустойчивостью пульса, артериальной гипотензией, расширением сердца влево, приглушением тонов, систолическим шумом на верхушке. На ЭКГ отмечаются нарушение возбудимости и проводимости и другие изменения. При диффузном (распространенном) миокардите развивается тяжелая картина сердечной недостаточности. У больных наблюдается синдром Рейно. Поражение легких редко связано с основным заболеванием. Чаще его причиной является банальная инфекция, к которой больные предрасположены вследствие пониженной вентиляции легких или проникновения в них пищи из-за нарушения глотания. Желудочно-кишечный тракт вовлекается в процесс почти у половины больных. Как правило, отмечаются анорексия, боли в животе, симптомы гастроэнтероколита, гипотония (снижение тонуса) верхней трети пищевода. Возможно поражение слизистой оболочки желудка и кишечника с образованием некрозов, с отеком и кровоизлияниями, вплоть до тяжелых желудочно-кишечных кровотечений, перфорации желудка, кишечника; иногда отмечаются симптомы, стимулирующие кишечную непроходимость. Лабораторные данные неспецифичны. Обычно наблюдаются умеренный лейкоцитоз с выраженной эозинофилией (до 25–70 %), стойкое, хотя и умеренное повышение СОЭ, гипергаммаглобулинемия (увеличение гамма-глобулина в крови). Диагностическое значение имеют биохимические исследования крови и мочи и биопсия мышц, особенно при хроническом и подостром течении (обнаруживается утолщение мышечных волокон с потерей поперечной исчерченности, фрагментацией и дистрофией вплоть до некроза, наблюдается значительная клеточная реакция — скопление лимфоцитов, плазматических клеток и т. д.). При остром течении наблюдается катастрофически нарастающее распространенное поражение поперечно-полосатой мускулатуры вплоть до полной обездвиженности, явлений нарушения глотания и подвижности (дизартрии). Отмечается общее тяжелое лихорадочно-токсическое состояние с разнообразными кожными высыпаниями. Причиной смертельного исхода, который в нелеченых случаях наступает через 3–6 месяцев, обычно являются аспирационные пневмонии или легочно-сердечная недостаточность в связи с тяжелым поражением легких или сердца. Подострое течение отличается цикличностью, но все же неуклонно нарастают адинамия (неподвижность), поражения кожи и внутренних органов. Хроническое течение заболевания — наиболее благоприятная форма, при которой поражаются лишь отдельные мышцы. Поэтому, несмотря на значительное число обострений, общее состояние больных остается удовлетворительным и они длительно сохраняют трудоспособность. Исключение составляют молодые люди, у которых развиваются обширные кальцинозы в коже, подкожной клетчатке, мышцах с формированием стойких контрактур и почти полной неподвижностью больных.
Диагностика Диагноз устанавливается на основании одного кожного критерия и четырех критериев полимиозита. Кожные критерии 1. Гемотропные высыпания (на верхнем веке красно-пурпурная эдематозная эритема). 2. Признак Готтрона (на поверхности разгибателей суставов пальцев красно-пурпурная атрофическая или макулезная эритема). 3. Эритема на поверхности разгибателей суставов конечностей (красная эритема под локтевым и коленным суставами). Критерии полимиозита 1. Проксимальная мышечная слабость. 2. Повышение сывороточной креатинфосфокиназы или спонтанная боль. 3. Мышечная боль при нажатии или спонтанная боль. 4. Миогенные изменения при электромиографии. 5. Положительные анти-Jo-1 антитела. 6. Недеструктивные артриты и артралгии. 7. Признаки системного воспаления (лихорадка, СОЭ и цереактивный белок). 8. Патологические изменения, связанные с воспалительным миозитом.
Лечение и профилактика При наличии злокачественной опухоли ее удаление ведет к стойкой ремиссии. При остром и подостром течении показаны глюкокортикоиды в больших суточных дозах (подавляющая доза преднизолона 60–80 мг и более при необходимости). После достижения эффекта, который наступает не скоро, дозу кортикостероидов снижают очень медленно (по 1/2 таблетки каждые 7—10 дней), до поддерживающей дозы на фоне делагила (0,25 г), плаквенила (0,2 г) по 1 таблетке после ужина. Лишь при развитии стойкой ремиссии глюкокортикоиды могут быть полностью отменены. Триамцинолон из-за его способности усиливать миастенический (нарушение мышечного тонуса) синдром противопоказан. В терапии сохраняют свое значение нестероидные противовоспалительные препараты в общепринятых дозах, особенно при снижении доз кортикостероидов. В комплексном лечении рекомендуются витамины группы В и аскорбиновая кислота. При выраженной утомляемости мышц показаны прозерин и его аналоги в обычных дозах, АТФ и кокарбоксилаза, метандростенолон (неробол). При развитии кальцинатов рекомендуется динатриевая соль этилендиаминтетрауксусной кислоты, способная образовывать комплекс с ионами кальция и выводить их из организма. Вводят ее внутривенно в 5 %-ном растворе глюкозы (на 500 мл глюкозы 2–4 г препарата) капельно в течение 3–4 ч или дробно каждые 6 ч. Курс лечения 3–6 дней, после 7-дневного перерыва курсы можно повторять. Препарат противопоказан при поражении почек и печени. В период затихания острых явлений могут быть рекомендованы осторожная лечебная гимнастика, массаж конечностей. В хронической стадии с выраженными атрофиями и контрактурами показаны настойчивая лечебная гимнастика и массаж. При раннем лечении соответствующими дозами кортикостероидов у больных острым дерматомиозитом наступает стойкое выздоровление. При подостром течении обычно удается добиться лишь ремиссии, поддерживаемой глюкокортикоидами. При хроническом дерматомиозите заболевание приобретает волнообразное течение. Рекомендуется внутривенное введение больших доз иммуноглобулинов по схеме в течение 3–4 месяцев.
ДЕМПИНГ-СИНДРОМ
ОпределениеДемпинг-синдром — заболевание, возникающее у больных, перенесших удаление обширной части желудка, особенно в модификации Бильрот-II.
Этиология и патогенез Выделяют ранний и поздний демпинг-синдром. Ранний демпинг-синдром наблюдается у большинства оперированных больных в ближайшем послеоперационном периоде, в отдаленные сроки — у 30 % больных легкой степени и у 10 % — тяжелой. Частота демпинг-синдрома зависит от характера выполненной операции: она максимальна после операции по Бильрот-2, менее выражена после операции по Бильрот-1 и меньше всего — после ваготомии с дренирующими желудок операциями. Причиной развития демпинг-реакции является быстрое поступление в верхний отдел тонкой кишки необработанной пищи, которая вызывает раздражение стенки желудка. Это приводит к перемещению в просвет кишки внеклеточной жидкости, растяжению стенки кишки и выделению биологически активных веществ: гистамина, серотонина, кининов. В результате этих процессов происходят уменьшение объема циркулирующей крови, расширение сосудов, усиливается перистальтика кишечника.
Клиническая картина Через 10–15 мин после приема пищи, особенно сладких и молочных блюд, появляются слабость, головокружение, головная боль, боль в области сердца, сердцебиение, обильный пот, чувство жара. Наряду с этим распирание и боль в верхней части живота, урчание, коликообразная боль и понос. При выраженном демпинг-синдроме больные вынуждены после еды принимать горизонтальное положение. Диагностика основывается на клинической симптоматике, данных рентгенологического исследования продвижения рентгеноконтрастной пищевой смеси по желудочно-кишечному тракту. Поздний демпинг-синдром (гипогликемический) развивается через 2–3 ч после приема пищи. Он связан с избыточным выделением инсулина во время ранней демпинг-реакции, которая сопровождается повышением уровня сахара в крови. Повышенный выброс инсулина снижает уровень сахара почти до нормы. Симптомами позднего демпинг-синдрома являются слабость, резкое чувство голода, острая сосущая боль в верхней части живота, дрожь, головокружение, сердцебиение, снижение артериального давления, понижение сердечного сокращения, бледность, пот. Эти симптомы быстро проходят после приема небольшого количества пищи, особенно углеводистой. Больные нередко носят с собой сахар, печенье и при первых симптомах снижения уровня сахара принимают их. Диагноз основан на типичных проявлениях заболевания, снижении уровня сахара в крови в момент приступа. Классификация демпинг-синдрома по степени тяжести: легкая демпинг-реакция возникает только после молочных и сладких блюд, характеризуется незначительной слабостью, учащением пульса на 10–15 ударов в минуту, продолжительность приступа до получаса, дефицит массы тела не более 5 кг, трудоспособность сохранена; средняя — при приеме любой пищи, на высоте реакции больной вынужден ложиться, учащение пульса на 20–30 ударов в минуту, артериальное давление с тенденцией к повышению. Длительность приступа до 1 ч, дефицит массы тела до 10 кг, трудоспособность снижена; тяжелая демпинг-реакция развивается при приеме любой пищи; больные принимают пищу лежа и находятся в горизонтальном положении до 2–3 ч после еды, учащение пульса более чем на 30 ударов в минуту, артериальное давление изменчивое, иногда урежение сердечных сокращений, гипотензия, шок. Дефицит массы тела более 10 кг, трудоспособность утрачена.
Лечение и профилактика Лечение может быть консервативным и хирургическим. Консервативное лечение: диета с высоким содержанием белков, ограничением углеводов, особенно простых. Раздельный прием плотной и жидкой пищи небольшими порциями, 5–6 раз в день. Для уменьшения реакции на быстрое поступление пищи в тонкую кишку перед едой назначают новокаин, анестезин, антигистаминные препараты (пипольфен, супрастин), резерпин, инсулин подкожно. Заместительная терапия: желудочный сок, соляная кислота, панзинорм, фестал, витамины. При появлении симптомов нарушений в психической сфере — лечение по согласованию с психиатром. Хирургическое лечение применяется редко. Оно показано при демпинг-синдроме тяжелой степени, если лечебное питание и длительное комплексное медикаментозное лечение неэффективны. Тонкокишечный трансплантат замедляет опорожнение культи желудка, а включение двенадцатиперстной кишки улучшает пищеварение и у ряда больных может уменьшить интенсивность демпинг-реакции. Профилактика: широкое применение органосохраняющих операций в сочетании с ваготомией при лечении язвенной болезни двенадцатиперстной кишки. В случае необходимости выполнения резекции желудка целесообразно произвести наложение гастродуоденоанастомоза.
ДЕТСКИЙ ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ (ДЦП)
ОпределениеДетский церебральный паралич — хроническое патологическое состояние, характеризующееся ограниченными двигательными возможностями, обусловленное поражением головного мозга, которое обнаруживается на ранних этапах жизни.Детский церебральный паралич — это группа заболеваний новорожденных; проявляется непрогрессирующими двигательными нарушениями.
Этиология и патогенез Имеют значение внутриутробная патология, асфиксия в родах, родовая травма (гематома парасагиттальной щели). Частота заболеваний — 1–2 случая на тысячу новорожденных. Среди недоношенных детей ДЦП встречается чаще.
Клиническая картина и диагностика Диагноз гематомы парасагиттальной щели должен быть поставлен врачом в первые часы после рождения ребенка. Симптомы ее: вялость, анизокория, расходящееся косоглазие, брадикардия (уменьшение числа сердечных сокращений). Гематома легко удаляется путем пункции через большой родничок. Эта процедура осуществляется либо нейрохирургом, либо обученным этому методу микропедиатром. Если гематома не была своевременно удалена либо причины болезни другие, то развивается врожденная диплегия (болезнь Липла), характеризующаяся слабостью и спастичностью ног. Спастичность в выраженных случаях может полностью обездвиживать ребенка. Из-за тенденции к перекрещиванию ног возникает походка «по типу ножниц». Руки поражаются значительно меньше. Нередки мозжечковые и подкорковые нарушения — расстройство координации движений, дистония (нарушение тонуса), хореоатетоз. При преимущественном поражении мозжечка вместо спастичности наблюдается понижение артериального давления. При болезни Литтла интеллект в большинстве случаев нормален (при врожденной гемиплегии обычно снижен и половина больных страдает эпилептическими припадками). Как правило, дети отстают в физическом развитии. Выделяют так называемую церебральную (мозговую) дисфункцию — рудиментарный вариант церебрального паралича, которая проявляется легкими поведенческими нарушениями, едва намеченными двигательными дефектами, эпилептическими эпизодами, некоторыми дефектами деятельности и знания. Сходную группу составляют так называемые неуклюжие дети, обучение которых на ранних стадиях представляет немалые трудности.
Лечение Лечение основано на многолетней программе обучения движениям. Контрактуры корригируются хирургически. Для борьбы со спастичностью показан систематический прием сибазона и баклофена. В тяжелых случаях ребенок редко доживает до 1–2 лет, погибая обычно от пневмонии. В среднем у 25 % больных отмечается значительное улучшение, у 50 % лечение дает более или менее выраженное смягчение двигательных дефектов, у 25 % оно неэффективно. Важным прогностическим моментом является также степень интеллектуального дефекта.
ДИАБЕТ НЕСАХАРНЫЙ
ОпределениеДиабет несахарный — это заболевание, обусловленное абсолютной или относительной недостаточностью антидиуретического гормона (вазопрессина) и характеризующееся полиурией и полидипсией (повышением жажды и мочевыделения).
Этиология Острые и хронические инфекции, опухоли, травмы (случайные, хирургические). Известны сосудистые поражения гипоталамо-гипофизарной системы. У некоторых больных причина заболевания остается неизвестной — эту форму выделяют как идиопатический несахарный диабет.
Патогенез Нарушение выработки антидиуретического гормона (центральная форма заболевания) или недостаточность физиологического действия антидиуретического гормона при нормальной его выработке (относительная недостаточность). В развитии последней имеют значение неполноценность регуляции водносолевого обмена, снижение способности канальцевого эпителия почек реагировать на антидиуретический гормон (нефрогенная форма заболевания) при кистозных, дегенеративных и воспалительных поражениях почек, усиленная инактивация антидиуретического гормона печенью и почками. Недостаточность антидиуретического гормона приводит к снижению реабсорбции (обратного всасывания) воды в нижних отделах почечных канальцев и собирательных трубках почек и способствует выделению большого количества неконцентрированной мочи, общему обезвоживанию, появлению жажды и приему большого количества жидкости.
Клиническая картина Заболевание возникает у лиц обоего пола в молодом возрасте. Внезапно появляются частое и обильное мочеиспускание (полиурия), жажда (полидипсия), которые беспокоят больных ночью, нарушая сон. Суточное количество мочи составляет 6—15 л и более, моча светлая, низкой относительной плотности. Отмечаются отсутствие аппетита, снижение массы тела, раздражительность, повышенная утомляемость, сухость кожи, снижение потоотделения, нарушение функции желудочно-кишечного тракта. Возможно отставание детей в физическом и половом развитии. У женщин может наблюдаться нарушение менструального цикла, у мужчин — снижение потенции. Характерны психические нарушения: бессонница, эмоциональная неуравновешенность. При ограничении потребляемой жидкости у больных развиваются симптомы обезвоживания: головная боль, сухость кожных покровов и слизистых оболочек, тошнота, рвота, повышение температуры тела, тахикардия (увеличение числа сердечных сокращений), психические нарушения, сгущение крови, коллапс.
Диагностика Диагноз основывается на наличии полидипсии (жажды), полиурии (повышения мочевыделения) при низкой относительной плотности мочи и отсутствии патологических изменений в мочевом осадке; отсутствии повышения относительной плотности мочи при пробе с сухоядением: высокой осмолярности плазмы, положительной пробе с введением питуитрина и низком содержании при центральной форме заболевания антидиуретического гормона в плазме крови. Прогноз для жизни благоприятный, однако случаи выздоровления наблюдаются редко.
Лечение Лечение направлено в первую очередь на ликвидацию основной причины заболевания (нейроинфекции, опухоли). Проводят заместительную терапию адиурекрином, адиуретином, питуитрином. Применяют также хлорпропамид (под контролем уровняглюкозы в крови), клофибрат (мисклерон), тегретол (финлепсин, карбамазепин), гипотиазид. Общеукрепляющая терапия.
ДИАБЕТ САХАРНЫЙ
ОпределениеСахарный диабет — это заболевание, обусловленное абсолютной или относительной недостаточностью инсулина и характеризующееся грубым нарушением обмена углеводов с повышением количества глюкозы в крови и моче, а также другими нарушениями обмена веществ.
Этиология Имеют значение наследственное предрасположение, аутоиммунные, сосудистые нарушения, ожирение, психические и физические травмы, вирусные инфекции.
Патогенез При абсолютной недостаточности инсулина снижается уровень инсулина в крови вследствие нарушения его синтеза или секреции бета-клетками островков Лангерганса поджелудочной железы. Относительная инсулиновая недостаточность может являться результатом снижения активности инсулина вследствие его повышенного связывания с белком, усиленного разрушения ферментами печени, преобладания эффектов гормональных и негормональных антагонистов инсулина (глюкагона, гормонов коры надпочечников, щитовидной железы, гормона роста), изменения чувствительности инсулинзависимых тканей к инсулину. Недостаточность инсулина приводит к нарушению углеводного, жирового и белкового обменов. Снижается проницаемость для глюкозы клеточных мембран в жировой и мышечной ткани, возникают гипергликемия, глюкозурия, которые сопровождаются полиурией и полидипсией. Снижается образование и усиливается распад жиров, что приводит к повышению в крови уровня кетоновых тел. Это вызывает сдвиг кислотно-щелочного состояния в сторону ацидоза, способствует повышенному выделению ионов калия, натрия, магния с мочой, нарушает функцию почек. Наблюдается усиленный синтез холестерина. Снижается синтез белка, в том числе и антител, что приводит к уменьшению сопротивляемости инфекциям. Неполноценный синтез белка является причиной развития диспротеинемии (уменьшение фракции альбуминов и увеличение альфа-глобулинов). Значительная потеря жидкости вследствие полиурии (повышенного мочевыделения) приводит к обезвоживанию организма. Усиливается выделение из организма калия, хлоридов, азота, фосфора, кальция. Сахарный диабет у детей развивается относительно остро, приобретая тяжелое, прогрессирующее течение. Это обусловлено неустойчивостью нейроэндокринной регуляции обмена, интенсивным ростом организма и высоким уровнем обменных процессов. В начале заболевания у детей раннего возраста обнаруживаются значительные колебания уровня сахара в крови в течение суток. Склонность детей к образованию кетоновых тел (кетозу) объясняет высокую частоту циркуляции кетоновых тел в крови и быстроту развития диабетической комы. Одним из тяжелых проявлений сахарного диабета в детском возрасте является синдром Мориака, который характеризуется значительной задержкой роста, гипогенитализмом, увеличением размеров печени, кетозом, гиперлипидемией и ожирением. При проведении инсулинотерапии у детей чаще, чем у взрослых, может развиться гипогликемическая кома (неустойчивость обмена, анорексия и недостаточное поступление пищи после введения инсулина). Диабетические поражения сосудов, гломерулосклероз с почечной недостаточностью (болезнь Киммелстила-Уилсона), ретинопатии и катаракта относятся к поздним последствиям сахарного диабета и у детей наблюдаются редко.
Клиническая картина Принятая классификация сахарного диабета и смежных категорий нарушения устойчивости к глюкозе, предложенная научной группой ВОЗ по сахарному диабету (1985 г.), выделяет клинические классы, к которым относятся: — сахарный диабет; — инсулинзависимый сахарный диабет; — инсулиннезависимый сахарный диабет у лиц с нормальной массой тела и у лиц с ожирением; — сахарный диабет, связанный с недостаточностью питания; — другие типы сахарного диабета, связанные с определенными состояниями и синдромами (заболеваниями поджелудочной железы; болезнями гормональной природы; состояниями, вызванными лекарственными средствами или воздействием химических веществ; изменениями инсулина и его рецепторов; определенными генетическими синдромами; смешанными состояниями (нарушенная устойчивость к глюкозе у лиц с нормальной массой тела и у лиц с ожирением, нарушенная устойчивость к глюкозе, связанная с другими состояниями и синдромами; нормальная устойчивость к глюкозе, но со значительно увеличенным риском развития сахарного диабета; предшествовавшие нарушения устойчивости к глюкозе; потенциальные нарушения устойчивости к глюкозе); сахарный диабет беременных). В клинической практике наиболее часто встречаются больные с нарушением устойчивости к глюкозе, у которых содержание глюкозы в крови натощак и в течение суток не превышает нормы, но при введении легкоусвояемых углеводов уровень гликемии превышает значения, характерные для здоровых лиц, и истинный сахарный диабет: инсулинзависимый сахарный диабет типа I и инсулиннезависимый сахарный диабет типа II у лиц с нормальной массой тела или у лиц с ожирением, характерными клиническими и биохимическими симптомами заболевания. Инсулинзависимый сахарный диабет чаще развивается у молодых людей до 25 лет, имеет выраженную клиническую симптоматику, часто неустойчивое течение со склонностью к повышенному образованию кетоновых тел и снижению глюкозы крови, в большинстве случаев начинается остро, иногда с возникновения диабетической комы. Содержание инсулина и С-пептида в крови ниже нормы или не определяется. Основные жалобы больных: сухость во рту, жажда, повышенное мочеотделение, похудение, слабость, снижение трудоспособности, повышенный аппетит, кожный зуд и зуд в промежности, пиодермия, фурункулез. Часто наблюдаются головная боль, нарушение сна, раздражительность, боль в области сердца, в икроножных мышцах. В связи со снижением устойчивости организма у больных сахарным диабетом часто развиваются туберкулез (см.), воспалительные заболевания почек и мочевыводящих путей (пиелит, пиелонефрит) (см.). В крови и моче определяется повышенный уровень глюкозы. Инсулиннезависимый сахарный диабет II типа возникает обычно в зрелом возрасте, часто у лиц с избыточной массой тела, характеризуется спокойным, медленным началом. Уровень инсулина и С-пептида в крови в пределах нормы или может превышать ее. В некоторых случаях сахарный диабет диагностируется лишь при развитии осложнений или при случайном обследовании. Компенсация достигается преимущественно диетой или пероральными препаратами, изменяющими уровни глюкозы и кетоновых тел в крови. В зависимости от уровня гликемии, чувствительности к лечебным воздействиям и наличия или отсутствия осложнений выделяют три степени тяжести сахарного диабета. К легкой степени относят случаи заболевания, когда компенсация достигается диетой, кетоацидоз отсутствует. Возможно наличие ретинопатии I степени. Обычно это больные с сахарным диабетом II типа. При среднетяжелой степени компенсация достигается сочетанием диеты и пероральных гипогликемизирующих препаратов или введением инсулина в дозе не более 60 ЕД в сутки, уровень глюкозы в крови натощак не превышает 12 ммоль/л, имеется склонность к повышенному образованию кетоновых тел в крови, могут быть нерезко выраженные явления микроангиопатии. Тяжелая степень сахарного диабета характеризуется неустойчивым течением (выраженные колебания уровня сахара в крови в течение суток, склонность к гипогликемии, кетоацидозу), уровень сахара в крови натощак превышает 12,2 ммоль/л, доза инсулина, необходимая для компенсации, превышает 60 ЕД в сутки, имеются выраженные осложнения: ретинопатия III–IV степени, нефропатия с нарушением функции почек, периферическая нейропатия; трудоспособность нарушена. Ранним признаком сахарного диабета у детей является повышенное потребление и выделение жидкости с мочой, которая у маленьких детей рассматривается как ночное недержание мочи. Белье после высыхания становится жестким, как бы подкрахмаленным. Моча выделяется в большом количестве (3–6 л в сутки), ее относительная плотность высокая (более 1020), моча содержит сахар и в большинстве случаев ацетон. О развитии комы свидетельствует ряд признаков: увеличивающийся диурез (объем мочевыделения), быстрое падение массы тела, обезвоживание, рвота, вялость, сонливость, запах ацетона изо рта. Признаками повышенного образования кетоновых тел и нарастающего ацидоза служат увеличение глубины дыхания, учащение пульса, снижение артериального давления. По современной классификации принято выделять статистические классы риска, когда сахар крови не выходит за пределы нормальных величин, проба на устойчивость к галактозе также не выявляет отклонений при наличии у детей неблагоприятной в отношении диабета наследственности (крупная масса тела при рождении, нарушения углеводного обмена в прошлом) и развитии ожирения. У детей с отягощенной наследственностью физиологическая перестройка в периоде роста и полового созревания, в частности нейроэндокринные сдвиги, сами по себе могут явиться факторами, способствующими проявлению генетически обусловленных аномалий обмена веществ и реализации их в нарушениях обмена веществ диабетического типа. Ожирение, наследственно тесно связанное с диабетом, может длительно предшествовать диабету. Определенным признаком предрасположенности к диабетическим нарушениям обмена веществ наряду с отклонениями физического развития могут быть нарушения полового созревания. Явному проявлению диабета могут предшествовать сосудистые нарушения (изменения кровообращения сосудов сетчатки глаза, артериального давления). При исследовании устойчивости к глюкозе с помощью стандартного теста и методом двойной нагрузки по Штаубу-Трауготту могут выявляться различные типы гликемической кривой (гиперинсулинемический, сомнительный, гипоинсулинемический, преддиабетический и даже диабетический), отражающие последовательность и глубину нарушений устойчивости к углеводам среди детей с отягощенной по диабету наследственностью. Высокая вероятность возникновения явных форм диабета среди детей, наследственно отягощенных (диабет, ожирение), требует специального диспансерного наблюдения за этой группой детей.
Осложнения сахарного диабета Характерны сосудистые осложнения: специфические поражения мелких сосудов, микроангиопатии (ангиоретинопатия, нефропатия и другие висцеропатии), нейропатия, ангиопатия сосудов кожи, мышц и ускоренное развитие атеросклеротических изменений в крупных сосудах (аорта, коронарные церебральные артерии и т. д.). Ведущую роль в развитии микроангиопатий играют обменные и аутоиммунные нарушения. Поражение сосудов сетчатки глаз (диабетическая ретинопатия) характеризуется расширением вен сетчатки, образованием капиллярных микроаневризм, экссудацией и точечными кровоизлияниями в сетчатку (I стадия, непролиферативная); выраженными венозными изменениями, тромбозом капилляров, выраженной экссудацией и кровоизлияниями в сетчатку (II стадия, препролиферативная); при III стадии — пролиферативной — имеются вышеперечисленные изменения, а также прогрессирующая неоваскуляризация и пролиферация, представляющие главную угрозу для зрения и приводящие к отслойке сетчатки, атрофии зрительного нерва. Часто у больных сахарным диабетом возникают и другие поражения глаз: блефарит, нарушения рефракции и аккомодации, катаракта, глаукома.
Узелковый тип диабетического гломерулосклероза
Хотя почки при сахарном диабете часто подвергаются инфицированию, главная причина ухудшения их функции состоит в нарушении микрососудистого русла (диабетическая нефропатия). Первым признаком диабетического гломерулосклероза является преходящая альбуминурия, в дальнейшем — микрогематурия и цилиндрурия. Прогрессирование распространенного и узелкового гломерулосклероза сопровождается повышением артериального давления, нарушением мочевыделения, ведет к развитию уремического состояния. В течении гломерулосклероза различают 3 стадии: в пренефротической стадии имеются умеренная альбуминурия, диспротеинемия; в нефротической — альбуминурия увеличивается, появляются микрогематурия и цилиндрурия, отеки, повышения артериального давления; в нефросклеротической стадии появляются и нарастают симптомы хронической почечной недостаточности. Нередко имеется несоответствие между уровнем гликемии и глюкозурией. В терминальной стадии гломерулосклероза уровень сахара в крови может резко снижаться. Диабетическая нейропатия — частое осложнение при длительно текущем сахарном диабете; поражаются как центральная, так и периферическая нервная система. Наиболее характерна периферическая нейропатия: больных беспокоят онемение, чувство ползания мурашек, судороги в конечностях, боли в ногах, усиливающиеся в покое, ночью и уменьшающиеся при ходьбе. Отмечается снижение или полное отсутствие коленных и ахилловых рефлексов, снижение тактильной, болевой чувствительности. Иногда развивается атрофия мышц в верхних отделах ног. Возникают расстройства функции мочевого пузыря, у мужчин нарушается потенция. Диабетический кетоацидоз развивается вследствие выраженной недостаточности инсулина при неправильном лечении сахарного диабета, нарушении диеты, присоединении инфекции, психической и физической травме или служит начальным проявлением заболевания. Характеризуется усиленным образованием кетоновых тел в печени и увеличением их содержания в крови, уменьшением щелочных резервов крови; увеличение глюкозурии сопровождается усилением диуреза, что вызывает обезвоживание клеток, усиление экскреции с мочой электролитов; развиваются нарушения кровообращения.
Диабетическая ангиопатия сетчатки
Диабетосклеротическая ретинопатия
Диабетическая (кетоацидотическая) кома развивается постепенно. Для диабетической прекомы характерна симптоматика быстро прогрессирующей декомпенсации сахарного диабета: сильная жажда, повышенное мочеотделение, слабость, вялость, сонливость, головная боль, отсутствие аппетита, тошнота, запах ацетона в выдыхаемом воздухе, сухость кожных покровов, гипотензия, учащенное сердцебиение. Увеличение сахара в крови превышает 16,5 ммоль/л, реакция мочи на ацетон положительная, высокое содержание глюкозы в крови. Если своевременно не оказана помощь, развивается диабетическая кома: спутанность и затем потеря сознания, многократная рвота, глубокое шумное дыхание типа Куссмауля, резко выраженное снижение сосудистого давления, гипотония глазных яблок, симптомы обезвоживания, снижение или отсутствие мочевыделения, увеличение глюкозы в крови, превышающее 16,55–19,42 ммоль/л и достигающее иногда 33,3—55,5 ммоль/л, увеличение кетоновых тел в крови, снижение калия и натрия в крови, липемия, повышение остаточного азота, нейтрофильный лейкоцитоз. При гиперосмолярной некетонемической диабетической коме отсутствует запах ацетона в выдыхаемом воздухе, имеется выраженное увеличение глюкозы в крови — более 33,3 ммоль/л при нормальном уровне кетоновых тел в крови, повышенное содержание хлора, натрия, азота в крови, высокие показатели гематокрита. Лактацидотическая (молочнокислая) кома возникает обычно на фоне почечной недостаточности и кислородной недостаточности, наиболее часто встречается у больных, получающих бигуаниды, в частности фенформин. В крови отмечаются высокое содержание молочной кислоты, повышение коэффициента лактат/пируват, ацидоз.
Диагностика В основе диагноза лежат: — наличие классических симптомов диабета: повышенное потребление и выделение жидкости с мочой, выделение кетоновых тел с мочой, снижение массы тела, повышение уровня глюкозы в крови; — повышение уровня глюкозы натощак (при неоднократном определении) не менее чем 6,7 ммоль/л; — гликемия натощак менее 6,7 ммоль/л, но при высокой гликемии в течение суток либо на фоне проведения глюкозотолерантного теста (более 11,1 ммоль/л). В неясных случаях, а также для выявления нарушения устойчивости к глюкозе проводят пробу с нагрузкой глюкозой, исследуют содержание глюкозы в крови натощак после приема внутрь 75 г глюкозы, растворенной в 250–300 мл воды. Кровь из пальца для определения содержания глюкозы берут каждые 30 мин в течение 2 ч. У здоровых с нормальной устойчивостью к глюкозе гликемия натощак менее 5,6 ммоль/л, между 30-й и 90-й минутой теста — менее 11,1 ммоль/л, а через 120 мин после приема глюкозы гликемия меньше 7,8 ммоль/л. Нарушение устойчивости к глюкозе фиксируется, если гликемия натощак менее 6,7 ммоль/л, между 30-й и 90-й минутой соответствует или меньше 11,1 ммоль/л и через 2 ч колеблется между 7,8 и 11,1 ммоль/л.
Лечение Используют диетотерапию, пероральные препараты, нормализующие уровень сахара в крови, и инсулин, лечебную физкультуру. Цель терапевтических мероприятий — нормализация нарушенных обменных процессов и массы тела, сохранение или восстановление работоспособности больных, предупреждение или лечение сосудистых осложнений. Диета обязательна при всех клинических формах сахарного диабета. Основные ее принципы: индивидуальный подбор суточной калорийности; содержание физиологических количеств белков, жиров, углеводов и витаминов; исключение легкоусвояемых углеводов; дробное питание с равномерным распределением калорий и углеводов. Расчет суточной калорийности производят с учетом массы тела и физической нагрузки. При умеренной физической активности диету строят из расчета 30–35 ккал на 1 кг идеальной массы тела (рост в сантиметрах минус 100). При ожирении калорийность уменьшают до 20–25 ккал на 1 кг идеальной массы тела. Соотношение белков, жиров и углеводов в пище должно быть близким к физиологическому: 15–20 % общего числа калорий приходится на белки, 25–30 % — на жиры и 50–60 % — на углеводы. Диета должна содержать не менее 1–1,5 г белка на 1 кг массы тела, 4,5–5 г углеводов и 0,75—1,5 г жиров в сутки. Следует придерживаться тактики ограничения или полного исключения из пищи рафинированных углеводов. Однако общее количество углеводов должно составлять не менее 125 г в день с целью предупреждения кетоацидоза. Диета должна содержать малое количество холестерина и насыщенных жиров: из общего количества жиров около 2/3 должно приходиться на моно- и полиненасыщенные жирные кислоты (подсолнечное, оливковое, кукурузное, хлопковое масло). Пищу принимают дробно 4–5 раз в день, что содействует лучшему ее усвоению при минимальном увеличении глюкозы в крови и моче. Общее количество потребляемой пищи в течение дня распределяется обычно следующим образом: первый завтрак — 25 %, второй завтрак — 10–15 %, обед — 25 %, полдник — 5—10 %, ужин — 25 %, второй ужин — 5—10 %. Набор продуктов составляют по соответствующим таблицам. Целесообразно включать в рацион питания продукты, богатые пищевыми волокнами. Содержание в пище поваренной соли не должно превышать 10 г/сут. ввиду наклонности больных к артериальной гипертензии, сосудистым и почечным поражениям. Показаны дозированные ежедневные физические нагрузки, усиливающие утилизацию глюкозы тканями. В виде самостоятельного метода лечения диетотерапию применяют при нарушении устойчивости к углеводам и легкой форме инсулиннезависимого сахарного диабета. Показателем компенсации сахарного диабета является гликемия в течение суток 3,85— 8,9 ммоль/л и отсутствие глюкозы в моче. Таблетированные сахароснижающие препараты относятся к двум основным группам: сульфаниламидам и бигуанидам. Сульфаниламидные препараты являются производными сульфанилмочевины. Их сахароснижающее действие обусловлено стимулирующим влиянием на бета-клетки поджелудочной железы, повышением чувствительности к инсулину инсулинзависимых тканей путем воздействия на рецепторы к инсулину, увеличением синтеза и накопления гликогена. Препараты оказывают также антилиполитическое действие. Различают сульфаниламидные препараты I и II генерации. Препараты I генерации дозируются в дециграммах. К этой группе относятся хлорпропамид (диабинез, меллинез), букарбан (надизан, оранил), орадиан, бутамид (толбутамид, орабет, диабетол) и др. К препаратам, дозируемым в сотых и тысячных долях грамма (II генерация), относят глибенкламид (манинил, даонил, эуглюкан), глюренорм (гликвидон), гликлазид (диамикрон, предиан, диабетон), глипизид (минидиаб). При применении препаратов I генерации лечение начинают с малых доз (0,5–1 г), повышая до 1,5–2 г/сут. Дальнейшее увеличение дозы нецелесообразно. Гипогликемизирующее действие проявляется на 3—5-е сутки от начала лечения, оптимальное — через 10–14 дней. Доза препаратов II генерации обычно не должна превышать 10–15 мг. Необходимо учитывать, что почти все сульфаниламидные препараты выводятся почками, за исключением глюренорма, выводящегося из организма преимущественно кишечником, поэтому последний хорошо переносится больными с поражением почек. Некоторые препараты, например предиан (диамикрон), оказывают нормализующее действие на реологические свойства крови — уменьшают агрегацию тромбоцитов. Показаниями к назначению препаратов сульфанилмочевины являются инсулиннезависимый сахарный диабет средней тяжести, а также переход легкой формы диабета в среднетяжелую, когда одной диеты недостаточно для компенсации. При сахарном диабете II типа средней тяжести препараты сульфанилмочевины могут быть использованы в комбинации с бигуанидами; при тяжелой и инсулинрезистентной формах сахарного диабета I типа они могут применяться с инсулином. Комбинированное лечение инсулином и сульфаниламидами проводится в ряде случаев при небольших операциях, при наличии инфекции, при поражении почек и печени без выраженных нарушений их функции. Побочные действия при применении сульфаниламидных препаратов редки и выражаются лейкопенией и тромбоцитопенией, кожными, аллергическими реакциями, нарушением функции печени и желудочно-кишечными расстройствами. При передозировке может возникнуть состояние со снижением уровня глюкозы в крови. Критерием компенсации при назначении сульфаниламидных препаратов являются нормальный уровень сахара крови натощак и его колебания в течение суток, не превышающие 8,9 ммоль/л, отсутствие глюкозурии. У больных с тяжелыми сопутствующими поражениями сердечно-сосудистой системы, не ощущающих начальных признаков гипогликемии, во избежание возможной гипогликемии допускаются повышение уровня сахара в крови в течение суток до 10 ммоль/л, глюкозурия не более 5—10 г. В амбулаторных условиях компенсация оценивается на основании определения уровня сахара в крови натощак и через 1–2 ч после завтрака. Одновременно собирают 3–4 порции суточной мочи. Бигуаниды являются производными гуанидина. К ним относятся фенилэтилбигуаниды (фенформин, диботин), бутилбигуаниды (адебит, буформин, силубин) и диметилбигуаниды (глюкофаг, диформин, метформин). Различают препараты, действие которых продолжается 6–8 ч, и препараты продленного (10–12 ч) действия. Сахароснижающий эффект обусловлен потенциированием влияния инсулина, усилением проницаемости клеточных мембран для глюкозы в мышцах, торможением неоглюкогенеза, уменьшением всасывания глюкозы в кишечнике. Важное свойство бигуанидов — торможение липогенеза и усиление липолиза. Показанием к применению бигуанидов является инсулиннезависимый сахарный диабет (II тип) средней тяжести без кетоацидоза и при отсутствии заболеваний печени и почек. Препараты назначают главным образом больным с избыточной массой тела, при устойчивости к сульфаниламидам, применяют в комбинации с инсулином, особенно у больных с избыточной массой тела. Используется также комбинированная терапия бигуанидами и сульфаниламидами, позволяющая получить максимальный сахаропонижающий эффект при минимальных дозах препаратов. Побочные явления: нарушения функции желудочно-кишечного тракта (ощущение металлического вкуса во рту, тошнота, рвота, поносы) и печени, аллергические реакции в виде кожных высыпаний. При применении больших доз, при склонности к гипоксии, наличии сердечной недостаточности, нарушении функции печени и почек может развиваться токсическая реакция в виде повышения содержания в крови молочной кислоты. Наименее токсичны метформин, диформин и глиформин. Общие противопоказания к назначению пероральных сахароснижающих средств: кетоацидоз, кетоацидотическая, гиперосмолярная, лактацидотическая кома, беременность, кормление, обширные операции, тяжелые травмы, инфекции, выраженные нарушения функции почек и печени, заболевания крови с лейкопенией или тромбоцитопенией. Инсулинотерапию назначают при следующих показаниях: сахарный диабет I типа, увеличение кетоновых тел различной степени тяжести, кома (кетоацидотическая, гиперосмолярная, лактацидотическая), истощение больного, тяжелые формы сахарного диабета с наличием осложнений, инфекции, оперативные вмешательства; беременность, роды, кормление (при любой форме и тяжести сахарного диабета), наличие противопоказаний к применению пероральных сахароснижающих препаратов. Основным критерием, определяющим дозу инсулина, является уровень глюкозы в крови. Применяют препараты, различные по длительности действия. Препараты инсулина короткого действия (простой инсулин) необходимы для быстрого устранения острых нарушений обмена веществ (особенно в состоянии прекомы и комы), а также при острых осложнениях, вызванных инфекцией, травмой. Простой инсулин применим при любой форме сахарного диабета, однако кратковременность действия (5–6 ч) делает необходимым его введение до 3–5 раз в сутки. При декомпенсации сахарного диабета простой инсулин вводят 4–5 раз в сутки. Применение препарата позволяет также определить истинную потребность в инсулине. При постоянном лечении простой инсулин используется вместе с препаратами пролонгированного действия. Кроме инсулина, полученного из поджелудочных желез крупного рогатого скота, применяют также свиной инсулин (суинсулин), актрапид (Дания). Среди пролонгированных различают препараты инсулина средней продолжительности и длительного действия. К препаратам средней продолжительности действия относятся суспензия цинк-инсулина аморфного; действие проявляется через 1–1,5 ч, максимум через 4–6 ч, длительность действия 12–16 ч. По действию цинкинсулин близок к зарубежному препарату Инсулин семиленте, инсулину Б. Начало действия через 1–2 ч после введения, максимум — через 4–6 ч, длительность действия 10–18 ч. Препараты инсулина длительного действия: протаминцинк-инсулин; начало действия через 6–8 ч, максимум — через 14–18 ч, длительность действия 20–24 ч (при назначении протаминцинк-инсулина необходимо дополнительное введение простого инсулина утром для снижения гипергликемии в дообеденные часы); суспензия инсулин-протамина, начало действия через 60–90 мин, максимум — через 8—12 ч, длительность действия 20–24 ч; суспензия цинк-инсулина кристаллического — начало действия через 6–8 ч, максимум — через 12–18 ч, длительность действия 30 ч; инсулин-цинк-суспензия — начало действия через 60–90 мин, максимум — через 5–7 и 10–14 ч, длительность действия — 18–24 ч. В последние годы начат выпуск очищенных, лишенных белковых высокомолекулярных примесей монопиковых или монокомпетентных инсулинов короткого, средней продолжительности и длительного действия. Это: М-инсулин, имеющий такое же начало, максимум и продолжительность действия, как и су-инсулин. Суспензии инсулина семилонг, лонг и ультралонг по параметрам гипогликемизирующего действия соответствуют инсулинам группы цинк-инсулина. Эти препараты инсулина обладают меньшими аллергизирующими свойствами, поэтому значительно реже вызывают аллергические реакции. Соответствующие зарубежные препараты — актрапид-МС, монотард-МС, рапитард-МС, протафан-МС, ленте-МС, семиленте-МС, ультраленте-МС. За рубежом налажен выпуск препаратов человеческого инсулина (актрапид-КМ, протафан-НМ, монотард-НМ). Эти препараты предпочтительнее назначать только при выявленном сахарном диабете I типа, особенно в детском и юношеском возрасте, при аллергии к инсулину, дистрофии жировой ткани, беременности. Рассчитать потребность в вводимом извне инсулине бывает очень трудно из-за различной индивидуальной реакции и чувствительности к инсулину в разные периоды заболевания. Для определения потребности в инсулине и получения компенсации вводят инсулин короткого действия 4–5 раз в сутки, по достижении компенсации больных переводят на 2-разовую инъекцию инсулинов средней продолжительности или длительного действия в сочетании с инсулином короткого действия. Например, введение инсулина средней продолжительности действия и простого инсулина перед завтраком и ужином либо перед завтраком — средней продолжительности и короткого действия, перед ужином — короткого и сном — средней продолжительности действия; могут быть и другие варианты. Применяя такие режимы введения инсулина, можно соотнести «пики секреции» инсулина с периодами увеличения глюкозы в крови после приема пищи и таким образом имитировать в определенной степени секрецию инсулина в норме. Критерий компенсации сахарного диабета I типа: гликемия не должна превышать в течение суток 11 ммоль/л. Необходимо также учитывать отсутствие гипогликемии, признаков декомпенсации, трудоспособность больного, длительность заболевания, наличие сердечно-сосудистых нарушений. Поэтому в каждом конкретном случае к критериям компенсации необходим индивидуальный подход. Завышение доз инсулина, стремление добиться нормогликемии и аглюкозурии, особенно при применении одной инъекции инсулина суточного действия, может привести к развитию у больного синдрома хронической передозировки инсулина (синдрома Сомоджи). Вечернее и ночное снижение глюкозы в крови (максимум действия инсулинов суточного действия) вызывает реактивное увеличение глюкозы в крови, которая и фиксируется при определении уровня сахара натощак. Это может побудить врача увеличить дозу инсулина и привести к еще более выраженным колебаниям уровня глюкозы в крови (тем самым усилить неустойчивость течения заболевания). Диагностика синдрома хронической передозировки инсулина основывается на анализе самочувствия больного и колебаний гликемии и глюкозурии в течение суток. В этих случаях необходимо постепенно снизить дозу инсулина: больной переводится на 4—5-разовое введение инсулина короткого действия, а затем на 2-разовое введение инсулинов короткого и средней продолжительности действия. При лечении препаратами инсулина может развиться гипогликемия — состояние, обусловленное резким снижением уровня глюкозы в крови. Провоцирующими моментами являются: нарушение диеты и режима питания, передозировка инсулина, тяжелая физическая нагрузка. Симптомы: резкая слабость, потливость, чувство голода, возбуждение, дрожание рук, головокружение, немотивированные поступки. Если не дать больному легкоусвояемых углеводов, то возникают судороги, утрачивается сознание — развивается гипогликемическая кома. Особенно опасны гипогликемии у больных пожилого и старческого возраста из-за возможности развития ишемии миокарда и нарушения мозгового кровообращения. Частые гипогликемии способствуют прогрессированию сосудистых осложнений. Тяжелые и длительные гипогликемии могут привести к необратимым дегенеративным изменениям в центральной нервной системе. Другое осложнение инсулинотерапии — аллергические реакции: местная (покраснение, уплотнение и зуд кожи в месте введения инсулина) или общая, которая проявляется слабостью, высыпанием на коже (крапивница), распространенным зудом, повышением температуры, редко может развиться анафилактический шок. Инсулинорезистентность — большая потребность в инсулине для достижения компенсации. Считается, что доза инсулина у больных сахарным диабетом должна составлять около 0,6–0,8 ЕД/кг. Инсулинорезистентность в большинстве случаев развивается в результате действия негормональных и гормональных антагонистов инсулина. Различают 3 степени инсулинорезистентности: легкую (суточная потребность в инсулине не более 80—120 ЕД), средней тяжести (суточная потребность 120–200 ЕД) и тяжелую (суточная потребность более 200 ЕД инсулина). В местах инъекции инсулина могут развиваться дистрофии жировой ткани (гипертрофическая или атрофическая). В основе лежат иммунные процессы, приводящие к разрушению подкожной клетчатки. Их развитие не зависит от дозы вводимого инсулина, компенсации или декомпенсации диабета. Инсулиновые отеки являются редким осложнением и наблюдаются при декомпенсации сахарного диабета. Лечение осложнений сахарного диабета. При возникновении кетоацидоза назначают дробное введение простого инсулина (дозировка индивидуальная), в рационе ограничивают жиры (до 20–30 г), увеличивают количество легкоусвояемых углеводов (300–400 г/сут. и более), назначают витамины С, группы В, кокарбоксилазу, щелочное питье, ксилит. При прекоматозном состоянии необходима срочная госпитализация, отменяют препараты инсулина продленного действия, дробно вводят п/к простой инсулин (в 4–5 инъекциях). Начальная доза обычно не превышает 20 ЕД, последующие введения дозируют с учетом динамики клинической картины и уровня глюкозы в крови. Рекомендуются щелочное питье, ксилит. Одновременно с введением первой дозы инсулина начинают капельное вливание изотонического раствора хлорида натрия (1,5–2 л в течение 2–3 ч). Лечение кетоацидотической комы проводят в стационаре. Мероприятия направлены на компенсацию углеводного, жирового, белкового, водно-электролитного обмена и предупреждение вторичных осложнений. В настоящее время получил признание метод лечения небольшими дозами инсулина, вводимого внутривенно, — режим малых доз инсулина. Это обеспечивает высокий стабильный уровень инсулина в крови, уменьшает его количество, необходимое для устранения коматозного состояния, способствует плавному снижению гликемии, более быстрой ликвидации кетоза, уменьшает возможность развития гипогликемии. Начальная доза зависит от тяжести состояния, уровня глюкозы в крови и кетоновых тел в моче. Внутривенно вводят свиной или обычный инсулин в дозе 8—12 ЕД одномоментно. При гликемии, превышающей 33,3 ммоль/л, доза инсулина может быть увеличена до 12–16 ЕД. Доза последующего введения зависит от уровня глюкозы в крови, который определяют каждые 1–2 ч. Если содержание глюкозы в крови в первые 2–4 ч не снизилось на 30 %, то первоначальную дозу увеличивают вдвое. При снижении уровня сахара до половины исходного доза вводимого инсулина также снижается наполовину. При клиническом улучшении, снижении гипергликемии и кетонемии, восстановлении кровообращения, функции почек, ЦНС начинают введение инсулина подкожно каждые 3–6 ч. Вводят внутривенно изотонический раствор хлорида натрия (до 3–5 л/сут.). При быстром снижении гликемии примерно через 3–4 ч от начала инсулинотерапии вводят 5 %-ный раствор глюкозы. Для улучшения окислительных процессов в инфузируемый состав добавляют 5 %-ный раствор аскорбиновой кислоты, кокарбоксилазу. Проводят кислородотерапию. Для коррекции электролитных сдвигов в капельницу добавляют 10 %-ный раствор хлорида калия (3–6 г/сут.), вводят спустя 4–6 ч после того, как больной начинает выходить из коматозного состояния, под контролем содержания калия в сыворотке крови, выделительной функции почек и мониторного ЭКГ-наблюдения. При гиперлактацидемической коме для устранения ацидоза вводят бикарбонат натрия. По показаниям — строфантин (коргликон), кордиамин, мезатон, антибиотики. После восстановления сознания в течение 3–4 дней продолжают дробное введение инсулина и постепенно расширяют диету. В дальнейшем переводят на лечение препаратами инсулина продленного действия (лучше средней продолжительности действия и 2 инъекциями). Основной принцип лечения микроангиопатии — полная компенсация обменных нарушений, достигаемая адекватной диетой и инсулинотерапией (или пероральными сахароснижающими средствами). Используют ангиопротекторы (дицинон, доксиум, трентал, диваскан, пармидин), анаболические гормоны (метандростенопон, ретаболил, силаболин), препараты, понижающие содержание в крови холестерина и липопротеидов (клофибрат, мисклерон), препараты никотиновой кислоты (никошпан, нигексин, компламин), витамины (аскорутин, витамины группы В, ретинол). Для лечения ретинопатии применяют коагуляцию при помощи лазера, для лечения неосложненной нейропатии — физиотерапевтические методы (индуктотермия, электрофорез и т. д.). Для устранения гипогликемии назначают внутрь легкоусвояемые углеводы или внутривенно 40 %-ный раствор глюкозы (20—100 мл), адреналин, глюкагон (внутримышечно). Для устранения аллергических реакций используют метод быстрой десенсибилизации, вводят препараты инсулина другого типа либо более очищенные препараты инсулина (монокомпонентные, монопиковые). При инсулинорезистентности применяют очищенные препараты инсулина, кортикостероиды (20–40 мг) с постепенным снижением дозы, комбинированное лечение — инсулин и пероральные гипогликемизирующие средства. При наличии липодистрофии рекомендуются обкалывание свиным инсулином, электрофорез с лидазой. Большое значение в лечении сахарного диабета имеет обучение больных методам самоконтроля, особенностям гигиенических процедур, так как это является основой поддержания компенсации сахарного диабета, предупреждения осложнений и сохранения трудоспособности.
ДИАРЕЯ
ОпределениеДиарея — это учащенное (свыше 2 раз в сутки) выделение жидких испражнений, связанное с ускоренным прохождением содержимого кишечника вследствие усиления его перистальтики, нарушением всасывания воды в толстом кишечнике и выделением кишечной стенкой значительного количества воспалительного секрета.
Этиология и патогенез В большинстве случаев поносы являются симптомом острого (см.) или хронического (см.) колита, энтерита (см.). Инфекционные поносы отмечаются при дизентерии (см.), сальмонеллезах (см.), пищевых токсикоинфекциях (см.), вирусных болезнях (вирусная диарея), амебиазе (см.) и т. д. Алиментарные поносы могут быть при неправильном питании или при аллергии к тем или иным пищевым продуктам. Диспепсические поносы наблюдаются при нарушении переваривания пищевых масс из-за недостаточной выработки желудком и поджелудочной железой печени секрета или недостаточного выделения тонкой кишкой некоторых ферментов. Токсические поносы сопровождают уремию, отравление ртутью, мышьяком. Медикаментозные поносы могут быть следствием подавления физиологической флоры кишечника, развития дисбактериоза. Неврогенные поносы наблюдаются при нарушении нервной регуляции моторной деятельности кишечника (например, поносы, возникающие под влиянием волнения, страха).
Клиническая картина Частота стула бывает различной, испражнения — водянистыми или кашицеобразными. Характер испражнений зависит от заболевания. Так, при дизентерии кал имеет сначала плотную консистенцию, потом становится жидким, скудным, в нем появляются слизь и кровь; при амебиазе — содержит стекловидную слизь и кровь, иногда кровь пропитывает слизь и испражнения приобретают вид малинового желе. При поносах могут быть боль в животе, ощущение урчания, переливания, вздутие живота, тенезмы. Легкие и недлительные поносы мало отражаются на общем состоянии больных, тяжелые и хронические приводят к истощению, гиповитаминозам, выраженным изменениям в органах.
Диагностика и дифдиагностика Для установления причины поноса проводят копрологическое и бактериологическое исследование. О тяжести поноса можно судить по скорости продвижения по кишечнику карболена (появление черной окраски кала после приема больным карболена через 2–5 ч вместо нормальных 20–26 ч) или сульфата бария при рентгенологическом исследовании. При подозрении нахолеру (см.), сальмонеллез (см.), пищевуютоксикоинфекцию (см.) больные подлежат немедленной госпитализации в инфекционное отделение.
Лечение и профилактика Лечение направлено на устранение причины, вызвавшей понос. Например, при гиповитаминозах внутривенно вводят соответствующие витамины, при нарушении выработки желудочного сока назначают желудочный сок или его заменители, при недостаточности поджелудочной железы — панкреатин или панзинорм, фестал и др. При поносах, не связанных с инфекцией, показана щадящая диета (ограничение углеводов, тугоплавких жиров животного происхождения), частое дробное питание, тщательное пережевывание пищи. В качестве симптоматических средств используют карбонат кальция, препараты висмута, танальбин; отвары из коры дуба, травы зверобоя, корневища змеевика, лапчатки или кровохлебки, плодов черемухи, настой черники, соплодий ольхи, цветов ромашки, настойку красавки и др. При поносах, обусловленных дисбактериозом, назначают колибактерин, лактобактерин, бификол, бифидумбактерин. В современной врачебной практике особую актуальность приобретает вирусная диарея. У детей ведущим фактором, вызывающим острый инфекционный понос, становится ротавирус. Чаще всего ротавирусный понос наблюдается у детей до 2 лет в виде единичных случаев; возможны эпидемии ротавирусной инфекции, чаще зимой. У взрослых ротавирус редко оказывается возбудителем гастроэнтерита, и процесс, им вызванный, протекает стерто. Скрытый период у ротавирусной инфекции — от одного до нескольких дней. Начало вирусного гастроэнтерита острое — со рвоты, у детей сильно выраженной; затем возникают понос, а также общие симптомы инфекции: головные и мышечные боли, лихорадка, но эти явления, как правило, умеренно выражены. Боли в животе не характерны для вирусного гастроэнтерита. Отек и воспаление в стенке тонкой кишки, вызываемые вирусом, ведут к нарушению выработки и всасывания жидкости, богатой натрием и калием. Понос носитводный характер, теряемая с поносом жидкость содержит мало белка, но много солей. Эта картина напоминает секреторный понос, вызываемый холерным вибрионом или энтеротоксинами кишечной палочки; он может привести к массивной потере жидкости, превышающей у взрослого 1 л в час. При вирусном поносе не страдает толстая кишка и в стуле нет лейкоцитов, вирусный понос у взрослых длится 1–3 дня, у детей — вдвое больше. Выраженное обезвоживание может угрожать жизни больного. Терапия сводится главным образом к замещению потерянной жидкости. Это замещение может проводиться с помощью назначения питья, содержащего глюкозу и соли (глюкоза стимулирует всасывание натрия). Жидкость вводится из расчета 1,5 л на 1 л стула, но основным контролем является видимое наполнение сосудов кожи, слизистых оболочек. Антибиотическая терапия при водном поносе не меняет длительности болезни.
ДИАТЕЗ
ОпределениеДиатез — аномалия конституции, характеризующаяся предрасположением к некоторым заболеваниям. Наиболее часто встречаются аллергический, лимфатикогипопластический, экссудативный диатезы.Данная аномалия конституции является довольно распространенной. Она выявляется обычно в возрасте 3–6 месяцев, держится на протяжении 1–2 лет и у части детей в дальнейшем исчезает.
Этиология и патогенез Причины возникновения заболевания и механизм развития полностью не выяснены, но важную роль играют наследственная предрасположенность, а также воздействие факторов внешней среды. Положительный семейный «аллергический анамнез» выявляется у 2/3— 3/4 детей с аллергическим диатезом. Нередко у таких детей определяется высокий уровень иммуноглубина Е в крови или избыточная секреция и освобождение гистамина из тучных клеток, недостаточная его инактивация, что и определяет склонность к аллергическим реакциям. Провоцирующие факторы могут проявиться рано — токсикозы первой и второй половины беременности, инфекционные заболевания, употребление лекарств во время беременности, нарушение пищевого режима как беременной, особенно в последние месяцы беременности (однообразное с чрезмерным употреблением одного из облигатных трофоаллергенов — яиц, меда, кондитерских изделий, молока, мандаринов), так и во время кормления грудью. Ребенок еще во внутриутробном периоде может сенсибилизироваться к аллергенам, циркулирующим в организме матери. Во внеутробном периоде аллергены передаются с грудным молоком и пищей (трофоаллергены), через кишечную стенку, обладающую повышенной проницаемостью, особенно у детей грудного возраста, тем более после желудочно-кишечных заболеваний, а также в период выздоровления от различных заболеваний, при потере массы тела и истощении. Потенциальным сенсибилизирующим агентом может быть пища, не подвергнутая тепловой обработке (гоголь-моголь, сырое молоко, взбитые с белком ягоды и пр.), а также такие продукты, как рыба, орехи и некоторые другие, не снижающие своих аллергизирующих свойств и при тепловой обработке. Аллергизация может быть вызвана и бычными продуктами, если ребенок получает их в избыточном количестве (перекорм), особенно при однообразном наборе питательных средств. Легко становятся аллергенами продукты, употребляемые в тот или иной сезон или нечасто, при включении их в рацион в большом количестве (ягоды, овощи, орехи и др.), а также при введении в рацион не положенных по возрасту продуктов (икра, креветки и др.). Имеет значение беспорядочное питание, злоупотребление сладостями, острыми, солеными блюдами, введение в рацион ребенка многих новых продуктов за короткий промежуток времени. Ребенок с аллергическим диатезом легко приобретает повышенную чувствительность не только к пищевым веществам, но и к таким внешним аллергенам, как шерсть, домашняя пыль (аллергический респираторный синдром по Ратнеру). Аллергены могут поступать в организм ребенка через кожные покровы и слизистые оболочки (конъюнктива и др.), а также во время многочисленных инъекций, вакцинаций. У детей первых лет жизни, особенно грудных, основным источником аллергенов является пища (соотношение повышенной чувствительности к пище и к вдыхаемым антигенам составляет 20:1); в течение этого года жизни нарастает число антигенов, получаемых при вдыхании (соотношение как 2:1); к 4–5 годам антигены поступают одинаково часто как через пищу, так и воздушным путем. У детей с аллергическим диатезом обнаруживаются нарушения в корково-подкорковых взаимоотношениях, выявляются парасимпатическая настроенность или дистония вегетативной нервной системы, функциональные изменения печени, интермедиарного обмена (жирового, углеводного, белкового, водного, солевого, витаминного, кислотно-щелочное состояние), что небезразлично для организма в процессах его адаптации к внешней среде и питанию. У детей с аллергическим диатезом отмечаются и явления дискортицизма — относительно высокая секреция минералокортикоидов, нарушение превращения кортизола в печени. Развитие аллергической реакции сопровождается повышением в крови ряда биологически активных веществ (до 12 видов): гистамина, серотонина, лейкотриенов и др. В механизме развития заболевания определенную роль играют и аутоаллергические процессы, скорее всего возникающие вторично в процессе заболевания. Развитие процессов аутоаллергизации с постоянным поступлением в кровь аутоаллергенов способствует более торпидному течению аллергического диатеза.
Клиническая картина и диагностика Как клинический признак характерна большая масса тела при рождении (особенно если это первый ребенок в семье), рано появившиеся и упорно сохраняющиеся в условиях правильного ухода опрелости; исчезающая и вновь появляющаяся себорея волосистой части головы; неравномерное слущивание эпителия слизистой оболочки языка («географический язык»), повышенная гидролабильность тканей (проба Мак-Клюра-Олдрича ускорена до 5—15 мин); значительно превышающие возрастную норму прибавки массы тела и большие ее колебания под влиянием неблагоприятных условий; положительные кожные пробы на внешние аллергены еще при отсутствии каких-либо клинических проявлений аллергического диатеза. При осмотре обращает на себя внимание одутловатое бледное лицо, излишняя масса тела, снижение упругости тканей (пастозный тип) или худоба, отставание в физическом развитии, нервозность. Симптоматика чрезвычайно разнообразна. Она складывается из симптомов поражения слизистых оболочек (ринофарингиты, стенозирующий ларингит, блефариты, фликтены, конъюнктивиты, кератиты, вульвовагиниты, неустойчивый стул, «географический язык»), лимфатической системы (увеличение лимфатических узлов, аденоиды, увеличение миндалин), кожи (себорея, молочный струп, строфулус, экзема, нейродермит и др.). У этих детей могут наблюдаться бронхиальная астма, поллинозы (сенная лихорадка) и др. В крови — повышенный уровень эозинофилов, может быть умеренная анемия, относительный нейтрофилез, моноцитопения. В моче — обилие клеточных элементов в осадке, не исключая и повышенное содержание лейкоцитов. В кале — большое количество эпителия и эозинофилов. Гнейс встречается только у детей грудного возраста: грязно-серые или коричневого цвета себорейные чешуйки в виде чепчика или панциря на волосистой части головы, преимущественно на макушке и темени. Течение гнейса обычно благоприятное, но у части детей он трансформируется в себорейную экзему (отечность, краснота, мокнутие, усиленное коркообразование), которая нередко распространяется на ушные раковины, лоб, щеки.
Экссудативный диатез. Типичное расположение сыпи
Экссудативный диатез. Эритематозно-папулезные высыпания
Экссудативный диатез. Детская экзема
Частым симптомом аллергического диатеза, особенно у детей 1-го года жизни, является молочный струп (или корка): на коже щек, часто вблизи ушных раковин образуется резко отграниченная от здоровой кожи краснота, отечность нередко с признаками шелушения. У части детей молочный струп сопровождается зудом, часто трансформируется в экзему. Упорная форма опрелости — интертриго — один из важных симптомов аллергического диатеза. Опрелость может быть сухой, в других случаях наблюдается мацерация (мокнутие кожи) кожи (обычно у тучных, отечных детей грудного возраста). Самой тяжелой формой аллергического диатеза следует считать детскую экзему, которая у детей более старшего возраста может трансформироваться в нейродермит. В группе детей с аллергическим диатезом более высоки и показатели смертности от различных острых заболеваний. У детей с экземой иногда регистрируется неожиданная молниеносная смерть («экземная смерть»), причиной которой является анафилактический шок. Диагноз основывается на данных анамнеза и клинических симптомах. Дифференциальный диагноз проводят с истинной экземой, эритродермиями, дерматитами, псориазом, иммунодефицитами, синдромом нарушенного кишечного всасывания.
Лечение Стандартной диеты не существует. Необходимо рациональное питание. Грудное кормление не прекращают, хотя и не исключено наличие в нем трофоаллергенов. Диета матери должна быть бедна углеводами, жирами, поваренной солью и возможными трофоаллергенами. В некоторых случаях (жирное грудное молоко) сцеженное грудное молоко подвергают пастеризации (в течение 30 мин при температуре 65 °C) и верхнюю пленку снимают или ставят молоко на 3–4 ч в холодильник, а затем снимают сливки, после чего пастеризуют. Детям более старшего возраста рекомендуют исключить кисели, муссы, свинину, бульон из говядины, рыбу, яйца в любом виде, бобовые продукты, орехи, специи, приправы: умеренно ограничить жиры и белки, жидкость. Из каш предпочтение отдается гречневой; вечером рекомендуются овощи, салаты, запеканки. Если экзема явилась следствием употребления трофоаллергена, то она за 24 ч может стихнуть при следующей диете: блюда из рисового отвара, 1 блюдо из фруктов (не желтой окраски), 1 блюдо из овощей (картофель), 1 блюдо из риса с фруктовым соком (не желтой окраски). В каждый последующий день к этому основному рациону добавляют новое блюдо под контролем за динамикой заболевания. Если на фоне аллергического диатеза диагностируют дисбактериоз, то могут оказаться эффективными 10-дневные курсы лактобактерина и бифидумбактерина. Назначают лекарственные средства, способствующие уменьшению зуда и проницаемости сосудистой стенки, а также седативные: 3–5 %-ный раствор бромида натрия, димедрол и другие антигистаминные средства в возрастной дозировке; 5—10 %-ный настой (1 ч. л. или 1 ст. л. 3 раза в день) либо настойка лагохилуса опьяняющего (по 1 капле на каждый месяц ребенка, но не более 15 капель на прием детям старше 1 года). Назначают также витамины В5, B6, B12, В15, А, С (аскорбиновая кислота может усилить зуд) в лечебных дозах в течение не менее 3–4 недель. По стихании остроты кожных проявлений применяют гистоглобин (препарат гистамина и иммуноглобина). Стерильно приготовленный препарат (разовую дозу разводят 2 мл изотонического раствора натрия хлорида перед инъекцией) вводят подкожно в область плеча каждые 3–4 дня (курс лечения 3–5 инъекций). Противопоказания — параллельно текущие заболевания, одновременное применение гормонов (через 1–2 месяца после применения последних). Местное лечение, вначале примочки с ихтиолом и анестезином, по исчезновении отечности, мокнутия — мазевая терапия. Кроме того, назначают умеренно теплые ванны (не выше 38 °C) на 10–15 мин с пшеничными отрубями или картофельной мукой (400–600 г на ванну), с дубовой корой, чередой, чистотелом, с добавлением лагохилуса (0,1–0,5 %-ный раствор), перманганата калия (до светло-розового цвета). Применяют общее ультрафиолетовое облучение от 1/4 до 1 эритемной дозы 15–20 раз (ежедневно или через день). Устранение очагов вторичной инфекции также улучшает общее состояние больного.
Профилактика Рациональное питание беременной и кормящей матери, особенно если у них имеется «аллергическая настроенность», с употреблением умеренных количеств разнообразной, хорошо кулинарно обработанной пищи, с исключением из питания яиц, ограничением молока (до 1–2 стаканов в сутки), сахара, шоколада, меда, конфет, орехов, а также колбас, сосисок, рыбных консервов. Организация питания ребенка в соответствии с возрастом. Bо время заболевания и в период выздоровления рекомендуется давать ребенку хорошо обработанную пищу в умеренных количествах, избегать введения новых пищевых продуктов. Соблюдение правил вакцинации, которую желательно проводить только в период ремиссии и после соответствующей подготовки. Гигиенический уход за ребенком грудного возраста. Избегать применения духов, шампуней, туалетной воды. Прогноз при соблюдении всех мер профилактики и лечения благоприятный.
ДИАТЕЗЫ ГЕМОРРАГИЧЕСКИЕ
ОпределениеДиатезы геморрагические — это формы нарушений, характеризующиеся склонностью к кровоточивости, могут возникать при нарушениях сосудистой стенки и изменении свойств крови.Болезнь Виллебранда — один из наиболее частых наследственных геморрагических диатезов. Диспротромбии — геморрагические диатезы, обусловленные наследственным дефицитом некоторых факторов свертывания крови. Дисфибриногенемии — наследственные молекулярные аномалии фибриногена. Они характеризуются либо замедлением свертывания этого белка под влиянием тромбина и тромбиноподобных ферментов, либо неправильным его превращением. Геморрагические диатезы, обусловленные патологией тромбоцитов: тромбоцитопении и тромбоцитопатии. Тромбоцитопеническая пурпура — сборная группа заболеваний, объединяемая по принципу единого механизма тромбоцитопении; укорочения жизни тромбоцитов, вызванного наличием антител к тромбоцитам или иным механизмом их разрушения. Спленогенные тромбоцитопении — тромбоцитопении, обусловленные увеличением и повышением функции селезенки. Тромбоцитопатии — заболевания, в основе которых лежит врожденная (чаще всего наследственная) или приобретенная качественная неполноценность тромбоцитов. При ряде тромбоцитопатий возможна непостоянная вторичная тромбоцитопения (обычно умеренная), обусловленная укорочением продолжительности жизни дефектных тромбоцитов. Тромбастения (болезнь Гланцманна) — наследственное заболевание, поражающее лиц обоего пола. Дезагрегационные тромбоцитопатии — нарушение одной или нескольких склеивающих функций пластинок. В группу включают формы с нарушением реакции освобождения тромбоцитарных факторов свертывания и без него, а также с нарушением накопления в этих клетках некоторых биологически активных веществ. Наследственная тепеангиэктазия (геморрагический ангиоматоз, болезнь Ослера-Рандю) — наследственное заболевание. Характеризуется истончением и недостаточным развитием каркаса стенок мелких сосудов на отдельных участках сосудистого русла, неполноценностью внутреннего слоя стенок.
Этиология и патогенез Различают наследственные (семейные) формы с многолетней, начинающейся с детского возраста кровоточивостью и приобретенные формы, в большинстве своем вторичные (симптоматические). Большая часть наследственных форм связана с нарушениями строения и функций клеток крови либо с дефицитом или дефектом факторов свертывания крови, а также фактора Виллебранда, реже — с неполноценностью мелких кровеносных сосудов (телеангиэктазия, болезнь Ослера-Рандю). Большинство приобретенных форм кровоточивости связано с синдромом ДВС, иммунными поражениями сосудистой стенки (васкулит Шенлейна-Геноха, эритемы) и тромбоцитов (большинство тромбоцитопений), с нарушениями нормального кроветворения, токсико-инфекционным поражением кровеносных сосудов (геморрагические лихорадки, сыпной тиф и др.), заболеваниями печени и желтухой (ведущими к нарушению образования в печеночных клетках факторов свертывания крови), воздействием лекарственных препаратов, нарушающих свертывание крови (дезагреганты, антикоагулянты, фибринолитики), либо провоцирующих иммунные нарушения — тромбоцитопению, васкулиты. При многих перечисленных заболеваниях нарушения свертывания крови носят смешанный характер и резко усиливаются в связи с вторичным развитием синдрома ДВС, чаще всего в связи с инфекционными, иммунными, разрушающими или опухолевыми (включая лейкозы) процессами. По механизму развития различают следующие группы геморрагических диатезов: — обусловленные нарушениями свертываемости крови; — обусловленные нарушением тромбоцитарно-сосудистого свертывания (тромбоцитопении, тромбоцитопатии); — обусловленные нарушениями свертываемости крови и механизма остановки кровотечения с помощью тромбоцитов (болезнь Виллебранда, ДВС-синдром, при белковых нарушениях, лучевой болезни и др.); — обусловленные первичным поражением сосудистой стенки (наследственная телеангиэктазия Ослера-Рандю, гемангиомы, геморрагический васкулит Шенлейна-Геноха, эритемы, геморрагические лихорадки, гиповитаминозы С и В и др.). В особую группу включают различные формы так называемой невротической, или имитационной, кровоточивости, вызываемой у себя самими больными вследствие расстройства психики. Ими наносятся механические повреждения ткани (нащипывание или насасывание синяков, травмирование слизистых оболочек и т. д.), тайно принимаются лекарственные препараты геморрагического действия (чаще всего антикоагулянтов непрямого действия — кумаринов, фенилина и др.); проявляются самоистязание или садизм на эротической почве и т. д. Реже встречаются близкие к ДВС-синдрому заболевания, протекающие с выраженной лихорадкой, — тромботическая тромбоцитопеническая пурпура (болезнь Мошкович) и гемолитико-уремический синдром. Общая диагностика геморрагических заболеваний и синдромов основывается на следующих основных критериях: — определение сроков возникновения, давности, длительности и особенностей течения заболевания (появление в раннем детском, юношеском возрасте либо у взрослых и пожилых людей, острое или постепенное развитие геморрагического синдрома, недавнее или многолетнее (хроническое, рецидивирующее) его течение и т. д.; — выявление по возможности семейного (наследственного) происхождения кровоточивости (с уточнением типа наследования) либо приобретенного характера болезни; уточнение возможной связи развития геморрагического синдрома с предшествовавшими нарушениями, воздействиями (в том числе и лечебными — лекарственные препараты, прививки и др.) и фоновыми заболеваниями (болезни печени, лейкозы, инфекционно-септические процессы, травмы, шок и т. д.); — определение преимущественной локализации, тяжести и типа кровоточивости. Так, при болезни Ослера-Рандю преобладают и часто являются единственным проявлением упорные носовые кровотечения; при дефектах тромбоцитов — синяковость, маточные и носовые кровотечения, при гемофилиях — глубокие гематомы и кровоизлияния в суставы. Болезнь Виллебранда — нарушается взаимодействие стенок сосудов с тромбоцитами, вследствие чего повышается ломкость микрососудов (положительные пробы на ломкость капилляров), при большинстве форм резко возрастает время кровотечения, снижается прилипание тромбоцитов к стенкам сосудов и их склеивание с последующим образованием тромба. Одновременно в большей или меньшей степени снижается активность основного свертывающего фактора крови, что сближает болезнь Виллебранда с легкими формами гемофилии А (отсюда старое название болезни — ангиогемофилия). Комплексный приобретенный дефицит витамин-К-зависимых факторов чаще всего обусловлен приемом антикоагулянтов непрямого действия, К-витаминной недостаточностью при обтурационной желтухе и кишечном дисбактериозе, тяжелыми заболеваниями печени, системным амилоидозом, чрезмерным подавлением этих факторов (ниже 20 % от нормы) на 3—7-й день после рождения (геморрагическая болезнь новорожденных). Следует, однако, учитывать, что в указанных ситуациях кровоточивость часто возникает и вследствие одновременного развития ДВС-синдрома. Геморрагические диатезы, обусловленные патологией тромбоцитов, — различают несколько форм иммунных тромбоцитопений. В свою очередь иммунные тромбоцитопении могут быть как первичными, так и вторичными. В происхождении иммунных форм тромбоцитопении ведущее значение имеют медикаменты и инфекции. Спленогенные тромбоцитопении — увеличение селезенки любого происхождения — могут сопровождаться повышенным распадом тромбоцитов. Диагноз основан на обнаружении тромбоцитопении при увеличенной селезенке и нормальном (или даже увеличенном) числе клеток крови в костном мозге. Дезагрегационные тромбоцитопатии — наследственно обусловленное или приобретенное снижение всех или отдельных склеивающих свойств. Свойством провоцировать скрытое нарушение функции пластинок или вызывать ее обладает ряд лекарственных препаратов: ацетилсалициловая кислота, бутадион (фенилбутазон), индометацин (метиндол) и др. Тромбастения — первичный дефект склеивания тромбоцитов при сохранении реакции освобождения из них пластиночных компонентов свертывания при воздействии коллагеном. Геморрагические диатезы, обусловленные патологией сосудов, — в детском или юношеском возрасте образуются тонкостенные, легко кровоточащие и травмируемые малые ангиомы; в ряде случаев формируются артериовенозные соустья в легких и других органах, прочие признаки неполноценности ткани — растяжимость кожи (резиновая кожа), слабость связочного аппарата (привычные вывихи, западение створок клапанов сердца). Возможно сочетание с болезнью Виллебранда.
Клиническая картина Различают следующие типы кровоточивости. Гематомный тип свойствен ряду наследственных нарушений свертываемости крови (гемофилии А и В) и прибретенных нарушений свертываемости крови, передозировке антикоагулянтов (забрюшинные гематомы). Характеризуется болезненными напряженными кровоизлияниями в подкожную клетчатку, мышцы, крупные суставы, в брюшину и забрюшинное пространство (со сдавлением нервов, разрушением хрящей, костной ткани, нарушением функций опорно-двигательного аппарата), в некоторых случаях — почечными и желудочно-кишечными кровотечениями, длительными, приводящими к анемии кровотечениями из мест порезов, ран, после удаления зубов и хирургических вмешательств. Капиллярный, или микроциркуляторный (точечно-синячковый), тип свойствен тромбоцитопениям и тромбоцитопатиям, болезни Виллебранда, умеренной передозировке антикоагулянтов. Часто сочетается с кровоточивостью слизистых оболочек, маточными кровотечениями. Возможны тяжелые кровоизлияния в мозг. Смешанный капиллярно-гематомный тип кровоточивости — точечно-пятнистые кровоизлияния в сочетании с обширными плотными кровоизлияниями и гематомами. Если кровоточивость имеет наследственное происхождение, этот тип свойствен тяжелому дефициту факторов свертываемости, тяжелым формам болезни Виллебранда. При уточнении диагноза следует учитывать и большие различия в частоте и распространенности геморрагических диатезов, одни из которых исключительно редки, тогда как на другие приходится подавляющее большинство встречающихся в клинической практике случаев кровоточивости. Геморрагические диатезы, обусловленные нарушениями в свертывающей системе крови. Среди наследственных форм подавляющее большинство случаев (более 95 %) приходится на дефицит основных факторов свертывания крови (гемофилия А, болезнь Виллебранда, гемофилия В). Крайне редки (единичные наблюдения) формы, связанные с наследственным дефицитом других факторов свертывания (дефект Хагемана). Среди приобретенных форм, помимо ДВС-синдрома, преобладают нарушения свертываемости, связанные с дефицитом свертывающих белков, — болезни печени, желтуха, кишечные дисбактериозы, передозировка антикоагулянтов, геморрагическая болезнь новорожденных; формы, связанные с появлением в крови иммунных белков, нарушающих свертывание крови; кровоточивость, обусловленная введением гепарина, стрептокиназы, арвин, анкрод. Болезнь Виллебранда — у женщин с сильнейшими маточными кровотечениями болезнь часто протекает намного тяжелее, чем у мужчин. Тип кровоточивости в тяжелых случаях смешанный, в более легких — микроциркуляторный. При незначительной травматизации возникают кровоизлияния в кожу и подкожную клетчатку, носовые и маточные кровотечения, часто ошибочно расцениваемые как дисфункциональные, реже — желудочно-кишечные, внутричерепные. Кровоизлияния в полость суставов редки и поражают лишь единичные суставы, не ведут к глубоким нарушениям функции опорно-двигательного аппарата. Наиболее мучительны изнуряющие и приводящие к анемиям маточные кровотечения, из-за которых иногда приходится прибегать к удалению матки. Во время беременности фактор Виллебранда при одних формах нормализуется и роды протекают нормально, при других — остается сниженным и роды осложняются при отсутствии необходимой терапии опасными для жизни кровотечениями. Возможно сочетание болезни Виллебранда с различными сосудистыми нарушениями — сосудистыми звездочками (форма Квика), артериовенозными соустьями, западением створок клапанов сердца, слабостью связочного аппарата и т. д. Диагноз устанавливают по типичной форме пожизненной кровоточивости и выявлению в разных сочетаниях следующих признаков: положительных проб на ломкость капилляров; удлинения времени кровотечения, особенно в пробах с наложением манжеты по Айви, Борхгревинку или Шитиковой, при нормальном содержании тромбоцитов в крови, нормальной их величине; снижения прилипания тромбоцитов к стеклу, снижения их слипания при тромбообразовании и одновременного нарушения начального этапа свертываемости крови. При большинстве форм снижены активность фактора Виллебранда в плазме и (или) тромбоцитах, а также уровень связанного с ним антигена. При легких формах диспротромбии — микроциркуляторный, при более тяжелых — смешанный тип кровоточивости. Кровоизлияния в полость суставов редки. При всех формах значительно удлинено время свертывания крови (так называемое протромбиновое время). Внутренний механизм свертывания нарушен. Разграничение дефицита различных факторов свертывания проводят с помощью корректирующих проб, тестов со змеиными ядами, путем количественного определения каждого из факторов. Комплексный приобретенный дефицит витамин-К-зависимых факторов первоначально проявляется точечно-синячковой кровоточивостью (в частности, кровоизлияниями в местах инъекций, носовыми и десенными кровотечениями, кровью в моче), затем более обширными кровоподтеками и гематомами в области спины, в забрюшинном пространстве, кровоизлияниями в брюшину и стенку кишок, нередко имитирующими острый живот, дегтеобразным стулом (меленой), иногда кровоизлияниями в мозг. Диагноз устанавливают по наличию геморрагического синдрома и характерных нарушений свертываемости крови. Учитывают предшествующие заболевания и воздействия, в том числе возможность отравления кумаринами (лекарственные формы, крысиный яд и др.). Дисфибриногенемии — кровоточивость (как правило, легкая точечно-синячковая) выявляется лишь при некоторых формах, тогда как при большинстве форм нет угрозы кровотечений или имеется наклонность к тромбозам. Геморрагические диатезы, обусловленные патологией тромбоцитов, — нарушено тромбоцитарно-сосудистое свертывание крови. Характерны синяки и кровоизлияния различной величины и формы на коже; кровотечения из носа, десен, матки, иногда из почек, желудочно-кишечного тракта. Кровотечения возникают спонтанно; появлению синяков способствуют ушибы. Увеличение селезенки отсутствует. Заболевание осложняется хронической железодефицитной анемией различной тяжести. Течение заболевания может быть легким, средней тяжести и тяжелым. Диагноз тромбоцитопенической пурпуры предполагается при наличии синяков на коже в сочетании с носовыми и маточными кровотечениями. Лабораторная диагностика: тромбоцитопения в анализах крови, удлинение времени кровотечения по Дьюку, Айви или Борхгревинку-Ваалеру, положительные пробы на ломкость капилляров, повышенное или нормальное содержание клеток крови в костном мозге. Клинически диагноз тромбоцитопении предполагают на основании отсутствия семейного происхождения и других признаков наследственного дефицита тромбоцитов, а также положительного результата стероидной терапии. Симптоматические тромбоцитопении, обусловленные нарушением образования тромбоцитов, встречаются при различных заболеваниях костного мозга (острые и хронические лейкозы, нарушения кроветворения различного происхождения, миелофиброз, болезнь Педжета и некоторые другие заболевания костей). Диагноз ставят при выявлении заболевания кроветворной системы с тромбоцитопенией, нарушении образования клеток крови по данным клеточного исследования костного мозга. Геморрагические диатезы, обусловленные патологией сосудов, — преобладают рецидивирующие кровотечения из сосудистых звездочек, расположенных чаще всего в носу. Реже кровоточат расширения сосудов на кайме губ, слизистых оболочках ротовой полости, глотки, желудка. Число звездочек и кровотечений нарастает в период полового созревания и в возрасте до 20–30 лет. При наличии артериовенозных соустий возникают одышка, синюшность, увеличение количества эритроцитов. При рентгенологическом обследовании в легких обнаруживают единичные округлые или неправильной формы тени, ошибочно принимаемые нередко за опухоли. Возможно сочетание с западением створок клапанов сердца (шумы, аритмия), повышенной подвижностью суставов, вывихами и другими нарушениями, и с дефицитом фактора Виллебранда (синдром Квика). Заболевание может осложниться циррозом печени. Диагноз основан на обнаружении типичных сосудистых звездочек, рецидивирующих кровотечений из них, семейного характера заболевания (возможны и единичные случаи). Существенных нарушений системы свертывания крови нет (кроме случаев сочетания с дефицитом фактора Виллебранда). При частых и обильных кровотечениях развивается постгеморрагическая анемия; при артериовенозных соустьях — увеличивается количество эритроцитов, повышено содержание гемоглобина в крови.
Лечение и профилактика Болезнь Виллебранда — при кровотечениях и хирургических вмешательствах — введения криопреципитата и струйно свежезамороженной плазмы. Дозы и частота их введения могут быть в 2–3 раза меньше, чем при гемофилии А. С первого и до последнего дня менструального цикла, а также при носовых и желудочно-кишечных кровотечениях назначают внутрь аминокапроновую кислоту (8—12 г/сут.) либо осуществляют гормональный гемостаз. В качестве профилактики заболевания следует избегать браков между больными (в том числе между родственниками) в связи с рождением детей с тяжелой формой болезни. Комплексный приобретенный дефицит витамин-К-зависимых факторов — при наследственном дефиците факторов протромбинового комплекса — заместительная терапия (свежезамороженная плазма внутривенно). При приобретенных формах — такая же терапия и введение водорастворимых препаратов витамина К (викасола) по 20–40 мг внутривенно повторно до прекращения кровоточивости и нормализации протромбинового времени. Дисфибриногенемии — лечение в большинстве случаев не показано; при острых обстоятельствах (большие операции, множественные тромбозы) плазмаферез с заменой таким же объемом свежезамороженной или свежей донорской плазмы (по 800—1000 мл в день в течение 2–3 дней). Геморрагические диатезы, обусловленные патологией тромбоцитов. Консервативное лечение — назначение преднизолона в начальной дозе 1 мг/кг в сутки. При недостаточном эффекте дозу увеличивают в 2–4 раза (на 5–7 дней). Продолжительность лечения 1–4 месяца в зависимости от эффекта и его стойкости. О результатах терапии свидетельствует прекращение кровотечения в течение первых дней. Отсутствие эффекта (нормализации уровня тромбоцитов в крови через 6–8 недель лечения преднизолоном) или его кратковременность (быстрый рецидив тромбоцитопении после отмены стероидов) служит показанием к удалению селезенки. Абсолютные показания к операции — тяжелый тромбоцитопенический синдром, не поддающийся консервативной терапии, появление мелких множественных кровоизлияний на лице, языке, кровотечений, начинающееся кровоизлияние в мозг, а также тромбоцитопения средней тяжести, но часто рецидивирующая и требующая постоянного назначения гормонов. Терапию иммунных патологий крови химиотерапевтическими препаратами — иммунодепрессантами (азатиоприн, циклофосфан, винкристин и др.) изолированно или в комплексе с преднизолоном назначают только при неэффективности стероидной терапии и удалении селезенки в условиях специализированного стационара и лишь по жизненным показаниям. Прекращение кровотечения осуществляют путем тампонады (когда возможно, местного или внутривенного применения аминокапроновой кислоты, назначения адроксона, этамзилата (дицинона) и других симптоматических средств. Маточные кровотечения прекращают приемом аминокапроновой кислоты (внутрь по 8—12 г в день), местранола или инфекундина. Спленогенные тромбоцитопении — в качестве лечения — удаление селезенки. Симптоматические тромбоцитопении — лечение направлено на основное заболевание. Геморрагические диатезы, обусловленные патологией сосудов, — в периоды кровотечений используют средства местной и общей кровоостанавливающей терапии — орошения тромбином с 5 %-ным раствором аминокапроновой кислоты, тампонада носа масляными тампонами, прижигания и др. Более эффективна криотерапия. В иных случаях приходится прибегать к хирургическому лечению (иссечение ангиом, пластика перегородки носа, перевязка артерий). Используют баротерапию, прижигания с помощью лазера. Все эти мероприятия часто дают лишь временный эффект. Введение викасола не показано. При сопутствующем дефиците фактора Виллебранда показаны переливания свежей плазмы. При развитии анемии — переливания крови, введение препаратов железа. Прогноз в большинстве случаев относительно благоприятный, но встречаются формы с неконтролируемыми кровотечениями. Необходимо избегать травматизации слизистых оболочек в местах расположения ангиом. Смазывание слизистой оболочки носа ланолином (с тромбином) или нейтральными маслами.
ДИВЕРТИКУЛЕЗ
ОпределениеДивертикулез — это образование множественных мешковидных выпячиваний в стенке кишки.
Этиология и патогенез Дивертикул представляет собой карман, образующийся в кишке в результате выпячивания слизистой сквозь мышечный слой кишечника. В случае появления ряда дивертикулов говорят о дивертикулезе. Заболевание чаще развивается после 40 лет, в 50 % у лиц старше 60 лет и в 60 % у лиц старше 80 лет. Возникновение дивертикулов связывают с длительным повышением частичного давления в нижних отделах ободочной кишки в результате регуляторных нарушений двигательной функции на фоне чаще всего возрастных изменений соединительнотканных и мышечных элементов кишечной стенки. Застой каловых масс в дивертикулах приводит к травмированию слизистой оболочки, развитию воспалительного процесса (дивертикулит), распространяющегося на прилежащую часть стенки кишки и на окружающие органы. Дивертикулит может сопровождаться изъязвлением слизистой оболочки (кровотечение) или перфорацией дивертикула. Следствием этого могут быть перитонит (местный или разлитой), воспалительные образования вокруг кишки. При стихании острого воспаления образуются массивные рубцовые изменения тканей, обусловливающие возникновение сужения кишки.
Клиническая картина Дивертикулез может долго не иметь клинических проявлений или протекать под видом колита (неустойчивый стул, боль по ходу левой половины толстой кишки); возможно сильное кровотечение. При остром дивертикулите наблюдаются резкая боль, признаки перитонита, болезненное образование преимущественно в левой половине живота, повышение температуры тела, озноб, нередко дизурия (вовлечение мочевого пузыря в воспалительный процесс или образование внутреннего свища вследствие перфорации дивертикула и расплавления стенки мочевого пузыря).
Диагностика и дифдиагностика Диагноз затруднен. С несомненностью дивертикулез устанавливают обычно при ирригоскопии, а также при колоноскопии. Проводятся также эндоскопия с биопсией, УЗИ органов брюшной полости, компьютерная томография. Чаще всего дивертикулезом поражается сигмовидная кишка. Острый дивертикулит и перфорации дивертикулов распознают предположительно по локализации боли в левой половине живота в сопоставлении с признаками хронического колита. В этих случаях необходимы госпитализация и наблюдение хирурга. Острые явления при дивертикулезе склонны к рецидивированию.
Лечение Лечение преимущественно консервативное и направлено на нормализацию стула и снятие спастических и воспалительных изменений толстой кишки (см. Колит, лечение). При кровотечениях из дивертикулов показана гемостатическая терапия; операция возможна лишь в случаях профузных кишечных кровотечений. При остром дивертикулите с образованием воспалительных образований проводят консервативное лечение в условиях стационара (постельный режим, бесшлаковая диета, холод на область воспалительного образования, антибиотики). Перфорации дивертикулов с развитием разлитого перитонита, а также рубцовые сужения кишки и явления непроходимости требуют хирургического лечения. Кроме того, операция показана при дивертикулезе с выраженным и стойким болевым синдромом. Прогноз у большинства больных благоприятный для жизни, но заболевание всегда прогрессирует и у определенной части больных приводит к серьезным и даже опасным для жизни осложнениям. Хирургическое вмешательство часто сопровождается осложнениями.
ДИВЕРТИКУЛЫ
ОпределениеДивертикул — это мешковидное выпячивание слизистой оболочки и подслизистого слоя в дефекты мышечной оболочки пищеварительного тракта.
Этиология и патогенез Дивертикулы бывают врожденными (стенка их состоит из всех слоев кишки; они расположены на противобрыжеечном крае кишки) и приобретенными. Приобретенные дивертикулы возникают за счет воспалительных изменений в стенке органа и окружающих тканях; могут быть пульсионными (в основе — повышение давления в просвете органа с последующим выпячиванием слизистой) и тракционными (воспалительный участок втягивает стенку органа). Дивертикулы пищевода локализуются в шейном отделе (70 %), на уровне бифуркации трахеи (20 %) и над диафрагмой (10 %). Бифуркационные дивертикулы относятся к тракционным, остальные — к пульсионным. Для диагностики дивертикулов чаще прибегают к рентгенологическому исследованию с контрастом; эндоскопическое исследование необходимо применять по показаниям и с осторожностью (возможна перфорция дивертикула, особенно шейного). Шейный дивертикул возникает в результате слабости задней стенки глоточно-пищеводного перехода, с одной стороны, и дискинезии перстневидно-глоточной мышцы — с другой. Вероятно, причиной является нарушение координации сокращений глотки и перстневидно-глоточной мышцы, действующей как верхний сфинктер пищевода. В результате преждевременного сокращения верхнего сфинктера возникает повышение давления, и слизистая оболочка треугольника Киплиана выпячивается, образуя дивертикул. Бифуркационный дивертикул является тракционным, возникает преимущественно за счет воспалительных процессов соседних органов, например рубцевания лимфатических узлов и гранулем. Эпифренальный дивертикул пульсионного характера располагается в нижней трети пищевода над пищеводным отверстием диафрагмы. Он исходит чаще всего из правой стенки пищевода, но растет влево. Дивертикулы желудка встречаются редко, чаще локализованы на задней стенке верхнего отдела ближе к малой кривизне. Дивертикулы двенадцатиперстной кишки по частоте занимают второе место после дивертикулов ободочной кишки, большей частью врожденные. Только 4–5 % дивертикулов сопровождаются клиническими проявлениями. Локализуются они преимущественно на внутренней поверхности кишки. Дивертикулы могут быть одиночными и множественными (каждый 3—4-й дивертикул). Меккелев дивертикул представляет собой остаток желчного протока. Частота 2–3 %. Располагается на противобрыжеечном крае подвздошной кишки в 60—100 см от слепой кишки. Это истинный дивертикул, в его стенке находятся все слои кишки, но может попасть и ткань желудка, поджелудочной железы, островки толстокишечной стенки.
Клиническая картина Основной симптом — нарушение глотания. Даже маленький дивертикул может обусловить выраженные нарушения спастического характера. При большом дивертикуле после приема пищи возникает ощущение давления и распирания в области шеи. Одновременно с этим спереди от левой кивательной мышцы появляется образование. Постепенно наполняющийся пищей дивертикул сдавливает пищевод и вызывает иногда полное нарушение глотания. При опорожнении дивертикула возникает забрасывание остатков пищи в пищевод, сопровождаемое специфическим шумом, прохождение пищи по пищеводу восстанавливается. При надавливании на дивертикул также происходит заброс остатков пищи; кислого желудочного содержимого при этом нет. Забрасывание пищи может происходить и по ночам, на подушке остаются следы пищи и слизи, появляется неприятный запах изо рта, кашель, голос приобретает булькающий оттенок. Клиническая картина бифуркационного дивертикула аналогична дивертикулам шейного отдела ипровоцируется симптомом Вальсальвы (напряжение брюшного пресса после максимального вдоха). Застой пищи в дивертикуле приводит к развитию дивертикулита и перидивертикулита, последний может осложниться перфорацией дивертикула в трахею, в результате чего развивается аспирационная пневмония и абсцесс легкого. Симптомы эпинефрального дивертикула: боль, обусловленная повышением давления в дивертикуле, дисфагия. Осложнения — эзофагит, перфорация (при дивертикулите). Дифференциальный диагноз проводят с кардиоспазмом, параэзофагеальной грыжей и раком пищевода.
Схема дивертикула пищевода: 1 — сфинктер; 2 — шейка мешка; 3 — перстневидно-глоточная мышца; 4 — дивертикул; 5 — сужение пищевода вследствие сдавления дивертикулом; 6 — пищевод; 7 — трахея; 8 — перстневидный хрящ
Клинические проявления дивертикулов желудка возникают при воспалении дивертикула, они напоминают язвенную болезнь. Диагностика основывается на данных рентгенологического исследования и фиброгастроскопии. Клинические проявления дивертикулов двенадцатиперстной кишки возникают только при осложнениях. Дивертикулы верхнего горизонтального отдела проявляются клиническими симптомами язвенной болезни. Это связано с тем, что в дивертикул попало кислое содержимое и возникли язвы и эрозии. Дивертикул нисходящего отдела кишки при возникновении воспаления в нем может обусловить сдавление большого сосочка двенадцатиперстной кишки (фатерова соска) с последующим развитием холангита, панкреатита, механической желтухи. Возможен и непосредственный переход воспаления на поджелудочную железу с развитием хронического панкреатита. Клиническая картина: боль в правой половине живота, чувство тяжести, тошнота, рвота, кровотечения, возможна желтуха. Дивертикулы нижнего горизонтального отдела при развитии воспалительного перипроцесса могут вызвать сдавление двенадцатиперстной кишки и привести к ее непроходимости. Диагноз ставят на основании клинической картины, контрастного рентгенологического исследования желудка и двенадцатиперстной кишки, гастродуоденоскопии. Неосложненный Меккелев дивертикул протекает бессимптомно. Половина больных моложе 10 лет и половина — моложе 30 лет. Иногда первым симптомом, особенно в детском возрасте, может быть кишечное кровотечение, источником которого является изъязвление островков перемещенной слизистой оболочки желудка. Сипмтомы возникающего диверкулита могут напоминать острый аппендицит, причем дооперационная диагностика практически невозможна. Поэтому, если при удалении аппендикса не обнаружены изменения червеобразного отростка, соответствующие признакам острого аппендицита, необходимо исследование примерно 1 м подвздошной кишки. Другие осложнения: перфорация в свободную брюшную полость с развитием перитонита, развитие кишечной непроходимости, озлокачествление перемещенной слизистой оболочки желудка с развитием рака. Возможно сочетание нескольких осложнений.
Лечение Лечение показано при наличии жалоб. Проводится оперативное лечение: выделение и иссечение дивертикула, пересечение перстневидно-глоточной мышцы. Прогноз благоприятный. Лечение при дивертикулах двенадцатиперстной кишки в основном консервативное. Оно направлено на лечение и профилактику дивертикулита. Если вновь отмечаются осложнения, при наличии больших размеров дивертикула показано оперативное лечение. Во время операции иногда трудно найти дивертикул, поиск облегчается введением воздуха через зонд, введенный в двенадцатиперстную кишку. После обнаружения дивертикула производят погружение его и ушивание дефекта мышечной оболочки кишки. При больших парафатеральных и внутрипанкреатических дивертикулах иногда производят удаление части желудка по методу Бильрот-II, выключая двенадцатиперстную кишку из пищеварения. Прогноз благоприятный.
ДИЗЕНТЕРИЯ
ОпределениеДизентерия (дизентерия бактериальная, шигеллез) — это инфекционная болезнь с фекально-оральным механизмом передачи, вызывается бактериями рода шигелл. Протекает с преимущественным поражением слизистой оболочки нижнего отдела толстой кишки.
Этиология и патогенез Возбудителями являются 4 вида шигелл: — шигелла дизентерии; — шигелла Флекснера (с подвидом Ньюкастл); — шигелла Бойда; — шигелла Зонне. Шигеллы содержат термостабильный соматический О-антиген. При его разрушении выделяется эндотоксин, с которым связано развитие интоксикационного синдрома. Шигеллы способны выделять эндотоксин в большом количестве. Вирулентность шигелл определяется следующими чертами: способностью к адгезии к мембранам эпителиальных клеток, инвазии в них и продукции токсинов. Наиболее распространенными являются шигеллы Зонне и Флекснера. Возбудители могут длительно сохраняться во внешней среде (до 1,5 месяцев). На некоторых пищевых продуктах они не только сохраняются, но и могут размножаться (молочные продукты и др.). Отмечается возрастание устойчивости шигелл к различным антибиотикам, а к сульфаниламидам устойчиво большинство видов. Источником инфекции являются больной человек, реконвалесцент и больной с субклинической формой заболевания. Дизентерия имеет фекально-оральный механизм передачи возбудителя, который передается пищевым и контактно-бытовым путем. Заражение происходит через пищевые продукты, воду, руки, мух, почву. Получено несколько видов шигелл, не вызывающих заболевания и использующихся для разработки живых ослабленных вакцин, применяемых с целью выработки иммунитета. Инфицирующая доза при дизентерии мала. Доказана возможность паразитирования шигелл в эпителии кишечника. Заболевание возникает при проникновении в кровь токсинов шигелл. Дизентерийные токсины действуют на стенку сосудов, центральную нервную систему, периферические нервные узлы, симпатико-адреналовую систему, печень, органы кровообращения. При тяжелых формах дизентерии больные обычно умирают от инфекционно-токсического шока.
Клиническая картина Инкубационный период от 1 до 7 дней (чаще 2–3 дня). По клиническим проявлениям дизентерию можно разделить на следующие формы. I. Острая дизентерия: — типичная (разной тяжести); — атипичная (гастроэнтероколитическая); — субклиническая. II. Хроническая дизентерия: — рецидивирующая; — непрерывная (затяжная). III. Нарушения функций кишечника после дизентерии (постдизентерийный колит).
Нормальная слизистая оболочка кишечника
Катаральный колит
Эрозивно-язвенный колит
Атрофический гастрит
Рубцевание слизистой оболочки после перенесенной дизентерии
Типичные формы дизентерии начинаются остро и проявляются симптомами общей интоксикации (лихорадка, ухудшение аппетита, головная боль, неподвижность, понижение артериального давления) и признаками поражения желудочно-кишечного тракта. Боль в животе вначале тупая, разлитая по всему животу, постоянная, затем становится более острой, схваткообразной, локализуется в нижних отделах живота, чаще слева или над лобком. Боль усиливается перед дефекацией. Появляются также тенезмы — тянущие боли в области прямой кишки, отдающие в крестец. Они возникают во время дефекации и продолжаются в течение 5—15 мин после нее. Тенезмы обусловлены воспалительными изменениями слизистой оболочки средней части прямой кишки. С поражением нижнего отдела толстого кишечника связаны ложные позывы и затянувшийся акт дефекации, ощущение его незавершенности. При прощупывании живота отмечаются спазм и болезненность толстого кишечника, более выраженные в области сигмовидной кишки. Стул учащен (до 10 раз в сутки и более). Испражнения вначале каловые, затем в них появляется примесь слизи и крови, а в более тяжелых случаях при дефекации выделяется лишь небольшое количество кровянистой слизи. При легких формах (до 80 % всех заболеваний) самочувствие больных удовлетворительное, температура тела нормальная или слегка повышена, боль в животе незначительная, тенезмы и ложные позывы могут отсутствовать. Стул 3–5 раз в сутки, не всегда удается обнаружить примесь слизи и крови в испражнениях.
Лабораторная диагностика дизентерии 1. Посев на чашках Петри: слева — среда Плоскирева, справа — среда с эозином и метиленовым синим (в проходящем свете). 2 и 3. Нативные препараты испражнений под микроскопом: 2 — слизь с большим количеством лейкоцитов; 3 — слизь с большим количеством жировых капель. 4—9. Дифференциальные цветные среды: 4—6 — скошенный столбик из сухой питательной среды (4 — расщепление мочевины, 5 — расщепление лактозы, 6 — расщепление глюкозы); 7—9 — среда Рассела с индикатором Андраде (7 — расщепление глюкозы с образованием газа, 8 — расщепление мочевины, 9 — расщепление лактозы)
Доклинические формы дизентерии обычно выявляются при бактериологическом исследовании, клинические симптомы выражены слабо. Подобные больные нередко считают себя здоровыми и никаких жалоб не предъявляют. При атипичных формах в сочетании с вышеприведенными симптомами отмечаются явления острого гастрита (боль в верхней части живота, тошнота, рвота), что создает трудности для диагностики. Тяжелая форма дизентерии встречается у 3–5 % заболевших. Она протекает с высокой лихорадкой или, наоборот, с пониженной температурой. Отмечаются резкая слабость, неподвижность, аппетит полностью отсутствует. Больные заторможены, апатичны, кожа бледная, пульс частый, слабого наполнения. Может развиться картина инфекционного коллапса (прогрессирующее падение артериального давления, синюшность, чувство холода, головокружение, пульс едва прощупывается). Стул до 50 раз в сутки, слизисто-кровянистый. При тяжелом течении может иногда наступать паралич сфинктеров, зияние заднего прохода, из которого выделяется кровянистая слизь.
Диагностика и дифдиагностика Для диагностики, помимо клинической симптоматики, большое значение имеет ректороманоскопия. В зависимости от тяжести заболевания изменения слизистой оболочки толстого кишечника выражаются в разной степени. Выявляются катаральные, катарально-геморрагические, эрозивные, язвенные, фибринозные изменения. Наиболее характерно для дизентерии появление кровоизлияний и изъязвлений на воспаленной слизистой оболочке. Доказательством дизентерийной природы заболевания является выделение шигелл из испражнений, однако это удается лишь у 50 % больных (во время вспышек чаще). Для диагноза хронической дизентерии важно указание на перенесенную острую дизентерию в течение последних 6 месяцев. Хроническая дизентерия вначале протекает в виде отдельных обострений (рецидивов), в дальнейшем переходит в непрерывную (затяжную) форму, когда периоды улучшения состояния отсутствуют. Нарушения функции кишечника, возникающие после дизентерии, формируются спустя 2 года после перенесенной дизентерии. В этот период шигелл от больного выделить уже не удается. Дизентерию нужно дифференцировать с острым колитом другого происхождения (сальмонеллезные и др.), а также амебиазом, балантидиазом, неспецифическим язвенным колитом, раком толстой кишки.
Лечение Больных дизентерией можно лечить как в инфекционном стационаре, так и в домашних условиях. Госпитализируют больных со среднетяжелыми и тяжелыми формами, детей в возрасте до 3 лет, ослабленных больных, а также при невозможности организовать лечение на дому; по эпидемиологическим показаниям госпитализируются дети, посещающие дошкольные учреждения, работники питания, лица, проживающие в общежитиях. В качестве препаратов, устраняющих причины заболевания, назначают антибиотики, сульфаниламиды, производные нитрофурана 8-оксихинолина. Для лечения используются антибиотики, полимиксин М по 100 мг/кг или полимиксин с фуразолидоном. Используется бактрим, бисептол, невиграмон 15 мг/кг в течение 5 дней. Нитрофураны (фуразолидон, фурадонин, фураэолин) назначают по 0,1 г 4 раза в день в течение 5–7 суток. Производные 8-оксихинолина (энтеросептол, мексаза) дают по 2 таблетки 4 раза в сутки в течение 5–7 дней. Назначают комплекс витаминов. Для предупреждения рецидивов дизентерии необходимы тщательное выявление и лечение сопутствующих заболеваний. Прогноз благоприятный. Переход в хронические формы наблюдается при совершенной терапии относительно редко (1–2 %).
Профилактика Выздоравливающие после дизентерии выписываются не ранее чем через 3 дня после клинического выздоровления, нормализации стула, температуры тела и однократного отрицательного бактериологического исследования, проведенного не ранее 2 дней после окончания лечения, направленного на прекращение дальнейшего развития заболевания. Диспансерному наблюдению подлежат работники питания и лица, к ним приравненные, а также больные хронической дизентерией. Срок диспансерного наблюдения 3–6 месяцев. При оставлении больного дома в квартире проводят текущую дезинфекцию. За лицами, находившимися в контакте с больными, устанавливают медицинское наблюдение в течение 7 дней.
ДИСБАКТЕРИОЗ КИШЕЧНЫЙ
ОпределениеКишечный дисбактериоз — это синдром, характеризующийся нарушением количественного и качественного состава микрофлоры, в норме заселяющей кишечник.Если у здоровых людей в нижних отделах тонкой кишки и в толстой кишке преобладают анаэробные стрептококки, кишечная палочка, энтерококки и другие микроорганизмы, то при дисбактериозе равновесие между этими микроорганизмами нарушается, обильно развивается гнилостная или бродильная флора, грибы, преимущественно типа Candida. Обнаруживаются микроорганизмы, в норме нехарактерные для кишечника, большое количество микробов находится в содержимом верхних отделов тонкой кишки и в желудке. Активно развиваются условноболезнетворные микроорганизмы, обычно обнаруживаемые в содержимом кишечника в небольших количествах, вместо неболезнетворных форм кишечной палочки (эшерихии) нередко обнаруживаются ее более болезнетворные формы. Таким образом, при дисбактериозе наблюдаются качественные и количественные изменения состава микробных популяций в желудочно-кишечном тракте.
Этиология и патогенез К кишечному дисбактериозу приводят заболевания и состояния, которые сопровождаются нарушением процессов переваривания пищевых веществ в кишечнике: диспепсии кишечные (см.), хронические гастриты (см.) с секреторной недостаточностью, хронические панкреатиты (см.), энтериты (см.), колиты (см.) и т. д. Причиной кишечного дисбактериоза может быть длительный, неконтролируемый прием антибиотиков, особенно широкого спектра действия, подавляющих нормальную кишечную флору и способствующих развитию тех микроорганизмов, которые имеют устойчивость к этим антибиотикам. При дисбактериозе нарушается активность микрофлоры кишечника в отношении болезнетворных и гнилостных микроорганизмов. Продукты ненормального расщепления пищевых веществ необычной для кишечника микрофлорой, образующиеся в больших количествах, раздражают стенку кишки. Возможно также возникновение аллергии либо на обычные продукты расщепления пищевых веществ, либо на антигены бактерий.
Клиническая картина и диагностика Характерны симптомы расстройства пищеварения, снижение аппетита, неприятный вкус во рту, тошнота, метеоризм, понос или запоры. Каловые массы имеют резкий гнилостный или кислый запах. Часто появляются признаки общей интоксикации, наблюдается вялость, снижается трудоспособность. Диагноз подтверждается повторными исследованиями фекальной микрофлоры. При дифференциальной диагностике следует различать дисбактериозы, возникающие на фоне нерационального применения антибактериальных препаратов, на фоне систематических погрешностей в питании (что устанавливается на основании анамнеза), и дисбактериозы, сопутствующие острым и хроническим заболеваниям органов пищеварения. При длительном течении возможны гипоавитаминозы (особенно дефицит витаминов группы В). Некоторые виды кишечного дисбактериоза (особенно стафилококковый, кандидамикозный, протейный, реже другие) могут переходить в распространенную форму (сепсис) (см.).
Лечение и профилактика В легких случаях лечение амбулаторное, в более тяжелых — в стационарных условиях. Прекращают введение антибактериальных средств, которые могли повести к развитию дисбактериоза, назначают общеукрепляющую и десенсибилизирующую терапию (витамины, противогистаминные препараты и т. д.). При кандидамикозе рекомендуются нистатин и леворин, при стафилококковом дисбактериозе — эритромицин. Для нормализации кишечной флоры целесообразно применение энтеросептола, колибактерина, бифидумбактерина, бификола, лактобактерина. При дисбактериозах, возникающих на фоне основного заболевания пищеварительного тракта (энтерит, колит и т. д.), необходимо рациональное его лечение. Нередко целесообразно назначение препаратов пищеварительных ферментов (абомин, полизим, фестал и т. д.). Профилактика сводится к рациональному назначению антибиотиков, полноценному питанию и общеукрепляющей терапии лиц, переболевших тяжелыми общими заболеваниями органов пищеварения.
ДИСПЕПСИЯ
ОпределениеДиспепсия — это собирательный термин для обозначения расстройств пищеварения преимущественно функционального характера, возникающих вследствие недостаточного выделения пищеварительных ферментов или нерационального питания (диспепсия алиментарная).
Этиология Диспепсия алиментарная возникает в результате длительного нерационального питания. Различают бродильную, гнилостную и жировую диспепсию. Бродильная диспепсия связана с чрезмерным употреблением в пищу углеводов (сахара, меда, мучных продуктов, фруктов, винограда, гороха, бобов, капусты и т. д.), а также бродильных напитков (кваса), в результате чего в кишечнике создаются условия для развития бродильной флоры. Гнилостная диспепсия возникает при преимущественном употреблении в пищу белковых продуктов, особенно бараньего, свиного мяса, которое медленнее переваривается в кишечнике. Иногда гнилостная диспепсия возникает вследствие использования в пищу несвежих мясных продуктов. Жировая диспепсия обусловлена чрезмерным употреблением медленно перевариваемых, особенно тугоплавких, жиров (свиной, бараний). Нарушение двигательной функции пищеварительного тракта затрудняет нормальное переваривание и способствует развитию диспепсий. В то же время при диспепсиях необычные или образующиеся в чрезмерных количествах продукты расщепления пищевых веществ (органические кислоты, сероводород и др.) раздражают рецепторы слизистой оболочки кишечника и вызывают ускорение кишечной перистальтики. Расстройство процессов пищеварения нарушает нормальное развитие кишечной микрофлоры и вызывает дисбактериоз.
Клиническая картина Диспепсия бродильная проявляется метеоризмом, урчанием в кишечнике, выделением большого количества газов, частым, слабо окрашенным жидким пенистым стулом с кислым запахом. При копрологическом исследовании определяется большое количество крахмальных зерен, кристаллов органических кислот, клетчатки, йодофильных микроорганизмов. Реакция кала резко кислая. Диспепсия гнилостная также проявляется поносом, но цвет испражнений насыщенно темный, запах — гнилостный. Вследствие общей интоксикации продуктами гниения нередки ухудшение аппетита, слабость, понижение работоспособности. Микроскопическое исследование испражнений выявляет недостаточность пищеварения (креаторею). Реакция кала резко щелочная. При жировой диспепсии испражнения светлые, обильные, с жирным блеском, нейтральной или щелочной реакции. Копрологическое исследование обнаруживает в них большое количество непереваренного нейтрального жира (в виде капель), кристаллов жирных кислот и их нерастворимых солей.
Диагностика и дифдиагностика Диагноз устанавливают на основании расспроса больного (характер питания), клинических проявлений диспепсии, данных копрологического исследования. При ректоромано- и колоноскопии признаков воспаления слизистой оболочки толстой кишки не выявляется. Дифференциальный диагноз проводят с органическими заболеваниями системы пищеварения — атрофическим гастритом (см.) с секреторной недостаточностью, хроническим панкреатитом (см.) с недостаточностью внешнесекреторной функции поджелудочной железы, хроническим энтеритом (см.), энтероколитом (см.) и другими болезнями нередко с синдромом диспепсии. Установлением факта нерационального питания больных при отсутствии изменений в секреторной функции и функционировании органов пищеварения подтверждают функциональный (алиментарный) характер диспепсии. Быстрое устранение симптомов диспепсии при нормализации питания больных также подтверждает диагноз. Дифференциальный диагноз необходимо также проводить с инфекционными паразитарными энтероколитами и колитами (бациллярной, амебной дизентерией (см.) и пр.). В этих случаях имеют значение соответствующий эпидемиологический анамнез, нарушение общего состояния больных (лихорадка, спастические боли в животе, тенезмы), данные ректороманоскопии (воспалительный процесс), выявление сальмонелл, шигелл, энтамеб и их цист, лямблий, балантидий и других возбудителей в испражнениях или соскобе слизистой оболочки прямой кишки, взятом во время ректороманоскопии. Панкреатическая диспепсия обусловлена внешнесекреторной недостаточностью поджелудочной железы (вследствие хронического панкреатита, опухоли и т. д.). Недостаточное поступление в кишечник ферментов поджелудочной железы (панкреатической липазы, амилазы и трипсина) нарушает переваривание пищевых веществ. Возникает ощущение урчания и переливания в животе, метеоризм, нарушается аппетит, возможны коликообразные боли в животе, характерны обильный «панкреатогенный» понос (жирный кал), стеаторея, амилорея, креаторея.
Лечение и профилактика Большое значение имеет правильно отрегулированная диета. При алиментарных диспепсиях назначают голод в течение 1–1,5 суток, затем при гнилостной диспепсии в суточном рационе больного необходимо увеличить количество углеводов, при бродильной диспепсии — белков (одновременно уменьшают количество низкомолекулярных углеводов). При жировой диспепсии ограничивают поступление в организм жиров, особенно тугоплавких, животного происхождения (свиной, бараний). При желудочной и панкреатической диспепсии проводят заместительную терапию препаратами пищеварительных ферментов (ацидинпепсином, абомином, панкреатином, полизимом и др.). Необходимо лечить основное заболевание (хронический гастрит, хронический панкреатит и др.). Профилактика диспепсий сводится к рациональному питанию и профилактике заболеваний, ведущих к развитию диспепсии.
ДИСПИТУИТАРИЗМ ЮНОШЕСКИЙ
ОпределениеДиспитуитаризм юношеский — это дисфункция гипоталамо-гипофизарной системы с увеличением секреции адренокортикотропного гормона и гормона роста, нарушением секреции гормонов поджелудочной и половых желез; наблюдается в период полового созревания.
Этиология и патогенез Инфекции, травмы, ожирение с раннего детского возраста, уменьшение физической нагрузки, прекращение систематических занятий спортом. На этом фоне возрастная физиологическая активация нейроэндокринной системы ведет к ее дисфункции.
Клиническая картина и диагностика Наблюдается в равной степени у юношей и девушек в возрасте 12–23 лет, преимущественно в 15–18 лет. Характерны высокорослость, чаще у юношей (иногда субгигантизм). Ожирение II–III степени, равномерное. На коже груди, живота, бедер, плеч — множественные розовые или красные полосы растяжения, чаще короткие, поверхностные. Половое развитие может быть нормальным, ускоренным или замедленным. Увеличение молочных желез (гинекомастия) у юношей и нарушение менструального цикла у девушек. Нередко отмечается преходящее увеличение артериального давления (чаще у юношей). На рентгенограммах черепа — признаки увеличения внутричерепного давления, участки обызвествления твердой мозговой оболочки в области турецкого седла. На ЭЭГ — признаки нарушения функции неспецифических структур среднего мозга и диэнцефальной области. У части больных нарушена устойчивость к глюкозе, повышена функция коры надпочечников, имеется повышенная продукция инсулина. Течение синдрома обычно доброкачественное.
Лечение Диета с пониженной калорийностью и повышенная физическая нагрузка нормализуют массу тела, одновременно уменьшаются другие симптомы заболевания. В стационаре назначают специальную диету (1200–1500 ккал; 80—100 г белка, 70–80 г жира, 80—120 г углеводов), препараты аноректического действия (фепранон, дезопимон, бигуаниды), спиронолактоны, мочегонные средства, тиреоидные препараты, адипозин. Для улучшения функциональной активности мозга назначают курсами церебролизин (20–40 инъекций на курс), аминалон (в течение 1–3 месяцев), ноотропил, стугерон, кавинтон, циннаризин (1–3 месяца). При нарушении устойчивости к глюкозе применяют бигуаниды. При симптомах половой недостаточности юношам назначают хорионический гонадотропин по 1500 ЕД 2–4 раза в неделю (курсами по 3–4 недели). Лечение юношеских форм ожирения является профилактикой развития сахарного диабета, гипертонической болезни, бесплодия.
ДИСТОНИЯ ВЕГЕТОСОСУДИСТАЯ
ОпределениеДистония вегетососудистая — это распространенное в лечебно-диагностической практике обозначение разнообразных по происхождению и проявлениям, но функциональных в своей основе вегетативных расстройств, обусловленных нарушением нейрогуморальной регуляции вегетативных функций.
Этиология и патогенез Эти расстройства наиболее часто наблюдаются при неврозах, малоподвижности, при эндокринной дисгармонии в период полового созревания и в климактерический период, а также при неврозоподобных состояниях, связанных с нервно-психическим или физическим переутомлением, инфекциями, интоксикациями, синдромом отмены у токсикоманов и другой природы. В механизме развития вегетососудистой дистонии обычно участвуют расстройства регуляции вегетативной деятельности на всех уровнях — от коры головного мозга до периферических отделов вегетативной нервной системы, а также эндокринных звеньев регуляции. Однако в зависимости от происхождения и проявлений вегетососудистой дистонии нередко может быть выделено преимущественное значение нарушений по механизму развития на каком-либо уровне — корковом, гипоталамическом, с преобладанием активности парасимпатического или симпатического отдела вегетативной нервной системы и т. д.
Клиническая картина У большинства больных имеются какие-либо проявления астении — утомляемость, раздражительность, расстройства сна, низкий порог болевой чувствительности с различными сенестопатиями (или ощущение неудовлетворенности вдохом, кардиалгии, жжение в разных участках тела и т. п.). Из признаков вегетативной дисфункции могут быть ощущения сердцебиений при склонности к понижению или повышению сердцебиения; наджелудочковая (редко желудочковая) экстрасистолия, приступы учащения ритмической сердечной деятельности обычно свыше 140–150 ударов в минуту с внезапным началом и окончанием; патологические сосудодвигательные реакции — ощущение приливов жара или холода, повышение или понижение артериального давления, бледность или покраснение кожи, зябкость кистей, стоп; общая или преимущественно местная (подмышечная, ладонная) потливость; признаки нарушения секреторной и двигательной функций желудочно-кишечного тракта; расстройства половых функций и др. В зависимости от характера и уровня расстройств регуляции проявления вегетососудистой дистонии могут быть представлены как немногими из перечисленных расстройств преимущественно в пределах какой-либо одной системы (например, сердечно-сосудистой, пищеварительной) или даже одного органа, так и разнообразным сочетанием признаков нарушения деятельности многих органов. При наличии вегетососудистого дисбаланса преобладание активности парасимпатических нервов выражается склонностью к урежению сердечных сокращений, покраснению кожных покровов, усиленной перистальтикой желудка и кишечника, урежением пульса более чем на 10 ударов в минуту (обычно в сочетании со снижением артериального давления более чем на 10 мм рт. ст.) при отклонении головы назад (рефлекс Ортнера), при надавливании на глазные яблоки (рефлекс Ашнера). Отсутствие урежения пульса при вызывании этих рефлексов, его учащение более чем на 12 в минуту с одновременным подъемом артериального давления более чем на 15 мм рт. ст. при переходе в вертикальное положение, а также симптом стойкого белого дермографизма расценивают как признаки преобладания активности симпатического отдела нервной системы. Течение зависит от природы вегетососудистой дистонии. Часто оно бывает постоянным, непрекращающимся, с волнообразным усилением и ослаблением проявлений в зависимости от динамики состояния, с которым связано ее развитие, и от изменяющихся условий жизни больного. В ряде случаев вегетососудистая дистония проявляется приступообразно, в том числе в форме «вегетативной бури», или кризов, с картиной преимущественного возбуждения холинорецепторов (холинергический криз) или адренорецепторов (адренергический, симпатоадреналовый криз). Симптомы холинергического криза: чувство страха, тоски, тошнота, гиперсаливация, урчание в животе, диарея; поллакиурия; обильная потливость головы и туловища; миоз, брадикардия; в редких случаях также гипертония скелетных мышц, фасцикуляции, подъем артериального давления. Симптомы адренергического криза: чувство тревоги, возбуждение; пятнистая гиперемия кожи лица, шеи, груди (иногда резкая бледность), дрожание пальцев кистей, дрожь в теле (чаще без ощущения холода); расширение зрачков; тахикардия, повышение артериального давления; полиурия; иногда императивная дефекация; в крови нередко лейкоцитоз, гипергликемия.
Диагностика и дифдиагностика Диагноз вегетативно-сосудистой дисфункции является по существу синдромным. В медицинских документах он должен указываться после обозначения основного по отношению к вегетососудистой дистонии заболевания (например: «Неврастения; вегетативно-сосудистая дисфункция с пароксизмами суправентрикулярной тахикардии» или «Патологический климакс; вегетативно-сосудистая дисфункция с симпатоадреналовыми кризами» и т. п.). Однако это не всегда легко осуществить, так как формы, представленные в действующей классификации болезней, охватывают не все возможные причины вегето-сосудистой дистонии, среди которых имеют место так называемые «предзаболевания»-состояния, как малоподвижность или рассогласование в развитии исполнительных и управляющих систем у подростков и юношей. Для более точного обозначения такого типа вегетососудистой дистонии с преобладанием циркуляторных расстройств (в основном у молодых лиц) часто употребляют термин «нейроциркуляторная дистония». Дифференциальный диагноз проводят, во-первых, между вегетососудистой дистонией и болезнями с органической основой нарушений какой-либо функции (например, при экстрасистолии — с миокардитом, ишемической болезнью сердца, кардиосклерозом, кардиомиопатией и т. д.); во-вторых, по происхождению вегетососудистой дистонии, с установлением основного заболевания. При этом требуется тщательное исключение органической патологии нервной и эндокринных систем. Так, приступы проявления вегетососудистой дистонии в форме «вегетативной бури» всегда указывают на основное участие гипоталамических расстройств, которые могут быть проявлением как невроза, так и органического поражения центральной нервной системы с формированием диэнцефального синдрома; при адренергических кризах необходимо исключение феохромоцитомы.
Лечение Лечение направлено прежде всего на основное заболевание (невроз, патологический климакс и т. д.), включает также патогенетическую терапию (седативные средства; при необходимости холинолитики, блокаторы адренорецепторов) и применение симптоматических средств — гипотензивных, антиаритмических и др. Во всех случаях показаны нормализация режима труда и отдыха, обеспечение полноценного сна, занятия физкультурой, закаливание. Неотложную терапию вегетативных кризов начинают с внутривенного введения 10 мг седуксена. При адренергическом кризе показаны бета-адреноблокаторы (например, индерал внутривенно или внутрь), а при выраженном подъеме диастолического артериального давления также альфа-адреноблокаторы (фентоламин, тропафен). При холинергическом кризе подкожно вводят атропин, платифиллин, а при сопутствующем выраженном подъеме артериального давления, возбуждении дыхания — ганглерон.
ДИСТРЕСС-СИНДРОМ РЕСПИРАТОРНЫЙ НОВОРОЖДЕННЫХ
ОпределениеДистресс-синдром респираторный новорожденных (синдром дыхательных расстройств) — это неинфекционные патологические процессы (первичные ателектазы, болезнь гиалиновых мембран, отечно-геморрагический синдром), формирующиеся во внутриутробном и новорожденном периодах развития ребенка и проявляющиеся нарушением дыхания.Частота развития респираторного дистресса зависит от степени недонашивания и составляет в среднем 60 % у детей, родившихся при сроке беременности менее 28 недель, 15–20 % — при сроке 32–36 недель и 5 % — при сроке 37 недель и более. При рациональном выхаживании таких детей смертность приближается к 10 %.
Этиология и патогенез Развивается в основном у недоношенных детей от матерей с отягощенным акушерским анамнезом (сердечно-сосудистые заболевания, сахарный диабет, нефропатии, патология плаценты, маточные кровотечения). Имеет значение внутриутробная кислородная недостаточность, удушье и повышенное содержание углекислого газа в родах при наличии незрелости ткани легкого. Под действием кислородной недостаточности и повышенного содержания углекислого газа наступает нарушение легочного кровообращения. Образование гиалиновых мембран возможно и в результате снижения фибринолитической активности крови. Отмечается также отсутствие или резкое снижение активности антиателектатического фактора (сурфактанта), что способствует возникновению ателектазов. Определенное значение имеет дефицит плазминогена, альфа-2-макроглобулина и развитие локального или диссеминированного внутрисосудистого свертывания крови. Отмечаются недоразвитие эластической ткани легкого, незрелость альвеол, аспирация околоплодной жидкости и слизи, особенно у глубоконедоношенных детей.
Клиническая картина Большинство детей рождаются в состоянии удушья и врожденной кислородной недостаточности, но расстройства дыхания могут появиться не сразу, а спустя несколько часов после рождения. Типичными являются резко выраженные признаки дыхательной недостаточности: одышка с частотой дыханий 60 и более в минуту (нередко с апериодическим дыханием), синюшность (периоральный акроцианоз распространенный), бледность кожных покровов, участие в акте дыхания вспомогательной мускулатуры (напряжение крыльев носа, втяжение уступчивых мест грудной клетки — межреберных промежутков, мечевидного отростка грудины, втягивание надключичных ямок), ригидность грудной клетки, иногда пена у рта, затрудненный «ворчащий» вдох (спазм глосовой щели), раздувание щек. Отмечается снижение двигательной активности, гипорефлексия, мышечная гипотония. Для раннего выявления и оценки тяжести дыхательных расстройств у новорожденных используют шкалу Сильвермана. Оценка производится в динамике каждые 6 часов на протяжении 2–3 дней. По мере прогрессирования болезни дыхательные расстройства и симптомы угнетения нервной системы нарастают, усиливается синюшность, появляются затруднение дыхания, «хрюкающий» выдох и парадоксальное дыхание (при выдохе передненижние отделы грудной клетки втягиваются, а живот выпячивается), рассеянная крепитация (похрустывание). Часто появляются местные и распространенные отеки; пенистые, иногда кровянистые выделения изо рта. Поражается сердечно-сосудистая система, наблюдаются учащение сердцебиения, глухие тоны сердца, нарастают признаки легочной гипертензии, развивается кардио- и гепатомегалия (увеличение сердца и печени).
Диагностика и дифдиагностика Диагноз респираторного дистресса основывается на данных клинической картины. Его можно предсказать на основании изучения содержания лецитина или тромбопластической активности околоплодных вод. Если отношение уровней сфингомиапин — лецитин в околоплодных водах более 2,0, то вероятность развития респираторного дистресса 2 %, если менее 2,0 — 50 %, если менее 1,0 — 100 %. Может быть использован также простой тест на зрелость легких — «пенистый тест» Клементса с содержимым желудка, полученным при зондировании. Дифференциальный диагноз проводят с пневмониями, пороками развития легких и сердца, внутричерепной родовой травмой, диафрагмальной грыжей.
Лечение Прежде всего это профилактика охлаждения (последнее снижает или прекращает синтез сурфактанта). Ребенка сразу после рождения заворачивают и помещают под лучистый источник тепла, а далее в кувез. Проводят мероприятия по оживлению и восстановлению дыхания. Хорошие результаты дает противоацидотическая терапия. Основным показанием к коррекции гидрокарбонатом натрия считается общее тяжелое состояние ребенка (менее 6 баллов по Апгар) и развитие декомпенсированного ацидоза (рН меньше 7,3). Раствор гидрокарбоната натрия вводят повторно в последующие 2–3 дня до нормализации показателей кислотно-основного состояния (рН 7,35—7,4). Широко применяют введение витаминов, сердечных средств (0,05—0,1 мл 0,06 %-ного раствора коргликона), эуфиллина и др. Инфузионная терапия должна проводиться медленно в небольшом объеме со скоростью 3–5 капель в минуту. Состав вводимой жидкости определяется поставленной целью: доставка организму калорий, снижение процессов катаболизма (разрушения) и степени ацидоза, улучшение водно-солевого обмена, предупреждение снижения или увеличения калия в крови и увеличения аминокислот в крови. При шоке и кровопотере показаны переливания крови (10 мл свежей крови). Необходима постоянная ингаляция 30 %-ной кислородно-воздушной смеси. Показанием к искусственной вентиляции является рО2, равное 40–50 мм рт. ст. при вдыхании 100 %-ного кислорода, и рСО2, равное 70–80 мм рт. ст. Эффективно применение кислородно-гелиевых смесей (70 % гелия и 30 % кислорода). Большое значение имеет уход: покой, содержание в кувезе. Время начала кормления определяют индивидуально с учетом функционального состояния ребенка и степени недоношенности. При тяжелом течении, особенно при нарушении координации глотания, сосания и дыхания, назначают кормление через зонд. По мере выздоровления детей переводят на кормление сцеженным женским молоком, а затем прикладывают к груди матери. Прогноз при развитии отечно-геморрагического синдрома тяжелый, в остальных случаях благоприятный.
ДИСТРОФИЯ ГЕПАТОЦЕРЕБРАЛЬНАЯ
ОпределениеДистрофия гепатоцеребральная (гепатолентикулярная дегенерация) — это наследственное заболевание, возникающее обычно в возрасте от 10 до 35 лет и характеризующееся нарушением синтеза белков и обмена меди, прогрессирующим поражением подкорковых нервных узлов (ганглиев) и печени.
Этиология и патогенез Наследственное нарушение синтеза медь-связывающего протеина (белка) — церулоплазмина, в результате которого возникает избыточное накопление токсических доз меди в подкорковых ганглиях, печени, почках. Клеточные изменения нервной системы, максимально выраженные в скорлупе, представлены дегенерацией ганглиозных клеток и разрастанием нейроглии. При компьютерной томографии обнаруживаются распространенная атрофия мозга и очаги пониженной плотности в области базальных ганглиев примерно у половины леченых больных. Поражение печени носит характер многодольчатого цирроза, которому нередко сопутствует увеличение селезенки. Отложение меди по периферии роговицы лежит в основе специфического признака болезни — роговичного кольца Кайзера-Флейшера.
Клиническая картина Первые проявления болезни — подергивания лица и рук; в других случаях на первый план выдвигается паркинсоноподобная ригидность, осложненная атетозом и крупным дрожанием. При попытке развести руки в стороны возникает крупный гиперкинез, напоминающий взмахи крыльев птицы. Позже развиваются контрактуры, расстраивается глотание и артикуляция. Лицо маскообразное, нередко отмечается застывшая улыбка, насильственный смех и плач. Во всех случаях имеет место слабоумие. В поздних стадиях возникают тяжелые трофические расстройства, сочетающиеся с признаками печеночной недостаточности. Пирамидные симптомы редки, расстройств чувствительности обычно нет. Ядро клинической картины на всем протяжении болезни составляют сложные подкорковые нарушения. В крови снижено содержание церулоплазмина и меди, повышено содержание не связанной с церулоплазмином меди и аминокислот в моче.
Диагностика идифдиагностика Диагноз при выраженности клинических и параклинических признаков (дрожание, ригидность, корнеальное кольцо, печеночная патология, нарушения медного обмена) прост.
Лечение Ежедневный прием D-пеницилламина (купренила) до 1,5 г в течение всей жизни. Своевременно начатое лечение нередко обеспечивает нормальное развитие детей, существенное смягчение неврологических симптомов и даже их полное исчезновение у взрослых. При наличии в семье ребенка с гепатоцеребральной дистрофией больше иметь детей не рекомендуется.
ДИФТЕРИЯ
ОпределениеДифтерия — острая инфекционная болезнь с воздушно-капельным механизмом передачи; характеризуется крупозным или дифтеритическим воспалением слизистой оболочки в воротах инфекции — в зеве, носу, гортани, трахее, реже в других органах и токсическим поражением преимущественно сердечно-сосудистой и нервной системы.
Этиология и патогенез Возбудитель — токсигенная дифтерийная палочка, грамположительная, устойчивая во внешней среде. Болезнетворное действие связано с экзотоксином. Нетоксигенные коринобактерии (не продуцирующие экзотоксин) непатогенны. Дифтерийная палочка паразитирует на слизистых оболочках зева и других органов, где развивается крупозное или дифтеритическое воспаление с образованием пленок. Продуцируемый возбудителем экзотоксин всасывается в кровь и вызывает общую интоксикацию с поражением миокарда, периферической и вегетативной нервной системы, почек, надпочечников.
Клиническая картина Инкубационный период — от 2 до 10 дней. В зависимости от локализации процесса различают дифтерию зева, носа, гортани, глаз и др. Различают локализованную, распространенную и токсическую дифтерию зева. При локализованной форме образуются фибринозные пленчатые налеты на миндалинах. Отмечается умеренное воспаление в зеве, боль при глотании выражена незначительно, регионарные лимфатические узлы слегка увеличены. Общая интоксикация не выражена, температурная реакция умеренная. Разновидностью этой формы является островчатая дифтерия зева, при которой налеты на миндалинах имеют вид небольших бляшек, нередко расположенных в лакунах. При распространенной форме дифтерии зева фибринозные налеты переходят на слизистую оболочку небных дужек и язычка; интоксикация выражена, температура тела высокая, более значительна и реакция регионарных лимфатических узлов. Токсическая дифтерия характеризуется резким увеличением миндалин, значительным отеком слизистой оболочки зева и образованием толстых грязно-белых налетов, переходящих с миндалин на мягкое и даже твердое небо. Регионарные лимфатические узлы значительно увеличены, окружающая их подкожная клетчатка отечна. Отек шейной подкожной клетчатки отражает степень интоксикации. При токсической дифтерии I степени отек распространяется до середины шеи, при II степени — до ключицы, при III степени — ниже ключицы. Общее состояние больного тяжелое, отмечаются высокая температура (39–40 °C), слабость, анорексия, иногда рвота и боль в животе. Наблюдаются выраженные расстройства сердечно-сосудистой системы. Разновидностью этой формы служит субтоксическая дифтерия зева, при которой симптомы выражены слабее, чем при токсической дифтерии I степени.
Дифтерия зева локализованная
Распространенная форма дифтерии зева
Дифтерия гортани (дифтерийный, или истинный, круп) в последнее время встречается редко, характеризуется крупозным воспалением слизистой оболочки гортани и трахеи. Течение болезни быстропрогрессирующее. В первой катаральной (дисфонической) стадии, продолжающейся 1–2 дня, наблюдается повышение температуры тела, обычно умеренное, нарастающая осиплость голоса, кашель, вначале «лающий», затем теряющий свою звучность. Во второй (стенотической) стадии нарастают симптомы стеноза верхних дыхательных путей: шумное дыхание, напряжение при вдохе вспомогательной дыхательной мускулатуры, инспираторные втяжения уступчивых мест грудной клетки. Третья (асфиктическая) стадия проявляется выраженным расстройством газообмена: синюшностью, выпадением пульса на высоте вдоха, потливостью, беспокойством. Если своевременно не оказывают врачебную помощь, больной умирает от удушья.
Дифтерия зева токсическая

Дифтерия влагалища
Дифтерия носа, конъюнктивы глаз, наружных половых органов в последнее время почти не наблюдается. Характерны осложнения, возникающие главным образом при токсической дифтерии II и III степени, особенно при поздно начатом лечении. В раннем периоде болезни могут нарастать симптомы сосудистой и сердечной слабости. Миокардит выявляется чаще на 2-й неделе болезни и характеризуется нарушением сократительной способности миокарда и его проводящей системы. Обратное развитие миокардита происходит относительно медленно. Миокардит — одна из причин смерти при дифтерии. Моно- и полирадикулоневриты проявляются вялыми периферическими парезами и параличами мягкого неба, наружных главных мышц, мышц конечностей, шеи, туловища. Опасность для жизни представляют парезы и параличи гортанных, дыхательных межреберных мышц, диафрагмы и поражение иннервационных приборов сердца. Могут возникать осложнения, обусловленные вторичной бактериальной инфекцией (пневмонии, отиты и др.).
Диагностика и дифдиагностика Диагностика производится на основании клинических и эпидемиологических данных о контактах с больными дифтерией. Подтверждением диагноза служит выделение дифтерийных палочек. Дифференцировать нужно с ангинами, инфекционным мононуклеозом, ложным крупом, пленчатым аденовирусным конъюнктивитом (при дифтерии глаза).
Лечение Основной метод терапии — как можно более раннее внутримышечное введение противодифтерийной сыворотки в соответствующих дозах. При легких формах дифтерии сыворотку вводят однократно, при выраженной интоксикации (особенно при токсических формах) — в течение ряда дней. Во избежание анафилактических реакций проводят внутрикожную пробу с разведенной (1:100) сывороткой, при отсутствии в течение 20 мин реакции вводят 0,1 мл цельной сыворотки и через 30 мин — всю лечебную дозу. При токсических формах с целью дезинтоксикации проводится также неспецифическая патогенетическая терапия: — внутривенные капельные вливания белковых препаратов (плазма, альбумин), а также неокомпенсана, гемодеза в сочетании с 10 %-ным раствором глюкозы; вводят преднизолон, кокарбоксилазу, витамины. Постельный режим при токсической форме дифтерии в зависимости от ее тяжести должен соблюдаться 3–8 недель. При дифтерийном крупе необходимы покой, свежий воздух. Рекомендуются седативные средства (фенобарбитал, бромиды, аминазин — не вызывать глубокий сон). Ослаблению сужения гортани способствует назначение глюкокортикоидов. Применяют (при хорошей переносимости) парокислородные ингаляции в палатках-камерах. Хороший эффект может оказать отсасывание слизи и пленок из дыхательных путей с помощью электроотсоса. Учитывая частоту развития при крупе пневмонии (особенно у детей раннего возраста), назначают антибиотики. При тяжелом стенозе (при переходе второй стадии стеноза в третью) прибегают к назотрахеальной (оротрахеальной) интубации или нижней трахеостомии. При дифтерийном бактерионосительстве рекомендуют пероральное применение тетрациклина или эритромицина с одновременным назначением аскорбиновой кислоты; длительность лечения 7 дней.
Профилактика Активная иммунизация — основа успешной борьбы с дифтерией. Иммунизация проводится всем детям (с учетом противопоказаний) адсорбированной коклюшно-дифтерийно-столбнячной вакциной (АКДС) и адсорбированным дифтерийно-столбнячным анатоксином (АДС). Первичная вакцинация проводится начиная с 3-месячного возраста троекратно по 0,5 мл вакцины с интервалом 1,5 месяца; ревакцинация той же дозой вакцины — через 1,5–2 года по окончании курса вакцинации. В возрасте 6 и 11 лет детей ревакцинируют только против дифтерии и столбняка АДС-М-анатоксином (препаратом с уменьшенным количеством антигенов). Больные дифтерией подлежат обязательной госпитализации. В квартире больного после его изоляции проводят заключительную дезинфекцию. Выздоравливающих выписывают из больницы при условии отрицательного результата двукратного бактериологического исследования на дифтерийные палочки; в детские учреждения они допускаются после предварительного двукратного бактериологического исследования. Бактерионосителям токсигенных дифтерийных палочек (детям и взрослым) разрешается посещать детские учреждения, где все дети привиты против дифтерии, через 30 дней после установления бактерионосительства.
ДИФИЛЛОБОТРИОЗ
ОпределениеДифиллоботриоз — гельминтоз, протекающий с признаками преимущественного поражения желудочно-кишечного тракта и часто сопровождающийся развитием мегалобластной анемии.
Этиология Возбудители — более 12 видов лентецов из рода дифиллоботриум, из которых наиболее изучен и распространен лентец широкий. Это крупный ленточный червь, стробил которого достигает 10 м и более и состоит из 3–4 тыс. коротких и широких у переднего конца тела проглоттид (сегментов), принимающих квадратную форму по направлению к концу части тела. Сколекс (головка) длиной 3–5 м имеет продолговато-овальную форму, сплющен с боков и снабжен двумя длинными присасывательными бороздками на боковых поверхностях — ботриями, посредством которых прикрепляется к слизистой оболочке кишечника. Яйца овальной формы, крупные, с двухконтурной оболочкой, снабжены крышечкой на одном полюсе и бугорком на другом.
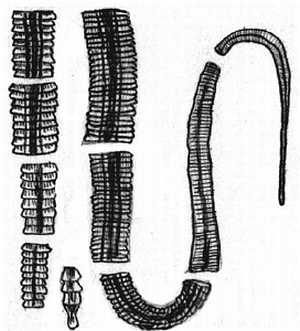
Лентец широкий

Лентец широкий (зрелые членики)
Эпидемиология, патогенез и патанатомия Дифиллоботриоз — гельминтоз, протекающий с признаками преимущественного поражения желудочно-кишечного тракта и часто сопровождающийся развитием анемии (см.). Восприимчивость к инвазии (заражению) всеобщая. Иммунитет изучен недостаточно. Распространение дифиллоботриоза связано с крупными пресноводными водоемами. Очаги его преобладают в Северной Европе, Восточном Средиземноморье, районе Великих озер США, Канаде и на Аляске. В России заболевание регистрируется преимущественно в Карелии, Красноярском крае, на Кольском полуострове. Окончательными хозяевами и источниками заражения являются человек и значительно реже рыбоядные животные: свиньи, медведи, лисы, тюлени, нерпы, в тонкой кишке которых паразитирует зрелый гельминт. Первыми промежуточными хозяевами являются низшие веслоногие рачки, вторыми — рыбы: щука, окунь, ерш, налим, форель и др., в организме которых формируются личинки плероцеркоиды. Заражение человека происходит при употреблении в пищу свежей или недостаточно просоленной икры и сырой рыбы (щука, окунь, омуль, хариус и др.). Паразитируя в органах окончательного хозяина, лентецы выделяют незрелые яйца, развитие которых происходит в пресноводных водоемах. Формирующийся в яйце зародыш выходит в воду спустя 6—16 дней. При температуре ниже +15 °C корацидии (подвижные личинки) из яиц не выходят, оставаясь жизнеспособными до 6 месяцев. После заглатывания пресноводными рачками корацидии через 2–3 недели превращаются в процеркоиды (личиночная стадия, развивающаяся в организме первого промежуточного хозяина). В организме рыб, заглатывающих рачков, процеркоиды проникают во внутренние органы и мышцы, где через 3–4 недели развиваются в плероцеркоиды (личинки, развивающиеся в организме дополнительного хозяина) длиной до 4 см и имеющие сформировавшийся сколекс. В половозрелых лентецов плероцеркоиды превращаются в организме окончательного хозяина. Лентец, прикрепляясь к слизистой оболочке кишки своими присосками, травмирует ее. Большие скопления паразита могут закупорить просвет кишечника. Продолжительность жизни лентеца широкого в организме человека может достигать 25 лет, в организме собаки — 1,5–2 лет, кошки — 3–4 недель. Поглощение широким лентецом витамина В12 непосредственно из пищеварительного тракта ведет к гиповитаминозу В12 и развитию анемии. В развитии клинических проявлений заболевания играют роль механическое воздействие гельминтов на стенку кишечника в месте его прикрепления с развитием атрофии (см.) и некрозов (см.), раздражение рецепторов с формированием рефлекторных реакций и нервно-трофических расстройств, аллергические реакции вследствие сенсибилизации организма хозяина продуктами обмена лентеца.
Клиническая картина и диагностика Дифиллоботриоз может иметь как клинически явное, так и скрытое течение. Инкубационный период составляет от 20 до 60 дней. Заболевание начинается постепенно. Возникают тошнота, реже — рвота, боли в верхней части живота или по всему животу, снижается аппетит, стул становится неустойчивым, появляется субфебрилитет (невысокая температура). В случаях длительного течения гельминтоза у некоторых больных может наступить кишечная непроходимость (см.) из-за скопления большого количества гельминтов в тонком кишечнике. Параллельно появляются и нарастают признаки астеноневротического синдрома (слабость, утомляемость, головокружение) и В 12-дефицитной анемии (см.). Возникают боль и парестезии (неприятные ощущения жжения, покалывания и т. д.) в языке, в тяжелых случаях наблюдается глоссит — наличие на языке яркокрасных болезненных пятен и трещин. Позднее сосочки языка атрофируются, он становится гладким и блестящим («лакированным»). Отмечаются учащенное сердцебиение, расширение границ сердца, шум волчка, гипотензия (пониженное артериальное давление). Количество эритроцитов и гемоглобина резко снижается, цветовой показатель остается высоким, отмечаются нарастание непрямого билирубина сыворотки крови, относительный лимфоцитоз и нейтропения, ускорение СОЭ. При свежей инвазии (заражении) может выявляться эозинофилия. В мазке крови в небольшом количестве обнаруживаются мегалобласты, тельца Жоли, кольца Кэбота, гиперхромные макроциты, полихроматофильные эритроциты и эритроциты с базофильной зернистостью. У некоторых больных число эритроцитов и количество гемоглобина остаются в пределах нормы, но имеются признаки макроцитоза. Выраженность анемии (см.) зависит от характера питания и условий жизни. При тяжелом течении заболевания развивается фуникулярный миелоз (нерезкие парестезии, нарушения поверхностной и глубокой чувствительности). В диагностике дифиллоботриоза информативен эпиданамнез (пребывание в очаговой области, употребление сырой рыбы, недосоленной икры). Часто больные сообщают о выделении с калом частей гельминтов. Для дифиллоботриоза характерно выделение обрывков стробилы, что отличает его от инвазии цепнями (бычьим и свиным). Дифференциальный диагноз между дифиллоботриозом и различными анемиями (см.) возможен на основании определения в содержимом желудка фактора Касла, который при пернициозной анемии (см.) отсутствует. Окончательный диагноз устанавливают при обнаружении в кале яиц гельминта.
Лечение и профилактика Препаратом выбора при дифиллоботриозе является празиквантел (билтрицид, отечественный аналог — азинокс), вызывающий угнетение метаболизма (обмена веществ) гельминта путем нарушения проницаемости его биологических мембран. Препарат назначают в течение одного дня в суточной дозе 60–75 мг/кг массы тела в 3 приема с интервалом 4–6 ч во время еды (таблетки не разжевывают). Подготовки и назначения слабительных не требуется. Противопоказание — беременность (см.). Препараты мужского папоротника и фенасал сейчас утратили свое значение ввиду высокой частоты побочных действий и сложности при подготовке больных к проведению лечения. При наличии выраженной анемии (см.) до назначения антигельминтных препаратов проводят ее лечение (цианкобаламин по 500 мкг внутримышечно через день, фолиевая кислота, витамин В12 по 300–500 мкг внутримышечно 2–3 раза в неделю в течение месяца, препараты железа, гемостимулин, гематоген). Чтобы не заразиться дифиллоботриозом, следует употреблять в пищу рыбу только после тщательного прожаривания, проваривания и длительного посола. Плероцеркоиды погибают после просаливания рыбы в крепком солевом растворе через 2–7 дней, в икре при 3 %-ном посоле — через 2 дня, при 10 %-ном — через 30 мин. Большое значение имеют санитарная охрана водоемов от фекального загрязнения и своевременная дегельминтизация больных. Не рекомендуется употреблять в пищу сырую, непроваренную или недостаточно просоленную и провяленную рыбу, а также «живую» щучью икру. Необходимо проводить изгнание гельминтов у зараженных людей.
ДУОДЕНИТ
ОпределениеДуоденит — это воспалительные заболевания двенадцатиперстной кишки. Встречаются часто, преимущественно у мужчин. Различают дуодениты острые и хронические, распространенные и ограниченные главным образом луковицей двенадцатиперстной кишки (бульбит).Острый дуоденит обычно протекает в сочетании с острым воспалением желудка и кишечника как острый гастроэнтерит, гастроэнтероколит; бывает катаральным, эрозивно-язвенным и флегмонозным. Дуоденит хронический бывает поверхностным, атрофическим, интерстициальным, гиперпластическим или эрозивно-язвенным.
Этиология и патогенез Острый дуоденит Пищевые токсикоинфекции (см.), отравления токсическими веществами, обладающими раздражающим действием на слизистую оболочку пищеварительного тракта, чрезмерный прием очень острой пищи обычно в сочетании с большим количеством крепких алкогольных напитков, повреждения слизистой оболочки двенадцатиперстной кишки инородными телами.
Хронический дуоденит Нерегулярное питание с частым употреблением острой, раздражающей, слишком горячей пищи, алкоголизм. Вторичный хронический дуоденит наблюдается при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки, хроническом панкреатите, лямблиозе, пищевой аллергии, уремии. Помимо непосредственного воздействия раздражающего агента на слизистую оболочку двенадцатиперстной кишки, в механизме развития хронического дуоденита имеет значение протеолитическое действие (разрушающие структурные белки) на нее активного желудочного сока (при трофических нарушениях, дискинезиях (нарушениях моторики желчевыводящей системы).
Клиническая картина и диагностика Острый дуоденит Характерны боль в верхней части живота, болезненность при прощупывании в данной области, тошнота, рвота, общая слабость. Диагноз (в необходимых случаях) подтверждается дуоденофиброскопией, обнаруживающей воспалительные изменения слизистой двенадцатиперстной кишки. При очень редком флегмонозном дуодените резко ухудшается общее состояние больного, определяется напряжение мышц брюшной стенки в эпигастральной области, положительный симптом Щеткина-Блюмберга, лихорадка, нейтрофильный лейкоцитоз, повышение СОЭ. Дуоденальное зондирование и дуоденофиброскопия противопоказаны. Острый катаральный и эрозивно-язвенный дуоденит обычно заканчивается самоизлечением в несколько дней; при повторных дуоденитах возможен переход в хроническую форму. При флегмонозном дуодените прогноз серьезный. Возможны осложнения: кишечные кровотечения, перфорация стенки кишки, развитие острого панкреатита.
Хронический дуоденит Характерна боль в верхней части живота — постоянная, тупого характера или язвенноподобная, ощущение полноты или распирания в верхних отделах живота после еды, снижение аппетита, тошнота, иногда рвота. При прощупывании отмечается болезненность глубоко в верхней части живота. Диагноз подтверждается дуоденофиброскопией. При необходимости проводят биопсию слизистой оболочки двенадцатиперстной кишки. Данные рентгенологического исследования малохарактерны. Течение длительное, с периодами обострения (при пищевых погрешностях и пр.). Прогноз благоприятный при соответствующем лечении. Осложнения: кишечные кровотечения при эрозивно-язвенной форме дуоденита.
Лечение и профилактика Острый дуоденит При остром катаральном и эрозивно-язвенном дуодените 1–2 дня — голод, постельный режим, промывания желудка слабым раствором перманганата калия с последующим введением 25–30 г магния сульфата в стакане воды (с целью очистить кишечник). В последующие дни — диета № 1а—1, вяжущие и обволакивающие средства внутрь, при боли — спазмолитические и холинолитические препараты. При флегмонозном дуодените лечение оперативное в сочетании с антибиотикотерапией.
Хронический дуоденит Период обострения проводят в стационаре. Назначают диету № 1а, затем 1б, антацидные (при сохраненной кислотности желудочного сока), вяжущие, спазмолитические, ганглиоблокирующие и холинолитические средства. Для улучшения процессов регенерации (восстановления) назначают витамины (А, В6, В12), внутривенные капельные вливания белковых гидролизатов (аминопептид, аминокровин и др.), алоэ, пентоксил и др. При вторичных дуоденитах необходимо лечение основного заболевания. Больные хроническим дуоденитом должны находиться под диспансерным наблюдением, им показано проведение лечения для профилактики обострения. В профилактику входит рациональное регулярное питание, борьба с алкоголизмом, своевременное лечение других заболеваний, на фоне которых возникает вторичный дуоденит.
♦ Е ♦
ЕВНУХОИДИЗМ
ОпределениеЕвнухоидизм — патологическое состояние, возникающее в результате функциональной недостаточности половых желез и уменьшения секреции половых гормонов, обычно сопровождающееся недоразвитием первичных половых признаков у мужчин.
Этиология и патогенез Различают евнухоидизм врожденный, возникший до начала полового созревания, и поздний, наступивший после периода возмужания. Врожденный евнухоидизм развивается в результате наследственного поражения половых желез в эмбриональном периоде. Евнухоидизм может возникнуть также в результате воспалительных процессов при инфекционных заболеваниях (паротит (см.), сифилис (см.), гонорея (см.), туберкулез (см.) с локальными поражениями яичек, вследствие травматических поражений последних, а также как вторичное заболевание при повреждении передней доли гипофиза (см. Гипогонадизм), управляющей функциями половых желез.
Патанатомия Нарушения яичка и придатков встречаются очень редко. К нарушениям развития, приводящим к евнухоидизму, относится анорхизм — врожденное отсутствие обоих яичек. Нарушение может заключаться в отсутствии собственно ткани яичка при наличии придатка и семявыносящего протока. Такое нарушение сопровождается резким недоразвитием половых желез и евнухоидизмом. Снижение функций при врожденном недоразвитии яичка может приводить к уменьшению его размеров до нескольких миллиметров. Снижение функций обоих яичек равноценно анорхизму и сопровождается недоразвитием полового члена и признаками евнухоидизма.
Клиническая картина При врожденном евнухоидизме отмечаются высокий рост, отсутствие бороды и усов, высокий тембр голоса, непропорционально длинные по сравнению с туловищем руки и ноги, отсутствие или незначительное оволосение лобка и подмышечных впадин. Либидо и потенция отсутствуют. Во втором случае, когда недоразвитие функций половых желез возникло после периода возмужания, наблюдаются следующие признаки: замедление роста бороды и усов, уменьшение размеров предстательной железы и полового члена, снижение половой активности вплоть до импотенции и развития ожирения. В значительной степени страдает психика больных, которые становятся апатичными, вялыми, унылыми. При наличии значительного недоразвития половых органов и отсутствии вторичных половых признаков диагноз нетруден. Необходимо в каждом конкретном случае исключить возможную опухоль гипофиза.
Лечение Симптомы заболевания устраняют систематическим введением препаратов мужского полового гормона. Ввиду необходимости длительного лечения назначается метилтестостерон, эффективный при подъязычном введении, в то время как тестостерона пропионат вводят внутримышечно и подкожно (имплантаты, масляные растворы отдельных эфиров или их сочетание). Режим дозирования подбирается индивидуально в зависимости от заболевания, возраста больных и лекарственной формы препарата. Сочетанием быстро и медленно действующих эфиров в одном препарате добиваются продолжительного (более 4 недель) эффекта при введении масляных растворов внутривенно, использовании имплантатов и накожных пластырных форм медленного высвобождения. Из других препаратов рекомендуется вводить омнандрел-250, обладающий анаболическим действием, который связывает и активирует соответствующие (тестостероновые) рецепторы клеток.
ЕВСТАХИИТ
ОпределениеЕвстахиит (тубоотит) представляет собой воспаление евстахиевой трубы.
Этиология и патогенез Острый евстахиит развивается при переходе воспалительного процесса из полости носа и носоглотки на слизистую оболочку слуховой трубы и барабанной полости. Возбудителями могут быть различные микроорганизмы (стрептококки, стафилококки и др.), у детей чаще встречаются пневмококки. В основе заболеваний слуховой трубы могут лежать затрудненное носовое дыхание, причиной которого служат полипы (см.), сильно увеличенные носовые раковины, аденоидные разрастания, ринофарингит (см.), сосудодвигательные процессы, заболевания придаточных пазух носа, опухоли (см.). В норме просвет слуховой трубы не зияет, так как стенки ее прилегают друг к другу в перепончато-хрящевом отделе, выполняя при этом вентиляционную и дренажную функции. Следует различать чисто механическое закрытие слуховой трубы (носоглоточного ее устья) аденоидами (см.), трубными миндалинами или опухолью и закрытие слуховой трубы вследствие припухания слизистой оболочки и слипания ее стенок в результате воспалительного процесса. В первом случае закрытие является более стойким, во втором — преходящим. При этом находящийся в барабанной полости воздух (главным образом кислород) всасывается капиллярами, в результате чего возникает снижение давления в барабанной полости. Внешне это проявляется втяжением барабанной перепонки, что частично компенсирует изменение давления в барабанной полости. Вследствие длительного и интенсивного разрежения воздуха в среднем ухе возникает венозный застой в слизистой оболочке слуховой трубы и барабанной полости с выпотом транссудата, т. е. наступает начальная стадия воспаления.
Клиническая картина Евстахиит является начальной стадией острого катарального воспаления евстахиевой трубы (I стадия катарального отита) и среднего уха. Евстахиит может быть острым и хроническим.
Острый евстахиит Основными жалобами больных являются заложенность одного или обоих ушей, ощущение тяжести в голове, шум в ушах, аутофония; нередко больные указывают на ощущение переливающейся жидкости в глубине уха при наклонах и поворотах головы. Болевых ощущений в ухе нет. Общее состояние больного страдает мало. Температура держится на нормальных цифрах. При остром евстахиите понижение слуха зависит от количества транссудата в барабанной полости. Если изменить положение головы, при перемещении транссудата в барабанной полости слух улучшается.
Хронический евстахиит Хронический евстахиит часто сопровождается изменением барабанной перепонки и стойким сужением евстахиевой трубы. Симптоматика сходна с таковой при остром евстахиите, но все проявления носят более стойкий характер. Диагноз евстахиита основывается на клинических данных и результатах отоскопии, указывающей на втяжение барабанной перепонки, резкое выступание короткого отростка молоточка, кажущееся укорочение рукоятки молоточка, находящейся в более горизонтальной плоскости, изменение светового конуса. Для определения проходимости евстахиевой трубы применяют метод ушной манометрии.
Аэроотит В результате баротравмы, связанной с воздушными полетами, решающими факторами являются сила и быстрота изменения атмосферного давления, а также степень проходимости слуховой трубы. Когда разница между давлением в барабанной полости и наружном ухе весьма значительна, при ухудшенной проходимости слуховой трубы развивается аэроотит. Больного беспокоят заложенность в ухе и боли различной интенсивности, понижение слуха, звон в ушах, иногда головокружение. При отоскопии в легких случаях наблюдается втяжение барабанной перепонки и инъекция сосудов рукоятки молоточка, в более тяжелых случаях отмечаются распространенное покраснение барабанной перепонки, подслизистые кровоизлияния в перепонке, серозно-кровянистой жидкости в полости среднего уха, а иногда и разрыв барабанной перепонки. Изменение слуха отражает степень поражения звукопроводящего аппарата уха. Осложнением евстахиита является развитие острого среднего отита.
Лечение Назначается щадящий режим для предупреждения развития осложнений. Лечение проводится консервативно. В качестве местной терапии применяют дезинфицирующие средства, воздействующие на слизистую оболочку среднего уха. Антибактериальные средства выбираются с учетом особенностей заболевания и клинической фармакологии препаратов. Наиболее эффективными средствами при острых и хронических евстахиитах являются цефуроксин аксетил, амоксициллин, доксициклин. Вторая цель лечения медикаментами — устранение болевого синдрома. С этой целью местно в виде капель можно назначить осмотол — карболовый глицерин и 70 %-ный спирт в соотношении 1:1. Применяют осмотол чаще в виде компрессов. Для перорального применения рекомендуют препараты типа колдрекса, обладающие жаропонижающим, обезболивающим и противовоспалительным действием и способствующие значительному уменьшению отечности слизистой оболочки верхних дыхательных путей. По показаниям назначаются антигистаминные препараты первого и второго поколений. Для стимуляции защитных сил организма используется применение поливитаминов группы А, Е, С, Р в связи с их антиоксидантным действием. При лечении евстахиита хороший эффект можно получить при использовании импульсного полупроводникового лазера с длиной волны 0,89 мкм. Рекомендуется курс импульсной лазеротерапии, состоящий из 10 сеансов; разовая экспозиция — 4 мин, частота импульсации — 1500 Гц, выходная мощность — не менее 7 мрт. Лечение острого евстахиита предусматривает лечение носа, носоглотки, восстановление проходимости евстахиевой трубы. Лечение заключается в обеспечении домашнего режима. С целью восстановления вентиляционной и дренажной функций слуховой трубы назначают сосудосуживающие или вяжущие средства в виде капель, содержащих гентамицин и називин и уменьшающих отечность слизистой оболочки, а также другие средства. По прекращении острого процесса, если слух остается пониженным, показаны продувание и пневматический массаж. Благодаря этим действиям восстанавливаются вентиляционная и дренажная функции евстахиевой трубы. Для продувания уха используют способ Политцера или способ катетеризации. Продувание уха проводят с помощью резинового баллона, соединенного резиновой трубкой с оливой. Оливу плотно вводят в одну ноздрю больного и пальцами левой руки прижимают одно крыло носа к оливе, а другое — к носовой перегородке. Чтобы воздушная струя попала в барабанную полость, больному предлагают сделать глоток воды или громко по слогам произнести слово «пароход» или «кукушка». В момент глотка или произнесения слога, на котором стоит ударение (мягкое небо при этом приподнимается и плотно прижимается к задней стенке глотки), правой рукой сжимают баллон. Сжимание баллона не должно быть сильным и быстрым. Легкое продувание можно с успехом применять у маленьких детей. Попадание воздуха контролируется с помощью отоскопа. При удачном продувании уха у большинства больных состояние улучшается через 1–3 сеанса. В других случаях слух может улучшаться на несколько часов или несколько дней. Тогда требуются сеансы повторных продуваний через 1–2 дня в течение 2–3 недель. Из общих лечебных средств назначают антибиотики, сульфаниламидные препараты сроком на 4–6 дней.
♦ Ж ♦
ЖЕЛТУХА
ОпределениеЖелтуха — это симптом окрашивания в желтый цвет слизистых оболочек, непрозрачной оболочки глаз, кожных покровов. Она развивается при определенных нарушениях и формирует синдром, требующий дифференциальной диагностики. Все желтухи делят на 3 вида: гемолитические (надпеченочные), паренхиматозные (печеночные) и механические (подпеченочные).Истинную желтуху следует отличать от ложной, которая возникает при длительном приеме некоторых лекарственных средств (акрихин, этакридин), при постоянном контакте с некоторыми промышленными красками, обильном употреблении моркови (каротинемия) или апельсинов. Ложную желтуху позволяет отличить отсутствие окрашивания слизистых оболочек.
Этиология и патогенез Окрашивание слизистых оболочек при желтухе не является отличительным признаком для установления причин заболевания. В зависимости от уровня обмена билирубина выделяют надпеченочную (гемолитическую), печеночную (паренхиматозную) и подпеченочную (механическую, обтурационную) желтуху. Билирубин образуется при распаде гемоглобина. Этот билирубин циркулирует в крови, он нерастворим в воде, не выделяется с мочой. Его называют свободным, или непрямым. При гемолитической анемии (см.) в результате обильного разрушения эритроцитов возникает большое количество свободного билирубина, которое печень не в состоянии преобразовать. В случаях повреждения печеночных клеток возникает паренхиматозная желтуха, в результате которой в крови содержится повышенное количество связанного (прямого) билирубина, который выделяется с мочой, окрашивая ее в темный цвет. Одновременно в кишечнике образуется большое количество желчных пигментов, часть которых всасывается, но поскольку печеночные клетки повреждены, нарушается их дальнейшее превращение. При обтурационной желтухе желчь не поступает в кишечник, поэтому стул становится светлым, повышается уровень прямого билирубина, желчные пигменты в моче отсутствуют. На основании билирубинового обмена дифференцировать желтуху не всегда возможно. Необходимо учитывать клиническую картину, данные опроса, лабораторных и инструментальных исследований.
Клиническая картина Гемолитическая (надпеченочная) желтуха В основе гемолитической желтухи лежит разрушение эритроцитов, избыточное образование билирубина в костном мозге, с которым даже нормально функционирующая печень не может справиться. Она встречается при врожденной и приобретенной гемолитической анемии (см.), сепсисе (см.), лучевой болезни (см.), болезни Аддисона-Бирмера (см.), отравлениях (см.) мышьяком, фосфором, фенолами, при ДВС-синдроме. Печень при этом находится в состоянии повышенной нагрузки, но функционально поражена мало. Больной с гемолитической желтухой должен быть проконсультирован гематологом. При надпеченочной желтухе различают ряд общих симптомов, позволяющих ее отличить от других видов желтухи. К ним относятся умеренная желтушность слизистых оболочек, непрозрачной оболочки глаз и кожи наряду с более или менее выраженной бледностью, увеличением содержания непрямого билирубина в сыворотке крови, увеличение селезенки, а иногда и печени, резко окрашенный кал, повышенное количество предшественников эритроцитов в крови и увеличение выработки самих эритроцитов в костном мозге, укорочение продолжительности их жизни. Функциональные печеночные пробы при гемолитической желтухе изменяются незначительно.
Печеночная желтуха Печеночная желтуха возникает при поражении печеночной стенки, в результате чего страдает пигментный обмен в печени. Это отмечается при гепатитах (см.) А и В (гепатит С протекает большей частью без желтухи), токсических гепатитах, некоторых формах цирроза печени (см.), опухолях (см.), кистах (см.), паразитарных заболеваниях печени, острой и хронической печеночной недостаточности. Прежде всего у такого больного необходимо исключить наличие инфекционного заболевания. В зависимости от локализации патологического процесса выделяют три вида печеночной желтухи: печеночно-клеточную, холестатическую и энзимопатическую. Печеночно-клеточная желтуха — одно из самых частых проявлений острых и хронических поражений печени. Возникновение ее может быть связано с вирусным гепатитом (см.), инфекционным мононуклеозом (см.), лептоспирозом (см.), токсическим поражением печени (алкогольная интоксикация, отравление химическими веществами, непереносимость лекарственных препаратов и др.), хроническим активным гепатитом, циррозом печени, печеночно-клеточным раком (см.). Выведение билирубина в кишечник при данном виде желтухи понижено, а в разгар желтухи иногда вовсе отсутствует. Отмечается выведение билирубина с мочой (билирубинурия). Холестатическая желтуха часто наблюдается при хроническом холестатическом гепатите, первичном билиарном циррозе печени и приеме различных лекарственных препаратов, особенно аминазина, тестостерона, сульфаниламидов. Причиной этого вида желтухи является нарушение превращения и образования компонентов желчи, а также изменение проницаемости капилляров. Отмечаются повышенное содержание в сыворотке крови прямого и непрямого билирубина, желчных кислот, выделение желчных пигментов с мочой и калом. Энзимопатическая желтуха обусловлена недостаточностью ферментов, ответственных за захват, транспорт и выделение билирубина из клеток печени. Этот вид желтухи наблюдается при длительном голодании, иногда после введения некоторых лекарственных веществ, конкурирующих с билирубином за захват клетками печени.
Подпеченочная желтуха Подпеченочная (обтурационная) желтуха развивается при нарушении оттока желчи по желчным путям. Причиной ее являются закрытие печеночного или общего желчного протока камнями, паразитами, сдавление головки поджелудочной железы или фатерова соска опухолью, а также кистой (см.) и хроническое воспаление поджелудочной железы, рубцовое сужение общего желчного протока и др. Препятствие току желчи обусловливает повышение давления в вышележащих желчных путях. Желчный пигмент при этом проходит через стенки расширенных желчных капилляров, клетки печени наполняются желчью, которая поступает в кровь. Обтурационная желтуха характеризуется постоянным нарастанием желтушности кожи. В редких случаях, например при периодической закупорке камнем общего желчного протока, желтуха то появляется, то исчезает. При продолжительной желтухе, особенно механической, кожа приобретает зеленоватый и даже черный оттенок. При отсутствии в кишечнике желчи испражнения светлые, землистого цвета, с большим количеством жиров. Желчные пигменты в моче отсутствуют, содержание билирубина в крови значительно повышено, в крови накапливаются и другие составные части желчи.
Переполнение желчных путей при закупорке больших желчных протоков: 1 — закупорка печеночного протока — пузырь в спавшемся состоянии; 2 — закупорка общего желчного протока — пузырь переполнен желчью
Диагностика и дифдиагностика Диагноз и дифференциальный диагноз основывается на клинических проявлениях, лабораторных данных, результатах инструментального (УЗИ, ФГДС) и рентгенологического обледования (табл. 3).
Желтуха у детей Повышение уровня билирубина крови у новорожденных дает клиническую картину желтухи при уровне сывороточного билирубина 14 мг% и выше. Другими критериями желтухи могут быть: — желтуха, проявившаяся в первые 24 ч жизни и продолжающаяся больше одной недели у доношенных новорожденных и дольше 2 недель — у недоношенных; — уровень общего сывороточного билирубина 13 мг% и выше у доношенных новорожденных и 15 мг% и выше — у недоношенных; величина прямого билирубина больше 1,5–2 мг%; — повышение содержания общего сывороточного билирубина на 5 мг% и больше за 24 ч.
Схема рентгеновского снимка камней желчного протока (1) и общего желчного протока (2)
Рекомендуется исследовать следующие лабораторные показатели: общий и прямой билирубин, группу крови, резус-фактор, гематокрит. Важно проанализировать данные опроса со стороны матери, исключить нарушения беременности и родов и произвести внимательный осмотр новорожденного.
Гипербилирубинемии с повышением прямого билирубина В эту группу входят в основном повышения уровня билирубина крови, сопровождающие врожденные инфекции и холестаз. Холестатическая билирубинемия связана с невозможностью выделения связанного прямого билирубина из клеток печени в двенадцатиперстную кишку. Различают 2 типа гепатобилиарной болезни: — гепатит новорожденных, или гигантоклеточный гепатит, имеющий обычно хороший прогноз; — дефекты развития печеночных путей. Весьма важно дифференцировать дефекты развития желчных путей с нарушениями ихпроходимости с целью своевременного оперативного лечения. К последним, в частности, относятся опухоли, сдавливающие желчные пути, болезнь желчной пробки и муковисцидоз (меконеальная непроходимость). Продолжительное внутривенное питание может спровоцировать холестатическую желтуху. При прекращении внутривенных вливаний желтуха проходит. Механизм ее остается неясным. Дифференциальная диагностика гепатита новорожденных и билиарной атрезии трудна, так как нельзя рассчитывать на данные лабораторных исследований. Врожденное кистозное расширение желчного протока редко встречается у новорожденных. Муковисцидоз и его ранняя форма — мекониальная непроходимость — могут привести к повышению уровня прямого билирубина. Галактоземия является ферментным заболеванием. При этом поражается печень, что выражается в резкой желтухе с повышением прямого, а отчасти непрямого билирубина. Другими симптомами заболевания являются расстройства пищеварения и отставание детей в умственном развитии. При врожденном тирозинозе и его острой форме у новорожденного поражается печень, увеличивается селезенка, на коже появляются мелкие кровоизлияния в связи со снижением количества белка, отвечающего за свертывание крови. Моча имеет специфический запах. Лечение тирозиноза заключается в прекращении кормления грудью.
Гипербилирубинемии с повышением непрямого билирубина К группе гипербилирубинемий с повышением непрямого билирубина относится, в частности, гемолитическая болезнь. Гемолитическая болезнь новорожденных делится в зависимости от фактора возникновения на иммунную и наступившую в результате приобретенных дефектов эритроцитов. Гемолитическая болезнь, обусловленная иммунными нарушениями, является наиболее частой формой гипербилирубинемии новорожденных. Она развивается при несовместимости организмов матери и плода по резус-фактору и системе АВ0 (табл. 4). Редко встречается гемолитическая болезнь при несовместимости более редких факторов крови.
Как известно, сенсибилизация при резус-несовместимости не наступает во время первой беременности. Это возможно лишь в том случае, если у первородящей были аборты или переливания резус-положительной крови. Клиническая картина при иммунных на рушениях зависит от времени проникновения антител: в очень малых количествах во время беременности или в более значительных количествах при поврежденной плаценте и во время родов. Симптоматика зависит от реактивности организма матери и связанной с ней способности к выработке антител, повреждающего воздействия антигена, зрелости печени и других органов новорожденного. Известны три классические формы гемолитической болезни новорожденных: — фетальный гидропс (водянка); — желтуха новорожденных; — анемия новорожденных. Обычно не останавливаются на отдельных формах, а указывают на желтуху и анемию как на отдельные симптомы. Непосредственно после рождения желтуха может отсутствовать в связи с тем, что билирубин внутриутробно выделился через плаценту. Однако анемия выражена различно в зависимости от того, до какой степени организм компенсирует процессы разрушения эритроцитов. Новорожденный может родиться с фетальным гидропсом, основной причиной которого, по мнению некоторых авторов, являются анемия, кислородная недостаточность, снижение количества белков в плазме крови (табл. 4). Гемолитическая болезнь при АВ0-несовместимости является также проявлением реакции антиген — антитело при группе крови матери 0, а новорожденного — АВ или ВА или матери — АВ, а ребенка — ВА, и наоборот.
Метаболические эндокринные гипербилирубинемии Более трудны в диагностике метаболические эндокринные гипербилирубинемии. Синдром Криглера-Найяра характеризуется гипербилирубинемией непрямого типа без разрушения эритроцитов. Желтуха у ребенка проявляется уже в первые дни после рождения. Транзиторная семейная неонатальная гипербилирубинемия, или синдром Люцея-Дрискола, проявляется в повышении непрямого билирубина без данных, указывающих на разрушение эритроцитов. Считают, что она возникает под воздействием высокого содержания эстрогенов в сыворотке крови матери, нарушающих нормальное связывание билирубина. Желтуха почти всегда сопутствует гипотиреоидному синдрому новорожденных. Больные имеют характерный вид, у них наблюдаются пониженное давление, грубый голос, большой живот и специфические отклонения в содержании гормонов щитовидной железы. У детей отмечается повышение уровня билирубина непрямого типа. Многие лекарственные средства, гормоны и другие вещества играют роль в появлении повышенного уровня билирубина у новорожденных детей (сульфаниламиды, витамин К).
Лечение и профилактика Профилактика и лечение гипербилирубинемии у новорожденных проводится в соответствии с диагнозом. Прогноз при нарушении билирубинового обмена у детей, сопровождающегося желтухой, зависит от основного заболевания и степени нарушения билирубинового обмена. При резком повышении содержания в крови непрямого билирубина у новорожденного выше 340 ммоль/л (более 20 мг%) и при отсутствии мер, направленных на его снижение (заменное переливание крови), возможно поражение головного мозга (билирубиновая энцефалопатия).
ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ
ОпределениеЖелчнокаменная болезнь — заболевание, связанное с нарушением обмена веществ. Оно характеризуется образованием желчных камней в печеночных желчных протоках (внутрипеченочный холелитиаз), в общем желчном протоке (холедохолитиаз) или в желчном пузыре (холецистолитиаз). Чаще камни формируются в желчном пузыре и гораздо реже в желчных протоках.Заболеваемость желчнокаменной болезнью в последнее десятилетие повысилась и продолжает возрастать. В развитых странах эта так называемая «болезнь благополучия» по частоте конкурирует с язвенной болезнью желудка и двенадцатиперстной кишки и приобретает значение социальной проблемы. По материалам вскрытий клинические проявления болезни встречаются лишь у 10 % носителей камней, преимущественно у женщин в возрасте 30–55 лет. Желчные камни образуются в любом возрасте. Однако у детей холелитиаз наблюдается крайне редко.
Этиология Желчнокаменная болезнь развивается при сочетании трех следующих факторов. I. Нарушение обмена составных частей желчи. Основные компоненты желчи — билирубин и холестерин — плохо растворимы в воде и находятся в растворе благодаря расщепляющему действию желчных кислот. Для выпадения холестерина в осадок должно нарушиться его равновесное состояние с желчными кислотами, что происходит либо при повышении концентрации холестерина (например, при ожирении, сахарном диабете, беременности), либо при понижении концентрации желчных кислот. Кроме того, женские гормоны тормозят транспорт желчных кислот, поэтому возникновению желчнокаменной болезни больше подвержены женщины детородного возраста. Реже формирование билирубиновых камней связано с массивным разрушением эритроцитов при гемолитической анемии (см.). II. Застой желчи вследствие гипомоторной (гипотонической) и гипермоторной (гипертонической) дискинезии (см.) желчевыводящих путей приводит к усилению всасывания жидкой части и увеличению концентрации солей в желчи. Застою желчи способствуют беременность (см.), запоры (см.), малоподвижность, бедная жирами пища. III. Воспаление, в результате чего образуется экссудат, основу которого составляют белок и минеральные соли (кальций). Считается, что белок как раз и является тем ядром, вокруг которого осаждаются камни. Кальций также способствует образованию билирубиновых камней.
Желчный пузырь с камнями
Роль инфекции в развитии желчнокаменной болезни до сих пор не доказана. Образование желчного камня приводит, с одной стороны, к нарушению оттока желчи, а с другой — к развитию воспалительных процессов за счет постоянного механического воздействия.
Патогенез Ни количество камней, ни их объем не имеют существенного значения в возникновении желчной колики (см.), которая может быть вызвана даже маленьким камнем в пузырном протоке или, напротив, может не развиться при наличии крупного камня. Значение имеет положение камней в желчном пузыре: камни, лежащие на дне пузыря, никогда не вызывают желчной колики; она возникает только при перемещении камня к шейке пузыря. В основе приступа желчной колики лежит внезапно возникающее растяжение желчного пузыря; в это время шейка пузыря, пузырный и общий желчные протоки не заполнены, а сам желчный пузырь увеличен в 1,5 раза. Причиной острого растяжения желчного пузыря и желчных протоков является либо спазм сфинктеров, либо закупорка пузырного протока камнем. Внезапное и сильное растяжение желчного пузыря вызывает боль, а медленное и постепенное — ощущение тяжести или давления. Во время приступа возникают двигательные расстройства в виде сильных сокращений гладкой мускулатуры желчного пузыря. Они играют основную роль в продвижении камня по направлению к пузырному или общему желчному протоку, где камень сам становится причиной повторных спазмов сфинктеров. Клинически это проявляется периодическими болями. Когда проходимость желчных путей восстанавливается, давление в желчном пузыре быстро снижается, боли исчезают. Таким образом, ведущее значение в развитии синдрома желчной колики принадлежит дискинезии (см.) желчного пузыря вследствие воспаления или каких-либо причин, повреждающих или раздражающих рецепторы. Поэтому обострение болезни возникает после сопутствующих инфекций, у женщин — перед менструацией или после нее, после обильного приема жирной пищи; тряская езда или сильное физическое напряжение также способствуют развитию обострения на фоне уже имеющейся инфекции.
Патанатомия По внешнему виду, форме и цвету камни делятся на следующие 4 группы: — преимущественно одиночные крупные — яйцевидной формы, круглые или цилиндрические; поверхность их гладкая или неровная, напоминающая малину; — маленькие множественные камни различной формы: круглые, плоские, фасеточные, иногда двояковогнутые или двояковыпуклые, с гладкой поверхностью и зернистые, иногда в виде тутовой ягоды; фасетки образуются от давления соприкасающихся поверхностей в тот период, когда консистенция камня еще мягкая; по цвету камни бывают темнобурого цвета; — камни темного, почти черного цвета, встречающиеся главным образом во внутрипеченочных желчных путях и желчном пузыре; — так называемый желчный песок, имеющий бледно-желтый цвет, представляющий собой нормальную стадию формирования камней. Большие камни весят до 50 г. По консистенции камни бывают как твердыми (холестериновые и известковые), так и легко расслаивающимися, с большим количеством органического вещества и пигмента. Желчные камни могут состоять из одного холестерина, смеси холестерина и билирубиновой извести, углекислого кальция. Большая часть камней содержит от 64 до 98 % холестерина. Изменения в желчевыводящей системе при желчнокаменной болезни обусловлены воспалением. Большое количество камней в желчном пузыре ведет к атрофии слизистой оболочки и склерозу глубжележащих слоев. Отмечены следующие изменения в мышечном слое желчного пузыря: — простая гипертрофия; — балочное строение желчного пузыря; — гипотонический желчный пузырь с атрофией мышечного слоя.
Желчные камни
К патологоанатомическим изменениям при желчнокаменной болезни относят так называемый земляничный желчный пузырь, или холестероз желчного пузыря. Слизистая желчного пузыря усеяна желто-бурыми очажками холестериновых отложений, образующихся вследствие всасывания жиров слизистой оболочкой желчного пузыря.
Клиническая картина В центре клинической картины желчнокаменной болезни как самое яркое ее проявление находится острый приступ желчной (печеночной) колики (см.), потрясающий своей внезапностью, драматичный по тяжести страданий и грозный по возможным осложнениям. Наиболее типичными для желчной колики являются боль, желтуха (см.), увеличение желчного пузыря, лихорадка и рвота. Отхождение камней ввиду непостоянства этого симптома следует отнести не к основным, а скорее к возможным проявлениям болезни. Клинические проявления желчнокаменной болезни различны в период приступа и во внеприступный период. Основной признак — приступ резких болей в правом подреберье с характерной отдачей в правую лопатку, обусловленный возникновением спазма гладкой мускулатуры желчного пузыря и желчных протоков. Печеночная колика часто сопровождается рвотой, ознобом, повышением температуры. При прощупывании печень резко болезненна, особенно в области желчного пузыря. При закупорке камнем общего желчного протока развивается механическая желтуха со всеми ее характерными проявлениями и может прощупываться растянутый желчный пузырь в виде округлой опухоли. Приступ может продолжаться несколько минут, часов или дней, оставляя после себя чувство тяжести и небольшую боль в области печени. Клинические симптомы возникают обычно при перемещении камней и мало зависят от их состава. Камни образуются обычно в области дна и тела желчного пузыря и, находясь там, являются случайной находкой. Симптомы желчнокаменной болезни и острого холецистита (см.) начинают проявляться при попадании камней в так называемую чувствительную зону. В дальнейшем особенности клинической картины зависят от пути камня: — если камень попадает вновь на дно пузыря либо выходит в кишечник, боль проходит и приступ завершается; — если камень закупоривает проток желчного пузыря, то накапливающаяся желчь вызывает раздражение и воспаление слизистой оболочки. Желчный пузырь растягивается; если не приняты соответствующие меры, то возможна его водянка, а в случае присоединения инфекции — гнойное воспаление или эмпиема (см.) желчного пузыря; — если камень вызвал закупорку общего желчного протока в области фатерова соска, у больного возникают симптомы механической желтухи (см.). Если камни продолжают образовываться, происходит постоянное раздражение стенки желчного пузыря и стойкое нарушение его двигательной функции, что поддерживает хроническое воспаление. Нередко желчнокаменная болезнь проявляется нерезко выраженными признаками хронического холецистита без приступов печеночной колики. Хронический холецистит (см.) может быть как калькулезным, так и некалькулезным. Хронический калькулезный холецистит может проявляться в фазе обострения следующими признаками: — интенсивные приступообразные боли в правом подреберье, отдающие в правую лопатку, правое плечо, шею и сопровождающиеся рвотой, горечью, сухостью во рту, кожным зудом, ознобами, повышением температуры тела; — возможно появление желтухи (не у всех больных); — напряжение и резкая болезненность в правом подреберье в проекции желчного пузыря при прощупывании; — лейкоцитоз, повышение СОЭ в общем анализе крови; — общий анализ мочи: положительная реакция на билирубин; — биохимический анализ крови; — дуоденальное зондирование: повышение удельного веса желчи и активности перекисного окисления жиров, микрокамни, песок и другие показатели; — холецистография и ультразвуковое обследование желчного пузыря выявляют камни на фоне воспалительных изменений стенки желчного пузыря.
Диагностика и дифдиагностика Желчнокаменную болезнь нужно отличать от дискинезии (см.) желчных путей, холецистита (см.) без наличия камней, острого гепатита (см.), цирроза печени (см.), рака (см.) и эхинококкоза (см.) печени, других заболеваний. Правильному диагнозу помогают обнаружение камней в желчном пузыре, повышенное содержание в крови холестерина, семейные и личные данные (желчнокаменная болезнь у ближайших родственников).
Болевые точки при заболевании желчного пузыря: 1 — точка желчного пузыря; 2 — эпигастральная зона болезненности; 3 — холедохоанкреатическая зона; 4 — плечевая зона; 5 — точки VIII, IX и XI позвонков; 6 — точка лопаточного угла; 7 — точка диафрагмального нерва
Осложнения Основные осложнения, возникающие при желчнокаменной болезни: перихолецистит, желчные свищи, перфорация желчного пузыря, холангит, билиарный цирроз печени. Перихолецистит возникает, когда воспаление в стенке пузыря, доходя до серозной оболочки, вызывает реактивные изменения со стороны брюшины и приводит к развитию спаечного процесса. Различают 2 формы перихолецистита — пластический и гнойный. Пластический встречается наиболее часто. Основными симптомами являются боль и прощупываемое в брюшной полости образование. Боль носит неопределенный характер, локализуется в правом подреберье, распространяется иногда влево и может принимать опоясывающий характер; некоторые движения, в особенности разгибание туловища и поднимание рук, очень мучительны и усиливают боль. Прощупывание также весьма болезненно. Наряду с этим при прощупывании определяется ограниченное образование, которое в некоторых случаях ощущается как мышечное напряжение. При большой выраженности спаечного процесса опухоль спускается в подвздошную область и имитирует аппендицит или увеличенную почку. Повышение температуры, расстройства пищеварения, головная боль встречаются непостоянно. Распространение спаечного процесса на прилегающие органы лучше всего распознается при рентгенологическом и ультразвуковом обследовании. Гнойный перихолецистит возникает при прободении стенки желчного пузыря. Желчные свищи являются следствием гнойного перивисцерита. Диагноз может быть поставлен на основании следующих рентгенологических признаков: — появление воздуха в желчных путях; — ненаполнение желчного пузыря; — наполнение свища барием при исследовании желудка и кишечника. Перфорация желчного пузыря, содержащего экссудат и гной, является серьезным осложнением желчнокаменной болезни. При отсутствии спаек, отграничивающих желчный пузырь, гной изливается в свободную брюшную полость и вызывает желчный перитонит (см.), отличающийся высокой смертностью. К числу других осложнений относятся холангит — катаральное или гнойное воспаление желчных протоков, развивающееся при затруднениях оттока желчи, и билиарный цирроз печени (см.), возникающий вследствие длительного застоя желчи, когда камнем закрывается просвет желчных протоков.
Лечение Лечебно-профилактические мероприятия в стадии обострения желчнокаменной бо лезни включают общий гигиенический режим, рациональное питание, предупреждение ожирения и нарушений функции желудочно-кишечного тракта, устранение застоя желчи. Возможна медикаментозная коррекция печеночно-клеточной и желчнопузырной дистонии. Рекомендуется физиологическая строго сбалансированная диета № 5 с исключением пищевых излишеств, жирной, высококалорийной и богатой холестерином пищи. Медикаментозная терапия должна быть направлена на стимуляцию образования или выработки желчных кислот, а также на подавление тех же процессов в отношении холестерина. Для этих целей назначают зиксорин по 0,3–0,4 г в сутки. Курс лечения продолжается от 3–4 до 6 недель. После курса лечения снижается уровень общего билирубина и холестерина, нормализуется спектр желчных кислот. С целью профилактики образования холестериновых камней может использоваться лиобил по 0,4–0,6 г 3 раза в день в течение 4 недель. В настоящее время накоплен опыт по использованию препаратов хенокола, хенофалька, урсофалька с целью растворения холестериновых камней в желчном пузыре. Противопоказаниями являются камни диаметром более 2 см, а также нефункционирующий желчный пузырь, желчная колика, цирроз печени, язвенная болезнь. Суточная доза хенокола и хенофалька составляет 750—1000 мг в зависимости от веса больного. Камни обычно растворяются через 12 и более месяцев. В последние годы разработан и внедрен в практику метод ударно-волновой литотрипсии, заключающийся в дроблении крупных камней диаметром до 3 см на камни меньшего диаметра. При не поддающихся удалению с помощью обычной эндоскопической техники камнях в желчном протоке применяют эндоскопическую лазеролитотрипсию. Операции по дроблению камней производят в плановом порядке. В экстренном порядке операции проводят при подозрении на перитонит. Основной операцией является удаление желчного пузыря. Она может сочетаться с удалением камней из желчных протоков и с последующим дренированием общего желчного протока. В консервативной терапии используются средства, нормализующие функцию сфинктеров желчных протоков или двенадцатиперстной кишки (нитроглицерин, дебридат, но-шпа, гепатофальк), адсорбенты желчных кислот (ремагель, фосфалюгель, холестирамин), уменьшающие воспаление слизистой оболочки (де-нол, викаир, вентер и т. д.), подавляющие активность микробной флоры, вызывающей нарушения (фуразолидон, бисептол, эритромицин). При реактивном гепатите назначают средства защиты печени (эссенциале, планта, менамид). Вопросы профилактики камнеобразования у перенесших холецистэктомию тесно связаны с проблемой ожирения. В связи с этим наряду с гипоаллергенной диетой, обеспечивающей уменьшение массы тела, для нормализации химического состава желчи рекомендуются препараты желчи (лиобил и др.), а также урсофальк и хенофальк. Спорным и нерешенным остается вопрос об использовании после удаления желчного пузыря холеретиков и холекинетиков. Прямым показанием к применению этих средств служит лишь сохраняющаяся склонность желчи к камнеобразованию, несмотря на длительное соблюдение диетического режима. Консервативное лечение желчнокаменной болезни направлено на создание условий для улучшения оттока желчи и уменьшения наклонности к камнеобразованию: рекомендуются подвижный образ жизни с ограничением продуктов, содержащих холестерин, минеральные воды и желчегонные препараты. При желчнокаменной болезни высокоэффективно санаторно-курортное лечение, которое в фазе выздоровления показано в Ессентуках, Железноводске, Пятигорске, Трускавце, Боржоми, Геленджике, Моршанске, а также санаториях местного значения. Из нетрадиционных методов лечения применяются фитотерапия, диетическое лечение с применением соков и настоев (сок моркови, настой кукурузных рылец, чай из брусники).
Профилактика Центральное место в борьбе с желчнокаменной болезнью принадлежит профилактике. Значение гигиены питания особенно велико. Самой распространенной причиной болезней, связанных с перееданием, является избыточное употребление тех или иных продуктов, их общее несоответствие физиологическим потребностям организма, что имеет особенно большое значение даже при небольших нарушениях регуляции. Незначительные погрешности, повторяющиеся изо дня в день годами, истощают приспособительные механизмы организма, и возникает постепенно или быстро прогрессирующая прибавка в весе. Отрицательно влияет также нередкое увеличение с возрастом суточной калорийности диеты. Большая роль принадлежит приему пищи в одно и то же время. Важное профилактическое значение имеет гармоническое и всестороннее физическое развитие. Люди, занимающиеся физическим трудом, меньше подвержены риску развития желчнокаменной болезни. Немалое значение имеют регулярные отправления кишечника, в первую очередь — борьба с запорами (см.). Нарушение подвижности толстой кишки прямо связано с понижением двигательной функции желчного пузыря и с кишечной аутоинфекцией, играющей большую роль в возникновении желчнокаменной болезни. К профилактике желчнокаменной болезни относится также энергичная терапия бактериальных и вирусных инфекций. В межприступном периоде профилактика сводится к предупреждению рецидивов. Решающее значение принадлежит борьбе с застоем желчи. Первое место отводится режиму и кратности питания. Калорийность рациона должна быть снижена в пределах 10–15 %, следует ограничивать прием богатых холестерином и жирных продуктов.
♦ З ♦
ЗАВОРОТ ВЕКА
ОпределениеЗаворот века (энтропион) — неправильное положение века, при котором его край с растущими ресницами частично или на всем протяжении повернут к глазному яблоку. Различают заворот века рубцовый, спастический и старческий.
Этиология и патогенез При рубцовом завороте века причинами возникновения являются трахома (см.) и другие конъюнктивальные процессы, ведущие к развитию рубцов в конъюнктиве, а также химические и термические ожоги конъюнктивы. Рубцовое укорочение конъюнктивы и искривление хряща стягивают край века и отклоняют его по направлению к глазу. Заворот века спастический возникает вследствие спастического сокращения вековой части круговой мышцы глаза. Хронические воспалительные процессы в конъюнктиве вызывают раздражение круговой мышцы глаза и ведут к ее судорожному сокращению. В результате хрящ века может повернуться вокруг своей оси по направлению к глазу. Заворот века старческий возникает в пожилом возрасте в связи с возрастными изменениями. Возрастное накопление орбитального жира и потеря эластичности кожи приводят к тому, что веко (обычно нижнее), легко заворачивается внутрь не только при судорожном, но и при простом смыкании глазной щели.
Клиническая картина Заворот века рубцовый Веко корытообразно изогнуто выпуклостью вперед. Заднее ребро края века закруглено, весь край века и его кожная поверхность повернуты к глазу, ресницы травмируют глазное яблоко, вызывая резкое раздражение. Заболевание развивается медленно, постепенно прогрессируя. Трение ресниц и утолщение края века способствуют возникновению воспалительных образований на роговице. Такое же длительное течение наблюдается при рубцовых заворотах, вызванных ожогами (см.) конъюнктивы, поскольку заворот века приводит к хроническому раздражению слизистой оболочки. Сходную картину дает трихиоз (см.) (врожденная аномалия расположения ресниц). При трахоме часто отмечаются завороты в сочетании с трихиозом (ростки ресниц направлены в разные стороны).
Заворот века спастический Край века с ресницами и кожная поверхность века повернуты к глазу и раздражают его. Отсутствие рубцов на конъюнктиве отличает эту форму от рубцового заворота, а наличие спазма — от старческого.
Заворот века старческий Край века с ресницами и кожная поверхность века повернуты к глазу и вызывают его раздражение. Течение длительное, хроническое, склонно к постоянному прогрессированию.
Лечение При рубцовом завороте лечение оперативное. Профилактика сводится к лечению основного заболевания. При спастическом завороте терапия сводится к лечению основной болезни и закладыванию дезинфицирующих мазей и капель в конъюнктивальный мешок. Упорные завороты часто ликвидируются простой перерезкой наружной спайки век. При сильном раздражении, не поддающемся лечению, проводят оперативное лечение. При случайном завороте иногда достаточно поставить веко в правильное положение и зафиксировать его в этой позиции узкими полосками липкого пластыря. В конъюнктивальный мешок необходимо вводить вяжущие средства и цинковые капли. При стойком завороте показана операция.
ЗАВОРОТ КИШОК
ОпределениеЗаворот кишок — поворот петли кишечника вокруг брыжейки с последующим омертвением части кишечника.
Этиология и патогенез В происхождении заворота большую роль играют состояние брыжейки, особенности ее прикрепления, наличие рубцовых изменений, обусловливающее сближение между собой кишечных петель и удлинение участка кишки и брыжейки вследствие застоя и растяжения, фиксация петель кишечника и брыжейки спайками. Способствующими факторами могут быть повышение внутрибрюшного давления при физическом напряжении (поднятие тяжестей), усиление перистальтики при переполнении кишечника неудобоваримой пищей в больших объемах, особенно после длительного голодания, запоры (см.). Заворот кишок является одной из частых форм непроходимости. Поворот петли происходит вокруг оси брыжейки и при ее достаточной длине. Степень перекрута различна — от 90° до одного-двух полных оборотов. Проходимость петли и ее питание нарушаются тем значительнее, чем сильнее перекручивание. Заворот встречается чаще всего в области S-образной кишки, в нижнем отделе подвздошной и в области слепой кишки при наличии у нее брыжейки. Перекручиванию могут подвергнуться отдельные петли тонкого кишечника, значительные его участки и даже весь тонкий кишечник.
Клиническая картина Заворот тонких кишок дает наиболее бурные и тяжелые симптомы. Внезапно появляются сильные боли в области пупка, в верхней части живота или боли неопределенной локализации, отмечается задержка газов и испражнений, иногда после освобождения нижних частей кишечника наблюдаются рвота, вздутие живота, расстройства в виде симптома Валя (при изолированной петле или в виде нескольких поперечных или косо идущих валов), шум плеска, бледность, ослабление или учащение пульса, падение кровяного давления и др. Симптоматика выражена тем резче, чем выше заворот и чем больше перекручен отрезок кишечника. При завороте сигмовидной кишки заболеванию предшествуют хронические запоры (см.) и приступы болей (неполные завороты), которые повторяются иногда неоднократно. Начало заболевания бурное: резкие боли в животе, полное прекращение отхождения газов, отсутствие стула, быстрое нарастание асимметричного вздутия живота, чувство напряжения в животе и затруднение дыхания; появляющаяся вначале рефлекторная рвота прекращается до развития перитонита (см.). Общие явления (падение кровяного давления, ослабление пульса) вначале могут быть выражены нерезко; относительно хорошее самочувствие может сохраняться довольно длительное время. При клизмовании удается ввести 1–2 стакана жидкости, которая быстро выводится — совершенно не окрашенной и без газов. При завороте слепой кишки начало заболевания такое же, как и при других локализациях заворотов. Характерен резко выраженный симптом Валя в виде определяемой через кожные покровы вздутой кишечной петли, чаще в левой половине живота при пустой правой подвздошной кишке, иногда петля располагается справа.
Частичный заворот тонкой кишки
Заворот сигмовидной кишки
При высоких заворотах тонкого кишечника и при обширных заворотах больные иногда погибают при развитии картины шока (см.) в течение первых суток, при развитии картины перитонита (см.) — через несколько дней. Диагноз ставится на основании данных характерного течения болезни, рентгенологического и ультразвукового исследования.
Лечение и профилактика Срочная операция. При завороте сигмовидной кишки иногда помогают сифонные и высокие клизмы. При безрезультатности клизм показано оперативное вмешательство. Профилактика сводится к устранению факторов, повышающих внутрибрюшное давление при физическом напряжении.
ЗАЕДА
ОпределениеЗаеда — заболевание слизистой оболочки и кожи углов рта.
Этиология и патогенез Вызывается стрептококками или дрожжеподобными грибками. Стрептококковая форма встречается чаще у детей, дрожжевая — у взрослых, особенно у женщин после 45 лет. Заболевание может передаваться через посуду, игрушки, при поцелуях. В число предрасполагающих факторов входят заболевания желудочно-кишечного тракта, зубные протезы, недостаточность в организме витамина В2, заболевания десен, частое употребление кислой и острой пищи.
Клиническая картина Стрептококковая заеда характеризуется появлением в углу рта покраснения и быстро вскрывающегося поверхностного пузыря с образованием трещин. Заеда может приобрести длительное течение, особенно выраженное при недостатке витамина В2. При дрожжевой заеде в углу рта образуется эрозия с разрушением эпидермиса и беловатым творожистым налетом. Дифференцировать заболевание необходимо с сифилитическими поражениями.
Лечение и профилактика Необходимо лечение заболеваний желудочно-кишечного тракта, гингивита (см.), пиореи (см.). Назначается диета с высоким содержанием витаминов комплекса В. Витаминотерапия: комплекс витаминов группы В с преобладанием рибофлавина по 0,01 г 3 раза в день в течение 3–4 недель, смазывание очагов поражения 1 %-ным раствором генцианвиолета или метиленовой сини, эритромициновой мазью, оксикортом. Прогноз благоприятный. Профилактика заключается в соблюдении правил личной гигиены и витаминизированном питании (витамины группы В).
ЗАИКАНИЕ
ОпределениеЗаикание — расстройство темпа и ритма речи, проявляющееся ее прерывистыми и непреднамеренными паузами, судорожными движениями мышц, участвующих в речевом акте, дополнительными движениями мышц лица, шеи и конечностей.
Этиология Заикание обусловлено расстройствами высшей нервной деятельности, регулирующими функции речевых механизмов. Заикание — симптом заболеваний различного происхождения с характерными нарушениями и клиническими проявлениями. Оно всегда соседствует с другими нервно-психическими расстройствами. Заикание может возникать при психической травме (одномоментной или длительно действующей), при инфекционных заболеваниях. Обычно заикание формируется в период интенсивного развития речи, наиболее часто — в возрасте 3–5 лет, когда ребенок начинает говорить фразами, чаще у мальчиков. Возможны рецидивы в критические периоды развития (6–7 лет и период созревания).
Патогенез Различают заикание невротическое, неврозоподобное и смешанное. Причины и механизмы их развития различны. Невротическое заикание усиливается в обстановке эмоционального напряжения, рано появляются дополнительные движения в мышцах лица, шеи и конечностей, обычно оно сочетается с другими невротическими расстройствами (страхами, нарушениями сна, ночным недержанием мочи) (табл. 5). Неврозоподобное заикание может носить наследственный характер. В этих случаях у одних детей заикание прекращается или уменьшается к 10–12 годам, у других в той или иной степени сохраняется всю жизнь (табл. 6).
Независимо от того, что вызвало неврозоподобное заикание (наследственность, органические причины или их сочетание), внешне оно выглядит одинаково. Речь монотонна, однообразна, не зависит от ситуации, больные не стараются бороться с имеющимся дефектом. Если пациента заставляют следить за своей речью, фиксируют его внимание на речевом дефекте, то заикание уменьшается; по этим параметрам неврозоподобное заикание отличается от невротического (табл. 5).
Невротическое заикание — это психогенное заболевание с преимущественным поражением речевой функции. Различают три критерия психогенных расстройств: — расстройство, вызванное психической травмой; — содержание психической травмы отражается на картине заболевания; — ликвидация психогенного расстройства по мере удлинения периода после психической травмы. На фоне невротических расстройств (пониженное настроение, чувство неполноценности, тревожное ожидание чего-то неприятного, медленное засыпание, частое просыпание, сниженный аппетит) развиваются признаки нарушения речи, среди которых встречаются, в частности, логофобия — навязчивый страх речи. Она заключается в том, что после психической травмы возникает напряженное ожидание невозможности произнесения звука, слова, фразы, предложения. Ожидание своей несостоятельности приводит к выраженному страху речи, при котором у больного как бы парализуется механизм звукопроизнесения. Логофобия всегда непостоянна. Выраженность логофобии бывает столь заметной, что пациент вообще не способен что-либо сказать. Подобный симптом очень непостоянен. Логофобия как один из главнейших и распространеннейших механизмов развития приводит к невротическому заиканию. Невротическое заикание обнаруживается в психотравмирующей ситуации. При фиксации внимания пациента на своем речевом дефекте оно усиливается, а при отвлечении внимания нарушение плавности речи резко уменьшается или вообще проходит (табл. 7, 8).
Заикание, обусловленное логофобией, обычно сочетается с невротическими тиками и невротическими кинезиями (сопутствующими движениями), которые имеют то же течение, что и все расстройства, вытекающие из логофобии. Помимо логофобического варианта невроза (см.), можно выделить истерический механизм, при котором вследствие психической травмы шокового характера парализуются центральные механизмы речи. Больной не испытывает страха речи, он просто не может говорить, потому что у него полностью отключилась речь. Возникает истерический мутизм (см.), как правило, полный, больной молчит в любой обстановке. После исчезновения истерического мутизма нередко наступает истерическое заикание, при котором страх речи не выражен. Данные параклинических обследований при различных видах заикания выявляют ряд отличий. При неврозоподобном заикании на рентгенограмме выявляется субкомпенсированная гидроцефалия (см.), на электроэнцефалограмме преобладают органические изменения, нередко с повышенной судорожной готовностью. При невротическом заикании обследование не выявляет особых отклонений. Прогноз заикания в различных возрастных группах различен, однако у ряда больных оно полностью исчезает.
Лечение Лечение необходимо начинать как можно раньше. Оно должно быть комплексным и включать медикаментозное лечение, психотерапию и посещение специальных логопедических занятий. Медицинская реабилитация предусматривает правильную диагностику формы заикания и сопутствующих расстройств, а также анализ факторов, провоцирующих и поддерживающих заикание. Проведение общеоздоровительного лечения (общеукрепляющие средства, удаление хронических очагов воспаления), сочетающееся с энергичной терапией проявлений мозговой недостаточности (патогенетическая, дегидратационная, противосудорожная, стимулирующая), уменьшает судорожную готовность речевых органов. Лечение невротических наслоений проводится с учетом их конкретных проявлений (снижение речевой активности, избирательный речевой контакт, снижение общественной активности, логофобия и т. д.). Помимо медикаментозных средств, лечебной физкультуры, физиотерапии, музыкальных занятий, трудотерапии, применяются различные виды психотерапии, стимулирующие пациентов к постепенному преодолению своих речевых и психологических трудностей. Кроме того, проводится логопедическая коррекция путем формирования техники речи. Работа над различными отделами речевого аппарата проводится одновременно по трем основным признакам (дыхание, голос, дикция) в соответствии со специально разработанными комплексными упражнениями.
ЗАПОРЫ
ОпределениеПод истинным запором подразумевается расстройство кишечной подвижности, при котором дефекация происходит нерегулярно, более чем через 48 ч, с чувством неполного опорожнения кишечника и отхождением малого количества кала повышенной твердости.Выделяют несколько признаков истинного запора: — полное отсутствие стула; — неоднократное опорожнение кишечника в течение суток, но небольшими порциями (фрагментарный стул); — ежедневный стул без чувства облегчения и освобождения кишечника; — неприятные ощущения во время и после дефекации; — повторное выделение газов, слизи или крови без каловых масс, принимаемое больными за признаки поноса, а на самом деле являющееся одной из форм запора (ложный, или запорный, понос).
Этиология В происхождении запора играют роль причины, нарушающие двигательную функцию толстых кишок, — аномалия длины и просвета отдельных петель кишечника, ненормальная подвижность толстых кишок. Наряду с ними наиболее важными факторами являются пищевые, корковые и рефлекторные нервные влияния, расстраивающие акт дефекации, систематическое подавление рефлекса на дефекацию, длительное применение слабительных средств, эндокринные и токсические влияния, слабость нервно-мышечного аппарата, воспалительные процессы в толстом кишечнике. Различают факторы общие и частные, что позволяет выделить несколько форм запоров в зависимости от причины возникновения. Однако в большинстве случаев запор зависит не от одной, а от нескольких причин. Почти всегда удается увидеть преобладающий или первичный фактор, приведший к развитию запора. Это пищевые, неврогенные, воспалительные, механические, токсические, врожденные, эндокринные и другие факторы. Запоры классифицируются в зависимости от фактора, способствующего их возникновению. Простой алиментарный (пищевой) запор встречается наиболее часто, так как на его возникновение может повлиять множество факторов, связанных с режимом питания и составом пищи. К ним относятся неправильный режим питания и нарушения ритма продвижения содержимого кишечника, посколькувсякий прием пищи вызывает рефлекс, способствующий продвижению каловых масс. Перебой в часах приема пищи вызывает рефлекс, влияющий на ритмичность кишечной моторики. Столь же вредное влияние оказывает нерациональный состав пищи: недостаток растительных шлаков, обеспечивающих нужный объем каловых масс (черный хлеб, овощи, зелень), или, наоборот, избыток продуктов, замедляющих моторику (рис, белый хлеб), наличие продуктов, оказывающих вяжущее действие (крепкий горячий чай, какао, картофельная мука). Запору также способствует еда всухомятку. Запоры, связанные с синдромом раздраженной кишки. Кал этих больных по виду напоминает овечий. Он твердый, имеет форму шариков небольшого размера; в некоторых случаях запор сменяется кишечной непроходимостью под влиянием усиленных перистальтических сокращений суженного отрезка кишки после резкого натуживания брюшного пресса или приема слабительного. Рефлекторный запор сопровождает различные заболевания, главным образом органов брюшной полости: язвенную болезнь (см.), хронический холецистит (см.), аппендицит (см.), пиелонефрит (см.), болезни малого таза у женщин. Типичным для рефлекторного механизма развития является его усиление в фазе обострения основного заболевания. Гиподинамический запор встречается у больных, длительно соблюдающих постельный режим. Он часто наблюдается у пожилых людей, когда отмечаются недостаточная физическая активность и слабость мускулатуры. Воспалительные запоры чаще возникают на почве колита (см.). В этой группе причина и следствие взаимообусловлены, запор обычно поддерживает или усиливает явления колита. Воспалительный запор возникает при ряде инфекционных заболеваний (пневмония (см.), грипп (см.), туберкулез (см.) кишечника и др.). Эндокринный запор возникает при гипотиреозе (см.), микседеме, аддисоновой болезни (см.), недостаточности гипофиза, паращитовидных, половых желез и коры надпочечников; эндокринные запоры у женщин развиваются в период беременности (см.) и в менопаузе. Главную роль в развитии запоров у беременных играют производные прогестерона, выработка которых усиливается с началом беременности. В поздние сроки играют роль недостаточная физическая активность беременной и сдавление сигмовидной кишки увеличенной маткой. Неврогенный запор возникает при сочетании атонии и спазма. Его причиной служат функциональные и органические изменения, сопровождающиеся выделением кашицеобразного кала, содержащего много слизи. В некоторых случаях у больного возникает 2–3 дефекации в сутки. В начале дефекации выделяется шарик твердого кала, за которым следует небольшое количество слизи. Запоры постоянно сочетаются с болью в животе слева или в околожелудочной области. Боль в животе обычно резко усиливается сразу же после еды. После дефекации или при отхождении газов она уменьшается или даже исчезает. Синдром раздраженной кишки диагностируется обычно в возрасте 20–30 лет. Обострения наступают в стрессовой ситуации. Запоры при врожденных нарушениях развития толстой кишки связаны с расширением толстой кишки, сопровождающимся ее удлинением. При болезни Гиршпрунга у больных отсутствуют первичные нервные узлы в прямой кишке и имеются нарушения сфинктера. Идиопатический мегаколон (см.) встречается в любом возрасте. Детский мегаколон начинается на первом году жизни, когда запоры сочетаются с нарушением поведения, а болезнь осложняется недержанием кала. Взрослый идиопатический мегаколон характеризуется появлением запоров в среднем или пожилом возрасте и расширением всей ободочной кишки. Ампула прямой кишки при этом всегда туго заполнена калом. Механический запор вызывается препятствием на пути кишечного пассажа в виде воспалительных спаек, опухолей, пакетов лимфатических узлов или одной из форм кишечной непроходимости (внедрение, заворот, перегибы). Само препятствие может быть невелико и не закрывать целиком просвета кишки, но часто осложняется рефлекторным спазмом, временно закрывающим ее просвет. Неврологические расстройства (невриты (см.), миозиты (см.), прогрессивный паралич (см.), энцефалит (см.), арахноидит (см.), паркинсонизм, вегетативные неврозы, общие психоневрозы и независимые неврозы кишечника) также играют существенную роль в развитии запоров. В этих случаях нарушаются механизмы регуляции акта дефекации: подавление физиологического позыва вследствие бытовых условий (спешка, очередь в туалет), недостаточность гигиенических навыков, неумение приурочить акт дефекации к определенному часу дня, психическое перенапряжение, конфликтные ситуации, органические заболевания нервной системы. Медикаментозный запор развивается при систематическом применении лекарств (гипотензивные средства, атропин, успокаивающие средства и транквилизаторы). Запор умеренной тяжести возникает у больных, регулярно применяющих мочегонные средства, антациды, препараты железа. При отмене препаратов запор прекращается. Запор вследствие нарушения водно-электролитного обмена возникает в результате потери организмом жидкости при асците (см.), сердечной и почечной недостаточности, дефиците калия, холестазе.
Патогенез Механизм развития запоров сводится к понижению сократительной способности кишечной мускулатуры, уменьшению чувствительности стенки кишечника, нарушению нервно-мышечной регуляции или, наоборот, к повышению сократительной способности кишечной мускулатуры вплоть до развития спазмов, что приводит к возникновению сопротивления продвижению кишечного содержимого (при спастическом запоре кал имеет овечий или лентовидный характер). Основная функция толстой кишки заключается в превращении жидкого содержимого подвздошной кишки в плотные каловые массы. Нормальная функция толстой кишки обеспечивается всасыванием жидкости и перистальтическими сокращениями, обеспечивающими перемешивание кишечного содержимого, продвижением каловых масс к прямой кишке; процесс заканчивается актом дефекации. Механизм дефекации складывается из трех компонентов: — непроизвольное сокращение гладких мышц прямой и сигмовидной кишки с расслаблением ануса; — произвольное спиральное продвижение содержимого кишки из сигмы в ампулу прямой кишки; — полупроизвольное сокращение мышцы, поднимающее задний проход, одновременно с расслаблением анальных сфинктеров. Нарушение слаженной работы этих механизмов вызывает расстройства акта дефекации.
Клиническая картина Несмотря на разнообразие форм происхождения, клиническая картина запора практически одинакова. Задержка дефекации вызывает ряд симптомов расстройства пищеварения: чувство расширения и полноты в животе, переходящее в тупую боль, отрыжку воздухом, скопление газов, пустые позывы на стул, иногда позывы сопровождаются частичным отхождением скудного плотного кала без чувства полного облегчения. Если в первые дни эти симптомы удается снять приемом слабительного или клизмой, то в дальнейшем такие мероприятия уже не достигают цели; задержка кала продолжает прогрессировать, становится постоянной и мучительной, достигая нескольких суток и даже недель. Общая реакция организма на запор бывает различной. Некоторые больные переносят запор легко и без всяких жалоб. Другие, наоборот, реагируют болезненно: задержка у них дефекации сверх привычного срока вызывает головную боль, дурноту, головокружение, познабливание, разбитость, усталость, потерю работоспособности, бессонницу. Все эти явления связаны с развитием спазмов. Объективно у больных, страдающих запором, наблюдаются бледность кожи, сухой обложенный язык, вздутие либо втяжение живота при легком его напряжении, петли толстого кишечника справа чаще расширены, в слепой кишке отмечается плеск, левосторонние петли спастичны, иногда в виде тонкого шнура или четок, но болезненность при прощупывании наблюдается только при запоре, осложненном колитом (см.), а не в начальной стадии болезни. При более длительном (многодневном) отсутствии стула могут наблюдаться волны кишечной перистальтики или антиперистальтики (при относительной непроходимости) и кишечные колики (см.) с усилением образования и неполным отхождением газов (газовая колика) или полное прекращение перистальтики. Особенности клинического течения запоров связаны с различной локализацией застоя кишечного содержимого (тифлоколит, проктосигмоидит, долихосигма).
Осложнения Самым частым осложнением является так называемый запорный колит как результат механического раздражения кишечной стенки каловыми массами, реактивным воспалением, инфекцией. Присоединившийся колит является дополнительным источником раздражения кишечника; оба состояния взаимно отягощают друг друга. Колит накладывает отпечаток и на клиническую картину, когда запор сменяется компенсаторным поносом. Воспаленные петли кишечника становятся болезненными, стенки их утолщаются и уплотняются, вовлекаются в воспалительный процесс все его слои вплоть до серозного, что приводит к воспалительным сращениям и перегибам. В наиболее узких участках, например в области печеночного, селезеночного и сигмовидного перегибов, может развиться непроходимость. Особенно опасен в этом отношении селезеночный угол, где может возникнуть непроходимость в результате спазмов и механических препятствий. Особое значение имеют вторичные проктосигмоидиты и их последствия в виде геморроя (см.) и трещин с образованием эрозий и язвочек на слизистой оболочке. Следует считаться с возможностью развития общей болезненной реакции организма (изменения психики, ипохондрическое состояние, появление бессонницы и мигреней). Больные становятся мнительными, у них развиваются различные фобии (страхи), так как они приписывают свое состояние вредному влиянию той или иной пищи и даже питьевой воды, суживая круг принимаемой пищи и лишая свой кишечник необходимых стимуляторов, отчего, разумеется, еще больше нарушается кишечная моторика и усиливаются запоры. Хотя при запоре все двигательные расстройства ограничены толстым кишечником, а процессы всасывания и усвоения пищи в тонком кишечнике не нарушаются, в толстой кишке происходят нарушения, влияющие на флору, всасывание воды, бактериальное переваривание клетчатки и крахмала, некоторых витаминов и минеральных веществ. В результате страдают общее питание и витаминный обмен, процессы кроветворения, состояние нервной системы.
Диагностика Диагностика запора не представляет трудностей. На основании расспроса больного сравнительно легко установить характер кишечных расстройств, степень замедленного ритма дефекации, наличие недостаточного опорожнения кишечника, не дающее чувства облегчения и освобождения, отсутствие позывов на стул или мучительные ложные позывы (при отсутствии кала в прямой кишке) на почве раздражения кишечной стенки воспалительными процессами. Важно выяснить, не имеется ли чередования запоров с поносами, выделения слизи или крови, что указывает на присоединившийся колит. Узловым вопросом диагностики является уточнение характера кишечных расстройств (наличие истинного запора, недостаточно регулярной и обильной дефекации или же запорного поноса с учащенными позывами, но без достаточного эффекта). Специального изучения требует диетический анамнез. Важны сведения о перенесенных заболеваниях, времени начала запоров, возрасте больного. Для подтверждения диагноза применяются рентгенологические и эндоскопические методы исследования, ультразвуковое исследование, при необходимости — компьютерная томография; лабораторные исследования; обследование на дисбактериоз; анализ крови.
Лечение Важным моментом в лечении запоров является диетотерапия. Назначаемая при запорах диета должна быть физиологически полноценной, с нормальным содержанием белков, жиров, углеводов, поваренной соли и других минеральных веществ, повышенным содержанием механических и химических стимуляторов моторной функции кишечника, с исключением продуктов и блюд, усиливающих процессы брожения и гниения в кишечнике. Пища должна даваться в неизмельченном виде, приготовленной на пару или отваренной в воде; овощи и фрукты лучше назначать в сыром и вареном виде. Продукты должны быть натуральными. Кроме свежих овощей и фруктов, богаты растительными волокнами хлеб из муки грубого помола, крупы, макаронные изделия, неочищенный рис, бобовые и овес. В зависимости от вида моторных расстройств рекомендуются различные диеты. При гипомоторной дискинезии (см.) толстой кишки в первую очередь используются продукты, богатые растительной клетчаткой (морковь, свекла, кабачки, тыква, капуста, помидоры, листовой салат на гарниры). Исключаются овощи, богатые эфирными маслами: репа, редька, лук, чеснок, редис, грибы. Рекомендуется хлеб из ржаной и пшеничной муки грубого помола, диетические сорта хлеба с добавлением отрубей, каши из пшеничной, гречневой, перловой, овсяной круп, сваренные на воде с добавлением молока. Супы готовят на некрепком обезжиренном мясном или рыбном бульоне, овощном наваре. Мясо и рыба нежирных сортов в отваренном виде или на пару, яйца всмятку и в виде паровых омлетов. Стимулируют моторику кишечника также органические кислоты и сахара, содержащиеся во фруктах и ягодах (рекомендуются соки, а также инжир, финики, чернослив, курага, бананы, некислые яблоки). Рекомендуются молочнокислые продукты (свежий кефир, простокваша, ацидофилин). Рекомендуется во время завтрака добавить 1 ст. л. отрубей грубого помола. К послабляющим продуктам относятся растительные масла и специальные смеси (овсяные хлопья с молоком или сливками). Исключаются хлеб из муки высших сортов, сдобное тесто, жирные сорта мяса, копчености, консервированные и острые блюда, шоколад, кофе, крепкий чай. Ограничивается потребление рисовой и манной каши, вермишели, картофеля. Не рекомендуются продукты, вызывающие повышенное газообразование (бобовые, капуста, щавель, шпинат, яблочные и виноградные соки). При запорах, обусловленных спазмами толстой кишки, и при запорах прямой кишки лечение начинают с применения бесшлаковой диеты с примесью растительных масел с постепенной добавкой в рацион овощей в отварном виде, а также сырых (включая соки). Можно использовать пшеничные отруби по 1 ст. л., далее по показаниям постепенно увеличивают дозу до 2–4 ст. л. в день. Страдающим запорами необходимо выработать привычку освобождать кишечник в определенное время дня. В этих случаях рекомендуется выпивать по утрам натощак стакан холодной воды или фруктового сока, которые активизируют перистальтику. Через 30 мин следует с помощью определенных приемов (соответствующие позы, массаж живота, ритмичное втягивание заднего прохода, надавливание на область между копчиком и задним проходом) попытаться вызвать дефекацию. При неэффективности этих мер целесообразно ввести ректально глицериновую свечу. Показаны минеральные воды (ессентуки, джермук и др.). Медикаментозная терапия при запорах, обусловленных моторной дискинезией, включает препараты, усиливающие перистальтику кишечника: — реглан или церукал по 10 мг 3 раза в день за 40 мин до еды; — мотилиум по 10 мг 3 раза в день за 40 мин до еды; — цизаприн или препульсид по 20 мг 2 раза в день; — депрадат по 1 таблетке 3 раза в день; — координакс по 1 таблетке 3 раза в день. Можно использовать аллохол, ферментные препараты (панзинорм, фестал, энгистал), лиобил в течение 10–14 дней. Курс лечения — 2–4 недели с перерывами в сочетании с координаксом или депрадатом. При неэффективности этих препаратов назначают хлорид калия по 0,5 г 3 раза в день в течение 5–7 дней в сочетании и с инъекциями витамина В1. Если перечисленные препараты не дают эффекта, назначаются слабительные, которые по механизму действия делятся на 3 группы: — препараты, раздражающие нервно-мышечный аппарат кишечника и усиливающие перистальтику (сенна, глаксена, сенамур, кафиол, регулакс, кора крушины, нормакол, ревень, касторовое масло, гутталакс), которые действуют на уровне толстой кишки; антихолинэстеразные препараты (прозерин внутримышечно 2 раза в неделю); — препараты, увеличивающие объем и изменяющие консистенцию кала, повышающие осмотическое давление в толстой кишке (солевые слабительные, многоатомные спирты — сорбит, ксилит или препараты, разбухающие в кишке, — агар-агар, льняное семя, морская капуста и др.); — средства, смягчающие консистенцию кала и улучшающие скольжение его по кишечнику (вазелиновое масло с добавками). Длительный прием слабительных средств ведет к привыканию к ним, развитию синдрома мальабсорбции, дисбактериоза (см.), нарушению кислотно-щелочного состава крови. В комплексную терапию спастических запоров включают спазмолитики, желчегонные средства, свечи со спазмолитиками, масляные микроклизмы. При некоторых запорах назначают газообразные свечи, свечи с бисакодилом, гутталакс. Противовоспалительная терапия может включать сульфасалазан, препараты висмута, местно назначают кишечные орошения с отваром ромашки, чередуя их с микроклизмами 1 %-ного колларгола, переходя затем на масляные микроклизмы. Любые физические упражнения сокращают время прохождения пищи по кишечнику. При занятиях физическими упражнениями могут на 56 % ускориться процессы усвоения пищи, так как сокращения мышц живота во время поднятия тяжестей способствуют более быстрому проталкиванию отработанных продуктов кишечника. Кроме того, физические упражнения улучшают кровоток в сосудах кишечника, что положительно влияет на перистальтику. Санаторно-курортное лечение обеспечивает смену обстановки, климато-двигательную терапию, меньшее значение имеет бальнеотерапия. Больным с нейрогенными и привычными запорами показано климатическое лечение в домах отдыха, а при воспалительных формах — на курортах Железноводска, Пятигорска, Боржоми, Ессентуков и др. Кроме питьевого применения минеральных вод, широко используются ректальные процедуры, способствующие ликвидации воспалительного процесса в слизистой оболочке кишечника за счет механического удаления слизи, гноя и нормализации микрофлоры. Из нетрадиционных методов лечения применяют дыхательные упражнения, очистительные упражнения по системе йогов, фитотерапию и другие методы.
Профилактика В большинстве случаев запор становится хроническим из-за несвоевременного и недостаточно энергичного лечения. Профилактика заключается в соблюдении общегигиенического режима с регулярным приемом пищи, достаточным по объему и разнообразию, непременном моционе, физкультурных занятиях и т. д. В число гигиенических навыков должен обязательно входить туалет заднего прохода после дефекации.
ЗОБ ДИФФУЗНЫЙ ТОКСИЧЕСКИЙ
ОпределениеЗоб диффузный токсический (базедова болезнь) — заболевание, характеризующееся диффузным (распространенным) увеличением щитовидной железы и стойкой избыточной выработкой ее гормонов, вызывающее нарушение всех видов обмена веществ и энергии, а также функций различных органов и систем.
Этиология В возникновении болезни важную роль играют нервно-психические факторы, органическое поражение нервной системы, инфекции, функциональное состояние половых желез. Диффузный токсический зоб является следствием ускоренного синтеза гормонов щитовидной железы с увеличением их концентрации в сыворотке крови. При диффузном токсическом зобе обнаруживают нарушение иммунных процессов, в частности находят антитела к белкам щитовидной железы. Большое значение в развитии болезни придают обнаружению длительно действующего стимулятора, который является иммунным белком и образуется в вилочковой железе и лимфоцитах больного. Параллельно с ним наблюдается также повышенная продукция тиреоидного гормона гипофизом под влиянием повышенной активности гипоталамуса. Избыточная продукция тиреотропного гормона приводит к повышенному выбросу в кровь активных форм тиреоидных гормонов — тироксина и особенно трийодтиронина.
Патогенез При диффузном токсическом зобе образуется дефект в системе иммунного гомеостаза. Активность лимфоцитов снижена, что способствует накоплению патологических клонов лимфоцитов, которые взаимодействуют с органоспецифическими антигенами щитовидной железы. Кроме этого, в процессе участвуют и В-лимфоциты, которые продуцируют тиреостимулирующие иммуноглобулины. Они взаимодействуют с рецепторами на мембранах тиреоидных клеток. Это приводит к повышению функции щитовидной железы и появлению гиперфункции, гиперплазии и гипертрофии железы. Высокий уровень гормонов щитовидной железы вызывает усиление реакции распада: повышенный распад белка с повышением уровня остаточного азота в сыворотке крови, выход креатина в кровь. Повышенная выработка гормонов щитовидной железы приводит к повышению окислительных процессов и повышению основного обмена; результатом этих нарушений является увеличение затрат энергии, ведущее к похудению, возникновению чувства жара, усиленному мочевыделению, обезвоживанию, развитию миокардиодистрофии (см.). Последняя поддерживается высокой активностью катехоламинов, что приводит к тахикардии (см.), повышению систолического артериального давления, усилению тонов сердца. Высокая тиреоидная и катехоламиновая активность приводит к вегетососудистой дистонии (см.), проявляющейся потливостью и незначительным повышением температуры. Потеря белка и воды приводит к появлению мышечной слабости, дрожанию пальцев вытянутых рук, век, языка или всего туловища. Могут отмечаться жажда, резкое похудение. Повышенная продукция гормонов щитовидной железы усиливает окисление жиров, тормозит переход глюкозы в жир, что ведет к снижению уровня холестерина и увеличению содержания сахара в крови. Гипергликемия (см.) может быть обусловлена усилением всасывания сахара в кишечнике, распадом гликогена в печени и мышцах, повышенным образованием глюкозы из белка. Таким образом, повышенная продукция гормонов щитовидной железы влияет на все виды обмена веществ и вызывает ее гиперплазию (увеличение), что и определяет многообразие клинических проявлений диффузного токсического зоба.
Патанатомия Изменения щитовидной железы при токсическом зобе крайне характерны. Железа (гораздо реже — неравномерно, узлами) увеличена (иногда значительно), плотной консистенции, полнокровна. При сильном увеличении щитовидной железы могут наблюдаться признаки сдавления соседних органов. Микроскопическое исследование обнаруживает, что клетки железы не круглой формы, как обычно, а имеют неправильные очертания. Они часто имеют звездообразный просвет вследствие того, что эпителиальный покров образует выступающие сосочки. Крайне типично то, что слизистая оболочка щитовидной железы приобретает вид высоких цилиндрических клеток. Иногда наблюдается неодинаковый вид клеток и их ядер, расположение их в несколько слоев, образование многослойных «подушек». В большинстве случаев имеется переразвитие лимфатических узлов и лимфатических клеток, сильно увеличиваются лимфатические узлы шеи. Иногда отмечаются малые размеры надпочечников. Сердце увеличено за счет утолщения стенки левого желудочка, в начале заболевания в нем находят очаги омертвевших клеток, а также лимфоидные образования или явления серозного миокардита (см.), в далеко зашедших случаях — очаговые мелкие рубцы и диффузный миофиброз (тиреотоксический миокардит). В печени в начале заболевания находят серозный гепатит (см.) и цирроз (см.). Иногда наблюдаются изменения нервных клеток межуточного мозга (так называемый тиреотоксический энцефалит (см.). Нередко отмечается атрофия мускулатуры тела с последовательным развитием в ней жировой ткани. Смерть при тиреотоксикозе иногда наступает внезапно при явлениях комы. Иногда такая кома развивается во время удаления зоба или вскоре после него, что объясняется повышенной чувствительностью больных к операционной травме.
Клиническая картина Клиническая картина характеризуется явлениями тиреотоксикоза с синдромом поражения нервной и сердечно-сосудистой систем, желудочно-кишечного тракта, глазными симптомами и увеличением щитовидной железы. По закону обратной связи при тиреотоксикозе угнетается функция желез внутренней секреции. Поражение нервной системы проявляется повышенной возбудимостью, раздражительностью, беспокойством, неустойчивым настроением, плаксивостью, жалобами на плохой сон и быструю утомляемость. Наблюдаются нарушения нервной системы: потливость, чувство жара, легкое повышение температуры тела, дрожание пальцев рук и век. У части больных выявляются хореоподобные гиперкинезы (см.), нарушения координации, быстрый и стойкий красный дермографизм. Иногда отмечается общее дрожание (симптом телеграфного столба). Сердечно-сосудистые нарушения часто сопровождаются жалобами на приступы сердцебиения, появление одышки, ощущение пульсации в голове, конечностях, подложечной области. Тахикардия (см.) является постоянным и ранним признаком заболевания. При тиреотоксикозе она сохраняется во сне, что является важным диагностическим критерием; могут регистрироваться беспорядочные сокращения. Тоны сердца обычно усилены, характерно повышение систолического и снижение диастолического давления. Пульс становится высоким и быстрым. При длительном течении болезни и поздно начатом лечении появляется расширение границ и ослабление тонов сердца, формируются признаки относительной недостаточности митрального клапана. На электрокардиограмме регистрируется высокая частота сердечных сокращений, определяется изменение внутрипредсердной и внутрижелудочковой проводимости, выявляются признаки значительного нарушения окислительно-восстановительного процесса в миокарде. Желудочно-кишечные расстройства проявляются повышением аппетита, появлением жажды, нарушением функций кишечника, увеличением печени, спазмом сфинктера двенадцатиперстной кишки. Тиреотоксикоз приводит к резкому похудению. Специфическими симптомами являются изменения со стороны глаз. При взгляде вниз с открытыми глазами, над зрачками появляются белая полоска, глаза блестят, широко распахнуты (симптом Дальримпля), мигание редкое, глазное яблоко выглядит выпяченным и увеличенным. Глазная симптоматика проявляется экзофтальмом (обычно двусторонним) с широким раскрытием глазных щелей, что придает лицу испуганно-гневное выражение. Среди других глазных симптомов отмечаются усиление пигментации век, их отечность и дрожание, повышенный блеск глаз, редкое мигание, а также нарушение тонуса мышц глаза, что обусловливает симптом Грефе — отставание верхнего века от движения глазного яблока при переводе взора вниз. Увеличение щитовидной железы является обязательным симптомом диффузного токсического зоба. Однако степень увеличения щитовидной железы не определяет степени тяжести тиреотоксикоза. Тиреотоксикоз классифицируется по степени увеличения щитовидной железы: I степени соответствует отсутствие видимого увеличения, но при этом прощупывается перешеек щитовидной железы; при II степени железа видна при глотании; при III степени железа хорошо заметна и занимает область шеи между грудино-ключичными мышцами. При IV степени железа значительно увеличена (резко выступает вперед и в стороны), при V степени железа достигает очень больших размеров. При прощупывании обнаруживается распространенное увеличение железы, реже — распространенно-узловое. Наличие узлов в щитовидной железе требует обязательного сканирования для исключения кист (см.) и опухолей (см.). Повышенная функция щитовидной железы подтверждается увеличением в крови содержания тиреоидных гормонов: тироксина Т4 (в норме — 50—117 мг/кг), трийодтиронина Т3 (в норме — 1,06—1,88 мг/кг), йода, связанного с белками (в норме — 40–80 мкг/л). Диффузный токсический зоб может протекать в легкой, среднетяжелой и тяжелой формах (табл. 9).
Осложнения Тиреотоксический криз (одно из основных осложнений тиреотоксикоза) может развиться после психической травмы, острых инфекций, операций. Тиреотоксический криз характеризуется быстрым и резким нарастанием тяжести тиреотоксикоза, повышением температуры тела, ухудшением деятельности сердца и усилением симптомов заболевания. Понос и упорная рвота приводят к обезвоживанию организма. Тиреотоксическая кома (см.) может привести к смертельному исходу. Тяжелым осложнением является тиреотоксический криз, проявляющийся повышением температуры тела, возбуждением с бредом и галлюцинациями, неукротимой рвотой, поносом, учащением сердцебиения, мерцанием предсердий, желтухой (см.), снижением мышечного тонуса. Крайне тяжелым осложнением является развитие комы, ведущей к смерти больного.
Диагностика Диагноз ставится на основании клинических симптомов, ощупывания щитовидной железы, исследования количества гормонов щитовидной железы, УЗИ. Повышение общего тироксина до 200 нмоль/л и выше, трийодтиронина до 3 нмоль/л и более, уменьшение Т-лимфоцитов, увеличение В-лимфоцитов.
Лечение В терапии диффузного токсического зоба применяют: — медикаментозное лечение для устранения тиреотоксикоза; — лечение радиоактивным йодом; — операцию удаления щитовидной железы. Операция показана при больших размерах щитовидной железы, непереносимости лекарственной терапии, недостаточной эффективности консервативного лечения, а также в молодом возрасте, при наличии узлов и тяжелом течении тиреотоксикоза. Перед проведением операции проводится терапия антитиреоидными препаратами (мерказолил или тиомизол для ликвидации симптомов тиреотоксикоза). При лечении необходимо обеспечить пациенту психический и физический покой, при среднетяжелой и тяжелой формах лечение проводится стационарно. Среди лечебных средств значительное место занимают йодистые и тиреостатические препараты. Перхлорат калия блокирует поступление йода в железу, показан при легких формах болезни. Эффективность зависит от индивидуальной чувствительности больного. В качестве более эффективного средства применяют лечение радиоактивным йодом. В начале лечения используются препараты, подавляющие функцию щитовидной железы — тиреостатики (тиамазол, карбимазол, пропицил) по определенным схемам. Лечение продолжается до полного исчезновения симптомов токсического зоба. Курс лечения не менее 12 месяцев. Затем назначаются тиреоидные гормоны (тироксин). В комплексном лечении применяются бета-блокаторы, Т-активин. Для угнетения антителообразования применяют сердечные гликозиды, мочегонные средства, препараты калия, поливитамины. Лечение тиреотоксической комы включает комплекс мероприятий, направленных на основные нарушения этого тяжелого осложнения. Уровень тиреоидных гормонов можно снизить применением мерказолила в дозе 60—100 мг в первые сутки, назначают бета-блокаторы, глюкокортикоиды, плазмаферез, успокаивающие средства.
ЗОБ ХАШИМОТО
ОпределениеБолезнь Хашимото (аутоиммунный зоб, аутоиммунный тиреоидит) — хроническое заболевание щитовидной железы, развивающееся в результате иммунных нарушений организма. Данное нарушение встречается очень редко. Если зоб Хашимото находят в неизмененной железе, процесс определяется как тиреоидит, при развитии его на фоне бывшего зоба говорят о струмите.
Клиническая картина Отличительной особенностью является функциональная фазность течения заболевания: повышенная функция щитовидной железы сменяется нормальным состоянием, а затем происходит понижение функциональной способности. Течение медленное, поэтому клиническая картина разнообразна. Субъективные ощущения сводятся к чувству сдавления шеи, ощущению першения и комка в горле при глотании, осиплости голоса. В начале заболевания наблюдаются симптомы гипертиреоза: раздражительность, слабость, сердцебиение, могут быть нарушения зрения. В позднюю стадию наблюдаются проявления гипотиреоза: зябкость и сухость кожи, снижение памяти, заторможенность. При объективном исследовании выявляется увеличенная щитовидная железа с единичными или множественными уплотнениями, она подвижна и не спаяна с окружающими тканями, безболезненна, могут быть увеличены и уплотнены регионарные лимфоузлы. В крови характерны изменения в лейкоцитарной формуле: лимфоцитоз, снижение моноцитов и белков. Содержание гормонов щитовидной железы и поглощение тканью железы йода зависят от стадии заболевания. В ткани щитовидной железы выявляется скопление лимфоцитов, плазматических клеток, отмечается дегенерация железистых клеток. Иммунное исследование (реакция Бойдена) выявляет высокое количество антител к тиреоглобулину. Для дифференциальной диагностики проводят пробу с преднизолоном (по 10–20 мг в сутки в течение 7—10 дней), при которой отмечается быстрое снижение плотности щитовидной железы, чего не дает никакое другое нарушение.
Диагностика Диагноз устанавливается на основании клинических симптомов. Производится определение титра антитиреоидных антител, данных пункционной биопсии, сканирование, проведение УЗИ.
Лечение Лечение консервативное, препаратами типа левотироксина, восполняющими дефицит гормонов щитовидной железы. Оперативное лечение показано при подозрении на озлокачествление, сдавлении органов шеи, быстром росте железы, отсутствии эффекта от медикаментозного лечения.
ЗОБ ЭНДЕМИЧЕСКИЙ
ОпределениеУвеличение щитовидной железы, изменяющее форму шеи, возникающее в связи с недостатком поступления в организм йода в определенных регионах и поражающее более или менее значительные массы населения.
Этиология и патогенез Наиболее вероятным фактором, способствующим возникновению зобной болезни, является недостаток йода в воде, почве, а следовательно, в растениях и организмах животных тех местностей, которые являются очагом распространения эндемического зоба. Подтверждением теории йодной недостаточности является тот факт, что при поступлении йода в организм ее симптомы исчезают. При хронической недостаточности йода активизируется гипофиз, стимулирующий функцию щитовидной железы. Это приводит к ее переразвитию в отдельных участках, в которых образуются кисты и фиброзные кальцинаты, обусловленные формированием узлов. Угнетается кора надпочечников, что проявляется неустойчивостью психики, особенно во время стрессовых ситуаций, и повышенной болевой чувствительностью. Функция самой щитовидной железы длительное время не нарушается. Рост и увеличение железы бывает медленным (продолжается годами и десятилетиями), что отличает данное нарушение от рака щитовидной железы.
Коллоидный зоб
Развитие зоба принято рассматривать как компенсаторную реакцию организма на недостаточное поступление йода в организм. Щитовидная железа продолжает увеличиваться в размерах, в результате чего ее физиологическое увеличение становится нарушением.
Патанатомия Клеточные изменения при эндемическом зобе изучены довольно полно, различные формы зоба (узловой, узловой кистозный, узловой фиброзный) имеют свои структурные особенности. При исследовании ткани узлового коллоидного зоба хорошо заметны большие фолликулы в строении ткани щитовидной железы. Она состоит из клеток округлой формы с характерными выростами. Плотный однородный коллоид полностью заполняет фолликул, который выстлан низким эпителием с темными крупными ядрами. При кистозном зобе, помимо полостей с бурой жидкостью, обнаруживают изменения в стенках кисты. При паренхиматозном зобе имеются нарушения формы клеток и однообразие их строения. При врожденном зобе в очаговой местности наблюдается картина паренхиматозного зоба или увеличения железы вследствие сильного растяжения и переполнения кровью сосудов. В местах, где наблюдается эндемический зоб, часто встречается эндемический кретинизм (см.). Щитовидная железа при эндемическом кретинизме часто дает картину коллоидного зоба, но иногда имеет обычное строение или даже атрофирована.
Клиническая картина Различают диффузный (равномерно увеличенная щитовидная железа), узловой (наличие в массе железы узлов) и смешанный зоб (когда наряду с диффузным увеличением в щитовидной железе прощупываются отдельные узлы). По локализации зоб может быть односторонним и двусторонним. В некоторых случаях зоб располагается в необычном месте — за грудиной, распространяясь в средостение. В таких случаях говорят о загрудинном зобе, верхний полюс которого удается прощупывать только при натуживании и кашлевых толчках. Встречается и полупогружной зоб, частично прощупываемый над яремной ямкой. Степень развития узлового зоба определяют по размерам щитовидной железы, что является основным клиническим признаком. 0 степень — щитовидная железа не видна и при прощупывании не определяется. 1 степень — щитовидная железа не видна при осмотре, но при прощупывании во время глотания определяется перешеек и могут прощупываться ее доли. Подразделяется на группы: — щитовидная железа не видна при осмотре, при пальпации определяются обе доли; — щитовидная железа видна при подъеме головы вверх, пальпируются увеличенные доли и перешеек, но контуры шеи не изменены. II степень — щитовидная железа видна при осмотре во время глотания, хорошо определяется при прощупывании, но не изменяет форму шеи. III степень — увеличенная щитовидная железа изменяет форму шеи в виде «толстой шеи». IV степень — щитовидная железа видна при осмотре и изменяет форму шеи в виде выступающего собственно зоба. V степень — увеличение щитовидной железы приводит к сдавливанию трахеи, органов средостения и нервно-сосудистых стволов. В очаговых местностях увеличение щитовидной железы отмечается обычно с раннего детского возраста и при эутиреоидных формах никаких общих симптомов не дает. С годами, по мере роста, зоб начинает оказывать давление на соседние органы — трахею и пищевод, вследствие чего наступает затруднение дыхания и глотания. Сдавление вен шеи приводит к нарушению кровообращения: расширению вен шеи и сосудов груди, чувству напряжения в голове при наклонах, одутловатости лица. Нарушение дыхания и застой в малом круге кровообращения, вызванный механическим сдавлением сосудов, ведут к развитию зобного сердца, т. е. увеличению и расширению правых его отделов. Давление зоба на нервные стволы способно вызывать охриплость голоса, изменение глазной щели, расширение зрачка, нарушение потоотделения. В зависимости от состояния функции щитовидной железы различают эутиреоидный, гипертиреоидный и гипотиреоидный зоб. Наиболее часто встречающийся (20 % случаев) эутиреоидный зоб протекает при нормальной функции щитовидной железы. Однако людей с эутиреоидным увеличением щитовидной железы нельзя считать практически здоровыми, поскольку у них наблюдаются умеренно выраженные отклонения в деятельности сердечно-сосудистой, нервной и других систем. Гипотиреоидный зоб встречается в горных местностях и большей частью имеет форму узловатого зоба. У жителей равнинных районов зоб чаще имеет распространенный характер и протекает с симптомами гипертиреоза. Степень гипертиреоза невелика и проявляется умеренным учащением сердцебиения, тенденцией к пучеглазию, похудением. Диагноз ставится на основании увеличения щитовидной железы. Для подтверждения диагноза проводятся биохимические, радиоиммунные, радиоизотопные, рентгенологические исследования, при необходимости — компьютерная томография, ЯМР, термография. Осложнениями эндемического зоба могут стать кровоизлияние в зоб с острым стенозом трахеи, дистрофические изменения зоба и его злокачественное перерождение.
Диагностика Производится на основе данных о проживании в эндемичной по зобу местности определение зоба при пальпации. В крови соотношение тироксина и трийодтиронина нарушено в сторону преобладания последнего. Определяется повышенное поглощение щитовидной железы радиактивного йода I131. При УЗИ определяются кистозные изменения, участки кальциноза и фиброза.
Лечение и профилактика Лечебные мероприятия на начальных стадиях заключаются во введении йода в виде препаратов йодит-100, йодит-200, йодостин и биодобавок (тирамин и др.). Развитие гипотиреоза вынуждает к применению гормонов щитовидной железы — тиреоидина и трийодтиронина, причем эти препараты не только прекращают симптомы недостаточности щитовидной железы, но и снижают повышенную деятельность. В профилактических целях показано широкое применение йодированных соли, хлеба, назначение йодида калия внутрь (1–2 мг) в виде таблеток и т. д.
ЗОЛЛИНГЕРА-ЭЛЛИСОНА СИНДРОМ
ОпределениеСиндром Золлингера-Эллисона (аденома поджелудочной железы ульцерогенная, гастринома) — опухоль островкового аппарата поджелудочной железы, характеризующаяся возникновением пептических язв двенадцатиперстной кишки и желудка, не поддающихся лечению и сопровождающаяся упорными поносами.
Этиология и патогенез Различают 2 типа синдрома: — I тип синдрома связан с гиперплазией G-клеток антрального отдела желудка; — II тип синдрома связан с развитием опухоли из D-клеток островкового аппарата поджелудочной железы, продуцирующих гастрит. Синдром возникает в результате опухоли, располагающейся в области головки или хвоста поджелудочной железы (85 % случаев). В 15 % случаев опухоль локализуется в желудке или является проявлением множественного эндокринного аденоматоза (множественной эндокринной неоплазии). Развитие пептических язв, устойчивых к лечению, связано с повышенной выработкой желудочного сока и,соответственно, соляной кислоты и ферментов. У подавляющего большинства больных язва локализуется в двенадцатиперстной кишке, реже обнаруживается в желудке и тощей кишке. Довольно часто наблюдаются множественные язвы желудка, двенадцатиперстной и тощей кишки.
Клиническая картина и диагностика Клиническими проявлениями заболевания являются боли в верхней части живота, которые имеют те же закономерности по отношению к приему пищи, что и при обычной язве двенадцатиперстной кишки и желудка (см.), но в отличие от них очень упорны, отличаются большой интенсивностью и не поддаются противоязвенной терапии. Характерны упорная изжога и отрыжка кислым. Важным признаком являются поносы, обусловленные попаданием в тонкий кишечник большого количества соляной кислоты и усилением вследствие этого моторики тонкой кишки и замедлением всасывания. Стул обильный, водянистый, с большим количеством жира. Возможно значительное снижение массы тела, что характерно для злокачественной гастринемии. Язвы желудка и двенадцатиперстной кишки при синдроме Золлингера-Эллисона не поддаются заживлению даже при продолжительной соответствующей терапии. У многих больных отмечаются явления эзофагита (см.), иногда даже с образованием сужения пищевода. При прощупывании определяется выраженная болезненность в верхней части живота и области проекции нижней части желудка, может быть положительный симптом Менделя (локальная болезненность в проекции язвы). В случае злокачественного течения болезни возможны опухолевые образования в печени и значительное ее увеличение. Рентгенологическое и эндоскопическое исследования выявляют язву, которая не отличается от язвы при обычной язвенной болезни двенадцатиперстной кишки (см.). Относительными лабораторными критериями синдрома Золлингера-Эллисона являются: — гипергастринемия (содержание гастрина в крови до 1000 пг/мл и более, при обычной язвенной болезни она не превышает верхней границы нормы — 100 пг/мл); — кислотность основного секрета более 100 ммоль/ч. Выявление самой опухоли производится с помощью УЗИ, компьютерной томографии, селективной абдоминальной ангиографии. Наибольшей информативностью обладает метод селективной абдоминальной ангиографии со взятием крови из панкреатических вен и определением в ней гастрина. Лечение оперативное или консервативное. При I типе синдрома показана резекция желудка, при II типе — гастрэктомия ликвидирует возможность образования повторных язв.
ЗУД ЗАДНЕГО ПРОХОДА
Этиология, клиническая картина Зуд заднего прохода могут вызывать паразиты прямой кишки, заболевания толстой кишки, желудка и печени, сахарное мочеизнурение, геморрой (см.), трещины, свищи, нейродермит. У пациентов отмечается мучительный постоянный зуд, более тягостный, чем боль, и хроническое раздражение кожи. Зуд, вызывающий почесывание заднего прохода, особенно усиливается в постели, в тепле, летом. Это мучительное состояние лишает больных работоспособности, буквально доводит их до отчаяния. Диагноз не представляет трудностей, основывается на данных опроса и виде кожи в области заднего прохода.Лечение Необходимо соблюдать тщательную гигиену и чистоту заднего прохода, после испражнения задний проход ополаскивают прохладной водой без мыла и тщательно осушают. Немаловажную роль играет туалетная бумага, так как больные усердно ею пользуются, втирая ее в кожу, вызывая тем самым дерматит и усиливая зуд. Хороший результат дают в летнее время холодные купания и длительные воздушные ванны. Народная медицина рекомендует следующий сбор: трава чистотела — 10 г, череда — 20 г, фиалка трехцветная, лист березы, черная смородина. 2 ст. л. сбора залить стаканом воды и настаивать 1 ч. Принимать внутрь на ночь по 100 г. Вечером рекомендуются сидячие ванны из ромашки аптечной.
ЗУД КОЖИ
ОпределениеЗуд кожи — видоизмененное болевое ощущение, обусловленное раздражением нервных окончаний в коже, воспринимающих боль, вызывающее стремление расчесывать кожу.Зуд кожи — частый симптом многих кожных заболеваний, он наблюдается и при отсутствии каких-либо видимых изменений на коже. Зуд является основным признаком при аллергических заболеваниях, заболеваниях печени, укусах насекомых.
Этиология и патогенез Причины зуда разнообразны. Острые приступы зуда чаще бывают связаны с повышенной чувствительностью организма к некоторым пищевым продуктам или лекарствам. Кожный зуд может: — развиться вслед за воспалительным процессом в коже; — существовать самостоятельно без изменений кожного покрова, как следствие избирательного раздражения нервных окончаний некоторыми внутренними и внешними веществами; — возникать в результате некоторых внутренних расстройств — в этих случаях импульсы с симпатических нервов передаются на чувствительные кожные; — ощущаться больными в течение более или менее длительного времени уже после устранения вызвавшей его причины — зуд центрального происхождения. Зуд может быть: — психогенным (у некоторых людей только разговор, например, о вшах, вызывает неудержимое желание чесаться); — сопровождающим различные нарушения кожи; — спровоцированным, возникающим в результате попадания на чувствительную кожу различных веществ, к которым у субъекта имеется повышенная чувствительность; — токсическим, развившимся в результате действия различных лекарственных веществ (кофеин, мышьяк и т. д.) у людей с повышенной чувствительностью к этим медикаментам; — аутотоксическим в результате раздражения рецепторов кожи токсическими веществами, образующимися в самом организме при некоторых заболеваниях и состояниях. В результате длительного зуда и расчесов возникают пигментация, рубцы, лихенизация (см.), пиодермия (см.), иногда гипертрихоз (см.); на рубцах отсутствует рост волос. Больные страдают от бессонницы, становятся раздражительными, у них пропадает аппетит, падает вес. Часто ногтевые пластинки пальцев становятся полированными, иногда свободный край их стачивается. Локализованный зуд чаще всего наблюдается в области промежности, заднего прохода, наружных половых органов. Диагноз распространенного и локализованного кожного зуда не представляет затруднений. Диагноз кожного зуда ставится при отсутствии каких-либо первичных структурных элементов.
Лечение Каждый больной с кожным зудом должен быть всесторонне обследован в целях выявления и устранения причины страдания. По соответствующим показаниям назначают эндокринные препараты, проводят противоглистное лечение, лечат заболевания печени, кроветворных органов, принимают меры к устранению желудочно-кишечных расстройств. Необходимо исключить из пищевого рациона алкоголь, кофе, какао, копчености, консервы и т. д. Важны общий режим, устранение всяких психических и внешних раздражителей, пребывание на свежем воздухе, теплые ванны с отваром дубовой коры и хвойным экстрактом, внутрь назначают антигистаминные препараты. Для лечения используются седативные средства (валериана, настойка пустырника и др.), антигистаминные препараты, транквилизаторы (элениум, седуксен), препараты кальция. Применяются магнитотерапия, УФО. Местно применяются мази и болтушки, содержащие анестезин, тимол, ментол и другие вещества. Для снятия зуда народная медицина рекомендует следующие средства: анис обыкновенный, береза, бузина черная, валериана, тысячелистник, фиалка трехцветная, чистотел, петрушка, овес, крапива.
♦ И ♦
ИДИОСИНКРАЗИЯ
ОпределениеИдиосинкразия (от греч. idios — «своеобразный», «особый», «необычный» и synkrasis — «смешение») — непереносимость, болезненная реакция, которая возникает у некоторых людей в ответ на определенные неспецифические (в отличие от аллергии) раздражители.
Этиология В основе идиосинкразии лежит врожденная высокая реактивность и чувствительность к некоторым раздражителям либо реакция, возникающая в организме вследствие повторных слабых воздействий некоторых веществ, не сопровождающаяся выработкой антител. В настоящее время термин используется редко, его главное современное значение близко к понятию ферментопатия, так как болезненные симптомы часто связаны с недостаточностью некоторых звеньев обмена веществ в условиях той или иной внешней нагрузки. Отличие идиосинкразии от аллергии еще и в том, что она может появиться и после первого контакта с раздражителем (небелковые соединения, не обладающие признаками аллергенов; компоненты пищевых продуктов — рыба, икра, крабы, молоко, яйца, земляника и др.; лекарственные препараты — амидопирин, антибиотики, сульфаниламиды и др.; запах различных животных). Вызывают идиосинкразию большинство физических факторов — облучение солнечным светом, охлаждение, травма.
Клиническая картина Вскоре после контакта с раздражителем возникает головная боль, повышается температура, нередко — психическое возбуждение, расстройства функции органов пищеварения (тошнота, рвота, понос), дыхания (одышка, насморк и др.), отек кожи и слизистых оболочек, крапивница. Эти явления, вызванные нарушениями кровообращения, увеличением проницаемости сосудов, спазмами гладкой мускулатуры, как правило, вскоре проходят, но нередко длятся до нескольких дней. Перенесенная реакция не создает нечувствительности к повторному действию агента.
Лечение Предупреждение дальнейших контактов с непереносимым раздражителем, снижение повышенной реактивности организма.
ИМПЕТИГО
ОпределениеИмпетиго — поверхностное гнойное заболевание кожи (пиодермия), характеризующееся возникновением гнойничков, засыхающих с образованием корок. Фактически под этим названием объединяют несколько различных заболеваний, сходных между собой по внешним проявлениям.
Этиология и патогенез Импетиго вызывается стрептококками или стафилококками. Возникновению способствуют плохое содержание кожи, загрязнение и раздражение ее смазочными материалами, травматизация, мацерация кожи. Длительное охлаждение кожи, уменьшение пото- и салоотделения, сухость и нарушение целостности эпидермиса, перегревание и повышенное потоотделение с последующей мацерацией рогового слоя, ослабление кислой реакции также способствуют развитию пиодермии. В зависимости от вида возбудителей гнойничковые заболевания кожи делятся на 3 группы: стрептодермии, стафилодермии, стрептостафилодермии. Для стрептодермии характерным элементом кожных проявлений является фликтена — пузырь с быстро мутнеющим содержимым; для стафилодермии более характерен фолликулярный гнойничок. Скопление лейкоцитов во фликтене обычно свидетельствует о присоединении вторичной стафилококковой инфекции и возникновении стрептостафилодермии. Возбудители проникают через трещины и ссадины кожи, устья волосяных фолликулов; импетиго также может возникать в результате осложнения при воспалении кожи. Различают импетиго стрептококковое, стафилококковое, а также смешанные формы, или вульгарное импетиго.
Патанатомия При пузырчатке новорожденных в верхнем слое кожи образуется резко отграниченная полость, покрышкой которой служат роговой и зернистый слои кожи, а дном — шиповатый слой; полость заполняется серозной жидкостью, лейкоцитами и измененными клетками. В сосочковом слое отмечаются расширение капилляров, отечность и незначительная околососудистая инфильтрация. При стафилококковых импетиго пустула заложена в толще мальпигиева слоя и располагается вокруг устья волосяного мешочка. Ее покрышку составляет роговой слой, а дно — нижние слои эпителия, клетки которых сдавлены и утолщены. Вокруг отмечаются разрыхление ткани и скопление лейкоцитов в межклеточных щелях. В сосочковом слое определяются незначительное расширение капилляров и умеренная околососудистая инфильтрация клеточными элементами. При остиофолликулите, помимо внутриэпидермального гнойника вокруг волоса, имеются островоспалительные явления в дерме, окружающей фолликул, расширение кровеносных сосудов и небольшие скопления лейкоцитов.
Клиническая картина Клиническая картина различна и зависит от вида возбудителя.
Стрептококковое импетиго Стрептококковое импетиго чаще всего наблюдается у детей и молодых женщин, реже у мужчин. Стрептококковое импетиго локализуется преимущественно на лице, чаще всего — около рта и носа, но может располагаться на кистях, стопах и голенях.
Стрептококковое импетиго
Первичным элементом является фликтена с тонкой, дряблой, легко рвущейся покрышкой размером с горошину и окруженная периферическим воспаленным ободком. Содержимое фликтен вначале серозное, затем очень быстро мутнеет. При разрыве покрышки обнажается эрозия с ярко-красным дном, отделяющая клейкую мутноватую жидкость. Подсыхание жидкости приводит к образованию корочек соломенно-желтого цвета. Когда они отпадают, остается красноватое пятно с периферической бахромкой отслоенного рогового покрова. Длительность существования отдельных элементов составляет 5–7 дней. Множественные фликтены и корки, сливаясь, образуют большие очаги поражения. Больной ощущает небольшой зуд, а при наличии эрозий — некоторую болезненность. Различают кольцевидное, щелевидное и пузырчатое импетиго. При кольцевидном импетиго центральная часть фликтены подсыхает в толстую корку, а периферическая остается в виде ободка, заполненного серозно-мутноватой жидкостью. При периферическом росте фликтены она может достигнуть размеров монеты. При щелевидном импетиго (импетиго складок) процесс развивается в одном или обоих углах рта, в носогубных складках, за ушными раковинами, на сосках у женщин. Элементы представляют собой фликтену, быстро превращающуюся в трещину. Заболевание длительное, часто передается посредством поцелуев и при пользовании общей посудой, наблюдаются школьные и семейные очаги. Пузырчатое импетиго характеризуется крупными, величиной с горошину или лесной орех, беспорядочно рассеянными фликтенами с напряженной или дряблой покрышкой. Пузырчатка новорожденных поражает детей в первые дни жизни. Высыпаниям предшествует кратковременная лихорадка. Высыпания состоят из напряженных или дряблых пузырей размером от горошины до лесного ореха с прозрачным или молочномутным содержимым. Они локализуются на шее, конечностях, туловище. В легких случаях общее состояние больного не нарушается, эрозии зарастают и заболевание заканчивается выздоровлением. В тяжелых случаях заращения эрозий не происходит, поражение распространяется по периферии, отслаивая поверхностную часть кожи. Появление новых пузырей на коже и слизистых оболочках рта и носа, резкая болезненность, высокая температура и нарушение общего состояния ребенка дополняют клиническую картину этого тяжелого заболевания, которое может закончиться летальным исходом. Распознавание стрептококкового импетиго и его разновидностей не представляет особых затруднений, однако необходимо дифференцировать его с проявлениями сифилиса (см.), основным отличительным признаком которого является локализация пузырей на ладонях и подошвах при наличии положительных серологических реакций. Прогноз обычно благоприятный, при эпидемической пузырчатке — серьезный. Ввиду большой опасности контактного заражения дети, болеющие стрептококковым импетиго и его разновидностями, не допускаются в организованные коллективы. Профилактика болезни сводится к содержанию кожи в чистоте.
Обыкновенное (вульгарное) импетиго Стрептококковое импетиго, осложняясь стафилококковой инфекцией, становится вульгарным импетиго. Заболевание может быстро распространяться и в детских коллективах может принимать характер эпидемии. Инфекция передается как непосредственно от больного человека к здоровому, так и через предметы домашнего обихода.
Вульгарное импетиго
Вначале обыкновенное импетиго не отличается от стрептококкового, но уже через несколько часов образуется рыхлая корка соломенно-желтого или янтарно-желтого цвета, состоящая как бы из отдельных мелких крупинок, напоминающих мед. Периферический рост элементов сыпи, появление новых высыпаний и слияние их с соседними приводят к образованию крупных, неровных, мелкозернистых корок с неправильными фестончатыми краями. Локализуются они обычно на лице, но могут быть и на других участках кожного покрова. Нередко при распространении поражения могут отмечаться умеренное повышение температуры и недомогание.
Стафилококковое импетиго Стафилококковое импетиго (остиофолликулит) развивается в устьях сально-волосяных фолликулов и встречается чаще у мужчин. Его возникновению способствует нечистоплотность (химическое раздражение кожи, повышенная потливость, применение антисептических веществ). Нередко остиофолликулит осложняет другие зудящие воспаления кожи. Остиофолликулиты бывают преимущественно у взрослых, поражая в основном разгибательные поверхности конечностей. У детей встречается редко и исключительно на волосистой части головы. Они имеют вид мелких пустул, расположенных в устье волосяной воронки, образуя конусообразную корочку желтого цвета. Из остиофолликулита при отсутствии лечения могут развиться фолликулит, фурункул (см.) и карбункул. Острый фолликулит развивается в окружности волоса и является дальнейшим этапом развития остиофолликулита. Клинически он проявляется плотными на ощупь, коническими или полушаровидными фолликулярными папулами с пустулой на вершине. Они слегка болезненны и окружены островоспалительным красным венчиком. При подсыхании содержимого пустул образуется желтоватая корочка, после отпадения которой остается быстро исчезающее пигментное пятно. Осложнением болезни являются фурункул (см.), карбункул и стафилококковый сикоз (см.), при котором количество элементов значительно возрастает при их сливании. Заболевание встречается у мужчин и длится годами.
Лечение и профилактика Лечение проводится амбулаторно. Здоровый участок кожи 2 раза в день протирают 2 %-ным салициловым спиртом. Фликтены вскрывают, обрабатывают спиртовым раствором, анилиновым красителем, фукорцином, используются дезинфицирующие мази 3–4 раза в день без повязок 5—10 дней до эпителизации эрозии. При распространенном импетиго проводят антибактериальную терапию. При повышении температуры и наличии токсикоза у детей лечение проводится в условиях стационара. Профилактика всех форм импетиго заключается в лечении заболеваний, способствующих развитию импетиго, соблюдении правил личной гигиены, обработке микротравм дезинфицирующими средствами. В детских учреждениях необходим систематический санитарно-эпидемиологический надзор.
ИМПОТЕНЦИЯ
ОпределениеИмпотенция — нарушение половой функции, при которой половой акт или совершенно не может быть выполнен, или возможен в неполном объеме, что связано с трудностями достижения или сохранения эрекции.
Этиология и патогенез Причины любой сексуальной проблемы могут быть весьма сложными и включают тесно связанные между собой физиологические, эмоциональные и межличностные компоненты. Некоторые факторы, вызывающие нарушения сексуальной функции, имеют предрасполагающий характер, т. е. представляют собой какие-то биологические особенности или предшествующие жизненные обстоятельства, которые создают явные предпосылки для возникновения сексуальных расстройств. Скажем, диабет (см.) или сексуальное насилие, которому человек подвергся в прошлом, могут быть причиной половых расстройств. Затем эта причина активизируется способствующими факторами, такими как алкоголизм (см.) или стрессовая ситуация. Наконец, существуют и поддерживающие факторы, например длительно накапливающиеся проблемы в межличностных взаимоотношениях. По происхождению причины импотенции могут быть психическими и органическими. Расстройства могут быть связаны с попаданием в организм каких-либо веществ, являясь следствием употребления алкоголя или наркотиков либо побочным эффектом принимаемых лекарств. Расстройства могут также иметь психологическое происхождение, когда их обусловливают какие-то психические процессы (например, стресс) или социальная среда. Из органических причин импотенцию могут вызывать врожденные нарушения пениса или его травма. Рассеянный склероз или повреждение спинного мозга, атеросклероз (см.) или закупорка кровеносных сосудов, болезни эндокринной системы в случаях недостаточной выработки тестостерона, диабет (см.) — все эти заболевания могут быть органической основой импотенции.
Клиническая картина Различают пять основных форм импотенции: вследствие функциональных изменений в центральной нервной системе, вследствие органических изменений нервной системы, вследствие заболеваний половых органов, вследствие механических препятствий, при нарушениях в работе эндокринных желез. При импотенции, обусловленной нарушением деятельности центральной нервной системы, речь идет о двух ее формах: кортикальной и спинальной импотенции. Выделяют следующие группы кортикальной импотенции: — с повышением тормозящего влияния на половую функцию; — с повышением возбуждающего влияния на половую функцию; — с извращениями половой функции. Наиболее часто встречается кортикальная форма импотенции с повышением тормозящего влияния на половую функцию. При торможении половой возбудимости в большей или меньшей степени понижается половое влечение, эрекция может оставаться нормальной, однако нередко ослаблена или отсутствует, оргазм в случае совершения полового акта понижен. При торможении центра эрекции нарушается эрекция. Появляясь, эрекция обычно исчезает перед самым началом полового акта, не бывает при этом и эякуляции. Половое влечение у таких больных нормальное, сексуальные центры и половые органы не имеют нарушений, что доказывается наступлением эрекции во сне или в состоянии бодрствования при близком нахождении женщины, при мыслях о возможном половом акте с ней. Причинами, способствующими усилению тормозящих влияний коры головного мозга на половую функцию, могут быть различного рода страхи, боязнь неудачи, заражения венерической болезнью, возможности нежелательного оплодотворения, страх быть застигнутым врасплох. Тормозящим фактором может быть неприятный запах изо рта у женщины, случайно замеченное родимое пятно на необычном месте и т. д. Торможение половой функции с ослаблением потенции может быть обусловлено депрессивным состоянием, суровым аскетическим воспитанием, психическим переутомлением, сильными отрицательными эмоциями. Торможение половой функции характерно для больных неврастенией и психастенией. Кортикальная импотенция характеризуется быстрым извержением семени, наступающим до начала полового акта, а иногда в результате лишь психического воздействия (например, эротического представления). Эрекция при этом может быть нормальной или ослабленной, но наступает часто и быстро, иногда по самому ничтожному поводу. Подобное нарушение половой функции нередко является одним из симптомов общей неврастении или психастении. Возникновение преждевременного семяизвержения кортикального происхождения провоцируют те же психогенные факторы, которые вызывают торможение эрекции. Если у неустойчивого в психическом отношении мужчины под влиянием какой-либо из указанных причин когда-то произошла «осечка», он часто не может забыть об этом, что приводит к повторному преждевременному семяизвержению при последующих попытках к половому сближению. Спинальная форма импотенции вызывается поражением спинномозговых центров эрекции и эякуляции. Ее причиной могут быть половые излишества, прерванный или затянутый половой акт, онанизм (см.), неудовлетворенное половое возбуждение и т. д. При нарушенном возбуждении спинномозговых центров эрекция нормальная, но часто и быстро возникает по ничтожному поводу. Семяизвержение наступает быстро, иногда до начала полового акта. Некоторые больные жалуются на учащение ночных (а иногда и дневных) поллюций. Повышение возбудимости спинальных центров обычно сменяется их истощением. При этом раньше, как правило, истощается легкоранимый центр эрекции, тогда как более стойкий центр эякуляции еще продолжает находиться в состоянии раздражения. У больных с подобным состоянием половых центров происходит быстрое семяизвержение при более или менее ослабленной эрекции. Импотенция вследствие органических поражений центральной нервной системы является результатом травм и органических заболеваний головного мозга (склероз, опухоли (см.), прогрессивный паралич). Этот вид импотенции отличается многообразием проявлений. Импотенция вследствие заболеваний половых органов обусловлена простатитом (см.) и колликулитом. В возникновении этих заболеваний имеют большое значение те факторы, которые вызывают длительное нарушение кровообращения и явления застойного кровенаполнения в задней части мочеиспускательного канала и предстательной железе. Застойное длительное кровенаполнение приводит к серозному пропитыванию тканей, а затем к развитию воспалительного процесса в задней части мочеиспускательного канала, семенном бугорке и предстательной железе. Причинами этого могут быть половые излишества, прерванный половой акт, неудовлетворенное половое возбуждение, чрезмерный онанизм (см.). Наступившие в половых органах патологические изменения вызывают нарушения функции спинномозговых половых центров, в результате чего наступает патологическое повышение их возбудимости, которое в дальнейшем сменяется их истощением. Клинические проявления импотенции вследствие урологического нарушения и спинальной импотенции одинаковы и зависят от состояния спинальных половых центров. Эндокринная импотенция вызывается падением секреторной функции яичек, обычно сопровождающейся как понижением полового влечения, так и ослаблением эрекции вплоть до полного ее исчезновения. Нарушение функции яичек может явиться следствием их врожденного недоразвития или травмы либо нарушения их эндокринологического взаимодействия с другими железами внутренней секреции (гипофиз, надпочечники, щитовидная железа). Возрастные изменения в яичках тоже могут явиться причиной этого вида импотенции. Импотенция вследствие механических препятствий связана с пороками развития полового члена (недоразвитие, чрезмерная величина, короткая уздечка), слоновостью мошонки, большими паховыми и мошоночными грыжами и т. д. Избежать снижения половой функции с возрастом невозможно, но отодвинуть время ее наступления вполне реально.
Лечение При лечении сексуальных расстройств применяются различные лекарственные препараты. Трудности с эрекцией можно успешно лечить с помощью гормональных инъекций, мышечных релаксантов и химических препаратов типа иохимбина, который активизирует клетки симпатической нервной системы, повышает сексуальное влечение, усиливает эрекцию. Формой такой терапии является психодинамическая терапия, включающая в себя требующий длительного времени анализ детских переживаний пациента и иных психодинамических факторов, которые могли в итоге вызвать нежелательные симптомы. Лечение гипнозом используется как дополнение к другим лечебным методам, его можно считать разновидностью психотерапии, использующей релаксацию и внушение. Групповая терапия эффективна при нарушениях эрекции. Несмотря на это, большинство пациентов отдает предпочтение индивидуальным методам. Поведенческая терапия также используется при лечении сексуальных расстройств. Она включает в себя определенные физические действия, которые практикуют в домашних условиях парой или в отдельных случаях индивидуально (в качестве метода самолечения). При использовании суррогатных (платных) партнеров возникают этические трудности, поскольку секс за деньги осуждается общественным мнением. Лечение импотенции должно проводиться сексопатологом и строго индивидуально. Из нетрадиционных методов рекомендуют настойку женьшеня, пыльцу растений, маточное молочко. В пожилом возрасте рекомендуется сохранять привычный, сложившийся с годами уклад жизни во всем, в том числе и в сексе. Замечено, что половую функцию поддерживают такие пищевые продукты, как кофе, шоколад, грецкие орехи, желток куриного яйца, петушиные гребни, полезна также морковь. Необходимы солнечные ванны. Особо следует остановиться на оздоровительном беге, ибо ничто так не нормализует гормональный обмен, как бег трусцой. Полезен вечерний бег за 1 ч до сна.
ИНФАРКТ МИОКАРДА
ОпределениеИнфаркт миокарда — это одна из клинических форм ишемической болезни сердца (см.), сопровождающаяся развитием ишемического некроза миокарда, возникающего вследствие нарушения венечного кровообращения. Инфаркт миокарда является заболеванием, которое привлекает большое внимание врачей. Это определяется не только частотой, но и тяжестью этого заболевания, серьезностью прогноза и высокой смертностью. На самого больного и окружающих всегда производит тяжелое впечатление та катастрофичность, с которой нередко развивается болезнь, приводящая к нетрудоспособности на долгое время.
Этиология и патогенез В основе развития инфаркта миокарда лежит атеросклеротическое поражение сосудов сердца крупного и среднего калибра. Большое значение в развитии инфаркта миокарда имеют сопутствующие атеросклерозу (см.) нарушения свойств крови, предрасположенность к повышенной свертываемости, патологические изменения тромбоцитов. На атеросклеротически измененной сосудистой стенке образуются скопления тромбоцитов и формируется тромб, который полностью закрывает просвет артерии. Инфаркт миокарда обычно развивается в конце пятого, но чаще на шестом десятке жизни. Среди больных больше мужчин, чем женщин. В настоящее время имеются данные о семейной предрасположенности к инфаркту миокарда. К развитию инфаркта миокарда предрасполагают профессия и работа, связанная с интенсивным умственным трудом и перенапряжением при недостаточной физической активности. Гипертоническая болезнь (см.) является фактором, способствующим развитию инфаркта миокарда. Курение, алкоголизм (см.) также способствуют развитию заболевания. У половины больных среди факторов, способствующих развитию инфаркта миокарда, обнаруживаются психические травмы, стрессы, нервное перенапряжение. Если недостаточность кровообращения в области сосудов сердца наступает быстро, что наблюдается при рефлекторном спазме или тромбозе сосудов, миокард быстро подвергается некрозу, в результате чего развивается инфаркт. В механизме развития инфаркта миокарда существенное значение имеют: — спазм артерий, в которых имеются атеросклеротические изменения, оказывающие раздражающее влияние на рецепторы сосудов, вызывающих спазматические сокращения артерий; — тромбоз артерии, измененной атеросклеротическим процессом, развивающийся нередко вслед за спазмом; — функциональное несоответствие между потребностью миокарда в крови и количеством притекающей крови, также возникающее вследствие атеросклеротических изменений артерий.
Инфаркт миокарда. Светлые участки некроза в толще боковой стенки левого желудочка миокарда
При быстро развившемся несоответствии между притоком крови и функциональной потребностью в ней миокарда (например, при выраженной физической нагрузке) в разных участках миокарда могут возникать мелкоочаговые омертвения мышечной ткани (микроинфаркты).
Патанатомия Нарушения в сердечной мышце связаны с развитием ишемического некроза, претерпевающего в своем развитии несколько стадий. Ишемический (острейший период) — это первые несколько часов после закупорки коронарного сосуда до формирования некроза миокарда. При микроскопическом исследовании обнаруживаются очаги разрушения мышечных волокон, расширение капилляров с нарушением движения крови в них. Острый период — первые 3–5 дней заболевания, когда в миокарде преобладают процессы омертвения с пограничной воспалительной реакцией. Стенки артерий в зоне инфаркта набухают, просвет их наполнен однородной массой эритроцитов, на периферии зоны некроза отмечается выход из сосудов лейкоцитов. Подострый период длится 5–6 недель, в это время в зоне некроза образуется рыхлая соединительная ткань.
Хроническая аневризма (А) левого желудочка сердца на почве рубцового замещения ткани миокарда после инфаркта
Период рубцевания заканчивается через 5–6 месяцев от начала болезни формированием полноценного соединительнотканного рубца. Иногда возникает не один, а несколько инфарктов, в результате чего в мышце сердца образуется ряд рубцов, которые дают картину кардиосклероза. Если рубец имеет большую протяженность и захватывает значительную часть толщи стенки, то от давления крови он постепенно выбухает, в результате чего образуется хроническая аневризма (см.) сердца. Макроскопически инфаркты миокарда имеют характер ишемических или геморрагических. Величина их колеблется в весьма значительных пределах — от 1–2 см в поперечнике до размеров ладони. Деление инфарктов на крупно- и мелкоочаговые имеет большое клиническое значение. Некроз может охватывать всю толщу миокарда на пораженном участке (трансмуральный инфаркт) или располагаться ближе к эндокарду и эпикарду; возможны изолированные инфаркты межжелудочковой перегородки, сосочковых мышц. Если некроз распространяется на перикард, имеются признаки перикардита (см.). На поврежденных участках эндокарда иногда выявляются тромбы, которые могут быть причиной эмболии артерий большого круга кровообращения. При обширном трансмуральном инфаркте стенка сердца в зоне поражения нередко растянута, что указывает на образование аневризмы сердца (см.). Из-за непрочности омертвевшей сердечной мышцы в зоне инфаркта возможен ее разрыв; в таких случаях обнаруживается массивное кровоизлияние в полость перикарда или прободение (перфорация) межжелудочковой перегородки.
Клиническая картина Чаще всего основным проявлением инфаркта миокарда является интенсивная боль за грудиной и в области сердца. Боль возникает внезапно и довольно быстро достигает большой выраженности. Может распространяться на левую руку, левую лопатку, нижнюю челюсть, межлопаточное пространство. В отличие от боли при стенокардии (см.) при инфаркте миокарда боль значительно интенсивнее и не проходит после приема нитроглицерина. У подобных больных следует учитывать наличие ишемической болезни сердца в течении болезни, смещение боли в шею, нижнюю челюсть и левую руку. Вместе с тем следует учитывать, что у лиц пожилого возраста заболевание может проявляться одышкой и потерей сознания. При наличии этих симптомов необходимо как можно быстрее снять электрокардиограмму. Если на ЭКГ отсутствуют изменения, характерные для инфаркта миокарда, рекомендуется частая повторная регистрация ЭКГ. Инфаркт миокарда в некоторых случаях развивается внезапно. Признаки, предвещающие его, отсутствуют иногда у лиц, не страдавших до этого ишемической болезнью сердца (см.). Этим объясняются случаи внезапной смерти дома, на работе, в транспорте и т. д. У части больных перед возникновением инфаркта наблюдаются предшествующие явления, они возникают у 50 % больных. Предвестниками инфаркта миокарда являются изменения частоты и интенсивности приступов стенокардии (см.). Они начинают возникать чаще, при меньшем физическом напряжении, становятся более упорными, продолжаются дольше, у некоторых больных они возникают в состоянии покоя, а в промежутках между болевыми приступами иногда в области сердца остается тупая боль или чувство давления. В некоторых случаях инфаркту миокарда предшествуют не боли, а проявления общей слабости и головокружение. Типичными для инфаркта миокарда являются высокая интенсивность и большая длительность болей. Боли носят давящий, сжимающий характер. Иногда они становятся невыносимыми и могут приводить к затемнению или полной потере сознания. Боли не устраняются при применении обычных сосудорасширяющих средств, а иногда не прекращаются инъекциями морфина. Почти у 15 % больных болевой приступ продолжается не более часа, у трети больных — не более 24 ч, в 40 % случаев — от 2 до 12 ч, у 27 % больных — свыше 12 ч. У части больных возникновение инфаркта миокарда сопровождается шоком (см.) и коллапсом (см.). Шок и коллапс развиваются у больных внезапно. Больной чувствует резкую слабость, головокружение, бледнеет, покрывается потом, иногда наступает затемнение сознания или даже кратковременная потеря его. В некоторых случаях появляются тошнота и рвота, иногда понос. Больной ощущает сильную жажду. Конечности и кончик носа становятся холодными, кожа влажной, постепенно принимает пепельно-серый оттенок. Артериальное давление резко падает, иногда не определяется. Пульс на луче вой артерии слабого напряжения или не прощупывается совсем; чем ниже артериальное давление, тем тяжелее коллапс. Особенно тяжел прогноз в тех случаях, когда артериальное давление на плечевой артерии не определяется. Число сердечных сокращений во время коллапса может быть нормальным, увеличенным, иногда уменьшенным, чаще наблюдается тахикардия (см.). Температура тела становится слегка повышенной. Шоковое состояние и коллапс могут продолжаться часами и даже сутками, что имеет плохое прогностическое значение. Описанная клиническая картина соответствует первой фазе шока. У некоторых больных в самом начале инфаркта миокарда наблюдаются симптомы второй фазы шока. Больные в этот период бывают возбуждены, беспокойны, мечутся и не находят себе места. Артериальное давление может быть повышено. Возникновение симптомов застоя в малом круге изменяет клиническую картину и ухудшает прогноз. У некоторых больных развивается острая прогрессирующая левожелудочковая недостаточность с резкой одышкой и удушьем, иногда — астматическое состояние. Правожелудочковая недостаточность обычно развивается уже при наличии левожелудочковой недостаточности. Из объективных симптомов наблюдается увеличение границ сердца влево. Тоны сердца не изменены или глухие. У части больных выслушивается ритм галопа, указывающий на слабость сердечной мышцы. На митральном клапане выслушивается шум. Появление разлитого сердечного толчка или пульсация в области сердца могут указывать на аневризму сердца. Некоторое значение имеет прослушивание в редких случаях шума трения перикарда, что свидетельствует о распространении некроза вплоть до перикарда. У больных инфарктом миокарда могут наблюдаться значительные расстройства со стороны желудочно-кишечного тракта — тошнота, рвота, боли в подложечной области, парез (см.) кишечника с явлениями непроходимости. Очень существенные нарушения могут возникнуть со стороны центральной нервной системы. В некоторых случаях резкий болевой приступ сопровождается обморочным состоянием, кратковременной потерей сознания. Иногда больной жалуется на резкую общую слабость, у некоторых больных появляется упорная, трудноустранимая икота. Иногда развивается парез кишечника с резким его вздутием и болями в животе. Особенно большое значение имеют более серьезные нарушения мозгового кровообращения, развивающиеся при инфаркте миокарда и иногда выступающие на первый план. Нарушение мозгового кровообращения проявляется коматозным состоянием, судорогами, парезами, нарушением речи. В других случаях мозговые симптомы развиваются позднее, чаще всего между 6-м и 10-м днем. Помимо специфических симптомов со стороны различных систем и органов, у больных инфарктом миокарда наблюдаются и общие симптомы — лихорадка, повышенное количество эритроцитов в крови, а также ряд других биохимических изменений. Типична температурная реакция, нередко развивающаяся в первые сутки и даже часы. Чаще всего температура не превышает 38 °C. У половины больных она падает к концу первой недели, у остальных — к концу второй. Таким образом, можно выделить следующие клинические формы инфаркта миокарда: — ангинозная форма (начинается с приступа болей за грудиной или в области сердца); — астматическая форма (начинается с приступа сердечной астмы); — коллаптоидная форма (начинается с развития коллапса); — церебральная форма (начинается с появления болей и очаговой неврологической симптоматики); — абдоминальная форма (появление болей в верхней части живота и диспепсических явлений); — безболевая форма (скрытое начало инфаркта миокарда); — смешанная форма.
Диагностика и дифдиагностика Диагноз основывается на клинической оценке состояния больного, дифференциальной диагностике с другими нарушениями данных ЭКГ. Дифференциальная диагностика проводится с болями в грудной клетке другого происхождения: расслаивающая аневризма аорты (см.), острый перикардит (см.), острый миокардит (см.), спонтанный пневмоторакс (см.) и эмболия (см.) легочной артерии. В конце первых — начале вторых суток увеличивается количество нейтрофильных лейкоцитов, достигающее максимума в среднем на третьи сутки, и затем постепенноснижается до нормы. При этом, когда начинает снижаться количество лейкоцитов, увеличивается СОЭ, которая также обычно не достигает высоких цифр. Таким образом, в течение острого периода наблюдается перекрест кривых лейкоцитоза и СОЭ. В первые несколько суток от начала болезни в крови повышается активность некоторых тканевых ферментов. Электрокардиографическое исследование является одним из основных методов диагностики инфаркта миокарда. На основании данных ЭКГ можно судить об обширности и локализации повреждения миокарда, давности развившегося процесса. ЭКГ показывает наличие при инфаркте миокарда трех зон — омертвения, повреждения и ишемии. Повторные инфаркты вызывают трудности при ЭКГ. Все многообразие электрокардиографических сдвигов при повторных инфарктах можно представить в трех основных вариантах: — вновь возникшие изменения при повторных инфарктах миокарда полностью маскируют признаки, оставшиеся на ЭКГ после первичного инфаркта миокарда; — ЭКГ-признаки повторного инфаркта полностью маскируются признаками, обусловленными рубцовыми изменениями; — на ЭКГ сохраняются изменения после перенесенного инфаркта, на которые наслаиваются новые изменения.
Осложнения Осложнения острого периода часто обусловливают довольно высокую смертность. В остром периоде заболевания возможно развитие следующих осложнений: острая сердечная недостаточность, кардиогенный шок (см.), аневризма сердца (см.), нарушения ритма и проводимости сердца, разрыв миокарда, перикардит (см.), тромбоэмболические осложнения, острые эрозии и язвы желудочно-кишечного тракта. Осложнения подострого периода: хроническая недостаточность кровообращения, нарушения ритма и проводимости, хроническая аневризма сердца, постинфарктный синдром (синдром Дресслера). В качестве основных критериев перехода острого периода в подострый период следует считать следующие: — нормализацию расстройств кровообращения, стабилизацию сердечного ритма; — появление на ЭКГ признаков подострой фазы; — нормализацию количества ферментов, изменений в периферической крови, нормализацию температуры тела. Наиболее грозным осложнением острого периода инфаркта миокарда, приводящим к высокой смертности, является острая сердечно-сосудистая недостаточность, которая проявляется острой левожелудочковой недостаточностью с развитием кардиальной астмы (см.), отека легких (см.) и кардиогенного шока (см.).
Кардиогенный шок В основе кардиогенного шока (см.) лежит нарушение сократительной функции левого отдела сердца с последующим снижением его минутного объема. К уменьшению сердечного выброса приводят также нарушения сердечного ритма, особенно часто — политопная экстрасистолия и пароксизмальная тахикардия (см.). Ведущим механизмом развития является падение сократительной способности миокарда. По мере прогрессирования шока развивается синдром ДВС, нарушается микроциркуляция. В микроциркуляторном русле образуются микротромбы. Необратимость шока зависит от резкого снижения сократимости миокарда и далеко зашедших нарушений микроциркуляции. Из-за большого расхода факторов свертываемости возникает уменьшение свертываемости крови и развитие геморрагического синдрома. У основной части больных шок возникает на фоне болевого приступа, но иногда кардиогенный шок следует за астматическим или гастралгическим вариантом начала инфаркта миокарда. Это происходит чаще в первые минуты и часы заболевания. Больной малоподвижен, заторможен, жалоб на боли не предъявляет, на вопросы отвечает с трудом, у него отмечается резкая слабость. Могут наблюдаться психическое и двигательное возбуждение, спутанное сознание и даже его потеря. Лицо бледное, с синюшным или серовато-пепельным оттенком, губы и слизистые оболочки синюшного цвета, конечности холодные, кожные покровы с мраморным рисунком, холодный и липкий пот. Очень характерно резкое падение кровяного давления: у нормотоников систолическое давление опускается ниже 80 мм рт. ст., у гипертоников ниже 90 мм рт. ст. Пульс малого наполнения, частый, более 100–120 ударов в минуту при сохранении синусового ритма. При снижении артериального давления до 60–80 мм рт. ст. пульс становится нитевидным. Дыхание становится частым и поверхностным (25–35 дыхательных движений в минуту), при низком артериальном давлении нарастают застойные явления в легких. Печень в пределах нормы, диурез снижается, возникает анурия (см.).
Аритмический шок Клинические проявления аритмического шока (см.) непосредственно связаны с острой бради- и тахикардией (см.). Чаще наблюдаются случаи тахисистолического шока, в основе которого лежит приступ желудочковой тахикардии или тахикардической формы фибрилляции предсердий. Брадисистолический шок отмечается у больных с полной атриовентрикулярной блокадой, частота идиовентрикулярного ритма очень низка (менее 20 в минуту), прогноз неблагоприятный.
Рефлекторный (болевой) коллапс Больные беспокойны, стонут от болей, кожа холодная и влажная, пульс урежается до 60–40 ударов в минуту, малого наполнения, систолическое артериальное давление резко снижено (до 70 мм рт. ст.), диастолическое почти не определяется. От истинного кардиогенного шока (см.) рефлекторный коллапс отличается кратковременностью и обратимостью. Коллапс исчезает после устранения тяжелых загрудинных болей.
Разрыв сердца Различают внешние и внутренние разрывы. Первые встречаются чаще. Среди внешних преобладают разрывы стенки левого желудочка. К внутренним разрывам относят разрыв капиллярных мышц и перфорацию межжелудочковой перегородки.
Аневризма сердца Аневризма (см.) сердца — осложнение распространенного трансмурального инфаркта миокарда — представляет собой распространенное выбухание или мешковидную полость, обычно содержащую пристеночный тромб. Острая аневризма формируется в период развития разрушения миокарда в остром периоде инфаркта миокарда. Реже аневризма развивается за счет растяжения неокрепшего рубцового поля. Как правило, полость аневризмы заполнена тромбами, которые приобретают плотный, слоистый или пластинчатый характер. На ее поверхности часто откладываются свежие отложения тромбов, часто крошащиеся, которые могут явиться причиной тромботических осложнений. В результате потери сократительной способности значительного участка сердечной мышцы при аневризме сердца нарушается кровообращение. Сопутствующими признаками являются предшествующая инфаркту миокарда артериальная гипертония (см.), повторные инфаркты, упорная, не поддающаяся терапевтическому лечению застойная сердечная недостаточность. Основным клиническим проявлением аневризмы сердца является прогрессирующая недостаточность кровообращения, протекающая по левожелудочковому типу с нарастающей одышкой, синюшностью, развитием застойных явлений в малом круге кровообращения, появлением приступов сердечной астмы (см.) с переходом в развернутый отек легкого (см.). При объективном исследовании в диагностике аневризмы имеет значение обнаружение в III–IV межреберьях кнаружи от срединно-ключичной линии пульсации, которая носит разлитой, иногда сотрясающий характер. По мере образования и тромбирования аневризматического мешка пульсация исчезает. При развитии аневризмы сердца в этой области могут прослушиваться шумы низкого калибра, которые связаны с завихрением крови в аневризматическом мешке. Нередко аневризма сердца сопровождается проявлениями тромбоэндокардита (см.). Клинические проявления пристеночного тромбоэндокардита складываются из длительного лихорадочного состояния, протекающего с ознобами, слабостью, потливостью. Отмечается анемия (см.), повышенное содержание лейкоцитов и увеличение СОЭ. У больных отмечается застойная недостаточность кровообращения с появлением синдрома нарушения мозгового кровообращения, острого нарушения проходимости основных сосудов конечностей, сосудов кишечника. Течение аневризмы прогрессирующее, часто приводящее больных к инвалидизации или смерти.
Тромбоэмболические осложнения Причиной тромбоэмболических осложнений являются аневризмы сердца с пристеночным тромбоэндокардитом. В подостром периоде тромбоэмболии связаны с возникновением тромбофлебита (см.) вен нижних конечностей и малого таза. Тромбоэмболии наиболее часто локализуются в системе легочной артерии. Клинические проявления тромбоэмболии легочной артерии разнообразны. Тромбоэмболия ствола легочной артерии приводит в большинстве случаев к летальному исходу. В течение первых суток после тромбоэмболии мелких ветвей легочной артерии развивается картина инфаркта легкого. Тромбоэмболия абдоминального отдела аорты и артерий нижних конечностей приводит к острому нарушению проходимости соответствующих крупных сосудов с появлением острых болей в ноге, бледности кожных покровов, исчезновением пульсации артерии. В дальнейшем, если не принять срочных мер, развивается гангрена конечности. Тромбоэмболия мозговых артерий сопровождается внезапным нарушением мозгового кровообращения. Тромбоэмболия почечных артерий проявляется болями в поясничной области, а также может напоминать симптомы острого живота, почечнокаменную колику. Тромбоэмболия мезентериальных сосудов напоминает острую катастрофу в брюшной полости и приводит к высокой смертности.
Постинфарктный синдром К поздним осложнениям относятся постинфарктный синдром, описанный в 1955 г. Дресслером, характеризующийся клиническим симптомокомплексом в виде перикардита (см.), плеврита (см.) и пневмонии (см.). В основе синдрома лежат нарушения иммунных реакций. Этот симптомокомплекс развивается не ранее 10-го дня в подостром периоде. Клиническими проявлениями являются лихорадка и боли в сердце. Боли носят постоянный характер, связаны с актом дыхания. Развитие болевого синдрома (см.) всегда заставляет дифференцировать это осложнение и повторный инфаркт миокарда. Постинфарктный синдром может протекать циклически, в виде повторных вспышек температурной реакции, перикардита, плеврита и изменений лабораторных показателей. В постинфарктном периоде отмечается постинфарктная недостаточность кровообращения. Крупноочаговый кардиосклероз после обширного инфаркта миокарда может протекать бессимптомно или уже в подостром периоде приводить к недостаточности кровообращения. При этом выделяют скрытую и выраженную форму сердечной недостаточности. Недостаточность кровообращения после перенесенного инфаркта протекает в основном по левожелудочковому типу. В развитии хронической формы левожелудочковой недостаточности основную роль играет нарушение сокращения левого желудочка вследствие наличия рубцовой зоны. С истощением компенсаторных возможностей левого желудочка возникает нарушение сократительной функции, проявляющееся в развитии левожелудочковой недостаточности. Клинические проявления левожелудочковой недостаточности могут быть различными — от упорной тахикардии (см.) и одышки при физической нагрузке до развернутых приступов сердечной астмы (см.). Клинически выделяют левожелудочковую недостаточность I степени (тахикардия в покое, одышка при ходьбе), II степени (присоединение к указанным признакам одышки в покое и застойных хрипов в нижних отделах легких) и III степени (наличие приступов сердечной астмы). У больных, которые перенесли инфаркт миокарда, застойная сердечная недостаточность с повышением давления в венозной системе при выраженных явлениях кардиосклероза (см.), аневризмы (см.) сердца развивается значительно позже и протекает с нарастающими признаками правожелудочковой недостаточности. К факторам, способствующим развитию правожелудочковой недостаточности у больных, перенесших инфаркт миокарда, следует отнести длительно существующую артериальную гипертонию (см.), повторные инфаркты миокарда, развитие недостаточности митрального клапана.
Лечение Одним из первых терапевтических мероприятий является прекращение болевых ощущений. С этой целью применяются инъекции обезболивающих средств (мор фин, пантопон), лучше внутривенно, дроперидола 0,25 %-ный раствор по 1–4 мл внутривенно или струйно в зависимости от артериального давления. До введения при хорошей переносимости назначают нитроглицерин по 0,5 мг под язык, затем повторно через 3–5 мин (всего до 3–4 таблеток). Возникающие у некоторых больных гипотония и брадикардия обычно устраняются атропином, угнетение дыхания — налоксоном. В качестве дополнительных мер в случае недостаточной эффективности при повторном введении опиатов рассматривается внутривенное введение бета-блокаторов или использование нитратов. В случае остановки сердца рекомендуется стандартный набор мероприятий, относящихся к сердечно-легочной реанимации. Ряд назначений направлен на предупреждение осложнений и уменьшение вероятности неблагоприятных исходов. Они должны проводиться у всех больных, не имеющих противопоказаний. Наиболее важным в лечении острого инфаркта миокарда является восстановление и поддержание кровотока в коронарной артерии. Время после обращения за помощью до начала тромболитической терапии должно составлять не более 90 мин. С практической точки зрения при поступлении в стационар больного с затяжным приступом боли за грудиной предлагается выделять наличие острого коронарного синдрома с изменениями на ЭКГ или острого коронарного синдрома без изменений на ЭКГ. Первое подразумевает сохранение закупорки сосуда сердца и необходимость мероприятий по восстановлению его проходимости, второе — отсутствие показаний для подобных вмешательств. Эффективность тромболитической терапии зависит в первую очередь от времени начала лечения и максимальна в ранние сроки наблюдения. Внутрисосудистый метод основан на механическом восстановлении просвета сосуда с помощью раздувающегося баллона (чрескожная чреспросветная коронарная ангиопластика). В зависимости от ситуаций, в которых она применяется, выделяют несколько видов вмешательств. Прямая ангиопластика проводится как первичное вмешательство, без предшествующей или сопутствующей тромболитической терапии. Особо показана прямая ангиопластика при наличии кардиогенного шока, при высоком ожидаемом успехе от реканализации инфарктсвязанной артерии и при наличии противопоказаний к тромболитической терапии (при противопоказаниях, связанных с риском кровотечения). Ангиопластика после успешного проведения тромболитической терапии не показана. Хирургическая реваскуляризация (операция аортокоронарного шунтирования) в остром периоде инфаркта миокарда имеет ограниченное значение. Аспирин необходимо назначать всем больным с острым коронарным синдромом, не имеющим противопоказаний, независимо от тромболитической терапии. Гепарин применяется у всех больных, подвергшихся тромболитической терапии и одновременно получающих аспирин. Профилактическое применение противоаритмических препаратов не рекомендуется. Применение бета-блокаторов показано после введения наркотических анальгетиков при наличии тахикардии в отсутствие сердечной недостаточности, относительного повышения артериального давления и сохраняющихся болей в области сердца. Схемы реанимационных мероприятий при различных синдромах, характерных для инфаркта миокарда Прекращение болевого синдрома при инфаркте миокарда. I. Нитроглицерин по 0,5 мг под язык, при хорошей переносимости повторно через 3–5 мин, до 3–4 таблеток суммарно или нитроглицерина 1 %-ный раствор по 1 мл внутривенно капельно, скорость введения зависит от величины артериального давления. Снижение систолического давления должно составлять не более 10 % от исходного, а при гипертонической болезни — не более 30 %. Нитроглицерин не назначается при инфаркте правого желудочка. II. Морфина 1 %-ный раствор по 1 мл внутривенно струйно молодым или злоупотреблявшим ранее алкоголем; 2 %-ный раствор в дозе 1–2 мл внутривенно струйно пожилым больным вместе с 0,25 %-ным дроперидолом по 1–4 мл внутривенно струйно в зависимости от артериального давления; димедрола 1 %-ный раствор по 1–2 мл внутривенно струйно; аспирин по 250 мг внутрь (разжевать). III. При сохранении болей в течение 5–7 мин назначают фентанил 0,005 %-ный (2 мл) внутривенно струйно, или омнопон 2 %-ный (3 мл), или промедол 2 %-ный (1,0 мл) внутривенно струйно вместе с 0,25 %-ным дроперидолом внутривенно струйно; димедрол 1 %-ный по 1 мл внутривенно струйно, атропин 0,1 %-ный по 1 мл внутривенно струйно, гепарин по 5—10 тыс. ЕД внутривенно струйно. IV. Стрептокиназа, если от начала острого инфаркта миокарда прошло не более 6 ч. Вводится 1,5 мл в течение 30 мин с предварительным введением 70—100 мг преднизолона внутривенно струйно. Гепарин по 5 тыс. ЕД, если не вводился ранее. V. При сохранении остаточных болей назначают 50 %-ный раствор анальгина по 2–4 мл, или баралгина 5 мл внутривенно, или спазгана 5 мл с димедрола 1 %-ным раствором (1 мл) или реланиума 0,5 %-ным раствором (2 мл) внутривенно струйно. VI. Ингаляция закиси азота в комбинации с кислородом в соотношении 1:4 (затем — 1:1) дает положительный эффект. Допускается введение следующих препаратов: — кардиоселективные бета-адреноблокаторы (метопролол по 5 мл внутривенно трижды с перерывом 15 мин или атенолол по 5—10 мл внутривенно, затем по 50 мг 2 раза в день внутрь). Следует учитывать, что бета-блокаторы противопоказаны при гипотонии, брадикардии, сердечной недостаточности, бронхоспазме в течение болезни; — магния сульфат 25 %-ный — 5—10 мл внутривенно, медленно при высоком давлении; — аминазин 2,5 %—0,5 %-ный внутримышечно. Схема прекращения кардиогенного шока при остром инфаркте миокарда: — нитроглицерин 0,5 мг под язык каждые 5 мин до начала капельной терапии; — нитроглицерин 1 %-ный по 1 мл (или изокет 0,1 %-ный, или нитро 0,5 %-ный — 2 мл) на 200 мл физиологического раствора или 5 %-ный раствор глюкозы внутривенно капельно по 10–20 мкг в минуту; — дофамина 25—200 мг, при систолическом давлении более 70 мм рт. ст. вводится внутривенно капельно со скоростью 10–30 мкг/мин; — норадреналин 0,2 %-ный при систолическом давлении менее 70 мм рт. ст. в составе капельницы со скоростью от 0,5 до 30 мкг/мин; — обязательно катетеризируется крупная вена, устанавливается мочевой катетер; — проводится тромболитическая терапия, прекращается болевой синдром по схеме; — вводится лазикс (фуросемид) 1 %-ный по 2–4 мл внутривенно струйно при систолическом давлении более 80 мм рт. ст. в течение 30–60 мин до появления соответствующего диуреза; — ингаляции кислорода; — при частоте дыхательных движений более 30 в минуту показана искусственная вентиляция легких; — если больной получал бета-блокаторы, рекомендуется глюкагон по 5—10 мг внутривенно, агонисты кальция — кальция хлорид по 5—10 мл внутривенно, допускается введение преднизолона по 60–90 мг внутривенно струйно, эуфиллин 2,4 %-ный по 2 мл внутривенно при частоте сердечных сокращений более 70 в минуту, повторное введение каждые 2 ч; сердечные гликозиды (строфантин 0,025 %-ный по 0,3–0,5 мл, коргликон 0,06 %-ный по 0,5 мл). Схема снятия отека легких I. Положение в постели с приподнятым головным концом или сидя. II. Нитроглицерин по схеме, морфин, лазикс, дроперидол или эуфиллин. III. Внутривенное введение медикаментов вызывает перегрузку и ухудшает состояние больного, в связи с чем вводить медикаменты следует очень медленно. IV. Медикаментозная терапия проводится при постепенной даче кислорода и ингаляции постоянного аэрозольного пеногасителя (96 %-ный спирт или 10 %-ный спиртовой раствор антифомсилана). V. Допускается введение преднизолона, димедрола, сердечных гликозидов, накладываются турникеты из жгутов на 3 конечности с перемещением каждые 15 мин по часовой стрелке. Диета больных с острым инфарктом миокарда: показана легкоусвояемая пища с отсутствием богатых клетчаткой продуктов, вызывающих вздутие живота; необходимо уделить внимание регуляции функции кишечника. Физическая реабилитация включает 2 программы внутрибольничной реабилитации — двухнедельную и трехнедельную. Согласно первой программе больному в первую неделю заболевания разрешается самостоятельно сидеть в кресле-кровати, в начале второй недели — ходить по палате, затем по коридору, а с начала 3-й недели — подниматься по ступенькам лестницы. Вторая 5-недельная программа предназначена для больных с тяжелым течением инфаркта миокарда. Она предусматривает более медленную активизацию больного. Затем реабилитация проводится в местном санатории. Третий этап — диспансерно-поликлинический, на этом этапе решаются вопросы поддержания физической работоспособности, временной нетрудоспособности.
ИНФАРКТ КИШЕЧНИКА
ОпределениеИнфаркт кишечника — это очаги омертвения в кишечнике, возникшие в результате нарушения доставки крови по артериям кишечника.
Этиология и патогенез Редким осложнением атеросклероза (см.) артерий кишечника является развитие в них тромбоза в результате закрытия их просвета. При тромбозе мелких ветвей артерий кишечника благодаря развитию обходного кровообращения может не наблюдаться тех грозных явлений, которые возникают при закрытии просвета крупных артерий; в последнем случае образуются инфаркты кишечника.
Клиническая картина Тромбозу артерий кишечника могут предшествовать приступы сильных болей в животе, часто со рвотой. При закрытии просвета артерии и возникновении инфаркта кишечника развивается тяжелая клиника на протяжении очень короткого отрезка времени. Больной жалуется на внезапное появление резких, разлитых, нередко блуждающих болей в животе, чаще более выраженных в области пупка. Боль не прекращается при введении наркотических препаратов. Резко ухудшается общее состояние, порой развивается тяжелая картина коллапса. Симптомы раздражения брюшины вначале отсутствуют, они появляются позднее, с развитием явлений перитонита. Вскоре при тромбозе верхней артерии кишечника появляется повторная рвота с примесью крови цвета кофейной гущи, а также желчи. Затем рвотные массы принимают каловый характер. При тромбозе нижней кишечной артерии рвота обычно отсутствует. Более характерно обнаружение в кале крови, которая в связи с кишечным кровотечением может выделяться из заднего прохода в неизмененном виде в большом количестве (1 л и более). Наличие чистой крови в стуле часто ведет к ошибочному диагнозу кровотечения из геморроидальных узлов. В дальнейшем развивается тяжелая картина кишечной непроходимости, прекращается отхождение стула и газов, в результате омертвения петель кишечника появляются симптомы перитонита (см.). Больной быстро погибает, если своевременно не применены экстренные меры (дезинтоксикация, хирургическое вмешательство), что случается нечасто. Правильное прижизненное распознавание тромбоза артерий кишечника на почве атеросклероза (см.) встречается редко. В большинстве случаев больные поступают в стационар с диагнозом других заболеваний органов брюшной полости: аппендицит (см.), кишечная непроходимость (см.), желчнокаменная болезнь (см.), желудочное или кишечное кровотечение, острый живот. Важными для установления правильного диагноза являются пожилой возраст, наличие выраженного атеросклероза (см.), особенно атеросклероза брюшной аорты и нижних конечностей, тромбоэмболических процессов.
Лечение и профилактика При быстром распознавании тромбоза назначение в первые же часы гепарина внутривенно с интервалом в 6 ч на протяжении двух дней на фоне применения тромболитических препаратов и ацетилсалициловой кислоты под контролем свертываемости может способствовать восстановлению кровообращения в закупоренной артерии. Хирургическое вмешательство с удалением пораженного отрезка кишки при омертвении небольшой части кишечника, предпринятое своевременно, до развития разлитого перитонита, может привести к благоприятному исходу. Профилактика связана с лечением атеросклероза и гипертонической болезни.
ИРИДОЦИКЛИТ
ОпределениеИридоциклит представляет собой воспаление переднего отдела сосудистой оболочки глаза (радужки и ресничного тела).
Этиология и патогенез Причины заболевания многообразны: общие заболевания организма, чаще инфекционной природы, вирусные инфекции, ревматизм (см.), туберкулез (см.), очаговые инфекции, травмы глаза, сифилис (см.), токсоплазмоз (см.), диабет (см.), подагра (см.), гонорея (см.), бруцеллез (см.). Заболевание возникает в результате заноса с кровью в ткань радужки и ресничного тела возбудителей различных инфекций и их токсинов. Причиной заболевания могут также быть различные токсикоаллергические реакции на разного рода воспалительные процессы, а также как осложнение воспалительных заболеваний роговицы или проникающих повреждений глазного яблока.
Клиническая картина Различают две формы иридоциклита — острую и хроническую.
Острый иридоциклит При остром иридоциклите возникают сильная боль в глазу, светобоязнь, слезотечение, блефароспазм, головная боль. Характерны распространенное покраснение непрозрачной оболочки глаза вокруг роговицы с лиловым оттенком (перикорнеальная инъекция), изменение цвета и стушеванность рисунка радужки, сужение и деформация зрачка, плохая реакция его на свет. При расширении зрачка (1 %-ный раствор платифиллина, 1 %-ный раствор гоматропина, 0,25 %-ный раствор скополамина или 1 %-ный раствор атропина) в результате спаек радужки с передней поверхностью хрусталика зрачок принимает неправильную звездчатую форму. Влага передней камеры мутнеет, в области зрачка образуется желатинообразный экссудат. На задней поверхности роговицы появляются серовато-белые, округлой формы отложения экссудата (преципитаты). В тяжелых случаях виден гнойный экссудат, определяется помутнение в стекловидном теле. Заболевание длительное, с рецидивами. Гриппозный иридоциклит возникает и протекает остро, болевой синдром выражен незначительно. Процесс развития нарушений проявляется в резкой воспалительной реакции, появлении серозной жидкости, отложении воспалительных веществ в виде мелких точек на задней поверхности роговой оболочки. Быстро появляются сращения зрачкового края радужной оболочки с передней капсулой хрусталика в виде отдельных пигментных точек. С течением времени в результате повышения проницаемости сосудов ресничного тела в стекловидном теле образуется нежное помутнение. Исход процесса благоприятный, но возможны рецидивы. Чаще поражается один глаз. Ревматический иридоциклит начинается остро и бурно протекает. Наблюдается кровоизлияние в переднюю камеру, а также под конъюнктиву, имеется резкая смешанная инъекция глазного яблока. Экссудация имеет желатинозный характер, незначительная; однако возникают многочисленные пигментные точки. Стекловидное тело редко вовлекается в патологический процесс. Поражаются оба глаза. Заболевание возникает осенью и весной, совпадает с рецидивами ревматизма. Иридоциклит при коллагеновых заболеваниях. Наиболее изученным является иридоциклит при инфекционном неспецифическом полиартрите. Поражение глаз возникает внезапно, течение его вялое. Наиболее ранними признаками являются мелкие отложения воспалительных веществ на задней поверхности роговой оболочки у внутреннего и наружного угла. В дальнейшем на задней поверхности роговой оболочки появляются лентовидные и множественные сухие отложения, а также нежные лентовидные помутнения в глубоких слоях роговой оболочки у внутреннего и наружного лимба. В дальнейшем на роговой оболочке лентовидные и множественные помутнения становятся грубыми, захватывают роговицу на протяжении всей глазной щели. Строма радужной оболочки атрофична, видны сосуды, образуются новые сосуды, множественные задние синехии, а иногда и сращения; могут наблюдаться заращение зрачка и помутнение стекловидного тела. Затем развивается вторичная катаракта. Чаще поражаются оба глаза.
Хронический иридоциклит Хронические иридоциклиты характеризуются вялым рецидивирующим течением, отмечаются незначительная боль, некоторое покраснение, но часто выражена экссудация, что приводит к образованию грубых спаек радужки с хрусталиком, отложению экссудата в стекловидном теле, атрофии глазного яблока. Большую роль в развитии хронических иридоциклитов играют вирус простого герпеса, туберкулез (см.), проникающие ранения глаза. Туберкулезный иридоциклит имеет вялое течение, возникает постепенно, характерно появление в радужной оболочке новых сосудов, которые иногда подходят и окружают одиночные или множественные туберкулезные бугорки. Могут отмечаться летучие узелки по краю зрачка. Отложения крупные, имеют сальный вид, содержат много экссудата. Точки широкие, сравнительно часто они приводят к полному сращению и заращению зрачка, в стекловидном теле имеются помутнения. Могут поражаться роговая оболочка и белочная непрозрачная оболочка глаза. Чаще поражается один глаз.
Осложнения Вторичная катаракта (см.), заращение зрачка, срастание зрачкового края радужки на всем протяжении с передней капсулой хрусталика, что сопровождается нарушением оттока внутриглазной жидкости, в результате чего возникает вторичная глаукома. Лечение осложнений проводится в соответствии с клинической картиной и лечением основного заболевания.
Лечение и профилактика Лечение иридоциклита сводится к терапии основного заболевания и специальному офтальмологическому лечению. Последнее включает расширение зрачка мидриатиками. При образовании задних спаек рекомендуется введение путем электрофореза фибринолизина и смеси мидриатиков. Назначаются противовоспалительные и противоаллергические средства: кортикостероиды в виде инстилляций 5 %-ного раствора кортизола по 5–6 раз в день или подконъюнктивальные инъекции. При затихании процесса показана рассасывающая терапия: введение этилморфина, электрофорез с экстрактами алоэ, лидазы, тепловые процедуры. Профилактика заключается в своевременном лечении основного заболевания и ликвидации хронических очагов инфекции.
ИРИТ
ОпределениеИрит — воспалительный процесс радужной оболочки.
Этиология и патогенез Занос инфекции внутрь глаза при травмах, различных заболеваниях (грипп (см.), болезни зубов и миндалин, туберкулез (см.), ревматизм (см.), бруцеллез (см.) и т. д.). Занос возбудителей или их токсинов в сосудистую оболочку глаза происходит через систему сосудов ресничного тела.
Клиническая картина Воспалительный процесс в радужке начинается с ломящих болей в глазу, которые впоследствии распространяются в височную область. Одновременно появляются светобоязнь, слезотечение, спастическое смыкание век, ухудшается зрение. При осмотре отмечается расширение проходящих сосудов. При этом в окружности роговицы возникает розовато-фиолетовый венчик. Конъюнктивальная полость остается чистой, а роговица — блестящей и прозрачной. Характерный признак ирита — изменение цвета радужки. Чтобы получить четкое представление об этом изменении, рекомендуется осматривать радужку при естественном освещении, сравнивая цвет в одном и другом глазу. Серая и голубая радужка приобретает зеленый или ржавый оттенок, коричневая становится желтой. Меняя цвет, радужка мутнеет и теряет характерный рисунок углублений (крипт радужки). Покраснение сосудов при ирите обусловливает сужение зрачка, которое легко можно заметить, сравнивая больной глаз со здоровым. Чтобы правильно диагностировать заболевание, необходимо знать характерные отличия ирита от приступа глаукомы (см.). При ирите зрачок больного глаза значительно меньше и не так живо реагирует на свет, как зрачок здорового глаза, при прощупывании больной глаз кажется мягче здорового; при глаукоме (см.) зрачок больного глаза шире, чем зрачок здорового, и не суживается при освещении глаза, при прощупывании больной глаз кажется намного тверже здорового. Характерной особенностью ирита являются так называемые спайки (синехии); спайки радужки с передней поверхностью хрусталика называются задними спайками радужки. Обнаружить их можно при закапывании в глаз мидриатиков (1 %-ного платифиллина, 1 %-ного гоматропина гидробромида или 1 %-ного атропина). Под их действием зрачок расширяется неравномерно и форма его становится неправильной. Если же закапать мидриатики в здоровый глаз, зрачок хотя и будет расширяться неравномерно, но сохраняет круглую форму. Задние спайки представляют определенную опасность при ирите. Их большое скопление может препятствовать проникновению внутриглазной жидкости через зрачок в переднюю камеру. Это приводит к образованию избытка жидкости и, как следствие, к повышению внутриглазного давления. Если его не снизить, может наступить слепота. Осложнениями ирита являются снижение остроты зрения, катаракта (см.), вторичная глаукома (см.).
Лечение Неотложная помощь в лечении воспалительного процесса сосудистой оболочки глаза заключается прежде всего в предупреждении образования задних спаек радужки или их разрывов, если они уже появились. Для этого применяют повторное закапывание мидриатиков. Следует помнить, что мидриатики можно применять только при пониженном внутриглазном давлении (при повышенном вместо указанных препаратов лучше использовать 0,1 %-ный раствор адреналина или 1 %-ный раствор мезатона). Тампон, смоченный одним из этих растворов, закладывают за нижнее веко. Затем проводят многократное закапывание раствора офтан-дексаметазона или 1–2 %-ной суспензии гидрокортизона. Одновременно необходим прием антибиотиков. Лечение зависит от происхождения заболевания, проводится соответствующая терапия антибиотиками, местно применяют кортикостероиды. Обязательно проводят витаминотерапию. При уже образовавшихся задних спайках рекомендуется введение путем электрофореза фибринолизина, папаина и смеси мидриатиков. При затихании воспалительного процесса показаны рассасывающая терапия, электрофорез с экстрактами алоэ, лидазой, тепловые процедуры.
ИСТЕРИЯ
ОпределениеПод истерией, или истерическим неврозом, понимают заболевание, вызванное психической травмой, в результате которой возникает так называемый механизм «бегства в болезнь», или условной желательности болезненного симптома.
Этиология и патогенез Врачами давно подмечено, что истерический симптом является желательным и дающим определенные житейские выгоды для больного: либо уход от невыносимой действительности, либо выход из тяжелой ситуации. И. П. Павлов считал, что временное нарушение психики под воздействием психотравмирующего фактора, дающее ту или иную выгоду в данной ситуации человеку, склонному к истерии, может закрепиться по механизму образования условного рефлекса. В мирное время неврозы (см.) связаны в основном с семейными, бытовыми или служебными конфликтами. При этом такие истерические симптомы, как слепота, глухота (см.), немота, параличи (см.) рук и ног, т. е. симптомы, которые существенно ограничивают возможности больного, нерациональны и встречаются редко. Чаще наблюдаются астенические симптомы, депрессивные и ипохондрические (см.) состояния, сердечно-сосудистые приступы, так как широкая известность симптомов этих заболеваний способствует их имитации при истерии. Приятными, выгодными и желательными для больных могут быть заболевания или легкие ранения, избавляющие их от тех или иных неприятных обязанностей. Этот механизм является специфическим для истерии и отличает ее от других неврозов. При истерии всегда необходимы зрители. Когда их нет, то нет и истерических проявлений. Механизм внушения довольно часто играет заметную роль в возникновении истерических симптомов. Однако под влиянием внушения могут возникнуть не только истерические симптомы, но и явления помешательства, сверхценные идеи и т. д. Самовнушение играет большую роль в возникновении невроза ожидания и тех форм неврастении, при которых нарушаются функции внутренних органов. Если в возникновении внушенного или самовнушенного симптома участвует механизм «условной приятности» и желательности болезненного симптома, то симптом этот истерический, если не участвует — не истерический. Таким образом, возникновение симптома путем внушения или самовнушения еще не говорит о его истерической природе. Она может быть и при других состояниях, например при органических болезнях мозга. Типичны для истерии проявления повышенной эмоциональности, носящие характер театральности, демонстративности, нарочитости и обладающие чертами «приятности» или «выгодности» для больного. Психотравмирующие раздражители, вызывающие истерический невроз, могут быть не столько интенсивными и сильными, сколько длительными. Но если к моменту действия раздражителя уже имеется болезненная ситуация, то это часто приводит к истерической реакции. Легче всего истерия возникает у лиц художественного типа или склонных к грезам, фантазиям, театральности, лживости, стремлению обратить на себя внимание окружающих.
Клиническая картина Для истерии характерны разнообразие и изменчивость симптомов. Так как внушаемость больного повышена, то один симптом может быстро сменять другой. Клинически различаются истерические припадки, истерические параличи (см.) и контрактуры (см.), истерические нарушения чувствительности, истерические боли, истерическая рвота, истерический амавроз, глухота (см.), афония (см.), психические расстройства (см.). Истерические судорожные припадки могут сопровождаться криками, плачем, состоянием экстаза со стонами, больные рвут на себе волосы, но при этом обязательно должны быть зрители. Большой истерический припадок — это целое представление, которое состоит из нескольких актов. Вначале развивается приступ, напоминающий эпилептический, возникают судороги, возможна так называемая «истерическая дуга», когда больной выгибается дугой, опираясь на затылок и пятки. Эта фаза переходит в фазу больших движений и клоунизма. Совершаются крупные размашистые движения, больные могут биться головой, руками, ногами. Затем может развиться серия «страстных поз», когда лицо больного, его позы, движения выражают гнев, ужас, экстаз. Далее следует фаза галлюцинаторно-делириозных переживаний, когда больной начинает плакать или смеяться, что-то шептать, прислушиваться, видеть «картины» и т. д. Больные помнят свои видения, но не все могут пересказать. Припадки длятся от часа до нескольких часов (в зависимости от аудитории). Многие истерические припадки не сопровождаются падением. Чаще всего это жалобы на дурноту, боли в области сердца, сердцебиение, спазмы в области горла, затрудненное дыхание. Лицо может краснеть или бледнеть. Пульс хорошего наполнения, ритмичный. Больные могут производить руками какие-то движения, обычно беспорядочные, но могут и оставаться неподвижными в течение какого-то времени. Могут наблюдаться приступы истерической спячки (припадки летаргии), которые могут повторяться несколько раз в день. Длительные состояния истерической спячки являются истерическим ступором. Истерические припадки необходимо отличать от припадков эпилепсии (см.), при которых нет зрителей, больной находится в тяжелом состоянии, может прикусить себе язык, возможны непроизвольные мочеиспускание и дефекация. При припадках истерии всегда должен быть зритель, без зрителей припадок не развивается. При истерическом припадке больной падает на кровать, диван или кресло и никогда не наносит себе сколько-нибудь серьезных травм. При эпилепсии (см.) отмечаются сокращение мышц лица и резкое «зажатие» большого пальца в кулак. После приступа у больного эпилепсией наблюдается глубокий сон, а у истериков никакого последействия нет. Истерические параличи и контрактуры (см.) поражают какую-либо часть тела (руку, ногу, кисть, стопу и т. д.); часто граница поражения проходит строго по линии сустава. Чаще всего наблюдаются параличи мышц конечностей. Может страдать одна рука или одна нога, обе руки или одна рука, одна нога на одной половине тела или все конечности разом. Параличи мышц языка и шеи встречаются редко. Истерические контрактуры чаще всего поражают мышцы шеи (истерическая кривошея) или туловища. Они могут фиксировать тело в вычурных позах, которые не наблюдаются при органических поражениях. Если при истинных параличах и контрактурах наблюдается повышение рефлексов и снижение тонуса мышц, то при истерических параличах и контрактурах этого нет. Рефлексы остаются живыми, а тонус мышц не изменен. У больных с истерическими нарушениями движений нет характерной позы истинно парализованных людей. При истерии также наблюдаются расстройства чувствительности, которые выражаются в снижении болевой чувствительности или ее повышении, истерических болях. Распространение участков нарушения чувствительности не соответствует характеру иннервации, а связано с субъективными представлениями о распределении функций. Чаще всего это анестезии по типу «перчаток», «куртки», «чулок» и т. д. Истерические боли могут носить самый различный характер и иметь разнообразную, подчас самую немыслимую, локализацию (например, ограниченный участок на голове, как от вбитого гвоздя). Истерические боли очень трудно отличить от физических. При истерии могут наблюдаться расстройства вегетативных функций, которые чрезвычайно разнообразны. К описываемой форме относятся спазмы мускулатуры пищевода, которые вызывают «истерический комок». Приистерической рвоте обязательно должны быть зрители, требуется мотив «приятности» или выгодности ситуации. Истерические расстройства органов чувств чаще всего выражаются в нарушении слуха и зрения. Истерический амавроз — полная истерическая потеря зрения — может быть как на один глаз, так и на оба. При полной истерической слепоте на один глаз бинокулярное зрение оказывается сохраненным. При полной истерической слепоте больные уверены, что они «абсолютно ничего не видят», однако в действительности обнаруживается сохранность зрительного восприятия, такие больные никогда не попадают в опасные для жизни ситуации. Истерическая глухота (см.) чаще всего возникает в военное время и встречается чаще, чем истерическая слепота. Глухота может сочетаться с нарушениями речи, часто при истерической глухоте наблюдается отсутствие или снижение чувствительности ушных раковин, чего в действительности быть не может. Люди с истерической глухотой прекрасно воспринимают речь и направленность внимания. Таким образом, глухота носит избирательный характер; вся информация, которая относится к их особе, усваивается и соответственно обрабатывается. Истерическая афония (см.) (утрата звучности голоса) и истерический мутизм (см.) (немота) — также нередкие нарушения. В основе мутизма лежит спазм голосовых связок. В отличие от органически обусловленной афонии, кашель у больных остается звучным. Больные с истерическим мутизмом охотно общаются жестами и письменно, у них сохраняется понимание устной речи, чтения, письма. Психические расстройства при истерии разнообразны. Могут возникнуть кратковременные галлюцинации (см.) с яркой эмоциональной окраской, театрально-драматическим характером переживаний. Истерическое нарушение памяти выступает в виде амнезии (см.). К истерии относятся и различные страхи, истерическая астения, ипохондрия. Могут наблюдаться сумеречные состояния, истерический ступор и другие психические расстройства (см.).
Лечение и профилактика Основным методом лечения является психотерапия во всех ее разновидностях. С первых дней заболевания следует всячески укрепить состояние, обеспечить покой, отдых, общеукрепляющее лечение. Если больной возбужден, ему назначают препараты валерианы, брома, транквилизаторы или малые дозы нейролептиков. При упорной бессоннице дают снотворное перед сном. Необходимо выяснить травмирующий фактор и попытаться устранить его, помочь больному найти разумный выход из сложившейся ситуации, прибегнуть к методу косвенного внушения, назначить физиопроцедуры и витаминотерапию. Следует попытаться внушить больному, что его состояние вызвано «бегством в болезнь», поэтому главное — изменение тех жизненных условий, которые способствовали его возникновению. Большое значение имеют правильные трудовой и бытовой режимы, а также рациональное воспитание. Нужно осторожно проводить психотерапию, выявить болезненные переживания, нарушающие психические функции, уделить внимание сексуальным проблемам. При этом следует остерегаться фиксировать внимание больного на тягостных переживаниях во избежание закрепления или дальнейшего развития болезненных явлений. Многие симптомы могут быть устранены гипнозом. Припадки, приступы возбуждения следует либо игнорировать, либо прекращать с использованием авторитета врача и простого внушения. Решающее значение имеет трудовая терапия, отвлекающая больного от его переживаний и создающая условия для здорового общения с коллективом. Если истерические психозы проявляются более выраженно, необходимо стационарное лечение и удаление больного из вредно действующей на него обстановки. Целесообразно применять психотерапию — лечение прямым и косвенным внушением наяву и в гипнотическом сне. При лечении косвенным внушением применяют электропроцедуры, массаж, витаминотерапию. Можно использовать внушение во сне. Применение репрессивных методов лечения у больных истерией недопустимо. Больному показано назначение трав, способствующих успокоению нервной системы (валериана, пустырник), также назначают препараты брома, либриум, андексин, малые дозы аминазина и резерпина. Хороший эффект при лечении двигательных нарушений, мутизма, сурдомутизма оказывает применение амитал-кофеиновых растормаживаний. Для этого вводят подкожно 1 мл 20 %-ного раствора кофеина и через 5 мин — 3–6 мл свежеприготовленного 5 %-ного раствора амитал-натрия внутривенно. Во время процедуры необходимо давать больному разъяснения, которые направлены на ликвидацию болезненных нарушений. Проводят 5—10 таких сеансов. При затяжных истерических припадках вводят хлоралгидрат в клизме. Показание — хвойносолевые ванны. Применяются точечный массаж, иглорефлексотерапия, традиционный успокаивающий массаж. Профилактика истерии сводится к созданию условий, уменьшающих возможность травматизации психики; основное значение имеют правильное воспитание, удовлетворительные условия в быту и на работе.
ИХТИОЗ
ОпределениеИхтиоз — наследственный дерматоз, характеризующийся ороговением и связанный с эндокринно-вегетативной недостаточностью.
Этиология, патогенез и патанатомия Играют роль эндокринные нарушения, возможно врожденное нарушение обмена веществ. Заболевание передается по наследству, характеризуется склонностью к образованию чешуек и постоянному шелушению и без того очень сухой кожи, нередко с повышенной пигментацией. При ихтиозе отмечаются гиперкератоз (см.) различной степени выраженности, истончение или даже полное отсутствие зернистого слоя, незначительные скопления тучных клеток вокруг сосудов сосочкового и подсосочкового слоев, а также атрофия сальных желез.
Клиническая картина Выделяются несколько клинических форм, обусловленных различными группами мутантных генов: ксеродермия, простой ихтиоз и змеевидный ихтиоз. Ксеродермия — самая легкая форма, которая выражается слущиванием тонкого слоя, главным образом на разгибательных поверхностях конечностей. Чешуйки мелкие, отделяющиеся от конечностей, прикрепленные в центральной части к коже, края чешуек загнуты кнаружи. Наблюдается ладонно-подошвенная кератодермия, часто вплоть до ангидроза. Кожа шероховатая, легкая царапина ногтем вызывает появление мучнистобелой полоски.
Врожденный ихтиоз
При простом ихтиозе на сухой коже имеются округлые или полигональные серовато-белые блестящие чешуйки-пластинки, плотно приращенные в центре и несколько отстающие по периферии, напоминающие рыбью чешую. Змеевидный ихтиоз характеризуется образованием возвышенных, многогранной кубической формы щитков — чешуек серо-зеленого, буроватого и даже черного цвета, отделенных друг от друга глубокими бороздками. В одних случаях поражение бывает распространенным, в других занимает только ограниченный участок кожи, тогда как на остальных имеются изменения, свойственные простому ихтиозу или ксеродермии. Самой тяжелой формой является иглистый ихтиоз, при котором чешуйки выступают на несколько миллиметров над уровнем кожи в виде шипов грязно-серого или буро-черного цвета. Эта форма ихтиоза обычно комбинируется со змеевидной. Ихтиоз всегда имеет симметричное расположение, наиболее резко выражен на разгибательных поверхностях конечностей (локти, колени) и в области крестца. Остальные участки кожного покрова, в том числе волосистой части головы, поражаются значительно слабее. Слизистые оболочки остаются свободными. Потоотделение или отсутствует, или крайне незначительное. Функция сальных желез снижается. Волосы в резко выраженных случаях истончаются, становятся сухими, тусклыми и нередко выпадают. Ногти обычно не изменяются, но иногда истончаются и становятся ломкими или, наоборот, утолщаются. Субъективно больные отмечают легкий зуд. Лица, страдающие ихтиозом, обычно худы, слабо развиты физически, нередко у них наблюдается недоразвитие половых желез. Начавшись в раннем детском возрасте, болезнь достигает максимального развития к периоду полового созревания и в таком виде остается на всю жизнь. В летнее время наблюдается некоторое улучшение, а при простом ихтиозе даже кажущееся выздоровление, но с наступлением зимы вновь отмечается утяжеление процесса.
Лечение В лечении применяются: ретинол, токоферол ацетат, аевит, аскорбиновая кислота, иммуноглобулин, при гипофункции щитовидной железы — тиреоидин. В тяжелых случаях назначаются внутрь кортикостероидные препараты. В остальном лечение симптоматическое. Назначаются теплые ванны, массаж, показано пребывание в теплом влажном климате, который приносит больному некоторое облегчение.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ КИШЕЧНИКА
ОпределениеИшемическая болезнь — острая или хроническая недостаточность кровообращения в бассейнах чревной, верхней и нижней кишечных артерий, приводящая к недостаточности кровотока в отдельных участках или во всех отделах кишечника.
Этиология, патогенез и классификация Основными причинами ишемической болезни кишечника являются атеросклероз (см.), системные васкулиты (см.), системные заболевания соединительной ткани, фиброзная дисплазия (см.), аномалии развития сосудов, сдавление сосудов извне, инфекционный эндокардит (см.), сепсис (см.), наследственная гемолитическая анемия (см.), полицитемия. Нарушение кровоснабжения различных отделов кишечника приводит к выраженным дистрофическим, ишемическим (различной степени выраженности) изменениям кишечной стенки и (как высшая степень ишемии) омертвению кишки. Ишемическую болезнь кишечника подразделяют следующим образом. I. Острая мезентериальная ишемия: — неокклюзионная мезентериальная ишемия; — эмболия верхней мезентериальной артерии; — тромбоз верхней мезентериальной артерии; — локальная сегментарная ишемия. II. Хроническая мезентериальная ишемия (абдоминальная колика). III. Ишемия толстой кишки: — обратимая ишемическая колонопатия; — преходящий язвенный ишемический колит; — хронический язвенный ишемический колит (см.), стриктура толстой кишки, гангрена (см.) толстой кишки.
Клиническая картина Эмболия верхней мезентериальной артерии Верхняя мезентериальная артерия кровоснабжает всю тонкую кишку, слепую, восходящую и частично поперечно-ободочную кишку. Наиболее частыми источниками эмболии верхней мезентериальной артерии являются тромбы в левом предсердии, на протезированных или измененных вследствие нарушений клапанах (митральном или артериальном), частицы атеросклеротических бляшек. Основными клиническими признаками эмболии верхней мезентериальной артерии являются острая внезапная боль в области пупка или правом верхнем квадранте живота, холодный липкий пот, рвота, жидкий стул, кишечное кровотечение, которое является признаком инфаркта слизистой оболочки кишки (появляется через несколько часов). Отмечаются вздутие живота и болезненность брюшной стенки. При прогрессировании патологического процесса появляются симптомы раздражения брюшины, свидетельствующие о некрозе всех слоев кишечной стенки и развитии перитонита (см.). В этот период исчезают кишечные шумы, появляется пневматизация кишечных петель на обзорных рентгенограммах брюшной полости.
Тромбоз верхней мезентериальной артерии Наиболее частая причина — распространенный атеросклероз. Клинические проявления тромбоза верхней мезентериальной артерии такие же, как при описанной выше эмболии. Однако тромбоз отличается тем, что боли менее интенсивные, не носят схваткообразного характера. Мезентериальный тромбоз может протекать в скрытой форме, но в дальнейшем, по мере нарастания ишемии кишечника, симптомы становятся все более явными, развиваются инфаркт кишки и картина перитонита (см.).
Неокклюзионная мезентериальная ишемия Одной из основных причин, вызывающих развитие неокклюзионной мезентериальной ишемии, является сердечная недостаточность различного происхождения. Клиническая картина сходна с клиникой эмболии и тромбоза верхней мезентериальной артерии. Однако клинические проявления выражены значительно меньше, в том числе болевой синдром (см.), характерны поносы, урчание в животе, метеоризм, похудение.
Тромбоз брыжеечных вен Тромбоз брыжеечных вен может привести к острой ишемии кишечника. Клинически это проявляется нелокализованной болью в животе, вздутием живота, диареей (см.), слегка повышенной температурой тела. Усиление болей в верхней части живота, появление симптомов перитонита (см.), увеличивающееся количество лейкоцитов в крови — признаки, указывающие на развитие инфаркта кишечника. При обзорной рентгенографии определяется расширение петель кишечника. Для диагностики всех форм кишечной непроходимости (см.) применяют лапароскопию.
Хроническая мезентериальная ишемия Основные причины хронической мезентериальной ишемии — облитерирующий атеросклероз (см.) и неспецифический аортоартериит. Чаще всего поражаются чревный ствол и верхняя кишечная артерия, поражение нижней кишечной артерии наблюдается реже. В соответствии с классификацией Б. В. Петровского хроническую мезентериальную ишемию принято подразделять следующим образом: — I стадия — стадия относительной компенсации. На этой стадии нарушения функции желудочно-кишечного тракта незначительны, а заболевание часто выявляется случайно, при обследовании больных по какому-либо иному поводу; — II стадия характеризуется выраженным нарушением функции кишечника и болью в животе после приема пищи; — III стадия проявляется нарушением функции кишечника, постоянными болями в животе, прогрессирующим похудением. Первые проявления хронической мезентериальной недостаточности сводятся к боли в животе, которая часто связана с приемом пищи, возникает через 20–40 мин после еды. Боль не имеет четкой локализации, носит схваткообразный характер, прекращается спазмолитиками. Хроническая ишемия кишечника приводит к нарушению его функций, что проявляется выраженным метеоризмом, урчанием в животе после еды и запором (см.), при длительном течении появляется диарея (см.). Характерные признаки абдоминальной ишемии обнаруживаются при прослушивании живота: шум в точке, расположенной на середине расстояния между мечевидным отростком и пупком, усиление кишечной перистальтики и шумов после еды. При хронической ишемии отмечается снижение массы тела больных. Это обусловлено отказом больного от еды, так как прием пищи вызывает боли в животе и нарушение всасывательной способности кишечника. Данные ангиографии позволяют подтвердить диагноз ишемии кишечника — обнаруживается деформация верхней и нижней мезентериальной артерии.
ИШИАС
Ишиас — поражение ствола седалищного нерва.
Клиническая картина Проявляется болью по задней поверхности бедра, ягодице. Боль усиливается при ходьбе, кашле, чихании. Ишиас нередко является сигналом появления дисковой грыжи или разрыва диска в нижней части спины, когда поврежденный диск давит на спинномозговые нервы, образующие седалищный нерв. Также ишиас может возникнуть вследствие продолжительного сидения в одном положении, иногда из-за общих заболеваний организма типа сахарного диабета.
Лечение В целом лечение ишиаса направлено на уменьшение боли: обеспечение пациенту нескольких дней покоя и прием противовоспалительных лекарственных препаратов и спазмолитиков.
♦ К ♦
КАВЕРНИТ
ОпределениеКавернит — воспалительное заболевание пещеристых тел полового члена. Относится к редкой патологии. Хронический кавернит выявлялся у 0,32 % из числа обследованных (12 486 человек) (И. Ф. Юнда, 1989 г.).
Этиология и патогенез Заболевание имеет гонорейное происхождение. Возбудитель попадает с гноем в пещеристые тела и формирует ограниченный или разлитой воспалительный процесс.
Клиническая картина При остром каверните начало заболевания внезапное, появляются озноб и повышение температуры тела. Местно возникают ограниченная или разлитая припухлость кожи, краснота, эрекции резко болезненны. Половой член во время эрекции искривляется настолько, что совершение полового акта становится невозможным. При прощупывании определяется болезненное образование, которое может увеличиваться или уменьшаться в зависимости от эффективности проводимых мероприятий. Хронический кавернит возникает вследствие недолеченного острого процесса, но чаще развивается как первичный хронический процесс. Проявляется в виде малоболезненного воспалительного образования разной протяженности.
Осложнения При увеличении воспалительное образование разрешается нагноением и вскрытием гнойника. Ограниченный кавернит чаще всего локализуется в пещеристых телах мочеиспускательного канала. Он, как правило, заканчивается околоуретральным абсцессом (см.). Может наблюдаться флегмонозная или гангренозная форма воспаления.
Лечение и профилактика Острый кавернит лечат в условиях стационара по схемам лечения гнойных воспалительных процессов. Назначают пенициллин по 150–200 тыс. ЕД 6–8 раз в сутки внутримышечно или понталицина сульфат по 40 мг 4 раза в сутки внутримышечно, амандомицина фосфат внутримышечно по 250 мг 4–6 раз в сутки в течение 6–7 дней, олететрин по 0,25 г 4–5 раз в сутки. Курс составляет 5—14 дней. Показаны УВЧ-терапия, монофорез антибактериальных препаратов. Из лекарств рассасывающего действия применяют 10 %-ный раствор токоферола ацетата по 2 мл в сутки внутримышечно в течение 20–30 дней или 30 %-ный раствор по 1 мл внутримышечно через день (курс — 15–20 инъекций); трипеин кристаллический по 0,005—0,001 г в ампулах (растворяют в 1–2 мл 2 %-ного раствора новокаина (вводят внутримышечно). Курс составляет 6— 15 инъекций. Хорошее действие оказывают ультразвук, диадинамофорез калия йодида или гидрокортизона. Профилактика кавернита сводится к предупреждению заболеваний, передаваемых половым путем.
КАЛЬЦИНОЗ
ОпределениеКальциноз (синонимы: кальцификация, обызвествление, известковая дистрофия) — это выпадение солей кальция из жидкостей организма, где они находятся в растворенном состоянии, и отложение их в тканях.
Патогенез и патанатомия Обызвествление — сложный процесс, развитию которого способствуют изменение белкового состава и уровня кислотности крови, нарушение регуляции уровня кальция в крови, местные ферментативные и неферментативные факторы. Обызвествлению предшествуют повышение обменной активности клеток, увеличение синтеза ДНК, РНК и белка, а также активизация ряда ферментных систем. Различают клеточное и внеклеточное обызвествление. Его основой могут быть клеточные структуры, гликозаминогликаны основного вещества, коллагеновые и эластические волокна соединительной ткани. Участки обызвествления могут иметь вид мельчайших зерен, обнаруживаемых лишь под микроскопом (пыльцевидное обызвествление), или очагов, хорошо видимых простым глазом. Обызвествленная ткань становится плотной и ломкой, напоминает камень (петрификация ткани) и нередко содержит железо. Химический состав солей кальция в обызвествленной ткани качественно соответствует соединениям кальция в костях скелета. В участках обызвествления возможно образование кости (оссификация). Вокруг отложений появляется реактивное воспаление с разрастанием элементов соединительной ткани, скоплением гигантских клеток инородных тел и развитием капсулы.
Клиническая картина Преобладание тех или иных факторов в механизмах развития кальциноза определяет клиническую картину болезни. Различают метастатическое, дистрофическое и метаболическое обызвествление. Процесс может быть системным (распространенным) или локальным (местным), с преобладанием отложений извести внутри или вне клеток.
Метастатическое обызвествление Возникает при повышении уровня кальция в связи с усиленным выходом кальция из депо, пониженным его выведением из организма, нарушением эндокринной регуляции обмена кальция. Эта патология развивается при разрушении костей (множественные переломы (см.), миеломная болезнь (см.), метастазы опухоли), остеомаляции и паратиреоидной остеодистрофии, поражении толстой кишки и почек (при поликистозе и хроническом нефрите (см.), избыточном введении в организм витамина D и др. Известно, что при метастатическом обызвествлении кальций выпадает в разных органах и тканях, но чаще всего — в легких, слизистой оболочке желудка, в миокарде, в почках и стенке артерий. Это объясняется особенностями обмена в легких, желудке и почках, связанными с выделением кислых продуктов и большой щелочностью их ткани, что является физиологической предпосылкой к обызвествлению. Отложению извести в миокарде и стенках артерий способствует омывание их тканей артериальной кровью, относительно бедной углекислотой. При известковых метастазах соли кальция инкрустируют клетки, волокна и основное вещество соединительной ткани. В миокарде и почках первичное отложение фосфорного кальция находят в клеточных структурах. В стенках артерий и соединительной ткани известь первично выпадает по ходу перегородок и волокнистых структур.
Дистрофическое обызвествление (петрификация) Петрификация — отложение извести в тканях, омертвевших или находящихся в состоянии глубокого истощения. Это местное обызвествление, основная причина которого — изменения тканей, способствующие поглощению извести из крови и тканевой жидкости. Наибольшее значение придается ощелачиванию среды и усилению активности ферментов, высвобождающихся из омертвевших тканей. При дистрофическом обызвествлении в тканях образуются разных размеров известковые скопления каменной плотности (петрификаты). Они возникают в туберкулезных очагах некроза (см.), гуммах, инфарктах (см.), на месте погибших клеток и в очагах хронического воспаления. При обызвествлении экссудата на плевре возникают так называемые «панцирные легкие». При обызвествлении перикарда процесс завершается возникновением «панцирного сердца».
Метаболическое обызвествление (интерстициальный кальциноз) Эта форма занимает промежуточное положение между дистрофическим обызвествлением и известковыми метастазами. Механизм метаболического обызвествления до конца не изучен. Большое значение придается нестойкости компенсирующих систем крови, в связи с чем кальций не удерживается в крови и межклеточной жидкости. Определенную роль может играть повышенная чувствительность организма к кальцию, которую Г. Селье называл кальцификацией. При этом возможна местная и системная кальцификация. Метаболический кальциноз может быть системным и ограниченным. При системном кальцинозе известь выпадает в коже, подкожной клетчатке, по ходу сухожилий и оболочек в мышцах, нервах и сосудах. Предполагают, что при системном кальцинозе первично возникают нарушения обмена жиров соединительной ткани, в связи с чем процесс принято обозначать как липокальциевый гранулематоз. Ограниченный кальциноз, или известковая подагра, характеризуется отложением извести в виде пластинок в коже пальцев рук, реже ног. У детей гиперкальциемия с последующим патологическим обызвествлением внутренних органов наблюдается при первичном паратиреозе, универсальном интерстициальном кальцинозе, синдроме Конради-Хюнерманна, повышенном рассасывании солей кальция в пищеварительном тракте, идиопатической гиперкальциемии, интоксикации витамином D, синдроме чрезмерного потребления молока и щелочей, аномалиях почечных канальцев, синдроме Батлера-Олбрайта, врожденной недостаточности почечной фильтрации со вторичным гиперпаратиреоидизмом. Гиперкальциемия в сочетании с разрежением костей может развиться при недостаточной нагрузке на кость (остеопороз (см.) бездействия), которая наблюдается у детей с глубокими повреждениями конечностей. Кальциноз определяется механизмом развития, распространенностью и характером обызвествлений. Так, универсальный интерстициальный кальциноз представляет собой тяжелое прогрессирующие заболевание, а известковые метастазы обычно не имеют клинических проявлений. Дистрофическое обызвествление стенки артерий при атеросклерозе (см.) ведет к функциональным нарушениям и может являться причиной ряда осложнений (например, тромбоза). Наряду с этим отложение извести в омертвевшем туберкулезном очаге свидетельствует о его заживлении.
КАНДИНСКОГО-КЛЕРАМБО СИНДРОМ (ПАРАНОИДНЫЙ СИНДРОМ)
ОпределениеКандинского-Клерамбо синдром (синдром психологического автоматизма) — одна из разновидностей галлюцинаторно-параноидного синдрома; включает в себя псевдогаллюцинации (возникающие внутри тела, не связанные с объективной реальностью, «наведенные кем-то ощущения»), бредовые идеи воздействия (психологического и физического характера) и явления психического автоматизма (чувство отчужденности, неестественности, «сделанности» собственных движений, поступков и мышления).
Клиническая картина Синдром Кандинского-Клерамбо характеризуется бредовыми идеями политематического характера (бред преследования и др.). Бредовые высказывания сочетаются с галлюцинациями, эмоциональным напряжением и бредовым возбуждением. У больных создается впечатление, что мысли звучат громко и их слышат окружающие. Больные слышат голоса, шумы, крики. В зависимости от преобладания тех или иных симптомов выделяют две разновидности синдрома Кандинского-Клерамбо: с преобладанием нервно-галлюцинаторных расстройств и с преобладанием бреда (см.) воздействия, что обусловлено большей выраженностью патологии образных чувственных восприятий или сферы мышления соответственно. Синдром Кандинского-Клерамбо наиболее характерен для шизофрении (см.), особенно ее параноидной формы, и малоблагоприятен в плане прогноза. Параноидный синдром входит в клиническую картину шизофрении, олигофрении, эпилептических и реактивных психозов.
Лечение Лечение комплексное: медикаментозное (трифтазин, галоперидол), психотерапия (при положительном эффекте психотропных препаратов) с последующей реабилитацией.
КАРБУНКУЛ
ОпределениеКарбункул — острое гнойно-некротическое воспаление нескольких волосяных мешочков и сальных желез, распространяющееся на окружающую подкожную жировую клетчатку и кожу. Оно сопровождается образованием общего воспалительного уплотнения, омертвением кожи и подкожной клетчатки вследствие тромбоза сосудов.
Этиология и патогенез Наиболее частый возбудитель карбункула — золотистый стафилококк, реже стрептококк, иногда встречается смешанная инфекция (стафилококк и стрептококк). Предрасполагающим моментом к развитию карбункула является ослабление общей устойчивости организма при гипо- и авитаминозах (см.), болезнях обмена веществ (сахарный диабет (см.). Основные места локализации карбункула — задняя поверхность шеи, затылок, верхняя и нижняя губа, спина, поясница. Заболевание начинается с появления очага воспаления, охватывающего несколько волосяных фолликулов и сальных желез. Возникает расстройство кровообращения, обусловленное местным тромбозом сосудов с образованием омертвения кожи, подкожной клетчатки, а иногда и глубжележащих тканей. Наряду с омертвением происходит гнойное расплавление тканей с выделением гноя через устья волосяных фолликулов. После отторжения образуется гнойная рана с глубоким дефектом тканей, заживление которой идет вторичным натяжением.
Клиническая картина Больные жалуются на сильную боль, наличие болезненного очага воспаления, повышение температуры тела, озноб, недомогание, слабость, разбитость, потерю аппетита, головную боль. Обязательно следует уточнить возможное наличие сахарного диабета, авитаминозов и истощения. При обследовании, кроме общих признаков гнойного воспаления (повышение температуры, учащение пульса), отмечается сине-багровая припухлость в области задней поверхности шеи или спины, поясницы, лица, реже — конечностей. В начале заболевания может быть несколько очагов воспаления, которые затем сливаются между собой и образуют выраженные припухлости, возникающие над поверхностью кожи. Кожа над ними напряженная, лоснящаяся. В центре ее окраска наиболее интенсивная, сине-багровая, а к периферии постепенно бледнеет. На поверхности очага воспаления определяется несколько гнойников, которые в центре сливаются между собой с образованием обширного омертвевшего участка кожи. Истонченный участок некроза прорывается в нескольких местах с образованием отверстий (симптом сита), из которых выделяется гной. Воспалительное образование имеет плотную консистенцию, резко болезненно, сопровождается выраженным отеком тканей. Регионарные лимфатические узлы увеличены и болезненны (лимфаденит (см.). Реже наблюдается лимфангит. При самостоятельном отторжении омертвевших тканей в центре очага воспаления образуется большая полость, покрытая серозелеными омертвевшими тканями, с обильным отделением гноя.
Осложнения Если отмечаются увеличение отека тканей, прогрессирование омертвения, нарастание симптомов общей интоксикации (учащенное сердцебиение, головная боль, вялость), присоединение потрясающего озноба, проливного пота, лимфангита, лимфаденита (см.) и тромбофлебита (см.), то это расценивается как неблагоприятное течение карбункула с возможным развитием флегмоны (см.) и сепсиса (см.). Особую опасность представляет карбункул лица из-за возможности развития менингита (см.).
Лечение и профилактика В начальной стадии лечение консервативное. Оно включает полный покой пораженного органа. При карбункулах лица больным необходим постельный режим. Им запрещают разговаривать, назначают жидкую пищу. После обработки карбункула 70 %-ным этиловым спиртом накладывают асептическую повязку, назначают УВЧ-терапию. Внутривенно вводят антибиотики, перорально — сульфаниламидные препараты длительного действия. При карбункулах у больных сахарным диабетом необходимы коррекция нарушений обмена веществ, тщательное проведение инсулинотерапии. Безуспешность консервативной терапии в течение 2–3 дней (нарастание процессов омертвения и гнойной интоксикации) является показанием к операции, которую выполняют под наркозом. Крестообразным разрезом рассекают образование до оболочки и производят иссечение омертвевших тканей на всем протяжении, отделяя их от оболочки, кожи, вскрывают гнойные затеки. Кровотечение при этом незначительное (сосуды в области образования закупорены), оно прекращается при введении в рану тампонов с кровоостанавливающими средствами. На лице карбункул вскрывают линейным разрезом после созревания абсцесса. В послеоперационном периоде лечение карбункула проводят по принципу лечения гнойных ран, для окончательного удаления омертвевших тканей применяют протеолитические ферменты. Профилактика заключается в соблюдении общепринятых правил личной гигиены, поддержании общего иммунитета организма на высоком уровне, особенно во время межсезонной адаптации. Это препятствует внедрению возбудителей в волосяные фолликулы.
КАРБУНКУЛ ПОЧКИ
ОпределениеКарбункул почки — метастатическое гнойное поражение почки в виде изолированного очага в веществе почки, содержащего множество мелких гнойничков, окруженных воспалительным образованием; по внешнему виду он напоминает карбункул кожи.
Этиология, патогенез и патанатомия Карбункул почки, являясь разновидностью острого гнойного пиелонефрита, обусловлен проникновением инфекции в почку с появлением в ней воспалительного процесса. Первичными очагами инфекции, откуда она может быть занесена в почку, являются гнойно-воспалительные процессы в любом месте организма. Принято различать следующие пути проникновения инфекции в почку: — вместе с кровотоком; — по лимфатическим сосудам; — по стенке мочеточника; — по просвету его при наличии обратного заброса мочи. Установить в каждом конкретном случае путь проникновения инфекции в почку не всегда возможно. Патанатомия карбункула почки характеризуется образованием ограниченного нагноительного процесса. Его отличают опухолеобразный прогрессирующий рост и воспалительная инфильтрация без наклонности к образованию абсцесса (см.). Размеры карбункула почки колеблются от величины чечевичного зерна до размеров крупного яйца. Изредка вся почка превращается в один гигантский карбункул. На поверхности почки карбункул чаще всего имеет округлую форму. Консистенция карбункула плотная. На разрезе он состоит из массы мелких, сливающихся между собой гнойных очагов, окруженных воспалительным уплотнением и участками некроза (см.). Микроскопически находят множественные очаги гнойного воспаления в почечной ткани и обильный серозно-гнойный экссудат. Отмечаются также скопления мелкоклеточных образований с очагами омертвения. Мочевые канальцы сдавлены и смещены воспалительными образованиями. Эпителий канальцев в местах уплотнения плохо дифференцируется и находится в стадии распада. Вслед за образованием гнойников в почечной ткани имеет место переход воспалительного уплотнения на клетчатку вокруг почки. Механизм образования карбункула начинается с занесения током крови инфекции в какую-нибудь артериальную ветвь, где его развитие приостанавливается и он как бы сидит на ее разветвлении. Возникающий вследствие этого инфарктоподобный процесс осложняется тем, что инфицированный участок постепенно крошится и в виде мельчайших множественных частиц заносится в капиллярную сеть почечной ткани. Вокруг внедрившихся микроорганизмов возникает воспалительная инфильтрация гнойными элементами, которая распространяется по околососудистым пространствам, окружая и сдавливая почечные клубочки и канальцы. Вследствие омертвения инфицированной почечной ткани с постепенным слиянием отдельных мелких гнойничков образуются крупные гнойные очаги — карбункулы.
Клиническая картина Поскольку карбункул почки имеет ограниченный участок поражения, его относят к так называемой подострой форме пиелонефрита (см.). Она характеризуется тем, что общие симптомы отходят на второй план и преобладают явления местного характера. Местные симптомы выражаются в неопределенных болях в верхней части живота или в поясничной области. Боль часто смещается кпереди, в подреберье, иногда — в паховую область и половые органы. Больные отмечают усиление боли при кашле, движении соответствующей ногой. При прощупывании определяется болезненность на стороне пораженной почки, напряжение мускулатуры поясничной области и брюшной стенки. Известное значение может иметь резкая болезненность сзади — на уровне перекрестка нижнего края XII ребра с длинными поясничными мышцами, и спереди — соответственно верхней мочеточниковой точке, на три пальца справа или слева от пупка. Иногда большой карбункул удается прощупать в виде узла на передней поверхности почки. В случаях, когда гнойник локализуется на передней поверхности почки, могут наблюдаться явления перитонита (см.), симулирующие острый холецистит (см.), острый аппендицит (см.), прободную язву желудка (см.) и другие острые заболевания органов брюшной полости. Изменения со стороны мочи у больных карбункулом почки могут быть минимальными или отсутствовать. Однако, как в случае острого пиелонефрита (см.), при выраженности процесса у больных карбункулом почки со стороны мочи могут отмечаться снижение количества мочи, высокая относительная плотность, появление в ней белка, гноя и бактерий. Появление клеток крови в моче может быть при любой форме острого пиелонефрита (см.). Рентгенодиагностика может помочь при выявлении карбункула почки. Так, на обзорном снимке карбункул может быть виден как очаговое выпячивание контура почки или как увеличение ее размеров. Выпячивание контура почки может сочетаться с изменениями в околопочечной клетчатке. Карбункул почки проявляет себя сдавливанием чашечки и лоханки, сужением шейки чашечки либо ампутацией чашечек. Если карбункул в результате абсцедирования вскрывается в лоханку или чашечку, то на рентгенограмме за пределами чашечно-лоханочной системы можно обнаружить дополнительные тени. В том случае, когда гнойно-воспалительный очаг локализуется в верхнем полюсе почки, рентгеноскопия грудной клетки выявляет ограничение подвижности диафрагмы на соответствующей стороне, а иногда и наличие жидкости в плевральной полости. Общие симптомы при карбункуле почки, как правило, выражаются в вялом течении заболевания с относительно невысокой температурой тела при удовлетворительном самочувствии больного. Количество лейкоцитов может быть лишь слегка повышено или в норме.
Осложнения При большой величине карбункула и прогрессирующем воспалительном уплотнении процесс может распространиться на глубжележащий слой и вскрыться в чашечки и лоханку. В других случаях, когда гнойный воспалительный процесс распространяется в сторону капсулы почки, может произойти инфицирование околопочечной клетчатки или вскрытие гнойного очага в нее с образованием паранефрита. В тех случаях, когда карбункул локализуется в верхнем полюсе почки, воспалительный процесс может перейти и на надпочечник, что проявляется снижением его функции.
Лечение и профилактика Лечение карбункула почки оперативное. Цель операции — приостановить прогрессирование гнойно-воспалительного процесса в пораженной почке и предотвратить его возникновение в здоровой. При наличии на поверхности коркового вещества почки гнойничков наиболее крупные из них или их скопления вскрывают, а карбункулы рассекают или иссекают. При своевременно выполненной операции послеоперационный период протекает гладко, температура тела снижается и постепенно приходит к норме, функции пораженной почки быстро восстанавливаются. Профилактика сводится к ликвидации очагов инфекции. При вторичном пиелонефрите (см.) очень важно своевременное лечение урологических заболеваний, осложняющихся воспалительным процессом, а также устранение всех факторов, приводящих к нарушению оттока мочи из верхних мочевых путей. Каждый больной, перенесший острый пиелонефрит, должен оставаться под наблюдением врача и периодически подвергаться обследованию.
КАРДИОМИОПАТИИ
ОпределениеКардиомиопатии — это группа идиопатических невоспалительных заболеваний неясного генеза, не связанных с коронарной болезнью и характеризующихся поражением сердечной мышцы.
Этиология, патогенез и патанатомия Различают дилатационную кардиомиопатию, гипертрофическую кардиомиопатию и рестриктивную кардиомиопатию. При дилатационной кардиомиопатии масса сердца увеличена (часто вдвое), камеры расширены, миокард бледный и дряблый. Стенки желудочков, несмотря на гипертрофию, часто бывают нормальной толщины. Более чем в 50 % случаев наблюдается тромбообразование. В миокарде нередко можно обнаружить очаги замещения соединительной тканью. Коронарные артерии, как правило, не изменены. Исследование ткани не выявляет никаких специфических изменений. В неспецифически утолщенном эндокарде часто обнаруживают увеличение количества волокон соединительной ткани, однако в еще большей степени увеличено количество гладкомышечного компонента. При гипертрофической кардиомиопатии выявляется отчетливо видимая асимметричная гипертрофия межжелудочковой перегородки, непропорциональная остальным отделам увеличенного левого желудочка. Часто на первый план выступает смещение передней сосочковой мышцы. Также отмечается утолщение эндокарда под аортальным клапаном. В большинстве случаев утолщение межжелудочковой перегородки приводит к исчезновению полости желудочка, но последнее встречается не всегда. При рестриктивной кардиомиопатии наблюдается легкая или умеренная степень увеличения сердца с выраженной ретракцией правого желудочка. Часто оказываются пораженными пути притока, верхушка и часть пути оттока из левого желудочка. Аппарат митрального клапана пронизан соединительной тканью, которая обычно захватывает заднюю створку. Предсердия вовлекаются в процесс не очень часто. В случае вовлечения правого желудочка характерно поражение верхушки. При прогрессировании болезни верхушка постепенно подтягивается в направлении клапанов, обусловливая заращение полостей. Коронарные артерии обычно не поражены. В обоих желудочках, а также в предсердиях иногда появляются тромбы. При исследовании ткани обнаруживаются характерные утолщения эндокарда. У поверхности под тромбом и (или) отложением фибрина находится слой коллагеновой ткани, разделенный на две пластины. Под этим слоем расположена зона новой растущей ткани, состоящая из рыхлой соединительной ткани с многочисленными расширенными кровеносными сосудами и воспалительными клетками, среди которых встречаются эозинофилы. Часто выявляют обызвествление и окостенение эндокарда. Различают следующие стадии: — I стадия — градиент давления до 25 мм рт. ст.; — II стадия — градиент давления до 36 мм рт. ст., самочувствие ухудшается при физической нагрузке; — III стадия — градиент давления до 44 ммрт. ст., стенокардия, одышка, нарушение гемодинамики; — IV стадия — градиент давления выше 45 мм рт. ст., значительное нарушение гемодинамики.
Клиническая картина Для клинической картины дилатационной кардиомиопатии характерны нарушения кровообращения. Сердечный выброс и ударный объем снижены, реакция на физическую нагрузку слабее, чем в норме. Наблюдается митральная и трикуспидальная регургитация. Степень регургитации пропорциональна степени сердечной недостаточности. Нередки случаи эмболии (см.) в большом и малом кругах кровообращения. При гипертрофической кардиомиопатии важнейшие нарушения кровообращения касаются диастолы, а фракция выброса из левого желудочка повышена. Часто наблюдаются повышение конечного диастолического давления и запаздывание открытия митрального клапана, что указывает на регургитацию. Наполнение желудочка изменено в результате как нарушенной релаксации, так и вследствие (возможно) неправильной формы полости желудочка. При эндомиокардиальном фиброзе (см.) отмечается сочетание нарушений диастолической функции, которые осложняются атриовентрикулярной регургитацией различной степени выраженности, с перикардиальным выпотом на поздних стадиях и снижением нагнетательной функции сердца. При гипертрофической кардиомиопатии может не быть симптомов нарушений. Однако у больных с препятствиями на пути оттока наблюдаются три характерных симптома: неравномерный толчкообразный пульс, прощупываемые сокращения левого предсердия и шум, который поздно возникает и прослушивается у левого края грудины и у верхушки. Клинические симптомы при рестриктивной кардиомиопатии (одышка и слабость) аналогичны таковым при диастолическом заболевании сердца, стенокардия встречается редко. Заболевание часто поражает детей. При любой форме эндомиокардиального фиброза (см.) может обнаруживаться воспалительная жидкость в перикарде, что в некоторых случаях является ведущим симптомом. Из лабораторных данных следует отметить увеличение количества лейкоцитов. Высокую достоверность диагностики кардиомиопатий дает современный комплексный подход (электрокардиография, рентгенография, радиоизотопная вентрикулография и биопсия миокарда).
Диагностика Больным проводят ЭКГ, фонокардиографию, рентгенологическое исследование, вентрикулографию, эхоэнцефалографию. Катетеризация сердца проводится, если диагноз остается под сомнением.
Лечение и профилактика Дилатационная кардиомиопатия лечится так же, как любая форма застойной сердечной недостаточности, обусловленная нарушением нагнетательной функции сердца. Назначаются диуретические средства, в том числе спиронолактон. Препараты наперстянки показаны в случае мерцания предсердий. Терапию сосудорасширяющими препаратами следует проводить лишь при условии, что давление в большом круге не ниже 95 мм рт. ст. (каптоприл). Для профилактики тромбоза назначают антикоагулянты. Больным, у которых не наступает улучшения, а эндомиокардиальная биопсия выявляет признаки миокардита (см.), может помочь курс стероидных гормонов и иммунодепрессантов. Больные с гипертрофической кардиомиопатией, у которых наследственность не отягощена этим заболеванием, а имеются лишь признаки легкой формы без ярких симптомов и аритмий, часто вообще не нуждаются в лечении. Они должны лишь находиться под наблюдением. В случае наличия симптомов стенокардии используют бета-блокаторы типа пропранолола (300–400 мг в сутки). При множественной желудочковой экстрасистолии и желудочковой тахикардии назначают амиодарон. В некоторых случаях при данном заболевании прибегают к хирургическому лечению в виде удаления перегородки, протезирования митрального клапана и удаления сосочковых мышц. Больные рестриктивной кардиомиопатией получают симптоматическое консервативное лечение. На ранней стадии заболевания острые приступы сердечной недостаточности иногда поддаются лечению покоем, диуретическими средствами, преднизолоном по схеме. При необходимости назначаются антикоагулянты. Когда заболевание достигает стадии замещения соединительной тканью, хирургическое лечение дает хорошие результаты. Положительный эффект дает иссечение плотной соединительной ткани, что при наличии показаний следует сочетать с протезированием клапана. Профилактика кардиомиопатии возможна лишь в том случае, когда речь идет о рестриктивной форме заболевания. Ранний диагноз заболевания и своевременное лечение позволяют повлиять на дальнейшее его течение.
КАРДИОСКЛЕРОЗ
ОпределениеКардиосклероз — очаговое или распространенное разрастание соединительной ткани в сердечной мышце, наступающее вслед за гибелью мышечных волокон или параллельно ей.
Этиология и патанатомия Кардиосклероз может быть проявлением ишемической болезни сердца (см.). При этом гибель мышечных волокон с замещением их соединительной тканью является следствием коронарного атеросклероза (см.), который приводит к нарушению нормального кровотока в артериях сердца с развитием кислородного голодания и омертвением мышечных волокон. После инфаркта миокарда (см.) формируется очаговый постинфарктный кардиосклероз. Еще одной из наиболее частых причин развития кардиосклероза являются миокардиты (см.). Реже кардиосклероз развивается после кардиомиопатий (см.). В редких случаях выступает как первичный процесс. Различают следующие виды кардиосклероза: постинфарктный, заместительный, миокардитический как следствие миокардиопатий и первичный. Постинфарктный кардиосклероз возникает после крупно- и мелкоочаговых инфарктов миокарда (см.) в результате замещения погибших участков мышцы сердца соединительной тканью. Обширность рубцовых полей зависит от величины зоны инфаркта миокарда.
Атеросклероз венечной артерии сердца
Поперечный разрез левой венечной артерии. Атеросклеротическая бляшка суживает просвет артерии. Светлые поля — атероматозная масса, темные поля — известь
Заместительный кардиосклероз (миофиброз) наблюдается при стенозирующем атеросклерозе (см.) венечных артерий сердца при отсутствии очаговых некротических изменений в миокарде в силу постепенной и медленно развивающейся дистрофии, атрофии и гибели отдельных мышечных волокон в связи с кислородной недостаточностью и нарушением обмена веществ в миокарде, сопровождающихся огрубением волокон. Этот тип кардиосклероза отмечается также при гипертонической болезни (см.). Для него характерно наличие в миокарде микроскопических рубчиков, замещающих отдельные мышечные волокна или небольшие группы их. Миокардитический кардиосклероз возникает на почве перенесенных миокардитов (см.). Может быть как распространенным, так и очаговым. Кардиосклероз как следствие кардиомиопатий в большинстве случаев носит характер распространенного фиброза: дистрофически измененные атрофирующиеся и гибнущие мышечные волокна замещаются соединительной тканью. Первичный кардиосклероз возникает при некоторых коллагеновых болезнях, врожденном фиброэластозе, внутриутробном эндокардите (см.).
Кардиосклероз с образованием крупной мозоли
Клиническая картина и диагностика В клинической практике различают атеросклеротический (диффузный или крупноочаговый постинфарктный) и миокардитический кардиосклероз. Клинические симптомы атеросклеротического кардиосклероза длительное время могут оставаться скудными, хотя при полном исследовании можно обнаружить смещение левой границы сердца кнаружи за счет увеличения левого желудочка, приглушенность тонов над верхушкой, систолический шум вследствие относительной недостаточности митрального клапана, признаки атеросклероза аорты. При рентгенологическом исследовании обнаруживается расширение сердца, главным образом влево. На ЭКГ — горизонтальная электрическая позиция по Вильсону, признаки увеличения левого желудочка, распространенные, а при постинфарктном кардиосклерозе — и очаговые рубцовые изменения миокарда. При прогрессировании заболевания можно выделить следующие группы признаков различной выраженности и связанных с ними симптомов: — симптомы недостаточности кровообращения — острой левожелудочковой (сердечная астма) и хронической; — разнообразные нарушения ритма сердца и проводимости; — симптомы стенокардии. Клинические проявления миокардитического кардиосклероза изменяются в зависимости от формы и происхождения предшествующих миокардитов, их патологоанатомических особенностей (распространенность поражения). Обычно в ходе болезни отмечаются перенесенные инфекции, ревматизм (см.). Чаще болеют лица молодого возраста. Разнообразные нарушения ритма и проводимости наблюдаются чаще, чем симптомы сердечной недостаточности. При выраженном поражении миокарда недостаточность сердца развивается обычно сразу же по правожелудочковому типу. Обнаруживают полное увеличение сердца, при прослушивании тоны ослаблены, часто определяется ритм галопа, над верхушкой и трехстворчатым клапаном — самостоятельные систолические шумы, признаки различной выраженности недостаточности кровообращения, разнообразные нарушения ритма сердца и проводимости. На электрокардиограмме при миокардитическом кардиосклерозе обнаруживают изменения миокарда распространенного характера, преимущественно правого желудочка.
Схема специфической проводящей системы сердца: 1 — синусовый узел; 2 — атриовентрикулярный узел; 3 — левая ножка пучка Гиса; 4 — сеть разветвлений ножек; 5 — межжелудочковая перегородка; 6 — левый желудочек; 7 — правый желудочек; 8 — правая ножка пучка Гиса; 9 — трехстворчатый клапан; 10 — нижняя полая вена; 11 — овальная ямка; 12 — правый синусовый клапан; 13 — верхняя полая вена
Лечение и профилактика Лечение кардиосклероза заключается в проведении мероприятий по борьбе с нарушениями ритма и проводимости, а также с недостаточностью кровообращения. В случаях атеросклеротического кардиосклероза часто необходимо лечить стенокардию (см.) и хроническую коронарную недостаточность, а также атеросклероз (см.). При миокардитическом кардиосклерозе проводится тщательное лечение очагов инфекции. Профилактика кардиосклероза заключается в своевременном и активном лечении атеросклероза (см.), коронарной недостаточности, миокардитов (см.).
КАРДИОСПАЗМ
ОпределениеКардиоспазм (охалазия пищевода, идиопатическое расширение пищевода) — редкое хроническое нервно-мышечное заболевание пищевода, характеризующееся нарушением рефлекторного раскрытия кардии при глотании и сопровождающееся нарушением перистальтики и снижением тонуса грудного отдела пищевода.
Этиология и патогенез Факторы, влияющие на возникновение заболевания, окончательно не выяснены, поэтому существуют множество различных теорий. Бард и др. считают кардиоспазм врожденным нарушением. Согласно органической теории, кардиоспазм развивается вследствие механического препятствия в области кардии. Здесь, а также в зоне пищеводного отверстия диафрагмы обнаруживают изменения в сторону замещения соединительной тканью. Теория развития спазма кардии объясняет кардиоспазм преобладанием активности симпатической нервной системы над парасимпатической. Начало кардиоспазма часто связывают с психической травмой. У больных кардиоспазмом выявляются нарушения нормального взаимодействия коры, подкорки и внутренних органов. Нервно-психические расстройства обнаруживаются у 70 % больных кардиоспазмом.
Патанатомия Различают 4 стадии патологоанатомических изменений. В I стадии видимые макроскопические изменения отсутствуют. Во II стадии просвет пищевода расширяется до 2,5–3 см, а кардия суживается. Микроскопически отмечаются увеличение и отек мышечных волокон. Во внутристеночном сплетении наблюдается резкое утолщение нервных стволов со вздутиями, обусловленными очаговой дистрофией (см.). В III стадии просвет пищевода расширяется до 3–5 см. Все слои стенки пищевода утолщены, в мышечной оболочке увеличен преимущественно круговой слой, слизистая полнокровна. В подслизистой оболочке обнаруживаются лимфоидные образования. Отмечается дальнейшее прогрессирование дистрофии нервных волокон с потерей их структуры. В межмышечных слоях определяется разрастание соединительной ткани. В IV стадии расширение просвета может быть свыше 5 см. Пищевод удлиняется и приобретает S-образную форму. Слизистая оболочка становится грубой, лишенной складок. Микроскопические изменения становятся еще более выраженными, клиническая картина кардиоспазма разделяется на четыре стадии: I — непостоянный спазм кардии; II — стабильный спазм; III — рубцовые изменения кардии и расширение пищевода; IV — резкие рубцовые изменения кардии и выраженное расширение пищевода.
Клиническая картина Обычно появление заболевания больные связывают с какой-нибудь психической травмой, нервным переживанием. Вначале они испытывают неловкость при глотании, замедленное прохождение пищи по пищеводу, загрудинные боли. Такие явления могут продолжаться месяцами и годами. В других случаях наблюдается более быстрое развитие заболевания, и больной обращается к врачу сразу с основной жалобой на затруднение глотания. Появляются также неприятные ощущения за грудиной, чувство сдавления и распирания, загрудинные боли. В далеко зашедших случаях для опорожнения пищевода больные вызывают срыгивание. Загрудинные боли при кардиоспазме напоминают стенокардические. На I–II стадиях боль возникает одновременно с ощущением задержки пищи. Она имеет преходящий, эпизодический характер. В III–IV стадии боль обусловлена растяжением пищевода, поэтому бывает более постоянной и исчезает после опорожнения пищевода. Общее состояние больных при кардиоспазме, как правило, страдает незначительно, редко развивается выраженная потеря веса. Осложнения кардиоспазма, как общие, так и местные, развиваются в запущенных случаях. К ним относится прежде всего застойный эзофагит (см.), проявления которого варьируют от легкого покраснения до образования язв в стенке пищевода. Наиболее грозные общие осложнения кардиоспазма — пневмония (см.) и абсцесс (см.) легких, обусловленные проникновением в них содержимого пищевода. Нередко при кардиоспазме встречаются дивертикулы (см.) и рак (см.) пищевода.
Лечение Лечение кардиоспазма консервативное и хирургическое. Консервативная терапия включает мероприятия общеукрепляющего характера. Больных ограничивают от излишних переживаний. Создаются щадящие условия питания, диетотерапия, витаминотерапия. Некоторого уменьшения расстройства глотания в I–II стадиях добиваются приемом перед едой или во время нее спазмолитиков нитрогруппы — нитроглицерина, амилнитрата, а также платифиллина, но-шпы, папаверина и др. В далеко зашедших случаях, при выраженном застое в пищеводе и эзофагите (см.) применяют промывание пищевода слабым раствором антисептиков. Современная консервативная терапия в изолированном виде применяется только в начальных стадиях кардиоспазма, а в подавляющем большинстве случаев ее используют при подготовке больных к оперативному лечению или как дополнение к кардиодилатации, являющейся основным методом лечения кардиоспазма. Кардиодилатация является высокоэффективным методом лечения кардиоспазма. Почти у 99 % больных добиваются отличных и хороших результатов. Кардиодилатацию можно проводить в любой стадии кардиоспазма. Обычно больные не нуждаются в специальной подготовке. Процедуру проводят утром натощак, как правило, без анестезии. Начинают курс дилатаций с помощью расширителей меньшего размера, которые заводят через пищевод под рентгеноскопическим контролем. Промежуток между сеансами — 1–2 дня. При неэффективности повторных эндоскопических дилатаций проводится хирургическое лечение — кардиотомия.
КАРИЕС ЗУБА
ОпределениеКариес — патологический процесс, проявляющийся деминерализацией и последующим разрушением твердых тканей зуба с образованием дефекта в виде полости.
Этиология и патогенез Возникновение кариеса зубов обусловлено сочетанием воздействия факторов внешней среды и внутренней среды самого организма. На каждом этапе развития организма выделяются основные факторы, взаимодействие которых может приводить к возникновению кариозного процесса. Во внутриутробном периоде большое значение отводится наследственному фактору, нарушению формирования внутренних органов и систем, недостаточному поступлению некоторых микроэлементов и витаминов. В период детства и юношества кариес может быть обусловлен влиянием эндокринных факторов в связи с половым созреванием, перенесенными заболеваниями, нарушением функции печени, снижением устойчивости тканей зуба, недостаточностью фтора, нарушением слюноотделения и изменением среды полости рта. В период от 20 до 40 лет определенное значение имеют сопутствующие болезни (желудочно-кишечного тракта, печени, эндокринной системы), болезни зубочелюстной системы. После 40 лет приобретают значение нарушение деятельности внутренних органов и систем (половой, гормональной). Механизм развития кариеса зубов определяется двумя основными группами факторов — общими и местными: нарушениями общей обменной системы организма, включая обмен в обызвествленных тканях, и нарушениями в местной системе (слюнные железы — слюна — ротовая жидкость — зубной налет — пелликула ткани зуба — пародонт). Нормальное строение и функции эмали обеспечиваются подвижным равновесием процессов деминерализизации и минерализации. Если создаются условия, при которых это равновесие нарушается и возникает преобладание процесса деминерализации, наступает разрушение эмали с образованием кариозного пятна. Прогрессирование этого процесса приводит к образованию кариозной полости. Механизм разрушения эмали заключается в том, что на поверхности зуба в зубном налете в результате переработки микроорганизмами сахаров образуются молочная, уксусная, пировиноградная и другие кислоты. В силу того что ферменты микроорганизмов зубного налета разрушают поверхностный слой эмали, кислоты непосредственно воздействуют на минеральные вещества эмали. Если критический уровень кислотности поддерживается долгое время в ситуации, способствующей возникновению кариеса, начинается растворение минеральных кристаллов эмали. Это приводит к проникновению кислот в подповерхностный слой. Зона деминерализации распространяется параллельно поверхности зуба. Процесс деминерализации начинает распространяться в глубину, образуя конусовидный очаг поражения. Разрушение твердого вещества зуба происходит при непосредственном участии микроорганизмов. Зубной налет приобретает болезнетворные свойства при следующих условиях: — скопление значительных масс микроорганизмов в углублениях и щелях; — накопление молочной, лимонной и других кислот; — торможение распространения нейтрализующих агентов внутрь зубного налета.
Патанатомия Различают раннюю и позднюю фазы структурных изменений при кариесе зубов. Стадия пятна — ранняя фаза изменений. Она характеризуется потерей естественного цвета и вызывается поверхностной деминерализацией эмали. При изучении тканей зуба в очаге определяют три зоны: тело поражения, темную и прозрачную зоны; появление зон обусловлено образованием микропространств, различных по объему и количеству. Электронномикроскопически выявляются изменения в очаге, заключающиеся в потере неорганического вещества по периферии призм, ослабление межкристаллических связей в эмали, нарушение ориентации кристаллов и изменение их формы и размеров. Стадия кариозной полости возникает в результате распространения процесса на более глубокие слои эмали. Формируется поражение, имеющее форму треугольника или конуса. Подвергшаяся разрушению часть эмали отторгается, в результате чего образуется полость с неровными контурами. Разрушение эмали и проникновение микробов в канальцы полости зуба обусловливают кариес твердого вещества зуба. В области кариозного поражения канальцы расширены, частью вздуты, местами сливаются, образуя микро- и макрополости, содержащие омертвевшие массы и обильное скопление микробов. На поздних стадиях процесса слой твердого вещества зуба полностью разрушается и устанавливается сообщение кариозной полости с полостью зуба. По глубине поражения различают: — начальный кариес зуба (в стадии пятна); — поверхностный — дефект эмали без нарушения эмали; — средний кариес — нарушение эмалеводентинной границы, но при наличии значительного слоя твердого дентина на дне кариозной полости; — глубокий кариес зуба — над пульпой определяется незначительный слой дентина, часто размягченного.
Клиническая картина Начальный кариес (в стадии пятна) протекает бессимптомно, но обнаруживается при внимательном осмотре. Эмаль теряет блеск, возникает белое или пигментированное пятно. Поверхностный кариес характеризуется быстро проходящей болью при попадании на зуб сладкого, кислого, соленого. При осмотре и зондировании обнаруживается неглубокий, иногда слегка болезненный дефект. Средний кариес протекает, как правило, безболезненно. Иногда возникает кратковременная боль от раздражителей. При осмотре и зондировании выявляется кариозная полость, заполненная остатками пищи и размягченного вещества зуба. Глубокий кариес характеризуется болевыми ощущениями от раздражителей, но после их удаления боль исчезает. Кариозная полость значительных размеров. На дне ее обнаруживается размягченное и пигментированное вещество зуба, зондирование дна полости болезненно. В случаях нелеченого кариеса микроорганизмы проникают в мягкие ткани зуба. На дне кариозной полости образуется отверстие и возникает осложнение — пульпит (см.) (воспаление пульпы зуба).
Лечение и профилактика Общее лечение направлено на активизацию реакции организма, нормализацию деятельности систем и органов и снижение действия кариесогенных факторов. Это особенно важно при множественном кариесе зубов у детей и беременных женщин. Составной частью комплексного лечения является удаление очагов инфекции из полости рта и зубов, ограничение в диете углеводов и сладких мучных продуктов. Местное лечение различно в зависимости от стадии процесса. При начальном кариесе в стадии пятна предложены средства, усиливающие минерализацию эмали (10 %-ный раствор глюконата кальция, 10 %-ный раствор подкисленного фосфата кальция в виде нанесений). У детей приоритетной профилактикой кариеса премоляров и моляров является герметизация фиссур силантами со фтором. Поверхностный кариес на гладких поверхностях постоянных зубов у детей и подростков лечат также с помощью нанесений с фтористым лаком, растворами, способствующими минерализации. Если кариес находится в щелях и на соприкасающихся поверхностях, зубы пломбируются. При среднем и глубоком кариесе зубов обработка полости бором с целью удаления размягченного вещества зуба и придания полости соответствующей формы обязательна. Тщательная обработка кариозной полости и хорошее качество пломбировочного материала практически исключают рецидив кариеса. Профилактику кариеса зуба нужно начинать с заботы о здоровье будущей матери. Ведущая роль принадлежит полноценному сбалансированному питанию беременной и кормящей женщины. В профилактических целях и особенно при множественном кариесе зубов рекомендованы специальные диеты с учетом содержания фтора в питьевой воде. Большое значение в профилактике кариеса зуба принадлежит гигиене полости рта, так как образование мягкого налета и задержка остатков пищи в межзубных пространствах и у шеек зубов являются существенными кариесогенными факторами. Наиболее эффективно удаление зубного налета с помощью зубной щетки. Определенное значение в поддержании полости рта в гигиеническом состоянии придается твердой пище (овощи и фрукты). Необходимо периодическое, не реже 1 раза в год, посещение стоматологических кабинетов с целью осмотра и возможного удаления очагов инфекции полости рта.
КАРЦИНОИД
ОпределениеКарциноид — редко встречающаяся гормонально-активная опухоль (см.) с возможностью озлокачествления, происходящая из аргентофильных клеток. Преимущественная локализация этой опухоли — в червеобразном отростке, реже в подвздошной, толстой (особенно прямой) кишке, еще реже — в желудке, желчном пузыре, поджелудочной железе; исключительно редко она возникает в бронхах, яичнике и других органах.
Этиология и патанатомия Факторы, способствующие возникновению карциноида, пока неясны. Микроскопически карциноид представляет собой округлое опухолевидное образование желтоватого цвета на разрезе. Оно состоит из мелких однородных клеток круглой или многоугольной формы. Клетки могут образовывать розетки и тяжи. Иногда клетки карциноида, принимая призматическую форму, формируют по периферии таких островков розетки с круглой полостью, имеющей на внутренней поверхности кутикулярную каемку. Сетчатая ткань опухоли выражена слабо, обильно снабжена кровеносными сосудами и аргирофильными волокнами; иногда в ней обнаруживаются гладкомышечные пучки. Гормонально-активный карциноид выделяет в кровь вещества, вызывающие значительный рост соединительной ткани в непосредственной близости от места локализации опухоли. Основным признаком карциноида может служить наличие в содержимом его клеток двоякопреломляющих жиров, которые при фиксации в жидкостях с хромовыми солями выявляются в виде желтой зернистости, а при импрегнации серебром по методу Массона-Фонтаны — в виде мелких аргирофильных зерен. Для подтверждения диагноза карциноида используют флюоресцентную микроскопию для определения количественного содержания серотонина в изолированных тромбоцитах у больных и сравнения с содержанием его в тромбоцитах здорового человека, у которого оно очень высокое. При лабораторном исследовании выявляются повышенное содержание в крови 5-гидрокситриптамина (до 0,1–0,3 мкг/мл) и в моче — конечного продукта его превращения — 5-гидроксиндолуксусной кислоты (свыше 100 мг/сут.). Происхождение многих симптомов заболевания обусловлено гормональной активностью опухоли.
Клиническая картина Клиническая картина карциноида складывается из местных симптомов, обусловленных самой опухолью, и так называемого карциноидного синдрома, обусловленного ее гормональной активностью. Местные проявления — это локальная болезненность, нередко отмечаются признаки, напоминающие острый и хронический аппендицит (см.) (при наиболее частой локализации опухоли в червеобразном отростке) или симптомы кишечной непроходимости (см.) и кишечного кровотечения (при локализации опухоли в тонкой или толстой кишке). Отмечаются также боль при дефекации и выделение с калом алой крови (при карциноиде прямой кишки), похудение, развитие анемии (см.). Карциноидный синдром включает своеобразные сосудодвигательные реакции, приступы бронхоспазма, повышенную подвижность желудочно-кишечного тракта, характерные изменения кожи, поражение сердца и легочной артерии. В выраженной форме он наблюдается не у всех больных, чаще встречаясь при прорастании опухоли в печень и другие органы (особенно при множественных поражениях). Наиболее характерным проявлением карциноидного синдрома является внезапное кратковременное покраснение кожи лица, верхней половины туловища, сопровождающееся общей слабостью, ощущением жара, учащенным сердцебиением, понижением артериального давления, иногда слезотечением, насморком, бронхоспазмом, тошнотой и рвотой, поносом и схваткообразной болью в животе. Приступы продолжаются от нескольких секунд до 10 мин, в течение дня они могут повторяться многократно. С течением времени покраснение кожи может стать постоянным и обычно сочетается с синюшностью, возникают гиперкератоз (см.) и повышенная пигментация кожи. Часто у больных определяются недостаточность трехстворчатого клапана сердца и сужение устья легочной артерии (реже другие пороки сердца), недостаточность кровообращения. При рентгенологическом исследовании опухоль выявить трудно из-за ее небольших размеров. Особенностью опухоли является медленный рост и сравнительно редкое метастазирование, вследствие чего средняя продолжительность жизни больных составляет 4–8 лет и более. Наиболее часто метастазы обнаруживают в регионарных узлах печени. Смерть может наступить от множественных метастазов и кахексии (см.), сердечной недостаточности, кишечной непроходимости (см.).
Лечение Лечение карциноида хирургическое (радикальное удаление опухоли и метастазов). Симптоматическая терапия заключается в назначении блокаторов альфа- и бета-адренергических рецепторов (анаприлин, фентоламин и др.). Менее эффективны кортикостероиды, аминазин и антигистаминные препараты.
КАРЦИНОМА
ОпределениеКарцинома — внутриэпителиальный рак, карцинома нулевой стадии, скрытый рак — начальный этап развития рака (см.) без признаков выраженного роста. Карциному относят к предраку (Бродес, 1932 г.).
Этиология и патогенез Причины возникновения и механизм развития заболевания окончательно не установлены. В результате воздействия канцерогенных факторов возникает процесс распространенных изменений тканей, характеризующийся ускоренным ростом клеточных элементов. В очагах повышенного разрастания у людей с ослабленной иммунной системой могут появиться множественные микроскопические невоспалительные разрастания клеток незрелой эпителиальной ткани с наклонностью к проникающему росту. Такие процессы закономерно предшествуют раку (см.) и при длительном существовании сравнительно часто в него переходят. Поэтому они получили название предраковых. Карцинома развивается на фоне дисплазий — патологического разрастания и структурного атипизма клеток. Она может быть обнаружена в матке, гортани, трахее, бронхах, молочной железе, пищеводе, желудке, кишечнике и других органах.
Патанатомия Одна из наиболее часто встречающихся локализаций — шейка матки, которой предшествуют лейкоплакия (см.), эрозия, рубцовые изменения. Встречается в любом возрасте, но чаще в 30–40 лет.
Карцинома печени (прижизненная пункция)
Микроскопически многослойный плоский эпителий при карциноме обычно утолщен, структура эпителиального пласта нарушена. Клетки атипичные, различны по величине и форме, с увеличенными и многоструктурными ядрами. Подлежащая соединительная ткань обычно насыщена лимфоцитами. Отмечается многоцентричность развития, множественность поражений, выраженное врастание в шеечные железы с восполнением их просвета и нарастанием степени нарушений в них. Сходную клеточную картину принимает слизистая оболочка бронхов, трахеи и гортани, где карцинома развивается на фоне измененного эпителия. Процесс в молочной железе развивается при дисплазии долек железы на фоне мастопатии, реже на фоне фиброаденом. Наблюдается в большинстве случаев у женщин в предклимактерическом периоде. Микроскопически концевые дольки увеличены, а прилегающие протоки укрупнены, лишены просвета и выполнены небольшими атипичными однообразными клетками. В части случаев клетки более светлые, крупные, с увеличенными ядрами. По некоторым данным, возможно метастазирование процесса в регионарные лимфатические узлы.
Клиническая картина Клинически заболевание проявляется признаками предраковых изменений, предшествующих развитию рака (см.) поражаемого органа. Диагностируется карцинома лишь при микроскопическом исследовании.
Лечение и профилактика Лечение оперативное. Объем оперативного вмешательства зависит от локализации патологического процесса и определяется в каждом конкретном случае. Чтобы предупредить возникновение злокачественных новообразований, необходимо как можно раньше выявлять и устранять нарушения гормональной регуляции и обмена веществ, свойственные предраковому состоянию (канкрофилии). Так как синдром канкрофилии закономерно развивается в процессе нормального старения, то устранение канкрофилии должно препятствовать возрастному нарастанию частоты злокачественных опухолей. Чтобы задержать процесс старения, необходимо нормализовать внутреннюю среду. С этой целью используют низкокалорийную диету с учетом потребности в витаминах (особенно А, С и Е) и микроэлементах. Следует также поддерживать высокий уровень мышечной деятельности, оптимальный уровень состояния высшей нервной деятельности, в том числе психического статуса, а также учет индивидуальных данных о состоянии менструальной функции, деторождении, длительности кормления и т. д. Если эти методы недостаточны, то следует использовать лекарственные способы воздействия, в частности гиполипидемические (снижающие уровень вредных жиров) и антидиабетические средства и другие препараты, уменьшающие утилизацию клетками свободных жирных кислот. Могут использоваться препараты, применяемые при лечении атеросклероза (см.), понижающие свертывающие свойства крови, гипотензивные и некоторые психотропные препараты. Необходимы во многих случаях заместительная терапия гормонами щитовидной железы и назначение препаратов для снижения выработки глюкокортикоидов, например дифенина.
КАРЦИНОСАРКОМА
ОпределениеКарциносаркома — редкая злокачественная опухоль (см.), состоящая из эпителия и соединительной ткани.
Этиология и патанатомия Этиология карциносаркомы до конца не установлена. Микроскопически карциносаркома выглядит как полиповидное образование на толстой ножке умеренно плотной консистенции, розовато-желтого или желто-серого цвета. Верхние клетки опухоли чаще всего имеют структуру плоскоклеточного рака, реже — переходно-клеточного, низкодифференцированного или аденокарциномы. Степень распространения и частота метастазирования различны в зависимости от локализации опухоли. Метастазирует либо эпителиальный, либо соединительнотканный компонент, иногда оба одновременно. Метастазы распространяются вместе с лимфотоком. Опухоль встречается преимущественно в слизистой оболочке матки, шейке матки, влагалище, пищеводе, гортани, легком, желчном пузыре, желудке, предстательной и щитовидной железе.
Клиническая картина и лечение Клиническая картина карциносаркомы зависит от локализации. Карциносаркома отмечается выраженной злокачественностью и быстро приводит к летальному исходу. Лечение карциносаркомы оперативное.
КАТАРАКТА
ОпределениеКатаракта — частичное или полное помутнение вещества или капсулы хрусталика с понижением остроты зрения вплоть до полной его утраты. Различают первичные и вторичные катаракты, приобретенные и врожденные. Врожденные катаракты могут быть наследственными или возникать в результате нарушений внутриутробного развития, например инфекция у матери (краснуха (см.) и др.).
Этиология В зависимости от этиологического фактора выделяют несколько групп катаракт: — старческие; — травматические; — осложненные; — лучевые; — токсические; — метаболические.
Патогенез Механизм образования катаракты происходит в соответствии с воздействием фактора, вызвавшего ее. Механизм развития возрастных катаракт является многофакторным и изучен не полностью. С возрастом увеличиваются масса и толщина хрусталика и уменьшается его преломляющая сила. Ядро хрусталика подвергается сдавлению новыми слоями волокон, формирующихся концентрично, и становится тверже. В результате прозрачность хрусталика резко уменьшается. Химически измененные белки ядра постепенно прокрашиваются. С возрастом хрусталик принимает оттенки от желтого до коричневого. Тупое непроникающее ранение может стать причиной помутнения хрусталика, затрагивая часть его или весь целиком. Начальным проявлением контузионной катаракты часто бывает звездчатое или розеткообразное помутнение, обычно расположенное по центру хрусталика, куда вовлекается задняя часть хрусталика. Розеткообразные катаракты могут прогрессировать до полного помутнения. В некоторых случаях капсула хрусталика при тупой травме разрывается с последующим отеком волокон хрусталика, что приводит к его помутнению. Осложненная катаракта часто формируется на фоне хронического увеита (см.) различного происхождения из-за токсического воздействия продуктов воспаления на хрусталик. Хрусталик очень чувствителен к лучевым воздействиям: инфракрасному излучению, вызывающему повреждение передней капсулы хрусталика в виде шелушения поверхностных слоев, ультрафиолетовой радиации (290–329 нм), ионизирующей радиации.
Зрелая катаракта
В результате воздействия ряда химических веществ (нафталина, динитрофенола, таллия, ртути, спорыньи) развивается токсическая катаракта. Попадание щелочи в конъюнктивальную полость вызывает повреждение конъюнктивы, роговицы и радужки и часто приводит к развитию катаракты. Щелочные соединения легко проникают в глаз, понижают кислотность камерной влаги и снижают в ней уровень глюкозы. Катаракта возникает при некоторых обменных заболеваниях: — сахарном диабете; — галактоземии; — гипокальциемии; — болезни Вестфаля-Вильсона-Коновалова; — миотонической дистрофии; — белковом голодании. При сахарном диабете (см.) с повышением уровня сахара в крови увеличивается содержание глюкозы в камерной влаге и хрусталике. Затем в хрусталик поступает вода, приводя к набуханию хрусталиковых волокон. Отек влияет на силу преломления хрусталика. У 75 % больных классической галактоземией (см.) катаракта развивается обычно в течение первых недель после рождения. Накопление галактозы внутри хрусталика ведет к повышению внутриклеточного давления, жидкость поступает в ядро хрусталика, и слои коры приобретают вид «капель масла», видимых в проходящем свете. Катаракта может сформироваться при любом состоянии, которое ведет к снижению уровня кальция в крови: тетании, спазмофилии, рахите (см.), почечной недостаточности (см.). При болезни Вестфаля-Вильсона-Коновалова (см.) нарушен обмен меди. Возникает кольцо Кайзера — Флейшнера золотисто-коричневого цвета, которое образовано гранулами пигмента. Кольцо отделяет от угла глаза полоса прозрачной роговичной ткани. При миотической дистрофии у больных появляются многоцветные переливающиеся кристаллы в задних внутрикапсульных слоях хрусталика. Заболевание наследственное.
Патанатомия Патологоанатомические изменения при катаракте проявляются в зависимости от локализации, вида и степени помутнения хрусталика. Выделяют следующие разновидности катаракты: — полярную; — шовную; — ядерную; — капсулярную; — зонулярную; — полную; — пленчатую. При полярной катаракте изменения в хрусталике формируются во внутрикапсульных слоях переднего или заднего полюса капсулы. Шовные катаракты — помутнение Y-образного шва ядра. Врожденная ядерная катаракта представляет собой помутнение любого эмбрионального ядра. Капсулярная катаракта — это ограниченное помутнение эпителия и передней капсулы хрусталика. Зонулярная катаракта — это двустороннее симметричное поражение. Полная катаракта представляет собой помутнение всех хрусталиковых волокон. Пленчатая катаракта встречается при рассасывании белков хрусталика. При этом передняя и задняя капсулы хрусталика спаиваются в твердую мембрану.
Различные виды катаракт: 1 — передняя и задняя капсулярные; 2 — околоядерная слоистая; 3 — ядерная; 4 — корковая; 5 — полная
Клиническая картина Клиническая картина катаракты при первичной форме проявляется жалобами на снижение остроты зрения. Иногда первыми симптомами катаракты являются искажение предметов, монокулярная полиопия (множественное видение предметов). В клиническом течении старческой катаракты выделяют начальную, незрелую, зрелую и перезрелую стадии. В начальной стадии больные могут не иметь жалоб, другие отмечают снижение остроты зрения, появление «летающих мушек», иногда полиопию. При биохимическом исследовании на этой стадии определяется появление внутрикапсульных пузырей, расслоение хрусталиковых волокон. Через 2–3 года наступает стадия незрелой катаракты. В этой стадии явления оводнения хрусталика нарастают, и больные жалуются на резкое снижение зрения. Стадия незрелой катаракты длится годами. Постепенно хрусталик начинает терять воду, и помутнение приобретает интенсивно-серый оттенок, становится однородным. Возникает стадия зрелой катаракты. В этой стадии видна фигура хрусталиковой звезды, интенсивное помутнение в области хрусталиковых швов. Больные жалуются на отсутствие предметного зрения. При перезрелой катаракте измененные хрусталиковые волокна подвергаются дистрофии и полному распаду.Корковое вещество превращается в разжиженную массу молочного цвета, которая подвергается рассасыванию, объем хрусталика уменьшается. При ядерной катаракте центральное зрение нарушается рано, больше страдает дальнее зрение. Может возникнуть временная близорукость. При боковом свете хрусталик в этих случаях имеет светло-зеленый оттенок. Осложнениями катаракты являются факолитическая глаукома (см.), факогенный иридоциклит (см.). Факолитическая глаукома развивается при незрелой катаракте вследствие всасывания распадающегося вещества, увеличения его объема и в результате нарушения оттока внутриглазной жидкости. При выпадении катарактальных масс в переднюю камеру глаза и задержке их рассасывания может возникнуть иридоциклит, связанный с развитием повышенной чувствительности к хрусталиковому белку.
Лечение Консервативная терапия катаракты применяется при начальном помутнении хрусталика для предупреждения его прогрессирования. Лекарственные препараты, применяемые для лечения катаракты, содержат средство для коррекции обменных процессов, нормализации электролитного обмена, окислительновосстановительных процессов и уменьшения отека хрусталика (офтан-катахром, сонкаталин, витайодурол, квинакс). Хирургическое лечение — удаление катаракты — остается основным методом лечения помутнения хрусталика. Показания к оперативному лечению устанавливают индивидуально. Это зависит от состояния зрительных функций, характера и интенсивности помутнения хрусталика. Удаление может быть внутри- и внекапсулярным. При внутрикапсулярном удалении хрусталик извлекают в капсуле. При внекапсулярном удалении после вскрытия передней капсулы хрусталика ядро выдавливают, а хрусталиковые массы отсасывают. Разработан метод удаления катаракты через тоннельные разрезы, на которые накладывают швы. В настоящее время к основным методам удаления катаракты у детей можно отнести отсасывание, ультразвуковую факоэмульсификацию и механическое удаление хрусталика.
КАШЕЛЬ
ОпределениеКашель — рефлекторный процесс, характеризующийся резким нарастанием внутригрудного давления за счет одновременного напряжения дыхательной и вспомогательной мускулатуры при закрытой голосовой щели с последующим ее открытием и толчкообразным быстрым выдохом, при котором из дыхательных путей активно удаляется их содержимое. Кашель является симптомом патологического процесса, чаще всего связанного с заболеваниями органов дыхания.
Патогенез Кашлевой рефлекс начинается с раздражения окончаний блуждающего нерва в дыхательных путях или с рецепторов плевры. От них раздражение передается в кашлевой центр продолговатого мозга, где кодируются реакции мышц бронхов, гортани, грудной клетки, живота, диафрагмы. Выражается эта реакция в начальной фазе в виде глубокого вдоха. Затем наступает фаза напряженного выдоха при замкнутой голосовой щели и сокращенных бронхах. При этом внутригрудное давление нарастает, достигая 333 гПа, или 250 мм рт. ст. В следующий момент голосовые складки раскрываются и происходит стремительный выдох через рот. Из-за резкого перепада давлений происходит выбрасывание струи газа из легкого с большой скоростью (6—46 м/с), увлекающей и содержимое дыхательных путей. По завершении фазы стремительного выдоха заканчивается одиночный акт кашля, который, однако, может повториться. Формирование кашлевого рефлекса находится под контролем деятельности головного мозга. Он может быть подавлен или вызван произвольно. Выделяют кашель центрального происхождения (в том числе невротический) и рефлекторный кашель, обусловленный раздражением рецепторов слухового прохода, пищевода и рецепторов другой локализации вне дыхательных путей.
Клиническая картина Частота и интенсивность кашля зависят от силы раздражителя и от его локализации, которая имеет индивидуальные различия, зависит от формы заболевания, фазы болезни, характера патологического процесса. Наиболее чувствительными рефлекторными зонами являются задняя поверхность надгортанника, область межголосовых связок и подкладочного (подсвязочного) пространства, место раздвоения трахеи и место отведения долевых бронхов. Количество рецепторов в бронхах убывает параллельно уменьшению их диаметра. Кашель при раздражении легочной ткани не вызывается. Кашель бывает частым и редким, слабым и сильным, болезненным и безболезненным, постоянным и периодическим, сухим или с выделением мокроты. Постоянный кашель наблюдается при хронических заболеваниях глотки, гортани или трахеи, хроническом бронхите (см.), при длительном застое крови в легких при нарушениях кровообращения. Периодический кашель бывает у курильщиков и алкоголиков, у больных пневмонией (см.), бронхиальной астмой (см.), эмфиземой (см.) легких, при острых заболеваниях дыхательного тракта и других болезнях. Односторонний приступ сильного кашля возникает при попадании дыма и других раздражающих веществ, инородного тела, пищи. Грубый лающий кашель обусловлен набуханием слизистой оболочки гортани и голосовых складок. Часто наблюдается при ларингите (см.), а у детей — при истинном и ложном крупе (см.). Судорожный кашель характеризуется быстро следующими друг за другом кашлевыми толчками, прерывающимися длинными и громкими вдохами. Нередко приступы кашля повторяются и сопровождаются рвотой. Такой кашель типичен для коклюша (см.). У детей при туморозном бронхоадените появляется двухтональный кашель, при котором к грубому основному тону присоединяется музыкальный высокий обертон. Резкий кашель бывает при трахеобронхите, плеврите (см.), пневмонии (см.). Беззвучный кашель возникает при параличе или разрушении голосовых складок, наличии искусственного отверстия в трахее и при значительной слабости больного. Покашливание — малозвуковой, слабый и короткий кашель — означает слабое раздражение рецепторов. Покашливание наблюдается при хроническом фарингите (см.), туберкулезе (см.) легких. Глухой ослабленный кашель типичен для хронического обструктивного бронхита (см.), осложненного эмфиземой (см.) легких. Сухой кашель (см.) характерен для сужения трахеи и крупных бронхов, для поражения плевры, средостения, для патологических процессов в окружностях бронхов, верхних дыхательных путей и проводников чувствительных нервов (сдавление опухолью, увеличенными лимфатическими узлами, аневризмой (см.) аорты и т. п.). Он наблюдается при пневмотораксе (см.), попадании в дыхательные пути инородного тела, а также при неспецифических процессах в легких (рак (см.), туберкулез (см.), саркоидоз (см.), коллагенозы (см.). Сухой кашель может быть в самом начале развития ларингита (см.), трахеита (см.), бронхита (см.), пневмонии (см.), бронхиальной астмы (см.). Кашель с мокротой наблюдается при заболеваниях, сопровождающихся повышенной выработкой бронхиальной слизи (бронхиты), образованием воспалительной жидкости (бронхиты, пневмонии) или жидкости. При хроническом воспалении верхних дыхательных путей, особенно у курильщиков, кашель наблюдается утром с отхаркиванием накопившейся мокроты. Кашель в ночное время может быть связан с физиологическим ночным усилением тонуса блуждающего нерва при заболеваниях, сопровождающихся бронхоспазмом (аллергический бронхит, бронхиальная астма, кардиальная астма), при локализации процесса в зонах повышенной рецепторной чувствительности (увеличение бронхопульмональных лимфатических узлов, туберкулез и др.), а также продвижением мокроты под действием силы тяжести из полостей — бронхоэктазы (см.), абсцессы (см.). Диагностическое значение имеет характер отделяемой мокроты.
Осложнения Кашель может оказывать на организм вредное влияние. Частые длительные приступы упорного кашля сопровождаются повышением внутригрудного давления и могут способствовать развитию повышения артериального давления малого круга кровообращения, эмфиземы (см.) легких, формированию легочного сердца. Повышение давления в венах большого круга кровообращения во время кашля иногда приводит к появлению мелких кровоизлияний в сосудах белочной оболочки глаз и системе бронхиальных вен. Приступ кашля может осложниться обмороком (см.), потерей сознания, нарушением сердечного ритма, эпилептическим припадком. При буллезной эмфиземе легких сильный кашель может вызвать разрыв альвеол и пневмоторакс (см.).
Лечение В терапевтических мероприятиях при кашле любой природы решающее значение имеет лечение основного заболевания. Для более эффективного отхождения мокроты, чему способствует кашель, назначаются отхаркивающие и бронхолитические средства. Для успокоения мучительного кашля применяются противокашлевые средства. При длительном назначении лекарств, подавляющих кашель, предпочтительны ненаркотические противокашлевые средства с преимущественным влиянием на кашлевые рецепторы и в меньшей степени — на рецепторы продолговатого мозга (лидокаин и др.).
КЕРАТИТ
ОпределениеКератит — воспаление роговицы различного происхождения, сопровождающееся ее помутнением.
Этиология Различают экзогенные и эндогенные кератиты. К экзогенным относятся: эрозия роговицы; травматические кератиты, обусловленные механической, физической или химической травмой; инфекционные кератиты бактериального происхождения; кератиты, вызванные заболеваниями края век, мейбомиевых желез; конъюнктивиты; грибковые кератиты. К эндогенным кератитам относятся: инфекционный кератит (туберкулезный, сифилитический, вирусный); нейропаралитический; авитаминозный; кератиты невыясненной этиологии. Причины возникновения воспаления роговицы разнообразны. Наибольшее значение имеет попадание на нее инфекции, как из внешней среды, так и изнутри. Возбудителями инфекции могут быть пневмококки, палочка Коха — Уикса, вирусы и грибки. Развитию кератита способствуют хронические заболевания век, конъюнктивы, желез хряща век и слезных путей. Кератиты возникают при воздействии механических, химических и физических факторов окружающей среды.
Патанатомия и патогенез Основным признаком воспаления роговой оболочки является проявление в ней помутнения вследствие отека и насыщенности клеточными элементами. Воспалительное уплотнение может состоять из лимфоидных, плазматических клеток или полинуклеарных лейкоцитов, проникающих из краевой петлистой сети сосудов. Инфильтрация роговицы сопровождается различными изменениями ее слоев — эпителия, стромы и эндотелия. При тяжелых кератитах происходит омертвение роговицы, что приводит к размягчению стромы, образованию абсцесса (см.) и развитию язвы; иногда наблюдается гнойная инфильтрация с распадом всей роговицы. При негнойных кератитах роговичные клетки подвергаются разрастанию и дистрофии (см.) с последующим распадом. Наряду с инфильтрацией происходит врастание в роговицу новообразованных сосудов из краевой петлистой сети. Сосуды проходят между пластинками роговицы и сопровождаются тяжами соединительной ткани. В механизме развития кератита имеет значение общее состояние организма, состояние иммунитета. От этого зависят тяжесть и характер течения воспалительного процесса.
Клиническая картина Основными клиническими признаками кератита являются: — симптомы раздражения роговицы, слезотечение, светобоязнь, блефароспазм, боль; — помутнение роговицы, сопровождающееся нарушением прозрачности, зеркальности, блеска, сферичности и чувствительности роговицы. Воспалительные образования могут быть точечными, округлыми, иметь вид точек, штрихов или захватывать всю роговицу. При небольшом скоплении лимфоцитов воспалительное уплотнение имеет сероватый цвет, при гнойной инфильтрации — желтоватый, а при большом количестве мелких сосудов — ржавый оттенок. Границы уплотнения расплывчаты. В большинстве случаев при кератитах возникает прорастание роговицы новообразованными сосудами. Одновременно с инфильтрацией и врастанием сосудов вокруг роговицы появляется перикорнеальная инъекция (проявление покрасневших сосудов на поверхности глазного яблока). Она бывает различной интенсивности — от легкого розового венчика до темнофиолетового широкого пояса, охватывающего роговицу; встречается и поверхностная — конъюнктивальная — инъекция. Исход кератита зависит от его происхождения, степени вовлечения роговицы и сопротивляемости организма. Небольшие поверхностные уплотнения, не разрушающие предельную пограничную пластинку или расположенные на периферии недалеко от перикорнеальной сосудистой сети, могут бесследно рассосаться. Инфильтраты, расположенные под оболочкой в поверхностных слоях, частично рассасываются, а другая их часть организуется без распада, оставляя нежный рубец в виде облачковидного помутнения. Распространенная инфильтрация стромы роговицы в средних и глубоких слоях обычно не склонна к распаду, составляет более или менее выраженное рубцовое помутнение. Гнойные инфильтраты протекают обычно со значительными омертвениями и, как правило, распадаются и изъязвляются.
Осложнения В случае перехода воспалительного процесса с роговицы на другие оболочки глаза возникают осложнения в виде кератоирита, кератоиридоциклита и кератосклерита. Вследствие токсичного действия микроорганизмов и продуктов их жизнедеятельности может развиться неврит (см.) зрительного нерва. В редких случаях разрушение гнойной язвы роговицы может привести к гнойному эндофтальмиту, вторичной глаукоме (см.), атрофии глазного яблока и воспалению другого глаза.
Лечение и профилактика Лечение кератита в условиях стационара. С целью уменьшения воспалительных явлений и боли, а также предупреждения сращения зрачка необходимо назначение мидриатических средств — закапывание 1 %-ного раствора сульфата атропина 4–6 раз в день, 1–2 раза в день назначают атропин в глазной лекарственной пленке, на ночь — 1 %-ную атропиновую мазь, электрофорез с 0,25— 0,5 %-ным раствором атропина. Назначают также 0,25 %-ный раствор скополамина. Оба эти средства можно сочетать и закапываниями 0,1 %-ного раствора адреналина, который применяют также на ватных тампонах, вводимых за нижнее веко на 15–20 мин, или введением этого раствора под конъюнктиву в количестве 0,2 мл. Для лечения больных бактериальными кератитами и язвами роговой оболочки назначают сульфаниламиды и антибиотики в виде растворов, мази, глазной лекарственной пленки. При тяжелых язвах роговицы антибиотики вводят под конъюнктиву. Назначают также антибиотики внутрь. После окончания воспалительного процесса проводят осмотерапию и рассасывающее лечение. Применяют 2–3 %-ные растворы йода калия в виде электрофореза. Используют биогенные стимуляторы — экстракт алоэ, ФИБС, пеллоидодистиллят, стекловидное тело и др., аутогемотерапию. При соответствующих показаниях прибегают к оперативному лечению (кератопластика, оптическая иридоэктомия, антиглаукоматозная операция). Профилактика сводится к предупреждению травм глаза, своевременному лечению блефарита (см.), конъюнктивита (см.) и общих заболеваний. Для профилактики аденовирусного кератита необходимо исключить контакт с больными, выполнять правила асептики при лечебных процедурах.
КЕРАТОАКАНТОМА
ОпределениеКератоакантома (синонимы: сальный или роговой моллюск, псевдокарциноматозная гиперплазия) — сравнительно редкая доброкачественная опухоль, по своей структуре напоминающая плоскоклеточный рак.
Этиология и патанатомия Происхождение кератоакантомы неизвестно. Кератоакантома имеет круглую форму, плотную консистенцию, выступает над кожей в виде полушара. Микроскопически напоминает моллюск, вирусную бородавку или плоскоклеточный рак. В центральных отделах опухоли имеется углубление, выполненное роговыми массами. По периферии и в дне углубления обнаруживаются тяжи и комплексы эпителия, которые нередко проникают далеко вглубь формы. В тяжах отмечаются паракератоз, дискератоз и очаги ороговения, напоминающие раковые «жемчужины». По периферии тяжей и в глубине опухоли наблюдается значительное количество лимфоцитов и плазматических клеток. Иногда (особенно в стадии обратного развития) обнаруживаются гигантские клетки инородных тел.
Кератоакантома
Изредка в кератоакантомах отмечаются явные признаки злокачественного роста в виде комплексов опухолевых клеток в лимфатических щелях или сосудах, периневральных (вокруг нервного волокна) пространствах. Подобные кератоакантомы могут метастазировать в лимфатические узлы. Наиболее трудно отличить кератоакантому в фазе роста от плоскоклеточного рака (см.). В подобных случаях необходимы детальные клинические сведения. Имеет значение обнаружение очагов омертвения, так как в кератоакантоме их не бывает.
Клиническая картина Кератоакантома представляет собой узел шаровидной формы, имеет плотную консистенцию, цвет ее бледно-розовый. В центре этого образования располагается кратерообразное углубление, которое заполнено роговыми массами, и по периферии наблюдается плотный красноватый валик. Образованный узел может быть одиночным или множественным. Кератоакантома характеризуется циклическим течением и склонностью к самоизлечению. Локализуется главным образом на лице и кистях рук. Встречается у больных пожилого возраста, несколько чаще у мужчин. Изредка бывает множественной. Довольно быстро растет в первые 2–3 недели, затем стабилизируется в росте и через 6–8 месяцев может исчезнуть, оставив после себя рубец. Иногда опухоль неоднократно рецидивирует в течение многих лет.
Диагностика Диагноз основывается на типичной клинической картине. При гистологическом исследовании обнаруживается гиперкератоз, окруженный акантозом.
Лечение Производят хирургическое иссечение очага поражения или диатермокоагуляцию, криотерапию, лучевую терапию.
КЕРАТОЗЫ
ОпределениеКератозы (синонимы: кератодерматоз, кератома, кератодермия) — группа кожных заболеваний, которые характеризуются утолщением рогового слоя.
Этиология и патогенез По причине возникновения кератозы разделяют на: наследственные; эссенциальные — приобретенные кератозы неясного происхождения; симптоматические, являющиеся симптомами другого заболевания или возникающие под воздействием факторов внешней среды. Клеточная картина кератозов характеризуется следующими общими признаками — гиперкератозом и акантозом; в сосочковом слое возможны воспалительные инфильтраты, преимущественно вокруг сосудов.
Клиническая картина Наследственные кератозы Наследственные кератозы представляют самую многочисленную группу. Акрокератоз бородавчатый — многочисленные многоугольные ороговевшие бородавчатоподобные невоспалительные узелки красновато-бурого цвета. Они образуются на тыльной поверхности кистей и стоп и являются разновидностью твердого эпидермального бородавчатого невуса (см.). Заболевание начинается в раннем детстве и не исчезает в течение жизни, не вызывая каких-либо расстройств. Кератоз наследственный ладонно-подошвенный (наследственная кератодермия) — симметричное поражение ладоней и подошв в виде четко ограниченных роговых наслоений с усилением узора кожных бороздок. Роговые массы состоят из широких, спаянных, сухих, жестких, желтовато-восковидных или коричневатых пластинок, достигающих 1 см в толщину. В результате возникают затруднения при движениях, притупляется чувствительность. Часто по краю наслоений видна эритематозная или сине-багровая кайма. Кератодермия Папийона-Лефевра проявляется на 2—4-м году жизни. Гиперкератоз локализуется на ладонях и подошвах, переходит на тыл кистей и стоп. У больных наблюдаются аномалии прорезывания зубов, гингивит (см.), пародонтоз (см.). Кератоз точечный ладонно-подошвенный — симметричное поражение подошв и ладоней в виде многочисленных распространенных или сгруппированных прозрачных и плотных, желтых или темно-коричневых, конических роговых образований диаметром 1–3 мм. Кератоз Унны-Тоста. Первые признаки в виде шелушения проявляются через 1–2 месяца после рождения. Поражение обычно ограничивается ладонями и подошвами. Одновременно наблюдаются жировики, олигофрения (см.), дистрофия роговицы. Кератодермия пятнистая диссеминированная Бушке-Фишера. Заболевание возникает в возрасте старше 20 лет в виде многочисленных внутрикожных мозолистых желтоватых или коричневых узелков на ладонях и подошвах. Сначала они незаметны, затем увеличиваются до размера чечевицы и возвышаются над кожей. Кератодермия Меледа — заболевание, наблюдаемое у жителей островов Меледа. Кожа ладоней и подошв утолщена, желтовато-восковидна; видны места выводных протоков потовых желез. Поверхность очагов влажная, жирная, с неприятным запахом. Сименса синдром — кератоз ладоней и подошв с образованием пузырей, фолликулярный акнеподобный кератоз с преимущественной локализацией в области локтей и коленей, вокруг рта и в ягодичной области. Кроме того, наблюдаются лейкоплакия (см.) полости рта, складчатый язык, пахионихия, онихогрифоз, олигофрения (см.). Шеффа синдром — ладонно-подошвенный кератоз в сочетании с другими поражениями и врожденными расстройствами. Ядассона-Левандовского синдром является разновидностью поликератоза Турена. Кератоз фолликулярный шиповидный с облысением. У мальчиков к концу первого года жизни на лице, затылке, плечах и тыле кистей возникают фолликулярные светлые роговые шипы, на ресницах образуются узелки. Могут развиться светобоязнь, слезотечение, конъюнктивит (см.), помутнение роговицы. В области затылка образуется рубцовая атрофия (см.). Кератоз фолликулярный серпингинозный. Наблюдается чаще у мужчин в юношеском возрасте. Плотные гиперкератотические узлы склонны к группированию и периферическому росту. Локализуются только на боковых поверхностях шеи или на затылке, в области коленных и локтевых суставов. Течение хроническое. После зарастания очагов остается незначительная атрофия (см.) кожи. Эритрокератодермия изменчивая фигурная. Заболевание начинается обычно в раннем детстве. Основным клиническим симптомом являются эритематозно-кератические очаги фигурных очертаний в виде сухих однородных желтовато-красноватых бляшек. Очаги склонны к периферическому росту и слиянию. Симметрично захватывают обширные участки кожи вплоть до полного распространения процесса. Возникают зуд (см.), чувство стягивания, болезненность.
Фолликулярный кератоз (пласты эпителия с очагами кератинизации)
Фолликулярный кератоз
Эритрокератодермия прогрессирующая симметричная характеризуется фиксированными очагами избыточного ороговения на фоне легкого покраснения, локализующегося преимущественно на тыле кистей, на стопах.
Эссенциальные кератозы Кератоз идиопатический возникает в период половой зрелости или позднее, характеризуется отдельными островками гиперкератоза на пятках, а также на ладонных и подошвенных сторонах всех пальцев. Кератоз волосяной, или фолликулярный простой, характеризуется скоплением роговых чешуек в устьях волосяных фолликулов. Чешуйки образуют плотные, конические, белесовато-серые узелки величиной от булавочной головки до конопляного зерна. Болезнь начинается в раннем детстве. Кератоз существует стойко в течение многих лет. С течением времени волосы атрофируются и исчезают, а узелки разрешаются в точечные рубчики. Лихен шиповидный Кроккера-Адамсона — одна из форм фолликулярного кератоза. В устьях фолликулов образуются роговые пробки или шипики размером до нескольких миллиметров, телесного или розоватого цвета. Высыпания располагаются симметрично, чаще на шее и разгибательных поверхностях конечностей. Встречается чаще у детей, особенно у мальчиков. Имеется тенденция к самопроизвольному излечению. Кератоз фолликулярный контагиозный Морроу-Брука — на затылке, лбу, под раковинами ушей, на губах, щеках, туловище, задней стороне подмышечных впадин и особенно на разгибательных поверхностях конечностей развивается фолликулярный гиперкератоз; затем возникают многочисленные черные точки, в дальнейшем трансформирующиеся в маленькие шиповидные серые или желтые выросты от 0,5 до 3 мм длиной. Эти выросты, разрастаясь, превращаются в коричневатые папулы. Папулы располагаются изолированно или группами, а сливаясь, образуют плотные, жесткие, желтовато-коричневые бляшки. Окружающая их кожа пигментируется до темно-бурой. Какие-либо ощущения обычно отсутствуют. Возможно ороговение языка, слизистой оболочки щек. Сальные железы атрофируются, волосы выпадают. Гелодермия проявляется своеобразными мозолистыми образованиями на тыле кистей.
Симптоматические кератозы Кератоз ладонно-подошвенный инфекционный проявляется очагами чрезмерного ороговения на ладонях и подошвах на фоне эритемы. Они возникают вследствие инфекционных заболеваний (ангина (см.), тяжелый грипп (см.), туберкулез (см.), сифилис (см.), гонорея (см.), лепра (см.) и др.) и самопроизвольно исчезают. Кератоз лучевой наблюдается как позднее лучевое повреждение кожи в виде сухих бородавчатых роговых наслоений на фоне развивающейся атрофии кожи. Кератоз климактерический наблюдается в соответствующем периоде, обычно в сочетании с ожирением (см.), гипертонической болезнью (см.), деформирующим артрозом (см.). Характеризуется ограниченными очагами гиперкератоза на ладонях и подошвах. Кератоз профессиональный, или травматический, — распространенные односторонние или симметричные омозолелости, возникающие в результате постоянного травмирующего раздражения, трения, давления. Кератоз дегтярный в виде бородавчатых разрастаний возникает у лиц, имеющих соприкосновение на производстве с неочищенным каменноугольным дегтем. Частицы дегтя внедряются в устья волосяных фолликулов, образуют пробки в виде черных точек, затем возникают бородавчатые разрастания. Кератоз токсический развивается при хронической интоксикации — отравлении мышьяком и некоторыми другими медикаментами. К нему относится и лекарственный кератоз, как правило, распространенный. Развивается симметрично на ладонях и подошвах в виде зудящих эритем, болезни сопутствуют раздражение конъюнктивы, понос. Старческий кератоз — дерматоз пожилых людей. На открытых обычно участках — на лбу, висках, носу, щеках, реже на спине, плечах, предплечьях и других местах появляются множественные и плотные ороговевшие и бородавчатоподобные образования желто-коричневого или грязно-серого цвета. В центре такого образования развивается рубцовая атрофия. Кератоз является старческим перерождением кожи.
Профилактика Профилактику в отношении кератозов можно осуществлять, лишь говоря о симптоматических формах. Она состоит в раннем выявлении и лечении основного заболевания, устранении вредных воздействий (например, при профессиональном, токсическом и травматическом кератозе).
КЕССОННАЯ БОЛЕЗНЬ
ОпределениеКессонная болезнь (декомпрессионная болезнь) — патологическое состояние, развивающееся вследствие образования в крови и тканях пузырьков газа при снижении внешнего давления (у человека при выходе из камеры, всплытии с глубины на поверхность, при подъеме на высоту).
Этиология и патогенез Кессонная болезнь является следствием перехода газов крови и тканей из растворенного состояния в свободное — газообразное в результате понижения окружающего атмосферного давления. Образующиеся при этом газовые пузырьки нарушают нормальное кровообращение, раздражают нервные окончания, деформируют и повреждают ткани. При понижении окружающего давления (подъем водолаза с глубины, выход рабочего из кессонной камеры, подъем летчика на высоту) газовое равновесие нарушается, ткани и жидкости организма оказываются перенасыщенными газами, прежде всего — азотом. В случае достаточно быстрой декомпрессии перенасыщенность тканей газами достигает критических уровней. Создаются условия для образования пузырьков газа в тканях и жидкостях. Газы из тканей проникают внутрь первоначально возникшего пузырька. Это обусловливает его рост до установления газового равновесия. Упругие эластические свойства ткани тоже влияют на размеры газового пузырька. Различают два основных вида постдекомпрессионных газовых пузырьков. Первый тип — внесосудистые пузырьки. Их образование и обратное развитие целиком определяется процессом распространения. Внутритканевые пузырьки относятся к этому типу. При избытке растворенных в ткани газов они растут и оказывают давление на окружающие ткани, вызывая их деформацию, что может привести к возникновению болевых ощущений. Таков механизм развития мышечно-суставных болей. Внесосудистые пузырьки, образуясь в органах и жировой ткани, вызывают их разрушение. Второй тип — газовые пузырьки, образование которых связано не только с распространением, но и слиянием друг с другом или дроблением на мелкие части. К этому типу относятся в большинстве своем внутрисосудистые газовые пузырьки. Зарождаясь в венозном русле (в тканевых капиллярах), они сливаются друг с другом, обуславливая возможность острой аэроэмболии. Газовые пузырьки обволакиваются веществами крови — белками, жирами и другими взвешенными веществами в крови, вследствие чего затрудняется их рассасывание.
Патанатомия Наиболее выраженными и специфическими патологоанатомическими изменениями при быстрой смерти от кессонной болезни являются наличие многочисленных газовых пузырьков в венозной системе, переполненная и растянутая пузырьками газа правая половина сердца, явления отека и повышенной воздушности легких, множественные очаги кровоизлияний в различных органах и тканях. Иногда в легочной артерии обнаруживается пенистая кровь. Трупы погибших подвергаются быстрому и резкому окоченению. Кожные покровы и слизистые оболочки синюшны.
Клиническая картина По тяжести течения кессонную болезнь разделяют на легкую, среднюю и тяжелую. Для легкой формы характерны зуд и сыпь, нерезкие боли в мышцах, костях, суставах и по ходу нервных стволов. При средней тяжести болезни происходит резкое ухудшение общего состояния, появляются холодный пот и сильные боли в мышцах, костях и суставах, сопровождающиеся вздутием, тошнотой, рвотой, кратковременной потерей зрения. При тяжелой форме у больных развиваются симптомы поражения центральной нервной системы (парезы и параличи (см.) конечностей), сердечно-сосудистой и двигательной систем. Отмечаются загрудинные боли, удушье, синюшность, коллапс (см.).
Лечение и профилактика Радикальным способом лечения является рекомпрессия — воздействие повышенным давлением в рекомпрессионной камере. Рекомпрессия способствует рассасыванию пузырьков, т. е. устранению фактора, влияющего на распространение болезни. Лечебная рекомпрессия проводится по специальным режимам. В зависимости от состояния больного применяют симптоматическую терапию: стимуляцию сердечно-сосудистой системы, согревание, кислород, болеутоляющие средства, мероприятия, направленные на профилактику и ликвидацию отека легких. Для предупреждения кессонной болезни необходимо прежде всего строго соблюдать режимы декомпрессии и рекомпрессии. Немалую роль играет проведение предварительного медицинского отбора кадров для специальных условий труда — профессиональный отбор, выполнение требований по режиму труда под повышенным давлением, исключение провоцирующих факторов (тяжелая физическая нагрузка, охлаждение и др.), что уменьшает вероятность возникновения кессонной болезни.
КИСТА
ОпределениеКиста (от. греч. kystis — «пузырь») — патологическое образование, состоящее из стенки и содержимого, образующееся в различных органах и тканях организма. Киста может быть приобретенной или врожденной. Строение стенки кисты и ее содержимое зависят от механизма образования кисты и от органа или ткани, в которых эта киста располагается.
Патанатомия и патогенез Размер кисты, содержимое и строение стенки бывают различными в зависимости от механизма и давности образования, локализации и т. д. Различают истинные кисты и ложные: истинные выстланы эпителием, ложные специальной выстилки не имеют. Кисты бывают приобретенными и врожденными, т. е. возникающими при порочном формировании тканей и органов. По механизму образования различают кисты ретенционные, паразитарные, травматические, дизонтогенетические, опухолевые. Ретенционные кисты, как правило приобретенные, встречаются в различных железисто-секреторных органах. Они возникают вследствие затруднения или полного прекращения оттока секрета из железы в результате закупорки протока камнем, пробкой из сгустившегося секрета, сдавлением протока опухолью или рубцом. Секрет, накапливаясь в протоке или железистой дольке, растягивает их, образуя постепенно увеличивающуюся полость с сальным, слизистым, водянистым и другим содержимым. Таковы кисты сальных, слюнных, молочных желез, фолликулярные кисты яичников, поджелудочной и предстательной желез и др. Стенка ретенционной кисты выстлана уплощенным эпителием железы или ее протока. При внутриутробных атрезиях протоков желез развиваются врожденные ретенционные кисты. Рамолиционные кисты (от размягчения) образуются в компактной ткани при очаговом омертвении ее (при кровоизлиянии, воспалении, инфаркте) и последующем размягчении, разжижении и рассасывании мертвой ткани. Стенка такой кисты образована тканью того органа, в котором она находится, но в дальнейшем может заместиться соединительной тканью. Рамолиционные кисты обнаруживают в головном и спинном мозге, в опухолях. К таким кистам относятся кисты желтого тела яичников, зубные, костные кисты при остеобластомах, фиброзном остите. Паразитарные кисты представляют собой пузырчатую личиночную стадию ленточных червей (эхинококк, цистицерк). Травматические кисты возникают в результате смещения эпителиальных тканей. К ним относятся травматические эпителиальные кисты пальцев и ладоней вследствие внедрения эпителиального покрова в подлежащую ткань и последующего накопления секрета в образовавшемся мешочке. Такого же происхождения травматические эпителиальные кисты радужной оболочки глаза, поджелудочной железы. Дизонтогенетические кисты чаще всего врожденные. Они представляют собой кистовидное превращение иногда сохраняющихся эмбриональных каналов и щелей или возникают в смещенных тканях при формировании эмбриона. К дизонтогенетическим относят кисты из сохранившихся жаберных щелей, кисты из остатков желточно-кишечного хода; кисты предстательной железы, возникающие в связи с нарушением формирования паранефротических протоков; сирингоцистаденомы и сирингоэпителиомы — пороки развития потовых желез, параовариальные кисты, эндометриозные кисты яичников, дермоидные кисты, множественные кисты почек, поджелудочной железы, печени, легких и центральной нервной системы. Опухолевые кисты возникают в тех случаях, когда растущая ткань опухоли формирует одно- и многокамерные полости. Такие кисты нередко образуются в железистых органах (кистозная аденома слюнных желез, кистозная лимфангиома, кистозная амелобластома).
Клиническая картина и лечение Клинические проявления кисты зависят от типа, локализации, величины, а также характера возникающих осложнений (нагноение, разрыв, озлокачествление). Небольшие кисты могут не давать симптомов. В тех случаях, когда киста создает неудобства, вызывает болезненные ощущения, нарушает функции органа или грозит каким-либо осложнением, производится изолированное удаление кисты или вместе с органом (частью органа), в котором она находится.
КИФОЗ
ОпределениеКифоз — искривление позвоночника выпуклостью кзади. Различают физиологический и патологический кифоз.Физиологический кифоз, захватывающий все отделы позвоночника, наблюдается только у новорожденных детей первых 2–3 месяцев жизни. По мере роста ребенка физиологический кифоз остается только в грудном и крестцовом отделах. Патологический кифоз — один из пороков позвоночника. Он является клиническим симптомом многих заболеваний опорно-двигательного аппарата.
Этиология Кифоз может быть врожденным и приобретенным. Врожденный кифоз обусловлен наличием врожденного клиновидного позвонка или полупозвонка. Наблюдается также и при других аномалиях позвоночника, например при сращивании тел позвонков. К приобретенным видам относятся кифозы при болезни Кальве, болезни Шейерманн-Мау, болезни Кюммеля (см.), рахите (см.), болезни Бехтерева (см.), при разрушении тел позвонков, после операции ламиноэктомии. Выделяют также старческий кифоз вследствие клиновидной деформации тел позвонков.
Клиническая картина Кифоз характеризуется дугообразным или углообразным искривлением позвоночника выпуклостью кзади, в выраженной форме — в результате деформации грудной клетки и уменьшенной высоты туловища. Степень выраженности может быть различной: от точечного горба, обусловленного выстоянием одного остистого отростка, до «гигантского», с острым углом кривизны позвоночника и грубой деформацией последнего. Различают нефиксированный, мобильный и фиксированный кифозы. Примером мобильной деформации является паралитический кифоз, фиксированная деформация бывает при старческом кифозе. Врожденный кифоз, как правило, наблюдается в грудном отделе позвоночника. Деформация выявляется вскоре после рождения и не поддается исправлению или изменению при перемене положения тела. При болезнях Кальве (см.) и Шейерманна-Мау (см.) в грудном отделе возникает нефиксированный дугообразный кифоз — так называемый юношеский кифоз, который развивается в возрасте 14–17 лет. При болезни Кюммеля (см.) наблюдается нерезко выраженный дугообразный кифоз, чаще всего в грудном отделе позвоночника. Рахитический кифоз определяется в младенческом возрасте, когда ребенок начинает сидеть. Он бывает дугообразным, нефиксированным, полностью исправляется в положении лежа. Кифотическая деформация позвоночника типична для туберкулезного спондилита (см.). Наиболее пораженный процессом позвонок смещается кзади, вышележащий отдел позвоночника наклоняется вперед. При болезни Бехтерева (см.) кифоз имеет дугообразную форму, он фиксированный, возникает в возрасте 30–40 лет, чаще у мужчин. При кифозе, вызванном остеомиелитическим процессом, превалируют симптомы острого гнойного воспаления. Кифоз чаще углообразный, образуются свищи. Для клиники кифоза, вызванного первичными или метастатическими опухолями (см.), характерны боли. Заболевание развивается в поздней стадии — при разрушении и сдавливании тела позвонка, присоединяются неврологические симптомы. Кифоз при значительном травматическом сдавливании тела одного позвонка имеет углообразную форму. При переломе нескольких позвонков может образовываться дугообразный кифоз. Кифоз в результате расширенной ламинэктомии с удалением части дужек и суставных отростков позвонков образуется из-за ослабленных задних элементов даже в поясничном отделе. Старческий кифоз имеет место на фоне выраженного остеопороза позвоночника, тела позвонков приобретают клиновидную форму, а межпозвоночные диски истончаются.
Осложнения Осложнения возникают при тяжелых, прогрессирующих формах кифоза. Сначала развивается сдавливание корешков, в дальнейшем могут быть парезы и параличи (см.) нижних конечностей, нарушения функций тазовых органов. Неврологические спинномозговые корешковые расстройства редко связаны с механическим сдавлением. Чаще имеют место вторичный менингит (см.) и рубцовые сдавления спинного мозга и его сосудов.
Лечение и профилактика Терапевтические мероприятия по поводу кифоза являются составной частью комплексного лечения основного заболевания, вызвавшего деформацию позвоночника. При мобильном кифозе эффективно консервативное лечение: лечебная физкультура, массаж мышц спины, физиотерапевтические процедуры, плоская постель или гипсовая кроватка с валиком, иногда назначают корсет. Фиксированный кифоз в ряде случаев удается путем вытяжения и корректирующих упражнений перевести в мобильную форму. Однако удержать достигнутую коррекцию без операции практически не удается. При свежих кифозах туберкулезного происхождения эффективен метод Финка: постоянное давление на верхушку горба ватномарлевыми прокладками в гипсовой кроватке. Метод применяется для лечения детей с начальными формами спондилита (см.). Оперативное исправление кифоза сводится к реклинации позвоночника. После операции назначают более или менее длительный постельный режим и ношение корсета. Для профилактики кифоза у детей применяют физические упражнения в комплексе с санитарно-гигиеническими мероприятиями (сон на плоской постели, правильная поза при учебных занятиях, рациональная учебная мебель и др.) в сочетании с занятиями физкультурой и спортом.
Клонорхоз — биогельминтоз из группы трематодозов, характеризующийся преимущественным поражением печени и поджелудочной железы.
Этиология, эпидемиология и патогенез Возбудитель — китайский сосальщик листовидной формы, размеры которого составляют в среднем 10–20 х 2–4,5 мм. Передний конец тела утончен и несет ротовую присоску. Имеется и брюшная присоска. Яйца китайского сосальщика желто-коричневого цвета, имеют крышечку на одном конце и утолщение — на другом, в воде сохраняют жизнеспособность до 3 месяцев. Продолжительность жизни зрелого паразита — несколько десятилетий. Клонорхоз является биогельминтозом, жизненный цикл паразитов проходит со сменой окончательного и одного или более промежуточных хозяев. Окончательными хозяевами сосальщика могут быть люди и млекопитающие, использующие в пищу рыбу, в числе последних — домашние кошки и собаки. Основными промежуточными хозяевами являются моллюски, в большом количестве обитающие в водоемах, загрязненных фекалиями окончательных хозяев (главным образом — человека и собак), дополнительными — преимущественно рыбы семейства карповых. Клонорхоз представляет собой глистное заболевание с выраженной природной очаговостью. Источники заражения — животные и люди, выделяющие во внешнюю среду яйца паразита. В них формируются личинки, способные к дальнейшему развитию только в организме промежуточного хозяина. Конечным фактором передачи возбудителя служит пресноводная рыба — сырая, мороженая, малосоленая или не прошедшая достаточной кулинарной обработки. Клонорхоз встречается чаще всего в Китае, Корее, Японии. На территории Российской Федерации случаи заражения регистрируются на Дальнем Востоке, в бассейне реки Амур. В механизме развития клонорхоза на ранних стадиях ведущая роль принадлежит токсическому и аллергическому воздействию ферментов и экскретов гельминтов и их яиц на организм человека, а впоследствии на первый план выходит механическое повреждение желчевыводящих путей, тканей печени и поджелудочной железы.
Клиническая картина и диагностика Клонорхоз распространен в Китае, Корее, Японии. В этих странах имеются районы, где заражено до 80 % населения. В России клонорхоз регистрируется на территории Дальнего Востока, в бассейне реки Амур. Клонорхоз является гельминтозом хронического течения с преимущественным поражением гепатобилиарной системы. Особенно тяжелое течение клонорхоза отмечается у приезжих в очаговые районы. Клиническая картина сходна с клиникой описторхоза. В острой фазе заражения отмечаются выраженные аллергические проявления и симптомы общего характера (слабость, недомогание, снижение аппетита и пр.). В дальнейшем течение заболевания характеризуется рядом симптомов, связанных с поражением печени, желчевыводящих путей и поджелудочной железы. Больные предъявляют жалобы на лихорадку, боли в верхней части живота и в правом подреберье, объективно определяются увеличение печени, симптомы воспаления желчного пузыря и желчных протоков. Периодически отмечается смена обострений и относительных ремиссий. Прогноз серьезный в связи с развитием тяжелых осложнений. В диагностике ведущую роль играют лабораторные методы исследования, однако немаловажны также данные клиники и опроса больного (пребывание в районах, неблагополучных по клонорхозу, употребление в пищу недостаточно обработанной рыбы). В клиническом анализе крови отмечается выраженная эозинофилия (увеличение количества эозинофилов). В периоды обострений при биохимическом исследовании определяют повышение уровня билирубина и умеренное нарушение белкового состава крови. Специфическая диагностика осуществляется при помощи серологических реакций для обнаружения яиц китайского сосальщика в содержимом двенадцатиперстной кишки и в кале. Дифференциальный диагноз описторхоза и клонорхоза возможен только по результатам лабораторных исследований.
Лечение и профилактика Лечение клонорхоза проводится бильтрицидом (20–60 мг/кг в сутки в 1–3 приема, курс — 1 день, прием через час после еды, эффективность — 80–90 %) и хлоксилом (60 мг на кг массы тела в сутки в 3 приема, курс — 5 дней, через 15–20 мин после еды, запивать молоком; эффективность — 75 %). Хорошие результаты получены при лечении никлофоланом в дозе 1–2 мг/кг массы тела в течение 2–3 дней. Профилактика сводится к строгому санитарному надзору за продажей рыбы и приготовлением из нее продуктов, недопущению сброса нечистот и отходов рыбного производства в водоемы. Следует исключить употребление в пищу сырой и полусырой рыбы.
КОКЛЮШ
ОпределениеКоклюш — острое инфекционное заболевание, передающееся воздушно-капельным путем, характеризующееся острым воспалением дыхательных путей и приступами спазматического кашля; типичный антропоноз.
Этиология Возбудитель коклюша представляет собой короткую палочку с закругленными концами (0,2–1,2 мкм), неподвижную, хорошо окрашивающуюся анилиновыми красками. Антигенные свойства довольно разнообразны. Антиген представлен рядом компонентов, которые могут встречаться в различных комбинациях. Эти компоненты в количестве 14 служат для распознавания возбудителей коклюша и паракоклюша. Возбудитель коклюша крайне неустойчив во внешней среде, вследствие чего посев материала необходимо выполнять непосредственно после его забора. Бордетеллы (возбудители коклюша) погибают под воздействием ультрафиолетового облучения и при простом высушивании. Чувствительны к эритромицину, левомицетину, антибиотикам тетрациклиновой группы, стрептомицину.
Эпидемиология Инфекция широко распространена во всех странах мира. По данным ВОЗ, ежегодно заболевают коклюшем до 60 млн человек, из которых до 12 % составляют лица старше 15 лет, несмотря на то что инфекция относится к типичным детским болезням. Заболевание встречается и в тех странах, где имеется длительная многолетняя история вакцинации против коклюша. Наиболее восприимчивы к коклюшу дети раннего и дошкольного возраста, причем заболевание у половины детей раннего возраста можно связать с недостаточностью специфического противококлюшного иммунитета у матери и соответствующей нехваткой переданных через плаценту антител. Возможно, что среди взрослых заболеваемость коклюшем значительно больше, однако выявление его затруднено в связи с отсутствием приступов типичного спазматического кашля (см.). Серологическим же методом наличие коклюшной инфекции выявляется у 1/5—1/4 всех лиц, страдающих упорным продолжительным кашлем. Коклюш является типичной антропонозной инфекцией, т. е. источник и носитель ее — только человек (больной, особенно атипичной формой заболевания, а также бактерионоситель). Путь передачи — воздушно-капельный. Наибольшую опасность представляют собой больные в начальной (катаральной) фазе заболевания. При контакте с ними заболевание развивается у 90 % лиц восприимчивого контингента. Отмечается незначительное повышение заболеваемости в осенне-зимний период, хотя в целом сезонность выражена достаточно слабо. Если количество привитых детей снижается до 30 % и менее, динамика и уровень заболеваемости соответствуют таковым до начала массовых противококлюшных прививок.
Патогенез В организм инфекция попадает через слизистую оболочку дыхательных путей. Возбудители коклюша размножаются на клетках мерцательного эпителия, но сами в кровоток не проникают. Их жизнедеятельность приводит к развитию воспаления, угнетению функции ресничного аппарата мерцательного эпителия и повышенной выработке слизи. Воспалительный процесс характеризуется нарушениями целостности эпителия дыхательного тракта (изъязвление) с дальнейшим его омертвением. Особенно страдают при этом концевые отделы дыхательной системы, включая мелкие бронхи и бронхиолы. Вышерасположенные отделы (гортань, трахея, крупные бронхи) менее подвержены развитию выраженных очагов омертвения и воспаления.) Мелкие бронхиолы подвергаются закупорке разрушенными клетками и слизью с образованием пробок. При этом в соответствующих участках легких развиваются эмфизема (см.) и очаговый ателектаз (см.). Отмечается околобронхиальное воспалительное уплотнение. Отравляющий продукт коклюшной палочки постоянно раздражает слизистую оболочку дыхательного тракта, а также воздействует на центральную нервную систему. Определенную роль в развитии приступов спазматического кашля играют аллергические механизмы. Наличие стойкого очага возбуждения в центральной нервной системе объясняет развитие приступов кашля в ответ на неспецифические раздражители, а также спазмы недыхательной мускулатуры (у маленьких детей вплоть до судорог).
Огрубение аргирофильного каркаса легких при коклюше
Иммунитет после перенесенного заболевания недостаточно напряженный, чтобы обеспечить пожизненную невосприимчивость к коклюшу. То же самое относится и к противококлюшным прививкам. Поэтому при определенных обстоятельствах возможны повторные случаи заболевания.
Клиническая картина Периоды заболевания: — инкубационный (скрытый) период — от 3 до 14 дней; — катаральный (продромальный) период — 7—10 дней; — период разгара болезни (период судорожного кашля) — 3–6 недель; — период выздоровления (период остаточных явлений) — 2–3 недели.
Коклюш. Разгар спазматического кашля
Коклюш. Язвочка на уздечке языка
Коклюш. Кровоизлияния в конъюнктиву
Длительность инкубационного периода — 2—14 дней, однако чаще составляет 5–7 дней. Начало воспалительного периода характеризуется незначительным недомоганием, небольшим повышением температуры, умеренным насморком и кашлем. Затем кашель усиливается, отмечается повышенная раздражительность, а у детей — капризность. Переход к следующей фазе заболевания происходит постепенно. Продолжительность начального периода составляет 10–12 дней, после чего наступает период спазматического кашля. Типичные спазматические приступы характеризуются рядом последовательных кашлевых толчков, чередующихся с глубоким свистящим вдохом. После него опять происходит серия кашлевых толчков. Количество циклов на протяжении одного приступа может варьировать в пределах от 2 до 15. Окончанием приступа служат выделение вязкой стекловидной мокроты или рвота. В момент приступа отмечаются общее возбуждение больного, одутловатость и синюшная окраска кожи лица, точечные кровоизлияния на конъюнктиве глаз, выбухание шейных вен. Дети при кашле высовывают наружу язык, вследствие чего его уздечка нередко травмируется с образованием язвочек. У маленьких детей высок риск развития остановки дыхания с последующим удушьем, а также судорог на высоте приступа. Количество приступов в день может колебаться от 5 до 50, что зависит от степени тяжести заболевания. У детей раннего возраста типичные свистящие вдохи не выражены. Длительность периода спазматического кашля составляет 3–4 недели, после чего типичные приступы сменяются простым (несудорожным) кашлем: наступает период разрешения, который продолжается еще 2–3 недели. У взрослых коклюш протекает без типичных приступов спазматического кашля. Температура тела не повышается, самочувствие, как правило, не страдает. Заболевание проявляется в виде затяжной формы бронхита (см.) с упорным кашлем. Стертые формы коклюша характерны и для детей, получивших противококлюшные прививки. Среди осложнений коклюша на первом месте находятся пневмонии (см.), обусловленные самой коклюшной палочкой либо вторичной бактериальной инфекцией. Именно пневмонии являются причиной летальных исходов среди детей младшего возраста (до 3 лет) в 90 % случаев. Из других осложнений могут наблюдаться острый ларингит (см.) с сужением гортани (ложный круп), бронхиолиты, ателектазы (см.), энцефалопатия, остановка дыхания, пупочная и паховая грыжи (см.), разрыв диафрагмы, выпадение прямой кишки. У детей старшего возраста может обостриться туберкулезный процесс, у взрослых осложнения бывают редко. Дети первого года жизни, заболевшие коклюшем, подвержены значительной опасности, особенно при присоединении осложнений. Прогноз усугубляется при развитии заболевания на фоне сопутствующей патологии (рахит (см.), последствия родовой травмы и пр.).
Диагностика и дифдиагностика Диагностика коклюша в катаральном периоде проводится на основании эпидемиологических данных (контакт с больным коклюшем, отсутствие профилактических прививок и др.), которые являются поводом для проведения бактериологического исследования. При получении положительного результата диагноз коклюша считается установленным. Забор материала можно осуществлять двумя способами: методом кашлевых пластинок и мазком с носоглотки сухим тампоном, причем в последнем случае посев должен быть осуществлен немедленно в чашки с питательной средой. Метод кашлевых пластинок несколько менее результативен. Для получения посева чашку Петри со средой устанавливают на расстоянии 10 см от рта кашляющего ребенка и улавливают до 5–6 кашлевых толчков, после чего закрывают крышкой и помещают в термостат. При транспортировке чашки с материалом следует оградить ее от воздействия низких температур. Частота получения положительных результатов при бактериологическом исследовании напрямую зависит от сроков забора материала: в начальном периоде частота высева коклюшной палочки достигает 95 %, в разгар периода спазматического кашля (4-я неделя заболевания) — уже 50 %, а начиная с 5-й недели болезни выделить инфекционный агент не удается. В периоде спазматического кашля при наличии типичных приступов диагноз не представляет затруднений. Однако необходимо учитывать возможность сходной симптоматики при ряде других инфекций дыхательного тракта (аденовирусной инфекции (см.), вирусных пневмониях (см.), сдавлении дыхательных путей при злокачественных новообразованиях, инфекционноммононуклеозе (см.) и др.). Напротив, стертые формы и коклюш у взрослых протекают без типичных приступов, поэтому на первом месте остаются лабораторные методы исследования. Серологические методы используются в целях ретроспективного анализа, а также у пациентов с отрицательными результатами бактериологического исследования. При помощи лабораторных методов обнаруживают антитела к коклюшной палочке в сыворотке крови и слизи носоглотки. Эти антитела выявляются со 2—3-й недели заболевания и сохраняются в течение последующих 3 месяцев. Дифференциальная диагностика в начальном периоде проводится с ОРЗ, в период спазматического кашля — с заболеваниями, сопровождающимися приступообразным кашлем при нормальной температуре тела без выраженной общей интоксикации организма.
Лечение Госпитализации подлежат больные коклюшем дети в возрасте до 1 года, а также пациенты с тяжелым и осложненным течением заболевания. Для остальных заболевших возможно проведение лечения в домашних условиях. Антибиотикотерапия при коклюше применяется в начальном периоде, что может приводить к абортивному течению заболевания без периода спастического кашля. В случае назначения препаратов противомикробного действия в период развития типичных приступов не отмечено положительного влияния на течение и симптоматику заболевания. Поэтому в легких случаях и при среднетяжелом течении коклюша антибиотики не рекомендуют к назначению. Однако антибактериальная терапия показана при наслоении вторичной инфекции при тяжелых и осложненных формах заболевания. Коклюшная палочка чувствительна ко многим антибиотикам, среди которых можно отметить макролиды, тетрациклины, хлорамфеникол. Однако препаратами выбора являются эритромицин и азитромицин, поскольку левомицетин достаточно токсичен, а тетрациклин противопоказан детям до 8 лет. При присоединении вторичной микрофлоры следует учитывать ее чувствительность к антибиотикам, однако в качестве доказательной терапии обычно используются антибиотики пенициллинового ряда, а также стрептомицин. Из средств, направленных на прекращение развития заболевания, при коклюше применяются антигистаминные препараты (димедрол, тавегил, супрастин, пипольфен), кальцийсодержащие средства, в тяжелых случаях — глюкокортикостероиды (преднизолон) коротким курсом. Для снижения частоты и тяжести спазматических приступов можно использовать нейролептики (аминазин, пропазин). Признаки кислородного голодания являются показанием к проведению оксигенации, необходимо периодически отсасывать мокроту, при временной остановке дыхания назначают искусственную вентиляцию легких. Для разжижения густой мокроты используют ингаляции химопсина и химотрипсина. Помимо лекарственной терапии, большое значение имеет физиологический режим, а также регулярный доступ свежего воздуха в помещение, где находится пациент. Важно способствовать устранению всех причин, которые могут повлечь за собой развитие приступа спазматического кашля (в том числе отрицательные эмоциональные раздражители). В фазе разрешения при низкой неспецифической резистентности организма показаны биогенные стимуляторы, физиотерапевтические процедуры, витаминотерапия.
Профилактика Специфическая иммунопрофилактика вакциной АКДС выполняется всем детям в интервале от 3 месяцев до 3 лет, не болевшим коклюшем. Курс представляет собой 3 внутримышечные инъекции 0,5 мл вакцины АКДС с интервалом 1,5 месяца. Повторную вакцинацию делают через 1,5–2 года после законченной вакцинации. Детей старше 3 лет прививают только против дифтерии и столбняка. Вакцинация или полностью предупреждает возникновение заболевания (у 70–80 %), либо заболевание протекает в легкой форме. Побочные реакции на проведение вакцинации АКДС связаны преимущественно с коклюшным компонентом вакцины: в частности, отмечались асептический менингит, многоформная экссудативная эритема, синдром Гийена-Барре, периферические мононевриты, тромбоцитопения, гемолитическая анемия (см.), энцефалопатия (10 случаев на 1 млн привитых), анафилактические реакции (2 случая на 100 тыс. привитых). Необходимо учитывать значительное превышение положительного эффекта вакцинации над риском развития серьезных неврологических осложнений. Созданная для иммунизации взрослых цельноклеточная противококлюшная вакцина менее реактогенна, чем бесклеточная, и в настоящее время она проходит клиническую апробацию. Изоляция больного осуществляется на срок 30 дней с момента начала заболевания. Здоровых бактерионосителей удаляют из коллектива до получения двух отрицательных результатов бактериологического посева, но не ранее 14 дней с момента выделения коклюшной палочки. Дети в возрасте до 7 лет, находившиеся в контакте с больным, не привитые и не болевшие коклюшем, должны находиться в карантине сроком 14 дней с момента изоляции больного. Если изоляция не проводилась, то срок карантина удлиняется до 25 дней. 3аключительная дезинфекция не проводится. С профилактической целью можно назначить эритромицин в возрастных дозировках на период 5–7 дней детям, контактировавшим с больным коклюшем, а также больным в начальный период болезни, что приводит к быстрому обезвреживанию бактериовыделителей и прекращению заболевания у контактировавших лиц.
КОЛИКА ПЕЧЕНОЧНАЯ
ОпределениеПеченочная колика — приступ интенсивной боли в области правого подреберья, возникающий чаще всего после приема жирной или жареной пищи, сопровождающийся тошнотой, рвотой, отсутствием аппетита.
Этиология Печеночная колика возникает при желчнокаменной болезни (см.), хроническом бескаменном холецистите (см.), дискинезии (см.) желчевыводящих путей. Причиной являются спазм гладкой мускулатуры желчевыводящих протоков, закупорка протока камнем, нарушение оттока желчи.
Клиническая картина Отмечается интенсивная боль в правом подреберье, которая может отдавать в правое плечо, под правую лопатку и возникает при нарушении диеты (после приема жирной и жареной пищи). Боль носит колющий, ноющий или режущий характер и сопровождается тошнотой, рвотой съеденной пищей, которая приносит некоторое облегчение, а также потерей аппетита. Боль несколько уменьшается после применения спазмолитиков и анальгетиков. Диагноз ставится на основании клинической картины желчной колики, данных УЗИ печени и желчного пузыря, рентгенографии желчного пузыря.
Лечение Лечение начинают с назначения анальгина, папаверина, но-шпы, баралгина, которые вводятся внутримышечно или внутривенно. Если такое лечение оказалось неэффективным, необходима госпитализация в хирургический стационар для дальнейшего наблюдения и решения вопроса об оперативном лечении.
КОЛИКА ПОЧЕЧНАЯ
ОпределениеПочечная колика — синдром, наблюдающийся при ряде заболеваний почек, основное проявление которых — острые боли в поясничной области.
Этиология и патогенез Наиболее частыми причинами почечной колики бывают почечнокаменная болезнь (см.), гидронефроз (см.), нефроптоз (опущение почки), при которых нарушается продвижение мочи в верхних мочевых путях. Почечную колику могут вызвать закупорка мочеточника сгустком крови, омертвевшими массами при туберкулезе (см.) почек или опухолью (см.), а также поликистоз и другие заболевания почек и мочеточников. Ведущая роль в развитии клинической картины принадлежит спазму мочевых путей с их ишемией, растяжению фиброзной капсулы почки и обратному току мочи из лоханки почки в верхние отделы мочевых путей.
Клиническая картина Приступ чаще всего развивается неожиданно и проявляется сильными болями в поясничной области, но иногда ему предшествует нарастающий дискомфорт в области почки. Ходьба, бег, езда на мотоцикле, поднятие тяжестей нередко провоцируют приступ, но он может возникнуть и в покое. Интенсивность боли быстро нарастает, больной мечется, не находя места от боли, громко стонет, держась руками за больной бок. Боль локализуется в поясничной области, но затем перемещается вниз по ходу мочеточника, отдает в паховую область и половые органы. При исследовании мочи, как правило, обнаруживают эритроциты и небольшое количество белка, иногда — камни, соли, сгустки крови. Нередко при камнях мочеточника почечная колика сопровождается болями в животе и парезом (см.) кишечника, как при картине острого живота. В таких случаях дифференциальная диагностика с аппендицитом (см.), холециститом (см.), кишечной непроходимостью (см.) и панкреатитом (см.) бывает нелегкой, тем более что приступ часто сопровождается тошнотой и рвотой, а наличие эритроцитов в моче не исключает диагноза аппендицита (см.). Если камень небольшого размера локализуется в нижнем отделе мочеточника или почечная колика связана с отхождением песка, то возникают частые и болезненные позывы на мочеиспускание. Приступ может сопровождаться ознобом, повышением температуры, учащением сердцебиения, лейкоцитозом, повышением СОЭ. Он может быстро закончиться или продолжаться много часов.
Диагностика и дифдиагностика Диагноз почечной колики ставят на основании характерной локализации и иррадиации боли, усиливающейся при прощупывании и поколачивании в области почки, на основании изменений мочи, данных хромоцистоскопии и внутривенной урографии. При почечнокаменной болезни (см.) и гидронефрозе (см.) приступ может возникнуть как днем, так и ночью (больные спят на любом боку), при нефроптозе боль чаще возникает днем (больные предпочитают спать на больном боку). При хромоцистоскопии во время приступа индигокармин (контрастное вещество) с больной стороны не выделяется или выделение его значительно запаздывает. Иногда в области устья мочеточника видны отек, кровоизлияние или ущемленный камень. Вне приступов при гидронефрозе выделение индигокармина всегда замедленное, а при нефроптозе, как правило, нормальное. Внутривенная урография — наиболее ценный метод диагностики почечной колики и ее дифференциальной диагностики с острыми хирургическими заболеваниями органов брюшной полости. Она позволяет при нефролитиазе обнаружить камень и изменения мочевых путей, при гидронефрозе — расширение лоханки и чашечек, а при нефроптозе — патологическую смещаемость почки и изгиб мочеточника. Внутривенная урография выявляет также и другие, более редкие причины почечной колики.
Лечение Лечение начинают с применения тепла (грелка, ванна с температурой 37–39 °C), спазмолитических и обезболивающих средств. Приступ можно прекратить внутримышечным введением 5 мл раствора баралгина в сочетании с приемом баралгина внутрь по 0,5 г 3 раза в день или подкожной инъекцией 1 мл 0,1 %-ного раствора атропина в сочетании в 1 мл 2 %-ного раствора промедола или 1 мл 2 %-ного раствора пантопона (или 1 мл 1 %-ного раствора морфина). При затянувшемся приступе целесообразна новокаиновая блокада семенного канатика или круглой связки матки со стороны поражения. Почечная колика, сопровождающаяся повышением температуры, — показание к госпитализации в урологическое отделение, где с лечебной целью может быть проведена катетеризация мочеточника. Прогноз при своевременном и соответствующем лечении благоприятный.
КОЛИТ
ОпределениеКолит — поражение толстого кишечника воспалительного или воспалительно-дистрофического характера. По локализации поражения различают панколит и сегментарный колит: тифлит (правосторонний колит с повреждением верхних отделов толстой кишки), сигмоидит, проктосигмоидит (колит нижних отделов кишечника). Колит может быть острым и хроническим, у лиц пожилого и старческого возраста выделяют также ишемический колит.
Этиология и патогенез Ишемический колит Основной причиной возникновения и развития ишемического поражения стенки толстой кишки является нарушение кишечного кровообращения, чаще всего связанное с атеросклерозом ветвей брюшной аорты. Атеросклеротическая бляшка закупоривает просвет нижней брыжеечной артерии частично или полностью, что приводит к дистрофическим и, в последнем случае, к некротическим изменениям стенки толстой кишки. Реже причиной нарушения кровообращения кишечника могут быть геморрагический васкулит, узелковый периартериит, системная красная волчанка и пр. Преимущественная локализация поражения — область селезеночного угла.
Острый колит Подавлящее большинство случаев острых колитов связано с инфекционным фактором. Возбудителями острого колита могут быть сальмонеллы, шигеллы, эшерихии, иерсинии и пр., реже некоторые вирусы и другая болезнетворная флора. Иногда причиной могут быть аллергические реакции, небактериальные отравления, грубые погрешности в диете. В зависимости от типа воспаления острые колиты подразделяются на катаральные, эрозивные, язвенные, фибринозные. Острое воспаление кишечной стенки приводит к нарушениям всех функций толстой кишки разной степени выраженности.
Язвенный колит
Некротически-фибринозный колит
Хронический колит Хронический колит — заболевание, связанное с рядом различных факторов. Причинами хронического колита могут быть инфекционные заболевания (прежде всего дизентерия), паразитарные заражения, а также факторы неинфекционного происхождения. Алиментарные колиты возникают из-за систематических дефектов в режиме и качестве питания, токсические — в результате воздействия ядовитых агентов бытового и промышленного применения (соли свинца, мышьяка, ртути). Лекарственные колиты связаны с длительным и бесконтрольным приемом антибиотиков, слабительных, сопутствующие колиты развиваются на фоне секреторной недостаточности желез желудка, поджелудочной железы и возникают вследствие постоянного раздражения слизистой толстой кишки продуктами неполного переваривания пищи в вышележащих отделах желудочно-кишечного тракта. Описаны случаи хронического колита аллергической природы. В механизме развития хронических колитов ведущую роль играют воспалительные, дистрофические и атрофические изменения слизистой толстой кишки, сопровождающиеся нарушениями ее двигательных и секреторных функций. Определенное значение придается нарушениям иммунного статуса.
Клиническая картина Ишемический колит Ишемический колит может протекать в доброкачественной (обратимой), стенозирующей (обусловленной постепенным прекращением кровотока) и молниеносной (некрозирующей) формах. Тип течения зависит от калибра пораженного сосуда, степени выраженности нарушения кровотока и развития коллатерального кровоснабжения. Молниеносная форма, связанная с необратимым омертвением кишечной стенки, проявляется резчайшей болью в левой половине живота, признаками кишечной непроходимости, прямокишечным кровотечением, исходом является перитонит. В случае развития доброкачественной и стенозирующей форм заболевания клиника не такая острая. Как правило, пациенты отмечают интенсивную боль в верхней части или левой половине живота, обычно сразу после еды, рвоту, метеоризм и другие расстройства пищеварения. Нередко повышается температура тела. В половине случаев наблюдается диарея, часто с примесью крови, но могут встречаться и запоры, а также их чередование с поносами. При прощупывании отмечается выраженная болезненность по ходу нисходящей ободочной кишки, иногда защитное мышечное напряжение в левой половине живота.
Острый колит Острый колит протекает, как правило, в сочетании с острым энтеритом или гастроэнтеритом, сопровождает многие кишечные инфекции.
Острый катаральный колит
Больные жалуются на остро возникшую тянущую или спастическую боль в животе, урчание, потерю аппетита, жидкий стул с примесью слизи, в тяжелых случаях — крови. Частота приступов составляет от 4–5 до 15–20 раз в сутки. Могут возникать тенезмы, при быстром развитии заболевания стул приобретает характер «ректального плевка». Температура тела может достигать высоких цифр. В особо тяжелых случаях на первый план выступают симптомы общей интоксикации. При прощупывании живота отмечаются урчание, болезненность по ходу толстой кишки.
Хронический колит Хронический колит — одно из самых распространенных заболеваний желудочно-кишечного тракта. Часто сочетается с хроническим гастритом и гастроэнтеритом. Течение заболевания в одних случаях длительное и малосимптомное, в других — хронически-рецидивирующее. Обычно имеет место панколит, при котором пациенты жалуются на нарушение стула — поносы, иногда чередование поносов и запоров (неустойчивый стул), при выраженных изменениях в кале могут быть прожилки крови, большое количество слизи. Живот вздут, отмечается метеоризм. Характерным симптомом является чувство неполного опорожнения кишечника после дефекации. При спастическом колите каловые массы имеют фрагментированный вид («овечий кал»). Тупые, ноющие боли отмечаются в разных отделах живота, преимущественно слева и внизу, но могут быть и разлитыми без четкой локализации. Характерно усиление после еды и перед дефекацией. Могут присоединиться боли в заднем проходе из-за воспаления слизистой прямой и сигмовидной кишок. При переходе воспаления на серозную (внешнюю) оболочку кишки (периколит) боли могут усиливаться при ходьбе и тряске и ослабевать в горизонтальном положении. Облегчают боль теплая грелка, прием спазмолитиков, холинолитиков. При прощупывании живота определяется болезненность по ходу толстого кишечника, чередование спазмированных и расширенных участков, наполненных жидким и плотным содержимым, сильное урчание и даже плеск в одном из отделов кишки. Наличие хронического перивисцерита приводит к устойчивости мышц передней брюшной стенки над участками поражения. Наиболее часто из всех отделов толстого кишечника страдают прямая и сигмовидная кишки. Нередко проктосигмоидит возникает после острой дизентерии, при хронизации инфекционного процесса. Клиническая симптоматика отличается наличием склонности к запорам. Стул может быть и по типу овечьего кала с большим количеством слизи, иногда с прожилками крови. Боли чаще в левой подвздошной области, анальном проходе, сохраняются некоторое время после дефекации, очистительной клизмы. При прощупывании определяется болезненность спазмированной сигмы.
Особенности колитов у детей Острые колиты у детей протекают так же, как и у взрослых. Хронические колиты у детей в большинстве случаев являются исходом острых кишечных инфекций, чаще дизентерии. В некоторых случаях причиной могут служить глистные заражения. При длительности заболевания до 2–3 лет обычно имеет место сегментарный колит с преимущественным поражением нижних отделов толстой кишки. В ряде случаев предрасполагающими факторами могут служить врожденные аномалии развития кишечника, такие как мегаколон, долихосигма. При длительности свыше 3 лет заболевание принимает характер панколита. Клиническая картина варьирует в зависимости от фазы заболевания и преимущественной локализации патологического процесса. В период обострения характерно наличие болей в животе, чаще в околопупочной области или по ходу толстой кишки в правой (при тифлите) или левой (при сигмоидите) подвздошных областях. Усилению болей способствуют: физические нагрузки, употребление больших количеств растительной клетчатки, молока, а также метеоризм и усиление моторики перед дефекацией. У детей младшего возраста болевому синдрому соответствует синдром «проскальзывания», когда отмечается послабление стула после приема пищи. В более старшем возрасте часто встречается неустойчивый стул либо склонность к запорам. Как и у взрослых, отмечаются урчание в животе, метеоризм. При вовлечении в процесс вышележащих отделов желудочно-кишечного тракта могут присоединяться тошнота, отрыжка, реже изжога и рвота. При прощупывании толстая кишка местами спазмирована, болезненна. В фазе неполной клинической ремиссии жалобы у детей отсутствуют, однако расстройства стула сохраняются, как и некоторая болезненность при прощупывании. В стадии полной клинической ремиссии инструментальные методы исследования позволяют выявить изменения в толстой кишке. Особой формой колита является тяжелое поражение толстого кишечника — псевдомембранозный колит, не связанный с развитием дисбактериоза. Возбудителем псевдомембранозного колита является клостридия, токсин которой вызывает разрушающие процессы в слизистой оболочке толстой кишки. Заболевание может развиться после приема первой же дозы антибиотика, но может возникнуть и в отдаленном периоде. Диарейный синдром при псевдомембранозном колите носит тяжелый характер с ярко выраженным колитическим стулом (слизь, кровь и лейкоциты), сочетается с лихорадкой и схваткообразными болями в животе без четкой локализации.
Диагностика В диагностике колитов важная роль принадлежит как данным анамнеза и физикального обследования, так и лабораторным и инструментальным. Для выявления (исключения) инфекционной природы острых и хронических колитов требуется тщательный опрос больного. Во всех случаях необходимы копроскопия и бактериологическое исследование кала, для диагностики и дифференциальной диагностики применяют эндоскопические методы исследования.
Ишемический колит Для подтверждения диагноза пациентам с частичной закупоркой нижнебрыжеечной артерии проводят ирриго-, колоно- или ректороманоскопию. Ирригоскопия обнаруживает в месте поражения дефект наполнения в виде «отпечатка большого пальца», при эндоскопическом исследовании выявляется отечность участка слизистой, подслизистые кровоизлияния, изъязвления и сужения при длительном течении заболевания. Окончательно диагноз можно подтвердить при помощи селективной ангиографии нижнебрыжеечной артерии.
Хронический колит В диагностике большое значение имеют как данные опроса и объективного осмотра, так и результаты инструментальных исследований. Ирригоскопия специфических нарушений не выявляет. Обычно обнаруживаются ускорение или замедление перистальтики, спастические сокращения или атония кишечной стенки. Колоноскопия и ректороманоскопия выявляют катаральное воспаление слизистой оболочки толстой кишки, в тяжелых случаях могут быть гнойное или некротическое поражение. При необходимости во время колоноскопии берется биопсия слизистой. Дифференцировать хронический колит необходимо с энтеритом, дивертикулезом, язвенным неспецифическим колитом, опухолевыми процессами кишки. Сложным является вопрос о разграничении колита и функционального заболевания кишечника — его дискинезией или синдромом «раздраженной кишки». Обычно явления дискинезии сочетаются с наличием невротической симптоматики, однако первые преобладают. В отличие от колита при ректоромано- и колоноскопии слизистая толстой кишки не изменена, отмечается спазм отдельных участков кишечной стенки. Ирригоскопия выявляет множественные сокращения круговых мышц, продвижение контрастного вещества по кишечнику ускорено, не упорядочено. Опорожнение сигмовидной кишки неполное. Для подтверждения диагноза псевдомембранозного колита помимо четкой связи заболевания с приемом антибиотиков широкого спектра действия требуется проведение эндоскопического обследования сигмовидной кишки.
Лечение Ишемический колит При молниеносной форме ишемического колита с развитием клиники острого живота больному показано экстренное оперативное вмешательство — удаление пораженного участка толстой кишки. В терапии стенозирующей формы используют спазмолитики, холинолитики, антисклеротические препараты, ангиопротекторы. При присоединении инфекции применяются антибактериальные средства. Эффективным методом лечения является удаление пораженной внутренней оболочки артерии, пластика сосудов. При развитии стриктур также выполняется удаление пораженной зоны кишки. Противопоказано использование сердечных гликозидов, которые вызывают сужение брыжеечных артерий.
Острый колит Лечение острого колита проводится в амбулаторных или стационарных условиях в зависимости от степени тяжести состояния пациента. Назначают механически и химически щадящую диету (стол № 4 по Певзнеру) до улучшения самочувствия с последующим постепенным ее расширением. Для восполнения утраченной жидкости и солей используются солевые растворы («Регидрон», «Оралит», трисоль, квартасоль и др.). Метод восстановления водно-солевого баланса выбирается исходя из состояния пациента. В качестве патогенетической и симптоматической терапии используются ферментные препараты, обволакивающие средства и адсорбенты (активированный уголь, белая глина и др.) и сердечно-сосудистые препараты по показаниям. При установленной инфекционной природе колита этиотропная терапия заключается в назначении антибактериальных средств с учетом чувствительности к ним выделенного возбудителя. В легких случаях предпочтительнее не использовать антибиотики, особенно широкого спектра действия, ограничиваясь применением диеты и симптоматических средств.
Хронический колит Лечение хронического колита в зависимости от фазы заболевания и состояния пациента может проводиться как в стационарных, так и в амбулаторных условиях и должно быть непрерывным. Диетотерапия при хроническом колите должна быть строго специфичной. В период обострения назначают дробное питание 6–7 раз в сутки, рекомендована одна из диет № 4а, 4б, 4 в. При выраженном обострении первые один — два дня в стационаре можно провести лечебное голодание. На дому лечебное питание включает в себя слизистые супы, некрепкие мясные бульоны, протертые каши на воде, отварное мясо в виде паровых котлет и фрикаделек, яйца всмятку, вареную речную рыбу, кисели, сладкий чай. В период ремиссии диета может быть расширена с включением сначала отварных, протертых, а затем и свежих овощей и фруктов. Антибактериальную терапию назначают курсами по 4–5 дней, при легкой и средней степени тяжести — сульфаниламиды, при отсутствии от них эффекта — антибиотики строго с учетом чувствительности высеваемой флоры. При выраженных болях — спазмолитики (папаверин, но-шпа), платифиллин. С общеукрепляющей целью применяют витамины группы В, аскорбиновую кислоту (лучше в инъекциях). Средством симптоматической терапии являются ферментные препараты, при поносах — вяжущие и адсорбирующие средства, подогретые минеральные воды без газа — «Ессентуки» № 4 и 20, «Березовская», а также настои и отвары лекарственных трав с вяжущим и противовоспалительным эффектом (плоды черники, кора дуба, лист шалфея, соплодия ольхи и др.); при запорах применяют растительные слабительные — лист сенны, кору крушины, плоды жостера и пр., а из минеральных вод — «Ессентуки № 17», «Смирновскую», «Славяновскую», «Баталинскую». При выраженном метеоризме в сборы лекарственных трав целесообразно добавлять семена тмина, укропа, цветки ромашки, стебли золототысячника. При упорных запорах рекомендуется прием отрубей, которые перед употреблением заваривают крутым кипятком и настаивают, а после остывания используют в чистом виде или добавляя в различные блюда, начиная с чайной ложки и доводя дозу до 1–2 ст. л. 3 раза в день. При преимущественном поражении прямой кишки назначают лечебные микроклизмы: масляные (масло облепихи, шиповника), теплый отвар ромашки. В комплекс лечебныхмероприятий включают (при необходимости) седативные средства, психотерапию, иглоукалывание, а также физиотерапевтические процедуры (согревающие компрессы на живот, электрофорез папаверина, новокаина, грязелечение). В период ремиссии для нормализации моторики кишечника пациентам назначают глубокий массаж живота (колон-массаж). Санаторно-курортное лечение проводится в местных санаториях и на бальнеологических курортах (Друскининкай, Трускавец, Кавказские Минеральные Воды, Феодосия). Прогноз при хроническом колите в целом благоприятный, однако в плане полного выздоровления — сомнительный. В легких случаях псевдомембранозного колита отмена антибиотика приводит к полному выздоровлению пациента, тогда как в тяжелых требуется назначение трихопола или ванкомицина.
КОЛЛАПС
ОпределениеКоллапс — угрожающая жизни острая сосудистая недостаточность, сопровождающаяся резким снижением сосудистого тонуса, уменьшением объема циркулирующей крови, признаками гипоксии мозга и угнетением жизненно важных функций.Выделяют следующие виды острой сосудистой недостаточности: — церебральная; — гипоксическая; — бактериотоксическая; — ортостатическая; — при демпинг-синдроме; — при острой сердечной недостаточности.
Этиология Чаще всего острая сосудистая недостаточность развивается при отравлении (см.) барбитуратами (фенобарбитал, люминал), небарбитуровыми снотворными (бролиутвал, хлоралгидрат, виадрил), нейролептиками (фенотиазин, аминазин), антидепрессантами (амитриптилин, мелипрамин), опиатами (морфина гидрохлорид, кодеин, омнопон), поражении надпочечников при тяжелом менингококковом менингите (см.), а также при нарушении нервной регуляции сосудистого тонуса, что может быть обусловлено травмой, кровоизлиянием, опухолью и воспалением в различных отделах нервной системы, авитаминозом В.
Клиническая картина и лечение Клинически острая сосудистая недостаточность проявляется бледностью или даже синюшностью кожных покровов, похолоданием и потливостью конечностей, уменьшением количества мочи, нарушением сознания и дыхания, при этом на фоне прогрессирующего падения артериального давления нарастает частота сердечных сокращений. Лечебные мероприятия проводятся немедленно. Больного укладывают горизонтально со слегка запрокинутой головой, необходимо обеспечить свободную проходимость дыхательных путей. Внутривенно вводится реополиглюкин или инфузионная терапия проводится кристаллоидами (0,9 %-ный раствор хлорида натрия). В течение 20–30 мин одновременно вводится гидрокортизон или преднизолон внутривенно или внутримышечно. При отсутствии эффекта вводят допамин под контролем артериального давления и частоты сердечных сокращений. По степени выраженности симптомов выделяют три стадии острой сердечной недостаточности, в соответствии с которыми определяется объем терапии. Экстренная терапия включает применение средств, повышающих сосудистый тонус и предотвращающих отек мозга (см.) (глюкокортикостероиды). Терапию проводят в условиях реанимационных отделений и палат интенсивной терапии под постоянным контролем артериального давления и пульса.
КОМА
ОпределениеКома — полное выключение сознания с утратой восприятия окружающей среды и самого себя, отсутствием активных движений, потерей чувствительности, рефлексов и реакций на раздражение, расстройством дыхания и сердечной деятельности.
Этиология По глубине нарушений выделяют три стадии комы — умеренную, глубокую и запредельную. По темпу развития угнетения сознания различают острую и постепенно развивающуюся кому: к первой группе относится угнетение сознания, развивающееся при острой черепно-мозговой травме, тяжелых формах кровоизлияния в мозг, тяжелой электротравме (см.), а также гипогликемическую кому при сахарном диабете (см.); ко второй — медленно развивающееся угнетение сознания при опухолях (см.) и абсцессах (см.) мозга, тяжелых формах нейроинфекций (менингиты (см.), менингоэнцефалиты, энцефалиты (см.), отравлениях (см.) лекарственными средствами, угарным газом, средствами бытовой химии, инсектицидами, а также как исход хронической почечной и печеночной недостаточности (см.).
Клиническая картина Каматозные состояния по классификации имеют 4 степени глубины. I степень — поверхностная кома, которая характеризуется отсутствием сознания, реакцией на сильные болевые раздражители, отмечается двигательное беспокойство, стон. Зрачки сужены, корнеальные и зрачковые рефлексы сохранены; конъюнктивальные рефлексы снижены или отсутствуют; непроизвольное мочеиспускание. II степень — умеренная кома. К вышеперечисленному присоединяется сосудистая гипотония, слабый пульс, цианоз, снижение глазных рефлексов. Появляются дыхательные нарушения, парез глазодвигательных нервов. III степень — глубокая кома, при которой сознание отсутствует. Глотание нарушено, корнеальные и зрачковые рефлексы отсутствуют. Зрачки расширены, имеют неправильную форму. Дыхание аритмичное. Имеют место коллапс, гипотиреоз. IV степень — терминальная (запредельная) кома. Спонтанное дыхание отсутствует (проводится ИВЛ). Глаза вращаются в разные стороны. Полная мышечная атония, микроциркуляторные нарушения. Клиника различных видов ком определяется механизмами их развития, поэтому, кроме общих для всех ком симптомов угнетения сознания, утраты чувствительности и рефлексов, а в стадии запредельной комы — расстройств дыхания и кровообращения, — каждая разновидность имеет свои отличительные особенности. Гипогликемическая кома чаще всего развивается у больных сахарным диабетом (см.), получающих инсулинотерапию, при несоответствии дозы инсулина уровню сахара в крови, что может происходить при увеличении дозы инсулина, пропуске приема пищи, активной физической нагрузке, стрессах, сопутствующих заболеваниях. Такой коме обычно предшествует период резкой слабости, бледности, тошноты, головной боли, беспокойства и резкого чувства голода. Диабетическая кома развивается при повышении уровня сахара в крови. При этом сначала отмечаются постепенное угнетение сознания и сонливость, а при выраженном коматозном состоянии — снижение артериального давления, сухость кожи и слизистых оболочек, увеличение частоты сердечных сокращений.
Лечение Независимо от причины коматозного состояния экстренная терапия проводится по следующей схеме: поддержание артериального давления и частоты сердечных сокращений и дыхания, уровня сахара в крови и необходимая симптоматическая терапия. Дальнейшее лечение осуществляется в соответствии с причиной, вызвавшей развитие угнетения сознания.
КОНЪЮНКТИВИТ
ОпределениеКонъюнктивит — воспаление слизистой оболочки, выстилающей заднюю поверхность век и глазное яблоко.
Этиология По причине возникновения выделяют бактериальные конъюнктивиты (стафилококковый, стрептококковый, гонококковый, дифтерийный, пневмококковый); вирусные конъюнктивиты (герпетический, аденовирусный, эпидемический кератоконъюнктивит); хламидийные конъюнктивиты (трахома); аллергические и аутоиммунные конъюнктивиты (лекарственный, поллинозный, туберкулезноаллергический). По характеру течения конъюнктивиты делят на острые и хронические.
Клиническая картина Общие симптомы, характерные для всех конъюнктивитов, включают субъективные жалобы больного и объективные признаки. К субъективным симптомам относятся чувство жжения и зуда в глазу, ощущение засоренности, светобоязнь. Объективные симптомы представлены слезотечением, сужением глазной щели, покраснением и набуханием конъюнктивы век, из-за чего она теряет блеск и становится «бархатистой». Покраснение глазного яблока при конъюнктивитах наблюдается на периферии. Острый инфекционный конъюнктивит — самый частый из всех бактериальных конъюнктивитов — вызывается стафилококками и стрептококками. В патологический процесс вовлекаются оба глаза, но чаще не одновременно, а последовательно. Кроме общих для всех конъюнктивитов симптомов, для этого вида характерно наличие гнойного отделяемого, склеивающего ресницы. Заболеванию могут предшествовать охлаждение или перегревание, купание в загрязненном водоеме или пребывание в запыленном помещении, а также острое респираторное заболевание. Объективно ярко выражено покраснение конъюнктивы век и глаз. Пневмококковый конъюнктивит развивается чаще всего у ослабленных лиц, стариков и детей. Для него характерны точечные кровоизлияния в конъюнктиву, отек век и образование белесовато-серых пленок. Острый эпидемический конъюнктивит Коха-Уикса характеризуется очень высокой заразностью, передается через загрязненные руки, одежду и белье. Заболевание начинается внезапно с резкого отека век, покраснения конъюнктивы век и глазного яблока; кроме прочих общих симптомов, часто наблюдаются недомогание, повышение температуры тела, насморк и головные боли. Отделяемое сначала носит скудный характер, затем становится обильным и гнойным. Болезнь длится 5–6 дней, заболевших необходимо изолировать. Гонококковый конъюнктивит (гонобленнорея) вызывается гонококком и клинически подразделяется на гонобленнорею новорожденных, детей и взрослых.
Гонорейный конъюнктивит новорожденных
Новорожденные могут заразиться либо при прохождении через естественные родовые пути больной гонореей (см.) матери, либо через предметы ухода за малышом. Клинически гонобленнорея проявляется на 2—3-й день после рождения выраженным отеком век, резким покраснением конъюнктивы с обильным кровянистым отделяемым (цвета мясных помоев), которое через 3–4 дня, когда отек век уже уменьшается, приобретает гнойный характер. Осложнением гонобленнореи является изъязвление роговицы, что может привести к образованию бельма, а при прободении роговицы — к проникновению инфекции в глубокие отделы глазного яблока и слепоте. В настоящее время такие серьезные осложнения встречаются сравнительно редко. Гонобленнорея взрослых протекает с выраженными общими симптомами: лихорадкой, поражением суставов и сердечно-сосудистой системы. У взрослых осложнения гонококкового конъюнктивита встречаются достаточно часто. Дифтерийный конъюнктивит встречается редко — при несоблюдении режима противодифтерийной вакцинации и сопровождается выраженной интоксикацией, высокой температурой тела, увеличением лимфатических узлов и их болезненностью. Местные отличительные признаки дифтерийного конъюнктивита — серые пленчатые налеты на конъюнктиве век и глазного яблока. Их удаление болезненно и сопровождается кровоточивостью. Через 1–1,5 недели отделяемое становится гнойным, пораженные участки конъюнктивы отторгаются и в течение 1,5–2 недель заживают рубцом. При этом возможно образование спаек между глазным яблоком и внутренней поверхностью век. Возбудитель герпетического конъюнктивита — вирус простого герпеса. Чаще всего герпетический конъюнктивит бывает односторонним и отличается длительным течением. Выделяют три его формы — катаральную, фолликулярную и фолликулярно-язвенную; при первой воспаление выражено слабо, сопровождается появлением пузырьков на краях век и слизистым или слизисто-гнойным отделяемым, в последнем случае образуются эрозии и язвы. Аденовирусный конъюнктивит вызывается аденовирусами и сопровождается лихорадкой и фарингитом (см.). Аллергические и аутоиммунные конъюнктивиты развиваются при повышенной чувствительности организма к самым разнообразным веществам. Лекарственный конъюнктивит возникает при длительном местном лечении антибиотиками, анестезирующими препаратами и является частным случаем аллергических конъюнктивитов.
Лечение При остром инфекционном конъюнктивите назначают антимикробные препараты: 30 %-ный раствор сульфацил-натрия, растворы антибиотиков, раствор фурацилина в разведении 1:5000, 2–4 %-ный раствор борной кислоты, 3 %-ный раствор колларгола. В первый день болезни капли закапывают в конъюнктивальный мешок через каждый час, в последующие 3–4 дня — 5–6 раз в день. При остром конъюнктивите нельзя накладывать на пораженный глаз стерильную повязку, чтобы не вызвать застой гнойного отделяемого. Профилактика острого конъюнктивита заключается в соблюдении правил личной гигиены. Лечение гонококковых конъюнктивитов включает использование сульфаниламидных препаратов и антибиотиков широкого спектра действия внутрь и внутримышечно, частые промывания глаз слабым раствором калия перманганата с закапыванием альбуцида. На ночь за веки закладывают мазь, содержащую антибиотики или сульфаниламиды. Лечение проводят до полного выздоровления, которое должно быть подтверждено бактериологически. Прогноз при своевременном и адекватном лечении благоприятный. У новорожденных проводят обязательную профилактику гонобленнореи — сразу после рождения трижды в течение часа закапывают в каждый глаз 30 %-ный раствор сульфацил-натрия. Лечение дифтерийного конъюнктивита осуществляется в инфекционном отделении с использованием противодифтерийной сыворотки и антибиотиков или альбуцида и 1 %-ной тетрациклиновой мази местно. Лечение вирусных конъюнктивитов включает в себя местное применение антивирусных препаратов (0,1–1,2 %-ный раствор оксолина, 0,25 %-ная оксолиновая мазь), специфической противовирусной иммунотерапии (гамма-глобулин) и общеукрепляющих средств (витамины). Лечение аллергических и лекарственных конъюнктивитов требует немедленной отмены препаратов, вызвавших такую реакцию, и применения десенсибилизирующих и антигистаминных препаратов внутрь, а также глюкокортикостероидов местно (глазные капли и мази).
КОРОНАРИИТ
ОпределениеКоронариит — это воспаление сосудов, питающих сердечную мышцу.
Этиология и патогенез Коронариит — это синдром, встречающийся при инфекционном миокардите, ревматизме, системной красной волчанке, дерматомиозите и проявляющийся воспалительными изменениями стенки сосудов, местными нарушениями свертывания крови и ее реологических свойств, тромбозами мелких сосудов. В результате всех этих изменений нарушается снабжение кислородом сердечной мышцы.
Клиническая картина Коронариит проявляется жгучими, напоминающими стенокардические, болями за грудиной и в области сердца с нечеткой связью возникновения с физической нагрузкой, с положительным эффектом от нитроглицерина, но, в отличие от стенокардии, боль проходит не через несколько минут, а через 30–60 мин. Сходный со стенокардией характер болей объясняется нарушением кровоснабжения сердечной мышцы, вызванным отеком и спазмом сосудов.
Лечение Лечение коронариита сводится к лечению основного заболевания. Для облегчения болей в сердце используют нитроглицерин по 1 таблетке под язык, нестероидные противовоспалительные средства — ортофен, диклофенак, индометацин.
КОРЬ
ОпределениеКорь — острая вирусная болезнь с воздушно-капельным механизмом передачи, характеризующаяся лихорадкой, интоксикацией, воспалением дыхательных путей и пятнистой сыпью.
Этиология и патогенез Возбудитель из семейства парамиксовирусов быстро обезвреживается во внешней среде. В конце инкубационного периода и до 3-го дня от начала высыпаний вирус содержится в крови. Происходит системное поражение лимфоидной ткани с образованием гигантских многоядерных структур. Вирус поражает слизистые оболочки дыхательных путей и вызывает гнездное воспаление вокруг сосудов верхних слоев кожи, что проявляется сыпью.
Корь. Продромальный период. Инъекция сосудов и склер
Коревой распространенный бронхит с бронхоэктазиями, перибронхитами и перибронхиальной пневмонией
Доказана роль аллергических механизмов. Установлена возможность постоянного переживания коревого вируса в организме после перенесенной кори с развитием подострого склерозирующего панэнцефалита (воспаления головного мозга), имеющего прогрессирующее течение и заканчивающегося смертью.
Клиническая картина Инкубационный период составляет 9—10 дней, иногда он удлиняется до 17 дней. Катаральный (начальный) период характеризуется повышением температуры тела, общей интоксикацией и выраженным катаром верхних дыхательных путей (насморк, кашель). Характерным симптомом, возникающим за 1–2 дня до начала высыпаний, являются пятна Бельского-Филатова-Коплика: на слизистой оболочке щек, реже губ, десен появляются мелкие белесоватые папулы, не сливающиеся между собой. Этот симптом держится 2–3 дня. На 3—5-й день болезни при новом повышении температуры появляется сыпь. Начинается период высыпаний, который продолжается 3 дня и характеризуется этапностью: вначале сыпь обнаруживается на лице, шее, верхней части груди, затем на туловище, а на 3-й день — на конечностях. Элементы сыпи представляют собой пятна и узелки, сливающиеся между собой и после угасания оставляющие пятнистую пигментацию и мелкое отрубевидное шелушение. В период высыпания катаральные явления и симптомы интоксикации нарастают; в крови отмечается снижение количества лейкоцитов с относительным увеличением эозинофилов, которые являются отражением аллергизации организма.
Схема этапности коревого высыпания у детей
Корь. 1-й день высыпаний. Пятнисто-папулезная сыпь. Инъекция сосудов склер и конъюнктив
Корь. Синдром Стивена-Джонсона. Некротически-язвенное поражение слизистой оболочки рта, носа и глаз
Корь. Геморрагическая сыпь на спине. Начало пигментации
Корь. Аллергическая сыпь типа узловатой эритемы
Продолжительность болезни — 7–9 дней. В период выздоровления отмечаются похудение, сохраняющаяся слабость и снижение сопротивляемости организма к различным болезнетворным агентам. Корь протекает в легкой, среднетяжелой и тяжелой формах. У лиц, получавших серопрофилактику (вакцинированных), наблюдается ослабленная (митигированная) корь, характеризующаяся небольшой выраженностью всех симптомов. Среди осложнений наиболее часты ларингит (см.), который может сопровождаться сужением гортани — ранним крупом, связанным с действием коревого вируса, и поздним крупом с более тяжелым и длительным течением; пневмония (см.), связанная, как и поздний круп, со вторичной бактериальной инфекцией и особенно частая у детей раннего возраста; стоматит (см.), отит (см.), блефарит (см.) (воспаление век), кератит (см.). Очень редким и опасным осложнением являются коревой энцефалит (см.) и менингоэнцефалит. В типичных случаях диагноз может быть установлен уже в катаральном периоде. Точному распознаванию помогает серологическое исследование. Дифференцировать корь следует от ОРЗ, краснухи (см.), аллергических и лекарственных сыпей.
Лечение и профилактика Специфические методы терапии не разработаны. Основа лечения — постельный режим, гигиеническое содержание больного, симптоматические средства. При осложнениях бактериальной природы назначают антибиотики. Лечение пневмоний, крупа и энцефалита проводится по общим правилам. Госпитализация больных осуществляется по клиническим (тяжелые формы, осложнения) и эпидемиологическим показаниям. Смертельные исходы при кори очень редки и наблюдаются главным образом при коревом энцефалите. В целях профилактики проводится активная иммунизация всех детей с 15–18 месяцев. Применяется живая вакцина Л-16. Прививку проводят однократно путем подкожного введения 0,5 мл разведенной вакцины. При контакте с больным корью непривитым детям до 3-летнего возраста (а также ослабленным детям без возрастных ограничений) с целью профилактики вводят 3 мл иммуноглобулина. Больной корью изолируется не менее чем до 5-го дня с момента высыпания. Дети, бывшие в контакте с больным и ранее не подвергавшиеся активной иммунизации, подлежат разобщению с 8-го по 17-й день, а пассивно иммунизированные — до 21-го дня с момента предполагаемого заражения. Дезинфекция не проводится.
КОСОГЛАЗИЕ
ОпределениеКосоглазием считается отклонение одного или обоих глаз от общей точки фиксации, при этом нарушается нормальное зрение (скоординированная работа обоих глаз).
Этиология Выделяют явное и скрытое косоглазие; патологией считается только явное косоглазие, подразделяющееся на паралитическое и содружественное. Паралитическое косоглазие наблюдается при слабости мышечного аппарата глазного яблока, что может быть обусловлено травмой, опухолью (см.), нейроинфекциями, содружественное косоглазие развивается в детском возрасте.
Клиническая картина Клинически паралитическое косоглазие проявляется ограничением или отсутствием движений косящего глаза в сторону пораженной мышцы, при этом возникает чувство двоения предметов. При длительно существующем косоглазии возможно снижение зрения (вплоть до слепоты) косящего глаза. Содружественное косоглазие развивается в детском возрасте, при этом движения глазных яблок сохранены в полном объеме, а двоения нет. При отклонении глаза к носу косоглазие считают сходящимся, а к виску — расходящимся; выделяют также косоглазие кверху, книзу и сочетание горизонтального и вертикального отклонения глаз. При постоянном отклонении одного глаза косоглазие считается односторонним, обоих глаз — двухсторонним, попеременном отклонении то одного, то другого глаза — перемежающимся.
Лечение Лечение паралитического косоглазия включает устранение причины, вызвавшей парез глазодвигательной мышцы, и местное воздействие (физиотерапия); для коррекции двоения назначают призматические очки. Хирургическое лечение заключается в усилении пораженных мышц и применяется при неэффективности консервативной терапии. Лечение содружественного косоглазия начинают сразу после его обнаружения, что зависит от родителей и организации профилактической работы с детьми. Консервативная терапия, включающая использование очков, призматических стекол при систематическом наблюдении и коррекции и систему специальных упражнений для глаз, осуществляется на протяжении 1,5–2 лет. При ее неэффективности показано оперативное вмешательство, после которого также необходимо пройти функциональное лечение (система упражнений, в том числе и аппаратных). Медикаментозная терапия включает витаминные препараты, средства общеукрепляющего свойства и пр. Имеют также значение режим зрительной нагрузки, особенно на близком расстоянии, и условия освещенности. Восстановление нормального зрения в среднем наступает через 2–3 года.
КРАПИВНИЦА
ОпределениеКрапивница — аллергическое заболевание, формирующееся как проявление реакции гиперчувствительности (повышенной) немедленно-замедленного типа на аутогенные и экзогенные факторы (внешней и внутренней среды), характеризующееся образованием на коже и слизистых оболочках волдырей.
Этиология и патогенез Заболевание полиэтиологично, т. е. его возникновение может быть обусловлено рядом факторов. Выделяют экзогенные факторы: физические — температурные, механические; химические — лекарственные препараты, пищевые продукты и другие. Эндогенные факторы — патологические процессы во внутренних органах — желудочнокишечном тракте, нервно-эндокринной и других системах организма. Роль аллергена могут играть не полностью расщепленные продукты белковой природы, токсические вещества, образующиеся в толстом кишечнике при колитах. Возможна бактериальная аллергия.
Крапивница. Пигментные изменения кожи
В результате взаимодействия аллергена с реагинами (Ig Е) происходит разрушение клеточных мембран и высвобождение из клеток биологически активных веществ: гистамина, серотонина, медленно реагирующей субстанции и других, вызывающих расширение капилляров, повышение проницаемости сосудистых стенок, отек сосочкового слоя дермы, обуславливающий появление на коже и слизистых оболочках характерных волдырей. Большую роль в механизме развития крапивницы играют функциональные нарушения вегетативной нервной системы. Известна холинергическая крапивница, развивающаяся при нервном возбуждении и обусловленная выделением ацетилхолина в тканях под влиянием раздражения парасимпатической нервной системы. Ацетилхолин вызывает сосудистую реакцию, сходную с реакцией на гистамин. При укусах кровососущих насекомых (москитов, блох, клопов, мошек, комаров) со слюной паразитов в кожу проникают биологически активные вещества типа гистамина, вызывающие образование волдыря в месте укуса.
Клиническая картина Заболевание проявляется образованием на коже (реже на слизистых оболочках) волдырей (уртикарий). Плотные, ярко-розового цвета, возвышающиеся над поверхностью кожи экссудативные бесполостные элементы различных размеров от маленьких (диаметром 0,5 см) до больших (диаметром до 15 см), иногда сливных. Волдыри могут быть различных очертаний: кольцевидных, овальных, напоминающих кленовый лист с фестончатыми краями, нередко определяется зона побледнения в центре. Располагаются они в самых различных частях тела, иногда их появление сопровождается местным отеком кожи и всегда — мучительным местным зудом. Чаще всего крапивница появляется внезапно, но иногда ее проявлению предшествуют и затем сопутствуют общая слабость, головная боль, боль в области суставов, озноб, повышение температуры. Обычно волдыри исчезают бесследно.
Клинические формы Различают острую, к которой относится острый отек Квинке, хроническую рецидивирующую и стойкую папулезную формы крапивницы.
Острая крапивница Данная форма заболевания чаще является проявлением лекарственной или пищевой аллергии, внутривенным введением препаратов крови, сывороток, вакцин. Клиническая картина острой крапивницы характеризуется внезапным началом, появлением уртикарных высыпаний различных размеров и очертаний на коже, сопровождающихся сильным зудом, возможно слияние пузырей. Как правило, нарушается общее состояние организма: повышается температура тела, появляются озноб и недомогание. Могут быть высыпания на слизистых оболочках губ, языка, мягкого неба, гортани. Редко могут появляться геморрагические волдыри, оставляющие после себя гиперпигментацию. Острый отек Квинке, или гигантская крапивница, проявляется как ограниченный отек кожи или слизистых оболочек и подкожной жировой клетчатки, чаще всего развивается на коже лица, половых органов. На ощупь кожа плотноэластической консистенции, белого или бледно-розового цвета. Возможно появление субъективных ощущений жжения, зуда кожных покровов. При отеке в области гортани возможна асфиксия, при отеке в области век отклонение глазного яблока, снижение остроты зрения. Клинические проявления при благоприятном течении прекращаются в течение от нескольких часов до 1–2 дней.
Хроническая рецидивирующая Данная форма крапивницы обычно развивается при наличии длительной сенсибилизации, обусловленной очагами хронической инфекции в организме (тонзиллиты, гепатиты, аднекситы, колиты, гастриты и др.). Рецидивы заболевания характеризуются появлением уртикарных высыпаний на различных участках кожи, которые чередуются с периодами ремиссии различной продолжительности. Во время обострения заболевания, как правило, ухудшается самочувствие больного: беспокоят головная боль, слабость, повышение температуры тела, боли в суставах, при отеке слизистой оболочки желудочно-кишечного тракта возникают тошнота, рвота, понос. Мучительный зуд сопровождается бессонницей и невротическими расстройствами.
Стойкая папулезная При этой форме крапивницы наблюдаются длительно сохраняющиеся уртикарные высыпания, трансформирующиеся в папулы в результате присоединения к явлениям стойкого ограниченного отека клеточной инфильтрации в дерме. На коже преимущественно разгибательных поверхностей конечностей туловища определяются зудящие узелки красно-бурого цвета. У детей в возрасте до 3 лет стойкая папулезная крапивница обычно развивается на фоне экссудативного диатеза, при повышенной чувствительности ребенка к некоторым пищевым продуктам (цитрусовые, яйца, сладости и др.), перекармливании и нерациональном питании. Клиника характеризуется высыпанием волдырей маленького размера, в центре которого через некоторое время образуется папуловезикула размерами с булавочную головку, после чего волдырь исчезает, а на его месте образуется кровянистая корочка. Как правило, сыпь локализуется на разгибательных поверхностях конечностей, туловища, слизистые оболочки не поражаются.
Крапивница. Резкое набухание и растворение периваскулярной аргентофильной мембраны
Папулезные элементы при крапивнице
Солнечная крапивница является проявлением фитодерматоза. Чаще страдают женщины. Развивается при заболевании печени и нарушении порфиринового обмена веществ или при выраженной сенсибилизации к ультрафиолетовым лучам. Характерна сезонность (весна — лето) заболевания. Клиническими проявлениями являются высыпания в виде волдырей на открытых участках тела. При длительном пребывании на солнце возможна общая реакция организма в виде нарушения дыхания, сердечной деятельности, возможен шок. Контактная крапивница — один из вариантов аллергического дерматита. Характеризуется появлением на коже уртикарных элементов в ответ на контакт с антигенами (косметические средства, шерсть, шелк, химические вещества). Диагноз заболевания ставится на основании характерной клинической картины. В анализе крови обычно эозинофилия, тромбоцитопения.
Лечение Ликвидация фактора возникновения, устранение контакта с аллергенами. Применение антигистаминных средств, препараты кальция, в тяжелых случаях назначение кортикостероидных препаратов внутривенно. При острой крапивнице, вызванной приемом внутрь аллергенов (пищевых, лекарственных), назначают слабительные средства. Наружно назначают противозудные средства: 1 %-ный спиртовой раствор ментола, салициловой кислоты, календулы, кортикостероидные мази. При хронической крапивнице необходимо тщательное обследование для выявления фактора, вызвавшего заболевание. При выявлении аллергена показана специфическая гипосенсибилизация, удаление очагов хронической инфекции, лечение заболеваний желудочнокишечного тракта, дегельминтизация. При невротических расстройствах назначают седативные препараты. Диета безаллергеновая молочно-растительная с исключением экстрактивных возбуждающих средств. Показана общая ионогальванизация с хлоридом кальция. В случаях солнечной крапивницы показаны фотодесенсибилизирующие препараты. В период ремиссии возможно осторожное применение гистоглобулина, если нет указаний на аллергическую реакцию в ответ на применение гамма-глобулина в прошлом.
КРАСНУХА
ОпределениеКраснуха — острая вирусная инфекционная болезнь с воздушно-капельным путем передачи; характеризуется кратковременным повышением температуры, появлением пятнисто-узелковой (кореподобной) сыпи и увеличением заднешейных и затылочных лимфатических узлов.
Этиология и эпидемиология Возбудителем является вирус, летучий и неустойчивый во внешней среде, который проникает в организм через слизистые оболочки верхних дыхательных путей. Источник инфекции — больной, который заразен за несколько дней до высыпаний, а также больные с бессимптомными формами заболевания. Контагиозность наиболее выражена в разгаре болезни, угасает вместе с исчезновением сыпи. Выделение вируса у некоторых выздоравливающих может продолжаться некоторое время. Передача вируса воздушно-капельным путем. Восприимчивость к краснухе высокая, особенно у детей. Необходимо оберегать от общения с больным краснухой беременных женщин, не болевших краснухой. При внутриутробном заражении эмбрион либо погибает, либо у него развивается хроническая внутриутробная инфекция с поражением различных органов и формированием пороков развития (анэнцефалия, микроцефалия, гидроцефалия, пороки сердца, катаракта, ретинопатии, нарушение развития скелета и др.). При внутриутробном инфицировании после завершения органогенеза у плода формируются фетопатии (поражение костей, гепатиты, анемии, тромбоцитопеническая пурпура и др.). У таких детей длительно сохраняется персистенция вируса. При заболевании беременной в первые 3 месяца беременности показано прерывание беременности по медицинским показаниям. При контакте беременных с краснухой рекомендуется введение до 20 мл гамма-глобулина. У переболевших сохраняется пожизненный иммунитет.
Краснуха. Мелкопятнистая сыпь на туловище
Краснуха. Кожная сыпь на небе
Клиническая картина Инкубационный период от 11 до 22 дней, в среднем 15–20 дней. Предшествующий период в виде невысокого повышения температуры и легких катаральных явлений короткий и часто проходит незамеченным. Типичный симптом — припухание заднешейных, затылочных и других групп лимфатических узлов. Одновременно с повышением температуры на коже лица, шеи, а затем и туловища появляется бледно-красная пятнистая кожная сыпь. Характер сыпи пятнисто-узелковый, напоминающий сыпь при кори. Величина отдельных элементов от булавочной головки до чечевицы, сыпь не имеет склонности к слиянию, исчезает бесследно. В отличие от кори сыпь локализуется на разгибательных поверхностях конечностей, спине и ягодицах. В отдельных случаях может наблюдаться сыпь на слизистой оболочке зева. Температура обычно поднимается не выше 38 °C. В периферической крови характерно появление значительного количества плазматических клеток.
Осложнения Осложнения возникают редко и проявляются в виде синовиита, отита, нефрита, артрита, пневмонии, энцефалита.
Диагностика Диагностика основывается на клинических проявлениях. Точная диагностика осуществляется серологическими методами (ИФА, РПГА), основанными на определении специфических антител. Дифференциальная диагностика проводится с корью, скарлатиной, аллергическими сыпями, сывороточной болезнью.
Лечение Лечение симптоматическое. Обильное теплое питье, препараты кальция, десенсибилизирующие препараты, витаминотерапия. Прогноз благоприятный. Профилактика. Разработан метод активной иммунизации девочек подросткового возраста, не болевших краснухой, с целью создания иммунитета и исключения заражения во время беременности, который в широкой практике пока не применяется.
КРАШ-СИНДРОМ
ОпределениеКраш-синдром (синдром раздавливания, синдром длительного сдавления) — травматический токсикоз, характеризующийся местными и общими патологическими изменениями в ответ на длительное и обширное повреждение мягких тканей.
Патогенез В результате длительного сдавления мягких тканей происходят некробиотические изменения в мышцах. Это сопровождается выбросом в кровь миоглобина и различных токсических продуктов. Возникает тяжелый токсический шок. В последующем миоглобин оседает в почечных канальцах, возникает почечная недостаточность и почечная блокада.
Клиническая картина После освобождения от сдавления, как правило, развивается шок. Начиная с 3—4-го дня проявляются местные симптомы: плотный отек, бледность, нарушение функции конечности и острая почечная недостаточность, олигурия (уменьшение мочевыделения), переходящая в анурию (отсутствие мочевыделения). Из-за того, что в первые дни заболевания симптомы не выражены, проводят малоэффективное запоздалое лечение. Особой формой является позиционное сдавление — сдавление части тела при длительном сне в состоянии алкогольного опьянения или в бессознательном состоянии. Ранние симптомы стерты, на 3—4-й день начинаются клинические проявления, развивается симптом острой почечной недостаточности.
Лечение Срочная госпитализация пострадавшего, предварительная иммобилизация конечности, холод на место травмы, профилактика шока. Помощь при поддержке госпитализации: поврежденной конечности придают возвышенное положение. Ранее наложенный бинт разбинтовывают, конечность обкладывают льдом. При шоке назначается инфузионная терапия. Производится футлярная новокаиновая блокада выше места сдавления. Переливают кровозаменители и солевые растворы. Внутрь — обильное питье. Внутримышечно — антибиотики. Прогноз при развитии острой почечной недостаточности неблагоприятный.
КРЕТИНИЗМ
ОпределениеКретинизм — вид эндокринного заболевания, связанного с врожденной гипофункцией щитовидной железы. Заболевание выражается в задержке физического и психического развития, слабоумии.
Этиология В возникновении заболевания имеют значение наследственные дефекты ферментных систем, обеспечивающих синтез и обмен тиреоидных гормонов (гормонов щитовидной железы), приводящие к развитию спорадического нетоксического зоба и к гипотиреозу. Кретинизм связан с нарушением эмбрионального развития щитовидной железы, атиреозом, гипоплазией или эктопией щитовидной железы. Причиной гипотиреоза может быть лечение матери при беременности радиоактивным йодом или тиреостатическими препаратами. Дефицит тиреоидных гормонов во внутриутробном и раннем послеродовом периодах, когда развитие мозга находится в критической фазе, приводит к задержке соматического и психического развития ребенка.
Клиническая картина и диагностика Отмечаются костные изменения (различной степени карликовость, недоразвитость основания и деформация черепа, утолщение лобных и теменных костей), внутренние органы уменьшены в размерах, гипоплазия и нарушение функции половых желез, нарушение слуха и речи до глухонемоты, нарушение психики, тупое выражение лица, вялость, сонливость, слабоумие различной степени. Диагноз ставится на основании клиники и гипотиреоза.
Лечение При лечении применяют тиреоидные препараты: тиреоидин, трийодтиронин, эутирокс, L-тироксин. Прогноз в отношении жизни благоприятный. Прогноз в отношении развития умственных способностей зависит от возраста, в котором начата заместительная терапия.
КРИВОШЕЯ
ОпределениеКривошея — стойкое неправильное положение головы, выражающееся в наклонении набок с одновременным поворотом в противоположную сторону.По времени возникновения различают приобретенную и врожденную кривошею. В зависимости от первичной локализации патологических изменений в тканях различают костную, неврогенную, кожную и мышечную формы кривошеи.
Клиническая картина Костная форма Развивается при заболеваниях шейного отдела позвоночника либо при аномалиях шейного отдела позвоночника (клиновидные позвонки, добавочные полупозвонки, одностороннее сращение атланта с затылочной костью, наличие добавочных, шейных ребер и др.).
Кривошея
Неврогенная форма кривошеи Возникает при поражении центральной или периферической нервной системы каким-либо патологическим процессом (энцефалит, ОНМК) или в результате черепномозговой травмы, в том числе и родовой травмы. При спастическом параличе добавочного нерва (IX пара) иннервирующих грудино-ключично-сосцевидную и трапециевидную мышцы, на всем протяжении ядра, корешков или ствола нерва развивается атрофия грудино-ключично-сосцевидной мышцы. Затруднен поворот головы в здоровую сторону, развивается кривошея на стороне поражения. При вялом параличе затылочных нервов развивается кривошея на здоровой стороне.
Кожная форма кривошеи Развивается как осложнение после перенесенных травм, ожогов кожи. Врожденная кожная кривошея может наблюдаться при синдроме Шерешевского-Тернера. В большинстве случаев встречается врожденная мышечная кривошея. Причиной ее могут быть родовая травма, внутриутробная ишемия грудино-ключично-сосцевидной мышцы с последующим рубцеванием ее, внутриутробный интерстициальный миозит, наконец, пороки развития грудино-ключично-сосцевидной мышцы. Гистологически определяются дегенеративные изменения мышечного волокна, потеря поперечной и продольной полосатости, глыбчатый распад и развитие соединительной ткани, это приводит к резкому укорочению и сужению грудино-ключично-сосцевидной мышцы. Клинически определяется фиксированный наклон головы в сторону одной из грудиноключично-сосцевидных мышц в сочетании с поворотом головы в противоположную сторону, приподнятость подбородка, асимметрия черепа и лица. Одним из ранних симптомовявляется припухлость веретенообразной формы, плотной консистенции, без признаков воспаления в области средней или нижней части мышцы. С ростом кривошея увеличивается. В редких случаях возможно самоизлечение с полным восстановлением функции мышцы.
Лечение Как можно раньше следует начинать корригирующую гимнастику, ношение воротника Шанца, массаж пораженной мышцы, физиопроцедуры (электрофорез лидазы, йодистого калия, токи УВЧ и др.). При неэффективности консервативного лечения выполняют пластическую операцию, после которой продолжают корригирующую гимнастику, массаж, физиотерапию. Чем раньше начато лечение, тем более благоприятный исход заболевания.
КРИЗЫ
ОпределениеКриз — внезапно наступивший острый приступ болезни, внезапное изменение в организме, которое характеризуется приступообразным появлением или усилением симптомов заболевания и носит преходящий характер.Течение гипертонической болезни и вторичных симптоматических гипертензий нередко осложняется гипертензивными кризами, которые наблюдаются у 20–35 % больных. Церебральный криз — очаговые преходящие симптомы поражения головного мозга. Гипертонический криз является проявлением общих (центральных нейрогормональных) и местных (почки, мозг) механизмов адаптации к стрессорным воздействиям на фоне изменений реактивности кровеносных сосудов. У большинства больных гипертонической болезнью с повторяющимися кризами выявляется дисфункция диэнцефальной области и сетчатой формации ствола мозга, перепады секреции антидиуретического гормона, усиление реактивности симпатико-адреналовых механизмов. Возникновение гипертензивных кризов могут провоцировать, как факторы внешней среды (психоэмоциональный стресс, метеорологические явления, избыточное потребление соли и воды), так и самого организма (усиление вторичного альдостеронизма с задержкой натрия и воды, избыточное выделение ренина, повышение чувствительности адренорецепторов артериол к катехоламинам). Во многих случаях эти факторы комбинируются (см. Гипертонический криз).
Этиология и патогенез Гемолитический криз Характеризуется внезапным и быстрым развитием гемолитической анемии. Может быть следствием аутоиммунных процессов в организме больного, возникать в результате отравления гемолитическими ядами или переливанием несовместимой по группе или резус-фактору крови.
Гемолитический криз у новорожденных Гемолитический криз у новорожденных развивается в результате иммунологического конфликта между матерью и плодом и занимает существенное место среди причин перинатальной заболеваемости и смертности. Механизм развития: — изоиммунизация матери при изоантигенной несовместимой беременности, переливании аллогенной (несовместимой) крови или при пересадке тканей; — образование изоантител; — проникновение изоантител через плаценту. Изоиммунологический конфликт, поражение плода. Реакция антиген-антитело происходит на эритроцитах плода, это приводит к их разрушению, в крови накапливается билирубин. Незрелость ферментативных систем печени новорожденного приводит к накоплению в крови новорожденного непрямого билирубина и к развитию желтухи различной интенсивности. Тяжесть болезни определяется темпом почасового прироста билирубина. При почасовом приросте билирубина 0,25—0,3 % заболевание протекает в среднетяжелой форме.
Церебральный криз В основе мозгового криза лежит спазм сосудов головного мозга с последующим сужением; незначительного спазма достаточно, чтобы вызвать отек и преходящую анемию данного участка мозга. При нем проявляются вегетативные (тошнота, рвота, звон и шум в ушах, головокружение, потливость, покраснение лица) и общемозговые симптомы (головная боль, головокружение, нарушение зрения, нарушение координации движений, нарушение памяти). Данные явления проходят бесследно в течение нескольких часов или дней, и нарушенная функция мозга полностью восстанавливается. Развитие кризов провоцирует физическая и умственная нагрузка, эмоциональный стресс, нейроэндокринные нарушения, метеорологические изменения. Церебральные кризы могут быть первичные и вторичные. Первичные кризы возникают при функциональном или органическом поражении головного мозга с расстройством центров регуляции вегетативных функций, в том числе тонуса сосудов, функций ряда внутренних органов; таким образом, они являются церебральными вегетативными кризами. По локализации поражения или дисфункции мозга церебральные кризы могут быть височными, гипоталамическими (диэнцефальными) или стволовыми. Вторичные церебральные кризы (висцеральные церебральные) характеризуются неврологическими нарушениями, обусловленными соматическими заболеваниями.
Клиническая картина Гемолитический криз В качестве клинических проявлений отмечаются озноб, лихорадка, головная боль, оливково-желтый цвет кожных покровов, одышка, иногда боли в животе, могут быть рвота, диарея, моча темного цвета, в тяжелых случаях развивается острая почечная недостаточность. Причиной летального исхода является уремическая кома.
Гемолитический криз у новорожденных Гемолитическая болезнь новорожденных может протекать в 4 клинических формах: отечной, анемичной, желтушной и внутриутробной смерти с мацерацией (размягчением). Отечная форма наиболее тяжелая. Дети часто рождаются недоношенными, мертвыми и мацерированными или умирают в первые часы после рождения. Послеродовая желтушная форма развивается при хорошей барьерной функции плаценты, поступлении изоантител к плоду в небольшом количестве во время беременности либо во время родов. При среднетяжелой и легкой форме болезни дети рождаются внешне здоровыми. Картина болезни развивается остро, через несколько часов или к концу 1—2-х суток. Нарастает желтушность кожных покровов, кожа принимает желтозеленый, иногда желто-коричневый оттенок. Печень и селезенка увеличены. Наблюдается склонность к кровотечениям и кожным кровоизлияниям. Дети вялые, плохо сосут, рефлексы снижены, тоны сердца глухие. Моча темного цвета, дает положительную пробу Гмелина. Окраска стула нормальная. В периферической крови анемия, цветовой показатель около или больше единицы, макроцитоз, лейкоцитоз, ретикулоцитоз, эритробласты, миелобласты и миелоциты.
Церебральный криз Проявляется нестойким нарушением функции головного мозга в результате преходящего нарушения мозгового кровообращения и может быть как первичным, так и вторичным. В зависимости от объема и локализации сосудистых изменений в мозге различают генерализованные и регионарные церебральные кризы (охватывающие отдельный сосудистый бассейн). В основе церебрального сосудистого криза лежит механизм сосудистой мозговой недостаточности, либо микроэмболия, либо ангиодистония с изменением проницаемости сосудистой стенки. Сосудистый мозговой криз возникает по типу сосудистой мозговой недостаточности на фоне изменений артериального давления, нарушения сердечной деятельности, кровопотери и др., которые приводят к спазму сосудов, питающих мозг, что приводит к ишемии мозга в бассейне этого сосуда. Церебральные кризы часто имеют место при атеросклерозе. Развитию церебрального сосудистого криза может способствовать нарушение нервной регуляции мозгового кровообращения. При церебральном мозговом кризе ишемия неглубокая и кратковременная, в связи с чем очаговые мозговые симптомы исчезают после восстановления кровообращения. При микроэмболии происходит либо разрушение эмбола, либо формирование коллатерального кровообращения. Остеохондроз шейного отдела позвоночника в сочетании с атеросклерозом основных сосудов головы нередко обуславливает возникновение регионарного сосудистого криза при поворотах головы. При врожденных пороках сердца механизм развития церебральных кризов заключается в гипоксии (кислородной недостаточности) мозга, вызванной недостаточностью кровообращения в большом круге кровообращения, аномалиями основных сосудов. При приобретенных пороках сердца механизм развития обусловлен недостаточностью кровообращения, колебаниями артериального давления, ведущими к ишемии мозга. Церебральные сосудистые кризы при гипотензии развиваются на фоне снижения артериального давления, характеризуются бледностью кожных покровов, ослаблением пульса, повышенным потоотделением, слабостью, головокружением, ощущением пелены перед глазами.
Осложнения Гемолитический криз у новорожденных Если концентрация билирубина у недоношенных детей достигает 15 %, у доношенных 18–20 %, может развиться билирубиновая энцефалопатия. Поражение нейронов мозга заканчивается их гибелью, тяжелое поражение мозга может явиться причиной смерти новорожденного. При легкой форме и своевременно начатом лечении прогноз благоприятный, при тяжелых формах болезни — плохой. Анемичная форма заболевания наиболее легкая. Проявляется бледностью кожных покровов, увеличением печени и селезенки, в анализах крови анемия, микроцитоз, анизоцитоз, ретикулоцитоз, полихромазия. Цветовой показатель около единицы. Прогноз благоприятный.
Лечение Гемолитический криз При аутоиммунных процессах назначают глюкокортикоиды в больших дозах (преднизолон 50—100 мг в сутки). Проводят дезинтоксикационную терапию, включающую внутривенное введение жидкости: 40 %-ный раствор глюкозы, полиглюкин, гемодез и др. Эффективный метод борьбы с уремией — гемодиализ. При остром гемолитическом кризе, вызванном внутриклеточным гемолизом (при болезни Минковского — Шоффера), показана операция спленэктомии, под защитой переливания крови.
Гемолитический криз у новорожденных Основным методом лечения является заменное переливание крови. Показанием для заменного переливания крови является снижение гемоглобина в пуповинной крови ниже 90 ЕД по Сали, повышение билирубина более 3–4 мг%, почасовой прирост билирубина более 0,2 мг/ч, клинические проявления заболевания. При тяжелых формах болезни заменное переливание проводят 2–3 раза в течение первых суток жизни, затем по показаниям на 2-е или 3-и сутки жизни, всего до 4–5 раз. Вместе с заменным переливанием проводят дезинтоксикационную терапию, введение плазмы, альбумина, кровезаменителей, гемодеза, из расчета 10 мл на килограмм веса. Назначают мочегонные препараты, витамины группы В, С, РР. При наличии геморрагического синдрома назначают кровоостанавливающие средства: викасол, дицинон, рутин, препараты кальция. Превращению непрямого билирубина в конъюгированный способствует облучение прямыми солнечными лучами, лампой дневного или синего цвета. При нарушении дыхания, сердечной деятельности, надпочечниковой недостаточности проводят посиндромную терапию. Грудное вскармливание разрешается при удовлетворительном состоянии ребенка на 5—7-е сутки. Дети, перенесшие гемолитическую болезнь новорожденных, находятся под диспансерным наблюдением у педиатра, психоневролога, оториноларинголога, при необходимости им проводится антианемическое лечение. Профилактические прививки до года противопоказаны.
Церебральный криз Назначение постельного режима. Дегидратационная терапия включает назначение мочегонных средств (внутривенно медленно лазикс 1 %-ный — 4,0 мл) и назначение сернокислой магнезии 25 %-ной — 10,0 мл, эуфиллин 2,4 %-ный — 10,0 мл внутривенно. Назначают седативные средства (реланиум 2,0 мл внутримышечно) и препараты, улучшающие мозговое кровообращение (2–4 мл 0,5 %-ного раствора кавинтона в 500—1000 мл изотонического раствора натрия хлорида внутривенно капельно, 10,0 мл 20 %-ного пирацетама внутривенно медленно или внутримышечно). Лечение назначают с учетом исходного тонуса вегетативной нервной системы вне приступа: при преобладании симпатического тонуса назначают адренолитические средства: аминазин, пропазин, пирроксан, дигидроэрготамин, спазмолитические, сосудорасширяющие, гипотензивные, резерпин, никотиновая кислота, компламин, стугерон, папаверин. При повышении тонуса парасимпатической нервной системы при первичных церебральных кризах назначают холинолитики центрального действия: циклодол, амизил и другие, внутривенно препараты кальция, антигистаминные препараты. При дисфункции обоих отделов вегетативной нервной системы назначают средства, оказывающие адрено- и холинолитическое действие: беллоид, беллатаминал, белласпон. При тяжелых кризах вводят сердечно-сосудистые средства (кордиамин, камфора, мезатон). При лечении сосудистого криза атеросклеротического характера необходимо поддерживать артериальное давление на нормальных цифрах, при сердечной недостаточности внутривенно вводят 0,06 %-ный раствор коргликона (0,25—1,0 мл) или 0,5 %-ный раствор строфантина. Возможно назначение антикоагулянтов, под контролем свертывающей системы крови. При гипотонических кризах вводят эфедрин, мезатон, кофеин, кортин. Во всех случаях назначают успокаивающие. Висцеральные кризы требуют комплексного лечения в зависимости от соматических заболеваний, вызвавших криз, и характера криза. В восстановительном периоде назначают церебролизин, актовегин, инстенон, сермион. Церебральный сосудистый криз в отечественной литературе получил название преходящего нарушения мозгового кровообращения, в зарубежной — транзиторной ишемической атаки.
КРИПТОКОККОЗ
ОпределениеКриптококкоз — заболевание из группы глубоких микозов, относится к группе СПИД-ассоциируемых инфекций. Возбудитель заболевания относится к дрожжеподобным грибам Криптококкус. Грибы данного рода постоянно обнаруживаются во внешней среде. Заражение происходит аэрогенным путем, при вдыхании мелких дрожжевых клеток с частями пыли. Реже криптококк проникает через поврежденную кожу и слизистые или при поедании зараженной пищи. Возбудитель может поражать любые клетки организма, отдавая предпочтение клеткам центральной нервной системы. Входными воротами являются легкие, затем возбудитель с током крови распространяется по организму, проникая в различные органы и ткани.
Клиническая картина Клиническая картина зависит от локализации процесса и от состояния иммунной системы инфицированного. Различают хроническое течение процесса (чаще хронический рецидивирующий менингоэнцефалит) и острое, часто молниеносное. Для криптококкозного менингоэнцефалита характерны головные боли с локализацией в лобной, реже височной и затылочной областях, головокружение, тошнота, рвота, раздражительность, утомляемость, снижение памяти, психические расстройства. При поражении черепных нервов появляется снижение остроты зрения, диплопия, нистагм, анизокория, птоз, первичная атрофия зрительного нерва, паралич лицевого нерва. Температура тела повышается незначительно. Иногда возможны проявления со стороны дыхательной системы — небольшой кашель, иногда с мокротой, боли в грудной клетке, ночные поты. Во многих случаях заболевание протекает бессимптомно. Течение заболевания у больных со сниженным иммунитетом (в том числе у больных СПИДом) острое, характерно развитие острого менингоэнцефалита, сопровождающегося признаками дисфункции мозга, часто отмечается генерализация процесса. При поражении легких часто отмечаются кровохарканье и симптомы дыхательной недостаточности. У 10 % больных с генерализованной формой наблюдаются кожные проявления в виде узелков, гнойников, изъязвлений. При распространении процесса по организму возбудитель заносится в кости черепа, ребер и трубчатых костей. Диагностика основана на совокупности клинических данных и данных лабораторных исследований (электронная микроскопия патологического материала, серологические методы определения криптококкового АГ и АТ в сыворотке крови и спинномозговой жидкости.
Лечение Применяют амфотерицин В, обычно в сочетании с другими противогрибковыми препаратами (5-фторцитозин, кетоконазол, миконазол, изоконазол и др.). Амфотерицин В вводят внутривенно, под оболочку спинного мозга (при менингоэнцефалите), лечение длительное, до 6 недель (при менингоэнцефалите), курсовая доза 1–2,5 г. Прогноз при иммуно-дефицитных состояниях (ВИЧ-инфекции) неблагоприятный.
КРИПТОРХИЗМ
ОпределениеКрипторхизм — неопущение одного или обоих яичек.
Этиология Заболевание может вызываться рядом факторов. Имеет значение механический фактор (короткая связка яичка, узкое паховое кольцо), несостоятельность яичек и недостаточность гипофиза. Крипторхизм бывает истинным и ложным. Ложный крипторхизм — расположение яичек вне мошонки за счет повышенной сократимости мышцы, поднимающей яичко. При данной патологии яичко удается низвести в мошонку в положении лежа, во сне, при купании.
Клиническая картина В зависимости от места расположения яичка по пути опускания различают внутрибрюшной и паховый истинный крипторхизм. Крипторхизм может быть осложненным (эндокринопатия, паховая грыжа, водянка яичка или семенного канатика). Яичко, расположенное в паховом канале, подвержено травматизации, имеются указания на возникновение злокачественных новообразований яичка. Дифференциальный диагноз проводят с анорхизмом (отсутствие двух яичек). При крипторхизме яичко часто не удается пальпировать (яичко в брюшной полости), либо оно находится в паховом канале. При двустороннем крипторхизме наблюдаются признаки инфантилизма и гормональной дисфункции.
Лечение Лечение совместно эндокринологом и хирургом, применяют гонадотропный гормон гипофиза, андрогены в малых дозах. При безуспешности консервативного лечения проводят оперативное лечение в возрасте от 2 до 5 лет.
КРИПТОСПОРИДИОЗ
ОпределениеКриптоспоридиоз является СПИД-ассоциируемым заражением. Относится к группе зоонозов, возбудитель — представитель кокцидий.
Этиология и патогенез Механизм передачи фекально-оральный. Ооцисты возбудителя, выделяющиеся от больного или носителя, обсеменяют окружающую среду (предметы, почву, воздух). Заражение происходит при непосредственном контакте с больным, через грязные руки, при употреблении сырой воды, некипяченого молока, при купании, употреблении немытых овощей. В пищеварительном дыхательном тракте больного из ооцисты выделяются спорозоиты, они прилипают к эпителиальным клеткам. Основным местом обитания паразитов является верхний отдел тонкой кишки, хотя инфекция может распространяться по всей длине пищеварительного тракта, от миндалин до прямой кишки; кроме этого, криптоспоридий может поражать желчевыводящие пути и дыхательный тракт.
Клиническая картина Инкубационный период от 5 дней до 2 недель. Основной симптом — водянистая диарея, характеризуется увеличением количества жидкости в просвете кишки. Причиной этого является нарушение всасывания и нарушение секреции воды и электролитов из плазмы. Стул учащается от 2 до 20 раз в сутки. Испражнения имеют отвратительный запах, не содержат примесей крови и воды. Потери жидкости могут достигать до 10 % массы тела. Диарея сопровождается лихорадкой, тошнотой, рвотой, болями в мышцах, снижением аппетита, болями в животе, которые носят спастический характер. Заболевание длится 1–2 недели, заканчивается выздоровлением. У лиц с иммунодефицитами криптоспоридиоз — тяжелое диарейное заболевание с хроническим течением, нередко заканчивающееся летальным исходом.
Диагностика Метод электронной микроскопии испражнений, иммунологические методы диагностики, метод биопсии.
Лечение Эффективных этиотропных препаратов до настоящего времени не имеется. Имеются данные об успешном применении спирамицина в дозе 75 мг/кг в сутки, курс лечения 5 дней. Лечение симптоматическое, при диарее проводят оральную или внутривенную регидратацию. Назначают антидиарейные препараты. Диета с исключением лактозы, жиров и кофеина, тяжелым больным назначают внутривенное питание. Иммунотерапию, антибиотики широкого спектра действия используют по показаниям.
КРОВОИЗЛИЯНИЯ В МОЗГ
ОпределениеКровоизлияния в мозг (мозговой инсульт) — острое нарушение мозгового кровообращения.
Этиология В подавляющем большинстве случаев инсульты являются осложнением гипертонической болезни и атеросклероза. Реже обусловлены болезнями клапанного аппарата сердца, инфарктом миокарда, врожденными аномалиями сосудов мозга, геморрагическими синдромами и артериитами, сахарным диабетом, осложненным ангиопатиями.
Клиническая картина В зависимости от характера поражения сосудов мозга инсульты подразделяются на: — преходящие нарушения мозгового кровообращения; — неэмболический инфаркт мозга; — эмболический инфаркт мозга; — кровоизлияние в мозг; — оболочечные кровоизлияния.
Преходящие нарушения мозгового кровообращения — остро возникающие нарушения мозгового кровообращения, при которых общемозговые и очаговые симптомы держатся не более 24 ч. Фактором возникновения является патология основных сосудов шеи либо микроэмболия сосудов мозга кристаллами холестерина, фрагментами атеросклеротических бляшек или конгломератами тромбоцитов. Микроэмболы вызывают регионарный спазм сосудов и вслед за ним отек мозговой ткани, что приводит к внезапному появлению очаговых симптомов. Обычно микроэмболы подвергаются распаду, вслед за этим восстанавливается кровоток, проходит отек и прекращается неврологическая симптоматика. Нарушение циркуляции в бассейне сонных артерий проявляется онемением половины лица или гемипарестезиями. Недостаточность кровотока в вертебробазилярной системе проявляется неустойчивостью при ходьбе и головокружением. Вторым вариантом преходящих мозговых расстройств является гипертонический церебральный криз (см. Церебральный криз).
Неэмболический инфаркт мозга (тромбоз) — вариант ишемического инсульта, другое его название — нетромботическое размягчение. Характеризуется постепенным (ступенеобразным) развитием очаговых симптомов, малой выраженностью симптоматики, сохраненностью сознания, отсутствием крови в спинномозговой жидкости.
Эмболический инфаркт мозга возникает в результате эмболии мозгового сосуда, может быть как ишемическим, так и геморрагическим, для него характерно острое начало, нередко с потерей сознания. У некоторых больных перед инсультом имеется стадия предвестников, для которой характерны сильные головные боли, иногда преходящие очаговые симптомы. У большинства больных имеются указания на перенесенный инфаркт миокарда либо на ревматизм с поражением митрального клапана. При врожденном незаращении межпредсердной перегородки возможно попадание в мозговые сосуды эмбола из тромбированных вен нижних конечностей, развивается так называемая «парадоксальная эмболия».
Кровоизлияние в мозг характеризуется острым нарушением мозгового кровообращения (апоплексическим ударом), развитием коматозного состояния и кровянистой спинномозговой жидкостью. Как правило, оно возникает у больных, страдающих гипертонической болезнью. В редких случаях, когда очаг кровоизлияния не сообщается с желудочками мозга и с подоболочечным пространством, спинномозговая жидкость не содержит крови. Серьезным осложнением геморрагического инсульта является развитие тенториальных мозговых грыж. Увеличение объема пораженного полушария мозга за счет отека или кровоизлияния приводит к тому, что медиальные отделы височной доли вклиниваются в вырезку мозжечкового намета и ущемляют средний мозг. Проявлением данного осложнения служит появление у больного в бессознательном состоянии глазодвигательных нарушений (косоглазие, птоз, мидриаз). Кровоизлияние в мозжечок может вызвать сдавливание продолговатого мозга.
Субарахноидальные кровоизлияния в большинстве случаев обусловлены аневризмами сосудов мозга в области артериального круга большого мозга (виллизиева круга). Реже их причиной являются атеросклероз, гипертоническая болезнь, геморрагические синдромы. Клиническая картина обусловлена симптомами раздражения мозговых оболочек: головная боль, рвота, симптом Кернига, ригидность мышц затылка, психическое и двигательное возбуждение, нарушение сознания различной степени, иногда возникает судорожный припадок. На 2—3-й день болезни отмечается повышение температуры. При базальном расположении аневризм часто появляются симптомы поражения глазодвигательных нервов. Приблизительно у 30 % больных возникает стойкий спазм сосудов мозга, вслед за этим формируется ишемический очаг размягчения, в частности в стволе мозга. Начиная с первых часов заболевания на глазном дне можно обнаружить кровоизлияния или застойные соски. Многие случаи протекают с резким повышением артериального давления, это обусловлено раздражением излившейся кровью стволовых вегетативных центров, этим же объясняется изменение на ЭКГ. Наличие крови в спинномозговой жидкости позволяет дифференцировать субарахноидальное кровоизлияние с менингитом.
Диагностика В анализе крови значительный лейкоцитоз (увеличение количества лейкоцитов) в первые сутки — косвенный признак геморрагического инсульта, повышение индекса Кребса (отношение нейтрофилов к лимфоцитам) больше 5 характерно для геморрагического инсульта. Рентгеноскопия органов грудной клетки выявляет увеличение левого желудочка — явный признак длительно существующей артериальной гипертонии. Краниография позволяет исключить травмы черепа. Спинномозговая пункция позволяет исследовать характер спинномозговой жидкости с целью дифференциальной диагностики геморрагического и ишемического инсульта. Спинномозговая пункция противопоказана в агональном состоянии, при развитии левожелудочковой недостаточности, при подозрении на мозговую грыжу. Эхоэнцефалография позволяет выявить степень смещения срединных структур мозга, крайние степени смещения характерны для объемных процессов мозга. Во всех сомнительных случаях проводят ангиографию.
Лечение Лечение предпочтительно в стационаре. Противопоказаниями к транспортировке являются агональное и предагональное состояние больного, тяжелые нарушения дыхания и сердечно-сосудистой деятельности, а также старческий возраст с тяжелыми соматическими и психическими заболеваниями. Лечебные мероприятия направлены на поддержание жизненно важных функций (дыхательной, сердечно-сосудистой систем, системы гомеостаза), профилактику застойной пневмонии, тромбоэмболии, пролежней, при задержке мочи проводится катетеризация мочевого пузыря. Из лекарственных препаратов назначают гипотензивные средства, мочегонные препараты, сердечные гликозиды, при гипотонии назначают внутривенное введение жидкости и гипертензивные средства.
КРОВОТЕЧЕНИЯ
ОпределениеКровотечение — истечение крови из кровеносных сосудов при нарушении целостности или проницаемости их стенки.По происхождению различают: травматические, вызванные механическим повреждением сосудистой стенки, и нетравматические, связанные с патологией стенки сосудов. По механизму возникновения кровотечения бывают с разрывом, с разъеданием (аррозивные). По виду кровоточащего сосуда различают: артериальные, артериовенозные, венозные, капиллярные. По месту излияния крови различают наружные (излияние крови на поверхность) и внутренние (излияния крови в замкнутые полости). По локализации различают кровотечения акушерские, маточные, желудочно-кишечные, легочные, носовые и др. Акушерские кровотечения являются частой патологией, составляют 20–25 % среди причин материнской летальности. Желудочно-кишечное кровотечение является излитием крови различной интенсивности в просвет желудочно-кишечного тракта. Легочным кровотечением называется отхаркивание крови. Маточные кровотечения являются симптомами различной гинекологической патологии. Они могут быть следствием органических заболеваний, доброкачественных и злокачественных опухолей, внутреннего эндометриоза и нарушений гормональной функции яичников. Последние принято называть дисфункциональными, подчеркивая этим отсутствие анатомических изменений в репродуктивной системе. Дисфункциональными маточными кровотечениями называют ациклические маточные кровотечения после периода задержки менструации от 1,5 до 6 месяцев.
Этиология и патогенез Акушерские кровотечения Они делятся на кровотечения, возникающие в первой половине беременности, во второй половине беременности, во время родов и в послеродовом периоде. Кровотечения в первой половине беременности возникают при беременности до 20 недель. К ним относятся: 1. Кровотечения, не связанные с патологией плодного яйца — «ложные менструации», псевдоэрозии, полипы и рак шейки матки, травмы влагалища, варикозное расширение вен наружных половых органов и влагалища. 2. Кровотечения, связанные с патологией плодного яйца: угрожающее прерывание беременности, нарушенная внематочная беременность, пузырный занос. Кровотечения во второй половине беременности, особенно в последние недели ее и во время родов, в большинстве случаев возникают в связи с аномалиями прикрепления и отделения плаценты — предлежание плаценты, преждевременная отслойка нормально расположенной плаценты. 3. Кровотечения в послеродовом и раннем послеродовом периодах. Основными их причинами являются: гипотония матки, остатки плацентарной ткани в матке, травмы мягких тканей родового канала.
Желудочно-кишечное кровотечение Причиной пищеводно-желудочных кровотечений являются варикозное расширение вен (при портальной гипертензии), язвы пищеварительного тракта, эрозивный гастрит, полипоз, рак, саркома, невринома, аневризмы мелких артерий. Основными причинами кишечных кровотечений являются: язвенный колит, опухоли, дивертикулы, болезнь Крона, перфорирующие аневризмы аорты и мезентериальных артерий. Реже причинами желудочно-кишечных кровотечений являются: медикаментозные язвы, грыжи пищеводного отверстия, геморрагические диатезы.
Легочные кровотечения Причиной данной патологии являются: туберкулез легких, пневмония, бронхоэктатическая болезнь, гангрена легкого, опухоли органов дыхания (рак, аденома), инфаркт легкого, сердечно-сосудистые заболевания (аневризма аорты, стеноз митрального клапана), эндометриоз легких. В механизме развития имеют значение следующие процессы: аррозия сосуда (при опухолях, кавернах, бронхоэктазах); разрыв сосудистой стенки (при атриовентрикулярных аневризмах, телеангиоэктазии, легочной форме болезни Рандю-Ослера); излияние крови в альвеолы из бронхиальных артерий (при инфаркте легкого); диапедезное пропитывание (при застойном полнокровии легочных сосудов).
Дисфункциональные маточные кровотечения Дисфункциональные маточные кровотечения — заболевание, возникновение которого может быть обусловлено рядом разнообразных факторов, способствующих его развитию: возрастные особенности организма, нервно-психические факторы, вредные профессиональные факторы, неблагоприятные материально-бытовые условия, расстройство функции периферических эндокринных желез, хронические воспалительные заболевания половых органов, острые и хронические инфекционные заболевания, особенно в период полового созревания. В зависимости от морфологических изменений в яичниках кровотечения подразделяют на овуляторные и ановуляторные. При овуляторных маточных кровотечениях происходит овуляция и образуется желтое тело. К овуляторным маточным кровотечениям относятся: — двухфазный укороченный менструальный цикл; — гиполютеинизм — недостаточность желтого тела; — гиперлютеинизм — персистенция желтого тела. Ановуляторные маточные кровотечения характеризуются отсутствием овуляции и отсутствием формирования желтого тела и обусловлены следующими причинами: — кратковременной персистенцией фолликула; — длительной персистенцией фолликула; — атрезией или персистенцией незрелого фолликула. Дисфункциональные маточные кровотечения в зависимости от возраста делятся на три группы: — ювенильные (вирильные, юношеские) — маточные кровотечения, обусловленные нарушением гипоталамо-гипофизарно-яичниковой системы у девочек в период полового созревания до 20 лет; — кровотечения в период половой зрелости (с 20 до 40 лет); — кровотечения климактерического возраста (старше 40 лет до менопаузы). В первую очередь у больных нарушается циклическая продукция гонадотропинов, что обусловлено нарушением гипоталамической регуляции циклического освобождения и секреции гонадотропинов гипофизом.
Носовые кровотечения Основными причинами являются острые инфекционные заболевания, травмы носа, хирургические вмешательства в полости носа, геморрагические диатезы, опухоли, повышение артериального давления.
Клиническая картина Акушерские кровотечения По объему кровопотери акушерские кровотечения можно разделить на умеренные и массивные. Допустимая физиологическая кровопотеря составляет 0,5 % от веса женщины. Установлено, что женщина во время беременности и родов может восстановить потерю крови до 20 % объема циркулирующей крови за счет аутогемодилюции и мобилизации крови из депо. При кровопотере, превышающей 25 % объема циркулирующей крови, аутогемодилюция не способна ее восполнить, несоответствие между емкостью сосудистого русла и объемом крови ликвидируется за счет спазма сосудов. Развивается изменение циркуляции крови, которое получило название централизации кровообращения (см. Шок геморрагический). Исходя из этого нижняя грань массивного кровотечения установлена в 1200 мл. Синдром массивной кровопотери, как правило, развивается при патологическом преморбидном фоне (гиповолемия беременных, врожденные и приобретенные нарушения гомеостаза), нарушающем компенсаторные механизмы адаптации при объеме внешней кровопотери более 1200 мл, и клинически характеризуется шоком с множественными поражениями жизненно важных органов и систем (мозг, печень, почки, легкие) и острым синдромом ДВС. К факторам, определяющим индивидуальную реакцию организма на кровопотерю, относятся: гестоз, анемия, гиповолемия, хроническая кислородная недостаточность, хроническое ДВС, врожденные дефекты системы гемостаза, экстрагенитальные заболевания, осложненный родовой акт. При акушерских кровотечениях тактика врача зависит от причины кровотечения.
Желудочно-кишечное кровотечение При желудочных кровотечениях отмечается рвота темного цвета (кофейной гущи), имеющая кислую реакцию, возможен жидкий дегтеобразный стул (мелена). При кишечных кровотечениях основным симптомом является мелена. В лабораторных анализах крови диагностируется анемия. При диагностике желудочно-кишечного кровотечения показана срочная госпитализация в хирургический стационар. Основными причинами кровотечений из анального отдела прямой кишки являются трещины, кровоточащий геморрой, опухоли. В отличие от желудочно-кишечных кровотечений при данной патологии кровь алая, обычно кровотечение усиливается во время акта дефекации.
Легочное кровотечение Основным симптомом является отхаркивание мокроты с прожилками крови или отхаркивание алой крови полным ртом. Иногда бывают предвестники кровотечения: ощущение локальной боли, неприятной теплоты в груди, солоноватый привкус мокроты. При прослушивании могут выслушиваться влажные хрипы. Так называемая «ржавая мокрота» характерна для крупозной пневмонии, мокрота типа «малинового желе» отмечается в поздней стадии рака легких.
Дисфункциональные маточные кровотечения Основным симптомом дисфункциональных маточных кровотечений является маточное кровотечение, характер которого зависит от морфологических изменений в яичниках. Длительностью кровотечения и степенью кровопотери определяются вторичные проявления, которыми являются слабость, анемия, головные боли, утомляемость, снижение артериального давления, тахикардия (увеличение частоты сердечных сокращений).
Носовые кровотечения Выделение из полости носа алой крови, которое может начаться внезапно, без видимой причины, в большинстве случаев отмечается из одной половины носа, бывает из любых отделов слизистой оболочки носа, чаще из передней части носовой перегородки. Может остановиться самостоятельно или продолжаться длительное время.
Диагностика Легочное кровотечение Дифференциально-диагностическим признаком является алый цвет крови, щелочная реакция, кровь отделяется при кашле, пенистая, не свернувшаяся. Мокроту с кровью необходимо обследовать на наличие микобактерий туберкулеза, клеток сердечных пороков (сидерофагов) и опухолевых клеток. Основными методами диагностики легочного кровотечения являются: бронхоскопия, томография, бронхография, ангиопульмонография. Кровохарканье считается массивным при выделении 600 мл крови в сутки.
Дисфункциональные маточные кровотечения Наиболее часто из методов диагностики применяются: — тесты функциональной диагностики (измерение температуры, феномен папоротника и симптом зрачка, гормональная кольпоцитология, биопсия эндометрия); — определение выделения половых гормонов с мочой; — определение гормонального профиля крови.
Лечение и профилактика Акушерские кровотечения При кровотечениях в первую половину беременности проводят профилактику или лечение угрожающего прерывания беременности. При сочетании беременности с кровоточащей эрозией шейки матки проводят местное противовоспалительное лечение мазевыми тампонами, при продолжающемся кровотечении показана биопсия. При наличии полипа эндоцервикса у беременной показана операция полипэктомии и последующее гистологическое исследование полипа. При диагностике рака шейки матки у беременной проводится расширенная экстирпация беременной матки. При кровотечении из варикозно расширенных вен влагалища производят ушивание кровоточащего сосуда. При диагностике пузырного заноса производят немедленное его удаление. Тактика врача при кровотечениях во второй половине беременности. Следует сказать, что данные кровотечения наиболее часто приводят к массивной кровопотере. При преждевременной отслойке нормально расположенной плаценты родоразрешение должно осуществляться по жизненным показаниям в течение 1 ч. Выжидательная тактика оправдана только при частичной непрогрессирующей отслойке плаценты и удовлетворительном состоянии плода. В других случаях показано оперативное родоразрешение. Предлежание плаценты обычно диагностируется во время УЗИ. Кровотечения при данной патологии, как правило, проявляются при сроке беременности от 28 до 32 недель. При кровянистых выделениях во второй половине беременности женщина должна находиться в акушерском стационаре под круглосуточным наблюдением медперсонала, где при необходимости ей будет оказана экстренная помощь. Акушерская тактика при частичном предлежании плаценты определяется объемом кровопотери. Выжидательная тактика допустима при кровопотере до 250 мл, хорошей родовой деятельности, открытии маточного зева на 5–6 см, дающем возможность определить вариант предлежания. При полном предлежании плаценты и доношенной беременности показано плановое оперативное родоразрешение. Нельзя забывать, что влагалищное исследование при подозрении на предлежание плаценты необходимо проводить в условиях развернутой операционной. Существует опасность массивного кровотечения. Для профилактики кровотечений в третьем периоде родов рекомендуется активно-выжидательная тактика, включающая катетеризацию мочевого пузыря, на низ живота кладут пузырь со льдом, вводят утеротонические средства. Единственным способом остановки кровотечения является опорожнение матки. При наличии признаков отделения плаценты применяют наружные приемы выделения последа. При их отсутствии под внутривенным или масочным наркозом проводят ручное отделение плаценты и выделение последа. При диагностике истинного приращения плаценты проводят операцию удаления матки. Акушерская тактика при кровотечениях в раннем послеродовом периоде зависит от объема кровопотери. При кровопотере 250–400 мл производят наружный массаж матки и введение утеротонических средств, производят осмотр родовых путей в зеркалах. При кровотечении более 400 мл под наркозом проводят ручное обследование полости матки, во время которого производят удаление остатков последа, сгустков крови и производят наружно-внутренний массаж матки, начинают инфузионно-трансфузионную терапию, обязательно введение утеротонических средств. При кровотечении 900—1000 мл проводят клеммирование сосудов матки при помощи зажимов и оперативное лечение (надвлагалищная ампутация матки, при массивном продолжающемся кровотечении — экстирпация матки с перевязкой внутренних подвздошных артерий).
Желудочно-кишечное кровотечение Лечение проводится в зависимости от причины кровотечения.
Легочное кровотечение Лечение проводится в стационаре и зависит от причины, вызвавшей кровотечение. Из медикаментозных препаратов назначают: седативные препараты и транквилизаторы для уменьшения кашля, при инфаркте легкого назначают гепарин и фибринолизин. Для уменьшения давления в сосудах легких назначают ганглиоблокаторы (пентамин). Массивное легочное кровотечение и упорное кровотечение при митральном стенозе является показанием к оперативному лечению.
Дисфункциональные маточныекровотечения Лечение проводится комплексно: включает применение общеукрепляющих, симптоматических, хирургических и физических методов. Для быстрой остановки обильного кровотечения, особенно у анемизированных больных, применяют выскабливание матки, которое применяется как с диагностической, так и с лечебной целью. Следует сказать, что при ювенильных кровотечениях данный метод используется редко. Обычно после выскабливания кровотечение прекращается, однако без соответствующего лечения возможен рецидив. Из консервативных методов остановки кровотечения применяют: сокращающие матку препараты — окситоцин 5 ЕД внутримышечно 1–2 раза в сутки, маммофизин по 1 ЕД внутримышечно 1–2 раза в сутки; кровоостанавливающие средства: хлористый кальций 10 ЕД внутривенно 1 раз в сутки, дицинон 1 ЕД внутримышечно 1 раз в сутки; препараты, укрепляющие сосудистую стенку, — аскорутин 1–2 таблетки — 3 раза в сутки; а также растительные препараты (настойка водяного перца, крапивы, тысячелистника и др.). Остановки кровотечения можно достичь путем использования физиотерапии, с этой целью используют: электростимуляцию шейки матки, вакуумстимуляцию сосков или шейки матки. Большое значение в лечении дисфункциональных маточных кровотечений уделяется гормональной терапии, которая используется для остановки кровотечения, регуляции менструального цикла с профилактикой рецидива кровотечения и осуществления искусственной менопаузы у больных в климактерическом периоде. При ановуляторных кровотечениях с этой целью используют ударные дозы эстрогенов, с 14-го дня после начала лечения подключают прогестерон. При необильных и непродолжительных кровотечениях возможно применение гормонального кюретажа при помощи прогестерона (кровотечение обычно усиливается). Применяют инъекцию комплекса стероидных гормонов в одном шприце — 1 мл 2 %-ного раствора синэстрола, 1 мл 1 %-ного раствора прогестерона, 1 мл 5 %-ного раствора тестостерона. Введение проводят через день, всего от 4 до 10 инъекций. Возможно остановить кровотечение при помощи синтетических, эстрогенгестагенных контрацептивов, которые для остановки кровотечения применяются по 1 таблетке каждый час до полной остановки кровотечения, не более 8 таблеток в день. На следующий день доза уменьшается на 1 таблетку в день. Снизив дозу до 1 таблетки в день, прием продолжают до 21-го дня. У больных с фибромиомой матки, эндометриозом в климактерическом периоде целесообразно проведение гемостаза при помощи андрогенов (омнадрен, сустанон, тестэнат) или гестагенов продленного действия (депо-провера). В дальнейшем с целью профилактики дисфункциональных маточных кровотечений и регуляции менструального цикла назначают циклическую гормональную терапию на 3–6 месяцев или гормоны второй фазы менструального цикла с 16-го (11-го) по 25-й день цикла (прогестерон, норкалут, дюфастон, утрожестан). У женщин старше 45 лет для достижения атрофии эндометрия и искусственной менопаузы возможно применение андрогенов в течение 3–6 месяцев (омнадрен, тестостерон, тестэнат). Для достижения овуляторного цикла, при ановуляторных маточных кровотечениях, особенно с целью лечения бесплодия, применяют гонадотропины (пергонал, пурегон, хориогонин) и антиэстрогены (кломифенцитрат, клостильбегит и др.). Кроме гормональной регуляции менструального цикла, назначается циклическая витаминотерапия (витамины группы В, фолиевая кислота с 6-го по 15-й день цикла, витамины А и С с 16-го по 25-й день цикла), витамин Е по 50 мг в день в течение месяца. Лечение витаминами проводят в течение 2 месяцев, курс повторяют через 6 месяцев. Симптоматическое и общеукрепляющее лечение включает рациональный режим, седативную терапию, антианемическую терапию, лечение инфекционных, соматических и нервно-психических заболеваний, соблюдение диеты, богатой белком и витаминами.
Носовые кровотечения Необильное кровотечение можно остановить, прижав пальцем крыло носа к носовой перегородке. Можно попробовать остановить кровотечение, введя в носовой ход ватный тампон, смоченный вазелином или перекисью водорода. Голову необходимо запрокинуть назад, на затылок положить пузырь со льдом, что рефлекторно уменьшает кровотечение. При отсутствии эффекта в стационаре проводят переднюю тампонаду полости носа при помощи марлевого тампона, смоченного вазелиновым маслом или перекисью водорода, тщательно заполняя все углубления полости носа. Кровоточащий сосуд можно прижечь нитратом серебра, хромовой кислотой после предварительной анестезии. При продолжающемся кровотечении проводят заднюю тампонаду полости носа. Местно можно применить гемостатическую пленку, фибринные пленки, биологический антисептический тампон. Если причиной носового кровотечения является заболевание крови, то после удаления тампона кровотечение может возобновиться; необходимо лечить основное заболевание. При артериальной гипертонии носовое кровотечение может играть положительную роль. Наряду с тампонадой носа следует назначать кровоостанавливающие препараты (хлористый кальций, аминокапроновая кислота, галаскорбин, крапива, водяной перец, дицинон, викасол) и препараты, укрепляющие сосудистую стенку (аскорбиновая кислота, рутин, аскорутин). При большой кровопотере проводят инфузионно-трансфузионную терапию.
КРОНА БОЛЕЗНЬ
ОпределениеБолезнь Крона — рецидивирующее заболевание, характеризующееся трансмуральным гранулематозным воспалением с сегментарным поражением разных отделов пищеварительного тракта.Крона болезнь — неспецифическое воспалительное заболевание желудочно-кишечного тракта в любом его отделе, сопровождающееся образованием воспалительных инфильтратов и глубоких продольных язв в его стенке, осложняющихся кровотечением, перфорациями стенки желудочно-кишечного тракта, образованием длительно не заживающих наружных и внутренних свищей. Болезнь Крона в толстой кишке проявляется в виде гранулематозного колита.
Этиология и патогенез Заболевание может быть обусловлено рядом факторов. Установлены генетическая зависимость и влияние этнического фактора. Некоторые исследователи склоняются к мнению, что болезнь Крона — это псевдотуберкулезный иерсиниоз. Возникновение очагов гранулематозного воспаления с последующим изъязвлением обширных участков стенки кишечника приводит к истощающей диарее, кишечному кровотечению, анемии, интоксикации, диспротеинемии, нарушению электролитного баланса и в конечном итоге к септическим осложнениям.
Клиническая картина Формы заболевания: — воспалительно-инфильтрационная — сопровождается диареей, признаками острого воспаления, уменьшением массы тела; — стенозирующая — часто приводящая к кишечной непроходимости, развивающаяся в тонком кишечнике; — приступообразующая (перфоративная) — приводит к образованию обдоминальных инфильтратов, межкишечных свищей и абсцессов. При поражении илеоцекального отдела клинические проявления выражаются общим недомоганием, повышенной температурой, при прощупывании определяется инфильтрат в правой половине живота. Нередко заболевание начинается остро, сходно с острым аппендицитом, иногда диагноз устанавливается во время операции по поводу острого аппендицита: устанавливают терминальный илеит или илеоколит. В дальнейшем в месте поражения образуются незаживающие свищи. Клинические проявления сходны с неспецифическим язвенным колитом, однако при гранулематозном колите прямая кишка поражается реже, чем другие отделы толстой кишки. В данном случае в правильной постановке диагноза помогают рентгенологическое исследование, колоноскопия, биопсия, при которой выявляются плазмолимфоцитарная инфильтрация, саркоидные гранулемы.
Лечение Консервативное лечение предпочтительно проводить в стационаре. Назначают постельный режим, высококалорийную механически и химически щадящую диету, внутривенное введение жидкости, электролитов, белковых растворов, глюкозы, переливание препаратов крови. Для профилактики осложнений применяют антибиотики широкого спектра действия, сульфаниламидные препараты, нередко назначают гормональные препараты (преднизолон, гидрокортизон). При отсутствии эффекта от лечения либо развитии осложнений (перфорация, кровотечение, кишечная непроходимость, токсическая дилатация кишечника) показано оперативное лечение, во время которого проводится резекция пораженных участков кишечника. После оперативного лечения возможны длительная ремиссия и выздоровление.
КСАНТОМАТОЗ
ОпределениеКсантоматоз — отложение холестерина в форме очаговых скоплений (ксантом) в коже, сухожилиях, других тканях и внутренних органах. Развивается при наличии повышенной концентрации холестерина и (или) триглицеридов в плазме крови.
Ксантомные клетки в атеросклеротической бляшке
Ксантома
Ксантелазма
Этиология и патогенез Различают первичный ксантоматоз, связанный с наследственным нарушением обмена липопротеидов, и вторичный ксантоматоз, причиной которого являются нарушение обмена липопротеидов и повышение уровня холестерина, возникающие как следствие различных эндокринных и обменных заболеваний: сахарного диабета (см.), гипотиреоза (см.), нефротического синдрома (см.), билиарного цирроза (см.) печени и др. Нередко отмечается сочетание ксантоматоза и атеросклероза (см.). Холестерин откладывается преимущественно внутриклеточно, при этом клетка приобретает «пенистый», ксантомный вид. Этот тип характерен для плоских и бугорчатых ксантом кожи и сухожильного ксантоматоза. Триглицериды откладываются обычно внеклеточно, образуя эруптивные ксантомы (мелкоузелковые высыпания).
Клиническая картина Клиническая картина зависит от типа нарушения. Наследственная недостаточность липопротеидного фермента с повышением содержания в крови триглицеридов обычно проявляется ксантоматозом уже в детском возрасте. На коже спины, ягодиц, разгибательных поверхностях конечностей, слизистых оболочках (губы, мягкое и твердое небо) у детей отмечаются мелкоузелковые высыпания, появлению которых в ряде случаев может предшествовать зуд (см.). Эти высыпания непостоянны и зависят от уровня триглицеридов в крови: при высоком их уровне ксантомы проявляются на коже, при снижении уровня триглицеридов — исчезают. Клинически, помимо ксантом, отмечается увеличение печени и селезенки. При II типе гиперлипопротеидемии, по Фредриксону, для которого типично наличие повышенного уровня холестерина и липопротеидов низкой и очень низкой плотности, характерно появление сухожильных ксантом в виде узелков разной величины (от 2 мм до 5 см в диаметре). Как правило, их возникновение отмечается у лиц старше 20 лет. Помимо сухожильных, определяются и кожные ксантомы — плоские и бугорчатые. Плоские ксантомы представляют собой желтоватооранжевого цвета округлые бляшки, слегка возвышающиеся над поверхностью кожи. Бугорчатые ксантомы — более крупные узловые образования того же цвета с неровной, бугристой поверхностью. Ксантомы могут располагаться изолированно или группами, преимущественно на разгибательной поверхности рук (особенно на локтевых суставах), ягодицах, реже — на спине и ногах. После появления они остаются на всю жизнь, постепенно увеличиваясь в размерах и количестве. При накоплении в крови липопротеидов, холестерина и триглицеридов часто встречаются плоские ксантомы на ладонях (иногда могут отмечаться и эруптивные, а также эруптивно-бугорчатые ксантомы кожи, сухожильные ксантомы). Одной из форм ксантоматоза, особенно часто встречающейся среди лиц пожилого возраста, являются ксантелазмы век. Они представляют собой плоские ксантомы, расположенные на коже век. Другим проявлением может быть липоидная дуга роговицы. Диагностика при типичных формах ксантоматоза не представляет затруднений. Необходим комплекс исследований, направленных на обнаружение его причины: клинический и биохимический анализ крови, изучение наследственности и пр.
Лечение Лечение направлено на основное заболевание и преимущественно имеет целью устранение повышенного уровня холестерина и липопротеидов. Используются низкожировая и антихолестериновая диеты. Из косметических соображений ксантомы можно удалить или подвергнуть диатермокоагуляции (прижиганию).
КСЕРОДЕРМА ПИГМЕНТНАЯ
ОпределениеКсеродерма пигментная (синонимы: ретикулярный прогрессирующий меланоз, Пика прогрессирующий ретикулярный меланоз) — наследственное заболевание кожи, проявляющееся повышенной чувствительностью к ультрафиолетовому облучению. Является предраковым состоянием кожи. Встречается редко.
Этиология и патогенез Имеет значение наследственный фактор. Характер наследственного дефекта заключается в отсутствии или малой активности ферментов, устраняющих повреждающий эффект ультрафиолетового (УФ) излучения на клетки кожи. Изучены два вида нарушений. При одном из них, помимо высокой чувствительности к УФ-излучению, у больных имеет место и повышенная чувствительность к ионизирующей радиации. Результатом в обоих случаях являются нарушения пигментации и ороговения кожи, атрофические изменения эпидермиса и дистрофия соединительнотканных волокон, а конечным эффектом — клеточная атипия и озлокачествление.
Клиническая картина Клиника ксеродермы характеризуется тремя стадиями. Первая стадия отмечается у детей 2–3 лет жизни (в редких случаях — позже), обычно в весенне-летний период после пребывания на солнце. На открытых участках кожи (лицо, шея, предплечья, кисти) возникает стойкая воспалительная реакция, характеризующаяся пятнами, шелушением и последующим развитием неравномерной повышенной гиперпигментации по типу лентиго, веснушек. Каждое повторное облучение приводит к усилению этих проявлений. Клинические проявления второй стадии приобретают выраженность спустя несколько лет. Она характеризуется наличием участков атрофии (см.) кожи разных размеров и очертаний, сосудистыми звездочками, неравномерной пигментацией, что все вместе придает коже пестрый вид. Внешне картина кожи очень напоминает проявления хронического радиационного дерматита (см.). На отдельных участках кожи могут наблюдаться бородавчатые разрастания, корки, трещины, изъязвления, пятнистость. Страдает не только кожа, но и хрящевая и соединительная ткань: ушные раковины и естественные отверстия (носовые ходы, ротовое отверстие) деформируются, хрящи носа истончаются. Отмечаются, помимо того, выворот век (см.), блефариты (см.), изъязвления слизистой оболочки век, выпадение и нарушение последующего роста ресниц, помутнение роговицы, слезотечение и светобоязнь. Третья стадия заболевания развивается в подростковом или юношеском возрасте. Она характеризуется появлением в очагах поражения доброкачественных и злокачественных опухолей (см.) (фибром, кератом, ангиом, базалиом, меланом и пр.). Высокой степенью озлокачествления и метастазированием во внутренние органы отличаются очаги бородавчатых разрастаний. Прогноз неблагоприятный: 2/3 больных погибают в возрасте до 15 лет. Ксеродермическая идиотия (Де Санктиса-Каккьоне синдром) — наиболее тяжелая форма пигментной ксеродермы. Она характеризуется наличием выраженных нарушений со стороны центральной нервной системы на фоне кожных проявлений. Отмечаются микроцефалия (см.), недостаточное развитие гипофиза и мозжечка, идиотия, парезы (см.), судороги, координационные и рефлекторные расстройства. Помимо этих проявлений, для ксеродермической идиотии типичны задержка роста и полового развития, потеря слуха. Диагноз в большинстве случаев основывается на данных клиники: связь заболевания с солнечным облучением, поражение открытых участков кожи (пигментация и сосудистые звездочки) с последующим озлокачествлением.
Лечение и профилактика Ранние этапы заболевания подлежат амбулаторному лечению у дерматолога. Рекомендуют прием синтетических противомалярийных препаратов (типа хингамина), которые уменьшают чувствительность кожи к солнечным лучам. Показаны витамины А, РР, группы В. Местно используются кортикостероидные мази, в участках бородавчатых разрастаний — цитостатические. Применяют также фотозащитные кремы и мази (хининовая 5 %-ная, салоловая 10 %-ная и др.). При развитии опухолевого процесса лечение больного осуществляется онкологом. При ксеродермической идиотии лечение проводится под наблюдением невропатолога в специализированном стационаре. Первичная профилактика не разработана. Для замедления процесса озлокачествления больные должны постоянно находиться под диспансерным наблюдением дерматолога, онколога, при необходимости — офтальмолога и невропатолога. Важны меры по защите открытых участков тела от облучения (больным рекомендуют носить широкополые шляпы, перчатки, зонтики от солнца, пользоваться фотозащитными кремами). При появлении бородавчатых разрастаний целесообразно их оперативное удаление в возможно более ранние сроки во избежание озлокачествления.
КУНТА-ЮНИУСА БОЛЕЗНЬ
ОпределениеКунта-Юниуса болезнь представляет собой одну из форм старческой дегенерации сетчатки — хронический дистрофический или дегенеративный процесс в слое капилляров сосудистой оболочки, стекловидной пластинки и пигментного эпителия. Болезнь возникает у лиц в возрасте старше 60 лет и является наиболее частой причиной нарушения центрального зрения в этой возрастной категории. Этиология и патогенез изучены недостаточно.
Клиническая картина Заболевание характеризуется наличием нескольких последовательных фаз. В начальной I стадии отмечается возникновение мелкоочаговых нарушений пигментации сетчатки, на фоне которых возникают светло-желтые очажки округлой или овальной формы (друзы), представляющие собой скопление коллоида под слоем пигментного эпителия. Они не приводят к снижению остроты зрения, даже если располагаются в области центральной ямки. Экссудативно-геморрагическая II стадия характеризуется развитием отека сетчатки. Воспалительная жидкость отслаивает пигментный эпителий от стекловидной пластинки, благодаря чему на глазном дне просматривается округлый или овальный очаг в форме купола желтоватого цвета с четкими границами и размером до нескольких диаметров диска зрительного нерва. В этот период острота зрения снижается в незначительных пределах. Клинически отмечаются различные виды нарушений зрения. Отслойка может длительно сохраняться без каких-либо изменений, а в ряде случаев — спонтанно исчезать или увеличиваться в размерах. Резкое снижение остроты зрения характеризует ее разрыв. Часто появляются подоболочечные кровоизлияния, обычно незначительные, но иногда они дают образования большого объема с прорывом в стекловидное тело. Заключительная (рубцовая) III стадия характеризуется замещением высокоспециализированной ткани сетчатки соединительной тканью, что сопровождается резким снижением зрительной функции. В целях диагностики используются клинические и инструментальные методы исследования. Помимо офтальмоскопии, важную роль играет флюоресцентная ангиография.
Лечение В начальных стадиях заболевания лечение заключается в назначении препаратов, улучшающих микроциркуляцию в сосудах сетчатки и сосудистой оболочке (дезагреганты, антиоксиданты, ангиопротекторы). Показана стимуляция сетчатки низкоэнергетическим лазером. В экссудативной стадии применяют обезвоживающие средства и лазерную коагуляцию сетчатки в центральной зоне.
КЮММЕЛЯ БОЛЕЗНЬ
ОпределениеКюммеля болезнь (болезнь Кюммеля-Вернея) — заболевание позвоночника, характеризующееся клиновидной деформацией одного из позвонков и локальными болями. Встречается преимущественно у мужчин молодого и среднего возраста. Чаще поражается один из грудных позвонков, реже — позвонки поясничного отдела.
Этиология и патогенез Природа заболевания неясна, хотя все исследователи считают несомненной его связь с травмой. Основной критерий болезни Кюммеля — наличие клиновидной деформации позвонка, которая аналогична таковой при его компрессионном переломе (см.), в связи с чем ряд авторов ставит под сомнение существование болезни Кюммеля в качестве самостоятельной нозологической единицы.
Клиническая картина Клиника характеризуется наличием трех последовательных стадий. Первая стадия возникает после травмы позвоночника, когда в его грудном отделе возникает локальная боль различной интенсивности. Однако в отличие от компрессионного перелома (см.) больные не предъявляют жалоб на ощущение «перехватывания дыхания». Продолжительность болевого синдрома составляет 1–2 недели. После его исчезновения заболевание переходит в скрытую (вторую) стадию, на протяжении которой никаких признаков неблагополучия со стороны позвоночника больным не ощущается. Длительность второй стадии — несколько месяцев, иногда лет. Затем наступает третья стадия, которая характеризуется повторным появлением локального болевого синдрома, аналогичного отмечавшемуся в первой стадии. Он возникает беспричинно либо вследствие повторной травмы позвоночника. Подвижность грудного отдела позвоночника становится ограниченной, спустя некоторое время формируется слабовыраженный дугообразный кифоз (см.), или кифосколиоз. Прогноз определяется степенью деформации и своевременностью терапии. Исходом заболевания чаще всего становится раннее развитие остеохондроза (см.) позвоночника.
Диагностика и дифдиагностика Диагностика основывается на данных клинических и инструментальных исследований, ведущая роль среди которых принадлежит рентгенологическим методам. Применяется рентгенография в стандартных проекциях — прямой задней и боковой. Однако в начальных стадиях заболевания патологические изменения на рентгенограмме обнаружить трудно, поэтому более эффективным методом является компьютерная томография. На томограммах пораженного позвонка в первой стадии можно выявить его трещину, травматическую хрящевую грыжу (см.), а во второй — остеопороз (см.) позвонка. Третья стадия определяется рентгенографически и томографически с большей легкостью. На снимках отмечается типичное патологическое сдавление позвонка. Дифференцировать заболевание необходимо с компрессионным переломом (см.) позвоночника, туберкулезным спондилитом (см.), болезнями Шейерманна-Мау и Кальве, метастазами опухолей (см.) в тело позвонка.
Лечение и профилактика Используются меры по разгрузке позвоночника. При болевом синдроме показан постельный режим, под область кифоза необходимо подкладывать небольшой валик. После стихания болей показаны ношение съемного корсета, лечебная гимнастика и массаж, направленный на укрепление мускулатуры спины, но не на увеличение объема движений позвоночника. Профилактика сводится к предупреждению травматизма — производственного, бытового и транспортного.
♦ Л ♦
ЛАБИРИНТИТ
ОпределениеЛабиринтит — разлитое или ограниченное поражение периферических отделов звукового и вестибуляторного анализатора.Лабиринтит — воспалительное заболевание внутреннего уха, которое возникает в результате проникновения в него болезнетворных микробов или их токсинов и проявляется сочетанным нарушением функций слухового и вестибулярного рецепторов. Различают следующие лабиринтиты: I. По фактору возникновения: — неспецифический; — специфический (туберкулезный, сифилитический). II. По механизму развития: — тимпаногенный; — менингогенный; — гематогенный. III. По течению: — острый; — хронический (явный, латентный). IV. По распространенности: — ограниченный; — распространенный. V. По характеру воспалительного процесса: — серозный; — гнойный; — некротический.
Этиология Лабиринтит может быть вызван различными вирусами, бактериями и их токсинами. Источником инфекции чаще всего является расположенный в непосредственной близости от лабиринта очаг воспаления в полостях среднего уха или черепа. Тимпаногенный лабиринтит развивается вследствие попадания во внутреннее ухо флоры, обнаруживаемой в среднем ухе при гнойном воспалении. Преобладающая роль принадлежит мукозному стрептококку, стафилококку, туберкулезной микобактерии. Чаще возбудителем менингогенного лабиринтита является менингококк, реже — пневмококк, туберкулезная микобактерия, бледная трепонема, вирусы гриппа и эпидемического паротита. Возникновению лабиринтита может способствовать также травма (механическая, химическая, термическая).
Патанатомия Различают серозный, гнойный и некротический лабиринтит. Клеточные изменения при серозном лабиринтите имеют распространенный характер, в легких случаях сводятся к отеку в пространствах лабиринта. Иногда наблюдается набухание и распад нейроэпителия. При гнойном лабиринтите вначале отмечается скопление полинуклеарных лейкоцитов и бактерий на фоне расширенных кровеносных сосудов. Отек прогрессирует, присоединяется омертвение перепончатых, а в дальнейшем и костных стенок лабиринта. При благополучном исходе наблюдается замещение соединительной тканью и образование новой костной ткани, что приводит к уничтожению всех еще сохранившихся нервных элементов. Некротический лабиринтит характеризуется наличием чередующихся участков гнойного воспаления и омертвения мягких тканей и костного лабиринта. Исход двоякий: замещение омертвевшего участка рубцовой тканью с последующим новообразованием кости или разрушение костного лабиринта. Воспалительный процесс может захватить весь лабиринт, как это наблюдается при острых гнойных средних отитах, либо ограничиться одной из частей лабиринта. Завершается процесс лабиринтитным склерозом. При специфической инфекции лабиринтит имеет некоторые особенности. Так, изменения при туберкулезном лабиринтите, как правило, проявляются в двух формах: пролиферативной и экссудативно-некротической. Для первой характерно образование туберкулов, постепенно разрушающих как перепончатые, так и костные образования лабиринта. Вторая форма чаще бывает серозной, реже — гнойной. Поражение внутреннего уха при сифилисе проявляется как лабиринтит, остит височной кости с вовлечением перепончатого лабиринта. Отмечаются отек, нарастающая дистрофия перепончатого лабиринта, участки разрастания соединительной ткани наряду с рассасыванием кости.
Патогенез На механизм развития лабиринтита влияет ряд факторов — общая и местная реактивность организма, характер и степень болезнетворности возбудителя, особенности проявления воспалительного процесса в среднем ухе и полости черепа, путь проникновения инфекции во внутреннее ухо. Различают тимпаногенные лабиринтиты, когда источником распространения инфекции во внутреннее ухо служит полость среднего уха; менингогенные лабиринтиты, возникающие при переходе воспаления из подпаутинного пространства; гематогенные лабиринтиты, развивающиеся при некоторых общих инфекционных заболеваниях преимущественно вирусного происхождения (грипп, эпидемический паротит), когда предполагается гематогенный путь (вместе с кровотоком) внедрения инфекции в лабиринт. Переход воспалительного процесса из среднего уха возможен на любом участке стенки лабиринта, но происходит он, как правило, через перепончатые образования окон лабиринта и полукружный канал. При остром гнойном воспалении среднего уха патологический процесс распространяется чаще через окна лабиринта, не нарушая при этом их целостности. Прорыв вторичной барабанной перепонки также обусловливает развитие острого распространенного серозного или гнойного лабиринтита. Аналогичный путь возможен при обострении мезотимпанита. При хронических гнойных эпитимпанитах воспаление распространяется путем разрушения патологическим процессом костного лабиринта внутреннего уха, нередко в сочетании с прорывом перепончатых образований окон. Возможен переход инфекции в лабиринт из среднего уха. Из полости черепа со стороны мозговых оболочек инфекция проникает во внутреннее ухо и внутренний слуховой проход. Возможно распространение воспаления через преддверие и по пространствам стержня улитки. В механизме развития лабиринтита, развившегося в результате травмы, имеет значение нарушение целости перепончатого и костного лабиринтов, сотрясение, кровоизлияние в полость лабиринта. Некротический лабиринтит развивается в результате нарушения кровообращения в одной из конечных ветвей внутренней слуховой артерии. Сдавлению сосудов способствует отек, отмечающийся особенно часто при серозном воспалении. Ограниченный лабиринтит наблюдается только при хроническом гнойном эпитимпаните с кариесом или холестеатомией. Разрушение стенки костного лабиринта происходит под влиянием остита, а также холестеатомы, которая путем давления, разъедания кости постепенно врастает в нее вплоть до установления непосредственного сообщения полостей среднего и внутреннего уха. Излюбленное место локализации фистулы — полукружный канал, но она может образоваться и в области основания стремени и полукружных каналов. В период обострения воспаления в среднем ухе появляется воспалительная жидкость, в связи с чем ограниченный лабиринтит переходит в диффузный. При сифилисе возможен любой путь перехода специфического воспаления на лабиринт. В механизме развития сифилитического лабиринтита, помимо токсического или инфекционного воздействия на эпителий, большое значение имеет сифилитический эндартериит.
Клиническая картина Острый лабиринтит По течению различают острый и хронический (явный, скрытый) лабиринтиты. В типичных случаях острый лабиринтит проявляется так называемой лабиринтной атакой — внезапными и ярко выраженными симптомами сочетанного нарушения функций внутреннего уха: головокружением, сопровождающимся тошнотой (см.), рвотой (см.), нарушением статического и динамического равновесия тела, шумом в ухе, понижением слуха. При серозном лабиринтите лабиринтные симптомы сохраняются 2–3 недели и, постепенно утрачивая свою выраженность, исчезают. При гнойном лабиринтите после стихания острого воспаления заболевание может принять затяжное течение.
Хронический лабиринтит Иногда лабиринтит развивается как первично хронический, т. е. имеет хроническое течение (туберкулезный лабиринтит, ограниченный лабиринтит с фистулой) и характеризуется периодическими явными или менее выраженными симптомами лабиринтных расстройств. Слуховые расстройства проявляются шумом в ухе и понижением слуха вплоть до его выпадения. Стойкая глухота свидетельствует о гнойном воспалении в лабиринте. Резкое угнетение слуховой функции, практически неотличимое от глухоты при распространенных гнойных лабиринтитах, может наблюдаться и при распространенном серозном лабиринтите. Однако для серозного лабиринтита характерно постепенно нарастающее и преходящее снижение слуха. При серозных лабиринтитах, как распространенных, так и ограниченных, понижение слуха чаще бывает умеренным, и в легких случаях возможно полное восстановление его. Наиболее существенными признаками лабиринтита являются спонтанные нарушения функций вестибулярного аппарата. Решающее значение имеет спонтанный нистагм. Направление и интенсивность нистагма изменяются соответственно выраженности воспаления в лабиринтите. В начальных стадиях как серозного, так и гнойного воспаления спонтанный нистагм направлен в сторону пораженного лабиринта. Обычно он наблюдается в течение нескольких (3–5) суток. При гнойном лабиринтите спонтанный нистагм через несколько часов меняет направление в сторону здорового лабиринта. По прошествии острой стадии воспаления, спустя 2–3 недели, спонтанный нистагм исчезает благодаря вступлению в действие компенсаторных механизмов в центральных отделах вестибулярного анализатора. У больных лабиринтитом в позе Ромберга, при ходьбе вперед и назад может наблюдаться отклонение в сторону медленного компонента нистагма, спонтанное гармоническое отклонение рук и реакция промахивания в ту же сторону, а также вынужденное отклонение головы и туловища в сторону здорового уха. Головокружение при лабиринтите имеет системный характер, возникает или усиливается при изменении положения головы, часто сочетается со спонтанным нистагмом и в резко выраженных случаях сопровождается тошнотой, рвотой, обильным потоотделением, изменением окраски кожи лица и так далее. При скрытом течении лабиринтита вестибулярные расстройства практически не выражены. Характерным признаком ограниченного лабиринтита с фистулой и сохраненной функцией внутреннего уха является фистульный симптом, т. е. появление нистагма в сторону больного уха и других вестибулярных нарушений, при искусственном сгущении (компрессии) и разрежении (декомпрессии) воздуха в наружном слуховом проходе. Симптоматика ограниченных лабиринтитов отличается многообразием, неустойчивостью, характерно снижение вестибулярной возбудимости на стороне поражения. Клиника односторонних менингогенных лабиринтитов аналогична симптоматике серозного или гнойного тимпаногенного лабиринтита. При менингококковой инфекции поражаются оба лабиринта, поэтому вестибулярные расстройства не выражены. На фоне тяжелого течения менингита ранним и постоянным признаком лабиринтита является резкое угнетение слуховой функции вплоть до глухоты. Одновременно наблюдается полное выпадение вестибулярной возбудимости. Гематогенные лабиринтиты протекают остро, чаще с односторонним поражением лабиринта. Клиника различна. Для туберкулезного лабиринтита характерно хроническое скрытое течение, прогрессирующее угнетение функций лабиринта. Разнообразна клиника сифилитического лабиринтита. При приобретенном сифилисе выделяют три формы течения лабиринтита: — апоплектиформная — внезапное и необратимое сочетанное или изолированное выключение обеих функций лабиринта в одном или обоих ушах, нередко одновременно наблюдается поражение лицевого нерва; встречается во всех стадиях сифилиса, но чаще — во второй; — острая — перемежающийся шум в ушах и головокружение резко усиливаются к концу второй недели, быстро наступает резкое угнетение функций лабиринта; наблюдается во второй и третьей стадиях сифилиса; — хроническая — шум в ушах, незаметное для больного постепенное снижение слуха; нарушение слуховой и вестибулярной функций нередко обнаруживается лишь при специальных исследованиях, иногда сопровождается поражением лицевого нерва; наблюдается преимущественно во второй стадии сифилиса. Течение и симптомы лабиринтита при врожденном сифилисе зависят от тяжести инфекции и специфических изменений в организме. Заболевание начинается в детском возрасте, проявляется симптомами нарушения функций внутреннего уха. При позднем врожденном сифилисе часто выявляется так называемый фистульный симптом. При этом, в отличие от типичного фистульного симптома, нистагм при компрессии направлен в сторону противоположного, здорового уха, а при декомпрессии — в сторону раздражаемого уха. Особенности течения, симптоматика травматического лабиринтита определяются характером и тяжестью самой травмы.
Лечение Больной должен быть госпитализирован, так как он нуждается в постоянном и тщательном наблюдении. Предписывается полный покой, легкая диета. Для понижения внутри- лабиринтного давления назначают безводную и бессолевую диету, глюкозу, уротропин. Основным видом лечения является применение антибиотиков (со времени их широкого внедрения в практику). Выбор того или иного антибиотика производится после определения чувствительности к ним флоры среднего уха. При остром гнойном отите следует прежде всего улучшить условия оттока гноя. В зависимости от характера изменений производится пункция барабанной перепонки, расширение образующегося отверстия, удаление сосочка, гранулемы. При мастоидите и обострении хронического отита, при холестеатоме, т. е. при наличии в сосцевидном отростке патологического очага, откуда инфекция поступает в лабиринт, а также при фистуле лабиринта возникает вопрос о хирургическом вмешательстве. Операции на среднем ухе и сосцевидном отростке являются разгрузочными, они улучшают условия для самоизлечения. При серозном лабиринтите цель лечения — предупреждение перехода в гнойную форму и восстановление функции; при гнойном лабиринтите — отграничение процесса от подпаутинного пространства в результате образования спаек, новых тканей, запустевания каналов, ходов и так далее и предупреждение лабиринтогенных внутричерепных осложнений. При ограниченном лабиринтите для излечения необходимо достигнуть заращения фистулы соединительной или костной тканью. Это достигается удалением патологического очага — из височной кости при радикальной операции уха. Операцию не рекомендуется делать во время приступа, так как вследствие этого возможно распространение процесса и переход его в диффузный. Для лечения гематогенных и менингогенных лабиринтитов применяют антибиотики широкого действия. Лечение специфических лабиринтитов туберкулезного и сифилитического см. в соответствующих разделах (туберкулез, сифилис).
ЛАРИНГИТ
ОпределениеЛарингит — воспаление слизистой оболочки гортани. Может быть острым и хроническим.Стенозирующий ларингит (синдром крупа) — острый воспалительный процесс в гортани, нередко захватывающий трахею и бронхи.
Этиология Острый ларингит Ларингит острый редко бывает изолированным. Чаще это одно из проявлений острого респираторного заболевания, гриппа, скарлатины, коклюша и т. д. Его развитию способствуют общее и местное переохлаждение, перенапряжение голоса, вдыхание запыленного воздуха, раздражающих паров и газов, погрешности в питании, курение, злоупотребление спиртными напитками.
Хронический ларингит Ларингит хронический, как правило, возникает под влиянием тех же причин, что и острое воспаление, но действующих постоянно и длительно. В результате нарушается трофика тканей и развивается дистрофический процесс. В зависимости от характера указанных расстройств различают катаральную, гипертрофическую и атрофическую формы хронического ларингита.
Стенозирующий ларингит Стенозирующий ларингит наблюдается, как правило, в начальном периоде ОРВИ как проявление самого заболевания, но может быть и результатом присоединения бактериального фактора, и тогда стенозирующий ларингит рассматривается как осложнение ОРВИ. Особенно часто он возникает у детей с аллергическим диатезом и протекает тяжелее в раннем возрасте, нередко имеет волнообразное течение. Воспаление и отек слизистой оболочки при относительно узком просвете гортани у детей и обусловливают затруднения дыхания, усиливающиеся рефлекторным спазмом.
Клиническая картина и диагностика Острый ларингит Отмечаются ощущение сухости, першения, саднения, царапанья в горле; кашель вначале сухой, а в дальнейшем сопровождается отхождением мокроты; голос становится хриплым, грубым или совсем беззвучным; иногда боль при глотании, головная боль и небольшое повышение температуры. Продолжительность болезни обычно не превышает 7—10 дней. При неблагоприятных условиях может перейти в подострую или хроническую форму. При ларингоскопии отмечают разлитую гиперемию и отечность слизистой оболочки гортани. Голосовые складки утолщены, гиперемированы, на них комочки вязкой мокроты, при фонации они смыкаются не полностью. При гриппе возможны кровоизлияния в слизистую оболочку (так называемый геморрагический фарингит). Если патологические изменения наблюдаются лишь на одной стороне гортани и ларингит принял затяжное течение, необходимо исключить туберкулезное, сифилитическое поражение, новообразование.
Хронический ларингит Хронический катаральный ларингит сопровождается хроническим воспалением слизистой оболочки гортани, чаще диффузным. Отмечается охриплость, быстрая утомляемость голоса, ощущение першения, саднения в горле, периодический кашель с мокротой. Все эти признаки усиливаются при обострении ларингита. При ларингоскопии видна диффузно утолщенная, умеренно гиперемированная слизистая оболочка, голосовые складки утолщены, на них видны инъецированные кровеносные сосуды; иногда одновременно отмечается парез внутренних мышц гортани, что проявляется неполным закрытием голосовой щели при фонации. Хронический гипертрофический ларингит характеризуется разрастанием эпителия и подслизистого слоя. Может быть ограниченным или диффузным. Отмечается охриплость, иногда доходящая до афонии, ощущение неловкости, жжения, саднения в горле, кашель при обострении ларингита. При ларингоскопии — равномерное утолщение слизистой оболочки гортани, больше выраженное в области голосовых складок. При ограниченной форме определяется гиперплазия отдельных участков слизистой оболочки гортани, чаще голосовых складок или вестибулярных складок, подскладочного пространства, межчерпаловидной области. Дифференцировать следует со специфическими инфекционными гранулемами (туберкулез, сифилис и др.) иопухолями. Хронический атрофический ларингит проявляется истончением и атрофией слизистой оболочки гортани. Как правило, бывает одним из компонентов атрофического процесса в слизистой оболочке верхних дыхательных путей. Присутствуют ощущение сухости, першения, саднения в горле, сухой кашель, охриплость. При ларингоскопии слизистая оболочка выглядит истонченной, сухой, покрыта густой слизью, местами засохшей в корки. При усиленном откашливании могут отходить корки с прожилками крови.
Стенозирующий ларингит Стенозирующий ларингит возникает нередко остро, преимущественно ночью. У части детей ему предшествуют симптомы ларингита (сухой, особенно лающий кашель, першение в горле, небольшая охриплость голоса). Тяжесть стенозирующего ларингита определяется степенью стеноза и дыхательной недостаточностью. Различают четыре степени стеноза. Стеноз I степени — кратковременное затруднение дыхания или более продолжительное, но слабо выраженное; приступы затрудненного дыхания возникают редко, дыхание шумноватое, сиплый голос, лающий кашель, небольшой цианоз (синюшность), незначительно выраженное втяжение податливых мест грудной клетки, в основном в эпигастрии. Дыхательная недостаточность отсутствует. Стеноз II степени характеризуется продолжительностью (до 5 суток), нарушением общего состояния ребенка, который становится беспокойным, усиливается лающий, грубый кашель, часто возникают приступы затрудненного дыхания, сопровождаясь втяжением всех податливых мест грудной клетки; дыхание шумное, слышимое на расстоянии. Стеноз может быть постоянным или иметь волнообразный характер. Умеренно выражена дыхательная недостаточность. Характерно резкое ухудшение общего состояния, отмечаются выраженная бледность, цианоз губ, конечностей. Стеноз III степени — значительное и постоянное затруднение дыхания с втяжением всех податливых мест грудной клетки (яремная ямка, над- и подключичные пространства, эпигастральная область). Наблюдается потливость, резкое беспокойство ребенка (больной мечется в постели), дыхание в легких ослаблено. Отмечаются признаки сердечно-сосудистой недостаточности (выпадение пульсовой волны и др.), признаки нарастающей гипоксемии — бледность, адинамия. Дыхательная недостаточность резко выражена. Стеноз IV степени — стадия асфиксии. Диагноз ставят на основании данных анамнеза и клинической картины. Дифференциальный диагноз проводят с инородным телом, респираторными аллергозами.
Лечение Острый ларингит Необходимо устранение причин, вызвавших заболевание. Для полного покоя гортани в течение 5–7 дней больному рекомендуют не разговаривать, запрещают курить, употреблять спиртные напитки. Необходимо также исключить острые приправы, пряности. Полезны теплое питье (молоко, боржом), полоскание горла отваром ромашки или шалфея, теплые щелочные ингаляции, ингаляции аэрозолей антибиотиков, тепло на шею (повязка или согревающий компресс), горячие ножные ванны (42–45 °C на 20–30 мин). При кашле назначают кодеин, ипекакуану. Применяют также физиотерапевтические методы: соллюкс на переднюю поверхность шеи, ультрафиолетовое облучение, электрофорез новокаина на область гортани, УВЧ и микроволновую терапию.
Хронический ларингит При хроническом катаральном ларингите рекомендуют щадящий голосовой режим; исключение факторов, способствующих заболеванию; масляные и щелочные ингаляции, ингаляции аэрозолей антибиотиков; устранение погрешностей в питании; запрещение курения и употребления спиртных напитков. При кашле — кодеин. Полезно теплое питье (молоко, боржом). Эффективно применение физиотерапевтических процедур (УВЧ, микроволновая терапия, электрофорез новокаина на область гортани, соллюкс, ультрафиолетовое облучение передней поверхности шеи). При хроническом гипертрофическом ларингите лечение то же, что и при хроническом катаральном ларингите. Кроме того, после анестезии слизистой оболочки гортани раствором кокаина или дикаина гиперплазированные участки прижигают 3–5 %-ным раствором нитрата серебра. Участки резко выраженной гиперплазии удаляют эндоларингеально хирургическим путем. При хроническом атрофическом ларингите лечение в основном симптоматическое. Применяют щелочные и масляные ингаляции, смазывание гортани раствором Люголя в глицерине. Для лучшего отхождения корок можно назначить ингаляции аэрозолей протеолитических ферментов (химопсин, химотрипсин и др.)
Стенозирующий ларингит Лечение определяется степенью выраженности стеноза, его продолжительностью, а также наличием токсикоза, вызванного ОРВИ, возрастом ребенка, его преморбидным состоянием. При стенозе I степени необходимы: широкий доступ воздуха; отвлекающая терапия — горчичники на икры и круговые горячие ванны при температуре воды до 38–39 °C, обильное частое теплое питье (чай, боржом, молоко с содой), паровые щелочные ингаляции (4 %-ный раствор гидрокарбоната натрия с витамином А, эуфиллином, гидрокортизоном; антиспастическая терапия (атропин, папаверин, люминал внутрь в возрастных дозах); седативные (1–2 %-ный раствор бромида натрия по 1 ч. л., дес. л., ст. л. 3 раза в день в зависимости от возраста) и гипосенсибилизирующие средства (димедрол, пипольфен и др.), витамины. При отсутствии эффекта — внутриносовая новокаиновая блокада, способствующая уменьшению отека слизистой оболочки гортани и снятию рефлекторного спазма. Уже при этой стадии стеноза, особенно при наличии лихорадки, рекомендуют назначать антибиотики. Желательно помещать ребенка в палату, где воздух увлажнен паром. При стенозе II степени, кроме указанных выше средств, широко применяют увлажненный кислород; с целью уменьшения отека слизистой оболочки дыхательных путей — гипертонические растворы внутривенно (20–30 мл 20 %-ного раствора глюкозы, 5— 10 мл 10 %-ного раствора глюконата кальция); гормональные препараты: гидрокортизон — 5 мг/кг, преднизолон — 1–1,5 мг/кг в сутки); сердечные средства (строфантин или коргликон внутривенно или дигоксин внутрь), мочегонные препараты; нейролептики (аминазин, промазин и др.), но осторожно, чтобы не подавить кашлевой рефлекс и не упустить момент для оперативного лечения. При стенозе III степени преднизолон внутривенно (1,5–2 мг/кг), причем первая доза составляет половину суточной; более широко применяют сердечные средства; антибиотики широкого спектра действия (цепорин, тетраолеан и др.), а также оксибутират натрия (ГОМК). При отсутствии эффекта проводят лечебную ларингоскопию, во время которой полиэтиленовым катетером отсасывают слизь, удаляют сухие кровянистые корки, смазывают слизистую оболочку раствором эфедрина, гидрокортизоном, персиковым, абрикосовым или вазелиновым маслом. Иногда прямую ларингоскопию повторяют несколько раз. При стенозе III степени показана также лечебная бронхоскопия (удаление слизи, гноя, корок, промывание бронхов, интратрахеобронхиальное введение антибиотиков), но при этом должна быть полная готовность к немедленному проведению трахеостомии. Если перечисленные выше мероприятия оказываются неэффективными, выраженность стеноза не уменьшается, имеется тенденция к прогрессированию сердечно-сосудистой недостаточности (отмечаются парадоксальный пульс — выпадение пульсовой волны, нарастают адинамия, бледность кожных покровов на фоне стойкого цианоза губ, конечностей и пр.), показана интубация или трахеостомия. Прогноз при III степени стеноза и асфиксии серьезный; при I–II степени и рано начатом лечении — благоприятный. Для исключения развития стенозирующего ларингита необходимо предупреждение ОРВИ, особенно у детей с аллергическим диатезом.
ЛЕГИОНЕЛЛЕЗ
ОпределениеЛегионеллез (синонимы: болезнь легионеров, питтсбургская пневмония, лихорадка Понтиак, лихорадка Форт-Брагг, легионелла-инфекция) — острая инфекционная болезнь бактериальной природы, характеризующаяся развитием пневмонии и нередко инфекционно-токсического шока, а также поражением центральной нервной системы, желудочно-кишечного тракта, почек.
Этиология и эпидемиология В 1979 г. в Филадельфии у 182 участников конгресса «Американский легион» возникло острое респираторное заболевание с тяжелой пневмонией, отмечались случаи со смертельным исходом. Из легочной ткани человека, умершего во время вспышки, была выделена палочка, роль которой в возникновении и развитии заболевания была доказана наличием специфических антител к возбудителю. Подобные вспышки лихорадочных заболеваний регистрировались в 1965 г. в Колумбии, в 1968 г. в Мичигане и в 1973 г. в Испании. Изучение сывороток больных позволило доказать, что возбудителями этих вспышек были различные виды легионелл. В 1978 г. на Международном симпозиуме по болезни легионеров возбудитель нового заболевания был назван легионеллой. Известно 8 видов легионелл. Возбудитель данного заболевания является наиболее представительным по числу входящих в него штаммов, которые подразделены на 7 серогрупп. Легионелла — грамотрицательная подвижная палочка. Для выращивания возбудителя используют куриные эмбрионы и организм морской свинки. Фактором патогенности и вирулентности легионелл является термостабильный эндотоксин. Есть данные, подтверждающие наличие у бактерий сильнодействующего экзотоксина. Микроб обладает гемолитической активностью, а также вирулентностью и иммуногенностью. Легионеллы довольно устойчивы в водной среде: в речной воде они сохраняются до 3 недель, в водопроводной — более года, в дистиллированной — до 140 дней. Дезинфицирующие растворы (70 %-ный раствор спирта, 5 %-ный раствор йода, 1 %-ный раствор формалина, 5 %-ный раствор фенола, гипохлорит кальция) быстро снижают активность возбудителя. Предполагают, что легионеллез относится к инфекции, обладающей способностью размножаться вне организма в естественных условиях внешней среды, которая является для него местом обитания (прежде всего водоемы). Источники инфекции пока не установлены. Механизм передачи инфекции — аспирационный (воздушный и воздушно-пылевой). Основными факторами передачи являются воздух, вода и почва (пыль). Легионеллез в виде вспышек отмечается в психиатрических больницах, гематологических центрах, отделениях реанимации, центрах по трансплантации почек и других специализированных клиниках. Передача инфекции от человека к человеку маловероятна. Заражение детей может происходить в детских дошкольных учреждениях, школах, домах ребенка и других помещениях, оборудованных неисправными кондиционерами. Описаны внутрибольничные вспышки легионеллеза, что дает основание некоторым авторам рассматривать это заболевание как внутрибольничную инфекцию. Наиболее подвержены заболеванию легионеллезом лица пожилого возраста, курильщики, хронические алкоголики, наркоманы, а также лица с первичными и вторичными иммунодефицитами. Нередко болезнь возникает у людей, участвующих в земляных и строительных работах. Чаще болеют мужчины. Максимальное число случаев болезни приходится на летне-осенние месяцы. Вспышки легионеллеза зарегистрированы в США, Великобритании, Испании, Италии, Франции. Единичные случаи болезни выявлены во всех странах мира, в том числе и в России. Болезнь выявляют повсеместно и чаще всего там, где есть условия и возможность для специфической лабораторной диагностики. Факторами передачи являются: — почва в очаговых районах, головки в душевых установках, пыль, поднятая во время земляных работ, и т. д.; — вода в системах кондиционирования воздуха рециркуляторного типа.
Патогенез и патанатомия В организм инфекция попадает через дыхательные пути. Возбудитель, вызывая воспалительно-геморрагические и некротические изменения, гибнет, освобождая эндотоксин. Легионеллы могут обнаруживаться в крови и, поступая в различные органы, вовлекать их в патологический процесс. Эндотоксин обусловливает системные поражения, а в тяжелых случаях — развитие инфекционно-токсического шока с острой дыхательной и почечной недостаточностью, энцефалопатией. Инфекционно-токсический шок может стать непосредственной причиной смерти больных. На вскрытии выявляют очаговые и сливные участки омертвения легких, нередко с абсцессом, плевральным выпотом. Макроскопически выявляется ткань легкого сероватого цвета с очагами уплотнения и нередко явлениями фибринозного плеврита. При тканевом исследовании в альвеолах обнаруживается жидкость с большим количеством нейтрофилов, макрофагов и фибрина. Характерен интерстициальный некроз легочной ткани. В некоторых участках легочной ткани с большим постоянством удается обнаружить внутри- и внеклеточно расположенные легионеллы. Очаги воспалительной инфильтрации с явлениями некробиоза могут обнаруживаться и в других пораженных органах: печени, селезенке, веществе мозга, желудочно-кишечном тракте, почках и др.
Клиническая картина Инкубационный период колеблется от 2 до 10 суток, в среднем составляя 4–7 дней. Выделяют следующие клинические формы легионеллеза: болезнь легионеров, протекающая с тяжелой пневмонией; острое респираторное заболевание без пневмонии (лихорадка Понтиак); острое лихорадочное заболевание с экзантемой (лихорадка Форт-Брагг). Болезнь легионеров начинается остро с озноба, повышения температуры, головной, мышечной и суставной болей. В тяжелых случаях наблюдаются нарушения походки, расстройство координации движений, затруднения речи, обмороки, галлюцинации. Со 2—4-го дня болезни присоединяются кашель со слизисто-гнойной или кровянистой мокротой, одышка, боли в грудной клетке. При простукивании и прослушивании выявляются очаги притупления над легкими, мелкопузырчатые влажные хрипы, шум трения плевры. Пневмония может быть односторонней или двусторонней, чаще имеет долевой, реже очаговый характер. Обычно поражаются нижние доли легких, особенно правая. В тяжелых случаях наблюдаются абсцедирующая пневмония, экссудативный плеврит. Возможно течение болезни с картиной распространенного бронхиолита или альвеолита. У 1/3 больных с первых дней болезни возникает диарея, что может вызвать ошибки в диагностике. Печень и селезенка не увеличены. При тяжелом течении легионеллеза возможны боли в животе, повторная рвота, жидкий стул, нарушение функции почек вплоть до почечной недостаточности, желудочно-кишечные кровотечения, нередко развивается инфекционно-токсический шок со смертельным исходом в первую неделю заболевания. При благоприятном течении болезни признаки интоксикации постепенно исчезают, воспалительные же очаги в легких рассасываются медленно, в течение 4–6 недель и более. Смертность при этой форме достигает 20 %. Возможно легкое и среднетяжелое течение болезни, которое не отличается от других бактериальных пневмоний. Острое респираторное заболевание (лихорадка Понтиак) протекает без пневмонии, с клинической картиной бронхита и ринита. При этой форме легионеллеза наблюдаются мышечные боли, неврологические симптомы, рвота, жидкий стул. Летальных исходов не описано. Острое лихорадочное заболевание с экзантемой (лихорадка Форт-Брагг) не имеет каких-либо характерных, специфических лишь для него проявлений. Кожная сыпь может быть крупнопятнистой, кореподобной, петехиальной с различной локализацией. Шелушение кожи после исчезновения сыпи, как правило, не наблюдается. При этой форме имеются бронхит и общетоксические симптомы. У больных легионеллезом отмечают нейтрофильный лейкоцитоз со сдвигом влево до молодых клеток, тромбоцитопению. В моче выявляются токсическая альбуминурия, цилиндрурия, лейкоциты, эритроциты. Прогноз наиболее серьезен при болезни легионеров. Во время эпидемических вспышек смертность может достигать 20 %. Остальные формы протекают более благоприятно.
Осложнения В связи с абсцедированием процесса в легких, развитием накопления гноя в плевре, множественных тромбоэмболий, острой почечной недостаточности с азотемией и почечной энцефалопатией возникают осложнения.
Диагностика и дифдиагностика Клиническая диагностика легионеллеза сложна. Эту инфекцию можно заподозрить лишь при наличии эпидемиологических данных о групповых заболеваниях, чаще возникающих у лиц, отягощенных сопутствующими заболеваниями с иммунодефицитами различной природы. Следует учитывать наличие ряда симптомов, свойственных легионеллезу: поражение дыхательных путей, нарушение функции центральной нервной системы, печени, почек, кишечника. Важно принимать во внимание при клинической диагностике отсутствие эффекта от лечения общепринятыми при пневмонии антибиотиками. Лабораторная диагностика легионеллеза проводится путем выявления возбудителя иммунофлюоресцентным методом, получения культуры возбудителя и серологического анализа, направленного на обнаружение специфических антител. Бактериологический метод, направленный на выделение культуры возбудителя, сложен и доступен лишь специализированным лабораториям. Внедряются в практику иммуноферментные и радиоиммунные методы обнаружения растворимых антигенов легионелл. Этими методами выявляют антигены в крови, мокроте и моче. Широкое применение получил серологический метод диагностики легионеллеза. Антитела в сыворотке крови появляются с 6—7-го дня болезни, количество их нарастает на 2—3-й неделе заболевания. Диагностическим считается нарастание количества антител в 4 раза и более. Дифференциальную диагностику следует проводить с бактериальными пневмониями (см.) стафилококковой и пневмококковой этиологии, орнитозом (см.), лихорадкой Ку (см.), микоплазмозом (см.) и другими заболеваниями, протекающими с поражением легких. Ведущее значение в этих случаях имеет лабораторная диагностика.
Лечение Наиболее эффективным средством является эритромицин в суточной дозе 2,0 г в 4 приема. Лечение эритромицином продолжают не менее 3 недель. Целесообразно дополнительно с эритромицином применять рифампицин в суточной дозе 0,6–1,2 г. Левомицетин также может быть использован в дозе 4 г в сутки. Используют комплекс средств, направленных на коррекцию водно-электролитных расстройств, кислотно-щелочного состояния.
Профилактика Необходимы санитарная охрана водоисточников и обеззараживание воды, дезинфекция систем кондиционирования, душевых помещений и установок. Больных легионеллезом размещают в отдельных палатах, боксах. Работу с материалом от больных проводят в перчатках, масках. Персонал лабораторий по выделению возбудителя работает в защитном костюме второго типа. Специфическая профилактика легионеллеза не разработана. Разрабатывается активная иммунизация с помощью вакцинных препаратов.
ЛЕГОЧНОЕ СЕРДЦЕ
ОпределениеЛегочное сердце представляет собой комплекс нарушений гемодинамики (вторичная легочная гипертония), развивающийся вследствие заболеваний легочного аппарата, проявляющийся необратимыми изменениями правого желудочка с развитием недостаточности кровообращения.Острое легочное сердце — клинический симптомокомплекс, возникающий прежде всего вследствие развития тромбоэмболии легочной артерии (см.), а также при ряде заболеваний сердечно-сосудистой и дыхательной систем. За последние годы отмечается тенденция к росту частоты развития острого легочного сердца, связанная с учащением тромбоэмболий в системе легочной артерии. Наибольшее количество тромбозов и эмболий легочной артерии отмечается у больных с сердечно-сосудистыми заболеваниями (ишемическая болезнь сердца (см.), гипертоническая болезнь (см.), ревматические пороки сердца (см.), флеботромбозы (см.). Хроническое легочное сердце развивается в течение ряда лет и протекает вначале без сердечной недостаточности, а затем с развитием декомпенсации. За последние годы хроническое легочное сердце встречается чаще, что связано с ростом заболеваемости населения острыми и хроническими пневмониями, бронхитами (табл. 10).
Таблица 10. Классификация легочного сердца Течение: Острое легочное сердце (с тяжелым течением) Компенсация: Декомпенсированное Генез: Преимущественно васкулярный: — эмболия массивная легочной артерии; — эмболия газовая, жировая, опухолевая; — тромбоз легочной артерии; — тромбоз легочных вен. Бронхолегочный: — тяжелый приступ бронхиальной астмы; — распространенная пневмония со значительным цианозом; — пневмоторакс, пневмомедиастинум. Клиническая картина: Острое развитие в течение нескольких минут, часов с частым летальным исходом * * * Течение: Острое легочное сердце (с подострым течением) Компенсация: Компенсированное Декомпенсированное по правожелудочковому типу Генез: Васкулярный: — эмболия ветвей легочных артерий; — тромбоз ветвей легочных артерий, часто с рецидивирующим течением; — артерииты системы легочной артерии. Бронхолегочный: — инфаркт легких; — вегетильный пневмоторакс; — распространенная острая пневмония; — тяжелое течение бронхиальной астмы (status astmaticus); — раковый лимфангоит легких. Торакодиафрагмальный: хроническая гиповентиляция центрального и периферического генеза (ботулизм, полиомиелит, миастения). Клиническая картина: Развитие в течение нескольких дней, недель с возникновением декомпенсации с возможным летальным исходом * * * Течение: Хроническое легочное сердце Компенсация: Компенсированное Декомпенсированное Генез: Васкулярный: — первичная легочная гипертензия; — артерииты; — повторные эмболии; — резекция легкого. Бронхолегочный: — обструктивные процессы в бронхах (эмфизема, астма, хронический бронхит, пневмосклероз); — рестриктивные процессы — фиброзы и гранулематозы. Торакодиафрагмальный: — поликистоз легких; — поражение грудной клетки и позвоночника с деформацией; — плевральные шварты; — ожирение. Клиническая картина: Развитие в течение ряда лет
Этиология Острое легочное сердце Основными причинами этого состояния являются: — массивная тромбоэмболия в системе легочной артерии; — клапанный пневмоторакс; — тяжелый затяжной приступ бронхиальной астмы; — распространенная острая пневмония. При повторных тромбоэмболиях мелких ветвей легочной артерии (тромбы, эмболы, яйца паразитов и др.), раковом лимфангиите, ботулизме, миастении может развиваться острое легочное сердце с подострым течением. К числу факторов, способствующих развитию тромбоэмболии легочной артерии, следует отнести повышение артериального давления в малом круге кровообращения, застойные явления в малом круге кровообращения, повышение свертываемости и угнетение противосвертывающей системы крови, нарушение в системе микроциркуляции малого круга кровообращения, атеросклероз и васкулиты в системе легочной артерии, малоподвижность при длительном постельном режиме, оперативные вмешательства на венах таза и нижних конечностей.
Хроническое легочное сердце Все заболевания, ведущие к развитию хронического сердца, можно разделить на три большие группы: — болезни, поражающие воздухоносные пути и альвеолы: хронический обструктивный бронхит, эмфизема легких, бронхиальная астма, пневмокониозы, бронхоэктазы, поликистоз легких, саркоидоз, пневмосклероз и др.; — болезни, поражающие грудную клетку с ограничением подвижности: тифосколиоз, болезнь Бехтерева, состояние после торакопластики, плевральный фиброз, нервно-мышечные болезни (полиомиелит), парез диафрагмы, пикквикский синдром при ожирении и др.; — болезни, поражающие легочные сосуды: первичная легочная гипертензия, тромбоэмболия в системе легочной артерии, васкулиты (аллергический, облитерирующий, узелковый, волчаночный и др.), атеросклероз легочной артерии, сдавление ствола легочной артерии и легочных вен опухолями средостения, аневризмой аорты.
Патогенез и патанатомия Острое легочное сердце В развитии острого легочного сердца имеют значение заболевания малого круга кровообращения, приводящие к распространенному сужению легочных сосудов и развитию бронхоспазма, падению давления в большом круге кровообращения, нарушения соотношения вентиляции и газообмена. Указанные выше механизмы в конечном итоге способствуют повышению артериального давления в малом круге кровообращения и перегрузке правых отделов сердца. При этом могут возникать повышение проницаемости легочных капилляров, выход жидкости в альвеолы, межклеточное пространство с развитием отека легкого.
Хроническое легочное сердце В основе развития хронического легочного сердца лежит гипертония малого круга кровообращения вследствие патологических процессов в легких. При обструктивных процессах вследствие нарушения бронхиальной проходимости становится неравномерной альвеолярная вентиляция, нарушается газообмен и снижается содержание кислорода в альвеолярном воздухе (альвеолярная гипоксия), что также способствует нарушению снабжения тканей кислородом. Рестриктивные процессы характеризуются снижением эластичности и сопротивления легких, уменьшением дыхательной поверхности и сосудистого ложа малого круга кровообращения, увеличением кровотока по легочным шунтам, повышением внутригрудного давления, что также приводит к снижению уровня кислорода в альвеолах. Альвеолярная гипоксия вызывает повышение тонуса легочных сосудов (рефлекс Эйлера-Лильестранда) и увеличение давления в малом круге кровообращения с переразвитием (гипертрофией) правых отделов сердца. Гипоксия способствует также увеличению количества эритроцитов крови, повышению вязкости крови, замедлению кровотока и увеличению объема циркулирующей крови. Это приводит к уменьшению минутного объема крови и наряду с дистрофическими процессами в правом желудочке способствует развитию правожелудочковой декомпенсации. По мере прогрессирования у больных легочным сердцем наступают сдвиги кислотно-щелочного состояния, которые первоначально компенсированы, но в дальнейшем может наступить декомпенсация нарушений. Основными признаками легочного сердца являются увеличение размеров правого желудочка и изменения в крупных сосудах малого круга в виде переразвития мышечной оболочки, сужения просвета с последующим склерозированием. В мелких сосудах нередко обнаруживаются множественные тромбы. Со временем в увеличенном и измененном миокарде развиваются дистрофические и некротические изменения.
Клиническая картина Острое легочное сердце Острое легочное сердце развивается в течение нескольких часов, дней и, как правило, сопровождается явлениями сердечной недостаточности. При более медленных темпах развития наблюдается подострый вариант данного синдрома. Острое течение тромбоэмболии легочной артерии характеризуется внезапным развитием заболевания на фоне полного благополучия, нередко у больных с обострением хронического тромбофлебита. Появляются резкая одышка, синюшность, боли в грудной клетке, возбуждение. Тромбоэмболия основного ствола легочной артерии быстро, в течение от нескольких минут до получаса, приводит к развитию шокового состояния, отека легких. При прослушивании выслушивается большое количество влажных и рассеянных сухих хрипов. Может выявляться пульсация во втором-третьем межреберье слева. Характерны набухание шейных вен, прогрессирующее увеличение печени, болезненность ее при прощупывании. Нередко возникает острая коронарная недостаточность, сопровождающаяся болевым синдромом, нарушением ритма и электрокардиографическими признаками ишемии миокарда, особенно у больных с хронической болезнью сердца. Развитие этого синдрома связано с возникновением шока, сдавлением вен, расширенным правым желудочком, раздражением нервных рецепторов легочной артерии. Дальнейшая клиническая картина заболевания обусловлена формированием инфаркта миокарда, характеризуется возникновением или усилением болей в грудной клетке, связанных с актом дыхания, одышки, синюшности. Выраженность двух последних проявлений меньше по сравнению с острой фазой заболевания. Появляется кашель, обычно сухой или с отделением скудной мокроты. В половине случаев наблюдается кровохарканье. У большинства больных повышается температура тела, обычно устойчивая к действию антибиотиков. При исследовании выявляется стойкое учащение сердечного ритма, ослабление дыхания и влажные хрипы над пораженным участком легкого, рассеянные сухие хрипы. Часто отмечается несоответствие между тяжестью течения заболевания и сравнительно скудными изменениями в легких.
Легочное сердце в ранней стадии
Подострое легочное сердце Подострое легочное сердце клинически проявляется внезапной умеренной болью при дыхании, быстро проходящей одышкой и учащенным сердцебиением, обмороком, нередко кровохарканьем, симптомами плеврита.
Хроническое легочное сердце Следует различать компенсированное и декомпенсированное хроническое легочное сердце. В фазе компенсации клиническая картина характеризуется главным образом симптоматикой основного заболевания и постепенным присоединением признаков увеличения правых отделов сердца. Клинические признаки увеличения правого желудочка обычно выражены неярко и наблюдаются не во всех случаях. У ряда больных выявляется пульсация в верхней части живота. Развернутая клиническая симптоматика наблюдается при декомпенсированном легочном сердце. Основной жалобой больных является одышка, которая обусловлена как дыхательной недостаточностью, так и присоединением сердечной недостаточности. Одышка усиливается при физическом напряжении, вдыхании холодного воздуха, в положении лежа. Нередко больные жалуются на боли в области сердца, не связанные с физической нагрузкой и не прекращаемые приемом нитроглицерина. Причинами болей в области сердца при легочном сердце являются обменные нарушения миокарда, а также относительная недостаточность коронарного кровообращения в увеличенном правом желудочке. Болевые ощущения в области сердца можно объяснить также наличием легочно-коронарного рефлекса вследствие легочной гипертензии и растяжения ствола легочной артерии. При исследовании часто выявляется синюшность. На фоне распространенного теплого цианоза, являющегося симптомом основного легочного заболевания, появляется «холодный» цианоз, синюшное окрашивание конечностей. Цианоз усиливается при обострении воспалительного процесса, упорном кашле. Важным признаком легочного сердца является набухание шейных вен. В отличие от дыхательной недостаточности, когда шейные вены набухают в период вдоха, при легочном сердце шейные вены остаются набухшими как на вдохе, так и на выдохе. Характерна пульсация в верхней части живота, обусловленная увеличением правого желудочка. Основными клиническими признаками правожелудочковой недостаточности являются учащенное сердцебиение, увеличение печени, сопровождающиеся чувством тяжести в правом подреберье, отеки, устойчивые к лечению. При исследовании сердца отмечается глухость сердечных тонов. Аритмии при легочном сердце бывают редко и обычно возникают в сочетании с атеросклеротическим кардиосклерозом. Артериальное давление обычно нормальное или пониженное. Одышка у части больных с выраженным снижением уровня кислорода в крови, особенно при развитии застойной сердечной недостаточности, вследствие компенсаторных механизмов наблюдается развитие артериальной гипертонии. У ряда больных отмечается развитие язв желудка, что связано с нарушением газового состава крови и снижением устойчивости слизистой оболочки системы желудка и двенадцатиперстной кишки. Основные симптомы легочного сердца становятся более выраженными на фоне обострения воспалительного процесса в легких. У больных легочным сердцем имеется наклонность к понижению температуры, и даже при обострении пневмонии температура редко превышает 37 °C. В терминальной стадии нарастают отеки, отмечается увеличение печени, снижение количества выделяемой мочи, возникают нарушения со стороны нервной системы (головные боли, головокружение, шум в голове, сонливость, апатия), что связано с нарушением газового состава крови и накоплением недоокисленных продуктов.
Диагностика и дифдиагностика Острое легочное сердце Диагноз острого легочного сердца устанавливают на основании характерной клинической картины (внезапное начало, резкая одышка, синюшное окрашивание кожи, боли в грудной клетке), данных ЭКГ (электрокардиографии) и рентгенологического исследования. При постановке диагноза необходимо учитывать наличие в прошлом тромбофлебита нижних конечностей. Значительное место в диагностике тромбоэмболии легочной артерии занимает метод легочной ангиографии, позволяющий определить локализацию и распространенность патологического процесса. При исследовании крови в случае развития инфарктной пневмонии выявляются непостоянное повышение уровня лейкоцитов, длительное увеличение СОЭ, изменение ряда биохимических тестов, свидетельствующие о наличииз воспалительного процесса. При рентгенологическом исследовании выявляются одностороннее увеличение тени корня легкого, повышенная его прозрачность. Одновременно могут отмечаться высокое стояние купола диафрагмы на стороне поражения, расширение венозных сосудов, увеличение правых отделов сердца. При развитии инфаркта легкого выявляется затемнение малой интенсивности, располагающееся чаще под плеврой. Приблизительно в половине случаев затемнение имеет треугольную форму. Нередко определяется жидкость в плевральной полости с последующим развитием плевральных сращений.
Хроническое легочное сердце В начальных стадиях развития легочного сердца клинические проявления мало отличимы от симптомов дыхательной недостаточности. Диагноз легочного сердца устанавливают в тех случаях, когда у больных с дыхательной недостаточностью появляются признаки увеличения правого желудочка, в выявлении которой наибольшее значение принадлежит электрокардиографическому и рентгенологическому методам исследования. Кроме того, в диагностике легочного сердца имеют значение исследования кровообращения (красочный, радиоизотопный методы), которые выявляют уменьшение минутного и сердечного выброса, замедление скорости кровотока, увеличение объема циркулирующей крови, повышение венозного давления.
Электрокардиограмма при хроническом легочном сердце
Диффузный пневмосклероз, легочное сердце
В фазе декомпенсированного легочного сердца необходимо проводить дифференциальную диагностику этого состояния и сердечной недостаточности, развивающейся при ряде заболеваний сердца (кардиосклероз, пороки сердца, миокардит и др.). Решающая роль в дифференциальной диагностике принадлежит данным опроса и результатам клиникоинструментальных исследований. В крови при хроническом легочном сердце отмечается повышение уровня эритроцитов, повышение содержания гемоглобина и уменьшение СОЭ до 2–4 мм/ч. Увеличение СОЭ до 10–15 мм/ч может свидетельствовать о наличии обострения воспалительного процесса. Количество лейкоцитов обычно нормальное. При рентгенологическом исследовании грудной клетки наиболее часто выявляется картина эмфиземы легких и распространенного, реже очагового, пневмосклероза. При исследовании сердца отмечаются его небольшие размеры даже при наличии увеличения правого желудочка. Важную роль играет также электрокардиографическое исследование, выявляющее характерные изменения. Наибольшее практическое значение имеет дифференциальная диагностика декомпенсированного легочного сердца и сердечной недостаточности у больных с ишемической болезнью сердца, атеросклеротического кардиосклероза (табл. 11).
Таблица 11. Основные дифференциально-диагностические критерии при сердечной недостаточности у больных легочным сердцем и ИБС, атеросклеротическим кардиосклерозом Критерии ∙ Легочное сердце ∙ Атеросклеротический кардиосклероз К: Анамнез Лс: Повторные обострения хронического бронхита Ак: Стенокардия, инфаркт миокарда, артериальная гипертония
К: Одышка Лс: Субъективно, часто не ощущается Ак: Часто выраженная
К: Цианоз Лс: Чаще диффузный, теплый, пепельного цвета Ак: Чаще холодный, акроцианоз
К: Мерцательная аритмия Лс: Редко Ак: Часто
К: Полицитемия Лс: Часто Ак: Редко
К: ЭКГ Лс: Отклонение электрической оси вправо, гипертрофия правого желудочка; блокада правой ножки пучка Гиса Ак: Чаще отклонение электрической оси влево; гипертрофия левого желудочка; блокада левой ножки пучка Гиса; часто мерцание предсердий
К: Рентгенологическое исследование сердца Лс: Увеличение правых отделов, выбухание conus pulmonalis Ак: Часто увеличение левого желудочка; уплотненная и развернутая аорта
К: Показатели функции внешнего дыхания Лс: Часто изменения обструктивного и рестриктивного характера Ак: Чаще не изменены К: Терапия гликозидами и диуретиками Лс: Малоэффективны Ак: Часто эффективны
Лечение и профилактика Острое легочное сердце При развитии шокового состояния и наступлении клинической смерти необходимо срочное проведение реанимационных мероприятий (искусственная вентиляция легких, массаж сердца). При успехе реанимационных мероприятий показана срочная операция с целью удаления тромба из ствола легочной артерии или введение тромболитических препаратов в легочную артерию через зонд. Терапевтические мероприятия сводятся к прекращению болевого синдрома (введение анальгетиков, наркотических средств, препаратов нейролептанальгезии), снижению давления в легочной артерии (применение эуфиллина, при отсутствии пониженного давления — ганглиоблокаторов), лечению сердечной недостаточности, борьбе с шоком (назначение симпатомиметиков, глюкокортикоидов, полиглюкина). Одним из важных методов лечения тромбоэмболии легочной артерии (см.) является ранняя антикоагуляционная терапия, которая начинается с введения гепарина в первоначальной дозе 20–25 тыс. ЕД внутривенно с последующим переходом на внутримышечное или подкожное введение по 5— 10 тыс. ЕД через каждые 6 ч под контролем свертываемости крови. Лечение гепарином следует продолжать в течение 7—10 дней, затем переходят на антикоагулянты непрямого действия. Одновременно с введением гепарина используют внутривенное капельное введение фибринолитических препаратов (фибринолизин, стрептокиназа и др.). При тромбоэмболии в системе легочной артерии, являющейся наиболее частой причиной развития острого легочного сердца, профилактика сводится к раннему выявлению и правильному лечению тромбофлебитов (см.), флеботромбозов (см.), своевременной активизации больных инфарктом миокарда, с нарушением мозгового кровообращения, послеоперационных и рациональному применению антикоагулянтов.
Хроническое легочное сердце Важным компонентом комплексной терапии легочного сердца является лечение основного заболевания. В периоде обострения воспалительного процесса в легких проводится антибактериальная терапия. При бронхоспастическом синдроме назначают бронхолитики, антигистаминные препараты, глюкокортикоиды. При наличии вязкой мокроты используют отхаркивающие и муколитические средства. С целью снижения давления в малом круге кровообращения используют эуфиллин, препараты раувольфии, ганглиблокаторы. Высокая терапевтическая эффективность эуфиллина у больных с легочным сердцем обусловлена его свойством снижать давление в системе легочной артерии, выраженным бронхолитическим эффектом, слабым кардиотоническим действием и способностью увеличивать почечный кровоток. Эуфиллин вводят в виде 2,4 %-ного раствора в дозе 5—10 мл внутривенно. Нежелательным эффектом эуфиллина является увеличение частоты сердечных сокращений. При развитии симптомов сердечной декомпенсации показано назначение сердечных гликозидов. Однако их применение у больных легочным сердцем часто малоэффективно и нередко сопровождается явлениями гликозидазной интоксикации. Эффективность действия сердечных гликозидов возрастает при сочетании их с мочегонными. Из диуретических препаратов предпочтение отдается антагонистам альдостерона (верошпирон, альдактон по 0,1–0,2 г 2–4 раза в день). Кроме того, применяют блокаторы карбангидразы (диакарб по 0,125—0,25 г 1 раз в день в течение нескольких дней), салуретики (фуросемид по 0,04—0,08 г 1 раз в день), производные птеридина (триамтерен по 0,05—0,1 г в сутки). Большое значение в комплексном лечении легочного сердца имеет кислородотерапия, а также вспомогательная искусственная вентиляция легких. Наиболее рационально применение увлажненного кислорода с содержанием его в дыхательной смеси не более 40–60 % с помощью носового катетера. Проводят повторные ингаляции длительностью 15–20 мин со скоростью 6–9 л/мин. Для стимуляции дыхательного центра применяют кордиамин через 2–3 ч, камфору. Комплексная терапиябольных легочным сердцем включает дыхательную гимнастику, массаж грудной клетки, ЛФК. Профилактика заключается в рациональном лечении острых и обострений хронических воспалительных процессов в легких.
ЛЕЙКЕМОИДНЫЕ РЕАКЦИИ
ОпределениеЛейкемоидные реакции — это обратимые, вторичные симптоматические изменения со стороны белой крови, характеризующиеся глубоким сдвигом лейкоцитарной формулы влево.Различают лейкемоидные реакции миелоидного типа, эозинофильного, лимфатического, моноцитарного, моноцитарно-лимфатического типов, а также вторичные эритроцитозы и реактивные тромбоцитозы. Под лейкемоидными реакциями понимают преходящие изменения в крови и кроветворных органах, напоминающие лейкозы и другие опухоли кроветворной системы, но всегда имеющие реактивный (преходящий) характер и не трансформирующиеся в ту опухоль, с которой они обнаруживают внешние черты сходства. Это патологическое состояние, при котором, несмотря на повышенное содержание лейкоцитов, с возможным сдвигом формулы не наблюдаются явления аплазии, метаплазии и гиперплазии кроветворных органов (недоразвития, измененного и увеличенного образования клеток крови).
Этиология и патогенез Лейкемоидные реакции наблюдаются чаще всего при бактериальных и вирусных инфекциях, различных пищевых, лекарственных и других интоксикациях, гипернефроме, метастатическом карциноматозе, раке, сепсисе, коллагенозах, при различных соматических заболеваниях. Лейкемоидные реакции миелоидного типа наблюдаются при различных инфекционных и неинфекционных процессах, септических состояниях, интоксикациях эндогенного и экзогенного происхождения, тяжелых травмах, остром гемолизе. В ряде случаев может развиться лейкемоидная реакция миелоидного типа с выраженной бластемией (образованием молодых клеток крови). Подобная реакция наблюдается у больных сепсисом, при хроническом легочном нагноении, при септическом эндокардите, туберкулезе, туляремии и др. В таких случаях приходится дифференцировать лейкемоидную реакцию с лейкозом (см.). Среди реакций миелоидного типа доминируют промиелоцитарные нейтрофильные реакции. Резкий промиелоцитарный сдвиг в пунктате костного мозга на фоне омоложения гранулоцитов крови может быть обусловлен токсикоинфекцией, аллергическими реакциями лекарственного происхождения, при выходе из иммунного агранулоцитоза. Лейкемоидные реакции эозинофильного типа определяются интенсивностью костномозгового эозинофилопоэза (образования эозинофилов), скоростью элиминации (выведения) эозинофилов из костного мозга и миграции их в ткань. Различают малую и умеренную эозинофилию периферической крови (10–15 % при нормальном и незначительном лейкоцитозе) и так называемую большую эозинофилию крови, достигающую высокой степени выраженности (до 80–90 % и сотен тысяч лейкоцитов). Эозинофилии являются реактивными состояниями, сопровождающими различные проявления аллергических диатезов, эндогенную сенсибилизацию паразитами, вирусами, лекарствами, пищевыми продуктами, при злокачественных опухолях. Реактивные (токсико-аллергические) эозинофилии наблюдаются особенно часто при так называемых тканевых стадиях гельминтозов (трихинеллезе, фасциолезе, стронгилоидозе, описторхозе, аскаридозе) и других паразитарных заболеваниях (лямблиозе, амебиазе и др.) как проявление неспецифического синдрома в результате аллергизации организма чаще в период гибели паразитов в тканях под влиянием терапии. Эозинофильные реакции возможны при лимфогранулематозе с поражением забрюшинных лимфоузлов, селезенки, тонкого кишечника, при этом высокая эозинофилия — прогностически неблагоприятный признак. Лейкемоидные реакции эозинофильного типа могут обнаруживаться при миокардитах, коллагенозах, бронхиальной астме, аллергических дерматитах, при эозинофильных инфильтратах легких. Лейкемоидные реакции моноцитарного типа наблюдаются при ревматизме, инфекционном мононуклеозе, саркоидозе, туберкулезе. Резкое увеличение количества зрелых моноцитов отмечают у больных дизентерией в период острых явлений и в период выздоровления. Кроме того, лейкемоидные реакции моноцитарного типа наблюдаются при болезни Вальденстрема, хроническом пиелонефрите.
Мазок крови при миелоидной лейкемии
Лейкемоидные реакции лимфатического и моноцитарно-лимфатического типов наиболее часто встречаются в детском возрасте при таких заболеваниях, как коревая краснуха, коклюш, ветряная оспа, скарлатина, инфекционный мононуклеоз и ряде аденовирусных инфекций. К лейкемоидным реакциям лимфатического типа относят и иммунобластные лимфоциты, отражающие иммунный процесс в лимфатических узлах, возникающий при действии антигена-аллергена. Вторичные эритроцитозы также рассматривают как лейкемоидные реакции. Причины развития вторичных эритроцитозов чаще всего связывают с повышенной продукцией в почках эритропоэтина как реакции на гипоксию (недостаток кислорода), развивающуюся при хронической дыхательной недостаточности, сердечной недостаточности, врожденных и приобретенных пороках сердца, болезнях крови. Эритроцитозы возникают при болезни и синдроме Иценко-Кушинга, при усиленной выработке андрогенов. Эритроцитозы при контузиях, стрессе, гипертоническом синдроме имеют центральный генез. Реактивные тромбоцитозы наблюдаются у некоторых больных со злокачественными образованиями, после спленэктомии (удаления селезенки) или атрофии селезенки, при гемолитических анемиях, ревматическом полиартите, атеросклерозе, хроническом гепатите.
Клиническая картина, диагностика и дифдиагностика Останавливаясь на общих закономерностях и особенностях развития отдельных видов лейкемоидных реакций, следует отметить их принципиальное отличие от лейкозов. Так, лейкемоидные реакции не являются самостоятельным заболеванием, в отличие от лейкоза (см.), а носят вторичный симптоматический характер, причем нередко очевидна причина, индуцировавшая развитие лейкемоидной реакции. Как правило, лейкемоидные реакции возникают вследствие воздействия на организм бактериальных, вирусных инфекций, чрезвычайных стрессорных раздражителей, а также разнообразных патогенных факторов бактериальной и небактериальной природы, вызывающих сенсибилизацию организма. С устранением действия основного причинного фактора возникает и быстрая нормализация состава периферической крови. Для лейкемоидной реакции не характерны признаки опухолевой прогрессии, свойственные лейкозам, в связи с чем при них не возникают анемии и тромбоцитонемии метапластического характера. Как и при лейкозах, на фоне развития лейкемоидной реакции возникает выраженное омоложение периферической крови, вплоть до появления бластных элементов, однако в большинстве случаев развития лейкемоидной реакции, за исключением бластомической формы лейкемоидной реакции, количество бластных элементов в периферической крови не превышает 1–2 %. В отличие от лейкоцитозов, лейкемоидные реакции характеризуются, как правило, более высоким содержанием лейкоцитов в периферической крови (исключение — цитопенические варианты лейкемоидной реакции) и более глубоким сдвигом в лейкоцитарной формуле до единичных бластных элементов (табл. 12).
Таблица 12. Дифференциально-диагностические признаки хронического миелолейкоза и лейкемоидной реакции миелоидного типа Признаки ∙ Хронический миелолейкоз ∙ Лейкемоидная реакция миелоидного типа П: Красная кровь Хм: Прогрессирующая анемия Лр: Изменения в зависимости от основного заболевания
П: Количество лейкоцитов Хм: Лейкоцитоз, гиперлейкоцитоз Лр: Лейкоцитоз не превышает 30–50 г/мл
П: Изменения в формуле крови Хм: Постепенно нарастающий сдвиг влево до миелобластов; базофильно-эозинофильная ассоциация Лр: Сдвиг влево до миелоцитов, изредка единичные промиелоциты, эозинофилы
П: Морфология клеточных элементов Хм: Анаплазия нейтрофилов. Токсическая зернистость отсутствует Лр: Не изменены. Токсическая зернистость, может быть пикноз
П: Тромбоциты Хм: Гипертромбоцитоз, сменяющийся тромбоцитопенией Лр: Не изменены
П: Щелочная фосфатаза Хм: Снижение или отсутствие Лр: Активность повышена
П: Течение Хм: Прогрессирующее Лр: Исчезает после основного заболевания
П: Содержание миелокарноцитов Хм: Значительно повышено (400–600 тыс. в 1 мм2) Лр: Нормально или слегка повышено
П: Соотношение молодых и зрелых форм Хм: Нарушение созревания на стадии миелоцитов и промиелоцитов Лр: Нарушений нет
Лейкемоидные реакции протекают с разной степенью лейкоцитоза, однако характер, клиника, течение и прогноз их не зависят от степени увеличения количества лейкоцитов. Различают фазу выраженной лейкемоидной реакции, спада и остаточных явлений. Миелоидные лейкемоидные реакции развиваются на фоне тяжелых инфекционных и других заболеваний с повышенной или высокой температурой, иногда может быть увеличение селезенки. Высокое содержание лейкоцитов в пределах или свыше 20 тыс., сдвиг формулы влево может быть регенераторным или дегенеративным. Регенераторный сдвиг характеризуется большим количеством в периферической крови палочкоядерных и юных форм. При дегенеративном сдвиге наряду с высоким процессом палочкоядерных форм, единичных юных, одновременно отмечаются: токсическая зернистость, пикноз, сморщивание, вакуолизация цитоплазмы, анизопойкилоцитоз (изменение формы и размеров) нейтрофилов. В костном мозге наблюдается резкое увеличение процента миело-промиелоцитов, а соотношение лейкоцитов и эритроцитов может достигать 20/1. Лейкемоидную реакцию миелоидного типа прежде всего следует дифференцировать с хроническим миелолейкозом. Эозинофильные лейкемоидные реакции возникают в разгар клинических проявлений (высокая температура, боли в мышцах, отеки лица, а иногда и всего тела, кожные высыпания, боли в животе). Эозинофильные лейкемоидные реакции миелоидного типа могут протекать как легко и обнаруживаться случайно, так и тяжело с явлениями анемии, высокой температуры и интоксикации. Большая эозинофилия наблюдается при эозинофильных инфильтратах органов, чаще всего легких. Могут быть подобные инфильтраты в желудке, печени, миокарде. Причиной их появления являются гельминты, вдыхание пыльцы разных растений, применение некоторых лекарственных веществ, погрешности в диете и т. д. Таким образом, эозинофильные инфильтраты являются полиэтиологическим синдромом с единым аллергическим механизмом развития. В большинстве случаев они отличаются летучестью, способны к быстрому исчезновению и характеризуются бедностью клинической симптоматики. Однако иногда наблюдаются длительно текущие инфильтраты по типу сливных пневмоний, нередко с сопутствующим плевритом. Эозинофильные миокардиты часто сопровождаются аллергическими проявлениями типа Квинке, сердечной недостаточностью, кардиалгией, увеличением числа лейкоцитов до 50 г/л, эозинофилов до 80 %. Высокая эозинофилия сопутствует узелковому периартриту, тяжелой форме лимфогранулематоза и наблюдается при злокачественном новообразовании печени, кишечника. В клинической практике иногда встречаются циклические лихорадочные состояния с небольшой лимфаденопатией, спленомегалией (увеличением селезенки), болями в мышцах, тахикардией, гипотонией, катаром верхних дыхательных путей, высоким лейкоцитозом (до 50 г/л) и эозинофилией (до 80 %). После исключения других известных причин это заболевание может быть отнесено к «инфекционному эозинофилезу». В костном мозге при этом выявляется значительная эозинофилия, но без омоложения клеточного состава.
ЛЕЙКОЗ
ОпределениеЛейкоз — опухолевое заболевание системы кровеобразования, при котором лейкемические изменения происходят на уровне стволовых полипотентных клеток или коммитированных уни- или бипотентных костномозговых клеток-предшественниц.Заболеваниями системы крови являются гемобластозы, являющиеся аналогом опухолевых процессов в других органах. Часть из них первично развивается в костном мозге и называется лейкозами. Другая часть первично возникает в лимфоидной ткани органов кроветворения и называется лимфомами или гематосаркомами. Классификация лейкозов основывается на структурных и функциональных особенностях лейкозных клеток, а также их способности к дифференциации (специализации). В связи с этим все лейкозы делятся на две основные группы — острые и хронические. При острых лейкозах опухолевой трансформации подвергаются недифференцированные или малодифференцированные клетки крови. В связи с резким угнетением дифференцировки клеток крови и преобладанием бластных (молодых) форм для всех острых лейкозов характерны выраженная анемия и тромбоцитопения, значительное снижение количества лейкоцитов в единице объема крови. При хронических лейкозах класс созревающих клеточных элементов подвергается опухолевой трансформации. Дифференциация клеток в значительной мере сохранена. Лейкоз — системное заболевание крови, характеризующееся следующими особенностями: — прогрессирующим клеточным переразвитием в органах кроветворения, а нередко и в крови с резким преобладанием пролиферативных процессов (с увеличением клеточной массы) над процессами нормальной дифференциации (созревания в соответствии со специализацией) клеток крови; — разрастанием различных патологических элементов, развивающихся из исходных клеток, составляющих морфологическую сущность того или иного типа лейкоза; — явлениями аплазии (неразвития), метаплазии (извращенного развития), метастазирования и возникновением очагов экстрамедуллярного (внекостномозгового) кроветворения; — закономерной сменой специализированных клеток, составляющих опухоль при хронических лейкозах и лимфоцитомах, бластными, определяющими развитие бластного лейкоза; — все лейкозные клетки представляют собой клон — потомство одной мутированной клетки — и несут все ее признаки (лейкозный клон); — всем лейкозным клеткам свойственна опухолевая прогрессия, возникающая в результате повышенной изменчивости их наследственного аппарата и приводящая к возрастанию количества клеток-клонов. В зависимости от количества лейкоцитов в крови различают следующие формы лейкозов: — лейкемические — количество лейкоцитов больше 50 тыс. в 1 мкл крови; — сублейкемические — количество лейкоцитов от 10 до 50 тыс. в 1 мкл крови; — алейкемические — количество лейкоцитов в 1 мкл крови соответствует норме; — лейкопенические — количество лейкоцитов менее 5 тыс. в 1 мкл крови. Под алейкемическим понимают такую форму лейкоза, которая характеризуется низким или нормальным содержанием лейкоцитов в крови и отсутствием сдвига в лейкограмме до незрелых патологических клеток, в то время как в костном мозге имеются клеточные изменения, типичные для лейкоза. Все острые лейкозы делятся на две большие группы: острые миелоидные, или нелимфобластные, и лимфобластные лейкозы. В соответствии с ФАБ-классификацией бластные клетки больных острым нелимфобластным лейкозом разделяются на 9 типов и обозначаются буквой М. Соответственно выделяют 9 вариантов острых нелимфобластных лейкозов: 1. М0 — миелобластный с минимальной дифференцировкой; 2. М1 — миелобластный без созревания; 3. М2 — миелобластный с созреванием; 4. М3 — промиелоцитарный; 5. М4 — миеломонобластный; 6. М5а — монобластный без созревания; 7. М5б — монобластный с созреванием; 8. М6 — эритромиелоз; 9. М7 — мегакариобластный. Острый недифференцированный лейкоз — М0 — бласты представляют собой самый ранний тип миелоидных лейкемических клеток. Они не имеют каких-либо отчетливых признаков морфологической дифференцировки. Острый миелобластный лейкоз с незрелыми миелобластами — М1 — бласты М1 по клеточному строению сходны с бластами М0. Острый миелобластный лейкоз со зрелыми бластами — М2 — миелобласты характеризуются средним или крупным размером. Острый промиелоцитарный лейкоз — М3 — лейкемические промиелоциты отличаются от миелобластов. Острый миеломонобластный лейкоз — М4 — в лейкемической популяции костного мозга, как правило, определяются два типа бластов: миелобласты (М1 или М2) и монобласты (М5а и М5б), каждый из которых имеет специфические морфоцитохимические и цитогенетические признаки.
Пунктат костного мозга при остром эритробластозе
Острый монобластный лейкоз — М5а и М5б — монобласты с созреванием и без созревания характеризуются большим размером. Признаком клеточной специализации для монобластов является форма ядер: М5а характеризуются округлыми, М5б — более зрелыми моноцитоидными ядрами. Острый эритробластоз (острый эритромиелоз) — М6 — характеризуется лейкемической пролиферацией клеток красного ряда. В большей части случаев наряду с бластами определяются созревающие эритроидные клетки. Их количество может широко варьировать. Острый мегакариобластный лейкоз — М7 — морфологически бласты имеют некоторые отличительные признаки: неправильные, отросчатые очертания цитоплазмы, выраженную базофильную окраску. Хронический лейкоз подразделяют на две подгруппы: миелоидные и лимфоидные (миело- и лимфопролиферативные) заболевания. Миелопролиферативные заболевания (основные заболевания миелоидной группы лейкозов): — хронический миелолейкоз; — сублейкемический миелоз (миелофиброз, остеомиелосклероз); — эритремия (истинная полицетемия); — хронический миеломоноцитарный лейкоз; — хронический моноцитарный лейкоз; — хронический мегакариоцитарный лейкоз (идиопатическая тромбоцитемия). К лимфопролиферативным заболеваниям относятся: — хронический лимфолейкоз; — плазмоцитома (миеломная болезнь) (см.); — лимфогранулематоз (см.); — неходжкинские лимфомы (см.). Хронический миелолейкоз — опухоль миелоидной ткани. Сублейкемический миелоз (миелофиброз, остеомиелофиброз) — опухоль миелоидной ткани, в основе которой лежит трехростковая пролиферация миелоидных элементов и соединительной ткани. При миелофиброзе опухолевая трансформация происходит на уровне стволовой кроветворной клетки или клетки-предшественницы миелопоэза. Эритремия (истинная полицитемия, болезнь Вакеза-Ослера) — клональная опухоль миелоидной ткани, субстратом которой преимущественно являются эритрокариоциты. Хронический моноцитарный лейкоз — опухоль миелоидной ткани. Заболевание имеет прогрессирующее течение. Хронический миеломоноцитарный лейкоз возникает в результате опухолевой трансформации. Хронический мегакариоцитарный лейкоз (идиопатическая, геморрагическая тромбоцитемия) — миелопролиферативное заболевание с преимущественным поражением мегакариоцитарного ростка. Ведущими симптомами являются увеличение количества тромбоцитов и переразвитие мегакариоцитов в костном мозге. Хронический лимфолейкоз представляет собой доброкачественную опухоль иммунокомпетентной ткани, основа которой — зрелые лимфоциты.
Этиология Лейкоз — многофакториальное заболевание. У каждого человека могут быть различные факторы, послужившие причиной заболевания. Выделяют четыре группы: 1-я группа — инфекционно-вирусные причины. Известно более ста бластомогенных вирусов, которые подразделяются на две большие группы: РНК-содержащие вирусы и ДНК-содержащие вирусы. К РНК-содержащим вирусам относятся вирусы лейкозов птиц, саркомы Рауса, миелобластоза, эритробластоза, вирусы лейкозов мышей, вирусы рака молочных желез мышей. Наиболее важными из ДНК-содержащих вирусов являются группы паповавирусов (объединенное название вирусов, вызывающих папилломы у человека, кроликов, собак; полиому у мышей), вирусы группы герпеса, группы оспы и др. Р. Хюбнером и Д. Тодаро предложена теория онкогенов, согласно которой в клетках человека и животных уже имеется геном онкогенного вируса, заблокированный и не проявляющий своей активности. При воздействии любых канцерогенов эта неактивная ДНК начинает функционировать как часть генома клетки, вызывая преобразование нормальной клетки в раковую. 2-я группа — наследственные факторы. Подтверждается наблюдением за лейкозными семьями, где один из родителей болен лейкозом. По статистике, есть или прямые, или через одно поколение передачи лейкоза. Отмечено, что различные формы острых и хронических лейкозов нередко встречаются у лиц с наследственными заболеваниями, сопровождающимися нарушениями и нестабильностью генотипа. В семьях с наследственными хромосомными дефектами, такими как трисомия по 21-й паре хромосом (синдром Дауна) (см.), нерасхождение половых хромосом (синдром Кланфельтера, синдром Тернера) (см.), спонтанные разрывы хромосом (синдром Блюма, синдром Фанкони и др.) (см.), отмечено заметное учащение случаев хронического миелолейкоза и острого эритромиелоза. Лейкозы нередко развиваются при наследственных болезнях, связанных с дефектами иммунитета. При синдромах Луи — Барра, Вискотта — Олдрича, Брутона наряду с дефектами клеточного и гуморального иммунитета наиболее часты лимфосаркомы, острые лимфобластные лейкозы. 3-я группа — действие химических лейкозогенных факторов: цитостатики при лечении онкозаболеваний приводят к лейкозу, антибиотики пенициллинового ряда и цефалоспорины (не следует злоупотреблять приемом этих лекарственных средств); химические вещества промышленного и бытового назначения (ковровые покрытия, линолеум, синтетические моющие средства и т. д.); 4-я группа — лучевое (ионизирующее) воздействие. При самых разнообразных формах лейкозов доказана возможность прямого участия радиационного повреждения хромосом в развитии опухоли, так как клетки, составляющие субстрат опухоли, имеют специфические радиационные повреждения — кольцевую хромосому.
Патогенез и патанатомия Лейкозы характеризуются системным прогрессирующим разрастанием лейкозных клеток сначала в костном мозге, селезенке и лимфатических узлах, затем они переселяются в другие органы и ткани, образуя лейкозные образования вокруг сосудов и в их стенках, в крови появляются лейкозные клетки. При лейкозах бластные клетки подавляют дифференциацию нормальной стволовой клетки. Лейкозные клетки, подобно всем опухолевым, характеризуются атипизмом разной степени выраженности. Применение хромосомного анализа позволило установить, что при любом лейкозе происходит расселение по организму клона опухолевых лейкозных клеток — потомков одной первоначально мутировавшей клетки. Группу острых лейкозов объединяет общий признак: субстрат опухоли составляют молодые, бластные клетки. Течение их злокачественное. Субстрат хронических лейкозов составляют зрелые клетки. Течение их относительно доброкачественное. При остром миелобластном лейкозе костный мозг становится красным, сероватым или приобретает зеленоватый оттенок. Селезенка, печень, лимфатические узлы увеличены. Некрозы в полости рта, зеве, миндалинах, желудке. В почках встречаются распространенные и очаговые опухолевые образования. В трети случаев развивается лейкемическая инфильтрация легких — лейкозный пневмонит, в четверти случаев — лейкозные инфильтрации оболочек мозга — лейкозный менингит. Обнаруживаются кровоизлияния в слизистых и серозных оболочках, внутренних органах. При остром лимфобластном лейкозе лейкемическая инфильтрация выражена наиболее резко в костном мозге, селезенке, лимфатических узлах, лимфатическом аппарате желудочно-кишечного тракта, почках, вилочковой железе. Костный мозг — малиново-красный, сочный. Селезенка резко увеличивается. Значительно увеличиваются лимфатические узлы средостения, брыжеечные. Вилочковая железа достигает гигантских размеров. Нередко лейкозное образование выходит за пределы вилочковой железы и прорастает ткани переднего средостения, сдавливает органы грудной полости. Хронический миелолейкоз развивается в результате злокачественной трансформации стволовой кроветворной клетки, сохраняющей способность к специализации и созреванию до зрелых клеточных элементов. Для хронического миелолейкоза свойственно первичное поражение костного мозга с постепенным нарастанием опухолевой массы, которое сопровождается увеличением количества лейкозных миелокариоцитов, замещением жирового костного мозга и инфильтрацией лейкозными клетками органов и тканей. Вытеснение нормальных ростков кроветворения, неэффективный эритропоэз (образование эритроцитов), появление аутоантител к эритрокариоцитам и тромбоцитам приводят к развитию анемии и тромбоцитопении. Большая опухолевая масса, особенно в период цитотаксической терапии, характеризуется быстрым увеличением ее размеров, что способствует развитию тяжелых осложнений. По мере прогрессирования заболевания в опухолевом клоне возникают дополнительные мутации, которые приводят к развитию новых клеток-клонов, обладающих высокой пролиферативной активностью. Появление их указывает на клональную эволюцию заболевания, переход его в конечную стадию. Опухолевые клетки теряют способность к созреванию. При этой форме заболевания костный мозг сочный, серо-красный, серо-желтый, содержит молодые и бластные клетки. В костях иногда остеосклероз. Кровь серо-красная, органы малокровные, селезенка резко увеличена, иногда занимает почти всю брюшную полость. Масса ее достигает 6–8 кг. Печень увеличена до 5–6 кг. Лимфатические узлы значительно увеличены. Лейкозные клетки образуют тромбы в кровеносных сосудах, проникают в сосудистую стенку. В связи с этим нередки инфаркты, кровоизлияния. Довольно часто бывает аутоинфекция. Сублейкемический миелоз характеризуется нарушением костномозгового кроветворения. Развитие миелофиброза происходит в различных костях скелета и распространяется на все кости. При этом развиваются лейкоцитоз и тромбоцитоз. Анемия при миелофиброзе является следствием неэффективного образования эритроцитов и их аутоиммунного распада, редукции эритропоэза или недостаточности костномозгового кроветворения. Иногда отмечается активация эритропоэза. Сублейкемический (алейкемический) характер лейкоза объясняют нарушением координации между костной и кроветворной тканью и элиминацией (выведением) лейкоцитов на периферию вследствие развития фиброза. Помимо лейкозной трансформации кроветворной ткани, заболевание характеризуется наличием лейкозной инфильтрации в других органах и в первую очередь в селезенке, а также в лимфатических узлах и печени, дисплазией (нарушением образования) костной ткани в виде патологического костеобразования. Увеличение кроветворных органов происходит не только в результате миелоидной метаплазии (нарушения образования клеток костного мозга), но и вследствие разрастания в них соединительной ткани. При эритремии в костном мозге наблюдается полная гиперплазия (увеличение образования) трех ростков миелопоэза, преимущественно эритрокариоцитов. Клеточные элементы сохраняют способность к специализации и созреванию. Накопление опухолевой массы приводит к увеличению количества эритроцитов как в сосудистом русле, так и в синусах костного мозга, селезенке и других органах, вызывает нарушение реологии (движения тока) крови и как следствие кислородной недостаточности тканей и тромботические осложнения. Эритремии свойственна определенная стадийность процесса. В результате несостоятельности костномозгового кроветворения болезнь сопровождается резкими структурными изменениями. Все органы резко полнокровны. Часто в артериях и венах образуются тромбы. Желтый костный мозг трубчатых костей становится красным. Резко увеличивается селезенка. Возникает увеличение миокарда, особенно левого желудочка. Хронический моноцитарный лейкоз развивается в результате опухолевой трансформации и проявляется разрастанием моноцитоидных клеточных элементов в костном мозге, увеличением их содержания в крови и инфильтрацией ими селезенки и печени. Хронический миеломоноцитарный лейкоз возникает в результате опухолевой трансформации. Механизмы развития опухоли, в основе своей свойственные всем лейкозам, приводят к подавлению эритрои тромбоцитопоэза, к недостаточности костномозгового кроветворения. Хронический лимфолейкоз — это доброкачественная опухоль лимфатической ткани. Клетки опухоли составляют преимущественно зрелые лимфоциты. Увеличивается количество лимфоцитов в лимфатических узлах, селезенке, печени. Костный мозг красного цвета с участками желтого. Лимфатические узлы всех областей тела резко увеличены, сливаются в огромные мягкие или плотноватые пакеты. Увеличиваются размеры миндалин, лимфатические фолликулы кишечника. Печень, почки и селезенка увеличены. Лейкемическая инфильтрация отмечается во многих органах средостения, брыжейке, миокарде, серозных и слизистых оболочках. Парапротеинемические лейкозы. В группу парапротеинемических лейкозов входят опухоли из В-лимфоцитов: — миеломная болезнь; — первичная макроглобулинемия (болезнь Вандельстрема); — болезнь тяжелых цепей (болезнь Франклина). Опухолевые клетки синтезируют однородные иммуноглобулины или их фрагменты, так называемые патологические иммуноглобулины. Наибольшее значение имеет миеломная болезнь. Наиболее часто миеломная болезнь развивается в возрасте 45–60 лет. Одинаково часто болеют мужчины и женщины. В селезенке, печени, почках, легких, лимфатических узлах отмечаются миеломные метастазы. В почках развивается нефроз, склероз. Отмечается отек миокарда, легких. В легких и почках обнаруживаются воспалительные изменения в виде пневмонии и пиелонефрита. В органах откладывается известь, а также измененный белок — амилоид.
Клиническая картина Острый лейкоз В течении острого лейкоза выделяется несколько стадий: — начальная; — развернутая; — ремиссия (полная или неполная); — рецидив; — терминальная (конечная). Первичный период лейкоза (скрытый период — время от момента действия фактора, вызвавшего лейкоз, до первых признаков заболевания). Этот период может быть коротким (несколько месяцев), а может быть длительным (десятки лет). Происходит размножение лейкозных клеток от первой, единственной, до такого количества, которое вызывает угнетение нормального кроветворения. Клинические проявления зависят от скорости размножения лейкозных клеток. Начальная стадия характеризуется значительным многообразием клинических симптомов. Со стороны красной крови существенных изменений не отмечается, реже встречается анемия. Со стороны белой крови могут наблюдаться лейкопения или лейкоцитоз (снижение уровня лейкоцитов или повышение), небольшой процент незрелых форм, а в некоторых случаях — тенденция к снижению числа тромбоцитов. Более важное диагностическое значение на ранних этапах развития лейкоза имеет исследование костномозгового пунктата, так как в нем обнаруживается повышенное содержание бластных клеток. Начальная стадия острого лейкоза диагностируется чаще всего тогда, когда у больных с предшествующей анемией в дальнейшем развивается картина острого лейкоза. Вторичный период (период развернутой клинической картины заболевания). Первые признаки чаще выявляются лабораторно. Развернутая стадия характеризуется наличием основных клинических проявлений заболевания: угнетением нормального кроветворения, высоким бластозом (омоложением) костного мозга и появлением в крови незрелых патологических форм. Возможны следующие ситуации: — самочувствие больного не страдает, отсутствуют жалобы, но в крови отмечаются признаки (проявление) лейкоза; — есть жалобы, но в клетках крови нет выраженных патологических изменений. Лейкоз характерных клинических признаков не имеет, они могут быть любыми. В зависимости от угнетения кроветворения симптомы проявляются по-разному. Все клинические проявления делятся на 3 группы синдромов: — инфекционно-токсический синдром — проявляется в виде различных воспалительных процессов; — геморрагический синдром — проявляется повышенной кровоточивостью и возможностью кровоизлияний и кровопотери; — анемический синдром — проявляется уменьшением содержания гемоглобина, эритроцитов. Появляются бледность кожи, слизистых, быстрая утомляемость, одышка, головокружение, снижение сердечной деятельности. Ремиссия может быть полной или неполной. К полной ремиссии относятся состояния, при которых отсутствуют клинические симптомы заболевания, количество бластных клеток в костном мозге не превышает 5 % при отсутствии их в крови. При неполной ремиссии имеет место отчетливое клиническое и гематологическое улучшение, однако количество бластных клеток в костном мозге остается повышенным. Рецидив острого лейкоза может возникать в костном мозге или вне костного мозга (кожа и т. д.). Каждый последующий рецидив прогностически более опасен, чем предыдущий. Терминальная стадия острого лейкоза характеризуется устойчивостью к цитостатической терапии, выраженным угнетением нормального кроветворения, развитием язвенно-некротических процессов В клиническом течении всех форм значительно больше общих «остролейкозных» черт, чем различий и особенностей, но дифференциация острого лейкоза важна для прогнозирования и выбора средств цитостатической терапии. Клиническая симптоматика очень разнообразна и зависит от локализации и массивности лейкемической инфильтрации и от признаков подавления нормального кроветворения (анемия, гранулоцитопения, тромбоцитопения). Первые проявления заболевания носят общий характер: слабость, снижение аппетита, потливость, недомогание, повышение температуры неправильного типа, боли в суставах, появление небольших синяков после мелких травм. Болезнь может начинаться остро — с катаральных изменений в носоглотке, ангины. Иногда острый лейкоз выявляется при случайном исследовании крови. В развернутой стадии заболевания в клинической картине можно выделить несколько синдромов: анемический синдром, геморрагический синдром, инфекционные и язвенно-некротические осложнения.
Специфическое поражение при остром лейкозе
Анемический синдром проявляется слабостью, головокружением, болями в области сердца, одышкой. Отмечается бледность кожных покровов и слизистых оболочек. Выраженность анемии различна и определяется степенью угнетения эритропоэза, наличием гемолиза (распада эритроцитов), кровотечений и прочее. Геморрагический синдром встречается практически у всех больных. Обычно наблюдаются десневые, носовые, маточные кровотечения, кровоизлияния на коже и слизистых оболочках. В местах уколов и внутривенных инъекций возникают обширные кровоизлияния. В конечной стадии на месте кровоизлияний в слизистой оболочке желудка, кишечника появляются язвенно-некротические изменения. Наиболее выраженный геморрагический синдром наблюдается при промиелоцитарном лейкозе. Инфекционные и язвенно-некротические осложнения встречаются более чем у половины больных острым лейкозом. Часто возникают пневмонии, ангины, инфекции мочевыводящих путей, абсцессы в местах инъекций. Температура может быть различной — от слегка повышенной до постоянно высокой. Значительное увеличение лимфатических узлов у взрослых встречается редко, у детей — довольно часто. Особенно характерны лимфаденопатии для лимфобластного лейкоза. Чаще увеличиваются лимфоузлы в надключичных и подчелюстных областях. При прощупывании лимфатические узлы плотные, безболезненные, могут быть слегка болезненны при быстром росте. Увеличение печени и селезенки не всегда наблюдается, преимущественно при лимфобластном лейкозе. Нередко анемия является первым проявлением лейкоза. Число лейкоцитов обычно повышено, но не достигает таких высоких цифр, как при хронических лейкозах. Формы острого лейкоза с высоким лейкоцитозом прогностически менее благоприятны. Наблюдаются формы лейкоза, которые с самого начала характеризуются лейкопенией (снижением количества лейкоцитов в крови). Полная бластная гиперплазия (полное омоложение клеток крови) при этом наступает лишь в конечной стадии болезни. Для всех форм острого лейкоза характерно снижение количества тромбоцитов до 15–30 г/л. Особенно выраженная тромбоцитопения наблюдается в конечной стадии. В лейкоцитарной формуле в основном обнаруживаются бластные клетки (до 90 % всех клеток) и незначительное количество зрелых элементов. Выход в периферическую кровь бластных клеток является основным морфологическим признаком острого лейкоза. Для дифференциации форм лейкоза, кроме морфологических признаков, используют цитохимические исследования. Острый промиелоцитарный лейкоз характеризуется чрезвычайной злокачественностью процесса, быстрым нарастанием тяжелой интоксикации, выраженным геморрагическим синдромом, приводящим к кровоизлиянию в мозг и к гибели больного. Острый миелобластный лейкоз характеризуется прогрессирующим течением, выраженной интоксикацией и лихорадкой, тяжелой анемией, умеренной интенсивностью геморрагических проявлений (склонностью к кровоточивости), частных язвенно-некротических поражений слизистых и кожи. Острый лимфомонобластный лейкоз является подвариантом острого миелобластного лейкоза. По клинической картине они почти идентичны, однако миеломонобластная форма протекает злокачественней, с более выраженной интоксикацией, глубокой анемией, тромбоцитопенией, более выраженным геморрагическим синдромом, частыми некрозами слизистых и кожи, переразвитием десен и миндалин. В крови выявляются бластные клетки — крупные, неправильной формы. При исследовании в клетках определяется положительная реакция на пероксидазу, гликоген и липиды. Характерным признаком является положительная реакция на неспецифическую эстеразу в клетках и лизоцим в сыворотке и моче. Средняя продолжительность жизни больных вдвое меньше, чем при миелобластном лейкозе. Причиной смерти обычно являются инфекционные осложнения. Острый монобластный лейкоз — редкая форма лейкоза. Клиническая картина напоминает острый миелобластный лейкоз и характеризуется наклонностью к кровотечениям и развитием анемии, увеличением лимфатических узлов, увеличением печени, язвенно-некротическим стоматитом. Отмечаются анемия, тромбоцитопения, повышенный уровень лейкоцитов. Появляются молодые бластные клетки. При исследовании в клетках определяется слабоположительная реакция на липиды и высокая активность неспецифической эстеразы. Лечение редко вызывает клинико-гематологические ремиссии. Острый лимфобластный лейкоз чаще встречается у детей и у лиц молодого возраста. Характеризуется увеличением какой-либо группы лимфоузлов, селезенки. Самочувствие больных не страдает, интоксикация выражена умеренно, анемия незначительная. Геморрагический синдром часто отсутствует. Больные жалуются на боли в костях. Острый лимфобластный лейкоз отличается частотой неврологических проявлений (нейролейкемия). При цитохимическом исследовании: реакция на пероксидазу всегда отрицательная, липиды отсутствуют, гликоген в виде крупных гранул. Отличительной чертой лимфобластного острого лейкоза является положительный ответ на применяемую терапию. Частота ремиссии — от 50 до 90 %. Ремиссия достигается применением комплекса цитостатических средств. Рецидив болезни может проявляться нейролейкемией, инфильтрацией нервных корешков, костномозговой ткани. Каждый последующий рецидив имеет худший прогноз и течет более злокачественно, чем предыдущий. У взрослых заболевание протекает тяжелее, чем у детей. Эритромиелоз характеризуется тем, что патологическая трансформация кроветворения касается как белого, так и красного ростков костного мозга. В костном мозге обнаруживаются молодые недифференцированные клетки белого ростка и бластные анаплазированные (молодые недоразвившиеся) клетки красного ростка — эритро- и нормобласты в большом количестве. Красные клетки больших размеров имеют уродливый вид. Отмечаются стойкая анемия, анизоцитоз эритроцитов (изменение размеров), пойкилоцитоз (изменение формы), полихромазия и гиперхромия. Часто отмечается лейкопения, но может быть умеренное увеличение лейкоцитов до 20–30 г/л. По мере развития болезни появляются бластные формы — монобласты. Лимфаденопатии не наблюдается, печень и селезенка могут быть увеличены или оставаться в норме. Заболевание протекает более длительно, чем миелобластная форма, в некоторых случаях отмечается подострое течение эритромиелоза (до двух лет без лечения). Начало лейкозов протекает бессимптомно. Больные чувствуют себя здоровыми вплоть до повсеместного расселения опухолевых клеток по кроветворной системе. Вследствие угнетения нормального кроветворения обычно развиваются инфекции, вплоть до септического заболевания, появляется кровоточивость из-за снижения числа тромбоцитов. Отмечается слабость, утомляемость, сердцебиение и одышка в связи с анемией. Больные умирают от кровоизлияния в мозг, желудочно-кишечных кровотечений, язвенно-некротических осложнений, сепсиса. Для острого миелобластного и монобластного лейкозов характерен подъем температуры до высоких значений. Селезенка увеличена умеренно. Печень обычно непрощупывается. Наиболее часто лейкозная инфильтрация бывает в селезенке, печени, мозговых оболочках, коже, яичках, легких, почках. В 25 % случаев встречается лейкозный менингит с соответствующей симптоматикой. Лейкозный пневмонит характеризуется появлением сухого кашля, хрипов в легких. На поздних этапах болезни в коже появляются множественные лейкемиды кожи — очаги лейкозной инфильтрации. Кожа над их поверхностью становится розовой или светлокоричневой. Печень увеличена, безболезненна при прощупывании, край становится плотным. Лейкозная инфильтрация почек иногда приводит к почечной недостаточности, вплоть до отсутствия мочевыделения. В результате цитостатической терапии значительно учащаются случаи некротического поражения слизистой оболочки кишечника. Вначале появляется небольшое вздутие живота, урчание при прощупывании, кашицеобразный стул. Затем возникают сильные боли в животе, симптомы раздражения брюшины. При прободении язвы кишечника боль постоянная, сильная. При лимфобластном лейкозе типично увеличение лимфатических узлов и селезенки. Лимфатические узлы плотноваты, обычно локализуются в надключичной области, вначале с одной стороны, затем с другой. Обычно они безболезненны. От места локализации этих узлов зависит симптоматика. Если лимфатические узлы увеличены в средостении, то возникает сухой кашель, одышка. Увеличение кишечных узлов вызывает боли в животе. Часто больные жалуются на боли в голени, повышенную температуру. Часто поражаются яички, обычно на одной стороне. Яичко становится плотным, увеличивается. Острый эритромиелобластный лейкоз в большинстве случаев начинается с анемического синдрома. Другие формы лейкозов лишены какой-либо специфики. Для острого лейкоза типична триада признаков: лейкоцитоз, появление большого числа бластных клеток и лейкемический провал (в периферической крови присутствуют бласты и зрелые клетки белой крови без промежуточных стадий созревания). В начале острого лейкоза может отмечаться анемия. Количество тромбоцитов снижено или нормально. При остром лейкозе костный мозг содержит десятки процентов бластных клеток. Основным диагностическим признаком является однообразная картина костномозгового кроветворения. По мере прогрессирования острого лейкоза лейкозные клетки становятся более уродливыми. Начальный период длится 2–3 недели, иногда несколько месяцев. Период выраженных клинических явлений — несколько недель — месяцев, конечный период, характеризующийся скачкообразным усилением всех симптомов и повышением температуры, — 1–2 недели. В отдельных случаях при подостром течении болезнь продолжается до 1–2 лет. При правильно подобранной терапии общая продолжительность жизни больных может достигать 26 месяцев, иногда до 3 лет и более.
Хронические лейкозы Хронический миелоидный лейкоз (хронический миелоз) протекает в две стадии. Первая стадия — доброкачественная, занимает несколько лет, характеризуется увеличением селезенки. Вторая стадия — злокачественная, длится 3–6 месяцев. Селезенка, печень, лимфатические узлы увеличены, появляются лейкозные инфильтрации кожи, нервных стволов, мозговых оболочек.
Развивается геморрагический синдром.
Часто регистрируются инфекционные заболевания. Типичны признаки интоксикации — слабость, потливость. Иногда первым симптомом является небольшая боль, тяжесть в левом подреберье, что связано с увеличением селезенки, в последующем бывают инфаркты селезенки. Без видимой причины поднимается температура, появляются боли в костях. Специфическое поражение кожи при хроническом миелозе В типичном случае характерен нейтрофильный лейкоцитоз (повышение уровня нейтрофильных лейкоцитов) с появлением молодых форм нейтрофилов, сопровождающийся увеличением количества тромбоцитов, уменьшением лимфоцитов. По мере развития болезни нарастают анемия и тромбоцитопения. У детей чаще наблюдается ювенильная форма хронического миелолейкоза без увеличения количества тромбоцитов, но с повышенным количеством моноцитов. Часто увеличивается число базофилов, имеет место повышенный уровень эозинофилов. В первую доброкачественную стадию клетки костного мозга по всем параметрам соответствуют норме. Во вторую стадию в костном мозге и крови появляются бластные формы, отмечается быстрый рост числа лейкоцитов в крови (до нескольких миллионов в одном мкл). Характерными признаками конечной стадии являются обнаружение в крови осколков ядер мегакариоцитов, угнетение нормального кроветворения. Болезнь протекает хронически с периодами обострения и ремиссиями. Средняя продолжительность жизни 3–5 лет, но известны отдельные случаи длительного течения хронического миелолейкоза до 10–20 лет. Клиническая картина зависит от стадии заболевания. Выделяют 3 стадии хронического миелолейкоза — начальную, развернутую и терминальную (конечную). В начальной стадии хронический миелолейкоз практически не диагностируется или выявляется при случайном исследовании крови, поскольку симптоматика в этот период почти отсутствует. Обращает на себя внимание постоянное и немотивированное повышение лейкоцитов. Увеличивается селезенка, что вызывает неприятные ощущения в левом подреберье, чувство тяжести, особенно после еды. Важным гематологическим признаком является увеличение количества базофилов и эозинофилов различной зрелости. Анемия в этот период не наблюдается. Отмечается тромбоцитоз до 600—1500 г/л. Практически эту стадию выделить не удается. Болезнь, как правило, диагностируется на стадии полного распространения опухоли по костному мозгу, т. е. в развернутой стадии. Развернутая стадия характеризуется появлением клинических признаков заболевания, связанных с лейкемическим процессом. Больные отмечают быструю утомляемость, потливость, повышенную температуру, потерю веса. Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. При объективном исследовании почти постоянным признаком в этот период является увеличение селезенки, достигающей в ряде случаев значительных размеров. При прощупывании селезенка остается безболезненной. У половины больных развиваются инфаркты селезенки, проявляющиеся острыми болями в левом подреберье со смещением в левый бок, левое плечо, усиливающимися при глубоком вдохе. Печень также увеличена, однако ее размеры индивидуально вариабельны. Функциональные нарушения печени выражены незначительно. Гепатит проявляется расстройствами пищеварения, желтухой, увеличением размеров печени, повышением прямого билирубина в крови. Лимфаденопатия в развернутой стадии хронического миелолейкоза наблюдается редко, геморрагический синдром отсутствует. Могут наблюдаться нарушения со стороны сердечно-сосудистой системы (боли в сердце, аритмия). Эти изменения обусловлены интоксикацией организма, нарастающей анемией. В лейкоцитарной формуле представлен весь гранулоцитарный ряд — до миелобластов. Количество лейкоцитов достигает 250–500 г/л. Продолжительность этой стадии без цитостатической терапии составляет 1,5–2,5 года. Клиническая картина при лечении заметно изменяется. Самочувствие больных длительно остается удовлетворительным, сохраняется работоспособность, количество лейкоцитов — 10–20 г/л, прогрессирующего увеличения селезенки не наблюдается. Развернутая стадия у больных, принимающих цитостатики, длится 4–5 лет, а иногда и больше. В терминальной стадии отмечается резкое ухудшение общего состояния, усиление потливости, стойкое немотивированное повышение температуры. Появляются сильные боли в костях и суставах. Важным признаком является появление нечувствительности к проводимой терапии. Значительно увеличена селезенка. Нарастает анемия, тромбоцитопения. При умеренном повышении количества лейкоцитов формула омолаживается за счет увеличения процента незрелых клеток (промиелоцитов, миелобластов и недифференцируемых). Геморрагический синдром, отсутствовавший в развернутой стадии, почти постоянно появляется в терминальном периоде. Опухолевый процесс в терминальной стадии начинает распространяться за пределы костного мозга: возникает лейкемическая инфильтрация нервных корешков, вызывающая радикулярные боли, образуются подкожные лейкемические инфильтраты (лейкемиды), наблюдается саркомный рост в лимфоузлах. Лейкемическая инфильтрация на слизистых оболочках способствует развитию в них кровоизлияний с последующим некрозом. В терминальной стадии больные склонны к развитию инфекционных осложнений, которые нередко являются причиной смерти. Доброкачественный сублейкемический миелоз представляет собой самостоятельную форму среди опухолей кроветворной системы. Субстрат опухоли составляют зрелые клетки одного, двух или всех трех ростков костного мозга — гранулоциты, тромбоциты, реже эритроциты. В костном мозге развивается гиперплазия (увеличение образования) миелоидной ткани (миелоз), разрастается соединительная ткань (миелофиброз), отмечается новообразование патологической костной ткани (остеомиелосклероз). Разрастание в костном мозге соединительной ткани носит реактивный характер. Постепенно развитие миелофиброза приводит в терминальную стадию заболевания к замещению всего костного мозга рубцовой соединительной тканью. Эритремия (болезнь Вакеза, истинная полицитемия) — хронический лейкоз, относится к группе доброкачественных опухолей системы крови. Наблюдается опухолевая пролиферация всех ростков кроветворения, особенно эритроидного ростка, что сопровождается повышением числа эритроцитов в крови (в некоторых случаях лейкоцитов и тромбоцитов), гемоглобина, массы и вязкости циркулирующей крови, повышением свертывания крови. Увеличение массы эритроцитов в кровяном русле и сосудистых депо обусловливает особенности клинической симптоматики, течение и осложнения заболевания. Эритремия встречается преимущественно в пожилом возрасте. Выделяют 3 стадии течения заболевания: начальная, развернутая (эритремическая) и терминальная. В начальной стадии больные обычно жалуются на тяжесть в голове, шум в ушах, головокружение, повышенную утомляемость, снижение умственной работоспособности, зябкость конечностей, нарушение сна. Внешние характерные признаки могут отсутствовать. Развернутая стадия характеризуется более яркой клинической симптоматикой. Наиболее частым и характерным признаком являются головные боли, носящие иногда характер мучительных мигреней с нарушением зрения. Многие больные жалуются на боли в области сердца, иногда типа стенокардии, боли в костях, в подложечной области, похудение, нарушение зрения и слуха, неустойчивое настроение, слезливость. Частым симптомом эритремии является кожный зуд. Могут быть приступообразные боли в кончиках пальцев рук и ног. Боли при этом сопровождаются покраснением участков кожи. При осмотре обращает на себя внимание типичная красно-синюшная окраска кожи с преобладанием темно-вишневого тона. Отмечается также краснота слизистых оболочек (конъюнктив, языка, мягкого неба). В связи с частыми тромбозами конечностей наблюдается потемнение кожи голеней, иногда — трофические язвы. Многие больные жалуются на кровоточивость десен, кровотечения после удаления зубов, синяки на коже. У 80 % больных отмечается увеличение селезенки: в развернутой стадии она увеличена умеренно, в терминальной часто наблюдается выраженная увеличенная селезенка. Обычно увеличена печень. Часто у больных эритремией выявляется повышение артериального давления. Гипертония при эритремии характеризуется более выраженной церебральной симптоматикой. Как результат нарушения питания слизистой оболочки и тромбозов сосудов могут возникнуть язвы двенадцатиперстной кишки и желудка. Важное место в клинической картине заболевания занимают тромбозы сосудов. Обычно наблюдаются тромбозы мозговых и коронарных артерий, а также сосудов нижних конечностей. Наряду с тромбозами, больные эритремией склонны к развитию геморрагий (кровоизлияний). В терминальной стадии клиническая картина определяется исходом заболевания — циррозом печени, коронаротромбозом, очагами размягчения в головном мозге на почве тромбозов мозговых сосудов и кровоизлияний, миелофиброзом, сопровождающимся анемией, хроническим миелолейкозом и острым лейкозом. В начальной стадии заболевания может наблюдаться лишь умеренный эритроцитоз. Характерным признаком развернутой стадии эритремии является увеличение в крови количества эритроцитов, лейкоцитов, тромбоцитов (панцитоз). Наиболее типичным для эритремии является увеличение количества эритроцитов до 6–7 г/л и гемоглобина до 180–220 г/л. Параллельно увеличению эритроцитов и гемоглобина отмечается повышение показателя гематокрита. Увеличение густой части крови и ее вязкости приводит к резкому снижению СОЭ вплоть до полного отсутствия оседания эритроцитов. Количество лейкоцитов увеличено незначительно — до 15–18 г/л. В формуле выявляется нейтрофилез (увеличение нейтрофилов в крови), реже появляются метамиелоциты и миелоциты. Число тромбоцитов увеличено до 1000 г/л. Постоянно обнаруживается альбуминурия (увеличение выделения альбумина с мочой), иногда гематурия. В терминальной стадии картина крови зависит от исхода эритремии. При переходе в миелофиброз или миелолейкоз нарастает количество лейкоцитов, появляются нормоциты, количество эритроцитов снижается. В случае развития острого лейкоза в крови выявляются бластные клетки, постоянно встречаются анемия, тромбоцитопения. В костном мозге у больных развернутой стадией эритремии типичным признаком является гиперплазия (увеличение образования всех 3 ростков (панмиелоз) с выраженным мегакариоцитозом. В терминальной стадии наблюдается миелофиброз при сохраняющемся мегакариоцитозе.
Хронические лейкозы лимфоцитарного происхождения Выделяют следующие формы: — хронический лимфолейкоз; — лимфоматоз кожи (болезнь Сезари); — парапротеинемические лейкозы. Хронический лимфолейкоз представляет собой доброкачественное опухолевое заболевание лимфоидной (иммунокомпетентной) ткани, при этом, в отличие от других форм лейкозов, не обнаруживается опухолевой прогрессии на всем протяжении болезни. Основным морфологическим субстратом опухоли являются зрелые лимфоциты, которые разрастаются и накапливаются в повышенном количестве в лимфатических узлах, селезенке, печени, костном мозге. Среди всех лейкозов хронический лимфолейкоз занимает особое место. Несмотря на морфологическую зрелость лимфоцитов, функционально они неполноценны, что выражается в снижении иммуноглобулинов. Поражение иммунокомпетентной системы обусловливает склонность больных к инфекциям и развитие аутоиммунных анемий, тромбоцитопений, реже — гранулоцитопений. Заболевание встречается преимущественно в пожилом возрасте, чаще у мужчин, нередко встречается у кровных родственников.
Пакет увеличенных лимфатических узлов брыжейки при лимфатическом лейкозе
Мазок крови при лимфатическом лейкозе. Значительное увеличение количества лимфоцитов
Болезнь начинается исподволь без выраженной клинической симптоматики. Часто диагноз ставится впервые при случайном исследовании крови, выявляется повышение количества лейкоцитов, наличие лимфоцитоза. Постепенно появляются слабость, повышенная утомляемость, потливость, похудение. Отмечается увеличение периферических лимфатических узлов, преимущественно в шейной, подмышечной и паховых областях. Впоследствии поражаются медиастинальные (средостенные) и забрюшинные лимфатические узлы. При прощупывании определяются периферические лимфоузлы мягкой или тестоватой консистенции, не спаянные между собой и кожей, безболезненные. Селезенка значительно увеличена, плотная, безболезненная. Печень чаще всего увеличена. Со стороны желудочно-кишечного тракта отмечаются поносы. Геморрагический синдром при типичной неосложненной форме отсутствует. Значительно чаще, чем при других формах лейкозов, встречаются поражения кожи. Кожные изменения могут носить специфический и неспецифический характер. К неспецифическим относятся экзема, эритродермия, псориатические высыпания, пузырчатка, к специфическим — лейкемическая инфильтрация сосочкового и подсосочкового слоев дермы. Инфильтрация кожи может быть очаговой или распространенной. Одной из клинических особенностей хронического лимфолейкоза является пониженная устойчивость больных к бактериальным инфекциям. Среди наиболее частых инфекционных осложнений регистрируются пневмонии, инфекции мочевыводящих путей, ангины, абсцессы, септическое состояние. Тяжелым осложнением заболевания являются аутоиммунные процессы, связанные с появлением антител против антигенов собственных клеток крови. Чаще всего возникает аутоиммунная гемолитическая анемия. Клинически этот процесс проявляется ухудшением общего состояния, повышением температуры тела, появлением легкой желтухи, снижением гемоглобина. Могут наблюдаться аутоиммунные тромбоцитопении, сопровождающиеся геморрагическим синдромом. Реже встречается аутоиммунный лизис лейкоцитов (разрушение лейкоцитов в результате аутоиммунных реакций). Хронический лимфолейкоз может трансформироваться в гематосаркому — постепенное превращение увеличенных лимфатических узлов в плотную опухоль с выраженным болевым синдромом, резким ухудшением общего состояния. Выделяют несколько форм хронического лимфолейкоза: — типичная доброкачественная форма заболевания с распространенным увеличением лимфоузлов, умеренным увеличением печени и селезенки, лейкемической картиной крови, отсутствием анемии, редкими инфекционными и аутоиммунными нарушениями. Эта форма встречается наиболее часто и характеризуется длительным и благоприятным течением; — злокачественный вариант, отличающийся тяжелым течением, наличием плотных лимфоузлов, образующих конгломераты, высоким лейкоцитозом, угнетением нормального кроветворения, частыми инфекционными осложнениями; — спленомегалическая форма, протекающая часто без периферических лимфаденопатий, нередко с увеличением брюшных лимфоузлов. Число лейкоцитов в пределах нормы или слегка снижено. Характерна быстро нарастающая анемия; — костномозговая форма с изолированным поражением костного мозга, лейкемической картиной крови, отсутствием увеличения лимфоузлов и селезенки. Нередко развивается анемия, тромбоцитопения с геморрагическим синдромом; — кожная форма (синдром Сезари) протекает с преимущественной лейкемической инфильтрацией кожи; — формы с изолированным увеличением отдельных групп лимфоузлов и наличием соответствующей клинической симптоматики. Изменения со стороны периферической крови характеризуются высоким лейкоцитозом — до 20–50 и 100 г/л. Иногда количество лейкоцитов повышено незначительно. Лимфоциты составляют 60–90 % всех форменных элементов. В случае трансформации хронического лимфолейкоза в гемосаркому отмечается смена лимфоцитоза нейтрофилезом. Содержание эритроцитов и тромбоцитов при отсутствии аутоиммунных осложнений существенно не меняется. В случае развития аутоиммунного гемолиза наблюдаются нормохромная анемия, ретикулоцитоз, СОЭ увеличена. В миелограмме больных хроническим лимфолейкозом выявляется резкое увеличение процента зрелых лимфоцитов вплоть до полной метаплазии (нарушение образования) костного мозга лимфоцитами. В сыворотке крови отмечается снижение содержания гамма-глобулинов.
Парапротеинемические лейкозы Миеломная болезнь. Миеломная болезнь протекает в две фазы. Первая фаза, во время которой показатели крови не изменяются, кости не разрушаются или разрушаются медленно, относительно доброкачественная. Вторая фаза — злокачественная. Во время этой фазы нарастает разрушение костей, появляются метастазы во внутренних органах. Разрушающие процессы прежде всего развиваются в плоских костях (ребра, кости черепа и позвоночника, иногда в средних частях плечевой и бедренной кости). В костях образуются гладкостенные, как бы штампованные дефекты. Кости становятся хрупкими, часты переломы. У части больных увеличиваются печень и селезенка, появляется почечная недостаточность, которая занимает одно из первых мест среди причин смерти больных. Слизистая оболочка обладает повышенной кровоточивостью. Повышенное содержание в крови кальция сопровождается тошнотой, рвотой, сонливостью, потерей ориентации, иногда наблюдаются психические расстройства, кома. По мере прогрессирования болезни в крови развивается анемия, снижение числа лейкоцитов, увеличение числа моноцитов и эозинофилов. Средняя продолжительность жизни больных 2–5 лет, нелеченных — 7—13 месяцев. Смерть наступает при явлениях общей интоксикации или от уремии.
Диагностика и дифдиагностика Острый лейкоз Диагноз основывается на клинической и гематологической картинах. Помогает исследование пунктата костного мозга. Особое затруднение при диагностике вызывает начальный период, который может напоминать сидероахрестическую анемию, апластическую анемию, гемолитическую анемию Маркиафы-Микеле. Иногда острый лимфобластный лейкоз путают с инфекционным мононуклеозом. Хронический миелоидный лейкоз (хронический миелоз). Диагноз основывается на клинической картине, картине крови и костного мозга. Хронический миелолейкоз и его алейкемический вариант следует дифференцировать с гепатолиенальным синдромом, лимфогранулематозом, инфекционными болезнями: малярией, бруцеллезом. Дифференциальный диагноз хронического миелолейкоза должен проводиться прежде всего с лейкемоидными реакциями миелоидного типа (в результате ответа организма на инфекцию, интоксикацию и т. д.). Бластный криз хронического миелолейкоза может давать картину, напоминающую острый лейкоз. В этом случае в пользу хронического миелолейкоза свидетельствуют данные истории болезни, выраженное увеличение селезенки, наличие в костном мозге филадельфийской хромосомы. Доброкачественный сублейкемический миелоз. Диагностируется главным образом в пожилом возрасте. В течение ряда лет больные не предъявляют никаких жалоб. По мере прогрессирования заболевания появляются слабость, утомляемость, потливость, ощущение дискомфорта и тяжесть в животе, особенно после еды. Отмечаются покраснение лица, кожный зуд, тяжесть в голове. Основным ранним симптомом является увеличение селезенки, увеличение печени обычно не столь выражено. Увеличение печени и селезенки может вести к портальной гипертензии. Частый симптом болезни — боли в костях, которые наблюдаются во всех стадиях болезни, а иногда длительное время являются единственным проявлением ее. Несмотря на высокое содержание в крови тромбоцитов, наблюдается геморрагический синдром, который объясняется неполноценностью тромбоцитов, а также нарушением свертывающих факторов крови. В терминальной стадии заболевания отмечаются лихорадка, истощение, нарастание анемии, выраженный геморрагический синдром, саркомный рост в тканях. Изменения в крови у больных с доброкачественным сублейкемическим миелозом напоминают картину «сублейкемического» хронического миелолейкоза. Лейкоцитоз не достигает высоких цифр и редко превышает 50 г/л. В формуле крови — сдвиг влево до метамиелоцитов и миелоцитов, увеличение количества базофилов. Гипертромбоцитоз (увеличение количества тромбоцитов в крови) может достигать 1000 г/л и более. В начале заболевания может быть повышение количества эритроцитов, которое в дальнейшем нормализуется. Течение заболевания может осложняться гемолитической анемией аутоиммунного происхождения. В костном мозге наблюдается гиперплазия (увеличение образования) гранулоцитарного, тромбоцитарного и эритроидного ростков наряду с фиброзом и остеомиелосклерозом. В терминальной стадии может отмечаться повышение бластных клеток — бластный криз, который в отличие от хронического миелолейкоза встречается редко. Эритремия. Диагноз основывается на увеличении массы циркулирующих эритроцитов и клинической картине. Дифференциальный диагноз следует проводить с вторичным синдромом полицитемии при опухоли гипофиза, надпочечников, туберкулезе селезенки. Основные трудности заключаются в дифференциальной диагностике эритремии со вторичными симптоматическими эритроцитозами. Различают абсолютные и относительные эритроцитозы. Абсолютные эритроцитозы характеризуются повышенной активностью процессов кроветворения и увеличением массы циркулирующих эритроцитов. При относительных эритроцитозах отмечается уменьшение объема плазмы и относительное преобладание эритроцитов в единице объема крови. Масса циркулирующих эритроцитов при относительных эритроцитозах не изменена. Абсолютные эритроцитозы встречаются при гипоксических состояниях (заболеваниях легких, врожденных пороках сердца, высотной болезни), опухолях (гипернефрома, опухоли надпочечников, гепатома), некоторых заболеваниях почек (поликистоз, гидронефроз). Относительные эритроцитозы возникают главным образом при патологических состояниях, связанных с повышенной потерей жидкости (длительная рвота, понос, ожоги, повышенная потливость). Хронический лимфолейкоз. Диагноз ставится по картине крови. Решающее значение имеет пункция костного мозга. Дифференциальный диагноз проводят с лимфогранулематозом и лимфосаркоматозом. Парапротеинемические лейкозы. Миеломная болезнь. Диагноз ставят на основании типичных клинических симптомов (поражение костной ткани, кроветворной и мочевыделительной систем), данных рентгенографии костей, гиперпротеинемии, костномозговой пункции с обнаружением типичных миелоидных клеток. Боли в костях надо дифференцировать с болями, возникающими при ревматических болезнях.
Лечение Острый лейкоз Тактика лечения зависит от стадии острого лейкоза: начальная стадия, развернутый период, частичная ремиссия, полная ремиссия, рецидив (лейкемическая фаза с выходом бластов в кровь и лейкемическая фаза без появления бластов в крови), терминальная стадия. Для лечения острых лейкозов применяют комбинацию цитостатических препаратов, назначаемых курсами. Лечение делится на этапы: период лечения для достижения ремиссии, лечение в период ремиссии и профилактика нейролейкемии (лейкозного поражения головного мозга). Цитостатическая терапия проводится в период ремиссии курсами или непрерывно. Лечение лимфобластного и недифференцируемого лейкозов у лиц моложе 20 лет. Для достижения ремиссии за 4–6 недель применяют одну из пяти схем: — винкристин-преднизолон (эффективна у детей моложе 10 лет); — 6-меркаптопурин-преднизолон; — винкристин-преднизолон-рубомицин; — винкристин-преднизолон-L-аспарагиназа; — винкристин-метотрексат-6-меркаптопурин-преднизолон (VAMP). При отсутствии в течение четырех недель эффекта от лечения по схеме 1 назначают лечение по схемам 2, 3, 5. Достижение ремиссии подтверждается контрольной пункцией костного мозга. Первая пункция — через неделю после начала терапии, затем — через четыре недели. Вслед за достижением ремиссии без перерыва проводят непрерывную поддерживающую терапию в течение 3–5 лет. У детей до 12 лет применяют VAMP. В первый год ремиссии проводят пункцию костного мозга один раз в месяц, на втором-третьем году ремиссии — 1 раз в 3 месяца. Лечение других форм острых лейкозов детей и всех форм острых лейкозов взрослых. При остром лейкозе, который с самого начала течет с уровнем лейкоцитов в крови ниже 2000 в одном мкл, с глубокой тромбоцитопенией, угрожающим или начавшимся геморрагическим синдромом, опасно начинать терапию цитостатическими препаратами без введения тромбоцитарной массы. При наличии признаков сепсиса также следует подавить инфекцию антибиотиками, затем вводить цитостатики. Обычно для лечения острого лейкоза при отсутствии тромбоцитопении и инфекции назначают короткие курсы, в течение 4–5 дней, преднизолона. Затем совместно с преднизолоном (при следующем пятидневном курсе) назначают винкристин или циклофосфан. В последующие 10 дней назначают L-аспарагиназу. В период ремиссии продолжается терапия той комбинацией цитостатических препаратов в полной дозе, которая привела к ремиссии. При этом интервалы между курсами удлиняются до 2–3 недель, до восстановления лейкоцитов до уровня 3 тыс. в одном мкл. Лечение больного острым лейкозом при рецидиве. В случае рецидива назначают терапию новой, не применявшейся во время ремиссии комбинации цитостатиков. У детей нередко эффективной оказывается L-аспарагиназа. Длительность непрерывной поддерживающей терапии должна быть не менее трех лет. Для своевременного выявления рецидива необходимо производить контрольные исследования костного мозга не реже 1 раза в месяц в первый год ремиссии и 1 раз в 3 месяца после года ремиссии. В период ремиссии может проводиться так называемая иммунотерапия, направленная на уничтожение оставшихся лейкемических клеток с помощью иммунологических методов. Иммунотерапия заключается во введении больным вакцины БЦЖ или аллогенных лейкемических клеток. Рецидив лимфобластного лейкоза лечится обычно теми же комбинациями цитостатиков, что и в период индукции. При нелимфобластных лейкозах основная задача сводится обычно не к достижению ремиссии, а к сдерживанию лейкемического процесса и продлению жизни больного. Это связано с тем, что нелимфобластные лейкозы характеризуются резким угнетением нормальных ростков кроветворения, в связи с чем проведение интенсивной цитостатической терапии часто невозможно. Для индукции (стимуляции) ремиссии у больных нелимфобластными лейкозами используют комбинации цитостатических препаратов: цитозинарабинозид, дауномицин; цитозинарабинозид, тиогуанин; цитозинарабинозид, онковин (винкристин), циклофосфан, преднизолон. Курс лечения длится 5–7 дней с последующим 10—14-дневным перерывом, необходимым для восстановления нормального кроветворения, угнетаемого цитостатиками. Поддерживающая терапия проводится теми же препаратами или их комбинациями, применяющимися в период индукции. Практически у всех больных нелимфобластными лейкозами развивается рецидив, требующий смены комбинации цитостатиков. Важное место в лечении острого лейкоза занимает терапия внекостномозговых локализаций, среди которых наиболее частым и грозным является нейролейкемия (менингоэнцефалический синдром: тошнота, рвота, нестерпимая головная боль; синдром локального поражения вещества головного мозга; псевдотуморозная очаговая симптоматика; расстройство функций черепно-мозговых нервов; глазодвигательного, слухового, лицевого и тройничного; лейкозная инфильтрация нервных корешков и стволов: синдром полирадикулоневрита). Методом выбора при нейролейкемии является внутриспинномозговое введение метотрексата и облучение головы в дозе 2400 рад. При наличии внекостномозговых лейкемических очагов (носоглотка, яичко, лимфатические узлы средостения и др.), вызывающих сдавление органов и болевой синдром, показана локальная лучевая терапия в общей дозе 500—2500 рад. Лечение инфекционных осложнений проводится антибиотиками широкого спектра действия, направленными против наиболее частых возбудителей, — синегнойной палочки, кишечной палочки, золотистого стафилококка. Применяют карбенициллин, гентамицин, цепорин. Антибиотикотерапию продолжают не менее 5 дней. Антибиотики следует вводить внутривенно каждые 4 ч. Для профилактики инфекционных осложнений, особенно у больных с гранулоцитопенией, необходим тщательный уход за кожей и слизистой оболочкой полости рта, помещение больных в специальные асептические палаты, стерилизация кишечника с помощью неадсорбируемых антибиотиков (канамицин, ровамицин, неолепцин). Основным методом лечения геморрагии у больных острым лейкозом является переливание тромбоцитарной массы. Одномоментно больному переливают 200—10 000 г/л тромбоцитов 1–2 раза в неделю. При отсутствии тромбоцитарной массы можно переливать свежую цельную кровь или пользоваться прямым переливанием. В некоторых случаях для прекращения кровоточивости показано применение гепарина (при наличии внутрисосудистого свертывания крови), эпсилонаминокапроновой кислоты (при повышенном фибринолизе). Современные программы лечения лимфобластного лейкоза позволяют получить полные ремиссии в 80–90 % случаев. Длительность непрерывных ремиссий у 50 % больных составляет 5 лет и выше. У остальных 50 % больных терапия оказывается неэффективной и развиваются рецидивы. При нелимфобластных лейкозах полные ремиссии достигаются у 50–60 % больных, однако рецидивы развиваются у всех больных. Средняя продолжительность жизни больных составляет 6 месяцев. Основными причинами смерти являются инфекционные осложнения, выраженный геморрагический синдром, нейролейкемия.
Хронический лейкоз Хронический миелоидный лейкоз (хронический миелоз). В развернутой стадии болезни назначают малые дозы миелосана, обычно в течение 20–40 дней. При падении лейкоцитов до 15–20 тыс. в одном мкл (15–20 г/л) переходят к поддерживающим дозам. Параллельно с миелосаном используют облучение селезенки. Кроме миелосана возможно назначение миелоброма, 6-меркаптопурина, гексафосфамида, гидроксимочевины. Лечение хронического миелолейкоза в развернутой и терминальной стадиях имеет свои отличия. В развернутой стадии терапия направлена на уменьшение массы опухолевых клеток и ставит своей целью сохранить как можно дольше соматическую компенсацию больных и отсрочить наступление бластного криза. Основные препараты, применяющиеся при лечении хронического миелолейкоза: миелосан (милеран, бусульфан), миелобромол (дибромоманнитол), гексофосфамид, допан, 6-меркаптопурин, лучевая терапия 1500–2000 рад. Больному рекомендуется ликвидация перегрузок, максимально длительное пребывание на свежем воздухе, отказ от курения и употребления спиртных напитков. Рекомендуются мясные продукты, овощи, фрукты. Исключается пребывание (загорание) на солнце. Тепловые, физио- и электропроцедуры противопоказаны. В случае понижения показателей красной крови назначаются гемостимулин, ферроплекс, курсы витаминотерапии (В1, В2, В6, С, РР). Противопоказаниями к облучению служат бластный криз, выраженная анемия, тромбоцитопения. При достижении лечебного эффекта переходят на поддерживающие дозы. Рентгенотерапия и цитостатики должны применяться на фоне еженедельных переливаний по 250 мл одногруппной крови и соответствующей резус-принадлежности. Лечение в терминальной стадии хронического миелолейкоза при наличии бластных клеток в периферической крови проводят по схемам острого миелобластного лейкоза. ВАМП, ЦАМП, АВАМП, ЦОАП, сочетание винкристина с преднизолоном, цитозара с рубомицином. Терапия направлена на продление жизни больного, так как получить ремиссию в этом периоде трудно. Прогноз этого заболевания неблагоприятный. Средняя продолжительность жизни — 4,5 года, у отдельных больных — 10–15 лет. Доброкачественный сублейкемический миелоз. При небольших изменениях в крови, медленном росте селезенки и печени активное лечение не проводится. Показаниями к цитостатической терапии являются: — значительное повышение числа тромбоцитов, лейкоцитов или эритроцитов в крови, особенно с развитием соответствующих клинических проявлений (очаги кровоизлияний, тромбы); — преобладание в костном мозге клеточной гиперплазии над процессами фиброза; — увеличение функциональной активности селезенки. При доброкачественном сублейкемическом миелозе применяют миелосан — 2 мг ежедневно или через день, миелобромол — 250 мг 2–3 раза в неделю, имифос — 50 мг через день. Курс лечения проводится в течение 2–3 недель под контролем показателей крови. Глюкокортикоидные гормоны назначают при недостаточности кроветворения, аутоиммунных гемолитических кризах, повышенной функциональной активности селезенки. При значительном увеличении селезенки может быть применено облучение селезенки в дозах 400–600 рад. Для лечения анемического синдрома применяют анаболические гормоны, переливания эритроцитарной массы. Больным противопоказаны физио-, электро-, тепловые процедуры. Прогноз в целом относительно благоприятный, больные могут жить долгие годы и десятилетия находиться в состоянии компенсации. Эритремия. Показано кровопускание по 500 мл через 1–2 дня. При лейкоцитозе свыше 10–15 тыс. в одном мкл (10–15 г/л) и тромбоцитозе свыше 1 млн в одном мкл (1000 г/л), спленоцитозе показано применение цитостатиков: имифоз, миелосан, миелобромон, хлорбутин, циклофосфамид. Наиболее эффективным препаратом является имифос. Эффект кровопускания нестойкий. При систематических кровопусканиях может развиться дефицит железа. В развернутой стадии эритремии при наличии панцитоза, развитии тромботических осложнений показана цитостатическая терапия. Наиболее эффективным цитостатическим препаратом при лечении эритремии является имифос. Препарат вводится внутримышечно или внутривенно в дозе 50 мг ежедневно первые 3 дня, а затем через день. На курс лечения — 400–600 мг. Эффект от имифоса определяется через 1,5–2 месяца, так как препарат действует на уровне костного мозга. В отдельных случаях наблюдается развитие анемии, которая обычно постепенно ликвидируется самостоятельно. При передозировке имифоса может возникнуть угнетение кроветворения, для лечения которого применяются преднизолон, неробол, витамины В6 и В12, а также переливания крови. Средняя продолжительность ремиссии составляет 2 года, поддерживающая терапия не требуется. При рецидиве заболевания чувствительность к имифосу сохраняется. При нарастающем лейкоцитозе, быстром росте селезенки назначают миелобромол по 250 мг в течение 15–20 дней. Менее эффективен при лечении эритремии миелосан. В качестве симптоматических средств лечения эритремии используют антикоагулянты, гипотензивные препараты, аспирин. Прогноз относительно благоприятный. Общая продолжительность заболевания в большинстве случаев составляет 10–15 лет, а у отдельных больных достигает 20 лет. Значительно ухудшают прогноз сосудистые осложнения, которые могут явиться причиной смерти, а также трансформация заболевания в миелофиброз или острый лейкоз. Хронический лимфолейкоз. Показаниями к началу терапии хронического лимфолейкоза являются ухудшение общего состояния больного, развитие цитопении, быстрое увеличение лимфатических узлов, печени, селезенки, неуклонное нарастание уровня лейкоцитов. Для лечения используют хлорбутин в течение 4–8 недель. При снижении чувствительности к хлорбутину назначают циклофосфан. Эффективны стероидные гормоны, но при их применении в крови нередко нарастает уровень лейкоцитов. Возможны комбинации препаратов: циклофосфан — винкристин — преднизолон. Эффективной при хроническом лимфолейкозе может быть локальная лучевая терапия селезенки. Для лечения инфекционных заболеваний используют антибиотики антистафилококкового спектра, гамма-глобулин. При лечении опоясывающего лишая используют дезоксирибонуклеазу, цитозар, левамизол. При хроническом лимфолейкозе проводятся цитостатическая и лучевая терапия с целью уменьшения массы лейкозных клеток. Симптоматическое лечение, направленное на борьбу с инфекционными и аутоиммунными осложнениями, включает антибиотики, гамма-глобулин, антибактериальные иммунные сыворотки, стероидные препараты, анаболические гормоны, переливания крови, удаление селезенки. При нарушении самочувствия при доброкачественной форме рекомендуется курс витаминотерапии: В6, В12, аскорбиновая кислота. При прогрессирующем увеличении числа лейкоцитов и размеров лимфоузлов назначают первично сдерживающую терапию наиболее удобным цитостатическим препаратом хлорбутином (лейкераном) в таблетках по 2–5 мг 1–3 раза в день. При появлении признаков декомпенсации процесса наиболее эффективен циклофосфан (эндоксан) внутривенно или внутримышечно из расчета 200 мг в сутки, на курс лечения —6–8 г. При малой эффективности полихимиотерапевтических программ используется лучевая терапия на область увеличенных лимфоузлов и селезенки, суммарная доза — 3 тыс. рад. В большинстве случаев лечение хронического лимфолейкоза проводится амбулаторно на протяжении всего периода заболевания за исключением инфекционных и аутоиммунных осложнений, требующих лечения в стационаре. Продолжительность жизни больных доброкачественной формой составляет в среднем 5–9 лет. Некоторые больные живут 25–30 лет и более. Всем больным лейкозами рекомендуется рациональный режим труда и отдыха, питание с высоким содержанием животного белка (до 120 г), витаминов и ограничением жиров (до 40 г). В рационе должны быть свежие овощи, фрукты, ягоды, свежая зелень. Практически все лейкозы сопровождаются анемиями, поэтому рекомендуется фитотерапия, богатая железом, аскорбиновой кислотой. Используют настой плодов шиповника и земляники лесной по 1/4—1/2 стакана 2 раза в день. Отвар листьев земляники лесной принимают по 1 стакану в день. Рекомендуется барвинок розовый, в траве содержится более 60 алкалоидов. Наибольший интерес представляют винбластин, винкристин, лейрозин, розидин. Винбластин (розевин) является эффективным препаратом для поддержания ремиссий, вызванных химиотерапевтическими средствами. Он хорошо переносится больными при проведении длительной (в течение 2–3 лет) поддерживающей терапии. Винбластин имеет некоторые преимущества перед другими цитостатиками: обладает более быстрым действием (особенно это заметно при высоком уровне лейкоцитов у больных лейкозом), не оказывает выраженного угнетающего влияния на процесс образования эритроцитов и тромбоцитов, что позволяет иногда применять его даже при легкой анемии и тромбоцитопении. Характерно, что вызываемое винбластином угнетение лейкопоэза чаще всего обратимо и при соответствующем уменьшении дозы может восстанавливаться в течение недели. Розевин применяют прираспространенных формах лимфогранулематоза, лимфо- и ретикулосаркоме, хронических миелозах, особенно при устойчивости к другим химиотерапевтическим препаратам и лучевой терапии. Вводят внутривенно 1 раз в неделю в дозе 0,025—0,1 мг/кг.
Парапротеинемические лейкозы Миеломная болезнь. Для лечения миеломной болезни используются цитостатические препараты в сочетании с гормонами: сарколизин — преднизолон или циклофосфан — преднизолон в течение трех месяцев. При гепатите, циррозе печени назначение циклофосфана нежелательно. Используется локальная лучевая терапия на отдельные опухолевые узлы при сдавлении ими окружающих органов. Инфекционные осложнения лечат антибиотиками, дополнительно назначают высокие дозы гамма-глобулина. Лечение почечной недостаточности проводят диетой, обильным питьем, гемодезом, гемодиализом. При переломе костей конечностей используют обычные в травматологии способы фиксации. При переломе позвонков — вытяжение на лямках на щите, ходьба на костылях. Рекомендуется лечебная физкультура, максимальная физическая активность. Постельный режим назначают только при свежих переломах костей.
ЛЕЙКОМА
ОпределениеЛейкома — рубцовое перерождение ткани роговой оболочки глаза.
Этиология, патогенез и клиническая картина Такое перерождение происходит либо в результате тяжелых воспалительных процессов (кератитов, трахомы, язв роговицы), либо как последствие травмы глаза. Иногда лейкомы бывают врожденными, что является следствием воспалительного процесса, перенесенного еще во внутриутробный период. При рубцевании роговая оболочка утрачивает свойственную ей прозрачность, а следовательно, и способность беспрепятственно пропускать внутрь глаза световые лучи. Роговая оболочка при лейкоме приобретает характерный фарфорово-белый цвет, иногда прорастает идущими со стороны лимба новообразовательными кровеносными сосудами. В дальнейшем лейкома может подвергаться перерождению (гиалиновому или жировому), отчего принимает иногда несколько желтоватую окраску. Сильно снижают остроту зрения не только наиболее интенсивные и обширные рубцы — собственно лейкома, но и рубцы роговицы меньших размеров, так называемые пятна, и даже совсем тонкие, обнаруживаемые лишь при помощи лупы «облачка» роговицы; при таких тонких распространенных помутнениях зрение не утрачивается полностью, но острота его сильно снижается из-за большого светорассеивания. Массивные лейкомы, особенно расположенные в центральных, оптически важнейших частях роговицы, дают очень резкое снижение остроты зрения, иногда вплоть до полной слепоты. В тех случаях, когда лейкома является следствием кератита (чаще всего сифилитического паренхиматозного или глубокого туберкулезного), ее поверхность остается гладкой и блестящей, никакого истончения роговицы в области рубца не происходит. Если же она образовалась после язв роговой оболочки или травматических повреждений, нередко поверхность лейкомы оказывается неровной, возможно истончение всей роговицы в области лейкомы. Характерный блеск роговицы при этом не нарушается, так как быстро восстанавливающийся эпителий сразу обрастает оставшийся после язвы дефект ткани. Так как в этом месте роговица остается истонченной и не может достаточно противостоять действию внутриглазного давления, она иногда набухает, образуя так называемую эктазированную лейкому. Характерный вид имеют лейкомы, развившиеся после прободных язв или после проникающих ранений роговицы. Любое сквозное прободение роговой оболочки вызывает немедленное истечение из глаза влаги передней камеры, причем радужная оболочка вплотную приближается к задней поверхности роговицы. При быстром истечении влаги радужная оболочка втягивается током жидкости в рану роговицы и укрепляется в ней. При последующем рубцевании радужка оказывается вовлеченной в рубец; образуется так называемая спаянная с радужкой лейкома. Если одновременно наблюдается выпячивание (эктазия лейкомы), возникает картина настоящей стафиломы роговой оболочки. Выпадение радужки неизбежно влечет за собой изменение со стороны зрачка, который принимает грушевидную форму и смещается по направлению к рубцу. В некоторых случаях при лейкоме не стафиломатозное выпячивание бельма, но, наоборот, уплощение роговой оболочки. Это явление может в некоторой степени зависеть от усиленного развития в роговой оболочке рубцовой ткани. Главным же образом оно объясняется начинающейся атрофией глаза, приводящей к резкому снижению его тонуса. Лейкома роговицы до сравнительно недавнего времени встречалась очень часто и рассматривалась как одна из основных причин неизлечимой слепоты. В настоящее время благодаря усилению борьбы с глазным травматизмом и с теми инфекциями (сифилис, туберкулез, гонорея и особенно трахома), которые чаще всего приводили к развитию лейкомы, частота последних резко уменьшилась. В то же время успехи кератопластики и других хирургических, а также терапевтических средств лечения показали реальную возможность значительного восстановления зрения.
ЛЕЙКОПЛАКИЯ
ОпределениеЛейкоплакия — очаговое хроническое воспаление слизистой оболочки, сопровождающееся различной степенью ороговения эпителия.
Этиология и патогенез Происхождение и механизм развития в точности не выяснены. Многие авторы XIX–XX вв. рассматривали лейкоплакию как симптом сифилиса или как парасифилитическое заболевание. В настоящее время наиболее распространена вирусная теория развития заболевания. Курение является фактором, способствующим возникновению и развитию лейкоплакии. Наиболее провоцирующее действие оказывает теплый дым папиросы, попадающий непосредственно на какой-либо участок слизистой оболочки рта. Табачный дым содержит смолы и другие вещества, сильно раздражающие слизистую оболочку и поддерживающие хронический воспалительный процесс, который является непременным условием образования лейкоплакии. Аналогичную роль в механизме развития лейкоплакии играет длительное раздражение слизистой оболочки алкоголем. Большое значение имеют также многократные мелкие травмы, вызываемые разрушенными зубами, плохо поставленными протезами, частыми ожогами горячей пищей. Длительное раздражение может происходить от слабых электрических токов, которые возникают в полости рта при ношении протезов, сделанных из различных металлов. Одним из факторов, вызывающих лейкоплакию, могут являться нейротрофические процессы в полости рта, осложненные хроническим воспалением. Некоторые авторы рассматривают лейкоплакию как синдром, возникающий в результате длительного хронического воспаления в слизистой оболочке, вызванного различными инфекциями, повторными травмами, химическими и термическими раздражителями. Однако важно помнить, что не всякий очаг гиперкератоза в соединении с воспалительным процессом на слизистой оболочке надо рассматривать как лейкоплакию. Отдельные острые и подострые травмы в полости рта могут вызывать эрозию или поверхностную язву, которые при заживлении могут симулировать лейкоплакию, так как представляют очаги ограниченных покраснений, покрытые беловатым измененным эпителием, соскабливающимся шпателем. Если травма была острая и вызвана разрушением слизистой оболочки, то помутнение эпителия может происходить от гиперкератоза, возникающего как реакция на длительное слабое раздражение. Эта ложная лейкоплакия исчезает, как только устраняется вызвавшая ее причина. Различают 3 формы лейкоплакии. 1. «Лейкоплакия-симптом», возникающая на месте воспалительной гранулемы в толще слизистой оболочки (например, при интерстициальном сифилитическом глоссите). 2. «Лейкоплакия-болезнь», при которой невозможно обнаружить вызвавшую ее причину (истинная лейкоплакия). 3. Ложная лейкоплакия, развивающаяся при других болезнях на слизистой оболочке, например при красном плоском лишае (см.), красной волчанке (см.), болезни Девержи и других, напоминающих клинической картиной лейкоплакию. Все авторы отмечают потенциальную возможность лейкоплакии перерождаться в рак, а именно в наиболее злокачественную его форму — спиноцеллюлярную эпителиому. Многие из них относят лейкоплакию к предраковым состояниям.
Патанатомия При патологоанатомическом исследовании лейкоплакия представляет собой очаг хронического воспаления в толще слизистой оболочки, местами он располагается около сосудов. Эластические волокна в месте воспаления значительно разрежены и разрушены. В большей степени изменения проявляются в эпителии слизистой оболочки: появляются отсутствующие в норме зернистый и роговой слои, в последнем часто обнаруживается паракератоз (зернистый слой может состоять из 5–7 рядов гранулез). Ясно выражен акантоз без атипизма клеточного строения, без разрушения слоев оболочки. При тканевом исследовании при лейкоплакии мочевого пузыря и верхнего отдела мочевого тракта отмечается метаплазия (перерождение) переходного эпителия в многослойный плоский эпителий наружных покровов.
Клиническая картина Появление рогового и зернистого слоев эпителия на слизистой оболочке, где они в норме отсутствуют, вызывает образование очагов беловато-серого цвета с плотным роговым налетом, не снимающимся при соскабливании. Первое время просвечивающая гиперемированная (покрасневшая) слизистая оболочка придает поверхности очага бледнорозовый цвет. В дальнейшем ороговение увеличивается, очаг лейкоплакии несколько утолщается и слегка возвышается над уровнем окружающей слизистой. Поверхность лейкоплакии может быть окрашена неравномерно: местами в беловато-розовый, местами в серовато-белый и перламутровый цвета. Могут возникать несколько очагов лейкоплакии, которые, медленно увеличиваясь в размерах, иногда сливаются, образуя фигуры различных очертаний, занимающие нередко значительную поверхность слизистой оболочки рта. Обычно лейкоплакия не вызывает каких-либо значительных ощущений и часто даже не замечается больными. Иногда на поверхности лейкоплакии возникают плотные роговые разрастания, достигающие высоты 3–5 мм с образованием трещин и эрозий, вызывающих резкую болезненность. Хронические язвы, образовавшиеся в очаге лейкоплакии, протекают торпидно (вяло) и плохо заживают, несмотря на проводимое лечение. Различают две клинические формы лейкоплакии: плоские гладкие очаги беловато-серого цвета, без видимых явлений воспаления, так называемая плоская лейкоплакия; очаги, поверхность которых состоит из бородавчатых ороговевших разрастаний, часто осложняющихся образованием трещин, эрозий, язв, так называемая веррукозная лейкоплакия или лейкокератоз, который является вероятным предраковым состоянием. Кроме того, некоторыми авторами выделяются мягкая лейкоплакия, характеризующаяся появлением очагов ороговения, прикрытых рыхлым, легко снимающимся налетом, без воспалительных явлений, локализуется чаще всего на слизистой оболочке щек и губ; лейкоплакия курильщиков в виде перламутровых бляшек обычно на слизистой углов рта. Наиболее часто лейкоплакия встречается на слизистой оболочке рта, где чаще всего поражается спинка и боковые поверхности языка и слизистая щек ближе к углам рта. Нередко лейкоплакия локализуется и на красной кайме губ, чаще нижней. Нижняя поверхность языка, слизистая оболочка неба, десен и дна полости рта поражаются значительно реже. Лейкоплакия может располагаться и в мочевом пузыре, мочевых путях, вульве, на шейке матки, во влагалище, на головке мужского полового члена, на клиторе и на половых губах. При лейкоплакии курильщиков на слизистой оболочке твердого неба образуется бляшка опаловидно-белого цвета, в форме четырехугольника или многоугольника, на поверхности которой располагаются мелкие углубления красного цвета, соответствующие выходным отверстиям желез. Иногда этот «лейкокератоз курильщиков» наблюдается также на слизистой оболочке альвеолярного отростка и мягкого неба. Кроме того, встречается вариант образования на слизистой оболочке щек «перламутровых бляшек курильщиков» в виде треугольника, основание которого располагается у угла рта, а вершина направлена к коренным зубам. Лейкоплакия возникает преимущественно у лиц в возрасте 30–50 лет, но нередко и старше 60 лет. Некоторые авторы отмечали появление лейкоплакии в юношеском и даже детском возрасте. Лейкоплакия гораздо чаще наблюдается у мужчин. Лейкоплакия вульвы чаще наблюдается на клиторе, малых губах. Клиническая картина выражена в начале развития лейкоплакии преобладанием явлений хронического воспаления с очагами темнокрасного цвета. В дальнейшем происходит ороговение слизистой оболочки с образованием белых участков, которые затем сливаются. Нередко отмечается сильный зуд. Большинство авторов не отождествляют лейкоплакию вульвы с краурозом. Хотя на отдельных стадиях развития их клиническая картина может быть очень сходна. Лейкоплакия головки мужского полового члена и внутреннего листка крайней плоти имеет такое же течение, клиническую картину и прогноз, как лейкоплакия с другой локализацией. Лейкоплакия мочевого пузыря и мочевыводящих путей наблюдается реже, чем лейкоплакия полости рта, что, возможно, зависит от большой трудности обследования мочевых путей. Клиническая картина при этой локализации такая же, как и при лейкоплакии слизистой оболочки в других местах.
Диагностика и дифдиагностика Распознавание обычно не составляет трудности. Больные иногда предъявляют жалобы на чувство жжения во рту. Следует дифференцировать с красным плоским лишаем (см.), красной волчанкой (см.), сифилитическими бляшками (см.) и склерозирующим глосситом (см.). Диагноз уточняется биопсией с тканевым исследованием.
Лечение и профилактика Лечение лейкоплакии слизистой оболочки полости рта должно состоять в санации (очищении) полости рта, устранении всех раздражающих факторов, в первую очередь курения и употребления алкоголя. Необходимо также исправление протезов, состоящих из разных металлов. При истинной лейкоплакии и особенно при лейкокератозе противопоказано смазывание различными прижигающими веществами, способствующими усилению воспалительных явлений в бляшке лейкоплакии. В отдельных случаях некоторые авторы прибегают к рентгенотерапии. В гинекологической практике существует метод лечения лейкоплакии витамином А по 100 тыс. МЕ в сутки в течение нескольких месяцев. При лейкоплакии полости рта рекомендуется комплекс витаминотерапии, особенно групп В и А; при вероятности озлокачествления показаны электрокоагуляция, декортикация, хирургическое иссечение единичных очагов лейкокератоза с немедленным тканевым исследованием; в случаях установленного злокачественного перерождения проводят радикальную хирургическую операцию и последующие рентгено- и радиотерапии. Больные с лейкоплакией должны находиться на диспансерном учете у специалистов в зависимости от локализации патологического процесса (у стоматологов, онкологов, гинекологов, урологов) и степени его озлокачествления.
ЛЕЙШМАНИОЗ
ОпределениеЛейшманиозы — группа острых и хронических протозойных паразитарных заболеваний человека и животных, характеризующихся преимущественным поражением внутренних органов (висцеральный лейшманиоз) или кожи и слизистых оболочек (кожный лейшманиоз). Заболевания вызываются паразитами из класса жгутиковых — лейшманиями, которые передаются при укусе кровососущими насекомыми — москитами.Лейшманиоз висцеральный — протозойная болезнь, характеризующаяся преимущественно хроническим течением, волнообразной лихорадкой, увеличением печени и селезенки, прогрессирующей анемией, лейкопенией, тромбоцитопенией и кахексией (истощением). Лейшманиоз кожный (пендинская язва, болезнь Боровского, восточная язва, годовик и др.) — трансмиссивный протозооз, очаговый для районов тропического и субтропического климата, клинически характеризующийся ограниченными поражениями кожи с последующими изъязвлениями и рубцеванием. Клинические формы, тяжесть течения и исходы обусловлены реактивностью организма.
Этиология и эпидемиология Жизненный цикл лейшманий протекает со сменой хозяев и состоит из двух стадий: безжгутиковой — в организме человека и других позвоночных и жгутиковой — в организме москита. Лейшмании в безжгутиковой стадии имеют овальную форму и размер 3–5 х 1–3 мкм. Лейшмании в жгутиковой стадии имеют веретенообразную форму длиной 10–20 мкм и шириной 4–6 мкм. На переднем конце паразита выявляется жгутик, с помощью которого осуществляется активное движение. Лейшмании в жгутиковой стадии обнаруживают в теле москита.
Возбудители лейшманий под микроскопом
Кожный лейшманиоз (пендинская язва) на руке
Различают висцеральный лейшманиоз: — антропонозный (передающийся от человека человеку) — индийский висцеральный лейшманиоз, или кала-азар (синонимы: черная болезнь, или лихорадка дум-дум); — зоонозный (передающийся от животных) висцеральный лейшманиоз — средиземноморско-среднеазиатский висцеральный лейшманиоз, или детский кала-азар; восточноафриканский висцеральный лейшманиоз и висцеральный лейшманиоз Нового Света. В России регистрируются завозные единичные случаи болезни, преимущественно средиземноморско-среднеазиатского висцерального лейшманиоза. Различают кожный лейшманиоз Старого Света (антропонозный и зоонозный подтипы) и кожный лейшманиоз Нового Света. В России регистрируются преимущественно завозные случаи болезни. Среди кожных лейшманиозов Старого Света выделяют: — антропонозный (поздно изъязвляющийся) кожный лейшманиоз, синонимы: I тип болезни Боровского, городской тип, ашхабадка, годовик, сухой лейшманиоз кожи; — зоонозный (рано изъязвляющийся) кожный лейшманиоз, синонимы: II тип болезни Боровского, пустынно-сельский лейшманиоз, влажный кожный лейшманиоз, пендинская язва; — суданский кожный лейшманиоз (синонимы: египетский кожный лейшманиоз, нодулярный кожный лейшманиоз); — эфиопский кожный лейшманиоз.
Висцеральный лейшманиоз Средиземноморско-среднеазиатский висцеральный лейшманиоз — это зооноз (передающийся от животных), склонный к очаговому распространению. Различают три типа очагов заражения: — природные очаги, в которых лейшмании циркулируют среди диких животных (шакалы, лисицы, барсуки, грызуны, в том числе суслики и т. п.), являющихся носителями возбудителей; — сельские очаги, в которых циркуляция возбудителей происходит преимущественно среди собак — главных источников-возбудителей, а также среди диких животных, способных иногда становиться источником инфекции; — городские очаги, в которых основным источником инфекции являются собаки, но возбудитель обнаруживается также у крыс этого ареала обитания. Собаки в сельских и городских очагах являются наиболее значимым источником заражения людей. Ведущий механизм передачи инфекции — трансмиссивный, т. е. через укус зараженных переносчиков — москитов. Возможно заражение при переливаниях крови от доноров со скрытым заражением и вертикальной передачей лейшманий. Болеют преимущественно дети от 1 до 5 лет и взрослые, приехавшие из неочаговых районов. Заболеваемость носит случайный характер, в городах возможны локальные эпидемические вспышки. Сезон заражения — лето, а сезон заболеваемости — осень того же или весна следующего года. Очаги болезни располагаются между 45° с. ш. и 15° ю. ш. в странах Средиземноморья, в северо-западных районах Китая, на Ближнем Востоке, в Средней Азии, Казахстане (Кзыл-Ординская область), Азербайджане, Грузии. К индийскому кала-азару восприимчивы люди всех возрастов, но чаще болеют лица 10–30 лет. Очаговые районы расположены в Индии, Пакистане, Бангладеш, Непале, Китае. Описаны случаи передачи инфекции при переливаниях крови. Перекрестного иммунитета к кожным лейшманиозам не возникает.
Кожный лейшманиоз Старого Света Основным носителем и источником инфекции является большая песчанка; установлена естественная зараженность других видов грызунов и некоторых хищников (ласка). Переносчики возбудителей — москиты определенных видов, которые становятся заразными через 6–8 дней после кровососания на грызунах. Заражение человека происходит через укус инфицированного москита. Характерна четкая летняя сезонность заражения, совпадающая с летом москитов. Заболевание встречается в сельских районах, восприимчивость к нему всеобщая. В очаговых районах инфекция выявляется в основном у детей и приезжих. Возможны эпидемические вспышки. Инфекция распространена в странах Африки, Азии (Индия, Пакистан, Иран, Саудовская Аравия, Йемен, Ближний Восток, Туркмения, Узбекистан).
Патогенез и патанатомия Висцеральный лейшманиоз Жгутики лейшманий захватываются макрофагами, превращаются в них в амастиготы и размножаются. В месте внедрения паразита формируется гранулема, состоящая из макрофагов, содержащих лейшмании, ретикулярных, эпителиоидных и гигантских клеток (первичный аффект). Через несколько недель гранулема подвергается обратному развитию или рубцеванию. В дальнейшем лейшмании могут проникать в регионарные лимфоузлы, затем диссеминировать (распространяться) в селезенку, костный мозг, печень и другие органы, но в большинстве случаев в результате иммунного ответа происходит разрушение зараженных клеток и инфекция приобретает субклинический (с невыраженной клинической картиной) или скрытый характер. В этих случаях становится возможной передача инфекции при переливаниях крови. В случаях пониженной реактивности или при воздействии иммуносупрессорных факторов отмечается интенсивное размножение лейшманий в макрофагах, возникает специфическая интоксикация с увеличением паренхиматозных органов, с нарушением их функций. Происходит атрофия клеток печени. Печеночная ткань начинает замещаться соединительной. Отмечаются атрофия пульпы селезенки и нарушение костномозгового кроветворения, возникают анемия и кахексия. Часто развиваются вторичная инфекция, амилоидоз почек. Во внутренних органах отмечаются изменения, характерные для гипохромной анемии. У выздоравливающих формируется стойкий иммунитет.
Кожный лейшманиоз В месте внедрения паразит размножается в макрофагах и вызывает очаговое продуктивное воспаление с образованием специфической гранулемы. Через 1–2 недели она подвергается разрушению, образуется язва, которая затем рубцуется. Часто наблюдается распространение инфекции по лимфатическим путям с образованием последовательных лейшманиом, лимфангита и лимфаденита. При повышенной реактивности наблюдается туберкулоидный тип поражений. Лейшмании в очагах поражения обнаруживаются редко.
Клиническая картина Висцеральный лейшманиоз Инкубационный период висцерального лейшманиоза кала-азар составляет от 20 дней до 3–5 месяцев, иногда год и более. В месте внедрения паразита у детей 1–1,5 лет, реже у более старших детей и взрослых, возникает первичный аффект в виде узелка, иногда покрытого чешуйкой. Этот симптом появляется задолго до общих проявлений болезни. В течении висцерального лейшманиоза различают три периода: начальный, разгара болезни и терминальный. В начальный период отмечаются слабость, понижение аппетита, малоподвижность, небольшое увеличение печени и селезенки. Период разгара болезни начинается с ведущего симптома — лихорадки, которая обычно имеет волнообразный характер с подъемами температуры тела до 39–40 °C, сменяющимися ремиссиями. Длительность лихорадочных периодов колеблется от нескольких дней до нескольких месяцев, продолжительность ремиссий также различна — от нескольких дней до 1–2 месяцев. Постоянными признаками висцерального лейшманиоза являются увеличение и уплотнение печени и селезенки, последняя может занимать большую часть брюшной полости. Увеличение печени, как правило, менее значительно. При прощупывании оба органа плотны и безболезненны. Под влиянием лечения размеры органов уменьшаются и могут нормализоваться. Кожные покровы при кала-азаре приобретают темный, почти черный цвет (отсюда название болезни). Для средиземноморско-среднеазиатского (висцерального) лейшманиоза характерно вовлечение в патологический процесс лимфатических узлов с развитием лимфаденита, мезаденита, бронхоаденита. Часто выявляются пневмонии, вызванные бактериями. При отсутствии правильного лечения состояние больных постепенно ухудшается, они худеют вплоть до кахексии. Отмечаются симптомы повышения функций селезенки, прогрессирует анемия, усугубляемая поражением костного мозга. Возникают уменьшение количества нейтрофилов и агранулоцитоз (уменьшение количества всех клеток крови), нередко развивается некроз миндалин и слизистых полости рта и десен (нома). Нередко развивается геморрагический синдром с кровоизлияниями в кожу, слизистыми, носовыми и желудочно-кишечными кровотечениями. Выраженное увеличение печени и селезенки и фиброз печени приводят к портальной гипертензии, появлению асцита и отеков. Возможны инфаркты селезенки. Вследствие увеличения селезенки и печени и высокого стояния купола диафрагмы сердце смещается вправо, его тоны становятся глухими. Как в период лихорадки, так и при нормальной температуре отмечается учащенное сердцебиение. Артериальное давление понижено. Возникает диарея, у женщин обычно наблюдается олигоили аменорея, у мужчин снижается половая активность. Отмечается выраженное уменьшение числа эритроцитов и снижение гемоглобина (до 40–50 г/л). Характерны анизоцитоз, пойкилоцитоз, анизохромия (специфические изменения со стороны клеток красной крови). Отмечаются лейкопения и нейтропения при относительном лимфоцитозе. Обычно выявляется также тромбоцитопения, постоянный признак — анэозинофилия (отсутствие эозинофилов в крови). Характерно резкое повышение СОЭ (до 90 мм/ч). Понижаются свертываемость крови и устойчивость эритроцитов. При кала-азаре у 5—10 % больных развивается кожный лейшманиоз в виде узелковых и (или) пятнистых высыпаний, появляющихся через 1–2 года после успешного лечения и содержащих лейшмании, которые могут сохраняться в них годами и даже десятилетиями. В настоящее время кожный лейшманоид наблюдается только в Индии. В терминальный (завершающий) период болезни развиваются кахексия, падение мышечного тонуса, истончение кожи. Через брюшную стенку проступают контуры огромной селезенки и увеличенной печени. Кожа приобретает «фарфоровый» вид, иногда с землистым или восковым оттенком, особенно при выраженной анемии. Средиземноморско-среднеазиатский висцеральный лейшманиоз может протекать в острой, подострой и хронической формах. Острая форма, обычно выявляемая у детей младшего возраста, встречается редко, отличается бурным течением и при несвоевременном лечении заканчивается смертью. Подострая форма встречается более часто, протекает тяжело в течение 5–6 месяцев с нарастанием симптоматики и осложнениями. Без лечения больные часто погибают. Чаще всего встречается хроническая форма висцерального лейшманиоза. Она самая благоприятная, характеризуется длительными ремиссиями и обычно заканчивается выздоровлением при своевременном лечении. Наблюдается у детей старшего возраста и взрослых. Значительное число случаев заражения протекает в скрытой форме. Прогноз серьезный, при тяжелых и осложненных формах и несвоевременном лечении — неблагоприятный, но легкие формы могут заканчиваться спонтанным выздоровлением. Особенностями восточноафриканской формы являются: — частое развитие первичного аффекта в виде узелка или язвы до 0,5 см в диаметре; — нередкое возникновение кожного лейшманоида после клинического выздоровления; — тенденция к рецидивам заболевания.
Кожный лейшманиоз Инкубационный период продолжается от 1 недели до 1–1,5 месяца, средняя его продолжительность — 10–20 дней. Различают следующие формы кожного антропонозного лейшманиоза: I. Первичная лейшманиома: — стадия бугорка; — стадия изъязвления; — стадия рубцевания. II. Последовательная лейшманиома. III. Диффузно-инфильтрирующий лейшманиоз. IV. Туберкулоидный кожный лейшманиоз. В месте внедрения появляется первичная гладкая папула (узелок) розового цвета величиной 2–3 мм, быстро приобретающая значительные размеры, иногда напоминая фурункул с лимфангитом (см.) и воспалительной реакцией окружающих тканей, но малоболезненная при прощупывании (первичная лейшманиома). Спустя 1–2 недели начинается центральный некроз лейшманиомы с последующим образованием язвы размером до 1–1,5 см и более, с подрытыми краями, обильным серозно-гнойным, часто сукровичным отделяемым. Язва умеренно болезненна при ощупывании. Вокруг лейшманиомы часто формируются множественные (от 5—10 до 100–150) мелкие узелки («бугорки обсеменения»), которые изъязвляются и, сливаясь, образуют язвенные поля. Локализуются лейшманиомы обычно на открытых участках кожи верхних и нижних конечностей, на лице. Через 2–4, иногда 5–6 месяцев начинается заращение и рубцевание язвы. С момента появления папулы и до формирования рубца проходит не более 6–7 месяцев. Туберкулоидный и диффузно-инфильтрирующий типы поражения встречаются редко. Прогноз заболевания благоприятный, но возможно возникновение косметических дефектов. Клиническая классификация зоонозного (передающегося от животных) кожного лейшманиоза идентична таковой при антропонозной форме кожного лейшманиоза. Развитие первичной лейшманиомы очень напоминает развитие гранулемы при антропонозном кожном лейшманиозе, но с самого начала лейшманиома при зоонозном подтипе имеет большие размеры. Иногда первичная гранулема приобретает сходство с фурункулом вследствие воспалительной реакции окружающих тканей, но малоболезненна. При зоонозном подтипе чаще, чем при антропонозном, возникают узловатые безболезненные лимфангиты (см.), часть узлов может изъязвляться с исходом в рубец. Особенностью суданской формы является то, что лейшманиомы редко изъязвляются. Обычно они эволюционируют в келоидные узлы, существующие неопределенно долгое время. Регионарные лимфатические узлы и сосуды в патологический процесс не вовлекаются. Эфиопский кожный лейшманиоз протекает, как правило, по типу распространенного лейшманиоза покровов и клинически напоминает описываемый ниже лепроматозный кожный лейшманиоз. Высыпания на коже распространенные, без склонности к изъязвлению и рассасыванию. Заболевание продолжается годами, очень плохо поддается терапевтическим мероприятиям. Лепроматозный, или диффузный, кожный лейшманиоз — неблагоприятная форма болезни, практически не поддающаяся лечению. Характеризуется поражением кожи в виде обширных инфильтратов и бляшек, которые редко изъязвляются, но не имеют тенденции к рассасыванию.
Диагностика Висцеральный лейшманиоз В очаговых районах клинический диагноз не представляет трудностей. Его подтверждают с помощью микроскопического исследования. Иногда лейшмании удается обнаружить в мазках и толстой капле крови, но наиболее информативно обнаружение паразита в препаратах костного мозга — до 95— 100 % положительных результатов. Применяют также серологические методы; может использоваться биопроба с заражением хомячков. У выздоравливающих отмечается положительная внутрикожная проба с лейшманином (реакция Монтенегро). Дифференциальный диагноз проводят с малярией (см.), тифами (см.), гриппом (см.), бруцеллезом (см.), сепсисом (см.), лейкозами (см.), лимфогранулематозом (см.) и др.
Кожный лейшманиоз Строится на анализе клинико-эпидемиологических данных и результатах микроскопического исследования содержимого из соскобов со дна язвы или краевого инфильтрата, где обнаруживаются внутри- и внеклеточно расположенные паразиты. Возможно использование биопробы. При туберкулоидном типе поражения обнаруживается положительная реакция Монтенегро. Дифференцировать кожный лейшманиоз приходится с эпителиомами, лепрой (см.), туберкулезом кожи (см.), сифилисом (см.), тропическими язвами и др.
Лечение и профилактика Висцеральный лейшманиоз Наиболее эффективны препараты пятивалентной сурьмы и пентамидина изотионат. Препараты сурьмы вводят внутривенно в течение 7—16 дней в нарастающей дозе. При их неэффективности назначают пентамидин по 0,004 г/кг ежедневно или через день, на курс — 10–15 инъекций. Помимо специфических препаратов, необходима патогенетическая терапия и профилактика бактериальных наслоений. Профилактика висцерального лейшманиоза основана на мероприятиях по уничтожению москитов и санации (оздоравливанию) больных собак.
Кожный лейшманиоз В ранних стадиях болезни эффективным может быть внутрикожное обкалывание лейшманиом раствором мепакрина (акрихина), мономицина, уротропина, берберина сульфата, а также использование мазей и примочек, содержащих указанные средства. На стадии язвы эффективно лечение мономицином (взрослым препарат назначают по 250 тыс. ЕД трижды в день, на курс — 10 млн ЕД, детям — 4–5 тыс. ЕД на 1 кг массы тела 3 раза в день), аминохинолом (по 0,2 г трижды в день, 11–12 г на курс). Помогает лазеротерапия, особенно в стадии бугорка (по Б. Г. Барджадзе), после которой не образуется грубых рубцов. В тяжелых случаях применяют препараты пятивалентной сурьмы. В целях профилактики проводят комплекс мероприятий по борьбе с москитами и пустынными грызунами. Дает эффект вакцинация специальной живой культурой, которую проводят не позднее чем за 3 месяца до въезда в очаговый район. Вакцина обеспечивает пожизненный иммунитет. Антропонозный кожный лейшманиоз характеризуется меньшей выраженностью и более медленной динамикой («язва-годовик») поражений.
ЛЕПРА
ОпределениеЛепра (синонимы: болезнь Хансена, хансениаз, хансеноз, проказа, финикийская болезнь; устаревшие названия: скорбь, северная болезнь (якуты), крымская болезнь, крымка, черная немочь, лисья короста, ленивая смерть, болезнь святого Лазаря) — хроническая генерализованная инфекционная болезнь человека, вызываемая микобактериями лепры, характеризующаяся поражением тканей эктодермального (наружного слоя кожи) происхождения, периферической нервной системы и внутренних органов.Лепра относится к числу древнейших известных заболеваний человека. В европейских странах лепра впервые встречается в V–III в. до н. э. прежде всего в Греции и Италии, куда она была завезена из Египта, Финикии и стран Азии в результате развития торговых связей, войн и других передвижений народов. Распространению лепры в Европе способствовал массивный занос ее в I в. до н. э. римскими солдатами Помпея, возвращавшимися из длительных походов в страны Юго-Восточной Азии. В Южную и Центральную Америку лепра была занесена европейцами в XVI–XVII вв. В первых упоминаниях о лепре европейских авторов (Аристотель, IV в. до н. э.) болезнь называлась монтиазис. Наиболее полно клинические симптомы заболевания описаны в Европе во II в. врачами Аретеем и К. Галеном, который выделил шесть основных признаков лепры: воспаление кожи, язвы, утолщение нижних конечностей, львиное лицо, выпадение волос, мутиляции. В Европе болезнь длительное время фигурировала под названием элефантиаз. Только в III в. христианский богослов Ориген (ок. 185–254 гг.) указал на то, что название элефантиаз соответствует библейскому названию «zaraath», а поскольку 70 толковников, переводившие Библию в III в. до н. э. на греческий язык, перевели термин «zaraath» словом «lepra», болезнь следует называть лепра. Необратимая инвалидизация больных и неизвестность причин развития болезни на протяжении многих веков внушали человечеству ужас перед лепрой. Трагична была судьба больных: стать «прокаженным» в те годы означало гражданскую смерть, изгнание из общества. В конце XIII в. и в начале XIV в. широко проводилась изоляция больных в специальные лечебные учреждения — лепрозории, являвшиеся в то время фактически местом пожизненного заключения больных. Попытки покинуть лепрозорий сурово наказывались, вплоть до смертной казни. В 1871 г. норвежскому врачу Хансену удалось выделить из лепром своеобразные микроорганизмы, «коричневые тельца», которые в 1874 г. были признаны возбудителями лепры и получили название палочек Хансена. В 1961 г. японский лепролог Митсуда предложил лепроминовый тест, сыгравший большую роль в выявлении больных заразными формами лепры. Даниэльссен и Бек (1847 г.) выделили две разновидности лепры: узловатую и анестетическую. В конце XIX в. появляется представление о смешанной, макуло-анестетической и вторично-нервной формах лепры. Вопросы классификации обсуждались на большинстве международных конгрессов по лепре. По каирской классификации различали два типа заболевания — лепроматозный и нервный, выделяя впоследствии три подтипа: нервно-пятнистый, туберкулоидный и нервно-анестетический. По гаванской классификации выделяли три типа заболевания: лепроматозный, туберкулоидный и недифференцированный. Лепрозный процесс рассматривается как непрерывный иммунологический процесс, при этом туберкулоидный и лепроматозный типы лепры — как полярные группы; кроме того, выделяют три промежуточные (пограничные) группы. Таким образом, классификация включает следующие основные группы лепры: — ТТ — туберкулоидный тип (синонимы: полярный туберкулоид, полярная туберкулоидная группа); — ВТ — погранично-туберкулоидная группа (пограничный туберкулоид); — ВВ — пограничная лепра (пограничная группа); — BL — погранично-лепроматозная группа (пограничный лепроматоз); — LL — лепроматозный тип лепры (полярный лепроматоз — полярная лепроматозная группа). Все группы отличаются характерными клиническими проявлениями, течением, прогнозом, а также эпидемиологической значимостью.
Этиология и эпидемиология Возбудитель лепры — микобактерия лепры Гансена, относится к роду Микобактериум, семейству Микобактериумсее. Имеет вид прямой или слегка изогнутой заостренной палочки размером 1–1,5—6–8 х 0,2–0,5 мкм и нередко обладает утолщением на одном конце в виде посоха. Возбудитель лепры человека был описан в 1874 г. норвежским врачом Г. Хансеном. Он выявил его в соскобе с поверхности разреза узла у больного узловатой лепрой. В 1879 г. немецкий микробиолог А. Нейссер предложил методы окраски бактерий лепры. Именно поэтому в литературе иногда возбудитель лепры описывается как микробактерия Хансена-Нейссера.
Возбудитель проказы (палочка Хансена)
Описаны различные морфологические варианты возбудителя, в том числе и фильтрующие формы. Жгутиков не имеет, спор не образует. В лепромах встречаются также зернистые, кокковидные, нитевидные, ветвистые, булавовидные, почкующиеся, гантелевидные формы возбудителя. По своим свойствам микобактерия лепры сходна с микобактерией туберкулеза и другими микобактериями (лепрамуриум, авиум) и актиномицетами. Как и другие микобактерии, микобактерии лепры грамположительны, окрашиваются по Цилю-Нельсену в красный цвет, в клетках тканей они выявляются в виде шаровидных плотных скоплений (глоби), в которых отдельные бактерии располагаются параллельно друг другу, что нередко сравнивают с видом сигарет в пачках («сигарные пачки»). Токсинов не образует. На известных питательных средах возбудитель лепры не растет. В трупах людей, умерших от лепры, возбудитель может сохранить свои тинкториальные и морфологические свойства в течение ряда лет, но быстро утрачивает жизнеспособность. Лепра относится к малоконтагиозным инфекциям. Единственным резервуаром инфекции является больной человек, особенно страдающий лепроматозным типом этой болезни. Поражаемость лепрой населения различных стран зависит прежде всего от социально-экономических факторов, материального уровня жизни, общей санитарной культуры. Еще в конце XIX в. Шеффер установил, что больной туберкулезной формой лепры при кашле, чиханье и даже при разговоре выделяет в окружающее пространство большое количество микобактерий лепры. Высказывается мнение, что вероятность заражения находится в прямой зависимости от длительности и характера контакта. Большинство исследователей допускают как воздушно-капельный путь передачи лепры, так и через кожу (например, имеются случаи заражения при нанесении татуировки). Кроме того, возбудитель лепры выделяется с молоком матери, семенной жидкостью и менструальной кровью, иногда с мочой и каловыми массами. Механизм заражения лепрой окончательно не установлен. Наряду с воздушно-капельным и чрескожным путем передачи рассматриваются алиментарный и трансмиссивный пути передачи (посредством кровососущих насекомых). Трансплацентарный путь передачи инфекции, по-видимому, не имеет места: от больных лепрой матерей рождаются в основном здоровые дети, случаи врожденной лепры крайне редки. Преобладающая форма болезни в тропических странах — малоконтагиозная туберкулоидная лепра. Лепроматозная форма болезни с большой частотой регистрируется в европейских странах. Противолепрозорные мероприятия включены в специальную программу ВОЗ по борьбе с тропическими болезнями.
Патогенез и патанатомия Основным способом размножения микобактерий лепры является деление материнской клетки путем врастания поперечной перегородки. Микобактерия лепры является облигатным внутриклеточным паразитом тканевых макрофагов или ретикуло-эндотелиальной системы, проявляет выраженный тропизм к коже и периферическим нервам, но на последних стадиях развития процесса встречаетсятакже на многих других клетках и тканях организма. В тканевой клетке микобактерии лепры размножаются только в цитоплазме, внутриядерный паразитизм для них не характерен. Микобактерии в лепрозных клетках иногда отграничены от цитоплазмы клетки-хозяина фагосомной мембраной. На поздних стадиях инфекции паразитирование возбудителей лепры человека сопровождается нарушением строения эндоплазматического ретикулума и митохондрий клетки-хозяина. Попавший в организм возбудитель лепры, преодолев слизистые барьеры, проникает в нервные окончания, в лимфатическую и кровеносную системы и медленно диссеминирует, не вызывая на месте внедрения видимых изменений (локализация входных ворот в виде «лепрозного шанкра» не установлена). При достаточной иммунологической резистентности макроорганизма возбудитель лепры либо погибает, либо вызывает персистентную латентную инфекцию, без явных клинических признаков. В других случаях развивается абортивная лепра, туберкулоидный или лепроматозный тип болезни. При неустойчивой резистентности организма развивается недифференцированный тип проказы, который может переходить в лепроматозный или туберкулоидный тип. О степени аллергизации организма к возбудителю лепры и, следовательно, о возможности развития того или иного варианта заболевания можно судить по лепроминовой пробе (реакция Митсуда), которая обычно положительна у больных туберкулоидной лепрой и у здоровых лиц, но отрицательна у больных лепроматозной лепрой. При туберкулезной и недифференцированной лепре патологическая картина развивается в кожных покровах и периферических нервах, а при лепроматозной поражение распространяется на слизистые оболочки верхних дыхательных путей, глаза, различные внутренние органы, костную систему. В гранулеме лепроматозного типа образуются крупные клетки с вакуолизированной цитоплазмой («пенистые», лепрозные клетки); обнаруживаются лимфоциты, плазмоциты, фибробласты и различные включения. В цитоплазме «лепрозных» клеток выделяются компактные скопления возбудителя. В пораженных тканях определяются отложения иммунных комплексов. Туберкулоидная гранулема образуется из эпителиоидных и гигантских клеток в центре, а по окружности из лимфоцитов. В зоне поражения изменены нервные окончания, расширены сосуды, определяется отек. Количество микобактерий лепры незначительно, или они не обнаруживаются. При туберкулоидной лепре, во многих случаях пограничной лепре в развитии поражения нервов важную роль играет клеточный иммунитет. При недифференцированной лепре очаги поражения состоят преимущественно из лимфоцитов, образующих периневральный инфильтрат. В нервах развиваются дегенеративные и дистрофические изменения в виде вздутий и утолщений, нервные стволы обызвествляются. Вследствие этого появляются амиотрофии, контрактуры конечностей. Резорбция, секвестрация костного скелета приводит к мутиляциям (лепре мутилянс).
Клиническая картина Инкубационный период при лепре составляет в среднем 3–7 лет. Известны случаи удлинения инкубационного периода до 15–20 лет и более. Редко инкубационный период составляет несколько месяцев. Продромальные явления (предшествующие заболеванию) обычно отсутствуют. Заболевание, как правило, развивается медленно.
Туберкулоидный тип лепры При туберкулоидном, наиболее доброкачественном типе болезни поражается кожа, реже — периферические нервные стволы и редко — внутренние органы. В типичных случаях высыпания бывают преимущественно на коже туловища и конечностей и состоят из мелких папул и бугорков. Кожные проявления в зависимости от стадии развития болезни имеют вид одиночных пятен или папулезных высыпаний, бляшек, бордюрных или саркоидных элементов. Пятна при ранней туберкулоидной лепре гипопигментные или слегка эритематозные, с четко очерченными краями. В дальнейшем по краю пятен появляются мелкие полигональные красновато-синюшные плоские папулы, они быстро сливаются в сплошные несколько возвышающиеся над уровнем кожи воспалительные бляшки, трансформирующиеся потом в бордюрные элементы. Поверхность бляшек гладкая, иногда шелушится. Наиболее типичными, классическими проявлениями развитой туберкулоидной лепры является большая эритоматозная бляшка с резко очерченным валикообразно поднятым краем и склонностью к периодическому росту. По мере увеличения бляшки центральная ее часть уплощается с появлением атрофии и гипопигментации. Это приводит к появлению больших кольцевидных сливающихся бордюрных элементов (фигурный туберкулоид). Ширина бордюра может колебаться от нескольких миллиметров до 2–3 см и более. Наружный край его приподнят, внутренний уплощен. Размеры бляшек и бордюрных элементов могут быть от 10–15 мм до обширных очагов, захватывающих большую часть спины, груди, поясницы. Расположение высыпаний обычно асимметричное, на любом участке тела. Одной из разновидностей поражения кожи при этой форме лепры являются саркоидные (моноидные) образования размером от 2–3 мм до 2–3 см красно-бурого цвета с четкими границами и гладкой поверхностью, склонные к группированию, локализующиеся обычно на лице и конечностях, реже на туловище. При регрессе всех элементов на их месте остаются гипопигментные пятна или участки атрофии кожи. Поражение периферической нервной системы и обусловленные этим сенсорные, трофические и вазомоторные нарушения выявляются очень рано. В очагах поражения отмечается расстройство температурной, болевой и тактильной чувствительности, выпадение пушковых волос, изменение пигментации, нарушение самоотделения, сухость кожи, иногда гиперкератоз. Зона расстройства температурной и болевой чувствительности выходит за 0,5–1,5 см за видимые границы высыпания, а нарушение тактильной чувствительности и потоотделения регистрируется только в пределах высыпных элементов. На ранней стадии нередко отмечается диссоциация нарушений чувствительности, в отдельных случаях возможно кратковременное повышение всех видов чувствительности, а затем полная анестезия. В дистальных отделах конечностей могут быть нарушены все виды чувствительности. Вокруг бляшек и пятен можно обнаружить утолщенную поверхностную веточку кожного нерва, чего не бывает при лепроматозном типе лепры. Поражения нервных стволов выражаются в диффузном или четкообразном их утолщении, болезненности, а иногда в развитии коллективационного некроза в местах, наиболее уязвимых для микобактерий лепры. Обычно вначале поражается нервный ствол, в зоне иннервации которого располагаются бляшки. Без лечения поражение нервов развивается по типу полиневрита. В результате поражения крупных стволов периферической нервной системы развиваются парезы и параличи, трофические язвы, контрактуры пальцев, атрофия мелких мышц, изменение костей, мутиляции и другие изменения кистей и стоп. Часто встречается поражение лицевого нерва, что сопровождается лагофтальмом и парезом мышц лица (маскообразное лицо). Другие черепные нервы в процесс вовлекаются редко. В запущенных случаях могут нарушаться рефлексы с пяточных (ахилловых) сухожилий и сухожилий трехглавой мышцы. Проприоцептивная чувствительность, как правило, не страдает. Выделяют реактивный туберкулоид и туберкулоидную реактивацию. Реактивный туберкулоид развивается как первичное заболевание или вследствие превращения пятен недифференцированной лепры. При нем высыпания в виде красных блестящих бляшек могут встречаться и на волосистой части головы, на ладонях и подошвах, оставляя после рассасывания атрофические следы. При туберкулоидной реактивации происходит обострение имеющихся туберкулоидных высыпаний, которые приобретают ярко-красную окраску и могут перейти в пограничный (туберкулоидная лепра) тип. В очагах поражения нередко обнаруживаются микобактерии лепры.
Лепроматозный тип лепры Лепроматозный тип отличается большим разнообразием клинических проявлений на коже (нечеткие метки, инфильтраты, бляшки, узлы), ранним вовлечением в процесс слизистых оболочек, внутренних органов и более поздним — нервной системы, труднее поддается лечению. Заболевание начинается с появления на лице и дистальных отделах конечностей эритематозных пятен без четко выраженных границ. В дальнейшем кисти и стопы становятся подушкообразными, на коже лица развиваются инфильтраты, глубокие складки. Высыпания на коже чаще представлены многочисленными эритоматозными или эритоматозо-пигментными пятнами, характерными признаками которых являются симметричное расположение, небольшие размеры и отсутствие четких контуров. Наиболее часто пятна локализуются на лице, разгибательных поверхностях кистей, предплечий и голеней, а также на ягодицах. Поверхность их гладкая и блестящая. Со временем первоначальный красный цвет пятен приобретает бурый или желтоватый (медный, ржавый) оттенок. Чувствительность и потоотделение в пределах пятен не нарушены. В течение длительного времени (месяцы, годы) пятна остаются без изменений, иногда исчезают, но чаще трансформируются в инфильтраты или лепромы. При развитии инфильтрата пятна приобретают вид ограниченных бляшек или значительных участков поверхностной инфильтрации кожи без четких границ, постоянно переходящих во внешне неизмененную кожу. Развитие пареза сосудов и гемосклероза обусловливает бурый или синюшно-бурый цвет инфильтрата. Инфильтрация кожи сопровождается усилением функции сальных желез, в результате чего кожа в местах поражений становится жирной, блестящей, лоснящейся. Расширение фолликулов пушковых волос и выводных потоков потовых желез придает коже вид апельсиновой корки. Потоотделение в области инфильтратов сначала снижается, а в поздних стадиях полностью прекращается.
Лепра. Лепроматозный тип
Лепра. Пятнистые поражения кожи (лепрозы)
На ранних стадиях процесса рост пушковых волос не нарушается, в более поздние периоды (3–5 и более лет) наблюдается выпадение бровей (начиная с наружных сторон) и ресниц, а также пушковых волос на участках инфильтрации кожи, возможно выпадение волос бороды, усов. При диффузной инфильтрации кожи лица естественные морщины и складки углубляются, надбровные дуги резко выступают, нос утолщается, щеки, губы и подбородок имеют «дольчатый» вид — «львиная морда». Волосатая часть головы, внутренние части век, подмышечные ямки, как правило, не поражаются (иммунные зоны), но при распространенном процессе в этих зонах выявляются гистопатологические изменения, характерные для лепроматозной формы лепры. В области инфильтратов часто уже на ранних стадиях появляются одиночные или множественные бугорки и узлы (лепромы), размеры которых варьируются от 1–2 мм до 2–3 см. Лепромы чаще локализуются на лице (надбровные дуги, лоб, крылья носа, подбородок, щеки), мочках ушных раковин, а также на кистях, предплечьях, локтях, реже — на бедрах, ягодицах, спине. Они редко отграничены от окружающей кожи, безболезненны, в скарификатах с них при микроскопическом исследовании обнаруживаются микобактерии лепры. Лепромы могут быть дермальными или гиподермальными. Гиподермальные лепромы вначале выявляются пальпаторно, но в дальнейшем они достигают дермы и становятся видимыми. Дермальные лепромы вначале имеют вид овальных папул, постепенно превращаясь в бугорки красноваторыжеватого цвета, возвышающиеся в виде полушарий над уровнем кожи. Поверхность их гладкая, лоснящаяся, часто испещрена телеангиэктазиями, иногда шелушится. Из плотновато-эластичных они становятся более мягкими, а в редких случаях фиброзного перерождения — очень плотными. Иногда они подвергаются рассасыванию, оставляя после себя пигментированное, несколько запавшее пятно. Наиболее частым исходом лепромы при отсутствии лечения является изъязвление. Процесс развивается вяло, торпидно, без выраженных воспалительных явлений и заканчивается образованием небольшого гипопигментного рубца. Реже наблюдается быстрый распад лепром, начинающийся с поверхности или центра узла с образованием неглубоких, длительно не заживающих язв, которые могут сливаться, образуя обширные язвенные поверхности. Края язв крутые или подрытые, инфильтрированные, несколько возвышаются над окружающей кожей, могут быть болезненными, впоследствии становятся омозолелыми. Дно язв покрыто серовато-желтым налетом. После заживления остается ровный, слегка запавший, гипохромический, иногда келоидный рубец. Во всех случаях поражаются слизистые оболочки носа, а в запущенных случаях — слизистые оболочки полости рта, гортани, а также спинка языка и красная кайма губ. Ринит, носовые кровотечения нередко встречаются еще до появления кожных поражений. Слизистая оболочка носа гиперемирована, отечна, с небольшими эрозиями; в дальнейшем появляются лепромы, инфильтрация, массивные корки, резко затрудняющие носовое дыхание. Распад лепром, расположенных на хряще перегородки носа, приводит к ее перфорации и деформации носа. В запущенных случаях возможно изъязвление лепром на слизистой оболочке мягкого неба. Поражение области голосовых связок может привести к резкому сужению голосовой щели, афонии. Отмечаются специфические поражения органа зрения: поражаются передний отдел глазного яблока и веки, чаще всего встречаются эписклериты (см. Склерит), очаговый кератит (см.), иридоциклиты (см.), помутнение хрусталика, а также конъюнктивиты (см.) и блефариты (см.). Развитие эписклеритов начинается с появления у лимба роговицы гиперемии, на месте которой образуется диффузный инфильтрат или небольшая (диаметром 2–4 мм) лепрома. В нелеченных случаях эписклеральные лепромы увеличиваются, могут прорастать в радужку и ресничное тело. Кератиты характеризуются появлением мелких белых (просовидных) лепром на фоне очагового помутнения роговицы. В дальнейшем лепромы увеличиваются, изъязвляются, в роговой оболочке появляются сосуды (лепрозный паннус), кератит становится диффузным, распространяется на всю роговицу. В запущенных случаях возможно поражение радужки (гипертрофия пигментного зрачкового ободка, распад пигмента, явления ирита, с перикорнеальной инъекцией сосудов, светобоязнью, болями). Появление мелких лепром и отложение фибринозного экссудата в виде белых хлопьев и нитей на поверхности радужки приводят к деформации зрачка и нарушению аккомодации. На веках могут локализоваться диффузные инфильтраты и лепромы, что приводит к выпадению ресниц. Особенностью лепрозного конъюнктивита является отсутствие отделяемого и слабовыраженного явления раздражения. При лепроматозном типе лепры специфический процесс часто поражает периферическую нервную систему, лимфатические узлы, печень, стенки большинства кровеносных сосудов, яички. Бедренные, паховые, поднижнечелюстные, подмышечные и другие лимфатические узлы (кроме грудных и брыжеечных) увеличены, плотной консистенции. Поражение периферической нервной системы проявляется достаточно поздно и развивается, как правило, по типу симметричного плеврита. Нарушение чувствительности в зоне кожных высыпаний долгое время отсутствует, но со временем оно всегда появляется. Осевые цилиндры нервов сравнительно устойчивы к развитию в них лепрозного инфильтрата, чем объясняется довольно длительное сохранение его функции. Однако в дальнейшем наблюдается инфильтрация лепрозными клетками всего поперечника нервного ствола, по мере развития которой теряется чувствительность до полной анестезии. Пораженные нервные стволы уплощенные, плотные, гладкие. На очень поздних стадиях неврита, кроме расстройств чувствительности, развиваются различные трофические и двигательные нарушения (лагофтальм, парез жевательной и мимической мускулатуры, прободающие и трофические язвы стоп). Глубокие виды чувствительности, а также сухожильные и надкостничные рефлексы обычно сохраняются без нарушения. Хронические гепатиты выявляются довольно рано, они имеют склонность к обострениям, особенно в период реактивных фаз. Печень может быть увеличена, иногда болезненна, отмечаются различные нечетко выраженные функциональные нарушения (см. Гепатит), обусловленные наличием мелких, просовидных лепром в парапортальных областях и дольках печени. Орхит (см.) и орхоэпидимит характеризуются хроническим течением с последующим нарушением функции яичек (инфантилизм и гинекомастия). Иногда при распространении лепроматозной формы наблюдаются нарушения менструального цикла. При этой форме, как и при других формах лепры, наблюдаются изменения ногтей: они становятся тусклыми, сероватыми, утолщенными и изрезанными продольными бороздками, ломкими, легко отслаиваются, крошатся.
Стертые и атипичные формы лепроматозного типа К стертым формам относятся одиночные пятна, инфильтраты и лепромы (абортивное течение), а также очень мелкие лепромы, развивающиеся вокруг фолликулов пушковых волос (фолликулярные лепромы). Из атипичных проявлений описаны ихтиозиформные, склеродермоформные, пеллагроидные, эризипелоидные, лихеноидные, герпетиформные, псориазиформные высыпания, гистоидная лепра и лепра Лусио. Гистоидная лепра клинически характеризуется особой четкостью границ и обрывистыми краями элементов (бляшек и узлов), на которых нередко бывают шелушение, точечные вдавления в центре. Лепра Лусио (синонимы: лепра Лусио Альварадо, диффузная лепроматозная лепра, диффузная лепра Лусио-Лапати, пятнистая диффузная лепра) — это распространяющаяся на все тело диффузная форма без отдельных пятен, бляшек и лепром. Кожа становится блестящей и напряженной, как при склеродермии. Волосяной покров иногда отсутствует. Диффузная инфильтрация лица (лунообразное лицо), хриплый голос, отеки ног напоминают микседему (см.). Лепра Лусио характеризуется выраженной воспалительной реакцией и васкулитом, сопровождающимся тромбозом кожных кровеносных сосудов, что приводит к обширным изъязвлениям кожи. Васкулит встречается при других формах лепры, обычно не сопровождается тромбозом. Лепра Лусио сопровождается обширными изъязвлениями, называется лепрой святого Лазаря. На поздних стадиях лепры Лусио развивается ихтиоз (см.). Встречается также так называемая сливная пятнистая лепроматозная форма лепры, при которой едва заметные гипопигментированные или эритематозные пятна, быстро сливаясь, образуют единое пятно, покрывающее всю кожу, за исключением иммунных зон. При этих разновидностях лепры решающим в диагностике является бактериологическое исследование скарификатов пораженной кожи, при которых обнаруживается большое количество микобактерий лепры.
Пограничные группы В клинике пограничной лепры в той или иной мере выражены признаки обоих полярных типов (пограничные состояния). При пограничной лепре кожные проявления, помимо сходства с основными группами, характеризуются типичными, не присущими полярным типам признаками: наряду с многочисленными асимметричными эритематозными пятнами, часто неправильной формы, с четкими границами или бляшками с отчетливым пологим краем и более выпуклой центральной частью, как правило имеют «пробитые» или «штампованные» пятна и бляшки, получившие название дырочек сыра. Это обусловлено появлением в центральной части высыпаний четко очерченных участков регресса. Элемент сначала принимает вид «перевернутого блюда», а затем возвышающихся над уровнем кожи округлых или полосовидных бордюрных элементов с четким обрывистым внутренним краем (в отличие от бордюрных элементов при погранично туберкулоидной лепре, где внутренний край уплощен). Как правило, такие бордюрные проявления приобретают фиолетовую окраску. Рядом с пятнистыми и бордюрными элементами обычно выявляются гроздья мелких высыпаний — сателлитов. Довольно рано развиваются множественные асимметричные поражения периферических нервных стволов. В самих высыпаниях выявляются умеренные нарушения чувствительности. Потоотделение на высыпаниях обычно не нарушено, пушковые волосы частично сохранены. Лепроминовая проба, как правило, отрицательная, реже слабоположительная. При погранично-туберкулоидной группе кожные высыпания по внешнему виду, расположению и состоянию чувствительности очень напоминают проявления туберкулоидного типа лепры. Но при этом пятна и бляшки обычно маленьких размеров, множественные, встречаются элементы с нечеткими границами. Как правило, имеются утолщения периферических нервных столбов, нарушения чувствительности, потоотделения и роста пушковых волос, но по сравнению с туберкулоидной формой все эти проявления менее выражены. Реакция на лепромин слабоположительная или положительная. При погранично-лепроматозной, как и при лепроматозной форме, основными элементами являются не имеющие отчетливых границ пятна, папулы, бляшки, диффузные инфильтраты и узлы. Основной отличительной особенностью погранично-лепроматозной группы является наличие «пробитых», «штампованных» высыпаний и округлых или полосовидных бордюрных элементов с приподнятыми внутренними краями. Характерно также наличие небольших вдавлений в центре некоторых папул и бляшек. Высыпания не столь множественны, как при лепроматозном типе лепры, нередко располагаются асимметрично. На некоторых элементах уже в ранней стадии выявляется снижение чувствительности. Функция потовых желез страдает, чаще нарушается и рост пушковых волос. Как и в случае пограничной лепры, при погранично-лепроматозной форме обычно выявляется утолщение периферических нервных стволов, что, в отличие от лепроматозного типа лепры, может предшествовать появлению высыпаний на коже. Не развиваются также типичные для лепроматозного типа проявления, как выпадение бровей и ресниц, деформация носа, поражение глаз, изъязвление слизистой оболочки носа, «львиная морда». Реакция на лепромин всегда отрицательная. При бактериоскопии во всех кожных высыпаниях в большом количестве выявляются микобактерии лепры.
Диагностика и дифдиагностика Ранняя диагностика лепры снижает вероятность инфицирования окружающих. Основой для диагностики лепры является клиническая симптоматика. Диагностика поздних стадий лепры (множественные лепромы, выпадение бровей и ресниц, парезы, параличи, мутиляции, западание носа, «львиная морда») не представляет обычно затруднений, в то время как ранние проявления лепрозного процесса нередко трудно диагностируются, поскольку многие проявления лепры в этом периоде могут быть стертыми и атипичными. Учитывая многообразие ранних дерматологических и неврологических проявлений лепрозного процесса, вполне оправданно во всех случаях высыпаний на коже (эритемы, гипер- или гипопигментация, папулы, инфильтраты, бугорки, узлы) проводить дополнительное исследование больного с целью исключения лепры. Проявлять настороженность следует также при снижении или исчезновении чувствительности на отдельных участках кожного покрова, появлении парестезий, нерезко выраженных контрактур V, IV и III пальцев рук, снижении мышечной силы, начинающейся атрофии мышц, отечности кистей и стоп, при стойких поражениях слизистой оболочки носа, сопровождаемых носовыми кровотечениями, наличии трофических язв и др. Для правильной диагностики процесса тщательно изучают внешний вид поражений, их число, расположение, степень нарушения чувствительности и состояние роста пушковых волос, наличие в высыпаниях и в соскобах со слизистой оболочки носа микобактерий лепры, а также результаты реакции на лепромин. Наиболее точно при клиническом обследовании больного диагностируется лепроматозный тип лепры. При установлении остальных групп окончательный диагноз возможен только на основе результатов гистологического исследования. Установлено, что выявляемые гистологические изменения иммунологической реактивности опережают изменения в клинической картине на недели, месяцы, а иногда и 1–2 года. При этом необходимо тщательное изучение неврологического статуса, включая состояние болевой, тактильной и температурной чувствительности, бактериологическое, гистологическое, рентгенологическое обследование, постановку функциональных проб (с гистамином, с никотиновой кислотой, с горчичником, на потоотделение и др.). При лепре поражаются главным образом кости дистальных отделов конечностей. Для лепроматозного типа основными рентгенологическими признаками являются единичные или множественные очаги специфической воспалительной деструкции (лепромы) и нервно-трофические изменения, характеризующиеся атрофией, остеопорозом (см.) и рассасыванием костной ткани. Лепромы чаще локализуются в губчатом веществе, реже в корковом веществе фаланг, пястных плюсневых костей. При разрушении ими суставных поверхностей происходит смещение дистально расположенных костей с образованием подвывиха или вывиха. При туберкулоидном типе очаговая деструкция встречается довольно редко. Явление остеолиза как следствие нервно-трофических и сосудистых нарушений наблюдается при всех типах лепры, сопровождающихся полиневритами. Вначале эти изменения проявляются сглаженностью ногтевых отростков, расширением каналов, питающих кость, а в более поздних стадиях — ведут к мутиляции фаланг кистей и стоп. Концентрическая атрофия фаланг, являющаяся характерным признаком лепры, вызывает своеобразную деформацию костей в виде шахматной пешки. Резорбция костей может вести к патологическим переломам, подвывихам, вывихам, анкилозам, частичному или полному отторжению костей. Изменения в костях стоп обычно более выражены вследствие присоединения остеомиелита, вызывающего секвестрацию, деструкцию костей, и ведут к глубокой инвалидности больного. Встречаются также периоститы и гиперостозы плюсневых метакарпальных, реже трубчатых костей предплечий и голеней. Фармакодинамические (функциональные) пробы помогают выявить характерные для лепры очень ранние поражения периферической нервной системы, проявляющиеся, помимо нарушений поверхностных видов чувствительности, различными вазомоторными, секреторными и трофическими расстройствами. Наиболее широко применяется проба с гистамином, морфином или дионином. На исследуемый пораженный участок и на внешне не измененную кожу наносят одну каплю 0,1 %-го водного раствора гистамина и через каплю делают небольшую царапину. Появляющаяся на месте царапины ограниченная эритема должна через 1–2 мин смениться рефлекторной эритемой диаметром в несколько сантиметров, в центре которой через несколько минут образуется волдырь или папула. Полностью все три фазы реакции (триада Льюиса) наблюдаются у здоровых людей, на пораженной коже у больных лепрой и на высыпаниях нелепрозной этиологии. На поражениях лепрозного происхождения, т. е. при поражении нервных окончаний, рефлекторная эритема, развивающаяся по принципу аксон-рефлекса, отсутствует или выражена значительно слабее. Лабораторная диагностика заключается в проведении бактериоскопического и гистологического исследования. Бактериоскопическое исследование имеет решающее значение для ранней диагностики лепры только при получении положительных результатов и особенно важно при подозрении на лепроматозный тип или погранично-лепроматозный тип. При туберкулоидном типе и погранично-туберкулоидном типе микобактерии могут не выявиться. Обычно для бактериоскопического исследования берут соскоб со слизистой оболочки носа и скарификаты из пораженного участка кожи, а также кожи надбровных дуг, мочек ушных раковин, подбородка, дистальных отделов конечностей. Для взятия скарификата кожу зажимают двумя пальцами в складку, вдоль которой скальпелем делают небольшой надрез (глубиной 1–2 мм), и соскоб со стенок надреза переносят на предметное стекло, мазки окрашивают по Цилю-Нильсену для выявления микобактерий. Лепру называют «великим имитатором», способным имитировать многие болезни кожи и периферической нервной системы. Из кожных болезней, клинические проявления которых сходны с лепрой, необходимо иметь в виду бугорковый сифилид, сифилитические гуммы (см. Сифилис), токсикодермию (см.), многоформную экссудативную эритему (см. Эритема эсскудативная многоформная), красный плоский лишай (см. Лишай красный плоский), туберкулезную волчанку (см. Туберкулез кожи), саркоидоз (см.), склеродермию, витилиго (см.), грибовидный микоз (см. Микоз грибовидный), ретикулезы кожи (см.), лейшманиоз (см.), узловатую эритему (см. Эритема узловатая), трофические и прободающие язвы различной этиологии (см. Язвы трофические), рожу, пеллагру (см.), пигментную крапивницу (см. Мастоцитоз) и др. В странах тропического пояса дифференциальный диагноз лепры необходимо проводить с такими заболеваниями, как актиномикоз (см.), споротрихоз, бластомикоз (см.), онхоцеркоз (см.), пинта (см.), фрамбезия (см.). Определенные трудности могут встречаться при дифференциации лепры и тех поражений нервной системы, при которых имеются нарушения чувствительности, контрактуры, амиотрофии, мутиляции. К ним относятся сирингомиелия (см.), травматические невриты (см.), миелодисплазии (см.), акроостеолиз, невральная амиотрофия Шарко-Мари (см. Амиотрофия), гипертрофический неврит Дежерина-Сотта. При дифференциации с этими болезнями следует принимать во внимание, что у больных лепрой преобладают нарушения поверхностных видов чувствительности, тогда как двигательные функции и глубокая чувствительность сохраняются, поэтому атаксии у них нет. Поражения чувствительности при лепре никогда не развиваются по сегментарному типу. Не развивается также атрофия мышц плечевого пояса и проксимальных отделов конечностей. Центральная нервная система при лепре не поражается. Следует учитывать, что лепра — это хроническое заболевание. При всех видах лепры могут наблюдаться острые или подострые активации процесса (реакции, реактивные фазы, обострения). Несмотря на неоднократные попытки унифицировать описание реактивных состояний при лепре, общепризнанной классификации их не существует. Чаще различают два типа реакций: реакции, сопровождающиеся переходом (трансформацией) болезни в другую классификационную группу (так называемые пограничные реакции), и реакции, не сопровождающиеся трансформацией процесса. Пограничные реакции могут развиваться у больных туберкулоидным, погранично-туберкулоидным и погранично-лепроматозным типами лепры и субполярным лепроматозом, кроме лепроматозного типа лепры, и делятся на восходящие (обратные, оборонительные, реверсивные), при которых происходит трансформация в направлении туберкулоидного типа, и на нисходящие, сопровождающиеся сдвигами в направлении лепроматозного типа. Во второй группе реакций выделяется обострение типа лепрозной узловой эритемы, встречается только у больных лепроматозным и погранично-лепроматозным типом. Нередко реакции носят характер рожистого воспаления. Основными признаками развития пограничной реакции являются быстрое видоизменение некоторых или всех имеющихся кожных высыпаний (покраснение, напряженность, блеск), местное, а иногда и общее повышение температуры, болезненность нервных стволов или зоны иннервации пораженного нерва, отек на лице и конечностях. Процесс распространяется также на лимфатические узлы, слизистые оболочки носа и полости рта, глаза, некоторые внутренние органы. Позже могут развиваться изъязвления высыпаний, некроз пораженных нервных стволов. Появление новых высыпаний чаще свидетельствует о нисходящем характере обострения. Однако окончательный вывод можно сделать только на основе гистологического исследования. При реверсивной реакции выявляются признаки усиления клеточного иммунитета: увеличение количества лимфоцитов, эпителиоидных и гигантских клеток и уменьшение числа микобактерий лепры (при нисходящей реакции — наоборот). При туберкулоидном типе реверсивная реакция может привести к выздоровлению. В соответствии с направлением трансформации при пограничных реакциях показатели лепроминовой пробы изменяются в сторону усиления при реверсивных реакциях и в сторону ослабления — при нисходящих реакциях. При обострении лепроматозного типа лепры могут появиться новые высыпания, отечность лица и конечностей, возникают или обостряются невриты, поражения глаз, лимфатических узлов и внутренних органов, изъязвляются старые лепромы. Иногда в реактивной фазе лепроматозного типа появляются атипичные (уртикарные, лихеноидные, акнеформные, ихтиозиформные, фурункулоидные, розеолезные, пемфигоидные) высыпания. Чаще всего при этом встречаются обострения типа лепрозной узловатой эритемы, при которых появляются элементы, типичные для узловатой эритемы. Появившиеся ярко-красные узлы и бляшки могут быть болезненными, бледнеют при надавливании, иногда изъязвляются, температура в них заметно выше, чем в окружающей их коже. Как правило, обострения лепроматозного типа сопровождаются повышением температуры, болями по ходу нервных стволов, в суставах и костях, расстройствами сна. Появление на высыпаниях шелушения свидетельствует о начале регресса реакций. Обострение при лепре Лусио проявляется появлением на коже болезненных эритематозных бляшек, в центре которых развивается некроз (иногда перед этим появляется пузырь). В дальнейшем формируется темная корка (струп), отходящая через несколько дней. Особенно выражены изъязвления на ногах. В основе реактивных состояний при лепре лежат изменения напряженности реакций гуморального и клеточного иммунитета. Лепрозная узловатая эритема и другие реакции при лепроматозном и погранично-лепроматозном типах развиваются по типу феномена Артюса. Наличие в сыворотке больных лепроматозного типа большого количества изменяющихся антител или высокая концентрация в организме антител приводят к образованию иммунных комплексов антиген-антитело. Оказываясь в стенках сосудов и тканях, они вызывают развитие ответной аллергической реакции. Нередко при этом выявляется гломерулонефрит иммунного происхождения, а в сыворотке крови — отклонения в содержании комплемента. Обострения при других видах лепры (туберкулоидный, погранично-туберкулоидный, пограничные типы) отражают изменения в интенсивности гиперчувствительности замедленного типа. С введением эффективной химиотерапии количество реакций (обострений) увеличилось. Факторами, способствующими развитию реактивных состояний, являются также сопутствующие заболевания, особенно инфекционные, психические перенапряжения, хирургические операции, иммунизации, беременность, роды и др.
Лечение Больные подлежат лечению в специальных загородных больницах (лепрозориях). Лечение больных лепрой — продолжительный и трудоемкий процесс. Больным назначают комплексную терапию, включающую общеукрепляющие и химиотерапевтические средства. Из последних наибольшее распространение получили сульфоновые препараты — дапсон и др. Дапсон назначают внутрь по 6—10 мг на 1 кг массы тела в неделю, что составляет для взрослого больного 50—100 мг в сутки, или внутримышечно по 300–400 мг препарата 2 раза в неделю, или 600 мг еженедельно. Больным туберкулоидным или погранично-туберкулоидным типом лепры и недифференцированной лепрой с бактериоскопическими негативными показателями достаточно суточной дозы 50 мг дапсона. Продолжительность курса лечения несколько лет. При лепроматозной и погранично-лепроматозной лепре эффективно сочетание дапсона в полной дозировке с лампреном в дозе 100 мг в сутки или 100 мг три раза в неделю в течение 4–6 месяцев с последующим лечением одним дапсоном. Лампрен можно заменить рифампицином, назначаемым в суточной дозе 300–600 мг в течение двух недель и дольше. В процессе лечения больных лепрой нередко развиваются вторичные резистентные возбудители к дапсону, о чем свидетельствуют клинические и бактериоскопические рецидивы лепроматозной и пограничной лепры или отсутствие эффекта лечения на протяжении 3–6 месяцев. В таких случаях следует назначить больному рифампицин по 600 мг в сутки и лампрен до 100 мг в сутки ежедневно в течение 2–3 месяцев с последующим лечением одним лампреном. Для предупреждения вторичной резистентности микобактерий лепры к сульфонам рекомендуется начинать и продолжать лечение свежих случаев дапсоном в полной дозировке и проводить его регулярно без перерывов; больным лепроматозной и погранично-лепроматозной лепрой лечение следует начинать с комбинированной терапии. Следует заметить, что у ряда больных возбудитель лепры обнаруживается даже после 5—10 лет химиотерапии. При лечении больных сульфонами назначают железо для профилактики анемии. При туберкулоидной лепре раннее лечение сульфонами предотвращает возникновение деформаций. Больные иногда подвергаются лечению в течение всей жизни, так как наблюдаются рецидивы, частота которых пока неизвестна. При нарушении чувствительности (термической и тактильной) больные должны быть тщательно проинструктированы с целью предупреждения возможных повреждений. Показана физиотерапия. Начинать ее нужно как можно раньше. Часто бывают нужны ортопедические мероприятия для корригирования деформаций, обусловленных повреждением периферических нервов. При незначительном туберкулоиде редко отмечаются какие-либо серьезные реакции на лечение, в то время как при значительном туберкулоиде может наблюдаться усиление реакции, приводящее к поражению существующих кожных поражений, отеку окружающей ткани, сжатию периферических нервов и их болезненности, увеличению количества микробов, делающих больного временно заразным. Далее могут развиться параличи. При лепроматозной форме обычным проявлением токсической реакции при лечении служит узловатая лепрозная эритема. При выраженной реакции с развитием невритов, дерматозов и общими нарушениями лечение больных дапсоном прекращается, или назначают талидомед (по 300 мг в сутки) и лампрен (до 300 мг в сутки) в течение 2–3 месяцев, преднизолон (в начальной дозе 30 мг в сутки). После лечения кортикостероидами далее больному снова назначают дапсон, но в меньшей дозировке, или солапсон. При иридоциклите, сочетающемся с узловатой лепрозной эритемой, в глаза закапываются 1 %-ный раствор атропина (утром и вечером) и 1 %-ный раствор гидрокортизона (каждый час до прекращения воспалительного процесса). Если больные не получают кортикостероидов внутрь, можно вводить субконъюнктивально от 5 до 8 мг гидрокортизона, растворенного в 0,3 мг стерильного изотонического раствора хлорида натрия. При наличии изъязвления роговицы кортикостероиды назначают с осторожностью и только в сочетании с антибиотиками.
Профилактика В системе профилактических мероприятий лепры обязательны регистрация и учет больных. Больные подлежат госпитализации в лепрозории. Периодически осматривают членов семей заболевших, особенно детей, и проводят профилактические осмотры всех жителей населенных пунктов, неблагополучных по лепре. Среди населения проводится санитарно-просветительская работа. Контактным по лепроматозной лепре лицам назначают дапсон. Новорожденных от больных матерей отделяют и передают здоровым родственникам или в специализированные детские учереждения. В эндемических по лепре очагах детям и лицам с лепронегативными реакциями, имевшим контакт с больными лепрой, в целях иммунопрофилактики вводят вакцину БЦЖ. Однако еще нет достаточных оснований рекомендовать эту вакцину в качестве специфической профилактической меры для предупреждения лепры. Вакцинированные лица положительно реагируют на лепромин, и среди них заболеваемость лепрой резко снижается, а если появляются отдельные заболевания, то они протекают доброкачественно по туберкулоидному типу. Улучшение социально-экономических и санитарно-гигиенических условий жизни населения является основой успешной борьбы с лепрой.
ЛЕПТОСПИРОЗ
ОпределениеЛептоспироз (синонимы: болезнь Васильева-Вейля, водная лихорадка) — острая инфекция, передающаяся от животных, характеризующаяся явлениями интоксикации с резко выраженными болями в мышцах, преимущественным поражением почек, печени, нервной и сосудистой систем, сопровождающаяся развитием геморрагического синдрома и нередко желтухи.
Этиология Возбудители лептоспироза подразделяются на два вида: паразитический и сапрофитный. Лептоспиры являются гидробионтами (с водной средой обитания), и этим во многом обусловлены эпидемиологические особенности заболевания. В настоящее время известно более трех десятков различных болезнетворных лептоспир, из которых одни имеют повсеместное распространение, а другие встречаются лишь в определенных климато-географических и ландшафтных зонах.
Желчно-геморрагические лептоспиры
Лептоспиры характеризуются наличием многочисленных (15–20) завитков. Длина лептоспир составляет 6—15 мкм, толщина — 0,25 мкм. Тело их состоит из тонкой осевой нити толщиной 200–300 нм, окруженной спиралью, выполняющей функции органоида движения. Концы лептоспир утолщены и крючковидно загнуты. Лептоспиры отличаются способностью к поступательным, вращательным и сгибательным движениям. При разрушении микроорганизмов выделяется эндотоксин. Фактором болезнетворности лептоспир является их адгезивность (склонность прикрепляться) в отношении эндотелиальных клеток, капилляров и эритроцитов. Лептоспиры устойчивы к действию низких температур, длительно выживают в воде. В естественных водоемах они сохраняют жизнеспособность до 2–3 недель, в почве — до 3 месяцев, на пищевых продуктах — несколько дней. Лептоспиры малоустойчивы к нагреванию, действию ультрафиолета, кислот, щелочей, дезинфицирующих веществ. Из лабораторных животных к ним наиболее восприимчивы морские свинки.
Эпидемиология Лептоспироз — заболевание, присущее только человеку. Различают природные, созданные человеком и смешанные очаги болезни. Источником инфекции являются больные и переболевшие дикие и домашние животные, заражающие воду и почву и образующие природные, хозяйственныеи смешанные очаги. Природные очаги обусловлены наличием инфекции среди диких животных. Они расположены преимущественно в лесной, лесостепной и лесотундровой зонах. Природные очаги могут быть обнаружены в приозерных котловинах, зарослях тростника, заболоченных травяных участках лесов, на сырых вырубках. Основными носителями инфекции в природных очагах являются мелкие влаголюбивые грызуны и насекомоядные: полевки, полевые мыши, серые крысы, землеройки, ежи. В хозяйственных очагах, которые могут возникать как в сельской местности, так и в городах, носителями инфекции являются крупный рогатый скот, свиньи, овцы, лошади, собаки и крысы, а также пушные звери клеточного содержания (лисицы, песцы, нутрии). Главное эпидемиологическое значение в распространении инфекции имеют очаги, возникающие в животноводческих хозяйствах и на производствах по убою скота и первичной обработке животного сырья. У животных-носителей лептоспиры длительно сохраняются в извитых канальцах почек и выделяются с мочой в течение нескольких месяцев. Больной человек источником инфекции не является. Основные пути передачи инфекции — алиментарный (вместе с пищей) и контактный. Заражение лептоспирозом происходит при купании и употреблении воды из естественных и искусственных водоемов, пищевых продуктов, через предметы быта и производства, загрязненные инфицированной мочой. Чаще лептоспирозом болеют лица, работающие на заболоченных лугах, в рисоводческих и животноводческих хозяйствах, на мясокомбинатах. Возможно заражение лептоспирозом работников собачьих питомников и владельцев собак. Лептоспирозу свойственна летне-осенняя сезонность, однако единичные случаи регистрируются круглый год. Перенесенное заболевание вызывает стойкий типоспецифический иммунитет, вследствие чего возможны повторные заболевания, вызванные различными штаммами лептоспир. Лептоспироз распространен повсеместно; случаи заболевания зарегистрированы на всех континентах, кроме Антарктиды. Однако уровень заболеваемости во многом зависит от природно-климатических условий: он наиболее высок в районах с густой речной сетью, частыми летними паводками, а также с высокой плотностью сельскохозяйственных животных. На территории России существуют три основных района, неблагополучных по лептоспирозу и характеризующихся устойчивой тенденцией к росту заболеваемости: Северо-Западный, Центральный и Северо-Кавказский. Каждый тип паразитических лептоспир имеет свой круг хозяев-животных, что в определенной степени придает эпидемиологические особенности некоторым лептоспирозным заболеваниям.
Патогенез и патанатомия Лептоспироз — острая, циклически протекающая распространенная инфекция. Различают пять фаз инфекционного процесса. Первая фаза (первая неделя после заражения, соответствующая инкубационному периоду) — внедрение и размножение лептоспир (кратковременная первичная лептоспиремия). Из области входных ворот (кожа, слизистые), не вызывая воспаления в месте внедрения, возбудитель с лимфой попадает в кровь. Эта стадия длится около недели и клинически проявляется симптомами интоксикации. Продукты распада лептоспир действуют на вегетативную нервную систему, поражают капилляры, повышая проницаемость сосудистой стенки. Лептоспиры могут преодолевать гематоэнцефалический барьер, при этом развивается распространенная гиперплазия (увеличение) лимфатических узлов. В первые дни болезни возбудитель может быть обнаружен и в спинномозговой жидкости. Лептоспиры вместе с кровотоком проникают во внутренние органы (преимущественно в печень, почки, селезенку, легкие, надпочечники и другие органы), где и происходит их размножение — это является началом второй стадии. Вторая фаза (вторая неделя болезни) — вторичная лептоспиремия и распространение инфекции, обусловливающие накопление токсичных продуктов и проникновение лептоспир в межклеточные пространства органов и тканей, особенно в печени, почках, нервной системе. Клинически эта фаза соответствует начальному периоду болезни. Поражение печени является наиболее характерным для лептоспироза признаком. При легких формах заболевания нарушение функционального состояния печени выявляется путем биохимических исследований. При тяжелых формах заболевания наблюдается желтуха, связанная с развитием паренхиматозного гепатита и с повышением гемолиза (распада эритроцитов) вследствие токсического воздействия лептоспир на эритроциты. При лептоспирозе закономерно поражаются почки по типу очагового геморрагического нефрита. Клиническим выражением этого являются уменьшение мочевыделения, появление в моче белка и крови. В тяжелых случаях развивается острая почечная недостаточность. В моче длительное время обнаруживаются лептоспиры. Волнообразность течения с наличием повторных лихорадочных волн объясняется антигенными особенностями лептоспир, способностью их к последовательной смене антигенных свойств. В третьей фазе (третья неделя болезни) токсинемия, панкапилляротоксикоз (всеобщий капилляротоксикоз) и органные нарушения достигают максимального развития. В результате повреждения эндотелия и повышения сосудистой проницаемости развиваются множественные кровоизлияния. Возникают дегенеративные и некротические изменения в клетках печени и эпителии почечных канальцев, следствием чего являются желтуха и признаки почечной недостаточности ренального типа. Характерно развитие гемолиза, у ряда больных отмечается менингит. При тяжелом течении болезни наблюдается картина шока с возможным летальным исходом. Менингеальные явления, наблюдаемые нередко при лептоспирозе, связаны с проникновением лептоспир в спинномозговую жидкость и воздействием их и продуктов их распада на нервную систему. Исследование спинномозговой жидкости в таких случаях выявляет изменения, свойственные серозному менингиту. При вскрытии умерших от тяжелой формы лептоспироза обнаруживаются желтушное окрашивание кожных покровов, слизистых оболочек и внутренних органов, множественные кровоизлияния в различных органах и тканях. Наблюдается инфильтрация сосудистой стенки, ожирение эндотелия. Это приводит к неравномерному распределению крови во внутренних органах, ломкости сосудов, повышению их проницаемости. Печень отечная, увеличена в объеме. При тканевом исследовании ее обнаруживаются отек межуточной ткани, дистрофические изменения цитоплазмы, очаги омертвения с явлениями элементов восстановления. В пространствах Диссе обнаруживается серозно-кровянистая жидкость. Некротические изменения в печени при лептоспирозе выражены не столь значительно, как при вирусном гепатите. Почки увеличены, на разрезе их поверхность красного цвета, под капсулой и в ткани определяются кровоизлияния. Наиболее выраженные изменения наблюдаются в канальцевом аппарате — просвет извитых канальцев расширен, в клетках отмечаются дегенеративные и некротические изменения. Клубочки поражены меньше, чем канальцы. Тяжелые поражения почек являются обычно причиной смертных исходов. В скелетной мускулатуре и особенно в икроножных мышцах имеются кровоизлияния. Лимфатические узлы, а иногда и селезенка увеличены в размерах, капсула их напряжена. При тканевом исследовании выявляются переразвитие клеток ретикулоэндотелиальной системы, кровоизлияния. В центральной нервной системе обнаруживаются дегенеративные изменения вещества мозга и воспалительные изменения со стороны мозговых оболочек. Воспалительно-дистрофические изменения описаны в миокарде и легких. В четвертой фазе (3—4-я неделя болезни) при благоприятном течении формируется нестерильный иммунитет, нарастает количество различных антител, активизируется процесс поглощения и разрушения лептоспир, однако они еще могут сохраняться в межклеточных пространствах (до 40-го дня болезни). Наблюдается обратное развитие органных и функциональных расстройств. Эта фаза соответствует периоду угасания клинических проявлений. В пятой фазе (5—6-я неделя болезни) формируется стерильный иммунитет к соответствующему типу лептоспир, происходит восстановление нарушенных функций, наступает выздоровление, редко сопровождающееся остаточными явлениями.
Клиническая картина Течение лептоспироза определяется типом лептоспиры и зависит прежде всего от степени болезнетворности возбудителя, а также от инфицирующей дозы и реактивности организма. Варианты клинических проявлений болезни чрезвычайно многообразны — от легких кратковременных форм до тяжелейших, приводящих к смерти. Основным критерием тяжести являются степень интоксикации (в том числе высота лихорадки), выраженность поражения различных органов и систем (особенно почек, печени, центральной нервной системы, сердца, надпочечников), геморрагические (кровоизлияния) проявления. Наиболее полной представляется классификация лептоспироза, основанная на различиях в клинической картине и механизмах развития. Формами лептоспироза являются: желтушная форма и безжелтушная форма. По тяжести заболевания выделяют легкую, среднетяжелую и тяжелую формы заболевания, а по течению — острую без рецидивов и острую с рецидивами, а также острую и затяжную форму с осложнениями. Осложнения могут быть специфическими (острая почечная недостаточность, острая почечно-печеночная недостаточность, уремическая кома, кровотечения (внутренние и наружные), миокардит, острая сердечно-сосудистая недостаточность, отек мозга, ириты, иридоциклиты, помутнение стекловидного тела) и неспецифическими (вторичными): гнойные паротиты, отиты, гипостатические пневмонии и др. Исходом заболевания может быть выздоровление с обратимыми изменениями (длительная астения, некронефроз, ириты, иридоциклиты, помутнение стекловидного тела и др.) и необратимыми (потеря остроты зрения). Причиной смертного исхода обычно являются: острая почечная недостаточность; острая почечно-печеночная недостаточность; кровотечения; острая сердечно-сосудистая недостаточность; отек мозга. Инкубационный период колеблется от 3 до 30 дней, составляя в среднем 6—14 дней. Клинические проявления лептоспироза широко варьируют. В течении болезни выделяют начальный (лихорадочный) период, периоды разгара (органных поражений) и выздоровления. Начальный период (продолжительностью около 1 недели) проявляется общетоксическим синдромом и признаками распространения инфекции. Начало болезни острое, часто внезапное, температура тела с ознобом повышается до высоких цифр (39–40 °C), возникают сильная головная боль, слабость и головокружение. Частым симптомом являются интенсивные боли в мышцах, наиболее выражены боли в икроножных мышцах, их прощупывание болезненно. Лихорадка сохраняется в течение 5–8 дней, имеет постоянный или ремиттирующий характер и снижается критически или по типу ускоренного лизиса. Больные в это время обычно возбуждены, беспокойны. Характерны одутловатость лица, покраснение лица и шеи, расширение сосудов склер и конъюнктивы, часто появляются герпетические высыпания на губах и крыльях носа с геморрагическим (кровяным) пропитыванием. С 3—6-го дня болезни на коже туловища и конечностей выявляется многообразная сыпь. При тяжелом течении могут обнаруживаться кровоизлияния на склерах и конъюнктиве, в подмышечных и паховых областях, в локтевых сгибах. Высыпания, по данным различных авторов, отмечаются в 12–85 % случаев, однако в последнее время этот симптом стал наблюдаться гораздо реже. Сыпь держится от нескольких часов до 7—10 дней. При тяжелом течении лептоспироза могут наблюдаться признаки дыхательной недостаточности с появлением кровохарканья и развитием геморрагического отека легких. Характерны учащение сердцебиения и понижение артериального давления, глухость сердечных тонов. В тяжелых случаях могут появляться признаки сердечно-сосудистой недостаточности. Язык со 2—3-го дня болезни становится сухим, покрывается бурым налетом. При прощупывании живота определяется увеличенная и слегка болезненная печень, а у трети больных отмечается увеличение селезенки. У большинства больных в этот период выявляются признаки поражения почек — положительный симптом Пастернацкого, уменьшение мочеотделения, белок, лейкоциты, эритроциты и гиалиновые цилиндры в моче. У 10–20 % больных наблюдается ряд симптомов менингита в виде усиления головной боли, головокружений, тошноты и рвоты, симптомов Кернига и Брудзинского. В спинномозговой жидкости могут обнаруживаться лептоспиры. В крови отмечается повышение уровня нейтрофильных лейкоцитов, значительное увеличение СОЭ. В конце 1-й — начале 2-й недели болезни температурная реакция и общетоксические проявления начинают уменьшаться; одновременно прогрессируют органные расстройства. При тяжелой форме болезни развиваются печеночная и почечная недостаточность, геморрагический синдром. Желтуха, проявляющаяся у части больных уже в течение первой недели, прогрессирует, окраска кожных покровов приобретает яркий шафрановый оттенок, возникают множественные кровоизлияния в кожу и слизистые. По мере нарастания желтухи еще более увеличиваются печень и селезенка. Биохимические исследования выявляют повышение уровня билирубина в крови и другие явления. Белково-осадочные пробы обычно не изменяются. Характерный признак периода разгара лептоспироза — поражение почек. У больных отмечается снижение мочевыделения вплоть до его отсутствия, нарастает количество в ней белков, в осадке мочи в большом количестве выявляются лейкоциты, эритроциты, клетки почечного эпителия. Характерны повышенный уровень калия, нарастание уровня остаточного азота и креатинина в крови, ацидотические сдвиги кислотно-основного состояния. Из мочи могут быть выделены возбудители. Прогрессирующая почечная недостаточность — одна из основных причин гибели больных. Наряду с симптомами поражения внутренних органов усиливаются проявления геморрагического синдрома как в виде кровоизлияний в кожу, так и в виде желудочных, кишечных и маточных кровотечений. У части больных выявляется кровохарканье, прогрессируют признаки дыхательной недостаточности в результате кровоизлияний в легкие. Нередко возникают кровоизлияния в мышцы, особенно поясничные и брюшной стенки, симулирующие картину острого живота. Характерно усиление признаков анемии. На фоне своевременной и соответствующей терапии при благоприятном течении болезни с 3-й недели заболевания признаки органных расстройств начинают регрессировать. Однако у ряда больных возникают осложнения, проявляющиеся поражением глаз (ирит, увеит, иридоциклит, помутнение стекловидного тела), сохраняющиеся в течение нескольких недель. Длительное время сохраняется анемия. У части больных (треть случаев) возникают рецидивы болезни, протекающие с менее значительными токсическими и органными проявлениями. У некоторых больных в связи с повторными рецидивами лихорадка приобретает волнообразный характер. Продолжительность болезни составляет в среднем 3–4 недели, при наличии рецидивов может удлиняться до 2–3 месяцев. Прогноз при соответствующей терапии благоприятный, летальные исходы наблюдаются в 1–3 % случаев, однако известны эпидемические вспышки с очень высокой смертностью (до 20–30 % и более).
Диагностика и дифдиагностика Распознавание лептоспироза основано на тщательном анализе данных эпидемиологического анамнеза и правильной оценке результатов клинико-лабораторного обследования. Специфическая диагностика включает методы обнаружения возбудителя и серологические тесты. В начальный период болезни лептоспиры могут быть обнаружены в крови и спинномозговой жидкости при исследовании методом «раздавленной капли» в темнопольном микроскопе или при посеве 0,2–0,5 мл крови на 5—10 мл специальной питательной среды при температуре 30 °C, а также путем заражения лабораторных животных. В период разгара болезни и в более поздние сроки лептоспиры могут быть выделены также и из мочи больных. В органах погибших от лептоспироза возбудители наиболее часто обнаруживаются в почках. Диагноз подтверждается на основе постановки титра реакции агглютинации в сыворотке (выше 1:2000). Лептоспироз дифференцируют в начальный период с гриппом (см.), тифо-паратифозными заболеваниями, геморрагическими лихорадками (см.), менингитами (см.), а в период разгара — с желтушными формами вирусных гепатитов (см.), малярией (см.), желтой лихорадкой (см.) и иерсиниозами (см.).
Лечение Больные лептоспирозом подлежат обязательной госпитализации в инфекционные стационары. Для устранения причины заболевания проводят лечение пенициллином, который вводят внутримышечно 6 раз в сутки в дозе 6—12 млн ЕД в зависимости от формы и тяжести болезни на протяжении 7—10 суток. При тяжелых формах болезни дополнительно проводят лечение противолептоспирозным гамма-глобулином, содержащим антитела к наиболее распространенным сероварам лептоспир. Его вводят внутримышечно в первые сутки в дозе 10–15 мл, в последующие два дня — по 5—10 мл. Раннее применение гамма-глобулина снижает частоту и выраженность органных поражений. Для прекращения дальнейшего развития заболевания в терапию включают дезинтоксикационные растворы, диуретики, средства, повышающие устойчивость сосудов и свертывание крови, антигистаминные препараты и анальгетики. При тяжелом течении болезни назначают глюкокортикостероиды (преднизолон в дозе от 40–60 до 120 мг в сутки и более). Важное значение имеет профилактика ассоциированной инфекции, а также тщательный уход. При выраженной анемии назначают гемотерапию (переливание кровезаменителей). Выздоравливающие подлежат наблюдению в течение 6 месяцев с участием инфекциониста, нефролога, офтальмолога и невропатолога.
Профилактика Для предупреждения лептоспироза необходимо проведение комплекса гигиенических и ветеринарных мероприятий. Запрещается употребление сырой воды из открытых водоемов и купание в малопроточных водоемах, доступных сельскохозяйственным животным. При мелиоративных и гидротехнических работах необходимо пользоваться защитной одеждой и обувью. В хозяйственных очагах необходимы дератизационные мероприятия и обязательная изоляция и лечение больных животных. Контингенты высокого риска (животноводы, ветеринары, рабочие мясокомбинатов, ассенизаторы, дератизаторы и др.) подлежат вакцинации убитой лептоспирозной вакциной. Эффективна вакцинация сельскохозяйственных животных.
ЛИМФАДЕНИТ
ОпределениеЛимфаденит — острое или хроническое воспаление лимфатических узлов, чаще всего вследствие поступления с притекающей лимфой элементов, вызывающих воспалительную реакцию (микроорганизмов, их токсинов, продуктов тканевого распада, мельчайших инородных тел и т. д.).Лимфаденит чаще наблюдается при острых, подострых и хронических воспалительных процессах (фурункул, язва, гнойная рана, свищи, кариес зуба и др.), реже при общих инфекционных заболеваниях. Лимфаденит обычно сопровождается увеличением лимфатических узлов, однако не всякое увеличение означает их воспаление. В некоторых случаях, особенно при множественном распространенном увеличении лимфатических узлов, при процессах, близких к бластоматозному росту (см. Лейкозы, Лимфогранулематоз), или при различных эндокринных заболеваниях, при «лимфатическом статусе» имеет место не лимфатический процесс, а переразвитие лимфаденоидной ткани узлов.
Патанатомия При остром лимфадените в начальной фазе структурные изменения сводятся к покраснению кожи над увеличенным лимфатическим узлом, расширению синусов и слущиванию их эндотелия. Далее следует нарастающее серозное пропитывание паренхимы узла, разрастание элементов лимфоидной ткани и лейкоцитарная инфильтрация. В дальнейшем развитии воспалительного процесса жидкость может принять гнойный характер. В зависимости от интенсивности фактора, вызвавшего лимфаденит, от продолжительности его воздействия и от собственной реакции организма процесс быстро проходит все эти фазы либо ограничивается какой-либо. В соответствии с достигнутой фазой различают формы острого лимфаденита: — простой или катаральный; — гиперпластический; — гнойный. Некоторые особенности патологоанатомической картины обусловливают возникновение и других форм лимфаденита: при процессе, остановившемся в стадии экссудации, но с обильным пропотеванием фибрина — фибринозный лимфаденит; при быстром и обширном омертвении лимфатического узла — некротический лимфаденит. В качестве особой формы выделяют геморрагический лимфаденит, при котором значительное нарушение проницаемости капилляров ведет к имбибиции (пропитыванию) лимфатического узла кровью (сибиреязвенный, чумной лимфаденит).
Специфическое поражение кожи при лимфадените
В начальных фазах, т. е. при менее тяжелых формах (простой и гиперпластический лимфаденит), воспалительный процесс способствует обратному развитию, но может принять и хроническое течение. При формах, характеризующихся преобладанием явлений повреждения (гнойный, некротический лимфаденит), наступает гибель лимфатического узла и его гнойное расплавление или, в зависимости от характера инфекции, гнилостный распад. Образовавшееся гнойное скопление может довольно длительно оставаться в пределах капсулы лимфатического узла и ограничиваться гнойной мембраной, образуя абсцесс (см.). В других случаях происходит быстрое разрушение капсулы лимфатического узла и инфицированное содержимое прорывается в окружающую клетчатку. При начальных формах лимфаденита воспалительный процесс чаще не выходит за пределы капсулы лимфатического узла, ограничиваясь ее серозной инфильтрацией. При гнойном же лимфадените обычно развивается и периаденит — воспаление окружающей узел клетчатки, в которой наблюдается гиперемия (покраснение), отек, лейкоцитарная инфильтрация. Гнойный периаденит возникает главным образом как следствие прорыва гноя из лимфатического узла. В зависимости от длительного течения лимфаденита гнойный периаденит принимает форму либо абсцесса, окружающего остатки лимфатического узла, либо флегмоны (см.), так называемой аденофлегмоны (см.), примером которой может служить ангина Людовика (см.).
Патогенез Инфекция поступает в регионарные лимфатические узлы с током лимфы, оттекающей из первичных гнойных очагов. Лимфаденит может возникнуть и без предшествующего лимфангита, причем первичный очаг бывает настолько ничтожен и так быстро заживает, что к моменту возникновения лимфаденита обнаружить место вхождения инфекции уже не всегда удается. В редких случаях возможно попадание инфекции в лимфатические узлы вместе с кровотоком. Лимфаденит иногда возникает и вследствие непосредственного перехода воспалительного процесса с тканей, окружающих узел. Лимфаденит следует рассматривать как проявление барьерной функции лимфатической системы, ограничивающей дальнейшее распространение инфекции и ее токсинов. Вместе с тем лимфаденит сам по себе может стать исходным пунктом для развития тяжелого гнойного процесса (аденофлегмона, сепсис).
Клиническая картина Острый лимфаденит Острый лимфаденит начинается с боли в области пораженных регионарных узлов и их увеличения. При серозной и гиперпластической формах увеличенные лимфатические узлы хорошо прощупываются, болезненность их незначительна, общие явления могут отсутствовать или быть маловыраженными. При переходе процесса в нагноение боли увеличиваются, в области регионарного лимфатического узла появляется плотное болезненное уплотнение, повышается температура тела, исчезает аппетит. Малозаметные в начале заболевания покраснение и отек в этой области резко увеличиваются, контуры лимфатического узла утрачивают четкость, узел становится малоподвижен (периаденит). Больной щадит пораженную область, так как движения усиливают боли (особенно сильной болезненностью отличается паховый гонорейный лимфаденит). Вскоре в области инфильтрата (воспалительного образования) начинается флюктуация вследствие гнойного расплавления лимфатического узла. Если абсцесс лимфатического узла не будет вскрыт вовремя, гной прорывается наружу или просачивается в глубину и по окружности, в процесс вовлекаются окружающие ткани. Возникает аденофлегмона, признаками которой служат быстро нарастающий плотный и болезненный инфильтрат в подкожной и межклеточной клетчатке, иногда с отдельными очагами размягчения, а при гнилостных формах — с газовой крепитацией (похрустыванием). Возможен переход нагноительного процесса на соседние лимфатические узлы. Высокая температура, учащенный пульс, озноб указывают на прогрессирующее гнойное воспаление. Общие явления особенно выражаются при стрептококковой и гнилостной инфекции.
Хронический лимфаденит Хронический неспецифический лимфаденит развивается при инфекции, вызванной возбудителями со слабой способностью к заражению при инфицированной (импетигинизированной) экземе у детей, при кожных проявлениях экссудативного диатеза, пиодермии и др. Причиной развития заболевания также могут быть повторные слабые инфекционные раздражения регионарного лимфатического аппарата вследствие частых поверхностных повреждений кожи в связи с профессиональной травмой. Нередко хронический лимфаденит связан с хроническим воспалением слизистой носа или хроническим отитом. Хронический лимфаденит специфического происхождения обычно имеет туберкулезное происхождение и поражает чаще шейные лимфатические узлы; реже бывает универсальное поражение лимфатических узлов различных областей тела, включая бронхиальные и забрюшинные. Хроническое увеличение лимфатических узлов наблюдается при врожденном и приобретенном сифилисе. Клиническая картина хронического лимфаденита характеризуется увеличением лимфатических узлов различной консистенции и подвижности. При неспецифической инфекции преобладают отдельные, отчетливо прощупывающиеся подвижные увеличенные лимфатические узлы, обычно безболезненные при прощупывании. При туберкулезе чаще прощупываются пакеты средней плотности узлов; при сифилисе увеличенные лимфатические узлы вследствие склероза отличаются большей плотностью.
Осложнения Из осложнений острого гнойного лимфаденита, кроме периаденита, абсцесса и аденофлегмоны, возможно развитие общей инфекции, образование тромбофлебитов смежных вен, разъедание стенок кровеносных сосудов с последующим кровотечением. При прорыве гноя из пораженных гноем трахеобронхиальных лимфатических узлов в трахею и пищевод образуются хронические бронхопульмональные или пищеводные свищи. Нагноение при хронических неспецифических лимфаденитах наблюдается редко и рассматривается как переход в острый лимфаденит вследствие вспышки дремлющей инфекции. Казеозное расплавление лимфатических узлов при туберкулезном лимфадените протекает обычно при отсутствии выраженных общих явлений (нормальная или повышенная температура, удовлетворительное самочувствие).
Диагностика и дифдиагностика Диагноз поверхностного лимфаденита не представляет затруднений. Распознать лимфаденит, исходящий из глубоких лимфатических узлов, бывает трудно. При глубоком лимфадените конечностей отмечаются выраженные боли, отек, иногда свойственное только для данного заболевания положение конечностей, зависящее от той или иной локализации глубоких регионарных лимфатических узлов, выраженные общие явления. Диагноз уточняется, если удается обнаружить первичный воспалительный очаг, послуживший источником развития лимфаденита. Диагноз может представить трудности. Иногда приходится решать вопрос о происхождении хронического лимфаденита (туберкулез, сифилис, лимфогранулематоз), что имеет большое значение для правильного и наиболее эффективного лечения. Важнейшее значение имеет дифференциальный диагноз лимфаденита и метастазов злокачественной опухоли в лимфатические узлы. Бугристая поверхность инфильтрата при некоторых формах хронического лимфаденита и периаденита может вызвать подозрение на новообразование. В этих случаях иногда приходится использовать метод диагностической пункции лимфатического узла или биопсии. Исходом хронического лимфаденита неспецифического происхождения чаще бывает рубцевание и постепенное сморщивание и атрофия лимфатической ткани. Лимфоузлы уменьшаются в размерах и становятся плотными на ощупь. В некоторых случаях с исчезновением первичного очага, поддерживающего состояние хронического воспаления регионарных узлов, процесс в узлах заканчивается излечением. Туберкулезный лимфаденит может закончиться процессом обызвествления и рассасывания. Разрастание соединительной ткани в лимфатических узлах конечностей при хроническом лимфадените, особенно если этому сопутствует запустение лимфатических сосудов, может повлечь за собой стойкий лимфостаз с развитием плотного отека конечностей и, нередко, слоновости.
Лечение и профилактика Острый лимфаденит Лечение серозной формы острого или подострого лимфаденита, пока нет перехода в нагноение, — консервативное. Рекомендуются покой, тепло, асептические повязки, антибиотикотерапия с учетом чувствительности микробной флоры основного очага. Существует в практике блокада очага путем введения в ткани вокруг инфильтрата и в толщу очага пенициллина 100–150 млн ЕД с новокаином 0,25 %-ным 10–15 мл. Одновременно необходимо лечение первичного очага (вскрытие гнойника, послужившего причиной лимфаденита). При гнойных лимфаденитах, особенно осложненных прогрессирующим флегмонозным или некротическим процессом, показан разрез и удаление гноя, омертвевших тканей и дренирование вскрытой гнойной полости, антибиотики, сульфаниламиды. Лечение аденофлегмоны (см. Флегмона).
Хронический лимфаденит Лечение хронического лимфаденита должно быть прежде всего направлено на ликвидацию основного заболевания — источника хронического воспаления регионарных лимфатических узлов. В случаях, когда обнаружить причины и источник лимфаденита не удается, показано общеукрепляющее лечение и местная рентгенотерапия. Оперативное лечение (удаление поврежденных лимфатических узлов) не показано, так как оно нередко приводит к лимфостазу (замедлению тока лимфы) с хроническим плотным отеком конечности и развитием слоновости. Лечение специфических лимфаденитов см. в соответствующих разделах сифилис, туберкулез. Для предупреждения лимфаденита необходимо правильное и своевременное лечение первичных очагов инфекции (своевременное вскрытие и дренирование гнойных очагов и др.).
ЛИМФОГРАНУЛЕМАТОЗ
ОпределениеЛимфогранулематоз (синонимы: болезнь Ходжкина, злокачественная гранулема, хронический злокачественный лимфоматоз) — злокачественное новообразование лимфоидной ткани, характеризующееся ее гранулематозным строением с наличием гнойных клеток Березовского-Штернберга, поражением лимфатических узлов и внутренних органов.Лимфогранулематоз встречается в любом возрасте, чаще у мужчин; подъем заболеваемости отмечается в возрасте от 20 до 35 и старше 50 лет.
Этиология, патогенез и патанатомия Причины возникновения и развития лимфогранулематоза до конца не выяснены. В XX в. господствовало представление о туберкулезной природе лимфогранулематоза. Обсуждаются проблемы вирусной и генетической теории, однако в соответствии с Международной классификацией опухолей кроветворной и лимфоидной ткани (ВОЗ, 1976 г.) лимфогранулематоз считают разновидностью злокачественной лимфомы. В настоящее время продолжают рассматриваться вирусная, иммунная и наследственная теории происхождения лимфогранулематоза. Многие исследователи придерживаются вирусной теории, однако присутствие вируса Эпштейна-Барр у больных с лимфогранулематозом, по мнению других, не доказывает его влияния на возникновение заболевания. В механизме развития лимфогранулематоза большое значение придают иммунологическим изменениям и прежде всего нарушению функции Т-лимфоцитов, что выражается в подавлении клеточного иммунитета. Апоптоз (программированная гибель клетки) — это активная форма гибели клетки, являющаяся результатом реализации ее генетической программы или ответом на внешние силы и требующая затрат и образования макромолекул снова. Апоптоз является одним из ключевых процессов, определяющих формирование антигенспецифической составляющей иммунной системы и в значительной степени — реализацию ее эффекторных функций. Апоптоз — сложный механизм, в осуществлении которого участвует огромное количество факторов, одним из которых является определенный белок, играющий одну из ведущих ролей во включении механизма апоптоза. Его присутствие приводит к гибели клеток с нарушением в геноме, тогда как при мутациях гена такие клетки выживают и часто становятся источником злокачественного роста. Злокачественная трансформация является постепенным процессом, который приводит к образованию клеток, обладающих способностью к неконтролируемому росту и заражению. Для формирования опухоли, в зависимости от ее происхождения, имеют значение мутации более сотни различных генов. Особую роль в развитии рака играют дефекты генов, контролирующих повреждения ДНК и клеточный рост. Повреждения ДНК могут возникать спонтанно в процессе клеточного роста либо провоцироваться различными внешними воздействиями. Специфические белки вируса Эпштейна-Барр приводят к ослаблению апоптоза и коррелируют с прогрессированием и метастазированием опухолей и их устойчивостью к терапии. Лимфогранулематоз, встречающийся у близких родственников, предполагает семейный аутоиммунный лимфопролиферативный синдром. Первым проявлением лимфогранулематоза обычно является увеличение шейных или надключичных лимфатических узлов. Реже первичный очаг может возникнуть в других группах периферических и внутренних лимфатических узлов, а также в некоторых органах, например в легких, желудочно-кишечном тракте. Макроскопически пораженные лимфатические узлы увеличены, сероватого или серо-розового цвета на разрезе, иногда спаяны в бугристые скопления. В ткани лимфоузлов нередко встречаются фиброзные прослойки, разделяющие ее на отдельные узелки с заметными, иногда неправильной формы желтоватыми участками некроза. Капсула лимфоузлов, как правило, сохранена, ее прорастание может наблюдаться лишь в поздних стадиях процесса, особенно в тех случаях, когда лимфогранулематозная ткань становится неотличима от низкодифференцированной саркомы (см.) и инфильтрирует (проникает) окружающие ткани и органы.
Лимфогранулематоз
Лимфогранулематоз. Увеличение паховых лимфоузлов
Изменения селезенки в типичных случаях представлены сероватыми опухолевыми узелками, проступающими на темно-красном фоне и придающими ей характерный пестрый вид, получивший классическое определение «порфирная селезенка» за сходство со шлифом камня порфира. В ткани селезенки очаговые проявления лимфогранулематоза сочетаются с лимфоидной гиперплазией (увеличенным образованием, особенно в начальных стадиях) и усиленным разрушением эритроцитов. Макроскопически при лимфогранулематозе легких различают диффузно-инфильтративную (медиастинально-прикорневую), крупно- и мелкоочаговую и массивную (склеротическую и пневмониоподобную) формы. В процесс могут вовлекаться плевра, крупные бронхи, трахеи. Массивный пневмониоподобный лимфогранулематоз может сопровождаться образованием каверн (полостей в легочной ткани). Лимфогранулематоз желудочно-кишечного тракта носит главным образом вторичный характер в результате распространения процесса с пораженных забрюшинных и брыжеечных лимфоузлов. Однако в ряде случаев встречается первичное поражение желудочно-кишечного тракта, при котором опухолевые разрастания вначале располагаются преимущественно на месте групповых и единичных лимфоидных фолликулов. В дальнейшем они проникают в мышечную и слизистую оболочку с последующим ее изъязвлением, кровотечением, а иногда с перфорацией стенки и развитием перитонита. При исследовании печени лимфогранулематозные изменения обнаруживаются не всегда даже при резком увеличении массы органа; различают мелко-, крупноочаговое и распространенное поражение. В патологоанатомической картине лимфогранулематоза почек преобладают изменения в межуточной ткани с вторичными атрофическими и дистрофическими изменениями в паренхиме органа. Клеточные изменения нервной системы при лимфогранулематозе развиваются чаще всего в результате перехода процесса с пораженных костей черепа, позвонков или лимфатических узлов. Попадание опухолевых клеток лимфогранулематоза в мозг с кровотоком отмечается редко.
Пунктат печени при лимфогранулематозе печени
Среди изменений костей при лимфогранулематозе, по некоторым данным, большинство составляют: поражение позвоночника, в котором определяются одиночные, реже множественные очаги разрушения тел позвонков. На втором месте по частоте стоит поражение ребер, затем грудины и тазовых костей. Лимфогранулематоз трубчатых костей и костей черепа наблюдается реже. При лимфогранулематозе могут также поражаться миндалины, сердце, молочные железы, щитовидная железа, глаза, яичники, матка, яички, серозные оболочки и другие, которые вовлекаются в патологический процесс в терминальной (конечной) стадии болезни или при распространении опухолевого процесса. Микроскопическая картина лимфогранулематоза характеризуется разрастанием лимфоидных и плазматических клеток, гистоцитов, фибробластов, эозинофильных и нейтрофильных лейкоцитов, разрастанием клеток эндотелия сосудов, что в совокупности создает пеструю картину, напоминающую по виду строение грануляционной ткани. На фоне гранулематоза обнаруживаются гигантские клетки Березовского-Штернберга, основными отличительными особенностями которых являются гигантский размер. При разных структурных типах лимфогранулематоза они встречаются в различном количестве, при этом в терминальной (конечной) стадии они отличаются многообразием и гиперхромией ядер. Высокая специфичность для лимфогранулематоза клеток Березовского-Штернберга послужила основанием к тому, чтобы называть их диагностическими клетками. При лимфогранулематозе встречаются также клетки Ходжкина — гигантские одноядерные клетки, являющиеся, по некоторым данным, предшественниками клеток Березовского-Штернберга, но лишенные признаков деления ядра. В соответствии с чисто логической классификацией по количественному соотношению клеточных элементов и характеру склероза выделяют четыре тканевых типа лимфогранулематоза: — лимфогистиоцитарный; — нодулярный склероз; — смешанно-клеточный; — ретикулярный вариант и диффузный фиброз. Нодулярный склероз — самый распространенный тканевый тип лимфогранулематоза (до 78 %), отличается от других наличием коллагенового фиброза. При гистологическом исследовании видно, что паренхима лимфатического узла разделена на нодулярные (узловые) участки, ограничена плотными тяжами фиброзной ткани. Степень фиброза лимфатического узла варьирует. Смешанно-клеточный вариант лимфогранулематоза встречается в 25–50 % случаев развития заболевания. Характеризуется выраженным клеточным многообразием, пролиферацией эозинофилов, нейтрофилов, макрофагов, плазматических клеток, лимфоцитов, значительным количеством клеток Березовского-Штернберга и Ходжкина. Каолиновый фиброз не определяется. Могут наблюдаться небольшие очаги некроза. Вариант лимфогранулематоза с подавлением лимфоидной ткани подразделен на диффузный фиброз и ретикулярную форму. При тканевом исследовании диффузный фиброз характеризуется полным стиранием структуры лимфатического узла. Ретикулярная форма отмечается обилием клеток Березовского-Штернберга с выраженным многообразием, который касается их формы, размеров, формы ядер. В лимфатических узлах при всех вариантах лимфогранулематоза, за исключением вариантов с подавлением лимфоидной ткани, присутствует большое число плазмоцитарных моноцитов. Они располагаются в основном по периферии лимфоидных скоплений. Цитологическая диагностика лимфогранулематоза основывается на обнаружении различных типов клеток Березовского-Штернберга. Иммунный профиль сильно варьирует.
Клиническая картина Клиника лимфогранулематоза характеризуется динамичностью течения, многообразием симптомов и форм, обусловленных поражением различных органов и групп лимфатических узлов. Острый лимфогранулематоз протекает с высокой температурой, увеличением лимфатических узлов, селезенки и печени, выраженной анемией, нередко с положительной реакцией Пауля-Буннелля. Возможен вариант острого лимфогранулематоза, проявляющийся только высокой температурой в сочетании с астенией, похудением, анорексией, болями в животе, анемией и резко ускоренной СОЭ. Переходные по характеру клинического течения формы ранее рассматривались как подострый лимфогранулематоз. В большинстве случаев наблюдается хроническое течение лимфогранулематоза с ограниченным поражением одной группы лимфатических узлов. Заболевание часто начинается с появления в какой-то определенной области малоболезненных лимфоузлов плотноэластичной консистенции, затем присоединяются быстрая утомляемость, лихорадка волнообразного характера с ознобами, потливостью, кожным зудом. В других случаях эти общие симптомы предшествуют выявлению патологически измененных лимфатических узлов. В первую очередь увеличиваются шейные и надключичные лимфоузлы, чаще справа, после чего поражаются медиастинальные(средостения). Левые шейные лимфоузлы чаще являются «пусковой зоной» для последующего поражения медиастинальных, аксиллярных, паховых и забрюшинных лимфоузлов. Иногда с самого начала лимфогранулематозный процесс охватывает несколько областей. Распространенные лимфоузлы вначале более эластичны, затем они становятся плотными и сливаются друг с другом, образуя плотные опухолевые образования, которые, однако, редко спаиваются с кожей. Образование некрозов происходит только при присоединении бактериальной инфекции. При поражении узлов средостения часто возникают явления сдавливания (кашель, боли в грудной клетке, одышка, синюшность, отек шеи и конечностей, развитие венозной сыпи на коже груди). При мезентериальной форме лимфогранулематоза развиваются громадные опухоли в брюшинной области. Иногда лимфоузлы не определяются, но возникают метастазы, боли, чувство онемения в поясничной области, высокая температура и другие проявления интоксикации. При изменениях в подвздошных узлах могут наблюдаться признаки нарушения лимфооттока, чувство тяжести в ногах, отечность голени и стоп. Лимфогранулематоз желудка и кишечника протекает бурно, с болями приступообразного характера, поносами, непроходимостью, с выраженной интоксикацией и обезвоживанием. Селезенка, плевра и легкие также могут быть поражены первично; однако изолированное поражение внутренних органов при лимфогранулематозе встречается нечасто. Органные поражения при лимфогранулематозе являются, как правило, признаком распространения процесса. Однако у ряда больных при единственной ограниченной органной локализации течение и прогноз могут быть вполне благоприятными. Поэтому классифицировать эти поражения как распространенную стадию заболевания представляется не во всех случаях верным. Специфические поражения кожи, костей, эндокринной и нервной систем относятся к редким внелимфатическим локализациям. По мере развития заболевания происходит распространение процесса, появляются дополнительные очаги поражения; отчетливое выявление их не всегда возможно. Согласно международной клинической классификации по степени распространенности процесса выделяют четыре стадии: — I стадия (локальные формы) — поражение одной или двух смежных групп лимфоузлов или одного внелимфатического органа; — II стадия (регионарные формы) — поражение любых групп лимфоузлов по одну сторону диафрагмы, которое может сочетаться с локализованным вовлечением одного внелимфатического органа; — III стадия (генерализованные (распространенные) формы) — поражение лимфатических узлов по обе стороны диафрагмы, которое может сопровождаться локализованным вовлечением одного из внелимфатических органов, селезенки; — IV стадия (диссеминированные формы) — вовлечение в процесс костного мозга, легочной паренхимы, плевры, печени, костной ткани, желудочно-кишечного тракта в сочетании с поражением лимфоузлов и селезенки. Каждую стадию, в свою очередь, подразделяют в зависимости от отсутствия (А) или наличия (Б) одного или нескольких симптомов интоксикации: повышенной температуры тела выше 37 °C, ночных потов; кожного зуда, быстрой потери веса более чем на 10 % (при этом наличие только кожного зуда считается недостаточным для отнесения случая к подгруппе Б). Кроме общих симптомов лимфогранулематоза, учитываются также так называемые биологические признаки активности опухолевого процесса, к которым относятся ускоренная СОЭ, повышеннный уровень нейтрофильных лейкоцитов, высокий уровень фибриногена в крови, низкое содержание сывороточного железа и другие признаки (отсутствие или наличие признаков биологической активности обозначают малыми буквами «а» и «б»). Кроме клинических стадий, могут устанавливаться так называемые патологические стадии, в которых более точно, с помощью данных, полученных при лапаротомии или лапароскопии с пункционной биопсией, определяется степень распространенности процесса. Патологические стадии обозначают с помощью специальных символов, показывающих наличие или отсутствие изменений во взятых для тканевого исследования во время биопсии тканей органов. Клиническая картина лимфогранулематоза в I стадии проявляется единственным постоянным симптомом — увеличением одного или нескольких периферических лимфоузлов одной анатомической области. Общее состояние больных в I стадии обычно не изменяется, однако в крови, по данным некоторых авторов, у ряда больных обнаруживается повышенный уровень нейтрофильных лейкоцитов, пониженное количество лимфоцитов в крови и ускоренная СОЭ. Во II стадии в подавляющем большинстве случаев самым ранним симптомом является увеличение периферических лимфоузлов, расположенных выше диафрагмы. А также, как и в I стадии, встречается повышенное количество нейтрофильных лейкоцитов и лимфоцитов, несколько чаще отмечается ускоренная СОЭ. Во ПБ стадии, кроме того, отмечаются симптомы заболевания — слабость, потливость, высокая температура, кожный зуд, сухой кашель, обусловленный поражением узлов средостения. В ША стадии течение заболевания отличается относительной доброкачественностью. Общее состояние и трудоспособность не нарушаются длительное время. Как и во ПА стадии, отмечаются жалобы на умеренную потливость, незначительное повышение температуры, увеличение периферических лимфоузлов и появление вызванных этим увеличением болей. В ША стадии заметно чаще встречаются жалобы на кожный зуд. В ШБ стадии заболевание протекает тяжело: почти все больные предъявляют жалобы на слабость, недомогание, часто отмечаются высокая температура, потливость, кожный зуд, большая потеря веса и ряд других симптомов. В ША и ШБ стадиях примерно с одинаковой частотой обнаруживаются повышенный уровень нейтрофильных лейкоцитов и лимфоцитов, ускоренная СОЭ и другие характерные признаки. Поражение внутренних органов (IV стадия) чаще всего наблюдается при распространении лимфогранулематоза, но может также развиться в результате местного распространения опухолевого процесса с регионарных лимфоузлов на смежные с ними отделы внутренних органов. Сложное сочетание клинических проявлений лимфогранулематоза, обусловленное особенностями локализации опухолевого процесса, наличием или отсутствием общих симптомов, различной скоростью прогрессирования заболевания, нередким присоединением неспецифических или так называемых паранеопластических синдромов, позволяет выделить кожные, костные, неврологические, тораксальные клинические формы с преимущественным или изолированным поражением желудочно-кишечного тракта и др. Первичный лимфогранулематоз кожи относится к числу крайне редких его клинических форм. Описаны единичные случаи нодулярного склероза с множественным изолированным поражением кожи. При этом специфические проявления возникают как в начальной, так и в конечной стадии болезни. Они могут быть единичными и множественными в виде отдельных узелков диаметром от нескольких миллиметров до 3–5 см или обширных инфильтратов обычно круглой формы темно-красного цвета, окруженных нередко отечной кожей. Наиболее частая их локализация — область спины, верхние и нижние конечности. Вторичные поражения кожи могут быть обусловлены прорастанием в нее опухолевой ткани из лимфоузлов, молочной железы, грудины, ребер с последующим образованием язв величиной до 10 см в диаметре и с более обильным гнойно-некротическим отделяемым. При лимфогранулематозе часто, особенно в конечных стадиях заболевания, наблюдаются неспецифические токсико-аллергические изменения кожи, причина возникновения которых окончательно не выяснена. К неспецифическим поражениям кожи относятся высыпания типа экземы, крапивницы, зуд кожи, коре- и скарлатиноподобные высыпания, пятна, повышенная пигментация кожи. Поражения могут быть локализованными и распространенными. Чаще всего наблюдаются кожный зуд и высыпания типа почесухи в виде небольших твердых папул розового цвета. Течение основного заболевания нередко отягощает опоясывающий лишай. Поражение костей при лимфогранулематозе развивается чаще вторично в тех отделах скелета, к которым близко прилежат большие группы лимфатических узлов. Костные изменения возникают преимущественно на фоне распространения процесса, иногда они являются единственными проявлениями лимфогранулематоза. Ведущими клиническими симптомами при лимфогранулематозе позвонков являются боли, локализованные или смещающиеся, которые объясняются сдавлением нервных стволов при прорастании в них опухолевой ткани. Боли могут усиливаться при надавливании на остистые отростки пораженных позвонков; при локализации процесса в нижнегрудных и верхнепоясничных позвонках они смещаются в нижние конечности; возникают чувство онемения, слабость и подергивания в ногах.
Лимфогранулематоз. Язвенно-некротическое поражение кожи
В результате сдавления твердой мозговой оболочки спинного мозга могут наступить парезы и параличи нижних конечностей с нарушением функции органов малого таза. Постоянными симптомами при вовлечении в процесс ребер и грудины являются боли и возникновение мягкотканного опухолевидного образования соответственно пораженному участку; при прощупывании грудины иногда определяется характерный звук — симптом так называемого пергаментного хруста. Изменения в костях таза связаны с прорастанием в них опухолевой ткани из подвздошных и тазовых лимфатических узлов и значительно реже в результате распространения процесса с током крови. Для этой локализации характерны боли постоянного или приступообразного характера, иногда смещающиеся в ноги, что объясняется давлением опухолевых масс на нервные сплетения. Клиническая картина поражения легочной ткани определяется распространенностью процесса, наличием симптомов интоксикации и осложнений; отмечаются боли в грудной клетке, кашель, одышка, иногда кровохарканье. Первичный лимфогранулематоз средостения обычно характеризуется длительным бессимптомным течением. Притом увеличение лимфатических узлов долгое время может оставаться единственным проявлением процесса. Какие-либо проявления в большинстве случаев возникают в связи с развитием кист органов средостения. В дальнейшем при местном прогрессировании процесса могут развиться признаки поражения крупных сосудов в системе верхней полой вены с типичной картиной медиастенального (средостенного) синдрома, симптомы поражения диафрагмального и возвратного гортанного нервов, экссудативный плеврит, перикардит и др. При лимфогранулематозе желудочно-кишечного тракта чаще поражается тонкая кишка, реже желудок и пищевод; лимфогранулематоз толстой кишки встречается редко. Клиническая картина лимфогранулематоза желудочно-кишечного тракта обусловлена местными и общими симптомами заболевания, в значительной мере зависит от характера роста опухоли, размеров и локализации патологического очага. Лимфогранулематоз желудка и двенадцатиперстной кишки иногда протекает с клиническими симптомами, свойственными язвенной болезни: отмечаются тошнота, боли в надчревной области в правом подреберье, болезненность при прощупывании живота. Для лимфогранулематоза тонкой кишки характерны боли в животе, метеоризм и диарея. Первичное поражение селезенки встречается редко и характеризуется относительной доброкачественностью течения. Известны случаи, когда процесс в течение длительного периода времени остается локализованным, что является основанием для выделения некоторыми авторами так называемой селезеночной клинической формы лимфогранулематоза. При поражении селезенки могут возникать боли в левом подреберье, усиливающиеся в положении на левом боку, при ходьбе, беге. При лимфогранулематозе наблюдаются нарушения иммунитета, связанные с количественным дефицитом лимфоцитов в организме, что проявляется уменьшением содержания лимфоцитов в лимфатических узлах. Степень уменьшения лимфоцитов в крови соответствует тяжести клинических проявлений. Изменения периферической крови довольно постоянны, но специфичны: повышенный уровень лейкоцитов (10–15 г/л), при абдоминальных формах — уменьшение количества лейкоцитов, выраженное увеличение нейтрофилов, уменьшение лимфоцитов, увеличение эозинофилов, моноцитов и тромбоцитов. Гипохромная микроцитарная (уменьшение размеров эритроцитов) анемия возникает часто в начале заболевания. Макроцитоз (увеличение размеров эритроцитов) наблюдается обычно вследствие нарушений обмена фолиевой кислоты, дефицит которой может возникать из-за быстрого клеточного обновления, нарушения питания при тяжелом состоянии. Причиной анемии в некоторых случаях является аутоиммунный гемолиз (разрушение эритроцитов). Отмечается резкое ускорение СОЭ — 30–50, а в периоды обострения — до 70–80 мм/ч. Течение лимфогранулематоза отличается разнообразием. Обычно продолжительность заболевания ограничивается 3–4 годами. В некоторых случаях наблюдается более спокойное течение, с длительными ремиссиями после курсов лечения. Особенно это касается больных, у которых наблюдается изолированное поражение группы лимфоузлов и возможно их удаление оперативным путем. Срок жизни таких больных 6—10 лет. При проявлении признаков распространения и интоксикации течение болезни становится быстро прогрессирующим. Если заболевание начинается с поражения внутренних органов и выраженных явлений интоксикации, длительность его редко превышает год.
Лимфогранулематоз. Рентгенологическая картина при поражении лимфатических узлов средостения и корней легких
Диагностика и дифдиагностика Диагностика лимфогранулематоза основывается на анализе клинических, рентгенологических и морфологических данных. Важнейшая роль в распознавании лимфогранулематоза принадлежит исследованию пунктата лимфатического узла, позволяющему установить предварительный диагноз, и тканевому исследованию материала, полученного с помощью биопсии, в том числе и при диагностической лапаротомии. Диагноз лимфогранулематоза возможен только при обнаружении в исследуемой ткани гигантских клеток Березовского-Штернберга. Наличие в препаратах клеток Ходжкина позволяет высказать лишь предположительный диагноз, который не является основанием для проведения соответствующего лечения.
Лимфогранулематоз. Мелкоочаговое поражение легких. Макропрепарат
Пунктат лимфатического узла при лимфогранулематозе
Особенные трудности для дифференциального морфологического диагноза представляют лимфогистиоцитарный тип и диффузный фиброз. Лимфогистиоцитарный тип лимфогранулематоза необходимо дифференцировать с реактивным распространением лимфоидной ткани различного происхождения (инфекционной, вирусной, поствакцинальной, лекарственной и др.), специфическими лимфацимитами при некоторых инфекционных заболеваниях, например бруцеллезе (см.), токсоплазмозе (см.), а также с саркоидозом (см.) и лимфоцитарной лимфосаркомой (см.). При лимфоидном истощении по типу диффузного фиброза необходимо исключить фиброз ткани лимфоузла воспалительного происхождения, а при ретикулярном варианте лимфогранулематоза следует проводить дифференциальный морфологический диагноз с лимфосаркомой и ремикулосаркомой (см.). В системе клинико-лабораторной и инструментальной диагностики лимфогранулематоза обязательными являются: общий анализ крови, биопсия одного из пораженных лимфоузлов, определение уровня щелочной фосфатазы в сыворотке крови и других биохимических показателей, исследующих функции почек и печени; рентгенография органов грудной клетки, внутривенная пиелография, двусторонняя нижняя рентгеноконтрастная лимфография. При определенных условиях проводят дополнительные исследования — томографию органов грудной клетки, нижнюю кавографию, трепанобиопсию, лапаротомию с удалением селезенки (при подозрении на поражение органов брюшной полости). Из числа вспомогательных исследований применяют скелетную сцинтиграфию, сканирование печени и селезенки, иммунологические методы исследования.
Лечение Важнейшее условие — максимально раннее назначение комплексного поэтапного лечения, включающего удаление селезенки, лучевую и опухолевую терапию. У больных с I–II A стадией при локализованных формах (изолированные лимфоузлы, лимфогранулематоз селезенки, желудка и т. п.) по возможности производится хирургическое лечение — удаление единичных конгломератов (лимфатических узлов, селезенки), с обязательной последующей рентгенотерапией. Облучение осуществляется на гамма-терапических аппаратах.
Лимфогранулематоз: 1 — больной до рентгенолечения; 2 — тот же больной после рентгенолечения
В настоящее время с успехом используется последовательное субтотальное и тотальное многопольное с хорошей системой защиты облучение по так называемой радикальной программе всех лимфоузлов: шеи, подмышечных, над- и подключичных, медиастенальных, абдоминальных, паховых. При этом облучаются как пораженные зоны, так и профилактически внешне не измененные лимфатические зоны, являющиеся наиболее вероятными «кандидатами» на метастазирование процесса; суммарная доза на каждую область у взрослых достигает 3,5–4,5 тыс. рад, у детей 2,5–3,5 тыс. рад. Для предупреждения уменьшения количества лейкоцитов рекомендуются переливания крови 2–3 раза в месяц, при возникновении этого состояния — лейкоген и батилол. Облучение повторяют через месяц в полной или половинной дозе. Пока имеется локальное положение даже нескольких групп лимфоузлов, процесс может быть полностью ликвидирован и часто не требует поддерживающего лечения, или могут быть достигнуты длительные полные ремиссии (более 5 лет), особенно у больных лимфогистиоцитарным и склеронодулярным вариантами. У больных с ПБ и ША стадиями всегда существует опасность распространения заболевания из необлученных узлов, особенно расположенных ниже диафрагмы, еще во время проведения лучевой программы. В этих случаях для индукции ремиссии показана полихимиотерапия («вводная» — сокращенная схема) в сочетании с облучением вначале только тех узлов, которые остались увеличенными после химиотерапии (минимальная программа), затем с включением в зону облучения всех отделов лимфатической системы, расположенных выше или ниже диафрагмы (максимальная программа). После лучевого воздействия назначается поддерживающая полихимиотерапия в течение 2–3 лет. При генерализованных и диссеминированных (распространенных) формах в III Б и IV стадиях лимфогранулематоза после морфологического подтверждения диагноза, проведения лапаротомии и удаления селезенки можно применить комбинированную химио- и рентгенотерапию. Общая схема лечения включает в себя два этапа: индукцию (стимуляцию) ремиссии с помощью цикловой полихимиотерапии (по какой-либо из апробированных схем) и консолидацию (поддержание) ремиссии посредством назначения поддерживающих циклов лекарственной терапии или радикальной лучевой терапии. Используют несколько композиций различных цитостатиков: циклофосфан (эндоксан), натулан (прокарбазин), мустарген (эмбихин), допан, диранол, хлорбутин, онковин (винкристин), винбластин. Нитрозомочевина и др.; противоопухолевые антибиотики (брутомицин, адриамицин, блеомицин) эффективны при легочной форме. В сочетании с цитостатиками показан преднизолон, особенно при гемолитическом синдроме и в конечной стадии. Существуют различные схемы лечения лимфогранулематоза, выбор которых осуществляется в индивидуальном порядке с учетом тяжести и длительности течения заболевания, степени поражения и наличия сопутствующей патологии. Одной из таких схем является схема СОРР (циклофосфан — 600 мг/м2 и онковин — 1,4 мг/м2 в первый и восьмой день внутривенно, прокарбазин — 100 мг/м2 и преднизолон — 40 мг/м2 ежедневно внутрь). Учитывая синхронизирующий эффект онковина, циклофосфан вводится часто не одновременно с ним, а через сутки, т. е. во второй и девятый дни лечения. Циклофосфан можно заменить мустаргеном (схема МОРР) или допаном (ДОРР), онковин — винбластином (СУРР). Лечение по любой схеме предусматривает проведение 2-недельных циклов с 2-недельными интервалами между ними. Программа состоит из 6 циклов (преднизолон назначается только в 1-м и 4-м циклах). У больных лимфогистиоцитарным и склеронодулярным вариантами более эффективно применение схемы МОРР и СОРР, а при смешанноклеточном варианте — композиция СУРР. При очень тяжелом течении заболевания используют блеомицин, адриомицин. Существуют и другие схемы лечения. При применении полихимиотерапии клинический эффект, как правило, наблюдается уже в процессе проведения первого цикла. Он выражается в улучшении самочувствия больных, исчезновении симптомов интоксикации, уменьшении размеров опухолевых образований и нормализации показателей крови. В этом случае при появлении признаков ремиссии полихимиотерапия должна быть продолжена до 6 циклов (в стационаре или амбулаторно). Если после первого цикла терапевтический эффект отсутствует или процесс прогрессирует, то схему следует изменить. В любой стадии заболевания при малейших признаках интоксикации обязательно вновь использование химиотерапии. При снижении показателей периферической крови редуцируют (восстанавливают) дозы цитостатиков, вводят лейко-тромбовзвесь, эритромассу. При отсутствии преднизолона в 1-м и 4-м циклах возможны аллергические реакции на натумен (крапивница, «лекарственная» лихорадка, токсикодермия, геморрагический васкулит), для прекращения которых следует использовать средства десенсибилизирующей терапии. Возникновение побочных явлений лекарственной терапии — алопеция (облысение) и аменорея — не является показанием к отмене противоопухолевых препаратов и специального лечения не требует. Появление симптомов токсического полиневрита, связанного с введением онковина, требует его отмены или замены, а также назначения кокарбоксилазы, витаминов группы В, глютаминовой кислоты, ганглерона. Поддерживающая химиотерапия проводится циклами по той или иной схеме в течение первого года наблюдения (отсчет производится с момента окончания 6-го цикла) — один цикл в 2–3 месяца, на второй год — в 3–4 месяца, в течение третьего года —1 цикл в 6 месяцев. Ее рекомендуется проводить при вовлечении в патологический процесс костного мозга, множественном поражении костей либо одновременно двух или более органов, а также при наличии противопоказаний к лучевому лечению (интоксикация, цитонемия, кахексия). При этом целесообразно применять схемы полихимиотерапии, с помощью которых достигнута ремиссия. Если остальным больным с ШБ и IV стадиями лимфогранулематоза, находящимся после циклов той или иной схемы полихимиотерапии в ремиссии, рекомендуется проведение лучевой терапии на зоны, где первоначальная опухоль достигла наибольших размеров или не произошло ее полного обратного развития, продолжительность перерыва между полихимио- и лучевой терапией зависит в основном от показателей крови. При нормальном количестве лейкоцитов и тромбоцитов он не должен превышать 2–3 недели. Участки, в которых не произошло полного рассасывания опухоли под влиянием предшествующей полихимиотерапии, облучаются в суммарных очаговых зонах — радикальных для лимфогранулематоза, остальные ранее пораженные области — в половинной дозе. Возникновению рецидивов способствует несоблюдение курсов поддерживающей терапии, необходимого ее режима, физические перегрузки, облучения, беременность, роды; физио-, электро- и тепловые процедуры противопоказаны. Санаторно-курортное лечение с учетом вышеназванных рекомендаций в привычном для больного климате или в средней полосе вполне допустимо. Всем больным лимфогранулематозом противопоказана работа, связанная с воздействием повышенной радиации, токов высокой частоты, солей тяжелых металлов, неблагоприятных метеорологических условий, облучением, значительным нервным и физическим напряжением. Диспансеризация производится у гематолога или онколога.
ЛИМФОРЕТИКУЛЕЗ ДОБРОКАЧЕСТВЕННЫЙ
ОпределениеЛимфоретикулез доброкачественный (синонимы: болезнь кошачьих царапин, регионарный небактериальный лимфаденит, флиноз, болезнь Молларе-Рейли) — острое, передающееся от кошек инфекционное заболевание, характеризующееся воспалением регионарных лимфатических узлов, лихорадкой и общей интоксикацией.
Этиология и эпидемиология А. Дебре и К. Фошей в 1932 г. описали доброкачественно протекающие аденопатии (увеличения лимфатических узлов), связанные с царапинами кошек. В 1950 г. П. Молларе и соавт. выделили это заболевание под названием «доброкачественный инокуляционный лимфоретикулез». Вначале предполагалась вирусная природа инфекции, но в 1963 г. В. И. Червонским и соавт. в качестве возбудителя был описан микроорганизм, отнесенный ими к хламидиям, так как у больных доброкачественным лимфоретикулезом нередко обнаруживались в РСК антитела к возбудителю орнитоза и отмечалась положительная кожноаллергологическая проба с орнитином. В то же время антибиотики тетрациклинового ряда, к которым чувствительны все известные хламидии, оказались неэффективными. Возбудитель, выделенный Червонским, был отнесен к микроорганизмам группы ОЛТ (орнитоз — лимфогранулема — трахома) — гальпровиям, хламидиям. Хотя возбудитель лимфоретикулеза относят к группе хламидий, однако обсуждается его самостоятельность, так как он принципиально отличается от последних устойчивостью к тетрациклину и характером специфических поражений лимфатических узлов у кроликов и обезьян при внутрикожном введении. Возбудитель — мелкая многообразная грамотрицательная палочка, выращиваемая на специальных питательных средах. Паразитирует у кошек, собак, грызунов, обезьян. Во внешней среде малоустойчива, при температуре 37 °C гибнет через 12 ч, но выносит длительное замораживание; под действием эфира гибнет через 30 мин. Вопрос о роли других микроорганизмов в развитии инфекции остается открытым. Название болезни происходит от слова Felis (родовое название кошек), так как источником инфекции являются кошки — скрытые носители возбудителя болезни, который обнаруживается в слюне, моче, на лапках внешне здоровых животных. Предполагают, что носителем возбудителя в природе служат грызуны и птицы, однако они не имеют эпидемиологического значения. Заражение осуществляется при прямом контакте с инфицированными животными и реализуется через кожные покровы и слизистые оболочки, иногда — через зараженную воду, предметы, пищевые продукты. Описана глазная форма болезни при попадании слюны на конъюнктиву. Заболевание встречается в виде единичных случаев, чаще у детей. Наблюдается осенне-зимняя сезонность; передача возбудителя от человека к человеку не описана.
Патогенез и патанатомия Механизм развития изучен недостаточно. Из места внедрения возбудитель вместе с лимфой заносится в регионарные лимфатические узлы, где происходит его интенсивное размножение с выделением токсина. При тканевом исследовании в лимфоузлах выявляется переразвитие ретикулярных клеток с образованием туберкулезоподобных гранулем. Затем возбудитель вместе с лимфой и кровотоком проникает во внутренние органы, где развивается гранулематозный процесс. В регионарных лимфатических узлах развитие гранулемы может сопровождаться омертвением и образованием микроабсцессов. Клеточные изменения обнаруживаются в регионарных лимфатических узлах в непосредственной близости от первичного аффекта, при этом в процесс может вовлекаться как один, так и группа лимфатических узлов. Лимфатические узлы увеличены, умеренно уплотнены и спаяны между собой. На разрезе они темно-красного цвета, гомогенны или с участками омертвения и расплавления в соответствии со стадией патологического процесса. На ранних этапах болезни преобладает переразвитие ретикулярных клеток с постепенной трансформацией в гранулему, состоящую исключительно из эпителиальных клеток. Центральная часть гранулемы подвергается омертвению, и формируется микроабсцесс. В дальнейшем микроабсцессы могут сливаться, и в процесс вовлекается весь лимфатический узел, а также и окружающая клетчатка — формируется воспалительное скопление с тенденцией к расплавлению. При тканевом исследовании в очагах воспаления нередко обнаруживаются скопления гигантских многоядерных клеток типа Березовского — Штернберга. Клеточные изменения при доброкачественном лимфоретикулезе не отличаются строгой специфичностью, они могут напоминать из менения при туляремии (см.), бруцеллезе (см.), туберкулезе (см.), лимфогранулематозе (см.). У большинства больных омертвевшие массы подвергаются рассасыванию или частичному склерозированию. Реже абсцесс вскрывается и после удаления гноя наступает быстрое заживление. При тяжелых распространенных формах гранулематозный процесс обнаруживается в головном мозге (энцефалит), легких (пневмония), печени (гепатит), костях (остеомиелит), брыжейке (аденит) и других органах.
Клиническая картина Инкубационный период продолжается от нескольких дней до 42–56 дней (в среднем 1–3 недели). На месте уже зажившей царапины более чем у половины больных образуется первичный аффект — красноватые безболезненные припухлости на коже, которые нередко нагнаиваются и медленно заживают без образования рубца. Заболевание начинается остро с умеренно выраженной лихорадки продолжительностью от 5–7 до 19–20 дней, повышенной утомляемости, недомогания, головной боли, анорексии. В это время на коже часто появляется многообразная аллергическая сыпь. В ряде случаев обнаруживают микрополилимфаденит (множественное увеличение лимфатических узлов), увеличенную селезенку, реже — печень. Характерным признаком заболевания является регионарный лимфаденит. Спустя примерно 2 недели после выявления первичного аффекта увеличиваются регионарные лимфатические узлы, иногда значительно (до 8—10 см в диаметре). При прощупывании они плотные, малоболезненные, не спаянные с окружающими тканями. Чаще всего увеличиваются подмышечные и локтевые лимфатические узлы, реже — паховые и шейные, что связано с входными воротами инфекции. Постепенно наступает разрешение процесса в лимфоузлах — медленное склерозирование или их нагноение и вскрытие с выделением зеленоватого гноя. Увеличение регионарных лимфатических узлов можно считать ведущим клиническим признаком доброкачественного лимфоретикулеза.
Мазок из пунктата костного мозга при остром ретикулезе
Нередко заболевание начинается с регионарного лимфаденита, а симптомы интоксикации появляются позже или вообще не выражены, и тогда аденит является практически единственным симптомом болезни. Однако у большинства больных на пике заболевания отмечаются лихорадка, головные и мышечные боли, снижение аппетита. В редких случаях возможны дисфункция кишечника, высыпания на коже по типу скарлатиноподобных, кореподобных, эритематозных или крупнонодозных. У большинства больных на месте входных ворот инфекции (чаще руки, лицо, шея) отмечается припухлость красного цвета, иногда можно видеть язвочку, пустулу, корочку или инфильтрированную, красноватую и болезненную царапину от когтей кошки. Первичный аффект появляется задолго до регионарного лимфаденита, и потому на пике клинических проявлений изменения на коже могут быть минимальными или полностью отсутствовать. Описанные формы доброкачественного лимфоретикулеза принято относить к типичным. Атипичными формами являются железисто-глазная, ангинозная, абдоминальная, легочная, церебральная и другие редкие формы болезни. Клинические проявления при этом будут соответствовать очагу поражения (конъюнктивит с регионарным лимфаденитом, пневмония, ангина, энцефалит, мезаденит и др.). Они отличаются длительным вялотекущим, но доброкачественным течением. К атипичным относят стертые и субклинические формы болезни. Возможно развитие затяжных и рецидивирующих форм заболевания. Известны тяжелые, но крайне редкие осложнения — энцефалиты, энцефаломиелиты.
Диагностика Клиническая диагностика строится на выявлении первичных изменений в месте входных ворот инфекции и связанного с ними регионарного лимфаденита. Важное значение имеют данные о контакте с кошками, наличии царапин, укусов или ослюнения. В крови может быть обнаружено увеличение числа эозинофилов и повышение СОЭ. При посеве гноя из расплавленных лимфатических узлов отсутствует рост флоры. Лабораторная диагностика основана на РСК и внутрикожной аллергической пробе с родственным орнитозным или гомологичным антигенами. Дифференциальная диагностика проводится с банальными лимфаденитами (см.), туляремией (см.), чумой (см.), содоку (см.), бруцеллезом (см.), листериозом (см.), орнитозом (см.), инфекционным мононуклеозом (см.), иерсиниозами (см.), туберкулезом (см.), лимфогранулематозом (см.), лимфомами (см.).
Лечение и профилактика У больных с выраженным синдромом интоксикации и при подозрении на присоединение бактериальной инфекции используют антибиотики широкого спектра действия (азитромицин, бисептол и др.). В большинстве случаев назначают симптоматическое лечение. Применяют десенсибилизирующие и противовоспалительные средства, а также витамины. В период размягчения лимфатического узла показано хирургическое вмешательство — разрез или пункция для удаления гноя. В целях профилактики проводятся общие мероприятия, предусмотренные при заболеваниях, передающихся от животных. Места укусов и царапин обрабатывают дезинфицирующими средствами. Иммунопрофилактика не разработана, мероприятия в очаге не проводятся.
ЛИМФОЦИТОЗ ОСТРЫЙ ИНФЕКЦИОННЫЙ
ОпределениеЛимфоцитоз острый инфекционный (синоним: малосимптомный инфекционный лимфоцитоз) — инфекционная болезнь, вызываемая вирусом и характеризующаяся многообразием клинических симптомов, увеличением количества лейкоцитов и высоким количеством лимфоцитов в крови и костном мозге.
Этиология, патогенез и эпидемиология Источником возбудителя инфекции являются больные дети, а также дети со стертыми и бессимптомными формами заболевания. Лимфоцитоз острый инфекционный встречается повсеместно и характеризуется выраженной контагиозностью (заразностью). Чаще наблюдается у детей от 4 до 15 лет в осенние и весенние месяцы в виде эпидемических вспышек в закрытых коллективах. После выздоровления остается длительный иммунитет, однако описаны случаи повторного заболевания спустя 2–3 года. Считают, что возбудителем болезни является лимфотропный вирус, который через слизистую оболочку носовой части глотки или желудочно-кишечный тракт и с током лимфы попадает в ближайшие лимфатические узлы и локализуется в клетках ретикулоэндотелиальной системы. Вирус может локализоваться также в ретикулоэндотелии синусов миндалин, селезенки, кишечника. Развитие патологического процесса зависит от состояния реактивности организма и его защитных свойств.
Клиническая картина Симптомы болезни варьируют от еле заметных, стертых форм до ярко выраженной симптоматики. Инкубационный период от 12 до 28 дней. Начало болезни постепенное, в виде недомогания, повышения температуры тела и незначительного катара (воспаления) верхних дыхательных путей. Это так называемая малосимптомная форма, при которой дальнейшего нарастания симптомов не наблюдается. Возможно острое (гриппоподобное) начало с выраженным катаром верхних дыхательных путей. Нередко заболевание осложняется пневмонией (респираторная форма). В процесс могут вовлекаться органы и системы организма, при этом появляются симптомы, определяющие другие формы болезни: — аденопатическая форма, характеризуется умеренным увеличением шейных лимфатических узлов, миндалин, селезенки; — нервная форма, при которой наблюдаются симптомы менингита или энцефалита; — кожная форма, характеризуется появлением кореподобной или скарлатиноподобной сыпи; — абдоминальная форма, при которой могут быть боли в животе или явления энтероколита.
Диагностика и дифдиагностика Диагноз затруднен из-за пестроты клинических проявлений болезни. Правильная постановка диагноза возможна лишь с учетом данных исследования крови. Картина крови характеризуется лейкоцитозом до 20—120 г/л с преобладанием в формуле лимфоцитов — до 60–97 %, в основном мезо- и микрогенераций лимфоцитов. Изменения выявляются уже в начале болезни, достигая максимума в период наиболее высокой температуры. Уровень гемоглобина, количество эритроцитов, тромбоцитов обычно нормальные, СОЭ нормальная или несколько ускорена. Описаны случаи болезни с умеренной анемией и некоторым уменьшением количества тромбоцитов. Костномозговое кроветворение не изменяется. Однако наблюдается увеличение количества лимфоцитов за счет примеси их из крови. При биопсии лимфатических узлов отмечается переразвитие ретикулоэндотелия, блокада лимфатическими клетками синусов узлов и дегенерация лимфатических фолликулов. Дифференцировать острый инфекционный лимфоцитоз следует с заболеваниями, при которых характерно повышение уровня лейкоцитов в крови с высоким количеством лимфоцитов: инфекционным мононуклеозом (см.), острым лимфобластным лейкозом (см.), коклюшем (см.). Необходимо отличать острый инфекционный лимфоцитоз от заболеваний, в клинической картине которых имеются симптомы, сходные с симптомами различных форм этого заболевания, — лимфогранулематоза (см.), гриппа (см.), пневмонии (см.), энцефалита (см.), аппендицита (см.). Проводится дифференциальный диагноз с различными инфекционными болезнями (корь, краснуха, ветряная оспа, скарлатина (см.)), сопровождающимися лейкемоидными реакциями (см.) лимфоидного типа.
Лечение Используют постельный режим, щадящую диету, симптоматические средства, десенсибилизирующие препараты, витамины; антибиотики показаны при появлении вторичных признаков инфекции. Клинические проявления держатся 4–5 дней, реже 10–14 дней, изменения в крови сохраняются значительно дольше (до 2–6 месяцев).
Профилактика Необходима изоляция больного в зависимости от тяжести заболевания либо в стационар, либо в домашних условиях. Проводят текущую дезинфекцию, за детьми, бывшими в контакте с больными острым инфекционным лимфоцитозом, устанавливают наблюдение.
ЛИМФОЭПИТЕЛИОМА
ОпределениеЛимфоэпителиома (синонимы: опухоль Шминке, синцитиальная карцинома, переходно-клеточный рак) — злокачественная опухоль глотки, разновидность плоскоклеточного рака.
Этиология, патогенез и патанатомия Одни авторы относят лимфоэпителиому к опухолям кроветворной ткани, другие рассматривают ее как анаплазированный (недоразвитый) рак, третьи — как переходно-клеточный рак. Некоторые авторы считают, что распространенный термин «лимфоэпителиома» не отражает сущности патологического процесса, так как дает ошибочное представление о возникновении опухоли из лимфоидной и эпителиальной ткани. Как правило, лимфоэпителиома возникает в ротовой и носовой частях глотки, богатых лимфоидной тканью. Она встречается чаще в возрасте 30–40 лет, но может быть и удетей. Лимфоэпителиома имеет форму узла или крупнобугристого образования плотноэластической консистенции, покрытого первоначально не измененной слизистой оболочкой, бледно-серого цвета на разрезе. Опухолевые клетки имеют различную форму, контуры их неотчетливы. В ткани лимфоэпителиомы иногда встречаются очаги плоскоклеточной дифференциации вплоть до ороговения отдельных клеток и образования так называемых раковых жемчужин.
Клиническая картина Клиническое течение лимфоэпителиомы обусловлено инфильтративным характером роста опухоли, склонностью к раннему метастазированию в глубокие лимфатические узлы шеи и быстрым распространением процесса. Особенности клинической симптоматики зависят от локализации и распространенности лимфоэпителиомы (например, начальный симптом лимфоэпителиомы в носовой части глотки — затрудненное носовое дыхание; при поражении трубной миндалины — понижение слуха; при лимфоэпителиоме задней поверхности мягкого неба — затрудненное глотание и изменение тембра голоса). С помощью обычной задней риноскопии или фиброриноскопии чаще на боковой стенке носовой части глотки или в ее своде определяется крупнобугристое образование плотноэластической консистенции (в отличие от мягких аденоидных (железистых) разрастаний). По мере роста опухоль выпячивает мягкое небо, может распространяться в полость носа, околоносовые пазухи и глазницу. Иногда лимфоэпителиома прорастает кости основания черепа и инфильтрирует среднюю черепную ямку, поражая при этом многие черепные нервы. При локализации опухоли в области ротовой части глотки, главным образом небных миндалин, первыми симптомами являются ощущение инородного тела и небольшая боль при глотании. Небная миндалина увеличена в размерах, уплотнена, слизистая оболочка растянута и гиперемирована, устья лакун почти не видны. Прорастание лимфоэпителиомы в ткани глотки и корень языка сопровождается изъязвлением. При этом усиливается боль, появляется слюнотечение, гнилостный запах изо рта, затрудняется жевание, дыхание и нарастает истощение. По данным различных авторов, метастазы лимфоэпителиомы в регионарные лимфатические узлы (чаще верхние отделы шеи) наблюдаются в 80–95 % случаев; в 20–25 % случаев увеличение лимфатических узлов шеи является первым симптомом лимфоэпителиомы, и рост метастазоввпоследствии может значительно опережать развитие первичной опухоли. Двусторонняя локализация метастазов под верхнюю треть грудино-ключично-сосцевидной мышцы характерна для лимфоэпителиомы носовой части глотки; расположение метастатических узлов позади и ниже угла нижней челюсти — для лимфоэпителиомы ротовой части глотки. Отдаленные метастазы развиваются рано, обнаруживаются в лимфатических узлах различных областей, в легких, печени, желудочно-кишечном тракте.
Диагностика Диагноз ставится на основании данных клинических и клеточных исследований первичной опухоли и увеличенных плотных лимфатических узлов шеи.
Лечение Лучевая терапия, при распространенных формах лимфоэпителиомы химиотерапия. Прогноз неблагоприятный, зависит от локализации и клинической стадии заболевания.
ЛИПОИДОЗЫ
ОпределениеЛипоидозы — большая группа наследственных аномалий липидного обмена, общей чертой которых является высокий уровень липидов в плазме крови (плазматические липоидозы) либо накопление метаболитов липидного обмена внутри клеток (внутриклеточные липоидозы). К липоидозам относят болезни обмена липопротеидов.
Этиология и патогенез Наиболее распространенными формами липоидозов являются болезни Гоше и Ниманна-Пика, Тей-Сакса, относящиеся к так называемым «болезням накопления», клиническая дифференцировка которых крайне трудна. Болезнь Гоше — наследственное заболевание обмена липидов, характеризующееся накоплением глюкоцереброзидов в клетках нервной и ретикулоэндотелиальной систем. В основе ее лежит снижение активности фермента глюкоцереброзидазы. Основным продуктом накопления при ней является глюкоцереброзид — нерасщепленный субстрат реакции, катализируемой кислотой бета-глюкозидазой (глюкоцереброзидазой), который накапливается в ретикулоэндотелиальных клетках. Активность кислоты бета-глюкозидазы при этой болезни снижается в разной степени в зависимости от формы — вплоть до полного отсутствия. Для наиболее тяжелой инфантильной формы болезни остаточная активность глюкоцереброзидазы составляет менее 9 % от активности фермента в норме. Юношеская форма болезни характеризуется 10–17 % остаточной активности глюкоцереброзидазы, а взрослая форма — даже 40 % активности фермента. Существование различных форм при болезни Гоше обусловлено, по-видимому, различными мутациями в одном и том же (или сходных) генетическом локусе, контролирующем образование глюкоцереброзидазы. Химическая структура цереброзидов, накапливающихся при болезни Гоше, отличается от нормальной: до 70–90 % углеводных компонентов приходится на долю глюкозы, тогда как в норме преобладает галактоза. Имеются указания на то, что при болезни Гоше изменен и качественный состав жирных кислот, входящих в структуру цереброзидов. Болезнь Ниманна-Пика характеризуется наследственным нарушением обмена сфингофосфолипидов, при котором происходит накопление фосфолипида сфингомиелина в мозге, печени, ретикулоэндотелиальной системе. Первичным биохимическим дефектом при болезни Ниманна-Пика является утрата активности энзима сфингомиелиназы. При этом в состав сфингомиелина включаются жирные кислоты, в норме отсутствующие, что приводит к нарушению процессов распада и избыточному накоплению сфингомиелина в клетках. При генетически обусловленном дефекте сфингомиелиназы в ретикуломакрофагальной системе и головном мозге, а также в мезенхимальных и эпителиальных элементах многих органов накапливается большое количество сфингомиелина. В костном мозге появляются многоядерные макрофаги — клетки Пика. Болезнь Тей-Сакса (амавротическая идиотия) — врожденное заболевание. В его основе лежит накопление липидов в центральной нервной системе. Развивается распад глиозных клеток в центральной нервной системе. Ганглиозидозы — это большая группа заболеваний, среди которых наиболее часто диагностируется болезнь Тей-Сакса (GM2-ганглиозидот, тип 1). В мозге больных этой болезнью накапливаются значительные количества GM2-ганглиозида в отсутствие гексозаминидазы А, для которой GM2-ганглиозид является субстратом. При так называемом нулевом варианте болезни Тей-Сакса — болезни Санзгоффа (GM2-ганглиозидозе 2-го типа) в тканях больных отсутствуют активности гексозаминидаз А и В. Кроме болезни Санзгоффа, различают юношеский 2-ганглиозидоз 3-го типа, или болезнь Фернгеймера-Зайтельбергера, характеризующийся уменьшением активности гексозаминидазы А, и инфантильный (детский) GM2-ганглиозидоз, вариант АВ, при котором активность гексозаминидаз А и В не изменяется, но отсутствует специфический термолабильный фактор, необходимый для расщепления GM2-ганглиозида гексозаминидазой А. Этот тип GM2-ганглиозидоза может быть выявлен только в том случае, если в качестве субстрата используется природный GM2-ганглиозид, так как на расщепление синтетического субстрата специфический белковый фактор влияние не оказывает. К частичным ганглиозидозам, связанным с нарушением распада GM1-ганглиозида, относятся генерализованный GM1-ганглиозидоз, или болезнь Нормана-Ландгенга (отсутствуют бета-галактозидазы А, В и С), и юношеский GM1-ганглизидоз, или болезнь Дерри (значительно снижена активность В и С форм бета-галактозидазы). GM3-ганглиозидоз связан не с накоплением нерасщепившихся ганглиозидов (т. е. с генетически обусловленным блоком их катаболизма (разрушения), а с нарушением их биосинтеза. Накопление в печени и мозге больных этой болезнью 3-ганглиозида происходит в результате отсутствия специфической 8-ацетилгалактозамитилтрансферазы, катализирующей превращение GM3-ганглиозида в GM2-ганглиозид. Болезнь Фабри — единственная патология среди гликолипидозов, при которой генетический дефект определенно связан с Х-хромосомой; она обусловлена дефицитом активности церамидтриксозид-альфа-галактозидазы А. При болезни Фабри в тканях больных, а также в их лейкоцитах и фибробластах накапливается большое количество церамидтригесозида, который выводится с мочой. При болезни Краббе (глобоидноклеточная лейкодистрофия) и семейной метахроматической лейкодистрофии Гринфилда-Шольца, в основе которых лежит генетически детерминированный дефект бета-галактозидазы (церамидгалактозидазы) и цереброзидсульфатазы (арилсульфатазы А), продуктом накопления является церамидгалактозид (галактоцереброзид). При болезни Краббе в нервных клетках, в нервных волокнах, а также в сетчатке глаз, канальцах почек и лейкоцитах накапливаются цереброзидсульфатиды (при семейной метахроматической лейкодистрофии). Плазматический липоидоз (гипергликемия эссенциальная, гепатоспленомегалический липоидоз) — группа наследственных ферментопатий, характеризующихся нарушениями жирового обмена. Наследование по аутосомно-рецессивному типу. Характеризуется накоплением в плазме крови нейтральных жиров. Различают 5 типов гиперлипидемий (табл. 13): — тип I характеризуется гиперхолестеринемией, гипертриглицеридемией и гиперхолестеринемией; — тип IIА — гипер-бета-липопротеидемией, гиперхолестеринемией при незначительной гипертриглицеридемии; — тип IIВ — высокой гипер-бета-липопротеидемией и гипертриглицеридемией; — тип III — гиперхолестеринемией и гипертриглицеридемией; — тип IV — гипер-пребета-протеидемией и гипертриглицеридемией; — тип V — смешанный, проявляется гиперхиломикронемией, гиперглицеридемией, гипер-пребета-липопротеидемией и гиперхолестеринемией.
Таблица 13. Генетические варианты первичных гиперлипопротеинемий Тривиальное название ∙ Тип ∙ Причина Тн: Семейная гиперхиломикронемия ∙ Т: I или V ∙ П: Дефицит липопротеинлипазы или апоС-2 Тн: Семейная гиперхолестеринемия: гомозиготная или гетерозиготная ∙ Т: IIА ∙ П: Дефицит липопротеинов низкой плотности рецепторов (аnоВ, Е-рецепторов) Тн: Семейная гиперхолестеринемия, обусловленная структурным дефектом аnоВ-100 ∙ Т: IIА ∙ П: Нарушение катаболизма липопротеинов низкой плотности, дефект апоВ (мутация 3900) Тн: Семейная комбинированная гиперлипидемия ∙ Т: IIА, IIБ или IV ∙ П: Повышенный синтез аnоВ-100 Тн: Полигенная гиперхолестеринемия ∙ Т: IIА ∙ П: Неизвестен Тн: Семейная дис-бета-липопротеинемия (ремнантная гиперлипидемия) ∙ Т: III ∙ П: Гомозиготный тип Е-2—Е-3. Усиленное образование липопротеинов очень низкой плотности. Нарушение катаболизма ремнантных частиц Тн: Семейная гипертриглицеридемия ∙ Т: IV ∙ П: Усиленное образование и замедленный клиренс триглицеридов, липопротеидов очень низкой плотности Тн: Семейная гиперлипопротеидемия ∙ Т: — ∙ П: Усиленное образование липопротеинов Тн: Семейная гипер-альфа-липопротеинемия ∙ Т: — ∙ П: Повышенный уровень липопротеинов высокой плотности. Усиленное образование аnоА-1. Дефицит эфиров холестерина, замедленный катаболизм липопротеинов высокой плотности
Плазматический липоидоз (дислипопротеинемия) может быть первичным, наследственным (моногенным и полигенным) заболеванием и обусловленным факторами внешней среды; вторичным, связанным с соматическими и другими заболеваниями. I тип гиперлипопротеинемии: гиперхиломикронемия (семейная гиперхиломикронемия, индуцированная жирами липемия) — результат нарушения лизиса хиломикронов, связанного с аутосомно-рецессивным дефицитом липопротеинлипазы в капиллярах жировой ткани, а следовательно, и в плазме крови. В качестве вторичного этот тип гиперлипопротеинемии может наблюдаться при гипотиреозе (см.), панкреатите (см.), алкоголизме (см.), диабетическом ацидозе (см.) (табл. 15).
II тип: гипер-бета-липопротеинемия (семейная гиперхолестеринемия, множественная бугорчатая ксантома). Выделяют семейные гиперхолестеринемии, обусловленные дефицитом липопротеинов низкой плотности — рецепторов (аnоВ, Е-рецепторов) или структурным дефицитом белка аnоВ-100. Известно более 300 мутаций в гене аnоВ, Е-рецептора, включая делеции в различных его участках, контролирующих синтез и созревание белка рецептора. Болезнь передается по аутосомно-доминантному типу наследования. Вторичная форма гиперлипопротеинемии IIA может быть вызвана избытком жиров (холестерина) в питании, гипотиреозом (см.), заболеваниями печени, нефротическим синдромом, гиперкальциемией, порфирией. Гиперлипопротеинемия IIВ в качестве вторичной формы может сопровождать сахарный диабет, заболевания печени (табл. 14).
Таблица 14. Клинические и сопутствующие синдромы плазматического липоидоза
Тип дислипопротеинемии ∙ Синдромы I ∙ Липемическая ретинопатия. Приступы абдоминальной колики. Увеличение печени и селезенки IIА ∙ Ишемическая болезнь сердца, ранняя дистрофия роговицы, снижение толерантности к глюкозе IIБ ∙ Ишемическая болезнь сердца, инфаркт миокарда, рано (до 30 лет), диабет, ксантоматоз III ∙ Ожирение, ишемическая болезнь сердца, дистрофия роговицы, атеросклероз сосудов нижних конечностей, диабет IV ∙ Увеличение печени и селезенки, диабет, панкреатит, ишемическая болезнь сердца, атеросклероз периферических сосудов, развивается медленно V ∙ Атеросклероз мезентериальных сосудов, увеличение печени и селезенки, диабет, ожирение, ишемическая болезнь сердца (редко)
III тип: дис-бета-липопротеинемия (синонимы: ремнантная гиперлипидемия, семейная гиперхолестеринемия, флотирующая гиперлипопротеинемия, индуцированная углеводами гиперлипемия) вызывается замедленным метаболизмом липопротеинов очень низкой плотности, что связано с появлением в их составе дефектной изоформы белка аnоЕ, а именно аnоЕ2, которая слабо взаимодействует с аnоВ, Е- и аnоЕ-рецепторами. IV тип: гипер-пребета-липопротеинемия (синонимы: семейная гипертриглицеридемия, семейная эссенциальная гиперлипидемия, индуцированная углеводами липемия). Причиной ее развития предположительно считается повышенное образование липопротеинов очень низкой плотности в печени, замедленный их катаболизм или то и другое, вместе взятое. Отличается гиперинсулинизмом. Нередко сочетается с диабетом. Как вторичная форма сопровождает гликогенозы, подагру (см.), алкоголизм (см.), гипофункцию гипофиза (см.), сахарный диабет (см.), нарушения переваривания липидов. V тип: гиперхиломикронемия и гипер-пребета-липопротеинемия — комбинированная липемия, вызванная жирами и углеводами. Часто сочетается с сахарным диабетом.
Клиническая картина Болезнь Гоше Выделяют 3 типа этого заболевания: — тип I — хроническая форма; — тип II — инфантильная (злокачественная) форма; — тип III — ювенильная форма. Основными признаками болезни Гоше являются: гепатоспленомегалия (увеличение печени и селезенки); склонность к развитию геморрагического синдрома (кровоизлияния в кожу, носовые и кишечные кровотечения); отставание в физическом развитии; изменения костной системы при рентгенологическом исследовании (остеопороз, истончение кортикального слоя; дистрофия вплоть до кахексии). Болезнь Гоше может проявляться в различном возрасте, причем инфантильная форма заболевания развивается уже в первые месяцы жизни, хронический тип отмечается у детей более старшего возраста. Кроме того при болезни Гоше проявляется неврологическая симптоматика (гипертония мышц, судороги, тризм) при инфантильном типе, своеобразная коричневая окраска кистей, лица; анемия; хроническая дыхательная недостаточность, интермиттирующий цианоз (синюшность), кашель. Для хронической формы не характерны нарушения со стороны нервной системы, течение болезни длительное, нередки ремиссии. Основными симптомами при этом являются увеличение селезенки, умеренное увеличение печени. Детская (или инфантильная) форма заболевания характеризуется быстрым и злокачественным течением. В период новорожденности симптомов болезни не обнаруживается, однако уже в первые месяцы жизни обнаруживается задержка физического и нервнопсихического развития. Поражение нервной системы рассматривается как острое нейропатическое заболевание. Ювенильная форма болезни Гоше по тяжести и особенностям течения занимает промежуточное положение между 1-м и 2-м вариантами.
Болезнь Ниманна — Пика Выделяют следующие варианты этого заболевания: типичная (классическая) форма — вариант А; атипичные формы — вариант В, С, D. Основными симптомами заболевания являются: рвота, гипотрофия, увеличение печени и селезенки, увеличение размеров живота, задержка психического и двигательного развития, лимфаденопатия, поражение нервной системы (спастические парезы, гипотония мышц, гипорефлексия), слепота, глухота, снижение иммунологической реактивности, анемия, тромбоцитопения, повышение уровня холестерина в крови, остеопороз, остеомаляция, асцит, бронхопневмония, пигментация кожи (коричневый оттенок), гепатит с переходом в цирроз печени, отставание в нервнопсихическом развитии. Вариант А характеризуется классической клинической картиной и злокачественным течением. При этом доминирует тяжелое поражение нервной системы. Вариант В протекает без вовлечения в процесс центральной нервной системы. Для варианта С типично более благоприятное течение с поздним проявлением неврологических симптомов. Вариант Д протекает атипично, с подострым гепатитом, переходящим в цирроз печени.
Болезнь Тей-Сакса Развивается прогрессирующее снижение зрения и деградация интеллекта. Могут быть различные неврологические симптомы. На глазном дне обнаруживается характерное вишнево-красное пятно. Возникает атрофия зрительного нерва. Болезнь заканчивается летальным исходом.
Плазматический липоидоз Основными признаками при всех типах является гиперлипидемия (увеличение липидов в крови). На коже часто появляются ксантомы. Печень и селезенка нередко увеличены. Гиперхиломикронемия встречается крайне редко, проявляется в детском возрасте коликами в верхнем отделе живота, панкреатитом, гепатоспленомегалией, которая обусловлена усиленным захватом хиломикронов из кровотока клетками ретикулоэндотелиальной системы в печени и селезенке. Причиной абдоминальных болей у пациентов со спленомегалией является инфаркт селезенки. Гиперпротеинемия IIА проявляется ранним атеросклерозом (коронаросклерозом, инфарктом миокарда), ксантоматозом, коагулопатией. Семейная дис-бета-липопротеинемия проявляется ранним атеросклерозом многих артерий, в том числе сосудов нижних конечностей, ожирением, сахарным диабетом, ксантоматозом. Гипер-пребета-гипопротеинемия встречается часто, проявляется ранним атеросклерозом, снижением толерантности к глюкозе, гиперурикемией. Эруктивные ксантомы образуются при содержании триглицеридов в крови более 17,0 ммоль/л, они легко рассасываются при нормализации уровня триглицеридов. При еще большем повышении триглицеридов в крови могут появиться признаки панкреатита. Нередко гиперлипемия сочетается с диабетом. В отличие от I типа V тип редко выявляется в детском возрасте. Наблюдаются эруктивные ксантомы, непереносимость глюкозы, гиперурикемия и симптомы периферической нейропатии.
Осложнения При болезнях Гоше и Ниманна-Пика основными осложнениями являются: дистрофия, геморрагический синдром, спонтанные переломы и деформации скелета, слепота, глухота, легочно-сердечная недостаточность. Прогноз при болезни Ниманна-Пика неблагоприятный, при болезни Гоше может определяться возрастом ребенка к началу заболевания: чем меньше возраст, тем тяжелее прогноз. Основными критериями тяжести при этих заболеваниях являются: выраженность нервно-психических нарушений (от задержки развития до идиотии), выраженность неврологических нарушений; характер проявления гиперспленизма (анемия, лейкопения, тромбоцитопения); степень выраженности гипотрофии; степень вовлечения в патологический процесс других органов и систем.
Диагностика и дифдиагностика Болезнь Гоше Диагноз устанавливается по обнаружению специфических клеток Гоше в образце ткани селезенки или в костном мозге. Дифференцируют болезнь Гоше с такими заболеваниями, как болезнь Ниманна-Пика, лимфогранулематоз, цирроз печени, сепсис, туберкулез и др.
Болезнь Ниманна-Пика При генетически обусловленном дефекте сфингомиелиназы в ретикуломакрофагальной системе и головном мозге, а также в мезенхимальных и эпителиальных элементах многих органов накапливается большое количество сфингомиелина. В костном мозге появляются многоядерные макрофаги — клетки Пика.
Плазматический липоидоз (дислипопротеинемия) Основным критерием фенотипирования типов дислипопротеинемии является содержание липидов и липопротеидов в плазме крови.
Лечение и профилактика При болезни Гоше назначают комплекс поливитаминов, липокаина, метионина, препаратов кальция, железа курсами по 1 месяцу, противосудорожные средства — длительно. К препаратам выбора относят гормонотерапию (преднизолон в дозе до 2 мг на 1 кг массы тела в сутки), проводимую по прерывистой схеме, общей длительностью 3–4 месяца, с дополнительным назначением препаратов калия (оротат калия, панангин). При выраженных явлениях гиперспленизма — спленэктомия. Проводится симптоматическая терапия при неврологических расстройствах, поражении других органов и систем. Проводятся диетотерапия с ограничением животного жира, общеукрепляющие мероприятия, массаж, гимнастика. Больной находится на диспансерном наблюдении. Профилактика связана с лечением сопутствующих заболеваний. При болезнях Ниманна-Пика, Тей-Сакса эффективных методов лечения пока тоже нет. Проводят симптоматическую терапию, как и при болезни Гоше. При плазматическом липоидозе в основе лечения находится диетотерапия с ограничением животных и заменой их растительными жирами, богатыми полиненасыщенными жирными кислотами. А при 3-м и 4-м типах заболеваний диета с ограничением и углеводов. Показаны: лечебная физкультура, препараты, снижающие содержание холестерина в крови (мисклерон, полиспонин, менетол и др.). Профилактические меры направлены на профилактику ишемической болезни сердца, атеросклероза, инфаркта миокарда (см.).
ЛИПОМА
ОпределениеЛипома — доброкачественная опухоль, развивающаяся из жировой ткани.
Этиология и патогенез Липома чаще наблюдается у женщин в возрасте от 30 до 50 лет. Она локализуется в коже, подкожной, межмышечной, забрюшинной, околопочечной клетчатке, молочной железе, органах желудочно-кишечного тракта, легких, средостении, миокарде, мозговых оболочках, по ходу нервных стволов, в костях. Липома может встречаться в полости черепа, печени, матке; развивается из дисэмбриогенетических (нарушенных) зачатков жировой ткани. Рост липом не связан с общим состоянием организма, так как при истощении они продолжают накапливать жир. Липома иногда достигает больших размеров. В этих случаях опухоль отвисает, ее основание выпячивается в тонкую ножку из кожи, что создает условия для застоя крови, отека, омертвения и изъязвления. Забрюшинные липомы чаще встречаются у женщин от 40 до 50 лет; большие размеры позволяют иногда прощупывать их через брюшную стенку. По мнению некоторых авторов, большинство забрюшинных липом являются медленно развивающимися липосаркомами.
Патанатомия Липома имеет узловатую форму — узел дольчатого строения, окружен капсулой, реже встречается так называемая распространенная липома, с разлитыми, лишенными соединительнотканной капсулы разрастаниями жировой ткани (при болезни Деркума, синдроме Маделунга). Липома построена по типу жировой ткани и отличается от нее различными размерами долек и жировых клеток. Последние то очень малы, то достигают гигантских размеров.
Клиническая картина Обычно липома мягкой консистенции; при выраженном развитии соединительной ткани она становится более плотной. В зависимости от преобладания жировой или соединительной ткани говорят о липофиброме или фибролипоме. При обильном развитии кровеносных сосудов в опухоли ее называют ангиолипома, при обнаружении в липоме ослизненной ткани — миксолипомой, гладкомышечных волокон — миолипомой. Редкой разновидностью липом является миелолипома, в которой зрелая жировая ткань находится в смеси с кроветворной. Миелолипома встречается в клетчатке забрюшинного пространства и малого таза, а также в надпочечниках, носит доброкачественный характер и не сочетается с нарушениями кроветворения. Интрамуральная (инфильтрирующая) липома располагается в толще мышц, не имеет четких границ. Большим своеобразием отличается так называемая гибернома — весьма редкое новообразование в подкожной клетчатке, напоминающее отек некоторых впадающих в зимнюю спячку животных. Особую форму представляет липома арборесценс, которая наблюдается обычно на фоне различных хронических воспалений в тканях коленного сустава в виде множественных разветвленных липоматозных образований. Опухоль растет медленно и вызывает незначительные функциональные расстройства. Липома долгое время может оставаться неизменной или расти очень медленно. Под влиянием травмы или без ясной причины липома приобретает характер злокачественной опухоли с инфильтрацией соседних тканей (см. Липосаркома).
Диагностика и дифдиагностика Распознавание поверхностных липом основано на их местоположении, мягкой эластической консистенции, подвижности, безболезненности при прощупывании и типичных втяжениях при растягивании кожи над опухолью. Множественные мелкие липомы, располагающиеся по ходу нервных стволов, иногда болезненны вследствие давления на нерв. Диагноз глубоколежащих липом затруднителен, устанавливается только при тканевом исследовании. Дифференциальная диагностика липом проводится в основном со злокачественными опухолями, в сомнительных случаях применяют цитологическое исследование пунктата и ангиографию. Рентгенологическая диагностика липом мягких тканей основана на применении длинноволнового («мягкого») рентгеновского излучения. «Жесткость» излучения и экспозицию подбирают в зависимости от толщины исследуемого участка мягких тканей, величины и плотности пальпируемого образования. Изучение кожи, подкожной клетчатки проводится на более «мягком» снимке; рентгенография липом, залегающих, например, в мышечной ткани, требует увеличения «жесткости» пучка рентгеновских лучей. При липоме, расположенной в тканях конечностей, шеи и туловища, рекомендуется рентгенография «мягкими» лучами или «жесткими» лучами с применением отсеивающей сетки. При локализации липомы в грудной клетке, брюшной полости или забрюшинном пространстве рентгенологическое исследование проводится только «жесткими» лучами с решеткой в условиях искусственного контрастирования газом (пневморетроперитонум, пневмомедиастинум и др.). На рентгенограммах липома представляет собой гладко очерченное просветление обычно правильной формы. Просветление, образуемое липомой, как правило, гомогенное, но изредка в нем встречаются мелкие участки обызвествления. Форма просветления зависит от плотности органов, между которыми заключена липома. Подкожная узловатая липома проявляется в виде четко очерченного, округлой формы образования, интенсивность тени которого одинакова с окружающей жировой тканью. Большие, длительно существующие липомы вызывают смещение окружающих тканей. Дифференциальный диагноз при рентгенодиагностике глубоких липом туловища, шеи или конечностей проводят с натечным абсцессом, гематомой, кистой, мио- или фибросаркомой.
Лечение Лечение липомы оперативное. Удаление узлов липомы, окруженных капсулой, как правило, не вызывает затруднений. Оперативные вмешательства при распространенных липомах представляют значительные технические трудности. Показаниями к операциям являются большой размер липомы и локализация, при которой возникают функциональные расстройства или косметический дефект. Прогноз хороший. После нерадикальных операций наблюдают рецидив липом.
ЛИПОМАТОЗ
ОпределениеЛипоматоз — процесс повышенного отложения жира в клетках и тканях в результате нарушения обмена веществ; опухолеподобные разрастания жировой ткани. По распространению липоматоз может быть общим и местным (регионарным), по характеру процесса — диффузным, узловатым и диффузно-узловатым.
Этиология, патогенез и патанатомия Диффузный липоматоз наблюдается в подкожной клетчатке при ожирении (см.), в строме некоторых органов (поджелудочная железа, вилочковая железа), при так называемой межмышечной липоме, характеризуется размытыми, лишенными четких границ, разрастаниями жировой ткани по ходу пучков мышечных волокон и в прослойках соединительной ткани. Узловатый липоматоз по макро- и микроскопическим изменениям сходен с липомой (см.) — узлы носят множественный характер и нередко располагаются симметрично. Диффузно-узловатый липоматоз характеризуется наличием диффузных и узловатых разрастаний жировой ткани, сочетание которых встречается, например, при синдроме Маделунга и болезни Деркума. Микроскопически липоматозные разрастания всех типов повторяют строение зрелой жировой ткани, отличаясь от нее некоторым многообразием клеток и долек, неравномерной толщиной прослоек соединительной ткани, особенно выраженных при так называемом фибролипоматозе.
Клиническая картина Множественные узлы липоматоза чаще обнаруживаются в подкожной клетчатке, реже в желудочно-кишечном тракте и по ходу нервных стволов. При так называемом мультицентрическом липоматозе Тедеши множественные липомы обнаруживаются в коже и во внутренних органах. При множественном липоматозе желудка, по данным некоторых авторов, в 70 % случаев поражается антральный отдел желудка, при этом могут наблюдаться атрофия и изъязвления слизистой оболочки над липоматозными узлами, кровотечение из язв, сужение привратника и внедрение узлов в двенадцатиперстную кишку. Выделяют особые формы липоматоза, которые некоторые авторы относят к опухолям: — болезненный липоматоз Деркума; — множественный, симметричный липоматоз, или синдром Маделунга; ограниченный симметричный липоматоз или синдром Рома-Лери, с развитием в подкожной клетчатке туловища и конечностей единичных или множественных узлов диаметром 3–4 см; синдром Рома-Лери развивается чаще в возрасте 35–40 лет, редко встречается у детей и в период полового созревания, при этом, как правило, не поражаются части тела, расположенные выше уровня сосков молочной железы и ниже коленных суставов; в механизме развития придают значение наследственно-конституциональным и нервно-трофическим факторам; — диффузный липоматоз детского возраста наблюдается исключительно у детей, от ограниченного симметричного липоматоза отличается преимущественным развитием узлов на предплечьях и бедрах, нередко в сочетаниях с мышечной гипертрофией конечности; — нейролипоматоз по своим клинико-анатомическим проявлениям сходен с нейрофиброматозом (см.); — псевдогипертрофический липоматоз наблюдается при атрофии паренхимы некоторых органов и мышечной ткани, при которой происходит вакантное разрастание жировой ткани, например, между атрофированными дольками поджелудочной железы, в околопочечной клетчатке при сморщивании почки, в строме вилочковой железы, в подслизистой основе червеобразного отростка. Течение липоматоза может носить прогрессирующий характер, особенно при диффузных и диффузно-узловых формах; локализация, по мнению большинства авторов, отличается очень редко.
Лечение Лечение липоматоза оперативное, после операции могут быть рецидивы. При диффузно-узловых формах развитая сосудистая сеть в липоматозных разрастаниях может явиться причиной кровотечений при операции.
ЛИПОМЕЛАНОТИЧЕСКИЙ РЕТИКУЛЕЗ
ОпределениеЛипомеланотический ретикулез (синонимы: синдром Потрие-Воренже, липомеланотический гиперпластический ретикулит, липомеланотическая лимфаденопатия, пигментированная лимфогранулема с распространенными кожными явлениями, доброкачественный гиперпластический ретикулогистиоцитоз с меланодермией, лимфаденическая эритродермия, дерматопатическая лимфаденопатия, дерматопатический лимфаденит) — неспецифическая доброкачественная реактивная ретикулярная гиперплазия (увеличение) поверхностных лимфатических узлов, сопровождающая различные хронические болезни кожи.Липомеланотический ретикулез, или дерматопатический лимфаденит, отражает сущность патологического процесса, который не является истинным ретикулезом.
Этиология, патогенез и патанатомия Причинами развития липомеланотического ретикулеза являются различные хронические дерматозы (см.), особенно протекающие с явлениями эритродермии и сопровождающиеся упорным зудом. Так, липомеланотический ретикулез наблюдается у больных эритродермией, развившейся при рецидивах экземы (см.), нейродермита (см.), красного плоского лишая (см.), псориаза (см.), а также при упорном распространенном зуде, грибковом микозе (см.). Развитие липомеланотического ретикулеза связывают с проникновением в лимфатические узлы меланина. При развитии этого процесса в пораженной коже активизируются меланофаги и усиливается транспортировка меланина по лимфатическим сосудам в регионарные узлы. Происхождение жировых веществ, обнаруживаемых в лимфатических узлах, остается неясным. Капсула лимфатического узла сохранена, периаденит отсутствует. Структура узла, как правило, не нарушена. Иногда она может быть стертой. В корковом веществе имеется скопление ретикулярных клеток с веерообразно расположенными новообразованными капиллярами. Синусы сохранены, хотя нередко бывают замаскированы воспалительным инфильтратом, состоящим из лимфоцитов и в меньшей степени эозинофилов, нейтрофилов и плазматических клеток. Лимфатические фолликулы могут быть гиперплазированы, однако в периферических зонах лимфатического узла они чаще кажутся атрофичными в результате их сдавления ретикулярными клетками. В большинстве случаев часть ретикулярных клеток содержит поглощенные меланин, липиды, иногда гемосидерин. Меланин обнаруживается и внеклеточно. Описаны случаи трансформации липомеланотического ретикулеза в лейкоз (см.), лимфогранулематоз (см.), лимфосаркому (см.). Ряд авторов отождествляет липомеланотический ретикулез с фолликулярной лимфомой Брилла-Симмерса. Ряд авторов рассматривает липомеланотический ретикулез как процесс, который не озлокачествляется даже в тех случаях, когда сопровождает злокачественно текущие заболевания. Считается, что дерматопатический лимфаденит, развивающийся при системных опухолевых или лейкемических поражениях кожи, относить к липомеланотическому ретикулезу не следует. Понятие «липомеланотический ретикулез» принято ограничивать аденопатией, сопровождающей «банальные» дерматозы.
Клиническая картина В наибольшей степени страдают подмышечные и шейные лимфатические узлы. При локализации дерматоза на нижних конечностях липомеланотический ретикулез ограничивается пахово-бедренной областью. С другой стороны, липомеланотический ретикулез может проявляться полиаденопатией. Глубокие лимфатические узлы в процесс не вовлекаются. Лимфатические узлы увеличиваются до размеров 3–4 см в диметре, плотные, безболезненные, друг с другом не спаиваются и не нагнаиваются. С разрешением причинного дерматоза аденопатия регрессирует (подвергается обратному развитию). Ряд авторов отмечает как характерный признак липомеланотического ретикулеза — повышенную пигментацию кожного покрова, подчеркивая параллелизм ее развития с отложением меланина в лимфатических узлах.
Диагностика и дифдиагностика Диагноз основывается на клинических проявлениях, обязательно подтвержденных тканевым исследованием лимфатических узлов. Липомеланотический ретикулез дифференцируют с лимфогранулематозом (см.), фолликулярной лимфомой Брилла-Симмерса (см.) и специфическим поражением лимфатических узлов при грибковом микозе (см.). Для липомеланотического ретикулеза характерна сохранность структуры и капсулы лимфатических узлов и интенсивное поглощение меланина и липидов ретикулярными клетками, для лимфогранулематоза — клетки Березовского — Штернберга, для грибкового микоза — «микозные» клетки. Ретикулярные клетки при липомеланотическом ретикулезе обычно крупнее, чем опухолевые клетки грибовидного микоза.
Лечение и профилактика Лечение и прогноз зависят от характера дерматоза, на фоне которого развился липомеланотический ретикулез (экзема, нейродермит, псориаз (см.)). Профилактика состоит в своевременном лечении дерматозов.
ЛИПОСАРКОМА
ОпределениеЛипосаркома — злокачественная опухоль, развивающаяся из жировой ткани.
Этиология, патогенез и патанатомия По строению липосаркома может напоминать эмбриональную фетальную или незрелую жировую ткань. Липосаркома из эмбриональной ткани имеет тонкую полупросвечивающую капсулу, студенистую консистенцию, сероватый цвет с темно-красными прожилками, другие липосаркомы с плохо выраженной капсулой, более плотной консистенции, желтого цвета, с тяжами соединительной ткани, очагами омертвения и кровоизлияний. Липосаркома состоит из клеток, находящихся на различных стадиях дифференцировки липобласта. Фигуры митоза в ткани липосаркомы встречаются редко. Крупные опухолевые клетки лежат обычно тесно друг к другу. Разрастания соединительной ткани в липосаркоме встречаются в виде неравномерных прослоек и широких полос. При тканево-химическом исследовании в ткани липосаркомы определяется небольшая активность эстеразы, кислой и щелочной фосфатазы. Происхождение заболевания и механизм развития до конца не изучены, основные предрасполагающие факторы такие же, как и при любом онкологическом процессе (см. Опухоли).
Клиническая картина Различают высокодифференцированную липосаркому (синонимы: полиморфноядерная липома, полиморфноядерная фиброаденома, склерозирующая липома), миксоматозную липосаркому (синоним: эмбриональная липома), круглоклеточную липосаркому (синонимы: аденоидная липома, липома инфильтративно-фетально-клеточная, липобластическая саркома) и полиморфную липосаркому (синонимы: истинная липосаркома, липоцитарная саркома). Липосаркомы могут быть множественными и встречаться в различных областях тела, однако замечено, что излюбленной локализацией высокодифференцированной липосаркомы является забрюшинная клетчатка; миксоматозной липосаркомы — межмышечная жировая ткань бедра и голени. Липосаркомы обычно медленно растут и редко метастазируют; описаны случаи заноса метастазов вместе с кровотоком в легкие, печень, костный мозг при миксоматозном и полиморфном типах липосаркомы.
Лечение Лечение оперативное или комбинированное (удаление липосаркомы в сочетании с лучевой терапией). Прогноз чаще неблагоприятный, после операции наступают рецидивы.
ЛИСТЕРИОЗ
ОпределениеЛистериоз (синоним: листереллез) — острая инфекционная болезнь зоонозной природы, вызываемая листерией и характеризующаяся множественностью путей заражения, многообразием клинической картины с поражением затылочных и других лимфатических узлов, мононуклеарной реакцией белой крови, часто с септицемией и поражением центральной нервной системы.
Этиология и эпидемиология Начало изучения листериоза относится к 1911 г., когда был описан новый вид микроорганизма, в последующем названный листерией. В России листериоз впервые был описан Слабоспицким (1936 г.) у свиней. Сахаров и Гудков описали это заболевание у людей при раневых менингоэнцефалитах. Билибин в 1949 г. представил общую симптоматику листериоза и клинику некоторых форм этого заболевания. Возбудитель болезни — листерия — представляет собой короткие (0,5–0,6 мкм) палочки или кокко-бациллы, грамположительные, аэробы, способные вызывать гемолиз. Хорошо развиваются на обычных питательных средах. Устойчивы во внешней среде. В почве, воде, соломе, зерне при низких температурах листерии могут сохраняться несколько лет. В молоке, мясе при 4–6 °C они не только не гибнут, но и интенсивно размножаются. На них губительно действуют обычные дезинфицирующие вещества в рабочих концентрациях. Листерии чувствительны к пенициллину, тетрациклинам, эритромицину, левомицетину. Листерии спор не образуют, но могут иметь капсулу, имеют 1–4 полярно расположенных жгутика, обеспечивающих подвижность. Листерии имеют антигенное родство со стафилококками, энтерококками, сенной палочкой и особенно с возбудителем свиной рожи (эризипелоид), что затрудняет серологическую диагностику болезни. Листерии образуют фаги, по которым выделяют 9 фаговаров. Установлены L-формы листерий, которые в 4–5 раз менее вирулентны и обладают меньшей ферментативной активностью. Листериоз представляет собой типичную инфекцию, передающуюся от животных. Носителем возбудителя в природе являются многие виды грызунов (мыши, крысы, песчанки, тушканчики, зайцы и др.). Листерии выделены от лисицы, енота, дикого кабана, глухаря, куропатки. У большинства диких животных листериоз протекает доброкачественно. Зараженные животные обсеменяют возбудителем внешнюю среду. Из домашних животных листериоз отмечен у коз, овец, свиней, крупного рогатого скота, лошадей, собак, кошек, кур, гусей, уток. Заражение человека чаще всего происходит от инфицированных домашних животных при употреблении в пищу недостаточно термически обработанных мясных и молочных продуктов. Эпидемиологическую опасность представляют вода и пищевые продукты, загрязненные выделениями больных грызунов. Возможен контактный путь заражения при уходе за больными животными, при разделке мяса и обработке шкур. Заражение через клещей и других кровососущих паразитов имеет второстепенное значение. Не исключается заражение листериозом при вдыхании инфицированной пыли. Но наибольшее значение имеет заражение при поедании пищи, содержащей возбудитель. Заражение человека от человека не описано, но внутриутробное заражение плода от больной матери наблюдается часто. Заболевание людей происходит круглогодично. Чаще всего возникают единичные случаи заболевания. К инфекции восприимчивы все группы населения, но чаще всего болеют работники животноводства, полеводы, ветеринары. Листериоз обнаружен во всех странах Европы и во многих странах других континентов.
Патогенез и патанатомия Листерии могут проникать в организм через слизистые оболочки пищеварительного тракта, зева, глаза, носа, органы дыхания, через поврежденную кожу. Из мест внедрения листерии распространяются вместе с лимфо- и кровотоком. По мере продвижения возбудителя в лимфатической системе отмечается увеличение лимфатических узлов, но обычно без нагноения. При попадании возбудителя в кровь развивается острое лихорадочное заболевание. В дальнейшем происходит фиксация возбудителя в ретикулоэндотелиальной системе (печень, селезенка, лимфатические узлы) и в нервной системе с развитием менингита и менингоэнцефалита. Листерии могут длительно сохраняться в почках, что имеет значение для внутриутробногозаражения плода. Лимфогенная и гематогенная диссеминация (распространение) в паренхиматозные органы (миндалины, печень, селезенку, надпочечники, мозг) сопровождается развитием милиарных узелков с некрозом в центре. Последние представлены как гранулемы (листериомы). Этим, а также интоксикацией объясняется развитие распространенного процесса в виде ангинозно-септической (с мононуклеозом), глазожелезистой, нервной и тифоидной форм. При этом из крови, из пунктатов лимфатических узлов или из спинномозговой жидкости можно выделить листерию. При ангинозно-септической форме описаны увеличение селезенки, миндалин, глубоких шейных и верхушечных (над- и подключичных) лимфатических узлов, изъязвления в миндалинах, на слизистой оболочке десен, полости рта, носа, глотки, пищевода. При тканевом исследовании в стенке глотки, в области язв, в печени, легких выявляются главным образом периваскулярные (вокруг сосудов) инфильтраты из лимфоидных клеток. В печени наряду с ними наблюдаются светлые ретикулярные клетки. В селезенке и лимфатических узлах — разрастание ретикулярных клеток, местами с образованием своеобразных очагов из крупных светлых клеток. При глазожелезистой форме в материале биопсии конъюнктивы обнаруживают обильную лимфоцитарную инфильтрацию с формированием фолликулов из ограниченных скоплений лимфоидных клеток. При нервной форме наряду с воспалительными изменениями на мягкой мозговой оболочке могут быть мелкие беловатые узелки, главным образом по ходу сосудов. В веществе мозга, кроме отека, гиперемии, диапедезных (в результате пропотевания) кровоизлияний, выявляются серовато-красные очажки в мосту мозга, продолговатом мозге, реже в мозжечке и ядрах ствола. При тканевом исследовании видны периваскулярные инфильтраты из полинуклеарных клеток, омертвевшие участки то с большим количеством лейкоцитов, содержащих возбудителя, то окруженные многоструктурными клетками, иногда гранулемы из гистиоцитарных клеток, среди которых располагаются листерии. Тифоидная (септико-тифозная) форма характеризуется сходными с ангинозно-септической формой изменениями, за исключением поражений миндалин и лимфоидного аппарата носовой части глотки. При листериозе беременных наряду с поражением внутренних органов листериозные гранулемы обнаруживаются в плаценте. При вскрытии погибших от листериоза новорожденных в различных органах и тканях определяются хорошо отграниченные беловатые узелки, которые постоянно видны в печени, часто в легких, селезенке, реже в надпочечниках, слизистых оболочках глотки, пищевода, кишечника, миндалинах, лимфатических узлах, в мозге, почках, яичках, миокарде, коже. Часто поражаются мозговые оболочки, но гранулемы могут быть также в любой части нервной системы. Характерные для листериоза изменения выражаются в образовании гранулем (листериом) с разнообразной структурой в зависимости от длительности болезни. В развитии гранулем различают несколько стадий: — I стадия — очаговые омертвения клеток, связанные с заражением их листериями, распространяющимися в организме вместе с кровотоком; — II стадия — появление клеточных элементов вокруг очагов омертвения с последующим формированием гранулем, состоящих главным образом из полиморфно-ядерных лейкоцитов и лимфоидных клеток; — III стадия — некробиотические изменения в центре гранулем с присоединением экссудативных процессов; — IV стадия — организация некротических очагов с последующим рубцеванием.
Клиническая картина Инкубационный период при листериозе колеблется от 3 до 45 дней. Длительность инкубационного периода зависит от места внедрения, болезнетворности возбудителя, реактивности организма. Выделяют четыре основные клинические формы листериоза: — ангинозно-септическая; — нервная; — тифоидная; — глазожелезистая. Листериоз может носить характер острой, подострой, хронической и абортивной формы. Известны случаи длительного бессимптомного носительства листерий. Заболевание начинается остро с возникновения головной боли, озноба, болей в мышцах, общей слабости, бессонницы, повышения температуры в первые же дни до высоких цифр. Длительность лихорадки различна: от 3 дней до 3 недель и более. Температурная кривая неправильного типа. Нередко у больных наблюдается сыпь эритематозного характера, особенно в области суставов, на лице образуется фигура «бабочки». Аппетит снижается, появляются тошнота, запор. В отдельных случаях ведущими симптомами являются рвота, расстройство стула. Печень и селезенка увеличиваются не всегда. Могут увеличиваться и становятся болезненными отдельные лимфатические узлы. Лихорадочный период продолжается от 10 до 25 дней. Ангинозно-септическая форма листериоза встречается наиболее часто. Она проявляется в виде легких катаральных и фолликулярных ангин без заметных сдвигов в формуле крови или ангинозно-септических форм с тифоподобным течением и нервным синдромом. Листериозные ангины по клиническим проявлениям близки к стрептококковой ангине. При катаральной или фолликулярной листериозной ангине наблюдаются покраснение зева, увеличение миндалин, увеличение лимфатических узлов. Температура повышается до 38,5 °C и держится на этом уровне 5–6 дней. Заболевание обычно завершается полным выздоровлением. При язвенно-пленчатой ангине появляется яркая гиперемия (покраснение) зева, на миндалинах образуются пленчатые налеты и язвы, покрытые пленками; увеличиваются и становятся болезненными регионарные лимфатические узлы. Температура достигает 39 °C. Печень и селезенка увеличиваются. Заболевание длится 10–12 дней. Как при катаральной, так и при других листериозных ангинах могут быть выражены катаральные (воспалительные) симптомы (кашель, насморк). Прогрессирование процесса приводит к развитию ангинозно-септической формы метеоризма, наблюдающейся преимущественно у взрослых. Лихорадка ремиттирующего характера с вечерним подъемом температуры до 38–39 °C в течение 15–20 дней. Отмечаются покраснение лица, конъюнктивит, насморк. В зеве выявляются гиперемия (покраснение), увеличение миндалин и налеты на них белого цвета. Шейные лимфатические узлы увеличены и уплотнены. Незначительно увеличены печень и селезенка. На коже возникает сыпь по типу крапивницы. В крови появляются мононуклеары. В разгар заболевания не исключено развитие менингеальных симптомов (ригидность затылочных мышц), симптомов Кернига. При современной терапии заболевание заканчивается полным выздоровлением, но бывают и летальные исходы. Одним из осложнений является эндокардит. При нервной форме листериоза возникают менингит, менингоэнцефалит, энцефалит, абсцесс мозга. Поражается и периферическая нервная система. Клинически листериозный менингит выражается резкой головной болью, многократной рвотой, ригидностью затылочных мышц, положительным симптомом Кернига. Отмечаются гиперестезия (повышенная чувствительность), клонические судороги, напряжение всех мышц, нарушение сознания, бред. При менингоэнцефалите добавляются очаговые симптомы: птоз век (опущение век), анизокория, стробизм, появление патологических рефлексов, нарушение кожной чувствительности. Могут быть параличи и психические расстройства. В ранний период листериоза в периферической крови отмечается моноцитоз, в поздние периоды болезни обнаруживаются лейкоцитоз и гранулоцитоз. Спинномозговая жидкость вытекает под повышенным давлением. В ней обнаруживаются повышенное содержание белка, нейтрофилы, лимфоциты; сахар и хлориды содержатся в нормальном количестве. В поздние сроки заболевания спинномозговая жидкость становится гнойной. Температура при нервной форме листериоза может не превышать 38 °C (листериоз центральной нервной системы чаще всего встречается у детей в возрасте до месяца и у взрослых старше 40 лет). В пожилом возрасте болезнь проявляется как вторичная инфекция на почве ослабления организма другими заболеваниями (диабет, сердечно-сосудистые заболевания, туберкулез). В качестве остаточных явлений у некоторой части выздоравливающих, перенесших листериоз центральной нервной системы, отмечаются нарушения координации движений и психики. Поражения периферической нервной системы листериозного прохождения проявляются главным образом парезами и параличами. В отдельных случаях заболевание носит характер полирадикулоневрита. Глазожелезистая форма возникает чаще в результате контакта с инфицированными животными. Для глазного листериоза характерны явления конъюнктивита, выраженный отек век, сужение глазной щели. Роговица в патологический процесс не вовлекается. Острота зрения снижается. Увеличиваются околоушные и подчелюстные лифматические узлы, они болезненны. В крови увеличивается количество моноцитов и лимфоцитов. Температура обычно нормальная или повышенная. Длительность заболевания — 1–3 месяца. Тифоидная (септико-тифозная) форма характеризуется тифоподобным течением с длительной лихорадочной реакцией, нередко сопровождается появлением сыпи неопределенного характера, артериальной гипотензией (пониженным давлением), увеличением печени и селезенки, в которых при летальных исходах выявляются некротические гранулемы. Часто бывает гепатит с желтухой. Ангина не наблюдается или слабо выражена, не увеличиваются лимфатические узлы. Описываются полисерозит (воспаление серозных оболочек) с перикардитом и плевритом, тромбоцитопения (снижение числа тромбоцитов в крови), понижение свертываемости крови, кровотечения. Некоторые клиницисты к этой форме относят и ангинозно-септическую форму, если при ней появляется сыпь. Хроническая форма листериоза нередко клинически почти не проявляется. Обострения заболевания часто сопровождаются кратковременной лихорадкой, катаральными (воспалительными) явлениями; иногда заболевание протекает по типу хронического пиелонефрита, зачастую наблюдаются расстройства пищеварения. У лиц с пониженным иммунитетом обострение хронического листериоза может приобрести характер тяжелого распространенного септического процесса. Абортивное течение листериоза характеризуется острым началом заболевания, развитием симптомов одной из его форм, но заканчивается заболевание быстро, при полном угасании всех симптомов. Нередко наблюдаются смешанные формы течения листериозной инфекции. Описаны также эндокардит, уретрит у мужчин, первичная атипичная пневмония и изолированные абсцессы, энцефаломиелит, листериозная природа которых была диагностирована лишь с помощью бактериологических и серологических тестов. Листериоз у беременных чаще протекает атипично или стерто без определенной клинической картины, по типу гриппа, острых респираторных вирусных заболеваний, ангины, диареи, пиелита, затруднения мочеиспускания. Кровь почти не изменяется. Рождение мертвого плода должно вызвать подозрение на листериоз. Допускается возможность длительного обитания листерий во влагалище с повторной заболеваемостью. У значительного числа болеющих регистрируется мертворождение. При врожденном листериозе инфицирование плода может произойти как в ранние, так и в последние месяцы беременности или во время родов при аспирации (вдыхании) и заглатывании околоплодных вод с находящимися в них листериями. При инфицировании в ранние сроки беременности может наступить самопроизвольный аборт или родиться ребенок с пороками развития. При заражении во второй половине беременности рождается ребенок с признаками врожденного листериоза. Клинические проявления болезни в этих случаях не отличаются строгой специфичностью. Септико-гранулематозная форма наблюдается у плодов и новорожденных детей. Структурную основу этой формы инфекции составляет септико-гранулематозный процесс с узелковыми перерождениями — листериомами печени, легких и других внутренних органов, а также зева, гортани, пищевода. При распространении инфекции на головной мозг возникают гнойный менингит и гидроцефалия (водянка мозга). Листериоз новорожденных, появившихся на свет преждевременно, обычно не распознается. Общие признаки заболевания проявляются расстройством дыхания и кровообращения. Кроме того, наблюдаются рвота, слизистый стул, розеоло-папулезная сыпь, гнойный менингит, который завершается смертью. При раннем поражении плода развиваются уродства. У грудных детей листериоз начинается в виде острого респираторного заболевания: повышается температура, появляются насморк, кашель, возникают мелкие очаги бронхопневмонии. Пневмония иногда протекает как интерстициальная (межклеточная). Листерии могут вызывать гнойный плеврит. Одновременно развиваются расстройства пищеварения. Печень увеличивается, нередко возникает желтуха. Селезенка увеличивается не всегда. У части больных наблюдается сыпь. На стенке глотки видны многочисленные гранулемы. Отмечаются учащение сердцебиения, глухость сердечных тонов, менингеальные симптомы, судороги, параличи. В случае выздоровления у детей после перенесенного заболевания иногда остаются расстройства деятельности периферической и центральной нервной системы. У беременных женщин листериоз может протекать в хронической форме бессимптомно, оставаясь нераспознанным. Заражение плода происходит с 4—5-го месяца беременности и в более поздние сроки.
Осложнения Наиболее часто отмечается пневмония, развивающаяся вследствие присоединения вторичной микрофлоры в очагах некротизирующихся листериом. Описан подострый листериозный эндокардит (см.). При врожденном листериозе наиболее часты гидроцефалия (см.), гнойныгй менингит (см.), отставание в умственном развитии.
Диагностика В связи с многообразием клинических проявлений болезни основное значение в диагностике придается результатам лабораторных исследований. Для этого производят посев материала от больного на питательные среды. Материалом для исследования являются слизь из носоглотки и зева, гнойное отделяемое конъюнктивы, кровь, спинномозговая жидкость, пунктат лимфатического узла. От трупов погибших от листериоза для посева берут кусочки печени, селезенки, головного мозга. Посевы делают на мясной бульон с 0,5 %-ным содержанием теллурита калия или на кровяной агар. Для ориентировочного обнаружения листерий в инфицированном материале используют метод люминесцентной микроскопии. Из серологических методов диагностики листериоза применяют реакцию агглютинации и реакцию связывания комплемента с использованием антигенов в парных сыворотках. Сыворотка больного берется не ранее 7-го дня болезни, вторую пробу берут через 10–14 дней после первой. Доказательным является лишь очень высокий титр ее (1:400 — 1:800) и нарастание титра в динамике заболевания в 4 раза и более. Эту реакцию нельзя считать строго специфичной. Более специфична реакция связывания комплемента (РСК). Диагностическим титром РСК считается 1:10 (не ниже) с обязательным нарастанием титра в процессе болезни. Вспомогательное значение имеет биологическая проба (заражение материалом от больного внутрибрюшинно белых мышей). Известное значение для диагностики имеет кожная аллергическая проба в ответ на введение больным внутрикожно 0,1 мл убитой взвеси листерий.
Дифдиагностика Дифференциальная диагностика листериоза проводится со многими заболеваниями в зависимости от его клинических проявлений. Ангинозно-септическую форму листериоза дифференцируют с ангинами (см.) другого генеза, инфекционным мононуклеозом (см.), дифтерией (см.), стрептококковыми ангинами, агранулоцитарной ангиной, ангинозножелезистой формой туляремии (см.) и др. Глазожелезистая форма листериоза по клиническим проявлениям сходна с глазожелезистой формой туляремии, конъюнктивитами различного происхождения. Листериоз, протекающий с поражением центральной нервной системы, требует тщательного дифференцирования с менингококковым (см.), лептоспирозным (см.), пневмо- и стафилококковым и другими серозными менингитами (см.) и др. Тифоидную форму дифференцируют с брюшным тифом (см.), сепсисом (см.), псевдотуберкулезом (см.) и др. Энцефалитическую форму листериоза дифференцируют с вирусными и другими энцефалитами (см.), менингоэнцефалитами (см.), абсцессами (см.) и опухолями мозга (см.) и др. Листериозные аборты у женщин по форме происхождения дифференцируют с абортами при бруцеллезе (см.) и токсоплазмозе (см.). Диагноз ставится с учетом данных эпидемиологии. Врожденный листериоз дифференцируют с врожденной цитомегалией (см.), токсоплазмозом (см.), сифилисом (см.), стафилококковым сепсисом (см.), гемолитической болезнью новорожденных (см.), внутричерепной травмой (см.) и др.
Лечение Больным листериозом требуются тщательный уход и полноценное питание. Лечение листериоза проводят в соответствии с его клинической формой. Эффективными этиотропными препаратами являются антибиотики тетрациклинового ряда. Эффективен левомицетин, эритромицин, пенициллин или ампициллин и др. Лечение продолжают весь лихорадочный период и еще 5–7 дней на фоне нормальной температуры при угасании других клинических симптомов. При поражении центральной нервной системы назначают препараты тетрациклинового ряда со стрептомицином. Более эффективным является сочетание ампициллина с гентамицином или ампициллина с тобрамицином. При нервных формах гентамицин и тобрамицин не назначаются, так как они не проникают через гематоэнцефалический барьер. При тяжелых формах этиотропная терапия продолжается до 14–21 дня нормальной температуры. Кроме того, проводят дегидратационную терапию. В случае тяжелого течения листериоза антибиотики сочетают с преднизолоном (5—10 мг 4 раза в сутки с постепенным уменьшением дозы). Преднизолон применяют в течение 7—14 дней. Рекомендуются антигистаминные препараты (димедрол, супрастин, дипразин и др.) в обычных дозах. С целью дезинтоксикации внутривенно вводят большое количество жидкости (5 %-ный раствор глюкозы, раствор Рингера, изотонический раствор хлорида натрия по 500—1000 мл) с одновременным применением средств форсированного диуреза (средств, усиливающих мочевыделение). При глазожелезистой форме, кроме того, применяют закапывание в глаза 2 %-ного раствора альбуцида, 1 %-ную эмульсию гидрокортизона. При хроническом листериозе назначают антибиотики в той же дозе, что и при острой форме, в течение 7— 10 дней, после чего назначают сульфадимезин по 0,5 г 4 раза в день в течение 7 дней. При значительных обострениях хронического листериоза терапия аналогична применяемой при остром его течении.
Профилактика Специфические методы профилактики листериоза не разработаны. В настоящее время профилактика сводится к комплексу санитарно-ветеринарных мероприятий. В населенных пунктах проводится систематическое истребление домовых грызунов (мышей, крыс), а также уничтожение бродячих кошек и собак. Лиц, больных листериозом, госпитализируют. За населенными пунктами, где были выявлены больные, устанавливают эпидемиологическое наблюдение. Беременные женщины с отягощенным акушерским анамнезом подлежат обследованию на листериоз, проводится химиопрофилактика листериоза плода. В природных очагах листериоза необходимо проводить борьбу с грызунами и принимать меры личной профилактики от нападения кровососущих членистоногих — возможных переносчиков листерий. Прогноз у взрослых более благоприятный. У новорожденных и пожилых лиц заболевание может протекать очень тяжело и заканчиваться летальным исходом. У беременных листериоз может приводить к тяжелому поражению плода.
ЛИХОРАДКА
ОпределениеЛихорадка — защитно-приспособительная реакция организма в ответ на воздействие эндо- или экзогенных пирогенов (агентов, вызывающих температурную реакцию), выражающаяся в повышении порога терморегуляции и временном поддержании более высокой, чем обычно, температуры тела.Лихорадка характеризуется не только повышением температуры, но и нарушением деятельности всех систем организма. Степень повышения температуры имеет важное, но не всегда решающее значение для оценки тяжести лихорадки.
Этиология, патогенез и клиническая картина Лихорадка сопровождается учащением пульса и дыхания, снижением артериального давления, выражены общие симптомы интоксикации: головная боль, разбитость, чувство жара и жажды, сухость во рту, отсутствие аппетита; уменьшением мочеотделения, повышением обмена веществ за счет катаболических процессов (процессов разрушения). Быстрое и сильное повышение температуры (например, при воспалении легких) обычно сопровождается ознобом, который может длиться от нескольких минут до часа, реже — дольше. При сильном ознобе характерен вид больного: из-за резкого сужения кровеносных сосудов кожа становится бледной, ногтевые пластинки приобретают синюшный цвет. Испытывая чувство холода, больные дрожат, стучат зубами. Для постепенного повышения температуры характерно небольшое познабливание. При высокой температуре кожа имеет характерный вид: красная, теплая («огненная»). Постепенное падение температуры сопровождается обильным потом. При лихорадке вечерняя температура тела обычно выше утренней. Подъем температуры выше 37 °C днем — основание заподозрить заболевание. В зависимости от степени повышения температуры различают следующие виды лихорадок: — субфебрильная (повышенная) температура 37–38 °C: а) малый субфебрилитет 37–37,5 °C; б) большой субфебрилитет 37,5—38 °C; — умеренная лихорадка 38–39 °C; — высокая лихорадка 39–40 °C; — очень высокая лихорадка — свыше 40 °C; — гиперпиретическая — 41–42 °C, она сопровождается тяжелыми нервными явлениями и сама является опасной для жизни. Большое значение имеет колебание температуры тела в течение суток и всего периода. Основные типы лихорадки: — постоянная лихорадка — температура долго держится высокой, в течение суток разница между утренней и вечерней температурой не превышает 1 °C; характерна для крупозной пневмонии, II стадии брюшного тифа; — послабляющая (ремиттирующая) лихорадка — температура высокая, суточные колебания температуры превышают 1–2 °C, причем утренний минимум выше 37 °C; характерна для туберкулеза, гнойных заболеваний, очаговой пневмонии, в III стадии брюшного тифа; — истощающая (гектическая) лихорадка — большие (3–4 °C) суточные колебания температуры, чередующиеся с падением ее до нормы и ниже, что сопровождается изнуряющими потами; типична для тяжелого туберкулеза легких, нагноений, сепсиса; — перемежающаяся (интермиттирующая) лихорадка — кратковременные повышения температуры до высоких цифр строго чередуются с периодами (1–2 дня) нормальной температуры; наблюдается при малярии; — волнообразная (ундулирующая) лихорадка — периодические нарастания температуры, а затем понижение уровня до нормальных цифр, такие «волны» следуют одна за другой в течение длительного времени; характерна для бруцеллеза, лимфогранулематоза; — возвратная лихорадка — строгое чередование периодов высокой температуры с безлихорадочными периодами, при этом температура повышается и понижается очень быстро, лихорадочная и безлихорадочная фазы продолжаются в течение нескольких дней каждая; характерна для возвратного тифа; — обратный тип лихорадки — утренняя температура бывает выше вечерней; наблюдается иногда при сепсисе, туберкулезе, бруцеллезе; — неправильная лихорадка — разнообразные и неправильные суточные колебания; часто отмечается при ревматизме, эндокардите, сепсисе, туберкулезе, эту лихорадку еще называют атипичной (нерегулярной). В течении лихорадки различают период нарастания температуры, период высокой температуры и период снижения температуры. Резкое снижение повышенной температуры (в течение нескольких часов) до нормы называют кризисом, постепенное понижение (на протяжении нескольких дней) — лизисом. Для первой стадии лихорадки характерно снижение теплоотдачи — наблюдаются спазм периферических сосудов, снижение температуры кожи и потоотделения. Одновременно усиливается температура, что сопровождается познабливанием (ознобом) на протяжении одного или нескольких часов. Больные предъявляют жалобы на головную боль, чувство общего дискомфорта, тянущие боли в мышцах. При выраженном ознобе характерен вид больного: кожные покровы бледные из-за резкого капилляроспазма, отмечается периферическая синюшность, мышечная дрожь может сопровождаться постукиванием зубами. Вторая стадия лихорадки характеризуется прекращением подъема температуры, теплоотдача уравновешивается с теплопродукцией. Периферическое кровообращение восстанавливается, кожа становится теплой на ощупь и даже горячей, бледность кожных покровов сменяется яркой розовой окраской. Потоотделение также усиливается. В третьей стадии теплоотдача преобладает над теплопродукцией, кожные кровеносные сосуды расширяются, потоотделение продолжает нарастать. Снижение температуры тела может протекать быстро и резко (критически) или постепенно. Иногда наблюдается кратковременное повышение температуры в течение нескольких часов (однодневная, или эфемерная лихорадка) при легких инфекциях, перегревании на солнце, после переливания крови, иногда после внутривенного введения лекарственных веществ. Лихорадка продолжительностью до 15 дней называется острой, длящаяся более 45 дней — хронической. Чаще всего причиной лихорадки бывают инфекционные заболевания и образования продуктов распада ткани (например, очага омертвения или инфаркта миокарда). Лихорадка обычно является реакцией организма на инфекцию. Иногда инфекционное заболевание может не проявляться лихорадкой или временно протекать без повышения температуры (туберкулез, сифилис и др.). Степень повышения температуры в значительной мере зависит от организма больного: при одной и той же болезни у разных лиц она может быть различной. Так, у молодых людей с высокой реактивностью организма инфекционное заболевание может протекать с температурой до 40 °C и выше, в то время как это же инфекционное заболевание у лиц старшего возраста с ослабленной реактивностью может протекать с нормальной или слегка повышенной температурой. Степень повышения температуры не всегда соответствует тяжести заболевания, что связано также с индивидуальными особенностями реагирования организма. Лихорадка при инфекционных заболеваниях является наиболее ранней и типичной реакцией на внедрение микробного агента. При этом бактериальные токсины или продукты жизнедеятельности микроорганизмов (вирусов) являются экзогенными пирогенами. Они же вызывают и другую защитную реакцию, заключающуюся в развитии механизмов стресса с усилением выброса нейтрофильных лейкоцитов. Повышение температуры неинфекционного происхождения наблюдается нередко при злокачественных опухолях, омертвении ткани (например, при инфаркте), кровоизлияниях, быстром распаде в крови эритроцитов, введении подкожно или внутривенно чужеродных веществ белковой природы. Значительно реже встречается лихорадка при заболеваниях центральной нервной системы, а также рефлекторного происхождения. При этом подъемы температуры чаще наблюдаются в дневные часы, поэтому возникает необходимость ее почасового измерения. Лихорадка центрального происхождения может наблюдаться при травмах и заболеваниях центральной нервной системы, она отличается тяжелым злокачественным течением. Высокая температура может развиться без участия пирогенов при тяжелом эмоциональном стрессе. Лихорадка характеризуется не только развитием высокой температуры, но и нарушением деятельности всех систем организма. Максимальный уровень температурной кривой имеет важное, но не всегда решающее значение для оценки тяжести лихорадки. Помимо высокой температуры, лихорадка сопровождается учащением пульса и дыхания, снижением артериального давления, возникновением общих симптомов интоксикации: головной боли, недомогания, чувства жара и жажды, сухости во рту, отсутствием аппетита, уменьшением мочеотделения, повышением обмена веществ за счет катаболических процессов. На пике лихорадочного состояния в ряде случаев могут наблюдаться спутанность сознания, галлюцинации, бред вплоть до полной потери сознания. Однако большей частью эти явления отражают особенности течения самого инфекционного процесса, а не только лихорадочной реакции. Частота пульса при лихорадке прямо связана с уровнем высокой температуры только при доброкачественных лихорадках, вызванных малотоксичными пирогенами. Это происходит не при всех инфекционных заболеваниях. Например, брюшной тиф характеризуется выраженным урежением сердцебиения на фоне выраженной лихорадки. В таких случаях влияние высокой температуры на частоту сердечного ритма ослабевает под влиянием других причинных факторов и механизмов развития заболевания. Частота дыхательных движений также увеличивается при развитии высокой температуры. При этом дыхание становится более поверхностным. Однако выраженность урежения дыхания не всегда соответствует уровню высокой температуры и подвержена значительным колебаниям. В лихорадочном периоде у больных всегда нарушается функция пищеварительного тракта. Обычно полностью отсутствует аппетит, что связано с понижением переваривания и усвоения пищи. Язык покрывается налетом различных оттенков (чаще белого), пациенты жалуются на сухость во рту. Значительно снижается объем секрета пищеварительных желез (слюнных, желудочных, поджелудочной железы и пр.). Нарушения двигательной функции желудочно-кишечного тракта выражаются в разного рода нарушениях двигательных функций, обычно с преобладанием спастических явлений. В результате продвижение содержимого кишечника значительно замедляется, как и выброс желчи, концентрация которой возрастает. Заметных изменений в деятельности почек при лихорадке не наблюдается. Повышение суточного мочевыделения в первой стадии (рост повышения температуры) зависит от повышения кровотока в почках вследствие перераспределения крови в тканях. Напротив, некоторое снижение мочевыделения с усилением концентрации мочи на высоте лихорадочной реакции объясняется задержкой жидкости. Одним из важнейших компонентов защитно-приспособительного механизма лихорадки является усиление фагоцитарной активности лейкоцитов и тканевых макрофагов, и, что особенно важно, отмечается рост интенсивности продукции антител. Активация клеточных и гуморальных механизмов иммунитета позволяет организму адекватно реагировать на внедрение чужеродных агентов и прекращать инфекционное воспаление. Высокая температура сама по себе способна создать неблагоприятные условия для размножения различных болезнетворных микроорганизмов и вирусов. В свете вышеописанного понятна цель развития лихорадочной реакции, выработанной в ходе эволюции. Именно поэтому лихорадка является неспецифическим симптомом большого количества разнообразных инфекционных заболеваний.
Диагностика и дифдиагностика Чаще всего лихорадка является наиболее ранним симптомом инфекционного заболевания и решающей для пациента причиной обращения к врачу. Ряду инфекций свойственна типичная температурная кривая. Уровень повышения температуры, длительность и характер лихорадки, а также периодичность ее возникновения могут явиться значительным подспорьем в диагностике. Однако распознать инфекцию в первые дни по одной только лихорадке без дополнительных симптомов практически невозможно. Длительность лихорадочного периода позволяет разделить все подобные состояния на кратковременные (острые) и длительные (хронические). К первым относят высокую температуру продолжительностью не более двух недель, к последним — свыше двух недель. Острые лихорадки длительностью не более одной недели чаще всего возникают вследствие различных вирусных инфекций верхних дыхательных путей и прекращаются самостоятельно без постороннего вмешательства. Ряд кратковременных бактериальных инфекций также вызывает острую лихорадку. Наиболее часто они поражают глотку, гортань, среднее ухо, бронхи, мочеполовую систему. Если лихорадка сохраняется более длительно, то даже при кажущейся ясности клинической картины пациенту требуется более тщательное обследование. Если длительная лихорадка не соответствует другим клиническим проявлениям или общему состоянию больного, обычно употребляется термин «лихорадка неясной этиологии» (ЛНЭ). Выделяют следующие лихорадочные состояния. А. Острые: I. Вирусные. II. Бактериальные. Б. Хронические: I. Инфекционные: — вирусные (инфекционный мононуклеоз, вирусный гепатит В, цитомегаловирусная инфекция, ВИЧ); — бактериальные (туберкулез, бруцеллез, септический эндокардит и др.); — у лиц с вторичным иммунодефицитом. II. Опухолевые. III. При системных заболеваниях соединительной ткани. IV. При прочих состояниях и заболеваниях (эндокринных, аллергических, повышении порога чувствительности центра терморегуляции). Среди инфекционных причин длительной хронической лихорадки следует отметить в первую очередь туберкулез. Трудности в диагностике ряда форм этого заболевания и угрожающая эпидемиологическая ситуация требуют обязательного проведения диагностических тестов на туберкулез у всех длительно лихорадящих пациентов. Среди менее распространенных причин хронической лихорадки следует отметить такие заболевания, как бруцеллез, токсоплазмоз, сальмонеллез, цитомегаловирусную инфекцию (у детей и ослабленных больных). Кроме того, среди заболеваний вирусного происхождения длительные лихорадочные состояния могут вызывать вирусные гепатиты (особенно гепатит В), а также инфекционный мононуклеоз. Неинфекционные причины длительной лихорадки встречаются не более чем в одной трети случаев. К ним можно отнести лихорадку при подостром септическом эндокардите, который достаточно трудно диагностировать при первоначальном отсутствии шумов в сердце. Помимо этого, посевы крови в 15 % случаев не выявляют наличия бактерий в крови. Нередко отсутствуют и периферические признаки заболевания (увеличение селезенки, узелки Ослера и др.). Гнойная инфекция органов брюшной полости и внебрюшинной локализации (подпеченочный и поддиафрагмальный абсцессы, пиелонефриты, апостематозный нефрит и карбункул почки, гнойный холангит и обструкция желчевыводящих путей) также могут приводить к развитию длительно текущих лихорадочных состояний. Помимо последних, причиной хронической лихорадки могут быть воспалительные процессы женской половой сферы, однако в данном случае лихорадка чаще всего протекает по типу длительного субфебрилитета. Около 20–40 % лихорадок неясной этиологии (при неясном факторе возникновения) могут быть обусловлены системной патологией соединительной ткани (системная красная волчанка, системная склеродермия, ревматоидный полиартрит, болезнь Шегрена и пр.). Среди прочих причин наиболее важными являются опухолевые процессы. Среди последних особое место занимают опухоли, происходящие из системы кроветворения (лейкозы, лимфогранулематоз и др.). В ряде случаев лихорадка может быть обусловлена присоединением инфекции, как, например, при карциноме бронха, когда развивается обструкция (затруднение дыхания) и пневмония нижерасположенного участка легкого. Длительные лихорадки могут возникать при патологии эндокринной системы (болезнь Аддисона, тиреотоксикоз). У ряда пациентов после детально проведенного обследования и при отсутствии каких-либо патологических изменений можно говорить о повышении порога чувствительности центра терморегуляции. Особое место среди причин длительных лихорадок занимает синдром приобретенного иммунодефицита, вызванный ВИЧ-инфекцией. Для начального периода СПИДа характерно длительное повышение температуры выше 38 °C, постоянное или перемежающееся. В сочетании с распространенной лимфаденопатией такое состояние должно послужить поводом для экстренного серологического обследования больного на ВИЧ. В обязательный минимум лабораторных исследований длительно лихорадящих больных входят общий анализ крови с подсчетом лейкоцитарной формулы, определение в мазке малярийных плазмодиев, тесты функционального состояния печени, бактериологические посевы мочи, кала и крови до 3–6 раз. Помимо этого, необходимо провести реакцию Вассермана, туберкулиновую и стрептокиназную пробы, серологическое исследование на ВИЧ, а также рентгенологическое исследование легких и УЗИ органов брюшной полости. Даже наличие незначительных жалоб на умеренную головную боль, слабо выраженное изменение психического статуса требуют проведения пункции спинномозговой жидкости с последующим ее исследованием. В дальнейшем, если диагноз продолжает оставаться неясным, ориентируясь на результаты первичного обследования, следует определить у пациента наличие таких признаков, как антиядерные антитела, ревматоидный фактор, антитела к бруцелле, сальмонелле, токсоплазме, гистоплазме, вирусу Эпштейна-Барра, цитомегалии и др., а также провести исследование на грибковые заболевания (кандидоз, аспергиллез, трихофитоз). Следующим этапом обследования при неустановленном диагнозе у длительно лихорадящего больного является проведение компьютерной томографии, которая позволяет локализовать опухолевые изменения или абсцессы внутренних органов, а также внутривенной пиелографии, пункции и посева костного мозга, эндоскопии желудочно-кишечного тракта. Если причину длительной лихорадки установить не удается, рекомендуется назначать таким пациентам пробное лечение, обычно представленное антибиотикотерапией либо специфическими противотуберкулезными препаратами. Если больной уже получает лечение, следует отменить его на некоторое время для исключения лекарственной природы лихорадки. Лекарственная лихорадка развивается в результате аллергической реакции на вводимый препарат (препараты) и сопровождается, как правило, лимфоцитозом с эозинофилией (повышением уровня лимфоцитов и эозинофилов), многообразной сыпью, хотя в ряде случаев этих симптомов может и не быть. Вторичный иммунодефицит встречается у пациентов с опухолевыми процессами, получающих специфическую терапию, в том числе лучевую, у лиц с индуцированной иммуносупрессией, а также у большинства пациентов, часто принимающих антибиотики. Нередко причиной лихорадки у таких больных является инфекция, вызванная условноболезнетворной флорой. Они также являются контингентом, наиболее подверженным возникновению внутрибольничной инфекции. Помимо стафилококка, стрептококка и анаэробов, возбудителями заболеваний у стационарных больных с иммунодефицитом могут являться грибы рода Candida и Aspergillus, пневмоцисты, токсоплазмы, листерии, легионеллы, цитомегаловирусы и вирусы герпеса. Обследование таких пациентов необходимо начинать с бактериологического исследования посевов крови, мочи, кала и мокроты, а также спинномозговой жидкости (в зависимости от клинических проявлений инфекции). Нередко требуется начинать антибиотикотерапию до получения результатов бактериологического посева. В таких случаях следует ориентироваться на наиболее характерную природу возбудителя для данной локализации инфекции у больного (стрептококки и кишечная палочка, а также анаэробы при энтероколитах, кишечная палочка и протей для инфекций мочевыводящих путей). Для распознавания причин острых лихорадок важнейшее значение имеют характер повышения температуры, ее периодичность и высота, а также длительность различных периодов лихорадки. Различная длительность периода повышения температуры может являться характерным признаком ряда острых инфекционных процессов. Например, для бруцеллеза и брюшного тифа типично постепенное нарастание температурной кривой в течение нескольких дней до максимума. Для гриппа, сыпного тифа, кори и большинства вирусных заболеваний дыхательного тракта характерен короткий — не более суток — период повышения температуры до высоких цифр. Острейшее начало заболевания, когда температура достигает максимальных показателей за несколько часов, характерно для менингококковой инфекции, возвратного тифа, малярии. В дифференциальной диагностике причин лихорадочных состояний следует опираться не только на один симптом (повышение температуры), а на весь симптомокомплекс особенностей течения периода высокой температуры. Для риккетсиозов типично сочетание острого развития лихорадки с упорной головной болью и бессонницей, а также покраснение лица и двигательное возбуждение больного. Появление типичной сыпи на 4—5-й день заболевания позволяет диагностировать клинику сыпного тифа. Лихорадка при сыпном тифе — важный клинический признак заболевания. Обычно температура повышается в течение 2–3 дней до 39–40 °C. Температура нарастает как вечером, так и утром. У больных отмечается незначительный озноб. С 4—5-го дня болезни характерен постоянный тип лихорадки. Иногда при раннем применении антибиотиков возможен ремиттирующий тип лихорадки. При сыпном тифе могут наблюдаться «врезы» температурной кривой. Обычно это бывает на 3—4-й день болезни, когда температура тела понижается на 1,5–2 °C, а на следующий день с появлением сыпи на коже вновь поднимается до высоких цифр. Это наблюдается в разгар заболевания. На 8— 10-й день болезни у больных сыпным тифом также может отмечаться «врез» температурной кривой, аналогичный первому. Но затем через 3–4 дня температура снижается до нормы. При применении антибиотикотерапии редко встречаются типичные лихорадочные реакции. При неосложненном сыпном тифе лихорадка длится обычно 2–3 дня, реже — 4 дня и больше. Бореллиозы (возвратный вшивый и клещевой тифы) характеризуются быстрым подъемом температуры до высоких цифр, сопровождающимся выраженными симптомами интоксикации и потрясающим ознобом. В течение 5–7 дней высокая температура сохраняется надостигнутом уровне, после чего критически снижается до нормальных цифр, а затем через 7–8 дней цикл повторяется. Лихорадка — постоянный и характерный симптом брюшного тифа. В основном для этого заболевания характерно волнообразное течение, при котором температурные волны как бы накатываются одна на другую. В середине прошлого столетия немецкий врач Вундерлих схематически описал температурную кривую. Она состоит из фазы нарастания температуры (длящейся около недели), фазы разгара (до двух недель) и фазы падения температуры (около 1 недели). В настоящее время в связи с ранним применением антибиотиков температурная кривая при брюшном тифе имеет различные варианты и отличается разнообразием. Чаще всего развивается ремиттирующая лихорадка и лишь при тяжелом течении — постоянного типа. К числу острых лихорадочных заболеваний относится лептоспироз. Для лептоспироза типично повышение температры в течение суток до 39–41 °C с параллельным возникновением выраженной интоксикации (головной боли, тошноты, рвоты, мышечных болей) и (иногда) болей в животе. Это заболевание человека и животных, характеризующееся интоксикацией, волнообразной лихорадкой, геморрагическим синдромом, поражением почек, печени, мышц. Температура держится на высоких цифрах в течение 6–9 дней. Характерен ремиттирующий тип температурной кривой с колебаниями в 1,5–2,5 °C. Затем температура тела нормализуется. У большинства больных отмечаются повторные волны, когда после 1–2 (реже 3–7) дней нормальной температуры тела вновь отмечается ее повышение до 38–39 °C в течение 2–3 дней. Малярийным приступам свойственна строгая периодичность (кроме тропической малярии). Часто имеет место предшествующий период (1–3 дня), после чего отмечаются характерные, с промежутком в 48 или 72 ч, приступы повышения температуры, когда на фоне потрясающего озноба отмечается подъем температуры в течение 30–40 мин (реже 1–2 ч) до 40–41 °C с выраженной головной болью, тошнотой (реже рвотой). Через 5–9 ч стойкой высокой температуры начинается усиленное потоотделение и критическое снижение температуры до нормальных или слегка повышенных цифр. Тропическая малярия отличается наличием более длительных приступов высокой температуры на фоне укорочения безлихорадочного периода. Граница между ними размыта, иногда ознобы и поты могут совсем не наблюдаться. Для рожистого воспаления также характерно острое начало и отсутствие предшествующего периода. Повышение температуры достигает 39–40 °C, может сопровождаться рвотой, возбуждением. Обычно сразу возникают боль и жжение в области пораженного участка кожи, который вскоре приобретает ярко-красную окраску с валиком, резко ограничивающим область воспаления. Для менингококцемии и менингококкового менингита также характерно острое начало с быстрым подъемом температуры и выраженным ознобом. Характерна острейшая головная боль, могут быть рвота и возбуждение. Для менингита типично появление повышенной кожной чувствительности, а затем менингеальных знаков (оцепенелости затылочных мышц, симптомов Кернига и Брудзинского). При менингококцемии через несколько (4—12) часов на коже возникает звездчатая геморрагическая сыпь.
Менингококцемия. Звездчатая геморрагическая сыпь
При менингококковой инфекции температура тела может колебаться от слегка повышенной до очень высокой (до 42 °C). Температурная кривая может быть постоянного, интермиттирующего и ремиттирующего типа. На фоне антибиотикотерапии температура снижается ко 2—3-му дню, у некоторых больных еще в течение 1–2 дней сохраняется слегка повышенная температура. Менингококцемия (менингококковый сепсис) начинается остро и протекает бурно. Характерным признаком является геморрагическая сыпь в виде звездочек неправильной формы. Элементы сыпи у одного и того же больного могут быть различной величины — от мелкоточечных до обширных кровоизлияний. Сыпь появляется через 5—15 ч от начала заболевания. Лихорадка при менингококцемии имеет чаще интермиттирующий характер. Характерны выраженные симптомы интоксикации, температура повышается до 40–41 °C, появляются сильный озноб, головная боль, геморрагическая сыпь, учащение сердцебиения, одышка, синюшность. Затем резко падает артериальное давление. Температура тела снижается до нормальных или слегка повышенных цифр. Двигательное возбуждение нарастает, появляются судороги. И при отсутствии соответствующего лечения наступает смерть. Менингиты могут иметь не только менингококковое происхождение. Менингит, так же как и энцефалит (воспаление головного мозга), развивается как осложнение любой перенесенной инфекции. Так, самые безобидные, на первый взгляд, вирусные инфекции, такие как грипп, ветряная оспа, краснуха, могут осложниться тяжелейшим энцефалитом. Обычно отмечается высокая температура тела, резкое ухудшение общего состояния, появляются общемозговые расстройства, головная боль, головокружение, тошнота, рвота, нарушение сознания, общее беспокойство. В зависимости от поражения того или иного участка мозга могут обнаруживаться различные симптомы — расстройства со стороны черепно-мозговых нервов, параличи. Большую группу острых инфекционных заболеваний составляют различые геморрагические лихорадки, которые отличаются выраженной очаговостью (на территории РФ распространены крымская, омская и геморрагическая лихорадка с почечным синдромом). Для них типично острое начало с периодом повышения температуры до 39–40 °C в течение суток, выраженной головной болью, бессонницей, болями в мышцах и глазных яблоках. Отмечается покраснение лица и верхней половины туловища, инъекция склер. Состояние больных прогрессивно ухудшается. На 2—3-й день в типичных местах появляется геморрагическая сыпь (при омской лихорадке сыпь развивается на фоне второй лихорадочной волны). Грипп характеризуется острым началом с ознобом и коротким (4–5 ч) периодом повышения температуры до 38–40 °C. При этом развивается выраженная интоксикация с появлением головной и мышечной боли, слабости, головокружения. Отмечаются катаральные явления в области носоглотки, может быть конъюнктивит, несколько позже присоединяются симптомы трахеита. Длительность лихорадочного периода обычно не превышает 5 дней. Парагрипп отличается отсутствием длительной лихорадки, она может быть непостоянной или кратковременной (1–2 дня, как при обычной вирусной инфекции дыхательных путей), обычно не превышает 38–39 °C. Корь протекает у взрослых значительно тяжелее, чем у детей, и характеризуется периодом повышения температуры в течение суток до 38–39 °C на фоне выраженных катаральных явлений. На 2—3-и сутки заболевания уже можно определить пятна Филатова-Коплика на слизистой оболочке внутренней поверхности щек. На 3—4-й день отмечаются крупнопятнистые папулезные высыпания сначала на лице, а затем на туловище и конечностях. Для острой формы бруцеллеза характерна высокая лихорадка с ознобом до 40 °C, при которой, однако, ряд больных сохраняет удовлетворительное самочувствие. Головная боль умеренная, типична повышенная потливость (или проливные поты). Отмечается увеличение всех групп лимфатических узлов, увеличение печени и селезенки. Заболевание обычно начинается постепенно, реже остро. Лихорадка у одного и того же больного может быть различной. Иногда заболевание сопровождается типичной для бруцеллеза волнообразной температурной кривой ремиттирующего типа, когда колебания между утренней и вечерней температурой больше 1 °C, интермиттирующей — снижение температуры с высокой до нормы или постоянной — колебания между утренней и вечерней температурой не превышает 1 °C. Лихорадочные волны сопровождаются обильным потоотделением. Число волн лихорадки, их длительность и интенсивность различны. Промежутки между волнами — от 3–5 дней до нескольких недель и месяцев. Лихорадка может быть высокой, длительно субфебрильной, а может быть и нормальной. Заболевание чаще протекает с длительным субфебрилитетом. Характерна смена длительного лихорадочного периода безлихорадочным промежутком также различной продолжительности. Несмотря на высокую температуру, состояние больных остается удовлетворительным. При бруцеллезе отмечается поражение различных органов и систем, прежде всего страдают опорнодвигательная, урогенитальная (мочеполовая), нервная системы, увеличиваются печень и селезенка. Иерсиниоз имеет несколько клинических форм, однако для всех них (кроме субклинической) характерно острое начало с ознобом, головной и мышечной болью и повышением температуры до 38–40 °C. Длительность лихорадочного периода в среднем составляет 5 дней, при септических формах бывает лихорадка неправильного типа с повторяющимися эпизодами озноба и профузного пота. При аденовирусной инфекции температура повышается до 38–39 °C в течение 2–3 дней. Лихорадка может сопровождаться ознобом и длиться около недели. Температурная кривая носит постоянный или ремиттирующий характер. Явления общей интоксикации при аденовирусной инфекции обычно выражены слабо. Инфекционный мононуклеоз чаще начинается остро, реже постепенно. Повышение температуры обычно постепенное. Лихорадка может быть постоянного типа или с большими колебаниями. Лихорадочный период зависит от тяжести течения заболевания. При легких формах он короткий (3–4 дня), при тяжелом течении — до 20 дней и более. Температурная кривая может быть различной — постоянного или ремиттирующего типа. Лихорадка может быть и слегка повышенной. Явления высокой температуры (40–41 °C) наблюдаются редко. Свойственны перепады температуры в течение суток с размахами 1–2 °C и литическое ее снижение. При полиомиелите — остром вирусном заболевании центральной нервной системы — также отмечается повышение температуры. Поражаются различные отделы головного и спинного мозга. Заболевание наблюдается преимущественного у детей до 5 лет. Ранними симптомами болезни являются озноб, желудочно-кишечные расстройства (понос, рвота, запор), повышается температура тела до 38–39 °C и более. При этом заболевании нередко наблюдается двугорбая температурная кривая: первый подъем длится 1–4 дня, затем температура снижается и держится в пределах нормы 2–4 дня, затем снова отмечается ее подъем. Бывают случаи, когда температура тела повышается в пределах нескольких часов и остается незамеченной, либо заболевание протекает по типу общей инфекции без неврологической симптоматики. Паразитарное заболевание, такое, как токсоплазмоз, тоже сопровождается лихорадкой. При остром токсоплазмозе температура тела повышается до 38–39 °C, снижаясь до слегка повышенной или нормальной на второй неделе заболевания. Заболевание протекает тяжело, с поражением печени, селезенки, увеличением лимфоузлов, макуло-папулезной сыпью на кожных покровах по всему телу, симптомами общей интоксикации. Токсоплазмоз может протекать как острое заболевание с поражением центральной нервной системы (энцефалит, менингит). В случае выздоровления остаются стойкие изменения — олигофрения, снижение слуха, парез конечностей и т. д. Орнитоз — болезнь, возникающая в результате заражения человека от больных птиц. Заболевание сопровождается лихорадкой и атипично протекающей пневмонией. Температура тела с первых дней повышается до высоких цифр. Лихорадочный период длится 9—20 дней. Температурная кривая может быть постоянной или ремиттирующей. Снижается она в большинстве случаев постепенно. Высота, длительность лихорадки, характер температурной кривой зависят от тяжести и клинической формы болезни. При легком течении температура тела повышается до 39 °C и держится 3–6 дней, снижаясь в течение 2–3 дней. При средней тяжести температура поднимается выше 39 °C и сохраняется на высоких цифрах в течение 20–25 дней. Повышение температуры сопровождается ознобом, снижение — обильным потоотделением. Для орнитоза характерны лихорадка, симптомы интоксикации, частое поражение легких, увеличение печени и селезенки. Заболевание может осложниться менингитом. Клиника туберкулеза — многообразна. Лихорадка у больных длительное время может протекать без выявленных органных поражений. Чаще всего температура тела держится на повышенных цифрах. Температурная кривая носит интермиттирующий характер, обычно не сопровождаясь ознобом. Иногда лихорадка является единственным признаком заболевания. Туберкулезным процессом могут быть поражены не только легкие, но и другие органы и системы (лимфатические узлы, костная, мочеполовая системы). У ослабленных больных возможно развитие туберкулезного менингита. Заболевание начинается постепенно. Симптомы интоксикации, вялость, сонливость, светобоязнь постепенно нарастают, температура тела держится на повышенных цифрах. В дальнейшем лихорадка становится постоянной, обнаруживаются отчетливые менингеальные признаки, головная боль, сонливость. Сепсис — тяжелое общее инфекционное заболевание, возникающее вследствие недостаточного местного и общего иммунитета организма при наличии очага воспаления. Развивается преимущественно у недоношенных детей, у ослабленных другими заболеваниями, переживших травму. Диагностируется по септическому очагу в организме и входным воротам инфекции, а также симптомам общей интоксикации. Температура тела чаще остается на повышенных цифрах, периодически возможна высокая температура. Температурная кривая может носить гектический характер. Лихорадка сопровождается ознобом, снижение температуры — резкой потливостью. Увеличиваются печень и селезенка. Нередки высыпания на кожных покровах, чаще геморрагического характера. Повышение температуры тела может отмечаться при гельминтозах (паразитарных заболеваниях). Так, для трихинеллеза характерны плохое самочувствие, головная боль, отеки на лице, лихорадка. У большинства больных лихорадка носит ремиттирующий характер и сопровождается умеренно выраженными симптомами общей интоксикации, потливостью. Длительность лихорадки различная, зависит от тяжести состояния. При легком течении — от 5 до 7 дней; при тяжелом — может продолжаться до 6 недель и более. Ведущим симптомом заболевания являются мышечные боли. При тяжелом течении трихинеллеза могут появляться тяжелейшие мышечные боли с ограничением их подвижности. Повышение температуры тела может наблюдаться при различных заболеваниях легких, сердца, других органов. Так, воспаление бронхов (острый бронхит) может возникать при острых инфекционных заболеваниях (грипп, корь, коклюш и др.) и при охлаждении организма. Температура тела при остром очаговом бронхите может быть слегка повышенной или нормальной, а при тяжелом течении может повышаться до 38–39 °C. Беспокоят также слабость, потливость, кашель. Развитие очаговых пневмоний (воспаления легких) связано с переходом воспалительного процесса с бронхов на легочную ткань. Они могут быть бактериального, вирусного, грибкового происхождения. Наиболее характерными симптомами очаговой пневмонии являются кашель, лихорадка и одышка. Лихорадка у больных бронхопневмонией бывает различной продолжительности. Температурная кривая чаще послабляющего типа (суточные колебания температуры в 1 °C, причем утренний минимум выше 38 °C) или неправильного типа. Нередко температура бывает слегка повышенной, а в пожилом и старческом возрасте может вообще отсутствовать. Крупозная пневмония чаще наблюдается при переохлаждении организма. Для крупозной пневмонии характерна определенная цикличность течения. Болезнь начинается остро, с потрясающего озноба, повышения температуры тела до 39–40 °C. Озноб обычно продолжается до 1–3 ч. Состояние очень тяжелое. Отмечаются одышка, синюшность. В стадии разгара болезни состояние больных еще больше ухудшается. Выражены симптомы интоксикации, дыхание частое, поверхностное, тахикардия до 100/200 уд./мин. На фоне выраженной интоксикации может развиться сосудистый коллапс, который характеризуется падением артериального давления, учащением сердцебиения, одышкой. Температура тела также резко снижается. Страдает нервная система (нарушается сон, могут быть галлюцинации, бред). При крупозной пневмонии, если не начато лечение антибиотиками, лихорадка может держаться на протяжении 9—11 дней и иметь постоянный характер. Падение температуры может происходить критически (в течение 12–24 ч) или постепенно, на протяжении 2–3 суток. В стадии разрешения лихорадки обычно не бывает. Температура тела нормализуется. Лихорадка может сопровождать такое заболевание, как ревматизм. Он имеет инфекционно-аллергическую природу. При этом заболевании происходит поражение соединительной ткани, страдают преимущественно сердечно-сосудистая система, суставы, центральная нервная система и другие органы. Заболевание развивается через 1–2 недели после перенесенной стрептококковой инфекции (ангина, скарлатина, фарингит). Температура тела обычно слегка повышается, появляются слабость, потливость. Реже заболевание начинается остро, температура повышается до 38–39 °C. Температурная кривая носит ремиттирующий характер, сопровождается слабостью, потливостью. Через несколько дней появляются боли в суставах. Для ревматизма характерно поражение сердечной мышцы с развитием миокардита. Больного беспокоят одышка, боли в области сердца, сердцебиение. Может отмечаться незначительное повышение температуры тела. Лихорадочный период зависит от тяжести заболевания. Миокардит может развиться и при других инфекциях — скарлатине, дифтерии, риккетсиозах, вирусных инфекциях. Могут возникать аллергические миокардиты, например при применении различных лекарственных препаратов. На фоне острого тяжелого септического состояния возможно развитие септического эндокардита — воспалительного поражения эндокарда с поражением клапанов сердца. Состояние таких больных очень тяжелое. Выражены симптомы интоксикации. Беспокоят слабость, недомогание, потливость. Вначале отмечается незначительное повышение температуры тела. На фоне слегка повышенной температуры возникают нерегулярные подъемы температуры до 39 °C и выше («температурные свечи»), типичны познабливание и обильное потоотделение, отмечаются поражения со стороны сердца и других органов и систем. Диагностика первичного бактериального эндокардита представляет особые трудности, так как в начале заболевания поражение клапанного аппарата отсутствует, и единственным проявлением заболевания является лихорадка неправильного типа, сопровождающаяся ознобом с последующим обильным потоотделением и понижением температуры. Иногда подъем температуры может отмечаться в течение дня или в ночное время. Бактериальный эндокардит может развиться у больных с искусственными клапанами сердца. В ряде случаев встречаются лихорадки, обусловленные развитием септического процесса у больных с наличием катетеров в подключичных венах, которые используются в инфузионной терапии. Лихорадочное состояние может возникать у больных с поражением желчевыделительной системы, печени (холангит, абсцесс печени, скопление гноя в желчном пузыре). Лихорадка при этих заболеваниях может являться ведущим симптомом, особенно у больных старческого и пожилого возраста. Боли таких больных обычно не беспокоят, желтухи нет. При обследовании выявляется увеличенная в размерах печень, незначительная ее болезненность. Повышение температуры отмечается при заболеваниях почек. Особенно это характерно для острого пиелонефрита, который характеризуется тяжелым общим состоянием, симптомами интоксикации, высокой лихорадкой неправильного типа, ознобом, тупыми болями в области поясницы. При распространении воспаления на мочевой пузырь и уретру возникают болезненные позывы на мочеиспускание и рези при мочеиспускании. Источником длительной лихорадки может быть урологическая гнойная инфекция (абсцессы и карбункулы почек, паранефрит, нефрит). Характерные изменения в моче в таких случаях могут отсутствовать или быть слабовыраженными. Ведущее место среди лихорадочных состояний занимают опухолевые заболевания. Повышение температуры может встречаться при любых злокачественных опухолях. Наиболее часто лихорадка наблюдается при гипернефроме, опухолях печени, желудка, злокачественных лимфомах, лейкозах. При злокачественных опухолях, особенно при небольшом по размеру гипернефроидном раке и при лимфопролиферативных заболеваниях, может отмечаться выраженная лихорадка. У таких больных лихорадка (чаще в утренние часы) связана с распадом опухоли или присоединением вторичной инфекции. Особенностью лихорадки при злокачественных заболеваниях являются неправильный тип лихорадки, нередко с максимумом подъема в утренние часы, отсутствие эффекта от антибиотикотерапии. Нередко лихорадка является единственным симптомом злокачественного заболевания. Лихорадочные состояния нередко встречаются при злокачественных опухолях печени, желудка, кишок, легких, предстательной железы. Известны случаи, когда лихорадка длительно являлась единственным симптомом злокачественной лимфомы с локализацией в забрюшинных лимфатических узлах. Основными причинами лихорадки у онкологических больных принято считать присоединение инфекционных осложнений, рост опухоли и влияние на организм опухолевой ткани. Третье место по частоте лихорадочных состояний занимают системные заболевания соединительной ткани (коллагенозы). К данной группе относятся системная красная волчанка, склеродермия, узелковый артериит, дерматомиозит, ревматоидный артрит. Системная красная волчанка характеризуется неуклонным прогрессированием процесса, иногда довольно длительными ремиссиями. В остром периоде всегда имеется лихорадка неправильного типа, иногда принимающая гектический характер, с ознобами и профузным потом. Характерны дистрофии, поражение кожи, суставов, различных органов и систем. Следует отметить, что распространенные заболевания соединительной ткани и системные васкулиты сравнительно редко проявляются изолированной лихорадочной реакцией. Обычно они проявляются характерным поражением кожи, суставов, внутренних органов. В основном лихорадки могут встречаться при различных васкулитах, нередко их локализованных формах (височный артериит, поражение крупных ветвей дуги аорты). В начальном периоде таких заболеваний появляется лихорадка, которая сопровождается болями в мышцах, суставах, похудением, затем появляются локализованные головные боли, обнаруживается утолщение и уплотнение височной артерии. Васкулит чаще встречается у лиц пожилого возраста. Среди больных с длительной лихорадкой в 5–7 % случаев встречается лекарственная лихорадка. Она может возникать на любые лекарственные препараты, чаще на 7—9-й день лечения. Диагностике способствуют отсутствие инфекционного или соматического заболевания, появление папулезной сыпи на кожных покровах, по времени совпадающее с приемом лекарств. Для данной лихорадки характерна одна особенность: симптомы основного заболевания на фоне терапии проходят, а температура тела растет. После отмены препарата температура тела обычно нормализуется через 2–3 суток. Повышение температуры тела наблюдается при различных эндокринных заболеваниях. Прежде всего к данной группе относится такое тяжелое заболевание, как диффузный токсический зоб (гипертиреоз). Развитие данного заболевания связано с избыточной продукцией гормонов щитовидной железы. Возникающие в организме больного многочисленные гормональные, обменные, аутоиммунные нарушения приводят к повреждениям всех органов и систем, нарушению функций других эндокринных желез и различных видов обмена. В первую очередь поражаются нервная, сердечно-сосудистая, пищеварительная системы. Больные испытывают общую слабость, утомляемость, сердцебиение, потливость, дрожание рук, отмечается выпячивание глазных яблок, снижение массы тела, увеличивается щитовидная железа. Расстройство терморегуляции проявляется почти постоянным чувством жара, непереносимостью жары, тепловых процедур, слегка повышенной температурой тела. Повышение температуры до высоких цифр (до 40 °C и выше) характерно для осложнения диффузного токсического зоба — тиреотоксического криза, который возникает у больных с тяжелой формой заболевания. Резко обостряются все симптомы тиреотоксикоза. Появляется резко выраженное возбуждение, доходящее до психоза, пульс учащается до 150–200 уд./мин. Кожа лица покрасневшая, горячая, влажная, конечности синюшны. Развиваются мышечная слабость, дрожание конечностей, выражены параличи, парезы. Острый гнойный тиреоидит — гнойное воспаление щитовидной железы. Может вызываться различными бактериями — стафилококком, стрептококком, пневмококком, кишечной палочкой. Он возникает как осложнение гнойной инфекции, пневмонии, скарлатины, абсцессов. Клиническая картина характеризуется острым началом, повышением температуры тела до 39–40 °C, ознобом, учащенным сердцебиением, сильными болями в области шеи, смещающимися в нижнюю челюсть, уши, усиливающимися при глотании, движении головы. Кожа над увеличенной и резко болезненной щитовидной железой покрасневшая. Продолжительность заболевания — 1,5–2 месяца. Полиневрит — множественные поражения периферических нервов. В зависимости от причин, вызвавших заболевание, выделяют инфекционные, аллергические, токсические и другие полиневриты. Для полиневритов характерно нарушение двигательной и чувствительной функции периферических нервов с преимущественным поражением конечностей. Инфекционный полиневрит начинается обычно остро, по типу острого лихорадочного процесса, с повышением температуры тела до 38–39 °C, болями в конечностях. Температура тела держится несколько дней, затем нормализуется. На первый план в клинической картине выступают слабость и поражение мышц рук и ног, нарушение болевой чувствительности. При аллергическом полиневрите, развивающемся после введения антирабической вакцины (применяемой для профилактики бешенства), также может отмечаться повышение температуры тела. В течение 3–6 дней после введения может наблюдаться высокая температура тела, неукротимая рвота, головная боль, расстройство сознания. Существуют конституционально обусловленная гипоталамопатия («привычная лихорадка»). Данная лихорадка имеет наследственную предрасположенность, чаще встречается у женщин молодого возраста. На фоне вегетососудистой дистонии и постоянного субфебрилитета отмечается повышение температуры тела до 38–38,5 °C. Подъем температуры связан с физической нагрузкой или эмоциональным стрессом. При наличии длительной лихорадки следует иметь в виду искусственную лихорадку. Некоторые больные искусственно вызывают повышение температуры тела с целью симуляции какого-либо заболевания. Чаще всего подобного рода заболевания встречаются у лиц молодого и среднего возраста, в основном женского пола. Они постоянно находят у себя различные заболевания, длительно лечатся различными препаратами. Впечатление, что у них имеется серьезное заболевание, усиливается тем, что эти больные часто лежат в стационарах, где им ставятся разнообразные диагнозы, проводится терапия. При консультации данных больных психотерапевтом выявляются истероидные черты (признаки истерии), что дает возможность заподозрить у них фальсификацию лихорадки. Состояние таких больных обычно удовлетворительное, самочувствие хорошее. Необходимо измерить температуру в присутствии врача. Таких больных необходимо тщательно обследовать. Диагноз «искусственная лихорадка» может быть заподозрен только после наблюдения за больным, обследования его и исключения других причин и заболеваний, которые вызывают повышение температуры тела. Лихорадка может наблюдаться при различных острых хирургических заболеваниях (аппендицит, перитонит, остеомиелит и др.) и связана с проникновением в организм микробов и их токсинов. Значительное повышение температуры в послеоперационном периоде может быть обусловлено реакцией организма на операционную травму. При травме мышц и тканей температура может повышаться в результате распада белков мышц и образования аутоантител. Механическое раздражение центров терморегуляции (перелом основания черепа) часто сопровождается повышением температуры. При внутричерепных кровоизлияниях (у новорожденных), постэнцефалитных поражениях мозга также отмечается высокая температура, главным образом в результате центрального нарушения терморегуляции. Для острого аппендицита характерно внезапное появление болей, интенсивность которых прогрессирует по мере развития воспалительных изменений в червеобразном отростке. Отмечаются также слабость, недомогание, тошнота, может быть задержка стула. Температура тела обычно повышена до 37,2—37,6 °C, иногда сопровождается ознобом. При флегмонозном аппендиците боли в правой подвздошной области постоянные, интенсивные, общее состояние ухудшается, температура тела повышается до 38–38,5 °C. При нагноении аппендикулярного воспалительного уплотнения образуется периаппендикулярный абсцесс. Состояние больных ухудшается. Температура тела становится высокой, гектической. Резкие перепады температуры сопровождаются ознобами. Боли в животе усиливаются. Грозным осложнением острого аппендицита является разлитой гнойный перитонит. Боли в животе носят разлитой характер. Состояние больных тяжелое. Отмечается значительное учащение сердцебиения, причем частота пульса не соответствует температуре тела. Травмы головного мозга бывают открытыми (с повреждением костей черепа, вещества мозга) и закрытыми. К закрытым травмам относят сотрясение, ушиб и контузию со сдавлением. Наиболее часто встречается сотрясение головного мозга, основными клиническими проявлениями которого являются потеря сознания, повторная рвота и амнезия (выпадение из памяти событий, которые предшествовали расстройству сознания). В ближайшие дни после сотрясения мозга может отмечаться незначительное повышение температуры тела. Длительность ее может быть различной и зависит от тяжести состояния. Также наблюдаются головная боль, головокружение, слабость, недомогание, потливость. При солнечном и тепловом ударе общее перегревание организма не обязательно. Нарушение терморегуляции возникает вследствие воздействия прямых солнечных лучей на непокрытую голову или обнаженное тело. Беспокоят слабость, головокружение, головная боль, тошнота, иногда могут отмечаться рвота и понос. В тяжелых случаях возможны возбуждение, бред, судороги, потеря сознания. Высокой температуры, как правило, не бывает.
Лечение При гипертермическом (высокая температура) синдроме лечение проводится в двух направлениях: коррекция жизненно важных функций организма и непосредственно борьба с высокой температурой. Для снижения температуры тела используются как физические методы охлаждения, так и медикаментозные. К физическим средствам относятся методы, обеспечивающие охлаждение организма: рекомендуется снять одежду, произвести обтирание кожных покровов водой, спиртом, 3 %-ным раствором уксуса, можно приложить лед к голове. На запястья рук, к голове можно приложить бинт, смоченный холодной водой. Применяют также промывание желудка через зонд холодной водой (температура 4–5 °C), ставят очистительные клизмы, также с прохладной водой. В случае проведения инфузионной терапии все растворы вводят внутривенно охлажденными до 4 °C. Больного для снижения температуры тела можно обдувать вентилятором. Эти мероприятия позволяют снизить температуру тела на 1–2 °C в течение 15–20 мин. Не следует снижать температуру тела ниже 37,5 °C, так как после этого она продолжает снижаться самостоятельно. В качестве медикаментозных средств применяют анальгин, ацетилсалициловую кислоту, бруфен. Наиболее эффективно использовать препарат внутримышечно. Так, применяют 50 %-ный раствор анальгина, 2 мл (детям — в дозе 0,1 мл на год жизни) в сочетании с антигистаминными препаратами: 1 %-ный раствор димедрола, 2,5 %-ный раствор пипольфена или 2 %-ный раствор супрастина. Для снижения температуры тела и уменьшения беспокойства может быть использован 0,05 %-ный раствор аминазина внутрь. Детям до 1 года — по 1 ч. л., от 1 года до 5 лет — 1 дес. л., 1–3 раза в день. Для приготовления 0,05 %-ного раствора аминазина берут ампулу 2,5 %-ного раствора аминазина и разводят содержащиеся в ней 2 мл в 50 мл воды. При более тяжелом состоянии для уменьшения возбудимости центральной нервной системы используют литические смеси, в состав которых входит аминазин в сочетании с антигистаминными веществами и новокаином (1 мл 2,5 %-ного раствора аминазина, 1 мл 2,5 %-ного раствора пипольфена, 0,5 %-ный раствор новокаина). Разовая доза смеси для детей составляет 0,1–0,15 мл/кг массы тела, внутримышечно. Для поддержания функции надпочечников и при снижении артериального давления применяют кортикостероиды — гидрокортизон (детям по 3–5 мг на 1 кг массы тела) или преднизолон (1–2 мг на 1 кг массы). При наличии дыхательных нарушений и сердечной недостаточности терапия должна быть направлена на ликвидацию этих синдромов. При повышении температуры тела до высоких цифр у детей может развиться судорожный синдром, для прекращения которого используют седуксен (детям до 1 года в дозе 0,05—0,1 мл; 1–5 лет — 0,15—0,5 мл 0,5 %-ного раствора внутримышечно). Для борьбы с отеком мозга используют магния сульфат 25 %-ный раствор в дозе 1 мл на год жизни внутримышечно. Первая помощь при тепловом и солнечном ударе сводится к следующему. Необходимо немедленно прекратить воздействие факторов, приведших к солнечному или тепловому удару. Необходимо перенести пострадавшего в прохладное место, снять одежду, уложить, приподнять голову. Проводят охлаждение тела, головы, прикладывая компрессы с холодной водой или обливая холодной водой. Пострадавшему дают понюхать нашатырный спирт, внутрь — успокаивающие и сердечные капли (капли Зеленина, валерианы, корвалол). Больному дают обильное прохладное питье. При остановке дыхательной и сердечной деятельности необходимо немедленно освободить верхние дыхательные пути от рвотных масс и начать искусственное дыхание и массаж сердца до появления первых дыхательных движений и сердечной деятельности (определяют по пульсу). Больного срочно госпитализируют в стационар.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ
ОпределениеГеморрагические лихорадки — группа острых вирусных природно-очаговых заболеваний, характеризующихся развитием универсального капилляротоксикоза, проявляющихся интоксикационным и геморрагическим синдромами и признаками поражения различных систем и органов.
Этиология В настоящее время различают 14 геморрагических лихорадок; из них 12 свойственны человеку и 2 — животным. У человека различают три группы геморрагических лихорадок: — клещевые геморрагические лихорадки — крымская геморрагическая лихорадка, омская геморрагическая лихорадка и кайясанурская лесная болезнь (табл. 16); — комариные геморрагические лихорадки — желтая лихорадка, геморрагическая лихорадка Денге, геморрагическая лихорадка Чикунгунья и геморрагическая лихорадка Рифт-Валли; — контагиозные зоонозные геморрагические лихорадки — геморрагическая лихорадка с почечным синдромом, аргентинская геморрагическая лихорадка, боливийская геморрагическая лихорадка, лихорадка Ласса, лихорадка Марбурга, или церкопитековая, и геморрагическая лихорадка Эбола. Возбудителями геморрагических лихорадок человека являются арбовирусы групп А, В, аденовирусы группы, рабдовирусы.
Эпидемиология Различают природные (первичные) и антропургические (вторичные) очаги геморрагических лихорадок. Носителем возбудителей в природных очагах являются дикие животные (грызуны, сумчатые, приматы, птицы и др.) и инфицированные люди; в последнем случае заболевание принимает черты антропонозной инфекции (например, городская форма желтой лихорадки или Денге, лихорадка Ласса), т. е. передающейся от больного человека (табл. 17).





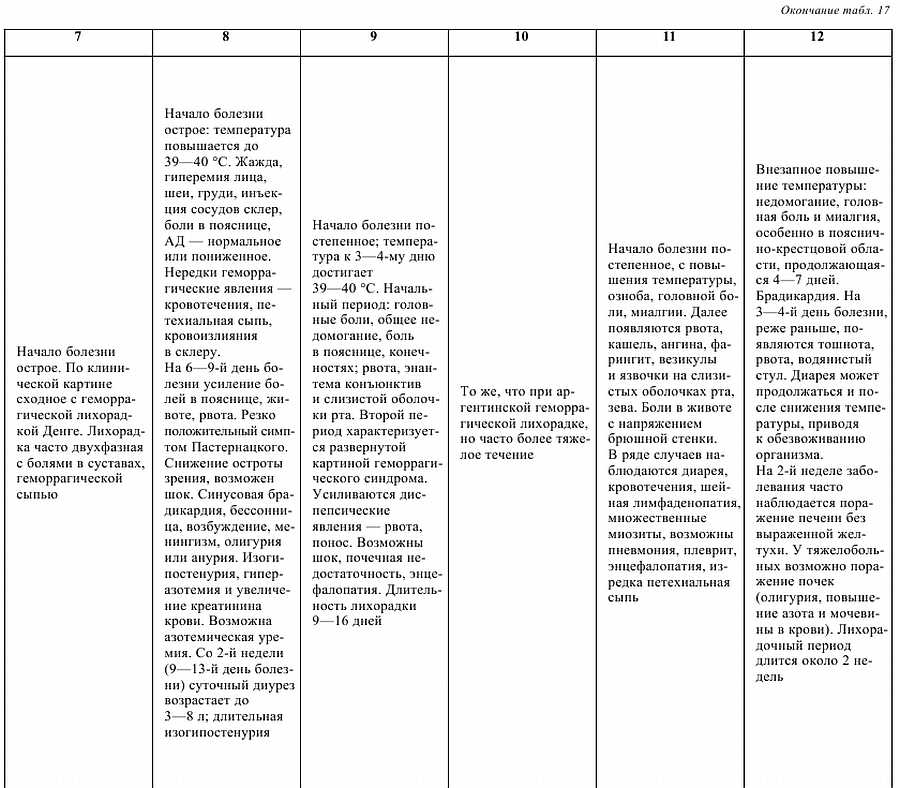
Человек заражается арбовирусными геморрагическими лихорадками в природных или антропургических очагах через укус инфицированных кровососущих членистоногих (клещи, комары, мокрецы). Геморрагические лихорадки, вызываемые аденовирусами или рабдовирусами, распространяются воздушным, контактно-бытовым путями, при поедании зараженной пищи, содержащей возбудителя, или при попадании его в кровь. Путь передачи от животного-переносчика к человеку не установлен, но может иметь место у животных в природных очагах. Восприимчивость к геморрагическим лихорадкам высокая. Особенно часто и тяжело болеют лица, впервые посещающие очаговый район, и дети. Смертность составляет от 1— 10 до 50–70 % и более. У местных жителей нередко отмечаются стертые формы болезни. Геморрагическим лихорадкам свойственно очаговое распространение преимущественно в субтропических и тропических странах, где они нередко принимают характер эпидемий со значительной смертностью. Заболеваемость большинством геморрагических лихорадок повышается в период активной хозяйственной деятельности человека (сельскохозяйственные работы). В последнее десятилетие в связи с развитием межконтинентальных связей внимание медицинских работников привлекают африканские геморрагические лихорадки (Ласса, Марбурга, Эбола), отличающиеся высокой смертностью и способностью распространяться при контакте с больным человеком воздушным, парентеральным или контактнобытовым путем.
Патогенез Механизм развития геморрагических лихорадок включает ряд последовательных фаз с развитием патологических и саногенных реакций, сходных при различных нозологических формах данной группы болезней. Проникший в организм человека вирус после 1–3 недель выходит в кровь, обусловливая начало болезни и неспецифические общетоксические проявления. Вирус фиксируется в клетках кровеносных сосудов. Проницаемость сосудистой стенки значительно повышается. Устойчивость стенки, соответственно, снижается, развивается агрегатность (склеивание) тромбоцитов, возникают кровоизлияния. Повышение проницаемости капилляров ведет к уменьшению объема циркулирующей крови, увеличению ее вязкости. Таким образом, возникают нарушение перфузии (проникновения) и насыщения тканей кислородом, метаболический ацидоз и дистрофические изменения в различных органах. При тяжелых формах развиваются инфекционно-токсический шок, диссеминированная внутрисосудистая коагуляция, массивный геморрагический синдром. Наряду с капилляротоксикозом наблюдается поражение центральной нервной системы, вегетативных ганглиев, клеток печени, почек, костного мозга, миокарда, селезенки и других органов. В результате — развитие в них дистрофических и некробиотических изменений, и часто со значительным нарушением их функции, что придает своеобразие клинической картине различных геморрагических лихорадок. По мере формирования саногенных реакций в период выздоровления наблюдаются элиминация (удаление) вируса, восстановление нарушенных функций и вырабатывается стойкий видоспецифический иммунитет.
Клиническая картина В клинической картине большинства геморрагических лихорадок различают: — начальный период (от 2–3 до 5–7 дней), характеризующийся синдромом интоксикации в виде высокой лихорадки, головной боли, распространенных болей в мышцах и суставах, часто сыпью на лице и шее, инъекцией сосудов склер и конъюнктивы, геморрагической сыпью, гипотонией и урежением частоты сердечных сокращений, изменениями показателей крови гематологическими сдвигами в виде снижения уровня лейкоцитов и тромбоцитов в крови; — период разгара болезни (1–2 недели), начинающийся часто после кратковременного понижения температуры и характеризующийся нарушениями кровообращения, шоком, геморрагическим синдромом, симптомами поражения различных органов; — период выздоровления (3–4 недели и более) с преобладанием ряда симптомов астении.
Диагностика Распознавание геморрагических лихорадок наряду с клинико-эпидемиологическими данными предусматривает лабораторную диагностику, которая включает изоляцию вируса в период вирусемии (циркуляции вируса в крови) из крови больного, его экскретов или тканей (заражение новорожденных белых мышей, культуры клеток, электронная микроскопия) и серологические исследования — непрямая реакция иммунофлюоресценции (НРИФ), реакция торможения пассивной гемагглютинации (РТПГА), РСК, реакция диффузной преципитации в агаровом гене (РДПА), РН, РЭМА и другие, позволяющие выявить антитела в конце первой — начале второй недели и в более поздние сроки болезни. При дифференциальной диагностике геморрагической лихорадки в начальном периоде следует исключить грипп, лептоспироз, сыпной тиф (болезнь Брилла) и другие риккетсиозы, боррелиозы, малярию, арбовирусные системные лихорадки, а в период разгара — менингококковую инфекцию, сепсис, болезнь Верльгофа, болезнь Шенлейн-Геноха и прочие геморрагические диатезы.
Лечение Лечение больных геморрагической лихорадкой проводится с учетом выраженности патологических реакций и направлено на прекращение интоксикации, расстройств кровообращения, нарушений гемокоагуляции, предупреждение ассоциированной инфекции и повышение неспецифической устойчивости организма больного. Специфическая терапия разработана недостаточно. В остром периоде болезни показаны постельный режим и щадящая диета с ограничением белков иповаренной соли. С целью профилактики и прекращения шоковых реакций и выведения токсических продуктов обмена возбудителя применяют метод управляемой гемодилюции с использованием коллоидных и кристаллоидных растворов и диуретических средств. Назначение коллоидных препаратов (гемодез, реополиглюкин, полиглюкин, макродекс, перистон, сывороточный альбумин и др.) способствует стабилизации объема циркулирующей крови, уменьшению интерстициального отека, дает дезагрегирующий эффект, улучшая таким образом реологические показатели, восстанавливает перфузию тканей, нормализует почечный кровоток и способствует выведению шлаков. Изотонический раствор хлорида натрия, 5 %-ный раствор глюкозы, раствор Рингера и другие кристаллоидные препараты, диффундируя в интерстициальный сектор, способствуют выведению токсических субстанций через почки. Препараты назначают в дозе от 10–20 до 30–50 мл/кг. Суточная доза вводимой жидкости — от 1,5–2 до 3–4 л, иногда более. Инфузию производят с небольшой скоростью (10–15 мл/мин) с помощью постоянного катетера, под контролем гематокрита и диуреза. Показано введение салуретических (лазикс, урегит) и осмотических (маннитол, мочевина) диуретических препаратов. Метаболический ацидоз устраняют введением 4 %-ного раствора гидрокарбоната натрия в дозе, равной произведению массы тела больного в килограммах на 1/2 дефицита оснований ВЕ, или назначением 0,3 М раствора трисамина (ТНАМ) в дозе, равной произведению массы тела больного в килограммах на ВЕ. Показано введение глюкокортикостероидов (преднизолона — 9—120 мг, гидрокортизона — 250–300 мг), ингибиторов протеолиза (контрикал, трасилол в дозе до 80—100 тыс. ЕД). Отмечено положительное влияние раннего применения гепарина (10–15 тыс. ЕД). В комплекс патогенетических средств включают большие дозы аскорбиновой кислоты, витамина Р, назначают сосудистые аналептики, сердечные гликозиды, осуществляют кислородотерапию. В случаях массивного геморрагического синдрома проводят заместительную гемотерапию преимущественно свежей гепаринизированной или цитратной кровью. Предупреждения ассоциированной инфекции достигают назначением антибиотиков широкого спектра действия. Выздоравливающие подлежат диспансерному наблюдению в течение 3–6 месяцев.
Профилактика В очаговых районах профилактика геморрагических лихорадок основана на проведении комплекса мероприятий, направленных на уменьшение численности переносчиков вирусов и предупреждение заражения людей в природных очагах инфекции (пользование защитной одеждой, репеллентами, пологами), на повышение специфической невосприимчивости. Специфическая профилактика разработана в отношении желтой лихорадки, крымской, омской и аргентинской геморрагических лихорадок. Больные геморрагическими лихорадками подлежат строгой изоляции в инфекционных стационарах с использованием щадящих методов транспортировки и соблюдением мер предупреждения внутрибольничного заражения, в том числе при внутривенных инъекциях.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ (ДЕНГЕ И ЧИКУНГУНЬЯ)
ОпределениеЛихорадка геморрагическая Денге и Чикунгунья (синоним: геморрагические лихорадки Юго-Восточной Азии) — группа острых арбовирусных заболеваний, вызываемых преимущественно вирусами Денге и Чикунгунья, которые передаются комарами рода Aedes и проявляются лихорадочной реакцией, геморрагическим синдромом и нередко шоком.Впервые геморрагические лихорадки, вызванные арбовирусами Денге, были описаны в Маниле во время эпидемической вспышки болезни в 1954 г. В дальнейшем в различных странах Юго-Восточной Азии неоднократно отмечались эпидемические вспышки геморрагических лихорадок, известных как «филиппинская» и «таиландская» геморрагические лихорадки, вызванные вирусами Денге и Чикунгунья. Одна из последних серий таких вспышек наблюдалась в 1971–1974 гг. на островах Науру, Гилберта, Тувалу, на Новых Гебридах, Фиджи, Тонга, Таити. Указанные вспышки характеризовались тяжелым течением и высокой смертностью среди населения молодого возраста.
Этиология и эпидемиология Заболевания в большинстве случаев вызываются I и II серологическими типами вируса Денге и в 5 % случаев — вирусом Чикунгунья. Геморрагические лихорадки Юго-Восточной Азии — очаговые трансмиссивные антропонозы (передающиеся от человека). Носителями инфекции являются больные дети в течение первых 3–5 дней болезни. Предполагается существование природных очагов инфекции, в которых носителем вирусов служат различные виды обезьян. Передача вируса от больных людей здоровым осуществляется комарами рода Aedes и, возможно, москитами. Инфицированные переносчики становятся заразными после размножения вирусов в их организме в течение 8—14 дней и сохраняют вирусы пожизненно. Геморрагические лихорадки, вызванные вирусом Денге, наблюдаются преимущественно у коренных жителей очаговых районов Юго-Восточной Азии, тогда как европейцы в этих же районах в ходе эпидемических вспышек болезни переносят классический вариант лихорадки Денге. Очевидно, развитие геморрагического варианта болезни у коренного населения Юго-Восточной Азии обусловлено особенностями имунной системы и наследственным фактором. Наиболее чувствительными к заболеванию являются дети в возрасте от 3–5 до 14–15 лет. У взрослого населения очаговых районов выявляются большое количество антител к вирусам Денге. Сезонное повышение заболеваемости отмечается в период дождей, когда численность популяции комаров становится весьма значительной. Заболевание распространено на Филиппинах, в Таиланде, Лаосе, Камбодже, Малайзии, Индонезии, Сингапуре и в Индии.
Патогенез и патанатомия Ведущими механизмами развития заболевания являются инфекционно-токсический шок и геморрагический синдром, развивающиеся вследствие чувствительности организма человека в результате перенесенной в прошлом инфекции вирусом Денге. Развитию шока способствуют изменения проницаемости сосудов. Повышение проницаемости сосудистой стенки приводит к выходу плазмы крови из кровеносного русла, вследствие чего развивается гиповолемия, уменьшается венозный возврат, что влечет за собой компенсаторный спазм капилляров. Нарушается функция жизненно важных органов, в первую очередь почек, миокарда. Развивающийся геморрагический синдром увеличивает степень интоксикации. Возникают метаболический ацидоз, анорексия, нарушения электролитного обмена, нередко обусловливающие летальный исход болезни. Патологоанатомическое исследование обнаруживает кровоизлияния в коже и слизистых оболочках, мышцах, внутренних органах — мио- и эпикарде, легких, печени и других органах, в центральной нервной системе.
Клиническая картина Инкубационный период болезни колеблется от 6 до 14 дней, в среднем составляя 4—10 дней. Начало заболевания острое: температура внезапно повышается до 39–40 °C, появляются сильная головная боль, тошнота и рвота, быстро наступает прострация. Отмечаются боли в животе и в различных мышцах. При осмотре больных выявляются одутловатость лица, резко выраженный конъюнктивит, петехиальные элементы на коже и слизистых оболочках. Пульс учащен, артериальное давление понижено. У ряда больных определяется увеличение печени. С 3—5-го дня болезни возникают основные геморрагические проявления в виде геморрагической пурпуры или экхимозов, отмечаются положительный симптом Кончаловского, носовые, легочные или желудочно-кишечные кровотечения. У 40 % больных развивается тяжелый инфекционно-токсический шок, сопровождающийся резко выраженным геморрагическим синдромом, угнетением центральной нервной системы, нитевидным пульсом, снижением пульсового давления (до 20 мм рт. ст. и ниже), сгущением крови, гипопротеинемией (снижением белка в крови), уменьшением мочевыделения или его отсутствием. При исследовании периферической крови определяются снижение количества лейкоцитов и тромбоцитов в крови. В моче обнаруживаются белок и эритроциты. Продолжительность лихорадочного периода — 2–7 дней. Выздоровление длительное (до 8 недель). Прогноз в большинстве случаев благоприятный. У детей в возрасте до 15 лет в 10–15 % случаев наступает летальный исход на фоне шока.
Диагностика Распознавание геморрагических лихорадок Юго-Восточной Азии основано на изучении анамнестических, эпидемиологических, клинических и лабораторных данных. Дифференцировать заболевание приходится с геморрагическими синдромами неинфекционного происхождения, при которых обычно наблюдаются постепенное нарастание геморрагических проявлений и отсутствие интоксикации, а также от других вирусных геморрагических лихорадок. В последнем случае решающая роль принадлежит вирусологическим и серологическим исследованиям. Выделение вируса возможно в течение первых трех дней болезни. Из серологических методов наиболее информативны РТГА и РН.
Лечение Терапевтические мероприятия при геморрагических лихорадках Юго-Восточной Азии сходны с таковыми при других арбовирусных заболеваниях и направлены на прекращение интоксикационного синдрома, восстановление расстройств кровообращения и обмена веществ, повышение неспецифической устойчивости. В тяжелых случаях, сопровождающихся развитием шока, показано внутривенное введение препаратов декстрана, поливинилового спирта, поливинилпирролидона, щелочных буферных растворов (бикарбонат или лактат натрия), глюкокортикостероидов (преднизолон по 120–150 мг в сутки или гидрокортизон по 250–300 мг сутки) и кардио- и вазотонических средств. При выраженном геморрагическом синдроме показаны переливания крови.
Профилактика Специфическая профилактика болезни не разработана. Основной метод предупреждения заболеваний — проведение комплекса противокомариных мероприятий, использование индивидуальных защитных средств (сетки, пологи, репелленты и др.).
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ КАЙЯСАНУРСКАЯ
ОпределениеЛихорадка геморрагическая кайясанурская (синоним: кайясанурского леса болезнь) — острая инфекционная вирусная болезнь с природной очаговостью, передающаяся клещами рода гемафизалис и характеризующаяся общей интоксикацией, выраженным геморрагическим синдромом, лейкопенией, тромбоцитопенией и папулезно-везикулезной сыпью.
Этиология и эпидемиология Возбудитель — вирус КЛБ из рода флавовирус, семейства тогавириде, антигенной группы В. Заболевание описано в Индии, штат Майсор. Носитель вирусов находится среди позвоночных — обезьяны (лангуры, макаки), возможно, другие животные. Переносчики и носители инфекции среди членистоногих — некоторые виды клещей, блохи. Вирус передается при укусе клеща и через дыхательные пути в лабораторных условиях.
Клиническая картина и диагностика Инкубационный период составляет 3–8 дней. Начало острое: высокая лихорадка, головные и мышечные боли, с 3—4-го дня болезни — рвота, диарея, бред. Характерны распространенная макулоапулезная сыпь, лимфаденопатия, урежение частоты сердечных сокращений, гипотония. Наблюдаются кровоизлияния в кожу, внутренние кровотечения. На 2-й неделе возможны энцефалит и пневмония. Выздоровление занимает 1–2 месяца. Смертность — 1—10 %. При исследовании отмечаются снижение уровня лейкоцитов, тромбоцитов, анэозинофилия (отсутствие эозинофилов в крови), затем повышение уровня нейтрофильных лейкоцитов в крови, преходящее появление альбуминов и крови в моче. Изоляция вируса из крови в 1—5-й день болезни с использованием белых мышей-сосунков, куриных эмбрионов и культуры клеток; РСК, РТПГА, РДПА.
Лечение и профилактика Лечение проводится с учетом выраженности патологических реакций и направлено на прекращение интоксикации, расстройств кровообращения, предупреждение ассоциированной инфекции (антибиотики широкого спектра действия) и повышение неспецифической устойчивости организма больного. Профилактика заражения через дыхательные пути в лаборатории. Борьба с клещами. Защита от их нападения на человека.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ КРЫМСКАЯ-КОНГО
ОпределениеЛихорадка геморрагическая крымская — острая инфекционная вирусная болезнь с природной очаговостью, передающаяся иксодовыми клещами и характеризующаяся общей интоксикацией, выраженным геморрагическим синдромом, снижением уровня лейкоцитов и тромбоцитов в крови.Заболевание впервые описано М. П. Чумаковым в 1944–1945 гг. в Крыму и позднее в республиках Средней Азии. В 1956–1969 гг. очаги сходных заболеваний выявлены в Болгарии, Югославии, Венгрии, Восточной и Западной Африке (Заир, Нигерия, Уганда, Кения и Сенегал), Иране, Пакистане и Индии. Крымская геморрагическая лихорадка распространена в Крыму, Краснодарском и Ставропольском краях, в Астраханской, Ростовской, Донецкой, Херсонской областях, в Казахстане, Узбекистане, Туркменистане и Азербайджане.
Этиология, эпидемиология и патогенез Возбудитель — вирус КГЛ рода КГЛ-Конго-Хазара, антигенной группы КГЛ-Конго-Хазара. Носители вирусов — дикие (зайцы, африканские ежи и др.) и домашние (коровы, овцы, козы) животные, а также клещи более 20 видов из 8 родов. Обычно заражение происходит через укус инфицированного клеща и мокрецов. Возможно воздушное заражение (в лабораторных условиях) и при контакте с кровью больных людей (внутрибольничное заражение). В очаговых районах заболеваемость имеет сезонный характер и повышается в период сельскохозяйственных работ (в июле — августе), нередко приобретая профессиональный характер. Заболеванию свойственно тяжелое течение; у неиммунных лиц болезнь протекает с высокой смертностью, достигающей в отдельные годы 5—40 %. Вирус проникает в организм человека при нападении инфицированных клещей через кожные покровы, приводит в дальнейшем к проникновению вируса в кровь, с которым и связывают инфекционно-токсические проявления начального периода. Действие вируса создает предпосылки для повышения проницаемости сосудистых стенок, нарушений свертывающей системы крови, развития диссеминированного внутрисосудистого свертывания (синдрома ДВС). Кроме того, к числу причин геморрагического синдрома относят подавление роста клеток костного мозга и нарушение функций печени. Многие стороны механизма развития остаются неясными до настоящего времени, в частности не изучен механизм таких тяжелейших проявлений крымской геморрагической лихорадки, как шок и гепаторенальный синдром (см.).
Клиническая картина Инкубационный период продолжается от 2 до 14 (в среднем 3–5) дней. Заболевание может протекать в стертой, легкой, средней тяжести и тяжелой формах. Начальный период крымской геморрагической лихорадки продолжается 3–6 дней и характеризуется внезапно появляющимся ознобом, быстрым повышением температуры тела до 39–40 °C, распространенными болями в мышцах и суставах, сильной головной болью, нередко болями в животе и в поясничной области. Может определяться положительный симптом Пастернацкого. Частыми симптомами являются сухость во рту, головокружение и многократная рвота. Больные обычно возбуждены, лицо, слизистые оболочки, шея и верхние отделы груди покрасневшие, губы сухие. Нередко отмечается герпетическая инфекция. Гематологические изменения в этот период проявляются снижением уровня лейкоцитов и тромбоцитов в крови, повышением СОЭ. Длительность периода разгара болезни — от 2 до 6 дней. Часто он начинается после кратковременного (в течение 1–2 дней) понижения температуры. В этой стадии болезни выявляется выраженный геморрагический синдром в виде петехиальной сыпи на боковых участках туловища, в области крупных складок и конечностей. При тяжелых формах крымской геморрагической лихорадки наблюдаются пурпура, экхимозы, возможны кровотечения из десен, носа, желудка, матки, кишечника и легких. Больные находятся в подавленном состоянии, бледны. Определяются синюшность конечностей, увеличение частоты сердечных сокращений и гипотония. В 10–25 % случаев отмечаются менингеальные симптомы, возможны бред и возбуждение больных, судороги с последующим развитием комы. Печень обычно увеличена. У некоторых больных имеются признаки острой печеночной недостаточности. Часто развиваются олигурия, микрогематурия, гипостенурия, пневмония, отек легких, тромбофлебит, острая почечная недостаточность, шок. Продолжительность лихорадки — от 4 до 8 дней. Период выздоровления длительный (1–2 месяца и более), характеризуется симптомами астении. В очаговых районах нередко наблюдаются абортивные формы крымской геморрагической лихорадки без выраженного геморрагического синдрома. При лабораторных исследованиях, помимо характерных изменений показателей крови, выявляется повышение показателей гематокрита, остаточного азота, активности аминотрансфераз, признаки метаболического ацидоза. Значительное повышение уровня тромбоцитов в крови и высокие показатели гематокрита могут свидетельствовать о неблагоприятном прогнозе. Смертность достигает 10–40 %.
Диагностика Специфическая диагностика предполагает изоляцию вируса и постановку серологических реакций. Ретроспективная диагностика крымской геморрагической лихорадки возможна с использованием РСК. Дифференцировать крымскую геморрагическую лихорадку следует с менингококковой инфекцией (см), гриппом (см), лептоспирозом (см), сыпным тифом (см.), тромбоцитопенической пурпурой и болезнью Шенлейна-Геноха, у жителей тропических стран — с желтой лихорадкой и другими африканскими и американскими геморрагическими лихорадками.
Лечение и профилактика Лечение больных крымской геморрагической лихорадкой проводится в соответствии с общими принципами лечения больных геморрагическими лихорадками. Положительный эффект дало применение иммунной сыворотки (по 60—100 мл) и гипериммунного гамма-глобулина. Госпитализация больных крымской геморрагической лихорадкой требует профилактики внутрибольничного заражения, в том числе парентеральным путем. В очагах болезни проводится комплекс дератизационных и дезинфекционных мероприятий. По эпидемиологическим показаниям осуществляется вакцинация.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ ЛАССА
ОпределениеЛихорадка Ласса — острое аденовирусное природно-очаговое заболевание, протекающее с поражением печени, почек, сосудистой и центральной нервной системы. Проявляется лихорадкой, желтухой, геморрагическим синдромом и почечной недостаточностью. Смертность высокая, до 43 %.Заболевание впервые описано в 1969 г. в г. Ласса (северо-запад Нигерии) у медицинской сестры миссионерского госпиталя как внутрибольничная инфекция. Несколько позже аналогичное заболевание было отмечено в г. Джосе (Нигерия). В 1970 г. Баклей и Казалс выделили вирус болезни, что способствовало более точной ее диагностике. Анализ клинических проявлений лихорадки Ласса выявил большее ее сходство с описанным ранее Хендерсон (1950–1952 гг.) и Россе (1956 г.) заболеванием районов Западной Африки под названием «тропический сыпной тиф». В 1970 г. и в последующие годы в некоторых медицинских учреждениях Европы и Америки наблюдались тяжелые случаи лихорадки Ласса с летальными исходами у медицинского персонала вследствие заражения от больных, прибывших из Западной Африки.
Этиология и эпидемиология Возбудитель болезни — Ласса вирус, относится к роду аренавирус. Его размеры колеблются от 70 до 150 нм. Вирус чувствителен к эфиру. По антигенному строению сходен с вирусом лимфоцитарного хориоменингита, на что указывают перекрестные серологические реакции (РСК) между этими вирусами. Лихорадка Ласса — типичное антропозоонозное (передающееся от человека и животных) природно-очаговое заболевание стран Африки. Основной носитель инфекции — дикие грызуны, в частности один их вид, широко распространенный в странах Африки. Болеют преимущественно сельские жители, занимающиеся промыслом грызунов, шкурки которых представляют известную ценность. В большинстве очаговых по лихорадке Ласса районов заболевание отмечается круглогодично. В северо-западных районах Нигерии наиболее высокий уровень заболеваемости приходится на январь — февраль, когда грызуны устремляются к человеческому жилью. Больной лихорадкой Ласса представляет серьезную опасность для окружающих, в том числе для медицинского персонала, заражение которого происходит при проведении парентеральных (внутривенных, внутримышечных и т. д.) вмешательств, при поедании пищи, содержащей возбудитель, и через непосредственный контакт. Из медицинского персонала наиболее угрожаемыми контингентами являются хирурги, оториноларингологи, медицинские сестры, патологоанатомы, уборщицы, лаборанты. Вторичные случаи болезни представляют меньшую эпидемическую опасность, однако описаны случаи заражения при контакте с больным, заразившимся от первичного больного. Восприимчивость к заболеванию всеобщая. Более тяжело болезнь протекает у лиц, прибывающих в очаговые районы впервые. Ареал лихорадки Ласса определяется ареалом грызуна и охватывает ряд стран южнее Сахары: Нигерия, Либерия, Сьерра-Леоне, Того, Сенегал, Мали, ЦАР, Гвинея, Верхняя Вольта. Антитела к вирусу Ласса обнаруживаются у 2–8 % коренного населения Западной и Центральной Африки, преимущественно у мужчин в возрасте 20–40 лет. Это свидетельствует о значительной широте распространения инаппарантных форм инфекции. Описан завоз лихорадки Ласса в медицинские учреждения Нью-Йорка, Лондона и Гамбурга.
Патогенез и патанатомия Вирус лихорадки Ласса размножается в лимфатической системе и через 3— 17 (в среднем 7—10) дней проникает в кровь, обусловливая развитие начальных клинических проявлений болезни. В крови вирус циркулирует около двух недель. Затем происходит концентрация вируса в тропных системах и органах, каковыми обычно являются печень и почки. С мочой и калом вирус выделяется во внешнюю среду. Вирус, размножаясь в клетках печени, вызывает развитие тяжелого, часто со смертельным исходом, гепатита, с очагами эозинофильного и ацидофильного некрозов печеночной дольки. Выраженные дистрофические и некробиотические изменения выявляются в почечных клубочках. При патологоанатомическом исследовании обнаруживаются гиперемия внутренних органов, отек тканей, кровоизлияния по ходу желудочно-кишечного тракта, асцит, экссудативный плеврит, миокардит, геморрагии (кровоизлияния) и набухание почек. Тканевое исследование указывает на наиболее тяжелые нарушения в печени в виде развития омертвения клеток печени. Большое значение в развитии описанных нарушений придается патологическому эффекту иммунного комплекса: вирус + антитело + комплемент. Появление специфических антител отмечается в конце 2-й — начале 3-й недели заболевания в РСК и непрямой реакции иммунофлюоресценции (НРИФ). Минимальный диагностический титр для РСК — 1:16.
Клиническая картина Клиническая картина болезни характеризуется широким спектром проявлений — от инаппарантных и субклинических форм до молниеносных шоковых вариантов. Инкубационный период длится 7—10, реже 3—17 дней. Начало заболевания обычно постепенное, но может быть и острым. В ранней стадии болезни выражены неспецифические симптомы: озноб, мышечные боли, недомогание. Температура повышается до 38–39 °C. Головные доли часто сопровождаются головокружением, рвотой. Нередко бывают боли в горле, связанные с развитием фарингита, кашель и боль в груди при дыхании. Осмотр больных в этот период выявляет красноту лица, инъекцию сосудов склер и конъюнктив. Периферические лимфатические узлы увеличены. Нередко можно наблюдать появление крупноузелковой сыпи. Отмечается экссудативно-язвенный фарингит. Пульс замедлен. Артериальное давление обычно понижено. Тоны сердца приглушены, возможен шум на верхушке сердца. В течение 2-й недели болезни появляются кашель с мокротой, признаки инфильтрации легочной ткани, часто развивается экссудативный плеврит. Отмечаются боли в животе, могут появиться тошнота, многократная рвота и частый жидкий стул. Размеры печени несколько увеличены, прощупывание ее болезненно. Уменьшается мочевыделение. Выявляются появление в моче альбуминов, крови, цилиндров. В конце 2-й или на 3-й неделе болезни температурная реакция становится менее выраженной, наблюдается постепенное снижение лихорадки. Одновременно развивается желтуха, часто с геморрагической сыпью и желудочно-кишечными кровотечениями. В тяжелых случаях возникает анурия (отсутствие мочевыделения) с азотемией. Возможно появление признаков энцефалита в виде нарушения сознания, психического и двигательного возбуждения, очаговых симптомов и патологических рефлексов. В течение 4-й недели болезни происходит обратное развитие патологических проявлений и наступает выздоровление. Наиболее тяжелы клинические проявления на 2—3-й неделе болезни, когда наблюдается наибольшее число смертных исходов. Возможны также молниеносные варианты лихорадки Ласса, приводящие к смерти больных от острой печеночно-почечной недостаточности и геморрагического синдрома. Смертность колеблется от 41–50 % у африканцев и до 64 % у европейцев. Особенно неблагоприятно протекает заболевание у беременных: смерть наступает почти в 70 % случаев. Лихорадка Ласса может вызывать обострение хронических или активацию скрытых инфекций, что усугубляет ее течение.
Диагностика и дифдиагностика Диагностика лихорадки Ласса основывается на эпидемиологических данных (пребывание в сельских районах Западной и Центральной Африки), а также на результатах клинического и лабораторного обследования. Специфическая диагностика проводится вирусологическим и серологическим методами. Вирус можно выделить из крови больного в течение двух недель от начала болезни, а из мочи — в течение месяца. Серологическая диагностика проводится с помощью НРИФ или РСК. Более предпочтительна НРИФ, которая выявляет специфические иммуноглобулины за 2–3 дня до фиксации вируса в тканях, т. е. на 7—10-й день болезни, и сохраняется положительной в течение нескольких лет. Комплементсвязывающие антитела обнаруживаются в РСК через 10–14 дней после появления флюоресцирующих антител в минимальном диагностическом титре 1:16. Возможно также использование РПГА. Необходимо дифференцировать лихорадку Ласса с другими геморрагическими лихорадками. Решающее значение имеют вирусологические или серологические методы диагностики.
Лечение Специфическое лечение болезни не разработано. Терапевтические мероприятия заключаются в применении комплекса средств, способствующих восстановлению водного баланса, нормализации объема циркулирующей плазмы, устранению геморрагических проявлений, улучшению функции печени. Больным назначают солевые растворы (раствор Филлипса № 1, раствор Рингера, препараты с высоким сорбционным и диуретическим эффектом (неокомпенсан, сывороточный альбумин, реополиглюкин, маннитол и др.), глюкокортикостероиды (преднизолон по 60—120 мг или гидрокортизон по 250–375 мг в сутки). Эффективно проведение переливаний свежецитратной крови или прямых переливаний крови. Назначаются также сосудистые и дыхательные аналептики, витамины, анальгетики. При развитии стойкой почечной недостаточности показан гемодиализ.
Профилактика Профилактические мероприятия направлены на уничтожение популяции основных источников инфекции (крыс) с использованием различных ратицидов: зоокумарина, хлорпикрина и др. Эффективно разведение хищных крыс раттус раттус, которые в короткое время уничтожают мастомус наталенсис. Необходимо разъяснять жителям очаговых по лихорадке Ласса районов опасность отлова мелких грызунов и крыс. Больные лихорадкой Ласса подлежат госпитализации в специализированные или боксовые отделения с режимом работы при карантинных инфекциях. Обслуживающий персонал должен работать в защитных костюмах. При проведении лечебных парентеральных мероприятий необходимо оберегать кожу от случайных повреждений. Лаборатории, исследующие материал от больных, должны работать в режиме карантинных инфекций. Выписка выздоравливающих допускается не ранее одного месяца от начала заболевания при условии полного клинического выздоровления.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ МАРБУРГА
ОпределениеЛихорадка Марбурга (синоним: церкопитековая геморрагическая лихорадка) — острое аденовирусное природно-очаговое заболевание, протекающее с поражением печени, почек, сосудистой и центральной нервной системы. Проявляется лихорадкой, геморрагическим синдромом, почечной недостаточностью. Характерен пленчатый фарингит. Смертность высокая, 70–85 %.В 1967 г. в Марбурге и Франкфурте-на-Майне возникло 29 случаев заболеваний, а в Белграде — 2 случая в связи с заражением от обезьян в лаборатории.
Этиология и эпидемиология Возбудитель болезни — вирус Марбург. Лихорадка Марбурга — природно-очаговое заболевание стран Африки (Судан, Заир). Основной носитель инфекции — африканские обезьяны (зеленые мартышки). Пути передачи вируса — при контакте с больным человеком или инфицированным материалом от него через кровь и органы обезьян; в больницах и лабораториях — через кровь больных и при работе с культурами тканей обезьян.
Клиническая картина Инкубационный период продолжается от 3 до 9 дней, чаще 5 дней. Начало острое: высокая лихорадка, недомогание, головная боль, характерен пленчатый фарингит, мышечные боли, особенно в пояснично-крестцовой области, продолжающиеся 4–7 дней. Урежение частоты сердечных сокращений. На 3—4-й день болезни, реже раньше, появляются тошнота, рвота, водянистый стул. Диарея может продолжаться и после снижения температуры, приводя к обезвоживанию организма. На 5—6-й день болезни появляются макулоапулезная сыпь, энцефалопатия, почечная недостаточность. На 2-й неделе заболевания часто наблюдается поражение печени без выраженной желтухи. У тяжелобольных возможно поражение почек (олигурия, повышение азота и мочевины в крови). Лихорадочный период длится около двух недель, выздоровление длительное. Картина крови и мочи. С 3-го по 5-й день отмечается снижение количества лейкоцитов, тромбоцитов, в ряде случаев повышение уровня лейкоцитов. Повышение гематокрита, азотемия, ацидоз, гиперферментемия, появление в моче белка, крови.
Диагностика и дифдиагностика Диагностика основана на эпидемиологических данных, а также на результатах клинического и лабораторного обследований. Специфическая диагностика основана на изоляции вируса из крови больного или органов с использованием новорожденных белых мышей, культуры клеток и др. Применяются электронная микроскопия, метод флюоресцирующих антител, РСК (титр 1:64 и более), НРИФ, РТПГА в парных сыворотках. Необходимо дифференцировать лихорадку Марбурга с другими геморрагическими лихорадками. Решающее значение имеют вирусологические или серологические методы диагностики.
Лечение и профилактика Терапевтические мероприятия заключаются в применении комплекса средств, способствующих восстановлению водного баланса, нормализации объема циркулирующей плазмы, устранению геморрагических проявлений, улучшению функции печени и почек. Изоляция больного в стационаре с соблюдением строгих мер безопасности (бокс с пониженным давлением, использование респираторов, перчаток, очков при обследовании больного и исследовании патологического материала, дезинфекция испражнений). Наблюдение контактных в течение 17 дней. Соблюдение строгого карантина в течение 6 недель для импортных обезьян. Специфическая профилактика не разработана.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ ОМСКАЯ
ОпределениеЛихорадка геморрагическая омская — острое инфекционное заболевание вирусной природы, передающееся с инфицированным переносчиком и характеризующееся лихорадкой, геморрагическим диатезом, скоропроходящим поражением почек, центральной нервной системы и легких.Заболевание впервые описано в 1945–1948 гг. в ходе эпидемической вспышки в Омской и Новосибирской областях. С 1958 г. в связи с подавлением переносчика регистрации случаев болезни не отмечается.
Этиология, эпидемиология, патогенез и патанатомия Возбудитель — вирус ОГЛ из рода флавовирус, семейства тогавириде, антигенной группы В. Носители вирусов — ондатры, водяные крысы и другие грызуны. Переносчики — некоторые виды клещей и блохи. Заражение человека происходит при контакте с инфицированными ондатрами, через укусы клещей, через дыхательные пути в лабораторных условиях. Наибольшая частота заболеваний омской геморрагической лихорадкой наблюдается в летние месяцы в период активности клещей. Основным свойством вируса является способность поражать стенки сосудов, что обусловливает геморрагический синдром и очаговые кровоизлияния во внутренних органах. Важное значение имеет поражение вирусом центральной и вегетативной нервной системы, а также надпочечников и кроветворных органов. После перенесенного заболевания остается стойкий иммунитет. Для омской геморрагической лихорадки характерны полнокровие и кровоизлияния во внутренние органы (почки, легкие, желудочно-кишечный тракт и др.). Наблюдается распространенное поражение мелких кровеносных сосудов преимущественно в головном и спинном мозге, а также в легких. Течение болезни благоприятное. Смертность относительно невысока — от 0,5 до 3 %.
Клиническая картина Инкубационный период составляет 3— 10 дней. Начальный период болезни протекает остро, с высокой лихорадкой, потрясающим ознобом, головной и мышечной болью. Отмечаются разлитая краснота лица и шеи, яркая инъекция сосудов склер и конъюнктивы. С первых дней болезни можно выявить петехиальные (мелкоточечные) элементы на слизистой оболочке ротовой полости, в зеве и на конъюнктивах. В отличие от крымской геморрагической лихорадки, геморрагическая экзантема при омской геморрагической лихорадке отмечается непостоянно (у 20–25 % больных). Реже наблюдается массивное кровотечение из желудочно-кишечного тракта и других органов. В разгар болезни возможно развитие менингоэнцефалита. У 30 % больных выявляется атипичная пневмония или бронхит. Часто обнаруживается увеличение печени. Лихорадочный период продолжается от 4–5 до 12 дней, температура часто бывает двухволновой. В крови обнаруживаются снижение уровня нейтрофильных лейкоцитов, тромбоцитов, анэозинофилия. В период второй температурной волны возможно повышение нейтрофильных лейкоцитов. Диагностика, лечение и профилактика аналогичны таковым при крымской геморрагической лихорадке.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ РИФТ-ВАЛЛИ
ОпределениеРифт-Валли геморрагическая лихорадка — острое арбовирусное заболевание, передающееся комарами. Широкое распространение Рифт-Валли геморрагическая лихорадка получила в Египте, Судане, Южной Африке.
Этиология и эпидемиология Носителем вируса среди позвоночных является мелкий и крупный рогатый скот. Переносчиками и носителями инфекции среди членистоногих являются комары эдес, кулекс, мансониа. Пути передачи вируса — через укус комара, через инфицированные экскреты животных, возможно — при проведении искусственной вентиляции легких.
Клиническая картина, диагностика и дифдиагностика Инкубационный период болезни колеблется от 3 до 7 дней. Начало заболевания острое: высокая лихорадка, сильная головная боль, мышечные боли, покраснение лица, конъюнктивит. На 3—4-й день болезни появляются кровоточивость десен, пурпура, желудочно-кишечное кровотечение. Часто понижается зрение вследствие проникновения в глазное яблоко воспалительной жидкости. Возможен энцефалит. Выздоровление занимает 1–1,5 месяца. При исследовании периферической крови определяются снижение уровня лейкоцитов, тромбоцитов. В моче — преходящее наличие альбуминов, крови. Прогноз в большинстве случаев благоприятный. В 0,1–0,5 % случаев наступает летальный исход. Специфическая диагностика — изоляция вируса из крови в 1—5-й дни болезни с использованием культуры клеток почки обезьян. РСК, НРИФ, РТПГА. Диагностика основана на изучении эпидемиологических, клинических, лабораторных и данных опроса. Дифференцировать заболевание следует с геморрагическими синдромами неинфекционного происхождения, при которых обычно наблюдается постепенное нарастание геморрагических проявлений и отсутствие интоксикации, а также от других вирусных геморрагических лихорадок.
Лечение и профилактика Терапевтические мероприятия направлены на устранение интоксикационного синдрома, расстройства кровообращения и обмена веществ, повышение неспецифической устойчивости. Предупреждение или борьба с вторичной инфекцией требуют назначения антибиотиков широкого спектра действия. Профилактика состоит в борьбе с комарами, защите от их нападения на человека.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ С ПОЧЕЧНЫМ СИНДРОМОМ
ОпределениеЛихорадка геморрагическая с почечным синдромом (синонимы: геморрагический нефрозоефрит, тульская, уральская, ярославская лихорадка) — острая инфекционная болезнь вирусной природы, характеризующаяся лихорадкой, интоксикацией, геморрагическим и почечным синдромами.Заболевание впервые описано в 1913 г. на Дальнем Востоке («маньчжурский гастрит»). В последующие годы очаги инфекции были выявлены на Урале, в Поволжье, в центральных и северо-западных районах России, в странах Скандинавии, Восточной и Центральной Европы, на Балканском полуострове, в Корее и на севере Китая.
Этиология и эпидемиология Вирусная природа болезни установлена А. А. Смородинцевым в 1940 г. и подтверждена М. П. Чумаковым в 1956 г., однако вирус до настоящего времени не изолирован. Американские исследователи Ч. В. Ли и П. В. Ли в 1976–1977 гг. в Корее методом иммунофлюоресценции выявили вирусный агент в легких полевых мышей. Возбудители заболевания относятся к РНК-содержащим вирусам диаметром 85—110 нм. Носители вирусов — несколько видов полевок, полевые мыши, лесные мыши, возможно, лемминги и другие грызуны. Заражение человека осуществляется в природных очагах контактно-бытовым путем, вместе с пищей или при вдыхании пыли, содержащей инфицированные экскременты грызунов. Единичные случаи заболеваемости геморрагической лихорадкой с почечным синдромом регистрируются на протяжении всего года, преимущественно среди сельских жителей, чаще у мужчин. Групповые заболевания отмечаются летом и осенью (особенно часто в июне и октябре, что связано с более частым посещением людей территории природного очага и миграцией грызунов в населенные пункты).
Патогенез и патанатомия Патогенетическим реакциям при геморрагической лихорадке с почечным синдромом свойственна стадийность, характерная и для других геморрагических лихорадок. В разгар болезни часто развиваются гипоталамо-гипофизарно-надпочечниковая недостаточность, тяжелый инфекционно-токсический шок. Вследствие флебовазотропности (сродства к сосудистой ткани) вируса геморрагической лихорадки с почечным синдромом в почках происходит венозный стаз в сочетании с серозно-геморрагическим отеком. При этом сдавливаются канальцы и собирательные трубочки, развиваются дегенеративные изменения в эпителиальных клетках и их слущивание; канальцы заполняются фибрином. Развивается характерная для этой лихорадки картина двустороннего серозно-геморрагического нефрита и острого деструктивно-обструктивного гидронефроза. Патологические изменения в почках усугубляются развитием анемии коркового слоя почек вследствие «сброса» крови в вены пирамид через открывающиеся шунты Труэтта.
Клиническая картина Длительность инкубационного периода колеблется от 4 до 43 дней, но чаще она составляет 2–3 недели. Болезнь отличается цикличностью. В ее течении различают 4 стадии: — лихорадочную (1–5—6-й день болезни); — олигурическую (с 5—6-го по 8—12-й день); — полиурическую (с 8—12-го по 20—24-й день); — стадию выздоровления. Начало болезни острое. Реже отмечается короткий предшествующий период (астения, боли в мышцах, чувство неловкости при глотании, повышенная температура тела). Начальный период болезни характеризуется быстрым повышением температуры до 38–40 °C с выраженным ознобом, сильной головной болью, болями в мышцах спины и в поясничной области, светобоязнью, ретроорбитальными болями и нередко нарушением зрения, ощущением «сетки» перед глазами, расплывчатостью отдаленных предметов. При осмотре больных в этой стадии выявляются яркое покраснение лица, шеи и верхних отделов груди, инъекция сосудов склер и конъюнктивы, выраженное покраснение зева и обложенность языка. Пульс вначале учащен, затем развивается относительная брадикардия (урежение частоты сердечных сокращений), понижается артериальное давление, приглушаются сердечные тоны. Часто отмечаются явления бронхита или пневмонии. Прощупывание живота чувствительно в подреберьях. Может определяться увеличение печени и селезенки. На 2—3-й день болезни можно обнаружить геморрагическую энантему на твердом небе, а на 3—4-й день появляется петехиальная сыпь в подмышечных областях и на боковых отделах туловища, иногда в виде полос. В последующие дни может развиться пурпура, а при тяжелом течении болезни — экхимозы. Симптом щипка постоянно положителен. В последние дни начального периода состояние больных заметно ухудшается. Нарастают явления интоксикации, появляется многократная рвота, может развиться менингеальный синдром. Более выраженными становятся признаки геморрагического синдрома.Обнаруживаются кровоизлияния в непрозрачную оболочку глаз, возможны носовые кровотечения. На 6—9-й день болезни температура обычно понижается кризолитически до повышенного или нормального уровня, состояние больного резко ухудшается. Появляются бледность кожных покровов, синюшность нижних отделов конечностей, кровоточивость слизистых оболочек, кровоизлияния в местах инъекций, кровохарканье, кровавая рвота, дегтеобразный стул. Одновременно больные отмечают сильные боли в поясничной области, часто нестерпимые, заставляющие принимать вынужденное положение в постели. Прогрессивно снижается мочевыделение вплоть до полного его отсутствия. Заболевание переходит в следующую — олигурическую — стадию. Характерным признаком геморрагической лихорадки с почечным синдромом является массивная протеинурия (выделение белка с мочой) на фоне резкого уменьшения диуреза (количества мочи). Выведение белка достигает 33–85 г/л мочи. Интенсивность протеинурии может значительно изменяться в течение суток. Вследствие нарушения почечной функции прогрессивно нарастает азотемия, может развиваться почечная эклампсия, являющаяся в 48 % случаев причиной смерти при геморрагической лихорадке с почечным синдромом. Олигурический период нередко осложняется разрывом почечной капсулы и надрывом коркового слоя почек, часто связанными с неправильной тактикой ведения больного. Возможны кровоизлияния в миокард, легкие, головной мозг, гипофиз, надпочечники и в другие органы. С 10—16-го дня болезни состояние больных геморрагической лихорадкой с почечным синдромом начинает улучшаться, увеличивается мочевыделение — наступает полиурическая фаза болезни. Суточное количество мочи достигает 5 л, наблюдается никтурия. Плотность мочи снижается до 1,001—1,003. Гипоизостенурия может сохраняться в течение нескольких недель. Иногда развивается пиелонефрит. Выздоровление больных медленное, с постепенной нормализацией функции почек, неустойчивостью сердечно-сосудистой системы. Повышенная чувствительность к изменению водного режима у отдельных выздоравливающих сохраняется в течение 1–2 лет. Прогноз серьезный. Смертность составляет от 1 до 10 %, в отдельные периоды — 15 % и более.
Диагностика и дифдиагностика При лабораторных исследованиях в начальной стадии болезни выявляется снижение уровня лейкоцитов и тромбоцитов, сменяющееся нейтрофильным лейкоцитозом со сдвигом формулы до промиелоцитов. Повышенные показатели гематокрита в олигурической фазе снижаются, нарастает уровень остаточного азота, развивается дефицит оснований, нередко повышается активность аминофераз. В моче, помимо протеинурии, обнаруживаются «фибринные цилиндры», инкрустированные эпителиальными клетками. Дифференциальная диагностика геморрагической лихорадки с почечным синдромом проводится с геморрагическими лихорадками и рядом других болезней, протекающих с почечной недостаточностью (острый нефрит, хронический нефрит, токсические повреждения почек). Из серологических методов диагностики используется выявление антител и нарастание их количества в парных сыворотках.
Лечение и профилактика При геморрагической лихорадке с почечным синдромом лечение проводится в соответствии с принципами лечения больных геморрагическими лихорадками. В случаях выраженной азотемии показан гемодиализ, возможен перитонеальный диализ. В период полиурии лечение направлено на компенсацию водно-электролитных нарушений. Больные подлежат обязательной госпитализации в инфекционный стационар. Доставка больных производится наиболее щадящим способом. Обслуживание больных предполагает соблюдение мер по предупреждению внутрибольничного заражения. Изоляция контактных. Разобщение не применяется. Устанавливают медицинское наблюдение в течение трех недель. Допуск в коллектив. Разрешается не ранее двух недель после выписки из стационара с полным клиническим выздоровлением, нормализацией всех лабораторных показателей, не ранее 25-го дня болезни. Может оставаться изогипостенурия. Наблюдение проводится не менее 6 месяцев. Первые 3 месяца запрещается тяжелая физическая нагрузка. Лабораторное обследование (кровь, моча) — на 1, 3 и 6-м месяце наблюдения. Дальнейшие сроки наблюдения и объем обследования зависят от клинических проявлений. Специфическая профилактика не разработана. Неспецифическая профилактика. В очаговых районах осуществляются борьба с грызунами и меры личной профилактики.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ ЮЖНОАМЕРИКАНСКАЯ
ОпределениеЛихорадка геморрагическая южноамериканская (синонимы: аргентинская геморрагическая лихорадка) — острое аденовирусное природно-очаговое заболевание, очаговое для центральных районов Аргентины. Протекает с высокой лихорадкой, геморрагическим синдромом, поражением почек и центральной нервной системы; боливийская геморрагическая лихорадка — природно-очаговое вирусное заболевание, очаговое для центральных провинций Боливии. Характеризуется высокой лихорадкой, геморрагическим синдромом.Аргентинская геморрагическая лихорадка выявлена в 1943 г. в аргентинской провинции Буэнос-Айрес. В дальнейшем были зарегистрированы случаи заболевания и в других провинциях Аргентины (более 16 000 больных) и некоторых других странах Южной Америки. В 1974–1975 гг. разработаны методы вакцинации против аргентинской геморрагической лихорадки. Интенсивные вспышки боливийской геморрагической лихорадки отмечались в 50—60-х гг. XX в. в провинциях Сан-Хоакин, Маморе, Якумо, департаменте Бени. Во время эпидемии 1963 г. в Маморе заболела 1/3 населения, а смертность достигла 15 %.
Этиология и эпидемиология Аргентинская геморрагическая лихорадка Возбудитель аргентинской геморрагической лихорадки относится к антигенной группе токарибе рода аренавирус. Вирус проходит через фильтры с диаметром более 100 нм, чувствителен к растворителям жиров, разрушается при нагревании, в кислой среде, при воздействии ультрафиолетовых лучей и формалина. Аргентинская геморрагическая лихорадка — природно-очаговое заболевание. Естественным носителем инфекции являются хомякообразные грызуны и паразитирующие на них клещи. У грызунов вирус вызывает как явные, так и скрытые формы инфекции, что способствует продолжительной циркуляции вируса в природных очагах. Человек заражается аргентинской геморрагической лихорадкой в природных очагах в процессе хозяйственной деятельности. Заражение осуществляется через переносчика, воздушным путем и при поедании пищи, содержащей возбудитель. Риск заражения повышается во вновь формирующихся очагах болезни. Обычно болезнь наблюдается у мужчин активного возраста в сельскохозяйственных районах. В сезон уборки урожая, особенно в мае, заболеваемость заметно повышается, что обусловлено изменениями численности популяции грызунов. Возможна передача вируса от больного человека.
Боливийская геморрагическая лихорадка Возбудитель заболевания — вирус антигенной группы. Естественным носителем вируса является хомякообразный грызун, у которого наблюдается постоянная форма инфекции.
Патогенез и патанатомия Аргентинская геморрагическая лихорадка Механизмы развития аргентинской геморрагической лихорадки изучены недостаточно. На экспериментальных моделях показано, что после внедрения вирус размножается в клетках ретикулоэндотелия, после чего развивается вирусемия (в течение 7—12 дней), способствующая распространению вируса и проникновению его в различные системы организма. Вследствие прямого вазотропного и нейротропного эффекта вируса развиваются распространенный специфический васкулит и энцефалит. Вследствие поражения сосудистой стенки наблюдается расширение капилляров, повышение их проницаемости, что приводит к экстравазации, выходу жидкой части крови во внесосудистый сектор, сгущению крови, кислородной недостаточности и нарушению тканевого обмена веществ. Наряду с этим развивается диссеминированная внутрисосудистая коагуляция, усиливающая шоковые реакции. Отмечено значительное повреждение нижних и прямых почечных канальцев. Характерны дистрофические изменения в печени. Описаны кровоизлияния, некрозы, специфические гранулемы в ткани головного мозга и вегетативных ганглиях.
Клиническая картина Аргентинская геморрагическая лихорадка Инкубационный период колеблется от 6–8 до 12–16 дней. Заболевание обычно развивается постепенно. В начальном периоде продолжительностью 3–4 дня наблюдаются общетоксические проявления — недомогание, головная боль, раздражительность, познабливание. Часто отмечаются мышечные боли, особенно в поясничной области. Нередко на слизистых оболочках полости рта можно выявить кровоизлияния, эрозии. Могут отмечаться катаральные (воспалительные) изменения верхних дыхательных путей. К концу этого периода лихорадка достигает уровня 39–40 °C. В дальнейшем развивается стадия разгара болезни продолжительностью 8—12 дней. В этом периоде наблюдаются ремиттирующая высокая лихорадка и развитие шоковых реакций. При осмотре больных отмечаются яркое покраснение и одутловатость лица, шеи, иногда субиктеричность (незначительная желтушность) склер и кожи. На слизистых оболочках появляются кровоизлияния, часто геморрагическая сыпь. При тяжелом течении болезни наблюдаются желудочно-кишечные кровотечения, кровохарканье. Обследование сердечно-сосудистой системы обнаруживает урежение частоты сердечных сокращений и повышение артериального давления. Нередко выявляются трахеобронхит и бронхопневмония. Часто определяются увеличение печени и селезенки, а также полиаденит. Мочевыделение у больных обычно снижается. В зависимости от степени выраженности токсического и геморрагического синдромов выделяют стертые, легкие, среднетяжелые и тяжелые формы болезни. Последние характеризуются массивным геморрагическим синдромом, энцефалитом, комой, почечной недостаточностью и ранней смертью больных (на 3—5-й день болезни).
Боливийская геморрагическая лихорадка Механизм развития и клинические признаки болезни сходны с таковыми при аргентинской геморрагической лихорадке. Инкубационный период — 8—12 дней. Клинические проявления те же, что и при аргентинской геморрагической лихорадке, но часто наблюдается более тяжелое течение.
Диагностика Аргентинская геморрагическая лихорадка При исследовании крови отмечаются снижение уровня лейкоцитов, увеличение количества лимфоцитов, почти полное отсутствие нейтрофилов, снижение уровня тромбоцитов. Закономерно выявляется понижение уровня протромбина, фибриногена и других факторов свертывания крови. Часто определяются наличие в моче альбуминов, крови, цилиндров. Смертность колеблется от 6 до 20 %. Болезнь распознается на основании данных опроса, клинического обследования и лабораторных исследований. Специфическая диагностика заключается в выделении вируса в первые 3—12 дней болезни и антител, нейтрализующих вирус в конце 3-й недели заболевания. Боливийская геморрагическая лихорадка В крови определяется снижение уровня лейкоцитов, тромбоцитов; в моче — слущенные почечные клетки, эритроциты, белок.
Лечение и профилактика Аргентинская геморрагическая лихорадка Специфическая терапия не разработана. Обычно применяются терапия, направленная на устранение шока, дезинтоксикация, переливания крови, симптоматическая терапия. В последние годы положительный эффект дает внутривенное введение больным плазмы выздоравливающих. Широкое проведение дератизационных и инсектицидных мероприятий в очагах инфекции. Получены положительные результаты от применения живой аттенуированной вакцины. Боливийская геморрагическая лихорадка Лечение направлено на прекращение дальнейшего развития заболевания. Меры, препятствующие проникновению грызунов в жилища, производственные помещения и к продуктам питания, истребление грызунов. Применение фосфида цинка с целью истребления грызунов привело в последние годы к заметному снижению заболеваемости.
ЛИХОРАДКА ГЕМОРРАГИЧЕСКАЯ ЭБОЛА
ОпределениеЛихорадка Эбола — острое природно-очаговое вирусное заболевание, протекающее с поражением печени, почек, сосудистой и центральной нервной систем; проявляется лихорадкой, желтухой, геморрагическим синдромом и почечной недостаточностью.
Этиология и эпидемиология В 1976 г. на юге Судана и в северных районах Заира наблюдались вспышки геморрагической лихорадки с очень высокой смертностью (60–87 %). Из материала, полученного от больных и умерших, был выделен вирус, по строению и свойствам сходный с вирусом Марбурга, но имевший другой антигенный состав. Новый вирус получил название вируса Эбола, а вызываемая им инфекция — лихорадки Эбола. В описанных вспышках заболевание носило черты антропонозной инфекции (передаваемой от человека). Источником возбудителя были больные люди. Роль животных как источников инфекции и возможность передачи возбудителя в настоящее время изучаются. Заражение человека происходит при непосредственном, тесном и длительном контакте с больными лихорадкой Эбола (медицинский уход, пребывание в одной больничной палате, проживание в одной комнате и т. п.). Наиболее вероятна передача возбудителя через руки, загрязненные кровью (или испражнениями, содержащими кровь) и мочой больного. По-видимому, заражение вирусом Эбола возможно через шприцы при инъекциях. Восприимчивость к инфекции не зависит от пола и возраста, но дети заражаются реже взрослых. В описанных вспышках значительную часть больных составили медицинские работники, особенно медицинские сестры стационаров. Инфекция имеет склонность к эпидемическому распространению. Однако эпидемии развиваются сравнительно медленно, с интервалами между отдельными случаями болезни в несколько дней.
Патогенез и патанатомия Патанатомия и механизм развития заболевания изучены недостаточно, в общих чертах совпадают с таковыми при любой острой вирусной инфекции, в частности имеют большое сходство с механизмом развития и патоморфологией церкопитековой лихорадки, вызываемой вирусом Марбурга, и лихорадки Ласса.
Клиническая картина Инкубационный период при лихорадке Эбола составляет в среднем 7—14 дней. Заболевание начинается внезапно с сильной головной боли в лобной, а затем и в затылочной части головы. Одновременно появляются прогрессирующая слабость, боли в суставах, преимущественно крупных, шейные и поясничные мышечные боли. С первого дня болезни температура тела повышается до 39–40 °C и держится на высоком уровне 5–7 дней. На 2—3-й день (у некоторых больных с первого дня) у большинства больных развивается понос, к которому позже присоединяется рвота. Диарея сопровождается схваткообразными болями в животе, главным образом вокруг пупка. На 3—5-й день болезни практически у всех больных развивается геморрагический синдром, который проявляется меленой, кровавой рвотой, кровотечениями из носа, рта, влагалища, мест инъекций; возможны субконъюнктивальные кровотечения. Гематурия развивается редко. На 5—7-й день болезни может появиться макуло-папулезная сыпь, напоминающая коревую. Она, как правило, распространенная, но лучше заметна на конечностях и в нижней части живота. Спустя 5–6 дней наблюдается шелушение. Очень характерны боли режущего характера в груди и сухой кашель. Потери жидкости с испражнениями и расстройства водного обмена часто приводят к обезвоживанию, которая проявляется сухостью слизистых оболочек, снижением упругости кожи. Больные быстро худеют, что связано также с полной потерей аппетита. Довольно часто развиваются расстройства психики: неадекватное поведение, возбуждение, агрессивность и др. Шок, обезвоживание и кровотечения приводят к гибели больного на 5—8-й день болезни. Выздоровление длительное, с выраженным астеническим синдромом. В целом клиническая картина лихорадки Эбола почти идентична проявлениям церкопитековой лихорадки (Марбурга) и лихорадки Ласса. Прогноз при лихорадке Эбола всегда серьезный, смертность превышает 50 %.
Диагностика Диагноз устанавливается на основании клинической картины болезни, свидетельствующей о развитии у больного геморрагической лихорадки, и подтверждается изоляцией возбудителя из крови больного, а также серологически — постановкой НРИФ.
Лечение и профилактика Терапия лихорадки Эбола направлена на прекращение дальнейшего развития заболевания. При установлении диагноза вводится иммунная плазма, полученная от выздоравливающих после лихорадки Эбола. Включает выявление и изоляцию больного в стационаре с соблюдением строгих мер безопасности (бокс с пониженным давлением, использование респираторов, перчаток, очков при обследовании больного и исследовании патологического материала, дезинфекция испражнений). Строгое соблюдение режима стерилизации, использование одноразовых шприцев, игл, систем для переливания плазмы, крови, кровезаменителей в медицинских учреждениях.
ЛИХОРАДКА ЖЕЛТАЯ
ОпределениеЖелтая лихорадка — острая антропозоонозная трансмиссивная болезнь (передающаяся через укусы комаров от животных и человека) вирусной природы, характеризующаяся двухфазным течением, лихорадкой, желтухой, геморрагическим синдромом, нефропатией. Известна с давних времен в тропических и субтропических странах.Желтая лихорадка относится к группе болезней, предусмотренных Международными медико-санитарными правилами, и подлежит обязательной регистрации в ВОЗ. Первое описание клиники желтой лихорадки, проявившейся в виде эпидемии на Антильских островах, восходит к 1635 г. Значительная эпидемическая вспышка этой болезни наблюдалась в 1648 г. на полуострове Юкатан. Крупные эпидемии желтой лихорадки с высокой смертностью, начиная с конца XVII столетия, имели место в странах Южной и Центральной Америки, бассейне Карибского моря, Бразилии, на Африканском континенте. Только в США с 1793 по 1900 гг. переболело около 500 тыс. человек. В Гаване во время эпидемий с 1803 по 1900 гг. умерло 35 900 человек. Около 10 тыс. людей умерли в годы строительства Панамского канала. Будучи завезенной в Европу больными людьми и инфицированными комарами, желтая лихорадка вызвала эпидемии в Испании, Португалии, Франции, Англии, Италии. Эпидемии желтой лихорадки продолжали поражать население ряда африканских стран и в XX столетии (Судан, 1960 г.). В 1805 г., когда эпидемия желтой лихорадки вспыхнула в Испании и на юге Франции, Медицинский совет в Петербурге в своем описании этой болезни высказал предположение о передаче ее возбудителя насекомыми. Но только в 1881 г. кубинский врач К. Финлей доказал, что распространение желтой лихорадки происходит посредством комара определенного вида. В 1901 г. У. Рид в Гаване установил вирусную природу желтой лихорадки. Позже этот и другие исследователи доказали наличие вируса в крови больных людей в первые 3 дня болезни и способность комаров передавать вирус через 12 суток после инфицирующего кровососания.
Этиология Возбудитель желтой лихорадки — флавовирус фабрицис — принадлежит к роду флавовирусов, семейству тогавирусов. Его размеры — от 17 до 25 нм. Форма — сферическая. В жидкой среде при температуре 60 °C вирус погибает через 10 мин. Вирус не обладает устойчивостью к температурным изменениям, чувствителен к обычным дезинфектантам. В высушенном состоянии переносит температуру 100–110 °C до 5 ч, в замороженном виде — до 1 года, в запаянных ампулах с азотом — до 12 лет. Различают несколько видов вируса желтой лихорадки, обладающих пантропностью (всеобщей чувствительностью) или нейротропностью, что используют для пассирования (проведения) его на животных с целью получения вакцинных штаммов. Вирус хорошо растет на тканевых средах, особенно на хорионаллантоисной среде, которая используется для получения основного вакцинного штамма 17-Д.
Эпидемиология Желтая лихорадка — природно-очаговое заболевание, способное к эпидемическому распространению и передающееся через переносчика. Различают два эпидемиологических типа желтой лихорадки — джунглевый (первичный, или природный, зоонозный) и городской (вторичный, или синантропный, антропонозный). Носителем вируса в природных, или джунглевых, очагах являются различные животные — обезьяны, опоссумы, броненосцы, муравьеды, сумчатые ежи, грызуны, у которых инфекция может протекать в скрытой форме. Переносчиками вируса здесь являются комары определенных видов. Эпидемиология джунглевой формы желтой лихорадки различна в Африке и Южной Америке. В Африке основным носителем вируса являются обезьяны, живущие в кронах деревьев. Переносчиками вируса служит комар, обитающий в тропических лесах. Некоторые виды обезьян в дневное время устраивают набеги на плантации, расположенные вблизи человеческого жилья, где они подвергаются нападению комаров, которые и передают вирус от животных человеку в процессе кровососания. Заболеваемость этим типом желтой лихорадки обычно имеет очаговый характер. В очагах инфекции болеют преимущественно неиммунные лица, дети и приезжие. Взрослое коренное население очаговых районов вследствие многократного заражения приобретает устойчивость к вирусу. В странах Южной Америки основным носителем вируса являются обезьяны, живущие в верхнем ярусе джунглей, а также другие млекопитающие, ведущие наземный образ жизни. В передаче вируса участвуют комары некоторых видов. Нападению этих комаров может подвергаться и человек, попавший в природный очаг болезни. Заболевание чаще отмечается у охотников, лесорубов и носит случайный характер. Занос вируса зараженными людьми в населенные пункты может вызвать эпидемическое распространение инфекции среди населения. Передача вируса в населенных пунктах происходит при посредстве комаров. Источником и носителем инфекции при городском типе заболевания является только больной человек в течение последнего дня инкубационного периода и первых трех дней заболевания. Заболеваемость имеет эпидемический характер. Основным переносчиком вируса от больного человека к здоровому служит комар, приобретающий способность передавать вирус после его размножения в течение 6—30 дней, в зависимости от температуры внешней среды. При температуре ниже 18 °C и выше 31 °C вирус в теле комаров не размножается. В передаче вируса могут принимать участие и другие виды комаров того же рода. Желтой лихорадке свойственна определенная сезонность — повышение заболеваемости в период, следующий за периодом тропических ливней, когда популяция комаров становится значительной. Выплод комаров возможен даже в самых мелких водоемах и происходит в течение всего года. Ввиду интенсивного развития международных транспортных связей зараженные комары могут быть завезены в неочаговые по желтой лихорадке районы (отмечены случаи завоза в некоторые области России) и вызывать заболевания среди населения этих районов. Заражение человека возможно и при попадании крови больного на кожу, где имеются царапины и микротрещины (дефекты), или слизистые оболочки здорового человека.
Патогенез и патанатомия Введенный в организм человека при укусе инфицированного комара вирус желтой лихорадки размножается в клетках ретикулогистиоцитарной системы, в регионарных лимфатических узлах в течение 3–6, реже 9—10 дней. Затем вирус проникает в кровь, вызывая вирусемию (циркуляцию вирусов в крови), обусловливающую начало болезни. С кровью вирус заносится в различные органы: печень, костный мозг, селезенку, почки, нарушая их функции. Характерными изменениями в пораженной печени являются мутное набухание, коагуляционный и колликвационный (сухой и мокрый некроз) некроз клеток печени, преимущественно в мезолобулярной зоне печеночной дольки, жировая дистрофия их, дистрофические изменения звездчатых ретикулоэндотелиоцитов. Поражение клеток печени сопровождается развитием синдрома цитолиза и холестаза. В почках наблюдается мутное набухание и жировая дистрофия эпителия канальцев, участки некроза. В просвете канальцев выявляются скопления гемоглобина, коллоидных масс, цилиндров. Клубочковый аппарат страдает в меньшей степени. В селезенке и лимфатических узлах отмечаются кровоизлияния, переразвитие фолликулов, образование атипичных мононуклеаров, ложные центры размножения с очагами некрозов, отсутствие лимфоцитов. При поражении нейротропными видами вируса развивается картина энцефалита. После болезни развивается иммунитет.
Клиническая картина В клиническом течении желтой лихорадки выделяют три периода: инкубационный, разгара, исходов болезни. Инкубационный период обычно длится 3–6 дней, реже 9—10 дней, сменяясь периодом разгара болезни. Период разгара протекает в виде трех последовательных фаз: — гиперемии; — ремиссии; — реактивной фазы, или фазы венозного стаза. Фаза гиперемии (покраснения) развивается остро с потрясающим ознобом, повышением температуры, достигающей в течение 1–2 дней максимального уровня — 39–40 °C. Выражен болевой синдром: сильная головная боль, особенно в области затылка, мышечные боли, распространяющиеся на область поясницы, нижние конечности. Больные возбуждены, в тяжелых случаях появляется бред. Отмечается резкое покраснение и одутловатость лица, отечность век, яркая инъекция сосудов непрозрачных оболочек и конъюнктив, глаза как бы налиты кровью («амарильная маска»). Аппетит снижен или отсутствует. Язык ярко-красный, наблюдается кровоточивость десен, носовые кровотечения. Часто бывает обильная рвота с примесью желчи и крови. Больные страдают от жажды. Пульс учащен до 120–130 в минуту, артериальное давление в норме или несколько повышено. Через 3–4 дня состояние больных несколько улучшается, понижается температура до 37–38 °C, исчезают головная боль, мышечные боли, улучшаются сон и аппетит. Наступает фаза ремиссии продолжительностью от нескольких часов до 2 суток; при легком течении болезни она может переходить в период выздоровления. При тяжелом и среднетяжелом течении болезни после периода ремиссии наступает фаза венозного стаза с повторным повышением температуры, усилением токсических и геморрагических проявлений. Наблюдаются кровавая многократная рвота, обильный кашицеобразный стул черного цвета. Появляются множественные кровоизлияния на коже и слизистых оболочках. Краснота лица сменяется выраженной синюшностью, развивается желтуха кожи и слизистых. Обычно в этом периоде повышенная частота сердечных сокращений начального периода сменяется их урежением (симптом Фаже), артериальное давление понижается, возможно развитие коллапса. В тяжелых случаях выявляются тахикардия, экстрасистолия. Печень значительно увеличена, при прощупывании болезненна; часто увеличена и селезенка. Развивается уменьшение мочевыделения вплоть до его отсутствия. При тяжелом течении болезни наблюдается токсический энцефалит с нарушением сознания и двигательным беспокойством. Исследование крови выявляет снижение уровня лейкоцитов, нейтропению и лимфоцитоз, увеличение СОЭ. Содержание билирубина в сыворотке крови увеличивается. В моче даже в первые дни болезни наблюдаются наличие альбуминов, крови, гиалиновые и зернистые цилиндры. Одновременно в крови повышен уровень остаточного азота. Спинномозговая пункция обнаруживает повышение внутричерепного давления, увеличение содержания белка в спинномозговой жидкости, положительные реакции Панди и Нонне-Апельта. Реактивная фаза продолжается 3–4 дня, но может растягиваться до 10–14 дней, сменяясь стадией выздоровления. Возможно развитие осложнений: пневмония, ангиохолиты, гнойный паротит, миокардит. Смертность при желтой лихорадке колеблется от 5—10 до 20–25 % и даже 60 % при тяжелых эпидемических вспышках. Наиболее часто смерть наступает на 6—9-й день болезни в фазе венозного стаза. Клиническое течение болезни может варьировать от стертых и легких до молниеносных форм со смертью больных в первые дни болезни.
Диагностика и дифдиагностика Основана на данных опроса (пребывание в очаговом районе в пределах инкубационного периода), результатах клинического обследования с выявлением ведущих симптомов болезни: желтухи, кровотечений, печеночнопочечной недостаточности и подтверждается лабораторными тестами. К специфической диагностике относится исследование крови на вирус в течение первых 3–4 дней болезни методом интрацеребрального (внутримозгового) заражения мышей или обезьян. Ставится реакция нейтрализации вируса. Выявляются специфические антитела в сыворотке крови больного постановкой РСК, РТГА, начиная со 2-й недели заболевания. Дифференциальная диагностика желтой лихорадки проводится с вирусным гепатитом, лептоспирозом, малярией, другими геморрагическими лихорадками.
Лечение В практике терапии желтой лихорадки используются средства, направленные на устранение проявлений заболевания и прекращение дальнейшего его развития. Больным назначаются строгий постельный режим и щадящая калорийная диета, большие дозы витаминов, особенно аскорбиновой кислоты и препаратов витамина Р. Показано внутривенное введение препаратов с высоким адсорбирующим эффектом (сывороточный альбумин, неокомпенсан, реополиглюкин и др.), плазмозаменителей, диуретических препаратов (маннитол, этакриновая кислота). При выраженном геморрагическом синдроме показано переливание свежецитратной донорской крови или прямое переливание крови. Терапия тяжелых форм болезни включает глюкокортикостероиды (преднизолон по 60–90 мг в сутки или гидрокортизон по 250–300 мг в сутки). В целях коррекции ацидоза (кислотности) вводятся бикарбонат или лактат натрия. В случаях выраженной почечной недостаточности рекомендуется проводить гемодиализ. Предупреждение или борьба с вторичной инфекцией требует назначения антибиотиков широкого спектра действия.
Профилактика Профилактика желтой лихорадки состоит в своевременной диагностике и изоляции больных, проведении противокомариных мероприятий и иммунизации лиц, находящихся в очаговом районе. Стационары, где лечатся больные желтой лихорадкой, должны быть тщательно защищены от проникновения комаров. Для борьбы с комарами используют различные ларвицидные средства, ультрамалообъемное опрыскивание малатионом, пропоксуром, фенитратионом. Для уничтожения личинок в питьевой воде эффективно применение абата. Большое значение в борьбе с комарами сохраняет бонификация мелких водоемов. Защита людей от нападения комаров достигается применением различных репеллентов. Специфическая профилактика желтой лихорадки состоит в вакцинации. Накожная вакцина «Дакар» отличается нейротропностью: ее введение детям до 14 лет не рекомендуется вследствие возможного развития поствакцинального энцефалита. Американская вакцина «17-Д» применяется подкожно по 0,5 мл с разведением 1:10. Иммунитет в результате прививки развивается через 7—10 дней и сохраняется в течение 6 лет. Вакцинация регистрируется в специальном международном свидетельстве. Вакцинации подвергается население очаговых по желтой лихорадке районов, а также лица, въезжающие в эти районы. Непривитые, прибывшие из очаговых районов, подвергаются карантину в течение 9 дней. Согласно Международным медико-санитарным правилам, о каждом новом случае заболевания желтой лихорадкой производится взаимная информация правительств, случаи болезни подлежат обязательной регистрации в ВОЗ. В районах возможного распространения заболевания проводятся тщательный надзор и дезинсекция международных транспортных средств.
ЛИХОРАДКА КЛЕЩЕВАЯ
ОпределениеЛихорадки клещевые пятнистые — группа острых трансмиссивных болезней человека (передающихся через клещей), вызываемых риккетсиями — облигатными (строгими) внутриклеточными паразитами.Термином «риккетсиозы» объединяются 5 групп различных заболеваний: — группа сыпного тифа (эпидемический сыпной тиф, болезнь Брилля и эндемический сыпной тиф); — собственно группа клещевых пятнистых лихорадок (пятнистая лихорадка Скалистых гор, марсельская лихорадка, клещевой сыпной тиф Северной Азии, североавстралийский клещевой сыпной тиф, осповидный или везикулезный риккетсиоз); — группа цуцугамуши (тропический клещевой сыпной тиф); — группа лихорадки-ку; — группа пароксизмальных риккетсиозов — волынская, или траншейная, лихорадка. В отличие от антропонозных риккетсиозов (эпидемический сыпной тиф и волынская лихорадка), возбудители которых циркулируют между человеком и его специфическими внешними паразитами — вшами, клещевые пятнистые лихорадки являются классическими заболеваниями, передающимися от животных к человеку, возбудители которых циркулируют между домашними или дикими животными и кровососущими членистоногими (чаще всего — клещами), способными заражать риккетсиями и человека. В связи с трансовариальной передачей риккетсий у акариформных и иксодовых клещей последние являются не только переносчиками, но и стойкими носителями инфекции в природных условиях. В группу клещевых пятнистых лихорадок входят сходные по клиническим проявлениям острые лихорадочные риккетсиозы с ярко выраженной сыпью, интоксикацией, поражением сердечно-сосудистой и нервной систем, передающиеся при укусах клещей.
Этиология и эпидемиология Возбудители — риккетсии (названные в честь американского исследователя Г. Т. Риккетса, погибшего при изучении сыпного тифа). Риккетсии занимают в систематике промежуточное положение между вирусами и бактериями. С вирусами их сближает строгое паразитирование внутри пораженных клеток, а с бактериями — клеточная организация с наличием капсулы, цитоплазмы и ядра, содержащего ДНК и РНК, и зернистых включений. Риккетсии обладают гемолизинами и токсинами и имеют сложную антигенную структуру. Все риккетсии чувствительны к антибиотикам группы тетрациклина и хлорамфениколу. В естественных условиях риккетсиозы наблюдаются у кровососущих членистоногих, у ряда диких (грызуны и мелкие животные) и домашних животных (мелкий и крупный рогатый скот, собаки), а также у человека.
Клиническая картина У членистоногих и позвоночных животных риккетсиозы обычно протекают в виде скрытой инфекции, однако наблюдаются и летальные формы. У людей риккетсиозы, как правило, протекают в виде острого лихорадочного заболевания с развитием множественных васкулитов и тромбоваскулитов мелких сосудов различных систем и органов, часто с поражением центральной нервной системы и характерной геморрагической сыпью. Наблюдаются также скрытые формы риккетсиозной инфекции, выявляемые серологически. Все зоонозные риккетсиозы являются типичными природно-очаговыми инфекциями, ареал которых определяется факторами внешней среды, распространением чувствительных животных и кровососущих членистоногих. Энзоотические (связанные с определенным ареалом обитания животных) очаги риккетсиозов могут приобретать эпидемиологическое значение в случае попадания на их территорию неиммунных лиц, подвергающихся инфицированию через укусы зараженных кровососущих членистоногих или при контакте с зараженным материалом. Риккетсиозы широко распространены. Некоторые из них встречаются повсеместно, например, ку-лихорадка, другие наблюдаются в тех странах, где ландшафтно-климатические условия способствовали формированию и поддержанию природных очагов этих инфекций. Значительное распространение они получили в странах с жарким климатом.
Диагностика Диагностика риккетсиозов основана на комплексе эпидемиологических и клинических данных. Большое значение в распознавании риккетсиозов и выявлении абортивных и скрытых форм инфекции имеют серологические методы исследований — РСК, РПГА, реакция агглютинации риккетсий, РИФ.
Лечение Лечение больных должно быть комплексным, т. е. включать устранение причины заболевания, прекращение дальнейшего его развития и клинических проявлений, а также обязательный правильный уход.
ЛИХОРАДКА КЛЕЩЕВАЯ ВОСТОЧНОАФРИКАНСКАЯ
ОпределениеВосточноафриканская клещевая лихорадка — острое очаговое заболевание, передающееся через переносчика. Протекает с умеренно выраженной лихорадкой, первичным аффектом, лимфаденитом на месте внедрения возбудителей — риккетсий — и пятнисто-узелковой сыпью.
Этиология и эпидемиология Возбудителем восточноафриканской клещевой лихорадки являются риккетсии, серологически почти неотличимые от возбудителя марсельской лихорадки и, возможно, являющиеся одним из его географических вариантов. Естественным носителем возбудителей восточноафриканской клещевой лихорадки служат различные виды иксодовых клещей некоторых родов, паразитирующих на диких грызунах и других животных. Установлена естественная пораженность риккетсиями 7 видов диких грызунов, обитающих в районах Восточной и Южной Африки. Заражение человека происходит в результате попадания и присасывания инфицированных клещей. Заболевание распространено в виде единичных случаев в Кении, Уганде, Эфиопии, Сомали, Танзании.
Клиническая картина Восточноафриканская клещевая лихорадка характеризуется доброкачественным течением и проявляется остролихорадочным состоянием, развитием первичного аффекта, регионарного лимфаденита, пятнисто-узелковой сыпью; идентична марсельской лихорадке.
ЛИХОРАДКА КЛЕЩЕВАЯ СЫПНАЯ СЕВЕРНОЙ АЗИИ
ОпределениеЛихорадка клещевая сыпная Северной Азии (синонимы: клещевой риккетсиоз, клещевой сыпной тиф Северной Азии, клещевой тиф Востока, восточный сыпной тиф, клещевой сыпной тиф Сибири) — острый доброкачественный природно-очаговый риккетсиоз, перадающийся только через переносчика и характеризующийся наличием первичного аффекта, лихорадочной реакцией, пятнисто-узелковыми высыпаниями на коже, увеличением и болезненностью регионарных лимфатических узлов.Болезнь впервые описана Е. И. Миллем в Приморье в 1936 г. Подробно происхождение, эпидемиология и клиника изучались с 1938 г. специальными экспедициями под руководством Е. Н. Павловского. Возбудитель выделен О. С. Коршуновой в 1938 г. из клеток очага омертвения на коже больного после присасывания иксодового клеща (М. К. Яцимирская-Кронтовская, 1940 г.).
Этиология и эпидемиология Возбудитель клещевого риккетсиоза имеет сходство с другими риккетсиями, размножается в пораженных клетках. В очагах заболевания циркуляция возбудителя происходит между дикими млекопитающими и иксодовыми клещами — естественными и основными носителями данного возбудителя. Заражение человека клещевым сыпным тифом происходит в природных очагах через укус инфицированных клещей, в слюне которых содержатся риккетсии. Клещевой сыпной тиф — сезонное заболевание. Максимальная заболеваемость наблюдается весной и в начале лета, что обусловлено периодом наибольшей активности клещей. Осенью возможен второй подъем заболеваемости, определяемый второй генерацией (потомством) членистоногих. Единичные случаи заболевания встречаются преимущественно у работников сельского хозяйства. Ареал клещевого сыпного тифа простирается от Урала до берегов Тихого океана, включая Дальний Восток, Забайкалье, Сибирь, Алтайский край, Казахстан и Киргизию, а также восточную часть Монголии.
Патогенез и патанатомия На месте входных ворот инфекции возникает первичный аффект — воспалительная реакция кожных покровов с регионарным лимфаденитом. Возбудитель внедряется в эндотелий мелких сосудов, вызывая в них воспалительные изменения. При этом пролиферативные процессы преобладают над разрушающими с развитием эндопериваскулита, чем объясняется более легкое течение заболевания по сравнению с эпидемическим сыпным тифом. Риккетсиемия и токсинемия при клещевом риккетсиозе обусловливают симптомы интоксикации организма.
Клиническая картина Инкубационный период длится 4–7 дней. Заболевание начинается остро: появляется озноб, быстро повышается температура тела до 39–40 °C. Реже наблюдается предшествующий период в виде недомогания, головной и мышечных болей, потери аппетита. Нередко отмечаются краснота лица, шеи, слизистой оболочки зева, а также сыпь на слизистой оболочке полости рта. В конце периода инкубации на месте укуса клеща на открытых частях тела (волосистая часть головы, шея, плечевой пояс) возникает первичный аффект, который представляет собой уплотнение, слегка болезненное при прощупывании. В центре его располагается омертвевшая корочка темно-коричневого цвета, по периферии — красный ободок гиперемии. Воспалительное уплотнение достигает 1–2 см в диаметре. Лихорадка ремиттирующего, реже постоянного типа длится в среднем 8—10 дней (иногда 20) и заканчивается постепенно. В зависимости от выраженности явлений интоксикации различают легкую, средней тяжести и тяжелую формы клещевого риккетсиоза. Ведущими в клинической картине болезни являются симптомы поражения нервной системы. Они выражаются упорной, иногда мучительной головной болью, болью в мышцах и пояснице. В отличие от эпидемического сыпного тифа при клещевом сыпном тифе тифозный статус отсутствует. Изредка выявляются менингеальные симптомы. Отмечаются конъюнктивит и склерит, урежение частоты сердечных сокращений и гипотония. Постоянный симптом — сыпь, которая появляется на 2—5-й день болезни. У большинства больных она выступает вначале на туловище, а затем распространяется на конечности, где локализуется преимущественно на разгибательной поверхности и в окружности суставов. При обильном высыпанииэлементы сыпи могут быть на лице, ладонях, подошвах. Сыпь отличается многообразием и имеет преимущественно розеолезно-папулезный характер. Более тяжелое течение болезни сопровождается геморрагическими высыпаниями (кровоизлияниями). Спустя несколько дней сыпь постепенно угасает, сохраняясь дольше всего в области нижних конечностей и ягодиц у выздоравливающих; на месте отдельных элементов сыпи длительно сохраняется буроватая пигментация. В крови находят умеренное повышение уровня нейтрофильных лейкоцитов, снижение количества лимфоцитов, СОЭ увеличена. Заболевание доброкачественное, рецидивы не наблюдаются.
Диагностика и дифдиагностика Специфическая диагностика предполагает выделение чистой культуры возбудителя из крови больного с использованием морских свинок. Серологическая диагностика осуществляется при помощи РСК. В острый период на высоком уровне гемагглютининов положительные результаты дает РНГА. Дополнительным методом служит реакция Вейля-Феликса, положительная у 80 % больных. Проводится дифференциация клещевого риккетсиоза с эпидемическим сыпным тифом, болезнью Брилла, крысиным тифом и другими риккетсиозами из группы клещевой пятнистой лихорадки.
Лечение и профилактика Лечение успешно проводится антибиотиками тетрациклинового ряда в стационаре. Наряду с антибиотиками применяются симптоматические средства. Профилактикой является защита от нападения клещей.
ЛИХОРАДКА КЛЕЩЕВАЯ ЮЖНОАФРИКАНСКАЯ
Южноафриканская клещевая лихорадка — заболевание, передающееся через переносчика (клеща). Протекает в виде тифоподобной лихорадки с наличием первичного аффекта и часто мелкопятнистой узелковой сыпи.История заболевания впервые описана в Анголе в 1911 г. Возбудитель болезни выделен и описан Пинкертоном в 1942 г.
Этиология и эпидемиология Возбудитель южноафриканской клещевой лихорадки сходен с Dermacentroxenus conori, однако у выздоравливающих наблюдается гомологичный иммунитет при сохраненной восприимчивости к заражению Dermacentroxenus. Как и при других заболеваниях из группы клещевой пятнистой лихорадки, естественным носителем риккетсий являются иксодовые клещи определенных видов. Человек заражается в очагах риккетсиоза, подвергаясь нападению инфицированных клещей. Заболевание обычно встречается в виде единичных случаев в жаркое время года в Анголе, восточных районах Южной Африки от мыса Кей до Кении.
Патогенез и патанатомия Патогенез и патанатомия данного риккетсиоза сходны с таковыми при марсельской лихорадке (см.).
Клиническая картина Клинические проявления южноафриканской клещевой лихорадки варьируют в зависимости от тяжести болезни и имеют большое сходство с клиникой марсельской лихорадки. Инкубационный период длится около недели. При тяжелом и среднетяжелом течении заболевания начальный период развивается остро, с потрясающим ознобом, повышением температуры до 40 °C; отмечаются интенсивная головная боль, бессонница, возможны помрачение сознания, светобоязнь и менингеальный симптомокомплекс. Высокая лихорадка сохраняется в течение 10–12 дней. При осмотре больных в первые дни болезни можно обнаружить первичный аффект, соответствующий месту укуса клеща, в виде безболезненного красного инфильтрата размером 2–5 см, с центральным некрозом темного цвета и регионарным лимфаденитом. На 5—6-й день появляется характерная розеолезная сыпь, переходящая вскоре в макулезно-папулезную багрово-красную кожную сыпь. Элементы сыпи распространяются по всему телу, нередко поражая ладонные и подошвенные поверхности. При снижении температуры сыпь исчезает, оставляя пигментацию. Легкие формы заболевания характеризуются непродолжительной лихорадкой, слабовыраженными проявлениями интоксикации, наличием первичного аффекта, скудной узелковой сыпью на туловище и верхних конечностях. В ряде случаев сыпь отсутствует. Прогноз благоприятный при всех формах болезни.
Диагностика Клиническая диагностика болезни основывается на эпидемиологических данных и результатах клинического обследования больного. Дифференцировать южноафриканскую клещевую лихорадку с марсельской лихорадкой затруднительно ввиду большого сходства этих заболеваний. Существует предположение, что южноафриканская лихорадка является вариантом марсельской. Специфическая диагностика проводится с помощью заражения морских свинок и серологическими методами.
Лечение и профилактика Лечение и профилактика идентичны таковым при других клещевых риккетсиозах (см.).
ЛИХОРАДКА-КУ
ОпределениеЛихорадка-ку — острый природно-очаговый риккетсиоз, распространяющийся воздушно-пылевым и контактным путями, а также при поедании пищи, содержащей возбудитель. Характеризуется лихорадкой, симптомами общей интоксикации, часто наличием атипичной пневмонии и отсутствием специфической кожной сыпи.Ку-лихорадку как самостоятельную форму описал в 1937 г. в Австралии (Южный Квинсленд) Е. Деррик, наблюдавший в 1935 г. случаи заболевания среди фермеров и рабочих мясных фабрик. В эксперименте на животных, зараженных кровью и мочой больных ку-лихорадкой, Е. Деррик в 1937 г. выделил возбудителя болезни, риккетсиозную природу которого установили Барнет и М. Фриман. В 1939 г. Деррик назвал возбудителя ку-лихорадки риккетсию Бурнети от местных грызунов-бандикутов и их экзопаразитов — клещей гемафизалис гумероза от коров, что в значительной мере расширило представление об эпидемиологии данного заболевания. Одновременно и независимо от австралийских исследований в США в 1938 г. Р. Кох выделил аналогичные риккетсии от клещей дермацентор Андерсон и показал способность данного микроорганизма образовывать фильтрующиеся формы. Исследованиями Р. Диера (1938 г.), Ф. Барнета и М. Фримана (1939 г.) было установлено тождество австралийского и американского вариантов риккетсий, получивших родовое название Коксиелла Бурнети Филип, 1948 г. Дальнейшее изучение выявило широкое распространение данного заболевания на Американском континенте. В годы Второй мировой войны в балканских странах наблюдались эпидемические вспышки так называемого балканского гриппа, возбудитель которого позднее был отождествлен с риккетсиями. В 60-х гг. XX в. очаги ку-лихорадки выявлены в ряде районов России и СНГ.
Этиология Возбудитель ку-лихорадки — мелкий микроорганизм преимущественно кокковидной, палочковидной или нитевидной формы. Его особенностью является способность к образованию фильтрующихся форм. Как и другие риккетсии, он хорошо окрашивается различными красителями, но устойчив к жирорастворителям. В отличие от других риккетсий он не имеет общих антигенов с протеями, обладает фазовой изменчивостью. Возбудитель ку-лихорадки отличается от других риккетсий высокой устойчивостью во внешней среде. В сухих фекалиях инфицированных клещей он сохраняет жизнеспособность до полугода и больше, в сухих фекалиях и моче пораженных животных — до нескольких недель, в шерсти животных до 9—12 месяцев, в стерильном молоке — до 273 дней, в стерильной воде — до 160 дней, в масле (в условиях рефрижератора) — до 41 дня, в мясе — до 30 дней. Пастеризация молока оказывает непостоянный дезинфицирующий эффект, надежная стерилизация молока достигается кипячением в течение не менее 10 мин. Вирус устойчив к ультрафиолетовому облучению, к воздействию ряда распространенных химических дезинфицирующих средств: формалину, фенолу, хлорной извести и др. Благодаря своей устойчивости возбудитель ку-лихорадки может перемещаться на большие расстояния, что приводит к появлению заболеваний в любом районе, вне очагов инфекции.
Эпидемиология Лихорадка-ку — типичный природно-очаговый зоонозный риккетсиоз. Носителем инфекции в природе являются иксодовые, частично гамазовые и аргасовые клещи (более 40 видов), у которых наблюдается трансовариальная передача риккетсий, дикие птицы (47 видов) и дикие млекопитающие (более 60 видов). Заражение птиц и млекопитающих происходит при нападении инфицированных клещей или при вдыхании пыли или поедании пищи, загрязненной сухими фекалиями пораженных клещей. Существование стойких природных очагов инфекции способствует заражению различных видов домашних животных, в первую очередь крупного и мелкого рогатого скота, пораженность которого составляет от 0,7 до 34,2 %, а также лошадей, птиц и др., у которых инфекция протекает в доброкачественной или скрытой форме. Животные выделяют риккетсии во внешнюю среду с экскрементами, мокротой, молоком, околоплодными водами. Пораженные домашние животные могут играть роль самостоятельного носителя инфекции, формируя синантропные (рукотворные) очаги ку-лихорадки. Заражение человека обычно происходит в синантропных очагах различными путями: при употреблении в пищу инфицированного молока или молочных продуктов и зараженной воды; воздушно-пылевым — при вдыхании пыли, содержащей сухие фекалии и мочу пораженных животных или фекалии инфицированных клещей; контактным — через наружные слизистые оболочки или поврежденную кожу. Инфицирование человека через переносчика не имеет существенного эпидемиологического значения. Больной человек может выделять возбудитель с мокротой, но обычно источником инфекции не является. Вместе с тем описаны небольшие эпидемические вспышки ку-лихорадки среди контактных лиц. К ку-лихорадке восприимчивы лица различного возраста. Чаще заболевание наблюдается среди сельских жителей и рабочих животноводческих ферм и боен, среди лиц, занимающихся обработкой кожи, шерсти, пуха. Заболеваемость регистрируется в течение всего года, повышаясь в сельской местности в весеннее время (связана с окотом и отелом скота), в городской местности осенью (убой скота). У перенесших инфекцию развивается стойкий напряженный иммунитет. ку-лихорадка распространена повсеместно.
Патогенез и патанатомия Возбудители заболевания проникают в организм через слизистые оболочки пищеварительного тракта, дыхательных путей, глаз, наружные слизистые оболочки или поврежденную кожу. Воспалительной реакции в месте проникания не возникает. Затем риккетсии попадают в кровь и фиксируются на клетках ретикулоэндотелия, вызывая пролиферативные изменения. В результате гибели части риккетсий высвобождается эндотоксическая субстанция. Это обусловливает развитие специфической риккетсиозной интоксикации. Выявляются специфические дистрофические изменения в сердечно-сосудистой, дыхательной и нервной системах, в почках и других внутренних органах. В легких часто отмечаются гиперемия, отек и экссудация (пропотевание жидкости) в альвеолах и бронхах, преимущественно в прикорневой зоне или нижних долях. В головном мозге определяются точечные кровоизлияния, периваскулит, поражение мозговых оболочек. В ряде случаев процесс может принимать рецидивирующий характер.
Клиническая картина Клинические проявления ку-лихорадки как в отношении тяжести течения болезни, так и ведущих клинических синдромов могут существенно различаться. Инкубационный период при ку-лихорадке длится в среднем 19–20 дней с колебаниями от 8 до 30 дней. Заболевание обычно начинается внезапно — с озноба и быстрого повышения температуры до 39–40 °C. Отмечаются разбитость, слабость, повышенная потливость, сильная головная боль, мышечные и суставные боли. У ряда больных наблюдаются сухой болезненный кашель, понижение аппетита, изредка рвота, нарушается сон. Средняя продолжительность лихорадочного периода составляет от 7 до 9 дней с колебаниями от 3 до 14, редко более. Снижение температуры происходит постепенно или по типу ускоренного лизиса. У некоторых больных температура после снижения держится на повышенных цифрах и может вновь повышаться, принимая волнообразный характер. Повышение температуры в таких случаях сопровождается усилением других симптомов болезни. С первых дней заболевания выявляются покраснение лица, инъекция склер, покраснение зева, иногда сыпь на мягком небе. Сыпь бывает редко (1–4 % случаев), она возникает на 6—8-й день болезни, не имеет постоянной локализации, носит обычно розеолезный характер. Непостоянно отмечаются урежение частоты сердечных сокращений, умеренная гипотония (снижение давления), приглушение сердечных тонов, иногда систолический шум на верхушке. У 5—15 % больных наблюдаются признаки поражения системы органов дыхания — бронхит, трахеит, пневмония, развивающиеся чаще при заражении через воздух. В этих случаях больные жалуются на боли в грудной клетке при кашле и дыхании, чувство стеснения за грудиной; у них отмечается кашель, сухой или со скудной мокротой и небольшой примесью крови. Прослушивание выявляет скудные данные в виде сухих, реже единичных влажных мелкопузырчатых хрипов. Как правило, пневмония у больных распознается лишь рентгенологически: определяются отдельные мелкие фокусы инфильтрации. Нередко выявляется уплотнение и расширение корней легких. Оно свидетельствует о том, что в патологический процесс вовлечен лимфатический аппарат легких. Очень редко определяется плевропневмония. Часть больных жалуются на непостоянные боли в животе без четкой локализации. Иногда боли носят острый характер и могут симулировать острый аппендицит. Подобные боли обусловлены спазмом кишечной мускулатуры вследствие поражения вегетативного отдела нервной системы. Нередко выявляется увеличение печени и селезенки, бывает задержка стула. У значительного числа больных ку-лихорадкой наблюдаются разнообразные признаки поражения нервной системы: головные и мышечные боли, боли при движении глазных яблок. Часто нарушается сон, у одних больных развивается угнетение, подавленность, развитие астении, у других — возбуждение, бред, галлюцинации. Возможно развитие серозного менингита, иногда менингоэнцефалита. Гемограмма характеризуется снижением количества лейкоцитов, нейтро- и эозинопенией, относительными лимфоцитозом и моноцитозом, умеренным увеличением СОЭ. В урограмме отмечаются появление белка, крови, цилиндров.
Острая форма Протекает в течение 2–3 недель с волнообразной ремиттирующей температурой, умеренно выраженными признаками интоксикации и органными расстройствами. Тяжелое течение и осложнения наблюдаются редко. У отдельных больных в период выздоровления могут возникать рецидивы.
Подострая и хроническая формы Подострая форма характеризуется волнообразным, чаще незначительным повышением температуры тела в течение 1–3 месяцев; протекает в легкой или среднетяжелой форме. Хроническая форма отличается вялотекущим течением на протяжении от нескольких месяцев до года и более, с частыми рецидивами и поражениями легких, миокарда и других органов.
Осложнения Могут наблюдаться осложнения со стороны сердечно-сосудистой системы в виде коллапса, миокардита, эндокардита, тромбофлебита глубоких вен конечностей; со стороны органов дыхания — плевриты, инфаркты легких, развитие абсцессов при повторном, наслаивающемся инфицировании, иногда наблюдается риккетсиозный гепатит. Бывают также панкреатиты, орхиты, эпидидимиты. У некоторых больных развиваются невриты, невралгии. Возможны рецидивы болезни, иногда через несколько месяцев и даже лет после первого заболевания. У выздоравливающих наблюдаются длительная астенизация и медленное восстановление работоспособности. Прогноз для жизни при ку-лихорадке благоприятный, летальные исходы редки.
Диагностика и дифдиагностика Диагноз основывается на комплексе клинико-эпидемиологических, эпизоотологических, лабораторных и инструментальных данных. Клиническое распознавание заболевания затруднено ввиду выраженного многообразия проявлений болезни, симулирующих многие инфекционные и неинфекционные формы. Поэтому в выявлении больных существенное значение имеют результаты лабораторных методов исследования. Специфическая лабораторная диагностика основана на выделении культуры возбудителя из крови, мокроты, спинномозговой жидкости, грудного молока или мочи больных, а также выявлении специфических антител. Для выделения чистой культуры используют биологическую пробу на морских свинках, белых мышах и хлопковых крысах, у которых через 7 дней после заражения обнаруживают скопления возбудителей в печени, селезенке и других органах. Для получения чистой культуры возбудителя применяют различные тканевые среды. Удобна и технически проста серологическая диагностика с помощью РСК и РА и со специфически растворимым антигеном. Положительное количество серологических реакций выявляется обычно с 10—12-го дня болезни, достигая максимальных значений на 3—4-й неделе. Надежным методом диагностики служит РФА. Большое распространение получила аллергологическая диагностика ку-лихорадки при помощи внутрикожной пробы с очищенным аллергеном возбудителя, используемая для непосредственной и ретроспективной (после перенесения) диагностики заболевания. Для оценки пораженности животных в природных или синантропных очагах риккетсиоза применяется иммунофлюоресцентный метод. Дифференциальная диагностика данного риккетсиоза проводится с гриппом, сыпным и брюшным тифами, бруцеллезом, орнитозом, лептоспирозом, туляремией, пневмониями различного происхождения и другими лихорадочными заболеваниями.
Лечение и профилактика Включает использование комплекса лечебных средств, дающих этиотропный и патогенетический эффект. С целью этиотропной терапии назначают антибиотики тетрациклинового ряда по 1,6–2,0 г в сутки в течение 7—10 дней или в комбинации с левомицетином (0,9 г в сутки тетрациклина + 1,5 г в сутки левомицетина на тот же срок). Тяжелые формы болезни требуют парентерального введения антибиотиков, назначения кортикостероидов, антигистаминных препаратов, проведения дезинтоксикационной и симптоматической терапии. Применяется комплекс ветеринарных, противоэпидемических и санитарно-гигиенических мероприятий. В районах, очаговых по ку-риккетсиозу, проводится тщательный ветеринарный надзор за скотом с целью своевременного выявления больных животных, осуществляются мероприятия по истреблению клещей у сельскохозяйственных животных. Лица, работающие с пораженными животными, а также занимающиеся обработкой инфицированного мяса и шкур, должны соблюдать правила личной профилактики, пользоваться защитной одеждой, респираторами, очками. Необходима тщательная термическая обработка мяса и молока. Специфическая профилактика Ку-риккетсиоза осуществляется с помощью как убитой, так и живой вакцины из Р. Бурнети. Предпочтение отдается живой вакцине из штамма М44, разработанной в лаборатории, руководимой П. Ф. Здродовским. Вакцина используется перорально в виде драже, накожно или подкожно; повторная вакцинация проводится через 2 года. У лиц, работающих с животными в зонах, очаговых по бруцеллезу и ку-риккетсиозу, используется ассоциированная вакцина против бруцеллеза и ку-лихорадки.
ЛИХОРАДКА МАРСЕЛЬСКАЯ
ОпределениеМарсельская лихорадка (синонимы: средиземноморская клещевая лихорадка, прыщевая лихорадка, болезнь Кардуччи-Ольмера, летний тиф) — острый трансмиссивный зоонозный риккетсиоз (передающийся от животных). Характеризуется доброкачественным течением, умеренно выраженным распространенным васкулитом, проявляется острым лихорадочным состоянием, наличием первичного аффекта и пятнисто-узелковой распространенной кожной сыпью.Заболевание впервые описали Конор, Брук в Тунисе в 1910 г. под названием «прыщевая лихорадка». Аналогичную клинику при изучении так называемой собачьей болезни описали Д. Олмер и Дж. Олмер в Марселе в 1928 г., после чего в литературе закрепился термин «марсельская лихорадка». В 1930 г. П. Дюранд, Е. Консейл в Тунисе доказали роль собачьего клеща в передаче инфекции, а Дж. Каминопетрос (1932 г.) установили трансовариальную передачу возбудителя у клещей. Возбудителя марсельской лихорадки выделил Дж. Каминопетрос (1932 г.) и подробно описал Е. Брумпт (1932 г.).
Этиология и эпидемиология Возбудитель марсельской лихорадки обладает всеми свойствами, присущими риккетсиям подрода дермацентоксенус. Размножается внутри пораженных клеток. Отмечена иммунологическая близость риккетсий с возбудителями пятнистой лихорадки Скалистых гор и североавстралийского клещевого тифа. Описаны географические штаммы риккетсий, вызывающие сходные с марсельской лихорадкой заболевания. Марсельская лихорадка — трансмиссивная зоонозная инфекция (передающаяся от животных). Естественным носителем и переносчиком возбудителя является собачий клещ. Продолжительность жизни этого вида иксодид достигает 5 лет. Возбудитель может передаваться всеми инфицированными подвижными фазами метаморфозами клещей. Имеет место трансовариальная передача риккетсий. Собачий клещ может паразитировать также на лошадях, буйволах, кошках, зайцах, ежах, на крупном рогатом скоте, поросятах, крысах. Наличие стойкого носителя инфекции среди млекопитающих достоверно не установлено. Человек является случайным звеном в цепи циркуляции Dermacentroxenus. Он заражается марсельской лихорадкой, подвергаясь нападению и укусу клеща, при раздавливании сытых клещей на коже, реже — при занесении инфицированных тканей переносчиков на слизистые оболочки. Восприимчивость людей к данному возбудителю относительно невысока во всех возрастных группах. Заболеваемость носит случайный характер, эпидемиологических вспышек не бывает. Передача инфекции в тропиках осуществляется в течение всего года, в районах с умеренным климатом наблюдается летний пик заболеваемости, связанный с максимальной активностью переносчиков. Марсельская лихорадка распространена преимущественно в странах с теплым и жарким климатом. Регистрируется в бассейне Средиземного моря (Португалия, Испания, юг Франции, Италия, Марокко, Тунис, Алжир, Триполи, Арабская Республика Египет), на территории России в прибрежных районах Каспийского и Черного морей, в Африке и Индии.
Патогенез и патанатомия Риккетсии, проникшие в организм человека через кожу или слизистые оболочки, размножаются в ретикулоэндотелиальных клетках и после их разрушения выходят в кровь, обусловливая специфическую эндотоксинемию. В месте внедрения риккетсий развивается характерное воспалительное образование с последующим омертвением и изъязвлением — первичный аффект («черное пятно»). Эндотоксины риккетсий вызывают функциональные и клеточные изменения в нервной, сердечно-сосудистой, эндокринной и других системах. В сосудах наблюдаются разрастание эндотелия и распространенная инфильтрация лимфоцитами, моноцитами, реже полинуклеарами, в дальнейшем — эндопериваскулиты. Поражения сосудов кожи проявляются в виде характерной сыпи.
Клиническая картина Марсельская лихорадка — доброкачественное заболевание. Инкубационный период продолжается от 3 до 7 (иногда до 18) дней. Начало заболевания острое: появляется кратковременный озноб, быстро повышается температура до 39–40 °C, отмечаются головная боль, общая слабость, бессонница, боли в мышцах и поясничной области. В редких случаях возможны кратковременное расстройство сознания, менингеальный симптомокомплекс. Общетоксические проявления наблюдаются в течение всего лихорадочного периода, продолжительность которого колеблется от 10–14 до 22 дней. Лихорадка обычно ремиттирующего характера. При осмотре больных в первые дни болезни отмечаются краснота лица и инъекция склер; у большинства из них выявляется первичный аффект в месте внедрения риккетсий. Первичный аффект располагается в месте укуса клеща на коже закрытых участков тела, особенно на нижних конечностях, и представляет собой небольшую язвочку диаметром 2–5 мм на гиперемированном (покрасневшем) инфильтрированном основании, с темным струпом в центре. Иногда могут выявляться 2–3 первичных аффекта. Струп сохраняется в течение всего лихорадочного периода и отпадает на 4—5-й день апирексии (отсутствия лихорадочного состояния) с образованием нежного, иногда пигментированного рубчика. В случаях внедрения риккетсий через слизистые оболочки глаза развивается конъюнктивит или кератоконъюнктивит, сопровождающийся хемозом. Регионарные лимфоузлы несколько увеличены, болезненны. Обратное развитие лимфаденита происходит к началу выздоровления. Со 2—3-го дня заболевания на коже лица, туловища и конечностей, включая ладонные и подошвенные поверхности, появляется обильная крупная розеолезная или пятнистоузелковая сыпь, которая через 2–3 дня превращается в папулезно-петехиальную экзантему с размерами папул от 5 до 10 мм. Сыпь сохраняется до конца лихорадочного периода и постепенно исчезает в периоде апирексии, остается пигментация в течение 2–3 недель (реже месяцев). Нарушения функции сердечно-сосудистой системы обычно умеренные и выявляются в виде замедленного сердцебиения. В некоторых случаях отмечаются дрожание языка, конечностей, бред и менингизм. Увеличение селезенки наблюдается непостоянно, редко бывает увеличена печень. В крови чаще снижен уровень лейкоцитов с относительным повышением уровня лимфоцитов. СОЭ увеличена. Осложнений, как правило, марсельская лихорадка не дает и заканчивается выздоровлением.
Диагностика и дифдиагностика Диагноз устанавливается на основании эпидемиологических, клинических и лабораторных данных. Важное значение имеет обнаружение первичного аффекта, регионарного лимфаденита, распространенной макуло-папулезной экзантемы. Эта триада отличает марсельскую лихорадку от других заболеваний, протекающих с кожной сыпью. Специфическая диагностика заключается в выделении культуры риккетсий при внутрибрюшинном заражении морских свинок и серологических исследованиях. Дифференцировать марсельскую лихорадку необходимо с другими риккетсиозами, тифо- и паратифозными заболеваниями, геморрагическими лихорадками, медикаментозными дерматитами.
Лечение Основой лечения является применение антибактериальных препаратов с противориккетсиозной активностью. К ним относятся тетрациклины, макролиды, рифампицин, фторхинолон, левомицетин. Тетрациклин назначают по 0,3 г 4 раза в день, доксициклин — 0,2 г на первый прием, далее — по 0,1 г два раза в сутки. Эритромицин, сумамед, рулид используют при лечении беременных и детей по обычным схемам. Рифампицин назначают по 0,3 г в сутки, фторхинолон — в средних терапевтических дозах дважды в сутки, левомицетин — по 0,5 г 4 раза в день. Антибиотики принимают до 2—3-го дня нормальной температуры. В случаях геморрагических проявлений показаны препараты кальция, викасол. В более тяжелых случаях назначают кортикостероиды, при необходимости — анальгетики, антипиретики, седативные препараты.
Профилактика Противоэпидемические мероприятия в очагах марсельской лихорадки сводятся в основном к уничтожению клещей с помощью акарицидных средств. Большое значение имеет ветеринарный надзор за собаками, осмотр их не менее 2 раз в год и уничтожение бродячих животных. Личная профилактика заключается в использовании репеллентов.
ЛИХОРАДКА ПЯТНИСТАЯ СКАЛИСТЫХ ГОР
ОпределениеПятнистая лихорадка Скалистых гор (синонимы: горная лихорадка, клещевой риккетсиоз Америки, тифо-малярийная лихорадка) — острое риккетсиозное природно-очаговое заболевание, характеризующееся ремиттирующей лихорадкой, поражением нервной и сосудистой систем, распространенной макуло-папулезной и геморрагической сыпью.Пятнистая лихорадка Скалистых гор давно известна в США. В 1899 г. Е. Макси впервые описал ее как острую очаговую лихорадочную болезнь с петехиальной или пурпурной экзантемой и выделил ее из группы других заболеваний. В 1906 г. Х. Риккетс доказал, что возбудитель этого заболевания передается через укус иксодовых клещей, в 1909 г. он же обнаружил возбудителя в крови больных людей и обезьян, а также в клещах. С. Вонебах (1919 г.) всесторонне изучил выделенного возбудителя, установив его способность к внутриядерному паразитированию. В 1925–1941 гг. была разработана вакцину против этого заболевания.
Этиология и эпидемиология Возбудитель лихорадки Скалистых гор относится к подроду Dermacentroxenus, роду Rickettsiae, семейству Rickettsiaceae. По своим свойствам он близок к другим видам риккетсий, отличаясь от них способностью размножаться внутри клеток и особенностями антигенной структуры. При нагревании выше 50 °C и воздействии дезинфицирующих препаратов погибает через несколько минут. Пятнистая лихорадка Скалистых гор относится к клещевым зоонозным риккетсиозам с природной очаговостью, носителями риккетсий в природе служат 14 видов иксодовых клещей. Кроме клещей носителями возбудителя являются грызуны (полевки, дикие кролики, земляные белки, зайцы) и некоторые домашние животные (собаки, овцы, крупный рогатый скот и др.). Риккетсии обнаруживаются у всех подвижных фаз развития клещей. Они содержатся и в яйцах, отложенных инфицированной самкой, что свидетельствует о наличии трансовариальной передачи D. rickettsi, известной в пределах нескольких поколений клещей. Заражение людей пятнистой лихорадкой Скалистых гор происходит в результате нападения и присасывания инфицированных клещей (через укус), реже — при раздавливании сытых самок клещей и втирании их тканей в кожу при расчесах. Наибольшая заболеваемость регистрируется среди сельского населения, а также у профессиональных групп, связанных с лесом (охотники, геологи, лесники). В тропических странах передача инфекции круглогодичная, с небольшим снижением в период дождей. В странах с более умеренным климатом наблюдается весенне-летняя сезонность, совпадающая с периодом максимальной активности клещей. Заболеваемость носит случайный характер. У переболевших развивается напряженный иммунитет. Природные очаги пятнистой лихорадки Скалистых гор известны только на Американском континенте (США, Канада, Мексика, Панама, Бразилия, Колумбия).
Патогенез и патанатомия Из места инокуляции риккетсии поступают в кровь, фиксируются в эндотелии сосудов и размножаются. Затем наступают риккетсиемия и специфическая токсемия. Основой механизма развития и патоморфоза инфекции является поражение сосудов в виде панартериита (распространенного артериита) различной степени тяжести, в тяжелых случаях — с некрозами не только эндотелия, но и мышечных волокон мезотелия. С повреждением сосудов связано возникновение микроинфарктов в мозге, специфического гломерулонефрита, сыпи и т. д. Характерной реакцией на инфекцию является разрастание ретикулоэндотелиальных элементов в легких, селезенке, печени и лимфатических узлах.
Клиническая картина Течение пятнистой лихорадки Скалистых гор весьма вариабельно: наблюдаются стертые, легкие, среднетяжелые, тяжелые и молниеносные формы болезни. Чаще всего инфекция протекает в среднетяжелой и тяжелой форме. Инкубационный период продолжается от 2 до 14 дней, в среднем — 6–7 дней. Заболевание, как правило, начинается остро: отмечаются озноб, быстрый подъем температуры до 38–41 °C и выше, интенсивная головная боль, а также боли в суставах и мышцах. В тяжелых случаях наблюдаются рвота, носовые кровотечения, прострация. Иногда заболевание проявляет себя непродолжительными явлениями в виде недомогания, разбитости, познабливания, умеренной головной боли. Лихорадка обычно ремиттирующего характера с утренними ремиссиями, продолжается 2–3 недели, разрешается литическим (в течение 3–4 дней) снижением температуры. При осмотре больных в начальном периоде можно обнаружить геморрагическую сыпь на слизистой оболочке рта, в том числе на мягком небе. Отмечаются урежение частоты сердечных сокращений, гипотония и приглушение тонов сердца. На 2—5-й день болезни появляется пятнистая сыпь, которая вскоре сменяется типичной розовато-красной макуло-папулезной экзантемой. Элементы сыпи обнаруживаются на локтях и запястьях, быстро распространяются на руки и ноги, включая ладонные и подошвенные поверхности, на кожу груди, спины и волосистой части головы. В последнюю очередь и менее интенсивно развивается сыпь на лице и животе. С каждым днем высыпания становятся более отчетливыми. Элементы сыпи могут сливаться и к 8—11-му дню болезни приобретают геморрагический характер. В тяжелых случаях болезни сыпь становится сливной, темно-красного или пурпурного цвета, часто развиваются некрозы в области половых органов, на кончиках пальцев, ушных раковинах; возможны некрозы мягкого неба. Сыпь угасает после снижения температуры, оставляя в течение нескольких недель шелушение и пигментацию. Появление и развитие кожной сыпи сопровождается выраженными симптомами интоксикации. Отмечаются сильная, упорная головная боль, повышенная кожная чувствительность, беспокойство, бессонница, нарушение сознания, бред, судороги. Выявляются патологические и повышенные нормальные рефлексы. В тяжелых случаях наблюдаются параличи черепных нервов, пара- и гемиплегии, парезы. Неврологические расстройства подвергаются медленному обратному развитию, сохраняясь в течение нескольких недель или месяцев. В разгар болезни отмечаются урежение частоты сердечных сокращений, значительная гипотония вплоть до коллапса. Появление в этот период учащения сердцебиения прогностически неблагоприятно. Аппетит у больных отсутствует. Наблюдается задержка стула. Селезенка, а иногда и печень увеличены, часто развивается желтуха. У всех больных выявляется наличие белка в моче. Изменения формулы крови не характерны. Возможно увеличение СОЭ. Описаны молниеносные формы болезни с развитием коматозного состояния и летальным исходом в течение первых дней болезни. Период реконвалесценции характеризуется постепенным улучшением состояния больного, но медленным восстановлением нарушенных функций даже при легких формах болезни. В ряде случаев заболевание отягощается различными осложнениями. Наиболее частыми из них являются ириты, тромбофлебиты, пневмонии, кровотечения, парезы и параличи, поражение черепных нервов. Прогноз серьезный, в тяжелых случаях может быть плохим. В отдельных очагах в некоторые годы смертность достигала 80 %, обычно же она не превышает 10–20 %.
Диагностика Распознавание заболевания осуществляется на основании эпидемиологических, клинических и лабораторных данных: пребывание в очаговом районе, острое начало и обычно тяжелое течение болезни с быстрым развитием ремиттирующей лихорадки, сыпью на слизистой оболочке полости рта и этапно распространяющейся узелковой и геморрагической кожной сыпью, выраженными признаками поражения центральной нервной системы. Диагноз подтверждается с помощью бактериологических и серологических методов. При бактериологическом исследовании кровью больных заражают внутрибрюшинно самцов морских свинок, у которых развивается типичная скротальная реакция с обнаружением в воспалительной жидкости D. rickettsi. Серологическое обследование проводят с помощью РСК с антигеном из D. rickettsi. Комплементсвязывающие антитела в диагностическом титре обнаруживаются со 2-й недели заболевания и сохраняются в крови больных до 7 лет. Эта реакция высокоспецифична, позволяет проводить дифференциальную диагностику с другими риккетсиозами и пригодна для ретроспективной диагностики. Выявлять острые случаи болезни можно с помощью РПГА. Дифференциальная диагностика пятнистой лихорадки Скалистых гор проводится с эпидемическим и крысиным сыпным тифом, с южноамериканскими геморрагическими лихорадками.
Лечение и профилактика Больные пятнистой лихорадкой Скалистых гор подвергаются комплексной терапии. Лечение, как и при прочих риккетсиозах, заключается во внутривенном и пероральном назначении тетрациклиновых производных или левомицетина в течение всего лихорадочного периода и 2 дней апирексии. Средства, направленные на прекращение развития заболевания и клинических проявлений, аналогичны таковым при сыпном тифе. Большое значение имеют уход за больными и профилактика вторичной инфекции. Противоэпидемические мероприятия в очагах пятнистой лихорадки Скалистых гор заключаются в проведении дератизации, использовании акарицидных препаратов, защите людей от нападения клещей. По эпидемиологическим показаниям проводят активную иммунизацию живой клещевой или желточной вакциной, а также живой химиовакциной.
ЛИХОРАДКА ЦУЦУГАМУШИ
ОпределениеЛихорадка цуцугамуши (синонимы: японская речная лихорадка, кустарниковый тиф, сыпной тиф джунглей, клещевая лихорадка Суматры, индийская клещевая лихорадка, тиф малайских деревень, Кедани) — очаговый для Юго-Восточной Азии острый антропозоонозный риккетсиоз, протекающий с множественными васкулитами, периваскулитами и проявляющийся высокой лихорадкой, выраженным поражением нервной, сердечно-сосудистой систем, наличием первичного аффекта и пятнисто-узелковой кожной сыпи.Заболевание издавна известно в странах Азии. В Китае оно описано в III в. до н. э. под названием «Shu-shu», что означает «укус мелких красных насекомых». В Японии еще в древности заболевание называлось Цуцугамуши кедани, агамуши, что отражало связь заболевания с укусами мелких клещей. Первое научное описание болезни принадлежит Хашимото (1810 г.), использовавшему народное название цуцугамуши, которое и закрепилось в литературе. В начале XX в. в эксперименте была установлена передача возбудителя через укус краснотелковых клещей. В 1928–1931 гг. был подробно описан возбудитель инфекций. В период Второй мировой войны лихорадка цуцугамуши получила широкое распространение в американских и английских войсках, дислоцированных в Юго-Восточной Азии и восточной части Тихого океана, что послужило поводом для углубленных исследований этой инфекционной формы. Тогда дополнительно были изучены различные виды краснотелковых клещей-переносчиков и описаны географические виды возбудителя. В 1945–1946 гг. была создана профилактическая вакцина для иммунизации населения районов, очаговых по лихорадке цуцугамуши.
Этиология и эпидемиология Возбудитель лихорадки цуцугамуши Rickettsia orietalis обладает сходными с другими риккетсиями свойствами. Антигенные свойства возбудителя позволяют дифференцировать их с другими риккетсиями. Данный возбудитель обладает сходным с протеями К антигеном, что используется для серологической диагностики заболевания. R. orietalis представлены многочисленными географическими видами, различными по степени болезнетворности, отличающимися антигенной структурой, что затрудняет проведение активной профилактики болезни. Лихорадка цуцугамуши — природно-очаговое заболевание. Носителями риккетсий в природе являются грызуны (крысы, полевки, землеройки, зайцы, бандикоты), переносящие обычно скрытую форму инфекции, а также их внешние паразиты — краснотелковые клещи, у которых наблюдается трансфазовая и трансовариальная передача риккетсий. Переносчиками риккетсий служат только личинки клещей, зараженные трансовариально, питающиеся кровью грызунов. Половозрелые краснотелковые клещи и нимфы ведут свободный образ жизни и не являются кровососами. Человек заражается в природных очагах вследствие нападения инфицированных личинок краснотелковых клещей, биотопом которых являются долины рек. Сезонность болезни различна в разных климатических зонах, но всегда совпадает с максимумом численности личинок переносчика. Болеют преимущественно лица, занятые на полевых и сельскохозяйственных работах. В очаговых по лихорадке цуцугамуши районах возможны единичные случаи заболевания и вспышки среди неиммунных контингентов. Самые крупные вспышки описаны во время войн в Юго-Восточной Азии. Восприимчивость к инфекции высокая во всех возрастных группах. Лихорадка цуцугамуши регистрируется в большинстве стран Юго-Восточной Азии и на островах Тихого океана, в Японии, Китае, Бирме, Вьетнаме, Тайване, Лаосе, Новой Гвинее, Северной Австралии, Шри-Ланке, Малайзии, Пакистане, Корее, Таджикистане, а также в России — в Приморье и на Курильских островах.
Патогенез и патанатомия Основой механизма развития заболевания является специфическая риккетсиозная интоксикация и поражение сосудистой сети в виде множественных очаговых васкулитов и периваскулитов мелких сосудов, инфильтрация их лимфоцитами и моноцитами, плазматическими клетками. Эти поражения сходны с таковыми при сыпном тифе, но менее выражены. В месте внедрения возбудителя развивается первичный аффект. Сосудистые поражения вызывают в различных органах дегенеративные изменения, особенно выраженные в миокарде, легких, головном мозге, печени, селезенке и почках. При патоморфологическом исследовании выявляют очаговый или распространенный миокардит, интерстициальную пневмонию, острый очаговый менингоэнцефалит, спленит, некрозы в печени, а также гломерулонефрит, часто обнаруживается воспалительная жидкость в серозных полостях. Сосудистые расстройства лежат в основе развития специфической кожной сыпи и геморрагического синдрома.
Клиническая картина Инкубационный период лихорадки цуцугамуши продолжается от 7 до 20 дней (в среднем 10–12 дней). Продромальные явления в виде слабости, недомогания, снижения аппетита наблюдаются редко. Чаще заболевание начинается остро — появляются озноб, интенсивная головная боль, мышечные боли, часто бессонница. Температура тела быстро повышается и к 3—4-му дню болезни достигает 39–40 °C и сохраняется на этом уровне с небольшими утренними ремиссиями в течение 14–16 дней (иногда до 3 недель и более). Как правило, лихорадочный период заканчивается ускоренным лизисом. В период апирексии (отсутствия лихорадочного состояния) возможны повторные лихорадочные волны. При осмотре больного впервые дни болезни наблюдаются гиперемия и одутловатость лица, инъекция сосудов склер, брадикардия. С первого дня болезни обычно выявляется первичный аффект, расположенный, как правило, в складках кожи или на участках, где плотно прилегает одежда (подмышечная область, талия, бедра, затылок). Первичный аффект вначале имеет вид уплотненного красного пятна диаметром до 0,3–2 см, на месте которого вскоре развивается пузырек. Через несколько дней он вскрывается и покрывается черной корочкой — струпом. Одновременно развивается регионарный лимфаденит. На 5—8-й день болезни на коже груди, живота, а затем и на конечностях (кроме ладонных и подошвенных поверхностей) появляется макулезная сыпь. Вскоре сыпь становится макуло-папулезной и через несколько дней исчезает в большинстве случаев без следа, но может наблюдаться незначительная пигментация. Период высыпания обычно сопровождается выраженными признаками интоксикации: сильной головной болью, стойкой бессонницей, возбуждением. В тяжелых случаях возможно развитие ступора, бреда, гиперкинезов. У части больных появляется менингеальный симптомокомплекс. Нарушения сердечно-сосудистой деятельности в этот период характеризуются гипотонией, учащением частоты сердечных сокращений, расширением границ сердца и приглушением сердечных тонов. В тяжелых случаях развиваются симптомы панкардита. Довольно постоянны бронхиты и атипичная специфическая пневмония. Печень обычно не увеличена, увеличение селезенки диагностируется чаще. У некоторых больных выявляются клинико-лабораторные признаки гломерулонефрита. Изменения гемограммы неспецифичны. Лихорадка цуцугамуши часто протекает тяжело, но встречаются средней тяжести, легкие и даже стертые формы. Наиболее тяжелое течение заболевания отмечается в Японии, а также среди приезжих в очаговые районы (например, среди военнослужащих). В период выздоровления могут развиваться различные осложнения: миокардит, менингоэнцефалит, гломерулонефрит, сердечно-сосудистая недостаточность и др. Длительность заболевания нередко превышает 4–6 недель. Прогноз при отсутствии терапии неблагоприятный. Смертность до внедрения антибиотикотерапии в различных районах Азии колебалась от 0,8 % (Пескадорские острова) до 60 % (Япония, остров Тайвань).
Диагностика и дифдиагностика В очаговых районах клиническая диагностика особых затруднений не представляет. Специфическая лабораторная диагностика заключается в выделении из крови больного возбудителя заболевания и обнаружении антител к нему. Изоляция возбудителя осуществляется в лихорадочном периоде путем введения крови больного внутрибрюшинно белым мышам с последующим микроскопированием мазков-отпечатков на внутренних органах погибшего животного. Используется также люминесцентный метод идентификации риккетсий. Серологические исследования заключаются в постановке реакции агглютинации с Proteus Ox со второй недели заболевания. Реакция становится высокоспецифичной для лихорадки цуцугамуши. Специфическая серодиагностика затруднена ввиду антигенного разнообразия штаммов возбудителя. Дифференциальный диагноз проводится с другими риккетсиозами, лихорадкой Денге, лекарственной и инфекционной эритемами.
Лечение Больным лихорадкой цуцугамуши назначают комплексное лечение с включением препаратов тетрациклинового ряда и левомицетина (хлорамфеникола).
Профилактика Профилактические мероприятия включают борьбу с клещами при помощи акарицидов путем обработки местности в эндемических районах. Индивидуальная защита достигается применением специальной одежды и использованием репеллентов. Для активной специфической профилактики цуцугамуши внутрикожно вводят живую ослабленную вакцину; через 7–8 дней назначают тетрациклин по 3 г в сутки 3–4 раза с интервалом в 3 дня. Разработана антибиовакцина, значительно упрощающая активную профилактику лихорадки цуцугамуши.
ЛИШАЙ
ОпределениеЛишай (синоним: лихен) — термин, объединяющий те хронические заболевания кожи, которые характеризуются высыпанием узелков, не трансформирующихся в какие-либо другие морфологические элементы.Этот термин применялся и в более широком смысле — для обозначения самых различных заболеваний.
Чешуйчатый лишай (псориаз)
В настоящее время к лишаям относятся: лишай красный плоский, лишай блестящий, лишай линейный (полосовидный), лишай тропический, лишай амилоидный (см. Амилоидоз), лишай микседематозный (см. Микседема), лишай скрофулезный (см. Туберкулез), лишай волосяной (см. Кератозы), лишай простой хронический Видаля (см. Нейродермит), лишай белый склеротический, атрофический (см. Склеродермия), лишай шиповидный Крокера-Адамсона (см. Кератозы), лишай опоясывающий, лишай отрубевидный, лишай розовый Жибера, лишай стригущий, лишай чешуйчатый (см. Псориаз), лишай асбестовидный.
ЛИШАЙ АСБЕСТОВИДНЫЙ
ОпределениеЛишай асбестовидный — заболевание кожи и волос головы, характеризующееся своеобразным ограниченным шелушением. Алибер (1806 г.), описавший болезнь, назвал ее лишаем ввиду внешнего сходства со стригущим лишаем (см.) кожи волосистой части головы.
Этиология, патогенез и патанатомия Причины возникновения и развития не известны. Одни авторы считают асбестовидный лишай тяжелой формой себорейной экземы, другие — атипическим или начальным проявлением псориаза, некоторые — проявлением стрептококковой инфекции. Многие авторы рассматривают асбестовидный лишай как особую форму реакции кожи головы на инфекцию, травму и другие патогенетические факторы. Гистологически асбестовидный лишай характеризуется гиперкератозом, скоплением роговых масс вокруг фолликулярных воронок волос.
Клиническая картина Асбестовидный лишай наблюдается преимущественно у детей и молодых людей. На одном, реже нескольких участках кожи волосистой части головы, преимущественно в теменной области, — очаги шелушения неправильных очертаний разной величины в виде серебристо-белых или сероватых сухих плотных чешуек, напоминающих волокна асбеста. Чешуйки плотно прилегают к коже и как бы окутывают волос или пучок волос белым чехлом. Кожа над ним слабо гиперемирована. Течение хроническое, рецидивирующее. В запущенных случаях волосы редеют, атрофии не наблюдается.
Дифдиагностика Дифференцировать следует с микроспорией (см.), фавусом (см.), с себорейной экземой (см.) и псориазом (см.) волосистой части головы.
Лечение и профилактика Лечение — 3–5 %-ная салицилово-дегтярная, 2 %-ная серносалициловая мази, внутрь поливитамины, аевит, В6, В12. Прогноз — благоприятный. Профилактика: соблюдение гигиены кожи волосистой части головы.
ЛИШАЙ БЛЕСТЯЩИЙ
ОпределениеЛишай блестящий (синоним: лихен блестящий) — редкое кожное заболевание, предполагается, что он близок к красному плоскому лишаю или является проявлением туберкулезной интоксикации. Чаще болеют дети, преимущественно мальчики.
Этиология, патогенез и патанатомия Причины возникновения и развития не известны. Имеются два типа изменений: резко ограниченная, напоминающая бугорок гранулема в сосочковом и верхних отделах сетчатого отдела дермы, состоящая из лимфоцитов, эпителиоидных клеток, фибробластов и гигантских клеток, в центре гранулемы — расширенные сосуды, в старых высыпаниях — некротические очаги; нетуберкулезная воспалительная гранулема.
Клиническая картина Характеризуется появлением на коже очень мелких округлых или гладких, перламутровых — блестящих, плоских, резко ограниченных, едва возвышающихся узелков цвета нормальной кожи. Несмотря на то, что узелки расположены очень густо, они почти никогда не сливаются. Субъективные ощущения отсутствуют. Лишай блестящий чаще локализуется на коже полового члена, реже на коже туловища, локтевых и коленных сгибах и других, иногда бывает распространенным, однако и в этом случае на лице, волосистой части головы, ладонях и подошвах сыпи обычно не бывает. Слизистые оболочки поражаются исключительно редко. Течение заболевания хроническое.
Диагностика и дифдиагностика Диагноз и дифференциальный диагноз нетруден. От так называемой гусиной кожи лишай блестящий отличается характером узелков и локализацией; от скрофулезного лишая — отсутствием сгруппированного расположения узелков, их блеском; от красного плоского лишая — меньшей величиной и цветом высыпаний, отсутствием тенденции их к слиянию и образованию бляшек; от шиповидного лишая — отсутствием группировки высыпаний и «шипиков» на верхушках узелков, блеском.
Лечение Назначают преимущественно общеукрепляющие средства (препараты железа, витамины А, С, В1, D2 и др.), общее ультрафиолетовое облучение. Местно — 1–2 %-ные салицилово-серные и салицилово-резорциновые пасты и мази.
ЛИШАЙ КРАСНЫЙ ПЛОСКИЙ
ОпределениеЛишай красный плоский (синоним: лишай Вильсона) — дерматоз местной этиологии, характеризующийся мономорфной (состоящей из одинаковых элементов) зудящей папулезной сыпью на коже и также поражением слизистых оболочек, реже ногтей. Чаще встречается у взрослых, однако наблюдается и у детей с 6-месячного возраста.
Этиология, патогенез и патанатомия Существует несколько теорий развития красного плоского лишая. Неврогенная теория основана на выявлении нарушения процессов возбуждения и торможения в центральной нервной системе, провоцирующей роли психической травмы, поражений вегетативной нервной системы, дистрофических изменений периферических окончаний нервных волокон в коже и др. Красный плоский лишай Эндокринная теория основана на обнаружении дисфункции коры надпочечников, повышения экскреции катехоламинов; предполагается, что нервные и эндокринные расстройства являются скорее факторами патогенетическими, чем этиологическими. Инфекционная теория предполагает в качестве возбудителя фильтрующийся вирус, вегетирующий внутрикожно; при электронной микроскопии выявлены морфологические структуры, сходные с вирусами, а также с микоплазмами и бактериями, однако выделить возбудитель пока не удалось. Инфекционно-аллергическая теория исходит из того, что поражение вирусом клетки эпидермиса индуцирует антителообразование и развитие аутоаллергических реакций, приводящих к повреждению базальной мембраны и клеток базального слоя с формированием клеточных инфильтратов в дерме. Определенное значение придается наследственному предрасположению. Допускается также возможность провоцирующей роли аутоинтоксикации из желудочно-кишечного тракта, некоторых медикаментов (мышьяк, стрептомицин, синтетические антималярийные препараты и др.), профессиональных вредностей (трихлорэтан, парафенилгидиалин и др.), изменения реактивности организма и пр. Патологически наблюдаются гиперкератоз, неравномерный гранулез, акантоз, вакуольная дистрофия клеток базального слоя эпидермиса. Базальная мембрана местами разрушена, тонофибриллы утратили электронную плотность, правильное расположение и связь с десмосомами, которые, как и полудесмосомы, разрушены. В ядрах клеток эпидермиса — пластичные и зернистые включения. Дермоэпидермальная граница смазана четко ограниченным снизу лимфоцитарным инфильтратом с единичными нейтрофилами, а позднее с примесью фибробластов и хроматофоров. Сосочки дермы куполообразны. Нервные окончания с явлениями дистрофии. Местами видны щели между эпидермисом и дермой.
Клиническая картина Красный плоский лишай характеризуется появлением мономорфных высыпаний в виде многогранных плоских с гладкой блестящей поверхностью папул (узелков) величиной с булавочную или спичечную головку. Центральная часть некоторых папул пупковидно вдавлена. Цвет высыпаний бывает различным. У одних больных или на отдельных участках они по цвету почти не отличаются от нормальной кожи, в то время как у других лиц или в иных областях тела имеют розовато-желтый, насыщенно-красный или даже фиолетово-красный цвет. Папулы очень медленно увеличиваются до размеров чечевицы, а иногда бывают и крупнее. Они могут располагаться в виде различных фигур, дуг, овалов, колец или сливаться в бляшки разнообразной формы и величины (от 1–2 мм до ладони взрослого человека). Цвет крупных папул и бляшек обычно бывает более насыщенным, вначале темно- или фиолетово-красным, а со временем коричневым, даже черноватым. При нанесении на папулы капли растительного масла или воды выявляется важный симптом заболевания — своеобразная сеть, обусловленная наличием под роговым слоем опалово-белых полос и точек («сетка» Уикхема). Сыпь локализуется на сгибательной поверхности лучезапястных, локтевых и коленных суставов, внутренней поверхности предплечий, на передней поверхности голеней, вблизи подкрыльцовых впадин. Довольно часто высыпания распространяются на слизистую оболочку рта, на кожу и слизистые половых органов. В ряде случаев сыпь появляется на коже боковых поверхностей туловища, поясницы, половых органов (головка полового члена, крайняя плоть, вульва), шеи, ладоней, подошв, изредка — на лице и волосистой части головы. Сыпь вызывает очень сильный зуд (наиболее характерный симптом красного плоского лишая). В зависимости от формы папул, их группировки, локализации, течения и исхода процесса различают ряд разновидностей заболевания. Кольцевидный красный плоский лишай образуется при группировке папул в кольцо диаметром до 20 мм или при центробежном росте отдельных бляшек со слегка запавшим и пигментированным центром чаще на коже мошонки и полового члена. Серпигинозный красный плоский лишай — папулы группируются в дуги, полукруги и другие фигуры. Линейный (золиформный) красный плоский лишай — папулезные элементы располагаются линейно, обычно по ходу нервных стволов на туловище или на нижних конечностях. Волосяной (фолликулярный) красный плоский лишай — мелкие папулы локализуются вокруг устьев фолликулов на волосистой части головы, часто завершается атрофической алопецией. Эритематозный красный плоский лишай возникает внезапно на значительной части кожного покрова в виде малиново-красной эритемы на туловище и конечностях с незначительным отеком и легким шелушением, папулезные элементы трудно различимы до уменьшения интенсивности эритемы. Пемфингоидный красный плоский лишай — помимо типичных папул образуются субэпидермальные пузыри с серозным или геморрагическим содержимым, расположенные на поверхности папул или на неизмененной коже; нередко возникает у больных со злокачественными опухолями внутренних органов, являясь параонкологическим дерматозом.
Пемфингоидный красный плоский лишай
Гипертрофический (бородавчатый) красный плоский лишай — четко ограниченные фиолетовые бляшки с расширенными устьями волосяных фолликулов и потовых желез, закупоренных роговыми пробками, покрытыми толстыми асбестовидными чешуйками; характеризуется упорным течением и преимущественной локализацией на коже голеней. Приплюснутый красный плоский лишай — полусферические, слегка шелушащиеся папулы диаметром до 10 мм, локализующиеся обычно на коже голеней. Коралловидный красный плоский лишай — уплощенные папулы величиной до 10 мм, располагающиеся в виде четок и чередующиеся с участками гиперпигментации (встречается очень редко). Пигментный красный плоский лишай — выраженная гиперпигментация, появляющаяся практически одновременно с появлением папул (встречается редко). Остроконечный красный плоский лишай — скученные на ограниченных участках фолликулярные остроконечные, конусовидные узелки, ороговевшие на вершине, диаметром до 1–3 мм, на ощупь напоминающие поверхность терки. Атрофический красный плоский лишай (синоним: вторичный склерозирующий лихен) — атрофические изменения кожи на месте папул (встречается редко). Острый остроконечный красный плоский лишай — мелкие ярко-красные конические, реже сферические, папулы на фоне эритемы и отека, возникающие остро и в течение нескольких дней покрывающие все тело с формированием эритродермии; типичные папулы при этом можно обнаружить только с помощью лупы. Этот вариант может через 1–2 месяца перейти в обычную хроническую форму. Универсальный красный плоский лишай наблюдается при очень обильных высыпаниях, когда может поражаться вся кожа. При этом она становится воспаленной, диффузно красной, инфильтрированной, заметно отечной (вторичная эритродермия). Течение заболевания обычно длительное, нередко рецидивирующее, сопровождающееся появлением все новых высыпаний. После разрешения сыпи часто остается буроватая очень медленно исчезающая пигментация. Красный плоский лишай довольно часто локализуется только на слизистой оболочке полости рта и губ. Чаще поражается нижняя губа, иногда — лишь красная кайма губ. Поражение слизистой оболочки рта в основном отмечается у людей в возрасте 40–60 лет, причем среди больных преобладают женщины. Различают пять клинических форм красного плоского лишая слизистой оболочки рта. Типичная форма красного плоского лишая — слившиеся серовато-белые папулы располагаются на неизмененной слизистой оболочке в виде сетки, полос, дуг, кружевных узоров, листьев папоротника. На языке они напоминают лейкоплакию (см.), на слизистой оболочке губ иногда имеют бородавчатый вид. На красной кайме губ папулы, обычно сливаясь, образуют сплошной очаг поражения в виде полосы, с шелушащейся поверхностью, изредка могут принимать звездчатую форму. Субъективно больные ощущают сухость слизистой и при приеме горячей пищи испытывают некоторую болезненность. Экссудативно-гиперемический красный плоский лишай характеризуется высыпаниями типичных папул на воспаленной гиперемированной, отечной слизистой рта. Эрозивно-язвенный красный плоский лишай — происходит отторжение эпителия с образованием эрозий и язв на слизистой рта и красной кайме губ. По периферии от них на гиперемированной и отечной слизистой можно видеть типичные папулы (сетку, узоры). Больные испытывают боль в эрозивных очагах. Течение этой формы упорное, длительное (иногда продолжается многие годы). Часто такие больные страдают язвенной болезнью желудка, двенадцатиперстной кишки, гастритами, хроническим колитом, заболеваниями печени. Эрозивно-язвенную форму в сочетании с гипертонической болезнью и сахарным диабетом называют синдромом Гриншпана. Буллезный красный плоский лишай наблюдается редко. Накапливающийся в сосочковом слое экссудат приподнимает эпителий. В результате образуются пузыри и пузырьки, после разрыва которых возникают эрозии. Последние быстро эпителизируются. Одновременно могут наблюдаться и типичные папулезные высыпания. Гиперкератотический красный плоский лишай встречается очень редко. Проявляется очагами ороговения, которые выступают над слизистой оболочкой или над красной каймой губ. Одновременно могут появиться и папулезные элементы, сливающиеся в полосы на переходных складках. Эту форму необходимо дифференцировать с веррукозной лейкоплакией (предрак), для чего требуется исследование биоптата. Поражение ногтей наблюдается у 10–15 % больных красным плоским лишаем и характеризуется образованием продольных гребнеобразных борозд, помутнением, истончением и углублением ногтевых пластинок, которые становятся хрупкими и разрушаются.
Диагностика и дифдиагностика Диагноз в большей части случаев не затруднен и ставится на основании клинической картины. Иногда для более четкого выявления характерных папул применяют некоторые тесты (после смазывания папул растительным маслом выявляется сероватая кружевная сетка, после согревающего компресса папулы набухают, приобретают перламутровый оттенок (симптом Поспелова). В острой стадии болезни зачастую наблюдается изоморфная реакция Кеблера, возникающая через 7—10 дней на месте травматизации кожи. Согласно гистопатологическим данным, при дерматозе в эпидермисе отмечаются явления гипер-, иногда паракератоза, увеличение числа рядов клеток зернистого слоя и количества в них кератогиалиновых гранул (на отдельных участках), что обуславливает выявление «сетки» Уикхема (гранулез), акантоз и папилломатоз (пиловидные сосочки); вакуольная дегенерация клеток базального слоя. В сосочковом слое дермы обнаруживается преимущественно крупноклеточный инфильтрат, имеющий резкую границу снизу и проникающий в нижние слои эпидермиса. Красный плоский лишай следует дифференцировать: на коже — с бородавчатым туберкулезом, бластомикозом (см.), вторичным сифилисом (см.), псориазом (см.), плоскими бородавками (см.), узловатой почесухой; на слизистой рта и половых органах — с простой и бородавчатой лейкоплакией (см.), кандидозом (см.), вторичным сифилисом (см.), простым герпесом (см.), акантолитической пузырчаткой, многоформной экссудативной и лекарственной эритемами.
Лечение Покой, исключение возбуждающих средств (кофе, пряности и так далее), теплые ванны, гипнотерапия, электросон, седативные препараты, по необходимости транквилизаторы, ликвидация очагов фокальной инфекции (тонзиллит, гайморит), антигистаминные препараты, витамины группы В, токоферола ацетат, ретинола ацетат. При острых распространенных высыпаниях назначают антибиотики широкого спектра действия или пенициллинотерапию, а также антигистаминные препараты (димедрол, диазолин, пипольфен и пр), хлорид, глюконат или пантетонат кальция, витамин С. В ряде случаев эффективная терапия гистоглобулином или антималярийными препаратами (резохин, делагил, хлорохин-дифосфат) в комбинации с небольшими дозами кортикостероидных препаратов (преднизолон, триамциналон, дексаметазон и др.). Наружно применяют зудоуспокаивающие растворы: этиловый спирт с анестезином (5 %-ный) или лимонной кислотой (3 %-ной), ментолом (1–2 %-ный), а также взбалтываемые смеси (болтушки) с анестезином, ментолом, серой и другие. При ограниченных высыпаниях определенный эффект дают мази с кортикостероидными гормонами. Бородавчатую форму высыпаний лечат криотерапией, ультрафиолетовым облучением, а также мазями с высоким содержанием дегтя (10–15 %-ным) и серы (10–20 %-ной). Для лечения эрозивно-язвенной и буллезной форм красной каймы губ и слизистой рта рекомендуют преднизолон (20–25 мг в сутки) или триамциналон (20–16 мг), дексаметазон (3–3,5 мг) и делагил или хлорохин (по 0,25 г 1–2 раза в сутки в течение 4–6 недель). При противопоказаниях одного из группы названных препаратов (кортикостероидов и антималярийных средств) можно применять только один из них: кортикостероидный или антималярийный. При локализованных формах эффективны обкалывания суспензией гидрокортизона. При эрозивно-язвенной форме на слизистой, сочетающейся с сахарным диабетом и гипертензией, назначают андекалин (20–40 ЕД через день, 15–20 инъекций). Иногда эффективно применение никотиновой кислоты. Наружно показаны мази с кортикостероидами (флуцинар, фторокорт, оксикорт, локакортен-Н, гиоксизон, оксизон и др.), 1 %-ная дибуноловая мазь, 10–20 %-ная бура в глицерине. После местной аппликационной анестезии 5 %-ной эмульсией анестезина в персиковом масле эрозивные или язвенные поверхности обрабатывают 2 %-ным раствором ронидазы либо дезоксирибонуклеазы и 1 %-ным раствором этония. На окружающую слизистую наносят эмульсию метилурацила или нуклеината натрия, флуцинар либо фторокорт. Иногда при упорном хроническом течении отдельные эрозии или язвы иссекают хирургически. Обязательно проводят лечение соматических заболеваний, болезней полости рта. Прогноз красного плоского лишая почти всегда благоприятный. Очень редко заболевание не поддается терапии в течение многих месяцев, даже лет. Исключительно редки случаи осложнения его вторичной эритродермией. При ограниченной или распространенной апруригинозной форме больные обычно сохраняют трудоспособность. При остром распространенном процессе, при эритродермии больные временно утрачивают трудоспособность; им проводится лечение в стационаре.
Профилактика Профилактика красного плоского лишая заключается в своевременном правильном назначении лечения с учетом общего состояния организма. Это может предупредить распространение процесса на обширные участки кожи и слизистых оболочек.
ЛИШАЙ ЛИНЕЙНЫЙ
ОпределениеЛишай линейный (синоним: лихен линейный) — редкий дерматоз, характеризующийся полосовидным расположением сыпи.
Этиология, патогенез и патанатомия Предполагается, что причиной заболевания являются невриты периферических нервов. Наблюдается обычно у детей, реже у женщин. Патологоанатомически выявляются незначительные изменения эпидермиса, слабовыраженный подострый воспалительный инфильтрат в сосочковом слое дермы.
Клиническая картина Характеризуется полосовидной односторонней сыпью, состоящей из мелких бледно-розовых, слегка возвышающихся узелков величиной 2–3 мм в диаметре, чаще локализующихся на нижних конечностях. Зуд и боль отсутствуют, возможны гипостезии и другие симптомы периферического неврита.
Диагностика и дифдиагностика Диагноз несложен. Дифференциальный диагноз проводят с линейной формой красного плоского лишая (см.), линейным невусом (см.).
Лечение Витамины группы В, противовоспалительные средства (кортикостероидные мази, крем-цинк, 2 %-ная нафталановая мазь и др. Прогноз благоприятный, через несколько месяцев сыпь самопроизвольно исчезает.
ЛИШАЙ ОПОЯСЫВАЮЩИЙ
ОпределениеОпоясывающий лишай — вирусное заболевание, характеризующееся высыпанием сгруппированных пузырьков на эритематозно-отечном основании по ходу кожных веточек нерва, обычно на одной стороне тела.
Этиология, патогенез и патанатомия Вызывается вирусом герпес зостер, идентичным вирусу ветряной оспы. Он проявляет дерматотропные свойства и выраженную тенденцию поражать центральную и периферическую нервную систему. Патогенез заболевания изучен недостаточно. Установлено, что его возникновению благоприятствует переохлаждение. Известны случаи заболевания опоясывающим лишаем взрослых, бывших в контакте с детьми, больными ветряной оспой, и наоборот. Заболевание, как правило, встречается у взрослых; у детей в возрасте до 10 лет наблюдается редко. По современным представлениям ветряную оспу следует рассматривать как гематогенную инфекцию у лиц, не имеющих иммунитета, тогда как опоясывающий герпес возникает при неврогенном распространении вируса у людей с наличием гуморального иммунитета, в результате активации вируса, персистирующего в организме. Доказано, что после перенесенной ветряной оспы вирус многие годы сохраняется в межпозвоночных ганглиях в виде латентной персистентной инфекции. Циркулирующие гуморальные антитела, равно как и реакции клеточной цитотоксичности, не способны полностью элиминировать в геном клетки. При резком ослаблении местного и общего иммунитета может наступить активация вируса, и инфекция проявляется в виде локального процесса, связанного с зоной иннервации пораженных сенсорных ганглиев.
Опоясывающий лишай
Опоясывающий лишай может возникать как самостоятельное заболевание (чаще) или как сопутствующее, осложняя травмы, пневмонию, лимфолейкоз, лимфогранулематоз, сепсис, рожу, туберкулез, грипп, менингиты, сифилис, раковые метастазы, интоксикацию морфином, ртутью, мышьяком, алкоголем и др. Гистопатологически в очагах поражения обнаруживают внутриэпителиальные пузыри с баллонирующей и ретикулярной дегенерацией клеток эпидермиса, в дерме — отек верхней части, расширение сосудов, пролиферация эндотелия; в инфильтрате — сегментоядерные лейкоциты и лимфоциты. Выявляются воспалительная инфильтрация лимфоцитами и плазмоцитами нервных узлов, кровоизлияния в них; дистрофия нервных клеток и волокон. Такие же изменения отмечаются в задних корешках, а дистрофические изменения — в периферических нервах.
Клиническая картина Заболевание начинается остро с повышения температуры тела, появления чувства жжения, зуда, покалывания и болей по ходу пораженных чувствительных нервов. Вскоре по ходу нервных ветвей появляется покраснение кожи, а затем к концу 1-х суток (реже на 2-е сутки) образуются группы тесно расположенных пузырьков величиной 0,3–0,5 мм, наполненных прозрачным содержимым. Сыпь имеет склонность к слиянию. Чаще высыпания появляются на эритематозной коже по ходу межреберного нерва (чаще), кожных нервов конечностей или одной из ветвей тройничного нерва. Иногда удается увидеть предшествующие пузырькам и пузырям узелковые и гиперемические пятнистые высыпания. Пузырьки и их группы окружает венчик гиперемированной, заметно отечной кожи. Содержимое свежих пузырьков серозное. Потом оно постепенно мутнеет и становится гнойным. Разрешение пузырьков сопровождается их высыпанием. В результате образуются грязно-желтые, желто-зеленые или коричневые корочки, по отхождении которых остаются пигментированные пятна. Высыпания иногда возникают на слизистой рта, зева, носа, конъюнктивы, вульвы, влагалища. Они обычно вызывают покалывание, часто сильные невротические боли, которые могут даже предшествовать сыпи. Изредка бывают висцеральные поражения, напоминающие приступы желчнокаменной болезни, почечной колики, аппендицита, непроходимости кишечника. Если такие субъективные ощущения наступают до появления высыпаний на коже или последних вообще не бывает, поставить правильный диагноз чрезвычайно трудно. Соответственно локализации высыпаний увеличиваются и становятся болезненными регионарные лимфатические узлы. Особенно тяжело протекает заболевание при поражении ушного нерва и коленчатого узла, двигательных и чувствительных волокон лицевого нерва. В таких случаях наряду с высыпаниями на коже ушной раковины, наружного слухового прохода, иногда на слизистой рта отмечаются сильнейшие невралгические боли в области уха (синдром Рамзая-Ханта). При этом иногда может развиться менингоэнцефалит (см.). Опоясывающий лишай ослабляет иммунитет.
Опоясывающий лишай. Герпетическая сыпь по ходу нерва
Некроз герпетической сыпи
Возможны и более тяжелые формы болезни, к ним относятся: буллезная (крупные пузыри), геморрагическая (содержимое пузырьков имеет геморрагический характер), гангренозная (образование черного струпа на месте пузырьков с последующим изъязвлением), генерализованная форма (высыпания отдельных пузырьков на разных участках тела, помимо типичных пузырьков по ходу чувствительных нервов). Наряду с тяжелыми вариантами встречаются и абортивные формы, двусторонние формы.
Диагностика и дифдиагностика Опоясывающий лишай дифференцируют на основании характерных сгруппированных пузырьков, расположенных на эритематозных пятнах по ходу чувствительного нерва. Из лабораторных методов используют выявление телец Арагао (скопление вируса) в окрашенных серебрением по Морозову мазках везикулярной жидкости при обычной или электронной микроскопии. Для серологической диагностики применяют реакцию связывания комплемента (РСК). Заслуживает внимания иммуно-флюоресцентный метод, с помощью которого можно обнаружить герпесный антиген в мазках-отпечатках из содержимого везикул. Вирус можно выделить на эмбриональных культурах клеток человека. Заболевание необходимо отличать от пузырькового лишая, острой экземы, стрептококкового импетиго, при генерализованной форме от ветряной оспы.
Лечение При лечении данного заболевания используются препараты салициловой кислоты, пиронал, анапирин, анальгин. При тяжелой форме назначаются инъекции пенициллина, а также тетрациклина. Для предупреждения гнойничковых осложнений очаги смазывают 1–2 %-ным водным или спиртовым растворами бриллиантового зеленого либо метиленового синего, мазями, содержащими антибиотики и сульфаниламиды; определенный эффект оказывает интерфероновый крем. При локализации очагов опоясывающего лишая на коже прогноз благоприятный: выздоровление наступает через 3–6 недель, хотя боли в очаге продолжаются месяцы. При вовлечении в процесс глаз прогноз не всегда благоприятный. Некротическая форма длится до 2–3 месяцев и оставляет на коже рубчики. При нестерпимых болях показаны ультразвук, ультрафиолетовое излучение, электрофорез с новокаином, новокаиновые блокады. Положительный эффект при лечении опоясывающего лишая оказывает интерферон в инъекциях.
Профилактика Больных ветряной оспой и опоясывающим лишаем изолируют дома до 5-го дня с момента последних высыпаний. Госпитализации подлежат только больные с тяжелыми и осложненными формами болезни в специализированное отделение или мельцеровские боксы. При наличии менингоэнцефалита госпитализация обязательна. Детей ясельного возраста (до 3 лет), бывших в контакте с больными ветряной оспой и опоясывающим лишаем и не болевших ранее, изолируют с 1-го по 21-й день с момента контакта. Заключительную дезинфекцию в очаге инфекции после изоляции больного не проводят из-за нестойкости вируса. Достаточно после изоляции больного проветрить помещение и сделать влажную уборку. Если в контакт попадают ослабленные дети, с целью профилактики можно ввести иммуноглобулин в дозе 3–6 мл. Для активной иммунизации разрабатывается живая ослабленная вакцина, однако в настоящее время иммунизация не проводится.
ЛИШАЙ ПРОСТОЙ ЛИЦА
ОпределениеЛишай простой лица (синонимы: сухая стрептодермия, эритематозно-сквамозная стрептодермия, белый лишай лица) — атипичная разновидность стрептококкового импетиго.
Этиология, патогенез и патанатомия Возбудитель заболевания — стрептококк. Возникновению болезни способствует мацерация, недостаточное высушивание при мытье, обветривание кожи лица, несоблюдение гигиены кожи. Описаны вспышки заболевания в детских коллективах. При гистологическом исследовании в очагах выявляются разрыхление рогового слоя эпидермиса, паракератоз (см.).
Клиническая картина Клинически простой лишай лица характеризуется появлением чаще у детей, на коже лица в области щек, вокруг рта, на подбородке светло-розовых эритематозных пятен различной величины округлых очертаний с довольно резкими границами, покрытых отрубевидными чешуйками. На месте высыпаний после их разрешения, особенно после воздействия инсоляции, остаются депигментированные участки кожи — псевдолейкодерма. В области этих пятен изредка может быть едва уловимая эритема. Пятна покрыты нежными отрубевидными, серовато-белыми шелушащимися чешуйками. Иногда шелушение столь незначительное, что чуть ли не единственным признаком заболевания является серовато-белый цвет высыпаний, которые особенно выделяются на загорелой коже. Простой лишай лица нередко сочетается с другими формами стрептококкового импетиго (заеды, заушная стрептодермия и др.).
Диагностика и дифдиагностика Диагностика заболевания несложна, в сомнительных случаях простой лишай лица дифференцируют с грибковыми заболеваниями кожи на основании отсутствия патогенных грибков в чешуйках; с себореей и витилиго.
Лечение и профилактика Для лечения заболевания очаги поражения смазывают 2–3 %-ной белой ртутной мазью, тетрациклиновой мазью или 10 %-ным стрептоцидным линиментом. Купать во время лечения не рекомендуется. Для предупреждения развития простого лишая тело после купания в водоемах необходимо тщательно вытирать чистым полотенцем.
ЛИШАЙ ПРОСТОЙ ПУЗЫРЬКОВЫЙ
ОпределениеЛишай простой пузырьковый — вирусное заболевание, характеризующееся высыпанием сгруппированных пузырьков на островоспаленном отечном основании.
Этиология, патогенез и патанатомия Заболевание возникает в результате герпетической инфекции, обусловленной первичным заражением вирусом простого герпеса или реактивацией латентно (скрыто) протекающей герпетической инфекции. При этом на коже, особенно на лице, вокруг рта, на красной кайме губ и слизистых оболочках полости рта, носовых ходов, глаз (кератоконъюнктивит), половых органов, вульвы, влагалища (вульвовагинит) появляется ограниченная или генерализованная везикулезная сыпь, развивается кератоконъюнктивит или даже изредка менингоэнцефалит либо энцефалит. При гистопатологических исследованиях очагов поражения в эпидермисе или эпителии обнаруживаются баллотирующая дегенерация, межклеточный отек, однокамерные и многокамерные (поверхностные) пузыри, вакуолярная дегенерация шиповатых клеток. В сосочковом и подсосочковом слоях дермы выявляются отек, расширение и полнокровие сосудов, воспалительная инфильтрация вдоль них лимфоцитами и полинуклеарами. Следует отметить, что пузырьковый лишай часто сопутствует различным инфекционным заболеваниям, пневмонии, травмам, переохлаждению, в редких случаях — менструации. Заболевание наблюдается как у взрослых, так и у детей. Около 90 % людей, инфицированных вирусом простого герпеса в раннем детстве, остаются носителями его всю жизнь. Поэтому больные рецидивирующим пузырьковым лишаем должны быть тщательно обследованы с целью выявления очагов хронической инфекции (носоглотка, придаточные полости носа, бронхи, женские половые органы, простата, уретра), а также хронических заболеваний печени, желчного пузыря, желудочно-кишечного тракта, эндокринных нарушений.
Клиническая картина Высыпания представляют собой располагающиеся группами (по одной или несколько) прозрачные пузырьки, размеры каждого из которых варьируют от величины булавочной до размеров спичечной головки. Они сосредотачиваются на отечной, умеренно гиперемированной коже. Возникновению их обычно предшествует ощущение несильного зуда или покалывания. Экссудат пузырьков в течение 1–2 дней мутнеет, а затем вместе с покрышкой засыхает в серую или коричневую (геморрагическую) корочку. Нередко пузырьки вскрываются и на их месте образуются мокнущие с полициклическими краями розово-красные эрозии, которые вскоре покрываются тонкой корочкой. Особенно быстро группки пузырьков превращаются в эрозию при локализации их на слизистых оболочках или на участках кожи с повышенной влажностью, подвергающихся трению. Заболевание часто рецидивирует.
Диагностика и дифдиагностика При локализации эрозий на половых органах его необходимо дифференцировать с твердым или мягким шанкром, раковой язвой, опоясывающим лишаем. Больных необходимо обследовать для исключения сифилиса.
Лечение Для лечения высыпания простого пузырькового лишая припудривают присыпкой, состоящей из окиси цинка и талька (1:1), смазывают интерфероновой, флореналовой, оксолиновой, 2–3 %-ной ихтиоловой или дерматоловой мазью. Применяют также мази с сульфаниламидными препаратами либо 3 %-ную мегасиновую, 1 %-ную риодоксоловую, 05 %-ную бонафтоновую, 5 %-ную алкизариновую мази. Эрозии рекомендуется смазывать 0,25 %-ным раствором нитрата серебра, буровской жидкостью, 2–3 %-ным раствором фурацилина или риванола. При рецидивирующем пузырьковом лишае назначают аутогемотерапию, инъекции витамина В^ противокоревого иммуноглобулина, внутрь — ауреомицин, тетрациклин, окситетрациклин, интерфероноген мегасин, внутримышечно — интерферон. При высыпании на слизистой полости рта следует полоскать несколько раз в день настоем цветов ромашки. Для лечения рецидивирующего герпеса применяют герпетическую вакцину, антигерпетический иммунный глобулин.
Профилактика Для профилактики простого пузырькового лишая следует проводить лечение очагов хронической инфекции, избегать переохлаждения, применять поливалентную противогерпетическую вакцину, специфический антигерпетический иммунный глобулин.
ЛИШАЙ РАЗНОЦВЕТНЫЙ
ОпределениеЛишай разноцветный, или отрубевидный (синоним: хроматофитоз) — грибковое заболевание кожи, возбудитель которого паразитирует в роговом слое и почти не вызывает воспалительных явлений; характеризуется появлением пятен коричневого цвета преимущественно на коже туловища.
Этиология, патогенез и патанатомия Разноцветный (отрубевидный) лишай — кератоз, возбудителем которого является грибок Питироипорум орбицеларе (овале). Заболевание малоконтагиозное, возникает у лиц с повышенной потливостью, изменением химического состава пота. Предрасполагают к развитию заболевания титры себореи, сахарный диабет, хронические заболевания легких; туберкулезная интоксикация. Патанатомически выявляется разрыхление рогового слоя, содержащего элементы грибка; в дерме воспалительные изменения не обнаруживаются.
Клиническая картина Отрубевидный лишай — контагиозное заболевание. Инкубационный период его длится от 2 недель до 2 месяцев. Затем на коже груди, живота, спины, шеи, подкрыльцовых ямок, плеч, боковых поверхностей туловища, реже бедер и волосистой части головы появляются желтоватые, светло-коричневые или розоватые пятна (отсюда и название), окаймляющие вход в волосяные фолликулы пушковых волос. Их размеры сначала с булавочнуюголовку. Затем они постепенно разрастаются до 1–3 см и, сливаясь, образуют обширные очаги поражения, включающие в отдельных случаях и участки нормальной кожи. Очаги имеют фестончатые очертания. Вокруг них обычно располагается множество более мелких очагов (пятен) различных размеров.
Диагностика и дифдиагностика Диагноз заболевания легко подтвердить смазыванием пятен настойкой йода или раствором анилиновых красок (бриллиантовой зелени, метиленовой сини). При этом разрыхленный роговой слой эпидермиса в очагах окрашивается в более насыщенный цвет, чем окружающая здоровая кожа. В случае облучения пораженной кожи люминесцентной лампой очаги дают желто-оранжевое или темно-коричневое свечение. При микроскопии чешуек, соскобленных с пятен, выявляются короткие изогнутые нити и споры с двухконтурной оболочкой. Отрубевидный лишай необходимо дифференцировать с сифилитической розеолой (см.) и розовым лишаем (см.). Дело в том, что розоватые пятна отрубевидного лишая иногда очень похожи на розеолы вторичного свежего сифилиса. Поэтому больной, у которого нити имеют розоватый цвет и при смазывании указанными выше растворами он не становится более интенсивным, чем цвет окружающей кожи, должен быть немедленно проконсультирован у венеролога и обследован серологическими методами. После загорания пятна отрубевидного лишая могут обесцвечиваться и напоминать аналогичную депигментацию при вторичном сифилисе (истинную лейкодерму). При этом вследствие отшелушивания разрыхленного рогового слоя под влиянием ультрафиолетовых лучей смазывание белых пятен разноцветного лишая растворами красящих веществ не вызывает интенсивного их окрашивания, что еще более усиливает подозрение на сифилис. Поэтому каждый такой больной должен быть проконсультирован у венеролога и обследован серологически. При отрубевидном лишае в отличие от розового не образуется «материнская» бляшка («медальон»), высыпания располагаются рассеянно, а не вдоль межреберных промежутков.
Лечение В план лечения входят противогрибковые препараты: ламизил, орунгал, экзифин, дифлюкан, низорал и др. При лечении заболевания очаги смазывают 5 %-ным резорциновым или салициловым спиртом, нитрофунгином; ограниченные высыпания 2 %-ным спиртовым раствором йода. Проводят также лечение по методу Демьяновича (в течение 1–2 недель втирают 60 %-ный тиосульфат натрия, затем 6 %-ный раствор химически чистой соляной кислоты). Эффективен и удобен метод Андриасяна: пораженную кожу ежедневно, в течение 5–7 дней, смазывают раствором следующего состава: уротропин — 10 мл; глицерин — 20 мл; 8 %-ный раствор уксусной кислоты — 70 мл. Для предупреждения рецидива один раз в неделю в течение 2–3 месяцев кожу протирают 2 %-ным салициловым или резорциновым спиртом либо обрабатывают по методу Демьяновича. Прогноз благоприятный, однако при неоднократном лечении часты рецидивы.
Профилактика С целью профилактики заболевания белье и одежду после окончания курса лечения дезинфицируют (кипятят и проглаживают горячим утюгом), соблюдают тщательную гигиену тела, проводят осмотр членов семьи.
ЛИШАЙ РОЗОВЫЙ
ОпределениеЛишай розовый (синонимы: розовый лишай Жибера, пятнистый круговой лишай Дюринга, шелушащаяся розеола Фурнье-Никола) — эритематозно-сквамозный дерматоз предположительно инфекционного генеза.
Розовый лишай
Этиология, патогенез и патанатомия Предполагается инфекционная (вероятнее, вирусная) этиология заболевания. Контагиозность розового лишая незначительна. Он нередко развивается после переохлаждения, острых респираторных заболеваний, чаще в весенне-осенний сезоны. Описаны единичные случаи семейного заболевания. При патологоанатомических исследованиях очагов в эпидермисе обнаруживаются акантоз, паракератоз, межклеточный и внутриклеточный отек; в сосочковом слое дермы — небольшой отек, расширение кровеносных сосудов, периваскулярные инфильтраты, состоящие из лимфоцитов.
Клиническая картина При развитии заболеваний на коже туловища, чаще в области плечевого пояса, сначала появляется розово-красное пятно (реже 2–3), которое, постепенно увеличиваясь, достигает размеров 3–4 мм, иногда даже крупнее. Форма его почти округлая, овальная, иногда с зубчатыми краями. Центральная часть пятна более бледного цвета, немного западает, слегка шелушится мелкими отрубевидными прозрачными чешуйками, напоминающими смятую папиросную бумагу. Периферическая краевая зона более яркого розово-красного цвета и слегка приподнимается над окружающей кожей. Это начальное пятно называют «материнской» бляшкой, или медальоном. Вслед за ним на коже туловища, часто вдоль межреберных промежутков, верхних и нижних конечностей, появляются многочисленные розовокрасные слегка шелушащиеся пятна, обычно с неровными краями, величиной от спичечной головки до 1–2 см в диаметре. Они могут быть очень обильными и частично сливаются краями. Иногда высыпания несколько приподнимаются (отек) и напоминают уртикарные или папулезные элементы. На коже лица, кистей, стоп и волосистой части головы высыпаний почти не наблюдается. Субъективных ощущений в основном не бывает или имеется слабый зуд. Заболевание чаще возникает весной или осенью и продолжается иногда более 6–8 недель. В организме к нему вырабатывается иммунитет; рецидивы бывают как исключение. В типичных случаях установление диагноза не вызывает затруднений. Особенно помогает распознаванию заболевания обнаружение среди высыпаний наиболее крупной первичной «материнской» бляшки (одной, реже нескольких). Однако она бывает не всегда. Поэтому однократного осмотра недостаточно, необходимо наблюдение за течением процесса. Пятна обычно располагаются на коже вдоль линий Лангера на туловище и проксимальных частях конечностей; значительно реже на шее и лице. В начале заболевания отмечается повышенная температура, через 4–5 недель пятна бледнеют и постепенно исчезают, не оставляя следов. К атипичным формам розового лишая относятся уртикарная, папулезная, везикулезная, фолликулярная и миллиарная, наблюдаемые крайне редко. Особо выделяют кольцевидный и окаймленный лишай Видаля, которые некоторые авторы называют гигантским розовым лишаем. Количество высыпаний при этой форме небольшое, но размеры их достигают 5–8 см в диаметре. Эта форма отличается хроническим течением (месяцы, даже годы). В некоторых случаях при применении средств, вызывающих раздражение кожи, или мытье кожи мылом и мочалкой розовый лишай может осложняться экзематизацией.
Диагностика и дифдиагностика Диагноз основывается на клинических данных — наличие «материнской» бляшки и типичных пятнистых высыпаний. Дифференцировать данные заболевания следует с псориазом (см.), дерматитом (см.), микозами гладкой кожи (см.), себорейной экземой (см.), каплевидным парапсориазом, сифилитической розеолой, отрубевидным лишаем. Диагноз «розовый лишай Жибера» следует ставить при отрицательной реакции Вассермана, отсутствии специфического полиаденита и папулезных высыпаний, следов (рубец) твердого шанкра на половых органах, а также исключении (в анамнезе) случайных половых связей.
Лечение Заболевание обычно не требует никакого лечения; пройдя цикл развития, высыпания бесследно разрешаются. Только при заметном зуде иногда необходимо назначать антигистаминные и десенсибилизирующие препараты. При осложненном варианте назначают антибиотики широкого спектра действия. Целесообразно назначение витаминов (особенно пантотеновой кислоты, аскорутина, витаминов группы В), риванола, аутогемотерапии, наружно применяют цинк-водную взвесь, кортикостероидные кремы.
Профилактика Методы предупреждения розового лишая не разработаны. Следует избегать переохлаждения. Профилактика заболевания заключается в соблюдении мер, исключающих развитие осложняющего дерматита.
ЛИШАЙ СТРИГУЩИЙ
ОпределениеСтригущий лишай, или трихофития — грибковое заболевание кожи и ее придатков, особенно контагиозное для детей в возрасте от 4 до 13 лет.
Этиология и патогенез Стригущий лишай вызывается антропофильными трихофитонами, паразитирующими преимущественно на коже человека, внутри волоса и в роговом слое эпидермиса, а также зооантропофильными (фавиформный, гипсовый) перихофитонами, которые паразитируют в основном на коже животных (крупный рогатый скот, мыши, лошади, некоторые дикие животные — лисицы и др.). В зависимости от характера возбудителя и ответной реакции организма заболевшего на его внедрение, от локализации очага поражения различают несколько клинических форм стригущего лишая: — поверхностную (развивается на волосистой части головы, гладкой коже); — хроническую; — трихофитию ногтей; — инфильтративно-нагноительную. Поверхностная трихофития волосистой части головы вызывается антропофильными трихофитонами: фиолетовым и кратероформным. Заболевание наиболее часто наблюдается у детей школьного возраста, но иногда может возникать у лиц любого возраста. Заражение детей чаще происходит от взрослых в семье, в которой не выявлены больные стригущим лишаем. Заболевание передается при непосредственном контакте с больными или через вещи, которыми он пользовался (платки, шапки, расчески, ножницы, щетки, постельное белье и так далее). Особенно легко передается поверхностная трихофития в детских коллективах (детские ясли и сады, школы и так далее), если там заболевает хотя бы один ребенок или кто-то из обслуживающего персонала. Это может привести к вспышкам заболевания. Аналогичная картина может наблюдаться в семье. Если заболевание, начавшееся в детском возрасте, не было своевременно диагностировано и излечено, оно длится до полового созревания, а затем у большинства мужчин спонтанно излечивается, у женщин же может трансформироваться в хроническую (черноточечную) форму. Хронический стригущий лишай обычно наблюдается только у женщин, болевших в детстве поверхностной трихофитией волосистой части головы или поверхностной трихофитией гладкой кожи. Эта форма заболевания возникает в связи с нарушениями функций щитовидной и половых желез, изменениями периферического кровообращения и иммунобиологической реактивности организма, со снижением витаминной обеспеченности. Инфильтративно-нагноительная, или глубокая, трихофития вызывается зооантропофильными трихофитонами. Эти грибы размножаются в эпителии волосяных фолликулов и вызывают их воспаление. Наиболее частым источником заражения являются больные животные, реже человек (заболевание передается при непосредственном контакте с ними). Инфицирование происходит и через предметы (щетка, одежда), которыми пользовался человек, бывший в контакте с больным животным (вместе с шерстью и чешуйками кожи переносится и возбудитель от больных коров, грызунов).
Клиническая картина Поверхностная трихофития волосистой части головы Заболевание проявляется образованием нескольких или множественных очагов значительного поредения волос и заметным шелушением в виде мелких отрубевидных серых или белесоватых чешуек. Волосы в очагах частично обламываются (как бы острижены) на расстоянии 1–3 мм от поверхности кожи и имеют вид пеньков (с этим связано само название заболевания — стригущий лишай). Изредка в очагах отмечается слабая эритема, а у их краев возникают мелкие пузырьки или желтые корочки. Очаги в большинстве случаев неодинаковые по размерам (от горошины до 3–5 см и крупнее), округлой или чаще неправильной формы. В связи с этим различают мелкоочаговую и крупноочаговую разновидности заболевания. При поверхностном стригущем лишае волосистой части головы кожа не претерпевает существенных воспалительных изменений, большинство больных, как правило, не испытывают каких-либо субъективных ощущений, лишь иногда отмечается легкий зуд.
Поверхностная трихофития гладкой кожи Эта форма проявляется возникновением на коже конечностей, шее, лице, туловище четко ограниченных, округлых, неправильной формы постепенно увеличивающихся очагов поражения. Периферический слегка возвышающийся валик их образован розовокрасными милиарными узелками, пузырьками и корочками. Иногда он выражен слабо, и очаги не имеют резких границ. Центральная часть очагов более бледная (бледнорозовая) и покрыта мелкопластинчатыми, сероватыми чешуйками. Субъективные ощущения в очагах отсутствуют, иногда же они сводятся к легкому зуду.
Хронический стригущий лишай Заболевание может проявляться поражением волосистой части головы, гладкой кожи и ногтей пальцев рук. При этом на волосистой части головы (чаще в височных и затылочных областях) возникают небольшие (с четверть поверхности ногтя мизинца и более мелкие), гладкие, напоминающие слегка атрофические рубчики или несколько шелушащиеся, без видимых воспалительных явлений очажки. Волосы в этих местах обламываются на уровне кожи, и образуются так называемые «черные точки». На гладкой коже ягодиц, бедер, разгибательной поверхности коленных и локтевых суставов, ладоней наблюдаются неостро воспалительные застойно-синюшного или розоватого цвета, плохо очерченные слегка шелушащиеся пятна крупных размеров. Субъективные ощущения в очагах чаще отсутствуют, иногда отмечается слабый зуд. Пораженные ногтевые пластинки пальцев рук теряют блеск, прозрачность, становятся мутными, серыми, их край зазубривается, легко крошится. Ногти то резко истончаются, то, наоборот, делаются очень толстыми.
Инфильтративно-нагноительная (глубокая) трихофития При заражении на волосистой части головы возникают крупные (до 6–8 см в диаметре), насыщенно-красные, бугристые, опухолеподобные очаги в виде бляшек, возвышающихся над кожей. Они образуются в результате слияния множественных гнойных фолликулов и выраженной инфильтрации дермы. Бляшки обычно болезненны. В очагах поражения из расширенных устий волосяных фолликулов выделяется обильный гной светло-желтого цвета, что придает им вид медовых сот. У отдельных больных нагноительный процесс не развивается (инфильтративная разновидность заболевания). Центр бляшек позднее может покрываться грязно-коричневыми рыхлыми корками. Заболевание сопровождается увеличением регионарных лимфоузлов. При пальпации они болезненны. Иногда появляется общее недомогание, повышение температуры тела, на теле наблюдаются аллергические сыпи (трихофитиды). Заболевание может длиться 2–3 месяца и более. У мужчин инфильтративно-нагноительная трихофития может наблюдаться в области роста волос бороды и усов. Тогда она носит название паразитарный микоз.
Диагностика и дифдиагностика Поверхностный стригущий лишай волосистой части головы следует отличать от фавуса и круговидного облысения. Диагноз должен быть подтвержден специальным бактериоскопическим или бактериологическим исследованием пеньков волос и чешуек. При поверхностной трихофитии гладкой кожи гистопатологическое исследование очагов трихофитии обнаруживает явления эпидермодермита (разрыхление рогового слоя, паракератоз, акантоз, спонгиоз), отек сосочков и подсосочкового слоя, расширение сосудов, периваскулярную инфильтрацию лимфоцитами, лейкоцитами, эозинофилами и фибробластами. Могут выявляться в волосах и верхних 2/3 рогового слоя мицелий и споры грибов. Данное заболевание необходимо дифференцировать с псориазом, себорейной экземой, микроспорией. Гистопатологические изменения при хронической трихофитии гладкой кожи аналогичны таковым при поверхностной форме, только выражены они более интенсивно. Поражение хронической трихофитией волосистой части головы следует отличать от обыкновенных угрей гладкой кожи, от хронической экземы ногтевых пластинок, от кандидоза, псориаза, красного плоского лишая и дистрофии ногтей. При гистопатологическом исследовании в очагах глубокого стригущего лишая обнаруживаются фолликулит и перифолликулит. Заболевание следует дифференцировать с стафилодермией (остиофолликулит, фолликулит головы), флегмоной, йододермой, бромодермой, вульгарным стафилококковым сикозом области бороды и усов.
Лечение При лечении поверхностного стригущего лишая волосистой части головы и множественных очагов на гладкой коже, а также при поражении пушковых волос больным назначается гризеофульвин по 15 мг на 1 кг массы тела в сутки (в три приема) ежедневно, до первого отрицательного анализа волос или чешуек на наличие грибов (примерно через 15–25 дней). После этого гризеофульвин назначают в той же дозе через день в течение 2 недель; затем один раз в три дня также в течение 2 недель. Одновременно утром очаги смазывают 3–5 %-ным раствором йода, а на ночь в них втирают серно-салициловую, 3 %-ную салициловую кислоты, 10 %-ную осажденную серу или серно-дегтярную (по 5 или 10 % серы и дегтя в равных частях по отношению к мазевой основе) мази. Перед началом лечения волосы на голове обрабатывают и в последующем бреют 1 раз в неделю. При противопоказаниях к гризеофульвину для лечения микозов волосистой части головы можно применять (для эпиляции волос) 4 %-ный эпилиновый пластырь. После эпиляции волос применяется упомянутая наружная терапия. При противопоказаниях к применению и эпилинового пластыря для эпиляции используют рентгеновские лучи. После удаления волос также назначают йодно-мазевую терапию. Единичные очаги трихофитий на гладкой коже лечат ежедневными смазываниями вышеупомянутыми растворами йода и серно-салициловой мазью в течение 2–3 недель, затем 3–4 недели 2 %-ным спиртовым раствором йода (ежедневно или через день). В конце курса терапии обязательно проводится 3-кратное микроскопическое исследование волос и чешуек, взятых в очагах с промежутками 5–7 дней, а потом через 2–3 месяца. Ребенок может посещать детский коллектив только после трех отрицательных результатов микроскопического исследования. Лечение хронического стригущего лишая проводится гризеофульвином и наружными средствами (как и при поверхностной форме заболевания) с обязательным применением препаратов, устраняющих патогенетические механизмы микоза (гормональные и сосудистые средства, витамин А, иммунотерапия). Пораженные ногтевые пластинки удаляются кератолитическими пластырями, мазями и хирургическим методом, затем на ногтевое ложе наносят фунгицидные растворы, мази (раствор йода, серно-салициловая, серно-дегтярная мази и прочие). Одновременно внутрь назначают гризеофульвин из расчета 15 мг на 1 кг массы тела в сутки в три приема. При проведении комплексного квалифицированного лечения заболевание излечивается, однако иногда могут возникать рецидивы. Лечение глубокого стригущего лишая проводится также гризеофульвином. В острой стадии процесса наружно вначале на очаги накладывают примочки (буровская жидкость, 2 %-ный раствор борной кислоты, 0,25 %-ный раствор нитрата серебра, 10 %-ные водные примочки ихтиола и др.). Затем, после уменьшения островоспалительных явлений, наносят серную, серно-салициловую мази или мазь Вилькинсона. Волосы в очагах удаляют ресничным пинцетом. При правильном лечении выздоровление наступает через 4–6 недель. После заживления очагов остаются лишенные волос рубцы. Поверхностная разновидность этой формы заболевания на гладкой коже клинически неотличима от поверхностной трихофитии гладкой кожи, обусловленной антропофильными грибами, и только бактериологический и эпидемиологический анализы помогают правильно определить источник инфекции.
Профилактика Профилактика стригущего лишая включает раннее выявление больных и срочное их лечение в стационаре, обнаружение источников заражения, параформалиновую дезинфекцию одежды, постельных принадлежностей и других вещей больных, сжигание их головных уборов, регулярные плановые и по показаниям обследования детских коллективов, ветеринарный надзор за животными, вакцинацию молодняка вакциной ТФ 130, изоляцию больных животных, санитарно-просветительную работу.
ЛОАОЗ
ОпределениеЛоаоз (синоним: калабарская опухоль) — биогельминтоз, передающийся через укусы кровососущих насекомых (слепней), проявляющийся общеаллергическими симптомами: небольшой лихорадкой, крапивницей, зудом кожи, нарушением кожной чувствительности, эозинофилией в крови. Лоаоз принадлежит к группе филяриозов (см.).
Этиология Возбудителем является небольшая нематода. Размеры микрофилярий — 0,25—0,3 х 0,006—0,008 мм.
Эпидемиология, патогенез и патанатомия Лоаоз распространен только в странах Западной и Центральной Африки. Восприимчивы к лоаозу люди любого пола и возраста, однако чаще болеют взрослые мужчины с черной кожей. Окончательный хозяин — человек, в организме которого зрелые филярии паразитируют в подкожной клетчатке, под серозными оболочками и конъюнктивой. Филярии отрождают микрофилярии, которые ночью находятся в сосудах внутренних органов, а днем концентрируются в периферических сосудах кожи. Промежуточными хозяевами паразитов являются слепни, в организме которых микрофилярии достигают зрелого состояния в течение 7—12 дней. В организме человека становятся половозрелыми через несколько месяцев (от 6 до 18) и могут паразитировать до 15 лет. Главная роль в механизме развития принадлежит токсико-аллергическим реакциям, возникающим на продукты жизнедеятельности паразитов, с чем связано большинство симптомов заражения. Большое значение имеет также фактор механического повреждения тканей в результате передвижения зрелых гельминтов. Патогенетически обусловлена возможность присоединения вторичной бактериальной флоры и формирование абсцессов.
Клиническая картина и диагностика После внедрения возбудителя в организм человека в типичных случаях возникают общие аллергические симптомы: лихорадка, крапивница, зуд кожи, нарушения кожной чувствительности, которые вскоре прекращаются. Через 1–3 года развиваются характерные признаки лоаоза: «калабарский отек», подкожное и внутриглазное перемещение зрелых гельминтов и увеличение эозинофилов в крови. Самым постоянным, обычным симптомом являются преходящие, ограниченные на разных участках туловища и конечностей отеки в виде куриного яйца или укуса осы, безболезненные; кожа над ними не изменена. Перемещение червей под кожей вызывает зуд и жжение, передвижение их в уретре приводит к сильнейшим болям. Проникший под конъюнктиву паразит вызывает отек и покраснение конъюнктивы, отек век, что нередко сопровождается сильной болью в глазу. Особенно опасные симптомы развиваются в связи с массовой гибелью микрофилярий, например при лечении. Отмечаются поражения почек с нефротическим синдромом, синдром менингоэнцефалита и тяжелая мозговая кома, возникающая в результате нарушения центральномозгового кровообращения из-за закупорки капилляров погибшими микрофиляриями. Гибель зрелых паразитов и вторичная инфекция могут повлечь за собой развитие абсцессов различной локализации. Не всегда лоаоз протекает в столь выраженной форме, иногда клинические проявления заражения малозаметны. Диагноз ставится на основании эпидемиологических указаний на пребывание в очаговых по лоаозу странах. Диагноз подтверждается обнаружением микрофилярий в крови, преимущественно в дневные часы. В качестве ориентировочных методов используются РСК и внутрикожная аллергическая проба.
Лечение и профилактика Применяется дитразин (диэтилкарбамазин), который эффективен против всех стадий гельминта. Лечение следует проводить осторожно, сначала с малых доз, лишь ко 2—3-му дню лечения дозу препарата можно довести до 200 мг 3 раза в сутки. Обычные дозы дитразина: 0,4 г мужчинам и 0,3 г женщинам в сутки в течение 14–20 дней. Специфическая терапия лоаоза дитразином требует назначения десенсибилизирующих средств и антибиотиков из-за сильной аллергизации организма в ответ на гибель гельминтов и реальной угрозы присоединения вторичной микробной флоры. Взрослых лоа, перемещающихся под конъюнктивой глаза или под кожей, удаляют хирургическим путем. Профилактика заключается в выявлении и лечении зараженных лиц, оздоровлении окружающей среды в целях ликвидации мест выплода слепней. В плане личной профилактики основой является защита от нападения слепней и химиопрофилактика: дитразин по 200 мг 2 раза в сутки в течение 3 дней подряд один раз в месяц.
ЛУЧЕВАЯ БОЛЕЗНЬ
ОпределениеЛучевая болезнь — определенный комплекс проявлений поражающего действия ионизирующих излучений на организм. Многообразие этих проявлений зависит от вида облучения — общее или местное, внешнее или от инкорпорированных радиоактивных веществ; от временного фактора — однократное, повторное пролонгированное, хроническое облучение; от пространственного фактора — равномерное или неравномерное; от облучаемого объема и локализации облученного участка. В связи с этим могут быть различными и клинические формы поражений (острые и хронические, общие и местные и их сочетания).Лучевая болезнь — завершающий этап в цепи процессов, развивающихся в результате воздействия ионизирующего излучения на ткани, клетки и жидкие среды целостного организма. Лучевая болезнь возникает в результате однократного короткого воздействия радиоактивной энергии в дозе более 100 рад на организм (100 рад = 1 Гр). При облучении тела в дозе менее 100 рад принято говорить не о лучевой болезни, а о лучевой травме.
Этиология, патогенез и патанатомия Из всех форм радиационной патологии наиболее характерной и актуальной является острая лучевая болезнь, которая возникает при однократном, повторном или пролонгированном (на протяжении часов, дней) облучении всего тела или большей его части проникающими излучениями (гамма-лучи, нейтроны, рентгеновские лучи) в дозе, обычно превышающей 1 Гр. Это заболевание характеризуется определенной периодичностью течения и полисиндромностью клинических проявлений, среди которых ведущими являются симптомы поражения гемопоэтической (кроветворной) системы, желудочно-кишечного тракта и нервной системы. Изменения на молекулярном уровне и образование химически активных соединений в тканях и жидких средах ведет к появлению в крови продуктов патологического обмена (в азотистом, водно-солевом, жировом, углеводном обмене), что при облучении в высоких дозах является основой лучевой токсемии. Повреждающее действие ионизирующих излучений особенно сказывается на стволовых клетках кроветворной ткани, эпителии яичек, тонкого кишечника и кожи, оно зависит от уровня и распределения дозы излучения во времени и объеме тела. В первую очередь поражаются системы, находящиеся во время облучения в состоянии активного органогенеза и дифференцировки (образования и развития). При облучении, особенно в малых дозах, имеет значение индивидуальная реактивность и функциональное состояние нервной и эндокринной систем. При костномозговой форме острой лучевой болезни микроскопически обнаруживаются признаки геморрагического диатеза: кровоизлияния в кожу, серозные и слизистые оболочки, паренхиматозные органы. Степень выраженности геморрагического диатеза колеблется в широких пределах в зависимости от тяжести поражения; дополнительные травмы усиливают явления кровоточивости. Обильные кровоизлияния в желудок и кишечник, в легкие, в надпочечники с их разрушением, обширные кровоизлияния в миокард, захватывающие проводящую систему сердца, могут иметь решающее значение в исходе заболевания. Костный мозг теряет обычную консистенцию и становится жидким, его цвет определяется примесью крови; лимфатические узлы выглядят увеличенными за счет геморрагического пропитывания ткани. Глубокие нарушения в кроветворной системе определяют склонность к кровотечениям и частоту развития инфекционных осложнений, которые, как правило, обнаруживаются в период разгара заболевания. К их числу относятся язвенно-некротические гингивиты, некротические ангины, пневмонии, воспалительные изменения тонкого и толстого кишечника. В других органах обнаруживаются признаки нарушения кровообращения и дистрофические изменения. Кожные поражения (выпадение волос, лучевые ожоги) могут отчетливо проявляться при значительном облучении. При микроскопическом исследовании наиболее характерны изменения органов кроветворения, начальные признаки поражения которых обнаруживаются в латентном периоде задолго до ярких клинических проявлений острой лучевой болезни. В лимфатических узлах в первые часы после облучения можно видеть распад лимфоцитов, особенно в центральной части фолликулов, т. е. в зоне расположения В-лимфоцитов; несколько позже выявляются изменения в паракортикальном слое (зона Т-лимфоцитов). В период разгара заболевания на фоне резкой гиперемии в основном видны элементы стромы лимфатического узла и плазматические клетки. Аналогичные изменения наблюдаются в миндалинах, селезенке, групповых фолликулах (нейеровых бляшках) и солитарных фолликулах желудочно-кишечного тракта. В костном мозге быстро развивается аплазия. В период разгара острой лучевой болезни в костном мозге почти не остается обычной кроветворной ткани, видны преимущественно элементы стромы и плазмолитические клетки. Поражение лимфоидной ткани и костного мозга приводит к снижению иммунобиологической реактивности организма и создает благоприятные условия для развития разнообразных осложнений, главным образом аутоинфекционного характера. Высокочувствительна к ионизирующему излучению слизистая оболочка тонкого кишечника, ранние изменения которой проявляются деструкцией активности клеток эпителия крипт с появлением патологических форм митоза. Терминальные изменения связаны с расстройством крово- и лимфообращения, аутоинфекционными процессами; слизистая оболочка отечна, имеются участки изъязвлений и некроза, по поверхности которых видны расплавленные массы фибрина, слизь и колонии микроорганизмов; почти полностью отсутствуют лейкоцитарная инфильтрация, пролиферации местных соединительнотканных и эпителиальных клеток. В печени обнаруживаются нарушения кровообращения и признаки дистрофии, а к моменту гибели — значительные деструктивные изменения с признаками микробной и вирусной инвазии. В сердечно-сосудистой системе при острой лучевой болезни глубокие изменения локализуются главным образом в мелких сосудах, что имеет значение в патогенезе геморрагического диатеза. В сердце имеются дистрофические изменения мышечных волокон, кровоизлияния под эндокард, в миокард и особенно под эпикард. В легких обнаруживаются изменения, связанные с нарушением кровообращения и инфекционными осложнениями, среди которых особого внимания заслуживает так называемая агранулоцитарная пневмония, сопровождающаяся выпадениями серозно-фибриозно-геморрагического экссудата, формированием очагов некроза с колониями микроорганизмов без перифокальной воспалительной реакции. В почках при острой лучевой болезни наблюдаются главным образом нарушения кровообращения и высокая проницаемость сосудов: в их ткани видны кровоизлияния, в просветах капсул клубочков накапливается белковая жидкость с примесью эритроцитов, отмечаются дистрофические изменения эпителия извитых канальцев. Для острой лучевой болезни характерно глубокое нарушение деятельности желез внутренней секреции, которое первоначально оценивается как проявление усиленной функции; в дальнейшем наступает относительная нормализация, а в периоде разгара заболевания выявляются признаки функционального истощения желез. Изменения в нервной системе в форме реактивных явлений или деструкции развиваются параллельно с сосудистыми расстройствами, имеют очаговый характер и локализуются в нервных клетках, волокнах и окончаниях. В морфологической картине при хронической лучевой болезни вначале отмечается сочетание одновременно протекающих процессов деструкции и регенерации; в кроветворной ткани нарастающая очаговая гипоплазия комбинируется с островковой гиперплазией. В условиях пролонгированного лучевого воздействия происходит оживление процессов регенерации, задержка дифференцировки и созревания клеток, что может проявляться цитопенией. В отдаленные сроки после радиационного воздействия различают возрастные изменения и органную патологию, обнаруживающуюся главным образом в тех органах, где преимущественно реализуется энергия ионизирующего излучения. При этом в случаях грубого повреждения происходит замещение соединительной тканью паренхимы органа. Так развивается пневмосклероз при локальном облучении легких в больших дозах, цирроз печени при инкорпорации церия-144, склерозирующий нефроз при поражении полонием-210. Существенные нарушения выявляются в железах внутренней секреции, в центральной и периферической нервной системе. В других органах выявляются признаки атрофии, извращение процессов регенерации и морфологические проявления, свойственные естественному старению. Возрастные изменения под влиянием ионизирующего излучения наступают и проявляются в более ранние сроки. Характерной особенностью воздействия ионизирующего излучения является высокая онкогенная эффективность, которая обусловлена мутагенным действием и общим подавлением иммунологической реактивности организма. В эксперименте опухоли можно получить при облучении любой ткани, при этом отличительной их особенностью является первичная множественность возникновения и мультицентричность развития. Под влиянием ионизирующего излучения может существенно меняться и спектр спонтанных новообразований.
Клиническая картина Острая лучевая болезнь В течении острой лучевой болезни выделяют 4 периода: начальный (период общей первичной реакции), скрытый (период мнимого благополучия), разгара и восстановления (исхода). Частота летальных исходов при острой лучевой болезни зависит от вида ионизирующего излучения, мощности источника и дозы облучения. Для людей (50 %) гибель наступает при дозах около 4,5 Гр. Неуклонно расширяется и становится все более разнообразным контакт человека с источниками ионизирующего излучения, что требует совершенствования лабораторной диагностики острой лучевой патологии, внедрения новых информационных методов экспресс-диагностики, а также принципов интерпретации полученных данных и прогностических критериев. Диагностика острой лучевой болезни, особенно в ранние сроки, представляет значительные трудности ввиду отсутствия каких-либо патогномоничных признаков. Наибольшие сложности возникают при диагностике типичной (костномозговой) формы острой лучевой болезни, для которой характерен довольно продолжительный скрытый период — от 1 недели до 1 месяца. На фоне относительного клинического благополучия в это время в организме формируется так называемый гематологический синдром — характерные цитопенические изменения костного мозга, селезенки, лимфатических узлов и форменных элементов периферической крови, которые в последующем служат патогенетической основой формирования основных синдромов периода разгара. Период первичной общей реакции характеризуется преобладанием нервно-регуляторных сдвигов, главным образом рефлекторных (диспепсический синдром), перераспределительными сдвигами — в составе крови, нарушениями деятельности анализаторных систем. Обнаруживаются симптомы прямого повреждающего действия ионизирующего излучения на лимфоидную ткань и костный мозг: уменьшение числа лимфоцитов, гибель молодых клеточных элементов, возникновение хромосомных аберраций в клетках костного мозга и лимфоцитах. Характерные клинические симптомы в начальном периоде — тошнота, рвота, головная боль, повышение температуры, общая слабость, эритема. В период первичной общей реакции на фоне развивающейся общей слабости и вазовегетативных сдвигов появляются повышенная сонливость, заторможенность, чередующиеся с состоянием эйфорического возбуждения. При острой лучевой болезни тяжелой и крайне тяжелой степени возникают менингеальные и общемозговые симптомы с нарастающим помрачением сознания (от гиперсомнии до сопора и комы), что в период восстановления может сказываться на структуре формирующегося психоневрологического синдрома. Латентный период продолжается в зависимости от дозы облучения от 10–15 дней до 4–5 недель и характеризуется постепенным нарастанием патологических изменений в наиболее поражаемых органах (продолжающееся опустошение костного мозга, подавление сперматогенеза, развитие изменений в тонком кишечнике и коже) при некотором стихании общих нервно-регуляторных нарушений и, как правило, удовлетворительном самочувствии больных. Переход к периоду выраженных клинических проявлений наступает в различные сроки для отдельных тканевых элементов, что связано с длительностью клеточного цикла, а также неодинаковой их адаптацией к действию ионизирующего излучения. Ведущими патологическими механизмами являются: глубокое поражение системы крови и ткани кишечника, изменение иммунитета, развитие инфекционных осложнений и геморрагических проявлений, интоксикация. Продолжительность периода выраженных клинических проявлений не превышает 2–3 недель. К концу этого срока на фоне еще выраженной цитопении возникают первые признаки регенерации костного мозга. В этом периоде острой лучевой болезни причинами летального исхода являются геморрагические проявления и инфекционные осложнения. При лучевой болезни, возникающей в результате облучения с преобладанием нейтронного компонента, возможна несколько большая интенсивность первичной реакции и раннее появление местных лучевых повреждений кожи, подкожной клетчатки, слизистой оболочки полости рта; характерно более частое и раннее возникновение желудочно-кишечных расстройств. При сочетанном гамма- и бета- облучении клиническая картина поражения складывается из симптомов острой лучевой болезни, сочетающейся с бета-поражением открытых участков кожи и бетаэпителиитом кишечника. Общая первичная реакция при этом сопровождается явлениями раздражения конъюнктивы и верхних дыхательных путей; более выражены диспепсические расстройства. Поражения кожи менее глубоки, чем при гамма-облучении, и отличаются относительно благоприятным течением. Типичными отдаленными последствиями острой лучевой болезни являются лучевые катаракты, при тяжелых формах могут быть лейкоцитопения, тромбоцитопения, умеренная общая астенизация и вегетативная дисфункции, очаговые неврологические симптомы. При острой лучевой болезни легкой степени у некоторых больных могут отсутствовать признаки первичной реакции, но у большинства через несколько часов после облучения отмечается тошнота, возможна однократная рвота. При острой лучевой болезни средней степени тяжести отмечается выраженная первичная реакция, проявляющаяся главным образом рвотой, которая наступает через 1–3 ч и прекращается через 5–6 ч после воздействия. При острой лучевой болезни тяжелой степени рвота возникает через 30 мин — 1 ч после облучения и прекращается через 6—12 ч; заканчивается первичная реакция через 6—12 ч. При крайне тяжелой степени лучевой болезни первичная реакция начинается рано: рвота возникает через 30 мин после облучения, носит мучительный, неукротимый характер. IV степень — крайне тяжелая степень острой лучевой болезни — в зависимости от уровня доз проявляется в нескольких клинических формах: костномозговой, кишечной, сосудисто-токсемической, церебральной (табл. 18).
IV степень костномозговой формы: в основе ее механизма развития лежит депрессия кроветворения, однако в клинической картине существенное место занимают признаки поражения кишечника; первичная реакция длится 3–4 дня (возможно развитие эритемы, жидкий стул), с 6—8-го дня могут выявляться энтероколит, энтерит, лихорадка. Общее течение заболевания тяжелое, выздоровление возможно лишь при своевременном лечении. Кишечная форма: первичная реакция тяжелая и длительная, наблюдается развитие эритемы, жидкий стул; в 1-ю неделю возникают выраженные изменения слизистой оболочки полости рта и глотки, температура субфебрильная, стул нормализуется; резкое ухудшение состояния наступает на 6—8-й день заболевания — лихорадка (до 40 °C), тяжелый энтерит, обезвоживание, кровоточивость, инфекционные осложнения. Сосудисто-токсемическая: первичная реакция как при кишечной форме; непосредственно после воздействия возможно кратковременное коллаптоидное состояние без потери сознания; на 3—4-е сутки развиваются тяжелая интоксикация, гемодинамические нарушения (слабость, артериальная гипотония, тахикардия, олигурия, азотемия), с 3—5-х суток — общемозговые и менингеальные симптомы (отек мозга). Церебральная форма: непосредственно после облучения возможен коллапс с потерей сознания, после восстановления сознания (при отсутствии коллапса — в первые минуты после воздействия) возникает изнуряющая рвота и понос с тенезмами; в дальнейшем нарушается сознание, возникают признаки отека мозга, прогрессируют артериальная гипотония, анурия; смерть наступает в 1-е сутки, при явлениях отека мозга. Тяжелая и крайне тяжелая формы лучевой болезни осложняются местными лучевыми повреждениями, которые возможны и при острой лучевой болезни меньшей тяжести с избирательным переоблучением отдельных участков тела. Местные лучевые повреждения имеют аналогичную общим фазность течения, однако латентный период их относительно короче и выраженные клинические проявления наблюдаются в первые 7—14 дней, т. е. в сроки, когда общие признаки лучевой болезни выражены слабо.
Хроническая лучевая болезнь Хроническая лучевая болезнь — заболевание с многообразными клиническими симптомами — развивается при длительном действииионизирующего излучения в относительно малых, но превышающих допустимые уровни дозах. Характерными чертами хронической лучевой болезни являются поражение различных органов и систем, длительность и волнообразность течения, сочетание симптомов повреждения критических органов с восстановительными и приспособительными реакциями адаптивных и регуляторных систем. Выделяют хроническую лучевую болезнь, развивающуюся вследствие общего длительного облучения от внешних источников, а также в результате поступления в организм равномерно и неравномерно распределяющихся радиоактивных нуклидов. Своеобразием хронической лучевой болезни при неравномерном облучении (поступление нуклидов радия, йода, фосфора и др.) является сочетание прогрессирующих глубоких местных изменений со слабо выраженными и поздно проявляющимися признаками общей реакции организма. В этих случаях имеются стертые проявления заболевания, обнаруживаемые только при специальном исследовании (доклиническая стадия). При общем длительном облучении относительно рано возникают многообразные нарушения нервно-висцеральной, и в первую очередь нервно-сосудистой регуляции, наблюдаются признаки функциональной недостаточности, а затем и структурного поражения наиболее радиочувствительных органов и систем. Первоначальная неустойчивость показателей крови сменяется уменьшением числа лейкоцитов (нейтрофилов) и тромбоцитов вследствие нарушения физиологической регенерации клеток белого и мегакариоцитарного рядов костного мозга. Анемия в результате глубокого подавления красного ростка костного мозга наступает редко (лишь при интенсивном облучении) и свидетельствует о тяжелом лучевом поражении и неблагоприятном прогнозе. При уменьшении дозы или прекращении облучения в кроветворной системе, как правило, хорошо выражены восстановительные процессы, напряженность которых таит в себе опасность перехода к патологической регенерации. Нервно-регуляторные нарушения кровообращения и сердечной деятельности сменяются в дальнейшем более выраженной недостаточностью регионарной гемодинамики: несколько снижается артериальное давление, позднее выявляется умеренное расширение границ сердца, приглушение сердечных тонов, изменение ЭКГ, указывающие на развитие нерезких диффузных изменений миокарда. Ранние нестойкие сдвиги ферментативной активности и секреторно-моторной функции желудочно-кишечного тракта по мере возрастания суммарной дозы облучения сменяются стойким закономерным угнетением секреции. Восстановительные процессы в эпителии слизистой оболочки наблюдаются даже при относительно высоких дозах облучения, возможна патологическая регенерация с развитием опухолей желудочно-кишечного тракта. В нервной системе при длительном воздействии ионизирующего излучения постепенно развиваются регуляторные сдвиги, ранее всего сказывающиеся в сфере вегетативно-сосудистой иннервации — синдром нейроциркуляторной дистонии, чаще гипотонического типа. Позднее возникает отчетливая функциональная недостаточность, формируется астенический синдром (см.), возможны микроструктурные изменения, обнаруживаемые при морфологическом исследовании. В случаях, когда суммарная доза при длительном общем облучении превышает 2–4 Гр, возможно появление симптомов, указывающих на легкие микронекротические и дистрофические изменения в центральной нервной системе. Для хронической лучевой болезни характерна астения. Развитие астении происходит исподволь, с колебаниями в интенсивности и заметным утяжелением по мере продолжения воздействия ионизирующего излучения. Нарастают чувство усталости, разбитости, нарушения сна, аффективная несдержанность с повышенной ранимостью и гиперпатией к внешним раздражителям; головные боли приобретают более стойкий характер, иногда сопровождаясь нерезкими оптико-вестибулярными расстройствами и вазовегетативными кризами по типу диэнцефальных. Психозы в собственном смысле, вне состояния редко; в их формировании существенна роль дополнительных факторов. При действии радиоактивных нуклидов, избирательно накапливающихся в отдельных органах, изменения зависят от уровня доз и анатомофункциональных особенностей ткани органов. Поражения костных структур (некрозы, опухоли) описаны при воздействии нуклидов стронция и радия; анемия — при тяжелых поражениях нуклидами тория; пневмосклероз и рак легкого — от сочетанного послерадиационного воздействия у работников урановых рудников. При высоких уровнях доз относительно рано возникают дистрофические и некробиотические процессы (остеонекроз, гипопластическая анемия, пневмосклероз); при меньших дозах в отдаленные сроки наблюдается развитие опухолей и лейкозов.
Диагностика Количественные изменения некоторых гематологических показателей находятся в обратной корреляционной зависимости от поглощенной дозы облучения, что и определяет важность лабораторных методов в ранней диагностике острой лучевой болезни. Все методы лабораторной диагностики лучевой болезни делятся на: — гематологические, позволяющие оценить динамику числа форменных элементов костного мозга и периферической крови и их качественные изменения; — цитогенетические или кариологические, включающие анализ хромосомных аберраций клеток костного мозга и лимфоцитов периферической крови после стимуляции их в культуре митогенами; — микробиологические — анализ аутофлоры (собственной флоры) кожи, слизистых, кишечника; — биохимические, включающие определение ферментов, метаболитов, продуктов обмена нуклеиновых кислот; — биофизические, основанные на люминесценции биологического материала. Наибольшее значение имеют те показатели, которые можно рассматривать в качестве биологических индикаторов поглощенной дозы ионизирующего излучения. С определенной долей условности по степени диагностической значимости: — определение хромосомных аберраций в культуре лимфоцитов и клеток костного мозга; — подсчет абсолютного числа лимфоцитов периферической крови в определенные сроки (3—6-е сутки после облучения); — подсчет количества пролиферирующих эритробластов и числа митозов в клетках костного мозга; — определение числа лейкоцитов периферической крови на 7—9-е сутки после облучения (табл. 20);
— определение продуктов деградации нуклеиновых кислот (тимидина, дезоксиуридина и дезоксицитидина) в моче. Представленные лабораторно-диагностические показатели позволяют с определенной степенью надежности ответить на принципиально важные вопросы (постановка диагноза, определение степени тяжести, периода и фаз болезни). Лабораторная диагностика лучевого поражения — это возможность в ранний период после облучения обнаружить лучевое поражение, определить степень тяжести, прогнозировать его возможный исход, возникновение осложнений в различные периоды болезни, обеспечить лабораторный контроль за эффективностью проводимого лечения (табл. 21). Методы индикации лучевого поражения должны регистрировать специфическую реакцию на облучение и определить форму и степень тяжести острой лучевой болезни в зависимости от доз облучения.
Выделяют соматические эффекты, зависящие от облучения данного индивидуума, и генетические эффекты у потомства, зависящие от радиационного воздействия на зародышевые клетки. Соматические эффекты, в свою очередь, подразделяются на ранние, проявляющиеся развитием различных вариантов острой или хронической лучевой болезни или местных радиационных повреждений, и поздние, к которым относят повышенный риск развития опухолей (лейкозы) и укорочение продолжительности жизни (так называемый синдром преждевременного старения). Соматические эффекты более отчетливо зависят от индивидуальной дозы и носят пороговый характер. Для ранних соматических эффектов характерна четкая зависимость от дозы облучения, удовлетворительно описываемая сигмовидной кривой с наличием минимальной дозы, обозначаемой как пороговая. Считают, что внешнее гамма-излучение в дозе 0,25 Гр не вызывает заметных отклонений в общем статусе и морфологическом составе периферической крови (табл. 19). Влияние облучения в дозе 0,25—0,5 Гр может быть выявлено при статистической обработке результатов подсчета форменных элементов крови у достаточно большой группы людей.
Дозы в диапазоне 0,5–1 Гр могут вызывать нерезко выраженные изменения в картине крови (снижение числа тромбоцитов и лейкоцитов и симптомы вегетативной дисрегуляции). Пороговой дозой для формирования острой лучевой болезни считают дозу 1 Гр. Доза пролонгированного облучения, не вызывающая клинических симптомов, значительно превышает дозу при одномоментном облучении. Хроническая лучевая болезнь развивается при фракционном облучении в дозе 1,5 Гр и выше. При неравномерном или преимущественно местном облучении характер изменений в тканях зависит как от локальной дозы, так и от многообразия структур, заключенных в облучаемом сегменте. С этим связано и различие сроков формирования изменений: более ранних — в тканях высокорадиочувствительных; более поздних — в тканях относительно резистентных. В условиях массовых поражений наибольшее практическое значение имеет острая лучевая болезнь от внешнего кратковременного гамма-нейтронного облучения, от внешнего равномерного гамма-бета облучения, от неравномерного облучения, а также местные радиационные поражения, возникающие при локальном воздействии любого вида радиации в дозах, вызывающих клинически значимые изменения локально облученной ткани. Острая лучевая болезнь развивается при внешнем гамма- и гамма-нейтронном облучении в дозе, превышающей 1 Гр, полученной одномоментно или в сроки от 3 до 10 суток. При значительном вкладе нейтронов в общую дозу увеличивается тяжесть первичной реакции, резче бывает выражено первичное снижение числа лейкоцитов, наблюдается нарушение обычного соотношения в поражении костномозгового и лимфоидного кроветворения (более выражено повреждение лимфопоэза, более заметны бывают хромосомные аберрации), велики, особенно в поздние сроки, изменения в более радиорезистентных органах и тканях — хрусталике, эндотелии сосудов, рано возникают кишечные расстройства. Значения показателей, систематизированных определенным образом, позволяют решить принципиально важные вопросы, кроме выше перечисленных — эффективность лечения и прогнозирования возможных осложнений. Расчет дозы по номограмме «доза-эффект»: — подсчитать число лимфоцитов больного (оно равно «х» г/л); — на левой шкале номограммы отложить значение «х» и провести прямую до пересечения с графиком, соответствующим для забора крови после облучения (на правой стороне номограммы соответственно каждому графику указывают день после облучения); — из точки пересечения прямой с графиком восстановить перпендикуляр к нижней шкале номограммы, указывающий дозу облучения. Расчет полученной дозы по продолжительности латентного периода: — на оси ординат отложить значение, соответствующее продолжительности латентного периода; — из этой точки провести прямую, перпендикулярную оси ординат, до пересечения с графиком; — из точки пересечения с графиком восстановить перпендикуляр к оси абсцисс и получить значение дозы облучения. Перспективными лабораторными тестами диагностики острой лучевой болезни являются: — микроядерный тест; — изучение седементационных характеристик эритроцитов; — методы оценки свечения ДНК.
Лечение Лечение проводится в соответствии с проявлением острой лучевой болезни. Лечение первичной реакции имеет симптоматический характер. Для предотвращения рвоты больным назначают церукал по 1 таблетке 5 раз в день. Препарат может вводиться внутривенно по 2 мл каждые 2 ч 4–6 раз в течение суток. Если введение церукала не предотвращает рвоты, могут быть применены инъекции дроперидона 0,5–1,0 мл 0,5 %-ного раствора внутримышечно или введение под кожу 0,5–1,0 мл 0,1 %-ного раствора атропина. Для профилактики инфекций больным создают асептические условия (боксы, применение асептических растворов, ультрафиолетовая стерилизация воздуха). Назначаются антибиотики для селективной контаминации кишечника. В условиях тяжелой и крайне тяжелой степени болезни в первые 2–3 суток после поражения проводят дезинтоксикационную терапию — реополиглюкин (400 мл в сутки внутривенно). В связи с массивным клеточным распадом, активизирующим процесс свертывания крови, снижение фибринолиза, освобождение кининов, возможно развитие ДВС-синдрома. О его появлении можно судить по быстрому свертыванию крови в игле при попытке получить кровь из вены и затруднению в получении крови из пальца для анализа. С целью купирования ДВС-синдрома может быть использовано применение плазмафереза (по 600 мл), свежезамороженной плазмы и гепарина (500—1000 Ед каждые 2 ч внутривенно). Для предотвращения инфекционных осложнений, которыми прежде всего опасен агранулоцитоз, необходим ряд профилактических мероприятий. С первого дня наступления агранулоцитоза независимо от появления септицемии, проявляющейся нередко только гипертермией, и от выявления очагов инфекции больной помещается в изолятор, обеспечивающий асептические условия его ведения. Для подавления эндогенной флоры, патогенной и условно патогенной производится санация слизистой желудочно-кишечного тракта с помощью неабсорбируемых антибиотиков, бактерицидных препаратов. Эффективен бисептол (суточная доза в 3 г) в сочетании с фолиевой кислотой (6—10 мг в сутки), гентамицин (внутривенно по 3 мг/кг в сутки и одновременно внутрь до 200 мг). В период агранулоцитоза, как и при глубокой тромбоцитопении, подкожные и внутримышечные инъекции отменяют, все препараты вводят внутривенно или назначают внутрь. При инфекционных осложнениях назначают пенициллин, цепорин, гентамицин, ацикловир (при герпесе), бисептол в больших дозах. Антибактериальная терапия назначается с первого дня подъема температуры при агранулоцитозе. Одним из грозных осложнений агранулоцитоза и прямого лучевого поражения является некротическая энтеропатия (кишечный синдром). Профилактическое назначение бисептола или стерилизующих желудочно-кишечный тракт комбинаций антибиотических препаратов и полное голодание на 1–1,5 недели способствует уменьшению тяжести. В этот период назначается парентеральное питание, стерилизация кишечника неабсорбированными антибиотиками плюс метронидазол внутривенно. Медикаменты внутрь в период голодания (кроме средств, купирующих диарею) не назначают, все препараты вводят внутривенно. Обычно уже после нескольких часов голодания больные отмечают уменьшение боли в животе и урежение позывов при поносе. Продолжительность голодания ограничивается временем прекращения всех признаков некротической энтеропатии и обычно не превышает 7—10 дней. При геморрагическом синдроме необходимо многократное переливание тромбоцитарной массы в лечебной дозе (4 ЕД). Срок выписки перенесших острую лучевую болезнь определяется индивидуально не ранее, чем когда количество лейкоцитов поднимается до 3–4 тыс., а тромбоцитов — до 100–150 тыс. в 1 мкл крови. После ликвидации всех выраженных проявлений лучевого поражения больные выздоравливают. При легком и среднетяжелом поражении выздоровление бывает обычно полным, хотя многие годы может сохраняться умеренная астения. После тяжелой лучевой болезни может развиться катаракта, кровоизлияние на глазном дне. Диспансеризация проводится в течение длительного периода.
ЛЯМБЛИОЗ
ОпределениеЛямблиоз — распространенная кишечная инфекция, вызываемая у человека одноклеточным паразитом лямблией, обитающей в организме человека в просвете тонкой кишки.Этот возбудитель первым обнаружил в фекалиях человека с диареей и описал Антон Ван Левенгук в 1681 г. Впоследствии эти простейшие были подробно описаны в 1859 г. Д. Ф. Лямблем, который наблюдал их в фекалиях детей с диареей в Праге; впоследствии они были названы в честь этого ученого.
Этиология Возбудителем лямблиоза у человека является лямблия, относящаяся к типу простейших, классу жгутиковых. Характерными свойствами лямблий являются стадийность развития и выделения и устойчивость во внешней среде. Особенности типа питания обеспечивают всасывание питательных веществ всей поверхностью тела. Стадийность развития и выделения обеспечивает высокую выживаемость лямблий как во внешней среде, так и в организме человека и животных. В организме человека и животных лямблии имеют две формы существования — вегетативную и в виде спор. В вегетативной форме лямблии (трофозоиты) преимущественно находятся в верхних отделах тонкой кишки. При попадании в толстую кишку вегетативные формы превращаются в цисты, которые выделяются с испражнениями во внешнюю среду.
Лямблия интестиналис
Вегетативная форма имеет размеры 10–18 мкм в длину и 8—10 мкм в ширину. Тело имеет грушевидную форму, снабжено жгутиками. Лямблии подвижны, они перемещаются из верхних в средние или нижние отделы тонкой кишки. Возможность паразитирования лямблий в желчных путях, желчном пузыре отрицается большинством исследователей. Концентрированная желчь оказывает губительное действие на лямблии. Трофозоиты питаются и размножаются в тонком кишечнике, прикрепившись к клеткам эпителия, поглощают питательные вещества и различные ферменты, а следовательно, вмешиваются в процесс мембранного пищеварения и нарушают его. Образование цист происходит в нижнем отделе тонкой кишки и в ободочной кишке. Цисты имеют овальную форму, их размеры — 8—12 и 7—10 мкм. Размножаются цисты путем деления ядра. Цисты обнаруживаются уже в верхних отделах тонкого кишечника, но наибольшее количество их концентрируется в слепой кишке, где они накапливаются. Лямблии размножаются в зоне максимального их количества в тонком кишечнике, где происходит деление вегетативных особей. Размножение вегетативных форм и инцистирование лямблий — независимые процессы. Нормальная жизнедеятельность лямблий в тонком кишечнике зависит от состояния пищеварительной системы. Голодание хозяина резко сокращает число лямблий. Богатая углеводами диета способствует резкому увеличению количества лямблий, преимущественно белковая диета угнетает паразита. Желчь в низких концентрациях стимулирует развитие и размножение лямблий. Свойственная организму детей высокая интенсивность пристеночного пищеварения является одной из причин их большей пораженности по сравнению со взрослыми. Находки лямблий у взрослых часто сопровождаются патологией желудочно-кишечного тракта, связанной с повышением уровня пристеночного пищеварения; у таких больных лямблиоз с трудом излечивается специфическими медикаментами. Благоприятствуют развитию лямблиоза удаление части желудка и снижение кислотности желудочного сока. Цисты лямблий устойчивы во внешней среде. В увлажненном кале сохраняются до трех недель, выживают в условиях холода. Во влажных условиях, в тени сохраняются до 70 дней. Обычные стандартные концентрации хлора, используемые для обеззараживания водопроводной воды, не оказывают на них губительного воздействия. В водопроводной воде лямблии сохраняются до трех месяцев. Только фильтрованная водопроводная вода свободна от цист лямблий. Цисты лямблий отличаются высокой кислотоустойчивостью. На инфицированном белье, полотенцах цисты лямблий сохраняются от 6 ч до 2 суток. При комнатной температуре цисты лямблий сохраняют жизнеспособность в течение 4–5 дней, в песчаной почве — до 12 дней, на солнце — до 9 дней. Заражение происходит посредством цист, так как вегетативные формы быстро погибают во внешней среде. Длительно они выживают на различных пищевых продуктах, особенно на влажных. При высыхании происходит незамедлительная гибель цист. Во влажной среде наблюдается выраженная устойчивость их к действию ультрафиолетовых лучей. В кишечнике мух цисты могут выживать от 30 ч до нескольких суток, в кишечнике тараканов — до 8 суток. Отношение к большинству дезинфицирующих растворов такое же, как у цист амеб. Водные растворы лизола и нафтализола в 5 %-ной концентрации убивают их в фекалиях через 30 мин, 2 %-ный раствор лизола — в течение 1 ч. Пищевой уксус (9 %-ная уксусная кислота), даже разведенный пополам с водой, убивает цисты в течение 5—10 мин. Они устойчивы к хлору — 5 %-ный водный раствор хлорамина не оказывает губительного действия на цисты лямблий. Однако при дозе активного хлора 30 мг/л через 3 ч погибает 62 % цист лямблий и только 5 % цист амеб.
Эпидемиология Лямблиоз относится к паразитарным заболеваниям, возбудители которых ведут зависимый образ жизни и существуют за счет хозяина (человека и некоторых животных). Лямблиоз распространен повсеместно. Зараженность им особенно высока у детей в возрасте от 1 до 5 лет (около 40 %), с возрастом она снижается. Лямблиоз широко регистрируется во многих городах России, в странах Прибалтики, на Украине, в Молдавии, в странах Средней Азии и Закавказья. За рубежом — в США, Швеции, Англии, Франции и других странах регистрировались эпидемические вспышки лямблиоза. Лямблиоз поражает различные виды животных — собак, кошек, кроликов, морских свинок и других млекопитающих. Источником заражения служат человек или животное, однако человеку принадлежит ведущая роль. Зараженные человек и животные выделяют зрелые цисты. Период выделения у человека цист начинается в среднем на 9—12-й день после заражения и может длиться многие месяцы. Скрытый инфекционный период укорачивается при заражении большими дозами возбудителя. Выделение цист происходит волнообразно, прерывисто. Периоды выделения чередуются с периодами затихания процесса, при этом продолжительность пауз между выделением цист составляет от 1 до 17 дней. При однократном инфицировании лямблиями заражение длится в среднем 6 месяцев. Наиболее опасен как источник заражения больной в период стихания диареи, так как именно в это время начинают выделяться цисты. В 1 г фекалий содержится до 22 млн жизнеспособных цист, а в среднем — 1,8 млн цист. Механизм передачи инфекции — фекально-оральный, пути распространения возбудителя — контактный, пищевой, водный. Контактно-бытовой путь наибольшее значение имеет в детских учреждениях. В качестве факторов передачи важную роль играют полы, ковры, игрушки, туалеты. Наиболее активным фактором передачи являются руки детей и персонала. Водный путь. Описано большое число вспышек лямблиоза, связанных с водным путем распространения. Известны случаи заражения в бассейнах, через воду открытых водоемов и водопроводную воду. В сточной воде, в малогабаритных очистных сооружениях цисты лямблий выживают до 120 дней. В молочных продуктах цисты могут выживать до 112 дней; на продуктах, таких как хлеб, яблоки, вареный картофель, цисты выживают несколько часов, а при большой влажности и дольше. Насекомые (мухи, тараканы) также могут способствовать распространению цист лямблий. Регистрируются в основном водные и пищевые вспышки лямблиоза. Установлена относительно более высокая частота лямблиоза у детей до 9 лет, которая в 2–3 раза превышает таковую у взрослых. Дети начинают заражаться с 3-месячного возраста, что объясняется более высоким для них риском заражения, отсутствием естественной иммунизации, более высоким уровнем пристеночного пищеварения. Мальчики поражаются в 2–3 раза чаще, чем девочки, а в возрасте старше 10 лет пораженность женщин уже достоверно превышает пораженность лямблиями мужчин. Выделяют профессиональные группы риска — работники детских дошкольных учреждений, работники ассенизационной и ирригационной служб. Установлено, что употребление большого количества сахарозы является фактором, предрасполагающим к развитию лямблиоза. В эпидемиологии лямблиоза существенную роль играют также предрасполагающие к заболеванию факторы, такие как белковое голодание, снижение соляной кислоты в желудке, нарушения иммунной системы, наркомания. Сезонность лямблиоза на территории центральной части Россойской Федерации наиболее выражена в весенние месяцы — апрель, май, а также летом; наименьшее число случаев регистрируется в ноябре — декабре.
Патогенез Вопрос о механизме развития лямблиоза крайне сложен и до сих пор окончательно не разрешен. Болезнетворность лямблий в течение ряда лет ставилась под сомнение, что связано с отсутствием отчетливых клинических симптомов заболевания и характерных патологоанатомических изменений пораженных органов при лямблиозе, а также с широким распространением случаев носительства лямблий. В настоящее время доказано, что лямблии не являются безвредными, и в ряде случаев заражение ими приводит к развитию болезни, которую необходимо диагностировать и лечить. Лямблии размножаются в кишечнике человека в огромных количествах, что не может быть безразличным для организма. В течение своей жизни они многократно прикрепляются и открепляются от стенки кишечника, что вызывает механическое раздражение, а также воздействует на нервные окончания стенки кишки и может привести к патологическим реакциям со стороны органов пищеварения. Происходят усиление обменных процессов и частая смена эпителия с заменой зрелых и функционально полноценных клеток молодыми, функционально незрелыми. Это приводит к нарушению всасывания пищевых веществ, в первую очередь жиров и жирорастворимых витаминов, а также углеводов и белков. Наиболее тяжелым патологическим синдромом является нарушение процессов всасывания вследствие токсического действия лямблий на подслизистый слой тонкой кишки, усиленного бактериальной колонизацией, общей недостаточностью белков (что часто встречается у жителей тропиков). Нарушается также синтез ферментов, играющих существенную роль в окончательном расщеплении углеводов до моносахаридов. Лямблиозу часто сопутствует дисбактериоз кишечника, особенно возрастает численность аэробной микрофлоры. Длительное паразитирование лямблий в организме человека приводит к нарушению функции печени и кишечника. Выделяемые лямблиями продукты обмена и вещества, образующиеся после их гибели, всасываются и вызывают сенсибилизацию организма человека. У больных отмечается выраженная эозинофилия. Выраженность гиповитаминоза С находится в прямой зависимости от выраженности клинических проявлений лямблиоза. Паразитирование лямблий в тонкой кишке сопровождается рядом важных аспектов. Схематически их можно представить последовательно следующим образом: — внедрение лямблий в глубину ткани кишечной стенки и непосредственное цитопатическое воздействие метаболитов паразита приводят к развитию воспалительного процесса; — в слизистой двенадцатиперстной и тощей кишок наблюдаются субатрофические и тотально-атрофические изменения. При этом происходит повреждение щеточной каймы эпителия слизистой кишечника, что приводит к развитию синдрома мальабсорбции; — с нарушением процессов всасывания дисахаридов, витаминов, жиров снижается выработка ферментов кишечных секретов, что ведет к развитию вторичной ферментопатии и нарушению процессов пищеварения; — нарушается связывание желчных кислот, появляются их токсические метаболиты, что служит одним из механизмов кожного зуда, а также двигательных расстройств желудочно-кишечного тракта, особенно желчевыводящих путей; — снижение выработки иммуноглобулина А, истощение системы иммунной защиты слизистых, что ведет к хронизации процессов в желудочно-кишечном тракте; — в результате длительного присутствия лямблий в организме, накопления продуктов нарушения метаболизма, в том числе за счет субстанций распада жизнедеятельности простейших, особенно при сниженной иммунной защите, способной ограничить их размножение, формируется синдром хронической внутренней интоксикации, приводящий к повреждению практически всех органов и систем организма; — развитие энтерита связывают с непосредственным действием метаболитов лямблий на клетки слизистой желудочно-кишечного тракта. Активация мигрирующих малых Т-лимфоцитов в слизистой кишки, продукция секреторных иммуноглобулинов А и Е, образование иммунных комплексов играют существенную роль в механизме развития заболевания. Иммунные комплексы активируют тучные клетки, выделяющие серотонин, гистамин, вазоактивный кишечный полипептид. Последний, увеличивая продукцию циклического аденозинмонофосфата, форсирует ток жидкости и хлоридов в просвет кишки. Повышенная продукция простагландина Е, нарушение регуляции образования пептидных гормонов — секретина, холецистокинина и панкреазимина — обусловливают нарушение двигательной функции кишечника, желчного пузыря и протоков, способствуя неустойчивому стулу, холестазу. Активированные антигенами паразита Т-лимфоциты оказывают цитопатическое действие на эпителий, стимулируют пролиферацию кишечного эпителия в криптах, повышенное слизеобразование бокаловидными клетками. В случае длительного течения заболевания это приводит к дистрофическим изменениям в стенке кишечника.
Клиническая картина Клиника лямблиоза многократно пересматривалась и переоценивалась. Острый период характеризуется диареей, тошнотой, анорексией, резкими болями в верхней и средней верхней части живота, вздутием кишечника. Очень характерным признаком острой фазы лямблиоза является непереносимость лактозы. Острый период длится обычно несколько дней, после чего лямблиоз чаще всего переходит в подострую или хроническую стадию, для которых характерны кратковременные обострения. Прежде всего они проявляются в появлении жидкого стула и вздутия кишечника. При этом часты жалобы на головные боли, потерю в весе, повышенную утомляемость. Выделяют 2 основные клинические формы кишечного лямблиоза: — первичная инфекция с диареей, клиническими и лабораторными признаками нарушения всасывания в пищеварительном тракте; течение этой формы лямблиоза кратковременное, обычно происходит быстрое самостоятельное прекращение болезни, она легко поддается лечению; — затяжное рецидивирующее течение, встречающееся чаще всего у больных с нарушением устойчивости слизистой кишечника специфической или неспецифической природы; развитие этой формы возможно даже при благоприятных санитарно-гигиенических условиях среды пребывания человека. Лямблиоз также может протекать в субклинической и бессимптомной формах. Частота встречаемости клинически выраженного лямблиоза составляет 13–43 % от всех инвазированных, субклинического — 49 %, бессимптомного — 25–28 %. Лямблиоз клинически классифицируют следующим образом: I. Лямблиоз без клинических проявлений (скрытый); II. Лямблиоз с клиническими проявлениями: — кишечная форма — функциональные расстройства кишечника (дуоденит, энтерит, дуоденогастральный рефлюкс, гастроэнтерит); — билиарно-панкреатическая форма — дискинезии желчевыводящих путей, диспанкреатизм, реактивный панкреатит; — форма с внекишечными проявлениями — нейроциркуляторная дисфункция, астеноневротический синдром, аллергические проявления; — смешанная форма. Первичное заражение у детей обычно сопровождается выраженными клиническими симптомами. В очаговых районах многие случаи заболевания, прежде всего у взрослых, протекают бессимптомно. Период клинической инкубации составляет от 1 до 4 недель, чаще всего 2 недели, однако во время вспышек он может сокращаться до 5—10 дней. Кишечная форма характеризуется явлениями дуоденита, еюнита или энтероколита. Стул больных неустойчив, наблюдается чередование нормального стула с периодическими поносами, кашицеообразными каловыми массами с примесью слизи, но без крови. Боли в животе колющего или режущего характера. Иногда бывают тошнота, рвота. Сюда же можно отнести в качестве самостоятельной желудочную, или гастродуоденальную, форму лямблиоза, протекающую при явлениях анацидного, гипацидного и, реже, гиперацидного гастрита. Кишечные формы лямблиоза могут симулировать острый или хронический аппендицит, а также проявляться симптомами язвенной болезни желудка и двенадцатиперстной кишки. Описана также отечная форма лямблиоза кишечника с резким исхуданием, общей слабостью, анемией, уменьшением уровня белка и явлениями поливитаминной недостаточности (см. Полигиповитаминная недостаточность). Эта форма может быть смешана с заболеваниями почек, сердца, алиментарной дистрофией. Печеночная форма дает клиническую картину холецистита, гепатохолецистита или холангита. У взрослых отмечаются боли в правом подреберье, горечь и сухость во рту, тошнота, неустойчивый стул, боли в верхней части живота, реже беспокоят боли вокруг пупка, снижение аппетита, отмечается болезненность в точке проекции желчного пузыря. В механизме развития лямблиозных холециститов, по-видимому, главную роль играют отраженные нервно-рефлекторные воздействия, так как в самом желчном пузыре лямблии обнаруживаются редко. Нервная форма лямблиоза протекает с преобладанием невротических симптомов: слабости, раздражительности, плаксивости, головных болей, болей в области сердца, головокружений, расстройств сна; в некоторых случаях эти симптомы являются преобладающими. Известны также клинические формы лямблиоза с преобладанием аллергических проявлений в виде неукротимого кожного зуда, крапивницы, бронхиальной астмы и астматического бронхита, эозинофильных легочных инфильтратов, иногда упорных блефаритов. Как правило, наблюдаются смешанные клинические формы лямблиоза с преобладанием тех или иных симптомов. Поэтому некоторые клиницисты характеризуют лямблиоз как гепато-колито-невротический синдром. При всех формах может наблюдаться нарушение обменных процессов, проявляющееся в упадке питания, отставании в весе, анемии гипохромного типа. Бессимптомный, или скрытый, лямблиоз встречается чаще, чем клинически выраженные формы, и может переходить в последние. Для этой формы употребляется термин «здоровое носительство». У значительной части детей имеют место изменения на кожных покровах инфекционно-аллергического генеза или усиление проявлений экссудативно-катарального диатеза. Как правило, из-за отсутствия целенаправленного обследования диагноз острой стадии лямблиоза не ставится, и поэтому врачи имеют дело у детей с хронической стадией лямблиоза. Для хронической стадии лямблиоза характерны симптомы: — нарушения функций желудочно-кишечного тракта — неустойчивый стул, стеаторея, чередование запоров и поносов, мальабсорбция, умеренные боли в животе, вздутие живота, тошнота, снижение аппетита; — нарушения общего состояния — отставание в физическом развитии, головные боли, недомогание, снижение массы тела, признаки нарушения питания; — на кожных покровах — мелкопятнистые аллергические сыпи, атопический дерматит, крапивница и редко — отек Квинке. У детей, больных лямблиозом, обнаруживают характерную симптоматику поражения кожи, которую с определенной долей достоверности можно использовать как «дерматодиагностику» паразитарного заражения. Основание для целенаправленного лабораторного исследования на лямблии — бледность кожных покровов, особенно кожи лица (при высоких цифрах гемоглобина) и носа («мраморная белизна» кожи носа); — неравномерная окраска кожи в сочетании с ее слабожелтушным оттенком или буровато-желтушная окраска кожи шеи, боковых поверхностей живота, подмышечных складок, или серый и серо-желтушный оттенок кожи (при стойких запорах); — фолликулярный точечный кератоз, клинически проявляющийся фолликулярными припухлостями на фоне нарастающей общей сухости кожи и создающий впечатление «гусиной кожи» с преимущественной локализацией на разгибательной поверхности рук, ног, боковых поверхностях живота и т. д., изменением кожи ладоней и подошв — вначале окраска кожи ладоней и подошв приобретает кирпично-красный цвет, затем оранжевый, появляются сухость кожи, шелушение, прежде всего на кончиках пальцев, а потом — на всей ладони; — изменения кожи шеи проявляются мельчайшей папулезной сыпью, в виде прерывистых цепочек, слегка пигментированных, что создает впечатление «волнистой» пигментации кожи шеи; — поражение красной каймы губ от легкой сухости и шелушения до выраженного воспаления с трещинами, заедами, шелушением вокруг рта; — изменения волос — они истончаются, рост их замедляется, окраска становится разноцветной. Выделяют некоторые особенности течения атопических дерматитов (как острых, так и хронических) у детей при лямблиозном заражении. У детей с лямблиозом чаще возникают острые аллергические состояния, чем у детей без паразитоза. Острый аллергоз носит распространенный характер, чаще наблюдается сочетание крапивницы с отеком Квинке. В большинстве случаев при лямблиозном заражении возникают псевдоаллергические (анафилактоидные) реакции. Течение острого аллергоза при этом упорное, затяжное; патологические изменения с трудом поддаются медикаментозной терапии, часто возникает необходимость в назначении продленного лечения гормональными препаратами. Больных беспокоят выраженный зуд кожи и конъюнктив, чувство «песка» в глазах, ринорея. Однако поражение желудочно-кишечного тракта при крапивнице, отеке Квинке у детей с лямблиозом малосимптомное, стертое; клиническая симптоматика проявляется в отдаленные сроки после острого процесса. Хронические формы дерматитов — на фоне интоксикационного синдрома с описанной дерматологической симптоматикой атопические дерматиты приобретают более тяжелое течение. У детей раннего возраста экзема носит распространенный характер. Течение непрерывноповторяющееся. Отмечаются упорное мокнутие, выраженный зуд. В большинстве случаев у детей с экземой и лямблиозом ярко проявляются признаки вторичного синдрома мальабсорбции (жидкий и частый стул, кал пенистый с неприятным запахом). Эффективность основной терапии низкая, заболевание носит упорный характер; улучшение отмечается только после назначения гормональных препаратов. У детей более старшего возраста обнаруживают нейродермит с распространенным поражением кожи. Течение заболевания также носит упорный характер, со склонностью к частым обострениям. В периоде обострения нейродермита характерны эритродермия и выраженный зуд. Обязательно присутствует симптоматика распространенного поражения желудочно-кишечного тракта (гастродуодениты, холециститы, колиты). Следует отметить, что у детей раннего возраста преобладает кишечная форма лямблиоза, в основном с функциональными расстройствами как секреторно-ферментативного, так и эвакуаторно-моторного характера. У детей старшего возраста и подростков, особенно на фоне иммунодефицитного состояния, наряду с кишечником поражаются желчевыделительная система и поджелудочная железа. При лямблиозе в сочетании с нерациональным питанием резко изменяется микрофлора кишечника. В двенадцатиперстной и тонкой кишках появляются микробы (чаще стафилококк) и грибы рода Candida, которые не живут в этих отделах кишечника у здоровых людей. Эти микроорганизмы в свою очередь стимулируют процесс размножения лямблий. В нижних отделах кишечника снижается количество обязательных микробов (эшерихий, бифидумбактерий, лактобацилл), обеспечивающих физиологический процесс пищеварения и всасывания. Развивается вторичная ферментопатия кишечника. Иммунный ответ организма на заражение лямблиями может быть различным как количественно, так и качественно, в зависимости от типа лямблий. Может развиться лишь неполный иммунный ответ к лямблиям. При иммунной недостаточности происходит безудержное размножение лямблий и как следствие — значительные изменения тонкой кишки. В частности, у ВИЧ-инфицированных лямблиоз протекает значительно тяжелее. У лиц с иммунодефицитами чаще наступают возвратные заболевания и повторные заражения. Иммунитет после перенесенного лямблиоза не очень напряженный и недлительный. В общем анализе крови у детей раннего возраста чаще имеют место увеличение количества лейкоцитов и эозинофилов в крови, моноцитоз, а у детей старшего возраста — увеличение количества лейкоцитов (у 55 % больных), эозинопения, моноцитопения, замедление СОЭ. Наиболее частыми осложнениями лямблиоза становится дисбактериоз и вторичная ферментопатия кишечника.
Диагностика и дифдиагностика Лямблиозное заражение дифференцируют с гастроэнтероколитами (см.) инфекционного и неинфекционного происхождения, а также с холецистопатиями (см.). Лямблиоз от амебной дизентерии отличают отсутствие упорных поносов, примеси кровянистой слизи в фекалиях, тенезмов, признаков интоксикации. При лямблиозе практически не встречается водянистой диареи, характерной для криптоспоридиоза. Холецистопатии, не связанные с лямблиозом, протекают с выраженным болевым синдромом с четкой локализацией болей в области правого подреберья, более длительной лихорадочной реакцией, с лейкоцитозом и нейтрофилезом, увеличением СОЭ, отсутствием эозинофилии. Диагноз лямблиоза обязательно должен быть подтвержден результатами лабораторного паразитологического исследования. Материал для исследования — пробы фекалий и дуоденального содержимого. В дуоденальном содержимом обнаруживаются только вегетативные формы лямблий. В плотных, оформленных фекалиях обнаруживаются только цисты, а в жидких и полуоформленных могут быть обнаружены цисты и вегетативные формы. Для повышения эффективности диагностики при наличии показаний следует проводить многократные исследования проб кала — от 2–3 до 6–7 раз с интервалами в 1–2 дня. Однако в большинстве случаев цисты лямблий в кале обнаруживаются уже при первом исследовании. Промежуток времени между взятием материала и его исследованием не должен превышать 15–20 мин. Вегетативные формы простейших чувствительны к воздействию химических веществ,поэтому пробы следует собирать в чистую сухую посуду. Даже незначительные остатки хлорсодержащих препаратов вызывают гибель вегетативных форм простейших, что может помешать диагностике. Пробы фекалий исследуются разными способами: метод нативного мазка (для обнаружения цист и трофозоитов), исследование мазка, окрашенного раствором Люголя, методы обогащения (при которых трофозоиты погибают). Лямблии легко обнаруживают при исследовании дуоденального содержимого, чаще в порциях А и В. Самым надежным методом диагностики лямблиоза служит дуоденальная биопсия. Показаниями к ее проведению являются типичная клиническая симптоматика при отрицательных результатах копрологического исследования и один из патологических признаков. Для серологической диагностики используют ИФА и ИФМ с целью обнаружения антигенов лямблий в фекалиях. Специфические антитела в сыворотке крови определяют через 2–4 недели после заражения, и реакции остаются положительными в течение 4–6 месяцев после освобождения от лямблий.
Лечение и профилактика Для правильного подхода к лечению больных лямблиозом необходимо учитывать: — выраженность и длительность существования клинической симптоматики лямблиоза; — наличие фоновых и сопутствующих заболеваний, стадию их течения (экссудативный диатез, лекарственная и пищевая аллергия и т. д.); — эффективность ранее проводимой противолямблиозной терапии (если таковая проводилась); — возможные источники заражения (в том числе среди членов семьи и в детских коллективах). Терапия каждого больного должна основываться на индивидуальных особенностях организма с учетом данных опроса и клинико-лабораторных данных. Начинать лечение сразу противолямблиозным препаратом нецелесообразно, поскольку это может привести к выраженной реакции повреждения с развитием токсико-аллергических реакций и обострением клиники лямблиоза. Лечение лямблиоза целесообразно проводить в три этапа. I этап — ликвидация проявлений эндотоксикоза, механическое удаление лямблий, улучшение ферментативной активности кишечника и повышение защитных сил организма больного. В зависимости от степени выраженности эндотоксикоза длительность данного этапа составляет 2–4 недели. В комплекс мероприятий входят следующие назначения. 1. Диета и режим питания, направленные на создание условий, ухудшающих размножение лямблий, и введение в рацион питания продуктов, выполняющих также роль сорбентов: каши, печеные яблоки, груши, брусника, клюква, сухофрукты, овощи, растительное масло. Следует ограничить употребление углеводов, особенно сладкого. 2. Прием желчегонных препаратов, так как они, уменьшая застой желчи в пораженном желчном пузыре, способствуют более быстрой ликвидации воспалительных изменений в нем. Предпочтение следует отдать холекинетикам. Эти препараты вызывают повышение тонуса желчевыводящих путей (5 %-ные или 10 %-ные растворы сернокислой магнезии, яичные желтки, сорбит, ксилит). Расслаблению тонуса желчных путей способствуют и холеспазмолитики (но-шпа, платифиллин, сухой экстракт белладонны, препараты барбариса обыкновенного, эуфиллин, метацин и др.). 3. Очищение желчевыводящих путей, желчного пузыря и кишечника с использованием тюбажа по Г. С. Демьянову у детей раннего и старшего возраста и трех-, пятикратного дренажа у подростков с интервалом в два дня. 4. Назначение энтеросорбентов — полифепана (полифана), смекты, реабана, полисорба МП, билигнина и др. 5. Ферменты (по результатам копрограммы) — фестал, энзистал, мезим-форте, панкреатин (креон), бактисубтил (фловинин-БС), хилак-форте. II этап — противопаразитарное лечение. Назначают препараты группы имидазола: трихопол (метронидазол, флагил, клион), тинидазол (фазижин), тиберал, фуразолидон и другие в возрастной курсовой дозе. Однако к большинству препаратов отмечается устойчивость лямблий, а тиберал является высокотоксичным препаратом. Из новых эффективных препаратов следует выделить макмирор. Макмирор (нифурантель) — производное 5-нитрофурана, обладает выраженным противопротозойным действием и является препаратом выбора при кишечном лямблиозе. Хорошая переносимость препарата обеспечивает максимальный терапевтический эффект. Через 7—10 дней следует повторить курс противолямблиозной терапии. Специфическое лечение лямблиоза назначают при обнаружении возбудителя и наличии клинических проявлений болезни. Для лечения лямблиоза используются соединения различных химических групп: акрихин, производные оксихинолина (энтеросептол, дийодохин, интестопан), 4-аминохинолины (хлорохин), эметина висмут-йодид, дегидроэметин и др. Однако первостепенное значение в настоящее время имеют метронидазол и пиридазол или сходные с ними препараты, их эффективность высока и составляет 70–90 %. Метронидазол (трихопол) назначают в дозе 400 мг 3 раза в сутки в течение 5 суток или в течение 10 дней. При этом суточная доза для взрослых составляет 500 мг, а детям препарат назначают из расчета 15 мг на 1 кг массы тела в сутки (максимальная суточная доза для детей до 10 лет — 300 мг). Как правило, препарат хорошо переносится больными, побочные явления выражены неярко и редко являются поводом для отмены лекарства. Наиболее часто отмечаются тошнота, рвота, болезненность в области живота, металлический привкус во рту. Частота возникновения побочных явлений составляет 15–30 %. Препарат нельзя назначать беременным женщинам и в период кормления, лицам с повышенной чувствительностью к этому веществу. Форма выпуска: таблетки по 250 и 500 мг, ампулы по 100 мл 0,05 %-ного раствора. Пиридазол (амбильгар) выпускается в таблетках по 100 и 500 мг. Препарат назначается только орально в суточной дозе 25 мг/кг массы тела, разделенной на несколько приемов. Курс лечения составляет 5–7 дней, в редких случаях его продлевают до 10 дней. Отмечаются побочные явления со стороны желудочно-кишечного тракта — тошнота, рвота, боли в животе. Чаще эти осложнения возникают у взрослых. Чтобы уменьшить вероятность и частоту побочных явлений, препарат следует принимать после еды. К тяжелым осложнениям относятся поражения центральной нервной системы. Противопоказанием к применению являются заболевания печени и нервной системы, эпилепсия и психические расстройства. Орнидазол (тиберал) — сходный с метронидазолом препарат. Высокая его концентрация в плазме крови создается уже через 1–2 ч после таблетированного приема. Взрослым и детям с массой более 35 кг дают 3 таблетки однократно вечером. Детям с массой до 35 кг препарат назначается из расчета 40 мг/кг массы тела однократно. Побочные явления встречаются примерно у 15 % пациентов (головокружения, мышечные боли, иногда тошнота, рвота). Противопоказания — индивидуальная чувствительность к препарату, беременность и кормление грудью. Таблетки выпускаются по 500 мг. Эффективность препарата достигает 90 %. Тинидазол (фазижин) — выпускается в таблетках по 150 и 500 мг. Взрослым назначают по 0,15 г 2 раза в сутки в течение 7 суток или однодневно по 0,5 г 1 раз в сутки. Эффективность — 77 %. Он менее токсичен, чем метронидазол. Противопоказания — беременность и кормление грудью, тяжелые нервные заболевания, невриты, эпилепсия. Для лечения детей в возрасте до 5 лет тинидазол не рекомендуется. Макмирор (нифурантель) — препарат нитрофуранового ряда, выпускается в таблетках по 200 мг, выводится из организма главным образом почками. Взрослым назначается по 400 мг 2–3 раза в день в течение 7 дней, детям — по 30 мг/кг массы тела на 2 приема в сутки в течение 5–7 дней. Хлорохин (делагил) выпускается в таблетках по 0,25 г и ампулах по 5 мл 5 %-ного раствора. Препарат оказывает выраженное противовоспалительное и десенсибилизирующее действие. Взрослым назначают по 0,25 г 3 раза в день в течение 5–6 суток. Побочные реакции возникают редко и только при длительном применении препарата. К ним относятся: снижение аппетита, тошнота, рвота, боли в животе, дерматит. Иногда встречаются снижение остроты зрения, понижение слуха. Противопоказания — беременность, дерматиты и псориаз, тяжелые поражения сердца, почек, печени, органические поражения центральной нервной системы, психозы. Фуразолидон выпускается в таблетках по 0,05 мг. Взрослым назначают 0,1 г 4 раза в сутки, детям — из расчета 10 мг/кг массы тела; суточную дозу дают в 3–4 приема, курс — 7 дней. Побочные явления — тошнота, рвота, аллергические реакции в виде кожных поражений. Паромомицин — антибиотик класса аминогликозидов, который предлагается для лечения беременных орально в дозе 25–30 мг/кг массы ежедневно в 3 приема в течение 5—10 дней. Препарат не вызывает осложнений. Эффективность составляет 65 %. Акрихин и аминохинол для лечения лямблиоза из-за плохой переносимости назначают редко и только взрослым. III этап — повышение защитных сил организма и создание условий, препятствующих размножению лямблий в кишечнике и желчном пузыре. Большое значение придают режиму и характеру питания. Для улучшения перистальтики кишечника назначают свекольное, тыквенное, кабачковое или морковное пюре, пюре из вареных сухофруктов (чернослив, курага), яблоки из компота, печеные яблоки, биокефир, бифидок, простоквашу, ряженку, спелые помидоры, ягоды и фрукты. С целью стимуляции различных звеньев иммунитета используют: метилурацил, пентоксил, нуклеинат натрия, тималин и другие. С целью создания среды, способствующей разрушению цист лямблий, рекомендуют прием отвара березовых почек в течение 2–3 недель. После двухнедельного перерыва проводят в течение двух недель прием отвара семян толокнянки. С целью ликвидации дисбактериоза и вторичной ферментопатии кишечника применяют бактерийные препараты (бифидумбактерин, бификол, колибактерин, лактобактерин, ацидофилус) и ферментативные препараты (бактисуптил (фловинин-БС), хилак-форте, фестал, энзистал, мезим-форте, панкреатин). Следует отметить, что нецелесообразно применять одновременно более 3–4 препаратов и необходимо строго соблюдать последовательность поэтапного лечения. Основой профилактики является строгое соблюдение правил личной гигиены и повышение санитарной культуры, контроль над цистоносителями и больными лямблиозом.
♦ М ♦
МАЛИГНИЗАЦИЯ
Малигнизация — процесс превращения нормальной клетки в злокачественную. Может возникать под влиянием канцерогенных факторов. Поврежденные (малигнизированные) клетки образуют первичный очаг злокачественной опухоли. Нередко наблюдается малигнизация доброкачественных опухолей.
МАЛЯРИЯ
ОпределениеМалярия — длительно протекающее инфекционное заболевание, характеризующееся периодическими приступами лихорадки, гепатолиенальным синдромом (см.) и прогрессирующей анемией (см.).
Этиология Возбудителем заболевания является малярийный плазмодий. В организме человека паразитируют четыре вида из известных в настоящее время более чем 60 видов плазмодиев. Наиболее часто встречаются возбудители, вызывающие четырехдневную малярию, трехдневную малярию, тропическую малярию, овале-малярию. Возбудитель малярии проходит сложный цикл развития, прежде чем становится опасным для человека. Этот цикл включает два периода: первый период — это бесполое развитие в организме человека, который при этом является промежуточным хозяином, и второй период — половое развитие в организме главного хозяина, которым являются самки комара рода Anopheles. В начале первого периода заражение человека происходит при укусе комара: со слюной в кровь человека попадают спорозоиты (одна из промежуточных стадий развития плазмодия). Спорозоиты с током крови проникают в клетки печени, где происходит тканевая фаза их развития. При трехдневной малярии продолжительность этой фазы составляет примерно 8 суток, при тропической — 6 суток, при четырехдневной — 15 суток. Результатом является образование мерозоитов, которые после завершения тканевого цикла выходят в кровоток и проникают в эритроциты. Начинается эритроцитарный цикл развития возбудителя. Поражение эритроцитов завершается их разрывом и выходом в кровь подвижных паразитов, которые вновь внедряются в другие эритроциты. Данный цикл может повторяться несколько раз. Продолжительность одного цикла при трехдневной и тропической малярии составляет около 2 суток, а при четырехдневной — 3 суток. После 3–4 эритроцитарных циклов в кровь человека выходят женские и мужские половые клетки (гаметоциты). Дальнейшее их развитие возможно только в желудке комара. При укусе комаром больного или паразитоносителя в его желудок попадают гаметоциты. С этого момента начинается половой этап развития плазмодия малярии. В желудке комара рода Anopheles происходит оплодотворение и образование гамет из мужских и женских половых клеток паразита. Конечным этапом полового периода развития являются спорозоиты, которые кровью и лимфой разносятся по организму комара, попадая в том числе и в слюнные железы, после чего комар становится опасным для человека.
Схема цикла развития малярийного плазмодия (тканевый и эритроцитарный циклы): 1 — спорозоит, выходящий из слюнной железы комара; 2—4 и 22—27 — внеэритроцитарные стадии развития; 5—11 — эритроцитарный цикл: 5 — форма кольца; 6—9 — амебовидный шизонт; 10—11 — меруляция; 12—13 — макрогаметоцит; 14—15 — микрогаметоцит; 16—21 — спорогония в организме комара; 16 — образование микрогамет; 17 — слияние микро- и макрогамет; 18 — проникновение оокинеты через стенку желудка комара; 19—22 — развитие плазмодия в теле комара
Эпидемиология Источником инфекции при малярии является человек, в крови которого присутствуют половые формы малярийных плазмодиев. В очагах малярии дети в качестве источника инфекции представляют большую опасность, чем взрослые. Это обусловлено отсутствием иммунитета или низкой его напряженностью, что приводит к увеличению интенсивности проникания возбудителя болезни. Возбудитель проникает в эритроциты, при этом увеличивается количество образующихся гаметоцитов (половых клеток) и продолжительность их носительства. При заражении тропической малярией человек становится источником инфекции через 10–12 дней и остается им в течение 1–2 недель, пока бесполые паразиты не исчезнут естественным путем или в результате лечения. При других формах малярии человек опасен для окружающих с момента появления бесполых форм до времени их исчезновения. Передача инфекции от человека к человеку возможна только самками комара рода Anopheles. Возможна передача инфекции от матери к плоду, если мать не болела малярией и не имеет иммунитета. В редких случаях инфекция передается внутривенно при прямом переливании крови от донора-паразитоносителя. При этом вероятность заражения зависит от количества паразитов в донорской крови и способности возбудителя к выживаемости в консервантах. Передача инфекции может быть осуществлена при многоразовом использовании недостаточно обработанных игл, шприцов, систем для переливания крови. Восприимчивость к малярии высокая. В очаговых районах болеют в основном дети, которые не имеют иммунитета. Сезонность имеет летне-осеннюю направленность. Спад заболеваемости в холодное время года обусловлен уходом комаров в состояние диапаузы на зимовку. В это время возбудитель сохраняется в организме человека, который является носителем малярийного плазмодия для заражения новой популяции комаров с наступлением теплого времени года.
Патогенез Клинические проявления заболевания обусловлены распадом инфицированных эритроцитов, выходом в кровеносное русло мерозоитов, продуктов их обмена, воздействущих на центр регуляции теплообмена, тем самым способствуя развитию лихорадки и оказывая общее токсическое действие на организм человека. Ответной реакцией являются выраженные нарушения циркуляции крови, которые при прогрессировании заболевания приводят к ухудшению кровоснабжения внутренних органов, изменению обмена веществ в тканях. Действие токсинов приводит к повышению проницаемости сосудистой стенки, выходу за пределы сосудов жидкой части крови и белка с развитием воспалительного застоя, полной закупорке сосудов и остановке кровотока. Разрушение эритроцитов при малярии происходит не только при воздействии паразита, но может продолжаться еще некоторое время после окончания фазы проникновения возбудителя заболевания в эритроциты. Средняя продолжительность заболевания после однократного заражения (при отсутствии лечения) составляет при тропической малярии около года, при трехдневной и овале-малярии — 1,5–2 года, при четырехдневной — 2–3 года (иногда десятки лет). Иммунитет после перенесенной малярии нестоек. При отсутствии повторного заражения в течение нескольких лет иммунитет снижается, и становится возможным повторное заражение, которое протекает значительно легче. Приобретенный иммунитет ограничивает размножение эритроцитарных форм и способствует прекращению приступов малярии. Ребенок может получить через плаценту от матери пассивный иммунитет, который поддерживается антителами грудного молока. Кроме того, препятствуют развитию малярии молочная диета и наличие гемоглобина в крови новорожденного ребенка, свойственные данному периоду. Наиболее тяжело малярия протекает у детей в возрасте от 3 до 12 месяцев жизни. В очаговых (многолетнее присутствие инфекции на определенной территории) по малярии областях у некоторых людей определяется аномальный гемоглобин, который обеспечивает невосприимчивость к тропической малярии.
Патанатомия Во многих органах при малярии откладывается характерный коричневый пигмент. Печень и селезенка увеличены, что обусловлено переразвитием соединительной и лимфоидной ткани. Малярийный пигмент откладывается в межтканевых пространствах и захватывается специальными клетками, поглощающими чужеродные клетки (макрофаги). Цвет органа может изменяться от синевато-серого до черного.
Гемомеланоз печени
Узелковые разрастания нейроглии в головном мозге
При тканевом исследовании в печени отмечается сужение сосудов венозной системы, в которой находятся инфицированные эритроциты. В печеночных клетках выявляют дегенеративные изменения, омертвение, уменьшение жировой ткани. В селезенке — локализованные инфаркты, а при длительном течении развивается фиброз (см.). Поражение почек характеризуется наличием симптомов острого транзиторного нефрита (см.). В легочной ткани выявляют кровоизлияния, сосуды заполнены инфицированными эритроцитами. В сердечной мышце — дегенеративные изменения. При тропической малярии возможно поражение головного мозга: выражены отек, кровоизлияния в белом веществе, вокруг которых обнаруживается скопление клеток крови (макрофагов), в сосудах инфицированные эритроциты, склеиваясь между собой, образуют паразитарную пробку. Данные изменения в кишечнике приводят к развитию покраснения, кровотечениям, омертвению тканей.
Клиническая картина Начальный период болезни (т. е. инкубационный период) в основном зависит от вида возбудителя, но на его продолжительность могут повлиять напряженность иммунитета, климатические условия (в южных районах инкубационный период укорачивается), применение химиопрепаратов в профилактических целях. При тропической малярии начальный период болезни относительно короткий и составляет от 7 до 15 дней. При трехдневной малярии этот период может быть коротким (2–3 недели) или длинным (до 1 года и более). Продолжительность начального периода болезни при четырехдневной малярии от 2 до 5 недель, а при овале-малярии — 2–5 недель. Период, предшествующий заболеванию, часто отсутствует, но иногда больные жалуются на общую слабость, недомогание, головную боль, познабливание. Температура тела при этом может держаться на средних цифрах. Чаще всего заболевание начинается остро, с потрясающего озноба. Больной не может согреться. Кожные покровы бледные, холодные на ощупь, появляется умеренная синюшность кожи конечностей. Отмечаются симптомы интоксикации: сильная головная боль, одышка, рвота, мышечные боли. Озноб в течение нескольких минут (в некоторых случаях в течение 1–2 ч) сменяется чувством жара. Температура тела больного в данный период повышается до 40–41 °C. Кожа сухая, горячая, лицо краснеет. Характерно выраженное возбуждение вплоть до бредовых состояний, потери сознания и развития судорог. Со стороны сердечно-сосудистой системы отмечается падение артериального давления, пульс аритмичный, частый, слабого наполнения и напряжения. Печень и селезенка увеличены и болезненны при прощупывании. Продолжительность приступа варьируется от 1 ч до 10–15 ч. Окончание приступа сопровождается резким падением температуры тела. Больной предъявляет жалобы на резкую слабость и головокружение. Состояние быстро нормализуется, и пациент чувствует себя удовлетворительно. Длительное и тяжелое течение малярии сопровождается развитием гемолитической анемии (см.), стойким увеличением размеров печени и селезенки. Возможна слабо выраженная желтушность кожи и оболочек глаз. Окраска мочи и кала при этом не изменена. На высоте приступа содержание лейкоцитов в крови уменьшается, а в периодах спада температуры отмечаются снижение количества лейкоцитов (лейкопения), повышение СОЭ. Течение малярии зависит от многих показателей: это видовая принадлежность возбудителя, возраст и иммунологическая реактивность пациента, климатические условия и т. д. Тропическая малярия отличается тяжестью клинических проявлений и нередко сопровождается осложнениями, имеет молниеносный (злокачественный) характер течения и часто заканчивается смертью. При благоприятном исходе длительность заболевания около года, иногда больше. Трехдневная малярия по тяжести течения занимает промежуточное положение. Приступы развиваются через день или ежедневно в строго определенные часы (обычно в первой половине дня). Продолжительность болезни составляет 1,5–2 года. Четырехдневная малярия характеризуется длительным, но в большинстве случаев доброкачественным течением. Приступы повторяются через два дня, могут быть продолжительными. При естественном течении больной страдает в течение 3–4 лет (иногда десятилетиями), но проявления заболевания с годами становятся менее выраженными. Для овале-малярии характерно наиболее легкое течение. Приступы развиваются в вечерние часы или ночью. Иммунитет формируется быстро. Продолжительность заболевания редко превышает 2 года. При своевременном лечении клинические проявления заболевания прекращаются после одного-двух приступов. Отсутствие адекватной терапии сопровождается неоднократным повторением приступов (до 10 раз и более), а затем они могут самопроизвольно прекращаться — наступает период видимого благополучия. В течение данного периода у больного могут возникать рецидивы заболевания — клинические и паразитарные. Клинические рецидивы диагностируют в том случае, когда у больного на фоне удовлетворительного состояния отмечается повторное (иногда неоднократное) повышение температуры тела до высоких цифр. Паразитарные рецидивы характеризуются обнаружением в крови паразитов на фоне полного клинического благополучия. Рецидивы, возникающие в течение первых двух месяцев после окончания первых проявлений заболевания, считаются ранними. Поздние рецидивы развиваются не раньше двух месяцев после клинического выздоровления пациента.
Малярия у детей первого года жизни Течение малярии у детей первого года жизни в большинстве случаев тяжелое. На первый план выходят симптомы токсикоза, поражение центральной нервной системы (судороги, менингеальные знаки), гепатолиенальный синдром (см.), дистрофия (см.), тяжелая анемия (см.). Характерные для типичного течения приступы лихорадки обычно не наблюдаются. Эквивалентом приступа являются внезапно появившиеся синюшность и похолодание конечностей, судороги. Ребенок беспокоен, отказывается от груди. Температура тела в начале болезни поднимается до высоких цифр, а затем держится на отметке 37–38 °C. Вместо обильного потоотделения отмечается умеренное увлажнение кожных покровов. Нередко бывают боли в животе и расстройства пищеварения. Водянистый стул может стать причиной острого обезвоживания организма. Печень и селезенка значительно увеличены в размерах, болезненны при прощупывании. В некоторых случаях селезенка занимает почти всю брюшную полость. Обращает на себя внимание прогрессирующая анемия.
Врожденная малярия Инфицирование плода в первой половине беременности часто заканчивается самопроизвольным выкидышем. Заражение во второй половине беременности обусловливает рождение недоношенного ребенка. С первых дней жизни отмечаются увеличение печени и селезенки, гипохромная анемия (см.). Приступы не бывают четко очерчены и протекают с синюшностью, судорогами, с температурной реакцией неправильного типа. Имеют место явления расстройства пищеварения. Лихорадка может отсутствовать.
Осложнения Тяжелое течение заболевания может сопровождаться осложнениями: малярийной комой (см.), малярийным алгидом (см.), острой почечной недостаточностью, отеком мозга, психическими расстройствами (см.). Малярийная кома развивается при тропической малярии. Проявления обусловлены тяжелыми нарушениями кровообращения в головном мозге. Появляются менингеальные симптомы, оглушенность, потеря сознания. Кожные и сухожильные рефлексы сначала вялые, а в дальнейшем не вызываются. Прогрессивно нарастают сердечно-сосудистая и дыхательная недостаточность, страдает функция почек. При отсутствии адекватной терапии нередко наступает смерть. Малярийный алгид — редкое осложнение тропической малярии, которое характеризуется острым развитием коллаптоидного состояния. Сознание больного сохранено. Кожные покровы бледные, с общей синюшностью, покрыты холодным липким потом. Пульс нитевидный или не прощупывается. Артериальное давление низкое. Температура тела субнормальная. Может быть жидкий стул, развивается острое обезвоживание организма. Причиной развития острой почечной недостаточности при малярии является интенсивное разрушение эритроцитов. Характерны глубокое нарушение почечной микроциркуляции, появление в моче гемоглобина, белков и другие признаки. Уменьшение выделяемого объема мочи быстро сменяется анурией (ее отсутствием) и уремией (появлением мочевины в крови). Отек мозга возникает при молниеносной форме трехдневной малярии. Развивается чаще у детей в весенний период. На высоте приступа внезапно появляются сильнейшая головная боль, потеря сознания, судороги. Смерть наступает в связи с остановкой сердечной деятельности и дыхания, что обусловлено вклиниванием продолговатого мозга в большое затылочное отверстие и нарушением деятельности дыхательного и сосудодвигательного центров. Психические расстройства (см.) сопровождаются нарушением сознания, двигательным возбуждением, галлюцинациями (см.). Данное осложнение характерно для тропической малярии на высоте подъема температуры тела, особенно в детском возрасте.
Диагностика и дифдиагностика Диагноз при типичном течении малярии ставят на основании данных опроса и результатов объективного обследования пациента. Подтверждают диагноз лабораторными исследованиями. Для обнаружения паразитов в крови исследуют толстую каплю крови, окрашенную по Романовскому — Гимзе. Кровь для исследования рекомендуется брать на высоте приступа малярии. При микроскопии выявляют плазмодии в эритроцитах. Для серологической диагностики используют реакцию иммунофлюоресценции, реакцию непрямой гемагглютинации. На ранних этапах болезни малярию чаще всего приходится различать с гриппом (см.), пневмонией (см.), пищевой токсикоинфекцией (см.), менингоэнцефалитом (см.). Правильной постановке диагноза в этой ситуации помогает тщательно собранный эпиданамнез и лабораторные методы диагностики. На поздних этапах болезни при наличии выраженного гепатолиенального синдрома (см.), анемии (см.) и (возможно) желтухи (см.) малярию следует отличать от сепсиса (см.), вирусного гепатита (см.), лептоспироза (см.), лейкоза (см.), брюшного тифа (см.), желтой лихорадки (см.), бруцеллеза (см.), туберкулеза (см.).
Стаз в коре головного мозга
Различные стадии развития возбудителей трехдневной, четырехдневной и тропической малярии (полусхематическое изображение по Е. Н. Павловскому): А — Плазмодиум вивакс: 1 — стадия кольца; 2—3 — рост шизонта; 4—5 — подготовка к размножению (шизогония); 6 — макрогаметоцит; 7 — микрогаметоцит; Б — Плазмодиум маляриа: 8 — стадия кольца; 9 — отложение пигмента в шизонте; 10 — шизонт в форме ленты (пояса); 11-12 — шизогония с освобождением мерозоитов и пигмента; В — Плазмодиум фальципарум: 13—14 — форма кольца; 15—16-17 — рост шизонта; отложение пигмента и подготовка плазмодия к шизогонии; 18 — микрогаметоцит (полулуние); 19 — макрогаметоцит
Лечение Больные должны быть госпитализированы и находиться под постоянным наблюдением (измерение температуры тела, артериального давления, подсчет пульса, определение числа эритроцитов, содержание гемоглобина, количество паразитов в 1 мкл крови, цвет и состав мочи, объем мочеотделения). Для специфической терапии используют препараты, действующие на бесполые эритроцитарные формы плазмодиев, на половые формы в крови и тканевые формы в клетках печени. Наиболее широко применяют хингамин (хлорохин, делагил), назначая его внутрь в течение 3 дней: в первый день суточная доза препарата делится на два приема с интервалом в 6–8 ч, а в остальные дни препарат дается однократно (табл. 22). При наличии значительного количества паразитов в организме курс удлиняется до 5 дней. Бесполые паразиты исчезают из крови через 48 ч.
При назначении хингамина в межприступный период он не предотвращает наступление очередного приступа. Лечение осложненной тропической малярии должно проводиться экстренно без лабораторного подтверждения (при яркой клинической картине у лиц, вернувшихся из очаговых по малярии регионов) по вышеуказанной схеме. Параллельно со специфической терапией проводят симптоматическое лечение, учитывая характер осложнений. Наличие осложнений требует госпитализации больного в отделение интенсивной терапии. При тяжелом течении хингамин вводят внутривенно или внутримышечно. Детям раннего возраста внутривенное введение противопоказано, а внутримышечное производится только по жизненным показаниям. Суточная доза при внутривенном введении не должна превышать 8—10 мг дифосфата (5–6 мг основания хлорохина) на 1 кг массы тела больного. Суточную дозу вводят в 2–3 приема с интервалом 6–8 ч. При внутривенном введении разовую дозу разводят в 20 мл изотонического раствора хлорида натрия и вводят очень медленно через тонкую иглу в течение 10–15 мин (лучше капельно). Быстрое введение препарата может вызвать резкое падение артериального давления и смертельный исход. При поражении центральной нервной системы рекомендовано внутривенное введение хинина (сульфат хинина, хиноформ, хинимакс) в возрастной дозировке. Для предупреждения рецидивов при трехдневной малярии и малярии овале наряду с обычной схемой назначают примахин (детям до 4 лет он противопоказан).
Профилактика Профилактические мероприятия осуществляются по двум направлениям: борьба с переносчиком и с возбудителем. Первое направление реализуется при обработке помещений и территорий инсектицидами длительного действия и путем использования средств индивидуальной защиты (инсектицидные мази, кремы, лосьоны, защитная сетка). Воздействие на возбудителя возможно путем специфической вакцинопрофилактики населения очаговых районов и выезжающих химиотерапии. В настоящее время существует три типа малярийной вакцины. Спорозоитная вакцина предотвращает заражение малярией. Мерозоитная вакцина способствует формированию иммунитета против бесполых кровяных форм малярийных паразитов. Гаметоцитная вакцина предотвращает заражение комаров, напившихся крови на вакцинированном носителе гаметоцитов. Мероприятия по химиопрофилактике подразделяются на массовые и индивидуальные. Все выезжающие в очаговые по малярии области за 2–3 дня до выезда должны начать курс индивидуальной химиопрофилактики, которая продолжается в течение всего периода пребывания. Для выявления случаев завозной малярии у граждан России и жителей очаговых районов, прибывших в Россию, при повышении температуры тела следует исключать малярию на протяжении 2 лет.
МАНИАКАЛЬНО-ДЕПРЕССИВНЫЙ ПСИХОЗ
ОпределениеМаниакально-депрессивный психоз (синонимы: циркулярный психоз, циклофрения, циклотимия) — заболевание, проявляющееся периодическими маниакальными и депрессивными состояниями (фазами), обычно разделенными светлыми промежутками; не приводит к формированию психического дефекта.
Этиология и патогенез Большую роль играют наследственное предрасположение и конституциональные факторы. Чаще всего заболевают лица циклоидного и психастенического склада. Определенное значение имеют также дисфункция подбугорной области и патология эндокринной системы. Женщины болеют чаще мужчин. Первые приступы могут возникать как в периоде полового созревания, так и в старости. В большинстве случаев болезнь начинается в 3—5-м десятилетии жизни.
Клиническая картина Для маниакально-депрессивного психоза характерно чередование фаз и светлых промежутков. Биополярное течение характеризуется переходом одной фазы в другую. При монофазном течении чередуются депрессивные фазы и светлые промежутки. Альтернирующее течение характеризуется следующим чередованием: за маниакальной или депрессивной фазой следует светлый промежуток, а затем возникает новая фаза, противоположная первоначальной. Выраженность аффективных расстройств варьирует от легких нарушений (циклотимия), которые обычно лечат в амбулаторных условиях, до тяжелых депрессий и маний, требующих срочной госпитализации. Для маниакально-депрессивного психоза типично полное обратное развитие болезненных нарушений, возвращение к состоянию, которое было до болезни. Реже, уже после неоднократных рецидивов, в период ремиссии, также отмечаются остаточные психопатологические проявления главным образом в виде стертых гипоманиакальных и субдепрессивных расстройств. Число фаз на протяжении болезни очень различно. Длительность фаз — от 1 недели до 1–2 лет и более, средняя продолжительность — 6—12 месяцев. Светлые промежутки в некоторых случаях могут отсутствовать (так называемое континуальное течение болезни), но обычно они измеряются месяцами, годами и даже десятилетиями. Биполярное течение — смена депрессивных и маниакальных фаз — наблюдается в 1/3 случаев. Депрессивная фаза характеризуется рядом признаков: пониженное настроение, замедление мыслительных процессов и двигательная заторможенность, характерным является угнетенное подавленное настроение. Внешний вид депрессивных больных соответствует их состоянию. Маниакальная фаза характеризуется следующими симптомами: повышенное настроение, ускорение мыслительных процессов и двигательной активности, доходящей до степени маниакального возбуждения. Чаще всего заболевание протекает в виде периодических депрессий.
Диагностика Диагноз основывается на возникновении и последующем рецидивировании аффективных фаз, на типичной для эндогенных аффективных расстройств картине мании и депрессии и наличии среди родственников лиц с циклотимическими проявлениями или больных маниакально-депрессивным психозом. Фазы маниакально-депрессивного психоза необходимо дифференцировать с эндогенно, психогенно, конституционально (фазы у психопатов) и соматогенно обусловленными аффективными состояниями. Отграничение маниакально-депрессивного психоза от периодической шизофрении основывается на отсутствии в момент приступа галлюцинаций, бредовых идей отношения, преследования и формальных расстройств мышления. В трудных для дифференцировки случаях поставить диагноз маниакально-депрессивный психоз удается лишь при длительном наблюдении, если в развитии заболевания не нарастают изменения личности.
Лечение Лечение зависит от фазы заболевания. Лечение депрессивных состояний проводят антидепрессивными средствами (амитриптилин, мелипрамин, пиразидол, инказан по 50—300 мг/сут.). В тяжелых случаях показано внутривенное (внутримышечное, капельное) введение препаратов. При устойчивых к психотропным средствам депрессиях проводят электросудорожную терапию. При гипоманиакальных состояниях эффективны транквилизаторы — диазепам (седуксен), оксазепам (тазепам), хлордиазепоксид (элениум) по 5—40 мг/сут., феназепам по 1–3 мг, нейролептики в небольших дозах, соли лития (карбонат лития по 900—1200 мг/сут.). Маниакальные состояния купируются нейролептиками (аминазин по 100–400 мг/сут., галоперидол по 6—20 мг/сут., трифтазин по 20–50 мг, лепонекс по 50—200 мг, сонапакс, хлорпротиксен по 100–300 мг/сут.). При явлениях маниакального возбуждения показано внутримышечное введение препаратов (аминазин, галоперидол, трифтазин). Прогноз в большинстве случаев благоприятный. При депрессивных фазах он осложнен в связи с опасностью суицидальных попыток. Основным средством предупреждения последующих аффективных фаз является превентивная терапия (в течение нескольких лет) солями лития и финлепсином. Соли лития дают под контролем содержания лития в крови (оптимальное содержание его, обеспечивающее профилактический эффект, составляет 0,4–0,8 ммоль/л).
МАРАЗМ В ДЕТСКОМ ВОЗРАСТЕ
ОпределениеМаразм в детском возрасте — это заболевание, протекающее с тяжелыми расстройствами питания и обусловленное недостаточным поступлением в организм ребенка питательных веществ.
Этиология Клинические проявления маразма обусловлены низкой калорийностью пищи при нехватке продуктов питания, нерациональным вскармливанием, наследственно обусловленными нарушениями и пороками развития. Недостаточное питание может наблюдаться при резко сниженном поступлении пищи в организм, при нарушении всасывания. Вредные пищевые привычки, наследственные нарушения и эмоциональные факторы в детском возрасте могут ограничивать достаточное поступление в организм питательных веществ. Потребность в незаменимых питательных веществах может повышаться при стрессах, различных заболеваниях, при введении антибиотиков. В особую форму маразма выделяют белковую недостаточность, причиной развития которой могут быть нарушения поглощения белка при диареях (см.), значительные потери белка при выделении его с мочой, инфекционных болезнях, кровоизлияниях и ожогах, нарушения синтеза белка.
Клиническая картина Нарушения питания могут протекать остро или хронически. Первым проявлением заболевания является отсутствие прибавки массы тела, а в тяжелых случаях течения отмечается ее снижение. Кожа становится дряблой, кожная складка расправляется медленно. Упругость тканей резко снижается. При крайнем истощении организма ребенка исчезают жировые подушечки на щеках, лицо становится сморщенным (так называемое «лицо старика»). Живот растянут и вздут, петли кишечника хорошо контурируются. Стул скудный, но в некоторых случаях отмечается «голодная» диарея (частые и скудные испражнения, содержащие слизь). В начале заболевания ребенок беспокойный, возбужден. По мере прогрессирования болезни аппетит снижается, а больной становится безразличным к окружающему. Прогрессируют атрофические изменения в мышцах, которые приводят к гипотонии (см.). Впоследствии присоединяются безбелковые отеки. В процесс вовлекаются все органы и системы организма ребенка, что сопровождается нарушением деятельности сердечно-сосудистой, дыхательной, нервной и других систем.
Белковая недостаточность (квашиоркор) Белковая недостаточность — наиболее серьезная форма недостаточности питания, которая чаще всего встречается в промышленно отсталых странах мира. Термин «квашиоркор» означает «отлученный ребенок», т. е. ребенок, отнятый от груди. Заболевание регистрируется в странах с высоким уровнем рождаемости, когда ребенка приходится отнимать от груди в раннем возрасте по причине повторных родов и появления у матери следующего ребенка, который должен находиться на грудном вскармливании. При этом предыдущего ребенка переводят на питание продуктами в основном растительного происхождения. Ранние проявления белковой недостаточности не имеют четкого начала. Ребенок возбудим, но возбуждение быстро сменяется вялостью и апатией. Постепенно замедляется (прекращается) процесс роста, мышцы подвергаются атрофии, появляются отеки. Отеки прежде всего находятся во внутренних органах и гораздо позже появляются на лице и конечностях. Размеры печени значительно увеличиваются. Такие дети часто болеют, и при отсутствии надлежащего ухода процент смертельного исхода в данном случае высок (имеет место вторичная иммунологическая недостаточность). Со стороны сердечно-сосудистой системы отмечаются приглушенность тонов сердца и учащенное сердцебиение на ранних этапах развития заболевания. Длительное хроническое течение сопровождается расширением границ сердца, брадикардией (см.), нарушениями ритма, падением артериальногодавления. Отмечаются нарушения функционирования почек. Характерным симптомом квашиоркора является дерматит (см.): кожа темнеет в областях раздражения, а после слущивания эпителия на этих участках отмечаются очаги депигментации. Волосы редкие, тонкие, тусклые, легко выпадают. При хроническом течении волосы становятся жесткими. Мышцы атрофированы, подкожно-жировой слой резко истончен или отсутствует. Одним из основных симптомов хронического течения белковой недостаточности у детей раннего возраста является значительное снижение (отставание) в психическом и двигательном развитии после отнятия ребенка от груди, тогда как при грудном вскармливании психодвигательный статус соответствует возрасту. В тяжелых случаях развиваются ступор и кома (см.) и наступает смерть. Достаточно частой причиной смертельного исхода является присоединение инфекции или паразитарное заражение.
Диагностика и дифдиагностика При постановке диагноза пониженного питания важно обратить внимание на сроки отнятия ребенка от груди и характер его питания на момент обследования, клинические проявления болезни и данные дополнительных методов исследования. У ребенка выражена анемия, которая может быть нормо-, микро- и макроцитарной. В крови значительно может быть снижен уровень глюкозы, но глюкозотолерантный тест имеет диабетический тип. Рост костей замедляется, но при этом в некоторых случаях выявляют повышение уровня гормона роста. Дифференциальную диагностику пищевого истощения проводят с хроническими инфекционными и соматическими заболеваниями, протекающими со значительными потерями белка с мочой и калом, с нарушениями синтеза белка.
Лечение Терапевтическое воздействие начинают с коррекции шока (см.), почечной недостаточности, возмещения энергетического и белкового дефицита. При тяжелом течении в первые часы, а иногда и дни от начала лечения энергетические потребности организма ребенка восполняются путем внутривенного введения 5—10 %-ного раствора глюкозы, альбумина (водорастворимого белка) и плазмозаменителей. Постепенно переходят на кормление ребенка малыми дозами, используя донорское грудное молоко или адаптированные молочные смеси. Высокобелковая диета с необоснованно ранним доведением суточной дозы питания до возрастной нормы может стать причиной нарушения деятельности желудочно-кишечного тракта, увеличения размеров печени и ухудшения состояния больного ребенка. Использование только белковых гидролизатов может привести к пониженному содержанию сахара в крови. В связи со сниженной ферментативной активностью желудочно-кишечного тракта показано назначение ферментных препаратов во время или после еды. Диетотерапия с первых дней должна сочетаться с витаминотерапией. При выраженной анемии показано введение препаратов железа и фолиевой кислоты. Лечение присоединившейся инфекции необходимо проводить с учетом чувствительности флоры, противопаразитарную терапию в некоторых случаях необходимо отложить до улучшения состояния пациента. Главным критерием эффективности проводимой терапии является стабильное нарастание массы тела ребенка. Важно помнить, что в первые дни от начала лечения масса тела может иметь тенденцию к снижению. Данный симптом при соответствующе подобранной диете обусловлен исчезновением явных и скрытых отеков. Значительное отставание ребенка в физическом и психодвигательном развитии может нарастать в течение некоторого времени. Впоследствии (при легком и среднетяжелом течении) данные изменения выравниваются, но при тяжелом течении есть вероятность того, что отставание от сверстников сохранится в течение всей жизни больного.
МАРАЗМ СТАРЧЕСКИЙ
ОпределениеМаразм старческий (распад личности) — наиболее тяжелый вид негативных расстройств с утратой возможности контакта с окружающей средой, обусловленный психическими изменениями при атрофических процессах головного мозга.
Этиология и патогенез Причина возникновения и развитие большинства заболеваний, обусловленных атрофическими изменениями головного мозга, остается неизученной. Определенное место отводится наследственной предрасположенности, но полностью исключить влияние внешних факторов (острые внутренние и инфекционные заболевания) нельзя. По возрастному критерию заболевания подразделяются на предстарческие (пресенильные) и старческие (сенильные) формы. Классификация по причине развития включает следующие формы: сенильная деменция, болезнь Альцгеймера, системные атрофические процессы позднего возраста (болезни Пика, Паркинсона, хорея Гентингтона). Современные концепции развития старческого слабоумия основываются на генетической (генетическая запрограммированность продолжительности жизни) и иммунологической теориях старения (развитие дистрофических изменений нервных клеток). Развитие болезни Альцгеймера мало изучено. В последние годы появились данные о нарушении процесса передачи наследственной информации в клеточных элементах нервной ткани. Нарушение считывания информации на уровне клетки проявляется изменением синтеза белков, активности ферментных систем, процессов клеточного обмена и накоплением в клетках токсических продуктов обмена (например, алюминия). Не исключают вирусное влияние как фактор, провоцирующий заболевания. При болезни Пика обнаружено повышенное содержание цинка в некоторых областях мозга, с чем связано изменение активности ряда важных металлозависимых ферментов и нарушение энергетических процессов в клетке, изменение функции рецепторов, проявление токсического действия самого микроэлемента.
Клиническая картина Психические расстройства, приводящие к маразму, представлены целой группой психических заболеваний позднего возраста, которые объединены по ряду общих признаков. Патологические изменения в головном мозге обусловлены внутренними причинами (в том числе и наследственной предрасположенностью), а внешние влияния играют провоцирующую или усугубляющую роль. В большинстве случаев начало заболевания медленное и малозаметное для окружающих. Течение хроническое, с постоянным нарастанием симптоматики и необратимое. Характерным клиническим симптомом является развитие слабоумия от почти незаметных изменений интеллекта до полного слабоумия. Общее состояние больного при маразме характеризуется тяжелым физическим истощением, нарушениями в питании тканей кожных покровов, развитием дистрофии (см.) внутренних органов, повышенной ломкостью костей.
Сенильная деменция Сенильная деменция (старческое слабоумие) характеризуется прогрессирующим распадом психической деятельности и развитием полного слабоумия вследствие органического заболевания головного мозга. Среди больных преобладают женщины. Средняя продолжительность заболевания составляет от 5 до 8 лет. Сенильная деменция начинается незаметно для окружающих больного людей. В некоторых случаях усилению проявлений заболевания способствуют инфекционные заболевания, перенесенные операции, нарушения сердечной деятельности, серьезные психические травмы. Обращает на себя внимание обострение личностных особенностей, свойственных больному, и (или) наличие признаков старческой перестройки личности, которая выражается в огрубении личности, сужении кругозора и интересов, нарастании признаков эгоцентризма, угрюмости, ворчливости пациента, склонности к подозрениям и мелким конфликтам. При этом нередко больные становятся легковерными — легко поддаются чужому влиянию даже во вред своим интересам. К характерным проявлениям заболевания относят расторможенность низших влечений (прожорливость, стремление к бродяжничеству, половые извращения, собирание ненужных вещей). Постепенно больные прекращают пользоваться старым словарным запасом, значительно снижается уровень суждений и умозаключений. В начале заболевания нарушения памяти выражены неярко (новый материал закрепляется не в полном объеме и быстро забывается), в дальнейшем отмечается фиксационная амнезия (см.). При этом больной становится дезориентирован во времени, окружающей обстановке и в собственной личности. Прогрессирующий распад памяти происходит в последовательности, противоположной получению знаний за всю предыдущую жизнь. Нарушается адекватное восприятие, что нередко сопровождается симптомом «жизни в прошлом»: в окружающих больные видят людей, которые уже умерли, себя считают школьниками, своих детей могут воспринимать братьями и сестрами, а братьев и сестер — родителями. Характерным проявлением старческого слабоумия является так называемый старческий делирий (см.), который от истинного отличается тем, что причиной нарушения познания действительности являются не галлюцинации (см.), а дефекты восприятия и ориентировки. С этим зачастую связано стремление к псевдодеятельности, когда поведение больного отличается повышенной деловитостью, не приносящей конкретного результата. Если начальный период болезни характеризуется угрюмостью, депрессией, нежеланием жить, то впоследствии в настроении начинают преобладать оттенки благодушия, эйфории, беспечности и, наконец, полного безразличия. Поведение пациента по мере нарастания признаков слабоумия претерпевает значительные изменения: на стадии маразма больные становятся беспомощными, лежат в позе эмбриона и ведут растительный образ жизни. Отличительной особенностью данного заболевания является тот факт, что даже в стадии маразма отсутствуют неврологические расстройства. Ночной сон нередко поверхностный и прерывистый, а днем отмечается выраженная сонливость. Для старческого слабоумия характерна повышенная речевая готовность, а на более поздних стадиях — лишенная смысла болтливость.
Болезнь Альцгеймера Болезнь Альцгеймера представляет собой проявляющееся в предстарческом возрасте заболевание. Средняя продолжительность заболевания составляет 8–9 лет с манифестацией (ярким проявлением) в возрасте 50–60 лет. Заболевание быстро прогрессирует и характеризуется развитием слабоумия и ранним присоединением очаговой симптоматики. Значимое место в проявлениях заболевания отводится распаду памяти: быстро наступают амнестическая дезориентировка и полная утрата приобретенного в жизни опыта. Амнестический синдром редко сопровождается оживлением прошлого опыта, не бывает обычно старческого делирия (см.). Рано появляются и быстро прогрессируют расстройства восприятия, осмысления и внимания. В начале заболевания больные нередко осознают изменения, произошедшие с ними, на поздних этапах преобладают благодушие и тупая эйфория. Характерный симптом болезни Альцгеймера — раннее перерастание компонентов слабоумия в неврологические расстройства. При этом больные утрачивают привычные навыки и бестолково выполняют хорошо знакомую работу. Впоследствии этот симптом превращается в стойкую апраксию (см.). Проявлением болезни Альцгеймера являются прогрессирующая слабость оптического внимания и неустойчивость зрительных установок на окружающие предметы. Изменения на ранних этапах характеризуются деловитостью и суетливостью, а затем сменяются однообразными, простейшими ритмичными движениями. Распад высших корковых функций при болезни Альцгеймера сопровождается нарушениями речевого понимания: стадия ограниченного понимания сменяется тотальной сенсорной афазией (см.). При данном заболевании выражены логорея (неудержимое словоизвержение), патологическая неграмотность, расстройство словообразования. Большое место занимают различные автоматизмы (формы насильственной речи). Часто встречается логоклония — псевдозаикание, когда отмечаются различной степени нарушения: от начального спотыкания на первых буквах или слогах до постоянного повторения звуков или «осколков» слов. Нарушения письменной речи появляются обычно на ранних стадиях болезни и нередко опережают распад устной речи. Психотические расстройства личности встречаются часто и могут быть представлены паранойяльными состояниями, психотическими эпизодами разрозненных бредовых идей ущерба, отравления или преследования, слуховыми и зрительными галлюцинациями, состояниями спутанности, психическими и двигательными возбуждениями, обусловленными ускорением атрофического процесса в головном мозге. При болезни Альцгеймера регистрируются и эпилептические припадки, которые возникают обычно на поздних этапах болезни (припадки чаще бывают единичными). Частым проявляющимся симптомом заболевания являются подкорковые расстройства: скованность в движении, изолированные расстройства походки, хореоподобные и миоклонические гиперкинезы (см.). На последней стадии болезни на фоне полного распада психической деятельности и полной беспомощности пациента наблюдаются резкое повышение мышечного тонуса с вынужденной эмбриональной позой, кахексия (см.) при булимии (см.), эндокринные нарушения, насильственные гримасы плача и смеха, оральные и хватательные автоматизмы. На электроэнцефалограмме обнаруживают распространенные нарушения электрической активности мозга и другие характерные изменения.
Болезнь Пика Заболевание относится к системным атрофиям с предпочтительным наличием атрофических изменений в определенных системах мозга, характеризуется постепенным развитием полного слабоумия, нарушением высших корковых функций и неврологическими расстройствами. При данном заболевании различают основную локализацию процесса в определенных долях или участках коры головного мозга и произвольную. Данное заболевание встречается в 4 раза реже болезни Альцгеймера. Болезнь Пика чаще всего регистрируется в возрасте 55–56 лет, а после 60 лет встречается значительно реже. Соотношение женщин и мужчин — 1,7:1 соответственно. Характерно медленное начало, но возможны острые явные проявления заболевания. Отличительной особенностью болезни Пика от других атрофических заболеваний является преобладание на ранних этапах глубоких личностных изменений, а некоторые функции интеллекта (запоминание, репродуктивная память, внимание, ориентировка, чувственное познание) и автоматизированные формы психической деятельности (счет) страдают меньше. Изменения личности зависят от локализации патологического процесса. При поражении лобных долей отмечаются бездеятельность, вялость, апатия, безразличие, притупление эмоций, оскудение психической, речевой и двигательной активности. Поражение базальной коры сопровождается псевдопаралитическим синдромом, эйфорией, импульсивностью, грубыми нарушениями понятийного мышления (обобщение, понимание пословиц и т. д.), больные утрачивают чувство такта, растормаживаются низшие влечения. При атрофии височных долей выявляют стереотипы речи, поступков, движений. Гораздо реже могут регистрироваться астенические проявления, начальные психотические расстройства, очаговые изменения, ранние проявления расстройств памяти. На ранних этапах болезни Пика грубые нарушения памяти нехарактерны, но имеет место нарушение сложных и различных видов мыслительной деятельности (способность к абстрагированию, обобщению, интеграции, гибкость и продуктивность мышления, критика и уровень суждений). На поздних этапах болезни на фоне полного слабоумия нередко сохраняются некоторые виды элементарной ориентировки и остатки способности к запоминанию, обычно не возникают выраженные оральные и хватательные автоматизмы. При болезни Пика происходит постепенный распад речи с полным разрушением речевых функций и развитием тотальной афазии (см.). Утрата речевых функций начинается с формирования речевых стереотипов и «нежелания» говорить. Поражение лобно-височной области может проявляться нарушением речи. Расстройства письменной речи характеризуются «стереотипией письма». Психические расстройства (см.) при болезни Пика встречаются нечасто и могут быть представлены паранойяльными синдромами, параноидными и галлюцинаторно-параноидными состояниями. У некоторых больных регистрируются состояния расслабления мускулатуры без полного выключения сознания. С частотой 25–30 % развиваются органические неврологические расстройства в виде паркинсоноподобного синдрома и экстрапирамидных гиперкинезов (см.). На последних стадиях состояние пациента при болезни Пика характеризуется полным слабоумием с полным распадом речи, действия и узнавания, развитием маразма и полной беспомощностью. На электроэнцефалограмме выявляют сглаженные «линейные» кривые и общее снижение биоэлектрической активности.
Хорея Гентингтона Хорея Гентингтона является наследственной формой атрофически-дегенеративного заболевания головного мозга. Первые признаки заболевания чаще всего регистрируются в среднем и пожилом возрасте, проявляются распространенными хореатическими гиперкинезами (см.) и другими неврологическими расстройствами и сопровождаются различными психическими нарушениями. Средний возраст составляет 44–47 лет, общая продолжительность болезни — до 12–15 лет. В большинстве случаев характерному симптомокомплексу заболевания предшествует период, когда у больного можно выявить психопатические отклонения: задержку умственного развития, неполноценность двигательных функций (неуклюжесть, недостаточная координация движений, плохой почерк и др.). Психические нарушения при хорее Гентингтона могут возникнуть в различные сроки после появления непроизвольных движений, одновременно с ними или предшествовать им. Психопатические отклонения подразделяют на 3 типа личностных аномалий: возбудимые (злобные, взрывные), истерические (капризные, склонные к демонстративному поведению), замкнутые, эмоционально холодные личности. На более поздних стадиях заболевания личностные особенности стираются, и начинает преобладать выраженное эмоциональное притупление с элементами эйфорического настроения. Слабоумие при хорее Гентингтона характеризуется тем, что при медленном течении патологического (атрофического) процесса оно не всегда носит полный характер. Некоторые больные могут выполнять привычную для них несложную работу, но теряются в незнакомой обстановке. Характерной особенностью слабоумия при хорее Гентингтона является выраженная неравномерность умственной работоспособности (скачкообразное мышление). Отсутствуют явные нарушения высших корковых функций. Расстройство речи в большинстве случаев обусловлено сокращением речевой мускулатуры. Постепенно нарастают признаки оскудения речи, развиваются речевая аспонтанность и «нежелание» говорить. Психотические расстройства на ранних этапах болезни обычно представлены расстройствами психики (нежелание жить), бредовыми расстройствами (бредовые идеи ревности, преследования, отравления). На более поздних стадиях возникают бредовые расстройства (параличеподобный, нелепый бред величия). Возможен переход одних бредовых расстройств в другие. Гораздо реже отмечаются галлюцинаторные эпизоды, галлюцинаторно-параноидные состояния. Неврологические изменения при хорее Гентингтона представлены генерализованными хореатическими гиперкинезами (см.), которые имеют медленный темп хореатических подергиваний с небольшой амплитудой и относительно продолжительными интервалами при относительно малой выраженности пониженного тонуса мышц. В большинстве случаев хорея Гентингтона приводит больных к смерти в состоянии полного слабоумия и маразма, а непроизвольные движения к этому моменту уменьшаются или полностью прекращаются.
Болезнь Паркинсона Болезнь Паркинсона развивается преимущественно в позднем возрасте (50–60 лет) и обусловлена дегенеративно-атрофическим поражением экстрапирамидной системы головного мозга. Течение заболевания хроническое. В клинической картине преобладают неврологические расстройства в виде характерных движений, гипертонически-акинетического синдрома (повышение мышечного тонуса, скованность, бедность движений, нарушение походки) и расстройства периферических нервных центров. Психические изменения наблюдаются редко. Начальный этап заболевания характеризуется наличием раздражительности, аффективной неустойчивости, подозрительности и назойливости. Депрессивное состояние может закончиться попыткой самоубийства. На поздних стадиях заболевания у больных отмечаются симптомы органического снижения психической деятельности, состояния спутанности и другие психотические расстройства. Для этого периода характерно нарастание апатии, безразличия («психодвигательное сужение личности»). Развивается выраженное слабоумие, проявления которого напоминают старческое слабоумие. У большинства пациентов, страдающих болезнью Паркинсона, психические расстройства (см.) занимают второстепенное место, что обусловлено локальным характером атрофических изменений.
Диагностика и дифдиагностика Диагностика заболеваний, обусловленных атрофическими процессами головного мозга, осуществляется на основании данных опроса и результатов объективного обследования пациента. Из дополнительных методов исследования применяют электроэнцефалографию и компьютерную томографию. Заболевания, обусловленные атрофическими процессами головного мозга и приводящие к развитию маразма, необходимо отличать друг от друга, особенно при атипичном их течении.
Лечение Возможности медикаментозного воздействия крайне ограничены. Важное место занимают уход и надзор, так как больные в некоторых случаях не могут осуществлять самоуход. Вследствие расторможенности влечений и расстройств памяти они становятся опасны для окружающих и для себя. Желательным является оставление больного как можно дольше в домашней обстановке (при возможности обеспечить соответствующий уход), так как необходимость привыкать к новой больничной обстановке может способствовать ухудшению состояния. Необходимо обеспечить максимальную активность пациента в течение всего дня, что препятствует развитию легочной патологии, ограничению подвижности в суставах, потере аппетита, появлению пролежней. Положительный эффект на течение заболевания оказывает своевременное лечение сосудистых нарушений. Показана витаминотерапия. Ноотропные препараты оказывают положительное действие лишь на начальных этапах болезни. Борьба с бессонницей включает соблюдение режима дня: прогулки на свежем воздухе, занятость в течение дня, осторожное отношение к соблюдению постельного режима в дневное время. На ночь рекомендуется назначение препаратов со снотворным эффектом в небольших дозах (нитразепам, диазепам). Нейролептические средства в малых дозах показаны только при наличии психотических расстройств или выраженной суетливости. Лечение хореи Гентингтона осуществляется с применением нейролептических средств (производные фенотиазина и бутирофенонов) или уменьшающих содержание допамина в тканях (резерпин). Резерпин в терапевтической дозе 0,75—1,5 мг в сутки и другие препараты подобного действия значительно уменьшают число непроизвольных движений, сглаживают аффективную напряженность и психопатические нарушения поведения. Наряду с указанными средствами показано введение аминазина и препаратов, нарушающих образование допамина (метил-дофа). Терапевтическое вмешательство при болезни Паркинсона включает назначение холинолитических средств (атропин, скополамин), синтетических препаратов (циклодол, тропацин, ридинол, динезин, мидокалм), витамина В6. Снизить мышечную неподвижность помогает L-дофа. Для лечения пациентов с болезнью Паркинсона более молодого возраста в некоторых случаях применяют хирургическое вмешательство. Лечение больных с нерезко выраженными психическими нарушениями проводят в неврологических стационарах. При наличии выраженных психических нарушений личности показана госпитализация в психиатрическое отделение с последующим наблюдением в психоневрологическом диспансере. Прогноз зависит от скорости процессов распада личности и наличия сопутствующих заболеваний. Все больные с признаками маразма нетрудоспособны, недееспособны и невменяемы.
МАСТИТ
ОпределениеМастит — это острое или хроническое воспаление молочной железы. Острый мастит в основном наблюдается у кормящих матерей в первые две недели после родов. Реже мастит развивается в последние недели перед родами и крайне редко — у девушек или женщин в климактерическом периоде. В детском возрасте выделяют мастит физиологический и мастит новорожденных.
Этиология Возбудителем заболевания могут быть стафилококки, стрептококки, кишечная палочка, иногда — протей, синегнойная палочка, анаэробная флора, грибы. В отдельную группу выделяют редкие специфические формы мастита — туберкулезный, сифилитический и гнилостный (см.). Источником инфекции являются больные со стертыми формами гнойно-воспалительных заболеваний и бактерионосители. Лидирующую роль для развития данного заболевания играет внутрибольничная инфекция.
Патогенез Входными воротами для инфекции обычно служат трещины сосков, возможно проникновение инфекции через протоки молочной железы при кормлении ребенка грудью и при сцеживании молока. Очень редко распространение инфекции происходит через кровь и лимфу. Факторами, благоприятствующими развитию заболевания, являются сопутствующие болезни женщины, снижение иммунитета, тяжелое течение родов, неправильное строение сосков, нарушение функциональной деятельности молочной железы, застой молока. Особенностью гнойного процесса в молочной железе, как и при поражении других железистых органов, являются быстрое распространение процесса с вовлечением больших участков железистой ткани, слабо выраженная способность к ограничению патологического процесса.
Расположение гнойников при мастите
Воспалительный процесс может ограничиваться только воспалением млечных протоков или желез околососкового кружка. Переход воспаления на ткань сопровождается последовательно фазами серозного и гнойного воспаления с последующими разрушающими изменениями. Вовлечение в патологический процесс сосудов и их последующее тромбирование приводит к омертвению участков железы, и тогда развивается гангренозная форма мастита. Для хронического гнойного мастита характерно образование мелких скоплений гноя с выраженным насыщением прилежащих тканей. Формированию хронического течения данного заболевания способствует нерациональное лечение путем местного применения антибактериальных средств. По характеру течения различают острый и хронический мастит. По характеру воспалительного процесса мастит подразделяют на серозный, острый инфильтративный и деструктивный (абсцедирующий, флегмонозный, гангренозный). В группе хронических маститов различают гнойную и негнойную формы.
Клиническая картина Острый мастит Серозная (начальная) фаза начинается остро, с повышения температуры тела до 39–40 °C, озноба, появляются боли в молочной железе. Женщина предъявляет жалобы на слабость, бессонницу, снижение аппетита. При осмотре отмечается равномерное увеличение размеров молочной железы без изменения цвета кожи. При прощупывании определяются распространенное уплотнение и болезненность. Сцеживание молока болезненно и облегчения не приносит. В общем анализе крови — повышение уровня лейкоцитов до 10 г/л и повышение СОЭ до 20 мм/ч. При отсутствии лечения патологический процесс через 3–6 дней переходит в следующую фазу — острую инфильтративную. Общее состояние тяжелое, нарастают симптомы интоксикации. Температура тела держится на высоких цифрах, боли усиливаются. Молочная железа значительно увеличивается в размере. Прощупывается болезненное уплотнение с нечеткими контурами. Над ним отмечается покраснение кожи. Увеличиваются в размере регионарные лимфатические узлы. В абсцедирующей фазе усиливается озноб. Температура тела постоянно высокая. Местно отмечаются резкое покраснение кожи молочной железы, расширение подкожной венозной сети, регионарный лимфаденит (см.). В флегмонозной фазе общее состояние резко ухудшается. Кожные покровы бледные, отмечается сухость слизистых оболочек. Больная жалуется на сильную головную боль, отсутствие аппетита. Молочная железа увеличена, выражены незначительная отечность и покраснение, с расширенной сетью вен и явлениями лимфаденита. Кожа молочной железы синюшная, блестящая, сосок втянут. Температура тела — 40–41 °C, в крови определяется повышение уровня лейкоцитов до 20 г/л, СОЭ составляет 40–50 мм/ч. В моче появляется белок. В гангренозной фазе общее состояние крайне тяжелое. В результате развития тромбоза и застоя в молочной железе развивается некротический процесс. Молочная железа резко увеличена в размере. Кожа отечная с пузырями, наполненными участками омертвевших тканей. Отек распространяется на окружающие ткани. Регионарные лимфатические узлы увеличены, болезненны при прощупывании. В крови — высокий лейкоцитоз до 30 г/л, со сдвигом лейкоцитарной формулы влево и токсической зернистостью лейкоцитов. В моче определяются белок, лейкоциты, эритроциты.
Хронический мастит В результате длительного местного применения антибиотиков при лечении мастита заболевание переходит в хроническую форму. Общее состояние больных удовлетворительное. Температура тела — не выше 37–38 °C или нормальная. Молочная железа несколько увеличена в объеме. При прощупывании определяется уплотнение хрящевидной плотности, не спаянное с кожей и малоболезненное. Над уплотнением отмечается покраснение кожи. На стороне поражения несколько увеличены регионарные лимфатические узлы.
Мастит новорожденных Мастит у новорожденных наблюдается с одинаковой частотой как у девочек, так и у мальчиков. Гнойный мастит развивается чаще всего в первые 2–3 дня жизни на фоне физиологического набухания молочных желез, обусловленного переходом женских половых гормонов (эстрогенов) через плаценту от матери к плоду. Предрасполагающим фактором для развития гнойного мастита у новорожденного ребенка является недостаточный уход за кожей, гнойничковые поражения. Заболевание начинается остро. Температура тела повышается до 38–39 °C. Ребенок беспокоен, нарушены сон и аппетит. В области молочной железы сначала с одной стороны, а затем и с обеих сторон появляются покраснение кожи и отек. На 2—3-и сутки от начала заболевания вблизи ареолы соска определяется флюктуация, а покраснение и отек распространяются на окружающие ткани. Осложнением мастита новорожденных при отсутствии своевременного лечения нередко является переход в сепсис (см.). При своевременной диагностике и правильном лечении течение заболевания без осложнений, исход благоприятный. Нерациональное лечение мастита приводит к хронизации заболевания или к развитию осложнений — сепсису (см.), или самопроизвольному вскрытию гнойников с образованием молочных свищей, которые закрываются самостоятельно в течение длительного времени. Обширные разрушающие процессы нередко приводят к нарушению функции молочной железы.
Диагностика и дифдиагностика Диагноз мастита ставят на основании данных опроса и данных объективного обследования пациента. При остром течении мастита различают несколько фаз патологического процесса и локализацию абсцесса (скопления гноя). При хроническом течении мастит отличают от рака (см.) молочной железы, реже — от актиномикоза (см.) и сифилиса (см.). В данной ситуации диагноз ставят на основании исследования гноя, а также данных тканевого исследования. Мастит новорожденных различают с физиологическим нагрубанием молочных желез (физиологический мастит новорожденных). Для гнойного воспаления молочных желез характерным признаком являются односторонний характер поражения в начале болезни, наличие местной воспалительной реакции и изменение общего состояния новорожденного.
Лечение и профилактика Лечение напрямую зависит от фазы патологического процесса. При серозном и инфильтративном мастите лечение консервативное, деструктивный мастит является показанием к хирургическому вмешательству. При наличии начальных форм мастита важно предупредить застой молока. С этой целью молоко регулярно сцеживают и придают молочной железе возвышенное положение (предупреждение венозного застоя) с помощью косынки или повязки. Назначают антибактериальную терапию: полусинтетические пенициллины, аминогликозиды, цефалоспорины, макролиды, сульфаниламиды в сочетании с антибиотиками. Дезинтоксикационную терапию проводят с использованием кровезамещающих жидкостей, белковых препаратов и солевых растворов внутривенно капельно. К консервативным методам лечения относятся новокаиновые блокады с антибиотиками и протеолитическими ферментами: 70–80 мл 0,5 %-ного раствора новокаина, 500 тыс. ЕД канамицина, 10 мг трипсина или химотрипсина. Показано физиотерапевтическое лечение молочной железы (ультрафиолетовое облучение, УВЧ, соллюкс). Деструктивные и хронические формы мастита подлежат оперативному лечению под общим наркозом. Производят глубокие разрезы молочной железы, удаляют все омертвевшие ткани и гной, разделяют перемычки и промывают раствором перекиси водорода. Рану дренируют (налаживают отток гноя и секрета) и накладывают швы. Лечение ран после вскрытия гнойника осуществляют с учетом фазы патологического процесса. Профилактика маститов сводится к предупреждению образования трещин сосков и застоя молока у кормящей женщины. С этой целью удаляют внутренние очаги инфекции, проводят обучение беременных женщин правилам кормления ребенка и ухода за молочными железами. Особое внимание необходимо уделять женщинам из группы риска: с маститом, мастопатией, аномалиями развития молочных желез и соска, с осложнениями беременности. Профилактика мастита у новорожденных сводится к строгому соблюдению правил асептики и антисептики медицинским персоналом родильных домов, регулярному уходу за кожей и слизистыми оболочками новорожденного ребенка.
МАСТИТ ГНИЛОСТНЫЙ
ОпределениеГнилостный мастит — воспаление молочной железы, обусловленное гнилостной флорой.
Этиология Возбудители внедряются через ссадины и трещины сосков и распространяется по молочным и лимфатическим ходам. Застойные явления в молочной железе способствуют возникновению заболевания. Инфекция имеет тенденцию к быстрому распространению в связи с присоединением тромбоза сосудов, нарушением кровоснабжения и прогрессированием некроза ткани железы, жировой клетчатки и кожи.
Клиническая картина и диагностика Состояние больной крайне тяжелое. Быстро нарастает интоксикация (температура тела достигает 40–41 °C, отмечаются тахикардия, слабость). Нередко развивается печеночная недостаточность на фоне интоксикации, сепсиса. Пораженная молочная железа увеличена в объеме, кожа напряжена, нередко покрыта пузырями, наполненными геморрагической жидкостью. В крови отмечается повышение уровня нейтрофильных лейкоцитов, появление в моче белка. Осложнениями гнилостного мастита могут быть сепсис, субпекторальная флегмона. Диагноз устанавливается на основании жалоб и данных объективного осмотра.
Лечение Необходима срочное оперативное лечение. Ранняя операция — широкое вскрытие гнойников, иссечение зон некроза, активное дренирование раны. Целесообразно использование гипербарической оксигенации (насыщение кислородом в барокамере), локальных изоляторов с управляемой абактериальной средой. Массивная антибиотикотерапия. При прогрессировании процесса показано удаление железы (мастэктомия).
МАСТОИДИТ
ОпределениеМастоидит — это заболевание, характеризующееся острым воспалением тканей сосцевидного отростка.
Этиология Причиной заболевания чаще всего являются острый гнойный отит (см.) или обострение хронического гнойного среднего отита, осложнениями которых и может быть мастоидит. Способствуют переходу инфекции на сосцевидный отросток при названных заболеваниях следующие причины: нерациональная терапия острого отита, высокая способность инфекции к заражению при ослаблении защитных сил организма, наличие сопутствующей патологии (диабет (см.), туберкулез (см.), нефрит (см.) и др.). У детей раннего возраста предрасполагающими факторами могут быть искусственное вскармливание, недостаточность питания, рахит (см.), диспепсия (см.), бронхопневмония (см.).
Патогенез Мастоидит обычно развивается на исходе острого отита и у больных с пневматическим (с воздушными полостями) типом строения сосцевидного отростка. Изменения в сосцевидном отростке находятся в прямой зависимости от стадии заболевания. Выделяют экссудативную и пролиферативно-альтеративную стадии мастоидита. Экссудативная стадия характеризуется наличием воспаления и утолщения слизистой оболочки ячеек отростка, а сами ячейки заполнены воспалительной жидкостью. Во второй стадии в процесс вовлекается костная ткань. Кость разрушается специальными клетками, образуются новые ткани. Через 10–20 дней от начала заболевания костные перегородки между ячейками омертвляются, образуя единую полость, которая заполнена гноем (эмпиема сосцевидного отростка). При неблагоприятном течении разрушение кости может перейти на твердую оболочку средней и задней черепных ямок. Нарушение целостности стенок сосцевидного отростка сопровождается выходом гноя под его надкостницу на поверхность. Гной из такого абсцесса может распространяться по капсульным пространствам между мышцами, образуя холодный гнойный натечник в области шеи.
Клиническая картина Клиническая картина мастоидита характеризуется наличием общих и местных симптомов. Обычно на исходе острого отита (через 2–3 недели от его начала) отмечаются повторное повышение температуры тела до высоких цифр, ухудшение самочувствия больного, появление пульсирующей головной боли и изменений воспалительного характера в крови: умеренное повышение лейкоцитов в крови, постепенное повышение СОЭ. Больной предъявляет жалобы на боль в области сосцевидного отростка, шум в ухе, который усиливается по ночам, и значительное снижение слуха на стороне поражения. При объективном обследовании пациента выявляют незначительную отечность и покраснение кожи, сглаженность заушной складки; ушная раковина оттопырена кпереди или книзу. При прощупывании определяется резкая болезненность сосцевидного отростка со сосредоточением точек наибольшей болезненности в области верхушки, площадки и по заднему краю. При отоскопическом исследовании больного определяется возобновление гноетечения и пульсации гноя сливкообразной консистенции, барабанная перепонка застойная, медно-красного цвета. Наиболее ценным диагностическим признаком при мастоидите является нависание задне-верхней стенки наружного слухового прохода в костном отделе, что обусловлено воспалением передней стенки сосцевидного отростка. В некоторых случаях к обычному гноетечению через прободение в барабанной перепонке присоединяется обильное выделение гноя через заднюю стенку наружного слухового прохода, что становится возможным при формировании свища. Распространенность воспалительного процесса в сосцевидном отростке и переход его на соседние анатомические образования зависят от общей устойчивости организма больного и степени пневматизации (воздушности) — развития воздухоносных клеток, которые могут быть в чешуе височной кости, пирамиде, скуловом отростке. Активизация воспаления может привести к образованию поднадкостничного абсцесса (см.) в результате прорыва гноя из клеток под надкостницу. Распространение гноя на те или иные анатомические области приводит к формированию различных форм мастоидита: бецольдовская форма (верхушечно-шейный мастоидит), зигоматицит (поражение скулового отростка), сквамит (поражение части височной кости), петрозит (поражение каменистой части височной кости). Чаще всего прорыв гноя осуществляется через тонкие стенки клеток верхушки на ее внутренней поверхности между двубрюшной и грудино-ключично-сосцевидной мышцами. В дальнейшем возможно проникновение гноя в средостение или заглоточное пространство, на переднюю поверхность позвонков. Подобная форма получила название верхушечно-шейного (бецольдовского) мастоидита. Характерным признаком бецольдовского мастоидита является наличие припухлости плотной консистенции на протяжении от верхушки сосцевидного отростка до ключицы. Цвет уплотнения варьирует от покраснения до синюшного оттенка. Пациент предъявляет жалобы на усиление боли при повороте головы, поэтому держит голову в вынужденном положении — голова склоняется на сторону поражения. Для клинической картины петрозита свойственно наличие сильнейшей головной боли на стороне больного уха, которая усиливается в ночное время. Головная боль смещается в область глазницы, лба, виска или в зубы. При петрозите у больного могут отмечаться двоение в глазах и ограничение движений глазного яблока кнаружи вследствие поражения отводящего нерва. Распространение процесса на глазодвигательный нерв сопровождается ограничением движения глазного яблока кнутри и книзу. Сочетанное поражение глазодвигательного и отводящего нервов приводит к полной неподвижности глазного яблока (офтальмоплегия). В случае перехода воспаления на нижнюю поверхность пирамиды возникают симптомы поражения IX, X, XI, XII пар черепно-мозговых нервов: ограничение подвижности мягкого нёба на пораженной стороне, отклонение в больную сторону высунутого языка, ограничение поднятия плеча.
Поражение сосцевидного отростка у детей раннего возраста Сосцевидный отросток полностью сформирован к концу 3-го года жизни ребенка, но уже в период новорожденности всосцевидной части височной кости имеется большая полость (антрум). Распространение воспалительного процесса при остром гнойном отите у детей раннего возраста получило название антрита, а у детей первых месяцев жизни — отоантрита. Антрит сопровождается воспалением слизистой оболочки пещеры сосцевидного отростка и остеомиелитом окружающих тканей. Учитывая клинические проявления заболевания, выделяют две формы антрита: явную и скрытую. Явная форма сопровождается всеми характерными симптомами острого отита, зачастую осложняется развитием поднадкостничного абсцесса. Болевой синдром (см.) проявляется плачем, ребенок отказывается от еды. При исследовании уха (отоскопии) отмечается размытость опознавательных пунктов барабанной перепонки, которая имеет розовый или сероватый цвет. В заушной области определяется припухлость, болезненная при прощупывании. При рентгенологическом исследовании выявляют снижение прозрачности полости сосцевидного отростка. При скрытой форме на первый план выходят симптомы токсикоза, а местные проявления заболевания выражены слабо или отсутствуют (особенно в первые дни от начала болезни). В последующем при скрытой форме нередко отмечается двусторонность поражения. В начале заболевания ребенок возбужден, сон нарушен. Нередко определяются признаки менингизма. Аппетит отсутствует, стул учащенный, жидкий. Ежедневная прибавка массы тела не соответствует возрастной норме или отсутствует. Кожные покровы бледные и влажные. Пульс частый, тоны сердца приглушены. Со стороны дыхательной системы определяется одышка. В крови повышено содержание нейтрофильных лейкоцитов и СОЭ. Температура тела повышается до 38–39 °C, а при тяжелом течении держится на нормальных цифрах или слегка повышена. При своевременной диагностике и адекватной терапии течение заболевания благоприятное, осложнения отсутствуют. Наибольшую опасность представляют атипичные формы мастоидита. Причиной развития атипичных форм могут быть возраст больного, реактивность организма пациента, неоправданное применение низких доз антибактериальных препаратов, способность к заражению инфекционного агента, анатомические особенности строения височной кости (распространенность воздухоносных клеток). Атипичное течение заболевания характеризуется отсутствием последовательности стадий развития мастоидита, а клинические проявления выражены незначительно. Отсутствие четких проявлений сопровождается обширными поражениями костной ткани, что нередко приводит к развитию внутричерепных осложнений.
Диагностика и дифдиагностика Распознавание типичной формы мастоидита основывается на данных опроса (наличие острого гнойного отита), данных объективного обследования больного (общие и местные симптомы) и результатах дополнительных методов исследования (рентгенография височных костей). С помощью рентгенографии височных костей проводят сравнение здорового и больного уха. Для мастоидита характерным является снижение пневматизации (воздушности), завуалированность полости сосцевидного отростка и клеток, а на поздних стадиях выявляют разрушение костных перегородок с образованием участков просветления за счет разрушения костной ткани и скопления гноя. Диагностика в детском возрасте часто затруднена отсутствием четких проявлений заболевания, что является показанием для проведения пробной пункции. Антропункцию осуществляют при положении ребенка лежа на спине, голову поворачивают и фиксируют на стороне здорового уха. После местной анестезии 0,25 %-ным раствором новокаина и двукратной обработки кожи 70 %-ным спиртом проводят пункцию толстой иглой, снабженной регулятором глубины вкола. Через иглу шприцем отсасывают содержимое полости сосцевидного отростка (гной, слизь) и вливают раствор пенициллина (100 тыс. ЕД в 1 мл). Осложнением пункции может быть попадание иглы в синус или мозг (в шприце содержится кровь или мозговое вещество). В данной ситуации срочно проводят вскрытие полости с исследованием травмированного участка. Мастоидит отличают от фурункула (см.) наружного слухового прохода с локализацией последнего в области задней стенки. При фурункуле надавливание на область уха (козелок), жевание, потягивание за ушную раковину приводят к усилению боли. Диагностическая картина при фурункуле характеризуется сужением в перепончато-хрящевом отделе, а при мастоидите — в костном. Слуховая функция при фурункуле, в отличие от мастоидита, не нарушена.
Лечение и профилактика Выбор метода лечения зависит от стадии развития мастоидита и включает консервативное лечение или хирургическое вмешательство. Больному назначают антибактериальное лечение с учетом чувствительности микрофлоры, десенсибилизирующие препараты, тепловые процедуры (УВЧ, СВЧ, согревающие компрессы на область уха и сосцевидного отростка). При наличии хронических очагов инфекции осуществляют их удаление (состояние носа, околоносовых пазух и носоглотки). При отсутствии положительного результата от консервативных методов лечения проводят трепанацию сосцевидного отростка и удаляют омертвевшие ткани. После удаления патологически измененной костной ткани и новой растущей ткани заушная рана тампонируется и обычно ведется открыто. Постепенно (по мере роста новой ткани) накладываются поздние отсроченные швы. В послеоперационный период наряду с манипуляциями по обработке раны назначают антибактериальную терапию и ультрафиолетовое облучение раны, витаминотерапию, переливание крови. Заживление раны при благоприятном течении послеоперационного периода наступает к 20-му дню. Рана закрывается вторичным натяжением. Излечение считается полным при закрытии послеоперационной полости, прекращении гнойных выделений из уха, восстановлении слуха. Профилактика заболевания в детском возрасте осуществляется путем сохранения грудного вскармливания, предупреждения развития инфекционных заболеваний, проведения закаливающих процедур, что способствует становлению иммунной системы и приспособлению ребенка к условиям внешней среды. Во всех возрастных группах важная роль принадлежит очищению верхних дыхательных путей, своевременной диагностике острого гнойного отита и адекватной терапии данного заболевания.
МАСТОЦИТОЗ
ОпределениеМастоцитоз — хроническое заболевание, поражающее кожу, а также внутренние органы, кости, характеризующееся наличием багрово-коричневых пятен и папул на коже и поверхности внутренних органов в результате пролиферации тучных клеток.
Этиология и патогенез В его основе лежат патологические процессы, обусловленные аккумуляцией и пролиферацией тучных клеток (или лаброцитов, мастоцитов) и высвобождением из них биологически активных веществ.
Клиническая картина и диагностика Наиболее частыми разновидностями болезни являются пятнистый и папулезный мастоцитоз, нередко сочетающиеся друг с другом и известные под названием пигментной крапивницы, которая характеризуется распространенными и обильными синюшно-розовыми, в дальнейшем коричневато-бурыми пятнами и папулами небольших размеров и округлых очертаний. Высыпания возникают обычно по типу многократных атак с короткими ремиссиями. Течение неопределенное. Пигментная крапивница, возникшая в раннем детском возрасте, — особенно в грудном, к началу пубертатного периода часто подвергается спонтанному регрессу. У взрослых она отличается нарастающей тяжестью. Реже мастоцитоз проявляется узлами размером от горошины до боба, обычно коричневато-желтоватой окраски, нередко сливающимися, особенно в крупных складках, в обширные конгломераты; пузырями, возникающими, как правило, в раннем детском возрасте и наслаивающимися чаще всего на другие варианты этого заболевания; диффузными очагами с четкими границами, при увеличении размеров и числа которых может сформироваться эритродермия; мастоцитомой, имеющей сходство с гистиоцитомой или невокарциномой; стойкой пятнистой телеангиэктазией в виде различной величины и очертаний пятен, состоящих из густо переплетающихся телеангиэктазий на пигментированном фоне. К изменениям кожи могут присоединиться поражения внутренних органов (особенно печени и селезенки), периферической крови и костного мозга и другие общие нарушения с возможным летальным исходом. Высыпания при трении, давлении, тепловых процедурах и других раздражителях становятся ярко-красными, отечными и зудящими (феномен Дарье-Унны). Диагноз всегда требует гистологического подтверждения.
Лечение Эффективная терапия отсутствует. Назначают антигистаминные препараты (фенкарол, диазолин, супрастин, тавегил и особенно задитен), проводят фотохимиотерапию.
МЕГАКОЛОН
ОпределениеМегаколон (синонимы: болезнь Гиршпрунга, болезнь Чагаса, идиопатический мегаколон и др.) — гигантизм толстого кишечника различного происхождения, характеризующийся хроническим застоем кишечного содержимого и расширением ободочной кишки с увеличением ее стенки и нарушением ее эвакуаторной функции.
Этиология Причиной развития заболевания в детском возрасте являются врожденный дефицит или отсутствие периферических нервных рецепторов, нарушение проводимости в нервных путях, что обусловлено нарушением миграции нервных клеток с 7-й по 12-ю неделю эмбрионального развития. У детей старшего возраста и у взрослых (чаще в возрасте 20–30 лет) заболевание может развиться на фоне токсического поражения нервных сплетений стенки толстого кишечника, дистрофического поражения центральной нервной системы, что приводит к нарушению двигательной деятельности нижних отделов толстого кишечника или его сегментов, а также органического сужения толстой кишки.
Патогенез Полное отсутствие или дефицит периферических нервных рецепторов и нарушение проводимости в нервных путях стенки толстого кишечника приводят к затруднению продвижения каловых масс по гладким мышцам или суженной части толстой кишки, что ведет к резкому расширению и увеличению стенки вышерасположенных ее отделов. Увеличение расширенной части толстой кишки формируется вследствие активизации перистальтики для продвижения содержимого через аганглионарную зону. В месте расширения отмечается вторичная гибель увеличенных мышечных волокон и замена их соединительной тканью. Патологический процесс захватывает подслизистый и слизистый слои. Замедление продвижения кишечного содержимого, длительный застой его в толстой кишке (стул отсутствует в течение 5–7, а иногда до 30 дней) угнетает позывы на дефекацию, приводит к перестройке регионарного кровотока, нарушению проницаемости, к рассасыванию, интоксикации и дисбактериозу (см.), задержке развития ребенка или резкому снижению трудоспособности у взрослых. Тяжесть течения заболевания, особенности клинических проявлений, возможные осложнения находятся в прямой зависимости от протяженности пораженного сегмента толстой кишки, регулярного проведения адекватной консервативной терапии, компенсаторных возможностей организма больного. Врожденный порок развития нижних отделов толстого кишечника встречается чаще у мальчиков (80–85 %). Анатомически различают несколько форм заболевания: — ректальная форма (с поражением промежностного отдела прямой кишки; с поражением ампулярной и надампулярной частей прямой кишки); — ректосигмоидальная форма (с поражением части сигмовидной кишки; с полным или частичным поражением сигмовидной кишки); — сегментарная форма (с поражением двух сегментов и участком нормальной кишки между ними; с поражением одного сегмента в ректосигмоидном переходе или сигмовидной кишке); — субтотальная форма (с поражением нисходящей и части поперечной ободочной кишки; с распространением на правую половину толстой кишки); — тотальная форма (поражение всей толстой кишки). По вариантам клинического течения заболевание подразделяется на компенсированную форму (хроническое течение), субкомпенсированную форму (подострое течение) и декомпенсированную форму (тяжелое течение).
Клиническая картина Основным симптомом заболевания является отсутствие самостоятельного стула — хронический запор (см.). При врожденном мегаколоне данный симптом отмечается с первых дней жизни. Наличие короткого аганглионарного сегмента проявляется запорами в течение 1–3 дней и легко ликвидируется после постановки очистительной клизмы. Наличие длинного сегмента характеризуется нарастанием симптомов кишечной непроходимости (см.). Запор постепенно прогрессирует. У детей грудного возраста этому способствует переход на искусственное вскармливание или введение прикорма, когда каловые массы приобретают более густую консистенцию. У детей старшего возраста и у взрослых клиническая картина и течение заболевания напрямую зависят от правильности консервативной терапии. В редких случаях стул бывает самостоятельным, а чаще всего только после клизмы. Вторым постоянным симптомом заболевания является метеоризм. Запоры и метеоризм способствуют расширению сигмовидной и других отделов ободочной кишки, что в дальнейшем приводит к увеличению живота, высокому стоянию диафрагмы. При этом грудная клетка приобретает бочкообразную форму. Реберная дуга развернута, ее угол тупой, легкие находятся в поджатом состоянии, дыхательная поверхность уменьшена, что создает условия для рецидивирующего течения бронхитов (см.) и пневмоний (см.). Постепенно брюшная стенка истончается и становится дряблой («лягушачий живот»). Через брюшную стенку видна перистальтика раздутых петель кишечника, а смещение кишки в ту или другую сторону придает животу асимметричную форму. При прощупывании кишечника, заполненного каловыми массами, ощущается тестоватая консистенция, а при наличии каловых камней — плотная. От давления пальцами на передней брюшной стенке остаются вдавления (симптом «глины»). Отсутствие адекватного ухода и лечения или тяжелое течение заболевания приводят к развитию хронической каловой интоксикации. У больных появляются сердечно-сосудистые и дыхательные расстройства, отмечаются анемия (см.), нарушение функций печени, белкового и электролитного обмена. У детей младшего возраста на фоне недостаточности питания формируется отставание в физическом, а при тяжелом течении — и в психодвигательном развитии. Осложнениями заболевания являются дисбактериоз и острая кишечная непроходимость. Дисбактериоз кишечника приводит к развитию воспалительного процесса и к изъязвлению слизистой оболочки толстого кишечника, что клинически проявляется так называемым «парадоксальным» поносом. При длительном отсутствии стула у больного может развиться острая кишечная непроходимость, появляется неукротимая рвота, больной жалуется на боли в животе. Если на данном этапе не оказать экстренной помощи, кишечная непроходимость может привести к прободению толстой кишки и перитониту (см.). Клиническое течение заболевания зависит от длины аганглионарного сегмента: компенсированное течение обычно соответствует ректальной и ректосигмоидальной формам аганглиоза, субкомпенсированное течение — сегментарной форме, а декомпенсированное течение — субтотальной и тотальной формам. Компенсированная форма (хроническая) характеризуется легким течением. Состояние больного может быть удовлетворительным. Наблюдаются задержка стула и метеоризм (см.). После введения газоотводной трубки или после очистительной клизмы происходит отхождение каловых масс. Компенсация сохраняется при хорошем уходе и регулярном опорожнении кишечника. Анемия (см.) выражена умеренно. Самочувствие больного обычно не страдает. Физическое и психодвигательное развитие детей соответствует возрасту. При нарушении диеты и отсутствии соответствующего лечения состояние ухудшается, образуются каловые камни, нарастает каловая интоксикация. Субкомпенсированная форма (подострая) характеризуется среднетяжелым течением и является переходной стадией от хронической формы к декомпенсированной (острой). Общее состояние пациента постепенно ухудшается. Задержка стула носит упорный характер, а консервативные методы лечения приносят лишь временное облегчение. Для опорожнения кишечника используют уже не очистительные, а сифонные клизмы. Ярко выражены симптомы интоксикации, анемия. Дети отстают в физическом развитии. Декомпенсированная форма (острая) характеризуется тяжелым течением и наблюдается при врожденном пороке развития нижних отделов толстой кишки или при отсутствии лечения и ухода при вторичном мегаколоне. Состояние тяжелое. Стул отсутствует, газы не отходят. Вздутие живота происходит на глазах, становится видно ритмичное сокращение мышц через переднюю брюшную стенку. У больного появляются рвота и симптомы обезвоживания. Нарастают симптомы низкой кишечной непроходимости. Очистительная клизма не приносит облегчения, так как каловые массы и газы отходят плохо (обязательна постановка сифонной клизмы). Нередко приходится накладывать каловый свищ. У новорожденных детей возможны симптомы высокой кишечной непроходимости.
Диагностика и дифдиагностика Диагноз мегаколона ставят на основании данных опроса, клинических проявлений заболевания и результатов дополнительных методов исследования. Диагноз основывается на следующих симптомах: ранний запор и отсутствие самостоятельного стула, вздутие живота, наличие суженной зоны на рентгенограмме толстой кишки. В практике большое значение имеет рентгенологическое исследование, которое проводят после опорожнения кишечника. На обзорной рентгенограмме отмечается наличие раздутых и расширенных петель толстой кишки, высокое стояние купола диафрагмы. Более достоверные данные получают с помощью рентгеноконтрастных методов исследования. В прямую кишку больного вводят барий через газоотводную трубку и осматривают под рентгеновским экраном в различных проекциях. В качестве контрастного вещества используют бариевую взвесь и 1 %-ный раствор натрия хлорида (30–80 мл новорожденным и детям грудного возраста, 100–300 мл детям в возрасте от 1 года до 3 лет, 300–500 мл детям старшего возраста, 500—1000 мл взрослым). У новорожденных можно использовать перитраст или 20 %-ный раствор триотраста. При рентгеноконтрастном исследовании выполняют четыре рентгенограммы: одна в прямой проекции, вторая — в боковой, третья и четвертая — после опорожнения кишечника. Две первые рентгенограммы выполняют при тугом заполнении кишечника с целью определения степени расширения зоны около суженного участка. Две последние рентгенограммы необходимы для выявления протяженности суженной зоны. Достоверным рентгенологическим признаком мегаколона является суженная зона по ходу толстой кишки и расширение вышележащих ее отделов, в которых отмечается отсутствие складчатости и сглаженность контуров. После отхождения каловых масс характерным для мегаколона признаком является задержка опорожнения кишечника, что важно при диагностике заболевания у детей раннего возраста, у которых разница в диаметре суженной и расширенной частей выражена незначительно. Наибольшие трудности возникают в диагностике при наличии у пациента ректальной формы. В данной ситуации для выявления аганглионарного участка выполняют рентгенограмму в косой проекции или при отведении кишки в сторону путем прощупывания нижних отделов живота. Важным методом диагностики заболевания является ректальная (через прямую кишку) биопсия стенки толстой кишки, которая подтверждает отсутствие нервных узлов в подслизистом и мышечном слоях терминального отдела толстой кишки. Биопсия у новорожденных детей должна включать оба слоя мышц прямой кишки, чтобы в препарате присутствовало ауэрбахово сплетение. Биопсию выполняют выше внутреннего сфинктера (мышечного жома). Функциональное состояние ректоанальной зоны регистрируют с помощью ректальной (через прямую кишку) манометрии. Для мегаколона характерными являются отсутствие ректоанального тормозного рефлекса, повышение тонуса глубокого мышечного жома на 50 %, увеличение максимально переносимого объема. При ректальной электромиографии отмечается снижение амплитуды медленных электрических волн. Комплексное обследование пациента позволяет не только поставить диагноз мегаколона, но и определить протяженность аганглионарной зоны, что важно знать при выборе тактики лечения. Дифференциальную диагностику осуществляют с аноректальными пороками развития, с заболеваниями, протекающими с хроническими запорами (см.), привычным запором, вызванным трещинами заднего прохода (см.).
Лечение Лечение заболевания только хирургическое. При наличии у больного врожденного порока развития толстой кишки оптимальными сроками выполнения радикальной операции считается возраст 2–3 года. Осуществляется удаление участка с частью расширенной толстой кишки. В период, предшествующий оперативному вмешательству, необходимо строго придерживаться принципов консервативной терапии. Основным условием является регулярное опорожнение кишечника. Больной должен соблюдать послабляющую диету с использованием продуктов, усиливающих перистальтику (овсяная каша, чернослив, свекла, морковь, яблоки и др.). Благоприятное воздействие на моторику кишечника и состояние его микрофлоры оказывает прием в пищу кисломолочных продуктов. Ежедневно за 10–15 мин до приема пищи необходимо проводить массаж живота. Комплекс лечебной физкультуры должен быть направлен на укрепление мышц брюшного пресса. Слабительные средства при мегаколоне не показаны, но назначают внутрь растительное масло (детям раннего возраста — 1 ч. л., дошкольного возраста — 1 дес. л., школьного возраста — 1 ст. л., взрослым — 1–2 ст. л. 3 раза в день). Учитывая отсутствие самостоятельного стула у больных, важное место в консервативном лечении отводится клизмам. В зависимости от компенсации патологического процесса используют очистительные, гипертонические, вазелиновые, сифонные клизмы. Для проведения очистительной и сифонной клизм используют воду комнатной температуры, так как теплая вода при плохом опорожнении кишечника начинает быстро всасываться. Это может привести к нарастанию симптомов интоксикации и отеку мозга, резкому ухудшению состоянию больного, а в некоторых случаях — к смертельному исходу. После клизмы обязательно вводят на 1–2 ч газоотводную трубку через суженную часть толстой кишки с целью эвакуации жидкости из расширенной части кишки. Лечение дисбактериоза проводится под строгим контролем состава микробной флоры толстой кишки (кал на дисбактериоз). Перорально (через рот) назначают антибактериальные препараты с учетом чувствительности микрофлоры, противогрибковые средства. В дальнейшем показано использование биопрепаратов. После оперативного вмешательства больной находится на диспансерном учете в течение 1–1,5 лет. Рекомендуется продолжить соблюдение послабляющей диеты и комплекса лечебной физкультуры. Стул должен быть регулярным. С этой целью в период реабилитации в одно и то же время суток проводят электростимуляцию прямой кишки, очистительные клизмы и тренировку анального сфинктера, что способствует выработке условного рефлекса на дефекацию. Для электростимуляции используют прибор «Амплипульс». Продолжительность процедуры составляет 15–20 мин курсом 10–15 дней. Курс повторяют через 3 месяца. Тренировку анального мышечного жома осуществляют с помощью раздувающегося баллончика в течение 15–20 дней. Медикаментозная терапия включает введение прозерпина из расчета 0,1 мл препарата на год жизни, но не более 1 мл в сутки.
МЕЛАНОМА
ОпределениеМеланома — злокачественная опухоль мягких тканей, образующаяся из пигментных клеток — меланоцитов. Наиболее часто локализуется в коже (90 %), редко в конъюнктиве, хориоидальной оболочке глаза, слизистой оболочке носа, полости рта, влагалища, прямой кишки.
Этиология Меланома кожи появляется чаще в возрасте 30–50 лет. Как факторы риска можно отметить значительные дозы ультрафиолетовой радиации, травмы невусов, семейную предрасположенность к меланоме, пигментную ксеродерму, меланоз Дюбрея. В 50–70 % случаев меланома кожи возникает из пигментных невусов. Наиболее опасен пограничный (эпидермальный) невус. Чаще встречается на коже мошонки, ладоней, подошв, представляет собой плоское пятно или пигментированный узелок размером около 1 см, не возвышающийся над кожей. Реже меланома развивается из внутридермального, голубого невусов. В больших невусах нередки включения пограничного невуса. В 1/3 случаев невус, предшествовавший меланоме, развился уже во взрослом возрасте; в 1/3 случаев был врожденным.
Клиническая картина и диагностика От своевременного диагноза меланомы зависит прогноз. Любые изменения невуса — увеличение, изменение цвета, изъязвление, кровоточивость — требуют немедленного хирургического вмешательства. Аналогичная тактика рекомендуется по отношению к растущим новым пигментным образованиям на прежде нормальной коже. Меланома кожи чаще возникает на коже головы, шеи, конечностей. После удаления меланомы кожи могут быть оценены факторы, влияющие на прогноз. Особую роль играет степень инвазии опухолью различных слоев кожи, что коррелирует с развитием метастазов. Уровни инвазии I (местно), II (вовлечение сосочкового слоя) и частично III (проникновение до ретикулярного слоя) характеризуют ранний диагноз заболевания. Степени IV (проникновение в ретикулярный слой) и V (в подкожную жировую клетчатку) свидетельствуют о позднем диагнозе. При ранних стадиях инвазии 5-летняя выживаемость составляет 60–80 %. Кроме степени инвазии кожи, на прогноз заболевания влияют локализация опухоли, наличие метастазов в рагионарные лимфатические узлы и другие факторы. Меланома метастазирует в кожу, подкожную клетчатку, легкие, печень, головной мозг и другие органы и ткани.
Лечение Основной метод лечения локализованной меланомы — хирургический. Регионарные лимфатические узлы удаляют в тех случаях, когда они увеличены. Адъювантная химиотерапия не улучшает результаты. При диссеминированной меланоме показана химиотерапия, при этом регрессия опухолевых образований наблюдается у 20–40 % больных. Наиболее эффективны следующие лечебные режимы: — имидазолкарбоксамид 200–250 мг/м2 внутривенно ежедневно, 5 дней; — ломустин 100 мг/м2 перорально в первый день в сочетании с винкристином — 1,2 мг/м2 внутривенно 1-й, 8-й и 15-й дни и дактиномицином — 500 мкг внутривенно 3 раза в неделю, 6 доз; — винбластин 6 мг/м2 внутривенно в 1-й день в сочетании с цисплатином — 120 мг/м2 внутривенно в 1-й день, и блеомицетином — 10 мг внутримышечно в 1—5-й дни. Интервалы между курсами химиотерапии — 4 недели.
МЕЛЕНА ИСТИННАЯ
Определение и этиологияМелена — это дегтеобразный черный стул. Причиной появления у больного дегтеобразного черного стула являются кровотечения при различных заболеваниях желудочно-кишечного тракта (грыжи (см.) пищеводного отдела диафрагмы, пептические язвы, полипы (см.), дивертикулы и доброкачественные опухоли (см.) пищевода, желудка и двенадцатиперстной кишки, инородные тела в желудке, болезнь Менетрие (см.), сифилитические и туберкулезные язвы желудка, травмы стенки живота с повреждением желудка и двенадцатиперстной кишки). Выраженной склонностью к кровотечениям отличаются симптоматические язвы (медикаментозные, стрессовые). Значительно реже кровотечения отмечаются при заболеваниях желчного пузыря (травмы, опухоли и др.) и поджелудочной железы (киста (см.), рак (см.), омертвение ткани). Появлению мелены могут способствовать заболевания сосудов при синдроме Ослера-Рандю, узелковом периартериите (см.), геморрагическом васкулите (см.), разрыве аневризмы (см.) аорты, тромбозе сосудов кишечника, септическом эндокардите (см.) и др. Кровотечения из желудка и двенадцатиперстной кишки, клинически проявляющиеся меленой, наблюдаются при заболеваниях с нарушениями свертывающей системы крови при повторных переливаниях крови.
Клиническая картина Мелена наряду с таким симптомом, как рвота с кровью, является прямым признаком кровотечения. Чаще всего мелена сопровождает кровотечение из двенадцатиперстной кишки, но может наблюдаться и при высоко расположенных источниках кровотечения (заболевания пищевода и желудка). Черный дегтеобразный стул возникает обычно через 8—12 ч от начала кровотечения при объеме кровопотери не менее 50–80 мл. Черный цвет каловых масс обусловлен распадом гемоглобина. При массивном кровотечении черный стул может иметь жидкую консистенцию, так как большое количество продуктов переваривания крови стимулирует продвижение содержимого по желудочно-кишечному тракту. Незначительное кровотечение проявляется черным, но оформленным калом. При наличии у больного тенденции к задержке стула мелена может появиться на 2—3-и сутки от начала кровотечения. В большинстве случаев мелену сопровождают общие симптомы (непрямые признаки кровотечения): общая слабость, мелькание мушек перед глазами, шум в ушах, одышка, тошнота, жажда, бледность кожных покровов, кратковременная потеря сознания. Нередко общие симптомы предшествуют мелене или даже выходят на первый план в клинической картине заболевания. При оценке цвета каловых масс необходимо помнить, что черный цвет наблюдается при приеме препаратов висмута, железа, карболена и при приеме в пищу красного вина, свеклы, черники и некоторых других продуктов.
МЕЛИОИДОЗ
ОпределениеМелиоидоз — это редкое заболевание, передаваемое человеку через животных.Данное заболевание встречается в Юго-Восточной Азии, Австралии, почти во всех странах Африки, Америки и Европы.
Этиология Возбудителем мелиоидоза является грамотрицательная палочка, не образующая спор. Бактерии подвижны, относятся к факультативным аэробам, хорошо растут на всех питательных средах, в том числе в водопроводной и дистиллированной воде. Возбудитель мелиоидоза продуцирует экзотоксин, который обладает некротическим и летальным свойствами. Во внешней среде возбудитель сохраняет жизнеспособность продолжительное время, обитая в почве, иле, воде или грязи. Чувствителен к растворам формалина, перманганата калия и хлорной извести.
Эпидемиология До настоящего времени не выявлен основной источник возбудителя мелиоидоза. Основным резервом инфекции является почва, куда микробы попадают с мочой, мокротой и выделениями из гнойников домашних животных, крыс и мышей. Передача инфекции обычно осуществляется при поедании пищи, содержащей возбудитель. Заражение может произойти через поврежденные кожу и слизистые оболочки. Возможно заражение при укусе комарами и блохами. Заболевание не передается от человека к человеку, встречается в виде единичных случаев.
Патогенез и патанатомия На месте проникновения инфекции в организм формируется воспалительный очаг, который обычно не беспокоит пациента. Возбудитель попадает через лимфу и кровь в различные органы и ткани, что приводит к развитию абсцессов (см.) в печени, легких, почках, селезенке, костях, лимфатических узлах, подкожной клетчатке. Возбудитель активно вырабатывает вещества, которые наряду с септицемией (наличие возбудителя болезни в крови) усугубляют течение заболевания и определяют тяжесть патологического процесса. Во внутренних органах отмечаются резкое полнокровие и точечные кровоизлияния. Все органы, особенно легкие и печень, покрыты желтоватыми бугорками, которые, сливаясь, формируют крупные очаги с творожистым содержимым и абсцессы со сливкообразным гноем. Кожа покрыта гнойничками и глубокими язвами. В мышцах, костях, лимфатических узлах и подкожной клетчатке формируются некротические очаги и абсцессы (см.), из содержимого которых выделяют возбудителя.
Клиническая картина Начальный период болезни точно не определен и может варьировать от 3 до 6 дней. Иногда возбудитель длительное время находится в микроочагах, а при неблагоприятных условиях обусловливает развитие клинических симптомов заболевания. Выделяют острую, подострую, хроническую, легочную и абортивную формы мелиоидоза.
Острая форма Начало острое, появляется озноб, температура повышается до 39–40 °C, больной жалуется на мышечные боли и головную боль. Боли в животе сопровождаются рвотой и частым жидким стулом. Со стороны дыхательной системы отмечается кашель с мокротой, которая постепенно приобретает гнойный характер. Увеличиваются и становятся болезненными при прощупывании периферические лимфатические узлы. На коже — сыпь, пустулы (пузыри, наполненные гноем). Изменения со стороны сердечно-сосудистой системы характеризуются тахикардией (см.), аритмией (см.), глухостью тонов сердца, снижением артериального давления. Постепенно увеличиваются размеры печени и селезенки, может быть желтушное окрашивание кожи и слизистых оболочек. В остром периоде болезни смерть наступает от инфекционно-токсического шока (см.). После стихания острого периода у пациента формируются абсцессы (см.) в различных органах и тканях.
Подострая форма Течение затяжное, с обострениями и ремиссиями (стабильное улучшение состояния). Интоксикация выражена меньше, но формируются многочисленные скопления гноя. Нередко развиваются эмпиема (см.), артрит (см.), перитонит (см.), пиелонефрит (см.), остеомиелит (см.), гнойный менингит (см.). Больной значительно худеет. При несвоевременном и неадекватном лечении исход летальный.
Хроническая форма Характеризуется формированием абсцессов в одном или нескольких органах. Температура тела нормальная или средняя. Чаще всего поражаются печень и легкие. Данная форма может протекать в течение нескольких месяцев или лет, когда обострения сменяются периодами длительного стабильного улучшения состояния. Рецидивы заболевания могут быть спровоцированы травмой, снижением сопротивляемости организма на фоне различных заболеваний.
Легочная форма Характеризуется поражением легких. Начало болезни острое или постепенное, повышается температура тела, появляется кашель с кровянистой мокротой. При прослушивании отмечаются влажные хрипы. При рентгенологическом исследовании определяются крупные воспалительные образования и полости. При своевременном лечении исход благоприятный.
Абортивная форма Данная форма протекает без специфической клинической симптоматики, сопровождается лихорадкой. Диагноз можно поставить серологически при обнаружении антител к возбудителю.
Диагностика и дифдиагностика Помимо специфической симптоматики, диагностировать мелиоидоз помогают бактериологические (посев крови, мочи, мокроты, гнойного отделяемого из язв и абсцессов, рвотных масс, испражнений) и серологические (нарастание количества антител) методы исследования. Мелиоидоз следует отличать от легочной и бубонной чумы (см.), сапа (см.), туляремии (см.), брюшного тифа (см.), милиарного туберкулеза (см.), актиномикоза (см.). Решающее значение имеют эпидемиологические данные и результаты лабораторного исследования.
Лечение и профилактика Показаны обязательная госпитализация и строгая изоляция. При проведении антибактериальной терапии преимущество отдают левомицетину, тетрациклину, канамицину, рифампицину. Антибиотики вводят внутривенно в максимальных дозах до стихания острых явлений, после чего дозу снижают; лечение продолжают не менее 30 дней. Далее переходят на пероральный прием антибиотиков в течение 3–6 месяцев. Учитывая значительные проявления токсикоза, внутривенно капельно вводят раствор Рингера, реополиглюкин, желатиноль и т. д. Высокая вероятность развития инфекционно-токсического шока предопределяет введение стероидных гормонов в сочетании с форсированным диурезом и искусственной вентиляцией легких. При наличии абсцессов проводят их дренирование, а при формировании крупных очагов антибиотикотерапию сочетают с хирургическим вмешательством. Выписку из лечебного учреждения осуществляют после двукратного отрицательного результата бактериологического исследования. Необходимо истребление грызунов в очаговых по мелиоидозу местностях, защита пищи и воды от выделений животных, уничтожение кровососущих насекомых и защита от них. Контактные находятся под наблюдением 15 дней. Специфическая профилактика не разработана.
МЕНЕТРИЕ БОЛЕЗНЬ
ОпределениеМенетрие болезнь (хронический гипертрофический полиаденоматозный гастрит) — заболевание, характеризующееся значительным переразвитием слизистой оболочки желудка с последующим развитием в ней аденом (см.) и кист.
Этиология и патогенез Этиологические факторы и механизм развития болезни Менетрие недостаточно изучены. Предполагают, что причинами изменения слизистой оболочки желудка могут быть хронические интоксикации (алкоголь, свинец), погрешности питания, гиповитаминоз, инфекционные заболевания (вирусный гепатит (см.), дизентерия (см.), брюшной тиф (см.), нарушения обмена веществ, нейрогенные и наследственные факторы, курение). Особое место в развитии заболевания отводят повышенной чувствительности организма к пищевым аллергенам, что приводит к повышению проницаемости слизистой оболочки желудка. Не исключено, что заболевание является следствием аномалий развития, воспалительного процесса в слизистой оболочке желудка или проявляется как вариант опухоли (см.) доброкачественного характера.
Патанатомия Макроскопическое исследование позволяет выявить характерное утолщение складок слизистой оболочки желудка, высота которых составляет не менее 2–3 см. Изменения слизистой оболочки, более всего выраженные в области большой кривизны желудка, чаще всего бывают распространенными (в некоторых случаях — ограниченными). При микроскопическом исследовании отмечаются отек и уменьшение количества главных и обкладочных клеток, часть которых замещается слизеобразующими клетками. Слизеобразующие клетки увеличены в размерах, секреция слизи повышена. Это способствует увеличению желудочных желез (некоторые из них проникают в мышечный слой) с последующим превращением их в кисты.
Клиническая картина Менетрие болезнь чаще всего регистрируется в возрасте 30–50 лет (соотношение мужчин и женщин составляет 3:1), но может встречаться и в детском возрасте. Заболевание в большинстве случаев развивается постепенно, но иногда регистрируется острое начало. Наиболее частыми симптомами являются боли в животе, значительная потеря массы тела, рвота, жидкий стул, повторные желудочные кровотечения. Боли появляются после приема пищи, сопровождаются чувством распирания и тяжести в животе и локализуются в подложечной области. У некоторых больных на высоте приступа боли появляется сначала рвота, а затем диарея (см.). Аппетит снижен. Больные могут терять до 10–20 кг веса. Нарушение секреции желудочного сока (снижение выработки соляной кислоты, потеря белка с желудочным соком вследствие повышения проницаемости слизистой оболочки желудка) и значительное снижение аппетита способствуют развитию периферических отеков. Желудочные кровотечения у большинства больных необильные и в редких случаях могут стать причиной выраженной анемии (см.). В крови отмечается умеренное снижение количества эритроцитов и гемоглобина, нейтрофильных лейкоцитов, количество тромбоцитов и СОЭ соответствуют возрастным показателям. В настоящее время при болезни Менетрие в зависимости от выраженности симптомов заболевания различают три варианта течения — диспепсический, псевдоопухолевый и бессимптомный. Возможно длительное течение болезни Менетрие с периодами продолжительной ремиссии. У некоторых больных наблюдается постепенное (в течение многих лет) стихание клинических проявлений заболевания с последующей трансформацией заболевания в хронический атрофический гастрит. Не исключается возможность того, что болезнь Менетрие является предраковым состоянием.
Диагностика и дифдиагностика Диагноз болезни Менетрие ставят на основании данных обследования пациента, полученных при постоянном наблюдении, и результатов дополнительных методов исследования (рентгенологическое, эндоскопическое, прицельная биопсия). Рентгенологическое исследование позволяет выявить характерные для болезни Менетрие изменения. Различают распространенную и ограниченную формы аномалии. При ограниченной форме болезни Менетрие обнаруживают скопление толстых извилистых складок, которые значительно выступают в просвет желудка и представляют собой дефект наполнения неправильной формы, состоящий из «подушкообразных» образований. Типичной локализацией скопления складок при данном заболевании является большая кривизна напротив угла желудка. При распространенной форме подобные изменения слизистой оболочки желудка определяются на большом протяжении с преобладанием в своде, теле и синусе желудка. При этом в антральном отделе выявляют нормальные складки. Расположение складок при ограниченной и распространенной формах сохраняет определенный порядок. Стенки желудка сохраняют эластичность, перистальтика регистрируется как по малой, так и по большой кривизне. Важное значение в диагностике болезни Менетрие имеет эндоскопическое исследование. Эндоскопическая картина при данном заболевании характеризуется наличием в теле желудка по большой кривизне резко утолщенных складок слизистой оболочки, которые имеют вид «мозговых извилин» или «булыжной мостовой». Складки в большинстве случаев бледные и отечные, иногда кровенаполненные, на верхушках складок могут быть многочисленные эрозии. Методика дозированногораздувания желудка воздухом при эндоскопическом исследовании позволяет выявить гигантские складки, которые не расправляются при давлении в желудке более 15 мм рт. ст. С помощью метода аспирационной биопсии осуществляют забор больших участков слизистой оболочки для тканевого исследования. Тканевое исследование подтверждает наличие увеличенных желудочных желез и кист. Менетрие болезнь следует отличать от гипертрофического гастрита (см.), полипов желудка и распространенного семейного полипоза (см.) желудочно-кишечного тракта (синдром Пейтца-Турена-Егерса, синдром Кронкхайта-Канада), синдрома Золингера-Эллисона (см.), поражений желудка при туберкулезе (см.) и сифилисе (см.), доброкачественных и злокачественных опухолях (см.) желудка. Наибольшую трудность представляет дифференциальная диагностика болезни Менетрие с раком (см.) желудка. В сомнительных случаях рекомендуется повторное обследование больного через 1–1,5 месяца или немедленное проведение пробной лапаротомии, чтобы не пропустить злокачественный процесс.
Лечение При болезни Менетрие применяют консервативные и оперативные методы лечения. Консервативная терапия включает механически и термически щадящую диету с повышенным содержанием белкового компонента, применение обволакивающих и вяжущих препаратов. По показаниям рекомендована заместительная терапия: натуральный желудочный сок, плантаглюцид, абомин, 1 %-ный раствор соляной кислоты с пепсином, полизим, мексазе, панзинорм. Улучшение общего состояния пациента и уменьшение потерь белка отмечается при использовании антихолинергических препаратов в возрастных дозировках. Все больные должны находиться на диспансерном учете и два раза в год проходить контрольное рентгенологическое и эндоскопическое обследование. При отсутствии эффекта от консервативного лечения, наличии осложнений (упорный болевой синдром, отеки, повторные желудочные кровотечения), невозможности исключить злокачественное новообразование осуществляют полную или частичную гастрэктомию с последующим тканевым исследованием.
МЕНИНГИТ
ОпределениеМенингит — это патологический процесс, характеризующийся воспалением оболочек головного или спинного мозга.
Этиология Возбудителями менингита могут быть бактерии (менингококк, стафилококк, пневмококк, стрептококк, кишечная палочка, микобактерии туберкулеза и др.), вирусы (герпеса, кори, краснухи, Коксаки, ЕСНО, ВИЧ и др.), грибы (рода Candida, криптококки и др.). Гораздо реже менингит обусловлен заражением простейшими или гельминтами. Возможно развитие асептического менингита, причиной которого могут быть нейролейкоз, карциноматоз, саркоидоз, болезни соединительной ткани или аллергические реакции на введение вакцин, укусы насекомых.
Патогенез Пути проникновения возбудителя в мозговые оболочки могут быть различными, но чаще всего входные ворота и первичный воспалительный очаг локализуются в носоглотке. Из первичного очага инфекция вместе с кровотоком попадает в оболочки мозга. При стрептококковой и пневмококковой инфекциях первичный очаг воспаления обычно локализуется в слизистой оболочке трахеи и бронхов. Распространение инфекции с кровотоком характерно и при наличии в организме хронических очагов инфекции (отит (см.), бронхоэктазы, абсцесс (см.), синусит (см.), фурункулез, холецистит (см.), пневмония (см.) и др.). При отитах, ринитах (см.), синуситах, остеомиелите (см.) костей черепа, при воспалении орбиты и глазного яблока, дефектах кожи и мягких тканей головы, после люмбальных пункций, при врожденных пороках развития центральной нервной системы, кожных свищах и синусах помимо распространения инфекции с кровотоком возможен контактный путь перехода инфекции в результате нарушения целостности костей черепа или прорыва гноя в полость черепа. Более редким путем распространения инфекции на оболочки головного мозга является распространение по лимфатическим сосудам полости носа. Менингитом заболевают люди различных возрастов, но чаще болеют дети, что обусловлено недостаточным развитием иммунитета и несовершенством гемато-энцефалического барьера (механизма, препятствующего проникновению в центральную нервную систему чужеродных веществ). Значительную роль в развитии менингита играют предрасполагающие факторы: травмы черепа, вакцинация, внутриутробная патология у детей, различные инфекционные заболевания. Из первичного очага инфекция попадает в кровоток. Микроорганизмы, минуя печень, попадают в центральную нервную систему, где происходит обсеменение мягких мозговых оболочек головного и спинного мозга. Воспалительный процесс захватывает обычно мягкую и паутинную оболочки, но может распространиться на твердую мозговую оболочку, корешки спинномозговых и черепно-мозговых нервов, на поверхностные отделы мозга. Жидкость обычно располагается в бороздах мозга, но при значительном ее количестве пропитывает оболочки сплошь и скапливается на основании мозга. Вследствие отека масса и объем мозга увеличиваются, что может привести к вклиниванию миндалин мозжечка в большое затылочное отверстие, сдавлению продолговатого мозга и смерти больного от паралича дыхательного центра. Впоследствии воспалительная жидкость подвергается фагоцитозу — процессу поглощения специальными клетками — фагоцитами. Процесс нередко сопровождается нарушением проходимости путей спинномозговой жидкости, что осложняется развитием окклюзионной гидроцефалии (см.). Воздействие самого возбудителя и его токсинов на организм больного приводит к нарушению функций многих органов и систем с развитием острой надпочечниковой, почечной, сердечно-сосудистой и дыхательной недостаточности. По характеру развития менингиты подразделяются на первичные (воспаление мозговых оболочек развивается самостоятельно, без предшествующей общей инфекции или местного инфекционного поражения какого-либо органа) и вторичные (воспаление мозговых оболочек развивается на фоне уже имеющегося общего или локального инфекционного заболевания). По происхождению различают менингиты бактериальные, вирусные, грибковые, паразитарные, смешанные, неспецифические; по характеру воспаления — гнойные и серозные; по локализации патологического процесса — диффузные, конвекситальные, базальные и локальные; по характеру течения выделяют острые (в том числе молниеносные), подострые, хронические и рецидивирующие менингиты.
Клиническая картина Независимо от фактора возникновения клиническая картина менингитов имеет ряд общих признаков: общеинфекционные симптомы, менингеальный синдром и характерные воспалительные изменения в спинномозговой жидкости. Из общеинфекционных симптомов на первое место выходит интоксикация, которая создает фон в клинической картине тяжелого заболевания и часто приводит к циркуляторным, водно-солевым и гормональным нарушениям. На фоне значительной интоксикации у больных отмечаются бледность кожных покровов, синюшность носогубного треугольника, одышка с участием вспомогательной мускулатуры. Пульс частый, а позднее развивается относительная брадикардия (см.). Тоны сердца приглушены. Артериальное давление при тяжелом течении низкое. Аппетит снижен, но больные много пьют. Отказ от приема жидкости является прогностически неблагоприятным признаком. На фоне интоксикации у пациента появляются изменения в моче: незначительное появление в ней альбуминов, цилиндров и другие признаки. Менингеальный синдром обусловлен раздражением и воспалением мозговых оболочек и клинически проявляется комплексом общемозговых симптомов и собственно менингеальных. К общемозговым симптомам относятся головная боль, головокружение, звуко- и светобоязнь. Головная боль возникает вследствие раздражения мозговых оболочек, воздействия токсических веществ, повышения внутричерепного давления. Головная боль отмечается у всех больных с менингитами. Она интенсивная, распирающая, ощущается по всей голове и может сопровождаться рвотой, усиливается при движении, на фоне сильных звуковых и световых раздражителей. Применение анальгетиков обычно малоэффективно. Рвота возникает внезапно на высоте головной боли, не связана с приемом пищи, не приносит облегчения, отличается интенсивностью (рвота «фонтаном»). У большинства больных отмечается общая повышенная чувствительность — зрительная, звуковая, тактильная. Повышенная чувствительность развивается вследствие раздражения задних корешков, клеток спинномозговых узлов, рецепторов мозговых оболочек, что снижает порог чувствительности к различным раздражителям. Даже легкое прикосновение к больному вызывает усиление боли. Больные обычно лежат отвернувшись к стене и накрыв голову одеялом. Дети грудного возраста беспокойны, часто вскрикивают, резко возбуждаются от любого прикосновения. Нередко, особенно у детей младшего возраста, одним из первых симптомов менингита являются судороги. Они имеют тенденцию к повторению. Начало болезни у взрослых и детей старшего возраста с судорожным подергиванием считается неблагоприятным признаком. Менингеальные симптомы появляются наиболее часто на 2—3-й день от начала болезни, но могут отмечаться и с первого дня: ригидность затылочных мышц, симптомы Кернига, Брудзинского, Лесажа и др. Ригидность затылочных мышц — ограничение или невозможность пассивного сгибания головы. Данный симптом является наиболее ранним и постоянным при менингитах. Симптом Кернига — невозможность разгибания ноги, предварительно согнутой в коленном и тазобедренном суставах. Симптом Брудзинского верхний — при пассивном приведении головы к груди в положении пациента лежа на спине происходит непроизвольное сгибание ног в коленных и тазобедренных суставах. Симптом Брудзинского средний — при надавливании на область лонного сочленения происходит непроизвольное сгибание ног в коленных и тазобедренных суставах. Симптом Брудзинского нижний — при проверке симптома Кернига происходит непроизвольное сгибание другой ноги в тех же суставах. Отдельную группу составляют симптомы, основанные на усилении болевых ощущений. Больные испытывают боль: — при надавливании на глазные яблоки через закрытые веки (симптом Лобзина); — при надавливании на переднюю стенку наружного слухового прохода изнутри (симптом Менделя); — при надавливании в точках выхода различных нервов; — при простукивании по скуловой дуге, что приводит к сокращению мимической мускулатуры (симптом Бехтерева); — при простукивании черепа (симптом Пулатова). У детей раннего возраста вышеуказанные менингеальные симптомы нередко слабо выражены, поэтому при обследовании обращают внимание на выбухание, напряжение и пульсацию большого родничка, симптом «подвешивания» Лесажа (при удерживании ребенка в области подмышек он подтягивает ноги к животу и удерживает их в этом положении), характерную позу ребенка — голова запрокинута назад, ноги согнуты в коленях и подтянуты к животу (поза «легавой собаки»). При локализации патологического процесса на основании мозга могут отмечаться поражения черепно-мозговых нервов, что клинически проявляется снижением зрения, нистагмом, двоением в глазах, птозом, косоглазием (см.), снижением слуха, парезом (см.) мимической мускулатуры и др. При вовлечении в процесс вещества головного мозга в клинической картине появляются симптомы очаговой неврологической симптоматики в виде парезов (см.) и параличей (см.). В большинстве случае у больных имеется изменение сознания. В первые дни от начала болезни преобладают процессы возбуждения, которые могут нарастать и сопровождаются двигательным беспокойством и галлюцинациями (см.) или сменяются вялостью, оглушенностью вплоть до развития коматозного состояния. Для менингита характерны изменения со стороны спинномозговой жидкости. Наличие таких изменений в спинномозговой жидкости позволяет диагностировать менингит независимо от выраженности менингеальных симптомов. Воспалительные изменения характеризуются клеточно-белковой диссоциацией. При гнойных менингитах спинномозговая жидкость мутная, повышается содержание белка, давление спинномозговой жидкости повышено, положительна реакция Панди. При серозных менингитах спинномозговая жидкость прозрачная или слегка опалесцирующая, преобладают лимфоциты, незначительно повышается содержание белка, спинномозговая жидкость вытекает под повышенным давлением, может быть положительной реакция Панди. Концентрация глюкозы при вирусных менингитах обычно не изменяется, а при бактериальных зависит от происхождения заболевания и степени выраженности патологического процесса в мозговых оболочках.
Менингококковый менингит Менингококковый менингит является типичным для гнойных менингитов. Возбудитель заболевания — диплококк, чувствительный к условиям внешней среды и передающийся воздушно-капельным путем. Для данного заболевания характерны зимне-весенняя сезонность и невысокие показатели заболеваемости. Эпидемический процесс среди населения проходит в основном в форме бактерионосительства или острого назофарингита (см.). Начало заболевания острое. Нередко больной или окружающие могут точно указать не только день, но и час начала болезни. Температура тела поднимается до 39–40 °C, появляются озноб, резкая головная боль, рвота, симптомы повышения чувствительности, менингеальные симптомы. Значительно выражены симптомы интоксикации. При обследовании пациентов с большой частотой выявляются герпетические высыпания на коже, губах, слизистых оболочках ротовой полости, красный дермографизм. При сочетании менингококкового менингита с менингококцемией помимо вышеуказанных симптомов у больного появляется характерная геморрагическая сыпь.
Менингококцемия. Геморрагическая сыпь на лице
Менингококцемия. Рубцевание некрозов
Менингококцемия. Геморрагическая сыпь с некрозом
Менингококковый менингит. Менингококцемия в спинномозговой жидкости
В общем анализе крови отмечаются повышение уровня лейкоцитов до 15–30 х 109, эозинофилов, палочкоядерный сдвиг до 14–45 %, повышение СОЭ до 45–70 мм/ч. Изменения спинномозговой жидкости типичны для гнойного менингита, но в первый день болезни спинномозговая жидкость может быть прозрачной, с некоторым преобладанием нейтрофилов. Со второго дня от начала болезни спинномозговая жидкость становится мутной, белого или желтовато-зеленого цвета, давление значительно повышено (до 300–500 мм вод. ст.), количество нейтрофилов существенно повышено, количество белка достигает 1–4,5 г/л, содержание сахара и хлоридов снижено. При своевременно начатом лечении менингококковый менингит протекает благоприятно и заканчивается выздоровлением к 8—12-му дню от начала лечения. Опасность представляют молниеносные формы, когда летальный исход может наступить в течение первых суток от острой сердечно-сосудистой, дыхательной или надпочечниковой недостаточности (см.).
Пневмококковый менингит Пневмококковый менингит стоит на втором месте после менингококкового менингита. Возбудителями являются пневмококки различных типов. Болеют данной формой менингита обычно дети раннего возраста. Развитию заболевания предшествует наличие гнойного очага: отиты (см.), гаймориты (см.), пневмонии (см.). Острые респираторные заболевания, другие инфекции верхних дыхательных путей на фоне черепно-мозговой травмы также приводят к развитию менингитов. Пневмококковый менингит протекает тяжело и дает высокую летальность. Температура тела поднимается до 40 °C. С первых часов выражены симптомы интоксикации и менингеальные симптомы, быстро наступает потеря сознания, появляются судороги. В конце 1-х — начале 2-х суток от начала болезни у больных отмечаются симптомы поражения черепно-мозговых нервов, парезы и параличи (см.), клиническая картина менингоэнцефалита. Кожные покровы бледные, наблюдаются синюшность конечностей и одышка. Тоны сердца глухие, пульс аритмичный, слабого наполнения и напряжения. Отмечается гепатолиенальный синдром (см.), возможно развитие токсического гепатита (см.). Больные нередко умирают в первые дни от начала болезни. Состав спинномозговой жидкости гнойного характера: мутная, желтовато-зеленого цвета, с высоким содержанием белка (до 30—160 г/л), уровень нейтрофилов высокий, количество сахара снижено с первых дней болезни. Позднее начало лечения может привести к затяжному и рецидивирующему течению, так как возбудитель, находясь в уплотненных участках гноя, мало доступен действию антибиотиков. Рецидивирующие случаи пневмококкового менингита сопровождаются осложнениями и стойкими остаточными явлениями.
Менингит, вызванный гемофилъной палочкой Заболевание вызывается палочкой Афанасьева-Пфейффера, которая часто обитает на слизистой оболочке верхних дыхательных путей и при соответствующих условиях может вызывать различные заболевания (риниты (см.), отиты, пневмонию, сепсис (см.), гнойный менингит). Данной формой менингита чаще всего болеют ослабленные дети раннего возраста. Развитию заболевания часто предшествуют пневмония, ринит, отит, гайморит. Менингит, вызванный гемофильной палочкой, начинается постепенно. Течение болезни вялое, волнообразное. Периоды ухудшения чередуются с периодами улучшения, которые могут наступить даже при отсутствии соответствующего лечения. При остром течении заболевания уже в первые часы от начала болезни может наблюдаться пониженное давление сосудов головного мозга (церебральная гипотензия). Внутричерепное давление у таких больных резко понижено (церебральный коллапс). Спинномозговая жидкость при ее пункции вытекает редкими каплями или ее можно получить только при отсасывании шприцем. Заболевание при данном состоянии протекает очень тяжело, с резким токсикозом и обезвоживанием. Симптомы церебральной гипотензии развиваются бурно в течение нескольких часов. Общее состояние пациента ухудшается на глазах. Больной резко обезвожен, черты лица заостренные, кожа имеет желтушную окраску, большой родничок запавший, менингеальные симптомы отсутствуют, мышечный тонус понижен, сухожильные рефлексы не определяются. Причиной развития церебральной гипотензии на 3—4-й день от начала лечения могут быть применение массивных доз бензилпенициллина и интенсивная дегидратирующая терапия. Состав спинномозговой жидкости имеет гнойный характер: мутная, молочно-белого или желто-зеленого цвета, цитоз до 400–600 в 1 мкл, большое количество возбудителей. При развитии церебральной гипотензии спинномозговая жидкость вытекает редкими каплями. Прогноз благоприятный при своевременно начатом лечении.
Стафилококковый менингит Развитию стафилококкового менингита предшествуют хронические пневмонии (см.), абсцессы (см.), остеомиелит (см.) костей черепа и позвоночника, сепсис (см.). Данная форма менингитов является прогностически неблагоприятной, так как высок процент летальных исходов. На фоне основного заболевания у больного внезапно повышается температура тела, появляются озноб и менингеальные симптомы, нарушается сознание вплоть до комы (см.). Нередко возникают симптомы очагового поражения нервной системы. Особенностью стафилококковых менингитов является склонность к абсцедированию, что обусловлено нечувствительностью к антибиотикам стафилококка, быстрая выработка возбудителем устойчивости в процессе проведения этиотропной терапии и трудности ликвидации первичного очага инфекции.
Менингит, вызванный вирусом эпидемического паротита Менингит в результате данной причины может развиться как у детей, так и у взрослых, не болевших эпидемическим паротитом (см.). В прошлом у таких больных имеют место контакт с больным эпидемическим паротитом, воспаление слюнных желез, клинические проявления поражения поджелудочной железы, яичек (у подростков и молодых мужчин). Паротитный менингит начинается остро, со значительного подъема температуры тела, появления менингеальных симптомов, головной боли и рвоты, не приносящей облегчения. При исследовании спинномозговой жидкости выявляют повышение давления, высокий уровень лимфоцитов, отмечается небольшое повышение количества белка.
Менингиты, вызванные вирусами Коксаки и ЕСНО Вирусы Коксаки и ЕСНО относятся к роду энтеровирусов, имеют летне-осеннюю сезонность и высокую контагиозность. Серозный менингит, вызванный энтеровирусами, протекает с типичной клинической картиной, но имеет некоторые особенности: для него характерно появление многообразной сыпи. Сыпь пятнисто-папулезная, напоминает сыпь при кори (см.) и краснухе (см.), появляется в начале болезни и через несколько часов исчезает. В крови регистрируются изменения уровня лейкоцитов при нормальной или повышенной СОЭ. Течение энтеровирусных менингитов обычно благоприятное, но возможны рецидивы болезни через 1–4 недели.
Туберкулезный менингит Туберкулезный менингит является проявлением гематогенно-диссеминированного туберкулеза с локализацией первичного очага в легких или внутригрудных лимфатических узлах. Данная форма менингита развивается медленно. Типичной клинической картине менингита предшествуют симптомы интоксикации: общее недомогание, снижение аппетита, незначительное повышение температуры тела по вечерам, умеренная головная боль, иногда рвота. Постепенно выраженность данных симптомов нарастает, появляются менингеальные симптомы, повышенная чувствительность, признаки поражения черепно-мозговых нервов, состояние пациента резко ухудшается. Спинномозговая жидкость при туберкулезном менингите бесцветная, вытекает под давлением, отмечается повышенный уровень лимфоцитов, количество белка выше нормы, а уровень сахара значительно снижен. Через сутки после люмбальной пункции на поверхности спинномозговой жидкости выпадает тонкая фибриновая пленка, в которой обнаруживаются микобактерии туберкулеза (табл. 23).
Менингиты, редко встречающиеся К данной группе заболеваний относятся менингиты, вызванные кишечной палочкой, сальмонеллами, синегнойной палочкой, грибами и др. Менингиты, вызванные кишечной палочкой, чаще всего регистрируются у новорожденных как осложнение сепсиса (см.). Входными воротами являются пупочные сосуды, инфицированная плацента, инфицированные родовые пути. Заболевание всегда протекает тяжело на фоне острого обезвоживания организма и кишечного токсикоза. Со стороны спинномозговой жидкости имеет место картина типичного гнойного менингита. Смертность высокая. При выздоровлении могут быть тяжелые поражения центральной нервной системы. Клиническая картина сальмонеллезного менингита складывается из симптомов первичного заболевания и менингеального синдрома. Спинномозговая жидкость прозрачная или мутная. Течение тяжелое во всех возрастных группах. Менингит, вызванный синегнойной палочкой, протекает тяжело, с клинической картиной менингоэнцефалита. Характерной особенностью спинномозговой жидкости является ее сине-зеленый цвет. Кандидозный менингит характеризуется подострым или хроническим течением. Температура тела поднимается до 38 °C. Больной малоподвижен и вял. Кожа бледная. Менингеальные симптомы выражены слабо или отсутствуют. Иногда кандидозный менингит выявляют случайно у больных с судорожным синдромом и прогрессирующей гидроцефалией (см.). Спинномозговая жидкость опалесцирующая, вытекает под давлением, повышено содержание белка. Наиболее частыми и опасными осложнениями при менингитах являются инфекционнотоксический шок (см.), острая надпочечниковая недостаточность (см.), отек и набухание мозга. Гораздо реже регистрируются эпендиматит, гидроцефалия (см.), лабиринтит, глухота (см.), парезы и параличи (см.).
Диагностика и дифдиагностика Диагноз менингита ставят на основании клинической картины и результатов дополнительных методов исследования. Важнейшее значение для диагностики менингитов имеет исследование спинномозговой жидкости, которую получают при люмбальной пункции. Лабораторный анализ спинномозговой жидкости должен включать подсчет количества и определение строения клеток, определение уровня глюкозы и белка, бактериоскопию фиксированной капли спинномозговой жидкости, окрашенной по Граму. Окончательный диагноз с причиной возникновения определяется по результатам бактериологических, вирусологических, микологических и иммунологических методов исследования. Наиболее быструю и надежную диагностику возбудителя заболевания можно провести с использованием иммунологических экспресс-методов исследования спинномозговой жидкости (методы иммунофореза и флюоресцирующих антител), которые позволяют диагностировать бактериальные, вирусные и даже смешанные менингиты. Для определения чувствительности возбудителя к антибиотикам осуществляют посев на питательные среды. Компьютерная томография головы показана для исключения абсцесса (см.) мозга, подоболочечного выпота, выявления участков инфарктов, кровоизлияний и тромбоза, локализованных в поверхностных структурах головного мозга. Менингит дифференцируют с менингизмом. Симптомы менингизма обусловлены раздражением мозговых оболочек и встречаются при опухолях головного мозга, черепно-мозговых травмах, кровоизлияниях под паутинную оболочку мозга, гипертонической болезни (см.), тепловом ударе, отравлении угарным газом, уремии (см.) и др. Менингизм характеризуется общемозговыми и менингеальными симптомами, но при этом отсутствуют общеинфекционные симптомы и изменения в спинномозговой жидкости.
Лечение Лечение больных менингитами должно осуществляться в стационаре. Основное место в терапии занимают этиотропная терапия и удаление первичного очага инфекции. Эффективность этиотропной терапии оценивают по клиническим данным и результатам микроскопии спинномозговой жидкости, повторное исследование которой проводят не позднее 48–72 ч от начала лечения. Противомикробная терапия менингитов Менингит, вызванный Neisseria meningitidis, — цефтриаксон, хлорамфеникол; S. pneumoniae — гентамицин, цефтриаксон; H. influenzae — ампициллин, цефатоксин; Staphylococcus — оксациллин, ванкомицин; Listeria monocytogenes — ампициллин, бензилпенициллин; Candida — флуканазол; Mycobacterium — изониазид, рифампицин; Tuberkulosis — стрептомицин. При лечении гнойных менингитов назначают большие дозы антибиотиков. Максимальный эффект при менингитах, вызванных кокковой флорой, отмечается при введении солей бензилпенициллиновой кислоты внутримышечно из расчета 200–300 тыс. ЕД/кг у взрослых и 300–400 тыс. ЕД/кг у детей. Введение антибиотиков осуществляют через каждые 4 ч у взрослых и через каждые 2 ч у детей раннего возраста. Продолжительность лечения определяется клиническим течением болезни и санацией спинномозговой жидкости. При неэффективности лечения пенициллином необходимо использовать парентерально другие антибиотики: левомицетина сукцинат натрия из расчета 50—100 мг/кг 3–4 раза в сутки, ампициллин из расчета 200–300 мг/кг в сутки, оксациллин и метициллин из расчета 300 мг/кг в сутки, ванкомицин по 2 мг в сутки, цефалоспорины третьего поколения. Если причина возникновения менингита не установлена, то показано комбинированное применение двух-трех антибиотиков или сочетание антибиотика и сульфаниламидного препарата. Если установлено вирусное происхождение менингита, больному можно назначить виферон по 500 000 МЕ 3 раза в неделю в течение 4 недель или неовир по 1 дозе ежедневно внутримышечно в течение 3 дней, а затем по 1 дозе через день в течение 2 дней. Основными препаратами для лечения менингитов грибкового происхождения являются амфотерицин В, флуконазол, дифлюкан в возрастных дозировках. Лечение туберкулезного менингита должно быть комплексным. Применяют препараты I ряда: изониазид или парааминосалицилат внутрь и стрептомицин внутримышечно. Лечение туберкулезного менингита осуществляется в условиях специализированного стационара в течение 12–18 месяцев с последующим направлением выздоравливающих в санатории. Наряду с этиотропной терапией важное значение имеет патогенетическое лечение, которое включает дезинтоксикацию, дегидратацию, десенсибилизирующее лечение и борьбу с гипоксией мозга. С целью дезинтоксикации вводят внутривенно капельно растворы гемодеза, реополиглюкина, альбумина, изотонические или (по показаниям) гипертонические растворы. Из дегидратирующих средств наиболее эффективен 15–20 %-ный раствор маннитола и (или) 30 %-ный раствор мочевины. Одновременно с осмотическими диуретиками применяют мочегонные средства (лазикс, урегит и др.). Для профилактики и лечения судорог и снятия двигательного возбуждения применяют литические смеси (аминазин, пипольфен, новокаин), которые вводят внутримышечно. При развитии судорожного синдрома назначают хлоралгидрат в клизме, фенобарбитал перорально, седуксен внутримышечно или внутривенно. При тяжелом течении заболевания (развитие отека мозга, синдрома Уотерхауса-Фридериксена) нередко применяют кортикостероиды: дексаметазон в дозе 3 мг/кг внутривенно капельно с последующим введением 8 мг каждые 4 ч. При наличии высокой температуры до 40–41 °C показаны жаропонижающие средства и холод на крупные сосуды, при болях — анальгетики. В случае вторичного менингита вышеуказанное лечение осуществляется на фоне лечения первичного очага инфекции.
МЕТАГОНИМОЗ
ОпределениеМетагонимоз — гельминтоз, вызываемый мелкой трематодой.
Этиология Возбудитель метагонимоза — мелкая трематода Метагонимус, тело которой покрыто шипиками и имеет размеры 1,0–2,5 х 0,4–0,7 см. Яйца возбудителя метагонимоза имеют крышечку и бугорок на конце.
Эпидемиология, патогенез и патанатомия Метагонимоз — глистное заражение, происходящее через рот, оно имеет природноочаговую способность к заражению. Окончательные хозяева гельминта и источники заражения — человек, собаки, кошки, свиньи и дикие плотоядные животные, выделяющие яйца червя, паразитирующего в их тонком кишечнике. При попадании в воду из яиц выходят личинки, внедряющиеся в тело моллюсков, развивающиеся в них до церкариев. После выхода в воду церкарии попадают в тело и чешую дополнительных хозяев — рыб. Заражение человека происходит при употреблении сырой рыбы. В кишечнике человека из метацеркариев метагонимуса вылупляются личинки, которые внедряются в слизистую оболочку и через 2 недели достигают половой зрелости, после чего выходят в просвет кишки. Там половозрелые гельминты начинают выделять яйца. В результате механического и токсико-аллергического воздействия развивается энтерит.
Клиническая картина и диагностика Начальный период болезни составляет 7—10 дней. Заражение часто протекает бессимптомно. В ранней фазе возникают аллергические симптомы (лихорадка, уртикарная сыпь, повышение количества эозинофилов в крови). В хронической фазе отмечаются энтерит (боли в животе, слюнотечение, упорный понос). Постепенно признаки поражения кишечника убывают, но возможны рецидивы. Общая продолжительность гельминтоза составляет около года. Прогноз благоприятный. Возможно самовыздоровление. Диагноз основывается на обнаружении в кале яиц Метагонимуса.
Лечение и профилактика Для лечения метагонимоза применяются следующие препараты: экстракт мужского папоротника однократно или дважды с интервалом 2–3 недели в дозе 3 г (взрослым) и нафтамон в суточной дозе 2,5–5 г. Празиквантел (бильтрицид, азинокс) по 25 мг/кг массы тела 3 раза в сутки в течение 2 дней. В целях профилактики — проведение комплекса санитарно-гигиенических мероприятий, соблюдение правил приготовления рыбы и рыбопродуктов.
МИАСТЕНИЯ
ОпределениеМиастения (астенический бульбарный паралич) — нервно-мышечное заболевание, которое характеризуется нарушением нервномышечной передачи и проявляется слабостью и патологической утомляемостью скелетных (поперечно-полосатых) мышц.
Этиология Причина возникновения миастении до настоящего времени до конца не выяснена. В литературе есть описания семейных случаев миастении, но наследственный характер заболевания не доказан. С большой частотой у больных миастенией обнаруживают опухоль или гиперплазию вилочковой железы. Определенная роль в развитии миастении отводится вирусам и микоплазмам.
Патогенез В основе развития клинических проявлений заболевания лежит нарушение нервномышечной передачи. Синаптический блок связывают с нарушением синтеза ацетилхолина как результат дефекта активности ферментов или недостаточной чувствительности холинергических рецепторов концевой пластинки. Возможно развитие конкурентного блока синаптической проводимости в результате захвата холинорецептора особым полипептидом, который продуцирует вилочковая железа. Остается открытым вопрос об аутоиммунном генезе заболевания: в сыворотке крови больных миастенией обнаруживаются антитела к скелетным мышцам и к эпителиальным клеткам вилочковой железы. Определенную роль в развитии миастении может играть относительная недостаточность калия, уровень активности половых гормонов и гиперфункция щитовидной железы. По характеру течения выделяют: — стационарную форму миастении, когда проявления заболевания остаются постоянными в течение длительного срока; — прогрессирующую форму, характеризующуюся нарастанием тяжести и распространенности патологического процесса; — миастенические эпизоды — проявления миастенических расстройств в течение непродолжительного периода времени, сменяющиеся длительной ремиссией. По наличию клинических проявлений миастению подразделяют: на локализованную (глазную форму с поражением глазодвигательных мышц; бульбарную с поражением мышц языка, гортани, глотки) и генерализованную, при которой в патологический процесс вовлекаются несколько групп мышц.
Клиническая картина Заболевание обычно начинается в возрасте 20–30 лет в основном среди лиц женского пола. Начало болезни в пожилом возрасте характерно для мужчин, у которых зачастую обнаруживают тимому. У больных появляется мышечная слабость и патологическая утомляемость, которая резко возрастает при повторении движений. В утренние часы и после сна состояние пациентов может быть удовлетворительным, а к вечеру клинические проявления значительно нарастают. Первыми симптомами обычно являются двоение в глазах и опущение век, что указывает на поражение глазодвигательных мышц. В дальнейшем присоединяется утомляемость жевательных мышц и мимической мускулатуры. Бульбарные расстройства проявляются затруднением глотания (больной поперхивается даже при попытке проглотить жидкость), во время еды жидкая пища попадает в нос, у пациента гнусавый оттенок голоса. Пациент жалуется на утомляемость во время разговора, голос имеет тенденцию к «затуханию». При тяжелом течении больные делают перерыв во время еды, у них постепенно снижается масса тела вплоть до алиментарного истощения. Бульбарные расстройства могут стать причиной развития аспирационной пневмонии. Распространение слабости и патологической утомляемости на конечности проявляется сначала в руках, а позднее в процесс вовлекаются мышцы шеи, дыхательная мускулатура, мышцы нижних конечностей. Сухожильные рефлексы сохранены или истощаются по миастеническому типу. При осмотре могут быть выявлены симптомы мышечной атрофии, которые при лечении уменьшаются и даже полностью исчезают. Чувствительность сохранена, тазовые расстройства отсутствуют. Наиболее опасным симптомом генерализованной формы миастении является нарушение дыхания периферического характера, что считается абсолютным показанием для перевода пациента в реанимационное отделение и подключения к аппарату искусственной вентиляции легких. Особенностью течения миастении в пожилом возрасте является быстрая генерализация процесса и появление дыхательных расстройств. У мужчин старше 20 лет может развиться особая форма миастении, которая характеризуется поражением отдельных экстраокулярных мышц и относительной резистентностью к антихолинэстеразным средствам. При данной форме обычно не регистрируется генерализации процесса. В детском возрасте различают четыре клинические формы миастении: неонатальная миастения, врожденная миастения, ранняя детская миастения и ювенильная форма миастении.
Неонатальная миастения Неонатальная миастения проявляется у детей, матери которых страдают миастенией. Уже при рождении у таких детей выражены гипотония, поверхностное дыхание, слабый крик, ребенок плохо сосет, двигательная активность отсутствует или слабо выражена.
Врожденная миастения Врожденная форма миастении встречается крайне редко. В антенатальном периоде отмечаются слабые шевеления плода, а в постнатальном периоде — слабый крик (писк), затруднено сосание, глотание, дыхание, движения вялые. Смертность при врожденной форме миастении высокая за счет бульбарных расстройств и нарушения дыхания.
Ранняя детская миастения Ранняя детская миастения развивается обычно в течение первых двух лет жизни. Поражаются в основном глазодвигательные мышцы, но может вовлекаться жевательная и мимическая мускулатура. Течение легкое или средней тяжести. Исход обычно благоприятный.
Ювенильная форма миастении Ювенильная форма является наиболее частой формой миастении, которая развивается преимущественно у девочек в период полового созревания, носит генерализованный характер. Под воздействием различных факторов внешней среды или эндогенных причин у больных даже с легким течением заболевания может развиться так называемый миастенический криз. Причиной нередко является недостаточная доза антихолинэстеразных препаратов. Возникновению миастенического криза могут предшествовать острые инфекционные заболевания, интоксикации, оперативные вмешательства по поводу основного или сопутствующего заболевания, физическое перенапряжение, психологические стрессы, применение аминазина, транквилизаторов, миорелаксантов. В большинстве случаев криз протекает очень тяжело, с развитием угрожающих жизни состояний. Наиболее тяжелым симптомом является расстройство дыхания. Различают генерализованный и парциальный миастенический криз. При генерализованном миастеническом кризе состояние пациента внезапно ухудшается. Больной тревожен, отмечается психомоторное возбуждение, которое в дальнейшем сменяется апатией и вялостью. Вегетативные расстройства проявляются тахикардией, сухостью кожи, нарушением функции тазовых органов, расширением зрачков. Быстро нарастают глазодвигательные нарушения и бульбарные расстройства (афония, дизартрия, дисфагия). В некоторых случаях нарастание мышечной слабости достигает степени тетрапареза или тетраплегии. Наиболее тревожным симптомом являются поверхностное дыхание и общий цианоз, что указывает на парез диафрагмы и межреберных мышц. Развитие острой гипоксии (недостаток кислорода) мозга может привести к смерти пациента в течение 10–15 мин. При парциальном миастеническом кризе на первый план выступают симптомы нарушения со стороны дыхательной системы вплоть до полной остановки дыхания и изменения со стороны сердечно-сосудистой системы. Чаще всего ночью у пациента появляются частое сердцебиение и неприятные ощущения в области сердца. При объективном обследовании отмечается частый нитевидный пульс, артериальное давление низкое, кожа бледная или цианотичная, дыхание частое поверхностное, с трудом определяется. Может быть потеря сознания. Основные симптомы миастении без существенных изменений или незначительно повышены. Продолжительность миастенического криза даже при адекватной терапии может быть значительной (до 1–3 недель). Передозировка антихолинэстеразных средств при лечении миастении приводит к развитию холинэргического криза, который характеризуется ухудшением состояния пациента, генерализацией мышечной слабости, нарастанием дыхательных расстройств и признаков поражения ствола мозга. Со стороны вегетативной нервной системы отмечаются гиперсаливация, повышенная потливость, повторная рвота, боль в животе за счет усиления перистальтики кишечника. Со стороны сердечно-сосудистой системы: брадикардия, гипотония. Характерны сужение зрачка, ощущение спазма в горле, судороги, потеря сознания, непроизвольное мочеиспускание, возможна внезапная остановка дыхания. Данные симптомы появляются на фоне приема обычной или повышенной дозы антихолинэстеразных препаратов. У больных миастенией могут быть смешанные кризы: в одной группе мышц отмечается миастенический криз, а в другой — холинергический криз. Острое развитие заболевания встречается редко и обусловлено воздействием провоцирующих факторов. Провоцирующими факторами могут явиться острые респираторно-вирусные инфекции, интоксикации, эндокринные сдвиги во время беременности и в климактерическом периоде. Наиболее часто регистрируется подострое или хроническое течение заболевания.
Диагностика Диагноз ставят на основании анамнестических данных и данных объективного обследования пациента, положительного результата прозериновой пробы и электромиографического исследования. Возможно проведение биопсии пораженных мышц. Прозериновая проба: больному вводят подкожно от 1,5 до 3 мл 0,05 %-ного раствора прозерина. При типичном течениимиастении через 20–40 мин после введения препарата клинические симптомы заболевания полностью купируются, и пациент чувствует себя практически здоровым. Через 2–2,5 ч симптомы появляются вновь. Необходимо помнить, что глазная форма миастении малочувствительна к антихолинэстеразным средствам. Стимуляционная электромиография устанавливает нормальный суммарный вызванный потенциал, амплитуда которого уменьшается при ритмической стимуляции частотой 3–5 и 50 в секунду. При биопсии в интерстициальной соединительной ткани обнаруживают лимфоцитарные и гистиоцитарные инфильтраты, атрофические и дистрофические изменения отдельных волокон. Поражены в основном волокна первого типа.
Дифдиагностика Дифференциальный диагноз проводят с полиоэнцефалитом, внутристволовой опухолью, базальным менингитом, рассеянным склерозом, миопатией, полимиозитом, болезнью Мак-Ардля.
Лечение Лечение миастении включает консервативный и оперативный этапы. При быстром развитии симптомов болезни у пациентов молодого возраста показано удаление вилочковой железы, что дает хороший результат при проведении хирургического вмешательства в течение первого года от начала заболевания. Возможно полное выздоровление. При наличии тимомы оперативному вмешательству предшествует рентгенотерапия на область вилочковой железы. Всем больным рекомендуется диета с пониженным содержанием соли, углеводов и богатая белками. Все больные должны получать антихолинэстеразные препараты с учетом формы заболевания, тяжести течения и индивидуальной реакции на препарат. Лекарственные средства вводят перорально. При тяжелом течении вводят 1,5–2,0 мл 0,05 %-ного раствора прозерина внутримышечно за 20–30 мин до еды. При миастеническом кризе прозерин вводят внутривенно из расчета 0,5–1,0 мл 0,05 %-ного раствора, а затем каждые 2–3 ч по 2,0–3,0 мл внутримышечно. Для разжижения слизи можно назначить 5 %-ный раствор эфедрина гидрохлорида подкожно, ингаляции аэрозоля натрия гидрокарбоната, ферментов (трипсин). Проводят туалет носа, глотки, трахеи, бронхов. Несколько раз в день больному придают дренажное положение. С этой целью приподнимают ножной конец кровати для облегчения выделения слизи. Для уменьшения саливации и секреции бронхов вводят 0,5–1,0 мл 0,1 %-ного раствора атропина сульфата подкожно. При тяжелых нарушениях со стороны сердечно-сосудистой системы назначают строфантин, коргликон, кордиамин, кофеин. Нельзя исключать перевод пациента на аппарат искусственной вентиляции легких. В подобной ситуации больному проводят интубацию, подключают к аппарату искусственной вентиляции легких и отменяют все антихолинэстеразные средства. Питание осуществляют через назогастральный катетер, вводят достаточное количество жидкости, солевых растворов, витамины. Основным методом лечения холинэргического криза является полная отмена антихолинэргических препаратов, применение искусственной вентиляции легких, проведение плазмафереза, назначение глюкокортикоидов и введение 0,5 мл 0,05 %-ного раствора атропина сульфата внутривенно и подкожно. Раствор атропина сульфата вводят повторно с интервалом 1–1,5 ч до расширения зрачков и появления сухости во рту. В тяжелых случаях вводят реактиваторы холинэстеразы (1,0 мл 15 %-ного раствора дипироксима). Критерием положительной динамики является восстановление самостоятельного дыхания. При тяжелом течении генерализованной формы миастении назначают стероидные препараты: двухдневную дозу больной принимает в течение 1–2 ч через день в течение одного года, а затем — поддерживающую дозу на протяжении 5–6 месяцев. Кортикостероиды можно сочетать с анаболическими стероидами и препаратами калия. В некоторых случаях целесообразно назначать цитостатики: метотрексат в начальной дозе 10,0—15,0 мг внутривенно, увеличивая дозу до 30,0— 50,0 мг. Препарат вводят с интервалом в 5–7 дней. При генерализованной форме миастении важно постоянно следить за дренированием дыхательных путей, своевременно удаляя слизь и бронхиальный секрет. Больным миастенией противопоказаны следующие препараты: бензодиазепины, хинин, хинидин, морфина гидрохлорид, мышечные релаксанты, ингаляционные анестетики, нейролептики, неомицин, стрептомицин, транквилизаторы, тетрациклин, сульфаниламиды, препараты магния.
МИГРЕНЬ
ОпределениеМигрень — повторяющиеся приступы острой головной боли, обычно односторонней и пульсирующей, которые продолжаются от 4 до 72 ч.
Этиология и патогенез Причины возникновения мигрени неясны. Сложные биохимические сдвиги, в частности увеличение в сыворотке крови серотонина и простагландинов, провоцируют кратковременный спазм интракраниальных сосудов, вслед за которым следует длительное расширение экстракраниальных артерий. Спазм лежит в основе фотопсий и других очаговых симптомов, а расширение сосудов является непосредственной причиной головной боли. Существенную роль играют аллергия и наследственные факторы.
Клиническая картина и диагностика При классической мигрени приступ начинается с преходящей скотомы, иногда мерцающей. Вслед за аурой, длящейся от нескольких минут до получаса, появляется односторонняя головная боль в лобно-височной области; нередко боль распространяется на всю половину головы. Боли обычно сопутствует тошнота и рвота. Приступ длится несколько часов. В отличие от классической мигрени (составляющей всего 10 % случаев мигренозных болей) обыкновенная мигрень не имеет зрительной ауры. Боль возникает утром, носит диффузный характер и длится несколько дней. Отдых провоцирует цефалгию (головная боль конца недели). Этот вариант мигрени чаще наблюдается у женщин с избыточной массой тела. Случаи, при которых мигренозная атака сопровождается преходящими очаговыми выпадениями (гемиплегия, афазия, офтальмоплегия), обозначаются как ассоциированная мигрень. Частота и тяжесть приступов головной боли широко варьируют: у половины больных приступы возникают реже одного раза в неделю. Мигрень — распространенное заболевание, ею страдает 5—10 % популяции. Болезнь обычно начинается в юношеском возрасте, реже — в детском. Первый приступ обычно вызывает значительные диагностические затруднения: интенсивная головная боль и рвота, несмотря на отсутствие повышения температуры, часто заставляют предполагать начало менингита. Такие исследования, как краниография, исследование глазного дна, ЭЭГ, эхоэнцефалография, не несут существенной информации, однако их выполнение обязательно для исключения симптоматического характера мигрени. Длительность пароксизма в течение нескольких часов, сопутствующая головной боли рвота и наследственное отягощение — основные опорные пункты для дифференцирования гемикрании от невралгических головных болей. Во всех сомнительных случаях, особенно при ассоциированной мигрени, показана ангиография для исключения аневризмы или артериовенозной мальформации.
Лечение Для профилактики приступов используют различные комбинации препаратов, применяемых в течение нескольких месяцев: амитриптилин (постепенное наращивание дневной дозы до 75 мг), анаприлин (постепенное наращивание дневной дозы до 160 мг), сибазон до 15–20 мг в день. В тяжелых случаях может оказаться полезным длительный прием ацетилсалициловой кислоты (500 мг 2 раза в день) или курантила (1 таблетку 3 раза в день) как ингибиторов простагландинов. Очень эффективен метисергид (3–6 мг в день), однако возможность развития ретроперитонеального фиброза с поражением расположенных забрюшинно органов заставляет использовать этот препарат (и его аналоги) только в очень тяжелых случаях с длительностью приема не более 6 недель. При возникшем приступе назначают внутрь или парентерально вазоконстрикторные средства (эрготамин, кофеин или их комбинированный препарат кофетамин), анальгетики, транквилизаторы (при необходимости — седуксен внутримышечно), антигистамины (пипольфен внутримышечно); при очень тяжелых и затяжных приступах (мигренозный статус) — дексаметазон 8 мг внутривенно. Прогноз: обычно удается добиться лишь временного ослабления и урежения приступов.
МИЕЛИТ
ОпределениеМиелит — воспаление спинного мозга, при котором патологический процесс захватывает большую часть его поперечника, поражает белое и серое вещество, а также корешки и оболочки.
Этиология Различают первичные и вторичные миелиты. Природа первичного миелита до конца не изучена, но предполагается, что возбудителями являются нейротропные вирусы. Вторичный миелит может развиться на фоне кори (см.), бешенства (см.), скарлатины (см.), брюшного тифа (см.), гриппа (см.), ВИЧ-инфекции (см.), сифилиса (см.), туберкулеза (см.), болезни Лайма (см.), диффузных болезней соединительной ткани и др.
Патогенез и патанатомия Возбудитель из внешней среды или из внутренних очагов инфекции вместе с лимфо- и кровотоком, а также по ходу нервов волокон проникает в подпаутинное пространство, а затем поражает белое и серое вещество спинного мозга. Воспаление может ограничиваться несколькими сегментами (поперечный миелит), локализоваться на нескольких уровнях спинного мозга (диссеминированный миозит), распространяться на зрительный нерв (оптикомиелит) и сопровождаться некрозом вещества спинного мозга (некротический миелит). Патологический процесс локализуется обычно в грудном и пояснично-крестцовом отделах, но встречаются и другие уровни локализации (шейный, шейно-грудной). В основе лежат воспалительные и дегенеративные изменения вещества головного мозга. Важную роль в развитии миелита играет состояние иммунной системы. Провоцирующими факторами могут быть интоксикация, наличие очагов хронической инфекции, переохлаждение, физические и психические травмы. Обычной локализацией патологического процесса при миелите является нижнегрудной отдел спинного мозга. Пораженный участок отечен, а при тяжелом течении заболевания определяются участки миомаляции (размягчения вещества спинного мозга). Мозговая ткань инфильтрирована лимфоидными клетками, характерны изменения нервных волокон и нервных клеток различной степени вплоть до их гибели. Сосуды пораженной области тромбированы, имеет место воспаление околососудистого пространства. На более поздних стадиях на уровне поражения формируется соединительнотканный и глиальный рубец.
Клиническая картина Типичная форма Начало заболевания острое или подострое, с повышением температуры тела до 38–39 °C, сопровождается ознобом, недомоганием. Больной жалуется на боли в грудном или поясничном отделе позвоночника, которые смещаются в области, соответствующие зонам иннервации пораженных корешков. Несколько позднее в этих же зонах развиваются нарушения кожной чувствительности и онемение. Болевой синдром сменяется развитием параличей (см.), проводниковых нарушений чувствительности, тазовыми расстройствами. В остром периоде заболевания параличи носят вялый характер. На ранних стадиях болезни обнаруживается симптом Бабинского и (или) другие патологические симптомы. Вялые параличи при миелите шейной и грудной локализации постепенно переходят в спастические, нарушается питание тканей, поэтому достаточно быстро у таких больных появляются пролежни (см.). Неврологическая симптоматика, развивающаяся в первые дни от начала болезни, обусловлена непосредственным воздействием вируса на спинной мозг, а начиная с 10—14-го дня осложнения носят аллергический характер. При тяжелом течении к поражению вещества спинного мозга часто присоединяется септический процесс. В данном случае входными воротами для проникновения инфекции являются обширные пролежни и мочевыводящие пути. Поражение мочевыделительной системы обусловлено нарушением функций тазовых органов с последующим развитием цистита (см.), уретрита (см.), пиелита, пиелонефрита (см.). Особенности двигательных и чувствительных расстройств зависят от уровня поражения спинного мозга. Могут наблюдаться спастические парезы (поражение на уровне С1-С4 сегментов), вялые парезы верхних и спастические парезы нижних конечностей (С5-D2), нижние спастические парезы (D3-D11) и вялые парезы нижних конечностей (L1-S2). При исследовании спинномозговой жидкости отмечается повышенное содержание белка. В большинстве случаев проба Квеккенштедта подтверждает нормальную проходимость подпаутинного пространства, но иногда регистрируется блок, который развивается вследствие резкого отека мозга или спаечного процесса. При благоприятном течении болезни клиническая симптоматика стабилизируется, а затем в той или иной мере подвергается регрессу. У некоторых пациентов пожизненно сохраняется клиническая картина поперечного поражения спинного мозга.
Подострый некротический миелит Подострый некротический миелит обычно регистрируется у людей пожилого возраста с хроническим легочным сердцем. Для клинической картины характерно постепенное нарастание симптомов амиотрофической параплегии, отмечаются вариабельные расстройства чувствительности и тазовые нарушения. Поражение нижних отделов спинного мозга и «конского хвоста» имеет тенденцию к распространению вверх и продолжается в течение нескольких лет. В спинномозговой жидкости отмечается белковоклеточная диссоциация с умеренным плеоцитозом. Летальный исход наступает через 1–2 года от начала болезни.
Оптикомиелит Клиническая картина болезни обусловлена поражением не только спинного мозга, но и зрительных нервов. Наряду с типичными для миелита клиническими проявлениями отмечаются выпадение боковых половин полей зрения, разнообразные скотомы, снижение остроты зрения, что может привести к слепоте. При исследовании глазного дна определяется побледнение дисков зрительных нервов.
Диссеминированный (демиелинизирующий) миелит Данная форма миелита характеризуется тем, что мелкие очаги воспаления располагаются в различных участках спинного мозга. При такой локализации патологического процесса в клинике могут отсутствовать проявления поражения спинного мозга или характерные клинические проявления миелита будут сопровождаться дополнительными симптомами. У больных с данной формой заболевания зачастую отмечается неодинаковая выраженность двигательных и чувствительных расстройств на правой и левой половине тела.
Диагностика и дифдиагностика Диагноз миелита ставят на основании общих инфекционных симптомов, которые сопровождаются клиническими проявлениями поражения поперечника спинного мозга. Помогают диагностике миелита магнитно-резонансная томография или компьютерная томография с контрастированием, а также исследование спинномозговой жидкости, бактериологическое исследование спинномозговой жидкости с целью выявления возбудителя заболевания, субокципитальная миелография. Дифференциальную диагностику миелита проводят с кистозным арахноидитом (см.), эпидуритом, злокачественными опухолями внутричерепного пространства, спинальным инсультом (см.), полирадикулоневритом Ландри-Гийена-Барре, рассеянным склерозом (см.), паранеопластической нейропатией при карциноме.
Лечение При наличии миелита обязательна госпитализация пациента. Терапия миелита находится в прямой зависимости от происхождения заболевания. При гнойных миелитах обязательна антибактериальная терапия в максимально высоких дозах. Необходимы тщательный и постоянный уход за кожей с целью профилактики пролежней и регулярное дренирование мочевого пузыря. При вирусных миелитах назначают массивные дозы противовирусных препаратов и антибактериальные средства с первых дней болезни с целью профилактики повторной инфекции. Независимо от происхождения показаны большие дозы глюкокортикоидов — дексаметазон 50 мг/сут. или метилпреднизолон до 1000 мг/сут. в первые дни от начала болезни. Продолжительность курса терапии стероидными гормонами определяется течением затухания клинической симптоматики. Показана дегидратационная терапия (маннитол, маннит, лазикс). Восходящие формы миелита нередко приводят к нарушению дыхания, что является причиной перевода больных в реанимационное отделение и подключения к аппарату искусственного дыхания. В качестве симптоматической терапии применяют анальгетики, жаропонижающие средства, витамины. В периоде выздоровления больные получают курс массажа, лечебной физкультуры, физиотерапии. При спастических параличах назначают элениум, диазепам, мидокалм. Прогноз при миелите зависит от этиологии заболевания и тяжести течения. Гнойные миелиты обычно имеют неблагоприятный исход. Развитие миелита в рамках острого диссеминированного энцефаломиелита протекает относительно благоприятно, поэтому возможно восстановление спинальных функций.
МИКОЗЫ
ОпределениеМикозы — группа инфекционных заболеваний, вызванных патогенными (болезнетворными) грибами.
Этиология Патогенные грибы многочисленны и разнообразны. Они поражают человека и животных, некоторые из них являются монопатогенными. В настоящее время известно несколько сотен грибов, опасных для человека. Патогенные грибы, их роды и виды распределяются в различных семействах, подклассах и классах грибов. Среди грибов встречаются одноклеточные и многоклеточные. Размеры и форма клеток варьируются в зависимости от среды обитания и возраста. Особенностью является способность образовывать мицелий (круглая трубка диаметром от 1 до 10 мкм и различной длины). Сплетения мицелия образуют грибницу. Грибы рода Кандида обладают способностью образовывать псевдомицелий. Размножение грибов осуществляется делением, прорастанием, почкованием клетки и многообразным спороношением. Споры у грибов являются средством размножения и распространения во внешней среде. Со споруляцией (образованием спор) связана жизненная активность, а у некоторых — болезнетворные свойства. Споры грибов, бедные водой, устойчивы к высыханию и солнечной радиации, легко и быстро поступают во внешнюю среду, инфицируют людей и животных при дыхании. Большое значение споры имеют в формировании аэрогенной сенсибилизации населения в густонаселенных регионах, неблагоустроенных жилищах, производственных помещениях и т. д. Некоторые патогенные грибы сапрофитируют в почве или воде, на живых растениях и мертвых растительных материалах, на коже и слизистых оболочках животных и человека, не вызывая заболевания. Грибы — аэробные микроорганизмы. Патогенные грибы неподвижны, распространение их в среде обитания осуществляется колонизацией субстрата или механическим переносом клеточных элементов воздухом, водой и другими факторами. Патогенным грибам свойственна изменчивость структуры клеток и характера культур, их биологических особенностей, жизнеспособности и патогенности. Пассажи через организм восприимчивых макроорганизмов усиливают, а невосприимчивых (иммунизированных) ослабляют болезнетворность грибов. По паразитарной активности грибы подразделяются на антропофильные (поражают только человека), зоофильные (только животных), а также патогенные для человека и для животных.
Патогенез Грибы проникают в организм различными путями. Первичный очаг локализуется в области входных ворот. Для некоторых микозов входными воротами являются органы дыхания, но большинство грибов попадают в организм человека через поврежденную кожу и слизистые оболочки (травмы, ушибы, порезы и т. д.). Развитию микозов способствует частое увлажнение кожи. Предрасполагающими к развитию микозов факторами являются хронические заболевания, длительное применение антибактериальных средств, стероидная терапия, оставление на длительное время в организме катетеров, недостаточность иммунной системы, лейкемия, злокачественные опухоли, лечение цитостатиками, облучение, гормональные и обменные нарушения. В некоторых случаях частый и длительный контакт с микроскопическими грибами приводит к развитию глубоких и системных поражений даже у практически здоровых людей: профессиональные микозы и аллергозы у мукомолов, сортировщиков хлопка, у людей, занимающихся обработкой конопли, льна и другого заплесневелого сырья. В развитии грибковых заболеваний условно выделяют несколько периодов. Сразу же после внедрения гриба наступает инкубационный период, продолжительность которого может быть от одной недели до нескольких месяцев. Далее следует период предшественников, не отграниченный четко при некоторых микозах. Без соответствующей терапии некоторые микозы могут проявляться в течение всей жизни больного. Летальный исход наблюдается при глубоких септикопиемических формах и при поражении жизненно важных органов. После внедрения в организм человека большинство грибов развиваются в месте входных ворот: в коже, слизистых оболочках, мягких тканях, в органах дыхания, желудочно-кишечном тракте, мочеполовой системе. Некоторые грибы из первичного очага мигрируют в лимфатические узлы, кроветворные органы, печень и селезенку, где могут размножаться. Способность грибов распространяться гематогенно приводит к микотическому поражению центральной нервной системы, суставов, костей. Большинство грибов обладает ярко выраженным тропизмом, т. е. избирательно поражает определенные ткани. При органных микозах часто поражаются легкие и кишечник, реже селезенка, печень и сердце, редко встречаются поражения нервной системы и опорно-двигательного аппарата. Патологические изменения внутренних органов характеризуются гранулематозными изменениями различной интенсивности. Нагноительные формы поражения характерны для особо опасных микозов (хронический кокцидиоз, бластомикоз). Вегетирующие и язвенные поражения кожи и подкожной клетчатки, лимфатических узлов и сосудов встречаются при хромомикозе, споротрихозе, иногда при дерматомикозах. В последнее время нередким клиническим проявлением являются микотоксикозы, микогенная сенсибилизация (аллергизация) живыми и мертвыми клетками грибов и продуктами их жизнедеятельности. Имеют место полимикозы, вызванные 2–3 видами грибов, и смешанные микозы, обусловленные ассоциацией патогенных и условно-патогенных грибов с различными бактериями и вирусами. При этом нередко встречаются атипичные, стертые формы грибковых заболеваний и миконосительство. Клеточная реакция на патогенные грибы разнообразна: 1) острое и хроническое нагноение с преобладанием: — лимфоцитов и плазматических клеток; — гистиоцитарной реакции с наличием или без образования гигантских клеток; 2) образование туберкулоидных гранулем с казеозным некрозом или без него, с микроабсцессами; 3) некротические изменения ишемического или токсического характера. Репаративные процессы направлены на отграничение гриба от здоровых тканей различными клеточными элементами, разной степенью фагоцитарной активности специальных клеточных форм, ретикулоэндотелиальной системой, кальцификацией очагов поражения в паренхиматозных органах, отторжением патогенного гриба и вытеснением его из поврежденных тканей, импрегнацией его веществами сложной природы, заключением в друзы и зерна или растворением (как более выраженный иммунный ответ). Устойчивость организма к патогенным грибам обеспечивается действием специфических и неспецифических механизмов защиты. Как и при других инфекционных заболеваниях, в процессе развития микозов в крови обнаруживаются антитела. Антитела появляются в течение первых 4–5 дней, интенсивно нарастают в течение нескольких недель, достигают максимальных титров, которые постепенно снижаются в дальнейшем, но сопровождаются усиленной продукцией антител и аллергическими реакциями на повторное попадание инфекции.
Клиническая картина Клинические проявления микозов разнообразны. По течению они подразделяются на острые и хронические, поверхностные и глубокие, очаговые и распространенные. В настоящее время регистрируются грибковые сепсисы и пиемии с диссеминацией (распространением и проникновением) возбудителя в различные органы и ткани (вторичные поражения). Различают следующие группы микозов: кератомикозы, дерматомикозы, кандидоз (см.), бластомикоз, кокцидиоидныймикоз, гистоплазмоз, плесневые микозы, споротрихоз, редкие микозы (риноспоридиоз, хромомикоз).
Кератомикозы При кератомикозах поражаются самые поверхностные участки рогового слоя и кутикула волос. Воспалительные изменения в нижележащих отделах слабо выражены или отсутствуют. Разноцветный лишай (отрубевидный лишай) (см. также Лишай) — грибковое заболевание, характеризуется располагающимися на поверхности кожи преимущественно верхней части туловища пятнами коричневого и белого цвета. Очаги обычно не сопровождаются воспалением и хорошо отграничены от прилежащих участков. Заболевание чаще всего распространяется в тропических зонах и странах с высокой влажностью воздуха. Болеют преимущественно молодые люди и дети. Заболевание контагиозно, но развивается при наличии предрасположенности. Предрасполагающими факторами могут быть повышенная потливость, изменение химического состава пота, себорея, пониженное питания. На коже появляются желтовато-розовые невоспалительного характера пятна, которые быстро принимают коричневую окраску. Очаги сначала мелкие, увеличиваются за счет периферического роста и располагаются вокруг волосяных фолликулов на коже шеи, груди, живота, спины, у детей — часто на волосистой части головы (волосы в процесс не вовлекаются). Поверхность очагов шелушится. Мелкие чешуйки напоминают отруби. В условиях влажного климата очаги быстро распространяются, сливаются и захватывают кожу лица, конечностей, паховые складки. После отшелушивания возникает псевдоахроматия — нормально пигментированные участки на фоне загоревшей кожи. Течение хроническое, склонное к рецидивам. Какие-либо ощущения (зуд, жжение) отсутствуют. Заболевание склонно к рецидивированию. Пьедра — заболевание кутикулы волос, характеризуется образованием на волосе узелков белого или черного цвета (белая пьедра, черная пьедра). Возбудитель белой пьедры — трихоспорон, черной — пьедрария. Белая пьедра встречается в странах Европы и Азии, черная — в странах с тропическим климатом. Заражение происходит при пользовании одеждой, бельем и предметами личной гигиены больного (расчески, повязки, головные уборы). Развитию заболевания способствует повышенная влажность, нарушение целости кутикулы волос, использование воды для мытья головы из непроверенных водоемов, смазывание волос молоком и льняным маслом. Заболевание протекает хронически. На поверхности волос появляются мелкие, очень плотные узелки белого или черного цвета, которые имеют овальную или неправильную форму. Поражается только стержень волоса, но обламывания его не происходит.
Дерматомикозы Дерматомикозы подразделяются на эпидермофитию, трихофитию, микроспорию и микозы стоп. Общим клиническим признаком является формирование кольцевидных розоватых очагов на коже с беловатым центром и краевым импетиго. Пораженные волосы беловато-серые, ломкие. Ногтевые пластины деформированы, утолщены, крошатся. Околоногтевые валики припухшие, воспалены. Могут развиться висцеральные, септико-пиемические и аллергические формы. Без лечения дерматомикозы тянутся годами. Болеют люди всех возрастов, животные, птицы. Эпидермофития — микоз крупных складок кожи, с редким вовлечением в патологический процесс ногтевых пластинок и кожи стоп. Встречается повсеместно. Возбудителем является эпидермофитон. Заражение происходит при пользовании предметами, поверхность которых загрязнена чешуйками от больного данным микозом, плохо дезинфицированными суднами, клеенками, термометрами и т. д. При локализации микоза на стопах — в банях и других местах общественного пользования, где ходят босиком. Особенностью заболевания является некоторый андротропизм, так как болеют чаще мужчины. Способствуют развитию заболевания влажная среда и повышенное потоотделение. Поражается кожа в крупных складках тела (паховые, ягодичные, подмышечные, под молочными железами, реже межпальцевые). Это воспалительного характера пятна красного или красно-коричневого цвета, хорошо отграничены от окружающей кожи, округлые, сливаются друг с другом. По периферии пятна имеют хорошо выраженный сплошной валик, состоящий из пузырьков, мелких пустул и чешуек. Течение сначала острое, а при отсутствии лечения переходит в хроническое. Микозы стоп — обычно хронически протекающие микозы с преимущественной локализацией высыпаний в межпальцевых складках и на коже стоп, частым поражением ногтевых пластинок. Возбудителем являются дерматофиты трихофитон и другие, а также плесневые грибки. Распространенность повсеместная. Заражение происходит чаще в местах общественного пользования: бани, душ, ванны, бассейны, пляжи, спортивные залы, и через обувь, зараженную дерматофитами. Предрасполагающими факторами являются условия повышенной и пониженной влажности, функциональные нарушения деятельности сосудов нижних конечностей, микротравмы, плоскостопие, длительное пользование резиновой обувью, снижение иммунитета. Для клиники заболевания характерно поверхностное изъязвление, экзематизация или крупнопластинчатое шелушение. Поражается кожа на сводах стоп, сначала в виде дисгидротических пузырьков, затем — крупнопластинчатого шелушения. Поражаются ногти. Они сероватогрязные, утолщены, крошатся, поверхность неровная. При аллергических формах кожные проявления разнообразны, возникают непостоянно и носят вторичный характер. Грибковые элементы в них не обнаруживаются. Течение хроническое со склонностью к обострению. Трихофития — грибковое заболевание кожи и ее придатков, обусловленное антропофильными, зоофильными и геофильными трихофитонами. Распространенность повсеместная. Источником являются больные люди и животные с поверхностной и хронической трихофитией. Инфицирование осуществляется путем непосредственного контакта или через предметы обихода. На гладкой и волосистой части кожи головы появляются кольцевидные, шелушащиеся, реже гнойничковые поражения.
Распространенная трихофития гладкой кожи
Поверхностная трихофития волосистой части головы
Волос, пораженный трихофитоном
Трихофития (нагноительная)
Трихофития ногтей
При нагноительной форме поражения волосистой части головы очаги воспаления обычные, ярко-красного цвета, мягкой консистенции, с гнойным содержимым. При хронической трихофитии взрослых на шелушащихся очагах волосистой части головы видны «черные точки» коротко обломанных, иногда перекрученных волос со спорами гриба, которые можно выявить с помощью лупы. Могут отмечаться глубокие гранулематозные поражения кожи, лимфатических узлов и внутренних органов (легкие, желудочно-кишечный тракт, центральная нервная система), а также септико-пиемические формы с летальным исходом. Особой формой трихофитии является фавус с характерными блюдечковидными корками крошковатой консистенции желтого цвета (скутулы), приводящий в последующем к рубцеванию и стойкому облысению в местах поражения. Поражение ногтей при трихофитии носит непостоянный характер, чаще при длительном течении и наслоении бактериальной флоры. Микроспория — микоз кожи, волос, иногда ногтей, обусловленный различными видами грибов рода Microsporum. Выделяют антропофильные, зоофильные и геофильные микроспорумы. Заражение происходит контактно-бытовым путем. Источник инфекции больной человек, кошки, собаки. Болеют в основном дети. Важное значение имеют микротравмы кожи, где грибы начинают быстро развиваться. Очаги поражения локализуются на волосах и гладкой коже, имеют различные размеры, могут сливаться в гирлянды. Пораженные волосы серовато-белые с чехлом в основании, легко извлекаются. На туловище поражены пушковые волосы. Иногда встречаются гнойничковые формы.
Микроспория
Фавус — хронически протекающее заболевание кожи и ее придатков, характеризуется образованием скутул, рубцово-атрофическими изменениями на месте бывших высыпаний и редким поражением внутренних органов. Возбудителя относят к роду трихофитон. Заболевание широко распространено в странах Азии и Африки. Болеют в основном дети. Источником инфекции является больной. Путь передачи контактнобытовой. Возбудитель может распространяться гематогенно (с током крови), что приводит к поражению внутренних органов и костей. Основным симптомом является образование фавусного щитка — скутулы. На месте внедрения образуется пятно красного цвета (вокруг волоса), которое легко шелушится, и желтая точка, которая увеличивается в диаметре до 2–3 и более сантиметров. Приподнимаясь по периферии, скутула похожа на миниатюрное блюдце. Скутулы сливаются, образуя корки «канареечного» цвета. Характерным является запах, который исходит от скутулы («амбарный», «мышиный»), обусловленный присутствием в скутулах микроорганизмов. Волосы тусклые, теряют блеск и эластичность, напоминают пучки пакли. Обломанных волос нет, но образуется рубцовая атрофия кожи — кожа истончается, фолликулярный аппарат атрофируется. На волосистой части головы кроме скутулярной встречается импетигинозная, сквамозная и нагноительная формы фавуса. На гладкой коже образуются эритематозносквамозные очаги, которые напоминают себорейную экзему, псориаз и другие дерматозы. Отмечается увеличение регионарных лимфатических узлов. Фавус ногтей чаще отмечается у взрослых: в толще ногтя просматриваются желтые пластинки. Конфигурация ногтя сохранена длительное время. Ногти стоп обычно не поражаются. В редких случаях поражаются внутренние органы.
Кандидомикоз Истинными возбудителями кандидомикозов являются дрожжеподобные грибы рода Candida. Грибы поражают кожу, слизистые оболочки, различные органы и ткани организма человека, нередко являясь причиной развития осложнений при нерациональной антибактериальной терапии. Возрастной фактор играет важную роль, так как дети раннего возраста и престарелые лица поражаются чаще. Кандидомикоз распространен повсеместно. Патогенетическими факторами могут быть гипотиреоз, гипопаратиреоз, нарушения углеводного обмена, связанные со снижением функции поджелудочной железы, нарушения кровообращения конечностей, аллергические изменения стенок сосудов различных тканей и органов, гипо- и авитаминозы, дисбактериоз, функциональные нарушения вегетативной нервной системы, гормональные нарушения и связанные с ними болезни обмена веществ, травматические повреждения кожи и слизистых оболочек. Кандидозы кожи чаще всего встречаются в детском возрасте и протекают по типу интертриго подкрыльцовых, межъягодичных и паховобедренных складок или генерализованного дерматита кожи. У некоторых больных поражение приобретает гранулематозный характер с локализацией грибов в очаге поражения. Поверхностный кандидоз у детей и взрослых проявляется в виде эритематозносквамозных, везикулезно-буллезных, псориазиформных или скарлатиноподобных высыпаний. Реже регистрируют бугорковые и язвенные формы, сосудистые поражения (капиллярит, васкулит, тромбофлебит). Кандидоз сосков у кормящих женщин нередко является причиной развития молочницы у ребенка. Клинически кандидоз сосков проявляется покраснением, отечностью, трещинами в области сосков.
Кандидоз инфекционный. Хейлит
Кандидоз инфекционный. Поражение лица, шеи и волос, части головы
Эрозии углов рта представляют собой интертригинозное поражение на границе слизистой ротовой полости и красной каймы губ. Поврежденная слизистая имеет серовато-белый цвет. Эрозии и трещины располагаются на дне складки, отмечается незначительная инфильтрация очага поражения. Хейлит — краснота, отек и шелушение красной каймы губ. Кожа при данной локализации инфекции истончена, исчерчена радиарными бороздками серовато-синюшного оттенка. У некоторых больных красная кайма губ покрыта болезненными кровоточащими трещинами, белыми пленками или кровянистыми корками с эрозиями или грануляциями под ними. Кандидозное поражение волосистой части головы напоминает себорейную экзему без выраженного экссудативного компонента. На голове и лице, в носу и ушах у детей могут быть пузырьки, гнойники, эритематозносквамозные очаги, бугорки и бородавчатые разрастания, покрытые буровато-серыми корками. После удаления корок обнаруживают папилломатозные разрастания, кровоточащие грануляции. Интертригинозное поражение кожи стоп и кистей начинается с появления пузырьков, после вскрытия которых образуются эрозии с воспалительным красным ободком по периферии. Больные нередко предъявляют жалобы на зуд, жжение, умеренную болезненность в зоне поражения. Без соответствующего лечения заболевание может длиться годами. Характерными симптомами является локализация патологического процесса в межпальцевых складках, беловатый оттенок очагов, крупнопластинчатое отторжение поврежденного эпидермиса, блестящая «сальная» поверхность эрозированных участков, трещины и эрозии в глубине межпальцевых складок. Паронихии и онихии — поражения мягких тканей околоногтевого валика и ногтевой пластинки сопровождают друг друга, являясь этапами одного процесса. Заболевание начинается с покраснения на месте внедрения гриба (у самого края валика), которое постепенно в течение нескольких дней нарастает параллельно с отеком. Из-под ногтевого валика при надавливании выделяется гной. В дальнейшем отек и гиперемия нарастают, кожа выступает над ногтевой пластинкой, краснеет, лоснится, иногда образуются трещины. Процесс быстро распространяется с формированием онихия. На ногтевой пластинке появляются борозды и возвышения, а в толще ногтя отмечаются буровато-коричневые участки. Ноготь постепенно теряет блеск, тускнеет, утолщается и начинает отделяться от ложа частично или целиком. Кандидоз слизистых оболочек — дрожжевой стоматит (молочница) является самой распространенной формой кандидоза слизистой оболочки полости рта у детей. При данной локализации поражения в клинической картине отмечаются «лаковый» язык, макроглоссия, трещины углов рта, воспаление красной каймы губ. На неизмененной или гиперемированной слизистой оболочке языка, губ, щек, неба обнаруживают группы перламутрово-белых пятен округлой формы различного размера. При отсутствии лечения пятна постепенно увеличиваются в размере, сливаются и образуют белую пленку, возвышающуюся над поверхностью слизистой, и напоминают свернувшееся молоко. Грибы сначала располагаются на поверхности слизистой и легко снимаются тампоном. В дальнейшем налет снимается с трудом и оставляет кровоточащую поверхность, что указывает на распространение процесса вглубь тканей.
Кандидоз инфекционный. Молочница. Налет на слизистой ротовой полости
Кандидоз инфекционный. Поражение языка
Микотическая ангина характеризуется наличием белых блестящих фолликулярных пробок без видимой воспалительной реакции слизистой, увеличением миндалин на фоне неяркой общей реакции организма больного. Глоссит сопровождается образованием налетов беловато-серого цвета, выраженной исчерченностью языка продольными и поперечными бороздками, очагами различного размера (гладкие, лишенные сосочков поверхности), увеличением размеров языка. Больные предъявляют жалобы на сухость и жжение в ротовой полости. При хроническом стоматите и глоссите в некоторых случаях отмечаются псевдолейкопластические, гиперпластические и гранулематозные процессы на слизистой оболочке полости рта. Кандидоз желудочно-кишечного тракта сопровождается симптомами эзофагита, гастрита, энтероколита, острой и хронической диареи, явлениями расстройства пищеварения и аноректальными поражениями. Важнейшими симптомами поражения пищеварительного тракта являются снижение аппетита вплоть до развития чувства отвращения к пище, затруднение глотания (непроходимость при закупорке пищевода грибковыми пленками), частая неукротимая рвота с выделением творожистых пленок. Характерны жидкий стул с примесью слизи и крови, эксикоз, токсикоз, малоподвижность, вздутие кишечника, лихорадка. Кандидоз органов дыхания занимает второе место после поражения пищеварительного тракта. Поражения глотки и гортани сопровождаются приступами кашля, изменением голоса, ларингостенозом с выделением слизисто-гнойной мокроты. Риниты и фарингиты кандидозного характера не имеют специфических клинических проявлений. Пневмонии кандидозного генеза наблюдаются у взрослых и детей, леченных антибиотиками и иммунодепрессантами. Течение кандидозной пневмонии похоже по своему характеру на течение туберкулезного поражения легких, опухолевого процесса и бактериальной пневмонии. Особенностью является тенденция перехода процесса в хронический с частыми рецидивами. При хроническом течении нередко заболевание сопровождается расплавлением легочной ткани с образованием полостей в нижних долях легких. Кандидоз мочеполовых органов характеризуется множественными гранулематозными очагами в виде мелких беловатых бугорков с некротическим распадом в центре. В моче обнаруживают белок, эритроциты и цилиндры с обилием возбудителя. Очаги поражения напоминают туберкулезные. Нарушается фильтрационная функция почек, что сопровождается повышенным выделением сывороточных белков. Нередко регистрируютуретриты, циститы, баланопоститы, вульвиты, вагиниты, кандидоз наружных половых органов. Кандидоз центральной нервной системы обнаруживают чаще всего случайно при выявлении грибов в мозговой ткани на вскрытии умерших с мозговыми абсцессами лиц пожилого возраста и детей, страдающих молочницей. Заболевание протекает вначале в стертой форме или в виде бактерионосительства, а при значительном поражении тканей мозга в клинической картине появляется симптоматика, характерная для абсцесса или опухолевого поражения мозга. Септические формы кандидоза имеют затяжное течение, характеризуются поражением многих органов и тканей: милиарные изменения в легких, почках, печени, поражение клапанов сердца, микроабсцессы в миокарде. Кандидозный сепсис может стать причиной поражения центральной нервной системы в виде менингитов, энцефалитов, менингоэнцефалитов, абсцессов головного мозга. Исход кандидозных поражений зависит прежде всего от иммунологической реактивности организма пациента, но септический вариант в детском возрасте зачастую приводит к летальному исходу. После перенесенного заболевания грибы обычно остаются в организме на всю жизнь.
Бластомикозы Криптококкоз (торулоз, европейский бластомикоз, болезнь Буссе-Бушке) — тяжелое заболевание, вызываемое почкующимися аспорогенными дрожжеподобными грибками, с преимущественным поражением центральной нервной и дыхательной систем. Заражение осуществляется через кожу, дыхательные пути, желудочно-кишечный тракт. Течение данного микоза хроническое. Прогноз при локализации патологического процесса в мозговой и легочной ткани неблагоприятный. Легочный криптококкоз протекает обычно в подострой форме с незначительным повышением температуры тела. Кашель непостоянный. Отмечается выделение слизистой мокроты с прожилками крови. Чаще всего поражение носит очаговый характер с вовлечением одной или нескольких долей. Рентгенологически определяется массивное затемнение. Криптококкоз нервной системы развивается постепенно: появляются головная боль, интенсивность которой нарастает, головокружения, менингеальные симптомы, расстройства зрительной функции, прогрессивно усиливается неврологическая симптоматика. В периферической крови отмечается гипохромная анемия, незначительный лейкоцитоз, повышение СОЭ. Первичные поражения на коже могут быть распространенными и локализованными. На открытых участках кожи появляются узелки, которые некротизируются, изъязвляются, распространяются по поверхности и в глубину. Дно язв покрыто грануляциями, слизисто-гнойным отделяемым со своеобразным блеском и красноватым оттенком, с наличием большого количества грибковых элементов. Течение заболевания медленное, периоды ремиссии сменяются обострениями. При отсутствии адекватной терапии у больного развивается кахексия, метастазы во внутренние органы, костный мозг, что в конечном итоге заканчивается смертью больного. Североамериканский бластомикоз является хроническим заболеванием, которое встречается в кожной и висцеральной формах. Возбудителем является бластомицес. Мужчины болеют в 9—10 раз чаще женщин. Заболевание малоконтагиозное, но не исключают возможность ингаляторного инфицирования. Предрасполагающими факторами являются травмы, укусы зараженными животными. Кожные формы могут передаваться контактным путем. Кожная форма болезни более доброкачественная. Течение длительное, до нескольких лет. Поражения кожи носят первичный и вторичный характер. Первичные поражения выявляют на открытых и закрытых частях тела. Начало заболевания сопровождается появлением узелково-гнойничковых элементов с кровянисто-гнойным содержимым, которые изъязвляются в центре и покрываются корочкой. Очаги могут расти, сливаться. При надавливании из глубины грануляционных разрастаний появляются капли сливкообразного гноя. Заживление кожных поражений начинается из центра, а периферический валик при этом продолжает распространяться по периферии. Появление подкожных узлов — прогностически неблагоприятный признак, так как является первым симптомом генерализации процесса. Вторичные поражения кожи носят узловатый, гуммозный характер, имеют темнокрасный цвет и размеры от 0,5 см до нескольких сантиметров в диаметре. Очаги в дальнейшем размягчаются, выделяют гной и имеют тенденцию к слиянию с формированием язвенного процесса веррукозного характера. Заживление может протекать с глубоким рубцеванием. Поражение слизистых оболочек не характерно для североамериканского бластомикоза. Висцеральная форма бластомикоза начинается как острая респираторная вирусная инфекция, которая приобретает хроническое течение. Прежде всего поражаются легкие, нередко вовлекается плевра. Клиническая картина напоминает течение туберкулезного поражения легких. Больные предъявляют жалобы на сухой кашель, боль в грудной клетке, ночные поты, повышение температуры тела. На рентгенограмме находят неправильной формы множественные тяжи затемнения, менее очерченные, чем при милиарном туберкулезе. В начале болезни поражение легких одностороннее, а в дальнейшем в процесс вовлекается второе легкое. Отмечается увеличение периферических лимфатических узлов, которые, сливаясь, образуют конгломераты, а затем некротизируются. Поражение костей характеризуется деструктивными и пролиферативными изменениями в ребрах и позвонках. У женщин заболевание может сопровождаться поражением половых органов (нарушение функции матки, патологические очаги в трубах и яичниках). При североамериканском бластомикозе развивается специфическая аллергия, определяемая внутрикожным введением вакцины из клеток дрожжевой фазы гриба или бластомикоцина. Аллергическое состояние, степень сенсибилизации оказывают существенное влияние на возможности терапевтического воздействия. Южноамериканский бластомикоз — тяжелое заболевание, которое сопровождается поражением кожи, слизистых оболочек ротовой полости, желудочно-кишечного тракта, легких, костей. Мужчины болеют в 10 раз чаще, чем женщины. Эндемическими очагами являются Калифорния, Бразилия (Рио-де-Жанейро), Аргентина, Парагвай, Перу. Источники инфекции неизвестны, резервуар в природе не найден. Клинические проявления заболевания могут иметь очаговый или генерализованный характер. Заболевание нередко заканчивается смертью больного в течение 2–3 лет. Различают кожно-слизистые (локальные) поражения, поражение лимфатических узлов, висцеральные и смешанные формы. Кожно-слизистые формы характеризуются появлением мелких папул, которые разрастаются в глубину и по периферии, быстро изъязвляются. В процесс вовлекаются периферические лимфатические узлы: увеличиваются в размерах, некротизируются, их содержимое выходит наружу после формирования свища. Поражения на коже имеют папиломатозно-веррукозный характер. Центральная часть очагов подвергается изъязвлению, а при локализации на лице (типичная локализация) распад тканей приводит к обезображиванию больного («рот амфибии»). Локализация патологического процесса на слизистых оболочках ротовой полости, зева, надгортанника, голосовых связок, язычка клинически сопровождается затруднением глотания и болевым симптомом, что приводит к развитию кахексии. Лимфатическая форма проявляется поражением шейных узлов (размягчаются, некротизируются и опорожняются наружу через фистулу). При развитии висцеральных форм больные предъявляют жалобы на боли в животе, расстройство стула. Язвенные поражения отмечаются в печени, селезенке, кишечнике, легких. Смешанная форма характеризуется поражением кожи, слизистых оболочек и внутренних органов, костей. Келоидный бластомикоз является антропонозным заболеванием. Заболевание регистрируется в Бразилии, неконтагиозно для окружающих. Инфицирование возможно при травмах кожи, при укусах змей и насекомых. Течение заболевания хроническое, с трудом поддающееся лечению. Очаги поражения локализуются преимущественно на открытых участках тела: кожа лица, предплечий, нижних конечностей. Элементы папулезно-бугристые, плотной консистенции, отграничены от окружающих тканей. Поверхность очага имеет блестящую розовую поверхность, которая напоминает келоидные рубцы. При наличии возбудителя в лимфоидной ткани отмечается регионарная аденопатия. Заболевание длится годами, но не опасно для жизни пациента. Кокцидиоидный микоз — данное заболевание описано в литературе под названием кокцидиоидоз, кокцидиоидная гранулема, долинная лихорадка, ревматизм пустыни, лихорадка святого Иоахима, болезнь Пасадас — Вернике. Возбудителем являются кокцидии. В процессе болезни формируется специфическая сенсибилизация организма, которая при раннем проявлении защищает организм от развития генерализованных форм, облегчает течение микоза. Кокцидиоидный микоз протекает в двух формах: первичной (острой) и вторичной (хронической). Первичная форма характеризуется массовым распространением в эндемичных очагах, имеет короткий инкубационный период (7—14 дней). Начало заболевания сопровождается недомоганием, головной болью, легким кашлем, повышением температуры тела, симптомами фарингита, ларингита. Больные могут предъявлять жалобы на боли в сердце и мелких суставах. Симптомы поражения дыхательной системы выражены не ярко и быстро сворачиваются. На рентгенограмме в острый период болезни выявляют инфильтрацию ворот легкого, средней и нижней долей, одиночные или множественные очаговые поражения и аденопатию в области медиастинальных лимфатических узлов и поражение плевры. Течение заболевания у некоторых больных напоминает по клинической картине туберкулез, сопровождается кровохарканьем. В большинстве случаев первичная форма кокцидиоидного микоза подвергается обратному развитию в течение 2–3 недель. При поступлении гриба в кровь отмечаются поражения костей, скелетной мускулатуры, нервной системы с развитием менингита. Вторичная форма характеризуется длительным и хроническим течением с разрушением структуры пораженных тканей и органов, с распадом очагов, образованием свищей, астенией, кахексией различной степени. Болезнь в большинстве случаев заканчивается смертью больного, так как медикаментозная терапия не дает положительного результата. Клиническая картина поражения легких и лимфатических узлов выражена ярко. Характерным симптомом кокцидиоидоза являются изменения костной ткани: ребер, ключиц, лопаток, позвонков, мелких костей рук и ног. Кожные изменения характеризуются образованием узелка, инфильтрата, которые некротизируются и изъязвляются с образованием папилломатозных разрастаний. Кожа может приобретать своеобразную плотность. Кожные уплотнения могут сохраняться длительное время, что напоминает склеродермию. Изменения кожи живота сопровождаются поражением глубоких лимфатических узлов в виде бугристого конгломерата различной величины — от нескольких сантиметров до десятков сантиметров в диаметре. Клинически поражение данной локализации проявляется лихорадкой, болями в нижней части живота. В некоторых случаях конгломерат, увеличиваясь в размерах, занимает большую часть брюшной полости. При хроническом течении периоды ремиссии продолжительностью 2–3 месяца сменяются периодами обострения, когда появляются новые абсцедирующие очаги, отмечается подъем температуры тела, развивается слабость, потеря аппетита, нарушается сон. Данные лабораторных методов исследования позволяют выявить изменения в составе белковых фракций плазмы крови, нарушение функциональной активности печени. Течение острого первичного кокцидиоидоза чаще доброкачественное. Генерализация инфекции при вторичном кокцидиоидозе приводит к летальному исходу.
Редкие микозы К редким микозам относятся риноспоридиоз, хромомикоз. Риноспоридиоз сопровождается папилломатозным поражением преимущественно слизистых оболочек и реже — кожи. Наиболее частой локализацией является поражение слизистой носа. В начале болезни поражения представлены папилломатозными и полипозными разрастаниями, которые располагаются на ножке, постепенно увеличиваются в размере, сливаются и напоминают цветную капусту. При этом нарушается носовое дыхание и глотание. Характерен ярко-розовый цвет. На поверхности разрастаний отмечается большое количество мельчайших пятен (спорангии), под которыми слизистая оболочка покрыта слизью. Поражения глаз в начале заболевания представлены мелкозернистыми подвижными образованиями на конъюнктиве и слизистой век, носят узелковый характер. Больной предъявляет жалобы на светобоязнь, слезотечение при закупорке слезного канала. У некоторых больных при наличии значительных разрастаний отмечается выворачивание век. Локализация поражения на слизистой влагалища напоминает собой цветную капусту, а на головке полового члена — сифилитические кондиломы или геморроидальные разрастания. Полипозные разрастания в слуховом проходе приводят к снижению слуха. На коже папилломатозные разрастания постепенно превращаются в бородавчатые, достигают больших размеров и становятся болезненными при ощупывании. Очаги поражения на коже и слизистых оболочках покрыты тягучей слизью, а при наслоении вторичной бактериальной флоры отделяемое имеет гнойный характер. Хромомикоз распространен повсеместно и представляет собой хроническое заболевание кожи гранулематозно-веррукозного характера. Клинические проявления микоза разнообразны и зависят от давности заболевания, особенностей гриба и степени его паразитарной активности, индивидуальных особенностей организма больного, локализации патологического процесса. Заболевание развивается медленно, но имеет прогрессивное течение. Очаги поражения носят первичный (формируются на месте внедрения гриба) или вторичный (возникают при наличии травматических повреждений) характер. Первым симптомом заболевания является формирование небольшого узелка или бородавки. Из первичного очага возбудитель с током лимфы или крови может распространяться в различные органы (печень, мозг, кости и т. д.). Излюбленной локализацией являются нижние, реже — верхние конечности, кисти и запястья. Редкой локализацией считается поражение кожи лица, шеи, туловища. Поражение сопровождается разрастанием соединительной ткани, что ведет к сдавлению лимфатических сосудов и развитию слоновости. В процесс нередко вовлекаются регионарные лимфатические узлы. Различают следующие типы поражения: узелковый, опухолевидный, веррукозный, чешуйчатый, рубцовый. Узелковый тип характеризуется наличием мягких розово-фиолетовых узелков с ровной чешуйчатой или бородавчатой поверхностью. При опухолевом типе узелки более крупные, папилломатозного или дольчатого характера, покрыты корками и шелушатся. Веррукозный тип сопровождается гиперкератозом, очаги бородавчатые, локализуются на краях ступни. Чешуйчатый тип представлен плоскими очагами инфильтрации различного размера и формы красновато-фиолетового цвета. Рубцовый тип поражения приводит к атрофическим и склеротическим изменениям в центре очага при наличии бородавчатых разрастаний по периферии. Прогноз заболевания всегда благоприятный, наилучший результат получают при раннем выявлении болезни и своевременно начатом лечении.
Гистоплазмоз Гистоплазмоз относится к особо опасным микозам. Заболевание представляет собой глубокий микоз преимущественно ретикуло-эндотелиальной системы человека и некоторых животных. Местами природной очаговости являются средние и западные штаты США, Южная Америка, Аргентина, Уругвай, Канада, Англия, Франция, Болгария, Турция и др. Болеют в основном дети. Распространение инфекции осуществляется ингаляционным путем при локализации гистоплазм в почве, помете животных, в заброшенных помещениях. Начальные поражения при гистоплазмозе отмечаются в носоглотке, гортани, легких или в желудочно-кишечном тракте. В месте входных ворот формируется поверхностный язвенный процесс. Легочная локализация характеризуется повышением температуры тела, кашлем с мокротой, истощением, а в тяжелых случаях — кахексией. У многих пациентов патологический процесс в легких приводит к развитию очагов обызвествления, образованию каверн. В данном случае отличить гистоплазмоз от туберкулеза помогает отрицательная реакция на туберкулин и положительная на гистоплазмин. Поражение ретикулоэндотелиальной системы может быть ограниченным или диссеминированным. В последнем случае течение заболевания приобретает молниеносный характер. Для клинической картины характерны лихорадка, увеличение печени и селезенки, резко выраженная гипотрофия, лейкопения и анемия. Заболевание по клинике напоминает болезнь Ходжкина, лимфосаркому, апластическую анемию. Поражение желудочно-кишечного тракта клинически проявляется снижением аппетита, рвотой, жидким стулом, увеличением мезентериальных лимфатических узлов.
Плесневые микозы В группе плесневых микозов выделяют аспергиллезы, пенициллиозы и мукорозы. Возбудители данных заболеваний широко распространены во внешней среде: в почве, на овощах, фруктах, растительных материалах, на старых вещах и предметах, в пыли. Заражение происходит при вдыхании пыли, заглатывании спор грибов с продуктами питания, при попадании грибов на поврежденные кожу и слизистые оболочки, при травматическом повреждении глаз, уха, ногтевой пластинки и околоногтевых валиков. Аспергиллез является грибковым заболеванием человека, животных и птиц, вызванным аспергиллами. Чаще болеют взрослые, чем дети. Заболевание встречается преимущественно у людей, занятых очисткой и разборкой шерсти, для обезжиривания которой применяют рисовую муку, содержащую споры гриба. Высокая заболеваемость регистрируется у мукомолов, в силикатной промышленности, на пивоваренных заводах и у рабочих других специальностей, чья профессиональная деятельность связана с растительным сырьем. Выделяют аспергиллез кожи и ее придатков, слизистых оболочек и внутренних органов. Развитию аспергиллеза кожи способствуют микротравмы, мацерация, воспалительные изменения кожи. Поражение кожи проявляется гиперемией, обильным шелушением и образованием корок. При локализации процесса на ногтевой пластинке отмечается преимущественное поражение ногтей больших пальцев ног. Ногтевая пластинка грязно-серого цвета с желтоватым оттенком, утолщена, легко крошится. Первичные поражения кожи и слизистых в некоторых случаях заканчиваются самоизлечением. Попадание возбудителя на ткани глаза приводит к помутнению роговицы, гнойному панофтальмиту, язвенному конъюнктивиту, блефариту. Тотальное поражение глазного яблока может стать причиной перехода патологического процесса на мозговую ткань и развития аспергиллезного менингита, который заканчивается смертью больного. Висцеральный аспергиллез обычно представлен патологией бронхо-легочной системы (поражение бронхов и легких). В большинстве случаев аспергиллез легкого развивается на фоне туберкулеза. При хроническом течении бронхомикоза развиваются фиброз, эмфизема, бронхоэктазы, перибронхиальные абсцессы. Прогноз при висцеральных формах всегда серьезный. Пенициллиоз вызван грибами, которые являются постоянными обитателями микробных ассоциаций почвы, встречаются в воздухе и на растениях, в больших количествах их выявляют в помещениях с антисанитарными условиями. Клинические проявления заболевания разнообразны: эпидермодермиты, узелковые и экзематозные поражения кожи, онихии и паронихии, единичные или множественные очаги по типу лейкоплакий на слизистой ротовой полости, псевдотуберкулезные поражения легких, острые и хронические поражения уха, гуммозные поражения языка и глаз. Грибок выделяют из злокачественных опухолей различной локализации. Мукороз — заболевания, возбудителями которых являются низшие грибы из семейства Мукороцее, класса Псикомицетес. Поражение тканей при мукорозах может быть поверхностным и глубоким, очаговым и распространенным. Течение заболевания протекает остро или приобретает хронический характер. Клинические проявления мукорозов разнообразны. Различают поверхностные и глубокие, очаговые и распространенные мукорозы, которые нередко сопровождаются симптомами интоксикации. Течение данных микозов может носить острый или хронический характер. Отличительной особенностью при мукоровых поражениях является своеобразное изменение языка, которое носит название «черный волосатый язык». В клинической картине могут иметь место отомикозы, кератиты, назофарингиты, онихии и паронихии. Генерализация грибковой инфекции проявляется поражением легких, селезенки, почек, органов брюшной полости, центральной нервной системы, костей. Нередко мукорозы осложняют течение другого заболевания.
Споротрихоз Заболевание регистрируется, в основном, во Франции и Северной Америке, что связано с определенным типом растительности, подходящей для споротрихумов. Различают различные типы споротрихозного поражения с вовлечением лимфатических узлов, кожи, слизистых оболочек, костной системы, внутренних органов. Поражения носят глубокий характер и сопровождаются рядом общих симптомов. Важное место в развитии заболевания имеет аллергическая реакция организма больного. Споротрихоз подразделяют на первичный (очаговый) и вторичный (диссеминированный). Чаще всего поражаются лимфатические узлы, которые увеличиваются в размере, уплотняются и образуют конгломераты. Кожа над ними имеет вначале розовую окраску, затем приобретает синеватый оттенок и наконец становится темно-коричневого цвета. В дальнейшем лимфатические узлы подвергаются некрозу с образованием свищей и своеобразных язв, носящих название «спиротрихозные шанкры». По ходу лимфатических сосудов появляются множественные узелки. Стенка лимфатических сосудов уплотняется, в процесс вовлекаются крупные лимфатические узлы, после разрушения которых грибы проникают в кровоток и диссеминируют по всему организму. Результатом септикопиемического процесса являются множественные плотные узлы в различных участках кожи и гранулематозные инфильтраты во внутренних органах. Споротрихозные узлы представляют собой холодные абсцессы, при вскрытии которых образуются язвы, напоминающие сифилитические. Язвы заживают рубцом, под которым через некоторое время повторно формируется холодный абсцесс. Описаны случаи молниеносного течения заболевания, заканчивающиеся смертью больного. Изменения на слизистых оболочках представлены эритематозными, язвенными, вегетирующими и папилломатозными высыпаниями. Висцеральные формы клинически проявляются симптомами пиелонефрита, орхита, эпидидимита, реже регистрируются поражения легких, костей, суставов, сухожилий, мышц. Изолированное поражение кожи сопровождается наличием высыпаний в виде узелков, гнойников, перифолликулярных инфильтратов, интертригинозных, экзематоидных и язвенных поражений, грибовидных бородавчатых разрастаний.
Грибовидный микоз
Диагностика Кератомикозы Диагноз разноцветного лишая ставят на основании клинической картины, обнаружения очагов микоза с помощью люминесцентной лампы (золотисто-желтое или буроватое свечение) и микроскопии (обнаружение чешуек гриба и его мицелия, круглых спор). Дифференциальный диагноз проводят с пигментным сифилидом, псориазом и другими дерматозами, себореей, розовым лишаем Жибера, хлоазмой, витилиго, пинтой и эритразмой. Диагноз пьедры ставят при обнаружении образования каменной плотности и элементов гриба при микроскопии, а также культуры гриба при посеве. Дифференциальный диагноз проводят с ложной пьедрой, которая вызывается бактериями.
Дерматомикозы Диагноз эпидермофитии ставят на основании данных объективного обследования пациента и выделения гриба. Дифференцируют эпидермофитию с микозом, обусловленным красным трихофитоном, эпидермофитией стоп, эритразмой. Диагноз микозов стоп ставят при выявлении возбудителя: посев на среду Сабура (чешуйки кожи, соскобы с поверхности ногтей).
Кандидомикоз Диагноз основывается на результатах общеклинических, иммунологических и бактериологических методов диагностики. Исследуемый материал сеют на дифференциально-диагностическую среду Сабура с последующей идентификацией возбудителей грибковой инфекции до вида.
Бластомикозы и гистоплазмоз Диагностика бластомикозов основывается на данных клинической, клинико-инструментальной и лабораторной диагностики.
Лечение и профилактика Кератомикозы Лечение разноцветного лишая местное. Втирают в кожу пораженного участка фунгицидные и кератолитические средства: 60 %-ный водный раствор гипосульфата натрия по 2–3 минуты, а после образования мелких кристалликов обрабатывают 6 %-ным раствором неразведенной соляной кислоты. Курс длится 5–6 недель (метод Демьяновича). Важным условием является лечение заболеваний внутренних органов и потливости. Через 1–2 месяца (после стихания клинической картины) курс лечения повторяют. Профилактика заключается в дезинфекции одежды и белья. Лечебные процедуры при пьедре включают ежедневное мытье головы горячим раствором сулемы 1:1000 или сулемовым уксусом с последующим вычесыванием волос частым гребнем и мытьем головы горячей водой с мылом. Быстрое выздоровление наступает при сбривании волос с поврежденных частей головы.
Дерматомикозы Лечение эпидермофитии местное и общее. Смазывают очаги 1–2 %-ной йодной настойкой в течение 3–5 дней, затем 3–5 %-ной серно-дегтярной мазью в течение 2–3 недель. Эффективны нипагин и нипазол в аэрозольной форме. Внутрь принимают 10 %-ный раствор хлористого кальция и антигистаминные препараты. Прогноз благоприятный. Профилактика: тщательное лечение, обследование контактных, санитарно-гигиенические мероприятия в очаге. В плане медикаментозной терапии микозов стоп показаны холодные примочки 1–2 %-ным раствором резорцина, раствором перманганата калия 1:6000 — 1:8000. После установления грибкового характера заболевания применяют фунгицидные жидкости, мази и другие лекарственные формы: 1–2 %-ный спиртовой раствор анилиновых красителей, 2 %-ную настойку йода, нипагин, уксусную кислоту. В мазях должна содержаться ундециленовая кислота, нипагин, нипазол, сера (от 3 до 10 %), деготь (2—10 %), салициловая кислота (2–3 %). Обязательно назначают десенсибилизирующую терапию: 10 %-ный хлористый кальций внутрь или внутримышечно, димедрол, пипольфен и другие седативные средства (валериана, пустырник). Витамины группы В, витамин С. Лечение ногтей проводят с помощью кератолитического пластыря, фунгицидными жидкостями и мазями. Прогноз: заболевание нередко принимает хроническое течение с обострениями в весенне-летний период. В обязательном порядке проводят терапию трихофитии гризеофульвином (таблетка по 0,125 г) из расчета 15 мг/кг в сутки. Суточная доза назначается ежедневно до первого отрицательного анализа на грибы волос и чешуек, что наблюдается на 15—25-й день от начала лечения. Затем антибиотик назначают через день в той же дозе 2 недели, а далее 1 раз в три дня 2 недели. Местно проводится йодно-мазевая терапия очагов: 3–5 %-ная настойка йода утром, а на ночь наносят и слегка втирают серно-салициловую или серно-дегтярную мази. Волосы на голове перед началом лечения остригают машинкой, затем сбривают 1 раз в неделю до окончания лечения. Учитывая клиническую картину, проводят симптоматическое лечение. Прогноз в большинстве случаев благоприятный. Исключение составляют случаи трихофитии волосистой части головы, когда лечение начато поздно, так как в этом случае формируются обширные рубцовые изменения. Профилактика: обследование, санитарнопросветительская работа. Больные с локализованными поражениями при микроскопии на волосистой части головы и множественными очагами поражения на туловище должны лечиться стационарно. Гризеофульвин назначают в суточной дозе 22 мг/кг через день (в течение 2 недель) до отрицательного анализа на грибы (3 отрицательных анализа на грибы с интервалом 5–7 дней). При невозможности пользоваться гризеофульвином используют 4 %-ный эпилиновый пластырь. При поражении только гладкой кожи применяют 2–5 %-ный йод, фунгицидные растворы (микосептин, салифунгин, нитрофунгин) утром и серно-салициловую мазь вечером. Для лечения поражения пушковых волос применяют 5 %-ный гризеофульвиновый пластырь, а для удаления единичных светящихся волос на голове используют электрокоагуляцию. Для повышения иммунитета применяют бактериальные пирогены (пирогенал, продигиозан), инъекции гаммаглобулина, витамин В1. Питание должно быть полноценным, калорийным. Прогноз в большинстве случаев благоприятный. Профилактические мероприятия заключаются в осмотре контактных каждые 5 дней. Лечение фавуса осуществляют гризеофульвином, как при трихофитии, а также применяют йодно-мазевую терапию. Без лечения заболевание может длиться десятки лет и приводить к полному облысению. При внутренних формах прогноз обычно неблагоприятный. Профилактика: всех контактных регулярно и тщательно осматривают на предмет выявления атипичных форм. В населенных пунктах, где выявлен больной, должны осуществляться массовые повторные осмотры населения в течение 3 лет. Проводится заключительная и текущая дезинфекция в очаге.
Кандидомикоз Легкие формы кандидозных поражений кожи и слизистых оболочек могут закончиться самоизлечением. Хронический кандидозный процесс требует серьезной медикаментозной терапии в комплексе с мероприятиями по уходу за больным. Важным условием успешного лечения является усиленное питание, которое должно соответствовать возрасту пациента, содержать достаточное количество белков и витаминов. Необходимо отменить антибактериальные препараты, устранить дисбактериоз, восполнить недостаток гормонов, провести курс общеукрепляющей терапии. Из медикаментозных средств показаны следующие препараты: нистатин, леворин, амфоглюкамин, микогептин, амфотерицин В. Нистатин и леворин применяют при наружном и висцеральном (внутреннем) кандидозе в дозе от 500 тыс. до 1 млн ЕД в сутки двухкратными 2—3-недельными курсами с 7-дневным перерывом. В качестве лекарственных форм этих препаратов для наружного применения используют 5 %-ные мази, лосьоны, суспензии и растворы. Поражение органов дыхания является показанием для назначения ингаляций водорастворимой натриевой соли леворина. Амфоглюкамин, микогептин, амфотерицин В назначают при висцеральных гранулематозных поражениях. Иммунотерапию кандидозных заболеваний осуществляют с помощью убитых вакцин и растворимых фракций грибов. Для лечения поверхностных очагов или распространенных форм применяют раствор каприлата натрия, 1–2 %-ный раствор йода, спирто-водные растворы эозина (в 20 %-ном алкоголе), серно-салициловую мазь Уайтфильда, фуксиновую смесь Кастеллани. Слизистые оболочки обрабатывают 10 %-ным раствором буры в глицерине, раствором Люголя на глицерине, 1–2 %-ным раствором питьевой соды в течение 5–7 дней. В дальнейшем курс лечения продолжают в течение 2–3 недель с профилактической целью. При тяжелом течении показано местное применение нистатина в возрастных дозах. Поражение влагалища является показанием для назначения промываний или его тампонады 2 %-ным раствором буры, 10 %-ным раствором бикарбоната натрия, раствором Люголя. Прогноз при наличии поверхностных кандидозных поражений и проведении интенсивной терапии благоприятный, при септическом течении — всегда осторожный.
Бластомикозы Лечение криптококкоза должно быть комплексным. Важное значение необходимо придавать усиленному питанию больного (диета, бедная тиамином). Консервативным средством лечения является назначение амфотерицина В (внутривенно капельно из расчета 0,2–1 мг в сутки в течение 3–4 месяцев); хирургическое лечение — удаление локализованных криптококкозных очагов. Из медикаментозных средств при североамериканском бластомикозе показано применение амфотерицина В внутривенно капельно в суточной дозе 12,5—50 мг, повторные курсы нистатина по 4–5 млн ЕД в сутки в течение 3 недель. Десенсибилизирующую терапию проводят путем подкожного введения постепенно возрастающих доз вакцины, начиная с 0,1–0,2—0,3 до 1 мл через каждые 2 дня в разведении 1:100 (если аллергическая реакция измеряется 2 см2), 1:1000 (если аллергическая реакция измеряется 3 см2) и 1:10 000 см2 (если реакция превышает 3 см2). Неплохие результаты получают при использовании йодотерапии совместно с рентгенооблучением, нанесением на очаги СО2 и хирургическим вмешательством. Прогноз при кожных формах благоприятный, а при диссеминированных — сомнительный. Продолжительность заболевания в большинстве случаев составляет не менее 2 лет. Лечение при дермальных поражениях южноамериканского бластомикоза включает ежедневное введение антибиотика сарамицина из расчета 4 мг/кг подкожно. Ограниченные очаги подлежат кюретажу, осуществляют иссечение карманов. Показано строгое соблюдение постельного режима. При висцеральных и смешанных формах назначают введение амфотерицина В в сочетании с некоторыми сульфаниламидными препаратами (сульфапиридин, сульфадиазин и др.). Лечение келоидного бластомикоза малоэффективно. Показано назначение противогрибковых препаратов внутрь (нистатин, леворин) или внутривенно (амфотерицин В). В качестве медикаментозной терапии пораженных участков кожи применяют препараты йода. Лечебные мероприятия при кокцидиоидном микозе носят комплексный характер и направлены на повышение защитных сил организма. Витаминотерапия показана в течение всего периода болезни. Из противогрибковых средств применяют амфотерицин В внутривенно капельно, внутрь спинно-мозгового канала. Некоторый эффект дают повторные переливания крови, кровезаменителей, плазмы, гидролизатов белка. К хирургическому вмешательству прибегают при наличии абсцедирующей мягкой кокцидиомы, легочного кровотечения, периферического расположения каверн с прорывом в плевру, при увеличении каверн и при их вторичном инфицировании, для иссечения свищевых ходов, вскрытия абсцессов.
Редкие микозы Лечение риноспоридиоза включает хирургическое удаление полипозных очагов с последующей электрокоагуляцией тканей для предупреждения рецидива. Местно при хромомикозе применяют мази следующего состава: салициловая кислота (1,0 г), бензойная кислота (2,0 г), сера осажденная (3,0 г), кальциферол (3 ампулы по 600 тыс. ЕД), вазелин (15,0 г), ланолин (15,0 г). Положительный эффект отмечается при использовании витамина D курсами по 2 месяца с интервалом 2–3 недели в течение 3–6 месяцев. Тяжелое течение является показанием для назначения амфотерицина В внутривенно капельно из расчета 1,0–1,5 г/кг в сутки. В некоторых случаях прибегают к хирургическому вмешательству (иссечение, кюретаж, диатермокоагуляция).
Гистоплазмоз Основным методом лечения является общеукрепляющая терапия, полноценное питание, поливитамины. Из симптоматических средств применяют анальгетики, жаропонижающие, седативные и антигистаминные препараты. При тяжелом течении заболевания показано применение противогрибковых средств длительными курсами (внутрь, внутривенно).
Плесневые микозы Лечение плесневых микозов имеет общие принципы. Антигрибковая терапия при генерализованных формах включает внутривенное капельное введение амфотерицина В. При легочных формах инфекции показаны ингаляции с натриевой солью нистатина или леворина, внутрь назначают амфоглюкамин, микогептин, гамицин и другие препараты той же группы. При наличии местных поражений применяют фунгицидные средства. В некоторых случаях (формирование каверн и полостей, свищей) прибегают к хирургическому вмешательству.
Споротрихоз В лечении споротрихозной инфекции значительное место отводится препаратам йода в больших дозировках (по 3–6 г йодида калия в день в течение 4–5 месяцев). При тяжелом течении показано интравенозное введение 10 %-ного раствора йодида натрия по 5—10 мл ежедневно. После окончания парентерального введения препарата йодид калия применяют на протяжении 4–6 недель. Как дополнительное терапевтическое средство используют спиротрихин по 0,2–1,3 мл в разведении 1:1000 (специфическая иммуногенная терапия). При тяжелом течении заболевания проводят курс антигрибковой терапии (нистатин, леворин, амфотерицин В). К хирургическому вмешательству прибегают при формировании незаживающих язв, при некротизации лимфатических узлов. Папилломатозные очаги удаляют путем криотерапии, рентгенотерапии и электрокоагуляции.
МИКОПЛАЗМОЗ
ОпределениеМикоплазмоз или микоплазменная инфекция — это группа острых инфекционных заболеваний человека и животных, вызванных микоплазмами.Микоплазменная инфекция характеризуется полиморфизмом клинических проявлений, умеренной интоксикацией и поражением органов дыхания. При урогенитальной локализации поражаются органы мочеполового тракта.
Этиология Микоплазмы занимают промежуточное положение между бактериями и вирусами. Относятся к классу Молликутес семейства Микоплазма, в состав которого входит более 40 видов. Большинство микоплазм являются возбудителями заболеваний у животных и птиц. Патогенным для человека считается M. Pneumoniae, а условно-патогенными — M. hominis и Т-группа микоплазм. Микоплазмы вызывают поражение сердца, органов дыхания, суставов, центральной нервной системы, мочеполового тракта человека. M. Pneumoniae чаще всего поражает дыхательную систему, центральную нервную систему и суставы (острые респираторные заболевания, пневмонии, бронхиты, бронхиолиты, менингиты, а также полиартриты). M. hominis и Ureaplasma ureafyticum выделяют из уретры больных негонококковыми уретритами, при воспалительных процессах женской половой сферы, нередко вызывают осложнения беременности. Другие виды микоплазм обнаруживают в соскобах уретры у больных, страдающих хроническими цервицитом, вагинитом, пиелонефритом и другими заболеваниями мочеполовой системы. Микоплазмы растут на агаре с добавлением дрожжевого экстракта и лошадиной сыворотки, а также способны размножаться в эпителиальных клетках куриного эмбриона, культурах клеток человека и животных. На плотных средах микоплазмы образуют мелкие колонии, их клетки имеют изменчивую форму и чувствительны к температурному воздействию, ультрафиолетовому облучению, действию обычных дезинфицирующих средств. Самые мелкие репродуктивные структуры микоплазм имеют размеры 125–250 мкм. Микроорганизмы плеоморфны из-за отсутствия ригидной клеточной оболочки, вместо которой они покрыты трехслойной «объединяющей мембраной», резистентны к пенициллину, но тетрациклин и эритромицин угнетают их рост. В последнее время обнаружены штаммы Уреаплазма уреалитика, устойчивые к тетрациклинам и эритромицинам.
Эпидемиология Источником инфекции является больной человек или здоровый носитель. Путь передачи воздушно-капельный (поражение органов дыхания), половой (поражение мочеполовой системы), возможен контактно-бытовой путь через предметы обихода. Дети могут быть инфицированы через игрушки, постельное белье, предметы обихода. Контактно-бытовой путь инфицирования имеет ограниченное значение, так как микоплазмы неустойчивы во внешней среде.
Патогенез При воздушно-капельном пути передачи инфекции входными воротами являются слизистые оболочки трахеи и бронхов. Микоплазмы фиксируются на эпителиальных клетках дыхательных путей, разрушают перемычки между клетками и нарушают тем самым структуру тканей. В патологический процесс постепенно вовлекается все большее количество клеток, в том числе и альвеолоциты, в цитоплазме которых образуются микроколонии возбудителя. Межальвеолярные перегородки утолщаются, развивается интерстициальная пневмония, а в дальнейшем — бронхопневмония. При тяжелом течении заболевания микоплазмы гематогенным путем распространяются в различные органы и ткани: центральную нервную систему (менингит), печень (гепатит), мочеполовую систему (уретрит, цистит, вульвовагинит, нефрит). При половом пути передачи входными воротами является слизистая влагалища (первичный вульвовагинит) и уретры (первичный уретрит). Вторичный уретрит может развиться при нарушении правил личной гигиены (при локализации первичного очага инфекции во влагалище) через предметы общего пользования: белье, полотенце, губки (контактный путь передачи инфекции). При развитии поражений микоплазменной этиологии значительную роль играет вторичная бактериальная флора. После перенесенной микоплазменной инфекции формируется иммунитет, напряженность которого зависит от тяжести течения заболевания (от 1–2 до 5—10 лет).
Патологическая анатомия Макроскопически слизистая оболочка пораженного органа гиперемирована с инъекцией сосудов, явлениями геморрагического диатеза, иногда — с очагами изъязвления. Микроскопически эпителиальные клетки увеличены в размерах, в цитоплазме обнаруживаются многочисленные мелкие ШИК-положительные тельца, которые представляют собой скопления микоплазм. Стенка пораженного органа инфильтрирована лимфоцитами, гистиоцитами, плазматическими клетками и единичными лейкоцитами. При тяжелом течении отмечаются явления некроза и десквамации. Увеличены размеры регионарных лимфатических узлов. При генерализованных формах очаги поражения локализуются в печени, почках, центральной нервной системе, суставах.
Клиническая картина Инкубационный период колеблется от 1–3 недель (до 4–5 недель в некоторых случаях). При локализации процесса в органах дыхания клиническая картина характеризуется разнообразием форм: от легких катаров верхних дыхательных путей до тяжелых сливных пневмоний. Поражение верхних дыхательных путей клинически проявляется постепенным началом. Температура тела повышается до субфебрильныхцифр. Больной предъявляет жалобы на сухой мучительный кашель, общую слабость, головную боль, сухость и першение в горле. Температура тела постепенно повышается, достигая своего максимума 38–39 °C к 3—5-му дню от начала болезни. Кожные покровы бледные, конъюнктива может быть гиперемирована, отмечается инъекция сосудов склер. Симптомы интоксикации выражены незначительно и не соответствуют длительно сохраняющейся лихорадке. При осмотре в зеве отмечается умеренная гиперемия слизистой оболочки, а на задней стенке глотки — явления фарингита с увеличением фолликулов. Носовое дыхание затруднено, отделяемое из носовых ходов скудное. Кашель сухой в начале болезни, к 4—5-му дню появляется скудная мокрота. При аускультации выслушиваются сухие хрипы на фоне жесткого дыхания. В некоторых случаях присоединяются симптомы ложного крупа: голос осипший, лающий кашель (иногда беззвучный), затруднение дыхания, одышка, акроцианоз (синюшность конечностей). Изменения в общем анализе крови характеризуются небольшим лейкоцитозом, нейтрофилезом, повышением СОЭ до 20–30 мм/ч. Микоплазменная пневмония носит обычно очаговый характер, но может быть и долевой. Развитие заболевания медленное. Первые признаки болезни: ринит, фарингит, температура тела повышена до субфебрильных цифр. Клинические симптомы пневмонии появляются на 3—5-й день от начала болезни и сопровождаются подъемом температуры тела до 39–40 °C. Нередко микоплазменная пневмония протекает на фоне субфебрильной или нормальной температуры тела. Важным симптомом заболевания служит прогрессирующее нарастание изменений со стороны легких при относительно слабых симптомах интоксикации. Общее состояние больных страдает незначительно. В патологический процесс нередко вовлекается плевра. Пациент предъявляет жалобы на боль в боку при кашле, при изменении положения тела. При аускультации выслушиваются мелко- и среднепузырчатые хрипы, шум трения плевры. В периферической крови имеет место тенденция к умеренному лейкоцитозу, лимфопении, моноцитопении, сдвигу лейкоцитарной формулы влево, СОЭ ускорена до 30–40 мм/ч. Урогенитальные микоплазмозы встречаются повсеместно, сопровождают трихомонадные, гонококковые и хламидийные поражения мочеполового тракта, острые и хронические воспаления женской генитальной сферы невыясненной этиологии, патологию беременности и плода. Урогенитальные микоплазмозы у женщин подразделяются по локализации на микоплазмоз наружных женских половых органов (вульвовагинит, уретрит, парауретрит, бартолинит и др.) и микоплазмоз внутренних женских половых органов (аднексит, эндометрит, сальпингит, воспаление и абсцессы яичников и др.). Наиболее часто инфекция проникает во влагалище, мочеиспускательный канал, преддверие влагалища, поражает малые железы преддверия и бартолинову железу. Микоплазменные вагиниты нередко развиваются в сочетании с другой патогенной и условнопатогенной флорой. Клинические проявления характеризуются небольшой эритемой в области уретры и гименального кольца со скудным отделяемым. Слизистая влагалища отечна и гиперемирована с серозно-гнойным отделяемым в заднем своде. Микоплазменные уретриты протекают в большинстве случаев латентно и длительно. Больные предъявляют жалобы на слабые боли при мочеиспускании, скудные слизисто-гнойные выделения из уретры, которые обильнее по утрам. Наружное отверстие мочеиспускательного канала гиперемировано. Моча в первой порции мутная, в ней могут отмечаться слизистые нити. При отсутствии соответствующего лечения у женщин уретрит может привести к развитию цистита. Этому способствуют анатомо-топографические особенности мочеполового тракта: короткая уретра, близкое анатомическое расположение влагалища и ануса к наружному отверстию мочеиспускательного канала. Данная особенность создает благоприятные условия для локализации постоянно вегетирующей микрофлоры и распространения ее из этих органов в просвет уретры и мочевой пузырь. Достаточно часто урогенитальный микоплазмоз у женщин не имеет ярких клинических проявлений. При воздействии неблагоприятных факторов (снижение иммунитета, гормональные нарушения и др.) могут развиваться различные осложнения вульвовагинита и уретрита: абсцесс бартолиновой железы, восходящие микоплазменные поражения внутренних женских органов, мочевого пузыря, почечных лоханок и почек. У мужчин цистит развивается значительно реже, но уретрит может сопровождаться баланитом и баланопоститом. Больные жалуются на зуд, выделения из препуциального мешка. После оттягивания крайней плоти в венечной бороздке обнаруживается интенсивное воспаление и мацерация эпидермиса. Поверхность головки и внутреннего листка набухшая, разрыхленная, гиперемирована. В дальнейшем на коже головки полового члена могут образоваться эрозии, ссадины и изъязвления. Длительно существующий баланит может оказаться причиной фимоза, а баланопостит — парафимоза. Среди осложнений микоплазменной инфекции у мужчин особенно часто встречается хронический простатит и эпидидимит. Наличие микоплазменной инфекции у беременной женщины может привести к внутриутробному инфицированию плода. Внутриутробное инфицирование микоплазмами может привести к самопроизвольному выкидышу или смерти плода сразу после рождения. Ребенок чаще всего рождается недоношенным, с низкой массой тела. Кожные покровы бледные с серым оттенком, акроцианоз или общий цианоз, желтуха, пневмония, склерема, кефалогематома. Нередко отмечается геморрагический синдром. Выражены симптомы интоксикации. В конце первой недели жизни появляются симптомы менингоэнцефалита. Течение катара верхних дыхательных путей в большинстве случаев легкое. Катаральные явления держатся в течение 1–2 недель, температура тела снижается до нормальных показателей к 7—10-му дню от начала болезни. При микоплазменной пневмонии изменения в легких подвергаются обратному развитию через 2–3 недели от начала лечения. Осложнения при поражении органов дыхания обусловлены наслоением бактериальной инфекции. В некоторых случаях возможно развитие специфического менингоэнцефалита, поражения сосудистой оболочки глаз, буллезного ларингита. При отсутствии своевременного и адекватного лечения урогенитального микоплазмоза патологический процесс имеет тенденцию к вялому и подострому течению. Генитальные штаммы микоплазм могут быть причиной бесплодия. Нередким является латентное, бессимптомное течение урогенитальной микоплазменной инфекции, которая активизируется при беременности, во время родов, при переохлаждении, в различных стрессовых ситуациях и является причиной тяжелых осложнений (сепсис, септические аборты, воспалительные процессы у новорожденных, воспалительные процессы в мочеполовых органах).
Диагностика Диагноз микоплазменной инфекции ставят на основании анамнестических данных, результатов объективного обследования пациента и данных дополнительных методов обследования (бактериологическое и серологическое исследование). При наличии поражения органов дыхания необходимо учитывать постепенное начало заболевания, мучительный кашель, продолжительность лихорадки при незначительных симптомах интоксикации, последовательное поражение бронхолегочной системы вплоть до развития малосимптомных пневмоний. Выделение микоплазм из фарингеальной слизи, мокроты и гноя является решающим при постановке диагноза. Учитывая латентное бессимптомное течение урогенитального микоплазмоза, диагноз нередко ставят при профилактических осмотрах на основании результатов исследования отделяемого или соскобов со слизистой оболочки мочеполовых органов. Микоплазмы можно обнаружить в выделениях мочеполовой системы, моче, воспалительных экссудатах. Забор материала для бактериологического исследования осуществляют перед началом антибактериального лечения. Для обнаружения колоний микоплазм используют световую микроскопию, фазовоконтрастную микроскопию или иммунофлюоресценцию. Серологические методы диагностики играют важную роль. В данном случае учитывают нарастание титра антител в реакции связывания комплемента и реакции непрямой гемагглютинации, реже прибегают к постановке реакций диффузии в геле, латекс-агглютинации, ингибирования роста и др. Диагностическим считается нарастание титра специфических антител в четыре и более раз.
Дифдиагностика Бронхолегочную локализацию микоплазменной инфекции следует дифференцировать с острыми респираторными вирусными инфекциями (особенно аденовирусной инфекцией и респираторно-синтициальной инфекцией), орнитозом, крупозной пневмонией. Аденовирусная инфекция отличается от микоплазменной выраженными катаральными явлениями, обильными выделениями из носа, поражением глаз, гиперплазией лимфоидных образований ротоглотки, увеличением регионарных лимфатичеких узлов, отсутствием изменений со стороны периферической крови. Главным отличием респираторно-синтициальной инфекции является наличие тяжелого бронхообструктивного синдрома. Крупозная пневмония протекает с выраженным токсикозом, значительными клиническими и рентгенологическими проявлениями, изменениями в картине периферической крови (нейтрофильный лейкоцитоз и высокая СОЭ). Для орнитозной инфекции характерно наличие контакта с голубями и другими птицами; выражается лихорадкой и токсикозом. Наряду с поражением легких имеет место увеличение печени и селезенки. В общем анализе крови выявляется лейкопения или нормоцитоз, повышена СОЭ. Дифференциальную диагностику урогенитальной микоплазменной инфекции проводят с гонореей и другими заболеваниями (трихомонадные поражения, хламидийная, бактериальная, вирусная и грибковая инфекции) мочеполовой системы. Особое внимание уделяют сбору анамнестических данных (половой контакт с больным или носителем микоплазменной инфекции). Учитывая скудные клинико-этиологические проявления, на первый план выходят бактериологические и серологические методы диагностики.
Лечение При бронхолегочной патологии (легкое и среднетяжелое течение) лечение симптоматическое амбулаторное или в условиях стационара. Больному назначают обильное витаминизированное питье, жаропонижающие средства, антигистаминные препараты, поливитамины, отхаркивающие микстуры, муколитики. При крупе показана дача кислорода, отвлекающая терапия (горячие ножные ванны, озокеритовые сапожки). Тяжелое течение микоплазменной пневмонии является показанием для назначения антибактериальной терапии (эритромицин, тетрациклин, сумамед, клиндамицин, рулид, линкомицин). В детском возрасте препаратами выбора являются рулид, вильпрафен, сумамед. При выраженной интоксикации проводят дезинтоксикационную терапию (внутривенно капельно вводят 5—10 %-ный раствор глюкозы, реополиглюкин, солевые растворы, гемодез), применяют мочегонные средства. Лечение урогенитальных микоплазмозов проводится с учетом фазы воспалительного процесса. Терапия должна быть комплексной и патогенетически обоснованной. В качестве этиотропной терапии используют антибиотики, активные в отношении микоплазм. Препаратами выбора при лечении урогенитальных микоплазмозов являются тетрациклин и эритромицин. Препараты назначают внутрь в течение 10–14 дней: тетрациклин по 500 мг 2 раза в день, эритромицин по 250 мг 4 раза в день. Женщинам дополнительно рекомендуют тетрациклин или эритромицин по 100 мг в форме влагалищных таблеток. Местное лечение осуществляют в виде инстилляций в уретру, мочевой пузырь через катетер ежедневно в течение 10 дней (2 %-ный раствор желатина, 50 мл масляный раствор витамина А 5 тыс. ЕД, инсулина 200 ЕД, тетрациклина 1 млн ЕД). Женщинам назначают влагалищные ванночки из этого раствора в течение 10–12 дней. При хроническом простатите, везикулите у мужчин, эндометрите, сальпингите у женщин назначают фонофорез с тетрациклином, эритромицином. Рекомендована физиотерапия: диатермия, ультразвук, токи УВЧ. Для установления излеченности больного микоплазмозом через 7–8 дней после окончания лечения следует повторно исследовать выделения из тех органов, в которых до лечения были обнаружены микоплазмы, а также осадок свежевыпущенной мочи, секрет половых желез (предстательной железы, семенных пузырьков), эякулят. При обнаружении микоплазм проводят повторный курс лечения. Необходимо обеспечить лечение полового партнера пациента. После завершения лечения за больным устанавливают диспансерное наблюдение в течение 2–3 месяцев. Прогноз при неосложненном течении благоприятный.
Профилактика В очаге инфекции важно как можно раньше изолировать больного и провести общие профилактические мероприятия. Необходимо выявить всех контактных и обследовать их на наличие микоплазменной инфекции. Активное выявление и привлечение больных к лечению остается одним из успешных методов борьбы с урогенитальными микоплазмозами, так как у большинства мужчин и женщин заболевание протекает хронически или в латентной форме без клинических проявлений. Такие люди считают себя здоровыми и остаются потенциальными источниками инфекции. В организованных детских коллективах источниками инфекции нередко становится обслуживающий персонал. Больные женщины допускаются к работе в детских учреждениях после полного курса лечения и установления полной излеченности. При выявлении вульвовагинита у ребенка в обязательном порядке обследуются родители, так как в данном случае заражение произошло, скорее всего, контактным путем. Дети, больные микоплазмозом (в том числе и микоплазменным уретритом, вульвовагинитом), не могут посещать организованный коллектив до полного излечения.
МИКСЕДЕМА
ОпределениеМикседема (гипотиреоз, болезнь Галла) — заболевание, обусловленное недостаточным уровнем гормонов щитовидной железы в органах и тканях. Наиболее современным считают название «гипотиреоз» (см.), так как термин «микседема» означает слизистый отек кожи и подкожной клетчатки и используется для характеристики тяжелых форм гипотиреоза, сопровождающихся универсальным слизистым отеком.В зависимости от уровня нарушения биосинтеза гормонов выделяют первичный (тиреогенный), вторичный (гипофизарный), третичный (гипоталамический) гипотиреоз и периферическую (тканевую) резистентность к тиреоидным гормонам.
Этиология В большинстве случаев клинические проявления заболевания обусловлены патологическим процессом в самой щитовидной железе, что приводит к снижению продукции гормонов (первичный гипотиреоз). Развитию первичного гипотиреоза могут способствовать осложнения лечебных мероприятий: оперативное лечение заболеваний щитовидной железы, лечение токсического зоба радиоактивным йодом, лучевая терапия злокачественных новообразований, расположенных на шее, неконтролируемая терапия тиреотоксическими препаратами, использование йодсодержащих лекарственных препаратов (в том числе рентгеноконтрастных веществ), прием кортикостероидных препаратов, женских и мужских половых гормонов, сульфаниламидных препаратов. Разрушающие поражения щитовидной железы (опухоли, острые и хронические инфекции) в некоторых случаях становятся фактором формирования первичного гипотиреоза. У новорожденных и детей первого года жизни гипотиреоз обусловлен врожденным отсутствием щитовидной железы или ее недоразвитием, что нередко регистрируется при дефиците йода в окружающей среде, нелеченным гипотиреозом у матери, наследственной предрасположенностью. Причиной развития вторичного гипотиреоза могут быть нарушения регулирующего и стимулирующего воздействия гормонов гипофиза или гипоталамического фактора: воспалительные, разрушающие, травматические поражения гипофиза и гипоталамуса со сниженной продукцией тиреотропных гормонов (гормонов щитовидной железы) и с последующим снижением активности щитовидной железы. Вторичный гипотиреоз часто сочетается с проявлениями общей гипофизарной недостаточности. Третичный гипотиреоз возникает и развивается при поражении гипоталамуса вследствие нарушения синтеза тиролиберина. Периферическая форма возникает в результате нарушения метаболизма тиреоидных гормонов, а также снижения чувствительности органов и тканей к тиреоидным гормонам. Уменьшение секреции тиреоидных гормонов приводит к замедлению всех процессов обмена веществ.
Патогенез Наиболее распространен первичный гипотиреоз. В основе заболевания лежит хронический аутоиммунный процесс. При хроническом тиреоидите ткань щитовидной железы постепенно атрофируется, заменяясь соединительной. При этом щитовидная железа может оставаться без изменений, уменьшаться или увеличиваться в размерах. В основе механизма развития лежит снижение продукции гормонов щитовидной железы, регулирующих физиологические функции и обменные процессы в организме человека. Дефицит данных гормонов приводит к угнетению всех видов обмена, угнетению процессов утилизации кислорода и окислительных реакций, что в свою очередь приводит к снижению активности ферментных систем, нарушению газообмена и основного обмена, замедлению синтеза и распада белков, нарушению выведения из организма токсических продуктов обмена веществ. Дефицит гормонов щитовидной железы оказывает значительное влияние на нервную деятельность, тормозя развитие тканей мозга в детском возрасте и приводя к развитию гипотиреоидной энцефалопатии у взрослых. Влияние на другие эндокринные железы ярче всего проявляется воздействием на функциональную активность коры надпочечников, деятельность которых резко снижается в условиях повышенной температуры, превращение кортикостероидов и половых гормонов. Вследствие низкого уровня гормонов щитовидной железы в крови развивается компенсаторное переразвитие ткани щитовидной железы, образование кист и аденом. Механизм развития гипотиреоидной комы запускается при угнетении дыхательного центра и прогрессирующем снижении сердечного выброса. В результате нарастают кислородная недостаточность мозга и пониженная температура тела на фоне угнетения обмена веществ и падения скорости утилизации кислорода. Затруднению легочной вентиляции способствуют накопление бронхиального секрета и снижение кашлевого рефлекса. В условиях низкой температуры имеет место значительное нарушение функций всех внутренних органов, что приводит к ухудшению состояния больного.
Патанатомия В основе заболевания лежат атрофические изменения в щитовидной железе. Капсула железы утолщена, хорошо развиты соединительнотканные прослойки и сосуды, между которыми располагаются небольшие островки тиреоидных клеток. В некоторых случаях выражена жировая инфильтрация. Неспособность щитовидной железы вырабатывать гормоны приводит к формированию зоба. Железа увеличена за счет увеличения тиреоидного эпителия с усилением его функции, появляются тяжи и солидные скопления. Тиреоидный эпителий крупный, с увеличенными клеточными структурами, интенсивно разрастается, что клинически проявляется ростом зоба. Усиленное разрастание эпителия обусловлено влиянием гормона щитовидной железы. При этом в железе часто образуются многочисленные аденомы. Изменения в скелетной мускулатуре характеризуются увеличением части мышечных волокон с исчезновением поперечной исчерченности, разрывом миофибрилл, нарушением целостности сарколеммы, отеком отдельных волокон. Поражение сердца сопровождается околосердечным отеком и множественными атеромами в коронарных артериях. Кора надпочечников атрофирована.
Клиническая картина Выраженность симптомов при гипотиреозе (см.) зависит от степени тиреоидной недостаточности. Начальные проявления заболевания характеризуются в большинстве случаев скудной симптоматикой: слабость, быстрая утомляемость, снижение работоспособности, боли в сердце, ощущение зябкости даже при высокой температуре окружающей среды. При нарастании клинических проявлений больные приобретают специфический внешний вид: лицо бледное, одутловатое и маскообразное, имеет место отек, черты лица укрупняются, волосы истончаются, становятся сухими и ломкими.
Внешний вид больного при микседеме
Кожные покровы бледные, холодные и сухие на ощупь, отмечаются участки ороговения на стопах, передней поверхности голеней, коленях, локтях. Отечность голосовых связок и языка проявляются нечеткостью речи, голос становится грубым, в ночное время могут быть случаи временной остановки дыхания. На боковых поверхностях языка видны отпечатки зубов. Секреция сальных и потовых желез снижена, отмечается желтушность кожи в виде пятен на ладонях. Больные нередко предъявляют жалобы на боли в мышцах, судороги. Мышцы становятся плотными, тугоподвижными, хорошо контурируются. Костные поражения не характерны для гипотиреоза у взрослых пациентов, но могут быть боли в суставах, артропатии, артрозы и синовиты. Поражения сердечно-сосудистой системы характеризуются одышкой при незначительной физической нагрузке, неприятными ощущениями в области сердца и за грудиной, которые иногда не прекращаются нитроглицерином, расширением границ сердца, приглушенностью сердечных тонов, брадикардией (см.). Брадикардия и пульс слабого наполнения и напряжения являются характерными симптомами гипотиреоза. Артериальное давление у больных низкое или нормальное, но с возрастом имеет тенденцию к повышению. Важным симптомом заболевания является наличие околосердечного выпота, объем которого постепенно увеличивается, что может привести к тампонаде сердца. Изменения дыхательной системы обусловлены мышечной дискоординацией, центральными регуляторными нарушениями, кислородной недостаточностью, отеком слизистой оболочки. Пациенты часто переносят бронхиты, пневмонии, которые носят затяжной и малосимптомный характер. Со стороны желудочно-кишечного тракта отмечаются снижение аппетита, тошнота, расстройства пищеварения. Утрата тонуса мочевыводящих путей является благоприятным фоном для присоединения инфекции. Поражение периферической нервной системы клинически проявляется невралгиями (см.), нарушением кожной чувствительности, замедлением сухожильных рефлексов. Гипотиреоидная энцефалопатия сопровождается ухудшением памяти, безразличием к окружающему, снижением интеллекта, апатией. Инверсия сна нередко сопровождается нервозностью и раздражительностью. При отсутствии адекватного лечения гипотиреоза психические расстройства (см.) могут перейти в психозы. Поражение зрительной функции протекает с периорбитальным отеком, птозом, аномалиями рефракции. Первичный гипотиреоз аутоиммунного генеза часто сочетается с первичной недостаточностью других эндокринных желез, часто развивается гипохромная анемия, лакторея и аменорея. Вторичный гипотиреоз сочетается с выпадением нескольких или всех функций гипофиза (пангипопитуитаризм). Наиболее тяжелым осложнением гипотиреоза является гипотиреоидная кома (см.). Предрасполагающими для развития комы факторами являются охлаждение в сочетании с гиподинамией, сердечно-сосудистая недостаточность, инфаркт миокарда (см.), острые инфекции, психоэмоциональные и физические перегрузки, кровотечения (см.), интоксикации. Клинические проявления комы характеризуются сухой и холодной (иногда с геморрагическими высыпаниями) кожей, замедленным сердцебиением, гипотонией (см.), редким дыханием, уменьшением выделения мочи, угнетением сухожильных рефлексов. При этом в крови выявляют анемию (см.), кислородную недостаточность, пониженное содержание натрия, ацидоз, высокий уровень холестерина, увеличение гематокрита и вязкости крови, низкий уровень гормонов щитовидной железы и высокий уровень тиреотропного гормона.
Гипотиреоз в детском возрасте Гипотиреоз в детском возрасте подразделяется на врожденный и приобретенный. Проявления врожденного гипотиреоза нередко наблюдаются уже в первые месяцы жизни: большая масса тела при рождении, вялость, позднее отпадение пуповинного остатка, затянувшаяся желтуха (см.), грубый голос. Симптомы заболевания усиливаются при искусственном вскармливании ребенка или при введении прикорма. Ребенок отстает в физическом и психодвигательном развитии, поздно закрываются роднички и прорезываются зубы. Типичен внешний вид больного ребенка: лицо отечное, переносица широкая и запавшая, язык не умещается в ротовой полости, волосы тонкие, редкие, тусклые, кожные покровы бледные и сухие (мраморность кожи), выражен значительный отек подкожножировой клетчатки на лице, в области кистей и стоп, в над- и подключичных пространствах. Со стороны сердечно-сосудистой системы постоянными признаками являются расширение границ сердца, брадикардия (см.), глухость тонов, снижение артериального давления. Мочеиспускания редкие. Длительное течение заболевания сопровождается не только отставанием в росте, но и развитием дистрофических изменений со стороны костной системы. При отсутствии адекватной и своевременной терапии нарушения становятся необратимыми. Приобретенный гипотиреоз протекает обычно в легкой или среднетяжелой форме. Основными симптомами являются отставание в физическом и половом развитии. Со стороны центральной нервной системы отмечаются замедленная речь и мышление, депрессия (см.), забывчивость. Чем младше ребенок, тем больше клинические проявления заболевания схожи с клиникой врожденного гипотиреоза.
Диагностика и дифдиагностика Диагностировать гипотиреоз возможно при комплексном подходе к обследованию пациента: подробный сбор данных (возраст больного на момент появления первых клинических симптомов, наличие признаков болезни у родственников), полное обследование пациента и дополнительные методы исследования. Среди дополнительных признаков наиболее показательными для гипотиреоза являются уровень холестерина крови, повышение уровня белка крови и нарушение соотношения белковых фракций, снижение активности щелочной фосфатазы, снижение уровня сахара в крови, характерные изменения на ЭКГ, анемия, снижение уровня гормонов щитовидной железы, повышение уровня тиреотропного гормона, а у детей — отставание костного возраста. Диагностика заболевания при типичном течении и у больных, перенесших операцию на щитовидной железе, получавших лечение радиоактивным йодом, обычно не вызывает затруднений. В этих случаях важно определить наличие первичного или вторичного гипотиреоза. Легкое течение заболевания со скудной симптоматикой необходимо дифференцировать с сердечно-сосудистой недостаточностью, заболеваниями почек, нервной системы, синдромом идиопатических отеков. При первичном гипотиреозе нужно проводить дифференциальный диагноз с синдромами Киари-Фроммеля (развивается в послеродовый период) и Форбса-Олбрайта, который обусловлен аденомой гипофиза. В детском возрасте дифференциальная диагностика проводится с рахитом (см.), болезнью Дауна (см.), хондродистрофией, врожденными пороками сердца (см.).
Лечение Основным методом лечения является пожизненная заместительная терапия препаратами щитовидной железы: левотироксин, тиреоидин, тироксин, трийодтиронин, комбинированные препараты (тиреокомб, тиреотом, тиреотом форте). Комбинированные препараты успешнее подавляют секрецию тиреотропного гормона. Доза препарата подбирается постепенно, начиная с малых доз и учитывая длительность и тяжесть течения заболевания. При наличии учащенного сердцебиения и повышенном артериальном давлении гормоны сочетают с бета-адреноблокаторами в небольших дозах. При вторичном гипотиреозе быстрое нарастание дозы гормонов может привести к развитию острой надпочечниковой недостаточности, поэтому показано назначение кортикостероидов малыми дозами (5—10 мг преднизолона) в первые 2–4 недели от начала заместительной терапии. Лечение гипотиреоидной комы основывается на комбинации больших доз гормонов щитовидной железы и глюкокортикоидов. Лечение начинают с внутривенного введения тироксина по 250 мкг каждые 6 ч, что способствует насыщению организма гормонами в течение 24 ч. Затем переходят на поддерживающие дозы — 50—100 мкг в сутки. Параллельно с введением гормонов внутривенно капельно, внутримышечно или через желудочный зонд каждые 2–3 ч вводят 10–15 мг преднизолона. Дозу начинают снижать через 2–4 дня с полной последующей отменой. Обязательным условием является проведение комплекса противошоковой терапии: введение 5 %-ного раствора глюкозы, плазмозаменителей, ангиотензина, сердечных гликозидов под контролем ЭКГ, глюкокортикостероидов, кислородотерапия (при тяжелых расстройствах дыхания показан перевод больного на аппарат искусственного дыхания), медленное повышение температуры окружающей среды до 25 °C (улучшает кровообращение внутренних органов). После восстановления сознания, улучшения общего состояния, нормализации частоты сердечных сокращений и дыхания дозу препаратов снижают до необходимых значений, а глюкокортикоиды постепенно отменяют. При назначении тиреоидной терапии необходимо учитывать тот факт, что в зимнее время потребность организма в гормонах щитовидной железы возрастает, а с возрастом снижается, особенно после 60 лет. Прогноз в большинстве случаев благоприятный. При врожденном гипотиреозе прогноз зависит от своевременности диагностики заболевания и адекватности назначенного лечения. Поздняя диагностика врожденного гипотиреоза приводит к стойким необратимым изменениям в состоянии больного ребенка. Все больные должны находиться на диспансерном учете у эндокринолога и ежегодно проходить обследование для переоценки компенсации заболевания.
МИОЗИТЫ
ОпределениеМиозиты — это заболевания различного происхождения, которые характеризуются воспалительным процессом в мышцах и сопровождаются болевым синдромом (см.), мышечной слабостью и возможной атрофией пораженных мышечных групп.По фактору возникновения выделяют миозиты гнойные, инфекционные негнойные, инфекционно-аллергические (полимиозит) и неинфекционные (нейромиозит, полифибромиозит, оссифицирующий миозит). По характеру течения различают острые, подострые и хронические миозиты, каждый из которых может быть локализованным или распространенным.
Этиология Возбудителями гнойных миозитов чаще всего являются представители кокковой флоры и анаэробной инфекции. Источником инфекции при гнойных миозитах могут быть воспалительные очаги в коже, женских половых органах, придаточных пазухах носа, среднем ухе. Данная форма миозита нередко развивается при септикопиемии. Негнойные инфекционные миозиты развиваются на фоне острых или хронических заболеваний (острые респираторно-вирусные инфекции, туберкулез (см.), ревматизм (см.), бруцеллез (см.), сифилис (см.)), а вирус из группы Коксаки вызывает особую форму негнойного инфекционного миозита — борнхольмовскую болезнь. Причиной развития оссифицирующего миозита являются травмы и микротравмы или дерматомиозит с доброкачественным течением. Причинными факторами могут быть различные инфекции (часто ангина (см.)), травмы, массивная инсоляция, злоупотребление некоторыми медикаментами (например, сульфаниламидами и антибиотиками). Факторами, способствующими развитию миозита, служат эндокринные сдвиги во время беременности, в родах, климактерическом периоде.
Патогенез Для миозита характерна выраженная реакция соединительной ткани с развитием фиброза в воспаленной мышце. При оссифицирующем миозите механизмом развития является прогрессирующий склероз межмышечной соединительной ткани и появление в ней костных элементов, когда поражаются не только мышцы, но и оболочки, сухожилия и апоневрозы. В основе механизма развития лежат аллергические реакции с образованием антител к мышечной ткани.
Клиническая картина Гнойные миозиты Заболевание начинается остро, с повышения температуры тела до высоких цифр, появляются симптомы интоксикации. Больной предъявляет жалобы на локальные мышечные боли, интенсивность которых быстро нарастает. При движении и при прощупывании боли значительно усиливаются, что вызывает сокращение пораженных мышц. В области воспалительного процесса отмечается отек мягких тканей и покраснение кожи, прощупывается уплотнение. Через несколько дней от начала болезни появляется флюктуация, а при пункции получают гной.
Инфекционные негнойные миозиты Для клинической картины инфекционного негнойного миозита характерно наличие локальной боли, которая усиливается при активных движениях и прощупывании, отмечается резкая болезненность в точке прикрепления мышц. При осмотре выявляется значительное мышечное напряжение, плотные болезненные образования размером от просяного зерна (точки Корнелиуса) и уплотнения, которые меняют свою форму при надавливании (симптом гипертонуса Мюллера). В некоторых случаях в глубоких слоях мышц прощупываются округлой или продолговатой формы уплотнения, имеющие студнеобразную консистенцию. Характерны повышенная чувствительность и выраженная мышечная слабость, что является следствием болевого синдрома. Особенностью течения ревматического миозита является «летучесть» мышечных болей, которые усиливаются при перемене погоды. При инфекционных негнойных миозитах развивается умеренная гипотрофия, атрофия не характерна.
Нейромиозит При нейромиозите в связи с поражением не только мышц, но и внутримышечных нервных волокон, а в некоторых случаях — концевых отделов нервов, болевой синдром выражен значительно. При осмотре отмечаются симптомы натяжения. На электромиограмме выявляются признаки денервации.
Полифибромиозит Регистрируются спонтанные боли и болезненность в местах прикрепления мышц. Сухожилия мышц утолщены, в них развиваются сокращения, а в дальнейшем формируются контрактуры (см.). Тяжелое течение характеризуется прогрессирующим замещением соединительной тканью мышц шеи, спины и плечевого пояса, что приводит к резкому ограничению двигательной активности и формированию патологических поз. В данном случае мышцы не расслабляются во время сна и даже под общей анестезией.
Оссифицирующий миозит (болезнь Мюнхмейера) Данная форма миозита чаще всего развивается в детском и юношеском возрасте у мальчиков. Поражаются мышцы, оболочки, сухожилия, апоневрозы. Прогрессирует ограничение двигательной активности вследствие скованности мышц лица, жевательной мускулатуры, шеи, спины, верхних отделов конечностей. В мышцах при прощупывании обнаруживаются плотные образования в виде пластинок.
Полимиозит Полимиозит встречается в основном у девочек в возрасте от 5 до 15 лет или у женщин 50–60 лет. При тяжелом течении болезнь начинается остро с повышения температуры тела. Появляются локальные или распространенные мышечные боли, быстро нарастает мышечная слабость вплоть до тетраплегии. Данная симптоматика может сопровождаться поражением внутренних органов (легких, сердца, почек). Часто исход летальный. Более легкое течение болезни сопровождается умеренным болевым синдромом. Мышечная слабость выражена незначительно в верхних отделах конечностей, мышцах плечевого и тазового пояса. У некоторых больных могут быть затруднения при глотании и пониженный тонус мышц пищевода. Постепенно в мышцах появляются уплотнения, определяется напряжение.
Диагностика и дифдиагностика Диагноз ставят на основании характерной клинической симптоматики и подтверждают дополнительными методами исследования. При гнойном миозите в общем анализе крови отмечаются увеличение количества лейкоцитов и повышение СОЭ. Посев гноя позволяет выделить возбудителя данной формы миозита. Проведение электромиографии при нейромиозите подтверждает элементы денервации. С целью выявления участков окостенения при оссифицирующем миозите проводят рентгенологическое исследование. На электромиограмме при полимиозите отмечаются специфические изменения. При тяжелом течении полимиозита в крови выявляют появление уровня лейкоцитов, нейтрофилов, увеличение СОЭ. В образце мышечной ткани определяются некроз, фагоцитоз, атрофия и дегенерация мышечных волокон в сочетании с четкими воспалительными образованиями и васкулитами (см.). Дифференциальный диагноз проводят между различными формами миозита, а также со спорадическими формами прогрессирующей мышечной дистрофии, спинальной амиотрофии, мышечной формой саркоидоза, гликогенозом V типа, эндокринными миопатиями (см.) (при гиперпаратиреозе (см.), тиреотоксикозе (см.), климактерической миопатии).
Лечение Лечение гнойных миозитов в обязательном порядке включает применение антибиотиков в максимальных терапевтических дозах, анальгетиков, хирургического вмешательства и физиотерапии. При инфекционных негнойных миозитах лечение направлено на уменьшение болевого синдрома (анальгетики) и проводится на фоне обязательного специфического лечения основного заболевания. В лечении нейромиозитов используют анальгетики, нестероидные противовоспалительные средства, тепловые процедуры, диадинамические токи, проводят новокаиновые блокады. В острой стадии полифибромиозита применяют анальгетики, противовоспалительные препараты, инъекции лидазы, в тяжелых случаях — стероидные препараты. В период стихания клинической симптоматики показаны ЛФК, массаж, физиотерапевтические процедуры, бальнеолечение. Лечение оссифицирующего миозита малоэффективно. Состояние некоторых больных улучшается при проведении повторных курсов внутривенных введений ЭДТУ (кальцийдинатриевая соль этилендиаминтетрауксусной кислоты). При легких формах полимиозита применяют десенсибилизирующие средства, противовоспалительные препараты, аскорбиновую кислоту и витамины группы В. Тяжелое течение требует подключения интенсивной терапии стероидными гормонами. В данном случае предпочтение отдают преднизолону, так как другие препараты этой группы могут привести к развитию стероидной миопатии.
МИОКАРДИОДИСТРОФИЯ
ОпределениеМиокардиодистрофия — невоспалительное поражение сердечной мышцы в результате нарушений ее метаболизма под влиянием внесердечных факторов и сопровождающееся дистрофией и нарушениями функций сердечной мышцы.
Этиология Причины, приводящие к развитию миокардиодистрофии, подразделяются на кардиальные и экстракардиальные. Заболевания сердца, сопровождающиеся нарушением обменных процессов в сердечной мышце, могут способствовать развитию миокардиодистрофии (миокардиты (см.), пороки сердца (см.), ишемическая болезнь сердца (см.) и др.). К экстракардиальным факторам относятся заболевания крови, эндокринных желез, заболевания, протекающие с нарушением обмена веществ, острые и хронические инфекции, гипо- и авитаминозы (см.), острые и хронические интоксикации, профессиональные вредности, воздействие некоторых физических факторов (ионизирующая радиация, вибрация, травмы грудной клетки, перегревание), нейрогенные воздействия (стресс, симпатикотония), острое и хроническое физическое перенапряжение, нервно-мышечные заболевания (миотония (см.), миастения, прогрессирующая мышечная дистрофия).
Патогенез В основе миокардиодистрофии лежит нарушение обменных процессов в клетках миокарда, что приводит к изменению их структурных компонентов. Особенностью патологического процесса при миокардиодистрофии является неоднородность поражения клеточных структур в пределах одной и той же клетки. Дистрофический процесс носит очаговый или распространенный характер и проходит 3 стадии развития. В течение первой стадии в сердечной мышце появляются очаги дистрофических изменений и первые признаки увеличения миокарда, обусловленные гибелью части мышечной ткани. Поражение и гибель мышечных клеток восполняется увеличением массы специфических структур в неповрежденных клетках. Прогрессирование патологического процесса приводит к слиянию очагов дистрофии и распространенному поражению миокардиоцитов, формируется расширение полостей сердца, появляются начальные нарушения сократительной функции сердца (II стадия). Тяжелое течение заболевания характеризуется нарастанием степени расширения и значительным снижением сократительной функции миокарда, что клинически проявляется симптомами застойной сердечной недостаточности и мерцательной аритмией. Дистрофические изменения в I и II стадиях обратимы. Устранение причины возникновения заболевания приводит к постепенной нормализации структур мышечных волокон путем внутриклеточного восстановления. III стадия дистрофического процесса в миокарде необратима, так как развивается некроз с последующим переходом в рубец (миодистрофический кардиосклероз (см.)).
Клиническая картина Клинические проявления миокардиодистрофии многообразны — от бессимптомного течения до тяжелой стадии сердечной недостаточности. Заболевание чаще регистрируют у мужчин старше 40 лет (нередко у пациента регистрируются различные дисгормональные нарушения). Первые признаки не вызывают у больного настороженности, но, постепенно нарастая (иногда в течение нескольких лет), становятся хорошо очерченными. Больной предъявляет жалобы на боли в области сердца, которые усиливаются в стрессовых ситуациях и не всегда имеют четкую связь с физическими нагрузками. В некоторых случаях первые жалобы появляются с развитием сердечной недостаточности: одышка, сердцебиение при физической нагрузке, быстрая утомляемость, значительное снижение трудоспособности, неприятные ощущения в области сердца. В некоторых случаях характер боли напоминает стенокардию. При полном обследовании больного выявляют расширение границ сердечной тупости вследствие увеличения и расширения полостей сердца, приглушенность тонов, ритм галопа, шум на верхушке и в точкеБоткина. Нарушения ритма проявляются мерцательной аритмией (см.) в виде пароксизмальной и постоянной формы. Фонокардиографическое исследование определяет низкоамплитудный низкочастотный систолический шум. При рентгенологическом исследовании увеличение сердца в большинстве случаев обусловлено сопутствующей патологией (порок сердца (см.), ишемическая болезнь сердца (см.), гипертоническая болезнь (см.)), но встречается изолированно при тиреотоксической и алкогольной миокардиодистрофии. На электрокардиограмме определяется изменение конечной части желудочкового комплекса. Каждая стадия миокардиодистрофии проявляется определенными изменениями электрокардиографических признаков. Нарушения ритма представлены тахикардией (см.) и экстрасистолией. Миокардиодистрофия может развиваться в острой или хронической формах, что зависит от многих составляющих: фактора возникновения, возраста пациента, состояния иммунной системы организма, наличия сопутствующих заболеваний и т. д. Причиной развития острой дистрофии миокарда чаще всего являются острое физическое перенапряжение, внезапное повышение артериального давления в большом и малом круге кровообращения при гипертоническом кризе, остром нефрите, эмболии легочной артерии. Остро возникшая дистрофия миокарда может стать причиной внезапной смерти больного вследствие контрактурной дистрофии миокарда. При хроническом течении миокардиодистрофии симптомы нарастают медленно, в течение нескольких лет, поэтому нередко больной не акцентирует на них своего внимания, так как на первый план выходят проявления сопутствующего заболевания. Осложнением дистрофии миокарда является развитие сердечной недостаточности.
Диагностика и дифдиагностика Диагноз миокардиодистрофии ставят на основании данных опроса (выявление воздействия фактора возникновения), результатов постоянного наблюдения за пациентом, данных дополнительных методов обследования больного (ФКГ, ЭКГ, рентгенологическое обследование). Особое значение при постановке диагноза миокардиодистрофии играет электрокардиографическое исследование с фармакологическими пробами. Применяют соли калия с целью создания искусственной гиперкалиемии, бета-адреноблокаторы (обзидан, анаприлин), альфа-адреностимуляторы (алупент, изопропилнорадреналин), ингибиторы кальция (изоптин). Проба с калием дает значительное улучшение или полную нормализацию ЭКГ (положительный результат пробы) при миокардиодистрофии, протекающей с дефицитом калия. При миокардиодистрофиях с избыточным влиянием катехоламинов положительный результат регистрируют при пробах с бета-адреноблокаторами и ингибиторами кальция. Если миокардиодистрофия обусловлена дефицитом катехоламинов, положительный результат дает проба с бета-адреностимуляторами. Достоверные результаты о наличии дистрофических изменений в сердечной мышце можно получить с помощью эндокардиальной биопсии. Субэндомиокардиальную биопсию осуществляют под местной анестезией под электрокардиографическим контролем. Технические сложности выполнения эндокардиальной биопсии не позволяют широко использовать данный метод в диагностике заболевания. Дифференциальный диагноз миокардиодистрофии следует проводить с атеросклеротическим кардиосклерозом (см.), миокардитом (см.), ишемической болезнью сердца (см.), пороками сердца (см.), легочным сердцем, болезнями перикарда, функциональными нарушениями сердца.
Лечение и профилактика Этиологическое лечение направлено на то заболевание или тот фактор, который вызвал развитие миокардиодистрофии: хирургическое и медикаментозное лечение эндокринных заболеваний и болезней сердца, удаление хронических очагов инфекции, профилактика повторных интоксикаций, устранение воздействия профессиональных вредностей на организм пациента, лечение гипо- и авитаминозов, ликвидация вредных привычек, исключение физического и эмоционального перенапряжения. Режим больного находится в прямой зависимости от выраженности сердечной недостаточности и может варьировать от временных ограничений физических нагрузок до строгого постельного режима. Диета должна включать достаточное количество белка и витаминов, соответствовать возрастным потребностям больного. При ожирении калорийность блюд снижают, а при пищевой дистрофии и авитаминозах — повышают. Одним из важных направлений медикаментозной терапии миокардиодистрофии является коррекция электролитных нарушений. При выраженном недостатке калия показано внутривенное капельное введение его препаратов: 1 г хлорида калия или 10–20 мл панангина разводят в 500 мл физиологического раствора или 5 %-ном растворе глюкозы. При легком течении заболевания препараты калия можно назначать перорально (панангин или аспаркам по 1–2 драже 3 раза в день). Лечение проводят в течение длительного времени, включая в рацион продукты, содержащие соли калия (изюм, курага, инжир). Основным критерием для отмены препаратов является устранение электролитных нарушений и стойкая нормализация показателей ЭКГ. Повышение адренергических влияний на сердце является показанием к применению бета-адреноблокаторов (обзидан, анаприлин) в дозах от 60 до 240 мг в день в зависимости от переносимости препарата. Лечение бета-адреноблокаторами сочетают с седативными средствами или транквилизаторами. При лечении всех форм миокардиодистрофии используют препараты, стимулирующие обменные процессы в миокарде: рибоксин, инозин, инозие-F, глио-6, витамины группы В, анаболические стероиды, оротат калия. Курс лечения составляет не менее 2–3 месяцев. При наличии симптомов сердечной недостаточности показано применение сердечных гликозидов. Необходимо учитывать, что при миокардиодистрофии повышается чувствительность к токсическому действию гликозидов. При нарушениях сердечного ритма назначают противоаритмические препараты в возрастных дозировках. Все больные после выписки из стационара подлежат диспансерному наблюдению у кардиолога, который определяет комплекс мероприятий для их реабилитации. Профилактика миокардиодистрофии направлена на предупреждение и своевременное лечение тех заболеваний, которые могут привести к развитию дистрофических процессов в сердечной мышце. Важным фактором является формирование у населения потребности в здоровом образе жизни: полноценное питание, профилактика (устранение) вредных привычек, умеренные физические нагрузки (с учетом возраста, уровня спортивной подготовки, регулярности занятий), своевременное выявление и устранение хронических очагов инфекции (кариес зубов, хронический тонзиллит, синуситы, отиты и т. д.). На производстве необходимо максимально устранить воздействие на организм человека физических и химических факторов, способных стать причинным моментом при развитии миокардиодистрофии.
МИОКАРДИТ
ОпределениеМиокардит — поражение сердечной мышцы воспалительного характера, проявляющееся нарушением ее сократимости, возбудимости и проводимости.
Этиология Поражение сердечной мышцы при миокардитах может быть вызвано непосредственным воздействием инфекции, паразитарными заражениями, химическими и физическими воздействиями, аллергическими повреждениями миокарда. Ведущая роль в возникновении миокардитов принадлежит инфекционным заболеваниям. Наиболее распространенной причиной миокардитов в последнее время являются вирусы, что связано с распространением эпидемий вирусных инфекций дыхательных путей в крупных населенных пунктах, снижением естественного иммунитета, улучшением диагностики по выявлению возбудителей. Чаще всего миокардит вызывается энтеровирусами Коксаки А и В, ECHO. В 20 % случаев течение миокардита, вызванного вирусом Коксаки В, приобретает хронический характер. Миокардиты бактериального происхождения занимают 4-е место, уступая не только вирусным, но даже паразитарным поражениям сердечной мышцы в некоторых регионах. Стрептококковые миокардиты составляют не более 5 %. При этом поражение сердца обусловлено либо непосредственным воздействием бактерий на миокард, либо имеет место инфекционно-аллергический механизм. Кардиты могут быть вызваны токсоплазменной инфекцией (особенно врожденные формы). Грибковые миокардиты развиваются у больных с хроническими заболеваниями при проведении массивной антибактериальной терапии. Регистрируют аллергические миокардиты (лекарственные, сывороточные, поствакцинальные), миокардиты при коллагенозах. Нельзя упускать из виду возможную наследственную предрасположенность к данному заболеванию.
Патогенез и патанатомия Механизмы развития миокардита обусловлены прямым воздействием фактора возникновения на сердечную мышцу, а также их сочетанием с нарушениями иммунитета. При снижении иммунологической реактивности организма инфекция из первичного очага попадает в кровоток и разносится в различные органы и ткани, где формируются очаги вторичного размножения инфекционного агента. Чаще всего поражается миокард. При этом возбудитель оказывает прямое повреждающее воздействие на сердечную мышцу, являясь пусковым механизмом при развитии воспалительного процесса. В ответ на повреждение выделяются специальные вещества с последующим развитием реакции повышенной чувствительности. При этом повышается проницаемость сосудистой стенки и повреждаются стенки сосудов. Аутоаллергия при данном процессе является одним из этапов патологического процесса. При хроническом течении миокардита возбудитель не играет значительной роли, а в основе заболевания лежат нарушения иммунной системы. Все указанные механизмы приводят к системному поражению миокарда, злокачественному и рецидивирующему течению заболевания, устойчивого к традиционному лечению. Изменения при миокардите характеризуются увеличением массы и размеров сердца, толщины желудочков, наличием очагового или распространенного замещения соединительной тканью в виде рубцов в миокарде, пристеночных тромбов.
Клиническая картина По признаку возникновения миокардиты подразделяются на вирусные (грипп (см.), инфекция Коксаки, ECHO и др.), бактериальные (скарлатина (см.), дифтерия (см.), туберкулез (см.), брюшной тиф (см.)), спирохетозные (сифилис (см.), лептоспироз (см.) возвратный тиф (см.)), риккетсиозные (сыпной тиф (см.), лихорадка-ку (см.)), паразитарные (токсоплазмоз (см.), болезнь Чагаса, трихинеллез (см.)), грибковые (актиномикоз (см.), кандидоз (см.), кокцидиомикоз, аспергиллез (см.)), инфекционно-аллергические, идиопатические, лекарственные, сывороточные, нутритивные, миокардиты при системных заболеваниях соединительной ткани (системная красная волчанка (см.), склеродермия (см.)), бронхиальной астме (см.), синдроме Лайелла (см.), синдроме Гудпасчера (см.), ожоговые, трансплантационные, тиреотоксические, уремические, алкогольные. По патогенетическому признаку выделяют 3 формы миокардитов: инфекционные и инфекционно-токсические, аллергические (иммунные), токсико-аллергические. По распространенности патологического процесса миокардиты подразделяют на очаговые и распространенные. По характеру течения миокардиты могут быть острыми и подострыми, абортивными, рецидивирующими, хроническими (скрытотекущими). В зависимости от выраженности клинических проявлений выделяют малосимптомный миокардит, псевдокоронарный, декомпенсационный (острая или хроническая сердечная недостаточность), аритмический, тромбоэмболический, псевдоклапанный, смешанный. Клинико-анатомические разновидности миокардитов могут быть систематизированы следующим образом: паренхиматозный, дистрофический, воспалительно-инфильтративный, некротический деструктивный, гигантоклеточный, смешанный. Первыми проявлениями миокардита могут быть быстрая утомляемость, повышенная потливость, повышение температуры тела, боли в сердце, сердцебиение и перебои в сердце, одышка при небольшой нагрузке и даже в покое. Стойкие болевые ощущения в области сердца наблюдаются практически у всех больных. Боли постоянные, тупые, не меняют своей интенсивности при физической нагрузке, отрицательных эмоциях и после приема коронаролитиков. Нередко вышеуказанные симптомы появляются на фоне острой респираторной вирусной инфекции. Через некоторое время у больного периодически развиваются приступы синюшности, усиливается одышка, в легких выслушиваются хрипы, отмечается учащенное сердцебиение. Мочевыделение снижается, выявляется отечность тканей, увеличиваются размеры печени (признаки правожелудочковой недостаточности). Границы сердца умеренно расширены. У больных с поражением проводящей системы тоны сердца чаще обычной звучности. Нарушение ритмичной деятельности при прослушивании определяется как учащенное сердцебиение, тахиаритмия, брадикардия и брадиаритмия. На вовлечение в процесс проводящей системы сердца указывают упорные приступы пароксизмальной тахикардии (см.). Кардиосклероз атриовентрикулярного соединения приводит к постоянному функционированию до того скрытого пучка Кента, что на ЭКГ проявляется приступами пароксизмальной тахикардии. Тахиаритмии при неревматических кардитах могут быть стойкими или преходящими, являясь результатом поражения миокарда в сочетании с энцефалогенными влияниями. При брадикардиях частота сердечных сокращений колеблется от 30 до 60 в минуту. При пульсе от 30 до 40 у больного могут возникать приступы Морганьи— Адамса — Стокса. Сердечная недостаточность выражена почти у всех больных неревматическим миокардитом, но при поражении проводящей системы сердца ее проявления минимальны. На ЭКГ отмечаются характерные изменения. На рентгенограмме грудной клетки имеют место усиление легочного рисунка при переполнении венозного русла (проявление левожелудочковой недостаточности), умеренное увеличение размеров сердца, конфигурация которого при неблагоприятном течении в течение 1–1,5 месяца становится шаровидной. В крови отмечаются изменения воспалительного характера: увеличение количества лейкоцитов, повышение СОЭ. Симптомы миокардита могут быть выражены в различной степени, что вызывает необходимость выделять заболевания легкой, средней тяжести и тяжелой формы. Легкое течение (слабо выраженный миокардит): общее состояние страдает незначительно, но больные предъявляют большое количество жалоб (боли в сердце, учащенное сердцебиение, повышенная температура тела). Течение средней тяжести (умеренно выраженный миокардит): общее самочувствие заметно страдает, выражена одышка, наблюдается резкая слабость. Симптомы поражения сердца выходят на первый план и сопровождаются увеличением размеров сердца, нарушением ритма и проводимости. Тяжелое течение (ярко выраженный миокардит): общее состояние больного тяжелое, определяется полная сердечная недостаточность. При миокардитах возможно острое, подострое и хроническое течение. При остром течении в клинической картине заболевания на первый план выходят кардиальные симптомы. Обратное развитие клинических и инструментальных данных происходит в течение 6—18 месяцев от начала болезни. В 50–60 % случаев регистрируется полное выздоровление. Подострое течение миокардита характеризуется постепенным нарастанием сердечной недостаточности в течение 4–6 месяцев. В острой фазе заболевания кардиальные симптомы выражены ярко, но постепенно стихают. Отмечается длительная сердечная недостаточность (несмотря на лечение) и другие признаки. У детей формируется сердечный горб. На ЭКГ изменения характеризуются постоянным ритмом, отклонением оси сердца влево, нарушением атриовентрикулярной и внутрижелудочковой проводимости, перегрузкой левого желудочка и обоих предсердий (больше левого). Рентгенологически определяется умеренное усиление легочного рисунка по венозному руслу, изменение конфигурации сердечной тени (трапециевидная или с вытянутым левым желудочком). Хронические миокардиты чаще регистрируются у взрослых и детей старшего возраста. Нередко имеет место наличие хронических воспалительных заболеваний других органов (почек, легких, нервной системы). Хронический миокардит может быть первично хроническим или развиться из острого и подострого миокардита. В основе заболевания лежит значительное изменение миокарда с развитием кардиосклероза, увеличением миокарда и снижением сократительной функции сердечной мышцы. Течение хронического миокардита нередко характеризуется относительным преобладанием внесердечных проявлений: рецидивирующие пневмонии (см.), увеличение печени, приступы потери сознания, быстрая утомляемость, снижение работоспособности, а у детей наблюдается отставание в физическом развитии. Нередко провоцирующими факторами, усиливающими кардиальные симптомы и приводящими к ухудшению состояния больного, являются простудные заболевания.
Миокардит идиопатический Идиопатический миокардит Абрамова— Фидлера в настоящее время рассматривают как многопричинное заболевание из группы тяжелых малообратимых форм некоронарогенных болезней миокарда. Выделяют 6 клинических вариантов заболевания: декомпенсированный, аритмический, инфарктоподобный, тромбоэмболический, псевдоклапанный, смешанный. Возраст больных самый различный — от первых месяцев жизни до 70 лет и старше. Клиническая картина характеризуется внезапным или постепенным развитием прогрессирующей сердечной недостаточности по тотальному или правожелудочковому типу. Больные предъявляют жалобы на одышку, иногда приступообразного характера в ночное время, кашель (возможно кровохарканье), слабость, сердцебиение, загрудинные боли различной интенсивности. Температура тела нормальная. Сердце увеличено в размерах. Тоны приглушены, часто фиксируется III тон при наполнении расширенного желудочка, отмечается предсердный ритм галопа как ранний признак, появляющийся до развития недостаточности кровообращения. В некоторых случаях выслушивается шум трения перикарда, а в тяжелых случаях — эмбриокардия и альтернирующий пульс. Эмболии могут быть первым проявлением заболевания. В финале болезни может развиться острая почечная недостаточность.
Миокардит тиреотоксический Характерными жалобами больных тиреотоксическим миокардитом являются сердцебиения, одышка, постоянное учащенное сердцебиение (до 90—140 ударов в минуту). Боли в сердце при данном миокардите регистрируются значительно реже. Увеличение размеров сердца отмечается при тяжелом тиреотоксикозе и обусловлено его расширением: сердце приобретает шаровидную форму, выбухает дуга легочной артерии, сглаживается сердечная талия. При прослушивании при тиреотоксическом миокардите выслушиваются усиленные или нормальной звучности тоны сердца, шум максимально выражен по левому краю грудины. На ЭКГ регистрируются неспецифические изменения, степень выраженности которых не соответствует тяжести тиреотоксикоза. Характерным является повышение функциональной активности миокарда. Воздействие гормонов щитовидной железы обусловливает ускорение кровотока, увеличение объема циркулирующей крови и минутного объема кровообращения вследствие учащенного сердцебиения или увеличения ударного объема и компенсаторное снижение периферического сопротивления в результате расширения сосудов. Нарушения ритма и проводимости представлены синусовой тахикардией. Степень выраженности тахикардии зависит от тяжести тиреотоксикоза и неадекватно усиливается в ответ на физическую нагрузку. Характерным признаком является отсутствие или слабая реакция частоты сердечных сокращений на действие дигиталисных препаратов (препаратов наперстянки). При тиреотоксическом миокардите может наблюдаться синдром слабости синусового узла, что ведет к пароксизмальной тахикардии и пароксизмальной мерцательной аритмии. Вторым по частоте нарушением ритма является мерцание предсердий. Застойная недостаточность кровообращения у больных тиреотоксическим миокардитом встречается редко и отмечается при отсутствии адекватного лечения.
Миокардит уремический Особенности клинического течения и тяжесть уремического миокардита (при хронической почечной недостаточности) обусловлены стойкой гипертонией (см.), увеличением левого желудочка, сердечной недостаточностью, прогрессирующей анемией, нарушениями электролитного баланса и кислотно-щелочного равновесия. Больные предъявляют жалобы на выраженную слабость, давящие боли в области сердца, которые усиливаются в горизонтальном положении. Одышка в начале заболевания регистрируется при физической нагрузке, но быстро нарастает и возникает в покое, проявляясь приступами удушья. Состояние больных обычно тяжелое, отмечается заторможенность. Кожные покровы бледные с желтушным или землистым оттенком, характерным симптомом является одутловатость лица. При объективном обследовании пациента выявляют выраженную тахикардию. Пульс малого наполнения и напряжения. Размеры сердца нередко значительно увеличены — левая граница может достигать подмышечной линии. Верхушечный толчок разлитой, усилен. Тоны сердца приглушены, в некоторых случаях выслушивается шум трения перикарда, определяемый прощупыванием и заглушающий при прослушивании тоны сердца. Симптомы сердечной недостаточности при данном миокардите могут преобладать над проявлениями почечной недостаточности. Изменения на ЭКГ характеризуются определенными изменениями. При уремическом миокардите они отличаются выраженной чувствительностью при применении дигиталисных препаратов.
Миокардит дифтерийный Развитие воспалительного поражения сердечной мышцы при дифтерии (см.) обусловлено циркуляцией в крови токсина. Миокардиты могут быть ранними и поздними. Поздние миокардиты, возникающие на 2—3-й неделе от начала болезни, протекают более благоприятно. Воздействие дифтерийного токсина на миокард приводит к изменениям сократительного миокарда и нарушениям проводящей системы сердца. Нарушение проводимости является самым частым проявлением дифтерийного миокардита и сопровождается синоаурикулярной, внутрипредсердной, предсердножелудочковой и внутрижелудочковой блокадами. При данном заболевании симптомы миокардита нередко сочетаются с признаками тяжелой сосудистой недостаточности, особенно при ранних осложнениях дифтерии.
Миокардит при брюшном тифе Воспаление сердечной мышцы при брюшном тифе нередко сочетается с миокардиодистрофией и наблюдается как результат неадекватной терапии на 2—4-й неделе от начала болезни. Изменения миокарда характеризуются слабостью сократительной функции и нарушением тонической функции сердечной мышцы. К концу 3-й недели от начала заболевания или спустя 1–2 недели после перенесенного брюшного тифа у больного выявляют выраженное учащенное сердцебиение (100–140 ударов в минуту), глухость сердечных тонов, расщепление I тона, расширение границ сердца, различные нарушения ритма. Экстрасистолия при брюшно-тифозном миокардите регистрируется редко, почти не наблюдается мерцательная аритмия и полная предсердножелудочковая блокада.
Миокардит сифилитический Сифилитические миокардиты часто сочетаются с сифилитическим аортитом. Хронический сифилитический миокардит проявляется гуммозной и фиброзной формами. При распространенном сифилитическом миокардите с поражением синусового узла и проводящей системы желудочков отмечаются сочетанные нарушения ритма и проводимости. При сифилитическом поражении восходящего отдела дуги аорты в клинике появляется ангинозный синдром. Для данной формы миокардита характерно хроническое течение. У больных сифилитическим миокардитом во II и III стадиях заболевания нередко развивается сердечная недостаточность по правожелудочковому типу, что является прогностически неблагоприятным признаком.
Миокардит туберкулезный Течение туберкулезного миокардита изначально принимает затяжное или хроническое течение. Воздействие на миокард туберкулезного токсина в начале заболевания проявляется учащенным сердцебиением. Позднее больные предъявляют жалобы на сердцебиения, боли в сердце, чувство распирания и давления в груди, выпадение сердечных сокращений. Границы сердца увеличены в поперечнике, с преимущественным поражением правых отделов. Этому может способствовать гипертония в малом круге кровообращения. Верхушечный толчок ослаблен и не соответствует наполнению пульса, I тон приглушен, а II тон акцентирован. При туберкулезном миокардите могут наблюдаться урежение частоты сердечных сокращений (обычно на более поздних стадиях болезни) и понижение артериального давления, что обусловлено течением туберкулезного процесса. Нарушения ритма наблюдаются в виде экстрасистолической аритмии, пароксизмальной тахикардии. Нарушения проводимости регистрируются во всех отделах интрамуральной нервной системы сердца. Характерными симптомами являются снижение показателей сократительной способности миокарда и проявления сердечной недостаточности.
Миокардит риккетсиозный Течение риккетсиозных миокардитов может быть острым и затяжным и сопровождается распространенным поражением сердечной мышцы. Уже в начале основного заболевания тоны сердца становятся глухими, регистрируются нарушения ритма по типу экстрасистолии и мерцательной аритмии. При хроническом риккетсиозном миокардите поражение миокарда происходит по типу кардиосклероза (см.) в сочетании с миокардиодистрофией (см.). Возможны тромбоэмболические осложнения и формирование аневризмы (см.) сердца в области верхушки. Прогрессирование хронического риккетсиозного миокардита нередко заканчивается летальным исходом на фоне полной сердечной недостаточности.
Миокардит ревматический Ревматическое поражение сердца в большинстве случаев характеризуется вовлечением в процесс всех оболочек сердца. При изолированном поражении миокарда больные жалуются на боли в сердце. Характерным признаком является расширение преимущественно левой границы сердца. Прослушивание также выявляет характерные изменения. На ЭКГ регистрируется нарушение сократительной функции миокарда, процессов реполяризации, внутрижелудочковой проводимости, синусовая аритмия. Подобное поражение сердца наблюдается при подостром и первично-затяжном течении ревматизма.
Диагностика и дифдиагностика Диагностика миокардита основывается на совокупности целого ряда данных: наличие предшествующей инфекции (доказывается клиническими и лабораторными исследованиями), результаты обследования пациента (ослабление тонов сердца, расширение его границ, учащенное сердцебиение, симптомы застойной сердечной недостаточности), данные дополнительных методов обследования больного (электрокардиографическое, рентгенологическое, эхокардиографическое исследования, результаты лабораторного обследования, методы исследования центрального кровообращения, радионуклидные методы, эндомиокардиальная биопсия). Электрокардиографическое исследование при подозрении на миокардит является обязательным. Выявление неспецифических изменений конечной части желудочкового комплекса в сочетании с нарушениями ритма и проводимости дает возможность заподозрить миокардит. Медикаментозные пробы при миокардите всегда отрицательны. При хроническом течении изменения на ЭКГ стойкие и обусловлены развитием миокардитического кардиосклероза (нарушения атриовентрикулярной и внутрижелудочковой проводимости и нарушения ритма). Рентгенологическое исследование больных с миокардитом позволяет уточнить степень увеличения сердца в целом и отдельных его камер. При тяжелых миокардитах увеличены все отделы сердца, отмечаются признаки нарушения кровообращения в малом круге. Легкое течение миокардита сопровождается увеличением только левого желудочка. Рентгенологический метод позволяет исключить в качестве причины расширения границ сердца экссудативный перикардит. Эхокардиографическое исследование помогает исключить другие причины увеличения сердца, точно определить выраженность расширения различных камер сердца. Результаты лабораторных методов исследования не являются доказательными для диагностики миокардита, но позволяют с большой точностью установить наличие перенесенной инфекции. В некоторых случаях для подтверждения диагноза прибегают к исследованию центрального кровообращения, с помощью которого определяют степень нарушения насосной функции сердца, а изменения показателей кровообращения позволяют оценить эффективность проводимого лечения. Радионуклидные методы доказывают наличие очагов кардиосклероза у больных с тяжелым течением миокардита. Наконец, метод эндокардиальной биопсии позволяет с высокой точностью определить качество и степень поражения миокарда. Миокардиты следует отличать друг от друга, от поражения эндокарда с формированием клапанного порока, миокардиодистрофии (см.), ишемической болезни сердца (см.), легочного сердца, кардиомиопатии (см.), фиброэластоза эндокарда, алкогольного поражения миокарда, пороков сердца (см.), болезней перикарда, функциональных нарушений сердечно-сосудистой системы.
Лечение Лечение миокардита включает стационарный и поликлинический (санаторный) этапы. Существенную роль в лечении играет соблюдение больным постельного режима параллельно с медикаментозной терапией. При легкой форме миокардита постельного режима следует придерживаться в течение 3–4 недель до нормализации или стабилизации ЭКГ. Течение средней тяжести предопределяет строгий постельный режим не менее 2 недель, а затем в течение 4 недель — расширенный. Тяжелое течение является показанием для перевода больного в палату интенсивной терапии, где соблюдается строгий постельный режим до периода компенсации нарушений кровообращения, а впоследствии назначается расширенный режим на срок не менее 4 недель. Питание больного должно быть полноценным, с достаточным содержанием белков и витаминов, ограничением поваренной соли, достаточным количеством продуктов, содержащих соли калия (курага, изюм, инжир, печеный картофель). Миокардиты средней тяжести и тяжелые требуют интенсивной медикаментозной терапии, которая направлена на ликвидацию воспалительных, аутоиммунных, аллергических процессов, уменьшение повреждающего действия антимиокардиальных антител, сокращение продукции биологически активных веществ, восстановление и поддержание кровообращения, воздействие на обмен веществ в миокарде. При подтверждении связи заболевания с инфекционным агентом показано назначение антибактериальных и противовирусных препаратов. Важным компонентом лечения является применение противовоспалительных препаратов, эффективность воздействия которых определяется уменьшением клинических проявлений миокардита, нормализацией показателей ЭКГ, снижением тестов лабораторной активности. В большинстве случаев хорошие результаты дает применение препаратов аминохинолинового ряда — их применяют длительно (в течение 6–9 месяцев от начала заболевания). Делагил (хлорохин, резохин, плаквенил) назначают в суточной дозе 0,25—0,5 г. Прием препаратов данной группы в большей дозировке может привести к развитию изменений глазного дна, отложению пигмента в роговицу, поэтому длительное лечение препаратами хинолинового ряда должно проводиться под контролем офтальмолога. Возможно применение ацетилсалициловой кислоты в дозе 3–4 г в сутки в течение 4–5 недель до уменьшения клинических и лабораторных проявлений воспаления. Хорошее противовоспалительное действие при миокардитах оказывает индометацин в дозе 75— 100 мг в сутки в течение 5–6 недель в сочетании с делагилом. По мере улучшения клинических и лабораторных показателей дозу постепенно снижают с полной последующей отменой. Индометацин не показан при язвенной болезни различной локализации, при беременности и кормлении, больным с психическими расстройствами. Препараты пиразолонового ряда назначают в некоторых случаях при обострении миокардита, но они обладают значительно меньшей эффективностью, чем другие противовоспалительные препараты. Положительным моментом является улучшение самочувствия больного, в основном за счет анальгезирующего эффекта препаратов пиразолоновой группы. При лечении тяжелых миокардитов или миокардитов средней тяжести показано применение кортикостероидных препаратов. Глюкокортикоиды показаны больным с тяжелым распространенным поражением миокарда, сопровождающимся увеличением сердца и застойной декомпенсацией кровообращения. Их действие наиболее ярко выражено при аллергическом поражении миокарда. Кортикостероиды способствуют снижению показателей аутоаллергии, уменьшению клинико-электрокардиографических признаков заболевания. Расчет дозы по преднизолону составляет 30–40 мг в сутки. Препарат назначают на 1,5–2 месяца с постепенным снижением дозы вплоть до полной отмены и переходом на прием делагила. Применение гепарина повышает устойчивость тканей к кислородной недостаточности, тормозит перекисное окисление жиров, уменьшает проницаемость сосудистой стенки. Гепарин назначают при возможности контроля свертываемости крови. Гепарин вводят подкожно, в первые 7—10 дней в дозе 10 тыс. ЕД 4 раза в день, затем по 5 тыс. ЕД 4 раза в день (7—10 дней), а в дальнейшем по 5 тыс. ЕД 2 раза в день (10–14 дней). С целью повышения иммунологической реактивности организма (малосимптомное течение миокардита, частые простудные заболевания, наличие очагов хронической инфекции) применяют левамизол в дозе 150 мг в день в течение 2 дней, затем следует перерыв на 5–7 дней. Далее прием левамизола повторяют. Отрицательному воздействию на организм пациента биологически активных веществ препятствуют препараты с антибрадикининовой направленностью: ангинин (пармидин, продектин), контрикал (трасилол). Курс лечения составляет 1,5–2 месяца. Учитывая наличие дистрофических процессов в миокарде, в некоторых случаях показаны анаболические стероиды, кокарбоксилаза, рибоксин, оротат калия. Метаболические и анаболические средства применяют в комплексе с вышеперечисленными группами лекарственных препаратов. Наличие симптомов недостаточности кровообращения является показанием для проведения постепенной дигитализации малыми дозами (терапевтический эффект проявляется не ранее 2 недель от начала терапии). При тахикардии следует назначать следующие препараты: дигоксин, дигитоксин, кордигит. У больных с нормо- и брадикардией применяют препараты: коргликон, адонис, изоланид. Сердечные гликозиды при миокардитах следует применять с большой осторожностью на фоне проведения противовоспалительной терапии в сочетании с препаратами калия и верошпироном. Нитроглицерин в дозе 5—10 мг принимают под язык. Интервалы между приемом данного препарата составляют 15–20 мин. Нитросорбид назначают в дозе 20 мг каждые 4–5 ч. Для лечения тяжелой сердечной недостаточности используют нитропруссид натрия: 50 мг препарата растворяют в 500 мл 0,5 %-ного раствора глюкозы и вводят медленно в течение 10–12 ч. Нитропруссид натрия позволяет устранить приступ тяжелой сердечной недостаточности в течение первых часов от начала введения. Больным, страдающим идиопатическим миокардитом, показано применение методов интенсивной терапии: катетеризация правых отделов сердца, капельное введение нитропруссида, фентоламина, допамина. При тяжелом течении используют искусственный водитель ритма.
Профилактика Больные с миокардитами после выписки из стационара должны находиться под наблюдением участкового врача и кардиоревматолога длительное время. Критерием снятия с диспансерного учета является стойкая нормализация показателей клинических и инструментальных исследований. Если поражение миокарда носит хронический характер, то необходимо постоянное наблюдение за пациентом с регулярным контролем ЭКГ 1 раз в 6 месяцев, рентгенографией грудной клетки 1 раз в 6—12 месяцев (при подозрении на рецидив — чаще). Профилактика миокардитов включает прежде всего предупреждение частых простудных заболеваний, повышение иммунологической реактивности организма путем проведения закаливающих процедур и удаление очагов хронической инфекции. С целью профилактики рецидивов сердечной недостаточности ограничивают двигательную активность, рекомендуют занятия лечебной физкультурой. Родственникам объясняют необходимость создания в семье доброжелательного психологического климата, так как стресс может стать причиной внезапной смерти больного (показана терапия седативными препаратами). В периоды подъема заболеваемости острыми респираторными инфекциями рекомендуется использование противогриппозных вакцин, противовирусных препаратов (ремантадин, интерферон).
МИОТОНИЯ
ОпределениеГруппа заболеваний характеризуется развитием миотонического синдрома, при котором отмечается патологическое состояние мышц, выражающееся в резком затруднении их расслабления после сильного сокращения.Различают врожденную миотонию (болезнь Томпсона), атрофическую миотрофию (болезнь Россолимо-Баттена-Штейнерта-Куршманна), холодовую парамиотонию (болезнь Эйленбурга), парадоксальную миотонию и синдром Шварца-Джампела. В зависимости от фактора, вызывающего миотонический феномен, заболевание подразделяют на миотонию действия, перкуссионную миотонию и электромиографическую миотонию. Миотония действия: если больного попросить сжать кулак и быстро его разжать, то пациенту потребуется некоторое время на выполнение этого действия. Перкуссионная миотония проявляется мышечным сокращением при энергичном ударе молоточком. Электромиографическая миотония проявляется тем, что на электромиограмме появляются высокочастотные разряды, которые вначале увеличиваются по частоте, а затем уменьшаются. Феномен миотонии в данном случае обусловлен усилением нестабильности мембраны мышечного волокна.
Этиология Миотонии являются наследственными заболеваниями с аутосомно-доминантным или аутосомно-рецессивным типом передачи. Часто наблюдаются при кровнородственном браке.
Патогенез и патоморфология Патологическое нарушение расслабления мышц при миотонии обусловлено нарушением проницаемости клеточных мембран, изменением ионного и медиаторного обмена. При атрофической миотонии клиническая симптоматика объясняется нарушением регуляции гипоталамо-гипофизарной системы или плейотропным действием мутагенного гена. При патоморфологическом исследовании находят изменения в мышечной ткани: при миотонии Томпсона выявляют атрофию мышечных волокон и перемещение их ядер к центру, при дистрофической миотонии — атрофию мышечных волокон и разрастание соединительной ткани, ядра клеток увеличиваются в количестве и располагаются под сарколеммой и в толще мышечного волокна, образуя длинные цепочки. Гистохимическое исследование позволяет определить уменьшение в размере и увеличение количества волокон I типа (волокна II типа не изменяются или несколько гипертрофированы). Исследование мышечной ткани под электронным микроскопом позволяет выявить гипертрофию саркотубулярной системы, увеличение размеров митохондрий, деструкцию миофибриллярного аппарата, разрушение митохондрий, увеличение количества лизосом. При атрофической миотонии имеет место изменение некоторых биохимических показателей: увеличен катаболизм иммунных глобулинов класса G, установлена группа сцепления с секретором.
Клиническая картина Врожденная миотония (болезнь Томпсона) Врожденная миотония, или болезнь Томпсона, миотония Томпсона, наследуется по аутосомно-доминантному типу, но возможен аутосомно-рецессивный вариант заболевания, который характеризуется более ранним началом и более тяжелым течением болезни. Впервые заболевание проявляется в детском возрасте в 10–12 лет, реже — с рождения или в более позднем возрасте. Клиническая картина в детском возрасте проявляется изменением голоса, особенно при плаче, ребенок начинает задыхаться, а после плача лицо медленно расслабляется. С возрастом проявляется типичный миотонический феномен. Больные предъявляют жалобы на локальное повышение мышечного тонуса. При этом мышечное сокращение нормальное, но расслабление значительно затруднено из-за характерной мышечной контрактуры или спазма. Подобное затруднение движения более всего выражено в жевательной мускулатуре, в кистях и пальцах, а при тяжелом течении заболевания — во всех группах мышц. Если больной повторяет одни и те же движения несколько раз подряд, то расслабление становится все более свободным и даже нормальным. После отдыха все проявления миотонического феномена повторяются вновь. Пассивные движения не приводят к развитию миотонической контрактуры («произвольная миотония»). При объективном обследовании пациента отмечаются признаки повышенной механической возбудимости мышц: при ударе молоточком в мышце появляется «ямка» или «валик», которые могут сохраняться в течение 1–1,5 мин. Патогномоничным симптомом является «ямка» в языке при ударе перкуссионным молоточком. Характерным является симптом «механической миотонии», когда при ударе по возвышению большого пальца тот приводится и остается в таком положении некоторое время. Постепенно у больных миотонией Томпсона формируется мышечная гипертрофия, что клинически проявляется атлетическим телосложением. Отличительным признаком является то, что внешний вид пациента не соответствует действительной силе мышц, которая в большинстве случаев снижена. Сухожильные рефлексы нормальные или отсутствуют. Ухудшение клинических проявлений миотонии регистрируется на холоде, при больших физических нагрузках, а у женщин — во время беременности. При тяжелом течении заболевания у больного может развиться генерализованный миотонический спазм при попытке удержать равновесие, при толчке или во время прыжка. В подобном случае пациент падает и остается лежать некоторое время. Миотония Томпсона протекает мягко, в редких случаях возможнопрогрессирование миотонического феномена. У некоторых больных с возрастом наблюдается сглаживание клинической симптоматики болезни.
Атрофическая миотония Атрофическая миотония, или болезнь Россолимо-Баттена-Штейнерта-Куршманна, — наследуется по аутосомно-доминантному типу и относится к группе мультисистемных. В литературе встречаются описания данного заболевания под названием «дистрофическая миотония» или «миотоническая дистрофия». Первые клинические проявления заболевания обычно регистрируются в возрасте 15–35 лет. Мужчины и женщины болеют с одинаковой частотой. В начале болезни на первый план выступает миотонический синдром, проявления которого постепенно угасают по мере развития парезов и атрофий. В дальнейшем у пациента нарастают симптомы миопатии. Мышечные атрофии сопровождаются снижением мышечной силы. Для данного заболевания характерно своеобразное распространение атрофий: поражаются мышцы лица, шеи, жевательная мускулатура, а в дальнейшем — мышцы верхних и нижних конечностей. Слабость круговой мышцы глаза клинически проявляется птозом. Атрофия жевательной мускулатуры приводит к западению щек и височных ямок. Атрофические поражения мышц шеи, особенно грудино-ключично-сосцевидной, на начальных стадиях способствуют запрокидыванию головы назад, а затем — вперед (симптом лебединой шеи). При осмотре пациента отмечается характерное поражение мышц дистального отдела верхних конечностей и перонеальной группы мышц нижних конечностей с формированием свисающей стопы. Сухожильные рефлексы снижены. Эндокринные и трофические расстройства проявляются нарушением репродуктивной функции, ранними климактерическими симптомами вследствие снижения активности половых желез, надпочечников, щитовидной железы и гипофиза. При этом пациенты предъявляют жалобы на выпадение волос и зубов, истончение кожи и значительное снижение веса. При объективном обследовании больного имеют место брадикардия, низкое артериальное давление, аритмия, пролапс митрального клапана, психические расстройства вплоть до олигофрении. Отмечается низкий уровень 17-кетостероидов, 17-оксикетостероидов. Скорость проведения импульса по нервным волокнам снижена. При близкородственных браках первые проявления заболевания могут регистрироваться уже в период новорожденности: ребенок плохо берет грудь, слабо сосет, замедлено физическое и психомоторное развитие. В течение нескольких лет состояние остается стабильным, а затем симптомы быстро прогрессируют. У близких (кровных) родственников пациента нередко имеют место единичные проявления миотонии, такие как гипогонадизм, гипотиреоз, бесплодие, сахарный диабет и др.
Холодовая парамиотония Холодовая парамиотония, или врожденная парамиотония Эйленбурга, передается по аутосомно-доминантному типу. Регистрируется очень редко. Врожденная парамиотония Эйленбурга обычно проявляется только на холоде. При этом у больного развивается миотоническое затруднение расслабления мышц. Охлаждение может быть локальным и общим. При локальном охлаждении, например, когда пациент ест мороженое, появляется мышечный спазм в виде миотонической контрактуры в глотке и языке, который можно ликвидировать согреванием. При общем охлаждении отмечаются типичные проявления миотонического феномена, а у некоторых пациентов развивается и значительная мышечная слабость, которая получила название «холодовой паралич». Вне охлаждения у больных выявляют только повышенную механическую возбудимость мышц. Для данного заболевания характерен семейный полиморфизм: у одних членов семьи заболевание проявляется только миотонией, а у других — только мышечной слабостью. С возрастом имеется тенденция к улучшению состояния больного.
Парадоксальная миотония Тип наследования данной формы болезни окончательно не установлен. Регистрируется крайне редко. Характерным клиническим симптомом заболевания является типичный миотонический спазм, который отличается от других форм миотонии тем, что при повторных движениях мышечный спазм не только не уменьшается, но все более нарастает и движения становятся невозможными.
Синдром Шварца-Джампела В литературе встречается описание данного синдрома под названиями хондродистрофическая миотония и остеохондромышечная дистрофия. Заболевание передается по аутосомно-рецессивному типу и регистрируется в семьях с близкородственными браками. Типичным проявлением синдрома Шварца-Джампела является миотонический феномен с характерным затруднением расслабления и повышенной механической возбудимостью мышц. Первые симптомы заболевания проявляются в раннем детстве, когда ребенок начинает отставать от сверстников в росте. Обращают на себя внимание короткая шея, сколиоз, деформация грудной клетки. При объективном обследовании отмечается частое болезненное сокращение различных мышечных групп. Интеллект обычно не страдает.
Диагностика При постановке диагноза миотонии учитывают не только характерные клинические проявления заболевания, но и результаты биопсии мышечной ткани и электромиографического исследования. При проведении биохимического исследования определяется повышение уровня мышечных ферментов. Особое внимание уделяют антенатальной диагностике миотонии с помощью метода амниоцентеза.
Лечение В большинстве случаев лечение миотонии не дает явного клинического эффекта. При миотонии назначают новокаинамид по 250–500 мг 3–4 раза в день, хинин по 5—10 мг/кг в сутки, дифенин по 100–200 мг 3–4 раза в день прерывистым курсом. При тяжелом течении проводят короткий курс лечения глюкокортикоидами, применяют антагонисты кальция, диуретики (диакарб). При атрофической миотонии наряду с указанной терапией показаны анаболические гормоны в сочетании с дробным переливанием крови, плазмы, витамин Е, комплекс витаминов группы В, небольшие дозы АТФ.
МОНОНУКЛЕОЗ ИНФЕКЦИОННЫЙ
ОпределениеМононуклеоз инфекционный (железистая лихорадка, болезнь Филатова) — острое инфекционное заболевание, возбудителем которого является вирус Эпштейна-Барра, характеризующееся лихорадкой, ангиной (см.), увеличением лимфатических узлов, печени, селезенки и появлением атипичных мононуклеаров в крови.
Этиология Вирус Эпштейна-Барра относится к семейству герпесвирусов, содержит ДНК, имеет сферическую форму и диаметр 180 нм. Данный вирус является возбудителем не только инфекционного мононуклеоза, но и лимфомы Беркитта и назофарингеальной карциномы. В настоящее время вирусу Эпштейна-Барра наряду с другими представителями семейства герпесвирусов отводится важная роль в формировании опухолевых клеток в организме человека. Вирус Эпштейна-Барра хорошо размножается в культуре клеток опухоли Беркитта, крови больных инфекционным мононуклеозом, лейкемических клетках и в культуре клеток мозга здорового человека. Вирус содержит специфические антигены. Чувствителен к воздействию эфира.
Эпидемиология Инфекционный мононуклеоз распространен во всех странах мира. Источником являются больные в остром периоде, со стертыми формами болезни и вирусовыделители (перенесшие данное заболевание в 90 % случаев периодически выделяют вирус со слюной). Основной путь передачи инфекции — воздушно-капельный. Контактно-бытовой путь осуществляется через предметы обихода и игрушки, загрязненные слюной больного. Заражение возможно при переливании донорской крови, половым путем, через плаценту от матери к плоду. Распространению инфекции способствуют скученность и грубые нарушения гигиенических норм — пользование общей посудой, бельем и т. д. Подъем заболеваемости регистрируется с интервалом 6–7 лет. Характерна весенняя сезонность. Болеют в основном лица мужского пола, преимущественно в дошкольном возрасте при посещении организованных коллективов. Попадание вируса Эпштейна-Барра в детский организм чаще всего не сопровождается какими-либо клиническими симптомами (бессимптомная инфекция). У детей первых 3 лет жизни первичное попадание вируса в организм проявляется нередко как острая респираторно-вирусная инфекция. Если вирус попадает впервые в организм детей более старшего возраста, то в 45 % случаев возникает типичная клиническая картина инфекционного мононуклеоза. После перенесенного заболевания формируется стойкий иммунитет.
Патогенез В основе развития инфекционного мононуклеоза лежит разрастание лимфоидной ткани, в результате чего увеличиваются органы иммунной системы и количество лимфоцитов. Входными воротами для вируса Эпштейна-Барра являются лимфоидные образования ротоглотки, где происходит первичное размножение и накопление возбудителя. Затем вирус вместе с лимфо- и кровотоком попадает в различные органы и ткани, поражая прежде всего периферические лимфатические узлы, печень и селезенку. В этих органах развивается воспалительный процесс с кровенаполнением и отеком слизистой оболочки, переразвитием всех лимфоидных образований. Увеличиваются небные и носоглоточные миндалины, а также все лимфоидные скопления на задней стенке глотки. Характерно системное поражение лимфатических узлов, печени и селезенки.
Инфекционный мононуклеоз. Увеличенные лимфоузлы
В период выздоровления образовавшиеся иммунные комплексы не удаляются из организма, а циркулируют в кровяном русле, что поддерживает нахождение возбудителя в организме, способствует возникновению аутоантител к различным тканям и органам. В механизме развития образования налетов на миндалинах при инфекционном мононуклеозе, кроме действия вируса, определенное значение имеет бактериальная или грибковая инфекция. При тяжелых формах патологический процесс может развиваться не только в лимфоидных тканях, но возможно и поражение центральной нервной системы, мышцы сердца, поджелудочной железы и др.
Патанатомия В лимфатических узлах развивается большое количество лимфоидных клеток. Тяжелое течение болезни характеризуется очаговыми или распространенными омертвениями и явлениями клеточной дистрофии в лимфатических узлах, небных и носоглоточной миндалинах и других образованиях лимфоидного глоточного кольца. В селезенке отмечается повышенное развитие фолликулов, в печени — отек ткани по ходу печеночных трактов, образование желчных тромбов, отложение желчного пигмента в клетках печени, явления отека, дистрофии и рассеянного некроза групп клеток печени. Лимфоидно-клеточные скопления выявляются в легких, миокарде, центральной нервной системе и т. д.
Клиническая картина Типичная форма Заболевание начинается остро с повышения температуры тела до высоких цифр. Инкубационный период варьирует от 5 до 43 дней. В первые дни появляются налеты на миндалинах, увеличиваются шейные лимфатические узлы, носовое дыхание затруднено. К концу первой недели заболевания выявляются все характерные признаки заболевания: лихорадка, острый тонзиллит, фарингит, полиаденопатия, гепатоспленомегалия и лимфомоноцитоз. Выражены симптомы интоксикации. Внешний вид пациента характеризуется одутловатостью лица и отеком век. Одним из первых симптомов заболевания является увеличение заднешейных лимфатических узлов, которые видны при осмотре, при прощупывании малоболезненны, не спаяны между собой и с окружающей клетчаткой, плотноэластической консистенции. Лимфатические узлы могут быть увеличены от размера мелкой горошины до размера куриного яйца. На шее вокруг лимфатических узлов может появиться отек подкожной клетчатки, но их нагноения не бывает. Со стороны ротоглотки характерны увеличение и отек небных миндалин, язычка. Повышение температуры часто связано с появлением налетов на миндалинах. Поражение носоглоточной миндалины обусловливает заложенность носа, затруднение носового дыхания, сдавленность голоса. У больного храпящее дыхание полуоткрытым ртом, отделяемого из носа практически нет. Задняя стенка глотки красная, отечная, зернистая, покрыта слизью. Налеты на миндалинах отмечаются в первые 3–4 дня от начала болезни, что сопровождается повышением температуры тела и ухудшением состояния. Налеты рыхлые, бугристые беловато-желтого или грязно-серого цвета, легко снимаются и при этом крошатся, растираются между предметными стеклами. Печень и селезенка начинают увеличиваться с первых дней, а максимума их размеры достигают к 4—10-му дню болезни. При прощупывании край печени плотный, острый. Больной жалуется при этом на легкую болезненность. На высоте клинических проявлений заболевания может появиться желтушное окрашивание кожи, склер и слизистых оболочек. Функциональные нарушения печени незначительны. Размеры печени нормализуются в течение трех месяцев. Селезенка не прощупывается уже к концу третьей недели от начала болезни. При инфекционном мононуклеозе отмечаются повышение уровня лейкоцитов до 15–30 х 109, повышение СОЭ до 20–30 мм/ч и наличие атипичных мононуклеаров. Количество атипичных мононуклеаров в крови больных инфекционным мононуклеозом варьирует обычно от 5—10 до 50 % и обусловлено тяжестью течения заболевания. Со стороны сердечно-сосудистой системы наблюдается тахикардия (см.), тоны сердца приглушены. Как на коже, так и на слизистой ротовой полости в острый период болезни может появляться разнообразная сыпь в виде точек, пятен, бугорков, мелких кровоизлияний по ходу сосудов, крапивницы (см.). Как осложнение при наслоении острой респираторно-вирусной инфекции или активации бактериальной флоры у больного может развиться пневмония (см.). Типичные формы по тяжести подразделяются на легкие, среднетяжелые и тяжелые. Показателем тяжести являются выраженность общей интоксикации, степень увеличения лимфатических узлов, характер поражения ротоглотки и носоглотки, степень увеличения печени и селезенки, количество атипичных мононуклеаров в крови. Зарегистрированы случаи токсических и токсико-септических форм инфекционного мононуклеоза с развитием инфекционно-токсического шока (см.) и надпочечниковой недостаточности (см.), отдельные случаи смертельных исходов от разрыва селезенки, энцефалитов (см.), миокардитов (см.). Смертельные исходы от инфекционного мононуклеоза очень редки.
Атипичные формы Стертая форма протекает со слабо выраженными основными симптомами или под маской острого респираторного заболевания. Диагностируется лишь в эпидемических очагах при тщательном обследовании. Бессимптомная форма характеризуется отсутствием клинических проявлений. Диагностика этой формы основывается только на результатах гематологических, серологических исследований и эпидемиологических данных. Висцеральная форма встречается крайне редко, поэтому отнесена к атипичным. Это очень тяжелая форма болезни, которая нередко заканчивается летально. Часто имеет место поражение сердечно-сосудистой и центральной нервной системы, почек, печени, надпочечников и других жизненно важных органов. Инфекционный мононуклеоз обычно протекает без осложнений. Заболевание заканчивается через 2–4 недели. В некоторых случаях по истечении этого срока сохраняются остаточные проявления болезни. Истинных рецидивов заболевания, как правило, не отмечается. Осложнения вызваны вторичной микробной флорой: синусит (см.), отит (см.), стоматит (см.), бронхит (см.), пневмония (см.). Длительность заболевания, частота осложнений и обратная динамика симптомов зависят от тяжести болезни. При легкой форме все основные симптомы подвергаются быстрому обратному развитию уже на 3-й неделе болезни. При среднетяжелой форме остаточные явления в виде увеличения небных миндалин, лимфатических узлов, печени и селезенки и наличия атипичных мононуклеаров в крови сохраняются до 2 месяцев. При этой форме болезни могут возникать бактериальные осложнения — пневмония, стоматит, отит, синусит, паратонзиллит (см.) и др. При тяжелой форме основные симптомы болезни исчезают лишь на 4-й неделе болезни. Изменение функции печени после перенесенного заболевания сохраняется 6—12 месяцев. Часто развиваются бактериальные осложнения, период выздоровления затягивается до 2–3 месяцев.
Хронический мононуклеоз Хроническая болезнь, обусловленная вирусом Эпштейна-Барра, характеризующаяся длительным, свыше 6 месяцев, персистированием возбудителя инфекционного мононуклеоза в организме. Больные жалуются на общую слабость, быструю утомляемость, боли в мышцах, умеренное повышение температуры, увеличение лимфатических узлов, а также могут быть пневмония, увеиты, фарингиты, тошнота, боли в животе, диарея, иногда рвота с частым увеличением печени и селезенки. Также наблюдаются экзантемы и оральный герпес.
Диагностика и дифдиагностика Диагноз инфекционного мононуклеоза подтверждается характерными клиническими проявлениями, наличием атипичных мононуклеаров в крови и результатами серологических методов исследования. Методы выделения вируса Эпштейна — Барра и его антигенов в практике не используются, но применяются в научных исследованиях. К перспективным методам лабораторной диагностики инфекционного мононуклеоза относится иммуноферментный анализ. При хроническом мононуклеозе в крови наблюдается лейкопения, тромбоцитопения, а также высокий титр ImG-антител к раннему антигенному комплексу (EA) и к капсидному антигену (VCA), высокая вирусная нагрузка, выявленная с помощью ПЦР. Инфекционный мононуклеоз следует отличать от дифтерии (см.) ротоглотки, скарлатины (см.), острой респираторно-вирусной инфекции (особенно аденовирусной инфекции (см.)), острого лейкоза (см.), лимфогранулематоза (см.), вирусного гепатита (см.).
Лечение и профилактика Больные среднетяжелыми и тяжелыми формами госпитализируются в инфекционный стационар, при легких формах госпитализация не обязательна. Специфическое лечение не разработано. Применяют симптоматическую и патогенетическую терапию. Назначают десенсибилизирующие препараты, жаропонижающие средства, витаминотерапию, антисептики для устранения местного процесса в ротоглотке. При функциональных нарушениях печени показаны желчегонные средства. Антибактериальную терапию назначают при значительных налетах на миндалинах и при наличии осложнений. Для проведения антибактериальной терапии рекомендован метронидазол в возрастной дозировке, который дает хороший результат в течение первых суток от начала лечения, снимая симптомы интоксикации и другие проявления мононуклеоза. При тяжелом течении применяют кортикостероидные препараты курсом 5–7 дней. При затяжном течении используют иммунокорректоры (метилурацил, левамизол). Оба препарата назначают не ранее 50-го дня от начала болезни. Специфической профилактики инфекционного мононуклеоза не разработано. Больной в остром периоде болезни изолируется. В очаге проводится текущая дезинфекция (кварцевание, проветривание, влажная уборка с использованием дезинфицирующих средств).
МУКОВИСЦИДОЗ
ОпределениеМуковисцидоз (кистозный фиброз поджелудочной железы) — это системное наследственное заболевание, обусловленное мутацией гена трансмембранного регулятора муковисцидоза и характеризующееся поражением желез внешней секреции, тяжелыми нарушениями функций органов дыхания и желудочно-кишечного тракта.
Этиология и патогенез В основе заболевания лежит генная мутация. Патологический ген локализуется в середине длинного плеча 7-й хромосомы. Муковисцидоз наследуется по аутосомно-рецессивному типу и регистрируется в большинстве стран Европы с частотой 1:2000—1:2500 новорожденных. Если оба родителя гетерозиготны, то риск рождения больного муковисцидозом ребенка составляет 25 %. В настоящее время идентифицировано около 1000 мутаций гена муковисцидоза. Следствием мутации гена является нарушение структуры и функции белка, получившего название трансмембранный регулятор муковисцидоза (МВТР). Следствием этого является сгущение секретов желез внешней секреции, затруднение эвакуации секрета и изменение его физико-химических свойств, что, в свою очередь, и обуславливает клиническую картину заболевания. Изменения в поджелудочной железе, органах дыхания, желудочно-кишечном тракте регистрируются уже во внутриутробном периоде и с возрастом пациента неуклонно нарастают. Выделение вязкого секрета экзокринными железами приводит к затруднению оттока и застою с последующим расширением выводных протоков желез, атрофией железистой ткани и развитием прогрессирующего фиброза. Активность ферментов кишечника и поджелудочной железы снижена. Наряду с формированием склероза в органах имеет место нарушение функций фибробластов. Установлено, что фибробласты больных муковисцидозом продуцируют цилиарный фактор, или М-фактор, который обладает антицилиарной активностью — он нарушает работу ресничек эпителия.
Патанатомия Патологические изменения в легких характеризуются признаками хронического бронхита с развитием бронхоэктазов и диффузного пневмосклероза. В просвете бронхов находится вязкое содержимое слизисто-гнойного характера. Нередкой находкой являются ателектазы и участки эмфиземы. У многих больных течение патологического процесса в легких осложняется наслоением бактериальной инфекции (патогенный золотистый стафилококк, гемофильная и синегнойная палочка) и формированием деструкций. В поджелудочной железе выявляются диффузный фиброз, утолщение междольковых соединительнотканных прослоек, кистозные изменения мелких и средних протоков. В печени отмечаются очаговая или диффузная жировая и белковая дистрофия клеток печени, желчные стазы в междольковых желчных протоках, лимфогистиоцитарные инфильтраты в междольковых прослойках, фиброзная трансформация и развитие цирроза. При мекониевой непроходимости выражена атрофия слизистого слоя, просвет слизистых желез кишечника расширен, заполнен эозинофильными массами секрета, местами имеют место отек подслизистого слоя, расширение лимфатических щелей. Нередко муковисцидоз сочетается с различными пороками развития желудочно-кишечного тракта. Различают следующие клинические формы муковисцидоза: — преимущественно легочная форма (респираторная, бронхолегочная); — преимущественно кишечная форма; — смешанная форма с одновременным поражением желудочно-кишечного тракта и органов дыхания; — мекониевая непроходимость кишечника; — атипичные и стертые формы (отечноанемическая, цирротическая и др.).
Клиническая картина Мекониевая непроходимость Первые симптомы заболевания появляются в большинстве случаев в течение первого года жизни. У 30–40 % больных муковисцидоз диагностирован в первые дни жизни в виде мекониевой непроходимости. Данная форма заболевания обусловлена отсутствием трипсина, что приводит к скоплению в петлях тонкого кишечника (чаще всего в илеоцекальной области) плотного, вязкого по консистенции мекония. У здорового новорожденного первородный кал отходит на первые, реже — вторые сутки после рождения. У больного ребенка отсутствует выделение мекония. Ко второму дню жизни ребенок становится беспокойным, живот вздут, отмечаются срыгивания и рвота с примесью желчи. Через 1–2 дня состояние новорожденного ухудшается: кожные покровы сухие и бледные, на коже живота появляется выраженный сосудистый рисунок, тургор тканей снижен, беспокойство сменяется вялостью и адинамией, нарастают симптомы токсикоза и эксикоза. При объективном обследовании пациента отмечаются одышка и тахикардия, при перкуссии живота — тимпанит, при аускультации перистальтика не прослушивается. Обзорная рентгенограмма органов брюшной полости позволяет выявить вздутые петли тонкого кишечника и спавшиеся отделы в нижней части живота. Осложнением мекониевой непроходимости может быть перфорация кишечника с развитием мекониевого перитонита. Нередко на фоне непроходимости кишечника у больных муковисцидозом на 3—4-е сутки жизни присоединяется пневмония, которая принимает затяжной характер. Кишечная непроходимость может развиться и в более позднем возрасте больного.
Легочная (респираторная) форма Первыми симптомами бронхолегочной формы муковисцидоза являются вялость, бледность кожных покровов, недостаточная прибавка массы тела при удовлетворительном аппетите. В некоторых случаях (тяжелое течение) с первых дней жизни у больного появляется покашливание, которое постепенно усиливается и приобретает коклюшеподобный характер. Кашель сопровождается отделением густой мокроты, которая при наслоении бактериальной флоры становится впоследствии слизисто-гнойной. Повышенная вязкость бронхиального секрета приводит к развитию мукостаза и закупорке мелких бронхов и бронхиол, что способствует развитию эмфиземы, а при полной закупорке бронхов — формированию ателектазов. У детей раннего возраста в патологический процесс быстро вовлекается паренхима легкого, что приводит к развитию тяжелой, затяжной пневмонии. Поражение легких всегда двустороннее. При объективном обследовании отмечаются влажные мелко- и среднепузырчатые хрипы, а при перкуссии выслушивается коробочный оттенок звука. У больных может развиться токсикоз и даже клиника шока на фоне заболеваний, протекающих с высокой температурой тела или в жаркое время года при значительной потере натрия и хлора с потом. В дальнейшем пневмония приобретает хроническое течение, формируются пневмосклероз и бронхоэктазы, появляются симптомы «легочного сердца» (см.), легочная и сердечная недостаточность. При этом в клинической картине обращает на себя внимание внешний вид больного: бледная кожа с землистым оттенком, акроцианоз, общий цианоз, одышка в покое, бочкообразная форма грудной клетки, деформации грудины по типу «клиновидной» и деформации концевых фаланг пальцев по типу «барабанных палочек», ограничение двигательной активности, снижение аппетита и уменьшение массы тела. Редкими осложнениями при муковисцидозе являются пневмо- и пиопневмоторакс, легочное кровотечение (см. Кровотечение). При более благоприятном течении муковисцидоза, что наблюдается при манифестации заболевания в более старшем возрасте, бронхолегочная патология проявляется медленно прогрессирующим деформирующим бронхитом с умеренно выраженным пневмосклерозом. При длительном течении заболевания в патологический процесс вовлекается носоглотка: синусит, аденоидные вегетации, полипы носа, хронический тонзиллит. Рентгенологическое исследование легких при муковисцидозе позволяет выявить распространенные перибронхиальные, инфильтративные, склеротические изменения и ателектазы на фоне выраженной эмфиземы. При бронхографии отмечается наличие каплевидных бронхоэктазов, отклонений бронхов и уменьшение числа мелких разветвлений, бронхи 3—6-го порядка в виде четок. При бронхоскопии нередко обнаруживают небольшое количество густой вязкой мокроты, располагающейся в виде нитей в просветах крупных бронхов. Микробиологическое исследование мокроты у больных муковисцидозом позволяет выделить патогенный золотистый стафилококк, гемофильную и синегнойную палочки. Наличие синегнойной палочки в мокроте является прогностически неблагоприятным признаком для пациента.
Кишечная форма Клиническая симптоматика кишечной формы обусловлена секреторной недостаточностью желудочно-кишечного тракта. Нарушение ферментативной активности желудочно-кишечного тракта особенно ярко выражено после перевода ребенка на искусственное вскармливание или прикорм и проявляется недостаточным расщеплением и всасыванием белков, жиров и в меньшей степени углеводов. В кишечнике преобладают гнилостные процессы, сопровождающиеся накоплением газов, что приводит к вздутию живота. Дефекации частые, отмечается полифекалия (суточный объем каловых масс в 2–8 раз может превышать возрастную норму). Кал у детей раннего возраста имеет кашицеобразную консистенцию, резко зловонный, жирный, светлый (нередко серого цвета). На пеленках остаются жирные пятна. Постепенно кал становится более плотным и приобретает «замазкообразную» консистенцию. Иногда жир выделяется каплями в конце акта дефекации. После того как больного муковисцидозом ребенка начинают высаживать на горшок, нередко отмечается выпадение прямой кишки (у 10–20 % больных). Больные предъявляют жалобы на сухость во рту, что обусловлено высокой вязкостью слюны. Больные с трудом пережевывают сухую пищу, а во время еды употребляют значительное количество жидкости. Аппетит в первые месяцы сохранен или даже повышен, но вследствие нарушения процессов пищеварения у больных быстро развивается гипотрофия, полигиповитаминоз. Мышечный тонус и тургор тканей снижен. Больные предъявляют жалобы на боли в животе различного характера: схваткообразные — при метеоризме, мышечные — после приступа кашля, боли в правом подреберье — при наличии правожелудочковой недостаточности, боли в эпигастральной области обусловлены недостаточной нейтрализацией желудочного сока в двенадцатиперстной кишке при сниженной секреции поджелудочной железой бикарбонатов. Нарушение нейтрализации желудочного сока может стать причиной развития язвенной болезни двенадцатиперстной кишки или язвенного процесса в тонком кишечнике. Осложнениями кишечной формы муковисцидоза могут быть вторичная дисахаридазная недостаточность, кишечная непроходимость, вторичный пиелонефрит и мочекаменная болезнь на фоне обменных нарушений, латентно протекающий сахарный диабет при поражении инсулярного аппарата поджелудочной железы. Нарушение белкового обмена приводит к гипопротеинемии, что становится причиной развития в некоторых случаях у детей грудного возраста отечного синдрома. Гепатомегалия (увеличение печени) обусловлена холестазом. При билиарном циррозе в клинической картине можно наблюдать желтуху, кожный зуд, признаки портальной гипертензии, асцит.
Смешанная форма Смешанная форма муковисцидоза является наиболее тяжелой и включает клинические симптомы как легочной, так и кишечной форм. Обычно с первых недель жизни больного отмечаются тяжелые повторные бронхиты и пневмонии с затяжным течением, постоянный кашель, кишечный синдром и резкие расстройства питания. Клиническая картина муковисцидоза отличается значительным полиморфизмом, что и определяет варианты течения заболевания. Отмечена зависимость тяжести течения муковисцидоза от сроков появления первых симптомов — чем младше ребенок к моменту манифестации болезни, тем тяжелее его течение и более неблагоприятен прогноз. Учитывая полиморфизм клинических проявлений муковисцидоза, тяжесть течения принято оценивать в большинстве случаев характером и степенью поражения бронхолегочной системы. Различают 4 стадии патологических изменений бронхолегочной системы при муковисцидозе: — стадия 1 — стадия непостоянных функциональных изменений, которая характеризуется сухим кашлем без мокроты, незначительной или умеренной одышкой при физических нагрузках. Продолжительность данной стадии может составлять до 10 лет; — стадия 2 — стадия развития хронического бронхита, которая характеризуется наличием кашля с отделением мокроты, умеренной одышкой (усиливается при напряжении), формированием деформации концевых фаланг пальцев. При аускультации выслушиваются влажные, «трескучие» хрипы на фоне жесткого дыхания. Продолжительность данной стадии может составлять от 2 до 15 лет; — стадия 3 — стадия прогрессирования бронхолегочного процесса с развитием осложнений. Формируются зоны диффузного пневмофиброза и ограниченного пневмосклероза, бронхоэктазы, кисты и выраженная дыхательная недостаточность в сочетании с сердечной недостаточностью по правожелудочковому типу («легочное сердце»). Продолжительность стадии от 3 до 5 лет; — стадия 4 характеризуется тяжелой кардиореспираторной недостаточностью, которая в течение нескольких месяцев приводит к смерти больного.
Диагностика Диагноз муковисцидоза определяется данными клинических и лабораторных методов обследования пациента. Для постановки диагноза заболевания необходимо наличие четырех основных критериев: хронический бронхолегочный процесс и кишечный синдром, случаи муковисцидоза у сибсов, положительные результаты потового теста. Пот для исследования собирают после электрофореза с пилокарпином. Минимальное количество пота, необходимое для получения достоверного результата, составляет 100 мг. Разница между показателями натрия и хлора в пробе не должна превышать 20 ммоль/л, в противном случае исследование повторяют. При отработанной методике допустимо определение одного из ионов. У здоровых детей концентрация ионов натрия и хлора в поте не должна превышать 40 ммоль/л. Диагностически достоверным критерием муковисцидоза является содержание ионов хлора выше 60 ммоль/л и натрия — выше 70 ммоль/л. Для подтверждения диагноза требуется трехкратный положительный потовый тест с содержанием хлоридов пота выше 60 ммоль/л. Важное значение в диагностике муковисцидоза имеет копрологическое исследование. В копрограмме больного муковисцидозом наиболее характерным признаком является повышенное содержание нейтрального жира, но возможно наличие мышечных волокон, клетчатки и крахмальных зерен, что позволяет определить степень нарушения ферментативной активности желез желудочно-кишечного тракта. Под контролем данных копрологического исследования проводят коррекцию дозы панкреатических ферментов. Ориентировочными методами для диагностики муковисцидоза являются определение протеолитической активности кала рентгенологическим тестом, активности ферментов поджелудочной железы в дуоденальном содержимом, концентрации натрия в ногтях и секрете слюнных желез. В качестве скрининг-теста в периоде новорожденности используют метод определения повышенного содержания альбумина в меконии — мекониальный тест (в норме содержание альбумина не превышает 20 мг на 1 г сухой массы). Особое место в диагностике занимает молекулярно-генетическое тестирование. В настоящее время в России по наличию известных мутаций доступны идентификации 65–75 % больных муковисцидозом, что не дает возможности использовать для верификации диагноза заболевания только молекулярно-генетическое обследование.
Дифдиагностика Дифференциальную диагностику муковисцидоза проводят с коклюшем, обструктивным бронхитом, бронхиальной астмой, бронхоэктазами, фиброзом легких непанкреатического происхождения. По наличию в поте высоких показателей электролитов муковисцидоз дифференцируют с такими заболеваниями, как несахарный почечный диабет (см.), недостаточность коры надпочечников (см.), наследственная эктодермальная дисплазия, гликогенная болезнь, дефицит глюкозо-6-фосфатазы, гипопаратиреоидизм, гипотрофия, гаргоилизм, фукозидоз, дегидратация, отеки.
Лечение Лечение муковисцидоза симптоматическое. Больные муковисцидозом нуждаются в постоянной заместительной ферментной терапии препаратами нового поколения (креон, панцитрат и др.). Муколитические препараты вводят в аэрозолях, состоящих из 2 %-ного раствора хлорида натрия, 5–8 %-ного раствора ацетилцистеина (синонимы бронхолизин, мукосольвин и др.). Важное значение имеет питание больного. Суточный калораж должен на 10–30 % превышать возрастную норму за счет увеличения в рационе белкового компонента. Потребность в белке удовлетворяют употреблением в пищу мяса, рыбы, яиц, творога. Потребление жиров значительно ограничивают. Можно использовать жиры, в состав которых входят жирные кислоты со средним размером цепи, так как их усвоение не зависит от активности липазы поджелудочной железы. При дефиците дисахаридаз в тонком кишечнике из рациона исключают соответствующие сахара (чаще всего лактозу). Пищу больным всегда подсаливают, особенно в жаркое время года и при высокой температуре, что необходимо, учитывая большие потери солей с потом. Больному обеспечивают потребление достаточного количества жидкости. В питание должны быть включены содержащие витамины продукты, фруктовые и овощные соки, сливочное масло. В обязательном порядке осуществляют коррекцию нарушенной функции поджелудочной железы путем применения панкреатина или комбинированных препаратов, содержащих наряду с панкреатином другие кишечные ферменты и липотропные вещества (полизим, панзинорм, мексаза и др.). Дозу ферментных препаратов подбирают индивидуально, ориентируясь на данные копрологического исследования. Показателями оптимального подбора дозы служат нормализация стула и исчезновение в кале нейтрального жира. Начальная доза препарата составляет 2–3 г в сутки. Дозу постепенно повышают до появления положительного эффекта. Для разжижения секретов желудочно-кишечного тракта и улучшения их оттока применяют ацетилцистеин в таблетках и гранулах, что показано при холестазе, вязком дуоденальном содержимом, невозможности провести зондирование. Лечение легочного синдрома включает комплекс мероприятий, направленных на разжижение мокроты и удаление ее из бронхов. С этой целью применяют физические, химические и инструментальные методы. Муколитическая терапия проводится ежедневно в течение всей жизни пациента. Эффективность лечения повышается при параллельном использовании аэрозольных ингаляций, ЛФК, вибрационного массажа, постурального дренажа. Количество и длительность ингаляций определяются тяжестью состояния больного. В качестве муколитических препаратов можно использовать соляно-щелочные смеси (1–2 %-ный солевой раствор — хлорид и карбонат натрия), бронхолитические препараты, ацетилцистеин (на одну ингаляцию 2–3 мл 7—10 %-ного раствора). Постуральный дренаж проводится каждое утро, а вибрационный массаж — не менее 3 раз в сутки. Лечебная бронхоскопия с промыванием бронхов ацетилцистеином и изотоническим раствором хлорида натрия показана как экстренная процедура при отсутствии эффекта вышеописанной терапии. В периоды обострения заболевания, при наличии острой пневмонии или острой респираторной вирусной инфекции показано применение антибактериальной терапии. Антибактериальные средства вводят парентерально (полусинтетические пенициллины, цефалоспорины второго и третьего поколения, аминогликозиды, хинолоны) и в виде аэрозолей (аминогликозиды: гентамицин, тобрамицин). Учитывая склонность пневмоний при муковисцидозе к затяжному течению, курс антибиотиков составляет не менее одного месяца, а иногда и больше. При тяжелом течении пневмонии применяют кортикостероидные препараты в течение 1,5–2 месяцев. Преднизолон назначают из расчета 1,0–1,5 мг/кг в сутки в течение 10–15 дней. Затем дозу постепенно снижают. Антибиотики применяют в течение всего курса кортикостероидной терапии. Наряду с антибактериальной и муколитической терапией проводят комплекс лечебных мероприятий, направленных на борьбу с гипоксией, сердечно-сосудистыми нарушениями, изменениями кислотно-основного состояния. При организации диспансерного наблюдения за больными муковисцидозом в амбулаторных условиях необходимо осуществлять контроль за стулом и массой тела больного, регулярно (1 раз в 3 месяца) проводить копрологическое исследование с целью коррекции дозы препаратов поджелудочной железы, весной и при обострении процесса назначать курсы витаминотерапии (оправдано назначение двойной дозы жирорастворимых витаминов А, Е, D в виде водных растворов). Родственников больного необходимо обучить приемам постурального дренажа, вибрационного массажа и уходу за пациентом. Наряду с занятиями лечебной физкультурой рекомендованы дозированные физические нагрузки и занятия спортом. При устойчивой ремиссии в течение 6 месяцев разрешается проведение профилактических прививок. Прогноз при муковисцидозе до настоящего времени остается серьезным. Летальность составляет 50–60 %, а среди детей раннего возраста — выше. Поздняя диагностика заболевания и неадекватная терапия значительно ухудшают прогноз. В настоящее время возможна диагностика данного заболевания на ранних сроках беременности, поэтому большое значение приобретает медико-генетическое консультирование семей, в которых есть больные муковисцидозом.
♦ Н ♦
НАВЯЗЧИВЫЕ СОСТОЯНИЯ
ОпределениеНавязчивые состояния (обсессии) — это такого рода переживания, когда у человека помимо его воли возникают («навязываются») какие-то мысли, страхи, влечения, сомнения, действия. Несмотря на критическое отношение к подобным явлениям, избавиться от них человек не может. Навязчивые состояния (навязчивости) — необязательно симптом болезни, они могут встречаться и у здоровых людей.Навязчивые мысли (навязчивые идеи) заключаются в появлении совершенно ненужных мыслей (умственная жвачка, мысли-паразиты), например о том, почему у человека две ноги, а у лошади четыре; почему у людей носы разной формы; что было бы, если бы солнце взошло на западе, а не на востоке. Понимая всю нелепость таких мыслей и относясь к ним с полной критикой, человек тем не менее избавиться от них не в силах. Навязчивый счет заключается в непреодолимом стремлении считать все, что попадается на пути: окна в домах, перекладины в заборе, пуговицы на пальто соседа, шаги на том или ином расстоянии. Подобные навязчивости могут также выражаться в стремлении к более сложным действиям, например в сложении цифр, составляющих номер того или иного телефона, в умножении отдельных цифр номеров машин, в подсчитывании общего числа всех букв на странице книги. Навязчивые сомнения, сопровождаемые обычно неприятным тягостным чувством, выражаются в постоянных сомнениях по поводу того, правильно ли человек сделал то или иное дело, закончил ли его. Так, врач, выписавший больному рецепт, потом бесконечносомневается, не сделал ли он ошибки в дозе; машинистка много раз перечитывает напечатанный текст и, не находя ошибки, тем не менее вновь испытывает сомнения; преподаватель литературы постоянно сомневается, правильно ли он назвал ученикам имена литературных героев, не стал ли он из-за ошибки посмешищем всего класса. Наиболее частый вид данного рода навязчивости — мучительные сомнения: выключил ли человек перед уходом газ, погасил ли свет, запер ли дверь. Нередко страдающий такими навязчивыми сомнениями субъект неоднократно возвращается домой, чтобы проверить, закрыл ли он дверь; но стоит ему отойти, как он вновь начинает беспокоиться, завершил ли он это действие, не забыл ли повернуть ключ или вынуть его из замка. Навязчивые воспоминания характеризуются непроизвольным появлением ярких воспоминаний обычно чего-то для человека неприятного, того, что он хотел бы забыть, например навязчиво вспоминается какой-то тягостный для больного разговор; все детали смешного положения, в которое он когда-то попал; обстановка экзамена, на котором он с позором провалился и где ему было так стыдно. Навязчивые страхи — фобии (от греч. phobos — «страх») — очень мучительные состояния, вызываемые самыми различными предметами и явлениями: боязнью высоты, широких площадей или, наоборот, узких улиц; нередко возникает страх совершить что-то неприличное, преступное или недозволенное (например, страх убить своего единственного горячо любимого ребенка, страх не удержать в общественном месте газы, страх громко закричать в обстановке торжественной тишины во время концерта), страх быть пораженным молнией, утонуть, попасть под машину, страх перед подземными переходами, перед спуском по эскалатору метро, страх покраснеть в общественном месте, особенно во время щекотливого разговора, когда все могут подумать, что у больного «не совсем чистая совесть», страх перед острыми, колющими и режущими предметами. Особую группу составляют нозофобии — навязчивые страхи заболеть тем или иным заболеванием (кардиофобия, сифилофобия, канцерофобия) или даже умереть от этой болезни либо от каких-то других причин (страх смерти — танатофобия, от греч. thanatos — «смерть»). Нередко встречаются фобофобии: человек, тяжело переживавший приступ навязчивого страха, потом испытывает уже страх самого страха. Возникновение навязчивых страхов обычно сопровождается появлением выраженной вегетативной реакции в виде резкого побледнения или покраснения, потливости, сердцебиения, учащенного дыхания. Характерно, что обычно вполне критическое отношение к своему состоянию, понимание несостоятельности, необоснованности навязчивых страхов в момент приступа последних исчезает, и тогда человек действительно уверен, что «немедленно умрет от инфаркта», «скончается от кровоизлияния в мозг», «погибнет от заражения крови». Навязчивые влечения (навязчивые желания) выражаются в появлении неприемлемых для нормального человека желаний (плюнуть в затылок впереди сидящего человека, дернуть за нос встречного, выскочить из машины на большой скорости), всю нелепость и болезненность которых человек понимает. Особенность подобных влечений заключается в том, что они обычно не переходят в действие, но для человека очень тягостны и мучительны. Очень мучительны для больных и контрастные навязчивости, выражающиеся в хульных кощунственных навязчивых мыслях, чувствах и страхах, оскорбляющих морально-этическую, нравственную сущность человека. У подростка, очень любящего свою мать, навязчиво возникают мысли и представления о ее физической нечистоплотности и возможном развратном поведении, хотя он твердо знает, что этого нет; у глубоко верующего человека появляются страхи, что он во время богослужения «сделает какую-нибудь непристойность»; у матери при виде острых предметов возникают навязчивые представления о том, как она втыкает такой предмет в горло своего единственного ребенка и т. д. Подобно навязчивым желаниям и влечениям контрастные навязчивости также никогда не реализуются. Навязчивые действия характеризуются непроизвольным выполнением движений, чаще всего совершаемых автоматически: человек во время разговора крутит в руках кусок бумаги, ломает спички, чертит карандашом фигуры, накручивает на палец прядь волос, без всякого смысла переставляет предметы на столе, во время чтения грызет ногти, дергает себя за ухо. Сюда же относятся и такие действия и движения, как шмыгание носом, прищелкивание пальцами, покусывание губ, постоянное одергивание пиджака, непроизвольное потирание рук и др. В отличие от других навязчивостей, эти движения и действия совершаются автоматически, их выполнение не сопровождается никакими неприятными чувствами, их просто не замечают. Более того, человек усилием воли может их задержать, помня о них, может их не совершать, но стоит ему отвлечься, как он снова начинает непроизвольно крутить в руках карандаш или перебирать лежащие перед ним на столе предметы. Ритуалы (от лат. ritualis — «обрядовый») — навязчивые действия и движения, совершаемые больными в качестве необходимого обряда при наличии у них фобий или мучительных сомнений. Эти ритуальные движения или действия (подчас очень сложные и длительные) выполняются больными для защиты от ожидаемого несчастья или успокоения при навязчивых сомнениях. Например, больная с навязчивым страхом загрязнения так часто моет руки, что в день расходует по куску мыла. Во время каждого мытья она намыливает руки не менее десяти раз, считая при этом вслух; если же почему-либо сбивается со счета или ее отвлекут, то она тут же должна число намыливаний утроить, затем вновь и вновь утроить и т. д. Больной с навязчивым страхом пожара время от времени поворачивается трижды вокруг своей оси, испытывая после этого на какой-то период успокоение. Девочка с навязчивым страхом подавиться перед каждым приемом пищи ставит тарелку себе на голову. Женщина, склонная к навязчивым сомнениям, закрыла ли она входную дверь, обязательно подергает за ручку 12 раз, напевая про себя один и тот же мотив. В отличие от бреда (см.), навязчивости могут быть и у здоровых людей (многим хорошо известна навязчивость какого-то мотива или мелодии). Способствуют возникновению навязчивостей у здоровых людей недосыпание, переутомление, астенизация.
НАРКОЛЕПСИЯ
ОпределениеНарколепсия — заболевание, основной признак которого — приступы неудержимой сонливости.
Этиология и патогенез У одних больных не удается выявить каких-либо факторов, способствующих возникновению нарколепсии, у других нарколепсия развивается после перенесенных инфекций (эпидемический энцефалит (см.), малярия (см.) и др.), черепно-мозговой травмы. В отдельных случаях отмечается роль наследственного фактора. Причиной нарколепсии могут быть также опухоли (см.) гипофиза, III желудочка, гидроцефалия (см.). Патологический процесс локализуется в веществе мозга, окружающем III желудочек и сильвиев водопровод. Патоморфологические находки (локализация процесса в области гипоталамуса и ростральных отделов ретикулярной формации ствола мозга), а также новые данные о роли ретикулярной формации в регулировании процессов сна и бодрствования позволяют думать о значении этих образований в развитии сонливости (патология восходящих влияний) и приступов потери мышечного тонуса (патология нисходящих влияний). При этом заболевании нарушаются мозговые механизмы, регулирующие циклическую организацию сна.
Клиническая картина Известны две формы заболевания: малосимптомная, проявляющаяся лишь дневными приступами засыпания, и полисимптомная, в картину которой входит комбинация пяти проявлений: дневные приступы засыпания, дневная катаплексия (утрата мышечного тонуса, приводящая к падению), нарушение ночного сна, гипнагогические (возникающие при засыпании) галлюцинации (см.) и катаплексия пробуждения (реже — засыпания). Приступы сонливости заключаются в непреодолимой потребности заснуть. Больные засыпают во время работы, во время ходьбы, езды на велосипеде. Чаще всего длительность сна невелика. Глубина сна также может быть различной: как правило, сон поверхностный, и больные просыпаются при незначительном шуме или при дотрагивании до них. Способствующими сну факторами являются тепло, монотонная, сидячая, однообразная работа, сытная еда. Чаще сонливость усиливается в определенное время (12, 16–17 и 19–20 ч). Во время сна отмечаются снижение мышечного тонуса и амплитуды сухожильных рефлексов, сужение зрачков. Катаплексия — кратковременное расслабление мышц, сопровождающееся падением больного; возникает обычно в связи с эмоциональными переживаниями, чаще положительного характера (больной падает во время смеха). Катаплексия наблюдается в 70 % случаев нарколепсии. Во время приступа свешивается голова, опускаются руки, слабеют ноги, больной не может пошевелить ни головой, ни конечностями, но сознание сохранено. Продолжительность приступа чаще невелика (от нескольких секунд до 3 мин). Лишь в очень редких случаях наблюдаются более длительные приступы. Припадок сопровождается покраснением лица, потливостью, замедлением пульса, исчезновением рефлексов со слизистых оболочек, сухожилий и кожи. В ряде случаев приступ сна и катаплексия развиваются одновременно или последовательно переходят одно в другое. Почти у всех больных нарколепсией отмечается поверхностный, тревожный, прерывистый ночной сон, сопровождающийся кошмарными сновидениями. Типичность для этого заболевания особых состояний, возникающих в период засыпания: появляются так называемые гипнагогические зрительные галлюцинации (больные видят различные предметы, чаще это животные, вызывающие у них яркие эмоциональные реакции). У отдельных больных наблюдается еще один признак заболевания — катаплексия пробуждения, проявляющаяся после неожиданного пробуждения. Больные не могут пошевелить руками, закричать. Это состояние обездвиженности быстро проходит. У больных нарколепсией отмечаются различные эндокринно-вегетативные нарушения. Нередко обнаруживаются артериальная гипотония (см.), ожирение (см.), лимфоцитоз, реже эозинофилия. У ряда больных развиваются амимия, повышение мышечного тонуса по пластическому типу. Течение нарколепсии хроническое, интеллектуальных дефектов она не вызывает. С возрастом интенсивность заболевания уменьшается. Чаще катаплексия присоединяется к уже имеющимся приступам сонливости, однако можно наблюдать и обратную картину. Мужчины заболевают чаще. На ЭЭГ во время нарколептического состояния определяется картина, характерная для различных фаз физиологического сна. Особенность заболевания — несвоевременное появление при полисимптомной нарколепсии фазы быстрого сна (в норме — через 70—100 мин). Необходим дифференциальный диагноз с другими формами гиперсомний (пиквикский синдром, периодическая спячка).
Лечение Лечение сводится к устранению причин, вызывающих нарколепсию: удаление опухоли, уменьшение гипертензивных явлений и т. д. Целесообразна стимуляция адренергических элементов ретикулярной формации (утром и днем) симпатомиметическими средствами (эфедрин, фенамин). Полезны также блокаторы моноаминоксидазы, разрушающей норадреналин. Хорошие результаты получены при использовании психотонических препаратов (центедрин, мелипрамин), особенно анорексантов. Для углубления ночного сна назначают димедрол, мепропан, эуноктин.
НАРКОМАНИЯ
ОпределениеНаркомания — это состояние временной или хронической интоксикации, вызываемой употреблением натуральных или синтетических токсических веществ (некоторые лекарственные препараты, пищевые и промышленные яды).
Этиология и патогенез Причинами аддиктивного (от англ. addiction — «пагубная привычка», «порочная склонность») поведения являются социально-психологические факторы. Основные мотивы начала злоупотребления разделяют на гедонистические (желание испытать приятное состояние), атарактические (стремление «забыться», «отключиться от неприятностей», ослабить действие эмоциональных стрессов) и субмиссивные (подчинение влиянию других людей, комфортность в компании). Природа психической зависимости остается невыясненной. Согласно гипотезе И. П. Анохиной, она связана с дефицитом дофамина и норадреналина в гипоталамической области мозга. Гипотеза предполагает существование единого патогенетического механизма зависимости от всех известных веществ — от алкоголя до опиатов. Однако далеко не все средства способны заменять друг друга. В механизме развития опийных наркоманий нельзя не учитывать существования так называемых эндогенных (внутренних) опиоидов — эндорфинов и энкефалинов, продуцируемых организмом. Наркомании характеризуются непреодолимым влечением к приему наркотиков (пристрастием к ним), тенденцией к повышению количества принимаемого вещества, психической (психологической), а иногда и физической (физиологической) зависимостью от наркотиков. Психическая зависимость (привязанность) возникает в процессе привыкания к наркотику. Чаще всего наблюдается так называемая негативная привязанность: прием наркотика для того, чтобы избавиться от напряжения и плохого самочувствия. Позитивная привязанность отмечается тогда, когда наркотик принимают для достижения приятного эффекта (эйфории, чувства бодрости, повышения настроения). Физическая зависимость означает тягостные и даже мучительные ощущения, болезненное состояние при перерыве в постоянном приеме наркотика (так называемый абстинентный синдром — синдром воздержания или отмены). От этих тягостных ощущений избавляет прием наркотиков. Физическая зависимость — возможный фактор усиления психической зависимости, заставляющей человека продолжать прием наркотика или возобновлять его употребление после попытки воздержания. Что побуждает человека принимать наркотические или токсические вещества? Здесь обязательно присутствует желание испытать новые ощущения, повысить свои способности, снять беспокойство и пр. Кроме простого любопытства, играет определенную роль стремление быть принятым в «свой круг», желание обрести чувство принадлежности, выразить свою независимость, а иногда и оппозицию к окружающим, приобрести новый волнующий опыт, а также потребность уйти от чего-то гнетущего, достичь искусственного покоя. Клиническое изучение наркоманов позволило ряду авторов ретроспективно выделить варианты предрасположения к недугу. Хотя точнее, на наш взгляд, говорить о психопатологической импрегнации — усилении путем «протравливания» наркотическими ядами различных теневых сторон личности. Относительно большую группу (примерно 18–20 %) составляют лица психопатического склада: беспокойные и жадные до новых впечатлений фантазеры и мечтатели без твердых принципов, «безвольно разнузданные» (по выражению одного клинициста), со склонностью к самообману, страхом перед жизненными трудностями, повседневной прозаической работой, а также неуравновешенные, тщеславные и инфантильные. Риск ранней алкоголизации и токсикомании повышен у подростков неустойчивого и гипертимного (гипертимия — повышенное настроение, сопровождающееся усилением психической и физической активности) типа, а также у подростков с эпилептоидным складом характера. Юноши конформного типа не имеют изначальной склонности к употреблению спиртного, но у них и нет твердой отрицательной установки. Другую группу (примерно 12–14 %) составляют лица с невротическими чертами, их иногда называют невропатами. Среди них выделяют субъектов с истероидными чертами характера (эгоцентризм, крайнее тщеславие, стремление блеснуть перед окружающими своими мнимыми деяниями и заслугами, поступками) и лиц со скрытой неуверенностью в себе, с так называемым комплексом неполноценности. Злоупотребление наркотиками или другими токсическими веществами без зависимости от них не считается наркоманией или токсикоманией. Для этих случаев предложено множество различных названий: наркотизм, токсикоманическое поведение, эпизодическое злоупотребление и др. В последние годы все большее распространение получает термин «аддиктивное поведение», который указывает, что это нарушение поведения требует скорее воспитательных мер, чем медицинских. Психическая зависимость проявляется все более овладевающим желанием продолжать употребление данного вещества, добывая его любыми путями и пренебрегая неприятными и даже опасными последствиями. Перерыв в употреблении вызывает напряжение и беспокойство, а также резкое усиление влечения к данному веществу. От истинной индивидуальной психической зависимости следует отличать групповую психическую зависимость, особенно выраженную при аддиктивном поведении у подростков и молодежи. Физическая зависимость развивается, когда вещество, которым злоупотребляли, становится необходимым для поддержания нормального функционирования организма. Абстинентный синдром (от лат. abstinentia — «воздержание») служит главным проявлением физической зависимости. Он развивается обычно через несколько часов после того, как в организм не поступила очередная доза наркотика или иного токсического вещества. Возникающие симптомы в значительной мере являются как бы антиподами тех признаков, которые характерны для опьянения данным веществом. Вместо эйфории наступает депрессия, вместо ленивого довольства — беспокойство и тревога, вместо усиления активности — апатия, вместо сужения зрачков — их расширение и т. д. Соматические и неврологические нарушения могут даже преобладать над психическими. Компульсивное влечение (от англ. compulsion — «принуждение») отличается неодолимостью, невозможностью его подавить. Больной не способен скрывать или как-то маскировать это влечение. Толерантность (устойчивость) к наркотику или иному токсическому веществу определяется минимальной дозой, способной вызвать обычный эффект или устранить явления абстиненции (см.). При одних наркоманиях устойчивость растет быстро и значительно (опиаты), при других развивается только при длительном злоупотреблении (гашиш), при третьих не возникает вовсе (кокаин). Встречается также анозогнозия — нежелание и неспособность признать наличие болезни. Медицинские классификации наркотических веществ основываются на особенностях их действия (эйфоризаторы, транквилизаторы, психостимуляторы, галлюциногены и т. д.). Однако одно и то же вещество в зависимости от дозы и способа введения может оказывать различное действие. Международная классификация болезней среди наркотиков и психоактивных веществ выделяет: — препараты опия; — снотворные и седативные; — кокаин; — препараты индийской конопли (каннабиноиды); — психостимуляторы; — галлюциногены.
Клиническая картина Опийная наркомания Из аптечных препаратов употребляются морфин, омнопон, промедол, дионин, кодеин и др. В подпольных лабораториях в нашей стране приготовляют героин и метадон. Кустарным образом делают различные вытяжки из мака. Чаще всего аптечные ампулированные препараты или самодельно приготовленные жидкости вводят внутривенно. Сразу после вливания краснеет лицо, ощущается горячая волна, проходящая по телу, возникают чувство покалывания иголками и зуд кожи лица. Нередко появляется кратковременное ощущение дурноты. Могут случаться обмороки. Через 10–15 мин все неприятные ощущения исчезают. Развивается эйфория — повышенное настроение с чувством необыкновенного душевного и телесного комфорта. Однако эта эйфория обычно не сочетается ни с повышенной активностью, ни с потребностью в общении. Приятным состоянием («кайфом») стремятся насладиться наедине или в стороне от других. Молча сидят, предаваясь заманчивым мечтам, воспоминаниям или желанным мыслям, но ярких зрительных фантазий не бывает. Сознание остается ясным. Только при передозировке развиваются оглушение, сопор или кома. Зрачки сужены и не расширяются в темноте. Опытные наркоманы при желании могут диссимулировать (скрывать) опийное опьянение; их выдают только узкие зрачки, поэтому для маскировки они носят темные очки или закапывают в глаза атропин. Опьянение длится несколько часов и сменяется вялостью и сонливостью. При передозировке быстро наступает сонливость и может возникнуть опасное для жизни больного коматозное состояние: сознание полностью утрачивается, он имеет вид глубоко спящего человека, которого невозможно разбудить. Узкие зрачки не реагируют на свет. Нарастают нарушения дыхания, оно становится периодическим, затрудненным, храпящим. Смерть наступает от паралича дыхательного центра. Первая стадия наркомании развивается довольно быстро: достаточно бывает 5—10 раз повторить вливания, чтобы возникла психическая зависимость от наркотика. Влечение к нему становится первой жизненной потребностью. Соматические изменения еще выражены умеренно: снижен аппетит, появляются запоры, начинается похудение. Из-за постоянного миоза (сужения зрачков) ухудшается зрение. При вынужденном перерыве в приеме наркотика явления абстиненции (см.) бывают стертыми. Резко усиливается влечение к наркотику. Настроение становится депрессивно-дисфорическим: угнетенность сочетается с раздражительностью, истериками с рыданиями, требованием денег от близких для приобретения наркотика. На первой стадии начинает расти устойчивость: чтобы вызвать эйфорию, дозу приходится увеличивать в 2–3 раза. От частых инъекций вены предплечий и локтевых сгибов склерозируются, на месте проколов образуются узелки. Вторая стадия наркомании характеризуется выраженной физической зависимостью от наркотика, которая обычно наступает через несколько недель или даже месяцев регулярных злоупотреблений. Абстиненция (см.) начинается через 12–24 ч после перерыва и протекает тяжело. Появляются сильные мышечные боли, судорожные сведения мышц, спазмы в животе, часто возникают рвота и понос, боли в области сердца. Зрачки становятся широкими, пульс — учащенным. Нередко начинаются слезотечение и слюнотечение, непрекращающееся чиханье. Озноб чередуется с проливным потом. Обостряются хронические соматические заболевания. Описаны случаи смерти от инфаркта миокарда (см.) во время абстиненции. Тяжелое состояние длится несколько суток, а вегетативные нарушения — 1–2 недели. Однако психическая зависимость и сильное влечение к наркотику могут удерживаться несколько месяцев. Рост устойчивости на второй стадии резко выражен. Описаны случаи, когда она достигала нескольких десятков смертельных доз в сутки. После перенесенной абстиненции устойчивость падает, поэтому прежняя, ставшая привычной доза может привести к смерти. Изменяется картина опьянения. Прежний «кайф» исчезает. Наркотик становится необходимым допингом для восстановления работоспособности, общительности, бодрости, аппетита. Его действие сохраняется лишь несколько часов, что заставляет повторять вливания в течение дня. Соматические нарушения резко выражены и постоянны. Кожа шелушится, волосы секутся, ногти ломаются, зубы крошатся. Характерны необычная бледность, запоры (см.), анемия (см.). Аппетит утрачен. Узкие («точечные») зрачки нарушают аккомодацию (изменение преломляющей силы глаза). Угасает половое влечение, у мужчин наступает импотенция (см.), у женщин — аменорея (см.). Сексуальная активность может проявляться в пассивной форме, включая гомосексуальную, в виде проституции с целью добычи денег на наркотик. Осложнениями являются вирусные гепатиты (см.), СПИД (см.), тромбофлебиты (см.) и тромбоэмболии как следствие постоянных внутривенных вливаний без соблюдения правил асептики. Смертность среди наркоманов в 20 раз выше, чем в общей популяции. Причинами служат передозировка наркотика, суициды (самоубийства), упомянутые соматические осложнения. Третья стадия наркомании встречается нечасто, так как не все наркоманы до нее доживают. Крайнее истощение, астения и апатия делают больного нетрудоспособным. Интерес сохранен только к наркотику. Устойчивость к нему снижается. Прежние высокие дозы могут вызывать тягостные состояния. Однако все время требуется несколько меньшая доза для предотвращения абстиненции. Активность под действием наркотика сводится лишь к тому, чтобы самостоятельно поесть и элементарно себя обслужить. Основное время наркоман проводит в постели. Нередко отмечаются коллапсы. Смерть наступает от сопутствующих заболеваний.
Каннабиноидная наркомания (гашишизм) В нашей стране чаще всего курят гашиш (анаша, план) — высушенное и спрессованное смолистое вещество, выступающее на поверхности цветущих верхушек женских особей конопли. Действующим началом служит тетрагидроканнабиол. В Америке и Европе больше распространена марихуана — высушенные измельченные листья и верхние части стеблей конопли («травка»). Действие марихуаны слабее гашиша в 10 раз. Первое в жизни курение гашиша обычно никаких ощущений не вызывает. Чтобы испытать «кайф», надо покурить 2–3 раза. Большая доза, принятая с пищей или алкоголем, может вызвать тошноту, головную боль, стеснение в груди, затруднение дыхания. Легкое субпсихотическое опьянение развивается через 5—15 мин от начала курения и проявляется эмоциональными перепадами — от безудержного веселья (приступы хохота) до мгновений страха и ужаса. Злоба не характерна, но эмоции заразительны: в компании участники, индуцируя друг друга, могут крушить и ломать все вокруг, возникает потребность двигаться и общаться. Они энергично жестикулируют, гримасничают, приплясывают, отбивают ритм руками и ногами. Безудержно говорливы, хотят со всеми поделиться своими мыслями. Появляются психосенсорные расстройства: краски становятся необычно яркими, звуки — насыщенными. Появляется ощущение обострения слуха — кажется, что улавливается каждый шелест и шорох. На самом деле слуховой порог не снижается. Искажается оценка расстояния — предметы отдаляются. Ощущается необычная легкость тела и движений («невесомость»). В компании обнаруживается своеобразное сужение сознания: ее участники воспринимают лишь то, что происходит в их кругу, а постороннего не замечают. Вегетативные нарушения сводятся к расширению зрачков, блеску глаз, сухости во рту. Опьянение длится до нескольких часов. При протрезвлении появляется сильный голод. Диагностическим признаком может служить своеобразный сладковатый запах от одежды курившего гашиш, который долго сохраняется. Тяжелое психотическое опьянение встречается редко и бывает следствием передозировки или повышенной чувствительности. Обычно развивается онейроид: отрешенные от окружающего больные погружаются в мир грезоподобных фантазий или заново переживают прежние эмоционально насыщенные события («сцены любви и ненависти»). При этом в контакт вступить с ними не удается, а выражение лица меняется от блаженства до ужаса и гнева. При делирии (см.) галлюцинации (см.) бывают устрашающего характера. От них спасаются бегством или проявляют агрессию по отношению к тем, кто случайно попадается на глаза. При состоянии спутанности растерянно оглядываются вокруг, не узнают окружающих, в контакт вступают с большим трудом. Длительность острых интоксикационных психозов, вызванных гашишем, составляет от нескольких часов до нескольких дней. Первая стадия наркомании характеризуется психической зависимостью и проявляется возникновением потребности курить по 2–3 раза в день. При вынужденном перерыве картина абстиненции (см.) бывает стертой: астения, сонливость, угнетенное или раздраженное настроение, головная боль, неприятные ощущения в области сердца — все это немедленно исчезает после курения гашиша. Вторая стадия развивается при регулярном курении гашиша в течение 2–3 лет и характеризуется изменением картины опьянения, психопатизацией, а иногда и признаками физической зависимости. При физической зависимости перерыв в курении на сутки и более вызывает выраженный абстинентный синдром, длящийся около недели. Тяжелая астения и депрессия сочетаются с крайне неприятными ощущениями в разных частях тела (сенестопатии), сжимающими болями в области головы и сердца, тошнотой, спазмами в животе. Могут быть ознобы, проливные поты, мышечный тремор (дрожание), гипертонические кризы (см.). Позднее астения сменяется дисфорией — злобно-тоскливым настроением. Психопатизация у одних проявляется нарастающей апатией ко всему, кроме гашиша, у других — эксплозивностью (вспышки раздражения, злобы и агрессии). Нарастает общее истощение, у мужчин наступает импотенция (см.), у женщин — аменорея (см.). Хронические психозы при гашишной наркомании встречаются у 15 % многолетних курильщиков гашиша. Их картина обычно сходна с параноидной шизофренией (см.), бред преследования и воздействия сочетаются с апатией, безволием, бездеятельностью, реже — со слуховыми галлюцинациями (см.). Предполагается, что эти психозы возникают лишь у тех, кто предрасположен к шизофрении, а гашиш является провоцирующим фактором. Иногда у таких лиц гашишное опьянение с самого начала протекает атипично — с тревогой, подозрительным отношением к другим, в злом умысле обвиняют своих же приятелей, само действие гашиша принимают за умышленное отравление.
Эфедроновая и первитиновая наркомания Эфедрон изготовляется в подпольных лабораториях из лекарств, содержащих эфедрин (глазные капли, мази от насморка, содержащие эфедрин, средства для лечения бронхиальной астмы (см.)); производное первитина — гидрохлорид йодпервитин — входит в состав самодельного препарата, на сленге наркоманов называемого «ширкой». Самодельные препараты вводят внутривенно. Сначала появляются озноб, ощущение покалывания в руках и ногах, шевеление волос на голове, сердцебиение. Затем развивается состояние, напоминающее гипоманиакальное. Настроение повышено, ощущается душевный подъем, появляется уверенность в своих необычайных способностях и талантах. В отличие от опийной эйфории, возрастает активность, тянет к общению, приключениям. Говорят без умолку, очень быстро, перескакивая с одной темы на другую и оживленно жестикулируя. Отмечается легкость во всем теле («невесомость»). Обстановка вокруг становится необычно интересной. Появляется чувство безграничной любви ко всем людям. Резко усиливается половое влечение, возникает длительное половое возбуждение. Агрессивность нехарактерна, но может быть спровоцирована попытками ограничить активность или недоброжелательным тоном. Вегетативные нарушения сводятся к повышению артериального давления, тахикардии (см.), экстрасистолии. Глаза блестят, губы сохнут. Опьянение длится несколько часов и сменяется вялостью, быстрой утомляемостью, дурным самочувствием. Тяжелая физическая зависимость может появиться в течение нескольких недель. Абстиненция проявляется дисфорией — мрачным и злобным настроением. Сонливость сочетается с невозможностью уснуть, уснувшие пробуждаются от кошмарных сновидений. Вегетативные нарушения во время абстиненции резко выражены: мышечный тремор, чередование озноба и проливного пота, сжимающие боли в области сердца; мучительная задержка мочи, гиперакузия (субъективное усиление звуков) и светобоязнь удерживаются несколько суток и сменяются тяжелой астенией. Со временем нарастает истощение, развиваются миокардиодистрофия (см.), хронический гастрит (см.) и спастический энтероколит (см.), у мужчин — импотенция (см.), у женщин — аменорея (см.). При кустарном изготовлении эфедрона используется калия перманганат, в результате чего при длительном злоупотреблении присоединяются симптомы хронического отравления марганцем: хореиформные гиперкинезы (см.), парез (см.) мягкого неба, языка, лицевых мышц.
Кокаиновая наркомания Препараты приготовляются из листьев кустарника кока, растущего в Южной и Центральной Америке. Порошок кокаина закладывают в нос (через слизистую оболочку он быстро всасывается); «крэк» — устойчивый к высокой температуре препарат кокаина — курят. Отмечается маниакальноподобное опьянение с выраженной эйфорией, повышенной активностью, самоуверенностью, ощущением раскрытия своих творческих возможностей. Собственные мысли кажутся необыкновенно глубокими и интересными. Возникает половое возбуждение. Вегетативные нарушения умеренные, проявляются сердцебиением, расширением зрачков, повышением артериального давления. При передозировке наступает психотическое опьянение с тревогой, страхом, растерянностью. Кажется, что окружающие что-то замышляют, хотят расправиться, убить. Особенно характерны тактильные галлюцинации (см.) — ощущение ползания насекомых по телу (симптом Маньяна), которых ищут и ловят, а кожу расчесывают до крови. Реже слышат оклики по имени и звон в ушах. Сердечные аритмии (см.) сочетаются с приступами стенокардии (см.), случаются обмороки, коллапсы (см.), судорожные припадки. Смерть может наступить от внезапной остановки сердца. Относительно редко вслед за интоксикацией или во время нее появляются страх, тревога и растерянность или возникает кокаиновый делирий (см.) (наплыв ярких зрительных, слуховых и тактильных галлюцинаций, обычно устрашающих, которые больной принимает за реальность), кокаиновый онейроид (пассивное созерцание сценоподобных картин), кокаиновый параноид (внезапно, как озарение, вспыхивает бред (см.) преследования или ревности при сохраняющемся упорядоченном поведении, отчего поначалу окружающие могут верить высказываниям больного). Опьянение длится несколько часов и сменяется тяжелой астенией. Кокаиновые психозы могут продолжаться по несколько дней, а параноид — даже затягиваться на недели и месяцы. В последних случаях кокаин может выступать в качестве провокатора параноидной шизофрении (см.). Признаками наркомании являются выраженная психическая зависимость (постоянное влечение к кокаину), а при вынужденном перерыве — тяжелые дисфории со вспышками гнева, направленными на окружающих и на себя, когда больные могут совершать поступки, ведущие к самоубийству. Изменяется картина кокаинового опьянения: эйфории уже не бывает, кокаин служит лишь для того, чтобы предотвратить тяжелую дисфорию. Отчетливых признаков физической зависимости не появляется. Постепенно нарастают истощение, апатия, ослабевает память.
Барбитуромания Применяются аптечные снотворные — производные барбитуровой кислоты. Злоупотребление снотворными встречается нередко, но наркомания развивается далеко не у всех. Некоторые люди, страдающие бессонницей (чаще всего как одним из проявлений невроза), без снотворных не могут заснуть и принимают их годами. У них также развивается зависимость, но не наркоманическая, а истинная обсессивная. Нередко со временем они вынуждены увеличивать дозу снотворного в 2–3 раза. В этих случаях может обнаружиться эйфоризирующий эффект некоторых барбитуратов и создаться угроза для развития наркомании. Другую группу барбитуроманов составляют те, кто нарочно прибегал к большим дозам барбамила не для того чтобы уснуть, а чтобы испытать его эйфоризирующее и опьяняющее действие. С этой целью раствор барбамила может вводиться внутривенно. Картина опьянения напоминает алкогольную. Беспричинное веселье, беспорядочная активность, бесцеремонность, развязность легко сменяются гневом и драчливостью. Нарушается координация (шаткая походка, неустойчивость позы, несоразмерность движений). Характерны брадикардия (см.), понижение артериального давления и температуры тела, расширение зрачков. Через 1–3 ч наступает глубокий сон, затем слабость и вялость. При передозировке легко развиваются сопор и кома (см.), опасные для жизни из-за возможного паралича дыхательного центра. Развитие наркомании начинается с психической зависимости. Сроки ее появления различны. У тех, кто употреблял снотворное для борьбы с бессонницей, она может сформироваться через несколько лет; тем, кто старался достичь эйфории, достаточно бывает нескольких недель. Проявлением психической зависимости служит дневной прием барбитурата не для засыпания, а чтобы «успокоиться» или «повеселиться». Прием снотворного часто чередуют с алкоголем. При присоединении физической зависимости изменяется картина опьянения: оно становится дисфорическим, со злобной агрессией, стремлением к дракам, нанесению тяжких повреждений, разрушительным действиям. Абстинентный синдром при вынужденном перерыве в приеме барбамила бывает тяжелым. Озноб чередуется с проливным потом, а бессонница — с беспокойством. Наблюдаются судорожное сведение мышц, мелкое дрожание, подъем артериального давления, тахикардия (см.). Затем присоединяются боли в желудке, рвота, а также боли в крупных суставах. На 3—5-е сутки нередко возникают эпилептические припадки. В течение 1–2 недель удерживается депрессия (см.) с дисфорией и тревогой. При появлении судорожных припадков и при развитии делирия (см.) абстиненция становится опасным для жизни состоянием. Течение наркомании отличается довольно быстрым (на протяжении месяцев) развитием энцефалопатии и психоорганического синдрома. Резко снижается сообразительность, нарушается память, особенно на недавние события. Речь делается смазанной (дизартрия), движения — плохо координированными (атаксия), рефлексы снижаются. Лицо становится маскообразным, бледным, с землистым оттенком. Кожа покрывается гнойничковыми высыпаниями, раны долго не заживают. Настроение угнетенное и злобное. Нередко возникают мысли о самоубийстве. Прогноз весьма неблагоприятный из-за самоубийств, смертельных передозировок барбитуратов, тяжелой абстиненции.
Лечение и профилактика Неотложная помощь при передозировке наркотиков и способы прекращения абстиненции сводятся к следующему.
Опийная наркомания Применяются внутривенные вливания налорфина — антагониста опийных препаратов. При его отсутствии можно воспользоваться вливанием бемегрида — антагониста барбитуратов и стимулятора дыхания. Дезинтоксикация осуществляется общепринятыми способами. К средствам, вводимым капельно в вену, добавляют кофеин. Прекращение абстинентного синдрома оказывается необходимым при одномоментном отнятии наркотика. Постепенное снижение дозы наркотика, предотвращающее тяжелую абстиненцию, допускается только в том случае, если наркомания сочетается с органическими заболеваниями сердца, тяжелой гипертонической болезнью (см.) и перенесенным инфарктом (см.).
Каннабиноидная наркомания (гашишизм) При явлениях абстиненции проводят дезинтоксикацию, при астении используют сиднокарб, при депрессии (см.) — амитриптилин, при дистрофиях — карбамазепин.
Эфедроновая и первитиновая наркомания При абстиненции используют инъекции сибазона, дезинтоксикационные средства, добавляя при дисфории неулептил или сонапакс, при тревоге — хлорпротиксен, при бессоннице — феназепам. В качестве дезинтоксикации применяют гемодез и глюкозу.
Кокаиновая наркомания При передозировке — дезинтоксикация и назначение симптоматических средств. Абстиненцию прерывают капельными вливаниями амитриптилина и сибазона (седуксена).
Барбитуромания Дозу барбитуратов необходимо уменьшать постепенно на протяжении 1–2 недель из-за опасности эпилептических припадков и делирия (см.) при внезапной отмене. Интенсивная дезинтоксикация показана после полной отмены наркотика. Подавление влечения осуществляется с помощью психотропных средств (неулептил, сонапакс и др.), аверсионной терапии (сочетание наркотического и токсического опьянения с отрицательными стимулами — рвотой, страхом и т. д.), а также различных методов психотерапии, направленных на убеждение больного прекратить злоупотребление. Все эти методы недостаточно эффективны. При длительном злоупотреблении принято проводить дезинтоксикацию (тиосульфат натрия, унитиол, сульфат магния, глюкоза и др.) и общеукрепляющее лечение. При наличии зависимости лечение необходимо проводить в стационаре с режимом, исключающим тайное продолжение злоупотребления. Лечение наркомании в нашей стране является обязательным. При отказе по решению суда назначается принудительное лечение. Реабилитация страдающих наркоманией после лечения их в стационаре строится на длительном (в течение 5 лет) активном наблюдении в наркологических диспансерах, врачи которых содействуют трудоустройству больных, проводят повторные амбулаторные курсы общеукрепляющего лечения и психотерапию, а при угрозе рецидива используют психотропные средства. Профилактика основывается на двух методах — системе запретов и санитарном просвещении. Незаконное изготовление, приобретение, хранение, перевозка и пересылка наркотических средств наказываются как уголовное преступление; особенно строго (до 10 лет лишения свободы), если это делается с целью сбыта. Интенсивная борьба с подпольными торговцами наркотиками является самой действенной мерой профилактики наркоманий. Необходимы строгий контроль и учет медицинского использования наркотиков в онкологической, хирургической и другой практике, где они незаменимы. Санитарное просвещение в области наркоманий и токсикоманий представляет непростую задачу. С одной стороны, необходима популяризация знаний об опасности употребления наркотиков и других дурманящих веществ, высоком риске привыкания к ним, вреде для физического и психического здоровья. С другой стороны, высказывается опасение, что широкое распространение сведений о наркотиках может пробудить среди молодежи и особенно среди подростков нездоровый интерес к ним и способствовать злоупотреблению.
НЕВРИТЫ И НЕВРАЛГИИ
ОпределениеНевриты и невралгии — это поражения отдельных периферических нервов, обусловленные воздействием различных этиологических (причинных) факторов.Невралгия возникает при раздражении чувствительных волокон нерва. В отличие отневралгий, неврит характеризуется выраженными изменениями в нерве, захватывающими миелиновую оболочку (внутренняя часть глиальной оболочки нервного волокна, содержащая миелин) и осевой цилиндр. Чаще всего поражаются зрительный, тройничный, лицевой, слуховой, лучевой и седалищный нервы. Функция нервных стволов заключается в проведении импульсов как в центростремительном, так и в центробежном направлении. Признаки нарушения функции нерва (боли, парестезии, парезы (см.), вегетативные нарушения) появляются с самого начала, когда на вредное воздействие реагируют оболочечные элементы вокруг осевых цилиндров. Эта реакция выражается в демиелинизации (разрушении миелина), а также в пролиферации шванновских клеток. Лишь при далеко зашедших процессах происходит распад осевых цилиндров. В связи с этим выделяют демиелинизирующие и аксональные невропатии. В клинической практике заболевания периферической нервной системы принято делить на невропатии и невралгии. При невропатиях имеются явные анатомические изменения в нервных стволах, поэтому клинически отмечаются симптомы выпадения: снижение силы, похудение мышц, угнетение рефлексов, снижение чувствительности. При невралгиях анатомические изменения менее выражены или отсутствуют, преобладают явления раздражения нерва, что клинически характеризуется приступами сильных болей, которые могут сочетаться с повышением рефлексов, извращением чувствительности и вегетативными расстройствами.
Этиология и патогенез Происхождение заболеваний периферической нервной системы весьма разнообразно: — инфекция (вирусы, бактерии, токсины); — токсические экзогенные (поступающие извне) вещества (растворители, соли тяжелых металлов, углеводороды, промышленные яды, лекарственные препараты); — нарушения обмена веществ (сахарный диабет (см.), дефицит витаминов B1 и B6, болезни крови, рвота беременных, уремия (см.)); — аллергены и аутоантигены; — травма (в результате механического, компрессионного, электрического или радиационного воздействия); — нарушения микроциркуляции; — опухоли (см.); — наследственные факторы; — узость костных каналов, через которые проходят нервы, а также сдавление корешков нерва остеофитом (костным разрастанием) или грыжей межпозвонкового диска. В развивающихся странах Азии, Африки и Латинской Америки нередко встречаются невралгии и невриты авитаминозно-дистрофического происхождения, а в развитых странах (США, Франция, Швеция, Великобритания, Германия и др.) подобная патология наблюдается в связи с длительным и бесконтрольным применением лекарственных средств (химиопрепараты, нейролептики, снотворные). Немаловажное значение имеет сосудистая патология — атеросклероз (см.), артериальная гипертензия (см.), вегетососудистая дистония. Невралгии и невриты чаще развиваются при сочетании нескольких причинных факторов (инфекция или охлаждение на фоне узости костного канала и т. д.). Механизм развития невралгий и невритов сложен и обусловлен главным образом токсическими, обменными и сосудистыми нарушениями в нерве, сдавлением нерва или образующих его корешков. При инфекциях, интоксикациях, авитаминозах (см.), дистрофиях (см.) нарушаются обменные процессы, затрагивающие и периферические нервные волокна. При этом обычно возникают сосудодвигательные расстройства с дисциркуляцией в артериях и артериолах, питающих тот или другой нерв. Непосредственное поражение периферического нерва инфекционно-воспалительными процессами по его ходу иногда наблюдается при таких заболеваниях, как сифилис (см.), проказа (см.), ревматизм (см.), бруцеллез (см.). Выделяют невралгии и невриты отдельных черепных и периферических нервов (зрительного, лицевого, срединного, малоберцового и т. п.). В зависимости от темпа развития симптомов невралгии и невриты разделяют на острые, подострые и хронические; в зависимости от происхождения — на инфекционные, токсические, травматические, ишемические, авитаминозно-дистрофические, аллергические и обусловленные охлаждением. В диагностике невралгий и невритов принято отражать остроту развития, факторы возникновения, уровень поражения и степень функциональных расстройств (например, остро развившийся неврит левого лицевого нерва с инфекционной (постгриппозной) этиологией и нижней ветви).
Клиническая картина Невропатия — это поражение отдельных периферических нервов, проявляющееся нарушением их функций. При невропатии патоморфологические изменения захватывают не только оболочку, но и осевой цилиндр. Симптоматика заболевания зависит от функции периферических нервов. Поскольку большинство из них имеют в своем составе двигательные, чувствительные и вегетативные волокна, то при невропатиях отмечается сочетание парезов (см.) и атрофий (см.), наблюдается выпадение всех видов чувствительности и регистрируются вазомоторнотрофические расстройства. Чаще всего невропатия начинается с болей и парестезий (неприятные ощущения онемения, покалывания, жжения и т. д.). Сначала выпадает поверхностная чувствительность, а позже возникают периферические парезы. Невралгия — это заболевание, проявляющееся кратковременными приступами сильных болей в зоне иннервации нерва в результате его раздражения. Боли носят стреляющий, колющий, жгучий характер, возникают спонтанно и сопровождаются вегетативными реакциями. При обследовании выявляются болезненность в местах выхода нервных стволов, нарушения чувствительности в виде гиперестезии, гиперпатии или гипестезии, снижение рефлексов. Наиболее часто встречается невралгия тройничного, языкоглоточного и межреберных нервов. Поскольку большинство нервов имеют в своем составе двигательные, сенсорные и вегетативные волокна, при невритах отмечаются сочетание парезов и атрофии мышц, выпадения поверхностной и глубокой чувствительности (в зоне автономной иннервации) и вазомоторно-трофические расстройства, хотя возможна и избирательность нарушений. Несколько большая «специализация» отмечается у черепных нервов: в их составе есть нервы, выполняющие преимущественно двигательную (III, IV, VI, VII, XI, XII пары), сенсорную (I, II, V, VIII пары) или вегетативную (X пара) функции. Отдельные формы невралгий и невритов проявляются следующим образом. 1. Обонятельный нерв — односторонняя аносмия (отсутствие обоняния). Изредка могут быть явления раздражения — ощущение несуществующих запахов. 2. Зрительный нерв — снижение остроты и изменение поля зрения (скотома, сужение). На глазном дне в зависимости от стадии, формы и происхождения заболевания отмечаются воспалительные изменения, отек, белая или серая атрофия (только при ретробульбарном неврите оно обычно нормально). На первом этапе могут быть явления раздражения в виде фотопсий (ощущение света, пламени, искр и т. п.). 3. Глазодвигательный нерв — опущение века (птоз), ограничение подвижности глазного яблока кнутри, вверх и частично вниз, расширение зрачка, диплопия (двоение в глазах). 4. Блоковый нерв — ограничение подвижности глазного яблока вниз и в небольшой степени кнаружи. Самый ранний симптом — двоение при взгляде вниз. 5. Тройничный нерв — кратковременные (1–2 мин) приступы интенсивных болей в области II–III, реже I ветвей нерва (невралгия). Они могут провоцироваться приемом пищи, разговором, прикосновением к высокочувствительной зоне. Отмечается болезненность точек выхода ветвей нерва — супра-, инфраорбитальной или медиальной; при неврите отмечаются длительные боли, выпадение чувствительности на лице. 6. Отводящий нерв — невозможность отвести глаз кнаружи. Больные жалуются на двоение при взгляде в сторону пораженной мышцы. 7. Лицевой нерв — парез (см.) или паралич (см.) всех мимических мышц половины лица. Больной не может закрыть глаз и наморщить лоб, оскалить зубы, надуть щеки. Угол рта опущен, носогубная складка сглажена, бровь приподнята. При попытке зажмурить глаз глазное яблоко перемещается кверху и кнаружи (симптом Белла). Нередко параличу предшествуют боли у сосцевидного отростка или на половине лица. 8. Слуховой нерв — нарастающее снижение слуха, иногда сопровождающееся ощущением шума и звона в ухе. 9. Языкоглоточный нерв — приступообразные боли в области миндалин, корня языка, глотки (при невралгии), гипестезия (пониженная чувствительность) и расстройства вкуса на задней трети языка, нарушение слюноотделения и глотания. 10. Блуждающий нерв — боли в ухе, нарушения глотания и речи. На стороне поражения мягкое небо опущено, язычок отклонен в здоровую сторону, глоточный рефлекс отсутствует. В случае вовлечения вегетативных волокон нерва наблюдаются нарушения в работе внутренних органов — брадикардия (см.), одышка, расстройства моторики пищевода, желудка и кишечника (спазмы), отек легких (см.) и т. п. 11. Добавочный нерв — ограничение поворота головы в здоровую сторону, голова несколько приведена в сторону пораженного нерва, плечо опущено. 12. Подъязычный нерв — отклонение языка в сторону пораженного нерва, атрофия и фибриллярные подергивания на этой половине языка. 13. Диафрагмальный нерв — боли в подреберье со смещением в шею и плечо, ощущение нехватки воздуха, одышка, икота. 14. Подкрыльцовый нерв — боли в области плечевого сустава, невозможность поднять руку горизонтально, атрофия и снижение чувствительности в области наружно-верхней части плеча. 15. Срединный нерв — нарушение сгибания кисти, I, II и III пальцев, а также чувствительности на лучевой стороне ладони и на трех с половиной пальцах. Из-за того что большой палец не сгибается и не может быть противопоставлен, кисть приобретает характерный вид «обезьяньей лапы». Больной может удержать лист бумаги между указательным и большим пальцами руки только в том случае, если он выпрямит и приведет палец (тест Деку). Часто имеют место вазомоторнотрофические расстройства (синюшность кожи, ломкость ногтей, гиперкератоз). Если поражение нерва обусловлено сдавлением его ствола в тесном канале, то при поколачивании по этой области возникают боли и парестезии в первых трех пальцах (синдром Тинеля). 16. Локтевой нерв — слабость сгибателей IV, V и отчасти III пальца, затруднение их приведения, атрофия межкостных мышц («когтистая лапа»), нарушение чувствительности на ульнарной стороне ладони (IV и V пальцы) и на ее тыле (IV и V пальцы). Если попросить больного удерживать лист бумаги между большим и указательным пальцами рук, то на больной стороне вместо приведения большого пальца отмечается сгибание его концевой фаланги (тест Фромана); если свести вместе пальцы рук, положенных на стол, то на стороне поражения IV и V пальцы привести к средней линии не удается (тест Питра). 17. Локтевой нерв — нарушение разгибания кисти и пальцев, в результате чего рука приобретает характерное положение («висячая кисть»), нарушение чувствительности на лучевой половине тыла кисти (I и II пальцы). Больной не может отвести большой палец, с трудом разводит остальные пальцы. 18. Межреберные нервы — боли в межреберье. Отмечается болезненность паравертебральных (околопозвонковых), аксиллярных (подмышечных) и стернальных (грудинных) точек выхода веточек нервов, иногда наблюдается легкая гиперестезия. 19. Наружный кожный бедренный нерв (болезнь Рота-Бернгардта) — боли, онемение и жжение по наружной поверхности бедра, которые усиливаются при стоянии и ходьбе. В верхней трети боковой поверхности бедра определяется полоска гиперестезии. 20. Бедренный нерв — нарушение разгибания голени в коленном суставе и сгибания бедра, атрофии по передней поверхности бедра. Коленный рефлекс снижается или выпадает. Боли и нарушения чувствительности определяются на нижних 2/3 передней поверхности бедра и на передневнутренней поверхности голени. 21. Седалищный нерв — боли по задней поверхности бедра и задненаружной поверхности голени, слабость сгибателей и разгибателей стопы, дряблость ягодичных мышц и опущение ягодичной складки на стороне поражения. При преимущественном вовлечении большеберцового нерва наблюдаются следующие симптомы: стопа разогнута, а согнуть ее больной не может. Вследствие преобладания тонуса разгибателей стопа приобретает специфическую форму, выпадает ахиллов рефлекс, больной не может «встать на пальцы». Чувствительность нарушена на задней поверхности голени и на подошве. У больных с поражением малоберцового нерва наблюдаются следующие симптомы: невозможность стояния на пятках и разгибания стопы, она свисает, поэтому больной при ходьбе вынужден высоко поднимать ногу над землей («петушиная походка»). Чувствительность расстроена по наружной поверхности голени и на тыле стопы. 22. Носоресничный узел — герпетические высыпания на коже носа, лба, явления кератита (см.) или ирита (см.) с преимущественной локализацией болей в области глаза и смещением в нос, болезненность при прощупывании внутреннего угла глазницы. 23. Крылонебный узел (синдром Сладера) — боли в области глаза, челюсти, зубов, распространяющиеся на язык, мягкое небо, ухо, шейно-лопаточную зону. Иногда возникает ритмичное сокращение мягкого нёба, проявляющееся цокающим звуком. После приступа — парестезии на больной половине лица и шум в ухе. Необходимо дифференцировать с невралгией тройничного нерва, при которой приступ длится секунды, обостряется в период разговора и жевания, а вегетативные нарушения не так отчетливы.
Лечение, прогноз и профилактика Терапия должна строиться с учетом происхождения заболевания, клинических особенностей невралгии и неврита. В случаях бактериального происхождения показаны антибиотики и сульфаниламиды; вирусного — интерферон, специфические сыворотки и гамма-глобулин; токсического — дезинтоксикационные препараты (реополиглюкин, унитиол, тиосульфат натрия), специфические антидоты; ишемического — вазоактивные средства (стугерон, эуфиллин) и т. д. Для прекращения болей применяют анальгетики, электрофорез с новокаином, токи Бернара, иглоукалывание. Высокоэффективны средства лечения невралгии тройничного нерва — противосудорожные препараты, прежде всего — карбамазепин (тегретол, финлепсин), которые дают по 0,2 г 3–4 раза в день. В остром периоде травматического неврита рекомендуется неподвижность конечности. С первых дней заболевания широко применяют витамины группы B (B1, B3, B6, В12), C, E. Регресс двигательных выпадений можно ускорить, применяя антихолинэстеразные препараты (прозерин, нивалин) или биогенные стимуляторы (алоэ, ФИБС). В случае инфекционно-аллергических невритов хороший результат наблюдается при добавлении к лечению кортикостероидов (преднизолон). Медикаментозное лечение должно сочетаться с физиотерапией, а также массажем и лечебной гимнастикой. Травматические невриты, невралгию тройничного нерва и неврит лицевого нерва лечат, кроме того, и хирургически. Если консервативная терапия в течение 3–4 месяцев не дает признаков восстановления функций, то производят ревизию места травмы — рассечение спаек, сшивание нерва, замещение дефекта гомотрансплантатом и т. д. При невралгии тройничного нерва прибегают к алкоголизации ветвей нерва, ретрогассеральной перерезке корешка нерва, трактотомии и т. п. При неврите лицевого нерва — к вскрытию фаллопиева канала, иногда к наложению анастомоза с XII и XI парой нервов. Результаты операции по наложению шва зависят от времени: если она произведена в первые 3–5 месяцев после травмы, выздоровления или значительного улучшения удается достичь почти у 90 % больных, если спустя 1–2 года — то только у 30–40 %. При неэффективности хирургического вмешательства на периферическом нерве можно выполнить ортопедическую операцию (пересадка или ушивание сухожилий и др.). Прогноз определяется формой, происхождением и тяжестью невралгии и неврита, а также своевременностью и объемом проведенных лечебных мероприятий. У значительного большинства больных отмечается полное или почти полное восстановление функции пострадавшего нерва. Случаи рецидивирующего течения, частичного или плохого восстановления функций наблюдаются при невралгии тройничного нерва, невритах лицевого нерва, травматических и авитаминозно-дистрофических невритах срединного, локтевого, малоберцового и некоторых других нервов. Это может приводить к длительной нетрудоспособности, а в отдельных случаях и к инвалидности. Профилактика невралгий и невритов основана на ранней диагностике и активном лечении общих инфекций, интоксикаций, авитаминозов, защите от переохлаждений, травм и т. п.
НЕВРОЗЫ
ОпределениеНеврозы — психогенные нервно-психические расстройства, вызванные воздействием психотравмирующих обстоятельств, проявляющиеся в специфических эмоционально-аффективных и соматовегетативных клинических феноменах. К неврозам относят только те заболевания, при которых обратимость нервно-психических расстройств сочетается с отсутствием видимых патоморфологических изменений в нервной системе.
Этиология и патогенез Любой невроз — это прежде всего психогения, т. е. следствие нервно-психических перенапряжений и конфликтов (несправедливость, материальные потери, утрата близких, непризнание заслуг, предание суду, измена жены или мужа и др.). Иными словами, невротическая реакция возникает лишь при том условии, когда на личность воздействует подходящий для нее ключевой раздражитель. Второй важнейший фактор — фенотипические особенности личности, которые складываются под влиянием наследственности и воспитания. По О. В. Кербикову, неврастеник-гиперстеник чаще формируется в условиях безнадзорности, неврастеник-гипостеник — в условиях притеснений («золушка»), страдающие истерией (см.) — в условиях чрезмерного внимания близких (кумир семьи) и т. д. У лишенного каких-либо невротических черт человека под воздействием чрезмерных нервно-психических перегрузок могут возникнуть неврастенические нарушения, реактивное состояние или вегетоневроз; однако без определенных конституциональных (преморбидных) особенностей личности обычно не развиваются такие виды неврозов, как истерия (см.) или невроз навязчивости. В качестве факторов риска неврозов следует назвать физическое перенапряжение, соматические болезни, травмы, неблагополучие в семье, профессиональную неудовлетворенность, злоупотребление алкоголем, бесконтрольное употребление транквилизаторов. Важное место в течении неврозов занимают изменения вегетативно-эндокринной системы и гомеостаза, обусловленные тесными связями психоэмоциональной сферы с высшими вегетативными центрами.
Клиническая картина Для неврозов характерны следующие признаки: наличие психогенной причины заболевания, связанной с межличностным конфликтом; преобладание эмоциональных, соматогенных нарушений; обратимость этих нарушений. К неврозам относят только те заболевания, при которых обратимость нервно-психических расстройств сочетается с отсутствием видимых патоморфологических изменений в нервной системе. Предложено много различных классификаций неврозов. Наиболее удачно разделение всех неврозов по форме на неврастению, истерию (истерический невроз), невроз навязчивых состояний, двигательные и вегетативные неврозы и неврозоподобные состояния (или синдром невроза); по течению — на реактивное состояние (невротические реакции), острый невроз и невротическое развитие. Неврастения — нервное истощение, переутомление. Проявляется сочетанием повышенной раздражительности и утомляемости. Характерны неадекватные реакции на небольшие раздражители и неумение их подавить, т. е. расстройства касаются прежде всего сферы эмоций. Могут раздражать яркий свет, слишком громкий разговор, включенное радио и т. п.; нередко все это служит поводом для очередного конфликта — вспышки гнева, грубости. Постоянные головные боли, ощущение тяжести в голове («голову распирает»), кажется, что на нее «надет обруч или каска» («каска неврастеников Шарко»). Много жалоб и симптомов, свидетельствующих о дисфункции вегетативной нервной системы: потливость, тахикардия (см.), плохой аппетит, вздутие живота, запоры (см.), учащенные позывы на мочеиспускание, плохой сон. В зависимости от преобладания возбуждения (раздражительность, вспыльчивость, гневливость) или астении (вялость, пониженное настроение) неврастению принято разделять на две формы — гиперстеническую (или раздражительную) и гипостеническую (или депрессивную). Истерия (истерический невроз) — более сложный невроз, его основу составляют особенности поведения, зависящие от повышенной эмоциональности и внушаемости. Чаще болеют женщины в возрасте 20–40 лет. Одна из главных черт поведения больных истерией — стремление быть предметом внимания окружающих, вызвать удивление, восхищение, зависть и т. д. Это достигается крикливой манерой одеваться, рассказами о своем якобы необыкновенном прошлом, трагических событиях и заболеваниях. Настроение в течение дня много раз меняется — от плохого и подавленного до чрезмерно радостного и даже восторженного. Повышенная эмоциональность влияет на все суждения и оценки — они крайне неустойчивы и переменчивы (так называемая аффективная логика). Частый симптом истерии — псевдоорганические сенсомоторные нарушения: анестезии по гемитипу или ампутационному типу (не соответствующие анатомическим законам распределения чувствительности), параличи или парезы (без симптомов центрального или вялого паралича), астазия-абазия — невозможность стоять и ходить (без парезов (см.) и нарушений координации), слепота или сужение полей зрения (без изменений на глазном дне и без натыкания больного на предметы) и т. д. Важно отметить, что вся эта симптоматика развивается обычно под влиянием вида других больных, разговоров врачей, прочитанного или услышанного, т. е. по механизму поражения. Невроз навязчивых состояний характеризуется обсессивно-фобическими проявлениями и общеневротическими симптомами. Чаще всего в клинической картине заболевания встречаются кардиофобия — навязчивый страх заболевания сердца, канцерофобия — страх заболеть раком (см.), клаустрофобия — боязнь закрытых помещений, агорафобия — боязнь открытых пространств и т. д. Нередко у одного и того же больного указанные фобии возникают в различных сочетаниях или последовательно сменяют друг друга. Более редкие проявления невроза навязчивых состояний — навязчивые мысли, воспоминания, а иногда движения и действия (ритуалы). Ритуалы сопровождаются навязчивыми сомнениями, опасениями, страхами. Больные таким неврозом обычно критичны к своему состоянию, собранны и стараются самостоятельно бороться со своим недугом. Из общеневротических симптомов у них чаще всего отмечаются снижение настроения (особенно во время обострения болезни), раздражительность, плохой сон. Иногда больные становятся тревожно-мнительными, что сближает их с лицами, страдающими психастенией, однако эти изменения характера обратимы. Двигательные неврозы — это локальные двигательные расстройства: тики, заикание (см.), профессиональные судороги (писчий спазм) и т. д. Они возникают обычно на фоне других неврастенических нарушений — повышенной раздражительности, утомляемости, головной боли, плохого сна и т. п. Вегетативный невроз (вегетативная дистония) — избирательное нарушение функций внутренних органов. Чаще наблюдаются нарушения сердечно-сосудистой (тахикардия (см.), повышение артериального давления, бледность, потливость), пищеварительной (отсутствие аппетита, ощущение полноты в желудке, тошнота, спазмы) или дыхательной (одышка, чувство сдавления и стеснения в груди) системы. Эти симптомы обычно сочетаются с другими проявлениями неврастении. К неврозоподобным состояниям относят преходящие, главным образом — неврастенические нарушения, обусловленные общесоматическими заболеваниями, инфекциями, интоксикациями и травмами. Нервно-психические и вегетативные расстройства в этих случаях обычно менее ярки, течение их зависит от основного заболевания. Невроз страха (тревоги) в отечественных монографиях не описан, а состояния страха описывались как симптомы, которые могут встречаться при различных неврозах, гипоталамических нарушениях и психозах. Основной симптом заболевания — появление чувства тревоги или страха. Чаще всего оно возникает остро, внезапно, реже — медленно, постепенно усиливаясь. Возникнув, это чувство не покидает больного в течение всего дня и держится нередко неделями или месяцами. Интенсивность его колеблется между легким чувством тревоги и выраженным страхом, сменяющимся приступами ужаса. Страх некондиционален (в чем, как мы увидим, заключается его основное отличие от фобий), т. е. он не зависит от какой-либо ситуации или каких-либо представлений, является немотивированным, бессодержательным, лишенным фабулы («свободно витающий страх»). Страх первичен и психологически понятным образом невыводим из других переживаний. Нередко под влиянием страха возникают тревожные опасения, психологически понятно с ним связанные. Они нестойки, а степень их интенсивности зависит от силы страха. Иногда в зависимости от содержания тревожных опасений больные принимают те или иные меры «защиты», более или менее адекватные содержанию опасения, например просят не оставлять их одних, чтобы было кому помочь, если с ними случится «что-то страшное», или избегают физической нагрузки, если опасаются за состояние сердца, просят спрятать острые предметы, если появляется опасение сойти с ума (ритуалов при этом не возникает). Состояние страха может периодически резко усиливаться, сменяясь приступами ужаса с немотивированным страхом или чаще всего с ожиданием смерти, например «от паралича сердца», «кровоизлияния в мозг» и т. д. В связи с преобладанием чувства тревоги или страха больные отмечают невозможность сосредоточиться на какой-либо деятельности, повышенную возбудимость, аффективную неустойчивость. Временами они тревожны, ажитированы (возбуждены), ищут помощи. Нередко у них отмечаются тягостные и неприятные ощущения в области сердца или верхней части живота, придающие чувству страха витальный оттенок. Артериальное давление в период болезни у больных остается в пределах нормы или на нижней ее границе. На высоте аффекта оно несколько повышается. В это время отмечаются учащение сердцебиений и дыхания, сухость во рту, иногда учащение позывов на мочеиспускание. Во время болезни аппетит снижен. В связи с постоянным чувством тревоги и снижением аппетита больные часто худеют, хотя и не очень резко. Половое влечение обычно понижено. У многих отмечаются трудность засыпания, тревожный сон с кошмарными сновидениями. Особым вариантом невроза страха является так называемый аффективно-шоковый невроз, или невроз испуга. Сверхсильными раздражителями, вызывающими невроз, обычно являются сигналы о серьезной угрозе жизни или благополучию больного, например сигналы, поступающие во время землетрясения, в боевой обстановке, а также при виде неожиданной гибели близкого человека. Чрезвычайная сила психической травмы зависит в основном не от физической мощности раздражителя (силы звука, яркости вспышки света, амплитуды качания тела), а от информационного значения, от того, в какой степени оно вызывает «рассогласование между фактической ситуацией и прогнозируемой». Неврозы эти чаще всего возникают у лиц со слабым типом нервной системы, а также с недостаточной подвижностью нервных процессов. На основании опыта военного времени выделены следующие пять форм аффективно-шоковых неврозов: простая, ажитированная, ступорозная, сумеречная, фугиформная. Простая форма характеризуется замедлением течения психических процессов и рядом соматовегетативных расстройств, свойственных аффекту испуга. Во всех случаях заболевание наступало остро вслед за действием шоковой психической травмы — раздражителя, сигнализировавшего о большой опасности для жизни. Наибольшая выраженность явлений возникала сразу или через несколько часов после действия патогенного раздражителя. Развивались соматовегетативные расстройства, свойственные аффекту испуга, но более резко и длительно выраженные. Наблюдались бледность лица, учащение сердцебиения, колебания артериального давления, учащение или поверхностный характер дыхания, учащение как позывов, так и самих актов дефекации и мочеиспускания, гипосаливация (пониженное слюноотделение), потеря аппетита, похудение, дрожание рук, коленей, чувство слабости в ногах. Со стороны психической сферы отмечалась легкая замедленность словесно-речевых реакций и мыслительных процессов. Ответы на вопросы (независимо от их содержания) давались с некоторой задержкой. Перечисление соподчиненных понятий проводилось медленно, скрытый период речевых реакций был удлинен (в среднем 1–2 с вместо 0,1–0,2 с в норме). Постепенно больные становились активнее, течение словесно-речевых реакций и мыслительных процессов у них ускорялось, уменьшались вегетативные расстройства, исчезало тягостное ощущение в груди. Дольше всего держались нарушения сна в виде кошмарных сновидений и двигательно-речевого беспокойства во время сна. Повторение ситуации, вызвавшей заболевание (действие условно-рефлекторных раздражителей, близких или аналогичных тем, которые вызвали заболевание, но менее интенсивных), у некоторых больных вызывало появление тягостного чувства в области сердца, легкого вздрагивания или рецидивов эмоции страха. Ажитированная форма характеризуется развитием тревоги и двигательного беспокойства, замедлением словесно-речевых реакций и мыслительных процессов и вегетативными нарушениями, свойственными простой форме. Особенно легко возникает невроз испуга у детей. Он чаще всего встречается у детей младшего возраста или детей инфантильных, с задержкой умственного развития. Заболевание могут вызвать новые, необычного вида раздражители, не оказывающие патогенного действия на взрослых, например человек в вывернутой шубе или маске, резкий звуковой, световой или другой раздражитель (гудок паровоза, неожиданное нарушение равновесия тела и т. п.). У более старших детей испуг нередко вызывается сценой драки, видом пьяного человека, угрозой избиения хулиганами. В момент испуга часто отмечаются кратковременные ступорозные состояния с мутизмом (оцепенением) или состояния резкого двигательного возбуждения с дрожанием. Далее обнаруживается страх перед испугавшим раздражителем или тем, что с ним связано. У маленьких детей может наступить утрата ранее приобретенных умений и навыков, например утрата функции речи, навыков опрятности, умения ходить. Иногда дети начинают грызть ногти, онанировать. Течение заболевания в большинстве случаев благоприятное, нарушенные функции восстанавливаются. У детей старше 5–7 лет пережитый испуг может привести к формированию фобий, т. е. невроза навязчивых состояний. Невроз ожидания выражается в затруднении выполнения той или иной повседневной функции вследствие навязчивого опасения неудачи. Основным и первичным является тревожное опасение невозможности выполнения функции, вторичным — сама невозможность ее выполнения. Невроз этот может наблюдаться как в рамках психастении, так и неврастении. Особенностью данного невроза является то, что навязчивое опасение ведет к нарушению какой-либо повседневной функции; возникшие же расстройства этой функции усиливают опасения невозможности ее выполнения, создавая так называемый «порочный круг». Исходным пунктом для развития заболевания является нарушение функции, вызванное какой-либо причиной, например травмой, инфекцией или интоксикацией. В дальнейшем представления о предстоящем выполнении этой функции начинают вызывать опасения невозможности ее выполнения. Возникает чувство тревожного ожидания неудачи. Представление о возможной неудаче при выполнении этой функции по механизму самовнушения приводит к торможению функции, к ее дезавтоматизации, а неудачная попытка, в свою очередь, ведет к еще большему закреплению возникшего ранее нарушения. Заболевание может возникнуть в любом возрасте, особенно часто в детском. Болеют как мужчины, так и женщины. Чаще всего оно возникает у тревожно-мнительных, боязливых, эмоционально неустойчивых субъектов. Способствуют его возникновению травмы, инфекции, интоксикации, сосудистые заболевания головного мозга, нарушения питания, длительное недосыпание и другие вредности. Клинические проявления заболевания выражаются в возникновении тревожного ожидания невозможности выполнения и нарушения способности выполнения какой-либо одной из повседневных функций (речи, ходьбы, письма, чтения, игры на музыкальном инструменте, сна, половой функции). Нарушение речи может возникнуть, например, после неудачного публичного выступления, во время которого под влиянием взволновавшей больного обстановки наступило торможение функции речи. В дальнейшем появляется чувство тревожного ожидания неудачи при необходимости публичного выступления, а в случаях генерализации расстройства — при выступлении в любых необычных условиях или обстановке, вызывающей эмоциональную реакцию (например, на экзамене). Некоторые формы заикания (см.), несомненно, относятся к неврозу ожидания. Аналогичным образом падение при попытке начать ходить после перенесенной травмы ноги или вследствие головокружения у больного с сосудистым заболеванием головного мозга может в дальнейшем привести к нарушению акта ходьбы. К проявлениям невроза ожидания у детей старшего возраста и подростков относится так называемый страх устных ответов в классе. Последний сопровождается невозможностью связно изложить материал при вызове к доске, несмотря на то что он хорошо подготовлен. Невозможность уснуть, вызванная возникновением эмоций страха, радости, печали или какой-либо другой причиной, может привести к возникновению тревожного ожидания нарушения функции сна и затруднению засыпания. Несомненно, что импотенция (см.) у мужчин, проявляющаяся в исчезновении эрекции «в самый ответственный момент», вызванная тревожным ожиданием неудачи, является самой частой формой этого заболевания. Дифференцировать невроз ожидания приходится главным образом с истерией и фобиями при неврозе навязчивых состояний (истерические припадки, параличи при истерии). Основное отличие фобий от невроза ожидания заключается в том, что при фобии больной может выполнять функцию, но боится это сделать; при неврозе ожидания нарушено само выполнение функции. Ипохондрический невроз. Под ипохондрией понимается болезненная сосредоточенность внимания на своем здоровье со склонностью приписывать себе заболевания по незначительному поводу. При этом легко возникают различные тягостные ощущения в тех или иных частях тела (сенестопатии). Античные врачи связывали это состояние с областью подреберья (ипохондрия), отсюда и произошло название. Для ипохондрического невроза характерно преобладание в клинической картине реактивно возникших тревожных опасений по поводу своего здоровья при отсутствии для этого достаточных оснований. Такие опасения чаще всего возникают у лиц тревожно-мнительных или астенических, отличающихся повышенным беспокойством за свое здоровье. Воспитание, при котором ребенку прививается чрезмерная забота о здоровье, может способствовать возникновению болезни. Поводом для появления ипохондрических идей могут стать рассказ о чьей-либо болезни или смерти, незначительное соматическое заболевание, перенесенное больным, или возникшие у него вегетативные нарушения (тахикардия (см.), потливость, чувство слабости) после, например, алкогольной интоксикации, неумеренного употребления кофе или чая, перегревания, а также сексуального эксцесса. Тревога у некоторых эмотивно-неустойчивых личностей может вызывать такие компоненты эмоции страха, как сердцебиение, стеснение в груди, сухость во рту, тошнота, нарушения со стороны желудочно-кишечного тракта и др. Последние, в свою очередь, могут явиться поводом для ипохондрической переработки. Весьма характерны для ипохондрического невроза психогенно обусловленные болевые или сенестопатические ощущения. Существуют лица, у которых такие ощущения, порой яркие, могут возникать под влиянием представлений. Эти люди реально испытывают боль или необычные ощущения (мурашки, покалывание, жжение в той или иной части тела). Одной из причин ипохондрического невроза у женщин является половая дисгармония (дисгамия). В качестве особой подгруппы ипохондрического невроза выделяют ипохондрическую депрессию (см.). Больные при этой форме жалуются на боли или тягостные ощущения в области желудка, головы, груди, конечностей или других частей тела, а также на чувство слабости, усталости, иногда тревоги. Постепенно нарастает чувство безнадежности, появляются мысли о самоубийстве, которые больные могут скрывать. Пониженное настроение трактуют как психологически понятную реакцию на якобы имеющееся тяжелое заболевание либо на наступившее падение работоспособности, невозможность усвоения нового материала. В действительности же пониженное настроение порождает у них ипохондрические представления, они являются его следствием, как это характерно для неврозов. Оно первично и невыводимо из других переживаний. Длительность эндогенных ипохондрических депрессий (см.) больных колеблется от 6 месяцев до 3 лет.
Лечение и профилактика Существует много способов лечения неврозов. Чаще всего применяют индивидуальную и групповую психотерапию, отдых, выключение из среды, спровоцировавшей заболевание, а также общеукрепляющие и психотропные препараты. В зависимости от формы и тяжести невроза их используют в различных комбинациях. Всегда важно во время беседы с больным вскрыть причину, травмирующую нервно-психическую сферу больного, попытаться устранить ее или, используя различные приемы психотерапии, уменьшить ее значимость. В случаях неврастении, невроза навязчивых состояний, вегетоневроза и неврозоподобных реакций применяют преимущественно метод рациональной психотерапии (психотерапия убеждением). При лечении истерии и двигательных неврозов чаще используют метод внушения как в бодрствующем состоянии, так и в состоянии гипноза. Довольно широко применяют аутогенную тренировку. Врач подбирает нужные словесные формулы, и в дальнейшем (через 2–3 сеанса) больной уже самостоятельно повторяет их про себя в течение 15–20 мин. Аутотренинг лучше проводить 2 раза в день — утром и вечером в отдельной комнате. Больной должен лечь на кушетку или сесть на стул и полностью расслабиться. Сеанс самовнушения начинают чаще с таких формул: «Я спокоен, я отдыхаю, я совершенно спокоен. Все мои мышцы расслаблены, я чувствую тяжесть и тепло в конечностях, они тяжелеют и тяжелеют все быстрее и больше. Моя нервная система находится в состоянии глубокого лечебного отдыха и покоя» и т. д. Далее следуют формулы, направленные на различные неполадки — раздражительность, головную боль, плохой сон, потливость, ощущение сдавления в грудной клетке, одышку и т. п. Завершить сеанс следует расширенной формулой спокойствия: «Я становлюсь все спокойнее и спокойнее, увереннее в себе. Я спокоен и впредь буду спокоен, выдержан, уверен в себе» и т. д. Большинство неврозов можно лечить амбулаторно (лучше с последующим отдыхом в санаторно-курортных условиях). Определяя срок больничного листа, следует учитывать, что для многих больных участие в труде является одним из основных методов лечения. Тяжелые формы истерии, двигательных неврозов требуют стационарного лечения. Прогноз зависит от формы невроза и возраста больных. Он наиболее благоприятен в отношении неврастении, вегетативного невроза и неврозоподобных состояний (если последние не вызваны тяжелым и продолжительным соматическим заболеванием). Труднее поддаются лечению истерия, психастения и двигательные неврозы. Однако с возрастом многие истерические и психастенические симптомы обычно сглаживаются. Уменьшению заболеваемости неврозами способствует ряд условий: правильное трудовое воспитание в семье и школе, нормальные отношения в производственном коллективе, регулирование нервно-психической физической нагрузки, своевременное лечение соматических болезней, широкое распространение спорта и туризма, а также борьба с алкоголизмом и курением. Поскольку причиной неврозов являются психотравмирующие воздействия, предупреждение их играет большую роль в профилактике неврозов. Социальные мероприятия, ведущие к устранению неуверенности в завтрашнем дне, уважению личного достоинства человека, нормализации жилищных и бытовых условий и т. п., способствуют ликвидации некоторых источников травматизации, вызывающей заболевание, и тем самым предупреждают возникновение неврозов. Поддержание мира между народами является лучшим средством профилактики «военных неврозов». Все факторы, ведущие к астенизации нервной системы, вместе с тем предрасполагают и к возникновению неврозов, поэтому в их профилактике большую роль играют борьба с острыми и хроническими инфекциями, травмами мозга, в том числе родовыми, острыми и хроническими интоксикациями, нарушениями питания организма и другими вредностями, а также нормализация режима труда и отдыха, достаточный сон. Недосыпание, особенно в детском возрасте, является одной из наиболее частых причин развития астенических состояний. Большое значение для предупреждения неврозов имеет правильное воспитание ребенка: развитие у него таких качеств, как выдержка, настойчивость, трудолюбие, умение преодолевать трудности, преданность высоким общественным идеалам. Ребенок, которому с детства было все дозволено, который рос избалованным, эгоистичным, не привыкшим считаться с интересами других, может в дальнейшем легче дать срыв в условиях, когда от него потребуется большая выдержка. При неправильном воспитании у ребенка могут возникнуть представления, которые делают его особенно чувствительным к действию определенных, адресованных ему раздражителей. У ребенка, которого все время захваливают, развивают у него тщеславие, представление оего якобы превосходстве над другими, нервный срыв особенно легко может наступить под влиянием неудачи, постигшей его при осуществлении этих стремлений. Вредно также прививать ребенку представление о его неполноценности, чрезмерно фиксировать внимание на имеющемся у него действительном или мнимом недостатке, а также подавлять его инициативу и требовать от него чрезмерного послушания. Это может способствовать развитию таких черт характера, как неуверенность в себе, мнительность, боязливость, нерешительность, и предрасполагать к неврозу навязчивых состояний. Для предотвращения нервности важно с самого раннего детства воспитывать ребенка так, чтобы он не получал ни прямых, ни косвенных выгод от нервности, вспыльчивости, тех или иных болезненных проявлений. Особого внимания заслуживает профилактика неврозов ятрогенной этиологии (обусловленных неосторожным высказыванием врача). Врач должен избегать всего, что может создать у больного представление о наличии у него тяжелого заболевания, а также не описывать болезненные симптомы, которых у больного нет, но которые встречаются при имеющемся у него заболевании. Часто ятрогении вызывают такие заболевания, как атеросклероз (см.), загиб матки, миокардиодистрофия (см.), психастения и другие, особенно если они были написаны в виде справки на официальном бланке или поставлены авторитетным врачом. К ятрогении могут привести и такие реплики врача: «Да, у вас совсем плохое сердце, ведь вы молодой человек, а тоны сердца у вас глухие, как у глубокого старика! Вы не замечали у себя одышки?» Говоря больному об обнаруженном у него заболевании, очень важно сообщить ему об этом в такой форме, которая не вызвала бы у него представления о чрезвычайной тяжести, опасности для жизни или неизлечимости болезни. Целесообразнее начать беседу с заявления, что у него не обнаружено сколько-нибудь тяжелого заболевания, что со стороны здоровья ему ничего не угрожает и что он сможет жить до глубокой старости и сохранить трудоспособность. При этом следует указать на выявленные у него расстройства со стороны каких-либо органов, требующие принятия соответствующих мер, для того чтобы избавиться от этих нарушений и не допускать ухудшения состояния здоровья. В лечебном учреждении желательно по возможности изолировать тяжелобольных от больных с легким течением того же заболевания, что особенно относится к больным в онкологических стационарах. Приходилось наблюдать развитие тяжелых реактивных депрессий (см.) с попытками самоубийства у больных в онкологическом отделении нейрохирургии, когда они видели послеоперационных больных с рецидивом опухоли (см.). Для профилактики рецидивов неврозов очень важно изменить отношение больного к психотравмирующим событиям, повлиять на те характерологические особенности, которые делают его к ним особо чувствительным. Это достигается беседами с больным. С успехом с этой целью могут быть использованы внушение и самовнушение. Для предупреждения развития тяжелых и затяжных форм заболевания имеют значение также их раннее распознавание и лечение. Большую роль в этом отношении призваны сыграть психоневрологические диспансеры. Семейные конфликты и половая дисгармония (дисгамия) являются частыми причинами неврозов. Предупреждению их может способствовать добрачная подготовка молодоженов как в психологическом, так и в сексологическом плане, а также консультативная помощь семье в разрешении конфликтов.
НЕДЕРЖАНИЕ МОЧИ (ЭНУРЕЗ)
ОпределениеЭто ночное недержание мочи, или непроизвольное мочеиспускание во сне, наблюдается главным образом у мальчиков 2—15 лет, в период полового созревания прекращается. Частота колеблется в пределах 6—18 %.
Причины возникновения Основной причиной энуреза является отсутствие или понижение сторожевой функции коры головного мозга, которая не воспринимает раздражения из мочевого пузыря. Одной из причин энуреза является слабость мочевого рефлекса, обусловленная врожденными аномалиями (незаращение дужек позвонков) или врожденной недостаточностью нервномышечного аппарата мочевого пузыря. Энурезу могут способствовать рефлекторные влияния, исходящие из других органов, где имеются патологические процессы. Непроизвольное мочеиспускание может возникать каждую ночь, через ночь или реже. Оно может быть один или несколько раз за ночь. Энурез может протекать со спокойными периодами, обострения обычно связаны с утомлением, перенесенными инфекциями и психическими травмами. К этиологическим факторам энуреза относятся: инфекции мочевыводящей системы; пороки развития; нарушения функции мочевыводящей системы; поражения центральной нервной системы; расстройства психики; нарушение ритма секреции гормонов, регулирующих секрецию воды и солей; отсутствие приобретения навыков регуляции мочеиспускания; воздействие неблагоприятных факторов на приобретенный рефлекс мочеиспускания; наследственная отягощенность.
Диагностика Диагностика ночного недержания не представляет трудностей. Помимо жалоб больного выявляется нарушение различных отделов нервной системы и нервно-мышечного аппарата мочевого пузыря. Коленные, ахилловы и медиоплантарные рефлексы нарушены. Вегетативные изменения нервной системы проявляются мраморностью кожи конечностей. Конечности холодные и влажные. Невротические изменения проявляются неустойчивостью эмоциональной сферы. При рентгеновском исследовании обнаруживается незаращение дужек поясничных и крестцовых позвонков, на цистограммах — затекание контрастного вещества из мочевого пузыря в заднюю часть мочеиспускательного канала. По данным электромиографии определяют биопотенциалы мочевого пузыря и сфинктеров.
Лечение Лечение нужно начинать с назначения тонизирующих препаратов. Эффективность лечения значительно повышается при дополнении его мерами воспитательного характера. Нормальное физическое развитие является залогом профилактики ночного энуреза. Особенно важно регулярно высаживать на горшок маленьких детей в дневное время, воспитывая у них тем самым условно-рефлекторную способность удерживаться от мочеиспускания в постели и мочиться только в горшок. Высаживать спящих детей ночью на горшок нельзя, так как это может способствовать развитию привычки к непроизвольному мочеиспусканию во сне. Лечение ограничением жидкости редко приводит к эффекту, в ряде случаев эффект наступает от смазывания адиурекриновой мазью слизистой оболочки носа, действие мази начинается через 15 мин и продолжается 6–8 ч. В некоторых случаях эффективны новокаиновые блокады. Хорошие результаты дают аппаратные методы лечения, которые направлены на выработку условного рефлекса. Для лечения больных энурезом применяют электростимулятор «Бион-2». Курс лечения — 10 процедур, проводят 1–4 курса с интервалом в 2–3 месяца, эффективность может достигать 83 %. При пониженной биоэлектрической активности мочевого пузыря и сфинктеров хорошие результаты обеспечиваются электрофорезом пчелиного яда. Для снижения повышенной возбудимости мускулатуры мочевого пузыря применяют экстракт белладонны или атропин сульфата. Иногда назначают снотворные, сеансы психотерапии. Хирургическое лечение производится при пороках развития мочевыводящей системы, при стойком длительном отсутствии эффекта от консервативной терапии. Прогноз благоприятный. Ночной энурез прекращается к 14–16 годам, редко наблюдается после 20 лет.
НЕДОСТАТОЧНОСТИ КИШЕЧНОГО ВСАСЫВАНИЯ СИНДРОМ
ОпределениеНедостаточность кишечного всасывания (синдром мальабсорбции, энтеральная недостаточность) — нарушение функции тонкой кишки. Различают расстройства пищеварения в просвете кишки или в мембране щеточной каймы энтероцитов (мальдигестия) и нарушение транспорта нутриентов через мембрану щеточной каймы (собственно мальабсорбция).
Этиология и патогенез Причины первичного синдрома недостаточности всасывания — наследственные нарушения структуры слизистой оболочки кишечной стенки и наследственно обусловленная кишечная ферментопия. Первичная недостаточность пищеварительной функции тонкой кишки (синдром мальдигестии) — интестинальные (кишечные) энзимопатии (недостаточность дисахаридаз, недостаточность энтерокиназы, недостаточность пептидаз). Первичная недостаточность всасывательной функции тонкой кишки (синдром мальабсорбции) связана с первичными нарушениями всасывания моносахаридов, аминокислот, жиров, витаминов, минеральных веществ, электролитов. Причина вторичного синдрома — приобретенные структурные изменения слизистой оболочки тонкой кишки. Приобретенная энтеральная недостаточность (вторичная, преимущественно генерализованная, синдром мальдигестии и мальабсорбции): — энтерогенная (энтериты (см.), болезнь Крона (см.), инфекционные, паразитарные, сосудистые и другие заболевания кишечника); — гастрогенная (язвенная болезнь (см.), гастриты (см.), рак (см.) желудка и др.); — панкреатогенная (панкреатиты (см.), муковисцидоз (см.), рак, опухоли островкового аппарата и др.); — гепатогенная (острые и хронические заболевания печени, внутрипеченочный и внепеченочный холестаз); — пострезекционная (вследствие операций на желудочно-кишечном тракте); — эндокринная (сахарный диабет (см.), гипер- и гипотиреозы, гипопаратиреоидизм и др.); — медикаментозная (неомицин, холестирамин, ПАСК, метилдопа, антациды, этиловый спирт, метформин и др.); — лучевая. При острых и подострых состояниях основное значение имеют нарушения внутрикишечного переваривания пищевых продуктов и ускоренное продвижение содержимого по кишечнику, при хронических состояниях — дистрофические и атрофически-склеротические изменения эпителия и собственного слоя слизистой оболочки стенки кишки, укорочение и уплощение ворсин и крипт, уменьшение числа микроворсинок, развитие соединительной ткани в стенке кишки с нарушением в ней крово- и лимфотока. Все перечисленные изменения приводят к нарушению процессов всасывания и недостаточному поступлению в организм продуктов гидролиза (разложения) белков, жиров, углеводов, а также минеральных солей и витаминов через кишечную стенку.
Клиническая картина Характерны поносы, постепенное истощение больного, симптомы расстройств всех видов обмена веществ (белкового, жирового, витаминного, водно-солевого), дистрофические изменения во внутренних органах с нарушениями их функций. Развиваются гипопротеинемия, гипокальциемия, умеренная гипогликемия. Характерны симптомы полигиповитаминоза, остеопороз (см.), гипопротеинемические отеки (см.), анемия (см.), трофические изменения кожи, прогрессирующая атрофия (см.) мышц, явления полигландулярной недостаточности, общая слабость, в тяжелых случаях — психические расстройства (см.), ацидоз (см.), кахексия (см.). Копрологическое исследование определяет повышенное выделение непереваренных пищевых веществ с калом, а также продуктов их ферментативного расщепления. Энтеробиопсия позволяет выявить атрофические изменения слизистой оболочки проксимальных отделов тонкой кишки. Йод-калиевая проба, пробы с Д-ксилозой, галактозой, каротином, тест на всасывание железа, методы с применением мечеными радиоактивными изотопами казеина, альбумина, олеиновой кислоты, метионина, глицина, витамина В12, фолиевой кислоты и другие методы позволяют конкретно оценить степень нарушения всасывания различных продуктов кишечного гидролиза, витаминов, микроэлементов.
Лечение Симптоматическая терапия: внутривенное (минуя кишечник) питание, введение витаминов, плазмы, белковых гидролизатов, раствора глюкозы, питательные кишечные клизмы, борьба с сердечной недостаточностью, коррекция нарушений электролитного обмена.
НЕДОСТАТОЧНОСТИ ПИЩЕВАРЕНИЯ СИНДРОМ
ОпределениеСиндром недостаточности пищеварения — симптомокомплекс, характеризующийся нарушением пищеварения в желудочно-кишечном тракте. Различают нарушения преимущественно полостного (диспепсии) или преимущественно пристеночного пищеварения, а также смешанные формы этого синдрома.
Этиология и патогенез Диспепсии — следствие некомпенсированной недостаточности секреторной функции желудка, внешнесекреторной функции поджелудочной железы, желчеотделения, нарушения пассажа (продвижения) химуса по желудочно-кишечному тракту (стазы, застой — в результате стенозирование или сдавление кишки, резкое ускорение продвижения вследствие усиленной перистальтики), кишечных инфекций, кишечного дисбактериоза (см.), алиментарных нарушений (чрезмерная пищевая нагрузка, питание преимущественно белковой, жировой или углеводистой пищей, большое количество бродильных напитков). Диспепсия может быть функциональной, но чаще является следствием заболеваний органов пищеварения. Характеризуется неполным расщеплением пищевых веществ пищеварительными ферментами, развитием дисбактериоза (см.), активным участием бактерий в ферментативном расщеплении пищевых продуктов с образованием ряда токсических продуктов (аммиак, индол, низкомолекулярные жирные кислоты и др.), вызывающих раздражение слизистой оболочки кишки, усиление ее перистальтики и интоксикацию организма. Недостаточность пристеночного пищеварения наблюдается при хронических заболеваниях тонкой кишки, сопровождающихся дистрофическими и воспалительно-склеротическими изменениями слизистой оболочки, нарушением структуры ворсинок и микроворсинок и уменьшением их количества, нарушением кишечной перистальтики (при энтеритах (см.), спру (см.), кишечной липодистрофии, энтеропатиях и пр.).
Клиническая картина Диспепсия желудочная наблюдается при атрофическом гастрите (см.) с секреторной недостаточностью, декомпенсированных стенозах привратника, раке (см.) желудка. Характеризуется ощущением тяжести, давления и распирания в верхней части живота после еды, частой отрыжкой воздухом и пищей, нередко с тухлым неприятным запахом и неприятным вкусом во рту, тошнотой, снижением аппетита. Нередки ахилические поносы, метеоризм. При исследовании желудочного сока выявляют ахлоргидрию или ахилию. Диспепсия кишечная наблюдается при хронических воспалительных заболеваниях тонкой кишки и т. д. Характеризуется вздутием живота, урчанием и переливанием в кишечнике, обильным выделением газов, поносами с гнилостным или кислым запахом каловых масс (редко бывают запоры (см.)). Копрологическое исследование: стеаторея, амилорея, креаторея. При рентгенологическом исследовании отмечается ускоренное продвижение бариевой взвеси по тонкой кишке. Исследования внешнесекреторной функции поджелудочной железы, аспирационная энтеробиопсия, определение энтерокиназы и щелочной фосфатазы в кишечном соке помогают уточнить причину кишечной диспепсии. Важное значение имеет изучение микрофлоры кишечника. Диспепсия панкреатогенная обусловлена внешнесекреторной недостаточностью поджелудочной железы. Характеризуется ощущениями урчания и переливания в животе, метеоризмом, коликообразными болями в животе, нарушением аппетита. Отмечаются обильные «панкреатогенные» поносы, стеаторея, амилорея, креаторея. При недостаточности пристеночного пищеварения симптомы те же, что и при кишечной диспепсии и синдроме недостаточности всасывания. Диагноз подтверждается определением активности ферментов (амилазы, липазы) при последовательной десорбции их в гомогенатах кусочков слизистой оболочки, полученных при аспирационной биопсии тонкой кишки. Аспирационная биопсия помогает выявить атрофические изменения слизистой оболочки тонкой кишки.
Лечение Назначают ферментные препараты (панкреатин, абомин, панзинорм и др.); при поносах — вяжущие препараты внутрь, при метеоризме — настой листьев мяты перечной.
НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ
ОпределениеНедостаточность кровообращения — патологическое состояние, заключающееся в неспособности системы кровообращения доставлять органам и тканям количество крови, необходимое для их нормального функционирования.
Этиология и патогенез Недостаточность кровообращения сопровождает не только болезни сердца, но и инфекционные заболевания, болезни обмена, оперативные вмешательства, а также заболевания легких, печени, почек, т. е. все заболевания, которые приводят к снижению сократительной способности миокарда, перегрузке объемом и давлением, тяжелым обменным нарушениям в миокарде. По форме выделяют сердечную и сосудистую недостаточность; сердечная недостаточность, в свою очередь, подразделяется по течению на острую и хроническую, по происхождению — на систолическую, диастолическую, смешанную (перегрузка давлением, объемом, первично-миокардиальная, нарушение ритмической деятельности, комбинированная). Клинические варианты сердечной недостаточности: левожелудочковая I, IIA, 11Б, III степени; правожелудочковая I, IIA, ПБ, III степени; тотальная. Сосудистая недостаточность по течению бывает острой, хронической, перманентной и пароксизмальной; по происхождению — связанной с нарушением нервной и гуморальной регуляции; изменением чувствительности рецепторного аппарата; структурными нарушениями сосудистой стенки; тромбозом. Клинические варианты сосудистой недостаточности: обморок, коллапс, шок, различные сосудистые дистонии.
Клиническая картина Объективно: бледность кожных покровов, синюшность, периферические нарушения (сухость кожи, зуд (см.), заеды (см.) в углах рта, расширение венозной сети на груди), одышка, тахикардия (см.), отеки (см.) на нижних конечностях или общие, увеличение печени, увеличение размеров сердца. ЭКГ: симптомы перегрузки или гипертрофии отделов сердца, нарушение сердечного ритма, обменных процессов. Рентгенограмма: снижение сократительной способности сердца, расширение корней и усиление легочного рисунка в срединных отделах легких, возможно скопление транссудата (выпота) в плевральной полости. Повышение центрального венозного давления более 120–140 мм вод. ст. Эхокардиография позволяет выделить компенсированный и декомпенсированный типы право- и левожелудочковой недостаточности. При правожелудочковой недостаточности линейные размеры и объем желудочка превалируют над массой; при левожелудочковой — одновременно увеличиваются объем и масса. Зондирование полостей сердца позволяет оценить выраженность сердечной недостаточности: при правожелудочковой недостаточности повышено систолическое давление, при левожелудочковой — диастолическое.
Недостаточность кровообращения острая Быстрое, нередко внезапное уменьшение минутного объема вследствие снижения насосной функции сердца, приводящее к жизненно опасным нарушениям в органах и тканях. Проявляется острой сердечной и сосудистой недостаточностью. Острая левожелудочковая сердечная недостаточность может быть в виде двух клинических синдромов: сердечной астмы (см.) и отека легких (см.). Сердечная астма проявляется приступами удушья, экспираторной (с затрудненным выдохом) одышки, возбуждением. При объективном исследовании: кожа бледная с синюшным оттенком, пульс учащен, малого наполнения. Верхушечный толчок усилен, смещен вниз в VI межреберье. Снижение интенсивности I тона на верхушке. Границы сердца увеличены влево, тоны глухие, артериальное давление повышено; в легких определяются нестойкие разнокалиберные хрипы. При присоединении отека легких количество хрипов увеличивается, дыхание становится шумным, клокочущим, выделяется пенистая, окрашенная кровью мокрота. При рентгенологическом исследовании: увеличение сердца влево, расширение корней, вялая пульсация. Рентгенокимография: уменьшение амплитуды, деформация зубцов. Эхокардиографически отмечается увеличение размеров левого желудочка. На ЭКГ выявляется перегрузка левых отделов сердца.
Острая правожелудочковая недостаточность Жалобы на слабость, боли за грудиной. Одышка, синюшность, отеки конечностей, увеличение печени, набухание шейных вен. Размеры сердца увеличены вправо, тоны глухие, тахикардия (см.), снижение артериального давления. Повышается центральное венозное давление. При рентгенологическом исследовании: выбухание конуса легочной артерии. Эхокардиография: линейные размеры и объем желудочка преобладает над массой. ЭКГ: перегрузка правых отделов сердца, блокада правой ножки пучка Гиса.
Острая сосудистая недостаточность Развивается в результате несоответствия объема циркулирующей крови объему сосудистого русла, проявляется в виде обморока (см.), шока (см.) и коллапса (см.). Обморок — внезапная кратковременная потеря сознания, сопровождающаяся расстройством сердечно-сосудистой и дыхательной деятельности. В течении обморока выделяют 3 фазы: предобморочное состояние, фазу обморока и послеобморочное состояние. Жалобы на головокружение, тошноту, ощущение нехватки воздуха, мелькание мушек перед глазами, звон в ушах. Объективно: больной падает, теряет сознание, кожа бледная, покрыта обильным холодным потом, конечности холодные, дыхание поверхностное, зрачки расширены, пульс слабого наполнения. Обморочное состояние длится от 3 до 10 мин, после чего остаются слабость и сонливость, больной не помнит, что с ним было. Коллапс — остро развивающаяся сосудистая недостаточность с падением сосудистого тонуса и уменьшением массы циркулирующей крови. Различают симпатотонический, ваготонический и паралитический коллапс в зависимости от тонуса сосудов. Ухудшается состояние, сознание сохранено (но возможна и его потеря), дыхание учащено, поверхностное. Пульс малого наполнения, тахикардия (см.). Тоны сердца громкие, хлопающие, аритмия. Артериальное давление снижено; могут быть судороги. Возникновение симпатотонического коллапса связано с нарушением периферического кровообращения вследствие спазма артериол и скопления крови в полостях сердца и крупных магистральных сосудах. Максимальное артериальное давление повышено, уменьшена амплитуда пульсового давления, выражена тахикардия (см.). Ваготонический коллапс (при обмороке (см.), инфекционном шоке (см.)) проявляется резким падением артериального давления в результате активного расширения артериол и артериовенозных анастомозов, что ведет к кислородной недостаточности мозга. Нарастает разница максимального и минимального давления при снижении минимального, нередко наблюдается тахикардия (см.). Паралитический коллапс является следствием истощения механизмов регуляции, возникает при тяжелом обезвоживании, диабетической коме (см.), в последней стадии нейротоксикоза. Развитие коллапса обусловлено пассивным расширением капилляров. Пульс нитевидный, тахикардия (см.), снижение артериального давления (максимального и минимального). Шок — остро развившийся и угрожающий жизни синдром, характеризующийся нарушением систем кровообращения, дыхания, центральной нервной системы, обмена веществ. Выделяют гиповолемический, циркуляторный и кардиогенный виды шока; последний возникает при слабости левого желудочка и развивается бурно. Быстро ухудшается состояние, нарастают бледность и синюшность, дыхание поверхностное. Пульс нитевидный, тоны сердца глухие, в легких хрипы. Артериальное давление снижено, печень увеличена, болезненна. Выделяют 3 стадии в течении шока — возбуждения, торможения и истощения.
Лечение Обморок Общие мероприятия: горизонтальное положение, устранение стесняющей одежды, приток свежего воздуха. Коллапс Восстановление объема циркулирующей крови (инфузионная терапия). Восстановление сосудодвигательной регуляции сосудистого тонуса; аминазин при симпатотоническом коллапсе. Нормализация микроциркуляции, метаболизма и кислотноосновного состояния: оксигенотерапия, борьба с ацидозом. Снятие эмоциональной нагрузки. Шок Восстановление кровообращения: инфузионная терапия под контролем ИВЛ. Нейровегетативная блокада (дроперидол).
НЕДОСТАТОЧНОСТЬ НАДПОЧЕЧНИКОВАЯ
ОпределениеНадпочечниковая недостаточность представляет собой эндокринное заболевание, вызванное недостаточной секрецией гормонов коры надпочечников в результате нарушения функционирования звеньев в цепи гипоталамус — гипофиз — надпочечники.Недостаточность коры надпочечников возникает при первичном нарушении коры надпочечников (болезнь Аддисона) или вторичном ее изменении в результате уменьшения секреции АКТГ; проявляется симптомами сниженной продукции гормонов коры надпочечников. Надпочечниковую недостаточность принято подразделять на острую и хроническую, причем последняя может быть как первичной, так и вторичной. Первичная хроническая недостаточность коры надпочечников (болезнь Аддисона) чаще встречается у мужчин; соотношение мужчин и женщин, страдающих этим заболеванием, составляет 2:1.
Этиология и патогенез Первичная хроническая недостаточность коры надпочечников Клинические проявления хронической недостаточности коры надпочечников возникают тогда, когда ткань коры надпочечников разрушена на 90 %. Раньше основной причиной хронической недостаточности надпочечников была туберкулезная инфекция, на долю которой приходилось до 80 % всех случаев заболевания. Другие патологические процессы (бластомикоз, амилоидоз (см.), гистоплазмоз, кокцидиомикоз, гемохроматоз и др.) при двустороннем поражении коры надпочечников являются причиной хронической их недостаточности в 10 % случаев. В настоящее время примерно в 50 % случаев первичная хроническая недостаточность коры надпочечников возникает в результате так называемой первичной, или идиопатической, атрофии коры надпочечников, причем в последние годы происходит увеличение частоты такого поражения до 60–65 % и соответствующее уменьшение частоты туберкулезного поражения коры надпочечников. В надпочечниках выявляются интенсивная лимфоидная инфильтрация и увеличение фиброзной ткани при выраженной атрофии клеток их коры.
Вторичная недостаточность коры надпочечников Развивается в результате первичного поражения гипофиза и недостаточной секреции АКТГ, что приводит к двусторонней атрофии коры надпочечников. Снижение секреции АКТГ возможно при поражении гипоталамо-гипофизарной области опухолевым или другим процессом (базальный менингит (см.), гистиоцитоз и др.), а также при врожденной или приобретенной сосудистой патологии. Как правило, недостаточность секреции АКТГ сопровождается нарушением секреции и других тропных гормонов гипофиза: гонадотропного, соматотропного и тиреотропного. Очень редко встречается изолированная недостаточность секреции АКТГ. Недостаточность секреции АКТГ также связана с длительным приемом с лечебной целью различных глюкокортикоидов. Длительная недостаточность секреции АКТГ приводит не только к функциональным, но и к морфологическим изменениям коры надпочечников — развивается атрофия пучковой и сетчатой зон. Клубочковая зона, а следовательно, и секреция минералокортикоидов страдают в меньшей степени. Атрофические изменения коры надпочечников могут достигать такой степени, что даже длительная стимуляция АКТГ не приводит к восстановлению секреции кортикостероидов.
Острая недостаточность коры надпочечников Острая недостаточность коры надпочечников — это синдром, развивающийся в результате резкого снижения или полного выключения функции коры надпочечников. Острая недостаточность коры надпочечников может быть осложнением первичной или вторичной хронической недостаточности (неадекватная заместительная терапия, снижение дозы или отмена глюкокортикостероидов, стрессовые ситуации — инфекция, травма, операция). Первичная острая недостаточность коры надпочечников (синдром Уотерхауса-Фридериксена) является следствием внутриутробного кровоизлияния в надпочечники во время тяжелых или осложненных родов, кровоизлияния в надпочечники при менингококковой или другой тяжелой септической инфекции, при синдроме острой диссеминированной внутрисосудистой коагуляции (свертывании), а также в результате острого тромбоза сосудов надпочечников. Синдром Уотерхауса-Фридериксена, как и первичная хроническая недостаточность коры надпочечников, связан с разрушением коры. Поскольку разрушающий процесс в этом случае протекает интенсивнее (обычно это кровоизлияние в надпочечники, реже острая ишемия), синдром недостаточности коры надпочечников развивается внезапно, без предшествующей стадии хронического дефицита кортикостероидов. Механизм развития классического синдрома Уотерхауса-Фридериксена, возникающего на фоне тяжелой и остро текущей (обычно септической) инфекции, окончательно не выяснен. Высказывается мнение, что этот синдром является частным случаем так называемого общего адаптационного синдрома, т. е. следствием тяжелого сепсиса, вызывающего перенапряжение и истощение адаптационных гипофизарно-адреналовых механизмов. Такая точка зрения подтверждается тем, что во многих случаях типичного (по этиологии и клинической картине) синдрома Уотерхауса-Фридериксена в надпочечниках отсутствуют анатомические изменения. По-видимому, таков же механизм развития острой надпочечниковой недостаточности у новорожденных в процессе осложненных родов или у беременных с тяжелым токсикозом, но не исключено, что во всех рассматриваемых случаях этот синдром является следствием каких-то других механизмов. Острая надпочечниковая недостаточность изредка осложняет некоторые системные заболевания (узелковый периартериит (см.), системная красная волчанка (см.) и др.). В этих случаях наблюдаются кровоизлияния в надпочечники или (чрезвычайно редко) тромбозы либо эмболии многочисленных мелких артериальных сосудов надпочечников. Если рассматривать синдром Уотерхауса-Фридериксена как стадию истощения общего адаптационного синдрома, то очевидно, что сюда же следует отнести и надпочечниковый (аддисонический) криз, развивающийся иногда во время тяжелых соматических заболеваний, обширных травм или сложных хирургических вмешательств. Адаптивная роль гипофизарно-адреналовой системы в формировании ответных реакций на воздействие факторов внутренней и внешней среды давно установлена и общепризнанна. В соответствии с теорией общего адаптационного синдрома, при длительном воздействии неблагоприятных (стрессовых) факторов развивается стадия истощения, которая сопровождается снижением функции надпочечников и клеточными изменениями в их коре. Многочисленные клинические исследования подтвердили, что функция коры надпочечников снижается при тяжелых нагноительных заболеваниях, туберкулезе (см.) легких, язвенной болезни (см.) желудка и двенадцатиперстной кишки, злокачественных опухолях (см.), пороках (см.) сердца и др. При обширных ожогах (см.), тяжелых множественных переломах (см.), массивных кровотечениях (см.), а также тяжелом течении вышеперечисленных заболеваний во время хирургических вмешательств, предпринимаемых у этих больных, в послеоперационном периоде (особенно если он осложнился кровотечением, перитонитом (см.), пневмонией (см.), сепсисом (см.) и т. д.) относительная недостаточность надпочечников усугубляется, и может развиться синдром острой их недостаточности. Хроническая или острая недостаточность коры надпочечников, связанная с врожденным нарушением ферментных систем в надпочечниках или с изменением чувствительности к АКТГ соответствующих надпочечниковых структур, обычно развивается в младенческом или раннем детском возрасте. В этой группе больных наиболее частой причиной функциональной недостаточности коры надпочечников является адреногенитальный синдром, точнее его сольтеряющая разновидность (синдром Дебре-Фибигера). При этой форме врожденной надпочечниковой гиперплазии развивается дефицит глюкокортикоидов и минералокортикоидов, что сопровождается выраженными обменными нарушениями. Редким патологическим состоянием и, следовательно, редкой причиной острой недостаточности коры надпочечников является врожденная надпочечниковая ареактивность. Синдром, описанный Т. Шепардом и др. (1959 г.), развивается на втором году жизни и характеризуется неполноценной секреторной реакцией надпочечников на эндогенную стимуляцию АКТГ. Клинически синдром проявляется развитием астении, повышенной пигментацией кожных покровов, мышечной слабостью и уменьшением двигательной активности. Под действием различных провоцирующих (стрессовых) факторов иногда спонтанно может развиться острый пароксизм, характеризующийся неукротимой рвотой, гипотонией (см.), судорогами и комой (см.). Большую группу среди лиц с повышенным риском развития острой недостаточности коры надпочечников в случае острых инфекционных заболеваний, травм и т. д. составляют больные, получающие с лечебной целью кортикостероиды. Число больных, которым по поводу болезни Иценко-Кушинга (см.) или других заболеваний была произведена двусторонняя адреналэктомия, постоянно возрастает. Острая недостаточность коры надпочечников у таких больных часто развивается в результате неадекватной заместительной терапии кортикостероидами (в частности, противопоказаны барбитураты, которые ускоряют распад кортикостероидов в печени, в связи с чем эффект заместительной терапии снижается). Однако и хорошо подобранная доза кортикостероидов может оказаться недостаточной уже при легких простудных заболеваниях или повышенной физической нагрузке, тем более при операциях, травмах или родах. Все эти факторы также являются частой причиной острой недостаточности коры надпочечников у больных после тотальной адреналэктомии. Острая недостаточность коры надпочечников неоднократно развивалась и после односторонней адреналэктомии.
Клиническая картина Первичная хроническая недостаточность коры надпочечников Больные, как правило, не могут определить время начала заболевания и указывают на постоянно прогрессирующую общую и мышечную слабость; общая слабость (которая уменьшается в течение дня) выражена не вечером, а утром. По мере прогрессирования надпочечниковой недостаточности общая и мышечная слабость переходит в адинамию, речь замедляется, голос становится тихим. Сравнительно часто необычная слабость выявляется во время сопутствующих инфекций или в период нарушений функции желудочно-кишечного тракта. Мышечная слабость является результатом нарушения обменных процессов. Наряду с общей слабостью отмечается снижение массы тела. Похудение происходит как за счет обезвоживания, так и за счет снижения аппетита и последующего присоединения тошноты и рвоты. Повышенная пигментация наблюдается почти у всех больных. Отложение меланина в первую очередь увеличивается в местах трения кожи, на участках, подвергающихся воздействию солнечных лучей, сосках молочных желез, а также на слизистых оболочках (губы, щеки и др.). В дальнейшем развивается распространенная гиперпигментация. У некоторых больных на фоне общей гиперпигментации кожи имеются участки депигментации (витилиго (см.)), что служит проявлением аутоиммунного процесса. Артериальная гипотония (см.) выявляется у 88–90 % больных. Пульс мягкий, малый, замедленный. Нарушаются функции желудочно-кишечного тракта. Наиболее часто встречаются тошнота, рвота, анорексия (см.), запоры (см.), сменяющиеся диареей (см.). Гипогликемия (см.) проявляется в виде приступов, сопровождающихся слабостью, раздражительностью, чувством голода, потливостью. Такие приступы обычно развиваются утром (натощак) или после длительного перерыва между приемами пищи. Никтурия (выделение большей части суточного количества мочи ночью) является одним из частых симптомов хронической недостаточности коры надпочечников. Изменение функции центральной нервной системы проявляется снижением умственной деятельности и памяти, концентрации внимания, иногда — состояниями депрессии (см.) и острого психоза. При обследовании у больных, страдающих хронической надпочечниковой недостаточностью, выявляются повышенное содержание эозинофилов в крови, анемия (см.) и относительный лимфоцитоз. Характерный признак — повышение уровня калия и креатинина при снижении концентрации натрия в сыворотке крови. Содержание кальция в сыворотке также повышено. Данный признак в таких случаях сочетается с гиперкальциурией, жаждой, полиурией и гипостенурией (моча низкого удельного веса). Наблюдаются нарушения функции почек: снижается скорость клубочковой фильтрации и почечного кровотока. Хроническая надпочечниковая недостаточность проявляется снижением содержания кортикостероидов в крови и уменьшением экскреции 17-ОКС и 17-КС с мочой.
Вторичная недостаточность коры надпочечников При вторичной недостаточности коры надпочечников клиника не отличается от таковой при первичной надпочечниковой недостаточности, за исключением отсутствия повышенной пигментации. Кроме того, при вторичной надпочечниковой недостаточности в меньшей степени выражены или даже отсутствуют симптомы недостаточности минералокортикоидов. Однако наряду с недостатком секреции АКТГ имеются клинические признаки недостаточности секреции гонадотропинов и других тропных гормонов гипофиза, что отсутствует при первичной надпочечниковой недостаточности.
Острая недостаточность коры надпочечников Наиболее характерными клиническими признаками аддисонического криза являются тошнота, рвота, резчайшая мышечная слабость, высокая температура, сердечно-сосудистые расстройства, диарея (см.), абдоминальный синдром и нарушение психики. Выраженность отдельных симптомов изменчива, что обусловливает разнообразие клинических форм криза. Ведущим клиническим симптомом острой недостаточности надпочечников обычно является глубокое снижение артериального давления, которое чаще всего носит характер коллапса или кардиоваскулярного шока (см.), устойчивого к стандартной противошоковой терапии. В частности, аддисонический коллапс не устраняется катехоламинами, что дополнительно свидетельствует об отсутствии их дефицита даже при тотальной адреналэктомии. Более того, такие присущие аддисоническому кризу симптомы, как акроцианоз (синюшность концевых участков тела), профузный (обильный) пот, похолодание конечностей, высокая температура, некоторые абдоминальные и психические симптомы, в определенной степени связаны именно с повышением активности симпатикоадреналовой системы. Психические расстройства (см.) широко варьируют как по форме, так и по глубине (заторможенность, оглушенность, галлюцинации (см.), делирий (см.), кома (см.)), поэтому нередко у больных с острой недостаточностью надпочечников ошибочно диагностируют маниакальный или параноидный психоз, токсический делириозный синдром, церебральную кому и др. Абдоминальные симптомы аддисонического криза — тошнота, рвота, диарея (см.), сильные боли в животе, метеоризм (см.), уменьшение перистальтических шумов, симптомы раздражения брюшины — также очень характерны. Довольно часто развивается острый геморрагический гастроэнтерит (см.), сопровождающийся напряжением передней брюшной стенки, кровавой рвотой, меленой (см.), т. е. типичной картиной острого желудочно-кишечного кровотечения. Если такая форма аддисонического криза наблюдается у больного после операции, возникает реальная угроза неоправданной и крайне опасной релапаротомии. Диагноз острой недостаточности коры надпочечников основывается в первую очередь на данных клинической картины и подтверждается лабораторными исследованиями.
Лечение Больные с первичной хронической недостаточностью коры надпочечников нуждаются в постоянном приеме кортикостероидов. У большинства больных для полной компенсации достаточно введения только глюкокортикоидов; в некоторых случаях дополнительно необходимо назначение и минералокортикоидов. Гидрокортизон (кортизол) является препаратом выбора и назначается по 30 мг в день (20 мг утром и 10 мг вечером). Кортизон обычно применяется в дозе 40–50 мг (25 мг утром и 12–15 мг вечером). Другие синтетические глюкокортикоиды (преднизолон, дексаметозон, триамцинолон и др.) менее желательны, так как они не оказывают минералокортикоидного действия. При выраженной минералокортикоидной недостаточности дополнительно рекомендуются ДОКСА (по 5 мг 1 раз в сутки внутримышечно), триметилацетат дезоксикортикостерона (по 1 мл 2,5 %-ного раствора внутривенно 1 раз в 2–3 недели) или фторгидрокортизон (0,05—0,2–0,2 мг в сутки). Избыток минералокортикоидов вызывает отеки, головные боли, повышение артериального давления, гипокалиемический алкалоз и мышечную слабость. В этих случаях необходимо отменить минералокортикоиды и назначить хлорид калия. При вторичной недостаточности коры надпочечников заместительная терапия проводится глюкокортикоидами (кортизон, гидрокортизон). Назначение минералокортикоидов не требуется. При явлениях недостаточности секреции других тропных гормонов гипофиза необходима соответствующая заместительная терапия. При развитии острой надпочечниковой недостаточности требуется энергичная терапия глюкокортикоидами. Введение АКТГ в этих ситуациях не показано, так как атрофированная кора надпочечников не в состоянии обеспечить организм необходимым количеством кортикостероидов. Кроме того, больным с хронической недостаточностью коры надпочечников рекомендуется прием повышенного количества поваренной соли и аскорбиновой кислоты. У женщин, страдающих хронической недостаточностью корынадпочечников, возможны беременность (см.) и нормальные роды (см.). Как правило, во время беременности необходимость в минералокортикоидах уменьшается вследствие повышения секреции прогестерона. Однако прием глюкокортикоидов необходимо увеличить, а в некоторых случаях требуется внутривенное введение гидрокортизона. В период родов глюкокортикоиды вводят внутривенно. Хирургическое вмешательство у больных с хронической недостаточностью надпочечников производят при условии внутривенного введения гидрокортизона (100–200 мг в зависимости от вида операции). В течение первых 3–4 дней послеоперационного периода кортизон вводят также внутривенно, а затем постепенно переходят на обычные дозы препаратов заместительной терапии. Основным лечебным мероприятием после установления диагноза острой недостаточности коры надпочечников является массивная кортикостероидная терапия. Предпочтительнее использовать водорастворимые препараты гидрокортизона (кортизола), причем обязательно методом внутривенной инфузии, так как любой другой путь введения и другие кортикостероидные препараты при данном состоянии значительно менее эффективны. В качестве первоначальной меры при аддисоническом кризе нужно немедленно одномоментно ввести в вену 100 мг гидрокортизона гемисукцината. В дальнейшем постоянное внутривенное введение водорастворимого гидрокортизона осуществляют вместе с введением изотонического раствора хлорида натрия и 5 %-ного раствора глюкозы (для предупреждения гипогликемии) со скоростью 1 л за первые 1/2—1 ч. Несмотря на то что при аддисоническом кризе содержание натрия в сыворотке крови обычно резко снижено, переливание гипертонического раствора не показано, за исключением тех редких случаев, когда в крови значительно повышена концентрация калия. Обычно после введения гидрокортизона быстро снижается содержание калия в сыворотке крови в связи с его перемещением в межклеточные пространства. В этой связи необходимо более частое определение уровня калия в сыворотке крови для своевременного выявления угрожающей гипокалиемии и предупреждения этого осложнения. Проводимая в сочетании с гормональной терапией внутривенная терапия направлена на коррекцию имеющихся нарушений обмена веществ. В первые сутки объем внутривенных введений составляет 3–4 л и включает 300–400 мг кортизола (гидрокортизона), изотонический раствор хлорида натрия, 5 %-ный раствор глюкозы и другие растворы, необходимые для полной коррекции водно-электролитных нарушений. Дополнительно вводят легкоусвояемые белковые препараты (альбумин, протеин и др.). Объемное соотношение перечисленных растворов зависит от динамики клинического статуса и данных лабораторного контроля. Особое внимание следует обращать на адекватную коррекцию (под тщательным лабораторным контролем) электролитных нарушений, так как при острой недостаточности надпочечников имеющаяся гиперкалиемия тем более опасна, что чувствительность миокарда к избытку ионов калия и склонность к развитию тяжелых нарушений возбудимости и проводимости (вплоть до фибрилляции (трепетания) желудочков) у таких больных повышены. Для предотвращения указанных осложнений лечение аддисонического криза должно сопровождаться ЭКГ-наблюдением. Большинство отечественных ученых рекомендуют дополнительно к введению кортизона при аддисоническом кризе вводить минералокортикоиды (ДОКА) или гормоны мозгового вещества надпочечников (адреналин, норадреналин). Несмотря на то что при аддисоновой болезни наряду с поражением коры надпочечника в патологический процесс вовлекается и мозговое вещество его (особенно при туберкулезном или другом деструктивном поражении надпочечника), недостаточности катехоламинов нет. Очевидно, нет нужды и применении минералокортикоидов, так как доза кортизола свыше 100 мг оказывает достаточное минералокортикоидное действие. Обычно со 2-го дня лечения необходимое количество жидкости вводят внутрь. Суточная доза кортизола при этом снижается до 100–150 мг, а на 3-й день — до 50–75 мг. В этот период, если минералокортикоидное действие указанных доз кортизола проявляется недостаточно, следует добавить гормоны и минералокортикоидного действия (ДОКА, 3-метил-ДОКА) или фторкортизон в дозе 0,05—0,2 мг в день. В дополнение к патогенетической гормональной и инфузионной терапии проводится этиотропное лечение, направленное на устранение причинного фактора недостаточности коры надпочечников (антитоксическая, противошоковая, гемостатическая, антибиотикотерапия и т. д.). Симптоматическое лечение состоит в назначении кардиотропных, аналептических, седативных, витаминных и других препаратов по показаниям. Своевременное выявление скрытой недостаточности коры надпочечников и адекватная заместительная терапия кортикостероидными гормонами под постоянным контролем — наиболее эффективные методы профилактики аддисонического криза. Прогноз при ранней диагностике и адекватной заместительной терапии, как правило, благоприятный. Больные не могут заниматься тяжелым физическим трудом. Лица, страдающие недостаточностью коры надпочечников, должны знать, что любые стрессовые состояния (инфекция, физическое или умственное перенапряжение и др.) требуют увеличения приема глюкокортикоидов. Принцип диспансерного наблюдения в отношении этих больных должен соблюдаться неукоснительно. Следует активно осуществлять и контролировать их трудоустройство, а также постоянно разъяснять окружающим необходимость щадящего режима в производственных и домашних условиях. Всем больным выдают специальную памятку, в которой приведен рациональный график приема кортикостероидов и указаны оптимальные для данного больного разовая и суточная дозы различных кортикостероидных препаратов. Подчеркивается необходимость немедленного обращения к врачу при появлении слабости, недомогания, повышении температуры, болях в животе, диарее и других признаках ухудшения состояния. Запрещается употребление алкоголя, прием барбитуровых снотворных, использование щелочных минеральных вод для запивания таблеток, содержащих кортикостероиды.
НЕДОСТАТОЧНОСТЬ СЕРДЕЧНАЯ
ОпределениеСердечная недостаточность — несостоятельность деятельности сердца как насоса, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца. Является следствием ишемической болезни (см.) и пороков (см.) сердца, артериальной гипертензии (см.), диффузных болезней легких; реже — миокардита (см.), дистрофии миокарда (в том числе тиреотоксической, спортивной), миокардиопатии (см.) (в том числе алкогольной), перикардита (см.) и других патологических состояний, первично поражающих миокард или затрудняющих работу сердца.
Этиология и патогенез Сердечная недостаточность возникает вследствие нарушения сократительной функции миокарда, часто сочетающейся с сосудистой недостаточностью. Следствием и проявлением сердечной недостаточности становится недостаточность кровообращения в целом либо преимущественно в малом или большом его круге, а также недостаточность внутрисердечного кровообращения. Изменения в кровообращении отражают не только недостаточность сократительной деятельности сердца, но и неполную достаточность компенсаторных реакций сердечно-сосудистой системы, которые, в свою очередь, ведут к патологическим изменениям как в самом сердце, так и в различных органах и системах. Это, в свою очередь, сопровождается постепенно возрастающими расстройствами, ограничивающими активность больного.
Клиническая картина Формы сердечной недостаточности I. Застойная левожелудочковая недостаточность, характерная для митрального порока и для тяжелой ишемической болезни сердца (см.), особенно в сочетании с гипертонической болезнью (см.). Проявления: одышка, ортопноэ (положение сидя, принимаемое больным для облегчения дыхания), сердечная астма (см.) и отек легких (см.), застойные изменения в легких, выявляемые прослушиванием и рентгенологически. II. Левожелудочковая недостаточность выброса характерна для аортального порока, ишемической болезни сердца (см.). Проявления: недостаточность мозгового кровообращения (головокружение, потемнение в глазах, обмороки, дыхание Чейна — Стокса); коронарная недостаточность; сфигмографические признаки (регистрация пульсовых колебаний стенок артерий). В тяжелых случаях выявляется пресистолический галоп (патологический IV тон) как признак несостоятельности левого желудочка с присоединением к недостаточности выброса застойной левожелудочковой недостаточности; редко отмечается альтернирующий (чередующийся) пульс. III. Застойная правожелудочковая недостаточность характерна для митрального и трикуспидального пороков, сдавливающего перикардита (см.). Часто присоединяется к застойной левожелудочковой недостаточности. Признаки: набухание шейных вен, высокое венозное давление, акроцианоз (синюшность концевых участков тела), увеличение печени, субиктеричность (легкая желтушность), отеки (см.), асцит (см.). IV. Правожелудочковая недостаточность выброса характерна для пульмонального стеноза, первичной легочной гипертензии. Диагностируется в основном рентгенологически. V. Дистрофическая форма, как правило, является последней стадией правожелудочковой недостаточности. Выделяют несколько ее вариантов: — кахектический; — отечно-дистрофический с дистрофическими изменениями кожи (истончение, блеск, сглаженность рисунка, дряблость) и отеками — распространенными, ограниченными, подвижными; — тяжелое некорригируемое солевое истощение. Изменения со стороны самого сердца: значительное увеличение (миогенная дилатация) камер, кардиомегалия, атриомегалия; мерцательная аритмия и другие существенные нарушения ритма, атриовентрикулярная блокада; выраженные склеротические изменения (электрокардиографические признаки). Особые формы сердечной недостаточности развиваются при «синих» врожденных пороках со сбросом справа налево; при легочных болезнях (легочное сердце), артериовенозной аневризме в системе большого круга и некоторых других патологических состояниях. Перечисленные формы наблюдаются в различных сочетаниях; нередко удается выделить лишь преобладающую форму сердечной недостаточности.
Стадии развития и степень тяжести застойной сердечной недостаточности I стадия — компенсация преимущественно на уровне непосредственно заинтересованных камер сердца; начальные объективные признаки сердечной недостаточности (при митральном пороке, например) обязательно связаны с увеличением левого предсердия; часто отмечаются симптомы сердечной недостаточности при умеренных или более значительных нагрузках (одышка или сердцебиение появляются, когда больной спешит, идя по ровному месту или поднимается полого в гору). Для IIA стадии характерны признаки прогрессирующей сердечной недостаточности: выраженные симптомы сердечной недостаточности при незначительных нагрузках (приходится останавливаться из-за одышки или сердцебиения при ходьбе обычной походкой по ровному месту, невозможно подняться выше второго этажа без остановки для отдыха); ортопноэ, приступы удушья, рентгенографические (возможны и электрокардиографические) признаки вторичной легочной гипертензии (см.), повторное появление отеков (см.); повторное увеличение печени; кардиомегалия (увеличение сердца) без других признаков этой стадии; мерцательная аритмия (см.) без других признаков этой стадии. Во ПБ стадии отмечается стойкая декомпенсация: повторные приступы сердечной астмы; постоянные отеки; существенные полостные отеки — постоянные или повторно появляющиеся; стойкое увеличение печени, уменьшающееся, но не исчезающее в ходе лечения; атриомегалия (увеличение предсердий); кардиомегалия в сочетании хотя бы с одним из признаков предыдущей стадии. III (терминальная, дистрофическая) стадия характеризуется тяжелыми субъективными расстройствами при минимальных физических нагрузках или в покое, неоднократными в течение недели приступами сердечной астмы, дистрофическими изменениями органов и тканей.
Лечение При I стадии сердечной недостаточности — соблюдение режима труда и отдыха, умеренные физические упражнения. При более выраженных стадиях сердечной недостаточности физические нагрузки должны быть ограничены, периодически или постоянно назначается постельный (полупостельный) режим. Диета — полноценная, легкоусвояемая, богатая белками, витаминами, калием. Этим требованиям лучше всего удовлетворяет диета, обогащенная фруктами и творогом. Эффективны разгрузочные дни (молочные, творожные, яблочные, яблочно-рисовые, арбузные и т. д.), в течение которых употребляется однообразная, легкоусвояемая, бедная хлоридом натрия пища. При наклонности к отекам показано умеренное ограничение поваренной соли; резкое ее ограничение может быть только кратковременным, так как длительное ограничение поваренной соли, особенно в сочетании с салуретиками (мочегонные, усиливающие выведение ионов натрия и хлора), может привести к солевому истощению. Сердечные гликозиды применяют в дозах, близких к максимально переносимым, при стойкой недостаточности — постоянно. Дозу уточняют в зависимости от состояния больного, его индивидуальной реакции. Доза недостаточна, если частота пульса превышает 74–78 в минуту в покое или 100 в минуту после минимальных нагрузок. При появлении признаков передозировки (брадикардия (см.) — менее 52–56 сокращений в минуту, тошнота, рвота, желудочковые экстрасистолы, частые (более 5–6 в минуту), политопные или парные) — лечение сердечными гликозидами следует немедленно прервать, не ограничиваясь снижением дозы. С исчезновением признаков передозировки, но не ранее чем через 2–3 дня, лечение возобновляют, но суточную дозу препарата уменьшают на 25–75 %. Подбирают дозы, как правило, только в стационаре. Внутривенное введение препаратов кратковременного действия (0,25—1 мл 0,05 %-ного раствора строфантина; 0,5–1 мл 0,06 %-ного раствора коргликона внутривенно, капельно или шприцем, медленно с 10–20 мл изотонического раствора натрия хлорида или 10 %-ного раствора глюкозы) используют в начале лечения более тяжелых больных с последующим переходом к пероральным препаратам. Больному и его родственникам целесообразно знать индивидуальную схему его лечения сердечными гликозидами и признаки их передозировки. Мочегонные средства показаны не только при отеках, увеличении печени, явных застойных изменениях в легких, но и при скрытой задержке жидкости (критерием последней являются увеличение диуреза (мочеотделения) и уменьшение одышки в ответ на пробную дачу диуретика). Назначают их в минимальных дозах, как правило, на фоне лечения сердечными гликозидами в сочетании с препаратами калия. Схема лечения всегда индивидуальна. В большинстве случаев назначают фуросемид (лазикс) в таблетках по 0,04 г. Мочегонные средства более эффективны, если их дают натощак; больной в течение 4–6 ч должен оставаться в постели, в день приема мочегонных и во второй половине предыдущего дня назначают гипонатриевую диету. Препараты калия назначают при лечении сердечными гликозидами, мочегонными и стероидными гормонами. Показания особенно настоятельны при появлении желудочковых экстрасистол, электродиографических признаков гипокалиемии, при рефрактерной (устойчивой) к сердечным гликозидам тахикардии (см.), метеоризме (см.) у тяжелобольных. Вводят внутривенно поляризующую смесь по 300–500 мл 1–2 раза в день. 30 %-ный раствор ацетата калия по 2 ст. л. 3 раза в день внутрь обычно хорошо переносится и особенно полезен при угрозе ацидоза (см.) у тяжелобольных. Другие препараты калия менее эффективны. Препараты калия нежелательны при выраженной брадикардии, неполной атриовентрикулярной блокаде и почечной недостаточности (см.). Калийсберегающий, регулирующий выведение электролитов антагонист альдостерона спиронолактон (верошпирон, альдактон по 0,025 г) назначают по 3–4 таблетки в день в легких и до 10–12 таблеток в тяжелых, устойчивых к терапии случаях. Для ограничения эмоциональных нагрузок систематически назначают транквилизаторы (тазепам, седуксен); в более легких случаях — настойку пустырника по 30–50 капель 2–3 раза в день. При бессоннице — нитразепам по 0,005—0,01 г на ночь. В дистрофической стадии может оказаться полезным введение в вену 10 %-ного раствора сывороточного альбумина, анаболических стероидов. Необходимость своевременно эвакуировать скопившуюся в плевральной полости или в перикарде (сердечной сумке) жидкость определяет показания к неотложной госпитализации. Следует иметь в виду опасность гипергидратации при неадекватных диурезу объемах капельных введений жидкости, которые надо, как правило, проводить под контролем уровня венозного давления, легко осуществимым и без специальной аппаратуры — при помощи стеклянной трубки, соединенной через тройник со шлангом системы для внутривенного вливания. Санаторное лечение показано в I и IIA стадиях, а в виде исключения — и в стадии IIБ. Развитие IIA стадии сердечной недостаточности означает перспективу неминуемого прогрессирования сердечной недостаточности, иногда достаточно отдаленную. Устранение основной причины сердечной недостаточности, например эффективное хирургическое лечение порока сердца, существенно улучшает прогноз; в I и IIA стадиях сердечная недостаточность может быть излечена. В I стадии больные трудоспособны, но сколько-нибудь тяжелый физический труд противопоказан. Во IIA стадии трудоспособность ограничена или утрачена, во IIБ — утрачена, в III стадии больные нуждаются в постоянном постороннем уходе.
НЕЗАРАЩЕНИЕ АРТЕРИАЛЬНОГО ПРОТОКА
ОпределениеНезаращение артериального протока — врожденный порок сердца. Артериальный проток соединяет аорту и легочную артерию. При незаращении артериального протока происходит сброс крови из аорты в легочную артерию, а затем в малый круг кровообращения, что ведет к перегрузке сосудов легких и левых отделов сердца. Рано развивается легочная гипертензия (см.), что приводит к перегрузке правого желудочка.
Этиология и патогенез Основная причина развития врожденных пороков сердца — полигенно-мультифакториальное наследование. Кроме того, имеют значение хромосомные нарушения, мутации одного гена, факторы среды (алкоголизм (см.) родителей, краснуха (см.), лекарственные препараты и др.).
Клиническая картина В прошлом отмечаются повторные пневмонии (см.), инфекции дыхательных путей. Клинические признаки: при больших размерах протока с первых дней и месяцев жизни обнаруживаются признаки сердечной недостаточности (одышка, тахикардия (см.), увеличение печени и селезенки), отставание в физическом и моторном развитии; при небольших размерах протока течение болезни может быть длительное время бессимптомным. Прощупыванием определяется дрожание у основания сердца слева. Прослушиванием определяются шум («машинный», шум «мельничного колеса») во II межреберье слева от грудины и на спине, акцент II тона над легочной артерией; пульс бывает высокий и быстрый. На ЭКГ — увеличение миокарда левого желудочка или обоих желудочков при легочной гипертензии. На ФКГ обнаруживают высокоамплитудный систолодиастолический шум во II межреберье слева, увеличение амплитуды II тона. ЭхоКГ — увеличение полостей левого предсердия и левого желудочка, увеличение амплитуды движений митрального клапана в период диастолы. Рентгенологически: усиление легочного рисунка, увеличение левых отделов сердца, выбухание дуги легочной артерии.
Лечение Оперативное лечение в возрасте старше 6—12 месяцев. Новорожденным назначают индометацин (способствует спазму протока с последующей его облитерацией) в дозе 0,1 мг/кг. Неоперированные больные погибают от сердечной недостаточности.
НЕЙРОДЕРМИТ
ОпределениеНейродермит принято подразделять на атопический и ограниченный.
Нейродермит атопический Нейродермит атопический — это наследственная болезнь с хронически рецидивирующим течением и определенной эволютивной возрастной динамикой. Характеризуется аномалиями клеточного иммунитета в коже с дисрегуляцией Т-клеточного звена и повышенной чувствительностью ко многим иммунным и неиммунным стимулам. Он проявляется зудящими воспалительными изменениями кожи с истинным многообразием экзематозно-лихеноидных высыпаний, зависящими от возрастных особенностей и сочетающимися с функциональными расстройствами нервной системы, дисфункцией сосудов и нарушениями барьерных свойств кожи, нередко — с атопическими поражениями респираторных органов (органов дыхания).
Нейродермит ограниченный (лишай хронический простой Видаля) С самого начала выделения ограниченного лишая Видаля подчеркивалось особое конституциональное предрасположение этой кожной реакции. Л. Брок и Л. Жако (1891 г.) назвали это состояние нейродермитом, характеризуя неврастеническую конституцию этих больных и их постоянную готовность отвечать зудом и расчесыванием на всякое раздражение.
Нейродермит
Отделяя распространенный нейродермит от ограниченного не только по клиническим проявлениям, но и по этиологии, они отметили важную роль особого предрасположения кожи больных с ограниченным нейродермитом в этом своеобразном ответе на механические и другие раздражения; также была отмечена его связь с наследственной предрасположенностью.
Этиология Атопический дерматит относят к многофакторной патологии. Большое значение имеет наследственность. Факторы внешней среды играют дополнительную роль в проявлении болезни, участвуя в реализации наследственной информации, провоцируя обострения и способствуя хроническому течению болезни. Восприимчивость к средовым воздействиям зависит от возраста больного, его конституциональных особенностей, таких как функциональные характеристики желудочно-кишечного тракта, эндокринной и нервной систем и т. д. В грудном и раннем возрасте преобладают нарушения в питании, пищеварении и всасывании. Важная роль принадлежит избытку продуктов, богатых аллергенами, пищевой аллергии, незрелости ферментных систем и дисбактериозу (см.), стафилококковой инфекции кишечника, заболеваниям печени, нарушениям обмена. В более старшем возрасте все большее место занимают аэроаллергены и психоэмоциональные нагрузки, переутомление, нерациональный режим. Их действие усиливается при постинфекционной астенизации, неврозах (см.), у детей — на фоне остаточной микросимптоматики врожденного характера, гидроцефального синдрома, диэнцефальной патологии. Отдается большая роль нарушениям нервной системы. Развитию атопического дерматита способствуют конституциональные особенности иммунитета, иммунодефицитные состояния, хронические фокальные инфекции, обменные нарушения.
Патогенез и патанатомия Несмотря на многостороннее изучение факторов, способствующих развитию атопического дерматита, начальные звенья его механизма развития не вполне ясны. В настоящее время специфические и основные звенья механизма развития атопического дерматита связывают с клеточной системой иммунитета кожи и нарушениями иммунной системы, обусловленными наследственностью. Этими нарушениями объясняют две основные клинические особенности атопического дерматита: повышенную чувствительность кожи к ряду антигенов и частые осложнения, вызванные вторичной инфекцией и обусловленные парциальным (частичным) иммунодефицитом кожного барьера. Клинические и некоторые лабораторные проявления измененной реактивности у больных атопическим дерматитом были отмечены уже в самых ранних наблюдениях и исследованиях. У многих больных атопическим дерматитом выявили ряд нарушений клеточного и гуморального иммунитета. Было замечено, что реакцию повышенной чувствительности у больных вызывают не все вещества. Выделили определенный круг веществ, провоцирующих образование атопенов: домашняя пыль, домашняя акварифауна и некоторые другие аэроаллергены (плесень, шерсть животных, их перхоть), некоторые виды пищевых продуктов (прежде всего — в раннем детском возрасте). Помимо атопенов, вызывающих аллергические реакции, воспалительные поражения кожи могут инициировать или обострять вещества внешней среды, вызывающие псевдоаллергические реакции, как предполагается, без участия атопенов. К таким веществам относятся многие продукты (клубника, земляника, малина, грибы, пряности, копчености, алкоголь, животные и растительные пигменты), некоторые медикаменты, токсины и т. д. Кроме того, микрофлора кожи, проявляющая болезнетворные свойства, может действовать непосредственно на клетки, выделяющие биологически активные вещества в ответ на их экзотоксины без предварительной сенсибилизации. На основании подобных фактов стали выделять иммунные и неиммунные, аллергические и псевдоаллергические варианты атопического дерматита. Тем не менее в ряде диагностических схем повышение уровня атопенов относили к важным диагностическим критериям атопического дерматита. Вместе с тем повышение общего уровня атопенов не является специфичным для атопического дерматита, так как они обнаруживаются и при других болезнях, особенно с аллергическим компонентом, при паразитарных заболеваниях, некоторых инфекциях, при таких дерматозах (см.), как чесотка (см.), псориаз (см.), Т-клеточная лимфома, фотодерматозы. Однако не у всех больных атопическим дерматитом выявляют повышенный уровень атопенов. Клинические наблюдения подтверждают, что иммунные нарушения, постоянное травмирование кожного покрова и дисбиоценоз кожи способствуют частым инфекционным осложнениям атопических кожных поражений, периодическому появлению буллезного импетиго (см.), эритемотозно-сквамозной стрептодермии (см.), пустул, фурункулов (см.), дерматита (см.). Многие авторы подчеркивают особенно активное размножение в очагах атопического дерматита и на интактной коже больных золотистого и коагулазонегативного стафилококков, а на некоторых участках кожи — дрожжеподобных грибов, что не только вызывает клинически типичные инфекционные осложнения, но и усиливает атопические поражения посредством выделяемых микроорганизмами токсинов. Учитывая многочисленные научные факты, полученные в последние годы и уточняющие ряд сторон механизма развития атопического дерматита, можно полагать, что большую роль в хронизации атопического дерматита и формировании непрерывного или часто рецидивирующего типа его течения играет условно-болезнетворная флора, в том числе грибковая, на что раньше обращали гораздо меньше внимания, чем на алиментарные (связанные с питанием) факторы. Снижение устойчивости к микрофлоре еще больше проявляется при наличии фокальных инфекций и паразитарных заболеваний, длительное течение которых может приводить к вторичному иммунодефициту. Подобные сопутствующие заболевания, так же как другие поражения внутренних органов, формируют патологический, отягощающий фон для развития атопического дерматита, но не являются основой формирования этой болезни, имеющей специфический механизм развития. Патологоанатомическая картина при обычных исследованиях не отличается патогномоничными (свойственными только данному заболеванию) чертами. Отмечают ее подобие банальным воспалительным состояниям, в том числе контактной экземе (см.), находят некоторые черты сходства с псориазом (см.), себорейной экземой, фотоаллергической реакцией и пр. Обнаруживаются различия в период обострения в хронических очагах. При хроническом течении в очагах поражения явления отека незначительны. Определяются выраженная гиперплазия акантотического эпидермиса, гиперкератоз, участки паракератоза; в дерме обнаруживается воспалительное образование. Имеются сообщения о том, что в период обострения в очагах атопического дерматита снижается уровень апоптоза — запрограммированной физиологической гибели клеток эпидермиса. В связи с этим увеличивается толщина эпидермиса. При наступлении ремиссии в пораженных воспалительным процессом участках кожи соотношение в системе «митоз-апоптоз» возвращается к равновесному состоянию и происходит уменьшение толщины эпидермиса. Известно, что митоз (деление соматических клеток) и апоптоз представляют собой противоположные процессы, регулирующие тканевый гомеостаз.
Клиническая картина Атопический нейродермит Заболевание чаще проявляется на 3-м месяце, иногда несколько раньше, но никогда не возникает сразу после рождения. Нередки случаи более поздних проявлений в детском возрасте. Допускается возможность первичных явных проявлений в подростковом и юношеском возрасте (не старше 20 лет). Заболевание может продолжаться десятки лет. В детстве поражения обычно более распространенные и острые, рецидивы наступают чаще. У взрослых преобладают локальные формы (поражения на кистях рук, лице, шее), нередко наблюдается полная ремиссия. Раньше считалось, что из числа заболевших в раннем детстве к 40 годам активные проявления остаются у 1–2 % больных. Последующие наблюдения показали, что заболевание сохраняется у 40 %. При многолетних ремиссиях не исключается возможность рецидива даже в пожилом возрасте. Рецидивы часто приурочены к периодам физиологического и эмоционального напряжения: к 7-летнему возрасту, окончанию школы, наступлению менструаций, беременности (см.) и пр. В детстве улучшение наступает обычно в летнее время, у многих взрослых сезонность не определяется. Прогностически неблагоприятным у ребенка с атопическим дерматитом считаются раннее начало болезни, женский пол, сочетание с респираторной атопией или другой наследственной патологией, ранняя аллергизация, упорные заболевания желудочно-кишечного тракта, фокальные инфекции. Различают три возрастные фазы болезни: первая (до 2 лет), вторая (от 2 лет до подросткового возраста) и третья (юношеский и зрелый возраст). Основные различия клинических проявлений по возрастным фазам заключаются в локализации очагов поражения и соотношении экссудативных и лихеноидных компонентов. В первой возрастной фазе очаги поражения более экссудативны, локализуются на участках кожи. Назальные поражения (поражения носа) представлены покраснением, нарастающим отеком, нередко везикуляцией (формированием пузырьков), мокнутием с образованием массивных серозных корок. Лихеноидные поражения, трофические изменения кожи с выраженной сухостью появляются позже (спустя несколько недель). На этом фоне у некоторых детей в последующем появляются мелкие пруригинозные (пруриго — почесуха) папулы. Очаги поражения чаще всего появляются на щеках, подбородке, латеральных (боковых) поверхностях голеней, разгибательных поверхностях верхних конечностей, на ягодицах. В дальнейшем поражения могут появиться на груди, животе, спине или развивается эритродермия (атопическая эритродермия Хилла). Границы очагов поражения обычно нечеткие. У детей с инфекционно-паразитарными болезнями кишечника возникают множественные приподнятые, четко отграниченные, яркокрасные, отечные очаги, покрытые корками. У некоторых детей с минимальной церебральной патологией и другими поражениями нервной системы рано развиваются лихенизация (см.), сухость, морщинистость кожи, мучительный зуд и плохой сон. Во второй возрастной фазе островоспалительные явления менее выражены или кратковременны, но всегда сохраняются покраснение и некоторая отечность в очагах поражения. Высыпные элементы включают лихеноидные плоские полигональные папулы, многочисленные фолликулярные папулы, при обострениях — папуловезикулы и пузырьки. Вторичные элементы представлены геморрагическими корками, чешуйками, лихенизацией, трещинами, эрозиями. Границы очагов поражения нечеткие; они наиболее часто располагаются в крупных складках (локтевых, подколенных), на шее, кистях рук и в области запястий. У многих больных обнаруживается распространенное поражение кожного покрова с наличием сухости, отрубевидного шелушения, мелких экскориаций (расчесов), многочисленных полушаровидных и округлых фолликулярных папул. Эти папулы бледные, обычно цвета кожи и лишь при обострении на короткое время приобретают красную окраску. У многих больных, особенно к концу второй фазы, выражены периоральная (вокруг рта) лихенизация (см.) и хейлит (см.). В третьей возрастной фазе снижается активность воспалительных проявлений, но нарастают явления лихенизации (см.) и сосудистых дисфункций. Локализация теряет приуроченность к складкам, становится заметной избирательность высыпаний в области верхней половины туловища с распространенными поражениями лица, шеи, верхних конечностей. Зуд (см.), часто очень сильный и пароксизмальный, является постоянным симптомом во всех возрастных фазах. Он усиливается ночью, при волнении, приеме пищи, которую больной не переносит, и пр. При хроническом течении у многих больных, особенно во второй фазе, выражены дисхромии (изменения окраски кожи) на туловище и плечах в виде крупноочаговых пигментаций и гипопигментаций. При тяжелом и длительном процессе формируются признаки «атопического лица»: псевдосимптом Хертога, поредение латеральной части бровей вследствие постоянного трения и расчесывания, складки Моргана, или линии Дени (углубленные складки на нижних веках), отечность и синюшность нижних век, шелушение верхних и нижних век, бледность лица или застойная красноватая окраска с отечностью, периоральная лихенизация (см.) и хейлит (см.). Белый дермографизм отмечается у многих, но не у всех больных; иногда дермографизм отсутствует или он бледно-розовый. Полиморфный рефлекс повышен. В подростковом возрасте часто наблюдаются мраморность кожи, ливедо (сине-фиолетовое окрашивание), акроцианоз, гипергидроз (повышенная влажность) ладоней и подошв. При поражении пальцев рук с трещинами и везикуляцией ногти становятся дистрофичными, с глубокими поперечными бороздами. Волосы при обострениях становятся тусклыми. Периодически возникающая вторичная кожная инфекция настолько характерна, что может быть включена в основную картину атопического дерматита. Встречаются эритематозно-сквамозная стрептодермия (см.), фолликулиты (см.), гнойные корки, фурункулы (см.), микробная паронихия (см.), дрожжевые поражения. Часты инфицированные очаги с трещинами и корками в заушных складках. Реже возникает импетиго (см.) или герпетиформная экзема (см.). При упорной или нерационально леченной пиогенной (гнойной) инфекции появляется лимфаденит (см.), особенно в подбородочной области и на шее, повышается температура тела. Среди сочетанных поражений следует отметить возникающие у некоторых больных уртикарные (аллергические) высыпания и отек Квинке (см.), кореподобные эритемы, вазомоторный ринит (см.), бронхит (см.) с астматическим компонентом, конъюнктивит (см.), иногда бронхиальную астму (см.) или полипоз (см.), реже — атопическую катаракту (см.). На основании различий в клинической морфологии высыпаний у детей с атопическим дерматитом выделяют формы, свойственные раннему возрасту, в том числе предэкзематозную стадию, а также бляшечную форму, возникающую у детей с тяжелым энтероколитом инфекционно-паразитарного происхождения. В зависимости от площади вовлеченного в патологический процесс кожного покрова различают локальные (обычно складки, кисти или периоральная лихенизация), распространенные и эритродермические формы. Выделяют три типа течения атопического дерматита: — тип I — выздоровление наступает до 2 лет; — тип II — выраженная манифестация высыпаний до 2 лет с последующими ремиссиями, иногда длительными; — тип III характеризуется непрерывным течением. Целесообразно при прогнозировании и назначении лечения учитывать все три степени активности процесса: I степень — минимальная: локальные поражения, умеренный зуд, лабораторные показатели без отклонений; II степень — умеренная: более распространенные и выраженные поражения, сильный зуд, нарастание лихенизации (см.) или воспаления, вторичная инфекция, небольшие отклонения лабораторных показателей; III степень — высокая: усиление остроты воспалительных явлений, отек, распространение высыпаний, значительная лихенизация (см.) с пруригинозными высыпаниями, интенсивный пароксизмальный зуд, тяжелые бактериальные осложнения, выраженные отклонения лабораторных показателей (эозинофилия, анемия, лейкопения или лейкоцитоз, моноцитоз, моноцитопения, повышенная СОЭ, диспротеинемия, патологические печеночные пробы, повышение уровня молекул средней массы, снижение общего числа лимфоцитов, Т-хелперов, показателей фагоцитоза. В редких случаях регистрируют IV степень тяжести — максимальную: универсальное поражение кожи, сопровождающееся выраженными воспалительными явлениями, маскирующими лихенизацию (см.), мучительный постоянный зуд, вторичная инфекция, лимфаденопатия, лихорадка, плохое самочувствие и тяжелое общее состояние, высокая степень внутренней интоксикации, значительные изменения лабораторных показателей. Осложнения: анафилактический шок (см.), синдром диссеминированного внутрисосудистого свертывания, герпетиформная экзема (см.) Капоши, длительная и распространенная пиогенная (гнойная) инфекция с лихорадкой и лимфаденопатией, септическое состояние.
Ограниченный нейродермит Локализованный нейродермит развивается на ограниченном участке кожи, однако он часто причиняет больному мучительные страдания вследствие резко выраженного зуда (см.), чаще проявляющегося вечером или ночью. Вначале кожа в местах зуда внешне не изменена. Со временем под влиянием зуда и расчесов возникают высыпания многоугольных плоских папул плотноватой консистенции, местами покрытых отрубевидными чешуйками.
Ограниченный нейродермит
В дальнейшем отдельные папулы сливаются, образуя овальные или округлые плоские бляшки различных размеров (сплошная папулезная инфильтрация), имеющие цвет от бледно-розового до буровато-красного. Постепенно рисунок кожи становится подчеркнутым, утрированным, кожа приобретает шагреневый вид. В типичных случаях на высоте развития локализованного нейродермита в очагах поражения можно различить 3 зоны: центральную, где имеется лихенизация (см.); среднюю — с изолированными блестящими папулами и периферическую (зона повышенной пигментации). На фоне покраснения неостровоспалительного характера часто наблюдаются экскориации, покрытые геморрагическими корками. При обострении процесса, помимо сгруппированных и слившихся лихеноидных папул, иногда появляются рассеянные пруригинозные элементы, усиливается шелушение, краснота приобретает более яркую окраску. Течение болезни длительное. Излюбленная локализация поражений — задняя и боковая поверхности шеи, аногенитальная область (область заднего прохода и половых органов), внутренние поверхности бедер, межъягодичные складки, разгибательные поверхности предплечий, область лодыжек.
Лечение Атопический дерматит При атопическом дерматите лечение многоплановое и индивидуализированное. В тяжелых случаях проводится интенсивная терапия с использованием инфузионных и симптоматических средств (эуфиллин, диуретики), по показаниям назначают гепарин, курантил, стугерон, антибиотики, плазмаферез, гемосорбцию. В более легких случаях используют обычные противовоспалительные и противотоксические средства (антигистаминные препараты, кальций, рутин, глицирам, гипосульфит натрия, пантотенат кальция, сорбенты, спленин, гепатопротекторы). Клинический опыт дерматологов показывает, что при этом заболевании предпочтительны седативные антигистаминные средства (димедрол, супрастин, пипольфен, тавегил, клемастин). В младенческом возрасте все антигистаминные средства должны применяться с особой осторожностью. При назначении антигистаминных препаратов следует учитывать не только снижение их терапевтической эффективности через определенное время, диктующее необходимость смены препарата, но и опасность длительного воздействия на иммунитет и нервную систему у детей, снижение внимания. Антигистаминные средства назначают на 3–4 недели в период острого процесса с выраженными воспалительными явлениями. В тяжелых случаях целесообразно применение препаратов в виде инъекций. В качестве антимедиаторных препаратов рекомендуют кетотифен, пармидин, индометацин и циннаризин, оказывающий антисеротониновое действие. Антигистаминное и антисеротониновое действие оказывают также амизил и ципрогептадин. Можно применять ингибиторы протеиназ — мефенамовую и аминокапроновую кислоты. Из перечисленных препаратов в практике наиболее часто используют циннаризин, улучшающий микроциркуляцию и оказывающий детоксицирующее и незначительное седативное действие, а также кетотифен. Последний обычно рекомендуют при сочетании атопического дерматита с респираторной атопией или как профилактическое средство; однако некоторым больным он помогает и в активной стадии атопического дерматита, улучшая сон. Устранение зуда, коррекция вегетативных дисфункций и психологических расстройств — главные задачи при лечении больных атопическим дерматитом. Поэтому большое значение придается разнообразным психо- и вегетотропным средствам. Сильный пароксизмальный зуд, особенно при слабой эритеме или уменьшении воспалительных поражений, но с большим количеством экскориаций и выраженной лихенизацией, является показанием для смены антигистаминных препаратов на психотропные средства с более сильным седативным действием. Назначают слабые нейролептики в небольших дозах, особенно при наличии навязчивостей — облизывание губ,онихофагия (обкусывание ногтей), псевдосимптом Хертога; сонапакс, хлорпротиксен, эглонил; антидепрессанты — амитриптилин, аурорикс, людиомил. В раннем детском возрасте эффективен фенобарбитал. С целью получения седативного эффекта используются разнообразные физиотерапевтические методы, в том числе диадинамические токи на паравертебральные симпатические узлы, центральную электроаналгезию аппаратом ЛЭМАР, интраназальный электрофорез димедрола, новокаина, успокаивающие ванны, пунктурную физиотерапию, электросон, гипноз. В современной терапии значительное место занимают цитокины и интерфероны. Используются иммунотропные свойства ультрафиолетовых и инфракрасных лучей, широко применяются фотохимиотерапия, селективная фототерапия, лазерная терапия. Эти методы назначают в комплексе с иммунокорригирующими и другими средствами: Т-активином, карбонатом лития, задитеном, перитолом, димоцифоном, миелопидом и т. д. Сильные иммуносупрессоры (глюкокортикостероиды, цитостатики) нецелесообразно использовать в широкой практике. Допускается возможность кратковременного назначения глюкокортикостероидов в крайне тяжелых случаях при распространенных и экссудативных формах атопического дерматита. В качестве иммуносупрессанта применяют также антибиотик с иммуномодулирующим действием — циклоспорин А (3–5 мг/кг в сутки с последующим снижением дозы до 1 мг/кг в сутки или переходом на интермиттирующую терапию с приемом препарата один раз в 5 дней). Кроме противовоспалительного действия, во время приема циклоспорина А наблюдается заметное снижение зуда. Возможность развития тяжелых, а иногда и необратимых побочных явлений (нефротоксическое и гепатотоксическое действие, артериальная гипертензия, дрожание) исключает широкое применение циклоспорина А при нейродермите. В особо тяжелых случаях он рекомендуется как один из препаратов выбора. Менее опасно наружное использование таких препаратов. Отмечена клиническая эффективность крема с циклоспорином. Больным с частыми осложнениями, вторичной инфекцией кожных покровов, фокальными инфекциями, дисбактериозом кишечника, паразитозами и плохими показателями иммунограммы, свидетельствующими о вторичном иммунодефиците, назначают метилурацил, нуклеинат натрия, спленин, милдранат, миелопид, дицифон, мипровит, бестатин, беметил, ксимедон, тимические пептиды и т. д. Благоприятное действие оказывает рузам. У ряда больных после курса инъекций рузама держалась длительная ремиссия. Особенно большое значение имеет адекватная наружная терапия, в которую входят противовоспалительные и рассасывающие средства, эпителизирующие и улучшающие трофику, противозудные и смягчающие препараты. По показаниям назначают наружные антимикробные препараты. В традиционной наружной терапии в нашей стране используются пасты с третьей фракцией АДС (антисептик — стимулятор Дорогова), древесным дегтем, нафталанской нефтью, дерматолом. В качестве антимикробных средств назначают анилиновые красители, эктерицид, хлорофиллипт, диоксидин, хлоргексидин, фастин, дермазин, сальвин, сиагвиритрин, новоиманин, бактробан, клотримазол, пасты и мази с линкомицином, гентамицином, фузидином. Для эпителизации применяют мазь ацемина, вулнузан и пантенол, для смягчения и питания кожи — мазь «Солкосерил», актовегин, линимент алоэ, липофундин, мазь Рыбакова, крем Унны. На очаги с выраженной лихенизацией и инфильтрацией следует более длительно воздействовать рассасывающими средствами (жидкость Митрошина, пасты и мази с АСД, нафталаном, ихтиолом), парафиновыми аппликациями и другими тепловыми процедурами. Применяют дарсонвализацию, местные горячие ванночки с отварами трав. На воспалительные атопические очаги, особенно у детей младшего возраста, благоприятно действуют пантотеновая мазь и бепантен. В острой стадии с мокнутием и везикуляцией на очаги поражения (особенно на лице) следует наложить на 30 мин теплый дерматологический компресс с 0,1 %-ным раствором риванола. Компресс надо снимать теплым и влажным, иначе кожа пересыхает и охлаждается. Можно использовать (на короткое время) цинковое масло. Применяют также общие ванны: в острой фазе — с крахмалом, отваром корня лопуха или аира, травы фиалки трехцветной, тысячелистника; при сухих лихенизированных поражениях — с маслами. Отмечается эффективность наружной иммуносупрессивной терапии. Слабыми супрессивными свойствами обладают давно известные дерматологические средства: дегти, ихтиол, нафталановая нефть, сера, а также мази с нестероидными противовоспалительными средствами. Более выражены свойства иммуносупрессоров у кортикостероидных кремов и мазей. Большинство дерматологов не рекомендуют пользоваться кортикостероидными мазями при легких и умеренно выраженных поражениях. Их назначают кратковременно и в тяжелых случаях при неэффективности других методов. Для предотвращения осложнений кортикостероидные мази необходимо назначать дифференцированно, учитывая не только возраст пациента, но и локализацию поражений. Детям показаны только слабые мази (гидрокортизон). Кортикостероидные мази применяют утром один раз в день (так как ингредиенты депонируются в роговом слое) на протяжении 4 дней в неделю, в остальные дни используют нестероидные мази. При назначении этих мазей следует определять площадь нанесения и ее соотношение с массой тела пациента, состояние поверхности кожи, так как с эрозивных очагов всасывание бывает больше, что может привести к тяжелым осложнениям.
Ограниченный нейродермит Широко применяются различные психотропные и вегетотропные средства: транквилизаторы (феназепам, тазепам, элениум, седуксен, бензоклидин), слабые нейролепики в небольших дозах, антидепрессанты (триптизол, азафен, пиразидол, людиомил, аурорикс), седативные травы (валериана, пустырник, сушеница, душица, синюха голубая), бром, пирроксан, беллатаминал и другие препараты белладонны, новокаин, антигистаминные средства. При дисфункции желудка, кишечника, печени, поджелудочной железы показана коррекция в зависимости от характера выявленной патологии: желудочный сок, пепсидил, панкреатин, холензим; ферментные препараты — мезим, фестал, дигестал, панзинорм и другие, а также биопрепараты при дисбактериозе кишечника. Необходима тщательная профилактика запоров соответствующей диетой, богатой растительной клетчаткой, показаны слабительные растительного происхождения. Ограничивают блюда, содержащие гистаминолибераторы, острую пищу, пряности, копчености, алкоголь, кофе, шоколад, какао, соль. Назначают гепатопротекторы и метаболическую терапию: карсил, силибор, эссенциале, липоевую кислоту, липостабил, рибоксин, метионин, витамины, антиоксиданты, средства, нормализирующие кислотно-щелочное равновесие. При выявлении эндокринной патологии необходима коррекция соответствующими гормональными препаратами. Эффективны некоторые средства физиотерапии: фонофорез или электрофорез противозудных и рассасывающих препаратов, дарсонвализация очагов поражения, различные виды акупунктуры, криотерапия, парафиновые нанесения, электросон, диадинамические токи. Целесообразно проводить обкалывание очагов поражения 0,1–0,2 %-ным раствором метиленового синего с 2 %-ным раствором бенкаина или новокаина с пролонгатором — желатином или поливинилпирролидоном. Наружно применяют те же средства, что и при атопическом нейродермите. При всех видах нейродермита показано курортное лечение.
Профилактика Профилактика заключается в следующем: — медико-генетическое консультирование семей; — элиминация (удаление) аллергенов или уменьшение контактов с аллергенами; сведение к минимуму других факторов риска и триггерных (пусковых) воздействий на пациента; — дородовая профилактика с тщательным наблюдением за беременными, болевшими атопическим дерматитом или имеющими родственников с атопическими заболеваниями.
НЕЙРОРЕВМАТИЗМ
ОпределениеНейроревматизм — ревматическое поражение элементов нервной системы. Ревматизм — общее инфекционно-аллергическое заболевание с системным поражением соединительной ткани, преимущественной локализацией в сердечно-сосудистой системе, а также вовлечением в процесс других внутренних органов и систем.Болезнь может начаться с ангины (см.), дать затем поражение суставов в виде острого суставного ревматизма (см.), поражение мозга в виде малой хореи (см.), поражение сердца в виде ревмокардита (см.) без пороков клапанов или с возвратным ревмокардитом и пороком клапанов, миокардиосклероз (см.). Поражения нервной системы при ревматизме многообразны, однако чаще всего встречаются мозговой ревмоваскулит, малая хорея, эмболия мозговых сосудов при митральной болезни.
Этиология, патогенез и патанатомия Установлена роль в возникновении нейроревматизма бета-гемолитического стрептококка группы А. В развитии ревматизма существенное значение придается аллергии, хотя конкретные этапы механизма развития не выяснены. Предполагается, что сенсибилизирующие агенты (стрептококк, вирус, неспецифические аллергены и т. д.) могут приводить на первых этапах к аллергическому воспалению в сердце, а затем к изменению антигенных свойств его компонентов с превращением их в аутоантигены и развитием аутоиммунного процесса. Важную роль в развитии ревматизма играет наследственная предрасположенность. Для ревматических поражений головного мозга характерны изменение нервных клеток, мелкие околососудистые кровоизлияния, серозно-продуктивные процессы в мягкой мозговой оболочке.
Клиническая картина Практическое значение имеет только малая хорея (см.). Слово «хорея» в переводе с латинского означает «танец», «хороводная пляска». Заболевание развивается обычно у детей школьного возраста 7—15 лет, чаще девочек. Н. Ф. Филатов, известный отечественный педиатр, считал инфекционную хорею (см.) ревматическим поражением головного мозга. О ревматическом происхождении хореи говорит тесная связь ее с суставным ревматизмом (см.), эндокардитом (см.) и тонзиллитом (см.). Симптомы болезни развиваются постепенно. Иногда заболевание начинается с гримасничанья, вычурности движений, рассеянности, что принимается родителями и учителями в школе за шалости и вызывает с их стороны соответствующую реакцию. В дальнейшем появляется ряд непроизвольных некоординированных (несоразмерных) и порывистых движений при значительном снижении мышечного тонуса. В некоторых случаях тонус мышц бывает настолько снижен, что можно даже говорить о паретическом состоянии конечностей (псевдопаралич). Такую форму хореи именуют малой хореей. Беспорядочно дергаются руки, мышцы туловища и лица. Стояние и ходьба в тяжелых случаях заболевания невозможны. В подергиваниях принимают участие язык, мышцы гортани, жевательная мускулатура. Вследствие этого могут сильно страдать глотание и речь. В особо тяжелых случаях все тело находится в постоянном сильном беспокойстве. Руки и ноги раскидываются в разные стороны, туловище и голова принимают самые причудливые положения, иногда больного даже сбрасывает с койки. Не только в тяжелых, но и в легких случаях хореи отмечается изменение психики ребенка: расстраиваются память и внимание, развиваются пугливость и безразличие, наблюдаются беспричинный смех и плач. Из неврологических симптомов почти всегда отмечается типичный для малой хореи рефлекс Гордона, заключающийся в следующем: при вызывании коленного рефлекса голень задерживается в разгибательном положении, не возвращаясь к исходной позиции на более длительное время, чем это бывает в норме. Если в этот момент вторично ударить по сухожилию коленной чашки, то нога вытягивается по прямой линии. Показательна также проба, которую не удается выполнить больному ребенку, — высунуть язык и одновременно зажмурить глаза. Малая хорея очень редко кончается смертью. Заболевание тем не менее серьезное, так как ему часто сопутствует поражение сердца в форме эндокардита. Малая хорея может повториться. Длительность ее — 1–3 месяца, а в тяжелых случаях и больше. Женщины, в детстве болевшие рецидивирующей хореей, должны помнить, что во время беременности, обычно на IV–V месяце, заболевание может легко проявиться вновь. В таких случаях хорею часто называют хореей беременных. Обычно она обусловлена ревматической инфекцией. Иной раз она проявляется настолько резко, что приходится прерывать беременность (см.), даже перешедшую во вторую половину. Это небезопасно для жизни женщины и в любом случае наносит тяжелую психическую травму будущей матери. Поэтому в подобных случаях следует предупредить об этом больную и ее родителей и посоветовать ей не иметь в будущем беременностей.
Лечение Лечение сводится к следующему: — постельный режим ввиду сочетания хореи с ревматическим эндокардитом; — сон благоприятно влияет на течение хореи, так как насильственные движения во сне прекращаются; — диета с ограничением содержания поваренной соли и углеводов при достаточном введении полноценных белков и повышенном содержании витаминов; — при резких гиперкинезах (см.) рекомендуется лечение сном сочетать с приемом аминазина; — назначают бензилпенициллина натриевую соль, затем препараты пролонгированного (продленного) действия (бициллин-3, бициллин-5); при непереносимости пенициллинов их заменяют цефалоспоринами; — глюкокортикостероиды; — нестероидные противовоспалительные препараты (аспирин, индометацин и др.); — препараты аминохинола.
НЕЙРОСИФИЛИС
ОпределениеНейросифилис — сифилис (см.) нервной системы. Сифилис — это венерическое инфекционно-аллергическое заболевание с поражением всех органов и систем, склонное к прогрессированию.Постоянный рост заболеваемости сифилисом обусловлен: — ухудшением социально-экономического положения общества; — снижением нравственных критериев; — ростом алкоголизма (см.), проституции и наркомании (см.); — ранним началом половой жизни; — недоступностью бесплатного лечения; — миграцией населения.
Этиология и патогенез Возбудителем нейросифилиса является бледная трепонема (спирохета). Раньше главной причиной сифилиса нервной системы считалось отсутствие или недостаточное предшествующее лечение. Современный нейросифилис отмечается ростом числа стертых, атипичных малосимптомных и серорезистентных форм. Перечисленные особенности объясняются измененной реактивностью организма и эволюцией болезнетворных свойств бледной трепонемы, частично утратившей свою нейротропность (сродство к нервной ткани). Человек заражается сифилисом (см.) от больного. Это обычно происходит половым путем, но возможен и бытовой путь заражения (через предметы обихода), так как во влажной среде возбудитель сохраняется в течение нескольких часов. Кроме того, заражение возможно через поцелуи, укусы перепончатокрылых насекомых, переливание крови. Встречается и профессиональный сифилис: медперсонал может заразиться при контакте с больным во время осмотра, проведении манипуляций, а также при оперативных вмешательствах и вскрытии трупов. Возбудитель сифилиса проникает в организм через поврежденную кожу и слизистые оболочки, причем повреждение может быть столь незначительным, что остается невидимым или оно может располагаться в местах, недоступных осмотру. Бледная трепонема распространяется в организме вместе с лимфо- и кровотоком, а также нейрогенным путем. Инкубационный период в типичных случаях длится 21 день. В ответ на присутствие в организме чужеродного антигена начинают активно вырабатываться антитела. Внедрение трепонемы в центральную нервную систему происходит за счет повышения проницаемости гематоэнцефалического барьера. Патоморфологические изменения при нейросифилисе характеризуются неспецифическими реакциями с преобладанием плазматических элементов, а также васкулитом (см.), гранулемами, изменениями нейронов и глии.
Клиническая картина Клиническая картина формируется по линии воспалительно-дегенеративных форм. Преобладают больные с рассеянной симптоматикой (выпадение и снижение ахилловых и коленных рефлексов, вялая реакция зрачков на свет, нарушение мышечно-суставного чувства и др.), симптоматикой прогрессивного паралича. Выраженные формы спинной сухотки и цереброспинального сифилиса, некогда составляющие основное ядро органической патологии нервной системы, в настоящее время почти не встречаются. Клинической казуистикой стали гуммы головного и спинного мозга, сифилитический шейный пахименингит. Эволюцию клинической картины лишь частично допустимо связывать с широким применением антибиотиков, обладающих противовоспалительным действием. Против решающей роли антисифилитических средств в эволюции нейросифилиса свидетельствует то обстоятельство, что указанная эволюция была зафиксирована еще в 20-е гг. ХХ в., до появления антибиотиков. В постановке диагноза нейросифилиса наряду с классическими серологическими реакциями (КСР), иммуноферментным анализом (ИФА) ценное значение приобрела реакция иммобилизации бледных трепонем (РИБТ или РИТ). Выявлена высокая специфичность РИБТ при третичном, позднем, врожденном сифилисе и сифилисе нервной системы, иногда превосходящая КСР. РИБТ и реакция иммунофлюоресценции (РИФ) — ценные методы при исследовании спинномозговой жидкости. Нейросифилис обнаруживается в 60 % случаев и условно делится на ранний и поздний. Ранний нейросифилис возникает до 5 лет от момента заражения и называется мезенхимальным (так как поражаются сосуды и оболочки мозга). При этом поражение нервной ткани всегда вторично и обусловлено патологическим процессом в сосудах. Поздний нейросифилис возникает после 5 лет от начала заболевания и называется паренхиматозным, так как при этом поражаются нервные клетки, волокна и глия. Патологический процесс имеет воспалительно-дистрофический характер. Нейросифилис классифицируют следующим образом. 1. Ранний нейросифилис: — бессимптомный; — клинически явный: церебральный (менингеальный и васкулярный), цереброменингеальный (диффузный и локальный гуммозный), цереброваскулярный; — спинальный (менингеальный и васкулярный). 2. Поздний нейросифилис: — спинная сухотка; — прогрессивный паралич; — атрофия зрительного нерва. 3. Врожденный нейросифилис.
Ранний нейросифилис Бессимптомный нейросифилис — это состояние, при котором имеются изменения спинномозговой жидкости и положительные серологические реакции, но отсутствуют неврологические симптомы. Подобный характер заболевания возможен уже при первичном сифилисе. Сифилис — практически единственная инфекция, которая может вызывать изменения в спинномозговой жидкости при отсутствии менингеальных симптомов. Спинномозговая жидкость обычно вытекает под давлением, определяются лимфоцитарный плеоцитоз (повышенное содержание лимфоцитов в цереброспинальной жидкости) и положительные серологические реакции. Клинически явный нейросифилис представлен несколькими формами. Цереброменингеальный диффузный сифилис чаще встречается в период рецидива общего заболевания. Процесс начинается остро: появляются головная боль, головокружение, шум в голове, рвота. Температура тела повышается до 39 °C. Выявляются резко выраженные менингеальные симптомы: ригидность (жесткость) затылочных мышц, симптомы Кернига и Брудзинского. В некоторых случаях на глазном дне выявляется гиперемия зрительного нерва. При исследовании спинномозговой жидкости выявляется лимфоцитарный плеоцитоз, белок повышен незначительно, спинномозговая жидкость вытекает под давлением. Локальная форма цереброменингеального сифилиса представлена гуммой. Клинически выявляется объемный процесс, напоминающий быстро растущую опухоль (головная боль, застойные диски зрительных нервов). Очаговая симптоматика зависит от локализации гуммы. В спинномозговой жидкости отмечаются лимфоцитарный плеоцитоз и положительные серологические реакции. Заболеваемость цереброваскулярным сифилисом значительно выросла в последние годы. При этой форме поражаются мелкие и более крупные сосуды (церебральный васкулит). Клиническая картина может быть самой разнообразной: с проявлениями распространенного поражения коры, подкорковых узлов, а также в виде рассеянной микросимптоматики. При поражении более крупных артерий может возникнуть картина ишемического или геморрагического инсульта (см.). При этом появляются очаговые симптомы, обусловленные сифилитическим церебральным васкулитом (см.). Клинически выявляются парезы (см.), параличи (см.), афазия (см.), патологические рефлексы и другие симптомы. Однако наличие в прошлом сифилиса, а также положительных серологических реакций в крови или спинномозговой жидкости указывает на специфический процесс в сосудах. В основе спинального (менингеального и васкулярного) сифилиса лежит поражение оболочек и сосудов спинного мозга. Клинически это может проявляться менингорадикулопатией и миелопатией. Сифилитическая миелопатия может возникать остро или подостро и характеризуется нижним парапарезом, тазовыми расстройствами и трофическими нарушениями. При преимущественной локализации процесса по задней поверхности спинного мозга клиническая картина может напоминать спинную сухотку при позднем нейросифилисе. При этом также снижаются ахилловы и коленные рефлексы, отмечается пошатывание в позе Ромберга, нарушение тазовых органов. Однако при миелопатии отмечается повышение мышечного тонуса, а при спинной сухотке мышечный тонус снижается. При поражении оболочек спинного мозга на уровне крестцовых сегментов возникает картина менингорадикулопатии. К спинальному менингеальному сифилису относят шейный гипертрофический пахименингит. В основе данной формы лежит образование рубцов в оболочках спинного мозга. Заболевание течет медленно (годами), клинически оно характеризуется корешковыми болями в шее и верхних конечностях, вялыми парезами (см.) рук, выпадением чувствительности в зоне С8-D1 сегментов, тазовыми расстройствами. При раннем нейросифилисе в процесс может вовлекаться периферическая нервная система, как правило, в виде радикулопатии и полиневропатии. Характерным является поражение шейно-грудных и поясничнокрестцовых корешков. Сильные боли возникают в ночное время, преобладают нарушения чувствительности (без двигательных расстройств). В спинномозговой жидкости отмечаются воспалительные изменения и положительные серологические реакции. При раннем нейросифилисе в процесс нередко вовлекается зрительный нерв. Как правило, процесс бывает двусторонним и приводит к нарушению зрения, обычно нарушается центральное зрение (от незначительного затуманивания до полной слепоты). При обследовании обнаруживаются гиперемия зрительного нерва, нечеткость границ, незначительное набухание ткани диска, расширение и извитость вен. Часто наблюдаются кровоизлияния, иногда обнаруживаются белые дегенеративные очаги. В тяжелых запущенных случаях неврит (см.) зрительного нерва заканчивается слепотой в результате атрофии (см.) зрительного нерва. Благоприятный исход возможен при рано начатом энергичном противосифилитическом лечении.
Поздний нейросифилис Спинная сухотка возникает через 10–15 лет после заражения сифилисом. При этом страдают задние столбы, задние рога, задние корешки спинного мозга, черепные нервы (I и VIII), кора головного мозга. Процесс обычно начинается с пояснично-крестцового отдела с вовлечением задних корешков и задних столбов спинного мозга. В клинической картине заболевания преобладают следующие симптомы: — корешковые пронизывающие боли; — атактическая походка за счет сенсорной атаксии (нарушения координации движений); — выпадение коленных и ахилловых рефлексов. Выделяют три стадии спинной сухотки: I стадия — невралгическая, для которой характерны чувствительные расстройства с локализацией в подошвах, спине, поясничном отделе. Характерны кинжальные стреляющие боли. Подобные боли могут возникать также и во внутренних органах. II стадия — атактическая, для которой характерно вовлечение в процесс задних столбов спинного мозга. В результате их поражения возникает сенсорная атаксия (см.), которая усиливается при отсутствии контроля зрения и в темноте. Больные при ходьбе постоянно смотрят на свои ноги и на пол, характерна так называемая «штампующая» походка. Отмечается пошатывание при ходьбе из стороны в сторону, неустойчивость в позе Ромберга. При этом больной обычно не падает, а стремится удержаться, открывая глаза и балансируя руками. В этой стадии появляются следующие симптомы: — мышечная гипотония; — тазовые расстройства (в том числе в половой сфере); — атрофия зрительных нервов. III стадия — стадия грубых двигательных расстройств из-за нарушения координации движений. В этой стадии возникают безболезненные язвы, выпадение зубов и волос, снижение потоотделения, остеопатии (ведущие к переломам (см.)), артропатии. Табетическая артропатия (сустав Шарко) приводит к изменению величины, формы и конфигурации суставов. Процесс охватывает один или два сустава (чаще коленный, реже — тазобедренный). Больные не могут ходить и даже вставать, так как не чувствуют движения своих ног в коленных и тазобедренных суставах. При исследовании спинномозговой жидкости выявляются незначительный лимфоцитарный плеоцитоз, повышенный белок и положительные серологические реакции. Однако в более позднем периоде спинномозговая жидкость может быть нормальной. Амиотрофический спинальный сифилис характеризуется дегенеративно-воспалительным процессом в передних корешках и оболочках спинного мозга. Данная форма проявляется атрофией мышц кистей и туловища, фасцикуляциями (непроизвольным сокращением отдельных мышечных волокон). Течение медленно прогрессирующее. Прогрессивный паралич характеризуется неврологическими и психическими расстройствами (см.) (в виде снижения критики по отношению к себе и окружающим). Преобладают психическая вязкость с раздражительностью, недовольство, обидчивость, злобность, взрывчатость. Психические нарушения проявляются в форме эпизодов и существуют длительно.
Врожденный сифилис нервной системы Проявляется на первом году жизни и в юношеском возрасте. Клинически характеризуется менингитом (см.), гидроцефалией (см.), глухотой (см.), эпилептическими припадками. При исследовании спинномозговой жидкости выявляются положительные серологические реакции. Кроме того, при врожденном сифилисе может наблюдаться триада Гетчинсона, включающая интерстициальный кератит (см.), деформацию зубов с полулунным дефектом и глухоту (полная триада встречается редко).
Лечение и профилактика Лечение зависит от выраженности клинической картины и стадии заболевания. Средство выбора при нейросифилисе — бензилпенициллин, надежно предупреждающий прогрессирование заболевания у больных с нормальной иммунной системой. Существуют различные схемы лечения. При бессимптомном нейросифилисе назначается водный раствор пенициллина — по 4 млн ЕД внутривенно 4 раза в сутки, или трокаинбензилпенициллин по 2,4 млн ЕД 1 раз в сутки внутримышечно и пробеницид по 500 мг 4 раза в сутки per os (в течение 14 дней), или бензатинбензилпенициллин по 2,4 млн ЕД внутримышечно 1 раз в неделю в течение 3 недель. При непереносимости пенициллина можно назначить тетрациклин —500 мг 4 раза в сутки (в течение месяца). Осмотр, исследование спинномозговой жидкости и сыворотки проводят каждые 3–6 месяцев. Нормальный состав свидетельствует о выздоровлении. Если через 6 месяцев он остается измененным и продолжают нарастать показатели нетрепонемных тестов, то требуются повторные курсы лечения пенициллином. Лечение нейросифилиса с клинически явными проявлениями проводится по следующим принципам: — водный раствор пенициллина — 12–24 млн ЕД в сутки внутривенно (3–6 млн ЕД х 4 раза) в течение 14 дней; — прокаинбензилпенициллин — 2,4 млн ЕД 1 раз в сутки внутримышечно и пробеницид — 500 мг 4 раза в сутки per os или этамид по 3 таблетки (0,35 г) 4 раза в сутки (14 дней). Этамид и пробеницид способствуют задержке пенициллинов в организме, тем самым повышая концентрацию антибиотика в спинномозговой жидкости; — после любой из схем лечение продолжают, назначая бензатинбензилпенициллин по 2,4 млн ЕД № 3 или экстенциллин по 2,4 млн ЕД (внутримышечно 1 раз в неделю). Можно рекомендовать и другие антибиотики: — тетрациклин — 500 мг 4 раза в сутки (30 дней); — эритромицин — 500 мг 4 раза в сутки (30 дней); — хлорамфеникол — 1 г 4 раза в сутки внутривенно (в течение 6 недель), цифтриаксон — 2 г 1 раз в сутки парентерально (в течение 14 дней). Эффективной терапии позднего нейросифилиса нет, заболевание может прогрессировать, несмотря на массивные дозы антибиотиков. Скорее всего, некоторые проявления позднего нейросифилиса являются результатом аутоиммунного процесса. Кортикостероиды (преднизолон — 40 мг в сутки) могут снижать плеоцитоз в спинномозговой жидкости. В процессе лечения желательно еженедельно исследовать спинномозговую жидкость на цитоз (наличие клеток), и, если он не снижается, антибиотикотерапию продлевают на более длительный срок. При нормализации люмбальную пункцию проводят не реже 1 раза в 6 месяцев. Если в течение года состояние остается стабильным, а спинномозговая жидкость остается нормальной, то последующие исследования проводят 1 раз в год. Заключительную люмбальную пункцию делают через 2 года после начала лечения. У некоторых больных нетрепонемные тесты в спинномозговой жидкости и сыворотке могут остаться положительными всю жизнь. Неспецифическое лечение включает в себя витаминотерапию (витамины группы А, B, C, E), общеукрепляющие средства (препараты железа, фосфоглицерофосфат, фитин), ноотропы (ноотропил, пирацетам), глицин (под язык), сосудистые препараты (стугерон, трентал, кавинтон, никотиновая кислота), антиагреганты (аспирин, курантил, гепарин). При поздних формах показана лидаза по 64 ЕД внутримышечно № 20, рекомендуется также электрофорез с ганглиоблокаторами (бензогексонием, пентамином). При пенициллинотерапии может возникнуть реакция бактериолизиса (Яриша-Герсеймера), которая развивается через 4–8 ч после первого введения пенициллина (в виде озноба, повышения температуры, головной боли). В целях профилактики назначают кортикостероиды — преднизолон по 5 мг 4 раза в течение 2 суток и после пенициллинотерапии). В борьбе с сенсорной атаксией (см.) применяются специальные комплексы ЛФК. Критериями насыщенности противосифилитического лечения являются данные клинического обследования. При отсутствии патологических изменений пациентов снимают с учета через 3 года, при положительных серологических реакциях они наблюдаются еще 2 года. Профилактика нейросифилиса должна быть направлена прежде всего на обязательное обследование неврологом больных с заразными формами сифилиса, при этом должно проводиться исследование спинномозговой жидкости.
НЕЙРОТОКСИЧЕСКИЙ СИНДРОМ УДЕТЕЙ
ОпределениеНейротоксический синдром развивается у детей (особенно раннего возраста) довольно часто и при самых различных заболеваниях (инфекционных).
Этиология и патогенез Ведущее значение в механизме развития имеет прямой «удар» токсинов по центральной нервной системе; в результате этого интенсивного воздействия развиваются отек мозга, некрозы (см.), кровоизлияния. Синдром может наблюдаться при дизентерии (см.), гриппе (см.), респираторных вирусных заболеваниях, менингите (см.), менингоэнцефалите, стафилококковой и других инфекциях.
Клиническая картина Важнейшим признаком нейротоксического синдрома является отсутствие или слабая выраженность явлений эксикоза. Характерны нарушения сознания различной степени выраженности вплоть до комы (см.), общие распространенные тонические и клонические судороги на фоне мышечной гипертонии, расстройства терморегуляции и теплопродукции (высокая температура), гипервентиляция, нарушение сердечной деятельности (коронарная недостаточность, тахикардия (см.) до 200 в минуту и более, смещение интервала S-T на ЭКГ), расстройства кровообращения по типу централизации, когда высокое артериальное давление сочетается с уменьшением пульсовой амплитуды, нарушение функции почек, расстройства осморегуляции (гиперэлектролитемия, задержка жидкости в тканях). Для большинства случаев характерно острое и бурное начало, ребенок возбужден, затем наступает угнетение сознания вплоть до комы. Иногда заболевание начинается рвотой, нередко повторной, не связанной с приемом и характером пищи. При среднемозговой коме (см.) резко повышается тонус симпатической нервной системы, температура тела поднимается в течение нескольких часов или сразу достигает высоких цифр (39–40 °C). В этот период отмечаются напряжение большого родничка, ригидность (жесткость) мышц шеи, а у более старших детей — симптомы Кернига и Брудзинского. Дыхание становится учащенным, поверхностным и прерывистым. В ряде случаев преобладают сердечно-сосудистые нарушения: отмечаются тахикардия (см.), артериальная гипертония (см.), повышается проницаемость сосудистой стенки, что способствует развитию отека мозга и легких, судорожного синдрома. Если лечебные меры не приняты или малоэффективны, то развивается шоковое состояние: кожа приобретает сероватый оттенок, артериальное давление падает, тоны сердца становятся глухими, тахикардия (см.) сменяется брадикардией (см.), быстро наступает парез (см.) кишечника и сфинктеров с непроизвольными мочеотделением и дефекацией, олигурия вплоть до анурии (см.) («стволовая» кома). При более легких вариантах нейротоксикоза преобладает высокая температура или гипервентиляционный синдром.
Лечение Больному придают возвышенное положение, назначают антибиотики широкого спектра действия (не менее двух одновременно), один из них дают внутривенно: бензилпенициллин или полусинтетические пенициллины в дозе 250 000–300 000 ЕД/кг в комбинации с гентамицином по 2–3 мг/кг, цепорином по 30–60 мг/кг, сукцинатом левомицетина (25–35 мг/кг). При возбуждении вводят седуксена 0,5 %-ный раствор внутримышечно или медленно внутривенно в дозе 0,3–0,5 мг/кг (не более 10 мг на введение). Дегидратационный и противосудорожный эффект достигается применением 25 %-ного раствора сульфата магния по 0,2 мл/кг внутримышечно, 3 %-ного раствора хлоралгидрата в клизме (до 1 года — 10–20 мл, до 5 лет — 20–30 мл, старшим детям — 40–60 мл, повторять по показаниям 2–3 раза в сутки). Для борьбы с высокой температурой назначают антипиретические (жаропонижающие) средства (50 %-ный раствор анальгина — 0,1 мл на 1 год жизни внутримышечно), физические меры охлаждения (пузыри со льдом к голове, паховой области, обдувание вентилятором, обтирание смесью спирта, воды и столового уксуса). При сердечной недостаточности и тахикардии (см.) вводят строфантин (разовые дозы 0,05 %-ного раствора внутривенно: детям до 6 месяцев — 0,05—0,1 мл, 1–3 года — 0,1–0,2 мл, 4–7 лет — 0,2–0,3 мл, старше 7 лет — 0,3–0,4 мл, введение можно повторять 3 раза в сутки) или коргликон (разовые дозы 0,06 %-ного раствора: до 6 месяцев — 0,1 мл, 1–3 года — 0,2–0,3 мл, 4–7 лет — 0,3–0,4 мл, старше 7 лет — 0,5–0,8 мл, вводить не более 2 раз в сутки на 10–20 %-ном растворе глюкозы). Для уменьшения тонуса симпатической нервной системы и нейровегетативной блокады применяют литическую смесь: 1 мл 2,5 %-ного раствора аминазина и 1 мл 2,5 %-ного раствора пипольфена разводят до 10 мл 0,5 %-ным раствором новокаина (для внутримышечного введения) или 5 %-ным раствором глюкозы (для внутривенного); разовая доза смеси — 0,1–0,15 мл/кг, повторять до 4 раз в сутки по показаниям (суточная доза аминазина и пипольфена не должна превышать 2 мг/кг). При компенсированной стадии терапию начинают с назначения внутрь или внутримышечно 2 %-ного раствора папаверина (0,15—1 мл) с 1 %-ным раствором дибазола (0,1–0,5 мл), в среднем 1–2 мг на 1 год жизни. При отсутствии эффекта к лечению добавляют внутрь оксибутират натрия (от 50 до 150 мг на 1 кг массы тела в сутки в 3–4 приема), внутримышечно вводят 0,25 %-ный раствор дроперидола — 0,3 мл на 1 год жизни (при внутривенном введении это количество разводят в 20 мл 5—10 %-ного раствора глюкозы — разовая доза не более 15 мг); дают 10 %-ный раствор глюконата кальция: детям грудного возраста — 1–2 мл, старшим — до 5—10 мл внутривенно или внутримышечно. При наличии шока и обезвоживания сразу вводят коллоидные растворы (плазма, альбумин, желатиноль) из расчета 20 мг/кг внутривенно до восстановления диуреза; регидратационную терапию продолжают преимущественно гипертоническими глюкозосолевыми растворами в соотношении 2:1 из расчета не менее 3/4 суточной потребности жидкости в течение 24 ч. В случаях стойкой артериальной гипотонии вводят 1 %-ный раствор мезатона по 0,5–1 мл на 150–200 мл 10 %-ного раствора глюкозы, вначале частыми каплями до 40–60 капель в минуту, затем более редкими под контролем артериального давления. Сразу после восстановления диуреза начинают дегидратационную терапию (концентрированная плазма, 10–15 %-ный раствор альбумина — 5—10 мл/кг, лазикс по 1–2 мг/кг; при недостаточной эффективности и нарастании признаков отека мозга вводят маннитол по 1,5 г сухого вещества на 1 кг массы тела в виде 10–15—20 %-ного раствора для введения в изотоническом растворе натрия хлорида или в 5 %-ном растворе глюкозы) с целью уменьшения внутричерепного давления под контролем гематокрита и уровня электролитов. Гепарин применяют в разовой дозе по 100–200 ЕД/кг внутривенно капельно, можно повторять введение через 6–8 ч под контролем времени свертывания. Для улучшения микроциркуляции применяют реополиглюкин — 10–20 мл/кг. Показано также назначение гормональных препаратов (преднизолон из расчета 1–2 мг/кг), при декомпенсированном метаболическом ацидозе — 4 %-ный раствор гидрокарбоната натрия из расчета: количество раствора (мл) = ВЕ х масса тела (кг) / 5. При тяжелой коме показаны ганглиоблокаторы: для детей до 1 года — пентамин (2–4 мг/кг), бензогексоний (1–2 мг/кг), для детей до 3 лет — пентамин (1–2 мг/кг), бензогексоний (0,5–1 мг/кг); при непрекращающихся судорогах добавляют гексенал: ректально 10 %-ный раствор (0,5 мл/кг), внутримышечно — 5 %-ный раствор (8,5 мл/кг), внутривенно — 0,5–1 %-ный раствор (не более 15 мг/кг, очень медленно), предварительно лучше ввести 0,1 %-ный раствор атропина сульфата из расчета 0,05 мл на 1 год жизни и 10 %-ный раствор глюконата кальция. Обязательным элементом комплексной терапии нейротоксического синдрома является введение витаминов, особенно С и группы В. Длительная чайно-водная диета и дробное кормление.
НЕЙРОФИБРОМАТОЗ РЕКЛИНГХАУЗЕНА
ОпределениеНейрофиброматоз Реклингхаузена относится к группе факоматозов. Факоматозы — это наследственные заболевания, которые относятся к эктодермомезодермальным дисплазиям (см.) с поражением кожи, глаз, нервной системы и внутренних органов. Обязательным симптомом этой группы заболеваний является наличие пигментных пятен на коже или сетчатке глаз.
Этиология и патогенез Нейрофиброматоз Реклингхаузена — наследственное заболевание, которое характеризуется наличием множественных опухолей (см.) в коже по ходу периферических нервов, пигментацией кожи, кожными невусами (бородавками) и костными аномалиями. Наследуется по аутосомно-доминантному типу с большой вариабильностью. Заболевание нередко проявляется во многих поколениях. Мужчины болеют чаще, чем женщины. При преимущественном поражении нейроэктодермальных образований у эмбриона и возникает данное заболевание. Морфологически проявления отличаются большим разнообразием. Наиболее характерным для болезни Реклингхаузена являются опухоли периферических и черепных нервов (невриномы) в виде узелков под кожей разной величины и опухоли центральной нервной системы (обычно глиомы или менингиомы), которые располагаются внутри черепа или позвоночного канала, сдавливая при этом головной или спинной мозг. Выделяют две формы нейрофиброматоза: классическую (периферическую), или нейрофиброматоз-1, и центральную, или нейрофиброматоз-2.
Клиническая картина Клиника нейрофиброматоза многообразна. Первые симптомы обычно появляются в период полового созревания, однако могут быть отмечены при рождении или значительно позже. Глиомы зрительных нервов обычно проявляются в детском возрасте. При классической форме нейрофиброматоза у взрослых чаще всего выявляются множественные опухоли (см.), которые располагаются на шее, туловище, голове, конечностях. Опухоли имеют округлую или овальную форму, их средний размер составляет 1–2 см в диаметре (иногда достигая гигантских размеров и веса до 2 кг). Опухоли при прощупывании безболезненны, более подвижны в продольном направлении, кожные покровы над ними иногда более пигментированы, а на верхушке может отмечаться рост волос. Образование неврином вдоль нервных стволов в области терминальных ветвей сопровождается «слоновостью» — распространенным увеличением пораженного участка тела за счет нарушения лимфооттока. При этом могут наблюдаться увеличение конечностей, лица, языка. Увеличение кожи головы и шеи может привести к образованию громадных складок кожи. Известны случаи увеличения внутренних органов. Все эти явления не приносят больному каких-либо болезненных ощущений и не представляют угрозы для жизни. Характерными для нейрофиброматоза являются пигментные пятна на коже цвета кофе с молоком. Пигментные пятна могут быть единичными или множественными и располагаются на туловище и шее, реже — на лице и конечностях, зачастую они покрыты волосами. В некоторых случаях пятна имеют синий или фиолетовый цвет, реже встречаетсядепигментация. Некоторые специалисты считают, что наличие 6 пигментных пятен диаметром не менее 1,5 см позволяет диагностировать нейрофиброматоз при отсутствии каких-либо других симптомов. Уникальным признаком нейрофиброматоза-1 является белесоватое пятно на радужке (гамартома) — узелок Лиша. Узелок Лиша обнаруживается у 94 % больных нейрофиброматозом-1 и никогда не выявляется при нейрофиброматозе-2. Довольно часто при болезни Реклингхаузена отмечаются изменения скелета. Нарушения со стороны скелета не являются специфическими и проявляются в виде сколиоза (см.), спондилолистеза, незаращения дужек позвонков, асимметрии черепа и др. Заболевание может также сопровождаться умственной отсталостью, эпилептическими припадками, преждевременным половым созреванием, гинекомастией (см.) и др.
Нейрофиброматоз
Центральная форма нейрофиброматоза имеет значительно худший прогноз и характеризуется образованием опухолей в центральной нервной системе. Их рост сопровождается возникновением симптомов, характерных для опухолей головного и спинного мозга, что требует хирургического вмешательства. Иногда единственным проявлением нейрофиброматоза-2 являются двусторонние невриномы слуховых нервов. Диагностика классической формы обычно не представляет особого труда. Поражения кожи в виде пигментных пятен и периферических нервов (подкожным неврином) указывают на болезнь Реклингхаузена. Значительно труднее диагностировать центральные формы, при которых появляются опухоли головного и спинного мозга. В этих случаях помогает наличие анамнеза с указанием подобного заболевания у родственников.
Лечение Лечение при нейрофиброматозе главным образом симптоматическое; при наличии опухолей прибегают к хирургическому лечению.
НЕЙТРОПЕНИИ НАСЛЕДСТВЕННЫЕ
ОпределениеНейтропении наследственные — это группа редких наследственных заболеваний с почти полным отсутствием в крови нейтрофилов, обнаруживаемым постоянно (постоянные нейтропении) или через равные промежутки времени (периодические нейтропении).Наследственные и врожденные нейтропении представляют собой чрезвычайно гетерогенную (разнородную) по механизму развития и клинической картине группу заболеваний. Ввиду относительной редкости многие стороны механизма развития, клиники, диагностики и терапии этих заболеваний изучены плохо. До настоящего времени не выяснены взаимоотношения некоторых наследственных нейтропений, описываемых под различными названиями.
Этиология, патогенез и клиническая картина Наследственные нейтропении При наследственной нейтропении блокируются созревание гранулоцитов в костном мозге на стадии миелоцитов и метамиелоцитов. Болезнь Костманна. Механизм развития данной формы нейтропении до настоящего времени окончательно не выяснен. По всей вероятности, основным механизмом нейтропении является уменьшение продукции нейтрофилов в костном мозге в результате дефекта созревания клеток-предшественников. Наследственная нейтропения аутосомно-доминантного типа характеризуется уменьшением продукции нейтрофилов в костном мозге в сочетании с перераспределением нейтрофилов внутри сосудистого русла. Причиной семейной доброкачественной нейтропении, очевидно, является нарушение созревания гранулоцитарных предшественников. Увеличение клеток-предшественников и нарушение созревания гранулоцитов сближает больных с семейной доброкачественной нейтропенией и больных с синдромом Костманна. Врожденная нейтропения характеризуется стойкой гранулоцитопенией при нормальных клеточных взаимоотношениях в миелограмме и встречается у йеменских евреев. Развитие гранулоцитопении может быть связано с нарушением поступления нейтрофилов в кровь. Поскольку заболевание протекает доброкачественно и не сопровождается снижением устойчивости к инфекции, больные не нуждаются в специальной терапии. Нарушение выхода гранулоцитов из костного мозга в кровь при синдроме «ленивых лейкоцитов» является ведущим механизмом развития нейтропении. Синдром относится к группе врожденных доброкачественно протекающих нейтропений, проявляется уменьшением количества зрелых нейтрофилов в крови, сочетающимся с увеличением их количества в костном мозге. Высказывается предположение, что при синдроме «ленивых лейкоцитов» имеется дефект клеточной мембраны, нормальное состояние которой необходимо для любого типа движения. Дефект клеточной мембраны нейтрофилов костного мозга у больных с синдромом «ленивых лейкоцитов» проявляется в замедлении поступления их в очаги воспаления (тест «кожного окна»). Периодический (циклический) агранулоцитоз (циклическая нейтропения) — одна из редких и необычных форм нейтропении. Яркой особенностью заболевания является четкая цикличность течения. Рецидивы заболевания отмечаются обычно через 3 недели и выражаются в типичных для агранулоцитоза клинико-гематологических проявлениях. Причины, приводящие к развитию заболевания, неясны. Чаще всего циклический агранулоцитоз начинается в раннем детском возрасте. Однако у некоторых больных он проявляется впервые в пожилом возрасте. Циклический агранулоцитоз одинаково часто встречается у мужчин и женщин. Хотя наследственный характер заболевания не доказан, единичные наблюдения подтверждают эту возможность. До настоящего времени не выяснен вопрос о том, является ли циклическая нейтропения у детей и лиц пожилого возраста одинаковым по механизму развития заболеванием, но подобное предложение представляется весьма вероятным. Состав крови и миелограмма существенно не отличаются от нормы. Изменения кроветворения предшествуют появлениям гранулоцитопении. Они заключаются в постепенном уменьшении в костном мозге количества зрелых нейтрофилов. Многочисленные исследования, выполненные в последние годы, свидетельствуют о том, что цикличность колебаний количества лейкоцитов в крови свойственна не только больным с циклическим агранулоцитозом. Умеренные колебания могут выявляться и у здоровых лиц. Четкие циклические колебания числа лейкоцитов иногда выявляются у больных хроническим миелолейкозом после химиотерапии. Механизм развития циклической нейтропении до настоящего времени окончательно не выяснен. В плане механизма развития циклической нейтропении у человека рассматриваются три возможных механизма: «внутренний» дефект стволовых гемопоэтических (кроветворных) клеток, нарушение гуморальной регуляции гемопоэза и нарушение короткодистанционных регуляторов кроветворения. Одной из клинических особенностей заболеваний является постепенное смягчение клинических проявлений с возрастом. При нейтропениях, обусловленных дефицитом гуморальных плазменных факторов, в костном мозге больных наблюдается резкое уменьшение количества зрелых гранулоцитов, а исследование клеточного состава костного мозга выявляет торможение созревания на уровне миелоцитов. При культивировании костного мозга больных in vitro (в стекле) с плазмой нормальных доноров выявлена нормализация созревания гранулоцитов, в то время как в культурах, содержащих плазму больных, дефект созревания сохранялся. Введение нормальной плазмы больным с этим типом нейтропении приводит к нормализации гематологических показателей. У всех больных введение нормальной сыворотки in vivo (в живом организме) вызывало увеличение количества нейтрофилов. Таким образом, доказано существование наследственных нейтропений, обусловленных дефицитом в организме гуморальных факторов, необходимых для нормального роста и созревания гранулоцитарных элементов. Истинная частота данной формы нейтропении неизвестна. Синдром Швахмана проявляется сочетанием нейтропении и кистозным фиброзом (см.) поджелудочной железы с нарушениями ее экзокринной (внешнесекреторной) функции и диареей (см.). У многих детей наблюдаются отставание в физическом развитии, нарушение развития эпифизов (расширенный конец трубчатой кости). Значительно реже отмечается умственное недоразвитие. Нередко заболевание носит семейный характер. Нейтропения обычно выявляется в раннем детстве. При значительном уменьшении количества нейтрофилов резко снижается устойчивость к инфекции. Причины развития нейтропении не выяснены. Единичные сообщения о важной роли иммунологических нарушений не получили подтверждения. По-видимому, ее развитие связано с нарушениями продукции нейтрофилов, конкретные механизмы которых не выяснены. Развитие нейтропении не может быть объяснено нарушениями всасывания веществ, необходимых для нормального функционирования гранулоцитопоэза, из-за хронического дефицита панкреатических ферментов, поскольку для лиц с удаленной поджелудочной железой не характерна нейтропения. Семейный характер заболевания, сочетание у ряда больных нейтропении с анемией и тромбоцитопенией позволяют считать, что в основе нейтропении лежат нарушения родоначальных клеток. Однако характер и причина этих нарушений нуждаются в уточнении. Типичной для больных с синдромом Чедиака-Хигаши является наклонность к развитию тяжелых гнойных осложнений, обусловленная угнетением фагоцитарной функции нейтрофилов. У большинства больных с этим синдромом отмечается наличие значительной гранулоцитопении. Механизм развития лейкопении при этом синдроме не выяснен. Для синдрома Цинссера-Коула-Энгмена (врожденный дискератоз) характерна дискератотическая дистрофия (см.) кожи и слизистых оболочек. Кроме того, для этой патологии характерны дистрофия ногтей, гипотрихоз (недостаточное развитие) ресниц, слезотечение и закупорка слезных протоков, поражение эндокринных желез. Интерес гематологов к врожденному дискератозу объясняется тем, что наряду с поражением кожи и слизистых у некоторых больных имеются различные изменения в системе крови. Это могут быть гипоплазия с панцитопенией, изолированная анемия (см.), тромбоцитопения или нейтропения. Изменения в системе крови и наличие многочисленных врожденных поражений других органов, особенно кожных покровов и слизистых, делают синдром Цинссера-Коула-Энгмена очень похожим на врожденную анемию Фанкони. Некоторые авторы считают неоправданным разграничение этих двух заболеваний и предлагают называть их синдромом Фанкони-Цинссера. Однако клиническая картина этих заболеваний имеет ряд существенных отличий, основным из которых является время появления гематологических нарушений. Если при анемии Фанкони цитопенический синдром проявляется в раннем детском возрасте (первая декада жизни), то при синдроме Цинссера-Коула-Энгмена изменения со стороны системы крови появляются во 2—3-й декаде жизни. Механизм развития цитопении при врожденном дискератозе совершенно не изучен. Возможно, затрагиваются иммунные механизмы цитопении.
Нейтропении при первичных иммунодефицитных состояниях Иммунные реакции организма осуществляются при взаимодействии различных клеточных популяций. Кроме того, в иммунных реакциях большую роль играют гранулоциты. Иммунодефицитные состояния можно подразделить на первичные и вторичные. Первичные иммунодефицитные состояния обусловлены генетическим дефектом иммунокомпетентных клеток. Вторичные иммунодефицитные состояния наблюдаются при многих инфекционных, раковых, гематологических и других заболеваниях. Практически при любом из иммунодефицитных состояний может наблюдаться нейтропения. В отношении механизма развития нейтропении при иммунодефицитных состояниях может быть высказано несколько предположений. Если исходить из правильности унитарной теории кроветворения, то в основе сочетания иммунодефицитных состояний и нейтропении может лежать патология стволовой клетки. Кроме того, снижение продукции нейтрофилов при иммунодефицитных состояниях может быть обусловлено угнетением или выпадением способности лимфоцитов стимулировать гранулоцитопоэз. Лимфоциты больных с иммунодефицитным состоянием подавляют образование эритроцитов. Нейтропении могут опосредоваться через влияние лимфоцитов на миграцию гранулоцитарных клеток-предшественников. Основные группы первичных иммунодефицитных состояний представлены следующими патологическими процессами. Типичным представителем иммунодефицитных состояний является агаммаглобулинемия Брутона, обусловленная наследственностью. Для больных характерны снижение количества иммуноглобулинов (антител) всех классов и стойкая нейтропения в периферической крови, сочетающаяся с морфологической картиной «торможения созревания» в костном мозге. Описана семейная нейтропения, сочетающаяся с гипогаммаглобулинемией. Особенностью этой нейтропении является то, что она протекает при большом количестве созревающих и зрелых нейтрофилов в костном мозге, что приближает ее к синдрому «ленивых лейкоцитов». К иммунодефицитным состояниям также относятся синдром III и IV фарингеальных карманов (синдром Ди Джорджа) и синдром II и III фарингеальных карманов. Эти синдромы характеризуются тяжелыми нарушениями клеточного иммунитета и нормальным функционированием гуморального иммунитета. Для больных с этими синдромами характерна патология эндокринных желез и аорты. У многих больных имеется нейтропения, механизм развития которой совершенно не изучен. Больные, как правило, погибают от вирусных пневмоний. Нейтропения новорожденных иммунного генеза проявляется значительной гранулоцитопенией, выявляемой уже при рождении ребенка, и повышенной чувствительностью к инфекционным осложнениям. В основе заболевания лежит наличие антител в организме ребенка, направленных против нейтрофи лов. Полагают, что их выработка связана с антигенной несовместимостью гранулоцитов матери и плода. Патогенез заболевания близок к механизму развития гемолитической анемии (см.) новорожденных и связан с выработкой антинейтрофильных антител организмом матери. Эти антитела проходят через плацентарный барьер. Менее вероятным является предположение о проникновении через плаценту иммуноцитов матери с последующей выработкой ими антител уже в организме плода, хотя возможность перемещения материнских клеток в плод через плаценту в настоящее время доказана. Хотя гранулоцитопения выявляется у детей уже при рождении, заболевание не может быть отнесено к группе врожденных. У большинства новорожденных состав крови восстанавливается через 5–7 недель после рождения. Ближайший и отдаленный прогноз благоприятный. Клиническая картина заболевания характеризуется склонностью к инфекциям (как правило, стафилококковым), тяжелой альвеолярной пиореей с детства (обнажение шейки зубов, их расшатывание и выпадение). При периодической форме болезни лихорадка и инфекции строго периодичны и соответствуют дням нейтропении. В крови почти полностью отсутствуют нейтрофилы, повышено число эозинофилов и моноцитов. При периодической форме эти изменения продолжаются несколько дней, возникая через строго определенные отрезки времени.
Лечение Антибиотики при наличии инфекционных осложнений, непрерывная терапия альвеолярной пиореи. Симптоматическая терапия. Глюкокортикоиды назначают при наследственной нейтропении Костманна, наследственной нейтропении аутосомно-доминантного типа, циклической нейтропении, синдроме Чедиака-Хигаши. Представляется целесообразным назначение препаратов, улучшающих созревание нейтрофилов (андрогены, литий). При нейтропении, обусловленной дефицитом гуморальных плазменных факторов, патогенетическая терапия заключается во введении нормальной плазмы. При синдроме Швахмана в период резкой гранулоцитопении показано переливание лейкоцитарной взвеси. В последние годы используют хирургические методы лечения: спленэктомию и пересадку костного мозга. Ликвидация инфекций позволяет сохранить жизнь больных детей.
НЕПРОХОДИМОСТЬ КИШЕЧНИКА
ОпределениеНепроходимость кишечника — синдром, характеризующийся нарушением прохождения кишечного содержимого по желудочно-кишечному тракту.Все формы кишечной непроходимости делятся на следующие группы: — по происхождению — на врожденные и приобретенные; — по механизму возникновения — на механические и динамические. Последнюю форму подразделяют на паралитическую и спастическую; — по наличию или отсутствию сдавления сосудов брыжейки, питающих кишку, — на странгуляционную (со сдавлением сосудов брыжейки), обтурационную (без сдавления сосудов) и сочетанную, при которой выражены одновременно обтурация (закупорка) и странгуляция, как это бывает при инвагинации (внедрение одной кишки в другую); — по клиническому течению — на частичную и полную, острую, подострую, хроническую и рецидивирующую.
Этиология и патогенез К врожденной непроходимости кишечника относятся врожденное отсутствие тонких и толстых кишок, заднепроходного отверстия. Все остальные формы непроходимости — приобретенные. Во вторую группу непроходимости входят различные функциональные расстройства кишечника, развившиеся на почве воспалительных процессов брюшной полости (перитонит (см.), аппендицит (см.), холецистит (см.), панкреатит (см.)) или вследствие чрезмерно сильных раздражений симпатической нервной системы после травмы и травматических операций на органах брюшной полости, при приступе почечной колики (см.), после обильной еды, диспепсической интоксикации, при отравлениях (см.) свинцом, тромбозе (см.) кишечных сосудов, забрюшинных кровоизлияниях. Спастическую и паралитическую непроходимость следует считать стадиями одного и того же процесса, причем спазм кишечника иногда предшествует паралитическому его состоянию. Наиболее обширную и разнообразную группу составляют различные формы механической непроходимости. Механическая непроходимость с нарушением кровообращения кишечника (странгуляционная) вызывается ущемлением кишечных петель в грыжевом отверстии, сдавлением спайками и воспалительными тяжами, перекручиванием кишечной петли вокруг своей оси, образованием узла между несколькими петлями кишок. Механическая непроходимость без нарушения кровообращения (обтурационная) возникает на почве закупорки кишечника проглоченными инородными телами, желчными камнями, перфорировавшими стенку желчного пузыря и кишки, клубком аскарид, каловым камнем и опухолями (см.), исходящими из стенки кишки, рубцами, образовавшимися после язв желудка или кишечника, суживающими их просвет. Также может образоваться закрытие просвета кишки при сдавлении ее различными опухолями, исходящими из почки, поджелудочной железы, яичника и других органов брюшной полости.
Инвагинация тонкой кишки в толстую
Сочетание странгуляции и обтурации представляет собой инвагинация — внедрение одной кишки в другую. При этом инвагинированная петля закупоривает просвет кишки и в то же время брыжейка (складка брюшины, посредством которой органы брюшной полости прикрепляются к брюшным стенкам) инвагинированной петли подвергается сдавлению.
Патанатомия Максимальные изменения наблюдаются при странгуляциях, которые развиваются сразу же после возникновения механического препятствия и сдавления питающих кишку сосудов брыжейки. Вначале развиваются явления венозного застоя в слизистой оболочке и подслизистом слое ущемленной кишки. Очень скоро — через 3–4 ч после развития странгуляции — появляются кровоизлияния между листками брюшины ущемленной брыжейки и в стенке кишки. Венозный застой в ущемленной петле сопровождается отеком всей стенки кишки и пропотеванием жидкой части крови как в просвет кишки, так и в свободную брюшную полость. Ущемленная петля перестает перистальтировать, а скапливающиеся в ней жидкость и газы растягивают ее просвет. В дальнейшем происходит тромбоз (см.) сосудов, прекращение артериального кровообращения, омертвение и отторжение слизистой, а затем омертвение всей стенки кишки. Одновременно с нарушением кровообращения в ущемленной кишке наблюдаются дегенеративные изменения в нервных сплетениях всего кишечного тракта, заключающиеся в разрушении с вакуолизацией нервных клеток и явлениями сморщивания и атрофии их. Все эти изменения в ущемленной петле кишки очень скоро становятся необратимыми, и уже через 4–6 ч может наступить омертвение кишки. Вместе с дегенеративнонекротическими процессами в стенке кишки развиваются и воспалительные изменения как в ущемленной петле, так и в свободной брюшной полости с распространением инфекции из просвета кишки через поврежденную ее стенку в брюшную полость. При обтурациях кишечника сосудистые расстройства менее выражены, но здесь наблюдается скопление газов и жидкого содержимого кишечника выше препятствия, закупоривающего просвет, растяжение стенок кишки жидкостью и газами и изъязвления слизистой («язвы от растяжения»). В самом начале закупорки просвета кишки отмечается усиленная перистальтика, затем она прекращается, наступают растяжение и несостоятельность кишечной мускулатуры с утратой тонуса приводящего отдела кишки. При динамической непроходимости на почве тромбоза (см.) и эмболии (см.) кишечных сосудов наблюдаются те же анатомические изменения, что и при странгуляционной непроходимости, иногда на значительном протяжении кишечника в связи с закупоркой основных сосудов и нарушениями кровообращения в соответствующих закупоренному сосуду отрезках кишки. Одновременно с указанными местными изменениями острая кишечная непроходимость вызывает и ряд грозных общих расстройств, имеющих решающее значение в течении и исходе заболевания. Эти изменения во всем организме в запущенных случаях непроходимости кишечника являются причиной смертельных исходов даже после устранения непроходимости и удаления лишенной питания и омертвевшей части кишечника. Тяжелые общие расстройства особенно резко проявляются при странгуляционной непроходимости и менее выражены при обтурациях кишечника. Тяжесть нарушений общего характера при всех формах непроходимости кишечника возрастает по мере повышения уровня непроходимости. В связи с нарушением продвижения пищевых масс и нарушением процессов пищеварения и всасывания в кишечнике в крови и во всем организме происходят значительные биохимические сдвиги, что ведет к мышечной слабости и коме. Организм теряет желчь, желудочный, панкреатический и кишечный соки и содержащиеся в них ферменты и желчные кислоты. Происходит потеря большого количества белка. У больного наступает белковое голодание, от которого в первую очередь страдает нервная система. В связи с нарушением выработки гликогена в печени нарушается сердечная деятельность. Вместе с рвотными массами больной теряет большое количество жидкости, в результате чего наступает обезвоживание организма. Распространение инфекции в брюшную полость через потерявшую жизнеспособность стенку кишки чревато развитием перитонита (см.). Сдавление нервных окончаний в ущемленной кишке вызывает сильные боли, которые могут рефлекторным путем воздействовать на центральную нервную систему и обусловить состояние шока. Раздражение нервных окончаний кишки вызывает сначала спастическое сокращение, а затем полную потерю тонуса мускулатуры кишечника. Все указанные изменения выявляются в большей или меньшей степени в организме при острой кишечной непроходимости, комбинируются друг с другом и обусловливают тяжесть общего состояния организма. Для объяснения этих общих расстройств в организме при кишечной непроходимости существует несколько теорий: интоксикационная, теория нарушения сокооборота, теория нарушения обмена и нервно-рефлекторная теория. Тяжесть общего состояния при острой кишечной непроходимости сторонники интоксикационной теории объясняют всасыванием токсинов, образующихся в кишечнике, и задержкой в крови и во всем организме продуктов неполного обмена веществ. Согласно нервно-рефлекторной теории, тяжесть состояния при острой кишечной непроходимости объясняется нарушением нервных механизмов с последующим изменением обменных процессов и расстройством кровообращения. Нарушения сокооборота при острой кишечной непроходимости заключаются в нарушении всасывания изливающихся в большом количестве в просвет кишечника и извергающихся с рвотой пищеварительных соков, вследствие чего в организме нарушаются процессы обмена веществ. Однако сложность патологических процессов в организме при острой кишечной непроходимости не укладывается в рамки какой-либо одной теории механизма развития, поэтому необходимо учитывать не один фактор, а совокупность многих причин и связанных с ними разнообразных изменений в организме.
Клиническая картина В данных опроса у больных острой кишечной непроходимостью нередко можно отметить погрешности в питании, сопровождающиеся усиленной перистальтикой и поносом. В особенности часто это наблюдается у детей. Подъем тяжестей может вызвать выхождение и ущемление внутренностей. В некоторых случаях у больных непроходимостью кишечника могут быть отмечены перенесенные в прошлом операции по поводу аппендицита (см.), холецистита (см.) или каких-либо гинекологических заболеваний. Заболевание обычно начинается внезапными болями в животе, которые носят резкий схваткообразный характер. При странгуляциях боли остаются и между приступами, тогда как при обтурациях боли между схватками могут отсутствовать. Боли в животе носят чаще разлитой характер и не имеют определенной локализации. Общее состояние больных с непроходимостью кишечника бывает очень тяжелым. Больные принимают согнутое положение, мечутся в постели от боли. Болевые приступы сопровождаются рвотой, сначала пищей, желчью, а затем безрезультатными позывами на рвоту. Лицо покрывается холодным потом и приобретает характерный для больных с перитонитом вид: запавшие глаза, заострившийся нос, бледный, с землистым оттенком цвет лица. Температура в начале заболевания в большинстве случаев нормальная, а у пожилых больных с пониженной реактивностью в начальной стадии заболевания, сопровождающейся коллаптоидным (см. Коллапс) состоянием, бывает даже ниже нормы. С другой стороны, температура может быть и повышенной, что может быть связано с развитием другого патологического процесса, вызвавшего непроходимость (воспаление червеобразного отростка, придатков матки, карцинома (см.) кишки, энтероколит (см.)). При осложнении непроходимости перитонитом (см.) температура повышается до 38–39 °C. Пульс и кровяное давление могут также колебаться в зависимости от разнообразных причин. В некоторых случаях в начале развития симптомов непроходимости наблюдается брадикардия (см.) в связи с раздражением блуждающих нервов. В большинстве же случаев отмечается учащение пульса. Расхождение между частотой пульса и температурой является неблагоприятным прогностическим признаком. Одновременно с болями в большинстве случаев (70 %) наблюдается рвота. Рвота бывает многократной при высокой непроходимости тонкого кишечника и однократной или совсем отсутствует в начальной стадии низкой непроходимости. В конечной стадии, когда к непроходимости присоединяется перитонит (см.), рвота приобретает каловый характер вследствие гнилостного разложения скопляющегося в приводящем отрезке кишечного содержимого. У большинства больных (84 %) с непроходимостью кишечника наблюдается задержка стула и газов, и лишь у 16 % больных бывает стул при неполном закрытии кишки или отхождении кала, скопившегося ниже препятствия. При инвагинации кишечника испражнения носят характер жидких кровянистых выделений. При кишечной непроходимости определяется вздутие живота. При непроходимости кишечника, вызванной обтурацией кишечника, в первые часы можно при выслушивании определить усиленную перистальтику (урчание, бульканье, переливание, звук падающей капли). Бурная перистальтика продолжается недолго. Прощупывание живота до развития перитонита малоболезненно, напряжение мышц отсутствует, несмотря на значительное вздутие живота. При непроходимости привратника прослушивается шум плеска в желудке. В крови у больных острой непроходимостью кишечника отмечаются увеличение количества лейкоцитов (10–20 тыс.), а в связи с обезвоживанием организма отмечаются увеличение количества эритроцитов, ускорение СОЭ и повышение количества гемоглобина. Эти изменения наступают не сразу, а развиваются постепенно — по мере обезвоживания организма (рвота, скопление жидкости в кишечнике и брюшной полости). У больных непроходимостью кишечника очень большое значение имеет биохимическое исследование крови. Наиболее постоянным симптомом высокой непроходимости кишечника является снижение хлоридов крови. Чем выше по ходу кишечника располагается препятствие, тем раньше появляется и бывает более выраженной гипохлоремия. Чем ниже уровень хлоридов крови, тем хуже прогноз. Также отмечается повышение безбелкового азота, резервной щелочности и сухого остатка крови. В моче появляются белок, цилиндры и форменные элементы крови, повышается количество индикана; количество мочи резко уменьшается.
Схема горизонтальных уровней в тонких кишках при кишечной непроходимости
Большое значение при диагностике непроходимости кишечника имеет рентгеновское исследование. При рентгеноскопии и на рентгенограммах при непроходимости можно видеть растянутые кишечные петли, наполненные газами и жидкостью. Скопление газов над уровнем жидкости в кишечных петлях имеет вид перевернутых чаш (так называемые чаши Клойбера). Для уточнения диагноза иногда прибегают к дополнительному исследованию с контрастной смесью, которую вводят через прямую кишку для определения уровня и характера непроходимости толстой кишки. При исследовании через прямую кишку иногда можно определить причину непроходимости: опухоль, суживающая просвет, наличие калового камня или инородного тела. Закупорка кишечника инородными телами встречается сравнительно редко. Это может быть при желчнокаменной болезни (см.), когда желчный пузырь спаивается с двенадцатиперстной или тонкой кишкой, а большой камень, попадая через перфорационное отверстие в тонкую кишку, закупоривает ее. Закупорка камнем кишки происходит чаще всего вследствие спазма ее мускулатуры. До появления симптомов непроходимости у больных, преимущественно женщин, в прошлом отмечаются приступы желчнокаменной болезни с типичными приступами. Явления непроходимости при закупорке камнем обычно развиваются остро и протекают бурно — с рвотой, задержкой стула и газов и явлениями шока (см.). Закупорка кишечника глистами встречается чаще у детей. Аскариды, свертываясь в клубок, могут совершенно закупорить просвет кишки. Клиническая симптоматика при этой форме непроходимости также развивается постепенно. Иногда удается прощупать через тонкую брюшную стенку тестоватое уплотнение в брюшной полости. В данных опроса отмечается отхождение с калом глистов. В кале или мазке, полученном из прямой кишки, можно обнаружить яйца глистов. При глистном заражении, сопровождающемся непроходимостью, применяют противоглистное лечение. Если это лечение не дает эффекта, показана операция. Закупорка кишечника опухолью чаще наблюдается у пожилых людей и встречается большей частью в толстой кишке, причем симптомы непроходимости развиваются медленно. Они наслаиваются на клиническую картину злокачественной опухоли, рост которой вызывает истощение, малокровие и интоксикацию. У больных отмечаются запоры (см.), отхождение лентовидного или так называемого овечьего кала в форме мелких комков. В кале имеется примесь слизи и крови. В данных опроса у таких больных отмечаются повторные приступы относительной непроходимости с задержкой стула и газов, которые затем самостоятельно или под влиянием клизм ликвидировались. Непроходимость на почве закупорки опухолью (см.) тонкой кишки протекает более остро и встречается чаще, при этом она раньше дает симптомы полной кишечной непроходимости, чем при опухолях толстой кишки. Инвагинация — внедрение одной части кишечника в другую. Инвагинация может иметь три, пять и даже семь расположенных один в другом цилиндров кишки. Вместе с кишкой внедряется и питающая ее брыжейка, вследствие чего при инвагинации очень быстро наступают расстройства кровообращения в инвагинате. Сначала образуются венозный застой, пропотевание жидкой части крови и кровяных элементов в кишечник, отек и кровоизлияния в инвагинированной кишке, а затем присоединяется сдавление артерий. Между серозными поверхностями инвагинированной кишки образуются фибринозные спайки. Слизистая оболочка кишки изъязвляется, и в конце концов весь лишенный кровоснабжения внедрившийся участок омертвевает и иногда в виде омертвевшего цилиндра кишки отходит через задний проход. Образующиеся сращения на границе внедрения препятствуют распространению инфекции в брюшную полость, поэтому может наступить самостоятельное выздоровление. В некоторых случаях эти сращения бывают недостаточными, и тогда развивается перитонит. Даже при благополучном исходе — отторжении инвагината — на месте вхождения внедрившейся кишки образуется в дальнейшем рубцовое сужение ее, ведущее к развитию непроходимости. Инвагинация встречается в 75 % случаев у детей в возрасте до 5 лет. У взрослых причиной инвагинации бывают большей частью опухоли (см.) стенки кишки, меккелев дивертикул (см.) или язвы, увлекаемые перистальтикой в просвет нижележащих отделов кишки. На вершине инвагината находят обычно или полип на ножке, или гипертрофированную пейерову бляшку. Нередко инвагинация развивается вслед за перенесенным энтеритом (см.), который сопровождался усиленной перистальтикой. У детей инвагинация иногда развивается при изменении диеты после отнятия их от груди и переходе на искусственное вскармливание. Происхождение инвагинации объясняется сочетанием спазма круговой мускулатуры кишки на определенном участке с усиленной перистальтикой приводящего отрезка кишки. Инвагинации могут развиваться остро и давать быстро картину полной непроходимости или протекать хронически, с продолжительным течением и явлениями неполной непроходимости. При остро развивающихся симптомах непроходимости у детей наблюдаются периодические схваткообразные спастические боли в животе, сопровождающиеся сильным криком и кровянистыми жидкими испражнениями. В животе можно в 60 % случаев прощупать с правой стороны колбасовидную опухоль. Живот не напряжен и в начальных стадиях инвагинации не вздут. Кровянистые испражнения появляются не ранее 12 ч после начала болей, но при исследовании пальцем кровянистые выделения в прямой кишке можно определить довольно рано. При острой форме инвагинации у детей развиваются тяжелые явления шока с падением пульса и уменьшением количества мочи. Остро протекающие инвагинации у детей без операции оканчиваются смертью в 90 % случаев, тогда как оперативное вмешательство в первые 24 ч после начала заболевания спасает 80–90 % больных. Хроническая форма инвагинации наблюдается в основном у взрослых; она протекает с менее тяжелыми явлениями, и ввиду этого у таких больных можно произвести дополнительное исследование — рентгеноскопию. При этом, если наполнить контрастной массой кишечник, в кишке определяется закупорка ее просвета на месте прощупываемой опухоли. Заворот кишок, или закручивание кишки и ее брыжейки вокруг своей оси, представляет собой тяжелую форму странгуляционной непроходимости. Заворот возможен только при наличии достаточно длинной брыжейки и наблюдается на тонкой, сигмовидной и слепой кишке при наличии у нее брыжейки. Завороту способствуют длинная брыжейка, воспалительные и рубцовые изменения в корне брыжейки, спайки между петлями кишки или с передней стенкой брюшной полости, опухоль и киста брыжейки, обильная растительная и богатая клетчаткой пища, принятая натощак после длительного перерыва в еде. При перекручивании кишки более чем на 180° закрывается ее просвет, развиваются расстройства кровообращения в перекрученной петле: венозный застой, транссудация в просвет кишки и в брюшную полость, кровоизлияние в стенку кишки, некроз (см.) и перитонит (см.). Заворот сигмовидной кишки встречается наиболее часто. Помимо значительной длины брыжейки, завороту способствует рубцовое ее сморщивание — так называемый мезосигмоидит, вследствие чего колена флексуры (изгиба) располагаются почти параллельно. При значительном переполнении кишки часть ее, наполненная жидкостью, опускается книзу, а половина, содержащая газы, поднимается кверху, в результате чего получается первый поворот кишки на 180°. При последующих перистальтических движениях кишечника, а также в связи с переменой положения тела и энергичными движениями во время работы и при затруднении опорожнения сигмовидной кишки происходит дальнейший ее перекрут, и развивается непроходимость. Увеличенная петля сигмовидной кишки иногда может достигать размеров автомобильной шины. Заворот тонкого кишечника протекает остро, с тяжелыми клиническими симптомами, характерными для острой непроходимости, очень сильными схваткообразными болями со смещением в пупок и в спину, с рвотой и задержкой стула. Вначале может определяться в животе раздутая и переполненная содержимым перекрученная петля кишки (симптом Валя), но в дальнейшем вздутие распространяется на весь кишечник, печень и диафрагма оттесняются кверху, а по всей передней поверхности живота определяется тимпанит (барабанный перкуторный звук). На рентгенограммах определяется скопление газов в тонких кишках с наличием уровней жидкости. Заворот сигмовидной кишки протекает менее остро, чем заворот тонкой кишки. Встречается это заболевание чаще у пожилых людей, страдающих длительными запорами (см.). Поэтому иногда первые признаки заворота не обращают на себя должного внимания больного, но затем появляются сильные боли, вздутие живота и рвота. Вследствие сильного вздутия перекрученной петли все брюшные внутренности и диафрагма отдавливаются кверху. У больных наблюдаются затрудненное дыхание и падение сердечной деятельности. При рентгеновском исследовании видна большая и раздутая газами сигмовидная кишка с уровнем жидкости. На операции у таких больных находят огромную, раздутую газами и жидким содержимым сигмовидную кишку диаметром с бедро взрослого человека. Стенка кишки отечна, покрыта кровоизлияниями. В области перекрута кишки имеется странгуляционная борозда. После выпускания газов и содержимого кишка представляет собой вялый атонический мешок.
Лечение Патогенетическое лечение кишечной непроходимости должно проводиться с учетом как местных процессов в кишечнике и брюшной полости, так и общих изменений в организме, связанных с нарушением функций желудочно-кишечного тракта. Лечение непроходимости кишечника может быть консервативным и оперативным. Методы консервативного лечения зависят от формы непроходимости, сроков, прошедших от начала заболевания, и состояния больного. Лечение должно заключаться в устранении причин непроходимости, поддержании сердечно-сосудистой деятельности, борьбе с нарушениями водно-солевого обмена и с расстройствами функций нервномышечного аппарата кишечника. Наиболее часто в начальных стадиях непроходимости применяются сифонные клизмы и опорожнение желудка путем его промывания и постоянного отсасывания содержимого тонким зондом, введенным через нос. С помощью сифонной клизмы можно расправить заворот сигмовидной кишки, отвести скопившиеся в ней газы, освободить толстый кишечник от каловых масс и в некоторых случаях расправить илеоцекальную или толстокишечную инвагинацию. Сифонные клизмы при лечении непроходимости должны производиться в различных положениях больного под непосредственным наблюдением врача с учетом количества вводимой жидкости, ощущений больного и эффективности процедуры. При непроходимости спастического характера, сопровождающейся схваткообразными болями, показано введение 1 мл 0,1 %-ного раствора атропина; при паралитической непроходимости — введение 1 мл 0,05 %-ного раствора прозерина. Указанные выше мероприятия (сифонные клизмы, промывание желудка, тем более — паранефральная блокада) не следует проводить, если состояние больного тяжелое, так как продолжительное использование этих методов неизбежно связано с отсрочкой операции и развитием необратимых изменений в кишечнике, внутренних органах и нервной системе. Совершенно противопоказано применение сифонных клизм и прозерина при симптомах перитонита. При подозрении на непроходимость кишечника нельзя также прибегать к наркотикам до тех пор, пока не будет установлен точный диагноз и решен вопрос об оперативном лечении. При всех формах механической непроходимости, за исключением немногих, которые могут быть устранены сифонными клизмами (заворот сигмовидной кишки, скопление каловых масс в нижнем отделе толстого кишечника), применяют оперативное лечение в неотложном порядке. Так же необходимо оперативное лечение и при некоторых видах динамической непроходимости, вызванной другими заболеваниями, которые подлежат хирургическому лечению (перитонит, аппендицит, панкреатит, тромбоз и эмболии мезентеральных сосудов и др.). Лечение закупорки кишечника инородными телами заключается в оперативном удалении камня через разрез кишки с последующим зашиванием кишки в поперечном направлении для предотвращения сужения ее. Закупорка камнями растительного происхождения, волосяными и шлаковыми камнями чаще встречается в желудке. При этих формах симптомы непроходимости развиваются медленно. Закупорка каловыми камнями наблюдаетсяисключительно у старых истощенных людей, страдающих запорами, или у больных с поражениями спинного мозга, сопровождающимися параличами. Симптомы непроходимости нарастают медленно и постепенно. При закупорке кишечника каловыми камнями оперативное вмешательство показано в тех случаях, когда все консервативные мероприятия для освобождения кишечника — масляные, глицериновые, промывные клизмы и попытки очищения кишечника пальцем через прямую кишку — не оказали эффекта. Операция в этих случаях заключается в наложении противоестественного заднего прохода.
Лечение при инвагинации В первые часы после начала инвагинации можно попытаться с помощью высоких клизм растянуть кишку и вправить инвагинат. В детской клинике больницы им. Филатова в Москве с успехом применяется для лечения инвагинации у детей метод введения воздуха через прямую кишку. Попытки вправления инвагината гидростатическим методом по прошествии 24–48 ч опасны ввиду возможности расправления нежизнеспособной кишки или разрыва ее с последующим перитонитом. При неудачной попытке вправления гидростатическим методом показано оперативное лечение. При жизнеспособной кишке производят дезинвагинацию путем давления снаружи на инвагинат. Если не удастся дезинвагинировать кишку, что обычно бывает при омертвении ее, производят удаление части кишки в один или два приема.
Лечение при завороте кишок В начальных стадиях непроходимости при завороте сигмовидной кишки можно попытаться расправить заворот с помощью сифонной клизмы. При отсутствии эффекта показана операция. При заворотах илеоцекального угла или тонкого кишечника должна быть произведена без промедления операция, так как консервативные мероприятия не могут дать эффекта. Смертность после операций по поводу острой кишечной непроходимости остается довольно высокой (15–18 %). В отдельных лечебных учреждениях, где организована быстрая доставка больных и систематически проводится комплексная терапия с учетом механизма развития острой кишечной непроходимости, удается снизить послеоперационную смертность. Для снижения смертности после операций по поводу непроходимости кишечника имеют большое значение организация оказания скорой помощи, активизация санитарно-просветительной работы среди населения и повышение квалификации фельдшеров, участковых врачей, педиатров, терапевтов, хирургов в области диагностики острых заболеваний органов брюшной полости. Ранняя диагностика и госпитализация и раннее оперативное вмешательство имеют весьма большое значение для благоприятного исхода лечения.
НЕФРИТ НАСЛЕДСТВЕННЫЙ
ОпределениеНаследственный нефрит — генетически детерминированная гломерулопатия, проявляющаяся гематурией (кровь в моче) и (или) протеинурией (белок в моче), имеющая тенденцию к прогрессированию вплоть до развития хронической почечной недостаточности, нередко сочетающаяся с патологией слуха и зрения.
Этиология, патогенез и патанатомия Установлен доминантный сцепленный с полом тип передачи. Заболевание связано с мутацией гена, контролирующего синтез структурных белков почечной ткани, а также других органов. Существуют два варианта наследственного нефрита — синдром Альпорта и гематурический нефрит. Более тяжелое течение болезни наблюдается у лиц мужского пола, что свидетельствует о возможности наследования по доминантному типу, частично сцепленному с полом. Механизм развития заболевания не изучен. При тканевом исследовании отмечается истончение базальной мембраны и ее дегенеративные изменения с потерей структуры и ее расщеплением. Клеточные изменения в почечной ткани характеризуются наличием фокально-сегментарного пролиферативного гломерулита, дистрофией (см.) эпителия проксимальных и атрофией (см.) дистальных канальцев, интерстициальной клеточной инфильтрацией и фиброзом (см.) с наличием «пенистых клеток». Электронно-микроскопическое исследование выявляет истончение базальной мембраны гломерул. Выделяют три разновидности наследственного нефрита. I. Синдром Альпорта — прогрессирующий гематурический нефрит, нейрогенный тип тугоухости, дефект зрения. II. Наследственный нефрит без тугоухости. III. Семейная доброкачественная эссенциальная гематурия.
Клиническая картина Гематурический вариант начинается незаметно, мочевой синдром выявляется случайно. Отеки (см.) и артериальная гипертензия (см.) отсутствуют, но появляются при развитии почечной недостаточности, как правило, в подростковом возрасте или у взрослых. Мочевой синдром характеризуется гематурией — от незначительного увеличения количества эритроцитов до макрогематурии. Обнаруживают также умеренную протеинурию, а у некоторых детей — преходящую лейкоцитурию. Бактериурии, как правило, не бывает. Биохимическое исследование крови не выявляет выраженных сдвигов, у некоторых детей могут наблюдаться нерезкая диспротеинемия и гиперлипидемия. Парциальные функции почек в течение длительного периода остаются ненарушенными, иногда выявляется гипераминоацидурия перегрузочного или ренального типа. Более тяжелые проявления характеризуют синдром Альпорта, при котором имеется сочетание поражения почек, глаз и тугоухости. В связи с тем, что тугоухость развивается в поздних стадиях болезни, раннее дифференцирование синдрома Альпорта может оказаться затруднительным. Нарушения слуха обусловлены поражением слухового нерва или кохлеарного (улиточного) аппарата, что у некоторых больных выявляется только при аудиометрическом исследовании. У большинства детей с наследственным нефритом обнаруживаются стигмы дизэмбриогенеза в виде анатомических аномалий строения мочевой системы (нефроптоз), а также внешние стигмы (гипертелоризм, аномалии строения ушных раковин, пальцев рук и ног). Для тяжелых форм наследственного нефрита характерно прогредиентное (непрерывное, с нарастанием дефекта) течение с постепенным развитием хронической почечной недостаточности.
Лечение и профилактика Лечение представляет трудную задачу в связи с отсутствием четких знаний о механизме развития болезни. В комплексе терапевтических мероприятий имеются общие элементы для воспалительных заболеваний почек: правильная организация режима сна и бодрствования ребенка, удаление очагов хронической инфекции, исключение из пищи острых и экстрактивных веществ. Антибиотики назначают только при сопутствующих заболеваниях. С целью торможения склеротических изменений могут быть назначены препараты 4-аминохинолинового ряда. Глюкокортикоиды не показаны. Удовлетворительные результаты получены от витаминотерапии, использования активаторов обмена (кокарбоксилаза, пиридоксин, АТФ). Применяются анаболические гормоны (ретаболил). Необходимо симптоматическое лечение (антианемические средства, гипотензивные препараты). Важно выявить ранние признаки хронической почечной недостаточности, чтобы начать лечение по программе «диализ — трансплантация». Для этого следует периодически определять содержание креатинина в плазме крови, исследовать показатели равновесия кислот и оснований. Профилактика наследственного нефрита не разработана. Хроническая почечная недостаточность при гематурическом варианте наследственного нефрита появляется в возрасте 20–25 лет, при синдроме Альпорта — в 12–16 лет (чаще у мальчиков).
НЕФРОПАТИЯ БЕРЕМЕННЫХ
ОпределениеНефропатия беременных, или поздний токсикоз беременности, — заболевание, возникающее у женщин со здоровыми почками, как правило, в III триместре беременности (см.) и проходящее после ее окончания. Такую нефропатию называют первичной. Проявляется она протеинурией (белок в моче), отеками (см.) и гипертензией (см.), причем токсикоз может проявляться как одним, так и несколькими симптомами. Среди причин материнской и перинатальной (вскоре после рождения) детской смертности нефропатия беременных занимает относительно высокий удельный вес. Частота нефропатии беременных, по данным различных авторов, колеблется в пределах 2,2—15,0 %.Выделяют сложный, или сочетанный, токсикоз, который развивается у беременных с наличием уже ранее существовавшего гломерулонефрита (см.), пиелонефрита (см.) и других заболеваний почек, а также при гипертонической болезни (см.), пороках (см.) сердца и особенно аортальной недостаточности, протекающей с повышенным артериальным давлением. Такой токсикоз еще называют вторичным. Для матери и плода опасность нежелательных последствий в этом случае значительно возрастает.
Этиология и патогенез Существует множество попыток с разных позиций объяснить развитие позднего токсикоза. Одни гипотезы решающим фактором признают возникновение в ишемизированной матке и плаценте вредных продуктов обмена. При этом полагают, что ишемическая плацента продуцирует вазопрессорные вещества (гистеротонные и др.), вызывающие распространенный спазм артериол, либо в ней образуются токсические продукты обмена, среди которых присутствуют протеолитические ферменты. Последние являются антигенами. Образующиеся комплексы антиген — антитело, оседая в почках, повреждают почечные клубочки. Возможно также, что из ишемизированной плаценты в общее кровообращение поступают тромбопластины, провоцирующие развитие синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром). В пользу данного предположения свидетельствуют повторные тромбоэмболии почек, легких, сосудов большого круга кровообращения. Из гипотез второй группы следует, что в основе развития нефропатии беременных лежит нарушение гормонального гомеостаза. Образующиеся в ишемизированных матке и плаценте метаболиты стимулируют секрецию гормонов надпочечников, в частности, минералокортикоида альдостерона и прессорных веществ мозгового вещества — катехоламинов. Это приводит к нарушению равновесия между альдостероном и прогестероном в пользу первого. Кроме того, повышается выработка ренина не только в почках — происходит экстраренальный его синтез в плаценте и матке. Плацента синтезирует важные регуляторы кровотока простагландины, в ней же при нефропатии беременных находят активный медиатор вазоконстрикции — серотонин. Существенное значение в механизме развития нефропатии беременных придают иммунологическому конфликту между матерью и плодом с образованием иммунных комплексов, содержащих IgG, IgM, а также фракцию С3 комплемента. При этом в организме матери развиваются реакции с выделением биологически активных веществ — ацетилхолина, серотонина, гепарина, гистамина и др. Изменения иммунологического статуса при поздних токсикозах рекомендуется учитывать даже при доклинической его диагностике. В возникновении позднего токсикоза беременных важная роль принадлежит и нарушению функции центральной нервной системы. Об этом свидетельствуют отклонения в центральной нервной системе, установленные на ЭЭГ задолго до появления клинических симптомов заболевания.
Патанатомия Морфологически обнаруживают распространенный спазм артериол, облитерацию их фибриновыми образованиями и внутрисосудистую агрегацию форменных элементов крови, которые обусловливают циркуляторные нарушения в жизненно важных органах. Значительные изменения обнаруживают и в почках. Клубочки увеличены, ишемизированы, стенки клубочковых петель утолщены, отечны, внутрикапсулярное пространство сужено, в нем находят отложения фибрина. Приносящие клубочковые артериолы отечны и сильно спазмированы. Выявляемые канальцевые изменения, преимущественно в верхних отделах, бывают разной степени выраженности: от дистрофических изменений эпителия до развития канальцевого некроза. При помощи электронной микроскопии устанавливают такие признаки нефропатии, как сужение просвета клубочковых капилляров с гиперплазией эндотелиальных клеток и утолщения в отдельных местах базальной мембраны. Следовательно, клеточные изменения в почках при нефропатии беременных подобны мембранозному или мембранознопролиферативному гломерулонефриту (см.) и отличаются от него лишь небольшим поражением артериол, более выраженными дистрофическими изменениями эпителия канальцев. Указанные изменения в почках при нефропатии носят обратимый характер и после родов (по данным пункционной биопсии) в большинстве случаев быстро исчезают. При нефропатии беременных возможны изменения в печени, миокарде, сосудах головного мозга.
Клиническая картина Основные клинические проявления нефропатии беременных — отеки (см.), гипертензия (см.), протеинурия. Классическая триада симптомов нефропатии наблюдается примерно у 50–60 % больных. В остальных случаях поздний токсикоз характеризуется двумя и даже одним симптомом. Однако эти варианты токсикоза не менее опасны, чем классическая нефропатия. Наиболее частым и важным проявлением нефропатии беременных служит гипертонический синдром. Если у женщины во второй половине беременности артериальное давление превышает 140 на 90—100 мм рт. ст., то следует подозревать нефропатию. При этом учитывают, что у здоровых женщин при нормальном течении беременности (см.) артериальное давление почти не изменяется. Гипертензия (см.) может быть значительной, но редко переходит в злокачественную форму. Она является как бы предвестником эклампсии (см.). Высокая гипертензия может вызвать перегрузку левого желудочка с явлениями сердечной астмы (см.) и отека легких (см.). Следует считать весьма неблагоприятным развитие позднего токсикоза на фоне имевшейся до беременности гипертензии, поскольку в таких случаях течение его бывает более тяжелым. Кроме того, имеется опасность недооценки исходного давления. Плохим прогностическим признаком является высокий уровень диастолического давления даже при относительно невысоком систолическом. Жалобы у беременных с поздним токсикозом могут отсутствовать, но в большинстве случаев их беспокоят головные боли, отмечаются раздражительность, повышенная утомляемость, нарушения зрения. Изменения сосудов глазного дна наблюдаются не всегда. Чаще они подобны тем, которые имеют место при гипертензии, — спазм артериол (гипертоническая ангиопатия), отек соска зрительного нерва, кровоизлияния и очаги дегенерации. В тяжелых случаях (при злокачественном гипертоническом синдроме) резко выраженные изменения глазного дна являются показанием для срочного родоразрешения. Для нефропатии беременных характерно исчезновение изменений со стороны глазного дна при нормализации артериального давления. Напротив, тяжелые и стойкие изменения на глазном дне чаще свидетельствуют о хроническом нефрите, гипертонической болезни. Вторым по частоте встречаемости является отечный синдром. Вначале отеки незначительные, а объективно их трудно определить. Поэтому обязательно еженедельное взвешивание беременной женщины. Увеличение массы тела более чем на 600 г за неделю свидетельствует о патологической задержке жидкости в организме. Сперва отеки (см.) появляются на ногах, затем распространяются на бедра, поясницу, живот, молочные железы, реже — на лицо. Полостные отеки встречаются редко. Диурез обычно снижен, а при значительных отеках, особенно развивающихся, может наблюдаться резко выраженная олигурия. Протеинурия, достигающая 1–6 г/л, а иногда и 40 г/л и более в сочетании с микрогематурией и цилиндрурией, — третий важный клинико-лабораторный признак нефропатии беременных. Более значительная гематурия может указывать на сочетание нефропатии с гломерулонефритом. Функция почек при чистом токсикозе существенно не нарушается: концентрационная способность почек, уровень в крови мочевины и креатинина находятся в пределах нормы. Лишь при тяжелом течении токсикоза с выраженной олигурией или анурией (см.) могут отмечаться преходящее снижение почечного кровотока, клубочковой фильтрации и умеренная гиперазотемия. В случаях, протекающих с поражением печени, наблюдаются боли в правом подреберье и увеличение печени, иногда появляется желтуха (см.). Одновременно происходит нарушение протромбинообразовательной, дезинтоксикационной, белковообразовательной функции печени. В последнем случае четко выражены дефицит альбуминов и диспротеинемия; повышено содержание липопротеидов, холестерина и сахара; СОЭ ускорена. Сосудистые расстройства ухудшают деятельность сердечной мышцы, обусловливая развитие так называемой ишемической миокардиопатии (см.), наблюдающейся при тяжелых формах позднего токсикоза. Наряду с этим отмечаются изменения свертывающей системы крови, водно-солевого обмена с задержкой натрия и воды, угнетение функции щитовидной и поджелудочной желез. На практике среди поздних токсикозов в настоящее время преобладают легкие формы с невыраженными клиническими проявлениями.
Лечение При нефропатии беременным прежде всего необходим щадящий режим. В тяжелых случаях нефропатии больным показаны постельный режим, диета и медикаментозное лечение. Как правило, лечение нефропатии беременных проводят стационарно в специализированных отделениях патологии беременных. Обязательный компонент лечения — диета (стол № 7). Основные требования к ней заключаются в следующем. Необходимо ограничить суточное потребление соли (до 1,5–3 г), особенно при высокой гипертензии и преэклампсии, и жидкости (до 1 л). Потребление последней распределяется равномерными порциями. Количество белка в суточном пищевом рационе сохраняется в норме (1–1,2 г на 1 кг массы тела, в том числе половина его должна быть животного происхождения). Количество жиров несколько уменьшается и составляет 0,7–1 г на 1 кг массы тела. В суточный рацион необходимо ввести достаточное количество продуктов, богатых углеводами и калием. Противопоказаны алкогольные напитки. Рекомендуются разгрузочные дни 1 раз в 7 дней (творожные, сухофруктовые и др.). Из медикаментозных препаратов сразу же необходимо применять седативные средства. Это позволяет нормализовать деятельность центральной нервной системы. В дальнейшем медикаменты назначают исходя из симптоматики токсикоза. Так, для устранения гипертензии можно рекомендовать индивидуально подобранные гипотензивные препараты всех групп. Противопоказано лишь применение производных гуанидина (изобарин, исмелгин), так как эти препараты могут вызвать ортостатический коллапс (см.) у беременной, тяжелые осложнения и даже гибель плода. Для устранения отеков и повышения диуреза (мочеотделения) используют диуретики в разных комбинациях одновременно или последовательно. Назначение мочегонных средств сочетают с достаточным приемом калия. Можно рекомендовать спиролактоны. При всех формах нефропатии параллельно назначают внутривенные или внутримышечные вливания эуфиллина и магния сульфата. При развитии преэклампсии и эклампсии (см.) первостепенное значение имеет борьба с отеком мозга. Классическим средством при этом является назначение 20,0 мл 10 %-ного раствора магния сульфата внутривенно, а затем 10 мл 25 %-ного раствора внутримышечно. Назначают внутривенно мочегонные (лазикс). Можно вводить реополиглюкин, маннитол, 40 %-ный раствор глюкозы. В качестве осмотического диуретического средства применяют глицерин по 0,5 г/кг массы тела 2 раза в день вместе с фруктовым соком; показано применение нейролептиков (дроперидол), барбитуратов, аминазина, хлоралгидрата в клизмах. Кроме перечисленных традиционных методов лечения тяжелых токсикозов, все шире применяются патогенетические средства. Положительные результаты получены при использовании антиагрегантов. Беременным с эклампсией вводят концентрированную плазму, 20 %-ный раствор альбумина. При лечении необходим постоянный контроль за показателями кислотно-щелочного равновесия, свертывающей системы крови и функциональным состоянием почек. Для нормализации иммунологических нарушений при тяжелых токсикозах применяют тиоловые препараты (курс внутримышечных инъекций унитиола). Если при консервативной терапии эффект отсутствует, проводят ургентное (срочное) родоразрешение. При правильном и своевременном лечении нефропатии беременных прогноз благоприятный. После родоразрешения в течение нескольких дней исчезают отеки, затем гипертензия, уменьшается и вскоре исчезает протеинурия, постепенно восстанавливается функция почек. В почечной ткани (при биопсии) уже через несколько дней после родов не обнаруживают имевших место патологических изменений. При тяжелом течении позднего токсикоза и в случаях преэклампсии клиническая картина складывается из симптомов остро возникающей злокачественной гипертензии. Преобладают резко выраженные головные боли, тошнота, рвота, потеря аппетита, часто отмечается потеря зрения. Могут возникать психические расстройства (скованность, заторможенность), острая сердечная недостаточность. Наряду с этим наблюдаются отеки, часто массивные, высокая протеинурия. Преэклампсия является переходной стадией к более тяжелому осложнению нефропатии беременных — эклампсии (см.), которая возникает примерно в 1,5 % случаев нефропатии беременных и характеризуется присоединением к описанной клинической картине тонических и клонических судорог, потери сознания. Механизм эклампсии (см.) аналогичен механизму гипертонической энцефалопатии при остром гломерулонефрите (резкое повышение внутричерепного давления, отек мозга). Каждый приступ эклампсии начинается с мелкого подергивания мышц лица и век, затем развиваются судороги всей скелетной мускулатуры (тонические), наконец, происходит бурное судорожное подергивание мышц лица, туловища, верхних и нижних конечностей (клонические судороги). Развитие эклампсии (см.) нередко сопровождается повышением температуры, остановкой дыхания, синюшностью. В период разрешения приступа развивается коматозное состояние с постепенным возвращением сознания. Продолжительность припадков — 30–40 с. В течение дня они могут часто повторяться, так что больная практически не успевает прийти в сознание. Изредка больная впадает в длительное коматозное состояние без предшествующих припадков. Это наиболее тяжелая и опасная форма эклампсии. Статистика показывает, что приступы эклампсии (см.) могут возникать до родов в 25 % случаев, во время родов — в 50 %, а после родов — в 25 % случаев. Исход приступа определяется уровнем артериального давления и степенью нарушения мозгового кровообращения. Смертность при эклампсии (см.) составляет 1–9 % и наступает от кровоизлияния в мозг или острой сердечной недостаточности. Спазм почечных артериол во время приступа может вызывать канальцевый некроз и острую почечную недостаточность. Диагностика эклампсии (см.) обычно не вызывает затруднений, но в ряде случаев необходимо уметь отличать ее от диабетической и уремической комы (см.), синдрома Морганьи-Адамса-Стокса. В 3,4 % случаев при последующих беременностях эклампсия (см.) рецидивирует. Осложненная эклампсией нефропатия вызывает стойкие последствия: у 1/3 больных наступают нарушения мозгового кровообращения, снижение зрения и другие изменения, у 20 % в дальнейшем наблюдаются отклонения со стороны функции почек вплоть до развития хронической почечной недостаточности, у 17,9 % больных нефропатия беременных трансформируется в гипертоническую болезнь.
НЕФРОТИЧЕСКИЙ СИНДРОМ
ОпределениеНефротический синдром сопровождает многие первичные и вторичные заболевания почек, а в отдельных случаях может выступать как самостоятельная нозологическая форма. В современной нефрологии общепризнан термин «нефротический синдром». Он введен в номенклатуру болезней ВОЗ.Нефротический синдром — симптомокомплекс, характеризующийся наличием протеинурии более 40 мг/м2 в час (или соотношением белок/креатинин в моче более 200 мг/мл), гипопротеинемии, гипоальбуминемии (менее 25 г/л), гиперлипидемии, отеков. Нефротический синдром встречается среди больных с различными заболеваниями почек примерно в 20 % случаев. Наиболее часто заболевают им дети в возрасте 2–5 лет, а у взрослых он выявляется преимущественно в возрасте 20–40 лет. Однако описаны случаи заболевания нефротическим синдромом как новорожденных, так и лиц пожилого и старческого возраста (70–95 лет). Частота обнаружения нефротического синдрома у мужчин и женщин зависит от основного заболевания, следствием которого он является. При ревматоидном артрите (см.) и особенно при системной красной волчанке (см.) нефротический синдром чаще встречается у женщин.
Этиология и патогенез По происхождению различают первичный и вторичный нефротический синдром. Первичный нефротический синдром является следствием первичных заболеваний почек, среди которых первое место принадлежит гломерулонефриту (см.) как самостоятельному заболеванию почек в его различных морфологических вариантах. Вторичный нефротический синдром является следствием многих заболеваний, при которых почки вовлекаются в патологический процесс вторично. Это амилоидоз (см.) почек, сахарный диабет (см.), нефропатия беременных (см.); такие хронические инфекции, как туберкулез (см.), сифилис (см.) и малярия (см.); диффузные заболевания соединительной ткани (системная красная волчанка (см.), системная склеродермия (см.), ревматоидный артрит (см.), узелковый периартериит (см.)); затяжной септический эндокардит (см.), различные аллергические заболевания, геморрагический васкулит (см.), миеломная болезнь (см.), лимфогранулематоз (см.), отравления (см.) тяжелыми металами (ртуть, золото, свинец), тромбоз почечных вен и нижней полой вены, опухоли (см.) почек и других органов, укусы змей и пчел, медикаментозные поражения почек (препараты ртути, золота) и др. Возможно развитие нефротического синдрома и у больных пиелонефритом (см.) Наиболее распространена и обоснована иммунологическая концепция механизма развития нефротического синдрома. В пользу данной концепции свидетельствуют такие факты, как возможность получения нефротического синдрома у здоровых животных путем введения им нефротоксической сыворотки; возникновение его у людей с повышенной чувствительностью к некоторым лекарственным препаратам и пыльце растений; большая частота развития этого синдрома у больных с заболеваниями аутоиммунного генеза (системная красная волчанка (см.), узелковый периартериит (см.) и др.) и положительный эффект иммуносупрессивной терапии (глюкокортикостероиды, иммунодепрессанты). При этом иммунные комплексы могут образовываться в крови в результате взаимодействия антител с антигенами как внутреннего, так и внешнего происхождения. К первым относятся ДНК, денатурированные нуклеопротеиды, криоглобулины, белки опухолей и другие, ко вторым — бактериальные, вирусные, пищевые, медикаментозные, пыльца растений и др. В других случаях иммунные комплексы образуются вследствие выработки антител к веществу базальных мембран клубочковых капилляров. Осаждаясь либо образуясь непосредственно на них, иммунные комплексы вызывают их повреждение, нарушения структуры и повышение проницаемости. Степень повреждения структуры почек зависит от концентрации иммунных комплексов, их состава и продолжительности воздействия. При этом также развивается воспалительная реакция, нарушается микроциркуляция в клубочковых капиллярах, процессов фибринолиза и свертывающей способности крови с развитием внутрисосудистой коагуляции.
Патанатомия Почки увеличены в размерах, поверхность их гладкая и ровная. На разрезе хорошо различается корковое и мозговое вещество почки. Корковое вещество обычно бледно-серое (большая белая почка), а мозговое — красноватое. Тканевая картина почечной ткани при световой и электронной микроскопии отражает изменения, свойственные не только нефротическому синдрому, но и основному заболеванию, явившемуся причиной его развития (гломерулонефрит (см.), амилоидоз (см.), туберкулез (см.), системная красная волчанка (см.) и др.). Для нефротического синдрома характерны такие клеточные изменения клубочков, как нарушение структуры подоцитов и базальных мембран клубочковых капилляров, которые могут встречаться изолированно либо сочетаться. Это наиболее ранние признаки нефротического синдрома, наиболее отчетливо выявляемые с помощью электронной микроскопии. Полагают, что самыми ранними признаками данного синдрома следует считать изменения подоцитов (клетки капсулы клубочка) с присоединением в последующем нарушений структуры базальных мембран клубочков. При благоприятном течении нефротического синдрома и в период его ремиссии структура подоцитов, в частности педикул, может восстанавливаться. Нарушение структуры базальных мембран клубочковых капилляров проявляется очаговым или распространенным их утолщением с отложением на их поверхности депозитов, состоящих из иммунных комплексов, повышением их проницаемости.
Клиническая картина Нефротический синдром всегда проявляется однотипно, независимо от причины, его вызвавшей. Для него характерны массивная протеинурия, гипо- и диспротеинемия, гиперлипидемия (в частности, гиперхолестеринемия) и отеки. Ведущим признаком считается протеинурия, превышающая 3,0–3,5 г в сутки и достигающая 5,0—10,0—15,0 г, а в ряде случаев и более. До 80–90 % выделяемого с мочой белка состоит из альбуминов. Полагают, что массивная протеинурия при нефротическом синдроме является одним из главных (но не единственным) патогенетических факторов гипо- и диспротеинемии. Гипопротеинемия может быть различной степени выраженности, но обычно уровень общего белка в сыворотке крови снижается до 60 г/л, а в тяжелых случаях — до 50–40 и даже 30–25 г/л. Следующим важным признаком нефротического синдрома являются отеки. Они наблюдаются у подавляющего большинства больных и достигают различной степени выраженности. Клинически проявляются так же, как и при нефротическим синдроме у больных хроническим гломерулонефритом (см.). Наиболее часты жалобы больных на общую слабость, потерю аппетита, жажду, сухость во рту, уменьшение количества мочи, головную боль, неприятные ощущения или тяжесть в области поясницы, реже на тошноту, рвоту, вздутие живота и жидкий стул (обычно при наличии выраженного асцита (см.)). Особенно значительной бывает слабость при длительном течении нефротического синдрома и многомесячном, а иногда и многолетнем применении диуретиков. В таких случаях возможны парестезии (неприятные ощущения покалывания, жжения и т. д.), боли в мышцах и даже судороги вследствие потери калия и хлоридов. При наличии гидроторакса (жидкость в плевральной полости) и особенно гидроперикарда (жидкость в сердечной сумке) отмечается одышка не только при физическом напряжении, но и в состоянии покоя. Выраженные отеки (см.) нередко приводят к значительному ограничению активности больного, затрудняют передвижение. Больные малоподвижны, иногда адинамичны, бледны. Температура тела нормальная либо снижена, кожные покровы на ощупь холодные, сухие. Нередко отмечаются шелушение кожи, ломкость ногтей и волос. Границы сердца в пределах нормы, однако при наличии транссудата (жидкости) в полости перикарда смещаются во все стороны. Число сердечных сокращений и пульс замедлены и лишь при сердечной недостаточности и анемии развивается тахикардия (см.). Тоны сердца приглушены, а при гидроперикарде — глухие. Артериальное давление крови чаще нормальное, но может быть понижено. На ЭКГ обнаруживаются признаки миокардиодистрофии (см.), низкий вольтаж всех зубцов. В легких при больших отеках определяется укорочение перкуторного звука, ослабление дыхания и нередко влажные мелкопузырчатые хрипы над нижними отделами, которые следует расценивать как застойные. Язык часто обложен, живот увеличен, иногда отмечается увеличение размеров печени (например, при амилоидозе (см.) или при недостаточности кровообращения (см.)). У некоторых больных нефротический синдром может сопровождаться так называемой нефротической диареей (см.) с потерей через желудочно-кишечный тракт большого количества белка (протеиндиарея), что, как полагают, может быть связано с повышением проницаемости слизистой кишечника. У больных с нефротическим синдромом наблюдается снижение основного обмена, что связывают со снижением функции щитовидной железы. Полагают, что сниженная функция щитовидной железы обусловливает в известной мере нарушение белкового и жирового обменов и способствует уменьшению мочеотделения (олигурия). Олигурия является одним из характерных и постоянных признаков нефротического синдрома. Суточный диурез обычно не превышает 1000 мл, составляя нередко не более 400–600 мл. При этом у больных с сохраненной функцией почек относительная плотность мочи нормальная либо повышена (до 1030–1040) за счет высокой концентрации в ней белка и других осмотически активных веществ. Гематурия (кровь в моче) нехарактерна для нефротического синдрома, однако возможна, чаще в виде микрогематурии, реже она может быть умеренной и еще реже — выраженной. В осадке обнаруживаются также жироперерожденный эпителий, кристаллы холестерина, иногда капли нейтрального жира. В отдельных случаях может наблюдаться небольшая и нестойкая лейкоцитурия. Со стороны периферической крови наиболее постоянным признаком нефротического синдрома является увеличение СОЭ, которое может достигать 60–85 мм/ч. Количество лейкоцитов и состав лейкоцитарной формулы обычно не претерпевают заметных изменений. Лишь при осложнениях и лечении глюкокортикостероидами возможно развитие лейкоцитоза. Иногда наблюдается преходящая эозинофилия, связанная, по-видимому, с приемом некоторых лекарств и повышенной к ним чувствительности организма. Возможно увеличение количества тромбоцитов (до 500–600 тыс.) и незначительное снижение уровня эритроцитов и гемоглобина. Кроме того, установлено, что нефротическому синдрому свойственна повышенная свертываемость крови, которая может варьировать от небольшого ее повышения до развития диссеминированной внутрисосудистой коагуляции. Это приводит к нарушению микроциркуляции в клубочковых капиллярах и способствует более быстрому развитию гиалиноза и склероза клубочков с нарушением функции почек. Выраженность клинических проявлений нефротического синдрома, быстрота его возникновения и развития могут варьировать в широких пределах. В одних случаях он может развиваться медленно, постепенно и вяло, в других — быстро и даже бурно (например, при остром и подостром гломерулонефрите). Клинически различают две формы нефротического синдрома — чистую и смешанную. О чистом нефротическом синдроме говорят, когда он протекает без гипертензии и гематурии. К смешанной форме относят те случаи заболевания, когда признаки, свойственные нефротическому синдрому, сочетаются с гипертензией или гематурией. Такие варианты нефротического синдрома некоторые авторы обозначают соответственно как нефротически-гипертоническую и нефротически-гематурическую формы.
Диагностика Установить диагноз нефротического синдрома несложно. Для этого не требуется каких-либо специальных методов исследования. Наличие отеков, выраженной протеинурии, гипо- и диспротеинемии, гиперхолестеринемии обычно не вызывает сомнения в том, что это клинико-лабораторные признаки нефротического синдрома. Труднее бывает решить, чем вызван нефротический синдром, какое основное заболевание или патологический процесс привели к его развитию, какова в каждом конкретном случае его причина, поскольку таких причин может быть много. Для уточнения этого важного вопроса, с решением которого во многих случаях связан выбор наиболее рациональной терапии, необходимо провести всестороннее клиническое, лабораторное и инструментальное обследование больного, а в ряде случаев приходится прибегать к специальным методам исследования — иммунологическим, радиоизотопным, ангиографическим вплоть до прижизненной пункционной биопсии почек, подслизистого слоя десны, прямой кишки и др.
Лечение и профилактика Все больные с нефротическим синдромом нуждаются в госпитализации, по возможности — в специализированное нефрологическое отделение для уточнения генеза (происхождения) нефротического синдрома, выбора и проведения наиболее рационального метода лечения. Независимо от причины возникновения нефротического синдрома всем больным назначаются постельный режим, диета с ограничением поваренной соли и жидкости, симптоматические средства (диуретики, антигистаминные средства, препараты кальция, аскорбиновая кислота, рутин, при необходимости — антибиотики и сердечные средства). В связи с аутоиммунным генезом нефротического синдрома в настоящее время для его лечения широко используются методы и средства иммунодепрессивной терапии, к числу которых относятся глюкокортикостероидные гормоны (преднизолон и его аналоги), цитостатические препараты (имуран, азатиоприн, лейкеран, циклофосфамид и др.), антикоагулянты прямого (гепарин) и непрямого (фенилин, пелентан, омефин и др.) действия. Используются также (хотя они и менее эффективны) противовоспалительные средства — индометацин, метиндол, вольтарен, бруфен и антиагреганты — курантил, дипиридамол, персантин. Вопросы диетотерапии, характеристика механизма действия упомянутых средств патогенетической терапии, дозировка, продолжительность основного курса лечения в условиях стационара и поддерживающей терапии в условиях поликлиники, оценка эффективности этого вида терапии, возможные побочные действия подробно изложены при описании лечения острого и хронического гломерулонефрита. Стероидная терапия наиболее показана при чистом идиопатическом (неясного происхождения) нефротическом синдроме, а также при нефротическом синдроме, обусловленном лекарственным поражением почек, системной красной волчанкой (см.) и диффузным гломерулонефритом (см.). В то же время назначение глюкокортикостероидных гормонов неэффективно и не показано больным с нефротическим синдромом при диабетическом гломерулосклерозе, опухолях почек, туберкулезе, сифилисе, амилоидозе почек, а также при сочетании нефротического синдрома с гипертензией (смешанная форма гломерулонефрита). Недостаточно эффективны глюкокортикостероиды при нефротическом синдроме у больных геморрагическим васкулитом и узелковым периартериитом. Цитостатики назначаются больным при наличии противопоказаний к стероидной терапии или при отсутствии эффекта от ее применения. Хороший терапевтический эффект дает лечение цитостатиками узелкового периартериита (см.), сопровождающегося нефротическим синдромом. Эти препараты (особенно в сочетании со стероидными гормонами и антикоагулянтами) показаны при смешанной форме хронического гломерулонефрита, у больных с синдромом Гудпасчера, волчаночным нефритом, подострым гломерулонефритом (см.) и при некоторых других заболеваниях, сопровождающихся нефротическим синдромом. После стационарного лечения в условиях поликлиники длительное время должна проводиться поддерживающая патогенетическая терапия. Ее продолжительность и дозы лекарственных препаратов, а также возможные их сочетания зависят от нозологической формы, течения нефротического синдрома и других факторов и должны указываться в выписке из истории болезни. Лечение необходимо проводить под тщательным контролем, с обязательным выполнением необходимого объема клинико-лабораторных методов исследования (общий анализ крови, мочи, сахар крови, мочевина и др.) в динамике. Существенное место в комплексной терапии больных с нефротическим синдромом занимает санаторно-курортное лечение на климатических курортах (Байрам-Али, в период ремиссии — на Южном берегу Крыма). Показания и противопоказания к направлению на санаторное лечение зависят от основного заболевания, следствием которого является нефротический синдром, и состояния функции почек. В целях профилактики необходимо рациональное и настойчивое лечение острого и хронического гломерулонефрита и других заболеваний почек, тщательное удаление очагов инфекции, а также профилактика тех заболеваний, которые могут быть причиной нефротического синдрома. Следует проявлять осторожность в назначении лекарственных препаратов, обладающих нефротоксичностью и способностью вызывать аллергические реакции. Больные должны избегать переохлаждения, избыточного облучения. Они нуждаются в трудоустройстве с ограничением физических и нервных нагрузок.
НОГОТЬ ВРОСШИЙ
ОпределениеНоготь вросший — врастание бокового края ногтевой пластины под ногтевой валик, вызывающее хроническое воспаление.
Этиология и патогенез Вросший ноготь — довольно частое заболевание, которое развивается на больших пальцах ног вследствие длительного ношения тесной обуви с узким носком, сдавливающим пальцы конечностей. Сдавление пальцев усиливается еще больше при ношении обуви с высокими каблуками. Постоянное сжатие пальцев приводит к искривлению ногтей, которые боковым своим краем углубляются в околоногтевой валик, а при усиленной ходьбе врезаются передним краем в мягкие ткани пальца и вызывают образование гноящихся язв и избыточного роста грануляций.
Клиническая картина, лечение и профилактика Характерны боли, а при присоединении инфекции отмечаются покраснение, отек пальца и хромота. При небольших степенях искривления можно устранить врастание в мягкие ткани подкладыванием под край ногтя небольших кусочков марли для профилактики искривленного роста ногтя и выведения его за пределы мякоти пальца. Ношение нормальной обуви с широким носком является необходимым условием лечения. При запущенных стадиях врастания ногтя показаны удаление его под местной анестезией и клиновидное иссечение ногтевого ложа с наложением швов. Профилактика сводится к правильному обрезаниюногтевой пластины (не иссекать глубоко боковые части ногтя), ношению обуви, соответствующей размеру стопы, гигиене кожи стоп.
НОСА ПАТОЛОГИЯ (ОПУХОЛИ, СИНЕХИИ ПОЛОСТИ НОСА, ТРАВМЫ)
Опухоли полости носа В полости носа и его придаточных пазухах почти одинаково часто встречаются доброкачественные и злокачественные опухоли (см.). Среди доброкачественных опухолей наиболее часто встречаются аденомы, ангиомы, фибромы, ангиофибромы, аденофибромы. Значительно реже встречаются остеомы, хондромы и еще реже — ангиомиомы и псаммомы, а также эстезиобластомы, гистогенетически связанные с обонятельными нервными рецепторами (локализуются в подслизистом слое верхнего носового хода) и менингиомы (в лобно-решетчатой области). Как единичные наблюдения в литературе описаны невриномы полости носа и гиомусные опухоли. Особо следует выделить папилломатоз полости носа и придаточных его пазух (верхнечелюстной, решетчатой) в связи с выраженной тенденцией его к озлокачествлению. Это заболевание следует рассматривать как предраковое. Однако и без озлокачествления при длительном существовании папилломы своим механическим давлением разрушают костные стенки и могут прорастать в глазницу и даже в полость черепа.Доброкачественные опухоли полости носа Полипы носа весьма условно относятся к опухолям носа, являясь продуктом воспалительной, чаще всего аллергической реакции придаточных пазух носа (доброкачественные опухоли полости носа и придаточных пазух встречаются с одинаковой частотой у мужчин и женщин вне зависимости от возраста. Лишь ангиофиброма носовой перегородки, или так называемый кровоточащий полип носовой перегородки, наблюдается преимущественно у молодых женщин в период беременности (см.) или кормления. На грани между опухолью и гиперпластическим процессом стоит эозинофильная гранулема. Симптоматика доброкачественных опухолей этой локализации чаще всего сводится к одностороннему затрудненному носовому дыханию. С присоединением вторичного воспалительного процесса появляются слизисто-гнойные выделения из носа и головная боль. Сосудистые опухоли — лимфангиомы, гемангиомы, ангиофибромы — иногда являются источником носовых кровотечений. Как на особый вид сосудистой опухоли следует обратить внимание на кровоточащий полип носовой перегородки, который отходит на широкой ножке от передней хрящевой части носовой перегородки. Он бывает величиной от горошины до грецкого ореха, поверхность его то гладкая, то дольчатая. Остеомы и хондромы, нарушая целость стенок полости носа или придаточных пазух, на которых они возникли, сопровождаются более или менее выраженной деформацией лица. Диагноз доброкачественных опухолей полости носа не представляет больших трудностей и ставится на основании данных передней риноскопии (осмотр полости носа), часто путем зондирования и пальпации. При опухолях придаточных пазух носа диагноз ставится чаще на основании не только клинических методов исследования, но и рентгенологических данных с использованием послойного исследования (томография). Иногда диагноз уточняется после вскрытия придаточной пазухи носа и тканевого исследования его содержимого.
Злокачественные опухоли полости носа Из злокачественных опухолей полости носа и придаточных пазух большинство составляют раковые опухоли — плоскоклеточный рак (см.), аденокарциномы, цилиндроклеточный рак, базалиомы; несколько реже встречаются саркомы — остеосаркомы, хондросаркомы, фибросаркомы, полиморфно-клеточная саркома и др., а также опухоли типа меланомы, плазмоцитомы, ретикулосаркомы, лимфоэпителиомы и пр. Злокачественные опухоли полости носа и придаточных пазух чаще встречаются у мужчин; наиболее часто раковые опухоли появляются после 40 лет, саркомы возникают в более молодом возрасте. Симптоматика злокачественных опухолей полости носа и придаточных пазух зависит главным образом, особенно в начальных стадиях, от места возникновения опухоли и ее тканевого строения, а также особенностей роста. Злокачественные опухоли полости носа вызывают затрудненное носовое дыхание, нарушение обоняния, спонтанные носовые кровотечения (см.). В дальнейшем при распаде опухоли и ее изъязвлении с учащением носовых кровотечений появляется зловонный запах из носа. Распространение опухоли из полости носа чаще происходит по направлению к носоглотке, а также в клетки решетчатого лабиринта, гайморову пазуху, глазницу и крылонебную ямку с появлением соответствующих симптомов. Злокачественные опухоли клеток решетчатого лабиринта сопровождаются почти теми же симптомами, что и опухоли полости носа, однако при поражении решетчатой кости у больных наблюдаются более интенсивные головные боли в области лба и затылка. Часто наблюдаются осложнения со стороны глазницы, связанные как со вторичными реактивными изменениями тканей, окружающих решетчатый лабиринт, так и в результате прорастания опухоли в глазницу. Гайморова, лобная и основная пазухи также не являются редкими местами, куда может распространиться опухоль из решетчатого лабиринта. Злокачественные опухоли гайморовой пазухи дают наиболее разнообразную симптоматику, зависящую от преимущественного поражения той или иной стенки. Риногенная симптоматика возникает при преимущественном расположении опухоли на медиальной стенке пазухи, глазная симптоматика — на верхней стенке, стоматологическая — на нижней, в области альвеолярного отростка, неврологическая — в верхне-наружном углу по соседству с крылонебной ямкой. Таким образом, при злокачественной опухоли гайморовой пазухи могут быть затрудненное носовое дыхание, нарушение обоняния, слизисто-кровянистые выделения из носа, смещение глазного яблока кверху и кнаружи и ограничение его подвижности, боль в области зубов верхней челюсти соответствующей стороны и их расшатанность, припухание твердого неба, тригеминальные боли II ветви тройничного нерва, припухлость щеки и пр. Из гайморовой пазухи опухоль может распространяться в глазницу, полость носа, полость рта, крылонебную ямку, носоглотку. Злокачественные опухоли лобной пазухи сопровождаются симптомами одностороннего закладывания полости носа, слизисто-кровянистыми выделениями из носа, отсутствием обоняния; сравнительно рано нарушается зрение, что связано с вовлечением в процесс мягких тканей глазницы. Первичные злокачественные опухоли основной пазухи встречаются очень редко и проявляют себя при распространении процесса в полость носа, носоглотки или в полость черепа. Так же редко наблюдаются прорастающие опухоли из средней черепной ямки в носоглотку. Злокачественные опухоли полости носа и в большей степени придаточных пазух носа отличаются многообразием симптомов, чаще связанных с распространением опухоли за пределы первичного очага. Метастазирование опухолей этой локализации наблюдается в регионарные лимфатические узлы заглоточного и окологлоточного пространства, а также в глубокие шейные лимфатические узлы сравнительно редко и поздно, когда опухоль вышла за пределы пазухи. Больные погибают от кровотечений или от прорастания опухоли в полость черепа еще до того, как у них возникнут проявления метастазирования. Это во многом связано с биологической активностью и сосудистой системой тканей этого участка верхних дыхательных путей. Диагностика основывается на клинической картине, а также строится на результатах рентгенологического обследования с использованием томографии. Окончательный диагноз базируется на данных тканевого исследования. В последнее время совершенствуется методика цитологического исследования материала, полученного при взятии мазков с гиперпластических участков или в результате центрифугирования промывной жидкости, полученной при диагностических пункциях придаточных пазух носа.
Лечение Лечение почти всех доброкачественных опухолей при отсутствии противопоказаний заключается в хирургическом вмешательстве с использованием электрокоагуляции, особенно при сосудистых опухолях. Чтобы избежать кровотечения при удалении кровоточащего полипа носовой перегородки, его следует удалять не холодной, а гальванокаустической петлей или посредством хирургической диатермии. При неполном удалении полипа нередко наблюдаются рецидивы. Лечение злокачественных опухолей комбинированное (при опухоли полости носа, передних клеток решетчатого лабиринта или гайморовой пазухи). Этот метод заключается в проведении предоперационной лучевой терапии. Спустя 2–3 недели после окончания облучения больному производят радикальное иссечение опухоли. В связи с тем, что эти операции сопровождаются повышенной кровоточивостью, перед операцией производят перевязку питающих сосудов, чаще перевязывают наружную сонную артерию. В послеоперационную полость вводят на несколько часов радиоактивный препарат. В дальнейшем при необходимости проводят и послеоперационную лучевую терапию. Больным в поздних стадиях опухолевого процесса, когда опухоль вышла за пределы пазухи, а удаление ее в пределах здоровых тканей не представляется возможным, как и при опухолях основной и лобной пазух, а также средних и задних клеток решетчатого лабиринта, осуществляют лучевую терапию как единственный противоопухолевый способ лечения. Для улучшения условий облучения производят своеобразное обескровливание тканей и опухоли с помощью перевязки и перерезки питающих сосудов (в основном сонных артерий). Нередко рационально проведенная лучевая терапия дает хороший терапевтический эффект даже в поздних стадиях опухолей. Однако прогноз при злокачественных опухолях придаточных пазух не считается благоприятным.
Синехии и атрезии полости носа Различают синехии, т. е. образование перемычек или тонких мостиков между отдельными частями слизистой оболочки полости носа, и атрезии — заращения, которые частично или полностью закрывают просвет носа. Сращения могут быть хрящевыми, костными или соединительнотканными. Синехии редко бывают врожденными: в большинстве случаев, как и атрезии, они являются следствием язвенных процессов в носу на почве таких острых инфекций, как оспа (см.), дифтерия (см.), тиф (см.), которые ведут к последующему рубцовому сужению или полному заращению, например, входа в нос. К причинам, вызывающим деформации полости носа и носовых отверстий, могут быть также отнесены системная красная волчанка (см.), сифилис (см.), склерома, травма, а также прижигания в носу, произведенные случайно или с лечебной целью едкими химическими веществами. Характер таких заращений обыкновенно соединительнотканный, реже — костный. Концентрические сужения, иногда вплоть до полного закрытия просвета, чаще наблюдаются у входа в нос; в самой же полости носа эти сращения имеют характер тяжей или толстых перепонок, располагающихся между носовыми раковинами и перегородкой носа. Сращения, располагающиеся в области хоан, чаще бывают односторонними, нередко имеют костный характер, и большинство из них являются врожденными, в то время как сращения в передних отделах носа чаще бывают приобретенными. Клинически определяется частичное или полное выключение носового дыхания на стороне поражения, что распознается с помощью передней риноскопии и зондирования полости носа, задней риноскопии и пальпации носоглотки.
Лечение С профилактической целью при производстве гальванокаустики и кровавых операций в полости носа необходимо избегать проведения оперативного вмешательства и одновременного прижигания на двух взаимно противолежащих частях. Это в особенности относится к гальванокаустике и прижиганиям кислотами. Если же имеется повреждение одновременно двух противоположных сторон слизистой оболочки, то необходимо предупредить образование рубцовых синехий путем повторного разъединения появляющихся спаек и вкладыванием на длительное время в нос пластинок из фольги, перчаточной резины или целлулоида. Наиболее трудными для лечения являются хоанальные атрезии. Рубцы перепончатого характера после крестообразного разреза перепонки выкусываются различной формы конхотомами, а при образовании костных перегородок приходится прибегать к выдалбливанию их долотом и восстановлению просвета хоаны. В некоторых случаях это удобнее проделать после подслизистой резекции (удаления) носовой перегородки и сдалбливания заднего края сошника.
Травмы носа и его придаточных пазух Встречаются открытые и закрытые травмы. Характер повреждения зависит от силы и направления удара. Тупые травмы сопровождаются закрытым переломом костей носа, а иногда и стенок придаточных пазух. При разрыве слизистой оболочки после сморкания появляется подкожная эмфизема (см.) лица. Тяжелые травмы носа нередко сопровождаются потерей сознания и шоком. Часто наблюдаются носовое кровотечение, гематома носовой перегородки. На лице определяются припухлость мягких тканей, деформация носа, кровоподтеки и кровоизлияния, нередко распространяющиеся на область верхнего и нижнего века. При прощупывании выявляется похрустывание отломков. При рентгенограмме удается выявить место перелома костей носа. После анестезии отломки вправляют. Боковое смещение спинки носа устраняют посредством давления на смещенные части носового скелета пальцами обеих рук. В ряде случаев при западении отломков их следует приподнять введенным в нос узким элеватором. После репозиции (сопоставления отломков) вводят в нос стерильные тампоны, смоченные вазелиновым маслом. Носовое кровотечение останавливают тампонадой.
♦ О ♦
ОБМОРОК
ОпределениеОбморок — внезапная кратковременная потеря сознания, вызванная ишемией головного мозга и сопровождаемая ослаблением деятельности сердца и дыхания.
Этиология и патогенез Развитие обморока обусловлено острым нарушением обмена веществ ткани мозга вследствие кислородной недостаточности или (реже) расстройством утилизации тканью мозга кислорода. Непосредственных причин, вызывающих обморок, достаточно много. Чаще всего обморок имеет неврогенное рефлекторное происхождение. Среди факторов, вызывающих преходящий спазм сосудов головного мозга, выделяют: — психогенные (испуг, конфликтная ситуация); — болевые, обусловленные применением лекарственных средств (ганглиоблокаторов); — обусловленные раздражением рефлексогенных зон, блуждающего нерва, вестибулярного аппарата. Обморок может развиваться у практически здоровых людей в результате функциональных нарушений, обусловленных такими факторами, как выраженное переутомление, недосыпание, интоксикации, негативное воздействие окружающей среды. Обморок может возникать при значительных физических нагрузках (кросс), интенсивной умственной деятельности, длительном неподвижном стоянии, быстром переходе из горизонтального положения в вертикальное. Обмороки могут быть обусловлены нарушениями сердечной деятельности (нарушения ритма и проводимости, пороки клапанов сердца, ишемическая болезнь сердца (см.)); артериальной гипотензией (см.) и гипертоническими кризами; расстройством мозгового кровообращения при органических заболеваниях головного мозга; вегетососудистыми пароксизмами (аллергия (см.), эндокринные и гормональные дисфункции, мигрень (см.)); болезнями крови и др.
Клиническая картина В течении обморока выделяют три последовательно сменяющих друг друга стадии: предобморочное состояние, или стадию предвестников; стадию нарушения сознания; восстановительный период. Обморок может развиться и внезапно, тогда стадия предвестников не выражена. В типичных случаях нарушению сознания предшествуют такие признаки, как ощущение дискомфорта, нарастающая слабость, головокружение, тошнота, неприятные ощущения в области сердца и живота. Характерны потемнение в глазах, появление шума или звона в ушах, похолодание и онемение конечностей, сужение объема внимания, ощущение уплывания почвы из-под ног, проваливания. При этом наблюдаются выраженные вегетососудистые расстройства — побледнение кожи и видимых слизистых оболочек, нестабильность пульса, расстройство дыхания, снижение артериального давления, гипергидроз (см.) и снижение мышечного тонуса. Эта стадия продолжается несколько секунд (реже до минуты), и пациенты нередко успевают пожаловаться на ухудшение самочувствия, а иногда успевают прилечь и принять лекарство, что зачастую позволяет предотвратить дальнейшее развитие обморока. Однако чаще имеет место неблагоприятное развитие патологического процесса: общее состояние продолжает стремительно ухудшаться, нарастает бледность кожи, снижается мышечный тонус, и пациент падает, порой пытаясь удержаться за окружающие предметы. В случае абортивного течения обморока наступает лишь кратковременное и частичное сужение сознания, отмечаются нарушение ориентировки или умеренная оглушенность. Легкое течение обморока сопровождается утратой сознания на несколько секунд, при глубоком обмороке отсутствие сознания продолжается несколько минут, в редких случаях оно затягивается до 30 мин. При потере сознания наблюдаются следующие симптомы: отсутствие контакта с больным, резкая бледность кожи, холодный пот, неподвижность тела. У пациента понижена кожная чувствительность, глаза закрыты, зрачки сужены или расширены, их реакция на свет замедлена, роговичный рефлекс отсутствует, пульс слабый, едва определяется, редкий, дыхание поверхностное, артериальное давление низкое (менее 95/55 мм рт. ст.), мышцы расслаблены. Глубокий обморок иногда может сопровождаться кратковременными судорогами. Но восстановление сознания в типичных случаях происходит в течение нескольких секунд. Полное восстановление функций и нормализация самочувствия (восстановительный период) продолжаются от нескольких минут до нескольких часов в зависимости от тяжести обморока. Для обморока характерно отсутствие симптомов органического поражения нервной системы.
Диагностика и дифдиагностика Обморок следует дифференцировать с коллапсом (см.), эпилептическим и истерическим припадком. Для обморока характерно его возникновение в определенной ситуации и преимущественно в вертикальном положении тела, относительно медленное падение, редкие ушибы, снижение мышечного тонуса, выраженная бледность кожи, поверхностный тип дыхания, быстрое восстановление сознания, отсутствие амнезии (см.). Кроме того, при обмороке нередко выражены симптомы периода предвестников. Для обморока нетипичны быстрое, сопровождающееся криком падение; шумное, хрипящее дыхание; судороги; прикусывание языка; непроизвольное мочеиспускание; сонливость и оглушенность после приступа; амнезия (см.).
Лечение С целью улучшения кровоснабжения и оксигенации головного мозга пациента укладывают с несколько опущенной головой и приподнятыми ногами. Далее больному необходимо обеспечить доступ свежего воздуха, освободить его от стесняющей одежды, лицо и грудь сбрызнуть прохладной водой, растереть ноги и руки. Показано вдыхание нашатырного спирта. Если этих мер недостаточно, прибегают к внутривенному введению кордиамина, кофеина, сульфокамфокаина; в редких случаях вводят мезатон и норадреналин. После восстановления сознания показан горячий чай. Если в течение часа после обморока сохраняются такие явления, как резкая общая слабость, тошнота, потливость, снижение артериального давления, следует подумать о серьезном органическом заболевании (внематочная беременность, внутреннее кровотечение) и госпитализировать пациента. Прогноз в большинстве случаев благоприятный.
ОЖИРЕНИЕ
ОпределениеОжирение представляет собой избыточное отложение жировой ткани в организме. Диагноз заболевания выставляют в том случае, если накопление в организме жира приводит к увеличению веса (массы) тела на 20 % и более от «идеального» (усредненного) нормального веса. Проблема ожирения существует давно; еще в трудах древних ученых, и прежде всего врачей, в частности в трактате основоположника современной медицины Гиппократа (460–377 гг. до н. э.) «О здоровом образе жизни», в трудах знаменитого древнеримского врача К. Галена (129–201 гг.) излагаются диетические рекомендации для пациентов, страдающих ожирением. Однако систематическое научное изучение проблемы ожирения, а также особенностей жирового обмена у человека началось с конца XVIII — начала XIX вв. и включало не только клинические исследования больных ожирением, но и постановку экспериментов.
Эпидемиология В настоящее время статистические исследования рассматриваемой проблемы свидетельствуют о значительном распространении ожирения, прежде всего — в индустриально развитых странах. При этом выявлена отчетливая закономерность: чем выше уровень жизни, тем больше страдающих ожирением. По данным ВОЗ, уже в последней четверти XX в. не менее 30 % населения экономически развитых странах имели вес, на 20 % и более превышающий норму; в настоящее время данная ситуация значительно не изменилась. Чаще ожирение отмечается у женщин, а также в возрастной группе старше 50 лет. Конкретные статистические данные ежегодно меняются, однако следует отметить, что по данным исследований последней четверти XX в. в индустриально развитых странах (США, Великобритания) тучность выявляется не менее чем у 1/3 населения. Специально проведенными эпидемиологическими исследованиями в разных странах было достоверно выявлено, что среди лиц, страдающих ожирением, смертность выше и наступает в более ранние годы. Отмечалось (США), что превышение веса тела на 10 % выше нормы приводит к увеличению смертности на 30 %. Ожирение является ярким отражением нарушения обмена веществ и служит фактором риска таких заболеваний, как атеросклероз (см.), гипертоническая болезнь (см.) и сахарный диабет (см.), дегенеративных заболеваний сердца, а также некоторых болезней печени и почек, легких, кожи, костно-суставной системы, подагры (см.) и желчнокаменной болезни (см.). При ожирении сахарный диабет развивается в 4 раза чаще, гипертоническая болезнь и атеросклероз — в 3 раза чаще, в 1,5 раза чаще развивается ишемическая болезнь сердца (см.) (стенокардия (см.), инфаркт миокарда (см.)). В этой связи проблема ожирения приобрела социально-экономическое значение. Кроме того, ожирение ухудшает прогноз при травмах, инфекционных заболеваниях и затрудняет проведение хирургических вмешательств. Единой общепринятой классификации ожирения не существует. В практике все формы ожирения принято подразделять на две большие группы — первичное и вторичное. Первичное (алиментарно-экзогенное) ожирение является самостоятельным заболеванием; диагноз его устанавливается при отсутствии каких-либо заболеваний, способных приводить к ожирению. Вторичное ожирение (симптоматическое) развивается при различных заболеваниях центральной нервной системы (церебральное) и желез внутренней секреции (эндокринное — гипотиреоидное, гиповариальное, так называемое климактерическое и надпочечниковое). Вторичное ожирение требует тщательного клинического обследования с обязательным исследованием уровня гормонов пациента. Различают также две стадии ожирения (прогрессирующую и стабильную) и четыре степени болезни: первая степень ожирения характеризуется превышением фактической массы над идеальной не более чем на 29 %; при второй степени избыток массы тела составляет 30–49 %; при третьей — 50—100 %, а при четвертой реальная масса тела превышает идеальную на 100 % и более. Кроме того, ожирение делится на общее, когда имеет место достаточно равномерное, симметричное, эстетически-привычное увеличение подкожно-жировой клетчатки на теле, и местное ожирение, характеризующееся накоплением жира в виде липом (жировиков) главным образом в подкожной клетчатке.
Этиология и патогенез Существует механизм, обеспечивающий поддержание постоянной массы тела, нарушение которого приводит к развитию ожирения и означает нарушение этого регуляторного механизма. Не вызывает сомнения, что ведущей причиной развития ожирения является переедание. На обмен жировой ткани оказывают влияние также наследственные, психосоциальные, в том числе культурные факторы, характер двигательной активности, работа желез внутренней секреции и т. д. Однако более 75 % всех случаев ожирения составляет первичное (алиментарно-экзогенное) ожирение, развивающееся при избытке поступающей в организм с пищей энергии. Развитие подкожной клетчатки определяется числом и размерами жировых клеток. Независимо от вида ожирения происходит увеличение размеров жировых клеток и содержания в них жира. Число жировых клеток у взрослого человека постоянно, поэтому ведущим показателем ожирения является увеличение их размеров. Объем жировых клеток напрямую связан с массой тела. При крайней степени ожирения масса жира в организме может увеличиваться в 10 раз. В то же время вес тела не может увеличиваться неограниченно. Установлено, что избыточный вес даже в крайних случаях, как правило, не превышает норму в 3 раза. Избыточное поступление в организм пищи приводит к расстройству жирового обмена и к энергетическому дисбалансу, развивающимся преимущественно за счет жиров животного происхождения и углеводов. Поступающие в организм пищевые вещества превращаются в жиры и откладываются в жировых депо. Этот механизм развития отмечается в 60 % случаев первичного ожирения. Большое значение в развитии ожирения имеет нарушение режима питания — в 40 % всех случаев первичного ожирения отмечается употребление основного количества суточного рациона в вечерние часы, а также редкие, но обильные приемы пиши. Развитию ожирения способствует употребление в значительных количествах алкоголя, особенно пива, содержащего много углеводов. Алкоголь легко сгорает в организме и часто сопровождается чрезмерным употреблением пищи. Чрезмерное питание женщины в период беременности и избыточное питание ребенка в первые месяцы его жизни способны оказывать негативное влияние на обмен жира в течение всей последующей жизни. Вместе с тем установлено, что не для всех форм ожирения характерно не только излишнее употребление пищи и ее избыточная калорийность. В частности, к увеличению массы тела при вполне рациональном питании (при нормальной калорийности) может приводить недостаточная физическая активность. Развитию тучности может способствовать низкая биологическая ценность пищевого белка — несбалансированность незаменимых аминокислот, т. е. качественный состав пищи. Однако основным фактором в развитии первичного ожирения является избыточная калорийность пищи. Лица, имеющие избыточный вес, едят больше, чем это требуется для удовлетворения энергетического баланса. Кроме того, они практически всегда с удовольствием едят любую пищу. Регуляция аппетита зависит от множества факторов. Аппетит служит отражением желания человека есть и зависит от множества причин, среди которых немаловажное значение принадлежит таким понятиям, как зрение, обоняние, вкус (известный кардиохирург, академик Н. Амосов предлагал простые рекомендации — «готовьте невкусно»), особенности обмена веществ, объем и температура пищи и т. д. В регуляции аппетита имеет значение уровень глюкозы (сахара) в крови: было установлено, что инсулин (гормон поджелудочной железы, регулирующий содержание сахара в крови человека) способствует отложению жира в жировой ткани, но одновременно он же тормозит выход жира из жировых депо. Несмотря на то что ожирение не является врожденным заболеванием, предрасположение к нему следует считать в определенной мере наследственно обусловленным: ожирение нередко носит семейный характер, т. е. предрасположенность к ожирению выражена достаточно отчетливо и прослеживается в поколениях. Достаточно ярко роль пищевого поведения характеризуют следующие наблюдения: если родители имеют нормальную, т. е. не превышающую средние показатели массу тела, их дети страдать ожирением будут достаточно редко — не более чем в 9 % случаев. Если же один или оба родителя были тучными, ожирение у детей может развиваться в 60–80 % случаев. В то же время в отсутствие избыточного питания даже при наследственной предрасположенности ожирение проявляется достаточно редко. На развитие ожирения оказывают влияние такие факторы, как возраст, профессия, образ жизни. Так, возрастная перестройка наблюдается в среднем после 40–45 лет, когда снижается обмен веществ, изменяется функционирование желез внутренней секреции. Даже при соблюдении рационального питания у лиц указанного возраста нередко отмечаются расстройства жирового обмена, склонность к тучности. У женщин ожирение развивается в среднем в 2 раза чаще, чем у мужчин. Значение малоподвижного образа жизни хорошо иллюстрируется следующими данными: во-первых, недостаточная физическая активность в сравнении с избыточным потреблением пищи в развитии ожирения может играть первостепенную роль; во-вторых, при лечении ожирения лучшие результаты отмечаются при сочетании рационального питания и лечебной физкультуры, в то время как только ограничение калорийности рациона в ряде случаев оказывается недостаточно эффективным. Исследования влияния нервной системы (прежде всего — центральной нервной системы) показали, что в регуляции аппетита значительная роль принадлежит гипоталамусу (мозговому подбугорью) — скоплению нервных клеток так называемого промежуточного мозга. Предполагалось наличие двух важнейших центров аппетита гипоталамуса: стимуляция одного (вентромедиальное ядро) приводила в эксперименте на животных к увеличению аппетита; разрушение другого (вентролатеральное ядро) вело к уменьшению аппетита и соответственно к снижению массы тела. Таким образом, предполагалось наличие в мозге человека центра сытости и центра голода. В последующем ученые пришли к выводу, что столь определенных центров не существует: центральное значение в контроле за угнетением или возбуждением аппетита у человека принадлежит коре головного мозга. Определенную роль в развитии ожирения играют железы внутренней секреции: щитовидная железа, надпочечники, поджелудочная железа, гипофиз, половые железы. Значение гормональных факторов в развитии ожирения связывают с тем, что активность большинства эндокринных органов оказывает влияние на жировой обмен и процесс отложения жира в тканях. Вторичное ожирение описано при гипотиреозе (см.), болезни Иценко-Кушинга (см.), инсуломе и др.
Клиническая картина Важным объективным показателем ожирения служит масса тела. Первичное ожирение в зависимости от выраженности принято подразделять на IV степени: I степень — избыточный вес превышает нормальный на 15–29 %; II степень — на 30–49 %; III степень — на 50—100 %; IV степень — более 100 %. Для подсчета нормального (среднего) веса предложено несколько способов. Широко известна формула (индекс, показатель) Брока, согласно которой рост в сантиметрах минус 100 равен нормальной (идеальной) массе тела. Однако индекс Брока может использоваться лишь для людей, имеющих рост от 155 до 170 см. Индекс Брейтмана предусматривает определение нормального веса по формуле: рост в сантиметрах умножается на 0,7 и из полученного вычитается 50. Индекс Борнгарда: нормальный вес в килограммах высчитывают по формуле — рост в сантиметрах умножается на окружность грудной клетки в сантиметрах и делится на 240. В связи с тем, что перечисленные способы расчета веса (индексы) могут применяться лишь у мужчин нормостенического (обычного) телосложения в возрасте 25–30 лет, было предложено множество других способов и таблиц, в которых учтены такие показатели, как возраст, пол, тип телосложения. Достаточно удобным способом определения идеального веса является Таблица, составленная с учетом пола, роста и телосложения, которое устанавливается измерением окружности запястья (табл. 24). По данной методике, женщины имеют узкий скелет при окружности запястья до 13,4 см; средний скелет — при окружности запястья от 13,4 до 15,2 см и широкий скелет — при окружности более 15,2 см. Мужчины соответственно имеют узкий скелет при окружности запястья менее 15,2 см; средний скелет — от 15,2 до 17,8 см и широкий скелет — при окружности запястья более 17,8 см.
В фармакологическом справочнике «Видаль» за 2000 г. опубликована удобная для практического применения таблица идеального веса с учетом пола и роста человека (табл. 25).
Ожирение развивается исподволь, постепенно. В начале заболевания самочувствие пациента не меняется, но по мере развития болезни отмечаются общее недомогание, повышенная утомляемость, слабость, иногда апатия и сонливость, одышка при незначительной физической нагрузке, повышенный аппетит, повышенная жажда. Нередко при ожирении наблюдаются сухость или повышенная потливость кожи, опрелости (см.), иногда гиперкератоз (см.), грибковые или воспалительные заболевания кожи, нарушения трофики. Многие жалобы обусловлены сопутствующими заболеваниями. При сочетании ожирения с патологией сердечно-сосудистой системы пациенты часто предъявляют жалобы на сердцебиение, одышку, отеки нижних конечностей, могут отмечаться боли в области сердца. При поражении органов пищеварения отмечаются изжога, подташнивание, расстройство стула, могут возникать боли в животе. На ранних стадиях первичного ожирения избыточное отложение жировой ткани в типичных случаях наблюдается на туловище, в области плеч, живота, на бедрах и на лице. Прогрессирование процесса характеризуется отложением жира в области предплечий и голеней; при резко выраженном ожирении кожные складки в области живота и спины приобретают вид свисающих участков кожи с подкожной клетчаткой значительной толщины.
Больной ожирением (тяжелая форма), 47 лет, рост 175 см, вес 206,0 кг
Цвет кожных покровов у страдающих ожирением пациентов чаще обычной окраски, реже отмечается бледность или покраснение кожи; иногда у молодых людей на коже живота, молочных желез, на внутренних поверхностях бедер образуются узкие, красноватого цвета стрии (полоски на коже с неровными краями, образующиеся после чрезмерного растяжения кожи). Трофические расстройства могут проявляться легко возникающей мацерацией кожи, выпадением волос, повышенной ломкостью ногтей, развитием гнойничковых заболеваний кожи, фурункулезом (см.), экземой (см.). Закономерно в патологический процесс при ожирении вовлекается опорно-двигательный аппарат. Для тучных людей характерны жалобы на боли в суставах (преимущественно в крупных — коленных, тазобедренных), а также в суставах стоп и позвоночнике, что обусловлено повышением на них нагрузки, трофическими расстройствами, нарушением кровоснабжения. Изменения аппарата опоры и движения у пациентов, страдающих ожирением, характеризуются преимущественно артрозами (см.), развивающимися как за счет обменных нарушений, так и в связи с увеличением нагрузки на суставы. В большинстве случаев поражаются несколько суставов. Довольно часто поражаются мелкие суставы кистей, а также плюснефаланговые и межфаланговые суставы стоп. При поражении крупных суставов рентгенологическое исследование выявляет характерные изменения, проявляющиеся деформацией суставов и отложением в них извести. Нередко у страдающих ожирением возникают вывихи (см.) и подвывихи, что связано с неадекватностью нагрузок на связочный аппарат суставов. Довольно типичным явлением при ожирении является спондилоартроз; нередко также выявляется остеопороз (см.), возможно развитие пупочной или паховой грыжи (см.). Выраженность изменений опорно-двигательного аппарата зависит от степени ожирения — чем выше степень тучности, тем более выражены изменения в суставах. Ожирение приводит к нарушению функций всех внутренних органов и систем организма. В патологический процесс оказываются вовлеченными сердечно-сосудистая, пищеварительная, эндокринная, дыхательная, мочевыделительная системы, затрагивается обмен веществ. Поражение сердца и сосудов у больных ожирением является ведущей причиной смертности. Повышение артериального давления является закономерным и одним из наиболее частых изменений сердечно-сосудистой системы. Доказана тесная взаимосвязь между тучностью и гипертонической болезнью (см.) (артериальной гипертензией) — значительно чаще гипертоническая болезнь выявляется у страдающих ожирением пациентов, чем у лиц с нормальным или пониженным питанием. Многочисленными исследованиями показано, что изменения гемодинамики (движение крови) у тучных пациентов создают дополнительную отягощающую нагрузку на сердце и сосуды и прогностически неблагоприятны. И хотя единого окончательного мнения о причинах гипертонии у тучных людей нет, практические выводы всех исследователей однозначны: — гипертоническая болезнь (см.) и ожирение взаимосвязаны; — ожирение в сочетании с гипертонией оказывает отчетливое влияние на качество и продолжительность жизни; — при помощи рациональной диеты и понижения массы тела удается снизить повышенное артериальное давление, в том числе без специальной гипотензивной терапии. Одним из наиболее ранних и распространенных поражений сердца при ожирении является дистрофия (см.) миокарда. Атеросклероз (см.) и ожирение возникают и развиваются параллельно. Развитию атеросклероза способствуют повышенная нагрузка на сосуды вследствие повышенного содержания жировой ткани; недостаточная физическая (мышечная) активность и переедание; предполагается также идентичность наследственного предрасположения к атеросклерозу (см.) и ожирению. Проявления атеросклероза напрямую зависят от степени тучности: если при ожирении I–II степени атеросклероз выявляется менее чем у половины больных, то при ожирении IV степени признаки атеросклероза отмечаются в 100 % случаев. Атеросклероз лежит в основе ишемической болезни сердца (см.) (стенокардия (см.), инфаркт миокарда (см.)), что объясняет уменьшение продолжительности жизни больных, страдающих ожирением. При ожирении чаще отмечается поражение сосудов мозга (энцефалопатия, инсульт (см.)) и нижних конечностей (варикозное расширение вен (см.), тромбофлебит (см.)). У тучных людей страдает деятельность органов дыхания. Причины этого многообразны: повышение внутрибрюшного давления приводит к высокому стоянию диафрагмы и снижению емкости легких; наблюдается увеличение внутриплеврального давления, сужение воздухоносных путей, уменьшение поверхности газообразования и легочной эластичности; характерно снижение уровня поглощения кислорода и др. Важно и то, что у больных с ожирением отмечается снижение адаптационно-компенсаторных способностей органов дыхания на физическую нагрузку. Клинически нарушение функции дыхательной системы у страдающих ожирением пациентов проявляется дыхательной недостаточностью разной степени выраженности. Кроме того, при ожирении вследствие снижения иммунитета чаще регистрируются острые респираторные вирусные инфекции (ОРВИ) и чаще, чем у лиц с нормальным весом, наблюдаются пневмонии (см.) и хронические бронхиты (см.). Повышение давления в брюшной полости, застой крови в венозных сплетениях и слабость брюшной стенки способствуют нарушению работы органов пищеварения. У больных, страдающих ожирением, нередко выявляются хронический гастрит (см.) и хронический колит (см.). Страдает и поджелудочная железа: хронический панкреатит (см.) у тучных обнаруживается чаще, чем у лиц с нормальным весом. Однако чаще, чем желудок и кишечник, при ожирении поражаются печень, желчный пузырь и желчные ходы. Для пациентов, страдающих ожирением, характерно развитие жировой инфильтрации печени, холецистита (см.) и холангита. Необходимо отметить, что нарушение функции печени закономерно приводит к выраженному расстройству белкового обмена. При ожирении страдает и функция почек — у 2/3 пациентов наблюдается никтурия (преобладание ночного диуреза над дневным), причем у половины из них она сопровождается изостенурией (выделение мочи монотонного удельного веса). Нередко может отмечаться повышение удельного веса мочи. У страдающих тучностью пациентов нарушается обмен веществ. Довольно часто выявляются нарушения водно-солевого обмена, что клинически проявляется пастозностью и отеками. Причины задержки в тканях организма жидкостей и электролитов (в том числе натрия) у больных ожирением окончательно не установлены. Установлена также возможность нарушения обмена микроэлементов: при ожирении I и II степени содержание микроэлементов существенно не меняется, однако у пациентов, страдающих ожирением III и IV степени, выявлено отчетливое снижение содержания меди, кобальта, стронция. Первичное (алиментарно-экзогенное) ожирение приводит к нарушению функционального состояния желез внутренней секреции. В патологический процесс оказываются вовлечены гипофиз, щитовидная, околощитовидные и половые железы, поджелудочная железа, надпочечники. Нарушения поджелудочной железы наиболее ярко проявляются недостаточностью ее инсулярного (островкового) аппарата, гиперинсулинемией, скрытым или даже явным сахарным диабетом (см.). У женщин развивается гипофункция яичников, сопровождающаяся нарушением менструального цикла. Подавляющее большинство изменений в работе органов и систем у больных первичным ожирением носят обратимый характер и при адекватном лечении могут быть полностью ликвидированы. Клинические проявления при вторичном ожирении определяются основным заболеванием.
Диагностика Диагноз ожирения обычно не представляет трудностей. Основным критерием тучности служит масса тела. Для определения ожирения и его степени используют формулы и таблицы, в которых приведены цифры нормального (идеального) веса с учетом возраста, пола и типа телосложения. Ожирение констатируют при превышениинормального веса более чем на 15 %. При установлении диагноза ожирения проводится обследование, включающее сбор анамнеза и осмотр пациента лечащим врачом, консультации эндокринолога и невропатолога, лабораторные и инструментальные исследования, в том числе анализы крови и мочи, определение содержания глюкозы, белков и жиров, уровня гормонов в крови и т. д., что необходимо для выявления вторичных форм ожирения. Одновременно выявляют сопутствующие ожирению болезни и осложнения. Критериями диагностики ожирения являются: — абдоминальный тип ожирения по показателям окружности талии (от 102 см у мужчин и от 88 см у женщин); — уровень триглицеридов не менее 150 мг/дл (1,69 ммоль/л); — снижение ХС ЛПВП до 1,04 ммоль/л для мужчин и 1,29 ммоль/л для женщин; — артериальное давление 130/85 мм рт. ст.; — уровень глюкозы плазмы натощак не менее 6,1 ммоль/л.
Лечение Общие положения Ведущий принцип лечения ожирения — перестройка питания путем значительного ограничения калорийности пищи с одновременным увеличением физической активности. Совокупность диеты и физических упражнений позволяет создать в организме необходимый для снижения массы тела отрицательный энергетический баланс. При всем многообразии причин развития тучности в основе ожирения, по мнению большинства ученых, лежит переходящее в привычку регулярное переедание на фоне наследственной предрасположенности. Диета пациентов, страдающих ожирением, предусматривает ограничение в рационе жиров и углеводов, но обеспечивает полноценное содержание белка, витаминов, микроэлементов. Такая диета называется субкалорийной, или редуцированной. Совершенно необходимо также соблюдать рациональный суточный ритм питания — следует есть не менее 3–4 раз в сутки небольшими порциями. Для многих тучных людей характерно обильное двухразовое питание, особенно поздно вечером. Кроме того, необходимо отказаться от повышающих аппетит специй. Специалисты в области диетологии рекомендуют четко разделять два понятия — аппетит и чувство голода. Есть следует тогда, когда человек испытывает голод; аппетит — категория достаточно постоянная, чаще всего он не нарушен и действительно «приходит во время еды». Также следует отказаться от чрезвычайно вредной привычки спать после еды.
Лечебное питание Основные научные принципы лечебного питания при ожирении в разных странах разработаны еще в XX в., они весьма сходны и, в сущности, остаются неизменными до настоящего времени. При выборе диеты при лечении первичного ожирения необходимо учитывать возраст пациента, наличие сопутствующих заболеваний и осложнений. В нашей стране были разработаны (см. «Справочник по диетологии» под ред. член-корреспондента АМН М. А. Самсонова и академика АМН А. А. Покровского) три основные редуцированные диеты, используемые при лечении первичного ожирения: основная, умеренная и максимальная. Основная диета (соответствует диете № 8) предусматривает поступление в организм 1750–1800 ккал в сутки за счет 100–110 г белков, 80–90 г жиров и 100–120 г углеводов; умеренная диета (соответствует диете № 8а) предусматривает поступление 1200–1300 ккал за счет 70–80 г белков, 60–70 г жиров, 70–80 г углеводов; максимальная диета (соответствует диете № 8о) — 700–800 ккал за счет 40–50 г белков, 30–40 г жиров и 50–70 г углеводов. Максимальное ограничение суточной калорийности, не вызывающее расстройств здоровья, составляет 600 ккал, но столь значительное уменьшение калорийности допускается только в условиях стационара. При этом многие специалисты-диетологи считают целесообразным начинать лечение ожирения с назначения диеты без чрезмерного ограничения ее энергетической ценности, т. е. в начале терапии лечебное питание должно строиться по основной диете, предусматривающей поступление в организм 1750–1800 ккал. Такой пищевой рацион можно смело применять в амбулаторных условиях, в санаториях-профилакториях, на курортах. Неправильно и даже опасно начинать лечение с самых строгих диет у необследованных или не полностью обследованных тучных лиц. Показателями правильного лечебного режима служит достаточно плавное снижение массы тела при одновременном улучшении общего самочувствия. Ниже приводятся некоторые из основных продуктов питания в граммах в пересчете на калорийность, исходя из трех вариантов редуцированной диеты. 1800 ккал будут содержать продукты в следующих количествах: мясо нежирное — 150–200 г; рыба — 100 г; творог — 100–200 г; одно яйцо; масло растительное — 25 г; масло сливочное — 20 г; капуста свежая белокочанная — 300–400 г; картофель — 200 г; помидоры, огурцы и другие овощи — 300–400 г; яблоки — 200 г; молоко (простокваша) — 300–400 г; сметана — 15–20 г; хлеб ржаной — 100–150 г. 1200 ккал: мясо — 150–200 г; рыба — 100 г; творог — 100 г; яйцо — одно; масло растительное — 15 г; масло сливочное — 15 г; капуста свежая белокочанная — 200–250 г; картофель — 200 г; помидоры, огурцы и другие овощи — 200–300 г; яблоки — 200 г; молоко (простокваша) — 200–300 г; сметана — 10–15 г; хлеб ржаной — 0. 800 ккал: мясо — 100 г; рыба — 100 г; творог — 100 г; яйцо — одно; масло растительное — 10 г; масло сливочное — 10 г; капуста свежая белокочанная — 150–200 г; картофель — 100 г; помидоры, огурцы и другие овощи — 150–200 г; яблоки — 100 г; молоко (простокваша) — 200 г; сметана — 10 г; хлеб ржаной — 0. Необходимо отметить, что здесь приведен ограниченный перечень некоторых базовых продуктов, довольно часто используемых в повседневном меню. Существует формула определения индивидуальной суточной калорийности пищи, необходимой для поддержания нормального энергетического баланса: идеальную массу тела, определяемую с учетом пола, возраста и телосложения, следует умножить на 33 ккал для мужчин и на 30 ккал для женщин. Основные принципы лечебного питания при ожирении следующие: — назначение редуцированной диеты с низкой энергетической ценностью; — ограничение введения углеводов, особенно легкоусвояемых сахаров, являющихся основными поставщиками энергии и легко переходящих в организме в жир; — ограничение жиров животного происхождения за счет увеличения введения в рацион растительных жиров (50 % от общего количества жира), так как растительные жиры обладают способностью активизировать процесс сгорания жира в организме; — создание чувства сытости путем назначения малокалорийной, но достаточной по объему пищи (сырые овощи, фрукты, блюда с добавлением целлюлозы); — многократное (до 6 раз в сутки, не менее 3–4 раз) питание, устраняющее чувство голода и исключающее процессы возбуждения аппетита за счет исключения из рациона пряностей; — ограничение соли до 5 г и жидкости — до 1–1,5 л в сутки. Перечень рекомендуемых тучным пациентам продуктов и блюд: 1. Хлеб и хлебобулочные изделия. Хлеб (только черный, вчерашней выпечки и не более 100–150 г в день) нередко приходится вовсе исключать из рациона питания на некоторое время, если масса тела не снижается. Из всех разрешенных продуктов хлеб (за исключением сахара) содержит наибольшее количество углеводов, поэтому, регулируя количество хлеба, в том числе при неизменности остального рациона, можно в значительной степени регулировать весь процесс. 2. Первые блюда следует готовить преимущественно на овощном отваре. Не чаще 2–3 раз в неделю можно приготовить первое блюдо на слабом мясном (говяжьем), рыбном или грибном бульоне; количество первого блюда на мясном бульоне уменьшают. 3. Блюда из мяса и птицы: разрешены тощая говядина, постная свинина, нежирная баранина не чаще 1–2 раз в 10 дней, постная птица (курица, индейка). Мясо готовится преимущественно в отварном, заливном (реже тушеном) виде. Разрешается нечастое употребление нежирной ветчины и колбасы. 4. Рекомендуются блюда из рыбы нежирных сортов (речная и прудовая — судак, щука, сазан, карась и др., морская — треска, навага и др.) преимущественно в отварном или заливном виде, изредка жареная. Рыба заменяется мясом в соотношении 1,5:1. 5. В среднем в дневном рационе должно быть не менее 400–500 г белковых продуктов (мясо, рыба, творог). Для повышения биологической ценности пищевого рациона в него следует непременно включать морепродукты: кальмары, мидии, морской гребешок и пр. Необходимость и целесообразность включения в пищевой рацион продуктов моря объясняется значительным содержанием в них незаменимых аминокислот и пищевого йода, а также низким содержанием углеводов. 6. Блюда и гарниры из овощей и зелени. Рекомендуются в первую очередь капуста белокочанная и цветная, салат, редис, огурцы, кабачки, помидоры в сыром, вареном и печеном виде. Блюда из картофеля, свеклы, моркови следует употреблять в количестве не более 200 г в день, причем только в отварном или печеном виде. 7. Разрешается съедать одно куриное яйцо в день. 8. Молоко, молочные продукты и блюда из них. Разрешаются кефир, простокваша, йогурт и др. кисломолочные продукты; пресное молоко менее желательно. Сметана добавляется в готовые блюда в количестве не более 1–2 ст. л.; творог (100–200 г в сутки), преимущественно обезжиренный, разрешается как в натуральном виде, так и в виде сырников, творожников, пудингов. Разрешаются и неострые сорта сыра. 9. Фрукты и ягоды. Рекомендуются кислые и кисло-сладкие сорта яблок, лимоны, апельсины, смородина, крыжовник, клюква и другие фрукты и ягоды по 200 г в день как в сыром виде, так и в виде компотов, сваренных без сахара. 10. Возможно употребление неострых соусов, приготовленных на овощном отваре. Рекомендуются различные овощные салаты и винегреты без соли, заправленные растительным маслом. 11. Из напитков рекомендуются овощные (без соли) и фруктовые и ягодные (из кислых плодов) соки, минеральная щелочная вода, разрешаются некрепкие чай и кофе. 12. Совокупное количество жидкости, включая первое блюдо, не должно превышать 1,5 л в день. Соль в количестве 5 г в день добавляется в готовые блюда, готовить пищу следует без соли. Перечень запрещенных продуктов и блюд: конфеты, шоколад, любые кондитерские изделия и сдоба, мороженое и другие сладости, а также острые, пряные, копченые и соленые блюда и закуски, перец, хрен и другие пряности, алкогольные напитки, сало, жирные сорта мяса и рыбы, мясные и рыбные консервы. Примерное однодневное меню для больных ожирением в соответствии с основной диетой (№ 8, 1635 ккал): — первый завтрак: творог кальцинированный — 100 г; морковь тушеная — 200 г; кофе с молоком без сахара — 200 мл; — второй завтрак: салат из свежей капусты без соли со сметаной — 170 г; — обед: щи вегетарианские (1/2 порции) — 200 г; мясо отварное — 90 г; горошек зеленый без масла — 50 г; яблоки свежие — 100 г; — полдник: творог кальцинированный — 100 г; отвар шиповника — 180 г; — ужин: рыба отварная (судак) — 100 г; рагу из овощей (1/2 порции) — 125 г; — на ночь: кефир — 180 г (1 стакан). — на весь день: хлеб ржаной — 150 г. Примерное однодневное меню для больных ожирением в соответствии с умеренной диетой (№ 8 а, 1200 ккал): — первый завтрак: мясо отварное — 90 г; салат овощной на растительном масле — 150 г; кофе с молоком и без сахара — 200 г; — второй завтрак: яблоко свежее — 100 г; — обед: борщ вегетарианский (1/2 порции) — 250 г; рыба отварная — 100 г; капуста тушеная на растительном масле — 150 г; компот из яблок без сахара — 200 г; — полдник: молоко (1 стакан) — 180 г; — ужин: рулет мясной, фаршированный омлетом, запеченный — 90 г; — на ночь: кефир — 180 г (1 стакан). Примерное однодневное меню для больных ожирением в соответствии с умеренной диетой (№ 80, 839 ккал): — первый завтрак: салат овощной на растительном масле — 150 г; кофе черный без сахара — 100 г; — второй завтрак: яблоки свежие — 100 г; — обед: щи вегетарианские (1/2 порции) — 250 г; курица отварная — 100 г; — полдник: отвар шиповника (1 стакан) — 180 г; — ужин: рагу из овощей (1/2 порции) — 125 г; — на ночь: кефир (1 стакан) — 180 г. Помимо соблюдения основной диеты, не менее одного раза в неделю (но и не более 2 дней в неделю) целесообразно применение разгрузочных дней, которые могут быть углеводными (фактически — фруктовыми или овощными), белковыми, жировыми и комбинированными. Если при этом сохраняется небольшая физическая активность, рекомендуются рыбные или мясные разгрузочные дни: в течение дня пациент съедает 250–350 г отварного мяса (рыбы) без соли с овощным (лучше капустным) гарниром, или 500–600 г нежирного творога с 2–3 стаканами чая или кофе с молоком без сахара. Если физическая нагрузка не предполагается, используются яблочные (1500 г яблок в день), арбузные (до 2 кг мякоти арбуза), кефирные (1,5 л кефира) разгрузочные дни. Более строгие разгрузочные дни предполагают прием лишь отвара из сухофруктов без сахара или отвара шиповника. При этом пища распределяется равномерно в течение дня на 5 приемов. Пример комбинированного разгрузочного дня: завтрак — 100 г сыра, 1 стакан черного кофе; обед — 2 яйца всмятку, 1 стакан черного кофе; ужин — 200 г творога и 1 стакан некрепкого чая. Перерыв между приемами пищи не должен превышать 6 ч. При трехразовом режиме питания оптимальными интервалами считаются следующие: завтрак в 8 ч; обед в 14 ч и ужин в 20 ч.
Лечебное голодание В условиях стационара в индивидуальном порядке под наблюдением подготовленного специалиста голодание может быть с достаточным эффектом использовано. При сочетании ожирения с подагрой (см.), атеросклерозом (см.), хроническим холециститом (см.), холангитом, наличии в моче солей из диеты полностью исключают мясные и рыбные бульоны и внутренние органы. Мясо и рыбу употребляют только в отварном виде. Вместо мясных и рыбных блюд следует вводить блюда из обезжиренного творога, несколько ограничивая в рационе общее количество белка. Если имеется сочетание ожирения и болезней системы пищеварения (гастрит (см.), колит (см.)), из рациона исключают грубую растительную клетчатку. Овощи и зелень даются в отварном и протертом виде. Мясо, рыба и птица даются в отварном виде или в виде паровых котлет. Показаны также протертые компоты и кисели. Вместо черного хлеба показан белый вчерашней выпечки хлеб. Сроки диетического лечения определяются индивидуально, они довольно продолжительны (месяцы); в итоге лечебное питание должно способствовать переходу к более рациональному постоянному — на всю жизнь — питанию у каждого пациента и в количественном, и в качественном отношении. Во время применения лечебного питания необходимо проводить систематическое взвешивание.
Физические методы лечения Физические методы лечения, помимо лечебной физкультуры, включают применение водных и воздушных процедур. Лечебная физическая культура (ЛФК) должна быть непременной составной частью лечения ожирения, так как рядом специальных исследований была доказана недостаточная эффективность изолированного применения лечебного питания. Особенность ЛФК у тучных пациентов состоит в том, что вид физических упражнений, форма и интенсивность их проведения определяются в первую очередь сопутствующей патологией сердечно-сосудистой системы и проявлениями основного заболевания — ожирения, а также зависят от возраста, пола и физической подготовки. Увеличение физических нагрузок должно происходить плавно и постепенно. Интенсивные скоростные упражнения для больных ожирением не показаны. Пациентам молодого и среднего возраста без патологии сердца и сосудов показаны упражнения на выносливость — ходьба, плавание, гребля, ходьба на лыжах, а также спортивные игры. Однако в подавляющем большинстве случаев курс ЛФК принято проводить в 2 этапа: на первом этапе основной целью является адаптация пациента к постепенно увеличивающимся физическим нагрузкам. Для этого применяются в основном гимнастические упражнения умеренной интенсивности и дозированная ходьба. Переход ко второму периоду начинается по мере улучшения функции сердечно-сосудистой системы и органов дыхания: уменьшение одышки, исчезновение сердцебиения. Во втором периоде ЛФК дополнительно могут быть использованы плавание, ходьба на лыжах, прогулки и туристические походы. У больных первичным ожирением наиболее эффективны продолжительные занятия ЛФК — по 45–60 мин. Упражнения в основном направлены на тренировку крупных мышц и брюшного пресса. Используют упражнения с различными предметами, возможно умеренное отягощение. Крайне желательны упражнения в воде (бассейн), а также массаж, в том числе самомассаж и дыхательные упражнения.
Медикаментозное лечение Необходимо сразу подчеркнуть, что не существует лекарственных средств, способных решить проблему ожирения. Лекарственная терапия тучности проводится обычно при недостаточной эффективности диетического или комплексного лечения. Накоплен определенный клинический опыт использования препаратов, угнетающих аппетит. Разработка самых первых препаратов данного действия (фепранона, дезопимона и др.) связана с известными эффектами фенамина. Эти средства назначали только в первой половине дня вследствие их возбуждающего действия на центральную нервную систему. К другим противопоказаниям для назначения этой группы препаратов относятся беременность (см.), глаукома (см.), психоневрологические расстройства, артериальная гипертензия (см.), сердечная и почечная недостаточность (см.), гипертиреоз (см.), сахарный диабет (см.), желчнокаменная болезнь (см.), нарушения сна и др. Также имеется опыт применения адипозина — полученного из гипоталамуса крупного рогатого скота лекарственного средства. Препарат способствует мобилизации жира из депо и последующему его сгоранию. При его использовании следует соблюдать осторожность в случаях аллергии (см.) и сердечной недостаточности у пациента. К побочным эффектам относятся боли в области сердца, тахикардия (см.), повышение артериального давления, уртикарная (аллергическая) сыпь на теле, развитие отека Квинке (см.); реже отмечаются диспепсические расстройства (расстройства пищеварения). При функциональной недостаточности щитовидной железы использовались препараты тиреоидных гормонов — тиреоидин и трийодтиронин. К противопоказаниям этих лекарств относятся индивидуальная непереносимость, артериальная гипертензия (см.), стенокардия (см.), нарушения сердечного ритма, эндокардит (см.), расстройства нервной системы с симптомами повышенной раздражительности, климакс (см.), туберкулез (см.). Отмена препаратов необходима при появлении расстройств сна, тахикардии (см.), раздражительности, что свидетельствует о передозировке. Кроме того, сведения об эффективности гормонов щитовидной железы при первичном ожирении противоречивы. Среди современных препаратов, используемых в комплексном лечении тучных пациентов, можно отметить следующие: — тримекс (синоним: фенилпропаноамин) угнетает возбудимость пищевого центра; — «Нова фигура» снижает аппетит и нормализует обмен веществ; — «Нова фигура капля» также подавляет чувство голода; — струмель может быть использован при пониженной функции щитовидной железы; — цюкли является бескалорийным подслащивающим средством и др. Однако любые лекарственные препараты для лечения ожирения не следует принимать самостоятельно, без врачебного контроля.
Психотерапия При любой форме ожирения психотерапия является обязательным компонентом лечения. Применяются методы рациональной психотерапии: пациент должен осознать свое состояние и негативные перспективы состояния собственного здоровья. Больной должен быть убежден в необходимости лечения и его значительной продолжительности. Тактика врача должна сочетать оптимизм, гибкость и одновременно быть активной и наступательной. Опыт свидетельствует, что без должной активности со стороны лечащего врача эффективность лечения тучности часто оказывается недостаточной.
Хирургическое лечение Оперативные методы лечения ожирения известны более 100 лет: еще в 1899 г. H. A. Келли впервые произвел иссечение жира на передней стенке живота. С середины XX в. начали производиться операции на тонкой кишке с целью уменьшения ее всасывательной способности. Однако до настоящего времени результаты оперативного лечения ожирения оцениваются неоднозначно; кроме того, в послеоперационном периоде обязательно проводится и консервативное лечение.
Профилактика По существу, профилактика тучности сводится к контролю за массой тела. Основные компоненты эффективной профилактики включают: — дальнейшее развитие медицинской науки, в том числе медицинской генетики и эндокринологии, имеющих первостепенное значение в профилактике вторичных форм ожирения; — развитие общей культуры и культуры питания в частности как составной части здорового образа жизни; — достаточную физическую активность; — дальнейшее развитие пищевой промышленности по выпуску специализированных продуктов питания для тучных и используемых для профилактики ожирения.
ОЖОГИ
ОпределениеОжоги — повреждение тканей организма, возникающее в результате местного воздействия высокой температуры, а также различных химических веществ, электрического тока или ионизирующего излучения.
Этиология Единой международной классификации ожогов до настоящего времени не существует. Важнейшим прогностическим показателем ожогов служит глубина поражения тканей. В разное время были предложены различные классификации ожогов в зависимости от глубины повреждения: Буайе (1814 г.) разработал трехступенчатую классификацию; Крейбих (1927 г.) предложил разделять пять степеней ожогов. В Российской Федерации с 1960 г. принята четырехступенчатая классификация, согласно которой в зависимости от глубины поражения тканей выделяют ожоги I степени, характеризующиеся покраснением, болезненностью и отеком кожи; ожоги II степени, при которых происходит поражение эпидермиса, на пораженных участках кожи образуются пузыри, заполненные прозрачной, желтоватого цвета жидкостью; ожоги III степени, которые подразделяются на две группы (ожоги IIIа степени (дермальные) характеризуются поражением собственно кожи, при котором имеется частичный некроз кожи с сохранением элементов дермы, т. е. кожа поражается не на всю ее глубину; при ожогах IIIб степени некроз кожи распространяется на всю ее толщу, а также частично или полностью поражается подкожный жировой слой с образованием некротического струпа); ожоги IV степени, характеризующиеся омертвением не только кожи, но и глубже лежащих тканей — мышц, костей, сухожилий, суставов. Исходя из особенностей лечения, ожоги подразделяют на две группы: ожоги I, II и II–Iа степени относятся к поверхностным, а ожоги IIIб и IV степени — к глубоким. При поверхностных ожогах погибают только верхние слои кожи, а восстановление кожного покрова в этих случаях происходит самостоятельно, за счет сохранившихся элементов кожи; лечение поверхностных ожогов консервативное. Глубокие ожоги (IIIб и IV степени) обычно требуют оперативного лечения. В клинической практике у пострадавших наблюдается, как правило, сочетание ожогов различных степеней. В зависимости от причин различают термические, химические, электрические и лучевые ожоги. В зависимости от обстоятельств, в которых произошло термическое поражение, ожоги подразделяют на производственные, бытовые и ожоги военного времени. По тяжести поражения различают легкие, средней тяжести, тяжелые и крайне тяжелые ожоги. Лучевые ожоги см. в разделе «Лучевая болезнь». Термический ожог возникает в результате действия пламени, горячего пара, раскаленных металлов, горящих газов или жидкостей, лучистой энергии, при прямом контакте с нагретым предметом или горячей жидкостью. При термических ожогах чаще всего поражаются поверхностные ткани организма, однако нередко отмечается при этом и поражение дыхательных путей. При пожарах, помимо ожогов, может наблюдаться отравление продуктами неполного сгорания (чаще окисью углерода) или другими ядовитыми веществами (например, при горении синтетических материалов).
Патогенез и патанатомия В начальном периоде ожога местные изменения клинически проявляются серозным или серозно-геморрагическим воспалением (ожоговым дерматитом (см.)), исход которого зависит от площади и глубины поражения и характера повреждающего фактора. Течение ожоговой раны зависит прежде всего от глубины поражения. Ожоги I и II степени протекают как серозное воспаление, нагноения обычно не наблюдается, после окончания воспаления достаточно быстро отмечаются полная регенерация (восстановление) и заживление ожоговой раны. При ожогах III и IV степени имеют место следующие процессы: омертвение тканей в момент ожога, травматический отек (см.), воспаление гнойного характера, постепенное очищение ожоговой раны от омертвевших тканей, образование грануляций, эпителизация и рубцевание. Причем если эпителиальный покров при ожогах Ша степени восстанавливается за счет сохранившихся элементов кожи, то при глубоких (IIIб и IV степени) ожогах отмечается неполная регенерация вследствие гибели придатков кожи, а заживление ожоговой раны в этих случаях происходит за счет краевой эпителизации и рубцевания. Ожоги помимо местных изменений вызывают комплекс системных нарушений в работе организма. Ожоги могут протекать преимущественно как местное поражение или в форме ожоговой болезни. При поверхностных повреждениях у взрослых, занимающих до 10–12 % поверхности тела, или при глубоких повреждениях 5–6 % поверхности тела течение ожогов, как правило, ограничивается местными симптомами. При более распространенных ожогах наблюдаются множественные нарушения в работе органов и систем, совокупность которых принято называть ожоговой болезнью. У детей, лиц пожилого и старческого возраста ожоговая болезнь может развиться и при меньших по тяжести поражениях. Выраженная ожоговая болезнь у взрослых развивается при поверхностных термических поражениях, занимающих более 25–30 % поверхности тела и более 10 % — при глубоких ожогах. Тяжесть течения ожоговой болезни, ее исход, а также частота развития осложнений определяются, в первую очередь, площадью глубокого поражения. Течение ожоговой болезни подразделяют на четыре периода: ожоговый шок, острая ожоговая токсемия, ожоговая септикотоксемия, период выздоровления. Ожоговый шок (см.) развивается преимущественно вследствие болевой импульсации из раны и термического поражения кожи и глубже лежащих тканей. Острая ожоговая токсемия развивается в результате интоксикации организма продуктами распада белков, всасывающимися из обожженных тканей. В периоде септикотоксемии ведущим патогенетическим фактором, определяющим клиническую симптоматику, служат рассасывание продуктов тканевого распада и жизнедеятельность микроорганизмов. Глубина ожогов во многом зависит от природы термического агента. При воспламенении одежды чаще всего развиваются глубокие ожоги. В то же время мгновенное действие даже очень высоких температур может ограничиваться поверхностным поражением, что наблюдается при вспышке паров горючего (бензина, газа). Горячая вода и пар у взрослых чаще вызывают поверхностные ожоги. Трудно прогнозировать глубину ожога при поражении горячими вязкими жидкостями — пластмассами или битумом. Одежда в целом защищает от ожогов, однако, например, шерстяная пропитанная горячей жидкостью ткань продлевает время теплового воздействия и увеличивает глубину поражения; искусственные ткани (типа нейлона или капрона) при горении плавятся и вызывают глубокие ожоги. Таким образом, глубина ожогового поражения зависит не только от продолжительности термического воздействия, но и от вида одежды. Кроме глубины поражения, для развития ожоговой болезни большое значение имеет площадь поражения. Существует немало способов определения площади ожоговой поверхности. Так как ладонь взрослого человека приблизительно равняется 1 % поверхности его тела, для ориентировочной оценки площади поражения можно использовать «правило ладони». Число укладывающихся на поверхности ожога ладоней соответствует числу процентов пораженной площади. В клинической практике также широко используется «правило девяток». Это правило основано на том, что площадь отдельных частей тела взрослого человека равна или кратна 9 % общей поверхности тела. Согласно «правилу девятки», поверхность головы и шеи составляют около 9 %, одной верхней конечности — 9 %, одной нижней конечности — 18 %, передней поверхности туловища — 18 %, задней поверхности туловища — 18 %, промежности — 1 % от общей поверхности тела. Кроме правил ладони и девяток разработаны специальные таблицы расчета пораженной поверхности тела, применяемые обычно в соответствующих стационарах.
Клиническая картина Термические ожоги Для ожогов I степени характерными симптомами являются разлитая краснота и умеренная отечность кожи, появляющаяся через несколько секунд после ожога пламенем, кипятком, паром или через несколько часов после действия солнечных лучей. В пораженном участке отмечаются сильные жгучие боли. В типичных случаях через несколько часов, а чаще в течение 3–5 дней эти явления проходят, поврежденный эпидермис слущивается и кожа приобретает обычное строение; иногда на месте ожога остается небольшая пигментация. Клиника ожогов II степени довольно характерна. Их отличительной особенностью служит образование пузырей. Пузыри образуются сразу или через некоторое время после воздействия термического агента. Если целостность отслоенного эпидермиса не нарушается, то размер пузырей в течение первых двух суток постепенно увеличивается. Кроме того, в течение этих двух суток возможно образование пузырей в местах, где при первичном осмотре их не было. Содержимое пузырей сначала представляет собой прозрачную жидкость, которая затем мутнеет. В типичных случаях через 2–3 дня содержимое пузырей густеет и становится желеобразным. Через 7—10 дней ожоги заживают без рубцов, однако краснота и пигментация могут сохраняться несколько недель. Иногда в пузырях возможно нагноение: в этих случаях жидкость, заполняющая пузыри, приобретает желто-зеленый цвет. Кроме того, одновременно отмечаются увеличение отека окружающей ожог ткани и нарастание красноты. В большей мере, чем при ожогах I степени, при ожогах II степени выражены краснота, припухлость и боли. Ожоги III степени в целом характеризуются образованием струпа. При ожогах IIIа степени возможно также образование пузырей. При ожогах Ша степени образуется два вида струпа: поверхностный сухой светло-коричневый или мягкий и белесовато-серый. При сухом некрозе кожа сухая, плотная, бурого или черного цвета, нечувствительна к прикосновению, с завитками сползающего и обгоревшего эпидермиса. При влажном некрозе (см.), возникающем чаще всего при действии кипятка или пара, кожа желтовато-серого цвета, отечна, иногда покрыта пузырями. Рыхлая клетчатка в зоне ожога и по его периферии резко отечна. В последующем наступает демаркация (разграничение) омертвевших тканей, сопровождающаяся, как правило, инфекцией и нагноением. Отторжение струпа начинается обычно через 7—14 дней, его расплавление продолжается 2–3 недели. В типичных случаях ожоги Ша степени независимо от площади поражения к концу 1-го — середине 2-го месяца эпителизируются за счет самостоятельных островкового и краевого процессов.
Схема Постникова для определения размера ожога
Ожоги IIIб степени (глубокие) клинически могут проявляться в виде сухого (коагуляционного) некроза, влажного (колликвационного) некроза и так называемой фиксации кожи. Под действием пламени или при контакте с раскаленными предметами развивается коагуляционный (сухой) некроз: на вид пораженная кожа сухая, плотная, бурого, темно-красного или черного цвета. В области крупных суставов кожа образует грубые складки, сморщивается. Характерным признаком при сухом некрозе служит незначительный отек и довольно узкая зона красноты вокруг очага поражения. Сухой струп довольно длительное время внешне не изменяется — вплоть до начала гнойного воспаления. Процесс восстановления под струпом начинается уже с 5—6-го дня, однако образование разграничительного вала (демаркации) и обособление зон некроза (см.) заканчивается лишь к концу 1-го — середине 2-го месяца, когда и наблюдается полное отторжение струпа. В отличие от поверхностных ожогов, эпителизация при глубоких термических поражениях происходит только за счет краевого процесса, протекает медленно, причем самостоятельная эпителизация глубоких ожогов возможна лишь при очень небольших по площади поражениях (диаметром не более 2 см). При ошпаривании (реже при тлении одежды на теле) развивается влажный некроз (см.). Омертвевшая кожа при влажном некрозе пастозна, отечна, причем отечность распространяется за пределы ожоговой поверхности. Цвет кожи варьирует от бело-розового, пестрого до темно-красного, пепельного или желтоватого. Эпидермис обычно свисает лоскутами, но изредка возможно образование пузырей. В отличие от сухого, при влажном некрозе демаркационная линия не столь отчетливо выражена, воспаление распространяется за пределы ожоговой раны; характерно развитие грануляций в зоне влажного некроза. Очищение ожоговой раны при влажном некрозе происходит в среднем на 10–12 дней раньше, чем при сухом некрозе. При дистанционных (от лат. distantia — расстояние) ожогах, развивающихся от интенсивного инфракрасного излучения, возникает своеобразное термическое поражение, так называемая «фиксация» кожи. Во-первых, при этом воздействии одежда над ожогом может не загораться. Во-вторых, обожженная кожа в первые 2–3 дня бледнее и холоднее окружающих неповрежденных зон. По окружности очага поражения образуется узкая зона красноты и отека. Образование сухого струпа при данном виде поражения наблюдается через 3–4 дня. По мере отторжения струпа независимо от вида некроза (см.) становится видна грануляционная ткань. При положительной динамике ожогового процесса и адекватной терапии грануляции ярко-розовые, выступают над уровнем кожи, крупнозернистые, гнойное отделяемое скудное, по краям ожоговой раны заметен процесс эпителизации. О негативном течении ожогового процесса свидетельствуют следующие признаки: грануляции серого цвета, дряблые, плоские, суховатые; поверхность раны покрыта гнойно-фибринозным налетом; краевая эпителизация замедляется или прекращается. Наиболее тяжелые ожоги — ожоги IV степени — развиваются чаще всего в анатомических областях, не имеющих выраженного подкожного жирового слоя под действием достаточно длительного теплового воздействия. При этом в патологический процесс последовательно вовлекаются мышцы и сухожилия, а затем кости, суставы, нервная и хрящевая ткань. Визуально ожоги IV степени могут проявляться: — образованием плотного струпа темнокоричневого или черного цвета; — обугливанием и последующим растрескиванием плотного и толстого струпа, через разрывы которого видны пораженные мышцы или даже сухожилия и кости; — образованием белесоватого струпа относительно мягкой консистенции, образующегося в результате длительного воздействия неинтенсивного — до 50 °C — теплового излучения. Для ожогов IV степени характерно, что точно определить будущие границы некроза (см.) мышц в первые дни после травмы практически невозможно, что связано с неравномерностью их поражения. Развитие очагов вторичного некроза внешне неизмененных мышц, расположенных на значительном расстоянии от точки приложения тепла, возможно через несколько дней после тепловой травмы. Для ожогов IV степени также характерно замедленное течение ожогового процесса (очищение раны от мертвых тканей, образование грануляций), частое развитие местных (прежде всего гнойных осложнений) — абсцессов (см.), флегмон (см.), артритов (см.). Поражения органов дыхания наблюдаются, как правило, при глубоких ожогах пламенем лица, шеи и груди. Непосредственно на слизистые оболочки зева, глотки и гортани воздействует термический агент, а поражение трахеи, бронхов и альвеол обусловлено действием продуктов горения. У обожженного отмечаются затруднение дыхания, осиплость голоса, редко развиваетсямеханическая асфиксия (см.). При осмотре выявляются синюшность губ, опаленные волосы в носу, отек, гиперемия (краснота) и белые пятна омертвления на слизистых оболочках губ, языка, твердого и мягкого неба, задней стенки глотки. Впоследствии нередко развивается пневмония (см.). Поражение органов дыхания при термических поражениях приравнивают к увеличению площади глубокого ожога на 10–15 % поверхности тела.
Схема для графической регистрации ожогов: 1 — I степень; 2 — II–III степень; 3 — IV степень
Ожоговая болезнь Течение ожоговой болезни подразделяют на четыре периода: ожоговый шок, острая ожоговая токсемия, ожоговая септикотоксемия, период выздоровления. Ожоговый шок длится от 1 до 3 суток, его сменяет период острой токсемии, продолжающийся в среднем 10–15 дней и постепенно переходящий в септикопиемию. Начало периода септикопиемии совпадает с началом отторжения мертвых тканей, его продолжительность варьирует и зависит от длительности заживления ожоговой раны. Период выздоровления начинается после заживления кожи. У лиц молодого и среднего возраста ожоговый шок развивается, как правило, при ожогах II–IV степени на площади более 15–16 % поверхности тела. Как и при других видах шока (см.), в течении ожогового шока выделяют эректильную и торпидную фазы. В первые минуты, реже часы после ожоговой травмы (эректильная фаза) отмечаются общее возбуждение и двигательное беспокойство. Сознание пострадавшего обычно сохранено. Выражены озноб, мышечная дрожь, обожженные стонут, жалуются на боль в обожженных участках. Отмечаются повышение артериального давления, учащение дыхания и пульса. Температура тела обычно не повышается, а при тяжелом шоке понижена. Эта фаза не всегда достаточно выражена. Через 2–6 ч эректильная фаза шока сменяется торпидной — на первый план выступают явления торможения. В первые 1–2 дня выражена жажда. Нередко отмечается тошнота, возможна многократная рвота, в том числе «кофейной гущей», что свидетельствует о желудочном кровотечении (см.). Со стороны органов дыхания наблюдается одышка, в легких на фоне жесткого дыхания выслушиваются сухие, а позднее и влажные хрипы. Нарушение функции почек характерно для ожогового шока, что клинически проявляется олигурией или анурией (см.), моча при этом насыщенно-желтая или темно-коричневая. Своевременная терапия имеет важнейшее значение, так как может значительно облегчить течение или даже предотвратить развитие торпидной фазы шока. В то же время дополнительная травматизация обожженных и запоздалая медицинская помощь способствуют развитию и более тяжелому течению торпидной фазы. Тяжесть клинических проявлений ожогового шока определяется глубиной и площадью термического поражения, возрастом и общим состоянием здоровья пострадавшего, своевременным и адекватным противошоковым лечением. По степени тяжести выделяют легкий ожоговый шок, тяжелый и крайне тяжелый шок. Легкий ожоговый шок развивается при общей площади поражения не более 20 % поверхности тела, в том числе глубоких — не более 10 %. Сознание остается ясным, иногда отмечается кратковременное возбуждение. Кожа пораженных бледная, отмечаются жажда, мышечная дрожь, «гусиная кожа», иногда бывает озноб. Тошнота и рвота наблюдаются редко. Больные чаще спокойны, иногда возбуждены, эйфоричны. Дыхание, как правило, не учащается, пульс достигает 100–110 ударов в минуту, артериальное давление остается в пределах нормы. Мочеиспускание не нарушено. Тяжелый шок наблюдается при глубоких ожогах, занимающих более 20 % поверхности тела. Иногда у молодых здоровых людей тяжелый шок может развиваться при площади поражения до 40 % поверхности тела. Тяжелый шок характеризуется тяжелым состоянием больного. При этом сознание чаще сохранено. Нередко отмечается кратковременное психомоторное возбуждение, сменяющееся затем заторможенностью. Кожные покровы необожженных участков и видимые слизистые оболочки бледные, сухие, на ощупь холодные. Температура тела обычно снижена на 1,5–2 °C. Пораженных беспокоят озноб, боли в области ожога, повышенная жажда, у многих больных отмечаются тошнота и рвота. Часто выражен акроцианоз (синюшность концевых частей тела). Дыхание учащено, пульс составляет 120–130 ударов в минуту, артериальное давление характеризуется неустойчивостью, но чаще отмечается его понижение. Выражено поражение почек: снижение суточного диуреза (отделения мочи) достигает 600 (олигурия), в моче определяется кровь. Крайне тяжелый шок развивается при глубоких поражениях, занимающих 40 и более процентов от площади тела. Возможно кратковременное возбуждение, сменяющееся вскоре заторможенностью и апатией. При крайне тяжелом шоке сознание спутано, но часто остается сохраненным. Состояние больных крайне тяжелое. Кожа бледная, синюшная, нередко с землистым оттенком, на ощупь холодная, с мраморным оттенком. Характерна мучительная жажда — пострадавший выпивает до 4–5 л жидкости в сутки, после чего нередко развивается неукротимая рвота. Температура тела значительно снижена. Дыхание частое, выражены одышка и синюшность слизистых оболочек. Пульс снижается до нитевидного, может не определяться. Артериальное давление снижается значительно (максимальное — до 100 мм рт. ст.). Развивается анурия (см.), реже наблюдается олигурия. Для крайне тяжелого ожогового шока характерна резкая гемоконцентрация (сгущение крови) и уменьшение объема циркулирующей крови на 20–40 %. Ожоговый шок продолжается от 2 до 48 ч, в редких случаях затягивается до 72 ч. При благоприятном исходе и своевременном лечении в первую очередь начинает восстанавливаться периферическое кровообращение, затем нормализуется мочеиспускание. В периоде ожоговой токсемии начинают проявляться симптомы интоксикации. Состояние пораженных зависит от площади и глубины поражения, а также локализации ожога. Самочувствие больных споверхностными ожогами чаще остается удовлетворительным. При глубоких поражениях отмечается лихорадка, температура тела повышается до 38–39 °C, наблюдаются возбуждение, бред (см.), бессонница или сонливость, иногда — мышечные подергивания и судороги. Возможно в отдельных случаях развитие коматозного состояния. Развиваются артериальная гипотензия, миокардит (см.). Важнейшими симптомами токсемии являются бледность, повышение температуры, тахикардия (см.), аритмии (см.). Со стороны желудочно-кишечного тракта отмечаются жажда, сухость языка, иногда наблюдается желтушность склер и кожи. Характерны снижение аппетита, тошнота, повторная рвота, парез (см.) кишечника или токсический понос. Ожоговая токсемия продолжается в среднем 10–15 дней и постепенно переходит в септикотоксемию. Ожоговая септикотоксемия развивается чаще всего при глубоких ожогах, превышающих 5–7 % поверхности тела, или у пораженных с распространенными поверхностными термическими поражениями. Начало септикотоксемии непосредственно связано с нагноением, которое обычно развивается на 12—15-е сутки после ожоговой травмы. В среднем от начала отторжения струпа до очищения ожоговой раны проходит 2 или даже 3 недели. Затем рана заполняется грануляциями. Длится этот период до заживления кожного покрова или его хирургического (оперативного) восстановления. Состояние пораженных в периоде септикотоксемии остается тяжелым — сохраняется высокая температура, выражена интоксикация. Клинически период септикотоксемии проявляется гнойно-резорбтивной лихорадкой, которая может быть постоянной, ремиттирующей (с подъемами и спадами), реже лихорадка носит гектический (изнуряющий) характер. Характерны бессонница, вялость, может наблюдаться бред (см.). Выражены учащенное сердцебиение, сохраняются явления токсического миокардита (см.), нарушения микроциркуляции. Усугубляются алиментарные расстройства, связанные со снижением аппетита (вплоть до анорексии — полного его отсутствия) и нарушением всех функций желудочно-кишечного тракта, в том числе с расстройством функций печени и поджелудочной железы. За счет токсического угнетения эритропоэза и кровопотерь во время перевязок и операций сохраняется вторичная анемия (см.), может развиваться бактериемия, переходящая в сепсис (см.). При улучшении состояния обожженных, по мере отторжения некротизированных тканей и развития грануляций, течение ожоговой болезни приобретает подострый характер с заметным улучшением клинического состояния больных. При менее благоприятном течении патологического процесса возможно развитие ожогового истощения. Оно обычно наблюдается при глубоких ожогах — при длительном существовании ожоговых ран, занимающих не менее 15–20 % поверхности тела, но в случаях неадекватного и несвоевременного лечения может развиться и при меньших по площади (в пределах 10 %) глубоких ожогах. При ожоговом истощении масса тела пораженных может снижаться на 10–20 %, а при особо тяжелом поражении — даже на 25–30 %. При ожоговом истощении наблюдается утяжеление клинической симптоматики — грануляции становятся бледными и дряблыми, легко кровоточат. Выражены общая заторможенность, неподвижность, образуются пролежни (см.), в крови определяются анемия (см.) и снижение содержания белка. Период выздоровления начинается после ликвидации острых проявлений ожоговой болезни и осложнений, но не означает окончательного выздоровления. В первую очередь отмечается улучшение состояния больных — снижается температура тела, нормализуется психика пострадавших, повышается их активность. Однако даже при незначительной физической нагрузке резко повышается число сердечных сокращений. Обследование выявляет расстройство функции почек и печени, что свидетельствует о незавершенности патологического процесса. Могут длительное время регистрироваться обменные нарушения (диспротеинемия, анемия (см.)), изменения сердечно-сосудистой системы (тахикардия (см.), гипотония (см.)), расстройства функции органов дыхания (одышка при физической нагрузке), желудочно-кишечного тракта (в том числе повышение или снижение аппетита), почек. В периоде выздоровления начинается формирование рубцов. Все указанные расстройства выражены в различной степени и в разных сочетаниях, их продолжительность и исход зависят от тяжести патологического процесса и качества терапии. В периоде выздоровления наступает полное или почти полное заживление ожоговой раны, происходит восстановление способности пациента к передвижению и элементарному самообслуживанию. Течение ожоговой болезни может сопровождаться психическими расстройствами (см.), для которых характерно острое начало и соответствие между нарушениями психоэмоциональной сферы и тяжестью соматических симптомов. Психические расстройства при ожоговой болезни относятся к соматогенным, симптоматическим нарушениям, обусловленным главным образом стрессом, интоксикацией, инфекционными и другими осложнениями со стороны внутренних органов. Психические расстройства (см.) при ожоговой болезни характеризуются двигательным возбуждением и астеническим синдромом, развивающимся, как правило, в периоде выздоровления и сохраняющимся длительное время. Для расстройств психики при ожоговой болезни характерны нарушения сна и кошмарные сновидения, содержание которых часто отражает непосредственные события, связанные с ожоговой травмой. Астенический синдром может сохраняться длительно (на протяжении 1–1,5 лет). Специфическим проявлением нарушений психики в отдаленном периоде может быть навязчивый страх огня. Типичным проявлением данного расстройства является боязнь зажигать огонь, в других случаях — боязнь смотреть на огонь. У лиц пожилого и старческого возраста отмечаются особенности течения ожоговой болезни, связанные как с частым наличием у них различных заболеваний (сахарный диабет (см.), ишемическая болезнь сердца (см.), гипертоническая болезнь (см.) и т. д.), так и с закономерным физиологическим снижением защитных и адаптационных способностей организма. В этих условиях даже ограниченные поверхностные термические повреждения могут сопровождаться развитием достаточно серьезных нарушений. У пожилых возможно развитие ожогового шока (см.) при относительно меньших по площади поражениях (шок у пожилых может возникать при ожогах II–IV степени на площади 8—12 % поверхности тела). У лиц пожилого и старческого возраста более тяжело протекают токсемия и септикотоксемия, также характерно большее число серьезных осложнений при меньших по тяжести ожоговых поражениях.
Осложнения Одним из наиболее тяжелых и опасных осложнений ожоговой болезни является сепсис (см.), угрожающий пострадавшим с глубокими поражениями более 20 % поверхности тела. Одним из механизмов развития ожогового сепсиса служит угнетение иммунитета пациентов с ожоговой болезнью. При площади поражения более 15–20 % поверхности тела у многих пострадавших развивается специфическое осложнение ожоговой болезни — ожоговое истощение. Развитие этого осложнения связано с самой ожоговой раной, способствующей продолжительной интоксикации организма, рассасыванию продуктов тканевого распада, микроорганизмов и продуктов их жизнедеятельности. Также имеют значение дефицит белка, нарушения функций органов пищеварения, в том числе печени. Симптомы ожогового истощения регистрируются с начала периода септикопиемии, в последующем наблюдается плавное прогрессирование признаков ожогового истощения: нарастает слабость, отмечаются нарушение сна, раздражительность, выраженная заторможенность и астенизация. Несмотря на соответствующую терапию и достаточное питание, отмечается снижение веса больного, достигающее в отдельных случаях 30 % массы тела. В целом симптоматика ожогового истощения характеризуется процессом общей атрофии (см.). Температура тела часто остается нормальной или повышается незначительно даже при присоединении инфекционных осложнений, характерны прогрессирующая адинамия, тахикардия (см.), тенденция к гипотонии, пролежни (см.), мышечная атрофия (см.), невриты (см.), отеки (см.), анемия (см.). В различные сроки ожоговой болезни, как правило в периоды токсемии и (или) септикотоксемии, может развиться пневмония (см.). В первые после ожога дни пневмония обычно обусловлена поражением органов дыхания продуктами горения. Для своевременной диагностики пневмонии первостепенное значение имеет рентгенологическое обследование, так как при ожоге в области грудной клетки услышать хрипы с помощью фонендоскопа сложно. Возможны многообразные осложнения со стороны системы пищеварения. У обожженных нередко развиваются острые язвы желудочно-кишечного тракта, которые могут сопровождаться кровотечением или перфорацией. Реже выявляется холецистит (см.); также возможно развитие тромбоза (см.) сосудов брюшной полости, острого панкреатита (см.), острого аппендицита (см.). Необходимо отметить, что при ожоговой болезни диагностика острых хирургических заболеваний брюшной полости объективно затруднена. При выраженной ожоговой интоксикации возможно развитие токсического гепатита (см.), печеночной недостаточности (см.). В поздние после ожогов сроки могут поражаться почки с развитием пиелита, пиелонефрита (см.). При ожоговом истощении могут образовываться мочевые камни, развиваться полиневриты. К местным осложнениям термических поражений относятся фурункулез (см.), флегмоны (см.), гнойные артриты (см.), а также гангрена (см.) конечностей при циркулярных ожогах. Неполное восстановление утраченного в результате глубокого ожога кожного покрова и подлежащих тканей приводит к развитию поздних осложнений — ожоговых деформаций, контрактур, подвывихов и вывихов (см.), анкилозов, а также длительно текущих трофических язв.
Лучевые ожоги (см. Лучевая болезнь)
Химические ожоги Химические ожоги вызываются крепкими неорганическими кислотами (азотная, серная, соляная, фтористо-водородная и др.), щелочами (едкий калий, едкий натрий, негашеная известь, каустическая сода), а также солями некоторых тяжелых металлов (нитрат серебра, хлористый цинк и др.). Кислоты и подобно им действующие вещества вызывают коагуляционный некроз, т. е. обезвоживание и коагуляцию тканей, в результате чего наступает их гибель по типу сухого некроза. Щелочи и подобно им действующие вещества вызывают омыление жиров и развитие влажного некроза. Выделяют также термохимические ожоги, обусловленные комбинированным воздействием агрессивного вещества и высокотемпературного фактора. При химических ожогах чаще всего поражаются открытые участки тела, однако при случайном приеме внутрь кислот и (или) щелочей возможны ожоги слизистой оболочки рта и пищевода. Особенность химических ожогов состоит в том, что попавшие на кожу жидкие агрессивные вещества растекаются по ее поверхности. Химические ожоги обычно бывают ограниченными по площади, с четкими границами поражения, имеют неправильную форму и характеризуются образованием по периферии подтеков — следов растекания химического вещества. Более глубоко поражаются участки кожи, на которые агрессивное вещество попало первоначально. Химические ожоги (как и термические) по глубине поражения тканей подразделяются на четыре степени. Ожоги I степени характеризуются краснотой, умеренным отеком и образованием тонких корочек и пятен. Отеки при ожогах щелочами выражены больше, чем при поражении кислотами. Течение ожогов I степени благоприятное, инфекционных осложнений и нагноений, как правило, не бывает. Отечность проходит на 3—4-й день, сухие корочки отпадают с обожженной поверхности в конце 1-й — начале 2-й недели, оставляя пигментацию, сохраняющуюся несколько недель. При химических ожогах II степени пузыри не образуются, что составляет их отличительную особенность. Отторжение струпа после ожога II степени кислотами происходит на 3—4-й неделе. При ожогах щелочами струп чаще всего нагнаивается и через 3–4 дня образуется гноящаяся, покрытая некротическими тканями рана. При ожогах кислотами III–IV степени струп начинает отторгаться с 20—25-го дня, этот процесс продолжается 1–4 недели; при глубоких ожогах щелочами рана очищается от некротизированных тканей в конце 3-й — начале 4-й недели. Течение химических ожогов в сравнении с термическими замедленное — отторжение мертвых тканей, образование грануляций и заживление ожоговой раны происходит медленнее. Ожоговая болезнь при химических ожогах развивается относительно редко, однако явления общей интоксикации вследствие всасывания в кровь образующихся в ожоговой ране соединений агрессивных веществ (прежде всего — кислот) возможны.
Электрические ожоги (см. Электротравма)
Ожоги у детей Ожоги у детей являются достаточно распространенными и опасными для жизни повреждениями, последствия которых могут стать причиной инвалидизации. Основные причины ожогов у детей — это попадание на кожу горячих жидкостей (69 % случаев) и прикосновение к горячим предметам (18 %). Такие ожоги характерны для детей в возрасте от 1 до 3 лет. Пламени как причине детских ожогов отводится третье место. Основные закономерности развития повреждений кожного покрова и ожоговой болезни у детей и взрослых не отличаются, но в связи с анатомическими и функциональными особенностями детского организма эти изменения проявляются более интенсивно, чем у взрослых. Объясняется это незрелостью детского иммунитета и анатомией: по сравнению со взрослыми кожа детей более тонкая и нежная, имеет более развитую сеть кровеносных и лимфатических сосудов, а значит, обладает более высокой теплопроводностью. Данная особенность кожи приводит к тому, что глубокие ожоги возникают у детей в результате действия термического агента, который у взрослого человека вызовет лишь поверхностное поражение. Развитие ожоговой болезни у детей, особенно младших возрастных групп, возможно при поражении всего 5 % поверхности тела. При этом протекает ожоговая болезнь тем тяжелее, чем меньше возраст ребенка. Площадь глубокого термического поражения уже в 10 % у ребенка является критической. Незрелость регуляторных и компенсаторных механизмов у маленьких детей может приводить к развитию клинической ситуации, когда внезапное, не поддающееся медикаментозной коррекции ухудшение состояния ребенка может наступить уже через несколько минут после ожоговой травмы. У детей в возрасте до 3 лет шок (см.) может развиваться при ожогах, занимающих 3–5 % поверхности тела, у более старших детей — при поражении 5—10 % поверхности тела. К особенностям ожогового шока у детей относятся более тяжелое, чем у взрослых, течение болезни и более высокая интенсивность клинических проявлений. У детей быстрее развиваются расстройства обмена, кровообращения, нарушения функционирования важнейших органов и систем. У детей ярко выражены такие симптомы, как возбуждение, иногда с судорожными припадками, сменяющиеся заторможенностью, озноб с подергиванием мимических мышц, резкая бледность кожи, синюшность носогубного треугольника, жажда, тошнота, повторная рвота. У детей младших возрастных групп одной из особенностей ожогового шока является выраженное повышение температуры тела. Наиболее тяжело шок протекает у новорожденных. Острая ожоговая токсемия развивается, как правило, после кратковременного удовлетворительного самочувствия ребенка. Особенности клинических проявлений токсемии у детей: высокая температура до 40 °C, часто сопровождающаяся бредом (см.), спутанность сознания, судороги, развитие осложнений (пневмония (см.), острый эрозивно-язвенный гастрит (см.), токсический гепатит (см.), миокардит (см.)). Продолжительность острой ожоговой токсемии у детей чаще всего составляет от 2 до 10 дней. Для периода септикотоксемии у детей, которая развивается после нагноения ожоговой раны, характерны выраженное расстройство сна, депрессия (см.), раздражительность, отсутствие аппетита, а также ремиттирующий тип лихорадки с размахами до 2 °C. Выздоровление у детей протекает с яркой положительной динамикой, когда отчетливо меняется настроение, улучшается сон, появляется аппетит, снижается температура. Осложнения ожоговой болезни у детей чаще отмечаются в периоде септикотоксемии. К типичным осложнениям у детей относятся отиты (см.), язвенный стоматит (см.), рецидивирующая пневмония (см.), лимфаденит (см.), абсцессы (см.), флегмоны (см.), нефрит (см.), гепатит (см.). Тяжелейшим осложнением периода септикотоксемии является ожоговое истощение, в развитии которого играет существенную роль неадекватное лечение. Ожоговое истощение у детей нередко осложняется сепсисом (см.) с формированием множественных гнойных очагов во внутренних органах. Среди осложнений отдаленного периода следует отметить возможность изменений деятельности желез внутренней секреции, в результате чего могут наступить остановка роста ребенка и задержка полового созревания.
Лечение Термические ожоги Первая помощь при ожогах на месте происшествия направлена на скорейшее прекращение действия термического агента. Принципиально важны при этом четкие и быстрые действия как самого пострадавшего, так и лиц, оказывающих пострадавшему первую медицинскую помощь. Воспламенившуюся одежду или горящие на теле вещества необходимо как можно быстрее погасить. Необходимо быстро сбросить горящую или пропитанную горячей (химической) жидкостью одежду. Пострадавшего в максимально короткие сроки следует удалить из очага поражения. В случаях, когда одежду снять не удается, необходимо прекратить доступ воздуха к горящему участку: закрыть его плотной тканью или одеялом; погасить струей воды; присыпать землей или песком; в порядке самопомощи необходимо лечь на землю так, чтобы прижать к ней горящую поверхность. Сбить пламя можно катаясь по земле; при наличии водоема или емкости с водой нужно прыгнуть в нее или погрузить в воду обожженный орган. Нельзя сбивать пламя незащищенными руками, бежать в горящей одежде, так как при этом горение усиливается. Для сокращения продолжительности термического воздействия на ткани и с целью уменьшения глубины повреждения следует быстро охладить участок поражения доступными средствами (погружение в холодную воду, снег и т. д.). После прекращения действия термического агента на обожженную часть тела накладывают сухую асептическую повязку. При обширных ожогах пострадавшего укутывают стерильной простыней, чистой тканью, бельем, защищают от охлаждения и максимально бережно транспортируют в стационар. Помимо наложения асептической повязки, производить какие-либо манипуляции на ожоговой ране не следует. Если поражены кисти, необходимо срочно снять имеющиеся кольца и (или) перстни. Важно знать, что с обожженных участков тела поврежденную одежду в целях профилактики дополнительной травматизации не снимают; нужно ее разрезать или распороть вдоль шва и удалить максимально осторожно. Не всегда следует снимать всю одежду с пострадавшего, особенно в холодную погоду. При поражении органов дыхания и при отравлении токсическими веществами, образующимися при горении (в первую очередь — синтетических материалов), важнейшими первоочередными мероприятиями являются обеспечение пострадавшему проходимости дыхательных путей, подача чистого воздуха и контроль за проходимостью дыхательных путей. При возможности до приезда «Скорой помощи» или при самостоятельной транспортировке пораженного в стационар перед госпитализацией необходимо ввести пострадавшему обезболивающие и успокаивающие средства. В машине «Скорой помощи» в пути следования для профилактики ожогового шока вводят обезболивающие препараты (в том числе наркотические анальгетики), антигистаминные и сердечно-сосудистые препараты, по показаниям прибегают к инфузионной терапии — внутривенно капельно или струйно вводят кровезаменители гемодинамического действия — полиглюкин, реополиглюкин и др. Для устранения возбуждения используют инъекции седуксена. При остановке сердца и дыхания на месте до прибытия специалистов («Скорая помощь», «Служба спасения») проводится весь комплекс реанимационных мероприятий — искусственное дыхание, непрямой массаж сердца. Окончательное лечение ожогов проводится в специализированных стационарах — ожоговых центрах и ожоговых клиниках, располагающих опытным подготовленным врачебным и сестринским персоналом и необходимым оборудованием. По показаниям проводится трансфузионная дезинтоксикационная терапия, используются современные сорбционные способы терапии, проводится борьба с инфекционными осложнениями. Оперативное лечение ожогов предусматривает максимально полное восстановление кожного покрова, в том числе с использованием современных методов дерматопластики.
Химические ожоги Тяжесть химических ожогов в значительной степени зависит от срока оказания первой медицинской помощи, основная задача которой заключается в скорейшем удалении (нейтрализации) попавшего на кожу или в пищеварительный тракт агрессивного вещества. Для этого применяется обмывание участка поражения (промыванием желудка) большим количеством холодной проточной воды. Если обмывание выполняется сразу после травмы, оно должно продолжаться не менее 10–15 мин, при задержке помощи — не менее 40–60 мин, а при поражении фтористо-водородной кислотой — в течение 2–3 ч. Критерием достаточности обмывания пораженного участка служит исчезновение запаха агрессивного вещества. Не применяется обмывание водой ожогов, вызванных органическими соединениями алюминия, так как эти вещества при взаимодействии с водой воспламеняются; их удаляют с кожи органическими растворителями — керосином, бензином, спиртом и др. Завершив обмывание пораженного участка, применяют химическую нейтрализацию химических агрессивных веществ: при ожогах кислотами используют 2–3 %-ный раствор гидрокарбоната натрия; при поражении щелочами применяют слабые кислоты; при ожогах известью используют 20 %-ный раствор сахара в виде примочек; при ожогах карболовой кислотой накладывают повязки с глицерином и известковым молоком; при ожогах хромовой кислотой применяют 5 %-ный раствор тиосульфата натрия; при ожогах солями тяжелых металлов накладывают повязки с 5 %-ным раствором сульфата меди. Ожоговая поверхность при воздействии химических веществ обрабатывается по общим правилам. Туалет ожоговой раны при поражении фосфором должен проводиться в темной комнате, так как остатки фосфора, находящиеся в ране, на свету не видны.
Ожоги у детей Первая помощь на месте происшествия направлена на прекращение воздействия термического агента на кожу: при ожогах пламенем необходимо погасить горящую одежду путем завертывания ребенка в плотную ткань, при ожоге горячими жидкостями произвести быстрое обмывание обожженных областей холодной водой. Затем следует осторожно снять с обожженного ребенка одежду, завернуть его в чистую простыню; если позволяет возраст, внутрь дать обезболивающее средство (панадол, анальгин и т. п.) и незамедлительно вызвать «Скорую помощь». Показания к инфузионной терапии во время госпитализации у детей возникают чаще, чем у взрослых. Лечение детей в стационаре проводится по тем же принципам, что и лечение взрослых пациентов — производится туалет ожоговых ран, наложение асептических повязок, введение противостолбнячной сыворотки и анатоксина и т. д. Особенности противошоковой терапии у детей при ожогах: — в проведении противошоковой терапии нуждаются все дети с ожогами на площади более 10 %, а дети до 3 лет — более 3–5 % поверхности тела; — в первые 8 ч после ожоговой травмы детям необходимо вводить в 2 раза больше инфузионных растворов, чем в остальные 16 ч, так как наиболее интенсивная потеря и перераспределение жидкости в организме детей отмечаются в первые 12–18 ч, особенно в первые 8 ч. Для расчета количества вводимых за сутки инфузионных растворов используют следующую формулу: 3 мл следует умножить на вес тела (кг) и на площадь ожога (%). Половину этой дозы вводят в первые 8 ч после ожоговой травмы.
ОЗЕНА
Озена — зловонный насморк. Это хроническое заболевание полости носа с резкой атрофией слизистой оболочки с образованием густых выделений.
Этиология и патогенез Причины возникновения заболевания неясны. Болезнь встречается редко, возникает преимущественно у молодых женщин, живущих в плохих социально-бытовых условиях, и продолжается всю жизнь. Она обостряется во время менструаций и стихает в период беременности и кормления, а также к старости. Заболевание характеризуется атрофическим процессом слизистой оболочки и костных стенок полости носа, в результате чего образуется густая зловонная жидкость, которая насыхает на стенках полости носа в виде корок.
Клиническая картина Заболевание впервые проявляется чаще в возрасте 8—10 лет. Вначале единственным признаком заболевания является неприятный запах из носа, который сами больные не ощущают. Затем больные начинают жаловаться на постоянное закладывание носа вязкой жидкостью, которая засыхает в виде корок и нарушает дыхание через нос. Удаление корок нередко вызывает небольшое кровотечение. С течением времени обоняние резко снижается или полностью исчезает. Больные подавлены, избегают общения с людьми из-за исходящего от них резкого зловонного запаха. Иногда нос приобретает широкую приплюснутую форму, но чаще форма его не изменена.
Лечение Лечение направлено на удаление корок. Полость носа промывают 2 %-ным раствором гидрокарбоната натрия (0,5 ч. л. на 1 стакан теплой воды). Промывание проводят с помощью резинового баллона или специального чайника с длинным носиком. Иногда раствор распыляют в полости носа с помощью пульверизатора. В полость носа вводят растворы йода в глицерине, протеолитические ферменты (трипсин, химотрипсин, лидаза), раствор Люголя. Назначают общеукрепляющую терапию: алоэ, стекловидное тело, витамины. Внутрь назначают антибиотики. Возможно проведение химиотерапии.
ОЛИГОФРЕНИИ
ОпределениеОлигофрении (синонимы: врожденное слабоумие, умственная отсталость) включают группу патологических состояний, основным проявлением которых является врожденное или приобретенное в первые годы жизни (до 3 лет) слабоумие. Состояние психики при олигофрении характеризуется преобладанием интеллектуального дефекта и затруднением социальной адаптации. Термин «олигофрения» — сборный, объединяющий три степени умственной отсталости: дебильность (наиболее легкая степень), имбецильность (средняя степень), идиотия (тяжелая степень умственной отсталости).Термин «олигофрения» принадлежит выдающемуся немецкому психиатру Э. Крепелину (1856–1926 гг.), однако описание врожденного слабоумия с выделением различных его степеней было произведено значительно раньше (Дюфур, 1770 г.; Эскироль, начало XIX в. и др.). Распространенность олигофрении, по данным ВОЗ (Всемирная организация здравоохранения), составляет 1–3 %; значительное увеличение выявления слабоумия происходит в возрасте от 7 до 19 лет, что объясняется такими социальными факторами, как начало обучения, освидетельствование при призыве на воинскую службу. Олигофрения выявляется у мужчин в 1,5 раза чаще, чем у женщин. Соотношение дебильности, имбецильности и идиотии составляет 75, 20 и 5 % соответственно. Олигофрении считают не заболеванием, а относят к порокам индивидуального развития, так называемым дизонтогениям. Таким образом, они не являются болезнью в строгом смысле этого понятия. Наиболее ярким клиническим проявлением олигофрении служит недоразвитие интеллекта; в то же время при олигофрении наблюдается как недоразвитие познавательных способностей, так и недоразвитие личности в целом. Характернейшей чертой олигофрении является отсутствие прогрессирования патологического состояния — слабоумие не нарастает с течением времени.
Этиология и патогенез В настоящее время известно более сотни различных факторов, способных приводить к слабоумию, однако и причины, и механизм развития олигофрении во многом изучены недостаточно. Прежде всего принято выделять повреждающие эндогенные и экзогенные (т. е. внутренние и внешние) факторы, возможно также и разнообразное их сочетание. Считается, что олигофрения эндогенной природы развивается вследствие поражения половых клеток родителей, в то время как экзогенные факторы действуют в пренатальном и раннем постнатальном периодах (т. е. до рождения и сразу после рождения ребенка). Среди множества причин, приводящих к развитию умственной отсталости, принято выделять следующие: — наследственно обусловленные расстройства обмена веществ и хромосомные болезни; — различные инфекционные агенты, способные оказывать повреждающее действие в период внутриутробного развития или в первые годы жизни, например нейротропные вирусы; — разнообразные интоксикации, например алкоголизм (см.); — действие ионизирующей радиации в период беременности (см.); — иммунологическая несовместимость тканей матери и плода; — разнообразные нарушения питания плода, особенно кислородное голодание; — недоношенность беременности, механические травмы в родах и в меньшей степени — в первые годы жизни ребенка; — влияние негативных социальных и культурных факторов. Действие вредного фактора возможно на еще неоплодотворенную клетку, приводя к гаметопатиям (поражение половых клеток). Также возможно повреждение зародыша на любом этапе внутриутробного развития, начиная с первой недели и вплоть до рождения ребенка. Важное значение в формировании олигофрении имеет сам этиологический фактор, продолжительность и интенсивность его действия, а также период развития организма. Скажем, вирус краснухи (см.) после четвертого месяца внутриутробного развития уже не опасен. Доказано, что к развитию олигофрении могут приводить и воздействия в перинатальном и постнатальном периодах, однако ведущее значение придается поражению во время внутриутробного развития, так как наиболее грубые пороки возникают в период закладки, формирования органов и их специализации. Общепринятой единой классификации умственной отсталости не выработано. По времени патологического воздействия выделяют три большие группы слабоумия: — наследственные и семейные олигофрении; — олигофрении, обусловленные поражением эмбриона или плода; — олигофрении, обусловленные поражениями во время родов (см.) и в первые месяцы или годы жизни. Принято также выделять олигофрении с выясненным и с невыясненным происхождением. Олигофрении с выясненным происхождением принято подразделять на следующие группы: — вследствие наследственных заболеваний; — вследствие воздействия различных вредностей в периоде внутриутробного развития; — вызванные воздействием различных вредностей в перинатальном периоде и в первые месяцы и годы жизни; — олигофрении как следствие негативных психосоциальных воздействий. Олигофрении вследствие наследственных заболеваний включают умственную отсталость в связи с генными болезнями и хромосомными болезнями. Среди генных болезней, приводящих к олигофрении, основное место занимают метаболические, или энзимопатические, расстройства, обусловленные наследственными болезнями обмена веществ. Из них более изучена фенилкетонурия (см.), или болезнь Феллинга, сопровождающаяся обычно глубокой степенью умственной отсталости — идиотией или имбецильностью. Среди других метаболических причин развития олигофрении отмечают галактоземию (см.), цитруллинурию, гаргоилизм, синдром Лоренса-Муна, синдром Барде-Бидля, синдром Крузона и др. Среди хромосомных болезней, сочетающихся с умственной отсталостью, наиболее известна болезнь Дауна (см.). Олигофрении в период внутриутробного развития могут развиваться вследствие краснухи (см.), гриппа (см.) (реже), токсоплазмоза (см.), на почве врожденного сифилиса (см.), резус-конфликта, на основе эндокринных нарушений. К этой же группе относят олигофрению вследствие родовых осложнений. Олигофрения раннего возраста может развиваться на почве перенесенных в раннем детстве менингитов (см.), менингоэнцефалитов и энцефалитов (см.), вызванных различными возбудителями — менингококками, вирусами энцефалитов, гриппа (см.), кори (см.), паротита (см.), краснухи (см.). Примером умственной отсталости вследствие негативных психосоциальных влияний служат неоднократно описанные случаи развития детей вне человеческой среды (человек-волк, синдром Маугли). Большое значение в этих случаях имеет феномен депривации — лишение или ограничение возможностей удовлетворения каких-либо потребностей. Клиническая классификация предусматривает деление умственной отсталости по степени ее выраженности: идиотия представляет наиболее резко выраженную степень олигофрении; имбецильность характеризует среднюю степень; дебильность означает наиболее легкую степень умственной отсталости.
Клиническая картина Общие проявления Для всех форм олигофрении типично общее недоразвитие психики, включая недоразвитие познавательных способностей и личности в целом. Страдают прежде всего высшие формы познавательной деятельности, а именно абстрактное мышление, в то время как эволюционно более ранние составляющие личности (инстинкты) значительно не меняются. Следует отметить, что дефекты психического развития при олигофрении проявляются в индивидуальном развитии постепенно. Нередко эти особенности становятся более заметны к концу дошкольного — началу школьного возраста ребенка. В раннем детском возрасте недоразвитие психических функций может проявляться недостаточностью эмоциональных реакций, отставанием в развитии речи, слабой выраженностью познавательного интереса к окружающему и т. д. Для детей школьного возраста типичны слабость или невозможность обобщения, неспособность выделения существенных признаков предметов и явлений. При глубокой степени умственной отсталости обучение вообще невозможно. Для подростков и взрослых, помимо недостаточности абстрактного мышления, характерна незрелость личности, что проявляется повышенной внушаемостью, неспособностью к принятию самостоятельных решений в непростых ситуациях, импульсивностью поступков, некритичностью. Олигофрения характеризуется интеллектуальной недостаточностью, что проявляется в недостаточности восприятия, расстройстве активного внимания, замедлении и непрочности запоминания, низком уровне логической памяти. Типичны следующие признаки: недоразвитие интеллектуальных и нравственных эмоций, неадекватность реакций на переживаемые события, слабость инициативы, недостаточная целенаправленность действий. При рассмотрении клинических проявлений олигофрении в зависимости от степени ее выраженности (дебильность, имбецильность, идиотия) следует отметить, что не во всех случаях удается четко отдифференцировать степени задержки психического развития (например, грань между легкой степенью идиотии и глубокой имбецильностью или между выраженной дебильностью и легкой степенью имбецильности нередко размыта). Одним из критериев выраженности олигофрении служит интеллектуальный коэффициент (IQ), определяемый на основе выполнения стандартных психологических тестов, позволяющих оценивать интеллект количественно.
Дебильность Наиболее легкой степенью умственной отсталости является дебильность. IQ при дебильности равен 50–60. Расстройства познавательной деятельности в этой группе олигофренов характеризуются прежде всего неспособностью к выработке сложных понятий, вследствие чего им обычно недоступны абстрактное мышление и сложные обобщения. Однако при наиболее легкой степени дебильности способность к абстрактному мышлению может быть в принципе сохранена, хотя и весьма ограниченна: при этом характерно преобладание конкретно-описательного типа мышления, типично отражение лишь внешних сторон происходящих или наблюдаемых событий. Речь при дебильности для обиходного общения развита достаточно, сохранена способность к освоению несложных знаний и профессиональных навыков, хотя усвоение информации дается с большим трудом. Также сохранены определенная степень адекватности и самостоятельности поведения в привычной обстановке. Во многих случаях дебилы способны удовлетворительно адаптироваться к стабильным, привычным для них условиям. Собственных суждений они не имеют, но могут запоминать различные правила, выражения, взгляды других людей и шаблонно им следовать; при легкой степени дебильности возможны хорошая ориентированность в окружающей обстановке, достаточная осведомленность и даже хитрость («их умение больше их знания»). Более того, у отдельных людей возможна односторонняя частичная одаренность — например, способность к умножению в уме больших цифр, великолепная механическая память без осмысления воспроизводимой информации и т. д. При разумном руководстве и профессиональной организации дебилы могут овладеть определенными несложными трудовыми профессиональными навыками. Типичными проявлениями дебильности являются высокая внушаемость и легкая управляемость со стороны окружающих, что в определенных ситуациях может представлять опасность. Кроме того, нередко встречаются среди дебилов лица с гиперболизированными примитивными инстинктами, в частности повышенной сексуальностью и распущенностью. Характер у дебилов может варьировать от приветливого и добродушного до агрессивного, мстительного и упрямо-злобного.
Имбецильность Имбецильность — средняя степень умственной отсталости; IQ равен 20–49. Для имбецильности характерны выраженная конкретность мышления, невозможность или резкое затруднение образования понятий, отсутствие способности к обобщениям и абстрактному мышлению. Имбецилы понимают простую речь, при этом своя речь у них развита явно недостаточно, она состоит чаще всего из очень коротких стандартных фраз, включающих обычно существительное и прилагательное (или глагол); для них также типично косноязычие. Адаптация к окружающему при имбецильности возможна только в определенных, очень стабильных условиях, в хорошо знакомой, привычной обстановке, что обусловлено неспособностью к самостоятельному мышлению. Имбецилы нуждаются в постоянном руководстве, малейшее изменение ситуации приводит их в замешательство, в затруднительное положение. Для имбецилов характерна очень высокая внушаемость, их собственные интересы остаются на примитивном уровне и направлены в основном на удовлетворение физиологических потребностей; довольно часто они много едят, бывают неряшливы. Сексуальность может быть как понижена, так и повышена; в последнем случае типично распущенное поведение. Однако имбецилы способны приобретать навыки самообслуживания, например самостоятельно есть и одеваться, а методом тренировки подражающих действий даже могут овладеть простейшими трудовыми навыками, например уборкой помещений. В зависимости от поведения их подразделяют на две группы: имбецилы подвижные, активные, непоседливые и равнодушные, вялые, апатичные. По характеру выделяют также две противоположные группы: приветливые, добродушные, покладистые и агрессивные, упрямые, злобные.
Идиотия Наиболее тяжелой степенью умственной отсталости является идиотия. Глубокая идиотия характеризуется почти полным отсутствием познавательной деятельности. IQ идиотов менее 20. Они чаще всего никак не реагируют на окружающее, их внимание не привлекают даже такие отчетливые раздражители, как яркий свет или громкий звук. Мышление и речь идиотов почти не развиты, расстройство их познавательной деятельности классифицируется как неспособность строить новые связи, образовывать представления. Их реакции на окружающее или отсутствуют, или неадекватны, эмоции ограничены чувствами удовольствия или неудовольствия, любая осмысленная деятельность, в том числе самообслуживание, недоступна. Речь при глубокой идиотии отсутствует полностью. При глубокой идиотии отсутствуют различия между горячим и холодным, высоким и низким, съедобным и несъедобным, сухим и мокрым. Самостоятельно эти люди не умеют одеться и раздеться, не в состоянии пользоваться даже ложкой, многие не могут самостоятельно стоять и ходить. При глубокой степени идиотии часто снижены многие виды чувствительности, в том числе болевая. Примитивностью и слабой координированностью характеризуются и двигательные реакции — движения у идиотов неуклюжие, однообразные, повторяющиеся, несогласованные; нередко отмечается монотонное равномерное раскачивание туловища вперед и назад, кивательные движения головой и т. п. Идиотия средней и легкой степени отличается проявлениями примитивной познавательной деятельности; при этом может быть сохранена способность различать окружающих, узнавать некоторых из них, выражать радость, усваивать элементарные навыки, отличать горячее (пламя, кипяток). При идиотии средней и (чаще) легкой степени сохранена способность издавать членораздельные звуки и запоминать отдельные слова из повседневного лексикона. Безусловно, лица с любой степенью идиотии нуждаются в специальном надзоре и уходе.
Другие проявления олигофрении Помимо расстройств интеллекта, олигофрении нередко сопутствуют самые разнообразные пороки развития, более выраженные при идиотии и имбецильности: пороки развития черепа (дискрании), в том числе микроцефалия и макроцефалия; пороки строения лица (заячья губа, волчья пасть, уродливые зубы, деформированные уши, поражения глаз); очень высокий или очень низкий рост; шестипалость или четырехпалость; ожирение; различные пороки развития внутренних органов. Кроме того, нередко выявляются различные неврологическиерасстройства: парезы и параличи черепных нервов (косоглазие, асимметрия лица, птоз, расстройства слуха, зрения); нарушения чувствительности, изменения рефлексов вплоть до полного их отсутствия, судорожные явления, различные трофические расстройства. Отдельные формы олигофрении с выясненным происхождением характеризуются отмеченными клиническими особенностями. Так, например, при олигофрении, протекающей на фоне фенилкетонурии, психическое состояние в целом отличается безразличием, астенизацией, вялостью, которые сменяются периодическими приступами раздражительности или даже злобы. Кроме того, могут отмечаться расстройства походки, повышение мышечного тонуса, судорожные припадки, а также нарушение пигментации глаз и волос, пороки развития верхней челюсти и зубов. При олигофрении, связанной с гаргоилизмом, отмечаются глубокая умственная отсталость, поражение нервной системы, внутренних органов и опорно-двигательного аппарата, глаз. Изменения внешности весьма характерны — карликовый рост с огромной головой, искаженные формы лица, ушей, носа, зубов, деформация позвоночника. При болезни Дауна (см.) чаще наблюдается идиотия или имбецильность, реже — дебильность; довольно характерны косноязычность, неловкость и неточность движений, часто в сочетании с непоседливостью. Типичной особенностью олигофрении при болезни Дауна (см.) является склонность к подражательности по типу бессмысленного копирования. Олигофрения, развившаяся вследствие краснухи (см.), может сопровождаться судорожными припадками за счет поражения центральной нервной системы. Для олигофрении на почве токсоплазмоза (см.) характерны выраженная степень слабоумия в сочетании со злобностью, поражение глаз (микрофтальмия, атрофия зрительных нервов), гидроцефалия (см.), очаги обызвествления в головном мозге, поражения внутренних органов (печени, почек).
Диагностика и дифдиагностика Помимо установления диагноза слабоумия, важной задачей является точное определение формы олигофрении, что в случае идиотии и (или) имбецильности обычно затруднений не вызывает. Как правило, определенные сложности могут возникать при определении дебильности. Обследование пациента при установлении диагноза «олигофрения» предусматривает тщательный сбор личного и семейного анамнеза, в том числе выявление среди родственников аналогичных случаев. Подробно исследуются течение беременности (см.) матери обследуемого, характер ее питания, наличие вредностей, течение родов (см.) и послеродового периода. Далее план обследования предусматривает диагностику психических, неврологических и физических нарушений. Изучение психического состояния прежде всего направлено на выявление уровня интеллекта и развития речи обследуемого. Также проводятся определенные лабораторные, в том числе биохимические, иммунологические, цитологические исследования, используются патофизиологические и психологические методики для установления причин и степени слабоумия. Дифференциальная диагностика олигофрении проводится со сходными внешне состояниями: — педагогической запущенностью; — длительной выраженной астенизацией из-за тяжелых соматических болезней и расстройств питания; — прогрессирующими психическими заболеваниями и прежде всего шизофренией (см.) и эпилепсией (см.), приводящими к развитию выраженного слабоумия. При педагогической запущенности и астенизации адекватная педагогическая и медицинская реабилитация довольно эффективно ликвидирует некоторую задержку психического развития ребенка; при этом не обнаруживаются кардинальные признаки олигофрении — нарушение абстрактного мышления, неспособность выработки понятий и представлений. В процессе дифференциальной диагностики олигофрении с шизофренией (см.) (эпилепсией (см.)) помимо истории болезни (в случае психического заболевания, как правило, ребенок успешно развивался до определенного времени) обнаруживают типичные симптомы, характерные для этих психических заболеваний. При психозах (шизофрения) крайне типично прогрессирование как общего патологического процесса, так и слабоумия; олигофрения характеризуется стойкостью, отсутствием прогрессирования имеющегося состояния.
Лечение и профилактика Основой борьбы с умственной отсталостью является профилактика, которая подразделяется на первичную и вторичную. Первичная профилактика предусматривает медико-генетическое консультирование, пренатальную диагностику аномалий развития центральной нервной системы эмбриона и плода, что позволяет предупредить рождение умственно отсталого ребенка. Кроме этого, к первичной профилактике относятся меры по охране здоровья беременных, в частности по предупреждению у них инфекционных заболеваний, а также родового травматизма. Важное значение имеет полноценное, максимально адекватное лечение внутриутробных и постнатальных нейроинфекций. Меры вторичной профилактики включают раннее выявление умственной отсталости, своевременное, полноценное лечение и реабилитацию лиц с олигофренией. Если выявление и лечение олигофренов является преимущественно медицинской проблемой, то реабилитация представляет собой комплекс мер, ведущее значение среди которых имеет социальное обеспечение. Лечение возможно в двух направлениях: — специфическая терапия при этиологически выясненных формах олигофрении, а именно при метаболических формах слабоумия; — общие лечебные мероприятия независимо от вызвавшей слабоумие причины. Удовлетворительные результаты у лиц с умственной отсталостью возможны при сочетании специальных педагогических и лечебных мероприятий, включающих не только медикаментозную, но и трудотерапию. Важно обучение больных навыкам самообслуживания: обучение чтению, письму, труду проводится по специальной методике и упрощенной программе. Не менее важно рациональное трудоустройство. Из медикаментозных средств используют препараты, влияющие на обменные процессы головного мозга: ноотропы (пирацетам, ноотропил, аминалон и др.), глютаминовую кислоту, глицин, витамины. При психотропном возбуждении назначаются транквилизаторы и нейролептики. При повышении внутричерепного давления назначается дегидратационная терапия.
ОМОЗОЛЕЛОСТЬ
ОпределениеОмозолелость представляет собой ограниченное утолщение рогового слоя кожи, развивающееся на месте повторных механических раздражений.Давление и трение на ограниченном участке способствуют расстройству местного кровообращения и усилению кератинизации (ороговения).
Этиология Развивается омозолелость преимущественно на ладонях и пятках, реже возникает в других местах. Способствуют развитию омозолелости ношение неудобной обуви, а также особенности профессии. У плотников и слесарей омозолелость развивается на ладонях и пальцах рук, у скрипачей и альтистов — на подбородке и кончиках пальцев левой (у левшей — правой) руки. К способствующим развитию омозолелости факторам относятся плоскостопие (см.) и гипергидроз (см.).
Клиническая картина и диагностика Омозолелость, как правило, не имеет четких границ, ее поверхность может быть гладкой или шероховатой, а форма плоской или выпуклой. В типичных случаях цвет омозолелости желтовато-бурый. Характерно снижение чувствительности в области омозолелости; появление болезненности связано обычно с давлением, инфицированием, образованием трещин. Частным случаем омозолелости является мозоль, чаще всего локализующаяся на дорсальной поверхности межфаланговых суставов, реже на боковой поверхности ног. Мозоль имеет вид узловатого участка гиперкератоза, вклинившегося в глубину кожи в виде конуса. Характерна выраженная болезненность мозоли при надавливании. Диагностика не вызывает сложностей; дифференцировать следует с подошвенными бородавками (см.), наследственными кератозами (см.).
Лечение и профилактика Современная фармакологическая промышленность предлагает широкий спектр кератолитических средств, большинство из которых используют после размягчения омозолелости тепло-горячими местными ванночками. Мерами предупреждения омозолелости являются тщательный повседневный уход за кожей (прежде всего стоп), правильный подбор обуви, лечение плоскостопия и гипергидроза (см.), профилактика постоянной травматизации кожи. Склонным к развитию омозолелости лицам рекомендуют прием повторными курсами витамина А внутрь.
ОМФАЛИТ
ОпределениеОмфалит представляет собой воспаление кожи и подкожной клетчатки в области пупка, развивающееся чаще всего у новорожденных в связи с инфицированием при перевязке пуповины.
Этиология Инфицирование прилежащих к пупку тканей происходит через культю пуповины или через ранку после ее отпадения. Возбудителем омфалита чаще служат кокки (стафилококки, стрептококки, реже пневмококки) и грамотрицательная флора. В отдельных случаях воспалительный процесс может распространяться по пупочным сосудам и вызывать флегмону (см.) в области пупка. Возможно также вовлечение в патологический процесс пупочной вены с развитием флебита (см.). Имеют значение и фоновые факторы, способствующие развитию омфалита: перинатальная гипоксия, неадекватная первичная и вторичная обработка пуповины, нарушение правил антисептической обработки новорожденного, анатомическая предрасположенность в виде толстой пуповины, вяло сокращающегося пупочного кольца.
Клиническая картина и диагностика Различают простую, флегмонозную и некротическую формы омфалита. Наиболее благоприятной в прогностическом отношении является самая распространенная простая форма (мокнущий пупок), при которой на пупке возникает длительно не заживающая гранулирующая рана со скудным серозным или серозно-гнойным отделяемым. Может наблюдаться избыточное разрастание гранулирующей ткани, что приводит к образованию выпячивания. Периодически рана покрывается коркой. Общее состояние ребенка не страдает. Флегмонозная форма проявляется острым воспалением вокруг пупочной раны — отечностью и покраснением кожи и симптомами общей интоксикации; состояние ребенка ухудшается, повышается температура тела. При ограниченном процессе повышение температуры не превышает обычно 38 °C, общее состояние ухудшается умеренно, однако при обширной флегмоне (см.) наблюдаются резкая интоксикация и высокая (выше 39 °C) температура. Крайне редкая некротическая форма омфалита представляет собой осложнение болезни у резко ослабленных детей, характеризующееся образованием в области пупка большой глубокой раны за счет стремительного некротического процесса. К наиболее опасным осложнениям омфалита относятся сепсис (см.), флегмона (см.) брюшной стенки, контактный перитонит (см.), абсцессы (см.) печени. Характерная клиническая картина омфалита и локализация процесса указывают на диагноз болезни; однако в отдельных случаях возникает необходимость дифференцирования простого омфалита с врожденными пупочными свищами и кальцинозом (см.) пупка, а флегмонозной формы — с флегмоной (см.) новорожденных.
Лечение и профилактика Лечение простого омфалита чаще всего проводится амбулаторно с помощью обработки раны дезинфицирующими и прижигающими растворами. Дети с флегмонозными и гангренозными формами госпитализируются в хирургические отделения стационаров, где проводится комплексное лечение, включающее оперативное вмешательство (вскрытие гнойников), использование медикаментов общего действия (антибиотики, средства дезинтоксикации), физиотерапевтические процедуры. Предупреждение омфалита заключается в соблюдении правил асептики при перевязке пуповины и последующем адекватном уходе за пупочной раной.
ОНАНИЗМ
ОпределениеОнанизм (мастурбация) — половое самоудовлетворение путем искусственного (чаще всего физического) раздражения эрогенных зон.Традиционное отношение к онанизму у иудеев и христиан негативное, это занятие считается греховным. Сам термин «онанизм» происходит от имени библейского персонажа Онана (Книга Бытия, 38:8-10). Отношение церкви к мастурбации и сегодня продолжает оставаться отрицательным. Это мнение разделяют большинство современных людей, но абсолютное неприятие мастурбации, вызывающей, согласно прежним представлениям, болезни и психические расстройства (см.), сегодня отсутствует. Статистические данные, касающиеся онанизма, у различных исследователей нередко значительно разнятся. Объясняется это тем, что необходимая статистика может быть основана только на анкетировании или опросах, что снижает достоверность полученных данных в силу человеческого фактора. Широко известными исследованиями по вопросам секса стали работы К. Кинзи (1894–1956 гг.), основанные на опросах тысяч мужчин и женщин из разных слоев общества по всей территории США. В 1948 г. К. Кинзи (в соавторстве с У. Помроем и К. Мартином) опубликовал труд «Сексуальное поведение мужчины», а в 1953 г. (в соавторстве с П. Гебхардом) — вторую часть знаменитого исследования — «Сексуальное поведение женщины». По данным К. Кинзи, в возрасте 15 лет мастурбацией до оргазма занимаются 82 % юношей и только 20 % девушек, причем это соотношение сохраняется практически в течение всего подросткового периода. В опубликованном в 1973 г. обзоре С. Соринсона данные иные: юноши — 58 %, девушки — 39 %, а к двадцати годам эти цифры составляют соответственно 85 % и 60 %. У. Мастерс и В. Джонсон (русский перевод 1991 г.) на основании опроса 580 женщин в возрасте 18–30 лет показали, что почти три четверти из них занимались мастурбацией в подростковом периоде. По данным К. Кинзи, хотя бы один раз в жизни мастурбацией занимались 92 % мужчин и 62 % женщин. Сходные результаты были получены в 1975 г. (М. Хант, по данным журнала «Плейбой»): 94 % взрослых мужчин и 63 % взрослых женщин занимались мастурбацией. Опрос, проведенный Арафатом и Коттоном среди студентов колледжа в 1974 г., показал, что опыт мастурбации имели 89 % юношей и 61 % девушек. Интересно, что вступление в брак не означает прекращение практики онанизма. Среди молодых мужчин 72 % занимаются мастурбацией не реже 24 раз в год, среди замужних молодых женщин 68 % прибегают к мастурбации приблизительно 10 раз в год. Более того, среди состоящих в браке людей старшего возраста мастурбация является распространенной формой сексуального поведения.
Этиология, клиническая картина и профилактика До настоящего времени существуют противоречивые суждения о влиянии мастурбации на здоровье. Часть специалистов считает, что онанизм лежит в основе самых различных половых расстройств; другие ученые полностью отрицают вредное влияние мастурбации на здоровье. В настоящее время признано, что исключительно медицинская точка зрения по данному вопросу не может быть всесторонней. По мнению большинства сексологов, первый опыт мастурбации люди получают в периоде полового созревания, но с началом половой жизни практика онанизма прекращается. В основе этого процесса лежит дисгармония между уже достаточно выраженной сексуальностью и социальной незрелостью. К мастурбации люди прибегают как к средству, позволяющему снять или уменьшить проявления физиологического дискомфорта, лежащего в основе биологической (сексуальной) потребности индивидуума при отсутствии возможности удовлетворения этой потребности адекватно. Кроме того, выделяют раннюю, или допубертатную, мастурбацию, начинающуюся до периода полового созревания; так называемую заместительную (чаще у женщин в начале половой жизни); и подражательную (у детей или подростков). По мнению большинства специалистов, онанизм периода полового созревания не влияет на состояние здоровья, в том числе на состояние полового благополучия. Сексуальные дисфункции не связаны с мастурбацией периода юношеской гиперсексуальности. Существует мнение, согласно которому негативное влияние онанизма связано прежде всего со страхом перед его последствиями, способным привести к невротическим расстройствам. В то же время чрезвычайно раннее пробуждение сексуальности как следствие раннего онанизма способно оказывать значительное влияние на формирование личности. Способствовать раннему онанизму может тесная одежда ребенка, некоторые действия родителей (раздражение эрогенных зон), стремление к подражанию. Для предупреждения ранней мастурбации рекомендуются следующие меры: ребенка нужно укладывать спать так, чтобы руки находились поверх одеяла; одежда не должна быть тесной; нижнее белье следует менять ежедневно. Немаловажное значение имеет режим сна, в том числе быстрый подъем, мытье на ночь ног прохладной водой, достаточная занятость ребенка, приобщение к физкультуре и спорту, закаливание. Для предупреждения раннего онанизма имеет большое значение своевременное выявление и полноценное лечение у ребенка глистных заражений. Энтеробиоз (см.), например, вызывает зуд области заднего прохода, промежности и гениталий. В большинстве случаев мастурбация осуществляется путем трения, поглаживания или сжимания половых органов или других частей тела, например молочных желез, внутренней стороны бедер, заднего прохода. Мастурбации почти всегда сопутствуют сексуальные фантазии и лишь у 7 % девушек и 11 % юношей мастурбация ими не сопровождается. Современная секс-индустрия предлагает множество различных приспособлений для мастурбации (как женщинам, так и мужчинам). Установлено, что оргазм, стремительно наступающий вследствие интенсивного действия вибратора, не всегда безобиден: при постоянном использовании механических средств возможно развитие у женщин фрустрации (сочетание подавленного настроения с напряжением и тревогой) и чувства неудовлетворенности. Не все приспособления для мужской мастурбации изготовлены с учетом медицинских рекомендаций и в отдельных случаях могут представлять опасность для здоровья. Современный взгляд на проблему мастурбации состоит в том, что каждый человек свободен в выборе; консультация специалиста нужна, если пациент испытывает внутреннее беспокойство, чувство вины или подавленности.
ОПИСТОРХОЗ
ОпределениеОписторхоз — пероральный биогельминтоз, вызываемый паразитическими червями и характеризующимся преимущественным поражением печени, желчного пузыря и поджелудочной железы.
Этиология Возбудитель описторхоза — сибирская или кошачья двуустка, относящаяся к классу сосальщиков. Он является гермафродитом и имеет ланцетовидное тело с ротовыми и брюшными присосками. Яйца мелкие, с крышечкой на одном из полюсов и небольшим утолщением оболочки на обоих полюсах.
Эпидемиология, патогенез и патанатомия Источником заражения служат зараженные описторхозом люди и плотоядные животные. Развитие паразита происходит в пресных водоемах. Попавшие в воду с калом больных людей и животных яйца паразита заглатываются обитающими в воде водоемов пресноводными моллюсками — промежуточными хозяевами. В моллюсках происходит развитие и размножение личиночных поколений гельминта, которое через два или три месяца заканчивается выходом в воду личинок — церкариев. Покинув моллюск, паразиты через кожу рыб внедряются в их подкожную клетчатку и мышцы, где личинки (церкарии) превращаются в метацеркарии (следующая стадия развития личинок — оболочечная, или инцистированная). Рыбы служат дополнительными хозяевами. Личинки паразитируют в мышцах рыб семейства карповых — язь, елец, линь, плотва сибирская, или чебак, плотва европейская, плотва каспийская, или вобла, лещ, сазан, красноперка, учас, густера, подуст, жерех, уклейка и др. Окончательным хозяином являются человек, кошки, собаки, лисицы, ондатры, норки, песцы. Заражение человека происходит при употреблении в пищу сырой (строганина) или недостаточно термически обработанной (проваренной, прожаренной или просоленной) рыбы с личинками гельминта. Попавшие в кишечник метацеркарии освобождаются от цистных оболочек, далее проникают в желчные пути и через две недели оформляются в половозрелых паразитов. Описторхисы паразитируют в желчных протоках, желчном пузыре, реже — в протоках поджелудочной железы окончательного хозяина. Описторхоз относится к природно-очаговым заболеваниям, так как циркуляция возбудителя в природе происходит без участия человека (роль окончательных хозяев выполняют дикие животные). В России известны два больших очага описторхоза — в Западной Сибири (в бассейнах рек Оби и Иртыша) и Пермской области (бассейн реки Камы). Групповые и единичные случаи заражения людей наблюдаются в районе побережья Черного и Каспийского морей, Ладожского озера, бассейнах Волги, Дона, Донца, Северной Двины, Немана. Болезнь регистрируется также в Европе — Австрии, Венгрии, Голландии, Франции. Кроме того, заболевание регистрируется также в Таиланде и ряде соседних стран, где описторхоз вызывается аналогичным гельминтом из класса сосальщиков. Окончательным хозяином гельминта являются человек, кошки, собаки и виверры (хищные млекопитающие), промежуточными хозяевами служат моллюски, дополнительными — пресноводные карповые рыбы. Гельминты оказывают механическое и токсическое воздействие на организм хозяина. Скопления паразитов затрудняют отток желчи и секрета поджелудочной железы. Стенки желчных протоков и протоков поджелудочной железы повреждаются и утолщаются. Продукты обмена веществ гельминтов сенсибилизируют организм. В желчных протоках создаются условия для присоединения вторичной бактериальной инфекции. В результате рефлекторных воздействий развиваются патологические изменения и нарушения функций желудка, двенадцатиперстной кишки, органов сердечно-сосудистой системы.
Клиническая картина Заболевание часто протекает как хроническое заражение с сенсибилизацией (повышением чувствительности) организма и аллергическими симптомами. Течение болезни довольно вариабельно — от бессимптомных форм до тяжелых, иногда со смертельным исходом. В острой фазе болезни выражены симптомы аллергии и общего недомогания. Затем развивается симптомокомплекс, обусловленный поражением печени, желчевыводящих протоков и желчного пузыря, поджелудочной железы. Более половины больных жалуются на боли в подложечной области и правом подреберье; у многих они смещаются в спину и (реже) в левую надреберную область. Боли могут периодически обостряться в виде приступов желчной колики (см.). Часто отмечаются головокружение, головные боли, выявляются диспепсические симптомы, может наблюдаться учащенный стул кашицеобразной консистенции. Температура тела обычно слегка повышенная или нормальная. Характерны увеличение и болезненность печени, ее уплотнение. Нередко прощупывается значительно увеличенный и напряженный желчный пузырь. Также может определяться болезненность при прощупывании поджелудочной железы. Для описторхоза характерны астенические симптомы — слабость, раздражительность, бессонница. Иногда появляются уртикарные (аллергические) высыпания. Часто отмечаются бледность кожных покровов, субиктеричность (легкая желтушность) кожи и слизистых оболочек. Эозинофилия обнаруживается со 2-й недели (раньше, чем при других гельминтозах), наблюдается умеренная анемия (см.). Почти у всех больных при исследовании желчи и дуоденального содержимого определяются слизь, лейкоциты; при застое желчи и присоединении инфекции развиваются воспалительные процессы. При описторхозе обычно развиваются хронические гепатит (см.) и панкреатит (см.). К осложнениям описторхоза относятся гнойное воспаление и разрыв желчных протоков с развитием желчного перитонита (см.); может отмечаться острый панкреатит (см.), реже регистрируется первичный рак (см.) печени, абсцессы (см.) печени, желчного протока (холангиома). Прогноз серьезный в связи с развитием тяжелых осложнений.
Диагностика Диагноз описторхоза основывается на комплексе клинико-эпидемиологических и лабораторных исследований. Для постановки диагноза важны такие эпидемиологические сведения, как пребывание пациента в очаговой зоне (рыбалка на реках Западной Сибири), употребление в пищу неправильно приготовленной рыбы семейства карповых. Лабораторная диагностика описторхоза включает обнаружение яиц паразита в дуоденальном содержимом (т. е. содержимом двенадцатиперстной кишки) и кале (она может быть эффективной не ранее чем через месяц после заражения — срок начала откладки яиц гельминтом). Концентрация яиц гельминта в дуоденальном содержимом может быть выше, чем в фекалиях, что следует учитывать при проведении лабораторных исследований. Для дифференциальной диагностики описторхоза с другими заболеваниями печени возможно проведение так называемой провокации, или пробной дегельминтизации: назначение 1/2— 1/3-суточной дозы хлоксила. В результате разрушения части паразитов повышается интенсивность выделения их яиц с желчью, что облегчает диагностику. В целях ранней диагностики могут быть использованы иммунологические методы исследования (постановка серологических реакций с сывороткой крови пациента).
Лечение До начала специфического лечения назначаются стол № 5 (лечебное питание, назначаемое при заболеваниях гепатобилиарной системы), спазмолитики (но-шпа, папаверин и др.) и желчегонные (в том числе фитопрепараты) средства. Специфические антигельминтные средства лечения описторхоза: 1. Хлоксил (гексахлорпарксилол) назначают внутрь через 15–20 мин после еды 3 раза в день. На курс лечения не назначают более 20 г препарата для взрослых. Цикл лечения занимает два (по 0,1–0,15 г на 1 кг массы тела в день) или пять дней (по 0,06 г на 1 кг массы тела в день). Порошок хлоксила взбалтывают в молоке. Слабительное при приеме хлоксила не назначают. Согласно современным исследованиям, «хлоксил действует только на половозрелых паразитов, и в связи с этим лечение в острой фазе болезни неэффективно. Целесообразно начинать лечение не ранее чем через 1,5 месяца после заражения». 2. Билтрицид в настоящее время является препаратом выбора; синоним билтрицида — празиквантел. Препарат назначают внутрь после еды по 20–25 мг/кг. Максимальная доза составляет 40 мг/кг. Лечение билтрицидом проводится в течение одного дня за 1, 2 или 3 приема. Таблетки проглатывают целиком с небольшим количеством жидкости. При одноразовом приеме таблетки рекомендуется принимать вечером, при 2—3-разовом — с интервалом 4–6 ч. Слабительное при приеме билтрицида не назначают. Препарат может оказывать следующие побочные эффекты: боли в животе, тошнота, рвота, сонливость, дезориентация в пространстве и времени, а также крапивница (см.), кожный зуд (см.) и повышение температуры.
Профилактика Человек до 30 лет может быть носителем паразита и выделять с калом яйца гельминта в окружающую среду. Поэтому точная и своевременная диагностика, выявление носителей, адекватное качественное лечение больных, а также охрана и обеззараживание воды водоемов являются важными профилактическими мерами в отношении описторхоза. Однако основное значение в профилактике заражения описторхозом имеет исключение из питания сырой, недостаточно просоленной или недостаточно термически обработанной рыбы. Связано это с тем, что предохранить водоемы от фекального загрязнения нереально — в природе дикие животные (кошки, собаки, лисицы, ондатры, норки) и рыбы семейства карповых (язь, елец, линь, плотва сибирская, или чебак, плотва европейская, плотва каспийская, или вобла, лещ, сазан, красноперка, учас, густера, подуст, жерех, уклейка и др.) поддерживают циркуляцию возбудителя, формируя природные очаги описторхоза. Установлено, что личинки описторхоза погибают при варке зараженной рыбы кусками от начала кипения через 20 мин, во фрикадельках из рыбного фарша — через 10 мин. Горячее копчение полностью обеззараживает зараженную рыбу. Жарить рыбу рекомендуется небольшими кусками в течение 15–20 мин, не менее. При засоле рыбы температура рассола должна быть 16–20 °C, а рыба должна находиться в нем не менее 14 дней. Для засола на 10 кг рыбы следует использовать 2,7–2,9 кг поваренной соли.
ОПРЕЛОСТЬ
ОпределениеОпрелость — воспалительное поражение кожных складок, развивающееся в результате трения соприкасающихся поверхностей кожи, раздражающего действия продуктов кожного секрета и других выделений организма.
Этиология Причинами опрелости являются усиленное пото- и салоотделение, недержание мочи, бели, геморрой (см.). У детей первого года жизни возникновению опрелости, помимо физиологических особенностей кожи (повышенная чувствительность и ранимость), могут способствовать внешние факторы — нерегулярный туалет кожи, недостаточное просушивание складок после купания, перегревание ребенка. Опрелость чаще наблюдается у детей с аллергическими дерматозами (см.), диатезом (см.), диспепсией (расстройство пищеварения).
Клиническая картина и диагностика Наиболее частая локализация опрелости — межпальцевые складки ног, пахово-бедренные и межъягодичные складки, подмышечные впадины, складки под молочными железами, складки живота у тучных пациентов. Различают три степени опрелости: — I степень имеет вид эритемы (ограниченного покраснения кожи) без четких границ; — II степень характеризуется образованием в глубине складок поверхностных трещин и мелких поверхностных эрозий; — III степень опрелости проявляется резкой мацерацией (размягчением и мокнутием) рогового слоя эпидермиса, образованием обширных мокнущих эрозивных поверхностей с неровными очертаниями. Обычно опрелость не сопровождается общими расстройствами, однако у маленьких детей могут отмечаться беспокойство, плаксивость, снижение аппетита, отсутствие прибавки веса. Течение опрелости может осложняться присоединением инфекции (кокки, грибки). В этих случаях опрелость характеризуется четкими фестончатыми границами за счет отслаивания рогового слоя, наклонностью к периферическому росту, наличием вокруг очага пятнистых, везикулезных (в виде пузырьков) или пустулезных элементов, торпидным течением. Такая инфицированная опрелость может со временем закончиться микробной экземой (см.). В типичных случаях диагноз опрелости сложностей не вызывает. Дифференцировать опрелость следует с эритразмой (псевдомикоз, вызываемый коринебактериями), эпидермофитией (см.), экземой (см.), реже псориазом (см.).
Лечение и профилактика Опрелость I степени требует лишь тщательного соблюдения гигиенических принципов; при этом не рекомендуется одновременное использование кремов и припудривания. При опрелости II степени после туалета и просушивания поверхности применяют различные противовоспалительные мази, содержащие кортикостероиды и (или) антибиотики. Местное лечение опрелости III степени начинают с примочек, затем наносят пасты и (или) мази. До сих пор в терапии опрелости не потеряли своего значения пасты и мази, содержащие цинк. Показано также ультрафиолетовое облучение, воздушные ванны. Однако нередко при опрелости III степени (а иногда и II степени) одно только местное лечение оказывается малоэффективным. В этих случаях следует принять меры по повышению общей сопротивляемости организма пациента (иммуномодуляторы, витаминотерапия). Профилактика опрелости — это комплекс повседневных гигиенических процедур, режима и правильного сбалансированного питания с достаточным количеством витаминов. У детей предупреждение опрелости основано на скрупулезном выполнении правил ухода за ребенком.
ОПУХОЛИ
ОпределениеОпухоли (синонимы: новообразования, бластомы) — избыточное, неконтролируемое организмом разрастание тканей, продолжающееся после прекращения действия вызвавших его причин. Основными признаками опухоли являются атипия клеток, автономный рост и прогрессирование опухоли.Различают доброкачественные и злокачественные опухоли. Доброкачественные опухоли характеризуются экспансивным ростом, способны отодвигать, сдвигать или (реже) сдавливать окружающие ткани. При этом образуются четкие границы между опухолью и окружающими ее тканями. Злокачественные опухоли инфильтрируют и разрушают окружающие ткани. Именно инфильтративный (инвазивный) рост служит главным критерием, отличающим злокачественные и доброкачественные опухоли. Злокачественные опухоли обладают также способностью метастазировать.
Этиология, патогенез и патоморфология В развитии злокачественных новообразований доказана существенная роль онкогенных веществ, ионизирующего излучения, вирусов, однако изучение причин и закономерностей распространения опухолей продолжается. Злокачественные опухоли развиваются, как правило, длительно. Под воздействием канцерогенных факторов развивается распространенное изменение тканей, проявляющееся ускоренным разрастанием клеточных элементов. В очагах ускоренного роста (поначалу на микроскопическом уровне) происходит предшествующий раку процесс роста клеток невоспалительного характера с наклонностью к инфильтрации. Такие процессы предшествуют раку (см.) и называются предраковыми. Предраковые заболевания характеризуются длительным течением и подразделяются на облигатные и факультативные. Облигатный предрак является хроническим заболеванием, на почве которого всегда или очень часто развивается злокачественная опухоль; факультативный предрак — болезнь, на почве которой рак (см.) развивается относительно редко, но чаще, чем у здоровых людей. Продолжительность развития рака (см.) зависит от интенсивности процессов роста и выраженности клеточной атипии. Нарушение структуры ткани в виде патологического разрастания и клеточного атипизма называется дисплазией. Интенсивность роста злокачественной опухоли определяется тканевым строением опухоли и индивидуальным состоянием макроорганизма. Ранний рак (этот термин принят для новообразований внутренних органов) представляет собой небольшую опухоль, не распространяющуюся за пределы слизистой оболочки и подслизистого слоя. Различают экзофитный рак (опухоль выступает в просвет полого органа или располагается в толще паренхиматозного); блюдцеобразный (образуется при распаде экзофитной (растущей вовне) опухоли); эндофитный, или инфильтративный рак (распространяется преимущественно по стенке органа) и язвенно-инфильтративный рак (образуется при распаде эндофитного рака). Классификация Международного противоракового союза (система TNM) учитывает три основных параметра: индекс Т обозначает размер опухоли; индекс N характеризует поражение регионарных лимфатических узлов; индекс M обозначает отдаленные или лимфогенные метастазы. Индекс Т: Т0 — первичная опухоль не определяется; Т1 — небольшая (обычно до 2 см) опухоль, расположенная на поверхности органа; Т2 — опухоль тех же или несколько больших размеров, но с инфильтрацией более глубоких слоев или с переходом на соседние анатомические части органа; Т3 — опухоль значительных размеров или прорастающая в глубину органа и ограничивающая его подвижность, или переходящая на соседние органы и ткани; Т4 — опухоль, прорастающая в соседние структуры с полным ограничением подвижности органа. Индекс N: N0 — метастазы в лимфатические узлы отсутствуют; N1 — одиночные (меньше 3) метастазы в лимфатические узлы; N2 — множественные метастазы в регионарные лимфатические узлы, спаянные или не спаянные между собой, но смещаемые по отношению к окружающим тканям; N3 — множественные несмещаемые метастазы в регионарные лимфатические узлы или поражение лимфатических узлов, расположенных в более отдаленных областях регионарного метастазирования; № — судить о поражении лимфатических узлов до оперативного вмешательства невозможно. Индекс М: M0 — метастазы в отдаленные органы и ткани отсутствуют; M1 — имеются отдаленные метастазы При отдельных опухолях система TNM использует дополнительные показатели: индекс P (прорастание) характеризует степень прорастания стенки органа при раке желудочно-кишечного тракта; индекс G (градус) обозначает степень злокачественности, используется при раке желудочно-кишечного тракта и яичников.
Клиническая картина Выделяют два периода развития злокачественной опухоли: доклинический и клинический. Доклинический этап обычно довольно длительный, он составляет большую часть времени развития опухоли и характеризуется отсутствием симптомов рака (см.). В этот период опухоль может быть случайной находкой во время хирургического вмешательства или профилактического осмотра. Клинический этап, напротив, характеризуется разнообразными проявлениями, и это позволяет онкологам утверждать, что при злокачественных новообразованиях могут регистрироваться фактически любые симптомы. Однако при всем разнообразии клинической картины нередко встречаются и характерные симптомы, свидетельствующие о возможной онкологической природе болезни. Н. Н. Трапезников и А. А. Шайн (1992 г.) выделяют пять основных клинических блоков (феноменов), характеризующих опухоль: феномен обтурации (признаки, характеризующие сдавление просвета того или иного органа); феномен деструкции (отражающий распад новообразования); феномен компрессии (отражает давление новообразования на окружающие органы, ткани, нервные стволы); феномен интоксикации (отражает нарушение обменных процессов); феномен опухолевидного образования. К другим проявлениям опухоли относят нарушение специфической функции органов, а также симптомы, которые не объясняются непосредственным влиянием новообразования или метастазами. Предшествующие заболевания и присоединение вторичной инфекции также могут сказываться на клинической картине опухоли.
Диагностика Процесс установления диагноза злокачественного новообразования включает традиционный алгоритм действий: изучение жалоб и анамнеза заболевания, физикальное обследование пациента и выполнение специальных инструментальных и лабораторных исследований. Среди инструментальных методов широко используют рентгенологическое, эндоскопическое, ультразвуковое, радиоизотопное, тепловизионное исследования, компьютерную томографию, феномен ядерно-магнитного резонанса. Для установления диагноза имеет значение исследование крови, выполнение биохимических и иммунологических тестов.
Лечение Основными методами лечения опухолей являются хирургический, лучевой и медикаментозный. Сочетание операций и лучевой терапии принято называть комбинированным лечением. Сочетание лекарственного лечения с хирургическим или с лучевой терапией называют комплексным. К концу XX в. около трети пациентов, которым ставится диагноз злокачественного новообразования, излечиваются.
ОРНИТОЗ (ПСИТТАКОЗ)
ОпределениеОрнитоз — инфекционное заболевание, передающееся человеку от инфицированных птиц преимущественно через дыхательные пути и характеризующееся первичным поражением легких и явлениями общей интоксикации. Болезнь может протекать в острой, хронической или скрытой форме.Первые случаи заболевания, возникшего при заражении от попугаев, имели клинику атипичной пневмонии и были описаны еще в XIX в. (в 1875 г., по др. сведениям — в 1876-м г). Отсюда другое название болезни — пситтакоз. В 1892 г. в Париже была описана крупная вспышка тяжелого легочного заболевания, связанная с завезенными из Буэнос-Айреса попугаями. Уже в XX в. (1930 г.) была доказана причинная связь заболевания человека и птиц. В 50-е гг. ХХ в. было установлено, что пситтакоз (болезнь попугаев) является частным случаем орнитоза.
Этиология и эпидемиология Возбудитель орнитоза широко распространен в природе. Эти патогенные микроорганизмы относятся к роду хламидий. Носителем и источником возбудителя являются около 140 видов домашних и диких птиц, причем эпидемиологическое значение их различно. В естественных условиях хранителем и носителем возбудителей являются голуби, дикие водоплавающие птицы (чайки, утки, буревестники и т. д.), возбудитель обнаружен также у снегирей, зябликов, дроздов, овсянок, куропаток, синиц, чижей, щеглов и др. В естественных условиях инфекция у птиц находится, как правило, в скрытом состоянии, но при попадании таких птиц в неволю или в другие неблагоприятные условия у них развивается заболевание. При непосредственном контакте дикие птицы заражают домашних уток, индеек, кур, что может приводить к возникновению вторичных очагов орнитоза в птицеводческих хозяйствах. Среди наиболее значимых в отношении эпидемиологической опасности представителей пернатых выделяют домашних птиц (особенно уток и индеек), сизых голубей (в том числе городских, полудиких), комнатных декоративных птиц (особенно попугаев и канареек), а также водоплавающих и колониальных диких птиц. Процент пораженности птиц орнитозом в естественных условиях высокий: у голубей в городах он достигает 50 % и более. Человек высоковосприимчив к орнитозу. Однако считается, что больной орнитозом человек для окружающих опасности не представляет. В то же время известны случаи внутрилабораторных заражений и даже внутрибольничных вспышек заболевания, что диктует необходимость соблюдения мер предосторожности. Заражение человека происходит преимущественно воздушно-капельным и пылевым путем, но возможен и путь передачи инфекции при поедании пищи, содержащей возбудителя. Птицы выделяют возбудителя с фекалиями и носовым секретом. Высохшие частицы слизи или фекалий, загрязненных возбудителем, попадают на различные объекты окружающей среды, смешиваются с пылью, что создает условия для заражения людей. От домашних птиц (утки, индейки) заражаются преимущественно люди, ухаживающие за птицамиили занимающиеся обработкой туш; от водоплавающих птиц — в основном охотники; от попугаев и канареек — любители комнатных птиц; велик риск заболеть орнитозом у любителей голубей.
Патогенез Внедрение в организм человека возбудителя орнитоза происходит через слизистые оболочки верхних дыхательных путей. Затем в эпителии дыхательных путей происходит его размножение и накопление, а в дальнейшем из легких возбудитель проникает в кровь. Кроме органов дыхания, при орнитозе поражаются лимфатическая ткань, печень, селезенка, нервная система, поражения сосудов обнаруживаются также в почках, желудке, кишечнике.
Клиническая картина Инкубационный (скрытый) период заболевания чаще продолжается 7—10–12 дней, однако в отдельных случаях может удлиняться до 3 недель. Болезнь почти всегда начинается остро — с озноба, головных и мышечных болей, повышения температуры. Продромальный период (период предвестников болезни) при орнитозе обычно не выражен. Только у части больных в течение 2 дней отмечается продромальный период в виде общей разбитости, недомогания, тошноты и болей в суставах. В типичных случаях температура тела быстро повышается до 38–39 °C и носит ремиттирующий (характеризующийся повторными периодами ослабления; от лат. remitto — «ослаблять, отпускать»), а при тяжелом течении — постоянный характер; при легком течении заболевания она субфебрильная и кратковременная (2–3 дня). В первые дни выражены также резкая слабость, бессонница, боли в горле, сухой кашель, гиперемия (покраснение) зева, тонзиллит (см.), инъекция сосудов склер и конъюнктив, боли в пояснице. Лицо больного обычно покрасневшее. На 3—4-й день у некоторых пациентов появляется сыпь аллергического характера. В связи с преобладанием в клинической картине тех или иных симптомов различают следующие варианты течения орнитоза: пневмонический, гриппоподобный, тифоидный и менингеальный. Течение орнитоза может быть тяжелым, среднетяжелым, легким и стертым, причем легкие и стертые формы встречаются редко, протекают кратковременно и нередко диагностируются как грипп или ОРВИ. Чаще всего в клинической картине орнитоза ведущую роль играют поражения легких. При пневмонической форме болезни отмечается острое повышение температуры до 39 и даже 40 °C, наблюдаются симптомы интоксикации — головная боль, озноб, профузная (обильная) потливость, боли в мышцах и суставах, заторможенность, тошнота. Со 2–3—4-го дня болезни у больных появляются сухой или со скудной слизистой мокротой кашель (см.), боли в груди, нарастают явления ларингита (см.) и особенно трахеобронхита. Воспалительные изменения в легких (пневмония) появляются с 5—7-го дня болезни и достигают своего развития к 8—12-му дню. Для орнитозной пневмонии (см.) характерны скудные специфические признаки поражения легких, выявляемые ухом: укорочение перкуторного звука определяется обычно только при массивном поражении легких или при периферической локализации очага; выслушивается жесткое дыхание; хрипы, нередко единичные, обычно выслушиваются в нижних отделах легких, чаще справа. Эти изменения непостоянны, а иногда вообще не определяются; они могут быть выражены в период обратного развития болезни при нормальной температуре тела. В то же время у 30–40 % больных отчетливые признаки пневмонии (усиление кашля, одышка, хрипы) выявляются с 8— 10-го дня болезни. Поражение легких необходимо подтверждать рентгенологически, что повышает качество диагностики орнитоза. Со стороны сердечно-сосудистой системы наблюдаются приглушение или (при тяжелом течении болезни) глухость сердечных тонов. Для орнитоза характерны неустойчивость пульса и в неосложненных случаях брадикардия (см.), которая при тяжелом течении сменяется тахикардией (см.). В периоде обратного развития болезни, а также при присоединении вторичной инфекции артериальное давление у подавляющего числа больных снижено. Признаки распространенного поражения миокарда (миокардит (см.)) отмечаются при среднетяжелом и тяжелом течении болезни. Изменения со стороны желудочно-кишечного тракта при орнитозе неспецифичны: у пациентов ухудшается аппетит, иногда отмечается полное его отсутствие, появляются тошнота, иногда рвота. Стул чаще жидкий, но может быть и запор (см.). Язык утолщен, обложен серым налетом. К концу 1-й недели болезни у большинства больных отмечается увеличение печени, у 1/3 увеличена селезенка. Нервная система поражается почти у всех больных орнитозом. Наиболее частыми симптомами являются головная боль, слабость, бессонница, адинамия (заторможенность), вялость. В тяжелых случаях развиваются депрессивное состояние и бред (см.), иногда наблюдаются спутанное сознание с психическим и двигательным возбуждением и эйфория; возможно кратковременное снижение остроты зрения, анизокория (неравенство диаметров зрачков), нистагм. В единичных случаях развивается серозный менингит (см.), течение которого обычно непродолжительное и благоприятное. В крови больных определяется лейкопения (в неосложненных случаях) или нормоцитоз, анэозинфилия. Лейкоцитоз отмечается при присоединении вторичной бактериальной инфекции. СОЭ обычно ускорена. Период выздоровления при орнитозе сопровождается астенией (слабостью), иногда анемией (см.). Рецидивы орнитоза отмечаются у 10–20 % пациентов. Примерно у 1/5 больных наблюдаются рецидивы на фоне еще не окончившихся процессов в легких и неполного выздоровления, что чаще случается у лиц старше 30 лет и при тяжелом течении орнитоза. Рецидивы могут быть ранние (на 2—4-й неделе) и поздние (через 3–6 месяцев). Иногда (до 10–12 % случаев) болезнь принимает длительное течение (до 2—10 лет) — орнитоз переходит в хроническую форму. В этих случаях у перенесших орнитоз пациентов длительно (в течение нескольких лет) отмечаются остаточные явления в виде астеновегетативных нарушений и хронических воспалительных процессов дыхательных путей и легких, очагов пневмосклероза (см.). Поражение других систем (хронические гепатиты (см.), артриты (см.)) наблюдается сравнительно редко. Встречается также скрытое течение орнитоза, которое может оканчиваться либо самопроизвольным выздоровлением и освобождением организма от возбудителя, либо (в силу неизвестных причин) развитием явных клинических проявлений с исходом в рецидивирующую или хроническую форму болезни.
Осложнения Осложнения наблюдаются довольно редко. К осложнениям орнитоза относятся парезы (см.) конечностей, параличи (см.) голосовых связок, полиневриты, тромбофлебиты (см.), энцефалит (см.), миокардит (см.).
Диагностика и дифдиагностика Диагностика и дифференциальная диагностика основывается на эпидемиологических, клинических данных и результатах лабораторных исследований. Распознавание случайных заражений орнитозом только на основании клиники, особенно в первые дни болезни, представляет очень сложную задачу. При групповых профессиональных заболеваниях диагностика болезни, когда отчетливо прослеживается эпидемиологическая цепочка, напротив, не очень сложна. К важнейшим клинико-диагностическим проявлениям орнитоза относятся острое начало заболевания, лихорадка, повышенная потливость, легочный синдром, вовлечение в процесс печени и селезенки. Важное значение для постановки диагноза имеет рентгенологическое исследование легких. Самым быстрым лабораторным методом диагностики является постановка внутрикожной пробы с орнитозным аллергеном. Наиболее убедительными методами лабораторной диагностики являются выделение возбудителя из крови или мокроты больных, а также современные иммунологические исследования (иммуноферментный анализ, иммунофлюоресценция). Не потеряли своего значения и некоторые традиционные серологические реакции, например РСК (реакция связывания комплемента). Дифференциальная диагностика орнитоза проводится с пневмониями (см.) различной этиологии, гриппом (см.) и другими вирусными респираторными заболеваниями, а также ку-лихорадкой (см.), туляремией (см.), лептоспирозом (см.), бруцеллезом (см.), инфекционным мононуклеозом (см.) и туберкулезом (см.) легких.
Лечение и профилактика Основу этиотропной терапии орнитоза составляют антибиотики. Исторически первыми эффективными препаратами стали антибиотики группы тетрациклина, не утратившие значения и сегодня: тетрациклин, метациклин, доксициклин. В настоящее время среди антибактериальных препаратов, применяемых для терапии орнитоза (пситтакоза), рекомендуются также антибиотики из группы макролидов: эритромицин, вильпрафен (синоним: джозамицин) и др. Дозы и продолжительность антибиотикотерапии определяет лечащий врач. В терапевтический комплекс включают также десенсибилизирующие (супрастин, пипольфен, гисталонг, кларитин) и противовоспалительные (аспирин) средства, а также витамины и симптоматические препараты. В случаях тяжелого течения болезни прибегают к глюкокортикоидам. Профилактика орнитоза со стороны государства включает санитарно-ветеринарные мероприятия в птицеводческих хозяйствах и карантинные меры при импорте декоративных и хозяйственных птиц. Индивидуальная профилактика сводится к информированию населения о заболевании, прежде всего об источнике инфекции и возможных путях заражения.
ОРХИТ
ОпределениеОрхит — воспаление яичка, протекающее в острой или хронической форме.
Этиология и патогенез Острый орхит В большинстве случаев острый орхит развивается вторично, в результате распространения инфекции вместе с кровотоком, реже — как проявление сепсиса. Острый гематогенный орхит развивается при эпидемическом паротите (см.) и бруцеллезе (см.), реже является осложнением пневмонии (см.), брюшного тифа (см.) и других сальмонеллезов (см.), ревматизма (см.), скарлатины (см.), ветряной оспы. Нередко инфекция лимфогенным (т. е. по лимфатическим сосудам) или контактным путем может переходить на яичко из его придатка, тогда развивается орхоэпидидимит. Кроме того, инфекция из предстательной железы, семенных пузырьков и заднего отдела уретры по семявыносящему протоку может достичь яичка. Инфицирование яичка и его придатка может быть обусловлено травмой или воспалением мочеиспускательного канала. Острому гонорейному орхиту обычно предшествуют уретрит (см.) и (или) уретропростатит. Расстройство кровообращения яичка (сдавление семенного канатика, длительное половое возбуждение без последующего семяизвержения), непосредственная травма яичка, гематома мошонки также могут осложниться острым орхитом.
Хронический орхит Хронический орхит подразделяют на первичный (хроническое воспаление) и вторичный — как следствие острого воспалительного процесса. Первичный хронический орхит формируется при специфических инфекционных заболеваниях (туберкулез (см.), бруцеллез (см.)). Неспецифический первичный орхит, в генезе (происхождении) которого определенная роль принадлежит аутоиммунному компоненту, нередко развивается после травмы яичка.
Клиническая картина Острый орхит Заболевание начинается с резкой боли в области яичка, отмечаются увеличение его размеров и повышение температуры. Часто боль смещается в паховый канал, по ходу семенного канатика, в пояснично-крестцовую область. Яичко быстро увеличивается, становится напряженным и плотным, прощупывание болезненно, но поверхность его остается гладкой. Кожа мошонки внешне не изменена, на ощупь становится горячей. Параллельно развиваются симптомы общей интоксикации — головная боль, тошнота, иногда рвота, озноб, повышение температуры тела до 39–40 °C. Такие симптомы сохраняются в течение нескольких дней, затем температура снижается, уменьшаются боли, яичко приобретает прежние размеры, нормализуется общее состояние пациента. Однако уплотнение, определяемое в ткани яичка, сохраняется довольно долго. Развитие гнойного орхита характеризуется яркой клинической картиной: температура носит интермиттирующий характер, значительно выражены симптомы общей интоксикации. Яичко еще более увеличивается в размерах, в процесс вовлекаются все ткани мошонки, в результате соответствующая половина мошонки увеличивается, ее кожа становится гиперемированной (покрасневшей), отечной, спаянной с яичком. В месте спайки может определяться очаг размягчения. При распространении воспалительного процесса на придаток развивается эпидидимит (см.), возможно и поражение семенного канатика. Известны случаи олигоспермии (уменьшение числа сперматозоидов в эякуляте) после перенесенного эпидемического паротита (см.) даже без клинически выраженных признаков орхита.
Хронический орхит Для хронического орхита характерны умеренные болевые ощущения в области яичка и семенного канатика. Яичко увеличено, при прощупывании определяются его болезненность и очаговые уплотнения. Постепенно развивается атрофия (см.) яичка. Течение заболевания волнообразное, периодически отмечается обострение процесса. В связи с длительностью заболевания могут развиваться неврозы и сексуальные дисфункции.
Диагностика и дифдиагностика Острый орхит Острый орхит необходимо дифференцировать с острым эпидидимитом (см.), острой водянкой, заворотом яичка, ущемленной пахово-мошоночной грыжей (см.). Эпидидимит характеризуется болезненным инфильтратом (очагом уплотнения) на задней поверхности яичка, в то время как размер его не меняется. Острая водянка характеризуется умеренной болезненностью, невыраженной интоксикацией, отсутствием напряжения мошонки. Диагноз подтверждает получаемая при пункции прозрачная жидкость. Ущемление пахово-мошоночной грыжи (см.) сопровождается увеличением размеров и плотности имевшегося грыжевого выпячивания, резким усилением боли, невозможностью вправления грыжи.
Хронический орхит Неспецифический хронический орхит дифференцируют с опухолью (см.) яичка, исключают туберкулез (см.).
Лечение Острый орхит В первые дни болезни назначаются постельный режим, максимальное ограничение подвижности и возвышенное положение мошонки с помощью суспензория (повязка для мошонки в виде мешочка, фиксируемого на поясе и бедрах), умеренная местная повышенная температура. Показаны антибиотики широкого спектра действия, противовоспалительные и анальгезирующие лекарственные средства, новокаиновая блокада семенного канатика. Физиотерапевтические процедуры и сухое тепло назначаются после стихания острых явлений. Ходить пациенту разрешают после нормализации температуры, однако ношение суспензория показано еще некоторое время. При симптомах нагноения яичка производят хирургическое вмешательство — вскрытие абсцесса (см.).
Хронический орхит При обострении воспалительного процесса показано назначение антибиотиков и противовоспалительных препаратов, местно применяют тепловые процедуры. В отдельных случаях показаны глюкокортикостероиды. Хирургическое лечение используется при безуспешности консервативной терапии.
ОСПА ВЕТРЯНАЯ
ОпределениеОспа ветряная — острое антропонозное (т. е. передающееся только от человека к человеку) инфекционное заболевание с воздушно-капельным механизмом передачи.
Этиология, эпидемиология и патогенез Возбудителем ветряной оспы является видимый в обычный световой микроскоп вирус крупных размеров, который с 3—4-го дня обнаруживается в содержимом оспенных пузырьков. Вирус ветряной оспы нестоек во внешней среде — он быстро погибает при воздействии солнечного света, нагревании, ультрафиолетовом облучении. Восприимчивость к ветряной оспе уникальна — она составляет 100 %. Заразными больные ветряной оспой становятся за 20–24 ч до появления сыпи и остаются ими до 5-го дня с момента регистрации последнего элемента сыпи. Передается ветряная оспа воздушно-капельным путем от больного при разговоре, кашле, чихании. Считается возможным заражение плода от матери во время беременности, что может приводить к врожденным уродствам. Попавший в организм вирус накапливается в клетках слизистой верхних дыхательных путей, откуда током крови разносится по организму, проявляя сродство к эпителию слизистых оболочек и кожи. На месте внедрения вируса образуется пузырек (везикула), который в дальнейшем заполняется гноем. Везикулы имеют однокамерное строение; обратное развитие кожных элементов характеризуется подсыханием и отпадением корочек с полным восстановлением поврежденного эпидермиса.
Кожные высыпания при ветряной оспе
Ветряная оспа. Полиморфизм сыпи
Клиническая картина Продолжительность инкубационного периода составляет 10–21 день. Продромальный период обычно не выражен; могут наблюдаться общее недомогание, головная боль, снижение аппетита. Заболевание нередко начинается сразу с появления сыпи на неизмененной коже на фоне полного здоровья. Повышение температуры обычно соответствует началу появления сыпи. Для ветряной оспы характерны «подсыпания» — периодическое появление новых элементов сыпи, что проявляется волнообразной температурной кривой. Именно при ветряной оспе можно одновременно обнаружить сыпь на разных стадиях развития. В типичных случаях у взрослых пациентов высыпания регистрируются в 2–5 приемов с интервалом 24–48 ч (дифференциально-диагностический признак).
Ветряная оспа. Высыпания на небе и деснах
Ветряночные элементы: 1 — на конъюнктиве; 2 — на половых органах
Гангренозная форма ветряной оспы
Ветряная оспа: 1 — типичная форма, 2 — атипичная форма
Ветряная оспа. Наложение бактериальной инфекции
Динамика сыпи: первыми появляются красные пятна, на месте которых через несколько часов образуются заполненные прозрачным содержимым пузырьки. Пузырьки имеют однокамерное строение, при проколе спадаются, центрального вдавления не имеют, иногда окружены красной каймой. Обнаружить многообразие сыпи обычно удается на 3—4-й день болезни: на одном кожном участке видны и пятнышки, и везикулы, и корочки, а иногда и нагноившиеся пузырьки. Изредка обнаруживаются высыпания на слизистой глаз, рта, гортани. Вовлечение лимфатических узлов при ветряной оспе отмечается довольно часто. Тяжелые формы ветряной оспы: буллезная форма, характеризующаяся образованием крупных мягких пузырей, после вскрытия которых заживление краев происходит медленно; гемморрагическая форма, проявляющаяся кровоизлияниями в пузырьки, кожу и гематурией (кровь в моче); гангренозная форма, которая отмечается у ослабленных больных и характеризуется образованием корок черного цвета на месте увеличившихся в размерах везикул. Стертые формы характеризуются отсутствием температурной реакции, единичными высыпаниями, отсутствием интоксикации. Особенностью ветряной оспы является возможность поражения плода при беременности — доказано влияние вируса на внутриутробное развитие, приводящее к абортам, смерти новорожденных. Осложнения (энцефалит (см.), менингоэнцефалит, присоединение бактериальной инфекции) встречаются нечасто.
Диагностика и дифдиагностика Для постановки диагноза важны эпидемиологические данные, знание особенности оспенных высыпаний и лабораторное подтверждение, при котором наряду с серологическими реакциями (РСК, РТГА) может использоваться непосредственное обнаружение вируса. Диагноз ветряной оспы дифференцируют с пузырчаткой, импетиго (см.), везикулезным риккетсиозом. Кроме того, принято исключать натуральную оспу, несмотря на официальное признание ее ликвидации.
Лечение и профилактика До настоящего времени не создано высокоэффективного этиотропного лекарственного средства лечения ветряной оспы. Использование интерферона уменьшает (иногда предотвращает) подсыпания, уменьшает число осложнений, облегчает течение болезни. Постельный режим следует соблюдать в течение всего лихорадочного периода, корочки рекомендуется обрабатывать раствором марганцовокислого калия. Показаны дезинтоксикационная терапия, прием антигистаминных препаратов. Местное лечение в случае кожного зуда (см.) предусматривает обработку кожи спиртом или уксусом. Применение ультрафиолетового облучения может быть показано для ускорения отпадения корочек. Прием антибиотиков имеет смысл для профилактики осложнений при выраженной интоксикации и при обильных высыпаниях. Применение противовирусных препаратов (типа ацикловира) возможно при отсутствии противопоказаний. Прогноз при ветряной оспе обычно благоприятный. Дезинфекция ввиду нестойкости вируса не проводится, достаточно проветривания и влажной уборки помещения.
Оспа натуральная Оспа натуральная (наряду с холерой (см.) и чумой (см.) принадлежит к особо опасным инфекционным заболеваниям, характеризуется чрезвычайно высокой контагиозностью (заразностью), выраженной интоксикацией и сыпью, оставляющей после себя рубцы. В связи с высокой смертностью описания натуральной оспы сохранились с IX–X вв. (Авиценна) до наших дней, хотя первые упоминания о ней относятся к добиблейскому периоду. Натуральная оспа являлась бичом народов, пока англичанин Э. Дженнер (примерно 1796 г.) не предложил способ иммунизации человека путем заражения его вирусом коровьей оспы. Практическое использование данного открытия позволило человечеству победить натуральную оспу. Важнейшее практическое значение имеет дифференциальная диагностика натуральной и ветряной оспы, основанная на данных эпидемиологии и клинических особенностях болезни. В пользу ветряной оспы говорят контакт с больным ветряной оспой, отсутствие данных о заболевании ветряной оспой в анамнезе (истории жизни), продолжительность инкубационного периода 21 день, умеренная выраженность продромального периода (температура не превышает 39 °C), совпадение подъемов температуры с появлением новых кожных элементов, последовательность появления и характер сыпи (наиболее обильные элементы высыпают на лице и туловище, где они появляются почти одновременно). Для ветряной оспы характерно отсутствие сыпи на ладонях и подошвах; обнаружение сыпи на слизистых оболочках представляет собой исключение. Сыпь у больных ветряной оспой характеризуется следующими отличительными признаками: везикулы не имеют центрального вдавления, характерен полиморфизм высыпаний — на одних и тех же участках кожи одновременно можно обнаружить пятна, пузырьки, подсыхающие корочки. Пузырек при ветряной оспе однокамерный, поверхностный, при проколе спадается, корочка образуется быстро, после себя не оставляет следа в виде рубца.
Локализация сыпи в продромальном периоде натуральной оспы: 1 — плечевой треугольник; 2 — бедренный треугольник Симона
Пустулезные высыпания на коже при натуральной оспе
Для натуральной оспы характерны следующие симптомы: появление продромальной сыпи (т. е. до начала клинических проявлений болезни), выраженная интоксикация с повышением температуры до 40 °C и более, сильные боли в крестце. До нагноения кожных элементов температура тела обычно не превышает 37,5 °C, затем повышается до 40–41 °C. Локализация сыпи при натуральной оспе отличается специфичностью: сыпь локализуется на волосистой части головы, на лице, поражает также конечности и туловище, может локализоваться на ладонях и подошвах. Характерно появление высыпаний на слизистых оболочках, совпадающее по времени с появлением сыпи на коже. Кожные элементы при натуральной оспе плотные, для них характерно наличие втяжения в центре везикулы и инфильтрация основания. Отсутствует многообразие высыпаний — все высыпания при натуральной оспе находятся на одной стадии. При проколе пузырек натуральной оспы не спадается, он многокамерный, после себя образует (после отпадения корки) разной глубины рубец. В 1980 г. на XXXIII сессии ВОЗ было официально объявлено о ликвидации натуральной оспы на планете. Потенциальную опасность представляют музейные штаммы натуральной оспы, хранящиеся в лабораториях специальных учреждений.
ОСТЕОМИЕЛИТ
ОпределениеОстеомиелит — инфекционный гнойновоспалительный процесс с вовлечением всех структурных элементов кости — надкостницы, губчатого и компактного вещества, костного мозга.По происхождению выделяют неспецифический остеомиелит, возбудителями которого являются чаще всего кокки, и специфический остеомиелит, развитие которого обусловлено специфической (туберкулезной и др.) микрофлорой. Различие путей внедрения возбудителя в кость привело к выделению гематогенного (острого гематогенного и первично-хронического) и негематогенного (травматического, огнестрельного) остеомиелита. Гематогенный остеомиелит обусловлен внутренней микрофлорой, принесенной с током крови из отдаленного очага; негематогенный вызывается внешней микрофлорой, попадающей в кость при ранениях и операциях. Кроме того, возможен путь непосредственного перехода воспаления на кость с соседних органов. Клинически выделяют острый и хронический остеомиелит, а также первично-хронический, включающий атипичные формы, и остеомиелит при определенных инфекционных заболеваниях (туберкулез (см.) и др.).
Этиология и патогенез По тяжести течения выделяют легкую, септикопиемическую (тяжелую) и токсическую формы. В большинстве случаев возбудителем острого неспецифического остеомиелита является гноеродная кокковая микрофлора, прежде всего — стафилококки, реже заболевание вызывают стрептококки и пневмококки. Велика роль и грамотрицательной микрофлоры, среди которой (в ассоциации с кокками или в виде монокультуры) чаще высеваются синегнойная и кишечная палочки, вульгарный протей, клебсиелла и некоторые другие микроорганизмы. Определенную роль играют и вирусы, способствующие снижению иммунитета макроорганизма и повышению агрессивности микробов. Хроническая форма длительно текущего остеомиелита обусловлена, как правило, грамотрицательной микрофлорой. Входными воротами инфекции при гематогенном остеомиелите могут быть слизистые оболочки носоглотки и рта, глоточное кольцо и кожа; у грудных детей ими часто служат пупочная рана, опрелость кожи. Большое значение в развитии остеомиелита имеют очаги хронической инфекции. Среди патогенетических факторов гематогенного остеомиелита выделяют особенности строения и кровоснабжения костей, феномен сенсибилизации (повышения чувствительности) организма скрытой бактериальной микрофлорой, иммунную недостаточность, расстройство гомеостаза, изменение свойств крови и кровотока, спазмы микрососудов, кислородную недостаточность. Развитию негематогенного остеомиелита способствуют травма, повышение чувствительности костной ткани к инфекции, снижение общей устойчивости макроорганизма и др.
Патанатомия Начинается острый гематогенный остеомиелит распространенным воспалением в костном мозге. В дальнейшем процесс прогрессирует, воспаление принимает характер флегмоны (см.), отмечаются некроз (см.) костного мозга, вовлечение губчатой ткани и даже компактной пластинки. В результате гнойного расплавления и одновременного отграничения очагов воспаления уже на 3-и—4-е сутки от начала заболевания происходит образование гнойников. Далее воспаление распространяется на периост (надкостницу) и мягкие ткани. При благоприятном течении болезни, адекватном лечении, раннем применении антибиотиков и высокой сопротивляемости макроорганизма развития абсцесса (см.) может и не быть, воспаление прекращается до образования участков омертвения. На месте крупных воспалительных очагов нередко образуются кисты (см.). У детей все следы перенесенного воспаления могут исчезать. Менее благоприятное течение заканчивается инкапсуляцией гнойников в кости. Омертвевшая костная ткань резорбции (рассасыванию) не подвергается и остается плотной. Постепенно развивается характерный для остеомиелита процесс отторжения находящихся в полости гнойника омертвевших участков от окружающей костной ткани. В итоге такие участки оказываются свободно лежащими в полости гнойника. Они препятствуют заживлению очага остеомиелита и не рассасываются самостоятельно. Рентгенологически очаги некроза (см.) выявляются к 3—4-й неделе болезни. Хронический остеомиелит развивается в результате продолжающегося воспалительного процесса в кости. При хроническом процессе в кости образуются четко отграниченные гнойники, содержащие омертвевшие участки. Обострения хронического остеомиелита приводят к сложному поражению кости и ее деформации.
Клиническая картина Острый гематогенный остеомиелит В подавляющем большинстве случаев острым гематогенным остеомиелитом болеют дети, причем мальчики болеют примерно в два раза чаще девочек. Наиболее распространенной формой является острый гематогенный остеомиелит, при котором чаще поражаются длинные трубчатые кости, реже — плоские и короткие кости. Наиболее часто поражаются бедренная, большеберцовая и плечевая кости; среди коротких отмечается поражение костей стопы, среди плоских — костей таза и верхней челюсти. Особенностью клиники остеомиелита является то, что при поражении различных костей проявления болезни носят однотипный характер. Течение острого гематогенного остеомиелита подразделяют на три формы: легкую, или местную; тяжелую, или септико-пиемическую; токсическую, или адинамическую. Легкая форма отличается преобладанием местных симптомов над общими и отсутствием признаков сепсиса (см.). Признаки интоксикации выражены умеренно, температура обычно не превышает 38 °C. Местные изменения обычно четко локализованы, боль выражена умеренно. В случае прорыва поднадкостничного абсцесса (см.) в мягкие ткани происходит распространение гноя по межфасциальным пространствам и вскрытие гнойника далеко от костного очага; при этом общее состояние улучшается, а процесс принимает хронический характер. Септико-пиемическая форма характеризуется внезапным началом, выраженным ознобом, подъемом температуры до 40 °C и выше. Состояние пациентов с самого начала тяжелое, выражены симптомы общей интоксикации — адинамия, резкая слабость, тошнота и рвота, отсутствие аппетита. Довольно быстро развиваются местные симптомы болезни: не позже второго дня болезни появляются выраженные резкие локальные боли. Вследствие боли конечность принимает вынужденное положение, наблюдается значительное ограничение пассивных движений и практическое отсутствие активных движений. Отек (см.) мягких тканей нарастает довольно быстро и имеет тенденцию к распространению — с плеча отек распространяется на грудную клетку, при локализации очага поражения в бедренной кости отек распространяется на голень и даже на переднюю брюшную стенку. Характерно изменение кожи над очагом поражения — кожа лоснится, выражены ее покраснение и напряжение, усилен венозный рисунок, отмечается местное повышение температуры. Начало отека морфологически соответствует вовлечению надкостницы, появление гиперемии (покраснения) соответствует прорыву абсцесса (см.) в мягкие ткани и началу феномена флюктуации. Довольно типичным проявлением остеомиелита является параллельное вовлечение в патологический процесс близлежащего сустава по типу артрита (см.). При неблагоприятном течении заболевания нарастают симптомы интоксикации, общее состояние еще более ухудшается, отмечаются признаки обезвоживания организма. Выражена головная боль, отмечается боль во всем теле, слабость, адинамия, жажда, потеря аппетита. Лабораторные исследования свидетельствуют о нарушении процессов регуляции: выражен метаболический ацидоз, расстроен водно-солевой баланс, снижен иммунитет, увеличивается содержание в крови медиаторов воспаления, отмечаются нарушения свертывания крови — в первые 10 дней типична гиперкоагуляция, сменяющаяся гипокоагуляцией. В крови определяются повышенное содержание лейкоцитов и ускорение СОЭ, в моче появляются белок и лейкоциты. Страдает функция миокарда, печени, почек, что усугубляет расстройство антитоксических функций организма. Возможно развитие гемолитической желтухи (см.). Все это приводит к распространению гнойного процесса, гематогенному метастазированию. Токсическая форма гематогенного остеомиелита характеризуется молниеносным течением и отмечается довольно редко, преимущественно у ослабленных больных. Уже в первые сутки заболевания развивается тяжелейшая интоксикация — сознание спутано или утрачено, отмечаются периодические судороги, симптомы раздражения мозговых оболочек, снижаются температура тела и артериальное давление, развивается острая сердечно-сосудистая недостаточность. При молниеносном течении остеомиелита больные погибают до появления местных воспалительных симптомов из-за тяжелых расстройств обмена веществ. Осложнениями острого гематогенного остеомиелита являются сепсис (см.), гнойный артрит (см.), пневмония (см.), плеврит (см.), перикардит (см.) и миокардит (см.), абсцесс (см.) мозга. Возможно развитие патологического перелома (см.) с формированием ложного сустава. Кроме того, у детей при локализации остеомиелита в ростковой зоне возможны нарушение роста костей и их деформация.
Хронический (вторичный) остеомиелит Хронический остеомиелит может явиться исходом любой клинической формы острого остеомиелита — гематогенного, травматического, огнестрельного, вследствие перехода гнойного процесса с окружающих тканей. Проявления остеомиелита в хронической стадии однотипны и не зависят от формы острого процесса. Формирование хронического заболевания происходит, когда в результате острого гнойного процесса развивается омертвение участка костной ткани. Переход острого остеомиелита в хронический зависит от многих составляющих: своевременной диагностики, начала адекватного лечения, в том числе оперативного, выбора антибиотиков, устойчивости организма. Хронический остеомиелит развивается практически всегда при поздней операции после самопроизвольного прорыва гноя наружу. О переходе острого остеомиелита в хронический свидетельствует триада: наличие гнойного свища, костного секвестра (фрагмент омертвевшей кости в гнойной полости) и рецидивирующее течение болезни. Переход острого гематогенного остеомиелита в хронический сопровождается улучшением общего состояния и самочувствия пациента: снижается температура тела, улучшается аппетит, ослабевают боли, нормализуются функции внутренних органов и лабораторные показатели. В месте операционных разрезов или самостоятельно вскрывшихся очагов формируются свищи. Свищи могут быть одиночными или множественными, исходить из одного очага или из нескольких очагов. В глубине мягких тканей свищи могут соединяться между собой ходами, образуя сеть каналов. Наружное отверстие свища иногда может располагаться довольно далеко от очага остеомиелита. Постепенно, по мере стабилизации процесса, при переходе острого воспаления в хроническое количество гнойного отделяемого уменьшается. Сохраняющаяся воспалительная инфильтрация мягких тканей также постепенно ликвидируется. Обычно довольно длительно сохраняется тугоподвижность прилегающего к очагу остеомиелита сустава, возможно развитие деформации конечности. В течение недель или месяцев происходит полное отделение омертвевших участков от здоровой костной ткани и образование костной полости. Секвестры различаются по величине и форме. Различают следующие виды секвестров: кортикальный, центральный, проникающий, тотальный, циркулярный, губчатый. Чаще образуются центральные, кортикальные и проникающие секвестры. Локализоваться секвестры могут как в костной полости — целиком или частично, так и в мягких тканях, вне костной полости. Вокруг костной полости образуется секвестральная капсула, внутри которой находятся секвестры и гной. Секвестральная капсула одним или несколькими отверстиями соединена со свищами, через которые выделяется гной. Сами секвестры не рассасываются и могут существовать десятилетиями. Иногда в пораженной кости могут образовываться множественные заполненные гноем и грануляциями небольшие полости без секвестров, соединенные между собой узкими ходами. Образование таких полостей значительно ухудшает течение и прогноз остеомиелита. Фаза ремиссии хронического остеомиелита характеризуется исчезновением болей, нормализацией температуры, значительным улучшением общего состояния. Выделения из свищей скудные, иногда свищи могут временно самостоятельно закрываться. Ремиссия может продолжаться от нескольких месяцев до нескольких лет; ее длительность определяется величиной и количеством секвестров, локализацией процесса, вирулентностью микроорганизмов, возрастом пациента и состоянием его иммунитета. Рецидив хронического остеомиелита повторяет симптомы острого, однако клинические проявления выражены обычно в меньшей степени: боли носят умеренный характер, интоксикация умеренная. Часто рецидиву предшествует закрытие свища; при этом происходит скопление гноя в полости и развитие флегмоны (см.) в результате пропитывания гноем мягких тканей. Рецидив характеризуется усилением боли в области очага остеомиелита, появлением отечности и покраснения кожи над очагом, местным повышением температуры. Одновременно за счет симптомов интоксикации ухудшается общее состояние: температура повышается до высоких цифр, появляются адинамия, потливость, учащенное сердцебиение, отмечается воспалительная реакция со стороны крови — повышение числа лейкоцитов, ускорение СОЭ. Без лечения (без вскрытия флегмоны) могут образовываться новые гнойные затеки, что приводит к дальнейшему ухудшению состояния и усилению интоксикации. Вскрытие флегмоны или прорыв гноя через открывшийся свищ довольно быстро приводит к улучшению состояния и затиханию местного процесса. Для хронического остеомиелита наиболее типичны местные осложнения, что объясняется длительным разрушающим процессом в кости и окружающих ее тканях. К осложнениям хронического остеомиелита относятся формирование новых гнойных очагов, патологические переломы (см.) кости, развитие гнойного артрита (см.) и анкилоза, формирование ложного сустава, деформация конечности и т. д.
Диагностика и дифдиагностика Острый гематогенный остеомиелит Зачастую диагноз острого гематогенного остеомиелита вызывает затруднения, особенно у детей и (или) при септико-пиемической форме заболевания. Характерными симптомами болезни являются резкие боли в месте поражения, синдром интоксикации, повышение температуры тела постоянного характера, присоединение артрита; способствует точному диагнозу тщательно собранный анамнез (история развития болезни). В то же время нередко первоначально выставляются диагнозы травматического повреждения, ревматизма (см.), пневмонии (см.), скарлатины (см.) и др. Диагностике помогает тщательное прощупывание конечности и выявление ее функциональной состоятельности, позволяющее обнаружить отечность, болевой участок, защитную контрактуру, боль при нагрузке по оси конечности и при перкуссии. Важнейшим диагностическим инструментальным исследованием остается рентгенологический метод: первоначальные признаки патологического процесса опытный специалист обнаруживает с 3—4-го дня болезни, в то время как очаги разрушения выявляются лишь на 2—3-й неделе от начала процесса. В целях раннего выявления болезни прибегают к диагностической пункции. Наиболее раннюю и достоверную информацию дает магнито-резонансная томография. Иногда определяется внутрикостное давление путем манометрии. В норме внутрикостное давление составляет 200 мм водного столба. В начальной стадии остеомиелита оно повышается до 400 мм водного столба. Дифференциальный диагноз острого гематогенного остеомиелита чаще всего проводят с флегмоной (см.) мягких тканей, глубоким тромбофлебитом (см.), острым ревматизмом (см.); у маленьких детей — с переломом (см.) кости.
Хронический остеомиелит Большое значение имеют указания на перенесенный ранее острый остеомиелит, наличие хронического гнойного свища, рецидивирующее течение заболевания. Важнейшим методом диагностики хронического остеомиелита является рентгенологический, включающий рентгенографию, томографию, фистулографию. Хронический остеомиелит дифференцируют с опухолями (см.), посттравматическим периоститом; также следует исключить специфический процесс (туберкулез (см.)).
Лечение Острый остеомиелит Комплексное лечение острого остеомиелита включает триаду: оперативное лечение местного патологического процесса; направленное воздействие на возбудителя заболевания; повышение общей устойчивости организма. Оперативное лечение предусматривает остеоперфорацию 2–3 участков на протяжении, что позволяет не только вскрыть и дренировать костномозговой канал, но и добиться декомпрессии, уменьшения боли, улучшения кровообращения пораженного участка, а также предотвратить распространение процесса. Антибиотики назначают с учетом чувствительности выделенной из раны микрофлоры; предпочтение отдается средствам широкого спектра действия, так как часто процесс обусловлен ассоциациями микробов. Нередко прибегают к комбинированному применению антибиотиков, включая средства,способные воздействовать на анаэробы. Обычно длительное применение антибиотиков при лечении остеомиелита диктует необходимость повторных антибиотикограмм. Повышение общей резистентности организма предусматривает полноценное питание, назначение витаминов, микроэлементов и иммуностимуляторов, проведение адекватной дезинтоксикационной и симптоматической терапии.
Хронический остеомиелит Лечение хронического остеомиелита имеет цель ликвидировать очаг разрушения кости, что возможно лишь при сочетании радикального оперативного вмешательства и комплексной терапии (антимикробной, иммунобиологической, использовании физических методов). Ведущая роль принадлежит оперативному лечению; при этом только декомпенсация сердечно-сосудистой деятельности, почек или печени может явиться противопоказанием для хирургического вмешательства.
ОСТЕОПОРОЗ
ОпределениеОстеопороз представляет собой заболевание, характеризующееся снижением плотности кости в результате уменьшения количества костного вещества или недостаточной его минерализации. При остеопорозе происходит прогрессирующая потеря костной массы, причем разрушение основной субстанции кости и губчатого вещества происходит быстрее, чем образование костной ткани. Результатом этого процесса является уменьшение как эластичности, так и стабильности кости, что приводит к вероятности переломов (см.) костей даже при незначительной механической нагрузке или падении.
Эпидемиология В настоящее время остеопорозу уделяется большое внимание в связи с тем, что, по прогнозам специалистов, число больных с данной патологией будет неуклонно увеличиваться. В Германии в 2010 г. насчитывалось не менее 4 млн (по другим данным — 6 млн) больных остеопорозом, и за двадцать лет прогнозируется удвоение этого числа. Предполагается, что к 2050 г. в Европе число переломов бедра, обусловленных остеопорозом, может превысить 972 тыс. Значительно распространены переломы тел позвонков — в возрасте старше 50 лет они регистрируются приблизительно у 1 млн жителей Европы. Кость представляет собой один из видов соединительной ткани и состоит из органических и неорганических компонентов. Каждая кость покрыта надкостницей, а внутри содержится костный мозг. Надкостница имеет два слоя — наружный волокнистый и внутренний. Кость состоит из компактного вещества, расположенного по периферии, и губчатого вещества, находящегося внутри кости и представленного костными перекладинами. Органические структуры, представленные костными клетками, основным веществом кости и коллагеновыми волокнами, отвечают за эластичность кости. Твердость и прочность кости обеспечиваются неорганическими компонентами, в том числе солями — фосфатом кальция, фосфатом магния, карбонатом кальция. Таким образом, определенное соотношение органических и неорганических веществ, входящих в состав кости, обеспечивают ее прочность и одновременно упругость. Контроль образования органического матрикса кости, его минерализации, а также перестройки кости и костной резорбции происходит при участии паратиреоидных гормонов, кальцитонина щитовидной железы, эстрогенов яичников, тестостерона, витамина D и др. Как и любая другая ткань организма, костная ткань постоянно обновляется, причем после окончания роста и до 30 лет, когда кости особенно плотны, образование костей и их резорбция (рассасывание) находятся в равновесии. Скелет взрослого содержит 900— 1400 г кальция, что составляет 98 % всего содержания кальция в организме; ежедневно по 500 мг кальция и оседает в костном скелете, и выводится из него. Кости скелета содержат 85 % всего находящегося в организме фосфора — 500–800 г. С возрастом меняется соотношение между органическими и неорганическими компонентами костной ткани. После 40 лет происходит постепенное физиологическое разрушение костной массы — по 0,3–0,5 % в год. После 50 лет процесс костной резорбции ускоряется в значительной степени, и у женщин при большой продолжительности жизни потеря костной массы может достигать 50 %.
Патанатомия Развитие патологического процесса при остеопорозе обусловлено снижением костеобразования и усилением резорбции кости. Остеопороз проявляется разрежением губчатого и коркового вещества. В результате корковое вещество кости утрачивает компактное строение. Костные перекладины губчатого вещества истончаются, часть их рассасывается полностью, что приводит к расширению пространств между ними. Разрежение губчатого вещества сопровождается уменьшением общего числа костных перекладин и уменьшением количества минеральных веществ в единице объема кости, что нередко приводит к утолщению и огрубению костных перекладин. Морфологическими проявлениями остеопороза является снижение общего объема костной ткани. В губчатом веществе нормальные костные пластинки истончаются и перфорируются. Решетчатая система балок становится нежнее и частично прерывается. Костные ткани рассасываются, расстояние между ними увеличивается. Это приводит к увеличению внутреннего костного пространства. При остеопорозе в большинстве случаев отсутствуют приспособительные компенсаторные процессы в виде утолщения остаточных балок. Остеопороз развивается в костях, в которых содержание губчатого вещества выше: это позвонки, шейка бедра, область вертелов, дистальный отдел лучевой кости.
Этиология и патогенез Важнейшими этиологическими (причинными) факторами остеопороза являются недостаточная двигательная активность, характер питания и связанная с ним масса тела, употребление алкоголя, курение, недостаток поступления в организм с пищей витаминов. Эластичность и стабильность костной массы ухудшается в случае длительной, в течение нескольких месяцев, неподвижности конечности. В то же время улучшение данных показателей доказано вследствие физических нагрузок. Недостаток физической активности, уменьшение нагрузки на мышцы приводит к тому, что весь опорно-двигательный аппарат, включая позвоночник, лишается необходимой мышечной поддержки, наступает редукция костной ткани. Дополнительным фактором, увеличивающим вероятность развития патологического процесса, служит как резкое снижение питания, так и булимия (см.), приводящие к уменьшению поступления в организм кальция и фосфора. Чаще остеопорозом болеют женщины, что связано с особенностями их физиологии: более предрасположены к заболеванию женщины с поздними первыми менструациями и рано наступившей менопаузой, а также с бесплодием (см.), что свидетельствует о недостаточности функций половых желез. Имеет значение и наследственная предрасположенность. Кроме того, повышают риск развития остеопороза у женщин алкогольная зависимость и курение: алкоголь и его производные непосредственно отрицательно влияют на костные клетки; никотин снижает содержание половых гормонов (эстрогенов). Повышенному выведению кальция почками способствует длительное употребление кофе. Развитие остеопороза напрямую связано с недостатком поступления в организм с пищей кальция, фосфора и витамина D. Исследования распространения остеопороза в Германии однозначно показали, что потребление кальция тесно связано с экономическим фактором, денежным доходом семьи: чем ниже доход, тем меньше употребление кальция. Относительно поступления в организм фосфора была выявлена разница по полу: мужчины полностью удовлетворяют потребность в фосфоре, у женщин отмечается его дефицит. Выявлено также недостаточное поступление в организм кальция и фосфора у пожилых и престарелых. Отмечено выраженное недостаточное поступление с пищей витамина D. По распространению процесса остеопороз подразделяют на местный и общий. Развитие местного остеопороза чаще всего связано с нарушением кровообращения, например венозного оттока при иммобилизации конечности и длительной обездвиженности. В основе развития болезни могут лежать также следующие факторы: удаление одной конечности или перегрузка одной конечности после нарушения функции другой, нарушение кровообращения вокруг патологического очага, переломы (см.), невриты (см.), ожоги (см.), отморожения (см.), флегмона (см.) и др. При этом местный остеопороз может быть очаговым или равномерным. Развитие общего остеопороза наблюдается при хронических интоксикациях, пищевых и обменных расстройствах, возрастной инволюции (старческий и климактерический остеопороз). Сюда также относят остеопороз при болезни Иценко-Кушинга (см.), гиперпаратиреозе (повышенной функции паращитовидных желез). Резко выраженный общий остеопороз наблюдают в ряде случаев после длительного применения кортикостероидов. К возникновению остеопороза могут привести следующие патологические состояния: повреждения крупных нервных стволов, болезнь Рейно (см.), склеродермия (см.), эндартериит (см.), острый артрит (см.) и др. В результате патологического процесса, развивающегося при остеопорозе, понижается прочность костей, происходят их деформации и возникают переломы (см.). Чем более выражено снижение эластичности и стабильности кости в целом, тем легче возникают переломы; при резко выраженном остеопорозе происходят переломы тел позвонков, ребер, костей конечностей. Остеопороз подразделяют на первичный и вторичный. Первичный остеопороз наблюдается в 95 % случаев, в 5 % случаев заболевание обусловлено вторичными причинами. В свою очередь, первичный остеопороз включает: — идиопатический остеопороз; — постклимактерический остеопороз, или первичный остеопороз типа I; — инволюционный (старческий) остеопороз, или остеопороз типа II. Идиопатический остеопороз регистрируется у детей и молодых людей и встречается реже, чем постклимактерический и инволюционный. Остеопороз типа I (постклимактерический) обусловлен угнетением функции половых желез в сочетании со снижением уровня эстрогенов у женщин и со снижением содержания тестостерона у мужчин. Постклимактерический остеопороз проявляется после 50 лет и регистрируется в 6 раз чаще у женщин, чем у мужчин. Для этой формы более характерны спонтанные переломы тел позвонков. Инволюционный (старческий) остеопороз, или остеопороз типа II, проявляется обычно после 60 лет, регистрируется в 2 раза чаще у женщин, чем у мужчин. Для этой формы заболевания более характерны переломы шейки бедра, верхние переломы плечевой кости, нижние переломы большеберцовой кости, также нередки переломы тел позвонков. Вторичный остеопороз может развиваться от многих причин: — внутренние заболевания; — действие лекарственных препаратов; — длительная неподвижность; — хроническая почечная недостаточность (см.); — хронические обструктивные заболевания легких; — первичный цирроз (см.) печени; — плазмоцитома (опухоль определенного типа). Кроме того, сравнительно редко может развиваться остеопороз при наследственных заболеваниях опорно-двигательного аппарата. Среди эндокринных заболеваний, приводящих к остеопорозу, выделяют гиперпаратиреоз, гиперпролактинемию, синдром Иценко-Кушинга, гипертиреоз, диабет (см.), гипогонадизм. Среди лекарственных средств, вызывающих остеопороз, ведущая роль принадлежит глюкокортикоидам, барбитуратам, гепарину, гидантоину, принимаемым длительно.
Клиническая картина Клинические проявления заболевания могут быть достаточно скудными: неосложненный остеопороз может протекать скрыто, в других случаях пациенты отмечают боли в костях и мышцах спины. При остеопорозе компрессионные (от сдавления) переломы тел позвонков могут появляться без травматического воздействия или после минимальной нагрузки. Типичным для остеопороза считают поражение на уровне VIII грудного позвонка. Выраженные боли в спине, появляющиеся после перелома тела позвонка, усиливаются при поднятии тяжестей. Длительность этих болей чаще всего не превышает одной недели, реже боли продолжаются три месяца. После множественных переломов тел позвонков может развиться искривление позвоночника (кифоз (см.)). Боли в области поясницы и нижних отделах грудной клетки имеют в типичных случаях колющий характер и обусловлены давлением на мышцы и связки спины. Переломы шейки бедра возникают обычно в результате падения. При вторичном остеопорозе симптоматика и течение болезни обусловлены в основном заболеванием, на фоне которого развивается остеопороз.
Диагностика и дифдиагностика При первичном остеопорозе содержание кальция и фосфора крови находится в пределах нормы. После переломов костей определяется повышение уровня щелочной фосфатазы. При постклимактерическом остеопорозе снижено содержание паратиреоидных гормонов (гормонов паращитовидных желез) и в 20 % случаев выявляется повышенное выведение кальция с мочой (гиперкальциурия). Повышенный уровень паратиреоидных гормонов выявляется при остеопорозе типа II. Рентгенологический метод исследования остается важнейшим в диагностике остеопороза, однако начинающийся процесс рентгенологически не выявляется. Обычно развитие остеопороза оценивают зрительно по плотности изображения кости на рентгенограмме, что возможно лишь при значительной (20–30 %) потере массы костного вещества, которое наступает в среднем спустя 2–3 недели после перелома или острого инфекционного заболевания. При рентгенодиагностике остеопороза для сопоставления на ту же пленку делают снимок симметричной части другой конечности. Очаговый остеопороз на рентгенограмме имеет вид множества нечетко отграниченных участков разрежения костного вещества округло-овальной или полигональной (многоугольной) формы. При равномерном остеопорозе кость выглядит более прозрачной, чем в норме, костные перекладины истончены, общий рисунок губчатого вещества более нежный, а при резко выраженном патологическом процессе исчезает совсем. Корковое вещество кости становится более тонким. К современным методам диагностики остеопороза относится измерение плотности кости. В настоящее время существуют методы генетического обследования для выявления наследственных форм остеопороза. Выявляется наследственный дефект рецепторов витамина D. Это отрицательно влияет на формирование костей в молодом возрасте и обмен веществ в костях в старшем возрасте. При дифференциальной диагностике остеопороза в первую очередь исключают остеомаляцию (рассасывание кости), для чего исследуют минеральный состав и применяют рентгенологическое обследование. Следует иметь в виду также костный туберкулез (см.) и метастазы опухоли (см.). В ряде случаев очаговый остеопороз дифференцируют с ограниченными множественными очагами деструкции при воспалительных заболеваниях костей.
Профилактика и лечение Профилактические мероприятия означают прежде всего здоровый образ жизни: — достаточная и регулярная двигательная активность, включающая комплексные тренировки и силовую гимнастику; с целью тренировки выносливости рекомендуются походы, пешие прогулки и занятия танцами; — рациональное питание с введением в рацион достаточного количества кальция и фосфора в соотношении 1:1. Суточная доза кальция до 25 лет составляет 1200 мг; женщинам 25–50 лет и мужчинам 25–65 лет рекомендуется 1000 мг. Женщинам старше 50 лет и мужчинам старше 65 лет необходимо 1500 мг кальция в сутки. Беременным и кормящим рекомендуется употреблять 1300 мг кальция. Традиционным источником кальция служат цельное молоко и молочные продукты — сыр, творог, йогурт. Уменьшают усвоение кальция организмом колбасы, консерванты, напитки «Кола», щавелевая кислота, кофе, алкоголь и никотин. Источником фосфора служат морепродукты, фасоль, пшеничные отруби. Женщинам в периоде менопаузы с целью замедления разрушения костей применяют заместительную терапию эстрогенами, однако при этом существует опасность внезапных кровотечений (см.), повышения риска развития рака (см.) груди, карциномы (см.) матки, поэтому лечение эстрогенами должен назначать и контролировать врач. Для лечения остеопороза показаны прием витамина D (его суточная потребность составляет 5 мкг), кальцитонина. Следует отметить, что в последние годы в связи с возрастанием социально-экономической значимости остеопороза разработано множество препаратов нового поколения, рекомендуемых для его лечения. Современные справочники представляют информацию о следующих препаратах: альфа Д3-Тева, андриол, ван-альфа, генодиан-депо, горомоплекс, дека-дураболин, калкохель, кальций Д3-никомед, кальций сандоз форте, кальцитонин лососевый, миокальцик, оссин, остеоген, остеокеа, остеохин, ретаболил, сустанон-250, тонокальцин, тридин и др. Однако необходимо иметь в виду, что многие из предлагаемых для лечения остеопороза и активно рекламируемых препаратов не только обладают побочными эффектами, но и имеют серьезные противопоказания, поэтому их прием следует согласовывать с лечащим врачом. Основу лечения вторичного остеопороза составляет лечение основного заболевания.
ОСТЕОХОНДРОЗ
ОпределениеОстеохондроз — заболевание позвоночника, обусловленное атрофией межпозвоночных дисков и характеризующееся разрастанием остеофитов тел позвонков, артрозом межпозвоночных суставов, часто грыжами дисков.Остеохондрозу подвержены все отделы позвоночника, но в большей степени патологический процесс выражен, как правило, в нижнешейном, верхнегрудном и нижнепоясничном отделах. Особенностью остеохондроза является широта его распространения — дегенеративно-дистрофическое поражение позвоночника к 40 годам обнаруживается практически у всех людей.
Этиология и патогенез Остеохондроз развивается в результате первичного поражения межпозвоночного диска, трофических систем и часто аномалий развития позвоночника. В развитии и прогрессировании заболевания играют значительную роль аутоиммунные нарушения. Несмотря на значительное распространение заболевания, причины развития остеохондроза полностью не установлены. Важными факторами развития болезни считают индивидуальное предрасположение, травматизацию, расстройства сегментарного кровообращения, возраст. Механизм развития остеохондроза связан с уменьшением амортизационных функций диска и повреждением фиброзного кольца.
Клиническая картина Начальным проявлением остеохондроза является боль в пораженном отделе позвоночника. Боль может быть или относительно постоянной, по типу люмбалгии (продолжительные боли в пояснично-крестцовой области), или носить характер прострела — люмбаго. В последующем по мере прогрессирования патологического процесса наблюдается преобладание боли в том или ином отделе позвоночника. Характерно усиление боли при физических нагрузках, длительном неподвижном или малоподвижном положении, нахождении в неудобной позе, ощущении дискомфорта. Дальнейшее развитие остеохондроза может приводить к выраженной деформации позвоночника по типу кифоза (см.), лордоза (см.) или сколиоза (см.). Для остеохондроза типичны многочисленные и разнообразные неврологические нарушения, выраженность которых зависит от стадии заболевания (обострение или ремиссия). При неосложненном течении остеохондроза наблюдаются периоды довольно длительной ремиссии, когда симптомы болезни не выражены. Для острой стадии характерно появление острой боли в соответствующем отделе позвоночника с последующей иррадиацией в руку, поясницу или ногу. Шейный остеохондроз проявляется болью сдавливающего или рвущего, реже жгучего характера. Боль при шейном остеохондрозе локализуется в затылке, шее, в области плеча и лопаток. Помимо боли нередко отмечаются расстройства чувствительности и двигательные нарушения в зоне иннервации соответствующих шейных корешков. При грудном остеохондрозе наряду с типичным болевым синдромом дискогенного происхождения (т. е. связанного с межпозвонковыми дисками) могут наблюдаться боли в области сердца и (или) за грудиной, весьма сходные с болью при стенокардии (см.). Поясничный остеохондроз часто проявляется болью в соответствующем отделе позвоночника, прострелом (люмбаго), нередко отмечаются расстройства чувствительности в ногах, снижение сухожильных рефлексов, а также вегетативные и трофические нарушения. Кроме отмеченных симптомов, при остеохондрозе выявляются контрактуры (тугоподвижность) мышц (мышц, начинающихся на позвоночнике, мышц плечевого пояса, таза или конечностей), рефлекторные нейрососудистые расстройства, проявляющиеся чувством зябкости, парестезиями, отечностью и изменением цвета конечности.
Диагностика и дифдиагностика Для подтверждения диагноза необходимо полное клиническое (включая ортопедическое и неврологическое) и рентгенологическое обследование; при грудном остеохондрозе необходимо исключение коронарной (сердечной) патологии. Проводится также компьютерная и магнито-резонансная томография, которые выявляют грыжу дисков, стеноз позвоночного канала, определяют взаимоотношение анатомических структур спинного мозга и позвоночника.
Лечение и профилактика Терапия остеохондроза проводится с учетом периода болезни. В начальном периоде, характеризующемся умеренными морфологическими изменениями, показаны лечебная физкультура, массаж, физиотерапевтическое лечение, подводное вытяжение. Однако по мере прогрессирования дегенеративно-дистрофического процесса ведущей задачей становится неподвижность позвоночника, в том числе использование ортопедических приспособлений. Оперативное лечение показано, как правило, при осложнениях, например при грыже диска; сдавление спинного мозга служит прямым показанием к оперативному лечению. Набор и последовательность лечебных воздействий с целью прекращения боли и неврологических проявлений определяется стадией болезни (обострение или ремиссия). При болевом синдроме назначается магнито- и лазеротерапия, УВЧ, рефлексотерапия, электрофорез с новокаином, фонофорез с гидрокортизоном. Показано втирание мазей (финалгон, апизартрон, випросал) и гелей. Прогноз заболевания при своевременно начатом и адекватном лечении в целом благоприятный. Предупреждение дистрофического процесса, поражающего позвоночник, включает предупреждение травматизма, активный двигательный режим, полноценное питание, контроль за массой тела.
ОТЕК ЛЕГКИХ
ОпределениеОтек легких — патологическое состояние, обусловленное обильным пропотеванием жидкой части крови в интерстициальную ткань (рыхлая соединительная ткань паренхиматозных органов) легких, затем в альвеолы, клинически проявляющееся тяжелым удушьем.
Этиология и патогенез В основе отека легких чаще всего лежит острая левожелудочковая недостаточность, являющаяся осложнением различных заболеваний и состояний, при которых очень быстро развивается нарушение кровообращения из-за снижения насосной функции левого желудочка или снижения его кровенаполнения. Это состояние клинически проявляется интерстициальным (сердечной астмой) или альвеолярным отеком. Реже отек легких обусловлен некардиогенными (внесердечными) причинами. Наиболее частыми причинами острого отека легких, как интерстициального, так и альвеолярного, являются гипертоническая болезнь (см.) и симптоматическая артериальная гипертензия (см.), недостаточность аортального клапана, острый инфаркт миокарда (см.) и постинфарктный кардиосклероз (см.), кардиомиопатии (см.) и диффузные миокардиты (см.) с тяжелым течением. Эти причины приводят к неполному опорожнению левого желудочка в диастолу, в то время как правый желудочек накачивает в легкие и левое предсердие больше крови, чем левый желудочек может изгнать. К отеку легкого приводит и митральный стеноз, при котором имеется недостаток поступления крови из левого предсердия в левый желудочек, а также целый ряд внесердечных факторов, среди которых выделяют избыточное внутривенное введение жидкостей, уремию (см.), пневмонию (см.) различного происхождения (аспирационную, бактериальную, вирусную), тромбоэмболию легочной артерии, легочную недостаточность травматического генеза (происхождения), ДВС-синдром и др. Ведущими факторами развития отека легких служат снижение сократительной способности миокарда, нарушение газообмена в легких, расстройство функции центральной и вегетативной системы, гипоксемия (пониженное содержание кислорода в крови), метаболический ацидоз, выделение значительного количества биологически активных веществ и др.
Клиническая картина У пациентов с кардиальной патологией при интерстициальном отеке определяется одышка в покое, усиливающаяся при малейшей физической нагрузке. Иногда регистрируются ночная одышка, дискомфорт при дыхании, общая слабость, учащенное сердцебиение, акроцианоз (синюшность концевых частей тела), причем какие-либо характерные изменения в легких, определяемые при прослушивании, отсутствуют или выражены слабо. Интерстициальный отек легких может проявляться остро в виде приступа сердечной астмы (см.), его затяжное течение возможно при застойной сердечной недостаточности. Приступу сердечной астмы может предшествовать сердцебиение. Продолжительность приступа варьирует от получаса до нескольких часов. Пациент возбужден, покрыт холодным потом. В нижних отделах легких выслушиваются сухие или влажные мелкопузырчатые хрипы, отражающие застойное состояние легких, и бронхоспазм. Мокрота обычно скудная, слизистая. Артериальное давление нормальное или (при гипертонической болезни (см.) или гипертоническом кризе) высокое. Пульс частый. Сердечная астма (см.) является эквивалентом интерстициального отека легких. Важным клиническим свидетельством перехода интерстициального отека в альвеолярный служит появление влажных хрипов. При альвеолярном отеке нередко во время сна и внезапно, а в других случаях на фоне приступа стенокардии (см.) появляется одышка, перерастающая в удушье. Больной принимает вынужденное сидячее положение, облегчающее его состояние. Появляется акроцианоз, частота дыхательных движений достигает 30–40 в минуту, дыхание становится клокочущим, слышным на расстоянии. Для альвеолярного отека легких характерно выделение обильной пенистой мокроты, нередко розового цвета за счет пропотевания крови. Также типичны возбуждение, страх смерти, обилие над всей поверхностью легких влажных разнокалиберных хрипов при прослушивании. Тоны сердца резко приглушенные или глухие, из-за шумного дыхания могут не прослушиваться вовсе. Характерно набухание шейных вен. Пульс частый, вначале напряженный, затем становится малым, слабонапряженным вплоть до нитевидного. Артериальное давление, часто повышенное в начале приступа, значительно снижается. Прогноз обусловлен характером и тяжестью основного заболевания; отек легких на фоне осложненного кардиогенным шоком (см.) острого инфаркта миокарда (см.) прогностически чрезвычайно неблагоприятен.
Диагностика и дифдиагностика В диагностике отека легких (помимо клинических проявлений) большое значение имеет рентгенологическое исследование. Интерстициальный отек характеризуется нечеткостью легочного рисунка и понижением прозрачности прикорневых отделов. При альвеолярном отеке чаще наблюдается интенсивное симметричное однородное затемнение центральных отделов в виде бабочки, реже — распространенные или очаговые изменения. Дифференциальную диагностику проводят между кардиальной и бронхиальной астмой (см.).
Лечение Терапия отека легких предусматривает комплекс мероприятий, предусматривающих нормализацию эмоционального статуса пациента, уменьшение преднагрузки и массы циркулирующей крови, разгрузку малого круга кровообращения, снижение давления в малом и большом кругах кровообращения, обезвоживание легких, повышение сократительной способности миокарда, разрушение пены. Прежде всего больному следует придать сидячее положение с опущенными ногами, обеспечить оксигенотерапию и приступить к медикаментозному лечению. Не следует отказываться от старого метода наложения жгутов на конечности с целью уменьшения преднагрузки; жгуты необходимо снимать каждые 10–15 мин. Дачу кислорода оптимально проводить через носовые катетеры. Противопенные мероприятия включают ингаляцию пропущенного через 70 %-ный этиловый спирт кислорода; показано также внутривенное введение раствора этилового спирта. Применение морфина, натрия оксибутирата, дроперидола, седуксена способствует перераспределению крови из малого круга, позволяет уменьшить одышку и периферический сосудистый спазм, нормализовать эмоциональный статус больного, снизить интенсивность обменных процессов. Морфин (1 мл 1 %-ного раствора) вводят внутривенно медленно в изотоническом растворе хлорида натрия или в 5 %-ном растворе глюкозы. Введение морфина не показано больным с нарушением мозгового кровообращения, бронхиальной астмой (см.), хроническими заболеваниями легких. Натрия оксибутират показан при тенденции к снижению артериального давления; препарат (20–30 мл 20 %-ного раствора) вводят очень медленно, в течение 6—10 мин. Дроперидол (1–2 мл 0,25 %-ного раствора) или седуксен (1–2 мл 0,5 %-ного раствора) вводят внутривенно медленно на изотоническом растворе хлорида натрия. Снижение преднагрузки достигается введением нитратов. Нитроглицерин применяется сублингвально (под язык) при умеренных изменениях уровня артериального давления и при невыраженных изменениях в легких. Если изменения в легких выражены и выслушивается много влажных хрипов, показано внутривенное введение нитроглицерина под контролем артериального давления, для чего в 500 мл изотонического раствора хлорида натрия растворяют 5 мл 1 %-ного раствора нитроглицерина и вводят с первоначальной скоростью 5 капель в минуту. С целью уменьшения пред- и постнагрузки применяется также натрия нитропруссид, однако предпочтение отдают нитроглицерину. Быстродействующие диуретики показаны для разгрузки малого круга кровообращения. Фуросемид (40 мг) вводят внутривенно медленно; при отсутствии эффекта эту дозу повторяют. Для устранения отека легких издавна с хорошим эффектом применяют ганглиоблокаторы, обладающие быстрым гипотензивным действием, позволяющие уменьшить давление в малом круге кровообращения. Введение пентамина (ганглиоблокатор средней продолжительности действия) должно осуществляться фракционно: 0,5–1 мл препарата растворяют в 20 мл изотонического раствора натрия хлорида и под контролем артериального давления вводят по 3–5 мл готового раствора, приостанавливая введение каждый раз на несколько минут для контроля артериального давления. Арфонад является ганглиоблокатором короткой продолжительности действия, он вводится медленно внутривенно капельно; особенностью препарата является возвращение уровня артериального давления к исходному через 10–15 мин после прекращения его введения. При умеренных клинических проявлениях отека легких и высоком артериальном давлении может быть использовано внутривенное введение клонидина (клофелина) в дозе 1 мл 0,01 %-ного раствора. В настоящее время введение сердечных гликозидов с целью повышения сократительной способности миокарда при лечении отека легких признано необоснованным. Удобна для практического использования схема неотложной терапии кардиогенного отека легких, в основе которой лежат два клинических показателя: уровень артериального давления и степень застойных изменений в легких (В. В. Руксин, 1994 г.). Схема предусматривает шесть вариантов: — нормальное артериальное давление и умеренные изменения в легких: положение сидя, нитроглицерин под язык повторно, лазикс внутримышечно или внутривенно, диазепам внутрь или внутримышечно, оксигенотерапия; — нормальное артериальное давление и выраженные изменения в легких: положение сидя, нитроглицерин под язык и внутривенно, лазикс внутривенно, морфин или диазепам внутривенно дробно, оксигенотерапия, положительное давление в конце выдоха, пеногашение; — повышенное артериальное давление и умеренные изменения в легких: положение сидя, нитроглицерин под язык повторно, клофелин внутривенно или пентамин внутривенно капельно, лазикс внутривенно, диазепам внутримышечно или внутривенно, пеногашение; — повышенное артериальное давление и выраженные изменения в легких: положение сидя, нитроглицерин под язык, натрия нитропруссид или нитроглицерин внутривенно капельно, лазикс внутривенно, оксигенотерапия, положительное давление в конце выдоха, пеногашение; — сниженное артериальное давление и умеренные изменения в легких: положение лежа, добутамин внутривенно капельно (систолическое артериальное давление повышается постепенно до 90–95 мм рт. ст.), лазикс внутривенно (после стабилизации артериального давления), оксигенотерапия; — резко сниженное артериальное давление и выраженные изменения в легких: положение лежа; дофамин внутривенно капельно (систолическое артериальное давление повышается постепенно до 90–95 мм рт. ст.; если артериальная гипертензия не корригируется дофамином, то дополнительно внутривенно капельно назначают норадреналин); лазикс внутривенно (после стабилизации артериального давления); нитроглицерин внутривенно капельно (в дополнение к дофамину, если в процессе стабилизации артериального давления сохраняется или нарастает отек легких); оксигенотерапия и пеногашение.
ОТИТ
ОпределениеОтит — воспаление уха. В зависимости от локализации патологического процесса различают наружный, средний и внутренний отит. Панотитом называют воспаление всех отделов уха. Средний отит может быть острым и хроническим.
Этиология Острый средний отит Причинами острого среднего отита служат воспалительные заболевания верхних дыхательных путей, переохлаждение организма; он развивается на фоне острых респираторных заболеваний, различных инфекционных болезней, при активизации микрофлоры полости рта, травмах барабанной перепонки. Как первичное заболевание острый средний отит встречается редко; он развивается также при искривлении носовой перегородки, аденоидах (см.), воспалительных заболеваниях носа и его придаточных пазух. На развитие среднего отита оказывает влияние состояние носоглотки и полости носа, но решающую роль играет состояние реактивности организма. Какого-либо специфического возбудителя острого среднего отита не выявлено — в отделяемом из уха обычно идентифицируют смешанную микрофлору (стрептококк, стафилококк и другие микроорганизмы).
Хронический средний отит Хронический средний отит представляет собой вялотекущее заболевание, при котором прогрессирование воспалительного процесса может наступить под влиянием таких факторов, как охлаждение, инфекционные болезни верхних дыхательных путей. Способствуют развитию хронического среднего отита патологические процессы в евстахиевой трубе, сужение наружного слухового прохода, рецидивы острого воспаления среднего уха. Первичное хроническое течение среднего отита встречается редко.
Клиническая картина Острый средний отит Начало заболевания обычно острое, отит быстро прогрессирует. Течение болезни подразделяют на три периода. Ведущим проявлением первого периода является боль в ухе, вначале в виде покалывания, затем она принимает стреляющий приступообразный характер и, постепенно нарастая, становится нестерпимой. Боль стихает или прекращается только на короткое время, ночью обычно усиливается, часто смещается в зубы и шею. Помимо боли в ухе отмечается головная боль. Симптомы общей интоксикации проявляются общей слабостью, расстройством сна, снижением аппетита, повышением температуры тела до 38–39 °C. Иногда повышения температуры может и не быть, что возможно при атипичных формах острого отита или резком снижении иммунитета пациента. Вскоре присоединяются заложенность, шум в ухе и выраженное снижение слуха — пациент не воспринимает шепот, разговорная речь слышна лишь вблизи ушной раковины. При осмотре врач отмечает гиперемию (покраснение) барабанной перепонки, ее выпячивание вследствие накопления жидкости внутри барабанной полости, болезненность сосцевидного отростка при его перкуссии. Иногда на барабанной перепонке образуются пузыри. Перфорация барабанной перепонки знаменует переход острого среднего отита во второй период болезни. С появлением перфорации исчезает боль в ухе, но появляются выделения: в первые 1–2 дня выделения по объему незначительны, характер выделений обычно серозный, нередко с примесью крови. Затем количество выделений увеличивается, изменяется и их характер — выделения становятся слизисто-гнойными. Примерно в это время нормализуется температура тела, улучшается общее самочувствие больного, однако понижение слуха и шум в ухе сохраняются. Перфорационное отверстие в типичных случаях имеет щелевидную или точечную форму. Третий период болезни характеризуется уменьшением выделений из уха, постепенным рубцеванием барабанной перепонки и восстановлением слуха. Общая средняя продолжительность острого среднего отита составляет 2–3 недели, при этом прекращение общих симптомов отмечается раньше, чем местных. Атипичное течение острого среднего отита встречается при сахарном диабете (см.), при выраженном снижении сопротивляемости организма, в преклонном возрасте. Атипичное течение при резком снижении сопротивляемости характеризуется острейшим началом, когда выделение слизисто-гнойного содержимого и выраженная болезненность области сосцевидного отростка обнаруживаются с первых часов заболевания, и общим тяжелым состоянием пациента. В крови обнаруживается повышенное количество лейкоцитов. В редких случаях отмечается молниеносное распространение процесса в полость черепа со смертельным исходом без перфорации барабанной перепонки. Иногда атипичное течение острого среднего отита характеризуется стертым или абортивным течением, когда симптомы болезни мало выражены, некоторые из них полностью отсутствуют: например, нет повышения температуры или боли в начале заболевания. Прогноз острого среднего отита в целом благоприятный — перфоративное отверстие обычно благополучно рубцуется, а заболевание в большинстве случаев оканчивается выздоровлением. Однако если перфорация остается незакрытой, слух остается пониженным. Кроме описанного острого банального среднего отита, выделяют также аллергический, секреторный, травматический отит, отит при инфекционных болезнях (гриппозный, коревой и т. д.), каждый из которых отличается особенностями происхождения и терапии.
Хронический средний отит При хроническом среднем отите в течение длительного времени отмечаются постоянные или периодические выделения, снижение слуха, иногда головокружение и головные боли. Хронический средний отит в зависимости от клиники и патоморфологических изменений подразделяют на мезотимпанит и эпитимпанит. При мезотимпаните в воспалительный процесс вовлекается слизистая оболочка барабанной полости, для заболевания характерны слизистые выделения из уха с примесью гноя, которые периодически могут значительно уменьшаться или даже прекращаться. Течение мезотимпанита длительное, иногда в течение всей жизни. Рубцевание структур среднего уха может приводить к стойкому снижению слуха. Типичной для мезотимпанита является центральная перфорация барабанной перепонки. Перфорационное отверстие может рубцеваться, а может и оставаться открытым. Возможно образование в барабанной полости грануляционной ткани или полипов. Для эпитимпанита характерны краевая или полная перфорация барабанной перепонки, поражение костных стенок барабанной полости, наличие гнойных с неприятным запахом выделений, развитие опасных (в том числе внутричерепных) осложнений. Хронический гнойный отит, помимо вышеуказанных симптомов, может вызывать расстройство вкуса.
Осложнения К осложнениям острого среднего отита относятся мастоидит (см.), парез лицевого нерва, лабиринтит (см.), реже встречаются внутричерепные осложнения. Наиболее опасным и частым осложнением эпитимпанита является холестеатома (опухолевидное образование, представляющее скопление кератина, кристаллов холестерина и слущенного ороговевшего эпителия, окруженного капсулой), которая в процессе роста вызывает значительное разрушение височной кости и приводит к внутричерепным осложнениям, а также периферическим парезам или параличам (см.) лицевого и отводящего нервов, образованию свища в костном лабиринте.
Диагностика и дифдиагностика В типичных случаях диагноз острого среднего отита затруднений не вызывает. При необходимости выполняется рентгенологическое исследование костей черепа. Иногда острый средний отит дифференцируют с острым наружным отитом, при котором боль усиливается при давлении на козелок или потягивании ушной раковины и не отмечается снижения слуха. При остром среднем отите боль локализуется в глубине уха, имеет пульсирующий характер и сопровождается снижением слуха. Диагностика хронического среднего отита основывается на совокупности типичных жалоб, данных анамнеза, результатах объективного обследования и, как правило, является успешной. Среди инструментальных методов важное значение имеет рентгенологическое исследование. Дифференцировать заболевание в определенных случаях необходимо с опухолями (см.) среднего уха, которые могут быть затушеваны воспалительными изменениями слизистой оболочки, а также с изменениями, обусловленными специфическим процессом (туберкулез (см.)).
Лечение Острый средний отит Продолжительность лечения острого среднего отита в среднем составляет 10–14 дней. В первые дни болезни показан постельный режим. При назначенииантибактериальных препаратов исключают группу ототоксичных средств (гентамицин, канамицин и др.). При резких болях в ухе и выраженной гиперемии барабанной перепонки показаны болеутоляющие препараты и средства местного воздействия. Нередко используют антигистаминные средства. Назначают также физиотерапевтические процедуры (УВЧ, СВЧ, УФО), перед проведением которых выполняется туалет уха. Улучшение дренажной функции евстахиевой трубы достигается закапыванием в нос сосудосуживающих средств. Выделения рекомендуется своевременно аккуратно удалять теплым дезинфицирующим раствором.
Хронический средний отит Лечение хронического среднего отита может быть консервативным или хирургическим. Консервативно лечат обычно мезотимпанит, в то время как эпитимпанит подлежит преимущественно оперативному лечению. Консервативное лечение в периоде обострения процесса включает применение лекарственных препаратов (антибиотиков, протеолитических ферментов, антигистаминных и дезинфицирующих средств) и физиотерапевтических процедур. Для определения чувствительности микрофлоры к антибиотикам производят посев выделений из уха. Применяется и местное лечение (удаление гноя, введение дезинфицирующих средств). Необходимо параллельное лечение заболеваний носа и носоглотки. При эпитимпаните консервативное лечение обычно малоэффективно, особенно при поражении кости и холестеатоме, поэтому важнейшим является определение срока оперативного вмешательства. При имеющихся симптомах внутричерепных осложнений операция проводится в срочном порядке по жизненным показаниям. В зависимости от степени поражения костного вещества оперативное вмешательство может быть радикальным или паллиативным. Радикальная операция предусматривает удаление патологического очага и формирование единой полости вместо сложной системы среднего уха.
ОТРАВЛЕНИЯ
ОпределениеОтравлением, или интоксикацией, называется патологическое состояние, развивающееся вследствие воздействия на человека попавшего в организм из внешней среды яда. Отравления принято отличать от внутренней интоксикации, развивающейся при функциональной недостаточности внутренних органов, и (или) инфекционной интоксикации, обусловленной болезнетворными микроорганизмами. При попадании в организм различных ядовитых веществ в токсических дозах развиваются нарушения жизненно важных функций и создается угроза жизни человека.Особенность отравлений состоит в том, что чаще всего они развиваются внезапно, быстро прогрессируют и тяжело протекают. Более того, отравления часто развиваются в случайной обстановке, затрудняющей диагностику и оказание помощи.
Этиология и классификация Единой общепринятой классификации отравлений не существует. В практике часто используется обозначение отравлений по названию вызвавших их веществ, например, «отравление алкоголем», «отравление мышьяком», «отравление фенобарбиталом» и т. д. Также применяется классификация по названию группы веществ, вызвавших отравление, например «отравление щелочами», «отравление ядохимикатами», «отравление лекарствами» и т. д. В зависимости от путей поступления яда в организм различают следующие виды отравлений: энтеральные (через рот); ингаляционные (через дыхательные пути); перкутанные (через кожные покровы); отравления путем инъекций; отравления при введении яда в прямую кишку и влагалище. В зависимости от причин и места возникновения различают две большие группы отравлений: случайные (производственные, бытовые, в результате медицинской ошибки) и преднамеренные (криминальные и самоубийства). Более распространены бытовые отравления, которые обычно возникают случайно при ошибочном приеме внутрь различных ядов (химикатов, инсектицидов, медикаментов наружного применения, ядовитых растений, недоброкачественных пищевых продуктов и других веществ), при укусах ядовитыми змеями и насекомыми. К одним из наиболее частых относится отравление алкоголем и его суррогатами. Умышленные отравления регистрируются значительно реже. Медицинские отравления отмечаются при ошибках в дозах лекарств или путях их введения в организм. Токсикологическая классификация ядовитых веществ учитывает специфику и механизм их действия на организм. В соответствии с этим различают: — вещества нервно-паралитического действия, вызывающие бронхоспазм, удушье, судороги (фосфорорганические инсектициды — хлорофос, дихлофос и т. д. и боевые отравляющие вещества — зарин и т. д.); — вещества кожно-резорбтивного действия, вызывающие местную воспалительную реакцию и общетоксическое резорбтивное действие (боевые отравляющие вещества — иприт, люизит, а также уксусная кислота, дихлорэтан, гексохлоран, ртуть, мышьяк и его соединения); — вещества общетоксического действия, вызывающие судороги, отек мозга, кому (см.), параличи (см.) (алкоголь и его суррогаты, угарный газ, синильная кислота, боевые отравляющие вещества — хлорциан); — вещества удушающего действия, которые вызывают токсический отек легких (см.) (боевые отравляющие вещества фосген и дифосген, а также окислы азота); — вещества слезоточивого и раздражающего действия, которые вызывают раздражение наружных слизистых оболочек (пары крепких кислот и щелочей, боевые отравляющие вещества типа си-эс, хлорпикрин); — вещества психотического действия, вызывающие нарушения психической активности, нарушения сознания, галлюцинации (см.) (кокаин, героин, препараты опия, атропин, боевые отравляющие вещества). Подразделяют также ядовитые вещества по преимущественному поражению того или иного органа (системы) организма: — сердечные яды вызывают нарушения ритма сердечной деятельности, развитие токсической дистрофии сердечной мышцы — сердечные гликозиды, трициклические антидепрессанты, некоторые растительные (чемерица, аконит) и животные яды (тетродотоксин), а также соли бария и калия; — нервные яды вызывают нарушения психической активности, токсическую кому (см.), параличи (см.) (наркотики, снотворные, транквилизаторы, алкоголь и его суррогаты, угарный газ, фосфорорганические соединения); — печеночные яды (бледная поганка, хлорированные углеводороды — дихлорэтан и др.); — почечные яды вызывают токсическую нефропатию (этиленгликоль, соединения тяжелых металлов); — кровяные яды вызывают нарушения свертывания крови и транспорта гемоглобина (нитриты, анилин и его производные, щавелевая кислота); — желудочнокишечные яды вызывают токсический гастроэнтерит (см.) (соединения тяжелых металлов и мышьяка, крепкие кислоты и щелочи); — легочные яды вызывают токсический отек легких (см.) (окислы азота, фосген — боевое отравляющее вещество). Избирательной токсичностью обладают также ядовитые растения, среди которых выделяют: — растения, вызывающие преимущественное поражение нервной системы: аконит (борец, голубой лютик, иссык-кульский корень), белена, белладонна (красавка), болиголов пятнистый, вех ядовитый (водяной болиголов, водяной омег), дурман, конопля индийская, табак, чина посевная, чистотел, чилибуха (рвотный орех); — растения, вызывающие преимущественно поражение желудочно-кишечного тракта: безвременник, волчье лыко, клещевица (турецкая конопля, касторка), крушина, молочай, паслен; — растения, вызывающие преимущественное поражение сердца: ландыш, наперстянка, чемерица; — растения, вызывающие преимущественное поражение печени: гелиотроп, горчак розовый, крестовик; — растения, вызывающие преимущественное поражение кожи: борщевик, крапива. В зависимости от токсичности выделяют чрезвычайно токсичные, высокотоксичные, умеренно токсичные и малотоксичные яды. По тяжести различают легкие, средней тяжести, тяжелые, крайне тяжелые и смертельные отравления. Выделяют также острые и хронические отравления. Острые развиваются при однократном поступлении в организм яда и характеризуются острым началом и выраженными специфическими симптомами. Хронические отравления развиваются при длительном, нередко прерывистом поступлении яда в субтоксических дозах, которые в начальном периоде проявляются неспецифическими симптомами со стороны нервной или эндокринной системы. Еще реже встречаются подострые отравления, характеризующиеся медленным развитием при однократном введении яда в организм.
Клиническая картина Общие проявления Развитие симптомов отравления может быть достаточно быстрым, с интенсивным прогрессированием клиники и функциональных расстройств, приводящих к смерти, или медленным, с постепенным появлением отдельных симптомов, что зависит от вида и количества попавшего в организм яда. Избирательность токсического действия многих ядов обусловливает преобладание в клинической картине отравления симптомов поражения отдельных систем — нервной, дыхательной, пищеварительной, сердечно-сосудистой и т. д. Токсическое поражение нервной системы развивается как вследствие прямого токсического воздействия ядов на различные структуры центральной и периферической нервной системы, так и в результате поражения внутренних органов, прежде всего печени и почек, ответственных за выведение ядов. Поражение нервной системы характеризуется разнообразными психическими и неврологическими симптомами. Нарушения психической активности могут проявляться как ее понижением, так и повышением. В неврологической картине острого отравления часто выражены симметричные изменения величины зрачков, нарушение секреции потовых, слюнных и бронхиальных желез, расстройства терморегуляции. О наиболее тяжелом поражении нервной системы при острых отравлениях свидетельствуют токсическая кома (см.) или острый интоксикационный психоз (см.), требующие интенсивного лечения. В периоде выздоровления у большинства пострадавших, имевших выраженные психоневрологические расстройства, формируется астенический синдром. Расстройства функции сердечно-сосудистой системы при острых отравлениях характеризуются изменением артериального давления (как проявление острой сердечно-сосудистой недостаточности нередко развивается коллапс (см.)), снижением сократительной способности миокарда, нарушением сердечного ритма и проводимости. Для поражений желудочно-кишечного тракта типичны диспепсические расстройства: тошнота, рвота, жидкий стул, пищеводные и желудочные кровотечения (см.), разнообразные боли в животе. Рвота может привести к проникновению желудочно-кишечного содержимого в трахею и бронхи и развитию аспирационной пневмонии (см.). Поражение органов дыхания при острых отравлениях может привести к острой дыхательной недостаточности, в основе которой лежит аспирационно-обструктивный синдром, обусловленный бронхореей, повышенной саливацией (слюноотделением), ларингоспазмом, отеком голосовых связок. Более чем в 30 % случаев всех острых отравлений выявляется нарушение функции печени и почек.
Отравления алкоголем (этанолом, спиртом этиловым) и его суррогатами Этанол быстро всасывается в желудке (20 %) и тонкой кишке (80 %), выводится он в течение 7—12 ч через дыхательные пути и с мочой. Спиртные напитки крепостью до 30 % всасываются быстрее. Замедляет всасывание алкоголя пища, ускорение всасывания отмечается при приеме алкоголя натощак, повторных приемах и у лиц с заболеваниями желудка. Достижение максимальной концентрации этанола в крови происходит в среднем через 1,5 ч. Средняя смертельная доза алкоголя составляет 300–400 мл 96 %-ного спирта, принятого в течение 1 ч, или 250 мл 96 %-ного спирта, принятого в течение 30 мин. До 10 % алкоголя через легкие, почки и кожу выделяется неизмененным, а 90 % подвергается окислению. Этанол оказывает наркотическое действие на центральную нервную систему; токсическим эффектом обладают сам алкоголь и ацетальдегид, образующийся в организме при расщеплении спирта. Алкогольное опьянение сопровождается преходящими изменениями психики. На начальном этапе возникает эмоциональное, речевое и двигательное возбуждение, понижаются самоконтроль и критическая оценка ситуации, развивается состояние эйфории. Наблюдаются блеск глаз, покраснение лица, повышенное пото- и слюноотделение, расслабление мышц, замедление пульса. Повышается аппетит, наступает чувство тепла и мышечной слабости, развивается состояние общего психического и физического удовлетворения, отмечается подъем настроения. При приеме токсических доз после симптомов опьянения через непродолжительное время (в среднем 20–30 мин) отмечаются симптомы алкогольной интоксикации. Характерны расширение зрачков, учащение мочеиспускания, бледность кожных покровов, сухость во рту. Возрастает психическая и физическая активность при снижении качества выполняемых действий. Движения плохо скоординированы, нарушены равновесие и мимика, речь громкая, смазанная, резко снижена концентрация внимания. Типична переоценка своих качеств и возможностей при отсутствии критики к своим словам и действиям. Выделяют легкую, среднюю и тяжелую степени алкогольного опьянения и две стадии алкогольной комы (см.) — поверхностную и глубокую. При легкой степени опьянения видимые проявления либо выражены слабо, либо отсутствуют, последствий на следующий день не отмечается. При опьянении средней степени тяжести симптомы алкогольной интоксикации выражены отчетливо, постепенно опьянение переходит в сонливость, вялость и, как правило, заканчивается глубоким сном. После опьянения средней степени при пробуждении наступает постинтоксикационное состояние («похмелье»), характеризующееся вялостью, разбитостью, отсутствием аппетита, тяжестью в голове, сниженным настроением, иногда тоскливостью, недовольством собой и окружающими, раздражительностью, угнетением психических процессов и снижением работоспособности. В 2/3 случаев при опьянении тяжелой степени отмечается рвота как защитный рефлекс, все признаки интоксикации ярко выражены, а по мере ее нарастания пострадавший впадает в коматозное состояние. Поверхностная кома (см.) проявляется потерей сознания, отсутствием речи, значительным снижением зрачковых рефлексов и угнетением болевой чувствительности. Мышечный тонус может быть как понижен, так и повышен. Зрачки чаще сужены, но могут быть и расширены. По отношению к болевым раздражениям выделяют два периода поверхностной алкогольной комы: в первом периоде укол (как и действие нашатырного спирта) вызывает расширение зрачков, мимическую реакцию и защитные движения рук; во втором периоде ответная реакция не выражена. Глубокая кома (см.) характеризуется полной утратой болевой чувствительности, отсутствием или резким угнетением всех рефлексов, выраженным мышечным расслаблением, снижением температуры тела. Кожа холодная, липкая, отмечается непроизвольное выделение мочи и кала. Дыхание замедленное, пульс слабый. Важнейшим диагностическим признаком комы (см.) является наличие специфического алкогольного запаха. При низком содержании алкоголя в крови и затянувшемся коматозном состоянии необходимо исключить черепно-мозговую травму. У больных сахарным диабетом (см.) даже небольшая доза этанола может вызвать кому.
Неотложная помощь: при тяжелой алкогольной интоксикации и коме показана неотложная госпитализация в стационар с отделением реанимации. Для предупреждения смерти от удушья рвотными массами производят туалет полости рта, фиксацию языка, отсос слизи из полости глотки. При адекватном дыхании производится экстренное промывание желудка через зонд в положении пострадавшего на боку до чистых промывных вод порциями по 500 мл, внутрь дают солевое слабительное. При тяжелой коме промывание желудка производят после интубации трахеи. Далее проводится дезинтоксикационная, противошоковая и симптоматическая терапия: внутривенно вводят полиглюкин, реополиглюкин, гемодез, 5 %-ный раствор глюкозы, 4 %-ный раствор гидрокарбоната натрия, изотонический раствор хлорида натрия. По показаниям (коллапс (см.)) используют преднизолон. Для ускорения окисления алкоголя показано внутривенное введение 400 мл 20 %-ного раствора глюкозы с 20 ЕД инсулина, витаминов В1 и В6, аскорбиновой и никотиновой кислот.Суррогаты разделяют на содержащие этанол и не содержащие этанола. К первой группе относятся бутиловый спирт (смертельная доза которого составляет около 30 мл), гидролизный и сульфитный спирты (получаемые из древесины путем гидролиза, они токсичнее этанола в 1,1–1,4 раза за счет примеси метилового спирта), денатурат (технический спирт с примесями метилового спирта и альдегида), одеколоны и лосьоны (содержат до 60 % этилового спирта), политура (технический этиловый спирт с ацетоном, бутиловым и амиловым спиртами), «нигрозин» (морилка для дерева, содержащая наряду с этиловым алкоголем красящие вещества, за счет которых кожа и слизистые оболочки пострадавшего приобретают синий цвет). Отравления суррогатами алкоголя этой группы протекают относительно благоприятно. Вторая группа включает метиловый спирт (метанол) и этиленгликоль, входящий в состав тормозной жидкости. Метиловый спирт быстро всасывается в желудке и тонком кишечнике, но в отличие от этилового спирта окисляется медленно с образованием токсичных формальдегида и муравьиной кислоты. До 75 % метанола выводится через дыхательные пути в неизмененном виде в течение 48 ч, а остальная часть — с мочой. Смертельная доза метилового спирта в среднем составляет 50—150 мл. Метанол оказывает выраженное токсическое действие на центральную нервную систему, вызывает повреждение сетчатки, зрительных нервов (дистрофию зрительных нервов) и почек. Чувство опьянения и эйфория выражены слабо, часто наблюдаются тошнота и рвота. Иногда уже в первые сутки отравления отмечаются характерные нарушения зрения (мелькание «мушек» перед глазами, неясность видения) вплоть до слепоты, но чаще выраженные признаки интоксикации метанолом развиваются через 1–2 суток. Пострадавшие жалуются на боли в животе, мышцах, суставах, пояснице, температура тела повышается до 38 °C, отмечается сухость кожи и слизистых оболочек. Для отравления метанолом характерны поражения органа зрения: расширение зрачков, угнетение их реакции на свет, расплывчатость видения, двоение в глазах, слепота. По мере нарастания интоксикации снижаются сухожильные рефлексы; типично увеличение печени. Артериальное давление снижено, развивается нарушение сердечного ритма. Характерна спутанность сознания, периодически возникает психическое и двигательное возбуждение с судорогами, затем развиваются ступор, кома (см.) и паралич (см.) конечностей.
Неотложная помощь: особенностями терапии является необходимость промывания желудка в течение трех дней после отравления (метанол выделяется через слизистую оболочку желудка) и экстренное проведение антидотной терапии этиловым спиртом, который нарушает обмен метанола в организме. С этой целью внутривенно капельно вводят этиловый спирт в виде 5 %-ного раствора из расчета 1–2 г/кг в сутки (в среднем суточная доза составляет 70 мл 96 %-ного этилового спирта). В более легких случаях 100 мл 30 %-ного этилового спирта назначают внутрь одномоментно, а затем через 2 ч дают по 50 мл 30 %-ного этилового спирта 4–5 раз в сутки. С целью детоксикации используют форсированный диурез и гемодиализ; показано введение глюкозо-новокаиновой смеси, витаминов группы В, аскорбиновой кислоты, преднизолона. Назначают повторные спинномозговые пункции с выведением 15–20 мл спинномозговой жидкости.Этиленгликоль быстро всасывается в желудочно-кишечном тракте, около 60 % его окисляется в печени с образованием токсических веществ, а 20–30 % выводится с мочой в неизмененном виде. Образующиеся в результате окисления токсические вещества (щавелево-уксусная кислота, гликолевый альдегид) вызывают дистрофию (см.) тканей печени и почек с развитием острой печеночной и почечной недостаточности (см.). При тяжелых отравлениях дистрофические процессы развиваются в клетках центральной нервной системы. Различают три периода отравления этиленгликолем: начальный, нейротоксический и нефротоксический. Начальный период характеризуется преобладанием симптомов поражения центральной нервной системы по типу алкогольного опьянения при общем хорошем самочувствии и продолжается обычно не более 12 ч. В нейротоксическом периоде симптомы поражения центральной нервной системы прогрессируют, затем присоединяются нарушения дыхания и сердечно-сосудистой системы. Отмечаются боли в животе, сильная жажда, головная боль, рвота, понос. Кожа сухая, слизистые оболочки синюшны. Зрачки широкие, температура тела повышена, выражены одышка и учащенное сердцебиение. Наблюдается психическое и двигательное возбуждение, при тяжелых отравлениях — потеря сознания и судороги. Дыхание становится глубоким и шумным, нарастает сердечная недостаточность. Нефротоксический период наступает на 2—5-е сутки и проявляется острой почечно-печеночной недостаточностью (см.).
Неотложная помощь: зондовое промывание желудка, прием солевого слабительного и экстренная госпитализация. В стационаре в первые сутки осуществляют форсированный диурез и гемодиализ.Проводится антидотная терапия этиловым спиртом: в 1—2-е сутки внутривенно капельно вводят 5 %-ный раствор из расчета 1–2 г/кг в сутки или 30 %-ный раствор этилового спирта дается по 50 мл через 3 ч. Для связывания щавелево-уксусной кислоты внутривенно вводят 10 %-ный раствор кальция хлорида или кальция глюконата по 10–20 мл, при возбуждении внутримышечно вводят 25 %-ный раствор сульфата магния. В тяжелых случаях и при поздней госпитализации показана пересадка донорской почки.
Отравление грибами Характерными симптомами при отравлениях грибами являются коликообразные боли в животе, резкая общая слабость, профузное (обильное) потоотделение, слюнотечение, тошнота и рвота, понос (часто с кровью), головная боль, головокружение, бред (см.), галлюцинации (см.), судороги, сужение или расширение зрачков, замедленный пульс, одышка, синюшность кожи, обезвоживание, кома (см.), паралич дыхания. Наиболее опасными являются бледная поганка и мухомор, однако опасное для жизни отравление могут вызывать также сморчки и строчки. Токсины бледной поганки не разрушаются при термической обработке и при высушивании, они быстро всасываются из пищеварительного тракта и в первую очередь поражают печень. Для ребенка смертельная доза составляет 1/3 гриба. Инкубационный период при отравлении бледной поганкой продолжается в среднем от 6 до 24 ч. Чаще всего через 6–8 ч после поступления яда в организм возникают неукротимая рвота, коликообразные боли в животе, понос с кровью, резкая слабость. На фоне рвоты и поноса развиваются нарушения водного и солевого баланса, появляются судороги. Отмечаются головная боль, головокружение, галлюцинации (см.), наблюдается выраженная тахикардия (см.), снижается артериальное давление, как проявление интоксикации и острой дистрофии (см.) миокарда развивается коллапс (см.). Вскоре пострадавший впадает в коматозное состояние. На 2—3-й день появляются симптомы острого токсического поражения печени и почек: желтуха (см.), увеличение и болезненность печени, развивается анурия. Крайне тяжело отравления протекают у детей.
Неотложная помощь: немедленное промывание желудка через зонд, внутрь дается солевое слабительное — сульфат магния в дозе 30 г, осуществляется срочная госпитализация пострадавшего в токсикологическое отделение стационара для проведения срочного — в первые сутки — гемодиализа и детоксикационной гемосорбции. Внутривенно вводятся липоевая кислота по 20–30 мг/кг в сутки и 0,9 %-ный раствор хлористого натрия, подкожно вводится 0,1 %-ный раствор атропина.Яд мухомора при термической обработке разрушается лишь частично. Более всего при отравлении мухомором страдают печень, почки, сердце и мозг. Скрытый период продолжается от получаса до 6 ч. Чаще всего не позднее 2 ч с момента отравления отмечается поражение пищеварительного тракта: тошнота, рвота, боли в животе, частый жидкий стул. Для отравления мухомором характерны повышенное потоотделение, слюнотечение, повышенная секреция бронхов, сужение зрачков. Отмечаются синюшность кожи, одышка, затем развиваются бред (см.), галлюцинации (см.), судороги и потеря сознания.
Неотложная помощь: промывание желудка через зонд, введение солевого слабительного и госпитализация пострадавшего в токсикологическое отделение стационара. Проводят инфузионную терапию внутривенным введением 10 %-ного раствора глюкозы до 2 л в сутки, назначают витамины группы В, аскорбиновую и глютаминовую кислоту, сердечно-сосудистые средства.Отравление сморчками и строчками происходит после употребления плохо проваренных грибов или грибного бульона. Яд сморчков оказывает преимущественное действие на эритроциты, вызывая их гемолиз; также поражаются печень и почки. Первые симптомы отравления наблюдаются со стороны желудочно-кишечного тракта: рвота, боли в животе, понос. На поражение почек указывает появление мочи красного цвета. Далее развивается желтуха (см.), что свидетельствует о поражении печени.
Неотложная помощь: промывание желудка через зонд, затем внутривенно капельно вводится 4 %-ный раствор натрия гидрокарбоната. Больной подлежит госпитализации в стационар, где проводится профилактика и лечение почечной и печеночной недостаточности.
Кислоты При отравлении кислотами смертельная доза составляет 20 мл и более концентрированного раствора. Приблизительно 6–7 % всех отравлений кислотами составляют отравления уксусной эссенцией. Смертельная доза уксусной эссенции составляет около 50 мл. Токсическое действие крепких кислот — азотной, соляной, уксусной — обусловлено как местным прижиганием тканей, так и резорбтивным действием кислот. Кислоты при приеме внутрь вызывают химический ожог (см.) полости рта, зева, глотки, пищевода, желудка, реже кишечника. Также развивается химический ожог дыхательных путей с последующим развитием воспалительных процессов в трахее, бронхах и легких. Резорбтивное действие кислот вызывает гемолиз эритроцитов, развитие синдрома внутрисосудистого свертывания крови, токсическое поражение почек и печени. При приеме кислот внутрь ведущее место в остром периоде отравления занимают резкие боли в полости рта, глотке и пищеводе. Могут быть боли в желудке, нередко отмечается слюнотечение. Типична многократная рвота с примесью крови, но пищеводно-желудочные кровотечения (см.), возникающие в первые 2 суток после отравления, обычно быстро прекращаются. Поздние пищеводные и желудочные кровотечения связаны с образованием кровоточащих язв. Распространенный химический ожог пищеварительного тракта и боль могут вызвать развитие шока (см.). При шоке (см.) отмечается психическое и двигательное возбуждение, затем наступают спутанность сознания и безучастность к окружающему, отмечается бледность кожи. Артериальное давление вначале повышено, затем прогрессивно снижается, нарастают тахикардия (см.), одышка, синюшность кожи, снижается количество выделяемой мочи. Нарушение функции почек может достигать степени тяжелой острой почечной недостаточности. Острая почечная недостаточность часто протекает тяжело и при одновременном поражении печени в 60 % случаев заканчивается смертью. При отравлении уксусной кислотой за счет разрушения эритроцитов моча приобретает красный, коричневый или вишневый цвет в зависимости от степени гемолиза (разрушения эритроцитов). Токсическое поражение печени проявляется увеличением печени, желтушностью склер и кожи разной степени интенсивности. Все осложнения ожоговой болезни от действия кислот разделяются на ранние и поздние. К ранним относятся механическая асфиксия (см.), кровотечения (см.), острый панкреатит (см.), интоксикационный психоз (см.), анурия (см.). Поздние осложнения — трахеобронхиты, пневмонии (см.), почечно-печеночная недостаточность (см.), пищеводно-желудочные кровотечения (см.), рубцовые деформации пищевода и желудка. Неотложная помощь: экстренное промывание желудка холодной водой на фоне обезболивания (введение 1 %-ного раствора морфина или 2 %-ного раствора промедола с 0,1 %-ным раствором атропина и 2 %-ным раствором папаверина или но-шпы). Безопасно и необходимо промывание желудка в первые 6 ч, в дальнейшем эффективность промывания снижается, а после 12 ч с момента отравления нецелесообразна. Для местного лечения больному дают каждый час по 20 мл эмульсии подсолнечного масла с анестезином и антибиотиками и кусочки льда. Беззондовое промывание желудка (вызывание рвоты) при отравлении кислотами не применяется. Применяется форсированный диурез и комплекс противошоковых мероприятий. Общий объем внутривенно вводимых растворов может достигать 10 л и более. Вводят 4 %-ный раствор гидрокарботата натрия до 1500 мл, 10 %-ный раствор глюкозы до 1000 мл. При тяжелом отравлении доза лазикса при одномоментном введении составляет до 200 мг. С целью профилактики инфекционных осложнений и деформаций применяют антибиотики в больших дозах. По показаниям используется гемосорбция. Основными причины смерти при отравлении кислотами является интоксикация и шок (см.), в более поздние сроки — пневмонии (см.).
Лекарственные средства Атропин (его содержат белладонна, белена, дурман). Признаки отравления атропином типичны — отмечаются сухость во рту и глотке, расстройство речи и глотания, нарушения близкого видения, двоение в глазах, светобоязнь, выраженное сердцебиение. Наблюдаются также одышка и головная боль, расширение зрачков, отсутствие их реакции на свет, сухость и покраснение кожи. Отмечаются психическое и двигательное возбуждение, бред (см.), галлюцинации (см.), судороги с потерей сознания, коматозное состояние. Тяжелее протекает отравление атропином у детей.
Неотложная помощь: при поступлении яда через рот производят зондовое промывание желудка. Зонд необходимо обильно смазать вазелиновым маслом. Показаны форсированный диурез, гемосорбция. В коматозном состоянии и при отсутствии возбуждения вводятся пилокарпин по 1 мл 1 %-ного раствора, 1 мл 0,05 %-ного раствора прозерина или 1 мл 0,05 %-ного раствора эзерина подкожно. При возбуждении и судорогах показано введение 2,5 %-ного раствора аминазина и 0,5 %-ного раствора диазепама.Среди барбитуратов наиболее широко используются барбамил, барбитал (веронал), фенобарбитал (люминал), этаминал-натрий (нембутал). Смертельная доза барбитуратов составляет 0,1 г/кг и колеблется от 5 до 10 г, но описана смерть и при приеме 1,5 г препарата. Барбитураты оказывают токсическое действие на центральную нервную систему с угнетением всех ее функций. Для клинической картины острой интоксикации барбитуратами характерно сочетание психоневрологических расстройств, нарушений дыхания, функций сердечно-сосудистой системы и поражения поверхности тела (у 6 % больных) в виде дерматитов (см.) и даже пролежней (см.). Ускорение всасывания барбитуратов происходит при одновременном приеме алкоголя. Выделяют четыре клинические степени интоксикации барбитуратами. При легкой степени отравления наблюдаются сонливость, апатия, незначительное урежение пульса, слюнотечение, умеренное сужение зрачков с сохранением их реакции на свет. Часто больной спит, но легко может быть разбужен. Дыхание и гемодинамические показатели (артериальное давление и пульс) без изменений, рефлексы сохранены. Через 10–15 ч пациент просыпается. Средняя степень отравления характеризуется глубоким сном в течение 1–2 суток, ослаблением реакции зрачков на свет, повышением или понижением сухожильных рефлексов, снижением или понижением мышечного тонуса, слюнотечением, возможны нарушение дыхания, рвота и западение языка. Но выраженных изменений артериального давления и пульса обычно не отмечается. При тяжелой степени отравления развивается глубокая кома (см.). Наблюдается полное расслабление мышц, отсутствие глазных и сухожильных рефлексов, резкое угнетение кашлевого и глоточного рефлексов, реакций на болевое раздражение. Зрачки узкие, дыхание частое, поверхностное. Пульс слабый, учащен, артериальное давление снижается, кожа синюшна. При продолжительности комы более 12 ч возможны развитие бронхопневмонии (см.), отека легких (см.), нарушений функций печени и почек. Продолжительность комы (см.) составляет 5–7 дней; без лечения на 5—6-й день наступает смерть от пневмонии (см.) или гипоксического отека мозга (см.). Для крайне тяжелой формы отравления характерно полное отсутствие рефлексов, патологические ритмы дыхания вплоть до апноэ, коллапс (см.). Без лечения пострадавшие быстро погибают. При благоприятном исходе в посткоматозной стадии типичны эмоциональная неустойчивость, депрессия (см.), шаткая походка.
Неотложная помощь включает промывание желудка и дачу солевого слабительного. У больных, находящихся в коматозном состоянии, промывание желудка проводят после интубации трахеи на фоне искусственной вентиляции легких. Промывание желудка проводится повторно через 3–4 ч, так как барбитураты, принятые в больших дозах, остаются в желудке в течение 24 ч, особенно при глубокой коме, когда нарушены перистальтика и всасывание. Наиболее эффективно промывание желудка в первые 6 ч. Внутрь применяют активированный уголь; применяют форсированный диурез, ранний гемодиализ. Показано введение витаминов группы В, аскорбиновой кислоты.Кордиамин, камфора, кофеин и другие дыхательные аналептики применяют исключительно в терапевтических дозах, так как применение их в больших дозах может вызвать судороги и дыхательные осложнения. Противопоказана использовавшаяся прежде при глубокой коме антидотная терапия бемегридом, так как препарат, временно стимулируя дыхательный центр, вызывает увеличение расхода кислорода, судороги и нарушение сердечного ритма. Димедрол быстро всасывается и выводится преимущественно с мочой в течение 24 ч. Препарат оказывает нейротоксическое и психотропное действие. Признаками отравления являются сухость во рту, сонливость, головокружение, тошнота, мышечные подергивания, учащенное сердцебиение, нарушение зрения. Артериальное давление снижено, дыхание резко угнетено, зрачки расширены, кожа сухая и бледная. Тяжелые отравления проявляются возбуждением, судорогами, потерей сознания и комой (см.).
Неотложная помощь включает промывание желудка, также показаны форсированный диурез и детоксикационная гемосорбция. Подкожно вводят 0,05 %-ный раствор физостигмина по 1 мл повторно, при отсутствии резкого возбуждения показан пилокарпин 1 %-ный — 1 мл. При возбуждении внутримышечно применяют аминазин по 2 мл; при судорогах — 0,5 %-ный раствор диазепама (2 мл).Изониазид (тубазид) широко используется при лечении туберкулеза (см.), оказывает нейротоксическое действие. Симптомы интоксикации — тошнота, рвота, боли в животе, головная боль, парестезии, сухость во рту, дрожание рук, расстройство координации движений, одышка, брадикардия (см.), затем тахикардия (см.). При тяжелом отравлении развиваются судороги с потерей сознания и расстройством дыхания.
Неотложная помощь включает зондовое промывание желудка, внутрь вводят солевое слабительное, назначают форсированный диурез и ранний гемодиализ (возможно развитие токсической нефропатии и поражение печени). Внутривенно вводят витамин В6 каждые 6—12 ч по 10 мл 5 %-ного раствора. Показано внутривенное капельное применение 4 %-ного раствора гидрокарбоната натрия — до 1000 мл.Инсулин оказывает гипогликемическое действие (снижение уровня сахара крови). Отмечаются слабость, усиленное потоотделение, тремор рук, чувство голода. При тяжелом отравлении развиваются психическое и двигательное возбуждение, судороги, кома (см.).
Неотложная помощь: на месте внутривенно струйно вводится 40 %-ный раствор глюкозы. При невозможности введения глюкозы пациенту дают теплый сладкий чай (сладкую воду), кусок сахара, конфету.Марганцовокислый калий. Марганец оказывает местное раздражающее и общее нейротоксическое действие. При действии паров развиваются острый назофарингит (см.), бронхит (см.), токсическая пневмония (см.). В последующем развиваются бессонница и головная боль. При поступлении внутрь отмечаются тошнота, рвота, отсутствие аппетита. Неотложная помощь: при попадании внутрь — промывание желудка через зонд, введение солевого слабительного. Специфическое лечение: назначают тетацин-кальций по 2–4 г в сутки в течение недели — внутривенно вводят 10 %-ный раствор по 20–40 мл в 500 мл 5 %-ного раствора глюкозы. Подкожно вводят эфедрин 5 %-ный — 1 мл, атропин 0,1 %-ный — 1 мл, внутривенно вводят 10 %-ный раствор кальция глюконата, 2,4 %-ный раствор эуфиллина. Показаны витамины группы В, гидрокортизон. В случаях повышенной чувствительности при употреблении обычных доз новокаина развиваются головокружение, общая слабость, падение артериального давления, иногда анафилактический шок (см.). При введении токсических доз вначале наблюдаются возбуждение и судороги, затем угнетение центральной нервной системы и развитие комы (см.). Для отравления новокаином характерны учащенное сердцебиение, падение артериального давления, парез (см.) кишечника.
Неотложная помощь: показан форсированный диурез. При снижении артериального давления внутривенно вводят норадреналин, эфедрин, мезатон. При судорогах показан диазепам по 2 мл 0,5 %-ного раствора.Новокаинамид (прокаинамид). Препарат быстро всасывается при приеме внутрь, оказывает местное анестезирующее действие и поражает сердце. Симптомы интоксикации: тошнота, рвота, головная боль, возбуждение, снижение артериального давления. При введении токсических доз развиваются коллапс (см.), выраженная брадиаритмия, возможна фибрилляция (трепетание) желудочков на фоне тошноты, рвоты и поноса. Отмечается вначале возбуждение, а затем угнетение центральной нервной системы.
Неотложная помощь: при приеме внутрь производят промывание желудка, внутрь вводят солевое слабительное, показан форсированный диурез. При снижении артериального давления показано введение норадреналина, мезатона, эфедрина, при брадикардии (см.) применяют 0,1 %-ный раствор атропина.Обзидан (анаприлин, пропроналол, индерал). Препарат оказывает токсическое действие на сердце и нервную систему. При его приеме внутрь отмечаются тошнота, рвота, диарея (см.) и бронхоспазм. Для интоксикации анаприлином характерно покалывание в конечностях, возможны зрительные галлюцинации (см.). Отмечаются брадикардия (см.), нарушение внутрисердечной проводимости, снижение артериального давления. В тяжелых случаях развиваются коллапс (см.), расстройство сознания.
Неотложная помощь включает промывание желудка и форсированный диурез. Показано внутривенное капельное введение изадрина (изупрела): 1–2 мл в 200 мл 5 %-ного раствора глюкозы или в 0,9 %-ном растворе хлорида натрия; подкожно вводят адреналин 0,1 %-ный — 1 мл.Психотропные препараты (транквилизаторы, нейролептики, препараты брома, валерианы, антидепрессанты). К нейролептикам принадлежат аминазин, пропазин, тизерцин, галоперидол, эглонил; среди транквилизаторов наиболее известны и широко применяются элениум, феназепам, нозепам (тазепам), диазепам (реланиум, седуксен, валиум, сибазон), мепробамат, триоксазин и др. К наиболее применяемым седативным средствам относятся натрия бромид, бромкамфора, настойка корня валерианы, корвалол (валокардин); среди антидепрессантов известны амитриптилин (триптизол), азафен, препараты лития. При поступлении внутрь 10 % психотропных препаратов распадается в печени, а 90 % выводится с мочой. Смертельная доза при отравлении психотропными препаратами колеблется от 0,1 до 0,3 г/кг, составляя в среднем 20 г. При введении в организм 10 г барбитуратов отмечаются ступор и падение артериального давления, а при более высоких дозах развивается кома (см.) с расстройством дыхания, выраженным коллапсом (см.), арефлексией (отсутствием рефлексов). Аминазин относится к нейролептикам, оказывает психотропное и нейротоксическое действие. Сходное действие оказывают дипразин (пипольфен,) тизерцин, пропазин, трифтазин и другие производные фенотиазина. Отравление аминазином вызывает сухость во рту, резкую слабость, тошноту, головокружение, сужение зрачков, понижение артериального давления, пульс учащен. Возможны судороги и потеря сознания. Зрачки сужены, повышены сухожильные рефлексы, артериальное давление снижено. Возможно появление кожных аллергических реакций.
Неотложная помощь: промывание желудка, введение солевого слабительного, назначение форсированного диуреза и гемосорбции. Показано введение витаминов группы В, при падении артериального давления подкожно вводят до 3 мл 10 %-ного раствора кофеина, 2 мл 5 %-ного раствора эфедрина. Амитриптилин (триптизол) относится к антидепрессантам, быстро всасывается в пищеварительном трате и выводится с мочой в течение 1–4 суток. Оказывает психотропное и нейротоксическое действие, поражает мышцу сердца и его проводящие пути.В начальном периоде отравления амитриптилином наблюдаются сухость во рту, нарушение зрения, психическое и двигательное возбуждение, ослабление перистальтики кишечника и задержка мочи. При тяжелых отравлениях развиваются спутанность сознания, судороги, кома (см.). Выражено расстройство сердечной деятельности — замедление или (реже) учащение пульса, острая сердечно-сосудистая недостаточность. Неотложная помощь включает промывание желудка, очистительную клизму,применение солевого слабительного. Показан форсированный диурез, при более тяжелых отравлениях производится детоксикационная гемосорбция. При резкой тахиаритмии показано внутримышечное введение 1 мл 0,05 %-ного раствора прозерина или 1 мл физостигмина подкожно или внутривенно каждый час до урежения пульса (60–70 уд./мин); может применяться и лидокаин. При выраженной брадикардии (см.) используется 0,1 %-ный раствор атропина подкожно или внутривенно по 1 мл повторно через 1 ч, при судорогах и возбуждении вводят внутривенно 10–20 мг диазепама. Перекись водорода. Интоксикацию вызывает 30 %-ный раствор (необходимо читать инструкции отбеливающих средств). Перекись водорода оказывает местное прижигающее действие и вызывает разрушение тканей с образованием в них кислорода. При попадании на кожу развивается ее побеление, возникают ожоги и волдыри. При приеме внутрь наблюдается ожог желудочно-кишечного тракта. Клинические проявления и оказание неотложной помощи — см. Отравления щелочами. Резерпин (рауседил), раунатин (раувазан) вызывают торможение центральной нервной системы, они медленно всасываются и так же медленно (за 2–3 суток) выводятся с мочой Признаки отравления: тошнота, рвота, боли в животе, гиперемия (краснота) кожи лица, шеи, туловища, набухание слизистой оболочки носа и сухость во рту. Характерно выраженное сужение зрачков. Сначала наблюдается период эйфории, возбуждения, затем развиваются сонливость, шаткость походки, мышечная гипотония. Выражены дрожание конечностей и нижней челюсти, иногда отмечаются судороги и кома (см.). Мочеиспускание часто задержано. Развиваются снижение артериального давления, брадикардия (см.), угнетение дыхания. У детей имеется опасность развития отека гортани.
Неотложная помощь включает зондовое промывание желудка, введение солевого слабительного и активированного угля. Показан форсированный диурез. При снижении артериального давления вводят полиглюкин, норадреналин, преднизолон. Показаны витамины группы В, аскорбиновая кислота. При тяжелом отравлении показана гемосорбция.Тетурам (антабус) используется для лечения алкоголизма, иногда анонимного. Тетурам медленно всасывается в пищеварительном тракте и медленно выводится в неизменном виде с мочой, он оказывает психотропный эффект, а также токсическое действие на печень и вегетативную нервную систему. После курса лечения антабусом прием небольшой дозы алкоголя вызывает резкое покраснение кожных покровов, чувство жара лица, затруднение дыхания, сердцебиение, чувство страха смерти, озноб. Постепенно реакция заканчивается самостоятельно и через 1–2 ч наступает сон. После приема больших доз алкоголя развиваются резкая бледность и синюшность кожных покровов, повторная рвота, учащение пульса и падение артериального давления, ишемия миокарда, токсическое поражение печени.
Неотложная помощь включает зондовое промывание желудка, форсированный диурез. Показано внутривенное струйное введение 40 мл 40 %-ного раствора глюкозы с аскорбиновой кислотой (5 %-ный раствор 10 мл) и 40 мг лазикса. Также показано введение витамина В1 и внутривенное капельное введение 4 %-ного раствора натрия гидрокарбоната.Формалин (формальдегид). При поступлении формалина внутрь развиваются ожоги пищеварительного тракта, проявляющиеся болями и жжением за грудиной и в подложечной области, тошнотой, рвотой кровью. О поражении печени свидетельствует развивающаяся желтуха (см.), о нарушении функции почек — уменьшение количества выделяемой мочи. При воздействии паров, повреждающих дыхательные пути, отмечаются слезотечение, кашель, одышка, разлитой бронхит (см.), ларингит (см.), пневмония (см.), психическое и двигательное возбуждение. При вдыхании паров необходимо вынести пострадавшего на свежий воздух. Показаны ингаляции водяного пара с добавлением нескольких капель нашатырного спирта.
Неотложная помощь при энтеральном отравлении предусматривает промывание желудка слабым раствором нашатырного спирта и обезболивание 1–2 %-ным раствором промедола (1 мл подкожно). Внутрь дают слабительное — 30 г сульфата магния, применяют форсированный диурез с введением 100–150 мл 30 %-ного раствора мочевины. Показано введение 0,1 %-ного раствора атропина.
Наркотики Наркотические анальгетики группы опия (опий, морфин, омнопон, героин, кодеин, промедол). Смертельная доза морфина при внутривенном введении составляет 0,2 г. Все препараты данной группы особенно токсичны для детей младшего возраста. При поступлении в организм токсических доз наркотических препаратов независимо от метода введения (внутривенно или через рот) развивается коматозное состояние — резкое сужение зрачков с ослаблением их реакции на свет, покраснение кожи, повышение тонуса скелетных мышц, иногда отмечаются судороги. В дальнейшем наблюдается угнетение дыхания вплоть до его остановки, появляется выраженная синюшность кожи, зрачки расширяются, снижается температура тела, пульс замедляется, снижается артериальное давление, наступает коллапс (см.). Для легкой степени отравления наркотическими препаратами группы опия характерно постепенное начало клинических проявлений — сонливость, снижение болевой чувствительности, рвота, помрачение сознания. Основные клинические симптомы: кожа синюшная, покрыта холодным потом, холодная. Зрачки сужены. Дыхание поверхностное, аритмичное. Пульс редкий, артериальное давление понижено. Возможны коллапс (см.), отек легких (см.). При тяжелом отравлении кодеином возможны нарушения дыхания и падение артериального давления при сохраненном сознании. Неотложная помощь: повторное промывание желудка через зонд с последующим введением 100–150 мл 33 %-ного раствора сульфата магния. Промывание желудка проводят даже при внутривенном введении морфина. Внутрь дается активированный уголь. Внутривенно вводят антидот: 1–3 мл 0,5 %-ного раствора налорфина (при необходимости дозу повторяют через 10–15 мин) или раствор налоксона. Внутривенно капельно вводят 500–800 мл 4 %-ного раствора гидрокарбоната натрия. Показаны ингаляции увлажненным кислородом. Кокаин быстро всасывается при нанесении на слизистые оболочки и оказывает вначале возбуждающее, а затем тормозящее действие на центральную нервную систему. Характерные симптомы отравления: немотивированное приподнятое настроение, ощущение довольства, эйфория, галлюцинации (см.), чувство жара, учащенное сердцебиение, расширение зрачков. Отмечаются боли в животе, тошнота и рвота. Наблюдается одышка, затем отмечается угнетение дыхания. Развивается коматозное состояние с резким снижением артериального давления и развитием коллапса (см.).
Неотложная помощь: при приеме внутрь показано промывание желудка через зонд 0,1 %-ным раствором перманганата калия, внутрь дают активированный уголь. При возбуждении и судорогах внутривенно вводят седуксен. Эфедрин быстро всасывается из желудочно-кишечного тракта. Выводится в неизмененном виде с мочой (75 % за 24 ч). Используется с целью наркотизации при внутривенном введении (эфедрон). Обладает психотропным (возбуждающим) и нейротоксическим действием. Смертельная доза для взрослых составляет 2 г.Клинические признаки отравления: тошнота, рвота, головная боль, беспокойство, повышение температуры, потливость. Отмечаются повышение артериального давления, учащение пульса, одышка. Характерно расширение зрачков, нарушение цветоощущения, психическое и двигательное возбуждение, судороги. В тяжелых случаях развивается кома (см.) с резким падением артериального давления и выраженными нарушениями дыхания.
Неотложная помощь: при приеме внутрь показано промывание желудка, прием активированного угля и солевого слабительного. При возбуждении и судорогах вводят седуксен (2 мл), при возбуждении и повышении артериального давления — аминазин (2 мл 2,5 %-ного раствора).Индийская конопля (анаша, гашиш, марихуана) оказывает двоякое действие: вызывает галлюцинации (см.) и угнетает центральную систему. Основные начальные клинические проявления отравления: психическое и двигательное возбуждение, расширение зрачков, шум в ушах, яркие зрительные галлюцинации (см.). Затем отмечаются нарастающая общая слабость и вялость, появляется плаксивость и наступает глубокий сон с понижением температуры тела, замедлением пульса, падением артериального давления.
Неотложная помощь: при попадании внутрь — промывание желудка, прием активированного угля. При резком возбуждении вводятся противосудорожные препараты (седуксен, дроперидол, аминазин).
Соединения тяжелых металлов и мышьяка К тяжелым металлам относятся соединения ртути (сулема, каломель), свинца, меди (купорос), висмута, железа и др. В качестве сырья соединения тяжелых металлов используются во многих отраслях промышленности, применяются в сельском хозяйстве, а также входят в состав различных лекарств. Отравления соединениями тяжелых металлов возникают при попадании их через пищеварительный тракт, путем ингаляции, а также через кожу и слизистые оболочки. Соединения железа (железа сульфат, железа лактат и т. д.) оказывают местное прижигающее действие на слизистые оболочки желудка и кишечника, а также общее токсическое действие на ткань печени, кровь и стенки кровеносных сосудов. Через 15–20 мин после приема внутрь яда возникают боли в животе и повторная рвота. Рвотные массы бывают коричневого цвета с примесью крови, вскоре присоединяется кровавый понос. Наблюдаются резкое падение артериального давления, учащенное сердцебиение, выраженная одышка, затем развивается коматозное состояние. При отравлении соединениями железа через 4–6 ч может наступить улучшение состояния, однако при тяжелом отравлении вновь развиваются рвота с кровью и понос, прогрессивно снижается артериальное давление, отмечаются повышенная кровоточивость, судороги и кома (см.).
Неотложная помощь: зондовое промывание желудка раствором гидрокарбоната натрия после обезболивания наркотическими анальгетиками (1 %-ный или 2 %-ный раствор промедола — 1 мл), внутрь дается активированный уголь. Показан форсированный диурез, внутривенное капельное введение 4 %-ного раствора гидрокарбоната натрия, 0,9 %-ного раствора хлорида натрия, 5 %-ного раствора глюкозы. Специфическое лечение: десферал внутрь (до 30–40 г с водой), внутримышечно по 1–2 г 3–4 раза в день или внутривенно капельно (до общей дозы взрослым 80 мг/кг) в первые сутки в зависимости от тяжести отравления; тетацин-кальция 10 %-ный раствор внутривенно по 20–40 мл в сутки в 5 %-ном растворе глюкозы (до 500 мл).Отравление соединениями меди. В быту чаще всего отравления вызывают медный купорос и бордоская жидкость. Соединения меди оказывают местное прижигающее и общее резорбтивное действие. В пищеварительном тракте всасывается около 25 % яда, большая часть поступает в печень. Характерно прямое токсическое действие яда на центральную нервную систему, печень, почки и систему крови. При поступлении медного купороса внутрь развиваются боли в животе, тошнота и рвота, понос, головная боль, головокружение, учащение сердцебиения и шок (см.). Характерны развитие почечной недостаточности с анурией, токсическое поражение печени, проявляющееся желтухой (см.), анемия (см.). Нередко отмечаются аллергические реакции на коже.
Неотложная помощь: зондовое промывание желудка после обезболивания наркотическими анальгетиками (2 %-ный промедол, 1 %-ный морфин) с 0,1 %-ным атропином. При упорной рвоте вводят 2,5 %-ный раствор аминазина внутримышечно, показано введение глюкозо-новокаиновой смеси (глюкоза 5 %-ная — 500 мл, новокаин 2 %-ный — 50 мл) и 4 %-ного раствора гидрокарбоната натрия, витаминов. При аллергических реакциях применяют кальция глюконат или хлорид по 10 мл внутривенно 10 %-ного раствора, преднизолон. Специфическая терапия проводится 5 %-ным раствором унитиола и 30 %-ным раствором тиосульфата натрия. Унитиол вводится вначале в дозе 10 мл, затем каждые 3 ч по 5 мл внутримышечно, тиосульфат натрия вводят внутривенно в дозе 100 мл.Отравление соединениями ртути (каломель, сулема, цианид ртути). В организм ртуть может поступать через дыхательные пути, желудочно-кишечный тракт и кожу. Через неповрежденную кожу проникает лишь 2–5 % ртути. Соединения ртути оказывают местное раздражающее действие, поражают ткани пищеварительного тракта, печени и почек, нервной системы. При отравлении парами ртути наиболее выражены признаки поражения дыхательных путей — насморк, трахеит (см.) и бронхит (см.), тяжелая пневмония (см.), нередко развивается токсический отек легких (см.). В то же время отмечаются симптомы со стороны пищеварительного тракта — частый жидкий стул и со стороны центральной нервной системы — сонливость с периодами возбуждения. С 3—4-го дня появляются симптомы токсического поражения почек (снижение диуреза, изменения в моче). При попадании внутрь концентрированных паров ртути возникают резкие боли в животе, рвота и вскоре присоединяется кровавый понос. Характерно медно-красное окрашивание слизистых оболочек полости рта и глотки, металлический вкус во рту, слюнотечение, кровоточивость десен и набухание шейных лимфатических узлов. Позже отмечается темная кайма ртути на деснах. Отмечаются повышенная возбудимость, повышение артериального давления, анемия (см.). На 2—3-и сутки развивается почечная недостаточность (см.).
Неотложная помощь: при отравлении сулемой необходимы повторные промывания желудка, внутрь вводится активированный уголь. Применяются форсированный диурез и ранний гемодиализ. Специфическое лечение: раннее внутривенное капельное введение 100–150 мл 5 %-ного раствора унитиола и дальнейшее внутримышечное введение унитиола по 10 мл; внутривенное введение 10 мл 10 %-ного раствора тетацин-кальция в 300 мл 5 %-ного раствора глюкозы, внутривенное введение 100 мл 30 %-ного раствора тиосульфата натрия. Показано введение 0,1 %-ного раствора атропина, витаминов группы В, антибиотиков.Отравление мышьяком и его соединениями (арсенид натрия и кальция, «парижская зелень»). Из желудочно-кишечного тракта яд всасывается медленно, депонируется в печени, почках, селезенке, стенке тонкой кишки, эритроцитах, легких. Выводится мышьяк с мочой, где обнаруживается через 2–8 ч после отравления. Токсическое действие проявляется нарушением процессов обмена в клетках центральной и периферической нервной системы, печени, почек, нарушением проницаемости кровеносных сосудов, прежде всего капилляров, и гемолизом (разрушением) эритроцитов. При поступлении яда внутрь появляются металлический вкус во рту, сильные боли в животе и рвота. Характерен зеленоватый цвет рвотных масс и жидкий стул, напоминающий рисовый отвар. Наблюдается резкое обезвоживание организма, что приводит в выраженным судорогам. Разрушение эритроцитов проявляется анемией (см.) и желтухой (см.). Развивается острая почечная недостаточность (см.), в терминальной фазе отравления пострадавший впадает в кому. Кроме описанной формы, может наблюдаться быстрая паралитическая форма отравления при попадании яда внутрь: выражены оглушение больного, судороги, потеря сознания, паралич (см.) дыхания. Реже регистрируются ингаляционные отравления при вдыхании мышьяковистого водорода, который оказывает прямое токсическое действие на эритроциты, клетки печени и почек. Симптомы отравления развиваются через 2 ч и проявляются общей слабостью, тошнотой и рвотой, головной болью. Характерны озноб и беспокойство пострадавшего, удушье, парестезии конечностей. Через 8— 12 ч состояние ухудшается — моча приобретает красный или бурый цвет, появляется синюшность кожи, часто отмечаются судороги и нарушение сознания. Через 2–3 суток появляются симптомы токсического поражения печени и почек.
Неотложная помощь: при попадании яда через рот — зондовое промывание желудка, назначают повторные сифонные клизмы. Показаны ранний форсированный диурез, гемодиализ, введение витаминов группы В, аскорбиновой кислоты, глюкозоновокаиновой смеси, 4 %-ного раствора гидрокарбоната натрия, 2,4 %-ного раствора эуфиллина. Специфическое лечение при отравлении мышьяком: введение 150–200 мл 5 %-ного раствора унитиола вначале внутривенно, затем по 5 мл внутримышечно 8 раз в сутки; внутривенное капельное введение 30 мл 10 %-ного раствора тетацин-кальция в 500 мл 5 %-ного раствора глюкозы. При ингаляционном отравлении мышьяковистым водородом в первые 2 суток специфическое лечение проводят 40 %-ным раствором мекаптида по 1–2 мл каждые 4 ч внутримышечно с новокаином, затем его вводят по 2 раза в день в течение 5–6 суток. Впоследствии к лечению подключают 5 %-ный раствор унитиола по 5 мл 3–4 раза в день.
Угарный газ (окись углерода) Угарный газ вызывает значительное число острых бытовых отравлений. Он является кровяным ядом, так как окись углерода в крови образует с гемоглобином стойкое соединение — карбоксигемоглобин. Карбоксигемоглобин неспособен переносить кислород, что приводит к кислородному голоданию. Отравление окисью углерода может развиваться в очаге пожара, при взрывах, неполном сгорании газов, при накоплении в помещении выхлопных газов. При тяжелых отравлениях отмечаются быстрая потеря сознания, расширение зрачков, приступы судорог, повышение мышечного тонуса. Тахипноэ (учащенное дыхание) сменяется уменьшением числа дыхательных движений. Характерно изменение слизистых оболочек. При отравлении угарным газом в помещении с высоким содержанием окиси углерода слизистые имеют розовую или карминно-красную окраску, но при перемещении больного на свежий воздух становятся синюшными и бледными. Различают три степени отравления — легкую, среднюю и тяжелую. При легкой степени отравления (содержание карбоксигемоглобина крови 10–30 %) отмечаются головная боль, стук в висках, головокружение, тошнота, рвота. При отравлении средней тяжести (уровень карбоксигемоглобина крови 30–40 %) наблюдается кратковременная потеря сознания, которая сменяется возбуждением со зрительными или слуховыми галлюцинациями (см.). Иногда вместо возбуждения наблюдаются заторможенность, адинамия. Артериальное давление обычно повышено, пульс частый. Для тяжелой степени отравления (концентрация карбоксигемоглобина 40–50 % и более) характерны длительное коматозное состояние, судороги, отек мозга, токсическое поражение сердечной мышцы вплоть до развития инфаркта миокарда (см.), выраженная дыхательная недостаточность. При концентрации карбоксигемоглобина крови 80 % и более быстро развивается тяжелое коматозное состояние с резким нарушением дыхания, выраженными судорогами, стремительным падением артериального давления, т. е. развивается молниеносная форма отравления с мгновенной потерей сознания, тоническими судорогами и быстрой смертью. Неотложная помощь предусматривает немедленный вынос пострадавшего на свежий воздух. Необходима непрерывная кислородная терапия в течение 2–3 ч. Показано облучение пострадавшего ультрафиолетовой лампой, ускоряющей распад карбоксигемоглобина. В стационаре наряду с искусственной вентиляцией легких при отеке мозга и повышении внутричерепного давления применяют гипотермию и спинномозговую пункцию с выведением 10–15 мл спинномозговой жидкости. При возбуждении внутримышечно применяют 2,5 %-ный раствор аминазина и 1 %-ный раствор промедола, при судорогах внутривенно вводят 0,5 %-ный раствор диазепама. Показана кислородотерапия в барокамере. Профилактически применяют антибиотики.
Фосфорорганические вещества Фосфорорганические вещества широко распространены в сельском хозяйстве для борьбы с насекомыми и клещами (инсектициды, акарициды), возбудителями болезней растений (фунгициды), для уничтожения сорняков (гербициды) и др. Они повсеместно применяются садоводами-любителями для обработки садов, огородов и виноградников на своих участках, в быту используются для борьбы с домашними насекомыми. Смертность при отравлении ФОВ составляет 20–24 %. В практике наиболее часто встречаются острые отравления различными инсектицидами — дихлофосом, хлорофосом, карбофосом и др. Отравление возможно при поступлении яда через дыхательные пути, желудочно-кишечный тракт, слизистые оболочки и кожу. В организме фосфорорганические вещества подвергаются окислению и гидролизу с образованием токсичных соединений. Выводятся яды через дыхательные пути, пищеварительный тракт и с мочой. Фосфорорганические вещества вызывают нарушение функции ферментов, имеющих важнейшее значение в работе как центральной, так и периферической нервной системы, в результате чего нарушается передача нервных импульсов и возникает токсическое поражение нервной системы. Угнетение ферментов развивается постепенно, поэтому первые симптомы интоксикации могут появиться только через 1,5–2 ч после попадания яда в организм. Средняя смертельная доза фосфорорганических веществ составляет 0,5–2 г. Клинические проявления интоксикации данными веществами складываются из психоневрологических расстройств, нарушений дыхания, деятельности сердечно-сосудистой и пищеварительной систем, печени и почек. Психоневрологические нарушения часто проявляются развитием раннего астенического синдрома: больные жалуются на общую слабость, головную боль, головокружение, невозможность сосредоточиться, ощущение страха, обеспокоенность. В других случаях нарушения психики характеризуются развитием интоксикационного психоза (см.), когда отмечаются резкое психическое и двигательное возбуждение, двигательное беспокойство, чувство панического страха, дезориентация во времени и месте. Также возможно раннее развитие коматозного состояния с резким угнетением или отсутствием реакции зрачков на свет и болевой чувствительности, снижением мышечного тонуса и сухожильных рефлексов, отсутствием брюшных рефлексов. Почти у всех больных с выраженной клинической картиной отравления фосфорорганическими веществами отмечается сужение зрачков, сопровождающееся нарушением зрения в виде «сетки перед глазами» или двоением в глазах. Тяжесть отравления соответствует степени сужения зрачков. При тяжелых отравлениях наблюдаются «точечные» зрачки с отсутствием их реакции на свет. Признаки поражения периферической нервной системы характеризуются выраженной мышечной слабостью, снижением тонуса мышц и болезненностью мышц конечностей при прощупывании. Специфическим симптомом поражения периферической нервной системы при интоксикации фосфорорганическими веществами являются мелкие подергивания языка, что наблюдается во всех случаях. Реже мелкие подергивания распространяются на мимические мышцы. Нарушения дыхания обусловлены тем, что фосфорорганические вещества вызывают резкое повышение секреции бронхиальных желез — бронхорею. Выделяющийся в больших количествах секрет (иногда до 1,5 л) закупоривает дыхательные пути, изо рта и носа выделяется пена, выражена одышка со стеснением в груди. Нарушение функции сердечно-сосудистой системы проявляется урежением сердечных сокращений и нарушением сердечного ритма, первоначальным повышением артериального давления. По мере ухудшения состояния развиваются резкая бледность кожных покровов и падение артериального давления, выраженная одышка и расстройство сознания. Со стороны пищеварительного тракта наблюдаются тошнота и рвота, схваткообразные боли в животе, непроизвольный жидкий стул. О поражении почек свидетельствует учащенное мочеиспускание. Общая клиническая картина отравления фосфорорганическими веществами при любом пути поступления токсического вещества однотипна, но сроки возникновения, тяжесть и продолжительность симптомов различаются. При поступлении яда через желудочно-кишечный тракт различают три стадии отравления. Первая стадия — стадия возбуждения — наступает вскоре после воздействия токсического вещества, обычно через 15–20 мин. Как правило, развивается психическое и двигательное возбуждение, сопровождающееся чувством страха. Пациенты нередко агрессивны, могут отказываться от лечения. Общие симптомы интоксикации поначалу неспецифичны — головокружение, головная боль, тошнота. Однако вскоре при обследовании можно обнаружить повышенную потливость, усиление слюноотделения, умеренное сужение зрачков, чувство стеснения в груди, одышку, что характерно для отравления данными веществами. В первой стадии отмечается также урежение сердечных сокращений и повышение артериального давления. Вторая стадия — стадия гиперкинезов (см.) и судорог с полной картиной отравления. Уже во второй стадии возможно развитие комы (см.). Психическое и двигательное возбуждение может сохраняться или постепенно переходит в заторможенность. Характерны подергивания мелких мимических мышц, периодически возникающие судороги, повышение общего мышечного тонуса, выраженное сужение зрачков с отсутствием реакции на свет. Резко выражены потливость, бронхорея и саливация, ригидность грудной клетки. Нарастают расстройства дыхания. Наблюдаются выраженное повышение артериального давления и брадикардия (см.) (иногда значительная), непроизвольный жидкий стул, учащенное мочеиспускание. Третья стадия — стадия параличей. Больные находятся в бессознательном состоянии — развивается кома (см.). Все рефлексы или значительно угнетены или отсутствуют, артериальное давление низкое, пульс или очень редкий (40–20 уд./мин), или учащен до 120 уд./мин и более, дыхание резко угнетено. Мускулатура находится в паралитическом состоянии. Среди осложнений при тяжелых поражениях фосфорорганическими веществами часто отмечается пневмония (см.), являющаяся основной причиной смерти в позднем периоде отравления. Нередко развиваются поздние постинтоксикационные психозы (см.) (особенно у лиц, злоупотребляющих алкоголем) и полиневриты (см.). Неотложная помощь: при попадании фосфорорганических веществ на кожу пораженные участки обмывают щелочными растворами. При проникновении яда через дыхательные пути пострадавшего срочно эвакуируют из помещения с зараженным воздухом. При попадании яда внутрь назначают повторные промывания желудка с интервалом 4–6 ч, внутрь дается вазелиновое масло, активированный уголь, назначают сифонные клизмы. Желудок промывают 10–15 л воды с температурой 12–15 °C до чистых промывных вод. Затем через зонд вводится 30–50 г сульфата магния в 100 мл воды или 300–500 мл вазелинового масла. Промывания желудка и сифонные клизмы выполняются ежедневно до исчезновения тяжелых симптомов отравления. С целью детоксикации в стационаре используется форсированный диурез, гемосорбция, гемодиализ. Специфическая терапия при отравлении фосфорорганическими веществами назначается всем больным в течение первого часа и заключается в комбинированном применении атропина и дипироксима. Антидотная терапия атропином в больших дозах проводится до исчезновения бронхореи. При положительном эффекте после введения атропина у больного появляется сухость во рту, сухость кожных покровов, уменьшается бронхорея, частота сердечных сокращений достигает более 70 уд./мин. Больным с начальными симптомами отравления (I стадия) атропин вводят подкожно по 2–3 мл, при развившейся картине отравления (II стадия) атропин вводят по 3 мл внутривенно в 10 мл 40 %-ного раствора глюкозы. Больным в тяжелой коме препарат вводят внутривенно капельно по 20–30 мл, используя в сутки до 100 мг атропина. Введение атропина продолжают обычно в течение 2–3 суток (период, необходимый для удаления или разрушения яда). В первые часы отравления одновременно назначают дипироксим (или изонитрозин). Наибольший эффект антидотного лечения наблюдается при сочетанном применении атропина и дипироксима (изонитрозина). Дипироксим вводят подкожно в дозе 1 мл 10 %-ного раствора повторно с интервалами между инъекциями 2–3 ч, суточная доза составляет 1–1,5 г. Изонитрозин вводят внутримышечно или внутривенно повторно через 30–40 мин по 3 мл 45 %-ного раствора в суточной дозе 5 г.
Хлорированные углеводороды (дихлорэтан, тетрахлорэтан, гексахлоран, хлороформ) Дихлорэтан широко используется в качестве органического растворителя в промышленности. Среди пострадавших преобладают мужчины (из-за внешнего сходства дихлорэтана и этилового спирта). Смертельная доза дихлорэтана составляет 15–20 мл. Отравление им считается одним из наиболее опасных — в стационарах погибает половина больных. Дихлорэтан поступает в организм через пищеварительный тракт, дыхательные пути и кожные покровы. Обладая наркотическим влиянием на центральную нервную систему, оказывает психотропное и нейротоксическое действие, поражает печень и в меньшей степени — сердечно-сосудистую систему. В течение первых 3 ч после приема дихлорэтана внутрь наблюдаются психоневрологические расстройства: головокружение, шаткость походки, заторможенность и адинамия. В других случаях превалируют психическое и двигательное возбуждение, эйфория, слуховые и зрительные галлюцинации (см.). При приеме внутрь одновременно отмечаются рвота, боли в животе, жидкий стул с резким запахом дихлорэтана, выраженная слабость. Нередко наблюдаются судороги икроножных мышц. Нарастают явления сердечно-сосудистой недостаточности, отмечающиеся у 80 % больных: выражена тахикардия (см.), артериальное давление первоначально (при возбуждении) повышается, затем при развитии шока (см.) падает. Нарастают симптомы печеночной и почечной недостаточности (см.), нередко возникает желудочно-кишечное кровотечение. Если количество принятого дихлорэтана составляет 50 мл и более, то быстро (в течение 1–3 ч) развивается коматозное состояние с расширением зрачков, повышением или понижением мышечного тонуса конечностей, повышением или угнетением сухожильных рефлексов, резким расстройством дыхания и летальным исходом. Прогностически более благоприятно течение ингаляционных отравлений дихлорэтаном: для них характерно повышенное слюноотделение, симптомы поражения желудочно-кишечного тракта выражены умеренно, печеночно-почечная недостаточность (см.) развивается постепенно. При попадании дихлорэтана на кожу развивается дерматит (см.) или крапивница (см.).
Неотложная помощь: экстренное и повторное (2–3 раза с интервалом 1–2 ч) промывание желудка большим количеством (до 20 л) воды с последующим введением через зонд 150–250 мл вазелинового масла. Применяются форсированный диурез, гемодиализ и перитонеальный диализ, гемосорбция. Внутривенно вводят 10 %-ный хлорид или глюконат кальция, при судорогах — 0,5 %-ный раствор диазепама по 2–4 мл, показано введение витамина РР, витаминов группы В. Инфузионная терапия проводится введением полиглюкина, реополиглюкина, гемодеза, 10 %-ного раствора глюкозы с инсулином, 4 %-ного раствора гидрокарбоната натрия. Для улучшения тканевого обмена применяется 10 %-ный раствор витамина Е по 1–2 мл внутримышечно, ферментные препараты — контрикал или трасилол до 500 тыс. ЕД. Для специфической терапии применяют 5 %-ный раствор унитиола по 5 мл внутримышечно 3–4 раза в сутки и внутривенно — 5 %-ный раствор ацетилцистеина в общей дозе 300–500 мг/кг в сутки.Хлороформ быстро всасывается слизистыми оболочками желудочно-кишечного тракта и дыхательных путей. Он оказывает наркотическое действие на центральную нервную систему, токсическое действие на печень и почки. Смертельная доза при приеме хлороформа внутрь составляет 20 мл, при вдыхании — 40 мл. При приеме хлороформа внутрь наблюдается раздражение слизистых оболочек полости рта, пищевода. Отмечаются тошнота, рвота, жидкий стул, головокружение, шаткая походка, заторможенность, реже — возбуждение и галлюцинации (см.), затем больной впадает в коматозное состояние. Выражены нарушения сердечно-сосудистой деятельности — снижение артериального давления, расстройства сердечного ритма. На 2—3-й день появляются увеличение и болезненность печени, желтушное окрашивание кожи и слизистых оболочек, признаки поражения почек. При попадании хлороформа на кожу развивается ожог (см.). При ингаляционном поражении наблюдается быстрая потеря сознания, часто развивается угнетение дыхания, нарушается ритм сердца и снижается артериальное давление, позднее выявляются симптомы токсического поражения печени.
Неотложная помощь: при приеме внутрь показано повторное обильное (15–20 л воды) промывание желудка через зонд с последующим введением вазелинового или касторового масла. В стационаре применяют форсированный диурез, гемодиализ или гемосорбцию.
Щелочи (нашатырный спирт, едкий натр, каустик — едкое кали, гашеная известь) Наиболее часто регистрируются отравления нашатырным спиртом, редко — каустической содой. Нашатырный спирт используется в медицине, технический раствор аммиака применяется в различных отраслях промышленности, каустик — в производстве искусственного волокна, в мыловаренном производстве, бумажной промышленности и относительно редко в быту. Смертельная доза нашатырного спирта составляет 10–15 мл. Механизм повреждающего действия щелочей отличается от действия кислот: при воздействии щелочей повреждение тканей более выражено, чем при действии кислот. Щелочи растворяют слизь, разрыхляют и размягчают ткани, делая их более доступными для проникновения яда в глубоко лежащие ткани. Щелочи оставляют глубокие ожоги в пищеводе, а слизистая оболочка желудка страдает меньше, так как в норме контактирует с кислым содержимым. В клинической симптоматике отравления щелочами ведущим проявлением является ожог пищеварительного тракта: выражены тошнота, рвота, боли в животе. При глубоких ожогах возникает опасность перфорации пищевода с развитием тяжелых осложнений. Как и при отравлении кислотами, развивается механическая асфиксия (см.) в результате ожога (см.) и отека гортани. Постепенно нарастают симптомы шока (см.), отмечаются повторные пищеводные и желудочные кровотечения (см.). В более поздние сроки — с 3—4-й недели — развивается рубцовое сужение пищевода. Неотложная помощь аналогична помощи, проводимой при отравлении кислотами.
Ядовитые растения Аконит (борец, голубой лютик, иссык-кульский корень) обладает нейротоксическим и кардиотоксическим действием. Симптомы отравления: тошнота, рвота, онемение языка, губ, щек, кончиков пальцев рук и ног, чувство ползания мурашек, ощущение жара и холода в конечностях. Для интоксикации аконитом характерно преходящее расстройство зрения — больной видит предметы в зеленом цвете. Также отмечается слюнотечение, сменяющееся сухостью ротовой полости, появляются жажда, головная боль, беспокойство, судорожное подергивание мышц лица и конечностей, потеря сознания. Дыхание учащенное, поверхностное, возможна внезапная его остановка. Расстройства сердечно-сосудистой деятельности характеризуются падением артериального давления, нарушением ритма — сначала отмечается урежение пульса, затем его резкое учащение.
Неотложная помощь: зондовое промывание желудка, внутрь вводятся солевое слабительное, активированный уголь. Применяются форсированный диурез и гемосорбция, внутривенно капельно вводится глюкозо-новокаиновая смесь (до 50 мл 1 %-ного раствора новокаина с 500 мл 5 %-ного раствора глюкозы), внутримышечно — 25 %-ный раствор сернокислой магнезии (10 мл); при судорогах показано внутривенное введение 0,5 %-ного раствора диазепама, 2 мл 2 %-ного раствора дитилина. При тахикардии (см.) применяют 10 %-ный раствор новокаинамида или 0,1 %-ный раствор обзидана, при брадикардии (см.) вводится 0,1 %-ный раствор атропина. Также показано введение витаминов В1 и В6, аскорбиновой кислоты, кокарбоксилазы.Болиголов пятнистый. Растение содержит никотин и оказывает нейротоксическое действие. Симптомы отравления: головокружение, головная боль, тошнота, рвота, понос, слюнотечение и холодный пот. Пульс вначале медленный, затем развивается его учащение и нарушение ритма. Характерны сужение зрачков, расстройство зрения и слуха, мелкие подергивания мышц и судороги. При тяжелом отравлении развиваются коматозное состояние, острая сердечно-сосудистая недостаточность.
Неотложная помощь: промывание желудка раствором перманганата калия (1:1000) с последующим введением солевого слабительного и активированного угля. Применяют форсированный диурез, а при тяжелом отравлении — гемосорбцию. Показано внутривенное введение глюкозо-новокаиновой смеси и внутримышечное — сернокислой магнезии. При судорогах с затруднением дыхания используют 10 %-ный раствор барбамила, при выраженной брадикардии (см.) вводят 0,1 %-ный раствор атропина.Борщевик оказывает сильное местное раздражающее действие. При попадании сока растений на кожу или при соприкосновении с растением, особенно с волосками стеблей и листьев, развивается эритема (краснота), возникают дерматиты (см.).
Неотложная помощь: обмывание кожи водой, затем смазывание пораженных участков кожи спиртовым раствором метиленовой сини; применяют мази с глюкокортикоидами, анестезином.Гелиотроп. В период его роста наиболее ядовиты листья, стебли и цветы, к концу вегетации — семена. Отравление чаще всего происходит при употреблении в пищу зерна, засоренного семенами гелиотропа. Яд растения оказывает прямое действие на клетки печени, а также на печеночные кровеносные и лимфатические сосуды. Симптомы отравления развиваются медленно: появляются слабость, снижение аппетита, похудение, тяжесть в правом подреберье, увеличение печени. Исходом поражения печени является ее цирроз (см.). Для лечения в остром периоде применяют кортикостероидные препараты (преднизолон, гидрокортизон). Горчак розовый относится к семейству васильковых. Отравления развиваются при употреблении зерна, засоренного семенами горчака. Яд растения вызывает токсическое поражение печени. Симптомы интоксикации развиваются чаще постепенно; наступающие изменения в печени, как правило, необратимы.
Для лечения используют преднизолон, витамины группы В, никотиновую и аскорбиновую кислоты.Заманиха применяется как природный растительный биостимулятор и выпускается в виде спиртовой настойки. Растение обладает местным раздражающими и общим психотропным и кардиотоксическим действием, вызывает возбуждение центральной нервной системы и нарушение внутрисердечной проводимости. Симптомы интоксикации: тошнота, повторная рвота, жидкий стул, головокружение, беспокойство. Отмечаются урежение пульса и снижение артериального давления.
Неотложная помощь: зондовое промывание желудка, форсированный диурез. Для коррекции брадикардии (см.) применяется 0,1 %-ный раствор атропина; при стойких нарушениях сердечного ритма показана гемосорбция.Клещевина (турецкая конопля) относится к семейству молочайных. Токсичны семена клещевины; у детей отравление развивается при употреблении 2–3 семян. Яд растения оказывает токсическое действие на клетки крови и желудочно-кишечный тракт. Симптомы отравления: уже через 1–3 ч после употребления семян клещевины развиваются тошнота, рвота, боли в животе, жидкий стул. Затем возникает поражение почек, возможны сердечно-сосудистая и почечная недостаточность (см.).
Неотложная помощь: зондовое промывание желудка, введение внутрь активированного угля. Показаны форсированный диурез, внутривенное введение 4 %-ного раствора гидрокарбоната натрия. Внутрь также назначаются обволакивающие средства.Ландыш майский содержит сердечные гликозиды, которые и вызывают отравление. Токсин оказывает действие на мембраны клеток сердечной мышцы, вызывает изменения функции миокарда и его проводящей системы. Симптомы отравления: вначале отмечаются тошнота и рвота, затем выявляются специфические нарушения ритма сердца: урежение сердечных сокращений (иногда развивается тахикардия (см.)), экстрасистолия, нарушения проводимости, мерцательная аритмия (см.). Далее наступают падение артериального давления, судороги, потеря сознания.
Неотложная помощь: промывание желудка, внутрь вводят солевое слабительное и активированный уголь. Специфическое лечение: внутривенное капельное введение 0,5 %-ного раствора хлористого калия, 20 мл 10 %-ного раствора тетацин-кальция в 300 мл 5 %-ного раствора глюкозы. Внутримышечно вводят 5 %-ный раствор унититола по 5 мл. Также обязательно подкожное или внутримышечное введение витамина Е по 1–2 мл 30 %-ного раствора 4 раза в сутки.Лютик ядовитый оказывает местное раздражающее и нейротоксическое действие. При попадании внутрь наблюдаются тошнота, рвота, боли в животе, снижается артериальное давление, развиваются судороги. При попадании на кожу сока растения развиваются дерматиты (см.), особенно сильные у детей.
Неотложная помощь: зондовое промывание желудка, внутрь вводится касторовое масло. Назначают форсированный диурез, внутрь показано введение обволакивающих средств (болтушка из 200 мл 10 %-ной эмульсии подсолнечного масла, 2 г биомицина, 2 г анестезина, 2 г сахарного сиропа) по 1 ст. л. 5–6 раз в день. При судорогах вводят 5—10 мл диазепама.Миндаль горький. Ядовиты ядра косточек миндаля, абрикоса, персика, вишни, сливы, черемухи, лавровишни, содержащие цианиды. Синильная кислота и цианистый калий оказывают нейротоксическое действие, угнетают тканевое дыхание. Для клинической картины отравления характерно быстрое развитие симптомов: головная боль, тошнота, рвота, боли в животе, нарастание общей слабости и одышки. Отмечаются сердцебиение, психическое и двигательное возбуждение, судороги. Вскоре больной теряет сознание. Кожные покровы ярко-розовые, слизистые оболочки синюшные. При поступлении внутрьсмертельной дозы появляются выраженные судороги, резкая синюшность кожи и слизистых оболочек, развивается острая сердечно-сосудистая недостаточность и остановка дыхания. При молниеносной форме отравления смерть может наступить в течение нескольких минут.
Неотложная помощь: вдыхание амилнитрита, зондовое промывание желудка 0,1 %-ным раствором перманганата калия или 0,5 %-ным раствором тиосульфата натрия, введение внутрь активированного угля. Внутривенное медленное введение 10 мл 1 %-ного раствора натрия нитрата 2–3 раза с интервалом 10 мин. Тиосульфат натрия (50 мл 30 %-ного раствора), метиленовый синий (50 мл 1 %-ного раствора), глюкозу (40 %-ный раствор до 40 мл), аскорбиновую кислоту (5 %-ный раствор 20 мл) вводят внутривенно. Показано внутримышечное введение витамина В12 в суточной дозе до 1000 мкг.Молочай прутьевидный. Ядовит млечный сок надземной части растения, оказывающий местное раздражающее действие. При попадании сока на кожу возникают пузыри, развивается эритема. При употреблении сока внутрь отмечаются тошнота, рвота, понос, боли в животе, развивается сердечно-сосудистая недостаточность и судороги.
Неотложная помощь: промывание желудка, введение внутрь активированного угля. При болях в животе вводят 0,1 %-ный раствор атропина подкожно 1 мл.Папоротник мужской. Токсическое начало содержит корень папоротника. Яд папоротника оказывает раздражающее, общее психотропное и нейротоксическое действие, поражает печень. Симптомы интоксикации: тошнота, рвота, понос, боли в животе, головокружение, головная боль, повышение температуры, одышка, тахикардия (см.), затемнение сознания, иногда кровавый стул. Возможно развитие психозов (см.), судорог, коматозного состояния. Для интоксикации характерны сужение зрачков и нарушения зрения; атрофия зрительного нерва развивается редко.
Неотложная помощь: промывание желудка, внутрь дают активированный уголь и солевое слабительное, показаны очистительные клизмы. При судорогах вводят 0,5 %-ный раствор диазепама.Паслен сладко-горький. Ядовиты ягоды, особенно незрелые, и трава растения. Яд паслена оказывает психотропное и нейротоксическое действие. Симптомы отравления: отмечаются расширение зрачков, головокружение, шаткость походки, тахикардия (см.) (учащение сердцебиения), понос, психическое и двигательное возбуждение, галлюцинации (см.).
Неотложная помощь: промывание желудка, внутрь вводятся активированный уголь и солевое слабительное. Показан форсированный диурез, введение 1 мл 0,05 %-ного раствора прозерина. При стойком возбуждении применяют аминазин или диазепам.Спорынья (маточные рожки) содержит токсические алкалоиды, оказывающие психотропное и нейротоксическое действие, что клинически проявляется первоначальным возбуждением, а затем угнетением центральной нервной системы. Алкалоиды выпускаются в виде лекарственных препаратов (эргометрин и др.). При отравлении через рот отмечаются слюнотечение, рвота, понос, жажда, боли в животе, головокружение, бледность кожи и слизистых оболочек, одышка, бред (см.), кома (см.), анестезия кожи конечностей, судороги, маточные кровотечения (см.). Беременность заканчивается выкидышем. В результате нарушения кровоснабжения конечностей в последующем могут появляться трофические язвы, возможно развитие гангрены (см.) конечностей.
Неотложная помощь: промывание желудка, введение солевого слабительного. Показан форсированный диурез, при тяжелом отравлении — гемосорбция. На месте проводится вдыхание амилнитрита, показано внутривенное капельное введение глюкозоновокаиновой смеси (2 %-ный раствор новокаина — 50 мл и 500 мл 10 %-ного раствора глюкозы). При судорогах вводят диазепам (до 20 мг).Стрихнин является алкалоидом семян чилибухи (рвотного ореха). На основе чилибухи выпускаются следующие препараты: стрихнина нитрат, экстракт чилибухи сухой, настойка чилибухи. Препарат всасывается преимущественно в тонком кишечнике, оказывает нейротоксическое действие. Первые симптомы интоксикации отмечаются через 15–20 мин: горький вкус во рту, страх, беспокойство, сведение затылочных мышц, тризм, тонические судороги, сердцебиение, затруднение дыхания, синюшность кожи.
Неотложная помощь: промывание желудка, внутрь дают солевое слабительное и активированный уголь. Показаны форсированный диурез и при тяжелом отравлении гемосорбция. При судорогах вводят 10–20 мг диазепама.Чемерица (чемеричник, смертоед, волчок, кукольник). Выпускается спиртовая настойка чемерицы для применения в ветеринарии. Яд оказывает токсическое действие на сердце и нервную систему (смертельная доза содержится в 1 г свежего растения). Клинические проявления: при приеме внутрь наблюдаются слюнотечение, тошнота, рвота, боли в животе, понос, мышечная слабость, нарушение зрения. Артериальное давление понижено, развивается урежение пульса, возникают нарушения сердечного ритма. При тяжелых отравлениях наблюдаются судороги, острая сердечно-сосудистая недостаточность.
Неотложная помощь: промывание желудка, внутрь вводятся солевое слабительное и активированный уголь. Показан форсированный диурез. При выраженной брадикардии (см.) вводят 1 мл 0,1 %-ного раствора атропина и внутривенно капельно хлористый калий на 5 %-ном растворе глюкозы. При судорогах вводят диазепам. При отравлении чемерицей противопоказано введение солей кальция.Чистотел относится к семейству маковых. Ядовиты все части растения. Токсин чистотела оказывает психотропное и местное раздражающее действие. При употреблении внутрь отмечаются тошнота, рвота, боли в животе, понос, понижение кожной чувствительности, сонливость. В тяжелых случаях развиваются потеря сознания, сужение зрачков, покраснение кожи, расстройства дыхания, снижение артериального давления, иногда судороги.
Неотложная помощь: промывание желудка, внутрь вводятся солевое слабительное и активированный уголь. Показаны форсированный диурез, введение 0,1 %-ного раствора атропина и витамина В1.
Диагностика и лечение Диагностика острых экзогенных отравлений предусматривает комплекс клинических, лабораторных и патологоанатомических методов. Клиническая диагностика строится на данных опроса, результатах осмотра места происшествия и изучения клинической картины интоксикации с выделением специфических симптомов; лабораторные методы включают качественное и количественное определение токсических веществ в крови, моче, слюне, сперме, спинномозговой жидкости; патологоанатомическими методами выявляют наличие специфических посмертных признаков отравления. На месте происшествия по возможности следует установить причину отравления и токсического вещества, его количество и путь поступления в организм, время отравления, предположительную концентрацию токсического вещества. Собранные на месте происшествия сведения передаются в стационар, куда госпитализирован пострадавший.
Общие принципы оказания неотложной помощи при острых отравлениях Все пострадавшие с клиническими признаками отравлений подлежат экстренной госпитализации (оптимально — в токсикологические отделения стационаров). Общие принципы неотложной помощи при острых отравлениях предусматривают: — установление причины отравления и вида токсического вещества, его количество, путь и время поступления в организм; — прекращение дальнейшего поступления яда в организм; — обеспечение ускоренного выведения токсического вещества из организма, т. е. активная детоксикация; — проведение антидотной терапии — введение противоядий (табл. 26); — симптоматическую терапию; — профилактику и лечение осложнений.
Таблица 26. Противоядия, вводимые при отравлении различными веществами
Яд — Противоядие ∙ Амитриптилин и другие трициклические антидепрессанты (азафен, фторацизин) — Прозерин 10 мл 0,05 %-ного раствора внутримышечно или физостигмин подкожно 0,1 %-ный раствор ∙ Анестезин — Метиленовый синий 1 %-ный раствор внутривенно с 10 %-ным раствором глюкозы (250–300 мл) и 5 %-ным раствором аскорбиновой кислоты ∙ Анилин (син.: аминобензол) — 1 %-ный раствор метиленового синего 1–2 мл /кг с 5 %-ным раствором глюкозы внутривенно; аскорбиновая кислота до 60 мл 5 %-ного раствора внутривенно в сутки; витамин В^; тиосульфат натрия 30 %-ный раствор 100 мл внутривенно ∙ Антикоагулянты (гепарин, дикумарин, пелентан) — Викасол 5 мл 1 %-ного раствора внутривенно; кальция хлорид 10 мл 10 %-ного раствора внутривенно. При передозировке гепарина вводится протаминсульфат 5 мл 1 %-ного раствора внутривенно ∙ Атропин — Пилокарпин 1 мл 1 %-ного раствора подкожно; прозерин 1–2 мл 0,05 %-ного раствора подкожно ∙ Барбитураты (барбамил, этаминалнатрий) — Бемегрид 0,5 %-ный раствор внутривенно барий и его соли, магния сульфат 30 %-ный раствор внутрь ∙ Бензол — Тиосульфат натрия 30 %-ный раствор до 300 мл внутривенно ∙ Бледная поганка — Липоевая кислота 0,5 %-ный раствор внутримышечно ∙ Индийская конопля (анаша, марихуана, гашиш) — Аминазин 2,5 %-ный раствор до 4 мл; дроперидол ∙ Инсулин — Глюкоза 40 %-ный раствор внутривенно ∙ Йод и его препараты — Тиосульфат натрия 30 %-ный раствор внутривенно до 300 мл ∙ Крепкие кислоты — Натрия гидрокарбонат 4 %-ный раствор внутривенно до 1500 мл в сутки ∙ Медь и ее соединения (медный купорос) — Унитиол 5 %-ный раствор одномоментно, затем по 5 мл каждые 3 ч внутримышечно; тиосульфат натрия 30 %-ный раствор 100 мл внутривенно ∙ Морфин (опий, омнопон, героин, кодеин) — Налорфин 0,5 %-ный раствор внутривенно 3–5 мл ∙ Мышьяк и его соединения — Унитиол 5 %-ный раствор внутримышечно по 5 мл; тетацин-кальций 10 %-ный раствор 30 мл в 500 мл 5 %-ного раствора глюкозы внутривенно ∙ Мухомор — Атропин 0,1 %-ный раствор 1–2 мл внутривенно ∙ Нафталин — Метиленовый синий 1 %-ный раствор внутривенно при выраженном цианозе ∙ Нитрат серебра — Натрия хлорид 2 %-ный раствор внутрь ∙ Пахикарпин — АТФ 1 %-ный раствор внутримышечно 2–3 мл; прозерин 0,05 %-ный раствор 1 мл подкожно; тиамин (витамин В1) 6 %-ный раствор внутривенно 10 мл ∙ Перманганат калия — Метиленовый синий 1 %-ный раствор; аскорбиновая кислота 5 %-ный раствор внутривенно 30 мл ∙ Пилокарпин — Атропин 0,1 %-ный раствор по 2–3 мл подкожно или внутривенно ∙ Сердечные гликозиды (строфантин, дигоксин) — Атропин 0,1 %-ный раствор подкожно 1 мл при брадикардии; тетацин-кальций 10 %-ный раствор 20 мл в 300 мл 5 %-ного раствора глюкозы ∙ Синильная кислота и другие цианиды — Натрия нитрат 1 %-ный раствор 10 мл внутривенно; тиосульфат натрия 30 %-ный раствор 50 мл и метиленовый синий 1 %-ный раствор 50 мл внутривенно ∙ Спирт метиловый — Спирт этиловый (питьевой) 30 %-ный раствор 100 мл внутрь и затем каждые 2 ч по 50 мл всего 5 раз; при коме 5 %-ный раствор спирта внутривенно в дозе 1 мл/кг в сутки ∙ Сулема (дихлорид ртути) — Унитиол 5 %-ный раствор 10 мл внутримышечно; тетацин-кальций 10 %-ный раствор 10 мл с 5 %-ной глюкозой 300 мл и тиосульфат натрия 30 %-ный раствор 100 мл внутривенно ∙ Тубазид, фтивазид — Пиридоксин (витамин В6) 5 %-ный раствор 10 мл внутривенно ∙ Фенолы — Тиосульфат натрия 30 %-ный раствор 100 мл внутривенно ∙ Формалин — Промывание желудка 3 %-ным раствором хлорида аммония или карбоната аммония ∙ ФОС (дихлофос, карбофос) — Атропин 0,1 %-ный раствор подкожно 2–3 мл; дипироксим 15 %-ный раствор 1 мл внутримышечно; изонитрозин 40 %-ный раствор 2–3 мл внутримышечно. Все три антидота вводятся последовательно ∙ Хромпик (бихромат калия) — Унитиол 5 %-ный раствор 10 мл внутримышечно ∙ Этиленгликоль (тормозная жидкость) — Хлорид или глюконат кальция 10 %-ный раствор внутривенно 10 мл; этиловый спирт 30 %-ный раствор по 30 мл внутрь или 5 %-ный раствор внутривенно 100–200 мл в суткиПри ингаляционном поражении пострадавшего эвакуируют из зараженной атмосферы, освобождают от стесняющий одежды, обеспечивают проходимость дыхательных путей. При попадании яда на кожу с пострадавшего снимают одежду, обмывают кожу прохладной проточной водой. При энтеральном отравлении первоочередным мероприятием является промывание желудка через зонд. Несмотря на то что эффективность его снижается по мере увеличения срока, прошедшего с момента отравления, промывание желудка необходимо проводить и позже, так как некоторые яды выделяются в полость желудка на протяжении суток и более. При невозможности введения зонда вызывают рвоту раздражением корня языка и задней стенки глотки после приема 3–4 стаканов воды. Не применяется искусственное вызывание рвоты при отравлениях кислотами и щелочами. При попадании токсического вещества в прямую кишку, влагалище, слуховой проход производят их обильное промывание водой с помощью клизмы, спринцеваний, катетеризации. Удаление яда из кровеносного русла производят внутривенным введением жидкостей с последующим назначением мочегонных препаратов, т. е. методом форсированного диуреза, что позволяет ускорить выведение токсических веществ из организма в 5—10 раз. С целью детоксикации прибегают также к гемосорбции, лимфосорбции, гемодиализу и другим методам.
Антидотная терапия Антидоты вводятся при отравлениях только в ранней фазе, когда токсическое вещество находится в крови, и при достоверно установленном диагнозе. В противном случае противоядие само может оказать токсическое воздействие на организм.
ОТСЛОЙКА СЕТЧАТКИ
ОпределениеОтслойка сетчатки — патологическое состояние, при котором сетчатка глаза теряет контакт с сосудистой оболочкой и отходит от нее.Сетчатка — самая внутренняя оболочка глазного яблока, имеющая вид тонкой прозрачной пленки. Сетчатка располагается между стекловидным телом и сосудистой оболочкой, она прочно удерживается только в зоне зрительного нерва и у зубчатой линии сосудистой оболочки. В остальных местах сетчатка рыхло соединена с сосудистой оболочкой и удерживается на месте за счет давления стекловидного тела.
Этиология и патогенез Вовлечение сетчатки в патологический процесс довольно часто происходит при разнообразных изменениях в сосудистой оболочке глазного яблока и в стекловидном теле. Сосудистая оболочка поражается при воспалительных, дистрофических и опухолевых процессах, стекловидное тело — при кровоизлияниях, разжижениях, воспалительной инфильтрации, фиброзе (см.). Среди наиболее частых причин отслойки сетчатки выделяют травму глазного яблока и высокую миопию. Отслойка сетчатки может произойти в результате непрямой травмы, например падения, ушибов головы, резкого поднятия тяжестей. Все эти факторы становятся причиной мельчайших разрывов, которые лежат в основе отслойки сетчатки. В результате под сетчатку из стекловидного тела проникает жидкость, которая и отслаивает сетчатку с образованием пузыря различной величины.
Клиническая картина и диагностика Для отслойки сетчатки характерны жалобы на понижение остроты зрения, выпадения полей зрения, появление в поле зрения различных пятен, как подвижных, так и фиксированных. Могут также образовываться дефекты в виде «занавески». Диагностика заболевания основана на использовании специальных методов исследования, включающих офтальмоскопию, биомикроскопию, гониоскопию, ультразвук. При исследовании полей зрения выявляются дефекты, соответствующие месту отслойки сетчатки.
Лечение Отслойка сетчатки требует оперативного вмешательства. В настоящее время применяется множество разнообразных хирургических методов: лазеркоагуляция, фотокоагуляция, диатермокоагуляция, криопексия, блокада разрывов сетчатки путем вдавления склеры силиконовой губкой, циркулярное вдавление по всей окружности и др. Операцию проводят после точного определения места разрыва. Прогноз заболевания определяется несколькими факторами: продолжительностью отслойки сетчатки, числом и величиной разрывов, соблюдением постельного режима. Оперативное лечение требует пребывания пациента в стационаре; обязателен 2—6-дневный постельный режим в послеоперационном периоде с использованием бинокулярной повязки. Лечебная тактика при отслойке сетчатки основана на необходимости оперативного вмешательства даже в случаях отсроченной диагностики и при невысокой ожидаемой результативности. В связи с развитием дистрофических процессов в сетчатке не во всех случаях возможно восстановление высокой остроты зрения. Возможны повторные операции у пациентов с отслойкой сетчатки.
♦ П ♦
ПАНАРИЦИЙ
ОпределениеПонятие «панариций» охватывает острые флегмонозные процессы пальцев за исключением открытых инфицированных ранений.
Этиология Панариций вызывается какой-нибудь видимой или незамеченной микротравмой (укол, ссадины, царапина, ранка при маникюре и др.). Предрасполагающими моментами являются диабет (см.), авитаминозы (см.) и нарушения кровообращения. В таких случаях заболевание протекает тяжелее и вызывает больше осложнений.
Клиническая картина и диагностика Кожный панариций — это внутрикожный абсцесс (см.), при котором поверхностные слои эпидермиса отслаиваются воспалительной жидкостью от мальпигиева слоя кожи. Это наиболее легкий вид гнойной инфекции кисти. Около 80 % случаев кожного панариция локализуется на ладонной поверхности пальцев. Кожа ладонной поверхности пальцев и кисти значительно толще и прочнее, чем на ее тыле, так как здесь эпидермис сильнее развит за счет рогового слоя. При осмотре на пальце обнаруживается ограниченный гнойник, окруженный пояском покраснения. Под приподнятым эпидермисом просвечивает прозрачный или мутный серозный, гнойный или геморрагический экссудат. По мере развития воспалительного процесса нарастает боль в пальце. Процесс как бы «ползет» под кожей, захватывая иногда всю фалангу. На тыле кисти и предплечья появляются признаки лимфангита; может повыситься температура тела. Кожный гнойник нередко встречается как осложнение подкожного панариция в форме «песочных часов», о чем необходимо помнить. Различить их можно по следующим признакам: при кожном панариции воспалительный процесс развивается быстро, иногда за несколько часов; при подкожном — медленнее, с периодами дискомфорта, боли и распирания в пальце. Прорыв гноя под эпидермис при подкожном панариции приносит облегчение, чего не наблюдается при кожном панариции. Паронихия — это воспаление ногтевого валика пальца. По локализации гноя различают две формы паронихии: поверхностная субэпидермальная и глубокая, когда гной скапливается в толще ногтевого валика. Основной причиной паронихии являются инфицированные заусеницы, маникюр, реже — укол и царапина. Причиной подногтевого панариция являются заноза или укол под свободный край ногтя, реже — ушиб, заусеница и другие мелкие травмы. Следует различать первичный и вторичный подногтевой панариций. В первом случае инфекция попадает непосредственно; во втором она распространяется под ногтевую пластинку как осложнение паронихии, кожного, подкожного или костного панариция или подногтевой гематомы. В первом случае процесс некоторое время ограничен входными воротами у дистальной части фаланги, а воспаление затрагивает только часть ногтевого ложа. В подобных случаях целесообразно удалить ноготь, гной, инородное тело и омертвевшие ткани, осмотреть очаг и обеспечить отток. Операция удаления ногтя очень проста, но необходимо сохранять целостность ногтевого валика, не выскабливать, а иссекать ткани острым скальпелем или ножницами. Неправильно выполненная операция может привести к остеомиелиту (см.), бугристости дистальной фаланги. Это осложнение протекает вяло, почти безболезненно, но операционная рана превращается в свищ и длительно не заживает. Когда нагноительный процесс локализуется у корня ногтя, требуется удаление ногтя. Вторичный подногтевой панариций чаще развивается у корня ногтя после паронихии, и операция Кеневела с удалением корня ногтя позволяет ликвидировать воспалительный процесс. Последствия подногтевого панариция — это расстройство питания (зябкость и синюшность пальца) и деформация ногтя. Подкожный панариций — это воспаление подкожной клетчатки пальцев. Анатомически к прочной ладонной поверхности пальцев и кисти прилегает толстый слой жировой клетчатки. Жировую клетчатку пронизывают соединительнотканные волокна, идущие от оболочки и надкостницы. На ладонной поверхности дистальной фаланги они образуют ячейки, в которых заложена жировая ткань в виде жировых долек. На пальцах часть соединительнотканных волокон срастается с надкостницей фаланг. Воспалительный процесс, возникающий в жировых ячейках, может продолжительно оставаться отграниченным, вызывает сильную боль, напряжение тканей и при мало заметной припухлости склонен распространяться вглубь. Подкожный панариций продолжает занимать первое место среди острых гнойных заболеваний кисти и почти всегда предшествует тяжелым и осложненным формам инфекции кисти. Основной причиной является укол в кончик пальца. Локализация процесса в 80–90 % случаев — ладонная поверхность дистальной фаланги, чаще I, II и III пальцев правой руки. У женщин подкожный панариций наблюдается чаще, чем у мужчин. Распознавание подкожного панариция, особенно дистальной фаланги, трудностей не представляет. Его клиническая картина достаточно характерна. Больной обращается к врачу, встревоженный распирающей острой болью в пальце, мешающей на работе и дома, иногда уже проведя бессонную ночь и испытав домашние средства лечения. Осмотр кисти обнаруживает припухлость дистальной и средней фаланги, иногда заметную лишь при сравнении больного пальца со здоровым. При подкожном панариции проксимальной фаланги припухлость распространяется на тыл кисти и ладонь. Покраснение при подкожном панариции бывает нерезким и появляется поздно, если абсцесс (см.) не принимает формы «песочных часов». При панариции средней и проксимальной фаланги на тыльной и боковой поверхностях краснота появляется раньше, а отечные ткани ладонной стороны приобретают иногда синюшный оттенок. Больной оберегает палец, держит его в полусогнутом положении. Пути распространения инфекции при подкожном панариции разнообразны: под кожей, по ходу соединительнотканных волокон на кость, в сухожильное влагалище, в сустав, по лимфатической системе, вместе с кровотоком. Большое значение в распознавании и уточнении локализации очага нагноения имеет ощупывание пальца пуговчатым зондом. При этом выявляется участок максимальной болезненности, обычно соответствующий очагу воспаления. Для дифференциальной диагностики подкожного панариция с другими формами границы болезненности сопоставляют с закономерностями распространения инфекции. Подкожный панариций прежде всего нужно отличать от костного. При костном панариции процесс развивается более длительно, боли менее острые и с иной локализацией, отмечается колбообразная припухлость фаланги, в некоторых случаях имеется свищ. Характерными для тендовагинита являются полусогнутое положение пальца, болезненность соответственно расположению сухожильного влагалища, припухлость всего пальца, отек тыла кисти, жестокая боль при разгибании пальца и ограничение функции соседних пальцев. При суставном панариции наблюдаются иная локализация боли и резкое ограничение функции сустава. Костный панариций — это остеомиелит (см.) фаланги. В кровоснабжении костей кисти участвуют все артерии руки, образуя густую сеть с массой анастомозов не только в мягких тканях, но и в скелете. У дистальной фаланги есть еще дополнительная артериальная ветвь, что обеспечивает эпифизу фаланги устойчивость к инфекции и возможность регенерации. В зависимости от строения фаланги, вирулентности микрофлоры, проводимого лечения и состояния здоровья пациента остеомиелитом (см.) поражается или часть фаланги (ограниченный краевой остеомиелит), или весь диафиз (диафизарный остеомиелит), или процесс захватывает всю фалангу (полный остеомиелит). Костный панариций как гематогенный остеомиелит и как первичный очаг воспаления наблюдается редко (5—10 %). У большинства больных (90–95 %) процесс в кости возникает вторично как осложнение гнойного воспаления в мягких тканях. Первичный костный панариций распознается на основании нарастающих местных признаков воспаления, локализующихся в фаланге пальца. Это непрекращающаяся боль в глубине, которая заставляет держать палец в вынужденном положении, оберегать руку от движений и прикосновения. Отмечается также напряженность мягких тканей пальца. Позднее появляются краснота и припухлость, общее недомогание, иногда с повышением температуры тела. При исследовании фаланги пуговчатым зондом определяется резкая боль с тыльной стороны и с ладони. Вторичный костный панариций распознается на основании осложненного течения панариция мягких тканей. У большинства больных наблюдаются клинические проявления при оперированном подкожном панариции дистальной фаланги. После нескольких дней улучшения общего состояния, стихания болей и уменьшения отека наступает задержка отделяемого. Появляются пульсирующая боль, отечность, покраснение; кончик пальца колбообразно распухает, становится горячим, суставы пальцев теряют подвижность, движения ограничены и болезненны, опять ухудшается самочувствие. Такая картина свидетельствует о том, что инфекция распространилась вглубь. Нужно выяснить, где она локализуется — в кости, суставе, сухожильном влагалище или процесс распространился на все ткани пальца. При указанных симптомах предполагают наличие костного панариция, так как это наиболее частый вид осложнений. Суставной и сухожильный панариций исключаются по характеру и локализации боли (при обследовании пуговчатым зондом), распространенности опухоли и характеру нарушения функции. Рентгенологическое исследование в первые 7—10 дней не дает убедительных данных, так как деструктивные изменения в кости обнаруживаются спустя 10–15 дней и служат уже подтверждением и уточнением клинического диагноза. Распознавание костного панариция через 3–4 недели уже не представляет трудностей, поскольку начинается отторжение омертвевшей ткани. Пораженная фаланга остается колбообразно вздутой, имеющей свищи с гнойным отделяемым, а на рентгенограмме видна картина разрушения кости, иногда с наличием очагов омертвевших тканей. Клинические проявления костного панариция средних и проксимальных фаланг и пястных костей схожи с таковыми при остеомиелите (см.) трубчатых костей. Суставным панарицием называется серозно-гнойное поражение межфаланговых и пястно-фаланговых суставов пальцев. Межфаланговые и пястно-фаланговые сочленения пальцев имеют обширную суставную капсулу, образующую завороты с тыльной и ладонной сторон. Ладонный заворот более обширный; при сгибании пальца он образует сборчатый карман неправильной формы, располагающийся между прилегающей костью и сухожильным влагалищем пальца. С боков суставная капсула пястнофаланговых и межфаланговых сочленений подкрепляется двумя коллатеральными (обходными) связками — медиальной и латеральной, натягивающимися при сгибании пальца. Поэтому длительная фиксация пальцев в разогнутом положении с расслаблением боковых связок приводит к их сморщиванию и укорочению с последующим ограничением сгибания. Наименее защищены тыльные поверхности суставов. Гнойный артрит (см.) может быть первичным, когда инфекция попадает непосредственно в сустав, и вторичным — при распространении инфекции с окружающих тканей. Причиной первичного суставного панариция являются проникающие в полость сустава ранки, уколы, укусы, вторичного — костный, сухожильный или подкожный панариций. Суставной панариций распознается на основании следующих признаков: вынужденное полусогнутое положение пальца; припухлость в области сустава, придающая пальцу веретенообразную форму; резкая боль при ощупывании, при попытке к активным и пассивным движениям и при надавливании по оси пальца. В запущенных случаях отмечаются хруст и нарушение подвижности. Рентгенологически определяется уплотнение окружающих сустав мягких тканей, иногда явления разрежения костной ткани, а в более запущенных случаях — деструктивные изменения и отторжение омертвевших тканей. Гнойная фаза суставного панариция характеризуется нарастанием местных и общих симптомов. В этой стадии показано оперативное лечение: артротомия или удаление сустава, антибактериальная терапия, сохранение неподвижности в функционально выгодном положении (не менее 2 недель). В зависимости от течения накладывается вторичный шов или назначаются УФ-облучение, УВЧ, лечебная гимнастика. Для третьей фазы суставного панариция (остеоартрита) характерно стихание боли, уменьшение отечности, образование свищей. При пассивных движениях в суставе определяются ненормальная подвижность и хруст. На рентгенограмме обнаруживается картина деструктивного остеомиелита (см.), иногда с наличием очагов омертвевшей ткани. Деструктивные изменения и отторжение омертвевших тканей чаще развиваются в головке проксимальной фаланги. Удаление показано при деструктивных изменениях сочленяющихся поверхностей с отторжением одной или обеих фаланг. Сухожильный панариций (тендовагинит) смежных II, III и IV пальцев. Сухожилия сгибателей пальцев окружены сухожильными влагалищами. Сухожильные влагалища пальцев — это крепкие, фиброзные тоннели с малой емкостью, почти нерастяжимые, простирающиеся от уровня пястно-фаланговых суставов до оснований дистальных фаланг. С ладонной стороны сухожильные влагалища покрыты плотной фиброзной пластинкой — утолщенной фасцией. Прирастая своими краями к боковым поверхностям фаланг, эта фасция замыкает на каждом пальце костнофиброзный канал, окружающий сухожилия вместе с их влагалищами. На уровне диафиза фаланг фиброзные слои канала образуют поперечные утолщения, так называемые кольцевидные связки фиброзного влагалища. Более слабые утолщения имеют косой ход, формируя так называемые крестовидные связки фиброзного влагалища. В области межфаланговых суставов между крестовидными связками внутренний синовиальный слой образует грыжевидные выпячивания, располагающиеся близко к коже. Здесь влагалище может повреждаться при незначительных колотых ранках. Внутренний слой сухожильного влагалища — это синовиальная оболочка. Она окружает сухожилие, срастаясь с его поверхностью (висцеральный листок), а затем переходит на фиброзный слой влагалища, образуя пристеночный (париетальный) листок. Места перехода представлены слепыми заворотами: проксимальным и дистальным концами влагалища, а также брыжейкой сухожилия, между листками которой к сухожилию подходят сосуды. Синовиальное влагалище — это капиллярная щель; в ней находится несколько капель вязкой жидкости, облегчающей скольжение сухожилия. В пальцевых каналах брыжейка прерывиста и укреплена тонкими связками. Полость синовиальных влагалищ I и V пальцев не замкнута на ладони, а продолжается в лучевую (у большого пальца) и локтевую (у мизинца) синовиальные сумки запястья. В сухожильном влагалище I пальца проходит только одно сухожилие длинного сгибателя большого пальца, прикрепляющееся к дистальной фаланге. Имея более выраженную брыжейку, это сухожилие богаче кровеносными сосудами в сравнении с другими пальцами. Причиной сухожильного панариция чаще всего бывают мелкие травмы пальца в местах поверхностного расположения сухожилий сгибателей. В таких случаях инфекция попадает непосредственно в сухожильное влагалище и вызывает первичный сухожильный панариций, в отличие от вторичного, возникающего как осложнение при костном, суставном или подкожном панариции. Распознать сухожильный панариций в начальной фазе заболевания трудно. Диагноз ставится на основании четырех известных признаков: равномерное опухание всего пальца с распространением на тыльную поверхность кисти; болезненность при давлении зондом по ходу всего сухожилия влагалища, точно ограниченная зоной его расположения; жесткая боль при движениях, особенно при разгибании; фиксация пальца в положении легкого сгибания. Повышенная температура тела, увеличение и болезненность лимфатических узлов, оберегающая руку поза больного, сдвиг формулы крови влево дополняют картину. Таких больных целесообразно госпитализировать. Сухожильный панариций I пальца и лучевой тендобурсит. Сухожильное влагалище большого пальца непосредственно переходит в лучевую синовиальную сумку запястья. Это обстоятельство обусловливает распространение инфекции с пальца на ладонь, запястье и прорыв гноя в пространство Пирогова в нижней трети предплечья. Симптомы сухожильного панариция большого пальца такие же, как и при тендовагините смежных пальцев, но они более выражены и быстро распространяются на возвышение большого пальца, запястье и нижнюю треть предплечья. Временное уменьшение боли и ослабление клинических симптомов наблюдаются после прорыва гноя из пальцевого влагалища в лучевую синовиальную сумку и пространство Пирогова. Пути распространения гноя при тендовагините I пальца разнообразны: в лучевую синовиальную сумку запястья; на предплечье в пространство Пирогова; в локтевую синовиальную сумку запястья (Y-образная флегмона (см.)); в щель мышц возвышения большого пальца; в межфаланговый сустав, на тыл кисти и через кожу с образованием свища. При вскрытии сухожильного влагалища и лучевой синовиальной сумки необходимо помнить, что разрез должен заканчиваться на поперечник пальца дистальнее проксимальной ладонной борозды, не заходя в «запретную зону». Сухожильный панариций V пальца и локтевой тендобурсит. Сухожильное влагалище в большинстве случаев (94 %) сообщается с локтевой синовиальной сумкой запястья, и тендовагинит мизинца часто сопровождается гнойным поражением локтевой синовиальной сумки. Картина гнойного тендовагинита и тендобурсита локтевой сумки характеризуется вышеизложенными симптомами и следующими дополнительными признаками: подвижность мизинца снижена, он и согнут; II, III, IV пальцы также полусогнуты в убывающей от V пальца степени; пассивные движения, особенно разгибание, вызывают резкую боль, распространяющуюся по ходу всей синовиальной сумки запястья и смещающуюся в локоть; движения остальных пальцев, в том числе и большого, особенно разгибание, болезненны. При ощупывании зондом очаги резкой болезненности проецируются на уровне головки V пястной кости и в области проксимального заворота локтевой синовиальной сумки. Отек и покраснение захватывают проксимальную фалангу, возвышение мизинца, локтевую сторону дистальной трети предплечья и тыл кисти. Пандактилит — гнойное воспаление пальца, при котором процесс распространяется на все ткани: кожу, подкожную клетчатку, суставы, сухожилия и кость. Пандактилит наблюдается значительно реже других видов панариция. Это тяжелое заболевание, часто заканчивающееся калечащей операцией — ампутацией или экзартикуляцией (ампутация с разрезом через сустав) пальца. Пандактилит не является самостоятельным видом гнойной инфекции, а развивается как осложнение костного, суставного или сухожильного панариция. Причины пандактилита — в основном ошибки в оказании помощи при микротравме (до 30 %), ошибки хирурга при лечении травм и панариция (до 45 %), поздняя обращаемость и недисциплинированность больного (до 20 %), общие заболевания, осложнившие течение панариция (до 5 %). Пандактилит развивается и протекает двояко: при явлениях расплавления тканей и при явлениях сухого некроза. В зависимости от локализации, распространенности и течения процесса клиническая картина пандактилита варьирует, но характерные черты сохраняются: прогрессирующее расплавление и омертвение тканей с потерей функции. Ограничение подвижности пальцев в большинстве случаев возникает из-за гибели сухожилий сгибателей и разгибателей пальца. В дальнейшем подвижность пальца частично восстанавливается за счет функции червеобразных и межкостных мышц и содружественной работы с соседними пальцами. Анкилозы (неподвижность в суставе) пальцев в межфаланговых сочленениях при функционально пригодном положении хотя и ограничивают, но не исключают функцию. Анкилоз пальцев в пястно-фаланговых суставах препятствует различным видам захвата.
Лечение Лечение кожного панариция не представляет трудностей. Нужно произвести обработку кожи кисти, дополнительно обработать спиртом кожу над гнойником и острыми маникюрными ножницами вскрыть гнойник. Затем, осторожно приподнимая пинцетом края разреза, тщательно иссечь отслоенный по краям эпидермис, нигде не оставляя карманов, из которых возможно распространение инфекции. Обнаженная поверхность кожи высушивается, осматривается (чтобы не проглядеть свищевой ход вглубь) и закрывается асептической повязкой. При лимфангите назначается УФ-облучение, неподвижность и дальнейшее лечение в зависимости от течения процесса. Перевязка после операции, если нет боли, производится на 3—5-й день. Во многих случаях к первой перевязке раневая поверхность кожного панариция полностью затягивается кожей, но остается повышенная чувствительность к прикосновению. Поэтому целесообразно в течение нескольких дней защищать палец повязкой. На тыльной стороне пальцев кожный панариций встречается реже и локализуется на средней фаланге. На тыле слой эпидермиса значительно тоньше, и гнойники часто самопроизвольно опорожняются. Боль при этом бывает незначительной, поэтому больные редко обращаются к хирургу. Лечение кожного панариция тыла кисти такое же, как и при локализации его с ладонной стороны. Паронихий. При полном поражении ногтевого валика и подлежащей клетчатки необходима операция Кеневела. После обработки кожи и обезболивания при односторонней паронихии на стороне очага производится разрез, начинающийся с тыльной стороны вдоль края ногтя, в проксимальноладонном направлении, длиной 1–1,5 см. Очень важно, чтобы разрез отклонялся к ладони, так как только при этом условии обнажается угол ногтевого ложа, где чаще всего задерживается гной. Затем эпонихий (надногтевая пластинка) отодвигается и отслаивается, тупой конец остроконечных ножниц вводится под отслоенный край ногтя, который и иссекается. При полной паронихии производятся два разреза по обеим сторонам ногтя. Важно обеспечить обнажение угла ногтевой пластинки, тщательно удалить гной и омертвевшие ткани, не повредив ногтевое ложе и ногтевой валик, иначе вырастающий ноготь будет деформированным. Сдвинутый лоскут укладывают на место и накладывают асептическую повязку. Лечение подкожного панариция в настоящее время складывается из следующих положений: — при подкожном панариции в фазе серозной экссудации хирургическое вмешательство не показано. Рекомендуется применение абортивных противовоспалительных средств (холод, УФ-облучение, УВЧ, обеспечение неподвижности, антибактериальная, энзимотерапия и др.); — при подкожном панариции в фазе гнойной экссудации производится операция. Костный панариций дистальной фаланги. Опыт показывает, что чем раньше распознана инфекция и чем дистальнее пораженная фаланга, тем больше шансов на излечение без дополнительной операции. Повторные операции на кисти производятся в плановом порядке под руководством ответственного хирурга. Перед операцией проводится не только подготовка кожи, но и антибактериальная терапия. Определив микрофлору и чувствительность ее к антибиотикам, можно произвести регионарную или внутрикостную инфузию антибиотиков с продленным депонированием их в очаге поражения. Если не наступило явного улучшения (уменьшения боли и отека), не отмечается восстановления подвижности сочленения, возможности пользоваться рукой, а при рентгенографии выявлены секвестры, нет оснований задерживаться с операцией. Для оценки результатов консервативного лечения и для подготовки больного достаточно в среднем 5–7 дней. Костный панариций средней, проксимальной фаланг и пястных костей. Пока нет отчетливой локализации процесса в кости, применяется весь арсенал абортивного лечения в сочетании с антибактериальной и иммунотерапией. Костный панариций в фазе гнойного расплавления следует оперировать. При осложненном течении, возникающем при запоздалом или недостаточно радикальном вмешательстве, костный панариций становится тяжелым заболеванием, требующим стационарного лечения.
Виды панарициев: 1 — кожный панариций; 2 — паронихия; 3 — костный панариций; 4 — кожный панариций (в виде запонки); 5 — сухожильный панариций
Сухожильный панариций (тендовагинит) смежных II, III и IV пальцев. Активная абортивная противовоспалительная терапия проводится в полном объеме. При гнойном тендовагините смежных пальцев рекомендуется промывание сухожильного влагалища теплым раствором антисептиков или антибиотиков. Когда из вскрытого влагалища выделяется гной в виде комочков и пробочек, выступает окруженное спайками мутно-желтоватое и отечное сухожилие сгибателей, говорят о некротической форме тендовагинита. В этом случае показано частичное или полное иссечение омертвевшего сухожилия сгибателя пальца. Сухожильный панариций V пальца и локтевой тендобурсит. Лечение проводится в зависимости от фазы воспалительного процесса. В серозной фазе назначаются антибактериальная терапия и активные противовоспалительные средства. В гнойно-некротической фазе производится вскрытие влагалища боковыми разрезами на проксимальной фаланге и на ладони.Необходимы промывание, осмотр и оценка состояния сухожилия. В зависимости от его состояния операция дополняется разрезом на предплечье или вскрытием пространства Пирогова. В настоящее время с применением регионарных инфузий антибиотиков широкого спектра действия и депонированием их в гнойном очаге гнойные тендовагиниты пальцев и тендобурситы кисти редко осложняются тяжелыми флегмонами (см.) с затеком гноя в пространство Пирогова.
Болезненные зоны при различных видах и локализациях панариция: 1 — при подкожном панариции большого пальца, суставном панариции указательного, сухожильном панариции среднего пальца и мозолистом абсцессе ладони; 2 — при флегмоне срединной части ладони; 3 — при флегмоне сухожильно-влагалищной ладонной сумки
Пандактилит. Каждый случай пандактилита имеет свои особенности, но в основе лечения лежат единые принципы. Больного пандактилитом надо госпитализировать и принять меры к отграничению процесса, используя антибиотики, энзимы (ферменты). Операция под наркозом с полным удалением омертвевших тканей и затеков, обеспечение неподвижности и последующее закрытие раны позволяют сберечь при пандактилите функционально пригодный палец. Цель операции — удалить омертвевшие ткани и обеспечить отток гноя. По мере ограничения воспалительного процесса неподвижность уменьшается и кисть постепенно включается в активную деятельность. Вычленение или ампутация пальца в период прогрессирующего расплавления тканей нецелесообразны. Они могут осложниться сепсисом (см.) и не ускоряют заживления. При пандактилите часто бывают необходимы повторные операции для удаления омертвевших тканей — секвестрэктомия, тендэктомия, вторичное закрытие раны.
ПАНКРЕАТИТ
ОпределениеПанкреатит — заболевание поджелудочной железы, возникающее в результате саморазрушения ткани ее липолитическими и активированными протеолитическими ферментами. Воспалительные изменения в поджелудочной железе возникают в ответ на некробиоз и некроз ее ткани.Среди неотложных хирургических заболеваний органов брюшной полости панкреатит занимает 3-е место, уступая лишь аппендициту и холециститу. Наиболее часто заболевают лица зрелого возраста (30–60 лет), женщины — в 3 раза чаще, чем мужчины. Различают острый и хронический панкреатит. Поджелудочная железа — орган внешней и внутренней секреции. Она выделяет в двенадцатиперстную кишку панкреатический сок. Поджелудочная железа и желчные протоки развиваются вместе с двенадцатиперстной кишкой, что проявляется в их анатомическом и функциональном единстве и взаимозависимости. Часто наблюдается одновременное заболевание этих органов. Поджелудочная железа расположена забрюшинно на уровне 1—11 поясничных позвонков, занимая поперечное положение между двенадцатиперстной кишкой и воротами селезенки. Тело поджелудочной железы передней своей поверхностью прилежит к задней поверхности желудка. Эти органы отделены друг от друга узкой щелью — сальниковой сумкой. Позади поджелудочной железы на уровне перехода ее головки в тело проходят верхние мезентериальные сосуды. Проток поджелудочной железы (вирсунгов проток) образуется из слияния мелких дольковых протоков. В головке проток поджелудочной железы соединяется с добавочным протоком поджелудочной железы и затем впадает в общий желчный проток. Лимфатическая система поджелудочной железы имеет тесную связь с лимфатической системой желудка, кишечника, двенадцатиперстной кишки и желчевыводящих путей. Паренхима поджелудочной железы состоит из множества долек, отделенных друг от друга прослойками соединительной ткани. Каждая долька состоит из эпителиальных клеток, образующих ацинусы. За сутки железа выделяет 1000–1500 мл панкреатического сока. Среди паренхиматозных клеток поджелудочной железы имеются особые клетки, которые образуют скопления величиной 0,1–1 мм, называющиеся панкреатическими островками. Внешнесекреторная деятельность поджелудочной железы стимулируется блуждающими нервами, гормонами желудка и двенадцатиперстной кишки (секретин, панкреозимин). Амилаза, расщепляющая углеводы, и липаза, расщепляющая жиры, выделяются поджелудочной железой в активной форме. Протеазы — трипсиноген и химотрипсиноген — выделяются в неактивной форме. Они активируются только в двенадцатиперстной кишке, где трипсиноген под влиянием энтерокиназы превращается в трипсин, который, в свою очередь, активирует химотрипсиноген в химотрипсин. Активация протеолитических ферментов в двенадцатиперстной кишке защищает поджелудочную железу от самопереваривания. Кроме того, клетки ацинусов выделяют ингибиторы протеаз. Клетки протоков поджелудочной железы также имеют механизмы защиты. Эндокринная секреция связана с деятельностью панкреатических островков, на 60–70 % состоящих из В-клеток, продуцирующих и депонирующих инсулин. Содержание инсулина в поджелудочной железе равно 6–7 мг, из которых около 2 мг идут на покрытие суточной потребности организма в инсулине. Основным стимулятором выделения инсулина является пища, богатая белками и углеводами. Компенсаторные возможности поджелудочной железы настолько велики, что лишь при удалении около 80 % ее паренхимы могут появиться клинические проявления недостаточности ее функций (сахарный диабет и т. д.).
Этиология и патогенез Все формы панкреатита развиваются в результате местных и общих реакций организма в ответ на патологическое воздействие активированных протеолитических и липолитических ферментов поджелудочной железы. Среди причин, способствующих развитию панкреатита, выделяют механические, нейрогуморальные и токсико-аллергические факторы. К механическим факторам относят нарушение оттока панкреатического сока вследствие блокады ампулы, в которую открываются общий желчный проток и проток поджелудочной железы. Причинами блокады могут быть: — стойкий спазм сфинктера Одди вследствие рецидивирующей желчной колики при желчнокаменной болезни, острого холецистита, дискинезии двенадцатиперстной кишки (дуоденостаз) и дуоденопанкреатический рефлюкс; — отек и воспаление большого сосочка двенадцатиперстной кишки; — травма (в том числе интраоперационная) поджелудочной железы и двенадцатиперстной кишки. Среди нейрогуморальных факторов наибольшее значение имеют нарушение жирового обмена и системные заболевания сосудов; среди токсико-аллергических — неумеренное потребление алкоголя. Лекарственная и пищевая аллергия занимает среди этих причин весьма скромное место. Указанные факторы реализуются часто после приема алкоголя, жирной и острой пищи. Вследствие развивающейся внутрипротоковой гипертензии повреждаются мелкие протоки, отводящие панкреатический сок из ацинусов. В результате секрет поджелудочной железы попадает в интерстициальную ткань. Под влиянием липолитических ферментов (фосфолипазы А и липазы) может наступить некроз экзокринных панкреоцитов и жировой клетчатки, окружающей дольки поджелудочной железы. Липаза способна разрушать только поврежденные клетки. Мембраны клеток повреждаются под действием фосфолипазы А при разрыве мелких протоков. В этих условиях липаза проникает внутрь клетки, гидролизует внутриклеточные триглицериды с образованием жирных кислот. Освобождение тканевой липазы усиливает повреждающее действие липолитических ферментов. В результате появляются очаги некробиоза и некроза паренхимы поджелудочной железы. По периферии очагов некроза развивается воспалительная реакция с участием медиаторов воспаления — гистамина, серотонина, калликреин-кининовой системы. В зоне воспаления резко нарушается микроциркуляция, возникает отек вследствие резкого повышения проницаемости сосудов. На этом этапе развития панкреатита процесс может принять абортивное течение, что приводит к развитию отечной формы панкреатита. При менее благоприятном течении процесса в поврежденных липолитическими ферментами клетках поджелудочной железы продолжается накопление жирных клеток, развивается внутриклеточный ацидоз. В условиях ацидоза в результате самораспада внутриклеточный неактивный трипсиноген трансформируется в активный трипсин. Повреждая клетки, трипсин высвобождает и активирует лизосомальные ферменты (эластазу, коллагеназу и др.). Трипсин в микроциркуляторном русле поджелудочной железы активирует калликреин-кининовую систему. Активный трипсин и другие протеазы вызывают омертвение и саморазрушение тканей поджелудочной железы. Эластаза подвергает разрушению стенки венул и междольковые соединительнотканные перегородки. В результате этого возникают обширные кровоизлияния, способствующие быстрому распространению саморазрушения ткани поджелудочной железы за пределами начальных очагов некроза, углубляются нарушения микроциркуляции, возникают диссеминированные микротромбозы. В этих условиях протеолитический некроз клеток поджелудочной железы, разрушения микрососудов и дальнейшее нарушение микроциркуляции прогрессируют быстро. При геморрагическом некрозе ткани поджелудочной железы освобождаются и липолитические ферменты. Таким образом, протеолитическая и липолитическая фазы развития деструктивного панкреатита взаимодействуют друг с другом. Это взаимодействие способствует трансформации жирового панкреонекроза в геморрагический. Попадание в общий ток крови токсичных продуктов саморазрушения ткани поджелудочной железы (токсичные полипептиды), панкреатических ферментов, биогенных аминов, продуктов нарушенного метаболизма, активация калликреин-кининовой системы вызывают резко выраженную интоксикацию организма. В процессе развития панкреонекроза значительная часть жидкости организма подвергается отторжению вследствие обширного отека парапанкреатической клетчатки, брыжейки ободочной кишки, забрюшинной клетчатки и развития паралитической непроходимости кишечника в связи с развивающимся перитонитом. Организм больного обезвоживается, наступают водно-электролитные нарушения и нарушение кислотно-основного состояния. Интоксикация в сочетании с гиповолемией приводит к развитию шока. Токсичные продукты, циркулирующие в крови, оказывают прямое токсическое действие на сердце, почки, печень, центральную нервную систему, вызывая нарушение центрального и периферического кровообращения, недостаточность функции паренхиматозных органов, диссеминированное внутрисосудистое свертывание (ДВС-синдром).
Патанатомия Острый панкреатит Изменения в поджелудочной железе рассматривают как реакцию на первичный некроз и некробиоз клеток ацинусов под влиянием собственных липолитических и протеолитических ферментов. Вокруг очажков некроза развивается демаркационное воспаление с аллергической (гиперергической) сосудистой реакцией, отеком поджелудочной железы, увеличением ее объема, что рассматривают как отечную форму панкреатита. У большинства больных развитие патологического процесса останавливается на этой стадии острого панкреатита. Реже под влиянием недостаточно изученных неблагоприятных факторов процесс прогрессирует: развивается морфологическая картина жирового панкреонекроза. Поджелудочная железа в этих случаях становится плотной, на разрезе имеет пестрый вид за счет множественных мелких очагов жирового некроза. Клеточные элементы в этих очагах не дифференцируются, находятся в состоянии глубокой дистрофии или некроза. Зона жирового некроза отделена от окружающей ткани перифокальным воспалением. Очаги этого некроза могут появляться на париетальной и висцеральной брюшине, в предбрюшинной и подкожной жировой клетчатке, на плевре, перикарде. Они имеют беловато-мутный цвет (стеариновые бляшки). Среди детрита очагов некроза видны глыбки кальциевых мыл, кристаллы жирных кислот. Вокруг поджелудочной железы развивается плотный опухолевидный инфильтрат, в который вовлечены желудок и поперечная ободочная кишка. В брюшной полости появляется серозная мутная воспалительная жидкость. При геморрагическом панкреонекрозе поджелудочная железа умеренно увеличенная, плотная. Цвет ее в связи с обилием кровоизлияний в паренхиму железы и в окружающие ткани становится багрово-черным. На разрезе выявляют чередование очагов темно-красного цвета с участками неизмененной паренхимы. Ткань поджелудочной железы полнокровная, с очагами кровоизлияний вокруг мелких сосудов. В брюшной полости обнаруживают в значительном количестве геморрагический экссудат. Висцеральная и париетальная брюшины покрыты тусклым налетом в связи с развитием асептического перитонита. По мере прогрессирования заболевания поджелудочная железа подвергается некрозу на обширных участках.
Хронический панкреатит При хроническом панкреатите различного происхождения происходит замещение эпителиальной ткани поджелудочной железы соединительной тканью с последующим развитием фиброза и склероза, что может приводить к уменьшению или увеличению размеров поджелудочной железы. Особое место занимает калькулезный (кальцифицирующий) панкреатит, при котором отмечают отложение солей кальция в ткани поджелудочной железы или в просвете выводных протоков (вирсунголитиаз). При закупоривании ее мелких выводных протоков вследствие воспалительного или склерозирующего процесса у некоторых больных формируются кисты.
Клиническая картина Острый панкреатит Различные формы острого панкреатита классифицируют по клинико-морфологическим признакам. Клинико-анатомические формы: — отечный панкреатит; — жировой панкреонекроз; — геморрагический панкреонекроз; — смешанный панкреонекроз. При геморрагическом диффузно-очаговом панкреонекрозе обычно наступает полное или почти полное омертвение поджелудочной железы. В случае выживания больного в последующем происходит отторжение омертвевших участков, а при инфицировании — нагноение их с образованием парапанкреатических и забрюшинных абсцессов. В позднем периоде образуются ложные кисты поджелудочной железы. Таким образом, абортивную форму очагового панкреонекроза можно назвать отечным, или интерстициальным панкреатитом. При прогрессирующем панкреатите в случае саморазрушения поджелудочной железы преимущественно липолитическими ферментами развивается жировой панкреонекроз. При воздействии преимущественно протеолитических ферментов развивается быстро прогрессирующий геморрагический панкреонекроз с образованием обширного отека в забрюшинной клетчатке и появлением геморрагического выпота в брюшной полости (панкреатогенный асептический перитонит). В ряде случаев наблюдаются смешанные формы панкреатита: геморрагический панкреатит с очагами жирового некроза и жировой панкреонекроз с кровоизлияниями. В зависимости от распространенности процесса различают локальный (очаговый), субтотальный и тотальный панкреатит. По клиническому течению процесс бывает абортивный и прогрессирующий. В зависимости от периода болезни — период нарушений кровообращения и панкреатогенного шока, период функциональной недостаточности внутренних органов, период гнойных осложнений. Клинические симптомы острого панкреатита зависят от морфологической формы панкреатита, периода развития и тяжести болезни. В начальном периоде заболевания (1–3 сутки) как при отечной (абортивной) форме панкреатита, так и при панкреонекрозе, т. е. прогрессирующем панкреатите, больные жалуются на резкие боли в эпигастральной области (верхней части живота), опоясывающие боли, тошноту, многократную рвоту. Боли чаще локализуются в левой половине эпигастрия, в спине, правом подреберье. Четкой связи болей с локализацией процесса в поджелудочной железе нет. Опоясывающий характер болей встречается наиболее часто. Интенсивность болей обычно зависит от тяжести изменений в поджелудочной железе. Чаще наблюдаются сильные и очень сильные боли. Иногда они сопровождаются коллаптоидным состоянием. Пульс обычно учащен. Артериальное давление нормальное или несколько повышено в течение короткого периода. При исследовании живота отмечают болезненность в эпигастральной области и левом подреберье. Напряжения мышц живота нет. Лишь иногда отмечают их болезненность в области проекции поджелудочной железы на передней брюшной стенке (симптом Керте). Пальпация в левом реберно-позвоночном углу (проекция хвоста поджелудочной железы) часто бывает болезненной (симптом Мейо-Робсона). Уже на ранних этапах выявляют ослабление перистальтических шумов. При жировом некрозе поджелудочной железы рано образуется постнекротический инфильтрат, который можно определить в эпигастральной области при пальпации. В связи с этим у больных не удается четко прощупать пульсацию аорты (симптом Воскресенского). Этому способствуют также парез и вздутие поперечной ободочной кишки. При осмотре живота отмечают некоторое его вздутие. Простукиванием определяют высокий тимпанит. Однако с появлением выпота в брюшной полости возникает притупление звука в отлогих частях живота, которое легче выявляется в положении больного на боку. Кожа живота при тяжелом панкреатите имеет иногда мраморный оттенок. В области пупка, на левой боковой стенке живота появляются синюшные, иногда с желтоватым оттенком пятна, свидетельствующие о рассасывании кровоизлияний в области поджелудочной железы. Эти пятна могут наблюдаться также при кровотечении в брюшную полость при внематочной беременности, при гангрене тонкой кишки. При тяжелой форме панкреатита простукиванием и прослушиванием можно выявить реактивный плеврит, который появляется сравнительно рано. Одновременно с этим у ряда больных развиваются серозно-геморрагический перитонит и явления шока, более свойственные геморрагическому панкреатиту. В период нарушений кровообращения появляются тахикардия (увеличение частоты сердечных сокращений), тахипноэ, снижается артериальное давление. В этом периоде для определения тяжести процесса необходимо иметь показания шокового индекса. В норме он равен 0,5. При потере жидкости со рвотой, отторжением ее в отечных тканях брюшины, забрюшиной клетчатке, в корне брыжейки кишечника и других тканях он возрастает до 1,0–1,5. Клинически шок проявляется бледностью кожных покровов и слизистых оболочек, повышенным потоотделением, синюшностью конечностей, частым нитевидным пульсом, спавшимися венами, уменьшением объема циркулирующей крови, центрального венозного давления, минутного и ударного объемов сердца. На ЭКГ выявляют признаки ишемии миокарда. У большинства больных наблюдают расстройство психики. Параллельно этому снижается мочевыделение, его уменьшение может смениться полным отсутствием и острой почечной недостаточностью. Функциональные нарушения печени проявляются желтушной окраской кожных покровов, увеличением печени; в анализах крови выявляют повышение уровня билирубина, снижение содержания белка, а также увеличение числа лейкоцитов и СОЭ; отмечают ацидоз, гиперкалиемию, снижение содержания Са, свидетельствующее о прогрессировании жирового некроза. Содержание Са+ ниже 2 моль/л является прогностически неблагоприятным фактором, так как отражает нарастающее связывание его стеариновыми бляшками жирового некроза в различных тканях организма. При остром панкреатите резко возрастает содержание амилазы и липазы в сыворотке крови, повышается уровень амилазы в моче, особенно резко их концентрация возрастает в воспалительной жидкости брюшной и плевральной полости. Строгого соответствия между уровнями амилазы и липазы в сыворотке крови и тяжестью панкреатита нет. Следует иметь в виду, что повышение активности амилазы и липазы может наблюдаться также при почечной недостаточности вследствие уменьшения выделения с мочой этих ферментов, при перфорации язвы, непроходимости кишечника (уменьшение всасывания из тонкой кишки), остром холецистите (сопутствующая реакция поджелудочной железы). Более специфичным исследованием является определение трипсина сыворотки крови, альфахимотрипсина, эластазы и особенно фосфолипазы Az, играющей ключевую роль в процессе развития геморрагического панкреонекроза. Однако сложность их определения сдерживает широкое распространение указанных методов.
Хронический панкреатит Выделяют четыре клинико-морфологические формы хронического панкреатита: — хронический индуративный; — ложноопухолевый; — ложнокистозный; — калькулезный (в том числе вирсунголитиаз). Симптомами хронического панкреатита являются тупые боли в эпигастральной области, правом или левом подреберье (в зависимости от локализации основного очага поражения железы), опоясывающие боли, усиливающиеся после погрешности в диете, расстройства пищеварения (тошнота, рвота скудным количеством желудочного содержимого), чередование запоров с поносами (при выраженной внешнесекреторной недостаточности поджелудочной железы), обтурационная желтуха, связанная со сдавлением конечного отдела общего желчного протока увеличенной головкой поджелудочной железы и обусловленная нарушением продвижения желчи и панкреатического сока в двенадцатиперстную кишку при сочетанном холедохолитиазе, рубцовой стриктуре большого сосочка двенадцатиперстной кишки. Часто наблюдается снижение массы тела, связанное с внешнесекреторной недостаточностью поджелудочной железы, нарушением переваривания пищи, а также уменьшением объема потребляемой больными пищи из-за боязни усиления болей после еды. При объективном исследовании в фазе обострения заболевания можно выявить симптомы, характерные для острого панкреатита. В фазе ремиссии отмечают болезненность по ходу поджелудочной железы, у худощавых субъектов можно прощупать плотную болезненную поджелудочную железу. Пальпацию железы производят в трех положениях: лежа на спине с подложенным под нее валиком, стоя с наклоном туловища вперед на 45° и лежа на левом боку. При преимущественном поражении головки поджелудочной железы и сдавлении конечного отдела общего желчного протока у некоторых больных выявляют симптом Курвуазье, характеризующийся триадой признаков: обтурационной желтухой, увеличением желчного пузыря, отсутствием боли. Почти у половины больных определяется положительный симптом Мейо-Робсона.
Диагностика и дифдиагностика Острый панкреатит Диагностика острого панкреатита основывается на данных опроса (появлении резких болей в животе после обильной еды, приема алкоголя, обострения фоновых заболеваний); данных объективного и лабораторного исследований. Значительную помощь в диагностике оказывает ультразвуковое исследование, позволяющее установить факторы возникновения (холецисто- и холедохолитиаз), тяжесть морфологических изменений в поджелудочной железе и течение болезни, сопутствующие осложнения заболевания. Точность диагностики холецистита и нарушения оттока желчи при ультразвуковом исследовании достигает 92–98 %. Признаками отека поджелудочной железы являются увеличение ее объема и уменьшение степени отражения сигнала. При некрозе поджелудочной железы выявляют нерезко ограниченные участки пониженной эхогенности или полного отсутствия эхосигнала. Распространение некроза за пределы поджелудочной железы («дорожки некроза»), а также абсцессы и ложные кисты могут быть обнаружены при ультразвуковом исследовании. Рентгенологическое исследование менее информативно. Оно позволяет иногда выявить рентгеноконтрастные конкременты в желчных путях, в протоке поджелудочной железы, изменение расположения желудка и двенадцатиперстной кишки при объемных процессах в поджелудочной железе. Рентгенологическое исследование является важным для выявления паралитической непроходимости кишечника, выпота в плевральной полости, дисковидных ателектазов легкого, которые часто сопутствуют острому панкреатиту. Исследование желудка и кишечника с контрастным веществом в остром периоде панкреатита противопоказано. Компьютерная томография дополняет ультразвуковое исследование. Она позволяет более четко выявить очаги некроза, изменения в парапанкреатической клетчатке, «дорожки некроза» за пределами поджелудочной железы, а также осложнения в виде абсцессов и кист. Ультразвуковое исследование легче применять для контроля за течением заболевания. Эзофагогастродуоденоскопия не имеет большого значения для диагностики панкреатита. Показания к ней возникают при желудочно-кишечном кровотечении на фоне панкреатита. Ретроградная холедохопанкреатография при остром панкреатите противопоказана, за исключением случаев ущемления конкремента в ампуле, когда требуются папиллотомия и его удаление. Лапароскопию применяют при неясном диагнозе, при необходимости лапароскопической установки дренажей для лечения острого панкреатита. Для взятия перитонеального экссудата и проведения диагностического лаважа можно воспользоваться введением в брюшную полость катетера через прокол в брюшной стенке. Электрокардиография необходима во всех случаях как для дифференциальной диагностики с острым инфарктом миокарда, так и для оценки состояния сердечной деятельности в процессе заболевания. Дифференциальную диагностику необходимо проводить прежде всего с тромбозом мезентериальных сосудов (сосудов кишечника), так как внезапные резкие боли, шоковое состояние при мягком животе и нормальной температуре тела могут напоминать острый панкреатит. Паралитическая непроходимость кишечника и перитонит встречаются при обоих заболеваниях. Инфаркт миокарда по клиническим данным трудно дифференцировать с острым панкреатитом, так как в острой фазе панкреатита возникают изменения ЭКГ, типичные для острого инфаркта миокарда. Как в случае мезентериального инфаркта кишечника, так и при инфаркте миокарда ультразвуковое исследование помогает дифференцировать эти заболевания. При неясном диагнозе целесообразно провести артериографию сосудов брюшной полости. Острый холецистит и его осложнения можно сравнительно легко отличить по типичной клинической картине и ультразвуковой симптоматике. Острый панкреатит приходится дифференцировать с прободной язвой, странгуляционной тонкокишечной непроходимостью, аневризмой аорты, почечной коликой.
Хронический панкреатит Диагностика хронического панкреатита проводится на основании жалоб больного, данных анамнеза, физикального, лабораторного и инструментальных методов исследования. При обострении заболевания и нарушении оттока панкреатического сока (чаще при вирсунголитиазе) отмечают увеличение уровня амилазы, липазы и трипсина в крови и амилазы в моче. При первично-хроническом панкреатите или хронической рецидивирующей форме заболевания в фазе ремиссии концентрация ферментов поджелудочной железы в крови и моче обычно не изменена, поэтому в данных ситуациях эти пробы не имеют диагностической ценности. Концентрация протеолитических и липолитических ферментов в дуоденальном содержимом, как правило, снижена. При копрологическом исследовании обычно выявляют креаторею и стеаторею. Примерно у 25 % больных отмечают признаки нарушения толерантности к глюкозе по данным гликемической кривой с углеводной нагрузкой. У больных с калькулезным панкреатитом частота недостаточности инкреторной функции поджелудочной железы возрастает до 60–80 %. В случае ложнокистозной и туморозной форм при обзорной рентгенографии брюшной полости можно выявить тени кальцинатов по ходу поджелудочной железы. При исследовании двенадцатиперстной кишки в условиях искусственной гипотонии (релаксационная дуоденография) определяют косвенные симптомы хронического панкреатита: развернутую вертикальную ветвь («подкову») двенадцатиперстной кишки, вдавление или дефект наполнения по ее медиальному контуру, сглаженность складок слизистой оболочки в данной зоне. При ультразвуковом исследовании и компьютерной томографии обычно выявляют увеличение того или иного отдела поджелудочной железы. Следует отметить, что указанные изменения не позволяют отличить хронический панкреатит от опухолевого поражения поджелудочной железы. С этой целью используют прицельную пункцию железы под контролем УЗИ или компьютерной томографии с последующим морфологическим исследованием биопсийного материала. При ретроградной панкреатохолангиографии у некоторых больных выявляют расширение главного протока поджелудочной железы, обусловленное стенозирующим папиллитом или вирсунголитиазом. Значительно чаще определяют сужение и деформацию протока поджелудочной железы.
Осложнения Острый панкреатит может сопровождаться многочисленными осложнениями. Наиболее тяжелыми из них являются: — гиповолемический шок; — острая почечная недостаточность, являющаяся в значительной степени следствием шока и панкреатогенной токсемии; — плевролегочные осложнения, проявляющиеся дыхательной недостаточностью в связи с развитием шокового легкого и тяжелой гипоксемией (высоким содержанием углекислого газа в крови), могут способствовать также развитию дыхательной недостаточности, экссудативный плеврит, ателектаз, высокое стояние диафрагмы и т. д.; — печеночная недостаточность (от легкой желтухи до тяжелого острого токсического гепатита, развивающегося вследствие перенесенного шока и влияния токсичных ферментов и белковых субстанций), чему способствует заболевание желчных путей и сопутствующий им холангит; — абсцессы поджелудочной железы и экстрапанкреатические абсцессы. Появление их обусловлено инфекцией, легко развивающейся в очагах некроза. Абсцесс может возникнуть в любом участке некроза забрюшинной клетчатки (поддиафрагмальной или подпеченочной). Прорыв его в полый орган или наружу может привести к возникновению внутренних и наружных свищей поджелудочной железы; — наружные свищи чаще развиваются на месте дренажей или ран. Сначала выделяется гнойно-некротическое содержимое, позднее — светлый панкреатический сок. Внутренние свищи обычно открываются в желудок, двенадцатиперстную, тонкую и толстую кишки; — кровотечения, возникающие вследствие аррозии сосудов. Кровь из брюшной полости выделяется наружу через рану или по каналу дренажа. Внутренние кровотечения чаще всего являются следствием эрозивного гастрита, стрессовой язвы, синдрома Маллори-Вейса, а также в связи с нарушением в системе гемостаза (коагулопатия потребления). В числе поздних осложнений следует упомянуть о формировании псевдокист. Некротизированная ткань поджелудочной железы при обширном некрозе не рассасывается полностью. Она инкапсулируется и превращается в псевдокисту, благодаря формированию соединительнотканной капсулы вокруг очага некроза. Содержимое кисты может быть стерильным или гнойным. Иногда происходит спонтанное рассасывание кист.
Лечение Острый панкреатит Программа лечения острого панкреатита должна быть построена с учетом причины возникновения заболевания, его тяжести и клинического течения. Больному необходимо наблюдение хирурга, терапевта и специалиста по интенсивной терапии (реаниматолога), которые совместно решают сложные вопросы его лечения. В программе лечения предусматривают базисную терапию, угнетение секреции ферментов, предупреждение аутолиза ткани железы и развития осложнений, устранение фактора возникновения, лечение осложнений и, наконец, хирургическое вмешательство. Основная терапия включает: — снятие боли (избегать введения морфина, повышающего тонус сфинктера Одди и затрудняющего отток панкреатического сока); — прекращение питания и приема жидкости через рот, а при появлении признаков непроходимости кишечника — назогастральный зонд для постоянного отсасывания содержимого желудка (покой для поджелудочной железы); — внутривенное восполнение дефицита жидкости и электролитов под контролем центрального венозного давления, почасового мочевыделения, внутривенное питание посредством введения растворов глюкозы с инсулином и жировой эмульсии (липофундин и др.); — восполнение дефицита альбумина при шоке и снижении альбумина сыворотки крови; — при снижении уровня гемоглобина и гематокрита — переливание крови. Для подавления боли применяют ненаркотические анальгетики (баралгин, амидопирин, анальгин). Во избежание развития или углубления шока спазмолитические средства следует назначать с осторожностью. При очень сильных болях вынужденно приходится вводить промедол. В условиях стационара для снятия болей рекомендуют паранефральную блокаду, блокаду круглой связки печени раствором новокаина или более эффективную перидуральную анестезию. Уменьшению болевого синдрома способствуют введение глюкозо-новокаиновой смеси с атропином, отсасывание содержимого желудка и промывание его холодной водой. Острый панкреатит сопровождается значительными водно-электролитными нарушениями, поэтому восполнение дефицита жидкости, электролитов, альбумина имеет первостепенное значение в профилактике и лечении шока, восстановлении нарушенного гомеостаза. С этой целью больным вводят растворы, содержащие натрий, калий, фосфор, глюкозу. Для восполнения дефицита объема циркулирующей крови целесообразно вводить полиглюкин, гемодез, альбумин, повышающие осмолярность крови и способствующие удержанию изотонических растворов в сосудистом русле. Кроме того, названные препараты способны связывать токсичные вещества и выводить их с мочой. Введение жидкостей должно контролироваться измерением центрального венозного давления и мочевыделения. При стабильном артериальном давлении применяют ускоренное мочевыделение с помощью мочегонных средств. Внутривенное питание является обязательным компонентом лечения, так как питание через рот прекращают на 3–5 дней. Энергетические потребности организма больного (30 кал в день на 1 кг массы тела с последующим повышением до 60 кал в день) обеспечивают путем введения растворов глюкозы с инсулином под контролем содержания глюкозы крови, растворов аминокислот и липидов (липофундин и другие аналогичные препараты). Жировые эмульсии применяют не только для восстановления энергетических расходов организма, но и для стабилизации мембран клеток поджелудочной железы, что способствует ограничению повреждения их ферментами. Для угнетения секреторной деятельности поджелудочной железы прежде всего прекращают прием пищи и жидкости через рот. Одновременно с отсасыванием желудочного содержимого больным назначают антацидные средства для связывания соляной кислоты. Однако при введении большого количества антацидных средств пероральным путем нарушается принцип воздержания от приема жидкости через рот. Угнетение желудочной секреции циметидином и антихолинергическими препаратами (гастрозепин, атропин) целесообразно только в раннем периоде заболевания. Ингибиторы протеолитических ферментов, таких как контрикал (трасилол), гордокс (ингибиторы трипсина, калликреина и др.), аминокапроновая кислота и ее производные, до недавнего времени широко применялись для лечения острого панкреатита. В последние годы эффективность использования их ставится под сомнение, хотя профилактическое применение при операциях на поджелудочной железе и желчных путях вполне оправдано. Введение контрикала или гордокса как препаратов, угнетающих калликреин-кининовую систему и трипсин, целесообразно в самые ранние сроки от начала заболевания. Дозировка препаратов колеблется от 120–200 тыс. ЕД до 1 млн ЕД. Более эффективным препаратом, угнетающим эндокринную функцию поджелудочной железы, является фторурацил. Перитонеальный лаваж применяют не только для диагностики, но и для лечения развившегося панкреатита: из брюшной полости удаляют воспалительную жидкость, богатую протеолитическими и липолитическими ферментами, кининами и другими токсичными субстанциями; продукты расплавленных некротизированных тканей. Перитонеальный лаваж предупреждает всасывание токсичных продуктов и уменьшает действие токсинов на внутренние органы. Перитонеальный лаваж более эффективен, чем ингибиторы протеолитических ферментов. Для проведения перитонеального лаважа в брюшную полость под контролем лапароскопа вводят 2 дренажа в верхний этаж брюшной полости, а также дренажи в полость малого таза и в правый боковой канал. По верхним дренажам диализирующую жидкость подают в брюшную полость, через нижние выводят наружу. При этом необходимо следить за балансом вводимой и выводимой жидкости, контролировать центральное венозное давление, следить за возможными легочными осложнениями. Для улучшения микроциркуляции, в том числе в поджелудочной железе, вводят реополиглюкин, небольшие дозы гепарина, производят блокаду чревных нервов, паранефральную блокаду, а также применяют гемодилюцию при инфузионной терапии. Устранение причины возникновения острого панкреатита возможно в тех случаях (около 50 %), когда развитие его связано с заболеванием желчного пузыря и внепеченочных желчных протоков, т. е. при билиопанкреатическом рефлюксе. Если при ультразвуковом исследовании обнаруживают желчнокаменную болезнь с расширением желчных протоков вследствие застоя желчи или камня в конечном отделе общего желчного протока либо в области большого сосочка двенадцатиперстной кишки, то необходимы срочная папиллотомия и удаление камня из общего желчного протока и сосочка (если они не отходят самостоятельно). Холецистэктомию осуществляют после стихания явлений острого панкреатита. Антибактериальную терапию при панкреонекрозе проводят как для профилактики инфицирования очагов некроза, так и для лечения уже развивающейся инфекции. Предпочтение отдают антибиотикам широкого спектра действия, подавляющим развитие как грамположительной, так и грамотрицательной микрофлоры. Почечная и дыхательная недостаточность часто сопровождают тяжело протекающий панкреатит. При скоплении воспалительной жидкости в плевральной полости необходима срочная ее пункция и удаление жидкости с обязательным определением содержания в ней ферментов поджелудочной железы, белка, а также его бактериоскопия и бактериологическое исследование. При дыхательной недостаточности, вызванной другими причинами (шоковое легкое), необходимо в ранние сроки перевести больного на искусственную вентиляцию легких с созданием положительного давления на выдохе. При почечной недостаточности (отсутствие мочевыделения, высокое содержание креатинина и мочевины в крови) показан гемодиализ в возможно ранние сроки. Несмотря на успехи интенсивной терапии в лечении острых панкреатитов, тяжелые их формы часто заканчиваются летально. Поэтому при определенных условиях возникает необходимость в хирургическом вмешательстве, которое является лишь дополняющим лечебным мероприятием. Показания к оперативному лечению возникают при следующих условиях: — при неуверенности в диагнозе; при установленном диагнозе острого панкреатита билиарного происхождения; — при локальном панкреонекрозе и инфицировании очагов некроза и «некротических дорожек» в забрюшинной клетчатке; — при панкреатогенном перитоните; — при отсутствии улучшения или при ухудшении состояния, несмотря на правильное интенсивное лечение, в том числе при безуспешности лапароскопического лаважа брюшной полости; — при наличии абсцессов в брюшной полости. Целью хирургического лечения является удаление омертвевших участков тканей до развития их нагноения, обеспечение оптимального дренирования брюшной полости при наличии перитонита, установка дренажей для терапевтического лаважа. В последнем случае в ложе поджелудочной железы устанавливают перфорированные дренажные трубки для того, чтобы обеспечить хорошее промывание этой области, удаление не только воспалительной жидкости и содержащихся в ней ферментов, но и образовавшегося в результате расплавления тканей детрита. Трубки укладывают по ходу поджелудочной железы и выводят наружу через боковые отделы живота. Одну или две трубки устанавливают в полости малого таза. В течение суток через них вводят 10–12 л диализата, содержащего 5,6 г хлорида натрия, 5,09 г лактата натрия, 0,52 г хлорида кальция, 0,15 г хлорида магния, 15 г глюкозы, до 1000 мл дистиллированной воды (осмолярность раствора 360 мосм/л). К раствору можно добавлять антибиотики по показаниям. Для лучшего осмотра и дренирования поджелудочной железы производят продольные разрезы брюшины по верхнему и нижнему краям ее, тупым путем выделяют железу из окружающей клетчатки, осматривают и укутывают сальником (абдоминализация железы). Это позволяет полнее удалить токсичную воспалительную жидкость, детрит, обеспечить не только изоляцию железы, но и в последующем улучшить ее кровоснабжение. Для этой же цели иногда ограничиваются лишь фиксацией сальника к передней поверхности поджелудочной железы. При выраженном очаговом (множественном) панкреонекрозе в сочетании с перитонитом прибегают к лапаростомии и этапному лаважу. Через открытую рану брюшной стенки отделяется перитонеальный экссудат в повязку. Рану подвергают ревизии с повторным промыванием брюшной полости и удалением очагов некроза через 24–48 ч.
Хронический панкреатит Основным методом лечения неосложненного хронического панкреатита является консервативный. Назначают диету с исключением жирной, жареной, соленой, острой пищи (перец, чеснок, уксус и т. п.). Лекарственная терапия направлена прежде всего на устранение болей и спазма сфинктера Одди с помощью ненаркотических анальгетиков, спазмолитических и холинолитических средств, ганглиоблокаторов. Необходимо также обеспечение функционального покоя поджелудочной железы (диета, пероральный прием щелочных растворов, в том числе минеральных вод). При выраженном снижении массы тела применяют внутривенное питание (растворы аминокислот, концентрированные растворы глюкозы, жировые эмульсии). Больным с выраженной экзокринной недостаточностью поджелудочной железы назначают препараты, содержащие ее ферменты (панкреатин, панзинорм, фестал и т. п.). Важная рольпринадлежит также комплексному лечению других заболеваний внутренних органов — желчнокаменной болезни, язвенной болезни желудка и двенадцатиперстной кишки. При обострении хронического панкреатита лечение проводят по тем же принципам, что и при остром панкреатите. Показаниями к оперативному вмешательству на поджелудочной железе являются вирсунголитиаз, стриктура протока поджелудочной железы и гипертензия в дистальных (по отношению к стриктуре) его отделах, тяжелые болевые формы хронического панкреатита, не поддающиеся комплексному консервативному лечению. Окончательный диагноз устанавливают на операционном столе и тут же выбирают метод хирургического вмешательства. В ходе операции хирург определяет преимущественную локализацию патологического процесса, проходимость желчных путей и протока поджелудочной железы. Для этого проводят пальпацию, интраоперационное ультразвуковое исследование поджелудочной железы и желчных путей, интраоперационную холангиографию. При необходимости выполняют вирсунгографию после предварительной пункции протока поджелудочной железы под контролем ультразвукового исследования. При довольно небольших по протяженности стриктурах терминального отдела протока поджелудочной железы выполняют трансдуоденальную папиллосфинктеротомию с рассечением устья протока и сшиванием его слизистой оболочки со слизистой оболочкой задней стенки общего желчного протока (вирсунгопластика). При протяженных стриктурах проксимальной части протока поджелудочной железы со значительным расширением его просвета дистальнее места препятствия для оттока панкреатического сока выполняют продольную панкреатоеюностомию. При этой операции рассекают в продольном направлении проток поджелудочной железы от ее головки до хвостовой части, после чего формируют анастомоз с изолированной по Ру петлей тощей кишки. У больных с тяжелыми формами болевого хронического панкреатита, не поддающимися длительному консервативному лечению, выполняют резекцию поджелудочной железы или панкреатодуоденальную резекцию.
ПАРАПРОКТИТ
ОпределениеПарапроктит — воспаление жировой клетчатки (расположенной вокруг прямой кишки и заднепроходного отверстия). Парапроктит бывает острый и хронический.
Этиология и патогенез Острый парапроктит чаще всего встречается у новорожденных и детей младшей возрастной группы. Развитию острого парапроктита у новорожденных способствует наличие врожденных параректальных свищей. В ряде случаев развитию острого парапроктита может способствовать опрелость и раздражение кожи промежности. Встречаются острые парапроктиты при общих аллергических состояниях, при экссудативно-катаральном диатезе, при глистных инвазиях. Острый парапроктит может развиться в любом возрасте в результате острой кишечной инфекции (см. Токсикоинфекции). Хронический парапроктит возникает чаще у лиц старшей возрастной группы (пожилого и старческого возраста) как результат хронического воспалительного процесса в толстом кишечнике (см. колит), и в частности в прямой кишке. Встречается при онкологических заболеваниях, особенно колоректальной зоны.
Клиническая картина При остром парапроктите общее состояние ребенка, как правило, не страдает. Местно появляются припухлость, гиперемия, резкая болезненность. При нагноении в центре припухлости определяется флюктуация. При самостоятельном вскрытии появляется свищ с гнойным отделяемым. Рецидивы острого парапроктита указывают на врожденный характер параректального свища. При остальных формах парапроктита клиническая картина соответствует состоянию, находящемуся в основе его развития.
Лечение Лечение острого парапроктита хирургическое: вскрывают абсцесс, стараясь не повредить волокна наружного сфинктера прямой кишки; затем назначают физиотерапию, ванночки с раствором перманганата калия, лечебные клизмы с настоем ромашки, свечи с антибиотиками, иногда проводят курс антибиотикотерапии. При неэффективности консервативной терапии и частом рецидивировании воспалительного процесса выполняют выскабливание свища. Чаще после очередного воспаления параректальные свищи облитерируются и заживают. При упорном рецидивировании производят операцию рассечения или иссечения свища после 1,5—2-летнего возраста. Лечение при остальных формах парапроктита осуществляется параллельно с лечением основного заболевания. Консервативная терапия направлена на уменьшение воспалительного процесса: проводится общая антибактериальная терапия либо с учетом основного возбудителя, либо антибиотиками широкого спектра действия; местно назначаются ванночки с антисептическими растворами, лекарственными растениями, способствующими уменьшению воспалительного процесса, а также микроклизмы и свечи, имеющие противовоспалительный и обезболивающий эффект.
ПАРЕЗЫ И ПАРАЛИЧИ
ОпределениеПарезы (параличи) — полное отсутствие (паралич) или ослабление (парез) двигательных функций с отсутствием или снижением силы мышц в результате различных патологических процессов в нервной системе, вызывающих нарушения структуры и функции двигательного анализатора.
Этиология Парезы и параличи — поражение двигательного центра в коре головного мозга, а также двигательного (пирамидного) пути на всем протяжении полушарий и ствола мозга до соответствующих мотонейронов передних рогов спинного мозга, приводящее к невозможности произвести произвольные движения из-за слабости в конечностях. Параличи проявляются полной утратой активных движений и мышечной силы. Парезы — уменьшением объема активных движений и ослаблением мышечной силы. Параличи и парезы обусловлены поражением центральной и периферической нервной системы. Поэтому различают центральные и периферические параличи и парезы. Бывают параличи (парезы) одной, двух конечностей. В случае ослабления мышечной силы и ограничения объема движений соответственно говорят о монопарезе, парапарезе, гемипарезе и тетрапарезе. Причиной этих поражений могут быть сосудистые болезни головного и спинного мозга (чаще — кровоизлияния в мозг), травмы, опухоли, воспалительные болезни нервной системы, а также способствующие ее перерождению (например, рассеянный склероз).
Клиническая картина Центральный (спастический) паралич Центральный (спастический) паралич или парез обычно распространяется на всю верхнюю или нижнюю конечность или половину тела. При нем отмечается неравномерное повышение мышечного тонуса, разных мышечных групп. В руке, например, тонус сгибателей предплечий превалирует над тонусом разгибателей (поэтому трудно разогнуть руку в локтевом суставе), а в ноге, наоборот, тонус разгибателей голени сильнее (трудно согнуть ногу в коленном суставе). Вследствие этого создается своеобразная поза: рука согнута в локтевом и лучезапястном суставах и приведена к туловищу, а нога разогнута во всех суставах. Характерно нарушение походки: рука приведена к туловищу и согнута в локтевом и лучезапястном суставах, а нога почти не сгибается в колене. Больной описывает ею во время ходьбы полукруг.
Периферический (вялый, атрофический) паралич или парез Периферическому (вялому, атрофическому) параличу или парезу, в отличие от спастического, свойственны понижение тонуса мышц, атрофия мышц, подергивание в них, снижение или исчезновение рефлексов с пораженных конечностей. Вялые парезы и параличи развиваются у больных радикулитами, полиневритами, невритами и невромами некоторых нервов, с последствиями полиомиелита и травм периферических нервов, наследственными болезнями нервной системы и др. Иногда возникают психогенные (истерические) параличи и парезы, при которых признаки поражения нервной системы не выявляются.
Паралич лицевого нерва Паралич лицевого нерва называют также «заячьим глазом» из-за характерных внешних проявлений. При попытке закрыть веки глазная щель остается открытой, в ней видна нижняя часть роговицы. Если веки открыты, глазная щель кажется шире, чем на здоровой стороне, вследствие того что нижнее веко слегка отстает от глаза. В результате нарушается отток слезы, больного беспокоит упорное слезотечение. Остающийся постоянно открытым, даже во сне, глаз подвергается внешним раздражениям. Отчего развивается воспаление слизистой оболочки и роговицы (конъюнктивит, кератит).
Паралич лицевого нерва
Парез мимических мышц Парез мимических мышц возникает после травм или вследствие воспаления уха, тканей челюстно-лицевой области и повреждения лицевого нерва. При этом лицо перекошено в здоровую сторону, лобные складки сглажены, поднимание брови невозможно или ограничено. Глазная щель широко раскрыта, закрывание глаза невозможно или ограничено, поэтому отмечается постоянное слезотечение из него. При улыбке рот перекашивается в здоровую сторону, носогубная складка сглаживается. Жевание на пораженной стороне затруднено, пища застревает между щекой и челюстями. При оказании помощи следует наложить сухой согревающий компресс на околоушно-жевательную область и ухо и побыстрее обратиться к врачу, так как могут наступить стойкие изменения лицевого нерва.
Парезы и параличи у детей Преимущественно проявляются нарушением двигательной функции конечностей, в меньшей степени — мышц глазного яблока, мимических и дыхательных мышц, диафрагмы. Выделяют парез кишечника, мочевого пузыря, голосовых связок и других внутренних органов. Парезы бывают врожденными (реже) и приобретенными. Чаще обнаруживаются врожденные парезы одной руки, обычно вследствие повреждений во время родов плечевого сплетения. Ручка на стороне поражения разогнута во всех суставах, повернута кнутри и свисает вдоль туловища. В ней нет даже незначительных движений или они резко ограничены. Иногда отмечаются врожденные парезы руки и ноги с одной стороны или только ног у детей с врожденными пороками развития головного или спинного мозга, внутричерепными кровоизлияниями во время родов. У некоторых детей с врожденными поражениями головного мозга вначале парезов нет. Они возникают лишь к концу первого или на втором полугодии жизни. Это обусловлено особенностями строения и функционирования головного мозга у новорожденных и грудных детей. Так, например, проявляется детский церебральный паралич — различной выраженности тетрапарезами, монопарезами или гемипарезами.
Парезы и параличи вследствие заболеваний нервной системы Более разнообразны признаки приобретенных парезов и параличей в результате различных заболеваний центральной (головного и спинного мозга) или периферической нервной системы — инсультов, опухолей нервной системы, энцефалитов, наследственных болезней, полиневритов и др. Парез одной конечности или только какого-то ее отдела типичен для больных полиомиелитом, невритами. У больных хроническими или медленно прогрессирующими болезнями нервной системы парезы развиваются медленно, постепенно. Вначале ребенок испытывает неловкость в одной или нескольких конечностях, хуже пользуется ими. Постепенно состояние ребенка ухудшается и возникает паралич. В случаях острых заболеваний нервной системы (например, инсульта, полиомиелита, невритов, полиневритов) парезы или даже параличи развиваются быстро или даже внезапно. Иногда в пораженной конечности (или конечностях) одновременно отмечается боль. Это в основном характерно для поражений периферической нервной системы. Иногда парезы (параличи), быстро (внезапно) начавшись, через минуты, часы или несколько дней полностью исчезают. Подобные явления обнаруживаются после односторонних ограниченных судорог у детей с некоторыми нарушениями обмена веществ (снижением калия в сыворотке крови и др.). При внезапно возникших парезах (параличах) ребенка необходимо уложить в постель и не пытаться «разработать» руку или ногу. К нему нужно срочно вызвать врача или доставить ребенка в ближайшее лечебное учреждение.
Лечение При центральных и периферических параличах и парезах больным необходима специализированная помощь в неврологическом стационаре. При параличе лицевого нерва без консультации с невропатологом в этом случае не обойтись. Наряду с этим желательно использовать дезинфицирующие капли, а также средства, улучшающие обменные процессы в роговице и защищающие ее от воздействия внешней среды — витаминные, белковые капли (их готовят из расчета: одна часть кипяченой воды и две части белка одного куриного яйца). Конечно, надежнее получить такие назначения от окулиста.
ПАРОТИТ
ОпределениеПаротит (эпидпаротит, «свинка») — острое вирусное заболевание, при котором поражаются слюнные железы и другие железистые органы, а также центральная нервная система.Околоушная железа — самая крупная слюнная железа, расположенная большей своей частью сзади нижней челюсти в ретромандибулярной ямке и имеющая сложные топографоанатомические отношения со многими нервами и сосудами. Считают, что существует гематогенный, стоматогенный (через кариозные зубы) и лимфогенный пути распространения инфекции.
Этиология Источник инфекции — больной человек с конца скрытого периода и до 10-го дня болезни. Инфекция передается воздушно-капельным путем. Болеют дети и подростки.
Клиническая картина Болезнь начинается с повышения температуры тела до 38–39 °C и появления болей при открывании рта и жевании твердой пищи. Обычно к концу первых суток увеличиваются околоушные слюнные железы с одной или двух сторон. Потом возникают симптомы поражения околоушных слюнных желез: боли в области уха, сухость во рту. Иногда в последующем в инфекционный процесс вовлекаются и другие слюнные железы, поджелудочная железа, нервная система, у мальчиков в период полового созревания — яички. Нередко изолированно увеличиваются подчелюстные или подъязычные слюнные железы, а также яички. Если к этому присоединяется воспаление поджелудочной железы и нервной системы, относительно часто возникает рвота и повторно повышается температура тела. Общие проявления паротитной инфекции у большинства заболевших усиливаются в первые 3–4 дня болезни, а затем ослабевают и к 9—10-му дню болезни исчезают.
Осложнения В качестве осложнения возможно развитие гнойного паротита, который в ходе инфекционных заболеваний обычно появляется во второй половине болезни. Местные явления выражаются в припухании, уплотнении и болезненном увеличении железы. Кожа над ней становится покрасневшей и отекает. Ввиду напряжения под плотной оболочечной капсулой, даже при наличии гноя флюктуации не бывает. Слизистая оболочка полости рта отекшая и около отверстия канала околоушной железы краснеет. Нередко наблюдается тризм. На 3—4-й день заболевания начинается выделение гнойной воспалительной жидкости из канала. Осложнения выражаются в распространении гнойного процесса на дно полости рта, в истечении гноя в парафарингеальное пространство, откуда опасность угрожает средостению. Возможны тромбозы яремных вен и синусовых сосудов, менингит и кровоизлияния вследствие разрушения сосудов. После излечения катарального и гнойного паротита функция железы полностью восстанавливается. Разрушенная паренхима восстанавливается благодаря разрастанию соединительной ткани.
Лечение В начале заболевания проводится консервативное лечение (антибактериальная терапия, уход за полостью рта, диета и т. д.). Чтобы предупредить тяжелое течение болезни, заболевшему необходимо соблюдать постельный режим в течение 7—10 дней. На это же время он изолируется от окружающих его детей. Кормить его нужно протертой, жидкой молочно-растительной пищей. На область пораженных слюнных желез накладывают согревающие компрессы. Если у больного высокая температура тела — дают жаропонижающие средства. Больные с поражением яичек и нервной системы, а также тяжелые больные подлежат госпитализации в инфекционные больницы вследствие того, что у мальчиков с воспалением яичка может развиться бесплодие, а у детей с поражением нервной системы в последующем снижается работоспособность. При наличии гнойного процесса не следует медлить с операцией. Дети моложе 10 лет, бывшие в контакте с больным, не допускаются в детский коллектив с 11-го по 21-й день после заражения.
Профилактика Вакцина против эпидемического паротита (живая, аттенуированная, штамм Jeryl Lynn) обеспечивает протективный иммунитет более чем у 95 % вакцинированных. Вакцину вводят п/к детям старше 1 года. В грудном возрасте ее применение не рекомендуется из-за возможного присутствия материнских антител. Активную иммунизацию детей обычно начинают в возрасте 15 месяцев, используя вакцину против кори, эпидемического паротита и краснухи. Иммунизация рекомендуется также неиммунным детям старшего возраста, подросткам и взрослым, особенно юношам, которые не болели эпидемическим паротитом. В данном случае можно использовать как вакцину против кори, эпидемического паротита и краснухи, так и вакцину против эпидемического паротита, желательно две дозы. Случайная вакцинация иммунных лиц заметных побочных реакций не вызывает. Вакцинация не рекомендуется беременным и лицам с ослабленным иммунитетом, в том числе принимающим глюкокортикоиды. Однако ВИЧ-инфицированных детей можно спокойно иммунизировать против эпидемического паротита, используя вакцину против кори, эпидемического паротита и краснухи.
ПЕНЕТРАЦИЯ ЯЗВЫ
ОпределениеПенетрация язвы — осложнение язвенной болезни (см.) в виде распространения разрушающего процесса из стенки желудка или двенадцатиперстной кишки в толщу соседнего органа — печени, поджелудочной железы, сальника.Пенетрация является разновидностью прикрытой перфорации. Выделяют три стадии пенетрации язвы: — I стадия — проникновение через все слои стенки желудка или двенадцатиперстной кишки, или пристеночная пенетрация; — II стадия — стадия фиброзного сращения с подлежащим органом (до 30 %); — III стадия — стадия завершения пенетрации и проникновения в соседний орган. Наиболее часто пенетрация язвы происходит в малый сальник, головку поджелудочной железы, печеночно-двенадцатиперстную связку. Возможна пенетрация язвы в печень, желчный пузырь, поперечную ободочную кишку с образованием внутреннего свища и в брыжейку поперечной ободочной кишки.
Клиническая картина и диагностика Появление болей в спине или болей опоясывающего характера наблюдается при пенетрации язвы в поджелудочную железу. Для пенетрирующей язвы тела желудка характерна боль со смещением в левую половину грудной клетки и область сердца. При пенетрации язвы в головку поджелудочной железы, печеночно-двенадцатиперстную связку может развиться обтурационная желтуха (см.). Рентгенологическим признаком пенетрации язвы является наличие глубокой ниши в желудке или двенадцатиперстной кишке, выходящей за пределы органа.
Лечение Консервативное противоязвенное лечение при пенетрирующих язвах неэффективно. Пенетрирующая язва является показанием к хирургическому лечению — ваготомии при язве двенадцатиперстной кишки или удалении части желудка с язвой при язве желудка (или с оставлением ее дна на органе, в который она пенетрировала).
ПЕРЕЛОМЫ
ОпределениеПереломы — повреждения кости с частичным или полным нарушением ее целостности.Переломы бывают закрытые (без повреждения кожи), открытые (с нарушением целостности кожи) и осложненные (кровотечением, размозжением окружающих тканей).
Этиология и патогенез Различают переломы травматические и патологические. Первые обычно возникают в результате внезапного воздействия значительной механической силы на нормальную кость. В отличие от них патологические переломы происходят в измененной каким-либо предшествовавшим патологическим процессом кости при сравнительно незначительной травме или даже спонтанно. Переломы костей всех локализаций чаще встречаются у мужчин, за исключением переломов шейки и вертикальной области бедренной кости. Среди больных с переломами около 55 % приходится на возраст 21–50 лет. Наиболее часто травматические переломы возникают в быту, на производстве, при падении с высоты и при дорожно-транспортных происшествиях. Механизм травмы может быть прямой (непосредственное действие травмирующего агента) и непрямой (в результате действия удара на наиболее слабый участок кости). Часто при травмах прямой механизм сочетается с непрямым. Перелом может быть полным или частичным. После полного перелома отломки кости смещаются, при неполном кость повреждается частично — образуется надлом, трещина. При переломах обе части разъединившейся кости называют отломками, более мелкие фрагменты поврежденной в зоне перелома кости — осколками. Наиболее тяжелые оскольчатые переломы — со смещением осколков. При наличии двух отломков — проксимального и дистального — говорят о простом переломе. При наличии двух и более крупных сегментарных фрагментов — полифокальном переломе. Переломы в двух и более анатомо-функциональных образованиях в одном или нескольких сегментах конечности — множественными. Переломы с одновременным повреждением внутренних органов принято называть сочетанными (перелом таза с мочевым пузырем). В зависимости от плоскости перелома различают: поперечные; продольные; косые; винтообразные; Т-образные; У-образные. Переломы костей с уцелевшей надкостницей, чаще у детей, обозначают как поднадкостничные. По локализации различают переломы: эпифизарные (внутрисуставные); диафизарные; метафизарные (околосуставные). В зависимости от механизма травмы различают: — переломы от сдавления (компрессионные); — от сгибания; — от скручивания; — отрывные переломы. Механизм возникновения переломов лучше всего объясняется на основе положений науки о сопротивлении твердых материалов. Под влиянием внешней силы, не превышающей пределов ее упругости, кость кратковременно деформируется и снова принимает свою первоначальную форму. Если же воздействующая внешняя сила превышает этот предел, целость кости нарушается. Давление на губчатую кость в продольном направлении вызывает ее сплющивание, при этом образуются компрессионные и вколоченные переломы (позвоночник). При действии скручивающей силы возникают винтообразные или спиральные переломы. Дырчатые переломы — огнестрельные ранения. Переломы в зависимости от направления линии перелома к оси кости: поперечные; продольные; винтообразные; косые. Ряд переломов, возникающих при сходном механизме повреждения, имеющих одну и ту же морфологическую картину, называют типичными или классическими (перелом лучевой кости в типичном месте, перелом таза Мальгеня). Патологические переломы возникают самопроизвольно под влиянием незначительной травмы (или даже без всякой травмы) кости, измененной каким-либо предшествовавшим патологическим процессом, чаще всего деструктивным. Они бывают при доброкачественных и злокачественных новообразованиях кости, при остеодистрофии, фиброзной остеодисплазии, при метастазах в кость (рак молочной железы, легких, щитовидной железы). Нередко патологический перелом при метастазах носит множественный характер (позвоночник). Ломкость костей наблюдается при миеломной болезни, паратиреоидной остеодистрофии, на почве спинной сухотки, сирингомиелии, реже они бывают при остеомиелите, туберкулезе и третичном сифилисе. Тщательно собранные данные опроса позволяют заподозрить патологический перелом, возникающий при незначительной травме или нагрузке. Смещение отломков при патологических переломах бывает редко, и оно бывает небольшим.
Клиническая картина и диагностика Общие признаки переломов: боль, припухлость, изменение формы и укорочение конечности, появление патологической подвижности в зоне повреждения, «хруста» отломков. С клинической точки зрения в понятие «перелом» включается не только нарушение целостности кости, но и одновременное повреждение окружающих мягких тканей. Чаще всего имеют место небольшие разрывы мышц и мелких сосудов, в результате которых в зоне переломов образуется гематома. Объем разлившейся крови различен и колеблется в широких пределах. Сместившиеся отломки могут повредить сосуды и нервы, кожу. Различают абсолютные признаки переломов: ненормальная подвижность; костная крепитация; изменение оси конечности; истинное укорочение конечности; нахождение костных отломков в ране. Относительные признаки: локальная болезненность; боль при осевой нагрузке; отек и деформация; нарушение функции; запоздалое появление кровоизлияния. Переломы костей позвоночника и таза характеризуются сильной болью в поврежденной области, исчезает чувствительность, может наступить паралич ног, нарушение мочеиспускания. При переломах ребер во время травмы возникает резкая боль в груди, усиливающаяся при дыхании, движении, кашле. Иногда начинается кровохарканье. Отломки ребра нередко разрывают плевру, ткань легкого, сосуды грудной клетки. В результате в плевральной полости скапливается кровь (гемоторакс) и воздух (пневмоторакс). Вследствие деформации грудной клетки могут развиваться тяжелые нарушения дыхания и кровообращения. В ближайшие дни после травмы нередко развивается пневмония.
Переломы костей лицевого черепа Чаще наблюдаются переломы нижней челюсти. Степень разрушения кости может быть различной: от трещин и надкостничных переломов до раздробления или отрыва значительной части челюсти. Переломы нижней челюсти часто располагаются в «слабых» анатомических зонах: шейке нижней челюсти, области угла, теле челюсти, на уровне клыков и моляров. Переломы тела нижней челюсти в пределах зубного ряда, как правило, бывают открытыми, так как при незначительном смещении отломков происходит разрыв слизистой оболочки, покрывающей альвеолярную часть. Типичными симптомами перелома нижней челюсти являются болезненность в месте перелома, усиливающаяся во время движения челюстью, смещение отломков с нарушением прикуса при попытках двигать нижней челюстью, деформация кости и подвижность отломков при пальпации, слюна с примесью крови. Переломы в области жевательных зубов кроме этих симптомов проявляются нарушением смыкания челюстей, ограничением открывания рта, иногда «онемением» нижней губы или ощущением покалывания, «ползания мурашек» на ней. Диагноз перелома уточняют с помощью рентгенографии. При этом делают снимки всей челюсти в двух проекциях с целью выявления двойного или множественных переломов. Признаки при переломах костей носа: повышенная подвижность костей носа и осязаемый при этом хруст, смещение носа в сторону или западение спинки носа, подкожное кровоизлияние, нередко распространяющееся на веки («очки под глазами»). Вследствие кровоизлияния в перегородку носа или ее искривления затрудняется носовое дыхание. При переломах костей мозгового черепа сломанные кости нередко повреждают головной мозг, он может сдавливаться и в результате кровоизлияния. Признаки: нарушение формы черепа, истечение ликвора и крови из ушей и носа, потеря сознания.
Особенности переломов у детей Переломы у детей имеют свою специфику, обусловленную возрастными анатомофизиологическими особенностями детского организма. Чем меньше возраст ребенка, тем больше выражены эти отличия. Травмы у детей бывают довольно часто, однако в большинстве случаев это ушибы, ссадины, а если возникает перелом, то он носит изолированный характер. Механизм травмы у детей чаще непрямой. У детей плотная и сравнительно толстая надкостница кости содержат большое количество органических соединений. В связи с этим кости ребенка по сравнению с костями взрослых более гибкие. Поэтому нередки поднадкостничные переломы по типу «зеленой ветви», при которых нарушается целость кортикального вещества, а целость надкостницы сохраняется. Открытые переломы у детей сравнительно редки: в 4 раза реже, чем у взрослых. Это связано с тем, что при полных переломах отломки смещаются в пределах неповрежденной надкостницы и не перфорируют кожу. Переломы у детей нередко возникают при падении с деревьев, заборов, во время спортивных занятий. Переломы верхних конечностей наблюдаются значительно чаще, чем нижних, — соответственно 69 и 31 % (у взрослых соотношение обратное). У детей существуют определенные отличия в частоте и локализации переломов. Так, например, чаще всего у детей возникают переломы в области локтевого сустава (над- и чрезмыщелковые переломы), отрывные переломы медицинского надмыщелка, сочетающиеся с вывихом костей предплечья. Довольно часты у детей переломы обеих костей предплечья, в основном поперечные в нижней трети на одном уровне. Весьма распространены изолированные переломы большеберцовой кости. У детей при травме голени, как правило, ломается большеберцовая кость и не ломается, а лишь прогибается в силу своей эластичности малоберцовая кость. Переломы лодыжек у детей и разрывы межберцового синдесмоза наблюдаются крайне редко. Переломы костей кисти встречаются довольно часто, значительно реже ломаются кости стопы. Переломы у новорожденных могут возникать во время родов. Диагностика их не представляет особых трудностей. Чаще ломаются ключица и бедренная кость. Срастаются такие переломы за 7—10 дней, но иногда на всю жизнь остаются угловые деформации. Для диагностики перелома большое значение имеет хорошо собранный анамнез, направленный на выявление условий и механизма травмы с применением рентгенологического метода. Рентгенограмма дает возможность распознать не только переломы со смещением отломков, но и трещины, вколоченные и другие переломы, при которых характерные клинические признаки отсутствуют. Рентгенологический метод позволяет установить характер смещения отломков, является средством наблюдения за развитием костной мозоли, обеспечивает контроль за самим лечением и его анатомическим результатом. Рентгенограммы следует производить не менее чем в двух взаимно перпендикулярных проекциях. На рентгенограммах должны получить отображение не только поврежденные, но и соседние здоровые отделы костей, захватывая оба смежные с переломом сустава.
Патологические переломы Ценную информацию о природе патологического процесса дает рентгенологическое исследование зоны патологического перелома и других отделов костно-суставной системы. Дополнительные лабораторный, клинический, биохимические, изотонические методы позволяют уточнить диагноз. В сомнительных случаях выполняют биопсию. Прогноз при патологических переломах зависит от основного процесса. При патологических переломах в результате метастазов и первичных злокачественных опухолей конечность должна быть иммобилизирована обычным способом.
Осложнения В первые дни после перелома всегда отмечается повышение температуры. Эта описанная впервые Фолькманом реакция возникает вследствие всасывания крови, продуктов саморазрушения, разрушенного костного мозга. Повышение температуры наступает обычно на второй или третий день и продолжается до 3–5 дней. Переломы длинных трубчатых костей представляют собой один из факторов возникновения жировой эмболии. Опасно и такое редкое осложнение перелома, как тромбоз вен конечностей, что может в дальнейшем вызвать тромбэмболию легочной артерии и смерть больного. К числу осложнений, наблюдаемых иногда после переломов, нужно отнести и психические расстройства, которые могут проявляться у больных в различных формах, начиная от простых навязчивых идей и кончая «белой горячкой», характерной для алкоголиков. Предвестником психического расстройства обыкновенно является мучительная бессонница. Следует также помнить о гипостатической пневмонии, которая развивается у пациентов преклонного возраста. При открытых и огнестрельных переломах нередко развивается нагноение, остеомиелит, значительно реже — анаэробная инфекция, столбняк.
Лечение Лечение имеет целью сохранение жизни больного, предупреждение возможных осложнений перелома и восстановление в кратчайший срок анатомической целости кости, функции конечности и трудоспособности больного. Лечение должно начинаться на месте происшествия. Основными задачами первой помощи при открытом переломе являются борьба с шоком, болью, кровотечением, предупреждение вторичного микробного загрязнения раны, иммобилизация поврежденной конечности с помощью транспортных шин. Осколки, смещаясь, нередко повреждают кровеносные сосуды, нервы и внутренние органы, поэтому ни в коем случае не шевелите сломанную ногу или руку. Все надо оставить как есть, но обеспечить костям наибольший покой. У пострадавших с открытыми переломами не пытайтесь вправить в рану торчащие отломки или удалить из раны осколки. Нужно остановить кровотечение, наложить на рану стерильную повязку, чистый носовой платок или полотенце. Затем осторожно, чтобы не усилить боль, следует наложить готовую шину (картонную, деревянную или проволочную) или сделанную из подручных средств — доски, палки, кусков фанеры, веток, зонтика, — и создать покой пострадавшему и конечности. Шину нужно накладывать на одежду, предварительно обложив ее ватой, обмотав бинтом, полотенцем или мягкой материей. После наложения шину необходимо зафиксировать. При переломе крупной трубчатой кости (бедренная или плечевая) шиной надо фиксировать одновременно три сустава, а если повреждены более мелкие кости, достаточно сделать неподвижными выше- и нижележащие суставы. При оказании неотложной помощи при переломах позвоночника укладывать пострадавшего на мягкие носилки нельзя. Можно использовать только щит (широкую доску, фанеру, снятую с петель дверь), покрытый одеялом или пальто. При укладывании на спину поднимать пострадавшего надо очень осторожно, в один прием, чтобы не вызвать смещения отломков и более тяжелых нарушений спинного мозга и органов малого таза. Человека с переломом шейного отдела позвоночника следует оставить на спине с валиком под лопатками, закрепить голову и шею, обложив их по бокам мягкими предметами. Если повреждены кости таза, ноги пострадавшего несколько разводят в стороны («положение лягушки») и под колени подкладывают валик из сложенного одеяла. При переломе бедренной кости для создания покоя поврежденной конечности снаружи, от стопы до подмышечной области, прибинтовываются шины, а по внутренней поверхности — от подошвы до промежности. Сзади конечность фиксируется от стопы до лопатки. Если нет шин, можно прибинтовать поврежденную конечность к вытянутой здоровой. При переломе костей голени шина накладывается по задней поверхности поврежденной ноги, от стопы до ягодицы, и фиксируется бинтом в области коленного и голеностопного суставов. При переломах ребер грудную клетку фиксируют повязкой, пострадавшего обезболивают и в полусидячем положении доставляют в ближайшую больницу. При переломе костей предплечья шина накладывается на руку, согнутую в локтевом суставе, снизу от кончиков пальцев до локтевого сустава. При переломе плечевой кости, согнув поврежденную руку в локтевом суставе и повернув ладонь к груди, накладывают шину от пальцев до противоположного плечевого сустава на спине. Если нет шин, можно прибинтовать поврежденную руку к туловищу или подвесить ее на косынке, на поднятую полу пиджака. При переломе ключицы для создания покоя следует подвесить руку на стороне повреждения на косынку или на поднятую полу пиджака. Для разведения отломков ключицы можно руки связать за спиной, зафиксировать отломки ключицы восьмиобразной повязкой или повязкой Дезо. При лечении больных с переломами нижней челюсти костные фрагменты устанавливают в правильное положение и фиксируют их. Для придания неподвижности, покоя нижней челюсти нужно наложить бинтовую пращевидную повязку, если нет бинта, можно изготовить простейшую пращевидную повязку из большого платка или косынки. Лечебную иммобилизацию при переломах нижней челюсти производят чаще всего путем наложения назубных шин из проволоки или специальных металлических заготовок. Шины накладывают на срок не менее 4–5 недель. Переломы верхней челюсти сопровождаются ее смещением, подвижностью по отношению к черепу, сильными болями, нарушением прикуса, нередко кровотечением из носа, рта и могут сочетаться с ушибом или сотрясением мозга, а в тяжелых случаях — с переломами основания черепа. Вначале западают мягкие ткани в соответствующей области, а через 2–3 ч после травмы в этой области развивается отек. Уплощение соответствующей половины лица вновь обнаруживается через 2–3 недели после того, как исчезает отек. При переломах верхней челюсти фиксацию производят путем подтягивания ее к своду черепа пращевидной или транспортной повязкой, использовав для этого шпатель, линейку или планку. Переломы скуловой дуги распознаются по умеренным болям в области травмы, резкому ограничению открывания рта. Однако пережевывание пищи и смыкание челюсти не сопровождается болями. Пострадавшего нужно доставить в лечебное учреждение, лучше в стоматологическое, в первые сутки после травмы. Для транспортировки пострадавший укладывается горизонтально на бок. На открытый перелом костей носа накладывают сухую чистую пращевидную повязку. Чтобы остановить кровотечение из носа, приподнимают голову, кладут холод на нос. Любой пострадавший, у которого предполагается перелом костей носа, должен посетить отоларинголога в первые часы после травмы. При переломах костей мозгового черепа, чтобы фиксировать шею и голову, на шею накладывают валик — воротник из мягкой ткани. Для перевозки тело пострадавшего кладут на щит, а голову — на мягкую подушку. Выбор метода лечения переломов в стационаре определяется общим состоянием больного. После выведения из шока проводят рентгенологическое исследование. Профилактика раневой инфекции — важнейшая задача лечения открытого перелома. В комплексном лечении основными методами ее являются тщательная первичная хирургическая обработка раны, обездвижение отломков. Все лечебные мероприятия, в том числе вправление отломков, иммобилизация должны обеспечиваться адекватным обезболиванием. Наиболее часто при свежих переломах применяют местное введение 20–40 мл 1–2 %-ного раствора новокаина. Реже используют футлярную, внутрикостную, проводниковую анестезию или наркоз. Основными методами лечения переломов костей являются: скелетное вытяжение; гипсовая повязка; наружный чрескостный компрессионно-дистракционный остеосинтез с помощью различных аппаратов и оперативный остеосинтез: накостный и внутрикостный. Каждый из этих методов имеет свои показания и противопоказания. Они дополняют друг друга и не должны противопоставляться. Скелетное вытяжение чаще всего используют при переломах таза, вертикальных и диафизарных переломах костей голени или бедренной кости. Вытяжение осуществляется на шинах Белера, Шулутко, ЦИТО. Костное сращение у взрослых при сложных переломах таза и переломах бедренной кости наступает в течение 3–4 месяцев. При переломах костей голени скелетное вытяжение часто применяют как первый этап лечения. Спустя 3–6 недель накладывают гипсовую повязку до проксимальной трети бедра. Костное сращение при переломах голени наступает через 2–4 месяца. Скелетное вытяжение применяют также в начале лечения, в качестве подготовительного этапа до операции при переломе шейки бедренной кости и вертельных переломах бедренной кости для репозиции отломков. Преимущество скелетного вытяжения заключается в том, что при этом методе обычно достигается хорошая репозиция отломков и возможность проводить функциональное лечение. Недостатком метода является то, что он не обеспечивает прочного обездвижения отломков после их репозиции до образования первичной мозоли. Гипсовая повязка (глухая и лангетная) как самостоятельный метод лечения переломов применяется часто: почти при всех переломах без смещения отломков также нередко для иммобилизации после одномоментной ручной или аппаратной репозиции. Гипсовую повязку накладывают после первоначального лечения скелетным вытяжением, а также в качестве дополнительной иммобилизации после оперативного лечения перелома. При переломе костей предплечья в типичном месте гипсовую повязку взрослым накладывают на 4–5 недель, при диафрагмальных переломах костей предплечья — на 2–3 месяца и более, при переломах лодыжек — на 6—12 недель, при переломе костей голени на 2–4 месяца. Положительная сторона гипсовой повязки состоит в том, что она хорошо моделируется, плотно и равномерно прилегает к телу, быстро твердеет, легко снимается и может быть применена в любых условиях и при большинстве закрытых и открытых переломов. Для лечения переломов применяется наружный чрескожный компрессионный остеосинтез аппаратами Гудумаури, Волкова, Илизарова. При этом удается репонировать отломки, создать плотный контакт между ними и обеспечить их устойчивую неподвижность. В процессе лечения больной может ходить. Показания к оперативному лечению переломов: открытый перелом; повреждение основных сосудов и нервов; интерпозиция мягких тканей; угроза перфорации кожи и угроза повреждения сосудисто-нервного пучка; двойные переломы; отрывные переломы; безуспешность консервативного сопоставления. Оперативное лечение противопоказано при тяжелом общем состоянии больного, сердечно-сосудистой недостаточности и других тяжелых соматических заболеваниях. Любой гнойный процесс в организме служит противопоказанием к операции. У детей,учитывая их психологические особенности, следует отдавать предпочтение консервативным методам лечения. Показания к открытой репозиции возникают при внутрисуставных переломах. При этом применяют в основном фиксации спицами Киршнера.
ПЕРИКАРДИТ
ОпределениеПерикардит — воспаление висцерального и париетального листков перикарда, проявляющееся фиброзными изменениями при накоплении в полости перикарда жидкости.Различают первичный и вторичный перикардит, возникающий как осложнение патологических процессов в миокарде, легких, плевре, пищеводе и других органах. В зависимости от особенностей клинического течения выделяют острый и хронический перикардит.
Этиология и патогенез Острый перикардит Острые воспаления перикарда наиболее часто бывают туберкулезного происхождения, а также возникают при коллагенозах. В хирургической практике чаще встречаются вторичные перикардиты, которые возникают при тяжелых воспалительных заболеваниях соседних органов или сепсисе. Значительно реже причиной острого перикардита бывает травма. Острые перикардиты можно разделить на сухой (фибринозный) и выпотные — серозный и гнойный. Первичный гнойный перикардит возникает в результате инфицирования перикарда при ранениях (открытые ранения, операции), вторичный — в результате заноса инфекции лимфогенным (плевральная эмпиема, медиастинит, субфренический абсцесс и др.) или гематогенным (грипп, тиф, ангина, рожа, остеомиелит, септикопиемия и др.) путем. Серозно-фибринозный сначала экссудат переходит в гнойный при гнилостной инфекции с газовыми пузырьками. Гнойный экссудат скапливается в основном позади сердечной и поперечной пазух. По мере увеличения экссудата заполняется и боковая часть перикарда. Количество экссудата колеблется между 100 г и 1 л. Гнойный перикардит может возникнуть как осложнение медиастинитов, плевритов, распадающихся опухолей легких и пищевода. Гематогенные перикардиты возникают при остеомиелитах, пневмококковых пневмониях, дифтерии и др.
Хронический перикардит Различают хронический экссудативный (выпотной) и констриктивный (сдавливающий) перикардит.
Хронический экссудативный (выпотной) перикардит Наиболее частой причиной заболевания является ревматизм. Обычно хронический перикардит является исходом острого экссудативного перикардита, реже с самого начала имеет хроническое течение. Хронический выпотной перикардит характеризуется резким утолщением париетального листка перикарда, который претерпевает соединительнотканное перерождение, спаивается с окружающими тканями, становится ригидным и не спадается после повторных удалений экссудата.
Констриктивный (сдавливающий) перикардит Причинами чаще всего являются туберкулез, реже неспецифические инфекционные заболевания; перикардит может также развиваться после перенесенной травмы грудной клетки, которая сопровождалась образованием гемоперикарда. Нередко причина заболевания остается невыясненной. Констриктивный перикардит представляет собой конечную (склеротическую) стадию перенесенных ранее фибринозного, серознофибринозного или гнойного перикардитов. В результате перехода процесса в фазу продуктивного хронического воспаления наступает фибринозное изменение париетального и висцерального листков перикарда. Они утолщаются, срастаются, теряют эластичность и нередко обызвествляются, полость перикарда облитерируется. Листки могут достигать толщины 1,5–2 см и более, образуя толстый соединительнотканный панцирь, который вследствие прогрессирующего сморщивания фиброзной ткани сдавливает сердце («панцирное сердце»). Перикардиальные сращения могут равномерно охватывать все отделы сердца или локализоваться только в области верхушки, предсердно-желудочковой борозды или устья полых вен. Одновременно с внутриперикардиальными сращениями возникают и сращения перикарда с окружающими тканями, что ведет к развитию рубцового медиастиноперикардита. Медиастиноперикардиальные сращения фиксируют перикард к медиастинальной плевре, легким, ребрам, позвоночнику, что значительно затрудняет работу сердца и приводит к еще большему сдавлению его. Интра- и экстраперикардиальные сращения, подвергаясь постоянным рубцовым изменениям, постепенно сдавливают сердце и устья полых вен и препятствуют нормальным сердечным сокращениям. В большей степени при констриктивном перикардите нарушается расслабление сердца в фазу диастолы. Это ведет к затруднению притока крови к правым отделам сердца, повышению венозного давления и появлению симптомов застоя в большом круге кровообращения. В большинстве случаев течение констриктивного перикардита прогрессирующее. Состояние больных постепенно ухудшается и со временем они становятся инвалидами. В миокарде и паренхиматозных органах развиваются вторичные необратимые изменения, и больные погибают от сердечной или печеночной недостаточности.
Клиническая картина Фибринозный («сухой») перикардит Данный перикардит характеризуется отложениями фибрина на висцеральном и париетальном листках перикарда. Заболевание протекает с небольшим и кратковременным повышением температуры тела, болями в области сердца, которые усиливаются при глубоком вдохе; кашлем; умеренной тахикардией и учащенным дыханием. Основным симптомом фибринозного перикардита является шум трения перикарда. Шум имеет грубый характер, синхронен с сердечными сокращениями, усиливается при наклоне больного вперед. В отличие от плевральных шумов он не исчезает при задержке дыхания. На фонокардиограмме шум трения перикарда регистрируют в обеих фазах сердечного цикла. На электрокардиограмме обнаруживают смещение интервала S-Т вверх в I и II стандартных и грудных отведениях, деформацию зубца Т, которые свидетельствуют о нарушениях кровообращения в субэпикардиальных слоях миокарда. Исход заболевания благоприятный, однако острый фибринозный перикардит нередко является начальной стадией других форм заболевания.
Выпотной перикардит К выпотным перикардитам принято относить серозный перикардит и гнойный перикардит. Серозный перикардит наряду с воспалительными изменениями в висцеральном и париетальном листках характеризуется образованием и скоплением в полости перикарда серозного или серозно-фибринозного экссудата. Основными симптомами заболевания являются боли в области сердца и одышка. Боли носят острый, нарастающий по интенсивности характер, иррадиируют в спину и область плеча. Из-за болей больной принимает вынужденное согнутое кпереди положение. В результате сдавления перикардиальным экссудатом пищевода, возвратных и диафрагмальных нервов могут возникать затруднения при глотании, икота, охриплость голоса. При обследовании выявляют умеренную синюшность, выбухание межреберных промежутков в области сердца. Верхушечный толчок ослаблен или не пальпируется. При скоплении в перикарде значительного количества выпота (свыше 300 мл) отмечают расширение абсолютной сердечной тупости. Тоны сердца становятся глухими, шум трения перикарда может сохраняться.
«Панцирное сердце»
При рентгенологическом и ультразвуковом исследованиях выявляют расширение тени сердца, контуры которой приобретают треугольную или шаровидную форму, скопление воспалительной жидкости в полости перикарда, снижение подвижности контуров сердца. На электрокардиограмме по мере накопления экссудата определяют снижение вольтажа комплекса QRS, изменение интервала SТ и деформацию зубца Т. При лабораторных исследованиях находят увеличение количества нейтрофильных лейкоцитов, увеличение СОЭ. Течение острого экссудативного, в том числе серозного, перикардита менее благоприятное, чем фибринозного. При быстром накоплении в полости перикарда большого количества экссудата может развиться тяжелая картина тампонады сердца. Клинически она проявляется нарастающей тахикардией, снижением артериального давления, резким цианозом, набуханием шейных вен, увеличением печени.
Гнойный перикардит Заболевание имеет такие же проявления, как и любой другой экссудативный перикардит. Однако течение гнойного перикардита более тяжелое. Преобладают симптомы интоксикации и выраженные нарушения кровообращения. Высокая температура перемежающегося характера, чувство тяжести и боли в сердечной области, тахикардия, одышка, общая слабость. Чаще всего гнойный перикардит бывает осложнением при другом основном заболевании, которое маскирует его клиническую картину. Увеличение гнойного экссудата вызывает симптомы компрессии с нарушениями сердечной деятельности. Появляются цианоз, застой крови в венах шеи и иногда увеличение печени. Пульс малый, учащенный, артериальное давление падает. Появляются боли в подложечной области, нередко сопровождаемые перитонизмом.
Хронический перикардит Наиболее частыми симптомами заболевания являются одышка, колющие боли в области сердца, приступы сердцебиения. При осмотре больного отмечают небольшой цианоз, умеренный отек лица, шеи, верхних конечностей, набухание шейных вен. Эти симптомы возникают после длительного лежания на спине. В таком положении происходит большее сдавление верхней полой вены. Верхушечный толчок исчезает или ослаблен. Перкуторно определяют значительное расширение области сердечной тупости. Тоны сердца глухие. Пульс у больных обычно учащен. Системное артериальное давление снижено, а венозное повышено. У некоторых больных отмечают увеличение печени, небольшой асцит. При рентгенологическом и ультразвуковом исследованиях выявляют значительное расширение тени сердца, снижение амплитуды сердечных сокращений. На электрокардиограмме видно снижение вольтажа желудочкового комплекса. Течение заболевания ремиттирующее. Периоды ухудшения сменяются периодами относительного благополучия. Увеличение притупления сердца, глухие тоны нарушения ритма, типичная ЭКГ, общие септические явления указывают на гнойный перикардит. Иногда выслушивается перикардиальное трение. При большом количестве экссудата нельзя установить биения сердца. С целью дифференциальной диагностики с другими формами перикардита производят диагностические пункции перикарда. Наиболее целесообразны пункции Ларрея и Марфана. Пункция производится из подложечной области под мечевидным отростком к перикарду.
Констриктивный (сдавливающий) перикардит Больные предъявляют жалобы на чувство сдавления в области сердца, одышку, общую слабость. При осмотре отмечают умеренный цианоз, расширение подкожных вен, увеличение живота (асцит), отеки на ногах. Нередко выявляют втяжение межреберных промежутков во время систолы желудочков, расширение и пульсацию вен шеи, связанные с наличием у больного экстраперикардиальных сращений. Пульс обычно слабого наполнения и напряжения, часто парадоксальный: на вдохе наполнение пульса уменьшается, а на выдохе увеличивается. Это указывает на резкое снижение диастолического наполнения правых отделов сердца. У больных наблюдается мерцательная аритмия. Границы сердца, как правило, не расширены, верхушечный толчок не определяется. Тоны сердца приглушены. Шумов нет. Печень застойная, значительно увеличена. В брюшной полости определяют асцит. Системное артериальное давление снижено. Для констриктивного перикардита характерно стойкое повышение венозного давления, величина которого может достигать 300–400 мм водного столба. В биохимических анализах крови определяют снижение содержания общего белка плазмы крови до 20 г/л. При рентгенологическом исследовании сердце имеет обычные размеры и четкие контуры. Первая дуга по правому контуру сердца увеличена за счет выбухания верхней полой вены. Часто имеются отложения извести в перикарде в виде отдельных островков или сплошной пластины. При ультразвуковой допплерокардиографии и на рентгенокимограмме выявляют снижение амплитуды зубцов сердечных сокращений; в плевральных полостях умеренный выпот. На электрокардиограмме регистрируют значительное снижение вольтажа всех зубцов, отрицательный зубец Т. При ультразвуковом сканировании сердца обнаруживают различную толщину перикардиальных сращений над разными отделами сердца, участки обызвествления в толще миокарда, предсердий и желудочков. Аналогичные результаты получают при компьютерной и магнито-резонансной томографии. Для констриктивного перикардита характерно наличие признаков уменьшения диастолического наполнения сердца: резкое и быстрое снижение внутрисердечного давления в начале диастолы с последующим быстрым его повышением и образованием «плато» на уровне 30–40 мм рт. ст. Дифференциальный диагноз следует проводить с экссудативным перикардитом, пороками сердца, миокардитами и экстракардиальными заболеваниями, сопровождающимися декомпенсацией кровообращения по большому кругу (портальная гипертензия, опухоли средостения).
Лечение Острый перикардит При острых формах заболевания в большинстве случаев проводят консервативное лечение, назначают анальгезирующие и сердечные средства, антибиотики широкого спектра действия, оксигенотерапию, мочегонные средства. По показаниям проводят специфическую и неспецифическую противовоспалительную терапию. При гнойных перикардитах и угрозе тампонады сердца выполняют пункции перикарда с целью эвакуации экссудата и введения антибактериальных препаратов. Обычно пункцию перикарда производят в левом реберно-мечевидном углу. После инфильтрационной анестезии прокалывают кожу и мягкие ткани на глубину 2,0–2,5 см. Иглу продвигают вдоль заднего края грудины на 3–5 см и достигают перикарда. После прокола перикарда поршень шприца слегка вытягивают, контролируя содержимое. При неэффективности повторных пункций производят перикардиотомию: после резекции седьмого реберного хряща широко рассекают париетальный листок перикарда; гной аспирируют, полость перикарда промывают и дренируют. Даже в случаях благоприятного течения гнойного перикардита нередко наблюдается переход в хроническую форму заболевания.
Хронический перикардит Лечение хронического перикардита хирургическое. Операцией выбора является субтотальная перикардэктомия, которую выполняют из продольной стернотомии. Операция заключается в радикальном удалении измененного перикарда. Для этого измененные листки перикарда отделяют от левого желудочка, передней поверхности сердца и правого предсердия. Обязательным является выделение из сращений аорты, легочной артерии и устья полых вен. При выполнении операции следует соблюдать осторожность в связи с возможностью ранения миокарда и венечных артерий. В области сращений с венечными артериями допустимо оставление участков обызвествленного перикарда в виде изолированных островков. Положительный эффект от радикальной перикардэктомии наступает уже в ближайшем послеоперационном периоде. В отдаленные сроки 90 % оперированных больных возвращаются к обычной трудовой деятельности.
ПЕРИТОНИТ
ОпределениеПеритонит — это острое или хроническое воспаление брюшины, сопровождающееся как местными, так и общими симптомами, серьезными нарушениями работы жизненно важных органов и систем.Брюшина — тонкая серозная оболочка, покрывающая изнутри внутреннюю поверхность брюшной стенки (париетальная брюшина) и расположенные в брюшной полости органы (висцеральная брюшина). Общая поверхность брюшины составляет около 2 м2. Полость брюшины у мужчин замкнута, а у женщин сообщается с внешней средой через отверстия маточных труб. В брюшной полости в нормальных условиях находится небольшое количество жидкости, увлажняющей поверхность внутренних органов и облегчающей перистальтику желудка и кишечника. За исключением поджелудочной железы, двенадцатиперстной кишки, слепой кишки, прямой кишки и мочевого пузыря, расположенных отчасти в забрюшинном пространстве, все остальные органы покрыты брюшиной. При этом образуются брюшинные дупликатуры, брыжейка и складки, которые формируют различных размеров и формы карманы. Поперечная ободочная кишка и брыжейка толстой кишки делят брюшную полость на два этажа. В верхнем расположены желудок, печень, желчный пузырь и селезенка, в нижнем — кишечник и тазовые органы. Естественно, они не разграничены герметически, а сообщаются латеральными каналами по протяжению восходящей и нисходящей толстой кишки, по которым жидкость может распространяться в обоих направлениях. Такая структура играет решающую роль в распространении и отграничении гнойно-воспалительной жидкости. Брюшина представляет собой полунепроницаемую активно функционирующую мембрану, через которую в обоих направлениях (в брюшную полость, а из нее в общий кровоток) проникают низкомолекулярные субстанции. Она обеспечивает всасывание из брюшной полости через лимфатические и кровеносные сосуды секретируемой жидкости, воспалительной жидкости, продуктов распада и разрушения белков, омертвевших тканей и бактерий. Экссудативная функция брюшины сводится к выделению жидкости и фибрина. Барьерная функция заключается не только в механической защите органов брюшной полости. Брюшина обеспечивает защиту организма от инфекции. Наиболее активной способностью всасывать жидкость обладает диафрагмальная брюшина, в меньшей степени — тазовая. В результате этой способности диафрагмальной брюшины вместе с разветвленной сетью лимфатических сосудов, связывающих поддиафрагмальную часть брюшинного листка и диафрагмальные отделы плеврального, воспалительный процесс может переходить из верхнего этажа брюшной полости в плевральную полость. В течение суток брюшина может секретировать и резорбировать 5–6 л жидкости. При перитоните развивается отек брюшины, что приводит к накоплению в ее полости до 4 л воспалительной жидкости. Клетки брюшины выполняют важные защитные функции: поглощают и переваривают проникшие бактерии и инородные частицы. Эта функция в основном свойственна большому сальнику, в котором содержится максимальное число иммунологически активных клеток. Париетальная брюшина иннервируется соматическими нервами (ветвями межреберных нервов). Поэтому она чувствительна к любому виду воздействия (механическому, химическому и т. п.), а возникающие при этом боли четко локализованы. Висцеральная брюшина имеет вегетативную иннервацию (парасимпатическую и симпатическую) и не имеет соматической. Поэтому боли, возникающие при ее раздражении, не локализованы и носят разлитой характер. Между чувствительностью органов и кожной поверхности существует особая взаимосвязь в том смысле, что заболевание данного органа брюшной полости приводит к гиперестезии и сосудодвигательным нарушениям в определенных зонах кожи (зоны Захарьина-Геда). Большое диагностическое значение при гнойно-воспалительных процессах в брюшной полости имеет взаимодействие, существующее между раздражением чувствительных нервов париетального листка брюшины и сокращением мышц передней брюшной стенки. Такие висцеромоторные рефлексы являются основой клинической диагностики острых гнойных заболеваний органов брюшной полости. Тазовая брюшина не имеет соматической иннервации. Этим объясняется отсутствие защитного напряжения мышц передней брюшной стенки (висцеромоторного рефлекса) при воспалительных изменениях тазовой брюшины. Брюшина обладает выраженными пластическими свойствами. В ближайшие часы после нанесения механической или химической травмы на поверхности брюшины выпадает фибрин, что приводит к склеиванию соприкасающихся серозных поверхностей и отграничению воспалительного процесса. Брюшина и вырабатываемая ею жидкость обладают и антимикробным действием.
Этиология и патогенез По характеру проникновения микрофлоры в брюшную полость выделяют первичный и вторичный перитонит. При первичном перитоните микрофлора попадает в брюшную полость вместе с кровью, лимфой или через маточные трубы. Первичные перитониты встречаются редко, приблизительно в 1 % всех наблюдений. Вторичный перитонит обусловлен проникновением микрофлоры из воспалительно измененных органов брюшной полости (аппендикс, желчный пузырь и т. п.), при перфорации полых органов, проникающих ранениях живота, в случае несостоятельности швов анастомозов (сообщение между полыми органами, кровеносными сосудами или полостями тела). По фактору возникновения выделяют перитониты, вызванные микрофлорой пищеварительного тракта (кишечная палочка, стафилококки, стрептококки, энтерококки и т. п.), и микрофлорой, не имеющей отношения к пищеварительному тракту (гонококки, микобактерии туберкулеза (см.), пневмококки и т. п.). При перитоните, вызванном микроорганизмами первой группы, из перитонеального экссудата высевают смешанную флору, в то время как при перитоните, вызванном микроорганизмами второй группы, высевают одну культуру. Кроме микробных перитонитов, выделяют асептические (абактериальные), вызванные попаданием в брюшную полость различных неинфекционных агентов, обладающих агрессивным действием на брюшину (кровь, моча, желчь, панкреатический сок). По характеру выпота выделяют серозный, фибринозный, фибринозно-гнойный, гнойный, геморрагический и гнилостный перитониты. В зависимости от распространенности воспалительного процесса по поверхности брюшины выделяют отграниченный и общий перитонит. Отграниченный перитонит (абсцесс (см.)) не имеет тенденции к дальнейшему распространению на другие отделы брюшной полости, от которых он четко отграничен спайками, фибринозными налетами, большим сальником или петлями кишечника. Наиболее часто встречаются аппендикулярные, поддиафрагмальные, подпеченочные и тазовые абсцессы. Диффузный перитонит не имеет четких границ и тенденций к отграничению. Диффузный (разлитой) перитонит, локализованный только в непосредственной близости от источника инфекции и занимающий лишь одну анатомическую область живота, может быть назван местным. Диффузный перитонит, занимающий несколько анатомических областей живота, называется распространенным. Поражение всей брюшины именуют общим перитонитом. По клиническому течению различают острый, подострый и хронический перитонит. Наиболее частой формой является острый перитонит. При формулировке диагноза на первое место ставят основное заболевание (деструктивный аппендицит (см.), холецистит (см.), перфоративная язва (см.) и т. п., а затем его осложнение — перитонит с указанием вышеописанных признаков. В клинической практике наиболее часто наблюдают распространенный гнойный перитонит. Самой частой его причиной является деструктивный аппендицит (см.) (свыше 60 % всех случаев перитонита), далее по частоте следуют деструктивные формы острого холецистита (см.) (10 %), заболевания желудка и двенадцатиперстной кишки (7 %), язва, рак (см.), осложненный перфорацией (7 %), острый панкреатит (см.) (3 %), перфорация дивертикулов (см.) и рака (см.) ободочной кишки, проникающие ранения живота, несостоятельность швов анастомозов после операций на органах брюшной полости. Послеоперационный перитонит встречается часто, протекает тяжело, диагностируется трудно и имеет наиболее неблагоприятный прогноз. Причинами его могут быть: — бактериальное загрязнение во время операции на органах брюшной полости — при вскрытии гнойных очагов или органов с инфицированным содержимым, а также в результате внесения микробной инфекции извне; — недостаточность шва, наложенного на желудочно-кишечный тракт или желчные пути; — попадание инфекции через стенку кишки (непроходимость кишечника (см.), гангрена (см.) кишечной стенки); — гнойные воспаления брюшной стенки (флегмона (см.), абсцесс (см.) раны). Наиболее частой и характерной формой является перитонит в результате несостоятельности швов анастомоза. Так, захватывающий ткани вглубь и густо наложенный шов при анастомозах нарушает питание краев. Наружные швы, когда они идут через просвет кишки, через канал, образованный ниткой, создают условия для инфицирования и недостаточности шва. Наложенные с натяжением швы (например, на культю двенадцатиперстной кишки или ректо-сигмоидальный анастомоз) ненадежны, могут вызвать омертвение или прорезать ткани. Несостоятельности благоприятствуют также гипопротеинемия и инфекция в области шва.
Клиническая картина и диагностика Различают три стадии в развитии перитонита. Стадия I (реактивная) — реакция организма на возникновение очага инфекции в брюшной полости. Она характерна для первых суток от начала развития перитонита. Эта стадия четко выражена при внезапном инфицировании брюшной полости (перфорация полого органа). Попавшие на брюшину микроорганизмы вызывают воспалительную реакцию с типичными признаками: покраснение, повышение проницаемости капилляров, отек, экссудация. Экссудат (воспалительная жидкость) вначале имеет серозный характер, а по мере накопления в нем бактерий и лейкоцитов становится гнойным. Больные жалуются на интенсивную боль в животе постоянного характера, усиливающуюся при перемене положения тела. Локализация боли зависит от локализации первичного очага. Боль связана с массивным раздражением многочисленных нервных окончаний брюшины. Любое изменение положения тела сопровождается растяжением того или иного участка воспалительно измененной брюшины, вызывает раздражение огромного количества рецепторов, что усиливает боль. Для уменьшения болей больные стараются лежать неподвижно с приведенными к животу ногами. Рвота большим количеством застойного желудочного содержимого не приносит облегчения. Она связана с переполнением желудка, что возникает из-за угнетения моторной (двигательной) активности пищеварительного тракта (динамическая непроходимость кишечника). При исследовании определяют учащение сердцебиения до 100–110 уд./мин; при этом артериальное давление может быть нормальным, а при мезентериальном тромбозе (см.) и перфорации полого органа — пониженным. При осмотре отмечают сухость слизистых оболочек, что связано с нарастающим обезвоживанием организма. При исследовании живота выявляют ограничение подвижности брюшной стенки при дыхании, более выраженное в зоне проекции основного воспалительного очага. При простукивании определяют зону болезненности, соответствующую области воспалительно измененной брюшины. При поверхностном прощупывании живота выявляют защитное напряжение мышц передней брюшной стенки, которое соответствует зоне воспалительно измененной париетальной брюшины. Мышечная защита наиболее резко выражена при перфорации полого органа (доскообразный живот). Защитное напряжение может отсутствовать при локализации воспалительного процесса в малом тазу, при поражении задней париетальной брюшины, у недавно рожавших женщин, стариков, лиц, находящихся в алкогольном опьянении. В диагностике перитонита ценным оказывается пальцевое исследование прямой кишки, при котором можно определить нависание ее передней стенки за счет скопления жидкости, болезненность при давлении на стенки прямой кишки. У женщин при исследовании через влагалище можно обнаружить нависание его заднего свода, болезненность при смещении шейки матки. Для выявления признаков воспаления задней париетальной брюшины необходимо определить тонус мышц задней брюшной стенки. Для этого врач помещает ладони в поясничной области больного в положении его на спине и легким давлением сравнивает тонус справа и слева. При глубоком прощупывании передней брюшной стенки можно определить воспалительное образование, опухоль, увеличенный орган и т. д. Характерным симптомом перитонита является симптом Щеткина-Блюмберга, механизм которого связан с висцеромоторным рефлексом — изменением степени растяжения воспалительно измененной париетальной брюшины в момент быстрого прекращения давления на стенку живота. Этот симптом более выражен в зоне проекции основного воспалительного очага. По мере удаления от наиболее измененных отделов брюшины уменьшается и степень его выраженности. Симптом Щеткина-Блюмберга можно определить и при воспалении задней париетальной брюшины. В этом случае методика его определения аналогична таковой при определении тонуса мышц задней брюшной стенки. При прослушивании живота определяют ослабление перистальтики, на поздних стадиях перитонита кишечные шумы не выслушиваются (симптом «гробовой тишины»). В общем анализе крови выявляют увеличение числа лейкоцитов, нейтрофилов, увеличение СОЭ, мочевины, креатинина (в поздней стадии). Рентгеновское исследование является обязательным. При обзорной рентгенографии живота выявляют скопление газа под правым или левым куполом диафрагмы (при перфорации полого органа), ограничение ее подвижности (при локализации патологического очага в верхнем этаже брюшной полости), высокое стояние купола диафрагмы на стороне поражения, «сочувственный» плеврит в виде скопления жидкости в реберно-диафрагмальном синусе. Можно определить паретичную (см. Парезы), раздутую газом кишку, прилежащую к очагу воспаления, а в поздних стадиях — уровни жидкости с газом в петлях кишечника (чаши Клойбера), характерные для паралитической непроходимости кишечника. Лапароскопия показана при неуверенности в диагнозе, когда неинвазивные (не нарушающие целостности брюшной стенки) способы исследования не дали информации. Более простым способом исследования является лапароцентез — прокол брюшной стенки с введением в брюшную полость катетера, через который отсасывают жидкость. По ее характеру (кровь, гной и т. п.) можно сделать заключение о природе изменений в брюшной полости. Ультразвуковое исследование позволяет определить скопление жидкости в том или ином отделе брюшной полости. Стадия II (токсическая) — реакция организма в ответ на поступление в общий кровоток экзотоксинов и эндотоксинов, интерлейкинов, а также продуктов белковой природы, образующихся при распаде клеток и токсичных веществ, накапливаемых в тканях за счет нарушения обмена веществ. Она развивается через 24–72 ч от начала заболевания. Прогрессирующий перитонит приводит к нарушению иммунной защиты организма: снижается поглощающая активность лейкоцитов, увеличивается содержание иммуноглобулинов G и М, повышается связывание комплемента, нарушается функция ретикулоэндотелиальной системы печени и селезенки. Воспаление в зависимости от возбудителя из серозно-фибринозного переходит в гнойное или гнилостное. Состояние больного ухудшается. Интерлейкины вызывают сильную пирогенную (температурную) реакцию организма и способствуют высвобождению кининов (биологически активные полипептиды, образующиеся при различных повреждающих воздействиях), резкому расширению периферических сосудов, снижению периферического сопротивления, что приводит к падению артериального давления. Вследствие этих процессов нарушается микроциркуляция в органах и тканях, развивается ДВС-синдром. Возникает недостаточность многих систем и органов, развивается катаболический (с преобладанием распада над синтезом) тип обмена веществ и т. п. Если механизмы местной, клеточной и гуморальной (иммунной) защиты способны преодолеть способность микрофлоры к заражению и обеспечить отграничение воспалительного процесса, т. е. формирование абсцесса (см.), то при соответствующем лечебном воздействии заболевание может быть излечено. Если местные и общие механизмы защиты не в состоянии локализовать воспалительный процесс, то воспаление прогрессирует и распространяется на другие отделы брюшной полости, при этом развивается диффузный перитонит. Интенсивность болей в животе несколько уменьшается, наблюдаются рвота жидкостью бурого цвета, задержка стула и отхождения газов. На этой стадии развития перитонита выражены общие симптомы, характерные для резкой интоксикации. Пульс учащается свыше 110–120 уд./мин, снижается артериальное давление. Сохраняется высокая температура, нарастает тахипноэ (учащенное дыхание); черты лица заостряются, язык становится сухим как щетка. Живот резко вздут вследствие пареза (см.) кишечника, защитное напряжение мышц несколько ослабевает вследствие истощения висцеромоторных рефлексов, кишечные шумы не выслушиваются. Симптом Щеткина-Блюмберга становится несколько менее выраженным. При специальном исследовании можно определить снижение объема циркулирующей крови, белка, нарушения водно-электролитного баланса и кислотно-основного состояния. Стадия III (терминальная) развивается спустя 72 ч от начала заболевания. В этой стадии перитонита часто развивается септический шок (см.). Местные и общие механизмы защиты организма оказываются неэффективными. Если на первой стадии перитонита за счет этих сил возможна локализация инфекции и даже излечение от перитонита, то в терминальной стадии заболевания такой исход невозможен без хирургического вмешательства и интенсивной терапии. В конечной стадии перитонита развиваются симптомы поражения центральной нервной системы: малоподвижность, иногда сменяющаяся эйфорией и психодвигательным возбуждением, спутанность сознания, бред (см.). Появляются бледность кожного покрова с акроцианозом (синюшностью концевых частей тела), заостряются черты лица, западают глазные яблоки, развиваются резкая тахикардия (см.) и гипотензия (см.). Из-за развития дыхательной недостаточности дыхание становится очень частым, поверхностным. Возникает рвота большим количеством желудочного и кишечного содержимого с каловым запахом, живот резко вздут, перистальтика отсутствует, появляется разлитая болезненность по всему животу. В анализе крови отмечается увеличение числа лейкоцитов, а затем снижение их количества. На ЭКГ выявляются признаки, характерные для токсического повреждения миокарда и электролитных расстройств. При исследовании коагулограммы отмечают признаки диссеминированного внутрисосудистого свертывания крови, которое ведет к нарушению микроциркуляции. Все эти неблагоприятные факторы приводят к декомпенсации функций жизненно важных органов и систем с развитием сердечно-сосудистой, легочной и печеночно-почечной недостаточности.
Послеоперационный перитонит В зависимости от причины послеоперационного перитонита его клинические проявления и течение различны. Обычно симптомы развиваются постепенно, исподволь, но при прорыве вследствие недостаточности шва в свободную брюшную полость они становятся тревожными и напоминают картину прободного распространенного перитонита. Перитонит обычно развивается в интервале между 4-ми и 9-ми послеоперационными сутками. Конечно, это не исключает возможности развития более поздних перитонитов вследствие недостаточности шва. Перитонит, вызванный попаданием инфекции через кишечную стенку при непроходимости кишечника (см.) и гангрене (см.), развивается на 2—4-й день после операции. Диагностировать послеоперационный перитонит трудно. Такое состояние обусловлено различными факторами: предшествующим заболеванием, по поводу которого производилась операция, оперативным вмешательством, травмой, метеоризмом (см.), кишечной атонией и парезом, рвотой, лечением антибиотиками и др. Определить состояние брюшной стенки нелегко. Спонтанная боль и боли при пальпации могут быть вызваны операцией. Пневмоперитонеум (воздух в брюшной полости) в ранние сроки может быть результатом лапаротомии. Необходимо тщательное наблюдение, чтобы можно было уловить начальные симптомы послеоперационного перитонита. Учащение пульса, повышение температуры, икота, рвота, длительный парез кишечника, вздутие живота и пониженное артериальное давление — все это те симптомы, которые как в отдельности, так и особенно в комбинации делают весьма вероятным наличие перитонита. Симптом Щеткина-Блюмберга и мышечная защита брюшной стенки являются убедительными симптомами.
Лечение Распространенный гнойный перитонит является абсолютным показанием к экстренному оперативному вмешательству. Своевременная диагностика ранних форм перитонита и адекватное хирургическое вмешательство определяют успех лечения. Основные принципы лечения перитонита заключаются в раннем проведении операции с удалением очага инфекции или дренированием гнойников; механическом очищении (отсасывание жидкости) брюшной полости; промывании ее антисептическими растворами во время и после операции (перитонеальный лаваж); массивной антибактериальной терапии; ликвидации паралитической непроходимости кишечника (отсасывание желудочного и кишечного содержимого, стимуляция деятельности кишечника); коррекции нарушений водно-электролитного обмена, кислотно-основного состояния, белкового обмена с помощью массивной инфузионной терапии; коррекции и поддержании на оптимальном уровне функционального состояния сердечно-сосудистой системы, легких, печени, почек. В качестве операционного доступа используют срединную лапаротомию. Очаг инфекции в каждом случае устраняют с учетом конкретных условий или дренируют зону катастрофы. Если источником перитонита является орган, который может быть удален (аппендикс, желчный пузырь), а технические условия позволяют это сделать, то его удаляют. В случае перфорации полого органа ушивают перфоративное отверстие или производят операцию на желудке. При послеоперационном перитоните, вызванном несостоятельностью швов ранее наложенного анастомоза и невозможностью наложить швы, выполняют двухэтапные паллиативные (нерадикальные) операции. В этом случае обычно приходится ограничиваться удалением гноя, подведением дренажной трубки к отверстию для отсасывания гнойного или кишечного содержимого, тампонированием данного участка для отграничения очага инфекции от остальных отделов брюшной полости или выведением самого анастомоза (межкишечного) из брюшной полости на кожу передней брюшной стенки. Брюшную полость тщательно осушают электроотсосом и марлевыми салфетками, удаляют рыхлые налеты фибрина, промывают изотоническим раствором хлорида натрия, а затем раствором антисептического вещества. Для декомпрессии кишечника в тонкую кишку через рот проводят длинный двухпросветный зонд с множественными отверстиями. Зонд можно также провести через прямую кишку. С его помощью из просвета кишечника отсасывают жидкость и газы и периодически промывают кишечник. При неэффективности этих действий прибегают к илеостомии. Выполнение энтеростомии или илеостомии при перитоните нежелательно, так как возможно развитие несостоятельности кишечных швов. В корень брыжейки тонкой кишки в конце операции вводят 100–120 мл 0,25 %-ного раствора новокаина для предотвращения пареза кишки. Для дренирования брюшной полости дренажи вводят в полость малого таза (справа и слева), под диафрагму (с обеих сторон) и под печень. Все дренажи выводят через отдельные проколы передней брюшной стенки по передней аксиллярной (подмышечной) линии. Рану передней брюшной стенки зашивают наглухо лишь в том случае, если полость ее дренируется трубкой со множеством отверстий для отсасывания раневого содержимого и постоянного промывания полости раны в подкожной клетчатке растворами антисептиков. При таком способе частота нагноений послеоперационной раны значительно снижается. Если во время операции выявлен распространенный гнойный перитонит и источник инфекции удален, то через дренажные трубки осуществляют перитонеальный лаваж. С его помощью достигается дальнейшее механическое очищение брюшной полости от инфекции. В последние годы для лечения распространенного гнойного перитонита с успехом применяют этапный лаваж (программированное промывание) брюшной полости. При этом после операции края раны лишь сближают швами на специальных прокладках. В зависимости от распространенности перитонита, агрессивности его течения и общего состояния пациента через 24–72 ч проводят повторную ревизию брюшной полости с механическим очищением петель кишок и других органов путем промывания большим объемом антисептических растворов (15–20 л), после чего края раны снова сближают. У больных с запущенными формами гнойного перитонита в среднем требуется проведение 3–5 сеансов этапного лаважа брюшной полости. Антибактериальная терапия включает введение антибиотиков местно (в брюшную полость через дренажи) и внутривенно. Цефалоспорины третьего поколения (например, цефотаксим в дозе 2 г) и метронидазол (по 500 мг каждые 12 ч) подавляют почти все болезнетворные бактерии. Ликвидацию паралитической непроходимости начинают уже на операционном столе (декомпрессия кишечника, введение раствора новокаина в корень брыжейки тонкой кишки). В послеоперационном периоде больному 2–3 раза в день откачивают желудочное содержимое. Если же его количество превышает 1 л, то в желудок через нос вводят тонкий зонд для постоянной декомпрессии верхних отделов пищеварительного тракта. Кроме того, производят стимуляцию кишечника прозерином, применяют соответствующую дезинтоксикационную инфузионную терапию. Во второй и третьей фазах перитонита на первый план выступают симптомы нарушения внутренней среды организма с явлениями декомпенсации водно-электролитного обмена, кислотно-основного состояния белкового обмена с глубоким нарушением функций жизненно важных органов. Поэтому своевременная коррекция нарушений внутренней среды является важнейшим компонентом лечения перитонита. Смертность при распространенном гнойном перитоните составляет в среднем 25–30 %, а при сочетании с недостаточностью нескольких органов — 85–90 %.
ПЕРФОРАЦИЯ ЯЗВЫ
ОпределениеПерфорация язвы — возникновение сквозного дефекта в стенке желудка или кишки с выходом содержимого в свободную брюшную полость.
Этиология и патогенез Различаютперфорацию язвы в свободную брюшную полость и прикрытую перфорацию, когда отверстие прикрывают пленки фибрина, соседний орган (большой сальник, печень), складка слизистой оболочки изнутри или кусочек пищи. Перфорируют чаще язвы передней стенки двенадцатиперстной кишки и препилорической зоны. Язвы передней стенки тела желудка перфорируют в свободную брюшную полость реже, так как разрушение стенки желудка, прикрытой левой долей печени, может завершаться пенетрацией язвы в печень. Перфорация язв, расположенных на большой кривизне желудка, встречается редко. Язвы задней стенки желудка могут перфорировать в сальниковую сумку. Возможна множественная перфорация нескольких одновременно существующих язв. Перфорации подвергаются как острые язвы, так и хронические. Перфорация язвы возникает в период обострения язвенной болезни, но может наступать у людей, не имевших ранее симптомов пептической язвы. Опасность открытой перфорации язвы связана с истечением в брюшную полость содержимого двенадцатиперстной кишки или желудка, которое действует на брюшину как физический и химический раздражитель и может явиться источником инфицирования. Перфорация язвы быстро ведет к развитию перитонита (см.).
Клиническая картина и диагностика Перфорация язвы в свободную брюшную полость В клиническом течении перфорации условно выделяют три периода: первый — период внезапных острых болей; второй — период мнимого благополучия; и третий — период диффузного перитонита (см.). Первый период длится 3–6 ч (в зависимости от величины образовавшегося отверстия и степени наполнения желудка содержимым к моменту перфорации язвы). При перфорации язвы в верхней части живота внезапно возникает чрезвычайно резкая, «кинжальная» боль. Больные характеризуют боль как «удар ножом», «ожог кипятком». Боль может сопровождаться явлениями шока (см.). Первоначально возникнув в верхней части или правом подреберье, боль распространяется на правую половину живота в нижний квадрант (при язве двенадцатиперстной кишки). Затем захватывает весь живот, следуя распространению излившейся жидкости из подпеченочного пространства по правому боковому каналу брюшины в правую подвздошную ямку и другие отделы брюшной полости. При перфорации язв, локализующихся на передней стенке тела желудка, вытекающее из желудка содержимое скапливается под левым куполом диафрагмы и распространяется вниз вдоль нисходящей части толстой кишки. Боль в этих случаях из верхней части живота смещается в левое надплечье, распространяется на левую половину живота, а затем на весь живот. Смещение болей под правую или левую лопатку и в надключичные области возникает в результате раздражения окончаний диафрагмального нерва. Рвота может предшествовать перфорации язвы. Характерен внешний вид больного в первые часы заболевания: лицо бледное, выражает испуг, покрыто холодным потом. Больной принимает вынужденное положение на спине или (чаще) на правом боку с приведенными к резко напряженному животу бедрами. Малейшее движение усиливает боль в животе. Температура тела пониженная или нормальная. Пульс хорошего наполнения, замедлен до 50–60 уд./мин или умеренно учащен (80 уд./мин), артериальное давление снижено. Дыхание грудное, поверхностное, учащенное. Живот втянут, имеет ладьевидную форму из-за резкого напряжения мышц брюшной стенки. У молодых худощавых людей прямые мышцы живота хорошо контурируются в виде продольных валов. Напряжение мышц брюшной стенки носит доскообразный характер. Такого напряжения мышц живота, как бывает при прободении язвы, не возникает ни при каком другом остром заболевании органов брюшной полости. Резкое напряжение мышц брюшной стенки наблюдают у 95–98 % больных с перфорацией язвы. У пациентов с дряблой брюшной стенкой напряжение ее мышц может быть не выражено. Оно может отсутствовать и у лиц, находящихся в состоянии алкогольного опьянения. У тучных людей напряжение мышц брюшной стенки бывает замаскировано обильной подкожной жировой клетчаткой. Прощупывание и простукивание живота резко болезненны. Симптом Щеткина-Блюмберга положительный. Наличие свободного газа в брюшной полости является характерным признаком перфорации органа, содержащего газ. Газ скапливается под диафрагмой (в 75–80 %) или под печенью. Для выявления свободного газа в правом поддиафрагмальном пространстве в положении больного на левом боку производят простукивание по правой средней подмышечной линии. Вместо обычного притупления звука над областью печени выявляют тимпанит (положительный симптом Спижарного). Исчезновение печеночной тупости можно обнаружить и при отсутствии перфорации, когда вследствие вздутия кишечника поперечная ободочная кишка расположена перед печенью. Перистальтические шумы в первый период выслушиваются, однако могут быть ослаблены. Пальцевое исследование прямой кишки и исследование через влагалище могут выявить болезненность тазовой брюшины в случае затекания в малый таз жидкости и экссудата, излившихся в брюшную полость. При рентгенологическом исследовании выявляют ограничение подвижности диафрагмы. При исследовании больного в положении стоя свободный газ определяют под диафрагмой в виде серповидной полоски просветления (у 75–80 % больных). При отсутствии газа в поддиафрагмальном пространстве можно ввести в желудок через зонд немного воздуха или перорально — водорастворимое контрастное вещество. Появление в свободной брюшной полости воздуха или выход контрастного вещества в брюшную полость свидетельствуют о наличии перфорации. Второй период — мнимого благополучия — наступает через 6 ч от начала заболевания. В этот период резко выраженные симптомы сглаживаются, самочувствие больного улучшается, уменьшаются боли в животе. Улучшение состояния больного может ввести в заблуждение как самого больного, так и врача. Однако при анализе клинических данных можно выявить нарастание признаков развивающегося перитонита (см.): учащение пульса, повышение температуры тела, парез (см.) кишечника, увеличение количества лейкоцитов. Больной эйфоричен, лицо его нормальной окраски, дыхание учащено. Температура нормальная или слегка повышена. Пульс умеренно учащен (70–80 уд./мин), артериальное давление нормальное. Язык и слизистые оболочки полости рта сухие. Напряжение мышц брюшной стенки ослабевает, перистальтика вялая. Прощупывание живота болезненно, симптом Щеткина-Блюмберга положительный. Частота выявления свободного газа в брюшной полости возрастает. Определяется свободная жидкость в брюшной полости. Исследования через прямую кишку и влагалище выявляют болезненность тазовой брюшины. В крови отмечается некоторое увеличение числа лейкоцитов. Третий период — период перитонита (см.) — наступает через 12 ч. Состояние больного тяжелое: умеренная боль в животе и многократная рвота. Температура тела понижена или высокая (38–40 °C). Пульс 110/120 уд./мин, слабого наполнения; артериальное давление понижено. Вследствие обезвоживания и интоксикации черты лица заострены, глаза теряют блеск, становятся тусклыми. Кожные покровы сухие, дыхание поверхностное и частое. Язык и слизистые оболочки полости рта сухие. Живот вздут вследствие пареза кишечника, брюшная стенка растянута, напряжена (эластическое напряжение) и болезненна при прощупывании и прослушивании. Симптом Щеткина-Блюмберга резко положителен. Перистальтика отсутствует. Имеется свободная жидкость в брюшной полости. Скопление в малом тазу большого количества экссудата можно обнаружить при пальцевом исследовании прямой кишки (нависание и болезненность передней стенки кишки), при исследовании через влагалище (уплощение и болезненность сводов влагалища). Снижается объем мочевыделения (уменьшение или полное его отсутствие) вследствие обезвоживания, наступающего в результате многократной рвоты, депонирования (скопления) жидкости в кишечнике и в брюшной полости. Данные лабораторных исследований выявляют высокое количество лейкоцитов, повышение показателей гемоглобина и гематокрита (отношение объема форменных элементов крови к объему плазмы) в результате обезвоживания, гиперкалиемию, метаболический ацидоз. При рентгенологическом исследовании обнаруживают высокое стояние диафрагмы и ограничение ее подвижности, свободный газ в брюшной полости, пневматоз тонкой и толстой кишок.
Перфорация язвы задней стенки желудка Содержимое желудка изливается в сальниковую сумку; острая боль в верхней части живота не такая резкая, как при попадании содержимого в свободную брюшную полость. При объективном исследовании больного в верхней части живота можно обнаружить болезненность и напряжение мышц брюшной стенки. Свободную жидкость в брюшной полости не выявляют. Печеночная тупость сохранена. При рентгеновском исследовании или эндоскопии выявляют язву. В сальниковой сумке формируется абсцесс (см.). Когда из сальниковой сумки содержимое вытекает через сальниковое отверстие в свободную брюшную полость, развивается диффузный перитонит. Если у больного с признаками перфорации язвы во время операции язву не находят, хирург должен вскрыть желудочно-ободочную связку, осмотреть заднюю стенку желудка и сальниковую сумку.
Дифдиагностика Перфорацию язвы в ранний период дифференцируют с острыми заболеваниями, при которых возникает острая боль в верхней половине живота. 1. Перфорация опухоли (см.) желудка. Возраст больных обычно старше 50 лет. Симптомы, характерные для опухоли желудка: снижение аппетита, слабость, похудение, предшествующий ахилический гастрит (см.). Клинические проявления перфорации опухоли аналогичны симптомам перфорации язвы. У больного иногда прощупывается опухоль в верхней части живота. Эндоскопия или рентгенологическое исследование выявляют опухоль. 2. Острый холецистит (см.). Чаще наблюдается у тучных женщин. Боль наступает после приема жирной и жареной пищи, локализуется в правом подреберье, смещается под правую лопатку и область правого плеча. Боль постоянная, сопровождается многократной рвотой, не приносящей облегчения. В ходе болезни отмечаются повторные приступы печеночной колики (см.) или острого холецистита с повышением температуры тела, иногда с желтухой (см.). Для приступа острого холецистита с самого начала характерны учащение пульса, высокая температура тела, увеличение числа лейкоцитов. При прощупывании живота обнаруживают напряжение мышц в правом верхнем квадранте живота, которое никогда не достигает такой выраженности, как при перфорации язвы. Иногда можно прощупать увеличенный болезненный желчный пузырь, выявить положительный симптом Ортнера (болезненность при легком поколачивании ребром ладони правой реберной дуги), положительный симптом Георгиевского— Мюсси (френикус-симптом: болезненность при надавливании в правой надключичной области между ножками грудино-ключичнососцевидной мышцы). При УЗИ выявляют камни в желчном пузыре, утолщение его стенок. 3. Печеночная колика (см.). Боль острая, схваткообразного характера в верхней части живота или в правом подреберье, быстро снимается спазмолитическими препаратами. Температура тела нормальная. При обследовании живота признаков острого воспаления не выявляют. 4. Острый панкреатит (см.) начинается с резкой постоянной боли в верхней половине живота, принимающей опоясывающий характер. Возникновению боли предшествует употребление обильной жирной пищи, алкоголя. Нет доскообразного напряжения мышц брюшной стенки, имеется вздутие живота вследствие пареза кишечника. Прощупывание в зоне проекции поджелудочной железы на брюшную стенку болезненно. 5. Острый аппендицит (см.). Дифференцировать перфорацию язвы двенадцатиперстной кишки с острым аппендицитом бывает трудно в тех случаях, когда в момент перфорации язвы боль в верхней половине живота была выражена нерезко, а гастродуоденальное содержимое, затекая по правому боковому каналу в правую подвздошную область, вызывает боль и напряжение мышц брюшной стенки в правом нижнем квадранте живота (см. Острый аппендицит). Следует учесть, что при перфорации язвы наибольшие болезненность и напряжение мышц брюшной стенки возникают в верхней половине живота, где воспалительный процесс начался раньше, чем в правой подвздошной области. Сходство динамики (развития) болевого синдрома при перфоративной язве с клиническими проявлениями острого аппендицита, недооценка обнаруженных симптомов, погрешности в клиническом исследовании больного приводят врача к ошибочному диагнозу острого аппендицита, по поводу которого иногда предпринимается операция. Если червеобразный отросток не изменен или слегка гиперемирован, а в брюшной полости имеется мутный выпот, поступающий из ее верхнего этажа, то во время операции должно возникнуть подозрение на перфорацию язвы. В экссудате при этом могут быть примесь желчи, слизь, остатки пищи. 6. Тромбоз и эмболия сосудов брыжейки. Это осложнение сердечно-сосудистых заболеваний характеризуется внезапным возникновением жестокой боли в животе без определенной локализации. Больной беспокоен, меняет положение. Пульс частый, быстро развивается коллапс (см.). Температура тела понижена. Живот вздутый, мягкий, имеются признаки паралитической непроходимости кишечника (см.). При пальцевом исследовании прямой кишки может быть обнаружена кровь. 7. Расслаивающая аневризма (см.) аорты проявляется внезапной жестокой болью в верхней половине живота. При обследовании в животе выявляют неподвижное болезненное пульсирующее образование, над которым можно выслушать грубый систолический шум. Выражено напряжение мышц брюшной стенки. Пульс частый, артериальное давление снижено. Пульсация подвздошных и бедренных артерий ослаблена. 8. Почечная колика (см.) характеризуется внезапным возникновением острой боли в правой или левой поясничной области со смещением в паховую область, половые органы, сопровождается дизурическими явлениями (расстройствами мочеиспускания). Больной беспокоен, мечется, кричит от боли. Живот несколько вздут и напряжен, печеночная тупость сохранена. В анализах мочи обнаруживают неизмененные эритроциты. При УЗИ почек выявляют камни, изменения в чашечно-лоханочном отделе. 9. Инфаркт миокарда (см.). Гастралгическая форма имеет сходство с клиническими проявлениями перфорации язвы. Характеризуется возникновением острой боли в верхней части живота, смещающейся в область сердца, между лопатками. На ЭКГ обнаруживают свежие очаговые изменения миокарда. 10. Базальная пневмония (см.) и плеврит (см.). Боль в верхней половине живота возникает остро, усиливается при дыхании и кашле (см.). Дыхание поверхностное, при прослушивании можно выявить в нижних отделах грудной клетки шум трения плевры, хрипы. Температура тела повышена (38–40 °C). Пульс частый. Язык влажный. Живот может быть умеренно напряжен в верхней области. Сохранена печеночная тупость, выслушиваются перистальтические шумы. При рентгенологическом исследовании легких подтверждается диагноз пневмонии (см.). 11. Спонтанный пневмоторакс (см.). Осложнение буллезной эмфиземы (см.) легких. Характерно внезапное возникновение острой боли в правой или левой половине грудной клетки с иррадиацией в эпигастральную область. Дыхание над соответствующим легким не выслушивается. При рентгенологическом исследовании обнаруживают воздух в плевральной полости. При гнойном перитоните, развившемся вследствие перфорации язвы, дифференциальную диагностику проводят между перфорацией язвы и всеми острыми заболеваниями органов брюшной полости, которые могут осложниться перитонитом (острый деструктивный холецистит (см.), деструктивный панкреатит (см.), деструктивный аппендицит (см.), непроходимость кишечника (см.), тромбоз (см.) мезентериальных сосудов). Показана срочная срединная лапаротомия для выявления источника перитонита и его лечения (см. Перитонит).
Лечение Перфорация язвы в свободную брюшную полость является абсолютным показанием к экстренной операции. Чем раньше установлен диагноз и проведена операция, тем больше шансов на выздоровление. В догоспитальный период категорически противопоказано введение наркотических препаратов. Их действие может затушевать клинические проявления перфорации и тем самым дезориентировать хирурга. Основной целью оперативного лечения перфоративной язвы является спасение жизни больного. В зависимости от тяжести состояния больного, стадии перитонита (см.), длительности язвенной болезни (см.) и условий для проведения операции применяют ушивание язвы, иссечение язвы с пилоропластикой в сочетании с ваготомией и резекцию желудка. Ушивание перфоративной язвы выполняют при общем перитоните (см.), высокой степени операционного риска (тяжелые сопутствующие заболевания, преклонный возраст больного), перфорации стрессовых и лекарственных язв. Отверстие ушивают в поперечном направлении по отношению к продольной оси желудка или двенадцатиперстной кишки отдельными серозно-мышечными швами, вводя иглу вне зоны инфильтрата. Края язвы по возможности экономно иссекают. Линию швов прикрывают прядью большого сальника, которую фиксируют несколькими швами. Ушивание язв не излечивает от язвенной болезни. В большинстве случаев (до 70 %) наступает рецидив заболевания. Более продолжительные и сложные операции, чем ушивание язв, рекомендуется проводить при достаточной квалификации хирурга, необходимого инструментария и возможности применения интенсивной терапии. Ваготомия с иссечением перфоративной язвы и пилоропластикой показана при локализации язвы на передней стенке луковицы двенадцатиперстной кишки или пилорического отдела желудка при отсутствии большого инфильтрата и резкой деформации выходного отдела желудка. Отверстие ушивается в поперечном направлении. При экстренной операции предпочтение отдают стволовой ваготомии с пилоропластикой: язву экономно иссекают, разрез продлевают на привратник и антральный отдел желудка (длиной до 6–7 см). Затем производят пилоропластику по Гейнеке-Микуличу. Ваготомия с дренирующей желудок операцией является малотравматичным вмешательством, снижающим желудочную секрецию и дающим стойкое излечение в большинстве случаев (90 % и более). Селективную проксимальную ваготомию с ушиванием перфоративной язвы или пилоропластикой допустимо производить в специализированных стационарах, где хирурги хорошо владеют техникой селективной проксимальной ваготомии. Пилороантрумэктомию с ваготомией выполняют при язвах, когда обнаруживают перфорацию язвы двенадцатиперстной кишки, хроническую язву желудка или хроническую язву двенадцатиперстной кишки и перфорацию язвы желудка. Экономная резекция желудка показана в случае прободения хронической язвы желудка при отсутствии перитонита (см.) и операционного риска. Заключительным этапом операции по поводу перфоративной язвы должен быть тщательный туалет брюшной полости: аспирация экссудата и гастродуоденального содержимого, промывание растворами антисептиков (см. Перитонит). При прикрытой перфорации язвы в течение первых двух суток показана срочная операция. Спустя двое суток с момента прикрытия при удовлетворительном состоянии больного и стихании местных воспалительных явлений можно рассчитывать на хорошее отграничение от свободной брюшной полости. При этом от операции целесообразно воздержаться и лечить больного консервативно. Консервативное лечение проводят в крайних случаях, когда нет условий для выполнения операции. При этом проводят постоянное отсасывание желудочного содержимого через зонд, назначают лекарственные препараты, снижающие секрецию желудочного сока, вводят большие дозы антибиотиков широкого спектра действия в течение 7—10 дней, осуществляют коррекцию водно-электролитного баланса, внутривенное питание. Перед удалением зонда больному дают водорастворимое контрастное вещество и рентгенологически определяют наличие или отсутствие затекания его за контуры желудка или двенадцатиперстной кишки.
ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ
ОпределениеПеченочная недостаточность — синдром, характеризующийся нарушением одной или нескольких функций печени вследствие острого или хронического повреждения ее паренхимы.Термин «печеночная недостаточность» является собирательным понятием, включающим в себя не только нарушение одной или нескольких функций печени, но и нарушение функционального состояния других жизненно важных органов, и прежде всего головного мозга.
Этиология и патогенез Наиболее частыми причинами, ведущими к развитию печеночной недостаточности, являются острый и хронический гепатиты, цирроз печени, заболевания, сопровождающиеся развитием механической желтухи (желчнокаменная болезнь, рак головки поджелудочной железы или большого сосочка двенадцатиперстной кишки, внепеченочных желчных путей). Печеночная недостаточность может быть также вызвана тяжелыми заболеваниями сердечно-сосудистой системы и системы мочевыделения, коллагенозами, тяжелой сочетанной травмой, обширными ожогами, отравлениями гепатотоксичными веществами (четыреххлористым углеродом, дихлорэтаном, некоторыми видами инсектицидов). Она наблюдается также при циррозе печени, в терминальной стадии развития общего гнойного перитонита, после операций на «открытом» сердце с применением искусственного кровообращения, при неадекватной перфузии органов и др. Выделяют острую и хроническую печеночную недостаточность. В зависимости от причины различают эндо- и экзогенную формы. В механизме развития печеночной недостаточности важная роль принадлежит не только характеру повреждения гепатоцитов (клеток печени) (дистрофия, некроз), но и поражению головного мозга, что во многом определяет тяжесть течения болезни. Поражение головного мозга связывают с накоплением в крови различных церебротоксических веществ: аммиака, ароматических и серосодержащих аминокислот, пировиноградной, молочной кислот и т. п.
Клиническая картина и диагностика Клинические проявления печеночной недостаточности разнообразны и определяются вызвавшей ее причиной. Они также зависят от того, какие функции печени пострадали более всего (белково-синтетическая, пигментообразования, дезинтоксикационная и т. д.). Симптомами печеночной недостаточности являются: — иктеричность кожных покровов и слизистых оболочек; — сосудистые «звездочки» на коже туловища (при хронической форме недостаточности); — подкожные или подслизистые кровоизлияния; — кровотечения в просвет пищеварительного тракта. В последующем развивается печеночная энцефалопатия, прогрессирует желтуха, присоединяются инфекционные осложнения, возникает гипогликемия, может возникнуть почечная недостаточность, ДВС-синдром, нарушения водно-электролитного баланса. При физикальном исследовании выявляют увеличение или, наоборот, уменьшение размеров печени, болезненность ее при пальпации, асцит, увеличение селезенки. В анализах крови отмечают гипопротеинемию, нарушение соотношения белковых фракций с преобладанием грубодисперсных компонентов (глобулины), повышенное содержание билирубина, снижение уровня фибриногена, протромбина, холестерина. Содержание трансаминаз повышено. Тимоловая проба, как правило, повышена, сулемовая значительно снижена. Довольно рано выявляют нарушения водно-электролитного обмена (снижение уровня калия и натрия в плазме крови). Тяжесть печеночной недостаточности тесно взаимосвязана с интенсивностью желтухи, гипераммониемии. Источниками гипераммониемии являются пищевые белки, кровь, изливающаяся в просвет пищеварительного тракта (чаще при кровотечении из варикозно расширенных вен пищевода). Под влиянием пищеварительных соков и ферментов из белков образуется аммиак. В условиях нарушения дезинтоксикационной функции печени аммиак не подвергается разрушению и попадает в общий кровоток, оказывая токсическое действие на головной мозг. Степень тяжести печеночной недостаточности определяет выраженность нервно-психических расстройств. На ранних стадиях выявляют психическую депрессию или, наоборот, эйфорию, которые часто сменяют друг друга. Позднее происходят изменения неврологического статуса: нарушение координации движений, речи, заторможенность сознания. В финальной стадии болезни развивается коматозное состояние.
Диагностика Диагноз печеночной недостаточности ставят на основании данных анамнеза, клинического обследования, лабораторных анализов, отражающих состояние различных функций печени, а также электроэнцефалографии. При лабораторных исследованиях обнаруживаются значительные отклонения почти всех печеночных проб; повышен уровень билирубина, фибриногена, холестерина; увеличено содержание в крови аминотрансфераз, особенно аланинаминотрансферазы. Со стороны крови определяется анемия, тромбоцитопения, увеличение СОЭ.
Лечение Все лечебные мероприятия начинают с лечения основного заболевания, послужившего причиной ее развития. При обтурационной желтухе показано оперативное лечение, направленное на восстановление оттока желчи и снижение уровня билирубина в крови. В зависимости от уровня препятствия в желчных путях используют наружное отведение желчи (холангиостомию) или наложение внутренних билиодигестивных анастомозов (с тощей или двенадцатиперстной кишками). При отравлении гепатотоксичными ядами проводят массивную инфузионную антитоксическую терапию. Питание должно быть высококалорийным с резким ограничением вводимого в организм белка. При портальном циррозе печени, осложненном кровотечением из варикозно-расширенных вен пищевода, необходимо эвакуировать излившуюся кровь путем отсасывания из желудка, постановки, очистительных клизм. Назначают антибиотики, не всасывающиеся из просвета пищеварительного тракта, для подавления микрофлоры, ведущей к разложению крови и образованию аммиака. Перспективным направлением в лечении печеночной недостаточности можно считать плазмо- и гемосорбцию, плазмафорез, наружное дренирование грудного протока, а при печеночной кислородной недостаточности — гипербарическую оксигенацию (кислородонасыщение). Причины и стадия развития печеночной недостаточности определяют прогноз заболевания. На ранних стадиях при интенсивной терапии удается добиться излечения больных, если причина печеночной недостаточности устранена. У больных с печеночной недостаточностью в финальной стадии с развитием печеночной комы прогноз неблагоприятный.
ПИЕЛОНЕФРИТ
ОпределениеПиелонефрит — неспецифическое инфекционное заболевание почек, поражающее почечную паренхиму, преимущественно интерстициальную ткань, лоханку и чашечки. Пиелонефрит может быть одно- и двусторонним, первичным и вторичным, острым (серозный или гнойный), хроническим или рецидивирующим.
Этиология и патогенез Чаще всего пиелонефрит вызывается кишечной эшерихией, энтерококком, протеем, стафилококками, стрептококками. У всех больных острым пиелонефритом и у 2/3 больных хроническим пиелонефритом микрофлора бывает смешанной. Во время лечения микрофлора и ее чувствительность к антибиотикам меняются, что требует повторных посевов мочи для определения адекватных уроантисептиков. Необходимо помнить о роли нечувствительных к антибиотикам бактерий в возникновении рецидивов пиелонефрита. Развитие пиелонефрита в значительной степени зависит от общего состояния макроорганизма, снижения его иммунобиологической реактивности. Инфекция проникает в почку, лоханку и ее чашечки с кровотоком или лимфотоком, из нижних мочевых путей по стенке мочеточника, по его просвету — при наличии ретроградных рефлюксов (заброса мочи). Важное значение в развитии пиелонефрита имеют стаз мочи, нарушения венозного и лимфатического оттока из почки. Пиелонефриту часто предшествует скрыто протекающий интерстициальный нефрит. Острый пиелонефрит бывает интерстициальным, серозным или гнойным. Апостематозный нефрит и карбункул почки — возможные последующие стадии острого гнойного пиелонефрита. Хронический пиелонефрит может быть следствием неизлеченного острого пиелонефрита (чаще) или первично-хроническим, т. е. может протекать без острых явлений Ретроградная пиелограмма. Хронический пиелонефрит. Начальная стадия с начала заболевания. У большинства больных хронический пиелонефрит возникает в детском возрасте, особенно у девочек. У 1/3 больных при обычном обследовании не удается выявить несомненных признаков пиелонефрита. Нередко лишь периоды необъяснимой лихорадки свидетельствуют об обострении болезни. В последние годы все чаще отмечаются случаи комбинированного заболевания хроническим гломерулонефритом (см.) и пиелонефритом.
Хронический пиелонефрит
Ретроградная пиелограмма. Хронический пиелонефрит. Начальная стадия
Клиническая картина Острый пиелонефрит Заболевание начинается остро. Появляются высокая (до 40 °C) температура, озноб, проливной пот, боль в поясничной области; на стороне пораженной почки — напряжение передней брюшной стенки, резкая болезненность в реберно-позвоночном углу; общее недомогание, жажда, расстройство мочеиспускания. Присоединяющиеся головная боль, тошнота, рвота указывают на быстро нарастающую интоксикацию. Отмечаются нейтрофильный лейкоцитоз, появление гноя, эритроцитов и белка в моче. Иногда при ухудшении состояния больных лейкоцитоз сменяется лейкопенией, что служит плохим прогностическим признаком. Симптом Пастернацкого, как правило, бывает положительным. При двустороннем остром пиелонефрите часто появляются признаки почечной недостаточности. Острый пиелонефрит может осложняться паранефритом, некрозом почечных сосочков.
Хронический пиелонефрит Односторонний хронический пиелонефрит характеризуется тупой постоянной болью в поясничной области на стороне пораженной почки. Явления расстройства мочеиспускания у большинства больных отсутствуют. В период обострения лишь у 20 % больных повышается температура. В осадке мочи определяется преобладание лейкоцитов над другими форменными элементами мочи. Однако по мере сморщивания пиелонефритической почки выраженность мочевого синдрома уменьшается. Относительная плотность мочи сохраняется нормальной.
Нефритически сморщенная почка
Диагностика Острый пиелонефрит Важную роль в диагностике играют указания в анамнезе на недавно перенесенный острый гнойный процесс или наличие хронических заболеваний (подострый септический эндокардит, гинекологические заболевания и др.). Характерно сочетание лихорадки с расстройством мочеиспускания, болью в поясничной области, появлением в моче белка, эритроцитов, гноя (пиурия) и наличием бактерий. Характерно снижение объема выделяемой мочи при ее высокой относительной плотности. Следует помнить, что патологические элементы в моче могут наблюдаться при любом остром гнойном заболевании и что пиурия может иметь внепочечное происхождение (предстательная железа, нижние мочевые пути). На обзорной рентгенограмме обнаруживается увеличение одной из почек в объеме, при экскреторной урографии — резкое ограничение подвижности пораженной почки при дыхании, отсутствие или более позднее появление тени мочевыводящих путей на стороне поражения. Сдавление чашечек и лоханки, ампутация одной или нескольких чашечек указывают на наличие карбункула. Одним из дополнительных методов исследования является пиелограмма.
Хронический пиелонефрит Для диагностики существенное значение имеет обнаружение в моче активных лейкоцитов. При скрытом течении пиелонефрита целесообразно проведение пирогеналового или преднизолонового теста: 30 мг преднизолона, растворенного в 10 мл изотонического раствора хлорида натрия, вводят внутривенно в течение 5 мин; через 1; 2; 3 ч и через сутки после этого мочу собирают для исследования. Преднизолоновый тест положителен, если после введения преднизолона за 1 ч мочой выделяется более 400 тыс. лейкоцитов, значительная часть которых — активные. Обнаружение в моче клеток Штернгеймера-Мальбина свидетельствует только о наличии в мочевой системе воспалительного процесса, но еще не доказывает существования пиелонефрита. Одним из симптомов заболевания у большинства больных является бактериурия, т. е. наличие бактерий в моче. Если их число в 1 мл мочи превышает 100 тыс., то необходимо определить их чувствительность к антибиотикам и химиопрепаратам.
Ретроградная пиелограмма. Поликистозные почки
Восходящая цистограмма. Двусторонний пузырно-мочеточниково-лоханочный рефлюкс. Вторичный гидронефроз и пиелонефрит
Артериограмма пиелонефритической почки. В верхнем и нижнем полюсе почки картина «обгорелого дерева»
Артериальная гипертензия — частый симптом хронического пиелонефрита, особенно двустороннего. Функциональное состояние почек исследуют с помощью хромоцистоскопии, экскреторной урографии, клиренс-методов (например, определение коэффициента очищения эндогенного креатинина каждой почкой в отдельности), радионуклидных методов (ренография с гиппураном, сканирование почек). При хроническом пиелонефрите рано нарушается концентрационная способность почек, тогда как азотовыделительная функция сохраняется на протяжении многих лет. Развивающийся вследствие нарушения функций канальцев ацидоз, а также почечные потеря кальция и фосфатов иногда приводят к вторичному паратиреоидизму с почечной остеодистрофией. При инфузионной урографии вначале определяются снижение концентрационной способности почек, замедленное выделение рентгеноконтрастного вещества, локальные спазмы и деформации чашечек и лоханок. В последующем спастическая фаза сменяется атонией, чашечки и лоханки расширяются. Затем края чашечек принимают грибовидную форму, сами чашечки сближаются. Инфузионная урография бывает информативной только у больных с содержанием мочевины в крови ниже 1 г/л. В диагностически неясных случаях прибегают к биопсии почек. Однако при очаговых поражениях почки при пиелонефрите отрицательные данные биопсии не исключают текущего процесса, так как возможно попадание в биоптат непораженной ткани. С развитием почечной недостаточности появляются бледность и сухость кожных покровов, тошнота и рвота, носовые кровотечения. Больные худеют, нарастает анемия. Из мочи исчезают патологические элементы. Осложнениями пиелонефрита могут быть нефролитиаз, пионефроз, некроз почечных сосочков. Диагноз нередко представляет большие трудности. При дифференциальной диагностике с хроническим гломерулонефритом важное значение имеют характер мочевого синдрома (преобладание лейкоцитурии над гематурией, наличие активных лейкоцитов и клеток Штернгеймера-Мальбина, значительная бактериурия при пиелонефрите), данные экскреторной урографии, радионуклидной ренографии. Нефротический синдром свидетельствует о наличии гломерулонефрита (см.). При артериальной гипертензии следует проводить дифференциальную диагностику между пиелонефритом, гипертонической болезнью (см.) и вазоренальной гипертензией. Характерный анамнез, свойственный пиелонефриту, мочевой синдром, результаты рентгенологического и радионуклидного исследований, выявляемая с помощью хромоцистоскопии асимметрия экскреции красителя в подавляющем большинстве случаев позволяют распознать заболевание. Вопрос о наличии вазоренальной гипертензии решается с помощью внутривенной урографии, радионуклидной ренографии и аортоартериографии.
Лечение Острый пиелонефрит В остром периоде назначают стол № 7а, потребление до 2–2,5 л жидкости в сутки. Затем диету расширяют, увеличивая в ней содержание белков и жиров. При развитии нарушения обмена веществ в сторону повышения кислотности назначают натрия гидрокарбонат внутрь 3–5 г или внутривенно 40–60 мл 3–5 %-ного раствора. Для улучшения местного кровообращения, уменьшения болей назначают тепловые процедуры (согревающие компрессы, грелки, диатермия поясничной области). Если боли не стихают, то применяют спазмолитики (платифиллин, папаверин, экстракт белладонны и др.). Проводится антибактериальная терапия налидиксовой кислотой (невиграмон, неграм), курс лечения которой должен продолжаться не менее 7 дней (по 0,5–1 г 4 раза в день), производными нитрофурана (фурадонин по 0,15 г 3–4 раза в день, курс лечения 5–8 дней), нитроксолином (5-НОК), назначаемым по 0,1–0,2 г 4 раза в день в течение 2–3 недель. Применение этих препаратов должно быть поочередным. Нельзя одновременно назначать налидиксовую кислоту и нитрофурановые производные, так как при этом ослабляется антибактериальный эффект. В течение первых 5–6 дней, особенно при инфекции, чувствительной к антибиотикам, можно применять гексаметилентетрамин (уротропин) внутрь по 0,5–1 г 3–4 раза в день или внутривенно 5—10 мл 40 %-ного раствора ежедневно. Весьма эффективно сочетанное лечение антибиотиками и сульфаниламидами. Подбор антибиотиков осуществляется в зависимости от чувствительности к ним микрофлоры. Назначают препараты группы пенициллина (бензилпенициллин по 1–2 млн ЕД/сут., оксациллин внутрь или внутримышечно по 2–3 г/сут., ампициллин внутрь до 6—10 г/сут., ампициллина натриевую соль внутримышечно или внутривенно не менее 2–3 г/сут. и др.) или вместе со стрептомицином (0,25—0,5 г внутримышечно 2 раза в сутки). Применяют также тетрациклины (тетрациклин внутрь по 0,2–0,3 г 4–6 раз в сутки; его производные (морфоциклин, метациклин и др.), антибиотики-макролиды (олететрин, тетраолеан внутрь по 0,25 г 4–6 раз в сутки), антибиотики-аминогликозиды (канамицин внутримышечно по 0,5 г 2–3 раза в сутки, гентамицин внутримышечно по 0,4 мг/кг 2–3 раза в сутки), антибиотики-цефалоспорины (цефалоридин, цепорин внутримышечно или внутривенно по 1,5–2 г в сутки) и др. Следует помнить о необходимости смены антибиотиков каждые 5–7—10 дней и о применении их в умеренных дозах с осторожностью при функциональной недостаточности почек. Из сульфаниламидных препаратов назначают уросульфан и этазол (по 1 г 6 раз в сутки), сульфаниламиды длительного действия (сульфапиридазин по 1–2 г в первые сутки, затем по 1 г в течение 2 недель; сульфамонометоксин, сульфадиметоксин. У большинства больных уже через несколько дней исчезают изменения в моче, однако антибактериальная терапия должна продолжаться (обычно курс лечения длится 4 недели). При неэффективности консервативной терапии (чаще при апостематозном нефрите и карбункуле почек) показано оперативное вмешательство.
Хронический пиелонефрит Лечение хронического пиелонефрита должно проводиться длительно (годами). Начинать лечение следует с назначения нитрофуранов (фурадонин, фурадантин и др.), налидиксовой кислоты (неграм, невиграмон), 5-НОК, сульфаниламидов (уросульфан, этазол и др.), попеременно чередуя их. Одновременно целесообразно проводить лечение клюквенным экстрактом. При неэффективности этих препаратов, обострениях болезни применяют антибиотики широкого спектра действия. Назначению антибиотика каждый раз должно предшествовать определение чувствительности к нему микрофлоры. Большинству больных достаточны ежемесячные 10-дневные курсы лечения. Однако у части больных при такой терапевтической тактике из мочи продолжает высеваться болезнетворная микрофлора. В таких случаях рекомендуется длительная непрерывная антибиотикотерапия со сменой препаратов каждые 5–7 дней. При развитии почечной недостаточности эффективность антибактериальной терапии снижается (из-за снижения концентрации антибактериальных препаратов в моче). При содержании в сыворотке крови остаточного азота более 0,7 г/л терапевтически действенной концентрации в моче антибактериальных препаратов достичь практически не удается. При отсутствии почечной недостаточности показано курортное лечение в Трускавце, Ессентуках, Железноводске, Саирме, Байрам-Али.
ПИЛОРОДУОДЕНАЛЬНЫЙ СТЕНОЗ
ОпределениеПилородуоденальный стеноз — сужение начального отдела двенадцатиперстной кишки или пилорического отдела желудка, характеризующееся нарушением эвакуации пищи из желудка. Это осложнение развивается у 10–40 % больных язвенной болезнью (см.). Причиной пилородуоденального стеноза чаще являются язвы двенадцатиперстной кишки, реже препилорические язвы и язвы пилорического канала.
Этиология Сужение просвета с формированием непроходимости той или иной степени происходит в результате рубцевания язвы, сдавления двенадцатиперстной кишки воспалительным образованием, закупорки просвета кишки отеком слизистой оболочки, пилороспазма или опухоли (см.) желудка. Причины и степень сужения определяются с помощью гастродуоденоскопии и биопсии. В ответ на затруднение эвакуации (удаления) из желудка мышечная оболочка его увеличивается в размерах. В дальнейшем сократительная способность мышц ослабевает, наступает расширение желудка (гастрэктазия).
Клиническая картина и диагностика В клиническом течении стеноза различают три стадии: I стадия — компенсации, II стадия — субкомпенсации (частичной компенсации) и III стадия — декомпенсации. Стадия компенсации не имеет выраженных клинических признаков. На фоне обычных симптомов язвенной болезни (см.) больные отмечают более продолжительное чувство тяжести и полноты в верхней части живота после приема пищи; изжога и отрыжка кислым возникают чаще, чем при неосложненной язвенной болезни; эпизодически бывает рвотаувеличившимся количеством желудочного содержимого. Рвота приносит облегчение больному. В стадии субкомпенсации у больных усиливается чувство тяжести и полноты в верхней части живота, появляется отрыжка с неприятным запахом тухлых яиц вследствие длительной задержки пищи в желудке. Больных часто беспокоят коликообразные боли, связанные с усиленной перистальтикой желудка, сопровождающиеся урчанием в животе. Почти ежедневно возникает обильная рвота, приносящая облегчение, поэтому нередко больные вызывают ее искусственно. Рвотные массы содержат примесь непереваренной пищи. Для стадии субкомпенсации характерно снижение массы тела. При осмотре живота у худощавых больных видна волнообразная перистальтика желудка, меняющая контуры брюшной стенки. Натощак определяется шум плеска в желудке. В стадии декомпенсации прогрессируют гастростаз и атония желудка. Перерастяжение желудка приводит к истончению его стенки и потере возможности восстановления моторно-эвакуаторной функции. Состояние больного значительно ухудшается. Отмечается многократная рвота. Чувство распирания в верхней части живота становится тягостным, заставляет больных вызывать рвоту искусственно или промывать желудок через зонд. Рвотные массы (несколько литров) содержат зловонные разлагающиеся остатки пищи многодневной давности. Больные с декомпенсированным стенозом обычно истощены, обезвожены, малоподвижны; их беспокоят жажда, уменьшение мочевыделения. Кожа сухая, упругость ее снижена. Язык и слизистые оболочки полости рта сухие. Через брюшную стенку у похудевших больных могут быть видны контуры растянутого желудка. Толчкообразное сотрясение брюшной стенки рукой вызывает шум плеска в желудке. При рентгенологическом исследовании в I стадии выявляют несколько расширенный желудок, усиление его перистальтики, сужение пилородуоденальной зоны. Полная эвакуация контрастной массы из желудка замедлена на срок до 6—12 ч. Во II стадии желудок расширен, натощак содержит жидкость, перистальтика его ослаблена. Пилородуоденальная зона сужена. Через 6—12 ч в желудке выявляют остатки контрастного вещества, которое через 24 ч полностью эвакуируется из желудка. В III стадии желудок резко растянут, натощак в нем определяется большое количество содержимого. Перистальтика резко ослаблена. Эвакуация контрастной массы из желудка задержана более чем на 24 ч. Степень сужения пилородуоденальной зоны определяют при эндоскопическом исследовании: в I стадии отмечается рубцово-язвенная деформация с сужением пилородуоденальной зоны до 1,0–0,5 см; во II стадии желудок растянут, а пилородуоденальная зона сужена до 0,3 см за счет резкой рубцовой деформации, перистальтическая активность снижена; в III стадии желудок бывает огромных размеров, отмечаются атрофия (см.) слизистой оболочки и выраженное сужение пилородуоденальной зоны. У больных с пилородуоденальным стенозом вследствие исключения нормального питания через рот и потери с рвотными массами большого количества желудочного сока наблюдаются обезвоживание, прогрессирующее истощение, нарушение электролитного баланса кислотно-основного состояния. Признаками водно-электролитных нарушений являются головокружения и обмороки (см.) при резком переходе больного из горизонтального в вертикальное положение, частый пульс, снижение артериального давления, склонность к коллапсу (см.), бледность и похолодание кожных покровов, снижение диуреза. Гипокалиемия (концентрация калия ниже 3,5 ммоль/л) клинически проявляется мышечной слабостью. Снижение уровня ионов калия в плазме до 1,5 ммоль/л приводит к параличу (см.) межреберных мышц, возможны паралич диафрагмы, остановка дыхания и сердечной деятельности. При гипокалиемии наблюдаются понижение артериального давления (преимущественно диастолического), нарушение ритма сердечных сокращений, расширение границ сердца, систолический шум на его верхушке. Может произойти остановка сердца в систоле. С гипокалиемией связана динамическая непроходимость кишечника (см.), проявляющаяся метеоризмом (см.). В результате обезвоживания организма снижается почечный кровоток, уменьшаются клубочковая фильтрация и объем мочевыделения, появляется азотемия. В связи с почечной недостаточностью из крови не выводятся кислые продукты обмена веществ. Кислотность крови снижается, гипокалиемический алкалоз переходит в ацидоз. Гипокалиемия сменяется гиперкалиемией. В результате нарушения содержания электролитов в крови изменяется нервно-мышечная возбудимость, в тяжелых случаях развивается желудочная тетания: общие судороги, тризм (тоническое сокращение жевательных мышц), сведение кистей рук («рука акушера» — симптом Труссо), подергивание мышц лица при поколачивании в области ствола лицевого нерва (симптом Хвостека). Гипохлоремический и гипокалиемический алкалоз, сочетающийся с азотемией, при отсутствии правильного лечения может стать несовместимым с жизнью. Пилородуоденальный стеноз язвенного происхождения следует отличать от стенозов, обусловленных опухолями (см.) выходного отдела желудка. Эндоскопическое (включая биопсию) и рентгенологическое исследования позволяют уточнить диагноз. Наличие пилородуоденального субкомпенсированного или декомпенсированного стеноза является абсолютным показанием к операции.
Лечение Больным с признаками обострения язвенной болезни проводят курс консервативного противоязвенного лечения в течение 2–3 недель, в результате которого исчезают отеки и периульцерозный (околоязвенный) инфильтрат, а язва может зарубцеваться. Это снижает риск операции. Больные с компенсированным стенозом могут быть оперированы после короткого (5–7 дней) периода интенсивного противоязвенного лечения. Больные с субкомпенсированным и декомпенсированным стенозом, имеющие выраженные расстройства водноэлектролитного баланса и кислотно-основного состояния, нуждаются в более тщательной комплексной предоперационной подготовке, в которую должны быть включены следующие мероприятия. 1. Нормализация водно-электролитных нарушений (введение растворов декстрана, альбумина, протеина, сбалансированных растворов, содержащих ионы К, Na и С1). Препараты калия можно вводить только после восстановления мочевыделения. Для поддержания водного равновесия больной должен получать изотонический раствор глюкозы по 500 мл каждые 6–8 ч. Об эффективности проводимого лечения судят по общему состоянию больного, показателям кровообращения (пульс, артериальное давление, центральное венозное давление, шоковый индекс, почасовой диурез, объем циркулирующей крови), показателям кислотно-основного состояния, концентрации электролитов плазмы (К, N), гемоглобина, гематокрита (отношение объема форменных элементов крови к объему плазмы), креатинина, мочевины крови. 2. Внутривенное питание, обеспечивающее энергетические потребности организма за счет введения растворов глюкозы, аминокислот, жировой эмульсии и др. 3. Противоязвенное лечение. Предпочтение следует отдавать блокаторам Н2-рецепторов, которые, подавляя секрецию желудочного сока, уменьшают потери электролитов Н, К, Na, Cl. 4. Систематическая декомпрессия желудка (отсасывание желудочного содержимого через зонд). О восстановлении проходимости через стенозированный (суженный) отдел можно судить по скорости эвакуации изотонического раствора натрия хлорида (500–700 мл), введенного в желудок: если через 30 мин в желудке остается больше половины введенного количества, то проходимость еще не восстановлена. Можно также использовать временное пережатие зонда после аспирации содержимого желудка: если при этом за 4 ч в желудке накапливается менее 100 мл сока, то проходимость частично восстановлена. В этом случае можно начать питание через рот. Эти пробы на проходимость позволяют отказаться от повторного рентгенологического контроля. Хирургическое лечение проводят с целью устранения непроходимости стенозированного отдела и излечения язвенной болезни (см.). Могут быть применены операции, обычно используемые при язвенной болезни. При компенсированном стенозе в случае достаточной проходимости пилородуоденальной зоны может быть выполнена селективная проксимальная ваготомия. Если во время операции через эту зону не удается провести толстый желудочный зонд, то ваготомию дополняют пилоропластикой или дуоденопластикой. При субкомпенсированном стенозе, когда сохранена сократительная способность мышц желудка, показана ваготомия с дренирующей желудок операцией. Удаление половины желудка или пилороантрумэктомия со стволовой ваготомией показаны при декомпенсированном стенозе и при язвах II типа, когда наряду с пилородуоденальным стенозом имеется язва желудка. Отдаленные результаты правильного оперативного лечения стенозирующих язв двенадцатиперстной кишки не отличаются от результатов лечения неосложненных язв.
ПНЕВМОНИЯ
ОпределениеПневмония — острое инфекционное заболевание, характеризующееся очаговым поражением респираторных отделов легких с внутриальвеолярной экссудацией, выявляемым при объективном и рентгенологическом обследовании; с выраженными в различной степени лихорадочной реакцией и интоксикацией.Большинство зарубежных пульмонологических школ характеризуют пневмонию как «острое респираторное заболевание с фокальными признаками и рентгенологически установленным затемнением, которое ранее отсутствовало, и нет других известных причин для его появления». В отечественной практической пульмонологии допускается постановка диагноза «пневмония» без характерных рентгенологических изменений («рентгеннегативная пневмония») на основании явных клинических проявлений болезни. Заболеваемость острой пневмонией остается высокой: в группе неспецифических заболеваний легких на ее долю приходится 29,3 % случаев, а в структуре общей заболеваемости она составляет в среднем 0,33 %.
Этиология и патогенез Классификация предусматривает разделение пневмоний. По этиологии (по фактору возникновения): — бактериальные (с указанием возбудителя); — вирусные; — микоплазменные и риккетсиозные; — аллергические; — обусловленные физическими и химическими факторами; — смешанные; — неуточненной этиологии. По патогенезу (по механизму развития): — первичная; — вторичная. По морфологическим признакам: — крупозная (долевая, фибринозная); — очаговая (дольковая, бронхопневмония). По течению: — остротекущая; — затяжная. Клинически значимым является подразделение пневмонии на внебольничную и нозокомиальную (госпитальную, внутрибольничную). Такое деление пневмоний никак не связано с тяжестью их течения. Основным и единственным критерием разграничения является то окружение, в котором развилась пневмония. К настоящему времени известно большое число возбудителей пневмонии: бактерии, вирусы, риккетсии, грибы, микоплазма, легионелла, хламидии, простейшие. Пневмококк остается наиболее частым возбудителем внебольничной пневмонии. Микоплазмы и хламидии часто встречаются у людей молодого и среднего возраста (до 20–30 %), а их роль в возникновении заболевания у пациентов старших возрастных групп менее значительна (1–3 %). Легионелла — редкий возбудитель внебольничной пневмонии, однако легионеллезная пневмония занимает второе место (после пневмококковой) по частоте летальности. Гемофильная палочка чаще вызывает пневмонию у курильщиков, а также на фоне хронического бронхита. Кишечная палочка и клебсиелла пневмонии (реже другие представители семейства энтеробактерий) встречаются, как правило, у пациентов с факторами риска (сахарный диабет, застойная сердечная недостаточность и др.). Вероятность стафилококковой пневмонии (золотистый стафилококк) возрастает у людей пожилого возраста или у людей, переболевших гриппом. Нозокомиальная (внутрибольничная) пневмония — пневмония, развившаяся у пациента не ранее чем через 48 ч от момента госпитализации и не находившаяся в периоде инкубации. В возникновении нозокомиальной пневмонии преобладает грамотрицательная микрофлора семейства энтеробактериацее — псевдомонас аэрогиноза (синегнойная палочка). Выделяют особый тип нозокомиальной пневмонии — вентилятор-ассоциированная пневмония (ВАП), связанный с длительностью пребывания пациента на искусственной вентиляции легких. При так называемой ранней ВАП (развитие в первые 4 дня нахождения на искусственной вентиляции легких) наиболее вероятными возбудителями являются стрептококк, гемофильная палочка и золотистый стафилококк и другие представители нормальной микрофлоры полости рта. Развитие поздней ВАП (более 4 дней нахождения на искусственной вентиляции легких) ассоциируется с синегнойной палочкой, ацинетобактер, представителями семейства энтеробактерий. Микоплазменные и вирусные пневмонии характеризуются преимущественно интерстициальными изменениями, когда отмечаются отек и инфильтративно-пролиферативные изменения в межальвеолярных и межлобулярных перегородках, перибронхиальной и периваскулярной ткани. Эти изменения вряд ли можно отнести к понятию «пневмония», так как они не являются процессом в респираторном отделе легких. Предрасполагающими факторами к развитию пневмонии являются острые и хронические заболевания органов дыхания, сердца (застойная сердечная недостаточность), почек, желудочно-кишечного тракта; различные варианты иммунного дисбаланса, переохлаждение, стрессы, курение, алкоголизм, наркомания, травмы грудной клетки. Кроме вышеназванных, к факторам риска развития пневмонии относят возраст (дети, пожилые люди), контакт с птицами, грызунами, другими животными; профессиональные факторы (частые переезды поездом, пребывание в гостиницах и др.). Фактору возраста принадлежит особая роль вследствие высокой летальности при пневмониях (около 10 % при пневмококковой и 70 % — при пневмониях, вызванных грамнегативной флорой) у пожилых людей. Сопутствующие заболевания, встречающиеся у большинства больных старше 60 лет (например, хронический бронхит, ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет), влияют на тяжесть течения пневмонии и возможности фармакологической коррекции. Наиболее агрессивным фактором риска является длительное курение, сопровождающееся формированием мукоцилиарной недостаточности и колонизацией болезнетворной микрофлоры в воздухоносных путях. По механизму развития выделяют первичную (бронхогенную) и вторичную (метастатическую) пневмонию. При бронхогенном распространении инфекции процесс в легких носит преимущественно односторонний характер с полисегментарным поражением легких, быстрым слиянием очагов инфильтрации, частыми плевральными осложнениями (пневмоторакс, пиопневмоторакс). Процесс носит, как правило, односторонний характер, локализуется вокруг бронхов и отчетливо связан с ними (панбронхит с обширным поражением бронхов, лейкоцитарной инфильтрацией и разрушением стенок). Развитие пневмонии находится в прямой зависимости от состояния макроорганизма (в первую очередь его иммунологической реактивности) и агрессивных свойств микробного возбудителя. С этих позиций крупозная пневмония рассматривается как результат гиперергической реакции, а очаговая — как проявление нормо- или гиперергических реакций макроорганизма на инфекционный агент. Есть и другая точка зрения, согласно которой крупозная пневмония вызывается более патогенными штаммами пневмококков. Микроорганизмы могут попадать в легкие различными путями: бронхогенным (через бронхи), гематогенным и лимфогенным (из крови и лимфы). Гематогенное поступление имеет место при сепсисе и общеинфекционных заболеваниях, а лимфогенное — при ранениях грудной клетки. Но основной путь поступления инфекции — бронхогенный (ингаляционный и аспирационный). Естественно, что при этом велико значение состояния дыхательных путей. Нарушение их ведет к обтурации бронхиального дерева и способствует развитию инфекционного процесса в респираторных отделах. Уменьшению активности защитных факторов системы дыхания способствует курение и вдыхание токсических или раздражающих веществ, нарушение кровообращения при сердечно-сосудистых заболеваниях, хронические истощающие заболевания (алкоголизм, сахарный диабет и др.). Предрасполагающими к развитию острой пневмонии факторами могут быть переохлаждение, физическое и психическое перенапряжение. При крупозной пневмонии возбудители заболевания попадают непосредственно в альвеолы, оказывая на них резкое токсическое действие. В результате местного раздражения развивается серозный воспалительный отек с усиленным размножением микроорганизмов, располагающихся по периферии отека. Процесс распространяется путем расплывания отечной жидкости из пораженных альвеол в соседние межальвеолярные поры Кона. Характерной является быстрота образования выпота, большое содержание в нем фибрина, что значительно затрудняет фагоцитоз (поглощение и переваривание) нейтрофилами и обеспечивает массивность поражения легочной ткани (как минимум — сегмент, нередко — целая доля легкого). Для крупозной пневмонии характерно малое поражение бронхов, которые остаются проходимыми. При очаговой пневмонии в зоне воспаления под действием микробного экзотоксина происходит быстрое образование очага некроза и ограничение участка воспаления от окружающей ткани. В большинстве случаев начальный воспалительный процесс развивается в бронхах. Очаги имеют небольшие размеры, занимая ацинус или дольку, но иногда сливаются, образуя более крупные очаги, и могут захватывать целую долю. Острая пневмония нередко бывает самостоятельным заболеванием — первичная пневмония, но еще чаще как осложнение других патологических процессов (заболевания сердечно-сосудистой системы, опухоли, инфекционные болезни, травмы, бронхолегочные болезни, хронический бронхит, бронхиальная астма и др.) — вторичная пневмония. Пневмония рассматривается как затяжная, если нормализация клинических и рентгенологических показателей затягивается более чем на 4 недели. Причины затяжного течения пневмонии различны. Наиболее частые из них: — несвоевременно начатое и (или) неадекватное лечение, что может быть обусловлено поздним обращением больного за медицинской помощью, неверной диагностикой, непереносимостью лекарственных препаратов, ранним прекращением антибактериальной терапии, недостаточным использованием всего арсенала лечебных мероприятий (в том числе методов немедикаментозного лечения); — наличие хронических заболеваний органов дыхания (особенно обструктивных); — хронические заболевания других органов и систем; — различные хронические интоксикации (в том числе производственные).
Клиническая картина Острая пневмония Клиническая картина острой пневмонии складывается из общих симптомов, не зависящих от причинной структуры болезни, и клинических проявлений, определяемых характером возбудителя. Общие клинические проявления выражаются рядом синдромов: — интоксикационных: слабость, повышенная утомляемость, головные и мышечные боли, снижение аппетита и др.; — воспалительных изменений: повышение температуры с чувством жара или ознобами, кашель с мокротой, признаки инфильтративных изменений в легких (перкуторные (при простукивании), аускультативные (при прослушивании), рентгенологические, лабораторные); — вовлечения других органов и систем (сердечно-сосудистой, нервной, почек и др.). Основными клиническими проявлениями пневмонии являются кашель с мокротой, боль в грудной клетке, одышка и лихорадка; у пожилых больных возможны расстройства сознания, бред. При перкуссии (простукивании) легких выявляются локальная болезненность и укорочение звука. Прослушивание позволяет выслушать крепитацию, сухие и влажные хрипы, а также изменение характера дыхания (ослабленное, везикулярное, бронхиальное). Рентгенологическое исследование определяет инфильтративные изменения в легочной ткани. Клинические варианты острой пневмонии во многом определяются видом возбудителя.
Крупозная пневмония Крупозная пневмония — «классическая форма» острой пневмонии. Она характеризуется поражением доли или даже целого легкого с обязательным вовлечением в процесс плевры (плевропневмония). Вызывается пневмококками I, II, III типов, значительно реже — палочкой Фридлендера, капсульной формой кишечной палочки. Заболевание начинается остро (больной может указать час начала болезни) с потрясающего озноба, повышения температуры до 39–40 °C. Почти одновременно с этим появляется боль в грудной клетке, связанная с дыханием, а потом и с кашлем. Кашель присоединяется позднее (в течение дня), сначала сухой или с трудно отделяемой вязкой мокротой, у части больных (1 из 5–7 больных) мокрота может принимать характер «ржавой». Длительность отделения такой мокроты обычно не превышает 4–6 дней.
Крупозная пневмония верхней доли легкого; серое опеченение
При осмотре состояние тяжелое: одышка в покое, лихорадочный румянец щек, более выраженный на стороне поражения, синюшность носогубного треугольника, герпетические высыпания на губах и крыльях носа. Отмечается отставание при дыхании пораженной стороны, иногда больные принимают вынужденное положение на больном боку с приподнятым головным концом. Отставание в дыхании на стороне поражения связано с вовлечением в процесс плевры. Уже с первого дня заболевания при перкуссии отмечается укорочение перкуторного звука над областью поражения (в первые часы может быть, наоборот, тимпанит), переходящее позднее в тупой звук. Тимпанический оттенок звука обусловлен уменьшением эластичности легочной ткани, снижением тонуса альвеол, при отеке межальвеолярных пространств. При заполнении альвеол экссудатом и уплотнении легочной ткани перкуторный звук становится тупым, происходит усиление голосового дрожания. Аускультативная картина в легких также зависит от характера морфологических изменений в легких: в стадии прилива сначала отмечается ослабление дыхания и может выслушиваться начальная крепитация, при плевральной реакции — шум трения плевры. В стадии гепатизации (уплотнения легких за счет выраженной экссудации в альвеолы) выслушивается бронхиальное дыхание и звонкие влажные хрипы разного калибра. При разрешении процесса и рассасывании экссудата появляется вторичная крепитация, дыхание становится жестким, ослабленным, затем — везикулярным. Для рентгенологической картины крупозной пневмонии характерно однородное гомогенное затемнение легочной ткани с четким контуром, ограниченным долей или сегментом, отмечается расширение тени корня легкого на стороне поражения. Разрешение процесса занимает 2–3 недели. Фебрильная лихорадка при крупозной пневмонии возникает с первых часов заболевания и носит чаще характер продолжающейся; продолжительность лихорадочного периода составляет в среднем 3–6 дней. Крупозная пневмония чаще всего возникает в правом легком, поражение обоих легких наблюдается сравнительно редко. Для современного течения крупозной пневмонии малохарактерен долевой процесс, чаще поражается 1–3 сегмента, наряду с высокой температурой нередки случаи с незначительно повышенной температурой.
Очаговая пневмония Заболеванию часто предшествует острая вирусная инфекция верхних дыхательных путей. Воспалительный процесс в большинстве случаев начинается в бронхах с последующим переходом на альвеолярную ткань. Поэтому ранними симптомами очаговой пневмонии являются повышение температуры, иногда с ознобами, и кашель. Кашель может быть сначала сухой, а через 1–2 дня со слизисто-гнойной мокротой. Начало заболевания бывает острым, но чаще постепенным, с появлением катаральных изменений верхних дыхательных путей, кашля, слабости, одышки, затем нерезких болевых ощущений в груди. Лихорадка при очаговых пневмониях обычно неправильного типа, продолжительностью от 3–5 до 10 дней и более. Снижение температуры, как правило, постепенное, нередко с длительным периодом субфебрилитета по вечерам. Объективные признаки зависят от распространения и глубины расположения воспалительных изменений в легких. У большинства больных отмечаются укорочение перкуторного звука над зоной поражения, усиление голосового дрожания или бронхофонии. Некоторые авторы ранним симптомом очаговой пневмонии считают укорочение перкуторного звука над корнем легкого на стороне поражения, что связано с воспалительной инфильтрацией корня. При аускультации выслушивается жесткое дыхание, иногда — ослабление дыхания, влажные мелко- и среднепузырчатые хрипы на ограниченном участке, часто в сочетании с сухими хрипами. В пользу пневмонии могут свидетельствовать только сухие хрипы, если они выслушиваются на ограниченном участке. Рентгенологическая картина очаговой пневмонии отличается пестротой изменений в легких — участки инфильтрации чередуются с участками неизмененной легочной ткани или участками компенсаторного вздутия легочной ткани. Могут быть одиночные, чаще крупные, очаги, а также мелкие множественные или сливные фокусы инфильтрации. В зонах инфильтрации имеется изменение межуточной перибронхиальной и периваскулярной ткани в виде тяжистых и ячеистых изменений с нечеткими контурами. Корни легких расширены, инфильтрированы с небольшим увеличением лимфатических узлов. Очаговая пневмония развивается чаще в нижних долях, больше справа, с преимущественным поражением базальных сегментов. Нередко имеет место двусторонняя локализация процесса. Клинические проявления очаговой пневмонии во многом определяются видом возбудителя. Пневмококковая пневмония характеризуется острым началом с высокой температурой (39–40 °C), выраженной интоксикацией, значительным увеличением нейтрофильных лейкоцитозов в крови, тяжелым течением. Препараты пенициллинового ряда в течение 1–2 дней у большинства больных вызывают снижение температуры и интоксикации. Клебсиелла-пневмония вызывается грамотрицательными капсульными бактериями. Заболевание чаще развивается у ослабленных больных, алкоголиков и у стариков. По течению оно может быть острым и затяжным («ползучим» — с медленным развитием процесса). Типичная остротекущая пневмония начинается с озноба, но температура редко доходит до 39 °C, отмечаются резкая общая слабость, выраженная одышка, адинамия. Кашель упорный, болезненный, с трудноотделяемой, очень вязкой, часто кровянистой (или содержит прожилки крови) мокротой, нередко имеющей запах пригорелого мяса. Почти всегда имеется плевральная боль, плеврит фибринозный или экссудативный. В мокроте содержится большое количество капсульных палочек. Процесс часто локализуется в верхней доле или носит подострый характер. Воспалительные инфильтраты сливаются и быстро образуют обширное поле поражения с картиной опеченения, как при крупозной пневмонии. Рентгенологически тень пораженной доли обозначена резко, объем ее увеличен; уже в первый день болезни возможны распад и расплавление легочной ткани с образованием полостей или тонкостенных кист. Формирование острого абсцесса часто заканчивается в первые 3–4 дня болезни. Простукивание чаще выявляет притупление, соответствующее долевому поражению. При прослушивании определяется бронхиальное дыхание и небольшое количество хрипов, так как бронхи и альвеолы заполнены вязкой слизью. Возможно снижение артериального давления, кровоизлияния на коже и слизистых, нередко имеют место расстройства пищеварения, иктеричность склер. При исследовании крови отмечается чаще лейкопения с моноцитозом и сдвигом лейкоцитарной формулы влево; лейкоцитоз появляется в большинстве случаев при гнойных осложнениях. Даже при правильном лечении течение клебсиелла-пневмонии отличается длительностью и частотой осложнений. Стафилококковая пневмония. Заболевание характеризуется высокой наклонностью пневмонического фокуса к абсцедированию и образованию полостей. Летальность при стафилококковой пневмонии у взрослых достигает 37 %. Наиболее часто стафилококковая пневмония возникает на фоне или после перенесенного гриппа. Метастатическая (вторичная) стафилококковая пневмония развивается при гематогенном заносе (с кровотоком) инфекции из гнойного очага (абсцесс, эндометрит и др.). В начале заболевания в легких определяются субплеврально расположенные множественные инфильтраты, которые в дальнейшем распадаются с образованием различной величины полостей и булл, при этом не бывает большого количества мокроты. Поражение, как правило, двустороннее. Клинико-рентгенологически выделяют следующие формы стафилококковой пневмонии: стафилококковый инфильтрат легкого, стафилококковая деструкция (разрушение) легкого (легочная форма — абсцедирующая и буллезная и легочно-плевральная). Для стафилококковой пневмонии характерно острое начало с высокой температурой, нередко с ознобами, кашлем (сухим или со слизисто-гнойной мокротой), болями в грудной клетке. Иногда наблюдается тифоподобное начало с высокой температурой (до 41 °C), выраженными симптомами интоксикации, менингеальными симптомами, спутанным сознанием. Тяжесть течения стафилококковой пневмонии не всегда соответствует размерам поражения легкого. При инфильтративной форме процесс локализуется в одном, реже двух сегментах, рентгенологически выявляются очаговые инфильтративные изменения в легких, иногда сливного характера. Легочная абсцедирующая форма стафилококковой деструкции характеризуется образованием одиночных или множественных гнойников в легком. Заболевание протекает тяжело, с выраженной интоксикацией, дыхательной недостаточностью, лихорадкой с гектическими размахами, выделением гнойной мокроты до 200–300 мл в сутки. В крови — очень высокое количество лейкоцитов, резкое увеличение СОЭ. Рентгенологически на фоне инфильтрации выявляются множественные полости, нередко с уровнем жидкости. Это, как правило, тонкостенные полости с быстро изменяющейся формой и размерами — буллы. Образование булл объясняется засасыванием воздуха в альвеолы при воспалении терминальных бронхиол и задержкой его на выдохе вследствие образования клапанного механизма. Восстановление проходимости бронхиол ведет к спадению булл, а длительное нарушение проходимости может вести к развитию воспаления с истинным абсцедированием. Выделение легочно-плевральной формы связано с наличием почти у каждого третьего больного стафилококковой пневмонией плевральных осложнений. Течение стафилококковых пневмоний различное — молниеносное, острое и затяжное. Молниеносные формы проявляются инфекционно-токсическим (септическим) шоком с бурно нарастающей интоксикацией, сердечно-сосудистой и дыхательной недостаточностью. Смерть наступает в течение 3–5 дней. У большинства больных имеет место острое течение, продолжительностью до 2 месяцев. Затяжное течение характеризуется вялой динамикой на протяжении 2–4 месяцев, но заканчивается при правильном лечении выздоровлением. Хроническое течение стафилококковой пневмонии завершается формированием хронического абсцесса или эмпиемы плевры. Особенно часто такой исход имеет место при нижнедолевой локализации воспаления и при нарушении дренажной функции бронхов, что особенно характерно для хронического обструктивного бронхита. Стрептококковая пневмония также встречается в основном в период эпидемических вспышек респираторных заболеваний, может развиваться как осложнение хронических неспецифических заболеваний легких. Заболевание начинается обычно остро с озноба, иногда — серии ознобов, повышения температуры, кашля, вначале сухого, затем с мокротой, в мокроте могут быть прожилки крови. Отмечаются одышка, симптомы интоксикации, синюшность. В 50–70 % случаев бывает плеврит и нередко развивается эмпиема плевры. При стрептококковой инфекции в очагах поражения рано развивается некроз легочной ткани, поэтому рано появляется гнойная мокрота, может сформироваться абсцесс легкого. Рентгенологически отмечаются множественные воспалительные фокусы средних и крупных размеров, чаще в обоих легких, склонные к слиянию и распаду с образованием тонкостенных полостей (как при стафилококковой деструкции). В крови — гиперлейкоцитоз, сдвиг влево до миелоцитов. Коли-пневмония вызывается грамотрицательной палочкой из группы энтеробактерий. Заболевание развивается у больных диабетом, алкоголиков, при онкологических заболеваниях, нарушениях кровообращения, при почечной недостаточности, у больных, ослабленных другими инфекционными заболеваниями. Пневмония чаще начинается постепенно, локализуется преимущественно в нижних долях. Иногда болезнь развивается остро, даже молниеносно, и ее первым симптомом может быть коллапс. На рентгенограммах определяются сливные очаги инфильтрации, иногда — полости абсцесса. Причиной болезни могут быть особые капсульные формы, обладающие более высокой способностью к заражению. Клиника и течение острой пневмонии при этом напоминает классические формы крупозной пневмонии, вызванной пневмококками, однако чаще поражаются оба легких. Вирусные пневмонии как самостоятельные заболевания встречаются редко и могут констатироваться только в первые 1–3 дня болезни, в более поздние сроки воспаление легочной ткани бывает связано с присоединением бактериальной инфекции и должно рассматриваться как вирусно-бактериальное. Для самостоятельного вирусного поражения аппарата дыхания характерны интерстициальные изменения, вирусно-бактериальные пневмонии протекают в виде очагового воспалительного процесса. Клиническая симптоматика вирусно-бактериальных пневмоний складывается из картины вирусной инфекции и проявлений бактериальной пневмонии. Гриппозные пневмонии характеризуются преобладанием признаков токсикоза: высокая температура, сильная головная боль, боль в глазных яблоках, ломота во всем теле, общая разбитость, слабость, головокружение, тошнота, рвота, нарушение сознания и даже бред. С 1-го дня болезни имеются признаки поражения верхних дыхательных путей: заложенность носа, насморк, сухой приступообразный, порой мучительный кашель, боль в грудной клетке. Поражение легких часто носит геморрагический характер, что связано с токсическим действием вирусной инфекции на сосуды легкого. Присоединение бактериальной инфекции вызывает ухудшение состояния больного: очень характерно появление второй волны лихорадки, появляются отчетливые клинические признаки пневмонии, развивается тахипноэ (учащенное дыхание), признаки бронхиальной обструкции, нарастает дыхательная недостаточность. Как особая форма гриппозной пневмонии выделяется геморрагическая пневмония, заканчивающаяся смертью больных на 2–3 сутки болезни. С первого дня болезни появляется серозно-геморрагическая мокрота, отмечается высокая температура, быстро нарастают одышка и синюшность. Одышка у большинства больных не соответствует размерам поражения легких. Это связано с распространенным бронхитом (даже бронхиолитом) и выраженными нарушениями диффузионной способности альвеолярно-капиллярной мембраны в результате ее геморрагического отека. Рентгенологически на фоне усиления, деформации, сетчатости легочного рисунка выявляются очаговая, сегментарная или долевая неравномерная инфильтрация легочной ткани. Парагриппозная пневмония вначале протекает как острое респираторное заболевание. Для парагриппа характерна незначительная интоксикация, повышенная температура. С присоединением пневмонии температура повышается до 38–39 °C, нарастают проявления интоксикации. При парагриппе очень характерно вовлечение в процесс гортани; ларингит может оказаться ведущим симптомом поражения верхних дыхательных путей. Респираторно-синцитиально-вирусная инфекция у взрослых часто осложняется пневмонией. С присоединением пневмонии отмечаются явные признаки бронхита с нарушением бронхиальной проходимости, происходит повышение температуры до фебрильной, усиление симптомов интоксикации. Для аденовирусной инфекции характерна картина ринофарингита, конъюнктивита, часто наблюдается генерализованная лимфаденопатия, может быть мелкопятнистая краснухоподобная сыпь. Температура обычно повышенная, интоксикация умеренная. Присоединение пневмонии сопровождается повышением температуры и усилением симптомов интоксикации. Орнитозные пневмонии характеризуются острым началом, высокой лихорадкой (39–40 °C), выраженными симптомами интоксикации, отсутствием поражения верхних дыхательных путей. Признаки поражения легких появляются на 2—5-й день от начала болезни. Типично несоответствие между высокой лихорадкой, отчетливым токсикозом и слабовыраженными изменениями в легких. К концу первой недели у большинства больных увеличиваются печень и селезенка. В период выздоровления возможны рецидивы болезни (через 7—12 дней нормальной температуры), позднее миокардиты. Заболевание протекает с лейкопенией и значительным повышением СОЭ. Для диагностики заболевания имеет значение выявление контакта с птицами. Рентгенологически определяются интерстициальные изменения, расширение корней легких, мелкие очаги (2–3 мм) и облаковидные фокусы инфильтрации в средних и нижних легочных полях. Микоплазменная пневмония вызывается особым возбудителем, имеющим свойства бактерий и вирусов, нередко обозначается как первично атипичная пневмония. Она характеризуется головными болями, мышечными болями, слабостью, повторными познабливаниями при повышенной температуре, умеренными явлениями ринофарингита. При рентгенологическом исследовании — интерстициальные изменения и неоднородные негомогенные инфильтраты в легких без четких границ. К «атипичным пневмониям» сегодня относят заболевания, вызванные внутриклеточными микроорганизмами (микоплазма, легионелла, хламидии, риккетсии). Эти возбудители не выявляются при обычном бактериологическом исследовании мокроты и нечувствительны к широко применяемым для эмпирической терапии пневмонии антибиотикам: пенициллинам, цефалоспоринам и аминогликозидам. Атипичную пневмонию, не имеющую каких-либо специфических симптомов, следует предположить в случае неэффективности терапии пенициллинами, цефалоспоринами и (или) аминогликозидами в течение 2–3 суток от начала лечения (сохраняется лихорадка, ухудшается состояние больного). Вероятность подобной патологии резко возрастает у лиц, прибывших из заграничных поездок в жаркие страны, находившихся в контакте с животными, птицами или общавшихся с больными атипичной пневмонией. Определение атипичных возбудителей возможно только в специализированных лабораториях, проводящих серотипирование, причем лишь на относительно поздних сроках болезни, что представляет ценность прежде всего с эпидемиологической точки зрения. Постоянно возрастающая частота атипичных вариантов течения требует детального изучения опорных диагностических признаков пневмоний в зависимости от причины возникновения. Так, эпидемиологические данные свидетельствуют о распространенности микоплазменной пневмонии в детском, юношеском, молодом возрасте. Эпидемические вспышки регистрируются в «замкнутых» коллективах и носят сезонный характер (осень — зима). Атипичная пневмония может дебютировать поражением верхних дыхательных путей (фарингит, трахеит), часто сопровождается конъюнктивитом, лимфаденопатией. Изредка определяется кожная сыпь папулезно-везикулярного характера. Наблюдается тенденция к гипотензии; характерны звучные мелкопузырчатые влажные хрипы, а также увеличение печени и селезенки. Рентгенологическое исследование документирует наличие негомогенной инфильтрации, преимущественно нижних долей легких, разрешение которой происходит очень медленно (свыше месяца, даже при условии адекватной терапии). Повышение уровня лейкоцитов обнаруживается не всегда; более постоянно ускорение СОЭ. Характерны динамический рост титра холодовых гемагглютининов, положительная проба Кумбса, признаки гемолиза. Риск возникновения легионеллезной пневмонии наиболее высок у лиц, занятых строительством, земляными работами, длительное время работающих в кондиционируемых помещениях или использующих увлажнители воздуха. Встречаются эпидемические вспышки с резким подъемом температуры тела. Начало заболевания острое, сопровождается одышкой, сухим кашлем, плевральными болями, синюшностью, преходящей диареей, нарушением сознания, болями в мышцах и суставах. При обследовании регистрируются брадикардия (урежение частоты сердечных сокращений), влажные хрипы, шум трения плевры; свидетельством токсического поражения почек являются появление в моче белка, небольшого количества клеток крови. Долевая инфильтрация на рентгенограмме сохраняется в течение длительного времени после ликвидации клинических признаков воспаления. Для гемограммы характерны относительная или абсолютная лимфопения на фоне умеренного лейкоцитоза со сдвигом влево, значительное ускорение СОЭ — до 50 мм/ч. Частыми осложненими легионеллезной пневмонии являются деструкция паренхимы, парапневмонический экссудативный плеврит, иногда — спонтанный пневмоторакс. Хламидии поражают лиц, имевших профессиональный или бытовой контакт с домашней птицей; эпидемические вспышки носят семейный характер или связаны с профессиональной деятельностью. Острый дебют заболевания и выраженность интоксикационного синдрома не соответствуют скромным акустическим находкам и объему поражения респираторной системы, определяемому при рентгенологическом исследовании. Характерна брадикардия. Рентгенологически определяется очаговая или очагово-сливная инфильтрация легочной ткани. В общем анализе крови обнаруживаются лейкопения, палочкоядерный сдвиг, резкое ускорение СОЭ.
Диагностика Очень важна ранняя диагностика, так как именно она обеспечивает своевременность начала лечения, позволяет избежать осложнений. В основеправильной диагностики лежит хорошо собранный и правильно проанализированный анамнез. Диагностика не представляет затруднений при остром начале болезни, сопровождающемся лихорадкой, признаками интоксикации, соответствующей клинической картиной: кашлем, болями в грудной клетке, связанными с дыханием и кашлем, наличием слизисто-гнойной мокроты, отчетливыми рентгенологическими изменениями в легких — инфильтрацией легочной ткани. При простукивании выявляется разной степени укорочение звука (вплоть до бедренной тупости) над зоной воспаления легочной ткани. При прослушивании может определяться ослабление дыхания или, наоборот, бронхиальное дыхание (при крупозной пневмонии), выслушиваются на ограниченном участке сухие и влажные, как правило, звучные хрипы, а при поражении плевры и шум трения плевры. В этой же зоне выявляются усиление голосового дрожания, или бронхофонии. При исследовании периферической крови в большинстве случаев наблюдается увеличение количества нейтрофильных лейкоцитов. В лейкоцитарной формуле возможен сдвиг влево до юных лейкоцитов и даже миелоцитов, при тяжелом течении наблюдается токсическая зернистость цитоплазмы нейтрофилов, лимфопения и эозинопения. При пневмонии происходят изменения в белковом составе крови: увеличивается содержание и гамма-глобулинов, повышается содержание С-реактивного белка и сиаловых кислот, особенно в разгар заболевания (первые 2–4 дня болезни). Важное место в диагностике острой пневмонии принадлежит исследованию мокроты. Бактериоскопия мазка мокроты (окрашенного по Граму) позволяет в большинстве случаев сразу поставить этиологический диагноз. Микроскопическое исследование мокроты определяет ее характер (слизистая, гнойная, кровянистая), наличие микробной флоры и ее вид (в частности, выявить микобактерии туберкулеза при окраске по Циль-Нильсену), атипические клетки, эластические волокна и другие примеси. Исследование чувствительности микробной флоры к антибиотикам дает возможность не только установить причину болезни, но и выбрать наиболее эффективный антимикробный препарат. Следует помнить, что диагностически значимой является концентрация бактерий 106 микробных тел в 1 мл мокроты, т. е. необходимо не только качественное, но и количественное бактериологическое исследование мокроты. Сложнее вопросы диагностики решаются при слабой выраженности, смазанности клинических симптомов, атипичном течении заболевания. Необходимо указать, что у 1/3 больных отсутствуют рентгенологические признаки воспаления легочной ткани, и диагностика основывается на данных анамнеза и клинической картины заболевания. У лиц пожилого и старческого возраста острая пневмония возникает в 2 раза чаще, чем в возрасте до 40 лет. Протекает у них пневмония вяло, с мало выраженной симптоматикой. Основными проявлениями болезни у стариков являются нарастающая и выраженная слабость, одышка, потливость. Как правило, отсутствует лихорадка (или наблюдается незначительное повышение температуры), часто нарушается сознание (дезориентация, иногда глубокая прострация), нередко отмечаются тошнота и рвота. У стариков скудна рентгенологическая картина (чаще изменение интерстициальной ткани, слабо выраженные из-за эмфиземы очаги инфильтрации). В патологический процесс очень часто вовлекаются почки, появляются белок, цилиндры и небольшое количество крови в моче. У стариков отмечается медленное обратное развитие воспалительных изменений в легких (до 4–5 недель). Причинами такого течения заболевания являются нарушения дренажной функции бронхов, развитие ателектазов при закупорке мелких бронхов, снижение активности фагоцитоза, уменьшение синтеза секреторных иммуноглобулинов, нередкое наличие недостаточности кровообращения и гиповитаминоза у лиц старших возрастных групп. Представляется целесообразным привести показания к госпитализации при внебольничных пневмониях Американской торакальной ассоциации: — возраст более 65 лет; — наличие одного из сопутствующих заболеваний; — хронические обструктивные заболевания легких, включая бронхоэктазы, фиброзы легких; — сахарный диабет; — хроническая почечная недостаточность; — хроническая сердечная недостаточность; — хронические заболевания печени различного происхождения; — предшествующая госпитализация до возникновения пневмонии с частотой не менее чем одна в году; — подозрение на проникновение в легкие содержимого желудка; — нарушения в психическом статусе; — состояние после удаления селезенки; — хроническое употребление алкоголя. Имеют значение некоторые физические (частота дыхания — больше 30 в минуту; систолическое артериальное давление — меньше 90 мм рт. ст., диастолическое — меньше 60 мм рт. ст.; температура тела больше 38,8 °C; внелегочная патология — септические артриты, менингиты и др.; спутанность сознания) и лабораторные данные (количество лейкоцитов меньше 4 г/л, или больше 30 г/л, или нейтрофилов — меньше 1 г/л; гематокрит — меньше 30 % или гемоглобин — меньше 90 г/л; креатинин — больше 1,2 мг/дл или мочевая кислота — больше 20 мг/дл (7 ммоль/л); сепсис, метаболический ацидоз, тромбоцитопения.
Дифдиагностика Многие заболевания легких могут иметь сходную с пневмонией симптоматику. Так, при инфильтративно-пневмонической форме туберкулеза имеется большое сходство клинико-рентгенологической симптоматики с пневмонией. Однако в первом случае больные предъявляют меньше жалоб, нередко не чувствуют себя больными, а изменения в легких являются случайной находкой рентгенологов. Туберкулезный инфильтрат имеет более четкие контуры, округлую или овальную форму; нередко виден симптом «дорожки», идущей к корню легкого, наличие плотных кальцинатов. Туберкулезные изменения локализуются по преимуществу во втором или шестом сегментах, а пневмония определяется в базальных сегментах и в прикорневой зоне. Пневмония диагностируется нередко и у больного раком легкого, тем более, что очень часто развивается так называемая параканкрозная пневмония, признаки которой уменьшаются, а иногда и исчезают под воздействием антибактериальной терапии. Следует всегда помнить о возможности рака легкого у лиц старше 50-летнего возраста, особенно у длительно курящих, при затяжном течении пневмонии, а также при кровохарканье. Следует иметь в виду, что под маской острой пневмонии могут скрываться обострения ряда хронических бронхолегочных процессов: бронхоэктазов, хронического абсцесса, кист легкого. Под маской острой пневмонии могут протекать заболевания, вызывающие сдавление бронхов увеличенными лимфоузлами с последующим ателектазом и развитием пневмонии. Это может быть при лимфогранулематозе, туберкулезе лимфоузлов. Высокоинформативны в такой ситуации томографическое исследование, биопсия лимфоузлов.
Осложнения Осложнения острой пневмонии могут быть связаны с органами дыхания или проявляться нарушениями других органов и систем. Острая дыхательная недостаточность — острое нарушение дыхания с недостаточным обеспечением тканей кислородом и, как правило, с нарушением выведения углекислоты. В механизмах развития острой дыхательной недостаточности важнейшее значение имеет сокращение дыхательной поверхности легких, особенно если оно сочетается с сохранением кровотока через невентилируемые участки легкого. Факторами, способствующими развитию дыхательной недостаточности, могут быть нарушение бронхиальной проходимости (особенно при бронхопневмонии) и замедление альвеолярно-капиллярной диффузии (как результат поражения интерстициальной межальвеолярной ткани). Проявляется дыхательная недостаточность выраженной одышкой и синюшностью. Острая дыхательная недостаточность требует неотложных мероприятий, включающих восстановление бронхиальной проходимости, оксигенотерапию, нормализацию газового состава крови. Плевральная реакция часто имеет место при острой пневмонии, особенно при субплевральном расположении воспалительного процесса, и, как правило, не требует специального лечения. Плевральный выпот с нарастанием зоны тупости перкуторного звука и ослаблением дыхания, усилением рестриктивной дыхательной недостаточности требует проведения плевральной пункции. Плевриты, развивающиеся в поздние сроки пневмонии (метапневмонические плевриты), часто приводят к формированию эмпиемы плевры. Инфекционно-токсический шок связан с бактериальной или вирусной интоксикацией: происходит нарушение вазомоторной регуляции с парезом венозных сосудов, депонированием в них крови и резким уменьшением объема циркулирующей крови, прогрессирующим расстройством микроциркуляции и развитием морфологических повреждений жизненно важных органов. Особенностью инфекционно-токсического шока является раннее развитие ДВС-синдрома. Другими осложнениями острой пневмонии могут быть острое легочное сердце, острая сердечная и сосудистая недостаточность, миокардит, перикардит, бактериальный эндокардит, менингит, гепатит, острые психозы и др.
Лечение Лечение острой пневмонии должно быть ранним и комплексным. Проводить его предпочтительно в стационарных условиях. В любом случае необходим постельный режим на период высокой лихорадки и щадящий — на весь период повышения температуры. Раннее начало лечения предупреждает развитие осложнений, переход процесса в затяжной или хронический. Комплекс лечения при острой пневмонии включает: — борьбу с инфекцией и интоксикацией; — восстановление бронхиальной проходимости; — нормализацию иммунологической реактивности и активизацию защитных сил организма; — ускорение регенераторных процессов, лечение осложнений. Имеют большое значение правильное питание и уход за больным острой пневмонией, которые включают: просторное помещение с хорошей вентиляцией и освещением, свежий прохладный воздух, уход за полостью рта и обильное питье до 2,5–3 л в день (морсы, жидкие фруктовые, овощные, ягодные соки); диета с достаточным содержанием белков, жиров, углеводов, витаминов; регулирование функции кишечника (чернослив, отварная свекла с растительным маслом натощак, кефир, простокваша или слабительные средства, очистительные клизмы). Ведущую роль при лечении острой пневмонии имеет антибактериальная терапия. Для выбора эффективного антибактериального средства необходима расшифровка этиологической структуры пневмонии. Но результаты бактериологического исследования мокроты становятся известны поздно. Поэтому этиологическая диагностика строится на основе особенностей клинической картины болезни, а также данных бактериоскопии мазка мокроты, взятой до начала лечения. При этом можно определить вид микробной флоры — кокки, палочки, ее культуральные свойства — отношение к окраске по Граму. Основными принципами антибактериальной терапии являются: — выбор наиболее активного и менее токсичного препарата; — определение оптимальных доз и методов введения; — своевременное начало и достаточный курс. При проведении антибактериального лечения предпочтительна монотерапия (лечение одним препаратом). Комбинированное применение антибиотиков оправдано при тяжелом течении заболевания, при смешанной инфекции, при отсутствии эффекта от достаточных доз антибактериальной монотерапии, при длительном течении заболевания, а также при необходимости уменьшения токсического действия антибиотиков. Дозы антибиотиков должны быть оптимальны и достаточны, так как низкие дозы ведут к селекции устойчивых микробных мутантов, снижению клинического эффекта. Это положение сохраняет силу и при комбинированной антибактериальной терапии: необходимо использовать полные терапевтические дозы компонентов. Лечение острой пневмонии лучше всего начинать с назначения антибиотиков бактерицидного действия. Если возникает необходимость комбинированной антибактериальной терапии, то рационально сочетать бактерицидные препараты с бактерицидными, бактериостатики с бактериостатиками. Оптимально подобранная антибактериальная терапия дает клинический эффект в течение 2—3-х дней. Отсутствие эффекта через 48 ч диктует необходимость или увеличения дозы антибиотика, или изменения пути введения, или смены препарата. Но следует предостеречь от частой, тем более необоснованной смены антибиотиков. Внутривенное применение антибиотиков приводит к развитию флебитов, поэтому при улучшении состояния следует перейти к другому пути введения. Продолжительность антибактериальной терапии определяется температурной реакцией — введение антибиотиков продолжается 4–5 дней после нормализации температуры. Нередко бывает достаточно 10–14 дней лечения, в случае необходимости длительного применения антибиотика следует производить замену каждые 10 дней. Так как в большинстве случаев пневмония имеет пневмококковую природу, антибактериальную терапию целесообразно начинать с пенициллина или его полусинтетических производных. Для получения терапевтического эффекта необходима разовая доза не менее 300 тыс. ЕД. Выбор дозы и способ введения проводятся с учетом степени тяжести заболевания. При легком течении назначается 1,2–1,5 млн. ЕД бензилпенициллина в сутки, при средней тяжести — 3–5 млн ЕД в сутки, при тяжелом — 15–20 млн ЕД в сутки и более. При стафилококковой пневмонии бензилпенициллин также сохраняет свое значение, но при этом предпочтительно внутривенное введение, которое можно сочетать с внутримышечным. При неэффективности пенициллина следует перейти на полусинтетические пенициллины — ампициллин, карбенициллин или устойчивые к действию пенициллиназы — метициллин (4—12 млн ЕД), оксациллин (4–6 млн ЕД), диклоксациллин (2–4 млн ЕД) в сутки. Стрептококковая пневмония хорошо лечится бензилпенициллином. Препаратами резерва во всех случаях являются цефалоспорины: цепорин, цефалексин, цефамезин (кефзол), а также эритромицин. Основными препаратами для лечения клебсиелла-пневмонии являются аминогликозиды, большей частью гентамицин (40–80 мг 2–3 раза в день), препараты резерва — эритромицин, тетрациклины, левомицетин. При пневмонии, вызванной кишечной палочкой, протеем, синегнойной палочкой, эффективны полусинтетические пенициллины, аминогликозиды, левомицетин. На микоплазму, легионеллу лучше всего действует эритромицин. При микоплазменной пневмонии несколько менее эффективны тетрациклин и линкомицин. При лечении пациентов с внебольничной пневмонией следует дифференцированно подходить к выбору антимикробных препаратов с учетом возраста, тяжести состояния, наличия сопутствующих заболеваний, места нахождения пациента (на дому, в общей палате стационара, в отделении реанимации и интенсивной терапии (ОРИТ), предшествующей антимикробной терапии, применения глюкокортикоидов и др). Прогностически очень важным является быстрое, не позже 4 ч после постановки диагноза, начало антимикробной терапии. При выборе антимикробных препаратов у пациента с нозокомиальной пневмонией учитывается характер отделения, в котором он находится (общего профиля или ОРИТ), применение искусственной вентиляции легких и время развития ВАП. Эмпирическая терапия планируется на основании локальных данных о чувствительности вероятных возбудителей. Обязательно исследование мокроты, при этом желательно получение материала инвазивными методами с количественной оценкой результатов, и гемокультуры. В лечении амбулаторных форм внебольничной пневмонии предпочтение следует отдавать антимикробным препаратам для приема внутрь. Однако при тяжелом течении инфекций антимикробные препараты необходимо вводить внутривенно. В последнем случае высокоэффективной является и ступенчатая терапия, которая предполагает переход с внутривенного введения на введение через рот. Переход следует осуществлять при стабилизации течения или улучшении клинической картины заболевания (в среднем через 2–3 дня от начала лечения). При неосложненной внебольничной пневмонии антибиотикотерапия может быть завершена по достижении стойкой нормализации температуры тела. Длительность лечения обычно составляет 7—10 дней. При наличии клинических и (или) эпидемиологических данных о микоплазменной, хламидийной или легионеллезной пневмонии продолжительность антибактериальной терапии должна быть большей из-за риска рецидива инфекции — 2–3 недели. Длительность применения антимикробных препаратов при осложненной внебольничной пневмонии и нозокомиальной пневмонии определяют индивидуально. В любом случае сохранение отдельных клинических, лабораторных и (или) рентгенологических признаков не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В большинстве случаев разрешение этих признаков происходит самостоятельно с течением времени. При легком течении пневмонии не утратили значения такие антибактериальные препараты, как сульфаниламиды (короткого и длительного действия), их производные (бисептол, сульфатон), а также нитрофураны. Их отличительной особенностью является хорошая проходимость через биологические фильтры. Медикаментозное лечение острой пневмонии наряду с этиотропной (антибактериальной) терапией включает в себя патогенетическое и симптоматическое лечение: — дезинтоксикационные и противовоспалительные средства; — бронхолитические и отхаркивающие препараты; — сердечно-сосудистые; — иммуномодуляторы; — оксигенотерапию. Для дезинтоксикации используют синтетические плазмозамещающие растворы (гемодез, реополиглюкин), гидролизаты белков по 200–400 мл внутривенно капельно 1–2 раза в день. Для ликвидации отека, улучшения микроциркуляции и вентиляции легких используют противовоспалительные средства (ацетилсалициловая кислота по 0,5 г 2–3 раза в день, реже — нестероидные противовоспалительные средства: индометацин, бруфен, вольтарен). Но их иммуносупрессивное действие и снижение ими эффективности фагоцитоза диктуют необходимость длительного их применения и строгой обоснованности назначения. При вялом течении болезни, особенно в сочетании с бронхоспастическим синдромом, возможно применение короткими курсами небольших доз глюкокортикоидов (преднизолон 10–15 мг в сутки в течение 3–5—7 дней). Для улучшения дренажной функции бронхов и восстановления бронхиальной проходимости показано применение бронхолитических средств (эуфиллин, теофедрин, эуспиран, астмопент и др.) и отхаркивающих препаратов. В начале заболевания при сильном непродуктивном кашле целесообразно назначение противокашлевых лекарственных средств (кодеин, либексин). В комплексном лечении пневмонии важную роль играет нормализация иммунных механизмов защиты и неспецифической реактивности организма (тималин, Т-активин, продигиозан, гамма-глобулин, экстракт алоэ, ФиБС и др.). При тяжелом течении острой пневмонии (крупозная, стафилококковая), а также у лиц пожилого возраста всегда имеет место тенденция к развитию острой сосудистой и сердечной недостаточности. В этих случаях нельзя обойтись без сердечно-сосудистых средств. При высокой лихорадке и выраженной интоксикации необходимо назначение сосудистых средств (кофеин, кордиамин, камфора, сульфокамфокаин), а при появлении признаков сердечной недостаточности и у пожилых больных необходимо назначение сердечных гликозидов (коргликон, строфантин, ланикор) парентерально. При появлении признаков отека легких к лечению необходимо добавить мочегонные средства (лазикс внутривенно или фуросемид внутрь). На всех этапах лечения острой пневмонии, особенно в начале заболевания, показана активная оксигенотерапия. С первых дней заболевания необходимо назначение немедикаментозных методов лечения. Они позволяют ускорить рассасывание воспалительных изменений, уменьшают интоксикацию, улучшают вентиляцию легких и кровообращение в них. В начальном периоде болезни — при высокой лихорадке — могут быть использованы только методы отвлекающей терапии: холодные компрессы на голову, горчичные обертывания. При снижении температуры ниже 38 °C могут применяться банки, горчичники. Важным фактором лечения являются физические методы. Они не назначаются при тяжелом состоянии, выраженной интоксикации, признаках сердечной недостаточности, кровохарканье, температуре выше 38 °C. В период активного воспалительного процесса (экссудация и отечность ткани легкого, нарушение капиллярного кровообращения) хороший эффект оказывает электрическое поле ультравысокой частоты (УВЧ) на область очага воспаления, ультрафиолетовое облучение грудной клетки эритемными дозами кварца (3–5 процедур). С 7—10-го дня болезни, в период рассасывания инфильтрации в легких, предпочтительно назначение микроволн (СВЧ-терапия), электромагнитных волн дециметрового диапазона, индуктотермии. В этот период эффективно назначение электрофореза с ионами кальция, магния, йода и др. При затяжном течении пневмонии, в период остаточных воспалительных изменений, особенно на фоне нарушения дренажной функции бронхов предпочтительно назначение амплипульс-терапии, тепловых процедур (парафин, озокерит, грязь), а также ультразвука. В этой же ситуации эффективно использование массажа грудной клетки, аэроионотерапии. В комплекс лечебных мероприятий на ранних этапах болезни должна включаться дыхательная гимнастика, способствующая улучшению дренажной функции бронхов, уменьшающая образование плевральных спаек. Одновременно с этим назначают и лечебную физическую культуру, особенно у лиц пожилого возраста. В плане реабилитационных мероприятий желательным этапом лечения острой пневмонии является санаторно-курортное лечение. Оно должно проводиться в основном в местных санаториях, но могут использоваться и климатические курорты в условиях низкогорья, в лесных зонах, на Южном берегу Крыма. Горные курорты находятся в основном на Кавказе, в Киргизии, Алтайском крае. Степные курорты расположены в Оренбургской области, Башкирии, Казахстане и Западной Сибири (Абастумани, Теберда, Домбай, Боровое и др.). Лица, перенесшие острую пневмонию с клиническими и рентгенологическими признаками выздоровления, подлежат обязательному диспансерному наблюдению в течение как минимум шести месяцев. При затяжной пневмонии диспансерное наблюдение должно проводиться в течение 12 месяцев. В этот период проводят мероприятия вторичной профилактики: назначение бронхолитических и отхаркивающих средств (особенно при сопутствующих бронхитах), лечение очагов хронической инфекции, а также комплекс мер первичной профилактики: борьба с курением и злоупотреблением алкоголя, закаливание. Все лица, перенесшие острую пневмонию, должны быть трудоустроены через КЭК, особенно при неблагоприятных условиях труда. При неосложненном течении болезни трудоустройство проводится на срок до 2–3 месяцев, а при затяжном течении — до 6 месяцев. Оно предусматривает освобождение от работ в условиях повышенной запыленности, тяжелой физической нагрузки, резкой смены температур в производственной зоне, а также от работ на улице в холодное время года.
ПНЕВМОТОРАКС СПОНТАННЫЙ
ОпределениеСпонтанный пневмоторакс — потеря отрицательного давления в плевральной полости, сопровождающаяся частичным или тотальным коллапсом легкого вследствие сообщения с внешней средой при целости грудной стенки. Внезапно развивающийся нетравматический спонтанный пневмоторакс обусловлен патологическими процессами в легких или плевральной полости.
Этиология и патогенез Спонтанный пневмоторакс может быть первичным и вторичным. Первичный возникает в результате прорыва субплевральных эмфизематозных булл, чаще в верхушках легких. Обычно это больные высокого роста с несоответственно меньшей массой тела. Пневмоторакс развивается в состоянии покоя, реже при нагрузке. Курящие более подвержены спонтанному пневмотораксу. При задержке вновь поступающего воздуха в полости плевры возникает напряженный (вентильный) пневмоторакс, быстро ведущий к массивному коллапсу легкого и смещению органов средостения. Вторичный спонтанный пневмоторакс чаще возникает на фоне хронических обструктивных заболеваний легких (туберкулез, силикотуберкулез, саркоидоз, бронхиальная астма, инфаркт легкого, ревматоидные заболевания, эхинококкоз, бериллиоз). Менструальный пневмоторакс связан с менструальным циклом у женщин старше 25 лет. Возникает в первые 48 ч после начала менструации. Происхождение неизвестно. Неонатальный пневмоторакс чаще наблюдается у новорожденных, примерно в 1–2 % (с клинической симптоматикой у 0,5 %), в 2 раза чаще у новорожденных мальчиков, обычно у доношенных и переношенных детей. Причина связана с механическими проблемами первого расправления легкого, а также респираторным дистресс-синдромом. Пневмоторакс у детей первых дней жизни чаще всего возникает в результате разрыва ткани легкого при проведении искусственной вентиляции легких. Причиной разрыва легкого может также служить повышенное внутрибронхиальное давление, возникающее в процессе родов, или порок развития легких (кисты, буллы). Возможно развитие пневмоторакса и при осложненном течении воспалительных процессов в легких, например прорыве абсцесса легкого в плевральную полость с образованием пиопневмоторакса.
Клиническая картина и диагностика Характерными симптомами являются внезапная интенсивная боль в грудной полости, возникающая нередко среди полного здоровья, нехватка воздуха, синюшность, тахикардия. Возможны снижение артериального давления, отсутствие тактильно определяемого голосового дрожания, перкуторно-коробочный звук, дыхательные шумы снижены либо исчезают. Дыхательная недостаточность может пройти без разрешения пневмоторакса. Окончательный диагноз устанавливают при рентгенологическом исследовании. Вероятность рецидива без плевродеза составляет примерно 50 %. Клиника вторичного спонтанного пневмоторакса более тяжелая. Клиническая картина неонатального пневмоторакса определяется характером и тяжестью патологического процесса в легких и выраженностью внутригрудного напряжения. В случае напряженного (клапанного) пневмоторакса состояние ребенка прогрессивно ухудшается, появляются и быстро нарастают беспокойство, затрудненное дыхание, одышка, синюшность. Выявляются коробочный перкуторный оттенок звука, смещение границ сердца и средостения в сторону, противоположную напряжению; дыхательные шумы над стороной поражения не выслушиваются, отмечается выраженная тахикардия. Прогноз при первичном спонтанном пневмотораксе благоприятный, при вторичном — обусловлен течением основного заболевания. Прогноз при неонатальном пневмотораксе обычно зависит от степени выраженности симптомов родовой травмы, исходного состояния ткани легкого к моменту развития пневмоторакса, своевременности оказания лечебных мероприятий, особенно при клапанном его характере. Рентгенологически определяют коллапс легкого, смещение границ сердца и средостения в здоровую сторону. При разрывах легочной ткани может также развиться эмфизема средостения. В этих случаях к указанным симптомам присоединяется одутловатость лица, подкожная крепитация на шее и туловище вплоть до мошонки. На рентгенограмме обнаруживают пневмомедиастинум, четко контурируются границы вилочковой железы.
Лечение Больные госпитализируются в хирургический стационар. Лечение спонтанного пневмоторакса преследует две цели: выведение воздуха из плевральной полости и снижение вероятности развития рецидива. Первая лечебная помощь — пункция плевральной полости и аспирация воздуха через прокол в 3—4-м межреберье по среднеключичной линии и вслед за этим дренирование по Бюлау, особенно при напряженном пневмотораксе, применение обезболивающих средств. В случае неэффективности пункций необходимо 2–3 дня дренировать плевральную полость. Дренаж проводят во II–III межреберье по среднеключичной линии с помощью троакара, который соединяют с опущенной под воду трубкой с клапаном на конце. Может быть применен любой вакуум-аппарат, обеспечивающий отрицательное давление в 20–30 см водного столба. Больше 4 дней его держать не рекомендуется в связи с опасностью инфицирования. Для профилактики рецидива используют плевродез склерозирующими веществами, в дозе внутриапаплеврально при расправленном легком. В случае неэффективности вакуум-аспирации и развитии осложнений, назначается оперативное лечение. Производится широкая торакотомия, ушивание дефектов легочной ткани, резекция участков, пораженных кистами или буллами. Для лечения менструального пневмоторакса используют препараты, подавляющие овуляцию. В противном случае — торакотомический плевродез. При клинической симптоматике неонатального пневмоторакса — лечение консервативное: плевральная пункция, дренирование плевральной полости. В тяжелых случаях при неэффективности указанных манипуляций выполняют бронхоскопию и временную окклюзию бронха поврежденной доли. При наличии нарастающей эмфиземы средостения показано оперативное вмешательство, заключающееся в дренировании переднего средостения силиконовой трубкой через разрез над вырезкой грудины.
ПОДАГРА
ОпределениеПодагра (лат. «капкан на стопе») — хроническое заболевание организма, в основе которого лежит нарушение пуринового обмена с избыточным отложением солей мочевой кислоты в тканях, что приводит к характерному поражению суставов, почек и других внутренних органов.На протяжении двух с половиной тысячелетий — со времени описания Гиппократом синдрома острых болей в области большого пальца стопы, который он назвал подагрой, — интерес к этой болезни всегда носил волнообразное течение, как правило, связанное с новыми открытиями, изменением точки зрения на природу этого заболевания. В XVII в. это открытие кристаллической природы тофусов (очагов патологического уплотнения) А. Левенгуком и блестящее описание клиники острого подагрического приступа, не потерявшее своего значения до сих пор. В XIX в. была установлена связь подагры с гиперурикемией, а артрита — с введенными в сустав кристаллами уратов (солей мочевой кислоты); также была показана эффективность Colchicum autumnale. В XX в. доказана профилактическая роль колхицина, введены в клиническую практику пробенецид и аллопуринол. Но особенно интересны данные по изучению кристаллов, вызывающих подагрический артрит. Показано, что это мононатриевые уратные кристаллы, обнаружение которых имеет абсолютное диагностическое значение. В сущности, к концу XX в. подагру стали рассматривать как болезнь накопления уратных кристаллов в структуре сустава, подкожной клетчатке, костях и почках в виде уролитиаза или тубулярной нефропатии. В этой связи важно подчеркнуть парадокс XX в. — у всех больных с подагрой определяется гиперурикемия (повышенное содержание мочевой кислоты в крови), но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита (см.). А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающимися воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия — необходимое, но недостаточное условие для развития уратной микрокристаллической болезни, а следовательно, гиперурикемия — отличный от подагры клинический синдром. Тесная связь клинических проявлений подагры с отложением кристаллов мочевой кислоты, в том числе такое яркое проявление, как артрит первого плюснефалангового сустава в начале болезни (собственно подагра), послужило основанием включить подагру в подкласс микрокристаллических артритов в Международной классификации болезней. Распространенность подагры составляет 0,1 % (в США — 1,5 %). Среди ревматических болезней на ее долю приходится 5 %. Болеют в основном мужчины в возрасте 35–60 лет. Подагра у женщин составляет 2–3 %.
Этиология и патогенез Гален еще в 150 г. н. э. указывал, что подагра обусловлена «распущенностью, несдержанностью и наследственностью». Современные представления о подагре близки к мнению патриарха медицины. В основе повышенного содержания мочевой кислоты в крови (основного обменного нарушения при подагре) лежит генетически детерминированный дефект ферментных систем, принимающих участие в эндогенном синтезе пуриновых оснований. При расстройстве пуринового обмена баланс нарушается и происходит гиперпродукция мочевой кислоты. У больных подагрой усилен синтез пуринов в организме, способствующим фактором развития заболевания является повышенное поступление пуринов с пищей. Увеличивается образование мочевой кислоты. Гиперурикемия может быть также следствием недостаточной экскреции мочевой кислоты в почках. Развивается гиперурикозурия. Отложение кристаллов мочевой кислоты в синовиальной оболочке суставов, коже, клетках почечных кристаллов обусловливает развитие основных клинических проявлений подагры — артрита (см.), тофусов и подагрической нефропатии. Таким образом, основными факторами риска развития подагры являются отягощенная наследственность, ожирение (см.), злоупотребление алкоголем, неумеренное потребление мясных продуктов. Причинами вторичной гиперурикемии являются опухоли (см.), особенно гемобластозы, когда имеется повышенный распад белка; лечение цитостатическими препаратами и тиазидными мочегонными. Процессы отложения солей мочевой кислоты в тканях определяют клинические проявления подагры. Наиболее типичным и ярким из них является острый подагрический артрит (см.). Непосредственной причиной последнего служит внезапная кристаллизация мочевой кислоты в полости сустава, наступающая под действием провоцирующих факторов. При подагре в организме регистрируются следующие патологические процессы: — стимуляция под влиянием уратных кристаллов синтеза противовоспалительных медиаторов фагоцитами, синовиальными клетками и другими компонентами сустава; — адгезия нейтрофилов к эндотелию и поступление нейтрофилов в полость суставов; — поступление противовоспалительных медиаторов в кровяное русло; — развитие системных проявлений, характерных для подагрического артрита. Существенное значение в механизме развития подагры имеет функция почек. При гиперурикемии выработка мочевой кислоты в дистальных извитых канальцах нефрона возрастает, однако этот механизм не в состоянии удалить из организма избыточное ее количество. Механизмы же регуляции выработки мочевой кислоты в почках пока не установлены. В зависимости от степени урикозурии выделяется 3 типа гиперурикемии и соответственно 3 типа подагры: метаболический (обменный), почечный и смешанный. При метаболическом типе (встречается у 60 % больных) отмечаются высокая уратурия (выделение солей мочевой кислоты с мочой — более 3,6 ммоль/сут.) и нормальный клиренс мочевой кислоты. Почечный тип (10 % больных) проявляется низкими уратурией (менее 1,8 ммоль/сут.) и клиренсом мочевой кислоты (3,0–3,5 мл/мин). Смешанному типу (около 30 % больных) свойственны нормальная или сниженная уратурия и нормальный клиренс мочевой кислоты. У здоровых клиренс мочевой кислоты составляет 6–7 мл/мин, а суточная уратурия — 1,8–3,6 ммоль/сут. (300–600 мг).
Клиническая картина Выделяют три стадии естественно прогрессирующего течения подагры: острый подагрический артрит, межприступная подагра и хроническая тофусная подагра. Наиболее типичным клиническим признаком подагры являются периодически возникающие приступы острого подагрического артрита (см.). Интермиттирующая (волнообразная) подагра характеризуется чередованием острых приступов с бессимптомными межприступными промежутками. У большинства больных клинически определяемое начало болезни совпадает с первым острым приступом артрита, который может возникнуть внезапно в любое время, но чаще ночью, у многих — ближе к утру. Больной ложится спать как будто здоровым, а ночью просыпается от сильнейшей жгучей, давящей, пульсирующей или рвущей боли в одном или нескольких суставах. В начале болезни чаще поражаются суставы ног, в основном типична асимметричность поражений. С убывающей частотой в подагрический процесс вовлекаются суставы стоп, голеностопные, коленные, пальцев рук, локтевые и др. У 60–75 % больных первые проявления подагры возникают в первом плюснефаланговом суставе большого пальца. Реже болезнь начинается по типу полиартрита. Возможно набухание местных вен. Больной ощущает легкий озноб, может быть повышение температуры тела, даже до высоких цифр. Болевой синдром настолько интенсивен, что подчас не снимается наркотиками. Боль усиливается даже от легкого прикосновения к воспаленной поверхности сустава. Наступает полное болевое ограничение подвижности в пораженном суставе. Припухание может постепенно распространяться на окружающие периартикулярные (околосуставные) ткани, свод стопы или тыл кисти. Внешне картина острого подагрического артрита сходна с таковой при флегмоне (см.) или гнойном воспалении сустава. К утру интенсивность боли заметно ослабевает, а иногда больной в состоянии даже выйти на работу. Однако в ночное время боль опять усиливается. Интенсивный болевой синдром может сопровождаться раздражительностью, душевными страданиями. Продолжительность первых приступов подагры составляет обычно 3–4 суток. Затем острые ночные боли заметно стихают, покраснение пораженного сустава сменяется багрово-синюшной окраской («цвет пиона»), удерживаются остаточные явления отека, умеренные боли в суставах при движении, но они постепенно ослабевают. Через 1–2 недели движения в пораженном суставе восстанавливаются. Во время приступа подагры изменяются лабораторные показатели. Выявляется умеренное увеличение числа лейкоцитов, иногда до значительных цифр увеличивается СОЭ, повышается уровень острофазовых показателей. В дальнейшем острые приступы подагры периодически повторяются. У одних больных в первые годы болезни рецидивы артрита отмечаются спустя 1–2 года, у других — через 5–6 месяцев или чаще. С годами частота приступов нарастает, они становятся более продолжительными, но менее острыми. Межприступные промежутки соответственно укорачиваются. При каждом повторном приступе в патологический процесс, как правило, вовлекаются все новые суставы. Провоцировать острый приступ подагры может употребление большого количества продуктов, содержащих в высоких концентрациях пуриновые основания, алкоголя, нервно-психическое перенапряжение, вирусные инфекции, переохлаждение, травмы, ушибы, резкие изменения атмосферного давления, прием лекарственных средств, способствующих развитию гиперурикемии (витамин В12, препараты печени, мочегонные, кортикостероидные гормоны, сульфаниламиды, соли золота и др.). Хроническая подагра характеризуется появлением тофусов или хронического подагрического артрита либо того и другого вместе. Тофусы (тканевые скопления уратов), как правило, возникают через 5—10 лет от начала первых суставных проявлений. Они локализуются на внутренней поверхности ушных раковин, в области локтевых суставов, суставов стоп и кистей, реже в области коленных суставов, ахиллова сухожилия и других местах. Подагрические узелки в ушных раковинах образуются в большинстве случаев незаметно и неожиданно для больного, в области суставов — чаще после острого подагрического воспаления. Размеры тофусов — от 1–2 мм до 10–15 см в диаметре. Хронический подагрический артрит (см.) развивается в суставах, где ранее отмечалось несколько острых подагрических приступов, проходивших без остаточных явлений. Появляются умеренная стойкая дефигурация пораженных суставов, чувство скованности, боли при движении. Функция же таких суставов даже при отчетливой деформации остается удовлетворительной. С течением времени в пораженных суставах возникают явления вторичного артроза (см.). Из внесуставных проявлений подагры наиболее часто встречается поражение почек (у 50–75 % больных). Риск поражения почек у больного подагрой пропорционален степени гиперурикемии и длительности болезни. Изменения в мочевыделительной системе появляются при снижении рН мочи ниже 5,4, когда резко падает растворимость солей мочевой кислоты. Причина высокой кислотности мочи при подагре окончательно не установлена. Обобщающим для всех видов подагрического поражения почек служит термин «уратная нефропатия». Наиболее часто встречается почечнокаменная болезнь (см.) (уролитиаз) с периодическими приступами почечной колики (см.). На фоне уролитиаза может развиваться вторичный пиелонефрит (см.), который проявляется обычными симптомами: повышением температуры, дизурией, лейкоцитурией и бактериурией. Повышение фильтрации и выработки уратов при подагре приводит к их отложению в мозговом слое почек, реже — в корковом. Недавно описан также иммунный гломеруонефрит (см.), протекающий как хронический скрытый нефрит, этиологически связанный с нарушениями пуринового обмена. Механизм развития этой формы уратной нефропатии нуждается в уточнении. Из других внесуставных проявлений подагры часто наблюдается поражение сухожилий, проявляющееся сильными болями, реже — отеком и покраснением в их зоне. В процесс в основном вовлекаются сухожилия, расположенные вблизи пораженных суставов. Подагре часто сопутствуют ишемическая болезнь сердца (см.) и гипертоническая болезнь (см.). Гиперурикемия — один из важных факторов риска ишемической болезни сердца. Примерно половина больных подагрой страдает ожирением (см.). Случаи подагры у женщин встречаются в основном в период менопаузы. У таких больных выявляются низкий тембр голоса, более грубые черты лица, гипертрихоз (повышенное оволосение), у них хорошо развита скелетная мускулатура («мужеподобные» женщины). Течение подагры у женщин чаще мягкое и доброкачественное, без типичных острых приступов. Диагностика подагры в подобных случаях затруднена из-за отсутствия выраженных экссудативных явлений впораженных суставах. Более доброкачественно протекает и вторичная подагра. Приступы подагрического артрита (см.), как правило, совпадают с обострением основного заболевания. Вторичная подагра может возникать на фоне лечения цитостатиками гематологических заболеваний (эритремия, лейкозы (см.), гемолитическая анемия (см.), лучевой и цитостатической терапии злокачественных опухолей («синдром распада опухоли»), врожденных пороков (см.) сердца синего типа, заболеваний почек с нарушением их функции, микседемы (см.), на фоне длительного приема ряда медикаментозных средств, свинцовой интоксикации. При рентгенологическом исследовании больных хроническим подагрическим артритом (см.) можно одновременно наблюдать симптомы деструкции, дегенерации и регенерации. На фоне умеренного остеопороза (см.) в эпифизах могут выявляться вакуолеобразные дефекты костной ткани с ободком склероза — симптом «пробойника». Типичен симптом «вздутия костного края» над порозными или кистевидно измененными участками кости. Иногда обнаруживается утолщение и расширение мягких тканей, что обусловлено отложением в них уратов. На рентгеновских снимках мы видим разрушения, вызванные внутрикостным отложением уратов (солей мочевой кислоты) На рентгенограммах типичны изменения, характерные для псориатического артрита (см.) и тофусной подагры. В редких и далеко зашедших случаях возможно полное разрушение эпифизов и замещение их уратными массами. При длительном течении болезни появляются рентгенологические признаки вторичного артроза (см.).
Диагностика и дифдиагностика Диагноз подагры в типичных случаях трудностей не представляет. Он основывается на учете периодически повторяющихся приступов артрита, поражении первого плюснефалангового сустава большого пальца стопы, обнаружении тофусов и гиперурикемии. Классификационные критерии диагноза подагры: — наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости; — подтвержденный тофус (химически или при поляризационной микроскопии); — наличие 6 из 12 клинических, лабораторных и рентгенологических признаков. Рентгенологические признаки: максимальное воспаление сустава в 1-й день; наличие более чем одной атаки артрита; моноартрит; покраснение суставов; боль и воспаление плюснефалангового сустава I пальца; асимметричное воспаление плюснефалангового пальца; одностороннее поражение тарзальных (предплюсневых) суставов; подозрение на тофусы; гиперурикемия; асимметричное воспаление суставов; субкортикальные кисты без эрозий при рентгенологическом исследовании; отсутствие микроорганизмов в культуре синовиальной жидкости. У здоровых содержание мочевой кислоты в сыворотке крови при ее исследовании без специальной подготовки пациента составляет 0,26—0,40 ммоль/л. Достоверные рентгенологические признаки подагры появляются, как правило, не ранее чем через 5 лет от начала заболевания, поэтому данный метод непригоден для ранней диагностики подагры. Важное значение в диагностике придается исследованию синовиальной жидкости. При подагре ее цвет прозрачный, вязкость не изменена или снижена, число лейкоцитов и гранулоцитов составляет 20–75 %. Микроскопически в поляризованном свете обнаруживаются кристаллы мочевой кислоты. Большие трудности представляет диагностика подагры в ранний период, когда отсутствуют тофусы и рентгенологические признаки. В дебюте болезни примерно у трети больных острый подагрический артрит протекает атипично. Дифференциальный диагноз проводится с ревматоидным артритом (см.), остеоартрозом, ревматизмом (см.), пирофосфатной артропатией, инфекционными артритами (см.), панарицием (см.), рожистым воспалением (см. Рожа).
Лечение Лечение подагры может быть успешным только при совместных усилиях врача и больного. Коррекция нарушений пуринового обмена должна быть длительной и комплексной. Лечение подагры сводится к прекращению острого подагрического артрита (см.) и профилактике повторных обострений. При возникновении острого подагрического приступа больному назначаются полный покой и обильное щелочное питье (2,0–2,5 л/сут.). Местно применяют компрессы с 50 %-ным раствором димексида (обладает выраженным противовоспалительным и обезболивающим действием). Из медикаментозных средств в остром периоде используются препараты: НПВП, системные и локальные кортикостероиды и колцехин. Для прекращения острого подагрического приступа необходимы нестероидные противовоспалительные средства. Наиболее эффективны препараты, обладающие хорошим противовоспалительным эффектом (индометацин, диклофенак натрия, напроксен, пироксикам и др.). Все препараты в первый день лечения назначаются в высоких терапевтических дозах: индометацин — вначале по 100 мг однократно, а затем еще 2–3 раза по 75—100 мг; напроксен — 750 мг однократно, затем по 250 мг каждые 8 ч; диклофенак натрия принимается в той же дозировке, что и индометацин. Если на следующие сутки интенсивность болевого синдрома уменьшается, доза противовоспалительного препарата снижается до среднетерапевтической. Противовоспалительные средства применяются до ликвидации признаков артрита, а затем они отменяются. Кортикостероидные гормоны для прекращения подагрического артрита (см.) используются исключительно редко в связи с их свойством вызывать гиперурикемию. Лишь при отсутствии заметного эффекта от нестероидных противовоспалительных препаратов или при выраженных экссудативных явлениях в крупных суставах и мучительном болевом синдроме однократно внутрисуставно вводится гидрокортизон или дипроспан. Наиболее же эффективным средством для подавления подагрической атаки считается колхицин — алкалоид, выделенный из безвременника осеннего. Если колхицин есть в аптечной сети, ему следует отдавать предпочтение перед нестероидными противовоспалительными препаратами. Колхицин назначается по следующей схеме: первый прием — 1 мг (2 таблетки), затем по 1 таблетке каждый час, но не более 6 мг (12 таблеток) в сутки. Колхицин противопоказан при тяжелых поражениях печени и почек, язвенной болезни (см.) желудка и двенадцатиперстной кишки. Лечение подагры в межприступный период должно быть направлено на борьбу с гиперурикемией, рецидивами приступов подагры, предупреждение поражения внутренних органов, восстановление нарушенной функции суставов. С этой целью назначается комплексная терапия, включающая лекарственные средства, диету, методы физического воздействия и санаторно-курортное лечение. Основной принцип базисной терапии — длительное применение средств, нормализующих содержание мочевой кислоты в крови, так как после их отмены опять могут возникнуть приступы подагры. Показания к длительному медикаментозному лечению подагры: — частые атаки подагрического артрита (3 и более на протяжении года, предшествующего наблюдению, длительность острого периода на протяжении года не менее 1,5 месяца); — подагра, сопровождающаяся гиперурикемией (0,48 ммоль/л и выше); — развитие или прогрессирование хронического подагрического артрита, появление и рост тофусов; — подагра с поражением почек (с почечнокаменной болезнью) при отсутствии выраженной хронической почечной недостаточности. При легком течении заболевания или после первых 1–2 непродолжительных атак, сопровождаемых незначительной и нестойкой гиперурикемией, необходимо воздержаться от длительного медикаментозного лечения. Не следует прибегать к нему и при сомнениях в диагнозе подагры, даже при стабильной умеренной гиперурикемии. Общие принципы лечения препаратами, уменьшающими гиперурикемию: — нельзя начинать лечение этими препаратами в момент острого приступа, лечение проводится только в межприступном периоде; — следует принимать препараты длительно (годами); можно делать небольшие паузы (по 2–4 недели) в период нормализации уровня мочевой кислоты в крови; — необходимо учитывать тип нарушения пуринового обмена (метаболический, почечный, смешанный); если тип не установлен, то применяют урикоингибиторы, но не урикозурические средства; — следует поддерживать суточный диурез около 2 л (потребление 2,5 л жидкости в сутки), назначать средства, повышающие рН мочи (натрия гидрокарбонат, уралит, магрулит, солуран); — целесообразно в первые дни лечения проводить профилактику суставных кризов колхицином (1 мг в сутки) или индометацином (75 мг в сутки). Антиподагрические средства делятся на 3 группы: — урикодепрессивные средства: уменьшают синтез мочевой кислоты путем ингибирования ксантиноксидазы; — урикозурические средства: повышают выделение мочевой кислоты путем уменьшения реабсорбции уратов и увеличения их выработки в почках; — средства смешанного действия. Перед назначением антиподагрических средств целесообразно установить тип нарушения пуринового обмена (метаболический, почечный, смешанный). Больным с гиперэкскреторной подагрой следует назначать урикозурические препараты, а при повышенной продукции мочевой кислоты — антагонисты синтеза пуринов. У лиц с нормальным выделением мочевой кислоты подагра может развиваться за счет сочетания повышенной продукции с пониженным выделением уратов. В этом случае рекомендуют назначать урикозурические средства, если суточное выделение мочевой кислоты менее 450 мг (2,7 ммоль/л), и ингибиторы, если оно составляет 450 мг и более. Ведущее место в лечении подагры занимают урикостатики (аллопуринол), угнетающие образование мочевой кислоты. Аллопуринол необходим в суточной дозе 100–900 мг в зависимости от степени гиперурикемии. При легком течении подагры исходная лечебная доза составляет 200–300 мг, при среднетяжелом — 300–400 мг и при тяжелом — 600–900 мг. Под воздействием урикостатиков содержание мочевой кислоты в крови начинает снижаться через 2–3 дня. В процессе лечения необходимо периодически (1 раз в 3–4 недели) исследовать ее уровень. После ликвидации гиперурикемии доза аллопуринола снижается до поддерживающей (100–300 мг/сут.). Поскольку урикостатические средства не обладают стойким и продолжительным действием, больные должны применять их постоянно. Лишь в летние месяцы, когда в пищевом рационе заметно увеличивается доля растительных продуктов, допускаются перерывы на 1–2 месяца. Поддерживающая доза урикостатических средств определяется индивидуально и может колебаться. Главный критерий выбора оптимальной дозы — содержание мочевой кислоты в крови не выше верхних пределов нормы. Урикозурические средства угнетают канальцевую реабсорбцию мочекислых соединений и увеличивают выработку, в связи с чем наиболее показаны при почечном типе гиперурикемии. Из этой группы используются этамид, бензбромарон, пробенецид (бенемид). Подобным действием обладают и салицилаты, принимаемые в суточной дозе не менее 4 г/сут. Этамид назначается по 0,7 г (2 таблетки) 3–4 раза в сутки в течение 7—10 дней с недельными перерывами, антуран — в суточной дозе 0,4–0,6 г. Урикозурические средства для длительной поддерживающей терапии, как правило, не используются. В случаях развития уратной нефропатии они не назначаются. Возможно и сочетанное применение аллопуринола и этамида, особенно при смешанном типе гиперурикемии, но дозы обоих препаратов должны быть уменьшены. В последние годы широкое применение в клинической практике получает алломарон, содержащий 100 мг аллопуринола и 20 мг бензбромарона. Он применяется по 1 таблетке в сутки. Алломарон может быть препаратом выбора при подагре. Это обусловлено удобством использования препарата — всего 1 раз в сутки, а также весьма малым числом побочных действий благодаря минимальной дозировке составляющих компонентов. Алломарон в меньшей степени повышает выделение мочевой кислоты в сравнении с «чистыми» урикозурическими средствами, что позволяет расширить показания к его назначению. Для растворения мочекислых камней и предотвращения образования новых целесообразно назначать больным препараты типа уралита (магурлит, блемарен и др.). Они повышают зависимую от величины рН растворимость мочевой кислоты в 10–50 раз. Соблюдение диеты при подагре помогает ограничить поступление пуринов в организм с пищей и уменьшить дозировку принимаемых лекарств. Одна из важных задач диетического питания — нормализовать массу тела за счет снижения количества потребляемой пищи. При подагре вне приступа назначают диету № 6. Это диета, полноценная по калорийности, с ограничением жиров животного происхождения, сниженным количеством белка, ограниченным содержанием соли. Диета богата щелочными валентностями и предусматривает потребление повышенного количества жидкости. Химический состав и энергетическая ценность диеты: белков 70–80 г, жиров 80–90 г, углеводов 400–450 г. Энергетическая ценность — 3 тыс. ккал. Из пищи исключают субпродукты (печень, почки, язык, мозги), мясо молодых животных (цыплята, телятина). Запрещают есть жирные сорта мяса и рыбы, мясные и рыбные бульоны, супы. Мясо и рыбу дают только в отварном виде, так как в процессе варки до 50 % содержащихся в продукте пуринов переходят в бульон. В пищевой рацион мясные и рыбные блюда включают 2–3 раза в неделю. Исключают богатые пуринами бобовые (горох, бобы, фасоль, чечевица), а также щавель и шпинат. Ограничивают потребление животных жиров, богатых насыщенными жирами, так как установлена прямая зависимость между количеством их в пище, возрастанием уровня мочевой кислоты в плазме и снижением ее выделения с мочой. Поваренную соль ограничивают до 5–7 г (вместе с содержащейся в продуктах). Больному подагрой рекомендуется выпивать перед сном 1 стакан жидкости (некрепкий чай, кофе, чай с молоком или лимоном, соки). Обязательно включение творожных, кефирных, молочных и фруктовых разгрузочных дней. При проведении разгрузочных дней больной должен получать не менее 1,5–2 л жидкости в день. Противопоказано лечение голодом и назначение «голодных» дней. Голодание уже в первые дни приводит к возрастанию урикемии с последующим возникновением приступа подагры. Для больных подагрой можно пользоваться и диетой № 5 с ограничением мяса и рыбы до 100–150 г в день (на 3–4 дня в неделю полностью исключают мясо и рыбу). При сочетании подагры с ожирением назначают диету № 8 с использованием разгрузочных дней. При всех вариантах лечения необходимо вводить 1,5–2 л жидкости в сутки. В дни, когда разрешают мясо или рыбу, в меню добавляют 150 г отварной говядины (белков — 17,7 г, жиров — 3,6 г, калорийность — 106 ккал) или 150 г отварной рыбы (белков — 14,9 г, жиров — 0,4 г, калорийность — 65 ккал). Можно сочетать рыбу с мясом в эквивалентных количествах. При подагре необходимо достаточное введение витаминов С и В1. Лечение острого подагрического приступа включает строгий постельный режим (желательна неподвижность пораженной конечности), соблюдение строгой диеты и лекарственную терапию. На весь период обострения исключают мясные и рыбные продукты. Диета состоит преимущественно из жидкой пищи (молоко, молочнокислые продукты, кисели, компоты, овощные и фруктовые соки, некрепкий чай с молоком или лимоном, овощные супы, жидкие каши). Необходимо следить, чтобы человек не голодал и употреблял до 2 л жидкости в сутки. Рекомендуются щелочные минеральные воды. В период обострения подагры нередко отмечаются пищеварительные расстройства, усугубляемые лекарственной терапией, действующей раздражающе на пищеварительный тракт; в связи с этим необходимо соблюдать щадящую диету. В период затихания обострения разрешается ограниченное количество мясных блюд (1–2 раза в неделю по 100–150 г отварного мяса). В остальные дни рекомендуются молочные продукты, яйца; крупы, картофель, овощи и фрукты. Такая диета назначается на 1–2 недели. При отсутствии недостаточности кровообращения (см.) и отчетливой артериальной гипертензии (см.) показано обильное питье — до 2,0–2,5 л/сут. С этой целью можно пить фруктовые соки и ягодные компоты. Полезны щелочные минеральные воды. Лечение минеральными водами проводится в течение 4–6 недель с перерывами от 3 месяцев до полугода. Минеральные воды заметно повышают растворимость уратов и способствуют их выведению из организма. Существенное значение в предупреждении повторных приступов подагры имеют нормальный образ жизни, достаточная физическая активность. После затухания острого приступа больным показаны лечебная физкультура и массаж. Для улучшения функции суставов на значаются курсы механотерапии. Полезна саунотерапия. Из физиотерапевтических процедур в межприступный период проводятся парафиновые или озокеритовые аппликации, назначаются диадинамические токи, ультразвук, электрофорез лития. Наличие у больного острого подагрического приступа служит основанием для освобождения его от работы и выдачи листка нетрудоспособности. Продолжительность временной нетрудоспособности определяется длительностью острого подагрического приступа и составляет, как правило, от 1 до 4 недель. При частых рецидивах суставных атак, возникающих несмотря на проводимое лечение, множественной деформации суставов, выраженных признаках вторичного остеоартроза, а также при развитии хронической почечной недостаточности больным подагрой в зависимости от характера профессии устанавливается III или II группа инвалидности. Прогноз при подагре определяется во многом уровнем гиперурикемии и адекватностью проводимого лечения. При умеренной гиперурикемии и соответствующем лечении прогноз довольно благоприятный. Эти люди на протяжении десятилетий сохраняют трудоспособность, а качество их жизни практически не страдает. Более тяжелое течение подагры наблюдается в следующих случаях: при ее возникновении в молодом возрасте, множественных поражениях суставов в начале заболевания, смешанном типе гиперурикемии. Тяжесть течения определяется частотой суставных атак, быстротой развития деформаций суставов и разрушения костей, характером поражения почек.
Профилактика Первичная профилактика подагры может проводиться у лиц со стойкой гиперурикемией. Им рекомендуют соблюдение диеты и систематическую физическую нагрузку. У больных подагрой профилактические мероприятия должны быть направлены на предупреждение новых суставных атак. Необходимо соблюдение диетических рекомендаций, исключение голодания, применения диуретиков, постоянный прием поддерживающих доз (100–200 мг) аллопуринола. Для сохранения функции почек больным уратной нефропатией показан длительный прием препаратов, способствующих растворению солей мочевой кислоты (уралит и др.).
ПОЛИОМИЕЛИТ ОСТРЫЙ ЭПИДЕМИЧЕСКИЙ
ОпределениеПолиомиелит острый эпидемический (детский спинальный паралич) — острое вирусное заболевание, обусловленное поражением клеток передних рогов спинного мозга и ядер двигательных черепных нервов, приводящее к развитию вялых параличей с арефлексией и атрофией мышц.
Этиология и патогенез Возбудитель — вирус полиомиелита, который вызывает острое воспаление тел периферических мотонейронов на высоте виремии. Вирус устойчив во внешней среде и действию различных неблагоприятных факторов: устойчив ко всем известным антибиотикам, выдерживает действие этилового спирта, лизола. Полиомиелит — очень высококонтагиозное заболевание. Источником является человек, больной бессимптомной формой. Основной путь передачи — фекально-оральный. Возбудитель проникает через рот, часто через грязные руки, посуду, воду. В определенном числе случаев вирус проникает через кишечный барьер, попадает в кровь, возникает виремия. В ряде случаев вирус проникает через гематоэнцефалический барьер и попадает в спинной мозг, вызывая повреждение двигательной иннервации. Иммунитет после полиомиелита пожизненный, типоспецифический.
Клиническая картина, диагностика и дифдиагностика Инкубационный период составляет в среднем 7—14 дней. Затем на фоне общеинфекционных и оболочечных симптомов развиваются вялые параличи. В зависимости от преобладания пораженных мышц выделяют спинальную и бульбарную формы болезни. Наиболее опасное осложнение полиомиелита — дыхательные нарушения — может быть обусловлено либо параличом респираторных мышц, либо поражением бульбарных ядер. Их вовлечение в процесс иногда сопровождается артериальной гипер- или гипотензией, тахикардией. По распространенности параличи очень различны: наблюдаются моно-, паратетраплегии с различной степенью вовлечения в процесс бульбарной мускулатуры и мускулатуры туловища. В цереброспинальной жидкости — лимфоцитарный плеоцитоз при нормальном содержании белка и глюкозы; в 5 % случаев жидкость нормальная. Диффузная мышечная слабость прогностически значительно более благоприятна, чем грубые параличи нескольких важных мышц; наиболее серьезен бульбарный паралич (10–20 % всех случаев болезни). Смертность от полиомиелита не превышает 5—10 %, но резидуальные явления у ряда больных остаются пожизненно. Осложнениями острого периода могут быть пневмонии, инфекция мочевых путей, отек легких; в резидуальной стадии — деформации скелета из-за паралича мышц, остеопороз, уролитиаз (у лежачих больных). Дифференциальный диагноз абортивных и непаралитических форм полиомиелита с серозным менингитом, вызванным энтеровирусами, труден и без вирусологического исследования возможен только при эпидемической вспышке полиомиелита.
Паралич обеих ног и парез левой руки
Поражения мышц плечевого пояса слева
Диагностически сложна дифференцировка с полирадикулоневропатией Гийена-Барре, при которой также остро появляются вялые параличи, но в цереброспинальной жидкости, как правило, с первых дней болезни повышено содержание белка (белково-клеточная диссоциация); кроме того, в некоторых случаях параличам сопутствует выпадение чувствительности по типу «перчаток» и «носков».
Лечение и профилактика Лечение симптоматическое; при появлении дыхательной недостаточности показана искусственная вентиляция легких. В восстановительном периоде — массаж, лечебная физкультура. Контагиозность полиомиелита очень высока; больных необходимо помещать в специализированные стационары. Обязательная вакцинация в детском возрасте проводится пероральной вакциной Сейбина. Лица, имевшие тесный контакт с больным (дети в возрасте до 15 лет и взрослые), подлежат однократной иммунизации живой полиомиелитной вакциной немедленно. Благодаря вакцинации полиомиелит в России в настоящее время практически не встречается.
ПОЛИПЫ И ПОЛИПОЗ
ОпределениеПолипы относят к доброкачественным новообразованиям, исходящим из эпителия, однако они склонны к малигнизации (озлокачествлению).
Этиология Наиболее часто полипы локализуются в желудке, затем в прямой и ободочной кишке, реже в пищеводе, двенадцатиперстной и тонкой кишке. Различают железистые, или аденоматозные, полипы, гиперпластические, или гиперрегенераторные, и воспалительно-фиброматозные полипы. К настоящим опухолям относят аденоматозные (0,5 %) и пограничные (7 %) полипы, к опухолеподобным образованиям — гиперпластический (90 %) и воспалительно-фиброматозный (около 3 %) полипы.
Полипы и полипоз желудка Полипы локализуются преимущественно в пилорическом отделе, реже — в теле и еще реже — в проксимальном (верхнем) отделе желудка. Диаметр полипов варьирует от нескольких миллиметров до 5 см. По форме они могут быть шаровидными, овальными, реже сосочкообразными, грибовидными, в виде цветной капусты. Опухоль свисает на ножке в просвет желудка или расположена на широком основании. Различают одиночный полип, множественные полипы и полипоз желудка. О полипозе говорят в случаях, когда их невозможно сосчитать. В механизме развития полипов решающее значение отводят нарушению регенераторного процесса в слизистой оболочке. Аденоматозный полип относят к предраковому заболеванию желудка. Гиперпластические полипы представляют начальную стадию аденом, возникновение в них рака тоже возможно. Наиболее вероятна малигнизация полипа больших размеров. Малигнизация полипов тела и кардии желудка происходит чаще (62,4 %), чем малигнизация полипов, локализующихся в его антральном отделе (35,5 %).
Полипы и полипоз ободочной и прямой кишки Среди всех проктологических больных полипы обнаруживают у 10–12 %, а среди лиц, которым при профилактическом осмотре выполняют ректороманоскопию — у 2–4 %. Мужчины заболевают в 2–3 раза чаще, чем женщины. Полипы могут быть одиночными и множественными. Обычно их диаметр составляет 0,5–2,0 см, но изредка они достигают 3–5 см и более. Полипы имеют ножку и свисают в просвет кишки, реже расположены на широком основании. Выделяют ювенильные, гиперпластические, аденоматозные (железистые), ворсинчатые полипы, ворсинчатые опухоли, а также множественный полипоз толстой кишки (истинный и вторичный). Ювенильные полипы наблюдаются преимущественно у детей. Чаще поражается слизистая оболочка прямой кишки. Макроскопически полипы имеют вид виноградной грозди, обладающей ножкой, поверхность их гладкая, окраска более интенсивная по сравнению с окружающей неизмененной слизистой оболочкой. Они являются характерными железисто-кистозными образованиями с преобладанием стромы над железистыми элементами. Как правило, ювенильные полипы не малигнизируются. Гиперпластические полипы — мелкие (2–4 мм) образования, чаще имеют форму конуса. В гиперпластических полипах сохраняется нормальное строение слизистой оболочки кишки с правильными строением и ориентацией желез при значительном увеличении их числа, за счет чего и создается впечатление об утолщении слизистой оболочки в виде полипа. Малигнизируются очень редко. Аденоматозные (железистые) полипы наблюдаются наиболее часто. Аденоматозный полип имеет вид опухоли округлой формы на ножке или без нее, с гладкой поверхностью. Представляет собой участок гиперплазии слизистой оболочки, построен из разнообразных по форме желез, нередко кистозно расширенных, выстланных цилиндрическим эпителием. Эти полипы часто малигнизируются (чем больше размеры полипа, тем чаще выявляют малигнизацию). Полипы размерами более 2 см малигнизируются в 50 % случаев. Ворсинчатый полип (аденопапиллома) покрыт тонкими нежными ворсинками. Частота малигнизации достигает 30–35 %. Ворсинчатые полипы имеют дольчатое строение, поверхность их бархатистая, покрыта множеством ворсин. Ворсинчатая опухоль — дольчатое новообразование с бархатистой поверхностью, розовато-красного цвета, выступающее в просвет кишки, расположенное на широком основании (узловая форма). Одной из разновидностей ворсинчатых опухолей является стелющаяся, ковровая форма, при которой опухолевого узла нет. В таком случае процесс распространяется по поверхности слизистой оболочки, занимая иногда довольно большую площадь по всей окружности кишки и проявляясь ворсинчатыми или мелкодольчатыми разрастаниями. Наиболее часто ворсинчатые опухоли локализуются в прямой и сигмовидной ободочной кишке. Размеры ворсинчатых опухолей 1,5–5 см. Склонность к малигнизации ворсинчатых опухолей очень большая (до 90 %). Среди всех новообразований толстой кишки они составляют около 5 %.
Клиническая картина и диагностика Полипы и полипоз желудка Полипы могут существовать бессимптомно или проявляться признаками атрофического гастрита, на фоне которого они возникли. Боль ноющего характера возникает сразу после приема пищи или через 1–3 ч. Аппетит понижен. Наблюдается отрыжка, неустойчивый стул. Слабость, головокружение могут быть обусловлены анемией, развивающейся вследствие ахилии или хронической кровопотери при изъязвлении полипа. Иногда изъязвившиеся полипы дают массивное кровотечение, проявляющееся рвотой с примесью крови. Повышение температуры тела возможно при инфицировании полипа в результате его некроза и изъязвления. Симптомы нарушения эвакуации из желудка могут возникать при больших полипах, локализующихся вблизи привратника. Иногда наблюдается пролабирование полипа в двенадцатиперстную кишку и его ущемление. Это вызывает сильную боль схваткообразного характера, сопровождающуюся рвотой желудочным содержимым без примеси желчи. При таком осложнении, являющемся разновидностью острой высокой тонкокишечной непроходимости, показана экстренная операция. Обтурация двенадцатиперстной кишки выпавшим из желудка полипом может иметь интермиттирующий характер. При рентгенологическом исследовании желудка выявляют дефект наполнения округлой или овальной формы с четкими ровными контурами. Смещаемость дефекта наполнения наблюдается в тех случаях, когда полип имеет ножку. При ворсинчатой опухоли (полипе) дефект наполнения имеет изъеденные расплывчатые контуры. При полипозе желудка выявляют множественные дефекты наполнения различной величины округлой или овальной формы с четкими контурами. Для точной диагностики полипов необходима гастроскопия с бипосией. Для этого берут несколько кусочков ткани, а при неясной картине, при аденоматозных полипах для исследования удаляют весь полип, как при полипах толстой кишки. Подозрение на злокачественный характер роста вызывают крупные полипы на широком основании, неровность и изъязвление поверхности, инфильтрация слизистой оболочки вокруг ножки полипа. Окончательный диагноз возможен только после электроэксцизии, проведения цитологического и гистологического исследования.
Полипы и полипоз ободочной и прямой кишки Одиночные полипы иногда протекают бессимптомно или являются причиной жалоб больных на выделение крови и слизи из прямой кишки, боли в животе, запор, понос, кишечный дискомфорт. Эти симптомы не являются патогномоничными для полипов, поэтому для выявления их необходимы пальцевое исследование прямой кишки, ректороманоскопия, колоноскопия, ирригография. Биопсия полипов необходима для определения их гистологической структуры, наличия или отсутствия малигнизации. Ворсинчатые опухоли толстой кишки проявляются выделением слизи при дефекации, причем количество слизи может быть значительным и достигать 1–1,5 л в сутки, что приводит к водно-электролитным расстройствам. Вследствие легкой ранимости ворсин опухоли почти у всех больных возникает кровотечение. К другим симптомам заболевания относят боли в животе, запор, понос, кишечный дискомфорт. Множественный полипоз толстой кишки бывает врожденным семейным и вторичным (как результат других поражений толстой кишки, например колита). Частота малигнизации при полипозе достигает 70—100 %, т. е. он является облигатным предраком. Врожденный семейный полипоз передается по наследству, поражая несколько членов семьи. Заболевание обычно выявляют у детей и людей молодого возраста. Частота малигнизации приближается к 100 %. Сочетание множественного полипоза толстой кишки с доброкачественными опухолями мягких тканей и костей называют синдромом Гарднера. Сочетание полипоза пищеварительного тракта с пигментными пятнами на слизистой оболочке щек, вокруг рта и на коже ладоней называют синдромом Пейтца-Джигерса; в детском возрасте он протекает бессимптомно. Для множественного полипоза толстой кишки характерны боли в животе без четкой локализации, понос, выделение крови и слизи с калом, похудение, анемия. Диагностику заболевания проводят на основании клинических симптомов и анамнестических данных, а также ректо- и колоноскопии, ирригографии.
Лечение Полипы и полипоз желудка Аденоматозный полип независимо от его величины и локализации удаляют путем эндоскопической электроэксцизии. Если при гистологическом исследовании удаленного полипа выявлена его малигнизация, то показана радикальная резекция желудка, как при раке. При распространенном полипозе желудка показана резекция или гастроэктомия в пределах здоровой ткани. При гиперпластических полипах ограничиваются удалением их через эндоскоп с последующим повторным контролем.
Полипы и полипоз ободочной и прямой кишки Выбор метода лечения полипов и множественного полипоза толстой кишки должен быть индивидуализирован. Одиночные полипы удаляют путем электрокоагуляции через ректо- или колоноскоп. Электрокоагуляция допустима и для удаления ворсинчатых опухолей с хорошо выраженной ножкой при отсутствии малигнизации. При малигнизации ворсинчатой опухоли выполняют радикальную операцию, объем которой определяется локализацией опухоли (право- или левосторонняя гемиколэктомия, резекция сигмовидной ободочной кишки). При клеточной атипии верхушки полипа без инвазии мышечной пластинки слизистой оболочки радикальной операцией является клиновидное иссечение стенки кишки в зоне полипа. При врожденном семейном полипозе толстой кишки выполняют субтотальную колэктомию с наложением илеоректального или илеосигмовидного анастомоза. При локализации множественных полипов на ограниченном участке производят резекцию пораженного отдела.
ПОРОКИ РАЗВИТИЯ
ОпределениеК порокам развития относятся пороки развития сосудов, различных внутренних органов, а также пороки развития шеи, молочных желез.
Пороки развития сосудов Флебоангиодисплазии — пороки развития вен, клинически проявляющиеся в детском и молодом возрасте. Они сопровождаются выраженными нарушениями кровообращения пораженной конечности, являясь причиной ранней инвалидизации больных. Артериовенозные дисплазии — порок развития кровеносных сосудов, характеризующийся наличием патологических соустий между артериями и венами (врожденные артериовенозные свищи). Гемангиомы — доброкачественные опухоли, развивающиеся из кровеносных сосудов. Различают капиллярные, кавернозные, рацемозные и смешанные формы гемангиом. Коарктация аорты — врожденное сегментарное сужение аорты, создающее препятствие кровотоку в большом круге кровообращения. Заболевание у мужчин встречается в 4 раза чаще, чем у женщин.
Пороки развития пищевода, диафрагмы и пищеводного отверстия диафрагмы Частота врожденных аномалий развития пищевода составляет 1:1000 новорожденных. Атрезия пищевода — полное отсутствие просвета пищевода на каком-либо участке или на всем его протяжении. Атрезия в 40 % случаев сочетается с другими пороками развития. Стеноз пищевода — порок развития, связанный с внутренним сужением пищевода, или сдавлением его извне. Удвоение пищевода — порок развития пищевода, связанный с удвоением части пищевода. Врожденная халазия (недостаточность) кардии — следствие недоразвития нервномышечного аппарата нижнего пищеводного сфинктера или выпрямления угла Гиса. Врожденный короткий пищевод — порок развития, при котором часть желудка оказывается расположенной выше диафрагмы.
Пороки развития желудка и двенадцатиперстной кишки Пилоростеноз — сужение привратника желудка. Наиболее частый порок развития. Дивертикулы желудка и двенадцатиперстной кишки представляют выпячивание стенки полого органа в форме мешка или воронки. Дуоденостаз — нарушение пассажа (продвижения) содержимого по двенадцатиперстной кишке.
Пороки развития печени и селезенки Аномалии формы печени проявляются в виде изменения размеров различных ее отделов, глубины борозд, появления добавочных долей. Все эти аномалии не имеют характерных клинических симптомов. Редко выявляют гипоплазию или агенезию печени. Ряд доброкачественных новообразований и кист (см.) печени также являются пороками развития. К порокам развития селезенки относятся врожденное отсутствие селезенки, удвоение селезенки, добавочные селезенки.
Пороки развития поджелудочной железы Добавочная поджелудочная железа встречается очень редко. Как правило, она не связана с основной тканью железы и располагается в стенках желудка или двенадцатиперстной кишки, брыжейке, дивертикуле подвздошной кишки. Кольцевидная поджелудочная железа — редкий порок развития, при котором нисходящая часть двенадцатиперстной кишки оказывается частично или полностью окруженной тканью головки поджелудочной железы; двенадцатиперстная кишка при этом сужена, что является причиной частичной хронической дуоденальной непроходимости.
Пороки развития трахеи Атрезия трахеи — частичное или полное отсутствие ее просвета. Ребенок с этим пороком развития погибает сразу после рождения. Врожденные трахеальные свищи представляют собой разновидность жаберных или бронхогенных свищей шеи. Они могут быть полными (открываться на кожу и в трахею) или неполными (открываться только на кожу — наружные свищи или в трахею — внутренние свищи). Чаще наблюдаются неполные наружные свищи.
Пороки развития легких Пороки развития легких могут формироваться как в дородовом периоде, так и в течение первых лет жизни ребенка. Различают пороки развития бронхиального дерева и легочной паренхимы и пороки развития сосудов легких. К порокам развития бронхиального дерева и легочной паренхимы относятся: агенезия, аплазия, гипоплазия, врожденные стенозы бронхов, легочная секвестрация, врожденная долевая эмфизема, киста легкого. Агенезия — полное отсутствие легкого; аплазия — отсутствие легкого при наличии рудиментарного бронха, заканчивающегося слепо. Гипоплазия — недоразвитие всего легкого или его доли. Легочная секвестрация — аномалия развития легкого, при которой участок его ткани формируется изолированно от бронхиальной системы и снабжается аберрантными (отклоняющимися) артериями, отходящими справа непосредственно от аорты, а слева — от межреберных артерий. Венозный отток осуществляется обычно в легочную вену, реже — в непарную вену. Врожденная долевая эмфизема легких характеризуется дефектом развития хрящевых колец долевого (или сегментарного) бронха. Возможны также перегиб бронха, сдавление сопровождающих его сосудов, увеличение слизистой оболочки, приводящие к частичному нарушению проходимости бронхов. Кисты легкого — врожденные единичные или множественные полости (сотовые легкие), выстланные изнутри эпителием. К порокам развития сосудов легких относятся аплазия, гипоплазия сосудов легких, артериовенозные свищи и аневризмы. Аплазия и гипоплазия — отсутствие или недоразвитие сосудов легкого. Артериовенозные аневризмы (см.) и свищи — наличие прямого патологического сообщения между легочной артерией и веной.
Пороки развития шеи Кривошея — деформация шеи, характеризующаяся неправильным положением головы (ее отклонением от срединной линии тела). Срединные кисты и свищи шеи располагаются по средней линии шеи или вблизи нее, возникают при незаращении щитовидноязычного протока в процессе развития и опускания на шею зачатка щитовидной железы. Бронхогенные кисты и свищи (боковые или жаберные) — врожденные кисты и свищи в тканях шеи, расположенные по внутреннему краю грудино-ключично-сосцевидной мышцы.
Пороки развития молочных желез Амастия — отсутствие одной или обеих молочных желез. Моноамастия — одностороннее отсутствие молочной железы. Анизомастия — компенсаторная гиперплазия второй молочной железы при аплазии первой. Полимастия — добавочные молочные железы. Полителия — добавочные соски.
Этиология и патогенез Пороки развития сосудов Дисплазии глубоких вен нижних конечностей — одна из врожденных форм ангиодисплазий нижних конечностей, в основе которой лежит частичная или полная непроходимость основных вен (обычно подколенной или бедренной). Наиболее частой причиной блока глубоких вен является врожденное сдавление вен фиброзными тяжами, аберрантными (отклоняющимися) артериальными ветвями, атипично расположенными мышцами. Врожденное отсутствие (аплазия) или недоразвитие (гипоплазия) глубоких вен также является причиной их непроходимости. Повышение давления в венозных отделах микроциркуляторного русла ведет к раскрытию артериоловенулярных анастомозов (сообщений), что ухудшает кровообращение в терминальном сосудистом русле. Возникают отек, лимфостаз пораженной конечности, тяжелая гипоксия, трофические изменения тканей. Артериовенозные дисплазии встречаются редко и локализуются чаще на конечностях, могут располагаться на голове, шее, лице, в легких, головном мозге. Различают распространенную форму поражения того или иного сегмента конечности и локальную, располагающуюся чаще на голове. Артериовенозные дисплазии могут сочетаться с другими пороками развития, например с гемангиомой кожи, лимфангиомой, аплазией и гипоплазией глубоких вен и т. д. (синдромы Клиппеля-Треноне и Паркса-Вебера). Артериовенозные соустья часто бывают множественными, имеют разнообразный калибр и форму. В зависимости от диаметра различают макрофистулы, заметные невооруженным глазом, и микрофистулы, которые выявляются только при исследовании тканей конечности. Соустья с наличием нарушения в нижних конечностях чаще располагаются по ходу бедренной и большеберцовой артерий, а также в бассейне подколенной артерии. Значительная часть артериальной крови при наличии свищей поступает в венозное русло, минуя капиллярную сеть, поэтому возникает тяжелая кислородная недостаточность в тканях, нарушаются обменные процессы. Стойкие анатомические изменения конечности у детей наступают чаще к 10–12 годам, становясь причиной инвалидизации больных. Из-за повышенного венозного давления увеличивается нагрузка на правые отделы сердца, сердечная мышца увеличивается в размерах, возрастают ударный и минутный объемы сердца. Однако по мерепрогрессирования заболевания сократительная функция миокарда начинает ослабевать, происходит миогенная дилатация (растяжение) сердца с расширением его полостей. Капиллярные гемангиомы поражают только кожу конечностей и других частей тела, состоят из расширенных, извитых, тесно расположенных капилляров, выстланных хорошо дифференцированным эндотелием. Кавернозные гемангиомы состоят из расширенных кровеносных сосудов и множества разнообразных по размерам полостей, выстланных одним слоем эндотелия, наполненных кровью и сообщающихся друг с другом анастомозами. Рацемозные гемангиомы представляют собой аномалию развития сосудов в виде сплетения утолщенных, расширенных и змеевидно извитых сосудов, среди которых часто встречаются обширные кавернозные полости. Обе последние формы гемангиом располагаются не только в коже и подкожной клетчатке, но и в глубжележащих тканях, включая мышцы и кости. Имеется возможность превращения гемангиомы в злокачественное новообразование. Причины развития коарктации аорты заключаются в неправильном слиянии аортальных дуг в эмбриональном периоде. Сужение располагается у места перехода дуги аорты в нисходящую аорту, что обусловливает появление в большом круге кровообращения двух его режимов. Ближе к месту сужения артериальное давление повышено, дальше от места сужения — понижено. Это приводит к развитию компенсаторных механизмов, направленных на нормализацию нарушений кровообращения: увеличению ударного и минутного объемов сердца, увеличению миокарда левого желудочка, расширению сети коллатералей (дополнительные сосуды в обход основного пути). При хорошем развитии коллатеральных сосудов в нижнюю половину тела поступает достаточное количество крови. Это объясняет отсутствие у детей значительного повышения артериального давления. В период полового созревания на фоне быстрого роста организма имеющиеся коллатерали не в состоянии обеспечить соответствующий кровоток, и артериальное давление ближе к месту коарктации резко повышается. В механизме развития синдрома устойчиво высокого артериального давления имеет значение и уменьшение пульсового давления в почечных артериях, которое влияет на юкстамедуллярный аппарат почек, ответственный за включение вазопрессорного механизма. Сужение аорты располагается, как правило, дальше места отхождения левой подключичной артерии. Протяженность поражения составляет 1–2 см. Восходящая аорта и ветви дуги аорты расширяются. Значительно увеличивается диаметр и истончаются стенки артерий, участвующих в коллатеральном кровообращении, что предрасполагает к образованию аневризм. Последние нередко возникают и в артериях головного мозга, чаще встречаются у больных старше 20 лет. От давления расширенных и извитых артерий на нижних краях ребер образуются узуры (своеобразные деформации). При тканевом исследовании участка коарктации выявляют уменьшение количества эластических волокон, замещение их соединительной тканью.
Пороки развития пищевода, диафрагмы и пищеводного отверстия диафрагмы Пороки развития пищевода, диафрагмы и пищеводного отверстия диафрагмы могут быть причиной изменения формы и положения желудка. При задержке опускания желудка в сочетании с нарушением развития пищеводного отверстия диафрагмы формируются пороки развития типа врожденного короткого пищевода — «грудного» желудка, параэзофагеальной (околопищеводной) грыжи (см.). Стеноз пищевода может развиться в результате увеличения мышечной оболочки, наличия в стенке пищевода фиброзного или хрящевого кольца, образования слизистой оболочкой тонких мембран (внутренние стенозы) или сдавления пищевода извне кистами (см.), аномальными сосудами. Удвоение пищевода — редкая аномалия. Просвет удвоений может быть изолированным или иметь сообщение с основным каналом пищевода, заполнен секретом, выделяемым их слизистой оболочкой. Иногда они имеют вид кист (см.), которые могут сообщаться с трахеей или бронхом. По мере их роста развиваются симптомы сдавления пищевода и дыхательных путей, у больных отмечаются нарушение глотания, кашель (см.), одышка.
Пороки развития желудка и двенадцатиперстной кишки. Дивертикулы желудка и двенадцатиперстной кишки Пульсионные дивертикулы возникают в результате давления на стенки из полости органа. Образуются они вследствие недостаточности мышечной и эластической ткани стенки органа при врожденной неполноценности, в результате снижения мышечного тонуса и механической прочности соединительнотканного каркаса при старении, а также атрофии после травмы и воспаления. Пульсионные дивертикулы имеют мешковидную форму. Тракционные дивертикулы возникают вследствие тяги за стенку полого органа снаружи (рубец). Они имеют воронкообразную форму; со временем, увеличиваясь в размерах, могут приобретать мешковидную форму. Величина дивертикулов различна: от едва заметных выпячиваний стенки до 5 см в диаметре. Входное отверстие может быть узким или широким. Дивертикулы бывают одиночными и множественными. Изнутри дивертикул выстлан слизистой оболочкой, в стенках имеются элементы органа, но со временем они замещаются соединительной тканью. Дивертикулы в желудке расположены преимущественно в субкардиальной части на задней стенке (до 70 %) и в двенадцатиперстной кишке, чаще нисходящей ее части (до 90 %). Дуоденостаз развивается вследствие органических и функциональных нарушений двенадцатиперстной кишки. Причинами дуоденостаза являются аномалии двенадцатиперстной кишки поджелудочной железы, опущение кишки с образованием угла в области связки Трейтца, сдавление ее верхней брыжеечной артерией. Функциональный дуоденостаз возникает при различных заболеваниях системы пищеварения и поражениях центральной нервной системы.
Пороки развития печени и селезенки Пороки развития печени встречаются редко. Аномалии положения органа наблюдаются при обратном расположении внутренних органов и дефектах развития связочного аппарата. Добавочные селезенки являются наиболее частым пороком развития и локализуются в области ворот, в ее связках и большом сальнике. К пороку развития можно отнести и так называемую блуждающую селезенку, обладающую чрезмерной подвижностью вследствие удлинения ее ножки. Однако это может произойти и в постнатальном периоде (после рождения) вследствие увеличения селезенки.
Пороки развития кишечника Аномалии и пороки развития тонкой кишки возникают вследствие нарушений развития в эмбриональном периоде и проявляются в виде врожденных стенозов, атрезий или аномалий вращения кишки. Аномалии развития тонкой кишки наблюдаются у 1 на 2500–3000 родившихся детей. При стенозе просвет кишки может быть сужен весьма значительно, но всегда в большей или меньшей мере сохранен, в то время как при атрезии он отсутствует вовсе на большем или меньшем протяжении, где кишка имеет вид фиброзного тяжа. На протяжении кишки может быть несколько таких участков. Выраженные стеноз кишки и атрезия проявляются симптомами непроходимости кишечника (см.) в первые дни после рождения ребенка и требуют хирургического вмешательства, направленного на восстановление нормального пассажа (продвижения) химуса по кишке. Среди аномалий тонкой кишки значительное место занимают пороки, связанные с нарушением обратного развития желточного протока, который в период внутриутробной жизни соединяет кишечную трубку с желточным мешком (пузырем). К 3-му месяцу развития плода желточный проток постепенно зарастает соединительной тканью и исчезает, а кишка полностью теряет связь с пупком. В результате нарушений эмбриогенеза (внутриутробного развития) проток может: — остаться открытым на всем протяжении; он в этом случае имеет свищ, через который содержимое тонкой кишки поступает наружу; — остаться незаращенным лишь на участке у пупка при полном его заращении у кишки; в этом случае из пупка постоянно выделяется слизь, которая вырабатывается слизистой оболочкой, выстилающей оставшуюся незаращенной часть желточного протока («мокнущий пупок»); — зарасти у пупка и у кишки, но сохраниться на каком-либо участке между ними; это ведет к накоплению в образовавшейся здесь замкнутой полости слизи с образованием истинной кисты (см.); — остаться незаращенным лишь у стенки тонкой кишки при полном его исчезновении на остальных участках; в таком случае образуется дивертикул подвздошной кишки (меккелев дивертикул). Наличие незаращенного на всем протяжении, у пупка или на ограниченном участке (с развитием кисты) желточного протока является показанием к удалению этого образования. Аномалии вращения (нарушения поворота кишки, незавершенный поворот) возникают при нарушении нормального поворота кишки в эмбриональном периоде, когда поворот не заканчивается, протекает неправильно или в обратном направлении, при фиксации различных отделов кишечника эмбриональными тяжами в аномальном положении. Незавершенный поворот кишки характеризуется высоким расположением слепой кишки в верхней части живота или под печенью, причем кишка фиксирована в этом положении спайками. Аномалии и пороки развития толстой кишки. Дистопии (аномалии положения) ободочной кишки возникают при нарушениях развития в эмбриональном периоде, вследствие чего возможно расположение всей кишки в левой или правой половине брюшной полости. Увеличение длины ободочной кишки может захватывать все ее отделы или ограничиваться какими-то ее участками. В таком случае нарушается моторно-эвакуаторная функция кишки и наступают запоры (см.), метеоризм (см.), боли в животе. Стенозы и атрезии сигмовидной кишки могут быть одиночными и множественными. Удвоение участка или всей ободочной кишки встречается очень редко. Врожденные аномалии прямой кишки встречаются в виде полной атрезии или атрезии со свищами. При полных атрезиях выхода для содержимого кишечника нет. Выделяют атрезию заднего прохода, прямой кишки, заднего прохода и прямой кишки. При атрезии заднего прохода на его месте имеется тонкая кожа, которую легко можно вдавить внутрь пальцем. При атрезии прямой кишки на ее месте находится соединительная ткань. Заднепроходное отверстие при этом может отсутствовать, но может и быть. В последнем случае оно ведет в слепой карман глубиной 1–3 см. Атрезия прямой кишки иногда сочетается со свищами, соединяющими кишку с одним из органов таза: прямокишечно-влагалищная атрезия, прямокишечно-пузырная атрезия, прямокишечно-уретральная атрезия.
Пороки развития трахеи Врожденный стеноз трахеи может быть первичным вследствие сужения просвета трахеи или вторичным при ее сдавлении извне увеличенной вилочковой железой, врожденными кистами (см.) средостения, аномальными сосудами и т. д. При первичных стенозах перепончатая часть трахеи полностью или частично отсутствует; сама трахея плотная, с деформированными хрящевыми кольцами. Различают три вида стеноза: ограниченный циркулярный, воронкообразный и распространенный.
Пороки развития легких Агенезия и аплазия могут быть одно- и двусторонними, несовместимы с жизнью и встречаются редко. Агенезия и аплазия доли встречаются еще реже и специального лечения не требуют. Различают простую и кистозную формы гипоплазии. При простой форме легкое или его доля уменьшены в размерах, бронхи сужены. Врожденные стенозы бронхов — редко наблюдающийся порок развития. Как и при стенозе трахеи, различают две формы: компрессионные стенозы, возникающие при давлении извне (ветвями сосудов и др.), и стенозы, обусловленные образованием внутренней диафрагмы, препятствующей нормальной вентиляции легкого или его доли. Легочная секвестрация: различают внутридолевую легочную секвестрацию (85 % случаев), при которой участок легкого, не связанный с бронхиальным деревом, находится в толще доли, и внедолевую легочную секвестрацию, при которой этот участок расположен вне легкого, имеет собственный плевральный мешок и соединен с легким лишь перемычкой из соединительной ткани. Иногда при этом обнаруживают шунт (анастомоз, сообщение) со сбросом крови слева (из артерий) направо, что сопровождается перегрузкой правых отделов сердца. Легочная секвестрация обычно наблюдается в заднемедиальных отделах нижних долей легкого, чаще слева. При врожденной долевой эмфиземе легких образование вентильного механизма ведет к резкому вздутию паренхимы легкого. Вздутие части легкого приводит к сдавлению соседних его отделов и смещению средостения. Артериовенозные свищи и аневризмы могут быть множественными и располагаться как на крупных сосудах, так и на уровне артериол. Иногда они образуют скопления аневризматически расширенных сосудов по типу гемангиомы. Располагаются преимущественно в нижних долях легких. Морфологически представляют собой выстланные эндотелием тонкостенные, легко повреждающиеся полости.
Пороки развития шеи Гипопластическая кривошея обусловлена врожденным недоразвитием трапециевидной и грудино-ключично-сосцевидной мышцы. Мышечная кривошея обусловлена поражением мышц шеи — дисплазией или воспалительным процессом. Заболевание является наследственным; девочки поражаются чаще, чем мальчики. Срединные кисты и свищи шеи — при неполном заращении щитовидно-язычного протока вследствие накопления секрета в его полости, выстланной эпителием, образуются срединные кисты (см.) по ходу протока. Локализация кист и свищей шеи: — срединная киста; — бронхогенный эктодермальный свищ; — бронхогенная киста; — дермоид; — кистозная лимфангиома. Срединные кисты (см.) располагаются по средней линии шеи между слепым отверстием языка и перешейком щитовидной железы. Срединные кисты, расположенные ниже подъязычной кости, обычно фиксированы к ней. При сообщении щитовидно-язычного протока с полостью рта возможно инфицирование кист. При спонтанной перфорации инфицированной кисты образуются свищи. Бронхогенные кисты и свищи шеи. Причина возникновения неясна. Считают, что они формируются из нередуцированных жаберных борозд и карманов зародыша.
Клиническая картина и диагностика Пороки развития сосудов При наличии у ребенка ангиодисплазий родители обращают внимание на наличие сосудистых пятен на коже конечности ребенка после рождения. Ко 2—3-му году жизни появляются резко расширенные вены в бассейнах большой и малой подкожных вен, к 6–7 годам присоединяются гипертрофия мягких тканей, лимфостаз, удлинение конечности. Диагноз ставят на основании клинической картины и данных флебографического исследования. Дифференциальный диагноз проводят с врожденными артериовенозными свищами, исключить которые помогают результаты артерио- и флебографического исследований. Клиническая симптоматика при наличии артериовенозных дисплазий обусловлена нарушениями регионарного и центрального кровообращения. Основными симптомами являются увеличение и удлинение пораженной конечности, гипергидроз (повышенная влажность), наличие варикозно-расширенных вен и обширных сине-багровых пятен, боли при физической нагрузке, усталость и чувство тяжести в конечностях. Для врожденных артериовенозных свищей типичны повышение температуры кожи в области поражения, непрерывный сосудистый шум в том или ином сегменте либо на всем протяжении конечности вдоль проекции сосудистого пучка. Нарушения микроциркуляции приводят к развитию дерматитов (см.), образованию язв и омертвению нижних отделов конечности. Из язв могут возникать повторные кровотечения. При значительном сбросе артериальной крови в венозное русло развивается сердечная недостаточность (см.), проявляющаяся одышкой, сердцебиениями, аритмией (см.), отеками, развитием застойной печени, асцита (см.), анасарки (распространенный отек подкожной клетчатки). Для врожденных артериовенозных свищей характерно урежение пульса после пережатия приводящей артерии. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20–30 %. Наиболее важным методом диагностики врожденных артериовенозных свищей является ангиография. При введении контрастного вещества одновременно заполняется артериальное и венозное русло, отмечаются расширение просвета приводящей артерии, обеднение сосудистого рисунка дистальнее расположения свища и усиление контрастирования мягких тканей в области поражения. Эти признаки составляют основу ангиографической диагностики врожденных артериовенозных свищей. Основными симптомами глубоких гемангиом, прорастающих мышцы и кости, являются боли в пораженной конечности. Боли обусловлены сдавлением или вовлечением нервных стволов в процесс развития нарушения. Характерно также наличие опухоли мягкоэластической или плотноэластической консистенции без четких границ. При артериальных рацемозных гемангиомах иногда удается заметить пульсацию припухлости, а прощупыванием определить симптом «кошачьего мурлыканья». Обширные гемангиомы нередко сочетаются с врожденными артериовенозными свищами, сопровождаются увеличением в размерах мягких тканей, некоторым удлинением конечности и ведут к нарушению ее функции. Окраска кожи в области гемангиомы меняется от красной до темно-фиолетовой. При капиллярных гемангиомах она ярко-красная, а при поверхностно расположенных кавернозных и рацемозных ангиомах — от синюшной до ярко-багровой. Температура кожи в области расположения гемангиом повышена, что объясняется усиленным притоком артериальной крови и большим количеством кровеносных сосудов. Поверхностно расположенные кавернозные и рацемозные гемангиомы обычно мягкой консистенции, напоминающие губку, податливые при сжатии. Осложнениями гемангиом, расположенных в толще кожи и подкожной клетчатки, являются кровотечения, возникающие чаще при травмах. Кровотечения бывают значительными, если опухоль сообщается с крупными сосудами. Диагностика гемангиом основывается на клинических данных, результатах дополнительных исследований, среди которых наиболее информативной является артериография. Она позволяет выявить строение опухоли, ее протяженность и связь с магистральными артериями. Чтобы уточнить состояние глубоких вен пораженной конечности, а также выяснить, связаны ли они с гемангиомами, применяют флебографию. При рентгенологическом исследовании костей в случае давления сосудистой опухоли на костную ткань на рентгенограммах обнаруживают неровность контуров кости, истончение коркового слоя, наличие костных дефектов, иногда — остеопороз (см.) с мелкими очагами разрежения. Коарктация аорты. Часто до периода полового созревания заболевание протекает в стертой форме. В последующем у больных появляются головные боли, плохой сон, раздражительность, тяжесть и ощущение пульсации в голове, носовые кровотечения, ухудшаются память и зрение. Из-за перегрузки левого желудочка они испытывают боли в области сердца, сердцебиения, одышку. Недостаточное кровоснабжение нижней половины тела становится причиной быстрой утомляемости, слабости, похолодания нижних конечностей, болей в икроножных мышцах при ходьбе. При осмотре выявляют нарушение пропорций мышечной системы верхней и нижней половины тела за счет увеличения мышц плечевого пояса, усиленную пульсацию артерий верхних конечностей (подмышечной и плечевой), более заметную при поднятых руках, и грудной стенки (межреберных и подлопаточных). Всегда видна усиленная пульсация сосудов шеи, в подключичной области и яремной ямке. При прощупывании отмечают хорошую пульсацию на лучевых артериях и ее ослабление либо отсутствие на нижних конечностях. Для коарктации аорты характерны высокие цифры систолического артериального давления на верхних конечностях, составляющие у больных в возрасте 16–30 лет в среднем 180–190 мм рт. ст., при умеренно повышенном диастолическом давлении (до 100 мм рт. ст.). Артериальное давление на нижних конечностях или не определяется, или систолическое давление более низкое, чем на верхних конечностях, диастолическое же соответствует норме. При простукивании выявляют смещение границы относительной тупости сердца влево, расширение сосудистого пучка. При прослушивании над всей поверхностью сердца определяют грубый систолический шум, который проводится на сосуды шеи, в межлопаточное пространство и по ходу внутренних грудных артерий. Над аортой выслушивают акцент II тона. Данные реографии указывают на существенную разницу в кровенаполнении верхних и нижних конечностей. В то время как на верхних конечностях реографические кривые характеризуются крутым подъемом и спуском, а также высокой амплитудой, на нижних конечностях они имеют вид пологих волн небольшой высоты. Ряд признаков, присущих коарктации аорты, выявляют при рентгеноскопии. У больных старше 15 лет определяют волнистость нижних краев 3–4 ребер вследствие образования узур. В мягких тканях грудной стенки выявляют тяжи и пятнистость — тени расширенных артерий. В прямой проекции определяют расширение тени сердца влево за счет увеличенного левого желудочка, сглаженность левого и выбухание правого контура сосудистого пучка. При исследовании во второй косой проекции наряду с увеличением левого желудочка сердца выявляют выбухание влево тени расширенной восходящей аорты. Аортография по Сельдингеру помогает уточнить диагноз. На аортограммах выявляют сужение аорты, локализующееся на уровне IV–V грудных позвонков, значительное расширение ее восходящего отдела и левой подключичной артерии, достигающей зачастую диаметра дуги аорты, хорошо развитую сеть коллатералей, через которые ретроградно заполняются межреберные и верхние надчревные артерии.
Пороки развития пищевода, диафрагмы и пищеводного отверстия диафрагмы Клинически эти пороки развития проявляются болями в верхней части живота и за грудиной, изжогой, срыгиваниями и рвотой, обусловленными желудочно-пищеводным рефлюксом (обратным забросом содержимого) в связи с отсутствием замыкательной функции пищеводно-желудочного перехода. В первые часы и дни у новорожденных с атрезией пищевода отмечают постоянное выделение слюны и слизи изо рта и носа, могут возникать сильный кашель (см.), одышка и цианоз в результате проникновения содержимого пищевода в дыхательные пути. С началом кормления ребенок срыгивает нествороженное молоко. Небольшие стенозы пищевода длительное время протекают бессимптомно и проявляются нарушением глотания лишь при приеме грубой пищи. При выраженном стенозе отмечаются нарушения глотания, срыгивание во время и после еды, расширение пищевода. Клиническая картина врожденного короткого пищевода обусловлена недостаточностью кардии, сопровождающейся желудочно-пищеводным рефлюксом (обратным забросом содержимого). После кормления у детей возникают срыгивания, рвота — иногда с примесью крови в результате развития эзофагита (см.). Клиническая картина врожденного халазия кардии аналогична проявлениям врожденного короткого пищевода. Диагноз врожденной аномалии устанавливают при рентгенологическом исследовании, при котором в просвет пищевода по тонкому катетеру вводят 1–2 мл йодолипола. Исследование позволяет обнаружить слепой конец пищевода, уровень его расположения, протяженность и величину сужения, супрастенотическое расширение пищевода, наличие сообщения просвета пищевода с бронхами или трахеей. При удвоении пищевода отмечают дополнительную тень с четкими контурами, примыкающую к тени средостения и оттесняющую пищевод. При коротком пищеводе он не имеет изгибов, а часть желудка расположена выше диафрагмы. Недостаточность нижнего пищеводного сфинктера проявляется желудочно-пищеводным рефлюксом контрастного вещества во время исследования. Главную роль в диагностике пороков развития пищевода играют эзофаго- и бронхоскопия. Самым частым осложнением при врожденной атрезии, стенозах, пищеводно-трахеальных и бронхопищеводных свищах является аспирационная пневмония (см.). Атрезия пищевода может привести к голодной смерти ребенка, при стенозах развивается застойный эзофагит (см.). Сдавление бронхов удвоенным пищеводом вызывает повторные пневмонии (см.) и развитие бронхоэктазов (см.). При наличии кисты (см.) возможно ее нагноение и прорыв в дыхательные пути или плевральную полость. Выстилка кист из эктопированной слизистой оболочки желудка может подвергаться изъязвлению с развитием кровотечения и перфорации. При врожденном коротком пищеводе и недостаточности нижнего пищеводного сфинктера возникают рефлюкс-эзофагит, пептическая язва, а затем стриктура (сужение) пищевода; частым осложнением являетсяаспирационная пневмония (см.).
Пороки развития желудка и двенадцатиперстной кишки При пилоростенозе мышца привратника резко утолщена. У ребенка со 2—4-й недели жизни наблюдаются рвота желудочным содержимым, нарастающая потеря массы тела, обезвоживание, уменьшение выделения мочи, запор (см.). При осмотре живота через брюшную стенку выявляют усиленную перистальтику желудка. При рентгенологическом исследовании определяют стеноз привратника, задержку эвакуации пищи из желудка. Дивертикулы могут существовать бессимптомно. Клинические проявления возникают при дивертикулите (см.) (катаральный, язвенный, флегмонозный). Воспалительный процесс может распространяться на соседние органы и ткани. Возможны кровотечение, перфорация дивертикула с развитием перитонита (см.). Переполнение большого дивертикула содержимым может вызвать сдавление двенадцатиперстной кишки и нарушение ее проходимости. Дивертикулы верхней части двенадцатиперстной кишки при изъязвлении проявляются признаками пептической язвы (боль в верхней части живота, связанная с приемом пищи). Дивертикулы нисходящей части двенадцатиперстной кишки чаще располагаются на заднемедиальной стенке, прилегающей к головке поджелудочной железы, и нередко своим дном проникают в толщу ткани последней. Нарушения функций желчного пузыря, развитие печеночной колики (см.), желтухи (см.), желчнокаменной болезни (см.), панкреатита (см.) обусловлено близким соседством с большим сосочком двенадцатиперстной кишки (фатеровым соском) и протоком поджелудочной железы. Иногда в полость дивертикула открываются общий желчный проток и проток поджелудочной железы. Дивертикулы нижней части двенадцатиперстной кишки при переполнении и воспалении могут сопровождаться симптомами высокой обтурационной (вследствие закупорки) непроходимости кишечника (см.). Диагностируют дивертикулы при рентгенологическом и эндоскопическом исследованиях. На рентгенограммах выявляют дополнительную тень овальной или округлой формы, локализующуюся вне просвета органа и связанную с ним тонкой или широкой ножкой. После эвакуации контрастной массы дополнительная тень может исчезнуть или остаться на некоторое время. Дуоденостаз. При нарушении пассажа химуса (пищевого комка) по двенадцатиперстной кишке симптомы заболевания возникают по мере истощения компенсаторных возможностей ее моторики. Появляются чувство тяжести, распирания в верхней половине живота; боли в правом подреберье, не зависящие от приема пищи; тошнота, рвота, снижение аппетита, похудение. Диагноз ставят на основании анамнеза и рентгенологического исследования.
Пороки развития желчевыводящих протоков Атрезия внутри- или внепеченочных протоков и желчного пузыря. Основным проявлением атрезии протоков бывает обтурационная желтуха (см.), которая появляется у ребенка при рождении и прогрессивно нарастает. Быстро развивается билиарный цирроз (см.) печени с портальной гипертензией (см.) за счет внутрипеченочного блока. Появляются нарушения белкового, углеводного, жирового обмена, а также уменьшение активности свертывающей системы крови. Киста общего желчного протока. Для кисты (см.) общего желчного протока характерно расширение зоны общего печеночного и общего желчного протоков шаровидной или овальной формы размером от 3–4 до 15–20 см. Болезнь проявляется тупыми болями в верхней части живота и правом подреберье, обтурационной желтухой (см.) за счет застоя густой желчи в полости кистознорасширенного общего желчного протока. Диагностика сложна и требует применения современных инструментальных способов исследования: холангиографии, ультразвукового исследования, компьютерной томографии, лапароскопии.
Пороки развития поджелудочной железы Наиболее часто добавочные поджелудочные железы проявляются клиническими симптомами, обусловленными давлением на тот или иной орган, сужением просвета полого органа, кишечным кровотечением, развитием эндокринных опухолей (синдром Золлингера-Эллисона (см.)). Кольцевидная поджелудочная железа. Сужение двенадцатиперстной кишки может проявиться в детском возрасте, а иногда выявляется только у лиц зрелого возраста. Часто кольцевидная поджелудочная железа является случайной операционной находкой без клинических проявлений. Диагноз устанавливают с помощью рентгенологического исследования: обнаруживают скопление газа в желудке и в луковице двенадцатиперстной кишки при обзорной рентгеноскопии и сужение двенадцатиперстной кишки с расширением ее верхних отделов при проведении релаксационной дуоденографии.
Пороки развития кишечника Клинические нарушения вращения кишки характеризуются симптомами острой или (чаще) хронической непроходимости кишечника (см.). Основным методом диагностики является рентгенологический. Аномалии и пороки развития толстой кишки. Полная атрезия заднего прохода или прямой кишки проявляется симптомами кишечной непроходимости с первых дней после рождения ребенка: вздутие живота, неотхождение газов и кала, икота, отрыжка, рвота. Осмотр промежности позволяет поставить правильный диагноз. При атрезии со свищами отхождение кала происходит в необычном месте (через влагалище, уретру). При прямокишечно-пузырной атрезии моча мутная, перемешанная с калом. Стенозы и атрезии сигмовидной кишки проявляются вскоре после рождения ребенка симптомами непроходимости кишечника (см.)
Пороки развития трахеи Для первичного стеноза трахеи характерны затруднение дыхания, резко нарастающее при заболеваниях, сопровождающихся отеком слизистой оболочки трахеи; осиплость голоса, кашель (см.), синюшность. Диагноз ставят на основании данных бронхоскопии и томографического исследования в прямой и боковой проекциях.
Пороки развития легких При ангиографии при гипоплазии выявляют обеднение кровотока в 3–4 раза против нормы. При кистозной форме, кроме симптомов, характерных для простой формы, обнаруживают расширение сегментарных и субсегментарных бронхов, резкое уменьшение объема легочной паренхимы. Клинические проявления обусловлены тем, что из-за присоединения инфекции в расширенных бронхах развивается воспаление. Больные жалуются на кашель (см.) с мокротой, одышку, частые простудные заболевания. Наиболее информативным методом диагностики при гипоплазии легкого или его доли является бронхография. При простой гипоплазии четко выявляются уменьшение объема легкого или его доли, сужение просвета бронхов. При кистозной гипоплазии, помимо уменьшения объема легкого или его доли, видны кистозные полости, которыми заканчиваются сегментарные и субсегментарные бронхи. Излечение возможно только после удаления измененной части легкого. Симптомы при врожденном стенозе бронхов зависят от локализации стеноза. Нарушения дыхания более выражены при стенозе крупного бронха. Присоединение инфекции, развитие постстенотических бронхоэктазов (см.) обусловливают клиническую картину, характерную для бронхоэктатической болезни. Для легочной секвестрации характерны кашель с мокротой, астматические приступы при рецидивирующей пневмонии, реже кровохарканье. В секвестрированном отделе легкого появляются кисты (см.), заполненные содержимым. Они хорошо выявляются в виде затемнений при рентгенологическом исследовании. Проведение аортографии обязательно, так как она позволяет обнаружить атипично расположенные сосуды, идущие к этой части легкого. С помощью бронхоскопии необходимо исключить рак (см.) бронха. Клинические симптомы при врожденной долевой эмфиземе легких могут появиться сразу после рождения ребенка. Характерны одышка, кашель (см.), приступы асфиксии (см.) при кормлении. Нередко происходит присоединение инфекции с развитием пневмонии (см.). При хроническом течении наступает привыкание организма к условиям, вызванным лобарной (долевой) эмфиземой (см.), которая, достигнув определенного объема, перестает нарастать. Физикальное исследование в большинстве случаев дает возможность поставить предположительный диагноз: при осмотре отмечают выбухание грудной клетки соответственно области эмфиземы и расширение межреберных промежутков; при простукивании обнаруживают характерный звук. При рентгенологическом исследовании и компьютерной томографии видно усиление прозрачности и обеднение легочного рисунка в области эмфиземы. Кисты легкого — при заносе инфекции с лимфой или через бронхи, в результате разрыва стенок и появления пневмоторакса (см.), кровоизлияния в полость кисты (см.) вследствие аррозии сосуда кисты дают осложнения. Диагноз устанавливают при рентгенологическом исследовании и компьютерной томографии. Дифференцировать кисты следует от абсцессов (см.) и пневмоторакса (см.) другого происхождения. Аплазия и гипоплазия, обычно сочетающиеся с недоразвитием, отсутствием доли или всего легкого, эмфиземой (см.), пневмосклерозом (см.), бронхоэктазами (см.). При удовлетворительной функции второго легкого показано удаление отдела с развившимся нарушением. Артериовенозные свищи и аневризмы. Различают локализованные и распространенные поражения. Вследствие наличия артериовенозных свищей происходит сброс неоксигенированной (бедной кислородом) крови из легочных артерий в вены. Основными симптомами заболевания являются кислородная недостаточность, одышка, резкий цианоз, тахикардия (см.), изменения пальцев рук в виде барабанных палочек. В дальнейшем возможно развитие таких осложнений, как тромбоэмболия, кровотечение в плевральную полость или легкое. Для диагностики артериовенозной аневризмы применяют томографию, компьютерную томографию, ангиопульмонографию, которые позволяют обнаружить округлую гомогенную (однородную) тень, соединяющую два сосуда — артерию и вену.
Пороки развития шеи При гипопластической кривошее, если в течение первого года жизни спонтанного излечения не происходит, то нарушаются рост и развитие лица на стороне поражения с его асимметрией и деформацией; деформируется также череп, укорачиваются все мягкие ткани на пораженной стороне. Мышечную кривошею следует отличать от спастической, возникающей вследствие клонической и тонической контрактуры (стойкого ограничения движений) центрального генеза (происхождения), а также от рубцовой (приобретенной) кривошеи, вызванной грубыми послеожоговыми рубцами, воспалительным и ревматическим процессами, травмой и др. При срединных кистах киста растет медленно, имеет вид безболезненного округлого выпячивания, смещается при глотании вместе с трахеей. Кожа над ней не изменена, подвижна. Киста имеет гладкую поверхность, упругоэластическую консистенцию. Иногда удается определить плотный тяж, идущий от кисты к подъязычной кости. Размеры кисты могут периодически изменяться, если сохранено сообщение ее с полостью рта через щитовидно-язычный проток. В случае воспаления кисты появляется боль при глотании, возникает болезненное образование без четких границ, при нагноении и расплавлении мягких тканей образуется свищ. Иногда он формируется после нерадикального удаления кисты, а также после вскрытия нагноившейся кисты. К осложнениям кист относятся сдавление трахеи, злокачественное перерождение эпителия кисты у взрослых пациентов. Срединные кисты шеи следует отличать от эктопически расположенной (не спустившейся на свое место) щитовидной железы, имеющей вид и консистенцию плотного узла. В этом случае необходимо проводить сцинтиграфию щитовидной железы, так как при отсутствии нормальной щитовидной железы удаление эктопированной железы приведет к крайней степени гипотиреоза (см.) — микседеме. Бронхогенные кисты и свищи шеи. Боковая киста локализуется в верхнем отделе шеи впереди грудино-ключично-сосцевидной мышцы, на уровне бифуркации (раздвоения) общей сонной артерии, чаще слева. Она представляет собой округлое образование, четко отграниченное от окружающих тканей. Инфицирование кисты приводит к образованию полных и неполных свищей. При полных свищах имеются наружное и внутреннее отверстия, при неполных — только одно из них. Внутреннее отверстие чаще всего располагается в нёбной миндалине, наружное — на шее; последнее часто бывает открыто уже при рождении ребенка. Боковые кисты шеи следует отличать от лимфом различного генеза (происхождения), кистозной лимфангиомы, кист щитовидной железы, дермоидов и воспаления слизистой сумки, расположенной впереди подъязычной кости.
Пороки развития молочных желез Полимастия и полителия. Добавочные молочные железы и соски располагаются от подмышечной ямки до паховой области, но чаще локализуются в подмышечных ямках. В предменструальном периоде, во время беременности (см.) и кормления они набухают и становятся болезненными. В них чаще, чем в нормальных молочных железах, развиваются дисгормональные гиперплазии, доброкачественные и злокачественные опухоли. Микромастия — симметричное недоразвитие молочных желез при эндокринных заболеваниях, чаще встречается в детском возрасте. Макромастия — увеличение молочных желез — особенно выражено в детском возрасте, в период полового созревания и во время беременности (см.). Макромастия у девочек до 10 лет обусловлена заболеваниями эндокринной системы, вызывающими преждевременное половое созревание. У мальчиков макромастию можно наблюдать при гормонально-активных феминизирующих опухолях половых желез. Макромастия, возникшая в период полового созревания и во время беременности, быстро прогрессирует. Молочная железа может достигать громадных размеров. При макромастии, наступающей в активном репродуктивном периоде жизни женщины (вне беременности), рост молочной железы не имеет такого безудержного характера, как в период полового созревания и при беременности. Макромастия может быть истинной (увеличение железистой ткани) и ложной (чрезмерное развитие жировой ткани). Мастоптоз — опущение молочных желез. Потеря упругости тканей с возрастом способствует прогрессированию заболевания у тучных женщин, а также в случае резкого похудения. Появляются боль вследствие нарушения кровообращения, лимфостаза и отека, мацерация (разрыхление) кожи в складках под молочной железой.
Лечение Пороки развития сосудов При ангиодисплазиях производят хирургическое вмешательство — ревизию блокированных вен, устранение странгуляций (фиброзных тяжей, аберрантных артерий или мышц). При обнаружении аплазий или гипоплазий магистральных вен хирургическая коррекция крайне сложна или невозможна. Лечение артериовенозных дисплазий также хирургическое. Операция заключается в перевязке всех сосудов, образующих соустья с нарушениями. При множественных свищах производят скелетизацию магистральной артерии с перевязкой и рассечением отходящих от нее ветвей в сочетании с сужением приводящей артерии. В последние годы в лечении данного порока используют методику эндоваскулярной окклюзии патологических соустий специальными эмболами. Тем больным, у которых изменения конечности настолько велики, что функция ее полностью утрачена, производят ампутацию. При консервативном лечении гемангиом применяют криотерапию, введение склерозирующих препаратов и электрокоагуляцию. Хирургическое лечение состоит в иссечении гемангиом. Удаление глубоко расположенных и обширных гемангиом связано с риском массивного кровотечения, поэтому в профилактических целях оправдана предварительная перевязка или эмболизация (искусственная закупорка) артерий, питающих опухоль, прошивание и обшивание гемангиом. В ряде случаев проводят комбинированное лечение, которое начинают с введения в сосудистую опухоль склерозирующих средств и криовоздействия, повторной эмболизации приводящих сосудов. Средняя продолжительность жизни больных с коарктацией аорты составляет около 30 лет; большинство из них умирают в возрасте до 40 лет от сердечной недостаточности (см.), кровоизлияния в мозг, разрыва аорты и различных аневризм (см.), поэтому лечение только хирургическое. Оптимальным для проведения операции является возраст 6–7 лет. При коарктации аорты существует четыре типа оперативных вмешательств. 1. Удаление суженного участка аорты с последующим наложением анастомоза конец в конец; это выполнимо в том случае, если после удаления измененного участка без натяжения удается сблизить концы аорты. 2. Удаление коарктации с последующим протезированием показано при большой длине суженного сегмента аорты или аневризматическом ее расширении. 3. Истмопластика: при прямой истмопластике место сужения рассекают продольно и сшивают в поперечном направлении с целью создания достаточного просвета аорты; при непрямой истмопластике в аортотомическое отверстие вшивают заплату из синтетической ткани. 4. Шунтирование с использованием синтетического протеза является операцией выбора при длинной коарктации аорты, кальцинозе (см.) или резкоматеросклеротическом изменении стенки аорты. Применяется редко.
Пороки развития пищевода, диафрагмы и пищеводного отверстия диафрагмы При атрезии пищевода накладывают анастомоз (сообщение) конец в конец в случае, если расхождение между выделенными концами пищевода не превышает 1,5 см. При значительном расхождении концов пищевода верхнюю часть его выводят на шею в виде эзофагостомы, накладывают гастростому для питания ребенка, а в последующем производят эзофагопластику. При врожденном стенозе пищевода протяженностью до 1,5 см производят продольное рассечение его стенки с поперечным сшиванием краев раны над катетером. Если протяженность участка сужения не превышает 2,5 см, то возможно удаление части пищевода с анастомозом конец в конец; если протяженности сужения более 2,5 см, показана эзофагопластика. При локализации сужения в области нижнего пищеводного сфинктера производят экстрамукозную миотомию (кардиомиотомия Геллера) с фундопликацией по Ниссену. При пищеводно-трахеальных и бронхопищеводных свищах производят пересечение свищевого хода и ушивание образовавшихся дефектов в обоих органах. В случае удвоения пищевода показано вылущивание или удаление дивертикулоподобного участка. При врожденном коротком пищеводе и отсутствии осложнений проводят консервативное лечение. Тяжелый рефлюкс-эзофагит (воспаление слизистой пищевода, обусловленное обратным забросом желудочного содержимого) служит показанием к пилоропластике или трансплевральной фундопликации с оставлением желудка в грудной полости. Врожденную недостаточность нижнего пищеводного сфинктера лечат консервативно. Обычно с течением времени наступает нормализация его функции.
Пороки развития желудка и двенадцатиперстной кишки Пилоростеноз. Производят пилоропластику Фреде-Рамштедта: стенку привратника рассекают в продольном направлении до подслизистой основы и накладывают швы в поперечном направлении. Дивертикулы желудка и двенадцатиперстной кишки. Хирургическое лечение показано при осложнениях дивертикулов. Метод операции зависит от характера осложнения, локализации дивертикула (иссечение дивертикула, выключение двенадцатиперстной кишки). При консервативном лечении дуоденостаза применяют метоклопрамид (церукал, реглан), спазмолитические средства, витамин В1; промывание двенадцатиперстной кишки через зонд. Хирургическое лечение направлено на устранение причины дуоденостаза, формирование гастроеюноанастомоза (сообщения между желудком и тощей кишкой) или дуоденоеюноанастомоза (сообщения между двенадцатиперстной и тощей кишкой).
Пороки развития желчевыводящих протоков Атрезии желчных протоков подлежат оперативному лечению — наложению билиодигестивных анастомозов между вне- или внутрипеченочными желчными протоками и кишкой (тощей или двенадцатиперстной) или желудком. При атрезии внутрипеченочных желчных протоков оперативное вмешательство невозможно. В этих случаях единственным шансом на спасение жизни больного является пересадка печени. При наличии кисты общего желчного протока накладывают билиодигестивные анастомозы между кистой и двенадцатиперстной или тощей кишкой (с иссечением большей части стенок кисты или без иссечения).
Пороки развития поджелудочной железы Удаляют добавочную поджелудочную железу хирургическим путем. Лечение кольцевидной поджелудочной железы — оперативное. Хирургическое вмешательство показано при выраженном стенозе. Обычно с учетом местных изменений накладывают обходные анастомозы.
Пороки развития кишечника Лечение хирургическое. Операция требуется лишь при наличии признаков нарушения прохождения кишечного содержимого и заключается в устранении механического препятствия. При необходимости производят удаление нежизнеспособного участка кишки, фиксацию того или иного отдела кишки при его аномальной подвижности, иногда накладывают обходной межкишечный анастомоз. Аномалии и пороки развития толстой кишки. Полная атрезия заднего прохода или прямой кишки является показанием к срочной операции. При атрезии заднего прохода рассекают кожу, закрывающую выход из кишки, низводят слизистую оболочку прямой кишки и подшивают ее к коже. Другие виды полной атрезии прямой кишки требуют выполнения сложных хирургических вмешательств. При атрезии со свищом операцию выполняют в плановом порядке, она направлена на ликвидацию атрезии и свища. Стенозы и атрезии сигмовидной кишки требуют хирургического вмешательства.
Пороки развития трахеи При первичном локальном стенозе, обусловленном наличием врожденной внутритрахеальной перепонки, ее удаляют через бронхоскоп; при циркулярном сужении проводят бужирование. Радикальным методом лечения является удаление суженного участка трахеи. При распространенном стенозе прогноз неблагоприятный. При вторичных стенозах лечение заключается в удалении кисты (см.) или опухоли (см.) средостения либо (при компрессии двойной дугой аорты) — в перевязке и рассечении одной из дуг. Врожденные трахеальные свищи. Диагноз основывается на данных фистулографии, позволяющей уточнить расположение свища, его связь с просветом трахеи. Внутренние неполные свищи, как правило, специального лечения не требуют. В остальных случаях показано иссечение свищевого хода или его коагуляция.
Пороки развития легких Так как существует постоянная опасность инфицирования и развития воспалительного процесса в секвестрированной доле легкого при легочной секвестрации, то выполняется удаление доли при внутридолевом расположении или ее экстирпация при внедолевой форме. При врожденной долевой эмфиземе легких применяют хирургическое удаление измененного отдела легкого. При развитии синдрома напряжения, резких расстройствах дыхания и кровообращения производят экстренную операцию. Если заболевание становится хроническим, то, учитывая, что в процессе роста и развития ребенка состояние элементов бронха может нормализоваться, операцию откладывают и проводят лишь при явлениях дыхательной недостаточности. Кисты легкого. Обычно применяют хирургическое лечение — удаление кисты. Лобэктомию производят редко. Иногда выполняют удаление участка плевры для лучшего склеивания легкого с грудной стенкой. В последние годы при артериовенозных свищах и аневризмах легкого с успехом применяют эндоваскулярные операции. Используя метод Сельдингера, проводят специальный катетер в область аневризмы или соустья и вводят специальную пружинку с клубком нитей; образующийся при этом тромб ведет к закрытию соустья. Сброс неоксигенированной крови в легочную вену прекращается, наступает выздоровление. С помощью такого метода можно добиться ликвидации нескольких артериовенозных свищей и аневризм, локализованных в различных отделах легких. При неэффективности эндоваскулярного вмешательства и локализации артериовенозных свищей в одной доле показана резекция пораженной части легкого — сегмент- или лобэктомия.
Пороки развития шеи При кривошее производят возможно раннее пересечение укороченных мышц. Голову в правильном положении фиксируют гипсовой повязкой или специальным бандажом, систематически проводят лечебную гимнастику. Срединные кисты и свищи шеи. После установления диагноза срединные кисты шеи должны быть удалены возможно быстрее для предупреждения их инфицирования из ротовой полости. В ходе операции полностью иссекают кисту и остатки протока. При этом применяют прокрашивание его красителем, что облегчает препаровку щитовидно-язычного протока вплоть до слепого отверстия языка. Во избежание формирования вторичных свищей среднюю часть подъязычной кости удаляют вместе с протоком. После радикального удаления кисты и протока рецидив маловероятен. При подозрении на эктопированную щитовидную железу необходима срочная интраоперационная биопсия для предупреждения экстирпации (полного удаления) ткани щитовидной железы. Бронхогенные кисты и свищи шеи. Производят иссечение кисты или кисты вместе со свищевым ходом после предварительного прокрашивания его метиленовым синим. Свищевой ход иссекают вплоть до внутреннего отверстия. Иногда возникает необходимость в тонзиллэктомии.
Пороки развития молочных желез Полимастия и полителия. Добавочные молочные железы удаляют, по поводу других аномалий делают пластические операции. Микромастия. При двусторонней микромастии проводят коррекцию эндокринных нарушений; у взрослых женщин следует рекомендовать пластические операции с косметической целью. Макромастия. В детском возрасте проводят коррекцию эндокринных нарушений. При макромастии, возникшей у взрослых женщин вне беременности, показаны удаление молочной железы и пластические косметические операции. При умеренно выраженном мастоптозе рекомендуют ношение свободных лифов, изготовленных по индивидуальным заказам. Молодым женщинам можно рекомендовать пластические операции.
ПОРОКИ СЕРДЦА
ОпределениеПороки сердца — это групповое понятие объединяет аномалии положения и морфологической структуры сердца и крупных сосудов. Выделяют врожденные и приобретенные пороки сердца. Существует более 100 различных видов врожденных пороков сердца.
Этиология и патогенез Пороки сердца врожденные — аномалии, возникающие вследствие нарушения или незавершенного формообразования сердца и крупных сосудов в период внутриутробного, реже послеродового развития. Частота врожденных пороков сердца колеблется от 5 до 8 случаев на 1000 новорожденных (т. е. 0,5–0,8 %). Среди всех пороков сердца чаще всего встречаются дефекты межжелудочковой перегородки. Без оперативного лечения большинство детей с врожденными пороками сердца погибают в течение 1— 2-го года жизни. Только 10–15 % из них живут 2 года и более. Пороки сердца приобретенные — наиболее частой причиной поражения клапанов сердца и развития порока является ревматизм (см.), далее следуют септический эндокардит (см.), инфаркт миокарда (см.), обусловливающий постинфарктные пороки (дефект межжелудочковой перегородки, недостаточность левого предсердно-желудочкового клапана, аневризма (см.) сердца), травмы грудной клетки. Вследствие поражения соединительной ткани при ревматизме (см.) створки правого и левого предсердно-желудочковых и аортального клапанов утолщаются и срастаются, что приводит к стенозированию, или вследствие истончения, деформации, изъеденности краев и отложения солей кальция возникает недостаточность клапана. Различают стеноз отверстий или недостаточность клапанов, а также комбинированный порок, когда имеются сращение створок и их недостаточность одновременно. Клапан легочной артерии поражается ревматическим процессом редко. Строение сердца и гемодинамика (кровообращение). В норме венозная кровь из верхней и нижней полых вен и вен сердца поступает в правое предсердие. Основными анатомическими образованиями правого предсердия являются овальная ямка, часто с небольшим отверстием (овальное окно), которое прикрыто клапаном со стороны левого предсердия так, что во время систолы предсердий они герметично разделены; устье нижней полой вены, прикрытое заслонкой нижней полой вены (евстахиева заслонка); и рядом расположенное устье венечного синуса с заслонкой венечного синуса (тебезиева заслонка). От переднего края устья нижней полой вены к комиссуре (спайке) между септальной (перегородочной) и передней створками правого предсердно-желудочкового (трехстворчатого) клапана проходит сухожилие (сухожилие Тодаро). Между этим сухожилием, основанием септальной створки правого предсердно-желудочкового клапана и устьем венечного синуса находится треугольник Коха. Пограничный гребень — мышечное образование, отделяющее венозный синус от полости правого предсердия. У самого устья верхней полой вены в толще стенки предсердия расположен синусовый узел (узел Киса-Флека), генерирующий биопотенциал, который по проводящим путям в стенке предсердия распространяется до предсердно-желудочкового узла (узел Ашоффа-Тавара). От предсердно-желудочкового узла берет начало предсердно-желудочковый пучок (пучок Гиса), по которому биопотенциал распространяется на миокард желудочков сердца. Из правого предсердия кровь поступает в правый желудочек через правое предсердно-желудочковое отверстие, снабженное правым предсердно-желудочковым клапаном. В клапане различают переднюю, заднюю и перегородочную створки, которые своими основаниями прикрепляются к фиброзному кольцу. Свободный край створок удерживается сухожильными хордами, соединенными с сосочковыми (папиллярными) мышцами. В систолу желудочков три створки герметично смыкаются, препятствуя обратному току крови в правое предсердие. В правом желудочке различают приточный и выводной отделы, париетальную стенку и межжелудочковую перегородку, а в последней — мышечную и перепончатую перегородки. Мышечная перегородка делится на трабекулярную и инфундибулярную. Перепончатая перегородка примыкает к фиброзному центру сердца. Из многочисленных анатомических образований правого желудочка следует выделить три сосочковые мышцы, удерживающие хорды створок правого предсердно-желудочкового клапана, перегородочно-краевую трабекулу и предсердно-желудочковый пучок (пучок Гиса). По обе стороны межжелудочковой перегородки расположены фиброзные основания створок предсердно-желудочковых клапанов. Основание передней створки левого предсердно-желудочкового (митрального) клапана на левой стороне межжелудочковой перегородки расположено несколько выше основания перегородочной створки левого предсердно-желудочкового клапана. Поэтому часть межжелудочковой перегородки между основаниями этих створок отделяет левый желудочек от правого предсердия (предсердно-желудочковая перегородка). Предсердно-желудочковый пучок переходит на левую сторону межжелудочковой перегородки на границе мышечной и перепончатой части предсердно-желудочковой перегородки. Из правого желудочка кровь поступает в легочный ствол, который делится на правую и левую легочные артерии. Устье легочного ствола снабжено клапаном легочного ствола, состоящим из трех полулунных заслонок (клапанов). Пройдя через легкие, кровь по четырем легочным венам поступает в левое предсердие и далее через левое венозное отверстие в левый желудочек. Левое предсердно-желудочковое отверстие снабжено левым предсердно-желудочковым клапаном, который имеет две створки. Передняя и задняя створки левого предсердно-желудочкового клапана удерживаются сухожильными хордами, прикрепленными к сосочковым мышцам. В систолу края створок смыкаются герметично. Из левого желудочка кровь поступает в аорту. Выход в аорту снабжен клапаном аорты, состоящим из трех полулунных заслонок (створок). На свободных краях створок имеются утолщения треугольной формы — аранциевы бугорки, способствующие герметичному смыканию створок клапана аорты в диастолу. Кровоснабжение сердца осуществляют две венечные (коронарные) артерии. Левая венечная артерия начинается от задней поверхности луковицы аорты из левого синуса аорты (синус Вальсальвы), проходит между легочным стволом и левым предсердием и направляется к передней поверхности сердца по левой венечной борозде, где делится на переднюю межжелудочковую и огибающую ветви. Передняя межжелудочковая ветвь, располагаясь в передней межжелудочковой борозде, достигает верхушки сердца, поворачивает на диафрагмальную его поверхность и дает заднюю восходящую ветвь, идущую по задней межжелудочковой борозде. Огибающая ветвь проходит у основания левого ушка по левой венечной борозде и заканчивается 1–3 ветвями на задней поверхности сердца. Правая венечная артерия начинается от правого синуса аорты (синуса Вальсальвы) устьем на передней поверхности луковицы аорты и по правой венечной борозде, отдав ветвь к синусовому узлу и выводному отделу правого желудочка, проходит к верхушке сердца. Затем по правой части венечной борозды достигает задней межжелудочковой борозды, отдает заднюю межжелудочковую ветвь, которая анастомозирует с передней межжелудочковой артерией. Вены сердца впадают в венечный синус и непосредственно в правый желудочек и правое предсердие (наименьшие вены сердца — тебезиевы вены). В покое сердце поглощает до 75 % кислорода, содержащегося в артериальной крови, протекающей через миокард. Механизм работы сердца. Из синусового узла возбуждение распространяется по миокарду предсердий, вызывая их сокращение; через 0,02—0,03 с возбуждение достигает предсердно-желудочкового узла и после предсердно-желудочковой задержки на 0,04—0,07 с передается на предсердно-желудочковый пучок. Через 0,03—0,07 с возбуждение достигает миокарда желудочков, после чего наступает систола. Сердечный цикл подразделяется на систолу и диастолу желудочков, в конце которой совершается систола предсердий. Объем крови, выбрасываемой желудочком сердца, называют ударным, или систолическим, объемом сердца, а произведение ударного объема сердца на частоту сердечных сокращений в минуту — минутным объемом. Минутные объемы большого и малого круга кровообращения в норме равны. Минутный объем сердца, отнесенный к площади поверхности тела, обозначают сердечным индексом (сердечный индекс выражают в литрах в минуту на 1 м2 поверхности тела. Отношение ударного объема к площади поверхности тела называют ударным индексом [мл/(мин х м2)]. В покое у взрослого человека величина сердечного индекса выше 2,5 л/(мин х м2). Нормальное давление в левом желудочке и аорте не превышает 120 мм рт. ст., а в правом желудочке и в легочной артерии — 25 мм рт. ст. В норме между левым желудочком и аортой, между правым желудочком и легочной артерией разницы систолического давления нет. Общее периферическое сосудистое сопротивление в 3–4 раза превышает общее легочное сопротивление. Этим обусловлена разница давления в правом и левом желудочках, в аорте и легочной артерии. Сокращения сердечной мышцы, выбрасывающие кровь в сосудистое русло, объем циркулирующей крови, сопротивление сосудов большого, малого и венечного круга кровообращения подчинены законам кровообращения и описываются многочисленными математическими уравнениями. Основной закон сердца — закон Франка-Старлинга (ударный выброс пропорционален конечному диастолическому объему).
Пороки сердца врожденные Классификация пороков сердца довольно сложна. В более ранних классификациях (по клиническим признакам) их разделяли на пороки с цианозом («синие» пороки) и без цианоза. В настоящее время клинически значимые пороки сердца подразделяют по характеру гемодинамических нарушений (нарушений кровообращения) в малом круге кровообращения на следующие группы: пороки с переполнением (гиперволемией); пороки с обеднением (гиповолемией); пороки с малоизмененным или неизмененным кровотоком. В первой и второй группах выделяют пороки с цианозом и без цианоза кожных покровов. К порокам первой группы, не сопровождающимся ранним цианозом, относятся открытый артериальный (боталлов) проток, дефект межпредсердной или межжелудочковой перегородки, коарктация аорты и др. К порокам, сопровождающимся цианозом, относятся атрезия трехстворчатого клапана с нормальным калибром легочного ствола и большим дефектом межжелудочковой перегородки, открытый артериальный проток со стоком крови из легочной артерии в аорту. Это наблюдается при выраженной гипертензии (см.) в сосудах малого круга кровообращения (комплекс Эйзенменгера). К порокам второй группы, не сопровождающимся цианозом, относится изолированный стеноз ствола легочной артерии. К числу пороков, сопровождающихся цианозом, относятся триада, тетрада и пентада Фалло (комбинация нескольких пороков), атрезия трехстворчатого клапана с сужением ствола легочной артерии или малым дефектом межжелудочковой перегородки и др. К порокам третьей группы с неизмененным или мало измененным кровотоком в сосудах легкого относятся аномалии дуги аорты и ее ветвей, отсутствие дуги аорты, стеноз (сужение) и коарктация аорты, митральная атрезия, атрезия аортального клапана, недостаточность митрального клапана и другие более редкие пороки. Выделяют также комбинированные пороки, при которых выявляются нарушения взаимоотношений между различными отделами сердца и крупными сосудами. У больных с пороками первой группы наблюдается сброс крови из артериального русла в венозное (из левого желудочка сердца и крупных сосудов, отходящих непосредственно от него, т. е. слева направо), когда в периферическое артериальное русло поступает недостаточное количество артериальной крови. В связи с этим дети отстают в физическом развитии, часто болеют пневмонией (см.), кожные покровы у них бледные, иногда с подчеркнуто яркой окраской губ. Бледность усиливается после физической нагрузки. Для всех пороков этой группы характерно переполнение кровью (гиперволемия) правых отделов сердца и сосудов легкого. При рентгенологическом исследовании легких признаки гиперволемии в малом круге кровообращения проявляются усилением легочного рисунка, расширением корней легких, выбуханием легочной артерии вследствие переполнения ее кровью. Перкуторно и рентгенологически определяется расширение правых камер сердца. На ЭКГ четко выявляются признаки перегрузки (увеличения) правого желудочка. При ультразвуковом исследовании или зондировании сердца, а также при ангиокардиографии подтверждается дилатация (растяжение) правых отделов сердца, повышение давления и содержания кислорода в крови, взятой из них. Эти методы исследования позволяют определить диаметр дефекта и величину сброса крови. Распознав синдром переполнения малого круга кровообращения, врач по клиническим признакам может выбрать из группы пороков с гиперволемией малого круга кровообращения тот, которому будут соответствовать характерные симптомы при прослушивании. Например, систолический шум во втором межреберье у левого края грудины характерен для открытого артериального (боталлова) протока, а резкий дующий систолический шум в четвертом межреберье слева от грудины — для дефекта межжелудочковой перегородки и т. д. Диагноз может быть подтвержден данными ультразвукового допплерографического исследования. Ко второй группе относят пороки, при которых имеется обеднение малого круга кровообращения кровью (гиповолемия) вследствие затруднения ее выброса правым желудочком в систему легочной артерии, например при стенозе легочной артерии. Ограниченное поступление крови в легкие наблюдается не только при стенозе путей оттока крови из правого желудочка, но и при сбросе крови из него в систему большого круга кровообращения (сброс справа налево). Это обычно наблюдается при тетраде, триаде, пентаде Фалло. При умеренном сужении легочной артерии у детей нередко отсутствуют какие-либо ощущения, обусловленные пороком, и дети обычно развиваются удовлетворительно. При значительном сужении легочной артерии дети испытывают слабость, быструю утомляемость, боли в области сердца, одышку при физической нагрузке. Цвет кожных покровов у таких детей нормальный, часто наблюдается сердечный горб. При прослушивании сердца выявляется ослабление II тона, выслушивается громкий высокого тембра систолический шум во втором межреберье у левого края грудины в сочетании с ослаблением II тона. Здесь же при прощупывании определяется систолическое дрожание. Эти симптомы характерны для сужения легочной артерии. При рентгенологическом и ультразвуковом исследовании выявляют не только стеноз, но и постстенотическое расширение легочной артерии, увеличение правых отделов сердца, увеличение правого желудочка вследствие постоянной повышенной систолической нагрузки. На ЭКГ определяют признаки гипертрофии и перегрузки правых отделов сердца, а при зондировании — повышение давления в правом желудочке и снижение давления в легочной артерии (увеличение градиента давления). Ультразвуковое исследование (как и ангиокардиография) позволяет выявить сужение клапана легочной артерии или подклапанное сужение с постстенотическим расширением легочной артерии. При комбинированных пороках (тетрада Фалло) наблюдается уменьшение кровотока в легочных артериях вследствие венозно-артериального (т. е. справа налево) сброса крови. Поступление в артериальное русло большого количества венозной крови приводит к снижению насыщения артериальной крови кислородом. У больных с момента рождения наблюдается цианоз кожных покровов и видимых слизистых оболочек («синий порок»). По мере прогрессирования болезни усугубляется недостаток кровотока по легочным артериям, развивается хроническое кислородное голодание. Оно проявляется неравномерной синюшностью кожных покровов и кистей рук, утолщением концевых фаланг пальцев, одышкой в покое, тахикардией (см.). Одновременно с этим развиваются одышечно-цианотические приступы, связанные со спазмом выходного отдела правого желудочка. Границы сердца расширены. По мере увеличения сердца деформируется грудная клетка, формируется сердечный горб. Над областью сердца определяется систолическое дрожание, выслушивается ослабленный II тон на легочной артерии и грубый систолический шум в третьем-четвертом межреберье у левого края грудины. На ЭКГ отмечается синдром гипертрофии правого желудочка. Ультразвуковое и ангиокардиографическое исследование позволяют подтвердить наличие сброса венозной крови в артериальное русло, уменьшения кровотока в сосудах легких. При этом можно измерить давление в полостях сердца, определить насыщение крови, взятой через катетер, кислородом. У больных с пороками третьей группы симптомы нарушения газообмена отсутствуют. Основные жалобы у таких больных — быстрая утомляемость, сердцебиение, головные боли. При коарктации аорты у больных старше 14–15 лет наблюдается повышение артериального давления на верхних и его снижение на нижних конечностях. Кожа и видимые слизистые оболочки обычной окраски. Верхушечный толчок усилен. Над верхушкой сердца выслушивается систолический шум. Границы сердца расширены влево. На ЭКГ отмечаются признаки синдрома увеличения левых отделов сердца. Глубину и характер нарушения позволяет уточнить ультразвуковое и ангиографическое исследование. При всех видах пороков ценные данные дает не только ультразвуковое допплеровское исследование, но и быстро внедряющиеся методы магнитно-резонансной томографии. Врожденные аномалии расположения сердца и магистральных сосудов включают праворасположенное сердце (правильно сформированное, без пороков — истинная декстракардия), поворот сердца к середине; удвоение полых вен, впадающих в венозное (правое) предсердие; правостороннее расположение дуги аорты. Варианты отхождения левой подключичной артерии от нисходящей аорты выделяют в особую группу. При пороках этой группы нарушений сердечной деятельности не отмечается. Диагноз устанавливают на основании данных простукивания, прощупывания, прослушивания, измерения артериального давления, электрокардиографии, ультразвукового, рентгенологического, в том числе ангиографического, исследований. Жалоб обычно нет. Чаще всего порок выявляется случайно при обычном исследовании. Однако некоторые больные предъявляют жалобы, характерные для сдавления пищевода, трахеи, возвратного нерва (осиплость голоса). Аномалии расположения сердца часто сочетаются с наличием дефектов в перегородках сердца, нарушением строения клапанов, неправильным отхождением и формированием магистральных сосудов. В этих случаях появляются симптомы, позволяющие отнести их к врожденным порокам сердца одной из указанных выше групп. Детальная характеристика пороков приведена в специальном разделе. Стеноз легочного ствола (изолированное сужение легочной артерии) может располагаться на разных уровнях. Стеноз выводного отдела правого желудочка, или подклапанный (инфундибулярный), стеноз легочной артерии образуется вследствие разрастания мышечной и фиброзной ткани в инфундибулярном отделе желудочка. Стеноз фиброзного кольца, т. е. места перехода миокарда правого желудочка в легочный ствол, часто сочетается с подклапанным (инфундибулярным) или клапанным стенозом. Изолированный клапанный стеноз — наиболее частое нарушение (7–9 % врожденных пороков сердца). Клапан легочной артерии при этом пороке представляет собой диафрагму с отверстием диаметром 2—10 мм. Часто разделение на створки отсутствует, комиссуры сглажены. Препятствие оттоку крови из правого желудочка ведет к повышению давления в нем. Для обеспечения нормального минутного объема правому желудочку приходится выполнять большую работу. Это приводит к выраженному увеличению его миокарда. Может развиться подклапанный стеноз вследствие значительного увеличения выводного отдела правого желудочка. Из-за стеноза систолическое давление в правом желудочке повышается до 200–300 мм рт. ст. Постепенно в миокарде правого желудочка развиваются дистрофические процессы, что ведет к развитию недостаточности кровообращения. Если у пациента имеется открытое овальное окно либо дефект межпредсердной или межжелудочковой перегородки, то развивается сброс венозной крови в артериальное русло (в левое предсердие, левый желудочек), что приводит к цианозу (синюшности), усиливающемуся при физической нагрузке. Врожденный стеноз устья аорты. Различают клапанный, подклапанный и надклапанный стенозы. Частота каждого из типов неодинакова (от 2 до 7 %). Чаще всего встречается стеноз клапана аорты. Сросшиеся створки имеют форму купола с отверстием на вершине. Клапан может быть двухстворчатым. Нарушение кровообращения вызывает постстенотическое расширение восходящей аорты, иногда напоминающее аневризму (см.). Подклапанный стеноз образуется фиброзным или фиброзно-мышечным валиком, реже — тонкой соединительнотканной диафрагмой с отверстием. Клинически и патоморфологически обособляют идиопатический гипертрофический субаортальный стеноз. Надклапанный стеноз локализуется в нижней трети восходящей аорты. Аортальный клапан при этом может быть нормальным. Препятствие току крови из левого желудочка приводит к увеличению последнего, а в запущенных случаях — к дегенеративным изменениям миокарда. Нарушения кровообращения, обусловленные стенозом, проявляются в первую очередь нарушениями коронарного кровообращения — развивается относительная коронарная недостаточность. Открытый артериальный проток. Среди врожденных пороков сердца изолированный открытый артериальный проток составляет 16–24 %. У 5—12 % больных он сочетается с другими врожденными пороками. Проток расположен между начальным отделом нисходящей аорты, тотчас после отхождения левой подключичной и левой легочной артерий или впадает в развилку легочного ствола. Длина протока достигает 1 см, диаметр — от 1 мм до 2 см и может быть таким же, как диаметр аорты. Стенки функционирующего протока по строению отличаются от стенки аорты и легочной артерии наличием большого количества соединительной ткани, в которой заключены отдельные пучки мышечных волокон. В стенке протока нередко обнаруживают воспалительные и дегенеративные изменения. Открытый артериальный проток необходим в эмбриональном периоде, так как по нему плацентарная кровь из правого желудочка и ствола легочной артерии, минуя нефункционирующие легкие, поступает в аорту и большой круг кровообращения. Вскоре после рождения проток закрывается, превращаясь в соединительнотканный тяж (артериальную связку). В послеродовом периоде по функционирующему протоку значительная часть крови из левого желудочка и восходящей аорты поступает в легочную артерию и затем из малого круга кровообращения по легочным венам вновь возвращается в левый желудочек. Таким образом, часть циркулирующей крови совершает кругооборот по укороченному пути, минуя большой круг кровообращения. Направление и величина сброса крови из аорты в легочную артерию определяются разностью сопротивления сосудов большого и малого круга кровообращения. При развитии высокой легочной гипертензии (см.) сброс может стать двунаправленным или происходить из легочной артерии в аорту, в этом случае насыщение крови кислородом в нижней части туловища будет меньше, чем в верхней. При открытом артериальном протоке увеличивается нагрузка на левый желудочек. Ударный и минутный объемы крови увеличиваются на величину сброса через проток. Соответственно увеличивается кровоток по малому кругу кровообращения и прогрессирует легочная гипертензия. Вследствие прогрессирующей легочной гипертензии возрастает нагрузка на правый желудочек. Появляются признаки недостаточности кровообращения, особенно выраженные у маленьких детей. Дефект межпредсердной перегородки. В изолированном виде данный порок среди всех врожденных пороков наблюдается у 7— 25 % больных. Дефект межпредсердной перегородки возникает в результате недоразвития первичной или вторичной перегородки. Исходя из этого, различают первичный или вторичный дефекты межпредсердной перегородки. Первичные дефекты расположены в нижней части межпредсердной перегородки и сочетаются с расщеплением передневнутренней створки митрального клапана. Диаметр дефекта колеблется от 1 до 5 мм. Вторичные дефекты встречаются наиболее часто (у 75–95 % больных). Они локализуются в задних отделах межпредсердной перегородки. Среди них выделяют высокие дефекты (в области впадения нижней полой вены) и дефекты в области овального окна. Вторичные дефекты часто сочетаются с впадением правых легочных вен в правое предсердие (примерно у 30 % больных). Нарушение кровообращения при дефектах межпредсердной перегородки обусловлено сбросом артериальной крови из левого предсердия в правое. В среднем величина сброса может достигать 8—10 л/мин; при наличии дефекта в перегородке значительная часть артериальной крови исключается из нормального кровотока, так как, минуя правый желудочек, она поступает из левого в правое предсердие, в правый желудочек, в сосуды легких и затем вновь возвращается в левое предсердие. Возникает перегрузка правого желудочка, что ведет к его увеличению, последующей дилатации и переполнению сосудистой системы легких избыточным количеством крови, а это вызывает легочную гипертензию. Последняя на ранних стадиях имеет функциональный характер и обусловлена рефлекторным спазмом артериол. Со временем спазм сосудов сменяется их заращением соединительной тканью. Легочная гипертензия становится необратимой и прогрессирует. При первичном дефекте межпредсердной перегородки нарушения кровообращения выражены в большей степени. Этому способствует митральная регургитация (обратный ток), при которой кровь в период каждой систолы из левого желудочка поступает обратно в левое предсердие. Поэтому при первичном дефекте перегородки имеется больший объем артериального шунтирования, быстро развивается перегрузка левого желудочка, приводящая к его расширению. Дефект межжелудочковой перегородки. Один из наиболее частых врожденных пороков сердца. В изолированном виде встречается приблизительно у 30 % всех больных с врожденными пороками сердца. Дефекты могут располагаться в различных местах межжелудочковой перегородки. Наиболее часто они локализуются в мембранозной части. Дефекты в мышечной части перегородки встречаются реже. Диаметр дефектов колеблется от нескольких миллиметров до 1–2 см, однако иногда достигает значительной величины, когда межжелудочковая перегородка почти полностью отсутствует. Примерно у 50 % больных имеются сочетанные пороки сердца. Нарушения кровообращения связаны со сбросом артериальной крови из левого желудочка в правый и затем в малый круг кровообращения. Направление артериовенозного шунта обусловлено более высоким давлением в левом желудочке, значительным превышением системного сосудистого сопротивления над сопротивлением в малом круге кровообращения. Величина сброса определяется размерами дефекта. Наличие артериовенозного шунта в первую очередь приводит к перегрузке правого желудочка и его гипертрофии. Вся сбрасываемая кровь, попадая в легкие, переполняет сосуды малого круга кровообращения. Возникает легочная гипертензия. Давление в легочной артерии становится равным системному или превышает его. Развивается синдром Эйзенменгера. Направление шунта меняется. Сброс крови через дефект идет справа налево. В большой круг кровообращения начинает поступать венозная кровь, что обусловливает появление синюшности. Стойкая и высокая легочная гипертензия приводит к сердечной недостаточности. Тетрада Фалло. Этот порок составляет 14–15 % всех врожденных пороков сердца. Характерно сочетание следующих признаков: стеноз устья легочного ствола; дефект межжелудочковой перегородки; смещение аорты вправо и расположение ее устья над дефектом межжелудочковой перегородки; гипертрофия стенки правых отделов сердца. Возможны следующие варианты сужения легочной артерии: — подклапанный стеноз — фибромускулярное сужение выходного отдела правого желудочка протяженностью от нескольких миллиметров до 2–3 см; — клапанный стеноз (срастание створок, неправильное формирование клапана); — комбинация клапанного и подклапанного стеноза; — гипоплазия основного ствола, атрезия устья легочной артерии или стеноз ее ветвей. Дефект межжелудочковой перегородки при тетраде Фалло имеет большие размеры, диаметр его равен диаметру устья аорты, дефект расположен в мембранозной части перегородки. Тетрада Фалло часто сочетается с дефектом межпредсердной перегородки (пентада Фалло), открытым артериальным протоком, двойной дугой аорты и др. Нарушения кровообращения при тетраде Фалло в первую очередь определяются степенью сужения легочной артерии. В результате сопротивления, возникающего на пути тока крови из правого желудочка в легочную артерию, правый желудочек выполняет большую работу, что приводит к его увеличению. Значительная часть венозной крови, минуя малый круг кровообращения, поступает в левый желудочек и аорту. Величина минутного объема малого круга кровообращения резко уменьшается, а большой круг кровообращения перегружается венозной кровью. Снабжение организма кислородом снижается, развивается кислородная недостаточность органов и тканей.
Пороки сердца приобретенные Стеноз левого атриовентрикулярного отверстия (митральный стеноз). Изолированный стеноз составляет 44–68 % всех приобретенных пороков сердца. В норме площадь левого атриовентрикулярного отверстия составляет 4–6 см и зависит от площади поверхности тела. Суженное левое атриовентрикулярное отверстие является препятствием для изгнания крови из левого предсердия в левый желудочек, поэтому давление в левом предсердии повышается до 20–25 мм рт. ст. Вследствие этого возникает рефлекторный спазм артериол легких, что уменьшает приток крови в левое предсердие. Прогрессирующее уменьшение левого атриовентрикулярного отверстия вызывает дальнейший рост давления в полости левого предсердия (до 40 мм рт. ст.), что приводит к повышению давления в легочных сосудах и правом желудочке. Если величина капиллярного давления в легочных сосудах и правом желудочке превышает онкотическое давление крови, то развивается отек легких (см.). Спазм артериол системы легочной артерии предохраняет легочные капилляры от чрезмерного повышения давления и повышает сопротивление в системе легочной артерии. Давление в правом желудочке может достигать 150 мм рт. ст. Значительная нагрузка на правый желудочек при стенозе левого атриовентрикулярного отверстия приводит к неполному опорожнению его во время систолы, повышению диастолического давления и развитию относительной недостаточности правого предсердно-желудочкового клапана. Застой крови в венозной части большого круга кровообращения приводит к увеличению печени, появлению асцита (см.) и отеков. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность). Причиной возникновения органической митральной недостаточности у 75 % больных является ревматизм (см.). Неполное смыкание створок левого предсердно-желудочкового клапана обусловливает обратный ток крови (регургитацию) из левого желудочка в предсердие во время систолы. Величина регургитации определяет тяжесть митральной недостаточности. Левый желудочек должен постоянно выбрасывать большее количество крови, так как часть ее в систолу возвращается в левое предсердие и вновь поступает в левый желудочек. Порок длительное время компенсируется работой мощного левого желудочка, вызывая его увеличение и последующую дилатацию (растяжение). Постепенно происходит увеличение и левого предсердия. Давление в полости левого предсердия ретроградно передается на легочные вены; повышается давление в легочной артерии, правый желудочек также увеличивается в размерах. Аортальные пороки сердца. Причинами возникновения аортальных пороков сердца могут быть ревматизм (см.), бактериальный эндокардит (см.), атеросклероз (см.). Аортальные пороки составляют 15–20 % всех приобретенных пороков сердца. Наиболее часто возникают ревматические поражения клапана аорты. По частоте поражения ревматическим процессом клапан аорты стоит на втором месте после левого предсердно-желудочкового клапана. Заболевание у мужчин наблюдается в 3–5 раз чаще, чем у женщин. Створки клапана аорты подвергаются обызвествлению, нередко массивному, с переходом кальциноза (см.) на фиброзное кольцо клапана, стенку аорты, миокард левого желудочка, переднюю створку левого предсердно-желудочкового клапана. Различают стеноз, недостаточность и комбинированные поражения, когда имеются одновременно стенозирование и недостаточность клапана аорты.
Клиническая картина и диагностика Пороки сердца врожденные Стеноз легочного ствола (изолированное сужение легочной артерии). При обследовании больного обнаруживают одышку, усиливающуюся при физической нагрузке, сердцебиение, быструю утомляемость. Над сердцем определяют систолическое дрожание и грубый систолический шум во 2—3-м межреберье у левого края грудины. II тон над легочной артерией ослаблен. На электрокардиограмме — отклонение электрической оси сердца вправо, признаки увеличения правого желудочка и правого предсердия. При рентгенологическом исследовании определяют увеличение тени сердца за счет увеличенного правого желудочка, выбухание дуги легочной артерии вследствие ее постстенотического расширения. Во втором косом положении видно заполнение аортального окна тенью расширенной легочной артерии. Легочный рисунок обедненный или нормальный. Эхокардиографическое исследование позволяет установить характер и локализацию сужения. Во время зондирования и при ангиокардиографии выявляют повышение давления в правом желудочке и определяют градиент систолического давления между правым желудочком и легочной артерией. Запись давления в правом желудочке и легочной артерии и ангиокардиокинография позволяют провести дифференциальный диагноз между клапанным и подклапанным стенозами, определить степень, протяженность и локализацию сужения. Прогноз без операции неблагоприятный. Продолжительность жизни не превышает 20 лет.
Врожденный стеноз устья аорты Больных беспокоят одышка, быстрая утомляемость, сжимающие боли в области сердца, головокружения и обмороки. При объективном обследовании определяют смещение верхушечного толчка влево; систолическое дрожание над областью сердца; грубый систолический шум во втором межреберье справа, который проводится на сосуды шеи. Усилен и раздвоен I тон на верхушке, ослаблен II тон над проекцией аортального клапана. При сфигмографии обнаруживают, что кривая каротидного пульса имеет крутой подъем с зазубриной на вершине, напоминающей по форме петушиный гребень. На ЭКГ выявляют признаки гипертрофии левого желудочка; при выраженном и запущенном стенозе — признаки ишемии миокарда и мерцательную аритмию (см.). На фонокардиограмме шум имеет ромбовидную форму с эпицентром во втором межреберье справа у края грудины. При эхокардиографическом исследовании определяют характер сужения, его локализацию, протяженность подклапанных изменений. Регистрируют нарушение сократительной функции миокарда левого желудочка при наличии коронарной недостаточности. При рентгенологическом исследовании обнаруживают типичную аортальную конфигурацию тени сердца с приподнятой и закругленной верхушкой, увеличенным левым желудочком, выбухающей первой дугой по левому контуру за счет расширения восходящей аорты. При зондировании и левой вентрикулографии регистрируют повышение систолического давления в левом желудочке, достигающее 200–250 мм рт. ст., градиент систолического давления между левым желудочком и аортой. Определяют также локализацию, характер и протяженность сужения, наличие регургитации через митральный клапан, степень гипертрофии миокарда, сократительную функцию сегментов левого желудочка. У больных старше 40 лет и у пациентов, жалующихся на загрудинные сжимающие боли, независимо от возраста выполняют селективную коронарографию. Определяют тип коронарного кровообращения, локализацию, протяженность и степень стенозов венечных артерий. Открытый артериальный проток. Основными симптомами являются одышка, усиливающаяся при нагрузке, и сердцебиение. Ребенок отстает в физическом развитии, часто страдает заболеваниями дыхательного тракта. При прослушивании во втором межреберье слева по среднеключичной линии определяется непрерывный систолодиастолический («машинный») шум. При нарастании легочной гипертензии диастолический компонент шума уменьшается и исчезает, остается только систолический шум. На электрокардиограмме выявляют нормограмму. При выраженной легочной гипертензии появляется правограмма. При рентгеновском исследовании выявляют симптомы увеличенного кровенаполнения сосудов легких — усиление легочного рисунка, выбухание дуги легочной артерии. При зондировании зонд может пройти из ствола легочной артерии в аорту через открытый проток. Определяют увеличение насыщения крови кислородом в легочной артерии, повышение давления в правом желудочке и легочной артерии. При аортографии конт растированная кровь поступает в легочную артерию. Осложнениями открытого артериального протока являются бактериальный эндокардит (см.), аневризматическое расширение протока и его разрыв. Дефект межпредсердной перегородки. Наиболее частыми симптомами являются одышка, приступы сердцебиения, утомляемость при обычной физической нагрузке, отставание в росте, склонность к пневмониям (см.) и простудным заболеваниям. При объективном исследовании определяют наличие сердечного горба. Во втором межреберье слева выслушивают систолический шум, обусловленный усилением легочного кровотока и относительным стенозом легочной артерии. Над легочной артерией второй тон усилен. Имеется расщепление второго тона вследствие перегрузки правого желудочка, удлинения его систолы, неодновременного закрытия клапанов аорты и легочной артерии. На рентгенограммах в прямой проекции отмечают расширение границ сердца, увеличение второй дуги по левому контуру сердца, усиление легочного рисунка. При вторичном дефекте обнаруживают увеличение только правого желудочка, а при первичном — обоих желудочков и левого предсердия. Эхокардиография выявляет изменение размеров желудочков, парадоксальное движение межпредсердной перегородки, увеличение амплитуды движения задней стенки левого предсердия. Диагноз ставят на основании данных ультразвукового исследования и катетеризации сердца, при которой устанавливают повышение давления в правом предсердии, правом желудочке и легочной артерии. Между давлением в желудочке и артерии может быть градиент, не превышающий 30 мм рт. ст. Одновременно обнаруживают повышение насыщения крови кислородом в правых отделах сердца и легочной артерии по сравнению с насыщением в полых венах. Для определения размеров дефекта применяют специальные баллонные катетеры, заполненные контрастным веществом. Зонд проводят через дефект и по диаметру судят о величине дефекта. Направление шунта и величину сброса изучают путем введения в левое и правое предсердия контраста и на ангиокардиокинограмме определяют последовательность заполнения отделов сердца контрастированной кровью. Дефект межжелудочковой перегородки. У новорожденных и детей первых лет жизни заболевание протекает тяжело, с явлениями декомпенсации, проявляющейся одышкой, увеличением печени, гипотрофией. У детей старшего возраста симптомы заболевания выражены менее резко. При обследовании выявляют бледность кожных покровов, задержку в физическом развитии, асимметрию грудной клетки за счет сердечного горба. Необратимые изменения в сосудах легких могут развиваться на первом году жизни. При возникновении венозно-артериального шунта у больных развивается правожелудочковая недостаточность. В третьем-четвертом межреберье слева от грудины выслушивают грубый систолический шум. При нарастании легочной гипертензии и уменьшении сброса шум становится короче и может исчезать. В этот период обычно появляется цианоз. Одновременно во втором межреберье по левому краю грудины выслушивается диастолический шум, который свидетельствует о присоединении относительной недостаточности клапана легочной артерии. На электрокардиограмме при умеренной легочной гипертензии определяют перегрузку и увеличение правого желудочка, при повышении сосудисто-легочного сопротивления и нарастании легочной гипертензии начинают преобладать признаки недостаточности кровообращения. Рентгенологическое исследование выявляет признаки увеличения кровотока в малом круге кровообращения: усиленный легочный рисунок, увеличение калибра легочных сосудов, увеличение второй дуги по левому контуру сердца, которое расширено в поперечнике за счет обоих желудочков. При катетеризации полостей сердца обнаруживают повышение содержания кислорода в крови. При введении катетера в левый желудочек определяют поступление контрастного вещества через дефект перегородки в правый желудочек и легочную артерию. Тетрада Фалло. Новорожденный с тетрадой Фалло развит нормально, так как в перинатальный период имеющиеся аномалии сердца не препятствуют нормальному кровоснабжению плода. Первые признаки порока появляются через несколько дней или недель после рождения. Во время крика ребенка или в периоды кормления отмечают появление синюшности. Цианоз и одышка становятся с каждым месяцем все более выраженными. У детей в возрасте 1–2 лет кожные покровы приобретают синеватый оттенок, становятся видны расширенные темносинего цвета венозные сосуды. Особенно резко синюшность выражена на губах, конъюнктивах, ушных раковинах, ногтевых фалангах рук и ног. Пальцы имеют вид барабанных палочек, ребенок отстает в физическом развитии. Нередко тетраде Фалло сопутствуют другие пороки развития: воронкообразная грудь, незаращение верхней губы и мягкого неба, плоскостопие и др. Для больных с тетрадой Фалло характерно вынужденное положение сидя на корточках: после нескольких шагов ребенок вынужден садиться для отдыха на корточки, ложиться на бок. Нередко больные полностью прикованы к постели. При выраженной картине заболевания часто развиваются приступы одышки с резким цианозом, во время которых больные часто теряют сознание. Причиной этих приступов у больных фибромускулярным подклапанным стенозом является внезапный спазм мышц выводного отдела правого желудочка, что еще больше уменьшает количество крови, поступающей из сердца в легочную артерию, и снижает насыщение артериальной крови кислородом. Без операции большинство больных умирают до совершеннолетия. При объективном исследовании нередко виден сердечный горб. Перкуторно определяют умеренное увеличение границ сердца, а при прослушивании — укорочение I тона на верхушке сердца и ослабление II тона на легочной артерии. Во втором-третьем межреберье у левого края грудины выслушивается систолический шум. В анализе крови отмечается увеличение количества эритроцитов до 6—10 Т/л, повышение уровня гемоглобина до 130–150 г/л. На фонокардиограмме регистрируется шум над легочной артерией. Электрокардиография выявляет признаки увеличения правого желудочка. При рентгенологическом исследовании обнаруживают признаки, характерные для тетрады Фалло: уменьшение интенсивности рисунка корней легких, обеднение легочного рисунка в связи с недогрузкой малого круга кровообращения, увеличение тени сердца, смещение верхушки сердца влево и вверх, западение контура сердца на уровне дуги легочной артерии, расширение восходящей части и дуги аорты. Сердце при этом принимает форму деревянного башмака. При катетеризации сердца катетер из правого желудочка без труда проникает через дефект в перегородке в восходящую часть аорты. При введении контрастного вещества в правый желудочек контрастированная кровь одновременно заполняет восходящую аорту и легочную артерию.
Пороки сердца приобретенные Стеноз левого атриовентрикулярного отверстия (митральный стеноз). При незначительном сужении левого атриовентрикулярного отверстия нормальное кровообращение поддерживается усиленной работой левого предсердия. При этом больные могут не предъявлять жалоб. Прогрессирование сужения и повышение давления в малом круге кровообращения сопровождаются одышкой, приступами сердечной астмы (см.), кашлем (см.) — сухим или с отделением мокроты, содержащей прожилки крови, слабостью, повышенной утомляемостью при физической нагрузке, сердцебиением, реже болью в области сердца. При объективном исследовании выявляют характерный румянец с лиловым оттенком в виде бабочки на бледном лице, цианоз (синюшность) кончика носа, губ и пальцев. При прощупывании области сердца отмечают дрожание над верхушкой — «кошачье мурлыканье». При прослушивании выявляют усиление первого тона (хлопающий тон). На верхушке слышен тон открытия митрального клапана. Хлопающий I тон в сочетании со II тоном и тоном открытия создает на верхушке характерную трехчленную мелодию — «ритм перепела». При повышении давления в легочной артерии во втором межреберье слева от грудины слышен акцент II тона. К характерным аускультативным признакам при митральном стенозе относят диастолический шум, который может возникать в различные периоды диастолы. Играют роль также показания электрокардиограммы. На фонокардиограмме регистрируют громкий первый тон, диастолический шум над верхушкой сердца, акцент второго тона над легочной артерией, митральный щелчок. Характерными эхокардиографическими особенностями порока являются однонаправленное диастолическое движение створок митрального клапана, снижение скорости раннего диастолического закрытия передней створки левого предсердно-желудочкового клапана, снижение общей экскурсии клапана, уменьшение диастолического расхождения его створок и увеличение размеров полости левого предсердия. При ультразвуковом сканировании определяют атриовентрикулярное отверстие («в торец»), кальциноз (см.) створок и их подвижность; вычисляют площадь отверстия и оба его диаметра. При ренттенологическом исследовании сердца в переднезадней проекции видно выбухание второй дуги левого контура сердца за счет увеличения легочной артерии. По правому контуру определяют увеличение тени левого предсердия, которое может выходить за контуры правого предсердия. В зависимости от степени сужения атриовентрикулярного отверстия различают следующие стадии заболевания. Стадия I — бессимптомная; площадь отверстия составляет 2–2,5 см, клинические признаки заболевания отсутствуют. Стадия II — площадь отверстия 1,5–2 см; при физической нагрузке появляется одышка. Стадия III — площадь отверстия 1–1,5 см; отмечается одышка в покое, при обычной физической активности одышка нарастает; присоединяются такие осложнения, как мерцательная аритмия (см.), образование тромбов в предсердии, артериальные эмболии (см.), фиброз (см.) легких. Стадия IV — стадия терминальной несостоятельности; площадь отверстия менее 1 см; отмечаются признаки недостаточности кровообращения в покое и при малейшей физической нагрузке. Стадия V — необратимая; у больного имеются тяжелые дегенеративные изменения в паренхиматозных органах и миокарде. Течение заболевания зависит от степени сужения левого атриовентрикулярного отверстия. Значительное ухудшение наступает при развитии осложнений: мерцательной аритмии (см.), грубого фиброза (см.) и кальциноза (см.) клапана, образования тромбов в левом предсердии с эпизодами артериальной эмболии (см.), легочной гипертензии (см.) и атеросклероза (см.) легочных артерий с присоединением относительной или органической недостаточности правого предсердно-желудочкового клапана. Смерть наступает от прогрессирующей сердечной недостаточности (см.), отека легких (см.), истощения. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность). В стадии компенсации порока больные могут переносить значительную физическую нагрузку, поэтому заболевание часто выявляют случайно при профилактическом осмотре. При снижении сократительной функции левого желудочка и повышении давления в малом круге кровообращения больные жалуются на одышку при физической нагрузке и сердцебиение. При нарастании застойных явлений в малом круге кровообращения у больных могут появляться одышка в покое и приступы сердечной астмы (см.). Во время осмотра выявляют расширение области сердечного толчка на 3–4 см, смещение влево верхушечного толчка. При прослушивании определяют ослабление первого тона, акцент второго тона; над легочной артерией он умеренно выражен и возникает при развитии застойных явлений в малом круге кровообращения. Часто у верхушки сердца выслушивают третий тон. Наиболее характерным симптомом при митральной недостаточности является систолический шум. При незначительно и умеренно выраженном пороке на электрокардиограмме наблюдают признаки увеличения левого предсердия и левого желудочка. На фонокардиограмме выявляют значительное уменьшение амплитуды первого тона. Систолический шум начинается сразу после первого тона и занимает всю систолу или большую ее часть. Изолированная митральная недостаточность на эхокардиограмме характеризуется дилатацией левых отделов сердца, избыточной экскурсией межжелудочковой перегородки, разнонаправленным диастолическим движением утолщенных створок левого предсердно-желудочкового клапана и заметным отсутствием их смыкания в систолу. При рентгенологическом исследовании в переднезадней проекции выявляют закругление четвертой дуги по левому контуру сердца вследствие увеличения и дилатации левого желудочка. Кроме того, увеличение левого предсердия обусловливает выбухание третьей дуги. Увеличение левого предсердия особенно четко выявляется в первой косой или левой боковой проекции, где этот отдел сердца смещает контрастированный пищевод по дуге большого радиуса (более 6 см). При большом увеличении левого предсердия тень последнего может выступать за правый контур сердца в виде добавочной тени. При рентгеноскопии в случаях выраженной митральной недостаточности можно наблюдать систолическое выбухание левого предсердия (симптом «коромысла»). При внутрисердечном исследовании определяют объем регургитации из левого желудочка в левое предсердие, площадь левого атриовентрикулярного отверстия, давление в полостях сердца и в легочной артерии. По количеству контрастированной крови, поступающей в момент систолы из левого желудочка в предсердие, различают четыре степени регургитации. Увеличение размеров сердца, развитие мерцательной аритмии (см.), приступы отека легких (см.) приводят к выраженной декомпенсации кровообращения, кахексии (истощению) и смерти от острой сердечной недостаточности. Аортальные пороки сердца. Больных беспокоят одышка, боли в области сердца стенокардитического характера, сердцебиение и нарушения сердечной деятельности, головокружения и обмороки (см.). Одышка может носить пароксизмальный характер (приступы сердечной астмы (см.) и завершаться развитием отека легких (см.). При аортальных пороках смерть иногда наступает внезапно, на фоне кажущегося благополучия. При осмотре больных обнаруживают разлитой приподнимающий верхушечный толчок сердца, который смещен вниз и влево в 6—7-м межреберье по передней аксиллярной линии. При недостаточности клапана аорты наблюдают усиленную пульсацию артерий; хорошо заметна каротидная пульсация (на сонных артериях). Систолическое давление повышено, характерно снижение диастолического давления (нередко до нуля) и значительное увеличение пульсового давления. В проекции клапана аорты при аортальном стенозе слышен грубый систолический шум, который распространяется на сонные артерии. На фонокардиограмме этот шум имеет ромбовидную форму. При недостаточности клапана аорты выслушивают и регистрируют диастолический шум, который следует сразу за вторым тоном и может занимать всю диастолу. Этот шум, обычно убывающий, распространяется вдоль левого края грудины, образован струей крови, возвращающейся из аорты в полость левого желудочка во время диастолы. При записи пульсации (сфигмографии) сонной артерии отмечают замедленное повышение восходящего колена кривой, зазубрины на ее верхушке («петушиный гребень») при аортальном стенозе и быстрый крутой подъем и такой же крутой спад кривой с острой вершиной при аортальной недостаточности. Рентгенологически выявляют увеличение размеров сердца за счет увеличения левого желудочка, восходящей аорты и ее дуги. Талия сердца хорошо выражена, сердце приобретает аортальную конфигурацию. Исследование с электронно-оптическим преобразователем позволяет увидеть отложение солей кальция в проекции клапана аорты. Эхокардиографическое исследование помогает определить степень расширения аорты и левого желудочка, преобладание процессов увеличения или дилатации (растяжения) миокарда, оценить его сократимость, диагностировать обызвествление клапана и его распространение на соседние структуры сердца. Катетеризацию полостей сердца и ангиографию применяют для уточнения степени стеноза или недостаточности и оценки состояния сократимости миокарда, выявления зон акинезии (неподвижности) левого желудочка. При стенокардии выполняют коронарографию для выявления сопутствующих нарушений проходимости коронарных артерий. При аортальных пороках прогрессирующее увеличение миокарда левого желудочка приводит к относительной коронарной недостаточности, стенокардии (см.), очаговым рубцовым изменениям миокарда и смерти от острой левожелудочковой недостаточности.
Лечение Пороки сердца врожденные Стеноз легочного ствола (изолированное сужение легочной артерии). При изолированном клапанном стенозе легочной артерии операцию выполняют с помощью катетера с баллоном, который проводят через бедренную вену пункционным методом до клапана легочной артерии. Баллон устанавливают на уровне клапана, раздувают с помощью углекислоты, что приводит к разрыву спаянных между собой створок, и таким образом устраняют стеноз. Об эффективности вальвулопластики судят по записям кривых давления в легочной артерии и правом желудочке. При подклапанном стенозе операцию производят в условиях искусственного кровообращения. Миокард правого желудочка рассекают над стенозом, тщательно иссекают гипертрофированные трабекулы, образующие сужение. Если над специальным бужом, подобранным по диаметру соответственно величине поверхности тела пациента, невозможно сшить рассеченный миокард правого желудочка, то необходима пластика выводного отдела с помощью заплаты. Непосредственные и отдаленные результаты при своевременно выполненной операции хорошие, большинство пациентов могут выполнять физическую работу. Врожденный стеноз устья аорты. Операция показана детям грудного возраста, если имеются признаки недостаточности кровообращения, не поддающиеся консервативному лечению. Детям старше 3 лет операция показана при градиенте систолического давления между левым желудочком и аортой более 50 мм рт. ст.; пациентам старшего возраста — при наличии жалоб и клинических признаков аортального стеноза независимо от величины градиента давления. Операцию выполняют в условиях искусственного кровообращения и кардиоплегии. Сросшиеся створки рассекают по комиссурам, имеющиеся фиброзные утолщения створок иссекают, восстанавливая функцию клапана. При значительных морфологических изменениях створок, их обызвествлении выполняют протезирование клапана. При подклапанном стенозе, обусловленном диафрагмой, ее иссекают. При идиопатическом гипертрофическом субаортальном стенозе выполняют операцию П-образной миосептэктомии: в гипертрофированной части межжелудочковой перегородки, загораживающей выход из левого желудочка, проделывают желобовидный ход. При надклапанном стенозе расширяют просвет аорты, рассекая ее продольно и вшивая заплату в разрез. При невозможности выполнить такую операцию суженный участок аорты удаляют с последующим наложением анастомоза конец в конец или заменяют участок аорты сосудистым трансплантатом. Открытый артериальный проток. Операцию выполняют из левостороннего бокового доступа. Артериальный проток выделяют, перевязывают двумя лигатурами и прошивают третьей. При легочной гипертензии проток пересекают. При двунаправленном сбросе через проток вследствие легочной гипертензии аортальное отверстие протока закрывают заплатой с клапаном, позволяющим предотвратить сброс крови из аорты и не препятствующим сбросу из легочной артерии в аорту. Дефект межпредсердной перегородки. Операцию проводят в условиях искусственного кровообращения. Доступ к дефекту осуществляется путем широкого вскрытия правого предсердия. При незначительных размерах дефекта его ушивают. Если диаметр дефекта превышает 1 см, то закрытие его производят с помощью синтетической заплаты. При впадении легочных вен в правое предсердие один из краев заплаты подшивают не к латеральному краю дефекта, а к стенке правого предсердия таким образом, чтобы кровь из легочных вен после реконструкции поступала в левое предсердие. Первичный дефект всегда устраняют с помощью заплаты. Перед закрытием дефекта производят пластику расщепленной створки митрального клапана путем тщательного ушивания. Таким образом ликвидируют митральную недостаточность. Дефект межжелудочковой перегородки. Операция должна быть выполнена до появления синдрома Эйзенменгера, при котором оперативное закрытие дефекта, как правило, неэффективно и приводит к быстрой недостаточности правого желудочка со смертельным исходом в ближайшие сроки после операции, так как правый желудочек не справляется с высоким давлением в сосудах легких. Оперативное закрытие дефекта межжелудочковой перегородки производят в условиях искусственного кровообращения и кардиоплегии. Доступ к дефекту чаще всего осуществляют через разрез стенки правого предсердия, реже желудочка. Порок ликвидируют путем закрытия отверстия заплатой. Тетрада Фалло. Различают радикальные и паллиативные методы коррекции порока. Радикальное устранение порока осуществляется в условиях искусственного кровообращения и кардиоплегии. Операция состоит в закрытии межжелудочкового дефекта и устранении стеноза. В зависимости от вида стеноза производят рассечение сросшихся створок клапана легочной артерии по их комиссурам, иссечение фиброзно-мышечного валика выводного отдела правого желудочка, вшивание синтетической заплаты в продольный разрез выводного тракта правого желудочка и ствола легочной артерии. Дефект межжелудочковой перегородки устраняют с помощью заплаты путем подшивания ее к краям дефекта. Паллиативные операции заключаются в наложении обходных межартериальных анастомозов. Наиболее распространенным типом операции является соединение правой или левой ветви легочной артерии с подключичной артерией путем наложения прямого анастомоза по типу конец в конец или с помощью трансплантата либо синтетического протеза, вшиваемого между указанными сосудами. Кровь по анастомозу поступает в легкие и далее по легочным венам в левое предсердие. Таким образом, количество оксигенированной крови, попадающей в левый желудочек, увеличивается и цианоз значительно уменьшается. Паллиативные операции выполняют у новорожденных и у детей, у которых имеются тяжелые приступы одышки с синюшностью. Цель операции — дать детям возможность пережить тяжелый период, с тем чтобы впоследствии произвести радикальную операцию.
Пороки сердца приобретенные Стеноз левого атриовентрикулярного отверстия (митральный стеноз). Выбор метода лечения стеноза левого атриовентрикулярного отверстия определяется тяжестью состояния больных, степенью нарушения кровообращения, стадией развития заболевания. В I стадии заболевания больной операции не подлежит. Во II стадии проведение операции предотвращает прогрессирование процесса и дает наилучшие результаты. В этой стадии показана катетерная баллонная вальвулопластика левого предсердно-желудочкового клапана. В III стадии оперативное лечение является необходимым, хотя наилучшие сроки для операции уже пропущены; лекарственная терапия дает временный положительный эффект. В IV стадии еще возможно проведение операции, однако риск ее значительно возрастает; лекарственная терапия дает незначительный эффект. В V стадии заболевания проводят лишь симптоматическое лечение. При отсутствии выраженных фиброзных изменений створок и кальциноза клапана у больных с синусовым ритмом выполняют закрытую митральную комиссуротомию с помощью баллончика, проведенного на катетере в левое атриовентрикулярное отверстие. Катетер с пластиковым баллончиком проводят в левое предсердие путем транссептальной пункции. Диаметр баллончика соответствует нормальному для данного пациента диаметру левого атриовентрикулярного отверстия. Баллончик устанавливают в отверстии и раздувают жидкостью под давлением до 5 атм. Происходит закрытая митральная комиссуротомия. В осложненных случаях показана операция в условиях искусственного кровообращения. Пластическая операция на левом предсердно-желудочковом клапане направлена на восстановление функции створок и подклапанных структур. При выраженных изменениях клапана, обусловленных кальцинозом (см.) и сопутствующей регургитацией, выполняют его протезирование. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность). Выбор метода лечения при недостаточности левого предсердно-желудочкового клапана определяется стадией развития болезни (см. Стеноз левого атриовентрикулярного отверстия). При I стадии хирургическое лечение не проводят. Операция показана преимущественно больным митральной недостаточностью II и III стадии. При IV стадии риск операции высокий, эффект менее стойкий, при V стадии в связи с необратимыми изменениями в сердце и паренхиматозных органах операция противопоказана. У больных с неосложненными формами недостаточности левого предсердно-желудочкового клапана и при отсутствии выраженного кальциноза (см.) створок, резких изменений подклапанных структур выполняют реконструктивную операцию. Клапаносохраняющая операция заключается в суживании фиброзного кольца опорным кольцом, укорочении хорд, за счет чего достигают сопоставления створок клапана. При наличии кальциноза (см.) и фиброза (см.) в области клапана показана замена его протезом. Все операции при недостаточности левого предсердно-желудочкового клапана выполняют в условиях искусственного кровообращения. Аортальные пороки сердца. Оперативное лечение проводится в основном во II и III стадиях заболевания. В случае изолированного стеноза операция показана при градиенте (перепаде) давления между левым желудочком и аортой, превышающем 30 мм рт. ст., в случае недостаточности клапана аорты — при регургитации (обратном токе крови) II степени. Операцию производят в условиях искусственного кровообращения. При аортальном стенозе в случае незначительных изменений в створках клапана возможна клапаносохраняющая операция — разделение сращенных створок по комиссурам. При обызвествлении створок, аортальной недостаточности, сочетании стеноза и недостаточности клапана показано его протезирование. В настоящее время используют шаровые и дисковые искусственные клапаны аорты, биологические протезы из аортальных гомо- и гетероклапанов или клапаны, сформированные из перикарда на опорных каркасах. Имплантированные протезы полностью устраняют имеющиеся нарушения внутрисердечного кровообращения и способствуют нормализации работы сердца, уменьшению его размеров. При аортальных пороках нередко имеются сопутствующие нарушения проходимости венечных артерий, грозящие развитием инфаркта миокарда (см.). Они подлежат хирургической коррекции — одновременному аортокоронарному шунтированию стенозированных венечных артерий
ПОЧЕЧНОКАМЕННАЯ БОЛЕЗНЬ
ОпределениеПочечнокаменная болезнь связана с образованием конкрементов в почечных лоханках и мочевыводящих путях, что вызывает разнообразные патологические изменения почек и мочевых путей.
Этиология и патогенез Причины возникновения камней в почках изучены недостаточно. Определенную роль играют нарушения обмена: фосфорно-кальциевого, щавелевой кислоты, мочевой кислоты и реже аминокислот. Важными факторами образования мочевых камней являются инфекции и нарушения уродинамической функции почек и мочевых путей. Расстройства фосфорно-кальциевого обмена бывают обусловлены гиперпаратиреозом, некоторыми эндокринопатиями, повреждениями костей, гипервитаминозом D, длительным приемом щелочей и солей кальция, т. е. избыточным выделением почками кальция и фосфатов. Камни из фосфата кальция образуются при рН мочи около 7,0. Усиленное выделение солей щавелевой кислоты и образование камней из оксалата кальция обусловлены избыточным эндогенным образованием оксалатов и избыточным поступлением с пищей щавелевой кислоты или веществ, формирующих оксалаты в результате метаболизма (например, прием больших доз аскорбиновой кислоты). Оксалаты выпадают в осадок при рН мочи около 5,5 и повышении концентрации ионов кальция. Растворимость оксалатов усиливается в присутствии ионов магния в моче. Уратурия и образование уратов наблюдаются при нарушении обмена мочевой кислоты (подагра), при заболеваниях, сопровождающихся распадом собственных белков, и при избыточном поступлении с пищей пуриновых оснований. Уратные камни образуются при рН мочи ниже 5,5, а при рН выше 6,2 они растворяются. Реже образуются конкременты из цистина при цистинурии и камни другого химического состава. Часто мочевые камни имеют смешанный состав. Для образования конкрементов необходимы определенные условия — мочевая инфекция и мочевой стаз. Камни почки вызывают не только воспаление слизистой оболочки лоханки и чашечек, но и вторичный интерстициальный нефрит. Инфекция и обструкция мочевых путей усугубляют патологические изменения (апостематозный нефрит, калькулезный пиелонефрит и др.) и нарушают функции почки.
Клиническая картина Иногда болезнь протекает скрыто и обнаруживается случайно при рентгенологическом исследовании по другому поводу или ее первые признаки появляются тогда, когда камень имеет большие размеры, а больной отмечает лишь тупые неопределенные боли в поясничной области. Чаще всего при небольшом камне заболевание проявляется приступами почечной колики, а в период между приступами — тупыми болями, изменениями мочи, отхождением камней и песка. Тупая боль в поясничной области усиливается при длительной ходьбе, во время тряской езды, после поднятия тяжестей, но чаще без определенных причин. Поскольку больной часто применяет грелку (после чего боль утихает), можно видеть «мраморную» пигментацию кожи в области над пораженной почкой. Повторные исследования мочи при почечнокаменной болезни всегда обнаруживают микрогематурию, усиливающуюся после ходьбы и физических нагрузок. Пиурия — нередкий симптом заболевания, который наряду с бактериурией свидетельствует об инфицировании камня. Повышение температуры тела и лейкоцитоз часто сопутствуют почечной колике и не всегда обусловлены гнойной инфекцией. Но длительно не купируемые боли в поясничной области, сопровождающиеся повышением температуры и лейкоцитозом, могут быть проявлением развивающегося апостематозного нефрита и служат показанием к госпитализации больного. Гнойная инфекция часто осложняет течение почечнокаменной болезни и приводит к возникновению калькулезного пиелонефрита (или пионефроза). При нарушении оттока мочи эти осложнения сопровождаются повышением температуры тела, симптомами интоксикации, лейкоцитозом, сдвигом лейкоцитарной формулы влево, повышением СОЭ. Другим грозным осложнением является анурия. Она может быть результатом обтурации мочевых путей с обеих сторон (или единственной почки), но нередко анурия развивается вследствие бактериального шока при обтурации одного. Прогноз при своевременном и адекватном лечении благоприятный.
Диагностика Почечнокаменную болезнь легко диагностируют, если после почечной колики появляется гематурия и отходят мочевые камни. При отсутствии этих признаков диагноз ставят на основании совокупности указанных выше симптомов и данных урологического обследования. Рентгенологическое исследование и УЗИ — основной метод диагностики почечнокаменной болезни. Наиболее ценна внутривенная урография, она позволяет установить наличие камней, их количество, локализацию, размеры, состояние почек и мочевых путей. Обнаружение камня, не задерживающего рентгеновские лучи, с большой вероятностью указывает на то, что это урат.
Схема рентгеновского снимка при лоханочном камне почки
Лечение и профилактика Лечение почечнокаменной болезни направлено на купирование приступов почечной колики, удаление камня, лечение инфекции и предупреждение рецидивного камнеобразования. Решение этих задач требует специальных знаний и консультации уролога. Самостоятельно может отойти лишь гладкий камень диаметром менее 10 мм. Хирургическое удаление камней почек показано при сопутствующей инфекции, обструкции мочевых путей, нарушающих функцию почек, и мучительных повторяющихся болях. Консервативное лечение и профилактика рецидивного камнеобразования зависят от состава камней. Устранение инфекции и подкисление мочи — основные мероприятия по профилактике рецидивов образования фосфатов. Диета должна быть богатой белками, содержать животные жиры. Можно назначать аскорбиновую кислоту по 3–4 г/сут. или метионин по 3–4 г/сут. Профилактика образования оксалатов заключается в соблюдении диеты, исключающей продукты, богатые щавелевой, аскорбиновой кислотами, солями кальция (щавель, бобы, шоколад, молоко и др.). При фосфатурии и оксалатурии целесообразно применять препараты магния (окись магния по 0,15 г 3 раза в день), а после операции — метиленовый синий. Уратные камни удается растворять, применяя диету и средства, подщелачивающие мочу, и препараты, уменьшающие образование мочевой кислоты. Диета при уратах исключает продукты, богатые пуриновыми соединениями (мясо птицы, почки, печень, сыры, кофе). Пища должна быть преимущественно растительной. Для подщелачивания мочи применяются магурлит, солуран, блемарен и другие подобные им препараты в дозах, обеспечивающих поддержание рН мочи между 6,2 и 6,6. Аллопуринол — препарат, уменьшающий образование мочевой кислоты, применяется при высокой концентрации мочевой кислоты в крови. В профилактике любого камнеобразования важно, чтобы моча была малоконцентрированной. Больной должен много пить жидкости, показано курортное лечение (Трускавец, Саирме, Железноводск и др.).
ПРОЛЕЖНИ
ОпределениеПролежни — некроз кожных покровов, обусловленный компрессией тканей с нарушенной трофикой.Пролежень — это язвенно-некротический процесс, развивающийся у ослабленных лежачих больных на тех областях тела, которые подвергаются постоянному давлению. Основными причинами являются ишемия и нейротрофические изменения тканей. Различают следующие виды пролежней: — экзогенные, т. е. вызванные механическими факторами, приведшими к ишемии и омертвению тканей. В этих случаях устранение причин, вызвавших пролежень, ведет к развитию репаративных (восстановительных) процессов и его заживлению; — эндогенные, развитие которых определяется нарушением жизнедеятельности организма, сопровождающимся нейротрофическими изменениями тканей. Заживление таких пролежней возможно при улучшении общего состояния организма и питания тканей.
Этиология и патогенез Пролежень — это повреждение кожных покровов в результате длительного действия локального давления. В результате этого сдавливаются капилляры, так что соответствующая область кожи больше не получает достаточного количества крови и кислорода. Уменьшенное кровообращение ведет к накоплению в ткани токсичных продуктов с последующим повышением проницаемости капилляров, расширением сосудов, образованием отека и развитием клеточной инфильтрации. Эти воспалительные реакции в своей начальной стадии вызывают повышенное кровенаполнение с ростом капиллярного давления, благодаря чему в это время токсичные продукты обмена еще могут удаляться, а клетки кожи сохраняют способность к регенерации — при условии, что с этой области полностью снята нагрузка. Однако если действие давления продолжается, из-за все усиливающейся кислородной недостаточности в коже происходят необратимые изменения, ведущие к ее омертвению. С практической точки зрения, если своевременно снять давление, всегда можно предотвратить развитие пролежней. Вторая причина, из-за которой могут образоваться пролежни, — различные манипуляции с лежачим больным: когда пациента тянут по постели, вытаскивают из-под него мокрое белье, пытаются подпихнуть под него судно. В это время происходит значительное смещение поверхностных слоев мягких тканей по отношению к глубоко расположенным слоям, в результате чего мелкие кровеносные сосуды рвутся и кровоснабжение этих отделов нарушается. Аналогичным образом пролежни могут образовываться и у слабых лежачих пациентов, которые, не имея упора в ногах, начинают медленно сползать по стулу или кровати из положения сидя или полусидя, что едва заметно глазу, но очень ощутимо для мягких тканей. Факторы, влияющие на развитие пролежней: нарушение осязания; травмы и заболевания спинного и головного мозга; повышенная температура и потоотделение; недержание мочи и кала; грязная кожа; крошки и мелкие предметы в постели; складки, швы, пуговицы на белье; сниженное питание и недостаток питья; особенности диеты, избыточный вес и истощение; сердечно-сосудистые заболевания; сахарный диабет (см.); аллергическая реакция на средства по уходу за кожей; возраст.
Клиническая картина Пролежни, в принципе, могут развиться на любой части тела. Наибольший риск имеет то место, где давление, создаваемое весом тела, и противодавление со стороны опорной поверхности действуют на область кожи, лежащую над костным выступом и имеющую незначительную прослойку подкожной жировой ткани. В качестве типичных мест локализации можно назвать крестцовую область, пятки, седалищные кости, большие вертелы бедренных костей, а также боковыелодыжки. В этих местах возникает до 95 % всех пролежней. Вначале появляются локальная бледность, синюшность и отечность кожи. Далее наступает отслойка верхнего слоя кожи с образованием пузырей и ее омертвение. Инфицирование углубляет и расширяет процессы омертвения тканей. Повреждение проходит в своем развитии различные стадии в зависимости от степени и продолжительности сжатия. Стадия I. Резко ограниченное покраснение кожи, которое можно устранить путем снятия давления. У лиц с темным цветом кожи заметить эту стадию можно также по обесцвечиванию кожи, повышенной температуре, отеку или затвердению. Стадия II. Частичная потеря кожи с разрушением эпидермиса (верхнего слоя кожи) и дермы, однако еще без вовлечения подкожной клетчатки. Речь идет о поверхностной язве, которая клинически проявляется в виде потертости, пузыря или плоского кратера. Стадия III. Повреждение всех слоев кожи, которое может достигать фасций (соединительнотканных оболочек, покрывающих мышцы), причем последние еще не поражаются. Язва имеет вид глубокого кратера с подрытыми или плоскими краями. Стадия IV. Потеря кожи на всю толщину с обширными очагами омертвения тканей и повреждениями мышц, сухожилий и костей, подрытыми краями раны и образованием карманов. В стадиях III и IV возникает опасность септических (инфекционных) осложнений.
Лечение Лечение представляет значительные трудности и проводится по общим правилам ведения гнойно-некротических язв. Самое благоприятное время для лечения пролежней — это стадия, предшествующая образованию пузырей. Если произошло образование пузыря, следует готовиться к продолжительному лечению. Эти раны заживают очень медленно, и сроки выздоровления будут исчисляться не днями, а неделями. Лечение пролежня опирается на три краеугольных камня. Первым требованием является восстановление кровоснабжения поврежденного участка кожи путем полного снятия давления. Без снятия давления заживление невозможно, и все дальнейшие мероприятия бессмысленны. При этом снятие давления должно быть обеспечено на весь период лечения. Любое, даже длящееся всего минуты давление снова вызывает повреждение и приведет к обратному развитию процесса. Местная терапия раны охватывает тщательную, по возможности хирургическую обработку раны, а также постоянную очистку ее гидроактивными повязками, кондиционирование раны со стимуляцией развития грануляционной ткани, а также завершающую эпителизацию, тоже с помощью влажной обработки раны. В качестве третьего мероприятия показана вспомогательная терапия для улучшения общего состояния пациента и устранения болей. У престарелых пациентов часто наблюдается кахексия (истощение) в сочетании с белковой недостаточностью, так что необходимо обеспечить соответствующий прием пищи с повышенным содержанием белка и достаточным количеством витаминов и минеральных веществ. Первичная оценка общей ситуации: локализация язвы, степень тяжести, общее состояние раны, оценка статуса пациента, его готовности к сотрудничеству. Этиологическая и местная терапия включают в себя полное устранение давления на язву вплоть до заживления. Кроме того дополнительно необходимы нормализация общего состояния, улучшение питания, борьба с болью, соответствующая хирургическая обработка раны, борьба с инфекцией, лечение влажными повязками для продолжения очищения раны, кондиционирования и рубцевания, при необходимости — пластическая хирургия. Если язва зажила, то необходимо осуществлять контроль и продолжение терапии согласно плану лечения. Если заживления язвы не произошло, то проводится тщательная проверка качества выполнения всех мероприятий (особенно снятие нагрузки), после чего назначается лечение очистившейся раны. Необходимо создать влажные условия содержания раны, используя, например, альгинаты (в форме салфеток и порошка для заполнения ран), гидроколлоидные повязки (Hydrocoll, Duoderm, Hydrosorb и др.), способствующие очищению и закрытию раны. Повязки эти достаточно дорогие. Для заживления раны можно использовать самые разнообразные заживляющие средства: мази «Левосин», «Левомиколь», «Актовегин», «Солкосерил», облепиховое масло и др. Нередко пролежни осложняются присоединением вторичной инфекции, и тогда необходимо использование антисептических и антибактериальных средств, таких как борная кислота, белый стрептоцид в порошке, 3 %-ный раствор перекиси водорода, раствор фурацилина в разведении 1:5000, мази «Левомиколь» и «Левосин». В целях фитотерапии пролежней можно использовать отвар коры дуба. Приготовление: 1 ч. л. высушенной и измельченной коры молодого дуба заливают 1 стаканом кипящей воды, кипятят 30 мин, настаивают 10 мин, процеживают. Отваром коры дуба смазывают и промывают поверхность пролежней. Салфетки, пропитанные отваром коры дуба, используют для повязок. Для лечения обширных и долго не заживающих пролежней применяют водные настои и отвары цветков календулы, которые оказывают успокаивающее, ранозаживляющее и противовоспалительное действие. Приготовление настоя: 2 ч. л. цветков календулы заливают 2 стаканами кипятка, настаивают 15 мин, процеживают. Принимают по 1/2 стакана 4 раза в день перед едой. Приготовленный настой также используют наружно для промывания нагноившихся пролежневых участков и пропитывания салфеток для повязок.
Профилактика Конечно, лучше всего предотвратить образование пролежней. Нужно постоянно следить за кожей лежачего больного, чтобы она не подвергалась раздражению. При наличии признаков образования пролежней необходимо принять ряд мер. Уменьшение давления в области поражения — это самое важное, что вы можете сделать. В частности, нужно поворачивать лежачего больного с бока на бок, если пролежни появляются на спине. Рекомендуется ночью лежать на животе. Это положение имеет ряд преимуществ: при положении на животе давление распределяется по всему телу; задняя сторона тела, испытывающая нагрузку днем при сидении, освобождается; утром пациент сам может легко обнаружить появление красных пятен на передней части тела; положение на животе предотвращает появление контрактур. Под места костных выступов дополнительно подкладывают валики, например мягкие подушки из пера или поролона. Под неподвижные конечности можно подложить мешочки, наполненные круглым зерном, например пшеном. Под крестец подкладывают резиновый круг. Смысл применения разнообразных валиков и противопролежневых матрасов в том, что они увеличивают площадь соприкосновения тела с поверхностью, на которой лежит пациент, а значит, уменьшают давление на каждый участок тела, минимизируя нарушения кровообращения и таким образом снижая риск возникновения пролежней. Уменьшение раздражения кожи — с этой целью необходимо стелить мягкое белье; исключить на белье пациента грубые швы, пуговицы, заплатки; регулярно и часто оправлять постель, чтобы под пациентом не было складок и мелких предметов; для ухода за кожей использовать низкоаллергенные проверенные средства, например детское мыло; избегать пахучих и ярких; чаще проводить туалет промежности, так как частицы кала и мочи являются сильными раздражителями; ни в коем случае не ограничивать в питье пациента с недержанием мочи, так как при недостатке жидкости повышается концентрация мочи, а соответственно и сила раздражения; коротко стричь ногти себе и пациенту: себе — чтобы случайно не поцарапать пациента, а пациенту — чтобы он не расчесывал кожу, так как при длительном лежании или сидении сдавленные участки зудят; следить за тем, чтобы пациент был одет и закрыт одеялом соответственно температурным условиям комнаты, так как при перегревании пациента усиливается потение и увеличивается риск развития пролежней. В сидячем положении пролежни прежде всего развиваются в нижней часть крестца (на копчике), в области шва ягодиц и на седалищных костях. Поэтому всех пациентов обучают отжиматься руками каждые 10–15 мин, таким образом освобождая от нагрузки седалищные кости. Подножки в коляске должны быть отрегулированы таким образом, чтобы бедра получали опору до колен по всей длине. Особую осторожность проявляют при смене подушек или обуви (особенно на каблуках). Если у человека, пользующегося инвалидной коляской, образовались пролежни в области ягодиц, его укладывают в постель на бок или на живот до заживления язв. Пациенту обеспечивают необходимую подвижность, чаще меняя положение тела. Если больной способен самостоятельно двигаться, он должен менять положение тела каждые 15 мин. При неспособности пациента к движению его положение меняют хотя бы через каждый час (если больной находится в кресле) или через каждые 2 ч (если он находится в постели). Многие люди используют решетки для хранения яиц или овечью шкуру в качестве покрывала для матраца. Но ни то ни другое не может уменьшить давление на кожу и предотвратить развитие пролежней. Необходим мягкий, но упругий матрац. Для этого подходит поролоновый матрац, толщина которого должна быть не менее 15 см. Ложе должно быть ровное, без бугорков и ямок. Можно приобрести специальный противопролежневый матрац, но даже при его наличии у больного все равно могут образовываться пролежни. Надувной матрац с насосом под кроватью гораздо удобнее. Его можно то подкачивать, то спускать. Сначала пролежни обрабатывают физиологическим раствором. Затем на рану накладывается самоклеящаяся повязка из прозрачной пленки. Она остается на ране до четырех дней. Дело в том, что в организме образуются особые вещества, так называемые факторы роста. Они способствуют заживлению ран. Если менять повязку каждый день, то с кожи будут удаляться и эти вещества, до того как они успеют проявить свое действие. Герметическая повязка обеспечивает надежный контакт факторов роста с раной и ускоряет заживление. Нельзя допускать загрязнения кожи, чрезмерной сухости и влажности, так как это понизит способность кожи к внешним воздействиям; следует использовать обычную воду, мыло и мочалку из хлопчатобумажной ткани или натуральной губки, питательные и увлажняющие кремы, подсушивающие мази, присыпку. Если внимательно наблюдать за кожей, становится ясно, в какой момент что применять. Общее правило такое: влажную кожу нужно подсушивать, а сухую — увлажнять. Антибактериальное мыло не используют, так как вместе с вредными бактериями уничтожаются и полезные микроорганизмы; кожа после такого мыла не способна сопротивляться даже незначительной инфекции. Спиртосодержащие средства, такие, как лосьоны и камфорный спирт, можно использовать только у пациентов с жирной кожей. При мытье кожу в местах сдавления не трут. Чтобы не травмировать верхние слои кожи, употребляют мягкие губки и пользуются ими очень осторожно. При высушивании кожи ее не вытирают, а промакивают. Покрасневшие участки кожи ни в коем случае не массируют, но легкий регулярный массаж вокруг этих мест весьма желателен. У людей, страдающих недержанием мочи, и лежачих больных вероятность возникновения пролежней в несколько раз выше, чем у обычных людей, так как моча и кал оказывают раздражающее влияние на кожу. Эти люди нуждаются в тщательном уходе за кожей. При уходе за ними используют средства, специально предназначенные для обмывания и протирания кожи в случае недержания мочи. Обязательно также устраивают воздушные ванны для кожи. Пациента в одиночку не подтягивают, не тащат и не выдергивают из-под него белье, особенно мокрое, не подпихивают под него судно. Для всего этого есть несложные приемы, основной смысл которых состоит в том, что больного надо сначала приподнять, а только потом двигать или подкладывать под него что-либо. Пациента не оставляют в неудобном положении, а слабых больных не усаживают с целью придать им полусидячее положение, так как их мышечной активности недостаточно, чтобы удержаться в этом положении, и они начинают сползать. Таких пациентов обеспечивают упором (любым приспособлением для упора) в ногах. Необходимы соответствующие питание и питье, чтобы поддерживать кожу в здоровом состоянии. Первое, что бросается в глаза у больных с пролежнями, — это истощение. Кожа является органом, наибольшим по площади. Подобно другим органам, она также подвергается серьезным повреждениям, когда не получает достаточного количества питательных веществ. Питье и питание должны быть полноценными с учетом ограничений, если таковые имеются. Пища должна содержать не менее 20 % белка. Выбирают продукты, содержащие много микроэлементов (очень важны железо и цинк), а также витамина С, — кисломолочные продукты, зелень, овощи, фрукты. Для тяжелых больных мясо — трудная пища. Поэтому для покрытия потребностей в белке используют куриный бульон, рыбу, бобы, крупы и молочные продукты. Жидкости следует давать не менее 1,5 л, если нет ограничений. Не употребляют сладких и газированных напитков, а также сублимированных продуктов, т. е. продуктов быстрого приготовления из сухого порошка путем растворения в воде. Исследования показывают, что прием препаратов витамина С в количестве 500 мг два раза в день позволяет сократить площадь поражения при пролежнях до 84 %. Но перед проведением терапии витамином С нужно получить разрешение врача. Для профилактики пролежней может использоваться травяной сбор, состоящий из березы повислой (листья) — 2 части, душицы обыкновенной (трава) — 1 часть, хвоща полевого (трава) — 1 часть, сосны обыкновенной (почки) — 2 части. Принимают в виде настоя по 1/2 стакана 3 раза в день за 30 мин до еды.
ПРОСТАТИТ
ОпределениеПростатит — воспаление предстательной железы, возникающее при попадании инфекции в железу гематогенным путем, восходящим путем из мочевых путей или проведении инструментальных вмешательств. Заболевание простатитом, как правило, не угрожает жизни больного, но, оказывая определенное воздействие на половую функцию, служит источником больших переживаний, особенно у молодых людей.
Этиология Выделяют несколько основных клиникоанатомических форм простатита: острый бактериальный простатит; хронический бактериальный простатит; небактериальный простатит (застойный, или конгестивный), атония предстательный железы (невроз, простаторея); атипичные формы хронического простатита; склероз предстательной железы; простатодиния, или нейровегетативная простатопатия. В настоящее время при острых простатитах принято различать следующие формы: катаральный, фолликулярный, паренхиматозный и абсцедирующий простатиты (абсцесс (см.) предстательной железы). Катаральный простатит характеризуется наличием воспалительного процесса в слизистой и подслизистой оболочках выводных протоков железистых долек предстательной железы. В тех случаях, когда воспалительный процесс прогрессирует, отек стенок выводных протоков приводит к застою слизисто-гнойного содержимого в фолликулах железы. В результате этого инфекция проникает в ткань долек, вызывая в них нагноение. Развивается фолликулярный простатит. Если имеется множественное поражение долек гнойно-воспалительным процессом, то говорят о паренхиматозном простатите. Когда же несколько мелких гнойников сливаются в один крупный, возникает абсцесс предстательной железы. Абсцесс может самостоятельно вскрыться в прямую кишку, мочевой пузырь, в область промежности. Однако чаще всего он вскрывается в мочеиспускательный канал. В этиологии простатитов различают две группы действующих факторов — инфекционные (бактерии, вирусы, микоплазмы, грибы) и застойные (прерванное половое сношение, половые излишества и извращения, отсутствие регулярной половой жизни, половая абстиненция (воздержание)). Простатит развивается более интенсивно и начинает проявлять себя при наличии неблагоприятных факторов: переохлаждение организма, малоподвижный образ жизни, сидячая работа (водители, операторы, руководители и пр.), длительное половое воздержание, регулярные запоры (см.), подавленная иммунная система, стрессы, некачественное питание, воспалительные, венерические и урологические заболевания.
Патогенез Простата начинает формироваться на 3-м месяце внутриутробной жизни и достигает физиологической зрелости к 16–17 годам. Врожденные предрасполагающие факторы возникновения простатита представлены ниже. 1. Особенности строения ацинусов (долек) и в первую очередь — выводных протоков, имеющих криптообразное строение. Просвет протоков покрыт слизистой оболочкой, образующей множество бухточек и изгибов. К тому же в стенке протоков отсутствует мышечная ткань. В связи с этим отток из простаты ее секрета от природы затруднен и возможен в основном при оргазме и эякуляции, когда одновременно сокращаются мышцы передней брюшной стенки, промежности, предстательной железы и задней части уретры. Степень эвакуации секрета зависит от высоты оргазма, который может быть физиологическим и психическим или только физиологическим, когда в сексуальных отношениях отсутствует эмоциональность. Неполное опорожнение выводных протоков ацинусов ведет к задержке и застою секрета, что является условием для возникновения воспалительного процесса. 2. Отсутствие мышечных жомов в отверстиях выводных протоков ацинусов. В связи с этим при наличии уретрита (см.) болезнетворные микробы и другие возбудители легко проникают через зияющие выходные отделы протока в предстательную железу. Это может наступить и при неосторожных лечебных манипуляциях, когда при остром уретрите пытаются провести промывание мочеиспускательного канала. 3. Особенность кровоснабжения простаты, когда артериолы заканчиваются не в железистой ткани, а в соединительнотканных прослойках между ацинусами (строме железы). Поэтому всякое увеличение предстательной железы вследствие начавшегося воспаления сдавливает эти артериолы и приводит к ишемии. Отсюда неэффективность противовоспалительной терапии. В связи с этим возникает необходимость в применении физических методов (электростимуляция, ультразвук, лазер, массаж и т. д.), расширяющих просвет сосудов, или электрофореза. 4. Наличие обильных анастомозов (сообщений, соустий) между венами таза и предстательной железы. Вены таза являются сексуальным «барометром» человека. Всякое сексуальное возбуждение приводит к застою крови в венах таза, распространяющемуся по анастомозам на простату. В застойной железе возникает конгестивный простатит, а при наличии активной микрофлоры в организме может развиться и неспецифический инфекционный простатит. 5. В связи с близким расположением выводных протоков предстательной железы и семявыводящих протоков инфекция может распространяться в семенные пузырьки, а по семявыносящему протоку и ретроградно — в яички и их придатки. 6. Двусторонняя гипоплазия и гипоандрогения. На фоне гормональных нарушений простатит (как конгестивный, так и инфекционный) может развиться у молодого человека, не ведущего половую жизнь и даже не мастурбирующего. При наличии внеуриногенного очага инфекции весьма вероятно развитие инфекционного неспецифического воспаления предстательной железы. Таким образом, имеются анатомо-физиологические предпосылки для упорного и длительно протекающего хронического простатита. Помимо скудного кровообращения, предстательная железа имеет мощную иннервацию, чем и объясняются выраженные боли при ее заболеваниях. Чувствительные симпатические и парасимпатические волокна попадают в нее из подчревного нервного сплетения. Поверхность железы опутана предстательным нервным сплетением и нервными узлами, от которых нервные импульсы идут в нижние крестцовые узлы симпатических стволов. Парасимпатические волокна начинаются в крестцовом отделе спинного мозга. Простата также получает ветви от почечного, аортального и брыжеечного нервных сплетений. Эти особенности объясняют многообразие клинических проявлений, а также возможности опосредованного лечебного воздействия. Острый простатит возникает вследствие проникновения инфекции вместе с кровотоком из отдаленных гнойных очагов (фурункул (см.), гайморит (см.), тонзиллит (см.) и др.). Другим путем заноса инфекции является каналикулярный путь при воспалении задней уретры (мочеиспускательного канала). Наиболее часто простатит развивается как осложнение уретрита (см.). Занос инфекции вместе с лимфой хотя полностью и не исключается, однако наблюдается редко.
Клиническая картина Клиническая картина острого простатита весьма разнообразна и зависит от его формы. Наиболее общие симптомы: — болевые ощущения в промежности, надлобковой области, яичках, пояснице. Боль при мочеиспускании беспокоит более половины больных. Боли при половом акте встречаются у 5—12 % больных; — проблемы при мочеиспускании — учащенное и болезненное мочеиспускание, учащенные позывы на мочеиспускание и боль в конце мочеиспускания, тонкая и вялая струя мочи; — расстройство сексуальной функции — болезненность при семяизвержении, стертый оргазм, раннее семяизвержение либо его задержка, вытекание секрета предстательной железы при дефекации и натуживании, ухудшение эрекции, ее неполнота и кратковременность; — бесплодие или снижение качества спермы — оплодотворяющая способность сперматозоидов снижена. Простатит более чем в 80 % случаев приводит к снижению сексуальной потенции мужчин. Катаральный простатит нередко возникает на фоне уже имеющегося уретрита (см.). Он может явиться осложнением и общих инфекций (грипп (см.), ангина (см.) и др.). В этих случаях симптомы заболевания могут быть нерезко выраженными. Больные отмечают учащенное мочеиспускание, особенно в ночное время, умеренную болезненность во время него. Однако иногда болевые ощущения отсутствуют, а наблюдается лишь тяжесть в промежности, особенно когда больной сидит. Дизурия (расстройства мочеиспускания) также непостоянна и чаще незначительна. Температура тела обычно нормальная или слегка повышена. Общее состояние резко нарушается. Ректально предстательная железа несколько увеличена или не изменена, слегка болезненна. В секрете предстательной железы содержатся большое количество лейкоцитов, слизисто-гнойных нитей, достаточное количество лецитиновых зерен. Состав мочи, как правило, не изменяется, однако иногда могут появляться лейкоциты в связи с опорожнением выводных протоков желез. Массаж предстательной железы в силу болезненности бывает невозможен. Поэтому исследование мочи следует производить после ректального исследования железы, а также во время акта дефекации, при котором имеются возможности выделения гнойных пробок из выводных протоков железок предстательной железы. При благоприятном течении болезни через 7—10 дней постепенно наступают улучшение и излечение. В случаях неблагоприятного течения катаральный простатит переходит в фолликулярный. Клинические проявления при этой форме более выраженные. Больные обычно жалуются на тупые ноющие боли в промежности со смещением в головку полового члена и задний проход и крестец, на учащенное, затрудненное и болезненное мочеиспускание. В отдельных случаях возможна острая задержка мочи. Наблюдаются боли при дефекации. Температура тела повышается до 38 °C и выше. Предстательная железа увеличена в размерах, напряжена, уплотнена, чаще асимметрична, резко болезненна при прощупывании. Болезненность в отдельных участках может быть больше выражена. В моче, полученной непосредственно после прощупывания железы, как правило, имеется большое количество гнойных нитей, быстро оседающих на дно сосуда, лейкоциты. Получение секрета предстательной железы (массаж железы) противопоказано. Прогноз при фолликулярном простатите может быть благоприятным при условии своевременно начатого и энергичного лечения. Однако возможен переход и в следующую стадию болезни — паренхиматозную. При этой форме воспалительный процесс носит гнойный характер и распространяется почти на все дольки железы. При паренхиматозном простатите гнойный секрет железок лишь в отдельных случаях может опорожниться в заднюю уретру. Это лучший вариант. Чаще этого не происходит, так как эпителий выводных протоков набухает, а просвет их закупоривается гноем и слизью. При этом воспалительный процесс распространяется в подслизистую оболочку. Отток секрета из железы нарушается. Клиническая картина паренхиматозного простатита проявляется бурно и носит резко выраженный характер. Температура тела держится на высоких цифрах (39 °C и выше), отмечаются озноб, общая слабость, разбитость, жажда, потеря аппетита, интенсивные боли при мочеиспускании и дефекации, резко учащенное и затрудненное мочеиспускание. Дизурия выражена и быстро нарастает. Возможна острая задержка мочи. Предстательная железа увеличена в размерах, с нечеткими контурами, прощупывание ее резко болезненно. Абсолютно противопоказан массаж железы. Поражение при паренхиматозном простатите редко ограничивается только паренхимой железы. Как правило, процесс распространяется на интерстициальную ткань. Воспалительный процесс может распространиться на капсулу железы, параректальную (околопрямокишечную) и даже предпузырную клетчатку. В тех случаях, когда заболевание явилось следующей стадией предшествующего фолликулярного простатита, наступает заметное ухудшение течения заболевания. Боль может быть очень сильной. Иногда больные находят облегчение в положении на спине с приведенными к животу бедрами. Отмечается задержка стула и газов. Если воспаление переходит на околопузырную клетчатку, возникают мучительные тенезмы. Боль может локализоваться в прямой кишке, носить пульсирующий характер. Больные ощущают наличие инородного тела в прямой кишке. Дефекация бывает резко болезненной. Поскольку значительно увеличенная предстательная железа глубоко вдается в просвет прямой кишки, наступают запоры (см.) и резкие боли в животе. В прямой кишке возможно развитие воспаления, появляются слизистые выделения из заднего прохода. Промежность в таких случаях резко болезненна, ввести палец в прямую кишку часто не удается из-за резкой боли. Это бывает особенно выражено при распространении процесса на параректальную клетчатку. В анализах крови определяется высокий лейкоцитоз со сдвигом лейкоцитарной формулы влево. Анализы мочи могут быть от нормальных до резко измененных. Временами моча становится мутной. Заболевание нередко принимает септический характер. В таких случаях следует производить неоднократные бактериологические посевы крови на гемокультуру. Показаны и повторные посевы мочи на флору и чувствительность к антибиотикам. Исходами острого гнойного паренхиматозного простатита могут быть разрешение, абсцедирование и переход в хроническую форму. Если лечение правильное, энергичное и длительное, возможно выздоровление, но при этом следует иметь в виду неизбежность потери паренхиматозной ткани железы с частичным заращением выводных протоков и сохранением условий для рецидива заболевания. Абсцесс предстательной железы является крайней формой острого простатита. Причиной образования абсцесса (см.) предстательной железы в этих случаях является гнойное расплавление фолликулов предстательной железы при остром фолликулярном и паренхиматозном простатите. Но совсем не обязательно, чтобы абсцессу предстательной железы предшествовали другие стадии. У части больных он бывает первичным и развивается, минуя стадии острого простатита. Проникновение инфекции возможно во время септикопиемии при флегмонах (см.), фурункулах (см.), гидраденитах (см.) и других гнойных заболеваниях. Абсцесс предстательной железы протекает с клинической картиной острого септического воспаления. В тех случаях, когда он идиопатический, в начале заболевания преобладают септикопиемические симптомы. В этих случаях наблюдаются высокая температура, потрясающий озноб с проливными потами, пульсирующие сильные боли в промежности, довольно часто отмечаются острая задержка мочи, резкая болезненность при мочеиспускании и дефекации, слабость, адинамия, тахикардия (см.) и другие симптомы интоксикации. Общее состояние больных тяжелое. В анамнезе имеется указание на гнойный очаг (пиодермия (см.), фурункулез (см.), гидраденит (см.), тонзиллит (см.), аднексит (см.) и др.). К этому времени, как правило, эти гнойные очаги уже бывают в стадии обратного развития. При абсцессах (см.) предстательной железы, являющихся осложнением простатита, на фоне уже имеющихся симптомов отмечается усиление боли в промежности, нарастает лихорадка, ухудшается общее состояние, усиливаются дизурические явления вплоть до задержки мочи и газов, боли в животе, симптомы общей интоксикации. Клинические проявления заболевания зависят от его стадии. В период активного формирования абсцесса особенно резко вырисовываются все симптомы — резкие боли в промежности, смещение их в крестец, внутреннюю поверхность бедер, прямую кишку, высокая температура, ознобы и т. д. При ректальном исследовании предстательной железы в это время отмечается крайняя ее болезненность, контуры нечеткие, определяются неравномерное увеличение железы, участки размягчения и флюктуации. При исследовании следует обращать внимание также на асимметрию увеличенной и болезненной железы, что может указывать на наличие гнойного очага, симптом баллотирования при надавливании на одну из боковых долей предстательной железы. Это может быть при глубоколежащей отграниченной полости. Иногда пальцем определяется пульсация железы, передаваемая с тазовых сосудов через долю железы. Этот симптом в литературе называют ректальным пульсом Гюйона. В крови больных абсцессом предстательной железы выявляются лейкоцитоз, сдвиг формулы влево, увеличение СОЭ. Следует иметь в виду, что СОЭ может оставаться увеличенной значительное время, даже при обратном развитии процесса. Изменения в моче появляются при опорожнении гнойника в уретру или в мочевой пузырь. При самопроизвольном вскрытии абсцесса в мочеиспускательный канал или прямую кишку наблюдается обильное выделение гноя с мочой или калом. Вслед за этим стихают боли и нормализуется температура, общее состояние улучшается, предстательная железа уменьшается в размерах, а на месте абсцесса выявляется западение. Однако так бывает далеко не всегда. Если больному не оказана своевременная помощь, прогноз абсцесса предстательной железы неблагоприятен. Гнойник может прорваться в парапростатическую клетчатку, клетчатку прямой кишки, распространиться по семявыносящим протокам в паховые каналы. Проявления хронического простатита многообразны. У каждого больного это заболевание может протекать по-своему, и каждый пациент требует индивидуального подхода. Жалобы, с которыми обращается больной, не представляют собой ничего характерного (зуд или жжение в уретре, ощущение давления и тяжести в области промежности, боль различной интенсивности в промежности и прямой кишке и т. д.). Примерно четверть больных хроническим простатитом могут вообще не предъявлять никаких жалоб, а заболевание выявляется у них случайно при урологическом обследовании. Гораздо более характерны функциональные расстройства, которые можно разделить на три группы: расстройства со стороны мочевого аппарата (частые и болезненные позывы к мочеиспусканию, частичная задержка мочи и т. д.); расстройства половой функции (боль в уретре и прямой кишке при эякуляции, слабая эрекция, преждевременная эякуляция, утрата оргазма и т. д.); расстройства нервной системы (невротические расстройства, обусловленные фиксацией внимания больных на своем состоянии). Хроническое воспаление предстательной железы может продолжаться неопределенно долго, но течение хронического простатита не бывает монотонным с одинаковой интенсивностью проявлений. Как правило, этому заболеванию свойственны периодические обострения, сменяющиеся периодами относительного затишья. Исход хронического простатита зависит от инфекционного фактора, формы заболевания, состояния организма и характера лечения. В зависимости от этих факторов исходом хронического простатита могут быть полное и стойкое выздоровление, выздоровление с наличием остаточных изменений (обычно рубцовая атрофия (см.) в ткани предстательной железы и соседних органах), переход в более или менее длительное состояние улучшения с последующим обострением воспалительного процесса.
Диагностика Диагностика острого простатита основывается на данных опроса, жалобах больного (боли в промежности, прямой кишке, болезненное и затрудненное мочеиспускание, слизисто-гнойные выделения из уретры, повышение температуры тела, озноб и др.), физикального и лабораторных методов исследования. Современная диагностика заболеваний предстательной железы. 1. Пальцевое обследование предстательной железы, представляющее собой весьма информативный способ. Тот факт, что 80 % случаев рака (см.) предстательной железы выявляется посредством ректального исследования, говорит сам за себя. Можно смело сказать, что этот метод исследования будет использоваться всегда. Пальцевое исследование предстательной железы выявляет ее увеличение, отечность, болезненность. Исследование предстательной железы следует проводить очень осторожно, не допуская грубых манипуляций, нажима и массажа железы. 2. Микроскопическое исследование секрета предстательной железы. Следует помнить, что увеличение числа лейкоцитов в секрете не всегда свидетельствует о простатите, так как методики получения секрета при массаже не гарантируют, что в него не попадет содержимое мочеиспускательного канала и семенных пузырьков. Ведущим критерием в оценке секрета предстательной железы является соотношение числа лейкоцитов и лецитиновых зерен. У здоровых лиц число лейкоцитов не превышает 8—10 в поле зрения, в то время как лецитиновых зерен достаточно много. При наличии воспалительного процесса число лейкоцитов возрастает, а лецитиновых зерен — уменьшается или они даже полностью исчезают. Однако как наличие, так и отсутствие лейкоцитов еще не означает, что имеется простатит. Наличие их может быть обусловлено и заболеваниями уретры и семенных пузырьков. Отсутствие же лейкоцитов может иметь место и при явном простатите, когда имеются очаговость воспаления и облитерирование (закупорка) части выводных протоков. 3. Бактериологическое исследование мочи и секрета предстательной железы. 4. УЗИ предстательной железы, при котором выявляются негомогенные умеренные эхопозитивные образования в инфильтративной стадии заболевания и выраженные — при склерозирующем процессе. Камней в предстательной железе при хроническом простатите не бывает; за них принимают белковые образования в ацинусах. 5. Иммунологический и гормональный профиль (по показаниям). 6. Прочие специальные методы обследования (рентгенологические, компьютерная томография, магнитно-ядерный резонанс, исследование ферментов предстательной железы, эндоскопические исследования и т. д.) необходимы при проведении дифференциальной диагностики и достаточно широко используются урологами в диагностически сложных случаях. 7. Радиоиммунное исследование уровня PSA (простат-специфический антиген) и отношения PSA/PSA free (свободного). Для исследования необходимо взятие 4 мл венозной крови. Это единственный метод в мире, способный выявить рак (см.) простаты на самой ранней стадии, когда возможно полное излечение.
Дифдиагностика Острый простатит необходимо дифференцировать от острого цистита (см.). Учитывая, что симптомы заболеваний довольно схожи, сделать это бывает не всегда просто. При остром цистите (см.) лейкоцитурия отмечается во всех трех порциях мочи, тогда как при остром простатите она более выражена в третьей порции и усиливается после пальпации железы. При остром простатите довольно часто бывают выраженные симптомы гнойной интоксикации, чего не бывает при остром цистите. Наконец, при остром простатите достаточно характерна картина изменений в предстательной железе при ректальном исследовании. При цистите ее изменения не бывает, а если оно и встречается, то чаще в пожилом возрасте, что связано с патологией железы — аденоме (см.), раке (см.).
Лечение Комплексное лечение простатита предусматривает применение: — антибактериальной терапии под контролем антибиотикограмм; — стимуляции неспецифической резистентности организма; — физиотерапии, включая лазеротерапию; — местного лечения (массаж простаты); — симптоматического лечения; — лечебной физкультуры, диеты. При любом виде лечения простатита исключают из рациона алкоголь, резко ограничивают кислые, консервированные, соленые продукты, жареную пищу. Для повышения эффективности лечения необходимо расширить овощной и фруктовый рацион, принимать поливитамины. Лечение острых воспалительных заболеваний предстательной железы должно быть направлено на устранение причин их возникновения и прекращение дальнейшего развития. Этиологическое лечение заключается в назначении антибактериальных средств в зависимости от выделенной болезнетворной бактериальной флоры и чувствительности ее к применяемым препаратам. Однако получить секрет предстательной железы, как было сказано выше, чаще всего не удается, а следовательно, состав микрофлоры и ее чувствительность нередко при острых простатитах бывают неизвестны. Поэтому назначают антибиотики широкого спектра действия (ампициллин, тетраолеан, канамицин, гентамицина сульфат, эритромицин, олеандомицин и др.). Избирательным бактерицидным действием при острых простатитах обладают тетрациклины и рондомицин. Назначение тетрациклинов целесообразно и в связи с их способностью воздействовать на вирусы и микоплазмы, которыми нередко инфицирована предстательная железа. Широко применяются сульфаниламидные препараты, нитроксолин (5-НОК, 5-нитрокс). Для уменьшения болей и болезненных позывов на мочеиспускание назначают 50 %-ный раствор анальгина по 3 мл внутримышечно или 2 %-ный раствор промедола по 1 мл. Хороший обезболивающий эффект дают ректальные свечи с белладонной, анестезином, промедолом или пантопоном. С этой же целью применяют тепловые процедуры в виде согревающего компресса на промежность, грелки, горячие сидячие ванны с температурой воды 38–40 °C, горячие микроклизмы (50 мл воды с температурой 39–40 °C и добавлением 1 г антипирина или пирамидона). Тепловые микроклизмы можно применять с 0,25 %-ным раствором новокаина, с ромашкой или шалфеем. Доказана большая эффективность ректального введения ряда лекарственных препаратов, в том числе и ректального электрофореза. Антибактериальную терапию целесообразно начинать в зависимости от особенностей избирательного действия некоторых препаратов на предстательную железу с последующей корреляцией при положительном результате бактериологического посева. При фолликулярных и паренхиматозных простатитах показаны антибактериальные препараты в больших дозах и комбинированное их применение по 10–12 дней с их сменой до получения клинического эффекта. В последующем рекомендуется наблюдение и противорецидивное лечение у уролога поликлиники на протяжении длительного периода. Для регулярного опорожнения кишечника назначают слабительные средства. Применение физиотерапевтических методов лечения в острой стадии ограничено. Для уменьшения воспаления назначают УВЧ-терапию и микроволновую СВЧ-терапию. При развитии острой задержки мочи следует отдать предпочтение капиллярной пункции мочевого пузыря. Катетеризация опасна, болезненна и часто безуспешна, поэтому к ней при острых простатитах прибегать не следует. Всем больным острым простатитом необходимы постельный режим и щадящая диета с исключением острой, раздражающей пищи. К патогенетическому лечению относят лечебные мероприятия, направленные на ликвидацию внеуриногенных очагов инфекции (тонзиллит (см.), кариозные зубы, заболевания придаточных пазух носа, пиодермия (см.) и др.), воспалительных заболеваний в уретре (уретриты (см.), стриктуры мочеиспускательного канала), а также заболеваний соседних органов таза (проктит (см.), ректальные свищи, геморрой (см.)). Как уже говорилось, фактором, вызывающим конгестивный простатит, являются нерегулярная половая жизнь и прерванный половой акт, застойные явления в венах малого таза, воспалительные и застойные заболевания тазовых органов и другие причины, на устранение которых должны быть направлены лечебно-профилактические мероприятия. При абсцессе (см.) предстательной железы показано оперативное лечение. Большинство авторов рекомендуют промежностный доступ для вскрытия абсцесса с последующим дренированием его полости. Возможен и ректальный доступ. Однако ректальный доступ нередко приводит к образованию ректально-простатических свищей, что способствует рецидивам простатита. В отдельных случаях прибегают к наложению надлобкового мочепузырного свища. Прогноз при остром простатите, как правило, благоприятный, однако в запущенных случаях, при позднем начале антибактериальной терапии, недостаточно энергичном и особенно неполноценном лечении возможен переход процесса в хронический.
Профилактика Профилактика простатита необходима каждому мужчине после 30 лет и заключается в соблюдении простых правил: — не допускать переохлаждения, не сидеть на холодных предметах; — регулярные занятия сексом (по различным данным, не реже 100 раз в год); — при сидячей работе (образе жизни) следует использовать любую свободную минуту для разминки и физкультуры и т. д.; — исключить запоры (слабительные препараты, диета и т. д.); — активный образ жизни — пешие прогулки, упражнения для исключения застойных явлений в области таза, занятия спортом; — обязательное обследование на предмет состояния простаты 1–2 раза в год; — соблюдение щадящей диеты (ограничение приема алкоголя, острой, жареной и консервированной пищи); — проведение превентивных курсов амбулаторного лечения на реже 2 раз в год в течение месяца и одного курса санаторно-курортного лечения.
ПСЕВДОПОДАГРА
ОпределениеПсевдоподагра — заболевание, вызванноеотложением пирофосфата кальция и характеризующееся острым и хроническим воспалительным процессом в суставах; обычно поражает больных старших возрастных групп. Наиболее типично поражение крупных суставов (например, коленных). Отложения кальция в суставной хрящ (хондрокальциноз) могут быть распознаны при рентгенологическом исследовании.
Этиология и патогенез Заболевание, вызванное отложением пирофосфата кальция, может быть разделено на три категории: наследственный тип; форма, связанная с обменными нарушениями; идиопатическая форма, связанная главным образом со старением.
Клиническая картина Острая псевдоподагра развивается приблизительно у 25 % больных с заболеванием, вызванным отложением кальция пирофосфата; наиболее часто поражаются коленные суставы, но могут быть поражены и другие суставы. Воспаленные суставы покрасневшие, припухшие, теплые и болезненные при ощупывании, большинство больных имеют проявления хондрокальциноза. У меньшей части больных в процесс вовлечено несколько суставов (псевдоревматоидное заболевание). Примерно у половины больных с заболеванием, вызванным отложением кальция пирофосфата, развивается хронический процесс с прогрессирующими дегенеративными изменениями во многих суставах. У них также встречаются рецидивирующие острые приступы болезни. Диагноз устанавливают, выявляя кристаллы кальция пирофосфатдигидрата в синовиальной жидкости и обнаруживая хондрокальциноз на рентгенограмме сустава.
Лечение Индометацин или другие нестероидные противовоспалительные средства (см. выше); инъекции глюкокортикоидов в полость сустава; колхицин не всегда эффективен.
ПСИХИЧЕСКИЕ РАССТРОЙСТВА
ОпределениеПсихические расстройства — это патологические состояния, характеризующиеся нарушениями психической, интеллектуальной деятельности различной степени выраженности и эмоциональными расстройствами.К психическим расстройствам относятся посттравматическое стрессовое расстройство, паранойя, а также психические и поведенческие расстройства, связанные с репродуктивной функцией у женщин (предменструальный синдром, расстройства периода беременности, расстройства послеродового периода — «родовые блюзы», послеродовые депрессии, послеродовые (пуэрперальные) психозы). Посттравматическое стрессовое расстройство — это расстройство психической деятельности в ответ на психосоциальный стресс, чрезмерный по своей интенсивности. Термин «паранойя» объединяет группу психических расстройств, главным и часто единственным проявлением которых является стойкий систематизированный бред. Распространенность его — примерно 0,03 % населения. Характерный возраст начала заболевания — 35–45 лет, мужчины болеют чаще. Предменструальный синдром — широко распространенный синдром (синонимы: синдром предменструального напряжения, предменструальное дисфорическое расстройство), которому в той или иной степени подвержено более 70 % женщин детородного возраста. В послеродовом периоде у женщин могут развиваться или обостряться самые разные психические нарушения, например шизофрения, реккурентное депрессивное и биполярное расстройство, органическое повреждение мозга и др. К категории собственно послеродовых психических нарушений относятся только те случаи, которые не укладываются в диагностические критерии другой патологии; не относят в эту рубрику и случаи, когда расстройство проявлялось еще до родов.
Этиология и патогенез Психические расстройства вследствие многочисленности причин, их вызывающих, чрезвычайно разнообразны. Это депрессии, и психомоторные возбуждения, и проявления алкогольного делирия, абстинентного синдрома, и различные виды бреда, и нарушения памяти, и истерические приступы и многое другое. Даже врачам различных специальностей трудно разобраться в хитросплетениях проявлений этих расстройств. Поэтому помощь, в том числе и неотложную, психически больным должен оказывать психиатр. Те или иные психические расстройства в течение жизни переносит практически каждый из нас. Распространенность психических и поведенческих расстройств у людей схематически может быть представлена следующим образом: — по крайней мере, 5 % населения страдает хроническими психическими расстройствами и нуждается в постоянном наблюдении и лечении у психиатра; — отчетливые психические расстройства в любой момент времени обнаруживаются, по меньшей мере, у 12–15 % населения; — от 40 до 60 % людей обнаруживают очевидные психические затруднения, влияющие на соматическое здоровье и социальное функционирование; — психические расстройства выявляются примерно у 25–30 % из числа лиц, обращающихся за помощью в учреждения первичного здравоохранения. Женщины страдают психическими расстройствами в 1,5–2 раза чаще мужчин. Эта тенденция наиболее заметна при депрессиях, тревожных, диссоциативных, конверсионных и иных невротических расстройствах, в меньшей степени — при органических мозговых поражениях, деменции пожилого возраста, умственной отсталости, психосоматической патологии и шизофрении. Мужчины, в свою очередь, чаще, чем женщины, страдают алкоголизмом и другими формами зависимости от психоактивных веществ, расстройствами личности, эпилепсией. Психические расстройства могут начаться в любом возрасте, т. е. быть врожденными или проявляться уже на первом году жизни (умственная отсталость), начинаться в детстве (генуинная эпилепсия, ранний детский аутизм), пубертатном периоде (периоде полового созревания) и юности (нарушение поведения, расстройства личности, нервная анорексия), молодости (шизофрения, паническое расстройство, обсессивно-компульсивное расстройство, зависимость от психоактивных веществ), середине жизненного цикла (депрессии), а также в инволюционном и старческом периодах (болезнь Альцгеймера, сосудистая деменция). У человека, прошедшего тот или иной возрастной период и не заболевшего характерными для этого периода психическими расстройствами, вероятность их развития резко уменьшается или даже исчезает, зато возрастает вероятность расстройств, типичных для следующей поры жизни. Несмотря на то что разные виды психической патологии имеют свой характерный возраст начала, однако изредка отмечаются случаи нетипичного, т. е. «слишком раннего» или «слишком позднего», дебюта заболевания, и тогда его клинические проявления будут существенно отличаться от таковых при типичных формах. Так, шизофрения иногда может начаться и в раннем детстве, а возрастная деменция — уже в 45–50 лет, и тогда они текут более злокачественно, чем типичные формы. Необходимо отметить, что распространенность психических расстройств в целом резко падает у лиц старше 45 лет. Вполне очевидно, что в сравнении с соматической медициной в психиатрии проблема нормы еще более усложняется в связи с целым рядом трудностей: отсутствием в большинстве случаев каких-либо объективных (инструментальных, лабораторных и др.) методов для точного и надежного распознавания психических и поведенческих расстройств, субъективным характером оценки психического состояния, огромными различиями в понимании «нормального» поведения в разных культурах, социальных группах, в различные исторические периоды и т. д. Основными критериями оценки нормы в психиатрии являются среднестатистические (вероятностные) закономерности. Иными словами, норма — это то, что встречается чаще, что характерно для значительного большинства индивидов. Психическое здоровье означает наличие способности человека хорошо адаптироваться к среде, прежде всего социальной, и состояние психического, психологического и социального благополучия. Болезнь — это состояние, при котором ухудшаются психические адаптационные способности человека, и в связи с этим снижается качество его жизни. Наконец, с утилитарной точки зрения врача, психическое здоровье и психическая норма — это состояние отсутствия болезни, т. е. когда по действующим в психиатрии диагностическим стандартам не представляется возможным установить диагноз какого-либо расстройства, имеющегося в номенклатуре заболеваний. Для современной психиатрии характерен формальный принцип, который можно обозначить как презумпция психического здоровья, в соответствии с которым любой человек считается психически здоровым, пока не доказано обратное (т. е., если врач не смог собрать доказательств того, что состояние индивида соответствует имеющимся в классификации психических и поведенческих расстройств критериям того или иного расстройства). Состояние же психического здоровья в доказательствах не нуждается. С целью образования пациента в этой области, а также для самого начального скрининга психического расстройства может быть использован рекомендуемый Всемирной федерацией психического здоровья (1988 г.) краткий опросник. Хорошо ли Вы чувствуете себя? — я получаю удовольствие от повседневных вещей и событий; — я чувствую в себе способность справляться с большинством ситуаций, и я не взволнован (спокоен); — я способен спокойно принимать жизненные неприятности; — я терпимо отношусь как к себе, так и к другим; — я реально оцениваю свои способности; — я способен понимать и принимать свои недостатки и посмеяться над собой. Хорошо ли Вы чувствуете себя в отношениях с другими людьми? — я способен любить других людей и вызывать у них интерес; — у меня есть длительные и доставляющие мне удовлетворение взаимоотношения с другими людьми; — я могу верить другим и чувствую, что они могут верить мне; — я не испытываю превосходства над другими людьми, но и не позволю другим испытывать превосходства по отношению ко мне; — я ощущаю свою ответственность перед людьми. Чувствуете ли Вы себя способным соответствовать требованиям жизни? — я предпринимаю те или иные шаги, чтобы устранить трудности, когда они возникают; — я принимаю на себя обязанности и ответственность; — я формирую окружающую среду, когда это возможно, и приспосабливаю ее к требованиям своей жизни; — я планирую жизнь наперед и не испытываю страха перед будущим; — я с радостью приобретаю новый опыт и ставлю для себя реальные цели. Хотя и вполне очевидно, что существует много степеней психического здоровья и отсутствие какой-либо из указанных характеристик еще не означает наличие болезни, однако отрицательные ответы на значительную часть предлагаемых вопросов позволяют заподозрить проблемы в психической и поведенческой сфере человека.
Посттравматыческое стрессовое расстройство Синонимы «вьетнамский синдром», «афганский синдром» представляет собой общепринятую сегодня в мире самостоятельную форму психической патологии, причиной которой является перенесенный пациентом крайне тяжелый психосоциальный стресс, который по своей интенсивности выходит за пределы обычного человеческого опыта. Воздействия такой экстраординарной силы возникают чаще всего в ходе военных действий, природных катастроф (землетрясения, наводнения, оползней и т. д.), пожаров, при транспортных и техногенных катастрофах (аварии на производстве, атомных электростанциях), изнасилованиях, пытках, других формах жестокого обращения с людьми, массовых беспорядках и т. п. При этом пациент либо сам подвергся тяжелой опасности, либо это произошло с кем-то другим на его глазах. Частота посттравматических расстройств в целом составляет 1–2 %, соотношение между мужчинами и женщинами 1:2. Хотя впервые подобные расстройства привлекли к себе внимание врачей еще в 70-х гг. прошлого века (описанное Da Costa так называемое «солдатское сердце» в гражданскую войну между Севером и Югом), многократно отражались в литературных произведениях (Э. М. Ремарк, Э. Хемингуэй и др.), однако осознание большой частоты и высокой социальной значимости этой патологии пришло лишь в 60—70-х гг. ХХ в. Это привело к выделению в МКБ-10 данной патологии в отдельную группу, ее тщательному изучению во многих странах мира и созданию специальных форм помощи таким пациентам. Посттравматическое стрессовое расстройство может возникать в любом возрасте, включая детский. Считается, что из числа лиц, подвергшихся тяжелым стрессовым воздействиям, данным расстройством заболевает в среднем 15 %, однако частота его существенно зависит от тяжести перенесенного стресса — так, например, у лиц, находившихся в концентрационных лагерях, удельный вес заболевших достигает 75 % и выше. Чем тяжелее стрессор, тем тяжелее и длительнее протекает расстройство. Наиболее значительный опыт этой патологии накоплен в США на материале ветеранов войны во Вьетнаме. Так, по данным на 1990 г., из 3 140 000 военнослужащих, служивших во Вьетнаме, подобными расстройствами страдают 479 тыс. (15,3 %) и еще 350 тыс. (11,1 %) обнаруживают частичные его симптомы. Для нашей страны проблема посттравматических стрессовых расстройств приобретает особую актуальность в связи с последствиями катастрофы на Чернобыльской АЭС, оставившей после себя, наряду с ростом соматических заболеваний, большое число больных с данными расстройствами. Кроме того, иные социально-политические события (война в Афганистане, локальные конфликты на территории стран бывшего СССР, военные действия в Чечне, рост преступности, миграция населения, частые производственные аварии и природные катаклизмы и т. д.) привели, вне всякого сомнения, к появлению значительного числа таких больных, которые в нашей системе медицинской помощи (как общей, так и психиатрической) почти не распознаются.
Паранойя Бредовые идеи при этих расстройствах формируются постепенно и нередко связаны с реальными жизненными обстоятельствами.
Психические ы поведенческие расстройства, связанные с репродуктивной функцией у женщин Предменструальный синдром. Состояние возникает спонтанно вскоре после овуляции, т. е. примерно за 10–12 дней до начала очередной менструации, достигает максимума за 5 дней до нее и проходит к 1—2-му дню менструального цикла. Психические и поведенческие расстройства периода беременности. Отчетливые психические расстройства в период беременности возникают примерно у 10 % женщин. Наиболее часто они наблюдаются в первом и последнем триместрах беременности, тогда как во втором триместре их частота такая же, как и в общей популяции.
Психические и поведенческие расстройства послеродового периода Этиологическими факторами послеродовых психических нарушений считаются резкие гормональные сдвиги в организме женщины после беременности, соматические осложнения в родах, а также психосоциальный стресс, который часто сопутствует деторождению. Многое зависит от того, насколько благоприятен брак, каким было отношение супругов к наступившей беременности, какие ожидания связывают они с появившимся на свет ребенком. Чем хуже отношения в браке и менее желательной была беременность, тем выше частота послеродовых психических расстройств. Роль инфекции в происхождении этой патологии весьма высоко расценивалась до 60-х гг. прошлого века, однако в последующем такая точка зрения не подтвердилась и была пересмотрена. Диагностическими критериями послеродовых расстройств, по МКБ-10, являются возникновение их в сроки до 6 месяцев после родов и невозможность отнести их в другие разделы и рубрики. Такие расстройства имеют очень широкое распространение и часто встречаются в работе врача общей практики — преимущественно три разновидности этих нарушений: так называемые родовые блюзы, постнатальные депрессии и собственно послеродовые психозы. Наиболее вероятной причиной «родовых блюзов» являются резкие сдвиги в обмене гормонов и нейромедиаторов, происходящие в организме женщины сразу же после родов, в частности повышение содержания кортизола и уровня активности моноаминоксидазы в плазме крови. Послеродовые депрессии чаще возникают у женщин, имевших в детстве конфликтные или натянутые отношения со своими родителями, а также тяжелые жизненные события в прошлом. Замечено, что у таких пациенток значительно чаще возникают состояния тревоги в период беременности. Вероятность послеродового психоза значительно (примерно в 2 раза) выше у первородящих, а также у женщин, имеющих семейную отягощенность как в плане послеродовых психозов, так и вообще любых психических нарушений. Высока вероятность (от 30 до 50 % в зависимости от клинической картины) повторения психоза и в последующих родах, о чем обязательно следует информировать пациентку и ее близких.
Клиническая картина Посттравматическое стрессовое расстройство Проявления посттравматических стрессовых расстройств возникают через несколько недель или месяцев, но не позднее чем через 6 месяцев после травмирующего события. Симптоматика разнообразна и включает следующие группы расстройств: — повторное, помимо воли пациента, переживание травмирующего события в виде навязчивых воспоминаний, повторяющихся сновидений или ночных кошмаров, стереотипных игр у детей, в которых отражается травма, а также страданий во время событий, которые чем-то похожи на травму или каким-то образом символизируют ее; — постоянное избегание стимулов, напоминающих о травме: человек все время заставляет себя не думать о перенесенной трагедии, избегает ситуаций и действий, которые могут о ней напомнить, в части случаев возникает психогенная амнезия травматических событий; — снижение активности и ответственности в повседневной жизни, безразличие к делам, чувство оцепенения и эмоциональной притупленности (неспособность любить, получать удовольствие от жизни, надеяться на лучшее в будущем), чувство обособленности от других; у детей — регресс в поведении с утратой приобретенных ранее навыков; — усиление вегетативных проявлений тревоги и уровня бодрствования в такой мере, как это бывает при других тревожных расстройствах, — чрезмерная настороженность, вздрагивания, раздражительность, трудность засыпания, потливость и т. д. Помимо указанных основных симптомов у пациентов часто встречаются острые вспышки страха, паники или ярости с агрессией, чувство вины перед погибшими в травматическом событии и самобичевание за то, что выжил, пьянство и антисоциальное поведение со склонностью к физическому насилию, демонстративное отрицание принятых в обществе норм и правил. Характерны деформация внутрисемейных и социальных отношений, недоверие к лицам, представляющим власть, тяга к азартным играм и рискованным развлечениям (например, езда на автомобиле с большой скоростью, затяжные прыжки с парашютом у ветеранов-десантников и т. д.), а также различные соматовегетативные жалобы. Диагностическими критериями ПТСР по МКБ-10 являются: — наличие в прошлом экстраординарного травматического события; — возникновение симптоматики не позднее 6 месяцев после травмы; — наличие характерной симптоматики; — симптомы должны сохраняться более 1 месяца после травмы (по DSM-IV). Прогноз посттравматического стрессового расстройства весьма различен и зависит от тяжести стрессора, возраста пациента, своевременности терапии, социальной поддержки, личностного склада пациента, наличия у него иных психических и соматических заболеваний и др. В целом треть пациентов полностью выздоравливает, у трети остаются незначительные нарушения, не влияющие на их социальную адаптацию, и в трети случаев болезнь принимает хроническое течение на многие годы и может закончиться стойкими изменениями личности. Течение подобного расстройства с годами осложняется алкогольной и лекарственной зависимостью, конфликтами с законом, распадом семей, стойким сутяжным поведением, суицидальными попытками.
Паранойя По своему содержанию бредовые идеи при паранойе — это чаще всего идеи ревности, отношения и преследования, сутяжнические, реже — физического недостатка (дисморфофобия и дисморфомания). Несмотря на некоторое сходство внешних проявлений, эти состояния по своим симптомам и течению существенно отличаются от шизофрении: у пациентов отсутствуют психические автоматизмы и галлюцинации, не возникают негативные шизофренические расстройства (эмоциональное уплощение, бездеятельность, отгороженность, безволие и т. д.). В поведении и социальных отношениях они остаются стеничными, монотонно активными, эмоционально заряженными, упорно отстаивают свои болезненные убеждения и нередко добиваются успеха. Сами больные, как правило, за психиатрической помощью не обращаются. Их поведение в ситуациях, не входящих в структуру бредовых переживаний, обычно остается достаточно нормальным, и окружающие воспринимают их не как психически больных, а как «негибких», «слишком правильных», «своеобразных», пытаются давать психологические объяснения их поведению. Необходимость контакта с психиатром возникает лишь в тех случаях, когда болезненное поведение пациента ведет к социальным конфликтам либо выходит за рамки закона (например, агрессивное поведение при патологической ревности — так называемый синдром Отелло и т. п.). Диагностическими критериями этой патологии, по МКБ-10, являются: — наличие стойкого систематизированного бреда на протяжении по меньшей мере 3 месяцев, при этом бред носит личностный, а не субкультуральный характер; — иная симптоматика (слуховые галлюцинации, эпизоды депрессии и др.) либо полностью отсутствуют, либо возникают лишь изредка, эпизодически; — нет соответствия критериям шизофрении; — нет признаков органической мозговой патологии. Такие пациенты хотя и нечасто, но все же встречаются врачу общей практики и могут иногда представлять для него определенную опасность, особенно если темой их болезненных переживаний являются якобы неправильные действия врача. Консультация психиатра особенно необходима в случаях, когда есть потенциальная вероятность социальных конфликтов и общественно опасных действий.
Психические и поведенческие расстройства, связанные с репродуктивной функцией у женщин Предменструальный синдром проявляется неглубокой депрессией, тревогой, аффективной лабильностью, раздражительностью, взвинченностью, слезами по незначительным поводам, сонливостью или инсомнией, повышением аппетита, утомляемостью, снижением интереса к обычной деятельности, а также рядом соматических симптомов — головной болью, ощущением напряженности молочных желез, мышечными болями и др. Общая продолжительность расстройств настроения составляет, таким образом, 11–12 дней. С учетом очень высокой распространенности отнесение предменструального синдрома к патологии проблематично. Тем не менее он может существенно затруднять повседневную жизнь женщины, часто многие из таких пациенток явно нуждаются в медицинской помощи. Предполагается, что причинами расстройства являются временные нарушения гормонального баланса — уровней эстрогенов, пролактина и тестостерона, при этом возникают нарушения обмена серотонина, сходные с теми, что отмечаются при большой депрессии. Психические и поведенческие расстройства периода беременности проявляются эпизодами легкой тревожной либо тревожно-депрессивной симптоматики. Фабула переживаний, как правило, концентрируется вокруг текущей беременности, перспектив на будущее, семейных и социально-экономических последствий. В ранние сроки переживания касаются прерываний беременности, которые были в прошлом, и того, какое воздействие это может оказать теперь, сомнений в том, правильно ли идет развитие плода и т. д. В последнем триместре пациентки обычно больше сконцентрированы на семейной и экономической ситуации после рождения ребенка и т. п.
Психические и поведенческие расстройства послеродового периода «Родовые блюзы» (от англ. blues — «хандра», «подавленность») встречаются более чем у половины женщин в первую неделю после родов. Проявляются нерезко сниженным настроением, беспокойством, тревогой, эмоциональной лабильностью с колебаниями настроения от подавленности до приподнятости, плаксивостью по незначительным поводам, трудностью концентрации внимания. В некоторых случаях это сопровождается также чувством вины, пессимистическим видением будущего, негативным отношением к мужу, родственникам и персоналу медучреждения, что иногда приводит к неоправданно ранней выписке из роддома. Описанная симптоматика обычно начинается в первый же день после родов, достигает максимума в период между 3—5-м днями и быстро исчезает к концу первой — началу второй недели после родов. Максимальная продолжительность — 2 недели, если по окончании этого срока состояние не нормализовалось, то диагноз должен быть пересмотрен. Послеродовые депрессии возникают у 10–20 % женщин. В отличие от «родовых блюзов» развиваются через несколько недель после родов и проявляются значительно более выраженной подавленностью, чувством безнадежности, слезливостью, утомляемостью, раздражительностью, тревогой, отсутствием аппетита и инсомнией. Пациентка часто испытывает чувство вины, говорит о своей неспособности справиться с уходом за ребенком, высказывает необоснованные опасения за его здоровье, предъявляет различные соматические жалобы. Продолжительность послеродовых депрессий — от 2 недель до 6 месяцев, однако при отсутствии терапии они могут затянуться. Послеродовые (пуэрперальные) психозы возникают с частотой 1–2 случая на 1000 родов в период между 3—20-м днем после них. Проявляются развернутыми синдромами аффективных нарушений (как депрессии, так и мании), а также симптоматикой, аналогичной таковой при шизофрении, — «голосами», психическими автоматизмами, бредовыми идеями отношения и т. д. Продолжительность состояния — до 3–4 месяцев, после чего наступает выздоровление.
Лечение Посттравматическое стрессовое расстройство Лечение посттравматического стрессового расстройства включает психотропные препараты, психотерапию, работу с семьей и меры социальной помощи. Первыми назначаются, как правило, ТАД-препараты с антидепрессивным действием (кломипрамин, имипрамин, мианесерин), действующие как на депрессивные, так и на тревожные проявления расстройства. Данные препараты особенно показаны в тех случаях, когда расстройство осложняется паническими приступами. Средняя продолжительность лечения ими — 1,5–2 месяца. Если эффекта нет, нужно перейти на антидепрессанты из группы ингибиторов МАО. При наличии обильной тревожной симптоматики проводится лечение транквилизаторами — альпразоламом, диазепамом, транксеном. Хороший противотревожный эффект может дать использование нейролептика меллерила (сонопакса). В случаях повышенной взрывчатости, импульсивности, а также при опасности формирования у пациента лекарственной зависимости от бензодиазепинов используются норомотимики — карбонат лития или финлепсин. В психотерапии посттравматических стрессовых расстройств применяются самые разные методы: систематическая десенсибилизация, когнитивные, психоаналитические, групповые и др., и проводить их должен специально подготовленный для работы с такими больными психотерапевт. Цель такого лечения — помочь пациенту осознать природу его болезни, преодолеть отрицание им травматического события, дать возможность отреагировать на вытеснение сознанием переживания, развить способность к самоанализу и самоконтролю, изменить патологические поведенческие стереотипы. Во многих странах эта работа ведется в специальных центрах (для ветеранов — участников войн, женщин, подвергшихся насилию, и т. д.), а также в группах взаимопомощи. Очень большое значение имеет работа с семьями (обучение здорового супруга роли «помощника», «тренера»), а также деятельность, направленная на формирование правильного отношения к этим людям в обществе, особенно к участникам военных действий.
Психические и поведенческие расстройства, связанные с репродуктивной функцией у женщин Лечение предменструального синдрома может включать назначение диуретиков, ограничение потребления соли и жидкости на этот период времени, прием анальгетиков (но не аспирина, так как он влияет на свертывающую систему). Иногда может потребоваться назначение транквилизаторов, витамина В6. В ряде исследований последних лет показана эффективность антидепрессантов — блокаторов обратного захвата серотонина: флуоксетина, сертралина и др. Во многих случаях бывает достаточно объяснить пациентке, с чем связано ее состояние, указав при этом, что оно быстро пройдет и без лечения. Помощь при психических и поведенческих расстройствах периода беременности заключается в консультировании и супружеской психотерапии, при этом необходимо выяснить характер отношений в семье, наличие социальной поддержки, отношение супругов к предстоящим родам. Необходимо помнить, что прием психотропных средств в ранние сроки беременности может вызвать тератогенные эффекты (особенно опасны транквилизаторы, соли лития, в меньшей степени — нейролептики), а накануне родов привести к появлению синдрома отмены у новорожденного сразу после родов. Поэтому прием психотропных средств на весь период беременности должен быть, как правило, прекращен. В случаях любых психических расстройств во время беременности весьма желательно наблюдение у психиатра в послеродовом периоде.
Психические и поведенческие расстройства послеродового периода Какого-либо специального лечения «родовые блюзы» не требуют, необходимы лишь правильный уход, психологическая поддержка со стороны персонала и родных, а также адекватное объяснение родственникам того, что происходит с женщиной. Послеродовые депрессии наряду с постоянным наблюдением и психологической поддержкой требуют назначения антидепрессантов в обычных дозах. Необходимо также консультирование членов семьи пациентки. Иногда может потребоваться госпитализация в психиатрический стационар. Послеродовые психозы. Во всех таких случаях необходимы госпитализация в психиатрический стационар и лечение в зависимости от синдромов, включая нейролептики, антидепрессанты, электросудорожную терапию. В состояниях острого психоза матери ребенок должен быть на некоторое время изолирован от нее ввиду опасности причинения ему вреда, вплоть до гомоцидомании. В последующем, по мере улучшения состояния матери, необходимо давать ей возможность ухода за ребенком под наблюдением подготовленного персонала, поэтому в ряде стран госпитализация матери осуществляется вместе с ребенком, и они находятся в разных палатах одного отделения. Психотропные препараты, применяемые в период кормления грудью, попадают в материнское молоко и, в принципе, могут вызвать токсические эффекты у ребенка, однако их концентрация в разных случаях очень варьирует. Так, содержание трициклических антидепрессантов в молоке незначительно, и поэтому кормление грудью не является противопоказанием для их приема матерью. В отношении нейролептиков — фенотиазинов и бутирофенонов необходима большая осторожность, и лечение ими при кормлении грудью возможно только в случаях, когда это крайне необходимо; безопаснее во время их приема прекратить лактацию. Следует категорически запретить кормление грудью в случаях приема матерью транквилизаторов и солей лития, так как они накапливаются в молоке в гораздо более высоких количествах и могут вести к интоксикации организма ребенка. После выхода из состояния острого психоза необходим сбор данных о психологической ситуации в семье, отношении женщины к ребенку и материнству, к мужу, другим родственникам. Часто требуется проведение психотерапии, семейной терапии и семейного консультирования с тем, чтобы разрешить имеющиеся конфликты, дать женщине возможность почувствовать также свою новую социальную роль, показать позитивные стороны материнства.
ПСИХОЗЫ
ОпределениеПресенильные (предстарческие, инволюционные) психозы — группа психических заболеваний, манифестирующих в возрасте 45–60 лет, протекающих в форме либо депрессии (инволюционная меланхолия), либо бредового психоза паранойяльной или парафренной структуры (инволюционный параноид). Значительно реже наблюдаются злокачественные формы, протекающие с тревожным возбуждением, растерянностью, бессвязностью речи; кроме того, отмечается поздняя кататония и галлюцинаторные психозы позднего возраста.Реактивные психозы наряду с неврозами составляют группу психогенных заболеваний, т. е. обусловлены психической травмой. Для них характерно соответствие содержания психопатологических проявлений травмирующему фактору и исчезновение их после ликвидации причины. Сенильные психозы (старческие психозы) возникают в старческом возрасте; к ним относятся старческое слабоумие, поздние депрессии и параноиды. Старческое слабоумие характеризуется неуклонным оскудением и распадом психической деятельности. Ослабление психической деятельности происходит и при физиологическом старении, но старческое слабоумие — не количественное усиление этого процесса, а патологическое явление. Такие больные составляют, по данным разных авторов, 12–25 % от общего числа больных психическими заболеваниями позднего возраста. Симптоматические психозы включают психические нарушения, возникающие при заболеваниях внутренних органов, инфекционных болезнях, эндокринопатиях. Острые симптоматические психозы обычно протекают с явлениями помрачения сознания; протрагированные формы проявляются в виде психопатоподобных депрессивно-параноидных, галлюцинаторно-параноидных состояний, а также стойкого психоорганического синдрома. Интоксикационные психозы возникают в результате острого или хронического отравления промышленными или пищевыми ядами, химическими веществами, применяемыми в быту, наркотиками, лекарственными средствами. Интоксикационные психозы могут быть острыми и протрагированными.
Этиология и патогенез Пресенильные психозы Этиология неизвестна. Предрасполагающими факторами могут служить перенесенные ранее психогенные травмы и соматические заболевания.
Реактивные психозы Реактивным психозам в отличие от неврозов свойственна большая острота и тяжесть симптоматики; наряду с психомоторными и аффективными расстройствами, бредом и галлюцинациями наблюдаются также истерические нарушения, нередко протекающие с явлениями расстроенного сознания (диссоциативные реакции). Больные утрачивают способность критически оценивать свое состояние, координировать поступки и адекватно вести себя в сложившейся ситуации. В качестве психической травмы, вызывающей реактивный психоз, могут выступать трагические события личного и общественного характера, коллизии, представляющие угрозу для жизни, индивидуально значимые патогенные ситуации. Существенным звеном в патогенезе реактивных психозов является психическая астенизация, связанная чаще всего с психическим или соматическим истощением (вынужденное бодрствование, ранения, соматические заболевания).
Сенильные психозы Этиология, патогенез неизвестны. Женщины болеют чаще мужчин. Риск заболевания в семьях больных старческим слабоумием выше, чем среди остального населения. Сопутствующие соматические болезни видоизменяют и утяжеляют картину психоза. Средний возраст начала болезни 70–78 лет, ее длительность 5–8 лет.
Симптоматические психозы При любом инфекционном и соматическом заболевании в патологический процесс часто вовлекается центральная нервная система. Это проявляется различным нарушением психической деятельности. Эти расстройства, возникшие на фоне основного заболевания, являются симптоматическими психозами. Острые симптоматические психозы манифестируют при воздействии интенсивной, но непродолжительной вредности; в возникновении затяжных психозов определенную роль играют также перенесенные ранее поражения мозга (травмы, интоксикации и др.).
Интоксикационные психозы Острые психозы возникают обычно при острых отравлениях и проявляются чаще всего нарушениями сознания, структура и глубина которых зависят от характера токсического агента, конституциональных и приобретенных особенностей организма.
Клиническая картина Пресенильные психозы Инволюционная меланхолия протекает с тревогой, ажитацией и бредовыми идеями ипохондрического содержания, самоуничижения, осуждения. Возможны суицидальные попытки. При ухудшении состояния возникают депрессивные идеи громадности или ипохондрически-нигилистический бред. Состояние ажитированной депрессии может сменяться депрессивным ступором. Течение инволюционной меланхолии обычно затяжное; спустя 2–3 года формируется состояние психической слабости с постоянной подавленностью и монотонной тревогой. Инволюционным параноидам свойственна конкретность, обыденность содержания психопатологических расстройств (бред «малого размаха»). По тематике это обычно бред ревности, ущерба, преследования. Чаще всего бред направлен на ближайшее окружение — соседей, сослуживцев, родственников, которых больной обвиняет в издевательствах, порче имущества, воровстве. Нередко наблюдается усложнение бредовой системы вследствие присоединения идей отравления, вербальных иллюзий и галлюцинаций. Больные сохраняют активность; признаки деменции долго не обнаруживаются.
Реактивные психозы Выделяют следующие формы реактивных психозов: аффективно-шоковые реакции, истерические психозы, реактивные депрессии, реактивные параноиды. Аффективно-шоковые реакции — наиболее острые формы реактивных психозов — возникают в связи с внезапными, чрезмерными по силе воздействия событиями (землетрясение, пожар и др.). Реакции проявляются либо в виде психомоторного возбуждения с беспорядочными движениями, стремлением куда-то бежать, либо в виде ступора с отказом от еды, утратой речи. Истерические психозы чаще всего наблюдаются во время войны, а также в связи с судебно-следственной ситуацией и в период тюремного заключения. Они многообразны, одни проявления могут трансформироваться в другие. Истерические сумеречные состояния отличаются демонстративностью, мозаичностью проявлений (смех, пение, плач, зрительные галлюцинации, яркие образные видения) и фрагментарностью амнезии. Бредоподобные фантазии — нестойкие, несистематизированные, изменчивые по содержанию идеи величия и богатства; подчас они становятся причудливыми, нелепыми. Псевдодеменция проявляется утратой элементарных знаний, неправильными ответами и действиями; иногда преобладают ребячливость, капризность, детская речь и моторика (пуэрилизм). Реактивные депрессии чаще всего возникают в связи с психогенными травмами, приобретающими для больного значение невосполнимой утраты (смерть близкого человека и др.); большое значение имеет также конституциональное предрасположение. В клинической картине наряду с подавленностью, слезливостью, соматовегетативными расстройствами и нарушениями сна нередко выступают массивные истерические проявления (рыдания со стонами, заламывание рук, обмороки). Сознание концентрируется на подробностях происшедшего несчастья, причем тема пережитого не дезактуализируется даже в тех случаях, когда депрессия приобретает затяжное течение. При приступах отчаяния, иногда возникающих на начальных этапах психогенной аффективной реакции, возможны тяжелые суицидальные попытки. Прогноз в большинстве случаев благоприятный.
Сенильные психозы Начальные проявления представляют собой медленно нарастающие изменения личности — огрубение, эгоцентризм, скупость. Утрачиваются индивидуальные особенности характера. Наряду с этим нарастает слабоумие — снижается уровень суждений, способность к приобретению новых знаний и навыков, утрачиваются запасы памяти — сначала недавний опыт, затем опыт более ранних периодов жизни, появляются конфабуляции (ложные воспоминания), оскудевает речь. Сохраняются лишь элементарные физические потребности. На фоне прогрессирующего слабоумия возможны редуцированные психотические состояния — тревожные или злобно-ворчливые депрессии, бред материального ущерба (воровства, порчи), ревности. Состояния спутанности сознания с суетливым беспокойством обычно возникают при сочетании с соматическими болезнями. Поздние депрессии и поздние параноиды не обусловлены грубыми органическими деструктивными процессами. Депрессии сравнительно нетяжелые, но длительные, характеризуются угрюмостью, недовольством, ипохондрическими переживаниями. Содержание переживаний при поздних параноидах ограничивается маломасштабным бредом ущерба, порчи, преследования.
Симптоматические психозы Особенности психических нарушений в известной мере зависят от соматического страдания, вызвавшего психоз. Остро развивающаяся сердечная недостаточность может сопровождаться явлениями оглушения, аменцией; при хронической сердечной недостаточности преобладают вялость, апатия, безынициативность, однако по мере нарастания декомпенсации ведущее место занимают тревожность, подавленность; возможны гипнагогические галлюцинации, делирии. При инфаркте миокарда чаще всего наблюдается тревога со страхом смерти, однако в некоторых случаях преобладает повышенное настроение, эйфория. Ухудшение состояния может протекать с явлениями расстроенного сознания (делирии, аменция). В стадии улучшения иногда формируются затяжные ипохондрические состояния с мнительностью, эгоцентризмом, стойкой фиксацией на болезненных ощущениях. Психические расстройства сосудистого генеза на инициальной стадии чаще всего определяются невротическими проявлениями (головная боль, шум в голове, головокружение, нарушение сна, повышенная утомляемость, лабильность настроения), а также заострением свойственных больному ранее психопатических черт. Более прогредиентное течение сопровождается снижением уровня личности с падениемпсихической активности, ослаблением памяти и завершается деменцией. Острые сосудистые психозы нередко бывают транзиторными и протекают с явлениями помрачения сознания (чаще всего наблюдаются состояния спутанности, возникающие обычно в ночное время). Наряду с этим возможны эпилептиформные пароксизмы, явления вербального галлюциноза. При раковых опухолях в терминальной стадии, а также в послеоперационном периоде возникают острые психотические вспышки, которые, как правило, кратковременны и сопровождаются помрачением сознания различной глубины (делириозные, делириозно-аментивные состояния). Наблюдаются также депрессивные и депрессивно-параноидные состояния. Хроническая почечная недостаточность с явлениями уремии осложняется делириозным, делириозно-онейроидным или делириозно-аментивным расстройством сознания, переходящим при ухудшении состояния в глубокое оглушение. Наряду с этим могут возникать эпилептиформные припадки. При заболеваниях печени (гепатит) наблюдаются стертые депрессии с апатией, чувством усталости, раздражительностью. Желтая дистрофия печени сопровождается делириозным и сумеречным помрачением сознания. При витаминной недостаточности (недостаток тиамина, никотиновой кислоты и др.) чаще наблюдаются астенические, тревожно-депрессивные, апатические состояния, а также делириозное и аментивное расстройство сознания; в далеко зашедших случаях могут развиться корсаковский синдром, слабоумие. Острые гриппозные психозы обычно протекают с делириозными расстройствами и явлениями эпилептиформного возбуждения; клиническая картина протрагированных психозов определяется депрессией с преобладанием астении и слезливостью. У больных туберкулезом нередко наблюдается повышенное настроение, иногда достигающее уровня маниакального состояния; отмечаются также астенические состояния с раздражительностью и слезливостью. В острой стадии ревматизма наряду со сновидноделириозными состояниями возможны кратковременные приступы психосенсорных расстройств с нарушением схемы тела, явлениями деперсонализации и дереализации. При протрагированных ревматических психозах наблюдаются маниакальные, депрессивные и депрессивно-параноидные картины. Эндокринопатии на начальных этапах характеризуются проявлениями эндокринного психосиндрома, для которого наиболее типичны изменения влечений (повышение или снижение аппетита), жажда, изменение чувствительности к теплу и холоду, повышение или снижение потребности в сне и др. Наряду с этим отмечаются изменения общей психической активности (потеря прежней широты и дифференцированности интересов) и настроения (гипоманиакальные, депрессивные, смешанные состояния, протекающие с повышенной возбудимостью, нервозностью, тревогой, дисфорией). Клиническая картина эндокринного психосиндрома видоизменяется в зависимости от природы гормональных нарушений. При гипопитуитаризме особенно часто наблюдаются торможение витальных влечений, физическая слабость и адинамия; при акромегалии — апатия и аспонтанность, иногда сочетающиеся с благодушно-эйфорическим настроением; при гипотиреозе — замедленность всех психических процессов, апатически-депрессивные состояния, снижение полового влечения; при гипертиреозе — повышенная возбудимость, бессонница, лабильность настроения. При утяжелении основного заболевания возможно возникновение делириозных, аментивных, сумеречных состояний, а также эпилептиформных припадков. Наряду с этим наблюдаются затяжные психозы с преобладанием аффективной и шизофреноподобной симптоматики. Психозы послеродового периода чаще всего протекают с преобладанием аментивных, кататонических или аффективных расстройств.
Интоксикационные психозы Оглушение, сопор, кома — наиболее частые формы расстройства сознания при отравлениях. Оглушение и сопор могут сопровождаться хаотическим двигательным возбуждением. Часто интоксикационные психозы проявляются делириозным помрачением сознания и галлюцинаторными расстройствами (при отравлении атропином, мышьяковистым водородом, бензином, производными лизергиновой кислоты, тетраэтилсвинцом). В тяжелых случаях расстройство сознания приобретает вид аменции. Протрагированные интоксикационные психозы проявляются чаще всего психоорганическими и реже эндоформными (аффективными, галлюцинаторнобредовыми, кататоническими) синдромами. Психоорганические расстройства могут ограничиваться астеноневротическими явлениями; в более тяжелых случаях наблюдаются интеллектуально-мнестическое снижение, психопатоподобные изменения личности. Наконец, психоорганические расстройства могут достигать степени слабоумия с грубыми расстройствами памяти (корсаковский синдром), благодушно-приподнятым настроением и дурашливым поведением (псевдопаралитический синдром). Указанные расстройства могут сопровождаться эпилептическими припадками и сочетаться с характерными для отравления конкретным токсическим веществом неврологическими и соматическими нарушениями. Острые интоксикационные психозы возникают или сразу после попадания яда в организм (окись углерода; бензин), или после латентного периода, который длится от нескольких часов до нескольких дней (тетраэтилсвинец, антифриз). Исход при абортивных формах острых психозов, как правило, благоприятный. По миновании острого психоза могут оставаться психоорганические расстройства разной тяжести и структуры. При хронических отравлениях психические расстройства нарастают медленно и проявляются главным образом психоорганическим синдромом. По прекращении контакта с ядовитым веществом возможно как регредиентное течение психических нарушений, так и дальнейшее их нарастание.
Диагностика и дифдиагностика Пресенильные психозы Диагноз пресенильного психоза правомерен лишь в случаях заболеваний, впервые возникших в периоде инволюции. При этом, однако, очень сложно дифференцирование с поздней шизофренией и маниакально-депрессивным психозом. Отграничение от других заболеваний, возникающих в инволюционном возрасте, облегчается при отсутствии расстройств, свойственных атеросклерозу головного мозга и старческому слабоумию.
Реактивные психозы В отличие от циркулярной меланхолии, при реактивных депрессиях не наблюдается выраженных идей самообвинения, двигательной и идеаторной заторможенности, немотивированной (витальной) тоски. Важнейшим патогенетическим звеном в формировании психогенных параноидов является фактор внешней обстановки (параноиды военного времени, железнодорожные параноиды, бред при иноязычном окружении и бред тугоухих, связанные с психической изоляцией, и др.). Характерны острота проявлений, элементарность, образность и эмоциональная насыщенность бреда, возникающего на фоне выраженного аффекта страха и тревоги; иногда появляются зрительные и слуховые галлюцинации. Чаще всего наблюдается бред преследования и отношения. Вслед за неясными опасениями (все вокруг как-то странно переглядываются, ведут себя необычно) и нарастающей подозрительностью у больных вдруг возникает ощущение смертельной опасности. Им кажется, что они окружены врагами, родственники уже уничтожены, вокруг слышат зловещий шепот, а иногда и отчетливые голоса недоброжелателей, замышляющих убийство. Реактивный параноид в большинстве случаев протекает остро и проходит через несколько дней после госпитализации, наблюдаются также бредовые реакции, возникающие по механизму индукции (сообщенный психоз), и сутяжные реакции. Против диагноза реактивного психоза свидетельствуют несоответствие между выраженностью реакции и относительно небольшой тяжестью предшествовавшей ей травмы, затяжное течение реакции с появлением в клинической картине симптоматики, несвойственной психогенным заболеваниям (беспредметная тревога, обонятельные галлюцинации, слуховые обманы абстрактного содержания, идеи воздействия, сенестопатии, нарушения мышления), формирование в процессе обратного развития психоза выраженных изменений личности, отсутствие критики к перенесенным болезненным расстройствам.
Симптоматические психозы Симптоматические психозы необходимо дифференцировать с эндогенными заболеваниями, провоцированными соматическим страданием. Уточнению диагноза способствуют данные о возникновении в процессе развития болезни хотя бы кратковременных эпизодов расстроенного сознания, выраженных астенических расстройств, а также о сочетании психических нарушений с неврологической и соматической симптоматикой. Острые симптоматические психозы следует отграничивать от экзогенных психозов иной этиологии (интоксикации, органические заболевания центральной нервной системы).
Лечение Пресенильные психозы Для лечения инволюционных депрессий используют антидепрессанты (амитриптилин и др.) в сочетании с нейролептиками (аминазин, тиоридазин (сонапакс), эглонил, хлорпротиксен). При резистентных к психотропным средствам состояниях показана электросудорожная терапия. При инволюционных параноидах назначают нейролептики (трифтазин, галоперидол, триседил, лепонекс).
Реактивные психозы Прежде всего необходимо по возможности устранить психотравмирующую ситуацию. Основным методом лечения, проводимого в тяжелых случаях в стационаре, является психофармакотерапия. Наряду с этим широко применяют психотерапию, общеукрепляющие средства, физиотерапию.
Симптоматические психозы Купирование психических нарушений, обусловленных соматической патологией, тесно связано с течением основного заболевания. При проведении медикаментозной терапии надо учитывать возможность неблагоприятного воздействия психотропных средств на течение соматического заболевания. Необходимо иметь в виду гипотензивный эффект психофармакологических препаратов и другие побочные явления, а также потенцирование действия барбитуратов, морфина и алкоголя. Осторожность не должна приводить к отказу от назначения психотропных средств, особенно в случаях психомоторного возбуждения, которое само по себе представляет опасность для жизни больного. Определяя тактику лечения острых симптоматических психозов (делириозные состояния, галлюцинозы и др.), необходимо учитывать их кратковременность и обратимость. В связи с этим весь объем медицинской помощи и уход за больным можно обеспечить в условиях соматического стационара (психосоматическое отделение). Перевод в психиатрическую больницу связан с опасностью ухудшения соматического состояния и необходим далеко не во всех случаях. При появлении начальных симптомов делирия и прежде всего стойкой бессонницы наряду с дезинтоксикационной терапией показано введение (при необходимости парентеральное) транквилизаторов (диазепам, хлордиазепоксид, элениум, оксазепам, нитразепам, эуноктин), а также нейролептических средств (хлорпротиксен, терален), обладающих снотворным эффектом. Больной в делириозном состояния нуждается в круглосуточном наблюдении. Купирование такого состояния следует начинать как можно раньше. Если помрачение сознания сопровождается тревогой, страхом, явлениями психомоторного возбуждения, наряду с дезинтоксикационной терапией (гемодез, полидез, полиглюкин) показано применение психотропных средств. С этой целью чаще всего используют аминазин и левомепромазин (тизерцин), а также лепонекс (азалептин). Учитывая соматическое состояние больных (контроль пульса и артериального давления), начинать лечение следует с минимальных доз (25–50 мг). Нейролептики назначают в таблетках или в виде инъекций в сочетании с сердечными средствами. Эффективно также внутривенное капельное введение транквилизаторов (седуксен, реланиум, элениум). В случаях возникновения выраженных явлений церебральной недостаточности показано парентеральное введение пирацетама (ноотропила). При протрагированных симптоматических психозах выбор препаратов определяется особенностями клинической картины. В случаях депрессии назначают тимолептики (пиразидол, амитриптилин, мелипрамин, петилил, герфонал); для лечения гипоманиакальных и маниакальных состояний используют транквилизаторы и нейролептики. Терапию галлюцинаторных и бредовых состояний проводят нейролептическими средствами (этаперазин, френолон, сонапакс, трифтазин, галоперидол и др.). Лечение соматогенно обусловленных невротических состояний во многом сходно с терапией неврозов. При астенических состояниях используют небольшие дозы транквилизаторов (особенно если в клинической картине преобладают явления раздражительной слабости и недержания аффекта) в сочетании с препаратами, активизирующими психическую деятельность (от 1,5 до 3–3,5 г гаминалона, 1,2–2,4 г пирацетама (ноотропила) в первую половину дня). В случаях выраженной вялости, заторможенного сознания, снижения работоспособности назначают психостимуляторы: 5—20 мг сиднокарба в первую половину дня, центедрин, ацефен.
Сенильные психозы Патогенетического лечения старческого слабоумия не существует. Проводится симптоматическая терапия. При психотических состояниях, состояниях спутанности сознания с беспокойством показаны нейролептики с седативным действием (сонапакс, тизерцин) в небольших дозах. При депрессиях назначают небольшие дозы антидепрессантов с седативным воздействием (амитриптилин, пиразидол). При расстройствах сна показаны транквилизаторы и нейролептики с гипнотическими свойствами (радедорм, феназепам, хлорпротиксен). Важное значение приобретает уход за больным.
Интоксикационные психозы Лечение в первые часы после отравления сводится к дезинтоксикации, в частности к массивному плазмаферезу и компенсации нарушенных функций. Психотропные средства следует применять осторожно, в малых дозах, главным образом при состояниях возбуждения (0,5–1 мл 2,5 %-ного раствора аминазина или тизерцина внутримышечно). При затяжных эндоформных психозах выбор психотропных средств определяется структурой синдрома. При депрессивных состояниях показаны антидепрессанты (амитриптилин, мелипрамин, пиразидол), при маниакальных — нейролептики (аминазин, тизерцин, галоперидол). Галлюцинаторнобредовые состояния также требуют назначения нейролептиков (трифтазин, галоперидол, лепонекс). При необходимости препараты можно сочетать. Важную роль при лечении как острых, так и хронических токсических поражений головного мозга играют витамины, особенно группы В, а также препараты метаболического действия — ноотропы (пирацетам, пиридитол, пантогам, аминалон). При психоорганических синдромах с затяжным течением и в исходных состояниях показаны периодические курсы дегидратационной терапии, витаминотерапии, лечение ноотропами. Для коррекции неврозо- и психопатоподобных расстройств рекомендуются транквилизаторы (хлозепид (элениум), сибазон (седуксен), нозепам (тазепам), феназепам) и нейролептики (сонапакс, хлорпротиксен, эглонил, неулептил).
ПСОРИАЗ
ОпределениеПсориаз (чешуйчатый лишай) — заболевание, характеризующееся нарушением кожного покрова с неясными причинами возникновения, очень сложным механизмом развития и рецидивирующим течением. Преобладает точка зрения, что это системное заболевание организма, вызываемое множеством факторов (с участием генетических и средовых). Примерно 1,5–2 % населения земного шара страдает этим заболеванием. Это болезненное состояние, при котором цикл развития и созревания клеток происходит за 4–5 дней, тогда как в нормальной коже он составляет 24–25 дней.
Этиология, патогенез и патанатомия Раньше всего появились паразитарная и инфекционная теории. Многие исследователи долго и упорно искали возбудителя псориаза. Еще более 100 лет назад сообщалось (Ланг, 1879 г.) об открытии паразитарного «гриба», являющегося возбудителем дерматоза (см.). Однако дополнительные исследования, проведенные другими авторами, не подтвердили этих сообщений. Существуют наблюдения, свидетельствующие, что на возникновение и течение псориаза влияют различные инфекционные заболевания. Действительно, наибольшее количество больных псориазом поступало в стационар в осенне-зимний и зимне-весенний периоды, когда наблюдается более частая заболеваемость ангинами (см.), катаром верхних дыхательных путей, гриппом (см.). Особенно часто псориазу сопутствовал хронический тонзиллит (см.) — у 89,9 %, что значительно выше средних показателей. Высказывается мысль, что острые инфекционные заболевания влияют на развитие нарушений кожи, ослабляя иммунитет на некоторых уровнях (обратимо и необратимо) и изменяя состояние вегетативной нервной системы. Особое место занимает вирусная теория. Еще в начале века сообщалось об открытии фильтрующегося вируса — возбудителя псориаза. В дальнейшем было опубликовано огромное количество работ, опровергающих вирусную природу псориаза. Например, показано, что «элементарные тельца», расцениваемые как вирусы, имеются и у здоровых людей и являются продуктами клеточного распада. Для подтверждения вирусной природы псориаза необходимы прежде всего изоляция и идентификация вируса, а этого сделать пока никому не удалось. И хотя вновь появились сообщения шведских исследователей, которые сфотографировали под электронным микроскопом искомый вирус, среда для его культивирования так пока и не подобрана. Речь идет о так называемом ретровирусе, который передается врожденным путем. Таким образом, вирусное происхождение псориаза не доказано, но соответствующая рабочая гипотеза продолжает разрабатываться. Нейрогенная теория связана с именем основоположника отечественной дерматологии А. Г. Полотебнова, который впервые (1886 г.) обратил внимание на роль функциональных нарушений нервной системы в развитии псориаза. Появился целый ряд сообщений о его возникновении после психических и физических травм, контузий, ожогов (см.). Нейрогенные влияния на возникновение и течение псориаза подтверждаются и терапевтическим эффектом при применении медикаментозных средств, направленных на нормализацию функций центральной и вегетативной нервной системы у больных. Однако существует точка зрения, согласно которой функциональные нарушения со стороны нервной системы у больных псориазом трактуются как вторичные, являющиеся следствием дерматоза (см.). Нервно-психический механизм хотя и объясняет некоторые особенности развития заболевания, но в целом оставляет много сомнений. Ясно одно — у больных псориазом часто наблюдаются функциональные нарушения нервной системы, которые не могут не оказывать влияния на течение дерматоза (см.), в частности на его рецидивы. Также с именем А. Г. Полотебнова, описавшего возникновение и обострение псориаза в период менструаций, связана эндокринная теория. О связи псориаза с функциональным состоянием половых желез впоследствии сообщали многие авторы. Известно также, что дерматоз (см.) может возникнуть во время грудного вскармливания, исчезнуть при следующей беременности (см.), а затем снова появиться во время кормления. Несмотря на большой фактический материал, не представляется возможным выделить непосредственную роль какой-либо железы или гормона в механизме развития псориаза. Наличие у больных этим дерматозом (см.) различных эндокринных заболеваний еще не позволяет утверждать, что они являются непосредственной причиной возникновения псориаза хотя бы потому, что подобные расстройства наблюдаются и при других заболеваниях, причина возникновения которых установлена достоверно. Обменная теория возникла на почве многолетних и многочисленных наблюдений, свидетельствующих о том, что при псориазе отмечается целый ряд нарушений обмена веществ. Уже давно отмечена несколько пониженная температура тела у больных, что является показателем замедленного обмена веществ. Впоследствии были обнаружены изменения со стороны белкового и жирового обмена. Это позволяет некоторым авторам рассматривать псориаз как своеобразный липоидоз кожи, или «холестериновый диатез», так как содержание общих жиров и холестерина у больных повышено. Это повышение является первичным и способствует начальным проявлениям дерматоза (см.). Обмен витаминов при псориазе также нарушен, что снижает приспособительные возможности организма. Содержание витамина С снижено в крови и повышено в коже;
Псориаз
витаминов А, В6, В12 — снижено в крови. Аналогичные сдвиги наблюдаются между содержанием меди, цинка и железа. Терапевтический эффект безжировой диеты дал основание считать псориаз кожным липоидозом. Умеренное голодание и малокалорийное питание, уменьшая самоотравление организма продуктами обмена веществ, ставит больного в наилучшие условия при терапии. Что касается углеводного обмена при псориазе, то одни авторы считают, что значительные нарушения этого обмена лежат в основе псориаза (примерно у 25 % больных имеется диабет (см.), а другие относят эти нарушения к одному из проявлений болезни. По-видимому, расстройства обменно-эндокринных процессов не говорят об их причинном значении, а представляют собой вторичные изменения, обусловленные псориатической болезнью. Аллергическая теория тесно соприкасается в настоящее время с трактовкой роли очаговой инфекции в развитии псориаза. Еще в 30-е гг. ХХ в. появились предположения о роли аллергических реакций в механизме развития этого дерматоза (см.). Позднее обсуждался вопрос об аллергической природе псориатических артритов (см.), ибо изменения суставов при псориазе имеют много общего с таковыми при ревматоидном артрите (см.). В 1971 г. был выявлен хронический тонзиллит (см.) у 90 % больных псориазом. Консервативная терапия особого эффекта не давала. Однако после удаления миндалин лечение привело к регрессированию или исчезновению высыпаний у 91 % больных, уменьшилось количество рецидивов и их острота, заметно нормализовались иммунологические процессы. В то же время очевидно, что рассматривать миндалины при хроническом тонзиллите (см.) только как источник инфекции нельзя. Взаимодействие микро- и макроорганизма значительно сложнее. Это подтверждают иммунологические исследования последних лет. Сторонники инфекционно-аллергической теории возникновения и развития псориаза предполагают, что это заболевание представляет собой аллергическую тканевую реакцию на сложную структуру стрептококков или вирусов или на продукты их жизнедеятельности. Наследственная теория ведет свое начало от наблюдений Р. Уиллана (1801 г.). В последние десятилетия уделяется большое внимание генетическим исследованиям. М. Штейнберг (1951 г.) указал, что дети, один из родителей которых болен псориазом, заболевают в 4 раза чаще, чем дети здоровых родителей. У 60 % пациентов обнаруживаются родственники и предки, страдавшие или страдающие этим дерматозом (см.). Вероятность заболевания ребенка псориазом в семье, в которой один ребенок уже болен, а родители здоровы, составляет 17 %. При наличии псориаза у одного из родителей вероятность заболевания ребенка составляет 25 %, а при заболевании обоих родителей — до 75 %. Р. Ф. Федоровская (1968 г.) считает, что наследуется не псориаз, а изменения нейроэндокринных механизмов, сдвиги в обмене веществ, особенности строения кожи. Инфекционные, психогенные и другие средовые влияния рассматриваются как разрешающие факторы на фоне наследственной предрасположенности, играющей главную роль в проявлении заболевания. Вместе с тем следует учитывать, что псориаз вообще встречается весьма часто, и потому наличие заболевания у родителей (или других родственников) и у детей не всегда связано с генетическими факторами. Нарушения в обмене белков, жиров, ферментов, передаваемые по наследству, показывают, что в основе возникновения чешуйчатого лишая (см.) лежат нарушения функций ферментов наследственного происхождения. Причины псориаза многочисленны: провоцирующими факторами являются изменения жирового, ферментного, частично белкового и углеводного обмена в сочетании с очагами инфекции стрептококковой или вирусной природы. Попытки выявить хромосомные нарушения при псориазе долгое время не приносили успеха; сегодня имеются сообщения, что определена хромосома, ответственная, по всей видимости, за развитие дерматоза (см.). Вирус, внедряясь в клетку, нарушает кодирование наследственной информации, в результате чего создаются новые трансформированные клетки с измененными наследственными свойствами. Концепция многофакториальной природы заболевания рассматривает развитие псориаза как результат взаимодействия некоторых генов и факторов окружающей среды. Наследственные факторы преобладают над средовыми, о чем свидетельствуют высокие значения коэффициента наследуемости псориаза. Вместе с тем фактор среды, играя определенную роль в возникновении дерматоза (см.), оказывает значительное влияние на характер течения и прогноз уже развившейся болезни. Существование провоцирующих факторов отмечают сами пациенты, нередко указывая на возможные причины возникновения или обострения у них заболевания. Важнейшими пусковыми механизмами при псориазе являются нервно-психическая травма, стрессовые состояния, длительное напряжение. Согласно нервно-психической концепции механизма развития чешуйчатого лишая (см.), стрессовые ситуации вызывают ряд биохимических и иммунологических реакций, приводящих к развитию псориатического очага. Известно также, что отрицательные эмоции могут не только способствовать возникновению и обострению псориаза, но и в редких случаях вызывать его обратное развитие и даже разрешение клинических проявлений дерматоза (см.). Велика роль очагов фокальной инфекции (тонзиллит (см.), холецистит (см.), гайморит (см.), отит (см.), кариес (см.), хламидиоз (см.), трихомониаз (см.) и др.) и как источника бактериальной токсемии. Такая инфекция повышает чувствительность организма пациента, что может привести к возникновению или обострению дерматоза (см.). Инфекции типа скарлатины (см.), рожи (см.) и другие (стрептококкового происхождения) часто провоцируют развитие и обострение псориаза. У 55 % больных псориазом выявлены положительные стрептококк-тесты, а у 68 % выделен стрептококк из очагов хронической фокальной инфекции. Что касается лекарственной агрессии, то чаще других обострение псориаза вызывали антибиотики (26 %): тетрациклин, пенициллин, бициллин, левомицетин и др.; нестероидные противовоспалительные средства (15 %): бутадион, ибупрофен, индометацин и др.; витамины группы В (15 %): тиамина бромид (В1), пиридоксина гидрохлорид (В6), цианкобаламин (В12); бета-блокаторы (13 %); делагил, различные цитостатики, вакцины, сыворотки и др. Возникновение и обострение псориаза может вызвать употребление алкоголя. Алкогольное отравление организма также способствует распространению процесса, возникновению осложненных форм псориаза, укорочению ремиссий. Этот дерматоз (см.) выявлен у 0,7 % лиц, не употребляющих алкоголь, и у 5,3 % пьющих. Пристрастие больного к алкоголю ограничивает возможности методов лечения. Неопрятность, неаккуратность, нарушения режима лечения зачастую сводят на нет все усилия врачей. При анализе влияния отдельных климатических факторов одни авторы выявляли взаимосвязь заболеваемости псориазом с повышенной влажностью и усилением солнечной радиации, другие — с количеством выпавших осадков и относительной влажностью или с температурой и влажностью. Первые проявления псориаза могут наблюдаться в любом возрасте — от 2–3 месяцев до глубокой старости, наиболее часто (около 65 %) — в возрасте 21–40 лет. Замечено, что чем ранее начинается псориаз, тем более тяжело и с частыми рецидивами протекает он в дальнейшем. У пожилых людей псориаз часто сочетается с гипертонией (см.), сахарным диабетом (см.), атеросклерозом (см.), гастритами (см.), язвенной болезнью желудка (см.), циррозом (см.) печени, желчнокаменной болезнью (см.), неврозами (см.), ожирением (см.), что заметным образом влияет на развитие псориаза. В механизме развития псориаза большую роль играют иммунные нарушения. Избыточное перемещение лимфоцитов из крови в пораженную кожу может быть причиной насыщенности эпидермиса этими клетками. Псориатические проявления на коже часто характеризуются как однообразные в связи с тем, что признанным первичным элементом является папула. Вместе с тем при псориатической эритродермии можно видеть первичным элементом эритему, а у больных пустулезным псориазом — пустулу. Кроме того, описана пятнистая разновидность псориаза. Поэтому диагностика псориаза представляет известную сложность и требует диагностической биопсии.
Клиническая картина В течении псориаза выделяют три стадии: прогрессирующую, стационарную и регрессирующую. В стадии прогрессирования болезни цвет папул более яркий, они отечные, напряженные. Вокруг папул определяется четкий пятнистый эритематозно-отечный бордюр (периферический розовый венчик роста). Многие папулы находятся в состоянии слияния, объединяясь в крупные участки папулезных образований или бляшки различных очертаний. Для прогрессирующей стадии псориаза характерен положительный феномен Кобнера. Он проявляется образованием папулезных элементов на местах трения и давления. Папулы располагаются линейно, повторяя своей локализацией место раздражения. Объясняется феномен Кобнера наличием настолько резко выраженных изменений, что даже внешне здоровая кожа находится в состоянии готовности к воспалительной реакции. Малейшее, даже физиологическое напряжение или давление (ремень, места прилегания лямок бюстгальтера, царапины и расчесы) сопровождается образованием папулезной сыпи. В стационарной стадии периферический рост высыпных элементов прекращается, а папулы уплощаются и бледнеют. Возможно образование кольцевидных очагов вследствие интенсивного разрешения инфильтрата в центре. Иногда папулы и участки папулезной инфильтрации разрешаются не с центра, а с периферии. Тогда папулезные элементы как бы «подтаивают» с краев и утрачивают правильную округлую форму. Период регресса характеризуется полным исчезновением папулезной инфильтрации на значительной части поверхности тела. На месте бывших высыпаний образуются очаги гиперпигментации или участки вторичной («ложной») лейкодермы. Вокруг регрессирующих псориатических элементов часто виден бледный, как бы складчатый бордюр — псевдоатрофический ободок Воронова — симптом активного разрешения процесса. Помимо типичной (классической) формы псориаза различают атипичные его разновидности: экссудативный; пятнистый; себорейный; застарелый; бородавчатый; раздраженный; интертригинозный.
Экссудативный псориаз Эта разновидность нередко наблюдается у лиц с избыточной массой тела, наличием диабета (см.) или при сниженной функции щитовидной железы. Процесс проявляется очагами острого отечного воспаления с нерезко выраженной, а иногда и отсутствующей инфильтрацией с нечеткими, неправильной формы очертаниями, обильным наслоением не характерных для псориаза серозных или серозно-гнойных корок и корко-чешуй. Довольно часто у больных с экссудативными проявлениями псориаза бывают мокнутие и интенсивный зуд (см.), что затрудняет диагностику. Локализация экссудативного псориаза отличается своеобразием: более часто очаги располагаются на нижних конечностях или в крупных кожных складках.
Пятнистый псориаз Эта форма отличается наличием эритематозных пятен, иногда со слабо выраженной инфильтрацией, а иногда и без нее, но с обильным характерным шелушением и наличием псориатической триады. Следует отметить, что пятнистые формы дерматоза (см.) наблюдаются в основном у молодых женщин, поэтому его именуют «женским» псориазом.
Себорейный псориаз Этот вид наиболее труден для диагностики, так как клинически наблюдаются особенности клиники себорейной экземы (см.) и проявления себорейного статуса у больных. Как правило, на себорейных участках (волосистая часть головы, носогубные и носощечные складки, за ушными раковинами, на груди и в межлопаточной области) обнаруживаются эритематозно-папулезные элементы с обильным крупнопластинчатым шелушением. Очаги на лице и груди чаше представлены пятнистыми высыпаниями с жирными серовато-желтыми чешуями, имитирующими себорейную экзему (см.). За ушными раковинами можно видеть участки инфильтрации насыщенного розового или красного цвета, также с обильным наслоением серозных или серозно-гнойных корок, наличием трещин, мокнутия, симулирующих картину стрептодермии (см.) или себорейной экземы (см.), осложненной пиодермией (см.). Однако на волосистой части головы всегда обнаруживаются папулезные инфильтративные элементы, а на коже лба по границе с волосами у больных псориазом, как правило, бывают папулы с характерным шелушением. Они или единичные и отдельно расположенные, или переходят с волосистой части головы на кожу лба в виде короны («псориатическая корона»).
Застарелый псориаз Эта разновидность проявляется длительно существующими участками сливного расположения папул с резко выраженной инфильтрацией и четко очерченными границами. Вследствие наличия мощного воспалительного образования и длительного течения процесса окраска очагов приобретает буроватый оттенок, а поверхность папул увеличивается с образованием участков гиперкератоза и бородавчатых разрастаний.
Раздраженный псориаз Иногда вследствие нерационального лечения, избыточного облучения, какой-либо стрессовой ситуации происходит бурное усиление воспалительной реакции. Папулезные проявления становятся отечными, приобретают интенсивный, яркий, насыщенный красный цвет. Вокруг папул быстро возникает отечный гиперемический пояс, способствующий слиянию отдельных высыпаний в сплошное распространенное поражение больших участков кожного покрова, нередко превращающееся в эритродермию. При раздраженном псориазе, как и в прогрессирующей стадии, значительно усиливается реактивность с явлениями повышенной чувствительности, вследствие чего даже на участках здоровой кожи при незначительном раздражении (трение, давление, царапина) возникают новые свежие папулезные проявления (феномен Кобнера).
Интертригинозный псориаз Расположение псориатических элементов в крупных складках кожи является атипичной локализацией и свойственно неопрятным больным, страдающим диабетом (см.), ожирением (см.), вегетососудистой дистонией (см.). При такой форме псориаза в подмышечных впадинах, межъягодичной, паховых и межпальцевых складках, под молочными железами возникают отечные эритематозно-папулезные очаги, часто мокнущие и эрозивные, с отслойкой рогового слоя по периферии. Интертригинозный псориаз может напоминать кандидоз (см.), рубромикоз, эпидермофитию (см.). В отличие от псориаза, кандидоз (см.) и дерматомикозы (см.) крупных и мелких складок протекают острее, а поверхность очагов поражения более яркая. По краю пораженных участков четко выражен бордюр из подрытого рогового слоя. По периферии, как правило, видны отсевы в виде пятнисто-узелковых проявлений. Помимо атипичных клинических форм псориаза существуют тяжелые разновидности, требующие особого внимания в плане диагностики и лечения. К ним относятся псориатическая эритродермия, пустулезный псориаз, артропатический псориаз ногтей и псориаз слизистых оболочек.
Псориатическая эритродермия Непосредственными факторами, способствующими формированию псориатической эритродермии, являются различные провоцирующие моменты. Отмечалось развитие эритродермии после ангины (см.), нервно-психических и травматических воздействий, после нерационального применения ультрафиолетового (УФ) и солнечного облучения, приема антибиотиков, сульфаниламидных препаратов, метотрексата, пользования раздражающими мазями. В этих случаях отдельно расположенные проявления активизируются, приобретая отечность, яркую насыщенную эритематозную окраску, образуя множественные фигуры слияния, а местами — сплошные распространенные участки. Папулы и бляшки становятся неразличимыми. Кожа туловища и конечностей приобретает вид плотного напряженного панциря застойнобурого цвета с интенсивной инфильтрацией, обильно шелушится. Возможен и другой путь формирования псориатической эритродермии — так называемая спонтанная идиопатическая псориатическая эритродермия. Без предшествующего раздражения или действия явных стрессовых факторов бурно развивается распространенное застойное покраснение кожи туловища и конечностей со значительной отечностью, напряжением, обильным шелушением. Правильной диагностике помогает наличие отдельных типичных псориатических папул по периферии. В отличие от лимфом кожи эритродермического типа, псориатическая эритродермия не сопровождается изменениями картины крови, а в тканевых препаратах отсутствуют клетки Сезари и скопления патологических лимфоцитарных элементов.
Псориаз ногтей Поражение ногтевых пластинок у больных псориазом всегда имеет место, но клинические изменения бывают выражены различно. Принято выделять две формы нарушений ногтей: точечную и распространенную. При точечном поражении в ногтевых пластинках образуются точечные, с маковое зерно углубления. Внешне ногтевые пластинки в этом случае напоминают поверхность наперстка, а псориаз называется наперстковидным. Распространенное изменение ногтевых пластинок характеризуется большим разнообразием и различной степенью выраженности клинических проявлений. Минимальные изменения, которые отмечаются практически у любого больного псориазом, представлены легким помутнением поверхностной пластинки, сероватым оттенком окраски ногтевой пластинки и едва заметной продольной исчерченностью. При значительных изменениях ногтевых пластинок распространенного характера выделяют атрофическую форму, гипертрофическую и псориатическую онихию (поражение ногтей) в виде подногтевых кровоизлияний. Атрофическая ониходистрофия, или псориатический онихолизис, характеризуется истончением вещества ногтя без предшествующих воспалительных изменений. Ногтевая пластинка, постепенно истончаясь, отделяется от ногтевого ложа или, постепенно разрушаясь, исчезает вплоть до остатков ногтевой пластинки сероватого цвета у луночки. Истончение ногтевой пластинки и ее разрушение чаще начинается по свободному краю ногтя, но может происходить и по ее боковым участкам. Клиническая разновидность ониходистрофии гипертрофического типа проявляется разнообразными изменениями как формы и цвета, так и консистенции. Наиболее часто происходит утолщение ногтевой пластинки с деформацией и изменением цвета от серовато-желтоватого до грязно-серого. Ногтевая пластинка теряет блеск, становится тусклой, неровной, бугристой. Деформация ногтевой пластинки начинается с проявления в области луночки борозд. По мере вовлечения в процесс ногтевой пластинки и подногтевого ложа усиливается инфильтрация, ногтевая пластинка еще больше утолщается и деформируется. Ноготь становится плотным, напоминающим коготь хищной птицы. Этот процесс называется онихогрифозом и чаще развивается в области стоп. В других случаях ногтевая пластинка разрушается. Ноготь становится рыхлым, крошащимся, ломким и постепенно отторгается, оставляя лишь небольшие рыхлые роговые наслоения у луночки. Существует два типа геморрагий (кровоизлияний). Геморрагические пятна первого типа, просвечивающие через ногтевую пластинку, могут быть в области луночки. Они образовываются за счет расширенных капилляров сосочков ногтевого ложа и исчезают при надавливании. Второй тип подногтевых геморрагий характеризуется точечными или полосовидными кровоизлияниями, приобретающими геморрагическую желтовато-бурую или черную окраску. Иногда тонкие стреловидные полоски ближе к концу ногтевой пластинки производят впечатление заноз. Все поражения ногтевых пластинок сопровождаются отеком, инфильтрацией, застойно-гиперемированным поражением околоногтевого валика. Задняя ногтевая кожица инфильтрирована, с обильным характерным шелушением, которое отсутствует при онихомикозах и кандидозе (см.). Псориатическая паронихия (воспаление околоногтевых тканей) нередко сопровождается серозным, иногда гнойным отделяемым из-под заднего ногтевого валика, что также является важнейшим отличительным признаком при диагностике. Это позволяет отличить псориаз от кандидоза (см.) и микотического поражения.
Пустулезный псориаз Заболевание проявляется гнойными элементами поверхностного характера типа стрептостафилококкового импетиго (см.). Выделяют первичный, или идиопатический, пустулезный псориаз, протекающий тяжело и злокачественно, и вторичный доброкачественный. Для идиопатической разновидности пустулезного псориаза характерно наличие первичных гнойных элементов, располагающихся на инфильтративном основании, с интенсивным шелушением и основными патогенетическими феноменами, свойственными псориазу. При доброкачественной форме пустулы обычно появляются на бляшках вульгарного псориаза или гнойные проявления заменяют ранее появившиеся папулы. Подобный вариант течения обычно именуют псориазом с пустулизацией. Это упорно текущий тип псориаза, часто заканчивающийся инвалидизацией или смертельным исходом. Пустулезные формы псориаза встречаются редко. Основными причинами возникновения пустулезной формы псориаза являются применение метотрексата, лечение кортикостероидными гормонами, злоупотребление алкоголем.
Артропатический псориаз (псориатический артрит) Несмотря на значительный прогресс в изучении псориаза, самой тяжелой и наименее управляемой в плане лечения формой псориаза является артропатическая. По прочно установившейся традиции, псориаз все еще относится к кожным болезням, хотя установлена системность этого процесса и способность псориаза поражать не только кожу, но и внутренние органы, нервную систему и суставы. Псориатический артрит характеризуетсякак системный процесс, при котором максимально выраженные изменения проявляются в структуре соединительной ткани. Псориатическая артропатия может протекать доброкачественно, по типу моно- или олигоартрита либо в виде полиартрита, а у части больных приобретает характер тяжелого деструктивного полиартрита. Псориатический артрит (см.) чаще возникает параллельно с кожными поражениями или несколько позже, а в некоторых случаях суставной синдром может предшествовать кожным проявлениям. Поражение суставов начинается с межфаланговых суставов кистей и стоп. Постепенно в процесс вовлекаются средние и крупные сочленения, включая и позвоночник, с развитием анкилозирующего спондилоартрита (болезнь Бехтерева (см.), коллагеноз (см.) с поражением связочно-суставного аппарата позвоночника). Разнообразие клинических вариантов псориатической артропатии и трудности ее диагностики способствовали созданию ряда классификаций, построенных преимущественно по клинико-анатомическим и рентгенологическим критериям. Помимо данных критериев, необходимо учитывать степень активности и функциональной способности костно-суставных сочленений. Существенное значение также имеет наличие у больных, помимо вегетодистонических и нейроэндокринных расстройств, множественных висцеропатий (поражения внутренних органов). Обращают на себя внимание прогрессирующее астеническое состояние вплоть до кахексии (см.), мышечные боли, атрофии (см.) мышц кистей, предплечий, голеней. Как и при обычном псориазе, у больных псориатической артропатией определяются недостаточность функции печени, почек, иммунодефицитные состояния, нарушения сердечно-сосудистой системы. Поражения опорно-двигательного аппарата и внутренних органов при псориатической артропатии не имеют характерных патогномоничных симптомов и признаков. Диагноз основывается на комплексном обследовании больных. При этом учитываются клинические особенности поражения суставов, кожи.
Псориаз слизистых оболочек Многочисленные исследования механизма развития псориаза позволили углубить понимание разнообразности комплексных нарушений, свидетельствующих о системности процесса. Это послужило основанием говорить о псориазе как о псориатической болезни. Поражение слизистых оболочек, в частности слизистой оболочки рта, в настоящее время является признанным фактом. Известно появление псориатических проявлений не только в области полости рта, но и на конъюнктиве, на слизистых оболочках половых органов. Высыпания на слизистых оболочках нередко составляют продолжение псориатических проявлений на коже. Псориаз слизистых оболочек, как и псориаз кожи, может иметь несколько разновидностей. Чаще псориаз кожи и слизистых оболочек протекает синхронно, начинается и регрессирует одновременно. Наиболее распространенной локализацией у больных вульгарным псориазом является поражение слизистой оболочки щек, красной каймы губ и языка. Характерно наличие воспалительных элементов округлой, овальной или неправильной формы, слегка выступающих над окружающей слизистой оболочкой. Границы проявлений четкие, часто резко ограниченные. Сыпь имеет сливной характер. Вокруг такого очага всегда наблюдается розовый отечный бордюр. На поверхности очагов возможно образование рыхлого беловато-серого налета, но чаще наблюдается эритематозная воспаленная поверхность, слегка отечная с незначительной эксфолиацией (отслоением) эпителия по типу шелушения. У больных распространенным псориазом в прогрессирующей стадии или экссудативной разновидностью болезни, а чаще у больных с псориатической эритродермией наблюдается поражение красной каймы губ. Процесс характеризуется зоной воспаления в виде ленты, идущей от одного угла рта до другого. Красная кайма в этом месте покрасневшая и отечная, нередко инфильтрированная, с поперечно расположенными трещинами и мелкими чешуйко-корочками. Наиболее резко выражены пятнистая отечность и покраснение в зоне Клейна (по линии смыкания губ). Процесс может локализоваться на одной (чаще нижней) губе, но может быть и на обеих губах. Псориатические высыпания на слизистой оболочке рта иногда сопровождаются жжением, но чаще протекают без каких-либо ощущений. В области половых органов псориатическая сыпь чаще формируется у мужчин на внутреннем листке крайней плоти, а у женщин — в области переходной складки больших и малых половых губ. В отличие от поражений на слизистой оболочке рта, при этой локализации четко определяются характерные симптомы псориатического процесса. Обычно видны розовые округлые папулы с четкими границами, склонные к слиянию и с наличием наслоения сероватобелых чешуек или чешуйко-корок, легко отторгающихся при поскабливании. Поражение слизистых оболочек у больных пустулезным псориазом наблюдается постоянно. Поражение слизистой оболочки полости рта является неотъемлемым признаком пустулезного псориаза. В соответствии со своеобразием кожной сыпи псориатические пустулезные проявления на слизистых оболочках имеют выраженную отечность, серозно-гнойную экссудацию, отличаются частым формированием эрозивно-язвенных элементов. Дифференциальный диагноз с красным плоским лишаем (см.) основывается на имеющейся у больных псориазом характерной розовой окраске сыпи с образованием точечного кровотечения при снятии беловато-серого налета или эксфолиативного (отслаивающегося) эпителия. От лейкоплакии (см.) псориаз отличается отсутствием плотных образований, наличием чередования периодов регресса и рецидива высыпаний, а также обнаружением при легком поскабливании точечного кровотечения. Для дифференциальной диагностики имеет значение такой фактор, как синхронность появления и течения высыпаний на коже и слизистых оболочках.
Лечение Для лечения псориатической болезни применяется так много различных препаратов, действующих на многофакториальные механизмы формирования дерматоза, что следует называть такие способы лечения направленной полипрагмазией (одновременное назначение множества лекарственных средств или лечебных процедур). Применяемые средства общего воздействия на организм, его внутреннюю среду, нервно-эндокринные и иммунологические механизмы в каждом конкретном случае действуют патогенетически (т. е. влияют на механизм развития болезни). Однако по результатам лечения не удается сделать каких-либо заключений о причине, вызвавшей появление псориаза. Способы патогенетической терапии самые различные, и поэтому прежде чем начать лечение, больного тщательно обследуют. В обследование включаются подробный опрос больного, исследование общего состояния, внутренних органов, нервно-эндокринной системы, изучение уровня активности гуморальных и клеточных факторов иммунитета, выявление очагов локальной инфекции. При назначении лечения учитываются стадия болезни, сезонность, клиническая разновидность дерматоза (диссеминированная, ограниченная, псориатическая эритродермия, псориатический артрит и т. д.). В процессе выбора фармакологических средств уточняют переносимость лекарств, эффективность предыдущей терапии, длительность ремиссии и причину наступившего рецидива. Известно, что более благоприятный и быстрый результат терапевтических мероприятий наблюдается при непродолжительных, неосложненных, ограниченных разновидностях псориаза. Вместе с тем следует отметить, что в этот период и психически больные склонны больше доверять врачу и не увлекаться самолечением, которое нередко противоречит назначениям врача. Труднее протекают тяжелые разновидности дерматоза. Значительно медленнее наступает улучшение состояния при экссудативной, пустулезной, эритродермической и артропатической формах псориаза. Своевременно начатое лечение, сочетающееся с рациональным режимом, с применением физио-, бальнео- и курортотерапии гарантирует длительную клиническую ремиссию. Перед выбором того или иного способа лечения псориаза следует определить и систему режима быта больного. Если у больного процесс распространенный, прогрессирующий, то более целесообразно проводить лечение в стационарных условиях. Общее лечение больных распространенным, прогрессирующим псориазом издавна рекомендовалось проводить препаратами кальция, обеспечивающими противовоспалительный и гипосенсибилизирующий (понижающий чувствительность) эффект, уплотняющими клеточную мембрану и уменьшающими проницаемость капилляров кожи. Более эффективно внутривенное введение 10 %-ного раствора кальция глюконата внутримышечно или внутривенно по 10 мл через день-два (10–15 инъекций на курс). Широко используются и другие соли кальция — кальция хлорид, глицерофосфат, пантотенат, лактат, обладающие успокаивающим и противовоспалительным действием, а также уплотняющие сосудистую стенку и уменьшающие выраженность вегетодистонии. Особенно показано применение солей кальция при экссудативным псориазе. Противопоказанием к их назначению является гиперкальциемия, гипертония (см.), наличие тромбофлебита (см.) и симптомов гиперкоагуляции (повышенного свертывания крови). Осложнений не наблюдается, если препараты назначают с учетом противопоказаний. Десенсибилизирующее, детоксицирующее и противовоспалительное действие широкого спектра свойственно также и натрию тиосульфату, который наиболее эффективно действует при внутривенном введении. Назначают его в виде 30 %-ного раствора по 5–7—10 мл через день в течение 20–30 дней. Возможно и пероральное применение по 1–2 г на прием в порошках, таблетках или в виде 10 %-ного раствора по 1–2 ст. л. 3–4 раза в день. К активным противовоспалительным гипосенсибилизирующим средствам относятся также салицилаты (натрия салицилат, кислота ацетилсалициловая). Натрия салицилат применяют внутрь в таблетках по 0,5–1 г на прием 2–3 раза в день или в виде 5—10 %-ного раствора по 1 ст. л. после еды. При приеме натрия салицилата возможны побочные явления: ослабление слуха, потливость, аллергические реакции. Во избежание расстройства пищеварения его назначают только после еды. Противопоказаниями к применению натрия салицилата являются: язвенная болезнь желудка и двенадцатиперстной кишки (см.), желудочно-кишечные кровотечения, нарушения свертывающей системы крови. Антигистаминные вещества не считаются основными препаратами; больным псориазом они назначаются только при наличии зуда (см.) или в тех случаях, когда псориаз протекает остро, с гиперергическими симптомами (гиперергия — повышенная реактивность). Наиболее часто используют димедрол, дипразин (пипольфен), супрастин, диазолин, тавегил, фенкарол. Названные средства также устраняют повышенную сосудистую проницаемость, снижают возможность воспаления тканей. Их гипосенсибилизирующее действие основано на нейтрализации гистамина, серотонина, брадикинина и ацетилхолина. Эти препараты, обладая способностью снижать возбуждение центральной нервной системы, облегчают наступление сна. Длительность применения антигистаминных средств ограничена, так как в действии антигистаминных лекарств существует три периода. В первом периоде проявляется выраженное антигистаминное действие, а во втором наступают явления привыкания, формирующиеся обычно через 1–1,5 месяца и характеризующиеся утратой терапевтического действия. В третьем периоде антигистаминный препарат сам становится аллергеном и может вызвать общие и местные аллергические реакции. Поэтому любое из этих средств используют короткими курсами по 7—10–15 дней, но не более 20–30 дней. При лечении хронического рецидивирующего псориаза препараты обязательно меняют. Более эффективно сочетанное применение антигистаминных средств с кальциевыми соединениями. Антисеротониновым действием обладают также новокаин и аминазин, которые улучшают терапевтический эффект. В организме новокаин относительно быстро гидролизуется (распадается), образуя вещества, принимающие участие в образовании фолиевой кислоты, обмен которой нарушен при псориазе. Новокаин вводят различными путями: внутрь, внутривенно, подкожно, внутримышечно и электрофоретически. Для перорального применения назначают 1–3 %-ный раствор по 1 ст. л. 3 раза в день после еды на протяжении 3–4 недель. Внутримышечно и подкожно новокаин применяют по различным схемам и в разных дозах. Чаще используют 2 %-ный раствор, вводимый по 1–2 мл ежедневно или через день в течение 1–1,5 месяцев. Затем следует перерыв на 1–1,5 месяца, после чего курс лечения повторяют. Внутривенные вливания 0,25 %-ного раствора новокаина производят ежедневно или через день, начиная с 2 мл и постепенно увеличивая дозу до 7–8—10 мл. Курс лечения составляет 10–15— 20 вливаний. Для лучшей переносимости новокаина рекомендуется к нему добавлять в одном шприце 5–7 мл 25 %-ного раствора магния сульфата. Перед началом введения новокаина при всех способах его назначения следует обязательно определить переносимость препарата, ибо возможна повышенная чувствительность или даже непереносимость. Новокаин назначают при любой клинической форме и стадии псориаза, но особенно новокаин показан при прогрессирующем течении дерматоза. Аминазин относится к препаратам антигистаминного действия, но обладает к тому же гипотензивным (понижающим артериальное давление), противовоспалительным и успокаивающим действием. Он снижает проницаемость капилляров и уменьшает возможность воспаления при реакции антиген— антитело. Его применение в комплексном лечении псориаза используется дерматологами с хорошим эффектом. Применяется аминазин в виде 2,5 %-ного раствора по 1 мл в 3 мл 0,5 %-ного раствора новокаина 1–2 раза в день или перорально по 0,025—0,05 г 2–3 раза в день после еды в течение 1–2 недель. Применение аминазина противопоказано при заболеваниях печени, почек, выраженном атеросклерозе (см.), тромбоэмболической болезни и склонности к аллергическим заболеваниям. К осложнениям и побочным явлениям препарата относятся нарушения процесса пищеварения, снижение аппетита, запоры (см.), ортостатический колит (см.). При длительном применении возможны лейкопения, агранулоцитоз, гепатит (см.). Широко распространено применение у больных псориазом успокаивающих средств и транквилизаторов. Однако на практике убедиться в действенности и эффективности этих методов не представляется возможным. Кроме того, при наличии у больных псориазом глубоких нарушений обмена веществ в результате действия ряда факторов, вследствие переедания, малой подвижности и эндокринной недостаточности предлагается применять седативную терапию или транквилизаторы только временно и лишь при наличии выраженных невротических реакций, а также если новокаин, аминазин и антигистаминные препараты с аналогичным влиянием оказались недостаточно действенными. В этих случаях используют магния сульфат, который, помимо успокаивающего и гипотензивного действия, оказывает слабительный, желчегонный и тонизирующий эффект. Особенно показан магния сульфат больным псориазом с ожирением (см.), нарушенной функцией печени, желчного пузыря, а также больным с гипертонией (см.), атонией кишечника, сосудистой спазмофилией кожи. Вводится магния сульфат внутримышечно или внутривенно в виде 25 %-ного раствора по 3–5— 7—10 мл через день-два с учетом величины артериального давления в течение 20–30 дней. У больных с ожирением и недостаточностью функции щитовидной железы наиболее целесообразно применять магния сульфат внутрь в виде 10–20 %-ного раствора по 1 ст. л. 2–3 раза в день в течение 2–3 недель. Как успокаивающие, нормализующие и удлиняющие физиологический сон больным псориазом целесообразно назначать сибазон, седуксен, реланиум, феназепам, нозепам, тазепам, мазепам — по 1 таблетке в дозе 0,005 г 1–2 раза в день. Положительный результат в лечении прогрессирующей стадии псориаза отмечается при добавлении к комплексу противовоспалительных средств липотропных препаратов в сочетании с алкалоидами красавки и фенобарбиталом. К ним относятся беллатаминал, белласпон, беллоид. К неспецифическим противопсориатическим средствам, обладающим широким фармакотерапевтическим действием, относятся витамины, активно влияющие на обменные функции. Известно, что жизненная потребность в витаминах обусловлена их участием в построении многих ферментов, что обеспечивает регуляцию обмена веществ, адаптационно-трофических механизмов, иммунокорригирующее действие. Для лечения псориаза широко используют витамины комплекса В, особенно В1, В2, В6, 12, В13, В15, витамины А, Е, С, Р в комбинации с другими терапевтическими средствами. Включение витамина В1, а еще лучше его кофермента — кокарбоксилазы, в комплексную терапию псориаза способствует регрессу высыпных элементов. Особое значение кокарбоксилаза имеет для регуляции углеводного обмена, функциональной активности нервной системы, эндокринных желез и сердечной деятельности. Вводят ее подкожно, внутримышечно или внутривенно по 0,05—1 г 1 раз в день или через день, на курс — 10–15 инъекций. Противопоказания — непереносимость, наличие аллергических заболеваний, гипертония. Витамин В2 (рибофлавин) входит в состав ферментов, регулирующих окислительновосстановительные процессы, участвует в углеводном, белковом и жировом обмене, необходим для поддержания нормальной функции зрительного анализатора. Для лечения псориаза применяют 1 %-ный раствор рибофлавина мононуклеотида, вводимый внутримышечно по 2 мл через день, на курс — 10–15 инъекций. Противопоказаниями служат идиосинкразия и нефролитиаз. Осложнений при применении рибофлавина не наблюдается. Целесообразно назначать витамин В5 — кальция пантотенат, который входит в состав коэнзима А, участвующего в процессах ацетилирования и являющегося одним из важнейших коферментов сложных ферментативных систем. В процессе ацетилирования при окислительном распаде углеводов, жиров и белков под влиянием витамина В5 нормализуется превращение трикарбоновых кислот — центрального обменного процесса на клеточном уровне. Кальция пантотенат применяют внутрь по 0,1–0,2 г 3–4 раза в день, а также внутримышечно в виде 20 %-ного раствора по 1–2 мл 1–2 раза в день на протяжении 2–3 месяцев. Противопоказания — индивидуальная непереносимость. Осложнения в виде аллергических реакций и расстройств пищеварения наблюдаются чрезвычайно редко. Положительное действие при псориазе оказывает витамин В6 (пиридоксин). Его кофермент — пиридоксальфосфат — вводят внутримышечно по 10 мкг ежедневно или через день в течение 1 месяца. Пиридоксин применяют внутрь в порошках или таблетках по 0,025 г 3–4 раза в день или в виде 5 %-ного раствора по 1–2 мл внутримышечно через день. Курс лечения продолжается 3–4 недели. Осложнения — аллергические проявления в виде дерматита (см.) или крапивницы (см.) — встречаются редко. Противопоказания — идиосинкразия. Витамин В12 (цианкобаламин) применяют довольно широко в лечении псориаза, так как он благоприятно действует на функциональное состояние печени, нервной системы. Обладает выраженным антианемическим действием, нормализует обмен углеводов и жиров. Препарат вводят внутримышечно от 50 до 400 мкг 1 раз в день через день. Продолжительность лечения составляет 1 месяц. Противопоказаниями являются тромбофлебит (см.), стенокардия (см.), эритроцитоз, нарушение реологических свойств крови. К осложнениям применения витамина В12, относятся аллергические дерматиты (см.), крапивница (см.), отек Квинке (см.), сердцебиение, эритролейкоцитоз, нервное возбуждение. Витамин В13 (оротовая кислота) является одним из предшественников нуклеотидов, которые входят в состав нуклеиновых кислот, участвующих в образовании белковых молекул. Оротовая кислота и ее соли рассматриваются как вещества анаболического действия и применяются при нарушениях белкового обмена и как общие стимуляторы обменных процессов. В дерматологии используется калиевая соль оротовой кислоты (калия оротат). Принимают калия оротат внутрь за 1 ч до еды по 0,25—0,5 г 3 раза в день. Курс лечения — 20–40 дней. Повторные курсы назначаются после месячного перерыва. Витамин В15 (пангамовая кислота и ее производное — кальция пангамат) применяется для лечения псориаза, особенно при эритродермии или псориатической артропатии. Он способствует нормализации жирового обмена, рациональному усвоению кислорода тканями, увеличению энергетических ресурсов мышц и печени. Вследствие наличия молекулы кальция витамин В15 обладает значительным противовоспалительным и гипосенсибилизирующим действием. Кальция пангамат назначают внутрь по 0,05—0,1 г в виде порошков или таблеток 3–4 раза в день на протяжении 20–40 дней с последующим перерывом на 2–3 месяца. Он противопоказан при глаукоме (см.), гипертонической болезни (см.). Побочные явления отмечаются редко, преимущественно у лиц пожилого возраста, в виде бессонницы, головных болей, раздражительности, тахикардии (см.), экстрасистолии. Хороший терапевтический эффект отмечается при лечении псориаза фолиевой кислотой, особенно у больных с большой продолжительностью течения болезни в стационарной стадии, в то время как в период обострения лечебный эффект мало выражен. Фолиевая кислота совместно с витамином В12 стимулирует процесс кроветворения, т. е. образования эритроцитов. Для лечения псориаза назначают внутрь по 0,01—0,03 г 3 раза в день 20–30 дней в комплексе с витамином В12. В терапии различных форм псориаза широко используется аскорбиновая кислота (витамин С), участвующая в регуляции окислительно-восстановительных процессов, способствующая образованию стероидных гормонов, коллагена, уплотнению клеточных мембран капилляров. Больным псориазом аскорбиновая кислота назначается в 5 %-ном растворе по 2–3—5 мл 1 раз в день в течение 1 месяца, внутрь — в таблетках или порошках по 0,05—0,25 г 3–4—5 раз в день после еды в течение 30–40 дней. Аскорбиновая кислота обладает гипосенсибилизирующим действием, особенно при внутримышечном введении. При летней форме псориаза и больным с выраженным нарушением жирового обмена целесообразно назначать никотиновую кислоту, которая принимает участие в окислительно-восстановительных процессах, снижает содержание холестерина, положительно действует на жировой обмен и обладает сосудорасширяющим действием. Для лечения псориаза никотиновая кислота применяется в дозе 0,05—0,12 мг 2–3 раза в день внутрь или в виде 1 %-ного раствора по 1–2 мл подкожно или внутримышечно в течение 15–20 дней. Противопоказанием может служить индивидуальная непереносимость. Резко ограничивается назначение никотиновой кислоты при тяжелых формах атеросклероза (см.), гипертонической болезни (см.). Побочные реакции проявляются в покраснении кожи лица, верхней половины туловища, головокружении, чувстве прилива, нарушении кожной чувствительности. Применяют витамин D2, который, регулируя обмен фосфора и кальция, способствует уплотнению клеточных мембран, оказывает положительное влияние на регенеративные (восстановительные) процессы в эпидермисе. Применяют витамин D2 из расчета 2 тыс. МЕ на 1 кг массы тела, что в среднем составляет 80—160 тыс. МЕ в сутки в течение 20 дней. При хорошей переносимости через 7—10 дней прием повторяют и продолжают 2–3 месяца до исчезновения клинических проявлений псориаза. Затем прием витамина D2 продолжается в течение года с месячным перерывом после каждого месяца лечения. Витамин D2 противопоказан при активных формах туберкулеза (см.) легких, язвенной болезни (см.) желудка и двенадцатиперстной кишки, заболеваниях печени и почек, органических заболеваниях сердца и сосудов. Частыми побочными явлениями являются расстройства пищеварения, повышенная температура, полиурия, диарея (см.), кальциноз (см.) внутренних органов. Нарушение образования кератина (кератинизация) при псориазе послужило основанием для применения витамина А, или ретинола. Этот витамин способствует росту и развитию, обеспечивает процессы кератогенеза в эпидермисе. Он нормализует пластические обменные процессы в коже и слизистых оболочках. Ретинол повышает усвоение белков, жиров и углеводов, активируя окислительно-восстановительные процессы и образование холестерина. При недостаточности витамина А возникает кератинизация эпидермиса, проявляющаяся сухостью кожи, шелушением и ороговением. Витамин А назначают внутрь по 10–30 тыс. МЕ в сутки через 10–15 мин после еды. Внутримышечное введение витамина производится редко из-за местной болезненности и возможного образования инфильтратов. При приеме больших доз витамина А могут возникать обострения гепатохолецистита и хронического панкреатита (см.), а также раздражительность, сонливость и гиперкератоз волосяных фолликулов. Весьма успешно лечение распространенного пустулезного, артропатического псориаза и псориатической эритродермии тигазоном. Тигазон назначают перорально из расчета первоначально 1 мг на 1 кг массы тела в сутки, а затем через 2–4 недели дозу снижают до 0,75—0,5 мг/кг. Продолжительность лечения колеблется от 1 до 6 месяцев. По данным большинства авторов, клиническое выздоровление наблюдается в 70–80 % случаев. Поддерживающая доза составляла 0,25—0,3 мг/кг в сутки. Из побочных симптомов более часто встречаются сухость слизистых оболочек, очаговое, а иногда и полное выпадение волос, паронихии (воспаление околоногтевых тканей), петехии, рвота, гепатит (см.). Все эти осложнения обратимы и быстро исчезают после отмены препарата. С целью уменьшения разовой и суммарной доз ретиноидов их назначают в малых дозах — 0,3–0,5 мг/кг в сутки в сочетании с ПУВА-терапией, УФ-облучением и наружным применением кортикостероидных мазей. Подобное сочетание обеспечивает такой же хороший терапевтический эффект, как и большие дозы ретиноидов. При этом значительно уменьшается вероятность развития различных побочных явлений и осложнений. Витамин Е (токоферола ацетат) стимулирует клеточный обмен веществ, участвуя в биосинтезе ДНК, РНК и в тканевом дыхании. Он является природным антиоксидантом и защищает обменные процессы жиров, белков и стероидных гормонов от патологических реакций окисления, не сопряженных с преобразованием и аккумуляцией энергии. Витамин Е назначают внутрь и внутримышечно. Для приема внутрь выпускают 5-, 10-, 30 %-ные масляные растворы токоферола ацетата. В 1 мл содержится соответственно 50, 100 и 300 мг синтетического альфа-токоферола ацетата. Больным псориазом назначают витамин Е от 15 до 100 мг в сутки в течение 20–40 дней. Внутримышечные инъекции из-за болезненности и возможности появления инфильтратов назначают редко. Для инъекций препарат выпускается в ампулах по 1 мл, содержащих 5-, 10- или 30 %-ный раствор. Для лечения псориаза назначается препарат, содержащий в 1 мл 5 %-ный или 10 %-ный раствор, т. е. по 50—100 мг через день или 2–3 раза в неделю, на курс — 10–12 инъекций. Поскольку витамин Е является синергистом витамина А и потенцирует его действие, применяют комплексный препарат аевит, содержащий в 1 мл аксерофтола ацетата (витамина А) 35 мг (10 тыс. МЕ) и альфа-токоферола ацетата (витамина Е) — 100 мг. Применяют аевит внутрь в капсулах по 1 мл 1–2 раза в день во время еды в течение 20–40 дней или внутримышечно (слегка подогревая) по 1 мл 1 раз в день через день, на курс — 15–20 инъекций. Витамин F условно относят к витаминам. Он состоит из комплекса ненасыщенных незаменимых жирных кислот. Ненасыщенные жирные кислоты оказывают существенное влияние на функциональную активность гепатоцитов (клеток печени), участвуя в обмене жиров, углеводов и минеральных солей. Ненасыщенные жирные кислоты содержатся в линетоле — препарате, получаемом из льняного масла. У больных псориазом с гиперхолестеринемией (повышенным холестерином крови) при лечении линетолом снижается содержание холестерина в сыворотке. Линетол назначают внутрь по 1 ст. л. утром непосредственно перед едой или во время еды 1 раз в день курсами в течение 1–1,5 месяцев, с перерывами 2–4 недели. Линетол переносится без побочных явлений и осложнений. Противопоказаниями являются колит (см.), энтероколит (см.) и гепатохолецистит. В последние годы больше применяются витаминные препараты, обладающие коферментными свойствами. К ним относятся фосфаден и дипромоний. Входя в состав коферментов, фосфаден оказывает гепатотропное действие, активизирует процессы микроциркуляции, регулирует содержание общих жиров и свободных жирных кислот, а также принимает участие в биосинтезе белка и восстанавливает синтез АТФ. Дипромоний — синтетический аналог витамина В15. Влияние дипромония на обменные процессы обусловлено улучшением функционального состояния печени, жирового обмена, повышением активности эндотермических реакций с нормализацией окислительно-восстановительных процессов и микроциркуляции при синдроме периферической ишемии. При лечении больных псориазом издавна широко используют мази с учетом стадийности процесса, так как местная терапия повышает эффективность медикаментозного лечения. В прогрессирующей стадии часто применяют 2 %-ную салициловую мазь, борно-салидоловую мазь (мазь Рыбакова), ланолиново-водный крем Унны. При выраженном воспалительном процессе с экссудативным компонентом назначают мази и кремы с кортикостероидными гормонами. Хорошее противовоспалительное, антиаллергическое и рассасывающее действие оказывают такие мази, как флуцинар, деперзолон, оксикорт, лоринден С, лоринден А и др. С целью ускорения лечебного эффекта у больных чешуйчатым лишаем (см.) кортикостероидные мази наносят после снятия чешуек и корок 2 %-ной салициловой или серно-салициловыми мазями. На местах выраженной инфильтрации и в области обширных бляшек мази наносят под повязку. Полного излечения псориаза не достигается. Однако мази или кремы с кортикостероидами показаны на всех стадиях псориаза и особенно в период прогрессирующего течения. В стационарной и регрессивной стадиях рекомендуются дегтярные и серно-дегтярные мази, 5-, 10- и 20 %-ные ихтиоловые, 5—10 %-ные ихтиолнафталановые. Особенно ускоряется процесс регресса эффлоресценций (высыпаний) при комбинации дегтярных, ихтиоловых или нафталановых мазей с кортикостероидными. Целесообразна смена мазевых средств, так как нередко наблюдается привыкание кожи к одной и той же мази. Особенно необходима смена средств наружной терапии в стадии регресса, когда следует интенсифицировать рассасывание инфильтрата бляшек. При отсутствии свежих высыпаний можно постепенно повышать концентрацию активно действующих компонентов мазей и кремов. Назначаются 2–5 %-ная белая ртутная мазь, 10–15 %-ная серно-дегтярная, 20–33 %-ная серная, мазь Вилькинсона, 0,5—10 %-ная хризорсебиновая, 0,5–1 %-ная цигнолиновая (диоксиантраноловая), антраминовая или мази «Псориазин» и «Антипсориатикум», обладающие не только отшелушивающим и противовоспалительным, но и редуцирующим и пластическим действием. Местное лечение больных чешуйчатым лишаем серными, дегтярными, салициловыми мазями, особенно при распространенном процессе, требует постоянного контроля за функцией почек. Дегтярные мази, помимо токсического действия, вызывают у некоторых больных фолликулиты, что является показанием для их отмены. Значительное лечебное действие проявляется и при употреблении мазей с метилксантиновыми соединениями: 5—10 %-ная теофиллиновая, 2–5 %-ная эуфиллиновая и 2–5 %-ная папавериновая мази и кремы. Предприняты также попытки лечения псориаза мазями, содержащими противовирусные средства. Назначают теброфеновую, оксолиновую, бонафтоновую (1–2—3 %-ную), а также 1–3 %-ную интерфероновую и 2–5 %-ную алпизариновую мази. Эти мази способствуют разрешению высыпаний, особенно при мелкопапулезных диссеминированных эффлоресценциях. Кроме того, они хорошо переносятся больными и не вызывают побочных явлений. С целью ускорения разрешения псориатических элементов применение дегтярных и ихтиоловых мазей сочетают с УФО. При этом УФ-лучи не только ускоряют разрешение воспалительных очагов, но и предупреждают развитие дерматита от этих мазей в тех случаях, когда их назначают в значительной концентрации (5—10–15 %-ной). В связи с наличием у больных псориазом расстройств обмена веществ, проявляющихся как количественными сдвигами в содержании холестерина, углеводов, белков, микроэлементов и витаминов, так и существенными ферментными патологическими состояниями, целесообразно регулировать режим питания, ограничивая употребление в пищу продуктов, содержащих животные жиры и белки, углеводы и пряности. Большое значение имеют и закаливание организма, увеличение мобильности, подвижности в виде лечебной физкультуры или в виде занятий спортом. В последние годы происходит значительное совершенствование методов лечения псориаза. Дополнительно к традиционным схемам и методам разрабатываются активные эфферентные способы, основанные на детоксицирующем и иммунокорригирующем эффектах. В связи с углубленными вирусологическими исследованиями расширяются показания к применению комплекса антибиотиков с противовирусными средствами. Сужены показания для применения цитостатиков и иммуносупрессивных препаратов. Осторожнее и сдержаннее назначаются кортикостероидные гормоны для общей терапии, ограничивается их местное применение. Уже в первые годы после внедрения кортикостероидов выявились их отрицательные свойства. При снижении дозы и отмене препарата почти всегда и очень быстро наступает рецидив. Для купирования обострения требуется значительное увеличение дозы, сопровождающееся осложнениями и побочными явлениями. Особо следует отметить, что у больных, получавших кортикостероиды, быстрее наступали рецидивы, устойчивые к другим методам терапии. С применением кортикостероидных гормонов связывают участившиеся случаи тяжелого течения пустулезного псориаза. На основании данных, полученных при изучении результатов фотохимиотерапии, стало известно, что этот метод является одним из наиболее эффективных при псориазе. Однако непродолжительные во многих случаях сроки клинической ремиссии, а также частые побочные действия и осложнения свидетельствуют о необходимости сокращения сроков лечения и применения фотохимиотерапии как составной части комбинированной схемы в сочетании с эфферентными методами или использования селективной фототерапии. Широкое внедрение в практику лечения дерматозов (см.) эфферентных методов — итог многолетних поисков эффективных способов борьбы с эндогенными токсическими факторами, изменяющими систему гомеостаза. Характерной чертой эфферентной терапии является элиминация (удаление) из организма ксенобиотиков самыми различными способами. Для выведения из организма аутотоксических продуктов метаболизма издавна применялись такие примитивные способы, как назначение рвотных и слабительных средств, кровопускание, быстрый диурез. В настоящее время разработаны такие перспективные методы дезинтоксикации, как гемодиализ, гемосорбция, гемофильтрация, ультрафильтрация и плазмаферез. У больных псориазом, особенно тяжелыми хроническими формами, имеют место перегруженность патологическими иммунными циркулирующими комплексами, блокирование, подавленность физиологических систем защиты и регуляции, функциональные нарушения желудочно-кишечного тракта. Все это обусловливает развитие синдрома внутренней интоксикации, в результате которого в организме накапливается избыточное количество промежуточных и конечных веществ обмена, оказывающих токсическое действие на функциональное состояние важнейших систем. Эфферентные методы оказывают детоксицирующее системное воздействие, при котором в результате удаления ксенобиотиков и различных токсических факторов осуществляется нелекарственная стимуляция систем естественного иммунитета, физиологических механизмов саногенеза с нормализацией жизненных процессов.
♦ Р ♦
РАБДОМИОМА
ОпределениеРабдомиома — это зрелая доброкачественная опухоль (см.), развивающаяся из поперечно-полосатой мышечной ткани. Встречается крайне редко и в любом возрасте, одинаково часто у мужчин и женщин.
Этиология, патогенез и патанатомия Этиология изучена недостаточно. Возможными причинами возникновения рабдомиомы могут быть воздействие неблагоприятных экологических факторов, дисгормональные и биохимические изменения в организме. Механизм развития болезни не изучен. Опухоль (см.) имеет вид одиночного узла, располагающегося в толще мышечной ткани или в подкожной клетчатке, подвижна, окружена капсулой, на разрезе коричневого или светло-коричневого цвета. При локализации в миокарде чаще встречаются множественные опухолевые узлы, которые обычно располагаются под эндокардом. Крайне редко наблюдается диффузная рабдомиома миокарда.
Клиническая картина и лечение Специфические клинические симптомы отсутствуют. Опухоль растет годами, не вызывая никаких расстройств, и выявляется случайно. Наиболее часто встречающаяся локализация рабдомиомы — это мышцы конечностей, однако известны случаи, когда ее обнаруживали во внутренних органах и языке. У новорожденных и детей до 10 лет можно встретить рабдомиому сердца, которая довольно часто сочетается с различными пороками сердца (см.). Осложнения может вызвать только рабдомиома сердца больших размеров, которая вызывает аритмию (см.) и развитие сердечной недостаточности (см.). Возможно также ее превращение в злокачественную рабдомиосаркому. Кроме объективных данных, достоверным критерием диагностики рабдомиомы является тканевое исследование (биопсия). Лечение только оперативное.
РАДИКУЛИТ
ОпределениеРадикулит — это патологическое состояние, сопровождающееся болями и нарушениями чувствительности корешков спинного мозга. Иногда нарушения чувствительности сопровождаются периферическими парезами (см.).Сочетанное поражение спинномозговых нервов и их корешков называется радикулоневритом. Если в патологический процесс вовлекаются и оболочки спинного мозга, то патологический процесс развивается по типу менингорадикулита. Заболевания корешков спинного мозга также обозначаются как спондилогенное повреждение, или спондилогенная радикулопатия (радикулоишемия). При вовлечении в процесс спинномозгового узла диагностируется радикулоганглионит. Вовлечение в патологический процесс при радикулите возможно не только одного, а сразу нескольких корешков спинного мозга. По уровню поражения различают шейногрудной радикулит (шейный и грудной отдельно) и пояснично-крестцовый в форме люмбаго или люмбалгии и ишиалгии. Возможно полное повреждение корешков всех отделов позвоночника.
Этиология и патогенез Основной причиной развития радикулита и радикулоневрита является остеохондроз (см.) позвоночника, который в последние годы значительно помолодел (случаи заболевания регистрируются уже в детском возрасте). Каждый второй человек в течение жизни ощущает клинические проявления остеохондроза позвоночника. К радикулиту чаще всего приводят смещение дисков и развитие межпозвонковой грыжи за счет дистрофических изменений, происходящих в позвоночном столбе. К таким же явлениям могут привести врожденные изменения и травматические повреждения. Радикулит и радикулоневрит могут развиваться и при опухолевых поражениях спинного мозга или при расположении опухоли рядом с позвоночником, когда она захватывает корешки спинного мозга. Воспалительно-дистрофические изменения позвоночника возможны и при других заболеваниях внутренних органов, гинекологических заболеваниях. При инфекционных заболеваниях, кроме радикулярного синдрома, часто развиваются радикуломенингиты. Провоцирующими факторами к развитию поражений корешков спинного мозга служат: длительная нагрузка на позвоночный столб, подъем тяжестей, неправильное положение тела, переохлаждение. При радикулите за счет дистрофических изменений межпозвоночного столба происходят: сужение межпозвоночной щели и сдавливание спинномозгового корешка в межпозвоночном отверстии с последующими корешковыми симптомами. Сдавливание корешков приводит к различным нервно-мышечным нарушениям с вегетососудистыми расстройствами, изменениями в сухожилиях и связках.
Клиническая картина Радикулит может быть первичным и вторичным. Первичный радикулит связан с инфекционной патологией, в основном вирусной. Вторичный радикулит развивается за счет дистрофических изменений позвоночного столба (деформирующий спондилез (см.), деформирующий спондилоартроз, спондилолистез), при опухолях (см.) позвоночного столба, нарушениях спинального кровообращения, травмах, переохлаждении, интоксикациях и др.). По уровню поражения корешков спинного мозга различают пояснично-крестцовый и шейно-грудной радикулит, или радикулоневрит, а также полирадикулоневрит при полном поражении корешков всех отделов позвоночника, хотя это деление достаточно условно. Клиническая картина радикулита разной локализации имеет общие черты: спонтанная боль в зоне иннервации пораженных корешков, усиливающаяся при движениях, кашле, чихании и натуживании; ограниченная подвижность позвоночника; защитная (противоболевая) поза больного; болезненность при надавливании на остистые отростки позвонков и в паравертебральных точках; повышенная или сниженная чувствительность; двигательные нарушения — слабость и гипотрофия (нарушение питания) мышц в зоне корешковой иннервации. Корешковый синдром отличается стадийностью течения. В I стадии — дискалгической (неврологической), стадии симптомов раздражения — преобладают резкая боль, повышенная чувствительность, оживление сухожильных рефлексов, защитное напряжение мышц, болезненность в паравертебральных точках. Для II стадии — невротической (стадии симптомов выпадения) — характерны менее резкие боли, выпадения чувствительности в зоне соответствующего корешка, угасание периостального рефлекса (рефлексов), локальные гипотрофии (атрофии), сохраняющееся локальное мышечное напряжение и болезненность в паравертебральных точках. В практике чаще встречается радикулярный синдром на уровне пояснично-крестцового отдела(пояснично-крестцовый радикулит). Пояснично-крестцовый отдел несет наибольшую функциональную нагрузку, поэтому межпозвонковые диски на этом уровне претерпевают значительные изменения. Пояснично-крестцовый радикулит чаще встречается у лиц мужского пола, испытывающих различного характера нагрузки на позвоночный столб, или, наоборот, при снижении подвижности в возрасте 30–50 лет, но может наблюдаться и в более молодом возрасте. Радикулярный процесс может быть односторонним и двусторонним. Поражение пояснично-крестцовых корешков обычно сопровождается жгучей и острой болью в этом отделе с ее смещением в ягодицу по задней поверхности ноги. Боли усиливаются при изменении положения тела, кашле, чихании. Наблюдается ограничение движений и сколиоз (см.) в поясничной области, снижение силы в мышцах голени и стопы. Определяются повышенная чувствительность по корешковому типу, болезненность в паравертебральных точках и по ходу седалищного нерва, оживление коленного рефлекса и угасание рефлекса с пяточного сухожилия. Возможен парез стопы, положителен симптом натяжения. В дальнейшем определяются вегетативные и трофические нарушения: защитное одностороннее напряжение мышц поясничной области, гипотрофия мышц ягодицы и голени, выпадение волос на голени, образование трофических язв на пятке. Функции тазовых органов не нарушены. В зависимости от локализации пораженного межпозвонкового диска или его грыжи (выпячивания) выявляются расстройства чувствительности в соответствующих зонах. Так, при поражении IV поясничного корешка боль локализуется в поясничной области, по передневнутренней поверхности бедра и голени, внутреннему краю стопы. При поражении V поясничного корешка боль локализуется в поясничной области, верхних квадратах ягодичной области, по заднебоковой поверхности голени, на тыле стопы. Поражение межпозвонкового диска LV-SI сопровождается сдавлением I крестцового корешка, а боли и расстройства чувствительности локализуются в области крестца, ягодичной области, задней поверхности бедра, голени, наружного края стопы. В некоторых случаях патологический процесс распространяется с корешков на седалищный нерв, что сопровождается развитием симптомов поражения ствола нерва и развитием неврита седалищного нерва (см. Ишиас). Под общим термином «радикулит» объединены рефлекторные синдромы, возникающие в результате раздражения рецепторов фиброзного кольца пораженного межпозвоночного диска, задней продольной, межостистой и других связок, а также капсул суставов. К рефлекторным синдромам, возникающим на уровне пояснично-крестцового поражения, относятся люмбаго, люмбалгия, люмбоишиалгия, нервно-мышечные нарушения в области малой и средней ягодичной мышц, синдром грушевидной мышцы, пояснично-крестцовый и крестцово-подвздошный синдромы, периартроз тазобедренного, коленного и голеностопного суставов и т. д.
Пояснично-крестцовый радикулит Люмбаго возникает при неловком или резком движении, подъеме тяжестей и сопровождается внезапной болью типа «прострела», длящейся в течение нескольких минут или секунд, или «рвущей» и пульсирующей болью, усиливающейся при кашле и чихании. Люмбаго вызывает ограничение подвижности в поясничном отделе позвоночника, «обезболивающую» позу, уплощение лордоза или кифоза. Рефлекторно возникает контрактура мышц треугольника Ливингстона и мышц спины. Сухожильные рефлексы сохранены, чувствительность не нарушена. Боль продолжается от нескольких часов до нескольких суток. Люмбалгия возникает после значительной физической нагрузки, длительной неудобной позы, тряской езды, переохлаждения. Клинически сопровождается тупой ноющей болью, усиливающейся при перемене положения тела (сгибании, сидении, ходьбе). Боль может распространяться на ягодицу и ногу. Изменения статики выражены в меньшей степени, чем при люмбаго. Движения в поясничном отделе затруднены, но ограничение незначительно. Определяется болезненность при прощупывании остистых отростков и межостистых связок на уровне поражения. При наклоне назад боль исчезает, при наклоне вперед отмечается резкое напряжение мышц спины. Коленные рефлексы и рефлексы с пяточных сухожилий сохранены. Процесс часто носит подострую или хроническую форму. Люмбоишиалгия возникает вследствие раздражения рецепторов фиброзного кольца и мышечных соединительнотканных образований при всех вышеперечисленных причинах. Возникает глубинная сдавливающая боль в ягодице и тазобедренном суставе, смещающаяся в ногу. Боль усиливается при кашле (см.), чихании, перемене положения. Также имеется ощущение зябкости или жара в ноге. При прощупывании соответствующих зон отмечаются болезненные участки нейроостеофиброза, в мышцах прощупываются образования плотноэластической консистенции без четких границ. Ишиалгия проявляется болями по ходу седалищного нерва, гипотрофией мышц со снижением силы, ахиллова рефлекса. Такую же картину может дать неврит седалищного нерва — ишиас, при котором боли приступообразные, резкие, жгучие, заставляющие больного принимать вынужденную позу (обычно на боку с согнутой ногой). Характерно изменение конфигурации поясничной области: лордоз уплощен, имеют место кифоз и сколиоз (см.), мышцы поясничной области напряжены, особенно паравертебральные — «симптом вожжей» (симптом Корнеева). Типичен болевой синдром Розе — подергивание отдельных мышечных волокон большой ягодичной мышцы при прощупывании в области крестца. Выявляются типичные болевые точки (Валле, Гара, Дежерина, Бехтерева, Шюделя). Для радикулярного синдрома характерны следующие симптомы натяжения. 1. Симптом Ласега: если больному, лежащему на спине, поднимать больную ногу, резко усиливается боль в позвоночнике и по ходу седалищного нерва; при ее сгибании боль утихает. Симптом Ласега усиливается при повороте бедра внутрь или при разгибании или сгибании стопы. Стоя этот симптом выявляется при наклоне туловища вперед, при этом вместе с усилением боли нога сгибается в колене, поворачивается кнаружи и отводится назад. 2. Симптом Бехтерева: если лежачего больного посадить, у него согнется в колене больная нога, а если ее распрямить, у него сгибается здоровая нога. 3. Симптом Нери: у сидячего больного наклон головы к груди вызывает усиление боли в пояснице или в ноге. 4. Симптом Дежерина: при кашле и чихании усиливается боль в пояснице. 5. Симптом Наффцигера: при надавливании на шейные вены появляется или усиливается боль в поясничной области. 6. Симптом Бонне: появление болей в пояснице при форсированном сгибании и приведении ноги к животу. Имеется сглаженность или исчезновение ягодичной складки на больной ноге. 7. Симптом Леррея: резкое усиление боли в пояснице при быстром переходе в сидячее положение. 8. Симптом Алажуанина-Тюреля: больной не в состоянии ходить на пятках, стопа на пораженной стороне отвисает. 9. Симптом Амоеса: при переходе из лежачего положения в сидячее больной опирается позади себя руками на постель или пол. 10. Симптом Файерштейна: при стоянии на больной ноге в ней появляется боль по задней поверхности в ответ на покачивание здоровой ногой. 11. Симптом Кроля: усиленное оволосение или, наоборот, облысение больной ноги. 12. Симптом Ожеховского: похолодание тыла стопы больной конечности. 13. Симптом Барре: щипок на внутренней поверхности бедра значительно болезненнее на стороне поражения. Боли часто обусловливают защитные «обезболивающие» позы при сидении, ходьбе, вставании, а также формируются рефлекторно-тонические рефлексы: при вызывании симптома Ласега происходит рефлекторное сгибание здоровой ноги, при подъеме здоровой ноги сгибается больная, при пригибании головы к туловищу сгибается больная нога. Синдром грушевидной мышцы возникает в результате сдавления сосудисто-нервного пучка между грушевидной мышцей и крестцово-остистой связкой. Постепенно появляются боли в ягодичной области, в области голени и стопы, ощущение потери кожной чувствительности, слабость в ноге при ходьбе. Клинически выявляются: болезненность при ощупывании точек прикрепления грушевидной мышцы к внутренней поверхности большого вертела, к нижней капсуле крестцово-подвздошного сочленения и симптом Бонне. При корешковых поражениях пояснично-крестцового отдела в патологический процесс могут вовлекаться один или несколько корешков и в ряде случаев — поясничные или крестцовые сцепления.
Шейно-грудной радикулит Шейно-грудной радикулит чаще встречается при деформирующем спондилезе (см.), остеохондрозе (см.), травматических опухолевых поражениях позвоночника, добавочных ребрах, заболеваниях внутренних органов и реже — при инфекционных вирусных поражениях. Синдром нарушения корешков на уровне С2—С5 называют шейным радикулитом, а на уровне D1—D12 — грудным радикулитом. В практике поражения корешков встречаются на уровне С5—D1-2. Шейный радикулит характеризуется резкими болями в области шеи и затылка со смещением в руку, лопатку, иногда в III–V пальцы. Боль усиливается при движениях головой и шеей и часто распространяется на затылок и грудь. Наблюдается ограничение движений в области шеи, особенно в больную сторону, за счет напряжения мышц шеи, положение головы часто вынужденное. Осевая нагрузка на шею и прощупывание болезненны. Выявляются характерные болевые точки — вертебральные и паравертебральные, особенно при наклоне головы. При двустороннем процессе голова имеет характерный вид — так называемая «свисающая голова». Имеются расстройства чувствительности в виде ее повышения, а затем понижения, которые распространяются через плечевое сплетение и по ходу лучевого нерва, сопровождаясь болью; впоследствии отмечается онемение IV и V пальцев кисти. Двигательные расстройства обычно не выражены. В зависимости от уровня поражения корешков нарушаются функции тех или иных групп мышц. Так, при поражении III–IV передних шейных корешков поражаются мышцы диафрагмы, V–VI корешков — мышцы плеча и плечевого пояса, VII шейного и I грудного — мышцы кисти. Могут иметь место рефлекторно-болевые синдромы, вегетативные расстройства, синдромы Бернара-Горнера и Броун-Секара при сдавлении спинного мозга. Грудной радикулит может возникать изолированно при заболеваниях мягких органов заднего средостения, поражениях плевры, позвонков и ребер, а также при инфекциях, в том числе при герпетическом (см. Герпес) поражении ганглиев симпатического ствола. Клинически при грудном радикулите возникают боли по ходу одного или нескольких межреберных нервов, чаще имеющие ноющий характер, реже — приступообразный. Отмечаются: болезненность в паравертебральных точках и межреберьях, гиперестезия или анестезия в зонах корешковой иннервации, иногда наблюдаются пузырьковые высыпания в этих зонах.
Диагностика Диагностика корешковых синдромов основывается на клинических данных и данных опроса. Кроме того, для подтверждения диагноза требуется рентгенологическое исследование в прямой и боковой проекциях. Миелография позволяет уточнить уровень и характер поражения. При шейно-грудном радикулите дополнительно проводят ультразвуковое исследование, допплерографию брахиоцефальных артерий и реоплетизмографию головного мозга. Для исследования функции позвоночника выполняют рентгенокимографию. Рекомендуются консультации невропатолога, гинеколога, уролога и онколога.
Лечение Лечение корешковых (радикулярных) болей включает несколько этапов. Первый этап направлен на снятие болевого синдрома. Для этих целей применяется медикаментозная терапия обезболивающими препаратами. К обезболивающим средствам относятся баралгин и анальгин. Баралгин при сильных острых болях применяется внутривенно или внутримышечно, по 5 мл каждые 2–3 ч до стихания боли. При экстренной помощи также хороший эффект дает сочетание смеси из анальгина в 50 %-ной концентрации (2 мл) и димедрола (1 мл). Как обезболивающие средства широко применяются нестероидные противовоспалительные препараты: ибупрофен, ортофен, бутадион, бруфен, метиндол, пироксикам. В последние годы предпочтение отдается диклофенаку (вольтарену), отличающемуся выраженным анальгезирующим эффектом и минимальным побочным действием. Хорошим анальгезирующим действием обладает препарат кеторал, применяемый как в инъекциях, так и перорально. Основными противопоказаниями к применению нестероидных противовоспалительных препаратов являются: язвенная болезнь (см.) желудка и двенадцатиперстной кишки, заболевания печени и почек, аллергическая непереносимость. Анальгезирующим действием при местном применении обладают мази с различными отвлекающими составами (апизатрон, финалгон, эспол, випросал, вилералгин, випраксин, фастум-гель и др.). Другим очень важным методом лечения корешковых болей являются лечебные медикаментозные блокады. Для выбора методов лечебного обезболивания важное значение имеет оценка болевого синдрома. Первая степень — это умеренно выраженный болевой синдром. Боль появляется при резкой перемене положения тела, физической нагрузке, особенно в неудобной позе. В покое и положении лежа боль отсутствует, при кратковременном пребывании на ногах ее также нет. Вторая степень — это выраженный болевой синдром. Боль появляется при малейшем изменении положения больного в постели и исчезает в положении лежа. Третья степень — резко выраженный болевой синдром: больной испытывает боль не только при движении, но и в покое, нарушаются сон, аппетит, функциональные движения конечностей. Боль иногда стихает только в вынужденном положении. Учитывая сложный механизм боли, прибегают к комплексному воздействию: — воздействие на местный источник боли; — воздействие на высшие отделы центральной нервной системы; — снижение накопления гистамина; — воздействие на эндокринно-гормональную регуляцию и электролитный баланс; — стимуляция эндокринной системы для выработки эндорфинов. Блокады, проводимые с целью лечения корешковых болей, могут быть однокомпонентными, с применением одного препарата (новокаина, лидокаина, румалона, папаина, тримекаина, баралгина, атропина и т. д.) или сложного состава (например, сочетание новокаина с витамином В12 и АТФ, или новокаина и платифиллина). Применяются для блокад и гормональные препараты: кортизона ацетат, эндоэксомитазол, средства рассасывающего действия (лидаза, тромболизин, папаин). Блокады могут сочетаться с любыми другими методами лечения радикулита. Рекомендуется сочетать блокады с одновременным внутримышечным введением препаратов калия и кальция, димедрола, витаминов группы В, биостимуляторов, гумизоля, ФИБС. Особенно важно сочетать блокады с обеспечением неподвижности пораженного отдела позвоночника, массажем, вытяжением, мануальной терапией, рефлексотерапией. Число блокад может варьироваться от 3 до 10–15 в зависимости от состояния больного. Блокады с гормональными препаратами рекомендуется проводить не более 10 раз во избежание остеопороза (см.) и гормональных расстройств. Кроме блокад, можно проводить также внутримышечную анестезию. Для этого прощупыванием определяют болевую точку и вводят анестетик непосредственно в нее. Второй этап лечения радикулярного синдрома направлен на устранение воспалительных и отечных процессов, возникающих при радикулите в корешках спинного мозга. Это достигается путем применения противовоспалительных препаратов, десенсибилизирующих средств, витаминотерапии. Следующим этапом является улучшение микроциркуляторных процессов путем назначения таких препаратов, как теоникол, трентал, компламин и т. д. Самым распространенным лечением радикулярных болей является физиотерапевтическое лечение. Оно применяется как при остром, так и подостром течении заболевания. Традиционными методами физиотерапевтического воздействия остаются УФ-облучение, токи Бернара, магнитотерапия, УВЧ, электрофорез, диадинамоэлектрофорез с анальгетическими и противовоспалительными препаратами. Проводится ультразвуковая терапия, которая улучшает микроциркуляцию в тканях, восстанавливает проводимость нервного волокна, улучшает восстановительные процессы, обладает противовоспалительным, обезболивающим и спазмолитическим действием. Разновидностью УЗИ-терапии является фонофорез, лечебное действие которого заключается в обезболивающем, противовоспалительном, спазмолитическом и антиаллергическом воздействии за счет целенаправленного введения медикаментозных средств. Для устранения пояснично-крестцовых болей возможно применение гипотермии и электроанальгезии при помощи аппаратов «Ятрань», «Ленар», «Пилан», «Биленар». Одним из наиболее эффективных методов физиотерапии в последние годы является чрескожная электростимуляция аппаратами ЧЭНС, СКЭНАР, ДЕНАС и др. Нестандартными физиотерапевтическими методами лечения также являются лазеротерапия и вакуум-дарсонвализация, особенно при тяжелом и выраженном болевом синдроме. При лечении радикулярных болей применяется тракционная терапия, или вытяжение. При вытяжении происходит декомпрессия корешков. Самый простой способ вытяжения в домашних условиях — это назначение постельного режима в течение 8—10 дней и более, чем достигается разгрузка пораженного сегмента позвоночника, уменьшение дискового давления и напряжения корешков. На кровать кладется деревянный щит по размеру кровати и матраца. Головной конец поднимается примерно на 2–3 кирпича, чтобы больной не соскальзывал с постели. В условиях стационара и специализированных ортопедических кабинетов вытяжение проводится на специальном столе. После снятия болевого синдрома назначаются водолечебные процедуры. Высокой эффективностью отличаются радоновые ванны, назначают также хлоридно-натриевые и сульфидные ванны. К водным процедурам можно отнести и подводное вытяжение в бассейне или в специальных ваннах на тракционном щите. Хорошим противовоспалительным, рассасывающим и антиспастическим действием обладает бишофит. В подострый период назначают также тепловые процедуры по типу контактного тепла — грязевые и нафталановые наложения. Лучше всего использовать торфяные и солончаковые грязи, а также гальваногрязь. В подостром периоде обязательно применение массажа, ЛФК и мануальной терапии. К физиотерапевтическим методам лечения корешковой патологии относится иглорефлексотерапия, которая широко применяется как при остром, так и подостром течении болезни. При радикулоневрите применяются антивирусные и иммуностимулирующие препараты (иммуноглобулин, интерферон, реоферон, ремантадин) в сочетании с симптоматической терапией. В случае наличия высыпаний в области позвоночного столба кожу смазывают настойкой бриллиантового зеленого или мазями «Синалар», «Локакортен виофора» и т. д. При неэффективности консервативного лечения в тяжелых случаях радикулярного синдрома прибегают к оперативному вмешательству с целью устранения декомпрессии корешков с ушиванием грыжи или удалением диска (дискэктомия). В подострый период при радикулите показано санаторнокурортное лечение с применением грязелечения, ванн, массажа, подводного массажа, мануальной терапии и ЛФК.
Профилактика Профилактика радикулита заключается в устранении всех причин возникновения корешковых болей: — профилактика развития остеохондроза (см.); — выработка нормальной осанки; — профилактика врожденной и приобретенной патологии спинного мозга и самого позвоночного столба; — устранение переохлаждения, длительной статической нагрузки, подъема тяжестей и резких движений у лиц, имеющих заболевания позвоночного столба или врожденные его изменения; — борьба с малоподвижностью; — своевременное и адекватное лечение инфекционных заболеваний, вызывающих радикулярный синдром; — организация рационального труда и отдыха.
РАЗРЫВ
ОпределениеРазрыв — закрытое механическое повреждение мягких тканей или органов с нарушением их анатомической целостности, возникающее в результате действия силы, превышающей пределы их эластичности. Возможны разрывы подкожной клетчатки, нервов, сосудов, оболочек, мышц, сухожилий, связок, внутренних органов. Поскольку кожа имеет хорошую растяжимость, она может оставаться неповрежденной, а разрывы тканей происходят под ней.
Этиология и патогенез Любой разрыв — это нарушение целостности ткани или органа, приводящее к разрыву слизистой, оболочек, мышц, нервов, связок или сухожилий, что вызывает кровотечение, боль и нарушение функции органа. Причинами разрывов органов или различных тканей в первую очередь являются травмы. К разрывам также могут приводить врожденные дефекты (аневризмы (см.), грыжи (см.), опухоли (см.) и т. д.), различные нагноения и гематомы, переломы костей, патологические роды (см.). При судорожном синдроме за счет сокращения мышц возможны разрывы прилегающих к ним сухожилий.
Клиническая картина и диагностика Клиническая картина при разрывах подкожно-жировой клетчатки проявляется развитием кровоподтека или кровоизлияния, которые не вызывают диагностических трудностей и видны на глаз; впоследствии они рассасываются самостоятельно с постепенным отцветанием: в первые два дня они имеют багрово-фиолетовый оттенок, до 5— 6-го дня — синий, до 9—10-го дня — зеленый и до 14-го дня — желтый цвет.
Разрывы наружных и внутренних гениталий в родах (схема)
При скоплении крови в подкожной клетчатке в результате разрыва (гематома) обнаруживается увеличение объема травмированного сегмента, часто контурно выступающего над кровоподтеком. При прощупывании определяется эластичное, мягкое, умеренно болезненное образование. Своеобразной разновидностью этой травмы может быть отрыв (отслойка) кожи от подлежащей ткани, что нередко наблюдается при транспортных травмах. При разрывах оболочек (фасций) прощупыванием определяется щелевой дефект, который может быть поперечным или косым. Через дефект фасций при напряжении мышц может определяться эластичное образование (мышечная грыжа), которое при расслаблении мышц исчезает. Разрывы мышц клинически сопровождаются резкой болью, часто ощущением щелчка, после чего наступает нарушение функции конечности с выпадением действия пораженной мышцы. Брюшко мышцы сокращается в сторону неповрежденного сухожилия (при разрыве в зоне брюшка — в отводящую и приводящую стороны сухожилия). При этом при прощупывании определяется дефект в месте расположения мышцы, а ее спазмированные участки прощупываются в виде эластичных болезненных валиков. Разрывы мышц бывают полные или частичные (надрывы). Наиболее часто повреждаются бицепсы при поднятии тяжестей, икроножные мышцы голени при прыжке с разбега, реже — мышцы бедра и прямая мышца живота при падении назад. Разрывы нервов приводят к выпадению функции иннервируемого участка и потере кожной чувствительности. К разрывам нервов часто приводят переломы костей. Разрыв сухожилия клинически сопровождается выпадением функции мышцы, прикрепленной к нему, повышенной функцией мышцы-антагониста, неправильным положением поврежденного сегмента, смещением брюшка мышцы в сторону неповрежденного сухожилия. Разрывы сочленений (акромиально-ключичного, лонного) протекают с болевым синдромом той или иной степени выраженности, что особенно заметно при движениях. Изменяется при расхождении лонного сочленения и подвижность нижних конечностей. Осмотр при разрыве акромиально-ключичного сочленения выявляет выступающие части ключицы, при надавливании сверху ключица как бы пружинит («симптом клавиши»). Разрывы сосудов проявляются развитием гематом, отсутствием пульсации на нижних концах, в дальнейшем — развитием анемии (см.). Разрывы крупных сосудов часто сопутствуют переломам костей. Разрывы внутренних органов имеют довольно яркую клиническую картину. Разрыв сердца дает картину инфаркта миокарда (см.); разрывы печени, желчного пузыря, поджелудочной железы, мочевого пузыря, желудка и кишечника обычно сопровождаются разлитым перитонитом (см.) с характерной симптоматикой (боль, симптом напряжения и раздражения в области брюшины, интоксикация). Разрыв селезенки приводит к кровотечению в перитонеальное пространство с развитием синдрома острой анемии (см.). Разрывы легкого и бронхов проявляются кровотечением в плевральную полость и инфарктом легкого (см.). При разрыве почки и мочеточника развивается паранефрит.
Неполный разрыв матки при ручном отделении плаценты
Отслойка плаценты: 1 — гематома ограничена краями плаценты; 2 — наружное кровотечение вследствие просачивания крови за пределы плаценты
Неполный разрыв матки. Рядом с маткой гематома широкой связки
Гематома вульвы
Разрыв промежности III степени: 1 — лоскут сфинктера; 2 — место отрыва сфинктера
Разрывы органа могут привести к полному или частичному выпадению функции этого органа, развитию гематомы, кровотечения, нагноения. Диагностика разрывов основывается на объективном обследовании и инструментальных методах (электромиография при разрыве мышц, проверка электровозбудимости иннервируемой данным нервом мышцы). При разрыве внутренних органов для диагностики используются и рентгенография, ультразвуковое исследование, цистография, перинеоскопия и т. д.
Лечение Лечение разрывов, как и любой травмы, прежде всего заключается в организации покоя и обеспечении неподвижности конечности при необходимости. В дальнейшем при разрыве сухожилий, мышц и развитии гематом показано применение холода. При обширных гематомах возможны пункция и разрез, при абсцедировании — дренирование. Консервативные методы лечения в зависимости от характера травмы сводятся к применению давящих повязок, компрессов, тепловых процедур, физиотерапевтического лечения. В лечении разрывов широко используется хирургический метод как с целью ушивания дефекта, так и с целью косметической пластики.
РАЙТА СИНДРОМ
ОпределениеРайта синдром (синдром малой грудной мышцы, гиперабдукционный синдром, клювовидно-пекторальный синдром) — один из группы шейно-плечевых синдромов, характеризующийся расстройством кровоснабжения и иннервации верхней конечности вследствие сдавления подмышечных сосудов и стволов плечевого сплетения.
Этиология и патогенез Причинами развития этого синдрома могут быть увеличение или склероз малой грудной мышцы. Предрасполагающими факторами к развитию синдрома Райта могут быть длительные работы, связанные с отведением плеча (например, проведение малярных работ без тренировки, работа кистью у художников). При максимальном отведении плеча натягивающаяся малая грудная мышца может прижимать сосудисто-нервный пучок к клювовидному отростку лопатки. Подобная микротравма, постоянно и длительно повторяясь, приводит не только к механическому сдавлению просвета артерии в момент прижатия, но и вызывает также спазм сосуда и поддерживает раздражение стволов плечевого сплетения.
Клиническая картина Синдром Райта клинически проявляется болями в области грудной мышцы, смещающимися в руку и плечо, нарушением кожной чувствительности конечностей, побелением кисти и пальцев, иногда с некоторой отечностью их, вегетативными расстройствами кисти, особенно на радиальной ее стороне. Характерно исчезновение пульса на лучевой артерии при максимальном отведении плеча при закидывании кисти на затылок.
Лечение Лечение предусматривает покой и устранение повреждающих факторов (перевод на другую работу). При упорных болях и других проявлениях Райта синдрома (если диагноз не вызывает сомнений) показаны физиолечение, грязелечение, парафиновые нанесения и другие тепловые процедуры. Применяют также новокаиновые блокады нижних шейных и верхних грудных симпатических ганглиев. При отсутствии эффекта от консервативной терапии прибегают к операции — пересечению сухожилия малой грудной мышцы.
РАК
ОпределениеРак — злокачественная опухоль, развивающаяся из эпителия кожи или слизистых оболочек. Рак также может рассматриваться как болезнь клеток, теряющих способность к нормальному функционально-структурному развитию (дифференцировке). В зависимости от ткани, в которой возникает опухоль, различают плоскоклеточный рак (из плоского эпителия), железисто-плоскоклеточный рак, аденокарциному (из клеток железистого эпителия), недифференцируемый и неклассифицируемый рак.
Этиология Происхождение рака окончательно не выяснено. Провоцируют развитие раковых опухолей в легких следующие факторы: воздействие канцерогенных веществ (никель, кобальт, железо) при вдыхании пыли в горнорудной промышленности, различных ароматических и фармацевтических веществ, продуктов неполного сгорания топлива в автомобильных двигателях; воздействие табачного дыма; хронические воспалительные и профессиональные заболевания легких, в том числе и туберкулез (см.); отягощенная наследственность; иммунодефицитные состояния. Провоцирующими факторами развития рака в желудочно-кишечном тракте могут быть хронические, механические, термические и химические воздействия на слизистую желудочно-кишечного тракта; систематический контакт с канцерогенными веществами; лучевое воздействие; рефлюкс-синдромы; атрофические процессы с секреторной недостаточностью в слизистой желудочно-кишечного тракта; прием горячей пищи и постоянные микротравмы пищевода и желудка; прием концентрированных спиртных напитков; полипоз (см.); неспецифический язвенный колит (см.); амебиаз (см.) и другие паразитарные заболевания кишечника; длительные запоры (см.) в результате механического раздражения слизистой оболочки кишки; сахарный диабет (см.) и другие эндокринологические заболевания; курение. Развитию рака могут способствовать прежде всего наследственная предрасположенность, гормональные нарушения, мастопатия, лейкоплакия, перерождение доброкачественных опухолей (см.) и кист (см.).
Патогенез и патанатомия Различают доброкачественные и злокачественные опухоли. Доброкачественные опухоли растут медленно, лишь отодвигая, раздвигая, а иногда и сдавливая окружающие ткани, но не прорастая в них. Злокачественные опухоли отличаются инфильтративным (инвазивным) ростом: они прорастают в окружающие ткани и разрушают их. С этим связана характерная для злокачественных новообразований возможность метастазирования. В экономически развитых странах злокачественные опухоли занимают второе место после сердечно-сосудистых заболеваний среди причин смерти. В механизме развития раковых опухолей их клетки безгранично распространяются в прилегающие ткани, врастают в лимфатические и кровеносные сосуды. По отношению к стенке полого органа в процессе роста опухоль может врастать в стенку либо в просвет органа. Ткань опухоли часто омертвевает, при этом образуются различной формы язвы. Избыточное развитие соединительнотканной опухоли создает картину фиброзного рака, или скирра, нежная же строма характерна, наоборот, для так называемого мозговидного рака. При повышенной продукции слизи возникает картина слизистого рака. В результате расстройств крово- и лимфообращения в опухолях происходят вторичные изменения — развитие воспалительного процесса, отек, кровотечения, миксоматоз, рубцевание, образованиекист (см.) и др. Распространение опухолевых клеток по лимфатическим и кровеносным сосудам приводит к возникновению вторичных очагов опухоли — метастазов в регионарные лимфатические узлы или отдаленные органы. При раке легких метастазирование по лимфатическим путям приводит к поражению регионарных лимфатических узлов и плевры с развитием серозно-геморрагического плеврита (см.). Внелегочные метастазы поражают печень, мозг, кости и другие органы. При раке желудка типично метастазирование в лимфоузлы левой подключичной области, а при блокаде опухолью лимфооттока может наблюдаться нисходящее метастазирование в пупок, а у женщин — в яичник. Морфологически выделяются мозговидноязвенная (блюдцеобразная) форма рака, инфильтративно-язвенная форма, скирр, сосочковый, грибовидный (или полиповидный) и простой рак. По международной классификации выделяют аденокарциному, недифференцированный, плоскоклеточный, железисто-плоскоклеточный и неклассифицируемый рак. Макроскопически раковая опухоль может состоять из одного или множественных узлов. Выделяют 4 стадии развития рака: — I стадия — опухоль не более 2 см в диаметре, не прорастающая за пределы слизистой оболочки и не метастазирующая; — II стадия — опухоль достигает в диаметре 4–5 см, прорастает в подслизистый и даже мышечные слои, имеются одиночные метастазы в лимфатические узлы; — III стадия — опухоль проникает в подсерозный и серозный слои, часто прорастает в соседние органы, имеются множественные метастазы в регионарные лимфатические узлы, нередко наблюдаются различные осложнения; — IV стадия — раковая опухоль любых размеров и любого характера при наличии отдаленных метастазов.
Клиническая картина Клиническая картина рака различных органов разнообразна и не укладывается в единую схему. Кроме признаков нарушения функции пораженного органа, возможны симптомы общей интоксикации, развивающейся за счет продуктов распада опухоли и под действием специфических веществ, выделяемых раковой опухолью (см.). В клинической картине рака выделяют ранний (начальный) период, период явных клинических проявлений и конечный период. В ранний (начальный) период больные отмечают немотивированную слабость, потерю аппетита, похудение. В зависимости от расположения раковой опухоли в начальный период могут появляться: кашель (см.), нарушение стула, боли в грудной клетке или животе, «беспричинная» лихорадка, малокровие, тошнота, отрыжка, хронические желудочные кровотечения или мелена (черный дегтеобразный стул), возможна примесь крови в мокроте, моче и т. д. В период явных клинических проявлений рак различных органов имеет свои характерные особенности. Рак губы в большинстве случаев локализуется на красной кайме нижней губы. Форма рака чаще папиллярная или язвенная. Встречается у лиц мужского пола, злоупотребляющих курением. При папиллярной форме появляется болезненное уплотнение округлой формы с нечеткими контурами, покрытое коркой, после снятия которой обнаруживается розовый участок. При язвенной форме имеется длительно незаживающая трещина. Эта форма более злокачественная. Метастазирование происходит сначала в подчелюстные, а затем в более глубокие лимфатические узлы шеи. Рак языка возникает на фоне лейкоплакии (см.), туберкулеза (см.) и сифилиса (см.). Первоначально возникает узел, а затем язва с приподнятыми краями и плотным некротическим дном. Опухоль чаще локализуется на краю или кончике языка. Язва и узел болезненны. Рак пищевода клинически протекает с резким исхуданием, а иногда и с кахексией (истощением) из-за невозможности проглатывания пищи. Спонтанные боли присоединяются при прорастании опухолью окружающих пищевод тканей, нервных стволов и сплетений. Боли локализуются за грудиной и в верхней части живота. Отрыжка воздухом, срыгивание и пищеводная рвота появляются при значительном сужении пищевода опухолью. Метастазирование происходит в подключичные и шейные лимфоузлы. Рак желудка проявляется в начальном периоде лишь нарушением прохождения пищи. Общие симптомы, такие как похудение, потеря аппетита, отвращение к мясной пище, слабость, анемия (см.), появляются при развитии обширных опухолей. Клиника рака поджелудочной железы многообразна и зависит от локализации, вида опухоли, ее размеров и отношения к близлежащим органам. При раке головки поджелудочной железы боли чаще локализуются в правом подреберье, напоминая боли при язвенной болезни (см.), холецистите (см.), приступе печеночной колики (см.). Для рака тела и хвоста поджелудочной железы боли еще более характерны и выступают на первый план как ранний и ведущий симптом заболевания, нередко они мучительны или даже невыносимы. Боли локализуются в верхней части живота, часто приобретая опоясывающий характер. Больные раком поджелудочной железы нередко принимают вынужденное положение, чтобы ослабить болевой синдром. Анорексия и отвращение к мясу — характерные симптомы рака желудочнокишечного тракта, но при раке поджелудочной железы анорексия наиболее выражена (вплоть до полной потери аппетита). Для опухоли, локализующейся в области головки поджелудочной железы, характерно развитиемеханической желтухи (см.) вследствие сдавления опухолью желчного протока или (реже) печеночных протоков. При раке тела и хвоста поджелудочной железы, помимо мучительных болей, анорексии и похудения, наблюдаются также жажда, увеличение глюкозы в крови и появление ее в моче. Рак желчного пузыря также отличается развитием механической желтухи (см.), болевым синдромом по типужелчнокаменной болезни (см.). При локализации опухоли в теле пузыря прощупывается опухоль больших размеров с нечеткими контурами, ограниченно подвижная. На ранних стадиях диагностика рака желчного пузыря практически невозможна. Рак печени дает клиническую картину, схожую с симптомами цирроза печени (см.) на первоначальном этапе. При обследовании в дальнейшем можно определить отдельные узлы опухоли. При раке печени могут возникать отеки нижних конечностей, расширение подкожных вен вокруг пупка и геморроидальных вен. Помимо желтушности (для таких больных характерен темно-зеленый или землистый оттенок кожи), отмечаются множественные кожные расчесы. Рак молочной железы развивается на фоне мастопатии в 11 раз чаще, чем в неизмененной железе. На ранних стадиях может возникнуть небольшое образование, а затем появляются боль и изменения кожи (втяжение ее над опухолью, симптом лимонной корки). При прощупывании определяется плотное образование с нечеткими контурами, вначале подвижное, а затем спаянное с кожей и более глубокими слоями грудной клетки. Регионарные лимфатические узлы увеличены. Рак молочной железы метастазирует вместе с лимфотоком в подмышечные, подключичные, парастернальные, надключичные лимфатические узлы противоположной стороны. Метастазирование вместе с кровотоком идет в кости таза, позвоночника и легкие, реже — в печень. Формы рака могут быть различными — рожеподобный рак, маститоподобный рак, панцирный рак, рак с язвенной и отечной формой и т. д. При раке матки наиболее ранним симптомом является появление белей водянистого, а позднее и сукровичного характера. Появление кровянистых выделений из матки в периоде постменопаузы считается признаком рака матки. Процесс по мере развития опухоли распространяется на мышечной слой матки, брюшину, тазовую клетчатку и соседние органы. Заболевание развивается относительно медленно. В начальной стадии процесс носит практически бессимптомный характер, а при значительном распространении опухоли появляются боли, истощение и интоксикация. Метастазы развиваются в тазовых и лимфатических узлах, близких к аортам, позднее — в отдаленных органах. Рак яичников бывает первичным, вторичным и метастатическим. Первичный рак яичников встречается реже, чем вторичный, и развивается из покровного эпителия. Вторичный рак яичника развивается из папиллярной или псевдомуцинозной ткани, иногда из дермоидной кисты яичника. Метастатический рак яичника обычно бывает двусторонним, опухоль достигает значительных размеров (метастазирование из желудка, кишечника, молочной железы). В ранней стадии заболевания симптомы отсутствуют. При прогрессировании процесса ухудшается общее состояние, появляются асцит (см.), боль, одышка, кахексия (истощение) и т. д. Наличие опухоли яичника (с одной или двух сторон) с бугристой поверхностью плотной консистенции и ограниченно подвижной, а также наличие свободной жидкости в брюшной полости (асцит) дают основание заподозрить рак яичника. Рак почки возникает из клеток канальцев или доброкачественных аденом. Главными симптомами являются: появление крови в моче, симптомы сдавления и оттеснения соседних органов (желудок, двенадцатиперстная кишка, ободочная кишка). Может определяться высокое стояние диафрагмы, довольно часто глубоко в подреберье прощупывается плотное неподвижное образование. Рак предстательной железы — гормональнозависимая злокачественная опухоль, чаще возникает после 50 лет. Длительное время протекает бессимптомно, а ее клиническая картина зависит от размеров и стадии опухоли. Рак прямой кишки чаще возникает на фоне полипов. В зависимости от места расположения опухоли развиваются следующие симптомы: — в ректосигмоидальном отделе — нарастающий запор (см.), а затем обтурационная кишечная непроходимость (см.), возможны кровотечения из кишки; — в ампулярном отделе — ощущение неполного опорожнения, затем (при распаде опухоли) тенезмы с выделением крови, слизи, гноя; — рак анального канала дает выраженный болевой синдром, небольшие кровотечения при дефекации, изменение каловых масс. Метастазирование происходит в лимфатические узлы таза и паховые лимфоузлы. Вместе с кровотоком возможно метастазирование преимущественно в печень. Осложнения раковой опухоли вызываются ее распадом, прорастанием в другие органы илиметастазированием. При распаде опухоли возможны значительное кровотечение и гнойные процессы. При прорастании опухоли в нерв происходит выпадение функции иннервируемого органа или ткани. Метастазирование или прорастание опухоли в кишечник вызывает обтурационнуюкишечную непроходимость (см.).
Диагностика Диагностика раковых заболеваний основывается на данных анамнеза, клинической картины болезни и инструментально-лабораторной диагностики. Ведущее место в диагностике рака занимают рентгенологический и эндоскопический методы. Эндоскопические исследования проводятся с прицельной биопсией для тканевого подтверждения раковой опухоли. При раке желчного пузыря, поджелудочной железы, почек диагностическую ценность могут иметь дуоденография и реография. Очаговые дефекты можно обнаружить с помощью эхографии и компьютерной томографии. Определенную роль в диагностике раковых заболеваний играет (особенно на ранних стадиях) тепловидение. Применяется также метод сканирования с использованием радиоактивных веществ. В наиболее сложных и запутанных случаях прибегают к диагностической лапаротомии. Особое значение имеет выявление предопухолевых заболеваний и ранних стадий рака.
Лечение Выбор метода лечения рака определяется характером опухоли, ее локализацией, стадией заболевания, общим состоянием больного и наличием осложнений. Существуют радикальные методы, которые направлены на полное излечение, и паллиативные, направленные на устранение осложнений. Радикальный метод — это хирургическое удаление опухоли в пределах здоровых тканей и регионарных лимфатических узлов. Лучевая терапия сводится к максимальному разрушению раковых клеток при сохранении здоровых тканей. Консервативная терапия (или химиотерапия) рассчитана на действие лекарственных средств на опухолевые клетки с предотвращением их роста и метастазирования. Из химиотерапевтических средств, применяемых при раке желудочно-кишечного тракта и женских половых органов, можно назвать 5-фторурацил-эбеве, фторафур, кампто, элосксантин; при раковых опухолях органов дыхания и грудной клетки применяют гикамтин, доксорубицин, кароплатин-эбеве, навельбин, таксол, веровинкристин; при злокачественных новообразованиях костей и суставных хрящей — бонефис, доксорубифер, цисплатин-эбеве и др. Для лечения рака также используют алкеран, аримидекс, депостат, гексален, золадекс и т. д. Для лечения рака применяются и комбинированные формы терапии, сочетающие в себе все вышеперечисленные методы. Применяется симптоматическая терапия, направленная на ослабление болевого синдрома, кровотечений, поддержание внутренней среды организма, сведение к минимуму осложнений. Лечение больных раком должно включать и реабилитационные мероприятия, предусматривающие восстановление социальной и профессиональной деятельности больного. Профилактика рака должна предусматривать исключение всех провоцирующих факторов этого заболевания, профилактические медицинские осмотры с целью раннего выявления предраковых заболеваний и ранних стадий рака. Большую роль в профилактике онкологических болезней имеют обучение населения самообследованию для раннего выявления опухолевых образований (например, в области молочных желез) и повышение санитарной грамотности людей.
РАНЫ
ОпределениеРана — это нарушение целостности кожи, слизистых или серозных оболочек с повреждением различных тканей и органов, вызванное механическим воздействием, сопровождающееся зиянием и кровотечением.
Этиология По характеру нанесения раны разделяются на случайные (бытовые и производственные травмы, ранения при авариях на автомобильном, авиационном и железнодорожном транспорте, при стихийных бедствиях), преднамеренные (операционные) и ранения, полученные при ведении боевых действий. По виду ранящего орудия выделяются резаные, рубленые, колотые, рваные, укушенные, огнестрельные, размозженные и скальпированные раны. По отношению к полостям тела раны могут быть непроникающие (поверхностные) и проникающие в полости (плевральную, сердечную, брюшную и т. д.). Проникающие раны подразделяются на раны с повреждением внутренних органов и без их повреждения. По инфицированности раны определяют как асептические, нанесенные в условиях стерильной операционной (преднамеренные); первичноинфицированные, нанесенные нестерильным предметом (когда в течение 12–24 ч внедрившаяся микрофлора может подвергаться действию местных факторов защиты и устраняться или сохраняться в скрытом состоянии); гнойные (внедрившаяся микрофлора вызывает гнойные воспаления). По наличию осложнений раны делятся на неосложненные и осложненные. К осложненным ранам относятся повреждения основных сосудов, нервов, костей, сухожилий и внутренних органов с развитием массивного кровотечения и шока (см.). Сочетание механического повреждения с воздействием других поражающих факторов (ионизирующее излучение, химические или радиоактивные вещества, болезнетворные микроорганизмы) называется комбинированным ранением. Повреждение одним ранящим предметом нескольких смежных органов или анатомических областей называется сочетанным ранением. Повреждение двух и более анатомических областей или органов несколькими раневыми каналами считается множественным ранением. По форме выделяют раны с потерей тканей, линейные, дырчатые, лоскутные, а по размеру — раны с малой и большой зоной повреждения. Огнестрельные, размозженные и ушибленные раны характеризуются разрушением тканей не только в ближайшей зоне, но и на значительном от нее расстоянии.
Патогенез Различают местные реакции в поврежденных тканях и собственно раневой процесс, проходящий различные фазы, последовательно сменяющие друг друга: фазу воспаления, включающую в себя период сосудистых изменений и период очищения раны от омертвевших тканей, и фазу регенерации (восстановления), в ходе которой происходит образование новой ткани и закрытие дефекта кожным покровом. Независимо от характера раны и ранящего предмета в ней выделяют зону прямого действия ранящего предмета (раневой дефект, раневой канал), зону контузии (ушиба), возникающую в результате бокового действия ранящего предмета и определяющую величину первичного травматического некроза (см.), и зону сотрясения, где возможно развитие очагов вторичного омертвения вследствие сосудистых изменений и нарушения трофических свойств тканей, а также очагов кровоизлияний. Заживление раны — это последовательная смена различных стадий раневого процесса. Общая реакция организма при неосложненном раневом процессе протекает в две фазы. На 1—4-е сутки после ранения (первая фаза) в кровь выбрасывается повышенное количество адреналина и кортикостероидов. Это способствует активации обмена веществ с повышенным распадом белков, жиров и углеводов. В результате активизируются факторы внутрисосудистой свертываемости крови, противовоспалительные процессы, понижается проницаемость сосудистой стенки, т. е. развивается адаптационный синдром в ответ на травму. Во второй фазе (4—10-е сутки после ранения) активизируются гормоны и вещества, стимулирующие процессы восстановления тканей. Нормализуется обмен веществ, особенно белковый, активизируются процессы заживления раны.
Клиническая картина Клиническая картина любой раны (ранения) сопровождается болью, нарушением или ограничением функции пораженной части тела, особенно при повреждении костных структур, суставов, мышц, сухожилий, нервных стволов. В первое время отмечается зияние раны, особенно выраженное при поперечном ранении мышечных волокон, обусловленное эластическими свойствами тканей. Любое ранение сопровождается кровотечением. При небольших ранениях отмечается капиллярное или смешанное кровотечение, которое останавливается самостоятельно или после наложения давящей повязки. При повреждении крупных сосудов кровотечение может быть интенсивным и требует либо наложения жгута, либо кровоостанавливающего зажима на сосуд в ране, или тампонирования. Возможно пропитывание тканей кровью или скопление ее в пространствах между мышцами, оболочками, клетками с образованием гематом. При проникающем ранении кровь может изливаться в серозные полости с образованием гемоперикарда, гемоторакса, гемартроза, гемоперитонеума (кровь в сердечной сумке, плевральной полости, полости сустава и брюшной полости соответственно). Когда гематома сообщается с крупным сосудом, определяется пульсирующая опухоль эластичной консистенции — травматическая аневризма (см.). Из раневого канала могут выделяться желчь, панкреатический сок, воздух, кишечное содержимое, моча, спинномозговая жидкость и др., что свидетельствует о проникающем характере ранения и повреждении соответствующих органов. Кроме местных проявлений, ранение сопровождается нарушением общего состояния организма, которое, естественно, зависит от характера повреждения, затронутости жизненно важных органов, крупных сосудов, нервных стволов. При обширных повреждениях или сочетанных ранениях возможно развитие травматического шока (см.). В зависимости от характера ранящего предмета и объема разрушения тканей каждый вид ран имеет свои специфические особенности. Неглубокие раны с повреждением только поверхностных слоев кожи и слизистой оболочки, нанесенные плоским предметом на большом протяжении, называются ссадинами, а поверхностные повреждения, нанесенные острым предметом в виде тонкой линии, — царапинами. Резаные раны наносятся острым предметом (скальпель, нож, финка, бритва и др.) параллельно поверхности тела линейным движением. Поэтому такие раны имеют линейную форму, наружные их размеры больше глубины, а дно хорошо просматривается. Края и стенки раны ровные, четкие, без кровоизлияний и размозжений, дно раны также ровное. Эти раны относятся к самым благоприятным в плане их лечения и заживления. Колотые раны наносятся любым острым предметом большой длины (узкий нож, шило, отвертка, ножницы, спица и др.). Характерной особенностью таких ран является превышение глубины над наружными размерами. Колотые раны в большинстве случаев бывают проникающими в полости с повреждением внутренних органов или глубоколежащих мягких тканей (нервно-сосудистый пучок, сухожилия, мышцы), имеют узкий раневой канал. Они чаще инфицируются, так как для развития микрофлоры создаются идеальные условия. В зависимости от остроты и формы ранящего предмета края раны могут быть ровными и четкими, линейной формы (узкий нож, штык, финка), округлыми (шило, спица, арматура), фестончатыми или звездчатыми (отвертка, ножницы) и др. В зависимости от остроты предмета края раны могут быть без кровоизлияний или иметь незначительные кровоизлияния и осаднения. Такую же особенность имеют и стенки раны. Но дном раны может быть все что угодно, вдобавок его, как правило, не видно, поэтому при обращении пострадавшего с колотой раной должен проводиться ее тщательный осмотр. Рубленые раны наносятся острым предметом большой кинетической массы и одним рубящим ударом (топор, сабля, лопасть, шашка и др.). Они отличаются большой глубиной и часто сопровождаются ампутацией сегмента конечности (например, пальцев). Края и стенки имеют линейную форму, ровные, но четкость зависит от остроты предмета, которым нанесена рана. Если предмет тупой, края раны будут осаднены, с участками кровоизлияний, зона которых обычно не обширна, что зависит от остроты предмета. Если предмет остро заточен, края и стенки раны будут ровными и четкими. На дне раны, которое легко просматривается, имеются перемычки, которые соответствуют зазубринам на ранящем предмете и должны быть измерены и описаны для последующей судебно-медицинской экспертизы и идентификации орудия. Рваные раны наносятся заостренным предметом крючковатой или зазубренной формы параллельно поверхности тела. При этом формируется разрыв (см.) кожи и подкожной клетчатки. Раны поверхностные, линейной формы. Края неровные (фестончатые) и нечеткие за счет осаднений. Стенки раны тоже неровные, с участками кровоизлияний. Дно раны — также с кровоизлияниями, неровное. Разновидностями рваных ран являются скальпированные, ушибленные и размозженные раны. Скальпированные раны черепа чаще всего возникают при попадании волос в движущиеся механизмы. Размозженные раны в практике встречаются редко, но это один из самых тяжелых видов повреждений, так как они формируются при раздавливании конечностей. Размозженные раны характеризуются наличием обширных участков раздавленных тканей и развитием их омертвения в результате травмы. Иногда они сопровождаются полным отчленением сегмента конечности, как правило, с отрывом кожи выше уровня повреждения глубжележащих тканей. Ушибленные раны наносятся тупым твердым предметом, имеющим большую кинетическую энергию (палка, кирпич, камень, бутылка). Сами ушибленные раны могут быть поверхностными, но из-за высокой кинетической энергии травмирующего агента часто сопровождаются повреждениями внутренних органов: при ранах головы — повреждениями мозга, груди — легких и сердца. Вид ушибленной раны может быть самый различный, все зависит от формы ранящего орудия, его массы и силы, с которой был нанесен удар, а также направления удара. Отличительной особенностью таких ран являются обширные кровоизлияния, осаднение и размозжение краев, стенок и дна раны. Если рана нанесена одним прямым ударом, перпендикулярным поверхности тела, вид ее повторяет контуры ранящего орудия. При этом происходит размозжение мягких тканей, равномерно распространяющееся на всю глубину. Края раны могут быть самой различной формы — квадратной, звездчатой, реже линейной; все зависит от ранящего предмета. Если удар наносится под углом, мягкие ткани буквально лопаются под воздействием силы. Форма краев раны зависит от угла приложения силы. При нанесении раны под углом больше 30° к поверхности тела (удар на излете) края раны имеют треугольную форму с основанием в месте приложения силы. При приложении силы под углом меньше 30° к поверхности тела или параллельно ей (например, при ударе палкой, кнутом, бичом и т. д.) края раны фестончатые, имеют линейную форму, но глубина ее неравномерная — центральная часть раны всегда глубже. Укушенные раны наносятся животным или человеком. Они характеризуются обильным микробным загрязнением за счет микрофлоры полости рта и осложняются, как правило, нагноением. При укусе животным, больным бешенством (см.), в организм человека может попасть вирус бешенства (см.). Укушенные раны по своему виду напоминают рваные, но отличаются тем, что имеют отпечатки зубов. Укушенные раны могут иметь дефект ткани вплоть до оскальпирования или ампутации (например, пальцы), при этом вырывается участок кожи и мягких тканей. Огнестрельные раны в силу своей специфики, тяжести повреждений, осложнений, сложности оказания первой помощи и последующего ведения больного, неблагоприятности исходов выделены в отдельную группу. По виду оружия среди огнестрельных ран различают пулевые, дробовые и осколочные. По характеру раневого канала выделяют сквозные, касательные и слепые ранения. При пулевых ранах входное отверстие имеет округлую форму с неровными и нечеткими краями за счет осаднений и кровоизлияний. Большое значение имеет расстояние, с которого произведен выстрел. При расстоянии до 1 м или при выстреле в упор вокруг раны имеются зона ожога и пороховые вкрапления; обширность их определяют расстояние и калибр оружия. При больших расстояниях этих отличий не отмечается. При осколочных ранениях входное отверстие напоминает рваную рану, но с обширной зоной кровоизлияний и размозжений тканей, а также наличием раневого канала. Пулевые и осколочные раны имеют три зоны повреждений: сам раневой канал, заполненный тканевым детритом (продуктами распада тканей), инородными телами и остатками ранящего предмета (пуля или осколок); зону размозжения тканей, которая в 2–5 раз больше раневого канала; зону молекулярного сотрясения, в 5—10 раз превышающую раневой канал. Эти ткани постепенно омертвевают и отторгаются, создавая угрозу тяжелых осложнений. Для дробовых ранений характерно множество мелкоточечных входных отверстий, часто с фестончатыми краями, небольшими зонами кровоизлияний и размозжений вокруг них. Дробовые ранения также сопровождаются переломами и повреждениями внутренних органов. Касательные огнестрельные раны определяются тем, что при них раневой канал не имеет верхней стенки и отсутствуют повреждения глубжележащих тканей и образований. При слепых огнестрельных ранениях имеется только входное отверстие, а огнестрельный снаряд застревает в тканях. Сквозные и слепые огнестрельные ранения могут быть как с повреждением, так и без повреждения внутренних органов. Выделяются также проникающие ранения, характеризующиеся нарушением целостности всех слоев стенки какой-либо полости (плевральной, брюшной, полости сустава, черепа и т. д.), и непроникающие ранения. В момент нанесения раны в нее могут попасть различные частицы (куски ранящего предмета, одежда и другие инородные тела), кроме того, рана может быть загрязнена самим ранящим предметом или загрязниться при падении человека, получившего ранение. Поэтому все случайные ранения имеют первичное микробное загрязнение. Возбудители инфекции могут попасть в рану и в процессе ее лечения при нарушении правил асептики и антисептики — так называемое вторичное микробное загрязнение. При условиях, благоприятных для развития в ране патогенной флоры и распространения возбудителей инфекции в окружающие ткани, возможно осложненное течение раневого процесса. Присоединение раневой инфекции делает невозможным заживление раны первичным натяжением, при этом создаются условия для развития гнойных осложнений. В момент ранения в раны могут проникать ядовитые вещества (отравленные раны), обладающие местным (щелочи, кислоты) или общим (яд змей, фосфорорганические соединения) действием. Вещества местного действия вызывают омертвение тканей, способствуют нагноению и осложненному течению раневого процесса. Ядовитые вещества общего действия вызывают отравление всего организма, так как раневая поверхность лишена специальных биологических барьеров, которыми обладает неповрежденный кожный покров. При попадании в рану радиоактивных веществ происходит ее радиоактивное заражение. Радиоактивное заражение сочетается, как правило, с общим воздействием ионизирующего излучения на организм в целом. Местно воздействие ионизирующего излучения способствует прогрессированию омертвения тканей, замедляет процессы раневого заживления. Клиническое течение раневого процесса зависит от характера, локализации, размеров раны, степени ее микробного загрязнения, адекватности проводимого лечения и иммунных свойств организма. При заживлении первичным натяжением на 2—3-и сутки уменьшаются болевые ощущения, на 3—5-е сутки — отек и покраснение окружающих рану тканей, но образование рубца в глубине раны происходит медленнее. В первые 2–3 дня возможны: подъем температуры до 38 °C, увеличение СОЭ, незначительное повышение уровня лейкоцитов; эти изменения потом быстро нормализуются. Заживление раны под струпом происходит медленнее. Клиническое течение ран, заживающих вторичным натяжением, характеризуется более выраженными явлениями общей интоксикации, особенно в первые недели после ранения, когда еще не сформировался ограничивающий воспалительный вал. Неосложненный раневой процесс при заживлении раны вторичным натяжением протекает в три периода: период инкубации, период распространения и период локализации инфекции. В первом периоде изменения в ране и нарушение общего состояния организма определяются тяжестью ранения и кровопотерей. Второй период наступает через 1–3 дня после ранения и характеризуется распространением микроорганизмов в окружающие рану ткани. Появляются признаки воспаления — серозно-гнойное, а потом гнойное отделяемое, краснота и инфильтрация кожи вокруг раны, некротические налеты на тканевой поверхности. Общее состояние соответствует тяжести гнойной интоксикации. Этот период продолжается до двух недель. Период локализации инфекции характеризуется очищением раны от некротических масс — раневая поверхность покрывается грануляциями (соединительной тканью), а по краям раны появляются островки заращения.
Осложнения Для первого периода раневого процесса характерны осложнения, связанные с кровопотерей, развитием травматического шока (см.), повреждением внутренних органов и головного мозга. В период распространения инфекции могут возникать гнойные затеки, флегмоны (см.), абсцессы (см.), лимфаденит (см.), рожистое воспаление (см. Рожа), гангрена (см.), вызванная анаэробной или гнилостной инфекцией, тромбофлебит (см.) и др. Кроме местных осложнений, могут возникать и общие — от гнойно-резорбтивной лихорадки до сепсиса (см.). В результате гнойного расплавления стенок сосуда может возникнуть вторичное аррозивное кровотечение. В период заживления раны возможно вторичное ее нагноение в результате дополнительной травмы, попадания болезнетворной флоры или снижения общей устойчивости организма в связи с тяжелым ранением или присоединение других заболеваний (пневмония (см.), отит (см.) и др.). В связи с нарушением процессов регенерации могут наблюдаться: расхождение краев раны после снятия швов, образование незаживающих язв или деформация ткани в виде грубых рубцов. Кроме осложнений в области раны, при обширных ранениях возможно развитие общих осложнений. Так, при массивном размозжении тканей и синдроме сдавления может развиться острая почечная недостаточность, а при длительном гнойном процессе — амилоидоз (см.). Возможно также развитие пневмонии (см.) или обострение хронических болезней желудочно-кишечного тракта. При ранении могут развиваться психические расстройства (см.) (так называемый раневой психоз).
Диагностика Диагностировать рану при объективном обследовании не представляет трудностей. Однако ее необходимо квалифицированно описать для последующей судебно-медицинской экспертизы, так как врач, оказывающий помощь пострадавшему, видит ее в натуральном виде в первый и последний раз. Экспертная оценка позволяет определить не только вид раны, но и вид оружия, которым она была нанесена (твердый тупой предмет, колюще-режущий, огнестрельное ранение и др.), механизм образования раны и ее давность, а при множественных ранениях — последовательность их причинения и степень тяжести телесных повреждений. Весьма важным в связи с этим является тщательное описание раны медработником, производящим осмотр и первичную хирургическую обработку. При описании ран предъявляются следующие требования: — указывают локализацию раны по анатомическому сегменту тела (голова, лицо, шея, грудь, конечность и т. д.); — дают уточненное положение раны с указанием анатомических ориентиров (например, в области груди, справа, в четвертом межреберье, по среднеключичной линии или в области бедра, по внутренней поверхности, выше коленного сустава на 6 см и т. д.); — указывают размеры зияния раны — 2 х 5 см, 3 х 4 см и т. д.; если видно дно раны, отмечают и ее глубину (2, 4, 6 см и т. д.); — описывают форму раны: линейная, округлая, звездчатая, овальная, серповидная, треугольная и т. д.; — указывают направление раны по продольной оси тела: косая, продольная, поперечная; — описывают края раны: ровные или неровные (фестончатые), четкие или нечеткие; наличие осаднений и размозжений, размеры кровоизлияний, особенности формы и цвет кровоподтеков; — описывают стенки раны аналогично описанию ее краев (ровные, неровные, наличие размозжений и кровоизлияний); — описывают дно раны. Дно раны требует особенно тщательного осмотра и описания. Если дна раны не видно, в некоторых случаях необходимо рассечение раны для его осмотра и ревизии. При проникающих ранениях в полостные образования необходимо проведение эндоскопических исследований или полостных операций с целью описания раневого канала, состояния дна и повреждений внутренних органов. Дно может быть ровное или неровное, иметь перемычки, размозжения, кровоизлияния, инородные тела, повреждения серозных листков и т. д. Обязательно указывается, что является дном раны, — мягкие ткани, кости, внутренние органы. Описывают состояние дна раны. Описывается направление раневого канала (при нанесении раны ножом или финкой она имеет узкий ход) — спереди назад, справа налево или наоборот; его содержимое (продукты распада тканей, костные отломки, земля, инородные тела, пуля, осколки и т. д.). Указывается наличие осложнений: повреждение внутренних органов, нервно-сосудистых пучков, сухожилий, мышц, мозга и т. д.
Лечение и профилактика Лечение ран включает в себя воздействие на местный патологический раневой процесс и весь организм в целом. Оно представляет собой комплекс последовательно выполняемых мероприятий в зависимости от характера и локализации ранения, а также состояния пострадавшего. Первым этапом при оказании помощи раненому является остановка кровотечения. Остановка кровотечения проводится либо наложением давящей повязки, либо созданием возвышенного положения, либо быстрым сгибанием пораженной конечности, либо наложением кровоостанавливающего жгута или пальцевым прижатием артерии выше места ранения. При возможности остановка кровотечения осуществляется путем наложения кровоостанавливающего зажима на сосуд в ране и тампонадой гемостатическими средствами. Вторым этапом оказания помощи служит наложение асептической повязки. Перед наложением асептической повязки поверхность, окружающую рану, освобождают от одежды или обуви, промывают дезинфицирующими растворами (раствор риванола 1: 1000, фурацилина 1: 5000, 3 %-ная перекись водорода) и обрабатывают края раны антисептическим раствором (5 %-ная спиртовая настойка йода или 1 %-ный раствор бриллиантовой зелени). При небольших ранениях без инородных включений на раневую поверхность возможно нанесение пленкообразующих препаратов (лифузола, пластубола и др.). При ранениях, сопровождающихся переломами костей, ранениях суставов, крупных кровеносных сосудов и при обширных повреждениях мягких тканей необходимо организовать иммобилизацию (путем наложения транспортной шины или шины из подручного материала). При отчленении сегмента конечности или пальцев рук их надо обернуть стерильными салфетками или поместить в полиэтиленовый пакет, уложить в другой пакет со льдом и доставить вместе с больным в специализированное микрохирургическое отделение. При оказании помощи пострадавшему в зависимости от тяжести состояния проводится симптоматическая терапия, включающая борьбу с шоком (см.) и кровотечением. Обязательно введение антибактериальных средств и противостолбнячной сыворотки. В условиях хирургического стационара проводятся мероприятия по профилактике и выведению раненого из шока, подготовке его при необходимости к оперативному вмешательству. Производится первичная и вторичная хирургическая обработка раны, осуществляются пластические операции по закрытию раневого дефекта. При значительном повреждении тканей во время первичной обработки производят очистку кожи вокруг раны. Края раны осторожно разводят ранорасширителями, удаляют все инородные тела, размозженные и оборванные участки тканей. После этого иссекают размозженные ткани, обрабатывают рану антисептическими веществами и рыхло тампонируют или дренируют. В первой и второй фазах раневого процесса при местном лечении применяют повязки с гипертоническим и антисептическим раствором, специфическим бактериофагом, ферментами, способствующими очищению и обеззараживанию раны. В период заживления и появления грануляций используют мазевые повязки для предупреждения подсыхания и травматизации гранулирующей поверхности раны. Мази с лекарственными и витаминными составами стимулируют образование соединительной ткани и заращение раны. В послеоперационном периоде для очищения раны, ликвидации воспалительного процесса и стимуляции процессов восстановления широко используют физиотерапевтическое лечение (УФ-облучение, УВЧ-терапию, электрофорез с антисептиками и протеолитическими ферментами). Возможно местное применение лазерного излучения и магнитных полей. В позднем периоде формирования рубца назначают грязевые и парафиновые нанесения. При обширных ранениях и комбинированных поражениях проводят лечение в управляемой абактериальной среде, а также гипербарическую оксигенацию. Оперативное лечение ран сочетают с общеукрепляющей, антибактериальной и иммуностимулирующей терапией, с применением анаболических средств, препаратов крови, ее заменителей и белковых гидролизатов, дезинтоксикационной терапией, введением специфических анатоксинов для борьбы с инфекционными осложнениями. На всех этапах лечения необходимо подключение ЛФК и массажа, особенно при ранениях конечностей. Профилактика ранений сводится к устранению причинных факторов. Профилактика осложнений раневого процесса заключается в своевременном и квалифицированном оказании медицинской помощи, соблюдении требований асептики и антисептики.
РАСЩЕЛИНА
ОпределениеРасщелина — анатомический дефект ткани в результате порока эмбрионального развития. Расщелина может располагаться в любом органе, но на практике чаще встречаются расщелины лица.
Этиология и патогенез Причины появления данного порока недостаточно изучены. Предполагают, что одной из причин развития расщелин является наследственная предрасположенность. Способствовать развитию такого порока на эмбриональной стадии могут различные внутренние и внешние факторы. Расщелины часто сочетаются с другими эмбриональными пороками развития (см.) костей черепа, сердца, языка, наблюдаются у детей с болезнью Дауна (см.) и Литтла и т. д. Расщелина верхней губы и неба наблюдается у детей с синдромом Робена. Врожденные расщелины — это результат несращения зародышевых бугров, образующих лицо эмбриона на ранних стадиях эмбрионального развития.
Клиническая картина и диагностика Клиническая картина расщелины зависит от ее локализации, размеров, сочетания с другими расщелинами или пороками развития (см.). Самыми первыми расщелинами, выявляемыми у новорожденных, являются расщелины лица. Форма и локализация их зависит от того, между какими зародышевыми буграми не наступило сращения. Срединные расщелины нижней челюсти образуются при несращении нижнечелюстных бугров. Они встречаются крайне редко. Косые расщелины лица образуются при отсутствии сращения между верхней челюстью и лобными буграми. Внешне они идут косо через верхнюю губу и подглазничную область к внутреннему и внешнему углу глаза. Поперечные расщелины лица возникают при несращении нижнечелюстных и верхнечелюстных бугров. Они встречаются чаще. Клинически проявляются в виде щели, идущей в поперечном направлении от угла рта через щеку. Такие расщелины могут быть одно- и двусторонними. Самый распространенный вид расщелины лица — это расщелина верхней губы («заячья губа»). Формы ее могут быть различными: от небольшой выемки до полного сообщения расщепленной губы с полостью носа. Иногда расщелина губы может быть ограничена только мышечной тканью (скрытая расщелина). При осмотре за счет разъединения мышечной ткани видна только западающая борозда. Расщелины верхней губы бывают как односторонними, так и двусторонними. В половине случаев расщелина верхней губы сочетается с расщелиной альвеолярного отростка и неба и сопровождается деформацией носа. Сквозная двусторонняя расщелина как бы отделяет среднюю часть верхней челюсти вместе с межчелюстной костью, которая выступает вперед, оставаясь соединенной с сошником и перегородкой носа. При полной расщелине губы у новорожденного ребенка затруднен, а в некоторых случаях и невозможен акт сосания. Затруднено также дыхание: оно становится поверхностным, что часто приводит в дальнейшем к пневмонии (см.) новорожденного. Среди пороков развития неба наиболее часто встречаются врожденные расщелины только мягкого или мягкого и твердого неба, которые возникают при отсутствии сращения между небными отростками верхней челюсти или мышечными образованиями мягкого неба. Расщелины нёба могут быть изолированными или сочетающимися с расщелинами верхней губы в виде сплошной расщелины, проходящей через губу, альвеолярные отростки верхней челюсти, твердое и мягкое нёбо. Это сквозная расщелина. При несквозной расщелине альвеолярный отросток развит нормально. Сквозные расщелины бывают односторонними, расположенными справа или слева от срединной линии, и двусторонними, когда соединение между челюстной (резцовой) костью с носовой перегородкой и верхнечелюстными костями отсутствует с обеих сторон. При такой комбинированной расщелине постепенно наступает нарушение развития верхней челюсти, что приводит к тяжелой деформации лица. Внешне это выглядит так: средний участок верхней челюсти — резцовая кость, соединенная с перегородкой носа и сошником, — не испытывая давления круговых мышц рта, сильно выступает вперед, а боковые отделы спереди сближаются («волчья пасть»). Несквозные расщелины делятся на полные (расщелина проходит через твердое и мягкое небо) и частичные (расщелина проходит через мягкое и только частично — через твердое небо). К частичным расщелинам относят также скрытые, или подслизистые, расщелины, при которых расщелина мышц мягкого неба, язычка, а иногда и части твердого нёба прикрыта слизистой оболочкой. При расщелинах (особенно сквозных) у новорожденных детей часть молока при сосании попадает в верхние дыхательные пути. С возрастом эта патология вызывает расстройства речи — гнусавость, нарушение артикуляции и, как следствие, психоневрологические нарушения. В редких случаях расщелина может наблюдаться в промежности: у мальчиков она располагается по ходу срединного шва и представляет собой узкий прямолинейный дефект ткани, стенки которого покрыты слизистой оболочкой, продуцирующей слизь, что вызывает зуд. У девочек расщелина сливается с половой щелью и покрыта слизистой оболочкой, идущей из преддверия влагалища. Задняя спайка половой губы отсутствует. Клинической симптоматики нет. Диагностика расщелин основывается прежде всего на внешнем осмотре. В некоторых случаях прибегают к рентгенологическому и ультразвуковому методам исследования.
Лечение и профилактика Лечение расщелин, особенно расщелин лица (расщелины губы, мягкого и твердого неба), комплексное. При невозможности организовать правильное питание новорожденного ребенка прибегают к раннему оперативному вмешательству для исправления врожденного дефекта. В дальнейшем к операции прибегают с косметической целью и для обеспечения нормального дыхания. Существуют также ортодонтические методы лечения, предупреждающие и устраняющие деформацию челюсти и исправляющие дефекты речи. С целью установления правильной речи проводятся занятия у логопеда. Профилактикой развития расщелин служат все мероприятия, проводимые до рождения ребенка и направленные на рождение здорового потомства.
РАХИТ
ОпределениеРахит — это заболевание интенсивно растущего организма, обусловленное недостатком витамина D и его производных, характеризующееся нарушениями фосфорнокальциевого обмена и минерализации новообразующейся кости.Рахит, по существу, является общим заболеванием организма, характеризующимся многообразием структурных и функциональных изменений различных органов и систем. Распространение, формы и тяжесть рахита зависят от климатических особенностей и условий жизни. Заболеваемость рахитом бывает выше при дефектах вскармливания и ухода, у недоношенных детей, при задержке внутриутробного развития, глубокой незрелости эндокринных органов и ферментных систем, у детей, перенесших внутричерепную родовую травму, а также при других видах перинатальной патологии. Различают витамин^-дефицитный рахит и витамин^-резистентный рахит.
Этиология Основными причинами витамин-D-дефицитного рахита являются: — неадекватное облучение; — недостаточное поступление витамина D с пищей; — синдром мальабсорбции (см.); — терапия антиконвульсантами (противосудорожные препараты типа фенобарбитала и др.); — тяжелые хронические заболевания печени и почек; — интенсивный рост, свойственный всем детям первых месяцев жизни, особенно недоношенным; — длительные инфекционные и желудочно-кишечные заболевания; — недостаток двигательной и эмоциональной активности детей; — недостаточное ультрафиолетовое облучение; — дефицит поступления в организм витаминов В1, В5, В6, С, А, Е (полигиповитаминоз), дефицит микроэлементов (магния, цинка, железа, меди и т. д.). Причинами витамин-D-резистентного рахита являются: — отсутствие выработки 1,25-дигидрооксихолекальциферола (витамина D) при почечной недостаточности; — повышение потери фосфора (при гипофосфатемии, синдроме Фанкони); — отсутствие щелочной фосфатазы при гипофосфатазии (редко). Предрасполагающими факторами являются: — повышенная потребность в витамине D детей раннего возраста (особенно первого года жизни), связанная с их усиленным ростом и интенсивным формированием скелета; — патология беременности (см.) и различные экстрагенитальные заболевания матери; — нерациональное вскармливание — избыток в питании углеводов или белков; — искусственное вскармливание (соотношение фосфора и кальция в коровьем молоке не соответствует потребностям детского организма); — желудочно-кишечные и инфекционные заболевания, приводящие к развитию ацидоза (что нарушает процессы оссификации (костеобразования)); — недостаточное пребывание на воздухе; — чрезмерное укутывание, запыленность воздуха, рассеянный свет (затрудняет внутреннее образование витамина D в детском организме).
Патогенез Подвижное равновесие уровней фосфора и кальция в крови и костной ткани (основное депо этих элементов в организме) регулируется паратгормоном паращитовидных желез и тиреокальцитонином щитовидной железы. Важную роль в фосфорно-кальциевом обмене играет витамин D, который поступает в организм с пищей или образуется в коже под влиянием ультрафиолетового облучения и представляет собой малоактивное соединение. Воздействуют на организм его активные производные, биологическая активность которых в десятки и сотни раз выше активности исходного витамина D. В коже под влиянием ультрафиолетовых лучей образуется витамин D3, производные которого являются активным антирахитическим средством. Таким образом, витамин D является предшественником по крайней мере трех гормонов, регулирующих всасывание кальция и фосфатов и минерализацию кости. Недостаток одного из производных D3 вызывает снижение образования кальцийсвязывающего белка и всасывания солей кальция в кишечнике. Недостаток кальция и магния ведет к усилению функции околощитовидных желез. Влияние витамина D на обмен кальция в организме зависит и от других факторов: уровня гормонов, электролитного обмена и функционального состояния органов. Паратгормон стимулирует всасывание кальция в кишечнике, всасывание кальция из кости, тем самым ликвидируя гипокальциемию (недостаток кальция). Поэтому понятно, что гипофосфатемия (недостаток фосфатов) — более ранний признак рахита, чем гипокальциемия, которая развивается лишь при тяжелом течении болезни. При рахите также нарастает активность щелочной фосфатазы в сыворотке крови, но роль ее еще окончательно не выяснена. Бесспорна роль нарушения обмена лимонной кислоты в механизме развития рахита. Увеличение концентрации цитрата на границе «кость — кровь» облегчает транспорт кальция в кровь и из кости. Недостаток витамина D усиливает выделение с мочой аминокислот, нарушает структуру органической матрицы кости — коллагена. В результате нарушений фосфорно-кальциевого обмена появляются патологические изменения в зоне роста, обызвествление, размягчение и деформация костей, избыточное развитие костной необызвествленной ткани. Нарушаются и другие виды обмена (белковый, углеводный, жировой), возникают расстройства функций нервной системы и внутренних органов. Определенную роль играют семейное предрасположение и индивидуальные особенности ребенка.
Клиническая картина Клинически выделяют следующие формы рахита. I. Витамин^-дефицитный рахит: — кальцийпенический вариант; — фосфорпенический вариант. II. Витамин^-зависимый рахит (псевдодефицитный): — тип 1-й — наследственный дефект образования в почках 1,25-диоксивитамина D; — тип 2-й — генетическая устойчивость рецепторов органов-мишеней к 1,25-оксивитамину D. III. Витамин^-резистентный рахит: — семейный врожденный гипофосфатный рахит, или фосфат-диабет; — болезнь Дебре — де Тони — Фанкони; — почечный тубулярный ацидоз; — гипофосфатазия. IV. Вторичный рахит: — синдром мальабсорбции; — при болезнях обмена веществ; — спровоцированный фенобарбиталом либо другими противосудорожными препаратами или глюкокортикоидами.
Первичные рахиты Клиническая картина рахита зависит от тяжести процесса (легкий, средней тяжести, тяжелый), характера течения (острое, подострое, рецидивирующее) и периода болезни (начальный, разгара, восстановления, остаточных явлений). Симптоматика менее выражена при легком течении болезни (I степень) и наблюдается преимущественно со стороны нервной и костной систем; при II степени (состояние средней тяжести) к последним присоединяются патологические нарушения со сторонымышечной и кроветворной систем, вторичные изменения со стороны органов дыхания, сердечно-сосудистой системы, а также желудочно-кишечного тракта; III степень (тяжелая) клинически дает резкие изменения со стороны всех перечисленных выше органов и систем. По характеру течения рахит может быть острым, подострым и рецидивирующим, что предопределяет различие в проведении лечебных мероприятий. Острое течение рахита наблюдается чаще в первом полугодии жизни, особенно у крупных детей. Оно характеризуется прогрессирующим течением с поражением нервной, костной и других систем; преобладанием процессов остеомаляции (размягчения костной ткани) над процессами остеоидной гиперплазии (усиленного разрастания костной ткани) либо гипогенеза (замедленного костеобразования); уменьшением уровня фосфора в крови, повышением активности щелочной фосфатазы. Подострый рахит отличается медленным и вялым развитием болезни, преобладанием симптомов остеоидной гиперплазии, мышечной гипотонией и анемией (см.). Рецидивирующий рахит проявляется повторным обострением уже затихающего процесса, что может быть вызвано изменением характера питания, особенностями ухода, недостаточным пребыванием на свежем воздухе, неадекватными лечением и профилактикой, повторными инфекционными заболеваниями. В начальном периоде рахита клиническая картина проявляется в основном расстройствами нервной системы: изменяется настроение и поведение ребенка, он становится капризным и раздражительным, пугливым (особенно при засыпании), появляется повышение чувствительности, заметно нарушается сон. Одновременно с этим повышается сосудодвигательная возбудимость кожи — усиливаются красный дермографизм и потливость. Потливость выражена прежде всего при кормлении и во сне, наиболее сильно потеют лицо и волосистая часть головы. Пот становится липким, с неприятным запахом, раздражает кожу. Ребенок беспрерывно трет голову о подушку, в результате чего волосы на затылке выпадают и появляется облысение затылка. На голове появляется четкий рисунок подкожных вен. Стул становится неустойчивым, моча приобретает резкий аммиачный запах. Красный дермографизм держится дольше обычного. Отмечаются легкая податливость краев большого родничка и костей черепа по ходу стреловидного и ламбдовидного швов и мышечная гипотония. Уровень кальция в крови остается в пределах нормы, а содержание фосфора несколько снижается. Нарастает активность щелочной фосфатазы, увеличивается выделение с мочой аммиака, аминокислот и фосфатов. Начальный период отчетливо проявляется у ребенка в возрасте 3–6 месяцев, хотя первые симптомы могут появиться и раньше — в 1,5–2 месяца. Начальный период рахита длится от 1,5 недель до 1 месяца и переходит в период разгара (цветущий рахит). В период разгара болезни отмечаются более выраженные нервно-мышечно-вегетативные расстройства, а также вовлечение в процесс внутренних органов. Ребенок становится вялым, малоподвижным, усиливается гипотония мышц и связочного аппарата, движения в конечностях становятся как бы разболтанными. Развиваются четкие изменения со стороны скелета. К легкости и податливости краев родничков и швов присоединяется размягчение плоских костей черепа: вдоль ламбдовидного шва и задних отделов теменных костей (реже в области чешуи затылочной кости) появляются участки размягчения величиной 15–20 см, дающие при надавливании ощущение толстого пергамента или тонкой целлулоидной пластинки. Мягкий череп меняет конфигурацию: уплощается затылок, возникает асимметрия головы. В результате избыточного образования новой костной ткани, которая не обызвествляется сразу, начинают выступать более отчетливо лобные и теменные бугры, а весь череп приобретает угловатую форму (квадратная голова); иногда западает переносица (седловидный нос) или сильно выступает лоб («олимпийский лоб»). При этом появляется экзофтальм (пучеглазие). Замедляется прорезывание зубов, изменяется его порядок, нарушается прикус, появляются дефекты эмали и кариес (см.). Большой родничок закрывается только в возрасте 1,5–2 лет или позже. В результате усиленного образования новой костной ткани на границе костной и хрящевой части ребер появляются утолщения, усиливается кривизна ключиц; грудная клетка за счет процессов размягчения становится мягкой и деформируется: она выглядит сдавленной с боков. На поверхности грудной клетки соответственно линии прикрепления диафрагмы появляется вдавление — гаррисонова (или перипневмоническая) борозда. В тяжелых случаях передняя часть грудной клетки вместе с грудиной несколько выпячивается кпереди — возникает так называемая куриная, или килевидная, грудь. В поясничном отделе позвоночника появляется кифоз (см.) — рахитический горб. В дальнейшем, когда ребенок начинает ходить, иногда присоединяются лордоз (см.), а в некоторых случаях — сколиоз (см.). В результате разрастания эпифизарного хряща и расширения метафизов у детей старше 6–8 месяцев наблюдаются утолщения эпифизов костей предплечья («рахитические браслеты») и голеней, фаланги пальцев также утолщаются, создавая так называемые «нити жемчуга». Кости нижних конечностей искривляются в виде буквы О (варусная деформация), реже — в виде буквы Х (вальгусная деформация). Почти всегда наблюдается плоскостопие. Таз деформируется довольно редко. В зависимости от тяжести рахитических явлений и времени их возникновения возможны самые разнообразные деформации нижних конечностей.
Поднадкостничные переломы при рахите
На рентгенограммах граница между эпифизом и диафизом трубчатых костей становится неровной, бахромчатой. Увеличивается щель между эпифизом и диафизом, эпифиз приобретает блюдцеобразную выгнутость. Для рахита характерны изменения со стороны мышечно-связочного аппарата: вялость и дряблость мышц, разболтанность суставов. Больной ребенок в положении на спине легко притягивает ногу к голове, даже кладет стопу на плечо. Вследствие расхождения прямых мышц живота и дряблости живот как бы распластывается — лягушачий живот. Задерживается развитие костно-мышечной системы: дети начинают позже держать голову, сидеть, вставать и ходить; пассивные движения обычно вызывают у них отрицательную реакцию, по-видимому, за счет имеющейся у них повышенной чувствительности. Деформация грудной клетки, снижение тонуса мышц, несколько вялые движения диафрагмы и изменения со стороны нервной системы нарушают легочную вентиляцию. В период разгара заболевания могут возникать одышка, ателектазы, легко развиться пневмония (см.). Также развиваются дистрофические изменения со стороны сердца — так называемое «рахитическое сердце» имеет расширенные вправо границы за счет увеличения сердечных полостей. Тоны сердца приглушены, пульс учащен, артериальное давление снижено. При рахите тяжелой степени нарушено функциональное состояние печени и желудочно-кишечного тракта, страдают белковый и жировой обмен, имеется дефицит витаминов В1, В6, В5, А, Е, С. За счет нарушения двигательной и секреторной функции желудочно-кишечного тракта при рахите в период разгара отмечаются нарушения аппетита, активности ферментов в сторону снижения, отмечается неустойчивость стула. Возможны нарушения функции почек и эндокринных желез. У большинства детей с рахитом II и III степени наблюдаются явления гипохромной анемии (см.), в генезе (происхождении) которой решающую роль играет дефицит железа и аминокислот. Происходит нарушение иммунитета, что способствует развитию у детей с рахитом острых респираторных и желудочно-кишечных заболеваний. При исследовании крови выражены биохимические изменения: по сравнению с нормой снижается концентрация в сыворотке крови неорганического фосфора, увеличивается активность щелочной фосфатазы, уровень же кальция в сыворотке крови остается в пределах нормы или несколько снижается, уменьшается концентрация в крови лимонной кислоты, увеличивается выведение с мочой фосфатов, аммиака, некоторых аминокислот. При снижении в крови ионизированного кальция могут возникнуть судороги. В периоде восстановления или остаточных явлений происходит обратное развитие симптомов, причем ликвидация основных клинических проявлений наступает иногда раньше нормализации биохимических показателей фосфорно-кальциевого обмена. В период репарации (выздоровления) у ребенка исчезают признаки активности рахита (симптомы нарушения состояния нервной системы, мягкость костей, мышечная гипотония, анемия (см.) и др.). Период остаточных явлений диагностируется, как правило, у детей в возрасте 2–3 лет и старше, когда нет признаков активного рахита, лабораторных отклонений, а имеются только последствия перенесенного рахита II–III степени (деформация костей, изменение размеров печени и селезенки). Развитие клинических проявлений у недоношенных детей имеет ряд особенностей. Признаки заболевания у них обнаруживаются намного раньше, чем у доношенных: на 4—6-й неделе жизни. Первым признаком является краниотабес, который считается патологическим симптомом лишь в тех случаях, когда уже имелось затвердение костей, а затем наступило размягчение (следует дифференцировать с псевдокраниотабесом — физиологической мягкостью костей за счет недостаточности первичного отложения кальция в кости). Часто уже на 2-м месяце жизни появляются рахитические четки, а потливость — лишь на 3—4-м месяце; лягушачий живот регистрируется после 3-го месяца, а облысение — на 4—5-м месяце. У недоношенных детей при тяжелом течении болезни возможны поднадкостничные переломы по типу «зеленой веточки».
Вторичные рахиты Среди вторичных рахитов, развивающихся у детей, нередко встречаются: печеночный рахит, рахит, сопровождающий судорожную терапию, рахит при гипофосфатазии, рахит при почечном тубулярном ацидозе и других нарушениях обмена веществ. Печеночный рахит развивается при внепеченочной атрезии желчных путей, когда нарушение секреции желчных солей приводит к нарушению всасывания (абсорбции) витамина D и других жирорастворимых витаминов. Рахит может сопровождать гепатит (см.) новорожденных или вызывать повреждение клеток печени в результате того, что ребенок находился на искусственном вскармливании. Рахит, сопровождающий противосудорожную терапию, встречается у детей, длительно получающих противосудорожные препараты. Несмотря на адекватное поступление в организм витамина D, развивается дефицитный по кальцию рахит. Это происходит вследствие того, что противосудорожные препараты активируют печеночный цитохром, а провитамин D превращается в неактивные производные. Такое состояние возникает особенно часто при сочетании фенобарбитала и дифенина. Для рахита при гипофосфатазии характерны искривление ног и низкорослость. Клинические проявления иногда спонтанно исчезают по мере созревания ребенка. Рентгенологическая картина заболевания сходна с первичным рахитом. Диагностическим признаком иногда служит лишь снижение активной фосфатазы в сыворотке крови. Как механизм развития гипофосфатазия представляет собой наследственное заболевание, отмечающееся низкой активностью щелочной фосфатазы, приводящей к нарушению фосфорно-кальциевого обмена и почечной недостаточности. Вторичный рахит, наступающий вследствие почечного тубулярного ацидоза, возникает у детей с хронической почечной недостаточностью из-за изменений минерального обмена и обмена веществ в кости. Эти изменения приводят к нарушению всасывания кальция, повышенной функции паращитовидных желез, обызвествлению сосудов кожи и внутренних органов, нарушению образования в почках биологически активного витамина D. К ранним симптомам вторичного рахита относится замедление роста. Отставание в росте иногда происходит без рентгенологических изменений скелета. При прогрессировании процесса развиваются мышечная слабость, боли в костях, деформация костей, смещение эпифизов и переломы в области метафизов. Особенно заметны у детей искривления коленного сустава, выступающие лобные кости, патологические изменения роста зубов.
Диагностика и дифдиагностика Для установления диагноза рахита, его периода и степени тяжести болезни прибегают, кроме оценки клинических проявлений, к биохимическому исследованию крови (содержание уровня кальция фосфора, цитратов, активность щелочной фосфатазы и др.). Рентгенологические исследования скелета, в первую очередь рентгенограмма запястий, помогают в диагностике рахита в период разгара болезни, в дальнейшем проводят рентгенологическое исследование и других костей скелета. Проводится также исследование мочи (реакция Сульковича) на содержание кальция. Характерны рентгенологические изменения: — расширение концов диафизов длинных костей; — расширение реберно-хрящевых сочленений (рахитические четки); — мягкий и выпуклый череп с боковым утолщением в большей степени, чем у доношенных; — относительно большие размеры родничка вследствие плохого развития костей черепа; — надломы (трещины) ребер и (или) длинных костей; — выраженный остеопороз (см.) (разрежение) всех костей; — гиперемия концов метафизов воспалительного генеза; — отсутствие контурирования концов метафизов; — признаки раннего заживления с развитием начальной линии кальциноза (см.). В биохимическом анализе крови отмечаются: выраженное повышение показателей щелочной фосфатазы, низкое содержание фосфора в плазме и низкие или нормальные показатели содержания кальция в крови. Иногда повышенный уровень щелочной фосфатазы является ранним указанием на наличие у недоношенного ребенка рахита. Дифференциальную диагностику проводят с рахитоподобными заболеваниями: хондродистрофией, врожденной ломкостью костей, почечно-тубулярным ацидозом, фосфат-диабетом, болезнью Дебре-де Тони-Фанкони, гипотиреозом, болезнью Дауна (см.) и другими.
Лечение Лечение рахита должно быть строго индивидуальным и зависит от степени тяжести, периода болезни и его течения, возраста ребенка, степени его доношенности, сезона года, климатических и материально-бытовых условий жизни ребенка. Лечение этого заболевания комплексное и включает в себя организацию диетического и гигиенического режима; проведение специфического лечения; проведение физиотерапии (ультрафиолетовое облучение, диатермия мышц и костей, соляно-хвойные ванны и др.); проведение закаливающих мероприятий (максимальное пребывание на свежем воздухе, морские и солнечные ванны); лечебный массаж и гимнастику. В организации питания при лечении рахита рекомендуется сбалансированная диета по содержанию белков, жиров и углеводов, преобладание продуктов, богатых витаминами и минеральными веществами, в частности кальцием, фосфором, магнием и т. д. Составлять рацион следует так, чтобы потребность в витамине D была минимальной. Следует ограничивать в питании каши и мучные изделия, своевременно вводить овощные и фруктовые соки, пюре. К овощному пюре необходимо добавлять сваренный вкрутую желток, богатый жирорастворимыми витаминами и витаминами группы В, а также фосфором, кальцием, микроэлементами. При искусственном вскармливании важно учитывать содержание витамина D в заменителях грудного молока — адаптированных молочных смесях. Гигиенический режим, кроме соблюдения режима питания, включает в себя организацию сна, прогулок, физическое и психомоторное развитие ребенка, а также закаливающие процедуры. Специфическое лечение витамин-D-зависимого рахита заключается в назначении витамина D и заменяющих его препаратов. Существует много рецептов лечебного назначения витамина D. Перорально эргокальциферол (витамин D2) назначают только при нарушениях всасывания. При лечении рахита можно использовать терапевтический режим, при котором 2–5 тыс. МЕ эргокальциферола назначают ребенку на протяжении 4–8 недель, а затем в профилактической дозе — по 400 МЕ в день до исчезновения клинических проявлений. В течение года допустимо лишь проведение одного терапевтического курса с последующей профилактически поддерживающей дозой. Вторым способом назначения эргокальциферола может быть stoss-терапия (или толчковая терапия). Она заключается в назначении 400–600 тыс. МЕ для перорального приема в один или более (до 6) приемов витамина D2 в сутки. При отсутствии ощутимого клинического эффекта лечение повторяют через 10–30 дней. Однако второй способ чаще приводит к развитию гипокальциемии, поэтому его применение нефизиологично. Пероральное применение эргокальциферола в терапии рахита требует постоянного контроля содержания уровня кальция в крови. Одновременно с витамином D2 не рекомендуется назначать препараты кальция, ультрафиолетовое облучение. Препараты кальция (глюконат кальция, глицерофосфат кальция) назначают только при имеющейся гипокальциемии, а ультрафиолетовое облучение — только после окончания терапевтического режима, спустя 1–2 месяца, главным образом в осенне-зимнее время. В комплекс медикаментозного лечения рахита обязательно должны входить витамины (аскорбиновая кислота, витамины А, В1, В2, В6, В5, В15, Е), а также адаптогены, такие, как дибазол и глютаминовая кислота. Недоношенным детям назначают цитратные смеси следующего состава: цитрат натрия — 3 г, лимонная кислота — 2 г, сироп простой — 20 мл, вода дистиллированная — до 200 мл; принимать по 1 ч. л. 3 раза в день. При лечении рахита у недоношенных детей также обычно повышают содержание минеральных веществ путем добавления 10–15 мл нейтрального фосфора на 100 мл молока (смеси); в случае внутривенной терапии добавляют фосфор во вводимую смесь. Детям, у которых отмечаются падения показателей содержания фосфора в сыворотке крови, а также нарастание активности щелочной фосфатазы (свыше 800 ЕД), показано дополнительное введение фосфора до того, как разовьется болезнь костей. При рахите в период восстановления и при выраженных остаточных явлениях широко применяют физиопроцедуры: хлоридно-натриевые (соляные) ванны, аппликации парафина, торфа, песка (при выраженной гипотрофии мышц). В зависимости от сезона применяются ультрафиолетовое облучение, морские и солнечные ванны. Широко применяются лечебный массаж и гимнастика. Ультрафиолетовое облучение проводится курсом из 15–20 сеансов, назначаемых через день с постепенным увеличением экспозиции. Первый сеанс назначают детям до 3 месяцев начиная с 1/8 биодозы, с 3 месяцев — с 1/4 биодозы, через каждые 2 сеанса увеличивают биодозу на 1/8 или 1/4. В разгар болезни курс повторяют через 2–3 месяца. Массаж и гимнастику применяют во все периоды, за исключением острой стадии. Нежелательные эффекты при приеме витамина D возникают при чрезмерных дозах, например при ударном назначении витамина D, когда за 2—10 дней вводят курсовую дозу. Гипервитаминоз легко возникает у детей, находящихся на искусственном вскармливании, перенесших родовую травму, при одновременном вскармливании смесями «Малыш», «Малютка», «Виталакт» и др., которые содержат в своем составе витамин D, а также у детей, чьи матери получали большие дозы витамина D. При гипервитаминозе происходит интенсивное всасывание кальция из кишечника и рассасывание костей, в результате чего возникает гиперкальциемия, повреждаются клеточные мембраны и нарушаются функции различных органов (сердце, почки, печень). Нарушается нормальный транспорт ионов калия и магния через клеточные мембраны. Возникает дефицит ионов в тканях, что ведет к нарушению сократительной деятельности сердца, развитию сердечной недостаточности. Для ликвидации гипервитаминоза витамина D большое значение имеет назначение витаминов А и Е, которые стабилизируют клеточные мембраны и блокируют проникновение кальция в ткани. Необходимо также назначение фуросемида, ускоряющего выведение кальция с мочой, и кальцитрина — препарата кальцитонина, препятствующего рассасыванию костной ткани. Одновременно назначают препараты, увеличивающие щелочные резервы, ликвидирующие ацидоз (натрия гидрокарбонат и т. д.), аспаркам, диету с ограничением кальция.
Профилактика Антенатальная профилактика Профилактику рахита надо начинать еще до рождения ребенка. Она заключается в назначении беременной женщине полноценного сбалансированного питания, обогащенного витаминами и микроэлементами, правильном чередовании труда и отдыха, соблюдении гигиенических норм и здоровом образе жизни, использовании естественных природных факторов (длительные прогулки). В последний триместр беременности (см.) для профилактики рахита у будущего ребенка показано ультрафиолетовое облучение, особенно если он приходится на осенне-зимнее время (10–15 сеансов). Рекомендован прием поливитаминных препаратов, куда обязательно должен входить витамин D (гендевит, «Матерна» и др.). Минимальная суточная потребность беременной в витамине D — 500 МЕ эргокальциферола. При неблагоприятных бытовых и геофизических условиях в последние 2 месяца беременности доза витамина D может быть увеличена до 1000 МЕ в день.
Постнатальная профилактика Профилактика начинается с первых дней жизни: борьба за естественное вскармливание с дальнейшим своевременным введением желтка, соков и прикормов, закаливание, массаж и гимнастика, максимальное пребывание на свежем воздухе. Специфическую профилактику витамином D следует проводить с осторожностью, чтобы не вызывать передозировки. Недоношенным детям витамин D назначают с 2—3-недельного возраста в дозе 500 МЕ в день и проводят лечение круглогодично в сочетании с поливитаминами (С, В1, В2, В5 и т. д.). Назначение витамина D должно сочетаться с назначением ультрафиолетового облучения (15–20 сеансов в год в осеннезимний период). При неблагоприятных условиях доза витамина может быть увеличена до 800—1000 ЕД (не более 1600 МЕ), но только при нахождении ребенка в неонаталогическом отделении; при выписке из него доза уменьшается до 400–500 МЕ. Недоношенные дети, находящиеся на грудном вскармливании, с целью профилактики рахита с первых дней жизни дополнительно должны получать фосфор; находящимся на искусственном вскармливании рекомендованы молочные смеси, обогащенные фосфором. Рекомендуется также дополнительное обогащение грудного молока (или адаптированной смеси) кальцием в количестве 20–40 мг на 100 мл. Доношенным детям, получающим адаптированные молочные смеси, куда входит термостабильный витамин D2, специфическую профилактику витамином D не проводят.
РВОТА
ОпределениеРвота — сложный рефлекторный акт, приводящий к извержению содержимого желудка (иногда вместе с содержимым кишечника) через рот. В физиологическом отношении рвота в большинстве случаев является защитной реакцией организма, направленной на удаление из него токсических или раздражающих веществ. Рвоте может предшествовать тошнота, сопровождающаяся вегетососудистыми реакциями.
Этиология Рвота и предшествующая ей тошнота связаны с возбуждением рвотного центра, расположенного на дне четвертого желудочка головного мозга. Она может возникать при заболевании органов брюшной полости (гастрит (см.), язвенная болезнь (см.), дуоденит (см.), холецистит (см.), диафрагмальная грыжа (см.), острых хирургических заболеваниях (аппендицит (см.), непроходимость кишечника (см.), желчные и почечные колики (см.)), инфекционных заболеваниях (дизентерия (см.), грипп (см.), менингит (см.), энцефалит (см.)), функциональных нарушениях нервной системы (мигрень (см.), невропатия, сотрясение головного мозга), поездках в транспорте, заболеваниях обмена веществ (сахарный диабет (см.), уремия (см.)), недостаточности кровообращения (см.), отравлениях (см.). Рвота может возникать под влиянием психических стимулов, при рефлекторном возбуждении рвотного центра за счет раздражения так называемых рвотных зон (глотка, корень языка, стенки желудка, брюшина, желчные протоки, брыжеечные сосуды и др.), при нарушениях вестибулярного аппарата или вследствие раздражения пусковой зоны, находящейся рядом с рвотным центром, различными раздражающими агентами, попавшими в кровь.
Патогенез Многообразие причин рвоты исключает ее специфичность как симптома определенной патологии. По механизму развития выделяют по меньшей мере три варианта рвоты: центральную (нервную, мозговую), гематогенно-токсическую и висцеральную (рефлекторную) рвоту. Центральная рвота наблюдается при органических заболеваниях головного мозга и его оболочек (при опухолях (см.), менингите (см.), энцефалите (см.), абсцессах (см.) и др.), черепномозговой травме (см.), отеке мозга, церебральных сосудистых кризах, мигрени (см.). Близкой этому варианту можно считать рвоту при поражении лабиринта внутреннего уха, глаукоме (см.). Особое место занимает психогенная рвота при психических болезнях, неврозах (см.), стрессовых ситуациях и как результат условного рефлекса на какой-нибудь продукт или его свойства. Гематогенно-токсическая рвота возникает при накоплении в крови продуктов нарушенного обмена (уремия (см.), сахарный диабет (см.), кетоацидоз, печеночная недостаточность и др.) или при попадании в кровь различных ядов и раздражающих веществ (угарный газ, алкоголь, грибы, ядовитые растения), токсинов микробного и вирусного происхождения (при токсикоинфекциях (см.), гриппе (см.), менингококцемии), а также лекарственных веществ (антибиотики, сульфаниламиды, сердечные гликозиды и др.). Висцеральная рвота, как правило, связана с патологией кишечного тракта, чаще всего она наблюдается при остром и хроническом гастрите (см.), язвенной болезни (см.), холецистите (см.), панкреатите (см.) и т. д. Часто обнаруживается связь рвоты при этих заболеваниях с приемом пищи. Без определенной связи с приемом пищи висцеральная рвота наблюдается при синдроме острого живота (аппендицит (см.), тромбоз мезентеральных сосудов и др.).
Клиническая картина Обычно рвоте предшествует тошнота — неприятное ощущение, сопровождающееся сосудисто-нервными реакциями: побледнением, слабостью, головокружением, чувством тяжести в желудке, шумом в ушах, потливостью, саливацией. Возможны как тошнота без рвоты, так и рвота без предшествующей тошноты. Клинически рвота является симптомом определенной патологии; немаловажное диагностическое значение имеет связь рвоты с приемом пищи. Так, утренняя рвота, рвота натощак или ранняя рвота (наступающая сразу после еды) характерны для гастрита (см.), язвенной болезни (см.) желудка. Поздняя рвота (наступающая спустя несколько часов после еды) наблюдается при пилородуоденальных язвах, дуодените (см.), панкреатите (см.), холецистите (см.). Выделяют также ночную рвоту, циклическую рвоту, не связанную с приемом пищи, при которых важно анализировать характер рвотных масс. При хронических эзофагитах (см.) рвота может представлять собой пассивные вытекания пищеводного содержимого в рот без предшествующей тошноты и без участия мышц передней брюшной стенки (пищеводная рвота). Кроме того, рвота может быть однократной, многократной, циклической, неукротимой, упорной. В зависимости от происхождения рвота может начинаться без предшествующей тошноты и болей в животе. Это происходит, например, при органической патологии центральной нервной системы. Извержение рвотных масс, состоящих, как правило, из недавно съеденной пищи без патологических примесей, наступает внезапно. Психогенная рвота часто распознается по анамнезу (больные сами указывают ее причину), иногда она сочетается с анорексией. Для гематогенно-токсической рвоты, вызванной экзогенными ядами, характерны предшествующая выраженная тошнота, повторяемость рвотных актов (вплоть до неукротимой рвоты). Кроме рвоты, наблюдаются и другие признаки общей интоксикации. Особое значение имеет кровавая рвота. Кровавая рвота (гематемезис) — симптом острого кровотечения из верхних отделов желудочно-кишечного тракта. Возникновение кровавой рвоты всегда связано с попаданием крови в полость желудка. Причиной кровавой рвоты чаще всего являются кровотечения из язвы желудка, из варикозно расширенных вен пищевода и желудка при повышении давления в верхней брыжеечной вене у больных циррозом печени (см.) или из полипов желудка. Реже источником кровотечений бывают язвы двенадцатиперстной кишки, трофические эрозии и язвы желудка у больных с сердечной недостаточностью (см.) и кислородной недостаточностью (в том числе и при инфаркте миокарда (см.)), эрозии и язвы пищевода, вызванные приемом лекарственных средств (в частности, аспирина). Кровавая рвота наблюдается при диапедезных кровотечениях из стенки желудка при синдроме острого его расширения, а также при геморрагических васкулитах (см.) и болезнях, сопровождающихся нарушениями свертываемости крови (гемофилия (см.), лейкозы (см.), уремия (см.), сепсис (см.), геморрагические диатезы (см.)). К очень редким причинам кровавой рвоты относятся ранения и ожоги (см.) пищевода и желудка. Кровавую рвоту распознают по окраске рвотных масс; сопутствующим признаком кровопотери в желудочно-кишечном тракте является дегтеобразный стул — мелена. Кроме рвоты, больные при кровотечениях из желудочно-кишечного тракта жалуются на слабость и головокружения. Отмечаются бледность кожных покровов, влажность в виде холодного липкого пота, снижение артериального давления, учащенное дыхание. Может наступить коллапс (см.). Окраска рвотных масс при кровавой рвоте зависит от длительности нахождения крови в желудке и секреции в нем соляной кислоты. Если пребывание крови в желудке непродолжительно или в нем отсутствует соляная кислота (при ахилии), то рвотные массы состоят из малоизмененной жидкой крови или ее рыхлых сгустков. Такая кровавая рвота распознается без труда. При продолжительном пребывании крови в желудке и под влиянием соляной кислоты образуется солянокислый гематин, придающий рвотным массам коричневатый цвет (вид кофейной гущи). При обильном кровотечении с повреждением крупного сосуда рвотные массы содержат большое количество алой крови. При беременности (см.) и токсикозах возникает рвота беременных. Рвота беременных — одна из форм раннего токсикоза, проявляющаяся тошнотой, понижением аппетита, изменением вкусовых и обонятельных ощущений. Легкие формы рвоты беременных обычно не отражаются на общем состоянии больных. При состояниях средней тяжести рвота повторяется до 10–12 раз в сутки, отмечаются общая слабость, потеря массы тела, снижение аппетита, уменьшение мочевыделения. Рвота до 20 раз в сутки и более — это неукротимая рвота. При ней быстро наступают истощение и упадок сил, прогрессирует потеря массы тела, отмечается снижение аппетита вплоть до анорексии. Снижается артериальное давление, развивается тахикардия (см.); такое состояние может осложняться обезвоживанием организма.
Рвота у детей Рвота у детей наблюдается чаще, чем у взрослых, и возникает тем легче, чем меньше ребенок. У новорожденных и детей грудного возраста появляются срыгивания. Срыгивания отличаются от рвоты тем, что при этом съеденная пища выделяется без усилий и выраженных сокращений мускулатуры брюшной стенки. Общее состояние не нарушается, выбросы желудочного содержимого менее энергичны, ребенок как бы срыгивает молоко изо рта сразу или через небольшой промежуток времени после кормления. Срыгивания не сопровождаются вегетативными симптомами, не отражаются на поведении, аппетите, настроении ребенка. Склонность к срыгиваниям — одна из характерных черт новорожденных и детей первых месяцев жизни. Это обусловлено определенными особенностями строения верхних отделов пищеварительного тракта в этом возрасте: слабостью кардиального сфинктера при хорошо развитом пилорическом, горизонтальным расположением желудка и его формой в виде мешка, высоким давлением в брюшной полости, наконец горизонтальным положением самого ребенка и большим объемом питания, которое он начинает получать уже к двухнедельному возрасту (1/5 массы тела в сутки). Срыгиваниям в этом возрасте обычно способствуют перекармливание и заглатывание воздуха. Срыгивания и рвота у детей могут быть важными симптомами ряда заболеваний. Рвоту у детей можно разделить на две большие группы: — первичная, когда причина находится в желудочно-кишечном тракте; — вторичная, когда причина находится вне пищеварительного тракта. С точки зрения лечебных мероприятий, желудочно-кишечные формы рвоты, в свою очередь, подразделяются на функциональные и органические. Последние у новорожденных сводятся к врожденным порокам развития (см.) желудочно-кишечного тракта. Вторичную (симптоматическую) рвоту можно условно разделить на инфекционную, связанную с церебральной патологией и с нарушением обмена веществ. Первичные (желудочно-кишечные) формы рвоты, в частности функциональная рвота, возникают в результате разнообразных нарушений регуляции. Наиболее частой функциональной патологией является недостаточность кардии (халазия кардии, недостаточность нижнего пищеводного сфинктера). Недостаточность кардии может быть следствием нарушения иннервации нижней части пищевода (при перинатальной энцефалопатии), дисбаланса гастроинтестинальных гормонов (гастрина, секретина, холецистокинина, мотилина), а также повышения внутрибрюшного и внутрижелудочного давления при целом ряде заболеваний. При несмыкании нижнего пищеводного сфинктера нарушается желудочно-пищеводный барьер в дополнение к патологическому рефлюксу и эзофагиту (см.). Срыгивания при недостаточности кардии возникают сразу после кормления в горизонтальном положении, они частые и необильные. Рефлюкс-эзофагит при этой патологии может вызывать у новорожденных приступ сердечно-сосудистой недостаточности (см.). У новорожденных рвота может проявляться беспокойством, отказом от еды, высовыванием кончика языка, выталкиванием соска, бледностью кожных покровов. Ахалазия пищевода (кардиоспазм) — стойкое сужение кардиального отдела в результате нарушения интрамуральной иннервации. Причинами этого служат: врожденное отсутствие или дефицит нейронов в ганглиях межмышечного (ауэрбахова) сплетения на протяжении пищевода и гибель этих клеток под воздействием внешних и внутренних факторов. При этом нарушается содружественное открытие кардии при глотании, отмечается атония пищевода на всем его протяжении, пища задерживается над спазмированной кардией, постепенно нарастает расширение пищевода. Клинически это проявляется рвотой во время кормления только что съеденным молоком без примесей желудочного содержимого, а также некоторым затруднением глотания, как будто ребенок «давится» во время еды. Пилороспазм — спазм мускулатуры привратника, обусловливающий затруднение опорожнения желудка. Причина заключается в повышенном тонусе симпатического отдела нервной системы вследствие дородовой, родовой и послеродовой энцефалопатии и кислородной недостаточности. Обычно дети с пилороспазмом имеют признаки повышенной возбудимости, плохо прибавляют в массе. Срыгивания у них появляются с первых дней жизни, но вначале они непостоянны. По мере нарастания объема питания пилороспазм вызывает рвотный синдром. Рвота появляется ежедневно, частота ее в течение суток варьирует. Рвотные массы довольно обильные, представляют собой створоженное кислое содержимое без примеси желчи, однако объем их не превышает объема съеденной пищи. Стул при пилороспазме остается нормальным. Прибавка в массе недостаточна, развивается гипотрофия. Острый гастрит (см.) у новорожденных может быть обусловлен пищевыми (перевод на искусственное вскармливание, неправильное приготовление смеси) и медикаментозными причинами (антибиотики, эуфиллин, противовоспалительные препараты внутрь), а также инфекцией (заглатывание инфицированных околоплодных вод) и несоблюдением санитарно-гигиенических требований при уходе за ребенком. Срыгивания и рвоты при остром гастрите обычно бывают створоженным молоком, беспорядочные и многократные, наступают, как правило, не сразу после кормления. Нередко одновременно отмечается диарея (см.). При упорной рвоте возможно развитие обезвоживания. Функциональные срыгивания и рвота у новорожденных могут возникать и при метеоризме (см.). При этом повышается давление в брюшной полости, нарушается эвакуация из желудка, снижается тонус кардиального сфинктера. Для снятия метеоризма важно откорректировать диету, использовать адсорбенты и ферментные препараты, эубиотики и ветрогонные травы. Первичные (желудочно-кишечные) формы рвоты часто связаны с органическими поражениями (пороками развития (см.)). Различные врожденные пороки желудочно-кишечного тракта, приводящие к нарушениям проходимости пищеварительной трубки на любом ее уровне, могут сопровождаться упорным рвотным синдромом и, как правило, требуют своевременной диагностики и хирургического лечения. К таким порокам относятся: врожденная атрезия пищевода, пилоростеноз, врожденная кишечная непроходимость и др. Вторичные (симптоматические) формы рвоты наблюдаются при мозговой патологии, инфекционных заболеваниях, нарушениях обменных процессов; в этом случае рвота является одним из симптомов заболевания. При церебральной патологии рвота сочетается с другими признаками патологии центральной нервной системы: неэмоциональным монотонным слабым криком, постаныванием, выбуханием родничка и расхождением швов черепа, синдромами возбудимости или угнетения, двигательными нарушениями, судорожным синдромом и т. д. Рвотный синдром при мозговой патологии может иметь разные проявления: от упорной рвоты «фонтаном» до «неудерживания» пищи, когда она без всяких усилий выливается изо рта ребенка. Выраженность рвоты и срыгиваний, как правило, зависит от степени поражения центральной нервной системы и часто сочетается с первичными функциональными формами рвоты. В лечении рвотного синдрома на фоне церебральной патологии проводится терапия основного заболевания. Специфические противорвотные средства являются лишь вспомогательными. Рвота, связанная с инфекционными заболеваниями, такими как острые вирусные инфекции, сепсис (см.), отит (см.), пневмония (см.), нейроинфекции и кишечные инфекции, рассматривается как один из симптомов данного заболевания. Рвота, связанная с нарушением обмена веществ, развивается при следующих синдромах: — адреногенитальном (сольтеряющая форма); — дисахаридазной недостаточности, мальабсорбции глюкозы-галактозы; — галактоземии (см.); — фруктоземии; — наследственных заболеваниях аминокислотного обмена; — обменных нарушениях, связанных с врожденной патологией почек (поликистоз, гидронефроз). Обычно рвота, связанная с нарушением обмена веществ, может возникать в том случае, если ребенок начинает получать продукты, плохо переносимые организмом, — молоко, глюкозу, соки, фрукты и т. д., поэтому с лечебной целью их исключают из питания. С целью диагностики нарушений обмена веществ используют ряд биохимических исследований крови, мочи и кала, ультразвуковые исследования, оценку гормонального и ферментного уровня. Упорный рвотный синдром любого генеза (происхождения) может стать причиной серьезных осложнений. Проникновение рвотных масс в легкие может стать причиной удушья, а также вызвать развитие аспирационной пневмонии (см.). Для профилактики этих осложнений важно организовать правильный уход за ребенком. Ребенок должен быть всегда в поле зрения матери или медицинского персонала и находиться в кроватке с возвышенным головным концом под углом 30°. Обезвоживание в результате упорной рвоты может привести к сольдефицитному (гипотоническому, внеклеточному) обезвоживанию. Для лечения этого вида дегидратации прежде всего необходимо восполнить объем циркулирующей крови, нормализовать кровообращение, восполнить потерю солей. Нарушения кислотно-основного баланса при упорной рвоте могут быть различными. Коррекцию его нарушений следует проводить только при строгом контроле показателей кислотности крови, давления углекислого газа в крови и т. д. У грудных детей рвота и срыгивания могут быть обусловлены теми же причинами, что и в периоде новорожденности. У детей дошкольного и школьного возраста синдром рвоты может быть связан с заболеванием органов брюшной полости (гастрит (см.), язвенная болезнь (см.), панкреатит (см.), холецистит (см.), диафрагмальная грыжа (см.)), острыми хирургическими заболеваниями (аппендицит (см.), непроходимость кишечника (см.), желчная и почечная колики (см.)), инфекционными заболеваниями (пищевая токсикоинфекция (см.), сальмонеллез (см.), дизентерия (см.), грипп (см.) и т. д.), заболеваниями нервной системы (менингит (см.), энцефалит (см.), опухоли (см.) головного мозга), функциональными нарушениями нервной системы (сотрясение головного мозга, мигрень (см.), невропатии), кинетозами (рвота при поездке в автотранспорте), заболеваниями, связанными с нарушениями обмена веществ (кетоацидоз, уремия (см.), сахарный диабет (см.)). Кроме того, рвота может возникать при недостаточности кровообращения (см.) и отравлениях (см.). Как самостоятельная форма болезни выделяется ацетонемическая рвота при ацетонемическом кризе. У детей любого возраста чаще, чем у взрослых, наблюдается психогенная рвота. Иногда она провоцируется возбуждением или страхом. В некоторых случаях желание обратить на себя внимание приводит к демонстративной рвоте, а отвращение к пище или принудительное кормление — к самовнушаемой рвоте. Кровавая рвота у детей имеет то же диагностическое и прогностическое значение, что и у взрослых. У детей она нередко обусловлена заглатыванием крови при носовом кровотечении. Обильная рвота кровью ночью или после завтрака, часто с темно-красными сгустками, является симптомом варикозного расширения вен пищевода в результате портальной гипертензии (повышения давления в системе воротной вены). Кровавая рвота может наблюдаться и при геморрагических диатезах (см.).
Рвота ацетонемическая Такая рвота возникает у детей дошкольного и школьного возраста (2—10 лет), чаще наблюдается у детей-невропатов с нервноартритическим диатезом. Ацетонемическая рвота — это синдром тяжелой рвоты, которая нередко повторяется с определенной периодичностью и сопровождается симптоматической ацетонемией. Механизм развития заболевания до сих пор не установлен. Считается, что предрасполагающими факторами могут быть: неправильное питание, избыточное употребление в пищу жиров и экстрактивных веществ, эмоциональный шок, физическая и умственная усталость. Эти факторы предположительно влияют на возникновение в промежуточном мозге преобладающих очагов возбуждения. Неукротимая рвота приводит к глубоким нарушениям промежуточного обмена, появлению ацетона в крови и кетоновых тел в моче. Заболевание возникает после короткого предшествующего периода и проявляется потерей аппетита, беспокойством или вялостью, головной болью, запахом ацетона изо рта при дыхании. Вскоре внезапно появляется рвота, которая повторяется 5-10–20 раз в день; продолжительность приступов рвоты составляет от нескольких часов до нескольких дней. Быстро наступает острое обезвоживание организма. Глаза западают, живот втянут, отмечаются бледность и сухость кожных покровов и слизистых оболочек, учащенное сердцебиение. При тяжелом течении возможны потеря сознания, судороги. С прекращением приступов рвоты сразу появляется аппетит, быстро наступает выздоровление.
Осложнения Рвота может утяжелить течение основного заболевания и сама стать причиной ряда осложнений. Изнурительная неукротимая рвота даже при малых количествах рвотных масс может стать причиной надрыва слизистой оболочки пищевода или желудка, вследствие чего возникают кровотечения. Длительная и обильная рвота (в частности, ацетонемическая) сопровождается обезвоживанием организма и приводит к кетоацидозу (кризу). Это сопровождается снижением давления в крови, потерей ионов калия, натрия, хлоридов и т. д. Эти обменные нарушения в дальнейшем могут привести к расстройствам деятельности сердца, почек, печени и мозга. Иногда, особенно у больных с нарушенным сознанием или у детей грудного возраста, может наблюдаться проникновение рвотных масс в дыхательные пути, что может привести к удушью или (в более легких случаях) к развитию аспирационной пневмонии (см.).
Диагностика При рвоте, являющейся симптомом некоторых заболеваний, диагностическое значение имеет исследование характера рвотных масс. Проводить исследование рвотных масс желательно при каждом случае рвоты. Определяют их объем, консистенцию, цвет, запах, присутствие остатков пищи, их состав, наличие патологических примесей (крови, слизи, гноя, желчи, глистов и т. д.). По характеру рвотных масс различают рвоту свежесъеденной пищей, давно съеденной пищей, желчную, кровавую, гнойную, каловую и другие разновидности рвоты. Непереваренная пища в рвотных массах может указывать на грыжу (см.) пищеводного отверстия или ахалазию пищевода. Гнилостный запах рвотных масс может наблюдаться при распадающемся раке (см.) желудка, запах спирта — при отравлении алкоголем, запах ацетона — при ацетонемической рвоте. Каловая рвота характерна для непроходимости кишечника (см.), кровавая рвота наблюдается при кровотечениях в желудочно-кишечном тракте. Желчная рвота характеризуется обилием желчи в рвотных массах, например, при зиянии канала привратника или сужении двенадцатиперстной кишки. При необходимости проводят лабораторные исследования рвотных масс: бактериологические, химические, токсико-химические, радиационные и др. Кровавую рвоту подтверждают исследованием рвотных масс на содержание в них крови (бензидиновая проба, гваяковая проба и др.). Также для исследования причин возникновения рвоты проводят инструментальные исследования состояния пищеварительного тракта (гастрофиброскопия, дуоденоскопия) и рентгенологическое исследование.
Лечение Лечение рвоты всегда направлено на лечение основного заболевания, вызывающего этот симптом. При органических нарушениях, вызывающих рвоту, таких как опухоли (см.), стенозы, кишечная непроходимость (см.), показано оперативное вмешательство. При рвоте, вызванной отравлением (см.), прежде всего осуществляют промывание желудка, проводят дезинтоксикационную терапию, введение антидотов. При рвоте, связанной с заболеваниями желудочно-кишечного тракта, такими как гастрит (см.), дуоденит (см.), язвенная болезнь (см.), назначаются антацидные препараты (альмагель, анестезин, белластезин, викалин, гастрикумель, кватемал, фосфалюгель и др.). При рвоте беременных проводят терапию с насыщением организма глюкозой, витаминами, седативными препаратами. Весьма эффективным является применение торекана (тиэтилпиразина) внутрь по 1 драже 2–3 раза в день или по 1 свече (6,5 мг) утром и вечером. При кровавой рвоте проводится терапия в рамках неотложной помощи с организацией полного физического и психического покоя, назначение голода, применение холода на живот. По показаниям осуществляется переливание крови или кровезаменителей. С целью остановки кровотечения вводят дицинон, аминокапроновую кислоту, реместин, октреотида раствор. При необходимости проводится срочное оперативное вмешательство. При частой, длительной и тем более неукротимой рвоте необходимо симптоматическое лечение. Оно включает в себя применение противорвотных средств (галоперидол, реглан, церукал, риабал, тропиндол, одестон и др.), назначение диеты или голода, антигистаминных препаратов (супрастин, димедрол, тавегил). Обязательно проводится дегидратационная терапия путем внутривенного введения жидкостей и растворов электролитов. Лечебные мероприятия при рвоте новорожденных заключаются в изменении характера питания (рекомендуется дробное питание по 40–50 мл до 10 раз в сутки), укладывании ребенка на живот с приподнятым под углом 10° головным концом кроватки. Для усиления тонуса кардиального сфинктера применяют бетанехол (0,2 мг/кг 3 раза в день), мотилиум или домперидон (1 мг/кг в сутки), церукал или реглан (1 мг/кг в сутки в 3 приема). При сужении пищевода показано введение спазмолитиков, новокаина, седативных препаратов. При отсутствии эффекта от медикаментозного лечения показано хирургическое вмешательство (кардиодилатация). При пилоростенозе в дробном питании применяют метод Эпштейна (в начале кормления дают ребенку по 1 ч. л. 10 %-ной манной каши). В случае эффекта от применения седативных и спазмолитических средств возможно применение трансэндоскопического зондирования для приема пищи. Лечение ацетонемической рвоты (криза) направлено на коррекцию водно-электролитного состава. В легких случаях — путем оральной регидратации и приемов минеральных вод, в тяжелых — проведением инфузионной терапии. Для внутривенного введения применяют 5 %-ный раствор глюкозы, изотонический раствор хлорида натрия в соотношении 1:4 или в равных количествах. При необходимости введение растворов повторяют. Желательно введение витаминов группы В1 и В12, а также аскорбиновой кислоты. Назначаются седативные средства (седуксен, реланиум), а в случаях судорожного синдрома — ГОМК, реланиум, феназепам. Применяются антирвотные симптоматические сердечно-сосудистые средства. При ацетонемической рвоте, вызванной инфекцией, применяют также антибактериальные препараты. Во время рвоты у детей необходимо предотвращать проникновение рвотных масс в легкие. Маленьких детей в момент рвоты надо держать на руках, наклонив туловище ребенка вперед. После рвоты очищают полость рта влажным тампоном или (у старших детей) полосканием.
Профилактика Основная профилактика рвоты — это устранение причин ее возникновения: — профилактика и лечение основного заболевания, исключение рецидивов, осложнений; — питание качественными и обработанными в соответствии с санитарно-гигиеническими требованиями продуктами; — профилактика отравлений (см.) как бытовыми и промышленными, так и лекарственными агентами; — профилактика инфекционных заболеваний, вызывающих рвоту, путем своевременной изоляции больных и иммунопрофилактики; — правильный уход за больным для профилактики аспирационных осложнений при рвоте. При рвоте у больных, находящихся в бессознательном состоянии, применяют роторасширитель. Ослабленным больным помогают сесть либо обеспечивают возвышенное положение головного конца постели и наклон головы больного вниз. Лежачим больным во время рвоты поворачивают голову набок, укладывая под щеку кусок клеенки, один конец которой опускают в таз для сбора рвотных масс. Затем очищают ротовую полость влажным тампоном или дают прополоскать рот водой.
РЕВМАТОИДНЫЙ АРТРИТ
ОпределениеРевматоидный артрит (полиартрит) — хроническое воспалительное системное заболевание соединительной ткани с преимущественным поражением периферических суставов по типу симметричного эрозивнодеструктивного полиартрита.
Этиология и патогенез Обычно циркуляция в крови иммунных комплексов и развитие в связи с этим васкулита синовиальной оболочки и других органов ведет к развитию стойкого артрита и деструкции сустава, а также к возникновению в ряде случаев системного поражения соединительной ткани и сосудов. В качестве антигенов могут выступать антигены бактериального, вирусного и даже паразитарного происхождения. Основу патогенеза ревматоидного артрита составляет недостаточно изученное сочетание генетически детерминированных и приобретенных дефектов нормальных иммунорегуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на патогенные или физиологические стимулы.
Клиническая картина Заболевание проявляется стойким артритом (обычно полиартритом) с ранним и предпочтительным вовлечением лучезапястных, пястнофаланговых, проксимальных межфаланговых суставов кистей и плюснефаланговых суставов. Могут поражаться любые суставы конечностей. Характерны ощущение утренней скованности, боль, припухлость суставов, гипертермия тканей над ними (цвет кожи не меняется), симметричность воспалительного процесса. Типично постепенное начало болезни с волнообразными колебаниями выраженности симптомов (иногда в начале болезни отмечаются даже более или менее длительные ремиссии), медленным, но неуклонным прогрессированием артрита, вовлечением все новых суставов. Иногда ревматоидный артрит начинается и относительно длительное время может проявляться моноартритом крупного, чаще коленного сустава. Известен также вариант острого начала болезни, при котором, помимо поражения суставов, отмечаются высокая лихорадка и внесуставные проявления (серозиты, кардит, гепатолиенальный синдром, лимфаденопатия и др.). Развернутая стадия болезни характеризуется деформирующим, деструктивным (рентгенологически) артритом. Типичны деформации пястнофаланговых (сгибательные контрактуры, подвывихи), проксимальных межфаланговых (сгибательные контрактуры) и лучезапястных суставов — отклонение кисти во внешнюю сторону (так называемая ревматоидная кисть) и плюснефаланговых суставов (молоточковидная форма пальцев, их подвывихи, плоскостопие, галлюкс вальгус, составляющие понятие ревматоидной стопы. В отдельных суставах могут преобладать воспалительные или пролиферативные изменения. Чаще изменения в суставах имеют смешанный характер. Внесуставные (системные) проявления при ревматоидном артрите наблюдаются относительно нечасто, главным образом при серопозитивной (по ревматоидному фактору) форме болезни, выраженном и генерализованном суставном синдроме; частота их нарастает по мере прогрессирования заболевания. К ним относят подкожные (ревматоидные) узелки, которые чаще располагаются в области локтевого сустава, серозиты — обычно умеренно выраженные адгезивный (спаечный) плеврит и перикардит; лимфаденопатию, периферическую невропатию — асимметричное поражение дистальных нервных стволов с расстройствами чувствительности, редко двигательными расстройствами; кожный васкулит, чаще проявляющийся точечными некрозами кожи в области ногтевого ложа, и др. Клинические признаки поражения внутренних органов (кардит, пневмонит и др.) отмечают редко. У 10–15 % больных развивается амилоидоз с преимущественным поражением почек, для которого свойственны постепенно нарастающая протеинурия, нефротический синдром, позже — почечная недостаточность. Ревматоидный артрит, для которого, помимо типичного поражения суставов, свойственны спленомегалия и лейкопения, носит название синдрома Фелти.
Диагностика Показатели лабораторных исследований неспецифичны. У 70–80 % больных в сыворотке крови выявляется ревматоидный фактор, эту форму болезни называют серопозитивной. Ревматоидный фактор, определяемый при ревматоидном артрите, представляет собой антитела к Fc-фрагменту IgG. Существующие методы его определения (проба Волера — Роуза и латекс-тест) позволяют выявить ревматоидный фактор класса IgM. С самого начала заболевания, как правило, отмечается повышение СОЭ, уровней фибриногена, гамма-глобулинов, С-реактивного белка в крови, а также снижение гемоглобина. Рентгенологически выделяют 4 стадии ревматоидного артрита: — I стадия (начальная) — только околосуставной остеопороз; — II стадия — остеопороз + сужение суставной щели; — III стадия — остеопороз + сужение суставной щели + эрозии костей; — IV стадия — сочетание признаков III стадии и анкилоза сустава. Раньше всего рентгенологические изменения при ревматоидном артрите появляются в суставах кистей и плюснефаланговых суставах.
Лечение При наличии инфекции или подозрении на нее (туберкулез, иерсиниоз и т. п.) необходима терапия соответствующим антибактериальным препаратом. При отсутствии ярких внесуставных проявлений (например, высокой лихорадки, синдрома Фелти или полиневропатии) лечение суставного синдрома начинают с подбора нестероидных противовоспалительных средств: индометацина (75—150 мг/сут.), ортофена (75—150 мг/сут.), напроксена (500–750 мг/сут.), реже ибупрофена (1–2 г^ут.); их применяют длительно (не курсами), годами. Одновременно в наиболее воспаленные суставы вводят кортикостероидные препараты (гидрокортизон, метипред, кеналог). Иммунокомплексная природа болезни делает показанным проведение курсов плазмофереза, в большинстве случаев дающего выраженный эффект. Нестойкость результатов указанной терапии является показанием к присоединению так называемых базисных средств: кризанола (34 мг золота, содержащегося в 2 мл 5 %-ного или в 1 мл 10 %-ного раствора препарата 1 раз в неделю внутримышечно), 0-пеницилламина (купренил, металкаптазе, 300–750 мг/сут.), делагила (0,25 г/сут.) или сульфасалазина (2 г/сут.). Эти препараты действуют медленно, поэтому должны применяться не менее 6 месяцев, а при отчетливом положительном эффекте лечение ими обязательно продолжается и дальше (годами). Кортикостероиды внутрь при отсутствии ярких внесуставных проявлений назначают как можно реже, обычно лишь при выраженных болях в суставах, не купирующихся нестероидными противовоспалительными средствами, и внутрисуставным введением кортикостероидов в небольших дозах (не более 10 мг/сут. преднизолона), на небольшой срок и в сочетании с основными средствами, позволяющими впоследствии уменьшить дозу гормонов и полностью их отменить. Кортикостероиды (преднизолон внутрь 20–30 мг/сут., иногда до 60 мг/сут. или в виде пульс-терапии: метипред внутривенно 1 г в течение 3 дней) абсолютно показаны при наличии высокой лихорадки, генерализованного ревматоидного васкулита. Иммунодепрессанты (хлорбутин — 6–8 мг/сут., азатиоприн — 100–150 мг/сут., циклофосфамид — 100–150 мг/сут., метотрексат — 2,5–7,5 мг/сут. в течение одного дня каждой недели) являются препаратами выбора при наличии ярких внесуставных проявлений (полиневропатия, генерализованный васкулит и т. п.), а в других случаях их применяют лишь при неэффективности всей предшествующей терапии. Применение базисных средств лечения ревматоидного артрита должно проводиться под постоянным наблюдением врача, знающего все аспекты действия этих препаратов. Важное значение в лечении имеет лечебная физкультура, направленная на поддержание максимальной подвижности суставов и сохранение мышечной массы. Физиотерапевтические процедуры (электрофорез нестероидных противовоспалительных средств, фонофорез гидрокортизона, аппликации димексида) и санаторно-курортное лечение имеют вспомогательное значение и применяются лишь при небольшой выраженности артрита. При стойком моно- и олигоартрите проводят синовэктомию либо введением в сустав изотопов золота и др., либо хирургическим путем. При стойких деформациях суставов проводят реконструктивные операции.
РЕВМАТИЗМ
ОпределениеРевматизм — системное воспалительное заболевание соединительной ткани с преимущественным поражением сердца. Болеют в основном дети и молодые люди: женщины в 3 раза чаще, чем мужчины.В соответствии с современной классификацией необходимо выделять прежде неактивную или активную фазу болезни. Активность может быть минимальной (I степени), средней (II степени) и максимальной (III степени). Для суждения о ней используются как выраженность клинических проявлений, так и изменения лабораторных показателей. Классификацию проводят также по локализации активного ревматического процесса (кардит, артрит, хорея и т. д.), характеру резидуальных явлений (миокардиосклероз и др.), состоянию кровообращения и течению болезни. Выделяется острое течение ревматизма, подострое, затяжное, непрерывно рецидивирующее и латентное (клинически бессимптомное). Выделение «латентного течения» оправдано только для ретроспективной характеристики ревматизма: латентное формирование порока сердца и т. д. Ревматические заболевания околосуставных мягких тканей — заболевания сухожилий (тендиниты, тендовагиниты), связок (дигаментиты), мест прикрепления этих структур к костям (энтезопатии), синовиальных сумок (бурситы), апоневрозов и фасций (апоневрозиты и фасцииты) воспалительного или дегенеративного характера, не обусловленные прямой травмой, ранением, инфекцией или опухолью, являются одними из наиболее частых причин болевых ощущений в области суставов и затруднений движений в них.
Этиология и патогенез Основной этиологический фактор при острых формах заболевания — бета-гемолитический стрептококк группы А. У больных с затяжными и непрерывно рецидивирующими формами ревмокардита связь заболевания со стрептококком часто не удается установить. В подобных случаях поражение сердца, полностью соответствующее всем главным критериям ревматизма, имеет, по-видимому, иную природу — аллергическую (вне связи со стрептококком или вообще инфекционными антигенами), инфекционно-токсическую, вирусную. В развитии ревматизма существенное значение придают иммунным нарушениям, хотя конкретные этапы патогенеза не выяснены. Предполагают, что сенсибилизирующие агенты (стрептококк, вирус, неспецифические антигены и т. д.) могут приводить на первых этапах к иммунному воспалению в сердце, а затем к изменению антигенных свойств его компонентов с превращением их в аутоантигены и развитием аутоиммунного процесса. Важную роль в развитии ревматизма играет генетическое предрасположение. Системный воспалительный процесс при ревматизме морфологически проявляется характерными фазовыми изменениями соединительной ткани (мукоидное набухание — фибриноидное изменение — фибриноидный некроз) и клеточными реакциями (инфильтрация лимфоцитами и плазмоцитами, образование ашофф-талалаевских гранулем). Начиная со стадии фибриноидных изменений полная тканевая репарация невозможна, и процесс завершается склерозированием.
Клиническая картина В типичных случаях заболевание развивается через 1–3 недели после перенесенной ангины или реже другой инфекции. При повторных атаках этот срок может быть меньшим. У некоторых больных даже первичный ревматизм возникает через 1–2 дня после охлаждения без какой-либо связи с инфекцией. Рецидивы болезни часто развиваются после любых интеркуррентных заболеваний, оперативных вмешательств, физических перегрузок. Наиболее характерным проявлением ревматизма, его «основным синдромом» является сочетание острого мигрирующего и полностью обратимого полиартрита крупных суставов с умеренно выраженным кардитом. Обычно начало заболевания острое, бурное, реже подострое. Быстро развивается полиартрит, сопровождающийся ремиттирующей лихорадкой до 38–40 °C с суточными колебаниями 1–2 °C и сильным потом, но обычно без озноба. Первым симптомом ревматического полиартрита является нарастающая острая боль в суставах, усиливающаяся при малейших пассивных и активных движениях и достигающая у нелеченых больных большой выраженности. К боли быстро присоединяется отечность мягких тканей в области суставов, почти одновременно появляется выпот в суставной полости. Кожа над пораженными суставами горячая, пальпация их резко болезненна, объем движений из-за боли крайне ограничен. Характерно симметричное поражение крупных суставов — обычно коленных, лучезапястных, голеностопных, локтевых. Типична «летучесть» воспалительных изменений, проявляющаяся в быстром (в течение нескольких дней) обратном развитии артритических явлений в одних суставах и столь же быстром их нарастании в других. Все суставные проявления исчезают бесследно; даже без лечения они длятся не более 2–4 недель. При современной терапии клинические симптомы ревматического полиартрита могут быть устранены в течение первых суток. Полагают, что при остром ревматизме полиартрит развивается в 60–70 % случаев. По мере стихания суставных явлений (реже с самого начала болезни) на первый план выступают обычно не столь яркие симптомы поражения сердца, считающегося наиболее частым и у многих больных единственным органным проявлением ревматизма. В то же время вопреки прежним представлениям заболевание не столь редко протекает без явных сердечных изменений. Ревматический миокардит при отсутствии сопутствующего порока сердца у взрослых протекает, как правило, нетяжело. Жалобы на слабые боли или неясные неприятные ощущения в области сердца, легкую одышку при нагрузках, реже — на сердцебиения или перебои. При исследовании области сердца патологии обычно не отмечается. По данным перкуссии и рентгеноскопии, сердце нормальных размеров или умеренно увеличено. Обычно наблюдается увеличение влево, реже — диффузное расширение. Для данных аускультации и ФКГ характерны удовлетворительная звучность тонов или небольшое приглушение I тона, иногда возникновение III, реже IV тона, мягкий мышечный систолический шум на верхушке сердца и проекции митрального клапана. Артериальное давление нормальное или умеренно снижено. Иногда отмечается умеренная тахикардия, несколько превышающая уровень, соответствующий температуре. На ЭКГ — уплощение, уширение и зазубренность зубца Р и комплекса QRS, реже — удлинение интервала PQ более 0,2 с. У ряда больных регистрируются небольшое смещение интервала S — T книзу от изоэлектрической линии и изменения зубца Т (низкий, отрицательный, реже двухфазный, прежде всего в отведениях V1—V3). Редко наблюдаются экстрасистолы, атриовентрикулярная блокада II или III степени, внутрижелудочковая блокада, узловой ритм. Недостаточность кровообращения в связи с первичным ревматическим миокардитом развивается в редких случаях. У отдельных больных чаще в детском возрасте встречается так называемый диффузный ревматический миокардит. Он проявляется бурным воспалением миокарда с его выраженным отеком и нарушением функции. С самого начала заболевания беспокоят выраженная одышка, заставляющая принимать положение ортопноэ, постоянная боль в области сердца, учащенное сердцебиение. Характерны «бледный цианоз», набухание шейных вен. Сердце значительно и диффузно расширено, верхушечный толчок слабый. Тоны резко приглушены, часто выслушивается четкий III тон (протодиастолический ритм галопа) и отчетливый, но мягкий систолический шум. Пульс частый, слабого наполнения. Артериальное давление значительно понижено, может развиваться коллаптоидное состояние. Венозное давление быстро повышается, но с присоединением коллапса также падает. На ЭКГ отмечается снижение вольтажа всех зубцов, уплощение зубца I, изменение интервала S-T, атриовентрикулярная блокада. Очень характерно для диффузного миокардита развитие недостаточности кровообращения как по левожелудочковому, так и по правожелудочковому типу. Данный вариант ревматического миокардита среди взрослых в настоящее время практически не встречается. Исходом ревматического миокардита при отсутствии активного лечения может быть миокардитический кардиосклероз, выраженность которого часто отражает степень распространенности миокардита. Очаговый кардиосклероз не нарушает функции миокарда. Диффузному миокардитическому кардиосклерозу свойственны признаки снижения сократительной функции миокарда: ослабление верхушечного толчка, приглушение тонов (особенно I), систолический шум. После физических нагрузок появляются умеренные признаки декомпенсации: пастозность голеней и небольшое увеличение печени. Часто сочетание миокардитического кардиосклероза с пороками сердца усугубляет его отрицательное действие на гемодинамику. Ревматический эндокардит, являющийся причиной ревматических пороков сердца, весьма беден симптомами. Его существенным проявлением служит четкий систолический шум при достаточной звучности тонов и отсутствии признаков выраженного поражения миокарда. В отличие от шума, связанного с миокардитом, эндокардитический шум бывает более грубым, а иногда имеет музыкальный оттенок. Его звучность возрастает при перемене положения больного или после нагрузки. Весьма достоверным признаком зндокардита является изменчивость уже существующих шумов и особенно возникновение новых при неменяющихся (тем более — при нормальных) границах сердца. Легкие и довольно быстро исчезающие диастолические шумы, выслушиваемые иногда в начале ревматической атаки на проекции митрального клапана или сосудах, отчасти также могут быть связаны с эндокардитом. Глубокий эндокардит (вальвулит) створок митрального или аортального клапанов у ряда больных имеет отражение на эхокардиограмме: утолщение створок, их «лохматость», множественные эхосигналы от них. Больные, у которых эндокардит является единственной или, по крайней мере, основной локализацией ревматизма, в течение длительного времени сохраняют хорошее общее самочувствие и трудоспособность, составляя группу больных с так называемым амбулаторным течением ревматизма. Только гемодинамические расстройства в связи с незаметно сформировавшимся пороком сердца заставляют таких больных впервые обратиться к врачу. Перикардит в клинике современного ревматизма встречается редко. Сухой перикардит проявляется постоянной болью в области сердца и шумом трения перикарда, выслушивающимся чаще вдоль левого края грудины. Интенсивность шума различна, обычно он определяется в обеих фазах сердечного цикла. На ЭКГ характерно смещение интервала S-T вверх во всех отведениях в начале заболевания. В дальнейшем эти интервалы постепенно возвращаются к изоэлектрической линии, одновременно образуются двухфазные или отрицательные зубцы Т. Иногда данные ЭКГ непоказательны. Сухой перикардит сам по себе не вызывает увеличения сердца. Экссудативный перикардит — по существу, дальнейшая стадия развития сухого перикардита. Часто первым признаком появления выпота бывает исчезновение боли в связи с разъединением воспаленных листков перикарда накапливающимся экссудатом. Появляется одышка, усиливающаяся в положении лежа. Область сердца при большом количестве экссудата несколько выбухает, межреберья сглажены, верхушечный толчок не пальпируется. Сердце значительно увеличивается и принимает характерную форму трапеции или круглого графина. Пульсация контуров при рентгеноскопии малая. Тоны и шумы очень глухие (в связи с выпотом). Пульс частый, малого наполнения; артериальное давление снижено. Венозное давление почти всегда повышено, отмечается набухание шейных и даже периферических вен. Электрокардиограмма в основном такая же, как при сухом перикардите; добавочным симптомом бывает лишь заметное снижение вольтажа комплекса QRS. Существенное диагностическое значение имеет эхокардиография, бесспорно устанавливающая наличие жидкости в сердечной сумке. Поскольку жидкость в полости перикарда ограничивает диастолическое расширение сердца, то при значительном накоплении выпота может возникать недостаточное наполнение полостей сердца в период диастолы — так называемая гиподиастолия. Последняя препятствует притоку к сердцу, что приводит к застою в малом и особенно в большом круге кровообращения. Своеобразной чертой гиподиастолической недостаточности кровообращения является развитие декомпенсации даже без существенного поражения миокарда. Исходом ревматического перикардита обычно бывают небольшие спайки между обоими листками или спайки наружного листка с окружающими тканями, что распознается лишь при тщательной рентгеноскопии (деформация контура перикарда). Наличие перикардита у больных ревматизмом часто означает поражение всех слоев сердца — ревматический панкардит. Среди поражений кожи практически патогномонична кольцевая эритема, представляющая собой розовые кольцевидные элементы, никогда не зудящие, располагающиеся преимущественно на коже внутренней поверхности рук и ног, живота, шеи и туловища. Она обнаруживается лишь у 1–2 % больных. «Ревматические узелки», описываемые в старых руководствах, в настоящее время практически не встречаются. Узловая эритема, геморрагии, крапивница совершенно нехарактерны. Поражения легких — ревматические пневмонии — наблюдаются крайне редко и обычно возникают на фоне уже развившегося заболевания. Их симптомы такие же, как и банальных воспалений легких; отличительными признаками считаются резистентность к лечению антибиотиками и хороший эффект противоревматических средств (без антибактериальных). Лишь при этом условии диагноз может считаться обоснованным. Многие современные авторы сомневаются в самом факте существования ревматических пневмоний. Ревматический плеврит по своим проявлениям также неспецифичен. Его диагностика облегчается при сочетании с другими признаками ревматизма. Он чаще бывает двусторонним и характеризуется хорошей обратимостью. Экссудат при ревматическом плеврите серозно-фибринозный и всегда стерильный. Проба Ривальты положительная. В начале болезни в экссудате преобладают нейтрофилы, позже — лимфоциты; возможна также примесь эритроцитов, эндотелиальных клеток и эозинофилов. Первым, а тем более единственным признаком ревматизма плеврит не бывает. Следует иметь в виду, что при недостаточности кровообращения у больных с пороками сердца застойные изменения в легких и гидроторакс смогут легко симулировать «ревматические» пневмонию и плеврит. Поражения почек. В острой фазе болезни, как правило, обнаруживаются незначительно выраженные протеинурия и гематурия (следствие генерализованного васкулита и поражения почечных клубочков и канальцев). Поражения органов пищеварения редки. Гастриты и тем более изъязвления желудка и кишечника обычно бывают следствием длительного применения лекарств, особенно стероидных гормонов. У детей, больных ревматизмом, иногда возникает сильная боль в животе, связанная с быстрообратимым аллергическим перитонитом. Боль может быть очень резкой и, сочетаясь с положительным симптомом Щеткина — Блюмберга, заставляет думать об остром хирургическом заболевании брюшной полости. Отличительными чертами являются: разлитой характер боли, ее сочетание с другими признаками ревматизма (или указания на эту болезнь в анамнезе), очень быстрый эффект противоревматической терапии; нередко боль через короткий срок исчезает самостоятельно. Изменения нервной системы и органов чувств. Малая хорея, типичная «нервная форма» ревматизма, встречается преимущественно у детей, особенно девочек. Она проявляется сочетанием эмоциональной лабильности с мышечной гипотонией и насильственными вычурными движениями туловища, конечностей и мимической мускулатуры. Малая хорея может протекать с рецидивами, однако к 17–18 годам она почти всегда заканчивается. Особенностями этой формы являются сравнительно небольшое поражение сердца и незначительно выраженные лабораторные показатели активности ревматизма (в том числе часто нормальная СОЭ). Острые ревматические поражения центральной нервной системы, протекающие по типу энцефалита или менингита, являются чрезвычайной редкостью. Они бывают только проявлением генерализованного ревматического васкулита, почти не встречающегося в наши дни, и всегда сочетаются с другими признаками ревматизма. Многочисленные сообщения невропатологов об изолированно существующих «ревматических цереброваскулитах» недостоверны. «Ревматических психозов» не существует (вопреки нередким описаниям в психиатрической литературе). Существование собственно ревматических плекситов, радикулитов и невритов достоверно не доказано. Непосредственная угроза жизни от собственно ревматизма возникает крайне редко и почти исключительно в детском возрасте в связи с диффузным миокардитом. У взрослых преимущественно суставные и кожные формы протекают наиболее благоприятно. Хорея чаще сочетается с меньшими изменениями сердца. В основном прогноз при ревматизме определяется состоянием сердца (наличие и тяжесть порока, степень миокардиосклероза). Одним из главных прогностических критериев является степень обратимости симптомов ревмокардита. Непрерывно рецидивирующие ревмокардиты наиболее неблагоприятны. При поздно начатом лечении вероятность образования пороков увеличивается. У детей ревматизм протекает тяжелее и чаще приводит к стойким клапанным изменениям. При первичном заболевании в возрасте старше 25 лет процесс течет благоприятно, а порок сердца образуется очень редко. Если первичный ревматизм протекал без явных признаков ревмокардита или последние оказались полностью обратимыми, то можно полагать, что будущие рецидивы также не приведут к формированию клапанного порока. Если со времени установления диагноза конкретного порока сердца прошло более 3 лет, то вероятность формирования нового порока невелика, несмотря на сохраняющуюся активность ревматизма. Плечелопаточный периартрит. Характерная клиническая картина — боль и ограничение движений в плечевом суставе — может наблюдаться при повреждении самых разных периартикулярных структур. Чаще других имеет место изолированное или комбинированное поражение сухожилий надкостной и двуглавой мышц, а также субакромиальной сумки. Умение выявлять точную топику поражения предопределяет успех лечения. Поражение сухожилия надостной мышцы может протекать в виде простого тендинита, кальцифицирующего тендинита и надрыва (разрыва) сухожилия. Простой тендинит надостной мышцы — наиболее частая форма плечелопаточного периартрита. Диагностика базируется на выявлении болезненности при напряжении надостной мышцы, что создается при попытке отведения руки больного против сопротивления врача. Характерен симптом Дауборна: активное отведение руки до 60° безболезненно, затем на ограниченном участке (70–90°) возникает резкая боль (из-за сдавления сухожилия между клювовидным отростком лопатки и головкой плечевой кости), а при дальнейшем отведении руки боль проходит. При кальцифицирующем тендините надостной мышцы, что выявляется при рентгенографии плечевого сустава, боль обычно более сильная, отмечается и в покое, а ограничения движений в плечевом суставе более значительные. Детальное исследование выявляет, однако, признаки изолированного поражения сухожилия надостной мышцы. Данная патология развивается преимущественно у лиц молодого и среднего возраста. При надрыве (или разрыве) сухожилия надостной мышцы, возникающем чаще у пожилых людей после подъема тяжести или неудачного падения с опорой на руку, помимо боли и ограничения движений, характерна невозможность удержать отведенную руку (симптом падающей руки). При наличии такой клинической картины обязательной является артрография плечевого сустава, так как в случае полного разрыва должно проводиться хирургическое лечение. Тендинит двуглавой мышцы плеча характеризуется стойкими болевыми ощущениями в переднебоковой области плечевого сустава, значительной болезненностью при пальпации сухожилий бицепса и болями, возникающими при напряжении этой мышцы (т. е. в случаях сгибания супинированного предплечья против сопротивления). Бурсит субакромиальной сумки чаще является не самостоятельным заболеванием, а следствием распространения изменений со стороны соседствующих с нею сухожилий надостной и двуглавой мышц. Именно комбинированное поражение этих структур объясняет наличие выраженной боли, значительно ограничивающей практически все движения (картина так называемого блокированного, или «замороженного», плеча). Рентгенологически в ряде случаев выявляется обызвествление в области субакромиальной сумки. Периартрит локтевого сустава. Наиболее частые периартикулярные заболевания в области локтевого сустава — энтезопатии в районе надмыщелков плечевой кости и воспаление сумки (бурсит) локтевого сустава. Энтезопатии сухожилий, прикрепляющихся к надмыщелкам плечевой кости, составляют патологическую основу клинического синдрома, известного как «локоть теннисиста». Боль отмечается чаще в области наружного надмыщелка, где прикрепляются разгибатели пальцев и супинатор предплечья, усиливается при любых напряжениях этих мышц. Боль в области медиального надмыщелка плечевой кости обусловлена обычно энтезопатиями сухожилий мышц, сгибателей пальцев и кисти. Диагноз бурсита локтевого сустава обычно не вызывает трудностей. Он устанавливается при наличии характерного баллотирующего при пальпации выпячивания над локтевым отростком. В области лучезапястного сустава наиболее часто отмечаются тендовагиниты. Тендовагинит де Кервена характеризуется поражением длинной отводящей и короткой разгибательной мышц большого пальца в месте их прохождения через костнофиброзный канал на уровне шиловидного отростка лучевой кости. Проявляется болью при движениях большого пальца, небольшой припухлостью в области «анатомической табакерки». Периартрит тазобедренного сустава — одна из частых причин болевых ощущений в области этого сустава. Болевой синдром имеет в ряде случаев характерные особенности — боль в покое отсутствует (она возникает лишь при лежании на больном боку или в положении сидя — «нога на ногу»), возникает при первых шагах, но затем при ходьбе постепенно уменьшается и проходит совсем. При пальпации определяется локальная болезненность в области большого вертела. При рентгенографии можно иногда обнаружить бахромистость контуров большого вертела, линейные тени обызвествлений сухожилий прикрепляющихся к нему мышц или расположенных здесь синовиальных сумок. Периартрит коленного сустава представлен чаще всего поражением сухожилий, составляющих так называемую гусиную лапку (прикрепление полусухожильной, стройной, портняжной, а также полуперепончатой мышцы в районе медиального мыщелка большеберцовой кости). Характерна боль в этой области как при активных, так и при пассивных движениях (сгибание, резкое разгибание или поворот голени), болезненность при пальпации. У детей ревматизм имеет значительную тенденцию к острому, тяжелому, рецидивирующему течению. Как правило, поражается сердечно-сосудистая система, причем с каждой атакой ее повреждение усиливается. Основой сердечно-сосудистой декомпенсации у детей всегда является активация ревматического процесса (несмотря на отсутствие таких симптомов, как лихорадка, полиартрит, увеличение СОЭ и др.). «Абсолютные» признаки ревматизма в детском возрасте — прогрессирующее поражение сердца, особенно в сочетании с поражением суставов, хорея, наличие анулярной сыпи и ревматических узелков. Латентный ревматизм — трудно распознаваемый вариант болезни, достоверность диагноза подтверждается только наличием сформированного клапанного порока сердца. Наряду с существованием первично-латентного имеется и вторично-латентный ревмокардит: протекая без клинически выраженной активности, эта форма также ведет к формированию пороков сердца, нередко комбинированных, и развитию кардиосклероза. Прогноз серьезным остается и при современных методах лечения, так как даже после первой атаки порок сердца формируется у 10–15 % детей. При рано начатом лечении и его адекватности прогноз в большинстве случаев благоприятный.
Диагностика и дифдиагностика Специфических методов диагностики ревматизма не существует. В то же время при развернутой картине болезни диагноз сравнительно несложен. Трудности возникают, как правило, вначале у тех больных, у которых заболевание проявляется каким-либо одним ярким клиническим симптомом (кардит или полиартрит). Наиболее принятой международной системой диагностики ревматизма являются критерии Джонса. Выделяют большие диагностические критерии ревматизма — кардит, полиартрит, хорея, кольцевая эритема, ревматические узелки и малые — лихорадка (не ниже 38 °C), артралгии, перенесенный в прошлом ревматизм или наличие ревматического порока сердца, повышенная СОЭ или положительная реакция на С-реактивный белок, удлиненный интервал Р-Q на ЭКГ. Диагноз считается достоверным, если у пациента имеются два больших критерия и один малый либо один большой и два малых, но лишь в том случае, если одновременно существует одно из следующих доказательств предшествующей стрептококковой инфекции: недавно перенесенная скарлатина (которая представляет собой бесспорное стрептококковое заболевание); высевание стрептококка группы А со слизистой оболочки глотки;повышений титр антистрептолизина-О или других стрептококковых антител. Эти критерии представляются весьма жесткими, но они служат серьезной гарантией объективно обоснованного диагноза и необходимым препятствием для чрезвычайно распространенной гипердиагностики ревматизма. Среди больших критериев диагноз кардита как такового, в свою очередь, требует наличия объективных признаков. К ним относятся: одышка, расширение границ сердца, появление четкого мягкого систолического шума на верхушке или проекции митрального клапана, нежного мезодиастолического шума в этой же области или протодиастолического шума на аорте, шум трения перикарда, динамичные и обычно умеренные изменения ЭКГ, в частности атриовентрикулярная блокада I степени. Значительное приглушение тонов сердца, выраженная кардиалгия и нарушения ритма (в частности, пароксизмальная тахикардия) нехарактерны. Субъективные расстройства и анамнестические сведения, не подтвержденные документально, не могут служить основанием для диагноза ревматизма. Сочетание повышенной температуры с нормальной СОЭ практически исключает диагноз активного ревматизма. Необходимо иметь в виду также, что больным ревматизмом совершенно не свойствен «уход в болезнь», невротизация и стремление подробно и красочно описывать свои ощущения. При остром ревматизме встречаются нейтрофильный лейкоцитоз (до 12–20 г/л) со сдвигом лейкограммы влево, тромбоцитоз, нарастание СОЭ до 40–60 мм/ч. При хроническом течении эти показатели изменены не столь выраженно, изредка развивается анемия (гипо- или нормохромная). Характерно нарастание титров противострептококковых антител: антистрептогиалуронидазы и антистрептокиназы более 1:300, антистрептолизина более 1:250. Высота титров противострептококковых антител и их динамика не отражают степень активности ревматизма. Кроме того, у многих больных хроническими формами ревматизма признаков участия стрептококковой инфекции вообще не наблюдается. Все известные биохимические показатели активности ревматического процесса неспецифичны и непригодны для нозологической диагностики. Лишь в тех случаях, когда диагноз ревматизма обоснован клинико-инструментальными данными, комплекс этих показателей становится очень полезным для суждения о степени активности болезни (но не о наличии ревматизма). К этим показателям относятся: повышение уровня фибриногена плазмы выше 4 г/л, альфа-глобулинов выше 10 %, гамма-глобулинов выше 20 %, гексоз выше 1,25 мг, церулоплазмина выше 9,25 мг, серомукоида выше 0,16 мг, появление в крови С-реактивного белка. В большинстве случаев биохимические показатели активности параллельны величинам СОЭ. Важно дифференцировать ревматизм с аллергическим (инфекционно-аллергическим) миокардитом, особенностью которого является частая диссоциация между отчетливыми сердечными изменениями и невысокими (часто нормальными) лабораторными признаками (СОЭ, глобулины, фибриноген и др.); пороки сердца никогда не образуются. Больным функциональной кардиопатией свойственны эмоциональная окрашенность жалоб, их многообразие и неадекватность отсутствию объективной сердечной патологии. Наиболее часты жалобы на постоянную боль в области сердца, совершенно не характерную для ревматизма, никогда не наблюдается достоверных признаков органического поражения сердца, лабораторные показатели нормальны.
Лечение В первые 7—10 дней больной при легком течении болезни должен соблюдать полупостельный режим, а при выраженной тяжести в первый период лечения — строгий постельный (15–20 дней). Критерием расширения двигательной активности являются темпы наступления клинического улучшения и нормализации СОЭ, а также других лабораторных показателей. Ко времени выписки (обычно через 40–50 дней после поступления) больного следует перевести на свободный режим, близкий к санаторному. В диете рекомендуется ограничить поваренную соль. До последнего времени основой лечения больных активным ревматизмом считалось раннее сочетанное применение преднизолона (реже триамцинолона) в постепенно уменьшающихся дозах и ацетилсалициловой кислоты в постоянной не снижающейся дозе 3 г в день. Начальная суточная доза преднизолона составляла обычно 20–25 мг, триамцинолона — 16 мг, курсовые дозы преднизолона — около 500–600 мг, триамцинолона — 400–500 мг. За последние годы, однако, были установлены факты, ставящие под сомнение целесообразность сочетания преднизолона с ацетилсалициловой кислотой. Так, при этом происходит суммирование отрицательного влияния на слизистую желудка. Выяснилось также, что преднизолон заметно снижает концентрацию ацетилсалициловой кислоты в крови (в том числе ниже терапевтического уровня). При быстрой отмене преднизолона концентрация ацетилсалициловой кислоты, напротив, может повыситься до токсической. Таким образом, рассматриваемая комбинация не представляется оправданной, и ее эффект, по-видимому, достигается преимущественно за счет преднизолона. Поэтому при активном ревматизме преднизолон целесообразно назначать в качестве единственного антиревматического препарата, начиная с суточной дозы около 30 мг. Это тем более рационально и потому, что объективных клинических доказательств каких-либо преимуществ комбинированной терапии не существует. Лечебный эффект глюкокортикоидов при ревматизме тем значительнее, чем выше активность процесса. Поэтому больным с особенно высокой активностью болезни (панкардит, полисерозит и т. п.) начальную дозу увеличивают до 40–50 мг преднизолона или более. Синдрома отмены кортикостероидов при ревматизме практически не бывает, в связи с чем при необходимости даже высокую их дозу можно резко уменьшить или отменить. Лучшим кортикостероидом для лечения ревматизма является преднизолон. За последние годы было установлено, что изолированное назначение вольтарена или индометацина в полных дозах (150 мг/сут.) приводит к столь же выраженным ближайшим и отдаленным результатам лечения острого ревматизма у взрослых, как и применение преднизолона. Быструю положительную динамику при этом обнаружили все проявления болезни, в том числе и ревмокардит. В то же время переносимость этих средств (особенно вольтарена) оказалась значительно лучшей. Однако остается открытым вопрос об эффективности вольтарена и индометацина при наиболее тяжелых формах кардита (с одышкой в покое, кардиомегалией, экссудативным перикардитом и недостаточностью кровообращения), которые у взрослых практически не встречаются. Поэтому пока при подобных формах болезни (прежде всего у детей) средством выбора являются кортикостероиды в достаточно больших дозах. На проявления малой хореи антиревматические препараты прямо не влияют. В таких случаях к проводимой терапии рекомендуется присоединить люминал либо психотропные средства типа аминазина или особенно седуксена. Для ведения пациентов с хореей особое значение имеет спокойная обстановка, доброжелательное отношение окружающих, внушение больному уверенности в полном выздоровлении. В необходимых случаях требуется принять меры, предупреждающие самоповреждение пациента в результате насильственных движений. При первой или повторных атаках острого ревматизма большинство авторов рекомендуют лечение пенициллином в течение 7—10 дней (для уничтожения наиболее вероятного возбудителя — бета-гемолитического стрептококка группы А). В то же время на собственно ревматический процесс пенициллин не оказывает лечебного действия. Поэтому длительное и не строго обоснованное применение пенициллина или других антибиотиков при ревматизме нерационально. У больных с затяжным и непрерывно рецидивирующим течением рассмотренные методы лечения, как правило, гораздо менее эффективны. Лучшим методом терапии в таких случаях является длительный (год и более) прием хинолиновых препаратов: хлорохина (делагила) по 0,25 г/сут. или плаквенила по 0,2 г/сут. под регулярным врачебным контролем. Эффект от применения этих средств проявляется не ранее чем через 3–6 недель, достигает максимума через 6 месяцев непрерывного приема. С помощью хинолиновых препаратов удается устранить активность ревматического процесса у 70–75 % больных с наиболее торпидными и резистентными формами заболевания. При особенно длительном назначении данных лекарств (более года) их доза может быть уменьшена на 50 %, а в летние месяцы возможны перерывы в лечении. Делагил и плаквенил можно назначать в комбинации с любыми антиревматическими лекарствами. Недостаточность кровообращения при ревматических пороках сердца лечится по общим принципам (сердечные гликозиды, мочегонные и т. п.). Если сердечная декомпенсация развивается в связи с активным ревмокардитом, то в лечебный комплекс необходимо включать антиревматические средства (в том числе стероидные гормоны, не вызывающие существенной задержки жидкости — преднизолон или триамцинолон; дексаметазон не показан). Однако у большинства больных сердечная недостаточность — результат прогрессирующей миокардиодистрофии в связи с пороком сердца; удельный вес ревмокардита, если его бесспорные клинико-инструментальные и лабораторные признаки отсутствуют, при этом незначителен. Поэтому у многих пациентов с пороками сердца и тяжелыми стадиями недостаточности кровообращения можно получить вполне удовлетворительный эффект с помощью только сердечных гликозидов и мочегонных средств. Назначение энергичной антиревматической терапии (особенно кортикостероидов) без явных признаков активного ревматизма может в подобных случаях усугубить дистрофию миокарда. Для ее уменьшения рекомендуются ундевит, кокарбоксилаза, препараты калия, рибоксин, анаболические стероиды. При переходе ревматизма в неактивную фазу больных целесообразно направлять в местные санатории, однако все методы физиотерапии при этом исключают. Считается возможным курортное лечение даже пациентов с минимальной активностью, но на фоне продолжающегося лекарственного антиревматического лечения и в специализированных санаториях. Больных без порока сердца либо с недостаточностью митрального или аортального клапана при отсутствии декомпенсации целесообразно направлять в Кисловодск или на Южный берег Крыма, а больных с недостаточностью кровообращения I степени, в том числе с нерезкими митральными стенозами, — только в Кисловодск. Противопоказано курортное лечение при выраженных признаках активности ревматизма (II и III степени), тяжелых комбинированных или сочетанных пороках сердца, недостаточности кровообращения II или III стадии. Лечение ревматических заболеваний околосуставных мягких тканей в первые 2 недели проводят нестероидными противовоспалительными средствами (напроксен, индиметацин, ортофен, бутадион), фонофорезом гидрокортизона на болезненные области, соблюдением покоя конечности. При отсутствии достаточного эффекта показано локальное введение кортикостероидов в месте наибольшей болезненности мягких тканей. При плохо поддающихся указанной терапии периартикулярных заболеваниях или частом их рецидивировании показана локальная рентгенотерапия. Лечение ревматизма у детей проводят в стационаре, его продолжительность 45–60 дней. Больному обеспечивают лечебный режим в зависимости от активности патологического процесса и выраженности изменений сердца. Питание должно соответствовать возрасту. Медикаментозное лечение: одно из противоревматических средств — амидопирин или анальгин по 0,15—0,2 г на год жизни (не более 2–2,5 г/сут.); ацетилсалициловая кислота — 0,2–0,25 г/сут. на год жизни; салицилат натрия — 0,5 г на год жизни в сутки в 4–6 приемов до стихания активности процесса, когда дозу начинают снижать до 2/3, а затем и до 1/3, но не ранее 30–35 дней от начала приступа. Бутадион назначают по 0,05 г 3 раза в сутки детям дошкольного возраста, по 0,08 г детям от 8 до 10 лет и по 0,1–0,12 г детям старше 10 лет. Нередко бутадион и амидопирин сочетают или дают их комбинированные формы в виде таблеток реопирина и пирабутола по 1/3 таблетки детям 6–8 лет, по 1/2 таблетки детям 8—10 лет и по 1 таблетке детям 12–15 лет 3 раза в день. Кортикостероиды в основном показаны в наиболее ранний период активной фазы ревматизма (для предупреждения развития порока сердца). Курс лечения не менее 1–1,5 месяца. В последние годы все больше используются такие высокоэффективные препараты, как метиндол (индометацин) и вольтарен в дозе 1–3 мг/кг в сутки самостоятельно или в комплексе с гормональными препаратами. При вялом течении и низкой активности процесса вместо глюкокортикоидов можно использовать препараты хлорохинового ряда — делагил, плаквенил по 0,5—10 мг/кг в сутки. Преднизолон назначают детям 4–7 лет по 10–15 мг/сут. (1 таблетка содержит 5 мг препарата); 8—10 лет — 15–20 мг/сут.; 11–14 лет и старше — 15–25 мг/сут. (детям раннего возраста по 1–3 мг/сут. на 1 кг массы тела) в 3–4 приема (утром и днем 2/3 суточной нормы) с постепенным снижением (с вечернего приема) до поддерживающей дозы, которую дают до исчезновения признаков активности. Назначают также триамцинолон (4 мг эквивалентны 5 мг преднизолона и 25 мг кортизона), дексаметазон (0,75 мг эквивалентны 4 мг триамцинолона и т. д.). Для предупреждения обострения хронической очаговой инфекции или во время присоединения инфекционных заболеваний одновременно с кортикостероидами вводят антибиотики (в течение 10–14 дней). При полиартрите на пораженные суставы рекомендуется сухое тепло, соллюкс, ультрафиолетовое облучение, УВЧ. При хорее одновременно с противоревматической терапией вводят витамины группы В: витамин B1 (пиридоксин) по 50 мг ежедневно в течение 10 дней, витамин В6 внутримышечно по 1 мл; витамин С — 1 мл 5 %-ного раствора в 10–15 мл 20 %-ного раствора глюкозы внутривенно; 0,5 %-ный раствор новокаина внутривенно от 3 до 10 мл (ежедневно прибавляя по 1 мл); антигистаминные препараты. При выраженных изменениях сердечно-сосудистой системы, сопровождающихся недостаточностью кровообращения, назначают сердечные гликозиды (строфантин — 0,05 %-ный раствор; наперстянка — 0,03—0,075 г 3 раза в сутки — доза насыщения; коргликон — 0,06 %-ный раствор) и диуретические средства (эуфиллин внутрь, в свечах и внутривенно; новурит 2–3 раза в неделю внутримышечно по 0,25—0,5–1 мл или в свечах по 0,25—0,5 г; фонурит). В стационаре больной ребенок проходит курс лечения в среднем в течение 1,5–2 месяцев, а затем на 2–3 месяца для этапного лечения направляется в санаторий. После санатория ребенок поступает под наблюдение педиатра-кардиолога; на ребенка заводится учетная форма № 30.
Профилактика Профилактика ревматизма включает активную санацию очагов хронической инфекции и энергичное лечение острых заболеваний, вызванных стрептококком. В частности, рекомендуется лечение всех больных ангиной инъекциями пенициллина по 500 тыс. ЕД 4 раза в сутки в течение 10 дней. Эти мероприятия наиболее важны при уже развившемся ревматизме. Если у больного в неактивной фазе болезни появились первые признаки предположительно стрептококковой инфекции, то помимо обязательного 10-дневного курса пенициллинотерапии, он должен в течение этого же срока принимать одно из противоревматических средств: ацетилсалициловую кислоту по 2–3 г, индометацин по 75 мг и т. п. В соответствии с методическими рекомендациями больным, перенесшим первичный ревмокардит без признаков клапанного поражения, показано назначение бициллина-1 по 1200 тыс. ЕД или бициллина-5 по 1,5 млн ЕД 1 раз в 4 недели в течение 3 лет. После первичного ревмокардита с формированием порока сердца и после возвратного ревмокардита бициллинопрофилактика рекомендуется на срок до 5 лет. Первичная профилактика — лечение острых стрептококковых заболеваний. Вторичная профилактика — бициллино-медикаментозная; проводят в течение 3–5 лет круглогодично в зависимости от тяжести течения болезни. Используют бициллин-1 (в дошкольном возрасте 600 тыс. ЕД 1 раз в 2 недели, школьном — 1,2 млн ЕД 1 раз в месяц) или бициллин-5 (в дошкольном возрасте 750 тыс. ЕД 1 раз в 2 недели, школьном — 1,5 млн ЕД 1 раз в месяц). Кроме этого, 2 раза в год (весной и осенью) проводят в течение 6 недель курсы нестероидных противовоспалительных препаратов. Всем детям, перенесшим ревматизм, при возникновении ОРВИ, ангины, синуситов в течение 10 дней назначают антибиотики и противовоспалительные препараты.
РЕЙНО БОЛЕЗНЬ
ОпределениеБолезнь Рейно — ангиотрофоневроз с преимущественным поражением мелких концевых артерий и артериол. Процесс локализуется на верхних конечностях, поражение обычно симметричное и двустороннее, чаще заболевают женщины молодого возраста.
Этиология Длительное ознобление, хроническая травматизация пальцев, эндокринные нарушения (щитовидной железы, половых желез), тяжелые эмоциональные стрессы.
Клиническая картина Выделяют 3 стадии заболевания: — ангиоспастическую (кратковременные спазмы сосудов концевых фаланг 2–3 пальцев кисти или 1–3 пальцев стопы; спазм быстро сменяется расширением сосудов с покраснением кожи, потеплением пальцев); — ангиопаралитическую (кисть и пальцы приобретают цианотичную окраску, отечность и пастозность пальцев); — трофопаралитическую (склонность к развитию панарициев и язв, очаги поверхностного некроза мягких тканей концевых фаланг, после отторжения — длительно не заживающие язвы).
Дифдиагностика Дифференциальный диагноз проводят с облитерирующим эндартериитом и нарушениями кровообращения в конечности, обусловленными сдавлением подключичной артерии (добавочное шейное ребро, высоко расположенное I ребро — реберно-подключичный синдром; гипертрофированная передняя лестничная мышца — синдром передней лестничной мышцы; патологически измененная малая грудная мышца). При этих синдромах имеется компрессия подключичной артерии и плечевого сплетения, отсюда симптоматика сосудистых и неврологических нарушений: боль, зябкость, парестезии, слабость мышц руки. При определенных положениях руки отмечается усиление симптоматики и уменьшение пульсации сосудов на кисти. Постоянная травматизация артерии приводит к рубцовым изменениям ее стенки, периартерииту и может закончиться тромбозом.
Лечение Лечение болезни Рейно консервативное, как при других облитерирующих заболеваниях сосудов. Из медикаментозной терапии применяются: никотиновая кислота, а также ксантинола никотинат (компламин, теоникол), трентал. Для снижения сосудистого тонуса назначается коринфар, кордафен (нифедипин) в дозе 30–60 мг/сут. Применяются также альфа-аденоблокаторы (фентоламин в дозе 75— 150 мг/сут.) и алкалоиды спорыньи (редергин 4,5 мг/сут.). Назначаются и дезагреганты (ацетилсалициловая кислота). Показаны внутривенные введения реополиглюкина с тректалом или никотиновой кислотой. При отсутствии эффекта производят грудную симпатэктомию, при некрозе — некрэктомию. Показаны курсы плазмафереза с полным замещением удаленной плазмы плазмой свежезамороженной. Применяется физиотерапия: УВЧ, СВЧ, УФО воротниковой зоны, местно на кисти ультразвук.
РЕЙТЕРА БОЛЕЗНЬ
ОпределениеРейтера болезнь (синдром Рейтера) — заболевание, развивающееся после некоторых острых заболеваний мочеполовых органов или кишечника у лиц с наследственной предрасположенностью, характеризующееся триадой клинических проявлений — артритом (см.), уретритом (см.) и конъюнктивитом (см.). Рейтера болезнь развивается, как правило, в молодом возрасте, преимущественно у мужчин, известны единичные случаи заболевания у детей.
Этиология и патогенез Происхождение и механизм развития болезни до конца не установлены. В происхождении Рейтера болезни, кроме наследственной предрасположенности, могут играть роль различные инфекции мочевыводящей и пищеварительной систем. В большинстве случаев заболевание начинается с уретрита (см.), возникающего после полового контакта или после обострения хронической инфекции мочевыводящих путей. При неблагоприятной эпидемической обстановке (в военных и туристических лагерях) Рейтера болезнь может развиться после острого энтероколита (см.) (шигеллезного, сальмонеллезного, иерсиниозного происхождения). В механизме развития поражения суставов большое значение придают иммунным процессам и наследственной предрасположенности.
Клиническая картина В клинической картине Рейтера болезни на первый план выступают проявления уретрита (см.), артрита (см.) и конъюнктивита (см.). Помимо этого, возможны изменения слизистых оболочек, паренхиматозных органов (печени, почек, миокарда, аорты, центральной нервной системы и др.). Последовательность основных симптомов может быть разной, но чаще заболевание начинается с уретрита. Уретрит (см.) при Рейтера болезни бывает различной выраженности — от острого с сильными гнойными выделениями из уретры до стертого, склонного к затяжному или даже хроническому течению. При этом имеются лишь симптомы нарушения мочевыделения с неприятными ощущениями при мочеиспускании, главным образом по утрам. Конъюнктивиты (см.) при Рейтера синдроме обычно бывают двусторонними, умеренно выраженными и быстро проходящими. Поражения суставов развиваются, как правило, остро, через 1–4 недели после появления первых симптомов уретрита или энтероколита (см.), часто сопровождаются лихорадкой (38–40 °C), иногда с ознобами. Поражение суставов возникает в срок до 6 недель от начала заболевания, обычно как острый асимметричный артрит коленных или голеностопных суставов. В последующем характерным являются 3 типичных проявления: сосискообразное поражение пальца кисти или большого пальца стопы; асимметричная ахиллодиния и подошвенный фасцит; боль в пояснице из-за поражения илиосакральных сочленений. Отмечаются боли и припухлости суставов. Поражение суставов пальцев стоп часто сопровождается отеком тканей всего пальца и багрово-синюшной окраской кожи (палец в виде сосиски). Типично развитие подпяточных бурситов (см.), тендовагинитов, ахиллова сухожилия. Вывихи (см.) в суставах рук возникают сравнительно редко. Некоторые больные могут жаловаться на боль в пояснично-крестцовом и других отделах позвоночника; при обследовании можно выявить симптомы сакроилеита. Поражение кожи и слизистой оболочки наряду с классической триадой симптомов являются наиболее типичными при болезни Рейтера. Может встречаться кератодермия, характеризующаяся появлением преимущественно на подошвах и ладонях небольших красных пятен, в центре которых образуется зона гиперкератоза, а отдельные очаги постепенно сливаются. Кроме того, возможны и псориазоподобные сыпи и изменения ногтей, поверхностные безболезненные эрозии на слизистых оболочках полости рта, языка, головки полового члена. Изменения кожи и слизистых оболочек обычно обнаруживаются в остром периоде болезни и исчезают по мере улучшения без специального лечения. К другим проявлениям Рейтера болезни относятся быстро развивающаяся атрофия (см.) мышц, прилежащих к пораженным суставам, и лимфаденит (см.), особенно паховых желез. Возможны нарушения сердечного ритма и проводимости вследствие поражения миокарда, перикардиты (см.). Могут быть поражения почек по типу гломерулонефрита (см.), пиелонефрита (см.), амилоидоза (см.), возможны полиневриты, энцефаломиелиты и психозы. Рейтера болезнь, в основном, длится 3–6 месяцев и заканчивается выздоровлением. При сохранении инфекции в мочеполовой системе возможны рецидивы заболевания. Существуют хронические варианты течения болезни со стойким артритом (см.) или спондилоартритом. Описаны смертельные исходы при остром течении заболевания, главным образом при поражении внутренних органов и центральной нервной системы. При Рейтера болезни осложнения связаны с симптоматикой триады. Уретрит у мужчин нередко осложняется простатитом (см.), а у женщин — цервицитом (см.) или аднекситом (см.). При конъюнктивите возможно развитие иридоциклита (см.) и других нарушений зрения. Артриты (см.) могут привести к бурситам (см.), тендовагинитам, а в поясничном отделе — к спондилоартриту.
Диагностика Диагноз при наличии характерной триады не вызывает затруднений. В атипичных случаях или при недостаточной выраженности отдельных симптомов прибегают к рентгенологическому исследованию суставов. Анализ синовиальной жидкости выявляет признаки воспаления. При биопсии синовиальной оболочки выявляется картина неспецифического острого или подострого воспаления. Отклонений в общем биохимическом анализе крови (умеренное повышение числа лейкоцитов, ускоренная СОЭ и другие признаки) не обнаруживается. В моче отмечается появление гноя.
Лечение Лечение болезни Рейтера комплексное, по проявлениям основных синдромов. При уретрите проводится антибактериальное лечение, прежде всего препаратами тетрациклинового ряда. При наличии артрита применяются различные нестероидные противовоспалительные препараты (диклофенак, аспирин, индометацин, вольтарен и т. д.). При высокой активности заболевания, особенно при выраженных системных проявлениях, прибегают к глюкокортикоидам. Часто применяют внутрисуставные и околосуставные введения кортикостероидов. В случае затяжного или хронического течения артрита назначают производные хинолина или соли золота, изредка — иммунодепрессанты. Меры первичной профилактики болезни Рейтера заключаются в соблюдении санитарно-гигиенических правил, особенно при неблагоприятных эпидемических ситуациях, постоянном лечении уретрита, цистита и других мочеполовых заболеваний. При наличии хламидийной инфекции необходимо лечение обоих половых партнеров.
РЕТИКУЛОСАРКОМА
ОпределениеРетикулосаркома (гистобластная злокачественная лимфома, злокачественная гистоцитарная лимфома, ретикулоклеточная саркома, ретикулоцитома, ретотельсаркома) — злокачественная опухоль, развивающаяся из клеток гистоцитарного ряда.
Этиология и патогенез Этиология болезни не изучена. Считается, что источником развития ретикулосаркомы являются ретикулярные клетки, хотя в последние годы с помощью иммунологических методов установлено, что подавляющее большинство ретикулосарком являются лимфосаркомами.
Клиническая картина и диагностика В настоящее время ретикулосаркому диагностируют крайне редко, поэтому ее достоверных клинических симптомов не описано. Специфических дифференциально-диагностических признаков ретикулосаркомы, позволяющих отличить ее от лимфосаркомы (см.), лимфогранулематоза (см.) и других опухолей (см.) кроветворной и лимфоидной ткани, нет. Диагноз может быть установлен только на основании изучения опухолевой ткани с применением специальных иммунологических, электронно-микроскопических, цитохимических и гистологических методов исследования.
Лечение и профилактика Лечение заключается в применении комплексной лучевой и химической противоопухолевой терапии. Профилактика не разработана.
РЕТИНИТ
ОпределениеРетинит — воспалительное заболевание сетчатки глаза. Многие формы воспалительного заболевания сетчатки глаза не являются строго локализованными, так как в процесс вовлекается и собственно сосудистая оболочка глаза — хориоидея, поэтому данную патологию лучше называть хориоретинитом или ретинохориоидитом.
Этиология Причинами возникновения ретинита являются занос микробной флоры из очагов инфекции (стафилококков, стрептококков, пневмококков и т. д.), а также их токсинов вместе с кровотоком. В ряде случаев ретинит может иметь вирусное происхождение (например, при гриппе (см.), герпесе (см.), кори (см.), опоясывающем лишае (см.) и т. д. Нередко эта патология возникает при туберкулезе (см.), токсоплазмозе (см.), сифилисе (см.). Встречаются ретиниты и при лепре (см.), тифах, актиномикозе (см.), саркоидозе (см.). Иногда развитие ретинита обусловлено воздействием светового или ионизирующего излучения, а также травматическими повреждениями сетчатки.
Патогенез В зависимости от причины заболевания различают туберкулезный, сифилитический, токсоплазмозный, метастатический, солнечный, лепрозный и другие разновидности ретинита. В активной стадии ретинита возникают дезорганизация и разрушение сетчатки с образованием очага воспаления, по краям которого отмечается скопление лимфоцитов, плазматических клеток, эозинофилов и фагоцитов. Наблюдается миграция клеток пигментного эпителия во внутренние слои сетчатки. Одновременно во внутренних слоях собственно сосудистой оболочки появляется лимфоцитарная инфильтрация. В результате организации очага воспаления образуется рубцовая ткань. Нервные элементы сетчатки при ретините распадаются и замещаются соединительной тканью, нервные волокна варикозно утолщаются, подвергаются жировой дистрофии ганглиозные клетки (ганглиозные нейроциты) и опорные волокна Мюллера (лучевые глиоциты). Вовлекаются в процесс палочки и колбочки, которые на поздних этапах заболевания подвергаются разрушению.
Клиническая картина Основной синдром ретинита любого происхождения — снижение остроты зрения. Степень миопии (близорукости) зависит от локализации процесса. Наибольшее нарушение центрального зрения происходит при локализации ретинита в макулярной зоне (зоне желтого пятна), при этом страдает даже цветовосприятие. Нередко больные жалуются на искаженные зрительные восприятия предметов (метаморфопсия), а также на ненормальные световые ощущения в глазах в виде блеска, молний, искр и др. При исследовании поля зрения определяют центральные, околоцентральные и периферические скотомы, которые могут быть абсолютными или относительными, положительными или отрицательными. Периферическая локализация ретинита сопровождается различными по конфигурации изменениями границ поля зрения, нарушениями тепловой адаптации, которые после благоприятного исхода болезни могут исчезать. При помощи офтальмоскопии обнаруживают белые или желтоватого цвета фокусы, которые в активной фазе представляются рыхлыми образованиями с четкими границами, окруженными зоной отека сетчатки. Сосуды сетчатки обычно изменяются при поражении их стенок (васкулиты (см.)). Изменения могут быть разнообразными: сужение или расширение сосудов, неравномерность их калибра, частичная закупорка, образование муфт и т. д. Нередко появляются обширные кровоизлияния в самой сетчатке и под ней. Активный воспалительный процесс на глазном дне вызывает реакцию стекловидного тела, в котором появляется жидкость. Обнаружение жидкости в стекловидном теле помогает дифференцировать воспалительный процесс на глазном дне от дистрофического. Снижение активности процесса сопровождается уплотнением очага, границы которого становятся более плотными. Старые хориоретиниальные фокусы имеют четкие границы, окрашены в белый и серый цвета с отложением глыбок пигмента. Осложнениями ретинита считаются обширные хориоретинальные рубцы, которые могут остаться после разрешения воспалительного процесса. Основным диагностическим исследованием при ретините является офтальмоскопия. С помощью флюоресцентной ангиографии глазного дна можно выявить свежий или старый воспалительный фокус и процессы разрушения пигментного эпителия. Происхождение ретинита устанавливают на основании анамнеза, объективной оценки состояния больного, данных инструментального обследования, постановки специальных диагностических проб.
Лечение и профилактика Лечение ретинита должно быть комплексным. Показаны антибиотикотерапия, местное и общее применение кортикостероидов, в исходе заболевания используются сосудорасширяющие средства и средства, стимулирующие обмен веществ в сетчатке. При туберкулезной, сифилитической, токсоплазменной, лепрозной и другой специфической природе ретинита в терапию включаются специфические препараты, направленные на лечение общего заболевания. Профилактика специфического ретинита заключается в раннем выявлении и адекватном лечении основного заболевания. При солнечном ретините необходима надежная защита глаз от светового излучения.
РЕТИНОБЛАСТОМА
ОпределениеРетинобластома — это истинное злокачественное новообразование, развивающееся в сетчатке глаза в первые месяцы или годы жизни ребенка. Она относится к врожденным опухолям (см.). Выявляется у детей в возрасте 2–4 лет. Ретинобластома может быть как односторонней, так и двусторонней. Чаще встречается двусторонний процесс.
Этиология, патогенез и патанатомия Этиология достоверно не установлена. Возможной причиной считается мутация хромосом половых клеток за счет внутренних и внешних факторов. Ретинобластома состоит из нейроглии, т. е. является по своей структуре глиомой. Глия развивается из эктодермы и обладает большой энергией к размножению и образованию новых элементов. Глиозная ткань пронизывает все слои сетчатки и зрительного нерва. Различают дифференцированные и недифференцированные формы опухоли. Специфической структурой дифференцированной ретинобластомы являются истинные розетки, которые состоят из нейроэпителиальных клеток эмбрионального типа. При недифференцированных формах обнаруживаются мелкие клетки, располагающиеся диффузно или образующие вокруг сосудов псевдорозетки, окруженные зоной некроза (см.) и кальцификатами (участками обызвествления). В опухоли часто отмечаются митозы (акты деления клеток), развивается распространение процесса в стекловидное тело и переднюю камеру глазного яблока.
Клиническая картина Ретинобластома может быть односторонней и двусторонней. Двусторонние опухоли часто сочетаются с маленьким черепом, незаращением неба и другими пороками эмбрионального развития. Начало заболевания обычно проходит незаметно. Первым клиническим симптомом может быть понижение остроты зрения. Иногда ранним клиническим признаком одностороннего поражения может быть косоглазие (см.). Затем присоединяется изменение цвета глаза (желтоватый рефлекс), наблюдаемое в глубине глазного яблока и видимое через зрачок (так называемый «кошачий глаз»). Такое явление возникает из-за наличия глиоматозных узлов на сетчатке и заставляет родителей ребенка обратиться к врачу. Опухоль отличается медленным ростом. В клинике ретинобластомы при объективном исследовании глазного дна различают 4 стадии. На первой стадии видны беловато-розовые очаги с гладким или неровным рельефом, новообразованными сосудами и серыми участками кальцификатов. Размеры их не превышают одного квадранта глазного дна, окружающие ткани не изменены. На второй стадии происходит внутриглазное распространение ретинобластомы. Беловатые включения различных размеров уже наблюдаются в стекловидном теле, отмечаются хлопьеподобные отложения в углу передней камеры глазного яблока и на задней поверхности роговицы. Появляются вторичная глаукома (см.) и буфтальм (крайняя степень гидрофтальма, проявляющаяся выпячиванием глазного яблока при глаукоме). При прорастании опухолью сетчатки скопление под ней воспалительной жидкости приводит к отслоению сетчатки (см.). Зрение снижается до полной слепоты. Третья стадия характеризуется внеглазным распространением опухоли. Сопровождающееся экзофтальмом прорастание опухоли в полость черепа, чаще всего по зрительному нерву, дает симптомы поражения головного мозга (головная боль, тошнота, рвота). Прорастание ретинобластомы в сосудистую оболочку глаза приводит к распространению ее с кровотоком и неблагоприятному исходу. В результате омертвения опухоли может развиться токсический увеит (см.). На четвертой стадии к глазной симптоматике присоединяются симптомы, обусловленные метастазированием. Метастазирование происходит в лимфатические узлы, кости, мозг, печень и другие органы. Осложнением ретинобластомы при благоприятном исходе может быть потеря зрения на одном или обоих глазах. Возможным осложнением являются превращение ретинобластомы в саркому (рабдомиосаркома (см.)) и развитие лейкоза (см.). Диагностическим критерием ретинобластомы на первой стадии заболевания служит обнаружение амавротического «кошачьего глаза». Для объективного подтверждения диагноза прибегают к офтальмоскопии, рентгенографии, ультразвуковому исследованию глазного яблока и черепа.
Лечение и профилактика На первой и второй стадиях болезни возможно проведение органосохранной криоаппликации. На более поздних стадиях лечение заключается в своевременном проведении хирургического удаления опухоли (энуклеация пораженного глаза при одностороннем процессе или обоих глаз при двустороннем). Энуклеация глазного яблока проводится с резекцией зрительного нерва на расстоянии 10–15 см от заднего полюса глазного яблока. В дальнейшем проводится лучевая терапия в сочетании с химиотерапией или самостоятельно. Может проводиться и фотокоагуляция. В качестве противоопухолевых препаратов применяют циклофосфан, проспедин, метотрексат-эбеве. Профилактика ретинобластомы заключается в своевременном генетическом обследовании тех семей, чьи родственники проходили лечение по поводу ретинобластом в прошлом.
РЕФЛЮКС-СИНДРОМ
ОпределениеРефлюкс-синдром — группа патологических состояний, вызванных перемещением жидкого содержимого в полых органах или сосудах в обратном направлении за счет нарушения в них градиента давления или сфинктерной системы.
Этиология и патогенез Причинами развития рефлюкс-синдрома в желудочно-кишечном тракте могут быть: — функциональная недостаточность кардиального жома при грыжах диафрагмы; — функциональная недостаточность кардиального жома после операций, сопровождающихся резекцией или повреждением его; — анатомический дефект мышечного кольца пищеводно-гастрального жома; — функциональная и органическая недостаточность привратника при патологии желудка, двенадцатиперстной кишки, поджелудочной железы после удаления части желудка; — атрофия (см.) гладких мышц зоны кардии, вызванной системными заболеваниями (склеродермия (см.)); — патология фатерова соска и сфинктера Одди; — нарушение техники проведения дуоденопанкреохолангиографии, ретроградной панкреохолангиографии. Причинами рефлюкса в мочеполовой системе могут быть следующие факторы: — повышение внутрилоханочного давления до 70 мм рт. ст. в результате разрыва чашечного свода или вследствие зияния устьев собирательных почечных трубочек при склеротических изменениях свода и почечных сосочков; — закупорка мочеточника камнем, перегиб мочеточника при нефроптозе и гидронефрозе; предрасполагающими факторами при этом могут быть туберкулез (см.), вторичный пиелонефрит (см.), выраженный нефросклероз; — проведение экскреторной урографии со сдавлением мочеточника; — ретроградная пиелография при быстром введении контрастного вещества; — врожденные анатомические дефекты в мочеполовой системе или незавершенное созревание пузырного устья мочеточников. Причинами рефлюкс-синдрома в венозной системе является недостаточность венозных клапанов при варикозном расширении вен. Рефлюкс в пищеварительной и мочевыводящей системах формируется за счет функциональных или органических изменений, что вызывает обратное движение содержимого в полых органах или сосудах.
Клиническая картина Рефлюкс-синдром в пищеварительной системе бывает гастроэзофагеальным, дуоденогастральным, панкреатобилиарным и билиарно-панкреатическим (холедохо-панкреатическим). Основные клинические проявления гастроэзофагеального рефлюкса выражаются в ощущении больным изжоги, иногда сопровождающейся жгучей болью. Дуоденогастральный рефлюкс-синдром клинически протекает с развитием эрозивных язв или полипов на фоне гастрита (см.). За счет функциональных или органических нарушений деятельности привратника при рефлюкс-синдроме происходит изменение кислотности желудочного сока (его ощелачивание), что дает предпосылки для перестройки желудочного содержимого по кишечному типу и приводит в дальнейшем к развитию хронического гастрита (см.) или полипоза (см.). Панкреатобилиарный рефлюкс-синдром появляется при органических изменениях двенадцатиперстной кишки и стаза ее содержимого. Значительная пептическая активность панкреатического сока дает тяжелый хронический холангит (см.), что проявляется поражением печени с развитием желтухи (см.) и тяжелой интоксикации. Билиарно-панкреатический, или холедохо-панкреатический, рефлюкс-синдром возникает при определенных анатомических взаимоотношениях: — слиянии общего желчного протока и протока поджелудочной железы в общий канал с образованием ампулы перед впадением в двенадцатиперстную кишку; — наличии препятствия оттоку желчи на уровне фатерова соска за счет холелитиаза (образования камней в желчных протоках), отека, сужения или воспаления; — повышении тонуса сфинктера Одди при гипотонической дискинезии желчевыводящей системы. Рефлюкс-синдром приводит к повреждению стенки протоков и попаданию панкреатического сока в межуточную ткань, что приводит к клиникеострого панкреатита (см.). В обычных условиях давление в панкреатическом протоке выше, чем в общем желчном, и заброса желчи не происходит. Рефлюкс в мочевыводящей системе подразделяется на: — лоханочно-почечный — из почечной лоханки в паренхиму почки и ее сосуды; — пузырно-мочеточниково-лоханочный — из мочевого пузыря в мочеточники и почечную лоханку; — мочеточнико-венозный, мочеточниколимфатический — из мочеточника в крупные вены или лимфатические сосуды; — уретровенозный — из уретры в вены таза; — уретроэякуляторный — из уретры всемявыводящий проток. Лоханочно-почечный рефлюкс в свою очередь подразделяется на форникальный и тубулярный. При форникальном рефлюксе содержимое почечной лоханки проникает через свод в синус, венозные или лимфатические сосуды, периваскулярные щели, под капсулу почки в ее межуточную ткань и забрюшинную клетчатку. Тубулярный лоханочно-почечный рефлюкс отличается тем, что содержимое проникает в канальцы почечного сосочка. Клинически все виды рефлюксов мочевыводящей системы могут протекать с болями в области почек, ознобом, высокой температурой или незначительным ее повышением. Характерным симптомом пузырно-мочеточникового рефлюкса является двухтактное мочеиспускание. В запущенных случаях отмечаются повышение мочевыделения и жажда. Пузырно-мочеточниковый рефлюкс имеет свои особенности у детей. В 25–30 % случаев он приводит к развитию пиелонефрита (см.). Пузырно-мочеточниковый рефлюкс у детей развивается за счет анатомических особенностей: короткий интрамуральный отдел мочеточника, прямой угол его впадения в мочевой пузырь, незрелость замыкательного мышечного аппарата двигательного отдела мочеточника, внутривезикальная обструкция, цистит (см.), нарушение иннервации мочевых путей, удвоение мочеточников. Высокий рефлюкс, который достигает почечных лоханок и канальцев (пиелотубулярный), повреждает почечные канальцы и межуточную ткань, что приводит к расширению и разрушению канальцев, дистрофическим изменениям нефротелия, развитию интерстициального нефрита (см.) с исходом в склероз. При инфекции мочевыводящих путей эти процессы усугубляются. Задержка роста почек и становления их функции может привести к почечной недостаточности из-за несоответствия между функциональными возможностями почек и потребностями растущего организма. У детей нет характерной клинической картины при рефлюкс-синдроме; он выявляется, как правило, только при исследовании мочеполовой системы.
Осложнения Осложнением рефлюкс-синдрома в сосудистой системе является варикозное расширение вен, что ведет к развитию аневризм (см.) и трофических язв. Рефлюкс-синдром в сосудистой системе приводит к уменьшению венозного объема сердца вплоть до ортостатических расстройств кровообращения. В пищеварительной системе следствием рефлюкса является развитие хронических заболеваний, язв, эрозий, полипов. Рефлюкс в мочевыводящей системе у новорожденных с обструкцией нижних мочевых путей может привести к асциту (см.). Разрыв свода и рефлюкс инфицированной мочи в почку представляет угрозу в плане развития уросепсиса, апостематозного нефрита (см.), паранефрита. Возможными осложнениями рефлюкса в мочевых путях являются: периуретрит, мочевая гранулема, ретроперитонеальный фиброз (см.) и развитие уриномы (фибролипоматозный и псевдокистозный процессы). Свищи между венозными сплетениями и полостями чашечек почек, повышение артериального давления также могут вызываться рефлюкс-синдромом в мочевыводящей системе. Диагностика рефлюкс-синдрома требует специальных методов исследования, таких как внутривенная холангиография, ретроградная дуоденопанкреохолангиография, эзофаготонография, пищеводная рН-метрия, радиоизотопная урография и реноцистография, кинематоцистография и др.
Лечение и профилактика В лечении рефлюкс-синдрома пищеварительной системы основными методами терапии должны быть: — стимуляция тонической функции кардии и привратника; — нормализация функциональных свойств желудка и его кислотного содержимого; — устранение основного заболевания путем консервативного или оперативного лечения. При рефлюкс-эзофагите применяются анацидные препараты (альмальгель, альмаль-гель А, гастразол, омефрез, ранитидин). Для снятия дуоденогастрального рефлюкса, кроме вышеперечисленных медикаментов, можно использовать зантак, кватемал, ланцид, омез, фосфалюгель, смекту и др. Лечение рефлюкс-синдрома в мочевыводящей системе также направлено на стимуляцию функции мочевого пузыря с помощью электростимуляции, назначения мелипрамина и седуксена. Оперативное лечение направлено на устранение обструкции и восстановление нормальной функции почек. Профилактика рефлюкс-синдрома заключается в тщательном лечении всех выявленных заболеваний в желудочно-кишечной и мочеполовой системах, отказе от сдавления мочеточников при экскреторной урографии, осторожном проведении ретроградной холецисто- и урографии.
РИНОЛИТ
ОпределениеРинолит — носовой камень. Встречаются ринолиты сравнительно редко, чаще у детей. Длительность пребывания ринолита в полости носа различна. Описан случай из практики, когда ринолит находился в полости носа 35 лет.
Этиология и патанатомия Причиной ринолита чаще всего являются инородные тела, которые при длительном пребывании в полости носа покрываются выпавшими из носовой слизи известковыми и фосфатными солями кальция и магния. Реже ринолиты бывают профессионального характера, например у рабочих цементного производства. По химическому составу ринолит содержит до 10–15 % органических соединений. По форме ринолиты разнообразны: круглые, продолговатые, с неровной поверхностью и острыми выступами. Большинство их небольших размеров, но встречаются и крупные.
Клиническая картина и диагностика Клинически ринолиты, как правило, вызывают длительное затруднение носового дыхания. При инфицировании появляются гнойные выделения, иногда с неприятным, зловонным запахом; беспокоят головная боль, повторные необильные кровотечения, ощущение давления в соответствующей половине лица, слезотечение. Большие ринолиты вызывают деформацию лица. При риноскопии определяют отек носа, слизистых оболочек носовых раковин и носовой перегородки, грануляции, гнойные корки, определяются и сами ринолиты, расположенные чаще в общем носовом ходе, реже в среднем и заднем отделах носа. Ринолиты могут осложняться хроническим ринитом (см.), гайморитом (см.), носовым кровотечением, фронтитом (см.), отитом (см.), перфорацией носовой перегородки. Диагноз ринолита устанавливается с учетом анамнеза, результатов проведения передней, средней и задней риноскопии, используют также зондирование, рентгенографию, в том числе с контрастным веществом, томографию.
Лечение и профилактика Лечение только оперативное. Удаляют ринолит крючками, преимущественно через передний отдел носа, реже под общим наркозом. Профилактика заключается в исключении попадания инородного тела в полость носа и быстрейшем его удалении в случае такового.
РИНОФИМА
ОпределениеРинофима — хроническое заболевание кожи носа, характеризующееся увеличением всех ее элементов и обезображиванием носа. Ринофима наблюдается чаще у мужчин 40–50 лет.
Этиология Причины возникновения болезни не установлены. Считается, что ринофима является третьей стадией красных угрей. Некоторые авторы придают большое значение в развитии ринофимы хроническому алкоголизму (см.). Предрасполагающими факторами для развития данной патологии имеют значение неблагоприятные условия окружающей среды: запыленность и повышенная влажность воздуха, резкая смена температуры, частые охлаждения.
Патогенез, патанатомия и клиническая картина Ринофима развивается медленно, в течение многих лет, но затем может быстро прогрессировать. Различают фиброзно-ангиоэктатическую и железистую (бугристую) формы ринофимы. При фиброзно-ангиоэктатической форме ринофимы за счет увеличения всех элементов кожи нос равномерно увеличивается в размерах, но не теряет своей конфигурации. В связи с развитием сосудов кожа носа при этом становится ярко-красной. При железистой форме ринофимы в области верхушки и крыльев носа образуются три бугристых, сидящих на широком основании клубнеобразных узла, которые в дальнейшем сливаются. Разрастания кожи иногда достигают огромных размеров, свешиваются вниз, закрывают ноздри и рот, затрудняя дыхание, прием пищи и обезображивая лицо. Узлы обычно мягкой консистенции, с блестящей сальной поверхностью и большим количеством расширенных сосудов и сальных желез, из устьев которых при надавливании выделяется зловонное кожное сало. Цвет узлов варьирует от присущего коже в норме до восковидно-багрового. Хрящи носа обычно не изменяются, но в отдельных случаях возможно утолщение или (чаще) истончение хрящей. При гистологическом (тканевом) исследовании установлено, что увеличение всех элементов кожи, особенно сальных желез, развивается на фоне хронического вялотекущего воспалительного процесса. В узлах при ринофиме обнаруживается разрастание соединительной ткани, отмечаются увеличение количества сальных желез с кистообразным расширением их просветов, числа лимфатических и кровеносных сосудов с их расширением и утолщением стенок. Вокруг сосудов и волосяных фолликулов видны воспалительные образования, состоящие из лимфоцитов, лейкоцитов, тучных клеток, гистиоцитов, фибробластов, гигантских и плазматических клеток. Гистологическая картина иногда трактуется как тяжелая фиброма (см.) или кистозная аденофиброма. Осложнением болезни считается озлокачествление ринофимы.
Лечение Лечение только оперативное с применением различных вариантов удаления ринофимы. При оперативном лечении применяют также электрокаутеры и гальванокаустические петли. Рецидивы ринофимы возможны при неполном удалении пораженных тканей.
РОБЕНА СИНДРОМ
ОпределениеРобена синдром — это врожденный порок сердца, характеризующийся тремя основными клиническими признаками: недоразвитием нижней челюсти (нижней микрогнатией), глоссоптозом (недоразвитием и западением языка) и наличием расщелины нёба. Робена синдром встречается на каждые 10–30 тыс. новорожденных.
Этиология и патогенез Факторы возникновения и механизм развития не выяснены. Имеются указания на то, что в основе Робена синдрома лежат нарушения эмбрионального развития, вызванные разнообразной патологией дородового периода.
Клиническая картина и диагностика Сразу же после рождения появляется резкое нарушение дыхания, связанное с западением языка. Ребенок беспокоен, выражена синюшность, может наступить удушье. Из-за нарушения акта глотания во время кормления ребенка может наступить удушье. Характерен внешний вид новорожденного — так называемое «птичье лицо», формирующееся в связи с недоразвитием нижней челюсти (от слабо выраженного недоразвития до полного ее отсутствия). Наряду с типичной триадой (нижняя микрогнатия, глоссоптоз и расщелина нёба) у больных с синдромом Робена имеются и другие пороки развития (см.) (врожденная катаракта (см.), миопия, пороки сердца (см.), мочеполовой системы, аномалии развития грудины и позвоночника, а также полидактилия и врожденное отсутствие конечностей). Умственное недоразвитие отмечается примерно у 20 % больных. Диагноз основывается на клинических проявлениях этого синдрома.
Лечение и профилактика Лечение должно проводиться практически сразу после рождения. В легких случаях для профилактики нарушения дыхания достаточно держать новорожденного в положении лежа на животе или вертикально, наклонив голову к груди. При кормлении нельзя держать ребенка горизонтально из-за опасности попадания пищи в дыхательные пути и развития аспирационной пневмонии (см.) с последующим смертельным исходом. При резко выраженной нижней микрогнатии и значительном смещении языка кзади требуется выведение языка вперед в физиологическое положение оперативным путем. Рекомендуется пришивать язык к нижней губе, щекам или нижней челюсти в нескольких точках сроком на 1–2 месяца. В тяжелых случаях накладывается гастростома. В более старшем возрасте устраняют расщелину неба, проводят ортопедическое и оперативное лечение нижней микрогнатии. Показаны занятия с логопедом для установления правильной речи. Профилактика заключается в исключении всех неблагоприятных факторов в дородовом периоде развития ребенка.
РОЖА
ОпределениеРожа — острое стрептококковое заболевание, характеризующееся поражением кожи с образованием резко ограниченного воспалительного очага. Латинское название рожи означает в переводе «красная кожа».Это широко распространенная стрептококковая инфекция с ростом заболеваемости в летне-осенний период. В современной структуре инфекционной заболеваемости рожа занимает 4-е место после заболеваний дыхательного тракта, желудочно-кишечных заболеваний и вирусного гепатита (см.). Заболевание регистрируется в старших возрастных группах и в трети случаев носит рецидивирующий характер. Рожей болеют чаще женщины.
Рожа лица
Этиология Возбудителем рожи может быть любой представитель бета-гемолитического стрептококка группы А, те же возбудители могут вызывать и другие стрептококковые инфекции (ангину (см.), сепсис (см.), пневмонию (см.), менингит (см.) и т. п.). Стрептококк широко распространен в природе, во внешней среде он довольно устойчив. Источником возбудителя рожистого воспаления могут быть больные с различными стрептококковыми инфекциями (ангина (см.), отит (см.), стрептодермия, пневмония (см.) и т. п.), а также бактерионосители. Внедрение стрептококков в кожу или слизистые происходит через небольшие повреждения (ранки, ссадины, уколы, расчесы и т. п.). Возможно инфицирование через загрязненные медицинские инструменты и перевязочный материал, а также из хронических очагов стрептококковой инфекции в носоглотке и миндалинах (хронический тонзиллит (см.), ринит (см.), фарингит (см.)). Реже распространение инфекции происходит вместе с лимфотоком из вышеперечисленных очагов инфекции и вызывает развитие обширного процесса, занимающего целую анатомическую область (лицо, конечность, туловище и др.). Иногда встречается распространение стрептококковой инфекции с кровотоком (сепсис (см.)), когда в процесс может вовлекаться вся кожа, или формироваться метастатические очаги воспаления. Факторами риска для возникновения рожи могут быть профессии, связанные с возможностью микротравм, постоянным загрязнением кожи, резким перепадом температур, работой в инфекционных очагах. При этом решающее значение имеет состояние реактивности организма, обусловливающее изменение восприимчивости по отношению к стрептококку. Восприимчивость к данному заболеванию неодинакова и зависит от индивидуальной предрасположенности; некоторые люди могут болеть рожей неоднократно. Отмечается высокая восприимчивость к рожистому воспалению новорожденных, особенно недоношенных, при несоблюдении санитарно-гигиенических норм.
Патогенез и патанатомия Болезнь начинается с внедрения стрептококка в кожу или слизистые оболочки из внешней среды или из внутренних очагов. Далее происходит размножение микроорганизмов в лимфатических сосудах кожи. Стрептококки и их токсины, всасываясь в месте внедрения, вызывают развитие воспалительного процесса, в результате чего появляется местный очаг инфекционно-аллергического воспаления кожи или слизистой, сопровождающийся регионарным лимфаденитом (см.). Воспалительный очаг проявляется отеком, покраснением и инфильтрацией кожи и подкожной клетчатки. Проникновение токсинов стрептококка в кровеносное русло приводит к лихорадке и другим проявлениям интоксикации (головной боли, ознобу, тошноте, рвоте (см.) и т. п.). При этом часто отмечается ломкость сосудов, проявляющаяся в точечных кровоизлияниях. Определенное значение при возникновении рожистого воспаления имеют так называемые факторы риска — сопутствующие фоновые заболевания: — варикозное расширение вен; — тромбофлебит (см.); — хронические заболевания носоглотки; — сахарный диабет (см.); — микоз (см.) нижних конечностей; — опрелости (см.) межпальцевых промежутков стоп и др. В коже и регионарных лимфатических узлах формируется очаг хронической стрептококковой инфекции, а аллергическая перестройка и чувствительность кожи к гемолитическому стрептококку приводит у ряда больных к возникновению рецидивов заболевания. В последние годы выяснено, что в развитии рожистого воспаления, особенно в случаях рецидива, имеет значение стафилококковая инфекция. Рожа характеризуется развитием серозного или серозно-геморрагического воспаления кожи с преимущественным поражением собственно дермы. В коже обнаруживаются отек, расширение кровеносных и лимфатических сосудов.
Клиническая картина Различают рожу первичную, повторную и рецидивирующую. Воспалительный процесс может располагаться на любом участке тела, но чаще локализуется на коже лица и голеней. На слизистых оболочках рожистое воспаление встречается редко. Если новый процесс возникает в другом месте, такое заболевание считается повторным, а рецидивирующее течение рассматривается как инфекционно-аллергическая форма рожистого воспаления. По характеру местных воспалений выделяют эритематозную, буллезную, пустулезную, геморрагическую, флегмонозную, некротическую, эритематозно-буллезную, буллезно-геморрагическую и другие формы рожистого воспаления.
Рожистое воспаление голени и стопы. Буллезная форма
Рожистое воспаление голени. Стадия заживления
Выделяют следующие формы рожи по В. А. Черкасову. I. По характеру местных проявлений: — эритематозная; — эритематозно-буллезная; — эритематозно-геморрагическая; — буллезно-геморрагическая. II. По степени интоксикации (тяжести течения): — легкая; — среднетяжелая; — тяжелая. III. По кратности: — первичная; — повторная; — рецидивирующая. IV. По распространенности местных проявлений: — локализованная; — распространенная, блуждающая (ползучая, мигрирующая); — статическая, с появлением отдельных друг от друга очагов воспаления. Рожистое воспаление начинается с продромального периода, который в большинстве случаев составляет 2–7 дней (чаще 3–5 дней), а впоследствии может сокращаться до нескольких часов. Данный период (инкубационный) проявляется усталостью, разбитостью, ознобом, головной болью, чувством распирания в области внедрения инфекции; увеличиваются регионарные лимфатические узлы, может повышаться температура вплоть до сильной лихорадки. Заболевание начинается остро. Общетоксический синдром предшествует локальным изменениям. Быстрый подъем температуры сопровождается ознобом, нередко потрясающим. Выявляются выраженные проявления интоксикации — головные боли, головокружение, слабость, тошнота, иногда рвота (см.), жидкий стул. В тяжелых случаях могут быть судороги и бред (см.). К ранним симптомам интоксикации относят также и мышечные боли (преимущественно в мышцах нижних конечностей и поясничной области, боли в суставах). Через 10–20 ч от начала болезни возникают местные проявления. Сначала на ограниченных участках развивающегося рожистого воспаления возникают зуд, чувство стягивания кожи, повышенная влажность. Затем в этих местах появляются припухлость и боль, соответствующие развитию регионарного лимфаденита (см.). Эти симптомы обычно предшествуют клинически явным очаговым изменениям кожи, развивающимся при роже. В большинстве случаев это проявления эритематозной формы рожи. Типичная рожистая бляшка представляет собой участок яркого насыщенного пятна (эритемы) с неровными контурами в виде языков пламени. Воспалительный процесс распространяется на подкожно-жировую клетчатку, вследствие чего развивается выраженный отек, особенно при локализации на участках с рыхлой подкожной клетчаткой (лицо, гениталии). Бляшка приподнята над окружающей кожей, так как отграничена от неизмененной кожи краевым валиком, при этом центр ее как бы западает. На ощупь бляшка плотная, горячая, болезненная при надавливании. Иногда можно обнаружить демаркационный валик в виде возвышающихся краев эритемы. В ряде случаев воспалительный процесс может этим и ограничиться, и тогда через несколько дней бляшка исчезает, оставляя после себя мелкое шелушение. Однако чаще без лечения процесс быстро прогрессирует, возникают так называемые ползучие, или метастатические, формы заболевания, нередко приводящие к сепсису (см.).
Рожа. Серозное воспаление кожи
При эритематозно-буллезной форме в зоне покраснения появляются пузыри, заполненные серозно-тестоватым содержимым. Размеры пузырей могут быть от очень мелких до крупных и сливных. После подсыхания пузырей остаются плотные корки. Если пузыри заполняются мутной жидкостью, то речь идет о пустулезной форме, а при геморрагической форме заболевания они заполнены геморрагическим экссудатом. Для эритематозно-геморрагической формы рожи характерно появление точечных или более обширных кровоизлияний. Буллезные и особенно геморрагические формы характеризуются особой тяжестью течения и чаще приводят к стойкому лимфостазу. Флегмонозная форма развивается при вовлечении в воспалительный процесс подкожной клетчатки, но в отличие от истинной флегмоны (см.) наблюдается краснота с размытыми краями и максимальной болезненностью в центре. Некротическая форма сопровождается образованием в области покраснения участков омертвения черного цвета с резкой болезненностью этой зоны. Легкая форма рожи протекает с незначительно выраженной интоксикацией или без нее, повышенной температурой и ограниченным местным процессом. При тяжелой форме наблюдаются резко выраженные симптомы интоксикации вплоть до явлений сепсиса (см.) или менингоэнцефалита. Местный процесс имеет распространенный характер, хотя иногда и локализованная форма может вызвать тяжелую интоксикацию, особенно на фоне сопутствующих заболеваний и низкой устойчивости.
Пигментация кожи Период выздоровления при роже наступает на 8—15-й день болезни. Он характеризуется исчезновением местных проявлений (могут длительно сохраняться отечность и пигментация кожи), улучшением общего состояния, снижением и нормализацией температуры, исчезновением симптомов интоксикации. Клиника ранних и поздних рецидивов рожи в основном такая же, что и при первичной роже. При часто рецидивирующей форме в период выздоровления почти у всех больных выражены остаточные явления в виде инфильтрации кожи, отечного синдрома, лимфостаза и регионарного лимфаденита (см.). На месте очага в дальнейшем появляется пигментация. Особенностью часто рецидивирующей формы рожи является слабая выраженность общетоксического синдрома: температура обычно достигает 37,5—38,1 °C в течение 1–2 дней с весьма умеренными симптомами интоксикации. Эритема часто не сопровождается отеком, слабо отграничена от окружающей кожи, имеются также последствия перенесенной рожи.
Особенности рожи у новорожденных Рожа новорожденных начинается чаще всего с области пупка или пальцев. Очень быстро рожистое воспаление мигрирует («путешествующая рожа», «бродячая рожа»). Эритема при роже у новорожденных может быть не такой интенсивной, как у более старших детей или взрослых, но припухлость, инфильтрация кожи и подкожной клетчатки имеется всегда. Края очага поражения имеют зигзагообразный контур, но ограничительный валик не выражен. У новорожденных может быть и так называемая «белая» рожа, когда краснота отсутствует, а в области поражения иногда появляются пузыри, подкожные абсцессы (см.) и омертвения. Заболевание начинается с высокой температуры и озноба; одновременно появляются плотные участки покраснения кожи, теплые на ощупь и с неровными краями. Иногда начало заболевания может быть коварным — без повышения температуры или с незначительным ее повышением. Затем общее состояние прогрессивно ухудшается, температура тела держится на уровне 39–40 °C, ребенок становится вялым, отказывается от груди, появляются расстройства пищеварения, явления миокардита (см.), нефрита (см.), менингита (см.), развивается сепсис (см.). Смертность новорожденных от рожистого воспаления крайне высока. Столь же опасна рожа и для детей первого года жизни.
Осложнения Из наиболее частых осложнений можно отметить язвы, некрозы (см.), абсцессы (см.), флегмоны (см.), нарушения лимфообращения. К местным осложнениям, возникающим непосредственно в патологическом очаге или вблизи него, относятся поверхностные или глубокие омертвения кожи, локализующиеся чаще на нижних конечностях и при геморрагической форме рожи; абсцессы, флегмоны, лимфангит, флебиты (см.), отиты (см.) и мастоидиты (см.). Общими осложнениями являются сепсис (см.), гнойный менингит (см.), холангит, гломерулонефрит (см.), острая сердечно-сосудистая недостаточность (см.), тромбоэмболия легочной артерии и др. К последствиям перенесенной рожи относят лимфостаз, а также лимфатический отек и собственно слоновость, являющиеся двумя стадиями одного процесса.
Диагностика и дифдиагностика Диагноз рожи в типичных случаях не вызывает затруднений и ставится на основании клинической картины. Дополнительным подтверждением диагноза служит наличие в крови повышенного уровня нейтрофильных лейкоцитов, токсической зернистости лейкоцитов, ускоренной СОЭ. Дифференциальная диагностика проводится с флегмоной (см.), фурункулом (см.), солнечной эритемой, опоясывающим лишаем (см.). Флегмона (см.) отличается отсутствием пограничного валика, максимальной краснотой в центре и постепенным побледнением к периферии; солнечная эритема не имеет склонности к прогрессированию, отсутствует интоксикация. Опоясывающий лишай (см.) напоминает рожу при эритематозно-буллезной форме, но при этом также нет пограничного валика, пузырьки и краснота располагаются по ходу нервов, а в крови отмечаются пониженный уровень лейкоцитов и повышенный — лимфоцитов.
Лечение В тяжелых случаях обязательна госпитализация больного в хирургическое или инфекционное отделение стационара. В лечебном учреждении необходима изоляция больного. На первом плане находится антибактериальная терапия. Самое эффективное средство при роже — пенициллин в обычных дозировках. Курс лечения должен составлять не менее 7—10 дней, недопустимо одно- или двукратное введение пенициллина даже при легких формах заболевания. При часто рецидивирующей форме результаты пенициллинотерапии значительно хуже. В этом случае достаточно эффективны антибиотики из группы макролидов — эритромицин и олеандомицин в дозе 6—20 г в сутки. Для усиления эффекта антибиотикотерапии рекомендуют назначать одновременно делагил (по 0,25 г 2 раза в сутки в течение 10 дней). Из химиотерапевтических средств можно использовать комбинированные препараты типа септрила (бисептол) и его отечественный аналог сульфатон (4–6 таблетки в сутки) в течение 7—10 дней. Для предупреждения рецидивов заболевания применяют бициллин. При среднетяжелой и тяжелой формах рожи применяют дезинтоксикационные средства, такие как перораль, трисоль, квартасоль, гемодез, полидез, реополиглюкин и др. При эритематозно-геморрагической форме рожи для снижения проницаемости капилляров целесообразно назначать аскорутин, аскорбиновую кислоту. При отсутствии склонности к тромбозам лицам молодого и зрелого возраста необходимы препараты кальция. При рецидивирующем и затяжном течении рожи с расстройствами питания кожи, замедлением восстановления тканей наряду с аскорбиновой кислотой показано назначение витаминов А, группы В, никотиновой кислоты, рекомендуется применение комбинированных поливитаминных препаратов типа «Пентовит», «Пангексавит», «Комплевит» и др. Для повышения неспецифической резистентности и иммуностимуляции широко применяют пентоксил (по 0,8–0,9 г в сутки), метилурацил (по 2–3 г в сутки), ретаболил (внутримышечно по 50 мг 2 раза в сутки) в течение 2–3 недель. Используется также местное лечение в сочетании с физиотерапией. Физиотерапевтическое лечение широко применяется при рецидивирующей роже (УВЧ, кварц, лазер). Для лечения остаточных проявлений рожистого воспаления, в первую очередь инфильтрации кожи в области отмечавшейся ранее эритемы, отечного синдрома, а также увеличения регионарных лимфоузлов, используют нанесение парафина или озокерита; при плохой переносимости последних назначают повязки с подогретой нафталановой мазью. При остром процессе хороший эффект получен при сочетании антибактериальной терапии с криотерапией (кратковременное замораживание поверхностных слоев кожи струей хлорэтила до побеления). При лечении рожи с буллезными проявлениями широко применяются местные повязки с антисептическими средствами (раствор фурацилина в разведении 1:5000, раствор риванола 1:1000). В дальнейшем при подсыхании на пузыри накладывают повязки с бальзамом Вишневского, ихтиоловой мазью, а для улучшения процессов регенерации — повязки с винилином, пелоидином, экстерицидом, метилурациловой мазью и др. Местно можно использовать и средства фитотерапии (листья подорожника, масло чайного дерева, «виватон» и др.).
Профилактика Для профилактики рожи прежде всего необходимо соблюдение правил личной гигиены и техники безопасности на производстве, предупреждение переохлаждения. Важную роль играет правильный уход за кожей и слизистыми оболочками. Необходимо следить за чистотой и целостностью кожных покровов: не рекомендуется принимать ванну или душ. Здоровая кожа ежедневно протирается тампоном, смоченным 1–2 %-ным салициловым спиртом. Микротравмы необходимо немедленно обрабатывать дезинфицирующими растворами (5 %-ным спиртовым раствором йода или 1–2 %-ным спиртовым раствором бриллиантового зеленого). Людям, страдающим хроническими заболеваниями носоглотки, следует тщательно проводить очищение полости носа. При заболеваниях кожи и слизистых необходимо проводить адекватное антибактериальное лечение. Лица, часто болеющие рецидивирующей формой рожи, подлежат диспансерному наблюдению в течение не менее 2 лет после последнего обострения. Эффективна при частых рецидивах бициллинопрофилактика. Не меньшее значение имеет просветительская работа в отношении профилактики заболевания рожей.
РУБЕЦ
ОпределениеРубец — участок соединительной ткани, замещающий дефект кожи, слизистой оболочки, органа или ткани, возникший в результате их повреждения или патологического процесса. Процесс образования рубца называется рубцеванием и служит проявлением репаративной регенерации (процесса восстановления).
Этиология, патогенез и патанатомия К развитию рубца приводят ожоги (см.), отморожения (см.), другие повреждения и хронические воспалительные процессы. Хирургическое вмешательство также приводит к возникновению рубца. Рубцевание как механизм развития — это проявление репаративной регенерации. При этом вместо ткани, идентичной погибшей, развивается соединительная рубцовая ткань. Иногда рубцовая ткань не полностью замещает омертвевший участок и отграничивает его от окружающей ткани. Рубцевание, особенно на большом участке, сопровождается стягиванием краев заживающей раны, что приводит к деформации органов и тканей. Мелкие рубцы на лице приводят к косметическим дефектам, а в области суставов — к нарушению их подвижности. При локализации рубцов в области естественных отверстий и в полых органах возможно развитие частичной или полной непроходимости. Рубцы в проводящей системе сердца, зрительных нервов, спинномозговом канале обусловливают тяжелые функциональные расстройства. Разновидностью рубца являются так называемые синехии, или спайки, возникающие в полостях тела при образовании экссудата, очагов некроза (см.), кровоизлияний и др. Формированию рубца обычно предшествует воспаление и развитие грануляционной ткани. Макроскопически рубец состоит из сосудов, фибробластов и продуцируемых ими коллагеновых волокон. Изредка в нем встречаются тучные и плазматические клетки. По мере формирования (созревания) рубца уменьшается количество сосудов и клеточных элементов, возрастает масса коллагеновых волокон. В рубцовой ткани легких, почечных лоханок, мочевого пузыря со временем могут появиться пучки эластических и гладких мышечных волокон. В формировании глиозного рубца в нервной ткани участвуют нейроглиальные элементы.
Клиническая картина и диагностика Рубец на коже вначале имеет розовую окраску, но в дальнейшем бледнеет вследствие уменьшения количества сосудов в рубцовой ткани. По мере созревания он все более уплотняется и делается едва видимым (атрофический рубец), однако может длительное время заметно выступать над поверхностью кожи (гипертрофический рубец). Рубцы могут иметь форму полос, звезд, полей неправильных очертаний. В ряде случаев, особенно после ожогов (см.), нормальное созревание рубца нарушается, в нем длительно сохраняются сосуды, а фибробласты продолжают продуцировать атипические по химическому составу и строению коллагеновые волокна, и тогда такой рубец называется келоидным. Он резко выступает над поверхностью кожи, имеет красноватый или багрово-красный цвет, покрыт тонким слоем эпителия. При развитии глубокого гипертрофического рубца могут наблюдаться нарушения питания в его центре с образованием длительно не заживающей язвы (трофической язвы). Наличие рубца в ткани железы (например, молочной) и на слизистых оболочках может служить фактором онкогенеза (развития опухоли (см.)). Диагностика основывается на объективном исследовании.
Лечение Лечение рубца заключается в комплексных мероприятиях, включающих в себя разнообразные процедуры, направленные на размягчение рубца, особенно в начале его образования. С этой целью проводят тканевую терапию нанесением озокерита, парафина, лечебных грязей. Применяют ультразвуковую терапию, импульсные токи, электро- и фонофорез с рассасывающими средствами, ферментными и гормональными препаратами. В комплексное лечение включают также лечебную физкультуру, гимнастику в воде и массаж. При лечении келоидного рубца эффективна лучевая терапия. При ее неэффективности прибегают к пластическим операциям.
♦ С ♦
САЛЬМОНЕЛЛЕЗ
ОпределениеСальмонеллез — острое зоонозно-антропонозное бактериальное инфекционное заболевание с фекально-оральным механизмом передачи возбудителя. Характеризуется преимущественным поражением желудочно-кишечного тракта и интоксикацией, протекающими чаще всего в виде гастроинтестинальных, реже генерализованных форм.Сальмонеллы вызывают 2 группы заболеваний: брюшной тиф и паратифы А и В, возбудители которых являются облигатными паразитами человека, а также собственно сальмонеллез, возбудители которых патогенны как для человека, так и для животных. Собственно термин «сальмонеллез» употребляется только для обозначения второй группы заболеваний. Брюшной тиф и паратифы выделены в самостоятельную группу (см. Тиф).
Этиология и эпидемиология Заболевание, эпидемически и клинически подобное сальмонеллезу, известно врачам давно. В 1885 г. Д. Сальмон и Т. Смит выделили возбудителя чумы свиней. В 1888 г. А. Гертнер обнаружил микроб в организме умершего человека и мясе коровы; впоследствии этот микроорганизм был назван его именем. В дальнейшем стали появляться сообщения о выделении бактерий, сходных по морфологическим и биохимическим свойствам с бактериями Сальмона и Гертнера. Все они были объединены в группу паразитарных микробов и в 1934 г. получили название сальмонелл. Сальмонеллы — палочки размером 2–4 х х 0,5 мкм, подвижные благодаря наличию жгутиков анаэробы. Спор и капсул не образуют, грамотрицательны. Растут на обычных питательных средах. Сальмонеллы устойчивы во внешней среде, в воде живут до 120 дней, в фекалиях — от 80 дней до 4 лет. В некоторых продуктах (молоко, мясо) сальмонеллы могут даже размножаться. Низкую температуру переносят хорошо, при высокой погибают мгновенно. Сальмонеллы способны продуцировать экзотоксины: энтеротоксины (термолабильный и термостабильный), усиливающие секрецию жидкости и солей в просвет кишки, и цитотоксин, нарушающий белково-синтетические процессы в клетках слизистой оболочки кишечника и воздействующий на цитомембраны. При разрушении бактерий выделяется эндотоксин, с которым связано развитие интоксикационного синдрома. Антигенная структура сальмонелл сложна: они содержат О- и Н-антигены. Антигенная структура сальмонелл положена в основу Международной серологической классификации сальмонелл (схема Кауфмана-Уайта). Различия в строении О-антигена позволили выделить серологические группы А, В, С, D, Е и др. Внутри каждой серологической группы по Н-антигену различают серологические варианты. В настоящее время описано более 2300 сероваров сальмонелл, из них у человека — более 700. Наиболее часто встречаются следующие сальмонеллы: тифимуриум, гейдельберг, энтеритидис, анатум, дерби, лондон, панама. Сальмонеллез может встречаться как в виде отдельных спорадических случаев, так и в виде вспышек. В настоящее время заболеваемость сальмонеллезом остается относительно высокой в течение всего года с некоторым подъемом в теплое время. Источником инфекции могут быть животные и люди, причем роль животных в эпидемиологии является основной. Сальмонеллез у животных встречается в формах клинически выраженного заболевания и бактерионосительства. Будучи внешне здоровыми, бактерионосители могут выделять возбудителей с мочой, калом, молоком, носовой слизью, слюной. Наибольшую эпидемиологическую опасность представляет инфицирование крупного рогатого скота, свиней, овец, кошек, домовых грызунов (мышей и крыс). Сальмонеллы обнаруживаются у многих видов диких животных: лис, бобров, волков, песцов, медведей, тюленей, обезьян. Значительное место в эпидемиологии сальмонеллеза занимают птицы, особенно водоплавающие. Сальмонеллы обнаруживают не только в мясе и внутренних органах животных и птиц, но и в яйцах. Основной путь заражения при сальмонеллезе — алиментарный, а факторами передачи инфекции являются различные пищевые продукты (мясо животных, рыб, лягушек, устриц, крабов, яйца и яичные продукты, молоко и молочные продукты, блюда из овощей). В качестве прямого фактора передачи инфекции нередко выступает вода. Описаны случаи воздушно-капельного заражения в детских коллективах. Известны случаи непосредственного заражения людей от больных животных при уходе за ними. Источниками сальмонеллеза могут быть больные сальмонеллезом люди или бактериовыделители. У детей раннего возраста преимущественно является контактный путь передачи инфекции, факторами передачи служат руки персонала, а также предметы ухода и пеленальные столики. Сальмонеллез регистрируется в течение всего года, но чаще в летние месяцы, что можно объяснить ухудшением условий хранения пищевых продуктов. Заболеваемость сальмонеллезом в целом возросла. Причина этого явления, по мнению большинства исследователей, связана с интенсификацией животноводства на промышленной основе, изменившимся характером и масштабами реализации пищевых продуктов, значительным увеличением экспортноимпортных связей между странами, интенсификацией миграционных процессов и др. Другой эпидемиологической особенностью сальмонеллеза в настоящее время является преимущественно спорадический характер его распространения. Установлено, что спорадическая заболеваемость по существу является следствием возникновения вспышек сальмонеллеза, характер которых изменился, вследствие чего эпидемиологическая расшифровка их затруднена. Они возникают преимущественно в результате поступления в торговую сеть различных пищевых продуктов, инфицированных сальмонеллами. Описаны водные вспышки сальмонеллеза. Дискутируется воздушно-пылевой путь передачи инфекции. Воздушно-капельный путь передачи не узаконен, но все чаще встречаются вспышки, имеющие гриппоподобный тип течения инфекционного процесса. Возможно инфицирование ребенка во время родов, допускается трансплацентарная передача инфекции. Одной из важных проблем современной медицины становится сальмонеллез как нозокомиальная (внутрибольничная, госпитальная) инфекция. Сальмонеллы, вызывающие внутрибольничные заболевания, получили название госпитальных штаммов, так как считается, что их биологические особенности (отсутствие чувствительности к типовым бактериофагам, множественная лекарственная устойчивость и др.) формируются в стационаре. Внутрибольничные вспышки характеризуются высокой контагиозностью, быстрым распространением и тяжестью клинического течения.
Патогенез Для развития манифестных форм болезни обязательно проникновение в желудочно-кишечный тракт не только токсинов сальмонелл, но и живых возбудителей. Массивное поступление живых бактерий (при алиментарном пути заражения) сопровождается разрушением их в верхних отделах желудочно-кишечного тракта (в желудке и преимущественно в кишечнике), в результате чего высвобождается большое количество эндотоксина, который, всасываясь в кровь, обусловливает возникновение эндотоксического синдрома, определяющего клиническую картину начального периода заболевания. Выраженность токсемии зависит как от инфицирующей дозы, так и от бактерицидных свойств желудочно-кишечного тракта. На этой стадии инфекционный процесс может закончиться. Клинически заболевание будет протекать по типу токсикоинфекции (см.) (гастроэнтеритическая форма). Если интенсивность бактериолиза недостаточна, специфический иммунитет отсутствует, а факторынеспецифической защиты желудочно-кишечного тракта несовершенны, сальмонеллы преодолевают эпителиальный барьер тонкой кишки и проникают в толщу тканей (в энтероциты и собственный слой слизистой оболочки кишечника), где захватываются (фагоцитируются) нейтрофилами и макрофагами. Возникает воспалительный процесс во всех отделах желудочно-кишечного тракта (гастроэнтероколитическая форма). В зависимости от состояния иммунной системы организма возникает либо только местный процесс, либо происходит прорыв кишечного и лимфатического барьеров и возникает следующий этап инфекционного процесса — бактериемия. Внутри макрофагов микробы не только размножаются, но и частично погибают с освобождением эндотоксина, проникающего в нервно-сосудистый аппарат кишечника и повышающего проницаемость клеточных мембран. Это способствует дальнейшему распространению сальмонелл по лимфатическим путям и занесению их мезентериальные лимфатические узлы и далее в кровь — происходит генерализация инфекции. При этом микробы с кровью разносятся в различные органы и ткани, размножаются в печени и селезенке. Этот процесс в значительной степени облегчается способностью сальмонелл к паразитированию и размножению в цитоплазме макрофагов. Сальмонеллы, попадая с током крови в различные органы и ткани, размножаются с формированием септических очагов поражения (септическая форма). Процесс накопления сальмонелл в организме одновременно сопровождается интенсивной их гибелью и распадом, а следовательно, и значительным выбросом токсинов, что знаменует конец инкубационного периода и обозначает начало синдрома интоксикации. Результатом совокупного действия эндотоксина и бактериальных тел на энтероциты является диарейный синдром. Внутриклеточное паразитирование в макрофагах является основным способом существования сальмонелл в организме человека. Оно определяет возможность их длительного персистирования с возникновением обострений и рецидивов, а также формированием хронического носительства. Местная реакция заключается в развитии энтерита. Воспалительные явления в слизистой оболочке возникают после того, как сальмонеллы проходят через эпителиальный барьер и захватываются макрофагами и лейкоцитами. В результате происходит гибель не только возбудителя, но и части фагоцитов и других клеток под действием эндотоксина и продуктов метаболизма сальмонелл, а также освобождение дополнительных порций токсинов, гистамина и прочих биологически активных веществ: серотонина, катехоламинов, кининов и пр. Токсины сальмонелл вызывают активацию синтеза простагландинов и циклических нуклеотидов, что приводит к резкому усилению секреции жидкости и ионов калия и натрия в просвет желудочно-кишечного тракта. Развивается диарея с последующими нарушениями водно-электронного баланса. Общая реакция организма на эндотоксины характеризуется нарушением функционально-адаптивных процессов во многих органах и системах. Большие потери жидкости приводят к сокращению объема циркулирующей крови, понижению артериального давления, компенсаторному спазму периферических сосудов и развитию гипоксии. Гипоксия, в свою очередь, приводит к развитию ацидоза. Дальнейшее усиление интоксикации происходит в основном вследствие нарушения обменных процессов, что обусловливает повышение в крови недоокисленных продуктов и уровня гистаминоподобных веществ и в конечном счете ведет к расширению капилляров, блокируя их реакцию на адреналин. В результате энтерита нарушаются процессы переваривания и всасывания в кишечнике, возникает дефицит липазы и лактазы, который сохраняется около 4 недель после исчезновения клинических проявлений болезни. Нередко нарушается состав микрофлоры кишечника — развивается дисбактериоз (см.). При генерализованных формах накопление и размножение сальмонелл происходит во внутренних органах и лимфатических образованиях. В этих случаях болезнь протекает по тифоподобному варианту или развивается септикопиемия.
Патанатомия Макроскопически желудок и тонкая кишка расширены, с зеленоватым слизистым содержимым, имеющим гнилостный запах. Слизистая оболочка тонкой кишки отечная, гиперемированная, с мелкими кровоизлияниями. Нередко обнаруживается гиперплазия единичных лимфатических фолликулов. Характерна макрофагальная реакция собственного слоя. В толстой кишке нарушается структура слизистой оболочки, нередко отмечаются глубокие воспалительные изменения, доходящие до подслизистого слоя, характерны сосудистые расстройства, отек, клеточная инфильтрация с выраженной пролиферацией макрофагов. При микроскопическом исследовании биоптатов слизистой оболочки обнаруживаются дистрофические изменения поверхностного и железистого эпителия. Типичны сосудистые расстройства, гиперплазия клеток ретикулоэндотелия лимфоидной ткани и слизистой оболочки. Изменения в кишечнике варьируют от легкого воспаления до выраженного распространенного энтерита (см.) и энтероколита (см.) с пленчатыми или отрубевидными наложениями и образованием эрозий и язв. При генерализованных формах отмечается увеличение печени, селезенки, лимфатических узлов, характерны множественные метастатические гнойники во внутренних органах, дистрофические изменения в мышце сердца, почках, надпочечниках. В ткани и оболочках мозга отмечаются: полнокровие сосудов, мелкие кровоизлияния, стазы, клеточная инфильтрация. Возможно развитие гнойного менингита (см.), очаговой пневмонии (см.), эндокардита (см.), пиелонефрита (см.). Отличительными признаками септического процесса являются пролиферация и гиперплазия лимфоидной ткани внекишечной локализации, очаговые скопления ретикулоцитов, гистиоцитов, лимфоцитов и плазмоцитов во многих органах и прежде всего в печени и селезенке. Обратное развитие морфологических изменений у большинства больных наступает на 3-й неделе болезни.
Клиническая картина Инкубационный период при сальмонеллезе составляет 12–24 ч. Иногда он укорачивается до 6 ч или удлиняется до 2 дней. Выделяют следующие формы и варианты течения сальмонеллезной инфекции. I. Гастроинтестинальная форма: — гастритический вариант; — энтеритический вариант; — гастроэнтеритический вариант; — энтероколитический вариант; — колитический вариант; — гастроэнтероколитический вариант. II. Генерализованная форма: — тифоподобный вариант; — септикопиемический вариант. III. Атипичные формы: — стертая; — субклиническая. Чаще всего регистрируется гастроинтестинальная форма сальмонеллеза, которая может протекать по указанным вариантам, а по тяжести подразделяется на легкое, среднетяжелое и тяжелое течение. Тяжесть течения болезни устанавливается по степени обезвоживания и выраженности интоксикации. Бактериовыделение может быть острым (до 1 месяца), затяжным (до 3 месяцев), хроническим (свыше 3 месяцев) и транзиторным.
Гастроинтестинальная форма Гастритический вариант (сальмонеллезный гастрит) развивается редко, клинически сопровождается умеренными явлениями интоксикации, болями в эпигастральной области, тошнотой и повторной рвотой. Поноса при этой форме течения болезни не бывает. Гастроэнтеритический вариант — наиболее частый клинический вариант сальмонеллезной инфекции. Начало острое. В начальном периоде отмечаются как признаки поражения желудочно-кишечного тракта, так и признаки интоксикации. Тошнота и рвота отмечаются у многих больных. Рвота однократная, иногда неукротимая. Стул жидкий, обильный, как правило, сохраняет каловый характер, иногда может напоминать рисовый отвар. Наиболее часто стул бывает с примесью слизи, реже — водянистый, без патологических примесей. Иногда кал имеет зеленоватую окраску. Живот обычно вздут умеренно, при пальпации болезненный в эпигастрии, вокруг пупка, в илеоцекальной области, выявляется урчание в области петель тонкого отдела кишечника. Нормализация кала у большинства больных наступает на первой неделе болезни, и только в отдельных случаях диарея сохраняется более 10 дней. Гастроэнтероколитический вариант сальмонеллеза может начинаться как гастроэнтерит, но затем все более отчетливо в клинике выступает симптоматика колита (см.). В этом случае сальмонеллез по своему течению напоминает острую дизентерию (см.). Заболевание начинается остро, повышается температура, появляются другие симптомы интоксикации. С первых дней заболевания стул частый, жидкий, с примесью слизи, иногда крови. Могут быть тенезмы и ложные позывы. При ректороманоскопии у таких больных выявляются воспалительные изменения различной интенсивности — катаральные, катарально-геморрагические, катарально-эрозивные. При гастроинтестинальной форме сальмонеллеза отсутствует характерный тип температурной кривой. Встречается постоянный, реже — ремиттирующий или интермиттирующий тип лихорадки. Иногда заболевание протекает при нормальной или субфебрильной температуре. Часто в процесс вовлекается поджелудочная железа, появляются клинические симптомы панкреатита (см.). При сальмонеллезе может поражаться и печень. Симптомы поражения поджелудочной железы и печени носят, как правило, преходящий характер. Характерным для сальмонеллеза является поражение сердечно-сосудистой системы, степень ее поражения зависит от выраженности общего токсикоза. Изменяются частота, наполнение и напряжение пульса, снижается артериальное давление, в тяжелых случаях наступает коллапс (см.). Поражается и миокард. Токсическое поражение почечной паренхимы проявляется, как правило, синдромом инфекционно-токсической почки: протеинурия, микрогематурия, цилиндрурия. Нарушение кровообращения почек наряду с изменениями водно-электролитного баланса может явиться причиной развития острой функциональной почечной недостаточности (см.). В разгар болезни нарушается водно-солевой обмен, приводящий к дегидратации и деминерализации организма. Обнаруживаются сдвиги кислотнощелочного равновесия, особенно в тяжелых случаях. В крови иногда повышается уровень гемоглобина и эритроцитов; определяется умеренный лейкоцитоз с нейтрофильным сдвигом; СОЭ, как правило, не изменяется. Длительное течение гастроинтестинальных форм средней тяжести непродолжительно. Температура снижается до нормы в течение 2–4 дней; еще раньше исчезает интоксикация, стул нормализуется к 3—7-му дню болезни. Нормализация функционального состояния кишечника наступает значительно позднее клинического выздоровления. У ряда больных нарушения всасывающей и пищеварительной функций могут сохраняться в течение нескольких месяцев.
Генерализованная форма Генерализованная форма сальмонеллеза может протекать в двух вариантах: тифоподобном и септикопиемическом. Тифоподобный вариант сальмонеллеза обычно начинается с поражения желудочнокишечного тракта, но может с самого начала протекать и без дисфункции кишечника. Клинически эта форма очень напоминает брюшной тиф и особенно паратифы. Синдром интоксикации резко выражен и сопровождается угнетением функций центральной нервной системы. Больные жалуются на головную боль, нарушение сна (сонливость днем и бессонница ночью), вялость, резкую слабость. В тяжелых случаях отмечаются адинамия, заторможенность, возможны бред (см.) и галлюцинации (см.). Лихорадка достигает 39–40 °C, часто носит постоянный характер и продолжается 10–14 дней. На коже груди и живота иногда появляется розеолезная сыпь (см.). Отмечается увеличение печени и селезенки. Пульс чаще замедлен, артериальное давление снижено. В ряде случаев встречаются явления со стороны верхних дыхательных путей, развиваются бронхиты (см.) и пневмонии (см.). В периферической крови находят лейкопению, но может быть и умеренный лейкоцитоз. Септикопиемический вариант представляет, по существу, сепсис (см.) сальмонеллезной этиологии. После короткого начального периода, протекающего по типу гастроэнтерита, развивается типичная картина септикопиемии с температурой гектического характера, головной болью и болью в мышцах ног, ознобами, потами, тахикардией (см.). Могут быть бред (см.) и возбуждение. Кожные покровы бледные, иногда зеленовато-желтого цвета, с петехиальными или геморрагическими высыпаниями. Характерны формирование вторичных септико-пиемических очагов различной локализации (пневмония (см.), плеврит (см.), эндокардит (см.), абсцессы (см.), флегмоны (см.) мягких тканей, пиелит, периостит, артрит (см.), остеомиелит (см.), иридоциклит (см.) и увеличение печени и селезенки. Септикопиемический вариант может также протекать по типу хрониосепсиса с локальным поражением отдельных органов. Типично длительное и тяжелое течение, возможен неблагоприятный исход.
Атипичная форма Стертая форма характеризуется слабо выраженной и быстропроходящей дисфункцией желудочно-кишечного тракта. Общее состояние не нарушается. Стул разжижен, имеет каловый характер, без видимых патологических примесей, наблюдается 2–3 раза в сутки в течение 1–2 дней. У отдельных больных возможны кратковременные боли в животе, урчание в правой подвздошной области. Диагноз ставится на основании эпидемиологических данных и высева сальмонелл в посевах испражнений. Субклиническая форма клинически не проявляется. Это, по существу, сальмонеллезное носительство, однако при нем отмечается нарастание титра специфических антител. Бактериовыделение как следствие перенесенного сальмонеллеза может быть острым и хроническим. Острое бактериовыделение, при котором возбудитель продолжает выделяться до 3 месяцев после клинического выздоровления, встречается значительно чаще. При затяжном носительстве возбудитель обнаруживается в испражнениях на протяжении 1–3 месяцев. При хроническом бактериовыделении возбудитель обнаруживается в испражнениях на протяжении более 3 месяцев после клинического выздоровления. Транзиторное бактериовыделение диагностируется в тех случаях, когда имеет место лишь одно- или двукратное выделение сальмонелл с последующими многократными отрицательными результатами бактериологических исследований кала и мочи. Кроме того, необходимыми диагностическими условиями является отсутствие каких-либо клинических проявлений болезни в момент обследования и на протяжении предшествующих 3 месяцев, а также отрицательные результаты серологических исследований в динамике.
Сальмонеллез у детей Течение сальмонеллезной инфекции у детей отличается рядом особенностей. Одной из них является то, что сальмонеллез стал широко распространенной в последние два десятилетия кишечной инфекцией у детей в связи с появлением новых, так называемых «госпитальных» штаммов сальмонеллы тифимуриум, обладающих лекарственной устойчивостью и способных вызывать вспышки (в том числе внутрибольничные) с контактно-бытовым путем передачи. В отличие от дизентерии (см.), этим сальмонеллезом значительно чаще болеют дети первого года жизни, преимущественно с отягощенным преморбидным фоном и находящиеся на искусственном вскармливании. В последние годы вторым доминирующим штаммом стали сальмонеллы энтеритидис, распространяющиеся преимущественно среди детей старшего возраста через яйца и куриное мясо. Сезонность заболеваний, вызванных сальмонеллами группы В, чаще весенне-летняя (с максимальным числом заболевших в мае — июне). Сальмонеллезы, вызванные возбудителями других серологических групп (С, D, Е), встречаются с разной частотой в разные сезоны года. Во-вторых, клиническая картина заболевания определяется возрастом заболевшего и свойствами возбудителя, а также путем инфицирования. У детей первого года жизни сальмонеллез вызывается в подавляющем большинстве случаев «госпитальными» штаммами сальмонеллы тифимуриум, распространяется чаще всего контактно-бытовым путем, в том числе в условиях стационаров, и имеет характерную клиническую картину. Начало болезни, как правило, подострое или постепенное с максимальным развитием всех симптомов к 3—7-му дню от начала заболевания. Характерно сочетание симптомов интоксикации (фебрильная температура, вялость, бледность, цианоз носогубного треугольника, снижение аппетита, тахикардия) с симптомами поражения желудочно-кишечного тракта (чаще по типу энтероколита и гастроэнтероколита (см.), реже — энтерита (см.)). Рвота отмечается у половины больных, она может появляться как с первого дня болезни, так и присоединяться позже, а у трети больных носит упорный характер. Стул обильный, жидкий, каловый, буро-зеленого цвета (типа «болотной тины»), с примесью слизи и зелени, а у 2/3 больных — и крови, которая, как правило, появляется в испражнениях на 5—7-й день болезни. Частыми проявлениями также являются синдром водянистой диареи (см.), метеоризм (см.), увеличение печени и селезенки. Сальмонеллезу у этой группы детей свойственно среднетяжелое и тяжелое течение, нередко длительное и рецидивирующее, возможна генерализация инфекционного процесса. Тяжесть болезни определяется как симптомами интоксикации, так и нарушениями водно-минерального обмена (эксикоз II–III степени), а также возникновением вторичных очаговых осложнений (пневмония (см.), менингит (см.), остеомиелит (см.), анемия (см.), ДВС-синдром). Особенно неблагоприятно протекает сальмонеллез, вызванный мультирезистентным к антибактериальным препаратам биоваром сальмонеллой тифимуриум у детей из закрытых детских учреждений (домов ребенка, психоневрологических стационаров), страдающих различными иммунодефицитами. У них заболевание нередко принимает затяжное течение с длительным (до 3–4 месяцев) бактериовыделением (из испражнений и мочи). В-третьих, сальмонеллез у детей старше года часто вызывается чувствительными к антибиотикам штаммами сальмонелл разных сероваров с преимущественно пищевым путем инфицирования и протекает в двух клинических вариантах. I вариант — наиболее частый — протекает по типу пищевой токсикоинфекции (см.) (гастрит, гастроэнтерит, гастроэнтероколит). Характерно острое начало заболевания с повышением температуры до фебрильных цифр, появлением рвоты, нередко повторной, симптомов интоксикации (головная боль, слабость, снижение аппетита, расстройство гемодинамики) и появлением обильного жидкого калового стула с примесью слизи и зелени, умеренных болей в животе (чаще в эпигастральной области и вокруг пупка). У половины детей частота стула превышает 10 раз в сутки. При своевременном начале терапии заболевание быстро купируется, инфекционный процесс далее не развивается, и в таких случаях сальмонеллез трудно дифференцировать с пищевой токсикоинфекцией другой этиологии. II вариант — дизентериоподобный — встречается у трети детей этого возраста. Как и при дизентерии, имеет место острое начало болезни с повышением на 1–3 дня температуры, появлением симптомов интоксикации и развитием признаков колита.
Осложнения Осложнения сальмонеллеза многочисленны и разнообразны. При гастроинтестинальной форме заболевания возможно развитие сосудистого коллапса, гиповолемического шока (см.), острой сердечной и почечной недостаточности. Больные сальмонеллезом склонны к септическим осложнениям: гнойным артритам (см.), остеомиелиту (см.), эндокардиту (см.), абсцессу (см.) мозга, селезенки, печени и почек, менингиту, перитониту (см.), аппендицитам (см.). Кроме того, могут возникнуть пневмонии, восходящая инфекция мочевыводящих путей (циститы, пиелиты), инфекционно-токсический шок. При всех клинических формах заболевания возможно развитие рецидивов. Прогноз при гастроинтестинальной форме и тифоподобном варианте сальмонеллеза благоприятный, особенно в случаях ранней диагностики и правильного лечения. Прогноз при септикопиемическом варианте всегда серьезный, летальность составляет 0,2–0,3 %.
Диагностика и дифдиагностика Сальмонеллез диагностируют на основании эпидемиологических данных, характерных клинических признаков и результатов лабораторного исследования. Сальмонеллез начинается остро с озноба, тошноты, рвоты; появляется боль в эпигастральной и умбиликальной областях, позже присоединяется обильный водянистый стул темно-коричневого или зеленого цвета с резким зловонным запахом. Из эпидемиологических данных важен групповой характер болезни, связь с употреблением недоброкачественных продуктов. В условиях спорадической заболеваемости диагноз сальмонеллеза правомочен только при наличии комплекса характерных клинико-эпидемиологических данных и лабораторного подтверждения. Из лабораторных методов наиболее важное значение имеют бактериологический и серологический. Бактериологическому исследованию подвергаются испражнения больных, рвотные массы, промывные воды желудка, моча, кровь, желчь, подозреваемые продукты. Для подтверждения «госпитальных» свойств сальмонелл тифимуриум рекомендуется определять их антибиограмму. Из серологических методов применяются РА и РНГА. В последние годы стали использоваться высокочувствительные серологические методы определения специфических антигенов сальмонелл в крови и других биосубстратах больных методом латексной агглютинации, коагглютинации, иммуноферментный анализ. Дифференциальный диагноз сальмонеллеза следует проводить с большой группой инфекционных заболеваний — пищевыми токсикоинфекциями (см.) другой этиологии, острой дизентерией (см.), холерой (см.), вирусным гастроэнтеритом, брюшным тифом (см.), гриппом (см.), менингитами (см.), терапевтическими и хирургическими заболеваниями (инфаркт миокарда (см.), острый аппендицит (см.), холецистит (см.), субарахноидальное кровоизлияние), а также с отравлениями (см.) ядами и солями тяжелых металлов. Дифференциальная диагностика сальмонеллеза с дизентерией у детей раннего возраста представляет значительные трудности из-за сходства клинических проявлений: — возможность как острого, так и постепенного начала болезни; — частое развитие гемоколита при обеих инфекциях и возможность появления примеси крови в испражнениях не с первого дня болезни; — редкость возникновения синдрома дистального колита. Различия в клинических проявлениях дизентерии и сальмонеллеза следующие: — большая тяжесть течения сальмонеллеза по сравнению с дизентерией в этом возрасте (с более выраженной и длительной лихорадкой и более частым развитием гемодинамических нарушений при сальмонеллезе); — гепатолиенальный синдром (см.) — хотя не ранний, но надежный дифференциально-диагностический признак, свойственный сальмонеллезу; — большая тяжесть при сальмонеллезе синдрома водянистой диареи (см.) и метеоризма (см.); — значительно большая длительность течения сальмонеллеза, нередко с волнами обострения, а также генерализацией болезни. В дифференциальной диагностике могут помочь и эпидемиологические данные, полученные при сборе анамнеза (указание на пребывание в другом стационаре или на выписку из него за 2–4 дня до настоящего заболевания при сальмонеллезе), а также разная сезонность и частота распространения этих инфекций у детей раннего возраста. При дифференциальной диагностике сальмонеллеза и дизентерии у детей старше одного года следует учитывать: — редкое развитие при сальмонеллезе изолированного колита и более частое — энтероколита и гастроэнтероколита, при этом стул длительно остается обильным, водянистым, несмотря на примесь слизи и даже крови, в то время как при дизентерии стул уже к концу первых суток болезни обычно приобретает типичный вид «ректального плевка»; — в отличие от дизентерии (см.), при сальмонеллезе у большинства больных примесь крови в стуле появляется не в первый, а лишь на 3—5-й день болезни и сохраняется более длительное время (особенно часто — при сальмонеллезе тифимуриум); — синдром дистального колита (см.), даже при наличии примеси крови в стуле, как правило, нехарактерен для сальмонеллеза, а метеоризм встречается значительно чаще; — увеличение печени при сальмонеллезе у старших детей наблюдается хотя реже, чем у детей раннего возраста, но значительно чаще, чем при дизентерии (см.), поэтому наличие этого симптома может помочь в дифференциальной диагностике. В копрограмме при сальмонеллезе в отличие от дизентерии не имеется специфических особенностей, а характер изменений зависит от локализации инфекционного процесса и степени выраженности нарушений пищеварения. При вовлечении слизистой тонкой и толстой кишки в воспалительный процесс в кале появляются форменные элементы крови (лейкоциты и эритроциты), а при функциональных нарушениях пищеварения обнаруживается много непереваренного нейтрального жира, крахмала и мышечных волокон.
Лечение Сложность патогенетических механизмов при сальмонеллезе, многообразие клинических форм болезни диктуют необходимость индивидуального подхода к лечению. Выбор метода лечения зависит от формы и тяжести заболевания. Больным с субклинической формой сальмонеллеза и лицам с острым бактериовыделением не требуется лечебных мероприятий. Бактериовыделение, как правило, прекращается самостоятельно, и назначение каких-либо лекарственных препаратов только удлиняет сроки санации. Основным методом лечения больных с гастроинтестинальной формой болезни является патогенетическая терапия, которая включает мероприятия, направленные на дезинтоксикацию, восстановление водно-электролитного баланса и гемодинамики, ликвидацию локальных поражений желудочно-кишечного тракта. Одновременно необходимо проводить лечение сопутствующих заболеваний. Общими при этих формах сальмонеллеза являются необходимость соблюдения диеты и отказ от использования этиотропной терапии. Диета должна быть механически и химически щадящей, что соответствует столу № 4 лечебного питания. Из рациона исключают цельное молоко и тугоплавкие жиры, ограничивают углеводы. Рекомендуются овсяные и рисовые каши на воде, отварная рыба, паровые котлеты, фрикадельки, фруктовые кисели, творог, неострые сорта сыра. Диету расширяют постепенно, а при полном клиническом выздоровлении, наступающем обычно на 28—30-й день от начала болезни, переходят на рацион здорового человека. Использование антибактериальных препаратов при этих формах противопоказано, так как приводит к более позднему клиническому выздоровлению, задержке сроков нормализации функциональной деятельности желудочно-кишечного тракта, удлиняет сроки санации организма от сальмонелл и способствует формированию дисбактериоза. Лечение больных начинают с промывания желудка с целью удаления инфицированных продуктов, возбудителей и их токсинов. Для промывания используют 2 %-ный раствор бикарбоната натрия или воду в количестве 2–3 л с температурой 18–20 °C. В легких случаях сальмонеллезной инфекции без признаков обезвоживания промыванием желудка исчерпывается весь объем медицинской помощи. Борьба с обезвоживанием в случаях заболеваний средней и легкой тяжести, протекающих с обезвоживанием I–II степени, проводится регидратационными растворами, которые вводят орально: применяются глюкосолан, оралит, регидрон. Объем вводимых перорально растворов должен определяться степенью обезвоживания, выраженностью интоксикации и массой тела больного. Обычно больным сальмонеллезом средней тяжести с обезвоживанием II степени растворы назначают в объеме 40–70 мл/кг, больным с выраженной интоксикацией, но при отсутствии обезвоживания — в объеме 30–40 мл/кг. Оральная регидратация осуществляется в два этапа. I этап — первичная регидратация с целью ликвидации обезвоживания, потери солей, интоксикации. Ее продолжительность обычно составляет 2–4 ч. II этап — поддерживающая терапия, направленная на ликвидацию продолжающихся потерь жидкости и солей, а также сохраняющегося интоксикационного синдрома. Она осуществляется в течение последующих 2–3 суток. В большинстве случаев при оральной регидратационной терапии наблюдается хороший терапевтический эффект. При повторной рвоте, нарастающем обезвоживании лечение больных начинают с внутривенного введения полиионных растворов «Квартасоль», «Хлосоль», «Ацесоль», «Трисоль» и др., подогретых до температуры 38–40 °C. Объем вводимой с целью регидратации жидкости зависит от степени обезвоживания и массы тела больного. После возмещения исходных потерь жидкости переходят на пероральный прием жидкости. В целях дезинтоксикации и восстановления кровообращения применяют синтетические коллоидные растворы: гемодез, полиглюкин, реополиглюкин. Однако их использование допустимо лишь при отсутствии или после ликвидации обезвоживания. При тяжелом течении болезни с обезвоживанием III–IV степени лечение следует начинать с внутривенного струйного (80— 120 мл/мин) введения указанных полиионных растоворов. Объем растворов, вводимых с целью регидратации, определяется степенью обезвоживания и массой тела больного. Переход на пероральный прием жидкости может быть рекомендован после стабилизации гемодинамических показателей, прекращения рвоты и восстановления выделительной функции почек. В случаях развития метаболического ацидоза рекомендуется введение расчетной дозы 4 %-ного раствора бикарбоната натрия. При наличии токсико-инфекционного шока лечебные мероприятия начинают с внутривенного вливания полиионных растворов (со скоростью 100–120 мл/мин). Объем вводимых растворов определяется состоянием гемодинамики и биохимическими показателями крови. С целью дезинтоксикации при незначительном обезвоживании вместе с солевыми растворами могут быть использованы синтетические коллоидные растворы (гемодез, полиглюкин, реополиглюкин) в объеме 400—1000 мл. При развитии надпочечниковой недостаточности показано введение глюкокортикоидов. Первоначальную дозу (60–90 мг преднизолона, 125–250 мг гидрокортизона) вводят внутривенно струйно, последующую дозу — внутривенно капельно через 4–6 ч. Одновременно внутримышечно вводят дезоксикортикостерона ацетат — по 5—10 мг каждые 12 ч. Интенсивную терапию продолжают до стойкой нормализации гемодинамических показателей и восстановления мочеотделения. Назначение больным гастроинтестинальной формой таких препаратов, как мезатон, норадреналин, эфедрин, противопоказано вследствие их способности вызывать спазм сосудов почек. При развитии острой почечной недостаточности, отеке легких или мозга проводится целенаправленная терапия с включением диуретиков (маннитол, фуросемид). С целью восстановления функциональной деятельности желудочно-кишечного тракта следует применять ферментные препараты (панзинорм, фестал, мезим-форте, абомин, холензим). Для связывания инфекционных агрессоров возможно применение энтеросорбентов — смекты, энтеродеза и др. С целью нормализации моторно-эвакуаторной деятельности кишечника показано назначение средств спазмолитического и вяжущего действия (папаверин, но-шпа, белладонна, атропин, висмут, танальбин, отвар коры дуба, плодов черники, коры граната, черемухи). При генерализованных формах сальмонеллеза наряду с патогенетической терапией необходимо назначение антибактериальных средств — левомицетина, ампициллина. При тифоподобном варианте левомицетин назначают по 0,5 г 4 раза в сутки в течение 10–12 дней. Предпочтительнее вводить левомицетина сукцинат из расчета 30–50 мг/кг в сутки. Ампициллин назначают на тот же срок по 0,5–1 г 3 раза в день внутрь или по 500—1000 мг 4 раза в сутки внутривенно. При септико-пиемическом варианте ампициллин назначают из расчета 200–300 мг/кг в сутки, а дозу левомицетина сукцината увеличивают до 70—100 мг/кг. Санация хронических бактериовыделителей сальмонелл должна быть комплексной. Первостепенное значение имеет применение средств, воздействующих на общую реактивность организма: использование препаратов пиримидинового ряда (пентоксил и метилурацил), лечение сопутствующих заболеваний желудочно-кишечного тракта, дисбактериоза кишечника. Целесообразно назначение сальмонеллезного бактериофага. Выписка из стационара производится после клинического выздоровления при наличии отрицательного результата бактериологического исследования кала. Контрольное обследование лиц из декретированной группы населения проводится троекратно. Лица, не выделяющие сальмонелл, после выписки из стационара допускаются к работе и диспансерному наблюдению не подлежат.
Профилактика Ветеринарно-санитарный контроль за убоем скота, за технологией обработки туш, за приготовлением и хранением мясных и рыбных блюд. После госпитализации больного наблюдают за очагом в течение недели. Работники пищевых предприятий подвергаются однократному бактериологическому обследованию. После выписки из стационара работники пищевых предприятий и дети, посещающие ясли, наблюдаются в течение 3 месяцев с бактериологическим исследованием кала (1 раз в месяц). Бактерионосители не допускаются на работу в пищевые и приравненные к ним предприятия. Специфическая профилактика не проводится.
САЛЬПИНГООФОРИТ
ОпределениеСальпингоофорит (аднексит) — воспаление придатков матки (маточных труб и яичников) — относится к наиболее часто встречающимся заболеваниям половой системы и занимает 1-е место среди всей гинекологической патологии. 40 % больных в стационаре — больные с воспалительными заболеваниями женских половых органов. Рост связан с сексуальной революцией. Повышается рост трансмиссивных инфекций, т. е. инфекций, передающихся половым путем.Послеродовой сальпингоофорит — воспаление придатков матки, возникающее в послеродовом периоде, — чаще всего является осложнением эндометрита (см.). У 2/3 пациенток наблюдается острое начало заболевания с развитием всей возможной симптоматики, у 1/3 больных начало заболевания, как правило, бывает стертым, вялым и в основном характеризуется только болями внизу живота. Инфекция распространяется лимфогенно или по маточным трубам (интраканаликулярно). Воспалительный процесс вначале захватывает маточные трубы, затем переходит на яичники, образуя единый конгломерат.
Этиология Наиболее частыми причинами обострения воспалительных заболеваний матки и придатков являются неспецифические факторы, такие как переутомление, переохлаждение, стрессовые ситуации, отрицательные эмоции, экстрагенитальные заболевания. Основной причиной всех воспалительных заболеваний гениталий являются микробы. Микробы проникают в 99 % случаев половым путем, но существует и лимфогенный путь передачи инфекции, прежде всего — из кишечника; гематогенный путь — главным образом туберкулез (см.), когда очаг инфекции в гениталиях является вторичным, а первичный очаг расположен экстрагенитально; по протяжению — например, из воспаленного аппендикса, при колитах (см.) и патологии кишечника и интраканаликулярный путь при специфической инфекции (гонорея (см.)). Факторы, способствующие распространению инфекции: — внутриматочные вмешательства: аборты (см.), диагностические выскабливания, гистеросальпингография, т. е. все инвазивные процедуры — зондирование полости матки, постановка и удаление внутриматочного контрацептива, роды (см.) и выкидыши; — переохлаждение; — ослабление организма в результате хронической инфекции экстрагенитального характера. К защитным факторам относятся влагалище и его содержимое, т. е. биоценоз влагалища. 1. Бели, которые выделяют железы влагалища в количестве 1–2 мл в сутки, являются нормальными. Все, что больше, — патологические бели. 2. Микрофлора влагалища, которая представлена аэробами и анаэробами. Имеется динамическое равновесие между сапрофитными группами и условно-патогенными группами, аэробы преобладают над анаэробами. 3. Достаточное содержание лактобактерий — палочек молочнокислого брожения, которые создают кислую среду во влагалище за счет своего метаболизма, являющуюся защитным барьером на пути проникновения микроорганизмов. 4. Слизистая пробка — бактерицидная пробка цервикального канала; пробка имеет огромное значение в предупреждении генерализации инфекции. В слизистой пробке имеются неспецифические антитела как факторы защиты; за счет изменения своей вязкости она препятствует проникновению микробов. На протяжении маточного цикла вязкость пробки изменяется: уменьшается вязкость в середине менструального цикла для облегчения проникновения сперматозоидов и процесса овуляции. Прием оральных контрацептивов обеспечивает увеличение вязкости слизистой пробки, затрудняет проникновение сперматозоидов в вышележащие отделы гениталий, что является одним из эффектов контрацепции. Прием оральных контрацептивов, особенно женщинами с хроническими воспалительными заболеваниями гениталий, снижает риск развития рецидивов и обострений воспалительного процесса. Так как сперматозоиды являются активными переносчиками микроорганизмов, то, затрудняя проникновение сперматозоидов, мы уменьшаем риск проникновения инфекции, т. е. прием оральных контрацептивов, особенно женщинами, страдающими хроническими воспалительными заболеваниями, дает двойной эффект: контрацепция + профилактика рецидивов и обострений. 5. Эндометрий: функциональный слой эндометрия ежемесячно отторгается, идет очищение организма, а на месте отторгнувшегося эндометрия образуется лимфоцитарный вал.
Патогенез Воспалительные заболевания гениталий возникают обычно восходящим путем при распространении инфекции из влагалища и полости матки, чаще всего в связи с осложненными родами (см.) и абортами (см.), а также нисходящим путем — из смежных органов (червеобразный отросток, прямая и сигмовидная кишка) или гематогенным путем. Механизм реализации переноса инфекции: — со сперматозоидами, которые являются переносчиками инфекции и обладают отрицательным зарядом, притягивающим микроб (таким образом, они являются транспортом для микроорганизмов); — со жгутиковыми (трихомонадами), которые являются активным транспортом для микробов. Существует и пассивный путь распространения инфекции, когда микроорганизмы проникают активно (половым путем), а затем пассивно распространяются по гениталиям. Воспалительный процесс начинается в слизистой оболочке, распространяясь и на другие слои маточной трубы. Экссудат, образовавшийся в результате воспалительного процесса, скапливаясь в полости трубы, изливается в брюшную полость, нередко вызывая спаечный процесс вокруг трубы, закрывая просвет ее ампулы, а затем и отверстие маточного отдела трубы. Непроходимость трубы ведет к образованию мешотчатого воспалительного образования. Скопление в полости трубы серозной жидкости носит название гидросальпинкса. Гидросальпинкс может быть как односторонним, так и двусторонним. При тяжелом течении сальпингита, высокой вирулентности микроорганизмов появляется гнойное содержимое в трубе и возникает пиосальпинкс. При пиосальпинксе в малом тазу образуются спайки с кишечником, сальником и мочевым пузырем. У 2/3 больных воспалительный процесс с маточной трубы переходит на яичник (сальпингоофорит).
Клиническая картина Сальпингоофорит может быть острым, подострым и хроническим. Для острого сальпингоофорита характерны боли внизу живота и пояснице, повышение температуры, дизурические и диспепсические явления, изменения крови, присущие воспалительному процессу, выраженные в той или иной степени процессы экссудации и инфильтрации в области придатков матки и окружающих тканей. Симптомы острого сальпингоофорита могут быть выражены в различной степени, что обусловлено вирулентностью возбудителя и реактивностью организма. Выраженность болевых ощущений связана с обширностью распространения воспалительного процесса по брюшине. Чем больше вовлекается в воспалительный процесс брюшина, тем более выражена болевая реакция. Как правило, боли сопровождаются изменениями в нервно-психическом состоянии больных (плохой сон, раздражительность, снижение трудоспособности, быстрая утомляемость и др.). Степень увеличения придатков матки зависит от выраженности гиперемии, экссудации и инфильтрации тканей лейкоцитами, а также вовлечения в патологический процесс окружающих тканей. Иногда острый сальпингоофорит имеет стертую клиническую картину, в то время как в придатках наблюдаются выраженные изменения вплоть до нагноения. В других случаях воспалительный процесс протекает тяжело, с резко выраженными клиническими проявлениями, особенно при пиосальпинксе. Наблюдаются высокая температура, озноб, резкая боль внизу живота, симптомы раздражения брюшины, выраженные изменения со стороны крови (увеличение количества лейкоцитов, сдвиг лейкоцитарной формулы влево, повышение СОЭ). Для хронической стадии процесса характерны уплотнение, ограничение подвижности, нерезко выраженная болезненность придатков при их смещении вследствие спаечного процесса. Хроническое воспаление придатков матки, особенно рецидивирующее, как правило, сопровождается нарушением функций нервной, эндокринной, сердечно-сосудистой, пищеварительной и мочевыделительной систем. Хронический сальпингоофорит протекает длительно, нередко с обострениями. Обострение может быть обусловлено усилением патогенных свойств возбудителя или вторичным инфицированием либо факторами неспецифического характера, связанными с переохлаждением, перегреванием, переутомлением, перенесенным гриппом и другими причинами, ослабляющими защитные силы организма. В результате длительного течения воспалительного процесса у таких больных нередко возникает трубное бесплодие. Частота бесплодия у больных хроническим сальпингоофоритом может достигать 60–70 %, причем в 2/3 случаев оно бывает вторичным. По данным литературы, после однократного эпизода сальпингита непроходимость маточных труб выявляется в 11–13 % случаев, после двукратного — в 23–36 %, при трех и более обострениях — в 54–75 % случаев. Важным проявлением хронического процесса в матке и придатках является нарушение менструальной функции. Существование стойкого очага воспаления в малом тазу приводит кнарушению менструального цикла у 45–55 % больных, что проявляется в виде мено- и метроррагий, олиго- и аменореи (см.), альгодисменореи. Предменструальные кровянистые выделения более характерны для больных с сопутствующей патологией гениталий, постменструальные — для больных с изолированным поражением эндометрия. Нарушения сексуальной функции у данной категории больных встречаются в 50–70 % случаев и проявляются в отсутствии или изменении либидо, аноргазмии (см.), вагинизме (см.), диспарейнии, что, в свою очередь, тесно связано с психоэмоциональным состоянием больных и степенью снижения функции яичников. Практически у каждой четвертой женщины, страдающей хроническим воспалением матки и (или) придатков, отмечаются бели. Они могут быть серозными или гноевидными, их количество также может быть различным и связано, как правило, с остротой воспалительного процесса. Послеродовой сальпингоофорит развивается на 8—10-й день после родов, сопровождается ухудшением общего состояния, повышением температуры до 38–39 °C, ознобом, тахикардией (см.), сильной болью в животе, тошнотой, метеоризмом (см.), перитонеальными симптомами. При влагалищном исследовании определяют признаки эндомиометрита и пастозность придатков матки с одной или двух сторон. Придатки матки резко болезненны при пальпации. При гиперергическом течении процесса возможно нагноение (пиосальпинкс, пиооварий) с угрозой развития диффузного гнойного перитонита (см.).
Диагностика и дифдиагностика Диагноз воспаления придатков матки основывается на данных анамнеза, особенностях клинических проявлений заболевания, увеличении придатков матки с одной или двух сторон, изменении гематологических показателей и др. Иногда значительные сложности возникают при решении вопроса о причинах обострения хронического воспалительного процесса. У одних больных обострение обусловлено активацией аэробной инфекции или реинфекцией, у других оно бывает тесно связано с воздействием неспецифических факторов. Воспаление придатков матки в острой стадии чаще всего приходится дифференцировать с аппендицитом (см.), при хроническом течении заболевания — с трубным абортом (см.). Иногда возникают трудности при дифференциации острого воспаления придатков матки с перекрутом ножки опухоли яичника. Для последнего характерны: внезапное начало заболевания, отсутствие указаний в анамнезе на воспалительный процесс в придатках матки, обнаружение в области придатков опухолевидного образования округлой формы, болезненного при смещении. УЗИ придатков матки может дать наиболее исчерпывающую информацию при использовании влагалищного датчика. При этом важная информация выявляется при объемных образованиях в области придатков матки. Гистеросальпингография назначается при хроническом сальпингоофорите. Она выявляет состояние проходимости и патологические изменения маточных труб.
Лечение Острый сальпингоофорит предусматривает комплексную терапию: антибактериальную, иммунотерапию, ферментотерапию, немедикаментозное лечение. Лечение антибиотиками проводят не менее 5 дней. Если ожидаемые результаты отсутствуют или незначительны, показана отмена или замена антибиотиков. Наиболее часто используются следующие антибиотики: — синтетические пенициллины (оксациллин, ампициллин, ампиокс); — тетрациклин и доксициклин; — макролиды (эритромицин, рокситромицин, азитромицин); — фторхинолоны (офлоксацин, цифран и др.); — клиндамицин и метронидазол. Нередко течение хронических воспалительных заболеваний матки и придатков может быть отягощено развитием дисбактериоза в результате побочного действия лекарств и аутоинфекции условно-патогенными микробами. К препаратам, устраняющим дисбактериоз, относятся бификол, ацилакт, лактобактерин, бифидумбактерин. Их применяют в течение 10–14 дней. Для профилактики дисбактериоза влагалища и при наличии кандидоза применяют свечи полижинакс (по 1 свече в день вагинально в течение 12 дней) и натамицин (по 1 свече в день вагинально в течение 6 дней), нистатин внутрь в течение 14–16 дней либо флюконазол (внутрь по 1–2 капсулы). Новым препаратом этой группы является натамицин — противогрибковый пентаеновый антибиотик, имеющий широкий спектр действия. Применяют натамицин по следующей схеме: по 1 вагинальной свече на ночь в течение 6–9 дней. Во время менструации терапию прерывают. При обнаружении трихомонад назначают метронидазол (внутрь по 0,25 г 3 раза в день в течение 3 дней), а при наличии герпес-вирусной инфекции — ацикловир (вагинально каждые 4–6 ч в течение 14 дней). Изменения в иммунном статусе женщины при хронических воспалительных процессах диктуют необходимость назначения препаратов, способствующих повышению резистентности организма. К таким препаратам относятся иммуномодуляторы, иммуностимуляторы, адаптогены, протеолитические ферменты. Иммуномодуляторы. Интерфероны — интерферон альфа-2в (по 2 свечи в сутки ежедневно в течение 10 дней, далее 3 раза в неделю через день по 2 свечи в сутки в течение 3—12 месяцев). Иммуностимуляторы. Левамизол обычно назначают в дозе 150 мг/сут. однократно или в 3 приема по 50 мг 3 дня подряд с последующим 2-недельным интервалом; Т-активин — по 1 мл 2 раза в неделю, всего 10 процедур, дибазол — по 0,5 таблетки 2 раза в день в течение месяца. Адаптогены. При отсутствии противопоказаний (гипертоническая болезнь, нарушения деятельности сердца) применяют экстракт элеутерококка по 20–30 капель 2–3 раза в день за 30 мин до еды; настойку женьшеня — по 20 капель 2–3 раза в день; сироп солодкового корня — по 40–50 капель 2–3 раза в день; пантокрин — по 30–40 капель или 1–2 таблетки 2–3 раза в день за 30 мин до еды. Препараты из группы биогенных стимуляторов также улучшают клеточный метаболизм, трофику и регенерацию тканей. Они оказывают, кроме того, иммуномодулирующее действие, стимулируя реакции клеточного иммунитета. К препаратам этой группы относятся: алоэ (1 мл подкожно, курс — 30 инъекций); гумизоль (1 мл внутримышечно первые 2–3 дня, затем 1 раз в сутки по 2 мл в течение 20–30 дней); лидаза (5 мл или 64 УЕ подкожно или внутримышечно через день, на курс — 10–20 инъекций; при необходимости курс лечения можно повторить через 1,5–2 месяца). Для улучшения микроциркуляции и снабжения кислородом органов и тканей в комплекс лечения больных с хроническими воспалительными процессами в матке и придатках необходимо включать препараты антикоагулянтного и антиагрегатного действия. К ним относятся аспирин и никотиновая кислота. Схемы применения следующие: аспирин — 0,25 г/сут.; никотиновая кислота — 0,15 г/сут. Длительное бессимптомное течение воспалительных процессов в эндометрии, как правило, сопровождается снижением концентрации прогестерона в крови. В связи с этим целесообразно в комплекс восстановительного лечения включать гестагенные препараты (норколут, оргаметрил, примолют-нор с 16-го по 25-й день цикла) и проводить циклическую гормональную терапию: микрофоллин с 5-го по 15-й день цикла, норколут с 16-го по 25-й день цикла или использовать для этих целей эстроген-гестагенный препарат циклопрогинова. В комплекс лечения хронических воспалительных процессов матки и придатков включают циклическую витаминотерапию: фолиевая кислота по 5 мг/сут. в I фазу менструального цикла, аскорбиновая кислота по 100 мг/сут. — во II фазу; витамин Е по 100 мг/сут. в течение 3 месяцев. В лечении послеродового сальпингоофорита показаны постельный режим, лед на живот, механически и химически щадящая пища, антибиотики, сульфаниламиды, обезболивающие препараты, десенсибилизирующая терапия (пипольфен, димедрол), 10 %-ный раствор хлорида кальция внутривенно, в дальнейшем — физиотерапевтические процедуры (осторожно). При гнойных образованиях производят пункцию. В случае угрожающего или наступившего разрыва пиосальпинкса или пиоовария показана срочная лапаротомия и удаление пораженных придатков; матку удаляют по показаниям. Для лечения хронического сальпингоофорита широко используют как природные, так и преформированные физические факторы. К первым относятся сероводородные, радоновые, йодобромные, углекислые воды, пеллоиды и факторы горного климата. Из преформированных физиотерапевтических средств эффективны ультразвук и магнитное поле, ВЧ и УВЧ, электро- и фонофорез, низкоинтенсивное лазерное излучение, низкочастотное магнитное поле. Устранению вегетоневротических расстройств, обменных нарушений, восстановлению репродуктивной и сексуальной функции способствует рефлексотерапия. Для снятия болевого синдрома можно использовать массаж, при этом проводится сочетанный массаж области живота и пояснично-крестцовой зоны. Массаж оказывает обезболивающее и противовоспалительное действие, способствует нормализации крово- и лимфообращения в зоне патологического очага, благоприятно влияет на нарушенный овариально-менструальный цикл и стимулирует общие защитно-приспособительные механизмы целостного организма. Курс — 10–12 процедур, ежедневно по 10–15 мин. Кроме того, для успешной ликвидации системных изменений организма женщины, вызванных хроническим воспалительным процессом, необходима определенная установка личности, направленная на активное преодоление болезни. Народные средства лечения воспалительных заболеваний женских половых органов. 1. Ромашка — 1 часть, листья крапивы — 3 части, трава горца птичьего — 5 частей. 2 ст. л. смеси залить 1 л кипятка, настоять в термосе 1 ч. Применять для спринцеваний 2 раза в день. 2. Корзинки бессмертника, листья березы, листья земляники, кукурузные рыльца, мать- и-мачехи листья, мяты трава, тысячелистник, створки фасоли — по 2 части; спорыш, крапива, череда, шиповника плоды — по 3 части; рябины плоды — 1 часть. 2 ст. л. смеси залить 500 мл кипятка, настаивать 10 ч в термосе. Пить по 100 мл настоя 3 раза в день. 3. Трава лаванды, цветки черемухи, трава полыни — по 1 части; кора дуба, листья земляники — по 2 части; плоды шиповника — 3 части. 1 ст. л. смеси залить 1 л кипятка, настоять 2 ч в термосе, процедить. Применять для спринцеваний перед сном в течение 2 недель. 4. Дуба кора — 6 частей, трава душицы — 4 части, корень алтея — 1 часть. 5 ст. л. смеси на 200 мл кипятка. Настоять в термосе 30–40 мин. Процедить, остудить, использовать для спринцеваний два раза в день. 6. Листья или цветки бессмертника, цветки мальвы лесной, цветки бузины черной, кора дуба — по 1 части. 5 ст. л. смеси залить 1 л кипятка, настоять в термосе 30–40 мин, процедить, остудить. Применять для спринцеваний утром и вечером. 7. Кора дуба — 3 части, цветки липы — 2 части. 4 ст. л. смеси залить 1 л кипятка, настоять в термосе 30 мин, остудить, процедить, использовать для спринцеваний утром и вечером. 8. Цветки липы — 2 части, цветки ромашки — 3 части. 4 ст. л. смеси залить 200 мл кипятка, настоять в термосе 30 мин, процедить, остудить, использовать для спринцеваний утром и вечером. 9. Чабрец, мать-и-мачеха, корень алтея — по 2 части; крапива, зверобой, тысячелистник — 1 часть. 3 ст. л. сбора на 1 л кипятка, настоять 2 ч, процедить. Пить по 100 мл настоя 3 раза в день в течение 2 месяцев. 10. Цветки донника, листья мать-и-мачехи, золототысячник, крапива — по 1 части; тысячелистник — 2 части. 1 ст. л. смеси на 500 мл кипятка, настоять 30 мин, процедить, пить по 100 мл 3 раза в день. 11. Корень валерианы, листья мелиссы — по 2 части; трава манжетки, крапива — по 3 части. 2 ч. л. смеси на 200 мл кипятка, настоять 30–40 мин, процедить, пить по 20 мл настоя в день. 12. Корень солодки, трава череды, корень аралии маньчжурской, трава хвоща полевого, плоды шиповника, корзинки бессмертника, корень девясила, соплодия ольхи — по 1 части. 2 ст. л. смеси на 500 мл кипятка, кипятить на водяной бане 8 мин, настоять 10 ч. Пить по 50 мл настоя 3 раза в день после еды. 13. Хороший эффект дают также мумие (его принимают за полчаса до еды 2 раза в день) и прополис (спиртовая настойка прополиса по 3 капли 2 раза в день). Сборы следует принимать по 1/3—1/2 стакана за 30–40 мин до еды. Одновременный прием лекарств и травяных сборов не рекомендуется — между двумя этими лекарственными формами должен быть перерыв не менее 1 ч. Сборы рекомендуется принимать по следующей схеме: 2 недели приема — 2 недели перерыв — 2 недели приема — 2 недели перерыв — сменить сбор и принимать его по схеме. Перед тем как принимать тот или иной сбор, изучите противопоказания ко всем травам, входящим в состав этого сбора в травнике.
Реабилитация больных хроническим сальпингоофоритом Определенные трудности при лечении пациенток с длительным воспалительным анамнезом представляют выраженные топографо-анатомические изменения гениталий при значительном угнетении клеточного звена иммунитета. Разработан комплекс реабилитации у подобных больных, включающий лапароскопию с целью ранней диагностики и адекватного эндохирургического вмешательства и последующее назначение с 1–2 суток после операции магнитного поля низкой частоты (до 1 Гц) и индукции до 1 Тл с формой импульса, графически близкой к форме спайки с длительностью переднего и заднего фронтов 1 мс и 50 мс. Сочетают наружное и полостное воздействие магнитным полем на органы малого таза в течение 5—15 мин. Курс — до 10–12 сеансов. Подобное лечение, дополненное назначением традиционных противовоспалительных средств, позволяет уже к 4—5-му дню терапии купировать болевой синдром, уменьшить отек и инфильтрацию в придатках, улучшить самочувствие больных. По окончании курса лечения наблюдаются: увеличение количества Т-лимфоцитов, активация фагоцитоза, снижение уровня иммунноглобулинов А, Ми G, быстрая стабилизация биохимических и гемодинамических показателей, повышение эффективности общепринятого лечения в 1,5 раза. Использование магнитотерапии при хронических сальпингоофоритах приводит к восстановлению проходимости маточных труб у 70,6 %, овуляции — у 46 %, генеративной функции — у 32,5 % больных. Прогноз чаще всего благоприятный, однако возможно распространение воспалительного процесса на брюшину малого таза, что может осложнить течение заболевания.
САП
ОпределениеСап (маллеус) — зоонозное инфекционное заболевание, протекающее по типу септикопиемии с образованием специфических гранулем и абсцессов в различных тканях и органах.
Этиология и эпидемиология Сап известен со времен античности; по-видимому, его знали уже Гиппократ и Аристотель. Заражение сапом человека от лошади впервые было описано в 1783 г. В 1797 г. Виборг установил передачу инфекции через предметы, зараженные выделениями больного животного, а румынский ученый Бабеш в 1881 г. выявил возбудителя сапа в гное из язв больного человека. Русский исследователь Н. П. Васильев (1883 г.) обнаружил возбудителя сапа в крови больных людей и указал на его тождественность с возбудителем болезни у лошадей. В чистой культуре микроорганизм был получен в 1882 г. Леффлером и Шютцем. Возбудитель сапа — псевдомонас маллеи — представляет собой грамотрицательную палочку размером 1–5 х 0,5–0,8 мкм, которая растет на обычных питательных средах с добавлением глицерина. При гибели палочек выделяется эндотоксин. Возбудитель достаточно устойчив: в воде и почве сохраняется до 1,5 месяца, в выделениях больных и трупах животных, павших от сапа, — несколько недель. Быстро погибает при нагревании, действии ультрафиолета, чувствителен к воздействию обычных дезинфектантов. Бактерии сапа не образуют спор и капсул, грамотрицательны, имеются неподвижные и подвижные штаммы. Бактерии сапа состоят из двух разновидностей антигенных групп. Первая содержит антиген, общий для бактерий сапа и мелиоидоза, вторая имеет антиген, который содержится только в бактериях сапа. Выделены две фракции: специфический видовой полисахарид и неспецифический нуклеопротеид. Одним из продуктов распада эндотоксина является маллеин, обладающий ярко выраженным аллергическим действием и подобно туберкулину использующийся в диагностических целях. Основным резервуаром и источником инфекции для человека являются больные сапом лошади, мулы, ослы, верблюды, зебры. Реже наблюдается инфицированность представителей семейства кошачьих (львы, тигры, барсы, леопарды), которые заражаются, поедая мясо больных сапом животных. Крупный рогатый скот, свиньи, козы, овцы, птицы сапом не болеют. Главную эпидемиологическую опасность представляют животные с острыми формами болезни, сопровождающимися обильным выделением гноя из открытых язв. Заражение человека чаще происходит контактным путем при попадании гноя и слизи на поврежденные кожные покровы и слизистые. Реже заражение может происходить алиментарным путем через инфицированную воду, еще реже — аэрогенно (в лабораторных условиях). Заражение носит, как правило, профессиональный характер у лиц, связанных с уходом за больными животными. Не исключается инфицирование сапом и от больного человека. В прошлом сап был достаточно широко распространен; заболеваемость людей в то время составляла 150–200 случаев в год. К концу XIX в. удалось добиться значительного снижения заболеваемости. Восприимчивость к сапу всеобщая, заболевания чаще регистрируются в холодное время года и носят спорадический характер, хотя описаны и семейные вспышки. Основной контингент больных — мужчины. В настоящее время в нашей стране сап не встречается, но возможен его занос из азиатских стран (Китай, Монголия, Афганистан и др.). Иммунитет к сапу кратковременный или отсутствует.
Патогенез и патанатомия Возбудитель сапа проникает в организм человека через поврежденную кожу и слизистые оболочки глаз, носа и дыхательных путей, реже — желудочно-кишечного тракта. В месте внедрения образуется воспалительный процесс с образованием гранулем, содержащих палочки сапа. Гематогенное и лимфогенное распространение инфекции ведет к формированию грануляционных узелков в различных органах. При остром течении болезни гранулемы претерпевают гнойное расплавление с развитием септикопиемии. Образуются метастатические абсцессы (см.) во внутренних органах и мышцах, гнойные остеомиелиты (см.) и артриты (см.). Часто в процесс вовлекаются легкие. Возможно развитие лобулярной, очаговой, сливной и даже лобарной пневмонии (см.). Нередко абсцессы образуются в печени и других органах (почки, селезенка, миокард, костный мозг, яички). При хроническом течении в узелках преобладают пролиферативные процессы. Развиваются хрониосепсис, абсцессы во внутренних органах, полиартриты, в легких наблюдаются карнификация, пневмосклероз, бронхоэктазы (см.). В редких случаях поражается нервная система в виде гнойного лептоменингита, эпидуральных и субдуральных абсцессов, абсцессов мозга.
Клиническая картина По клиническому течению различают острый и хронический сап. Инкубационный период при острой форме составляет 1–5 дней, реже 2–3 недели. С самого начала появляется озноб, температура повышается до 38,5—39,5 °C. К общим симптомам болезни относятся головные, мышечные и суставные боли, слабость, разбитость. В месте входных ворот инфекции возникает рожистоподобная инфильтрация, а на ней — папула красно-багрового цвета, которая преобразуется в пустулу с кровянистым содержимым. Через 1–2 дня пустула вскрывается и превращается в язву с подрытыми краями и сальным дном. Развиваются регионарный лимфангит и лимфаденит (см.). Болезнь быстро прогрессирует. На коже лица, слизистой оболочке рта и носа появляются множественные вторичные папулы, подвергающиеся пустулизации и изъязвлению. Выделения из носа становятся слизистогнойными с зеленоватым оттенком, затем сукровичными. Глубокие абсцессы (см.) и некротические очаги в мышцах вызывают резкие боли. В результате образования легочных гранулем возникают боли в груди и кашель с отделением слизисто-кровянистой или гнойной мокроты. Появляются акроцианоз, цианоз губ, одышка. Возможно формирование сливной ползучей пневмонии (см.) и вовлечение в патологический процесс плевры. В терминальном периоде острого сапа отмечаются септические поносы, гнойные артриты (см.), образуются длительно не заживающие свищи вследствие самопроизвольного вскрытия мышечных абсцессов. Отмечаются расширение границ сердца, глухость сердечных тонов, гипотензия, в тяжелых случаях развивается острая сердечная недостаточность. Селезенка и печень увеличены. В крови выявляется лейкоцитоз с нейтрофильным сдвигом, СОЭ повышена. Общая продолжительность острой формы сапа составляет 2–5 недель. Во всех случаях исход заболевания смертельный. Продолжительность хронической формы сапа — от нескольких месяцев до 3 лет. Все симптомы развиваются постепенно. Заболевание протекает в кожной, носовой и легочной формах со сменой периодов обострений и ремиссий. Кожная форма встречается наиболее часто: образуются изъязвляющиеся пустулы с багровым дном; язвы отличаются тенденцией к слиянию с медленным заживлением и последующим обширным рубцеванием. Кожные изменения сопровождаются лимфангитами и лимфаденитами (см.). В мышцах развиваются «холодные» абсцессы (см.), после спонтанного вскрытия которых образуются долго не заживающие свищи. В гное, выделяемом из абсцессов, содержится возбудитель сапа. Легочная форма хронического сапа проявляется лихорадкой, сливной ползучей пневмонией (см.), абсцедированием легких. При первичной носовой форме патологический процесс сосредоточен на слизистой носа. Пустулезные высыпания и образующиеся на их месте глубокие язвы распространяются со слизистой оболочки носа на слизистые зева, гортани и трахеи. Выделения из носа слизисто-сукровичные, кровянистые и слизисто-гнойные. При хронической форме сапа у больных развивается резкое истощение. Летальность достигает 50 %.
Диагностика и дифдиагностика При диагностике сапа большое значение придается клиническим проявлениям болезни, эпиданамнезу и эпизоотологической ситуации. В лабораторной диагностике применяют бактериологические, серологические и биологические методы исследования. Материалом для бактериологического исследования служат мокрота, кровь, содержимое абсцессов и отделяемое язв. Проводят бактериоскопию мазков и изучение культуры возбудителя. Из серологических методов применяют реакцию агглютинации, реакцию связывания комплемента, реакцию непрямой гемагглютинации, однако при хроническом сапе реакция связывания комплемента нередко бывает отрицательной. Важное значение имеет аллергическая проба с маллеином, которая становится положительной с 10— 15-го дня болезни. Все работы с инфекционным материалом проводятся в соответствии с правилами работы с особо опасными инфекциями. Сап необходимо дифференцировать с чумой (см.), натуральной оспой (см.), мелиоидозом (см.), сибирской язвой (см.), фурункулезом (см.), некоторыми формами сифилиса (см.) и туберкулезом (см.) лимфатических узлов.
Лечение и профилактика Больных обязательно госпитализируют. Из этиотропных средств с некоторым успехом используют сульфаниламиды (сульфатиазол по 5–6 г в сутки) в течение месяца. В ряде случаев наблюдается хороший результат от применения антибиотиков (стрептомицин и пенициллин) в сочетании с сульфаниламидами и от сульфаниламидов с одновременным введением маллеина внутрикожно или подкожно. Однако и эти меры недостаточно надежны. Из патогенетических средств применяют гемодез, неокомпенсан, реополиглюкин, желатиноль, физраствор в необходимых дозах. Рекомендуют препараты крови и витаминотерапию. Симптоматическая терапия включает сердечно-сосудистые, рассасывающие и болеутоляющие средства. При абсцессах необходимо хирургическое лечение. Если заболевание появилось при отсутствии возможности обратиться за медицинской помощью, первая помощь заключается в срочных мерах по обработке ранки, через которую может пройти инфекция, — прижечь раскаленным гвоздем эту ранку. Если она находится на слизистой оболочке носа, ее промывают раствором марганцовокислого калия (1: 5000) или прижигают ляписом. В целях профилактики сапа важнейшее значение имеют постоянный ветеринарный надзор и строгое выполнение санитарнопротивоэпидемических мероприятий при уходе за животными. Лиц, контактировавших с больными, наблюдают в течение 15 дней. Специфической профилактики сапа нет. Общавшимся с больным животным проводят экстренную антибиотикопрофилактику в течение 5 дней.
САРКОИДОЗ
ОпределениеСаркоидоз — хроническое доброкачественное мультисистемное гранулематозное заболевание неизвестной этиологии, характеризующееся образованием во многих органах эпителиоидно-клеточных неказеифицированных гранулем, нарушением нормальной архитектуры пораженного органа или органов, лечение которого до конца не обосновано.Термин «хроническое заболевание» означает, что оно может продолжаться длительный период времени, но это не значит, что пациент все время чувствует себя больным. Термин «мультисистемное» означает, что саркоидоз одновременно может поражать несколько органов или систем организма. Для саркоидоза в 90 % случаев типично поражение легких. Одновременно в патологический процесс могут быть вовлечены лимфатические узлы, селезенка, слюнные железы, кожа, кости, суставы, мышцы и глаза. Реже встречается саркоидоз печени, почек, сердца и нервной системы. Термин «гранулематозное» относится к образованию мелких воспалительных узелков, или гранулем, в пораженной ткани. Термин «гранулема» происходит от латинского слова, означающего небольшое зерно или гранулу. Гранулема представляет собой скопление иммунных клеток, которые в норме участвуют в защитных реакциях организма. Эти образования обнаруживают как во внутренних органах, так и в коже. Термин «аутоиммунное» означает, что болезнь характеризуется специфическим иммунным ответом не только на чужеродные агенты, но и на компоненты собственных тканей организма. Актуальность знакомства с саркоидозом врачей общей практики и различных специальностей диктуется изменением организации оказания помощи этой группе больных в России. В течение нескольких десятилетий больные саркоидозом находились под наблюдением фтизиатров (VIII группа учета), тогда как сотрудники ведущих институтов туберкулеза высказали мнение о том, что в сложившейся эпидемиологической ситуации целесообразно передать функцию наблюдения за больными саркоидозом в поликлиники по месту жительства (М. В. Шилова и др., 2001 г.). Впервые саркоидоз был описан как заболевание кожи (папиллярный псориаз) Ж. Гетчинсоном в 1869 г., затем Бенье в 1889 г. и Ц. Беком в 1899 г.; на основании сходства гистологических изменений в коже с саркомой (см.) был предложен термин «саркоид». Системный характер заболевания был отмечен Бенье, описавшим случай одновременного поражения кожи, периферических лимфатических узлов и суставов кистей. Позднее Ж. Шауманн (J. Schaumann, 1917 г.) установил характерное для саркоидоза поражение периферических и внутригрудных лимфатических узлов. В 1934 г. на международном съезде дерматологов в Страсбурге было предложено именовать заболевание болезнью Бенье-Бека-Шауманна, а с середины ХХ в. наиболее широко употребляется термин «саркоидоз».
Эпидемиология Распространенность саркоидоза очень неоднородна, хотя среди других диссеминированных процессов и гранулематозов он считается наиболее изученным. Вновь выявленные случаи чаще всего регистрируются в возрасте 20–50 лет с пиком в 30–39 лет, 2/3 пациентов — женщины. Тем не менее существует саркоидоз детского возраста и саркоидоз у пожилых. В России наиболее глубокие исследования по саркоидозу были проведены сотрудниками Центрального НИИ туберкулеза РАМН, Санкт-Петербургского НИИ пульмонологии и Российского НИИ фтизиопульмонологии. Так, по данным С. Е. Борисова (1995 г.), заболеваемость саркоидозом в России составляет 3 на 100 тыс. населения. В Воронеже в 1987 г. заболеваемость была 2,87 на 100 тыс., а в Смоленской области возросла за последние 15 лет с 1,35 до 2,96 на 100 тыс. населения. Распространенность саркоидоза в Республике Татарстан в 2010 г. составила 14,8 на 100 тыс. населения. Многочисленные эпидемиологические исследования подтверждают рост заболеваемости и распространенности саркоидоза во всем мире. Приводятся данные о том, что число больных саркоидозом ежегодно увеличивается на 1,9 %. В настоящее время средний показатель распространенности саркоидоза в мире составляет 20 на 100 тыс. населения (от 10 до 40 в разных странах). Заболеваемость саркоидозом варьирует от 1–2 до 17 на 100 тыс. человек. В России эти показатели составляют, по разным данным, соответственно 12–25 и 2–5 на 100 тыс. населения. Данные американских исследователей свидетельствуют о том, что у лиц черной расы саркоидоз встречается в 10–17 раз чаще, чем у белых. Крайне редки случаи болезни среди индейцев, эскимосов, жителей Новой Зеландии. Саркоидоз встречается несколько чаще у женщин, чем у мужчин (в 53–66 % случаев, по разным данным). Возраст 80 % больных составляет 20–40 лет, хотя известно, что болезнь может развиться в любом возрасте.
Этиология Этиология саркоидоза неизвестна. Гистологическое сходство саркоидной и туберкулезной гранулем и обнаружение у больных саркоидозом ультрамелких форм микобактерий дают основание предполагать, что саркоидоз вызывается измененными микобактериями. Обсуждается этиологическая роль различных бактерий, вирусов и грибов, а также неизвестного пока возбудителя. Наиболее распространена гипотеза о полиэтиологической природе заболевания. Возможно, продуктивное воспаление с гранулематозной реакцией при саркоидозе является защитным ответом организма, продолжающимся и после окончания воздействия этиологического фактора. Эпителиоидно-клеточные гранулемы могут формироваться в разных органах: лимфатических узлах, печени, селезенке, слюнных железах, глазах, сердце, коже, мышцах, костях, кишечнике, центральной и периферической нервной системе. Наиболее часто поражаются внутригрудные лимфатические узлы (ВГЛУ) и легкие. Формированию гранулем предшествуют и в дальнейшем сопутствуют васкулит (см.) и лимфоидно-макрофагальная инфильтрация пораженного органа (в легочной ткани — альвеолит). Гранулемы при саркоидозе имеют характерный «штампованный» вид, центральная часть их состоит из эпителиоидных и гигантских многоядерных клеток Пирогова — Лангханса, по периферии располагаются лимфоциты, макрофаги, плазматические клетки и фибробласты. Гранулемы при саркоидозе имеют большое сходство с туберкулезными, а также гранулемами, наблюдаемыми при микозах и экзогенных аллергических альвеолитах. Для саркоидных гранулем не характерен казеозный некроз, как при туберкулезе; в части гранулем может формироваться фибриноидный некроз (см.). Гранулемы могут рассасываться практически бесследно или фиброзироваться, приводя к развитию диффузного интерстициального пневмосклероза, вплоть до «сотового легкого», что наблюдается только в 5—10 % случаев. Предложены различные классификации саркоидоза. Согласно МКБ-10 саркоидоз отнесен к классу III «Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм» и подразделяется следующим образом: — саркоидоз; — саркоидоз легких; — саркоидоз лимфатических узлов; — саркоидоз легких с саркоидозом лимфатических узлов; — саркоидоз кожи; — саркоидоз других уточненных и комбинированных локализаций; — саркоидоз неуточненный. Академик А. Г. Хоменко в 1983 г. рекомендовал выделять саркоидоз органов дыхания, саркоидоз других органов и генерализованный саркоидоз. Наиболее широко используется классификация, в соответствии с которой выделяют 3 стадии болезни: 1 — изолированное поражение внутригрудных лимфатических узлов; 2 — сочетанное поражение ВГЛУ и легких; 3 — сочетанное поражение ВГЛУ и легких с выраженными распространенными фиброзными изменениями. В международной практике принято разделение внутригрудного саркоидоза на стадии, основанные на результатах лучевых исследований. Стадия 0. Нет изменений на рентгенограмме органов грудной клетки. Стадия I. Внутригрудная лимфаденопатия. Паренхима легких не изменена. Стадия II. Лимфаденопатия корней легких и средостения. Патологические изменения паренхимы легких. Стадия III. Патология легочной паренхимы без лимфаденопатии. Стадия IV. Необратимый фиброз легких. Указаны также фазы развития заболевания (активная, регрессии и стабилизации), характер течения (спонтанная регрессия, благоприятное, рецидивирующее, прогрессирующее), осложнения (стеноз бронха, ателектаз (см.), дыхательная и легочно-сердечная недостаточность) и остаточные изменения (пневмосклероз, эмфизема легких (см.), адгезивный плеврит (см.)).
Патогенез Гранулематозное воспаление является вариантом хронического воспаления, при котором в воспалительном клеточном инфильтрате преобладают производные моноцитов крови: макрофаги, эпителиоидные и гигантские многоядерные клетки, формирующие ограниченные компактные скопления. Частным случаем гранулематозного воспаления является эпителиоидно-клеточный гранулематоз; выделяют также варианты с диффузной инфильтрацией мононуклеарными фагоцитами и с макрофагальными гранулемами. Для развития гранулематоза необходима способность этиологического (повреждающего) агента вызывать в организме гиперчувствительность замедленного типа (А. А. Приймак и др., 1997 г.). В основе патогенеза саркоидоза лежит накопление T-лимфоцитов вследствие иммунного ответа Th-1 типа. Саркоидоз не сопровождается полной анергией, так как при известных признаках периферической анергии имеет место высокий уровень иммунологической активности макрофагов и лимфоцитов в местах развития патологического процесса. По неизвестной пока причине активированные макрофаги и лимфоциты скапливаются в том или ином органе и продуцируют повышенное количество интерлейкинов, фактора некроза опухолей (TNF-альфа). TNF-альфа считают ключевым цитокином, участвующим в формировании гранулемы при саркоидозе. Кроме того, при саркоидозе доказана неконтролируемая выработка активированными альвеолярными макрофагами 1-альфа-гидроксилазы (в норме она вырабатывается в почках) с высокой аффинностью к 1,25-дигидроксикальциферолу, что приводит к эпизодам гиперкальциемии, которая может служить маркером активности процесса и иногда приводит к нефролитиазу. Опосредованную легочными альвеолярными макрофагами реакцию 1-альфа-гидроксилирования стимулирует гамма-интерферон и угнетают глюкокортикоиды. Развитие гранулематозной реакции связывают также с нарушениями механизмов апоптоза (запрограммированной гибели клеток) иммунокомпетентных клеток. В то же время избыток IL-10 считают фактором, приводящим к спонтанной ремиссии альвеолита при саркоидозе. Интересно, что у больных саркоидозом бактерицидная активность жидкости БАЛ выше, чем у здоровых за счет LL-37, лизоцима, альфадефензинов и антилейкопротеазы. Более того, антибактериальный пептид LL-37 локализуется в альвеолярных макрофагах, клетках бронхиального эпителия и бронхиальных железах, что свидетельствует о его защитной роли слизистой дыхательных путей.
Клиническая картина Клинические проявления саркоидоза и степень их выраженности весьма разнообразны. Для большинства случаев характерно несоответствие удовлетворительного общего состояния и обширности поражения легочной ткани и ВГЛУ. Начало заболевания может быть бессимптомным, постепенным или острым. При отсутствии клинических проявлений, что наблюдается у 10 % больных, заболевание обычно выявляется при рентгенологическом обследовании грудной клетки. Наиболее часто (у 2/3 больных) имеет место постепенное начало заболевания со скудной клинической симптоматикой: болью в груди, между лопатками, сухим кашлем, одышкой при физическом напряжении, общим недомоганием. Аускультативные изменения в легких часто отсутствуют, иногда могут выслушиваться жесткое дыхание и сухие хрипы. Острое начало заболевания, наблюдаемое примерно у 1/4 больных, характеризуется лихорадкой, появлением узловатой эритемы, полиартрита. При осмотре выявляют узловатую эритему — пурпурно-красные, плотные (индуративные) узлы, которые чаще всего возникают на голенях. Указанный симптомокомплекс при саркоидозе ВГЛУ характерен для синдрома Лефгрена. Часто при саркоидозе поражаются слюнные железы, что проявляется их припухлостью, уплотнением и сухостью во рту. Сочетание саркоидоза ВГЛУ, слюнных желез, глаз (увеита (см.), иридоциклита (см.)) и лицевого нерва носит название синдрома Хеерфордта. Острое начало саркоидоза не является прогностически неблагоприятным признаком, для таких случаев характерно быстрое и полное рассасывание изменений в пораженных органах, а выраженная симптоматика позволяет своевременно установить диагноз и начать лечение. Саркоидоз органов дыхания сочетается с экстрапульмональными поражениями почти у 20 % больных. Наиболее частыми внелегочными локализациями процесса являются периферические лимфатические узлы (до 40 %), кожа и подкожная клетчатка (около 20 %), почки, печень, селезенка, сердце, нервная система. Реже поражаются щитовидная железа, глотка, кости, молочные железы. Интактными при саркоидозе остаются только надпочечники. Внелегочные локализации саркоидоза обычно имеют множественный характер, и их наличие, как правило, предопределяет рецидивирующее течение заболевания. Существует два основных пути выявления больных саркоидозом. На долю профилактических осмотров, в том числе флюорографии, приходится от 1/3 до 1/2 случаев преимущественно с бессимптомным или постепенным началом болезни. От 1/2 до 2/3 больных выявляют при обращении к врачам, причем как в связи с клиническими проявлениями саркоидоза, так и по поводу других заболеваний. Диффузное усиление и обогащение легочного рисунка за счет интерстициальной инфильтрации, рассеянные мелкие очаговоподобные тени. Основными задачами диагностики саркоидоза являются: выделение характерного клиникорентгенологического симптомокомплекса, гистологическая верификация диагноза и определение активности процесса. Важнейшая роль в выявлении и установлении предварительного диагноза принадлежит рентгенографии; томо- и зонографию легких через плоскость корней с поперечным размазыванием теней, компьютерную томографию используют как уточняющие методы. Основу рентгенологического симптомокомплекса при саркоидозе органов дыхания составляют внутригрудная аденопатия, диссеминация и интерстициальные изменения, обусловленные явлениями альвеолита и пневмосклероза. Для саркоидоза характерно двустороннее увеличение ВГЛУ преимущественно бронхо-пульмональных групп, хотя в 5–8 % случаев наблюдают одностороннее поражение, что может вызывать диагностические трудности. Симптом внутригрудной аденопатии наблюдают изолированно при саркоидозе ВГЛУ или в сочетании с изменениями легочной ткани при саркоидозе ВГЛУ и легких. Легочная диссеминация характеризуется рассеянными очаговоподобными тенями диаметром от 2 до 7 мм, тяготеющими к плевральным оболочкам и сосудам и более тесно располагающимися в аксиллярных зонах. Интерстициальные изменения проявляются мелкосетчатой деформацией легочного рисунка, обусловленной инфильтрацией внутридольковых интерстициальных структур. Часто наблюдают симптом «матового стекла» — диффузное снижение прозрачности легочной ткани, что является проявлением альвеолита. Реже встречаются изменения пневмонического типа, обусловленные инфильтрацией и гиповентиляцией участка легкого. Изолированные изменения в легких без аденопатии наблюдают примерно у 5 % больных саркоидозом. Достаточно редко при саркоидозе обнаруживают выпот в плевральные полости и полостные образования в легких. Сочетание клинических проявлений и характерного рентгенологического симптомокомплекса позволяет диагностировать саркоидоз органов дыхания в 30–40 % случаев. Тем не менее отсутствие гистологического подтверждения часто является источником диагностических ошибок, которые имеют место у 40–50 % больных. Верификацию саркоидоза осуществляют на основании гистологического исследования биоптатов пораженных органов. Достаточно информативным методом (80 %) является трансбронхиальная внутрилегочная биопсия, позволяющая получить для гистологического исследования фрагмент легочной ткани. Более информативны (до 95 %), но и более травматичны медиастиноскопия и медиастинотомия. Известен и другой специфический метод подтверждения диагноза саркоидоза — проба Квейма, предложенная в 1941 г. Гомогенат ткани пораженного лимфоузла или селезенки больного саркоидозом (антиген Квейма) вводят обследуемому внутрикожно. В месте введения через месяц формируются саркоидные гранулемы, которые обнаруживают при гистологическом исследовании иссеченного участка кожи. Информативность метода составляет 60–70 %. В настоящее время проба Квейма используется редко в связи со сложностью выполнения и опасностью переноса инфекции. Активность воспалительного процесса при саркоидозе может быть оценена на основании многих лабораторных тестов. В гемограмме могут иметь место как лейкопения, так и умеренный лейкоцитоз, а также абсолютная лимфопения и моноцитоз. У 2/3 больных определяется умеренная диспротеинемия. Гиперкальциурия и гиперкальциемия наблюдается у 15–20 % больных. Важнейшими признаками активности саркоидоза являются: повышение содержания лимфоцитов (более 8 %) в осадке бронхоальвеолярного смыва; накопление цитрата галлия-67 активированными макрофагальными элементами в пораженных органах, выявляемое при сканировании; повышение в сыворотке крови уровня ангиотензинпревращающего фермента, продуцируемого эпителиоидными клетками саркоидных гранулем. Лимфоцитоз в бронхоальвеолярном смыве характерен для активного саркоидоза как при наличии изменений в легких, так и при саркоидозе ВГЛУ без рентгенологически выявляемых изменений в легочной ткани, поэтому бронхоальвеолярный лаваж информативен при всех формах саркоидоза. Спирография и пневмотахография позволяют выявить у части больных саркоидозом органов дыхания рестриктивные и обструктивные нарушения, выраженностькоторых, как правило, незначительна и не соответствует обширности поражения легких. Саркоидоз ВГЛУ чаще всего приходится дифференцировать с туберкулезом (см.) ВГЛУ, медиастинальной формой лимфогранулематоза и другими лимфомами (см.), иерсиниозом (см.), метастазами рака (см.) в лимфатические узлы средостения, инфекционным мононуклеозом (см.), загрудинным зобом (см.), тератомой (см.), бронхогенными кистами (см.). Саркоидоз легких требует проведения дифференциальной диагностики с диссеминированным туберкулезом (см.), карциноматозом, бронхиолоальвеолярным раком (см.), пневмокониозами, токсоплазмозом (см.), альвеолитами, лейомиоматозом и целым рядом других заболеваний, для которых характерна легочная диссеминация.
Лечение Все методы лечения саркоидоза основаны на подавлении воспалительной реакции и предотвращении фиброзной трансформации гранулем. На сегодня наиболее эффективным средством терапии саркоидоза являются кортикостероиды, которые оказывают мощное противовоспалительное действие, подавляя выработку иммуноглобулинов, интерлейкинов и других медиаторов воспаления. Вопрос о показаниях к началу кортикостероидной терапии не решен однозначно. В соответствии с одной крайней точкой зрения, наличие активного воспалительного процесса и возможности формирования необратимых фиброзных изменений в органах требуют начинать лечение сразу же после установления диагноза. С другой стороны, высокая вероятность спонтанной регрессии с полным рассасыванием воспалительных изменений и вероятность возникновения осложнений от лечения делают нецелесообразным раннее начало лечения во всех случаях. Причина затруднений в определении лечебной тактики заключается в том, что у большинства пациентов при выявлении заболевания нельзя достоверно прогнозировать его дальнейшее течение. Абсолютными показаниями для немедленного начала лечения является наличие поражения сердца и глаз в связи с риском развития опасных для жизни осложнений и потери зрения. Целесообразно также назначение кортикостероидов в случаях: — острого начала саркоидоза с наличием высокой активности воспалительного процесса, проявляющегося полиартритом и узловатой эритемой; — значительного прогрессирующего поражения легочной ткани с выраженными нарушениями функции дыхания; — сочетания саркоидоза органов дыхания с любыми внелегочными локализациями, когда высока вероятность прогрессирующего или рецидивирующего течения; — рецидивов саркоидоза с выраженными клиническими проявлениями и функциональными нарушениями. В остальных случаях, особенно при первичном выявлении саркоидоза, вопрос о необходимости лечения решается после 3–6 месяцев наблюдения за больным. Кортикостероидная терапия проводится обычно длительно: в течение 6–8 месяцев. Короткого (3-месячного) курса лечения недостаточно для достижения стойкой ремиссии, и вероятность рецидива существенно возрастает. Используемые при саркоидозе дозы кортикостероидов варьируют от 20 до 80 мг эквивалента преднизолона в сутки. Оптимальной с точки зрения соотношения эффективности и побочных действий лечения является начальная суточная доза 25–30 мг. После 40–60 дней ежедневного приема препаратов у 70–80 % больных определяется отчетливая положительная динамика, выражающаяся в клиническом улучшении и уменьшении изменений в легких и ВГЛУ на рентгенограммах. Частота умеренно выраженных побочных проявлений кортикостероидной терапии обычно не превышает 15 %. Интермиттирующий (через день) прием 25–30 мг кортикостероидов позволяет добиться улучшения несколько позже — через 2–3 месяца, но частота и выраженность побочных действий лечения уменьшаются в 1,5–2 раза. После регистрации положительного эффекта от начатой кортикостероидной терапии возможен переход с ежедневного приема препарата на интермиттирующий: дозу постепенно уменьшают до полной отмены и продолжают наблюдение за пациентами (см. далее). Желательно использовать кортикостероидные препараты, обладающие лучшей переносимостью (метилпреднизолон, триамсинолон, бетаметазон). Кортикостероиды целесообразно сочетать с препаратами калия, при необходимости использовать известные средства для коррекции побочных проявлений лечения. Другие методы лечения саркоидоза можно рассматривать как альтернативу или дополнение к основной терапии системными кортикостероидами в случаях, когда имеются противопоказания или ограничения для ее применения. Результаты использования при саркоидозе ингаляционных кортикостероидов (беклометазона дипропионата, флунизолида, флутиказона) оценивают неоднозначно. Несомненна целесообразность назначения препаратов местного действия в случаях поражения слизистой бронхов, которое выявляется у 20 % больных. В то же время отсутствие системного действия, позволяющее избежать многих осложнений, одновременно снижает терапевтический эффект топических стероидов. Для лечения саркоидоза используют также нестероидные противовоспалительные средства (делагил, плаквенил), антиоксиданты (альфа-токоферол, аскорутин, тиосульфат натрия). Эффективность такого лечения значительно скромнее результатов системной кортикостероидной терапии. Профилактический курс противотуберкулезной терапии (обычно препаратами ГИНК) одновременно с кортикостероидами целесообразно назначать только больным саркоидозом, у которых имеются остаточные посттуберкулезные изменения. В лечении больных саркоидозом с успехом используют ряд немедикаментозных методов. Разгрузочно-диетическая терапия обладает мощным иммуносупрессивным действием, а также стимулирует функцию надпочечников. По данным М. М. Ильковича и соавторов, положительный эффект после 2 недель полного голодания и последующего недельного восстановительного периода отмечается у 30–80 % больных в зависимости от стадии болезни. Эффективным физиотерапевтическим методом при саркоидозе является КВЧ-терапия. Курс из 20 процедур воздействия с длиной волны 5,6, 6,4 или 7,1 мм на область вилочковой железы позволяет добиться улучшения при активном, впервые выявленном саркоидозе или рецидиве заболевания. Более эффективно сочетание КВЧ-терапии с редуцированными дозами (10–15 мг в сутки) кортикостероидов. Хорошие результаты в лечении больных саркоидозом дает применение плазмафереза, действие которого основано на удалении с плазмой крови медиаторов воспаления, иммунных комплексов, улучшении микроциркуляции. Плазмаферез показан при недостаточном эффекте базисной кортикостероидной терапии или в случаях ограниченной возможности ее проведения (например, у больных сахарным диабетом, тяжелой артериальной гипертонией, язвенной болезнью). Предложены различные режимы проведения плазмафереза. Хорошие результаты получены при проведении курса из 3–4 плазмаферезов объемом 700–800 мл с интервалом в 5–7 дней. Эффект лечения при хорошей его переносимости значительно увеличивается при сочетании плазмафереза с малыми дозами (10–15 мг в сутки) кортикостероидов. Пребывание больных саркоидозом в стационаре ограничивается сроком их обследования для установления диагноза и оценки переносимости назначенного лечения (обычно от 1 до 1,5 месяца). Курс разгрузочно-диетической терапии и инвазивные методы лечения также необходимо проводить в клинике. Лечение продолжают в амбулаторных условиях. При удовлетворительном самочувствии больных и хорошей переносимости лечения больным не противопоказана трудовая деятельность. Течение саркоидоза в большинстве случаев благоприятное: у 20 % пациентов происходит спонтанная регрессия, у половины после курса лечения не наблюдается рецидивов. Рецидивирующее течение отмечено у 25 %, а прогрессирующее — только у 5 % больных. На протяжении многих лет обследование и наблюдение за больными саркоидозом в нашей стране проводили преимущественно на базе противотуберкулезных учреждений. В соответствии с активностью заболевания больных саркоидозом относят к одной из трех подгрупп VIII группы диспансерного учета противотуберкулезных диспансеров. Подгруппу VIII-А составляют больные с впервые выявленным активным саркоидозом. Их обследование, включающее врачебный осмотр, рентгенографию, клинический анализ крови и спирографию, повторяют каждые 3 месяца в течение первого года и каждые 6 месяцев в течение второго года наблюдения. В подгруппу VIII-Б включают больных с рецидивами и прогрессирующим течением саркоидоза. Больных этой подгруппы, получающих кортикостероидную терапию, наблюдают ежеквартально. Больных VIII-В подгруппы (с неактивным саркоидозом) наблюдают 1 раз в год. При отсутствии рецидивов на протяжении 2 лет они могут быть сняты с учета, однако возможность рецидивов саркоидоза после многолетней ремиссии делает целесообразным более длительное наблюдение больных в подгруппе VIII-В. Пациенты с внелегочными локализациями саркоидоза нуждаются также в наблюдении специалистов соответствующего профиля. Таким образом, несмотря на то что этиология саркоидоза остается неустановленной, а многие нерешенные вопросы требуют дальнейшего изучения этого заболевания, диагностика и лечение саркоидоза разработаны достаточно хорошо, чтобы обеспечить больным удовлетворительный уровень качества жизни.
САРКОМА
ОпределениеСаркома (от греч. sarkos — «мясо» и oma — «опухоль») — злокачественная опухоль (см.) из различных типов соединительной ткани: эмбриональной (мезенхимома), костной (остеосаркома), мышечной (миосаркома) и др. По морфологической картине различают кругло-, веретено-, полиморфноклеточные саркомы и фибросаркому.Среди первичных злокачественных опухолей выделяют опухоли из костной ткани (остеогенная саркома, паростальная саркома, хондросаркома, злокачественная гигантоклеточная опухоль) и опухоли некостного происхождения (саркома Юинга, фибросаркома, хордома, ангиосаркома, адамантинома).
Этиология и патогенез Опухолевый рост обусловлен различными этиологическими агентами. По данным экспериментальных исследований, опухоль развивается под воздействием ионизирующего и ультрафиолетового облучения, различных химических веществ, ДНК-вирусов некоторых классов с горизонтальной передачей; опухоль может быть также обусловлена суперинфекцией некоторых РНК-вирусов и т. д. В медицинской практике особое внимание врача могут привлечь курящие женщины и мужчины, работники некоторых профессий, связанные с потенциально канцерогенными веществами (анилиновые красители, радиоактивное излучение, асбест и т. д.). Исключение или уменьшение концентрации этиологических факторов — реальный путь снижения заболеваемости злокачественными опухолями. Опухоли могут быть доброкачественными и злокачественными. Первые состоят в основном из однотипных клеток, не отличающихся существенно по морфологии от нормальных клеток, с небольшой потенцией к росту, без способности к инвазии и метастазированию. Многие доброкачественные опухоли сохраняют эти черты на протяжении всей жизни человека, редко перерождаясь в соответствующие злокачественные опухоли. Например, липома (см.) подкожной клетчатки и миома (см.) матки трансформируются в саркому крайне редко. Вместе с тем доброкачественные опухоли могут быть этапом развития рака (см.) и саркомы. Так, диффузный полипоз (см.) кишечника на протяжении жизни почти в 100 % случаев переходит в рак. Во многих случаях этап сохранения опухолью характеристик доброкачественного тканевого разрастания (предрак) может быть не столь очевиден, как при полипозе, но так или иначе такой этап, занимающий различный промежуток времени, существует. Малигнизацию связывают с повторными изменениями в генетическом аппарате опухолевых клеток, которые склонны к мутациям существенно больше нормальных клеток. В результате возникают новые клоны клеток, характеризующиеся резким клеточным полиморфизмом, атипией, прорастанием в прилежащие органы и способностью к росту в виде метастатических очагов в других органах и тканях. В патогенезе некоторых опухолей важное определяющее значение имеют генетические факторы. У животных роль генетической предрасположенности очевидна (на примере высоко- и низкораковых линий мышей). У человека опухоль может быть как единственным проявлением дефекта генома, так и частью различных нарушений в геноме, приводящих к множественным порокам развития и опухолям. Развитие злокачественных опухолей учащается при нарушениях иммунологического контроля (иммунодефицитные синдромы — агаммаглобулинемия, атаксия-телеангиэктазия и др.; длительное применение иммунодепрессивных средств в случае трансплантации органов и при некоторых болезнях). Такие больные также нуждаются в более частом врачебном контроле для своевременного выявления опухоли. Инвазия и метастазирование злокачественной опухоли определяют течение заболевания. Опухолевые клетки прорастают в соседние органы и ткани, повреждают сосуды и нервы. Инвазия нередко определяет и время развития метастазов. Метастазирование — одно из основных свойств именно злокачественных опухолей. Доброкачественные опухоли, как правило, не метастазируют. Метастазы злокачественных опухолей обнаруживаются в регионарных лимфатических узлах, а также в самых различных органах и тканях. Знание путей оттока лимфы важно при проведении обследования больных и планировании лечения. В ряде случаев считается обязательным одновременно с удалением первичной опухоли проведение операции на регионарных лимфатических узлах. Такой же подход используется при лучевой терапии, если она является основным методом лечения (планируется облучение также регионарных лимфатических узлов). Различные опухоли имеют особенности метастазирования в отдаленные органы и ткани. Например, рак молочной железы более часто дает метастазы в кости, рак яичка и почки — в легкие, рак толстой кишки — в печень и т. д. В большинстве случаев возникают множественные метастазы различных размеров, сохраняющие морфологические структуры и биологические характеристики первичной опухоли. Наиболее часто поражаются легкие, печень, кости, головной мозг. Особенности отдаленного метастазирования каждой опухоли важно знать при составлении заключения о том, что опухоль локализованная. Это необходимо при планировании операции и лучевой терапии, а также для динамического наблюдения. Срок развития метастазов может быть различным. Например, метастазы рака почки в основном проявляются в течение первого года после диагноза и операции, а при раке молочной железы — в течение 2–5 лет, а иногда и через 10–15 лет. Рецидив роста опухоли проявляется в той же зоне в ближайшие месяцы, если операция была нерадикальной или лучевая терапия и (или) химиотерапия не привели к полной регрессии опухоли. Рецидивы по морфологической структуре сходны с первичной опухолью, но могут иметь существенные отличия от нее по биологическим характеристикам.
Клиническая картина Саркома мягких тканей В состав мягких тканей конечностей и туловища входят: подкожная и межмышечная жировая клетчатка, фасции, сухожилия, внутримышечные и околососудистые соединительнотканные прослойки, синовиальная ткань, поперечно-полосатые мышцы и оболочки периферических нервов. Большинство злокачественных новообразований мягких тканей относится к числу сарком. Они характеризуются малосимптомным течением и сходством клинической картины с доброкачественными опухолями и неопухолевыми заболеваниями. На их долю приходится около 1 % от общего числа злокачественных новообразований. Заболеваемость злокачественными новообразованиями мягких тканей у мужчин выше, чем у женщин, но различия незначительны. Большинство заболевших — это лица 30–60 лет, но 1/3 больных моложе 30 лет. Саркомы мягких тканей возникают в любой части тела. Примерно у половины опухоль локализуется на нижних конечностях. Наиболее часто поражается бедро. У 25 % заболевших саркома располагается на верхних конечностях. У остальных — на туловище и изредка на голове. Злокачественная опухоль мягких тканей имеет вид округлого узла беловатого или желтовато-серого цвета с бугристой или гладкой поверхностью. Консистенция новообразования зависит от гистологического строения. Она может быть плотной (фибросаркомы), мягкой (липосаркомы и ангиосаркомы) и даже желеобразной (миксомы). Истинной капсулы саркомы мягких тканей не имеют, однако в процессе роста новообразование сдавливает окружающие ткани, последние уплотняются, образуя так называемую ложную капсулу, которая довольно четко контурирует опухоль. Злокачественное новообразование обычно возникает в толще глубоких слоев мускулатуры. По мере увеличения размеров опухоль постепенно распространяется к поверхности тела. Рост ускоряется под влиянием травмы и физиопроцедур. Опухоль обычно одиночна, но для некоторых видов сарком характерны множественные поражения. Иногда они возникают на большом расстоянии друг от друга (множественные липосаркомы, злокачественные невриномы при болезни Реклингхаузена (см.)). Метастазирование злокачественных новообразований мягких тканей происходит преимущественно гематогенным путем (по кровеносным сосудам). Излюбленной локализацией метастазов являются легкие. Реже поражаются печень и кости. Метастазы в лимфатические узлы встречаются в 8—10 % случаев. Особенностью новообразований мягких тканей является существование группы опухолей, промежуточных между доброкачественными и злокачественными. Эти опухоли обладают местнорецидивирующим инфильтрирующим ростом, часто рецидивируют, но не дают метастазов или метастазируют крайне редко (десмоидные опухоли брюшной стенки, межмышечные или эмбриональные липомы (см.) и фибромы (см.), дифференцированные фибросаркомы и др.). Ведущим признаком служит появление безболезненного узла или припухлости округлой или овальной формы. Размеры узла варьируют от 2–3 до 25–30 см. Характер поверхности зависит от вида опухоли. Границы новообразования при наличии выраженной ложной капсулы четкие, при глубоком залегании опухоли контуры припухлости нечеткие, трудноопределимы. Кожа обычно не изменена, но по сравнению со здоровой стороной над опухолью имеется местное повышение температуры, а при массивных быстро растущих и достигающих поверхности образованиях появляется сеть расширенных подкожных вен, отмечается цианотичная окраска и инфильтрация или изъязвление кожи. Подвижность прощупываемого образования ограничена. Это служит одним из наиболее характерных и важных для диагностики симптомов. Изредка саркомы мягких тканей приводят к деформации конечностей, вызывают чувство тяжести и неловкости при движениях, но функция конечности нарушается редко. «Сигналами тревоги», при наличии которых должно быть высказано подозрение на саркому мягких тканей, являются: — наличие постепенно увеличивающегося опухолевого образования, ограничение подвижности имеющейся опухоли; — появление опухоли, исходящей из глубоких слоев мягких тканей; — возникновение припухлости по истечении промежутка от нескольких недель до 2–3 лет и более после травмы.
Саркома легких Под первичной саркомой легких в настоящее время понимают злокачественную опухоль соединительнотканной природы. Источником развития сарком легкого чаще всего является соединительная ткань межальвеолярных перегородок и стенок бронхов. Однако в связи с тем, что в легких соединительная ткань широко представлена в различных анатомических структурах, каждая из которых может быть источником бластоматозного процесса, эта группа опухолей характеризуется достаточной разнородностью. Описаны ангиосаркомы, нейросаркомы, фибросаркомы (см.), хондросаркомы, липосаркомы, лейомиосаркомы, рабдомиосаркомы, карциносаркомы (см.), лимфосаркомы и некоторые другие виды опухолей. Такое морфологическое разнообразие дало основание полагать, что саркома легких как самостоятельная нозологическая форма не встречается, а является собирательным термином. По отношению к раку (см.) легкого частота первичной саркомы этого органа колеблется в пределах от 1 на 100 случаев рака легкого до 1 на 20. В большинстве случаев саркома легкого имеет вид массивного опухолевого узла, занимающего часть или всю долю легкого, а в ряде случаев поражает и все легкое. Опухоль может быть отграниченной от окружающей легочной ткани капсулой, но может и инфильтрировать легочную паренхиму, прорастая в крупные бронхи. При гистологическом исследовании препаратов при всех видах первичной саркомы легких отмечается выраженная связь морфологической структуры опухоли с кровеносными капиллярами. Обычно имеется и обилие новообразованных сосудов. Гистологическое исследование препаратов, полученных из опухолевого узла в легком, не всегда позволяет определить структурные элементы, послужившие первоисточником бластоматозного процесса. Поэтому термин «ангиосаркома легких» является в значительной степени собирательным, объединяющим все саркомы легкого, исходящие из различных элементов стенки кровеносных сосудов. Очевидно, по этой же причине ангиосаркома является частным видом первичной саркомы легких. Следующим по частоте видом саркомы легкого является фибросаркома, развивающаяся из соединительнотканных элементов бронхов или перибронхиальных тканей. Далее следуют первичные лимфосаркомы легких, источником возникновения которых являются лимфатические узлы бронхолегочной системы. Другие виды дифференцированных и недифференцированных первичных сарком легкого (нейросаркомы, хондросаркомы, липосаркомы, лейомиосаркомы, рабдомиосаркомы, гемангиоперицитомы и др.) встречаются значительно реже. В отдельную форму первичных сарком легких выделяется полипоидная саркома ствола легочной артерии. Источником возникновения опухоли являются клапаны легочной артерии или ее стенки как в области ствола, так и правой или левой ее ветвей. Макроскопически опухоль имеет вид полипообразного образования, тесно связанного с клапанами легочной артерии. Опухоль может прорастать адвентиций легочной артерии и проникать в аорту, ткани эпикарда и средостения, метастазируя в лимфатические узлы и паренхиму легких. Отдаленные метастазы отмечаются значительно реже. Микроскопическая картина полипоидной саркомы ствола легочной артерии весьма разнообразна, но наиболее часто характеризуется признаками недифференцированной саркомы, лейомиосаркомы, миосаркомы, фибросаркомы, миксосаркомы. Ряд авторов относит полипоидные саркомы ствола легочной артерии к мезенхимальным саркомам. Особое место среди первичных сарком легких занимает карциносаркома (см.). Данная опухоль характеризуется одновременным сочетанием мезенхимального и эпителиального компонентов. Эпителиальный компонент опухоли представлен часто очагами мелкоклеточного недифференцированного рака. Реже обнаруживаются участки железистого рака. Саркоматозный (мезенхимальный) компонент опухоли характеризуется выраженным разнообразием. Чаще всего в опухоли формируются структуры фибросаркомы (см.). Метастазы карциносарком могут иметь строение как рака, так и саркомы. Макроскопически карциносаркома (см.) имеет вид опухолевого узла различной величины, интимно связанного со стенкой бронха, который опухоль прорастает, обтурируя или сдавливая его просвет. Одной из разновидностей карциносарком (см.) является полиповидная интрабронхиальная опухоль. Чаще она развивается в крупных бронхах и хорошо визуализируется при фибробронхоскопии. Прогноз при карциносаркоме (см.) легкого более благоприятен, чем при раке (см.) легкого. Такие опухоли метастазируют и рецидивируют в пределах грудной клетки. Клиническая картина первичной саркомы легкого практически не имеет специфических признаков и аналогична клиническим проявлениям рака легкого. Она во многом определяется размерами, характером и темпом роста опухоли, характером метастазирования. Периферические саркомы в I стадии заболевания протекают, как правило, бессимптомно и обнаруживаются случайно. По мере прогрессирования заболевания появляются клинические проявления, обусловленные механическим давлением и ростом опухоли, имеющим обычно инфильтративный характер. В этих стадиях опухоль нередко прорастает в прилежащие органы и анатомические образования (пищевод, трахею, крупные кровеносные сосуды, грудную стенку, клетчатку средостения, перикард и др.), что проявляется соответствующими клиническими симптомами — дисфагией (см.), синдромом сдавления верхней полой вены, геморрагическим плевритом (см.), геморрагическим перикардитом (см.) и др. Как правило, изменения в легких при первичной саркоме обнаруживаются случайно при профилактических осмотрах, проведении планового рентгенологического исследования или при обследовании по поводу других заболеваний; часто истинная природа патологических изменений выясняется в процессе длительного безуспешного лечения предполагаемой пневмонии. Нередко на первый план в клинической картине заболевания выступают не симптомы поражения легких, а так называемые паранеопластические синдромы остеоартропатии в виде прогрессирующего утолщения костей конечностей, периоститы, полиневриты, системный оссифицирующий периостоз с мучительными суставными болями. Эти поражения не являются специфическими для первичной саркомы легких и наблюдаются при ряде других заболеваний. Причины таких системных расстройств окончательно не изучены. В настоящее время считается, что в их происхождении значительную роль играют опухолевая интоксикация, эндокринные нарушения, гипоксемия и некоторые другие факторы. Изменения в периферической крови могут отсутствовать или носят неспецифический характер. У таких пациентов могут отмечаться незначительный лейкоцитоз, повышенная СОЭ, анемия.
Саркома костной ткани Остеогенная саркома возникает чаще в период роста костей, в возрасте до 15 лет, реже в более позднем возрасте. Выделяют остеобластическую, хондробластическую и фибробластическую саркому. Клинические симптомы развиваются быстро: боль, затруднение движений, анемия (см.). Характерным лабораторным признаком является повышение щелочной фосфатазы. При рентгенографии обнаруживают поражение метафиза длинных трубчатых костей и костей таза (97 % случаев), реже опухоль локализуется в других отделах. Предопухолевые заболевания (болезнь Педжета, остеомиелит и др.) предшествуют остеогенной саркоме у 5 % больных. Диагноз остеогенной саркомы, установленный при рентгенографии костей, следует подтвердить путем биопсии опухоли. Остеогенная саркома имеет значительную склонность к метастазированию в легкие (70–90 % случаев); метастазы развиваются быстро, в течение первого года после установления диагноза. Раннему выявлению метастазов содействует рентгенотомография и компьютерная томография легких. Ранний диагноз болезни приводит к уменьшению объема операции и при дополнительной химиотерапии обеспечивает высокий шанс на излечение. Паростальная саркома отличается медленным ростом, метастазы возникают редко. Заболевают в возрасте 30–40 лет. Чаще поражается дистальный метафиз бедра. После операции выздоравливает 70–80 % больных. При недостаточно радикальной операции возможен рецидив заболевания. Хондросаркома возникает в возрасте 30–50 лет в костях таза, проксимальном отделе бедра, ребрах, плечевой кости. Растет медленно, достигает больших размеров. При этом боль отмечается не всегда, как и ограничение движений. Метастазы в легкие возникают на поздних этапах болезни. Более характерно появление рецидивов. После радикальной операции выздоравливают 50 % больных. Злокачественная гигантоклеточная опухоль возникает из доброкачественной (частота 10–20 %). Поражает эпифизы длинных трубчатых костей. Хирургическое лечение высокоэффективно. Метастазы в легкие редки, при этом может быть также использован хирургический метод. При локализации опухоли в крестце и костях таза проводят лучевую терапию, излечение при этом достигается реже. Саркома Юинга составляет 15–20 % злокачественных опухолей скелета. Возникает в возрасте до 25 лет. Поражает преимущественно диафизы длинных трубчатых костей, дает метастазы в другие кости и легкие. Клинические симптомы ярко выражены: острая боль, лихорадка, потеря массы тела, лейкоцитоз, анемия. На рентгенограммах видны литическая деструкция и реактивное костеобразование. Лучевая терапия имеет основное значение при лечении первичной опухоли, операция используется при противопоказаниях к лучевой терапии, неполном эффекте и рецидиве. Между тем лучевая терапия даже в комбинации с операцией, а тем более без нее, излечивает не более 20 % больных, поскольку основной проблемой является образование отдаленных метастазов. Поэтому лечение всегда должно включать химиотерапию, что увеличивает выживаемость больных до 70 %. Химиотерапевтические режимы включают адриамицин, дактиномицин, винкристин и циклофосфан. При метастазах в легкие дополнительно может быть применена лучевая терапия. Фибросаркома — редкий вариант костной саркомы. После операции 5-летняя выживаемость составляет 15–40 % (в зависимости от анаплазии опухоли). Хордома — костная саркома эмбрионального происхождения. Возникает в возрасте 40–60 лет, в основном в конечных отделах позвоночника. Растет медленно, сдавливает нервные корешки и спинной мозг. Метастазирует поздно и редко. После операции возможно появление рецидива опухоли. Адамантинома появляется обычно в большеберцовой кости (90 %) у больных старше 30 лет, растет медленно. Операция часто приводит к излечению больных. Первичные злокачественные костные опухоли необходимо дифференцировать с доброкачественными (остеоид-остеома, гигантоклеточная опухоль, остеома, хондробластома, гемангиома (см.) и др.), неопухолевыми процессами (гиперпаратиреоидизм, болезнь Педжета (см.), фиброзная дисплазия, кисты костей, гистиоцитоз и др.), метастазами других опухолей. Тщательный анализ рентгенограмм костей и биопсия имеют ведущее значение в диагностике.
Диагностика При постановке диагноза важна беседа врача с больным. Врач обращает внимание на изменение клинических симптомов при хронических заболеваниях, задает некоторые специфические вопросы. Врачебный осмотр может быть и предупредительным — для активного выявления симптомов и обследования. Значительную помощь оказывает в некоторых случаях регулярное самообследование людей (пальпация молочной железы, осмотр пигментных невусов и т. д.). Беседа и осмотр врача вносят начальную информацию в формулирование диагноза. Диагноз злокачественной опухоли всегда должен быть установлен с использованием цитологического и (или) гистологического исследования. Цитологическому исследованию подлежат материалы, полученные при пункции опухоли, отпечатки, смывы, центрифугаты жидкости и др. После пункции цитологические препараты немедленно фиксируют, а затем используют необходимые окраски. Важна роль цитологического анализа при раке молочной железы (предоперационная пункция опухоли), раке легкого (мокрота, материалы бронхоскопии, трансторакальной пункции), ранних стадиях рака желудка, пищевода, полости рта, влагалища и др. Следует подчеркнуть исключительно важное значение цитологического метода при раке Carcinoma in situ, когда возможности этого метода выше, чем гистологического. Роль цитологического исследования для ранней диагностики очевидна при раке шейки матки. Если каждой женщине регулярно проводить цитологическое исследование мазков, рак шейки матки может быть диагностирован в начальной стадии и излечен у 100 % больных. Гистологический метод дает наиболее полное представление о заболевании. Материал для исследования получают при биопсии и после удаления опухоли. Устанавливают морфологический тип и вариант опухоли, степень инвазии, уровень дифференцировки, сопутствующие тканевые реакции и т. д. Углубленное исследование (электронная микроскопия, иммуноморфологические и гистохимические методы) дает возможность углубить характеристику опухоли. Эндоскопические методы исследования важны для диагностики некоторых опухолей, а также при выяснении степени их распространения. Применяют эндоскопический осмотр носоглотки, гортани, трахеи и бронхов, пищевода, желудка, двенадцатиперстной кишки, толстой и прямой кишки, мочевого пузыря, плевральной и брюшной полости и т. д. Рентгенологические методы сохраняют важное значение при диагностике опухолевых заболеваний молочной железы, легкого, почки, желудочно-кишечного тракта и др. В последние годы с успехом используется компьютерная томография. Ее информативность велика при обнаружении опухоли небольшого размера в щитовидной железе, почке, печени, легком, поджелудочной железе и др. Меньшее диагностическое значение компьютерная томография имеет при раке желудка, кишечника и некоторых других опухолях. Во время исследования может быть выполнена прицельная пункция опухоли. Ультразвуковая томография — высокоинформативный метод исследования; применяется для диагностики опухолей органов брюшной полости и забрюшинного пространства, мягких тканей туловища и т. д. Во время исследования также может быть выполнена прицельная пункция опухоли. Радионуклидные методы весьма перспективны (имеется в виду создание опухолеспецифических меченых антител). В настоящее время для диагностики применяют сцинтиграфию костей скелета, мозга, легких; для характеристики функционального состояния — сцинтиграфию почек и печени. Биохимические методы исследования дают полезную информацию при обследовании онкологических больных. Специфических биохимических изменений в организме онкологических больных не установлено. При некоторых опухолях выявляются некоторые изменения: при диссеминированном раке предстательный железы высокий уровень кислой фосфатазы установлен у 75 % больных (однако при локализованном раке эта величина ниже 20 %); при раке поджелудочной железы — увеличение амилазы (25 %), при раке печени — увеличение печеночной фракции щелочной фосфатазы. Большое практическое значение имеет обнаружение высокого уровня k-фетопротеина при раке печени, яичка, различных тератокарциномах; карциноэмбрионального антигена — при раке толстой кишки; хорионического гонадотропина — при хорионэпителиоме матки и яичка. Биохимические тесты могут обнаружить эндокринную секрецию опухоли и объяснить многие клинические синдромы, обусловленные тканеспецифической или паранеопластической эндокринной активностью. Выявляется высокий уровень АКТГ, антидиуретического, паратиреоидного, тиреостимулирующего, фолликулостимулирующего, лютеотропного и меланостимулирующего гормонов, эритропоэтина, кортизола, адреналина, норадреналина, инсулина, гастрина, серотонина и т. д. Биохимические методы позволяют выяснить содержание рецепторов некоторых гормонов в опухолевой ткани (эстрадиол, прогестерон, тестостерон, кортикостероиды). Такой анализ производят при биопсии или удалении опухоли с быстрым замораживанием ткани; результат исследования полезен при выработке лечебной тактики (например, при раке молочной железы и др.). Перечисленные методы диагностики злокачественных опухолей наиболее информативны в том случае, если применяются в рациональном сочетании. В результате обследования устанавливают обоснованный диагноз злокачественной опухоли и классифицируют болезнь по международной классификации TNM (Т — размер первичной опухоли, N — состояние регионарных лимфатических узлов, М — отсутствие или наличие отдаленных метастазов). После операции классификация болезни уточняется. Для большинства опухолей разработаны соответствующие критерии TNM.
Лечение При лечении больных со злокачественными опухолями возникают многообразные проблемы, решение которых требует участия не только онкологов, но и квалифицированных врачей других специальностей, которые должны четко представлять себе особенности основных лечебных методов, применяемых в онкологии, и возможности последующей реабилитации больных. Основные методы лечения: хирургическое вмешательство, лучевая терапия, химиотерапия, биотерапия. Радикальная операция выполняется в основном в ранних стадиях заболевания, а также при местно распространенной опухоли после предшествующей эффективной лучевой или химиотерапии. Паллиативная операция направлена на сокращение массы опухоли, что повышает эффективность терапевтических воздействий. Такие операции существенно облегчают состояние больных (например, при кишечной непроходимости (см.), кровотечении (см.) и т. д.). Вариантом хирургического лечения может стать криогенная деструкция опухоли, выполняемая в качестве радикального или паллиативного воздействия. Лучевую терапию применяют при чувствительных к лучевому воздействию опухолях (мелкоклеточный рак легкого, рак молочной железы, носоглотки, гортани, другие опухоли головы и шеи, саркома Юинга, рак шейки матки и др.) самостоятельно или в сочетании с операцией и химиотерапией. Используют различные методы лучевой терапии (дистанционную гамма-терапию, внутриполостную лучевую терапию, нейтроны, протоны, радиоактивные изотопы и т. д.). Химиотерапия в настоящее время становится важнейшим методом лечения при злокачественных опухолях. Химиотерапию назначают для уменьшения массы опухоли при неоперабельной опухоли, после операции для предупреждения развития метастазов (адъювантная химиотерапия) или при наличии метастазов. В последнее время применяют также химиотерапию при операбельных опухолях с последующим продолжением лечения (при учете чувствительности) после операции (неоадъювантная химиотерапия). При некоторых заболеваниях современная химиотерапия, являясь основным компонентом лечения, обеспечивает излечение значительного числа больных (злокачественные семиномные и несеминомные опухоли яичка, хорионэпителиома матки, локализованные формы остеогенной саркомы, рак молочной железы, саркома Юинга, нефробластомы у детей и др.). Чаще химиотерапия приводит к полной или частичной регрессии опухоли с различной длительностью ремиссии (диссеминированный рак молочной железы, яичника, меланома (см.), мелкоклеточный рак легкого и др.), что увеличивает продолжительность жизни больных и уменьшает клинические проявления заболевания. Химиотерапия используется также при раке желудка, толстой кишки, предстательной железы, мочевого пузыря, почки и т. д. В современной клинической химиотерапии применяют различные противоопухолевые препараты (антиметаболиты, антибиотики, алкилирующие и некоторые другие). Противоопухолевые препараты применяют самостоятельно или в составе лекарственных комбинаций, что позволяет достичь наибольшей эффективности лечения. В основе химиотерапии лежит различие в ответе нормальных и опухолевых клеток на цитостатическое воздействие. Наиболее значительные успехи химиотерапии отмечаются при чувствительных опухолях небольших размеров, масса которых быстро увеличивается и обладает наибольшей чувствительностью к препарату. В дальнейшем в крупных опухолевых узлах время удвоения опухоли возрастает, падает фракция роста, снижается эффективность химиотерапии. Важное значение имеют и другие биологические характеристики опухоли, особенности фармакокинетики препаратов и др. Наибольшая эффективность противоопухолевых препаратов достигается путем их применения в рациональных комбинациях. Сведения о синергизме лекарств получают в результате предклинических исследований. При различных злокачественных опухолях человека существуют рекомендации по наиболее эффективной химиотерапии — так называемой химиотерапии первой линии, а также для дальнейшего лечения при недостаточном эффекте (вторая и третья линии). Актуален вопрос о рациональных режимах лечения. Принцип достижения максимального лечебного эффекта в короткий срок разделяется большинством онкологов. Лекарственная резистентность опухоли — труднейшая проблема современной химиотерапии, и нерациональное лечение больных углубляет ее. Среди причин резистентности опухоли отмечают активацию гена множественной лекарственной устойчивости, недостаточное поступление препарата в клетку, недостаточную его активацию, интенсификацию инактивации, увеличенную концентрацию связывающего фермента, возникновение альтернативных путей метаболизма, быстрое восстановление после повреждения и др. Рациональная химиотерапия предполагает применение различных режимов в зависимости от лечебной задачи. Лечебный режим может быть интенсивным, вызывающим значительные побочные эффекты, умеренно токсичным или просто нетоксичным. Обязательным считается проведение повторных курсов. Интервалы между курсами определяются задачей лечения и характеристикой побочного действия препаратов. Лечебное действие противоопухолевых препаратов оценивают после каждого курса лечения, обычно спустя 2–4 недели. При измеряемых опухолях пользуются сантиметром или циркулем для определения наибольшего диаметра и максимального второго диаметра, перпендикулярного первому. Эти данные сравнивают до и после лечения. При наличии множественных очагов выбирают для наблюдения 3–5 очагов, различных по размеру. При метастазах в легкие делают рентгенограммы, тщательно описывают локализацию и размеры опухоли. При некоторых опухолях важное значение имеют ультразвуковая и компьютерная томография, ангиография, другие рентгенологические методы, определение опухолевых маркеров. Регистрируются также проявления нечетко измеряемых и неизмеряемых опухолей. Важно подчеркнуть необходимость тщательного описания всех выявленных признаков болезни до и после лечения. Полная регрессия — исчезновение всех проявлений заболевания; значительная частичная регрессия — уменьшение размеров опухолевых очагов более чем на 50 %; незначительное объективное улучшение — уменьшение размеров опухоли на 25–49 %. Стабилизация болезни — длительное (на срок до 6 месяцев) отсутствие динамики, связанное с проводимой химиотерапией. Практические врачи должны также знать побочное действиецитостатических препаратов. Введение максимальных лечебных доз препаратов, т. е. лечебная тактика, предполагает развитие побочных эффектов различной степени. Они могут наблюдаться непосредственно (тошнота, рвота, аллергические реакции и т. д.), в ближайшие сроки (лейкопения, тромбоцитопения, диарея, стоматит и др.) или в отдаленном периоде как результат длительного применения препаратов (нефро-, кардио-, нейро-, ототоксичность и др.). Побочные эффекты следует тщательно регистрировать, что имеет значение при планировании дальнейшей химиотерапии. Кроме цитостатических препаратов, химиотерапия включает применение эндокринных лекарственных средств. Чаще их применяют при гормонозависимых опухолях (рак молочной железы, щитовидной железы, эндометрия, предстательной железы и др.). Рациональная терапия предполагает предварительный анализ содержания рецепторов эстрогенов, прогестерона, андрогенов в ткани опухоли. Рецепторы определяются в удаленной опухоли или при биопсии. Обычно первичная опухоль и множественные ее метастазы имеют сходные характеристики по уровням рецепторов гормонов. Применяют антиэстрогены, андрогены, кортикостероиды, прогестины — при раке молочной железы и раке эндометрия; эстрогены — при раке предстательной железы и т. д. Повышение эффективности лечения достигается удалением гормональных желез (яичников, яичек), выключением функции гипофиза (облучение, удаление, назначение рилизинг-гормонов гипофиза). Эндокринная терапия может быть основным методом лечения (например, при раке молочной железы и тела матки в глубокой менопаузе при высоком уровне рецепторов эстрогенов и (или) прогестерона). Часто цитостатические и эндокринные препараты применяют совместно, что увеличивает эффективность лечения. Биотерапия включает применение различных природных, биологически активных агентов (интерфероны, интерлейкины и т. д.), проведение иммунотерапевтических мероприятий с использованием вакцин, активированных лимфоцитов, иммуномодулирующих фармакологических препаратов и т. д. Это новая перспективная область медицины, развитие которой тесно связано с совершенствованием тестирования иммунологических реакций у человека, получением рекомбинантных и принципиально новых фармацевтических препаратов, а также с достижениями экспериментальной иммунологии. Применение биотерапии в онкологической практике только начинается. Введены в практику Т-активин и реаферон. Предстоит накопление научных сведений и более значительного практического опыта для выяснения роли биотерапевтических воздействий в общей системе современного лечения больных со злокачественными опухолями. Комплексный подход с использованием лучевого лечения и адъювантной химиотерапии привел к улучшению отдаленных результатов лечения. 5-летнего выздоровления удается достичь у 70–80 % больных саркомами мягких тканей и конечностей и у 50–75 % больных с опухолями, располагающимися на туловище.
СЕБОРЕЯ
ОпределениеСеборея — нарушение функции сальных желез, характеризующееся преимущественно усиленным выделением неполноценного кожного сала, что способствует снижению устойчивости кожи к микробной флоре и способствует развитию вторичной инфекции.Стафилококки и угревые бактерии вызывают острую воспалительную реакцию, которая проявляется угревой сыпью, атеромой (киста сальных желез), заболеванием волос. Различают жирную, сухую и смешанные формы себореи.
Этиология и патогенез Этиология болезни изучена плохо. Причиной себореи, по-видимому, являются функциональные нервные и эндокринные нарушения, возникающие в период полового созревания. Чаще всего себорея развивается в возрасте от 17 до 24 лет. Течение себореи осложняют заболевания желудочно-кишечного тракта (гастрит (см.), язвенная болезнь желудка и двенадцатиперстной кишки (см.), хронический колит (см.)), хронические очаги инфекции (хронический тонзиллит (см.), гайморит (см.), кариозные зубы), гиповитаминозы (особенно А и С), а также загрязнение кожи. Функциональные нейроэндокринные нарушения, в частности вегетативная дистония, играют заметную роль в патогенезе себореи. Эндокринные сдвиги выражаются в нарушении соотношения между андрогенами и эстрогенами (повышение уровня андрогенов при снижении эстрогенов). Возможно, нейроэндокринные нарушения при себорее обусловлены первичной гипоталамической или корковой патологией, так как явления себореи обычно резко выражены при энцефалитах (см.), болезни Паркинсона (см.), диэнцефальных расстройствах. Себорея усиливается от острой, соленой и сладкой пищи. Однако количественная и качественная характеристики кожного сала зависят также от состояния нервной и пищеварительной систем, характера питания, сопутствующих заболеваний. При себорее подавляются бактерицидные свойства сального секрета. Он скапливается в протоках сальных желез и на поверхности кожи, создавая условия для развития пиококковой инфекции, что проявляется образованием угрей (см.); этому способствует также неправильный уход за кожей.
Клиническая картина Себорея может развиться на любом участке кожи, где имеются сальные железы, но обычно она возникает там, где сальных желез особенно много и где они имеют наибольшую величину: на волосистой части головы, лице, груди и спине. Себорея особенно часто встречается в пубертатном периоде. Проявления себореи достаточно четко характеризуются термином «сальная кожа»: пораженные участки представляются влажными, сальными, имеют характерный блеск. Поры сальных желез расширены, нередко закупорены темными пробками (комедоны, «черные угри»). Кожа часто утолщается, приобретает грязновато-серый оттенок. Все это придает коже сходство с апельсинной или лимонной коркой. Волосы сальные, отмечается себорейная алопеция (см.). Нередко возникают сальные кисты в виде мелких желтовато-белых узелков (милиумы, «белые угри»). В зависимости от преобладания тех или иных симптомов различают жидкую (жирную) и густую (сухую) себорею. Себорея часто осложняется перхотью и вульгарными угрями. Перхоть — диффузное шелушение кожи волосистой части головы, обычно не сопровождающееся воспалительными явлениями. Возникновение перхоти обусловлено активацией сапрофитирующей здесь бактериальной флоры, внедряющейся в эпидермис и нарушающей его ороговение. Клиническая картина представлена очаговым или диффузным шелушением волосистой части головы, преимущественно в теменной области. Беловато-желтые сухие чешуйки, напоминающие волокна асбеста, склеивают волосы в пучки, охватывая их корни в виде муфты или чехла, что особенно хорошо выявляется при выдергивании волоса, скапливаются в виде толстых пластов, плотно прилегающих к слегка гиперемированной сухой коже. При зуде и расчесах кожа начинает мокнуть. Волосы сухие и как бы посыпаны пудрой; с течением времени может наступить их поредение. Дерматоз (см.) развивается преимущественно у детей и подростков, чаще у девочек. Течение хроническое и рецидивирующее, прогноз благоприятный. Дифференциальный диагноз проводится с микозами (см.), псориазом (см.), экземой (см.), ограниченным нейродермитом (см.). Жирная себорея локализуется на лбу, крыльях носа, подбородке, волосистой части головы. Пораженные участки как бы смазаны жидким маслом, волосы жирные и блестящие, пропитываются кожным салом уже на 2—3-й день после их мытья. Появляется зуд кожи головы, затем начинается выпадение волос, вначале малозаметное, а в дальнейшем способное привести к облысению. Сухая себорея встречается несколько реже, чем жирная. Поражает преимущественно волосистый покров головы, бороду, усы, брови, ресницы. Кончики волос обламываются, появляется перхоть, волосы приобретают из-за нее вид напудренных. Кожа лица сухая, шелушится, после умывания мылом появляется неприятное ощущение ее стягивания. Часто себорея приводит к появлению себорейных дерматитов (см.) и экзем (см.), а также угревой сыпи. Выделяют несколько видов угрей. Медикаментозные угри встречаются у лиц, не переносящих то или иное лекарство. Профессиональные угри возникают при контакте с углем, продуктами нефтехимических производств, цементом, смазочными маслами, керосином и ацетоном. Юношеские угри — самые распространенные, связаны с периодом полового созревания.
Себорейный кератоз
Диагностика и дифдиагностика Диагноз основывается на клинической картине. Дифференцируют себорею с псориазом (см.), алопецией (см.) гнездной и сифилитической. Нужно также исключить дисбактериоз (см.), сахарный диабет (см.), гормональные нарушения, патологию щитовидной железы, заболевания желудочно-кишечного тракта.
Лечение Для нормализации функции вегетативной нервной системы рекомендуются препараты кальция, бромкамфора, беллоид, белласпон, транквилизаторы. Предусматривается также нормализация функции желудочно-кишечного тракта (панзинорм форте, вигератин, липоболит, холензим и др.), назначается диета, лишенная грубых жиров, с ограничением углеводов, поваренной соли, холестеринсодержащих продуктов. Показано вегетарианское питание с обилием овощей, салатов, винегретов с растительным маслом, фруктов. Проводится терапия очагов хронической инфекции — тонзиллита, гайморита и т. д. Рекомендуется курс (2–3 месяца) витамина А по 100 000 ME в сутки внутрь ежедневно или внутримышечно через день. Показаны витамины группы В, С, D, Е, а также препараты серы, мышьяка, железа, фосфора и др. Полезны регулярные занятия физкультурой, прогулки, достаточный сон. При тяжелом течении жирной себореи проводится (под контролем эндокринолога) лечение женскими половыми гормонами и их синтетическими аналогами. Местное лечение сводится к правильному уходу за кожей. При жирной себорее лечение начинают с ее протирания водными 1–2 %-ными растворами натрия тиосульфата, натрия тетрабората или натрия гидрокарбоната, 3–5 %-ными растворами серы очищенной. По мере стихания острых явлений переходят на спиртовые растворы с настойкой валерианы, ландыша, боярышника, танином, резорцином, салициловой и борной кислотами. При резко выраженном салоотделении следует часто мыть кожу с мылом, протирать ее камфорным и салициловым спиртом, припудривать лицо тальком, окисью цинка или пудрой с серой, борной кислотой, жжеными квасцами. Выраженный эффект у женщин можно получить, используя наружные средства, содержащие эстрогены (женские половые гормоны). Применять эти препараты надо через 2 дня после окончания менструации и заканчивать за неделю до наступления следующей. Мужчины наружные эстрогенные средства применяют длительно, в течение 6–8 недель. Местное лечение сухой себореи предусматривает обтирание кожи 1 %-ным водным раствором соляной или уксусной кислоты, натрия тетрабората и натрия гидрокарбоната, 70 %-ным спиртовым раствором салициловой, борной или лимонной кислоты; смазывание взбалтываемыми взвесями с серой и ихтиолом. После исчезновения острых явлений назначают отшелушивающие и разрешающие препараты, способствующие отделению комедонов. Весьма полезны при сухой себорее кремы с витаминами А, Е, F (типа «Люкс» и «Янтарь»), с лечебными травами, а также фурацилином, серой и борной кислотой (типа «Маска»). Благоприятное влияние оказывают препараты, содержащие сульфид селена (сульсеновое мыло и др.). Парфюмерной промышленностью выпускается шампунь от перхоти «Себорин». С целью профилактики рекомендуется уничтожить головные щетки и расчески, которыми пользовался больной, сменить головной убор. При смешанной форме себореи комбинируют наружные лекарственные средства, указанные выше, т. е. мази и спиртовые растворы. Временное улучшение дает втирание нафталанной пасты со спиртом, а также препаратов, содержащих сульсен. При себорее волосистой части головы, перхоти (жирной или сухой) рекомендуется применять специальные шампуни и моющие средства: «Себорин», сульсеновую пасту, дегтярное мыло, шампунь и крем «Особый» и др. Однако в ряде случаев хороший эффект дает известное средство — луковый сок, разведенный водой в соотношении 1: 1 и втираемый 1 раз в течение 2–5 дней за 1–2 ч до мытья волос. После мытья волосы обязательно ополаскивают отварами трав, содержащих кремний и серу, — полевого хвоща, крапивы, корня лопуха. Аутогемотерапия, иммунокорригирующие препараты, анатоксины или антифагины и другие подобные препараты принимаются по назначению врача-дерматолога или терапевта. Себорейный дерматит и себорейная экзема также требуют консультации специалиста. До осмотра дерматологом можно рекомендовать пациенту следующее: — исключить из еды сладости, макароны, белый хлеб, жирную, жареную, острую пищу и консервы; — употреблять пивные дрожжи — принимать их по 1–2 ст. л. до еды 2–3 раза в день; — очищать кожу специальными лосьонами традиционных прописей: молоко Видаля, ОХУ-5 (10) или косметические лосьоны типа «Огуречный» и др.; — обрабатывать кожу противовоспалительными мазями: гентамициновой, линкомициновой, гелиомициновой или пиолизином. Мазь наносится на места поражения угревой сыпью после очищения кожи; — из современных средств можно рекомендовать «Зинерит» и «Скинорен», хотя их относительно высокая стоимость ограничивает применение. Проводится лечение заболеваний желудочно-кишечного тракта, санация очагов хронической инфекции. Прогноз у больных себореей, как правило, благоприятный. Регулярное общее и местное лечение, лечебная физкультура, сбалансированное питание и физиотерапия (УФО, токи д’Арсонваля, паровые ванны, сероводородные орошения, массаж) способствуют нормализации состояния кожи. Необходимо соблюдать личную гигиену, закаливать организм, предупреждать загрязнение кожи. Санаторно-курортное лечение показано в санаториях, специализирующихся на лечении кожных заболеваний.
СЕМИНОМА
ОпределениеСеминома (опухоли яичка) — злокачественная опухоль, которая развивается в тканях яичка.
Этиология, патогенез и патанатомия Яичко состоит из множества оболочек, которые образованы различными тканями. Из каждой ткани могут возникать опухоли (см.), чем и объясняется многообразие злокачественных опухолей яичка. Существует классификация опухолей яичка, которая включает три раздела — герминогенные опухоли, опухоли гонадной стромы и другие опухоли. Наиболее часто встречаются герминогенные опухоли (семинома, эмбриональная карцинома, хориокарцинома, опухоль желточного мешка, тератома (см.), смешанные опухоли), которые образуются из протоков, по которым сперматозоиды поступают от клеток, в которых образуются, в семявыносящие протоки, несущие сперму в мочеиспускательный канал. Среди герминогенных опухолей наиболее часто встречается семинома. Именно эта опухоль чаще всего регистрируется, и именно ей будет уделено далее основное внимание. Опухоли яичка составляют 3 % от всех злокачественных опухолей. Рак (см.) яичка чаще всего возникает у мужчин в возрасте 15–40 лет. Существует три пика частоты возникновения рака яичка: до 10 лет, в 20–40 лет и после 60 лет. Рак яичка составляет примерно 2 % всех новообразований у мужчин. Это одна из самых «молодых» опухолей. Факторы, предрасполагающие к возникновению опухолей: крипторхизм (см.), позднее низведение яичка (после 6 лет), травмы. Различают герминогенные опухоли (95 %), исходящие из семенного эпителия, и негерминогенные, исходящие из клеток, продуцирующих гормоны, и из стромы (5 %). Как уже упоминалось выше, более 90 % всех новообразований яичка составляют герминогенные опухоли, которые в целях удобства для клиники следует делить на семиномные и несеминомные. Для несеминомных опухолей важно отметить, являются ли они «чистыми», т. е. одного гистологического типа, или смешанными (более чем одного гистологического типа). В смешанной опухоли необходимо указать все ее компоненты в процентном соотношении для адекватного выбора лечения. Большинство герминогенных опухолей яичка поражают мужчин моложе 50 лет. У детей наиболее часто встречаются опухоль желточного мешка и зрелая тератома (см.), в основном в чистом виде. Эмбриональный рак (см.) чаще поражает молодых мужчин в возрасте 20–25 лет, пик обнаружения семиномы приходится на 30–35 лет. Встречающаяся в этом возрасте опухоль желточного мешка всегда комбинируется с элементами других герминогенных опухолей яичка. Редко обнаруживаемая у молодых мужчин сперматоцитная семинома поражает пациентов старше 40 лет. После 50 лет падает частота возникновения герминогенных опухолей яичка, уступая место опухолям негерминогенного происхождения. Герминогенные опухоли в основном возникают в одном яичке, билатеральное поражение характерно для сперматоцитной семиномы. Этиология злокачественных опухолей яичка в своей основе заключает различные гормональные нарушения в сторону гиперэстрогенизации. Подтверждением этому служат факты резкого увеличения заболеваемости у лиц с крипторхизмом (см.), гипоплазией (см.) и эктопией яичка, после травм и воспалительных процессов после орхиэктомии, а также у детей, матери которых во время беременности принимали эстрогены. Исследователи из США и Нидерландов (2002 г.) идентифицировали ген, имеющий непосредственное отношение к возникновению злокачественных опухолей мужских репродуктивных органов. Чрезмерная активность этого гена резко увеличивает вероятность образования семиномы, одной из разновидностей рака яичка. Профессор цитологии университета Дьюка Хайфан Лин и его коллеги обнаружили этот ген в двенадцатой хромосоме человека еще пять лет назад, однако им потребовалось немало времени, чтобы прояснить связь между его работой и раком тестикул. Следует различать герминогенные опухоли, развивающиеся из семенного эпителия, которые составляют 95 % всех злокачественных новообразований яичка, и негерминогенные, исходящие из стромы. К первым относятся семиномы (42–43 %), тератобластомы, эмбриональный рак и хорионэндотелиомы, а также смешанные формы. Ко вторым следует причислить злокачественную лейдигому, сертолиому, эмбриональную саркому (см.), рабдомиосаркому, миксофибросаркому, ретикулосаркому. Опухоли яичка относительно быстро метастазируют. Метастазирование протекает как лимфогенным, так и гематогенным путем. Регионарными лимфатическими узлами являются как параортальные (паракавальные), так и внутритазовые и паховые. Опухоли из герминальных клеток дают метастазы в печень или кости.
Клиническая картина На первых порах, кроме увеличения или уплотнения яичка, опухоль, как правило, ничем себя не проявляет. С увеличением опухоли появляются боли, чувство тяжести в яичке или внизу живота. При крипторхизме (см.) иногда единственным симптомом может быть появление опухоли в области живота. Иногда преобладают общие симптомы, характеризующиеся гормональными расстройствами (гинекомастия, локальный гермафродитизм (см.), снижение либидо и потенции, преждевременное половое созревание у детей и т. д.). Основная симптоматика связана с метастазированием в забрюшинные лимфатические узлы (у больных возникает мучительная боль в пояснице) и легкие, что приводит к появлению кашля и кровохарканья. Нередко наблюдается гинекомастия. При биохимическом исследовании крови при несеминомных опухолях обнаруживают альфафетопротеин. При хорионэпителиоме яичка в моче повышается содержание хорионического гонадотропина. Внутривенная урография, ультразвуковое исследование забрюшинного пространства, компьютерная томография и ангиография позволяют установить наличие метастазов в забрюшинном пространстве.
Диагностика и дифдиагностика Диагностика опухолей яичка не представляет больших трудностей и основана на пальпации и пункционной биопсии. Уточняющая диагностика направлена на выявление метастазов и включает в себя прямую лимфографию и лимфосканирование, экскреторную урографию, венокаваграфию, УЗИ и компьютерную томографию, а также томографию средостения. Если после тщательного обследования сомнения не разрешены, показана открытая биопсия на операционном столе.
Типичная семинома В сыворотке крови повышаются уровни плацентарной щелочной фосфатазы и лактатдегидрогеназы. Индикатором того, что в состав семиномы входят элементы синцитиотрофобласта, служит повышение в крови пациентов хорионического гонадотропина. Повышение уровня альфа-фетопротеина исключает «чистоту» семиномы. Очень важным в прогностическом отношении является повышение сывороточной нейрон-специфической энолазы, что бывает всегда при метастазировании семиномы. Макроскопическое исследование. Семинома представляет собой солидную опухоль в виде одного или нескольких, четко отграниченных от ткани яичка узлов, дольчатых и несколько выпуклых на разрезе. Цвет опухоли — бело-серый. Кровоизлияния и некрозы не типичны и встречаются только в крупных опухолях. В среднем опухоль достигает 5 см, реже бывает до 10 см. Микроскопическое исследование. Семинома состоит из крупных (15–25 мкм), мономорфных, полигональной или округлой формы клеток с четкими контурами клеточной мембраны. В клетках центрально расположено округлой или овальной формы ядро, в котором обнаруживаются одно или два выступающих, эозинофильных ядрышка. Часты фигуры митозов. Цитоплазма клеток обильная, за счет высокого содержания гликогена и липидов — светлая эозинофильная. В 10–20 % случаев обнаруживаются гигантские многоядерные клетки синцитиотрофобласта. Опухолевые клетки семиномы образуют пласты, разделенные прослойками стромы, которая нередко гиалинизирована. Строма опухоли диффузно инфильтрирована лимфоцитами, плазматическими клетками и гистиоцитами. Наблюдается воспалительная инфильтрация разной степени выраженности вплоть до образования лимфоидных фолликулов. Характерным для семиномы является наличие гранулематозной реакции стромы, т. е. пролиферация лимфоцитов, гистиоцитов, гигантских многоядерных клеток типа инородных тел и типа Лангганса. В некоторых случаях наблюдается фиброз стромы опухоли с кальцификацией и оссификацией. Окрашивание клеток семиномы PAS демонстрирует наличие гликогена в опухолевых клетках. Анапластический вариант семиномы составляет 5—15 % всех семином. Внешне опухоль ничем не отличается от типичной семиномы. При микроскопическом исследовании характеризуется повышенной митотической активностью (3 и более митозов в поле зрения) и ядерным полиморфизмом. Анапластический вариант семиномы отличается более агрессивным течением, хотя в этом отношении нет единого мнения. Иммуногистохимическое исследование. При проведении иммуногистохимического исследования (ИГХ) на обнаружение PLAP регистрируется мембранозное окрашивание клеток опухоли. Клетки семиномы NSE-позитивные. При наличии в семиноме гигантских клеток синцитиотрофобласта возможна положительная ИГХ-реакция на HCG и виментин, в некоторых случаях в опухолевых клетках семиномы удается обнаружить цитоплазматическое накопление HCG, LDH и FER. AFP и цитокератины не экспрессируются семиномой, в то время как ИГХ-реакция на виментин всегда положительна. Дифференциальную диагностику семиномы следует проводить с лимфомой (см.), эмбриональным раком (см.), опухолью желточного мешка, хориокарциномой, гранулематозным орхитом (см.), опухолью из клеток Сертоли и сперматоцитной семиномой. При лимфоме опухолевые клетки обладают более выраженным клеточным и ядерным полиморфизмом, чем опухолевые клетки семиномы, они меньше по размеру, с гиперхромными ядрами. Опухолевые клетки лимфомы инфильтрируют ткань яичка вокруг семенных канальцев. Отсутствуют пролиферация злокачественных клеток внутри канальцев, лимфоидно-клеточная инфильтрация и гранулематозная реакция стромы. При лимфоме в патологический процесс быстрее и чаще вовлекаются оболочки и придаток яичка, чем при семиноме. Проведение ИГХ-реакций и обнаружение PLAP и LCA (общего лейкоцитарного антигена) незаменимы при проведении дифференциальной диагностики семиномы с лимфомой. Эмбриональный рак (см.) в отличие от семиномы чаще поражает более молодых мужчин. Опухолевые клетки эмбрионального рака и их ядра характеризуются большим полиморфизмом, более высокой митотической активностью, чем опухолевые клетки семиномы, они образуют папиллярные структуры, не свойственные семиноме. При проведении ИГХ-исследований находят, что клетки эмбрионального рака экспрессируют цитокератины и Ki-1-антиген, что не характерно для семиномы. Сперматоцитная семинома поражает мужчин старше 50 лет и характеризуется наличием трех типов клеток. В опухоли отсутствуют лимфоидно-клеточная инфильтрация и гранулематозная реакция стромы. При гранулематозном орхите наблюдается разрушение семенных канальцев и отсутствует ИГН. PLAP не экспрессируется в пораженном яичке. При дифференциальной диагностике опухоли из клеток Сертоли и семиномы помогает использование ИГХ-исследования экспрессии PLAP, которая отсутствует в опухоли из клеток Сертоли. Семинома хорошо поддается химиотерапии и чувствительна к лучевой терапии. Наиболее значимым прогностическим фактором является клиническая стадия заболевания. Пятилетняя выживаемость больных семиномой яичка составляет при I стадии болезни 99 %, при II — 89 %, при III — 70–85 %. Размер опухоли коррелирует с возможностью рецидивирования.
Сперматоцитная семинома Сперматоцитная семинома является редкой опухолью, она составляет 3–7 % всех семином. Впервые была описана в 1946 г. Массоном. В свое время он утверждал, что типичная семинома происходит из недифференцированных герминогенных клеток, а сперматоцитная семинома развивается из более зрелых клеток, участвующих в сперматогенезе, и поэтому является наиболее дифференцированной опухолью среди герминогенных новообразований. Как правило, сперматоцитная семинома является «чистой» опухолью, однако изредка встречается опухоль с саркоматоидной дифференцировкой. Развивается сперматоцитная семинома у мужчин старше 50 лет, протекает бессимптомно и сопровождается только увеличением размеров яичка. В 10 % случаев опухоль бывает билатеральной в отличие от типичной семиномы яичка. Среди 150 имеющихся в мировой литературе наблюдений сперматоцитной семиномы только у одного больного зарегистрированы метастазы, а у 9 — саркоматоидная дифференцировка (5 из них умерли от метастазов). Эта опухоль не ассоциируется с крипторхизмом (см.) и ИГН. Макроскопическое исследование. Размеры опухоли могут варьировать от 3 до 15 см. На разрезе сперматоцитная семинома желтосерого цвета, мягко-эластической консистенции, отечная, с наличием кист и кровоизлияний, хорошо контурируется на фоне непораженной ткани яичка. В наблюдениях с саркоматоидной дифференцировкой опухоль имеет солидное строение, плотную консистенцию и темно-серый цвет. Микроскопическое исследование. При сперматоцитной семиноме наблюдается диффузная пролиферация полиморфных клеток трех типов. Опухоль часто распространяется внутрь семенных канальцев. Отсутствует выраженная фиброваскулярная строма, лимфоидно-клеточная инфильтрация и гранулематозная реакция не характерны. Гигантские клетки (50—100 мкм в диаметре) имеют несколько ядер и эозинофильную цитоплазму. Ядра их со спиралевидным хроматином, напоминают хроматин сперматоцитов первого порядка в мейозе. Клетки средних размеров (10–20 мкм) содержат круглые ядра с нежно-зернистым (реже спиралевидным) хроматином и эозинофильную цитоплазму. В мелких лимфоцитоподобных клетках (6–8 мкм) визуализируется гиперхромное ядро, окруженное полоской эозинофильной цитоплазмы. Характерный рисунок хроматина в ядрах больших и промежуточных клеток отличает сперматоцитную семиному от классической семиномы. Могут встречаться многочисленные митозы. В цитоплазме клеток опухоли отсутствует гликоген. Иммуногистохимическое исследование. Проведение ИГХ-реакций для обнаружения экспрессии в клетках сперматоцитной семиномы, PLAP, HCG, AFP и промежуточных филаментов дает отрицательные результаты. Хотя сперматоцитная семинома не похожа ни на одну из герминогенных опухолей яичка, ее иногда следует дифференцировать с высокодифференцированной саркомой, например с фибросаркомой или рабдомиосаркомой или с низкодифференцированной саркомой. В отличие от классической семиномы, злокачественной лимфомы и эмбрионального рака для сперматоцитной семиномы характерны три типа клеток, отсутствие гликогена в цитоплазме клеток при проведении PAS-окрашивания, отсутствие экспрессии PLAP и позднее развитие (после 50 лет). Наличие саркоматоидной дифференцировки в сперматоцитной семиноме делает ее высокоагрессивной. Этот тип сперматоцитной семиномы резистентен к химиотерапии. При сперматоцитной семиноме показана радикальная орхиэктомия, необязательно с ретроперитонеальной лимфаденэктомией. Классификация TNM Т — первичная опухоль. Классифицируется только после орхиэктомии. До операции применяется символ Тх. Послеоперационная классификация (постгистологическая) учитывает степень инвазии (рТ): — pTis — внутритубулярная карцинома (преинвазивный рак); — рТ1 — опухоль ограничена телом яичка, включая сеть; — рТ2 — опухоль распространяется на белочную оболочку или придаток; — рТ3 — опухоль распространяется на семенной канатик; — рТ4 — опухоль распространяется на мошонку; — рТх — недостаточно данных для оценки первичной опухоли. N — регионарные лимфатические узлы: — N0 — нет признаков поражения метастазами регионарных лимфатических узлов; — N1 — метастазы в одном лимфатическом узле до 2 см в наибольшем измерении; — N2 — метастазы в одном или нескольких лимфоузлах размером до 5 см в наибольшем измерении; — N3 — метастазы в лимфатических узлах размером более 5 см в наибольшем измерении. М — отдаленные метастазы: — M0 — нет признаков отдаленных метастазов; — М1 — наличие отдаленных метастазов; — Мх — недостаточно данных для определения отдаленных метастазов.
Лечение Лечение опухолей яичка должно быть основано на детальном клиническом обследовании и тщательном гистологическом изучении срезов удаленного препарата. Учитывая различные гистологические варианты опухолей яичка, адекватная терапия вырабатывается строго индивидуально. Первый этап лечения всех операбельных опухолей — хирургический (в объеме орхифуникулэктомии). При злокачественных опухолях яичка (семинома, рак) производят расширенную операцию — орхэктомию с удалением забрюшинных лимфатических узлов. Операцию производят в два этапа: I этап — удаление яичка, II этап — удаление забрюшинных лимфатических узлов. Дальнейшее успешное лечение зависит от гистологического варианта опухоли. Так, при семиномах, наиболее чувствительных к химиолучевому лечению, операция Шевассю-Грегуара не показана. Достаточно либо лучевого воздействия на пахово-подвздошные лимфатические узлы, либо адъювантных курсов химиотерапии каждые 3–4 месяца в течение 2 лет. Тропными препаратами являются сарколизин по 50 мг внутрь (или внутривенно) один раз в неделю до суммарной дозы 200–250 мг или циклофосфан по 400 мг внутривенно (или внутримышечно) через день до суммарной дозы 6–8 г. При несеминомых опухолях указанная химиотерапия малоэффективна. У больных с несеминомными герминогенными опухолями без отдаленных метастазов после орхифуникулэктомии должна производиться забрюшинная лимфаденэктомия от уровня ворот почек до подвздошных сосудов (операция Шевассю — Грегуара), Во II–IV стадии семиномных опухолей яичка проводится химиолучевое лечение. При одиночных метастазах предпочтение отдается лучевой терапии, при множественных — химиотерапии. В случае выраженного эффекта от лечения, но при наличии остаточной забрюшинной опухоли целесообразно произвести хирургическое ее удаление, а в послеоперационном периоде продолжить химиотерапию. При малой эффективности сарколизина и циклофосфана необходимо применять комбинацию нескольких препаратов, в частности винбластина, блеомицина, цисплатина. Лечение семином зависит от стадии процесса. I стадия — наличие опухоли только в яичке. На этой стадии болезни важнейшее значение имеет не только отсутствие клинических данных о наличии метастазов, но и нормализация уровня ХГ после выполнения ОФЭ. Стандартной тактикой на этой стадии заболевания считается проведение профилактической лучевой терапии на паховые лимфоузлы со стороны поражения и забрюшинные лимфоузлы в суммарной дозе 30 г. Дополнительное облучение медиастинальных лимфоузлов и надключичной области не улучшает отдаленные результаты лечения и не используется в настоящее время. При проведении профилактической лучевой терапии прогрессирование заболевания наблюдается у 5 % больных, которым необходимо проведение комбинированной химиотерапии с включением препаратов платины. II стадия — наличие метастазов в забрюшинных лимфоузлах. В этом случае тактика лечения зависит от размеров метастазов. При наличии метастазов менее 5 см в наибольшем измерении предпочтительнее проведение лучевой терапии на пахово-подвздошные лимфоузлы со стороны опухоли яичка и забрюшинное пространство до суммарной очаговой дозы 36–40 г. После проведения такого лечения частота рецидивов составляет около 5 %, а 5-летняя выживаемость — 90–97 %. При метастазах более 5 см (стадия IIС) эффективность лучевой терапии значительно снижается и частота рецидивов составляет 15–25 %. Таким больным предпочтительнее назначение химиотерапии, более детальное описание которой приводится ниже. III стадия — наличие метастазов в лимфоузлах выше диафрагмы и (или) в висцеральных органах. При таком распространении болезни, как и при наличии массивных метастазов только в забрюшинных лимфоузлах (стадия IIС), целесообразно проведение индукционной химиотерапии. Наиболее эффективными режимами для лечения семиномы являются комбинации ЕР и BEP. На этапе индукции проводят не менее 4 курсов лечения каждые 3 недели. Частота полных регрессий при этом составляет 70–85 %. У части больных, особенно с наличием крупных метастазов более 10 см, наблюдаются остаточные опухолевые массы. Хирургическое удаление их показало, что только у 10–15 % пациентов остаточная опухоль содержит жизнеспособные клетки семиномы, в остальных случаях выявляются лишь фиброзно-некротические ткани как следствие проведенной химиотерапии, которые в дальнейшем подвергаются рассасыванию. В связи с этим в настоящее время при достижении частичной регрессии после проведенной индукционной химиотерапии считается целесообразным наблюдение больного, а лучевую терапию на зоны оставшихся проявлений болезни проводят только в случае увеличения их размеров и (или) появления маркеров. Срок наблюдения больных семиномой должен составлять не менее 5 лет, так как при этом заболевании в 5—10 % случаев наблюдаются поздние рецидивы. Прогноз при семиномах I–II ст. после радикального лечения благоприятный (90–94 % 5-летней выживаемости), несеминомные опухоли в прогностическом отношении значительно хуже (20–40 % 5-летней выживаемости).
СЕННАЯ ЛИХОРАДКА
ОпределениеСенная лихорадка (поллиноз, пыльцевая аллергия) — заболевание, вызываемое пыльцой растений и возникающее у лиц с аллергической предрасположенностью в ответ на ингаляции пыльцевого аллергена, характеризующееся сезонностью клинических проявлений с преимущественным поражением дыхательных путей и слизистой оболочки глаз, иногда кожи, пищеварительной, нервной систем и сопровождающееся симптомами сезонного ринита (см.), конъюнктивита (см.), астматического бронхита (см.) и атопического дерматита (см.).В медицинской литературе можно встретить различные названия поллиноза: сенная лихорадка, весенний катар, сезонный ринит (см.) и конъюнктивит (см.), пыльцевая астма (см.) и др. Самоизлечения поллиноза, как правило, не наступает, поэтому во всех странах существует много методов лечения этого заболевания, которое применяют врачи, непрофессионалы, гомеопаты, народные целители и экстрасенсы. Хирургические, физиотерапевтические, психотерапевтические и другие методики малоэффективны и почти не отличаются от плацебо.
Эпидемиология Поллиноз относится к числу наиболее распространенных аллергических заболеваний людей любого возраста и пола. Важное влияние на эпидемиологию поллиноза оказывают климатогеографические особенности флоры региона. Среди детского населения поллиноз чаще встречается в возрасте от 6 до 14 лет, преобладают мальчики — 65 %. У детей поллиноз занимает от 26 до 36 % от всех аллергозов. В Англии поллиноз выявлен у 12 % детей, в Испании — у 5 %, в Чехии — у 13 %, в Туркменистане — у 25 %, в Восточной Сибири — у 5 % школьников, в Москве — у 3 %. На юге Казахстана поллиноз отмечен у 15 % детей, на севере республики — у 2 %. Во всех странах мира количество детей, больных поллинозом, увеличивается каждые 10 лет в среднем на 60 %. У взрослых поллиноз встречается чаще, чем у детей, и превалирует в возрасте от 18 до 40 лет, чаще болеют женщины. По данным эпидемиологических исследований, поллиноз в Финляндии выявлен у 14 % населения, в Англии — у 17 %, в Норвегии — у 12 %, в Швейцарии — у 10 %, в Италии — у 13 %, в Испании — у 23 %, в США — у 34 %. В России количество взрослых больных колеблется от 3 до 5 %; при этом в Ростове — 4,5 %, в Краснодаре — 6 %, в Саратове — 5 %, в Москве — 4 %, в Санкт-Петербурге — 3 %. В Казахстане количество больных в разных регионах различается: на юге в среднем —15 %, юго-западе — 18 %, в Алма-Ате — 13 %. Количество больных во всем мире каждые 10 лет удваивается. Клиницисты редко диагностируют поллиноз, поэтому число зарегистрированных официальной статистикой больных в 10 раз меньше истинной заболеваемости.
Этиология Поллиноз вызывает пыльца ветроопыляемых растений. Из многих тысяч распространенных во всем мире растений примерно 60 продуцируют пыльцу, которая вызывает поллиноз. Пыльца этих растений имеет чрезвычайно мелкие размеры — от 10 до 50 микрон, выделяется в огромных количествах и легко разносится ветром. Проникновению пыльцы через слизистую оболочку дыхательных путей и глаз способствует специальный содержащийся в ней фермент. Календарь цветения растений зависит от метеорологических условий (температура воздуха, осадки, ветер и др.). Немаловажную роль в возникновении заболевания играют плесневые грибы: пенициллинум, кладоспориум, альтернария, мукор и др. Споры грибов, вегетируя на пыльце, вызывают сенсибилизацию к ним. Осенью, когда в воздухе повышается их содержание, обострения поллиноза могут быть связаны с попаданием на слизистые спор грибов. Этиология поллиноза в каждой климатической зоне зависит от произрастающих растений. Так, в Японии чаще всего это пыльца кедра, в Казахстане — пыльца полыни, в России — пыльца луговых трав, в Испании — пыльца оливковых деревьев. Поллиноз у жителей промышленных городов встречается в 6 раз чаще, чем в сельской местности. Это подтверждает влияние загрязнения внешней среды поллютантами на частоту и распространение патологии. Установлено, что пики содержания пыльцы растений в воздухе совпадают с периодами обострений и ростом заболеваемости поллинозом среди жителей данного региона. Обычно отмечается три периода подъема содержания пыльцы в воздухе: весенний (цветение деревьев), летний (цветение луговых трав) и осенний (цветение сорных трав). Зная календарь цветения отдельных растений в данной местности и сравнивая его с началом заболевания, можно установить этиологию, т. е. «виновное» растение. В Казахстане развитие поллиноза связано с сенсибилизацией к пыльце деревьев (береза, карагач), луговых (овсяница, ежа, тимофеевка, мятлик) и сорных трав (полынь, лебеда, конопля). При этом важную роль играет также наследственность в связи с передачей от родителей конкретных генов, ответственных за формирование аллергического фенотипа. Если поллинозом болеет только мать — ген передается в 25 % случаев, если отец и мать — в 50 %. В некоторых случаях у больных поллинозом симптомы заболевания проявляются не только в период цветения растений, но регистрируются и зимой. Это связано с действием факторов риска (дым табака, запах красок, алкоголь, холод), которые влияют на слизистую оболочку носа в связи с ее гиперреактивностью даже в период ремиссии.
Патогенез Поллиноз относится к классическому аллергическому заболеванию, протекающему по первому типу аллергической реакции и характеризуется наследственной предрасположенностью и повышенной продукцией иммуноглобулинов класса Е. Попадание аллергенной пыльцы в организм больного поллинозом способствует выработке иммуноглобулинов класса Е. Последние, соединяясь с аллергеном, активируют ферментную систему клеток, что приводит к выделению биологически активных веществ (гистамин, простагландины, лейкотриены, фактор активации тромбоцитов, брадикинин и др.). Наиболее важная роль отводится гистамину. В воспалении принимают участие Т-лимфоциты, эозинофилы, базофилы, тучные клетки и другие клетки крови. Аллергическое воспаление вызывает ряд патофизиологических нарушений в больном органе: расширение капилляров, замедление кровотока, повышение проницаемости эндотелия стенок сосудов, транссудацию плазмы крови. Повышается секреция слизи, угнетается функция мерцательного эпителия, отмечается снижение артериального давления. Иногда повышается давление в спинномозговой жидкости, на коже появляется крапивница, возникает спазм гладкой мускулатуры бронхов и др.
Клиническая картина Для заболевания характерна строгая сезонность. Клинические проявления поллиноза зависят от локализации аллергического воспаления. Клиника аллергического ринита выявляется в 98 % случаев, аллергический конъюнктивит (см.) — в 90 % случаев, аллергическое воспаление придаточных пазух носа возникает у 48 % больных поллинозом, астенизация с головными болями — у 60 %, аллергические дерматиты (см.) — у 21 %. Поражение нижних дыхательных путей встречается у 18 % больных поллинозом (сезоннаябронхиальная астма). Описаны и другие локализации аллергического воспаления, но встречаются они реже (гастриты (см.), гепатиты (см.) и даже менингиты (см.)). Чаще всего у больного развивается сезонный аллергический ринит (см.). При этом больной жалуется на чихание, насморк, выделения из носа, зуд в носу и нарушение дыхания. Воспаление может распространиться на слуховые трубы, придаточные пазухи носа, глотку и гортань. При аллергическом конъюнктивите отмечаются отечность глаз, слезотечение, зуд в глазах, светобоязнь. Если воспаление распространяется на бронхи, больной жалуется на кашель, затрудненное дыхание, хрипы, одышку. При воспалении открытых кожных покровов лица и рук развиваются крапивница (см.), отек Квинке (см.), атопический дерматит (см.). По тяжести течения различают 4 степени развития заболевания: — I степень — легкое эпизодическое течение болезни; — II степень — легкое непрерывное течение; — III степень — течение средней тяжести; — IV степень — тяжелое течение. В качестве критериев выступают: работоспособность, общие симптомы, степень распространения процесса на другие органы, выраженность патологии.
Диагностика Диагностика заболевания состоит из двух этапов. Первый этап могут проводить врачи различных специальностей. Он включает в себя тщательный аллергологический анамнез, осмотр больного органа (нос, глаза, кожа), инструментальные методы диагностики (аускультация, рентгенография), лабораторные методы (анализ крови, носовой слизи, мокроты) и др. Второй этап проводят врачи-аллергологи для выявления конкретного этиологического фактора. Ставят пробы с различными аллергенами (кожные, провокационные), определяют содержание специфических иммуноглобулинов класса Е в крови и носовом секрете. Выявляют характерные для поллиноза показатели.
Лечение и профилактика В настоящее время описано три наиболее эффективных метода лечения поллиноза, которые зависят от времени года. Необходимо уехать из местности, где произрастают «виновные» растения, в другой регион страны или за границу на весь сезон цветения растений, иногда до 6 месяцев. Можно применять специальные маски (респираторы) или находиться весь сезон в закрытом помещении с очистителями воздуха от пыльцы растений. Имеются специализированные больницы — беатроны, — где воздух очищается от аллергенов. Больной поллинозом должен знать, что некоторые пищевые продукты имеют общие антигены с пыльцой трав. Так, например, при сенсибилизации к пыльце березы больной поллинозом дает реакцию на употребление яблок, черешни, слив, орехов, моркови. Пыльца полыни имеет сходство с цитрусовыми, подсолнечным маслом, халвой, пыльца лебеды — со свеклой и шпинатом. При сенсибилизации к амброзии не рекомендуют есть дыни и бананы. К вопросам профилактики поллиноза относят: исключение активного и пассивного курения, планирование рождения ребенка в зимний период, контроль за содержанием пыльцы в воздухе помещения (увлажнители и очистители воздуха), выход на улицу только после дождя, ограничение контакта с лаками и красками и др. Методы профилактики весьма дороги и не всегда выполнимы, особенно если больной работает или учится. Кроме того, на следующий сезон заболевание возобновляется. Метод профилактики и элиминации проводят в период обострения заболевания врачи различных специальностей. Применяют препараты, которые подавляют аллергическое воспаление или снижают выраженность симптомов: антигистаминные препараты, препараты кромогликановой кислоты, симпатомиметики, кортикостероиды. Применять их необходимо весь период цветения растений ежедневно. На следующий сезон заболевание повторяется и продолжает прогрессировать. Нужно помнить также, что лекарства имеют побочное действие. Этот метод могут проводить любые врачи, а не только аллергологи. Обычно фармакотерапию начинают с приема антигистаминных препаратов. Механизм их действия основан на конкурентном связывании рецепторов H1 или H2 клеток — мишеней аллергического воспаления (мастоциты, эозинофилы, базофилы и др.). Антигистаминные препараты обычно делят на лекарства первого и второго поколения. К первому поколению относятся хорошо известные супрастин, тавегил, димедрол, диазолин, пипольфен (дипразин), перитол (цитрогептадин) и др. Антигистаминным действием обладают также кетотифен и задитен. Однако все они существенно нарушают качество жизни больного (работоспособность, умственную деятельность и др.). Особенно это опасно при некоторых профессиях (пилоты, шоферы, монтажники, строители и др.). Кроме того, у них выявлено много побочных действий. Их нельзя назначать больным с аденомой простаты, эпилепсией, глаукомой, заболеваниями сердца, почек и печени, при беременности. Они усиливают действие алкоголя на организм. Из побочных эффектов следует отметить также нарушения координации, сухость во рту, сонливость, головную боль, тошноту, боли в желудке, запоры, экзантемы. Назначают их 2–3 раза в сутки и не более двух недель. Антигистаминные препараты 2-го поколения не проникают через гематоэнцефалический барьер, не обладают седативным действием и наиболее безопасны в отношении побочных действий. Эффект после приема наступает через 30–40 мин. Эти препараты можно применять длительно. К антигистаминам 2-го поколения относятся: лоратидин (кларитин), астемизол (гисманал, гисталонг), терфенадин (трексил, гистадин), эбастин (кестин), цетиризин (зиртек). Продолжительность действия одной дозы — 24 ч. Не выявлено серьезного побочного действия по сравнению с плацебо. В последние годы появился антигистаминный препарат 3-го поколения — телфаст (фексофенадин). В отличие от препаратов второго поколения он не метаболизируется в печени, его можно применять с антибиотиками, он не противопоказан при заболеваниях печени, почек и в пожилом возрасте. Телфаст не обладает седативным действием. Его применяют в дозе 120 мг один раз в сутки. Разработаны также топические антигистаминные препараты для лечения аллергического ринита, например на основе азеластина гидрохлорида. Их вводят в виде аэрозоля в полость носа. Из описанной выше группы препаратов антимедиаторного действия наименьшая доза и минимум побочных эффектов отмечено у кестина. Антигистаминные препараты действуют только на раннюю стадию немедленной аллергической реакции, которая вызывает такие симптомы, как чихание, зуд, водянистые выделения из носа. Если в патологический процесс вовлекаются другие медиаторы (лейкотриены, простагландины), возникает отек тканей и заложенность носа, которые требуют дополнительной терапии. Хороший, но непродолжительный эффект оказывают сосудосуживающие препараты. К ним относятся нафтизин, галазолин и др. Применяют их в виде капель. Предложен также симпатомиметик в виде аэрозоля африн (оксиметазолин). Действуют эти препараты в течение нескольких часов. Применять их рекомендуют не более 7 дней. Назначают также системные агонисты адренорецепторов, к которым относится судафед (псевдоэфедрин), применяют его внутрь 2–3 раза в день. Препарат противопоказан при артериальной гипертонии, заболеваниях почек и беременности. На его основе выпускают комбинированный препарат клариназе. Он состоит из лоратидена и псевдоэфедрина сульфата. Применяют его в виде таблеток, но он имеет ряд побочных действий: сухость во рту, нарушение сна, повышение давления и др. Предложена большая группа профилактических препаратов, производных кромогликановой кислоты (кромогликатов), которые связываются с мембранным белком мастоцита и базофила и препятствуют дегрануляции тучной клетки и выделению гистамина. Поэтому назначать их следует за 10–15 дней до начала обострения и применять в течение всего сезона цветения виновного растения. После начала обострения они малоэффективны. Препараты кромогликановой кислоты не имеют серьезных побочных действий и могут применяться в течение нескольких месяцев ежедневно по несколько раз в день. Иногда появляется сухость в горле или в носу. Вводят их местно, в зависимости от локализации аллергического воспаления, в глаза, нос или бронхи. Имеются капли, аэрозоли сухие и влажные. Противопоказанием служит только индивидуальная повышенная чувствительность к данным лекарственным средствам. Особо следует остановиться на новом препарате из группы кромогликатов — кромоглине, который производится фирмой «Мерклерациофарм ГМБХ», Германия. Препарат блокирует поступление ионов кальция в тучные клетки, тормозит их дегрануляцию, предотвращает высвобождение гистамина и других медиаторов, подавляет транспорт кальция через мембрану тучных клеток. Выпускают его в виде аэрозолей для носа и легких. При воспалении слизистой носа назначают назальный спрей кромоглин (взрослым и детям обычно назначают по 1 впрыскиванию в каждый носовой ход 4–6 раз в день). Для профилактики приступов бронхоспазма назначают дозированные аэрозоли кромоглина (взрослым и детям старше 5 лет — по 2 дозы 4 раза в сутки). При необходимости дозировку можно увеличивать. Курс лечения составляет в среднем 4 недели. Кромоглин следует назначать детям с 5 лет, когда особенно важно не допускать побочного действия лекарства. В тех случаях, когда указанная выше терапия малоэффективна, подключают глюкокортикоиды, которые обладают высокой противовоспалительной активностью. Начинать лечение следует с местных — топических гормонов. Системные кортикостероиды (в инъекциях и таблетках) следует применять в крайних случаях и короткое время, так как они обладают выраженным побочным действием, нередко опасным для жизни и могущим привести даже к инвалидизации. Применяется несколько групп кортикостероидов в виде аэрозолей для лечения поллиноза. Триамцинолон выпускают с коммерческим названием назакорт, флутиказон с коммерческим названием фликсоназе, будезонид — ринокорт, флунисолид-синтарис и беклометазон — под названием альдецин и беконазе. Назальные аэрозоли кортикостероидов могут дополнять прием антигистаминных препаратов, особенно в тех случаях, когда преобладает заложенность носа. Применять их следует короткими курсами (10–15 дней), так как при длительном применении возможны побочные действия: носовые кровотечения, перфорации носовой перегородки, сухость в носу и в глотке. Назначают обычно по 1–2 впрыскивания в каждую ноздрю 1–3 раза в сутки в зависимости от тяжести заболевания. Противопоказанием для их назначения являются сопутствующие грибковые, вирусные, бактериальные инфекции слизистой оболочки носа, беременность. При тяжелом течении аллергического конъюнктивита назначают глазные капли: гидрокортизон или бетаметазон по 1 капле 2 раза в день. При сенной астме показан фликсотайд. Специфическая вакцинация аллергенами применяется при всех четырех степенях заболевания в фазе ремиссии. Элиминация аллергена полезна при всех степенях заболевания. Препараты кромогликата натрия (кромоглин) или недокромила натрия применяют в фазе ремиссии для профилактики обострения заболевания и при первой степени болезни. Топические кортикостероиды — только при 3-й и 4-й степени, а системные стероиды — только при 4-й степени, если нет эффекта от топических стероидов. При очень тяжелом течении назначают пролонгированные кортикостероиды (дипроспан). При 1-й и 2-й степенях назначают кромоглин, топические антигистамины и симпатомиметики. Внутрь назначают неседативные антигистамины. Однако такая схема — это только информация для размышления. Таким образом, лекарственную терапию поллиноза рекомендуется проводить в зависимости от степени выраженности (тяжести) заболевания и только в период обострения заболевания. При легком эпизодическом и персистирующем течении заболевания рекомендуются кромоглин, галазолин и кестин. При средней тяжести течения заболевания добавляют производные беклометазона дипропината и азеластина гидрохлорида. При тяжелой форме заболевания подключают ринокорт и дипроспан коротким курсом. В тех случаях, когда заболевание затягивается после сезона цветения данного растения (октябрь) или начинается слишком рано (март, апрель), следует думать о сочетанной пыльцевой и грибковой сенсибилизации. В этом случае больной нуждается после диагностики микоза в дополнительном назначении противогрибковых препаратов. Хорошо зарекомендовал себя противогрибковый препарат кандибене в виде раствора и мази. Специфическая иммунотерапия виновными аллергенами-вакцинами. Метод описан еще в 1911 г. Л. Нуном, применяется во всех странах мира, общепризнан и считается наиболее эффективным методом лечения поллиноза. Принцип метода — это введение в организм больного вакцины, приготовленной из пыльцы растений, вызвавших заболевание, в постепенно возрастающих концентрациях. Заимствован он был у американских индейцев, которые жевали ядовитые травы в малых дозах, чтобы при случайном попадании их в пищу не получить тяжелого отравления. Следует подчеркнуть, что специфическая иммунотерапия — это единственный метод лечения, который позволяет добиться длительной ремиссии и предотвращает дальнейшее развитие заболевания и осложнений. Показания для специфической иммунотерапии. Ее могут проводить только врачи-аллергологи, которые знакомы с методами оказания помощи при побочных реакциях и имеют стандартизированные вакцины-аллергены. Проводить специфическую иммунотерапию необходимо в период ремиссии заболевания и после санации очагов инфекции. Назначать ее целесообразно в тех случаях, когда элиминация виновного аллергена невозможна. Проводят иммунотерапию после уточнения виновного аллергена по данным анамнеза, клинического обследования и специфических аллергологических тестов (кожных, провокационных, иммунологических). Специфическая иммунотерапия более эффективна при аллергозах, в патогенезе которых ведущую роль играют иммуноглобулины E (первый тип реакций). Специфическая иммунотерапия показана в тех случаях, когда лекарственная терапия оказалась малоэффективной. Назначение ее не исключает применения других методов лечения, сочетание специфической иммунотерапии с лекарствами в комплексе даже более эффективно. Однако одновременное их применение, особенно антигистаминных препаратов, может маскировать легкие аллергические реакции и в дальнейшем привести к тяжелым системным реакциям или шоку. Исключение составляет кромоглин, который можно назначать за 30 мин до введения аллергена в течение всего курса лечения. Иммунотерапия аллерговакцинами основана на постепенном увеличении количества аллергена, которое вводят больному аллергией с целью достичь той максимальной дозы, которая будет эффективно снижать симптомы заболевания при последующей встрече больного с аллергеном, вызвавшим заболевание. Иммунотерапию применяют при аллергическом рините, конъюнктивите, бронхиальной астме и атопическом дерматите. Хороший эффект получают при лечении пыльцевыми, а также бытовыми и эпидермальными аллергенами. После нее ремиссия может длиться несколько лет. Противопоказания для специфической иммунотерапии. Ее не рекомендуют проводить у больных активной формой туберкулеза любой локализации, а также при заболеваниях жизненно важных органов (печень, почки, сердце, мозг) с нарушением их функций, при психических заболеваниях, заболеваниях эндокринной системы (гипофиз, щитовидная железа, надпочечники), при беременности, в возрасте моложе 7 лет и старше 60 лет, при заболеваниях с сердечно-сосудистой недостаточностью, в фазе обострения заболевания. Оценка эффективности лечения. Большинство авторов оценивают результаты специфической иммунотерапии по пятибалльной системе: значительное улучшение или выздоровление — 5, улучшение — 4, незначительное улучшение — 3, состояние без изменений — 2, ухудшение и появление новых симптомов — 1. При клинической оценке результатов фиксируют частоту и силу наиболее характерных симптомов: чихания, заложенности носа, зуда, выделений из носа, а также длительности обострения, работоспособности и др. Побочные реакции при иммунотерапии. Главная причина скептического отношения к специфической иммунотерапии в ряде стран — это побочные реакции, которые обычно развиваются сразу же после введения аллергена. Особенно часто они отмечаются при парентеральном введении аллергена. Реакции могут быть местными (в области инъекции), системными (поражения кожи, слизистых оболочек) и общими (анафилактический шок). Описаны и смертельные реакции. Этот вопрос тщательно изучается. По данным ряда авторов, при проведении специфической иммунотерапии инъекционным методом у 915 больных поллинозом было выявлено 125 системных реакций у 190 больных. Одна системная реакция встречалась на 1831 инъекцию. Реакция со стороны кожи наблюдалась у 52 % больных, дыхательных путей — у 12 %, кожи и дыхательных путей — у 30 %, повышение артериального давления — у 1 %, анафилактическая реакция — у 5 %. Из этой группы больных большинство системных реакций (85 %) наступили через 30 мин после инъекции. Если лечение продолжалось в период цветения растений, то системные реакции отмечались у 75 % больных. Обзор литературы по смертельным реакциям выявил следующее. Впервые смертельная реакция описана в 1924 г. В США с 1945 по 1985 гг. описано 32 случая смерти. В Англии смертность от специфической иммунотерапии составляет 1 случай на 1 млн инъекций. В последние годы смертность при этом методе лечения равна 1 случаю на 500 тыс. инъекций. В США в 1989 г. описано 17 случаев смерти при ее проведении. Количество системных реакций и смертей при специфической иммунотерапии колеблется. В 1986 г. в Англии описано 28 смертельных случаев при ее проведении, в Германии в 1942 г. — 7 смертей после ее использования. Особенно много их было в Англии, поэтому специфическую иммунотерапию там мало применяют. Анализ всех случаев смерти после специфической иммунотерапии показал, что в 65 % случаев их можно было избежать при достаточной квалификации врача, который проводил лечение. Выявлена закономерность: чем быстрее проводится курс лечения, тем больше системных реакций. При медленном нарастании дозы отмечалось 0,8 % реакций, при быстром — 47 %. Основные причины побочных реакций, описанных в литературе, следующие: ошибка в дозе (передозировка), гиперсенсибилизация и тяжелое течение заболевания, лечение в период обострения заболевания, быстрое нарастание дозы, одновременное назначение бета-блокаторов. Все вышеизложенное послужило предпосылкой для дальнейшего совершенствования метода специфической иммунотерапии при поллинозах. Модификации специфической иммунотерапии. Метод специфической иммунотерапии вакцинами непрерывно совершенствуется. Модификации его направлены на сокращение срока лечения, возможность увеличения количества вводимого аллергена и уменьшения побочных системных реакций, особенно фатальных, более эффективное воздействие на иммуноактивные органы, снижение стоимости лечения, сокращение количества посещений аллергологических учреждений больными. Поэтому в настоящее время существует 9 альтернативных методов специфической иммунотерапии поллиноза пыльцевыми вакцинами. 1. Инъекционный метод специфической иммунотерапии. Аллерген вводят с помощью шприца внутрикожно или подкожно. У детей применяют накожный скарификационный метод введения — аллерген наносят на кожу, а затем иглой нарушают целостность эпителия и втирают аллерген под кожу. 2. Физиотерапевтический. Аллерген вводят под кожу с помощью специальной аппаратуры (ионофорез с аллергеном). 3. Оральный — аллерген вводят в полость рта (капли, капсулы, таблетки) и сразу проглатывают. 4. Орально-сублингвальный. Аллерген в виде капель вводят в полость рта под язык на 2 мин, а затем проглатывают. 5. Сублингвальный — вакцину в виде капель вводят под язык на 2 мин, а затем выплевывают. 6. Носовой — вакцину в виде аэрозоля с грубой дисперсностью вводят в полость носа (сухие или влажные аэрозоли) с помощью ингалятора. 7. Бронхиальный — вакцину (влажные или сухие аэрозоли) вводят в полость бронхов с помощью ингалятора. 8. Орофарингеальный (ротоглоточный), когда вакцину в виде таблетки вводят за щеку на 45 мин до полного рассасывания. 9. Комбинированный метод, когда применяют два из перечисленных выше методов (инъекции и аэрозоли). Обоснования для применения локальной специфической иммунотерапии аэрозолями аллергенов: филогенетически дыхательные пути более приспособлены для введения аллергенов, чем подкожная клетчатка, поэтому иммунный ответ более выражен и продолжителен; эпителий и субэпителиальная ткань респираторного тракта является первым заслоном для проникновения аллергенов в организм, а нарушение их проницаемости связано с нарушениями местного иммунитета; при респираторной аллергии в лимфоидных образованиях дыхательных путей резко снижается количество клеток, синтезирующих иммуноглобулины класса A и G, поэтому иммуноглобулины класса Е концентрируются в респираторном тракте, в результате чего местное воздействие эффективнее. Методики лечения пыльцевыми аллергенами (специфическая иммунотерапия). Предварительно с помощью аллергометрического титрования определяют пороговую дозу аллергена у данного больного. При инъекционном методе лечения различные разведения вводят внутрикожно или накожно, с учетом вида аллергена и степени сенсибилизации. Так, например, в Казахстане пороговая доза для пыльцы деревьев равна в среднем 10—1 разведениям, для пыльцевых луговых трав — 10—6, для пыльцы сорных трав — 10–12. Лечение начинают с субпороговой дозы, для каждого разведения планируют четыре инъекции: 0,1–0,2—0,4–0,8 мл. Далее переходят к более высокой концентрации. Лечение оканчивают на максимально высоких концентрациях — 10—1 или цельный аллерген. Эффективность зависит от полученной дозы. Аллерген обычно вводят в нижнюю треть плеча подкожно, ежедневно или через день. Ускоренные курсы лечения дают частые побочные реакции. В течение года проводят один курс лечения предсезонно. На следующий год лечение повторяют при положительном эффекте от первого курса. Всего проводят от 2 до 5 курсов. При неинъекционных методах лечения аллерген наносят либо на слизистую оболочку шокового органа (нос, глаза, бронхи) с помощью аэрозольного ингалятора или носового распылителя, либо в полость рта (при сублингвальном и орофарингеальном методах). Схема лечения мало отличается от инъекционного метода. Однако титрацию проводят на слизистой оболочке. Обычно пороговая доза в 10 или 100 раз выше, чем при инъекционном методе. Это связано с потерей части аллергена при всасывании. При сублингвальных методах лечения аллерген для титрации наносят на подъязычную область слизистой оболочки полости рта в виде капель, а затем проглатывают или выплевывают. При орофарингеальной методике аллерген наносят на индифферентный труднорастворимый носитель, который вводится за щеку. В течение 45 мин аллерген малыми порциями поступает в полость рта, а слюна проглатывается. Механизмы специфической иммунотерапии. Механизм ее при инъекционном методе введения вакцины изучают много лет. Он связан с воздействием на ответ Т-клеток. После введения постепенно нарастающих доз антигена происходит стимуляция продукции специфических IgG, подавление синтеза IgE, ослабление ответа на аллерген аллергенстимулированных лимфоцитов и, как следствие, снижение сенсибилизации тканей шокового органа. Механизм этого метода основан на усилении выделения IL-1 и 2, которые индуцируют переключение Th-2 иммунного ответа у больного на Th-1 после успешного лечения. При этом усиливается продукция IFN-гамма, снижается выделение гистамина базофилами и подавляется выделение IL-5 и IL-4 за счет изменения фенотипа с Th-2 на фенотип Th-1. Действие на В-лимфоциты снижается, что ведет к снижению содержания в крови IgE. Усиливается T-супрессорная активность лимфоцитов. В шоковом органе снижается количество CD4+ клеток и эозинофилов. Максимальные изменения наступают через 6 недель после начала лечения. При нанесении аэрозолей аллергенов на слизистые оболочки дыхательных путей с целью специфической иммунотерапии часть аллергена всасывается и вызывает положительный клинический эффект по механизму, описанному при инъекционном методе. Однако имеются и свои дополнительные положительные механизмы специфической иммунотерапии при локальном методе лечения. Иммунокомпетентные клетки паратрахеальных лимфатических узлов, мигрируя в подслизистую ткань дыхательных путей, выделяют секреторный иммуноглобулин класса А — sIgA. Последний обладает способностью фиксироваться на клетках реснитчатого эпителия дыхательных путей, при этом образуется защитная пленка, препятствующая проникновению экзоаллергенов через эпителиальный барьер. Кроме того, в слизистой оболочке респираторного тракта накапливаются плазматические клетки, которые синтезируют иммуноглобулин класса G, относящийся к блокирующим антителам. Локальная терапия стимулирует фагоцитарный ответ клеток крови, повышая барьерную функцию слизистой оболочки. Такое дополнительное местное действие на слизистую объясняет более высокую эффективность локальной специфической иммунотерапии. При длительном контакте аллергена и слизистой полости рта в защитной реакции участвует обширная поверхность лимфоидной ткани глоточного кольца: небные и глоточные миндалины, боковые валики глотки, многочисленные скопления лимфоцитов, а также слизистая оболочка рта и глотки, которая тесно связана с развитой сетью лимфокапилляров, лимфатическими узлами шеи и подчелюстной области. При проглатывании аллергена в реакции дополнительно участвуют лимфатические узлы кишечника. При орофарингеальном методе терапии аллерген вступает в контакт с активными образованиями иммунной системы четырьмя путями: непосредственно с открытой поверхностью лимфоидной ткани; путем проникновения в многочисленные регионарные лимфоузлы; путем контакта с лимфоидным аппаратом пищеварительного тракта — пейеровыми бляшками, стимулируя выделение IL-1 и 2, повышая активность Th-1 клеток и способствуя гипосенсибилизации; частично попадает в кровь и участвует в системной иммунной реакции. Введение аллергена в полость рта, носа и бронхов максимально стимулирует местный иммунитет шокового органа и в то же время при всасывании оказывает еще и общую защитную системную реакцию. Этот комплексный метод воздействия на иммунную систему объясняет преимущества локальной терапии. Эффективность лечения специфической иммунотерапии. После ее использования больные тратят на приобретение лекарств на 80 % меньше, чем до лечения. Эффективность лечения поллиноза инъекционным (подкожным) методом широко освещена в литературе. Результаты лечения больных оказались следующими. Оценка 5 — у 28 % больных, 4 — у 31 %, незначительное улучшение — у 9 %, оценка 2 — у 32 %. Положительный эффект до 1 года наблюдается у 23 % больных, свыше 1 года — у 21 %. После второго курса лечения эффективность возросла на 9 %. Если лечение производилось по индивидуальной схеме, т. е. после каждой инъекции врач корректировал дозы, то эффективность возрастала на 16 %, а количество побочных реакций снижалось. Выявлена и корреляция результатов с количеством введенного аллергена. Так, у больных, получивших до 20 инъекций, оценка 5 была в 11 % случаев, а при 40 и более инъекциях — в 33 % случаев. Чем выше была сенсибилизация у больного и соответственно более тяжелой клиника заболевания, тем хуже были результаты от ее применения. Лечение аллергенами пыльцы деревьев было эффективнее, чем лечение пыльцой сорных трав. Результаты больных поллинозом по методу Бламоутьер (накожное введение с последующей скарификацией) были следующими: оценка 5 — у 17 %, 4 — у 27 %, 3 — у 25 %, 2 — у 31 % больных. Оральный метод лечения — проглатывание пыльцевого аллергена — применяли 7 различных авторов, пролечено 120 больных поллинозом, положительный эффект получен у трех авторов. У многих больных были нежелательные побочные реакции со стороны желудка и кишечника (9 %). Пять различных авторов сравнивали два сублингвальных метода специфической иммунотерапии у 100 больных поллинозом. Часть больных аллерген вводили под язык с последующим проглатыванием, а вторая часть больных после двух минут сосания выплевывала аллерген. Эффективность методики с проглатыванием оказалась выше. Из пяти авторов, исследовавших этот метод, трое положительно оценивают данную методику лечения. Анализ специфической иммунотерапии аллерговакцинами показал, что: — неинъекционные методы специфической иммунотерапии пыльцевыми аллергенами у больных поллинозом теоретически обоснованы, экспериментально доказаны и клинически апробированы во всех странах мира; — из многочисленных методов специфической иммунотерапии пыльцевыми вакцинами наибольшего внимания заслуживают применение локальных аэрозолей и орофарингеальный путь введения препарата; — преимущество данных методик сводится к высокой эффективности, малому количеству побочных реакций, более низкой стоимости, безболезненности; — орофарингеальный метод позволяет проводить лечение этими методами на дому, что сокращает расходы и время, затрачиваемое больными на лечение.
Лечение осложнений Синуситы. Аллергический сезонный ринит способствует развитию многих осложнений (гиперреактивность слизистой оболочки носа, вазомоторный ринит (см.) и др.). Наиболее частым осложнением поллиноза является синусит (см.) — поражение придаточных пазух носа. Сочетание аллергического ринита и синусита при поллинозе отмечено в 36 % случаев. Длительное местное применение симпатомиметиков (сосудосуживающие капли) может вызвать застой крови в носу и последующее развитие синусита. За последние 10 лет количество больных синуситом увеличилось на 15 %. Для острого синусита характерна триада симптомов: слизистые или гнойные выделения в глотку, рецидивирование заболевания и головные боли, повышение температуры тела, кашель. Слизистая оболочка носовой раковины и перегородки носа нередко соприкасаются. Чаще синуситом болеют женщины; длится он от 2 до 8 недель. Хронический риносинусит длится более 8 недель, отмечаются постоянная заложенность носа, слизисто-гнойные выделения в глотку, кашель, неприятный запах изо рта, нарушения обоняния, лихорадка и головная боль. Обострения бывают 2–3 раза в год. В отделяемом из носа встречаются эозинофилы и нейтрофилы. На рентгенограмме отмечается затемнение гайморовых пазух носа. Для уточнения диагноза делают компьютерную топографию и бактериологическое исследование. Хронические синуситы в 56 % случаев бывают аллергическими. При наличии хронического аллергического риносинусита слизистая носа утолщается, нарушается выделение секрета из придаточных пазух носа ввиду закрытия отверстий и сгущения слизи в пазухах. Это способствует размножению микробов, а к аллергическому воспалению присоединяется инфекция. Симптомы аллергического и инфекционного синусита одинаковы, но при первом нет патогенных микробов в содержимом пазухи. Чаще всего аллергический синусит переходит в сочетанный инфекционно-аллергический. При бактериологическом исследовании в придаточных пазухах обнаруживаются стафилококки, анаэробы и грибы. Наиболее тяжелая форма аллергического синусита — сочетание с образованием полипов и повышенной чувствительностью к аспирину. Такая форма встречается у 10 % больных синуситом. Развитию синусита способствуют искривления носовой перегородки, утолщение средней носовой раковины и другие анатомические нарушения. Лечение острых синуситов включает ряд мероприятий и лекарственных средств. Назначают промывания носа гипотоническим раствором. На 1 л воды добавляют 5 г соды, 5 г поваренной соли, 30 капель йода. Перед промыванием закапывают сосудосуживающие препараты. Назначают антигистаминные препараты (кестин), топические кортикостероиды, антибиотики широкого спектра действия — макролиды нового поколения (ровамицин). При лечении хронических синуситов лечение антибиотиками продолжается до 4 недель. Добавляют сухие аэрозоли кортикостероидов. При выделение анаэробной флоры (зловонный запах) назначают метронидазол. При наличии полипов носа, сенсибилизации к аспирину и постоянного ринита применяют аколат — антилейкотриеновый препарат. Если консервативные методы лечения синусита неэффективны в течение 4 месяцев, назначают хирургическое лечение. Эндоскопически вскрывают пазуху через нижний носовой ход, срезают часть средней носовой раковины и увеличивают отверстие гайморовой пазухи. Бронхиальная астма. Очень часто выявляют одновременную патологию носа и легких у больного поллинозом. У 30 % больных бронхиальной астмой (см.) выявляют аллергический ринит (см.). Эпидемиологические, клинические, патофизиологические и анатомические исследования выявили тесную связь между аллергическим ринитом и бронхиальной астмой. Существует поговорка: «Слизистая носа — это часть слизистой оболочки легких, которую легко достать даже пальцем руки». Воспалительные процессы в носу и бронхах поддерживаются или усиливаются благодаря взаимодействию одинаковых патофизиологических механизмов. Принципы лечения бронхиальной астмы и аллергического ринита схожи. В обоих случаях важна базисная терапия: при бронхиальной астме — противовоспалительные препараты. При аллергическом рините в качестве базисной терапии выступают кромоглин, системные антигистамины (кестин и др.), а также глюкокортикостероиды местного действия. Раннее лечение сезонного аллергического ринита может предупредить развитие бронхиальной астмы или облегчить тяжесть ее течения. Доказано, что у больных астмой часто выявляют хронический аллергический синусит, последний способствует развитию тяжелой формы заболевания. У больных тяжелой формой бронхиальной астмы аллергические синуситы встречаются в два раза чаще, чем при легком течении заболевания. Терапия аллергического синусита одновременно способствует нормализации патологического процесса в бронхах. Лекарства, введенные орально (антигистаминные, антибиотики), действуют одновременно на нос и бронхи. Все вышеизложенное подтверждает, что слизистая оболочка бронхов и носа имеет много общего в норме и при патологии. Лечение атопической формы бронхиальной астмы при поллинозе требует назначения кромоглина и антигистаминных препаратов. Инфекционно-зависимая бронхиальная астма сопровождается хроническим бронхитом, при этом показано назначение антибиотиков. Поэтому применение новых антигистаминных препаратов и новых антибиотиков при лечении инфекционно-аллергических синуситов окажет также лечебный эффект на часто сопутствующую бронхиальную астму. Следовательно, выявление ринита или синусита у больного поллинозом указывает на возможность сопутствующей патологии бронхов — бронхиальной астмы — тяжелого и трудноизлечимого заболевания, опасного для жизни. В то же время своевременное лечение аллергических заболеваний верхних дыхательных путей и поллиноза является не только профилактикой развития бронхиальной астмы, но и облегчает ее течение при одновременном заболевании верхних и нижних дыхательных путей.
СЕПСИС
ОпределениеСепсис — общая генерализованная гнойная инфекция, вызванная различными микроорганизмами, чаще всего обуславливаемая очагами гнойной инфекции, являющаяся своеобразной реакцией организма с редким ослаблением его защитных свойств. Сепсис развивается при наличии гнойного очага вирулентной микробной флоры и снижении защитных свойств организма.Многочисленные симптомы сепсиса проявляются в зависимости от его формы и стадии. Принято различать 5 форм заболевания: — гнойно-резорбтивная лихорадка — обширные гнойные очаги и температура тела выше 38 °C не менее 7 дней после вскрытия гнойника; посевы крови стерильные; — септикотоксемия (начальная форма сепсиса) — наличие местного гнойного очага и картины гнойно-резорбтивной лихорадки; посевы крови положительные; комплекс лечебных мероприятий; через 10–15 дней значительное улучшение состояние больного; повторные посевы крови не дают роста микрофлоры; — септицемия — на фоне местного гнойного очага и тяжелого общего состояния длительно сохраняются высокая лихорадка и положительные посевы крови; метастатических гнойников нет; — септикопиемия — картина септицемии с множественными метастатическими гнойниками; — хронический сепсис — гнойные очаги в анамнезе, в данное время заживление, посевы крови нестерильные, периодически отмечаются подъемы температуры, ухудшение общего состояния, а у некоторых больных новые метастатические гнойники. Формы эти переходят одна в другую и могут приводить либо к выздоровлению, либо к смерти. Современное понимание сепсиса требует употребления новой стандартизованной терминологии. Согласительная конференция Американской коллегии врачей и общества критической медицины США, прошедшая в 1991 г., ввела следующую терминологию, характеризующую течение септического процесса. Клинические понятия, связанные с септическими состояниями, и их диагностические признаки следующие: — инфекция — воспалительный ответ, вызванный появлением микроорганизмов путем инвазии в обычные интактные ткани микроорганизма; — бактериемия — присутствие бактерий в крови; — синдром системной воспалительной реакции — системный воспалительный ответ, отличающийся тяжелым клиническим течением, характеризующийся двумя (или более) следующими признаками: температура тела выше 38 °C или ниже 36 °C; число сердечных сокращений свыше 90 уд./мин.; частота дыхания свыше 20 дыханий в минуту или рСО2 меньше 32 мм рт. ст.; количество лейкоцитов свыше 12 г/л или ниже 4 г/л, количество незрелых форм лейкоцитов превышает 10 %; — сепсис — наличие клинических признаков системной воспалительной реакции при явном инфекционном процессе; — сепсис-синдром — состояние, при котором на фоне прогрессирующего сепсиса развиваются органные нарушения, коррелируемые с помощью интенсивной терапии; — септический шок — сепсис с гипотензией (снижение систолического артериального давления до уровня менее 90 мм рт. ст. у «нормотоников» или более чем на 40 мм. рт. ст. от «рабочего» артериального давления у лиц с артериальной гипертензией), развивающийся, несмотря на адекватную инфузионную терапию, и нарушением тканевой инфузии, которая может сопровождаться (но не ограничиваться) лактатацидозом, олигурией и острыми нарушениями психического статуса; у пациентов, находящихся на инотропной поддержке, гипотонии может и не быть в то время, когда регистрируют нарушения инфузии; — синдром полиорганной недостаточности — присутствует острое повреждение функций органов и систем, при этом гомеостаз не может быть сохранен без вмешательств; — дисфункция в системе гомеостаза (коагулопатии потребления, тромбоциты менее 150 г/л, фибриноген менее 2 г/л); — острый респираторный дистресс-синдром — рО2 в артериальной крови 71 мм рт. ст.; отношение рО2 к содержанию кислорода во вдыхаемом воздухе (рО2/FiО2) менее 175; билатеральные легочные инфильтраты на рентгенограмме; необходимость ИВЛ с положительным давлением конца выдоха 5 мм вод. ст.; — почечная дисфункция — креатинин в крови более 17 мкмоль/л, натрий в моче менее 40 мкмоль/л, диурез менее 30 мл/ч; — печеночная дисфункция — билирубин в крови более 34 мкмоль/л, натрий в моче менее 40 мкмоль/л, увеличение активности АСТ, АЛТ или щелочная фосфатаза в 2 раза и более по сравнению с верхней границей нормы; — дисфункция центральной нервной системы — менее 15 баллов по шкале Глазго; — гастроинтестинальная недостаточность — кровотечение из острых язв («стресс-язвы» желудка, илеус длительностью более 3 суток; диарея (жидкий стул) более 4 раз в сутки. В соответствии с приведенной классификацией выделяют следующие фазы сепсиса: — сепсис (в отечественной классификации — начальная фаза сепсиса) — характеризуется признаками синдрома системной воспалительной реакции (два признака и более) и наличием гнойного очага; — сепсис-синдром или тяжелый сепсис (септицемия и септикопиемия в отечественной классификации), для которого характерно развитие полиорганной недостаточности; — септический шок — конечная фаза сепсиса (в отечественной классификации септический шок рассматривается как осложнение сепсиса). Формирование нового взгляда на патогенез сепсиса отразилось не только на терминологии, но и на диагностических критериях постановки диагноза. Диагноз сепсиса не вызывает сомнений при наличии 4 критериев: — инфекционного очага, определяющего природу патологического процесса; — синдрома системного воспалительного ответа (критерий проникновения медиаторов воспаления в системную циркуляцию; — признаков организменной дисфункции; — синдрома полиорганной недостаточности (критерий распространения инфекционно-воспалительной реакции за пределы первичного очага).
Этиология Возбудителями сепсиса могут быть почти все существующие патогенные и условнопатогенные бактерии. Наиболее распространенными считаются стафилококки, стрептококки, синегнойная палочка, протейные бактерии, анаэробная флора и бактероиды. При многолетних бактериологических исследованиях, проведенных в нашей стране, у больных септическим состоянием этиологическая структура представлена различными микроорганизмами, в том числе стафилококки обнаружены в 59,2 % случаев, стрептококки — в 13,4 % случаев, неферментирующие бактерии — в 5,9 % случаев и анаэробная микрофлора — в 1,2 %. Основными возбудителями сепсиса в последние годы у нас в стране являются стафилококки (35 %), кишечная палочка (11,5 %), другая грамотрицательная микрофлора (29 %), а также аспорогенные анаэробы. Частота выявления первичных очагов инфекции в зависимости от их локализации следующая: — респираторный тракт — 25 %; — брюшная полость /малый таз — 25 %; — бактериемия — 15 %; — мочевой тракт — 10 %; — кожа — 5 %; — внутрисосудистый катетер — 5 %; — другая — 5 %. Частота обнаружения микроорганизмов у септических больных в зависимости отих спектра следующая. Категории: — грамотрицательные — 25 %; — грамположительные — 25 %; — микст грамотрицательные / грамположительные — 20 %; — грибы — 3 %; — анаэробы — 2 %; — неизвестные — 25 %. Из них грамотрицательные бактерии: — кишечная палочка — 25 %; — клебсиелла / цитробактер — 20 %; — синегнойная палочка — 15 %; — энтеробактер — 10 %; — протей — 5 %; — другие грамотрицательные бактерии — 25 %. Из них грамположительные бактерии: — золотистый стафилококк — 35 %; — энтерококк — 20 %; — коагулазонегативный стафилококк — 15 %; — пневмококк — 10 %; — другие грамположительные бактерии — 20 %. В связи с этим выделяют: — легочный сепсис — заболевание типа септицемии или септикопиемии, при котором первичная гноеродная инфекция находится в легком; пиемический очаг чаще развивается у ослабленных людей, перенесших острые вирусные респираторные инфекции, имеющие отягощенный по другим заболеваниям анамнез; — кишечный сепсис — заболевание, при котором первичная гноеродная инфекция находится в кишечнике и может привести к развитию септицемии и септикопиемии; к нему могут привести язвенный энтероколит, язвенный колит, катаральный энтерит, язвенный энтерит; — кожный сепсис — источником заболевания могут явиться флегмона, везикулопустулез, псевдофурункулез, пузырчатка, гнойный гидраденит, гнойный мастит и др.; — бактериемия — при гнойном остеомиелите и других заболеваниях костной ткани, надкостницы, костного мозга; — отогенный сепсис — всегда является вторичным, развивается в результате острого или хронического отита, мастоидита и т. д.; — тонзиллогенный сепсис — возникает непосредственно в связи с поражением миндалин при ангине, хроническом тонзиллите или в связи с образованием паратонзиллярного и парафарингеального абсцессов и др.; — риногенный сепсис, развивающийся как осложнение воспалительных заболеваний носа и его придаточных пазух, иногда после травмы; — одонтогенный сепсис возникает в результате распространения инфекции из пораженных зубов; — уросепсис — входные ворота инфекции локализуются в мочевом тракте; — гинекологический сепсис — источником инфекции являются гинекологические гнойные заболевания, эндометрит, сальпингоофорит; — сепсис после катетеризации подключичной вены — обычно он развивается на фоне другого тяжелого заболевания, вызвавшего необходимость длительной катетеризации; первичный септический очаг имеет вид гнойного тромбофлебита. Кроме того, некоторыми авторами выделяют ятрогенный и криминальный сепсис, возникающий в результате неквалифицированных или неполноправных действий медицинских и немедицинских сотрудников, примером может служить криминальный аборт и постинъекционные абсцессы. Этиологический фактор сепсиса накладывает существенный отпечаток на клиническую картину заболевания. Так, стафилококк, обладая свойством свертывать фибрин и поэтому оседать в тканях, в большом проценте случаев дает ишемические очаги. К особенностям стрептококков относятся их большая изменчивость, выраженные фибринолитические свойства и ишемия, встречающаяся во много раз реже; стрептококки более чувствительны к воздействию антибиотиков. Кишечная палочка в основном действует токсически, изначально реже обуславливает образование ишемических очагов. Сепсис, вызванный синегнойной палочкой, обычно протекает по телу молниеносно с выраженной шоковой реакцией. Грамотрицательная флора способствует развитию явлений интоксикации и значительно чаще, чем при грамположительной флоре, приводит к септическому шоку. Возбудители анаэробного сепсиса (клостридиум перфрингенс, септикум, гистолитикум) образуют большое количество экзотоксина, оказывающего мио- и нейротропное действие. Полимикробная ассоциация анаэробов — одна из основных этиологических особенностей газовой инфекции. Кроме клостридий, сепсис могут вызывать другие анаэробы (бактероиды, фузобактерии, пентококки, пентострептококки). Клиническая картина сепсиса, вызванного бактероидами, характеризуется образованием гнойников в крупных суставах, брюшной и плевральных полостях, легких, головном мозге и других висцеральных органах. Бактероиды продуцируют энзим, разрушающий гепарин, что ведет к образованию тромбозов и эмболий. В их присутствии чаще всего происходят процессы диссеминированного внутрисосудистого свертывания крови. Широкое применение антибиотиков способствовало увеличению за последнее время случаев кандидозной инфекции и кандидозного сепсиса. Среди возбудителей кандидозного сепсиса наибольшее значение имеют грибы рода Candida (albicans, tropicalis), аспергиллы и криптококки. Генерализация процесса обусловлена выделением токсических субстанций, способностью кандидов к размножению в макрофагах, а также возрастанием интенсивности лечения гематологических злокачественных новообразований и увеличения числа пересадок органов. Диагностика генерализованных форм сепсисов затруднена, посевы крови становятся положительными лишь в поздней стадии болезни.
Патогенез В последние годы при исследовании патогенетических механизмов сепсиса основной акцент сместился на выяснение не только роли бактериальных продуктов в активации различных видов клеток (макрофагов, полиморфноядерных нейтрофилов, тромбоцитов, эндотелиальных клеток и др.), но и механизмов секреции активированными клетками разнообразных цитокинов и действия этих цитокинов на клетки человека. Эндотоксемия и бактериемия всегда приводят к развитию системного воспалительного ответа, при котором происходит увеличение синтеза и секреции разнообразных цитокинов, направленных на стимуляцию основных защитных систем организма. Если при нормальном течении инфекционного процесса подобные молекулярные реакции можно расценивать как реакции приспособления или адаптации, то во время сепсиса в силу ряда причин их активность имеет повреждающий характер. Синдром системного воспалительного ответа как универсальная реакция организма на инфекцию может протекать в трех вариантах. Первый вариант характеризуется локальной продукцией цитокинов в ответ на инфекцию, которые выполняют ряд защитных функций. Второй вариант сопровождается выбросом малого количества цитокинов, активизирующих макрофаги, тромбоциты и продукцию ряда гормонов; развивающаяся острофазовая реакция контролируется провоспалительными медиаторами (IL-1, IL-10, IL-13; фактор некроза опухоли). Третий вариант характеризуется генерализацией воспалительной реакции; регулирующие системы не способны поддерживать гомеостаз, в результате чего начинают доминировать деструктивные эффекты цитокинов и других медиаторов, способствующие нарушению проникаемости и функции эндотелия капилляров, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной недостаточности; он имеет место при сепсисе. В системном воспалительном ответе при сепсисе можно условно выделить несколько основных патогенетических механизмов: — медиаторный, в развитии которого ведущую роль играют эндотелий и цитокины, а также аутоиммунное поражение органов и тканей; — микроциркуляторный и связанный с ним реперфузионный механизмы; — инфекционно-септический механизм, в основе которого лежит кишечная недостаточность — важнейший компонент порочного круга при сепсисе, поскольку транслокации бактерий и их токсинов поддерживают воспалительную реакцию, усугубляется нарушение обмена веществ. Приведенные механизмы действуют в совокупности, хотя каждый из них может преобладать на разных этапах развития сепсиса. Участие медиаторного механизма в патогенезе сепсиса можно представить, по мнению В. Н. Руднева и соавторов (2000 г.), в виде следующих положений. 1. Инфект, экзо-, эндотоксин служат факторами, инициирующими в тканях организма сложный комплекс иммуновоспалительных реакций — «септический каскад». Центральная роль эндотоксина грамотрицательных бактерий связана с его способностью стимулировать различные аспекты воспалительного ответа. В частности, он активирует комплемент, нейтрофилы и моно- нуклеарные фагоциты: грамположительные бактерии не содержат в своей клеточной стенке эндотоксин и вызывают септические реакции через другие механизмы. 2. Сепсис представляет, в сущности, системный ответ на инфект, заключающийся в неконтролируемом выбросе из макрофагов, лимфоцитов и эндотелия целого комплекса медиаторов, важнейшими из которых являются цитокины. Считается, что ведущую роль в развитии генерализованного воспалительного каскада при сепсисе играют такие цитокины, как TNF-альфа, IL-1-бета, IL-2, IL-6, IL-8. Механизм формирования септического ответа, инициированного эндотоксином, состоит из трех фаз: — I фаза — индукция сепсиса, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа; — II фаза — септический каскад, заключающийся в секреции цитокинов и их воздействии на органы-мишени с последующим вторичным выделением этих медиаторов. Кроме цитокинового каскада, активизируются калликреин-кининовая система, система арахидоновой кислоты, свертывающая система крови и др. Взаимодействие эндогенных медиаторов воспаления с различными клетками макроорганизма приводит к тяжелым системным расстройствам с формированием в конечном итоге полиорганной недостаточности, которая является основной причиной летальности при сепсисе; — III фаза — вторичная агрессия — предельно выраженная органная дисфункция и стабильный катаболизм, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза. 3. Последующее течение заболевания и прогноз определяются концентрацией эндотоксина, отдельных цитокинов (TNF-альфа, IL-1-бета, IL-2, IL-6) в тканях и кровотоке, состоянии механизмов, контролирующих их освобождение, а также тяжестью возникших органных повреждений. 4. Медиаторами септического воспалительного ответа, помимо цитокинов, являются: компоненты комплемента, продукты метаболизма арахидоновой кислоты, фактор активации тромбоцитов, серотонин, гистанин, NО, активные формы кислорода и гидроперекиси, кининкалликреиновая и свертывающая системы, энзимы (протеазы, лизосомальные ферменты), гормональные пептиды (тироксин, гормон роста, инсулин, глюкагон). Комплекс ответных реакций на инвазию грамположительной инфекции является более сложным по сравнению с эндотоксином грамположительных бактерий. Разница строения клеточных стенок и другие факторы различных грамположительных бактерий обуславливают особенности ответных реакций на инфектанты. При рассмотрении механизмов развития септического процесса, имеющих соответствующую клиническую картину, необходимо также учитывать: — наличие моно- или полиинфекции (стафилококки, грамотрицательная флора), варианты микробной ассоциации; — входные ворота первичного инфекта (экзогенное инфицирование — пупочная область, кожные покровы, энтеральное заражение; эндогенное инфицирование — дыхательные, мочевыводящие пути, желудочно-кишечный тракт, а для детей — внутриутробное инфицирование или наличие перинатальной патологии); — пути диссеминации инфекции — гематогенный, лимфогенный. Эти и многие другие факторы способны видоизменять (отягощать, усложнять) развитие ответной реакции и септического каскада.
Патанатомия Морфология сепсиса не имеет характерных для него черт. Наблюдаются различной выраженности дистрофические изменения внутренних органов: в селезенке — флебит трабекулярных вен, лейкоцитарная инфильтрация красной пульпы, иногда с микробной флорой; в почках — гломерулит, острый тубулярный нефроз, пиелонефрит; в печени — некрозы, септический гепатит, иногда метастатические гнойники, в кишечнике — энтероколит. Можно выделить три основные разновидности изменений внутренних органов при сепсисе: глубокие расстройства кровообращения, распространенные дистрофические и воспалительные изменения. Расстройства кровообращения при сепсисе представлены неравномерным полнокровием, стазом и очаговыми кровоизлияниями во внутренние органы и кожные покровы, распространенным тромбозом мелких сосудов легких, печени, почек. Характерны дистрофические изменения сосудистых стенок в виде плазматического пропитывания, мукоидного набухания и фибриноидных изменений. Возможно развитие васкулитов (капилляритов). Практически всегда при сепсисе приходится говорить о ДВС (диссеминированном внутрисосудистом свертывании) или ТГС (тромбогеморрагическом синдроме), степень выраженности которого, однако, в разных случаях различна. В одних случаях проявления ДВС-синдрома обнаруживаются лишь при вскрытии, в других они очень ярко выступают в клинике в виде кровоизлияний в кожу, слизистые оболочки, развития носовых кровотечений, кровотечений из пупочной ранки у новорожденных, мест инъекции и оперативных вмешательств. Одним из клинико-анатомических вариантов сепсиса, где преобладают геморрагические явления, является так называемая болезнь Буля. Клинически этот вариант сепсиса характеризуется отеками, кровоизлияниями в кожу и слизистые оболочки, кровотечениями из пупочной ранки и носа; развивается желтуха; гистологически выявляется тяжелая жировая дистрофия печени, почек, сердца. Другим вариантом сепсиса является болезнь Винкеля, при которой ведущим оказывается гемолитический синдром. Проявляется она у недоношенных детей в первые дни жизни ядерной желтухой, гемоглобинурией, гемоглобиновыми инфарктами почек, геморрагическими и дистрофическими изменениями внутренних органов. Характерно увеличение селезенки и печени за счет интенсивного экстрамедуллярного кроветворения. Этот вариант сепсиса необходимо отличать от сепсиса, развивающегося на фоне гемолитической болезни новорожденных. Развитие дистрофических процессов во внутренних органах имеет важное пато- и танатогенетическое значение. Это особенно касается случаев длительно текущего сепсиса, когда дистрофические изменения внутренних органов и тяжелая гипотрофия подчас определяют всю патологоанатомическую картину заболевания. Следует в первую очередь назвать зернистую дистрофию миокардиоцитов, зернистую и жировую дистрофию гепатоцитов, канальцевого эпителия почек. При стафилококковом сепсисе нередко возникают крупноочаговые некрозы гепатоцитов. Дистрофические и некротические изменения обусловлены токсическим действием микробных токсинов, угнетенные микроциркуляции — глубоким нарушением всех видов обмена веществ. Воспалительные изменения при сепсисе носят распространенный характер и обнаруживаются во многих органах: легких, печени, почках, сердце, головном мозге, кишечнике. В легких наблюдается паретическое расширение бронхов со скоплением в них слизи и развитием бронхитов. В альвеолах также имеется воспалительный экссудат серозного или гнойного характера. Развитие такого рода воспалительных процессов в легких чаще связано не с гематогенным заносом инфекции, а с аутоинфекцией в результате местной тканевой резистентности. В большинстве таких случаев сепсиса микробная флора отличается от возбудителей пневмонического процесса. Такие пневмонии не следует смешивать с гематогенными абсцедирующими пневмониями при септикопиемии, когда возбудители в гнойниках-метастазах и крови идентичны. При сепсисе возможно развитие интерстициального пиелонефрита и различных видов гломерулопатий, в основе которых лежит активизация аутоинфекции. Морфологические изменения в органах в основном зависят от длительности заболевания и лечения. В селезенке имеются гиперемия кровоизлияния, редукция лимфоидных фолликулов, скопление лейкоцитов. Постоянно обнаруживаются очаги миелоза, которые являются динамическим признаком сепсиса. Лимфатические узлы имеют различную степень изменений. В лимфоидных органах выделяют 2 типа иммуно-морфологических сдвигов. К изменениям первого типа относятся интерпластические компенсаторноприспособительные процессы. Изменения второго типа характеризуют развитие декомпенсации лимфоидной системы. Степень выраженности этих процессов неодинакова при различной длительности течения сепсиса и разных его формах. Гиперпластические процессы в лимфоидной ткани отражают стимуляцию иммуногенеза. Иммунная реакция в этом случае представлена 3 типами ответных реакций (3 звена): афферентные, центральные и эфферентные (отмечаются изменения со стороны Т- и В-лимфоцитов и их субпопуляции, продукты антител — иммуноглобулинов IgM, IgG, противовоспалительных цитокинов, интерлейкинов, фактора некроза опухоли, фагоцитарной активности клеток гранулоцитарного ряда). Морфологические признаки декомпенсации иммуногенеза при сепсисе заключаются в развитии дистрофических изменений микрофагов, уменьшении их содержания в синусах лимфоузлов. Ослабляется миграция лимфоидных клеток, падает митотическая активность. В тяжелых случаях сепсиса происходит опустошение лимфоузлов и селезенки. Активность ферментов в лимфоцитах снижается, угнетен синтез иммуноглобулинов и др. Отмечается некробиоз ретикулярных элементов. Итерстициальное воспаление довольно постоянно выявляется в легких, в почках, миокарде, особенно в тех органах, которые поражаются септическими метастазами. Со стороны сердца наиболее постоянными являются дистрофические изменения миокарда, относительно редко — токсические миокардиты. Изменения в центральной нервной системе при сепсисе неспецифичны и в качественном отношении тождественны инфекционно-токсическим заболеваниям. Часто в мягкой мозговой оболочке наблюдается расстройство кровообращения, которое выражается в отеке, периваскулярных, диапедезных кровоизлияниях, набухании эндотелия, разрыхлении стенки сосудов. Весьма редко в центральной нервной системе обнаруживаются метастатический гнойный лептопахименингит и острые абсцессы мозга. При резко выраженном токсическом процессе, когда клинически на первый план выступают энцефалитические признаки заболевания в подкорковых узлах, субталамической области, варолиевом мосту, продолговатом мозгу, передних и задних рогах спинного мозга, наблюдается дистрофия нервных клеток, пролиферация клеток глии. Изменения в эндокринных органах зависят от длительности и тяжести заболевания и применении гормональной терапии.
Клиническая картина Клинические проявления сепсиса весьма многообразны и зависят от стадии и формы болезни. Для септицемии характерны: высокая (до 40–41 °C) температура тела с небольшими суточными колебаниями, учащение пульса и дыхания, сильные ознобы, вслед за подъемом температуры — скарлатинозные высыпания, увеличение селезенки и печени, желтуха и анемия. Сначала — высокий лейкоцитоз, затем лейкопения, анэозинофилия. В основе клинической классификации сепсиса лежат следующие факторы. I. Генез: — первичный; — вторичный (в результате иммунодефицитного состояния). II. Микроб-возбудитель: — стафилококк; — стрептококк; — кишечная палочка; — палочка синегнойная и др.; — смешанная инфекция; — другие инфекционные факторы. III. Входные ворота: — пупочная рана; — рана; — кожа; — пищевой тракт; — среднее ухо; — криптогенный сепсис и др. IV. Течение заболевания: — молниеносное; — острое; — подострое; — затяжное; — хроническое. V. Период болезни: — начальный; — разгар заболевания; — репарации; — дистрофический. Наиболее распространенным является стафилококковый сепсис. В клинической классификации стафилококкового сепсиса выделяют нижеследующее. I. Течение: — острое (до 2 месяцев); — затяжное (от 2 до 3 месяцев); — хроническое (более 3 месяцев). II. Входные ворота: — пупочный; — кожный; — респираторный; — тонзиллярный; — желудочно-кишечный; — отогенный; — одонтогенный; — урогенитальный; — глазной; — гинекологический; — смешанный. III. Период болезни: — инкубационный; — развитие местного очага; — остросептический, без локальных поражений (септицемия); — септико-метастатический; — нарастающей дистрофии; — латенций; — рецидивов; — репарации; — выздоровления. IV. Локальные и функциональные изменения органов: — центральная нервная система: гнойный менингит, абсцесс мозга, токсико-аллергические энцефалиты, нервно-психические заболевания; — остеомиелит; — вторичные легочные и легочно-плевральные пневмонии; — сердечно-сосудистая система: эндокардит, миокардит, перикардит, флебит; — поражения мочевой системы: пиелонефрит, абсцесс почки, паранефрит; — органы пищеварения: парентеральная диспепсия, энтероколит, парапроктит, аппендицит, перитонит, панкреатит, ангиохолецистит, абсцесс печени; — инфекционные анемии; — гипотрофия. Пупочный сепсис в начале заболевания клинически характеризуется преобладанием неспецифических симптомов, а в дальнейшем, по мере развития септического процесса, доминирует клиника осложнений сепсиса. Пупочная рана гиперемирована, отечна, нередко с обильным гнойным экссудатом. Прямые и косвенные признаки поражения пупочных сосудов проявляются также в виде расширения венозной сети верхнего отдела брюшной стенки, отечности нижней части живота и надлобковой области, увеличения паховых лимфоузлов. Кожа приобретает землистый оттенок, а иногда развивается затяжная желтуха. Причиной смерти больных пупочным сепсисом чаще всего является интоксикация. При продуктивном тромбофлебите пупочной или воротной вен наблюдается более поздняя смерть (до 2–6 или более месяцев). Наиболее частыми проявлениями пупочного сепсиса являются изменения в легких в виде мелкоочаговой и интерстициональной пневмонии, абсцедирующей и сливной пневмонии, гнойного и фибринозного плевритов, пиопневмоторакса. Реже встречаются изменения желудочно-кишечного тракта и брюшной полости: язвенный колит, язвенный энтероколит, катаральный колит, катаральный энтерит, гнойный перитонит, фибринозный перитонит. При пупочном сепсисе вовлечение кишечника в патологический процесс возникает вследствие перехода воспаления с пораженных пупочных сосудов сначала на париетальную, затем на висцеральную брюшину. Стафилококковый энтероколит у больных пупочным сепсисом является вторичным и развивается обычно в связи с дисбактериозом кишечника. Среди других проявлений пупочного сепсиса наблюдалось изменение кожи, характеризующееся различными гнойничковыми поражениями; остеомиелит; перикардит; менингит; флегмона средостения; метастатические гнойники в печени, которые образовались при локализации первичного септического очага в пупочной вене; также метастатические гнойники в головном мозге, надпочечниках, почках. Наиболее частым проявлением пупочного сепсиса является гнойный перитонит. Легочный сепсис чаще развивается у ослабленных больных, перенесших острые вирусные респираторные инфекции, имеющих иммунодефицитные состояния. Появление пиемического очага в легких сопровождается «гипертермическим» синдромом, появлением судорог. Нарастающая инфильтрация с последующим абсцедированием в легких осложняется развитием плеврита, пневмоторакса и плевропульмонального шока. В виде септического очага выявлены мелкоочаговая абсцедирующая и сливная пневмонии. Среди возбудителей первичного септического очага в легких преобладает стафилококк, а большинство острых легочных нагноений возникает вследствие аэробронхогенного инфицирования. При легочном сепсисе морфологические изменения плевры выражались гнойным и фибринозным воспалением, пиопневмотораксом. Крупноочаговое абсцедирование наблюдается у детей в 4–5 раз чаще, чем мелкоочаговое. Крупноочаговое абсцедирование у детей чаще всего является одной из форм стафилококковой деструкции легких (см.). Легочный сепсис сопровождается симптомами быстро развивающейся интоксикации (повышенной температурой тела, расстройством гемодинамики, микроциркуляции, метаболическими нарушениями). При легочном сепсисе выявлялись: язвенный энтероколит, катаральный энтероколит, гнойный и фибринозный перитонит, абсцессы в коже, головном мозгу, сердце, печени, почках, селезенке. Кишечный сепсис чаще всего выявлялся у ослабленных больных с тяжелым стафилококковым язвенным некротическим энтероколитом, катаральным или язвенным энтеритом. Первично септический очаг обычно локализуется в тонком кишечнике, как правило, в подвздошной кишке. Кишечный сепсис проявляется симптомами язвенного энтероколита, катарального энтерита, язвенного энтерита. При гистологическом исследовании выявляются глубокие некрозы слизистой оболочки, пропитанные фибрином; лейкоцитарные инфильтраты под слизистой и мышечного слоев; наличие язв со слабым гранулированием с вовлечением в воспалительный процесс серозной оболочки. Лимфатические фолликулы слизистой оболочки кишечника опустошены, с нечеткими контурами. Наиболее часто при этом виде сепсиса морфологически обнаруживались изменения легких: мелкоочаговая и абсцедирующая пневмония, гнойный и фибринозный перитонит, метастатические гнойники в легких и печени, поддиафрагменном пространстве, почках. Источником кожного сепсиса могут являться различные заболевания кожи, у детей наибольшее значение имеет флегмона. Источником наиболее часто являются: везикулопустулез, псевдофурункулез, опрелости, пузырчатка, гнойный гидраденит, гнойный мастит, инфицированные раны; в более редких случаях источником являются: некротический эпидермолиз (синдром Лайелла), эксфолиативный дерматит, буллезный эпидермолиз и ихтиоз. Клиническими проявлениями кожного сепсиса являются абсцедирующая и мелкоочаговая пневмонии; метастатические гнойники в средостении; миокарде; язвенный колит; остеомиелит. При гнойном остеомиелите, осложненном сепсисом, наиболее часто первично-септический очаг локализуется в большеберцовой кости, затем — в бедренной, плечевой, малоберцовых костях, костях предплечья. В последнее время увеличилось число поражений плоских костей. При локализации первично-септического очага в костном мозгу процесс в основном протекает в форме септикопиемии, при этом множественные метастатические гнойники располагаются в легких, в почках, в головном мозгу, селезенке, средостении. Остеомиелит, осложненный сепсисом, характеризуется множественными метастатическими гнойниками в легких, в почках, в головном мозгу, селезенке, средостении, диафрагме; развитием абсцедирующей пневмонии, гнойного перикардита, эндокардита, гнойного плеврита, гнойного менингита. При септической форме отогенного сепсиса развивается гнойный менингит, появляются гематогенные метастазы в виде абсцессов легких. При септицемии в почках, легких и печени преобладает интерстициальное воспаление. Тонзиллогенный, риногенный, одонтогенный сепсис, а также уросепсис проявляется гнойно-воспалительными местными реакциями, синдромом интоксикации и многообразием пиемических очагов. Практически во всех случаях септического процесса отмечается тахикардия (более 100 ударов в минуту), которая стойко и длительно держится, а также и гипервентиляция. Острая дыхательная недостаточность — один из патогномоничных симптомов сепсиса. Наиболее часто респираторная недостаточность обусловлена пневмонией, снижением онкотического давления, выраженной гипопротеинемией, диффузной внутрисосудистой коагуляцией с образованием тромбов в легочных капиллярах.
Диагностика и дифдиагностика Диагностика основывается на клинической картине и анализе результатов обследования больного. Лабораторные исследования должны быть направлены на решение следующих задач: — установить возбудителя, его вид, вирулентность, чувствительность к антибиотикам; — оценить выраженность интоксикации; оценка выраженности интоксикации позволяет определить не только тяжесть состояния больного сепсисом, но и эффективность детоксикационной терапии; — диагностировать расстройства в деятельности жизнеобеспечивающих систем гомеостаза; — оценить прогноз; — выявить нарушения системного воспалительного ответа и иммунного статуса; — оценить эффективность проводимого лечения. В настоящее время все чаще стали встречаться формы сепсиса, вызванные представителями аутомикрофлоры (собственной микрофлоры) человека, для которой характерен определенный тропизм (сродство) к органам и тканям. Их патогенность связывают с изменением условий жизнедеятельности в организме, и она является следствием нарушения или временного снижения резистентности организма и факторов естественного иммунитета. Вид микроба, его патогенность, токсичность и другие биологические свойства, а также уровень бактериальной обеспеченности, т. е. количество микробов, попавших в первичный очаг или находящихся во вторичном очаге, в значительной степени влияют на клиническое течение сепсиса. Для развития инфекционного процесса в ране и, тем более, генерализации инфекции наряду с другими факторами необходимо наличие в ране определенного количества микробов, или так называемый критический уровень бактериальной обеспеченности на 1 г ткани раны. Обеспеченность в 5-й степени и более на 1 г ткани, как правило, является «критической» и указывает на бурное развитие инфекции в первичном очаге и на вероятность ее генерализации. Диагностика сепсиса включает в себя выявление этиологического фактора — определение возбудителя и изучение его чувствительности к антибактериальным препаратам, так как именно использование соответствующих антибиотиков является при прочих равных условиях залогом окончательного излечения больного. К сожалению, возможности бактериологической службы не позволяют получить эти сведения в короткое время. Среди методов ускоренной диагностики сепсиса наибольшее распространение получили усовершенствованная прямая бактериоскопия, серологическая реакция, газовая хроматография, полимеразная цепная реакция. Прямая идентификация микробиологического патогена может быть осуществлена с помощью иммунологических методов, таких как встречный иммуноэлектрофорез, агглютинационные тесты, ИФА и прямая иммунофлюоресцентная микроскопия. Метод люминесцентной фазовоконтрастной микроскопии во многих случаях помогает провести идентификацию микробной флоры через 6—12 ч после посева отделяемого. Рэпидные панели к бактериологическому автоанализатору Walk avay 40 позволяют идентифицировать возбудителя и определить чувствительность к антибиотикам (и минимальную подавляющую концентрацию) в течение рабочего дня после получения культуры. Забор материала осуществляется в соответствии с основными требованиями к забору материала. Одним из основных объективных диагностических критериев любого нагноительного процесса, особенно сепсиса, принято считать изменения в периферической крови. В то же время следует помнить о неспецифичности нарушений отдельных показателей периферической крови, их зависимости от циркуляторного гомеостаза, постоянно меняющейся клиники заболевания и влияния лечебных факторов. В связи с этим целесообразнее рассматривать их в качестве вспомогательных тестов в диагностике сепсиса. Сепсис, как правило, сопровождается быстро нарастающей анемией. Количество эритроцитов в фазу напряжения и катаболических расстройств значительно уменьшается до уровня 2,3 т/л, а гемоглобина до 58–66 г/л. Характерным можно считать сужение красного ростка крови. В периферической крови определяются: анизопойкилоцитоз, тельца Жолли и Кебота, базофильная зернистость эритроцитов. Индекс созревания эритроцитов уменьшается за счет разрастания миелоидного ростка. Развивается гипохромная анемия, характеризующаяся превалирующим уменьшением количества гемоглобина и соответствующим снижением цветового показателя. В происхождении анемии при сепсисе важную роль играют: уменьшение эритропоэза в результате эндогенной интоксикации, дефицит пластических веществ, нарушение обмена железа, синтеза трансферрина. В дальнейшем анемия может иметь гемолитический характер (как следствие повышенной активности гемолизинов). Гемоконцентрация является неблагоприятным прогностическим признаком, способствующим развитию ДВС-синдрома к появлению новых очагов нагноений вследствие деструкции того или иного органа или ткани. При сепсисе выделяют два вида анемии: гипорегенераторный тип, характеризующийся сниженным количеством гемоглобина и эритроцитов, нормальным или повышенным содержанием ретикулоцитов и гипохромией; гипопластический тип — обусловлен поражением костного мозга. Выраженность анемии имеет определенное клиническое значение. Наиболее характерными изменениями лейкоцитарной формулы крови при сепсисе являются лейкоцитоз с нитрофильным сдвигом, редкое «омоложение» формулы и токсическая зернистость. Иногда динамика лейкоцитарной реакции имеет волнообразный характер: начальный лейкоцитоз сменяется лейкопенией, а затем вновь наблюдается быстрое нарастание лейкоцитоза. Грамотрицательный сепсис протекает с менее выраженным лейкоцитозом, значительное нарастание числа лейкоцитов при грамотрицательном сепсисе является плохим прогностическим признаком. Наиболее значительное изменение лейкоцитарной реакции наблюдают при септическом шоке. У больных с почечной недостаточностью довольно часто фиксируют нейтропению вплоть до агранулоцитоза. Возможны различные варианты изменений реакции лейкоцитарной формулы при сепсисе. Наиболее часто встречается миелоидная реакция, характеризующаяся увеличением количества в периферической крови незрелых форм лейкоцитов. Нередко отсутствуют промежуточные формы между незрелыми лейкоцитами и зрелыми лейкоцитами. Моноцитарная реакция сравнительно редко встречается и сопровождает стрептококковый сепсис. Колебания лейкоцитарного индекса интоксикации у септических больных соответствуют изменениям клинической картины и степени выраженности эндогенной интоксикации. Развитие синдрома системного воспалительного ответа характеризуется рядом ответных реакций — гемодинамической, метаболической и гормональной. Среди лабораторных данных у больных сепсисом большего внимания заслуживают показатели водно-электролитного гомеостаза: несоответствие между объемом сосудистого русла и объемом циркулирующей крови. Изменения в метаболизме при синдроме системного воспалительного ответа можно представить в следующем виде. I. Метаболизм белков: — перераспределение протеинов и аминокислот на глюконеогенез; — повышенный синтез острофазовых белков и цитокинов; — преобладание распада белковых субстанций (катаболизм, несмотря на повышенный синтез белка) — отрицательный азотистый баланс. II. Метаболизм углеводов: — повышенная толерантность клеток периферических тканей к инсулину и глюкозе; — возрастание скорости продукции глюкозы гепатоцитами с 2,5 до 4,4–5,1 мг (кг)/мин; — мобилизация аминокислот из миоцитов скелетной мускулатуры и висцеральных клеток на глюконеогенез; — сочетание толерантности периферических тканей к глюкозе и активного глюконеогенеза. III. Метаболизм липидов: — активизация липолиза; — снижение утилизации жирных кислот и триглицеридов тканями; — снижение активности липопротеинлипазы. В течение ДВС-синдрома при сепсисе обычно различают две фазы, из которых каждая имеет специфическую клинико-лабораторную картину. Для оценки прогноза лечения сепсиса используют различные шкалы или отдельные показатели. Наиболее привлекательными являются шкалы SAPS II — упрощенная шкала острых физиологических изменений. Система SAPS II основана на результатах Европейско-Североамериканского многоцентровового исследования и состоит из 5 частей: — оценка физиологических функций; осуществляется на основании показателей, полученных в первые 24 ч пребывания больного в отделении интенсивной терапии; наихудшее значение каждого показателя, выраженное в баллах, суммируют для получения оценки тяжести состояния пациента; — оценка тяжести по шкале Глазго; — тип поступления больного в отделение интенсивной терапии; — сопутствующая хроническая патология; — возрастные показатели больного. Конечный результат оценки состояния больного по системе SAPS II проводят на основании суммы баллов, полученных из слагаемых по всем перечисленным разделам системы. Прогностически неблагоприятными являются значения системы SAPS II более 50 баллов; максимальный уровень летальности наблюдают при 90 баллах и выше.
Профилактика и лечение На догоспитальном этапе оказывается неотложная медицинская помощь, объем которой зависит от наличия различных симптомов и синдромов. При гипертермии вводятся жаропонижающие средства (50 %-ный раствор анальгина внутримышечно), литические смеси, антибиотик широкого спектра действия. На госпитальном этапе проводят: — санацию очага инфекции и всего организма; — коррекцию нарушений функций жизненно важных органов, а также сдвиги метаболического характера; — стимуляцию ответной реакции организма на внутренние инфекции. Для санации очага инфекции хирургически обрабатывают гнойные раны и метастатические очаги с максимальным удалением некротических тканей и гноя, дренированием перфорированными полиэтиленовыми дренажами, длительным промыванием полостей растворами антисептиков, последующим наложением первичных, отсроченных первичных или вторичных швов. В алгоритме диагностики даются рекомендации по терапии и контролю за проводимым лечением. Тем не менее многие специалисты предпочитают антибактериальную терапию комбинированными препаратами, либо антибиотиками с широким спектром действия либо несколькими препаратами разных групп с учетом их синергетического действия на данную флору. Лечение сепсиса предусматривает массивную антибактериальную терапию, определяемую видом предполагаемого возбудителя. При неустановленном возбудителе назначается курс эмпирической антибактериальной терапии. Применяются цефалоспорины III–IV поколения — цефоперазон, цефепим и др. Часто в сочетании с аминогликозидами (амикацин, гентамицин, нетромицин) могут использоваться. пенициллины широкого спектра действия (пиперациллин, тикарциллин и др.). Оценивать эффективность антибактериальной терапии необходимо по улучшению субъективного состояния, стабилизации давления, снижению температуры, уменьшению высыпаний на коже. Инфузионная терапия направлена на: — дезинтоксикацию с использованием метода форсированного диуреза; — поддержание объема циркулирующей жидкости; — коррекцию гипопротеинемии и анемии. Применяется внутривенное питание, плазма; вводятся препараты: глюкоза, гемодез, децинон, котрикал, витамины и др. Она должна еще способствовать улучшению периферического кровоснабжения, реологических показателей крови и предупреждать агрегацию форменных элементов крови в капиллярах. В последние годы считается патогенетически обоснованным применение гипербарической оксигенации в лечении сепсиса, что следует использовать и в комплексной терапии. Иммунокорригирующая терапия: — в остром периоде направлена на создание иммунной защиты (гипериммунная плазма, иммуноглобулин, бактериофаг, лизоцим, УФО и лазерное облучение крови; — в восстановительном периоде проводят стимулирующее лечение: иммуномодуляторы и адаптогены (Т-активин, вилозен, продиогиозан и др.) под контролем иммунограммы. Проводится посиндромная терапия. Профилактика должна складываться из мероприятий по профилактике госпитальной инфекции, раннего распознавания, рационального лечения гнойных заболеваний а также послеоперационных гнойных осложнений.
СИБИРСКАЯ ЯЗВА
ОпределениеСибирская язва (антракс), или карбункул злокачественный, — острая бактериальная зоонозная инфекция, характеризующаяся интоксикацией, развитием серозно-геморрагического воспаления кожи, лимфатических узлов и внутренних органов и протекающая в виде кожной (с образованием в большинстве случаев специфического карбункула) или септической формы.Этиология и эпидемиология Сибирская язва, известная с древнейших времен под названиями «священный огонь», «персидский огонь» и другими, неоднократно упоминалась в сочинениях античных и восточных писателей и ученых. Подробное описание клиники этой болезни было сделано французским врачом С. Мораном в 1766 г. В дореволюционной России ввиду преимущественного распространения в Сибири это заболевание получило название сибирской язвы, когда русский врач С. С. Андреевский (1788 г.) описал в сочинении «О сибирской язве» крупную эпидемию этой инфекции в западносибирских губерниях, а в опыте самозаражения установил идентичность сибирской язвы животных и человека и доказал возможность ее передачи от животных к людям. Возбудитель заболевания был почти одновременно описан в 1849–1850 гг. сразу тремя исследователями: Ф. Поллендером, Ф. Брауэллем и К. Давеном. В 1876 г. Р. Кох выделил его в чистой культуре. Из всех патогенных для человека микробов возбудитель сибирской язвы был открыт первым. Общепринятое на сегодняшний день наименование сибирской язвы — антракс; в переводе с греческого означает «уголь»: такое название было дано по характерному угольно-черному цвету сибиреязвенного струпа при кожной форме болезни. Возбудитель сибирской язвы — бацилла антрацис. Она представляет собой крупную спорообразующую грамположительную палочку размером 5—10 х 1–1,5 мкм. Бациллы сибирской язвы хорошо растут на мясопептонных средах, содержат капсульный и соматический антигены и способны выделять экзотоксин,представляющий собой белковый комплекс, состоящий из вызывающего отек протективного и летального компонентов. Сибиреязвенная бактерия вне организма при доступе кислорода воздуха образует споры, вследствие чего обладает большой устойчивостью к высокой температуре, высушиванию и дезинфицирующим веществам. Споры могут сохраняться годами; пастбище, зараженное испражнениями и мочой больных животных, может долгие годы сохранять сибиреязвенные споры. Вегетативные формы сибиреязвенной палочки быстро погибают при кипячении и воздействии обычных дезинфектантов. При автоклавировании споры при температуре 110 °C гибнут лишь через 40 мин. Сухой жар при температуре 140 °C убивает споры через 2,5–3 ч. Прямые солнечные лучи споры сибирской язвы выдерживают в течение 10–15 суток. Спороцидным действием обладают также активированные растворы хлорамина, горячего формальдегида, перекиси водорода. Источником инфекции являются больные домашние животные: крупный рогатый скот, лошади, ослы, овцы, козы, олени, верблюды, свиньи, у которых болезнь протекает в генерализованной форме. Описаны отдельные случаи заболевания сибирской язвой диких животных. Сибирская язва у животных характеризуется следующими особенностями: — короткий инкубационный период, обычно не превышающий 3–4 дней; — выраженная клиника в виде тяжелого лихорадочного состояния, упадка сердечно-сосудистой деятельности, менингеальных явлений, кровавого поноса и рвоты; — стремительное развитие инфекционного процесса, заканчивающегося гибелью животных в течение, как правило, первых 2–3 суток. Эпизоотии сибирской язвы территориально привязаны к почвенным очагам — хранилищам возбудителей, которым французские крестьяне в свое время дали очень выразительное название «проклятые поля». Первичные почвенные очаги образуются в результате непосредственного инфицирования почвы выделениями больных животных на пастбищах, в местах стойлового содержания животных, в местах захоронения трупов (скотомогильники) и т. п. Вторичные почвенные очаги возникают путем смыва и заноса спор на новые территории дождевыми, талыми и сточными водами. Вообще же принято выделять три типа очагов сибирской язвы: профессионально-сельскохозяйственные, профессионально-индустриальные и бытовые. Для первого типа очагов характерна летне-осенняя сезонность, остальные возникают в любое время года. Человек заражается сибирской язвой контактным (наиболее распространенный путь передачи инфекции), алиментарным, воздушно-пылевым и трансмиссивным путями. Кроме непосредственного контакта с больными животными, заражение может произойти при участии большого числа факторов передачи. К ним относятся: выделения и шкуры больных животных, их внутренние органы, мясные и другие пищевые продукты, почва, вода, воздух, предметы внешней среды, обсемененные сибиреязвенными спорами. В трансмиссивной передаче возбудителя известное значение имеют кровососущие насекомые (слепни, мухи-жигалки). Восприимчивость к сибирской язве у человека не зависит от возрастных, половых и других физиологических особенностей организма; она связана с путями заражения и величиной инфицирующей дозы.
Патогенез и патанатомия Входными воротами возбудителя сибирской язвы обычно является поврежденная кожа. В редких случаях бацилла внедряется через слизистые оболочки дыхательных путей и желудочно-кишечного тракта. На месте внедрения возбудителя в кожу возникает сибиреязвенный карбункул (см.) в виде очага серозно-геморрагического воспаления с некрозом (см.), отеком прилегающих тканей и регионарным лимфаденитом (см.). Местный патологический процесс обусловлен действием экзотоксина сибиреязвенной палочки, отдельные компоненты которого вызывают выраженные нарушения микроциркуляции, отек тканей и коагуляционный некроз. Вне зависимости от входных ворот инфекции первая стадия представляет собой локализованное поражение регионарных лимфатических узлов, вторая стадия — генерализацию процесса. Генерализация инфекции с прорывом возбудителей сибирской язвы в кровь и развитием септической формы происходит при кожной форме сибирской язвы чрезвычайно редко. Сибиреязвенный сепсис (см.) обычно развивается при внедрении возбудителя через слизистые оболочки дыхательных путей или желудочно-кишечного тракта. В этих случаях нарушение барьерной функции трахеобронхиальных или мезентериальных лимфатических узлов приводит к генерализации процесса. Бактериемия и токсинемия могут явиться причиной развития инфекционно-токсического шока (см.). В основе патогенеза лежит действие экзотоксина возбудителя, который состоит по крайней мере из трех компонентов, или факторов: — первого (I) эдематозного (воспалительного) фактора; — второго (II) протективного (защитного) фактора; — третьего (III) летального фактора. Добавление ко II фактору I фактора увеличивает иммуногенные свойства, а добавление III фактора — снижает их. Смесь I и II факторов вызывает увеличение воспалительной реакции и отека за счет увеличения проницаемости капилляров. Смесь II и III факторов усиливает действие летального фактора и приводит к гибели морских свинок, крыс и мышей. Смесь трех факторов сибиреязвенного токсина (I, II, III) оказывает воспалительное (эдематозное) и летальное действие. Патологоанатомическая картина у погибших от сибирской язвы имеет характерные признаки. В кожном очаге отмечаются: резко выраженный воспалительный отек с геморрагическими изменениями окружающих тканей, серозно-геморрагическое воспаление регионарных лимфоузлов и выраженные гиперемия и полнокровие внутренних органов. У умерших от септической формы заболевания выявляют геморрагический синдром (кровоизлияния в миокард, эпикард, слизистые оболочки желудочно-кишечного тракта, легкие), серозно-геморрагический отек и поражения различных органов. Печень, селезенка и брыжеечные лимфоузлы увеличены, в плевральной и брюшной полостях — скопление кровянисто-серозной жидкости. Мозговые оболочки отечны, а множественные геморрагии придают им характерный вид «кардинальской шапочки». Генерализация инфекционного процесса происходит тремя путями: контактным, лимфогенным и гематогенным. В результате генерализации в процесс вовлекаются: клетчатка средостения, легкие, плевра, перикард, пищеварительный тракт, оболочки мозга, сам мозг. Медиастинит, плеврит (см.), перикардит (см.) и прикорневая пневмония (см.) развиваются при гематогенном и лимфогенном пути распространения возбудителя. Поражения желудка и кишечника, мозговых оболочек и мозга обусловлены исключительно гематогенной генерализацией. Морфологической сущностью сибиреязвенного сепсиса (см.) является острое серозно-геморрагическое, геморрагическое и реже — фибринозно-геморрагическое воспаление. Лейкоцитарная реакция в очагах воспаления при сепсисе выражена слабо или отсутствует. В органах иммуногенеза (селезенка, лимфоузлы, вилочковая железа) имеется подавление иммунной защиты организма с замещением лимфоидной ткани макрофагами и наличие примитивной защитной реакции в виде макрофагального незавершенного фагоцитоза возбудителя.
Клиническая картина Продолжительность инкубационного периода колеблется от нескольких часов до 14 дней, чаще составляя 2–3 дня. Заболевание может протекать в локализованной (кожной и висцеральной) или генерализованной (септической) форме.
Сибиреязвенный карбункул
Сибиреязвенный карбункул на лице
Кожная форма сибирской язвы Встречается в 98–99 % всех случаев сибирской язвы. Наиболее частой ее разновидностью является карбункулезная форма, реже встречаются эдематозная, буллезная и эризипелоидная формы заболевания. Поражаются преимущественно открытые части тела. Особенно тяжело протекает болезнь при локализации карбункулов на голове, шее, слизистых оболочках рта и носа. Обычно карбункул (см.) бывает один, но иногда их количество доходит до 10–20 и более. На месте входных ворот инфекции последовательно развивается пятно, папула, везикула, язва. Безболезненное пятно красноватосинего цвета и диаметром 1–3 мм, имеющее сходство со следом от укуса насекомого, через несколько часов переходит в папулу медно-красного цвета. Нарастают местный зуд (см.) и ощущение жжения. Через 12–24 ч папула превращается в пузырек диаметром 2–3 мм, заполненный серозной жидкостью, которая темнеет и становится кровянистой. При расчесывании или самопроизвольно пузырек лопается, и на его месте образуется язва с темно-коричневым дном, приподнятыми краями и серозно-геморрагическим отделяемым. Формирующиеся по краям язвы дочерние везикулы сливаются и увеличивают площадь поражения. Через сутки язва достигает 8—15 мм в диаметре, а дочерние везикулы обусловливают ее дальнейший эксцентрический рост. В результате некроза центральная часть язвы через 1–2 недели превращается в черный безболезненный плотный струп, вокруг которого выражен воспалительный валик красного цвета. Внешне струп напоминает уголек в пламени, что и послужило поводом для названия этой болезни (от греч. anthrax — «уголь»). Это поражение получило название карбункула. Его поперечник может колебаться от нескольких миллиметров до 10 см. Возникающий на периферии карбункула отек мягких тканей захватывает иногда большие участки с рыхлой подкожной клетчаткой, а удары перкуссионным молоточком вызывают его студневидное дрожание (симптом Стефанского). Локализация карбункула на лице весьма опасна, так как отек может распространиться на верхние дыхательные пути с развитием асфиксии (см.). В зоне некроза сибиреязвенный карбункул безболезнен (даже при уколах иглой), что служит важным дифференциально-диагностическим признаком. Эдематозная разновидность сибирской язвы характеризуется развитием отека без наличия видимого карбункула; последний формируется в более поздние сроки болезни и достигает больших размеров. Течение тяжелое. Отек при этой форме очень быстро распространяется: захватывает голову, спускается на шею, грудь, спину, верхние конечности, живот вплоть до паховых складок. В области век и на соответствующей стороне лица отек по мере развития принимает все более твердую консистенцию. Кожа становится напряженной, блестящей, часто принимает красноватый или синюшный оттенок. По мере удаления от лица отек становится все более мягким. С момента вскрытия пузырьков и начала некротизации отдельных участков кожи пораженная область по своему виду уже ничем не отличается от обычного сибиреязвенного карбункула большого размера. Исчезают и клинические особенности эдематозной формы, и в дальнейшем болезнь протекает как типичная карбункулезная разновидность сибирской язвы. При буллезной форме сибирской язвы на месте входных ворот образуются пузыри с геморрагической жидкостью, после вскрытия которых возникают обширные язвенные поверхности, принимающие вид карбункула. В дальнейшем болезнь протекает как и при карбункулезной разновидности сибирской язвы. Особенности эризипелоидной разновидности кожной формы состоят в развитии множественных пузырей с прозрачной жидкостью. После их вскрытия образуются язвы, трансформирующиеся в струп. С момента формирования струпа болезнь по своему дальнейшему течению ничем не отличается от типичной карбункулезной разновидности. Примерно у 80 % больных кожная форма сибирской язвы протекает в легкой и средней тяжести формах; у 20 % — в тяжелой форме. При легком течении болезни синдром интоксикации выражен умеренно, температура тела нормальная или субфебрильная. Струп отторгается к концу 2—3-й недели с образованием гранулирующей язвы, после заживления которой остается плотный рубец. При среднетяжелом и тяжелом течении болезни отмечаются недомогание, разбитость, головная боль, температура повышается до 39–40 °C, нарушается деятельность сердечно-сосудистой системы. При благоприятном исходе температура через 5–6 дней падает критически, происходит обратное развитие общих и местных симптомов, а струп отпадает к концу 2—4-й недели. Тяжелое течение сибирской язвы может осложниться развитием сибиреязвенного сепсиса (см.).
Септическая форма сибирской язвы Клиника генерализации сибиреязвенной инфекции вне зависимости от формы — кожной или висцеральной, а также вне зависимости от места проникновения возбудителя и преимущественного поражения тех или иных органов и систем, при крайнем многообразии проявлений в начальном периоде болезни в терминальной стадии однотипна: она сопровождается выходом в периферическую кровь сибиреязвенных микробов, концентрация которых достигает сотен тысяч и миллионов бактериальных клеток в 1 мм3 крови, что может рассматриваться как сибиреязвенный сепсис (см.), и представляет собой клинику токсико-инфекционного шока: тяжелые нарушения свертывающей и антисвертывающей систем крови, ацидоз, острая почечная недостаточность (см.), падение температуры тела ниже нормы, сильнейшая интоксикация.
Сибиреязвенный менингоэнцефалит. Массы бацилл кольцом окружают сосуд
Септическая форма встречается довольно редко. Заболевание начинается остро, с потрясающего озноба и повышения температуры до 39–40 °C. Наблюдаются выраженные тахикардия (см.), одышка, тахипноэ, боли в груди и кашель с выделением пенистой кровянистой мокроты. Физикально и рентгенологически определяются признаки пневмонии (см.) и выпотного плеврита (см.). При развитии инфекционно-токсического шока (см.) возникает геморрагический отек легкого (см.). Выделяемая мокрота сворачивается в виде вишневого желе. В крови и мокроте обнаруживают большое количество сибиреязвенных бактерий. У части больных появляются боли в животе, присоединяются тошнота, кровавая рвота, жидкий кровянистый стул. В последующем развивается парез (см.) кишечника, возможен перитонит (см.). Обнаруживаются симптомы менингоэнцефалита. Инфекционно-токсический шок, отек и набухание головного мозга, желудочно-кишечное кровотечение и перитонит могут явиться причиной летального исхода уже в первые дни заболевания. Прогноз при кожной форме сибирской язвы обычно благоприятный, при септической форме — во всех случаях серьезный.
Диагностика и дифдиагностика Диагноз ставится на основе клинико-эпидемиологических и лабораторных данных. Лабораторная диагностика включает бактериоскопический и бактериологический методы, а в целях ранней диагностики — иммунофлюоресцентный. Применяют также аллергологическую диагностику сибирской язвы путем внутрикожной пробы с антраксином, дающей положительные результаты после 5-го дня болезни. Материалом для лабораторного исследования являются содержимое везикул и карбункулов, а также мокрота, кровь, испражнения и рвотные массы при септической форме. Сибирскую язву дифференцируют с сапом (см.), банальными фурункулами и карбункулами (см.), чумой (см.), туляремией (см.), рожей (см.), пневмониями (см.) и сепсисом (см.) иной этиологии.
Сибиреязвенная пустула кожи. Масса бацилл в серозном экссудате
Лечение и профилактика Этиотропную терапию сибирской язвы проводят антибиотиками в сочетании с противосибиреязвенным иммуноглобулином. Назначают пенициллин в дозе 6—24 млн ЕД в сутки до купирования симптомов болезни (но не менее 7–8 дней). При септической форме целесообразно использовать цефалоспорины по 4,0–6,0 г в сутки, левомицетина сукцинат натрия по 3,0–4,0 г в сутки, гентамицин по 240–320 мг в сутки. Иммуноглобулин вводят при легкой форме в дозе 20 мл, при среднетяжелой и тяжелой — 40–80 мл. Курсовая доза может достигать 400 мл. В патогенетической терапии используют коллоидные и кристаллоидные растворы, плазму, альбумин, глюкокортикостероиды. Хирургические вмешательства при кожной форме болезни недопустимы: они могут привести к генерализации инфекции. Профилактические мероприятия осуществляют в тесном контакте с ветеринарной службой. Выявленных больных животных следует изолировать, а их трупы сжигать; инфицированные объекты необходимо обеззараживать. Для дезинфекции шерсти и меховых изделий применяется камерная дезинфекция. Лица, находившиеся в контакте с больными животными или заразным материалом, подлежат активному врачебному наблюдению в течение 2 недель. Вводятся противосибиреязвенный гамма-глобулин, антибиотики. Они не вводятся, если прошло более 5 суток после употребления инфицированного мяса или 10 суток после инфицирования кожи в результате контакта с больным животным. Важное значение имеет вакцинация людей и животных сухой живой сибиреязвенной вакциной.
СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА (СПИД)
ОпределениеСиндром приобретенного имммунодефицита (СПИД) — инфекционное заболевание, вызываемое ретровирусом, характеризующееся нарастанием иммунодефицита и присоединением в терминальной стадии оппортунистических заболеваний.В настоящее время термин СПИД применяется для обозначения только одной из стадий ВИЧ-инфекции (см.), а именно: манифестной ее стадии. Другие стадии ВИЧ-инфекции предшествуют стадии СПИДа, поэтому эту последнюю обозначают как конечную, или терминальную, стадию заболевания.
Этиология и эпидемиология Как самостоятельная болезнь СПИД впервые был описан в 1981 г., когда у пяти взрослых мужчин-гомосексуалистов была обнаружена пневмоцистная пневмония (см.), ранее встречавшаяся как вспышечное заболевание у глубоко недоношенных детей или у раковых больных, получавших интенсивную цитостатическую терапию. В 1983 г. французские ученые под руководством Люка Монтанье из лимфатических узлов больных (и американские ученые во главе с Робертом К. Галло из крови больных) выделили возбудитель заболевания — ретровирус, названный позднее вирусом иммунодефицита человека — ВИЧ. В настоящее время известно 5 видов ретровирусов, патогенных для человека. Все они лимфотропные, но три из них вызывают злокачественные заболевания (лейкемии (см.) и лимфомы (см.)) и относятся к подсемейству онковирусов, а два (ВИЧ-1 и ВИЧ-2) относятся к медленным вирусам, или лентивирусам. Источником инфекции является только больной человек. Основными путями передачи инфекции являются: — половой (у взрослых и подростков — гомосексуальный и гетеросексуальный, первый чаще); — гемотрансфузионный (после переливания инфицированной цельной крови или ее компонентов — плазмы, тромбоцитарной, лейкоцитарной или эритроцитарной массы, концентратов крови, факторов свертывания крови); — перинатальный (антенатальный, трансплацентарный — от инфицированной матери; интранатальный — при прохождении ребенка по инфицированным родовым путям матери); — инъекционный и инструментальный — при использовании загрязненных вирусом шприцев, игл, катетеров и т. п.; — трансплантационный (пересадка инфицированных органов, костного мозга, искусственная инсеминация инфицированной спермой); — молочный (заражение ребенка инфицированным молоком матери); — профессиональный и бытовой — заражение через поврежденные кожные покровы и слизистые оболочки людей, контактирующих с кровью или некоторыми секретами (слизью из влагалища, грудным молоком, отделяемым из ран, цереброспинальной жидкостью, содержимым трахеи, плевральной полости и др.) больных ВИЧ-инфекцией. В то же время ВИЧ не передается при бытовых контактах через слюну, слезную жидкость и воздушно-капельным путем, а также через воду или пищу. Инкубационный период от момента заражения до появления первых признаков СПИДа варьирует от нескольких месяцев до 5 лет и более. Большинство детей, родившихся от ВИЧ-инфицированных матерей, заболевают в первые 2 года жизни. Средний инкубационный период при трансплацентарном инфицировании — 3 года, при трансфузионном инъекционном —3,5 года. Сероконверсия (появление в крови антител к ВИЧ от момента инфицирования) обычно развивается через 6—12 недель. ВИЧ по стойкости во внешней среде напоминает вирус гепатита (см.) В: погибает при температуре 57 °C через 30 мин, 70–80 °C — через 10 мин, 100 °C — через 2 мин. Приблизительно через 10 мин вирус инактивируется в присутствии 20 %-ного спирта, эфира или ацетона, 0,2 %-ного раствора гипохлорита натрия. Вирус относительно устойчив к ультрафиолетовым лучам солнечного спектра, ионизирующей радиации.
Патогенез ВИЧ в начале инфекционного процесса избирательно поражает Т-лимфоциты-хелперы, макрофаги и моноциты (предшественники макрофагов). Нарушается нормальное соотношение между ними и супрессорами, цитотоксическими лимфоцитами; величина, равная в норме 1,5–2, становится менее 1. В результате нарушается иммунитет как единая реакция всех его звеньев на попадание в организм материала с генетически чужеродной информацией, и возникает иммунодефицит, проявляющийся в том, что для человека становятся опасными обычные комменсалы, т. е. повседневно окружающие его (и сожительствующие с ним) микроорганизмы — грибы (Candida), вирусы (прежде всего — цитомегаловирус, вирус герпеса), бактерии (стрепто- и стафилококки и др.). Эти инфекции называют оппортунистическими. Кроме того, возникает активная продукция аутоантител, причем не только к клеткам, пораженным вирусом. Также ВИЧ может находиться в дремлющем состоянии и не активизироваться в течение ряда месяцев и даже лет (до 10 лет). Изменчивость свойств вируса в ходе болезни у одного и того же больного, его мутации затрудняют получение стабильной вакцины против ВИЧ.
Клиническая картина Формы ВИЧ-инфекции По данным Центра по контролю за болезнями (США, 1987 г.), выделяют следующие формы ВИЧ-инфекции. I. Класс Р-0. Переменная, неясная инфекция. Дети в возрасте до 1,5 лет, родившиеся от ВИЧ-инфицированных матерей и имеющие антитела к ВИЧ, но клинически здоровые, у которых по общепринятым критериям нельзя диагностировать ВИЧ-инфекцию. II. Класс Р-1. Бессимптомная инфекция. Подкласс А. Нормальные иммунные функции. Подкласс В. Аномальные иммунные функции. Подкласс С. Иммунитет не исследован. III. Класс Р-2. Клинически проявляющаяся инфекция. Подкласс А. Неспецифические находки. Подкласс В. Прогрессирующие неврологические болезни. Подкласс С. Лимфоцитарный интерстициальный пневмонит. Подкласс D. Вторичные инфекционные болезни: — категория D-1 — типичные для ВИЧ-инфекции патологические состояния (кандидоз, криптококкоз, пневмоцистоз и др.); — категория D-2 — рецидивирующие тяжелые бактериальные инфекции; — категория D-3 — другие специфические инфекционные болезни. Подкласс Е. Вторичные опухоли: — категория Е-1 — типичные для ВИЧ-инфекции формы рака (саркома (см.) Капоши, лимфома (см.) мозга, неходжкинские лимфомы); — категория Е-2 — другие опухоли, возможно вторичные по отношению к ВИЧ-инфекции. Подкласс F. Другие болезни, возникшие, возможно, из-за ВИЧ-инфекции (гепатит (см.), кардиопатии, нефропатии, кожные болезни, гематологические расстройства). Нулевая стадия (класс Р-0) — это первый контакт с вирусом, первое выявление инфекции (мононуклеозо- или гриппоподобный синдром). Дальнейшие стадии соответствуют постепенному угнетению иммунной системы. Необходим лабораторный анализ на наличие ВИЧ-инфекции. Вторая стадия — хроническая лимфаденопатия. При третьей стадии уровень Т4-лимфоцитов составляет менее 400 в 1 мкл крови (N-800). Четвертая стадия — выявляются субклинические (бессимптомные) нарушения по типу гиперчувствительности замедленного типа (кожные пробы, реакция бласттрансформации). Пятая стадия — кожные пробы на гиперчувствительность замедленного типа (ГЗТ) отрицательны и (или) развивается кандидозный стоматит (см.) (молочница). Перечисленные симптомы считаются критериями лишь тогда, когда они наблюдаются по меньшей мере в течение 3 месяцев. Шестая стадия, т. е. собственно СПИД: — организм поражают генерализованные оппортунистические инфекции, обусловленные угнетением иммунной системы. СПИД — конечная стадия ВИЧ-инфекции. Системные поражения при СПИДе имеют тройственную природу: — прямое поражение вирусом клеток хозяина и развитие поражений безотносительно к иммунодефициту, вызываемому ВИЧ (например, поражение центральной нервной системы); — формирование под воздействием ВИЧ общего (системного) иммунодефицита, на фоне которого раскрывается патогенный потенциал условно-патогенных возбудителей; — угнетение под воздействием ВИЧ слизистого иммунитета, в связи с чем повышается чувствительность слизистых оболочек желудочно-кишечного тракта и респираторного тракта к воздействию возбудителей оппортунистических и банальных инфекций. В связи с этим целесообразно различать при ВИЧ-инфекции первичные поражения и многочисленные вторичные, характерные для всех систем организма.
Легочная патология Клетки респираторного тракта не инфицируются ВИЧ непосредственно, так что легочная патология при ВИЧ-инфекции является вторичной, развивающейся на фоне генерализованного иммунодефицитного состояния. Наиболее частые формы поражения респираторного тракта у больных СПИДом: I. Трахеиты и бронхиты (см.), вызываемые вирусом простого герпеса 1 и 2 типов, кандидами, аспергиллами. II. Бронхопневмонии (см.): — очаговые, вызванные грибком Candida и бактериями инфлюэнцы, золотистым стафилококком, аспергиллами, криптококками; — паренхиматозные и интерстициальные, вызванные пневмоцистами, цитомегаловирусом, вирусом простого герпеса (герпес симплекс) 1 и 2 типов, криптококками, кандидами, гистоплазмами, кокцидиями, криптоспоридиями, атипичными микобактериями, токсоплазмами. III. Плевриты (см.), вызванные токсоплазмами, кандидами, цитомегаловирусом, легионеллами, аспергиллами, гистоплазмами, кокцидиями. IV. Пиопневмоторакс, вызванный пиогенными бактериями. V. Аллергические заболевания — стронгилоидоз (см.), кандидоз, аспергиллез (см.). VI. Туберкулез (см.) органов дыхания. Герпетические трахеиты и трахеобронхиты (см.) протекают с общеинтоксикационным синдромом, сопровождающимся лихорадкой. Признаки поражения респираторного тракта неспецифичны, а клиническая картина заболевания сходна с другими вирусными поражениями легких. О возможности герпетического трахеобронхита можно думать при наличии у больного одновременно явлений афтозного стоматита (см.), лабиального герпеса (см.), герпетической кожной сыпи или язвенного поражения гениталий. При кандидозе бронхов больных беспокоят кашель со слизистой мокротой и недомогание; далее нарастает слабость, отмечается подъем температуры до 39 °C, количество мокроты увеличивается. Аспергиллезный бронхит (см.) протекает с явлениями бронхиальной обструкции, лихорадочным синдромом, выделением мокроты, содержащей «серые комочки». Пневмоцистная пневмония (см.) протекает с диспноэ, одышкой до 30–40 дыхательных движений в минуту, чувством нехватки воздуха, сухим малопродуктивным кашлем и лихорадкой до 38 °C. Она часто осложняется спонтанным пневмотораксом, пневмомедиастинумом, подкожной эмфиземой. Цитомегаловирусная пневмония (см.) проявляется лихорадкой, одышкой, непродуктивным кашлем, наличием атипичных мононуклеаров в крови, гепатолиенальным синдромом (см.), генерализованной лимфаденопатией, макулопапулезной сыпью, цитомегаловирусным хориоретинитом и возможным развитием судорог при поражении центральной нервной системы. Токсоплазменная пневмония (см.) проявляется диспноэ, выраженной одышкой, сухим непродуктивным кашлем, лихорадкой, внутригрудной лимфаденопатией, плевритом (см.). Криптококкоз (см.) проявляется симптомами выраженной дыхательной недостаточности. Атипичные микобактерии птичьего комплекса отличаются вялым течением и слабо выраженной симптоматикой, проявляющейся диспноэ, лихорадкой, сухим надсадным кашлем, затрудненным дыханием, ознобом, спастическими болями в животе, диареей (см.). Криптоспоридиозная пневмония (см.) проявляется как интерстициальная пневмония (см.), возникающая после продолжительной водянистой диареи. Диссеминированный гистоплазмоз (см.) протекает с диффузным поражением легочной ткани на фоне резкого похудения, лихорадки, гепатолиенального синдрома (см.), лимф аденопатии, гипотензии, анемии (см.), лейкопении, коагулопатии, острой почечной недостаточности (см.). Кокцидиоз возникает на фоне длительного исхудания, лихорадки, выраженного истощения. Отмечаются сухой или продуктивный кашель, диспноэ, выраженные плевральные боли, кроме того, наблюдаются поражения центральной нервной системы, подкожной клетчатки, кожи, костей и суставов, мышц, печени. Стафилококковые пневмонии (см.) начиняются остро, с потрясающего озноба, повышения температуры тела до 39–40 °C, реже — 38 или 41 °C. Больных беспокоят боли при дыхании на стороне пораженного легкого, в боку при движениях тела, отмечаются симптомы выраженной интоксикации, кровохарканье, тяжелая дыхательная недостаточность (диспноэ, цианоз, поверхностное дыхание, раздувание крыльев носа), гемодинамические расстройства (тахикардия (см.), гипотензия), могут развиться коллаптоидное состояние, гепатолиенальный синдром (см.), эмпиема (см.) плевры. Легионеллезная пневмония (см.): продромальный период характеризуется симптомами повышенной утомляемости, снижением аппетита, головными болями, преходящей диареей; период разгара — высокой лихорадкой до 39–40 °C ремиттирующего характера с потрясающими ознобами, интенсивными болями в грудной клетке, нарушением дыхательной функции, тахипноэ, цианозом, острой дыхательной недостаточностью. Кандидозные бронхопневмонии проявляются мучительным «царапающим» кашлем, одышкой, тахикардией, затрудненным дыханием, кровохарканьем. Аспергиллезная бронхопневмония сопровождается симптомами нарушения дыхания без температурной реакции. Стронгилоидоз (см.) легких протекает в виде диффузной интерстициальной пневмонии с развитием бронхо-обструктивного синдрома и гиперэозинофилии крови в сочетании с длительной профузной диареей (см.), дуодено-желчнопузырным синдромом, крапивницей (см.).
Поражения желудочно-кишечного тракта Желудочно-кишечный тракт является одной из главных мишеней для разнообразных оппортунистических инфекций и опухолей у ВИЧ-инфицированных и больных СПИДом. Наиболее частые формы поражения желудочно-кишечного тракта у больных СПИДом: — стоматит (см.) (кандида, герпес симплекс, цитомегаловирус); — эзофагит (см.) (кандида, герпес симплекс, цитомегаловирус); — гастрит (см.) (цитомегаловирус, атипичные микобактерии, криптоспоридии); — энтероколит (см.) (цитоме гало вирус, атипичные микобактерии, криптоспоридии, стронгилоиды, лямблии, амебы дизентерийные, сальмонеллы, шигеллы, кампилобактерии); — колит, проктит (см.) (цитомегаловирус, герпес симплекс, гонококк, хламидии, дизентерийная амеба, клостридии); — гепатит (см.) (цитомегаловирус, атипичные микобактерии, вирус гепатита В); — холецистит (см.), холангит (цитомегаловирус, криптоспоридии). При кандидозном стоматите различают три основные формы поражения желудочнокишечного тракта: — псевдомембранозный кандидоз (молочница); — атрофический кандидоз; — ангулярный хейлит. Герпетический стоматит протекает с образованием множества пузырьков, расположенных на слизистой, которые быстро сливаются и некротизируются с выделением гнойного экссудата. При кандидозном эзофагите пациенты обращают внимание на дисфагию, загрудинные боли, дискомфорт, жжение за грудиной, тошноту. В случае криптоспоридиоза (см.) тонкого и толстого кишечника отмечается непрекращающаяся водянистая диарея (см.), иногда до 150 раз в сутки, ей сопутствуют спастические боли в животе и умеренная лихорадка; быстро уменьшается масса тела. При изоспорозе кишечника отмечаются лихорадка, диарея (см.), стеаторея, потеря массы тела, спастические боли в животе. Диарея иногда носит дизентериоподобный характер. При цитомегаловирусном колите (см.) возникают приступы лихорадки и водянистой диареи, иногда с примесью крови, вздутие живота, схваткообразные абдоминальные боли; диарея (см.) может быть незначительно выраженной или упорной со значительной потерей веса. Атипичный микобактериоз кишечника характеризуется диареей, потерей веса, болями в животе, лихорадкой свыше 38 °C. Вирус простого герпеса чаще вызывает поражение толстой кишки, проявляющееся глубокими дефектами слизистой оболочки. Стронгилоидоз (см.) кишечника протекает с болями в животе, диареей, эозинофилией; стул приобретает гнилостный характер, содержит слизь и кровь; наступают обезвоживание организма, анемия (см.) и кахексия (см.). Кампилобактериальный энтероколит протекает с болями в животе и лихорадкой, стул содержит кровь и гной. Лямблиоз (см.) кишечника протекает с типичными симптомами тошноты, вздутием живота, диареей, спастическими болями в животе, отрыжкой. Поражение прямой кишки, анальной и перианальной областей вирусом простого герпеса сопровождается сильными болями в области ануса, запорами (см.), тенезмами, кровянистыми выделениями, протекает на фоне общей слабости, лихорадки с ознобом, головной боли, паховой аденопатии. Кандидозный проктит (см.) проявляется жжением и дискомфортом в области прямой кишки. Поражения центральной нервной системы при ВИЧ-инфекции могут быть распространенными (диффузными) или локальными. Неврологические расстройства подразделяют на очаговый, или диффузный энцефалит (см.), менингит (см.), ретинопатию, черепную нейропатию, миелопатию. Наиболее частые причины и формы поражения центральной нервной системы у больных СПИДом: — первичные поражения, вызываемые ВИЧ (ВИЧ-энцефалопатия, острый рецидивирующий ВИЧ-менингит, миелопатия); — возбудители вторичных вирусных инфекций (энцефалитов, ретинитов, васкулитов (см.), миелитов) — цитомегаловирус, вирус простого герпеса, герпес зостер и др.; — возбудители вторичных невирусных инфекций (энцефалитов, менингитов, абсцессов) — токсоплазма, криптококк, кандида, гистоплазма, аспергилла, атипичные микобактерии, туберкулезная палочка, листерия; — неопластические процессы — первичная лимфома, метастатическая саркома Капоши; — сосудистые нарушения — инфаркты, геморрагии, васкулиты (см.).
Основные поражения центральной нервной системы Герпетический энцефалит, вызванный вирусом простого герпеса, протекает подостро, атипично, а вирус герпес зостер вызывает два типа поражения: — преимущественное поражение белого вещества мозга; — герпетические васкулиты сосудов головного мозга с характерным поражением глазного нерва и специфической гемиплегией. Герпетический менингит может протекать без менингеальных симптомов; поражение периферической нервной системы герпетического характера протекает по типу полиневритов или полирадикулонейропатии — основные симптомы связаны с развитием вялых параличей, парестезий, боли, гиперестезии или анестезии, снижением или выпадением рефлексов. Церебральный токсоплазмоз (см.) проявляется головными болями, лихорадкой, сонливостью, судорогами, слабостью, гемипарезами, афазией, энцефалопатией, переходящей в кому. Криптококковый менингит протекает подостро и проявляется ухудшением психического статуса, лихорадкой, головными болями, менингеальными знаками, фотофобией. Церебральный аспергиллез (см.) проявляется как менингит, энцефалит или абсцесс мозга. Церебральный туберкулез (см.) проявляется менингитом, энцефалитом, абсцессом мозга.
Диагностика Предварительные критерии у взрослых, по которым можно заподозрить СПИД (критерии ВОЗ): — потеря более 10 % массы тела; — хроническая диарея длительностью более 1 месяца; — длительная (более 1 месяца) лихорадка (перемежающаяся или постоянная). Малые признаки: — персистирующий кашель (более 1 месяца); — генерализованный зудящий дерматит (см.); — рецидивирующий опоясывающий герпес; — кандидоз носоглотки, пищевода; — непрерывно прогрессирующий или диссеминированный простой герпес; — генерализованная лимфаденопатия. Наличие двух больших и одного малого признака при отсутствии убедительных причин подавления иммунитета (злокачественные опухоли, лечение свыше трех месяцев глюкокортикоидами и (или) цитостатиками, радиационное облучение, наследственные иммунодефициты) делает диагноз СПИД очень вероятным. В лабораторной диагностике ВИЧ-инфекции применяют ИФА, иммуноблот, полимеразную цепную реакцию (ПЦР). Лабораторная диагностика СПИД-ассоциируемых инфекций, инвазий и микозов заключается в следующем. Пневмоцистоз. Материалом для исследования служат слизь из горла и гортани, аспираты из бронхов, лаважная жидкость, биоптаты легочной ткани (мазки-отпечатки легочной ткани). Применяют спиртовые методы окраски (по Романовскому-Гимзе, гематоксилин-эозином, по Граму, по Райту и др.) и окончательные, или специфические, методы окраски (окраска толуидиновым синим, серебрением по Гомори). Криптоспоридиоз. Материалом для исследования служат фекалии, рвотные массы, мокрота, лаважная жидкость, биоптаты слизистой кишечника и дуоденальные аспираты. Окрашивают мазки карбол-фуксином по Цилю-Нильсену. Используют флотационные и седиментационные методы обогащения. Изоспороз. Материалом для исследования служат фекалии, дуоденальное содержимое и биоптаты слизистой кишечника. Используют флотационные методы обогащения (по Дарлингу). Акантамебиаз. Материалом для исследования служат соскобы с язвенных поражений роговицы и склеры, спинномозговая жидкость (на наличие вегетативных форм), жидкость передней камеры глаза, биоптаты различных тканей (мозга, роговицы, легких, кожи). Применяется окраска по Гомори. Используют методы культивирования и инокуляции. Бластоцистоз. Материалом для исследования являются фекалии. Применяют методы прямой микроскопии и обогащения. Токсоплазмоз. Материалом для исследования являются биоптаты лимфатических узлов, других органов, в том числе мозга, а также осадок спинномозговой жидкости. Окраска по Романовскому — Гимзе. Применяют кожную пробу для диагностики и различные серологические реакции (РСК, РНГА, ИФА и др.). Микроспоридиоз. Окраска мазков по Гомори и Граму, Гудпасчеру, Романовскому-Гимзе. Лейшманиоз. Материалом для исследования служит пунктат костного мозга. Окраска по Романовскому-Гимзе. Применяют различные серологические реакции (РСК, НРИФ, РНГА, РЭМА (ИФА)). Стронгилоидоз. Материалом для исследования являются фекальные массы, дуоденальное содержимое, мокрота, лаважная жидкость, моча, перитонеальная жидкость. Исследуют микроскопированием после обогащения и серологически — в НРИФ и РЭМА (ИФА). Цитомегаловирусная инфекция. Материалом для исследования являются: моча, слюна, промывные воды желудка, мокрота, лаважная жидкость, вагинальный и цервикальный секрет, кровь, грудное молоко. Исследуют микроскопически и серологически — в РНФ, НРИФ, ПЦР и др.
Лечение Эффективных средств излечения больных СПИДом не найдено, т. е. СПИД — необратимое заболевание. Лечение ВИЧ-инфекции включает создание охранительных режима, противовирусную терапию, профилактику и раннюю терапию вторичных осложнений. Противовирусная терапия проводится при наличии вирусной репликации, концентрация РНК ВИЧ в крови при этом должна быть не менее 5000 копий/мл. Назначаются следующие группы лекарственных средств: — нуклеозидные ингибиторы обратной транскриптазы: зидовудин, диданозин, зальцитобин, ламивудин, ставудин; — ненуклеозидные ингибиторы обратной транскриптазы: невирапин (верамун), делавердин; — ингибиторные протеазы: индинавир (криксиван), саквинавир, нелфинавир. Терапию проводят комбинированно тремя противовирусными средствами — два синтетических нуклеозида сочетают с одним препаратом из группы ингибиторов протеаз. Иммуноглобулин внутривенно при симптоматических формах ВИЧ-инфекции назначают 1 раз в 2–4 недели в дозе 0,5 г/кг. Легочная лимфоцитарная гипертензия и лимфоцитарный интерстициальный пневмонит — показание для назначения преднизолона. Профилактическое лечение пневмоцистной пневмонии — триметоприм и сульфометаксазон или пентамидин. Герпес-инфекция — показание для назначения ацикловира (зовиракс) или видарабина. Цитомегаловирусная инфекция — применяют ацикловир или фоскарнет. Генерализованные кандидозы — назначают дифлюкан или анкотил. Лечение поражений респираторного тракта при СПИДе проводят следующими средствами: — цитомиоловирусная пневмония — ганцикловир по 7,5—10 мк/кг в 3 приема внутривенно на протяжении 10–14 дней; — кандидоз, криптококкоз, гистоплазмоз, кокцидиоз легких — амфотерицин В по 0,3–1 мг/кг внутривенно капельно в течение 2–6 недель или низорал (кетокеназол) по 400 мг в 2 приема per os в течение 10–14 дней; — токсоплазмоз легких — хлоридин по 75 мг в первый день, далее по 25 мг в день в течение 6 недель и более; сульфадимезин по 4–8 г в день per os на протяжении 6 недель и более; — стрептококковая или стафилокковая пневмония — ампициллин по 2–3 г в 4–6 приемов внутримышечно в течение 10–14 дней или бензилпенициллин по 6—30 млн ЕД 6 раз в день внутривенно, внутримышечно в течение 10–14 дней, или цепарин (кефзол) по 2–6 г в 2–3 приема внутримышечно, внутривенно в течение 10–14 дней; — легионеллезная пневмония — эритромицин по 4 г внутривенно и рифампицин по 1,2 г в 2 приема в течение 10–14 дней; — атипичный микобактериоз птичьего комплекса — ансамицин в таблетках per os, амикацин по 10 мг/кг внутривенно и клофазимил по 1 таблетке в течение 6 недель и более. Лечениепоражений желудочно-кишечного тракта или СПИДе проводится следующими средствами: — кандидозный стоматит — нистатин по 400 тыс. ЕД 4–6 раз в день в течение 7—10 дней, кетокеназол по 200–400 мг в течение 2–7—10 дней; — кандидозный эзофагит — амфотерицин В по 0,3–0,6 мг/кг внутривенно в течение 7—10 дней или кетокеназол по 400 мг 2 раза в день, длительно; — цитомегаловирусная инфекция (стоматит, эзофагит, колит) — ганцикловир по 5 мг/кг 2 раза в день внутривенно на протяжении 3 недель, затем по 5–7 мг/кг в день 5 дней в неделю длительно; — герпетическая инфекция (гингивиостоматит, проктоколит) — ацикловир по 5—10 мг/кг 3 раза в день внутривенно, затем подкожно и 1–3 %-ная оксолиновая мазь местно 2–3 раза в день; — атипичный микобактериоз (гастроэнтерит) — изониазид по 300 мг в сутки длительно; этамбутол по 15–25 мг/кг в сутки, длительно; — криптоспоридиоз — спирамицин по 1 г в сутки в 3 приема в течение 5—14 дней; — изоспороз — метронидазол по 2 г в сутки в течение 30 дней и по 1 г в сутки на протяжении 100 дней; бисептол по 480 мг в течение 4—10 дней, затем по 240 мг в течение 2—28 дней. Ведение пациентов с ВИЧ-инфекцией имеет свои особенности. Профилактические прививки ВИЧ-инфицированным детям особенно необходимы. Противопоказана лишь живая полиомиелитная вакцина (оральная), ее заменяют на внутривенную вакцину (убитую). Все остальные вакцины, используемые у здоровых детей, также вводят и ВИЧ-инфицированным. ВОЗ не рекомендует воздерживаться от вакцинации БЦЖ у ВИЧ-инфицированных детей, но считает, что при симптоматической ВИЧ-инфекции ее делать не следует. При контакте с больным ветряной оспой ВИЧ-инфицированные дети должны получать специфический иммуноглобулин внутривенно. При наличии раны, опасной по столбняку, ребенок должен получить внутривенно противостолбнячный иммуноглобулин (или внутримышечно). Контакт с больным корью — показание для введения иммуноглобулина внутримышечно. Госпитализация ВИЧ-инфицированных больных должна происходить в инфекционные отделения (лучше всего в специализированные отделения или палаты). Все процедуры и манипуляции персонал должен осуществлять в одноразовых перчатках. При отсутствии повреждения кожных покровов (раны, экземы и др.) медицинскому персоналу достаточно мытья рук после контакта с мочой, фекалиями, рвотными массами, слезами, назальным и оральным секретом детей с ВИЧ-инфекцией. При повреждении перчаток и кожи с последующим контактом с кровью больного ВИЧ-инфекцией проводится превентивное лечение азидотимидином в течение первых 72 ч после контакта; это может предотвратить развитие ВИЧ-инфекции. Прогноз: обычно между выявлением первых клинических признаков СПИДа и смертью больного проходит 2–3 года, хотя есть и долгожители — 5 лет и более. Большинство детей, инфицированных перинатально, умирают в возрасте до 5 лет.
Профилактика Специфическая иммунопрофилактика ВИЧ-инфекции не разработана. Профилактика ВИЧ-инфекции включает: — пропаганду здорового образа жизни; — безопасный секс с использованием презервативов; — контроль за донорской кровью и ее препаратами, донорскими органами; — использование одноразовых шприцов или систем для трансфузий; — анонимное обследование; — обследование доноров крови, лиц из групп риска; — обследование на антитела к ВИЧ всех беременных; — контроль деторождения у инфицированных женщин и отказ от грудного вскармливания их детей. Профилактика инфицирования в медицинских учреждениях. Наибольшую опасность распространения ВИЧ представляют кровь и слюна. Необходимо тщательно избегать случайных повреждений кожных покровов острыми инструментами. Все манипуляции с больными, а также работу с биологическими материалами от больного медицинские работники проводят в резиновых перчатках и масках. Кроме того, необходимо соблюдать все меры предосторожности, предусмотренные при работе с больными вирусным гепатитом В. Обязательно тщательное мытье рук после снятия перчаток и индивидуальной одежды перед тем, как покинуть помещение, где проводится работа с потенциально инфицированным материалом. Госпитализация больных СПИД- и ВИЧ-инфицированных должна осуществляться так, чтобы предотвратить распространение инфекции, а также с учетом требований по содержанию больных с измененным поведением при поражении центральной нервной системы. При лечении больных с ВИЧ-инфекцией необходимо применять инструментарий и шприцы только одноразового использования. При загрязнении предметов обихода, постельных принадлежностей, окружающей среды выделениями больного необходимо проводить обработку дезинфицирующими средствами (0,2 %-ный раствор гипохлорита натрия, этиловый спирт). При соблюдении элементарных правил предосторожности общение с больными является полностью безопасным. При ВИЧ-инфицировании беременных производится прерывание беременности при согласии матери или родоразрешение путем кесарева сечения, отказ от грудного вскармливания ребенка. Новорожденные наблюдаются в течение 1 года. В случае выявления ВИЧ-инфицированного проводится эпидемиологическое обследование для выявления источника заражения и обследование контактировавших лиц. ВИЧ-инфицированные предупреждаются об уголовной ответственности за распространение ВИЧ-инфекции.
СИРИНГОМИЕЛИЯ
ОпределениеСирингомиелия — хроническое заболевание, характеризующееся образованием полостей в спинном и продолговатом мозге с развитием обширных зон выпадения болевой и температурной чувствительности.
Этиология и патогенез Причины болезни не выяснены. Процесс разрастания глиозной ткани с последующим распадом и образованием полостей локализуется преимущественно в задних рогах шейного утолщения спинного мозга и распространением на ствол мозга.
Клиническая картина Выпадение болевой и температурной чувствительности на обширных участках кожи, чаще всего на руках и туловище («куртка», «полукуртка»), что обусловливает многочисленные безболезненные ожоги и травмы. Атрофия кистей с выпадением рефлексов, сочетающаяся со спастическим парезом ног и синдромом Горнера (птоз, миоз, ангидроз). Указанная симптоматика характерна для наиболее часто встречающейся шейной формы болезни. При распространении процесса на ствол мозга (сирингобульбия) появляются нистагм, бульбарные расстройства (нарушения глотания, речи) и зоны диссоциированной анестезии в наружных отделах лица. Реже нарушения чувствительности и атрофии возникают в нижних отделах туловища и ногах. Значительно выражены трофические расстройства — утолщение и цианоз кожи на кистях, безболезненные панариции с мутиляцией концевых фаланг. Иногда возникают грубые артропатии (чаще локтевого и плечевого суставов) с расплавлением суставных костных элементов и их секвестрацией: сустав резко увеличен в объеме, движения в нем безболезненны и сопровождаются своеобразным шумом из-за трущихся друг о друга костных фрагментов (нейродистрофический сустав Шарко). Поражение пирамидных пучков в некоторых случаях, помимо нижнего парапареза, вызывает нарушение функции мочевого пузыря. Как правило, сирингомиелии сопутствуют аномалии развития (так называемые дизрафические признаки): кифосколиоз, непомерно длинные руки, полимастия и др. Болезнь обычно проявляется в позднем детстве и тянется многие годы. Прогрессирование очень медленное, поэтому больные редко оказываются обездвиженными. Болезнь медленно прогрессирует, однако на продолжительность жизни не влияет. В далеко зашедших стадиях значительную угрозу представляет урологическая инфекция. При сирингобульбии возможны расстройства дыхания из-за стридора, вызванного параличом гортани.
Диагностика и дифдиагностика Спинномозговая жидкость не изменена. Сирингомиелический синдром, неотличимый подчас от сирингомиелии, наблюдается при костных аномалиях краниовертебрального перехода, а также после перенесенного менингита. В отличие от сирингомиелии опухоли спинного мозга обычно проявляются более локальной и быстро нарастающей симптоматикой. При боковом амиотрофическом склерозе двигательные расстройства никогда не сопровождаются выпадением чувствительности.
Лечение Если при миелографии обнаруживается блокада подпаутинного пространства, то показано хирургическое опорожнение кисты. В подавляющем большинстве случаев лечение ограничивается массажем и лечебной физкультурой. Больным рекомендуют остерегаться повреждения кожных покровов. Эффект от рентгенотерапии пораженной области спинного мозга сомнительный.
СИНОВИТ
ОпределениеСиновит — воспаление синовиальной оболочки сустава с образованием в нем выпота.
Этиология Поражается чаще всего коленный сустав. Нередко возникает после травмы сустава, а также при артрите, аллергии, гемофилии. При попадании инфекции развивается гнойный синовит.
Клиническая картина и диагностика Различают острый и хронический синовит. При остром синовите наблюдаются боль, повышение местной температуры, выпот в суставе. Хронический синовит характеризуется нерезкой болью, периодическим накоплением выпота в суставе; при длительном существовании развивается деформирующий артроз. Диагноз ставят на основании клиники, однако причину синовита выявить нередко трудно. Рентгенографическое исследование исключает костные повреждения. Диагноз уточняют путем исследования жидкости, полученной при пункции сустава (вид клеток, количество белка, микрофлора).
Лечение Помимо терапии основного заболевания, применяют пункцию сустава, накладывают давящую повязку, производят иммобилизацию конечности гипсовой лонгетой, назначают физиотерапию. При остром синовите лечение проводят в стационаре.
СИФИЛИС
ОпределениеСифилис — инфекционное заболевание, передающееся половым путем, вызывается бледной трепонемой и имеет характерную периодизацию в течении. Сифилис склонен к хроническому и рецидивирующему течению, поражает все органы и системы.В настоящее время заболеваемость сифилисом возросла настолько, что он вновь считается банальной инфекцией. Особую трудность в диагностике представляют стертые и атипичные формы заболевания, получившие широкое распространение в связи с использованием пациентами для самолечения различных антибактериальных препаратов.
Этиология, эпидемиология, патогенез ипатанатомия Возбудитель сифилиса — бледная трепонема, относящаяся к роду трепонем, семейству спирохетацеа (спирохетозы (см.)) — проникает в организм человека через поврежденную кожу или слизистые оболочки. Источник инфекции — больной человек. Заразными считаются больные с первичным и вторичным (свежим и рецидивным) сифилисом, а также ранним врожденным и ранним скрытым сифилисом. Особенно активно возбудитель выделяется при первичном сифилисе — со дна язв при твердом шанкре. Основной путь заражения — прямой половой контакт с больным, однако в настоящее время увеличилось число случаев бытового сифилиса (заражение через предметы обихода). Различные биологические жидкости — слюна, пот, моча, слезы, грудное молоко, кровь — являются заразными у больных ранним сифилисом, так как в местах образования секрета и на их пути могут располагаться сифилитические очаги, откуда бледные трепонемы проникают в секрет. Врожденный сифилис имеет трансплацентарный путь инфицирования.
Бледная спирохета в электронном микроскопе
Бледные спирохеты в «темном поле»
Трепонемы (от латинского treponema — вид спирохет) — это тонкие и гибкие клетки с 12–14 завитками. Они не имеют видимой в микроскоп осевой нити или осевого гребня. Концы трепонем заострены или закруглены. Величина трепонем составляет 10–13 мкм в длину и 0,13—0,15 мкм в ширину. Трепонемы подвижны (обладают вращательным, поступательным, сгибательным и волнообразным движением), плохо воспринимают красители. По методу Романовского-Гимзы окрашиваются в бледно-розовый цвет; это объясняется незначительным содержанием нуклеопротеидов в их теле. К патогенным для человека трепонемам относятся: — бледная трепонема, вызывающая у человека венерический и врожденный сифилис во всех странах мира и беджель (невенерический сифилис) на юго-востоке средиземноморской зоны; — трепонема пертену, вызывающая фрамбезию в тропических странах Африки, Юго-Восточной Азии, на западных тихоокеанских островах и в тропических странах Южной Америки; — трепонема каратеум, вызывающая пинту, или карате, в Мексике, Центральной Америке, тропических странах Южной Америки, в Вест-Индии и на Кубе. Под влиянием факторов внешней среды и лечебных препаратов трепонемы в ряде случаев свертываются в клубки, образуя цисты, покрытые непроницаемой муциноподобной оболочкой; они длительное время могут находиться в организме больного в латентном состоянии; при благоприятных условиях цисты превращаются в зерна, а затем в типичные спиралевидные трепонемы. Цистообразование — одна из защитных форм существования трепонем, позволяющая им противостоять действию препаратов, применяемых для лечения больных сифилисом. Возбудитель сифилиса чувствителен к высыханию, колебаниям температуры. Вне человеческого организма бледная трепонема быстро гибнет, при соприкосновении с обычными дезинфицирующими средствами (70 %-ный спиртовой раствор, сулема, даже мыльная вода) погибает мгновенно, нагревание до 48 °C губит трепонемы через 30 мин. Бледная трепонема паразитирует не в крови, а в тканях. Поэтому для диагностики исследуют тканевую жидкость эрозий и язв первичного периода и жидкость, добытую путем пункции лимфатических узлов. Неповрежденные кожа и слизистые оболочки непроницаемы для бледных трепонем. Внедрение их в организм происходит обычно через небольшие повреждения кожи и полости рта, а также других участков (очень редко). Повреждения кожи на руках опасны для медицинского персонала, особенно стоматологов, хирургов и акушеров-гинекологов. Подобные мелкие повреждения рекомендуется заклеивать липким пластырем. Бледные трепонемы разносятся по организму с током крови и лимфы, активно размножаются и периодически попадают в различные органы и ткани, что вызывает разнообразные клинические проявления заболевания. Со временем нарастает сенсибилизация организма, что вызывает бурную реакцию даже при наличии небольшого числа возбудителей. Реакциями сенсибилизации обусловлена динамика симптомов при длительном течении заболевания. В течении сифилиса выделяют первичный, вторичный и третичный периоды; выделяют также скрытый и висцеральный сифилис и сифилис нервной системы (прогрессивный паралич и спинная сухотка). Инкубационный период в среднем составляет 20–40 дней. На месте внедрения трепонемы образуется небольшая эрозия — так называемый твердый шанкр. Никаких клинических симптомов, указывающих на заражение, нет. Первичный период — период от появления твердого шанкра до возникновения первых высыпаний. Продолжительность первичного периода — 6–7 недель. Обычно через неделю после появления твердого шанкра увеличиваются регионарные лимфоузлы. У некоторых больных отмечается воспаление лимфатического хода, идущего от шанкра к увеличенным лимфатическим узлам (сифилитический лимфангит). Других симптомов нет. Иногда наблюдаются общее недомогание, слабость, умеренная лихорадка, анемия (см.). Твердый шанкр (первичную сифилому) называют еще первичный склероз; он имеет вид плотного инфильтрата с поверхностной эрозией или язвой на месте внедрения трепонемы, дно и края язвы хрящеподобной консистенции. К концу первичного периода увеличиваются все лимфатические узлы (сифилитический полиаденит). Первичный сифилис подразделяют на: — первичный серонегативный — первые 3–4 недели после появления твердого шанкра, когда серологические реакции еще отрицательные; — первичный серопозитивный — следующие 3–4 недели, когда реакция уже положительная; — скрытый период. Помимо типичных, имеются и бессимптомные формы, которые впоследствии приводят к возникновению поздних нервных и висцеральных проявлений заболевания. Во вторичном периоде на коже и слизистых оболочках появляются различные высыпания, которые могут исчезать, сыпь у одних больных может быть обильной и яркой, у других — слабой и незаметной. Кроме кожи и слизистых, могут поражаться кости, внутренние органы, нервная система. Лимфатические узлы увеличены. Серологические реакции положительны почти у всех больных. Длительность вторичного период составляет три года. В ходе вторичного периода сифилиса различают вторичный свежий сифилис (первая вспышка сыпи), вторичный рецидивный сифилис (повторные вспышки сыпи) и латентный, или скрытый, сифилис. При вторичном сифилисе наблюдается генерализация процесса с высыпанием на коже и слизистых оболочках сифилид (розеолы, папулы, пустулы, широкие кондиломы). Третичный сифилис (гуммозный) отмечается не у всех больных. Для него характерно наличие в любых органах и тканях очагов поражения, которые приводят к тяжелому нарушению функций. Течение третичного сифилиса длительное. В коже, подкожной клетчатке, внутренних органах образуются папулы, бугорки, гуммы или гуммозные инфильтраты, склонные к распаду. Различают активный третичный сифилис и скрытый третичный сифилис. Серологическая проба часто отрицательная. Для третичного сифилиса характерно образование солитарных гумм и гуммозных инфильтратов в одном или нескольких органах. Особенно часто поражаются начальные отделы аорты. Переход воспалительного процесса со стенки аорты на аортальные клапаны приводит к формированию сифилитического аортального порока. Поздние проявления сифилиса характеризуются поражением нервной системы — нейросифилисом — в виде спинной сухотки и прогрессивного паралича, когда трепонемы в большом количестве локализуются в мозговой ткани, обусловливая глубокие органические и функциональные изменения центральной нервной системы. Многие ученые эти понятия относят к четвертичному сифилису. Врожденный сифилис возникает при внутриутробном (трансплацентарном) заражении плода и подразделяется на ранний и поздний. При раннем врожденном сифилисе кожные сифилиды (диффузные папулезные высыпания) сочетаются с деструктивным остеохондритом и межуточным воспалением внутренних органов с появлением в них «милиарных гумм». Печень при этом становится коричневой и плотной («кремниевая печень», легкие — плотными и белыми («белая пневмония»). Изменения при позднем врожденном сифилисе сходны с таковыми при приобретенном третичном сифилисе.
Клиническая картина Клиническая классификация сифилиса выделяет следующие формы: — сифилис первичный серонегативный; — сифилис первичный серопозитивный; — вторичный свежий сифилис; — вторичный рецидивный сифилис; — третичный активный сифилис; — третичный скрытый сифилис; — скрытый сифилис; — сифилис плода; — ранний врожденный сифилис; — поздний врожденный сифилис; — скрытый врожденный сифилис; — висцеральный сифилис; — сифилис нервной системы. Различают несколько вариантов течения сифилиса: — обычное течение; — злокачественное течение, которое характеризуется, помимо резко выраженной сыпи, различными расстройствами общего состояния (анемия (см.), кахексия (см.), головные боли); — стертое течение, когда вторичные рецидивы отсутствуют, а кожные проявления ограничиваются только шанкром и розеолой; — скрытый сифилис (длительное бессимптомное течение) — случаи заболевания, протекающие без видимых явлений, но дающие положительные серологические реакции; — сифилис без твердого шанкра, или трансфузионный сифилис: если инфекция заносится в кровь, то она проявляется через 2–2,5 месяца сыпями вторичного периода. Через несколько часов с момента внедрения трепонем в кожу или слизистую оболочку они попадают в лимфатические и кровеносные сосуды и быстро распространяются по всему организму. При этом лимфатическая система служит еще и местом интенсивного размножения трепонем. Несмотря на быструю диссеминацию возбудителя, клинически болезнь долго не проявляется. Длительность инкубационного периода зависит от многих факторов, таких как возраст больного, сопутствующие хронические заболевания, интоксикации, лечение препаратами группы имидазола и мышьяка, лечение кортикостероидами и небольшими дозами антибиотиков; кроме того, может извращаться клиника. В настоящее время отмечается некоторое удлинение инкубационного периода, особенно при лечении антибиотиками каких-либо параллельно текущих заболеваний (ангины (см.), пневмонии (см.) и т. д.). Укорочение инкубационного периода наблюдается при массивном обсеменении, когда входных ворот 2 и более.
Сифилитический панартериит (поражение всех слоев стенки) основной артерии мозга со значительным разрастанием внутренней оболочки и сужением просвета
Первичный сифилис Первичный период характеризуется наличием твердого шанкра и поражением лимфатических узлов. У отдельных людей наблюдаются общие симптомы: повышение температуры, анемия (см.), лейкоцитоз. Начало первичного периода сифилиса характеризуется возникновением первичного аффекта на месте внедрения бледной трепонемы через кожу или слизистые оболочки. Развитие его начинается с возникновения красноватого воспалительного пятна, которое затем инфильтрируется и принимает вид папулы. Затем происходит эрозирование ее поверхности. Твердый шанкр может развиваться в любом участке кожи или слизистых, но только на месте внедрения инфекции. Сформированный шанкр — гладкая безболезненная эрозия или язва с правильными округлыми или овальными очертаниями синюшно-красного цвета. Под ней при пальпации ощущается плотноэластический инфильтрат. Дно эрозии гладкое, блестящее, края приподняты над уровнем кожи. Примерно у 40 % больных эрозия трансформируется в более или менее глубокую язву с плотными краями и дном, покрытым грязно-серым налетом, здесь присутствует обильное отделяемое с примесью гноя. Различают разновидности шанкра по локализации — половой и внеполовой; по количеству — одиночный и множественный; по размеру — карликовый (1–3 мм) и гигантский (1,5–2 см); по очертаниям — округлый, овальный, полулунный, щелевидный и герпетический; по характеру поверхности — эрозивный, язвенный и корковый. Размеры, форма и глубина язвы зависят в большой степени от состояния макроорганизма, наличия сопутствующей патологии и локализации первичного аффекта. Бывает скрытый шанкр. У мужчин он локализуется в уретре, на головке полового члена, крайней плоти, в ладьевидной ямке, а симптомами напоминает подострую гонорею (см.). Выделения цвета мясных помоев, увеличение паховых лимфоузлов, уплотнение полового члена помогают установить диагноз. У женщин твердый шанкр чаще локализуется на шейке матки и на половых губах, не вызывая никаких ощущений. Обычно происходит увеличение глубоких тазовых лимфатических узлов. Однако возможна перигенитальная и перианальная локализация, а также локализация на коже лица, груди и пр.
Первичная сифилома (эрозивная форма) на половых органах мужчины
Первичная сифилома на красной кайме губ
Первичная сифилома (эрозивная форма) на половых органах женщины
Кроме типичных твердых шанкров, различают и атипичные шанкры: — индуративный отек, когда уплотнение под эрозией распространяется далеко за ее пределы, обычная локализация — нижняя губа, крайняя плоть, большие половые губы; — шанкр-панариций, внешне напоминающий панариций (см.). Локализуется на дистальной фаланге указательного пальца — она припухает, становится багрово-красной, мягкие ткани плотно инфильтрированы. Шанкр-панариций имеет вид глубокой с неровными краями и дном язвы, покрытой грязно-серым налетом. Сходство с панарицием усиливают боли; — шанкр-амигдалит локализуется на миндалинах, последние распухают, краснеют, уплотняются, повышается температура, появляются симптомы интоксикации, увеличиваются лимфоузлы. И только плотность миндалин, характерный вид лимфатических узлов, неэффективность лечения, применяемого при ангине (см.), позволяют поставить диагноз; — смешанный шанкр развивается чаще при одновременном заражении сифилисом и мягким шанкром (см.). В результате разницы в длительности инкубационного периода обеих инфекций вначале развивается язва мягкого шанкра, которая начиная с 4—5-й недели постепенно уплотняется; очищается, края ее выравниваются и принимают вид, свойственный твердому шанкру, а через неделю появляются и характерные сопутствующие фоны. Развитие признаков вторичного сифилиса запаздывает на 3–4 месяца, то же самое может быть и серологически. При присоединении вторичной гнойной инфекции твердый шанкр может осложниться развитием острого воспаления по периферии. При внедрении фузоспириллезного симбиоза возникает некроз (см.) дна и краев (гангренизация твердого шанкра). Повторная гангренизация (фагеденизм) наблюдается обычно у алкоголиков и приводит к значительному разрушению тканей. Экстрагенитальная локализация твердого шанкра представляет наибольшую эпидемическую опасность для бытового заражения, кроме того, она трудна в диагностике. Например, шанкр-панариций практически не отличается от банального панариция. Регионарный лимфаденит (см.) (сопутствующий бубон) — это постоянный признак первичного сифилиса. Развивается всегда в лимфатических узлах, близко лежащих от места расположения шанкра. Например, при локализации шанкра на половых органах бубон развивается в паховых областях, при локализации на соске — в подмышечной впадине. Лимфатические узлы увеличиваются, безболезненные, плотные, подвижные, кожа не изменена. Сопутствующий бубон может нагнаиваться. Выраженный регионарный лимфаденит развивается через 5–8 дней после появления твердого шанкра. Лимфатические узлы могут быть увеличены в различной степени, однако всегда остаются безболезненными. В последнее время увеличилось число случаев заболевания без выраженного регионарного лимфаденита (до 10 %). С другой стороны, отмечены и гиперергические реакции — резкое увеличение лимфатических узлов, образование их конгломератов, явления периаденита, выраженная болезненность. При регионарном лимфангите между твердым шанкром и сопутствующим бубоном под неизмененной кожей прощупывается плотный, подвижный и безболезненный тяж. Толщина его колеблется от толщины струны до гусиного пера. Его обычная локализация — спинка полового члена. Лимфангит в настоящее время — большая редкость, воспаление лимфатических сосудов на протяжении от твердого шанкра до регионарного лимфоузла встречается лишь у 8 % больных. Чаще всего обнаружить его у мужчин можно при локализации твердого шанкра на головке полового члена в виде плотноэластического тяжа, болезненного при пальпации, на спинке полового члена (дорсальный лимфангит). Сифилитический полиаденит — после возникновения бубона постепенно увеличиваются все лимфоузлы. Лимфатические узлы плотные, подвижные, безболезненные. Полностью развивается полиаденит к концу первичного периода. Это один из важнейших признаков вторичного сифилиса, когда отмечается умеренное увеличение всех групп лимфоузлов, сопровождающееся нерезкими общими явлениями — субфебрильной (редко фебрильной) температурой, общей слабостью, недомоганием, повышенной утомляемостью.
Вторичный сифилис Вторичный период характеризуется наличием сыпей. Чаще они поверхностные, их появление не сопровождается повышением температуры, сыпи появляются исподволь, на протяжении нескольких недель, имеют медно-красную или «ветчинную» окраску. При свежем вторичном сифилисе количество высыпных элементов велико, они расположены симметрично и вне мест раздражений, не сливаются; при рецидивах их меньше, расположены они асимметрично, образуя причудливые фигуры в виде колец, дуг, гирлянд.
Шанкр на лобке и папулезная сыпь на коже
Сифилитическая розеола
Папулезный сифилид
Сифилиды вторичного периода кожи и слизистых оболочек бывают пятнистыми (розеолезными), узелковыми (папулезными), гнойничковыми (пустулезными), пигментными (лейкодерма); встречается также облысение (алопеция). Сифилитическая розеола — это пятна бледно-розового цвета размером с чечевицу, неправильной или округлой формы, не возвышающиеся над кожей. При надавливании исчезают, не шелушатся. Располагаются на боковых поверхностях туловища, животе, спине, бывают сливные. Элементы держатся в течение 2–3 недель, затем исчезают. Без лечения могут неоднократно рецидивировать. Различают несколько видов розеолы: свежая возвышающаяся, сливная, зернистая, шелушащаяся, рецидивная. Папулезный сифилид встречается в форме сухих и влажных папул. Сухие папулы в свою очередь бывают лентикулярные (чечевицеобразные), резко отграниченные, плотные на ощупь и возвышающиеся над кожей. Папулезный милиарный сифилид — конусообразные, плотные, бледно-розовые папулы величиной от макового зерна до булавочной головки с маленькой чешуйкой на поверхности. После лечения остаются пигментные пятна. Себорейные папулы встречаются на участках кожи, богатых сальными железами: на коже лба, в носогубных и подбородочных складках. После исчезновения также остаются коричневые пятна и шелушения. Локализуются на боковых поверхностях туловища, груди, животе и на половых органах; если папулы локализуются на лбу, поражение называется «короной Венеры». Могут встречаться высыпания на ладонях и подошвах. Среди влажных сифилидов большое значение имеет мокнущий папулезный сифилид. Выглядит как папула при локализации в естественных складках кожи (половые органы у женщин, мошонка, подмышечные впадины, кожа заднего прохода). Папула бывает синего цвета, с обильным серозным отделяемым. Без лечения существует долго. Сифилитические папулы часто в зависимости от локализации меняют структуру поверхности (на слизистых — эрозии, омозолелые, с шелушением на ладонях и подошвах, вегетирующие в складках половых органов и анусе — широкие кондиломы). Сифилитические пустулы (пустулезный сифилид) в настоящее время встречаются достаточно редко, проявляются в виде гнойничков различного размера на плотном основании, имеют тенденцию к изъязвлению. Пустулезный сифилид развивается у ослабленных и истощенных людей. Элементы сифилиса склонны к гнойному расплавлению.
Сифилитические бляшки на кисти
Сифилиды могут локализоваться на слизистых зева, гортани. Различают эритематозную сифилитическую ангину (см.); она проявляется резко отграниченной синюшнокрасной эритемой, поверхность богата трепонемами и поэтому заразна. Папулезная сифилитическая ангина — папулы в зеве и на мягком небе разрастаются, сливаются, поэтому очень беспокоят больных. Могут появиться осиплость и афония. Сифилитическая лейкодерма — пятнистая или «кружевная» гипопигментация кожи шеи. Лейкодерма чаще встречается у женщин. На боковых поверхностях шеи развиваются белесые круглые и овальные образования. Сифилитическая алопеция — быстро развивающееся мелкоочаговое или диффузное поредение волос, в том числе бровей, ресниц, усов, бороды без наличия воспалительных изменений кожи. Алопеция встречается в течение первого года болезни. На голове возникают круглые проплешины величиной с монету. При поражении внутренних органов часто в процесс вовлекаются печень, почки, желудок, кости, суставы. В ряде случаев отмечается развитие периоститов, остеопериоститов (ночные боли в костях, чаще всего ног), полиартритических синовитов с гидрартрозами, гепатитов (см.), нефритов (см.), гастритов (см.) со свойственной им неспецифической симптоматикой, полиневритов (см.) и менинговаскулярного сифилиса. На всем протяжении вторичного сифилиса серологические реакции положительны. Однако встречаются и серонегативные формы заболевания. Значительные трудности в диагностике представляют собой стертые и малосимптомные формы вторичного сифилиса. Вторичный сифилис без лечения длится 3–4 года и характеризуется волнообразным течением. Высыпания обычно проходят самостоятельно через 2–3 месяца, после чего на неопределенное время наступает латентный период. После различных провоцирующих моментов — физического или нервного перенапряжения, параллельно текущих заболеваний, различного рода травм — высыпания появляются вновь. Начинается рецидив вторичного сифилиса, который затем вновь сменяется латентным периодом. Между вторичным и третичным периодами существует скрытая стадия болезни — латентный период, когда трепонемы в организме существуют в виде цистных форм.
Третичный сифилис Третичным сифилисом могут поражаться любые органы и ткани, но чаще сосудистая и нервная система, кожа и кости. Третичный период сифилиса возникает при отсутствии адекватного лечения на 4—5-м году болезни и длится до конца жизни. Однако чаще всего он развивается гораздо позже. При бессимптомном течении третичный сифилис может быть выявлен через 30 и более лет от момента заражения. В 97 % случаев между вторичным и началом третичного сифилиса имеется скрытый период. Проявления третичного сифилиса отличаются наибольшей тяжестью, однако в последнее время отмечается более благоприятное течение. В отличие от вторичного третичный сифилис имеет некоторые особенности: — высыпания не имеют распространенного характера; — высыпания изъязвляются и приводят к разрушению тканей; — отмечается поражение жизненно важных органов; — после излечения остаются рубцы; — симметричности высыпаний нет. Третичный период сифилиса имеет ряд характерных особенностей. Прежде всего это волнообразное течение с редкими рецидивами и многолетними латентными периодами. Другой особенностью является то, что сифилиды третичного периода малозаразны, так как в них находится очень небольшое количество бледных трепонем. Третичные сифилиды развиваются и регрессируют медленно (месяцы и годы). Островоспалительные явления отсутствуют, субъективные ощущения — тоже. Локализуются третичные сифилиды преимущественно в местах травм. Третичные сифилиды бывают бугорковыми и узловыми. Бугорковый сифилид — скопление клеточного инфильтрата в толще дермы. Он выступает над поверхностью кожи, имеет полушаровидную форму и плотноэластическую консистенцию, его размер — от просяного зерна до горошины. Цвет бугорков — от темно-красного (сначала) до бурого. Поверхность первоначально гладкая, затем шелушащаяся или покрытая корочкой. Разрешение бугорковых сифилидов протекает как рассасывание или изъязвление с последующим рубцеванием. Рубцы имеют характерный мозаичный вид с депигментацией по краям. Субъективные ощущения у больных отсутствуют, что позволяет им не обращаться к врачу. Различают следующие виды бугоркового сифилида: сгруппированный, площадкой и карликовый ползучий.
Сгруппированный бугорковый сифилид
Сифилитическая гумма — безболезненный узел в толще подкожной клетчатки. Гуммы обычно бывают одиночными, локализованы чаще всего на голове, голенях и предплечьях, но может встречаться и несколько гумм различной локализации. В развитии гуммозного сифилида выделяют следующие стадии: развитие и рост, размягчение, спаивание с кожей, изъязвление, расплавление и отторжение гуммозного стержня с последующим рубцеванием. Гумма достигает значительных размеров (до грецкого ореха), при спаивании с кожей приобретает синюшную окраску, затем в центре происходит изъязвление с отделением небольшого количества клейкой жидкости и образованием некротического гуммозного стержня. Гуммозная язва безболезненна, имеет четкие границы и валикообразные края. Гуммозный стержень представлен серо-желтой некротической тканью, после его отторжения язва очищается, и формируется очень стойкий, втянутый в центре рубец звездчатой формы. Иногда гумма может быть поражена вторичной гноеродной инфекцией. В ряде случаев гуммы могут сливаться между собой с образованием гуммозных инфильтратов — очагов с четко отграниченными краями, развивающимися так же, как и одиночная гумма. Через некоторое время язва очищается, уплотняется и заживает круглым рубцом, который затем становится бесцветным (звездчатым). Часто язвы захватывают не только кожу, но и мышцы, надкостницу, кости, кровеносные сосуды, вызывая их разрушение. Или, наоборот, гуммы из глубоких тканей иррадиируют в кожу. Бывает, что гумма рассасывается. Среди гуммозных сифилид слизистых оболочек выделяют гуммы носа, мягкого неба, языка и глотки. При гуммах носа гуммозный процесс начинается с перегородки носа. Усиливаются слизистые выделения, которые становятся гнойными и превращаются в массивные, резко пахнущие, трудноотделяемые корки. Дыхание через нос затруднено, при удалении корок возникают носовые кровотечения. Разрушается сошник, и образуется седловидный нос с вдавленным широким переносьем. Гумма мягкого неба наблюдается в виде утолщений мягкого неба с изменением окраски, в дальнейшем наступает распад и образование прободных отверстий, что происходит неожиданно. Гуммозное поражение языка бывает в двух формах: — гуммозный глоссит (см.) в виде одиночного узла; — склерозирующий глоссит, при котором язык полностью гипертрофируется, становится плотным и бугристым. Затем язык сморщивается и уменьшается в размерах. Затрудняются речь и процесс пережевывания. Возникает гнусавость голоса, а при глотании происходит попадание пищи в полость носа. Гуммами глотки поражается задняя стенка глотки. Гумма вызывает боль при глотании в период изъязвления, после чего появляется рубец. Образуются деформации зева, глотание затрудняется. Третичный сифилис внутренних органов характеризуется наиболее тяжелым поражением внутренних органов, нервной системы, костей и суставов. Поражение внутренних органов может сочетаться с поражением кожи и слизистых оболочек. Чаще всего страдает сердечно-сосудистая система, затрагиваются сосуды, что приводит к необратимым последствиям. Повреждается средняя оболочка восходящей части грудной аорты (мезаортит). Развивается он через 10–12 лет после заражения, чаще у мужчин. Из органов пищеварения поражается печень. Это проявляется также через 10–12 лет в виде гумм или хронического гепатита (см.). Могут поражаться желудок, кишечник, легкие, почки, яички, кости — в виде остеопороза (см.), остеомиелита (см.) и др. Поражения внутренних органов при третичном сифилисе в настоящее время в 90 % случаев оказываются поражениями сердечно-сосудистой системы. 4–6 % случаев — это редкие поздние поражения печени, на долю прочих органов приходится 1–2 %. При кардиоваскулярном сифилисе отмечаются: сифилитический аортит (см.), миокардит (см.) и их осложнения — аневризма (см.) аорты и стеноз устьев коронарных артерий. Сифилитический аортит неосложненный — довольно позднее проявление висцерального сифилиса. Больные могут жаловаться на общую слабость, одышку, сердцебиения, боли и чувство сдавления за грудиной и в области сердца. При объективном обследовании отмечаются систолический шум на аорте, акцент второго тона, «звенящий» металлический тон. Перкуторно определяется расширение границ восходящей части аорты — справа от грудины во II–III межреберных промежутках притупление перкуторного звука на 1–2 см в сторону от грудины. В крови имеют место неспецифические воспалительные реакции. Возможна повышенная температура. Стандартные серологические реакции при сифилитическом аортите бывают положительными в 50–75 % случаев. Для своевременной диагностики (до развития осложнений) семейный врач должен помнить о возможности сифилитического поражения сердечно-сосудистой системы. Сифилитический аортит может осложниться стенозом устьев коронарных артерий. Эти проявления возникают при распространении процесса на область сердца. При вовлечении аортальных клапанов развивается их недостаточность. В отличие от атеросклеротических поражений, при сифилисе процесс не захватывает всей длины венечных артерий, ограничиваясь только их устьями. В ряде случаев это поражение может приводить к интрамуральным инфарктам. Ведущим симптомом является упорная стенокардия (см.), не поддающаяся традиционному лечению коронаролитиками. Нередко может присоединяться сердечная недостаточность, чаще по левожелудочковому типу. Аневризма аорты — наиболее тяжелое осложнение аортита — в настоящее время встречается не так часто. В 2/3 случаев аневризма локализуется в восходящем отделе аорты. Она имеет мешотчатую форму. Нередко больные не предъявляют никаких жалоб. Иногда могут быть жалобы на одышку и загрудинные боли. Симптоматика зависит от размеров и локализации аневризмы. Могут отмечаться: пульсация в межреберных промежутках справа от грудины, перкуторное увеличение границ аорты, разница в пульсе (меньшее наполнение и отставание пульсовой волны со стороны аневризмы), а также симптомы сдавления органов средостения. Кроме сдавления жизненно важных органов, при аневризме возможен ее прорыв в трахею, бронхи, легкие, плевральнуюполость, полость средостения, пищевод, приводящие, как правило, к быстрому летальному исходу. К прорыву аневризмы нередко приводят чрезмерные физические нагрузки. При неосложненном аортите прогноз благоприятный, особенно при проведении адекватной противосифилитической терапии, которая способна предупредить развитие осложнений. Сифилитический миокардит может развиться самостоятельно либо на фоне предшествующего аортита. Больные жалуются на общую слабость, одышку, нерезкие боли в области сердца. Неспецифическая симптоматика затрудняет диагностику. Гуммы миокарда обычно бывают единичными и встречаются крайне редко. Очень важное диагностическое значение имеет пробное противосифилитическое лечение при выраженном клиническом эффекте от него. Исходом гуммы может быть образование аневризмы сердца или рубца.
Нейросифилис К проявлениям позднего нейросифилиса относят поздний сифилитический менингит (см.), менинговаскулярный сифилис, сифилис сосудов мозга, спинную сухотку (табес), прогрессивный паралич, гуммы головного мозга. Сифилитический менингит протекает со скудными жалобами (обычно на незначительную головную боль, шум в ушах, снижение слуха и головокружение). Диагностика основывается на данных анамнеза и патологических изменениях ликвора в сочетании с другими проявлениями третичного сифилиса. Диффузный менинговаскулярный сифилис обычно формируется после наличествующего сифилитического менингита. Менингеальные симптомы у больных не выражены, чаще отмечаются проявления, сходные с симптоматикой гипертонического криза и преходящих нарушений мозгового кровообращения. Могут отмечаться поражения черепно-мозговых нервов, нарушения чувствительности, расстройства рефлексов, появление патологических рефлексов, гемипарезы, эпилептиформные припадки, альтернирующий синдром, расстройства речи и памяти, общая астенизация. Табес (спинная сухотка, сухотка спинного мозга). Локализация поражения — задние корешки и столбы, а также оболочки спинного мозга. Может быть изолированное поражение шейного и поясничного отделов, а также их сочетанное поражение. Патогенез обусловлен одновременно протекающими процессами деструкции нервной ткани и пролиферации на ее месте соединительной. Деструктивные изменения необратимы. Больные жалуются на сверлящие кинжальные боли длительностью до нескольких суток, парестезии в определенных областях туловища (пациент четко указывает локализацию). Отмечаются тазовые расстройства — нарушения мочеиспускания, дефекации, импотенция (см.) у мужчин. Отмечаются парезы черепно-мозговых нервов (косоглазие (см.), девиация языка), анизокория или миоз. Симптом Аргайла-Робертсона — патогномоничный признак табеса: отсутствие или очень вялая реакция зрачков на свет при сохраненной реакции конвергенции. Нередко он может быть единственным симптомом табеса. Табетическая атрофия (см.) зрительных нервов обычно прогрессирует и в течение нескольких месяцев приводит к полной слепоте. Отмечаются атаксия, неустойчивость в позе Ромберга, нарушения при пальце-носовой и пяточно-коленной пробах, а также расстройства глубокого мышечно-суставного чувства — больной не может определить направление пассивных движений в пальцах ног. Выражены нарушения сухожильных рефлексов — они могут быть повышены, снижены, неравномерны либо вообще отсутствовать. К трофическим нарушениям при табесе можно отнести безболезненные прободные язвы стоп. Стандартные серологические реакции у 20–50 % больных спинной сухоткой отрицательны, а спинномозговая жидкость не затронута. В настоящее время описанная выше клиника табеса почти не встречается, однако необходимо помнить об этой форме третичного сифилиса в связи с неуклонным ростом заболеваемости этой инфекцией. Клинические проявления табеса значительно смягчились, сейчас среди этих больных нет лежачих. Из классических симптомов при современном малосимптомном табесе имеют место зрачковая анизокория, симптом Аргайла-Робертсона, слабовыраженные атактические явления, нарушения сухожильных рефлексов и атрофия зрительного нерва. Прогрессивный паралич может быть обнаружен через 15–20 и даже 40 лет после заражения. В основе лежит поражение вещества головного мозга, вызванное воспалительными изменениями мелких сосудов, чаще всего капилляров мозга. В конечном итоге развивается атрофия клеток коркового слоя. В клинике доминируют выраженные психические нарушения, приводящие к полному распаду личности. Наряду с ними имеют место различные неврологические симптомы (зрачковые, Аргайла-Робертсона, нарушения двигательной и чувствительной сфер, анизорефлексия, эпилептиформные припадки). В 90 % случаев имеют место положительные серологические реакции крови и в 100 % случаев — в спинномозговой жидкости. В настоящее время случаи прогрессивного паралича крайне редки, однако следует иметь в виду, что резкие изменения психики больных, при которых удается проследить время начала (родственники могут назвать число и месяц, с которого «человека словно подменили»), могут указывать на начало прогрессивного паралича. Прогноз при рано начатой пенициллинотерапии благоприятный. В далеко зашедших случаях заболевание необратимо. Гумма головного и спинного мозга в настоящее время практически не встречается. Гумма головного мозга может быть как единичной, так и множественной. Обычно клинически имеются признаки повышения внутричерепного давления, неврологическая симптоматика зависит от локализации и размеров гуммы. В крови обычно определяются положительные серологические реакции. Следует рассматривать возможность развития гумм головного мозга при дифференциальной диагностике с объемными процессами другой этиологии. Гумма спинного мозга проявляется различной неврологической симптоматикой в зависимости от уровня ее локализации и величины. Обычно она развивается из мозговой оболочки и обусловливает появление корешковых симптомов и парестезий. Затем развиваются и нарастают чувствительные и двигательные нарушения. В течение нескольких месяцев может развиться клиника полного поперечного поражения спинного мозга.
Врожденный сифилис Сифилис передается по наследству. Мать является источником инфекции, в плод трепонема попадает через плаценту на 4—5-м месяце беременности. Сифилис — частая причина произвольного прерывания беременности вследствие гибели плода в утробе матери. Заражение происходит трансплацентарно от больной сифилисом матери. Бледная трепонема из пораженной плаценты проникает в организм плода через пупочные вены или лимфатические щели пупочных сосудов. Нормальная неповрежденная плацента для бледной трепонемы непроницаема. Клинические проявления врожденного сифилиса разнообразны. Различают сифилис плода, ранний врожденный и поздний врожденный сифилис. Сифилис плода может привести к ранней гибели плода (на 3—4-м месяце), главным образом от поражения материнской части плаценты. Плоды выкидываются в мацерированном состоянии. Смерть наступает от нарушения питания. Типичные изменения наблюдаются лишь у плодов старше 5 месяцев; в их внутренних органах находят большое количество трепонем, чаще поражается печень (увеличивается), изменения происходят в селезенке, легких, поджелудочной железе. При раннем врожденном сифилисе типичен внешний вид новорожденных: они худые, хилые, голос слабый, лицо морщинистое, землистое, дряблое, конечности синие, череп деформирован. Но иногда ребенок бывает и внешне нормальным, симптомы болезни проявляются позже. Чаще первые признаки болезни появляются в первые 2 месяца жизни ребенка. Твердого шанкра нет. На коже имеются специфические высыпания, пустулезные и папулезные сифилиды. Кожа на лице, подбородке, губах, подошвах, ягодицах утолщается, она напряжена, красного цвета. Брови и ресницы выпадают. Сифилитическая пузырчатка характеризуется наличием пузырей на ладонях и подошвах величиной с чечевицу, жидкость в них сначала прозрачная, затем желтоватая. Сифилитический ринит (см.) характеризуется слизистыми выделениями, переходящими в гной, засыхающий в корки, затруднены дыхание и сосание. Процесс переходит на хрящ, в результате чего формируется седловидный нос. Ногти становятся ломкими, приобретают миндалевидную форму. Отмечается также поражение костей. Остеохондрит Вегнера (расстройства эндохондрального окостенения) сопровождается постоянным плачем, усиливающимся ночью, развивается паралич Парро, руки и ноги не двигаются, будучи поднятыми падают, как парализованные. Поражаются печень и селезенка — они увеличиваются, уплотняются, их края закругляются. Развивается асимметрия лица: «олимпийский лоб», ягодицеобразный череп. У детей в возрасте 1–2 лет проявления скудны. Возникают мокнущие и эрозивные папулы в окружности заднего прохода, половых органах, углах рта. Поражаются внутренние органы, нервная система. Серологически могут быть отрицательные ответы. Поздний врожденный сифилис проявляется в возрасте 6—15 лет. Диагностируется или у больных, которые в прошлом имели симптомы раннего врожденного сифилиса, или у пациентов, у которых болезнь протекала латентно. Клинически это проявляется симптомами на коже, слизистых оболочках и во внутренних органах идентично проявлениям, которые наблюдаются у взрослых больных с третичным сифилисом. У больных могут образовываться гуммы или бугорковые сифилиды на коже и слизистых оболочках. Часто поражаются кости, суставы, внутренние органы и нервная система. К безусловным признакам позднего врожденного сифилиса относится триада Гетчинсона: наличие зубов в форме отвертки; светобоязнь и помутнение роговицы; поражение лабиринта — головокружение, шум в ушах, ослабление слуха вплоть до глухоты. Основные признаки: высокое «готическое» небо, утолщение грудинного конца ключицы, радиальные рубцы Робинсона-Фурнье, различные зубные дисплазии. Возможны также ягодицеобразный череп, деформация носа, саблевидные голени, рубцы на коже, вокруг углов рта, губ и на подбородке, седловидный нос. Поражения нервной системы проявляются в виде эпилепсии (см.), расстройств речи, спинной сухотки. Постановке диагноза помогают результаты серологических реакций.
Гумма. Поздний врожденный сифилис
Врожденный сифилис может наблюдаться в третьем поколении, описаны случаи сифилиса у четвертого поколения.
Осложнения Осложнениями твердого шанкра чаще всего являются баланит, фимоз и парафимоз. Баланит — воспаление головки полового члена, баланопостит — воспаление головки и внутреннего листка крайней плоти. У женщин соответственно наблюдаются вульвит (см.) и вульвовагинит (см.). Фимоз — сужение отверстия препуциального мешка. При сифилисе фимоз является следствием баланопостита: крайняя плоть отекает и не может быть отодвинута за головку полового члена, из препуциального мешка выделяется сливкообразный или жидкий гной. При фимозе не всегда можно прощупать под крайней плотью твердый шанкр. При парафимозе крайняя плоть с суженным в результате фимоза отверстием, будучи насильственно отодвинутой, не возвращается в нормальное положение, вызывая ущемление головки и ее отек.
Диагностика и дифдиагностика Диагностика сифилиса строится на клинических проявлениях, результатах конфронтации (обследование предполагаемого источника), однако без лабораторного подтверждения диагноз не имеет юридической силы. Используют классическую реакцию Вассермана, экспресс-методы, однако более точны и специфичны реакция иммунофлюоресценции, которая положительна во всех стадиях болезни, и реакция иммобилизации бледной трепонемы, положительная при вторичном и третичном сифилисе. Используют скрининговые, экспертные и референтные схемы иммуноферментной диагностики сифилиса. Повторные положительные серологические реакции при отсутствии клинических проявлений позволяют выявить скрытый (латентный) сифилис. Нейросифилис выявляется в результате тщательного неврологического обследования. При свежем сифилисе подтверждением диагноза может служить обнаружение бледных трепонем в отделяемом твердого шанкра и пунктате регионарных лимфоузлов. Дифференцирование твердого шанкра с другими поражениями половых органов вызывает трудности, так как существует много заболеваний с различной этиологией, которые имеют сходство с сифилисом. Любые эрозивные или язвенные поражения на половых органах, в промежности и в полости рта требуют лабораторных исследований для исключения сифилитической природы заболевания. Дифференцируют сифилис со следующими заболеваниями: экземой (см.), нейродермитом (см.), зудом различной локализации, плоским лишаем (см.), бластомикозом, простым герпесом (см.), остроконечными бородавками (см.), афтами, туберкулезными язвами и др. Диагноз ставят на основании анализа, осмотра, клинических проявлений, бактериологического подтверждения. С первого раза не всегда удается выделить бледную трепонему, поэтому при отрицательном анализе следует еще раз провести бактериологическое исследование. Дифференциальный диагноз вторичного периода проводят с розовым лишаем (см.), токсикодермией (см.), крапивницей (см.), корью (см.), краснухой (см.), брюшным и сыпным тифом (см.), бруцеллезом (см.). При диффузном менинговаскулярном сифилисе проводят дифференциальную диагностику с преходящими нарушениями мозгового кровообращения на фоне атеросклероза (см.) (она основана на нестойкости симптоматики и благоприятном течении при сифилисе, поскольку сифилитические инфильтраты сосудов проходят без лечения, явления ишемии не приводят к последующим тромбозам, т. е. инсультов (см.) не бывает). Сифилис сосудов мозга также требует дифференциальной диагностики с гипертонической болезнью (см.) и атеросклеротическим поражением мозговых сосудов. В процесс вовлекаются только сосуды, поэтому патологических реакций ликвора не отмечается. В диагностике приходится опираться только на реакции крови. Без соответствующей терапии развиваются стойкие изменения неврологического статуса: моно-, пара- и гемиплегии, афазия (см.), поражения ЧМН ишемического генеза, парестезии, патологические рефлексы, различные психоэмоциональные расстройства, эпилептиформные припадки (малые или генерализованные). Сифилис сосудов головного мозга нередко может сочетаться с другими формами нейросифилиса, в частности с табесом.
Лечение Условием выздоровления больных является рано начатое и умело проводимое строго индивидуальное лечение с учетом переносимости лекарственных препаратов. Целесообразно сочетание специфической и неспецифической терапии, кроме того, применяют стимулирующую терапию. В настоящее время в основном применяются антибиотики, препараты висмута и йода. Из группы пенициллинов используют в основном бензилпенициллин, оксациллин, ампициллин, карбенициллин. Эти препараты хорошо всасываются в кровь и быстро выводятся. Чтобы постоянно поддерживать концентрацию антибиотика в крови, назначают введение препарата внутримышечно каждые 3 ч. Используют препараты пенициллина длительного действия — бициллин (разовая доза у взрослых — 1,2 млн. ЕД, которую вводят на протяжении 6 дней). Разовая доза бициллина-1 вводится в половинном количестве раздельно в обе ягодицы в виде суспензии в стерильной дозе или физрастворе. Бициллин-3 вводят по 100 тыс. ЕД 1 раз в 3–4 дня. Бициллин-5 — по 3 млн. ЕД 1 раз в 5 дней. За 30 мин до первой инъекции назначают введение антигистаминных средств (димедрол, диазолин, супрастин, тавегил, пипольфен). Эритромицин назначают по 0,5 г 4 раза в день за 30 мин до приема или через 1–1,5 ч после приема пищи. Суммарная доза препарата определяется врачом. Тетрациклины нужно принимать во время еды или после еды по 0,5 г 4 раза. К тетрациклинам длительного действия относится доксициклин, который принимается в зависимости от стадии болезни. Олететрин назначают по 0,5 г 4 раза в день. Суммарная доза устанавливается врачом. Больным сифилисом подбираются те антибиотики, которые подходят данному больному с учетом их переносимости. Антибиотики не следует применять больным сифилисом, страдающим бронхиальной астмой (см.), крапивницей, сенной лихорадкой (см.) и другими аллергическими состояниями. Бициллин нельзя назначать больным с гипертонической болезнью, перенесшим инфаркт миокарда, с заболеваниями желудочно-кишечного тракта, заболеваниями желез внутренней секреции, кроветворной системы, туберкулезом. Не рекомендуется ослабленным больным, лицам старше 55 лет и детям применять разовую дозу свыше 1,2 млн ЕД. В настоящее время широко используют антибиотики нового поколения и антисептики. Доксилан блокирует синтез белка в клетках чувствительных микробов. Применяется внутрь. Взрослым и детям с массой больше 50 кг в первый день назначают 200 мг в 1–2 приема, затем по 100–200 мг в день на протяжении не менее 10 дней. Ретарпен — антибактериальное средство. Блокирует синтез клеточной оболочки микробов, вызывая их гибель. Применяется внутримышечно, детям до 12 лет — 1,2 млн МЕ каждые 2–4 недели, взрослым — 2,4 млн МЕ 1 раз в неделю. При первичном серопозитивном и вторичном свежем сифилисе — 2.4 млн МЕ дважды, с интервалом в 1 неделю. При вторичном рецидивном и скрытом раннем сифилисе первую инъекцию производят в дозе 4,8 млн МЕ (по 2,4 млн МЕ в каждую ягодицу), вторую и третью инъекции — по 2,4 млн МЕ с интервалом в 1 неделю, новорожденным и детям младшего возраста — 1,2 млн МЕ. Ровамицин — макролидный антибиотик. Останавливает синтез белка. Для взрослых суточная доза для приема внутрь составляет 6–9 млн МЕ, детям с массой тела более 20 кг — 1.5 млн МЕ/10 кг в сутки за 2–3 приема. Детям массой до 10 кг — 2–4 пакетика гранул по 0,375 млн МЕ в сутки, 1—20 кг — 2–4 пакетика по 0,75 млн МЕ, более 20 кг — 2–4 пакетика по 1,5 млн МЕ. Назначают внутривенно только взрослым. Содержимое флакона растворяют в 4 мл воды для инъекций и вводят в течение 1 ч в 100 мл 5 %-ной глюкозы. Цефобид — третье поколение цефалоспоринов. Применяется внутримышечно и внутривенно. Взрослым — 2–4 г/сутки, детям — 50—200 мг/кг массы тела, доза вводится в 2 приема (через 12 ч). Взрослым во время лечения следует воздержаться от приема алкоголя. Цефривид применяют внутримышечно (растворяют в 2–2,5 мл воды для инъекций или 0,25—0,5 %-ном растворе прокаина), внутривенно капельно (в 5 %-ном растворе глюкозы, 0,9 %-ном растворе NaCl). Назначают по 1 г 2–4 раза в сутки в течение 7—10 дней. Максимальная доза — 6 г. Детям — 20–40 мг/кг, при тяжелом течении инфекции — до 100 мг/кг в сутки. Цефотаксим назначают внутривенно и внутримышечно по 1–2 г 2 раза в день (максимальная суточная доза — 12 г), новорожденным — по 0,005—0,1 г/кг в сутки. Экстенциллин назначают внутримышечно, глубоко, растворив порошок в воде для инъекций. Для лечения сифилиса — каждые 8 дней по 2,4 млн ЕД. Инъекции повторяют 2–3 раза. Юнидокс солютаб блокирует рибосомальную полимеразу и тормозит синтез белка у микроорганизмов. Применяется внутрь, во время еды, таблетку можно глотать целиком или развести в воде в виде сиропа (в 20 мл) или суспензии (в 100 мл). Взрослым и детям с массой не более 50 кг следует начинать прием с 200 мг в первый день в один или два приема, затем по 100 мг однократно ежедневно до 10 дней (при тяжелом течении — до 300 мг). Детям старше 8 лет с массой тела менее 50 кг — в первый день из расчета 4 мг/кг в один прием, затем — по 2 мг/кг однократно ежедневно. При тяжелом течении — до 4 мг/кг в сутки в течение всего курса лечения. Нельзя комбинировать с пенициллином, цефалоспоринами и средствами, содержащими металлы (антациды, железосодержащие препараты), в связи с их способностью связывать тетрациклины с образованием неактивных соединений. У пациентов с нарушенной функцией кожи применяют уменьшенные дозы. При введении препарат разносится током крови, откладывается и длительно удерживается во внутренних органах, вызывая раздражение их нервно-рецепторных зон. Наиболее популярным препаратом является бийохинол. Перед употреблением его нужно подогреть и взболтать. Вводят из расчета 1 мл на 1 день в течение 3 дней. Курс — 40–50 мл внутривенно и внутримышечно. Бисмоверол — комбинированный препарат висмута. Применяют по 1 мл через день внутримышечно. Курсовая доза — 16–20 мл. После препаратов висмута возможны осложнения: наличие висмутовой анемии, нефропатии, стоматитов, желтухи. Препараты йода чаще используются в виде йодида калия по 2–3 ст. л. после еды, запивая молоком. Настойка йода применяется в возрастающих дозах — от 50 до 60 капель в молоке 3 раза в день после еды. Сайодин назначают по 1–2 таблетке 3 раза в день после еды. Перед приемом таблетки надо разжевать. Мурамистин — антисептик. Увеличивает проницаемость клеточной оболочки микроорганизмов и приводит к цитолизу. Кроме того, он влияет и на грибы, стимулирует неспецифический иммунный ответ. Применяется местно, для индивидуальной профилактики, путем впрыскивания в уретру 2–5 мл раствора 2–3 раза; в день после полового контакта необходимо помочиться, вымыть руки и половые органы и струей раствора обработать кожу лобка, бедер, наружных половых органов. После введения в уретру не мочиться 2 ч. Женщинам дополнительно препарат вводят и во влагалище в дозе 5—10 мл. Кроме вышеперечисленных специфических препаратов, больным назначают и неспецифическое лечение. Это относится к больным со скрытыми и поздними формами заболевания (нейровисцеросифилис, врожденный сифилис). Неспецифическую терапию назначают больным с заразными формами сифилиса. К таким методам относятся: пиротерапия, витаминотерапия, ультрафиолетовые облучения, инъекции биогенных стимуляторов (экстракт алоэ, плаценты, стекловидного тела), иммуномодуляторы (левамизол, метилурацил, пирроксан). Пиротерапия — метод, усиливающий теплопродукцию, улучшает крово- и лимфообращение в пораженных органах и тканях, усиливает фагоцитоз. Пирогенал назначают внутримышечно, начальная доза — до 50—100 МПД, затем ее повышают. Вводят каждые 2–3 дня, всего 10–15 инъекций. Температура тела после введения повышается через 1–2 ч, держится до 10–15 ч. Доза продигиозана подбирается индивидуально, вводят препарат 2 раза в неделю в возрастающих дозах. Сульфазин вводят внутримышечно, начиная с 0,5–2 мл и добавляя по 2 мл до 7–8 мл. Иммунотерапия назначается больным со злокачественным течением болезни, при скрытых формах сифилиса, наличии сопутствующей патологии. Биогенные стимуляторы: экстракт алоэ, плаценты, стекловидное тело. Назначают подкожно по 1 мл в течение 15–20 дней. Левамизол назначают циклами по 150 мг в течение 3 дней с недельными перерывами, всего 2–3 цикла. Метилурацил назначают по 0,5 г 4 раза в день в течение 2 недель, затем после 5— 7-дневного перерыва прием повторяют. Диуцифон назначают по 0,1 г 3 раза в день в течение 6 дней. Проводят 2–3 цикла. Можно вводить внутривенно по 0,4 мл через день. Пирроксан — детоксицирующее средство. Назначают по 0,0015 г 3 раза в день 10-дневным циклом. Витамины С и группы В обязательны в качестве противосифилитического лечения беременных и детей. Назначают и другие неспецифические препараты: калия оротат, пантокрин, экстракт элеутерококка. Наружную терапию при наличии высокоэффективных методов проводить нецелесообразно. Местное лечение сводится к гигиеническому содержанию пораженных мест. При наличии у больного язвенных шанкров с инфильтратом в основании можно назначить теплые ванночки, примочки с раствором бензилпенициллина в димексиде, аппликацию мазей «Ацемин», желтой, ртутной, гепариновой. Для ускорения регенерации мокнущих папул на половых органах и около заднего прохода показаны присыпки и наложения пополам с тальком, мази с антибиотиками, при долго не заживающих гуммоидных язвах назначаются 3–5— 10 %-ная ртутная и ртутно-висмутовая мази, 1–3 %-ная эритромициновая, 5 %-ная левориновая, 5—10 %-ная синтомициновая, ртутный пластырь, местные ванны. При наличии высыпаний в полости рта — полоскания из растворов фурацилина (1: 10 000), 2 %-ной борной кислоты или 2 %-ного грамицидина. У людей пенсионного возраста или с варикозом гуммы на голенях протекают торпидно. Назначают повязки с сахарной пудрой или на несколько недель повязку с цинк-желатиновой мазью по Кейферу.
Профилактика Задачей врача является регулярная просветительная работа, поскольку недавние социологические исследования показали, как мало известно населению (особенно молодежи) о венерических заболеваниях. Использование мужского презерватива предохраняет от заболевания на 90 %. Личная гигиена является профилактикой венерических болезней. Методика заключается в следующем. I. Мужчина (после полового акта) моет руки, выпускает мочу, обмывает теплой водой с мылом половой член, мошонку, бедра и промежность. Проводится протирание тех же мест ватным тампоном, смоченным раствором сулемы в соотношении 1:1000. В уретру с помощью глазной пипетки вводят 2–3 %-ный раствор протаргола, 0,05 %-ный раствор гибитана и не мочатся 2–3 ч. II. Женщина моет руки, выпускает мочу, обмывает теплой водой с мылом половые органы, бедра, промежность. Проводится обработка тех же органов раствором сулемы в разведении 1: 1000. Спринцевание влагалища раствором перманганата калия (1:6000) с введением в уретру 1–2 %-ного препарата серебра. Смазывание шейки матки, слизистой оболочки влагалища этим же раствором. Можно вводить 0,05 %-ный водный раствор гибитана. Личная профилактика может проводиться самостоятельно лицом, опасающимся заражения в результате случайной половой связи. Если отсутствует возможность выполнить вышеперечисленные меры профилактики, рекомендуется спринцевание крепким солевым раствором половых органов, уретры и влагалища у женщин.
СКАРЛАТИНА
ОпределениеСкарлатина — острое инфекционное заболевание, характеризующееся симптомами общей интоксикации, ангиной (см.) и мелкоточечной сыпью, локализующейся преимущественно в месте естественных складок гиперемированной кожи.
Этиология и эпидемиология Скарлатина известна с давних времен, однако до XVI в. ее не выделяли из группы других заболеваний, протекающих с сыпью. В конце XVI в. эпидемии скарлатины описывались в большинстве стран Европы. Заболевание протекало большей частью в легкой форме, но отмечались и эпидемии с очень тяжелым течением. Возбудителем скарлатины является бета-гемолитический стрептококк группы А, способный продуцировать экзотоксин. Известно 85 сероваров бета-гемолитического стрептококка группы А. Ведущими из них являются 1–6 и 10. Возбудитель способен вырабатывать эритрогенный экзотоксин, эндотоксины (протеин-М и др.), лейкоцидин, фибринолизин, стрептолизин, гиалуронидазу, протеазу и некоторые другие вещества, которые оказывают биологическое воздействие на макроорганизм. Стрептококки устойчивы во внешней среде. В мокроте и гное возбудители сохраняются от 1,5 недель до 1 месяца. Они чувствительны к обычным дезинфицирующим растворам (0,5 %-ный раствор хлорамина, 1–2 %-ный раствор хлорной извести). Источником инфекции служат чаще всего больные скарлатиной, реже — больные ангиной (см.), рожей (см.) и носители токсических бета-гемолитических стрептококков. Больной скарлатиной заразен с 1-го и по 22-й день болезни. Особенно большую эпидемиологическую опасность представляют больные со стертой формой скарлатины. Основной путь передачи — воздушно-капельный. Второстепенное значение имеют контактно-бытовой (прямой и непрямой контакт — через игрушки, предметы быта) и алиментарный пути (с пищевыми продуктами). Чаще болеют дети дошкольного и раннего школьного возраста. У переболевших скарлатиной пожизненно остается стойкий антитоксический иммунитет. Повторные случаи заболевания редки и встречаются только в 2–4 % случаев. Поэтому перенесший ранее скарлатину при инфицировании другим типом бета-гемолитического стрептококка может заболеть ангиной, рожей или другой клинической формой стрептококковой инфекции, так как антимикробный иммунитет типоспецифический, т. е. невосприимчивость вырабатывается только к тому типу стрептококка, которым была вызвана скарлатина. Эпидемический процесс протекает волнообразно, т. е. с периодическими подъемами (примерно каждые 3–4 года). Максимум заболеваемости скарлатиной приходится на осенне-зимний период.
Патогенез Наиболее часто входными воротами служит слизистая оболочка ротоглотки. Иногда воротами инфекции могут быть раневая (ожоговая) поверхность кожи, поврежденные везикулы при ветряной оспе (см.), слизистая оболочка матки (послеродовая скарлатина) и легкие. Продуцируемые стрептококками продукты обмена оказывают на макроорганизм местное и общее действие. Местное действие проявляется на слизистой оболочке или поврежденной коже и характеризуется воспалительными и некротическими изменениями. Из места внедрения по лимфатическим путям и поврежденным кровеносным сосудам стрептококки проникают в регионарные лимфатические узлы, затем в общий кровоток и оказывают общее действие на сердечно-сосудистую, нервную, эндокринную и другие системы. Развитие характерной клинической картины, свойственной скарлатине, связано с токсическим, септическим и аллергическим действием стрептококков. Специфический токсикоз, выраженный в той или иной степени, в сочетании с повышенной реактивностью определяется во всех случаях скарлатины в первые 2–4 дня болезни. Токсический синдром при скарлатине обусловлен в основном термолабильной фракцией токсина Дика. Токсин Дика состоит из двух фракций: термолабильной (эритрогенный токсин), способной оказывать токсическое влияние на макроорганизм, и термостабильной, обладающей аллергическим действием. Эритрогенный токсин обладает цитотоксичностью, пирогенностью, подавляет функциональное состояние ретикуло-эндотелиальной системы, повышает проницаемость клеточных мембран, вызывает резкое расширение капилляров кожи и острое воспаление верхних слоев дермы с последующими некробиотическими изменениями клеток эпидермиса. Клинически токсический синдром проявляется повышением температуры тела, головной болью, рвотой, вялостью, обильной точечной сыпью, гиперемией кожных покровов. Септический компонент патогенеза обусловлен воздействием самого стрептококка и клинически проявляется гнойными и некротическими изменениями в месте входных ворот и гнойными очагами в виде отита (см.), гайморита (см.), лимфаденита (см.), аденофлегмоны и артрита (см.). Септические проявления могут возникать независимо от тяжести начального периода скарлатины. В ряде случаев септический компонент, связанный с действием стрептококка, является ведущим в клинической картине с первых дней болезни. Это проявляется обширными некротическими процессами в зеве, носоглотке, иногда в гортани, поражением придаточных пазух носа, ранним гнойным лимфаденитом (см.) или аденофлегмоной. Аллергический компонент патогенеза обусловлен сенсибилизацией организма к бетагемолитическому стрептококку и клинически проявляется на 2—3-й неделе в виде так называемых аллергических волн, сопровождающихся повышением температуры тела и различными высыпаниями на коже, гломерулонефритом (см.), эндокардитом (см.), лимфаденитом (см.), синовитом и другими патологическими состояниями. В ряде случаев аллергические проявления можно выявить с первых дней болезни, при этом наряду с мелкоточечной сыпью появляется пятнистая, или уртикарная, сыпь, отмечаются отечность лица и глаз, увеличение всех лимфатических узлов, в крови появляется большое количество эозинофилов и др. Поскольку аллергическое состояние сопровождается повышенной проницаемостью сосудистой стенки, снижением иммунитета и нарушением барьерных функций, создаются благоприятные условия для микробной инвазии и реализации септического компонента. Все три компонента патогенеза скарлатины тесно связаны и взаимообусловлены.
Клиническая картина Общепринятой является классификация клинических форм скарлатины, предложенная А. А. Колтыпиным. Она предлагает разделение скарлатины по типу, тяжести и течению. Выделяют следующие типы скарлатины. 1. Типичные формы. 2. Атипичные формы: A. Стертые. Б. Формы с аггравированными симптомами: — гипертоксическая; — геморрагическая. B. Экстрабуккальные формы: — позднее поступление. Среди типичных форм выделяют: — по тяжести заболевания: легкие формы, переходные к средней тяжести; среднетяжелые формы, переходные к тяжелым; тяжелые формы (токсическая, септическая, токсико-септическая); — по течению инфекционного процесса: без аллергических волн и осложнений; с аллергическими волнами; с осложнениями аллергического характера (нефрит (см.), синовит (см.), реактивный лимфаденит (см.)), гнойными осложнениями, септикопиемией; абортивное течение. Инкубационный период длится от 2 до 7 суток (редко от нескольких часов до 12 суток). Начальный период продолжается до начала высыпаний. Длительность периода высыпаний — 3–6 дней. Основными клиническими симптомами и синдромами являются следующие. 1. Синдром интоксикации. Острое начало заболевания с повышенной температурой, появление озноба, головной боли и вялости. У детей часто отмечаются тошнота и рвота. 2. Синдром сыпи. Через несколько часов от начала болезни на лице, туловище и конечностях появляется ярко-розовая мелкоточечная сыпь на гиперемированном фоне кожи. Сыпь более насыщенна в естественных складках кожи, на боковой поверхности туловища. Редко сыпь может быть милиарной, петехиальной и даже пятнисто-папулезной (у детей-аллергиков, наряду с мелкоточечной сыпью). Отмечается сухость кожных покровов. Сохраняется сыпь 3–7 дней и, исчезая, не оставляет после себя пигментации. Характерен внешний вид больного: глаза блестящие, лицо ярко-красное, слегка отечное, щеки пылающие, что резко контрастирует с бледным носогубным треугольником (симптом Филатова). 3. Синдром ангины. Больные жалуются на боль в горле при глотании. Ангина (см.) бывает катаральной, фолликулярной, лакунарной и редко некротической (некрозы исчезают в течение 7—10 дней). Увеличиваются тонзиллярные лимфоузлы, они становятся плотными, болезненными при пальпации. 4. «Пылающий зев». Типична яркая гиперемия миндалин, дужек, язычка с четкой границей между мягким и твердым небом. Одновременно с этим набухают лимфоидные фолликулы мягкого неба и приобретают вид бугорков ярко-красного цвета размером 1–1,5 мм в диаметре. 5. Малиновый язык. В начале болезни он суховат, густо обложен серо-бурым налетом, с конца третьих суток начинает очищаться с кончика и боков, становится ярко-красным с набухающими сосочками (этот «сосочковый» симптом держится 1–2 недели). Слизистая оболочка полости рта сухая из-за сниженного слюноотделения. 6. Верхний треугольник (симптом Филатова) — бледный носогубный треугольник. Нижний треугольник Филатова — усиление сыпи в паховой области. 7. Белый дермографизм. В начале болезни имеет удлиненный скрытый и укороченный явный период (у здорового человека скрытый период укорачивается, явный становится более стойким). 8. Изменения со стороны сердечно-сосудистой системы. В начальном периоде отмечаются: тахикардия (см.), отчетливые и громкие тоны сердца, умеренное повышение артериального давления; границы сердца в норме (имеет место симпатикус-фаза — за счет преобладания тонуса симпатической нервной системы, о чем свидетельствует и белый дермографизм). Через 4–5 дней, иногда со 2-й недели болезни начинает преобладать тонус парасимпатической нервной системы — брадикардия (см.), аритмия (см.), приглушение тонов сердца, систолический шум; могут быть расширены границы сердца влево; отмечается тенденция к снижению артериального давления («вагус-фаза»). Эти изменения держатся в течение 2–4 недель, реже дольше. 9. Пластинчатое шелушение на кистях и стопах. После исчезновения сыпи в конце первой — начале второй недели заболевания начинается отрубевидное шелушение, вначале в местах, где кожа более нежная (мочки ушей, шея и т. д.). Пластинчатое шелушение начинается у свободного края ногтей, а затем распространяется с кончиков пальцев на ладонь и подошву. Кожа на руках и стопах отслаивается пластами.
Типичные формы скарлатины Типичные формы разделяются по тяжести на легкие, среднетяжелые и тяжелые. Показатели тяжести определяются по выраженности симптомов общей интоксикации и местных воспалительных изменений в ротоглотке. Легкая форма характеризуется острым началом с повышением температуры тела до 38–38,5 °C, реже она субфебрильная (повышена незначительно) или нормальная. Симптомы общей интоксикации слабо выражены или отсутствуют. Могут отмечаться вялость, головная боль, часто бывает однократная рвота. Сыпь мелкоточечная, бледно-розовая, необильная, больше выражена в местах естественных складок кожи, угасает к 3—4-му дню. Гиперемия кожи слабо выражена. Боль в горле умеренная. Ангина (см.) катаральная, реакция со стороны тонзиллярных лимфоузлов слабо выражена. Язык претерпевает типичные изменения. К концу первой недели болезни обычно наступает клиническое выздоровление. Часто бывает типичное шелушение кожи. Возможны аллергические и гнойные осложнения. Среднетяжелая форма начинается остро с подъема температуры тела до 39–40 °C, отмечается повторная рвота, могут быть бред (см.), возбуждение, нарушается сон. Сыпь яркая, обильная на гиперемированном фоне кожи, сохраняется до 5–6 дней. Боль в горле сильная. Ангина (см.) чаще лакунарная, реже фолликулярная. Часто бывает энантема. Тонзиллярные лимфоузлы значительно увеличены, при пальпации болезненные, плотные. Язык с характерными изменениями. Симптомы острой фазы болезни исчезают через 5–7 дней, но окончательное выздоровление наступает через 2–3 недели. Характерной является смена симпатикус-фазы на вагус-фазу с развитием симптоматики «инфекционного сердца»; возникают аллергические и гнойные осложнения. Тяжелая форма может протекать в трех вариантах — в виде токсической формы, когда резко выражены симптомы общей интоксикации; в виде септической формы, когда резко выражено поражение некротическим процессом ротоглотки и регионарных тонзиллярных лимфоузлов; и в виде токсико-септической формы, когда тяжесть состояния обусловлена как общими, так и местными изменениями. Тяжелая токсическая форма характеризуется острым началом с повышением температуры тела до 40 °C и выше, наблюдаются сильная головная боль, повторная частая рвота, нередко понос, затемнение сознания, бред (см.), судороги, менингеальные симптомы. Симптомы интоксикации значительно выражены вплоть до развития клиники инфекционно-токсического шока (см.). Сыпь появляется на 2—3-й день болезни, цианотичная, с геморрагиями. Кожа резко гиперемирована или синюшна. Губы сухие, цианотичные. Язык сухой, густо обложенный. Яркая гиперемия в ротоглотке, иногда с цианотичным оттенком. Ангина (см.) катаральная или с небольшими поверхностными некрозами. Тахикардия (см.), глухость тонов сердца. При развитии инфекционно-токсического шока (см.) отмечаются цианоз, нитевидный пульс, похолодание конечностей, коллапс (см.). Смерть наступает в первые сутки. Тяжелая септическая форма проявляется обширными и глубокими некрозами, выходящими за пределы миндалин на дужки, язычок, слизистую оболочку носа, заднюю стенку глотки. Быстро развивается подчелюстной переднешейный лимфаденит (см.) с вовлечением в процесс окружающей клетчатки (регионарные лимфоузлы резко увеличены, плотные и болезненные). Характерны периаденит и аденофлегмона, другие гнойные осложнения вплоть до септикопиемии. Летальность была очень высокой до начала применения антибиотикотерапии. В последние годы скарлатина протекает преимущественно в легкой форме, реже — в среднетяжелой.
Атипичные формы скарлатины Стертая форма: все симптомы очень слабо выражены и кратковременны, некоторые из них могут отсутствовать.
Скарлатина. Некротически-язвенная ангина, фарингит. Язвы на миндалинах, в глотке и в начале пищевода
Разрушение стенки внутренней сонной артерии гнойно-некротическим процессом
Гипертоксическая и геморрагическая формы развиваются бурно, и смерть наступает до того, как разовьются типичные для скарлатины симптомы. Внезапное начало, судороги, повторная рвота, менингеальный синдром, энцефалитические знаки. Больные погибают через 1–2 дня при явлениях коллапса (см.). Экстрабуккальная форма (ожоговая, раневая, послеродовая) характеризуется локализацией первичного очага вне ротоглотки. Инкубационный период короткий. Симптомы интоксикации различной степени выраженности. Сыпь появляется и более выражена около входных ворот. Ангина (см.) отсутствует. Регионарный лимфаденит (см.) возникает в области входных ворот. Субклиническая форма диагностируется у контактных клинически здоровых людей с помощью серологических методов обследования. По характеру течения выделяют гладкое течение скарлатины без аллергических волн и осложнений и негладкое — с аллергическими или септическими осложнениями. В случае гладкого течения патологический процесс заканчивается в сроки от 2 до 3 недель. На 2—3-й неделе может возникнуть рецидив, который обусловлен реинфекцией или суперинфекцией стрептококками другого типа. Аллергические осложнения (простой лимфаденит (см.), синовит (см.), нефрит (см.)) возникают чаще со второй недели болезни и наблюдаются обычно у детей старшего возраста. Гнойные осложнения могут возникнуть и в ранние, и в поздние сроки от начала болезни, диагностируются у детей раннего возраста и у взрослых, ослабленных предшествующими заболеваниями. В связи с применением антибиотиков в лечении больных скарлатиной рецидивы и гнойные осложнения встречаются редко.
Диагностика и дифдиагностика Диагноз скарлатиныосновывается на клинических, эпидемиологических и лабораторных данных. В типичных случаях скарлатины диагностика не представляет затруднений. Затруднения возникают при атипичных формах и при позднем поступлении больного в стационар. Очень важны в таких случаях эпидемиологические данные — контакт с больным скарлатиной или другими формами стрептококковой инфекции. Для лабораторного исследования диагноза используют следующие методы. 1. Бактериологический метод — с первых дней болезни исследуют слизь из ротоглотки (реже носа) с целью выделения бета-гемолитического стрептококка и его титрования. Среда для первичного посева — кровяной агар. 2. Иммунофлуоресцентный метод: исследует мазки, приготовленные из слизи ротоглотки и обработанные специфической люминесцирующей сывороткой. 3. Серологический метод — в сыворотке крови определяют нарастание титра антител к стрептококковым антигенам — О-стрептолизину, М-протеину и др. 4. Иммунобиологическую пробу — с помощью постановки кожной пробы с токсином Дика определяют наличие восприимчивости к скарлатине. Внутрикожно вводят 0,1 мл стандартизированного раствора эритрогенного токсина. Если через 24 ч на месте инъекции появляются инфильтрат или гиперемия диаметром более 1 см, реакция считается положительной, что указывает на отсутствие антитоксического иммунитета и свидетельствует о том, что человек может заболеть скарлатиной. 5. Общий анализ крови — лейкоцитоз нейтрофильного характера со сдвигом влево и повышением СОЭ. Скарлатину следует дифференцировать с заболеваниями, протекающими с экзантемой, — скарлатиноподобной формой псевдотуберкулеза (см.), корью (см.), краснухой (см.), токсико-аллергическим состоянием и др. Псевдотуберкулез (см.). Скарлатиноподобная сыпь возникает на 2—3-й день от начала заболевания, но в отличие от скарлатины характеризуется сгущением элементов экзантемы на коже шеи, головы, а также кистей и стоп (симптомы «капюшона», «перчаток» и «носков»). Ангины (см.) не бывает. Кроме того, нередко увеличены размеры печени и селезенки, возможны артралгии, зуд кожи (см.), желтуха (см.). Корь (см.). Характерно этапное высыпание крупнопятнистой сыпи на 4—5-й день от начала болезни. При этом фон кожи не изменен. Отмечаются пигментация после угасания сыпи и отрубевидное шелушение кожи лица. Ангина (см.) отсутствует. Краснуха (см.). Интоксикация выражена слабо. Характерны: генерализованная лимфаденопатия с вовлечением в процесс затылочных лимфоузлов; мелкопятнистая сыпь, сгущающаяся на разгибательной поверхности конечностей; катаральные явления со стороны верхних дыхательных путей; отсутствие ангины (см.); лейкопения и лимфоцитоз в общем анализе крови. Токсико-аллергическое состояние чаще всего возникает при приеме антибиотиков, реже — других медикаментозных препаратов и пищевых продуктов. В этих случаях наряду со скарлатиноподобной сыпью можно видеть пятнисто-папулезные, геморрагические и уртикарные высыпания, располагающиеся в основном на разгибательной поверхности рук и ног вокруг суставов. Характерны зуд кожи (см.) и увеличение всех групп лимфоузлов. Изменения в ротоглотке отсутствуют.
Лечение и профилактика Госпитализация больного осуществляется по клинико-эпидемиологическим показаниям. Больных с легкой и среднетяжелой формами лечат в домашних условиях. Госпитализируют обязательно больных с тяжелой формой и при невозможности изолировать больного в домашних условиях. Во время острого периода болезни следует соблюдать постельный режим. Диета должна быть полноценной, механически щадящей, особенно в первые дни болезни. Антибактериальная терапия обязательна в лечении больного с любой формой скарлатины. Антибиотиком выбора является пенициллин. В домашних условиях удобно использовать феноксиметилпенициллин, а в условиях стационара назначают пенициллин внутримышечно. Длительность курса — 5–7 дней. В случаях аллергии больного к пенициллину используют макролиды. При выраженных симптомах интоксикации назначают обильное питье и инфузионную терапию (реополиглюкин, 10 %-ный раствор глюкозы) в течение 1–2 дней. Назначают также десенсибилизирующие препараты, витамины С, А, Е, симптоматические средства, полоскания и орошения ротоглотки раствором фурацилина в разведении 1:5000, 0,5 %-ном раствором диоксидина, настоями цветков ромашки или календулы. Назначают физиолечение (УВЧ, кварц, сухое тепло). Прогноз при своевременно и рационально проводимой терапии благоприятный. На 23-й день от начала болезни проводится осмотр с участием отоларинголога и кардиоревматолога, после чего решается вопрос об исходе заболевания. Рекомендуется осмотр отоларингологом и кардиоревматологом через 3–4 недели после клинического выздоровления. Специфическая профилактика не разработана. Неспецифическая профилактика включает мероприятия в отношении больных и контактных лиц. К ним относятся следующие. 1. Госпитализация проводится по клиническим и эпидемиологическим показаниям (невозможность изоляции больного от детей 3 месяцев — 7 лет и школьников первых двух классов, не болевших скарлатиной, а также от взрослых, работающих в дошкольных учреждениях, 1—2-х классах школ, в детских, хирургических и родильных отделениях, на молочных кухнях). 2. Осуществляется изоляция контактных. Дошкольников и школьников первых двух классов, не болевших скарлатиной, изолируют на 7 дней от момента госпитализации больного или на 17 дней при оставлении его на дому. За детьми, болевшими скарлатиной, и взрослыми, работающими в вышеперечисленных учреждениях, устанавливается медицинское наблюдение на те же сроки. Больных ангиной (детей и взрослых), выявленных среди контактных в течение 7 дней, изолируют из коллективов на 22 дня от начала у них заболевания. 3. Соблюдаются условия выписки. Клиническое выздоровление при отсутствии осложнений и воспалительных явлений в ротоглотке и носоглотке, с учетом результатов анализов крови, мочи и осмотра отоларингологом, но не ранее 10 дней от начала болезни. 4. Выздоравливающих детей допускают в дошкольные учреждения и первые два класса школы через 12 дней после клинического выздоровления. Реконвалесцентов-взрослых из вышеперечисленных учреждений переводят на эпидемиологически неопасную работу на срок 12 дней после клинического выздоровления.
СКЛЕРОДЕРМИЯ СИСТЕМНАЯ
ОпределениеСистемная склеродермия — заболевание, проявляющееся распространенным склерозированием кожи (стягивающие рубцы), внутренних органов, а также поражением сосудов.
Этиология Причины заболевания не ясны. Предполагается вирусное и наследственное происхождение заболевания. Провоцирующими факторами являются: охлаждение, вибрация, травма, контакт с некоторыми химическими веществами, аллергизация. Имеют место обменные расстройства в соединительной ткани, иммунные нарушения и поражение мелких сосудов. Активные вещества, которые при этом выделяются, вызывают усиленное развитие соединительной ткани.
Клиническая картина и диагностика Поражение кожи — один из ведущих признаков заболевания. Сначала изменения кожи проходят стадию отека (см.), затем уплотнения, наконец атрофии (см.). Наиболее часто поражается кожа лица и кистей рук. Плотный болезненный отек располагается симметрично в области кистей, пальцы приобретают сосискообразный вид. Рано или поздно, в зависимости от остроты процесса, кожа становится очень плотной, появляется характерная маскообразность лица (лицо лишено мимики), складки и морщины разглаживаются, лицо кажется застывшим. Кожа становится пятнистой (чередование участков пигментации и депигментации). В стадии атрофии кожа лица как бы натянута, имеет неестественный блеск, нос заостряется («птичий клюв»), вокруг рта появляются кисетообразные складки, полное открывание рта затруднено. Кожа пальцев и кистей рук резко уплотняется, пальцы перестают разгибаться. Наблюдаются деформация ногтей, изъязвление кожи на отдельных участках. Может наблюдаться синдром Рейно (см.) — внезапное появление чувства онемения, ползания мурашек в пальцах рук и ног, побледнение кожи, после чего ощущается боль, кожа при этом краснеет. Имеется также ряд других признаков: поражение суставов в виде артрита; поражение мышц в виде миозита (см.) или полимиозита; поражение костей, проявляющееся разрушением преимущественно концевых фаланг и укорочением пальцев; поражение желудочно-кишечного тракта — воспаление пищевода, желудка, толстого и тонкого кишечника; поражение сердечно-сосудистой системы — увеличение размеров сердца, аритмия (см.), сердечная недостаточность (одышка при физической нагрузке, отеки голеней и стоп); поражение почек вплоть до почечной недостаточности (см.). Отмечается значительная потеря массы тела, особенно выраженная при остром течении заболевания. Выделяют три стадии болезни. 1. Начальная стадия, которая проявляется синдромом Рейно (см.), болями в суставах, частым сердцебиением, частыми инфекциями дыхательных путей, зябкостью. Комплексное лечение в этой стадии приводит к длительному стиханию процесса или даже к выздоровлению. 2. Генерализованная стадия протекает со всеми вышеописанными симптомами и характеризуется максимальным их проявлением. 3. Терминальная стадия — стадия далеко зашедших изменений — сопровождается выраженной потерей массы тела. Лечение в этой стадии эффекта не дает. Диагноз ставится на основании клинической картины, течения болезни, характерных лабораторных изменений.
Лечение Лечение производится средствами, уменьшающими образование соединительной ткани (купренил, мадекассол), ферментативными препаратами, расщепляющими соединительную ткань (лидаза), противовоспалительными средствами (ортофен, диклофенак), иммунодепрессантами. При хроническом течении заболевания показано санаторно-курортное лечение в специализированных курортах Кавказа и Крыма (Пятигорск, Сочи, Евпатория).
СКОЛИОЗ
ОпределениеСколиоз — патологическое искривление позвоночника, бывает врожденным и приобретенным (рахит, паралич мышц спины, травмы).Развитие сколиоза может происходить вследствие структурных дефектов позвонков или неправильного положения тела.
Клиническая картина Выделяют три степени сколиоза: — I степень — незначительно исправляющееся искривление; — II степень — деформация выражена, исправляется при вытяжении; — III степень — выраженная стойкая деформация позвоночника, сочетающаяся с деформацией ребер и ограничением функции дыхания. Чаще всего возникает у детей от 1 года до 16 лет. Для уточнения степени сколиоза необходима рентгенография стоя, лежа и функциональная латерография.
Лечение и профилактика Лечение проводят под наблюдением ортопеда. При I и ряде случаев II степени — консервативное лечение сразу после выявления сколиоза. Детям и подросткам рекомендуется ношение специальных повязок и ремней, так как их кости не достигли полной зрелости, их подгоняют с учетом роста и выпрямления позвоночника. Лечебная гимнастика, массаж, корригирующие позы, плавание. При II–III степени — оперативное лечение, корригирующие корсеты, санаторно-курортное лечение. Профилактика — раннее выявление нарушений осанки у школьников, правильная посадка за партой, ношение ранцев вместо портфелей, занятия спортом.
СОЛНЕЧНЫЙ УДАР
ОпределениеПри этом состоянии происходит поражение центральной нервной системы, вызываемое интенсивным действием прямых солнечных лучей на область головы. Обычно поражение происходит при работе в полевых условиях с непокрытой головой, при злоупотреблении солнечными ваннами на пляжах, при трудных переходах в условиях жаркого климата. Солнечный удар может произойти как во время нахождения на солнце, так и через 6–8 ч после воздействия солнца.
Клиническая картина Отмечаются общее недомогание, разбитость, головная боль, головокружение, шум в ушах, тошнота, рвота. Кожа лица красная, пульс учащен, наблюдаются усиленное потоотделение, повышение температуры, иногда носовое кровотечение. В тяжелых случаях возникают сильная головная боль, снижение артериального давления, температура тела 40–41 °C, больной находится в прострации, теряет сознание. Дыхание учащенное, затем замедляется; пульс редкий, возможно развитие отека легких, судорог, комы, иногда отмечаются возбуждение, галлюцинации.
Лечение В большинстве случаев достаточно поместить больного в тень, освободить от одежды, дать выпить холодной воды, положить холодный компресс на голову, обернуть простыней, смоченной холодной водой. В тяжелых случаях проводят инфузионную терапию, при расстройствах дыхания вводят кофеин или кордиамин, при остановке дыхания выполняют искусственную вентиляцию легких, применяют сердечные гликозиды. Госпитализация необходима в тяжелых случаях.
СПАЕЧНАЯ БОЛЕЗНЬ
ОпределениеСпаечная болезнь (спаечная кишечная непроходимость) — острое или хроническое заболевание кишечника, возникающее в результате развития спаечного процесса в брюшной полости.
Этиология и патогенез Спаечная кишечная непроходимость встречается в 30 % случаев. Спайки могут привести к сдавлению кишки и обтурационной непроходимости, кроме того, массивные рубцы могут сдавить и брыжейку кишки вместе с кишечной стенкой — странгуляционная непроходимость. Спайки способствуют также развитию заворота.
Клиническая картина Спаечная кишечная непроходимость часто носит рецидивирующий характер: обычно после переедания отмечается усиление болевого синдрома, что обусловлено растяжением кишечной стенки, снижением сократительной способности кишки и декомпенсации пассажа кишечного содержимого.
Лечение После консервативного лечения с аспирацией кишечного содержимого эффективность перистальтики может восстановиться и непроходимость ликвидируется. Каждая повторная операция на брюшной полости, в том числе и по поводу непроходимости, приводит к увеличению спаечного процесса. Если спаечная непроходимость носит обтурационный характер, возможно проведение курса консервативной терапии. При неэффективности или явлениях странгуляции — оперативное вмешательство. С целью профилактики явлений непроходимости в ходе операции можно использовать шинирование тонкой кишки на назоинтестинальном зонде длиной 3–4 м или зонде, введенном через гастростому. Шинированные петли тонкой кишки тщательно укладывают, зонд удаляют не ранее 2 недель, когда положение кишечных петель уже сформировано. Иногда показана операция типа Нобля (эпликация путем проведения лигатур через брыжейку кишки). Прогноз сомнительный; ни одна операция, в том числе и операция типа Нобля, не ликвидирует возможность рецидива заболевания.
СПИРОХЕТОЗЫ
ОпределениеСпирохетозы — группа инфекционных заболеваний, вызываемых патогенными (болезнетворными) спирохетами, относящимися к семейству спирохетацеа.
Этиология Спирохеты имеют штопорообразную извитую форму. Спор, капсул, жгутиков не образуют. Спирохеты обладают активной подвижностью вследствие выраженной гибкости их тела. У спирохет различают вращательное, поступательное, волнообразное, сгибательное движение. К патогенным относится три рода: Treponema, Letospira, Borrelia. К патогенным для человека трепонемам относятся следующие виды: — Treponema pallidum (бледная спирохета), вызывающая венерический и врожденный сифилис во всех странах мира, беджель (невенерический сифилис) на юго-востоке среднеземноморской зоны; — Treponema pertunuye, вызывающая фрамбезию, или Яве, в тропических странах Африки, Юго-Восточной Азии, на западных тихоокеанских островах, в тропических странах Америки; — Treponema karateum, вызывающая пинта, или карате, в Мексике, Центральной Америке, субконтинентальных странах Южной Америки, Западной Индии, на Кубе. В России наиболее распространенным из трепонематозов (см.) является сифилис (см.) К патогенным лептоспирам относится лептоспира интерроганс, вызывающая лептоспироз (см.) К боррелиозам относится большая группа инфекционных заболеваний, вызываемых болезнетворными бореллиями. Наибольшее распространение по всему миру получили эндемический возвратный тиф (см.) (синонимы: вшивый возвратный тиф, европейский возвратный тиф, эндемический возвратный тиф, эндемический возвратный спирохетоз, возвратная лихорадка, возвратная горячка) и клещевой тиф (синонимы: клещевой спирохетоз, клещевая возвратная лихорадка, клещевой рекурренс, эндемический возвратный тиф, индийский, испанский, балканский, персидский, африканский рекурренс).
Эпидемиология Лептоспироз — антропозоонозное заболевание (распространяющееся через человека и животных). Различают природные, синантропные (созданные в результате жизнедеятельности) и смешанные очаги болезни. Основным резервуаром инфекции в природных очагах являются грызуны, насекомоядные и другие дикие животные. В синантропных очагах резервуаром инфекции служат различные домашние животные, а также синантропные грызуны. Каждый тип паразитических лептоспир имеет свой тип хозяев. Механизмы заражения лептоспирозом человека и животных — алиментарный (с продуктами питания) и контактный. При сифилисе (см.) источником болезни является больной человек. Болезнь передается при прямом контакте, преимущественно половым путем, иногда через посуду и другие предметы. Сифилис может передаваться через плаценту — врожденный сифилис. Эпидемический возвратный тиф — острая трансмиссивная антропонозная инфекция (распространяющаяся среди людей), вызываемая Borrelia recurrentis, передаваемой вшами. Единственным источником инфекции является больной человек, представляющий наибольшую эпидемиологическую опасность в период приступов лихорадки, когда в крови содержится большое количество боррелий. Передача возбудителя происходит трансмиссивным путем (при укусе). Переносчиком является платяная вошь. Лобковая и головная вши эпидемиологически значимы в передаче возбудителя возвратного тифа. Клещевой возвратный тиф — облигатнотрансмиссивное природно-очаговое заболевание мелких стран, вызываемое несколькими видами спирохет рода Borrelia, переносчиками которых являются орнитодоровые клещи. Инфицированные клещи заражают боррелиозом человека и животных во время кровососания. Тропические невенерические трепонематозы — фрамбезия, пинта и беджель — имеют общие эпидемиологические черты. Источником инфекции является больной человек в ранней стадии заболевания. Механизм передачи возбудителя связан с наличием у больного мокнущих и язвенных поражений кожи, содержащих трепонемы.
Патогенез и патанатомия Патогенез, патанатомия, клиническая картина и лечение сифилиса, тифов, лептоспироза описаны в соответствующих разделах (см.).
Тропические невенерические трепонематозы Фрамбезия (см. Фрамбезия). Пинта. Входными воротами инфекции являются поврежденные участки кожи и реже слизистых оболочек. Трепонемы локализуются преимущественно в клетках мальпигиева слоя кожи. Развиваются акантоз, гиперкератоз, межклеточный отек, нарушение пигментной функции клеток эпидермиса, регионарные лимфадениты. В поздней стадии болезни развивается очаговая атрофия эпидермиса и отмечается гибель меланоцитов в отдельных участках кожи. Беджель. Механизм развития сходен с таковым сифилиса и фрамбезии. Поражение внутренних органов нехарактерно.
Клиническая картина Тропические невенерические трепонематозы Пинта. Инкубационный период длится 7—20 дней. В месте внедрения возбудителя возникает зудящая папула, которая постепенно увеличивается. Вокруг папулы могут образоваться более мелкие узелки, которые затем сливаются. Исходом папулы является шелушащееся красное пятно до нескольких сантиметров в диаметре. Через 6—12 месяцев происходит генерализация высыпаний, появляются пинтиды в виде мелких папул и многочисленных шелушащихся пятен голубого, серого, бурого, желтого, фиолетового или красного цвета разных размеров и формы. Почти всегда пинтиды сопровождаются сильным зудом. В поздней стадии болезни (спустя несколько лет после заражения) развивается атрофия кожи с депигментацией. Кожные покровы приобретают характерный вид — на депигментированных истонченных ее участках располагаются разного цвета пятна (от испанского pinta — «крапинка»). Волосы в этих местах седеют и выпадают. На подошвах и ладонях часто возникает гиперкератоз с крайне болезненными трещинами. Слизистые оболочки вовлекаются в патологический процесс реже. Поражения костей, суставов и внутренних органов при пинте не бывает. Заболевание продолжается неопределенно долго. Беджель. Инкубационный период составляет несколько недель (до 3 месяцев). Клинические признаки болезни очень напоминают фрамбезию. Особенностью беджеля является частое поражение слизистых оболочек, главным образом рта и губ, гениталий и заднего прохода. В ранней стадии болезни преобладающими элементами являются пятна и мокнущие папулы, в поздней — гуммы и язвы.
Диагностика и дифдиагностика Тропические невенерические трепонематозы Пинту дифференцируют с пигментными дерматозами (см.), витилиго (см.), лепрой (см.), иногда с псориазом (см.) и парапсориазом, красным лишаем (см.). Беджель дифференцируется с теми же заболеваниями, что фрамбезия и пинта.
Лечение и профилактика Лечение и профилактика фрамбезии, пинты и беджеля одинаковы. Для лечения ранней стадии фрамбезии назначают бициллин 1,2–2,4 млн. ЕД внутримышечно (1–2 инъекции). При этом уже в течение 1–2 суток трепонемы исчезают из экссудата кожных поражений. Обратное развитие фрамбезидов наблюдается в течение 1 недели или 1,5 месяца. Для лечения поздней стадии фрамбезии дозу бициллина увеличивают вдвое, препарат вводят двукратно с интервалом в 5—10 дней. Отмечается терапевтический эффект и после других антибиотиков — хлорамфеникола и производных тетрациклина, которые назначают в дозе 1 г в сутки в течение 14 дней. В случае необходимости антибиотикотерапию следует сочетать с ортопедическими и пластическими операциями. Детям до 2 лет назначают 1/4, от 3 до 15 лет — 1/2 дозы антибиотиков для взрослых. Основной профилактикой служат выявление и лечение больных, улучшение санитарно-гигиенических условий, повышение культурного уровня населения, предупреждение контактов с больными фрамбезией, пинтой, беджелем, строгое соблюдение правил личной гигиены. Контактным лицам профилактически однократно вводят бициллин в дозе 600 тыс. ЕД (детям до 15 лет — 300 тыс. ЕД).
СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ
ОпределениеСтафилококковая инфекция — острое и хроническое воспаление, вызванное золотистым стафилококком, вызывающее нагноение на коже, подкожной клетчатке, поражение разных органов.
Поражение кожи (стафилодермия)
Стафилококковая инфекция. Вариант сыпи
Этиология и патогенез В настоящее время в результате широкого применения антибиотиков, а иногда и злоупотребления ими, возникла проблема дисбактериоза — важнейшего патогенетического фактора в активации стафилококка, сальмонелл, кишечной палочки и другой условно-патогенной флоры. Стафилококковые заболевания поражают преимущественно детей младшего возраста или людей, ослабленных другими заболеваниями. Эта особенность связана со свойствами возбудителя как условно-патогенного микроба и заставляет сосредоточивать внимание на реактивности организма. Главной причиной возникновения стафилококковой инфекции является нарушение механизмов естественной резистентности и патология местного иммунитета, так как в формировании аутофлоры ведущую роль играют специфические и местные иммунологические реакции организма. До 80 % патогенных штаммов, выделенных от здоровых лиц, устойчивы к одному или более антибиотикам. Стафилококки, выделяемые у больных и персонала, как правило, характеризуются множественной устойчивостью, нередко к 6–8 антибиотикам. Поэтому применение антибиотиков с профилактической целью не предохраняет от гнойно-септических заболеваний, а эти препараты, являясь иммунодепрессантами и снижая защитные силы организма, способствуют колонизации госпитальных штаммов микробов, которые характеризуются не только высокой вирулентностью, но и инвазивностью. Ограничение использования антибиотиков строгими показаниями может привести к снижению антибиотикорезистентности стафилококков. Значительную роль в распространении стафилококковой инфекции играют носители патогенного стафилококка. Носительство стафилококков характеризуется широким распространением как среди здоровых, так и особенно среди больных людей. Форма носительства может быть различной. Существует категория лиц, у которых постоянно обнаруживаются стафилококки одного и того же серотипа. Это, по-видимому, истинные носители. Менее опасны носители разных видов стафилококков, хотя последние у них обнаруживаются также постоянно. Различают носительство временное и непостоянное.
Клиническая картина, диагностика и дифдиагностика Клиническое течение стафилококковой инфекции характеризуется многообразием — от тяжелейших, генерализованных форм до легких: сепсис, пневмония, менингит, абсцессы внутренних органов, энтероколит, эндокардит, гинекологические заболевания, стафилококковая инфекция со скарлатиноподобным синдромом, гнойно-воспалительные заболевания кожи и мягких тканей и др. Нередко в таких случаях заболевание бывает смешанной этиологии. Кроме стафилококка, высеваются сальмонеллы, кишечная, синегнойная палочки, или стрептококк, пневмококк и др. При микробных ассоциациях течение заболевания характеризуется особой тяжестью. Особенностью течения стафилококковой инфекции у детей является склонность к генерализации процесса. Наиболее велика заболеваемость сепсисом среди новорожденных. Установлено, что стафилококки в 48–78 % случаев являются причиной острых поражений дыхательных путей. Стафилококковые пневмонии встречаются или как самостоятельная форма заболевания (редко), или как один из синдромов стафилококковой инфекции, либо сочетаются с другими инфекционными заболеваниями, чаще вирусной этиологии. В части случаев при стафилококковой пневмонии стафилококк высевается в ассоциациях с кишечной, синегнойной палочкой, с вульгарным протеем, с грибами рода Candida, стрептококком. При стафилококковой пневмонии, так же как и при других формах стафилококковой инфекции, нередко можно установить эпидемиологическую связь с пиодермией, другими малыми формами стафилококковой инфекции; заражение нередко связано с семейным контактом (мастит, ангина), внутрибольничным инфицированием в родильных домах, детских стационарах. Для легочной формы стафилококковой инфекции характерен прежде всего полисегментарный характер поражения с быстрым, нередко молниеносным развитием деструкции легочной ткани, осложненной пневмотораксом. Деструкция легких стафилококковая (см.) в настоящее время довольно распространена в связи с возрастанием значения стафилококка в патологии детского возраста. В развитии стафилококковой пневмонии придают значение как бронхогенному пути инфицирования (во время эпидемий и спорадических случаев ОРВИ), так и гематогенному пути поражения легких, когда инфекция поступает из других очагов, однако бронхогенный путь не исключает одновременно и гематогенного. Биологическую специфику стафилококка определяют выделяемые им в окружающую среду токсины (летальный токсин, лейкоцидин, гемотоксин или стафилолизин, некротоксин, энтертоксин и др.) и ферменты (коагулаза, гиалуронидаза, пенициллиназа и др.). В развитии стафилококковой деструкции ведущее значение принадлежит некротоксину и гиалуронидазе, под действием которых в легочной ткани очень быстро возникают очаги некроза (в некоторых участках легких образуются мелкие ателектазы), формируются полости распада — «стафилококковые буллы» (от 0,5 до 2–3 см в диаметре) и создаются условия для распространения инфекции на плевру (фибринозно-гнойные наложения). С одной стороны, это выдвигает на первый план «плевральную» симптоматику (пиопневмоторакс, тотальная эмпиема), а с другой — обусловливает тяжелую интоксикацию организма, вызывает глубокие функциональные расстройства дыхания и кровообращения, связанные также о острым развитием «синдрома напряжения» в грудной полости. Для первичной стафилококковой пневмонии более характерна односторонняя локализация процесса с частым и довольно быстрым (почти одновременным), вовлечением в патологический процесс плевры. Развитие вторичной стафилококковой пневмонии (эти формы реже, чем первичные) происходит вследствие генерализации гнойной инфекции в организме (остеомиелит, отит, пиодермия и др.) более медленно и постепенно. Первичная стафилококковая пневмония поначалу мало отличается от острой пневмонии другой этиологии, однако развитие болезни нередко приобретает стремительный характер. Молниеносное течение процесса иногда дает основание предполагать у больных появление острого живота (инвагинация кишечника, аппендицит и др.). Быстро нарастает интоксикация, проявлениями которой могут быть гипертермия (39–40 °C и выше, кривая гектического типа), сердечно-сосудистая и дыхательная недостаточность (акроцианоз даже в покое, одышка, синюшность слизистых оболочек и кожных покровов). Дети беспокойны, мечутся в постели, периодически стонут, иногда кричат; отмечаются потливость, озноб, инъецированность склер, одутловатость лица, гиперемия щек (преимущественно на стороне поражения), изредка приступы мучительного сухого (реже влажного) кашля. Возможен прорыв содержимого одной из напряженных булл в плевральную полость; в результате и без того тяжелое состояние ребенка катастрофически ухудшается, остро развивается цианоз, появляется холодный липкий пот, одышка достигает 80 дыхательных движений в минуту, тахикардия — 170–180 уд./мин, пульс становится нитевидным, возникает коллаптоидное состояние. Реже симптомы гнойного плеврита нарастают постепенно. Пораженная половина грудной клетки отстает при дыхании, при перкуссии определяется укорочение перкуторного тона вплоть до абсолютной тупости; при аускультации в отличие от взрослых больных дыхание определяется, причем с бронхиальным оттенком, и чем меньше ребенок, тем такие варианты чаще (тонкая грудная клетка, поджатое легкое). Над буллами дыхание имеет амфорический оттенок, выслушиваются разнокалиберные влажные хрипы. Характерно смещение органов средостения в здоровую сторону, особенно у больных с клапанным пневмо- или пиопневмотораксом. Особую угрозу для жизни представляет смещение и сдавление основных вен. Большое, иногда решающее значение в диагностике стафилококковой деструкции легких имеет динамическое рентгенологическое исследование. Вначале в легких обнаруживаются множественные плотные тени в пределах нескольких сегментов, одной или двух долей легкого, на 2—5-е сутки начинают выявляться округлые просветления различного размера с уровнем и без него («сухие буллы»), вокруг которых четко определяется инфильтрация легочной ткани. Выявляются также признаки поражения плевры со скоплением в ее полости гноя или воздуха или того и другого вместе. Поэтому одним из важнейших диагностических исследований наряду с рентгенологическим является пункция плевральной полости. При показаниях проводят бронхографию, томографию, плеврографию, ангиопневмографию, радиоизотопное исследование легких, диагностическую (она же и лечебная) бронхоскопию, торакоскопию. Стафилококковый энтероколит составляет от 4 до 30 % всех случаев острой кишечной инфекции. Это самое тяжелое заболевание среди всех кишечных инфекций. Летальность достигает 13 %. Заболевают преимущественно дети первого полугодия жизни с неблагоприятным преморбидным фоном (недоношенность, гипотрофия, раннее искусственное вскармливание, перенесенные заболевания, в частности острые респираторные и псевдофурункулез, повторное назначение антибиотиков, других лекарственных средств, нередко мастит у матери). В связи с этим желудочно-кишечные заболевания этого профиля нередко рассматривают не только как результат инфекционно-токсического воздействия, но и как следствие нарушения биоценоза кишечника в результате снижения резистентности организма или действия антибиотиков. Стафилококковый менингит у детей отличается наиболее тяжелым течением. Среди всех случаев гнойных менингитов на менингиты стафилококковой этиологии приходится 2–3 %. Стафилококк в современных условиях часто является причиной септических эндокардитов (в 67 % случаев). Его выявляют в 95—100 % случаев при гнойных заболеваниях мягких тканей и кожных покровов. Стафилококк отягощает течение ожогов, различных дерматозов, а при некоторых из них рассматривается как этиологический фактор.
Лечение Эффективность лечения зависит от своевременной диагностики и раннего применения комплексных специфических препаратов антистафилококкового действия. Большое значение имеет правильное выхаживание ребенка. Из антибиотиков наиболее эффективны аминогликозиды (канамицин, гентамицин) в терапевтической концентрации в сочетании с полусинтетическими антибиотиками пенициллинового ряда (метициллин, оксациллин, ампиокс, рационально объединяющий свойства ампициллина и оксациллина и др.), олеморфоциклин, цепорин, эритромицин фосфат (внутривенно), а также фузидин, особенно в сочетании с олеандомицином (показания к комбинации антибиотиков в настоящее время значительно сужены, так как при этом отмечается и отрицательный эффект; сочетанное применение их целесообразно только в очень тяжелых случаях). Широко используют нитрофураны, в частности фурагин К (внутримышечно, внутривенно и реже внутрикостно). Применять антимикробные препараты следует крайне осторожно и только в сочетании с препаратами, стимулирующими защитные механизмы и восстанавливающими экологическое равновесие. В остром периоде заболевания показаны средства пассивной иммунизации — прямые переливания донорской крови, введение антистафилококковой плазмы, антистафилококкового (из донорской крови) иммуноглобулина внутримышечно, иммуноглобулина направленного действия внутривенно. Используют ингибиторы протеолиза — контрикал (трасилол), синтетические средства — амбен и ему подобные. Необходимы также коррекция обменных нарушений, применение симптоматических средств. По показаниям (флегмона, пневмоторакс и др.) производят немедленное хирургическое вмешательство. При улучшении состояния больного применяют средства активной иммунизации — стафилококковый анатоксин, аутовакцину, стафилококковый бактериофаг. Для стимуляции иммуногенеза рекомендуют продигиозан, лизоцим, хлорофиллин. Все это используют в комплексе с такими биологически активными веществами, как лактобактерин, бификол, бифидобактерин, а также метацил, витамины.
Профилактика Профилактика стафилококковых заболеваний у детей разработана недостаточно. В предупреждении распространения инфекции главную роль должен играть строгий контроль за санитарно-эпидемическим режимом лечебно-профилактических учреждений, контроль за беременными женщинами, родильницами, новорожденными: своевременное выявление у них малых форм гнойно-воспалительных заболеваний и немедленный перевод их при обнаружении патологии из физиологических отделений в палаты и даже отделения с инфекционным режимом. Большое значение имеет централизация стерилизационных подразделений в составе медицинских учреждений. Важным мероприятием, направленным на снижение распространенности стафилококковой инфекции, является вакцинация беременных женщин очищенным адсорбированным стафилококковым анатоксином. Учитывая, что наиболее часто антибиотикоустойчивые культуры стафилококка высеваются из фекалий, для восстановления нормального биоценоза кишечника рекомендуется широко назначать бифидобактерин: — всем недоношенным и маловесным детям в родильных домах, а в последующем в отделениях для патологии новорожденных и недоношенных детей в течение 1—2-го месяца жизни; — детям, получавшим в раннем неонатальном периоде антибиотики; новорожденным, вскармливаемым донорским грудным молоком, или детям матерей, имеющих лактостаз, трещины сосков, возобновивших кормление грудью после мастита; — больным новорожденным и детям 1-го года жизни (с сепсисом, пневмонией, тем более кишечным синдромом), особенно тяжелобольным. Отменять бифидобактерин у больных детей следует не ранее чем через 10–15 дней после окончания лечения антибактериальными препаратами. Важно усилить контроль за использованием антибиотиков, средств иммуносупрессивной терапии.
СТЕНОЗ ГОРТАНИ
ОпределениеСтеноз гортани — значительное уменьшение или полное закрытие ее просвета.
Этиология и патогенез Различают острые и хронические стенозы гортани. Острые стенозы могут возникнуть внезапно, молниеносно или развиться постепенно в течение нескольких часов. Наблюдаются при истинном и ложном крупе (см. Дифтерия), остром ларинготрахеобронхите у детей, отеке гортани, флегмонозном ларингите (см.), хондроперихондрите, инородном теле, травме (механической, термической, химической), двустороннем параличе задней перстнечерпаловидной мышцы. Хронические стенозы характеризуются медленным развитием сужения просвета гортани и его стойкостью. Однако в период хронически протекающего сужения гортани при неблагоприятных условиях (воспаление, травма, кровоизлияние и др.) может быстро развиться острый стеноз гортани. Хронические стенозы возникают на почве рубцовых изменений гортани после травм, хондроперихондрита, склеромы, при дифтерии, сифилисе, опухоли.
Клиническая картина Симптомы, течение зависят от стадии стеноза. Стадия I — компенсации — сопровождается выпадением паузы между вдохом и выдохом, удлинением вдоха, рефлекторным уменьшением числа дыханий и нормальным соотношением числа дыхательных движений и пульса. Голос становится хриплым (за исключением стенозов, обусловленных параличом нижнегортанных нервов), на вдохе появляется стенотический шум, слышимый на значительном расстоянии. Стадия II — субкомпенсации — характеризуется инспираторной одышкой в покое с включением вспомогательных мышц. Отмечается втяжение мягких тканей над- и подключичной области, яремных ямок, хорошо слышен стридор, появляется бледность кожи. Больной обычно беспокоен. Стадия III — декомпенсации — отчетливо выступают все признаки кислородного голодания, усиливается одышка, кожные покровы и слизистые оболочки принимают синюшный оттенок, при вдохе наблюдается резкое втяжение межреберных промежутков, над- и подключичных ямок, яремной ямки. Больной становится беспокойным, мечется, покрывается холодным потом, дыхание учащается, усиливается дыхательный шум, пульс частый. Стадия IV — асфиксии (удушья) — характеризуется падением сердечной деятельности; дыхание редкое и поверхностное, усиливается бледность кожных покровов, больные становятся вялыми, безучастными к окружающему, зрачки расширены, наступают стойкая остановка дыхания, потеря сознания, непроизвольное отхождение кала и мочи. Для оценки степени стеноза наиболее существенна величина просвета голосовой щели. Однако при медленном нарастании стеноза больной иногда удовлетворительно справляется с дыханием при узком просвете гортани. При установлении диагноза следует исключить стеноз трахеи, расстройство дыхания вследствие болезней легких и сердца.
Лечение При любом заболевании гортани, если не исключена опасность стеноза, больного следует срочно госпитализировать, чтобы своевременно принять все необходимые меры по предупреждению асфиксии. В стадии компенсации еще возможно восстановление дыхания терапевтическими методами (горчичники на грудь, горячие ножные ванны, ингаляция кислорода, медикаментозные средства группы морфина, дегидратационная терапия, сердечные средства). В стадии декомпенсации и асфиксии необходимо немедленно произвести трахеостомию (в последние годы с успехом применяют продленную интубацию), при дифтерийном стенозе — интубацию. В случае остановки дыхания после вскрытия трахеи проводят искусственную вентиляцию легких. У больных с хроническим стенозом лечение должно быть направлено на основное заболевание (опухоль, склерома и др.). При рубцовых стенозах применяют бужирование и хирургические методы лечения — ларинго- и трахеостомию с иссечением рубцовой ткани.
СТЕНОКАРДИЯ
ОпределениеСтенокардия — это возникающие в результате ишемии миокарда внезапные приступы боли в груди вследствие недостатка кровоснабжения миокарда.Согласно современной классификации ишемической болезни (см.) сердца (ИБС) выделяют следующие формы стенокардии. I. Впервые возникшая стенокардия напряжения — болевые приступы, возникшие у больного в течение последнего месяца. II. Стабильная стенокардия напряжения — приступы у больных наблюдаются в течение достаточно длительного времени с более или менее определенной частотой (1–2 приступа в неделю или месяц). III. Прогрессирующая стенокардия. Критериями этой формы являются: внезапное изменение характера клинических проявлений стенокардии, появление приступов в покое у больных стенокардиейнапряжения, нарастание частоты, интенсивности и длительности приступов. Нередко такую форму стенокардии называют нестабильной. IV. Спонтанная (вариантная) стенокардия. Характерным признаком этой формы является возникновение приступов в покое без очевидной провокации или при выполнении самой обычной нагрузки. Приступы возникают чаще всего ночью или ранним утром, продолжительность их составляет 5—15 мин. Решает вопрос ЭКГ, снятая во время приступа (регистрируются повышение интервала ST и заострение зубца Т в ряде отведений, которые, однако, быстро возвращаются к норме). Для оценки тяжести стенокардии напряжения используется ее разделение на функциональные классы. Функциональный класс 1. Приступы редкие, только при физической нагрузке, значительно превышающей привычную, или при нагрузке в виде сильного рывка, подъема большой тяжести. Больной без затруднений ходит на любые расстояния и поднимается по лестнице. Функциональный класс 2. Приступы возникают при ходьбе по ровному месту в обычном темпе на расстояние более 500 м, при подъеме на лестницу более чем на один этаж. В целом отмечается лишь небольшое ограничение обычной активности. Функциональный класс 3. Приступы возникают при ходьбе по ровному месту в обычном темпе на расстояние 250–500 м, при подъеме на один этаж. Изредка бывают приступы стенокардии покоя. Физическая нагрузка в целом заметно ограничена. Функциональный класс 4. Приступы стенокардии возникают в ответ на минимальные физические усилия, например, при ходьбе по коридору, попытке подняться по лестнице. Как правило, наблюдаются ангинозные приступы в покое.
Этиология и патогенез Адекватность коронарного кровоснабжения метаболическим запросам миокарда определяется тремя основными факторами: величиной коронарного кровотока, составом артериальной крови (в первую очередь степенью ее оксигенации) и потребностью миокарда в кислороде. В свою очередь, каждый из этих факторов зависит от ряда условий. Так, величина коронарного кровотока обусловливается уровнем кровяного давления в аорте и сопротивлением коронарных сосудов. Кровь может быть менее богатой кислородом (например, при анемии (см.)). Потребность миокарда в кислороде может резко увеличиваться при значительном повышении артериального давления и при физической нагрузке. Нарушение баланса между потребностью миокарда в кислороде и его доставкой приводит к ишемии миокарда, а в более выраженных случаях — к его ишемическому некрозу. При инфаркте миокарда (см.) некротизируется определенный участок миокарда, локализация и величина которого во многом определяются местными факторами. Самой частой причиной, определяющей развитие ишемической болезни сердца (см.), является атеросклероз (см.) коронарных сосудов. Атеросклероз выступает в качестве главной причины развития ишемической болезни сердца, инфаркта миокарда, например при окклюзии коронарной артерии. Ведущую роль играет он и при наиболее частом механизме развития крупноочагового инфаркта миокарда — тромбозе коронарных артерий, который, согласно современным представлениям, развивается как в силу местных изменений интимы сосудов, так и в связи с повышенной наклонностью к тромбообразованию вообще, которая наблюдается при атеросклерозе. На фоне частичной окклюзии коронарной артерии провоцирующим и разрешающим фактором могут быть любые причины, приводящие к повышению потребности миокарда в кислороде. В качестве такой причины могут выступать, например, физическое и психоэмоциональное напряжение, гипертонический криз (см.). Функциональная способность атеросклеротически измененных коронарных артерий существенно снижается не только из-за механического фактора (сужение их просвета); во многом они теряют свои приспособительные возможности к адекватному расширению и при снижении артериального давления. Серьезное значение в патогенезе ишемической болезни сердца придается функциональному моменту, в частности спазму коронарных артерий. В качестве этиологического фактора при инфаркте миокарда (см.) могут выступать: септический эндокардит (см.) (эмболия коронарных артерий тромботическими массами), системные сосудистые поражения с вовлечением в процесс коронарных артерий, расслаивающие аневризмы аорты (см.) со сдавлением устьев коронарных артерий и некоторые другие процессы. Такие состояния встречаются редко, составляя менее 1 % случаев острого инфаркта миокарда. Немаловажное значение в патогенезе ишемической болезни сердца придают изменению активности симпатико-адреналовой системы. Возбуждение последней приводит к повышенному выделению и накоплению в миокарде катехоламинов (норадреналина и адреналина), которые, изменяя метаболизм в сердечной мышце, увеличивают потребность сердца в кислороде и способствуют возникновению острой гипоксии миокарда вплоть до его некроза (см.). При не пораженных атеросклерозом (см.) коронарных сосудах лишь чрезмерное накопление катехоламинов может привести к гипоксии миокарда. В случае склероза коронарных артерий, когда способность их к расширению ограничена, гипоксия может наступить и при небольшом избытке катехоламинов. Избыток катехоламинов вызывает нарушения как обменных процессов, так и электролитного баланса, что способствует развитию некротических и дегенеративных изменений в миокарде. Инфаркт миокарда (см.) рассматривается как результат нарушения метаболизма в сердечной мышце в связи с изменением состава электролитов, гормонов, токсических продуктов обмена, гипоксии и др. Эти причины тесно переплетаются друг с другом.
Клиническая картина Стенокардия может быть единственным проявлением ИБС, кардиосклероза (см.) (диффузного атеросклеротического или очагового постинфарктного), хронической аневризмы сердца. Многие больные, впервые обратившиеся к врачу по поводу стенокардии, сами того не подозревая, ранее перенесли инфаркт миокарда (по данным ЭКГ), а у некоторых больных обнаруживается аритмия (см.) или сердечная недостаточность как проявление ИБС. Чаще у больных обнаруживается стенокардия напряжения, которая возникает в ответ на физическую или эмоциональную нагрузку и может провоцироваться другими состояниями, сопровождающимися тахикардией (см.) и повышением артериального давления. Специального рассмотрения заслуживает стенокардия покоя, которая возникает в отсутствие явных провоцирующих факторов, но при ближайшем рассмотрении оказывается неоднородной по происхождению.
Стенокардия напряжения Распознавание стенокардии является надежным путем диагностики ИБС, а оценка частоты и тяжести приступов стенокардии в зависимости от уровня физической активности позволяет оценить функциональное состояние коронарного кровообращения и миокарда. Уже на амбулаторном этапе обследования больного, опираясь лишь на детальный расспрос, жалобы и анамнез, не прибегая к сложным и дорогостоящим методам исследования, 60 % больных можно правильно поставить диагноз ИБС. Приступ стенокардии может проявляться в различных формах, но при анализе жалоб больного и расспросе важно уметь выделить существенные черты. Большое диагностическое значение могут иметь такие особенности приступа стенокардии, которые не являются обязательными компонентами ангинозного синдрома, но наличие которых может подтвердить диагноз. Наконец, могут быть выявлены такие признаки болевых ощущений, которые несвойственны ишемии миокарда и помогают исключить диагноз стенокардии. Характер болевых ощущений заслуживает специального рассмотрения. Больные описывают приступ стенокардии как боль — режущую, давящую, как бы обжигающую сердце и сжимающую горло. Однако нередко ангинозный приступ больными воспринимается не как явная боль, а как трудновыразимый дискомфорт, который может быть охарактеризован как тяжесть, сжатие, стеснение, сдавление или тупая боль. Если врач ограничивается в таких случаях вопросом, испытывает ли больной боль в груди, то этот важный симптом может остаться нераспознанным. Иногда больной с явной стенокардией может отрицать наличие у него болей, что ведет к диагностической ошибке. Загрудинная локализация болевых ощущений с иррадиацией в левое плечо и руку наиболее типична. В большинстве случаев боль начинается внутри грудной клетки или за грудиной и отсюда распространяется во все стороны. Боль чаще локализуется за верхней частью грудины, чем за нижней ее частью. Реже она определяется слева от грудины, в эпигастрии, в области левой лопатки или левого плеча. Хорошо известна иррадиация ангинозных болей в лопатку, шею, лицо, челюсть, зубы, а также в правое плечо и правую лопатку. Описаны редкие случаи иррадиации болей в левую половину поясницы и левую часть живота, в нижние конечности. Чем тяжелее приступ стенокардии, тем обширнее может оказываться зона иррадиации боли. Хотя иррадиация болевых ощущений — важный признак стенокардии, ее наличие не обязательно для установления диагноза. Важное значение имеет жест больного, который иногда может сказать врачу больше, чем словесное описание болевых ощущений в грудной клетке. Надежным признаком ангинозного приступа является симптом «сжатого кулака», когда больной для описания своих ощущений кладет на грудину свой кулак, ладонь или две ладони. Если больной не склонен к жестикуляции, врач может попросить больного указать жестом на локализацию боли. Интенсивность и длительность ангинозных болей заметно варьируют у разных больных. Они не находятся в строгой зависимости от числа пораженных артерий сердца и от степени их поражения. Однако у одного и того же больного при стабильном течении заболевания приступы стенокардии вполне сравнимы друг с другом. Продолжительность ангинозного приступа при стенокардии почти всегда больше одной минуты и обычно меньше 15 мин. Чаще приступ стенокардии продолжается 2–5 мин и реже длится более 10 мин. Приступ будет более коротким и менее интенсивным, если больной сразу же прекратит нагрузку и примет нитроглицерин. Таким образом, если приступ стенокардии вызван физическим напряжением, его продолжительность и интенсивность в известной мере зависят от поведения больного. Если приступ стенокардии возник в ответ на эмоциональное напряжение, когда больной не в состоянии контролировать ситуацию, приступ может быть затяжным и более интенсивным, чем в ответ на физическую нагрузку. Если больной не примет нитроглицерина, болевой приступ может затянуться. Болевой приступ продолжительностью свыше 15 мин требует вмешательства врача. В некоторых случаях затянувшийся приступ стенокардии может непосредственно предшествовать возникновению острого инфаркта миокарда. Боли при стенокардии нарастают постепенно в виде следующих друг за другом и все более усиливающихся приступов жжения и сжатия. Достигнув своей кульминации, которая всегда примерно одинакова по интенсивности для данного больного, боли быстро исчезают. Длительность периода нарастания болей всегда значительно превышает время их исчезновения. Боли, длительность которых исчисляется секундами (менее одной минуты), как правило, имеют некардиальное происхождение. В большинстве случаев затяжные многочасовые приступы болей (если не развился инфаркт миокарда) не связаны с поражением крупных коронарных артерий и имеют другое происхождение. Важнейший признак стенокардии — появление загрудинного дискомфорта в момент физической нагрузки и прекращение болей через 1–2 мин после уменьшения нагрузки. В классическом описании ангинозного синдрома, очень коротком и выразительном, сделанном Теберденом более 200 лет назад, обращается внимание на четкую связь появления ангинозных болей с физическим напряжением (ходьба в гору, особенно после еды) и исчезновения их при прекращении нагрузки. Если нагрузка (быстрая ходьба, подъем по лестнице) не вызывает загрудинного дискомфорта, то с большой вероятностью можно предполагать, что у больного нет значительного поражения крупных венечных артерий сердца. Таким образом, связь возникновения болей с физической нагрузкой является одним из важнейших признаков классической стенокардии напряжения. Если болевые ощущения возникают не на высоте нагрузки, а спустя какое-то время после ее окончания, это не характерно для стенокардии напряжения. Боль, которая регулярно появляется после нагрузки или после тяжелого трудового дня, отмеченного физическим и эмоциональным напряжением, почти никогда не связана с ишемией сердца. Для ангинозного приступа характерно провоцирование его на морозе или на холодном ветру, что особенно часто наблюдается утром при выходе из дома. Охлаждение лица вызывает стимуляцию вазорегуляторных рефлексогенных зон, направленных на поддержание температуры тела. Эти рефлексы вызывают вазоконстрикцию и системную артериальную гипертензию, тем самым повышая потребность миокарда в кислороде, что провоцирует приступ стенокардии. У больных с изменениями в психоэмоциональной сфере приступы стенокардии могут возникать при меньшей степени поражения коронарных артерий. Частота приступов стенокардии во многом зависит от того, как часто повторяются обстоятельства, которые провоцируют боль. Если больной избегает воздействия факторов, провоцирующих ангинозную боль, то приступы стенокардии возникают реже. Разумеется, не все определяется поведением больного. Чем выраженнее патология коронарных артерий, тем ниже порог возникновения боли в ответ на провоцирующие факторы. Приступ стенокардии обычно облегчается нитроглицерином. Под его влиянием ощущения загрудинного дискомфорта проходят полностью или частично. Это важный, но не обязательный для диагноза признак. Еще один важный признак ангинозного синдрома — приступ быстрее купируется, когда больной сидит или стоит. При типичном приступе стенокардии больные избегают лежать. В положении на спине увеличиваются объем левого желудочка и напряжение стенки миокарда, что ведет к повышению внутрижелудочкового давления и возрастанию потребления кислорода миокардом. В положении сидя или стоя потребность миокарда в кислороде снижается. Вегетативная симптоматика может иногда сопровождать приступ стенокардии. В этих случаях наблюдаются: учащение дыхания, бледность кожных покровов, сухость во рту, повышение артериального давления, экстрасистолия, тахикардия (см.), позывы на мочеиспускание. Выраженность вегетативных симптомов не может служить критерием тяжести ангинозного синдрома, поскольку вегетативная окраска приступа также характерна и для кардиалгий различного генеза. Некоторые авторы даже считают, что чем тяжелее степень коронарной недостаточности, тем более скуп больной на внешние проявления во время приступа стенокардии.
Стенокардия покоя Проявление приступов стенокардии покоя у больного, ранее страдавшего только стенокардией напряжения, знаменует собой переход в более тяжелую фазу заболевания. У больных со стенокардией покоя, имеющих, как правило, тяжелый стенозирующий коронарный атеросклероз (см.), нарушаются компенсаторные механизмы поддержания коронарного кровоснабжения. При прогрессировании заболевания наступает такой период, когда для возникновения приступа стенокардии требуются минимальные нагрузки (стенокардия малых напряжений); наконец, приступы начинают возникать даже в условиях физического покоя (в постели, во сне и т. д.). Стенокардия покоя, присоединившись к стенокардии напряжения, обычно сочетается с ней. Днем у такого больного возникают приступы стенокардии напряжения, связанные с ходьбой или другими физическими нагрузками, а ночью могут возникнуть приступы стенокардии покоя. У части больных приступы стенокардии покоя могут возникнуть в результате первичного снижения кровотока по крупной коронарной артерии как следствие увеличения ее вазомоторного тонуса (т. е. в результате ангиоспазма). У ряда больных этой группы приступы стенокардии покоя могут сочетаться со сравнительно высокой толерантностью к физическим нагрузкам, а иногда могут носить изолированный характер, т. е. наблюдаться в отсутствие приступов стенокардии напряжения. Факторы, провоцирующие приступы стенокардии покоя, многообразны. В большинстве случаев возникновению приступа предшествуют состояния, повышающие потребность миокарда в кислороде. Причиной приступа стенокардии покоя может стать транзиторное повышение артериального давления или приступ пароксизмальной тахикардии (см.). Приступы стенокардии покоя чаще возникают ночью во время сна. Больной просыпается от ощущения, что кто-то мешает ему дышать, или из-за болей в области сердца. Иногда больной сообщает, что в сновидении ему приходилось выполнять тяжелую физическую нагрузку (подъем тяжестей, быстрый бег). Интенсивность и длительность болей при стенокардии покоя значительно больше, чем при стенокардии напряжения. Приступы могут сопровождаться страхом смерти и выраженными вегетативными реакциями. Эти приступы вынуждают больных пробуждаться, садиться в постели, принимать нитроглицерин. Приступ стенокардии возникает в период так называемой быстрой фазы сна. Чаще приступы стенокардии такого генеза возникают в ранние утренние часы. Назначение бета-адреноблокаторов таким больным оказывается эффективным. У ряда больных стенокардия покоя возникает в связи с левожелудочковой недостаточностью, которая усиливается в горизонтальном положении больного. В положении больного на спине возрастает объем левого желудочка, что ведет к возрастанию напряжения миокарда. Это увеличивает потребность миокарда в кислороде. Такой тип стенокардии, как правило, возникает у больных с заметным снижением функции миокарда. В патогенезе ночных приступов стенокардии у таких больных определенное значение имеют расстройства водно-электролитного баланса. Назначение диуретиков и сердечных гликозидов может оказать хороший лечебный эффект при этом типе стенокардии, способствуя предотвращению приступов. Сам приступ может быть купирован переходом больного в положение сидя, а также приемом нитроглицерина, который, являясь мощным быстродействующим вазодилататором, способствует перераспределению крови и разгрузке малого круга кровообращения.
Особая форма стенокардии У ряда больных может быть выявлена особая форма стенокардии (вариантная стенокардия, стенокардия типа Принцметала). Она получила название по имени клинициста, одним из первых описавшего ее как самостоятельную форму стенокардии в 1959 г. Для особой формы стенокардии (типа Принцметала) характерны приступы ангинозных болей, возникающие в покое, которые сопровождаются преходящими электрокардиографическими признаками повреждения субэпикардиальных отделов миокарда. В патогенезе стенокардии Принцметала решающее значение имеет периодически наступающий спазм венечных артерий сердца. Ангиоспазм может возникать у больных как с неизмененными и малоизмененными коронарными артериями, так и с распространенным стенозирующим процессом в коронарных артериях. Анатомическое состояние коронарного русла во многом определяет характер клинических проявлений при особой форме стенокардии. Можно выделить три группы больных с особой формой стенокардии (типа Принцметала), у которых спазм возникает: — в нормальной или малоизмененной коронарной артерии; — в единичной, пораженной атеросклерозом коронарной артерии; — на фоне распространенного атеросклероза коронарных артерий. По характеру и локализации боли в груди при стенокардии Принцметала мало отличаются от болей при обычной стенокардии. Приступ, как правило, возникает в состоянии покоя или на фоне выполнения обычной для больного физической нагрузки. Примерно у половины больных стенокардия Принцметала развивается без предвестников. Одним из признаков особой формы стенокардии является циклический характер болей. Особая форма стенокардии протекает часто в виде серий, состоящих из 2–5 болевых приступов, которые следуют один за другим с промежутками от 2–3 до 10–15 мин. У некоторых больных приступы могут иметь меньшую или большую продолжительность. Наибольшая продолжительность приступа может достигать 45 мин. Затянувшийся приступ особой формы стенокардии обычно расценивается врачами как угрожающий инфаркт миокарда и служит основанием для госпитализации. Период нарастания болей при особой форме стенокардии приблизительно равен периоду ее исчезновения, тогда как при обычной стенокардии первый период заметно длиннее второго. Важнейшим диагностическим признаком стенокардии Принцметала является подъем сегмента ST на ЭКГ в момент болевого приступа, что указывает на ишемию не только субэндокардиального, но и субэпикардиального слоя миокарда. Выраженность изменений ЭКГ варьирует от незначительного смещения сегмента ST вверх на 2 мм до резкого подъема на 20–30 мм, в результате чего кривая ЭКГ приобретает монофазный характер. Подъем сегмента ST регистрируется чаще в течение 10–20 мин, после чего он приходит к изоэлектрическому уровню. К особой форме стенокардии не относятся длительные подъемы сегмента ST, являющиеся одной из фаз эволюции электрокардиографической картины острого инфаркта миокарда (см.). В зависимости от локализации спазма в коронарном русле у некоторых больных признаком особой формы стенокардии может явиться преходящая депрессия сегмента ST, что в каждом отдельном случае требует специальных доказательств. В момент приступа возможны и другие, менее специфические изменения ЭКГ преходящего характера, в частности увеличение вольтажа зубцов и уширение зубца R, транзиторное появление зубца Q и кратковременное заострение зубца Т. Примерно у половины больных с особой формой стенокардии регистрируются разнообразные преходящие нарушения ритма сердца (экстрасистолия, пароксизмальная тахикардия (см.) и др.). Описаны случаи клинической смерти, вызванной фибрилляцией желудочков. Изменения ЭКГ чаще соответствуют передней локализации поражения миокарда, реже выявляются поражения задненижней или боковой локализации. У большинства больных локализация изменений ЭКГ соответствует локализации коронарных артерий, снабжающих кровью данный участок миокарда. Эта закономерность особенно хорошо прослеживается при поражении одной коронарной артерии. В промежутках между приступами ЭКГ может быть нормальной или измененной. ЭКГ покоя вне приступа бывает нормальной, как правило, у больных с неизмененными или малоизмененными коронарными артериями. Нарушения ЭКГ в межприступном периоде выявляются тем чаще, чем больше распространенность коронарного артериосклероза. При стенозе нескольких ветвей коронарных артерий изменения ЭКГ покоя находят у 90 % больных. Больной, страдающий особой формой стенокардии, может хорошо переносить физические нагрузки и в течение дня чувствовать себя здоровым. Результаты электрокардиографической пробы с физической нагрузкой могут оказаться отрицательными. Хорошая толерантность к физическим нагрузкам и отрицательная велоэргометрическая проба не дают основания исключить диагноз особой формы стенокардии, но позволяют предположить, что коронарные артерии у больного либо не изменены, либо имеется единичный локальный стеноз. В диагностике особой формы стенокардии большое значение имеет срочная регистрация ЭКГ непосредственно в момент приступа стенокардии покоя. Выявление специфических изменений ЭКГ дает важные предпосылки для диагноза стенокардии этой формы. У больных с типичными приступами стенокардии Принцметала, сопровождающимися характерными изменениями ЭКГ, могут наблюдаться преходящие подъемы сегмента ST, не сопровождающиеся болевыми ощущениями. Не каждый приступ болей в грудной клетке при особой форме стенокардии есть проявление основного заболевания. Регистрация суточной ЭКГ в этих случаях имеет дифференциально-диагностическое значение. У больных с многократными спонтанными приступами стенокардии Принцметала в течение суток большинство приступов может не сопровождаться болевыми ощущениями, а проявляться лишь преходящими изменениями ЭКГ ишемического типа. Диагностика особой формы стенокардии имеет большое практическое значение, так как позволяет применить патогенетическое лечение и определить прогноз. Появление приступов особой формы стенокардии на фоне стенокардии напряжения имеет неблагоприятное прогностическое значение. Стенокардия Принцметала, развившаяся на фоне тяжелого поражения коронарных артерий, часто ведет к развитию инфаркта миокарда или к летальному исходу, связанному с тяжелыми нарушениями ритма сердца, в частности с пароксизмальной желудочковой тахикардией. Больные с особой формой стенокардии нуждаются в стационарном наблюдении и лечении. Рецидивы особой формы стенокардии имеют неблагоприятное прогностическое значение.
Диагностика В диагностике стенокардии важная роль принадлежит тщательному расспросу больного и выяснению анамнеза заболевания. Клиника стенокардии не ограничивается болевыми приступами, поэтому при постановке диагноза врач стремится найти объективные признаки ишемии миокарда. Хотя во многих случаях диагноз может быть установлен только на основании жалоб больного, нужно учитывать, что он не всегда верно излагает свои ощущения, а врачу не всегда удается надежно собрать анамнез. Поскольку симптоматика стенокардии широко известна, в некоторых случаях больной может «подгонять» рассказ о своих ощущениях под классическую картину болезни или преувеличивать их. У ряда больных заболевание может протекать иногда бессимптомно. В качестве объективных критериев ишемии миокарда используются признаки, которые указывают на нарушения электрофизиологических и обменных процессов в зонах недостаточного кровоснабжения миокарда. Нередко в зонах ишемии удается зарегистрировать локальные нарушения сократительной функции миокарда. Регистрацию этих нарушений можно проводить в момент спонтанного болевого приступа или во время спровоцированного приступа, для чего используют физическую нагрузку, охлаждение, электрическую стимуляцию предсердий и ряд фармакологических воздействий. В результате несоответствия между потребностью в кровоснабжении миокарда и ограниченной возможностью пораженных коронарных артерий возникает дефицит перфузии миокарда, который может быть зарегистрирован с помощью различных методик. Клиническим проявлением ишемии миокарда служит боль. Данный критерий является весьма показательным, но малоспецифичным. С помощью электрокардиографии удается зарегистрировать нарушения трансмембранного обмена электролитов, которые проявляются изменениями сегмента ST, зубца Т и экстрасистолией. Существенное диагностическое значение имеет исследование состояния коронарных артерий путем их рентгеноконтрастирования. С введением метода селективной коронарографии диагностика ИБС встала на прочную морфологическую основу. При катетеризации коронарного синуса удается выявить такой метаболический сдвиг, как повышение выработки лактата клетками миокарда и возрастание его концентрации в венозной крови. Сцинтиграфия миокарда, проводимая во время физической нагрузки, позволяет увидеть участки сниженного наполнения индикатором в зонах ишемии. Гемодинамические исследования обнаруживают признаки левожелудочковой недостаточности. При диагностике стенокардии важно установить связь между болевым синдромом и признаками коронарной недостаточности, возникающими при нагрузочных пробах. Частым признаком ИБС является рубец в миокарде после перенесенного инфаркта. Наличие рубцовой зоны в миокарде не является патогномоничным признаком ИБС, но в большинстве случаев существенно помогает в диагностике. Большую ценность при этом имеют методы электро-, эхо- и вентрикулографии — как рентгеноконтрастной, так и радионуклидной. Нужно обратить внимание на то, что все методы имеют определенные пределы диагностических возможностей. Результаты, полученные с помощью даже самых совершенных инструментальных методов, следует оценивать только при всестороннем учете клинических данных. Врачебное обследование больного часто не обнаруживает ни одного прямого признака ИБС. У многих больных именно стенокардия является единственным признаком заболевания, в то время как ни данные осмотра, ни пальпация, ни аускультация не позволяют выявить отклонений от нормы. Отсутствие признаков органического поражения сердца не дает никаких оснований исключить коронарную патологию. При стенокардии на фоне кардиосклероза выявляются расширение границ сердца, глухость сердечных тонов, нарушения ритма. На верхушке сердца может выслушиваться патологический III тон, а также систолический шум, который может указывать на дисфункцию папиллярных мышц, вызванную хронической ишемией. Однако все названные проявления неспецифичны для ИБС и могут обнаруживаться и при других заболеваниях сердца, поэтому они не играют существенной роли в постановке диагноза. При аневризме сердца (см.) осмотр и пальпация выявляют систолическое выбухание в прекардиальной области. Как правило, аневризма сердца служит проявлением ИБС. Но значение ее невелико, потому что она встречается у небольшого числа больных ИБС. Определенные диагностические выводы врач может сделать, наблюдая за больным во время приступа. У некоторых больных систолический шум и патологический III тон появляются только в момент приступа стенокардии, исчезая после его окончания. При исследовании больного необходимо обращать внимание на такие признаки, как избыточная масса тела, повышение артериального давления, ксантоматоз, патологические изменения на глазном дне, отсутствие или снижение пульсации артерий, увеличение размеров сердца, нарушения ритма и проводимости, а также признаки эндокринных заболеваний. У больных с подозрением на стенокардию необходимо выявлять факторы риска ИБС, важнейшими из которых являются: артериальная гипертензия (см.), гиперлипопротеидемия, курение, сахарный диабет (см.) и ожирение (см.). У лиц, не имеющих факторов риска, заболевание встречается во много раз реже. В большинстве случаев факторы риска предшествуют развитию ИБС или сопровождают его. Для определения факторов риска большое значение имеет анамнез. При расспросе необходимо обратить внимание на семейный анамнез — наличие атеросклероза (см.) и гипертонической болезни (см.), привычное курение сигарет, привычное ограничение физической активности, наличие в анамнезе у больного артериальной гипертензии, гиперлипидемии, гиперурикемии, а также указаний на какие-либо сердечно-сосудистые заболевания. Гиперхолестеринемия свыше 2,6 г/л (260 мг/%) — основное и наиболее легко диагностируемое проявление гиперлипопротеидемии. Существует много доказательств того, что ИБС тесно коррелирует с уровнем гиперхолестеринемии. Особенно важное значение этот фактор приобретает у молодых лиц (когда речь идет о наследственной предрасположенности к нарушениям липидного обмена), а также у женщин. Для больных ИБС характерно повышение в крови уровня холестерина и триглицеридов или одной из этих фракций, повышение липопротеидов низкой и очень низкой плотности. Наряду с этим имеет место снижение уровня липопротеидов высокой плотности. При наличии гиперлипопротеидемии необходимо исключить ее вторичные формы, которые могут встречаться при таких патологических состояниях, как гипотиреоз, сахарный диабет (см.), нефротический синдром (см.), почечная недостаточность (см.), алкоголизм (см.), обструктивные заболевания желчных путей, дисглобулинемии, нарушения обмена гликогена, порфирии. Артериальная гипертензия (см.) как важнейший фактор риска ИБС обычно служит проявлением гипертонической болезни (см.) и (реже) симптоматической гипертонии. Если у взрослых артериальное давление удерживается при повторных измерениях на уровне 160/90 мм рт. ст. и выше, необходимо исследовать функциональное состояние почек и концентрацию электролитов в крови. Последнее обстоятельство особенно важно для больных с сердечной недостаточностью, которым может потребоваться назначение диуретиков и сердечных гликозидов. Курение является важным фактором риска ИБС. Воздействие никотина и повышение в крови концентрации карбоксигемоглобина способствует ускорению развития атеросклероза, а у лиц с уже имеющимся атеросклерозом оно способствует ускорению клинических проявлений ИБС (стенокардия, инфаркт миокарда). У больных стенокардией риск возникновения инфаркта миокарда повышается пропорционально интенсивности курения. Нарушения углеводного обмена могут проявляться как явным сахарным диабетом, так и латентной его формой, которая обнаруживается с помощью специальных нагрузочных тестов. Ожирение (см.) как фактор риска ИБС является классическим выражением роли алиментарного фактора в патогенезе этого заболевания, поскольку оно возникает, как правило, у лиц, злоупотребляющих высококалорийной пищей, содержащей большое количество таких продуктов, как животные жиры, холестерин и углеводы. Малоподвижный образ жизни, связанный с особенностями профессии, также предрасполагает к ожирению и нарушениям липидного обмена. У лиц с низкой физической активностью производственная деятельность нередко связана с нервно-психическими перегрузками, которые способствуют прогрессированию ИБС. Отрицательное воздействие нервно-психических факторов реализуется легче у больных с определенным типом личности. Сочетание нескольких факторов риска у большинства больных имеет решающее значение в возникновении и прогрессировании ИБС. В качестве фактора риска может быть рассмотрена также неблагоприятная наследственность. Генеалогические исследования убедительно показывают, что в семьях больных ИБС число больных родственников выше, чем в семьях здоровых. Предрасположенность к заболеванию передается путем наследования многих факторов — гиперхолестеринемии, наклонности к артериальной гипертензии, нарушений углеводного обмена и гормональных нарушений, нарушений в системе тромбообразования, вплоть до особенностей личности больного и особенностей строения коронарных артерий. Наличие нескольких факторов риска у одного пациента — четкий сигнал о необходимости всестороннего обследования на предмет выявления ИБС. Именно среди пациентов с несколькими факторами риска по ИБС имеется наибольший процент лиц с бессимптомным течением заболевания, когда только с помощью специальных исследований (например, электрокардиографического нагрузочного теста) удается выявить признаки болезни. В сложных дифференциально-диагностических случаях и при сомнительной симптоматике сочетание нескольких факторов риска ИБС часто склоняет мнение врача в пользу этого заболевания, что имеет под собой достаточные основания. Даже в тех случаях, когда заболевание выявить не удается, сочетание нескольких факторов риска ИБС обусловливает проведение действенных профилактических мероприятий по их коррекции, что представляет собой в настоящее время единственный реальный путь первичной профилактики ИБС. И даже при установлении диагноза ИБС у такого больного проблема факторов риска не снимается с повестки дня, поскольку устранение их является действенной мерой вторичной профилактики ИБС, которую следует применять в сочетании со специфической терапией заболевания. При диагностике стенокардии необходимо выявлять все состояния, которые могут нарушать баланс между потребностью миокарда в кислороде и возможностями его доставки. Системная артериальная гипертензия, которая у большинства больных сопровождает ИБС, ухудшает течение стенокардии. Возрастание напряжения миокарда при артериальной гипертензии из-за гипертрофии миокарда и повышения систолического давления ведет к повышению потребности миокарда в кислороде. У таких больных может повышаться сопротивление коронарных артерий. Потребность миокарда в кислороде может возрастать также за счет учащения сердечного ритма, наблюдаемого нередко у этих больных, и увеличения концентрации норадреналина в плазме крови. При легочной гипертензии возрастает напряжение миокарда правого желудочка, что связано с увеличением его размеров и повышением систолического давления. Увеличение напряжения миокарда является главным фактором повышения потребности миокарда в кислороде. Возрастание давления в правом желудочке может препятствовать коронарному кровотоку, направленному в правый желудочек в период систолы. Клапанный стеноз устья аорты, как и артериальная гипертензия, ведет к перегрузке и гипертрофии левого желудочка, повышая потребность миокарда в кислороде. Наблюдаемое при этом типе порока укорочение периода диастолического наполнения левого желудочка сердца способствует уменьшению коронарного кровотока. У больных стенокардией может быть выявлен пролапс митрального клапана, диагностика которого в настоящее время значительно улучшилась благодаря широкому применению в клинике ультразвуковых методов исследования сердца. Вполне возможно, что пролапс митрального клапана предрасполагает к спазму коронарных артерий. У больных гипертрофической кардиомиопатией (см.), как обструктивной, так и необструктивной, может наблюдаться стенокардия, не обусловленная коронарной патологией. Синдром стенокардии у этих больных возникает в связи с заметным возрастанием потребности миокарда в кислороде. Диагностические возможности выявления этого заболевания значительно возросли благодаря эхокардиографии. При ряде заболеваний снижается доставка кислорода к миокарду. Так, при заболеваниях легких нарушается оксигенация крови. Транспорт кислорода может уменьшаться также вследствие недостатка переносчиков кислорода, например в случаях тяжелой анемии (см.) и при интоксикациях. Высокая степень анемии сама по себе крайне редко обусловливает приступы стенокардии, приводя к уменьшению доставки кислорода к миокарду. Но обычно анемия (см.) провоцирует стенокардию у больных на фоне ранее развившегося коронарного атеросклероза. Причиной нарушения транспорта кислорода является интоксикация никотином у курящих. Возрастание концентрации карбоксигемоглобина с 3 до 15 %, наступающее при курении, ведет к уменьшению доставки кислорода к сосудистой стенке. Если этот процесс длится долго, возникает повреждение клеток сосудистой стенки, что ускоряет атерогенез. Нужно учитывать возможность и таких редких причин, уменьшающих коронарный кровоток, как аномалии развития коронарных артерий сердца, коронарные артериовенозные фистулы или аневризмы (см.), вторичные поражения артерий при системных заболеваниях соединительной ткани, сифилитический коронарит, оссифицирующий артериит и др. Поражения малых сосудов при инфекциях или системных заболеваниях также могут усилить проявления стенокардии. Тяжелые нарушения липидного обмена — гиперлипопротеидемии — могут оказать прямое неблагоприятное влияние на коронарный кровоток, что необходимо учитывать при обследовании больных стенокардией. Тромбоцитоз и различные аномалии тромбоцитов также могут способствовать провоцированию приступов стенокардии, ее дестабилизации. Высокая степень полицитемии, сопровождающаяся увеличением вязкости крови, может провоцировать приступы стенокардии. Это имеет место при эритремии, но может наблюдаться и при вторичных эритроцитозах, например при хронических неспецифических заболеваниях легких. Гипертиреоз (см.) также может усилить работу сердца и спровоцировать стенокардию. Аритмии (см.) с высокой частотой сокращения желудочков оказывают такой же эффект.
Лечение Ишемия миокарда возникает тогда, когда потребность миокарда в кислороде превышает способность измененных коронарных артерий доставлять его. Успех терапевтического воздействия на больного зависит от того, насколько удается изменить баланс между потребностью в кислороде и его доставкой в благоприятную сторону. Это может быть достигнуто либо путем повышения способности коронарной системы доставлять кровь в ишемизированные зоны, либо путем уменьшения потребности миокарда в кислороде. У больных ИБС, особенно с выраженным атеросклерозом, трудно изменить баланс между доставкой кислорода и потребностями миокарда в нем лишь за счет увеличения коронарного кровотока. Это воздействие в полном объеме иногда удается осуществить только при успешной операции аортокоронарного шунтирования. В остальных случаях решающего успеха при лечении стенокардии достигают с помощью воздействий, направленных на уменьшение потребности миокарда в кислороде. Главными факторами, определяющими потребность миокарда в кислороде, являются: величина систолического напряжения стенки миокарда, частота сердечных сокращений и сократительная способность миокарда. Напряжение его стенки зависит от внутрижелудочкового давления, а также от объема желудочка. Повышение давления в левом желудочке или увеличение объема последнего приводит к усилению напряжения стенки, а следовательно, к повышению потребности миокарда в кислороде. Такое состояние возникает при тахикардии. Наконец, любое вмешательство, ведущее к возрастанию сократительной способности миокарда (при отсутствии левожелудочковой недостаточности), будет вести к возрастанию потребности миокарда в кислороде. Следовательно, эффективное лечение стенокардии достигается путем коррекции факторов, определяющих потребность миокарда в кислороде, т. е. установления (по возможности) наибольшего числа факторов, как вызывающих у данного больного стенокардию, так и тех, которые потенциально способны вызвать приступы стенокардии (имеются в виду артериальная гипертензия, гипертиреоз, анемия и тахиаритмия). Нормализация образа жизни больного, упорядочение режима труда и отдыха, а при необходимости и трудоустройство, устранение физических и психоэмоциональных перегрузок, прекращение курения, соблюдение определенной диеты — все эти мероприятия являются обязательными слагаемыми любой программы лечения больного ИБС с приступами стенокардии. Игнорирование общих мероприятий и надежда на помощьантиангинальных средств являются грубой ошибкой. К важнейшим общим мероприятиям следует отнести назначение низкокалорийной диеты, направленной на устранение сопутствующего ожирения. Если больной имеет избыточную массу тела, максимальное потребление кислорода при любом уровне нагрузки будет выше, чем у человека с нормальной массой тела, что ведет к снижению способности выполнять нагрузки. Диета должна быть составлена таким образом, чтобы корригировать имеющиеся у больного нарушения липидного обмена, не допуская избыточного введения холестерина в организм. При наличии показаний она должна быть также противоподагрической и малонатриевой. Низкое содержание в диете поваренной соли особенно важно при сопутствующей артериальной гипертензии и при сердечной и почечной недостаточности. При назначении диеты должны быть предусмотрены возможные нарушения углеводного обмена, которые носят латентный характер. Прекращение курения устраняет неблагоприятное воздействие никотина на коронарное русло и нежелательный сдвиг кривой диссоциации оксигемоглобина, который возникает в ответы на вдыхание окиси углерода при курении. Большое значение имеют устранение гиподинамии и выработка определенного уровня физической активности, что достигается специальными физическими тренировками. Общие мероприятия имеют важное значение на всех этапах развития заболевания, но при менее выраженных проявлениях стенокардии (I и II функциональные классы) их комплексное применение может привести к ремиссии даже без назначения антиангинальных препаратов. Нельзя забывать и о психотерапевтическом воздействии на больного, которое должно начинаться с того момента, когда врач сообщает больному о диагнозе ИБС. В настоящее время большинство больных хорошо осведомлены о последствиях ИБС, которая часто становится причиной смерти или инвалидизации. Среди населения укрепился страх перед внезапной смертью от сердечных заболеваний, поэтому необдуманное высказывание врача о состоянии сердца больного может вызвать нежелательную эмоциональную реакцию. Между больным и врачом должны установиться такие взаимоотношения, чтобы больной стал активным участником лечебного процесса, а не пассивным исполнителем назначений врача. Общение больного с врачом должно способствовать устранению тревоги и беспокойства. Ничуть не преуменьшая значения психофармакологических средств, нужно иметь в виду, что их назначение должно быть лишь частью общего психотерапевтического воздействия на больного. Врач должен объяснить больному, каких результатов следует ожидать от назначенных антиангинальных препаратов, как правильно принимать их. И наконец, если в этом есть необходимость, следует обсудить с больным возможность хирургического лечения заболевания. Антиангинальные средства выравнивают нарушенное соответствие между потребностью миокарда в кислороде и его доставкой, устраняют ишемию миокарда, что клинически проявляется купированием или предупреждением приступов стенокардии и повышением толерантности к физической нагрузке. Антиангинальные препараты обладают различными фармакодинамическими свойствами, которые позволяют корригировать те или иные патофизиологические механизмы стенокардии. В зависимости от преобладающего механизма действия может быть выделено 5 основных групп антиангинальных препаратов: нитросоединения, блокаторы адренергических бета-адренорецепторов, антиадренергические препараты смешанного действия, антагонисты иона кальция и сосудорасширяющие средства. Ряд других препаратов, применяющихся у больных со стенокардией, относятся к другим группам лекарственных веществ: сердечные гликозиды, диуретики, некоторые антиаритмические средства, антикоагулянты. Нитросоединения наиболее широко применяются при стенокардии. Они подразделяются на нитраты и нитриты, которые представлены в приведенной ниже классификации. I. Нитриты (органические и неорганические) — амилнитрит, натрия нитрит. II. Нитраты органические: — короткодействующие — нитроглицерин; — пролонгированного действия — препараты депо нитроглицерина (сустак, нитронг, тринитронг), производные нитроглицерина (эринит, нитропептон, нитросорбид, нитронал). Нитроглицерин — самый известный и наиболее эффективный препарат этой группы. Более чем столетний опыт применения этого препарата укрепил положительное мнение врачей в его антиангинальной активности. Способность препарата устранять ишемию миокарда есть результат сочетанного влияния препарата на потребление кислорода и доставки его к миокарду. Важнейшие звенья механизма действия препарата — снижение потребности миокарда в кислороде за счет уменьшения напряжения стенки миокарда и повышение доставки кислорода в ишемизированные зоны вследствие перераспределения коронарного кровотока. Под влиянием нитроглицерина уменьшаются конечное диастолическое давление и объем левого желудочка, в результате чего уменьшается напряжение стенки миокарда. При любом уровне систолического внутрижелудочкового давления это ведет к снижению потребности миокарда в кислороде. Определенное значение в уменьшении напряжения стенки миокарда имеет снижение систолического артериального давления после приема нитроглицерина. Уменьшение конечного диастолического давления и объема левого желудочка и связанное с этим снижение напряжения стенки миокарда ведут к уменьшению давления на артерии и коллатерали в ишемизированной зоне, в результате чего в ней увеличивается кровоток. Уменьшение потребности в кислороде неишемизированного миокарда вызывает метаболически обусловленную констрикцию артериол, что ведет к повышению в них давления. Поскольку артерии, снабжающие ишемизированный миокард, могут при этом оставаться дилатированными, перфузионное давление у мест отхождения коллатеральных сосудов может возрастать, что ведет к шунтированию крови преимущественно от неишемизированных участков к ишемизированным. Необходимо учитывать также способность нитроглицерина устранять спазм коронарных артерий, вызванный механическим раздражением, патологическими рефлексами или различными веществами. Нитроглицерин оказывает выраженные периферические эффекты: снижает периферическое артериальное сопротивление и вызывает дилатацию вен. Препарат влияет на венозное русло, приводя к уменьшению венозного возврата. Это проявляется уменьшением сердечного выброса и работы левого желудочка. Быстрый и выраженный эффект нитроглицерина при стенокардии объясняется синхронностью взаимодействия. При приеме в дозе 0,3–0,5 мг под язык нитроглицерин надежно купирует приступ стенокардии. Препарат помещают под язык, и нитроглицерин в течение одной минуты рассасывается. Концентрация нитроглицерина в крови достигает максимума через 4–5 мин и начинает снижаться через 15 мин. Обычно приступ стенокардии купируется через 5—10 мин. Максимум гемодинамического и антиангинального действия удерживается в течение 20 мин. Через 45 мин препарат практически полностью выводится из организма. Если приступ не купируется в течение 10–15 мин после повторного приема нитроглицерина, нужно применять анальгетики, в том числе наркотические, так как затяжной ангинозный приступ может стать первым проявлением острого инфаркта миокарда. Препараты депо нитроглицерина. С момента введения нитроглицерина в клиническую практику более века назад врачи и фармакологи ищут способ продлить антиангинальный эффект нитроглицерина. Для этого используются различные лекарственные формы нитроглицерина и его производные (нитраты), имеющие различную молекулярную структуру. Широкое распространение получил препарат депо нитроглицерина сустак, который выпускают в двух дозировках: по 2,6 мг (сустак-митте) и по 6,4 мг (сустак-форте). Этот препарат принимают внутрь (но не под язык!). Чтобы не нарушать структуру таблетки, ее не следует ломать, жевать, а необходимо проглатывать целиком. Действие препарата начинается уже через 10 мин после приема. Благодаря постепенному рассасыванию таблетки и всасыванию нитроглицерина обеспечивается длительное сохранение эффективной концентрации нитроглицерина в крови, что дает пролонгированный терапевтический эффект. Аналогичным эффектом обладает препарат депо нитроглицерина нитронг, также выпускаемый в двух формах (нитронгмитте и нитронг-форте). Высокой терапевтической эффективностью обладает отечественный препарат депо нитроглицерина тринитролонг. Важно подчеркнуть, что эффективность препаратов депо нитроглицерина во многом зависит от тяжести клинических проявлений заболевания (частота приступов стенокардии, толерантность к физической нагрузке) и от выраженности поражения коронарного русла. У больных с поражением трех магистральных ветвей коронарных артерий клиническая эффективность препаратов этой группы на 20–25 % ниже, чем у больных с поражением одной магистральной артерии. Длительность антиангинального эффекта сустака зависит в первую очередь от тяжести коронарного атеросклероза, исходного уровня толерантности к физической нагрузке и наличия признаков сердечной недостаточности. Препараты депо нитроглицерина целесообразно назначать в первую очередь больным с частыми приступами стенокардии (но реже одного приступа в сутки). При более редких приступах (не ежедневных) профилактический эффект по предупреждению приступов стенокардии будет неощутим. У таких больных целесообразнее ограничиваться купированием приступов стенокардии приемом обычного нитроглицерина под язык. Прием сустака противопоказан при глаукоме (см.), повышении внутричерепного давления, инсульте (см.). При приеме нитратов в больших дозах возможно развитие устойчивости к их действию, что связано с исчерпанием фармакодинамических возможностей препарата на фоне стойкой вазодилатации периферических артерий и максимально возможного снижения напряжения стенки миокарда. Сходный по характеру фармакологического воздействия, но менее выраженный клинический эффект оказывают нитраты — производные нитроглицерина (эринит и нитросорбид). У ряда больных с частыми приступами стенокардии покоя, вынужденных принимать до 40 и более гранул нитроглицерина в сутки, применение нитросорбида по 20 мг сублингвально каждые 2 ч предотвращает возникновение приступов стенокардии. Больные начинают обходиться без нитроглицерина. Блокаторы бета-адренорецепторов. Стимуляция сердечной симпатической иннервации сердца и возрастание уровня циркулирующих в крови катехоламинов ведут к учащению темпа сокращений сердца и усилению сократительной способности миокарда. Эти сдвиги требуют усиления энергообеспечения сердца, что может, особенно у больных со стенозирующим коронарным атеросклерозом, создать условия для возникновения приступа стенокардии. Снижение адренергических влияний на сердце с помощью лекарственных препаратов, способных блокировать бета-адренорецепторы, является важным направлением медикаментозного лечения ангинозного синдрома при ИБС. Различают два типа бета-адренорецепторов: сердечные бета-рецепторы, обозначаемые как В1, и гладкомышечные бета-рецепторы (заложенные в кровеносных сосудах и бронхиальном дереве), обозначаемые как В2. Стимуляция сердечных бета-рецепторов изопротереном, адреналином и норадреналином ведет к положительному инотропному и хронотропному эффектам (усиление сократительной функции миокарда и увеличение числа сердечных сокращений). Стимуляция этими агентами бета-рецепторов гладкой мускулатуры вызывает вазодилатацию и бронходилатацию. Бета-адреноблокаторы, устраняя симпатические влияния на миокард, приводят к уменьшению частоты и силы сердечных сокращений, снижают сердечный выброс, коронарный кровоток и поглощение кислорода миокардом. Периферическое сопротивление при этом возрастает. Терапевтическая эффективность бета-адреноблокаторов при стенокардии обусловлена их способностью уменьшать работу сердца и понижать потребление миокардом кислорода, в результате чего, несмотря на повышение тонуса венечных сосудов, достигается соответствие между потребностью в кислороде и его доставкой тканям миокарда. Блокада бета-адренорецепторов уменьшает симпатически опосредованное учащение сердечного ритма и усиление сократимости миокарда, сопровождающее физическую нагрузку. Благодаря снижению сократимости миокарда бета-адренорецепторы ослабляют вызванное нагрузкой возрастание сердечного выброса и снижают степень повышения артериального давления во время нагрузки. Уменьшение числа сердечных сокращений, сократимости миокарда и артериального давления ведет к уменьшению потребления кислорода миокардом. Уменьшение потребности в кислороде на любом уровне физической активности обусловливает возрастание мощности нагрузок, которые больной может выполнять до достижения критического уровня потребления кислорода, когда вследствие ишемии миокарда возникает приступ стенокардии. Блокада бета-адренорецепторов способствует увеличению объема желудочков, что ведет к повышению потребности миокарда в кислороде. Применение бета-адреноблокаторов оказывает несомненный антиангинальный эффект, связанный с более рациональным расходованием кислорода миокардом при физических нагрузках. Уменьшение потребности миокарда в кислороде благотворно влияет на ишемизированные зоны миокарда, помогая восстановить баланс между потребностью в кислороде и ограничением его поступления. При практическом использовании бета-адреноблокаторов необходимо учитывать особенности их фармакокинетики, что существенным образом сказывается на продолжительности действия после однократного приема. В клинической практике применяют следующие бета-адреноблокаторы. I. Некардиоселективные (В1- и В2-блокаторы): — без внутренней симпатикомиметической активности — пропраналол (синонимы: апоприкин, обзидан, индерол); тимолол, соталол; — с внутренней симпатикомиметической активностью — оксипренолол (синоним: тразинор), альпреполол (синоним: аптин), пиндолол (синоним: вискен). II. Кардиоселективные (Врблокаторы): — без внутренней симпатикомиметической активности — метопролол (синоним: бетанол), атенопол (синоним: тенормин), талинолол (синоним: корданум); — с внутренней симпатикомиметической активностью: практолол (синоним: эрагдин), ацебутолол (синоним: сентроль). Все перечисленные препараты оказывают выраженный клинический эффект у больных стенокардией независимо от различий в «тонких» фармакологических свойствах. Кардиоселективные бета-блокаторы по сравнению с неселективными реже приводят к бронхоспазму, к нарушениям периферического кровообращения, вызывают менее выраженные нарушения кровообращения в ответ на гипогликемию (см.). Из бета-блокаторов в клинике наибольшее распространение получил пропранолол (синонимы: анаприлин, обзидан, индерол). Начальная доза пропранолола должна быть небольшой: по 10 мг 4 раза в день. Это особенно важно у пожилых и больных с одышкой в анамнезе. Затем дозу повышают до 40 мг в сутки каждые 3–4 дня до достижения 160 мг/сут. (разделенной на 4 приема). Большинству больных с тяжелой стенокардией (III–IV функциональные классы) необходим прием бета-адреноблокаторов. Снижение частоты приступов стенокардии у таких больных коррелирует со снижением уровня летальности. Пропранолол противопоказан при выраженной синусовой брадикардии (см.), атриовентрикулярных блокадах любой степени, бронхиальной астме (см.), обострении язвенной болезни (см.) желудка и двенадцатиперстной кишки. Сочетанное применение нитратов и бета-адреноблокаторов гемодинамически оправдано, если оно позволяет добиваться большего клинического эффекта, чем при раздельном назначении этих препаратов, и проявляется наибольшим увеличением толерантности больных к физическим нагрузкам. Антиадренергические препараты смешанного типа. По механизму действия и клинической эффективности к бета-адреноблокаторам близок амодарон (синоним: кордарон) — производное бензофурона. Кордарон обладает сложным механизмом действия. Одним из ведущих компонентов его действия является уменьшение адренергического возбуждения, торможения (но не блокады!) реакции альфа- и бета-рецепторов при систематической стимуляции. Кордарон оказывает сосудорасширяющий эффект, приводя к увеличению объема крови, притекающей к миокарду. Он снижает также потребление кислорода миокардом за счет разгрузки сердца вследствие уменьшения числа сердечных сокращений и снижения общего периферического сопротивления. Кордарон практически не оказывает отрицательного инотропного действия. Важное достоинство препарата — его антиаритмический эффект, основанный на антиадренергическом действии, которое заключается в частичной блокаде альфа- и бета-рецепторов симпатической нервной системы. Другой особенностью кордарона, с которой связано его антиаритмическое действие, является его прямое влияние на изолированные миофибриллы, удлинение фазы реполяризации без воздействия на фазу деполяризации. Этим кордарон отличается от других антиаритмических препаратов. На ЭКГ удлиняется интервал Q-T, но не изменяются ни волна Р, ни комплекс QRS. При тахикардии кордарон основное действие оказывает на атриовентрикулярный узел, замедляя проведение импульса через него. Кордарон можно назначать одновременно с сердечными гликозидами, но при этом особенно важен систематический контроль за частотой сердечных сокращений. Важным преимуществом кордарона является его противоаритмическая активность. Препарат показан при синусовой тахикардии, мерцании и трепетании предсердий, наджелудочковой экстрасистолии, «узловой» тахикардии, синдроме WPW, желудочковой экстрасистолии. Препарат противопоказан при синусовой брадикардии, синоатриальной, атриовентрикулярной и трехпучковой блокадах. Подобно бета-адреноблокаторам, кордарон хорошо сочетается с препаратами депо нитроглицерина и другими нитратами. При этом лечебный эффект выше, чем при раздельном применении препаратов. При тяжелых и частых ангинозных приступах можно внутривенно капельно вводить кордарон по 150 мг 2 раза в день в течение 7—10 дней. Такой способ применения кордарона показан не только для купирования аритмий, но и для быстрого достижения антиангинозного эффекта. Антагонисты кальция. В фармакотерапии ИБС большое значение придают антагонизму к ионам кальция. Антагонисты кальция тормозят или уменьшают проникновение ионов кальция внутрь клеток через мембраны миокардиальных и гладких мышечных клеток. В связи с этим количество кальция, усиливающего сцепление актиномиозина, уменьшается, и сокращение миоцита ослабевает. В настоящее время из антиангинальных препаратов, относящихся к группе антагонистов кальция, находят клиническое применение нифедипин, веропамил, дифрил, пергекселина малеат (синоним: пексид), фенигидин (синоним: сензит), дильтиазем. Сосудорасширяющие препараты. Классические сосудорасширяющие препараты не отвечают современным требованиям, предъявляемым к антиангинальным препаратам. Сосудорасширяющие препараты увеличивают приток крови к миокарду, не нарушая его работы, но они не способны уменьшать потребность миокарда в кислороде и не оказывают антиадренергического действия. Эти препараты не улучшают кровотока в ишемизированных участках миокарда, артериолы которых уже расширены до предела. В результате этого повышается приток крови к зонам миокарда с сохраненным кровоснабжением, что может вызвать даже ухудшение кровоснабжения в ишемизированных участках миокарда. Лечение ангинозного приступа. Первое, с чем приходится сталкиваться врачу у значительного большинства больных острым инфарктом миокарда, это тяжелый ангинозный приступ, который требует безотлагательного купирования. Боль не только доставляет тяжелейшие субъективные ощущения, но может послужить пусковым механизмом такого осложнения, как кардиогенный шок (см.). Самыми «старыми» средствами обезболивания при инфаркте миокарда являются наркотические анальгетики: морфин, пантопон, омнопон, промедол. Эффективность этих препаратов достаточно высока, поэтому они продолжают широко использоваться, несмотря на ряд серьезных недостатков. К ним относятся: снижение артериального давления, брадикардическое действие, возбуждение рвотного и угнетение дыхательного центра, развитие пареза желудочно-кишечного тракта, затруднение мочеиспускания. Морфин и морфиноподобные препараты усиливают ацидоз, а по некоторым данным — наклонность к тромбообразованию. Для уменьшения побочного действия и усиления обезболивающего эффекта используют комбинацию наркотических анальгетиков с атропином, нейроплегическими и антигистаминными препаратами. В лечении ангинозного приступа все более широкое применение получает нейролептанальгезия, которая осуществляется комбинированным введением мощного синтетического анальгетика фентанила и нейропептида дроперидола. Эффективный метод борьбы с ангинозным приступом — наркоз смесью закиси азота с кислородом. Закись азота и кислорода во вдыхаемой смеси берут в разных соотношениях — обычно вначале для быстрейшего достижения эффекта используют смесь 80 %-ной закиси азота и 20 %-ного кислорода. По мере достижения эффекта снижают концентрацию закиси азота и увеличивают содержание кислорода, пока их соотношение не станет равным. Антикоагулянтная и тромболитическая терапия при инфаркте миокарда. Целью антикоагулянтной терапии являются ограничение начинающегося тромбоза, профилактика нового тромбоза и тромбоэмболических осложнений. Если тромбоэмболические осложнения уже возникли, то антикоагулянтная терапия уменьшает число рецидивов осложнения. По механизму действия антикоагулянты делятся на две группы: прямого (гепарин) и непрямого действия. Лечение гепарином следует начинать как можно раньше, с созданием достаточной терапевтической концентрации его в крови. Первая доза гепарина должна быть не менее 10–15 тыс. ЕД. Предпочтителен внутривенный путь введения, действие начинается немедленно и продолжается 4–6 ч. К антикоагулянтам непрямого действия относятся производные оксикумарина (дикумарин, неодикумарин, синкумар и др.) и фенилиндандиона (фенилин, омефен). Все антикоагулянты непрямого действия являются антагонистами витамина К, необходимого для образования в печени протромбина. Действие их связано с нарушением биосинтеза протромбина и проконвертина (фактора VII и факторов IX и Х). Все непрямые антикоагулянты действуют медленно и обладают кумулятивными свойствами. Противопоказания к применению антикоагулянтов: — язвенная болезнь и другие заболевания желудочно-кишечного тракта с наклонностью к кровотечениям; — заболевания почек с гематурией, признаки почечной недостаточности; — заболевания печени (хронические гепатиты (см.), циррозы (см.)); — заболевания крови с нарушением гемостатических механизмов; — подострый септический эндокардит; — кавернозный туберкулез (см.) легких; — витаминная недостаточность. Одним из основных условий успешного лечения больных инфарктом миокарда является правильный режим физической активности. В остром периоде ее следует свести к минимуму. Обычно с такой целью предписывают строгий постельный режим. Основной задачей реабилитации является создание оптимальных условий для восстановления трудоспособности больного. Можно выделить несколько аспектов в реабилитации больных инфарктом миокарда. Медицинская реабилитация предусматривает максимальное восстановление функций организма, нарушенных болезнью. Физическая реабилитация, помимо этого, включает и мероприятия по восстановлению физической работоспособности больного (своевременная и адекватная активизация, лечебная гимнастика, массаж и т. д.). Психологический аспект реабилитации заключается в преодолении отрицательных эмоций больного, возникших в связи с инфарктом миокарда. Социально-экономический аспект касается вопросов, связанных с определением трудоспособности, трудоустройства больного Существенное влияние на течение заболевания и прогноз оказывают факторы риска, среди которых наибольшее значение имеют гиперхолестеринемия, артериальная гипертензия и курение. У мужчин в возрасте 30–59 лет, имеющих эти факторы риска, частота развития инфаркта миокарда в 8 раз выше, чем в среднем в популяции. Важное прогностическое значение имеет переносимость физической нагрузки. При низкой толерантности к нагрузке частота развития инфаркта миокарда выше, чем при средней и высокой толерантности. Инфаркт миокарда наиболее часто развивается у пациентов с IV (67,1 %) и III (52,8 %) функциональными классами стенокардии, у пациентов со II и I функциональными классами он возникает лишь в 20,5 и 9,5 % случаев соответственно. Частота смертельных исходов определяется в основном распространенностью коронарного атеросклероза. У пациентов с поражением одной коронарной артерии ежегодная смертность составляет в среднем 1,5 %. Но при стенозе начального отдела передней межжелудочковой ветви левой коронарной артерии, снабжающей кровью всю переднюю стенку и верхушку левого желудочка, смертность составляет 1,9 % в год, а при поражении огибающей ветви левой коронарной артерии или ствола правой коронарной артерии — 0,6 %. При поражении двух коронарных артерий смертность составляет 3,5 % в год, а у больных с поражением трех основных коронарных магистралей — 4,7 %. Исследования центральной гемодинамики во время приступа стенокардии у больных с поражением одной, двух и трех коронарных артерий показали, что с увеличением числа стенозированных артерий зона ишемии миокарда становится более обширной, а насосная функция сердца прогрессивно снижается. Эти гемодинамические изменения объясняют появление во время приступов симптомов левожелудочковой недостаточности (одышка, ритм галопа и др.), а также нарастание смертности с увеличением числа пораженных артерий: чем больше стенозировано коронарных магистралей и чем больше масса страдающего от недостатка крови миокарда, тем более выражено падение насосной функции сердца, а следовательно, выше вероятность смерти. Прогноз отягощается при снижении сократительной способности миокарда, в основе которой могут лежать наличие постинфарктного кардиосклероза, поражения миокарда при злоупотреблении алкоголем, сахарный диабет (см.) и т. д. Выживаемость при стенокардии, определяемая главным образом распространенностью стенозирующего коронарного атеросклероза и состоянием миокарда вне зоны ишемии, может прогнозироваться по насосной функции сердца во время приступов.
СТОЛБНЯК
ОпределениеСтолбняк (tetanus) — тяжелое острое зоонозное инфекционное заболевание, характеризующееся поражением нервной системы и проявляющееся тоническими и клоническими судорогами скелетной мускулатуры, приводящими к асфиксии.
Этиология и эпидемиология Столбняк — болезнь древняя. Его клиника была исчерпывающе описана Гиппократом (460–377 гг. до н. э.). Врачи древних цивилизаций — Греции, Индии, Китая — обращали внимание на связь между ранениями и развитием этой тяжелой инфекции. Врачи древности уже различали несколько форм столбняка в зависимости от того, какая группа мускулатуры поражена, — тотальный столбняк, опистотонус и др. У врачей той же эпохи (Аретей, 50 г. до н. э.) можно найти указания на то, что к этиологическим моментам столбняка относятся роды (см.) и аборты (см.), но главным условием развития болезни считали войны и связанные с ними ранения. Русский хирург Н. Бредов (1843 г.) считал, что после бешенства (см.) и чумы (см.) «нет почти болезни более смертельной, чем столбняк». Но подлинно научное изучение столбняка началось только во второй половине XIX в., когда были поняты причины и пути распространения инфекционных болезней. Инфекционную природу столбняка заподозрил еще Н. И. Пирогов, а в 1883 г. русский ученый Н. Д. Монастырский обнаружил столбнячную палочку в трупах людей, умерших от столбняка. Годом позже А. Николайер воспроизвел экспериментальный столбняк у лабораторных животных путем введения им под кожу садовой земли; при этом в гное абсцесса, образовавшегося на месте прививки, был найден возбудитель болезни. Чистую культуру микроорганизма выделил в 1887 г. японский бактериолог Китазато, он же в 1890 г. получил столбнячный токсин и совместно с Э. Берингом предложил для лечения столбняка антитоксическую противостолбнячную сыворотку. В 1923–1936 гг. французскому исследователю Г. Рамону удалось получить столбнячный анатоксин, который в дальнейшем стал применяться для профилактики заболевания. Столбняк и сегодня продолжает уносить жизни многих десятков тысяч людей самого цветущего возраста. Его летальность очень высока — в группе инфекционных заболеваний она уступает только бешенству (см.). В самых лучших специализированных учреждениях она достигает 40–45 %. Полагают, что это число необходимо по меньшей мере утроить. Для заболеваемости столбняком характерна тенденция к возрастанию по мере приближения к экватору. Смертность бывает наименьшей в странах холодного и умеренного климата с большими сезонными колебаниями температуры и наивысшей — в странах теплого и тропического климата с невыраженной сезонностью. Возбудитель болезни клостридиум тетани представляет собой сравнительно крупную, тонкую палочку с закругленными концами длиной 4–8 мкм и шириной 0,3–0,8 мкм. Микроорганизм образует крупную, терминально расположенную спору, размеры которой превышают его поперечник, что придает ему вид барабанной палочки. Споры устойчивы к воздействию физических и химических факторов внешней среды: они выдерживают нагревание до 90 °C в течение 2 ч, при кипячении погибают только через 30–50 мин, в сухом состоянии переносят нагревание до 155 °C, а в соленой морской воде выживают до 6 месяцев. В испражнениях, почве, на различных предметах они могут сохраняться годами. В условиях анаэробиоза (при отсутствии кислорода) при температуре 37 °C, достаточной влажности и в присутствии аэробных бактерий (стафилококки, сенная палочка и др.) споры прорастают в вегетативные формы. Вегетативные формы малоустойчивы и гибнут при кипячении через 5 мин. Cl. tetani подвижна, имеет до 20 длинных, перитрихиально расположенных жгутиков, грамположительна, хорошо окрашивается всеми анилиновыми красками. Относится к облигатным (строгим) анаэробам, высокочувствительным к действию кислорода. По антигенной структуре неоднородна: выделяют групповой специфический О-антиген и типоспецифический жгутиковый Н-антиген, по которому различают 10 сероваров бактерий. Важным свойством возбудителя является токсинообразование. Столбнячный токсин относится к группе экзотоксинов и представляет собой белок с повышенным содержанием аспарагиновой кислоты, изолейцина и лизина. Состоит из тетаноспазмина со свойствами нейротоксина, обусловливающего характерный для столбняка клинический синдром, и тетаногемолизина, растворяющего эритроциты. Экзотоксин возбудителя столбняка является одним из сильнейших бактериальных ядов. Токсин быстро инактивируется под влиянием нагревания, солнечного света, щелочной среды. Ферменты желудочно-кишечного тракта не разрушают токсин, но он не всасывается через слизистую оболочку кишечника, в связи с чем безопасен при введении через рот. Возбудитель столбняка относится к категории убиквитарных (вездесущих), но вместе с тем условно-патогенных микроорганизмов. Он является обычным обитателем кишечника травоядных животных и человека (5—40 %); здесь он живет и размножается, не проявляя патогенных свойств и не причиняя вреда организму паразитоносителя. Его можно обнаружить в почве огородов, садов, полей, пастбищ и на других объектах внешней среды, загрязненных фекалиями. Наибольшая обсемененность столбнячной палочкой наблюдается в черноземных, сильно увлажненных почвах, в южных районах с развитым сельским хозяйством, где регистрируется высокая заболеваемость столбняком сельских жителей. Заболеваемость носит резко выраженный сезонный характер (с конца апреля по октябрь включительно), что обусловлено определенным циклом жизнедеятельности возбудителя. Заболевание связано с травматизмом. Споры, а иногда и вегетативные формы заносятся из почвы на одежду и кожу человека и в случаях даже небольших повреждений вызывают заболевание. Только тогда, когда возбудитель столбняка попадает на поврежденные ткани живого организма, лишенные доступа кислорода, он приобретает патогенные свойства и начинает вырабатывать сильнодействующий токсин, вызывающий специфические поражения нервной системы. Особенно частой причиной заражения бывают микротравмы нижних конечностей (62–65 %). Ранения стоп при ходьбе босиком, уколы острыми предметами, колючками кустов, занозы настолько часто приводят к развитию столбняка, что его иногда называют «болезнью босых ног». Заболевание может развиться при ожогах (см.) и отморожениях (см.), у рожениц при нарушении правил асептики, особенно в случаях родов (см.) на дому, при криминальных абортах (см.), у новорожденных.
Патогенез и патанатомия Входными воротами инфекции при столбняке служат поврежденные кожные покровы и слизистые оболочки. Повреждения могут быть как значительными, так и едва заметными. Особенно опасны колотые или имеющие глубокие карманы раны, где создаются условия анаэробиоза, способствующие размножению столбнячной палочки и выделению ею токсина. Развитию возбудителя в организме благоприятствуют также ранения с размягченными и некротизированными тканями. Экспериментальные работы показали способность спор к размножению и развитию в зависимости от окислительно-восстановительного потенциала тканей. Его снижение в результате некроза (см.), ишемии или гипоксии при уменьшении содержания кислорода в дыхательной смеси приводит к переходу спор в вегетативные формы, быстрому их размножению и образованию токсина в значительной концентрации. Различают столбняк травматический, когда болезнь распространяется после ранений, ожогов (см.), отморожений (см.), электротравм (см.), криминальных абортов (см.), инъекций, операций и родов; воспалительный столбняк, возникающий на почве воспалительных процессов (язвы, пролежни, распадающиеся раковые опухоли (см.), фурункулы (см.)), и криптогенный столбняк, когда входные ворота инфекции остаются неустановленными. Считается, что возникновение клинического синдрома столбняка обусловлено действием токсина, а не самих микробных тел. Продвижение токсина происходит по двигательным волокнам периферических нервов и с током крови в спинной, продолговатый мозг и в ретикулярную формацию ствола. Не исключается, однако, лимфогенное распространение токсина, а также повышение проницаемости гематоэнцефалического барьера в патологических условиях. Происходит главным образом паралич вставочных нейронов полисинаптических рефлекторных дуг. Вследствие их паралича импульсы, вырабатываемые в мотонейронах, поступают к мышцам некоординированно, непрерывно вызывая постоянное тоническое напряжение скелетной мускулатуры. В результате усиления афферентной импульсации, связанной с неспецифическими раздражениями (звуковые, световые, тактильные, обонятельные и др.), возникают тетанические судороги. Генерализация процесса при столбняке сопровождается повышением возбудимости коры большого мозга и ретикулярных структур, повреждением дыхательного центра и ядер блуждающего нерва. Генерализация происходит по восходящему типу, т. е. ригидность мышц распространяется с пораженной конечности на противоположную, затем на туловище, шею, голову, а потом возникают клонико-тонические судороги. Вследствие судорожного синдрома, который в свою очередь усиливает тонические и тетанические судороги, развивается метаболический ацидоз. Может возникнуть паралич (см.) сердца. Столбнячный токсин блокирует выброс ГАМК, дофамина, а также глицина и других аминокислот; в малых дозах блокирует, а в больших усиливает выброс норадреналина. В больших дозах токсин нарушает выброс ацетилхолина. Именно центральные нарушения жизненно важных функций обусловливают высокую летальность при столбняке. Важное значение в патогенезе столбняка имеют метаболические нарушения, расстройства гемодинамики и гомеостаза, возникающие как следствие поражения столбнячным токсином вегетативной нервной системы и ядер продолговатого мозга. Немаловажную роль играют также вторичная бактериальная инфекция и интеркуррентные заболевания, наслаивающиеся вследствие ослабления специфических и неспецифических факторов защиты. Специфические патологоанатомические изменения при столбняке отсутствуют. Вследствие судорожного синдрома могут наблюдаться переломы костей, особенно компрессионный перелом позвоночника (тетанускифоз), разрывы мышц и сухожилий. Отмечается быстро наступающее трупное окоченение мышц. При микроскопическом исследовании скелетной мускулатуры выявляются базофилия волокон, признаки дегенерации и некроза в ткани мозга.
Клиническая картина Клинический симптомокомплекс столбняка, описанный впервые Гиппократом, не претерпел изменений до наших дней. В клинической классификации выделяют общий, или генерализованный, и местный столбняк. Заболевание чаще протекает в виде генерализованного процесса. Тяжесть заболевания и прогноз зависят от быстроты развития клинической картины. Различают следующие формы заболевания: — молниеносную форму, характеризующуюся быстрым развитием, тяжелым состоянием, заканчивающуюся смертью через 1–3 суток; — острую форму, отличающуюся сравнительно более легким течением болезни, когда при тяжелом состоянии больного судороги повторяются реже, а при своевременно начатом лечении возможно выздоровление; — подострую форму, которая характеризуется медленным развитием клинической симптоматики, редкими судорожными припадками, непродолжительными по времени; — местный столбняк, проявляющийся напряжением отдельных групп мышц около места ранения. У человека по восходящему типу болезнь развивается редко, поэтому местный столбняк наблюдается нечасто. Различают 4 периода болезни: инкубационный, начальный, разгара и выздоровления. Инкубационный период при столбняке колеблется от 5 до 14 дней, в ряде случаев укорачиваясь до 1–4 дней или удлиняясь до 30 дней. Заболеванию могут предшествовать продромальные явления в виде головной боли, повышенной раздражительности, потливости, напряжения и подергивания мышц в окружности раны. За несколько дней до развертывания характерной клинической картины могут быть озноб, бессонница, зевота, боли в горле при глотании и боли в спине. Чаще болезнь начинается остро. Наиболее ранний признак столбняка — появление тупых, тянущих болей в области входных ворот инфекции, где к этому времени нередко происходит полное заживление раны. Одним из начальных симптомов, имеющих важное диагностическое значение, является тризм — напряжение и судорожное сокращение жевательных мышц, что затрудняет открывание рта. В тяжелых случаях зубы крепко сжаты, поэтому открыть рот невозможно. Вслед за этим развиваются судороги мимических мышц, придающие лицу больного своеобразное выражение — одновременно улыбки и плача — получившее название сардонической улыбки: лоб обычно в морщинах, рот растянут в ширину, углы его опущены. Одновременно появляются другие кардинальные симптомы: затруднение глотания из-за судорожного спазма мышц глотки и болезненная ригидность мышц затылка. Ригидность распространяется и на другие мышечные группы в нисходящем порядке, захватывая мышцы шеи, спины, живота и конечностей. В зависимости от преобладания напряжений в той или иной группе мышц тело больного может принимать самые разнообразные, иногда причудливые позы. Вследствие резкого спазма мышц спины голова запрокидывается, больной выгибается на постели в виде арки, упираясь только пятками и затылком (опистотонус). В дальнейшем может появиться напряжение мышц конечностей, прямых мышц живота, который становится твердым, как доска. Гипертонус мышц затрудняет движения больного. В тяжелых случаях наступает полная скованность туловища и конечностей, за исключением кистей и стоп. На фоне постоянного гипертонуса мышц возникают мучительные, резко болезненные толчкообразные клонические судороги, вначале ограниченные, а затем распространенные, с охватом больших мышечных групп. Судороги, еще более усиливающие напряжение пораженных мышц, длятся от нескольких секунд до нескольких минут и истощают силы больного, частота их зависит от тяжести болезни. В легких случаях они появляются не чаще 1–2 раз в сутки, в тяжелых — продолжаются почти непрерывно, по нескольку десятков приступов в течение часа. Вследствие резко повышенной возбудимости нервной системы возможно развитие судорог при различных, даже незначительных раздражениях (прикосновение, свет и др.). Во время судорог лицо больного покрывается крупными каплями пота, делается одутловатым, выражает страдание, синеет, черты искажаются, тело вытягивается, опистотонус настолько выражен, что больной дугообразно изгибается кзади, при этом четко вырисовываются контуры мышц шеи, туловища и рук. Больные испытывают чувство страха, скрежещут зубами, кричат и стонут от боли. Судороги дыхательных мышц, голосовой щели и диафрагмы резко нарушают дыхание и могут привести к смерти. Появляются расстройства кровообращения с развитием застойных явлений и аспирационной пневмонии (см.). Спазм глоточных мышц нарушает акт глотания, что вместе с тризмом ведет к обезвоживанию и голоданию. Гипертонус мышц промежности затрудняет дефекацию и мочеиспускание. Сознание обычно остается ясным, что усугубляет страдания больного. Судороги сопровождаются мучительной бессонницей, не поддающейся воздействию снотворных и наркотических препаратов. Постоянный общий гипертонус мышц, частые приступы тетанических судорог приводят к резкому усилению обмена веществ, профузному потоотделению, гиперпирексии (41–42 °C). Нарушается деятельностьсердечно-сосудистой системы: со 2—3-го дня болезни выявляется тахикардия (см.) на фоне громких сердечных тонов, пульс напряжен, артериальное давление повышено. С 7—8-го дня болезни тоны сердца становятся глухими, сердце расширено за счет обоих желудочков, может наступить его паралич (см.). В крови нередко наблюдается нейтрофильный лейкоцитоз. По тяжести течения различают следующие формы столбняка: очень тяжелая (IV степень); тяжелая (III степень); средней тяжести (II степень); легкая форма (I степень). Легкая форма наблюдается редко. Обычно инкубационный период длится более 20 дней, но может быть и коротким. Симптомы болезни развиваются в течение 5–6 дней. Тризм, сардоническая улыбка, опистотонус выражены умеренно. Гипертонус других мышц проявляется слабо, тетанические судороги незначительны. Температура нормальная или субфебрильная. При среднетяжелой форме заболевания инкубационный период продолжается 15–20 дней, а клинический симптомокомплекс развивается в течение 3–4 дней. Наблюдаются те же симптомы, что и при заболевании I степени, но с присоединением нечастых и умеренно выраженных тетанических судорог. Температура нередко высокая, тахикардия (см.) умеренная. Для тяжелой формы болезни характерен короткий инкубационный период (7—14 дней). Клиническая картина развивается остро и быстро (в течение 24–48 ч с момента появления первых признаков болезни). Этой форме свойственны частые и интенсивные тетанические судороги, потливость, тахикардия (см.), высокая температура, постоянный мышечный гипертонус между приступами судорог, нередко — развитие пневмоний (см.). При очень тяжелой форме инкубационный период обычно длится до 7 дней. Болезнь развивается молниеносно, сопровождается гиперпирексией, значительной тахикардией (см.) и тахипноэ, сильными и частыми судорогами, цианозом и угрожающей асфиксией (см.). Так называемый головной стобняк Бруннера, или бульбарный столбняк, является одной из тяжелейших форм болезни, при которой поражаются верхние отделы спинного и продолговатого мозга (дыхательный центр, ядра блуждающего нерва и др.). Летальный исход при этом возможен в результате паралича сердца или дыхания. Эту форму следует считать генерализованным процессом, развивающимся по нисходящему типу. Очень тяжело протекает гинекологический столбняк, или столбняк, возникающий после криминального аборта и родов на дому. Тяжесть течения обусловлена анаэробиозом в полости матки и нередким наслоением вторичной стафилококковой флоры, что ведет к сепсису (см.), а также способствует активации столбнячной палочки (синергизм). Прогноз при этих формах обычно неблагоприятный. Следует выделить протекающий очень тяжело столбняк новорожденных, встречающийся в основном в странах Азии, Африки и Латинской Америки. Заражение новорожденных происходит при инфицировании пуповинного остатка при родах на дому без медицинской помощи. Новорожденные болеют очень тяжело. Клинический симптомокомплекс отличается непостоянством, но мышечный гипертонус и тетанические судороги (особенно выраженные у новорожденных в виде блефароспазма, тремора нижней губы, подбородка и языка) бывают всегда явными. Летальность новорожденных достигает 90—100 %. Местный столбняк у человека встречается редко. Первоначально поражаются мышцы в области раны, где появляется боль, а затем возникают мышечное напряжение и тетанические судороги. Типичным проявлением местного столбняка служит лицевой паралитический столбняк, возникающий при ранениях головы и лица. На фоне выраженного тризма и ригидности мимических и затылочных мышц развиваются парезы (см.) черепных нервов, реже глазодвигательных и отводящих. Поражение обычно двустороннее, но более выраженное на стороне ранения. Наблюдающиеся в ряде случаев спазм и судорожные сокращения глоточных мышц напоминают клиническую картину бешенства (см.), что позволило назвать эту форму тетанус гидрофобус. Нередко происходит генерализация процесса. Столбняк относится к числу острых циклических инфекционных болезней с длительностью клинических проявлений до 2–4 недель. Особенно опасен для жизни больного острый период до 10—14-го дня болезни. При выздоровлении лишь спустя 1,5–2 месяца человек, перенесший столбняк, может приступить к работе. Еще долго ощущается тугоподвижность в суставах, а компрессионная деформация позвоночника (тетанускифоз) может сохраняться до 2 лет. Могут оставаться контрактуры, требующие ортопедического лечения. Прогноз почти всегда серьезный. Летальность составляет 20–25 %. Из симптомов болезни, особенно неблагоприятных для прогноза, следует указать на судороги в области голосовой щели, дыхательных мышц и диафрагмы, ведущие к асфиксии (см.), гиперпиретическую температуру, нарастающую тахикардию (см.), тахипноэ. Более благоприятно протекает местный столбняк.
Осложнения Осложнения при столбняке могут возникать в связи с основным процессом (разрывы мышц и сухожилий, аспирационная пневмония (см.), отек легких (см.), переломы (см.) костей, вывихи (см.) и др.) или бывают обусловлены наслоением вторичной бактериальной инфекции (бронхопневмония (см.), сепсис (см.) и др.). Осложнения при столбняке делят на ранние и поздние. В ранние сроки болезни возникают бронхиты (см.) и пневмонии (см.) ателектатического, аспирационного и гипостатического происхождения. Пуэрперальный столбняк часто осложняется сепсисом (см.). Последствием судорог бывают разрывы мышц и сухожилий, переломы (см.) костей, вывихи (см.). Длительные судороги дыхательных мышц могут привести к асфиксии (см.). Нарастающая при судорогах гипоксия вызывает коронароспазм с развитием инфаркта миокарда (см.) у пожилых, а также способствует параличу сердечной мышцы, наступающему на высоте судорожного приступа. При этом не исключается прямое действие столбнячного токсина на миокард. К поздним осложнениям относят, по существу, последствия болезни — длительную тахикардию (см.) и гипотензию, общую слабость, деформацию позвоночника, контрактуры мышц и суставов, паралич (см.) черепных нервов, что иногда неправильно расценивают как хронический столбняк. Рецидивы болезни крайне редки.
Диагностика и дифдиагностика Диагноз столбняка основывается только на характерном симптомокомплексе, а также правильной оценке эпидемиологических данных и наличии патологических состояний (ранения, отморожения и т. д.). Лабораторная диагностика столбняка довольно ограничена и сводится к выделению из раны возбудителя, что удается не более чем у 30 % больных. Дифференцировать столбняк приходится с отравлением (см.) стрихнином, которое также проявляется судорогами, напоминающими столбнячные. В отличие от столбняка, в промежутках между судорогами мышечная ригидность полностью отсутствует. При отравлении стрихнином сильно расширяются зрачки, а при столбняке зрачки бывают нормальных размеров. Головной столбняк с выраженными судорогами глоточных мышц и другими бульбарными явлениями приходится дифференцировать с бешенством (см.). Помимо анамнестических данных (укус), в затруднительных для диагностики случаях надо учитывать, что при столбняке отсутствует гидрофобия, столь характерная для бешенства, а также то, что при последнем имеют место резкое общее возбуждение, временное затемнение сознания, саливация. Если столбнячные больные, как правило, неподвижны, то при бешенстве возникает выраженное психомоторное возбуждение. Дифференцируют столбняк также с истерией (см.), клиническая картина которой с явлениями судорожного припадка достаточно типична: приступы судорог, даже с выраженным опистотонусом, наступают внезапно на фоне нормального мышечного тонуса и сопровождаются эмоциональными реакциями (плач, рыдания, хохот), дрожанием век и общим двигательным возбуждением (моторный разряд). Во время клонических судорог больные производят целенаправленные движения: рвут одежду, бьются головой о твердые предметы, выкрикивают бранные слова, кусают пальцы и губы. Падение во время приступа истерии почти никогда не сопровождается сколько-нибудь серьезными травмами. После приступа у больных помрачается сознание, они переживают разнообразные эмоции. Потом наступает спокойное бредовое состояние с галлюцинациями (см.), а затем сон или состояние безучастности. С окончанием приступа больные возвращаются к нормальному состоянию. Дифференциальную диагностику столбняка проводят также с нейромиозитами и радикулитом (см.), перитонзиллитом и заглоточным абсцессом (см.), эпилепсией (см.), менингитами (см.) и энцефалитами (см.) различной этиологии. При нейромиозитах и радикулите в процесс вовлекаются отдельные группы мышц и отсутствуют тризм и общее повышение мышечного тонуса, нет сардонической улыбки и других признаков столбняка. Перитонзиллит и заглоточный абсцесс (см.) протекают с выраженными болями в горле и односторонней припухлостью шеи, затруднением глотания и высокой температурой тела. При этом возможны тризм и ригидность затылочных мышц, но не бывает сардонической улыбки, а в процесс не вовлекаются другие мышечные группы. Эпилептический приступ характеризуется не только наличием клонических судорог с тризмом и прикусом языка, но также потерей сознания с последующей прострацией и сном, ретроградной амнезией (см.), непроизвольным мочеиспусканием и полным расслаблением мускулатуры. Нужно помнить, что при столбняке судороги никогда не распространяются на кисти и пальцы рук, а сознание всегда остается ясным.
Лечение Без оказания медицинской помощи больной чаще всего погибает. Своевременное лечение позволяет спасти многих больных. Необходимо обеспечить постоянный и тщательный уход, создать максимальный покой. Больного следует поместить в отдельную палату, соблюдать тишину, осторожно переворачивать при медицинских манипуляциях и смене белья. Правильное высококалорийное питание больных столбняком является одной из важнейших задач. Если больной находится на консервативном лечении и может глотать, то назначают бульоны, компоты, молоко, сметану, кефир, сырые яйца, кисели, чай. Обычно это делают с учетом желания больных. Прием пищи осуществляется с помощью поильников с резиновыми наконечниками. При сильном тризме и гидрофобии приходится прибегать к осторожному введению через нос в желудок тонкого зонда и через него вводить указанную выше пищу. Обязательно также введение через зонд фруктовых соков (апельсинового и др.). У больных столбняком имеется нарушение кислотно-щелочного равновесия, и поэтому сохранение водно-электролитного баланса является одной из важнейших задач в лечебной тактике. Введение солей натрия, калия, кальция, хлора считается обязательным. Лучше всего прибегать к внутривенному вливанию солевых растворов. Лечение больных столбняком проводится в специализированных центрах. Терапия должна быть комплексной (этиотропная, патогенетическая, симптоматическая) и включать следующие мероприятия: борьбу с возбудителем в первичном очаге инфекции; нейтрализацию токсина, циркулирующего в крови; противосудорожное лечение; поддержание основных жизненно важных функций организма (сердечно-сосудистая деятельность, дыхание и др.); борьбу с гипертермией, ацидозом и обезвоживанием; профилактику и лечение осложнений; правильный режим, полноценное питание, хороший уход. Для решения первой задачи необходимы тщательная ревизия и хирургическая обработка раны с удалением инородных тел и некротизированных тканей, широким вскрытием слепых карманов, обеспечением хорошего оттока раневого отделяемого. С целью ограничения поступления токсина из раны рекомендуется перед обработкой произвести ее обкалывание противостолбнячной сывороткой в количестве 1–3 тыс. МЕ. Хирургические манипуляции проводят под наркозом, чтобы болевые ощущения не провоцировали судорожных приступов. Нейтрализация токсина в организме осуществляется введением антитоксической противостолбнячной лошадиной сыворотки. Фиксированный клетками спинного и продолговатого мозга столбнячный токсин не может быть реадсорбирован, поэтому сыворотку следует вводить как можно раньше. Ее вводят однократно внутримышечно с предварительной десенсибилизацией в дозах 100–150 тыс. МЕ взрослым, 20–40 тыс. МЕ новорожденным и 80—100 тыс. МЕ детям более старшего возраста. Указанные дозы обеспечивают высокий антитоксический титр в крови больного в течение 3 недель и более, поэтому необходимости в повторном введении сыворотки нет. Учитывая возможность развития анафилактического шока после введения, должно быть обеспечено медицинское наблюдение за больным на протяжении не менее 1 ч. В последние годы лучшим антитоксическим средством считается противостолбнячный человеческий иммуноглобулин. Лечебная доза препарата составляет 900 МЕ (6 мл) и вводится однократно внутримышечно. Судороги снимают введением седуксена или нозепама. Лучший эффект наблюдается при введении 0,25 %-ного раствора дроперидола в дозе до 5 мл и 20 %-ного раствора натрия оксибутирата до 20 мл. В тяжелых случаях применяются миорелаксанты с переводом больных на ИВЛ. При очень тяжелой форме (IV степень) и упорных судорогах единственным эффективным средством являются миорелаксанты, предпочтительно антидеполяризующего типа действия (тубокурарин). Действие релаксантов дополняют введением диазепама, барбитуратов или оксибутирата натрия. Переход на режим длительной миорелаксации (от 1 до 2–3 недель) всегда предполагает проведение искусственной вентиляции легких. Для лечения проявлений гиперадренореактивности (тахикардия, артериальная гипертензия) применяют бета-блокаторы (анаприлин, индерал, обзидан), альфа-блокаторы (тропафен, фентоламин) и перидуральную блокаду. В успехе лечения большое значение имеют терапия и предупреждение вторичных осложнений, особенно пневмонии, ателектаза легких и сепсиса. Показаны антибиотики с учетом чувствительности к ним микрофлоры. Устранение ацидоза и нарушений водносолевого и белкового баланса осуществляют введением ощелачивающих растворов, полиионных растворов, плазмы крови, альбумина и других препаратов. Огромную роль в лечении столбняка играют тщательный уход и калорийное питание. Иногда пищу приходится вводить посредством дуоденального зонда через нос на фоне медикаментозного сна.
Профилактика Профилактика столбняка осуществляется в двух направлениях: профилактика травм и специфическая профилактика. Специфическая профилактика проводится в плановом порядке определенным контингентам населения и экстренно — при получении травм. Активная иммунизация осуществляется анатоксином всем детям в возрасте от 5–6 месяцев до 17 лет, а также учащимся средних и высших учебных заведений, строительным рабочим, рабочим оборонной промышленности, спортсменам, землекопам, рабочим-железнодорожникам, а в зонах с повышенной заболеваемостью столбняком обязательны прививки для всего населения. Для иммунизации детей используют ассоциированные вакцины АКДС и АДС, создающие иммунитет не только против столбняка, но и против коклюша и дифтерии. Сроки прививок и дозы определены инструкциями. Взрослые люди против столбняка иммунизируются двукратно. Анатоксин вводят подкожно в количестве 0,5 мл с месячным интервалом между инъекциями. Первую ревакцинацию осуществляют через 9—12 месяцев после первичной вакцинации, последующие — через 5—10 лет в той же дозе. Введение анатоксина создает у привитых стойкий иммунитет на долгие годы. При угрозе развития столбняка (при ранениях, ожогах II и III степени, отморожениях II и III степени, родах на дому и внебольничных абортах, операциях на желудочно-кишечном тракте и т. д.) осуществляют экстренную его профилактику. С этой целью привитым достаточно ввести 0,5 мл столбнячного анатоксина. Непривитым необходима активно-пассивная иммунизация, при которой инъекцию 1 мл столбнячного анатоксина комбинируют с противостолбнячной сывороткой в дозе 3000 МЕ независимо от возраста. В дальнейшем вводят только анатоксин. Можно вводить противостолбнячный донорский иммуноглобулин внутримышечно в дозе до 3 мл. Профилактические мероприятия в отношении столбняка обязательно включают санитарно-просветительную работу среди населения.
СТРОНГИЛОИДОЗ
ОпределениеСтронгилоидоз — геогельминтоз, нематодоз, характеризующийся поражением желудочно-кишечного тракта и разнообразием токсико-аллергических проявлений.
Этиология Возбудитель — угрица кишечная, имеет сложный цикл развития с чередованием паразитических и свободноживущих поколений половозрелых червей. Популяция паразитических взрослых особей состоит в основном из самок. Паразитическая самка представляет собой бесцветную полупрозрачную нематоду размером 2,2 х 0,03—0,07 мм, свободноживущая самка бывает меньших размеров (1,0 х 0,06 мм); свободноживущие и паразитические самцы сходны по размерам и строению 0,7 х 0,04—0,05 мм. Вышедшие из яйца личинки очень мелкие.
Эпидемиология, патогенез и патанатомия Стронгилоидоз — геогельминтоз. Заражение происходит как перорально при проглатывании филяриевидных личинок с водой или пищей, так и вследствие внедрения личинок через кожу при ее контакте с почвой. Восприимчивость к заражению всеобщая. Стронгилоидоз встречается в районах умеренного климата, но особенно широко распространен в странах тропической и субтропической зоны с влажным климатом. Значительная пораженность стронгилоидозом отмечена в Юго-Восточной Азии, Африке, странах Южной Америки, во многих странах Европы, в том числе в Грузии, Молдавии, Азербайджане и Украине. Источником и окончательным хозяином является зараженный человек. В его организме зрелые самки паразитируют в двенадцатиперстной кишке и в верхней части тонкого отдела кишечника, проникая в кишечные крипты, где оплодотворенные самки откладывают яйца. Продолжительность жизни зрелой паразитической самки — 3–4 месяца. Самцы после оплодотворения самок погибают и с фекалиями удаляются из организма. Из яиц в криптах кишечника выходят рабдитовидные личинки, которые попадают в просвет кишки, выделяются с фекалиями и попадают в почву. При благоприятных условиях внешней среды личинки дают начало половозрелым гельминтам. Из этих личинок развиваются самки и самцы, которые ведут сапрофитный образ жизни и могут размножаться, образуя рабдитовидных личинок следующего свободноживущего поколения. При неблагоприятных условиях рабдитовидные личинки превращаются в филяриевидные (инвазионные). Эти личинки проникают в организм человека через кожу или через рот с пищей и водой. В организме человека филяриевидные личинки проделывают миграцию, током крови заносятся в правые отделы сердца, легкие, продвигаются в глотку и заглатываются. После двух линек личинки превращаются в самок и самцов. Оплодотворение самок происходит в легких или кишечнике. Самки откладывают яйца на 28—30-й день заражения. Иногда жизненный цикл паразита может завершаться без выхода личинок в почву. В этом случае они задерживаются в толстой кишке и превращаются в филяриевидные. Последние проникают через слизистую оболочку кишечника в кровь, легкие, просвет кишечника и развиваются до взрослых особей. Так происходит самозаражение. Патогенное влияние кишечной угрицы складывается из следующих факторов: — механического воздействия личинок во время их миграции в ткани больного и язвенных процессов в местах паразитирования взрослых гельминтов в кишечнике; — токсического воздействия паразита; — аллергической реакции организма. В механизме развития гельминта большое значение, особенно в ранней миграционной фазе, имеет сенсибилизация организма продуктами обмена паразитов. Особенности прикрепления и паразитирования взрослых самок гельминта приводят к значительным механическим повреждениям тонкой кишки. Миграция личинок делает механический фактор еще более значимым. В желудочнокишечном тракте обнаруживаются кровоизлияния, эрозии и даже язвы, описаны пневмонические паразитарные очаги, дистрофические изменения в печени и поджелудочной железе. Взрослые паразиты, находясь в стенке кишки, травмируют кишечные крипты (либеркюновы железы), солитарные фолликулы и способствуют изъязвлению слизистой оболочки, а личинки, совершая миграцию, — ткань печени, легких и других органов. Большое значение имеет токсико-аллергическое воздействие взрослых паразитов и их личинок на организм человека, а также вторичная инфекция.
Клиническая картина и диагностика Инкубационный период продолжается 17 дней. Течение заболевания длительное, с периодами ремиссий и обострений. Это связано с тем, что при этом гельминтозе (особенно при запорах) возможно повторное самозаражение. При отсутствии специфического лечения болезнь может продолжаться неопределенно долго. Специфических, характерных только для стронгилоидоза кишечных признаков не существует. В ранней фазе болезни (миграционной) развивается клиника аллергоза: больные жалуются на слабость, головные боли, кожный зуд (см.), полиморфные экзантемы. Могут повышаться температура, развиваться симптомы бронхита (см.) и пневмонии (см.). Нередко ранняя фаза стронгилоидоза проходит незамеченной. В кишечной (хронической) фазе в клинической картине выделяют следующие формы. Желудочно-кишечная, которая проявляется симптомами хронического гастрита (см.) с пониженной секрецией, энтерита (см.), энтероколита (см.), а иногда и дуоденита (см.) с симуляцией клиники язвенной болезни (см.). Нередко можно выявить признаки дискинезии (см.) желчного пузыря и желчных путей. Токсико-аллергическая форма характеризуется наличием уртикарной сыпи, ползучих линейных высыпаний, сильного зуда и расстройством функций нервной системы; возможно развитие аллергического миокардита (см.), бронхита (см.), уретрита (см.), язвенного кератита (см.). Смешанная форма включает в себя все или некоторые симптомы других вариантов течения стронгилоидоза. Инвазия может протекать в легкой, среднетяжелой и тяжелой формах. Возможны осложнения: язвенные поражения кишечника, перфоративный перитонит (см.), некротический панкреатит (см.), миокардит (см.), менингоэнцефалит, приводящие к неблагоприятному исходу. В крови определяются повышение уровня эозинофилов, лейкоцитов, увеличение СОЭ. Прогноз в большинстве случаев благоприятный, но при тяжелых формах и повторных самозаражениях, а также наличии параллельно текущих болезней — серьезный. Подтверждение диагноза возможно при обнаружении рабдитовидных личинок в дуоденальном содержимом и в кале (по методу Бермана). Фекалии исследуются свежевыделенные, предпочтительно после дачи слабительного. Для диагностики используется иммуноферментный метод (ИФА).
Лечение и профилактика Наиболее эффективна дегельминтизация следующими препаратами. 1. Медамин — по 10 мг/кг массы в сутки в 3 приема. Курс — 1 день взрослым и детям. При массивной инвазии курс составляет 2–3 дня. Препарат применяют после еды. Эффективность — 88–90 %. 2. Декарис — взрослым по 150 мг в один прием. Курс — 1 день. Детям назначают по 2,5 мг/кг массы в сутки в 2–3 приема. Курс — 1 день. Препарат назначают после еды, эффективность — 90 %. 3. Тиабендазол — взрослым и детям по 25 мг/кг массы в сутки в 2–3 приема. Курс — 2 дня. Показан при мигрирующих формах. Применяется через час после еды. Эффективность — 90 %. Кроме специфической терапии, проводится лечение больных десенсибилизирующими средствами. Обязательна коррекция запоров. В качестве профилактических мер проводят комплекс лечебных и санитарных мероприятий. Санитарные мероприятия направлены на предупреждение обсеменения внешней среды больными, исключение контактного и алиментарного путей заражения (защита открытых частей тела от внедрения личинок, мытье овощей и фруктов перед употреблением, фильтрование или кипячение воды в эндемичных районах). Лечебные мероприятия — дегельминтизация почв и фекалий.
♦ Т ♦
ТАХИКАРДИЯ
ОпределениеТахикардия — это увеличение частоты сердечных сокращений (для детей старше 7 лет и для взрослых в покое — свыше 90 ударов в минуту). Тахикардия у детей определяется с учетом возрастной нормы сердечных сокращений; у новорожденных в норме она составляет 120–140 в минуту, а к 5–6 годам снижается до 90 ударов в минуту. Различают физиологическую и патологическую тахикардию.
Этиология и патогенез Физиологическая тахикардия Под физиологической тахикардией понимают увеличение частоты сердечных сокращений под влиянием некоторых воздействий при отсутствии патологических изменений сердечно-сосудистой системы. Источником ритма сердца при физиологической тахикардии является синусно-предсердный узел. Физиологическая тахикардия возникает при физической нагрузке, эмоциональном напряжении, под влиянием различных факторов внешней среды (высокая температура воздуха, кислородная недостаточность), при резком переходе в вертикальное положение (ортостатическая тахикардия), глубоком вдохе, после приема чрезмерного количества пищи и возбуждающих напитков. Встречается тахикардия конституциональная — постоянная тахикардия, присущая некоторым практически здоровым людям, преимущественно астенического телосложения; бывает тахикардия, наблюдаемая при некоторых поражениях центральной нервной системы (например, при синдроме Пейджа), и тахикардия, обусловленная воздействием некоторых гормонов (тироксин, катехоламины). К физиологической относится тахикардия в результате действия некоторых лекарственных средств (группа атропина, симпатомиметики, кортикостероиды, артериолярные вазодилататоры и др.).
Патологическая тахикардия Причинами патологической тахикардии могут быть экстракардиальные (внесердечные) заболевания и различные поражения сердечно-сосудистой системы. Тахикардия при экстракардиальной патологии чаще носит номотопный характер (синусовая тахикардия, обусловленная повышенной активностью синусно-предсердного узла), а при заболеваниях сердца тахикардия нередко бывает гетеротопной, т. е. обусловленной импульсами, поступающими из очага возбуждения, расположенного вне основного номотопного водителя ритма, или патологической циркуляцией волны возбуждения по миокарду. Гетеротопная тахикардия может быть в свою очередь суправентрикулярной (предсердная и атриовентрикулярная) или желудочковой. Патологическая тахикардия возникает вследствие рефлекторных воздействий (при поражении бронхов, кожи, брюшины, слизистых оболочек), тиреотоксикоза (см.), острой кровопотери, анемии (см.), острых болевых приступов (например, почечная колика (см.)), неврозов (см.), органических поражений подкорковых структур и диэнцефальной области (структур промежуточного мозга), раздражения симпатического нервного ствола (инфекция, опухоли (см.)), аффективных психозов. Чаще всего патологическая тахикардия возникает при различных поражениях сердечно-сосудистой системы (ревматизм (см.), миокардиты (см.), пороки сердца (см.), инфаркт миокарда (см.), кардиосклероз (см.), легочное сердце, недостаточность кровообращения (см.) различного происхождения). Как физиологическая, так и патологическая тахикардия может быть постоянной (при хронических анемиях (см.), алкоголизме (см.), тиреотоксикозе (см.), недостаточности кровообращения (см.)). Синусовая тахикардия (номотопная) часто встречается при различной экстракардиальной патологии: неврозах (см.), как проявление расстройств при поражениях подкорковых узлов инфекционным процессом, поражении диэнцефальной области, тиреотоксикозе (см.), высокой температуре, раздражении симпатического нервного ствола каким-нибудь патологическим процессом (опухоль (см.), лимфома (см.)). Нередко синусовая тахикардия наблюдается и при кардиальной патологии. Она обычно является одним из механизмов компенсации при недостаточности кровообращения различного происхождения, но может быть и проявлением интоксикации миокарда при инфекциях (миокардиты (см.), септический эндокардит (см.), передозировка сердечных гликозидов). Гетеротопная тахикардия в большинстве случаев — проявление органических поражений миокарда, но может быть обусловлена и различными инфекциями и интоксикациями, в том числе передозировкой сердечных гликозидов. К возникновению тахикардии ведет один из двух основных электрофизиологических механизмов — повышение автоматизма и повторный ход возбуждения. Под повышением автоматизма понимают увеличение скорости развития медленной диастолической деполяризации в клетках синусового узла и быстрое достижение его пороговой величины, необходимой для возникновения распространяющегося возбуждения в сердце. Эктопический очаг, где генерируются импульсы, создается под влиянием различных факторов (воспаление, изменение кислотности и состава электролитов, кислородная недостаточность, нервные воздействия). Частота этих импульсов обычно значительно выше частоты импульсов, исходящих из синусового узла. В результате эктопический центр становится водителем ритма. Этот механизм наблюдается при гетеротопной тахикардии — непароксизмальной (предсердной и узловой), медленной желудочковой (ускоренный идиовентрикулярный ритм).
Клиническая картина и лечение При синусовой тахикардии симптомы часто отсутствуют или выражены незначительно (сердцебиение, чувство тяжести или боли в области сердца), начало и конец тахикардии при приступообразной форме постепенные, ритм правильный, с частотой сердечных сокращений 100–150 ударов в минуту. При выслушивании I тон усилен и может быть расщеплен; II тон ослаблен. Существовавшие ранее шумы обычно ослабевают и даже исчезают. Непароксизмальная узловая тахикардия встречается при тяжелых заболеваниях (свежий инфаркт миокарда (см.), кардиосклероз (см.), миокардиты (см.), врожденные и приобретенные пороки сердца (см.)); изредка наблюдается при отсутствии органических поражений сердца. Примерно в половине случаев связана с интоксикацией сердечными гликозидами. Клиническая картина определяется симптомами основного заболевания или интоксикации сердечными гликозидами. Непароксизмальная желудочковая тахикардия возникает при снижении функции синусового узла и повышении автоматизма желудочков, что характерно для интоксикации препаратами наперстянки, острого инфаркта миокарда (см.), недостатка калия. Диагноз тахикардии может быть поставлен уже при исследовании пульса. Однако этого совершенно недостаточно, так как терапия основывается на форме тахикардии. Поэтому обязательна регистрация ЭКГ в 12 общепринятых отведениях. Нередко и это исследование не позволяет идентифицировать форму тахикардии. По данным ЭКГ обычно можно отличить наджелудочковую тахикардию от желудочковой, что имеет решающее значение в выборе методов лечения. Эктопический предсердный ритм (непароксизмальная предсердная тахикардия) характеризуется в отличие от синусовой наличием на ЭКГ предсердного зубца Р измененной формы. Лечение направлено в первую очередь на устранение основного патологического процесса (ревматизм (см.), миокардит (см.) и др.). Не менее важна и коррекция обменных нарушений — назначение (или отмена) препаратов калия, противоболевых (при ишемической болезни сердца (см.)) и противовоспалительных средств. При явлениях интоксикации сердечными гликозидами необходима срочная их отмена, так как возможна фибрилляция (трепетание) желудочков. Синусовая тахикардия, не нарушающая кровообращение и хорошо переносимая субъективно, медикаментозной терапии не требует. Запрещается назначать симпатомиметики; противопоказаны возбуждающие напитки (крепкий чай, кофе, алкоголь), острая пища. При неврогенной тахикардии назначают седативные средства (седуксен, мепробамат и др.). При гиперкинетическом синдроме хороший эффект дают бета-блокаторы. При сердечной недостаточности (см.) показаны сердечные гликозиды. В случае непароксизмальной узловой тахикардии отменяют сердечные гликозиды и назначают препараты калия в оптимальной дозе. Однако лечение главным образом должно быть направлено на основной патологический процесс. Из желудочковых тахикардий наиболее часто встречается пароксизмальная тахикардия — внезапное и чаще всего резкое учащение сердечной деятельности. Различают наджелудочковую пароксизмальную тахикардию (возникает выше разветвления пучка Гиса) и желудочковую. В клинической практике чаще встречается наджелудочковая пароксизмальная тахикардия. Наджелудочковая пароксизмальная тахикардия возникает вследствие появления высокоактивного эктопического очага либо возвратного возбуждения по малому или большому кругу. Исходя из механизма возникновения, различают эктопическую (предсердную) и возвратную наджелудочковую пароксизмальную тахикардию. Предсердная эктопическая тахикардия встречается как у здоровых лиц, так и у больных с различной патологией сердца (кардиомиопатия (см.), инфаркт миокарда (см.), легочное сердце). К возникновению предсердной эктопической тахикардии предрасполагают токсическое воздействие сердечных гликозидов и гипокалиемия. Субъективные ощущения менее выражены, чем при наджелудочковой пароксизмальной тахикардии, из-за возвратного возбуждения, так как ее частота чаще всего меньше. В некоторых случаях при выслушивании можно констатировать более или менее выраженную временную аритмию (см.) сердца. У больных с выраженной патологией сердца предсердная эктопическая тахикардия может способствовать развитию сердечной недостаточности (см.) (например, у больных острым инфарктом миокарда (см.)). Предсердная пароксизмальная тахикардия характеризуется строгой ритмичностью, наличием на ЭКГ неизмененных желудочковых комплексов, перед которыми может быть заметен слегка деформированный зубец Р. Нередко предсердная тахикардия сопровождается нарушением предсердно-желудочковой и внутрижелудочковой проводимости, чаще — правой ножки пучка Гиса. Предсердножелудочковая тахикардия отличается наличием отрицательного зубца Р, который может располагаться возле комплекса QRST или (чаще) накладываться на него. Ритм строго регулярный. Возможны нарушения внутрижелудочковой проводимости. Различить по ЭКГ предсердную и предсердно-желудочковую тахикардии не всегда возможно. Иногда у таких больных вне пароксизма на ЭКГ регистрируются экстрасистолы, возникающие на том же уровне. Желудочковая тахикардия характеризуется значительной деформацией комплекса QRST. Предсердия могут возбуждаться независимо от желудочков, в правильном ритме, но зубец Р трудно различим. Форма и амплитуда комплекса QRST и контур изоэлектрической линии слегка меняются от цикла к циклу, ритм обычно не является строго правильным. Эти особенности отличают желудочковую тахикардию от наджелудочковой с блокадой ножки пучка Гиса. Иногда в течение нескольких дней после пароксизма тахикардии на ЭКГ регистрируются отрицательные зубцы Т, реже со смещением сегмента ST — изменения, обозначаемые как посттахикардиальный синдром. Такие больные нуждаются в наблюдении и исключении у них мелкоочагового инфаркта миокарда (см.). Пароксизм тахикардии обычно ощущается как приступ сердцебиения с отчетливым началом и окончанием продолжительностью от нескольких секунд до нескольких дней. Наджелудочковые тахикардии нередко сопровождаются другими проявлениями вегетативной дисфункции — потливостью, обильным мочеиспусканием в конце приступа, усилением перистальтики кишечника, небольшим повышением температуры тела. Затянувшиеся приступы могут сопровождаться слабостью, обмороками (см.), неприятными ощущениями в области сердца, а при наличии заболевания сердца — стенокардией (см.), появлением или нарастанием сердечной недостаточности (см.). Общей для разных видов наджелудочковой тахикардии является возможность хотя бы временной нормализации ритма при массаже области каротидного синуса. Желудочковая тахикардия наблюдается реже и почти всегда связана с заболеванием сердца. Она не отвечает на массаж каротидного синуса и чаще приводит к нарушению кровоснабжения органов и сердечной недостаточности (см.). Желудочковая тахикардия, особенно в остром периоде инфаркта миокарда (см.), может быть предвестником мерцания желудочков. Во время приступа необходимо прекратить нагрузку, важно успокоить больного, использовать, если необходимо, седативные средства. Надо исключить сравнительно редкие особые ситуации, когда пароксизм тахикардии связан с интоксикацией сердечными гликозидами или со слабостью синусового узла; таких больных следует сразу госпитализировать в кардиологическое отделение. При наджелудочковой тахикардии в первые минуты приступа необходимы стимуляция блуждающего нерва — энергичный массаж области каротидного синуса попеременно справа и слева, вызывание рвотных движений, давление на брюшной пресс или глазные яблоки. Иногда приступ прекращается задержкой дыхания, натуживанием, определенным поворотом головы и другими приемами. Из медикаментозных средств назначают 40–60 мг пропранолола, внутривенное введение верапамила (2–4 мл 0,25 %-ного раствора), новокаинамид — 5—10 мл 10 %-ного раствора. Эти препараты надо вводить медленно, в течение нескольких минут, постоянно контролируя артериальное давление. У некоторых больных эффективен дигоксин, вводимый внутривенно (если больной не получал сердечные гликозиды в ближайшие дни перед приступом). Лечение желудочковой тахикардии следует проводить в стационаре. Наиболее эффективно внутривенное введение лидокаина по 75 мг внутривенно с повторным введением по 50 мг каждые 5—10 мин под контролем ЭКГ и артериального давления (общая доза — 200–300 мг). Как при наджелудочковой, так и при желудочковой тахикардии эффективным может оказаться прием 50–75 мг этацизина (суточная доза — 75—250 мг), при желудочковой тахикардии эффективен этимозин в дозе 100–200 мг (суточная доза — 1400–1200 мг). При тяжелом состоянии больного, связанном с тахикардией, нельзя откладывать электроимпульсное лечение. После пароксизма тахикардии показан прием противоаритмических средств в малых дозах для профилактики рецидива; лучше для этого применять внутрь препарат, который снял пароксизм. Обнадеживающие результаты получены при оперативном лечении — иссечении эктопического очага или рассечении проводящих путей при их патологии.
ТЕНДОВАГИНИТ
ОпределениеТендовагинит — это воспаление синовиального влагалища сухожилия, возникающее при проникновении в него патогенной микрофлоры или вследствие дистрофических изменений синовиальных оболочек сухожилий.
Этиология По причине возникновения различают инфекционные и асептические тендовагиниты. Инфекционные тендовагиниты Инфекционные неспецифические тендовагиниты развиваются в результате проникновения в синовиальные влагалища сухожилий гноеродной микрофлоры при ранениях и распространении гнойного процесса из соседних гнойных очагов (например, при гнойных артритах (см.), остеомиелите (см.), панариции (см.) и др.); возбудители специфического тендовагинита (туберкулезные микобактерии, спирохеты и др.) чаще попадают в сухожильные влагалища вместе с током крови. Нередко тендовагинит возникает также как реактивное воспаление токсического характера при ревматизме (см.), болезни Бехтерева (см.), болезни Рейтера (см.).
Асептические тендовагиниты Асептические тендовагиниты (острый крепитирующий, хронический стенозирующий) возникают чаще в результате травматизации и перенапряжения влагалища сухожилий и окружающих их тканей у лиц определенных профессий (музыкантов, машинисток и др.), выполняющих продолжительное время однообразные движения, в которых участвует ограниченная группа мышц (профессиональные тендовагиниты); они могут наблюдаться также при перетренировке у конькобежцев, лыжников и других спортсменов.
Клиническая картина По клиническим признакам различают острые и хронические тендовагиниты. Острый инфекционный тендовагинит Клиническая картина острого инфекционного неспецифического тендовагинита характеризуется острым началом с быстрым развитием болезненной припухлости в области пораженных влагалищ сухожилий. Острый процесс чаще наблюдается во влагалищах сухожилий тыльной поверхности кистей и стоп, реже — сгибателей пальцев кисти, синовиальных влагалищах пальцев кисти. Болезненная припухлость и отек распространяются на предплечье (или голень). Отмечаются ограничение движений, иногда сгибательная контрактура (ограничение подвижности) пальцев. При возникновении гнойного воспаления быстро развивается септическое состояние с высокой температурой тела, ознобом, явлениями регионарного лимфаденита (см.) и лимфангита. Гнойный процесс чаще встречается в области синовиальных влагалищ сухожилий сгибателей кисти. При прогрессировании заболевания гнойный очаг может распространяться на предплечье в фасциальное пространство Пирогова. При гнойном тендовагините мизинца кисти может возникать локтевой тендобурсит.
Острый асептический тендовагинит Так называемый крепитирующий тендовагинит обычно поражает синовиальные влагалища, расположенные на тыльной поверхности кисти, реже — стопы, иногда — межбугорковые синовиальные влагалища двуглавой мышцы плеча. Заболевание начинается остро: в области пораженного сухожилия быстро образуется припухлость, при ощупывании которой во время движения большого пальца определяется похрустывание; движения пальца ограничены и болезненны. Нередко заболевание переходит в хроническую форму.
Хронический тендовагинит Хронический тендовагинит чаще всего локализуется во влагалищах сухожилий разгибателей и сгибателей пальцев в области их удерживателей. Наиболеехарактерна клиническая картина хронического тендовагинита общего синовиального влагалища сгибателей пальцев, расположенного в канале запястья. При этом в области канала запястья определяется болезненное опухолевидное образование продольной формы и эластической консистенции. При прощупывании иногда отмечается флюктуация, прощупываются рисовые тела, движения сухожилий ограничены. Своеобразной формой хронического тендовагинита является так называемый хронический стенозирующий тендовагинит, характеризующийся поражением влагалища сухожилий длинной отводящей мышцы и короткого разгибателя большого пальца кисти, стенки которого утолщаются, а синовиальная полость суживается. Клинические проявления заболевания начинаются с болей в области шиловидного отростка лучевой кости. По ходу влагалища прощупывается резко болезненная припухлость; появляется боль при отведении и разгибании большого пальца, смещающаяся в предплечье и плечо. Близко к стенозирующему тендовагиниту по клиническим проявлениям стоит стенозирующий лигаментит — реактивное воспаление связочного аппарата кисти. Стенозирующий лигаментит возникает в результате функционального перенапряжения, травмы, инфекционных заболеваний. Чаще поражаются коллатеральные (обходные) связки пястно-фаланговых и межфаланговых суставов кисти. Заболевание характеризуется болями, возникающими при движении и прощупывании, припухлостью, отечностью и покраснением кожи в области поражения. Иногда возникает частичное омертвение связок с нарушением скольжения сухожилия и затруднениями при сгибании и разгибании пальца, которые совершаются с характерным пощелкиванием. При туберкулезном тендовагините по ходу расширения влагалищ сухожилий прощупываются плотные образования — рисовые тела.
Диагностика и дифдиагностика Диагноз тендовагинита основывается на характерной локализации процесса и данных клинического исследования (болезненные шнуровидные уплотнения в характерных местах, нарушение движений, прощупывание рисовых тел и др.). Острый инфекционный тендовагинит дифференцируют с остеомиелитом (см.) и острым артритом (см.). При тендовагините в отличие от перечисленных заболеваний на рентгенограммах не обнаруживают изменений со стороны костей и суставов. Отсутствуют болезненность в области кости и деформация сустава. Для исключения стенозирующего лигаментита применяют лигаментографию. Исключают общие заболевания, которые могли стать причиной тендовагинита (бруцеллез (см.), туберкулез (см.) и др.).
Лечение Острый тендовагинит Лечение острого тендовагинита предусматривает применение общих и местных лечебных мероприятий. При неспецифическом остром тендовагините общее лечение направлено на борьбу с инфекцией путем применения противобактериальных средств и укрепления защитных сил организма. При туберкулезном тендовагините используют антитуберкулезную терапию. При асептическом тендовагините используют нестероидные противовоспалительные средства (ацетилсалициловую кислоту, индометацин, бутадион). Местное лечение как при инфекционном, так и асептическом тендовагините в начальной стадии заключается в наложении гипсовой лонгеты и согревающих компрессах. После стихания острых явлений назначают физиотерапевтические процедуры (микроволновую терапию, ультразвук, УВЧ, ультрафиолетовые лучи) и лечебную физкультуру. При гнойном тендовагините показано срочное вскрытие и дренирование влагалища сухожилия и гнойных затеков.
Хронический тендовагинит Лечение включает, кроме перечисленных выше физиотерапевтических методов, парафиновые или грязевые нанесения, массаж, электрофорез с лидазой, лечебную физкультуру. При прогрессировании хронического инфекционного процесса производят пункцию синовиального влагалища и вводят антибиотики направленного действия, назначают нестероидные противовоспалительные препараты, местно вводят раствор новокаина с гидрокортизоном. В упорных случаях хронического крепитирующего тендовагинита назначают 1–2 сеанса рентгенотерапии. При стенозирующем тендовагините иногда прибегают к рассечению суженного участка влагалища сухожилия. Прогноз при своевременном и правильном лечении тендовагинита благоприятный. При гнойном тендовагините нередко остаются стойкие нарушения функции кисти (стопы).
ТЕНИАРИНХОЗ
ОпределениеТениаринхоз — кишечный гельминтоз, вызываемый возбудителем Тениаринхус сагинатус (бычий цепень).
Этиология Возбудитель — цепень бычий. Тело лентовидной формы, составленное из большого числа проглоттид, достигает в длину 7— 10 м. Головка червя имеет 4 присоски. Тело состоит из множества члеников. Каждый членик содержит самостоятельную половую систему. В одном зрелом членике насчитывается до 170 тыс. яиц, внутри которых находится зародыш.
Эпидемиология, патогенез и патанатомия Тениаринхоз — глистное заражение, происходящее через рот, биогельминтозом, антропонозом. Развитие бычьего цепня происходит со сменой хозяев. Окончательный хозяин и источник заражения — человек. Промежуточный хозяин — крупный рогатый скот. Восприимчивость всеобщая. Тениаринхоз встречается во всех странах. Особенно широко он распространен в странах Африки, Австралии и Южной Америки. На территории стран СНГ чаще регистрируется на Кавказе и в Средней Азии. Членики, отделившиеся от тела цепня, попадают во внешнюю среду, активно ползают, обсеменяя яйцами растения. В яйцах происходит дозревание зародыша. Вместе с травой яйца попадают в желудочно-кишечный тракт крупного рогатого скота. В кишечнике из яиц выходит зародыш, который с помощью крючьев внедряется в капилляры кишечной стенки и током крови разносится по организму. Основная масса зародышей оседает в межмышечной соединительной ткани, где превращается в финны. Финны сохраняют способность к заражению в тканях крупного рогатого скота на протяжении 6–9 месяцев. Человек заражается при употреблении в пищу сырого мяса крупного рогатого скота, содержащего финны (личинки). При попадании финн в желудочно-кишечный тракт человека паразит освобождается от оболочки и прикрепляется с помощью присосок к слизистой оболочке кишечника, после чего начинается формирование члеников. Через 2–3 месяца в тонкой кишке из финны развивается взрослый паразит, который может прожить много лет. Развитие болезненных явлений при тениаринхозе обусловливается комплексным воздействием паразита на организм больного. Он оказывает механическое, токсико-аллергическое и рефлекторное воздействие на организм человека. Мощные присоски цепня нарушают кровообращение в слизистой оболочке кишечника. Активные сокращения мышц тела цепня раздражают рецепторы кишечной стенки, в результате чего происходит тоническое сокращение ее мышц и возникают приступообразные боли в области живота. Комплексное химико-механическое раздражение паразитом и продуктами его обмена рецепторов вызывает ответные реакции со стороны различных органов и систем — кишечной стенки, печени, слизистой оболочки желудка, кроветворных органов.
Клиническая картина и диагностика Клиническая картина тениаринхоза очень разнообразна. Заболевание может протекать бессимптомно. В дальнейшем больные отмечают самопроизвольное выползание члеников из ануса и выделение их с калом. Наиболее частыми жалобами при тениаринхозе являются головокружение, общая слабость, ненормально повышенный аппетит, боли различной интенсивности в той или иной области живота. Иногда могут быть тошнота, рвота, боль в животе, раздражительность, головная боль, ларингоспазм, синдром Меньера, эпилептиформные припадки, задержка стула и газов. В ряде случаев наблюдается потеря в весе. Со стороны желудочно-кишечного тракта можно наблюдать увеличение объема языка и появление на нем трещин. В крови обычно отмечаются незначительные отклонения от нормы — умеренная лейкопения, незначительная эозинофилия. При тениаринхозе могут наблюдаться кожные аллергические явления. Основанием для постановки диагноза тениаринхоза служит обнаружение самопроизвольного отхождения члеников цепня вне акта дефекации. Членик должен быть доставлен в лабораторию для макроскопического исследования. Диагноз устанавливается, если имеется указание на отхождение члеников. В случае обнаружения яиц тениид при исследовании фекалий установить точно диагноз не представляется возможным, поскольку отсутствуют диагностические отличия в морфологии яиц цепня вооруженного и невооруженного. Нередко бычьего цепня можно обнаружить при рентгенологическом исследовании кишечника человека. Дифференциальный диагноз проводят с дифиллоботриозом и тениозом; главными критериями при этом являются морфологические отличия в строении членика паразита, а также форма и строение яиц.
Лечение и профилактика Назначают фенасал натощак в дозе 2–3 г на ночь или утром, за 10–15 мин до приема фенасала назначают 1–2 г натрия гидрокарбоната в стакане воды. Используются комбинированные препараты дихлосал и трихлосал. Широко применяется эфирный экстракт мужского папоротника в капсулах в дозе 4,5–5,5 г. При тениаринхозе профилактика включает в себя проведение медико-санитарных мероприятий (выявление лиц, зараженных бычьим цепнем, их дегельминтизация), санитарно-гигиенических мероприятий, направленных на предупреждение загрязнения внешней среды фекалиями больных тениаринхозом, и ветеринарных мероприятий (проведение ветеринарной экспертизы на мясокомбинатах и рынках). Соблюдение технологии приготовления мясных продуктов предотвращает заражение тениаринхозом. Не рекомендуется употреблять в пищу сырое мясо, пробовать сырой мясной фарш.
ТЕНИОЗ
ОпределениеТениоз — кишечный гельминтоз, вызываемый цестодой Тениа солиум (цепень свиной).
Этиология Возбудитель — цепень свиной. Паразит имеет тело лентовидной формы длиной 1,5–2 м, число члеников от 800 до 1000 и сколекс около 1–2 мм в диаметре с четырьмя крестообразно расположенными присосками и хоботком, на котором находится двойная «корона» из 22–32 крючьев. Членики в передней части в длину меньше, чем в ширину, а у зрелых члеников в конце стробилы (тела паразита) длина всегда превышает ширину. Яйца практически не отличаются от яиц бычьего цепня.
Эпидемиология, патогенез и патанатомия Тениоз — глистное заражение, происходящее через рот (биогельминтоз, антропоноз). Восприимчивость к тениозу всеобщая, вопросы иммунитета изучены недостаточно. Распространен тениоз повсеместно, но особенно часто встречается в Индии, Северном Китае, Африке и Южной Америке. Заражение человека происходит при употреблении человеком в пищу сырого или полусырого мяса, содержащего личинки. Наибольшую опасность представляет свинина, не прошедшая ветеринарный контроль. Развитие цепня свиного происходит со сменой хозяев. Окончательный хозяин гельминта и источник заражения — человек, в тонкой кишке которого паразитирует взрослый цепень. От тела гельминта периодически отделяются зрелые, содержащие яйца членики, которые выбрасываются с калом во внешнюю среду. Промежуточные хозяева свиного цепня — домашние свиньи, редко — дикие свиньи, собаки, кошки. В желудке свиньи оболочка яйца цепня свиного разрушается, и освободившиеся онкосферы (подвижные личинки) активно проникают в кровеносную систему желудка или кишечника и током крови разносятся по телу. Через 24–72 ч онкосферы оседают преимущественно в межмышечной соединительной ткани, где через два месяца превращаются в финну. Цистицерки превращаются во взрослых паразитов в кишечнике человека, где под действием пищеварительного сока и желчи происходит выворачивание головки, которая с помощью присосок прикрепляется к слизистой оболочке. Паразит начинает расти, формируя членики, и через 2–2,5 месяца достигает зрелости. Свиной цепень может паразитировать у человека не только в половозрелой, но и в личиночной стадии, вызывая так называемый цистицеркоз. Взрослый гельминт паразитирует в тонкой кишке в течение многих лет. Патогенетические механизмы сходны с таковыми при тениаринхозе. В случаях заражения яйцами свиного цепня в различных тканях организма человека через 2–2,5 месяца формируются цистицерки диаметром 5–8 мм, сохраняющие жизнеспособность в течение ряда лет. В механизме развития тениоза значительную роль играют: сдавление тканей, воспалительный процесс вокруг паразитов, токсико-аллергические реакции вследствие воздействия продуктов их обмена и распада на организм человека, механическое раздражение слизистой оболочки присосками и крючками, поглощение питательных веществ хозяина.
Клиническая картина и диагностика Ранняя фаза тениоза изучена недостаточно. Клинические проявления цистицеркоза крайне разнообразны и зависят от нахождения цистицерков, массивности заражения и стадии развития паразита. В хронической фазе клиническая картина весьма похожа на тениаринхоз, но все симптомы выражены более ярко и тяжело. В отличие от тениаринхоза членики паразита активно из ануса не выходят (изредка с калом отходят нежные членики, которых больной обычно не замечает). У больных тениозом наблюдаются расстройства функции кишечника, слабость, головокружение. Отмечаются тошнота, рвота, боли в животе, периодические головные боли, нарушения сна. В некоторых случаях неврологические симптомы связаны с возможным наличием цистицеркоза мозга. Иногда тениоз сопровождается гипохромной анемией (см.). Нередко клинические проявления отсутствуют. Диагностика тениоза основывается на обнаружении в фекалиях больных зрелых члеников свиного цепня, которые отделяются группами по 5–6, реже поодиночке (активными движениями членики не обладают). Диагноз ставят на основании повторного исследования кала на наличие члеников гельминтов и слизи с перианальных складок (путем соскоба) на наличие яиц цепня. Диагноз подтверждается с помощью иммунологических методов (РСК с антигеном из цистицерков, более специфичны РПГА и РФА с сывороткой крови и спинномозговой жидкости).
Лечение и профилактика Используют эфирный экстракт мужского папоротника (3–4 г) и проводят профилактику рвоты. Консервативная терапия цистицеркоза разрабатывается. Получен эффект от применения празинквателя (бильтрицид) в дозе по 16,6 мг/кг в сутки в течение 14 дней или по 50 мг/кг в сутки в течение 10 дней в сочетании с глюкокортикоидами для профилактики аллергических реакций. По показаниям проводят хирургическое лечение. При тениозе профилактика заключается в массовом обследовании населения на гельминтозы, лечении зараженных, усилении ветеринарного контроля за убоем свиней и свиным мясом. Рекомендуется не употреблять в пищу непроваренную и непрожаренную свинину.
ТЕПЛОВОЙ УДАР
ОпределениеЭто состояние, обусловленное общим перегреванием организма.
Этиология и патогенез Возникает в результате воздействия внешних тепловых факторов (при пребывании в помещении с высокой температурой и влажностью, во время длительных маршей в условиях жаркого климата, при интенсивной физической работе в плохо вентилируемых помещениях). Развитию теплового удара могут способствовать теплая одежда, переутомление, прием неоправданно малого объема жидкости. Чрезмерное перегревание организма сопровождается нарушением водно-электролитного обмена, циркуляторными расстройствами, мелкоточечными кровоизлияниями в мозг.
Клиническая картина Отмечаются чувство общей слабости, разбитость, головная боль, шум в ушах, сонливость, жажда, тошнота, покраснение кожных покровов. Пульс и дыхание учащены, температура повышена до 40–41 °C. В тяжелых случаях дыхание замедлено, артериальное давление снижается. Больной оглушен, теряет сознание, иногда возникают судороги, развивается кома. Возможны бред, психомоторное возбуждение.
Лечение Неотложная помощь заключается в перемещении пострадавшего в прохладное место, обеспечении доступа свежего воздуха, питья холодной воды; на голову накладывают холодный компресс. В более тяжелых случаях пострадавшего обертывают простыней, смоченной холодной водой, прикладывают лед на голову и паховые области. Вводят сердечно-сосудистые средства, дыхательные аналептики, проводят инфузионную (внутривенную) терапию. В тяжелых случаях требуется госпитализация в реанимационное отделение.
ТИРЕОИДИТЫ
ОпределениеТиреоидиты — воспалительные болезни щитовидной железы, различные по происхождению и механизму развития. Воспаление диффузно (равномерно) увеличенной щитовидной железы называют струмитом.
Этиология Острый тиреоидит Острый тиреоидит бывает гнойным или негнойным, распространенным и очаговым. Острый гнойный тиреоидит развивается на фоне острой или хронической инфекции (тонзиллит (см.), пневмония (см.) и др.). Острый негнойный тиреоидит может развиться после травмы, кровоизлияния в железу, лучевой терапии, протекает по типу асептического воспаления.
Подострый тиреоидит Подострым тиреоидитом или тиреоидитом де Кервена — заболевают чаще женщины в возрасте 30–50 лет. Подострый тиреоидит развивается после вирусных инфекций.
Хронический фиброзный тиреоидит Хронический фиброзный тиреоидит или зоб Риделя — заболевание, факторы возникновения которого неясны.
Аутоиммунный хронический тиреоидит Аутоиммунный хронический тиреоидит или тиреоидит Хашимото (см. также Зоб Хашимото), — заболевание, в основе которого лежит аутоиммунное поражение щитовидной железы с развитием дистрофических изменений и лимфоидной инфильтрации щитовидной железы.
Клиническая картина Острый тиреоидит Острый тиреоидит клинически выражается болью в области передней поверхности шеи, смещающейся в затылок, нижнюю и верхнюю челюсть, усиливающейся при движении головы и глотании. Шейные лимфатические узлы увеличены. Отмечаются повышенная температура и озноб. При прощупывании — болезненное увеличение части или целой доли щитовидной железы, при сформировавшемся абсцессе (см.) — флюктуация. Отмечается высокий уровень количества лейкоцитов, повышенная СОЭ. При сканировании щитовидной железы определяется «холодная область», не поглощающая изотопов и соответствующая воспалительному очагу. Симптоматика при остром негнойном тиреоидите менее выражена, чем при остром гнойном воспалении щитовидной железы.
Подострый тиреоидит При подостром тиреоидите отмечаются: боль в области шеи, смещающаяся в затылочную область, нижнюю челюсть, уши, височную область; головная боль, слабость, снижение двигательной активности; повышение температуры. Отмечаются увеличение СОЭ и повышение уровня лейкоцитов, но может протекать и без изменений со стороны крови. В начале заболевания (гипертиреоидная, или острая, стадия) могут наблюдаться симптомы тиреотоксикоза (см.): учащенное сердцебиение, потливость, похудение, дрожание рук. При сканировании — снижение захвата изотопов щитовидной железой. При длительном течении могут развиться симптомы гипотиреоза (см.) (гипотиреоидная стадия): сонливость, вялость, заторможенность, зябкость, отечность лица, сухость кожи, урежение сердцебиения. Щитовидная железа увеличена (часто только правая доля), плотной консистенции, не спаяна с окружающими тканями, болезненна при прощупывании. В крови определяется низкое содержание тироксина и трийодтиронина и высокое — тиреотропного гормона. В стадии выздоровления исчезает болезненность щитовидной железы, нормализуются СОЭ, уровни тиреоидных (щитовидной железы) гормонов и тиреотропина в крови. Заболевание склонно к рецидивированию, особенно при повторных вирусных инфекциях и переохлаждении.
Хронический фиброзный тиреоидит Симптомы: распространенное, реже очаговое увеличение щитовидной железы. Железа очень плотная, неподвижная, не смещается при глотании, спаяна с окружающими тканями. Прогрессирование и распространение процесса на всю железу сопровождается развитием гипотиреоза (см.) (пониженной функции щитовидной железы). При больших размерах железы наблюдаются симптомы сдавления органов шеи: осиплость голоса, затрудненные глотание и дыхание. Важный диагностический метод — пункционная биопсия.
Аутоиммунный хронический тиреоидит Симптомы: распространенное, иногда неравномерное увеличение щитовидной железы, при прощупывании железа плотноэластической консистенции, подвижная. При больших размерах железы появляются симптомы сдавления шеи. По мере прогрессирования заболевания нарушается функция железы: вначале развиваются явления гипертиреоза вследствие поступления в кровь большого количества ранее синтезированных гормонов, в дальнейшем (или минуя гипертиреоидную фазу) — явления гипотиреоза. Содержание гормонов щитовидной железы в крови снижено, а концентрация тиреоидного гормона превышает норму. В диагностике большое значение имеют определение количества антитиреоидных антител, данные пункционной биопсии, сканирование (характерна неравномерность поглощения изотопа).
Лечение Острый тиреоидит При остром тиреоидите назначают антибиотики, симптоматические средства (седативные и др.), витамин С и группы В. При развитии абсцесса (см.) показано хирургическое лечение.
Подострый тиреоидит При подостром тиреоидите — длительное применение кортикостероидов (преднизолон, дексаметазон, триамцинолон), препаратов салицилового или пиразолонового ряда на фоне снижения кортикостероидов, при явлениях гипертиреоза — бета-блокаторы, гипотиреоза — небольшие дозы гормонов щитовидной железы.
Хронический фиброзный тиреоидит При хроническом фиброзном тиреоидите при наличии явлений гипотиреоза показана заместительная терапия гормонами щитовидной железы, при симптомах сдавления органов шеи — оперативное лечение.
Хронический аутоиммунный тиреоидит При хроническом аутоиммунном тиреоидите назначают лечение тиреоидными гормонами (трийодтиронин, тироксин, тиреотом, тиреотом-форте). При отсутствии уменьшения зоба на фоне адекватной заместительной терапии (3–4 месяца) назначают кортикостероиды на 2–3 месяца. При быстрорастущих и болезненных формах зоба, больших размерах щитовидной железы с явлениями сдавления органов шеи показано оперативное лечение (удаление части щитовидной железы).
ТИРЕОТОКСИКОЗ
ОпределениеТиреотоксикоз — патологическое состояние организма, обусловленное повышенным содержанием в крови гормонов щитовидной железы.
Этиология и патогенез Тиреотоксикоз не является самостоятельным заболеванием, а представляет собой симптомокомплекс, возникающий при следующих заболеваниях: — диффузном токсическом зобе (см.), в том числе развившемся вследствие гормонально-активной аденомы гипофиза, вырабатывающей тиреотропный гормон; — многоузловом гипертиреоидном зобе и тиреотоксической аденоме; — иногда тиреотоксикоз развивается при подостром тиреоидите (см.). Реже встречается тиреотоксикоз, вызванный избыточным введением в организм препаратов гормонов щитовидной железы — тироксина и трийодтиронина, используемых для заместительной терапии при гипотиреозе (см.), после струмэктомии (удаления щитовидной железы), субтотальной (неполной) резекции щитовидной железы и др. Тиреотоксикоз может впервые возникнуть как в период новорожденности, так и в более старшем возрасте или даже у взрослых; предрасположение к заболеванию сохраняется на протяжении всей жизни. Понятие «тиреотоксикоз» раньше связывали исключительно с диффузным токсическим зобом, позже были описаны и другие заболевания, сопровождающиеся тиреотоксикозом. Но в 1961 г. Международным конгрессом социалистических стран по проблеме эндемического зоба (см.) термин «зоб диффузный токсический» был введен в клиническую классификацию заболеваний щитовидной железы, а тиреотоксикоз был четко определен как комплекс симптомов, обусловленный избытком тиреоидных гормонов (гормонов щитовидной железы) в крови.
Клиническая картина и диагностика Тиреотоксикоз по степени выраженности симптомов делят на легкий, средней тяжести и тяжелый. Клинические проявления тиреотоксикоза не зависят от происхождения заболевания. Больные, страдающие тиреотоксикозом, жалуются на повышенную раздражительность, чувство беспокойства и страха, нарушение сна, потливость, дрожание пальцев рук, языка, всего туловища, плохую переносимость повышенной температуры окружающей среды, учащенное сердцебиение, иногда боли в области сердца, экзофтальм, диарею (см.), тошноту, рвоту (см.), снижение веса тела, пониженный аппетит (при легком и средней тяжести тиреотоксикозе аппетит часто бывает повышен). Функция печени сначала не нарушена, однако при нарастании симптомов тиреотоксикоза печень увеличивается. В крови повышается концентрация билирубина, может появиться желтуха (см.). При длительном и тяжелом тиреотоксикозе наблюдаются гипокортицизм (синдром недостаточной секреции кортикостероидов), нарушение функции половых желез (у женщин — дисменорея и аменорея, т. е. нарушение или отсутствие менструаций, а у мужчин — снижение половой потенции и гинекомастия (увеличение молочных желез)). Могут появиться симптомы тиреогенного диабета (см.). Почти у всех больных с тиреотоксикозом отмечают понижение психической активности, астению, расстройства эмоциональной сферы. Основной обмен при тяжелой форме тиреотоксикоза достигает 100 %. Усиление обмена и катаболизма (распада) белков при длительно текущем тиреотоксикозе ведет к развитию остеопороза (см.) (разрежению костной ткани) в результате потери основного вещества кости — оссеомукоида. В сердечнососудистой системе при тиреотоксикозе развивается комплекс нарушений, получивший название тиреотоксического сердца. При воздействии избыточного количества тиреоидных гормонов обменные нарушения в миокарде характеризуются разобщением тканевого дыхания и окислительного фосфорилирования, снижением интенсивности синтеза и усилением распада белка, неоднородностью электрического потенциала миокарда. Нарушения кровообращения характеризуются учащенным сердцебиением, увеличением скорости кровотока и объема циркулирующей крови. Нередко выявляются усиление тонов сердца, шум, преимущественно на верхушке сердца, увеличение левого желудочка, а позже и всего сердца. Кардинальным симптомом тиреотоксикоза является учащенное сердцебиение, при котором частота сердечных сокращений пропорциональна тяжести тиреотоксикоза. Выделяют особую форму тиреотоксикоза, проявляющуюся приступами тахисистолической формы мерцания предсердий на фоне нормального ритма или брадикардии (замедления частоты сердечных сокращений), практически при отсутствии симптомов токсического зоба (см.). У больных с тиреотоксикозом на фоне токсического зоба может появиться стенокардия (см.), особенно у больных с ишемической болезнью сердца (см.), заболевших токсическим зобом. Картина нарушения у больных с тиреотоксикозом в основном представлена правожелудочковой недостаточностью. Характерным является отсутствие эффекта от применения сердечных гликозидов без одновременного лечения антитиреоидными средствами. Диагноз тиреотоксического сердца сложен, если в картине тиреотоксикоза преобладают явления, характерные для порока сердца (см.). В этих случаях необходимо определение концентрации тиреоидных гормонов в крови. С диагностической целью проводят простое лечение (30–40 мг мерказолила в сутки в течение 2–3 недель, 50–60 мг мерказолила в сутки в течение 1 месяца). При тяжелом тиреотоксикозе и длительном его течении появляются симптомы надпочечниковой недостаточности: резкое снижение подвижности, снижение артериального давления, повышенная пигментация кожных покровов. Частым симптомом тиреотоксикоза является мышечная слабость, сопровождающаяся атрофией мышц, иногда развивается паралич верхних отделов мышц конечностей. Неврологическое обследование выявляет гиперрефлексию (усиление рефлексов), анизорефлексию (неравномерность рефлексов), неустойчивость в позе Ромберга. В некоторых случаях наблюдается утолщение кожи на передней поверхности голеней и тыле стоп. В пожилом возрасте развитие тиреотоксикоза вызывает потерю массы тела, слабость, мерцательную аритмию (см.), быстрое развитие сердечной недостаточности (см.), ухудшение течения ишемической болезни сердца (см.). Симптомы тиреотоксикоза достигают максимума при тиреотоксическом кризе, который развивается у людей с нелеченым диффузным токсическим зобом и у недостаточно лечившихся больных, особенно имеющих тяжелые сопутствующие заболевания. Развитие криза свидетельствует о тяжелом, прогностически неблагоприятном течении заболевания. Важным фактором механизма развития тиреотоксического криза является относительная надпочечниковая недостаточность при длительно текущем тиреотоксикозе, что подтверждает эффективность терапии этого состояния кортикостероидными препаратами. Наивысшее выражение тиреотоксического криза — кома (см.).
Тиреотоксикоз новорожденных В большинстве случаев тиреотоксикоз обнаруживается у детей, родившихся от женщин, страдающих тиреотоксикозом или имевших его в прошлом. В механизме развития тиреотоксикоза у новорожденных определенную роль отводят длительно действующему тиреоидному стимулятору и другим тиреоидстимулирующим антителам, которые часто определяются в крови матери и ребенка и могут проходить через плацентарный барьер, а также тиреолиберину, который способен проходить через плаценту и, кроме того, выделяется с грудным молоком. Тиреотоксикоз у новорожденных, как правило, проходит через 6—12 недель после рождения. Однако иногда тиреотоксикоз не исчезает и продолжается многие годы, сопровождаясь типичной клинической картиной диффузного токсического зоба. Преходящие формы тиреотоксикоза чаще отмечают у мальчиков. Дети с тиреотоксикозом в большинстве случаев рождаются недоношенными, характерным их внешним признаком является выпуклый выступающий лоб. У большинства детей отмечают увеличенную щитовидную железу. Температура тела повышена. Характерны плохая прибавка веса тела на фоне повышенного аппетита, рвота (см.) и диарея (см.), потливость, возбудимость, беспокойство, появление экзофтальма. Возможны учащение сердцебиения, увеличение печени и селезенки, желтуха (см.), тромбоцитопения, урежение дыхания, расширение границ сердца, аритмия (см.), отеки и переразвитие лимфоидной ткани. Рентгенологические исследования скелета выявляет ускоренное развитие костной системы и краниостеноз (раннее срастание черепных швов). В крови определяется повышенное содержание тиреоидных гормонов при очень низкой концентрации тиреотропного гормона или его полном отсутствии.
Лечение Применяют три основных метода лечения: консервативное, хирургическое и радиоактивным йодом-131. Консервативное лечение направлено на снижение избыточной продукции тиреотоксических гормонов путем торможения их синтеза и секреции с помощью тиреостатиков или антитиреоидных гормонов. Используется группа тиомочевины: — мерказолил по 5 мг (30–60 мг в сутки в зависимости от тяжести заболевания с постепенным переходом на поддерживающие дозы препарата по 2,5–5 мг в день через день или раз в 3 дня; курс лечения 1–1,5 года); осложнения — аллергические реакции и лейкопения; при непереносимости препарат отменяют, при лейкопении назначают преднизолон, лейкоген, пентоксил; — тиамазол в дозе 5 мг (30–40 мг в сутки); — проципил по 50 мг (300–400 мг в сутки); — дийодтирозин, который применяется преимущественно при легкой и средней тяжести тиреотоксикоза, при тиреотоксикозе беременных, тиреотоксическом экзофтальме. При тяжелом течении дийодтирозин применяют вместе с мерказолилом. Применяют также дийодтирозин при подготовке к операции у больных с тиреотоксическим зобом. Назначают внутрь по 0,05 г 2–3 раза в день циклами по 20 дней с 10—20-дневными перерывами. Максимальные дозы для взрослых: разовая — 0,075 г, суточная — 0,2 г. Лечение сердечно-сосудистых расстройств у больных с тиреотоксикозом симптоматическое, оно проводится с одновременным специфическим лечением антитиреоидными средствами. В комплексном лечении тиреотоксикоза применяют также бета-блокаторы (аналаприл, обзидан, тразикор в дозе от 40 до 200 мг в сутки), кортикостероиды (гидрокортизон, преднизолон), транквилизаторы (реланиум, рудотель, феназепам), перитол. При значительном истощении назначают анаболические стероиды (ретаболил, феноболин, силаболин), в некоторых случаях инсулин (по 4–6 ЕД перед обедом). При недостаточности кровообращения назначаются сердечные гликозиды (строфантин, коргликон, дигоксин, изоланид), мочегонные средства (триампур, верошпирон, фуросемид), препараты калия. При осложнениях со стороны печени — эссенциале, карсил. Назначают также поливитамины, аскорбиновую кислоту, кокарбоксилазу. При отсутствии стойкого эффекта медикаментозной терапии, развитии осложнений (аллергические реакции, лейкопения, агранулоцитоз при применении мерказолила), а также при тяжелом течении тиреотоксикоза, после соответствующей подготовки больных направляют на хирургическое лечение. Терапия радиоактивным йодом-131 возможна только в Обнинске. Профилактика тиреотоксического криза и комы заключается в адекватной терапии тиреостатическими средствами. При тиреотоксикозе новорожденных при проведении лечебных мероприятий антитиреоидные средства назначают в зависимости от тяжести тиреотоксикоза у новорожденного: раствор Люголя (1 капля каждые 8—24 ч до улучшения состояния, которое, как правило, наступает на 2—3-й неделе жизни), мерказолил (метимазол) в дозе 0,5–1 мг на 1 кг веса в сутки). Назначают также обзидан (2 мг на 1 кг веса в сутки), проводят симптоматическое лечение — введение изотонического раствора хлорида натрия, сердечных гликозидов, глюкокортикоидов и др. Профилактика тиреотоксикоза заключается в выявлении групп риска среди беременных и своевременном лечении тиреотоксикоза у беременных.
ТИРОЗИНОЗ
ОпределениеТирозиноз — это наследственное заболевание, обусловленное нарушением обмена тирозина (необходимого для жизнедеятельности организма человека и животных, так как он входит в состав молекул белков и ферментов), проявляющееся тяжелым поражением печени и почек.
Этиология и патогенез В типичной форме тирозиноз встречается редко. До 1978 г. было известно около 100 случаев заболевания. Многие проявления тирозиноза связывают с дисбалансом обмена аминокислот неясного генеза. При патологоанатомическом исследовании обнаруживаются: диффузный цирроз печени (см.), дилатация почечных канальцев, дистрофия островкового аппарата поджелудочной железы, рахитические изменения костной ткани. Заболевание может протекать остро и хронически.
Клиническая картина Клиника характеризуется признаками токсикоза, расстройством функций желудочно-кишечного тракта, отеками, геморрагическим синдромом, увеличением печени и селезенки, рахитоподобными изменениями костной системы. Бурное течение болезни приводит в первые недели жизни к тяжелой печеночной недостаточности со смертельным исходом. Случаи острого и хронического тирозиноза могут наблюдаться у членов одной семьи.
Диагностика и дифдиагностика Диагноз ставят на основании клинической картины и лабораторных данных. В крови отмечаются пониженное содержание сахара, повышение активности щелочной фосфатазы, а также высокий уровень гидроксипролина, треонина и других аминокислот. Все аминокислоты в повышенных количествах выводятся с мочой. В моче также определяется виноградная кислота, типично появление белка и глюкозы в моче, а также гиперфосфатурия. Дифференциальный диагноз проводят с транзиторной (преходящей) тирозинурией, которая обнаруживается у 10 % доношенных и у 30 % недоношенных новорожденных и бывает обусловлена задержкой физического становления печеночной оксидазы гидроксифенилпировиноградной кислоты. Транзиторная тирозинурия клинически не проявляется, а выведение тирозина с мочой нормализуется в первые месяцы жизни. Тирозиноз следует отличать от повышенного содержания тирозина в крови и моче больных при тяжелых приобретенных заболеваниях печени, например хроническом гепатите (см.) и выраженном гиповитаминозе С. Содержание тирозина в крови и моче повышается при особой разновидности нарушений тирозинового обмена — эссенциальной тирозинемии, связанной с генетически детерминированным блоком в обмене тирозина. В отличие от тирозиноза при эссенциальной тирозинемии отсутствует симптоматика со стороны печени и почек, наблюдаются отставание ребенка в умственном развитии, катаракта (см.), изъязвления роговицы. Лечение не разработано. Прогноз неблагоприятный.
ТИФ БЛОШИНЫЙ ЭНДЕМИЧЕСКИЙ
ОпределениеЭндемический сыпной тиф (синонимы: крысиный риккетсиоз, сыпной тиф) — острая инфекционная болезнь, обусловленная риккетсиями Музера, характеризуется доброкачественным течением с появлением на коже розеолезно-папулезной сыпи.Эндемический сыпной тиф в течение длительного времени отождествлялся с сыпным тифом и другими риккетсиозами (см.). Как самостоятельная болезнь, впервые описан в 1922 г., в 1928 г. Г. Музером выделен возбудитель. В 1931 г. был обнаружен возбудитель у блох, снятых с крыс в очаге болезни в Балтиморе. В этом же году Музер выделил риккетсии из мозга крыс.
Этиология и эпидемиология Возбудитель блошиного сыпного тифа имеет кокковидную или палочковидную форму. По своим морфобиологическим свойствам сходен с риккетсиями Провачека. К числу его особенностей следует отнести способность к интенсивному размножению в поражаемых клетках. По сравнению с риккетсиями Провачека риккетсии Музера обладают меньшим полиморфизмом (разнообразием). Различия этих родственных микроорганизмов обусловлены типоспецифическим термолабильным антигеном, выявление которого лежит в основе их серологической дифференциации. Эндемический сыпной тиф относится к риккетсиозам, передающимся человеку от животных. Естественным носителем возбудителя в природе являются грызуны — крысы, мыши и их внешние паразиты — блохи и гамазовые клещи. В организме риккетсии сохраняются до 16,5 месяца, в организме мышей — свыше 3 месяцев. Кошки, поедая инфицированных грызунов, могут заразиться блошиным риккетсиозом. У грызунов риккетсии Музера выделяются во внешнюю среду с мочой. Основными переносчиками заболевания являются крысиные блохи. У зараженных блох риккетсии размножаются в кишечнике и выделяются с испражнениями. В сухих фекалиях блохи риккетсии Музера сохраняются до 40 дней. Переносчиком риккетсий служит и крысиный клещ. У клещей наблюдается трансовариальная (через яйца, от поколения к поколению) передача риккетсий Музера. Заражение человека блошиным тифом обычно происходит при втирании в поврежденную кожу и слизистые оболочки инфицированных фекалий насекомых; при вдыхании воздуха, содержащего аэрозоль из инфицированных фекалий блох; через продукты, загрязненные мочой инфицированных грызунов. Допускается возможность заражения человека через укус гамазовых клещей, паразитирующих на грызунах. Через укус зараженных блох человеку риккетсии не передаются. Среди людей эндемический сыпной блошиный тиф наблюдается круглогодично, с подъемом заболеваемости в летне-осеннее время. Заболеванию подвержены все возрастные группы. От человека к человеку возбудитель не передается. Эндемический сыпной тиф широко распространен в тропических странах. В России в настоящее время не встречается.
Патогенез и патанатомия Сходством биологических свойств риккетсий Музера и Провачека, по-видимому, объясняется общность патоморфологической картины и механизма развития эндемического риккетсиоза и эндемического сыпного тифа. Ввиду редких смертельных исходов патологическая анатомия эндемического сыпного тифа изучена недостаточно.
Клиническая картина Инкубационный период в среднем составляет 5—15 дней. Начало болезни чаще острое, с появлением головной боли, суставных и мышечных болей, озноба. Подъем температуры может быть быстрым или постепенным и достигает 38–40 °C к концу первой недели заболевания. Температура постоянного или ремиттирующего типа. Длительность лихорадки — около 2 недель. Сыпь появляется чаще на 4—7-й день болезни (у 1/4 больных она отсутствует) и локализуется на груди, животе, лице, конечностях, ладонях и подошвах. Такая локализация сыпи отличает эндемический блошиный сыпной тиф от эпидемического. Сыпь в начале болезни розеолезная или макулезная; диаметр элементов от 2 до 5 мм. Позднее она трансформируется в макуло-папулезную или папулезную. Сыпь держится 7—10 дней; исчезая, она не оставляет пигментации. Нервная система у большинства больных поражается незначительно. Статус тифозус, бред (см.), менингеальные явления наблюдаются редко. Поражения сердечнососудистой системы проявляются понижением артериального давления и наклонностью к бронхоспазму. Могут выявляться явления бронхита (см.). Печень и селезенка не увеличены. В гемограмме сначала определяется лимфопения, а затем повышение лейкоцитов и лимфоцитов. Осложнений и рецидивов заболеваний не наблюдается. Прогноз благоприятный.
Диагностика и дифдиагностика Распознавание эндемического блошиного тифа основано на клинических,эпидемиологических и лабораторных данных. При клинической дифференциальной диагностике этих двух форм следует учитывать сроки возникновения, характер и локализацию сыпи: при блошином сыпном тифе возможно более позднее появление высыпаний розеолезно-папулезного характера и локализация их не только на коже туловища, но и на лице, ладонях и подошвах. Достоверное распознавание эндемического блошиного тифа возможно только при лабораторном обследовании больных. Серологическая дифференциация возможна с конца первой недели заболевания при параллельной постановке реакции агглютинации (РА) и РСК (реакции связывания комплемента) с антигенами из риккетсий Музера и Провачека. Диагноз учитывается при получении титров антител в реакции с антигеном риккетсий Музера в более высоких разведениях (в 2–8 раз), чем титры в реакции с антигеном из риккетсий Провачека.
Лечение При лечении больных эндемическим (блошиным) сыпным тифом применяются антибиотики (тетрациклин по 0,3–0,4 г х 3 раза в сутки). Лечение антибиотиками продолжается в течение всего лихорадочного периода и еще двух суток после нормализации температуры. Больной блошиным сыпным тифом не заразен для окружающих и обязательной госпитализации не подлежит. Профилактические мероприятия направлены на уничтожение источников инфекции — крыс, мышей и их наружных паразитов. Для этого производят дератизацию и дезинфекцию. К мерам профилактики относится и охрана пищевых продуктов от загрязнения выделениями грызунов. При широком распространении инфекции целесообразна вакцинация в очаговых районах с использованием убитой вакцины из риккетсий Музера.
ТИФ БРЮШНОЙ И ПАРАТИФ
ОпределениеТифо-паратифозные заболевания — группа острых инфекционных заболеваний с фекально-оральным механизмом передачи.Тиф брюшной — острое инфекционное заболевание, вызываемое бактериями рода сальмонелл, характеризующееся поражением лимфатического аппарата кишечника (главным образом тонкой кишки), бактериемией (проникновением возбудителя в кровь), выраженной интоксикацией, увеличением печени и селезенки; часто протекает с розеолезной сыпью. Паратиф (А и В) — острая инфекционная болезнь, по клиническому течению и патологоанатомической картине сходная с брюшным тифом. До начала XVIII в. под термином «тиф» объединяли все лихорадочные состояния, сопровождающиеся помрачением или потерей сознания. В середине XIX столетия появились описания особенностей течения брюшного тифа, но выделение его в самостоятельное заболевание произошло после открытия возбудителя болезни. В 1884 г. Г. Гаффки получил возбудителя в чистой культуре. А. И. Вильгур в 1887 г. выделил бактерию брюшного тифа из крови больного. В нашей стране классическое подробное описание брюшного тифа представил С. П. Боткин (1868 г.). Большой вклад в изучение этой инфекции внесли отечественные ученые Г. А. Ивашенцев, Н. К. Розенберг, Р. П. Руднев, А. Ф. Билибин, К. В. Бунин и др.
Этиология и эпидемиология Возбудители брюшного тифа относятся к роду сальмонелл, семейству кишечных бактерий и имеют форму палочек. Спор и капсул не образуют, подвижны, имеют жгутик. Растут на питательных средах, содержащих желчь. Содержат эндотоксин, который освобождается при разрушении бактериальной клетки. Возбудитель имеет антигенную структуру и содержит О-антиген, в состав которого входит Vi-антиген и Н-антиген. Различия в антигенной структуре бактерий брюшного тифа положены в основу подразделения их на серологические группы и типы. В связи с этим выделяют возбудителей паратифа А и В, которые не имеют Vi-антигена, однако не различающихся по морфологическим свойствам. Во внешней среде брюшнотифозные бактерии относительно устойчивы. В воде и почве они могут сохраняться от нескольких дней до нескольких месяцев. Бактерии хорошо переносят низкие температуры, но при нагревании быстро погибают. Дезинфицирующие средства (гипохлорит, хлорамин, лизол) в обычных концентрациях убивают возбудителя в течение нескольких минут. Паратифозные бактерии А и В имеют несколько большую устойчивость во внешней среде. Пути передачи и характер эпидемии такие же, как при брюшном тифе. Брюшной тиф относится к кишечным антропонозам. Источником инфекции является только больной человек или бактерионоситель. Из организма больного человека возбудители брюшного тифа выделяются во внешнюю среду с испражнениями и мочой. Массивное выделение возбудителя из организма больного начинается с 7-го дня заболевания, достигает максимума в разгар болезни и уменьшается в период выздоровления. Бактериовыделение может продолжаться до 3 месяцев (острое бактериовыделение), но иногда и пожизненно (хроническое бактериовыделение). Хронические бактериовыделители являются основными источниками брюшнотифозной инфекции. Для брюшного тифа характерен фекально-оральный механизм заражения, реализация которого осуществляется водным, пищевым и контактно-бытовыми путями. Так же как и при брюшном тифе, единственным источником возбудителей при паратифе А являются больные люди и бактериовыделители, а при паратифе В им могут быть и животные. Водный путь передачи брюшнотифозной инфекции играет существенную роль в возникновении эпидемий брюшного тифа. Водные эпидемии развиваются бурно, но обычно завершаются после прекращения пользования зараженным водоисточником. Единичные заболевания в настоящее время нередко обусловлены употреблением воды из открытых водоемов и технической воды, используемой на различных промышленных предприятиях. Опасны эпидемические вспышки, связанные с употреблением пищевых продуктов, в которых брюшнотифозные бактерии могут длительно сохраняться и размножаться. Для пищевых эпидемий характерны быстрое нарастание числа заболевших и стремительное распространение инфекции среди лиц, употреблявших инфицированные продукты. В заражении пищевых продуктов важную роль могут играть мухи. В ряде случаев заражение может происходить также контактно-бытовым путем через предметы, которыми пользовался больной человек. Для брюшного тифа характерно сезонное повышение заболеваемости в летнеосенний период.
Патогенез и патанатомия В механизме развития брюшного тифа различают несколько фаз: — фаза инфицирования, когда брюшнотифозная палочка попадает через рот в верхние отделы пищеварительного тракта и в просвет тонкой кишки; — фаза первичной регионарной инфекции, когда бактерии проникают в регионарные лимфатические узлы (преимущественно брыжеечные), где интенсивно размножаются, что приводит к развитию воспалительного процесса; — фаза бактериемии и токсинемии с развитием лимфаденитов (см.) и лимфангоитов; — период мозгового набухания лимфоидных образований тонкой кишки; — поступление возбудителя в кровь, циркуляция бактерий и их токсинов в крови, циркуляторные расстройства и дистрофические процессы во внутренних органах; — фаза паренхиматозного распространения возбудителей — поражаются внутренние органы с развитием в них брюшнотифозных гранулем, токсическое поражение центральной нервной системы и возникновение кожной сыпи в результате заноса возбудителей в сосуды дермы и развития в ней продуктивно воспалительных изменений; — выделительно-аллергическая фаза. В процессе освобождения организма от бактерий брюшного тифа существенное значение имеет усиление функции выделительных систем: печени, телец кишечника, почек. Начиная с 8—9-го дня болезни бактерии вместе с желчью выделяются в просвет кишечника и частично выводятся из организма. Другая часть бактерий вновь внедряется в первично сенсибилизированные групповые и солитарные (одиночные) лимфатические фолликулы нижнего отдела тонкой кишки. Быстрое развитие в них некротического процесса объясняют аллергической реакцией, проявляющейся в виде гиперергического (гиперергия — повышенная реактивность) воспаления; это 4—5-я неделя болезни. Затем наступает фаза формирования иммунитета и восстановления физиологического равновесия. Происходит нарастание количества антител и фагоцитарной активности макрофагов, очищение язв от омертвевших масс (период «чистых язв») в тонком кишечнике, нормализация микроциркуляции и восстановление нарушенных функций внутренних органов, заживление язв.
Язвы кишечника при брюшном тифе
Из локализованных очагов брюшнотифозные бактерии могут прорываться в кровь с последующим распространением инфекционного процесса в виде рецидивов болезни. Существенное значение в возникновении рецидивов имеет недостаточная напряженность формирующегося иммунитета. Основные изменения при брюшном тифе наблюдаются в лимфоидной ткани подвздошной кишки. На 1-й неделе болезни происходит набухание лимфоидной ткани тонкой кишки (период мозгового набухания).

Набухание и некроз лимфатических образований в кишечнике

Образование и заживление язв в кишечнике
На 2-й неделе начинается омертвение набухших лимфатических образований (период некроза). На 3-й неделе происходит отторжение отмерших элементов лимфоидной ткани с образованием язв (период образования язв). К концу 3-й — началу 4-й недели болезни отторжение омертвевших тканей заканчивается и начинается четвертый период — период чистых язв. Специфическими для брюшного тифа являются гиперпластические процессы в групповых и солитарных лимфатических фолликулах. Печень при брюшном тифе увеличенная, набухшая. Селезенка увеличена за счет воспалительного разрастания ретикулярных клеток с образованием тифозных гранулем. В почках определяется мутное набухание. Дегенеративные изменения часто наблюдаются в ганглиозных клетках симпатической нервной системы. Пневмонии (см.) при брюшном тифе в большинстве случаев обусловлены вторичной инфекцией, но встречаются и специфические брюшнотифозные пневмонии с образованием типичных гранулем. Розеолезная сыпь при брюшном тифе появляется в результате продуктивно-воспалительных изменений поверхностных слоев кожи по ходу кровеносных и лимфатических сосудов. В соскобах розеол обнаруживаются брюшнотифозные бактерии.
Клиническая картина Инкубационный период в среднем составляет 9—14 дней. Различают типичное и атипичное течение брюшного тифа.
Типичные формы брюшного тифа Типичные формы протекают циклически. Выделяют четыре периода заболевания: начальный, разгара, разрешения болезни и выздоровления. По тяжести клинических проявлений различают легкую, средней тяжести и тяжелую формы брюшного тифа. Начальный период болезни характеризуется постепенным развитием симптомов заболевания — отмечаются повышенная утомляемость, нарастающая слабость, познабливание, головная боль, отсутствие аппетита. Температура, ежедневно ступенеобразно повышаясь, к 5—7-му дню достигает 39–40 °C. К этому времени все явления интоксикации нарастают: значительная слабость, снижение двигательной активности, нарушение сна, упорная головная боль. При обследовании больных в начальном периоде болезни обращает на себя внимание некоторая заторможенность и снижение двигательной активности, лицо бледное, немного отечное. Отмечаются относительное урежение сердцебиения и дикротия (раздвоение) пульса. Артериальное давление снижено. Над легкими выслушиваются рассеянные сухие хрипы, что свидетельствует о развитии диффузного бронхита (см.). Язык обычно утолщен, с отпечатками зубов на боковых поверхностях, покрыт серовато-белым налетом. Живот умеренно вздут за счет метеоризма (см.). Выявляется положительный симптом Падалки (укорочение звука при простукивании в илеоцекальной области, что обусловлено гиперплазией воспалительно измененных лимфатических узлов брыжейки). К концу 1-й недели заболевания выявляется увеличение печени и селезенки. К концу 1-й — началу 2-й недели наступает период разгара болезни, когда все симптомы достигают своего максимального развития. Он продолжается 1–2 недели. Температура постоянно держится на высоких цифрах (39–40 °C). В этот период головная боль и бессонница нередко становятся мучительными. Развивается тифозный статус — резкая слабость, снижение двигательной активности, апатия, нарушение сознания от оглушенности до сопора или комы (см.). Возможно развитие инфекционного делирия (см.). На 8—10-й день появляется характерная сыпь на коже живота и нижней части груди. Сыпь скудная, по характеру розеолезная и мономорфная. Каждый элемент сыпи существует 1–5 дней. Могут появляться новые розеолы на фоне угасающих старых (феномен подсыпания), что связано с волнообразным течением бактериемии. В разгар болезни сохраняются относительное урежение сердцебиения и дикротия пульса, еще больше снижается артериальное давление. Симптомы поражения органов пищеварения в разгар болезни достигают максимального развития. Живот вздут вследствие метеоризма (см.). Стул задержан, иногда жидкий, в форме горохового супа. Печень и селезенка увеличены. В разгар болезни уменьшается количество выделяемой мочи. Возникает бактериурия (появление возбудителя в моче), которая приводит к воспалению почечных лоханок и мочевого пузыря. Период разрешения болезни характеризуется постепенным снижением температуры, причем перед нормализацией она начинает колебаться, приобретая амфиболический характер (различия между утренней и вечерней температурой достигают 2–2,5 °C). Прекращается головная боль, нормализуется стул, улучшается аппетит, увеличивается мочевыделение. Длительность периода разрешения не превышает 1 недели.
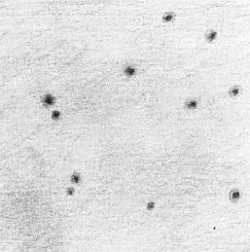
Розеолезная сыпь при брюшном тифе
В период выздоровления восстанавливаются нарушенные функции организма и происходит освобождение его от возбудителей брюшного тифа. Для данного периода типичен астеновегетативный синдром, который сохраняется 2–4 недели и зависит от тяжести перенесенного заболевания. Среди перенесших брюшной тиф 3–5 % пациентов становятся хроническими брюшнотифозными бактериовыделителями. Рецидивы чаще возникают на 2—3-й неделе нормальной температуры, но могут проявляться и в более поздние сроки (1–2 месяца), независимо от формы и тяжести болезни. Они бывают однократными и многократными. Продолжительность лихорадки при рецидиве может колебаться от 1–3 дней до 2–3 недель. Клинически рецидивы брюшного тифа сходны с первой волной заболевания и отличаются лишь более быстрым подъемом температуры, ранним появлением сыпи, меньшей длительностью лихорадки и обычно более легким течением.
Атипичные формы брюшного тифа При атипичных формах заболевания ряд характерных признаков брюшного тифа может отсутствовать. К атипичным относятся абортивная и стертая формы болезни. Абортивная форма имеет много общих черт с типичным течением болезни, но клиническая картина не достигает полного развития. Температура быстро (через 7— 10 дней) и нередко критически снижается, исчезают другие симптомы и наступает выздоровление. При стертой форме (амбулаторный тиф) интоксикация выражена незначительно. Температура слегка повышена, продолжительность ее не более 5–7 дней. Кожные сыпи бывают редко. Изменения внутренних органов выражены слабо. Больные, как правило, трудоспособны.
Паратиф По эпидемиологии, механизму развития, морфологии и клинической картине паратифы А и В в основном сходны с брюшным тифом, но имеют некоторые особенности. Инкубационный период при паратифе А короче, чем при брюшном тифе (8— 10 дней). Начало чаще острое, иногда сопровождается кашлем (см.) и насморком. При осмотре отмечаются покраснение лица, инъекция сосудов склер, герпес (см.) на губах. Температурная кривая имеет неправильный характер, чаще волнообразный или ремиттирующий. Лихорадка нередко сопровождается ознобом, а затем обильным потом. Сыпь при паратифе А появляется в более ранние сроки (4—7-й день болезни) и отличается многообразием с частыми дополнительными подсыпаниями. Сыпь может быть розеолезной, кореподобной и петехиальной. Интоксикация, как правило, выражена умеренно, отсутствует характерный тифозный статус. У большинства больных заболевание протекает в форме средней тяжести, но могут наблюдаться и тяжелые формы с осложнениями (кишечное кровотечение, перфорация кишки, бронхопневмония (см.)). Рецидивы при паратифе А встречаются довольно часто. Инкубационный период при паратифе В составляет 5—10 дней, но может быть и более продолжительным. Заболевание начинается остро, сопровождается выраженным ознобом, болями в мышцах и потливостью. В начальный период болезни явления интоксикации могут сочетаться с симптомами острого гастроэнтерита (см.). Температурная реакция короткая, часто волнообразного характера. Тифозное состояние у большинства больных отсутствует, симптомы интоксикации, наблюдаемые в начальный период (3–5 дней), быстро исчезают. Сыпь появляется в ранние сроки, имеет полиморфный характер, часто бывает обильной и напоминает коревую. В некоторых случаях течение паратифа В может быть тяжелым, с септическими проявлениями в виде гнойного менингита (см.) и менингоэнцефалита. Обычно заболевание длится 3–4 недели, но может быть и более коротким (5–7 дней). Диагностика, лечение, профилактика при паратифах А и В такие же, как при брюшном тифе.
Осложнения Из специфических осложнений брюшного тифа наибольшее значение для исхода заболевания имеют кишечное кровотечение, перфоративный перитонит (см.) и инфекционно-токсический шок (см.). Кишечное кровотечение чаще наблюдается на 3-й неделе болезни. Причиной его является аррозия (нарушение целости в результате язвенно-некротических процессов) сосуда в дне брюшнотифозной язвы. Кровотечение может носить распространенный капиллярный характер. Первым симптомом, указывающим на возможное кишечное кровотечение, является дегтеобразный стул. Небольшое кровотечение обычно не влияет на состояние больного. При массивных кровотечениях температура тела внезапно снижается до нормальной, возникает жажда, пульс учащается, артериальное давление понижается. Массивное кровотечение может привести к развитию геморрагического шока (см.), что всегда имеет серьезный прогноз. Перфоративный перитонит (см.) вследствие прободения язвы кишечника — опасное осложнение брюшного тифа. Он развивается на 2—4-й неделе болезни, иногда после нормализации температуры. Перфорации способствуют: метеоризм (см.), усиленная перистальтика, резкие движения, сильный кашель (см.), нарушение диеты. Наиболее часто прободение язвы происходит в подвздошной кишке на расстоянии 25–30 см от места перехода ее в слепую кишку. Клиническая картина брюшнотифозного перитонита имеет ряд особенностей: отсутствует резкая кинжальная боль, характерная для перфораций, поэтому появление даже небольших болей в животе должно привлечь внимание врача. Важным признаком перфорации является положительный симптом Щеткина — Блюмберга. Перфорация кишки иногда сопровождается тяжелым коллапсом (см.). Показано срочное оперативное вмешательство. Инфекционно-токсический шок (см.) развивается в период разгара болезни. Возникновение его обусловлено массивным поступлением в кровь брюшнотифозных бактерий и их токсинов. В клинической картине болезни инфекционно-токсическому шоку предшествуют симптомы высокой температуры и нейротоксикоза. При его развитии наблюдаются: резкое снижение температуры тела, повышенное потоотделение, учащение сердцебиения, тахипноэ (учащенное дыхание), падение артериального давления, уменьшение мочевыделения вплоть до его отсутствия. К числу неспецифических осложнений относятся пневмонии (см.), тромбофлебиты (см.), менингиты (см.), пиелиты, паротиты (см.). Прогноз при неосложненном брюшном тифе благоприятный.
Диагностика и дифдиагностика Диагностика выявления брюшного тифа и паратифов А и В едина. При брюшном тифе наиболее важна диагностика в первые 5–7 дней болезни. Это связано с эпидемиологическими требованиями. Для диагностики имеют значение как клинико-эпидемиологические, так и лабораторные данные. В лабораторной диагностике используют бактериологический и серологические методы исследования. На 1—2-й неделе заболевания возбудителя легче всего выделить из крови, со 2—3-й недели — из испражнений и мочи, а в течение всего заболевания — из дуоденального содержимого (содержимого двенадцатиперстной кишки). Можно выделить возбудителя при посеве соскоба розеол, костного мозга, гноя, экссудата, мокроты. Кровь засевают на 10–20 %-ный желчный бульон или среду Раппопорта. Для получения копро-, били- или уринокультуры используется среда Плоскирева. Для серологической диагностики брюшного тифа используется с 5—7-го дня заболевания РНГА (реакция непрямой гемагглютинации) с эритроцитарными диагностикумами (О, Н, Vi-антигенами). Положительной считается реакция в титре 1:200 и выше. Учитываются результаты в парных сыворотках, взятых в динамике заболевания, диагностически значимым считается четырехкратное и большее нарастание титра антител. Для выявления бактерионосителей используют РНГА с Vi-антигеном. Дифференциальная диагностика при брюшном тифе проводится с сыпным тифом (см.), малярией (см.), бруцеллезом (см.), листериозом (см.), пневмонией (см.), сепсисом (см.), туберкулезом (см.), лимфогранулематозом (см.).
Лечение и профилактика Лечение и исход брюшного тифа (паратифа) зависят от правильного ухода, диеты и своевременного назначения антибактериальных и патогенетических средств. Терапия осуществляется в условиях инфекционного стационара. Немаловажное значение имеют уход за полостью рта и кожей, постельный режим. Ходить разрешают больным с 10—11-го дня нормальной температуры при отсутствии противопоказаний. Диета должна быть щадящей, калорийной, легкоусвояемой. Назначают антибиотики — левомицетин, ампициллин. Антибиотикотерапия осуществляется в течение всего лихорадочного периода и первых 10 дней нормальной температуры. Левомицетин назначают внутрь по 0,5 г 4 раза в сутки. В случае невозможности использования левомицетина перорально (частая рвота) назначают левомицетина сукцинат внутримышечно или внутривенно. Суточная доза для взрослого составляет 3–4 г (50 мг/кг). Ампициллин в дозе 1,0 г 4–6 раз в сутки дает хороший эффект в острый период брюшного тифа и в некоторых случаях острого (до 3 месяцев) бактериовыделения. При устойчивости возбудителя к антибиотикам применяют бактрим (бисептол) или нитрофурановые препараты. Для повышения эффективности терапии и неспецифической резистентности организма, кроме полноценной диеты и витаминов, используют нестероидные анаболики (метилурацил или метацил, оротат калия). Для дезинтоксикации внутривенно назначают раствор Рингера, 5 %-ный раствор глюкозы, гемодез. Кортикостероиды применяют только в тяжелых случаях болезни. При кишечных кровотечениях показаны: срочный постельный режим в течение 12–24 ч, холод на живот, голод на 10–12 ч, хлористый кальций внутривенно, витамины С и К, гипертонический раствор хлорида натрия (5—10 мл внутривенно), желатиноль, плазма и другие препараты крови. При перфорации стенки кишки показано срочное оперативное вмешательство. В терапии инфекционно-токсического шока (см.) используют гемодез, реополиглюкин, желатиноль, кристаллоидные растворы в сочетании с введением вазоактивных препаратов (дофамин или допмин), массивные дозы глюкокортикостероидов. С целью повышения антиагрегационного эффекта кристаллоидных растворов к ним добавляют ингибитор протеолиза — контрикал (трасилол). Большое значение в профилактике брюшного тифа имеют ранняя диагностика, изоляция и провизорная (с целью наблюдения) госпитализация больного, эффективная терапия с полным освобождением организма от возбудителя. Перед выпиской больного при выздоровлении в стационаре с интервалом в 5 дней проводят трехкратное бактериологическое исследование кала и мочи и однократное — желчи. При обнаружении возбудителя в кале, моче или желчи выздоравливающего подвергают интенсивному лечению в стационаре. Переболевшие брюшным тифом состоят на учете в течение 2 лет, а лица, работающие на пищевых предприятиях, — на протяжении 6 лет. В очаге проводят текущую и заключительную дезинфекцию. За контактными устанавливается медицинское наблюдение в течение 21 дня с ежедневной термометрией. Проводится однократное бактериологическое исследование кала и мочи. Специфическая профилактика в очаге включает в себя назначение бактериофага всем контактным.
ТИФ ВОЗВРАТНЫЙ ЭНДЕМИЧЕСКИЙ
ОпределениеТиф возвратный эндемический — острая природно-очаговая болезнь, передающаяся клещами рода Орнитодорус, протекающая в виде лихорадочных приступов, чередующихся с периодами апирексии (отсутствия температуры).В 1857 г. Д. Ливингстон впервые описал лихорадочные заболевания людей в Южной Африке, связанные с укусами домовых клещей. В 1904 г. Ф. Росс обнаружил спирохеты в крови жителей Уганды, заболевших возвратной лихорадкой после укуса клещей. В 1912 г. в мазках крови больных в Иране был обнаружен новый вид возбудителя. Начиная с 1927 г. под руководством Е. Н. Павловского в нашей стране стали проводиться исследования, в процессе которых были детально изучены этиология, эпидемиология и клиника болезни, разработаны эффективные меры профилактики тифа возвратного эндемического.
Этиология, эпидемиология и патогенез Возбудителей эндемического возвратного тифа более 20 видов, все они близки по своим свойствам к боррелиям. Они имеют штопорообразный вид с 12 и более спиралевидными завитками. В лабораторных условиях существование возбудителя поддерживается в организме клещей, морских свинок, кроликов и белых мышей. Возможно культивирование боррелий эндемического возвратного тифа на искусственных питательных средах (среда Аристовского и Гельтцера). Основными носителями и переносчиками возбудителей тифа возвратного эндемического являются клещи семейства аргизид, у которых выявлена трансовариальная передача боррелий. Эти клещи распространены в зонах жаркого климата. Обитают в пустынях, предгорных районах и горах, в закрытых биотопах: норах диких животных, гнездах птиц, пещерах, под камнями. Заражение происходит через укус инфицированного клеща. В природных очагах циркуляция боррелий происходит между клещами и дикими млекопитающими, птицами и рептилиями. В антропургических (приближенных к жилью человека) очагах в цепь циркуляции возбудителя включаются человек и домашние животные. Тиф возвратный эндемический — сезонная инфекция с повышением заболеваемости в летний период года. Основной контингент больных составляют приезжие лица. Местное население обычно переносит заболевание в раннем возрасте, приобретая устойчивость к последующему заражению. Очаги инфекции известны в Казахстане, Киргизии, на Северном Кавказе, на юге Украины. Природные и антропургические очаги клещевого боррелиоза распространены во многих странах Южной Европы, Азии, Африки и Америки. Механизм развития эндемического возвратного типа близок к механизму развития тифа возвратного эпидемического. В результате заболевания вырабатывается видоспецифический иммунитет, в связи с чем возможны повторные заболевания, вызванные другими видами боррелий.
Клиническая картина Инкубационный период составляет 6— 10 дней. На месте укуса клеща всегда отмечается первичный аффект в виде точечного кровоизлияния и мелкого узелка, окруженного геморрагическим ободком. Выделяют легкие, средней тяжести и тяжелые формы болезни; последние наблюдаются редко. Заболевание чаще всего начинается внезапно и протекает с чередованием приступов лихорадки и апирексии. Во время приступа температура повышается до 39–40 °C. Отмечаются озноб, головные и мышечные боли, бессонница, исчезает аппетит. Больные проявляют беспокойство, иногда бредят. Лицо гиперемировано (покрасневшее), с желтушным оттенком. Пульс учащен. Первый приступ длится от нескольких часов до 2–6 дней и заканчивается критическим падением температуры и интенсивным потоотделением. Через 1–8 дней развивается второй приступ, длительностью от 4–8 ч до 4–8 суток. За ним следуют дальнейшие приступы, количество которых достигает 8— 10 и более. Продолжительность повторных приступов сокращается, а безлихорадочные интервалы между ними удлиняются. Болезнь длится 1–2 месяца и более. Во время приступа отмечается учащение сердцебиения. Иногда наблюдаются бронхиты (см.) и бронхопневмонии (см.). Возникают боли в животе, явления энтероколита (см.). Печень незначительно увеличена, уплотнена, но обычно безболезненна. Селезенка увеличена. В гемограмме отмечаются умеренная гипохромная анемия (см.), повышенный уровень лейкоцитов, повышение СОЭ до 40–60 мм/ч. В моче обнаруживают белок и единичные цилиндры. Как правило, возвратный эндемический тиф заканчивается полным выздоровлением. Редкие смертельные исходы обусловлены кровоизлияниями в головной мозг.
Диагностика и дифдиагностика Большое значение имеют данные эпидемиологического анамнеза, указывающие на пребывание больного в эндемичном очаге болезни, обнаружение следов укуса клеща. Для подтверждения диагноза кровь больного, взятую во время приступа и в период апирексии, исследуют на наличие боррелий по той же методике, что и при эпидемическом возвратном тифе. Биологический метод диагностики состоит в заражении морских свинок кровью больного, взятой в период приступа. Серологические методы не применяются. Диффенциальный диагноз проводится с эпидемическим возвратным тифом (см.), малярией (см.) и другими острыми инфекционными заболеваниями.
Лечение и профилактика Этиотропная терапия проводится с помощью тетрациклиновых препаратов (по 0,3 г 4–6 раз в сутки), левомицетина (по 2 г в сутки) до стойкого снижения температуры. По показаниям проводится дезинтоксикационная и симптоматическая терапия. В очагах болезни проводится комплекс мероприятий по борьбе с клещами и грызунами, принимаются меры по защите людей от нападения и присасывания клещей.
ТИФ ВОЗВРАТНЫЙ ЭПИДЕМИЧЕСКИЙ
ОпределениеОстрая антропонозная болезнь с механизмом заражения через переносчика, протекающая с чередованием периодов лихорадки и апирексии (отсутствия температуры), увеличением печени и селезенки. В настоящее время в нашей стране не регистрируется.Впервые это заболевание было описано Ратти в 1739 г. под названием «пятидневная лихорадка с возвратами». В 1808 г. О. Обермейер открыл возбудителя болезни, отнеся его к группе спирохет. Этиологическая роль спирохет Обермейера при возвратном тифе была доказана в опытах самозаражения Г. Н. Мниха (1874 г.), О. О. Мочутковского (1875 г.) и И. И. Мечникова (1881 г.). При этом было высказано предположение о передаче возбудителя через укус кровососущего насекомого, в частности вши. В 1912 г. в Тунисе Ш. Николь и А. Блайрот (1912 г.) доказали роль вши в передаче возбудителей болезни.
Этиология и эпидемиология Возбудитель болезни — спирохета, относящаяся к роду боррелий и имеющая извитое спиралевидное тело длиной 20–40 мкм. Во внешней среде боррелии неустойчивы, быстро погибают при нагревании и высушивании, но хорошо переносят низкие температуры. Тиф возвратный эпидемический — инфекция, передающаяся при контакте с больным человеком. Единственным источником возбудителя является больной человек, в крови которого находятся боррелии. Переносчиками боррелий являются платяная, головная и в меньшей степени лобковая вошь, которые становятся наиболее заразными с 6-го по 28-й день после инфицирующего кровососания. Человек заражается, втирая в кожу раздавленных вшей при расчесывании места укуса насекомого. Максимальная заболеваемость в период эпидемий наблюдалась в зимне-весеннее время года. В прошлом эпидемии возвратного тифа были неизбежными спутниками войн и социальных потрясений. В настоящее время случаи болезни сохраняются в некоторых странах Азии, Африки и Южной Америки.
Патогенез и патанатомия После размножения внедрившихся боррелий возникают боррелиемия и токсемия (проникновение в кровь возбудителя и его токсинов), определяющие начало клинических проявлений болезни. Под воздействием антител образуются агрегаты из боррелий, нагруженные тромбоцитами, которые задерживаются в капиллярах и вызывают расстройство микроциркуляции во внутренних органах. В дальнейшем происходит поглощение специальными клетками и разрушение боррелий, обусловливающие кризис и окончание приступа. Однако часть боррелий сохраняется и размножается в костном мозге и центральной нервной системе. Через определенное время они, проникая в кровь, вызывают развитие нового приступа болезни. Патологические изменения наиболее четко выражены в селезенке, печени, костном мозге. Селезенка значительно увеличена, переполнена кровью, в ней определяются многочисленные некрозы (очаги омертвения), а иногда и инфаркты (см.). Печень увеличена, в ее ткани обнаруживаются очаги омертвения. Мелкие очаги омертвения имеются и в костном мозге. В почках отмечается картина паренхиматозного нефрита (см.). В миокарде выявляются дистрофические изменения и очаги омертвения. В головном мозге, особенно в стволовой его части и мозговых оболочках, наблюдаются кровоизлияния.
Клиническая картина Инкубационный период составляет 7–8 ней. В клинике заболевания характерно чередование лихорадочных приступов с периодами апирексии. Болезнь может протекать в легкой, средней тяжести и тяжелой формах. Заболевание начинается внезапно, с озноба, температура повышается до 39–40 °C. Беспокоят мучительные головные и мышечные боли, бессонница. Особенно сильные боли отмечаются в икроножных мышцах, по ходу нервов и в области суставов. Аппетит отсутствует, бывают тошнота и рвота (см.). В первые дни болезни возникают боли в левом подреберье, обусловленные увеличением селезенки. У многих больных одновременно увеличивается печень, развивается желтуха (см.). Первый приступ продолжается чаще всего 5–8 дней. Затем следует безлихорадочный период продолжительностью 7—14 дней, вслед за которым возникают новые приступы с безлихорадочными интервалами. Всего бывает не более пяти лихорадочных приступов, при этом каждый последующий приступ короче предыдущего, а период апирексии, наоборот, продолжительнее. В безлихорадочном периоде болевые симптомы становятся умеренными, сохраняется общая слабость. При первом лихорадочном приступе температурная кривая всегда постоянного типа, при повторных приступах она может быть постоянной, ремиттирующей или неправильной. Во время приступа наблюдаются покраснение лица и конъюнктив, инъекция склер, появление петехий, крупнопятнистых элементов. К концу приступа выражена желтушность кожи и склер. Со стороны сердечно-сосудистой системы отмечаются учащение сердцебиения, глухость сердечных тонов, снижение артериального давления. В легких вследствие вторичной инфекции отмечаются бронхиты (см.), пневмония (см.), сухой плеврит (см.). В моче обнаруживаются повышенное содержание белка, выщелоченные эритроциты, лейкоциты. Во время приступов уменьшается мочевыделение, а после приступа наблюдается его повышение. В ряде случаев развивается менингит (см.) с характерным симптомокомплексом, в спинномозговой жидкости повышено содержание белка и лимфоцитов. Гемограмма характеризуется увеличением количества нейтрофильных лейкоцитов. При большой частоте и продолжительности лихорадочных приступов выявляется гипохромная анемия (см.). Осложнениями возвратного эпидемического тифа являются инфаркты и разрывы селезенки, носовые кровотечения, спонтанные аборты (см.). Наблюдаются пневмонии (см.), плевриты (см.), абсцессы (см.) селезенки, флегмоны (см.), обусловленные присоединением болезнетворной микрофлоры. Отмечены поражения глаз (ириты (см.), иридоциклиты (см.)), ушей (отиты (см.)), суставов и хрящей. При своевременном рациональном лечении смертность не превышает 1 %.
Диагностика и дифдиагностика Диагноз устанавливается на основании выявления характерного симптомокомплекса в виде острых приступов лихорадочного заболевания с быстрым увеличением печени и селезенки, выраженным общетоксическим синдромом, появлением рецидивов лихорадки у больных из эпидемического очага инфекции. Специфическая диагностика включает обнаружение боррелий в толстой капле и мазке крови, взятых на высоте лихорадочной реакции. Серодиагностика не нашла применения. В очагах используют метод биопроб, заражают белых мышей и крыс боррелиями Обермейера. Дифференциальный диагноз проводится с малярией (см.), гриппом (см.), брюшным и сыпным тифом (см.), эндемическим возвратным тифом (см.), сепсисом (см.).
Лечение и профилактика Больные подлежат обязательной госпитализации в инфекционный стационар с обязательной санитарной обработкой. Проводится лечение пенициллином (по 2–3 млн ЕД в сутки), тетрациклином (2 г в сутки), эритромицином (0,8–1 г в сутки) в течение 5–7 дней. В зависимости от течения болезни применяют дезинтоксикационную терапию, проводят лечение осложнений. Разрыв селезенки требует срочного оперативного лечения. Больные и подозрительные на это заболевание лица подлежат госпитализации. Во время эпидемий осуществляется выявление и госпитализация всех лихорадящих больных. Вещи больных подвергаются камерной дезинфекции. Контактные лица подвергаются санитарной обработке, за ними устанавливается медицинское наблюдение с ежедневным измерением температуры в течение 25 дней.
ТИФЛИТ
ОпределениеТифлит — воспаление слепой кишки, сегментарный колит (см.).
Этиология Возникновению тифлита способствует застой кала в слепой кишке, благоприятствующий развитию кишечной флоры. Тифлит может развиться в результате распространения инфекции при острых инфекционных болезнях (брюшном тифе (см.), сепсисе (см.), кори (см.), гриппе (см.) и др.) вместе с током крови. Возможен также переход воспалительного процесса на слепую кишку с соседних органов вместе с током лимфы. Тифлит может сопутствовать аппендициту (см.). При болезни Крона (см.), туберкулезе (см.) кишечника, абдоминальном актиномикозе (см.) развивается илеотифлит.
Клиническая картина Клиническая картина характеризуется тупыми болями в правой подвздошной области. Иногда боли имеют характер колики (см.), появляются через 5–6 ч после еды, усиливаются при движениях и длительном стоянии, а в положении лежа на левом боку могут смещаться в поясничную область. Отмечаются чувство распирания в животе, урчание, метеоризм (см.), тошнота, отрыжка, снижение аппетита, иногда понос. Чаще отмечается чередование поноса и запора, однако бывает и нормальный стул. В период обострения живот вздут (иногда только в правой подвздошной области), передняя брюшная стенка не напряжена, слепая кишка уплотнена, болезненна, раздута и подвижна. При илеотифлите определяется выраженный шум плеска. К осложнениям относятся развитие недостаточности илеоцекального (слепоподвздошнотонкокишечного) клапана — баугиневой заслонки и паратифлит — воспаление забрюшинной клетчатки. Перитифлит (воспаление брюшины, покрывающей слепую кишку) можно рассматривать как осложнение или как проявление тифлита. Клинически различить пери- и паратифлит трудно. При перитифлите боли становятся упорными, кишка не смещается при прощупывании.
Диагностика и дифдиагностика Диагноз ставится на основании клинической картины, а также данных копрологического и рентгенологического исследований. При копрологическом исследовании определяют слабокислую реакцию кала, большое количество переваренной клетчатки, внутриклеточного крахмала, йодофильной флоры, измененных мышечных волокон, незначительное количество расщепленного жира. Рентгенологическое исследование тифлита включает ирригоскопию и рентгеноскопию при антеградном заполнении илеоцекальной области, париетографию. Частым рентгенологическим симптомом тифлита является изменение просвета (увеличение или сужение) слепой кишки. Чаще отмечается сужение просвета слепой кишки, иногда неравномерное. При резком сужении пораженный отдел принимает вид шнура. Характерным признаком тифлита является укорочение и деформация слепой кишки, которая может принимать воронкообразную или цилиндрическую форму. Рельеф слизистой оболочки при тифлите изменен, имеет ячеистый вид, складки часто сглажены или отсутствуют. В некоторых случаях на внутренней поверхности слепой кишки имеются стойкие бариевые пятна, указывающие на наличие язв и эрозий. При обострении тифлита может быть выявлен симптом Штирлица. Для перитифлита характерны деформация, смещение и утолщение стенки слепой кишки, сращение ее с брюшной стенкой и соседними органами. Дифференциальный диагноз проводят с аппендицитом (см.), вторичными изменениями слепой кишки при аппендиците, почечной коликой (см.), гинекологическими заболеваниями, злокачественными новообразованиями, правосторонним дивертикулитом (см.) толстой кишки.
Лечение и профилактика Лечение этиологическое и симптоматическое. Основная диета в период обострения № 2, 4 и 4а (при наличии бродильных процессов), по мере стихания воспалительного процесса назначается диета № 4в (пища в непротертом виде). По показаниям проводится лечение кишечного дисбактериоза. Применяются антибиотики широкого спектра действия. Особенно эффективны энтеросептол, интестопан, оказывающие угнетающее действие на патогенную микрофлору. Короткими курсами назначаются колибактерин, бификол, лактобактерин. При жидком стуле рекомендуются вяжущие и обволакивающие средства (танальбин, танаксол, висмута нитрат и др.), настои и отвары растений, содержащихдубильные вещества (кровохлебка, черемуха, зверобой и др.). При метеоризме назначаются активированный уголь, настой мяты перечной, цветков ромашки и др. Профилактика сводится к предупреждению инфекционных заболеваний кишечника, своевременному лечению запоров (см.), удалению воспалительных очагов в организме, соблюдению режима питания.
ТИФ СЫПНОЙ ЭПИДЕМИЧЕСКИЙ И БОЛЕЗНЬ БРИЛЛА
ОпределениеЭпидемический сыпной тиф — острый антропонозный риккетсиоз (см.), проявляющийся лихорадкой, тяжелой общей интоксикацией, розеоло-петехиальной сыпью, увеличением печени и селезенки и признаками менингоэнцефалита. Болезнь Брилла — рецидивная форма инфекции.Сыпной тиф относится к древним инфекционным болезням. В самостоятельную нозологическую форму был выделен в 1793 г. А. Логвиновским, детально описан Я. Шировским (1811 г.) и С. Боткиным (1867 г.). Инфекционная природа сыпного тифа и наличие возбудителя в крови были доказаны одесским врачом О. О. Мочутковским при самозаражении кровью сыпнотифозного больного в 1876 г. Американский ученый Х. Риккетс в 1910 г. и чешский ученый С. Провачек (1913–1914 гг.) обнаружили в крови больных сыпным тифом возбудителя. Передачу риккетсий вшами предполагали врачи и ученые, Г. Н. Минх (1871 г.) и К. Ф. Гамалея (1908 г.) и доказали это в эксперименте. В 1910 г. американский ученый Н. Брилл описал самостоятельную нозологическую форму спорадического сыпного тифа, которую в 1933 г. объяснили рецидивом эндогенной сыпнотифозной инфекции. В нашей стране большие заслуги в изучении рецидивного сыпного тифа принадлежат Г. Ф. Здродовскому, К. Н. Токаревичу, К. М. Лобану, Г. С. Мосничу.
Этиология и эпидемиология Возбудитель эпидемического сыпного тифа — риккетсия Провачека — мелкий, неподвижный, не образующий спор и капсул микроорганизм. Обладает гемолизирующими и эндотоксическими свойствами, имеет соматический термостабильный антиген. В организме человека паразитирует в цитоплазме эндотелиальных и мезотелиальных клеток. Риккетсии Провачека чувствительны к нагреванию и действию дезинфицирующих средств, устойчивы к низкой температуре и высушиванию, длительно сохраняются в высушенных фекалиях вшей. Источником инфекции и носителем возбудителей инфекции является больной эпидемическим сыпным тифом или болезнью Брилла в период продрома и в течение последних 1–2 дней (до 7–8 дней) апирексии (нормальной температуры), т. е. на протяжении 3 недель. Ведущий механизм заражения — трансмиссивный. Переносчики риккетсий — вши, в основном платяные, реже головные, которые выделяют риккетсии с фекалиями спустя 4–5 дней после инфицирующего кровососания и на протяжении всей жизни (14–17 дней). Человек заражается риккетсиями при втирании инфицированных экскрементов насекомого в поврежденную расчесами кожу или при раздавливании на коже инфицированных вшей. В лабораторных условиях возможен и воздушный путь инфицирования. Восприимчивость человека к сыпнотифозной инфекции очень высока во всех возрастных группах. Характерно сезонное повышение заболевания в зимне-весенний период. Рецидивные формы сыпного тифа (болезнь Брилла) наблюдаются спорадически (в виде отдельных случаев), независимо от времени года, обычно у лиц пожилого возраста, перенесших в прошлом сыпной тиф. Больной болезнью Брилла заразителен для вшей, поэтому при наличии педикулеза (завшивленности) становится потенциальным источником эпидемической вспышки сыпного тифа. В прошлом эпидемии сыпного тифа были неизбежными спутниками войн и стихийных бедствий. В настоящее время эпидемический сыпной тиф регистрируется в ряде стран Африки и Латинской Америки. В России, европейских и североамериканских странах регистрируются случаи болезни Брилла.
Патогенез и патанатомия Механизм развития сыпного тифа может быть представлен в виде 5 последовательных фаз: — внедрение риккетсий в эндотелиальные клетки; — разрушение эндотелиальных клеток с развитием риккетсиемии и специфической интоксикации; — нарушение функции сосудов в различных органах и системах организма с расстройствами микроциркуляции; — деструктивно-пролиферативный тромбоваскулит (см.) мелких сосудов и формирование специфических гранулем; — формирование специфического иммунитета — выздоровление (или переход в скрытую форму инфекции с возможными отдаленными рецидивами). Специфические сыпнотифозные изменения сосудов — универсальный острый инфекционный васкулит (см.) — складываются из трех компонентов: тромбообразования с разрушением сосудистой стенки и клеточной мембраны; деструктивного тромбоваскулита с образованием внутрисосудистых тромбов; развития околососудистых сыпнотифозных гранулем в виде муфт. Сосудистые повреждения наблюдаются во всех органах и тканях, но наиболее выражены в головном мозге. Сосудистые расстройства лежат в основе возникновения розеолезно-петехиальной сыпи на коже и кровоизлияний в слизистые оболочки. Распространенный панваскулит обусловливает выраженные микроциркуляторные расстройства и дистрофические изменения в различных тканях. Часто возникает миокардит (см.). Характерны дистрофические процессы в шейных и грудных симпатических нервных узлах. Отмечаются отек и кровоизлияния в надпочечники, дистрофические изменения в печени и почках. С первого дня болезни и до 5—6-го дня периода апирексии во внутренних органах обнаруживаются риккетсии. В развитии патологических изменений существенное значение имеет нарушение процессов свертывания крови с преобладанием гиперкоагуляции (повышенной свертываемости). В ответ на внедрение и паразитирование риккетсий развиваются реакции клеточного и гуморального иммунитета. В ряде случаев риккетсии длительно сохраняются в клетках, например в лимфатических узлах. Факторами, способствующими активизации дремлющей инфекции, являются различного рода стрессовые воздействия. При болезни Брилла развертываются такие же патогенетические процессы, как и при первичной сыпнотифозной инфекции, однако они менее интенсивны.
Клиническая картина Сыпной тиф Инкубационный период при сыпном тифе колеблется от 5 до 25 дней, в среднем составляя 11–14 дней. Сыпной тиф относится к числу острых циклических инфекционных заболеваний. Различают начальный период до появления сыпи продолжительностью 4–5 дней, период разгара (от момента появления сыпи до нормализации температуры) длительностью от 5 до 10 дней и период выздоровления (2–3 недели). Болезнь может протекать в стертой, легкой, средней тяжести и тяжелой формах. Известно субклиническое (без явных клинических проявлений) течение сыпнотифозной инфекции. Типичный симптомокомплекс обычно выявляется при форме средней тяжести. Начало заболевание обычно острое, лишь изредка выявляется кратковременный продромальный период. Начальный период болезни характеризуется быстрым повышением температуры тела, которая в течение 1–2 (реже 3–4) дней достигает максимального уровня (39–40 °C), и другими признаками интоксикации (упорная головная боль, иногда с головокружением, тошнотой, слабостью, бессонницей, слуховыми и зрительными галлюцинациями (см.), повышением кожной чувствительности). Отмечаются некоторое беспокойство и эйфория больных. Характерен внешний вид больного — одутловатое покрасневшее лицо, блестящие глаза, инъецированные склеры («кроличьи глаза»), сухие яркие губы, горячая сухая кожа. На 2—3-й день болезни у основания небного язычка выявляется сыпь в виде точечных кровоизлияний (симптом Розенберга — Винокурова). С 3—4-го дня заболевания (чаще при тяжелых формах) на переходной складке конъюнктивы выявляется сыпь в виде багрово-фиолетовых пятнышек (симптом Киари-Авцына). Обычно наблюдаются учащенное сердцебиение и артериальная гипотензия. У большинства больных с 3—4-го дня болезни отмечается интоксикация. Мочевыделение может несколько понижаться. Период разгара характеризуется развертыванием тяжелых клинических проявлений сыпного тифа и продолжается в среднем 8— 10 дней. Лихорадка с 4—5-го дня устанавливается на высоком уровне (39–40 °C) и принимает постоянный характер. Степень повышения температуры и продолжительность лихорадки являются одними из критериев тяжести заболевания. С 4—6-го дня болезни присоединяются явления острого менингоэнцефалита. Рано выявляются нервно-психические расстройства — девиация языка, дизартрия, симптом Говорова-Годелье (толчкообразные движения языка при его высовывании). Больные эйфоричны, беспокойны, иногда раздражительны и грубы. Нередко при тяжелом течении сыпного тифа с 7—8-го дня заболевания развивается тифозный статус: больные дезориентированы во времени и пространстве, возбуждены, речь смазанная и бессвязная. Отмечаются яркие зрительные (реже слуховые) галлюцинации (см.) устрашающего характера, больные могут совершать агрессивные действия и попытки самоубийства. Продолжительность делириозного (см. Делирий) синдрома в зависимости от тяжести течения колеблется от 2–3 до 7–8 дней. Наряду с психическими расстройствами нередко отмечаются менингеальные симптомы: оцепенелость затылочных мышц, симптом Кернига. При исследовании спинномозговой жидкости выявляются признаки серозного менингита (см.). В период разгара заболевания, на 4—5-й день появляется розеолезная или розеолезно-петехиальная сыпь — обильная и многообразная. Розеолы при надавливании исчезают. Обычно сыпь располагается на коже груди, боковых поверхностях туловища и спины, затем распространяется на сгибательные поверхности конечностей. В тяжелых случаях сыпь рано принимает геморрагический характер, возникают новые элементы (подсыпание), которые крайне редко распространяются на лицо, ладонные и подошвенные поверхности. В легких случаях заболевания петехиальные элементы могут отсутствовать, но они выявляются при наложении жгута. Элементы сыпи сохраняются в течение 7–9 дней. Затем розеолы исчезают бесследно, а на месте петехий остается легкая пигментация. У больных сыпным тифом выявляется увеличение селезенки, а со второй недели — и увеличение печени. Язык сухой, покрыт темнокоричневым налетом. Нередко поражается мочевыделительная система: наблюдаются боли в поясничной области, появляются отеки и анурия. В тяжелых случаях болезни нарушение иннервации мышц и сфинктеров мочевого пузыря вызывает парадоксальную ишурию (расстройство мочеиспускания). В конце периода разгара сыпного тифа лихорадка часто принимает ремиттирующий характер и с 12—14-го дня болезни критически или кризолитически снижается до нормального уровня. Общая продолжительность лихорадочного периода составляет в среднем 12–16 дней. Период выздоровления характеризуется обратным развитием симптомов интоксикации и признаков поражения нервной системы, угасанием сыпи, нормализацией размеров печени и селезенки. В период выздоровления сохраняются слабость, шум в ушах, артериальная гипотензия (пониженное давление), астенический синдром. Клинические проявления эпидемического сыпного тифа могут заметно варьировать в зависимости от тяжести болезни. Наряду с тяжелыми наблюдаются стертые амбулаторные варианты, протекающие с кратковременной лихорадкой, часто без сыпи. Часто у детей сыпной тиф протекает в более легкой форме. Встречаются молниеносные формы сыпного тифа, приводящие к гибели больных на 2—5-й день заболевания. Течение сыпного тифа может отягощаться рядом осложнений: возможно развитие острой сердечной или сосудистой недостаточности (см.), вследствие сосудистых повреждений у больных образуются пролежни (см.), развиваются гангрена (см.) нижних отделов конечностей, тромбозы, тромбоэмболии и тромбофлебиты (см.). Бактериальная ассоциация обусловливает возникновение пневмоний (см.), гнойного отита (см.), паротита (см.), стоматита (см.), флегмоны (см.) подкожной клетчатки.
Болезнь Брилла Клинические проявления болезни Брилла отличаются от эпидемического сыпного тифа меньшей интенсивностью симптомов и преобладанием среди больных людей старшего возраста. Начальный период сопровождается умеренно выраженной интоксикацией в виде головной боли, нарушением сна, повышением температуры до 3 8— 39 °C. Интоксикация наблюдается редко (в 20 % случаев). Признаки поражения центральной нервной системы, как правило, выражены умеренно. Симптомы поражения продолговатого мозга ограничиваются симптомом Говорова-Годелье. Менингеальные симптомы выявляются редко. Кожная сыпь наблюдается у 60–96 % больных болезнью Брилла. Признаки поражения сердечно-сосудистой системы наблюдаются при болезни Брилла довольно часто, что связано, очевидно, с преобладанием среди больных лиц пожилого возраста. Увеличение печени и селезенки выявляется непостоянно. Осложнения болезни Брилла наблюдаются сравнительно редко, в основном бывают тромбозы и тромбофлебиты (см.) поверхностных вен и пневмонии (см.). Общая продолжительность лихорадочного периода при болезни Брилла составляет в среднем 9—11 дней. Период выздоровления обычно протекает гладко. Ранняя диагностика эпидемического сыпного тифа основывается на комплексе клинических и эпидемиологических данных. Для лабораторной диагностики сыпного тифа используют серологические методы — реакцию связывания комплемента, реакцию непрямой гемагглютинации. РСК (реакция связывания комплемента) пригодна для ретроспективной диагностики болезни (в титре 1:10).
Лечение и профилактика Этиотропное лечение (направленное на устранение причины болезни) осуществляется с помощью антибиотиков тетрациклинового ряда или левомицетина. Тетрациклин назначают перорально в суточной дозе для взрослого 1,2–1,6 г в четыре приема с интервалом в 6 ч на протяжении всего периода лихорадки и двух дней апирексии. Левомицетин назначают взрослым в суточной дозе 2 г. Терапия, направленная на прекращение дальнейшего развития заболевания, предусматривает введение дезинтоксикационных препаратов, диуретиков, сосудистых аналептиков, сердечных гликозидов, анальгетиков. При развитии психозов применяют бромиды, барбитураты, аминазин, седуксен, оксибутират натрия. С целью профилактики тромбозов и тромбоэмболических осложнений показано назначение антикоагулянтов. Обязателен тщательный уход за полостью рта и кожей. Больные сыпным тифом подлежат обязательной госпитализации. В очаге контактные проходят санитарную обработку. Одежда и постельные принадлежности больных подлежат камерной дезинфекции. В очаге проводится дезинфекция и дезинсекция. За контактными наблюдают в течение 71 дня, при болезни Брилла — 25 дней.
ТОКСОКАРОЗ
ОпределениеТоксокароз — гельминтоз из группы нематодозов, характеризующийся расстройствами пищеварения и аллергическими проявлениями, лихорадкой, бронхитом (см.), пневмонией (см.), увеличением печени, селезенки. У человека различают личиночный (висцеральный) и имагинальный (кишечный) токсокароз. У животных токсокароз распространен повсеместно, у человека встречается редко. В России описаны единичные случаи заболевания.
Этиология и патогенез Возбудители болезни — токсокары собак и кошек, паразитирующие в их тонкой кишке, и других плотоядных животных. У людей в отличие от животных личинки вновь попадают в кишечник очень редко (и только личинки токсокар кошек); там они превращаются в имаго (половозрелая стадия развития) и вызывают имагинальный токсокароз. Личиночный токсокароз описан Бивером в 1952 г. Случаи личиночного токсокароза регистрируются во многих странах мира. Встречается он в любом возрасте, однако чаще у детей 1–4 лет. У человека токсокары собак паразитируют только в личиночной стадии, а токсокары кошек — в личиночной и (изредка) половозрелой стадиях. Длина самца составляет 40–60 мм, самки — 55—120 мм. Яйца округлые, с гладкой толстой оболочкой, 75–85 мкм в диаметре. Внутри только что выделившегося с фекалиями яйца находится зародышевая клетка. Яйца, выделенные с фекалиями облигатных хозяев, созревают в окружающей среде при температуре 30 °C и достаточной влажности через 3 дня.

Оплодотворенное яйцо токсокары: 1 — зародышевая клетка; 2 — оболочка яйца
Яйца токсокар обоих видов округлой формы, неотличимы друг от друга, весьма устойчивы к воздействию окружающей среды и могут сохраняться жизнеспособными в почве несколько лет. У животных из проглоченных яиц в кишечнике выходят личинки, которые внедряются в стенку тонкой кишки и по кровеносной системе попадают в легкие. Часть из них затем выходит в просвет трахеи и бронхов, с мокротой заглатывается вновь; в кишечнике они достигают половой зрелости. На 25—28-й день с начала заражения самки токсокар откладывают яйца, которые с испражнениями животных попадают в окружающую среду. Часть личинок, проникших в капилляры легких, с током крови заносится в различные органы и ткани и инкапсулируется в них. Заражение человека происходит при употреблении пищи и воды, зараженных фекалиями животных, содержащими яйца гельминта, а также при контактах с зараженными животными. Из проглоченных человеком зрелых яиц выходят личинки, которые в течение нескольких дней перемещаются внутри кишечной стенки, а затем возвращаются в просвет кишечника, где превращаются в имаго (взрослую половозрелую особь). Личинки из кишечника могут вместе с током крови перемещаться в органы и ткани и там инкапсулироваться. У человека различают токсокароз, вызываемый мигрирующими личинками, и токсокароз, вызываемый половозрелыми гельминтами; обе формы болезни изучены недостаточно. Токсокароз, вызываемый личинками, характеризуется появлением эозинофильных инфильтратов в легких, гранулемами в различных органах и тканях (см. Гранулема), увеличением количества эозинофилов, лейкоцитов.
Клиническая картина и диагностика Клиническая картина зависит от интенсивности инвазии (заражения). При слабой инвазии отмечаются кожный зуд (см.), рецидивирующая крапивница (см.), бронхит (см.) и эозинофилия. При массивной инвазии болезнь протекает тяжело и проявляется рецидивирующей лихорадкой, увеличением печени и селезенки, бронхопневмонией (см.) с приступами кашля (см.) и бронхиальной астмы (см.), высыпаниями на коже, одутловатостью лица, образованием в различных органах специфических гранулем, содержащих личинки токсокар. В образцах ткани печени обнаруживаются эозинофильные гранулемы. Подобные изменения могут быть найдены в поджелудочной железе, почках, кишечной стенке, миокарде и других тканях. Клиническими проявлениями токсокароза, вызываемого половозрелыми формами, могут быть тошнота, рвота (см.), боли в животе, эозинофилия. Иногда половозрелых гельминтов обнаруживали в абсцессах (см.) подкожной клетчатки. Возможен токсокарозный офтальмит с поражением заднего сегмента глаза (хориоретинит), в результате чего может наступить слепота. Длительность болезни — от нескольких месяцев до нескольких лет. Имагинальный токсокароз описан лишь в единичных случаях. Клинически проявляется тошнотой, болями в животе, обильным слюнотечением, снижением аппетита, головокружением. Диагноз подтверждается обнаружением яиц возбудителя в фекалиях больного. Используются серодиагностика — РНГА и иммуноферментная агглютинация. Прогноз обычно благоприятный.
Лечение и профилактика Применяют вермокс по 100 мг 2–3 раза в день. Курс — 15–30 дней. Детям препарат назначают по 5 мг на 1 кг веса в сутки в 1–2 приема. Курс составляет 15–30 дней. Принимать лекарство следует через 1 ч после еды. Эффективность составляет 60 %. Тибендазол: по 25–60 мг на 1 кг массы в 2–3 приема. Курс —7—10 дней. Детям — по 25 мг на кг массы в сутки в 2–3 приема, курс 7—10 дней. Принимать через 1 ч после еды. Эффективность — 70 %. Альбендазол: по 10 мг на кг массы в 2–3 приема. Курс — 10–20 дней. Детям препарат назначают в тех же дозах. Принимать через 1 ч после еды. Эффективность — до 90 %. Профилактика состоит в периодической дегельминтизации собак, запрещении содержания этих животных на территории детских учреждений, соблюдении личной гигиены.
ТОКСИКОИНФЕКЦИИ ПИЩЕВЫЕ
ОпределениеТоксикоинфекции пищевые — заболевания, возникающие после употребления продуктов, обсемененных различными микроорганизмами и содержащих бактериальные токсины; характеризуются внезапным началом, бурным развитием, интоксикацией, гастроэнтеритом (см.) и нарушением водно-солевого обмена. Пищевые токсикоинфекции нередко носят групповой характер (вспышечная заболеваемость).
Этиология и эпидемиология К возбудителям пищевых токсикоинфекций относят многие виды условно-патогенных бактерий, способных продуцировать экзотоксины в период своей жизнедеятельности вне организма человека в различных пищевых продуктах. Наиболее частыми возбудителями пищевых токсикоинфекций, способными продуцировать энтеротоксины, являются клостридиум перфрингенс, вульгарный протей, чудесная палочка, бактерия цереус, клебсиелла, энтеробактерии, цитробактерии, золотистый стафилококк. Следует отметить, что далеко не каждый штамм вышеуказанных бактерий способен к образованию экзотоксинов. Поэтому употребление пищи, содержащей большое число бактерий, еще не ведет к развитию токсикоинфекции. Заболевание возникает лишь при инфицировании пищи токсинопродуцирующими штаммами бактерий. Возбудители пищевых токсикоинфекций широко распространены в природе и встречаются повсюду: в испражнениях людей и животных, в почве, воде, воздухе, на различных предметах. Лица, работающие в пищевой промышленности и страдающие гнойничковыми заболеваниями кожи или ангинами (см.), могут стать источниками пищевых токсикоинфекций. Среди зоонозных источников пищевых токсикоинфекций могут выявляться больные маститом животные — коровы, козы, овцы. Механизм передачи этой группы заболеваний — фекально-оральный. Пищевые токсикоинфекции распространяются через пищу: колбасы, студни, консервы, молочные продукты, которые являются для бактерий питательной средой. Стафилококковая интоксикация чаще всего связана с употреблением в пищу инфицированного молока и молочных продуктов, кондитерских кремов, мясных, рыбных и овощных блюд. Протей и клостридии хорошо развиваются в белковых продуктах (мясо, рыба, колбасы, молоко). Бактерии цереус неприхотливы, бурно развиваются в различных пищевых продуктах: овощных салатах, супах, пудингах, мясных и рыбных блюдах. Характерным для пищевых токсикоинфекций является не только групповой, но и взрывной характер заболеваемости. Они регистрируются на протяжении всего года, но чаще в теплое время, так как в этот период труднее осуществлять хранение приготовленных пищевых продуктов.
Патогенез и патанатомия При пищевых токсикоинфекциях к моменту поступления пищи в желудок в ней, кроме бактерий, содержится значительное количество экзотоксина. Это обусловливает развитие самого короткого в инфекционной патологии инкубационного периода (2–6 ч). Механизм развития и клиническая картина пищевых токсикоинфекций во многом зависят от вида и дозы экзотоксина, а также других токсических веществ бактериального происхождения, содержащихся в продукте питания. Энтеротоксины, связываясь с эпителиальными клетками желудка и кишечника, нарушают синтез биологически активных веществ. Под воздействием токсинов увеличивается скорость образования простагландинов, гистамина, кишечных гормонов. Все это приводит к повышению секреции жидкости и солей в просвет желудка и кишечника и развитию рвоты (см.) и поноса. Цитотоксины повреждают мембраны эпителиальных клеток и нарушают в них белково-синтетические процессы. Это может увеличивать проницаемость кишечной стенки для различного рода токсических веществ бактериального происхождения, а в некоторых слу чаях — и самих бактерий. Все это приводит к развитию интоксикации, нарушению микроциркуляции и местным воспалительным изменениям слизистой оболочки. Кратковременный характер течения пищевых токсикоинфекций связан с непродолжительным пребыванием их возбудителей в организме человека. Действие же токсинов, связывающихся с эпителиальными клетками желудка и кишечника, прекращается после десквамации (слущивания) этих клеток. Несвязанные молекулы токсина выводятся из организма. Лишь при определенных условиях, когда в результате предшествующих заболеваний нарушается система антибактериальной защиты тонкой кишки, возбудители пищевых токсикоинфекций могут более длительно находиться в кишечнике. Патологоанатомическая картина при пищевых токсикоинфекциях изучена мало. В редких случаях смерти находят отек, гиперемию (полнокровие) слизистой оболочки желудка и тонкой кишки, иногда десквамацию эпителия. В остальных органах обнаруживаются дистрофические изменения различной степени выраженности, развившиеся в результате интоксикации и нарушения кровообращения.
Клиническая картина Инкубационный период продолжается от 30 мин до 24 ч (чаще 2–6 ч). Клиническая картина пищевых токсикоинфекций, вызванных различными возбудителями, имеет много общего и представлена сходной симптоматикой. Начало заболевания острое. Появляется тошнота, к которой вскоре присоединяется рвота (см.). Рвота редко бывает однократной, чаще она повторная, иногда неукротимая, изнуряющая. Почти одновременно со рвотой начинается понос. Стул жидкий, водянистый, до 10–15 раз в сутки, обычно не содержит слизи и крови. У значительной части больных заболевание не сопровождается сильными болями в животе и повышением температуры тела. Но иногда токсикоинфекция протекает со схваткообразными болями в животе и кратковременной высокой температурой. В клинической картине пищевой токсикоинфекции, помимо желудочно-кишечной симптоматики, наблюдаются озноб, повышение температуры тела, умеренная головная боль, слабое недомогание. Повышение температуры тела до 39–40 °C происходит в первые часы болезни, а через 12–24 ч она, как правило, снижается до нормы. Объективно у больных находят бледность кожных покровов, иногда синюшность, похолодание конечностей. Язык покрыт белым налетом. Живот при прощупывании мягкий, болезненный в верхней части, реже вокруг пупка. Артериальное давление снижается, сердцебиение учащенное. В некоторых случаях развиваются обмороки, кратковременные коллаптоидные (см. Коллапс) состояния. При многократной рвоте и обильном поносе могут появляться симптомы обезвоживания, деминерализации и ацидоза (сдвиг кислотно-щелочного равновесия в кислую сторону). Возможны судороги в мышцах конечностей, снижение мочевыделения, понижение упругости кожи. При своевременной терапии эти явления быстро проходят. Печень и селезенка не увеличены. Заболевание в большинстве случаев длится 1–3 дня. Проявления пищевых токсикоинфекций мало зависят от возбудителя. Однако в отдельных случаях можно обнаружить некоторое этиологически (причинно) обусловленное своеобразие клинической картины заболевания. Так, диапазон клинических проявлений пищевых токсикоинфекций, вызванных клостридиями, довольно широк. Наряду с легко протекающими заболеваниями, в клинической картине которых преобладают симптомы гастрита (см.) или гастроэнтерита (см.), встречаются и тяжелые формы болезни, сопровождающиеся развитием некротического энтерита (см.) и анаэробного сепсиса (см.). При токсикоинфекциях, вызванных протеем, испражнения имеют резкий зловонный запах. У некоторых больных возникает кратковременное снижение остроты зрения и другие его нарушения. Стафилококковая интоксикация нередко протекает без диареи (см.). В клинической картине преобладают симптомы гастрита (см.) в виде повторной рвоты и схваткообразных болей в верхней части живота. Отмечаются признаки сосудистой дистонии. Температура тела у большинства больных нормальная или слегка повышена. К осложнениям пищевых токсикоинфекций относятся дегидратационный (связанный с потерями жидкости) шок (см.) и острая сердечная недостаточность (см.), связанная с нарушениями электролитного (гипокалиемия) обмена. Другие осложнения во многом зависят от неблагоприятного общего состояния больного. Прогноз обычно благоприятный. Летальность наблюдается редко и обусловлена такими осложнениями, как дегидратационный шок (см.), острая сердечная недостаточность (см.), некротический энтерит (см.), анаэробный сепсис (см.).
Диагностика и дифдиагностика Большое значение в диагностике пищевых токсикоинфекций имеют клинико-эпидемиологические данные: — острое начало с симптомами гастрита (см.) или гастроэнтерита (см.); — отсутствие высокой температуры или ее кратковременный характер; — короткий инкубационный период и непродолжительность самого заболевания; — групповой характер заболеваемости и ее связь с употреблением одного и того же пищевого продукта; — взрывной характер заболеваемости. В лабораторной диагностике пищевых токсикоинфекций большое значение имеет бактериологический метод исследования рвотных масс, промывных вод желудка, испражнений больного, остатков несъеденной пищи и др. Серологические методы диагностики пищевых токсикоинфекций самостоятельного значение не имеют, так как доказательным является лишь нарастание количества антител к аутоштамму выделенного микроорганизма. Дифференциальный диагноз проводится с острыми кишечными инфекциями, обострениями хронических заболеваний органов желудочно-кишечного тракта, другими видами пищевых отравлений (см.), хирургическими болезнями органов брюшной полости, гинекологической патологией, инфарктом миокарда (см.), заболеваниями центральной нервной системы.
Лечение и профилактика При установлении клинико-эпидемиологического диагноза пищевых токсикоинфекций необходимо провести тщательное и многократное промывание желудка до получения чистых промывных вод 2–4 %-ным раствором соды или 0,1 %-ным раствором перманганата калия. При выраженной диарее (см.) назначают активированный уголь. В случае отсутствия стула делают встречную высокую клизму типа сифонной. Ускоряют прекращение диареи препараты кальция (глюконат, лактат, глицерофосфат) — по 5 г на прием. Дальнейшая терапия проводится с учетом степени обезвоживания организма больного. Дают перорально глюкозо-электролитические растворы. В тяжелых случаях внутривенно вводят растворы «Квартасоль», «Ацесоль», «Лактасоль», «Трисоль» и др. Назначение антибиотиков, сульфаниламидных и других химиопрепаратов при неосложненном лечении пищевых токсикоинфекций нецелесообразно. Во время заболевания и в период выздоровления важное значение имеют диета и витаминотерапия. В целях профилактики большое значение имеют усиленные требования к качеству пищевых продуктов, санитарный контроль за работой пищевых предприятий, учреждениями общественного питания и торговли. Необходимо отстранять от работы лиц с гнойничковыми заболеваниями кожи, ангинами (см.). Следует проводить ветеринарный надзор за здоровьем молочного скота.
ТОКСОПЛАЗМОЗ
ОпределениеТоксоплазмоз — это паразитарная болезнь, вызываемая простейшими и характеризующаяся поражением нервной и лимфатической системы, глаз, скелетных мышц и миокарда. Различают приобретенный и врожденный токсоплазмоз.Возбудитель токсоплазмоза был впервые выделен от кролика итальянскими учеными, а в 1908 г. французские исследователи Ш. Николь и Л. Мансо в Тунисе обнаружили его у грызунов. В России первая обстоятельная работа по токсоплазмозу была опубликована В. Л. Якимовым в 1912 г., после обнаружения этого заболевания у собак. Важные исследования по токсоплазмозу людей и животных проведены американскими вирусологами. Американские исследователи наблюдали несколько случаев врожденного и приобретенного токсоплазмоза у людей. Систематическое изучение проблемы токсоплазмоза в нашей стране было начато в 1954 г. в лаборатории З. Засухина, по инициативе академика Е. И. Павловского.
Этиология Возбудитель токсоплазмоза — строго внутриклеточный паразит, относится к тканевым цистообразующим кокцидиям. Форма тела возбудителя зависит от фазы развития. Длина тела — 4–7 мкм, ширина — 2–4 мкм. Токсоплазмы — облигатные внутриклеточные паразиты, размножающиеся в клетках путем деления. Размножающиеся паразиты заполняют пораженные клетки, плотно прилегая друг к другу. Такие скопления паразитов называются псевдоцистами. Они не имеют собственной оболочки. Пораженные клетки разрушаются, освободившиеся токсоплазмы проникают в здоровые клетки, где вновь формируются псевдоцисты. Развитие токсоплазм происходит со сменой хозяев. Окончательные хозяева токсоплазм — кошки и другие представители семейства кошачьих, промежуточные — млекопитающие дикие животные, свиньи, овцы, человек и птицы. В процессе развития токсоплазм установлены следующие фазы: внекишечная тканевая фаза — бесполое размножение токсоплазм в различных тканях промежуточных хозяев; кишечная фаза — бесполое размножение и половое размножение токсоплазм в клетках эпителия слизистой оболочки кишечника окончательных хозяев; фаза спорогонии (деление оплодотворенной клетки), которая начинается в просвете кишечника окончательных хозяев и заканчивается в окружающей среде. После заражения через рот токсоплазмы в эпителиальных клетках пищеварительного тракта размножаются путем множественного деления, или шизогонии (деления ядра с образованием дочерних клеток) с образованием мерозоитов. В дальнейшем одна часть мерозоитов преобразуется в мужские половые клетки (микрогаметы), другая — в женские (макрогаметы). В результате слияния гамет — внеклеточно или в клетках хозяина — формируются ооцисты (оплодотворенные клетки), заключенные в собственную плотную оболочку. Ооцисты, выделенные с фекалиями в окружающую среду, могут сохранять жизнеспособность длительное время. При соответствующих температуре и влажности воздуха и доступе кислорода в каждой ооцисте через несколько дней образуются по две спороцисты с четырьмя спорозоитами. Такие ооцисты приобретают способность к заражению. Истинные цисты могут образовываться и во внутренних органах при хроническом токсоплазмозе. Они либо подвергаются обызвествлению, либо разрушаются с выходом токсоплазм и проникновением их в здоровые клетки, что влечет за собой рецидив заболевания. Токсоплазмы в стадии трофозоитов неустойчивы к действию термических и некоторых химических агентов. Они быстро погибают при нагревании до 55 °C и в течение 5—10 мин от воздействия 50 %-ного спирта, 1 %-ного раствора фенола, 2 %-ного раствора хлорамина.
Эпидемиология Токсоплазмоз встречается на всех материках в странах с различными климато-географическими условиями. Это объясняется тем, что источниками заражения служат многие виды домашних и диких млекопитающих и птиц, среди которых возникают значительные эпизоотии (эпидемии у животных). Известны антропоургические (вблизи человеческого жилья) и природные очаги токсоплазмоза. В антропоургических очагах источниками заражения служат сельскохозяйственные и домашние животные, а также домовые грызуны. Особое значение придается кошкам, в организме которых происходит половой цикл развития возбудителя, выделяемого с фекалиями в окружающую среду в виде ооцист, обладающих высокой устойчивостью. Кошки и другие представители семейства кошачьих являются единственными окончательными хозяевами токсоплазм. При отсутствии окончательного хозяина в естественных природных условиях циркуляция возбудителя долго продолжаться не может. Ооцисты, выделяемые кошками с испражнениями, в течение многих месяцев сохраняются в почве. Заражение происходит при попадании цист в пищеварительный тракт при употреблении сырого мясного фарша или недостаточно обработанного термически мяса овец, свиней, кроликов. Заражение осуществляется и при попадании в пищеварительный тракт ооцист, выделенных кошками (при загрязнении рук почвой, песком) или при прямом контакте с кошками. Человек, как и другие промежуточные хозяева, для окружающих не опасен, однако свежее заражение во время беременности (см.) может привести к внутриутробному заражению плода. Сезонность заболеванию не свойственна, оно регистрируется в любое время года; более восприимчивы лица молодого возраста, а у людей старше 60 лет токсоплазмоз встречается крайне редко.
Патогенез и патанатомия Из места внедрения возбудитель заносится макрофагами в лимфатическую систему, вызывая развитие лимфаденита (см.). При распространении процесса, который сопровождается поступлением возбудителя в кровь (паразитемия), токсоплазмы разносятся по всему организму и фиксируются в различных органах и тканях (в нервной системе, глазах, печени, селезенке, лимфатических узлах, скелетных мышцах, миокарде) с образованием в них внутриклеточных скоплений и формированием цист. Последние могут сохраняться в организме десятки лет или пожизненно. В нервной системе, мышцах образуются очаги омертвения с последующей их кальцификацией и формированием петрификатов (участков обызвествления).

Рентгенография черепа больного токсоплазмозом
Важное значение в механизме развития заболевания имеет аллергическая перестройка организма. Патологоанатомические изменения при приобретенном токсоплазмозе изучены недостаточно. Наиболее постоянно поражается лимфатическая система, прежде всего задние, подчелюстные, подмышечные, паховые и брыжеечные лимфатические узлы. При этом лимфатические узлы увеличены в размерах за счет гиперплазии (усиленного разрастания). Селезенка поражается реже, возможна ее умеренная гиперплазия. Характерно поражение печени — гепатит (см.) с холестазами, мелкие участки омертвения и милиарные (просовидные, размером с просяное зерно) гранулемы. Отмечены воспалительные изменения и в желчных путях. Типично поражение мышц, прежде всего икроножных, бедра, нижней половины спины. Головной мозг при приобретенном токсоплазмозе поражается в меньшей степени, чем при врожденном. При этом обнаруживаются мелкие очаги омертвения. В тяжелых случаях отмечаются морфологические изменения, характерные для энцефалита (см.) или менингоэнцефалита. Поражение глаз характеризуется очагами омертвения, продуктивным воспалением сетчатки и сосудистой оболочки.
Клиническая картина В зависимости от механизма заражения различают врожденный и приобретенный токсоплазмоз. По течению он может быть острым, хроническим и скрытым. Приобретенный токсоплазмоз Приобретенный токсоплазмоз можно разделить на следующие клинические формы: острый, хронический и скрытый. Последняя форма подразделяется на первично скрытую, без каких-либо клинических проявлений, которая редко дает обострения, и на вторично скрытую, при которой нередко отмечаются резидуальные (остаточные) проявления (кальцификаты, рубцы после хориоретинита, снижение зрения и др.). Эта форма чаще дает обострения. Острый токсоплазмоз — редкая форма заболевания, может протекать в распространенной тяжелой форме, характеризующейся острым началом, лихорадкой, выраженной общей интоксикацией, увеличением печени и селезенки, развитием миокардита (см.). Часто появляются полиморфная розеолопапулезная кожная сыпь и тяжелые поражения центральной нервной системы (энцефалит (см.), менингоэнцефалит). Энцефалит всегда выявляется на фоне других признаков генерализованного (распространенного) токсоплазмоза, что помогает распознаванию заболевания. Эта форма токсоплазмоза протекает тяжело, часто со смертельным исходом. У большей части больных острый токсоплазмоз протекает с маловыраженной симптоматикой (слабость, недомогание, мышечные боли, неврастенические реакции). Диагноз устанавливается с трудом. Болезнь заканчивается в большинстве случаев выздоровлением. Хронический токсоплазмоз — длительное вялотекущее заболевание, при котором отмечаются повышенная температура, симптомы хронической интоксикации, на фоне которых появляются множественные органные поражения нервной системы, глаз, миокарда, мышц. Заболевание начинается постепенно. Больные жалуются на общую слабость, снижение аппетита, нарушение сна, раздражительность, головную боль, снижение памяти, сердцебиение и боли в мышцах и суставах, иногда — нарушение зрения. Частый симптом — генерализованный лимфаденит (см.). Отмечается увеличение печени и селезенки. Частым проявлением токсоплазмоза является специфический миозит (см.). Отмечаются боли в мышцах, в толще которых прощупываются болезненные уплотнения. Часто поражается сердечно-сосудистая система, что проявляется снижением артериального давления, нарушениями ритма сердца, учащением сердцебиения, миокардитом (см.). Органы дыхания страдают редко. Изменения нервной системы довольно многообразны. В патологический процесс чаще вовлекается центральная нервная система. Иногда это проявляется в виде умеренно выраженных невротических симптомов (эмоциональная неустойчивость, снижение работоспособности, раздражительность, мнительность), развиваются тяжелые неврозы (см.) по типу истерии (см.), часто бывают диэнцефальные расстройства. Наблюдаются вегетососудистые нарушения. Часто отмечается поражение глаз — хориоретинит, увеит (см.), прогрессирующая близорукость. Нарушаются функции эндокринной системы (нарушения менструального цикла, импотенция (см.), вторичная надпочечниковая недостаточность). Латентный (скрытый) токсоплазмоз характерен тем, что его симптомы не выявляются или выявляются лишь резидуальные явления в виде старых очагов хориоретинита, кальцинатов, склерозированных лимфатических узлов.
Врожденный токсоплазмоз Врожденный токсоплазмоз разделяется на следующие формы: острая, хроническая, скрытая, резидуальная (гидроцефалия (см.), олигофрения (см.),эпилепсия (см.) и т. д.). Встречается относительно редко. Возникает в результате передачи инфекции через плаценту при заражении женщины во время беременности (см.) или незадолго перед ней. Острая форма врожденного токсоплазмоза протекает тяжело, в виде общего распространенного заболевания, которое проявляется выраженной интоксикацией, лихорадкой, увеличением печени (нередко с желтухой (см.)) и селезенки, кожной сыпью; на этом фоне могут развиться тяжелый энцефалит (см.) и поражения глаз. При переходе врожденного токсоплазмоза из острой формы в хроническую выявляются последствия энцефалита в виде гидроцефалии (см.), олигофрении (см.), развития симптоматической эпилепсии (см.), а также различные поражения органа зрения. После затихания активности процесса сохраняются лишь последствия энцефалита. В этих случаях можно говорить о резидуальном врожденном токсоплазмозе.
Диагностика Используются серологические реакции (РСК с токсоплазменным антигеном, РНГА, иммуноферментный анализ), которые становятся положительными через 1–2 недели после инфицирования. Важное значение приобрели реакции выявления иммуноглобулинов класса М, в частности РНИФ. Из аллергических методов применяется внутрикожная проба с токсоплазмином. Иммунологические методы достаточно специфичны, получение положительных диагностических титров достоверно свидетельствует о заражении человека токсоплазмами. Используется паразитологический метод, основанный на обнаружении возбудителя при микроскопировании окрашенных мазков крови и центрифугата церебральной жидкости, пунктата лимфатических узлов, а также срезов тканей органов трупов. Проводят биопробы на лабораторных животных.
Лечение и профилактика Терапия больных токсоплазмозом должна быть комплексной. При остром токсоплазмозе используют хлоридин по 0,025 г 2–3 раза в сутки (детям — по 0,5–1 мг на кг в сутки) в течение 5–7 дней в комбинации с сульфадимезином (по 2–4 г в сутки в течение 7—10 дней). Проводится 3 курса с интервалом 7—10 дней. Рекомендован как наиболее эффективный 3—4-недельный курс пириметамина в сочетании с сульфадимезином (ежедневно по 4 г дробными дозами). Пирамидин взрослым назначают в 1-й день в дозе 75 мг, со 2-го дня и до конца курса — 25 мг в сутки. Применяются и другие препараты, обладающие этиотропным действием, — аминохолин, хингамин, сульфаниламиды, антибиотики тетрациклинового ряда. При хроническом токсоплазмозе возбудитель находится в организме в форме цист, на которые указанные выше препараты практически не действуют. Хороший эффект в этих случаях дает комплексная терапия, включающая 5—7-дневный курс химиотерапии (хингамин, тетрациклин). В обязательном порядке проводится курс специфической иммунотерапии токсоплазмином, который в выбранном разведении вводят внутрикожно в 1-й день по 0,1 мл в 3 точки, на 2-й день — по 0,1 мл в 4 точки, затем ежедневно добавляют по одной инъекции и доводят число инъекций к 8-му дню до 10. Профилактика сводится к проведению мероприятий по борьбе с токсоплазмозом среди домашних животных, соблюдению правил личной гигиены, запрещению употребления и дегустации сырого мясного фарша и недостаточно термически обработанного мяса.
ТОМИНКСОЗ
ОпределениеТоминксоз — гельминтоз из группы нематодозов, характеризующийся поражением дыхательных путей. В Советском Союзе его впервые описал К. И. Скрябин в 1939 г. (всего зарегистрировано несколько случаев заболевания). За рубежом томинксоз у людей неизвестен, хотя у животных был описан во Франции, США и других странах.
Этиология, патогенез и эпидемиология Возбудитель — нитевидные нематоды светло-серого, иногда розового цвета, с более тонким головным концом. Размеры самца — 15–18 на 0,06—0,07 мм, самки — 18–20 на 0,96—0,105 мм. Яйца бочонковидной формы, асимметричные, с пробочками на обоих полюсах, напоминают яйца власоглава. В теле животного и человека личинки совершают миграцию с кровью и лимфой из кишечника в бронхи и трахею. Развитие до половозрелой стадии происходит за 25–29 дней. Срок жизни паразита в органах неокончательного хозяина — около года. Окончательными хозяевами томинксов являются собаки, кошки, дикие пушные звери — лисицы, песцы, куницы, соболи, норки, а также изредка человек; гельминты паразитируют у них в бронхах, трахеях и полости носа. Промежуточный хозяин — дождевой червь, в теле которого личинки томинкса живут более 11 месяцев. Заражение животных происходит в летне-осенний период, при поедании дождевых червей, пораженных личинками томинкса. Заражение человека возможно при загрязнении рук содержимым случайно раздавленных инвазированных (зараженных) дождевых червей во время ловли рыбы, земляных работ, работ на огороде и т. д.
Клиническая картина и диагностика Томинксоз у человека характеризуется длительным течением с явлениями трахеита (см.), бронхита (см.), бронхопневмонии (см.), лающим болезненным коклюшеподобным кашлем (см.) с выделением большого количества пенистой слизисто-гнойной мокроты, содержащей спирали Куршмана и эозинофилы, а иногда и прожилки крови; болезнь часто протекает в виде астматических приступов с эозинофилией крови до 25–30 % и выше и увеличением СОЭ до 45 мм/ч. Диагноз ставится при обнаружении яиц гельминта в мокроте или в фекалиях.
Лечение и профилактика Лечение заключается в интратрахеальном (внутритрахеальном) введении препаратов йода и назначении внутрь дитрацина цитрата или левамизола (декариса). Прогноз для жизни благоприятный, однако затянувшийся томинксоз может привести к истощению больного. В связи с сенсибилизацией (повышением чувствительности) организма выздоровление, даже после гибели паразита, наступает медленно (в течение ряда лет наблюдаются приступы астматического характера). Профилактика состоит в мытье рук после земляных работ и контакта с дождевыми червями.
ТОНЗИЛЛИТ
ОпределениеТонзиллит — воспаление небных миндалин. Различают острый (ангина (см.)) и хронический тонзиллит. Хронический тонзиллит чаще встречается у детей (12–15 %), у взрослых и лиц старше 60 лет хронический тонзиллит встречается редко.
Этиология и патогенез В развитии хронического тонзиллита доминирующее значение имеют гемолитический стрептококк, стафилококк, аденовирусы, грибки. Развитию заболевания способствуют неблагоприятные климатические условия и условия труда (запыленность, загазованность воздуха), охлаждение организма, нерациональное питание, наличие хронических гнойных очагов в полости рта (кариозные зубы) и гнойных синуситов, затрудненное носовое дыхание (гипертрофический ринит (см.), аденоиды (см.)). Решающее значение в возникновении тонзиллита имеет снижение реактивности организма. Формирование хронического воспалительного очага в миндалинах происходит в результате длительного взаимодействия инфекционного агента и организма, при котором важная роль принадлежит состоянию общей и местной реактивности организма. На этом фоне длительный и тесный контакт болезнетворной флоры в лакунах миндалин с их тканью приводит к нарушению структуры и денатурации (утрате природного строения, сворачиванию) собственных тканевых белков, приобретающих антигенный характер (эндоантигены). Небные миндалины становятся резервуаром для бактерий. Находясь в состоянии повышенной чувствительности, они становятся наиболее подготовленными к проявлению аллергической реакции. Болезнетворное воздействие микроорганизмов ведет к угнетению активности окислительно-восстановительных ферментов миндалин, нарушению внутриклеточного обмена и срыву отдельных процессов обмена веществ. Структурные изменения приводят к нарушению местного иммунитета на клеточном уровне. Бактериальная сенсибилизация (повышение чувствительности) в организме проявляется преимущественно аллергическими реакциями замедленного типа, обусловленными образованием аллергического фактора.
Патанатомия Морфологические изменения в нёбных миндалинах при хроническом тонзиллите отмечаются большим разнообразием. Наблюдаются: десквамация (слущивание) или ороговение эпителия, насыщение его лимфоцитами и лейкоцитами, которые мигрируют в лакуны, где образуются плотные пробки. В подэпителиальном слое отмечается разрастание соединительной ткани. В паренхиме (собственной ткани) небной миндалины выявляются очаги размягчения лимфоидной ткани либо массивные разрастания соединительной ткани. Нарушение лимфооттока из миндалин ведет к застойным и воспалительным изменениям в регионарных лимфатических узлах. В патологический процесс вовлекается и нервный аппарат миндалин. Патологические изменения нервных элементов — от начальных стадий дегенерации до значительных деструктивных процессов — приводят к нарушению рецепторной функции миндалин и нервно-рефлекторной связи их с некоторыми внутренними органами, в частности с сердцем. Патоморфологические изменения в нёбных миндалинах соответствуют стадиям развития хронического тонзиллита: изменения в эпителии лакун и ближайших участков паренхимы характеризуют начальную стадию развития процесса — хронический лакунарный и лакунарно-паренхиматозный тонзиллит; образование воспалительных образований в паренхиме свидетельствует о стадии хронического паренхиматозного тонзиллита; усиленное разрастание соединительной ткани характерно для последней стадии развития процесса — хронического паренхиматозного склеротического тонзиллита.
Клиническая картина Различают две клинические формы хронического тонзиллита — компенсированную и декомпенсированную. При первой форме имеются лишь местные признаки хронического воспаления миндалин без выраженной общей реакции организма. Больные жалуются на неприятный запах изо рта, боль или покалывание в горле при глотании. Вторая форма характеризуется не только местными признаками хронического воспаления миндалин, но и проявлениями декомпенсации в виде рецидивов ангин (см.), паратонзиллитов и паратонзиллярных абсцессов (см.), а также различными патологическими реакциями со стороны других органов и систем. Больные жалуются на слабость, головную боль, понижение трудоспособности, отмечается повышенная температура. В зеве — краснота, утолщения краев небных дужек, рубцовые спайки между миндалинами и небными дужками, рубцовые изменения и уплотнения миндалин, гнойные пробки или жидкий гной в лакунах, регионарный лимфаденит (см.). Очаг инфекции в миндалинах имеет существенное значение в развитии многих заболеваний — ревматизма (см.), нефрита (см.), сепсиса (см.), псориаза (см.), коллагеновых заболеваний (см.). Возникновение системной красной волчанки (см.), узелкового периартериита (см.), склеродермии (см.) особенно характерно для больных тонзиллитом детей. Длительная тонзиллогенная интоксикация может способствовать развитию иммунной патологии в организме, формированию геморрагического васкулита (см.). Заболевания, генетически связанные с хроническим тонзиллитом, называют тонзиллокардиальным синдромом.
Лечение и профилактика В зависимости от клинической формы заболевания при хроническом тонзиллите применяют консервативное или хирургическое лечение. Перед началом лечения проводят санацию полости рта. Из средств санирующего воздействия на небные миндалины при хроническом лакунарном тонзиллите чаще всего применяют промывание лакун растворами пенициллина, фурацилина, диоксидина, йодинола и т. д. Промывания проводят через день (на курс 10–15 промываний). При паренхиматозной форме хронического тонзиллита хороший эффект оказывает интра- и паратонзиллярное введение 1 %-ного раствора трипсина в 0,5 %-ном растворе новокаина (введения делают трижды с интервалами 3–4 дня), эффективны инъекции антибиотиков (с учетом чувствительности к ним микрофлоры), для чего чаще используют инъекции пенициллина. Применяют физиотерапевтическое лечение: ультрафиолетовое облучение, лазеротерапию, УВЧ, СВЧ, грязелечение. Для повышения резистентности организма рекомендуют витамины группы В, С, РР, курортно-климатические факторы и ЛФК. Назначают инъекции алоэ, стекловидного тела, внутрь — глюконат кальция, фитин, лактат железа. Курсы консервативного лечения обычно проводят 2 раза в год, лучше весной и осенью. В некоторых случаях целесообразно применять расщепление лакун специальным шпателем, гальванокаустику, диатермокоагуляцию. При отсутствии эффекта от консервативного лечения, а также в тех случаях, когда имеется уже декомпенсированный тонзиллит, проводится полное удаление нёбных миндалин — тонзиллэктомия. При резко увеличенных небных миндалинах, не пораженных воспалительным процессом, но вызывающих нарушение носового дыхания, фонации и глотания, применяют частичное удаление миндалин — тонзиллотомию. Чаще это делают у детей. Большую роль в профилактике осложнений играет диспансеризация часто болеющих ангинами (см.) и своевременное их лечение, чаще хирургическое. Больной должен избегать общих и местных охлаждений. При неблагоприятном течении ставится вопрос о радикальном лечении.
ТРАХЕИТ
ОпределениеТрахеит — это воспаление слизистой оболочки трахеи. Различают острый и хронический трахеит.
Этиология и патогенез Острый трахеит редко бывает изолированным; чаще всего он протекает в сочетании с острым ринитом (см.), фарингитом (см.) и ларингитом (см.). Наиболее частой причиной острого трахеита является вирусная инфекция. Заболеванию способствует вдыхание сухого, переохлажденного или запыленного воздуха, токсических паров и газов. У детей способствующими факторами могут быть экссудативно-катаральный диатез (см.), рахит (см.), дистрофия, а также неблагоприятные гигиенические условия. Изменения в трахее при остром трахеите характеризуются отеком, инфильтрацией и покраснением слизистой оболочки. Хронический трахеит может развиться из острого. Часто он бывает результатом курения и злоупотребления алкоголем, а также следствием застойных явлений в дыхательных путях на почве эмфиземы (см.) легких, болезней сердца и почек; нередко бывает обусловлен хроническим заболеванием носа и придаточных пазух носа.
Клиническая картина и диагностика Острый трахеит Клиническая картина острого трахеита обычно проявляется вслед за развитием острого воспаления вышележащих отделов дыхательных путей. Вначале появляется сухой кашель (см.) по ночам и особенно утром. Кашель начинается приступами при глубоком вдохе. Во время и после приступа ощущается саднящая боль в области глотки и за грудиной. Даже небольшое скопление мокроты в области разделения трахеи на бронхи вызывает очередной приступ сильного судорожного кашля. Голос (при часто сопутствующем ларингите (см.)) может быть хриплым. В легких при простукивании и прослушивании отклонений не находят. Общее состояние больного обычно страдает незначительно, температура чаще слегка повышена, особенно по вечерам: у детей она нередко достигает 39 °C, мокрота в начале заболевания отделяется с трудом и в небольших количествах, имеет слизистый, вязкий характер. Постепенно, начиная с 3—4-го дня заболевания, она становится слизисто-гнойной, более обильной, начинает выделяться легко; боли при кашле становятся менее интенсивными и через 1–2 недели заболевание прекращается. Иногда процесс захватывает крупные бронхи, и тогда клиническая картина приобретает характер трахеобронхита, при котором кашель более мучителен и постоянен, чем при трахеите, а температура тела выше. При прослушивании легких в начальном периоде трахеобронхита определяются сухие хрипы, позднее — незвучные влажные мелко- и среднепузырчатые хрипы, рассеянные по обоим легким. Наиболее частым осложнением трахеита и трахеобронхита является распространение воспалительного процесса на слизистую оболочку нижележащих дыхательных путей с развитием бронхопневмонии (см.). Диагноз острого трахеита не вызывает затруднений. Он основывается на клинической картине. Диагноз уточняется при осмотре трахеи с помощью ларингоскопа. Слизистая оболочка трахеи обычно покрасневшая, покрыта слизью, образующей иногда отдельные комки. При резко выраженном воспалении (например, при гриппе (см.)) на поверхности слизистой оболочки могут быть обнаружены точечные кровоизлияния.
Хронический трахеит При хроническом трахеите наблюдаются гипертрофические или атрофические изменения слизистой оболочки трахеи. Гипертрофический трахеит характеризуется расширением сосудов и набуханием слизистой оболочки, усиленным выделением слизи и гнойной мокроты. В случаях атрофии слизистая оболочка истончается, приобретает гладкий блестящий вид, становится серой, иногда покрывается мелкими корками, вызывающими мучительный кашель (см.). Атрофический хронический трахеит обычно сопутствует атрофии слизистой оболочки вышерасположенных дыхательных путей. Главным симптомом хронического трахеита является приступообразный мучительный кашель, сопровождающийся болями в области груди, более сильный по утрам и ночью. В некоторых случаях при сухом кашле количество вязкой мокроты невелико; в других — мокрота бывает более обильной, имеет серозно-гнойный характер и отделяется легко. Течение болезни в большинстве случаев длительное, с временными улучшениями, сменяющимися ухудшениями. Диагностика хронического трахеита основывается на тех же принципах, что и при остром процессе.
Лечение и профилактика Острый трахеит Лечение прежде всего должно быть направлено на устранение причинных и способствующих возникновению трахеита факторов. Больному назначают горчичники на верхнюю часть груди или спину, при наличии показаний — сульфаниламидные препараты, антибиотики, при мучительном кашле — противокашлевые средства, отхаркивающие. Прогноз неосложненного острого трахеита при своевременном и правильном лечении обычно благоприятный.
Хронический трахеит При хроническом трахеите применяют ингаляции антибиотиков, масляно-щелочные ингаляции, климатическое лечение на Южном берегу Крыма или Черноморском побережье Кавказа. Прогноз при своевременном и правильном лечении чаще благоприятный. Профилактика острого и хронического трахеита направлена на укрепление организма, особенно у лиц, предрасположенных к острым заболеваниям верхних дыхательных путей, и устранение причин, вызывающих трахеит. Большое значение имеют закаливание, соблюдение правил профессиональной и личной гигиены, снижение запыленности и загазованности воздуха на промышленных предприятиях.
ТРАХОМА
ОпределениеТрахома — это хроническое инфекционное заболевание глаз, вызываемое хламидиями и характеризующееся поражением конъюнктивы и роговицы с исходом в рубцевание конъюнктивы, хряща век и полную слепоту.
Этиология и эпидемиология Заболевание известно с древнейших времен, трахома издавна встречалась среди населения Африки и Азии. Появление трахомы в Европе связывают с походом войск Наполеона Бонапарта в Египет в 1798 г. В настоящее время в странах Африки, Юго-Восточной Азии, Южной Америки насчитывают более 400 млн больных трахомой, в том числе 200 млн случаев полной слепоты, вызванной трахомой. В России трахомы нет, встречаются лишь завозные случаи. Возбудитель трахомы был открыт в 1907 г., он обнаруживается в клетках эпителия конъюнктивы и роговицы. По своим свойствам и циклу внутриклеточного развития сходен с другими хламидиями. Трахома — антропонозное заболевание (передающееся только от человека к человеку) с эпидемическим распространением. В распространении трахомы большую роль играют условия жизни населения и уровень его санитарной культуры. Перенос возбудителя инфекции осуществляется прямым и косвенным путем (через руки, одежду, полотенце). Основными источниками инфекции в очагах трахомы являются больные активными формами заболевания. Существенная роль в передаче инфекции принадлежит также носителям возбудителя инфекции, лицам с необычной ее локализацией (например, в слезных путях) и атипичным течением процесса. Не исключена роль мух в механическом переносе возбудителя. Восприимчивость к трахоме всеобщая и высокая. Иммунитет после перенесенного заболевания отсутствует. Широко распространена трахома в странах тропического и субтропического пояса. В России эта инфекция ликвидирована.
Патанатомия В начальном периоде трахомы в конъюнктиве определяется диффузная инфильтрация нейтрофильными лейкоцитами и гистиоцитами. Начиная с 10—12-го дня развивается лимфоцитарная и плазмоклеточная инфильтрация. Кроме диффузной инфильтрации, для трахомы характерно образование фолликулов, которые вначале представляют собой очаговые скопления лимфоцитов. Трахоматозный процесс отмечается рано наступающими дистрофическими изменениями и омертвением тканей конъюнктивы, прежде всего в области фолликулов. Строма фолликулов подвергается склерозу и гиалинозу, но возможно их рассасывание без образования рубца. Вокруг фолликулов развивается волокнистая ткань, формирующая капсулу, в которой могут многие годы оставаться «замурованными» клеточные инфильтраты и возбудитель инфекции. У больных с тяжелым течением заболевания преобладают диффузно-инфильтративные процессы в конъюнктиве и отек, отмечается утолщение конъюнктивы с увеличением размеров фолликулов и их заметным выстоянием — папиллярная форма трахомы. В роговице отмечается диффузное воспаление различной интенсивности с проникновением новообразованных сосудов и инфильтрации в область верхней части лимба и образованием трахоматозного паннуса (помутнения поверхностных слоев роговицы). В тяжелых случаях в строме (собственном веществе) роговицы появляются фолликулы. В слезных органах наблюдается воспаление с лимфоидно-плазматической инфильтрацией и рубцеванием. В тяжелых случаях инфильтрация распространяется в глубокие слои хряща век. В мейбомиевых железах наблюдаются развитие кист (см.), вакуолизация, жировая дистрофия, гиалиноз, амилоидоз (см.) хряща.
Клиническая картина Инкубационный период составляет 7—14 дней. Начало заболевания острое, но у многих больных оно развивается исподволь, течение инфекции хроническое. Поражаются обычно оба глаза. Возможно начало болезни без каких-либо ощущений. Иногда появляется незначительное слизисто-гнойное отделяемое, ощущение инородного тела и чувство жжения в глазах. При остром начале болезни наблюдаются симптомы острого конъюнктивита (см.) (отмечаются краснота кожи век, светобоязнь, обильное слизистогнойное отделяемое, конъюнктива отечна и гиперемирована). Различают четыре стадии в течении трахоматозного процесса: — развитие фолликулярной реакции, лимфоидной подконъюнктивальной инфильтрации, лимбита (воспаления лимба) и паннуса роговицы; — появление рубцов, замещающих фолликулы; — преобладание рубцевания конъюнктивы и роговицы; — завершающееся рубцевание, охватывающее конъюнктиву, роговицу, хрящи век. В зависимости от преобладания тех или иных патологических элементов в активном периоде (I–III стадии) трахомы выделяют четыре формы заболевания: фолликулярную, при которой наблюдаются преимущественно фолликулы; папиллярную, с преобладанием сосочковых разрастаний; смешанную, когда обнаруживают и фолликулы, и сосочковые разрастания; инфильтративную, характеризующуюся преимущественной инфильтрацией конъюнктивы и хряща век. При заражении в раннем детском возрасте клиническая картина трахомы напоминает бленнорею (см.) новорожденных; при повторных обострениях у этих больных развиваются характерные для трахомы рубцовые изменения роговицы. Наиболее тяжелым осложнением трахомы является трахоматозная язва роговицы, возникновению которой способствует вторичная бактериальная инфекция. К осложнениям трахомы относятся также острые и хронические конъюнктивиты (см.), развившиеся вследствие присоединения бактериальной или вирусной инфекции. При трахоме часто наблюдаются заболевания слезных канальцев, вызываемые возбудителем трахомы в сочетании с вторичной инфекцией. Последствия трахомы обусловлены процессом рубцевания, что приводит к появлению сращений между конъюнктивой века и глазного яблока; при этом конъюнктивальные своды укорачиваются или исчезают совсем. Изменения в хряще верхнего века при трахоме приводят к завороту века (см.), неправильному росту ресниц. Как следствие трахомы, развивается опущение верхнего века (птоз), придающее лицу своеобразное сонное выражение. В исходе рубцовых изменений слезной железы уменьшается слезоотделение и наступает высыхание конъюнктивы и роговицы — ксероз. Выраженное рубцевание конъюнктивы в сочетании с трихиазом (неправильным ростом ресниц) и заворотом век (см.) приводит к снижению зрения, а рубцевание и помутнение роговицы — к частичной или полной потере зрения.
Диагностика Диагноз трахомы устанавливают при выявлении не менее 2 из 4 кардинальных признаков заболевания: фолликулы на конъюнктиве верхнего века; фолликулы в области верхнего лимба или их последствия (ямки); типичные рубцы конъюнктивы; паннус, более выраженный в верхней части лимба. В эпидемических очагах трахомы для диагноза достаточно одного из этих симптомов. Подтверждают диагноз цитологическим методом (выявление в клетках эпителия цитоплазматических включений возбудителя — телец Провацека-Хальберштедтера), обнаружением антигенов хламидий иммунофлюоресцентными методами в эпителиальных клетках соскобов с конъюнктивы, выделением хламидий из конъюнктивы методом культивирования в желчном мешке куриных эмбрионов или в культуре тканей, определением специфических антител в сыворотке крови.
Лечение и профилактика Местно применяют 1 %-ные мази или растворы тетрациклина, эритромицина, олететрина, 10 %-ные растворы сульфапиридазина натрия, 5 %-ные мази или 30–50 %-ные растворы этазола 3–6 раз в день. При необходимости спустя 1–2 недели от начала лечения производится экспрессия фолликулов. В случае тяжелой трахомы показаны общее применение тетрациклина, олететрина, этазола, сульфапиридазина, а также витаминотерапия и устранение аллергических проявлений. В комплексной терапии используют интерферон и индукторы интерферона, иммуномодуляторы. В стадии исходов и последствий проводят хирургическое лечение (корригирующее и пластическое). При своевременном и систематическом применении антибиотиков и сульфаниламидов удается добиться излечения и предупредить осложнения. Профилактика состоит в своевременном выявлении больных, их диспансеризации и регулярном лечении, соблюдении правил личной гигиены.
ТРЕЩИНА ЗАДНЕГО ПРОХОДА
ОпределениеТрещина заднего прохода — продольная щелевидная язва слизистой оболочки анального канала, чаще располагающаяся на задней его стенке.
Этиология Разрыв слизистой оболочки анального канала происходит при дефекации у больных, страдающих запорами (см.) и различными формами колита (см.).
Клиническая картина и диагностика Боль ведет к спазму внутреннего сфинктера, нарушая трофику тканей в области трещины, обусловливая повторную травматизацию при актах дефекации и препятствуя заживлению. Трещина часто превращается в хроническую, что может быть связано с инфицированием болезнетворными бактериями или грибками. При длительном существовании возможно озлокачествление процесса. Отмечается постоянная жгучая боль в заднем проходе, усиливающаяся при дефекации и в положении сидя; наблюдается выделение капель алой крови. Диагноз ставят на основании характерных жалоб. Трещину также можно выявить осмотром и прощупыванием при разведении краев заднего прохода. Необходимо дифференцировать трещину заднего прохода с опухолью (см.), венерическими заболеваниями и неполным внутренним свищом прямой кишки.
Лечение Лечение на разных стадиях консервативное: покой, послабляющая диета, свечи с обезболивающими и антиспастическими средствами, легкие слабительные и встречные клизмы, теплые сидячие ванны. Через 1,5–2 месяца нелеченая трещина превращается в хроническую и подлежит хирургическому лечению. При своевременном и настойчивом лечении наступает выздоровление.
ТРИПАНОСОМОЗЫ
ОпределениеТрипаносомозы — тропические инфекции, передающиеся от возбудителей, относящихся к типу простейших.
Этиология Трипаносомы — возбудители африканского трипаносомоза — проходят сложный цикл развития со сменой хозяев. Часть цикла осуществляется в организме позвоночных хозяев (человек, животные), другая часть — в организме насекомых. Трипаносомы проходят две стадии развития — стадию трипомастиготы и стадию эпимастиготы. У возбудителя американского трипаносомоза описаны еще две стадии — стадия промастиготы и стадия амастиготы. Трипомастиготы паразитируют только в организме человека и животных, размножаются внеклеточно повторным делением. Эпимастиготы существуют только в организме насекомого. Поступая с кровью в организм мухи цеце (переносчик африканского трипаносомоза), трипаносомы попадают в слюнные протоки и железы, где превращаются в эпимастиготы. Через 2–5 дней эпимастиготы трансформируются в трипомастиготы, и мухи становятся заразными.

Жизненные циклы трипаносом
Попадая с кровью в организм триатомовых клопов (переносчики американского трипаносомоза), трипаносомы в желудке насекомого превращаются в эпимастиготы и размножаются здесь в течение нескольких дней. Затем они проходят в заднюю и прямую кишку, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. Известны африканский и американский трипаносомозы человека.
Африканский трипаносомоз Африканский трипаносомоз, или сонная болезнь, — трансмиссивная инфекция, передающаяся через кровососущих переносчиков, в данном случае — муху цеце, характеризующаяся периодами неправильной лихорадки, наличием кожной сыпи, местных отеков и лимфаденитов (см.), развитием кахексии (истощения) и летаргии. Существует в двух формах — гамбийской и родезийской (восточноафриканской), отличающихся по эпидемиологии и особенностям клинического течения. Подробное изучение фаз трипаносомоза в организме мухи цеце было проведено в 1909 г. Второй возбудитель сонной болезни в Африке был описан в 1909–1912 гг.
Американский трипаносомоз Американский трипаносомоз — болезнь Чагаса. В 1907 г. Чагас обнаружил в кишечнике клопа трипаносому, в 1909 г. он выделил от больного трипаносому, идентичную найденной у клопа. Эти исследования положили начало изучению новой протозойной (вызываемой простейшими) инфекции. Трипаносома имеет длину 15–20 мкм. В организме человека и млекопитающих животных трипаносомы проникают в клетки внутренних органов и тканей, где превращаются в амастиготы. Со временем амастиготы превращаются в S-образные трипомастиготы, которые поступают в кровь, но в ней не размножаются.
Эпидемиология Африканский трипаносомоз Переносчиками трипаносом служат кровососущие мухи цеце. Развитие личинок и куколок происходит в умеренновлажных и затененных местах почвы. Мухи цеце питаются кровью человека и животных. В организме насекомых трипаносома проходит цикл развития длительностью около 20 дней, завершающийся образованием инвазионных (заразных) метациклических форм трипомастигот. Инвазионные мухи передают трипаносомы человеку в процессе кровососания в течение всей жизни, продолжительность которой составляет несколько месяцев. Одного укуса инфицированной мухой цеце достаточно для развития заболевания, так как она выделяет со слюной за один укус до 40 тыс. трипаносом. Возможна передача инфекции при гемотрансфузиях (переливаниях крови носителей трипаносом здоровым людям). Гамбийская форма африканского трипаносомоза относится к антропонозам (инфекциям, передающимся от человека к человеку); дополнительным носителем и источником инфекции, возможно, служат свиньи. Переносчики возбудителя обитают в так называемых галерейных лесах и зарослях по берегам рек и ручьев. Заболевание распространено в странах Западной и Центральной Африки. Заболеваемость может принимать характер эпидемических вспышек, чаще всего в сухой сезон года. Родезийская (восточноафриканская) форма африканского трипаносомоза — зоонозная природно-очаговая инвазия. Основным резервуаром служат лесная антилопа, другие дикие животные, иногда крупный рогатый скот. Заболевание распространено в саваннах Восточной и Южной Африки. Заражение людей происходит главным образом во время пребывания на территории природных очагов. Обычно родезийская форма трипаносомоза регистрируется в виде единичных случаев, но отмечены и эпидемические вспышки. Чаще болеют мужчины. В последние годы описаны вспышки трипаносомоза, вызванного паразитом животных, среди населения Эфиопии. Возможен завоз африканского трипаносомоза в Россию.
Американский трипаносомоз Основными переносчиками возбудителей американского трипаносомоза являются клопы. Заражение клопов происходит при питании кровью человека или животных, содержащей трипомастиготы. Через 10–30 дней в прямой кишке клопа появляются инвазионные (заразные) трипомастиготы, выделяемые с экскрементами наружу. Будучи однократно инвазированными, клопы сохраняют трипаносом в течение всей своей жизни (около 2 лет). Трипаносомы проникают в организм человека или животных во время укуса с фекалиями клопов. Возможны также алиментарный путь заражения (с пищевыми продуктами) и передача инфекции при гемотрансфузиях. Инфекция может распространяться и вертикально (через плаценту). Известны синантропные (расположенные вблизи человеческого жилья) и природные очаги болезни Чагаса. В очагах первого типа клопы обитают в глинобитных домах, хлевах, птичниках, норах домовых грызунов. В этих очагах, кроме человека, носителями возбудителя являются собаки, кошки, свиньи и другие домашние животные. В природных очагах резервуарами возбудителя служат броненосцы, муравьеды, лисы, обезьяны и др. Заражение людей происходит в теплое время года при посещении этих очагов, когда максимально активны переносчики. Чаще заражаются мужчины. Болезнь Чагаса регистрируется в течение всего года во всех возрастных группах, но чаще у детей. Более характерны единичные случаи, но при массовом нападении триатомовых клопов на людей возможны эпидемические вспышки. Болезнь Чагаса широко распространена, она выявляется практически во всех странах Американского континента, особенно значительные очаги расположены в латиноамериканских странах к югу от Мексики. Наиболее часто случаи болезни регистрируются в Бразилии, Аргентине, Венесуэле. В других частях света инфекция не встречается.
Патогенез и патанатомия Африканский трипаносомоз Во входных воротах (место укуса инфицированной мухи цеце) трипаносомы непосредственно размножаются, затем проникают в лимфатические сосуды и узлы, а затем в кровь, где размножаются. Через 20–25 дней они выходят в кровеносное русло и распространяются по всем органам и тканям (головной мозг, сердце, почки, печень, селезенка, костный мозг), где вызывают воспалительные и дегенеративные изменения. Существенное значение в механизме развития трипаносомоза имеют аутоиммунные процессы и связанные с ними реакции. В результате воспалительных и аутоиммунных повреждений в тканях внутренних органов развиваются воспалительные процессы. Поражение головного мозга наблюдается на всех стадиях заболевания. У переболевших вырабатывается иммунитет. У жителей эндемических очагов (регионов, где инфекция регистрируется постоянно) выявлены особенности иммунного ответа на возбудитель: у них трипаносомоз часто протекает в хронической форме, тогда как у приезжих, как правило, в острой.
Американский трипаносомоз Местом паразитирования и размножения трипаносом в организме человека служат макрофаги кожи и подкожной клетчатки, затем лимфатические узлы, а потом инфекция проникает и в другие органы. При внедрении трипаносом развивается местная тканевая реакция в виде разрушения клеток, инфильтрации и отека тканей, увеличиваются лимфатические узлы. Следующим этапом является паразитемия (проникновение возбудителя в кровь) и распространение с кровотоком трипаносом в различные органы, где и происходит их размножение (сердце, скелетная и гладкая мускулатура, нервная система). Затем развиваются аллергические и аутоиммунные процессы с образованием иммунных комплексов. В результате болезнетворного действия трипаносом и продуктов их распада, специфической сенсибилизации и аутоаллергии возникают воспалительные, инфильтративные и дегенеративные изменения клеток внутренних органов, центральной и периферической нервной системы. Чаще всего поражается сердце. В головном мозге развивается острый специфический менингоэнцефалит. Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов.
Клиническая картина Африканский трипаносомоз Инкубационный период при гамбийской форме трипаносомоза равен 2–3 неделям, а при родезийской — 1–2 неделям. В клинической картине различают две стадии: раннюю, или гемолимфатическую, и позднюю, или менингоэнцефалитическую. На месте укуса мухи цеце после инкубационного периода возникает красного цвета узелок размером 1–2 см с белой восковидной зоной вокруг (трипаносомный шанкр). Шанкр сохраняется несколько дней, а затем исчезает, оставляя после себя пигментированный рубец. Вслед за этим возникает лихорадка неправильного типа, продолжающаяся неделями. К характерным признакам заболевания относят кожные высыпания (трипаниды) на коже груди, спины, лица, голеней. Иногда у больных возникают элементы узловатого типа, а также зудящая папулезная сыпь. Часто наблюдаются местные отеки, которые локализуются на лице, веках, шее, держатся непродолжительное время и проходят бесследно. Постоянным и ранним симптомом африканского трипаносомоза является лимфаденит (см.). В последней стадии болезни наиболее заметными становятся лимфатические узлы в области заднего треугольника шеи — предвестник гибели больного. Печень и селезенка обычно увеличены. Постепенно развиваются поражения центральной нервной системы — повышенная утомляемость, бессонница, головные боли, гиперестезия (повышенная чувствительность к раздражителям), нарушения психики. Развивается анемия (см.). Ранняя (гемолимфатическая) стадия продолжается от нескольких недель или месяцев до нескольких лет. Если трипаносомоз на этой стадии не закончился смертельным исходом или выздоровлением, то наступает вторая, поздняя (менингоэнцефалитическая) стадия, или собственно сонная болезнь. Кардинальным симптомом менингоэнцефалитической стадии является нарастающая сонливость днем, сон может быть очень глубоким. По мере развития патологического процесса появляются фибриллярные подергивания мышц лица, языка, дрожание рук и ног. В дальнейшем дрожание сменяется судорогами и параличами (см.) конечностей. Появляется оцепенелость шейных мышц. В терминальном периоде больной лежит, безучастный ко всему окружающему. Параллельно с летаргией развивается кахексия, от которой и наступает смерть больного. Родезийская и гамбийская формы африканского трипаносомоза отличаются некоторыми особенностями клинического течения. Родезийская форма протекает более остро и быстро заканчивается летальным исходом. Заболевание редко длится более года, утрата работоспособности происходит с самого начала болезни, лихорадочные периоды следуют один за другим. Характерны тяжело протекающие сердечно-сосудистые расстройства. Нередко больные не доживают до летаргии. Гамбийская форма имеет относительно более доброкачественное течение, может длиться несколько лет, больные долго сохраняют трудоспособность. Но у европейцев и эта форма трипаносомоза протекает остро.
Американский трипаносомоз Инкубационный период составляет 7—14 дней. В месте внедрения трипаносом образуется первичный аффект — «чагома» (воспалительное темно-красное твердое уплотнение) с лимфангитом и увеличением регионарных лимфатических узлов. На 4—6-й неделе от начала заболевания происходит распространение инфекции. Появляются недомогание, головные и мышечные боли, температура тела повышается до 38–40 °C. Лихорадка имеет постоянный или ремиттирующий характер и держится не менее 2 недель. Нередко на коже появляется мелкая пятнистая сыпь, которая сохраняется 8—20 дней. Лимфатические узлы увеличены, болезненны. Печень и селезенка увеличены. Страдает сердечно-сосудистая система, возникают все признаки сердечной недостаточности (см.), которая и является основной причиной смерти при болезни Чагаса. Неблагоприятным в плане прогноза болезни является развитие менингоэнцефалита, который приводит к гибели больного в ранние сроки. Латентная (скрытая) стадия болезни следует за острой, если последняя закончилась клиническим выздоровлением, но избавления от возбудителя не произошло. Клиническая симптоматика у больных скрытой формой американского трипаносомоза отсутствует. В хронической стадии американского трипаносомоза различают две клинические формы — сердечно-сосудистую и нервную. При сердечно-сосудистой форме развивается хроническое поражение сердечной мышцы с тяжелой недостаточностью кровообращения. При нервной форме развиваются судороги и параличи (см.). Описаны случаи хронического американского трипаносомоза с недостаточностью функции щитовидной железы иразвитием микседемы (распространенного отека).
Диагностика Африканский трипаносомоз Диагноз устанавливается на основе эпидемиологических, анамнестических, клинических и лабораторных данных. Решающим в диагностике является обнаружение трипа носом в пунктатах лимфатических узлов, цереброспинальной (спинномозговой) жидкости, костного мозга, а также в периферической крови в лихорадочный период болезни. Используются иммунологические методы диагностики, из которых наиболее чувствительна реакция связывания комплемента.
Американский трипаносомоз Диагноз устанавливается на основании различных данных и подтверждается выделением трипаносомы из первичного аффекта, крови, спинномозговой жидкости, пунктатов лимфатических узлов, селезенки, костного мозга и других органов. Проводят биологическую пробу на морских свинках. Применяются серологические реакции (в основном в хронической стадии), чаще всего РСК. Используется внутрикожная аллергическая проба, а также некоторые другие реакции. Прогноз при тяжелом течении болезни Чагаса (особенно у детей) серьезный из-за частого развития менингоэнцефалита. У взрослых прогноз для жизни более благоприятный, но для выздоровления сомнительный. Развивающаяся сердечная недостаточность (см.) ограничивает социальную активность больного, резко сокращает продолжительность жизни.
Лечение и профилактика Африканский трипаносомоз В ранней (гемолимфатической) стадии применяются ломидин и сурамин. Курсовая доза ломидина — 40 мг на кг массы тела больного, препарат вводят внутримышечно ежедневно или через день (на курс 8— 10 инъекций). Как правило, требуется повторный курс терапии ломидином. Препарат эффективен лишь при гамбийской форме африканского трипаносомоза. Сурамин вводят внутривенно в суточной дозе 20 мг на кг массы тела взрослым и 10–15 мг на кг детям, курс лечения составляет 5 инъекций с интервалом 3–7 дней. При необходимости курс лечения сурамином повторяют через месяц после первого курса. В поздней (менингоэнцефалитической) стадии лечение проводится мышьяксодержащими препаратами. Арсобал вводят внутривенно по 1,8–3,6 мг на кг массы больного в течение 3 дней. Курс лечения при необходимости повторяют через неделю. Препарат токсичен. Используется препарат тримеларсен — двумя курсами подкожно или внутримышечно, ежедневно, в возрастающих дозах (1–2—3—4 мг на кг массы). Затем после 7-дневного перерыва назначают второй курс: в течение 4 дней больному вводят по 4 мг препарата на кг массы тела. Профилактика заключается в своевременной диагностике, изоляции и лечении больных, а также в предупреждении укусов человека мухой цеце и в уничтожении мух. В зоне распространения гамбийской формы трипаносомоза проводится успешная химиопрофилактика ломидином (внутримышечно 1 раз в 6 месяцев по 3–4 мг на кг массы тела). Химиопрофилактика родезийской формы не разработана.
Американский трипаносомоз Специфическая терапия при болезни Чагаса разработана недостаточно. В настоящее время наиболее эффективными считаются производные нитрофурана. Применяется лампит (нифуртимокс) в суточной дозе 8— 10 мг на кг массы тела в три приема, продолжительность курса — 3–4 месяца. Разработан и испытывается с обнадеживающими результатами 2-нитроимидазол (радонил). Профилактика сводится к уничтожению клопов — переносчиков болезни Чагаса и улучшению санитарно-бытовых условий. В очаговых районах проводится обязательное обследование доноров с помощью реакции Машадо с целью предотвращения передачи трипаносом при переливаниях крови.
ТРИХИНЕЛЛЕЗ
ОпределениеТрихинеллез (трихиноз) — кишечный гельминтоз, вызываемый возбудителем Трихинелла спиралис (мелкая нематода).
Этиология Возбудитель — трихинелла (мелкая нематода). Длина тела половозрелой самки — 1,5–0,8 мм, самца — не более 2 мм. Самка отрождает личинки длиной 0,09—0,1 мм, которые в мышцах хозяина увеличиваются в размерах, позднее закручивается в спираль и к 3—4-й неделе покрывается капсулой.
Эпидемиология, патогенез и патанатомия Трихинеллез — глистное заражение, происходящее через рот. В природных очагах источники заражения — дикие животные (волки, лисицы, енотовидные собаки, барсуки, кабаны, медведи), которые заражаются в результате хищничества и поедания трупов зараженных животных. Человек заражается при употреблении в пищу недостаточно термически обработанного мяса зараженных животных. Восприимчивость человека к трихинеллезу высокая. После перенесенного заболевания остается непродолжительный иммунитет. В личиночной стадии паразит попадает в организм человека с мясом свиней или диких животных (кабан, медведь, барсук и др.). После переваривания мяса содержащиеся в мышечной ткани трихинеллы освобождаются от капсул, внедряются в ткань ворсин кишечника, быстро растут и развиваются. Уже через 80–90 ч после заражения самки откладывают многочисленные личинки, которые разносятся по организму. Местом дальнейшего развития юных трихинелл служат поперечно-полосатые мышцы, особенно межреберные, жевательные, мышцы диафрагмы, языка, глотки, глаз. Здесь трихинеллы через 2–3 недели свертываются в спираль, покрываются капсулой, некоторые из них обызвествляются. Длительность кишечной стадии развития трихинелл — около 2 месяцев. Мышечные трихинеллы сохраняют жизнеспособность до 20 лет и более. Продукты распада и обмена трихинелл делают организм повышенно чувствительным (сенсибилизируют), вызывая эозинофилию, капилляропатию, образование в мышцах нестойких эозинофильных скоплений, отеки и другие болезненные явления. Имеет значение механическое воздействие взрослых трихинелл в кишечнике и их личинок в мышцах и других тканях, а также вторичная инфекция.
Клиническая картина и диагностика Начальный период заболевания продолжается от 3 до 45 дней. Характерные ранние симптомы: одутловатость лица, сопровождающаяся конъюнктивитом, лихорадка, боль в мышцах, эозинофилия. Миалгии (мышечные боли) появляются и нарастают параллельно отекам и могут быть очень интенсивными (вплоть до болевой неподвижности суставов). Часты различные высыпания на коже, а также желудочно-кишечные расстройства, отмечаются гипотония, глухость тонов сердца, сердцебиение, головная боль, бессонница. При легких формах наблюдается лишь отек век и эозинофилия. Продолжительность болезни — от 2–3 дней до 8 недель и более. Иногда наблюдается рецидивирующее течение трихинеллеза. При интенсивном заболевании возможны осложнения: миокардит (см.), менингоэнцефалит (см.), тромбозы артерий и вен (см.), пневмония (см.), нефрит (см.) и др. Диагноз основывается на эпидемиологических (употребление непроваренной свинины и другого мяса, групповые заболевания), характерных клинических данных (эозинофилия, отек век, лихорадка, боли в мышцах). Используют некоторые иммунологические тесты. Кожная аллергическая проба выявляет заражение уже со 2-й недели заболевания, она может быть положительной спустя 5— 10 лет после заболевания. Решающим в диагностике может стать исследование мяса, которое употреблялось заболевшими лицами. Подтверждением диагноза может быть обнаружение трихинелл и характерных эозинофильных скоплений в биоптатах мышц (трапециевидная, дельтовидная, икроножная) или в остатках мяса, вызвавшего заболевание. Биопсию проводят с 9—10-го дня болезни.
Лечение и профилактика Больных госпитализируют. Назначают мебендозол (вермокс), реже минтезол, действующие на все стадии заболевания, но в меньшей степени — на инкапсулированные формы (личинки, покрытые капсулой). Поэтому терапию следует начинать как можно раньше, в первые 2–3 недели заражения. Препарат выбора мебендазол назначают взрослым по 300–400 мг в сутки на протяжении 7—10 дней, применяют также симптоматические средства. Прогноз серьезный. Рекомендуется не употреблять в пищу сырую или недостаточно проваренную свинину, а также мясо кабана, медведя, барсука и других диких животных, проводить обязательное исследование мяса на наличие трихинелл.
ТРИХОМОНОЗ
ОпределениеТрихомоноз — воспалительное заболевание мочеполовых органов человека, вызываемое влагалищными трихомонадами.
Этиология Возбудитель открыт в 1836 г. Донне, в 1870 г. И. П. Лазаревич впервые доказал болезнетворную роль трихомонад в воспалении слизистой оболочки мочеполовых органов. Трихомонады относятся к типу простейших, классу жгутиковых, паразитирующих у человека и у некоторых животных (обезьян, коров, лошадей, кошек и др.). Трихомонада подвижна, погибает при температуре свыше 40 °C, высушивании, а также в дезинфицирующих растворах. У человека обнаружено несколько разновидностей трихомонад (влагалищная, ротовая, кишечная), однако заболевание вызывается только влагалищной трихомонадой. Влагалищная трихомонада наиболее крупная.
Эпидемиология, патогенез ипатанатомия Источником инфекции являются больные трихомонозом. Заражение происходит при половом контакте. Возникновению трихомоноза у женщин способствуют гиповитаминоз, снижение сопротивляемости организма в результате общих заболеваний, нейроэндокринные нарушения. Для мужчин характерно трихомонадоносительство. Внеполовое заражение трихомонозом встречается крайне редко. Основным местом паразитирования трихомонад у женщин является влагалище, но они могут внедряться в мочеиспускательный канал, мочевой пузырь, полость матки. У мужчин основным местом поражения является мочеиспускательный канал. Другие отделы мочеполовой системы обычно инфицируются вторично. При хроническом течении заболевания инфекция распространяется на мочевой пузырь, почечные лоханки, часто поражается предстательная железа. В инфицированной слизистой оболочке мочеполовых органов развиваются покраснение, набухание и отек, местами — мелкие кровоизлияния, слущивание эпителия и мелкоочаговые изъязвления. В очагах поражения наблюдается разрастание грануляционной ткани, в дальнейшем происходит образование остроконечных кондилом.
Клиническая картина Принято различать свежее заболевание с острым, подострым и торпидным течением, хроническое (более 2 месяцев) и бессимптомное течение (трихомонадоносительство). Течение заболевания и особенности клинической картины зависят от способности возбудителя к заражению, реактивности организма, сопутствующей патологии. Инкубационный период продолжается от 5 до 15 дней. Трихомоноз у женщин Характерно многоочаговое поражение мочеполовых органов. Чаще всего поражается влагалище, также могут поражаться мочеиспускательный канал, парауретральные протоки, железы преддверия влагалища, мочевой пузырь. В клинической картине преобладают признаки вульвовагинита (см.) и кольпита — зуд, жжение во влагалище, в области наружных половых органов и промежности, появление из влагалища пенистых гноевидных выделений желтого цвета, усиливающих зуд и жжение. При поражении мочеиспускательного канала и мочевого пузыря возможно учащенное болезненное мочеиспускание. Эндометрит (см.) трихомонадного происхождения проявляется маточными кровотечениями. Чаще заболевание принимает хроническое течение с периодами ремиссий и обострений. Для хронического трихомоноза характерна стертая клиническая картина. Упорное течение наблюдается при сочетании с гонореей (см.) и кандидозом (см.). Этому нередко способствует лечение, направленное только против трихомоноза.
Трихомоноз у мужчин Трихомоноз у мужчин протекает в виде уретрита (см.), баланопостита (см.), парауретрита, везикулита, куперита, простатита (см.), эпидидимита (см.), орхита (см.). Уретрит — самая частая клиническая форма трихомоноза у мужчин. Свежий трихомонадный уретрит клинически проявляется так же, как уретрит любого другого происхождения. Острому течению процесса способствуют половые излишества, повреждения кожи и слизистой оболочки мочеполовых органов, непривычная физическая нагрузка и другие причины. Острое течение заболевания более типично для смешанной гонорейно-трихомонадной инфекции. При остром трихомонадном уретрите обильные пенистые выделения через 1–2 недели самопроизвольно уменьшаются, и заболевание становится малосимптомным. В 95 % случаев болезнь принимает хроническое течение с периодическими обострениями. Трихомонадный уретрит часто сопровождается трихомонадным парауретритом, который может стать причиной упорного течения и инфицирования полового партнера. Воспалительные явления при этом наиболее выражены в острой стадии болезни. С острым уретритом часто сочетается острый баланопостит, характеризующийся скоплением пенистого содержимого серо-желтого цвета, в котором обнаруживаются трихомонады. Трихомонадный эпидидимит (см.) возникает в результате проникновения простейших из уретры по семявыносящему протоку в придатки яичка. Часто сочетается с орхитом (см.). В отличие от бурного начала острого гонорейного орхоэпидидимита трихомонадный развивается постепенно, в течение нескольких дней. Проявляется резкой болезненностью, инфильтрацией и увеличением придатка яичка и самого яичка с образованием единого воспалительного конгломерата. Поверхность воспаленного придатка бывает неровной, бугристой. Чаще поражается его хвостовая часть. Трихомонадные везикулит, куперит и простатит (см.) возникают на фоне хронического трихомонадного уретрита. Чаще встречается сочетание трихомонадного уретрита с простатитом (см.), который может годами протекать бессимптомно, иногда проявляясь периодическими обострениями уретрита.
Диагностика и дифдиагностика Диагноз должен быть обязательно подтвержден обнаружением трихомонад. Верификация диагноза трихомоноза основывается на обнаружении трихомонад одним из лабораторных методов: — исследованием нативного препарата; — микроскопическим исследованием препарата, окрашенного 1 %-ным раствором метиленового синего или бриллиантового зеленого и по Граму; — культуральным исследованием; с целью успешной диагностики рекомендуется многократный забор материала из разных очагов, а также исследование свежей мочи; следует соблюдать правила техники забора материала и транспортировки. У женщин производят микроскопическое исследование выделений из влагалища, уретры, парауретральных протоков, канала шейки матки и осадка мочи. У мужчин диагноз подтверждается обнаружением возбудителя в выделениях или в соскобах из уретры, воспаленных ходов парауретральных желез и семенных пузырьков, частым исследованием мочи. Дифференциальный диагноз проводят с воспалительными заболеваниями мочеполовой системы другого происхождения, особенно с гонореей (см.), на основании бактериологического и бактериоскопического исследования.
Лечение Лечение следует проводить как при клинических проявлениях заболевания, так и при трихомонадоносительстве обоим половым партнерам одновременно. В период лечения и последующего контроля половая жизнь запрещается. Рекомендуемые схемы лечения неосложненного трихомоноза: орнидазол по 1,5 г внутрь однократно перед сном или тинидазол в дозе 2,0 г внутрь однократно перед сном. Альтернативные схемы: орнидазол по 500 мг внутрь каждые 12 часов в течение 5 дней, или метронидазол по 500 мг внутрь каждые 12 ч в течение 7 дней, или ниморазол по 500 мг внутрь 2 раза в сутки в течение 6 дней (или 2,0 г внутрь однократно), или секнидазол по 2,0 г внутрь однократно перед едой, или нифурател в дозе 200–400 мг (1–2 таблетки 3 раза в день в течение 7 дней). Лечение осложненного трихомоноза: орнидазол по 500 мг внутрь каждые 12 ч 10 дней. Альтернативные схемы: метронидазол по 500 мг внутрь каждые 6 ч в течение 7 дней, или тинидазол по 2,0 г внутрь 1 раз в сутки в течение 3 дней, или ниморазол по 500 мг внутрь 2 раза в сутки в течение 6 дней (или 2.0 г внутрь однократно), или секнидазол по 2.0 г внутрь однократно перед едой, или нифурател в дозе 200–400 мг внутрь 3 раза в день на протяжении 7 дней. Возможно одновременное применение местнодействующих процистоцидных и противовоспалительных препаратов по следующим схемам: метронидазол в дозе 500 мг — вагинально 1 раз в сутки в течение 6 дней или макмироркомплекс: свечи — по 1 свече перед сном во влагалище в течение 8 дней, крем — по 2–3 г с помощью аппликатора 1 раз в сутки в течение 8 дней. В дополнение к основной терапии возможно применение интравагинального антисептика поливинилпирролидона йода по 1 свече 2 раза в сутки в течение 7 дней, при неосложненном процессе — по 1 свече перед сном в течение 14 дней. Во избежание тяжелых побочных реакций следует предупреждать о необходимости избегать приема алкоголя как в ходе терапии метронидазолом и тинидазолом, так и в течение 24 ч после его окончания. Лечение орнидазолом не сопровождается тяжелыми побочными реакциями. При непереносимости перорального применения метронидазола его интравагинальное назначение также противопоказано. Следует с осторожностью применять тинидазол на последних сроках беременности (см.), непосредственно перед родами (см.) и в период кормления.
ТРИХОСТРОНГИЛОИДОЗ
ОпределениеТрихостронгилоидоз — гельминтоз из группы нематодозов, характеризующийся преимущественно нарушением функции желудочно-кишечного тракта.
Этиология Возбудители — мелкие нематоды, среди которых выделяют 12 видов. Виды различают по особенностям строения тела самцов. Тело трихостронгилид нитевидное, длиной 5—10 мм. Ротовое отверстие у некоторых видов окружено тремя губами. Самки имеют хорошо развитую половую бурсу с большими латеральными полостями. Яйца овально-эллипсовидной формы, с одним заостренным полюсом и другим — закругленным.
Эпидемиология, патогенез и патанатомия Трихостронгилиды — геогельминты (паразитические черви, в жизненном цикле которых отсутствуют промежуточные хозяева, а одна из стадий развития протекает в почве). Их облигатными хозяевами являются многие травоядные животные — крупный и мелкий рогатый скот, в пищеварительном тракте которых они паразитируют. У человека трихостронгилиды паразитируют в тонкой кишке, чаще — в двенадцатиперстной, проникая своим передним концом в слизистую оболочку. Самки откладывают сегментированные яйца. Яйца попадают в окружающую среду с фекалиями. При благоприятных условиях в яйцах в течение нескольких суток развиваются рабдитовидные личинки. Проглоченные животными или человеком личинки в кишечнике перетерпевают две линьки, не совершая миграции, и развиваются в зрелого паразита приблизительно через три недели после заражения. Возможно длительное, до 8 лет и более, течение этой инвазии (заражения). Трихостронгилоидозы — зоонозные (инфекционные болезни животных, которыми болеют также люди) пероральные геогельминтозы. Источником заражения являются травоядные животные (овцы, козы, крупный рогатый скот), пораженные трихостронгилоидозом и выделяющие фекалии, в которых содержатся яйца гельминтов. Зараженные люди существенного эпидемиологического значения не имеют. Заражение окончательных хозяев происходит при проглатывании инвазионных личинок с пищей и водой или при заносе их в рот загрязненными руками. Вопросы восприимчивости и иммунитета изучены слабо. В связи с тем, что главными источниками служат домашние животные, очаги трихостронгилоидоза встречаются лишь в сельской местности и пригородных зонах. Часто поражаются дети. Трихостронгилоидозы распространены в странах Африки, Азии, Южной Америки и в Австралии. Почти на всей территории нашей страны регистрируются единичные случаи заболевания. В горных скотоводческих районах Армении и Азербайджана трихостронгилоидоз встречается чаще. Механизм развития болезни изучен мало. Трихостронгилиды, внедряясь в слизистую оболочку толстой кишки, вызывают расстройства пищеварения и аллергические реакции.
Клиническая картина и диагностика Клинические проявления редко бывают значительно выражены. При массивном заражении выявляются симптомы дуоденита (см.) и еюнита (воспаление тощей кишки), боли в верхней половине живота, урчание, наклонность к диарее (см.), тошнота, рвота (см.). Больные жалуются на расстройство аппетита, тошноту, запоры (см.) или понос, боли в животе, общую слабость и раздражительность. Отмечается бледность кожи и слизистых оболочек, иногда похудение. В крови резко выражена эозинофилия, иногда наблюдается гипохромная анемия (см.). Решающее значение для диагностики имеет обнаружение яиц паразита в фекалиях больного или в дуоденальном содержимом (содержимом двенадцатиперстной кишки). Иммунодиагностика не разработана.
Лечение и профилактика I. Вермокс — 100 мг 2 раза в день в течение 3 дней; детям до 7 лет — 25 мг 2 раза в день, 7–9 лет — 50 мг 2 раза в день, 10 лет и старше — 100 мг 2 раза в день в течение 3 дней. Употреблять через 1 ч после еды. Эффективность — 90 %. II. Комбактрин — по 10 мг на кг массы в сутки в 1–2 приема во время еды. Курс — 2–3 дня. Эффективность — 90 %. III. Тиабендазол — по 25–30 мг на кг массы в сутки в 2–3 приема. Через 1 ч после еды. Курс — 3 дня. Эффективность — 60–80 %. С целью профилактики проводятся оздоровление носителей трихостронгилид — крупного и мелкого рогатого скота — путем их дегельминтизации, контроль за соблюдением правил личной гигиены (мытье рук после ухода за животными или после земляных работ), мытье овощей перед употреблением в пищу.
ТРИХОСПОРИЯ
ОпределениеТрихоспория — это грибковое поражение волос, проявляющееся образованием на них твердых мелких узелков белого или черного цвета (белая и черная пьедра).
Этиология и эпидемиология Белая пьедра встречается главным образом в Великобритании, США, Италии, Японии и Франции, в России заболевание регистрируется спорадически (от случая к случаю). Черная пьедра распространена в странах Южной Америки, Африки и Юго-Восточной Азии. Пути передачи и распространения трихоспории не выявлены. Заболевание может встречаться у нескольких членов семьи. Чаще болеют женщины. Инфицирование возможно при пользовании расческой, головным убором больного. Развитию трихоспории способствуют нарушения целостности кутикулы волоса, использование для мытья головы воды из непроточных водоемов, отваров льняного семени, кислого молока, а также смазывание волос растительным маслом.
Клиническая картина Течение трихоспории хроническое, какие-либо ощущения отсутствуют. При белой пьедре на поверхности волос образуются мелкие узелки, напоминающие гниды. При черной пьедре грибок может поражать не только кутикулу, но и вещество волоса, узелки имеют черную окраску. При поражении длинных волос узелки могут сцепляться между собой, образуя так называемый колумбийский колтун. Диагноз устанавливается на основании клинической картины, подтвержденной микроскопическим исследованием волоса, при котором выявляют плотно сцепленные овальные или округлые споры грибка. Возбудитель черной пьедры образует аскоспоры размером от 5 до 80 мкм и колонии зеленовато-черного или черного цвета.
Лечение Трихоспорию дифференцируют с так называемой ложной пьедрой, вызываемой бактериями. При трихоспории волосы моют однократно горячим раствором дихлорида ртути (сулема) в разведении 1:1000 с последующим вычесыванием узелков частым гребнем и споласкиванием горячей водой с мылом. В ряде случаев сбривают пораженные участки волос и моют кожу с мылом. Прогноз благоприятный.
ТРИХОЦЕФАЛЕЗ
ОпределениеТрихоцефалез — гельминтоз, вызываемый возбудителем трихоцефалюс трихиурус (власоглав).
Этиология Возбудитель — власоглав. Тело червя состоит из волосистого головного и толстого хвостового отдела, имеет длину у самок 3,5–5,5 см, у самцов — 3–4,4 см. Хвостовой конец у самцов спиралевидно закручен. Яйца желтовато-коричневого цвета, по форме напоминают бочонок, имеют на полюсах пробки.
Эпидемиология, патогенез и патанатомия Трихоцефалез — глистное заражение, происходящее через рот. Окончательный хозяин и источник заражения — человек, в толстой кишке (преимущественно слепой) которого паразитируют зрелые черви, откладывающие яйца. Последние с экскрементами попадают в почву, где при благоприятных условиях в течение 20–24 дней из них развиваются личинки, способные к заражению. Заражение происходит в результате заглатывания яиц, содержащих способную к заражению личинку, при употреблении загрязненных овощей, фруктов и ягод, воды, а также при заносе яиц в рот грязными руками. Восприимчивость к трихоцефалезу всеобщая. В кишечнике из яиц выходят личинки, которые внедряются в ворсинки слизистой оболочки тонкой кишки. Спустя 3—10 суток личинки выходят в просвет тонкой, затем толстой кишки, где через 1–1,5 месяца превращаются в половозрелого червя. Продолжительность жизни паразита — около 5 лет. Власоглавы травмируют слизистую оболочку кишки, являются гематофагами (т. е. питаются кровью) и способствуют развитию болезнетворной микрофлоры, вызывают рефлекторные реакции в других органах брюшной полости. Продукты их обмена увеличивают чувствительность организма к чужеродным веществам.

Власоглавы (3 самца и 4 самки) в естественную величину
Патогенное влияние власоглава на организм складывается из механического и токсического воздействия, а также способа питания паразита (поглощение крови) и возможности возникновения вторичной инфекции на почве травмы тканей кишечника. Вокруг мест внедрения головного конца паразита в тканях наблюдаются воспалительные изменения. Воспалительная реакция в тканях дает власоглаву внедряться в более глубокие слои кишечника.
Клиническая картина и диагностика Клиническая картина очень разнообразна. Ранняя фаза гельминтоза не описана. Беспокоят слюнотечение, понижение (реже — повышение) аппетита, боль в правой половине и верхней части живота, тошнота, запор или понос. Могут быть воспалительные явления в кишечнике. Нередко отмечаются головная боль, головокружение, беспокойный сон, раздражительность; возможны умеренная гипохромная анемия и небольшой лейкоцитоз. При интенсивном заражении у детей описаны случаи выпадения прямой кишки (вследствие упорного поноса), эпилептиформных припадков, синдрома Меньера. При слабой интенсивности заражение власоглавами протекает бессимптомно. Диагноз устанавливают при обнаружении в кале яиц власоглава. Зрелые гельминты могут быть обнаружены при ректороманоскопии.
Лечение и профилактика Назначают дифезил, мебендазол, медамин, нафтамон, кислород. Дифезил применяют в суточной дозе 5 г (при двукратном приеме натощак) в течение 5 дней; он оказывает легкое послабляющее действие. Мебендазол (вермокс) назначают по 0,1 г во время еды 2 раза в день в течение 3 дней подряд. Кислород вводят через прямую кишку. Предварительно больному ставят очистительную клизму. Через 1 ч при положении больного на левом боку через резиновый наконечник для клизмы медленно вводят кислород. После введения кислорода больной должен лежать на спине 2 ч. Доза кислорода детям — из расчета 100 мл на год жизни. Цикл лечения продолжается 5–7 дней подряд или через день. После окончания оксигенотерапии назначают слабительное в течение 1–2 дней. Медамин назначают в суточной дозе 10 мг/кг в два приема после еды в течение 3 дней. Нафтамон (алкопар) принимают натощак за 3 ч до еды; разовая доза — 5 г. Препарат размешивают в 30–50 мл воды (лучше сахарного сиропа или сладкого чая) и выпивают в один прием. Больной должен лежать 3 ч. Цикл лечения — 5 дней. Нафтамон (в половинной дозе) можно сочетать с кислородотерапией. Профилактика складывается из комплекса мероприятий санитарного и лечебного характера.
ТРОМБОФЛЕБИТ
ОпределениеТромбофлебит — заболевание вен, характеризующееся воспалительными изменениями венозной стенки с последующим образованием тромба в просвете вены.
Этиология и патогенез Возникновению тромбофлебита предшествует воспаление вены — флебит и перифлебит. Флебит может развиться в связи с распространением инфекции из окружающего гнойного очага. В таких случаях воспаление начинается с окружающей вену клетчатки (перифлебит), откуда по лимфатическим путям и мелким сосудам, питающим стенку, а также через тонкую стенку самой вены проникают бактерии, токсины и ферменты. Оседанию микробов в стенках вены способствует ряд условий: застой крови, повреждение или сдавливание вены, изменение химизма крови. Тромбофлебит может присоединиться к любому воспалительному процессу. Часто встречаются послеродовые и послеоперационные тромбофлебиты, а также тромбофлебиты при варикозном расширении вен (см.). В процессе развития флебита на отдельных участках может быть нарушена целостность сосудистой стенки. В таких местах происходит образование и оседание тромбов, увеличение которых приводит к закупорке просвета вены — тромбозу. Помимо изменений в стенках вены, образованию тромбозов способствуют изменения биохимических и биофизических свойств крови — повышение ее свертываемости и вязкости. В некоторых случаях процесс может приостановиться, и тогда тромб постепенно рассасывается. В большинстве случаев тромб прорастает соединительной тканью, иногда обызвествляется (флеболит). Просвет вены после тромбофлебита обычно не восстанавливается, вена запустевает, и отток крови осуществляется лишь окольным путем или путем васкуляризации тромба. В других случаях тромб может вызвать местное гнойное расплавление с образованием одного или нескольких гнойников. При гнойном расплавлении тромба процесс может распространиться по току крови и привести к сепсису (см.).
Клиническая картина и диагностика Различают негнойный и гнойный тромбофлебит, восходящий (при распространении на более крупные вены) и септический (при поступлении продуктов распада тромба в общее кровяное русло), рецидивирующий и мигрирующий. По течению тромбофлебиты бывают острые и хронические. Местные явления при тромбофлебите выражаются в болезненности и уплотнении по ходу вен, последние прощупываются в виде плотных болезненных тяжей. Нередко по ходу вен появляется яркая краснота в виде отдельных пятен. Большинство больных испытывает чувство тяжести при ходьбе и стоянии, особенно во второй половине дня. При поражении крупных и глубоких вен конечностей появляется отечность и изменяется цвет кожи (синюшность, бледность). Свертываемость и вязкость крови повышаются. Различные формы тромбофлебита имеют свои особенности.
Негнойный тромбофлебит Негнойный тромбофлебит чаще развивается при травмах и варикозном расширении вен (см.) нижних конечностей, преимущественно в поверхностных венах. Помимо описанных местных симптомов, наблюдается повышенная температура, но состав крови чаще остается нормальным. Вены прощупываются в виде плотных болезненных тяжей, связанных с несколько покрасневшей кожей. Отмечаются рецидивы, часто наблюдается хроническое течение.
Гнойный тромбофлебит Гнойный тромбофлебит характеризуется общим тяжелым состоянием, ознобами, повышением температуры до 39–40 °C, высоким уровнем лейкоцитов. В вене прощупываются один или несколько гнойников; характерен восходящий тромбоз наружных вен, эмболии и пиелические (гнойные) очаги (сепсис (см.)).
Глубокий тромбофлебит Глубокий тромбофлебит характеризуется лихорадочным состоянием, неопределенными тянущими болями в конечности, затруднениями при вытягивании конечности. При пальпации глубоких вен прощупываются резко болезненные точки или воспалительные уплотнения. Отмечаются выраженный отек конечности ниже точки тромбоза, синюшность или побледнение кожи.
Мигрирующий тромбофлебит Мигрирующий тромбофлебит — негнойное поражение поверхностных вен, когда процесс затихает на одних и возникает на других новых участках, даже отдаленных. На этих участках образуются свежие тромбы; реального перемещения (миграции) тромбов с места первичного поражения в действительности нет. В некоторых случаях (болезнь Бюргера) мигрирующий тромбофлебит сочетается с одновременным поражением артерий. В этих случаях происходит спазм артерий, что сопровождается резкими болями.
Послеродовые тромбофлебиты Послеродовые тромбофлебиты развиваются чаще при наличии параметрита у родильниц. Конечность сильно отекает вследствие того, что отток крови резко нарушен. Такие отеки иногда становятся постоянными. Конечность болезненна, кожа ее имеет белый цвет. Диагноз поверхностного тромбоза несложен, только у больных с избыточным развитием подкожно-жирового слоя его распознавание затруднено. Глубокий тромбофлебит в начале болезни нередко просматривается, диагностируется на основании описанных выше симптомов. Мигрирующий тромбофлебит необходимо дифференцировать с тромбангиитом.
Лечение и профилактика Лечение направлено на ликвидацию воспалительного и приостановление тромботического процесса, восстановление проходимости тромбированных вен, устранение нарушений кровообращения в пораженной конечности, профилактику осложнений. Рекомендуется возвышенное положение конечности. Для уменьшения воспалительных явлений местно применяют холод, внутрь — аспирин, бутадион, бруфен, венорутон. При тромбофлебите поверхностных вен местно применяют повязки с гепариновой, бутадионовой или венорутоновой мазью, электрофорез гепарина и химопсина. При тромбофлебите, связанном с инфекцией, назначают антибиотики и сульфаниламиды. На 1— 12-й день заболевания назначают магнито-терапию, диадинамические токи или электрофорез с химопсином. Медикаментозная терапия включает следующие классы препаратов: — нестероидные противовоспалительные средства (диклофенак, кетотифен); — производные рутина (троксевазин, троксерутин); — дезагреганты (реополиглюкин, трентал); — смеси энзимов (флогэнзим, вобэнзим); — флеботоники растительного происхождения (диосмин, детралекс); — антикоагулянты (гепарин, фенилин, клексан). Оперативное лечение (вскрытие гнойников) применяется при образовании отграниченных гнойников. В редких случаях допустима перевязка вен. Профилактика сводится к лечению варикозного расширения вен (см.). Для предупреждения послеоперационных тромбофлебитов необходимы отказ от ранних операций после недавно перенесенных инфекций, ликвидация инфекционных очагов, раннее начало движений в постели и раннее вставание после операций.
ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
ОпределениеТромбоэмболия легочной артерии — острая окклюзия (закупорка) легочного ствола или ветвей артериальной системы легких тромбом, образовавшимся в венах большого круга кровообращения или в правых полостях сердца.
Этиология Тромбоэмболии легочной артерии предшествует тромбообразование в венах большого круга кровообращения или в правых полостях сердца. Тромбоэмболия легочной артерии часто наблюдается у больных с сердечной недостаточностью (см.) и аритмией (см.) сердца, у больных с инфарктом миокарда (см.) и пороками митрального и трехстворчатого клапанов (пороки сердца (см.)), а также при ревмокардите (см.), сепсисе (см.), лейкозах (см.), злокачественных новообразованиях (см. Рак), травмах, обширных ожогах (см.) и обморожениях (см.), после сильного кровотечения и гемолиза (разрушения эритроцитов) различного происхождения, при выраженной дегидратации (сгущении) крови. Возникновению тромбоэмболии легочной артерии способствуют катетеризация вен, операции на органах брюшной полости и в области малого таза, а также любые продолжительные или технически сложные оперативные вмешательства, особенно у лиц пожилого возраста. Таким образом, предпосылками для тромбоэмболии легочной артерии являются патологические процессы, а также лечебные воздействия, приводящие к замедлению кровотока, возникновению гиперкоагуляции (повышенной свертываемости) и повреждению сосудистой стенки. Источником тромбоэмболии легочной артерии чаще становятся тромбы из системы нижней полой вены (75–95 %), правого предсердия или желудочка (5—25 %) и из системы верхней полой вены (0,5–2 %). Наиболее часто отрыву тромба от места его прикрепления способствуют значительные колебания давления в брюшной и грудной полостях (натуживание, кашель (см.), физическая нагрузка).
Патогенез и патанатомия В патогенезе тромбоэмболии легочных артерий имеют значение два взаимодействующих патологических эффекта: механический и гуморально-рефлекторный. При выключении до 30 % кровотока возникает механический эффект в легочном артериальном русле, что приводит к гипертензии малого круга кровообращения и уменьшению газообмена в легких. При закупорке крупных артерий развивается острая правожелудочковая недостаточность. Основными факторами механизма развития, формирующими клинические проявления тромбоэмболии легочной артерии, являются нарушения лобарной (долевой) гемодинамики в легких, а также гипертензия в малом круге кровообращения, которая может стать причиной развития острого легочного сердца. Внезапная механическая окклюзия сосуда сопровождается местной рефлекторной вазоконстрикцией (сосудосуживанием), распространяющейся иногда на артерии всего малого круга кровообращения. Инфаркт легкого (см.) не развивается, если в зоне тромбоэмболии легочной артерии сохраняется достаточное коллатеральное (обходное) кровоснабжение. Он развивается либо на фоне посткапиллярной гипертензии, в том числе вследствие левожелудочковой недостаточности, либо в зоне склероза, реже — васкулита легочных сосудов, обусловленного предшествующими заболеваниями различного происхождения, т. е. в условиях, благоприятствующих регионарному тромбозу и ограничивающих возможность коллатерального кровоснабжения через систему бронхиальных артерий. При развитых легочных сосудах первый эпизод тромбоэмболии легочных артерий протекает нередко без развития инфаркта легкого. У 60,5 % умерших от тромбоэмболии легочной артерии обнаруживают сочетание массивной тромбоэмболии с эмболией мелких ветвей, причем в 1/3 этих наблюдений тромбоэмболия мелких ветвей предшествовала массивной тромбоэмболии легочной артерии. У умерших от массивной тромбоэмболии легочной артерии выявляют набухание яремных вен, растяжение легочного ствола и расширение правых полостей сердца (острое легочное сердце), особенно правого предсердия. Обнаруживается множественная эмболия субсегментарных или сегментарных ветвей артериального русла легких с выключением более 60 % его просвета либо наличие крупных тромбоэмболов в долевых или в главных ветвях легочного ствола, либо вклинение в легочный ствол большого тромбоэмбола, часть тела которого иногда располагается в полости правого желудочка сердца. Часто тромбоэмбол лежит в просвете легочного ствола в виде клубка, или концы его внедряются в обе главные ветви. В тех случаях, когда смерть от тромбоэмболии легочной артерии наступила через несколько часов, можно отметить отек и полнокровие зоны легких, выключенной из кровоснабжения системы легочной артерии. Если больной переживает период тромбоэмболии легочной артерии, то в зависимости от локализации тромбоэмбола и состояния кровотока в легком может развиться инфаркт, как правило геморрагический. Поскольку в большинстве случаев источником тромбоэмболии легочной артерии являются сосуды системы нижней полой вены, их исследуют в первую очередь. Сосуды системы верхней полой вены также подвергаются исследованию, если при жизни на этих венах производились лечебные или диагностические манипуляции.
Клиническая картина Для тромбоэмболии легочной артерии характерно острое начало, причем нередко первые симптомы возникают в момент натуживания (при дефекации, кашле (см.), подъеме тяжестей). Если не наступает молниеносная смерть, то в зависимости от уровня внедрения эмбола и состояния больного к моменту возникновения тромбоэмболии ее проявления варьируют от единичных неспецифических симптомов до развития тяжелейшего состояния с формированием синдромов острого легочного сердца, сосудистого коллапса (см.), острой дыхательной недостаточности, расстройств сознания и др., каждый из которых может стать доминирующим в клинической картине. Ранним симптомом часто бывает боль в грудной клетке без смещения, иногда имитирующая стенокардию (см.) и усиливающаяся на вдохе. Характерно раннее возникновение одышки по типу тахипноэ с частотой дыхания до 30–60 дыхательных движений в минуту в покое. Возможно психическое и двигательное возбуждение (изредка наблюдается заторможенность), отмечаются резкая изнуряющая слабость, потливость, сухой раздражающий кашель (см.). У 1/3 больных на 2—3-и сутки отмечается кровохарканье, в отдельных случаях — небольшое легочное кровотечение. Возможно повышение температуры тела (от незначительно повышенной до гектической (изнуряющей)) в первые сутки, реже — в течение нескольких суток. Нарастающая дыхательная недостаточность проявляется одышкой и распространенной синюшностью при выраженной артериальной гипоксемии (недостатке кислорода в крови). Развитие синдрома острого легочного сердца характеризуется возникновением синюшности конечностей, набуханием шейных вен, прогрессирующей тахикардией (см.), появлением ритма галопа. Вследствие быстрого развития декомпенсации при состояниях острого легочного сердца преобладающим проявлением тромбоэмболии легочной артерии может стать так называемый абдоминальный синдром: тошнота, рвота (см.), резкая боль в правомверхнем квадрате живота. Эти явления имитируют картину острого живота. К нередким проявлениям тромбоэмболии легочной артерии относятся острая артериальная гипотензия, синдром острой коронарной недостаточности и церебральный синдром в виде различных нервно-психических нарушений (резкое головокружение и внезапная мышечная слабость, помрачение или потеря сознания, иногда эпилептиформные судороги, появление очаговой неврологической симптоматики и признаков отека мозга). При обширной апоплексии легкого в крови повышается уровень непрямого билирубина, что сопровождается бледно-желтушным окрашиванием склер и кожи. Для массивной тромбоэмболии легочной артерии характерно, как правило, острое течение с быстрым нарастанием симптомов тяжелой легочной гипертензии; эмболия легочного ствола или обеих его ветвей с сокращением кровотока на 75 % и более приводит к моментальной смерти. Подострое течение (продолжительностью нередко до нескольких недель) отмечается чаще при эмболии долевых или сегментарных ветвей с пролонгированным (продленным) тромбозом; в этих случаях прогностически неблагоприятны стойкое снижение артериального давления, острые нарушения сердечного ритма, выраженная правожелудочковая недостаточность. Рецидивирующее течение свойственно в основном тромбоэмболии мелких ветвей с повторным возникновением легочных апоплексий (кровоизлияний), инфарктов (см.) и плевритов (см.) и постепенным развитием хронического легочного сердца. Инфаркт легкого (см.) осложняется иногда спонтанным (самопроизвольным) пневмотораксом (см.) или (чаще) экссудативным плевритом (см.). Значительное разрушение легочной ткани приводит к возникновению острого абсцесса (см.). Организация инфаркта заканчивается формированием пневмосклеротических очагов, бронхоэктазов (см.), петрификатов (очагов обызвествления).
Диагностика и дифдиагностика Несмотря на то что тромбоэмболия легочной артерии встречается весьма часто, диагностика ее не всегда проста и требует исключения патологических процессов, которые имитирует развивающаяся тромбоэмболия легочной артерии, — острого инфаркта миокарда (см.), расслаивающей аневризмы (см.) аорты, острого плеврита (см.) и других заболеваний органов грудной полости, сопровождающихся дыхательной недостаточностью, острых заболеваний органов брюшной полости, острого нарушения мозгового кровообращения. Решающее диагностическое значение имеют радионуклидные и рентгенологические методы исследования, полипозиционное перфузионное сканирование легких. Больше всего информации о локализации и распространенности патологического процесса дает ангиопульмонография и сцинтиграфия.
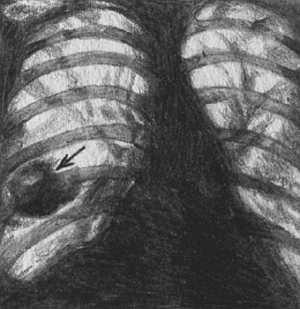
Рентгенограмма при множественной тромбоэмболии
Лечение и профилактика Терапия при тромбоэмболии легочной артерии заключается в комплексном применении трех групп препаратов (тромболитиков, антикоагулянтов и антиагрегантов) с целью лизиса тромба, восстановления проходимости сосуда и нормализации гемостаза. Из тромболитиков применяют фибринолизин, стрептокиназу или урокиназу, а также фибринолитически активную плазму. Из антикоагулянтов во всех случаях применяют гепарин, используются медицинские пиявки. По прошествии острого периода тромбоэмболии легочной артерии гепарин и пиявки отменяют, заменяя их антикоагулянтами непрямого действия. Антиагреганты способны тормозить или подавлять функциональную активность тромбоцитов, уменьшать вязкость крови и предотвращать расстройства микроциркуляции. Наиболее эффективными антиагрегантами считаются препараты низкомолекулярного декстрана (реополиглюкин), ацетилсалициловая кислота, бутадион, антуран, курантил, персантил, теофиллин, а также дигидрированные алкалоиды спорыньи. Симптоматическое лечение включает кислородную терапию и применение средств для устранения синдромов, преобладающих в клинической картине. После устранения острых проявлений тромбоэмболии легочной артерии проводят только симптоматическую терапию в связи с осложнениями тромбоэмболии. Основным показанием к эмболэктомии является массивная тромбоэмболия легочной артерии с тяжелым течением патологического процесса. Применяют прямую и непрямую эмболэктомию. Прямую эмболэктомию в настоящее время выполняют в условиях применения аппарата искусственного кровообращения. Непрямую эмболэктомию проводят с помощью специального зонда-катетера. Прогноз при тромбоэмболии легочной артерии зависит от уровня и обширности эмболизации просвета артериального русла и тяжести заболевания, на фоне которого развивается тромбоэмболия легочной артерии. Профилактика заключается в предупреждении и своевременном лечении флеботромбозов и тромбофлебита, борьбе с венозным застоем и превентивном использовании антиагрегантов (в ряде случаев и антикоагулянтов) у лиц, вынужденных длительно находиться на строгом постельном режиме. При наличии флотирующего (плавающего) тромба любой локализации показана хирургическая профилактика тромбоэмболии легочной артерии (тромбэктомия, парциальная окклюзия магистральной вены или ее перевязка).
ТУБЕРКУЛЕЗ
ОпределениеТуберкулез — инфекционное заболевание, вызываемое микобактериями туберкулеза и характеризующееся образованием специфических гранулем в различных органах и тканях (в легких, лимфатических узлах, почках, костях, суставах и других органах), а также многообразной клинической картиной с выраженной общей реакцией организма.
Этиология Возбудитель туберкулеза был открыт в 1882 г. Робертом Кохом. Различают человеческий вид туберкулезного возбудителя, промежуточный вид и бычий вид. Микобактерии туберкулеза человеческого вида наиболее часто (в 92 % случаев) являются возбудителями туберкулеза у человека, микобактерии туберкулеза бычьего и промежуточного видов вызывают развитие туберкулеза у человека в 3–5 % случаев. В современной микробиологической классификации микобактерии птичьего вида относят к нетуберкулезным микобактериям, которые могут быть возбудителями микобактериоза у человека и животных. Микобактерии туберкулеза — тонкие, прямые или слегка изогнутые палочки длиной 1–4 мкм. Они неподвижны, не образуют эндоспор и капсул, весьма устойчивы к воздействию факторов окружающей среды, характеризуются выраженным многообразием форм существования, большим многообразием и широким диапазоном изменчивости экологических свойств. Наряду с палочковидной формой возбудителя встречаются ветвистые и нитевидные, длинные и коккообразные, фильтрующиеся и L-формы. Все разновидности микобактерий способны вызвать у человека болезнь. Микобактерии туберкулеза считают аэробами. Размножаются они очень медленно. Для нормального развития микобактерий туберкулеза требуются специальные питательные среды, содержащие углерод, азот, кислород, водород, фосфор, магний, калий, натрий, железо, хлор и серу. Под влиянием антибактериальных средств микобактерии туберкулеза могут приобретать лекарственную устойчивость.
Эпидемиология Источниками возбудителей инфекции являются больной туберкулезом человек, а также больные туберкулезом животные. В настоящее время туберкулез встречается у млекопитающих 55 видов и у птиц более чем 80 видов. Однако эпидемиологическую опасность для человека представляют лишь немногие из них. Это в основном крупный рогатый скот, верблюды, козы, овцы, свиньи, куры. Особое значение как источник возбудителей инфекции имеет крупный рогатый скот, больной туберкулезом. Микобактерии туберкулеза могут попадать в организм через верхние дыхательные пути, иногда через слизистые оболочки и поврежденную кожу. Наиболее распространен воздушный путь заражения. Инфицирование микобактериями туберкулеза не всегда вызывает развитие туберкулезного процесса. Туберкулез — болезнь социальная. Ведущая роль в распространении туберкулеза принадлежит неблагоприятным бытовым условиям, низкому материальному уровню населения, нерациональному образу жизни (пьянство, наркомания (см.) и т. д.). К факторам, способствующим развитию туберкулеза, относятся сопутствующие заболевания — сахарный диабет (см.); заболевания, требующие длительного применения кортикостероидов; язвенная болезнь (см.) желудка и двенадцатиперстной кишки (особенно после удаления части желудка); психические болезни, сопровождающиеся депрессивным состоянием. Определенное влияние на заболеваемость туберкулезом сельского населения, особенно животноводов, оказывает уровень пораженности туберкулезом крупного рогатого скота. Больные животные выделяют микобактерии туберкулеза с молоком, мокротой, калом, мочой. Микобактерии туберкулеза могут длительное время сохраняться в молочных продуктах: в масле — до 240 дней, в сыре — до 200 дней. Пастеризация молока при температуре 85 °C в течение 30 мин гарантирует его обеззараживание. Туберкулез является важной медико-социальной проблемой. По данным Всемирной организации здравоохранения, третья часть населения планеты инфицирована туберкулезом. Ежегодно в мире регистрируется 9 млн новых случаев заболеваний туберкулезом и 3 млн случаев смерти от туберкулеза. В настоящее время отмечается рост основных эпидемиологических показателей распространения туберкулеза, особенно в странах Восточной Европы, в том числе и в России. Всемирная организация здравоохранения в апреле 1993 г. объявила туберкулез проблемой всемирной опасности. Рост эпидемиологических показателей обусловлен большим резервуаром инфекции, несвоевременным выявлением заразных больных, появлением остро прогрессирующих форм туберкулеза, увеличением случаев заражения лекарственноустойчивыми микобактериями туберкулеза, недостаточной эффективностью лечения. Эпидемиологическую ситуацию отягощают контингенты исправительно-трудовых учреждений, заболеваемость туберкулезом в которых превышает таковую среди населения России в 62 раза.
Патогенез Механизм развития туберкулеза сложен и зависит от многообразия условий, в которых происходит взаимодействие возбудителей инфекции и организма. В развитии туберкулеза выделяют первичный и вторичный периоды. Первичный период охватывает время от проникновения в организм микобактерий до полного заживления туберкулезного очага. Вторичный туберкулез развивается спустя некоторое время после состояния клинического благополучия. В настоящее время вторичные формы туберкулеза органов дыхания рассматриваются как результат внутренней реактивности старых очагов. Развитие туберкулеза вследствие повторного заражения наблюдается чрезвычайно редко. Первичный и вторичный туберкулез развиваются в условиях различной реактивности организма. Для первичного туберкулеза характерна высокая чувствительность тканей к микобактериям и их токсинам, которая обусловливает возможность развития токсико-аллергических тромбоваскулитов (см.) и склонность к распространению процесса. Во вторичном периоде туберкулезный процесс обычно локализуется в каком-либо органе и при неблагоприятных для организма условиях может прогрессировать. В зоне проникновения микобактерий в организм (органы дыхания, желудочно-кишечный тракт, кожа) или другом, благоприятном для развития туберкулезного воспаления месте может возникнуть воспалительный очаг, или первичный аффект. В ответ на образование первичного аффекта в связи с сенсибилизацией (повышением чувствительности) организма развивается специфический процесс по ходу оттока лимфы из первичного очага, и в регионарных лимфатических узлах формируется первичный комплекс. Он чаще выявляется в легких и внутригрудных лимфатических узлах. С первых дней проникновения в организм микобактерий туберкулеза развиваются функциональные и морфологические изменения органов иммунной системы, направленные на отграничение распространения и разрушение возбудителя болезни. В процессе формирования очагов первичного туберкулеза может наблюдаться распространение возбудителя с крово- и лимфотоком с образованием туберкулезных очагов в различных органах — костях, почках и др. Заживление очагов первичного туберкулеза сопровождается иммунной перестройкой организма, исчезновением явлений аллергии (см.), приобретением иммунитета. Однако в этих условиях возможно рассеивание возбудителя инфекции из очага первичного туберкулеза, особенно из пораженных лимфатических узлов, и формирование очагов отсева. Обычно они локализуются в легких или других органах (почках, половых органах, костной системе), как правило, не вызывают реакции регионарных лимфатических узлов и заживают обычно параллельно с очагами первичной инфекции. При снижении иммунитета эти очаги могут активизироваться и прогрессировать с развитием вторичного туберкулеза. Вторичный туберкулез характеризуется большим разнообразием клинических форм — от очагового до фиброзно-кавернозного туберкулеза. Заживление вторичных форм туберкулеза зависит от характеристики бактериальной популяции, способности макроорганизма обеспечить репарацию, переносимости туберкулостатиков.
Патанатомия Патоморфологические изменения при туберкулезе многообразны и зависят от формы, стадии, локализации и распространенности процесса. Общими для большинства форм туберкулеза являются вызываемые микобактериями специфические изменения в сочетании с неспецифическими реакциями. К специфическим изменениям относится туберкулезное воспаление, которое может проявляться формированием туберкулезного бугорка, или гранулемы. Неспецифическими изменениями являются различные реакции, обусловливающие так называемые маски туберкулеза. В зависимости от реактивности организма и способности возбудителя к заражению в туберкулезном очаге могут преобладать явления экссудации (воспалительного выпота), некроза (омертвения тканей) или пролиферации (разрастания). В участке воспаления вначале развивается обычная реакция, не имеющая признаков, типичных для туберкулеза. В ней в разной степени выражены явления альтерации (повреждения тканей) и экссудации. В следующей фазе воспалительной реакции — пролиферативной — появляются специфические для туберкулеза элементы (эпителиальные и гигантские клетки Пирогова-Лангханса), формируются участки своеобразного гомогенного казеозного (творожистого) некроза. Помимо эпителиальных и гигантских клеток, туберкулезная гранулематозная ткань содержит обычно значительное количество лимфоцитов разной степени зрелости, плазматических клеток, сегментарных лейкоцитов. Вокруг очага воспаления обычно имеется перифокальная (околофокусая) зона неспецифической воспалительной реакции. Другой специфической для туберкулеза формой воспалительной реакции является образование туберкулезного бугорка, или гранулемы, имеющей округлую форму различной величины. В зависимости от реактивности организма гранулемы могут быть экссудативными, состоящими преимущественно из лимфоидных клеток, экссудативно-продуктивными и некротическими; последние встречаются при резком угнетении защитных сил организма. Иногда в центре гранулемы формируется участок казеозного некроза. Гранулемы могут сливаться, образуя очаги, в которых различаются элементы стромы отдельных составляющих их гранулем. При заживлении на месте гранулемы развивается небольшой рубчик неправильной паукообразной формы.
Клиническая картина и дифдиагностика Выделяют следующие формы туберкулеза. А. Основные клинические формы. I. Туберкулезная интоксикация у детей и подростков. II. Туберкулез органов дыхания: — первичный туберкулезный комплекс; — туберкулез внутригрудных лимфатических узлов; — диссеминированный туберкулез легких; — милиарный туберкулез; — очаговый туберкулез; — инфильтративный туберкулез легких; — казеозная пневмония; — туберкулема легких; — кавернозный туберкулез легких; — фиброзно-кавернозный туберкулез легких; — цирротический туберкулез легких; — туберкулезный плеврит; — туберкулез бронхов, трахеи, верхних дыхательных путей и др. (носа, полости рта, глотки); — туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких. III. Туберкулез других органов и систем: — туберкулез мозговых оболочек и центральной нервной системы; — туберкулез кишечника, брюшины и брыжеечных лимфатических узлов; — туберкулез костей и суставов; — туберкулез мочевых и половых органов; — туберкулез кожи и подкожной клетчатки; — туберкулез периферических лимфатических узлов; — туберкулез глаз; — туберкулез прочих органов. Б. Характеристика туберкулезного процесса: — по локализации и протяженности в легких по долям и сегментам, а в других органах — по локализации поражения; — по фазе: а) инфильтрации, распада, обсеменения; б) рассасывания, уплотнения, рубцевания, обызвествления; — по бактериовыделению: а) с выделением микобактерий туберкулеза (БК+); б) без выделения микобактерий туберкулеза (БК-). В. Осложнения: кровохарканье и легочное кровотечение, спонтанный (самопроизвольный) пневмоторакс (см.), легочносердечная недостаточность, ателектаз (спадение участка легкого), амилоидоз (см.), свищи бронхиальные и торакальные. Г. Остаточные изменения после излеченного туберкулеза: — органов дыхания — фиброзные, фиброзно-очаговые, буллезно-дистрофические кальцинаты в легких и лимфатических узлах, плевро- и пневмосклероз (см.), цирроз (см.), состояние после хирургического вмешательства и др.; — других органов — рубцовые изменения различных органов и их последствия, обызвествление, состояние после оперативных вмешательств.
Туберкулезная интоксикация Туберкулезная интоксикация у детей и подростков возникает при заражении туберкуле зом и развитии первичной туберкулезной инфекции без локальных проявлений, выявляемых рентгенологическими или другими методами исследований. Туберкулезная интоксикация выявляется у детей (подростков) с впервые положительными, усиливающимися в процессе наблюдения и гиперергическими (усиленными) реакциями на туберкулин. Она характеризуется активностью туберкулезного процесса, сопровождается ухудшением общего состояния ребенка, выражающимся в периодическом повышении температуры тела до субфебрильных цифр, ухудшением аппетита, появлением нейровегетативных расстройств (повышенной нервной возбудимостью или ее угнетением, головной болью, учащенным сердцебиением); небольшим увеличением периферических лимфатических узлов (микрополиаденопатия) с явлениями периаденита; небольшим увеличением печени, реже — селезенки; остановкой физиологической прибавки или дефицитом массы тела; наклонностью к интеркуррентным (сопутствующим, осложняющим течение болезни) заболеваниям. Изменение картины периферической крови характеризуется нерезко выраженным увеличением СОЭ, повышенным уровнем эозинофилов, снижением количества лимфоцитов). Происходят изменения иммунологического статуса (снижение числа Т-лимфоцитов и их функциональной активности). Специфичность функциональных нарушений должна быть подтверждена тщательным обследованием ребенка для исключения неспецифических заболеваний. При обследовании следует использовать современные методы диагностики, включая прямые и боковые рентгенограммы, томограммы средостения в различных проекциях, бронхоскопию, туберкулинопровокационные пробы (гемотуберкулиновые и др.) до и после подкожного введения туберкулина, а также бактериологическое исследование. В сомнительных случаях рекомендуется применять пробное лечение противотуберкулезными препаратами длительностью до 3 месяцев.
Туберкулез органов дыхания Туберкулез органов дыхания — инфекционное заболевание, характеризующееся образованием в пораженных тканях очагов специфического туберкулезного воспаления и выраженной общей реакцией организма. Первичный туберкулезный комплекс характеризуется развитием воспалительных изменений в легочной ткани, поражением внутригрудных регионарных лимфатических узлов и лимфангитом. Встречается в настоящее время сравнительно редко: в легких определяется первичный эффект (очаги специфического воспаления) и регионарный лимфаденит. Он чаще наблюдается в детском возрасте, значительно реже — у лиц в возрасте 18–25 лет с виражом туберкулиновой реакции. Клинические проявления первичного туберкулезного комплекса зависят от фазы процесса, особенностей течения и реактивности организма. Он может протекать малосимптомно, но чаще имеют место признаки туберкулезной интоксикации, особенно при вовлечении в процесс серозных оболочек (плеврит (см.), полисерозит) и бронхов. Различают неосложненное и осложненное течение первичного комплекса. При осложненном течении могут наблюдаться: обширный инфильтрат (участок уплотнения тканей в результате клеточной реакции) с поражением сегмента или доли легкого, распад с образованием первичной каверны (полости), поражение бронхов, развитие ателектаза, а также переход в хронически текущий первичный туберкулез. Могут быть параспецифические аллергические реакции, повышенная чувствительность к туберкулину. В современных условиях у большинства больных первичный комплекс, особенно под влиянием химиотерапии, протекает малосимптомно, подвергаясь рассасыванию, уплотнению и обызвествлению. Обызвествление первичного очага в легких и лимфатических узлах у взрослых бывает редко. За последние десятилетия все реже наблюдается первичный туберкулезный комплекс с типичной биполярностью (двуполюсностью). Раньше эта форма первичного туберкулеза была наиболее распространена, с широким применением БЦЖ, она стала встречаться реже, уступая по распространенности туберкулезу внутригрудных лимфатических узлов. В своем течении первичный туберкулезный комплекс проходит четыре стадии: начальная (пневматическая); стадия организации, когда начинается рассасывание инфильтративной зоны и появляется биполярность (симптом Редекера); стадия кальцинации; стадия петрифицированного первичного туберкулезного комплекса. Эта клиническая форма может иметь довольно острое начало с интоксикацией, сходное с началом пневмонии (см.). В то же время нередко встречается стертое течение заболевания, когда туберкулез не диагностируется, а при очередном рентгенологическом обследовании в легком и его корне обнаруживают плотные очаги или кальцинаты. У подростков и молодых людей первичный туберкулезный комплекс может быть клинически распознан уже на стадии осложнений. Туберкулез внутригрудных лимфатических узлов развивается в результате первичного заражения туберкулезом детей, подростков и взрослых молодого возраста. Реже возникает вследствие эндогенной (внутренней) реактивности имевшихся туберкулезных изменений во внутригрудных лимфатических узлах. Клинические проявления туберкулеза внутригрудных лимфатических узлов зависят от реактивности организма, распространенности поражения внутригрудных желез. Различают инфильтративный, опухолевидный и так называемый малый вариант туберкулеза внутригрудных лимфатических узлов. Внутригрудные лимфатические узлы принято подразделять на паратрахеальные, трахеобронхиальные, бифуркационные и бронхопульмональные, что определяет топографическое расположение туберкулезного процесса при этой клинической форме. Инфильтративный туберкулез внутригрудных лимфатических узлов характеризуется не только их увеличением, но и развитием инфильтративных изменений в легочной ткани, в прикорневых ее отделах. В клинической картине заболевания преобладают симптомы интоксикации. Малые варианты туберкулеза внутригрудных лимфатических узлов проявляются их незначительным увеличением. Клинически проявляется умеренными симптомами интоксикации. Опухолевидный (туморозный) туберкулез внутригрудных лимфатических узлов представляет собой вариант первичного туберкулеза, при котором преобладает казеозное (творожистое) поражение лимфатических узлов или их групп, проявляется выраженной клинической симптоматикой и склонностью к осложненному течению (поражение бронхов, бронхолегочные поражения, очаги бронхогенной, лимфогенной и гематогенной диссеминации (рассеяния), плеврит (см.)). Контуры лимфатических узлов на рентгенограммах и томограммах четкие. В случаях позднего выявления и неэффективного лечения возможен переход в хронически текущий первичный туберкулез, который характеризуется длительным волнообразным течением и различными изменениями в лимфатических узлах (кальцинация, фиброз, свежее воспаление). В таких случаях типичны клинические проявления гиперсенсибилизации, описанные как «маски» хронического первичного туберкулеза (узловая эритема, фликтены (пузыри), полиартрит (см.) и др.). При всех вариантах туберкулеза внутригрудных лимфатических узлов, чаще при хроническом его течении, возможны осложнения в виде воспалительной реакции плевры, специфического поражения бронхов с развитием сегментарных или долевых ателектазов, диссеминации в легкие и различные органы. Диссеминированный туберкулез легких. Диссеминация — это распространение возбудителя инфекции из первичного очага по кровеносным, лимфатическим и иным путям в пределах одного органа или всего организма. Диссеминированный туберкулез легких характеризуется наличием множественных специфических очагов в легких. Диссеминация при туберкулезе может происходить на всех этапах развития болезни, поэтому в каждом клиническом случае процесс может носить черты как первичного, так и вторичного туберкулеза. Источником могут быть как свежий первичный туберкулез, так и старые очаги в лимфатических узлах, легких и других органах. По механизму развития различают гематогенно-диссеминированный туберкулез и диссеминированный туберкулез, развивающийся вследствие лимфо-бронхогенного распространения микобактерий. Клинически диссеминированный туберкулез легких может быть острым, генерализованным, гематогенно-диссеминированным, подострым и хроническим. Острый гематогенно-диссеминированный туберкулез легких выделен в отдельную клиническую форму — милиарный туберкулез. Распространение инфекции в этом случае происходит с током крови, и очаги образуются по ходу мелких сосудов. Своевременно выявленный милиарный туберкулез дает положительную динамику в ответ на лечение, поскольку проникновение химиопрепаратов из крови происходит достаточно интенсивно. Развитие милиарного туберкулеза при первичном процессе закономерно, поскольку бактериемия типична для раннего периода туберкулезной инфекции, а специфический иммунитет несовершенен или отсутствует. Источником диссеминации являются, как правило, внутригрудные казеозно измененные лимфатические узлы, топографически и функционально связанные с кровеносной и лимфатической системами. У взрослых и пожилых людей источником диссеминации может стать реактивация старого процесса в лимфатических узлах. Тогда заболевание приобретает черты вторичного туберкулеза. Общей для обоих вариантов механизма развития милиарного туберкулеза бывает лимфогенная фаза, поскольку изначально возбудитель двигается от пораженного лимфатического узла по лимфатическим путям, вызывая специфический туберкулезный лимфангит, а затем бактериемию (проникновение возбудителя в кровь). Чем чаще повторяются волны бактериемии, тем больше вероятность развития гематогенно-диссеминированного туберкулеза. Особенно опасна бактериемия при снижении сопротивляемости организма. Милиарный туберкулез характеризуется генерализованным образованием очагов, преимущественно продуктивного характера, в легких, печени, селезенке, кишечнике, мозговых оболочках. Реже милиарный туберкулез встречается как поражение только легких. По клиническому течению выделяют тифоидный вариант, характеризующийся лихорадкой и резко выраженной интоксикацией; легочный, при котором в клинической картине болезни преобладают симптомы дыхательной недостаточности на фоне интоксикации; менингеальный (менингит (см.), менингоэнцефалит) как проявления генерализованного туберкулеза. Милиарный туберкулез старыми врачами назывался скоротечной чахоткой. Судьба такого больного зависит от скорости постановки диагноза и назначения эффективного лечения. Естественное течение заболевания заканчивается фатально в течение нескольких недель или 1–3 месяцев. Первичная диагностика трудна, поскольку мокрота бывает не всегда, она скудна и редко содержит микобактерии. Лабораторные данные неспецифичны и характеризуются умеренной анемией (см.), увеличенной СОЭ, снижением количества лимфоцитов и моноцитозом. Подострый диссеминированный туберкулез развивается постепенно, но также характеризуется выраженными симптомами интоксикации. Клиническая картина близка к таковой при тяжелой двусторонней пневмонии (см.), хотя возможна и менее выраженная симптоматика. Больные жалуются на кашель (см.) с мокротой. При физикальном обследовании выслушиваются различные хрипы. Хронический диссеминированный туберкулез может быть гематогенным и лимфобронхогенным. Для него характерны постепенное нарастание клинической картины и длительное волнообразное течение. При хроническом диссеминированном туберкулезе могут последовательно поражаться различные органы и системы. При хроническом диссеминированном туберкулезе симптомы интоксикации в период улучшения состояния менее выражены, при вспышке процесса имеют место явления интоксикации, а также локальные проявления легочного и внелегочного процесса. Очаговый туберкулез легких может возникнуть в период первичного заражения в результате гематогенного или лимфагенного распространения инфекции, при обострении старых очагов и фиброзных рубцов, редко возникает при экзогенной суперинфекции как проявление вторичного туберкулеза. Он отмечается у 50 % впервые выявленных больных. Очаговый туберкулез характеризуется наличием немногочисленных очагов, преимущественно продуктивного характера, локализующихся в ограниченном участке одного или обоих легких, и малосимптомным клиническим течением. К очаговым формам относятся как недавно возникшие, свежие (мелкоочаговые) процессы с размером очагов менее 10 мм, так и более давние (фиброзно-очаговые) образования с явно выраженными признаками активности процесса. Свежий очаговый туберкулез характеризуется наличием мягких очаговых теней со слегка размытыми краями. При значительно выраженных перифокальных изменениях, развившихся по периферии очага в виде бронхолобулярных слившихся фокусов, следует определять их как инфильтративный туберкулез легких. Фиброзно-очаговый туберкулез проявляется наличием плотных очагов, иногда с включениями извести, фиброзными изменениями в виде тяжей и участков гиперпневматоза (повышенной воздушности). В период обострения могут также выявляться свежие мягкие очаги. При очаговом туберкулезе явления интоксикации и «грудные» симптомы, как правило, встречаются у больных в период обострения, в фазе инфильтрации или распада. Инфильтративный туберкулез легких является самой распространенной формой вторичного туберкулеза, характеризующегося наличием инфильтрата в легких, воспалительных изменений, преимущественно экссудативного характера с казеозным некрозом в центре, и относительно быстрой динамикой процесса (рассасывание или распад). Клинические проявления инфильтративного туберкулеза зависят от распространенности и выраженности инфильтративно-воспалительных изменений в легких. Различают следующие клинико-рентгенологические варианты инфильтративного туберкулеза легких: лобулярный, круглый, облаковидный, перисциссурит (инфильтрат в непосредственной близости от междолевой борозды), лобит. Кроме того, к инфильтративному туберкулезу относится казеозная пневмония (см.), которая характеризуется более выраженными казеозными (творожистыми) изменениями в участке поражения; она выделена в отдельную клиническую форму. Для клинико-рентгенологических вариантов инфильтративного туберкулеза характерно не только наличие инфильтративной тени, часто с распадом, но возможно и бронхогенное обсеменение. Инфильтративный туберкулез легких может протекать бессимптомно и распознается только при рентгенологическом исследовании. Чаще процесс клинически протекает под маской других заболеваний (пневмонии (см.), затянувшегося гриппа (см.), бронхита (см.), катара верхних дыхательных путей и др.), у большинства больных имеет место острое и подострое начало заболевания. Одним из симптомов инфильтративного туберкулеза может быть кровохарканье. У большинства больных заболевание характеризуется повышением температуры до 38 °C, которая может держаться 5—10 дней, а также другими симптомами интоксикации — потливостью, снижением работоспособности. Кашель (см.) незначительный, но с выделением мокроты, особенно при деструктивном процессе. При обширном поражении и особенно при наличии распада выслушиваются хрипы, которые после начала лечения быстро исчезают. У части больных инфильтративный туберкулез протекает бессимптомно или со скудной симптоматикой. Выделяют два основных варианта течения инфильтративного туберкулеза легких: прогрессирующий и инволютивный (с обратным развитием). Прогрессирующий вариант течения, характеризующийся обширными инфильтративными изменениями и быстрым распадом, наблюдается в основном при отсутствии лечения, снижении иммунитета, сопутствующих заболеваниях. Повышенная температура тела, характерная для начала болезни, постепенно снижается, уменьшается выраженность симптомов со стороны органов дыхания или они полностью исчезают. Наступает диссоциация между клиническими проявлениями заболевания и динамикой морфологических изменений в легких, в которых формируются полости распада. Такое улучшение состояния — мнимое выздоровление. В этих случаях после непродолжительного периода клинического благополучия возникает новая вспышка, и течение заболевания принимает волнообразный характер. Инволютивный вариант течения наблюдается в условиях рационального лечения. Для него характерно постепенное исчезновение всех симптомов, улучшение самочувствия, прекращение выделения с мокротой в течение первых 3 месяцев микобактерий туберкулеза. Однако структурные изменения в легких происходят медленно. Исход инфильтративного туберкулеза во многом определяется как своевременностью выявления больных, так и эффективностью химиотерапии. Казеозная пневмония характеризуется наличием в легочной ткани воспалительной реакции по типу острого казеозного распада, поражением одной доли легкого и более, угнетением иммунных реакций. Казеозная пневмония (см.) — вариант старинного диагноза скоротечной чахотки, иначе звучащего как остропрогрессирующая форма туберкулеза. Для казеозной пневмонии характерно крайне тяжелое течение с резко выраженной интоксикацией, высокой температурой, снижением двигательной активности, усиленным потоотделением, кашлем (см.), одышкой, учащенным сердцебиением, иногда кровохарканьем или легочным кровотечением, повышенным количеством лейкоцитов в крови, массивным бактериовыделением. При быстром разжижении казеозных масс происходит формирование гигантской полости или множественных небольших каверн. Казеозная пневмония может быть как самостоятельным проявлением болезни, так и осложнением течения инфильтративного, диссеминированного и фиброзно-кавернозного туберкулеза легких. Диагностика казеозной пневмонии трудна, особенно в первые дни; иногда она возможна только после разжижения казеозных масс и формирования гигантской полости или множественных каверн небольших размеров, что сопровождается выделением гнойной мокроты, содержащей большое количество микобактерий туберкулеза. В настоящее время такое течение процесса встречается крайне редко. Чаще развивается инфильтративно-казеозная пневмония, при которой имеется относительно небольшая протяженность участков казеозного некроза и преимущественно экссудативный тип воспаления, что определяет клиническую картину и течение болезни, напоминающие пневмонию (см.). Туберкулема легкого — относительно благоприятная форма, объединяющая разнообразные по генезу (происхождению) инкапсулированные казеозные фокусы величиной более 1 см в диаметре. Большое значение в формировании туберкулемы легкого придают местной гиперсенсибилизации (повышению чувствительности) легочной ткани. Предрасполагающими факторами могут быть нарушения обменных процессов (ее чаще всего обнаруживают у больных сахарным диабетом (см.)). Более чем у половины больных туберкулема легкого является исходом других клинических форм туберкулеза легких. Чаще всего ей предшествует очаговый туберкулез, реже она образуется на фоне инфильтративного процесса в результате рассасывания и осумкования его казеозного центра, еще реже (в 2–3 % случаев) она возникает при закупорке дренирующего полость бронха у больных кавернозным туберкулезом. Различают мелкие туберкулемы (до 2 см в диаметре), средние (2–4 см) и крупные (более 4 см в диаметре). Туберкулема чаще всего располагается в I, II или VI сегментах, непосредственно под плеврой или в более глубоких отделах легкого; вокруг нее наблюдаются незначительные фиброзные изменения, она может быть одиночной или множественной. По строению различают туберкулемы инфильтративно-пневмонического типа, гомогенные, слоистые, конгломератные и так называемые псевдотуберкулемы, или заполненные каверны (полости). На рентгенограмме туберкулемы выявляются в виде тени округлой формы с четкими контурами. В фокусе могут определяться серповидное просветление за счет распада, иногда перифокальное воспаление и небольшое количество бронхогенных очагов, а также участки обызвествления. Выделяют 3 клинических варианта течения туберкулемы: — прогрессирующее, характеризующееся появлением на каком-либо этапе болезни распада, перифокального воспаления вокруг туберкулемы, бронхогенного обсеменения в окружающей легочной ткани; — стабильное, с отсутствием рентгенологических изменений в процессе наблюдения за больным или редкими обострениями без признаков прогрессирования туберкулемы; — регрессирующее, характеризующееся медленным уменьшением туберкулемы с последующим образованием на ее месте очага или группы очагов, индурационного поля (участка уплотнения) или сочетания этих изменений. Клиническая картина при туберкулеме легкого определяется фазой процесса. Вне обострения клинические признаки отсутствуют. Однако и при обострении симптомы заболевания выражены незначительно. Общее состояние больных не страдает. У ряда больных наблюдается обострение процесса. Клинически отмечаются небольшой кашель (см.) с мокротой, непродолжительное незначительное повышение температуры, изменения в крови (повышение уровня лейкоцитов, увеличенная СОЭ). Кавернозный туберкулез легких возникает при появлении казеозного размягчения очагов и образовании очагов распада. Кавернозный туберкулез легких характеризуется наличием сформированной каверны (полости), вокруг которой может быть зона небольшой перифокальной реакции; отсутствием выраженных фиброзных изменений в окружающей каверну легочной ткани; возможным наличием немногочисленных очаговых изменений как вокруг каверны, так и в противоположном легком. Развивается кавернозный туберкулез у больных инфильтративным, диссеминированным, очаговым туберкулезом при распаде туберкулем, при позднем выявлении заболевания, когда фаза распада завершается формированием каверны, а признаки исходной формы исчезают. Рентгенологически каверна в легком определяется в виде кольцевидной тени с тонкими или более широкими стенками. Кавернозный туберкулез характеризуется наличием у больного эластической, ригидной, реже — фиброзной каверны. Клиническое течение волнообразное, со сменой периодов обострения и затихания процесса. Частота вспышек зависит от особенностей организма, его сопротивляемости и от эффективности и длительности химиотерапии. Вспышка характеризуется симптомами интоксикации — повышением температуры тела, общей слабостью, снижением аппетита, кашлем с выделением небольшого количества мокроты, иногда кровохарканьем. Показателем активности туберкулезного процесса является бактериовыделение. Нередко кавернозный туберкулез сопровождается эндобронхитом, препятствующим заживлению каверны. Эндобронхит может стать причиной феномена раздувания, или растяжения, каверны. Фиброзно-кавернозный туберкулез легких — наиболее неблагоприятная гиперхроническая форма. Фиброзно-кавернозный туберкулез легких характеризуется наличием фиброзных изменений в окружающей каверну легочной ткани. Характерны очаги бронхогенного отсева различной давности как вокруг каверны, так и в противоположном легком; как правило, поражаются дренирующие каверну бронхи. Развиваются и другие морфологические изменения в легких: пневмосклероз (см.), эмфизема (см.), бронхоэктазы (см.). Формируется фиброзно-кавернозный туберкулез из инфильтративного, кавернозного или диссеминированного процесса при прогрессирующем течении болезни. Протяженность изменений в легких может быть различной; процесс бывает односторонним и двусторонним, с наличием одной или множественных каверн. Клинические проявления фиброзно-кавернозного туберкулеза многообразны, они обусловлены не только самим туберкулезом, но и изменениями легочной ткани вокруг каверны, а также развившимися осложнениями. Различают три клинических варианта течения фиброзно-кавернозного туберкулеза легких: ограниченный и относительно стабильный фиброзно-кавернозный туберкулез, когда благодаря химиотерапии наступает определенная стабилизация процесса и обострения могут отсутствовать в течение нескольких лет; прогрессирующий фиброзно-кавернозный туберкулез,характеризующийся сменой обострений и ремиссий, причем периоды между ними могут быть разными — короткими и длинными, в период обострения появляются новые участки воспаления с образованием дочерних каверн, иногда легкое может разрушаться полностью, а у некоторых больных при неэффективном лечении прогрессирующее течение процесса завершается развитием казеозной пневмонии (см.); фиброзно-кавернозный туберкулез с наличием различных осложнений — чаще всего этот вариант также характеризуется прогрессирующим течением. Чаще всего у таких больных развиваются легочно-сердечная недостаточность, амилоидоз (см.), частые повторные кровохарканья и легочные кровотечения, обостряется неспецифическая инфекция (бактериальная и грибковая). Прогноз при этой форме часто неблагоприятный. Прогрессирование неизбежно приводит к осложнениям, от которых больной постепенно или скоропостижно погибает. Цирротический туберкулез легких характеризуется разрастанием грубой соединительной ткани в легких и плевре в результате инволюции (обратного развития) фиброзно-кавернозного, хронического диссеминированного, массивного инфильтративного туберкулеза легких, поражений плевры, туберкулеза внутригрудных лимфатических узлов, осложненного бронхолегочными поражениями. К цирротическому туберкулезу должны быть отнесены процессы, при которых сохраняются туберкулезные изменения в легких с клиническими признаками активности процесса, склонностью к периодическим обострениям, периодически бывает скудное бактериовыделение. Цирротический туберкулез бывает сегментарным и лобарным, ограниченным и распространенным, односторонним и двусторонним. Для него характерно развитие бронхоэктазов (см.), эмфиземы (см.) легких, наблюдаются симптомы легочной и сердечно-сосудистой недостаточности (см.). Цирротические изменения, при которых устанавливается наличие фиброзной каверны с бронхогенным отсевом и повторным длительным бактериовыделением, следует относить к фиброзно-кавернозному туберкулезу. От цирротического туберкулеза следует отличать циррозы легких, которые представляют собой посттуберкулезные изменения без признаков активности. Циррозы легких — остаточные изменения после клинического излечения. Это конечная, но не самая опасная форма легочного туберкулеза. Она нередко фатальна для пациента, но в эпидемиологическом отношении не слишком опасна, поскольку чаще всего больные олигобациллярны. Туберкулезный плеврит чаще сопутствует легочному и внелегочному туберкулезу. Он встречается главным образом при первичном туберкулезном комплексе, туберкулезе внутригрудных лимфатических узлов, диссеминированном туберкулезе легких. Туберкулезные плевриты бывают серозными, гнойными, реже — геморрагическими. Пневмоплеврит (наличие в плевральной полости воздуха и жидкости) возникает при спонтанном пневмотораксе (см.). Туберкулез плевры, сопровождающийся накоплением гнойного экссудата, представляет собой форму экссудативного плеврита — эмпиему (см.). Эмпиема развивается при распространенном казеозном поражении плевры, а также в результате перфорации каверны или субплеврально расположенных очагов, может осложниться образованием бронхиального или торакального (грудного) свища и принять хроническое течение. Хроническая эмпиема характеризуется волнообразным течением. Морфологические изменения в плевре проявляются рубцовым перерождением, развитием специфической грануляционной ткани в толще утратившей свою функцию плевры. Эмпиема должна быть обозначена в диагнозе. Клиническая картина разнообразна и зависит от возраста больного, состояния его организма, степени сенсибилизации, характера морфологических изменений, локализации и формы плеврита (аллергический, перифокальный или туберкулез плевры). По характеру течения процесса различают острый, подострый и хронический плевриты. Острый и подострый плеврит характеризуются повышением температуры до 38–39 °C, болями в боку, сухим кашлем, учащенным сердцебиением, постепенным нарастанием одышки. В начальном периоде костального (реберного) плеврита может выслушиваться шум трения плевры, который исчезает по мере накопления воспалительной жидкости. Хроническое течение плеврита отличается стертостью клинической картины, часто отсутствием температурной реакции, постепенным нарастанием симптоматики.
Туберкулез верхних дыхательных путей Представляет собой вторичный процесс, осложняющий различные формы туберкулеза легких и внутригрудных лимфатических узлов. Туберкулез верхних дыхательных путей — бронхов, трахеи и других органов — включает также туберкулез полости рта, небного язычка, небных миндалин, дужек и гортани. Туберкулез полости рта, верхних дыхательных путей и гортани рассматривается как вторичное проявление туберкулеза при деструктивных формах заболевания. Известны четыре основных возможных пути локального поражения слизистой оболочки верхних дыхательных путей и гортани: через мокроту, вместе с лимфотоком, гематогенный (с кровотоком) и контактный. Различают две формы поражения слизистых оболочек носа, рта, глотки и гортани — инфильтрат и язву. Инфильтрат может быть ограниченным и распространенным, редко — опухолевидным. В зависимости от фазы воспалительного процесса различают инфильтрацию, распад, обсеменение, а также уплотнение, обызвествление и рассасывание. Туберкулез носа при различных активных формах туберкулеза легких встречается редко, в 0,1 % случаев. Клиническая картина не является патогномоничной (специфичной для данного заболевания) — отмечаются сухость в носу, закладывание носа, нарушение носового дыхания, отделение корок, окрашенных кровью. Чаще поражается носовая перегородка, что может привести к перфорации хряща и деформации носа. Туберкулез полости рта наблюдается также довольно редко у больных с прогрессирующими формами деструктивного туберкулеза легких. Туберкулез глотки, небного язычка, нёбных миндалин и дужек чаще сочетается с туберкулезом полости рта и гортани у больных с фиброзно-кавернозным туберкулезом легких при неуклонном его прогрессировании и массивном выделении микобактерий. Острые и подострые формы туберкулеза глотки встречаются редко. Для клинической картины хронических форм характерны боли при глотании, чувство саднения и жжения. Туберкулез гортани встречается менее чем в 0,5 % случаев у взрослых, больных активным и прогрессирующим деструктивным туберкулезом легких. Частота поражения различных отделов гортани различна — чаще всего поражаются голосовые связки, затем межхрящевая часть голосовой щели, связки преддверия, подсвязочное пространство, надгортанник, черпаловидные хрящи. При поражении гортани больные жалуются на першение, жжение, сухость, боль в горле, охриплость голоса вплоть до полной афонии. При осмотре обнаруживают инфильтрат или язву гортани. При затруднении в диагностике показана биопсия. Туберкулез трахеи и бронхов развивается вторично при активном туберкулезном процессе в легких и внутригрудных лимфатических узлах. Инфицирование трахеи и бронхов чаще происходит содержимым каверны или очага деструкции, возможен также лимфогенный и гематогенный путь инфицирования. Клиническая картина туберкулеза бронхов в большинстве случаев развивается постепенно. Часто туберкулез бронхов протекает бессимптомно. Наиболее характерными проявлениями туберкулеза бронхов являются кашель (см.), иногда с болью в груди, выраженная одышка, ателектаз части или всего легкого, наличие блокированных и раздутых каверн. Однако эти симптомы могут отсутствовать даже при язвенном туберкулезе бронхов. Из осложнений следует отметить стенозы (сужения) разной степени, развитие грануляций, бронхиолиты. Под влиянием лечения может наступать клиническое излечение — без остаточных изменений или с остаточными изменениями в виде рубцов, фиброзных утолщений, стенозов и др. Туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких (кониотуберкулез). Туберкулез может сочетаться с профессиональными пылевыми заболеваниями легких — пневмокониозами (см.), чаще с силикозом (см.). Различают силикоз с последующим присоединением туберкулеза и туберкулез с присоединением силикоза, а также силикотуберкулеза, при котором установить характер первичного поражения не представляется возможным. Механизм развития силикотуберкулеза полностью не выяснен. Как правило, туберкулез при силикозе является вторичным. Чаще всего при силикотуберкулезе встречается очаговая форма туберкулеза — двустороннее поражение в верхних отделах легких. Диагноз очагового туберкулеза сложен на фоне выраженного силикоза. Инфильтративный туберкулез при силикозе может быть представлен лобарным (долевым) округлым инфильтратом, редко — казеозной пневмонией (см.) с преимущественной локализацией во II, III и IV сегментах легких. Рассасывания инфильтрата почти не наблюдается, чаще всего происходит его уплотнение и превращение в крупные фиброзные узлы, называемые силикотуберкулемами. При диссеминированном туберкулезе в сочетании с силикозом туберкулезные очаги полиморфны (разнообразны), располагаются преимущественно в верхних отделах легких. При фиброзно-кавернозном туберкулезе и силикотуберкулезе с обеих сторон на фоне несимметрично расположенных массивных участков фиброза определяются крупные каверны неправильной, часто бобовидной формы, нередко с уровнем жидкости. В отдаленных участках легких на фоне силикотического фиброза и эмфиземы (см.) выявляются очаги бронхогенной диссеминации. При всех формах силикотуберкулеза наблюдаются изменения корней легких, обусловленные увеличением, уплотнением, иногда кальцинозом (см.) лимфатических узлов и явлениями гипертензии (повышения давления) в малом круге кровообращения.
Туберкулез внелегочной локализации Внелегочный туберкулез встречается существенно реже, чем туберкулез органов дыхания, а его клинические проявления, как правило, характеризуются поздним развитием и медленным нарастанием симптомов, что затрудняет его раннюю диагностику. Для внелегочного туберкулеза характерно наличие длительного периода от момента инфицирования до возникновения первых клинических проявлений. Продолжительность внелегочного туберкулеза различной локализации составляет от 1 года до 30 лет и более. Повышенное внимание к внелегочному туберкулезу определяется его тяжелыми последствиями, имеющими большое социальное значение (слепота, бесплодие (см.) и др.). Туберкулез периферических лимфатических узлов разделяют на ограниченный и генерализованный. В большинстве случаев происходит поражение подчелюстных и шейных лимфатических узлов, реже — подмышечных и абдоминальных. Генерализованное поражение с вовлечением нескольких групп лимфатических узлов (не менее трех) составляет примерно 5—16 % случаев. Опасность для окружающих в качестве возможного источника инфекции представляют открытые (свищевые) формы заболевания, которые в настоящее время встречаются все реже. В возникновении туберкулезных лимфаденитов (см.) значительное место занимают микобактерии туберкулеза бычьего типа. В лимфатических узлах происходит развитие туберкулезных гранулем и их казеозное расплавление. Возможно поражение любых групп шейных узлов, но передний шейный треугольник — излюбленное место этой формы туберкулеза. Лимфатические узлы, расположенные вне шеи, страдают реже, составляя примерно 35 % туберкулезных лимфаденитов (см.). Течение этой формы туберкулеза волнообразное. Пораженные туберкулезом лимфатические узлы бывают упругими и безболезненными. При прогрессировании они становятся более плотными и спаянными. Могут образовываться кожные свищи с хронической лимфореей, но это происходит редко. В начале заболевания на фоне общего недомогания, повышения температуры тела, умеренного повышения количества лейкоцитов и увеличения СОЭ обнаруживается увеличение периферических лимфатических узлов. При пальпации лимфатические узлы мягкие, безболезненные, не спаянные друг с другом. При вовлечении в процесс окружающих тканей лимфатические узлы образуют крупные «пакеты», так называемый опухолевидный туберкулез периферических лимфатических узлов. Периаденит является характерным признаком туберкулезного лимфаденита. При прощупывании таких узлов отмечается болезненность, иногда флюктуация вследствие расплавления казеозных масс. Кожа над увеличенными лимфатическими узлами гиперемирована и истончена; в ряде случаев прорывается с образованием свищей и язв. В дальнейшем на месте этих поражений формируются обезображивающие рубцы с разрастаниями кожи в виде сосочков и тяжей. Патологический очаг в лимфатических узлах является источником постоянного токсического воздействия на организм, а также обострений и диссеминации туберкулезного процесса. Туберкулез мочевых и половых органов обычно имеет гематогенную природу. Более чем у 80 % больных туберкулезом органов мочеполовой системы можно обнаружить следы ранее перенесенного туберкулеза; чаще всего это туберкулез легких, лимфатических узлов и позвоночника. Туберкулез почек — наиболее распространенная форма туберкулеза мочевых органов. У 65 % больных он развивается в возрасте 30–55 лет, у мужчин несколько чаще, чем у женщин. Различают следующие формы туберкулеза почек: туберкулез почечной паренхимы, туберкулезный папиллит, кавернозный туберкулез почки, фиброзно-кавернозный туберкулез почки, почечные казеомы, или туберкулемы, туберкулезный пионефроз. Туберкулез почек сначала проявляется пиурией (гной в моче) и микрогематурией (кровь в моче) при отрицательных результатах бактериоскопии. Нередко диагноз устанавливается только после высева из мочи микобактерий. У некоторых больных отмечаются общее недомогание, периодически повышенная температура, тупая боль в поясничной области. Реакция на туберкулин сомнительная или слабоположительная, явления интоксикации обычно не выражены. Настороженность в отношении туберкулеза мочевой системы должна вызывать постоянно кислая реакция мочи у больных с лейкоцитурией (лейкоциты в моче), стойкой макро- или микрогематурией. На рентгенограммах обнаруживают стриктуры (сужения) и расширения мочеточника, каверны в почках. Прогрессируя, туберкулез поражает мочевой пузырь, придатки яичек, предстательную железу. Заключительной стадией может быть пионефроз, который характеризуется тотальной деструкцией (полным разрушением) почечной паренхимы и образованием гнойного мешка. Больной жалуется на чувство тяжести и боль в области пораженной почки. При прощупывании определяется увеличенная почка. Могут отмечаться явления интоксикации, лейкоцитурия, бактериурия. Почка перестает функционировать. Рентгенологически тень почки увеличена. Туберкулез мочеточника возникает только вторично, лимфогенно или в результате контакта с инфицированной мочой, во многом определяет течение и исход туберкулеза почек. У больных с поражением почек он встречается в 35–46 % случаев. Стенки мочеточника утолщены, наблюдается полнокровие сосудов, на слизистой формируются гранулемы и язвы, которые затем ведут к сужению, а в ряде случаев — и облитерации (заращению) его просвета. При туберкулезе мочеточника первыми симптомами являются почечная колика (см.) и затрудненное мочеиспускание. Туберкулез мочевого пузыря наблюдается у 5—10 % больных туберкулезом почки. Он возникает при прогрессировании туберкулеза почки, когда в процесс вовлекается слизистая оболочка мочевого пузыря. Туберкулезные бугорки и инфильтраты чаще всего образуются вокруг отверстий мочеточников. На слизистой оболочке, которая становится полнокровной, утолщенной и отечной, могут формироваться туберкулезные язвы. Рубцевание тканей приводит к сморщиванию мочевого пузыря, резкому уменьшению его объема. Туберкулез мужских половых органов развивается в результате гематогенного заноса микобактерий или как осложнение туберкулеза почек и мочевых путей. В первую очередь поражается предстательная железа, в дальнейшем — придатки яичка, само яичко, семенные пузырьки, семявыносящий проток. Различают туберкулез предстательной железы (очаговый и кавернозный), семенных пузырьков, придатков яичка (казеозно-кавернозный и рубцовый), яичка (очаговый и кавернозный), семявыносящего протока (эрозивно-язвенный и рубцовый). Течение может быть от острого до бессимптомного. Туберкулез предстательной железы в фазе инфильтрации и распада вызывает боли в промежности, прямой кишке и уретре, бывает выражена дизурия (расстройства мочеиспускания). При кавернозных изменениях в железе в моче обычно обнаруживают микобактерии туберкулеза, вторая порция мочи содержит гной. Туберкулез семенных пузырьков как самостоятельная форма не встречается, а сопутствует туберкулезу предстательной железы. Туберкулез придатка яичка (туберкулезныйэпидидимит (см.)) — наиболее часто встречающаяся форма туберкулеза мужских половых органов. Туберкулезный эпидидимит чаще протекает хронически, но возможно и острое течение. Туберкулез женских половых органов наиболее часто выявляется у женщин, страдающих бесплодием (см.). Туберкулезный процесс в половых органах женщин обычно является вторичным и возникает в результате гематогенной либо лимфогенной диссеминации возбудителей инфекций из первичного очага любой локализации. Заболевание чаще всего возникает в период полового созревания, что связано с выраженной эндокринной перестройкой и иммунологической незрелостью организма. У больных нарушается менструальный цикл и развивается бесплодие (см.). Характерны боли внизу живота и пояснице, усиливающиеся во время менструаций. Туберкулез гениталий у женщин, независимо от локализации, характеризуется длительным хроническим течением с периодами обострения и затихания. Туберкулез женских половых органов выявляют у больных, длительно страдающих хроническими воспалительными заболеваниями женской половой сферы, не поддающимися неспецифической терапии; бесплодием; стойкими нарушениями менструальной функции. Туберкулез костей и суставов — нередкое проявление туберкулеза. Он является специфическим воспалительным заболеванием, возникающим в условиях гематогенной диссеминации туберкулезного процесса. Одной из важнейших особенностей механизма развития туберкулеза костей и суставов являются выраженные дистрофические изменения в тканях, окружающих туберкулезный очаг. Развиваются характерные для туберкулеза костей и суставов остеопороз (см.) и мышечная дистрофия, которые обнаруживаются не только в пораженном суставе, но и на протяжении всей конечности. Костно-суставной туберкулез может протекать в виде первичного остита с поражением тела позвонка и его разрушением, но без распространения туберкулезного процесса за его пределы. При болезни Потта (туберкулез позвоночника, туберкулезный спондилит) микобактерии попадают в позвоночник вместе с током крови или по лимфатическим сосудам, идущим из плевральной полости к паравертебральным лимфатическим узлам. Эрозия передней поверхности тел позвонков приводит к их спадению и формированию выраженного кифоза (см.) без сколиоза (см.) с образованием горба. Возможна параплегия (паралич всех четырех конечностей). Если нет неврологических нарушений, болезнь поддается химиотерапии, хотя нередко нужна хирургическая коррекция позвоночника. При риске развития нового парапареза (пареза двух конечностей с обеих сторон) необходима срочная ортопедическая помощь. Прогрессирующий спондилит характеризуется распространением процесса за пределы позвонка с поражением прилежащих позвонков, искривлением позвоночного столба, появлением холодных абсцессов (см.) и спинномозговых расстройств. Абсцессы не требуют дренирования в случае проведения адекватной химиотерапии, если они не достигают больших размеров. К поздним симптомам относят образование свищей, из которых выделяется жидкий гной с примесью казеоза (творожистых масс). Распространение по межмышечным пространствам может приводить к развитию натечников — новых абсцессов, удаленных от основного очага. Туберкулез поражает также кости и суставы таза, грудной клетки и черепа. После внедрения микобактерий туберкулеза в кость возникает очаг воспаления, костное вещество замещается грануляциями, формируются секвестры (фрагменты костной ткани в очаге некроза), которые при поражении трубчатых костей широким основанием всегда обращены к суставу, а при поражении позвонков или тазовых костей — к периосту (надкостнице). Туберкулез часто поражает несущие наибольшую нагрузку крупные суставы — бедренный и коленный. Эти суставы достаточно просто иммобилизировать, процесс хорошо поддается химиотерапии. Туберкулезный синовит описывают как самостоятельную патологию или в сочетании с туберкулезным артритом (см.). Нередко встречаются туберкулезно-аллергические синовиты (см.) и артриты (см.), представляющие собой параспецифическую реакцию синовиальной оболочки сустава на отдаленные и скрытые очаги туберкулезной инфекции. Туберкулез глаз встречается среди внелегочных форм достаточно часто во всех возрастных группах, характеризуется разнообразием клинических проявлений и упорным, нередко рецидивирующим, течением. Имеются данные, что примерно у 51 % больных, страдающих туберкулезом глаз, туберкулезный процесс в глазном яблоке протекает на фоне мало выраженных, но не потерявших активность туберкулезных изменений в легких или прикорневых бронхиальных лимфатических узлах. В зависимости от механизма развития выделяют метастатический (гематогенно-диссеминированный) туберкулез глаз, на долю которого приходится 2/3 всех случаев туберкулеза глаз, и туберкулезно-аллергические поражения, составляющие 1/3 всех случаев туберкулеза глаз. При метастатическом туберкулезе глаз микобактерии туберкулеза попадают в ткани глаза из очагов внелегочной локализации гематогенным путем (с током крови), по периневральным и периваскулярным пространствам зрительного нерва (при туберкулезном менингите (см.)), а также контактно (из прилежащих областей, например кожи, придаточных пазух носа), откуда туберкулезный процесс распространяется на придатки глаза (веки, слезопроводящие пути и др.) и его наружную оболочку (роговицу, конъюнктиву и склеру). Многообразие форм метастатического туберкулеза глаз зависит от локализации туберкулезного процесса в глазном яблоке, степени его выраженности и проявлений сопутствующего перифокального воспаления, обусловленных состоянием общего и специфического иммунитета и уровнем сенсибилизации тканей глаза. В основе воспаления при туберкулезно-аллергических поражениях глаз лежат иммунные реакции типа антиген — антитело. Заболевание развивается у больных, организм и ткани глаза которых сенсибилизированы (имеют повышенную чувствительность) к туберкулезному антигену. Если организм и ткани глаза сенсибилизированы к микобактериям туберкулеза или продуктам их жизнедеятельности, сопутствующее аллергическое воспаление может носить гиперергический (высокореактивный) характер. К метастатическим формам туберкулеза глаз относят хориоретинит, кератит (см.), склерит и туберкулез придатков глаза (конъюнктивы век, слезопроводящих путей и др.). К туберкулезно-аллергическим заболеваниям относят фликтенулезный (пузырчатый) кератоконъюнктивит, конъюнктивит (см.) и кератит (см.), эписклерит, иридоциклит (см.) или передний туберкулезно-аллергический увеит (см.). Характерными для всех туберкулезно-аллергических поражений глаз являются острое начало, короткое течение, склонность к рецидивам. Поражаются всегда оба глаза, иногда в разные сроки, причем воспалительный процесс может чередоваться, поражая то один, то другой глаз. Различают милиарный, очаговый и диссеминированный туберкулезный хориоретинит. Милиарный туберкулезный хориоретинит развивается при бурно прогрессирующем милиарном туберкулезе. На глазном дне обоих глаз появляются множественные мелкие желтоватые округлые очажки с нечеткими границами. Они могут бесследно рассосаться или оставить четко отграниченные участки атрофии хориокапиллярного слоя. Очаговый туберкулезный хориоретинит характеризуется появлением в хориоидее (см. Хориоидит) единичного крупного очага воспаления — туберкула, который быстро распространяется на сетчатку, в результате чего развивается картина хориоретинита. Симптомы — ноющая тупая боль в глубине глаза, снижение остроты зрения, плавающее пятно перед глазами. Диссеминированный туберкулезный хориоретинит (см.) характеризуется наличием в хориоидее (сосудистой оболочке глаза) нескольких очагов специфического воспаления. При локализации хориоретинальных очагов у края диска зрительного нерва развивается нейроретинит. Так как в процесс вовлекается диск зрительного нерва, в ранней стадии клинические проявления нейроретинита сходны с таковыми при неврите или застойном соске зрительного нерва. По мере уменьшения отека сетчатки вокруг диска зрительного нерва начинают выявляться хориоретинальные очаги. Исходом нейроретинита является частичная атрофия зрительного нерва с атрофическими хориоретинальными очагами, окруженными пигментом. Передний туберкулезный увеит (иридоциклит) клинически протекает в виде серозного, пластинчатого (серозно-фибринозного) или очагового процесса. Серозный передний увеит (см.) может протекать остро или иметь вялое хроническое течение с периодическими обострениями, во время которых отмечается слабо выраженная перикорнеальная (околороговичная) инъекция, редкие, слабо пигментированные пятна, клеточная взвесь в стекловидном теле. Пластинчатый передний увеит начинается остро, но может принимать и вялое хроническое течение. Характерным является образование мощных и прочных задних синехий (спаек), плохо поддающихся рассасыванию. При остром течении увеита могут появляться «летучие» студенистые узелки в области зрачка или на поверхности радужки. Течение увеита длительное, рецидивирующее, в некоторых случаях вялое. При очаговом переднем туберкулезном увеите мелкие множественные очаги сероватого цвета могут располагаться в зрачковой части радужки. Процесс может протекать вяло, без выраженных признаков воспаления, в некоторых случаях воспаление может начинаться с острого диффузного иридоциклита (см.), а по мере затихания острых явлений в глубине стромы радужки виден очаг — туберкул. Процесс может сопровождаться повышением внутриглазного давления в результате нарушения оттока внутриглазной жидкости. В исходе очагового увеита туберкул рассасывается, оставляя после себя истонченную радужку. Туберкулезный кератит возникает вторично, в результате переноса микобактерий туберкулеза из очагов, локализующихся в прилежащих структурах: цилиарном (ресничном) теле, корне радужки. Как правило, к воспалению в роговице присоединяются явления иридоциклита (см.) и развивается картина кератоувеита. Туберкулезный склерит развивается при распространении воспалительного процесса из хориоидеи или цилиарного тела. При поражении склеры (белочной оболочки глаза) в области лимба в процесс вовлекается роговица и развивается клиническая картина склерокератита или склерокератоувеита. В исходе рецидивирующих склеритов, локализующихся у лимба, происходит краевое помутнение роговицы, растяжение ее и склеры. Течение процесса рецидивирующее, хроническое. Туберкулез конъюнктивы встречается очень редко. Для него характерно появление изъязвляющейся туберкулезной гранулемы в области конъюнктивы хряща верхнего века. Течение хроническое, с наклонностью к рецидивам. При туберкулезе слезоотводящих путей развивается дакриоцистит (см.), но проходимость слезных путей сохраняется. На коже в области слезного мешка могут быть видны отверстия свищевых ходов. Встречаются также фликтенулезные поражения глаз (конъюнктивит, кератит). Фликтеной называется инфильтрат, расположенный в поверхностных слоях роговицы или конъюнктивы глазного яблока, состоящий главным образом из лимфоидных клеток. Фликтенулезные повреждения представляют собой скорее проявления повышенной чувствительности к туберкулотоксинам, нежели микобактериальной инфекции. Фликтены могут рассасываться или крайне редко изъязвляться вплоть до прободения роговицы с образованием бельма, спаянного с радужкой. При тяжелом фликтенулезном кератите присоединяются признаки иридоциклита (см.). Особенно тяжело протекают осложненные гнойной инфекцией фликтенулезные язвы роговой оболочки. После рассасывания фликтен в роговице остаются различной степени и величины помутнения. Туберкулезно-аллергический эписклерит характеризуется формированием эписклерального узла, чаще вблизи лимба. При гиперергическом характере (повышенной реактивности) процесса заболевание протекает с резко выраженными признаками воспаления эписклеры и конъюнктивы, на выпуклой части эписклерального узла появляется абсцесс (см.) с быстрым расплавлением тканей на его поверхности, после чего начинается обратное развитие эписклерального узла, который рассасывается иногда бесследно. При туберкулезно-аллергическом переднем увеите (ириты и иридоциклиты) источником сенсибилизации переднего отрезка увеального тракта иногда может быть активный туберкулезный хориоретинальный очаг. Клинические проявления носят неспецифический характер и наблюдаются при всех увеитах аллергического происхождения. Осложнениями туберкулеза глаз являются вторичная отслойка сетчатки (см.), вторичная глаукома (см.), осложненная катаракта (см.), бельмо, спаянное с радужкой, субатрофия глаза. Туберкулез кожи и подкожной клетчатки возникает при распространении вместе с током крови и лимфы микобактерий туберкулеза из туберкулезных очагов, локализующихся в других органах, преимущественно лимфатических узлах. Туберкулез кожи и подкожной клетчатки — редкая форма туберкулеза, способная проявляться первичной или вторичной скрофулодермой, острым милиарным туберкулезом кожи, золотушным лишаем (см.) либо хроническим прогрессирующим туберкулезом кожи — волчанкой. Последняя форма — гранулематозное поражение кожи, хорошо поддающееся лечению. Клинические проявления этой формы очень многообразны — рассеянный васкулит (см.), пустулы (гнойные пузырьки), эрозии, поверхностные язвы, бугорки, инфильтраты, рубцы. Туберкулез брюшины обычно имеет гематогенную природу, реже бывает осложнением лимфаденита (см.). Как и при других серозитах, типично наличие воспалительной жидкости. Клинические проявления возникают либо при накоплении жидкости, либо при развитии адгезии (слипания). Отмечают интоксикацию, диспепсию (расстройства пищеварения), снижение массы тела, частичную кишечную непроходимость (см.). Туберкулез органов пищеварения отличается большим многообразием клинической картины. Сравнительно редко встречается туберкулез пищевода и желудка. В пищеводе туберкулезный процесс в основном локализуется на уровне разделения трахеи на бронхи, реже — в верхнем его отделе. Выделяют язвенную, милиарную и стенозирующую формы туберкулеза пищевода. Туберкулез проявляется болями за грудиной и явлениями затруднения глотания. В результате рубцевания язв могут развиться стенозы (сужения). Различают следующие формы туберкулеза желудка: язвенную, гипертрофическую, или опухолевую, фиброзно-склеротическую и смешанную, или язвенно-гипертрофическую, воспалительную и милиарную. При туберкулезе желудка беспокоят тупые боли, отрыжка воздухом, тошнота, чувство тяжести в желудке, снижение аппетита. При туберкулезе кишечника чаще поражаются терминальный отдел подвздошной кишки и слепая кишка (туберкулезный илеотифлит). Хроническая диарея (см.) и образование свища — типичные проявления, однако необходима дифференциальная диагностика с болезнью Крона (см.). При стриктуре (сужении) кишки развивается частичная кишечная непроходимость (см.). Наиболее тяжелое осложнение — перфорация кишки с развитием разлитого перитонита (см.). Туберкулезный мезаденит в инфильтративной фазе характеризуется скудной клинической картиной, только в казеозно-некротической фазе появляется симптоматика, обусловленная вовлечением в процесс брюшины. Это относительно редкое внелегочное поражение. Течение, как правило, хроническое, с ремиссиями и обострениями. Печень при туберкулезе поражается гематогенным путем (с током крови). Туберкулез печени встречается как самостоятельная клиническая форма или как проявление милиарного туберкулеза, при котором в печени формируются типичные туберкулезные гранулемы, аналогичные по строению легочным. Туберкулез печени возникает и диагностируется сравнительно редко. Туберкулез поджелудочной железы встречается редко и обнаруживается, как правило, на секции. Гематогенное инфицирование надпочечника, вероятно, происходит часто, но болезнь вследствие этого развивается редко и обычно сопровождает обширные легочные процессы. В большинстве случаев в специфический процесс бывает вовлечена кора надпочечника, что приводит к надпочечниковой недостаточности. В дифференциальной диагностике следует учитывать, что даже обширное поражение коры надпочечника при карциноматозе редко приводит к адреналиновой недостаточности. Туберкулезный перикардит иногда встречается в сочетании с плевритом (см.), он может быть признаком распространения процесса. Обычно происходит обсеменение перикарда (сердечной сумки) из пораженного лимфатического узла, т. е. с током лимфы. Для пациентов с перикардиальным выпотом характерны лихорадка и боль в груди. При прослушивании сердца можно выслушать шум трения перикарда. В некоторых случаях возникает тампонада сердца. Наиболее опасен хронический стенозирующий перикардит. Туберкулез мозговых оболочек и центральной нервной системы включает туберкулезный менингит (см.), туберкулему головного мозга, а также поражение спинного мозга при туберкулезном спондилите. Туберкулезный менингит (см.) — преимущественно вторичное туберкулезное заболевание мозговых оболочек, возникающее у больных с различными, чаще активными и распространенными формами туберкулеза, является наиболее тяжелой формой туберкулеза. В большинстве случаев микобактерии туберкулеза проникают в центральную нервную систему и мозговые оболочки с током крови при диссеминированном туберкулезе легких, внутригрудных лимфатических узлов и первичном туберкулезном комплексе. Возможен также лимфогенный (с током лимфы) путь инфицирования мозговых оболочек при туберкулезе внутригрудных лимфатических узлов. Неврологические признаки воспаления мозговых оболочек не имеют этиологической специфичности. У больного поднимается температура тела до 38 °C и выше, нарастает головная боль, появляется рвота (см.), не связанная с приемом пищи. По мере прогрессирования болезни развиваются заторможенность, сопор, кома (см.). Отмечаются менингеальные симптомы: ригидность затылочных мышц, положительные симптомы Брудзинского и Кернига. При течении процесса по типу менингоэнцефалита могут возникать гемипарезы и гемиплегии (парезы и параличи конечностей на одной стороне тела), нарушения функций тазовых органов. Туберкулез головного мозга связан с гематогенной диссеминацией возбудителей инфекции из первичного туберкулезного очага и представляет собой обычно округлый очаг инкапсулированного казеозного некроза. В случае прогрессирования процесса и при расположении туберкулемы вблизи поверхности мозга воспалительные явления могут переходить на мягкую мозговую оболочку головного мозга. Встречается два типа течения болезни. Одному из них присуще острое начало с подъемом температуры, быстрое развитие симптомов поражения мозга, зависящих от локализации процесса, с последующим волнообразным течением и длительным субфебрилитетом. При этом часто диагностируются менингит (см.) и менингоэнцефалит. Второй тип характеризуется медленным развитием с ремиссиями. Поражение спинного мозга при туберкулезном спондилите наблюдается при прогрессировании туберкулезного процесса в позвоночнике. Вследствие разрушения и смещения позвонков, развития грануляционной ткани и образования холодного абсцесса (см.), из которого казеозные массы распространяются под заднюю продольную связку позвоночника, может произойти сдавление спинного мозга и сосудов, питающих спинной мозг. При этом развиваются расстройства кровообращения, эндофлебиты, тромбозы, а также специфический васкулит (см.), вызывающие отек спинного мозга и компрессионный миелит. В клинической картине преобладают неврологические расстройства (локальные и радикулярные боли, нарушения чувствительности, двигательные расстройства, парезы и параличи). Параличи, возникающие в разгар болезни, называют ранними. При своевременной ликвидации абсцесса (см.) прогноз благоприятный. Поздние параличи появляются через несколько лет от начала спондилита (см.). Причиной их являются длительно существующий в рубцовой ткани абсцесс, сдавление спинного мозга разрушенными позвонками и фиброзно измененной твердой оболочкой, дегенеративные изменения спинного мозга. Прогноз неблагоприятный. Клиническая картина неврологических расстройств зависит и от локализации процесса.
Диагностика и дифдиагностика Применяемые методы. I. Туберкулинодиагностика — проба Манту с 2 ТЕ, введение 0,1 мл туберкулина внутрикожно. Туберкулин — неполный антиген (гаптен) микобактерий туберкулеза. Для массовой туберкулиновой диагностики в России используется очищенный туберкулин. Он освобожден от белковых фракций питательной среды, что существенно увеличивает специфичность аллергических реакций на него. Патофизиологическая основа туберкулиновой пробы — аллергическая реакция на вводимый внутрикожно антиген. Чтение такой реакции производят через 48–72 ч. Отрицательная реакция — папула (узелок, уплотнение) отсутствует, возможна гиперемия (краснота). Реакцию считают положительной, если диаметр папулы 5 мм и более. О гиперергической реакции говорят, если диаметр папулы более 17 мм у детей и подростков и более 21 мм у взрослых. II. Рентгенологические методы. Флюорография остается пока в России традиционным методом выявления туберкулеза. Ее проводят всем гражданам 1 раз в год, а лицам декретированных групп — 2 раза в год. Рентгенография органов грудной клетки — важный метод диагностики туберкулеза. Ее проводят в том случае, если после флюорографии возникло подозрение на туберкулез. Послойное исследование легких (томография) помогает выявить очаги в других отделах легких, характерные для туберкулеза. III. Бактериологический метод — выделение возбудителя туберкулеза из мокроты, отделяемого свища, мочи и других сред. В настоящее время наиболее результативным методом бактериологической диагностики туберкулеза является метод люминесцентной микроскопии, преимущество которого заключается в его высокой чувствительности. Посев материала на среду Левенштейна — Иенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4–8 недель. Современные методы с использованием высокоселективных сред позволяют выращивать культуры за 1–2 недели, но идентификация микроорганизма требует дополнительного времени. IV. Применяется также ИФА — иммуноферментный метод диагностики.
Туберкулез органов дыхания Рентгенодиагностика малых вариантов туберкулеза внутригрудных лимфатических узлов в фазе инфильтрации возможна только по косвенным признакам. Дифференциальную диагностику туберкулеза внутригрудных лимфатических узлов проводят с внутригрудной формой саркоидоза (см.) легких (в пользу саркоидоза будут свидетельствовать симметричность поражения и отрицательные туберкулиновые пробы), лимфогранулематозом (см.) (при лимфогранулематозе увеличение лимфатических узлов более выражено по степени и распространенности, преобладает поражение узлов переднего средостения, а не корней легких; в переднем средостении у детей расположена вилочковая железа, ее увеличение также может симулировать бронхоаденит). Загрудинный зоб без явлений тиреотоксикоза (см.) выявляют при рентгенологическом исследовании: при дыхании и глотании зоб смещается, еще более достоверно радиоизотопное исследование щитовидной железы. Милиарный туберкулез. При рентгенологическом исследовании определяется густая однотипная диссеминация в виде мелких очагов, расположенных чаще симметрично и видимых лучше на рентгенограммах и томограммах. Для рентгенологической картины подострого диссеминированного туберкулеза характерно поражение преимущественно верхних отделов легких, слияние очагов, наличие инфильтрации и формирование штампованных или очковых каверн, располагающихся довольно симметрично в верхних долях обоих легких. Увеличенные внутригрудные лимфатические узлы и наличие плеврита (см.) также будут свидетельствовать в пользу туберкулезной этиологии диссеминации. Чаще при подострой форме преобладает гематогенный (с током крови) путь обсеменения, по клинико-рентгенологической картине выделяют также диссеминированный туберкулез бронхогенного происхождения. В этом случае очаги в легких рассеяны неравномерно, их двустороннее распространение асимметрично. Диагноз подострой формы диссеминированного туберкулеза обычно подтверждают при бронхологическом исследовании. Хронический диссеминированный туберкулез. Рентгенологически выявляются очаги различной величины и плотности, при этом более плотные очаги локализуются в вышележащих отделах, на любом этапе болезни могут образовываться каверны в одном или обоих легких. Очаговые и деструктивные изменения определяются на фоне деформированного легочного рисунка: признаков пневмосклероза, бронхоэктазов (см.) и эмфиземы (см.). Несвоевременнораспознанный или неэффективно пролеченный хронический диссеминированный туберкулез может прогрессировать и через фазу инфильтрации перейти в дальнейшем в фиброзно-кавернозный туберкулез легких. Трудность определения развития диссеминации обусловила необходимость объединения их под общим названием диссеминированного туберкулеза легких. При наличии бронхогенного отсева из инфильтрата с распадом, кавернозном или при фиброзно-кавернозном туберкулезе легких, развитии аспирационной пневмонии (см.) после легочного кровотечения, прорыве в бронх казеозного лимфатического узла такие обсеменения необходимо обозначать как фазу соответствующего процесса, а не включать их в диссеминированный туберкулез. Дифференциальную диагностику проводят с такими заболеваниями, как саркоидоз (см.), пневмокониоз (см.), канцероматоз, фиброзирующие альвеолиты, гемосидерозы, различные виды гранулематозных поражений легких. Фиброзно-очаговый туберкулез. При выявлении фиброзно-очаговых изменений методом рентгенофлюорографии необходимо провести тщательное обследование больных для исключения активности процесса. Встречаются очаги в легких, которые не увеличиваются ни в объеме, ни в количестве и не реагируют на лечение; чаще всего это очаговый пневмосклероз. В распознавании инфильтративного туберкулеза легких, который может протекать бессимптомно, важную роль играет рентгенологическое исследование. Диагностика туберкулем мозга трудна. Рентгенологические исследования, ангиография, эхоэнцефалография, компьютерная томография позволяют установить локализацию и размеры туберкулемы. Дифференциальный диагноз туберкулемы легкого проводится с круглым туберкулезным инфильтратом, имеющим сходную с туберкулемой рентгенологическую картину, другими шаровидными образованиями в легких (рак (см.)), реже, с грибковыми поражениями и паразитарными заболеваниями. В случае диагностических сомнений между туберкулемой и опухолевидными образованиями другого генеза тактическим выбором должна быть операция на легких. Диагноз кавернозного туберкулеза легких ставят на основании клинико-рентгенологического, лабораторного и бронхологического исследований. Дифференциальный диагноз проводят с абсцессом (см.) легкого. Абсцесс легкого сопровождается острым началом, высокой температурой тела, ознобом, кашлем с обильной гнойной мокротой, высевом вирулентного возбудителя и даже кровохарканьем. Абсцесс чаще локализуется в нижних отделах и имеет горизонтальный уровень жидкости в полости. Дифференциальную диагностику проводят также с распадающимися периферическими опухолями (см.) легкого. Для этого мокроту исследуют на атипичные клетки. Для рака (см.) характерно наличие широкой зоны перикавитарной (околополостной) инфильтрации вследствие прорастания опухоли в окружающие ткани. Внутренний контур полости, образующийся при распаде опухоли, чаще неровный, ей свойственна широкая тяжистая дорожка к корню легкого. В корне легкого можно обнаружить увеличенные лимфатические узлы. Прогноз при кавернозном туберкулезе серьезный, так как очередное обострение может привести к развитию хронических деструктивных форм туберкулеза. Проблемы в части дифференциального диагноза при фиброзно-кавернозном туберкулезе возникают редко. Бактериовыделение в сочетании с типичной рентгенологической картиной снимает многие вопросы. У олигобациллярных (с небольшим бактериовыделением) больных возможны сомнения в диагнозе; в этом случае во внимание принимается возможность хронического абсцесса (см.), врожденные воздушные кисты (см.) легкого, буллезные (пузырчатые) образования, ограниченные скопления воздуха в плевральной полости при эмфиземе (см.). При поликистозе кольцевидные тени однотипные и множественные, отсутствуют плевропульмональные тяжи, характерные для каверн, и дорожка к корню легкого. Для булл более типична множественность образований, угловатость, фестончатость и прерывистость контуров вследствие многокамерности этих образований. Цирротический туберкулез требует дифференциальной диагностики с циррозом легких различного происхождения. Разница состоит в том, что цирротический туберкулез — активный процесс, а цирроз легкого — исход. Существенную роль играет тщательно собранный анамнез (история жизни), отражающий историю перенесенных заболеваний. Длительное отсутствие бактериовыделения и других признаков активности, отсутствие какой-либо рентгенологической динамики в течение ряда лет свидетельствует в пользу цирроза. Диагноз туберкулезного плеврита (см.) устанавливается по совокупности клинических признаков, а характер плеврита — при пункции плевральной полости или биопсии плевры. Дифференциальный диагноз проводят с плевритом (см.) другого происхождения. Прогноз, как правило, благоприятный. Туберкулез верхних дыхательных путей. Диагноз туберкулеза трахеи и бронхов устанавливается при бронхоскопии с биопсией и бактериологическом исследовании полученного материала. Туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких (кониотуберкулез). В дифференциальной диагностике слившихся силикотических узелков с туберкулезными очагами важное место имеют томография и бронхоскопия. Проявления кониотуберкулеза отличаются большим многообразием; течение его относительно доброкачественное. Прогноз зависит от распространенности процесса, а также от профилактических и лечебных мероприятий. Туберкулез внелегочной локализации. Диагноз туберкулеза периферических лимфатических узлов ставят, как правило, на основании биопсии. Взятый для биопсии лимфатический узел исследуют как бактериологически, так и гистологически. До проведения биопсии или сразу после нее начинают химиотерапию, позволяющую избежать образования послеоперационного свища. Дифференциальную диагностику проводят с воспалительными заболеваниями лимфатических узлов неспецифической этиологии, с сифилитическим лимфаденитом, лимфогранулематозом (см.), дермоидными кистами (см.), метастазами рака (см.) в лимфатические периферические узлы. При этом важная роль принадлежит биопсии. Туберкулез мочевых и половых органов. Ранняя диагностика доклинических форм туберкулеза почек возможна лишь при проведении многократных бактериологических исследований стерильно взятой мочи у инфицированных контингентов населения. Диагностика туберкулеза почки трудна, так как процесс протекает скрыто и выявляется случайно, когда почка частично или полностью утратила свою функцию. Косвенным признаком туберкулеза почки может служить беспричинное повышение артериального давления в молодом возрасте. Рентгенологическое исследование позволяет определить топографию и распространенность патологического процесса в почке. Радиоизотопные методы исследования (ренография и радиоизотопное сканирование), а также ультразвуковое сканирование дополняют комплекс диагностических исследований. Дифференциальный диагноз проводят с почечнокаменной болезнью (см.), пиелонефритом (см.), гидронефрозом (см.), аномалиями развития и опухолями (см.) почки. Прогноз для жизни зависит от течения и распространенности туберкулеза в почках и в других органах, в том числе в надпочечниках, наличия вторичных осложнений, прежде всего банального пиелонефрита (см.), хронической почечной недостаточности, амилоидоза (см.). При туберкулезном папиллите при своевременном лечении прогноз благоприятный, при единичных кавернах и почечной казеоме — также благоприятный, при туберкулезном пионефрозе в случае присоединения явлений сепсиса (см.) — сомнительный. Дифференциальный диагноз при туберкулезе мочеточника проводят с заболеваниями, ведущими к стенозированию мочеточника (уретрит (см.), почечнокаменная болезнь (см.), болезнь Ормонда и др.). Основой диагностики при туберкулезе мочевого пузыря является обнаружение микобактерий туберкулеза в моче, а также данные цистоскопии и рентгенологического исследования почек и мочевых путей. Туберкулез мужских половых органов. Диагноз туберкулеза предстательной железы основывается на данных пальпации, уретрографии, выявлении в простатическом соке микобактерий туберкулеза. В постановке диагноза туберкулеза мужских половых органов значительное место занимает также туберкулинодиагностика. Проба Манту с 2 ТЕ бывает гиперергической, если процесс протекает остро, и положительной — при хроническом течении. В сомнительных случаях производят микробиологическое исследование эякулята (семенной жидкости) на микобактерии туберкулеза или исследование яичка, биопсию и исследование ткани удаленного придатка. Прогноз для жизни благоприятный, однако заболевание часто заканчивается бесплодием (см.). Туберкулез женских половых органов. Диагностируется заболевание чаще в возрасте 20–40 лет, а также в постклимактерическом периоде (после 50 лет). Туберкулез женских половых органов проявляется в виде туберкулеза маточных труб (сальпингит (см.)), прогрессирующего туберкулеза придатков матки (сальпингоофорит (см.)), распространенного туберкулеза половых органов с переходом процесса с придатков на тело матки, туберкулеза наружных половых органов. Для ранней диагностики мочеполового туберкулеза необходимо проводить бактериологическое исследование выделений из половых органов, менструальной крови, соскоба эндометрия. Проводят рентгенологические исследования: обзорную рентгенографию малого таза, которая позволяет выявить казеозные очаги в придатках матки, рентгеноконтрастное исследование (метросальпингография). Большое значение имеет туберкулинодиагностика. При выявлении заболевания на ранних этапах его развития и адекватной терапии возможно восстановление генеративной функции. При рубцовоспаечных процессах прогноз в отношении генеративной функции (возможности иметь детей) менее благоприятный. Туберкулез костей и суставов. Компьютерная томография или магнитно-резонансная томография достаточно четко выявляют характерные для туберкулеза изменения, хотя дифференциальный диагноз включает другие инфекционные поражения и опухоли (см.). Аспират содержимого абсцесса (см.) или биоптат кости позволяют подтвердить туберкулезную этиологию, поскольку из этого материала часто высевают микобактерии или подтверждают диагноз гистологически (путем микроскопического исследования тканей). С целью своевременной диагностики туберкулеза костей и суставов на консультацию к фтизиатру следует направлять больных, длительно страдающих артритами (см.) и полиартритами, болями в грудной клетке, пояснице, нижних и верхних конечностях; лиц с незаживающими ранами и свищами мягких тканей и костно-суставной системы неясной этиологии. Туберкулезные пробы позволяют установить инфицированность организма и должны учитываться при определении причины заболевания. Диагностика туберкулеза глаз сложна из-за многообразия клинических проявлений, их сходства с клинической картиной заболеваний глаз другой этиологии, невозможности выделить микобактерии туберкулеза из тканей глазного яблока. Диагноз туберкулеза глаз ставят методом исключения. Диагноз основывается на данных комплексного обследования больного, из которых ведущими при метастатическом туберкулезе являются результаты реакции на введение туберкулина, а при туберкулезно-аллергических поражениях — выявление активного очага внелегочной локализации. С целью дифференциальной диагностики производят реакцию Вассермана, исследование крови на токсоплазмоз (см.), иммунологические исследования на вирусы (например, герпеса (см.)). Диагноз туберкулеза кожи ставят на основании результатов биопсии кожи. Типична в этом случае и туберкулиновая гиперчувствительность. Иногда встречается узловая эритема, хотя этот признак более типичен для других гранулематозных процессов (саркоидоз (см.), системный микоз (см.)). Иногда возникают туберкулиды — папулезные (узелковые) поражения кожи или слизистых оболочек, возникающие вследствие специфической сенсибилизации к возбудителю туберкулеза. Туберкулез брюшины. Начало процесса не имеет типичной картины, поэтому его иногда путают с циррозом печени (см.) у больных, страдающих алкоголизмом (см.). В жидкости, полученной при парацентезе (проколе), редко обнаруживают микобактерии. Для точного диагноза нередко требуется лапароскопия с биопсией. Туберкулез органов пищеварения. Туберкулез поджелудочной железы. Достоверный диагноз абдоминального туберкулеза можно установить лишь при лапароскопии и лапаротомии с гистологическим и бактериологическим исследованием биопсийного материала. Прогноз зависит от своевременной диагностики и лечения. Диагностика туберкулезного перикардита нередко трудна; для этого могут потребоваться торакотомия и биопсия перикарда. Туберкулез мозговых оболочек и центральной нервной системы. В дифференциальной диагностике при туберкулезном менингите решающее значение имеют результаты исследования спинномозговой жидкости. Спинномозговая жидкость прозрачная, вытекает частыми каплями (мутной она бывает при гнойном менингите). Цитоз составляет 100–600 клеток в 1 мм2, преобладают лимфоциты, повышено содержание белка, понижено содержание сахара и хлоридов (но это может встречаться и при гнойном менингите). В спинномозговой жидкости через сутки выпадает нежная фибриновая пленка в виде сетки или паутинки (микобактерии). Прогноз для жизни при своевременном лечении специфическими препаратами в большинстве случаев благоприятный.
Лечение Рациональное лечение больных туберкулезом основывается на следующих принципах: лечение должно быть ранним и своевременным; непрерывным, что достигается чередованием химиопрепаратов, перерывы в лечении приводят к формированию лекарственной устойчивости возбудителя; комплексным — каждому больному нужно применять комплекс лечебных методов, необходимых для достижения излечения, при этом сочетают этиотропные препараты с патогенетическими; этапным — начинают лечение в стационаре, продолжают в санатории и завершают поддерживающей терапией в амбулаторных условиях; комбинированным — необходимо назначение комбинации не менее чем трех туберкулостатиков с разным механизмом действия, монотерапия недопустима; контролируемым — должен соблюдаться строгий контроль за приемом больным каждой дозы препарата на всех этапах лечения; индивидуальным — учитывается возраст больного, переносимость им химиопрепаратов, сопутствующие заболевания. Основным методом лечения туберкулеза является химиотерапия. Существующая классификация предусматривает 3 группы противотуберкулезных препаратов: А — наиболее эффективные (ГИНК, рифампицин); В — средней эффективности (стрептомицин, канамицин, амикацин, флоримицин, пиразинамид, этамбутол, протионамид, этионамид, производные фторхинолонов); С — умеренной эффективности (ПАСК, тиоацетазон). На первом этапе впервые выявленным активным больным назначаются 4 туберкулостатика (изониазид, рифампицин, пиразинамид, стрептомицин или этамбутол). Такая интенсивная терапия проводится в течение 2 месяцев, а при сохранении бактериовыделения — 3 месяцев. На втором этапе используют 2 препарата (изониазид, рифампицин) в течение 4 месяцев ежедневно или через день. Впервые выявленным больным, прервавшим лечение, а также пациентам с рецидивом туберкулеза в интенсивной фазе назначаются 5 препаратов на 2 месяца, затем еще 1 месяц применяют 4 препарата (отменяется стрептомицин). Второй этап лечения у этой категории больных проводится тремя химиопрепаратами в течение 5 месяцев ежедневно или через день. Больным туберкулезом без бактериовыделения интенсивный этап лечения можно проводить тремя препаратами (изониазид, рифампицин, пиразинамид) в течение 2 месяцев, затем продолжить прием 2 препаратов (изониазид и рифампицин, или этамбутол) в течение 4 месяцев. Больных хроническими формами туберкулеза органов дыхания следует лечить по индивидуальным схемам с учетом устойчивости микобактерий туберкулеза к химиопрепаратам. Чаще всего таким пациентам назначают канамицин, амикацин, протионамид, этамбутол, производные фторхинолонов (офлоксацин, ломефлоксацин, ципрофлоксацин). Помимо этиотропного лечения для ускорения процессов заживления больным туберкулезом проводится патогенетическая терапия. Широко применяются кортикостероиды, антиоксиданты, иммуномодуляторы, нестероидные противовоспалительные средства и методы физиотерапевтического воздействия: УВЧ, лазер, ультразвук, индуктотермия, КВЧ-терапия.
Туберкулез внелегочной локализации Лечение проводится комплексное по общим правилам лечения туберкулеза. Основным методом лечения локализованного и фиброзно-казеозного туберкулеза периферических лимфатических узлов является оперативное вмешательство — иссечение всех пораженных лимфатических узлов вместе с их капсулой. Прогноз благоприятный при своевременной диагностике и полноценном лечении. Туберкулемы мозга. Лечение оперативное, прогноз серьезный. Основа лечения туберкулеза внутригрудных лимфатических узлов — длительная химиотерапия, ее лучше проводить в условиях санатория. Крупные лимфатические узлы, вызывающие сдавление или образование пролежней органов средостения, подлежат хирургическому удалению. Цирротический туберкулез легких. Лечение таких больных проблематично, поскольку туберкулостатики плохо проникают в измененную ткань. Прогноз неблагоприятный. Причиной смерти являются осложнения туберкулеза — легочное кровотечение, амилоидно-липоидный некроз, хроническая легочно-сердечная недостаточность, тромбоэмболия легочной артерии (см.) и др. Своевременно начатое лечение при туберкулезе почек дает хорошие результаты, при позднем выявлении процесса показаны как химиотерапия, так и хирургические методы лечения. В прошлом удаление почки при ее туберкулезном поражении проводили довольно часто. Теперь при проведении консервативной терапии необходимость в нефрэктомии возникает редко. Комплексное лечение туберкулеза костей и суставов включает консервативные и оперативные методы. Прогноз при туберкулезе костей и суставов для жизни больного благоприятный, но часто приводит к инвалидности и потере трудоспособности. Лечение туберкулеза глаз заключается в проведении этиотропной антибактериальной и патогенетической терапии в соответствии с общими принципами противотуберкулезного лечения. Антибактериальная терапия туберкулеза глаз имеет некоторые особенности. В глазной практике не применяют этамбутол, который обладает избирательным токсическим действием на сетчатку и зрительный нерв. В связи с необходимостью предупреждения процессов рубцевания стрептомицин назначают коротким курсом (20–30 дней) в начале основного курса лечения и больным с острыми экссудативными процессами. В комплексное лечение туберкулеза глаза включают гипосенсибилизирующие (понижающие сенсибилизацию) средства, в поздние сроки — ФИБС, стекловидное тело. Прогноз при туберкулезе глаз в отношении функции глаз всегда серьезный и зависит от локализации, тяжести и распространенности процесса. Лечение туберкулезного спондилита включает в себя иммобилизацию в гипсовой кроватке, использование противотуберкулезных средств и оперативное вмешательство.
Профилактика Специфическая профилактика туберкулеза осуществляется двумя способами: с помощью введения вакцины БЦЖ (создание противотуберкулезного иммунитета) и путем назначения химиопрепаратов. Химиопрофилактика назначается контактным с бактериовыделением; детям и подросткам с виражом туберкулиновой реакции; людям с гиперергическими реакциями на туберкулин; взрослым с посттуберкулезными изменениями в легких при наличии сопутствующих заболеваний, представляющих угрозу для реактивизации туберкулеза (хронические болезни органов дыхания, сахарный диабет (см.), язвенная болезнь (см.) желудка, нервно-психические заболевания, силикоз (см.), алкоголизм (см.), наркомания (см.)); взрослым с посттуберкулезными изменениями в легких при их лечении стероидными гормонами или иммунодепрессантами. Химиопрофилактика проводится одним противотуберкулезным препаратом (изониазид, фтивазид, метацид).
ТУЛЯРЕМИЯ
ОпределениеТуляремия — это природно-очаговый зооноз, протекающий с интоксикацией, лихорадкой, развитием лимфаденита (см.) и поражением различных органов.В 1910 г. американский ученый У. МакКой, обследуя природный очаг чумы в болотистой местности Туляре в Калифорнии, обнаружил у сусликов чумоподобное заболевание. В 1911 г. У. Мак-Кой и Ч. Чепик выделили от больных сусликов возбудителя этой болезни и дали ему название «бактерия туляренс» (по месту эпизоотии (эпидемии у животных) в районе озера Туляре). Вскоре выяснилось, что люди восприимчивы к данной инфекции, получившей по предложению Френелея (1921 г.) название туляремии. Туляремия у животных и человека регистрируется во многих странах Америки, Европы и Азии, в том числе и в СНГ.
Этиология Выделяют три подвида туляремийного микроба: — неарктический (американский); — среднеазиатский; — голарктический (европейско-азиатский). Неарктический подвид бактерии отличается высокой болезнетворностью для человека и лабораторных животных. Туляремийные микробы имеют вид очень мелкого кокка или короткой палочки размером 0,2–0,5 мкм. Во внешней среде возбудитель сохраняется длительное время, особенно при низкой температуре. Чем выше температура, тем быстрее погибают микробы. Нагревание до 60 °C убивает туляремийных бактерий в течение 20 мин, а кипячение — в течение 1–2 мин. Микроб туляремии нестоек к действию дезинфицирующих веществ. Для обеззараживания тех или иных объектов применяют обычные дезинфицирующие растворы: 2–3 %-ный раствор лизола или 3–5 %-ный раствор карболовой кислоты. Надежное обеззараживание этими растворами достигается при экспозиции (выдержке) в 30 мин. Значительным бактерицидным действием на туляремийные бактерии обладает формальдегид.
Эпидемиология Распространение природных очагов туляремии в нашей стране установлено от западных границ (Кольский полуостров, Карелия, побережье Балтийского моря, Калининградская область, запад Белоруссии, Украины и Молдавии) на восток до Якутии и Хабаровского края. К северу очаги туляремии местами распространяются до Полярного круга, на юге они имеются в Крыму, Закавказье и некоторых республиках Средней Азии. Таким образом, эта инфекция, в отличие от большинства других природно-очаговых болезней, встречается во всех без исключения равнинных ландшафтных зонах, в том числе в тундровой, лесной, лесостепной, степной, а местами проникает и в горные районы. Источники туляремийной инфекции, пути ее циркуляции в природе, а также условия заражения человека неодинаковы в различных местах. В эпидемиологическом отношении туляремия определяется как зооноз (инфекция, циркулирующая среди животных, которой заболевают и люди), имеющий природную очаговость, поддерживаемую в основном дикими грызунами и кровососущими членистоногими. Для эпидемиологии туляремии характерна не только множественность источников инфекции и путей ее передачи, но и значительное разнообразие условий, при которых возможно заражение. Одной из основных особенностей туляремии является приуроченность возникновения заболеваний людей к сельской местности, что связано с природной очаговостью этой инфекции и отсутствием условий для распространения ее в крупных городах среди домовых грызунов. Случаи заражения туляремией людей в условиях города редки и бывают связаны с завозом из сельской местности инфицированных продуктов или животных. Частыми источниками инфекции являются обыкновенные полевые и домовые мыши, водяные крысы, в меньшей мере зайцы, ондатры, хомяки и некоторые другие грызуны. Эти виды животных болеют остро, с массивным обсеменением туляремийными микробами органов и тканей, что при высокой численности грызунов приводит к туляремийным эпизоотиям. Переносчиками возбудителей туляремии являются кровососущие членистоногие: иксодовые и гамазовые клещи, слепни, комары, блохи. Из домашних животных туляремией болеют овцы, свиньи, крупный рогатый скот. Различают следующие пути заражения туляремией человека: при контакте с больными грызунами или их выделениями; при употреблении пищевых продуктов и воды, инфицированных выделениями грызунов; воздушно-пылевой путь при обработке зараженных зерновых продуктов и фуража; через переносчика, путем инокуляции (передачи возбудителя при кровососании) возбудителя кровососущими членистоногими. Одной из характерных эпидемиологических особенностей туляремии является почти 100 %-ная восприимчивость к ней человека без различия в возрасте, а также то, что больные люди не опасны для здоровых. Люди, перенесшие заболевание, приобретают стойкий иммунитет.
Патогенез и патанатомия Возбудитель туляремии может проникать в организм человека различными путями, что обусловливает многообразие его клинических проявлений. Входными воротами могут быть кожа, миндалины, слизистая глаз, дыхательные пути, желудочно-кишечный тракт. Внесение инфекта (инфекционного начала) при туляремии на слизистые оболочки или кожу человека еще не означает обязательности развития болезни, так как имеет значение ряд дополнительных факторов: состояние организма (его сопротивляемость), доза инфекта, болезнетворные свойства данного штамма возбудителя. Вслед за внедрением возбудителя (нередко с развитием первичного аффекта в месте входных ворот) следует его распространение вместе с током лимфы. Занос туляремийных бактерий в регионарные лимфатические узлы и их размножение вызывают воспалительные явления — лимфаденит (см.). Гибель бактерий сопровождается высвобождением эндотоксина, который усиливает развитие местного патологического процесса, а при поступлении в кровь вызывает интоксикацию организма. Если барьерная функция лимфатического аппарата оказывается нарушенной, туляремийные бактерии проникают в кровь (бактериемия) и распространяются по всему организму. Возникает генерализованная (распространенная) инфекция со специфическим поражением внутренних органов (селезенка, печень, легкие) и аллергизацией организма, имеющей большое значение в механизме развития туляремии. Таким образом, можно представить следующую схему механизма развития туляремии: — внедрение и первичная адаптация возбудителя инфекции; — фаза лимфогенного заноса; — фаза первичных регионарно-очаговых и общих реакций; — фаза гематогенных метастазов и генерализации; — фаза вторичной полиочаговости; — фаза реактивно-аллергических изменений; — фаза обратного метаморфоза и выздоровления. В пораженных внутренних органах и лимфатических узлах формируются специфические туляремийные гранулемы бело-желтого цвета, по внешнему виду они схожи с туберкулезными; со временем они подвергаются омертвению и замещаются соединительной тканью. Гранулематозный процесс наиболее выражен в регионарных лимфатических узлах, где развивается первичный лимфаденит (бубон). При нагноении и вскрытии бубона на коже образуется длительно не заживающая язва. Во вторичных бубонах, возникающих при распространении инфекции, гранулематозные и некротические изменения не сопровождаются нагноением.
Клиническая картина Инкубационный период при туляремии составляет в среднем 3–7 дней. Заболевание начинается остро, без продрома. Отмечается озноб, температура повышается до 38–40 °C. В дальнейшем она часто приобретает ремиттирующий или интермиттирующий характер. Развиваются головная боль, головокружение, мышечные боли, слабость. Лицо больного покрасневшее и отечное. Отмечаются инъекция сосудов склер и покраснение конъюнктив. Иногда бывает сыпь — эритематозная, макулопапулезная, розеолезная или петехиальная. Обнаруживаются лимфадениты (см.), локализация которых зависит от клинической формы туляремии (входных ворот). У части больных на 3—5-й день болезни возникает сухой кашель (см.). У большинства больных выявляется увеличение печени (со 2-го дня) и селезенки (с 5—8-го дня). Длительность лихорадочного периода при туляремии колеблется от 5–7 до 30 дней. Общая продолжительность заболевания в среднем составляет 16–18 суток. В крови в первые дни болезни наблюдается умеренное увеличение количества лейкоцитов, повышение СОЭ.
Макропрепарат легкого при туляремии

Макропрепарат селезенки при туляремии
Клинические формы туляремии различаются по локализации процесса: — туляремия с поражением кожи, слизистых оболочек и лимфатических узлов (бубонная, язвенно-бубонная, глазо-бубонная, ангинозно-бубонная); — туляремия с преимущественным поражением внутренних органов; — генерализованная форма. По длительности течения выделяют острую, затяжную и рецидивирующую туляремию; по тяжести — легкую, средней тяжести и тяжелую формы. Бубонная форма туляремии возникает обычно при проникновении инфекции через кожу и характеризуется развитием воспалительного процесса в регионарном лимфатическом узле, где накапливается возбудитель. Бубоны бывают одиночными и множественными. Чаще всего поражаются подмышечные, паховые и бедренные лимфатические узлы. Обычно бубон безболезненный, подвижный (окружающая его подкожная клетчатка незначительно вовлекается в воспалительный процесс). Кожа над бубоном не спаяна с ним и сохраняет нормальную окраску. Эволюция бубонов различна, они могут медленно рассасываться, в других случаях через 3–4 недели и позже туляремийные бубоны могут нагнаиваться, иногда наступает склерозирование бубонов. При язвенно-бубонной форме туляремии на месте внедрения возбудителя возникает первичный аффект. При этом с 1-го по 7-й день последовательно появляются пятно, папула (узелок), везикула (пузырек), пустула (гнойный пузырек), кратерообразная малоболезненная язва с приподнятыми краями. Язва покрывается темной корочкой со светлым шелушащимся ободком («кокардой»). Иногда имеется местный лимфангит. Поражение регионарных лимфатических узлов (лимфаденит) протекает по типу первичных бубонов. Глазо-бубонная форма развивается при попадании возбудителя на слизистую оболочку глаз. Она характеризуется резко выраженным конъюнктивитом (см.) с гиперплазией фолликулов и эрозивно-язвенными изменениями на слизистых оболочках пораженного глаза, сопровождается выделением густого желтоватого гноя. Роговица редко вовлекается в патологический процесс. Общее состояние больного обычно тяжелое, течение заболевания длительное. Ангинозно-бубонная (см.) форма туляремии возникает при проникновении возбудителей с инфицированной пищей и водой. Отмечаются боли в горле, затрудненное глотание, краснота зева. Миндалины увеличены, с некротическими налетами, которые спаяны с подлежащей клетчаткой, трудно снимаются, но за пределы миндалин не распространяются. Как правило, поражается одна миндалина. У больных появляются шейные, околоушные, подмышечные бубоны. Абдоминальная форма туляремии обусловлена воспалительным процессом в мезентериальных лимфатических узлах. Одновременно с симптомами общей интоксикации отмечаются боли в животе, тошнота, рвота (см.), анорексия (отсутствие аппетита). При прощупывании выявляют болезненность в области пупка и нередко — симптомы раздражения брюшины. Иногда можно прощупать увеличенные мезентериальные лимфатические узлы. Увеличены печень и селезенка. Легочная форма туляремии развивается вследствие воздушно-пылевого пути передачи. В этом случае заболевание протекает в двух вариантах: бронхитическом и пневмоническом. Бронхитический вариант, при котором поражаются лимфатические узлы грудной клетки (бронхиальные, паратрахеальные, медиастинальные), сопровождается умеренной интоксикацией, загрудинными болями, сухим бронхиальным кашлем (см.). В легких выслушиваются сухие хрипы. Заболевание длится 10–12 дней и заканчивается выздоровлением. Пневмонический вариант легочной формы туляремии характеризуется острым началом, выраженным синдромом интоксикации и затяжным течением (от 2 месяцев и более). Отмечаются сухой кашель и боли в груди. При прослушивании выслушиваются сухие и влажные мелкопузырчатые хрипы. При рентгенологическом исследовании легких обнаруживаются увеличенные прикорневые, паратрахеальные и медиастинальные лимфатические узлы. Инфильтративные изменения в ткани легких носят очаговый, реже лобарный или диссеминированный характер. Туляремийная пневмония (см.) отличается склонностью к рецидивам и осложнениям в виде бронхоэктазий (см.), абсцессов (см.), плевритов (см.). Генерализованная форма туляремии наблюдается преимущественно у ослабленных лиц. Развитие ее происходит без местных изменений. Отмечаются головная боль, общая слабость, мышечные боли, повышенная температура до 39–40 °C. Характерен неправильноремиттирующий тип температурной кривой продолжительностью до трех недель и более. больных нередко бывают спутанное сознание, бред (см.), низкое артериальное давление, глухость сердечных тонов, неустойчивость пульса. Уже в первые дни развивается увеличение печени и селезенки. В крови наблюдается умеренно выраженное повышение уровня лейкоцитов, увеличение СОЭ. В разгар заболевания у многих больных появляется розеолезная сыпь на нижних и верхних конечностях, лице, шее, груди, которая исчезает через 8—12 дней. К осложнениям этой формы туляремии относят вторичную пневмонию (см.), менингит (см.), менингоэнцефалит, инфекционный психоз, миокардиодистрофию, полиартрит (см.). Прогноз при туляремии благоприятный. Смертность не превышает 0,5 % и имеет место лишь при генерализованной, легочной и абдоминальной формах.

Подмышечный бубон при туляремии
Палец больного туляремией (язва)

Глазо-бубонная форма туляремии

Ангинозно-бубонная форма туляремии
Диагностика и дифдиагностика В диагностике туляремии, кроме учета клинических симптомов болезни, большое значение имеют тщательно собранные данные опроса. В первые дни болезни (до появления бубонов) диагностика туляремии представляет значительные трудности. При появлении бубонов диагностика облегчается. Туляремию необходимо дифференцировать с бубонной формой чумы (см.), сибирской язвой (см.), вульгарным лимфаденитом (см.), ангиной Венсана (см.), дифтерией (см.), туберкулезом (см.), сыпным, брюшным и возвратным тифом (см.). Для подтверждения диагноза применяют биологический, серологический и аллергический методы исследования. Биологический метод заключается в заражении лабораторных животных пунктатом бубонов, отделяемым конъюнктивы и кровью. Из серологических методов исследования применяют реакцию агглютинации с туляремийным диагностикумом. Диагностическим титром считается титр 1:100 и выше. Более чувствительной считается реакция пассивной гемагглютинации. Ранним методом диагностики является кожно-аллергическая проба с туляремином (0,1 мл внутрикожно), которая становится положительной с третьего — пятого дня болезни. Учет реакции производят через 24–48 ч.
Лечение и профилактика Ведущая роль принадлежит антибактериальным препаратам. Назначают стрептомицин, тетрациклин, левомицетин. Стрептомицин назначают по 1,0 г в сутки в течение 8—10 дней. При легочной и генерализованотдых в районы, неблагоприятные по туляремии. Для химиопрофилактики используется оксициклин внутрь по 100 мг 2 раза в сутки в течение 14 дней. По эпидемиологическим показаниям проводится специфическая профилактика.
♦ У ♦
УВЕИТ
ОпределениеУвеит — воспаление сосудистой оболочки (увеального тракта) глаза.Различают передний и задний отделы глазного яблока. Воспаление переднего отдела — радужки и ресничного тела — носит название иридоциклита (см.), или переднего увеита; а заднего отдела, или сосудистой оболочки, — хориоидита (см.), или заднего увеита. Воспаление всего сосудистого тракта глаза называют иридоциклохориоидитом, или панувеитом.
Этиология и патогенез Среди причин развития увеитов выделяются следующие: — бактериальные инфекции (туберкулез, сифилис, стрептококки и др.); — вирусные (грипп, аденовирусы и др.); — простейшие (токсоплазмоз, плазмодии малярии); — гельминты и продукты их жизнедеятельности (аскариды, цистицерки); — общие заболевания невыясненной этиологии (саркоидоз, лимфогранулематоз, коллагенозы и др.); — эндокринные и болезни обмена веществ (диабет, подагра, тиреотоксикоз); — прочие. Основной причиной заболевания является инфекция. Инфекция проникает из внешней среды при проникающих ранениях глаза и прободных язвах роговицы и из внутренних очагов при общих заболеваниях. В механизме развития увеита большую роль играют защитные силы организма человека. В зависимости от реакции сосудистой оболочки глаза различают атопические увеиты (см.), связанные с действием аллергенов внешней среды (пыльца растений, пищевые продукты и др.); анафилактические увеиты (см.), обусловленные развитием аллергической реакции на введение в организм иммунной сыворотки; аутоаллергические увеиты, при которых аллергеном является пигмент сосудистой оболочки или белок хрусталика; микробно-аллергические увеиты, развивающиеся при наличии в организме очаговой инфекции.
Клиническая картина и диагностика Наиболее тяжелой формой увеита является панувеит (иридоциклохориоидит). Он может протекать в острой и хронической формах. Острый панувеит развивается в связи с заносом микробов в капиллярную сеть сосудистой оболочки или сетчатки. Проявляется резкими болями в глазу и снижением зрения. В процесс вовлекаются радужка и ресничное тело, а иногда стекловидное тело и все оболочки глазного яблока. Хронический панувеит развивается в результате воздействия бруцеллезной и туберкулезной инфекции или герпетического вируса, встречается при саркоидозе (см.) и синдроме Фогта — Коянаги. Заболевание протекает длительно, с частыми обострениями. Чаще всего поражаются оба глаза, снижается зрение. При сочетании увеита с саркоидозом (см.) наблюдается лимфаденит (см.) шейных, подмышечных и паховых лимфатических желез, поражается слизистая дыхательных путей. Периферический увеит поражает людей 20—35-летнего возраста, поражение обычно бывает двусторонним. Заболевание начинается со снижения зрения и светобоязни. В дальнейшем в связи с помутнением стекловидного тела и его отслаиванием наступает резкое снижение зрения. При периферическом увеите возможны следующие осложнения: катаракта (см.), вторичная глаукома (см.), вторичная дистрофия сетчатки в макулярной области, отек диска зрительного нерва. Основой диагностики увеита и его осложнений является биомикроскопия глаза. Используются и общепринятые методы исследования.
Лечение Лечение острого увеита заключается во внутримышечном введении антибиотиков, введении их под конъюнктиву, ретробульбарно, в переднюю камеру глаза и стекловидное тело. Создают покой органу и накладывают повязку на глаз. При хроническом увеите наряду со специфической терапией назначают гипосенсибилизирующие препараты и иммунодепрессанты, а по показаниям проводят иссечение шварт (спаек) стекловидного тела. Терапия периферического увеита ничем не отличается от лечения других форм увеита.
УВЕОПАРОТИТ
ОпределениеУвеопаротит — синдром Хеерфордта-Милиуса, характеризуется сочетанием двустороннего паротита с двусторонним увеитом. Встречается чаще у женщин.
Этиология и патогенез Факторы возникновения не выяснены. Механизм развития изучен недостаточно. В слюнных и слезных железах в воспалительной жидкости обнаружили эпителиальные и гигантские клетки.
Клиническая картина В клинике увеопаротита имеется двустороннее безболезненное увеличение околоушных желез, поражение сосудистого тракта глаза, повышение температуры тела до 38,5 °C, иногда парез лицевого нерва, носящий временный характер. Иногда, в связи с параличом преддверно-улиткового нерва, развивается глухота (см.). При развитии менингоэнцефалита (см.) наблюдаются светобоязнь, судороги, головная боль, рвота. При сочетании увеопаротита с саркоидозом наблюдается лимфаденит шейных, подмышечных и паховых лимфатических желез, поражается слизистая дыхательных путей.
Лечение Специфическое лечение отсутствует. Назначается симптоматическое лечение. Оно направлено на повышение иммунного статуса (кортикостероиды, поливитамины), жаропонижающие и обезболивающие средства, высококалорийное питание, физиопроцедуры, ингаляции, на этапе выздоровления — лечебная гимнастика.
УГРИ
ОпределениУгри (юношеские) — заболевание кожи, возникающее преимущественно в пубертатном возрасте и характеризующееся гнойновоспалительным поражением сальных желез на фоне себореи. Различают угри обыкновенные, келоидные, красные, некротические, медикаментозные, профессиональные и др.
Этиология, патогенез и патанатомия Причины болезни остаются невыясненными. В механизме развития основная роль отводится себорее (см.), снижающей бактерицидный эффект кожного сала и приводящей к активизации кокковой флоры. Угри обыкновенные (юношескиеугри) развиваются у юношей и девушек в период полового созревания и постепенно исчезают к 25–30 годам.
Угри в виде узелков с гнойной коркой
Патоморфологически отмечаются себорея (см.), гиперплазия сальных желез, гиперсекреция кожного сала, гиперкератоз (см.), ведущий к образованию комедонов — сальнороговых пробок в протоках сальных желез с частичной или полной их закупоркой, имеющих вид черных точек.
Клиническая картина Клинически наблюдается разнообразие элементов сыпи, локализующейся на коже лица, верхней половине груди и спины, где располагаются наиболее крупные сальные железы. В основании угревых элементов возникает воспалительный процесс, расплавляющий местные ткани с образованием гноя. Пустула (гнойный пузырек), вскрываясь, освобождается от содержимого, засыхая, образуются корки, по снятии которых остаются синюшно-розовые рубцы. Глубокие угри болезненны. Клиническая картина многообразна, с непрерывным многолетним течением процесса.
Лечение и профилактика Лечение длительное и требует выдержки. Оно направлено на устранение себореи (см.), ограничение жирной, острой и сладкой пищи. Лечение зависит от характера, глубины и распространенности процесса. В тяжелых случаях назначаются третиноины (роаккутан), антибиотики, аутогемотерапию (переливание собственной крови), антистафилококковый гамма-глобулин, витамин А по 100 МЕ в день до 2 месяцев, эстрогены (фолликулин, диэтилстильбэстрол). Местно — обтирания 2–3 %-ным раствором борной или салициловой кислоты, УФ-облучение, нанесения жидкого азота, диатермокоагуляция сыпи. Комедоны удаляют, абсцедирующие угри вскрывают. Профилактика юношеских угрей заключается в лечении себореи (см.).
УЖАЛЕНИЯ СКОРПИОНА
ОпределениеВ состав яда скорпиона входят нейротоксины, воздействующие на нервы.
Клиническая картина Отмечается острая мучительная боль в месте ужаления, возникающая сразу и сохраняющаяся 1—24 ч и более. В месте укуса развиваются неприятные ощущения, возможны развитие отека и покраснение кожи, воспаление лимфатических сосудов, появление единичных крупных пузырей на коже вблизи места введения яда. Общая интоксикация при ужалении скорпионами, обитающими в России, возникает не всегда и бывает нетяжелой: потливость, слезотечение, слюнотечение, носовая и бронхиальная гиперсекреция (учащенное дыхание, кашель, хрипы в легких), учащение сердцебиения, «гусиная кожа». Это может сочетаться с болью в животе, поносом, рвотой. Температура может быть не очень высокой, артериальное давление нормальное или слегка повышенное; могут быть легкие мышечные подергивания.
Лечение Следует смазать место поражения растительным маслом (хлопковым, подсолнечным), приложить к нему тепло (грелку с теплой водой). Место укуса обкалывают раствором новокаина. Общая интоксикация купируется атропином, антигистаминными препаратами.
УКУСЫ ЖИВОТНЫХ
ОпределениеЧаще всего кусают домашние собаки, реже — кошки и дикие животные, опасны укусы бешеных животных и змей.
Клиническая картина Укушенные раны имеют неровные края, нередко с дефектом тканей, загрязнены слюной животных.
Диагностика Диагноз ставится на основании истории заболевания — известное или неизвестное животное нанесло укусы, домашнее или дикое, определяют местонахождение и размер раны, наличие кровотечения.
Лечение Если пострадавшего укусила домашняя собака и рана небольшая, то достаточно произвести туалет раны, наложить стерильную повязку и решить вопрос об антирабической вакцинации в травматологическом пункте. Укушенные раны больших размеров от неизвестной собаки или другого животного, подозрительного в отношении бешенства, требуют госпитализации, как и обширные и множественные раны, раны лица, головы, кистей рук.
УКУСЫ ЗМЕЙ
Этиология и патогенез По механизму токсического действия яды всех видов змей разделяются на следующие виды. 1. Преимущественно курареподобного действия, вызывающие паралич двигательной и дыхательной мускулатуры, угнетение дыхательного и сосудодвигательного центров, — яды кобры и других змей семейства аспидов. 2. Преимущественно геморрагического, свертывающего кровь и местного отечнонекротического действия. Это яды гадюковых — гюрзы, эфы, обыкновенной гадюки, также щитомордника обыкновенного. 3. Яды, обладающие как курареподобным, так и геморрагическим, свертывающим кровь, отечно-некротическим действием (гремучие змеи Центральной и Южной Америки, австралийские аспиды, некоторые виды гадюковых тропической фауны, обитающие на Ближнем Востоке и Африке). Среднеазиатская кобра миролюбива, укусы ее редки, но очень опасны; яды всех остальных змей относятся ко второй группе.Клиническая картина При укусах кобры и других змей первой группы в зоне укуса возникают острая боль, чувство онемения, неприятные ощущения, быстро распространяющиеся на всю пораженную конечность, затем и на другие части тела. Изменения в зоне укуса очень незначительны. Отмечаются головокружение, снижение артериального давления, обморок, чувство онемения в области лица и языка, нарушение речи и глотания, быстро возникает восходящий паралич, начинающийся с нижних конечностей (неустойчивая походка, затем невозможность стоять на ногах и передвигаться, полный паралич) и распространяющийся на туловище и дыхательную мускулатуру. Дыхание вначале кратковременно учащается, затем становится редким, сердечная деятельность аритмична. Тяжесть и темп развития интоксикации (отравления) — от полного отсутствия признаков отравления до крайне тяжелых форм, быстро приводящих к смертельному исходу. Наиболее тяжелые случаи развиваются при попадании яда в кровеносный или лимфатический сосуд (летальный исход наступает через 10–20 мин после укуса); обычно интоксикация (отравление) достигает наибольшей выраженности через 4 ч. Состояние больного крайне тяжелое в течение первых 24–36 ч, по течению волнообразное с повторными обмороками и угнетением дыхания. Более тяжело отравление протекает у детей и женщин, у лиц в состоянии алкогольного опьянения. При укусах змей семейства гадюковых и рода щитомордников, яды которых относятся ко второй группе, на месте укуса четко видны две глубокие колотые ранки. Уже в первые минуты возникают покраснение, затем отечность и точечные кровоизлияния, быстро распространяющиеся от места укуса во всех направлениях. Постепенно укушенная часть тела становится все более отечной, кожа над отеком лоснится, приобретает багрово-синюшную окраску, покрывается точечными и пятнистыми кровоизлияниями типа кровоподтеков. На ней могут образовываться пузыри с серозно-кровянистым содержимым, в зоне укуса — язвы. Ранки от укуса могут длительно кровоточить. В пораженной конечности развивается воспаление лимфатических сосудов, оно распространяется на регионарные лимфатические узлы. Мягкие ткани в зоне укуса пропитываются кровянистой жидкостью; отек распространяется в тяжелых случаях на всю конечность, содержит большое количество гемоглобина и эритроцитов, вследствие чего развивается тяжелая внутренняя кровопотеря, достигающая 2–3 л. Кроме местной кровопотери, возникают кровоизлияния в органы и серозные оболочки. Общетоксические проявления: возбуждение, сменяющееся резкой слабостью, бледность кожных покровов, головокружение, малый и частый пульс, снижение артериального давления; возможны обморочные состояния, тошнота, рвота. Кроме того, развивается тяжелый шок, уменьшается объем циркулирующей крови, снижается центральное венозное давление, развивается анемия. При легких формах отравления общетоксические признаки выражены слабо. Максимальной выраженности признаки интоксикации достигают через 8—24 ч. При неадекватном лечении состояние больного остается тяжелым в течение 2–3 дней после укуса.
Осложнения Возникают длительно не заживающие раны, гангрены, нагноение раны. Чаще всего осложнения связаны с неправильным оказанием первой помощи и дополнительной травматизацией тканей прижиганиями, перетяжками.
Лечение Немедленное интенсивное отсасывание яда из ранок, что позволяет удалить 30–50 % введенного змеей яда. Отсасывание производится как самим пострадавшим, так и сопровождающими. Процедура безопасна, так как яд, попавший в желудок, отравления не вызывает. Продолжительность отсасывания 10–15 мин; важно, чтобы пораженная конечность при этом оставалась неподвижной, так как движения усиливают лимфоотток и ускоряют поступление яда в общий кровоток. Необходимо обеспечить покой в положении лежа и неподвижность пораженной конечности, для чего ее фиксируют лангеткой или повязкой. Противопоказаны прижигания места укуса, обкалывание его любыми препаратами, разрезы. Наложение жгута на пораженную конечность противопоказано, так как усугубляет тяжесть интоксикации, усиливает патологические проявления в пораженной конечности. Только при укусах кобры, яд которой не вызывает местных нарушений обмена веществ тканей и быстро распространяется по сосудам, допустимо для замедления развития общей интоксикации наложение жгута выше места укуса на 30–40 мин. Показано обильное питье, алкоголь противопоказан категорически. При снижении артериального давления начинается инфузионная (внутривенная) терапия кристаллоидами, альбумином, плазмой; вводятся глюкокортикоиды, что предупреждает анафилактическую реакцию на последующее введение специфической противоядной сыворотки. Наиболее эффективны моновалентные сыворотки. При укусах гадюки обыкновенной, степной, щитомордника в большинстве случаев сывороточная терапия не показана, поскольку интоксикация хорошо поддается лечению традиционными средствами. Сыворотка вводится по Безредке по 30–40 мл при укусах кобры в связи с быстрым прогрессированием отравления (паралич, нарушение дыхания). Сыворотка вводится внутривенно вслед за введением гидрокортизона. При укусах кобры и других змей, помимо сывороток, внутривенно вводится 0,5 мл 0,1 %-ного раствора атропина и в последующем внутривенно вводится 3–6 мл прозерина. Этим ослабляется курареподобное действие яда.
УКУСЫ КАРАКУРТА
ОпределениеКаракурт — ядовитый паук, распространенный в Средней Азии, Казахстане, Нижнем Поволжье, в Крыму, приазовских и причерноморских степях. Яд нейротоксичен.
Этиология и патогенез В большинстве случаев укусам подвергаются спящие в затененных местах люди. Яд каракурта нейротоксичен, вызывает высвобождение ацетилхолина в нейромышечных синапсах, а также норадреналина, допамина и альфааминобутирата в синапсах центральной нервной системы.
Клиническая картина Укус малоболезненный и часто не ощущается пострадавшим, местная реакция на яд отсутствует или очень слабо выражена — вокруг места укуса может быть побледнение кожных покровов диаметром несколько сантиметров, окруженное ободком слабого покраснения, но чаще найти место укуса трудно. Общие токсические явления развиваются очень быстро (через 5—30 мин) и быстро прогрессируют от легких до очень тяжелых случаев с летальным исходом. Для выраженных проявлений характерны мучительные мышечные боли, сочетающиеся с неприятными ощущениями в конечностях, пояснице, животе, грудной клетке. Больные возбуждены, покрыты холодным потом, у них выражен страх смерти, лицо напряженное, красное, мимика бедна, выражение лица страдальческое, наблюдается слезотечение. Вскоре после укуса развивается резкая мышечная слабость, особенно в нижних конечностях, больные с трудом передвигаются, не могут стоять на ногах. Болевой синдром сочетается с выраженным напряжением мышц. Проявления могут напоминать признаки острого живота, так как развивается напряжение мышц передней брюшной стенки. Язык сухой, перистальтика кишечника ослаблена, газы не отходят, выражен лейкоцитоз с повышением температуры тела. Правильный диагноз легко поставить, учитывая напряжение мышц конечностей, спины, затылочных мышц (запрокинутая голова, положительный симптом Кернига), дрожание, судорожные подергивания, нарушение функции дыхательной мускулатуры, спазм сфинктеров (узкие зрачки, задержка мочи при перерастянутом мочевом пузыре, повышенное артериальное давление). В крайне тяжелых случаях больной апатичен, сознание спутанное, иногда возникают психотические реакции, артериальное давление снижается, дыхание затруднено, развивается отек легких (влажные хрипы, пенистая мокрота). У некоторых больных появляется сыпь на коже. При легкой форме отравления признаки купируются к концу 1-х суток, при формах средней тяжести и тяжелых могут длиться 3–4 дня.
Лечение Необходимо внутривенное введение растворов хлорида кальция и сульфата магния. При усилении болевого синдрома через 1,5–2 ч их введение повторяют. Эффективна антикаракуртная сыворотка при ее раннем введении. Рекомендуются обезболивающие, симптоматические средства. При задержке мочи производится катетеризация.
УКУСЫ КРЫСАМИ (СОДОКУ)
ОпределениеСодоку — острое инфекционное бактериальное заболевание, поражающее человека, протекающее с повторяющимися приступами лихорадки, сопровождающимися воспалительными изменениями в месте укуса, воспалением регионарных лимфатических узлов, разнообразными высыпаниями.
Этиология и патогенез Заболевание вызывают спирохеты — патогенные бактерии извитой формы, которые имеют низкий уровень устойчивости к факторам воздействия внешней среды. Основным источником и резервуаром заболевания являются крысы.
Клиническая картина Инкубационный период в среднем продолжается 2 недели, но может составлять от 3 дней до 2 месяцев. Заболевание начинается остро с повышения температуры тела до очень высоких цифр (40 °C и выше), озноба, ощущения разбитости, сильных головных и мышечных болей. В зажившей от укуса ранке развиваются воспалительные изменения, покраснение, сильная боль. В ряде случаев появляется пузырь, в результате чего на месте укуса образуется глубокая язва. Одновременно развивается воспаление регионарных лимфатических узлов. Лихорадка держится в течение нескольких дней, затем температура резко падает, что сопровождается обильной потливостью. В этот период отмечается улучшение состояния, уменьшение признаков местных проявлений. Затем, через несколько дней, вновь начинается лихорадочный период со всеми его проявлениями. В зависимости от тяжести заболевания, количество лихорадочных периодов колеблется от 2 до 4. По мере развития заболевания длительность лихорадочных периодов сокращается, а безлихорадочных — удлиняется. На 3—4-й лихорадочный период возникает разнообразная сыпь, которая не сопровождается кожным зудом и шелушением. Осложнения заболевания: возможно воспаление слизистой оболочки глаз, воспаление сумки суставов, поражение центральной нервной системы с развитием двигательных и чувствительных расстройств. Летальность в настоящее время сведена к нулю.
Лечение Обязательно должно проводиться в инфекционном стационаре. Большое значение имеет уход за больным и полноценное сбалансированное питание. Хороший эффект наблюдается от применения антибактериальных препаратов, которые лежат в основе лечения причины заболевания. Параллельно проводится лечение текущих симптомов и общего отравления организма.
Профилактика В основе профилактики лежат мероприятия, направленные на сокращение численности грызунов.
УКУСЫ ЧЛЕНИСТОНОГИМИ (ПЧЕЛАМИ, ОСАМИ, ШМЕЛЯМИ)
Клиническая картина Одиночные ужаления вызывают ограниченную местную болевую и воспалительную реакции, чувство жжения, покраснение, отек, особенно при укусе в лицо шею, слизистую оболочку рта. Общетоксические явления отсутствуют или слабо выражены: озноб, тошнота, головокружение, сухость во рту. Более тяжелые поражения связаны не с интоксикацией (отравлением), а с повышенной чувствительностью (аллергической реакцией) к насекомым и их ядам.Лечение При ужалении пчелой нужно удалить из ранки жало пинцетом или пальцами; смазать место ужаления спиртом или эфиром, приложить к нему холод. При множественных ужалениях подкожно вводят адреналин, дают больному антигистаминные средства (димедрол, пипольфен, супрастин), горячее питье. Аллергические (гиперергические) реакции на ужаление очень опасны, быстро развиваются и могут привести к смерти.
Клиническая картина Гиперергические реакции на ужаление могут быть местными, ограниченными (выраженный местный отек кожи и подкожной клетчатки), общими и смешанными с преобладанием местных или общих нарушений. Общая реакция может быть: — кожной или кожно-суставной (крапивница, боли в суставах); — циркуляторной (анафилактический шок); — отечно-асфиксической (отек Квинке, отек гортани, удушье); — бронхоспастической или астматической (одышка, сухие свистящие хрипы); — смешанной. Любое из этих проявлений может развиться в первые минуты после ужаления, но возможно и через 30–60 мин. Хотя большинство смертей при аллергических реакциях на яды насекомых наступает в течение первого часа после ужаления, интенсивное наблюдение за пострадавшим должно продолжаться не менее 3 ч.
Лечение Требуются холод на место укуса, подкожное введение 1 мл 0,1 %-ного раствора адреналина. Необходима инфузионная (внутривенная) терапия глюкозой с преднизолоном, антигистаминными препаратами. Вводятся обезболивающие средства. При удушье в результате отека языка и гортани производят трахеостомию (наложение дыхательного отверстия). При развитии тяжелого астматического синдрома дополнительно необходимы ингаляции алупента или гормональных препаратов.
УРЕМИЯ
ОпределениеУремия — синдром аутоинтоксикации, развивающийся при выраженной почечной недостаточности в результате задержки в организме азотистых метаболитов, расстройства водно-солевого, кислотно-щелочного и осмотического гомеостаза, сопровождающийся вторичными обменными и гормональными нарушениями, общей дистрофией тканей и дисфункций всех органов и систем.Уремия — это клинико-биохимическое проявление выраженной острой или хронической почечной недостаточности (см.).
Этиология Острая уремия обусловлена нарушением системной и внутрипочечной циркуляции крови вследствие шока (см.), отягощенного патологическим активированием гемостаза и фибринолиза, массивным гемолизом, иммунным цитолизом. Шок может быть результатом инфекции, нарушения водно-электролитного или кислотно-щелочного баланса. При остром интерстициальном нефрите, пиелонефрите, протекающих с анурией, развивается уремия ренального происхождения. Если нарушена проходимость в мочеточниках, то может развиться постренальная уремия. Причиной хронической уремии являются: гломерулонефрит, пиелонефрит, поликистоз почек, сахарный диабет, аденома простаты, почечнокаменная болезнь.
Патогенез В первую очередь надо иметь в виду интоксикацию продуктами обмена веществ, в норме выводящимися из организма с мочой. Задерживаются такие вещества белкового обмена веществ, как мочевина, аммиак, креатинин, мочевая кислота, альфа-2-глюкопротеин, пептиды, аминокислоты, амины, глюкуроновая и щавелевая кислоты и др. Признаками уремии являются: головная боль, повышенная утомляемость, тошнота, рвота, кожный зуд, нарушение сна, гипотермия, вначале беспокойство, потом чувство безразличия. Развиваются анемия (см.), отек легких (см.), дистрофия миокарда, сердечная недостаточность, поражается желудочнокишечный тракт, изъязвляются слизистые оболочки желудка и кишечника.
Клиническая картина При уремии поражаются многие органы и системы органов, потому и симптомы заболевания многочисленны и разнообразны. Характерен внешний вид больных с уремией. Они вялы, бледны, сонливы. Кожа сухая, дряблая, коричневатая, на ней могут быть кристаллы мочевины — «уремическая пудра». Появляются зуд кожи и расчесы. Развиваются бурситы и синовиты, мышечная слабость, миопатия (см.). Нарушается внимание, появляются галлюцинации, бред. Появляются полиневриты парестезии (см.). Нарушаются вкус и обоняние, ухудшается зрение. Дыхание Куссмауля, а при тяжелом ацидозе — Чейна-Стокса. Постоянно беспокоит чувство жажды. Удовлетворение ее ведет к «водному отравлению», застою в легких и их отеку. Выслушиваются влажные хрипы, появляются признаки дыхательной недостаточности. Развиваются признаки сердечной, а затем и легочно-сердечной недостаточности. Констатируются плеврит (см.) и перикардит (см.), появляются боли в груди, шум трения перикарда, лихорадка, лейкоцитоз.
Лечение Лечение больного складывается из комплекса мероприятий: лечебных, диеты, диализа крови, пересадки почки. При острой почечной недостаточности ведут борьбу с шоком, инфекцией, отравлением, гемолизом, обструкцией мочевых путей и направляют на специализированное лечение в почечный центр. При хронической уремии лечение направлено на выведение азотистых шлаков — диализ и формирование режима питания. Особое внимание уделяется коррекции нарушений водно-солевого баланса, стимуляции эритропоэтинов, замещению дефицита железа и фолиевой кислоты. При отсутствии должных результатов лечения прибегают к пересадке почки (см.). При проведении диализа крови, по показаниям, больные могут прожить до двух десятков лет.
УРЕТРИТ
ОпределениеУретрит — воспаление мочеиспускательного канала.
Этиология и патогенез Уретриты бывают гонококковые и негонококковые. Гонококковая инфекция вызывает гонорейные уретриты; негонорейные уретриты могут быть инфекционными и неинфекционными. Инфекционный уретрит вызывается бактериями, вирусами, спирохетами, трихомонадами, амебами и др. Неинфекционные уретриты возникают при повреждении мочеиспускательного канала в ходе диагностических и лечебных процедур (травматический уретрит), а также как реакция на пищевые и медикаментозные аллергены (аллергический уретрит). По локализации патологического процесса различают передний, задний и тотальный уретрит. Инфекция со слизистой оболочки мочеиспускательного канала внедряется в лакуны и железы, вызывая воспаление. При венерическом уретрите возможно одновременное заражение двумя и более возбудителями (трихомонады, хламидии и др.). Морфологические изменения при уретритах различного происхождения практически однотипны.
Клиническая картина и диагностика Различают острый и хронический уретрит. При острых уретритах находят расширение сосудов, лейкоцитарную инфильтрацию, на отдельных участках — разрушение слизистой оболочки уретры. При хроническом уретрите воспалительные образования приобретают очаговый характер, при рассасывании воспалительной жидкости образуются рубцы, иногда ведущие к сужению мочеиспускательного канала — стриктурам. При химических и термических уретритах наблюдается омертвение слизистой оболочки. Признаки уретритов, независимо от причины их возникновения, во многом схожи. Разница лишь в степени тяжести воспалительного процесса. При остром уретрите беспокоят боль в уретре, чувство жжения при мочеиспускании, выделения из мочеиспускательного канала. При осмотре отмечают гиперемию (покраснение) и отек наружного отверстия мочеиспускательного канала, обильное гнойное отделяемое; ощупывание задней стенки уретры болезненно. При затянувшихся уретритах воспаление распространяется на задний отдел уретры и даже на шейку мочевого пузыря, переходя в тотальный уретрит. По характеру течения он может быть острым и хроническим. Острый тотальный уретрит проявляется частыми мочеиспусканиями, болями, выделением гноя в конце мочеиспускания, а иногда гематурией (кровь в моче). Хронический уретрит наблюдается при недостаточно эффективном лечении острого. Жалобы связаны с невротическими расстройствами и осложнениями острого уретрита. Течение заболевания вялое, с периодическими обострениями, которые наступают под влиянием алкоголя, охлаждения, полового возбуждения; выделения из уретры скудные. Осложнения бывают и при остром, и при хроническом уретрите как со стороны мочеполовой системы, так и экстрагенитальные (поражения кожи, слизистых оболочек, суставов, глаз и др.). Наиболее частым осложнением является простатит (см.), нередко в сочетании с везикулитом (см.) и эпидидимитом (см.). Хламидийные уретриты часто осложняются конъюнктивитом (см.). Диагноз острого уретрита основывается на жалобах, данных осмотра и результатах исследования мочи, бактериоскопических и бактериологических исследований отделяемого из мочеиспускательного канала. При хроническом уретрите исследования проводят многократно; в сомнительных случаях проводят уретроскопию или ретроградную уретрографию.
Лечение и профилактика Лечение острых форм уретрита зависит от этиологического (причинного) фактора болезни. При хроническом уретрите назначаются общеукрепляющая диета и лечение сопутствующих заболеваний (анемия (см.), сахарный диабет (см.), гиповитаминоз и др.). Местное лечение зависит от локализации патологического процесса. Мочеиспускательный канал промывается антисептическими растворами перманганата калия, нитрата серебра. При трихомонадном уретрите показана специфическая терапия, при бактериальном, хламидийном и микоплазменном уретритах — хлортетрациклин по 1,5–2 г в сутки в течение трех недель, а также доксициклин, эритромицин, рифампицин и инстилляции леворина. Профилактика уретритов венерического происхождения заключается в соблюдении мер личной гигиены и общественной безопасности, также необходимы надлежащее лечение и диспансерное наблюдение.
УШИБ
ОпределениеУшиб — закрытое механическое повреждение тканей или органов без видимого нарушения их целостности.
Этиология Ушиб возникает от удара по телу человека тупым твердым предметом или от удара тела о твердый предмет. Ушиб чаще всего носит ограниченный характер.
Патогенез и патанатомия Повреждение тканей или органов при ушибах определяется характером травмирующего предмета, направлением его действия, особенностями поверхности этого предмета. Характерные патологоанатомические изменения в ушибленных тканях или органах происходят в кровеносных сосудах и нервных окончаниях тканей. При небольшом ушибе развиваются локальные нарушения микроциркуляции (см.), выражающиеся в кратковременном рефлекторном спазме сосудов с последующим их паралитическим расширением, ведущим к застойной гиперемии и серозному пропитыванию тканей (травматическому отеку). Ушибы большей интенсивности ведут к кровоизлиянию и имбибиции тканей. При повреждении крупных сосудов образуются гематомы (см.), реактивный воспалительный асептический отек (см.).
Клиническая картина и диагностика Ушибы характеризуются болью, припухлостью, кровоподтеком и нарушением функций. Особо сильные боли появляются при ушибах надкостницы, наружных половых органов и крупных нервных стволов. Кровоподтек проходит несколько стадий «цветения». Одним из осложнений является нагноение гематомы. Повышается температура тела до 38 °C и выше. Ухудшается общее состояние пострадавшего. Диагностика основывается на анализе, клинических симптомах и рентгенологических исследованиях.
Лечение В течение первых двух суток после травмы направлено на уменьшение кровоизлияния в ткани. Область ушиба орошают хлорэтилом и накладывают давящую повязку. Поверх повязки укладывают пузыри или полиэтиленовые пакеты со льдом. Для улучшения оттока крови и лимфы поврежденной конечности придают возвышенное положение. При тяжелых ушибах конечности (см.) иммобилизируют подручными средствами, затем гипсовой лангетой. При крупной гематоме или гемартрозе производят не пункцию, а удаляют кровь. Со 2—3-го дня после ушиба назначают согревающие компрессы с ронидазой, УВЧ-терапию, электрофорез с лидазой, трипсином. Через 10–12 дней назначают ЛФК.
♦ Ф ♦
ФАВИЗМ
ОпределениеФавизм — наследственная гемолитическая анемия при недостаточности фермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) в связи с употреблением в пищу или вдыханием цветочной пыльцы конских бобов.
Этиология В основе заболевания — недостаточность в эритроцитах фермента глюкозо-6-фосфат-дегидрогеназы (Г-6-ФДГ). Болеют дети до 15 лет, в основном мальчики до 15 лет, носители патологической хромосомы Х.
Патогенез Бобовые зерна ведут к уменьшению концентрации восстановленного глутатиона в эритроцитах. Дефицит Г-6-ФДГ приводит к лизису эритроцитов. При этом должно быть сочетание дефицита Г-6-ФДГ и нарушения токсина бобов.
Патологическая анатомия При фавизме отмечаются желтушность и дистрофические изменения внутренних органов, увеличение в размерах печени, селезенки, почек и др. В синусах этих органов наблюдается скопление гемотина и гемосидерина.
Клиническая картина и диагностика Заболевают фавизмом в весенние месяцы, в период цветения бобовых. Тяжесть заболевания — от слабовыраженных симптомов гемолиза до тяжелейшего гемолитического криза (см.), которому предшествуют недомогание, повышение температуры, желудочнокишечные расстройства. Признаки заболевания возникают в первые часы после приема конских бобов, редко — на 2—3-й день, а при вдыхании пыльцы — через несколько минут, появляются тошнота, рвота, понос. Различают легкие, средней тяжести и тяжелые формы фавизма. Гемолиз, вызванный вдыханием цветочной пыльцы, протекает легко, средней тяжести — вызывает картину гемолитической желтухи, с умеренной анемией и гемоглобинемией, но без гемоглобинурии. Тяжелая форма фавизма протекает с острой картиной внутрисосудистого гемолиза, желтухой, гемоглобинемией (см.), гемоглобинурией (см.), в эритроцитах полное отсутствие специфических для Г-6-ФДГ гранул. Диагноз устанавливают на основании данных опроса, клинической картины и методов, определяющих активность Г-6-ФДГ в эритроцитах. При этом надо иметь в виду регион проживания заболевшего (Азербайджан). Хронические формы повышенного гемолиза дифференцируют с талассемией, гемоглобинопатией, при которых определяется дефицит Г-6-ФДГ.
Лечение При первых признаках интоксикации показано промывание желудка и кишечника. Лечение фавизма производится комплексно в зависимости от тяжести состояния. Внутрь назначается рибофлавин по 0,015 г 2–3 раза в день, эревит внутримышечно по 2 мл в день. При тяжелом гемолитическом кризе для профилактики почечной недостаточности внутривенно вводится 5 %-ный раствор гидрокарбоната натрия (реополиглюкин противопоказан), назначается фуросемид по 40–60 мг внутривенно. Для усиления диуреза проводят повторные сеансы плазмафереза. При острой почечной недостаточности (см.) — гемодиализ (см.), пересадка почки, профилактика почечной недостаточности. Профилактика заключается в предупреждении детей от употребления в пищу конских бобов и вдыхания их цветочной пыльцы. По эпидпоказаниям — профилактические прививки.
ФАВУС
ОпределениеФавус (парша) — хроническое заболевание кожи, волосистой части головы и ногтей, вызываемое трихофитоном.
Этиология и эпидемиология Возбудитель имеет грибковую природу. Заболевание известно с глубокой древности, но Р. Ремак описал возбудителя лишь в 1837 г. Заражение происходит от больного человека или его вещей (шапка, платок, расческа). Контагиозность заболевания невелика. Чаще всего фавус находится в отдельных семьях. Кроме того, заражение может произойти от мышей и крыс.
Патогенез и патанатомия Заражению и распространению фавуса способствуют микротравмы рогового слоя эпидермиса и контакт с инфицированными вещами, снижение иммунитета и неполноценное питание. Грибок может проникать в кровь и поражать внутренние органы. Морфологическим элементом фавуса является скутула, или изиток — своеобразная корка желто-серого цвета с приподнятыми краями, что напоминает блюдечко. В начале поражается эпидермис, затем грибок проникает в дерму и фолликул волоса. Отдельные элементы, сливаясь, образуют крупные очаги с фестончатыми контурами. Скутулы состоят из массы гриба, клеток эпидермиса и жирового детрита.
Клиническая картина и диагностика Инкубационный период длится две недели. Поражается волосистая часть головы, кожи и ногти. Наблюдаются скутулярная, сквамозная, импетигинозная, инфильтративно-нагноительная, гранулематозная и др. формы фавуса. Скутулярная форма характеризуется краснотой, переходящей в пустулу с шелушением и расширением границ по периферии. Подсыхая, образуются блюдцеобразные корочки с пораженным волосом в центре — скутула. Скутулы, сливаясь, издают «мышиный» запах. По отпадении скутулярных масс обнажается скутулярная кожа. Иногда увеличиваются регионарные лимфатические железы. Кожа на месте бывших скутул становится тонкой, блестящей и гладкой. При сквамозной форме фавуса скутулы отсутствуют. Чешуйки на коже напоминают псориаз, но по снятии их обнажается гиперемированная, атрофированная кожа. У детей наблюдается импетигинозная форма фавуса. Элементы слоистые, грязножелтого цвета, трихофитоидного характера. Но появляются и пузырьки по периферии образования, и мелкие корочки, напоминающие импетиго (см.) Другие формы фавуса встречаются крайне редко. Диагноз при скутулярной форме несложен. При других формах парши производят микроскопическое исследование корок, а в сомнительных случаях — посев материала. Диффенциальной диагноз следует проводить с трихофитией (см.), микроспорией (см.), красной волчанкой, псориазом (см.) и др.
Лечение и профилактика Лечение проводят гризеофульвином в сочетании с местной терапией. Гризеофульвин принимают по 15 мг на кг веса в сутки в три приема во время еды с чайной ложкой масла. Местно: утром кожу смазывают 2–5 %-ным спиртовым раствором йода, вечером втирают серно-дегтярную мазь. Лечение длится до 4 месяцев. Профилактика должна проводиться в семьях, населенных пунктах, методом осмотра, в течение 3–5 лет. Выздоровевшие ставятся на учет в кожно-венерологическом диспансере.
ФАРИНГИТ
ОпределениеФарингит — воспаление слизистой оболочки глотки. Различают острый и хронический фарингит.Острый фарингит может быть самостоятельным заболеванием или сочетаться с острым воспалением верхних дыхательных путей.
Этиология и патогенез Причиной острого фарингита может быть прием горячей или холодной пищи, вдыхание через рот холодного воздуха, курение, принятие алкоголя, вдыхание производственной пыли. Хронический фарингит возникает при запоздалом лечении или при отсутствии лечения острого фарингита, а также является одним из проявлений хронических заболеваний желудочно-кишечного тракта, нарушения обмена веществ, воздействия профессиональных вредностей, злоупотребления алкоголем и курением.
Клиническая картина и диагностика В воспалительном процессе острого фарингита различают катаральную и гнойную формы. При катаральном фарингите наблюдается покраснение слизистой глотки, отек. На задней стенке глотки в виде красных зерен выступают отдельные фолликулы, скопление слизи; язычок отечный. При гнойном фарингите к описанному добавляются наличие гноя на задней стенке глотки и другие деструктивные процессы (язвочки). Клиническая картина хронического фарингита разнообразна. Больных беспокоят сухость в глотке, ощущение инородного тела, умеренная боль. Хронический фарингит подразделяется на гипертрофический, атрофический и катаральный. При гипертрофическом фарингите в глотке скапливается вязкое слизистое отделяемое, что вызывает постоянную необходимость откашливаться и отхаркиваться. Фарингоскопия: утолщение и разлитая гиперемия слизистой оболочки глотки, вязкий слизисто-гнойный секрет, увеличение группы фолликулов, мягкое небо и язычок отечны и утолщены. Скопление лимфоидной ткани на задней стенке глотки говорит о гранулезном фарингите, а на боковых стенках глотки за задними небными дужками — боковом фарингите. Клиническая картина катарального фарингита характеризуется ощущением сухости, саднения, першения в глотке, небольшой болью при глотании. Общее состояние удовлетворительное, температура тела в пределах нормы. Гнойный фарингит протекает тяжелее. Температура повышенная, головная боль, боль в горле, усиливающаяся при глотании. При фарингоскопии в глотке находят гнойно-некротические налеты. Диагноз ставится на основании данных опроса и методов обследования.
Лечение Лечение острого фарингита заключается в щадящем режиме питания (теплая, мягкая, не раздражающая пища), полоскании теплым щелочным раствором, отварами трав (ромашка, шалфей), лечении кариозных зубов. Лечение хронического фарингита индивидуальное. Назначаются вяжущие средства для полоскания, ингаляции и пульверизации, смазывание слизистой глотки раствором Люголя с глицерином, 2 %-ным раствором колларгола или протаргола. При гипертрофической форме — прижигание гранул 5— 10 %-ным раствором нитрата серебра, трихлоруксусной кислотой. Применяют также криохирургию (см.) и новокаиновую блокаду глотки.
ФАРИНГОМИКОЗ
ОпределениеФарингомикоз — разновидность микоза, поражающего преимущественно глотку.
Этиология и патогенез Фарингомикоз вызывают дрожжеподобные грибки лептотрикс. Способствуют развитию фарингомикоза длительное лечение антибиотиками, кортикостероидами и цитостатиками, тяжелые заболевания, гиповитаминозы, воспалительные процессы в глотке (тонзиллит, фарингит). На поверхности слизистой оболочки задней стенки глотки, боковых валиков, в лакунах небных миндалин появляются беловатые плотные шипы, плотно сидящие на основании. Они возникают вследствие усиленного разрастания эпителия с ороговением. Шипы видны при фарингоскопии.
Клиническая картина и диагностика Степень тяжести клинических признаков зависит от состояния реактивности организма. Вначале процесс локализуется на небных миндалинах, затем распространяется на нёбные дужки, мягкое небо, заднюю стенку глотки. Больные жалуются на боль в горле, чувство царапанья и жжения, ощущение инородного тела в глотке. При остром фарингомикозе отмечаются недомогание, разбитость, головная боль, температура тела повышенная. Местно: язвенно-некротические поражения. Острый фарингомикоз может распространиться на пищевод, гортань и паратонзиллярно, вызывая абсцесс. При хроническом фарингомикозе заболевание обнаруживается при медицинском осмотре, и лишь иногда больной отмечает чувство постороннего тела в горле. Диагноз ставится на основании клинической картины и результатов бактериологического и микологического исследований налетов и выделений со слизистой оболочки глотки.
Лечение Таблетки нистатина растворяются в ротовой полости. При недостаточной эффективности их дополняют леворин или декамин для промывания лакун. Также для промывания используются 0,1 %-ный водный раствор хинозола (2 раза в неделю, всего не более 10 раз). Смазываются пораженные участки раствором Люголя, генцианвиолетом (см. Генцианвиолет). При сопутствующем хроническом тонзиллите показано удаление миндалин. Хороший эффект дает криовоздействие на слизистую оболочку глотки.
ФАСЦИОЛЕЗ
ОпределениеФасциолез — гельминтоз человека и животных, характеризующийся хроническим течением с преимущественным поражением желчевыделительной системы.
Этиология Возбудителей фасциолеза два — печеночная и гигантская двуустки. Окончательным хозяином фасциол является человек, мелкий и крупный рогатый скот, свиньи, лошади, промежуточным — пресноводные моллюски. Наиболее часто фасциолезом поражаются такие животные, как овцы, козы, крупный рогатый скот и др. Основной источник заражения людей — сельскохозяйственные животные. Встречается преимущественно в жарких странах.
Эпидемиология, патогенез и патанатомия Фасциолез — зооноз. Человек заражается в теплое время года при употреблении воды, зелени, овощей, фруктов, облитых водой, загрязненной личинками гельминта. В организме человека личинки внедряются в стенку тонкой кишки, затем током крови переносятся в печень. Происходит сенсибилизация организма человека. Различают острую и хроническую фазы фасциолеза. В острой фазе фасциолеза происходит инфильтрация междольковой стромы, стенок желчных протоков, желчного пузыря. В дальнейшем — распространенные изменения в них и других органах, в том числе и в миокарде. В хронической фазе в желчевыводящей системе развивается фиброз с нарушением функций холангиол, общего желчного протока, желчного пузыря, изменением состава желчи, развитием вторичной бактериальной инфекции. Ведущими факторами являются меланические повреждения холангиол и паренхимы печени, желчных ходов и желчного пузыря. И как результат — холестаз и бактериальная инфекция желчных путей.
Клиническая картина и диагностика Инкубационный период 1–8 недель. Заболевание начинается остро, с повышения температуры до 38–39 °C и выше, болями в правом подреберье приступообразного характера. Печень и селезенка увеличены, болезненны. В первые же сутки появляется желтуха кожи и слизистых оболочек, которая держится около семи дней. Лихорадка держится от 2–5 дней до 2–3 недель; затем переходит в хроническую фазу. В хронической фазе фасциолеза выделяют два клинических варианта: неосложненный фасциолез и осложненный инфекцией желчевыводящих путей; неосложненный протекает с периодическими обострениями и ремиссиями. Обострения характеризуются умеренным болевым синдромом, снижением аппетита, тошнотой, иногда рвотой. Хронический осложненный фасциолез протекает без ремиссий, боли в правом подреберье носят приступообразный характер, сопровождается лихорадкой, повышенным уровнем лейкоцитов, эозинофилов, ускорением СОЭ. Диагноз труден из-за скудности и периодичности выделения гельминтом яиц, да и они выделяются 3–4 месяца спустя после заражения. Используют иммунологические методы. Дифференциальный диагноз в острой фазе болезни проводят с вирусным гепатитом (лептоспирозом (см.), желчнокаменной болезнью (см.)). Основными признаками острого фасциолеза являются: наличие желтухи лишь во время лихорадки, выраженный болевой синдром, не характерный для вирусных гепатитов, повышенный уровень лейкоцитов, эозинофилов, высокая СОЭ и др.
Лечение и профилактика Назначают хлоксил по 0,3 г/кг, курс лечения — 3–5 дней. При бактериальной инфекции желчевыводящих путей применяют антибиотики, предварительно проверив чувствительность к ним микрофлоры. У нас применяют 2 %-ный раствор этимина по 1,5 мл 2 раза в день, за рубежом — албендазол. Специфическое лечение фасциолеза в острой фазе проводят после снятия бурных аллергических проявлений с помощью антигистаминных веществ, глюкокортикоидов, спазмолитиков, дезинтоксикационной терапии. В хронической фазе болезни применяют спазмолитики, желчегонные, физиотерапию (см.), при инфекции желчных путей — антибиотики. Профилактика основана на повышении санитарно-гигиенической культуры населения по отношению к водоснабжению и продуктам питания. Борьба с фасциолезом сельскохозяйственных животных: массовая дегельминтизация животных, смена пастбищ, гидромелиоративные мероприятия.
ФЕЙРБАНКА БОЛЕЗНЬ
ОпределениеБолезнь Фейрбанка (множественная эпифизарная дисплазия) — эпифизарная дисплазия костей скелета, обусловленная замедленным и неправильным формированием эпифизов.
Этиология, патогенез и патанатомия Болезнь Фейрбанка — наследственное семейное заболевание, механизм развития которого окончательно не установлен. В основе заболевания лежит дефект окостенения эпифизов. Позднее появление точек окостенения эпифизов длинных трубчатых костей, их замедленное и неправильное развитие, преждевременное слияние эпифизов и диафизов приводят к резко выраженным изменениям костного скелета, что особенно выражено в тазобедренных и коленных суставах. Головка бедренной кости приобретает грибовидную форму. Нижние эпифизы бедренных костей уплощаются, изменяются эпифизы большеберцовой и плечевой костей, выявляется дольчатость надколенника, а иногда и его вывих. Наблюдаются несоответствие суставных поверхностей, дистрофические изменения в тазобедренных, коленных суставах и позвоночнике. Суставной хрящ эпифиза имеет гиалиновое (гиалин — стекловидное белковое вещество) строение, но в поверхностных слоях он частично заменен волокнистой соединительной тканью с включениями хряща. В эпиметафизарных отделах изменения выражаются разрежением костной ткани с образованием многочисленных линий перестройки, атрофией (см.) костных балок и субхондральной костной пластинки, нарушением ее целостности, дистрофическими изменениями эпифизарного хряща.
Клиническая картина и диагностика Клиническая картина болезни Фейрбанка проявляется тогда, когда ребенок начинает ходить. Возникают жалобы на быструю утомляемость, боли в суставах и нижних конечностях, хромота и нарушение походки. К 7 годам отмечается низкий рост за счет укорочения нижних конечностей, варусные или вальгусные (О- или Х-образные) деформации в коленных или голеностопных суставах, сгибательные контрактуры (тугоподвижность) в суставах верхних и нижних конечностей. С увеличением нагрузки на эпифизы нарастают дистрофические изменения хряща, что приводит к болевому синдрому и ограничению функций в пораженных суставах, атрофии (см.) мышц, перекосу таза, искривлению позвоночника. На рентгенограмме определяются типичные изменения в тазобедренных и коленных суставах. Эпифизы костей уменьшены в размерах, нижние концы диафизов бедренных костей уплощены, межмыщелковая ямка плоская. Диагноз ставится на основании характерных клинических данных и картины типичных рентгенологических изменений. Дифференциальный диагноз следует проводить с болезнью Моркио, остеохондропатией головки бедренной кости, ахондроплазией, остеопойкилией (пятнистой множественной остеопатией).
Лечение Лечение в основном консервативное. Оно направлено на устранение болевого синдрома, увеличение амплитуды движений и предупреждение нарушений подвижности в пораженных суставах. Назначаются лечебная гимнастика и массаж, способствующие улучшению питания и тонуса мышц, нормализации двигательной функции пораженных суставов. Большое значение имеет санаторно-курортное лечение, направленное на увеличение объема движений в суставах и улучшение походки. Оперативное лечение применяют только в тех случаях, когда имеются стойкие статико-функциональные нарушения (деформации и контрактуры в порочном положении).
ФЕЛТИ СИНДРОМ
ОпределениеФелти синдром — синдром, характеризующийся поражением суставов, увеличением селезенки и нейтропенией (снижением количества нейтрофилов).
Этиология и патогенез Причиной болезни является ревматоидная инфекция. Механизм развития Фелти синдрома сложен и до конца не изучен. Болеют чаще женщины старше 50 лет. Нейтропения развивается в связи с циркуляцией иммунных комплексов, нарушающих функции нейтрофилов, способствуя их ускоренному распаду в селезенке. В цитоплазме нейтрофилов обнаружены включения, состоящие из иммуноглобулинов и комплемента. В этом процессе основную роль играют специфические антитела к лейкоцитам, в том числе и к нейтрофилам, обнаруживаемые у больных Фел-и синдромом, а также клеточные и гуморальные факторы, угнетающие созревание лейкоцитов в костном мозге.
Клиническая картина Фелти синдром развивается у больных ревматоидным артритом (см.) при наличии в сыворотке крови ревматоидного фактора спустя 10 лет от начала заболевания. Полиартрит поражает в основном мелкие суставы кистей и стоп. У больных с Фелти синдромом обнаруживаются также системные поражения: подкожные узелки, полиневропатия, мышечная атрофия (см.), быстрая потеря веса, лихорадка, эписклерит, генерализованная лимфаденопатия, увеличение печени, полисерозит, миокардит (см.). Более чем у 50 % больных отмечаются признаки синдрома Шегрена (см.). Снижение количества лейкоцитов ведет к возникновению инфекционных заболеваний. Значительно увеличены размеры селезенки (спленомегалия), но возможно развитие синдрома Фелти без спленомегалии.
Диагностика и дифдиагностика Диагноз ставят на основании появления у больных ревматоидным артритом (см.) нейтропении и увеличения селезенки. В костном мозге выявляют миелоидную гиперплазию с относительным увеличением незрелых форм. Характерным является нарушение гуморального звена иммунитета. В сыворотке крови выявляют антинуклеарные антитела, особенно антигранулоцитарные, циркулирующие иммунные комплексы промежуточного типа. Дифференциальную диагностику проводят с миелопролиферативными заболеваниями, с лимфомами (см.), саркоидозом (см.), туберкулезом (см.), а при увеличении печени — с циррозом печени (см.).
Лечение и профилактика Лечение разработано недостаточно. Применяют кортикостероиды (по 20–30 мг преднизолона в сутки), соли лития, стимулирующие лейкопоэз (образование и созревание лейкоцитов). При выраженной нейтропении и увеличении селезенки показано ее удаление. В отдельных случаях подавляют активность ревматоидного артрита (см.) и уменьшают выраженность синдрома Фелти препараты солей золота, Д-пенициламин, цитотоксические иммунодепрессанты. Профилактика не разработана.
ФЕМИНИЗАЦИЯ
ОпределениеФеминизация — развитие у мужчин соматических (телесных, физических) и психических признаков, присущих женскому полу при наличии мужских половых желез, отсутствии матки и мужском половом хроматине (кариотип 46, XY). Феминизацию подразделяют на физиологическую, или изосексуьную (свойственную женскому организму), и патологическую, или гетеросексуальную (развитие женских психологических признаков у субъектов с генетическими и гонадными признаками, свойственными мужскому полу).
Этиология и патогенез Физиологическая феминизация Физиологическая феминизация начинается в период раннего эмбриогенеза под влиянием эстрогенов (женских половых гормонов), выделяемых яичниками матери и плацентой. Между 10-й и 12-й неделями эмбрионального развития формируются фаллопиевы трубы. Закладка наружных половых органов у эмбрионов одинакова, их половая дифференциация начинается с 3-го месяца внутритрубного развития. При отсутствии закладки половых желез наружные половые органы формируются по женскому типу независимо от генетического пола. Дальнейшая феминизация наружных половых органов и развитие женских вторичных половых признаков происходит в период полового созревания под воздействием эстрогенов яичников, вступающих в период эндокринной активности, свойственной репродуктивному возрасту. Феминизация наружных половых органов и развитие женских половых признаков начинается с увеличения малых половых губ, формирования чашеобразной формы преддверия влагалища и девственной плевы. Феминизация вторичных половых признаков предполагает развитие молочных желез, формирование широкого таза с лонным углом до 90°, относительно узких плеч, избирательное распределение жировой клетчатки в области молочных желез, ягодиц и бедер, формирование оволосения по женскому типу (горизонтальная линия роста волос на лобке, дугообразная — на лбу, трехконусная — на шее). Происходит и психическая феминизация. Она заключается в том, что формируется специфический женский сексуальный характер: потребность обращать на себя внимание, застенчивость, желание нравиться, кокетливость. Женщины более чувствительны и эмоциональны, чем мужчины.
Патологическая феминизация Патологическая феминизация проявляется гинекомастией (увеличением молочных желез), а также формированием телосложения по женскому типу. Патологическая феминизация развивается при абсолютном или относительном избытке эстрогенов. Она может развиться при гипогонадизме (недостаточности половых желез) — анорхии (отсутствии яичек), тестикулярной феминизации, а также эстрогенпродуцирующих опухолях (см.) яичек или надпочечников, пролактинпродуцирующих опухолях гипофиза, длительном приеме эстрогенных препаратов, при раке (см.) или аденоме (см.) предстательной железы. Преходящие признаки феминизации в виде юношеской гинекомастии (см.) наблюдаются у мальчиков в период полового созревания. Однако они кратковременны и выражены слабо. Патологическая феминизация при избытке эстрогенов связана с непосредственным влиянием женских половых гормонов на органы-мишени, а также с андрогенной недостаточностью (недостатком мужских половых гормонов), наступающей в результате торможения секреции гонадотропных гормонов и отсутствия антиэстрогенного влияния андрогенов на органы и ткани-мишени.
Клиническая картина Клиническая картина патологической феминизации у лиц мужского пола наблюдается при эстрогенпродуцирующих опухолях до возраста полового созревания. Наблюдается преждевременное половое созревание по гетеросексуальному типу: гинекомастия, ускорение роста, ускоренное созревание скелета, оволосение на лобке. Патологическая феминизация неопухолевого происхождения в период полового созревания развивается в связи с андрогенной недостаточностью, проявляющейся не феминизацией, а развитием евнухоидных фенотипических признаков (недоразвитие половых органов и вторичных половых признаков в сочетании с диспропорциональным телосложением). При гиперэстрогении в репродуктивном возрасте ее начальным клиническим проявлением является прогрессирующая демаскулинизация: уменьшение вторичного оволосения по мужскому типу, снижение либидо и потенции. На этом фоне возникают прогрессирующие черты феминизации: подкожная клетчатка перераспределяется по женскому типу, появляются признаки гинекомастии.
Диагностика и дифдиагностика Развитие патологической феминизации у мужчин можно наблюдать в любом возрасте. Причиной может быть повышенное содержание эстрогенов. Проводится анализ крови на содержание эстрогенов и пролактина, исследуются яички и надпочечники, производится рентгенография черепа, исключаются пролактинома, синдром гиперпролактинемического гипогонадизма и синдром Клайнфельтера (см.).
Лечение и профилактика Лечение при опухолях хирургическое, при гипогонадизме проводится терапия хорионическим гонадотропином, андрогенными препаратами. Профилактика заключается в ранней диагностике и своевременной адекватной терапии.
ФЕНИЛКЕТОНУРИЯ
ОпределениеФенилкетонурия — тяжелое наследственное заболевание, обусловленное нарушением аминокислотного обмена, характеризующееся поражением нервной системы.
Этиология и патогенез В результате мутации гена, контролирующего синтез фенилаланингидроксилазы, развивается метаболический блок на этапе превращения фенилаланина в тирозин. В связи с наличием метаболического блока основным путем преобразования фенилаланина становится дезаминирование и синтез токсических производных — фенилпировиноградной, фенилмолочной и фенилуксусной кислот. В крови и тканях значительно увеличивается содержание фенилаланина — до 0,2 г/л и более (при норме 0,01—0,02 г/л). Значительную роль в механизме развития фенилкетонурии играет недостаточный синтез тирозина, являющегося предшественником катехоламинов и меланина.
Клиническая картина Признаки фенилкетонурии обнаруживаются в первые месяцы жизни. Дети отстают в физическом и психическом развитии, отмечаются вялость, сонливость, раздражительность, плаксивость. По мере роста ребенка и прогрессирования болезни могут наблюдаться эпилептиформные припадки. Повышается тонус отдельных групп мышц, конечностей, дрожание рук, атаксия. Наблюдается пониженное артериальное давление. При отсутствии лечения развиваются глубокая олигофрения и глубокая психическая инвалидность.
Диагностика Все новорожденные обследуются по специальным программам скрининга на повышение концентрации фенилаланина в крови, равно как при задержке развития или неврологических проявлений. При первых пробах используют микробиологический метод определения концентрации фенилаланина в крови, а также пробу Фелинга на фенилпировиноградную кислоту в моче. Берется 5 %-ный раствор треххлористого железа и уксусной кислоты и прибавляется несколько капель к моче, появление зеленой окраски говорит о положительной реакции на фенилаланин. В дальнейшем определяют количественное содержание фенилаланина в крови и моче (хроматография аминокислот), исследование с помощью специальных анализаторов. Дифференциальный диагноз проводится с внутричерепной родовой травмой и внутриутробными инфекциями.
Лечение и профилактика Детям, больным фенилкетонурией, назначается специальная диета, ограничивающая прием фенилаланина, что предполагает нормальное нервно-психическое развитие. Исключается молоко и др. продукты животного происхождения. Назначаются белковые гидролизаты (цимогрин, лефанолак, берлофен, гипофенат и др.), которые дают с соками, пюре, супами. Лечение проводят под контролем содержания фенилаланина в крови, добиваясь его снижения до 0,03—0,04 г/л. Строгое ограничение белков животного происхождения показано на протяжении первых 2–3 лет жизни. Для вскармливания грудных детей используют лечебные смеси, лишенные фенилаланина, или гидролизаты белка с низким содержанием («Афенилак 0—12», «Аналог-ХР», «Фенил-Фри» и др.). Детям старше года назначаются смеси «Афенилак 1–3», «Тетрафен-40», «Тетрафен-70», «Фенил-Фри 24». Крупяные, макаронные изделия заменяют продуктами на основе кукурузного крахмала: безбелковый хлеб, безбелковые макаронные изделия. Специальное наблюдение за «семьями риска»: новорожденным этих семей проводят биохимическое исследование, а при показаниях — раннее лечение. Массовый скрининг также позволяет предупредить развитие тяжелой психической инвалидности.
ФИБРОЗНАЯ ОСТЕОДИСПЛАЗИЯ
ОпределениеФиброзная остеодисплазия (болезнь Лихтенстайна-Брайцева) — порок развития костной системы.
Этиология и патогенез Заболевание обусловлено нарушением окостенения, приводящим к деформации костей в период эмбрионального развития. По своему развитию фиброзная остеодисплазия относится к группе процессов, пограничных с доброкачественными опухолями. Они способны рецидивировать после удаления. Различают монооссальную и полиоссальную формы фиброзной остеодисплазии. Поражаются челюсти и верхние отделы конечностей; причем нижние конечности поражаются чаще, чем верхние. Начинается с метафизов и распространяется на диафиз.
Патанатомия Пораженные отделы костей деформированы, утолщены, трубчатые кости изогнуты. Над очагами фиброзной остеодисплазии пластинка компактного вещества истончена, на отдельных участках прерывается; в толще патологической ткани располагаются кисты с прозрачной жидкостью. При микроскопическом исследовании пораженных костей обнаруживается волокнистая соединительная ткань с фибробластоподобными клетками.
Клиническая картина Клиническая картина разнообразна и зависит от формы, локализации процесса и распространенности поражений. Жалобы на боли в ногах при ходьбе, повторяющиеся патологические переломы костей, их деформация. Большой вертел бедра может подниматься вверх до тела подвздошной кости, голени изгибаются кнаружи и кпереди. Плечо приобретает булавовидное утолщение. Поражаются кости черепа, обезображивается лицо. При локализации процесса в нижних конечностях наблюдается хромота. Полиоссальная форма часто сочетается с пигментацией кожи, ранним половым созреванием, гипертиреозом (см.). Костные изменения, пигментация кожи и преждевременное половое созревание у женщин (болезнь Олбрайта). Прогрессирование фиброзной остеодисплазии заканчивается с половым созреванием.
Диагностика и дифдиагностика Диагноз ставят на основании клинической картины и рентгенологических данных. На рентгеновском снимке видна зона диффузного просветления костной ткани. При очаговой форме фиброзной остеодисплазии обнаруживают участки ограниченного просветления костной ткани, так называемые гнездные образования. При диффузной форме поражается вся толща кости, образуются угловые и дугообразные деформации костей. Часто встречаются варусные деформации шейки бедренной кости, варусные или вальгусные деформации в коленном суставе. Участки оссификации и обызвествления напоминают матовое стекло. Дифференциальный диагноз проводят с хондродисплазией (см.), паратиреоидной остеодистрофией (см.), костной кистой (см.), туберкулезным оститом.
Лечение Лечение монооссальной формы фиброзной остеодисплазии оперативное. Чем раньше, тем лучше прогноз. При полиоссальной форме — тоже оперативное, но из-за множества пораженных костей операции ограничены. Это связано с озлокачествлением костей.
ФИБРОЭЛАСТОЗ СУБЭНДОКАРДИАЛЬНЫЙ
ОпределениеФиброэластоз субэндокардиальный — врожденное заболевание, характеризующееся разрастанием в эндокарде и субэндокардиальных отделах миокарда фиброзной (волокнистой соединительной) и эластической ткани.Различают изолированный фиброэластоз и фиброэластоз в сочетании с врожденными пороками сердца (см.) — сочетанный субэндокардиальный фиброэластоз.
Этиология Причиной изолированного субэндокардиального фиброэластоза являются вирусы. Проявления болезни обнаруживаются на 4—7-м месяце внутриутробного развития и относятся к ранней фетопатии (пороки развития (см.) плода с 4-го месяца эмбрионального развития). Вслед за альтеративными (повреждающими) изменениями происходит разрастание эластических и коллагеновых волокон. При сочетанном субэндокардиальном фиброэластозе могут быть нарушения кровообращения и гипоксия. При сочетании субэндокардиального фиброэластоза с коарктацией аорты (см.) и стенозом (сужением) аорты имеют значение гемодинамические факторы (перегрузка миокарда левого желудочка), дефицит коронарного кровотока, связанный с гипертрофией миокарда. Сочетание субэндокардиального фиброэластоза с синдромом гипоплазии левого желудочка также способствует снижению коронарного кровотока в миокарде левого желудочка в связи с ретроградным поступлением крови в коронарные артерии из аорты.
Патогенез и патанатомия Механизм развития болезни до конца не выяснен. Субэндокардиальный фиброэластоз является результатом неспецифической реакции организма в ответ на воздействие в ранний натальный период инфекционных и неинфекционных факторов, суммарный эффект которых сводится к кислородной недостаточности эндокарда и прилежащего к нему миокарда. Некоторые авторы считают, что диффузное утолщение эндокарда развивается в случае первичного поражения миокарда, другие расценивают субэндокардиальный фиброэластоз при врожденных пороках сердца (см.) как результат кислородной недостаточности эндокарда и миокарда. Во всех теориях патогенетической основой образования субэндокардиального фиброэластоза является гипоксия и связанное с ней повреждение эндокарда и миокарда. При изолированном субэндокардиальном фиброэластозе наблюдается расширение полости левого желудочка с деформацией митрального, а иногда и аортального клапанов. Сердце увеличено, вес возрастает в 2–4 раза. При разрезе отмечается хруст, на срезе выявляется диффузное утолщение (до 2–4 мм) пристеночного эндокарда — типичный признак субэндокардиального фиброэластоза. В полостях сердца обнаруживаются пристеночные тромбы, которые могут стать источником тромбоэмболии (см.). Миокард дряблый, утолщенный, гипертрофированный, похож на вареное мясо. Микроскопическая картина субэндокардиального фиброэластоза характеризуется своеобразными изменениями эндокарда и миокарда. Эндокард утолщен в 10–15 раз. Капилляры кровеносных сосудов выстланы обычным эндотелием. Иногда видны волокна проводящей системы сердца, замурованные в эндокард. Под утолщенным эндокардом располагаются венулы, наполненные кровью. В субэндокардиальной области отмечается уменьшение коронарных артерий (на единицу веса сердца). Изменения миокарда при субэндокардиальном фиброэластозе разнообразны. Кардиомиоциты субэндокардиального слоя гипертрофированы, с признаками жировой дистрофии (см.) В субэндокардиальном слое миокарда определяются участки очагового кардиосклероза (см.). Во внутренних органах наблюдается картина венозного застоя. При сочетанном субэндокардиальном фиброэластозе изменения эндокарда левого желудочка соответствуют изменениям при изолированном субэндокардиальном фиброэластозе, однако дополнительно в миокарде обнаруживаются субэндокардиальные и трансмуральные инфаркты миокарда (см.), очаговый и диффузный кардиосклероз (см.), формирование аневризмы (см.) сердца.
Клиническая картина Заболевание может протекать молниеносно, остро и хронически. Симптомы изолированного субэндокардиального фиброэластоза обнаруживаются в 6—12 месяцев, реже на 2—3-м году жизни. Появляются бледность, вялость, потливость, синюшность, усталость во время кормления, плохая прибавка в весе. Отмечаются артериальная гипотензия (см.), развивающийся сердечный горб, кардиомегалия (увеличение сердца), глухие тоны сердца, ритм галопа. Развивается левожелудочковая сердечная недостаточность (см.) в виде одышки, учащенного сердцебиения, застойных хрипов в легких. Печень выступает из-под края реберной дуги на 2–4 см. При хроническом течении субэндокардиального фиброэластоза кардиомегалия, глухость тонов и сердечная недостаточность остаются стабильными. В случаях относительно благоприятного течения размеры сердца несколько уменьшаются, но изменения на ЭКГ и рентгенограмме говорят о кардиосклерозе (см.). Сочетанный субэндокардиальный фиброэластоз характеризуется значительно увеличенными размерами сердца, глухими тонами и внутрисердечными блокадами. К числу осложнений относят синдром Морганьи-Адамса-Стокса (см.) и тромбоэмболический синдром с развитием гемипареза (см. Парезы и параличи).
Диагностика и дифдиагностика Диагноз основывается на анамнестических данных (вирусные инфекции, обострения хронических инфекционных заболеваний матери, токсикозы первой половины беременности), клинической картине заболевания и результатах дополнительных исследований. С помощью эхокардиографии обнаруживают расширение полости левого желудочка. Толщина стенок левого желудочка увеличена. На рентгенограммах отмечаются усиление легочного рисунка, кардиомегалия, шаровидная или овоидная форма сердца. Кардиоторакальный индекс составляет 70–75 % (в норме у детей — 50 %). В случаях неясного диагноза применяют эндомиокардиальную биопсию левого желудочка. Дифференциальный диагноз проводят с аномальным отхождением левой коронарной артерии от легочного ствола, для которого характерны шум во втором межреберье слева, приступы внезапного беспокойства, сопровождающиеся криком, мышечной слабостью, изменением ЭКГ. У детей раннего возраста субэндокардиальные фиброэластозы дифференцируют с приобретенным миокардитом (см.), у взрослых — с вторичными фиброзными изменениями миокарда на фоне перенесенных заболеваний сердца (инфаркт миокарда (см.), эндокардит (см.) и др.).
Лечение и профилактика Специфического лечения фиброэластоза субэндокардиального нет. Необходимы ограничение двигательной активности и диета с ограничением соли и жидкости при выраженной сердечной недостаточности. В случае вирусной или бактериальной инфекции назначают 2—3-недельный курс антибактериальной терапии. Назначают сердечные гликозиды, преднизолон, мочегонные; препараты, улучшающие обменные процессы в миокарде (панангин, оротат калия, кокарбоксилазу, рибоксин, витамины В5, В6, В15); при тахикардии (см.) показаны анаприлин и обзидан. В целях профилактики беременные женщины должны избегать встречи с больными острыми респираторными заболеваниями, принимать аскорбиновую кислоту и витамины группы В.
ФИЛЯРИОЗЫ
ОпределениеФиляриозы — гельминтозы, вызываемые представителями семейства филярий. К филяриозам относятся вухерериоз, бругиоз, лоаоз (см.), онхоцеркоз и др.).Филяриозы — группа биогельминтозов с хроническим течением, характеризующимся поражением лимфатической системы подкожной клетчатки и полостей тела. В России встречается только как завозное из тропиков.
Этиология Филярии имеют удлиненное нитевидное тело, утончающееся к концам. На вершине головного конца находится ротовое отверстие, окруженное тремя губами. Ротовая капсула отсутствует или рудиментарна. Кутикула филярий гладкая, реже поперечно исчерченная. Самки живородящие.
Эпидемиология, патогенез и патанатомия Филяриозы человека распространены главным образом в странах тропического пояса. Филярии являются биогельминтами. Их развитие происходит со сменой хозяев. Человек является окончательным хозяином, а промежуточными — представители членистоногих (комары, слепни, мошки, мокрицы). Филяриозы являются единственными гельминтозами, передающимися транссмиссивным путем, т. е. при укусе кровососущих насекомых. Взрослые филярии паразитируют в замкнутых системах и полостях тела человека, личинки (микрофилярии) циркулируют в крови, а личинки онхоцерков паразитируют в тканях хозяина. Циркуляция микрофилярий между глубокими и периферическими сосудами подчиняется суточному ритму физиологических функций хозяина. Кровососущие насекомые при укусе больного человека вместе с кровью всасывают и микрофилярии. Из кишечника насекомого они проникают через его стенку в полость тела, а затем в грудные мышцы и жировое тело. Там микрофилярии дважды линяют, увеличиваются в размерах и через 2–3 недели возвращаются в полость тела, попадают в ротовые органы и скапливаются в колющем аппарате — хоботке насекомого. При соприкосновении хоботка с кожными покровами окончательного хозяина личинки прорывают кутикулу на вершине хоботка насекомого и внедряются в кожу, после чего попадают в кровь. Затем они оседают в тканях различных органов, где продолжают развитие в течение 1–2 лет, превращаясь во взрослых паразитов.
Вухерериоз При вухерериозе в лимфатической системе человека паразитируют взрослые особи гельминта. Микрофилярии мигрируют в кровеносную систему. При этом днем они находятся в сосудах легких, сердца, мышц, а ночью перемещаются в периферические сосуды. Промежуточными хозяевами являются комары родов Anopheles, Culex, Aedes и Mansonia. После попадания в кровь человека в результате укуса комаром личинки мигрируют в лимфатическую систему человека и через 3—18 месяцев достигают половой зрелости. Взрослые паразиты живут в организме человека до 20 лет. Восприимчивость к данному гельминтозу всеобщая. У населения эндемических районов вырабатывается иммунитет, уменьшающий количество паразитирующих взрослых вухерерий и снижающий интенсивность микрофиляриемии. Гельминты оказывают сенсибилизирующее и токсическое воздействие на организм человека. Кроме того, имеет значение механическое повреждение лимфатических сосудов и узлов, нарушение лимфооттока, присоединение вторичной инфекции.
Бругиоз В зависимости от периодичности появления микрофилярий в периферической крови различают два штамма — периодический и ночной периодический. При первом личинки появляются в крови только ночью, а при втором — в течение суток с пиком в ночное время. Источником и окончательным хозяином первого штамма является человек, переносчики — комары. Источниками и окончательными хозяевами субпериодического штамма являются дикие и домашние кошки, собаки, некоторые виды обезьян, от которых могут заражаться люди. Переносчиками являются также комары. Жизненный цикл возбудителя бругиоза (нитевидного червя) сходен с таковым у вухерерий. Развитие личинок в теле комаров обычно происходит за 8–9 дней и сходно с таковым у вухерерий.
Онхоцеркоз Онхоцеркоз распространен очень широко, однако точные географические границы его не определены. При данном гельминтозе окончательным хозяином и источником возбудителя является человек, в организме которого паразитируют половозрелые гельминты, отрождающие микрофилярий. Переносчики и промежуточные хозяева — мошки рода Симулиум. При укусе мошкой человека личинки внедряются в кожу, мигрируют в лимфатическую систему, а затем в подкожную клетчатку и под апоневрозы мышц, где достигают половой зрелости. Вокруг зрелых онхоцерков формируются соединительнотканные узлы (онхоцеркомы) с возможным их нагноением или кальцификацией. В результате паразитирования микрофилярий в коже возникают депигментация, атрофия, изъязвление. Проникновение микрофилярий в роговицу и (или) радужную оболочку глаза вызывает склерозирующий кератит, иридоциклиты, поражение сетчатки, атрофию зрительного нерва.
Клиническая картина и диагностика Вухерериоз Инкубационный период равен 3—18 месяцам. В течении болезни выделяют три стадии. В первой, ранней стадии преобладают симптомы общей аллергической реакции: лихорадка, высыпания на коже, отеки, высокое количество эозинофилов в крови. Могут появляться лимфадениты, лимфангиты, развиваются фуникулит, орхит, эпидидимит, у женщин — маститы. Вторая стадия наступает через 2–7 лет после заражения. Основные ее симптомы связаны с варикозным расширением поверхностных (кожных) и глубоких лимфатических сосудов. Их разрывы во внутренних органах приводят к серьезным осложнениям. Лимфатические сосуды кожи и подкожной клетчатки варикозно расширены, воспалены. Возникают абсцессы вокруг паразитов, в подкожной клетчатке, мышцах, половых органах, полостях суставов, плевры, в брюшной полости. Вскрытие абсцессов приводит к возникновению эмпием, гнойных перитонитов и артритов. В третьей стадии развивается элефантиаз (слоновость) различных частей тела, чаще всего нижних конечностей, реже — рук, половых органов, других участков туловища, лица. Пораженный орган обезображивается, деформируется, приобретает огромные размеры, покрывается грубыми бородавчатыми разрастаниями и глубокими складками. Возникают трофические язвы. В случае присоединения вторичной микробной флоры развивается элефантоидная лихорадка. Течение вухерериоза может быть различным — быть крайне тяжелым или проявляться в легкой форме. Возможен и летальный исход. Диагноз основан на оценке клинической картины, а также обнаружении микрофилярий в крови. Используются иммунологические методы — РСК, РП, внутрикожная, аллергическая проба.
Бругиоз Схожесть данного гельминтоза с вухерериозом наблюдается и в клинической картине. Однако особенностью бругиоза является то, что элефантиазом поражаются почти исключительно нижние конечности. Диагностика та же.
Онхоцеркоз Клиническая картина зависит от стадии патологического процесса. Его можно предотвратить при распознавании и своевременной терапии в предшествующей и начальной стадии. Первые клинические проявления развиваются через несколько месяцев после заражения. Обычно самым ранним симптомом является кожный зуд различной интенсивности, постоянный или периодический. Чаще всего он локализуется в области бедер и голеней. В вечернее и ночное время зуд усиливается. Иногда данный симптом отсутствует. Может возникать пятнисто-узелковая сыпь без определенной локализации, сопровождающаяся сильным зудом, так называемая филяриозная чесотка. При значительной пораженности кожи микрофиляриями она приобретает вид «лимонной корки», появляются участки пятнистой депигментации кожи, особенно на передней поверхности голеней. При длительном течении онхоцеркоза развивается атрофия, кожа становится тонкой, сухой («старческий вид»). Подкожные поражения обусловлены паразитированием взрослых онхоцерков. Вокруг живых или погибших особей разрастается соединительная ткань. Иногда такие разрастания (онхоцеркомы) представляют собой полости с серозным или гнойным содержимым и гельминтами. Поражения лимфатической системы проявляются стазом и отеком. Паразитирование микрофилярий является причиной поражения глаз, которое может выражаться в светобоязни и конъюнктивальном зуде либо привести к полной потере зрения. При отсутствии соответствующего лечения в органах зрения наступают необратимые изменения, препятствующие его возвращению. Прогноз при онхоцеркозе всегда серьезный. Диагностика основывается на данных опроса и клиническом обследовании. Диагноз подтверждается при обнаружении микрофилярий в образцах кожи (поверхностных и глубоких) или взрослых гельминтов при удалении и вскрытии онхоцерком. Для диагностики поражений глаз выполняется офтальмологическое обследование. Применяется также РСК, РПГА, РФ А, внутрикожная аллергическая проба.
Лечение и профилактика Вухерериоз Для лечения вухерериоза применяются дитразин (диэтилкарбамазин, баноцид, гетразан, локсуран) — 72 мг/кг цитрата (или 36 мг/кг основания). Курс лечения — 14–21 день. При необходимости курс лечения повторяют. Имеются данные об эффективности против зрелых филярий антрипола (сурамин, наганин, германин и др.). В случае присоединения вторичной инфекции показаны антибиотики. В начальной стадии положительный эффект может быть достигнут назначением кортикостероидных гормонов. При слоновости выполняют хирургическое лечение, включающее иссечение пораженных тканей, кожную пластику, иногда ампутацию органа. В качестве мер профилактики служат выявление и лечение больных, а также борьба с переносчиками (комарами), защита от их нападения.
Бругиоз Лечение то же, что и при вухерериозе, но дозы дитразина меньше: на курс 30–40 мг/кг цитрата (или 15–20 мг/кг основания).
Онхоцеркоз Используется дитразин, сурамин и тримеларсан. Существует несколько схем терапии онхоцеркоза данными средствами в различных сочетаниях. Выбор метода и лечение больных проводятся только специально подготовленными и квалифицированными врачами. Онхоцеркомы удаляют хирургическим путем. Профилактика включает мероприятия по выявлению и лечению больных, а также борьбу с мошками-переносчиками.
ФИМОЗ
ОпределениеФимоз — сужение отверстия крайней плоти, не позволяющее обнажить головку полового члена. Фимоз может быть врожденным и приобретенным.
Этиология и патогенез При врожденном фимозе внутренняя поверхность крайней плоти соединена с головкой полового члена (так называемая физиологическая форма фимоза). Истинного фимоза в данном случае нет. Крайняя плоть возле отверстия достаточно растяжима, а склеивание ее с головкой полового члена непрочно и обусловлено главным образом не наступившим вовремя разделением этих поверхностей. Примерно к четырем годам узкое отверстие препуциального мешка ребенка растягивается, и создается возможность полного открытия головки полового члена. Характерным признаком врожденного фимоза является одновременное сужение и удлинение препуциального мешка в виде хоботка. Это так называемая гипертрофическая форма фимоза. В препуциальном мешке скапливается секрет тизоновых желез (желез крайней плоти) в виде беловатого сального вещества — смегмы, которое надо удалять ежедневно путем обмывания. Но при фимозе это невозможно. Застоявшаяся смегма под действием инфекции начинает разлагаться, что и ведет к развитию воспалительного процесса — баланита (см.) и баланопостита с последующим рубцеванием и сращением головки полового члена и препуциального мешка. Этому процессу могут также способствовать мягкий и твердый шанкр (см.) (см. Сифилис). Так возникает приобретенная форма фимоза. Иногда смегма пропитывается солями, в результате чего образуются камни, которые могут вызывать язвы и пролежни препуциального мешка. Выраженный фимоз с точечным отверстием крайней плоти может служить причиной задержки мочи и развития гидроуретеронефроза (сочетание водянки мочеточника и водянки почки).
Клиническая картина и диагностика При резко выраженном фимозе мочеиспускание происходит с натуживанием, тонкой струей. Хоботкообразное удлинение крайней плоти в момент мочеиспускания может приобретать шаровидное вздутие. Кроме неоткрытия головки полового члена, взрослые отмечают боли во время эрекции и полового сношения. Длительное затруднение мочеиспускания при фимозе приводит к расстройству уродинамики и развитию пиелонефрита (см.). При полной рубцовой облитерации (заращении) крайней плоти может наступить острая задержка мочи. Затруднение мочеиспускания при фимозе осложняется образованием грыж (см.) передней стенки живота, пахово-мошоночных и бедренных грыж. Длительный застой и разложение смегмы при фимозе способствуют развитию опухолей (см.) головки полового члена. Диагноз не вызывает затруднений. Он основывается на жалобах и типичных изменениях полового члена. Дифференциальный диагноз проводят с простым баланопоститом, сифилисом (см.), твердым и мягким шанкром и опухолью головки полового члена.
Лечение и профилактика Лечение физиологического фимоза консервативное. Если к 4-летнему возрасту головка не открылась, то ее пытаются раскрыть, не прибегая к операции. В отверстие крайней плоти вводят зонд, которым осторожно разъединяют рыхлые спайки между головкой и крайней плотью, расширяют с помощью вазелина препуциальное отверстие, обнажают и обмывают головку, обмывают и смазывают препуциальный мешок. У взрослых лечение фимоза только оперативное. Профилактика фимоза состоит в соблюдении гигиенических мероприятий и лечении воспалительных процессов в половом члене.
ФИШЕРА-ЭВАНСА СИНДРОМ
ОпределениеФишера-Эванса синдром — сочетание аутоиммунной гемолитической анемии (см.) с аутоиммунной тромбоцитопенией (пониженным содержанием тромбоцитов). Выделяют симптоматическую и идиопатическую формы синдрома Фишера-Эванса.
Этиология и патогенез Симптоматическая форма наблюдается при хроническом гепатите (см.), системной красной волчанке (см.), ревматоидном артрите(см.), хроническом лимфолейкозе, лимфоме (см.), саркоме (см.), лимфогранулематозе (см.). Иногда данный синдром является первым признаком перечисленных заболеваний. При идиопатической форме гемолиз (разрушение эритроцитов) и тромбоцитопению связать с каким-либо заболеванием не удается. В механизме развития синдрома Фишера-Эванса имеет значение повышенное разрушение эритроцитов и тромбоцитов в связи с фиксацией на их поверхности белков иммуноглобулиновой природы — аутоантител. Они специфически связываются с резус-антигенами клеток крови, а в некоторых случаях направлены против антигенов других систем. Разрушение эритроцитов и тромбоцитов происходит в селезенке, печени и костном мозге. В связи с этим наблюдается увеличение в костном мозге эритроидных клеток и мегакариоцитов.
Клиническая картина и диагностика Клиническая картина характеризуется анемией (см.), высоким ретикулоцитозом и непрямой гипербилирубинемией, сочетающимися с тромбоцитопенией, т. е. симптомами, свойственными аутоиммунной гемолитической анемии (см.) и тромбоцитопенической пурпуре. Болезнь начинается постепенно с болей в суставах и животе, повышенной температуры. Потом появляются слабость, одышка, экхимозы (обширные кровоизлияния в кожу или слизистые оболочки) и петехии (точечные кровоизлияния) на коже, кровоизлияния в слизистую рта, конъюнктиву, отмечаются носовые и маточные кровотечения. Геморрагический синдром предшествует появлению клинических и лабораторных признаков иммунного гемолиза (разрушения эритроцитов). Иногда анемия (см.) и тромбоцитопения появляются одновременно. Тромбоцитопения может развиться через несколько лет после удаления селезенки, произведенного по поводу аутоиммунной гемолитической анемии. Диагноз ставится на основании клинической картины и прямой пробы Кумбса, подтверждающей аутоиммунный характер гемолиза. Отрицательная проба Кумбса не исключает наличие у больного иммунного гемолиза. Установить причину гемолиза могут обнаружение повышенного содержания в крови ретикулоцитов, укорочение жизни эритроцитов, увеличение в костном мозге клеток эритроидного ряда. При тромбоцитопении в костном мозге увеличивается количество мегакариоцитов, что указывает на тромбоцитолиз.
Лечение и профилактика Применяют глюкокортикоидные гормоны, при отсутствии эффекта показано удаление селезенки. Если это не дает ожидаемого результата, назначают цитостатики (азатиоприн, циклофосфан, винкристин) совместно с глюкокортикоидами. При тяжелой анемии показаны трансфузии эритроцитарной массы. Переливание тромбоцитарной массы неэффективно. Профилактика заключается в исключении рецидивов гемолиза и тромбоцитолиза, особенно при вирусных заболеваниях. Больные должны избегать инсоляции (пребывания на солнце) и приема препаратов, блокирующих функцию тромбоцитов (салициловой кислоты).
ФЛЕБИТ
ОпределениеФлебит — острое или подострое воспаление стенки вены до момента образования тромба и перехода процесса в тромбофлебит или флебосклероз. Различают перифлебит — воспаление наружной оболочки стенки вены, эндофлебит — воспаление внутренней оболочки стенки вены и панфлебит — воспаление всех оболочек стенки вены.
Этиология и патогенез Перифлебит возникает в результате перехода воспалительного процесса на вену из окружающих тканей при абсцессе (см.), ожоговой ране (см.), панариции (см.), флегмоне (см.), туберкулезе (см.) и др. При неспецифическом воспалении наружная стенка вены отечна и инфильтрирована. Затем отек и инфильтрация распространяются на среднюю часть стенки вены, разрушая мышечный слой, и на эндотелий. Образуется пристеночный тромб и развивается тромбофлебит (см.). Если процесс заканчивается благополучно, то формируется флебосклероз. При туберкулезном поражении периваскулярного слоя вены воспалительный процесс глубже не проникает, ограничиваясь ее наружной оболочкой. Эндофлебит образуется в связи с травмой вены при длительном пребывании в ней иглы или катетера, при введении в вену гипертонических и склерозирующих растворов, варикозном расширении вен. Повреждение эндотелия вены всегда ведет к образованию пристеночного тромба. При туберкулезном эндофлебите во внутренней оболочке вены появляются милиарные бугорки, слияние которых может привести к образованию венозного полипа (до 20 см) с казеозным (творожистым) некрозом (см.) в центре. Панфлебит часто развивается в грудонадчревных венах (болезнь Мондора) в результате травмы грудной клетки и живота, инфекционных болезней и без видимой причины. Процесс заканчивается склерозированием этих вен и их облитерацией.
Клиническая картина и диагностика Клинику флебита можно наблюдать в начальной стадии в основном при локализации на нижних конечностях. При поражении поверхностных вен нижних конечностей больные предъявляют жалобы на острые локальные боли по ходу вен, лучевидные полосы покрасневшей кожи, болезненные уплотнения вен в виде шнура. С момента образования тромба развивается клиническая картина тромбофлебита (см.). Болезнь Мондора характеризуется наличием на переднебоковой поверхности грудной клетки болезненного шнуровидного тяжа или множества тяжей, по ходу которых ощущаются боль и чувство жжения; эти признаки исчезают не раньше чем через 3–4 недели. Флебит может осложниться кровотечением, септической эмболией (см.), абсцессом (см.) и др. При инфекционном флебите может развиться абсцесс в паравенозной (околовенозной) клетчатке. Диагноз флебита ставят на основании клинической симптоматики и лабораторных данных, указывающих на гиперкоагуляцию (повышенную свертываемость) крови и данных инструментальных исследований (ультразвуковая допплерография, реография, плетизиография, контрастная флебография). Болезнь Мондора дифференцируют с лимфангитом, наблюдающимся при злокачественных опухолях (см.) молочной железы.
Лечение и профилактика Лечение преимущественно консервативное. Применяется противовоспалительная терапия: ацетилсалициловая кислота, бутадион, реопирин, венорутон, гливенол, анавенол, эскузан. Для профилактики тромбообразования назначают трентал и курантил. При инфекционном флебите показана антибактериальная терапия. Местно применяют мази с гепарином, венорутоном, согревающие физиопроцедуры. Профилактика заключается во внутривенных инъекциях и катетеризации основных вен; необходимо своевременное лечение гнойно-воспалительных процессов.
ФЛЕБОТОМНАЯ ЛИХОРАДКА
ОпределениеФлеботомная лихорадка — вирусная болезнь, передающаяся через укусы москитов рода флеботомус.
Этиология и патогенез Заболевание вызывается вирусом. Источником инфекции является больной человек в течение последних двух дней инкубации и первых двух дней болезни. Переносчиком и резервуаром вируса являются москиты рода Phlebotomus. На человека нападает только самка москита, которая после насыщения кровью больного флеботомной лихорадкой через 6–8 дней становится способной передавать вирус со слюной при укусе другому человеку. Заболеваемость флеботомной лихорадкой носит сезонный характер. Восприимчивость к болезни всеобщая. Заражение человека происходит через кожу при укусе инфицированного москита. После 3–9 дней размножения вируса в лимфоидных клетках развивается вирусемия (проникновение вируса в кровь) с общетоксическими проявлениями. Флеботомная лихорадка характеризуется кратковременной лихорадкой, сильной головной болью, болями в глазах, икроножных мышцах и пояснице. Поражаются центральная нервная система, костный мозг и другие органы. Стойкий иммунитет вырабатывается у 80 % переболевших флеботомной лихорадкой.
Клиническая картина и диагностика Инкубационный период колеблется от 3 до 9 дней, чаще составляя 4–5 дней. Болезнь начинается внезапно с озноба, повышения температуры до 39–40 °C, головной боли в лобной и височной областях, выраженной боли в мышцах, суставах, глазных яблоках, особенно при надавливании (симптом Тауссига), отмечается выраженная светобоязнь. Нередко наблюдаются боли в животе, тошнота, рвота (см.), потеря аппетита. Лицо покрасневшее, сосуды склер инъецированы в виде треугольника основанием к наружным углам глаз, а вершиной к роговице (симптом Пика). Слизистая зева и язычка также гиперемирована. Язык сухой, на губах обнаруживаются герпетические высыпания. На месте укуса москита образуется узелок розового цвета, который исчезает через 4–5 дней. Пульс в первый день частый, затем развивается брадикардия (см.). Артериальное давление снижено. Отмечаются головокружение, бред (см.), потеря сознания, иногда судороги. Лихорадка длится 2–4 дня, после чего наступает период выздоровления, продолжающийся до 10 суток. Этот период характеризуется развитием астении и депрессией (см.); возможны также рецидивы болезни. Осложнения наблюдаются редко. Однако возможно развитие отита (см.), паротита (см.), полиневрита (см.) и пневмонии (см.). Диагноз ставится на основании данных клинической картины и лабораторных данных. Обычно наблюдается лейкопения (пониженное содержание лейкоцитов) с относительным лимфоцитозом. Также проводятся вирусологические и серологические исследования. Дифференциальный диагноз проводят с гриппом (см.), малярией (см.), сыпным тифом (см.), лептоспирозом (см.), денге лихорадкой (см.), клещевым возвратным тифом (см.).
Лечение и профилактика Лечение проводится в стационаре. Назначают постельный режим, диету, средства дезинтоксикации и симптоматической терапии. Выписывают больных на 7—10-й день после нормализации температуры. Профилактика сводится к уничтожению москитов с помощью инсектицидов, защите людей от них всеми доступными средствами (защитные сетки, импрегнированные репелленты и др.).
ФЛЕГМОНА
ОпределениеФлегмона — разлитое гнойное воспаление жировой клетчатки, склонное к распространению по клетчаточным каналам. Она может развиваться под кожей, фасцией, в межмышечных щелях, средостении, забрюшинном пространстве.
Этиология и патогенез Флегмона развивается в клетчатке в связи с внедрением в нее микроорганизмов. Она может быть гнойной, гнилостной и анаэробной. Возбудителями флегмоны являются стафилококк, стрептококк, синегнойная и кишечная палочки, вульгарный протей, анаэробы и другие микроорганизмы. Маловирулентные штаммы микробов (пневмококк, паратифозная палочка, стафилококк, дифтерийная палочка и др.) могут вызвать хроническую форму флегмоны, так называемую деревянистую флегмону. Проникновение микробов в клетчатку происходит при открытых повреждениях, реже — с током крови из воспалительного очага (см. Сепсис) из соседнего гнойного очага (карбункула (см.), буллезной рожи (см.), гнойного артрита (см.)), бывают и постинъекционные флегмоны. Флегмоны развиваются быстро и протекают с резко выраженной интоксикацией и подавлением иммунитета.
Патанатомия Различают серозную, гнойную, гнилостную и некротическую формы флегмоны. Вначале развивается серозное воспаление в клетчатке, при котором происходит инфильтрация мягких тканей лейкоцитами. При низкой способности микробов к заражению и высокой сопротивляемости макроорганизма процесс приобретает хроническое течение. Лейкоцитарная инфильтрация характерна и для молниеносно протекающих анаэробных инфекций (серозная флегмона). Если серозный экссудат превращается в гной, развивается гнойная флегмона; при инокуляции (изоляции) микробного очага развивается гнилостная инфекция. Мелкие очаги омертвения, сливаясь, образуют обширные очаги гнойного расплавления клетчатки (некротическая флегмона), а по периферии располагается зона серозного пропитывания тканей. При прогрессировании флегмоны воспаление может распространиться на соседние ткани (мышцы, сухожилия, кости). В мышцах нарушается кровообращение, они пропитываются гноем, состоящим из лейкоцитов, расплавившихся мышечных волокон и фибрина. Мышцы становятся бледными, приобретают желто-зеленый цвет. Гной распространяется по сухожильным влагалищам, вовлекая в процесс новые области. При благоприятном течении гнойно-некротический участок отграничивается от здоровых участков лейкоцитарным валом, а позже — грануляционным барьером. На месте флегмоны образуются абсцессы (см.), которые могут вскрываться самостоятельно.
Клиническая картина Флегмона может быть острой, хронической, отграниченной и прогрессирующей. По локализации она бывает подкожной, подфасциальной, межмышечной, подслизистой, забрюшинной, поддиафрагмальной, тазовой и др.
Острая флегмона Острая флегмона зависит от контагиозности (заразительной способности) микрофлоры, иммунитета больного и локализации воспалительного процесса. Подкожная гнойная флегмона характеризуется резкими болями в месте поражения, припухлостью и уплотнением тканей, краснотой и повышением местной температуры кожи, нарушением функции пораженного органа. Общее состояние больного прогрессивно ухудшается, повышается температура тела, появляется озноб, учащается пульс. Некоторое время спустя в районе плотной инфильтрации тканей образуются очаги размягчения и флюктуации. Если образуется грануляционный (соединительнотканный) вал, то распространение инфекции приостанавливается. Иногда же воспалительный процесс приобретает прогрессирующее течение, распространяясь на значительные участки. Общее состояние резко ухудшается, повышается температура тела, усиливается головная боль, в крови определяется высокий уровень лейкоцитов. Особенно тяжело протекает флегмона лица, мозговых сосудов и синусов твердой мозговой оболочки. Субфасциальная и межмышечная флегмоны относятся к глубоким гнойным поражениям. Начало болезни острое, с повышением температуры до 39–40 °C, озноба, слабости, разбитости. Местно определяются воспалительный отек ткани, резкая боль, нарушение функции органа. Кожа напряженная, покрасневшая, развивается регионарный лимфаденит (см.). Тяжелая интоксикация ведет к нарушению функций сердечно-сосудистой системы, дыхания, печени, почек и других органов. Клиническая картина глубоких флегмон во многом определяется топографо-анатомическими особенностями пораженной области, наличием в ней фасций и клетчаточных пространств. Фасции защищают окружающие ткани от воздействия гноя. Гнилостные флегмоны протекают тяжелее и скоротечнее, чем гнойные. Они наблюдаются при инфицированных мочевых затеках, ранениях толстой кишки, ретроперитонеальных гнойных процессах, гнилостных поражениях средостения и ротовой полости. Иногда наблюдается сочетание гнойной и гнилостной инфекции. При гнилостной флегмоне резко повышается температура (до самых высоких цифр), падает артериальное давление, рана становится темно-серого или черного цвета, пораженные ткани расплавляются, развиваются лимфаденит (см.) и лимфангит с выделениями из раны, с запахом и газами.
Хроническая флегмона Хроническая деревянистая флегмона шеи (флегмона Реклю) характеризуется медленным течением воспалительного процесса в межмышечной и подкожной соединительной ткани, повышенной температурой, образованием инфильтратов мягких тканей дна ротовой полости с последующим распространением на шею. Вначале поражается часть шеи в виде деревянистого малоболезненного инфильтрата, затем процесс прогрессирует и захватывает всю шею. Когда в воспалительный процесс вовлекается кожа, она спаивается с глубжележащими тканями, становится гиперемированной (полнокровной) и цианотичной (синюшной). От здоровых тканей инфильтрат отграничивается выступающим валиком. Через несколько недель или месяцев отдельные участки инфильтрата размягчаются, образуются безболевые абсцессы (см.). В области инфильтрата отмечается чувство распирания, давления и тяжести. Распространение инфильтрата на глубжележащие ткани шеи сопровождается болезненным отеком гортани, затруднением глотания и дыхания. Осложнения развиваются там, где процесс вовремя не остановлен. Это связано либо с поздним обращением больного, либо с затруднениями в диагностике. При органной и межорганной флегмоне могут наблюдаться перитонит (см.) и спаечная болезнь; при локализации процесса вблизи суставов — гнойные артриты (см.) и т. д.
Диагностика и дифдиагностика Диагноз ставится на основании клиники заболевания, лабораторных исследований крови и бактериологических исследований раневого отделяемого. Вызывает затруднения диагностики подслизистых флегмон полых органов. От других форм воспаления полых органов флегмона отличается острым началом и очень тяжелым клиническим течением. Резко повышается температура тела (до 40 °C и выше) с ознобами, тошнотой, рвотой (см.), спутанностью сознания, резкими болями в пораженной области живота. В крови определяются увеличение количества нейтрофильных лейкоцитов и ускоренная СОЭ. Используются клинические, рентгенологические и инструментальные методы исследования. При необходимости проводятся гастроскопия, дуоденоскопия, лапароскопия и др. Дифференциальный диагноз при глубокой флегмоне проводится с гематогенным острым остеомиелитом (см.), глубоким тромбофлебитом (см.), нагнаивающейся гематомой. Для дифференциации флегмоны с абсцессом (см.) применяют пневмоабсцессографию и контрастную абсцессографию. Флегмону Реклю дифференцируют с актиномикозом (см.), ангиной Людвига, скиррозной формой рака (см.), туляремией (см.) и др.
Лечение и профилактика Лечение в начальной стадии заболевания — антибиотики, повышение защитных сил организма, создание функционального покоя поврежденному органу, антигистаминные препараты, магнитотерапия, УВЧ-терапия, согревающие компрессы. При отсутствии эффекта, а тем более при нарастании интоксикации показано немедленное оперативное вмешательство с дренированием гнойных затеков. Для лечения деревянистой флегмоны Реклю используют физиотерапевтические процедуры (магнитное поле, УВЧ, соллюкс), сульфаниламидные препараты и антибиотики. При отсутствии эффекта показана операция. Профилактика сводится к предупреждению открытых травм, а также своевременному лечению больных с гнойными заболеваниями.
ФЛЕГМОНА НОВОРОЖДЕННЫХ
ОпределениеФлегмона новорожденных — воспаление кожи и подкожной клетчатки у детей первых недель жизни. Она характеризуется быстрым распространением процесса, омертвением подкожной клетчатки и кожи, иногда осложняется сепсисом (см.).
Этиология и патанатомия Возбудителем заболевания является золотистый стафилококк. В подкожную клетчатку он проникает через микро- и макротравмы кожи. Она у новорожденных легко ранимая, а особенности ее строения играют существенную роль в быстром развитии и распространении процесса вглубь и по периферии. Столь быстрое омертвение тканей объясняется обширным тромбозом кровеносных сосудов пораженной области. Возможен и гематогенный путь инфицирования клетчатки при вовлечении в воспалительный процесс пупочной ранки, пиодермии (см.) и др. На ранних стадиях заболевания наблюдается лимфогистиоцитарная инфильтрация вокруг кровеносных сосудов; они тромбированы, с признаками эндо- и периартериита, видны участки кровоизлияний. Пораженная клетчатка тусклая, не кровоточит, отделяется мелкими кусочками, а позже и пластинами. Кожа некротизируется, в соединительной ткани обнаруживается скопление бактерий. Иногда некроз (см.) может поражать фасции, мышцы, хрящи и кости.
Клиническая картина и диагностика Начало болезни острое, температура повышается до 40 °C, прогрессивно нарастает интоксикация. Возбуждение ребенка сменяется торможением, крикливость — вялостью и отказом от кормления. Кожа бледная, с серым оттенком и мраморным рисунком. Дыхание частое, поверхностное; тоны сердца приглушены, пульс учащен, малого наполнения, в крови повышено количество лейкоцитов, СОЭ ускорена. В ближайшие дни на коже появляются участки покраснения и уплотнения, она болезненная на ощупь и не собирается в складки. Через несколько часов участок поражения увеличивается в несколько раз. Он инфильтрирован, плотен, температура над ним повышена. Через 2–3 дня в центре инфильтрата появляется размягчение, образуются свищи, через которые выделяется содержимое инфильтрата. Иногда на месте инфильтрата образуется большая раневая поверхность. Дно раны серого цвета, края подрыты, грануляции отсутствуют. При отсутствии должного лечения могут развиться сепсис (см.) и раневое истощение. Диагноз основывается на клинических данных и лабораторных анализах. Дифференциальный диагноз проводят с рожистым воспалением (см.) и адипонекрозом (жировым некрозом).
Лечение Лечение флегмоны новорожденных оперативное и неотложное. Под местной анестезией 0,25 %-ным раствором новокаина с антибиотиками производят множественные разрезы кожи над очагом поражения в шахматном порядке длиной до 20 мм. Накладывают повязку с 5—10 %-ным раствором хлорида натрия с антисептиком (фурацилин, диоксин и др.). Показана физиотерапия (УФ-облучение, УВЧ). Для стимуляции грануляций и заращения применяют повязки с фибринной пленкой, воздействие на рану ультразвуком и лазером. В общее лечение включают дезинтоксикационные, антибактериальные и иммуностимулирующие средства.
ФЛЮОРОЗ
ОпределениеФлюороз — хроническое заболевание (интоксикация), развивающееся в результате избыточного поступления фтора и его соединений в организм человека.
Этиология и патогенез Причиной болезни является избыточное содержание фтора и его соединений в питьевой воде, вдыхаемом воздухе и продуктах питания. Различают профессиональный и эндемический флюороз. Профессиональный флюороз наблюдается у рабочих алюминиевой промышленности, на которых воздействуют повышенные концентрации соединений фтора. Эндемический флюороз встречается среди населения, употребляющего воду с повышенным содержанием фтора. В основе механизма развития профессионального флюороза лежат угнетение активности ферментов в организме и нарушение проницаемости клеточных мембран, приводящее к нарушению биоэнергетики и развитию патологических процессов в органах и системах органов человека. Поступление газообразных соединений фтора через верхние дыхательные пути ведет к атрофии (см.) их слизистых оболочек, а также к развитию ринита (см.), фарингита (см.), ларингита (см.), носовым кровотечениям, прободению носовой перегородки; нередко — к дистрофическим изменениям внутренних органов. Способность фтора к кумуляции (накоплению) в высокоминерализованных тканях приводит к развитию патологических изменений в костной системе: появляются меловидные и пигментные пятна на эмали зубов, повышается их хрупкость и стираемость. Степень поражения костной ткани определяется на рентгенограмме. Для I (докостной) стадии профессионального флюороза характерны функциональные изменения в органах и тканях. Появляются боли в костях, суставах, мышцах, верхней части живота и правом подреберье. Во II стадии выявляются изменения костной ткани в виде симметричных периостальных наслоений на трубчатых костях голеней. Нарастает мышечная слабость. Нарушаются функции печени и желудочно-кишечного тракта. Флюороз III стадии подразделяется на подстадии А и Б. При IIIA стадии, кроме изменений в костях, выявляются сужения костно-мозговых каналов, обызвествление связок, повышение плотности костной ткани. Для флюороза IIIБ стадии характерен генерализованный (распространенный) системный остеосклероз. Во II–III стадиях в костях таза и позвонках усиливается рисунок губчатой сети, утолщаются трабекулы, кость теряет свою структуру, становится недифференцированной и однородной. На позвонках определяются периостальные разрастания и смазанность контуров. Костномозговой канал трубчатых костей местами закрывается полностью из-за эндостальных (внутрикостных) разрастаний. Обызвествляются связки голени и предплечья. При тяжелом течении заболевания процесс распространяется на весь скелет.
Клиническая картина Профессиональный флюороз При ингаляционном поступлении в организм человека соединений фтора отмечаются раздражение слизистых оболочек верхних дыхательных путей, кашель (см.), чихание, боль в горле. Обращает на себя внимание боль в суставах и костях, мышцах, мышечная слабость и нарушение их подвижности, ломкость зубов и появление на них пятен. Беспокоят боли в правом подреберье и верхней части живота. Это связано с поражением печени и желудочно-кишечного тракта. Диагноз ставится на основании анализа клинической картины и рентгенологических данных. Дифференциальный диагноз проводят с мраморной болезнью (см.), остеомиелофиброзом, Гоше болезнью (см.) и другими заболеваниями.
Эндемический флюороз Местности с повышенным содержанием фтора в питьевой воде являются причиной эндемического флюороза местного населения. Но если человек старше 10–12 лет приезжает в местность, эндемическую по флюорозу, то выраженные формы флюороза у него не развиваются. Тем не менее у таких людей все-таки отмечается поражение зубов и костей по типу остеопороза (см.). Поражение зубов начинается с появления единичных меловидных пятнышек на симметрично расположенных зубах (чаще резцах). Затем развивается желто-бурая пигментация всех зубов, отмечается повышенная их стираемость, эрозия эмали и деформация зубов.
Лечение и профилактика Профессиональный флюороз Лечение проводят витаминами А, B, C, P, препаратами кальция и магния, солями молочной и пировиноградной кислот, воздействующими на патогенетические механизмы флюороза. Положительный эффект дают хвойные, сероводородные и радоновые ванны. Показано санаторно-курортное лечение. У больных профессиональным флюорозом I и II стадии возможно частичное восстановление нарушенных функций внутренних органов. Лиц в начальной стадии интоксикации фтором рекомендуется перевести на другую работу. Профилактика направлена на устранение контакта рабочих с соединениями фтора. Для этого должны предусматриваться механизация и автоматизация производства, герметизация технологического процесса, вентиляция, средства индивидуальной защиты, соблюдение правил личной гигиены, лечебное питание, регулярные медицинские осмотры.
Эндемический флюороз Лечение эндемического флюороза направлено на устранение дефекта зубов. Профилактика предусматривает замену источников водоснабжения, а если этого сделать невозможно, необходимо проводить дефторирование воды.
ФОСФАТ-ДИАБЕТ
ОпределениеФосфат-диабет (гипофосфатемический семейный рахит) — наследственное заболевание, обусловленное нарушением реабсорбции (обратного всасывания) фосфата в почечных канальцах, характеризующееся рахитоподобными изменениями костной системы.
Этиология, патогенез и патанатомия Заболевание передается по доминантному типу, сцепленному с полом. При фосфатдиабете нарушены энзиматические (ферментные) процессы преобразования витамина D в активные гормоноподобные субстанции при снижении чувствительности эпителия кишечника к действию этих метаболитов (продуктов обмена). Мужчины передают заболевание дочерям, женщины — детям обоих полов. Заболевание развивается вследствие первичного дефекта в ферментативных системах верхних почечных канальцев, участвующих в реабсорбции фосфатов, повышенной чувствительности эпителия почечных канальцев к паратгормону (гормону околощитовидных желез), а также к синтезу метаболитов витамина D, обладающих фосфатурическим действием. Повышенное выделение фосфора с мочой приводит к гипофосфатемии (пониженному содержанию фосфатов в крови), повышению активности щелочной фосфатазы, нарушениям фосфорно-кальциевого обмена и возникновению костных деформаций. Исследования костной ткани отмечают нарушение структуры гаверсовых каналов (каналов костной ткани) и трабекул. Зоны усиленного образования остеоидной (костной) ткани чередуются с участками остеопороза (см.).
Клиническая картина и диагностика Первые симптомы заболевания появляются в возрасте 1–2 лет. Отмечаются задержка роста, деформация скелета (О-образные искривления нижних конечностей, рахитические «браслеты» на руках), мышечная гипотония. Фосфат-диабет имеет сходные черты с обычным витамин-D-дефицитным рахитом (см.), но отличается от него тем, что при данном заболевании нет признаков интоксикации, а общее состояние больного удовлетворительное. В отличие от рахита (см.) процессы остеомаляции (рассасывания кости) и остеоидной гиперплазии (разрастания кости) выражены преимущественно в костях нижних конечностей (деформация коленных и голеностопных суставов). Без лечения болезнь прогрессирует. Рентгенологически обнаруживаются те же изменения, что и при рахите (см.), но патология особенно резко выражена в костях нижних конечностей. Структура губчатого вещества кости грубоволокнистая. Аналогичные изменения костей обнаруживаются у одного из родителей. Содержание фосфора в крови больных снижено; уровень кальция не изменен. С мочой фосфатов выделяется в 4–5 раз выше нормы. Диагноз ставят на основании клинической картины, лабораторных данных и рентгенологических исследований костей. В норме содержание неорганического фосфата в сыворотке крови составляет 2–7 мг на 100 мл. Активность щелочной фосфатазы в 2–4 раза превышает нормальные показатели. На рентгенограмме определяются поражение метафизов и признаки остеомаляции. Дифференциальный диагноз проводят с рахитом (см.) и рахитоподобными заболеваниями.
Лечение и профилактика Лечение проводят высокими дозами витамина D, начиная с 10–25 тыс. МЕ в сутки и постепенно увеличивая дозу на 10–15 тыс. МЕ вплоть до нормализации фосфатов в крови. При улучшении состояния назначают поддерживающие дозы — 1–5 тыс. МЕ с перерывами лечения на 3–7 дней. Следят за уровнем активности щелочной фосфатазы и динамикой рентгенологических изменений костей. Лечение проводят под контролем артериального давления, содержания кальция в моче и остаточного азота крови. Хорошим терапевтическим эффектом обладают метаболиты витамина D — 2,5-гидроксихолекальциферол и 1,25-дигидроксихолекальциферол. Профилактика направлена на раннее выявление фосфат-диабета и коррекцию фосфорно-кальциевого обмена.
ФРАМБЕЗИЯ
ОпределениеФрамбезия — высококонтагиозный (высокозаразный) трепонематоз тропических стран.
Этиология и эпидемиология Возбудителем фрамбезии является трепонема, очень подвижная спирохета в виде штопора, имеющая до 20 завитков. Фрамбезия распространена в тропических странах. Заражение происходит в результате прямого контакта с больным человеком, реже — через предметы домашнего обихода и еще реже — половым путем. Переносчиками могут быть мухи, клещи, тараканы и др. Болеют чаще всего дети от 2 до 14 лет, проживающие в неблагоприятных санитарно-гигиенических условиях.
Патогенез Механизм развития этого заболевания в основных чертах сходен с таковым сифилиса. Патогистологической основой фрамбезии являются акантоз, папилломатоз, гиперкератоз. Затем развиваются папулы воспалительного характера, гранулемы, язвы. Возникают изменения в собственно дерме (коже), инфильтрации, отек. Для поздней стадии характерны гуммозно-язвенные поражения, сходные с сифилитическими.
Клиническая картина Согласно Международной номенклатуре клинические проявления фрамбезии могут быть следующими. I. Ранняя фрамбезия: — начальная фрамбезома: папилломатозная форма; язвенно-папилломатозная форма; — ранние фрамбезиды кожи (пятнистые фрамбезиды (эритематозно-пятнистые, чешуйчато-пятнистые); пятнисто-папулезные фрамбезиды (чешуйчато-пятнисто-папулезные); папулезные фрамбезиды (простые папулезные, фрамбезиды с пупковым вдавливанием); микропапулезные фрамбезиды (остроконечные, чешуйчатые); бляшки; узлы (узловатые ранние фрамбезиды); папилломы): — ранние фрамбезиды слизистых оболочек: пятнисто-папулезные фрамбезиды слизистых оболочек; папилломы слизистых оболочек; — ранние фрамбезиды ладоней и подошв: папилломы ладоней и подошв; чешуйчато-слизистые фрамбезиды ладоней и подошв; ранний гиперкератоз ладоней и подошв; — ранняя фрамбезия костей и суставов: периостит; остит; остеопериостит; гунду; саблевидные голени; узлы; гидрартроз; — латентная ранняя фрамбезия. II. Поздняя фрамбезия: — поздние фрамбезии кожи: бляшки; узлы (узловатые поздние фрамбезиды кожи, подкожной клетчатки); узловато-язвенные поздние фрамбезиды (поверхностные, глубокие); — поздние фрамбезиды ладоней и подошв: поздний гиперкератоз ладоней и подошв; — поздние фрамбезии костей и суставов: гуммозный периостит; гипертрофический периостит; гуммозный остит; гипертрофический остит; гуммозный остеопериостит; артрит; гангоза; узлы; гидрартроз; бурсит; — прочие проявления поздней фрамбезии: околосуставные узлы; — латентная поздняя фрамбезия. Наиболее высока восприимчивость к фрамбезии у детей 2—14 лет. Дети до 2 лет болеют крайне редко, так же редко болеют взрослые люди. Инкубационный период продолжается 3–4 недели. У некоторых больных определяется предшествующий период с симптомами интоксикации — недомогание, слабость, головные боли, озноб и познабливание, повышение температуры, ночные боли в мышцах, суставах и костях. В течении фрамбезии выделяют ранний, первичный, вторичный и поздний периоды. На месте внедрения возбудителя образуется первичный аффект (очаг поражения) — фрамбезиома, представляющаю собой зудящую папулу (узелок) с папилломатозными разрастаниями. В центре папулы образуется участок казеозного некроза, а затем формируется язва с мягким основанием (в отличие от твердого шанкра при сифилисе (см.)). Через короткое время папула превращается в безболезненную зернистую, легко кровоточащую папиллому или язву. Язва имеет кратерообразную форму, основание ее не инфильтрировано, дно покрыто кровоточащими грануляциями, напоминающими малину. С поверхности первичной фрамбезомы отделяется обильный зеленоватожелтый экссудат с трепонемами. Ссохшийся экссудат покрывает папилломы и язвы в виде струпа, после удаления которого обнажается легкоранимая, кровоточащая, мокнущая поверхность. Наиболее частыми вариантами ранних кожных фрамбезидов являются папулы и папилломы. Они безболезненны (кроме локализованных на подошвах стоп), сопровождаются зудом, сходны по строению с первичной фрамбезомой, но всегда многочисленны и меньше по размерам. В обильном экссудате фрамбезидов содержатся трепонемы. Ранние фрамбезиды кожи, как правило, заживают без рубцов; на их месте остаются депигментированные и гиперпигментированные пятна. Обратное развитие элементов занимает 3—12 месяцев. Первичная фрамбезома, как правило, единична, достигает в диаметре 1—10 см, располагается на любом участке тела, чаще на ногах и руках, и сохраняется в течение нескольких недель (до 2–4 месяцев), не оставляет рубца после заживания, только в случае присоединения посторонней травматизации развиваются рубцы. Через 1–4 месяца после появления первичной фрамбезомы происходит генерализация патологического процесса с развитием множественных и многообразных поражений кожи, слизистых оболочек, суставов и костей (ранние фрамбезиды). За несколько дней до их появления и в течение периода высыпаний нарастают, обычно по ночам, симптомы интоксикации. Вторичный период характеризуется распространением инфекции, появлением на коже туловища и (реже) конечностей множественных, слегка зудящих высыпаний — фрамбезидов. Это сочные розоватого цвета папулы, поверхность которых покрывается веррукозными (бородавчатыми) разрастаниями, напоминающими ягоды малины. Во вторичном периоде могут наблюдаться эритематозные, эритематозно-сквамозные папулы, летучий лихеноидный лишай (см.), гиперкератоз ладоней и подошв, затрудняющий работу и ходьбу (симптом походки краба). Длится вторичный период до 1–2 лет, проявляясь циклической сменой активных проявлений и скрытых периодов болезни. Затем, после латентного (скрытого) периода, ранние фрамбезиды могут повторно рецидивировать. Поражение слизистых оболочек наблюдается значительно реже и проявляется макулопапулезной сыпью или папилломами. У некоторой части больных через 15–25 лет от начала заболевания может развиться третичный период фрамбезии, который характеризуется глубокими и обширными поражениями кожи, подкожной клетчатки, костей и зубов. Раннее поражение костей характеризуется появлением периоститов, оститов, преимущественно берцовой и лучевой костей. Часты полидактилиты, возможны оститы носовых отростков верхнечелюстных костей — гунду, иногда развиваются синовиты. Через пять лет и более от начала заболевания наступает поздний период фрамбезии, характеризующийся развитием гумм и язв в коже и костях. Для фрамбезии, особенно в поздней стадии, характерно поражение кожи ладоней и подошв. У большой части больных развивается выраженный упорный гиперкератоз с глубокими, безболезненными трещинами и эрозиями, затрудняющими ходьбу. Гуммы и язвы развиваются медленно, отличаются торпидным (вялотекущим) течением, заживают с образованием рубцов. Гуммозноязвенные поражения приводят к патологическим переломам костей, анкилозам, рубцовой деформации пораженных участков тела. При локализации гуммы на границе костной и хрящевой частей носа возникает тяжелый косметический дефект (гангоза), приводящий к обезображиванию больного. Специфических поражений внутренних органов не бывает. Заболевание длится многие годы. Поздняя фрамбезия характеризуется гуммозными проявлениями с наличием узлов в области суставов, а также специфической патологией (гангоза и гунду). Узлы локализуются на разгибательных поверхностях локтевых и коленных суставов. Это подкожные фиброзные (соединительнотканные) образования до 10 см в длину по 4–5 штук в области сустава, расположенные симметрично с обеих сторон. Они могут существовать десятилетиями, не изменяясь и не изъязвляясь. Гангоза начинается со стойкого ринита (см.), затем в результате некротических изменений мягкого и твердого неба может произойти их перфорация. При разрушении лобной кости возможно образование мозговых грыж (см.). Гунду — медленно увеличивающиеся болезненные костные образования (гиперостоз), располагающиеся симметрично по обе стороны носа. Этому предшествуют нарастающие головные боли и кровянистогнойные выделения из носа. Отек тканей носа приводит к сужению носовых ходов и затруднению носового дыхания. Диагноз ставится на основании клинической картины, лабораторных данных и положительной реакции Вассермана. Дифференцируют заболевание с сифилисом (см.).
Диагностика и дифдиагностика Распознавание фрамбезии основано на этиологических, анамнестических данных. Подтверждается диагноз серологически: реакциями Вассермана, Кана, цитохолевой, а также реакцией иммобилизации трепанем (РИТ). Диагностика пинты и беджеля аналогична. Диагностическая ценность серологических реакций невелика из-за большого сходства возбудителей пинты и беджеля с возбудителями сифилиса и фрамбезии. Прибегают к обнаружению трепанем в соскобах кожи. Дифференциальный диагноз фрамбезии проводится с другими трепонематозами (в том числе сифилисом (см.)), глубокими микозами (см.), лепрой (см.), туберкулезом кожи (см.), кожным лейшманиозом (см.).
Лечение и профилактика Лечение проводят антибиотиками. Наружно применяют повязки с антисептическими растворами. Все контактные с больным получают антибиотики пролонгированного (продленного) действия.
ФРОНТИТ
ОпределениеФронтит — воспаление слизистой оболочки лобной пазухи.
Этиология и патогенез Различают острый и хронический фронтит. Острый фронтит развивается на фоне острого насморка (ринит), гриппа (см.), кори (см.), скарлатины (см.) и других инфекционных заболеваний. Не последнюю роль играет травма лобной кости, особенно в области лобно-носового канала. В связи с развитием отека слизистой оболочки лобно-носового канала могут наступить его обтурация (закупорка) и глубокое изъязвление слизистой оболочки лобной пазухи. При недостаточном дренировании острого фронтита, что может быть обусловлено увеличением переднего конца средней носовой раковины и сильным искривлением перегородок носа, возможен переход острого фронтита в хроническую форму. Хронический фронтит часто сопровождается поражением пазух решетчатой кости и других придаточных пазух носа.
Клиническая картина и диагностика Клиническая картина острого фронтита начинается с появления боли в лобной области, которая усиливается при давлении или постукивании по передней стенке лобной пазухи или при надавливании на верхнюю стенку глазницы у внутреннего угла глаза. Кроме того, больных беспокоят головная боль, боль в глазах, светобоязнь, слезотечение. Затрудняется носовое дыхание, появляются выделения из соответствующей половины носа. Повышается температура тела до 39 °C, а затем постепенно падает до субфебрильных цифр. При передней риноскопии под средней раковиной обнаруживается слизисто-гнойное отделяемое, слизистая оболочка гиперемирована (полнокровна). Симптомы хронического фронтита менеевыражены. Головная боль слабее, ноющая или давящая в области пораженной пазухи. При затруднении оттока воспалительной жидкости боль усиливается. Она также усиливается при приеме алкоголя, курении, усталости. Выделения из носа особенно сильны по утрам, больной выделяет большое количество мокроты. Слизистая оболочка переднего конца средней носовой раковины полипозно изменена, отечна, гиперемирована. Переход воспалительного процесса со слизистой оболочки на переднюю костную стенку лобной пазухи может осложниться ее некрозом (см.), секвестрацией и образованием свища. Расплавляя нижнюю стенку лобной пазухи, воспалительный процесс может перейти на ткани глазницы и заднюю стенку, что приведет к абсцессу (см.) мозга и гнойному менингиту (см.). Возможно развитие сепсиса (см.). Диагноз фронтита ставят на основании клинических данных, рентгенологического исследования и диафаноскопии. Дифференциальный диагноз проводят с невралгией (см.) первой ветви тройничного нерва, при которой боль наступает внезапно в виде приступа. Боль при фронтите усиливается при физическом напряжении, кашле (см.), чихании.
Лечение Лечение фронтита чаще всего консервативное. Основная цель — обеспечить свободный отток отделяемого из пазухи. Производят смазывание, закапывание или распыление в области среднего носового хода 2–3 %-ного раствора кокаина гидрохлорида с 2–3 %-ным раствором эфедрина гидрохлорида. При остром фронтите в начале болезни показан постельный режим, для снятия болей назначают анальгин с кофеином, согревающие физиотерапевтические процедуры и антибиотики. При хроническом фронтите для уменьшения отека слизистой оболочки среднего носового хода ее смазывают 1 раз в 2 дня 2–5 %-ным раствором нитрата серебра, проводят электрофорез 2 %-ным раствором йодистого калия и др. В настоящее время при гнойном фронтите применяют трепанопункцию лобной пазухи через переднюю костную стенку и промывают пазуху через канюлю 2 раза в день антисептическим раствором с введением 10–15 мг протеолитического фермента (трипсин, химотрипсин, химопсин) в 3 мл изотонического раствора хлорида натрия с добавлением соответствующего антибиотика. При отсутствии эффекта применяется резекция (удаление) гипертрофированного переднего конца средней носовой раковины или резекция искривленной перегородки носа и зондирование лобно-носового канала. При хроническом фронтите производят лобно-решетчатую трепанацию. В послеоперационном периоде пазуху промывают и смазывают соустье 2–5 %-ным раствором нитрата серебра.
ФУНИКУЛЯРНЫЙ МИЕЛОЗ
ОпределениеФуникулярный миелоз — заболевание спинного мозга, сочетающееся с пернициозной анемией (см.).
Этиология, патогенез и патанатомия Причиной развития фуникулярного миелоза является дефицит витамина В12 и фолиевой кислоты, реже — дефицит только витамина В12 или только фолиевой кислоты. Механизм развития болезни не выяснен. Фуникулярный миелоз почти всегда сочетается с пернициозной (злокачественной) анемией (см.), но может встречаться и без нее. Вместе с тем дефицит витамина В12 является решающим звеном как в механизме развития фуникулярного миелоза, так и пернициозной анемии. Витамин В12 утилизируется в организме внутренним фактором гастромукопротеида (так называемый внутренний фактор Касла), вырабатываемого желудком. Отсутствие синтеза внутреннего фактора ведет к нарушению всасывания витамина В12 в кишечнике, где фолиевая кислота переходит в ее активную форму — фолиновую кислоту. При этом нарушаются процессы кроветворения. Фуникулярный мелиоз наблюдается у вегетарианцев, исключающих из пищи молочные продукты, в которых содержится достаточное количество витамина В12; при нарушении секреции внутреннего фактора Касла (ахилия, гастроэктомия, синдром мальабсорбции (см.), обусловленный спру (см.), терминальный илеит (см. Крона болезнь), целиакия (см.), туберкулезный энтерит (см.), пеллагра); при поглощении витамина В12 избыточной кишечной флорой (дивертикулез кишечника (см.), синдром «слепой петли» при энтероанастомозах, дифиллоботриоз (см.)). Играют роль иммунные нарушения: более чем у половины больных пернициозной анемией находят аутоиммунный атрофический гастрит (см.), а в плазме крови — антитела к внутреннему фактору Касла. Патоморфологически наблюдается умеренная атрофия (см.) спинного мозга. Микроскопически выявляются очаги некроза (см.) и дегенерации в нежном и клиновидном пучках задних канатиков, пирамидных и боковых канатиках, демиелинизация в заднебоковых канатиках спинного мозга (заднебоковой склероз). Наблюдаются изменения, характерные для пернициозной анемии: глоссит (см.), атрофия слизистой оболочки желудка, гиперплазия красного костного мозга, увеличение селезенки, включения железа в клетках мононуклеарных фагоцитов.
Клиническая картина Фуникулярный миелоз в 90 % наблюдений проявляется в возрасте старше 40 лет, хотя может встречаться у детей и в старческом возрасте. Первыми признаками этого заболевания являются парестезии (неприятные ощущения в виде чувства онемения, жара, покалывания, ползанья мурашек, возникающие в пальцах ног и рук, распространяющиеся на верхние отделы конечностей, живот и грудь). Нарушается мышечно-суставное чувство, развивается атаксия (см.) (нарушение координации движений). Отмечается слабость в руках и ногах. Изменяется характер сухожильных рефлексов: в начальных стадиях развития фуникулярного миелоза они повышены, а позднее снижаются и исчезают. Появляются патологические рефлексы (стоп-симптом Бабинского). Основными признаками фуникулярного миелоза является сочетание пирамидных симптомов с вялыми парезами (см.) и мышечной гипотонией. Позднее присоединяются нарушения функции тазовых органов (импотенция (см.), недержание мочи и кала). Нередко фуникулярный миелоз сочетается с полиневропатией, когда к поражению спинного мозга присоединяются поражения периферических нервов. Снижается зрение, изменяется психика, развиваются сонливость, апатия, депрессия (см.), эмоциональная неустойчивость, иногда с острыми психическими расстройствами (см.).
Диагностика и дифдиагностика Диагноз ставится на основании клинической картины, особенно если она развивается на фоне пернициозной анемии (см.). Дифференциальный диагноз проводят с В12-дефицитной полиневропатией и поражением пирамидной системы. Диагноз фуникулярного миелоза подтверждается наличием ахилического гастрита (см.) и мегалобластов в стернальном пунктате. Поражение задних канатиков спинного мозга по клинике напоминает спинную сухотку при сифилисе (см.), но при отсутствии синдрома Аргайлла-Робертсона (см.); отрицательные серологические тесты на сифилис (см.) в крови и спинномозговой жидкости говорят в пользу фуникулярного миелоза. Поражение боковых канатиков при фуникулярном миелозе напоминает картину рассеянного склероза (см.). Однако для рассеянного склероза характерны многоочаговость поражения, в том числе и головного мозга, ремиттирующее течение и повышение ахилловых рефлексов. Одновременное поражение задних и боковых канатиков типично не только для фуникулярного миелоза, но встречается также при компрессии спинного мозга опухолью (см.) или при вертеброгенной шейной миелопатии. Диагностика сдавления спинного мозга основывается на ликвородинамических пробах, картине блокады подпаутинного пространства и характерной картины при миелографии, спинальной радиоизотопной сцинтиграфии, компьютерной томографии. При сдавлении спинного мозга определяется четкая верхняя граница чувствительности. Важным критерием диагностики фуникулярного миелоза является симметричность неврологических дефектов и дефицит витамина В12.
Лечение и профилактика Лечение направлено на ликвидацию дефицита витамина В12. Начинают с внутримышечного введения 500—1000 мкг витамина В12 (цианокобаламина) ежедневно или через день. После 5 инъекций препарата в этой дозе витамин В12 вводят по 100 мкг 1 раз в месяц. Показаны также диета с большим содержанием витаминов группы В и парентеральное введение витаминов В1, В6 и фосфадена по 60 мг два раза в день в течение 4–8 недель повторными курсами. При фолиево-дефицитной форме фуникулярного миелоза назначают фолиевую кислоту в дозе от 5 до 15 мг в сутки. При гипертонусе (повышенном тонусе) мышц конечностей показаны седуксен, баклофен, мидокалм. Во время лечения необходимы тщательный уход и профилактика урогенной инфекции. Профилактика сводится к выявлению и лечению перциниозной анемии, а также, возможно, более раннему обнаружению симптомов поражения спинного мозга.
ФУРУНКУЛ
ОпределениеФурункул — острое гнойно-некротическое воспаление волосяного фолликула и окружающих его тканей.
Этиология и патогенез Чаще всего заболевание вызывается золотистым или белым стафилококком и другими болезнетворными микробами. Загрязнения кожи и микротравмы предрасполагают к развитию заболевания. Значительную роль в возникновении фурункулов и фурункулеза играют ослабление защитных сил организма вследствие истощающих хронических заболеваний, гиповитаминоза и диабета (см.), а также сенсибилизация (повышенная чувствительность) по отношению к стафилококковой инфекции.
Патогенез Фурункул может развиваться на любом участке кожи, но чаще локализуется на тех частях тела, которые обильно снабжены сальными железами и больше подвержены механическому раздражению (затылок, шея, спина, поясничная и ягодичная области). В начальной стадии заболевания формируется пустула (гнойный пузырек) в устье волосяного фолликула. Пустула содержит нейтрофильные лейкоциты, стафилококки и фибрин. В дальнейшем стафилококки, опускаясь по волосяному фолликулу до сосочковых тел, вызывают его воспаление. Вокруг воспалительного вала в соединительной ткани дермы отмечаются отек, расширение кровеносных и лимфатических сосудов и инфильтрат из нейтрофилов, лимфоцитов и плазматических клеток. В зоне некроза (см.) соединительная ткань расплавляется и образуется гной. Гнойный экссудат скапливается под эпидермисом вокруг устья фолликула, а затем вместе с некротическим стержнем и погибшим волосом выходит наружу. Дефект тканей заполняется грануляциями (соединительной тканью) с формированием рубца.
Клиническая картина и диагностика Вокруг волоса формируется поверхностная пустула с небольшим воспалительным уплотнением в виде болезненного узелка. В этот период больной ощущает зуд и покалывание. К концу первых-вторых суток образуется воспалительное образование, захватывающее область сальной железы и волосяного мешочка с центральным омертвением тканей. Уплотнение выступает конусообразно над уровнем кожи в виде стержня, а на его вершине видно небольшое скопление гноя с черной точкой в центре. В дальнейшем пустула прорывается и подсыхает, а на третьи — седьмые сутки инфильтрат гнойно расплавляется, и омертвевшие ткани в виде стержня вместе с остатками волоса выделяются с гноем. Образовавшаяся гнойная рана очищается, заполняется грануляционной тканью и заживает с образованием рубца.
Фурункулез
Фурункулы могут быть одиночными и множественными, т. е. одновременно или последовательно возможно появление нескольких очагов воспаления на различных участках кожи, что говорит о фурункулезе. Если множество фурункулов появилось на ограниченном участке тела, то его относят к местному фурункулезу. А если возникновение фурункулов в виде множественных высыпаний на разных участках тела продолжается с небольшими ремиссиями в течение нескольких лет, то это хронический рецидивирующий фурункулез. Фурункул обычно не вызывает значительных изменений в состоянии больного, но при некоторых локализациях оно может быть тяжелым. Боли бывают умеренными, но при локализации фурункула в наружном слуховом проходе или в носу могут быть очень сильными. Тяжелое течение процесса наблюдается при фурункулах лица выше линии разреза рта и ниже линии разреза глаз. Это объясняется тем, что выраженное развитие венозной и лимфатической сети на лице способствует быстрому распространению инфекции. Прогрессирующий тромбофлебит (см.) вен при фурункулезе лица может перейти по анастомозам (соединениям, шунтам) на венозные синусы твердой мозговой оболочки с развитием их тромбоза и угрозой тяжелого осложнения — гнойного базального менингита (см.). При этом быстро развивается отек лица, прощупываются плотные болезненные вены, резко ухудшается общее состояние больного, температура тела повышается до 40–41 °C, появляется ригидность затылочных мышц, нарушается зрение. К осложнениям фурункула следует отнести лимфангит и регионарный лимфаденит (см.), которые осложняют течение фурункула и сопровождаются общими явлениями (недомогание, повышение температуры и др.). Особую опасность представляют прогрессирующий острый тромбофлебит (см.) и сепсис (см.). Острый тромбофлебит обычно развивается при фурункулах, располагающихся вблизи крупных подкожных вен, а сепсис чаще наблюдается при фурункулах лица. Прогрессирующий тромбоз вен и сепсис при фурункуле лица нередко являются следствием попыток выдавливания содержимого фурункула, срезания его во время бритья или массажа. Прогноз в этих случаях серьезен, смертность достигает 65 %. Диагноз ставится на основании клинической картины и анамнестических данных. Дифференциальный диагноз проводится с гидраденитом (см.), сибирской язвой (см.), псевдофурункулезом новорожденных (см.) и некоторыми инфекционными гранулемами (туберкулез (см.), актиномикоз (см.), сифилис (см.)).
Лечение и профилактика Лечение подразделяется на местное и общее. Местное лечение состоит в тщательном туалете кожи вокруг очага воспаления: протирании 70 %-ным спиртом, 2 %-ным салициловым спиртом, раствором метилвиолета, бриллиантовой зелени. На голове и шее волосы вокруг уплотнения тщательно выстригают. В начале образования фурункула производят смазывание его поверхности 3–5 %-ным раствором йода. Это иногда приостанавливает процесс. На вскрывшийся фурункул накладывают повязку с гипертоническим раствором хлористого натрия, а после удаления гноя — с антибактериальной мазью (синтомициновой, тетрациклиновой и др.). Показано применение сухого тепла (грелка, соллюкс, лампа Минина, УВЧ и др.). Влажные повязки в виде компрессов противопоказаны. При фурункуле лица методом выбора является новокаино-пенициллиновая блокада плюс пенициллин внутримышечно и сульфаниламидные препараты. Проводимое таким образом лечение обрывает воспалительный процесс и ведет к выздоровлению. Осложнения наблюдаются редко. При рецидивирующих фурункулах с целью гипосенсибилизации проводят курс иммунотерапии стафилококковой вакциной (аутовакциной). Назначают аутогемотерапию (переливание собственной крови) по 5 мл через 1–2 дня, витаминотерапию, корригируют лечение сахарного диабета (см.). Профилактика заключается в соблюдении правил личной гигиены, предохранении кожи от травмирования и мацерации. Для профилактики фурункулеза важно выявить заболевания, способствующие его возникновению.
♦ Х ♦
ХАГЛУНДА-ШИНЦА БОЛЕЗНЬ
ОпределениеХаглунда-Шинца болезнь (остеохондроз (см.) апофиза пяточной кости) — вариант остеохондропатии апофизов в бугре пяточной кости.
Этиология и патогенез Причины возникновения заболевания окончательно не выяснены. Большинство ученых считают, что остеохондропатия бугра пяточной кости является следствием многих причин: микротравм, повышенной нагрузки на мышцы, сухожилия которых прикрепляются к пяточному бугру (икроножная и подошвенная), эндокринных нарушений, сосудистых и нервно-трофических расстройств. Основной причиной болезни является острая или хроническая травма в сочетании с местным нарушением кровообращения. Хаглунда — Шинца болезнь развивается на почве остеодистрофии бугра пяточной кости.
Клиническая картина и диагностика Заболевание начинается постепенно или остро. Больные предъявляют жалобы на боли в пяточной области при ходьбе, припухлость, хромоту. Отмечается локальная болезненность задней поверхности пятки. Из-за болезненности затруднено сгибание и разгибание стопы. На рентгеновском снимке при болезни Хаглунда-Шинца пропадает гомогенность тени бугра пяточной кости, наблюдаются ее пятнистость (секвестроподобная картина) и островки, состоящие из отложений минеральных солей. Возможно отделение краевых фрагментов. Расстояние между пяточной костью и апофизом увеличивается из-за разрастания хряща. Диагноз ставится на основании жалоб, анамнеза, объективных данных и рентгеновской диагностики. Дифференциальный диагноз проводят с туберкулезом (см.) пяточной кости, бурситом (см.), периоститом, остеомиелитом (см.), опухолью (см.).
Лечение и профилактика Лечение консервативное. В период обострения необходимы покой (обеспечение полной неподвижности при помощи гипсовой лонгеты), физиопроцедуры, направленные на улучшение местного кровообращения, ношение ортопедической обуви с расширенным задником. При резкой деформации заднего отдела пяточной кости возможно оперативное удаление костно-хрящевых разрастаний. Профилактика болезни заключается в ношении свободной обуви.
ХАЛЯЗИОН
ОпределениеХалязион — хроническое, пролиферативное воспаление хряща вокруг одной или нескольких мейбомиевых желез (желез хряща век).
Этилогия и патогенез Причиной халязиона является закупорка выводного протока мейбомиевой железы, ведущая к прорыву секрета в окружающие ткани и образованию осумкованной гранулемы. Халязион представляет собой грануляционную (соединительную) ткань. Это узелок в толще века, медленно увеличивающийся и достигающий в диаметре 5–6 мм и более.
Халязион
Клиническая картина и диагностика Кожа века над халязионом приподнимается и деформируется. При прощупывании определяется плотное безболезненное образование, спаянное с хрящом века. Кожа над ним легко смещается, конъюнктива в области халязиона приподнята, гиперемирована и утолщена. В дальнейшем может произойти истончение и прободение конъюнктивы в месте локализации халязиона с выходом содержимого наружу. Однако основная масса грануляционной ткани остается на месте, и халязион не исчезает, а лишь уменьшается в размерах. Иногда халязион вскрывается через кожу, при этом грануляционная ткань разрастается в подкожной клетчатке. Невскрывшийся халязион превращается в толстостенную кисту (см.) со слизистым содержимым. Диагноз ставится на основании клинической картины. Дифференциальный диагноз проводится с ячменем (см.) (острое начало и течение, нагноение, опорожнение и заживление) и аденокарциномой (см.) мейбомиевой железы (по результатам гистологического исследования).
Лечение Лечение заключается в назначении сухого тепла. В область халязиона можно ввести дексаметазон. Это способствует его исчезновению. Если это не помогает показано хирургическое лечение.
ХАММЕНА-РИЧА СИНДРОМ
ОпределениеХаммена-Рича синдром — прогрессирующий диффузный (распространенный) пневмофиброз с развитием дыхательной недостаточности, повышением артериального давления в малом круге кровообращения и формированием легочного сердца.
Этиология Причины возникновения болезни не установлены. Среди возможных причин выделяют некоторые лекарственные средства (гексаметонит, миелосан, нитрофураны, сульфаниламиды) и профессиональные вредности. Есть мнение о наследственном характере заболевания, так как оно встречается в нескольких поколениях одной семьи.
Патогенез и патанатомия Механизм развития заболевания не вполне ясен. Сочетание фиброзирующего альвеолита с системными заболеваниями соединительной ткани, ревматоидным артритом (см.) и системной склеродермией (см.), синдромом Шегрена (см.), системной красной волчанкой (см.) и хроническим гепатитом (см.) свидетельствует о важной роли иммунологических нарушений в механизме развития синдрома Хаммена-Рича. Иммунологические реакции, в которых принимают участие иммунные комплексы, система комплемента и альвеолярные макрофаги, приводят к накоплению в альвеолярных структурах нейтрофилов. При их гибели высвобождается большое количество протеолитических ферментов, в том числе коллагеназы, что ведет к изменениям коллагена в интерстициальной ткани легких и развитию альвеолита. Все это способствует быстрому развитию фиброза (волокнистой соединительной ткани). Патологические изменения в легких у больных с синдромом Хаммена-Рича характеризуются развитием в альвеолярных перегородках альтеративно-продуктивной реакции. Отмечают нарастающее разрастание клеток стромы легких, клеток альвеолярной выстилки, некроз (см.) альвеолярного и бронхиального эпителия, формирование гиалиновых мембран, отек.
Клиническая картина и диагностика В одних случаях заболевание начинается остро и протекает с лихорадкой, кашлем (см.), мокротой и быстро нарастающей одышкой, в других — симптоматика развивается постепенно. В нижних отделах легких выслушивается звонкое похрустывание. Ведущими признаками являются нарастающая одышка, кашель (см.), чувство стеснения в груди. Позже наступает дыхательная недостаточность, появляется синюшность, признаки повышения артериального давления в малом круге кровообращения, развивается картина хронического легочного сердца. Наблюдается утолщение концевых фаланг пальцев в виде «барабанных палочек», возникает кровохарканье. Диагноз ставится на основании характерных клинических признаков. На рентгенограмме определяются усиление и деформация легочного рисунка, тяжистость теней, сетчатый и ячеистый рисунок. Отмечаются уплощение плевры, уменьшение подвижности диафрагмы. В легких появляются кистовидные полости, бронхоэктазы (см.), снижается их диффузионная способность. В крови наблюдаются увеличенная СОЭ, дыхательный эритроцитоз (увеличение количества эритроцитов), гипергаммаглобулинемия, наличие ревматоидных и антинуклеарных факторов. Дифференциальный диагноз проводят с туберкулезом (см.) легких, саркоидозом (см.), лимфогенным карциноматозом.
Лечение Лечение синдрома Хаммена-Рича консервативное. В начале заболевания применяются глюкокортикостероиды (преднизолон), при выраженном фиброзе легких назначают цитостатики (азатиоприн, циклофосфамид). Чтобы обеспечить раннее и целенаправленное лечение, необходимо своевременное обращение к врачу.
ХЕЙЛИТ
ОпределениеХейлит — воспаление красной каймы, слизистой оболочки и кожи губ.
Этиология и патогенез Причиной хейлита являются стрептококк, стафилококк, дрожжевой гриб, длительное солнечное облучение, зубопротезные материалы, губная помада и др. Механизм развития хейлита связан с дефицитом в организме больного витамина B2 и повышенной чувствительностью к некоторым медикаментам. Предрасполагающими факторами хейлита являются заболевания эндокринных органов и плохой уход за ротовой полостью. В эпителии красной каймы губ определяются паракератоз (нарушение процесса ороговения клеток), акантоз (утолщение эпидермиса и эпителия слизистых оболочек) и крупные световые клетки. Различают собственно хейлит и симптоматические хейлиты. К собственно хейлиту относятся эксфолиативный, гландулярный, аллергический контактный, метеорологический, актинический и абразивный преканкрозный хейлит Манганотти. Симптоматический хейлит подразделяется на атопический хейлит и гранулематозный хейлит Мишера. Причины возникновения и механизм развития гранулематозного хейлита Мишера не выяснены. Патогистологический процесс характеризуется образованием в толще кожи губ мелких отграниченных гранулем. Течение гранулематозного хейлита Мишера хроническое, рецидивирующее. После нескольких рецидивов губа увеличивается в размерах и приобретает тестоватую консистенцию.
Клиническая картина Эксфолиативная форма хейлита — хроническое психосоматическое заболевание, при котором поражается только красная кайма губ. Характерной чертой эксфолиативного хейлита является распространение процесса по всей кайме губ от одного угла до другого угла рта, исключая полоски, граничащие с кожей. Эксфолиативная форма хейлита подразделяется на экссудативную и сухую. У них имеется сходство, однако при экссудативной форме изменения более выражены. При сухой форме в месте поражения образуются серые или коричневато-серые чешуйки, напоминающие слюду. Экссудативной форме хейлита может предшествовать сухая форма. При экссудативной форме образуются массивные желтые или коричневато-желтые корки, при снятии которых обнажается гладкая ярко-красная поверхность без эрозии. Затем на красной кайме губ и ее внутренней зоне появляется беловатая воспалительная жидкость, ссыхающаяся в корки. Беспокоит ощущение жжения и стягивания губ. Из-за слипания губ больные стараются держать рот полуоткрытым. Течение болезни длительное. Гландулярная форма хейлита характеризуется расположением мелких слюнных желез и их протоков в наружной и внутренней зонах красной каймы губ, их гиперплазией и гиперфункцией. Она может возникать как первично, так и вторично, в возрасте 30–40 лет. При исследовании наблюдается значительное увеличение слюнных желез и их выводных протоков, воспалительная инфильтрация тканей. При осмотре в зоне красной каймы губ в виде красных точек видны расширенные устья слюнных желез, из которых выделяются капельки слюны в виде росы. При оттягивании нижней губы больного через 20–30 с на слизистой оболочке губы появляются капельки слюны, выделяющейся из расширенных устьев мелких слюнных желез, чего не бывает при других хейлитах. Аллергический контактный хейлит протекает по типу аллергического контактного дерматита (см.). Он развивается в результате повышенной чувствительности тканей губы к различным химическим веществам (например, губная помада). Проявляется эритемой различной интенсивности, редко — папуловезикулезными (узелково-пузырьковыми) элементами, шелушением красной каймы губ. Больные чувствуют жжение губ. Метеорологический хейлит возникает в результате воздействия разнообразных метеорологических факторов (пониженной влажности, облучения, ветра, холода, запыленности и др.). Чаще всего болеют мужчины, работающие на открытом воздухе, процесс локализуется на нижней губе. При этом отмечается распространенная неравномерная гиперплазия эпителия красной каймы губ, местами с небольшим ороговением. Красная кайма нижней губы неравномерно гиперемирована и инфильтрирована, местами образуются плотно сидящие чешуйки. Течение длительное, хроническое, не зависящее от времени года. Чувствительность к солнечному свету отсутствует. При метеорологическом хейлите отсутствуют резкая граница красного пятна и ороговение по периферии очагов, имеющее вид частокола. Актинический хейлит развивается в результате чувствительности красной каймы губ к солнечному свету и может сочетаться с солнечной экземой (см.) лица. Процесс возникает и обостряется в весенне-летний период. Зимой высыпания бесследно исчезают. Существует две формы актинического хейлита — сухая и экссудативная. При сухой форме нижняя губа становится ярко-красной, покрывается мелкими чешуйками, иногда появляются веррукозные (бородавчатые) образования. При экссудативной форме нижняя губа покрасневшая, отечная, появляются мелкие, быстро вскрывающиеся пузырьки с мокнутием, корочки и кровоточащие болезненные трещины. В губе наблюдается жжение и зуд. Абразивный преканкрозный хейлит Манганотти является облигатным предраком, локализующимся на нижней губе. Болеют обычно пожилые люди. Способствуют заболеванию метеорологические условия, травматизация, нарушение кровообращения в нижней губе. Находят ограниченное разрастание эпителия с явлениями атипии, особенно в эпителиальных выростах. В центре очага разрастания имеется дефект эпителия, заполненный густым инфильтратом. На красной кайме нижней губы возникают одна — две поверхностные эрозии (дефект слизистой) красного цвета с гладкой поверхностью, иногда образуются корки. Течение заболевания длительное, эрозии могут заживать, но потом возникают вновь на том же или другом месте. Атопический хейлит — один из симптомов атопического дерматита (см.). При этом поражается красная кайма и кожная часть губ, причем процесс наиболее выражен в углах рта. Часть красной каймы, которая переходит в слизистую рта, не поражается. Поражение губ начинается с зуда, красного пятна и небольшого отека. Процесс никогда не переходит на слизистую рта. Красная кайма инфильтрируется, шелушится, ее поверхность приобретает вид гармоники из-за радиальных борозд. В летнее время высыпания исчезают и лишь кожа в области углов рта остается инфильтрированной, что способствует возникновению трещин. Гранулематозный хейлит Мишера характеризуется макрохейлией — стойким утолщением губ (чаще нижней) воспалительного характера.
Диагностика и дифдиагностика Диагноз эксфолиативного хейлита основан на определенной локализации процесса, типичной клинической картине, отсутствии первичных морфологических элементов. Его дифференцируют с атопическим хейлитом, контактным и актиническим хейлитами, поражением губ при пузырчатке (см.), системной красной волчанке (см.). Диагноз аллергического контактного хейлита ставят на основании данных опроса и клинической картины. Подтверждением диагноза может быть кожная проба с химическим веществом. Диагноз метеорологического хейлита ставится на основании данных опроса, тканевого исследования и клинического течения. Дифференциальный диагноз проводят с системной красной волчанкой, при которой синтетические противомалярийные препараты оказывают положительный эффект. Диагноз актинического хейлита ставится на основании связи заболевания с облучением в весенне-летний период и локализацией процесса на нижней губе. Дифференциальный диагноз проводится с плоскоклеточным раком (см.). Диагноз абразивного преканкрозного хейлита Манганотти ставится на основании данных опроса и клинической картины. Дифференциальный диагноз проводят с пузырчаткой (см.), герпетической эрозией (см.), эрозивно-язвенной формой красного плоского лишая (см.), системной красной волчанкой (см.), эрозивной лейкоплакией (см.) и др. Дифференциальный диагноз атопического хейлита необходимо проводить с эксфолиативным, актиническим и аллергическим контактным хейлитами, а также красной волчанкой губ. Для последней характерны гиперкератоз (повышенное ороговение) и снежно-белое свечение чешуек в лучах лампы Вуда, рубцовая атрофия и отсутствие зуда. Атопический хейлит дифференцируют с симметричными стрептококковыми и кандидозными заедами (см.), при которых процесс локализуется только в углах рта. Диагноз гранулематозного хейлита Мишера ставится по яркой клинической картине.
Лечение При лечении экссудативной формы назначают седативные средства, антидепрессанты, иглотерапию по второму варианту, дающую тормозной эффект. Лечение гландулярной формы оперативное: удаление или электрокоагуляция каждой слюнной железы. Вторичный гландулярный хейлит исчезает после излечения основного заболевания. Лечение аллергического контактного хейлита заключается в устранении аллергена; местно применяют преднизолоновую мазь и смягчающие кремы. Лечение метеорологического хейлита должно быть направлено на устранение неблагоприятных внешних воздействий. Назначают витамины B2, B6, B12, местно — фотозащитные кремы и преднизолоновую мазь. Лечение абразивного преканкрозного хейлита Манганотти включает санацию полости рта, назначение внутрь витаминов A и группы B, метилурацила и теоникола; наружно — кортикостероидной и метилурациловой мазей. При отсутствии эффекта лечения в течение 2 месяцев прибегают к хирургическому иссечению пораженных очагов. Лечение атопического хейлита направлено на основное заболевание. Местно применяют кортикостероидные мази, пасты, в упорных случаях — лучи Букки (длинноволновое рентгеновское излучение). Лечение гранулематозного хейлита Мишера направлено на устранение симптомов, иногда прибегают к хирургическому иссечению пораженной части губы.
Профилактика Профилактика заключается в своевременном лечении хейлита, что предотвращает возникновение трещин губ, эрозий, предраковых заболеваний и рака (см.), развивающегося из эпителия красной каймы губы. Профилактика аллергического контактного хейлита состоит в предупреждении повторной сенсибилизации. Профилактика метеорологического хейлита заключается в защите губ от повреждающих внешних воздействий. Профилактика абразивного преканкрозного хейлита Манганотти предполагает санацию полости рта, своевременное протезирование зубов, исключение механических и химических раздражений нижней губы. Профилактика гранулематозного хейлита Мишера не разработана.
ХОЛАНГИТ
ОпределениеХолангит — воспаление желчных протоков (внутрипеченочных и внепеченочных).
Этиология и патогенез Причиной холангита является инфекция в сочетании с нарушением оттока желчи. Холангит в чистом виде встречается редко, чаще он комбинируется с холециститом (см.) (холецистохолангит) и гепатитом (см.) (гепатохолангит). В большинстве наблюдений холангит вызывается бактериальной инфекцией. В желчные ходы она может попасть из кишечника, с током крови по воротной вене или по печеночной артерии и лимфатическим сосудам. Возбудителем чаще всего является кишечная палочка, реже — энтерококк, протей, стафилококк, брюшнотифозная палочка и анаэробная инфекция. Специфическая инфекция (туберкулез (см.), сифилис (см.), микоз (см.), сап (см.) и др.) встречается редко. Воспаление мелких междольковых протоков (холангиолит) встречается при вирусном гепатите (см.), при глистных инвазиях (заражениях) (клонорхозе (см.), фасциолезе (см.) и др.). Холангит может возникнуть при травмировании слизистой оболочки печеночных протоков и общего желчного протока камнем или панкреатическим соком (соком поджелудочной железы). Механизму развития воспалительного процесса в желчных протоках способствует застой желчи, наблюдающийся при закупорке камнем общего желчного протока, стриктурах (сужениях) большого дуоденального (двенадцатиперстного, фатерова) соска, опухолях (см.) желчных протоков и головки поджелудочной железы, а также кисты (см.) общего желчного протока, послеоперационные рубцы, холедохо-еюнальный анастомоз (сообщение между общим желчным протоком и тощей кишкой), перихоледохальный лимфаденит (см.), язвы и дивертикулы (см.) двенадцатиперстной кишки, эндоскопические манипуляции на общем желчном протоке. По характеру воспалительных изменений в протоках различают холангит катаральный, гнойный и дифтеритический.
Патанатомия Выделяют три вида воспалительных изменений при холангите. При катаральном холангите наблюдаются полнокровие слизистой оболочки, участки десквамации (слущивания) эпителия, примесь слизи и гноя в их просветах. Если катаральный холангит продолжает развиваться и переходит в хроническую фазу воспаления, то в результате обструкции (закупорки) и атрофии стенок желчных путей просвет протоков расширяется. Разрастается рубцовая ткань, атрофируются мышечный и слизистый слои. Гнойный холангит часто сочетается с воспалением желчного пузыря и печени. В просвете желчных протоков находится гной, окрашенный желчью. Печень набухшая, дряблая, на разрезе из желчных протоков выделяется гной. Дифтеритическая форма холангита характеризуется омертвением, изъязвлением и десквамацией эпителия слизистой оболочки желчных протоков, в просвете которых обнаруживают лейкоциты, отложение желчных пигментов, слущенный покровный эпителий, детрит (кашицеобразный продукт распада тканей), иногда колонии бактерий. Если воспалительный процесс прогрессирует, то это ведет к развитию перихолангита с разрушением стенок желчных протоков и выраженной воспалительной инфильтрацией окружающих тканей. Гной распространяется на соединительную ткань и паренхиму печени с последующим гнойным расплавлением и образованием холангитических абсцессов (см.). Последние локализуются преимущественно под капсулой печени и могут осложняться фибринозно-гнойным перигепатитом и перитонитом (см.). Гнойный холангит завершается разрастанием грануляционной (соединительной) ткани, что приводит к фиброзу и вторичному билиарному циррозу печени (см.). Изменения желчных протоков при брюшном тифе (см. Тиф брюшной) могут быть от катаральных до флегмонозных. В стенках мелких протоков обнаруживают гранулемы из крупных «тифозных» клеток, окружающих очаги некроза (холангиотиф). Морфологическая картина специфических холангитов зависит от вида возбудителя. Для милиарного туберкулеза (см.) характерно наличие в слизистой оболочке желчных протоков гранулем, содержащих палочки туберкулеза. При врожденном сифилисе (см.) наблюдаются фиброзные разрастания и гуммы по ходу протоков сосудов, а в дальнейшем происходит облитерация (заращение) желчных протоков. Актиномикоз (см.) ведет к деструктивному гнойному холангиту. Сап (см.) характеризуется дифтеритическим воспалением и изъязвлением печеночных протоков. Если на желчные протоки оказали воздействие ферменты поджелудочной железы, то развивается так называемое некротическое воспаление с дистрофическими и очаговыми некротическими изменениями. При склерозирующем холангите находят фиброзное утолщение стенок всех протоков желчевыводящей системы. Внутренний просвет протоков уменьшается, плотность их повышается. Большой дуоденальный сосок не изменен.
Клиническая картина По характеру течения холангиты подразделяют на острые и хронические. Острый холангит проявляется лихорадкой, ознобом, проливными потами, желтухой (см.). Последняя нарастает после каждого приступа лихорадки, иногда появляется зуд кожи (см.). Больные жалуются на боли в правом подреберье разной интенсивности, иногда по типу желчной колики (см.). Наблюдается рвота (см.) с примесью желчи. Симптомы могут быть однократными или повторяться ежедневно. При прощупывании отмечаются болезненность в правом подреберье, увеличенная и уплотненная печень, увеличенная селезенка. В связи с нарастающей интоксикацией нарушается функция других органов вплоть до септического шока (см.). Острый холангит подразделяется на острый рецидивирующий холангит, холангит у лиц старческого возраста и у детей. Острый рецидивирующий холангит возникает обычно при наличии вентильного камня в терминальной (конечной) части общего желчного протока. Он характеризуется периодическими ознобами, повышением температуры тела, длительным отсутствием боли и желтухи (см.), затруднением оттока желчи и обострением инфекции. У лиц старческого возраста в связи с частой инфицированностью желчи развивается гнойный холангит. При этом клиническая картина выражена слабо (нормальная температура тела, местные симптомы едва улавливаются), хотя могут происходить глубокие морфологические изменения в желчных протоках. Дети острым холангитом болеют редко. Однако если он возникает как вторичное проявление другого заболевания, чаще стрептококковой этиологии, то протекает очень тяжело и распознается с большим трудом. Острый холангит может осложниться абцедированием печени, поддиафрагмальным абсцессом (см.), правосторонним плевритом (см.), абсцессом легкого, перикардитом (см.), панкреатитом (см.), перитонитом (см.), сепсисом (см.). При неэффективном лечении он может осложняться токсической дистрофией печени и гепаторенальным синдромом. Хронический холангит может развиться первично или быть исходом острого холангита. При скрытой форме хронического холангита болезненность при прощупывании в правом подреберье выражена слабо или отсутствует, наблюдаются слабость, повышенная температура, познабливание, изредка отмечается кожный зуд (см.), происходит постепенное увеличение печени. Характерна деформация ногтей в виде часовых стекол, гиперемия ладони. Исходом этой формы может быть вторичный билиарный цирроз печени (см.). При рецидивирующей форме холангита боли и местные симптомы выражены слабо (при холедохолитиазе боли сильные). Обострение болезни сопровождается лихорадкой, кожным зудом (см.), иногда желтухой (см.). Печень увеличена, уплотнена и болезненна. Наблюдаются утолщение дистальных (концевых) фаланг пальцев, изменения ногтей в виде часовых стекол, покраснение ладоней. Иногда бывают увеличение селезенки и панкреатит (см.). Конечным результатом является развитие вторичного билиарного цирроза печени (см.). Редкой формой хронического холангита является длительно текущий холангит с септическим компонентом. Возбудителем его считают зеленящий стрептококк. Заболевание протекает тяжело, сопровождается бактериемией (проникновением бактерий в кровь), поражением почек и напоминает подострый бактериальный эндокардит (см.). Склерозирующий холангит — заболевание редкое. Частосочетается с язвенным неспецифическим колитом (см.), реже — с болезнью Крона (см.), тиреоидитом Риделя, васкулитом (см.) и др. Заболевание встречается в возрасте до 40 лет. Начинается с недомогания, озноба и повышения температуры тела. Основными симптомами являются желтуха (см.) и кожный зуд (см.), тошнота, чувство дискомфорта в правом подреберье. Симптомы то появляются, то исчезают. Печень увеличивается. В поздних стадиях развития холангита определяются признаки билиарного цирроза печени (см.).
Диагностика и дифдиагностика Диагноз острого холангита ставят на основании клинической картины и лабораторных данных. Отмечаются повышенное количество лейкоцитов в крови, увеличение СОЭ, повышенное содержание билирубина и другие характерные изменения. Холангиография не показана. Дифференциальный диагноз проводят с острым холециститом (см.), правосторонней пневмонией (см.), поддиафрагмальным абсцессом, абсцессом печени, аппендикулярным абсцессом, острым панкреатитом (см.), раком (см.) печени, паранефритом, сепсисом (см.), лимфогранулематозом (см.), коллагеновыми болезнями (см.). Диагноз хронического холангита ставят на основании клинической картины, а также данных лабораторного, рентгенологического и инструментального исследований. В крови — умеренный лейкоцитоз и небольшое повышение СОЭ. Для оценки состояния желчных протоков делают внутривенную холангиографию, ретроградную панкреатохолангиографию, ультразвуковое и радиоизотопное исследование. Решающими исследованиями при постановке диагноза являются холангиография, холангиоманометрия и холедохоскопия. Дифференциальный диагноз проводится с туберкулезом (см.), тиреотоксикозом (см.), подострым бактериальным эндокардитом (см.) и др.
Лечение и профилактика Лечение острого холангита комплексное. В начальных стадиях применяют консервативную терапию. В нее включаются антибиотики широкого спектра действия, сульфаниламиды (бисептол и др.); дезинтоксикационная терапия — форсированный диурез, гемосорбция, дренирование грудного лимфатического протока с лимфосорбцией. При неэффективности консервативного лечения, а также больным с повышенным операционным риском (гнойная интоксикация, сепсис (см.), печеночно-почечная недостаточность, тяжелые сопутствующие заболевания) показана срочная декомпрессия желчных протоков. Для этого применяют временное наружное и постоянное внутреннее дренирование желчных протоков. Временное наружное дренирование включает чрескожную чреспеченочную гепатохолангиостомию, холецистостомию, эндоскопическое транспапиллярное дренирование общего желчного протока, папиллосфинктеротомию, наложение билиодигестивных анастомозов. Декомпрессия желчных протоков повышает эффективность антибактериальной терапии, так как создаются условия поступления лекарственных средств в желчь, нарушенные при холестазе, и их можно вводить в желчные протоки через дренаж. При остром холангите, причиной которого является непроходимость желчных путей, необходима радикальная операция, устраняющая причину непроходимости (камень, рубцовая стриктура (сужение)) и восстановление оттока желчи. Эту операцию лучше проводить во время стихания острых воспалительных явлений. Для лечения хронических холангитов в стадии обострения применяют антибиотики широкого спектра действия курсами по 2–3 недели, в перерывах — антибактериальные средства типа сульфаниламидов, невиграмона, препараты нитрофуранового ряда, никодин. Назначают спазмолитики, витамины, тюбаж, желчегонные средства, физиотерапию и санаторно-курортное лечение в стадии ремиссии. Профилактика острого холангита направлена на предупреждение нарушений оттока желчи. Профилактика хронического холангита заключается в своевременном лечении острого холангита, а также заболеваний, приводящих к нарушению оттока желчи.
ХОЛЕРА
ОпределениеХолера — острая инфекционная болезнь, поражающая желудочно-кишечный тракт, нарушающая водно-солевой обмен и вызывающая обезвоживание организма вследствие потери жидкости и солей с испражнениями и рвотными массами.
Этиология и эпидемиология Возбудитель холеры — холерный вибрион. Различают два биовара вибрионов — классический и Эль-Тор. Оба биовара составляют серологическую группу 01. Возбудитель холеры впервые был обнаружен итальянским патологом Ф. Паччини в 1854 г. в кишечнике людей, погибших от холеры во Флоренции. В 1883 г. в Египте Р. Кох выделил и изучил холерный вибрион, а в 1906 г. в Египте Ф. Готшлих выделил вибрион на карантинной станции Эль-Тор, биологически идентичный выделенному Р. Кохом, но отличающийся гемолитическими свойствами. В 1962 г. в связи с седьмой пандемией (эпидемия, захватывающая целые страны и континенты) холеры вибрион Эль-Тор также признан возбудителем холеры. Размножается возбудитель холеры в кишечнике человека. Под микроскопом холерный вибрион имеет вид запятой с одним жгутиком, обеспечивающим ему подвижность. Холерный вибрион вырабатывает экзоэнтеротоксин — холероген. Устойчивость холерного вибриона во внешней среде относительно невелика; он весьма чувствителен к высыханию, быстро погибает при высокой температуре. Хорошо переносит низкую температуру. На белье сохраняется до 200 дней, в молоке — 10 дней, в масле — 20–25 дней. Особенно долго сохраняется холерный вибрион в воде и холодных пищевых продуктах. Холерный вибрион — факультативный анаэроб (т. е. может существовать и без доступа кислорода), хорошо растет на слабощелочных и щелочных средах. В России холера не встречается, но занос инфекции из других государств возможен. Источником инфекции является человек — больной холерой или выздоравливающий, реже вибриононоситель. Особенно опасны лица, страдающие атипичными формами холеры. Пути передачи холеры те же, что и других кишечных инфекций: контактный, пищевой и водный. Выживаемость вибриона Эль-Тор на мясных, рыбных и овощных продуктах — 2–5 дней, в открытых водоемах, загрязненных канализационными сбросами, — несколько месяцев.
Патогенез и патанатомия Холерные вибрионы в организм человека проникают через рот вместе с загрязненной ими водой или пищей. Если в кислой среде желудка они не погибают, то поступают в тонкую кишку, где в щелочной среде и при обилии расщепленного белка находят оптимальные условия для интенсивного размножения. В процессе размножения и разрушения холерных вибрионов выделяется большое количество токсических веществ (экзотоксин холероген). В результате выраженного воспалительного процесса идет массивное расщепление и слущивание поверхностного эпителия тонкой кишки. Ведущим звеном в механизме развития холеры является обезвоживание организма, сопровождающееся уменьшением массы циркулирующей крови, падением артериального давления, развитием острой почечной недостаточности, нарушением сердечной деятельности. Различают четыре степени обезвоживания организма: I степень — 1–3 % потери массы тела, что не вызывает заметных физиологических нарушений; II степень — 4–6 % потери массы, что проявляется умеренно выраженными признаками обезвоживания; III степень (7–9 %) характеризуется наличием всего симптомокомплекса обезвоживания и состоянием неустойчивой компенсации водно-электролитного баланса; IV степень — потеря 10 % массы и более. При обезвоживании IV степени (холерный алгид) отмечаются вторичные изменения важнейших органов систем, возможно развитие шока (см.). Кроме обезвоживания организма, заметную роль играет потеря при рвоте и поносе электролитов крови — калия, натрия и хлора, что приводит к нарушению функций миокарда и почечных канальцев, парезу (см.) кишечника и резкой мышечной слабости. В первые часы после смерти кожа сухая, дряблая, морщинистая; слизистые оболочки губ сухие и синюшные, глаза запавшие, щеки впалые. В желудке — картина серозного или серозно-геморрагического гастрита (см.). Желчный пузырь растянут, в нем обнаруживается водянистая желчь («белая желчь»). В печени — дистрофические изменения, в толстой кишке — дифтеритический колит (см.). Селезенка уменьшена в размерах, дряблая. В головном мозге определяется венозный застой.
Клиническая картина Инкубационный период длится от нескольких часов до 5 дней, чаще 2–3 суток. У вакцинированных он может удлиняться до 10 дней. Первым признаком холеры является понос. У больных появляются слабость, недомогание, головокружение, легкий озноб, иногда повышение температуры до 38 °C. К учащенному стулу присоединяется рвота (см.). У больных холерой с обезвоживанием I степени стул имеет кашицеобразный характер, до 3—10 раз в сутки, присоединяется рвота. Функции органов и систем не нарушены. Такое течение холеры сегодня наблюдается более чем у половины больных.
Холера. Ворсы тонкой кишки лишены эпителия
Для холеры с обезвоживанием II степени характерно острое начало болезни. Испражнения становятся водянистыми, напоминающими рисовый отвар, от 3 до 20 раз в сутки. Одновременно появляется рвота, сначала с примесью пищи, а потом водянистая. Все это ускоряет обезвоживание организма, появляются мышечная слабость, головокружение, обмороки (см.), учащенное сердцебиение, понижение артериального давления. У больных с обезвоживанием III степени рвота и водянистый стул бывают до 20 и более раз в сутки. Развиваются слабость, адинамия, неутолимая жажда, заостряются черты лица, западают глазные яблоки. Выражена сухость кожи и слизистых оболочек. Речь шепотная, осиплость голоса. Отмечаются учащенное сердцебиение, слабый пульс, пониженное артериальное давление, олигурия (уменьшенное количество мочи). Холера с обезвоживанием IV степени является наиболее тяжелой формой болезни и протекает со снижением температуры тела (холерный алгид). Декомпенсированное обезвоживание развивается на протяжении 12 ч. На первый план выступают нарушения кровообращения. Кожа холодная на ощупь, покрыта липким потом, отмечается акроцианоз (синюшность концевых участков тела), выражение лица страдальческое. Дыхание учащено, наблюдаются судороги мышц, развивается сопорозное состояние. Иногда холера с обезвоживанием IV степени протекает молниеносно и заканчивается летально в первые 1–4 ч. Холера Эль-Тор чаще всего дает обезвоживание I–II степени, протекает легче и заканчивается благополучно.
Диагностика и дифдиагностика Диагноз ставится на основании эпидемиологических данных, данных опроса, клинической картины и результатов лабораторных исследований рвотных масс, испражнений и крови. При обезвоживании I степени изменения крови умеренные: уменьшено число эритроцитов и содержание гемоглобина, СОЭ увеличена незначительно. При обезвоживании II степени наблюдается лейкоцитоз до 10 х 10 в степени 3 и выше в 1 мкл крови. У больных III степени обезвоживания отмечаются выраженные гипокалиемия и гипохлоремия. При IV степени обезвоживания определяется декомпенсированный метаболический ацидоз (накопление кислых продуктов обмена), респираторный алкалоз и тромбоцитопения (уменьшение количества тромбоцитов). Окончательный диагноз ставят на основании бактериологического и серологического исследований и обнаружения специфического бактериофага. Бактериологический метод является главным, он основывается на выделении чистой культуры возбудителя. Серологические методы исследования дают возможность выявить переболевших и судить о напряженности иммунитета у вакцинированных лиц путем определения антител в сыворотке или плазме крови. Для этого применяют реакции определения агглютининов, вибриоцидных антител и антитоксинов. Косвенным методом диагностики холеры является выделение специфического бактериофага (фагодиагностика). Отличить холеру от других острых кишечных инфекций довольно трудно, так как она часто протекает в легкой форме (обезвоживание I степени) и напоминает пищевую токсикоинфекцию (см.) и сальмонеллез (см.). В отличие от холеры они начинаются с сильного озноба, высокой температуры тела, болей в животе, рвоты (см.), и только потом присоединяется понос. Стул обильный, обычного калового характера. С резким обезвоживанием протекает сальмонеллез. Холеру надо дифференцировать с дизентерией (см.), ротавирусным гастроэнтеритом (см.), отравлениями (см.) грибами и другими заболеваниями.
Лечение Лечение наиболее эффективно в первые часы заболевания. Оно определяется степенью обезвоживания. Надо ввести в организм больного ровно столько жидкости и солей, сколько было потеряно с рвотой, поносом, мочой, дыханием и через кожу. Приемлемой для этого является жидкость «Оралит», содержащая в 1 л воды 3,5 г хлорида натрия, 2,5 г гидрокарбоната натрия, 1,5 хлорида калия и 20 г глюкозы. При этом исчезают признаки обезвоживания, восстанавливаются кровообращение и функция почек. Большой популярностью пользуются жидкости трисоль и квартасоль. Их вводят внутривенно и внутриартериально со скоростью 100–120 мл в минуту первые 2–3 л и по 30–60 мл в минуту в последующем до восстановления веса больного. Каждые 2 ч ведут подсчет потерянной жидкости и регулируют скорость введения раствора до тех пор, пока не прекратятся рвота и понос и не восстановится функция почек. Для больных с I–II степенью обезвоживания это переливание может продолжаться 25–30 ч, а для IV степени обезвоживания — 2–4 суток. За это время может быть введено до 36 л жидкости. Надо иметь в виду, что у детей и пожилых людей форсированное введение жидкости может вызвать гипергидратацию с возможным развитием отека мозга и легких (см.). Поэтому им жидкость вводят медленнее. В период выздоровления назначают соли калия (100 г ацетата калия, 100 г гидрокарбоната калия и 100 г цитрата калия в 1 л воды). Выздоравливающие принимают этот раствор по 100 г 3 раза в день. Переболевших холерой выписывают из стационара после исчезновения клинических симптомов и трех отрицательных результатов бактериологического исследования кала. Всем больным и вибриононосителям назначают тетрациклин по 0,3–0,5 г каждые 6 ч в течение 5 дней и бактериофаг по 20 мл 2 раза в день. Сегодня смертность от холеры составляет около 1 % наблюдений, до современных методов лечения она была в пределах 50 % и более.
Профилактика Профилактика холеры складывается из мероприятий административного, коммунального и медицинского характера. При этом учитывается информация о движении заболевания за рубежом, подготовка медицинских кадров, проведение профилактических прививок лицам, которые подвержены опасности заражения, и проведение общесанитарных мероприятий, направленных на устранение причин и условий, способствующих заносу и дальнейшему распространению холеры. К этим мероприятиям относится систематический контроль за водными источниками и водоснабжением. При сомнении в качестве воды применяют ее хлорирование и озонирование. Необходимы тщательная очистка и дезинфекция отхожих мест, выгребных ям и свалок. Осуществляется санитарный надзор за продуктами питания, борьба с мухами. Мероприятия по профилактике холеры проводит чрезвычайная противоэпидемическая комиссия (ЧПК) во главе с противоэпидемическим штабом области, города, района. В районах, где возможен занос холеры, активно выявляются больные с острыми желудочно-кишечными заболеваниями и госпитализируются в провизорные отделения с обязательным однократным бактериологическим обследованием на холеру. Прививки против холеры производятся по эпидемиологическим показаниям холерной моновакциной троекратно с 7—10-дневными промежутками в дозе 0,5–1—1 мл или поливакциной НИИСИ однократно. У 40–50 % зараженных холерой заболевание либо не развивается, либо протекает легко. Срок действия вакцины составляет около 6 месяцев. Выписанные из больницы выздоравливающие направляются в обсервационный пункт на срок 20 дней с систематическим обследованием на вибриононосительство. Наряду с корпускулярной вакциной в последние годы в СССР разработана новая вакцина — холерген-анатоксин. Эта вакцина имеет преимущества перед корпускулярной вакциной, но требует дополнительной проверки.
ХОЛЕЦИСТИТ
ОпределениеХолецистит — воспаление желчного пузыря, возникающее при попадании в него инфекции. Различают острые и хронические холециститы.
Этиология Основными причинами воспаления желчного пузыря являются бактериальная инфекция и застой желчи. Среди бактерий встречаются кишечная палочка, стафилококки, стрептококки и др. В желчный пузырь они проникают из двенадцатиперстной кишки, с током крови и лимфы из очагов острой или хронической инфекции, например при кариесе зубов (см.), пародонтозе (см.), хроническом тонзиллите (см.), отите (см.), гайморите (см.), аднексите (см.) и др. Застой желчи способствует развитию холецистита. Причиной застоя могут быть дискинезия (см.) желчных путей, врожденная деформация выходной части желчного пузыря, нарушение нервно-рефлекторной регуляции сфинктерного аппарата, воспаление большого дуоденального сосочка (фатерова соска), ранее образовавшиеся камни, закупоривающие пузырный и общий желчный протоки, опухоли (см.) брюшной полости, беременность (см.), малоподвижный образ жизни и др. При воспалении желчного пузыря нарушаются физико-химические свойства желчи, соотношение желчных кислот и холестерина. Желчь становится менее бактерицидной. Изменяется pH (реакция) желчи, создаются условия для образования желчных камней. К воспалительному процессу ведут сосудистые нарушения в стенке желчного пузыря, особенно при капилляротоксикозе, узелковом периартериите, перекруте желчного пузыря, гипертонических кризах, атеросклеротическом поражении сосудов органов брюшной полости.
Патогенез Холецистит развивается при наличии в желчном пузыре камней, травмирующих слизистую оболочку при своем перемещении, что способствует поддержанию воспалительного процесса и нарушению эвакуации содержимого из желчного пузыря. Крупные камни могут вести к эрозиям и изъязвлениям слизистой оболочки желчного пузыря с последующим образованием перифокального спаечного процесса, деформации желчного пузыря и нарушениям оттока пузырной желчи. К тому же сами камни являются резервуаром хронической инфекции. Причиной холецистита может быть также попадание в просвет желчного пузыря в результате панкреатобилиарного рефлюкса (обратного заброса) ферментов поджелудочной железы. Заболевание протекает бурно и сопровождается развитием желчного перитонита (см.) без нарушения целостности стенки желчного пузыря. В возникновении заболевания установлена роль местной аллергизации стенки желчного пузыря и пищевой аллергии. Поражения желчевыводящих путей при паразитарных заболеваниях — лямблиозе (см.), амебиазе (см.), описторхозе (см.), аскаридозе (см.) — могут способствовать возникновению заболевания или поддержанию воспалительного процесса в желчном пузыре. Острый холецистит чаще бывает калькулезным, но может быть и некалькулезным. Хронический холецистит может быть самостоятельным заболеванием или развиться как осложнение острого холецистита. Как и острый холецистит, он бывает калькулезным и некалькулезным, отсюда разная тактика лечения больных.
Патанатомия Острый холецистит Для острого холецистита характерно неспецифическое воспаление. Он может быть катаральным и деструктивным. Деструктивный холецистит, в свою очередь, подразделяется на гнойный, флегмонозный, флегмонозно-язвенный, дифтеритический и гангренозный. При остром катаральном холецистите желчный пузырь увеличен, напряжен, заполнен водянистой желчью (из-за примеси серозного экссудата). Слизистая оболочка пузыря гиперемирована (покрасневшая), отечна, покрыта мутной слизью. Обычно такое воспаление заканчивается полным восстановлением его структуры. Острый гнойный холецистит развивается чаще всего при наличии в желчном пузыре камней. Желчный пузырь увеличен, напряжен, серозная оболочка тусклая, покрыта налетом фибрина. В желчном пузыре обнаруживается гнойная воспалительная жидкость, окрашенная желчью, иногда с примесью крови. Острый гнойный холецистит чаще протекает по типу флегмонозного воспаления. Стенка пузыря утолщена, имеются участки омертвения и расплавления ткани. Слизистая оболочка полнокровная, набухшая, с кровоизлияниями, эрозиями и изъязвлениями. Иногда воспаление принимает гнойно-геморрагический характер. Нередко образующиеся абсцессы (см.) вскрываются либо в просвет пузыря с образованием язв, либо в брюшную полость, и тогда развивается перитонит (см.). Дифтеритический холецистит характеризуется образованием омертвевших участков на слизистой оболочке, покрытых фибрином. Они приобретают вид грязно-зеленых пленок, при отторжении которых образуются глубокие язвы. Если омертвение распространяется на всю толщу стенки пузыря, то развивается гангренозный холецистит. Он может возникнуть и в результате первичного поражения кровеносных сосудов, например при гипертонической болезни (см.) и узелковом периартериите.
Хронический холецистит Хронический холецистит может быть катаральным и гнойным. При катаральной форме стенка желчного пузыря толстая, плотная, склерозированная, слизистая оболочка атрофирована. Гнойный холецистит вовлекает в процесс все слои стенки желчного пузыря; образуются абсцессы (см.) — источники новых обострений хронического холецистита. При рецидиве заболевания отмечается полнокровие сосудов, питающих стенку желчного пузыря, ее отек. Слизистая оболочка утолщена, с полиповидными изменениями на отдельных участках и образованием язв. Последние, заполняясь грануляциями (соединительной тканью), образуют рубцовые изменения (деформации). Иногда образуются спайки с соседними органами (перихолецистит). При прободении стенки желчного пузыря развивается разлитой желчный перитонит (см.). Закупорка пузырного протока (камнем, опухолью и др.) может вести к водянке желчного пузыря — он наполнен «белой желчью» и напряжен. Активизация инфекции может привести к эмпиеме (см.) желчного пузыря. Длительное нахождение камней в желчном пузыре иногда ведет к пролежню стенки; из-за анатомической близости с другими органами возможно пенетрирование (проникновение) в них. Так образуются соустья с поперечно-ободочной кишкой, двенадцатиперстной кишкой, желудком и др. При обострении воспалительного процесса возможно образование подпеченочного и поддиафрагмального абсцессов (см.), а связь с передней брюшной стенкой может вести к появлению наружного желчного свища. Рефлюкс (обратный заброс) желчи в протоки поджелудочной железы ведет к тяжелой форме холецистопанкреатита — острому геморрагическому некрозу (см.) поджелудочной железы, токсическому отеку ее ткани с последующим переходом в фиброз. Занесение инфекции в поджелудочную железу с током лимфы ведет к хроническому панкреатиту (см.).
Клиническая картина Острый холецистит Клинические проявления острого холецистита, как калькулезного, так и некалькулезного, характеризуются как обострение хронического холецистита, наступающее иногда внезапно на фоне нормального здоровья. Главным признаком заболевания является боль, носящая характер печеночной (желчной) колики (см.). Колика возникает внезапно в правом подреберье, часто ночью и носит схваткообразный характер со смещением в поясницу справа, правое плечо и лопатку, правую половину шеи и лица. Боль связана с судорожными сокращениями пузыря, вызванными обтурацией (закупоркой) пузырного протока камнем, воспалительным процессом, рубцовыми изменениями, дискинезией (см.) шейки пузыря. Боли сопровождаются тошнотой и рвотой (см.), не приносящей облегчения, иногда замедлением частоты сердечных сокращений и повышением температуры. Боли бывают настолько сильными, что больные теряют сознание. Смещаясь в левую половину грудной клетки, боль может вести к аритмии (холецистокардиальный синдром). Приступ болей при холецистите может длиться от нескольких часов до 1–2 недель. Сначала боли острые, затем их интенсивность снижается, они становятся постоянными и тупыми. В случае возникновения острого холецистита на фоне хронического холецистита приступу болей в течение нескольких дней могут предшествовать чувство тяжести в верхней части живота, тошнота, дискомфорт. Приступу холецистита предшествуют погрешности в диете, физические и эмоциональные перегрузки. В зависимости от характера воспалительного процесса течение острого холецистита имеет свои особенности. Катаральный холецистит отличается доброкачественным течением: боль быстро исчезает, температура нормализуется, общее состояние выравнивается. Но он может перейти и в гнойный холецистит. Тогда температура повышается до 38–39 °C, появляются слабость и симптомы интоксикации. Общее состояние тяжелое, болевой синдром продолжительный. Наиболее тяжелой формой острого холецистита является гангренозный холецистит. Локальная боль может отсутствовать из-за некротического процесса в стенке желчного пузыря. Нарастают интоксикация и перитонеальные явления, обостряется гепатит (см.). Длительность течения острого холецистита — от 2–3 недель до 2–3 месяцев. Имеются случаи атипичного течения, особенно у пожилых людей с калькулезным холециститом. У детей обычно бывает некалькулезный холецистит. Увеличивается печень, отмечаются вздутие и боли в животе, симптомы раздражения брюшины, общая интоксикация.
Хронический холецистит Горечь во рту — один из признаков начальной стадии хронического холецистита; отмечаются также чувство дискомфорта и умеренная боль в правом подреберье. Интенсивность боли зависит от степени тяжести воспалительного процесса в желчном пузыре и сопутствующей дискинезии. Дискинезия (см.) по гипотоническому типу дает боль постоянную и несильную, при дискинезии по гипертоническому типу появляется резкая боль приступообразного характера, напоминающая желчную колику. Боли смещаются в правую поясничную область, правое плечо и лопатку. Отмечаются расстройства пищеварения (отрыжка, тошнота, рвота). Температура тела повышена. Хронический холецистит протекает с периодическими обострениями и ремиссиями. В зависимости от особенностей течения выделяют скрытую и рецидивирующую формы заболевания. В зависимости от течения хронического холецистита различают типичную и атипичную формы. Атипичная форма проявляется в виде ряда вариантов: — кардиальный (кардиалгии, аритмии); — ревматический (артралгии, затяжной субфебрилитет); — неврастенический (правосторонняя цефалгия, вегетососудистая дистония); — тиреотоксический (раздражительность, тремор рук, похудение и др.).
Диагностика и дифдиагностика Острый холецистит Диагноз ставят на основании жалоб больного, данных осмотра и лабораторных исследований. При этом выявляют предрасполагающие к развитию заболевания условия (малоподвижность), нарушение питания, сопутствующие заболевания органов пищеварения, наследственную отягощенность, беременность (см.). При прощупывании живота определяется локальная болезненность в правом подреберье, положительные симптомы Кера (усиление болезненности при прощупывании во время вдоха), Мерфи (больной не может глубоко вдохнуть из-за боли при погружении пальцев исследующего ниже края реберной дуги справа), Ортнера (боль усиливается при легком постукивании ребром ладони по правой реберной дуге), френикус-симптом (боль при надавливании над ключицей в месте развилки грудино-ключично-сосцевидной мышцы) и др. В крови повышено количество лейкоцитов, увеличена СОЭ. Из инструментальных методов обследования рекомендуются ультразвуковая диагностика и компьютерная томография. Дифференциальный диагноз острого холецистита проводят с аппендицитом (см.), прободной язвой двенадцатиперстной кишки (язвенная болезнь), правосторонней пневмонией (см.), плевритом (см.), поддиафрагмальным абсцессом (см.), инфарктом миокарда (см.).
Хронический холецистит Диагноз ставится на основании данных опроса, клинической картины, лабораторных данных, рентгенологического и инструментального методов исследования. При хроническом некалькулезном холецистите исследуется желчь путем хроматического фракционного дуоденального зондирования. Определяется сопутствующая гипотоническая или гипертоническая дискинезия (см.). Одним из достоверных методов обследования является рентгенологический. Делается обзорная рентгенография области правого подреберья, при которой можно обнаружить тени рентгеноконтрастных камней. С помощью ультразвука определяют состояние стенки желчного пузыря, наличие в нем камней и сократительную способность пузыря. Используется метод радиоизотопного исследования, а также компьютерная томография печени, желчного пузыря и поджелудочной железы у больных с желтухой (см.). При бактериологическом исследовании для посева берут желчь из разных порций. При хроническом холецистите выявляют смешанную колибациллярную и кокковую микрофлору. По мере развития воспалительного процесса в желчи понижается содержание холевой кислоты, билирубина, липопротеинового комплекса, изменяется холатохолестериновый индекс. В крови незначительный лейкоцитоз, увеличенная СОЭ. Если в воспалительный процесс вовлекается поджелудочная железа, то обнаруживают амилорею, креаторею, стеаторею. Дифференциальный диагноз проводится с язвенной болезнью (см.), хроническими воспалительными заболеваниями мочевыводящих путей и толстой кишки. У язвенной болезни имеется сезонность обострений, а рентгенологическое и эндоскопическое исследования дают другую картину. При хронических заболеваниях мочевыводящих путей боли смещаются в паховую область и промежность, наблюдаются дизурические расстройства (расстройства мочеиспускания) и изменения в моче.
Лечение и профилактика Острый холецистит Больные с острым холециститом должны быть госпитализированы в хирургическое отделение. При гангренозном и флегмонозном холециститах, а также при перитоните (см.) показано оперативное вмешательство в неотложном порядке. При катаральном холецистите, когда течение болезни относительно легкое, показано консервативное лечение. При любой форме холецистита назначаются постельный режим, голод на 1–2 дня, а затем щадящая диета: 4–6 раз в день малыми порциями (отварные рыба и мясо, паровой белковый омлет, вареные овощи, творог нежирный, каша овсяная или гречневая, отвары шиповника, черной смородины, фруктовые соки, вареные яблоки и др.). Из лекарственных средств назначают антибиотики широкого спектра действия, сульфаниламиды, спазмолитики, седативные средства; при сильных болях делают паранефральную новокаиновую блокаду. Если консервативное лечение оказалось неэффективным, а оно в 20 % наблюдений (В. И. Стручков и др.) положительного результата лечения не дает, то прибегают к срочному оперативному вмешательству. Необходимость срочной операции диктуется степенью воспалительного процесса и его распространенностью, а также наличием препятствия для оттока желчи. Промедлить — значит усугубить болезнь. Перед операцией проводится интенсивная подготовка больного в плане дезинтоксикационной и антибактериальной терапии с введением антиспастических средств, коррекцией водно-электролитного баланса, профилактикой холемического кровотечения. Обезболивание — эндотрахеальный наркоз с мышечными релаксантами. Объем операции — холецистэктомия (удаление желчного пузыря) с комплексным исследованием желчных протоков (холангиография, холедохоскопия и др.). При тяжелом состоянии больного, когда холецистэктомию выполнить не представляется возможным, производят холецистостомию или холецистолитотомию. Больные пожилого возраста составляют 50 % больных с острым холециститом. У них чаще наблюдаются деструктивные формы холецистита, протекающие без выраженных клинических проявлений. В связи с высоким риском операции на высоте приступа у пожилых людей нередко предпринимают пункцию желчного пузыря. Удалив жидкость, в желчный пузырь вводят антибиотики широкого спектра действия и кортикостероиды. При холедохолитиазе (особенно при наличии камня в большом дуоденальном соске), осложненном обтурационной желтухой (см.), показана эндоскопическая папиллотомия. Она способствует декомпрессии желчевыводящих путей и выходу камней из общего желчного протока. Если камни остались в желчном пузыре или общем желчном протоке, то после стихания процесса через 2–3 недели, пока больной не выписан из стационара, его оперируют по поводу калькулезного холецистита, либо операция проводится в «холодном» периоде через 4–6 месяцев; такой подход предпочтительней для прогноза.
Хронический холецистит Хронический калькулезный холецистит и осложненные формы хронического некалькулезного холецистита лечатся оперативным путем. Консервативным путем лечат неосложненный некалькулезный холецистит. Консервативное лечение направлено на ликвидацию воспалительного процесса, борьбу с застоем желчи и дискинезией (см.) желчных путей. Больным назначают щадящую диету (стол № 5), антибиотики и сульфаниламидные препараты в течение 2–3 недель. При дискинезии по гипотоническому типу показаны холецистокинетики — сульфат магния, карловарская соль, оливковое масло, гипофизин, сорбит, ксилит и др. При дискинезии по гипертоническому типу применяют холеретики — холагол, холосас, аллохол, а также спазмолитики — атропин, препараты белладонны, но-шпу, платифиллин и др. При смешанных формах дискинезий рекомендуют желчегонные средства растительного происхождения — отвар кукурузных рылец, шиповника и др.; седативные средства — валериану, пустырник, бром. В случае вовлечения в процесс поджелудочной железы лечение дополняют ферментными препаратами. При наличии аллергических реакций назначают димедрол, супрастин и др., иммунной недостаточности — левамизол. Эффективны дуоденальное зондирование, беззондовый тюбаж, минеральные щелочные воды при дискинезии по гипотоническому типу; Ессентуки № 4, № 20, Славяновская, Смирновская, Железноводская — при дискинезии по гипертоническому типу. Назначаются физиотерапевтические процедуры — диатермия, УВЧ, ультразвук, грязевые, озокеритовые, парафиновые нанесения на область желчного пузыря, радоновые и сероводородные ванны. В стадии ремиссии больным назначают санаторно-курортное лечение (Ессентуки, Боржоми, Железноводск и др.). Лечение хронического холецистита длительное и проводится под диспансерным наблюдением. Профилактика направлена на щадящую диету и борьбу с адинамией и ожирением (см.), лечение заболеваний органов брюшной полости, а также своевременное полное и эффективное лечение острого холецистита. Профилактика хронического холецистита основывается на образе жизни: режиме питания, борьбе с ожирением и запорами (см.), адинамией, болезнями органов брюшной полости.
ХОРЕЯ
ОпределениеХорея — форма гиперкинеза (см.), проявляющаяся быстрыми, беспорядочными, неритмичными, насильственными движениями различных мышечных групп.
Этиология и патогенез В основе развития хореических гиперкинезов (см.) лежат патологические изменения полосатого тела, в результате которых гибнут нейроны полосатого тела и клетки других отделов головного мозга, функционально связанных с полосатым телом. Характер и локализация патологического процесса определяются особенностями того или иного заболевания, степенью выраженности и распространенности диффузных и очаговых изменений головного мозга. В основе механизма развития хореи лежит гибель преимущественно малых нейронов полосатого тела при относительной или полной сохранности крупных нейронов и выраженной пролиферации нейроглиоцитов. Для хореи, обусловленной нарушениями мозгового кровообращения, характерны очаговые изменения (инфаркты, кровоизлияния, неполные некрозы) и изменения, распространяющиеся и на другие отделы головного мозга (при этом гиперкинез сочетается с другими неврологическими симптомами). Хореический гиперкинез наблюдается при разрушении красных ядер и верхних ножек мозжечка, таламуса, хвостатого тела. Хореический гиперкинез наблюдается в зоне инфаркта в бассейне ветвей задней мозговой артерии. Известны случаи развития гемихореи (хореи одной половины тела) при инфарктах мозга, локализующихся в полушариях головного мозга, при множественных поверхностных кровоизлияниях в коре мозжечка и др.
Клиническая картина и диагностика Клиническая картина характеризуется беспорядочными подергиваниями мышц конечностей (особенно верхних), туловища и лица. Больные суетливы, непоседливы, постоянно гримасничают. Подергивания прерывают произвольные движения, придавая им неустойчивость и некоординированность. Больные неуклюжи, часто ушибаются. Походка типичная, танцующая («пляска святого Витта»), больные с трудом и недолго могут выдерживать заданную позу (сжатый кулак, высунутый язык и др.). Из-за оральных гиперкинезов возникает дизартрия, пропадает желание говорить.
Малая хорея Малая хорея Сиденгама — чаще всего результат ревматического поражения мозга; встречается, как правило, у детей. Патологический процесс малой хореи составляют воспалительные, сосудистые и дегенеративные изменения нервной ткани. Клиническая картина малой хореи проявляется непроизвольными некоординированными движениями на фоне значительного снижения мышечного тонуса, эмоциональной неустойчивостью, слезливостью, импульсивностью, агрессивностью. Типична тоническая форма коленного рефлекса (симптом Гордона). Заболевание длится от нескольких недель до нескольких месяцев. В 1/3 наблюдений отмечаются рецидивы. Дифференциальный диагноз малой хореи следует проводить с тиками (см.), которым свойственна стереотипность и локальность гиперкинеза. С хореей следует дифференцировать синдром Жилля де ла Туретта, возникающий также у детей и проявляющийся сочетанием хореиформных гиперкинезов с насильственной вокализацией. Больные издают хрюкающие, лающие и воркующие звуки, которые с течением времени переходят в повторение непристойных слов (копролалия). Импульсивное поведение, копролалия и выкрики делают невозможным пребывание детей в коллективе.
Хорея Гентингтона Хорея Гентингтона — хореическая деменция (слабоумие). Хореические гиперкинезы появляются в возрасте 30–40 лет. Позднее присоединяется прогрессирующее слабоумие, доходящее до полного распада личности. Заболевание наследуется по аутосомно-доминантному типу.
Хорея беременных Хорея беременных возникает при первой беременности (см.) у молодых, особенно астеничных женщин и лишь в отдельных случаях при последующих беременностях. В основе этой патологии лежит органическое поражение центральной нервной системы с преимущественным вовлечением экстрапирамидной системы. Отмечена связь хореи беременных с ревматизмом (см.) и частое сочетание хореического гиперкинеза с поражением сердца и суставов. Некоторые считают хорею беременных одной из форм токсикозов беременных, а ревматизм при этом рассматривается как предрасполагающий фактор (хотя связь с ревматизмом прослеживается лишь у 1/3 больных). Для хореи беременных характерен определенный полиморфизм структурных изменений в головном мозге, который обусловлен степенью выраженности, локализацией и давностью деструктивных изменений, а также сочетанием их с патологией внутренних органов. Некоторые исследователи, рассматривающие хорею беременных как обострение ревматизма или рецидив перенесенной в детстве малой хореи, подчеркивают, что она часто сочетается с эндокардитом (см.), миокардитом (см.), перикардитом (см.), острым суставным ревматизмом (см.). Наиболее характерные изменения обнаруживаются в полосатом теле, таламусе, подбугорной области, черном веществе, коре и белом веществе больших полушарий. Происходит гибель преимущественно малых нейронов. Хорея беременных развивается в первом или втором триместре беременности. Движения непроизвольные и некоординированные, гиперкинезы выражены резко, изменения психики значительны, сон беспокойный, отмечаются повышенная раздражительность, общая слабость, головные боли, обидчивость, постепенно нарастают гиперкинезы различных групп мышц. При хорее беременных появляются психические нарушения, для нее характерна быстрая смена настроений. Иногда возникают приступы «двигательной бури» — больные пытаются бежать, вырываются, речь бессвязная. При обследовании выявляются характерные симптомы: в положении стоя с закрытыми глазами (поза Ромберга) больная падает назад, а при открытых глазах не может стоять на одной ноге. В положении сидя при попытке поднять обе ноги пораженная нога резко опускается (симптом Грассе), а поднятая вверх рука дает резкую пронацию кисти (симптом Томаса). В легких и средней тяжести случаях беременность удается сохранить, и роды (см.) заканчиваются благополучно. При тяжелой форме хореи беременных происходят выкидыш либо преждевременные роды (плод, как правило, нежизнеспособен).
Электрическая хорея Дубини Термин «электрическая» связан с тем, что проявления этого гиперкинеза напоминают сокращение мышц при раздражении электрическим током. Характерны острое начало болезни, высокая температура тела, наличие эпилептических припадков, атрофических параличей (см.). Для электрической хореи Дубини типичен ритмический гиперкинез, наступающий одновременно во многих мышечных группах и иногда переходящий в общий эпилептический припадок. Течение болезни тяжелое.
Эпилептическая хорея Впервые описана В. М. Бехтеревым в 1897 г. Это особая форма эпилепсии (см.). Судороги во время припадка имеют характер хореического гиперкинеза. В отличие отмалой хореи, насильственные движения при эпилептической хорее возникают только приступообразно, сопровождаются потерей сознания и другими симптомами, характерными для эпилепсии (см.). Отсутствуют типичные для ревматизма изменения сердца. Однако возможно сочетание эпилептической хореи с ревматическим поражением головного мозга, что проявляется чередованием периодов хореических гиперкинезов с периодами эпилептических припадков.
Судорожная хорея Морвана Хорея Морвана развивается при энцефалитах (см.) на фоне гипертермии, вегетососудистой дистонии, нарушении трофики и обмена веществ. К хореическим гиперкинезам могут присоединяться миоклонии, нередко наблюдаются генерализованные тонико-клонические судороги с развитием коматозного состояния.
Пароксизмальный хореоатетоз Маунта-Рибека Заболевание наследуется по аутосомно-доминантному типу, проявляется в детском возрасте периодическими приступами хореоатетоза (сочетание хореи и медленных стереотипных, часто вычурных движений) лица и дистальных отделов конечностей. Приступы длятся от нескольких минут до нескольких часов и могут повторяться по нескольку раз в сутки. У взрослых приступы провоцируются курением, приемом алкоголя, кофе, переутомлением. В межприступном периоде неврологических отклонений не наблюдается.
Доброкачественная наследственная хорея Заболевание наследуется по аутосомно-доминантному типу, патогенез его неясен. Характеризуется генерализованным хореическим гиперкинезом с интенционным тремором (дрожанием). Болезнь не прогрессирует и не сопровождается психическими нарушениями.
Гемихорея Гемихорея возникает при одностороннем повреждении полосатого тела. Гиперкинез охватывает половину тела и проявляется на противоположной очагу поражения стороне. Болезнь имеет сосудистое происхождение.
Врожденная хорея Врожденная хорея — это синдром, проявляющийся двусторонним хореическим гиперкинезом подобно двустороннему атетозу. Врожденная хорея возникает тотчас после рождения ребенка и обусловлена поражением подкорковых узлов во внутриутробном периоде или во время родов (см.). В отличие от атетоза (двойного атетоза) характеризуется гиперкинезом хореического, а не атетозного типа и экстрапирамидным повышением тонуса мышц (ригидностью).
Сенильная хорея Сенильная хорея развивается у лиц пожилого возраста на почве церебрального атеросклероза (см.) с нарушениями мозгового кровообращения. Наблюдаются инфаркты в белом веществе лобной доли, очаги гибели малых нейронов полосатого тела, диффузное разрежение белого вещества полушарий мозга и др. Сенильная хорея имеет некоторое сходство с хореей Гентингтона, но отличается от нее тем, что начинается в более пожилом возрасте, не носит наследственного характера, имеет более монотонное течение и может не сопровождаться расстройствами психики.
Лечение В связи с тем, что этиология и патогенез основного заболевания, на фоне которого возникает хорея, не всегда достоверно установлены, лечение многих гиперкинезов носит в основном симптоматический характер. Лечение малой хореи — постельный режим, фенобарбитал, транквилизаторы. С превентивной целью назначается противоревматическая терапия. Гиперкинезы и импульсивность поведения при хорее Гентингтона можно смягчить назначением нейролептиков (аминазин, галоперидол). Этой категории больных нельзя иметь детей. Лечение хореи беременных комплексное. Строгий постельный режим, полный физический и психический покой. Пища витаминизируется, ограничиваются углеводы. Лечение включает противоревматические средства, седативные препараты, антигистаминные препараты, витамины группы B и C, рутин. Для снятия возбуждения назначают нейролептики, фенобарбитал и бромиды. Искусственное прерывание беременности показано лишь при тяжелом и упорном течении хореи. Женщины, перенесшие в детстве малую хорею, должны избегать беременности в молодом возрасте, а перенесшие хорею при первой беременности должны отложить беременность на несколько лет. Лечение электрической хореи Дубини симптоматическое, прогноз неблагоприятный. Лечение эпилептической хореи симптоматическое. Применяют противосудорожные препараты и транквилизаторы. При ревматическом поражении центральной нервной системы проводят противоревматическое лечение. Прогноз для жизни благоприятный. Лечение судорожной хореи Морвана направлено на терапию основного заболевания. При судорожном статусе и гипертермической коме возможен летальный исход. Лечение пароксизмального хореоацетоза Маута-Рибека симптоматическое (фенобарбитал). Прогноз для жизни благоприятный. Лечение доброкачественной наследственной хореи симптоматическое. Прогноз для жизни благоприятный. Лечение гемихореи сосудорасширяющими средствами и препаратами, улучшающими метаболизм в головном мозге, может привести к улучшению состояния больного вплоть до полного выздоровления. Лечение врожденной хореи симптоматическое, назначают транквилизаторы, миорелаксанты, лечебную физкультуру, массаж. Прогноз для жизни благоприятный. Лечение сенильной хореи направлено на улучшение мозгового кровообращения и метаболизма мозга. Назначают сосудорасширяющие средства и биостимуляторы. Процесс склонен к замедлению и даже приостановке.
ХОРИОИДИТ
ОпределениеХориоидит — воспаление собственно сосудистой оболочки глаза.
Этиология и патогенез Причиной воспалительного процесса сосудистой оболочки глаза является инфекция — туберкулезная, стрептококковая, стафилококковая, вирусная, сифилитическая, бруцеллезная. Строение и функции хориоидеи таковы, что способствуют задержке в ней занесенных с током крови или лимфы бактерий, вирусов, простейших, гельминтов и других возбудителей. Механизм развития хориоидита основывается на иммунных реакциях. Изменения, определяющие клиническую картину хориоидита, являются следствием поступления в глаз антигенов и иммунных комплексов. Источниками антигенов служат внеглазные очаги инфекции. Возникновение хориоидита могут провоцировать переохлаждение организма, острые и хронические инфекционные заболевания, травма глаза. Определенное значение имеет микробная аллергия (см.), проявляющаяся гиперергическим воспалением (гиперергия — повышенная реактивность). При этом микробы могут играть роль пускового механизма, а воспалительная реакция развивается по типу аутоиммунного процесса. Хориоидиты могут быть эндогенными и экзогенными. Эндогенные вызываются туберкулезной палочкой, вирусами, возбудителем токсоплазмоза (см.), стрептококком, бруцеллезной инфекцией и др. Экзогенные возникают в результате вовлечения в воспалительный процесс хориоидеи при травматических иридоциклитах (см.) и заболеваниях роговицы. Хориоидиты делятся на очаговые и диффузные. При очаговом хориоидите воспалительные очаги могут быть единичными (изолированными) и множественными (рассеянный, диссеминированный хориоидит). В зависимости от локализации воспалительного образования хориоидиты разделяют на центральные (с очагом в центральной области глазного дна), перипапиллярные (с очагом вокруг диска зрительного нерва), экваториальные (с очагом в зоне экватора глаза) и периферические, при которых воспалительное образование локализуется в периферических отделах глазного дна вблизи зубчатой линии.
Патанатомия При очаговом хориоидите в сосудистой оболочке обнаруживают ограниченный инфильтрат (очаг воспаления с увеличенным объемом и повышенной плотностью) из лимфоидных элементов, располагающихся вокруг расширенных сосудов на всю ее толщу. При диффузном хориоидите инфильтрат состоит из лимфоцитов, эпителиоидных и иногда гигантских клеток. Инфильтрат сдавливает кровеносные сосуды, нарушает кровоснабжение тканей. Воспаление хорио идеи вызывает изменения в сетчатке из-за разрушения слоя пигментного эпителия, а также развития отека и кровоизлияния. В процессе лечения инфильтрат в хориоидее может рассасываться. Тогда клеточные элементы инфильтрата замещаются соединительной тканью, образуя рубец. По периферии рубца появляется разрастание пигментного эпителия сетчатки. При туберкулезном хориоидите клеточные изменения зависят от стадии развития туберкулезного процесса (см. Туберкулез). При первичном туберкулезе воспаление в хориоидее протекает по экссудативному типу. Диффузная инфильтрация включает в себя эпителиоидные клетки и гигантские клетки Пирогов-Лангханса. При вторичном туберкулезе (см.) образуются гранулемы с казеозным (творожистым) некрозом (см.) и последующим формированием туберкулем.
Клиническая картина У больных с хориоидитом отсутствуют боль в глазах и зрительные расстройства. Поэтому его выявляют только при офтальмоскопии. При вовлечении в процесс прилежащих отделов сетчатки (хориоретинит) возникают нарушения зрения. Когда хориоретинальный очаг расположен в центральных отделах глазного дна, наблюдаются резкое снижение зрения и искажение рассматриваемых предметов, а больной отмечает ощущение вспышек и мерцания (фотопсии). При поражении периферических отделов глазного дна снижается сумеречное зрение, иногда наблюдаются «летающие мушки» перед глазами. Выявляются ограниченные дефекты в поле зрения — скотомы, соответствующие месту расположения очагов. При воспалении на глазном дне видны сероватые или желтоватые очаги с нечеткими контурами, вдающиеся в стекловидное тело; сосуды сетчатки располагаются над ними, не прерываясь. В этот период возможны кровоизлияния в хориоидею, сетчатку и стекловидное тело. Прогрессирование заболевания ведет к помутнению сетчатки в области очага. Под влиянием лечебного процесса хориоретинальный очаг уплощается, становится прозрачным, приобретает более четкие контуры; хориоидея истончается, через нее просвечивает склера. При офтальмоскопии на красном фоне глазного дна виден белый очаг с крупными сосудами хориоидеи и пигментными глыбками, что говорит о наступлении стадии атрофии (см.) хориоидеи. При расположении хориоретинального очага около диска зрительного нерва возможно распространение воспаления на зрительный нерв. В поле зрения появляется характерная скотома, сливающаяся с физиологической; при офтальмоскопии определяется стушеванность границ зрительного нерва. Развивается перипапиллярный хореоретинит, или околососочковый нейроретинит Йенсена. При туберкулезном поражении хориоидеи чаще встречаются такие клинические формы, как милиарный, диссеминированный, очаговый (с центральной и околососочковой локализацией очага) хориоидит, туберкулема хориоидеи, диффузный хориоидит. Последний чаще наблюдается в молодом возрасте на фоне хронически текущего первичного туберкулеза (см.). Воспалительный процесс в хориоидее сопровождается выраженной реакцией сетчатки и стекловидного тела и завершается атрофией хориоидеи. При токсоплазмозе (см.) развивается очаговый хориоидит, при врожденном токсоплазмозе — центральный очаговый хориоидит. При приобретенном сифилисе (см.) возникает диффузный хориоидит. Течение хориоидита чаще бывает хроническим, с рецидивами. Осложнениями хориоидита могут быть вторичная дистрофия сетчатки, экссудативная отслойка сетчатки (см.), неврит с переходом во вторичную атрофию зрительного нерва, обширные кровоизлияния в стекловидное тело с последующим швартообразованием. Кровоизлияния в хориоидею и сетчатку могут привести к образованию грубых соединительнотканных рубцов и формированию неоваскулярной мембраны, что сопровождается резким снижением зрительных функций.
Диагностика и дифдиагностика Диагноз ставят на основании результатов прямой и обратной офтальмоскопии, флюоресцентной ангиографии глазного дна. Эти методы позволяют установить стадию заболевания, что имеет большое значение для лечения и исхода болезни. В 1/3 случаев причина заболевания остается невыясненной, что требует комплексного обследования больного. В настоящее время широко используются иммунологические методы диагностики, которые включают серологические реакции, выявление чувствительности к различным антигенам, определение иммуноглобулинов (антител) в сыворотке крови, слезе и внутриглазной жидкости, выявление очаговой реакции в глазу в ответ на введение аллергенов. Дифференциальный диагноз проводят с наружной экссудативной ретинопатией, невусом (пигментной опухолью) и начальной стадией меланомы (см.) хориоидеи. Диагноз уточняют с помощью ультразвукового и радиоизотопного методов исследования.
Лечение и профилактика Лечение направлено на ликвидацию основного заболевания. В лечебный комплекс включают патогенетическое, специфические и неспецифические гипосенсибилизирующие средства, физиотерапевтические и физические методы воздействия (лазеркоагуляция, криокоагуляция). Специфическую гипосенсибилизацию осуществляют с целью понижения чувствительности сенсибилизированных тканей глаза при туберкулезных, токсоплазмозных, вирусных, стафилококковых и стрептококковых хориоидитах. Антиген вводят в малых дозах неоднократно. Специфическая гипосенсибилизация является перспективным методом лечения, исключающим рецидивы. Неспецифическая гипосенсибилизация показана при хориоретинитах на всех этапах лечения — в период активного воспаления, при рецидивах, а также для профилактики обострения. Для этого применяют антигистаминные препараты. Большое место в лечении хориоидита занимает антибактериальная терапия, которую применяют в соответствии с характером процесса и для санации очагов инфекции. При неустановленной этиологии (причине) хориоидита применяют антибиотики широкого спектра действия. Назначаются кортикостероиды вместе с другими лекарственными средствами, иммунодепрессивные препараты (меркаптопурин, имуран, метатрексат, фторурацил, циклофосфан и др.) в сочетании с кортикостероидами. Антибиотики, кортикостероиды, цитостатики вводят внутримышечно, внутрь, ретробульбарно (за глазное яблоко), супрахориоидально и с помощью электрофореза. В арсенал лечебных средств включают витамины C, B1, B6, B12. Для рассасывания экссудата и кровоизлияний в хориоидее, сетчатке, стекловидном теле используют ферменты (трипсин, фибринолизин, лидазу, папаин, лекозим, стрептодеказу), которые вводят внутримышечно, ретробульбарно и с помощью электрофореза. Криокоагуляция хориоидеи показана при вторичных дистрофиях после перенесенного хориоидита для профилактики отслойки сетчатки (см.), для этих же целей при геморрагических хориоретинитах применяется лазеркоагуляция. Профилактика хориоидита сводится к своевременной диагностике и лечению острых и хронических инфекционных заболеваний.
ХРАП
Патогенез Механизм возникновения храпа прост. Когда человек лежит на спине, у него увеличивается глубина дыхания и открывается рот. Это явление называется гипервентиляцией легких. Именно она приводит в движение мягкие структуры глотки и вызывает стеноз (сужение) дыхательных путей. В итоге появляется храп. В любом случае причина одна и та же, храп — это признак избыточности легочной вентиляции. Храп — это всего лишь симптом, который может сопровождать как минимальные расстройства дыхания во сне, так и тяжелую форму синдрома обструктивного апноэ сна (СОАС). Слип-апноэ может привести к летальному исходу.Лечение Чтобы правильно лечить храп, необходимо следующее. 1. Обратиться в лабораторию сна, сомнологический центр или клинику храпа для осуществления консультации врачом-сомнологом. 2. В ходе консультации врач-сомнолог принимает решение о проведении полисомнографии, которая представляет собой регистрацию нескольких физиологических параметров во время сна, а именно: носового и ротового дыхания, насыщения гемоглобина кислородом, электрокардиограммы (ЭКГ), электроэнцефалограммы (ЭЭГ), электромиограммы (ЭМГ), движений грудной и брюшной стенки. Полисомнография позволяет выявить степень расстройств дыхания во время сна. 3. Осмотр ЛОР-врачом на предмет наличия ЛОР-патологии. 4. В зависимости от результатов полисомнографии и данных ЛОР-консультации врач-сомнолог клиники храпа (лаборатории сна, сомнологического центра) принимает решение о том, как лечить храп. Лечение данного заболевания в большинстве случаев носит индивидуальный характер.
♦ Ц ♦
ЦЕРВИЦИТ
ОпределениеЦервицит — это воспаление шейки матки.
Этиология и патогенез Возникновению заболевания способствуют разрывы и травматизация шейки матки во время родов (см.) и абортов (см.), раздражение внутренних половых органов химическими или механическими противозачаточными средствами. Предрасполагающими факторами являются воспалительные процессы во влагалище, матке и яичниках, ослабление иммунной системы организма. Возбудителями заболевания чаще всего являются стафилококки, стрептококки, кишечная палочка, энтерококки, реже — гонококки и трихомонады. Определенную роль играют хламидии и анаэробная инфекция (способная развиваться без доступа кислорода), очень редко встречается туберкулезный цервицит.
Клиническая картина и диагностика Клиническая картина зависит от стадии заболевания. При остром процессе больных беспокоят слабые боли внизу живота, неприятные ощущения во влагалище во время и после полового акта, иногда зуд, слизистые или слизисто-гнойные выделения из половых путей. При осмотре с помощью зеркал слизистая оболочка влагалищной части шейки матки гиперемирована и отечна. Хронический цервицит характеризуется скудными слизистыми выделениями из шейки матки, незначительной гиперемией (краснотой) и отеком. Диагноз ставится на основании данных опроса, влагалищного осмотра, кольпоскопии, а также бактериоскопического и бактериологического исследования отделяемого из канала шейки матки.
Лечение Лечение проводится с учетом характера инфекционного агента, стадии заболевания и сопутствующей патологии. При остром цервиците применяют гигиенические спринцевания настоем ромашки и раствором борной кислоты, а также антибиотики. Для терапии хронического цервицита применяют физиотерапевтические методы (электрофорез цинка). При гонорее (см.), трихомониазе (см.), сифилисе (см.) лечение должно осуществляться по методикам, принятым для терапии данных заболеваний.
ЦИНГА
ОпределениеЦинга (скорбут) — заболевание, характеризующееся полным отсутствием в пище витамина С. Для цинги типичны анемия, слабость, апатия, рыхлость десен, подкожные кровоизлияния и нарушения развития костной и хрящевой ткани (у детей). Детская цинга называется также болезнью Барлоу.
Клиническая картина Цинга развивается исподволь в течение 3–6 месяцев. У взрослых отмечаются потеря веса и аппетита, усталость, безразличие, слабость, анемия, рыхлость десен, расшатывание зубов, кровоточивость слизистых оболочек и подкожные кровоизлияния, желудочно-кишечные расстройства, отечность и напряженность икроножных мышц. Часто наблюдается слабая лихорадка, наличие крови в моче, отеки в области голеностопных суставов и одышка. Резко снижается сопротивляемость организма инфекциям. У взрослых цинга встречается относительно редко. При выраженной цинге у детей прежде всего страдают растущие кости, они становятся тонкими и хрупкими. Характерны кровоизлияния в оболочки, окружающие кости, тогда как подкожные кровоизлияния редки. Нередко наблюдаются потеря веса и аппетита, отечность век, крайняя мышечная слабость в конечностях, лихорадка, повышенная нервозность, раздражительность, дряблость мышц, учащение пульса и дыхания; прогрессирует гипохромная анемия (снижение содержания гемоглобина в эритроцитах и, соответственно, в крови). Выделяют три степени цинги. Для цинги I степени характерны жалобы больных на мышечную слабость и быструю утомляемость, появление болей в мышцах ног при ходьбе, болезненность десен при жевании и более выраженную, чем при гиповитаминозе С, склонность к их кровоточивости. Объективно устанавливаются начальные проявления цинготного гингивита в виде гиперемии и припухлости десен с выбуханием между зубами десневых сосочков, а также элементы скорбутной пурпуры на коже в форме мелких кровоизлияний, чаще выявляемых на сгибательных поверхностях нижних конечностей и туловище. II степень цинги обусловлена возникновением мучительных болей в ногах из-за внутримышечных, а в ряде случаев также поднадкостничных и внутрисуставных кровоизлияний. Больные не могут ходить и полноценно обслуживать себя без посторонней помощи. Наблюдаются общее похудение и выраженная психическая астенизация. Может быть субфебрилитет. Кожа становится темной, слегка шелушащейся, местами пятнисто-пигментированной; просматриваются разной величины элементы скорбутной пурпуры, часть их из-за отслойки эпидермиса имеет вид темно-красных пузырей, которые могут разрываться и инфицироваться с развитием язв. Возможны носовые кровотечения. Десны становятся синюшными, резко отечными, изъязвляются и кровоточат. Зубы расшатываются. АД обычно снижено, имеется тенденция к тахикардии. Цинга III степени соответствует крайне тяжелому состоянию больных из-за кровоизлияний во внутренних органах и присоединения различных осложнений. Больные истощены, поддержание их жизни возможно только при тщательном уходе и лечении, которое при ряде осложнений включает использование средств неотложной помощи. Гингивит приобретает гангренозный характер, зубы выпадают. Типичные для цинги кровоизлияния в кожу, подкожную клетчатку и ткани опорно-двигательного аппарата отличаются массивностью и частым инфицированием гематом. Образуются плохо гранулирующие язвы (преимущественно на коже нижних конечностей), возникают переломы костей.
Лечение Больные с цингой II и III степени нуждаются в госпитализации, что связано как с необходимостью ухода за ними, так и в связи с наличием или угрозой осложнений, требующих неотложной помощи (гемоперикард, гемоторакс, массивное кровотечение и др.) или лечения, которое возможно только в стационаре (например, при сепсисе). Специфическая терапия состоит в применении аскорбиновой кислоты в суточных дозах, превышающих в 5—10 раз и более ее суточную потребность у здоровых лиц. Детям аскорбиновую кислоту назначают в дозе 0,1–0,5 г в сутки; взрослым при цинге I и II степенях — от 0,5 до 1 г, при цинге III степени — 1–1,5 г, а при наличии тяжелых осложнений — до 2 г в сутки, сочетая пероральный и внутривенный способы введения. Одновременно применяют обогащенную аскорбиновой кислотой и механически щадящую (в связи с гингивитом) диету, а также рутин, витамины В2 и В6, при анемии — фолиевую кислоту и препараты железа. Для лечения гингивита назначают полоскания рта (по 6–8 процедур в день), применяя последовательно сначала 3 %-ный раствор перекиси водорода, а затем или крепкий настой чая (предпочтительно зеленого), или отвары ягод рябины, кожуры айвы (эти же отвары целесообразно принимать внутрь, особенно при энтерите); в промежутках между полосканиями рта и перед сном проводят орошение десен свежеприготовленным 1 %-ным раствором галаскорбина и масляными растворами витаминов А и Е. Для устранения тугоподвижности суставов и контрактур в реконвалесцентный период назначают лечебную физкультуру, массаж, физиотерапевтические процедуры. При потере зубов проводят их протезирование.
ЦИРРОЗ ПЕЧЕНИ
ОпределениеЦирроз печени — хроническое заболевание, характеризующееся дистрофией печеночных клеток, узловой регенерацией печеночной ткани, развитием соединительной ткани, диффузной перестройкой структуры и сосудистой системы печени.
Этиология и патогенез Циррозы печени могут быть следствием огромного числа факторов, вызывающих поражение клеток печени и их омертвение. Этот процесс может быть или постепенно прогрессирующим, или рецидивирующим. Ведущую роль в развитии этого заболевания играет вирусное поражение печени (особенно вирусный гепатит С), в исходе которого формируется цирроз печени. Ранее одной из ведущих причин возникновения циррозов печени считался хронический алкоголизм (см.). В настоящее время доказано, что наряду с хронической алкогольной интоксикацией в развитии этого заболевания имеют значение перенесенные вирусные гепатиты (см.), особенно гепатит С, а также сопутствующий фон недостаточного питания или дефицит в пище белков и витаминов. Однако не отрицается и специфическое воздействие алкоголя на многие процессы обмена, происходящие в печени. В эксперименте на животных показано, что длительная алкогольная интоксикация, несмотря на полноценное питание, вызывает дистрофические изменения в клетках печени. Алиментарный фактор (фактор питания) — в основном дефицит белков, витаминов и фолиевой кислоты — является одной из частых причин цирроза печени в ряде стран с тропическим и субтропическим климатом. В ряде случаев нарушение питания связано с расстройством всасывания белков и витаминов в желудочно-кишечном тракте. В странах с тропическим климатом цирроз нередко возникает на фоне хронических паразитарных и гельминтозных поражений печени. Токсический цирроз печени может возникнуть при повторных и длительных воздействиях гепатотоксических веществ, отравлении пищевыми ядами. К группе токсикоаллергических циррозов относят и поражения, связанные с повышенной чувствительностью к различным лекарствам, следствием чего является некроз (см.) печеночной клетки. Билиарный цирроз печени развивается вследствие закупорки желчных протоков и их воспаления, что приводит к застою желчи. Причиной застоя желчи часто является хроническое воспаление желчевыводящих протоков, сопровождающееся их деформацией и закупоркой. Другие причины — это сдавление протоков опухолью (см.) или длительная закупорка их гельминтами. Обменные и эндокринные факторы также могут быть причиной развития цирроза печени при заболеваниях щитовидной железы и сахарном диабете (см.). В некоторых случаях причина возникновения цирроза печени является смешанной, заболевание возникает в результате одновременного воздействия на организм нескольких факторов. Причинный фактор далеко не во всех случаях определяет пути развития цирроза печени. Один и тот же повреждающий агент может привести к формированию различных морфологических вариантов цирроза. Долгое время к циррозам печени относили ее поражения, возникающие при нарушении оттока крови по печеночным венам (при недостаточности функции сердца, воспалении печеночных вен). В этих случаях также наблюдается развитие соединительной ткани в печени и увеличение ее размеров. Однако при этом обычно отсутствует узловая регенерация печеночной паренхимы, поэтому такие поражения этого органа обозначают как «псевдоцирроз», или «фиброз печени».
Цирроз печени. Венозная сеть на спине
Портальная гипертензия (цирроз печени)
Происхождение заболевания во многих случаях связано с длительным непосредственным действием этиологического фактора (вирус, интоксикация) на печень, нарушениями кровообращения в ней. Развитие соединительной ткани в виде тяжей и рубцов, которые изменяют нормальную структуру печени, ведет к сдавлению ее сосудов, нарушению нормального кровоснабжения печеночных клеток; кислородное голодание способствует дальнейшим нарушениям нормального протекания ферментных реакций в печеночной ткани, усиливает дистрофические изменения и способствует прогрессированию процесса. Продукты распада клеток печени способствуют регенераторным процессам, а также развитию воспалительной реакции. Для прогрессирования хронических заболеваний печени и развития цирроза также имеют значение иммунные нарушения. Классифицируются циррозы исходя из нескольких признаков. I. По происхождению: — вследствие вирусного поражения печени; — вследствие недостаточности питания; — вследствие хронического алкоголизма; — холестатические; — как исход гепатитов; — наследственно обусловленные циррозы; — циррозы, развивающиеся на фоне хронических инфекций (туберкулез (см.), сифилис (см.), бруцеллез (см.)); — циррозы, возникшие вследствие невыясненных причин (криптогенные). II. По активности процесса: — активные, прогрессирующие; — неактивные. III. По степени функциональных нарушений: — компенсированные; — декомпенсированные.
Клиническая картина Клиника зависит от вида цирроза, стадии болезни (компенсированная или декомпенсированная) и степени активности патологического процесса в печени. Основными клиническими признаками цирроза печени, позволяющими отличить его от гепатитов и других поражений этого органа, являются: наличие увеличенной плотной печени и селезенки (в далеко зашедших случаях размеры печени могут быть уменьшены); асцит (см.) и другие признаки портальной гипертензии; так называемые печеночные стигмы (знаки), особенно кожные печеночные «звездочки» (телеангиэктазии). При различных вариантах цирроза боли возникают в области печени, по всему животу или в верхней его части, имеют тупой ноющий характер, усиливаются после еды, особенно жирной, обильного питья и физической работы. Причиной болей являются: увеличение печени и растяжение капсулы, появление очагов омертвения, близко расположенных к капсуле, и вовлечение в процесс участков печеночной капсулы. При циррозах печени обычны диспепсические явления в виде снижения аппетита до полного его исчезновения (чаще при алкогольном циррозе), тяжести в подложечной области после еды, тошноты, метеоризма (см.) и расстройства стула, редко — выраженной тошноты и рвоты. Выраженный метеоризм иногда сопровождается болями в животе, обычно кратковременными приступами. Частыми жалобами больных циррозом печени являются снижение трудоспособности, общая слабость, быстрая утомляемость и бессонница. Циррозы печени часто сопровождаются повышенной температурой тела. Лихорадка бывает в большинстве случаев неправильного, реже — волнообразного типа. Появление лихорадки можно расценить как проявление прогрессирующего омертвения клеток печени и активности процесса, а повышение температуры тела может рассматриваться как неблагоприятный симптом. Снижение массы тела особенно характерно для больных циррозом печени с выраженной портальной гипертензией (повышение давления в системе воротной вены), причем оно достигает значительных величин при далеко зашедшей стадии заболевания. Внешний вид таких больных типичен: исхудавшее лицо с серым желтушным цветом кожи, с яркими губами и языком, эритемой (ограниченным покраснением) скуловой области, тонкими конечностями и увеличенным животом, расширенными венами переднебоковых поверхностей грудной и брюшной стенки и отеками ног. Истощение связано с нарушениями пищеварения и всасывания в желудочно-кишечном тракте и синтеза белка в пораженной печени. Желтуха (см.) при циррозах может быть проявлением недостаточности функции печеночных клеток, связанной с дистрофически ми процессами и некрозами (см.). Раньше всего желтуха выявляется на склерах глаз, мягком небе и нижней поверхности языка. Затем окрашиваются ладони, подошвы и наконец вся кожа. Желтуха (см.) обычно протекает с неполным обесцвечиванием кала и присутствием желчи в дуоденальном содержимом (содержимом двенадцатиперстной кишки), нередко сопровождается кожным зудом (см.), который может быть и при ее отсутствии. В этих случаях осмотр может выявить множественные следы расчесов на коже конечностей, живота, поясницы, в подмышечных областях и между пальцами, которые могут подвергаться инфицированию и нагноению. При циррозе печени, возникшем в результате массивных очагов омертвения печеночной ткани, в период обострения болезни желтуха приобретает большое прогностическое значение: она особенно выражена в том случае, если процесс разрушения печеночных клеток превышает их способность к регенерации. При портальном циррозе желтуха не является ранним симптомом и обычно выражена слабо. При осмотре больного в большинстве случаев можно выявить печеночные признаки, некоторые из них настолько характерны, что их отсутствие ставит под сомнение диагноз заболевания. К ним относятся следующие: I. Сосудистые «звездочки» («паучки») — кожные артериовенозные соединения, наблюдающиеся у подавляющего большинства больных циррозом и в ряде случаев появляющиеся за несколько лет до выраженных симптомов этого заболевания. Они представляют собой слегка возвышающиеся над поверхностью кожи ангиомы, от которых лучеобразно разветвляются мелкие сосудистые веточки. Размер их колеблется от булавочной головки до 1 см в диаметре. При давлении стеклом на сосудистую «звездочку» она бледнеет вследствие оттекания крови, при прекращении давления наблюдается быстрое ее заполнение кровью. Наиболее часто сосудистые «звездочки» располагаются на коже верхней части туловища, на шее, лице, плечах, кистях и спине, реже — на слизистых оболочках носа, рта и глотки, очень редко они обнаруживаются на нижней половине туловища. II. Эритема ладоней (печеночные ладони) — разлитая ярко-красная диффузная окраска ладоней. На стопах подобная эритема выявляется реже. Ее причиной являются множественные артериовенозные шунты, развивающиеся в коже при циррозах печени. III. Красные блестящие губы, красная слизистая оболочка рта, красный печеночный («лакированный», «малиновый») язык выявляются у многих больных циррозом печени. IV. Признаки гормональных расстройств. У мужчин возникают гинекомастия (увеличение молочных желез) и другие женские половые признаки, что обусловлено нарушением обмена гормонов в связи с заболеванием печени и избыточным содержанием их в крови. На фоне длительно существующего цирроза печени нередко развиваются импотенция (см.) и атрофия (см.) яичек. У женщин часто наблюдаются нарушения менструального цикла (аменорея), нарушается детородная функция. Больной циррозом печени может выглядеть инфантильным, особенно если заболевание возникло в детстве или ранней юности. V. Ксантоматозные бляшки на коже: желтовато-коричневые бляшки, чаще располагающиеся на веках, иногда на ладонях, а также на груди, спине и коленях, наблюдаются у больных билиарным циррозом печени. Появление их связывают с повышением уровня холестерина в крови и внутрикожным отложением холестерина. Ксантоматоз не является строго специфическим симптомом, он наблюдается также при других заболеваниях, сопровождающихся нарушением холестеринового обмена. Увеличение печени часто обнаруживается у больных циррозом печени. Оно может быть равномерным или с преимущественным увеличением только правой или левой доли. Печень обычно плотная, безболезненная или слабоболезненная, с гладкой, реже неровной поверхностью, с острым и твердым краем. В конечной стадии цирроза в большинстве случаев печень уменьшается в размерах. Содружественное увеличение селезенки наблюдается у большинства больных. Оно является очень важным признаком, подтверждающим этот диагноз, и позволяет нередко отличить цирроз от хронического гепатита (см.) и других заболеваний печени. Геморрагический (повышенной кровоточивости) синдром встречается приблизительно у половины больных циррозом печени. Массивные кровотечения из расширенных вен пищевода и желудка, а также геморроидальных узлов обусловлены повышенным давлением в этих венах, истончением и травмированием стенок. Повторные носовые кровотечения могут быть одним из начальных признаков цирроза печени. Кровотечения из носа, маточные кровотечения, кожные геморрагии обусловлены нарушениями свертываемости крови в результате нарушения участия печени в выработке факторов свертывания. Они появляются при выраженной декомпенсации цирроза. Циррозы печени обычно имеют тенденцию к прогрессированию. В одних случаях прогрессирование болезни происходит быстро и на протяжении нескольких лет приводит больного к гибели (активный прогрессирующий процесс). Нередко он характеризуется чередованием периодов обострений и периодов ремиссий, когда самочувствие больного и многие клинические и лабораторные показатели значительно улучшаются. В других случаях отмечается замедленное течение болезни (десятки лет) с нерезко выраженными признаками активности (неактивный цирроз). Ремиссии могут быть очень длительными (годы), периоды обострения болезни четко не дифференцируются или возникают редко (после значительных нарушений в диете, на фоне тяжелых инфекционных заболеваний). Различают также циррозы декомпенсированные и компенсированные. При компенсированном циррозе печени жалобы могут отсутствовать или он может протекать с незначительными симптомами и выявляется при случайном обследовании на основании увеличения печени и селезенки, наличия печеночных знаков. Изменения лабораторных показателей также незначительны. Декомпенсация цирроза характеризуется резким снижением трудоспособности, общей слабостью, бессонницей, усилением диспепсических явлений, потерей массы тела, умеренной лихорадкой, появлением печеночного запаха изо рта. Появляется или усиливается желтуха (см.), кожа может быть не только желтушна, но и пигментирована за счет повышенного отложения меланина. Спонтанно возникают кровоизлияния в кожу и носовые кровотечения. Отмечается тенденция к снижению артериального давления. Быстро развивается асцит (см.), которому предшествует выраженный метеоризм (см.). Печень чаще или незначительно увеличена, с плотным краем, или резко сморщена и не пальпируется. Селезенка увеличена. Частыми осложнениями цирроза печени являются сильные кровотечения из варикозно расширенных вен пищевода и желудка и геморроидальные кровотечения. Непосредственной причиной варикозных кровотечений является физическое напряжение или местное повреждение слизистой оболочки (например, грубой пищей). Предрасполагают к кровотечениям трофические изменения стенки расширенных сосудов и слизистой оболочки пищевода, высокое давление в венах.
Диагностика и дифдиагностика Лабораторные исследования крови обычно выявляют снижение количества эритроцитов, лейкоцитов, тромбоцитов и повышение СОЭ. Особенно тяжелые анемии (см.) наблюдаются после кровотечений. В редких случаях развивается мегалобластическая анемия вследствие дефицита витамина В12. При мелкоузловом (портальном) и крупноузловом (постнекротическом) циррозах уровень билирубина сыворотки крови достигает значительной степени лишь в конечной стадии болезни. Обычно повышается содержание в крови прямой фракции билирубина не только при увеличенной, но еще и при нормальной концентрации общего билирубина. В результате нарушения соединения билирубина в печеночной клетке с глюкуроновой кислотой, а также усиленного внутриклеточного распада эритроцитов в сыворотке крови повышается содержание и свободного билирубина. Особенно высокая степень гипербилирубинемии может наблюдаться при билиарном циррозе, при котором уровень билирубина может достигать 255–340 мкмоль/л. В моче обнаруживается в больших количествах уробилин, а при выраженной желтухе — и билирубин. Количество стеркобилина в кале уменьшается. Поражение печеночных клеток проявляется изменениями белковых показателей: снижением концентрации сывороточных альбуминов и повышением количества глобулинов. В период ремиссии все эти изменения становятся менее выраженными. Проявлением нарушения функции печени при циррозе является снижение содержания в сыворотке крови протромбина и фибриногена, синтез которых осуществляется печеночными клетками; обычно увеличивается антитромбиновая активность плазмы, снижается ее общая свертывающая активность. Изменение этих показателей свертывающей и противосвертывающей систем крови отражает характерную для циррозов печени наклонность к кровотечениям. В диагностически сложных случаях прибегают к лапароскопии и чрескожной биопсии печени. Эти инструментальные методы дают возможность обнаружить и характерные морфологические признаки каждого из вариантов цирроза печени. Сканирование печени позволяет определить ее размеры, состояние поглотительной функции печени, а также определить сопутствующее увеличение селезенки. Для диагностики цирроза широко используется УЗИ, также позволяющее определить размеры печени и селезенки, их структуру. Диагноз устанавливают на основании характерной клинической картины заболевания. Он подтверждается в первую очередь пункционной биопсией печени, данными УЗИ, сканирования, компьютерной томографии, ангиографии и других методов исследования. Цирроз печени следует дифференцировать с хроническим гепатитом (см.), дистрофией печени, поражениями при хронических инфекциях, первичным или метастатическим опухолевым поражением, фиброзом (см.) печени. При жировой дистрофии (жировой гепатоз (см.)) печень обычно увеличена, но край ее не такой острый, как при циррозе. Увеличения селезенки обычно не наблюдается. При опухолевом поражении печени отмечается сравнительно быстрое нарастание симптомов (несколько месяцев — 1–1,5 года), печень постепенно увеличивается, нередко бугристая, с неровным краем, селезенка не увеличена. В случаях, когда рак (см.) печени возникает на фоне цирроза, диагноз становится более трудным. Решающее значение в дифференциальной диагностике имеют лапароскопия и пункционная биопсия, сканирование, УЗИ, компьютерная томография.
Лечение Лечение больных сразличными формами циррозов печени в стадии компенсации в основном состоит в предупреждении дальнейших повреждений печени, калорийном и полноценном диетическом питании с достаточным содержанием в пище белка и витаминов, установлении четкого 4—5-разового питания в течение дня. Запрещаются алкогольные напитки. В период декомпенсации лечение обязательно проводится в стационаре. Назначают диетотерапию, применяют кортикостероидные препараты (15–20 мг/сут. преднизолона), витамины. Кортикостероиды противопоказаны при циррозах печени, осложненных расширением вен пищевода, и при сочетании цирроза с язвенной болезнью (см.) желудка и двенадцатиперстной кишки. При асците (см.) назначают диету с ограничением соли и периодический прием мочегонных средств. С целью профилактики пищеводно-желудочных кровотечений у больных с портальной гипертензией широко проводится хирургическое лечение — наложение дополнительных портокавальных анастомозов (шунтов), способствующих снижению давления в пищеводных венах. Возникновение острого пищеводного кровотечения при циррозе печени требует неотложной госпитализации больного в хирургический стационар и проведения экстренных мероприятий для остановки кровотечения (тугая тампонада пищевода через эзофагоскоп, применение специального трехканального зонда Блейкмора с заполняющимся воздухом и сдавливающим вены баллоном, гемостатическая терапия). При неактивном циррозе с признаками печеночной недостаточности назначают препараты печени (сирепар по 2–3 мл внутримышечно или внутривенно 1 раз в сутки, антианемин). При активном циррозе эти препараты не назначают, так как они могут способствовать еще большей активизации процесса. Хороший эффект дает длительный прием эссенциале (по 2 капсулы 3 раза в день). При тяжелой печеночной недостаточности лечение проводят, как при печеночной коме (см.). При первичном билиарном циррозе печени применяют полноценную диету, богатую витаминами, особенно витаминами А, D и К. Некоторый эффект дают препараты липоевой кислоты, для уменьшения мучительного кожного зуда (см.) применяют холестирамин (полимер, связывающий желчные кислоты в кишечнике и предотвращающий их всасывание).
ЦИСТАЛГИЯ
ОпределениеЦисталгия — это совокупность разнообразных симптомов поражения мочевых путей у женщин, выявляемых при отсутствии изменений в анализах мочи.
Этиология и патогенез Наиболее часто цисталгия наблюдается у женщин в возрасте 30–40 лет. В основе этого заболевания лежат воспалительные изменения подслизистого слоя в области шейки мочевого пузыря, сопровождающиеся дистрофическими изменениями нервных волокон. Эти процессы протекают на фоне измененного гормонального фона.
Клиническая картина Основными симптомами цисталгии являются нарушения мочеиспускания, боли в области мочевого пузыря и промежности, смещающиеся в крестцовую область. Боль возникает в момент мочеиспускания или при половом акте, нередко этому предшествуют переохлаждение, употребление алкоголя, чрезмерно соленой или острой пищи. При цисталгии наблюдаются спонтанные ремиссии и обострения, спровоцированные менструацией, беременностью (см.), климаксом (см.).
Диагностика и дифдиагностика Диагностируется цисталгия лишь после исключения других заболеваний мочевого пузыря и уретры, которые могут сопровождаться нарушением мочеиспускания; с этой целью используют лабораторные, эндоскопические и рентгенологические методы обследования. Для цисталгии характерно отсутствие патологических изменений в моче, но при цистоскопии могут наблюдаться легкая гиперемия и отек слизистой оболочки мочевого пузыря в области его шейки.
Лечение При лечении цисталгии благоприятное воздействие оказывают физиотерапия, лекарственные средства с седативным эффектом, лечебная гимнастика. В период обострения также применяются новокаиновые блокады. Определенный эффект в лечении принадлежит диетотерапии (исключение из пищевого рациона острых блюд и алкоголя). При цисталгии, протекающей на фоне гормонального дисбаланса, рекомендуется его коррекция.
ЦИСТИТ
ОпределениеЦистит — это острый или хронический воспалительный процесс, характеризующийся воспалением слизистой оболочки мочевого пузыря и нарушением его функции.
Этиология и патогенез Различают циститы инфекционной и неинфекционной природы (первичные и вторичные). I. Первичные циститы: — острые — инфекционные (специфические и неспецифические), химические, термические, токсические, лекарственные, алиментарные, нейрогенные; — хронические — инфекционные (специфические и неспецифические), лучевые, лейкоплакия, нейротрофическая язва мочевого пузыря, посттравматические, инволюционные (старческие); — паразитарные. II. Вторичные циститы: — пузырного происхождения — при камнях и инородных телах, повреждениях и ранениях мочевого пузыря, опухолях (см.), аномалиях развития, после операций на мочевом пузыре; — внепузырного происхождения — при аденоме (см.) предстательной железы, заболеваниях и травмах позвоночника, стриктурах уретры, беременности (см.), родах (см.), послеродовые, при заболеваниях органов малого таза. Циститы неинфекционного происхождения возникают при раздражении слизистой оболочки мочевого пузыря химическими веществами и могут наблюдаться при ожогах слизистой оболочки, например в случае введения в мочевой пузырь концентрированного раствора химического вещества или в результате промывания мочевого пузыря раствором, температура которого превышает 45 °C (ожоговый цистит). Цистит также наблюдается при повреждении слизистой оболочки инородным телом, мочевым камнем, а также в процессе эндоскопического исследования, при лучевой терапии. В большинстве случаев к первичному асептическому воспалительному процессу вскоре присоединяется инфекция. При циститах инфекционной природы, которые встречаются намного чаще циститов неинфекционного генеза (происхождения), возбудителями чаще бывают кишечная палочка, стафилококк, стрептококк, энтерококк и протей, иногда — газопродуцирующие микроорганизмы. В моче при цистите инфекционной природы могут быть обнаружены друзы (колонии) актиномицетов, вызывающих микотический цистит, и влагалищные трихомонады — возбудители трихомонадного цистита. С каждым годом растет эпидемиологическое значение циститов, которые вызывают некоторые представители хламидий — возбудители урогенитальных хламидиозов, а также микоплазмы. Возбудителями циститов могут быть туберкулезные микобактерии и редко — бледная трепонема (возбудитель сифилиса (см.)). Встречаются и редкие формы циститов — пурпура, бильгарциоз, актиномикоз и др. Инфекционные циститы могут возникать восходящим, нисходящим, гематогенным, лимфогенным и контактным путями. Возбудители инфекций могут проникать в мочевой пузырь восходящим путем при воспалительных заболеваниях мочеиспускательного канала, предстательной железы, семенных пузырьков, яичка и его придатков. Нисходящий путь инфицирования чаще всего бывает при туберкулезном поражении почки. Гематогенный путь поражения слизистой оболочки мочевого пузыря встречается при инфекционных болезнях или наличии гнойного очага в организме — тонзиллите (см.), пульпите (см.), фурункулезе (см.). Лимфогенный путь заражения наблюдается при заболеваниях половых органов — эндометрите (см.), сальпингоофорите (см.), параметрите. Инфицирование мочевого пузыря может наступить при его катетеризации или во время цистоскопии. Прямое инфицирование мочевого пузыря может возникать при наличии свищей, соединяющих влагалище с мочевым пузырем или влагалище с прямой кишкой. Имеют значение нарушения оттока и застой мочи у больных с аденомой (см.) предстательной железы, стриктурой (сужением) уретры, камнем мочевого пузыря, нейрогенной дисфункцией мочевого пузыря. Предрасполагающим моментом служит нарушение кровообращения в стенке мочевого пузыря или малом тазу. Изменение слизистой оболочки мочевого пузыря при циститах регистрируется при цистоскопии, которая особенно показана при хронических циститах. На ранних стадиях острого цистита цистоскопию проводить не следует, чтобы не нанести больному дополнительного вреда.
Клиническая картина Острый цистит Острый цистит возникает обычно внезапно, через некоторое время после переохлаждения или воздействия другого провоцирующего фактора. Основными его симптомами являются частые болезненные мочеиспускания, боли внизу живота, пиурия (гной в моче). Интенсивность болей при мочеиспускании нарастает. Боль может принимать почти постоянный характер, но чаще связана с актом мочеиспускания и возникает в начале, конце или отмечается на протяжении всего акта мочеиспускания. В связи с учащенными императивными позывами к мочеиспусканию больные не в состоянии удерживать мочу. Выраженность клинических признаков при остром цистите различна. В некоторых более легких случаях больные ощущают лишь тяжесть внизу живота. Умеренно выраженная поллакиурия (учащенное мочеиспускание) сопровождается небольшими болями в конце акта мочеиспускания. Иногда эти явления наблюдаются в течение 2–3 дней и проходят без специального лечения. Однако чаще острый цистит, даже при своевременно начатом лечении, протекает 6–8 дней, иногда до 10–15 дней. Более длительное течение свидетельствует о наличии сопутствующего заболевания, поддерживающего воспалительный процесс, и требует дополнительного обследования. Для тяжелых форм острого цистита (флегмонозный, гангренозный, геморрагический) характерны выраженная интоксикация, высокая температура тела, олигурия (уменьшенное количество мочи). Моча при этом мутная, с гнилостным запахом, содержит хлопья фибрина, иногда — пласты омертвевшей слизистой оболочки и примесь крови. Продолжительность заболевания в этих случаях значительно увеличивается, возможно развитие тяжелых осложнений. При тотальном диффузном воспалении слизистой оболочки мочевого пузыря боли усиливаются по мере накопления мочи, растяжения воспаленной слизистой оболочки. Усиление болей в конце акта мочеиспускания связано с сокращением воспаленной слизистой оболочки мочевого пузыря и с соприкосновением воспаленных поверхностей. Помимо пиурии (лейкоцитурии), при остром цистите возможна макроскопическая и микроскопическая гематурия (кровь в моче). Гематурия, как правило, терминальная, что связывают с травматизацией воспаленной слизистой оболочки шейки мочевого пузыря и треугольника Льето в конце акта мочеиспускания. Эритроцитурия наблюдается так же часто, как и лейкоцитурия.
Хронический цистит Клиническая картина хронического цистита разнообразна и зависит от причины его возникновения, общего состояния больного и эффективности лечения. Основные клинические симптомы те же, что и при остром цистите, но выражены слабее. Хронический цистит протекает либо в виде непрерывного процесса с постоянными более или менее выраженными жалобами и изменениями в моче (лейкоцитурия, бактериурия), либо имеется рецидивирующее течение. Хронический цистит сопровождается щелочной реакцией мочи с различным содержанием в ней слизи. Кислая реакция мочи наблюдается при циститах, вызванных кишечной и туберкулезной палочкой. Протеинурия (белок в моче) у больных циститом связана с содержанием в моче форменных элементов (лейкоцитов и эритроцитов). Чем больше выражены лейкоцитурия и эритроцитурия, тем значительнее протеинурия. К осложнениям цистита относят переход воспалительного процесса со стенки пузыря на окружающую пузырь клетчатку с возникновением парацистита. При хроническом цистите микроорганизмы могут проникать восходящим путем по лимфатическим сосудам мочеточника в лоханку и ткань почки, вызывая в них воспалительный процесс. Хронический цистит, чаще всего туберкулезного происхождения, приводит к склерозу стенки пузыря, вследствие чего емкость его резко уменьшается, а дизурические расстройства (расстройства мочеиспускания) приобретают исключительно тяжелый характер.
Диагностика и дифдиагностика В большинстве случаев постановка диагноза цистита затруднений не вызывает. Так как цистит сопровождается характерными жалобами на частое болезненное мочеиспускание с резью, имеют значение данные о внезапном остром начале и быстром нарастании признаков заболевания с максимальной их выраженностью в первые дни. При исследовании мочи выявляются объективные признаки цистита в виде лейкоцитурии и гематурии. Глубокое прощупывание надлобковой области болезненно. При воспалении нижней стенки мочевого пузыря и выраженном локальном воспалении его шейки прощупывание со стороны прямой кишки и со стороны влагалища также резко болезненно. Основным симптомом туберкулеза (см.) мочевого пузыря является дизурия. В постановке диагноза помогают данные с жалобами на постепенное увеличение частоты мочеиспускания, которое со временем становится болезненным. Оно сопровождается пиурией и терминальной гематурией. Решающее значение для диагностики туберкулеза мочевого пузыря имеют обнаружение в моче туберкулезных микобактерий, специфические изменения при цистоскопии и рентгенографии мочевых путей и почек. При уриногенном (связанным с мочой) нисходящем распространении процесса при цистоскопии обнаруживают гиперемию (покраснение) и отечность слизистой оболочки в области устьев мочеточника пораженной почки, типичные мелкие туберкулезные бугорки желтоватого цвета с венчиком гиперемии, язвы с неровными подрытыми краями, дно которых покрыто серовато-желтым гнойно-фибринозным налетом. Иногда находят туберкулезные гранулемы (образования), симулирующие опухоль (см.) мочевого пузыря. На цистограммах при туберкулезе наблюдают деформацию контуров мочевого пузыря, скошенность одной из его стенок, уменьшение объема органа, пузырно-мочеточниковый рефлюкс. Зловонный запах мочи говорит о далеко зашедшем разложении ее, вызванном заболеванием мочевого пузыря. Реакция нормальной мочи кислая. Щелочная реакция указывает на процесс брожения в самом мочевом пузыре. Появление крови в моче, видимой простым глазом, всегда указывает на тяжелое поражение мочевых путей (геморрагическое воспаление почек, камень, туберкулез, рак (см.)). Острый цистит следует дифференцировать с целым рядом заболеваний других органов: почек, предстательной железы (аденома), уретры (стриктура), с камнями мочевого пузыря, цисталгией, заболеваниями женской половой сферы. Дизурия у пожилого мужчины заставляет заподозрить аденому (см.) предстательной железы или камень мочевого пузыря. Дизурия, обусловленная аденомой, наиболее выражена в ночное время и в покое. Днем и при активном образе жизни она уменьшается. При наличии камней в мочевом пузыре симптомы весьма похожи на жалобы больных при цистите. Вместе с тем при камнях мочевого пузыря боль часто появляется при ходьбе или тряской езде. Она имеет характерное смещение — в область промежности, яичка или головку полового члена. Боль усиливается при наличии шиповидных камней — оксалатов — или при часто встречающемся сопутствующем цистите. Боль обусловлена передвижением камня и раздражением слизистой оболочки, особенно шейки мочевого пузыря. Расстройство мочеиспускания проявляется учащением позывов и усилением их при перемещении тела. Во время сна боли прекращаются. Постоянные боли в области мочевого пузыря могут быть обусловлены злокачественной опухолью (см.). Такие боли могут усиливаться при распаде опухоли с возникновением вторичного цистита. Первые проявления рака (см.) предстательной железы также характеризуются учащением позывов на мочеиспускание, особенно ночью. У многих больных отмечается затрудненное мочеиспускание с натуживанием или вялая струя мочи с перерывами, иногда моча выделяется каплями; этому сопутствует чувство неполного опорожнения мочевого пузыря. Часто больной жалуется на болезненность в начале акта мочеиспускания. Боли при раке (см.) шейки матки могут быть неправильно истолкованы при прорастании опухоли в мочевой пузырь. Правильный диагноз может быть поставлен только при цистоскопическом исследовании. При цистите гной обычно быстро оседает на дно, и слой мочи выше осадка значительно просветляется, становясь иногда прозрачным. При пиелонефрите (см.) моча равномерно мутная, сероватая, при стоянии в сосуде на дне его образуется различной толщины осадок, состоящий из гноя и слизи. Слой мочи над осадком совершенно не просветляется и остается мутным. При цистите количество белка соответствует находящемуся в моче гною. При пиелонефрите (см.) протеинурия выражена больше. Если количество белка в гнойной моче превышает 1 % или количество лейкоцитов при таком содержании белка меньше 50 тыс., то можно предполагать поражение почек.
Лечение Острый цистит Неотложная помощь при острых циститах заключается в назначении спазмолитических средств: 2 мл 2 %-ного раствора папаверина, 1 мл 0,1 %-ного раствора атропина подкожно, тепло на низ живота. Проводят также антибактериальную терапию. Госпитализации подлежат больные с непрекращающимися болями, острой задержкой мочи, геморрагическим циститом. Лечение гангренозного цистита крайне затруднено. У мужчин показано оперативное лечение, направленное на выведение мочи и ревизию мочевого пузыря. У женщин можно проводить консервативные мероприятия. По жизненным показаниям должны проводиться цистостомия и освобождение мочевого пузыря от омертвевших тканей с отведением мочи, что спасает больного от опасных осложнений. При остром цистите больные нуждаются в постельном режиме. Назначают обильное питье, диету с исключением острых блюд, солений, соусов, приправ, консервов, запрещается употребление алкогольных напитков. Рекомендуются овощи, фрукты, мол очные продукты. Тепловые процедуры назначают только при установленной причине дизурии. От них следует воздерживаться при неустановленном диагнозе, особенно при макрогематурии, так как тепло усиливает кровотечение. При резко выраженной дизурии назначают микроклизмы с 2 %-ным теплым раствором новокаина. В тяжелых случаях производят пресакральные новокаиновые блокады. При непрекращающихся сильных болях допустимо применение наркотических средств. В качестве антибактериального лечения при остром цистите применяют фурагин по 0,1 г 2–3 раза в день, неграм — по 0,5 г 4 раза в день, 5-НОК — по 0,1 г 4 раза в день и антибиотики широкого спектра действия (олететрин, оксациллин, тетрациклин, эритромицин и др.) внутрь или внутримышечно. Обычно применяют один из перечисленных препаратов в течение 8—10 дней, что приводит к быстрому уменьшению дизурии и нормализации состава мочи.
Хронический цистит Лечение хронического цистита заключается в устранении причин, вызвавших хроническое воспаление. Антибактериальное лечение при хроническом цистите проводят только после бактериологического исследования и определения чувствительности микрофлоры к антибиотикам. Обычно назначается антибиотик в сочетании с нитрофурановыми или сульфаниламидными препаратами. Лечение проводится в течение нескольких месяцев. Взрослым и детям старшего возраста проводят промывание мочевого пузыря раствором фурацилина в разведении 1:5000 или растворами нитрата серебра в возрастающих концентрациях (1:20 000; 1:10 000; 1:1000) в течение 10–15 дней. Для улучшения кровоснабжения применяют УВЧ-терапию, индуктотермию, грязевые аппликации. Местное воздействие лекарств достигается с помощью ионофореза с нитрофуранами и антисептиками. При хроническом цистите, сопровождающемся стойкой щелочной реакцией мочи, показано санаторно-курортное лечение в Трускавце, Железноводске, Ессентуках, Боржоми. При лечении хронического цистита нельзя пренебрегать фитотерапией. Хороший эффект наблюдается при употреблении почечного сбора, урологического сбора и других трав, обладающих мочегонным и антибактериальным эффектом.
Профилактика В профилактике цистита важную роль играют соблюдение правил личной гигиены, своевременное лечение воспалительных заболеваний и нарушений уродинамики, предупреждение переохлаждения, соблюдение асептики при эндовезикальных (внутрипузырных) исследованиях и катетеризации мочевого пузыря. Профилактика послеродового цистита заключается в рациональном оказании помощи при родах (см.), борьбе с задержкой мочеиспускания, тщательном соблюдении асептики при взятии мочи катетером. Профилактика хронического цистита состоит в рациональном лечении острого цистита, а также своевременном выявлении и лечении заболеваний мочеполовой системы. Профилактика лучевого цистита состоит в рациональном планировании лучевой терапии с учетом радиационной чувствительности тканей и органов, а также использовании защитных приспособлений.
ЦИСТИЦЕРКОЗ
ОпределениеЦистицеркоз — заболевание, связанное с паразитированием в тканях человека личиночной стадии цепня свиного (цистицеркус целлюлоза).
Этиология Возбудителями цистицеркоза является кишечный гельминт — свиной цепень.
Эпидемиология, патогенез и патанатомия Цистицеркоз — заболевание, при котором в кишечнике человека, являющегося окончательным хозяином, паразитируют взрослые свиные цепни. В яйцах, заключенных в члениках, находится вполне сформированный инвазионный зародыш (онкосфера). Развитие из зародыша цистицерка (личиночной формы цепня) происходит в теле промежуточного хозяина, проглотившего яйцо (или зрелый членик). Заражение цистицеркозом происходит в результате попадания в желудок человека яиц — онкосферы свиного цепня. Онкосферы могут попасть в желудок через рот, с загрязненными пищевыми продуктами, в частности с сырыми овощами, загрязненными фекалиями. Второй путь имеет место только у инвазированных свиным цепнем, когда онкосфера попадает в желудок обратно из кишечника при рвоте. Дальнейшее развитие происходит так же, как в организме свиньи. Считается, что длительность жизни цистицерка обычно составляет 3—10 лет. В развитии личинки различают стадии жизнеспособного паразита, отмирающего и полностью погибшего. В последнем периоде наблюдаются наибольшие изменения в органах. Диаметр цистицерков обычно 5–8 мм, вокруг них образуется соединительнотканная капсула. Паразитирование цистицерков возможно в различных органах и тканях (мышцы, легкие, головной мозг, кости, глаза, подкожная клетчатка). Цистицерки могут паразитировать в полостях (в желудочках мозга, передней камере глаза или стекловидном теле). В мягких мозговых тканях иногда развивается ветвистая форма цистицерка до 25 см в длину. Стадия отмирания паразита характеризуется его набуханием и расплавлением с наиболее выраженным в этот период токсическим действием. Отмирание цистицерка нередко сопровождается последующей кальцификацией.
Клиническая картина и диагностика Клинические проявления цистицеркоза связаны с локализацией паразитов, интенсивностью инвазии и реактивностью микроорганизма. Цистицеркоз мозга характеризуется нестойкостью клинических симптомов; явления раздражения структур мозга преобладают над явлениями выпадения функций. Ведущие симптомы — приступообразные головные боли, тошнота, рвота, эпилептиформные припадки. Иногда нарушается психика в виде делириозных, галлюцинаторных и аментивных состояний, которые могут внезапно исчезать и вновь появляться. Цистицеркоз желудочков мозга сопровождается проявлениями внутричерепной гипертензии (повышенного давления); при ее развитии требуется срочное оперативное вмешательство. Цистицеркоз глаза вызывает нарушения зрения и нередко слепоту. Поражения мышц, подкожной клетчатки и кожи часто протекают без жалоб. Диагноз цистицеркоза ставится на основании клинических проявлений, биопсии подкожных узлов, данных рентгенологического исследования. Дифференциальный диагноз чаше проводят с опухолями (см.), воспалительными заболеваниями и эхино коккозом.
Лечение и профилактика При цистицеркозе хирургический метод в сочетании с противовоспалительной терапией является единственным радикальным методом лечения. Однако возможности оперативного вмешательства ограничены и находятся в зависимости от числа паразитов и их локализации. При множественном цистицеркозе показана рентгенотерапия. Иногда удается получить эффект от применения хлоридина в сочетании с сульфаниламидными препаратами. Появлялись сообщения об эффективности применения альбендазола по 15 мг/кг в сутки в течение 8 дней. Антигельминтные препараты противопоказаны в остром периоде цистицеркоидного энцефалита (см.), а празиквантел — при поражении глаз.
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
ОпределениеЦитомегаловирусная инфекция — широко распространенная вирусная инфекция, характеризующаяся многообразными проявлениями — от бессимптомного течения до тяжелых распространенных форм с поражением внутренних органов и центральной нервной системы. Возможна передача вируса от матери к эмбриону с внутриутробным поражением плода.
Этиология, эпидемиология и патогенез Возбудитель относится к вирусам герпеса. Диаметр вириона (вирусной частицы) — около 180 нм, вирус содержит ДНК, а при его развитии в ядрах инфицированных клеток образуются включения. Может развиваться на культурах фибробластов (клеток соединительной ткани) человека. Под воздействием вируса нормальные клетки превращаются в цитомегалические (гигантские), диаметр которых достигает 25–40 мкм. В культуре тканей не выявлено существенных нарушений хромосомного аппарата. Возможность онкогенного (провоцирующего развитие опухолей) действия вируса окончательно не изучена. Имеются антигенные различия между отдельными штаммами вируса. Он обладает свойствами, общими для всех вирусов группы герпеса. Носителем и источником инфекции является только человек. Вирус может находиться в слюне, молоке, моче, испражнениях, семенной жидкости, секрете шейки матки. Инфекция передается воздушно-капельным, контактным и половым путями, а также через плаценту от матери к плоду. Возможна также передача инфекции при пересадке почек и переливании крови инфицированного донора. О широком распространении цитомегаловирусной инфекции свидетельствует наличие специфических антител у 50–80 % взрослых людей. Будучи инфицированным, человек остается вирусоносителем в течение всей жизни, чаще всего это скрытое персистирование (переживание) вируса. Около 5 % новорожденных в США инфицировано цитомегаловирусом. В развивающихся странах этот процент выше. При исследовании умерших детей (новорожденных и детей раннего возраста) генерализованная (распространенная) цитомегалия обнаруживается у 5—15 %, локализованная — у 10–30 % по отношению к общему числу обследованных. В зависимости от путей передачи воротами инфекции могут служить слизистые оболочки верхних отделов дыхательного тракта, органов пищеварения и половых органов. Каких-либо изменений на месте ворот инфекции не отмечается. Не сказывается характер инфицирования и на клинических проявлениях болезни. Вирус имеет тропизм (сродство) к ткани слюнных желез и при локализованных формах обнаруживается только в этих железах. Вирус персистирует в организме пожизненно. В ответ на первичное внедрение развивается иммунная перестройка организма. Переход скрытой цитомегаловирусной инфекции в клинически выраженные формы обычно вызывается какими-либо провоцирующими факторами — параллельно текущими заболеваниями, назначением цитостатиков и других иммунодепрессантов. В последние годы особенно актуальной стала проблема обострения цитомегаловирусной инфекции у ВИЧ-инфицированных лиц. У беременных со скрытой цитомегаловирусной инфекцией плод поражается далеко не всегда. Необходимым условием для этого является обострение у матери скрытой инфекции с развитием вирусемии (проникновение вируса в кровь) с последующим заражением плода. Вероятность заражения плода будет значительно выше при инфицировании матери во время беременности (см.). Во время фазы вирусемии при отсутствии антител у матери (а следовательно, и у плода) передача инфекции плоду осуществляется значительно легче, чем в иммунном организме ранее инфицированной матери.
Клиническая картина Инкубационный период неизвестен, так как чаще цитомегаловирусная инфекция протекает в скрытой форме, а клинически выраженные формы болезни возникают после воздействия провоцирующего фактора. Общепринятой классификации цитомегалии не существует, но считается целесообразным выделять следующие клинические формы цитомегаловирусной инфекции. A. Приобретенная цитомегалия: — скрытая (локализованная) форма; — острая мононуклеозная форма; — генерализованная форма цитомегалии. Б. Врожденная цитомегалия: — острая форма; — хроническая цитомегалия. B. Цитомегалия у ВИЧ-инфицированных и других лиц с ослабленным иммунитетом.
Приобретенная цитомегалия О широком распространении скрытой цитомегаловирусной инфекции говорит факт наличия антител у здоровых лиц. Например, у доноров их обнаруживали у 63–68 % к общему числу обследованных. Скрытая цитомегаловирусная инфекция продолжается пожизненно и клинически не проявляется, однако под влиянием каких-либо причин активизируется и переходит в манифестные (клинически выраженные) формы. Чаще наблюдается первично-скрытая цитомегаловирусная инфекция, но у части инфицированных развивается клинически выраженная острая фаза, по стихании которой процесс переходит во вторично-скрытую цитомегалию. Острая форма приобретенной цитомегалии по своим клиническим проявлениям несколько напоминает инфекционный мононуклеоз (см.), но с отрицательными реакциями гетерогемагглютинации (реакции Пауля-Буннеля, Ловрика, Гоффа и Бауэра, Ли-Давидсона). Эта форма может развиться после переливания крови или у сексуально активных молодых людей. Длительность инкубационного периода довольно велика (от 20 до 60 дней). Заболевание длится от 2 до 6 недель. Болезнь проявляется в повышении температуры тела и появлении признаков общей интоксикации. Температурная кривая неправильная, нередко отмечаются ознобы, слабость, головная боль, боли в мышцах. Возможно увеличение селезенки. При исследовании периферической крови отмечается относительный лимфоцитоз, количество атипичных мононуклеаров составляет более 10 %. Количество лейкоцитов может быть нормальным, пониженным, реже — несколько повышенным. В отличие от инфекционного мононуклеоза (см.) отсутствуют тонзиллит (см.), а также генерализованная лимфаденопатия. Генерализованные формы цитомегалии протекают тяжело и обычно возникают на фоне какого-либо другого заболевания, резко снижающего иммуногенез (новообразования, лейкемия). Нередко в этих случаях, кроме основного заболевания и генерализованной цитомегалии, обнаруживается септическая бактериальная инфекция. Все это затрудняет четкое отграничение симптоматики, характерной только для цитомегалии. Можно отметить общую интоксикацию, лихорадку, увеличение печени, лимфаденопатию. Типично появление своеобразной вяло текущей пневмонии (см.), причем в мокроте удается обнаружить характерные для цитомегалии клетки. Генерализованные формы приобретенной цитомегалии встречаются редко.
Врожденная цитомегалия Характер поражения плода, как и при других инфекционных болезнях, зависит от сроков инфицирования. При инфицировании плода на ранних сроках беременности возможны гибель плода и самопроизвольные аборты (см.). При инфицировании в первые 3 месяца беременности (см.) возможно тератогенное (с появлением пороков развития) действие цитомегаловируса. При инфицировании в более поздние сроки у ребенка может быть врожденная цитомегалия, не сопровождающаяся пороками развития. Безусловно врожденным заболеванием цитомегалию можно рассматривать при выявлении симптомов болезни с первых дней жизни ребенка, тогда как выявление признаков болезни в более поздние сроки можно считать приобретенной цитомегалией. Заражение новорожденных происходит во время родов; 40–60 % новорожденных заражаются через грудное молоко серопозитивных матерей. Может наступить заражение и после переливания крови новорожденным. В этих случаях симптомы болезни проявляются не сразу: у детей постепенно развиваются анемия (см.) и лимфоцитоз, увеличивается печень, дети становятся склонными к интерстициальным пневмониям (см.) и плохо прибавляют в весе.
Врожденная цитомегалия. Дефект развития
Врожденная цитомегалия. Гидроцефалия
Для врожденной цитомегалии характерны желтуха (см.), увеличение печени и селезенки, тромбогеморрагический синдром (нарушения свертывающей и противосвертывающей систем крови с развитием в конечном итоге угрожающих жизни кровотечений), уменьшение числа тромбоцитов, прогрессирующая анемия (см.), увеличение числа ретикулоцитов (молодых эритроцитов, что свидетельствует о повышенном кроветворении в результате кровопотери). С первых дней жизни отмечаются желтушное окрашивание кожных покровов, геморрагические элементы сыпи на коже. Могут быть кровоизлияния в слизистые оболочки, кровавая рвота, примесь крови в стуле, кровотечения из пупка. Редко встречаются кровоизлияния в мозг и другие органы. Значительно снижается число тромбоцитов (до 50 г/л). Отмечается увеличение печени и особенно селезенки, которое сохраняется иногда в течение года, тогда как геморрагический синдром и тромбоцитопения исчезают через 2–3 недели. Интенсивность желтухи (см.) нарастает в течение первых 2 недель и затем медленно (иногда волнообразно) снижается на протяжении 2–6 месяцев. Помимо желтухи и увеличения печени, отмечается повышение активности сывороточных ферментов, а в образцах ткани печени можно обнаружить характерные цитомегалические клетки. При врожденной цитомегалии часто развивается энцефалит (см.) (при приобретенной цитомегаловирусной инфекции у более старших детей энцефалит почти не встречается). Очаги энцефалита чаще располагаются в околососудистых зонах больших полушарий. Здесь могут возникать участки омертвения с последующим образованием кальцинатов (отложений солей кальция). Последствием внутриутробного энцефалита могут быть микроцефалия (см.), гидроцефалия (см.) и др. Изменения центральной нервной системы часто сочетаются с поражением глаз (хориоретиниты, катаракта (см.), атрофия зрительного нерва). Очень часто при врожденной цитомегалии наблюдаются пневмонии (см.) и поражения почек, значительно реже поражается сердечно-сосудистая система. Важно отметить, что врожденная цитомегаловирусная инфекция всегда имеет генерализованный характер, хотя при ней обязательно поражаются и слюнные железы. Приобретенная цитомегалия может быть локализованной, с изолированным поражением слюнных желез.
Цитомегалия у ВИЧ-инфицированных и других лиц с ослабленным иммунитетом Цитомегаловирусная инфекция является важным патогенетическим (связанным с механизмом развития болезни) фактором у больных СПИДом. Некоторые рассматривают цитомегаловирусную инфекцию в качестве постоянного спутника синдрома приобретенного иммунодефицита, который часто приводит к генерализации цитомегалии, что и является причиной гибели больного. Цитомегаловирусная инфекция у лиц с иммунодефицитами начинается с продолжительной лихорадки, недомогания, анорексии (отсутствия аппетита), ночных потов, болей в мышцах и в суставах. Развиваются тромбоцитопения и лейкопения, появляются атипичные мононуклеары, нарушаются функции печени. Постоянно поражаются органы дыхания, что проявляется одышкой и кислородной недостаточностью, больных беспокоит сухой кашель (см.). Рентгенологически выявляются интерстициальные (реже — инфильтративные) изменения, обычно двусторонние, локализующиеся преимущественно в нижних долях легких. Однако этиологическую (причинную) роль цитомегаловирусов можно выявить только путем исследования образцов ткани легких. Сходные изменения могут наблюдаться при поражении легких другими вирусами, пневмоцистами, а также грибами (аспергиллез и др.). У ослабленных лиц цитомегаловирус вызывает поражение желудочно-кишечного тракта. Могут развиться язвы пищевода, желудка, кишечника (толстого и тонкого). Язвы могут приводить к кровотечениям, при их перфорации развивается перитонит (см.). Нередко развивается цитомегаловирусный гепатит (см.). У больных СПИДом цитомегаловирусная инфекция часто приводит к развитию хронического энцефалита (см.) или появлению подострой энцефалопатии. Нарастает апатия, которая через несколько недель или месяцев переходит в слабоумие. Вирус цитомегалии может обусловливать развитие ретинита (см.), который приводит к слепоте больных СПИДом, а также лиц, перенесших операцию по пересадке органов. На сетчатой оболочке появляются участки омертвения, которые постепенно расширяются. Поражения глаз необходимо дифференцировать со сходными изменениями, которые наблюдаются при токсоплазмозе (см.), кандидозе (см.) и герпетической инфекции (см.). Цитомегаловирусная инфекция является важным патогенетическим фактором, осложняющим операции по пересадке органов. При пересадке почек, сердца, печени цитомегаловирус вызывает лихорадку, лейкопению, гепатит (см.), пневмонию (см.), колит (см.), ретинит (см.). Чаще всего это происходит в течение 1–4 месяцев после операции. Следует отметить, что при первичном инфицировании осложнение протекает более тяжело, чем при активизации скрытой цитомегаловирусной инфекции. Тяжесть течения и клинические проявления зависят и от выраженности иммунодепрессии (подавления иммунитета), и от используемых иммунодепрессантных препаратов. Цитомегаловирусная пневмония (см.) развивается примерно у 20 % больных, перенесших операцию по пересадке костного мозга. Смертность в этой группе составляет 88 %. Максимальный риск развития болезни наблюдается с 5-й по 13-ю неделю после пересадки. Более тяжело цитомегалия протекает у лиц пожилого возраста. У лиц, перенесших пересадку почки, цитомегаловирусная инфекция может обусловить дисфункцию трансплантата (пересаженного органа).
Диагностика и дифдиагностика Клиническая диагностика врожденной цитомегалии представляет большие трудности. Сходную клиническую картину могут обусловить многие болезни, в частности гемолитическая болезнь, врожденный токсоплазмоз (см.), листериоз (см.), сифилис (см.), сепсис (см.) и др. Диагноз может быть подтвержден выделением вируса из клинического материала или четырехкратным повышением количества антител. Для выделения вируса используют культуры фибробластов эмбриона и некоторые культуры клеток человека. Для выявления антител применяют реакцию связывания комплемента, реакцию прямой гемагглютинации, реакцию иммунофлюоресценции, а также твердофазный иммуноферментный анализ. Однократное обнаружение даже высокого количества антител не может служить доказательством из-за широкого распространения скрытой инфекции. Для ранней диагностики цитомегалии у новорожденных можно определять наличие антител, связанных с иммуноглобулинами класс M.
Лечение и профилактика Этиотропного (направленного на устранение причины болезни) лечения не существует. Противогерпетические препараты (ацикловир, видарабин), успешно применяемые при других болезнях, при цитомегалии оказались неэффективными. Имеются данные, что препарат цимивин оказывает некоторый эффект при цитомегаловирусной инфекции, однако требуется дальнейшее его изучение, тем более что он вызывает побочные реакции (гранулоцитопению и др.). При приобретенной цитомегаловирусной инфекции беременных основной задачей является предупреждение распространения инфекции и внутриутробного заражения плода. С этой целью проводят десенсибилизацию и общеукрепляющую терапию. Рекомендуется также введение нормального человеческого иммуноглобулина, содержащего специфические антитела. Его вводят внутримышечно по 6—12 мл с интервалом 2–3 недели в течение первых 3 месяцев беременности. При пересадке почки профилактический эффект оказывало введение альфа-интерферона. Специфическая профилактика не разработана. При переливании крови новорожденным, а также лицам с ослабленным иммунитетом следует использовать кровь от доноров, у которых отсутствуют антитела против цитомегаловирусов. Мероприятия в очаге не проводятся.
♦ Ч ♦
ЧЕРЕПНО-МОЗГОВАЯ ТРАВМА
ОпределениеЧерепно-мозговая травма — это совокупность разнообразных видов механического повреждения мозга и костей черепа.Выделяют два основных вида травмы — открытую и закрытую.
Этиология и патогенез Механизм развития черепно-мозговой травмы включает в себя сочетание функциональных и структурных изменений, обусловленных механическим воздействием на череп и головной мозг. Механизм травмы складывается из прямого удара с местным повреждением черепа и мозга и противоудара. При противоударе возникает ушиб головного мозга о костные внутричерепные образования вследствие его смещения в полости черепа в сторону, противоположную месту приложения травмирующей силы. В результате возникают разрывы кровеносных сосудов и повреждения различных участков головного мозга. Значительная роль отводится гидравлическому удару, который связан с перемещением цереброспинальной жидкости в желудочках головного мозга и ликворопроводящих путях.
Клиническая картина Выделяют следующие основные клинические формы закрытой черепно-мозговой травмы: — сотрясение мозга; — ушиб мозга легкой степени; — ушиб мозга средней степени; — ушиб мозга тяжелой степени; — диффузное аксональное повреждение мозга; — сдавление мозга. Сотрясение мозга — преимущественно функциональная, обратимая и легкая форма черепно-мозговой травмы. Характерными ее признаками являются кратковременная потеря сознания и быстро проходящая неврологическая симптоматика. Ушиб головного мозга средней степени характеризуется выключением сознания длительностью от нескольких десятков минут до 6 ч после травмы. Выражены ретроградная амнезия (потеря памяти на события, предшествовавшие травме) и головная боль. Может наблюдаться многократная рвота. Встречаются нарушения психики. Возможны преходящие расстройства жизненно важных функций: брадикардия (см.) (частота сердечных сокращений менее 60 ударов в минуту) или тахикардия (см.) (частота сердечных сокращений более 80 ударов в минуту), повышение артериального давления, тахипноэ (число дыхательных движений более 20 в минуту) без нарушения ритма дыхания, повышение температуры тела до 38 °C. Часто выражены симптомы раздражения мозговых оболочек. Наблюдаются стволовые симптомы: нистагм (подергивания глазного яблока при взгляде вверх, вниз или в сторону), диссоциация менингеальных симптомов, мышечного тонуса и сухожильных рефлексов по оси тела, двусторонние патологические знаки. Отчетливо проявляется очаговая симптоматика (определяемая локализацией ушиба мозга): зрачковые и глазодвигательные нарушения, парезы (см.) конечностей, расстройства чувствительности, речи и др. Эти знаки постепенно (в течение 3–5 недель) сглаживаются, но могут держаться и длительно. Давление цереброспинальной (спинномозговой) жидкости чаще повышено. Нередко наблюдаются переломы костей свода и основания черепа, отмечается значительное субарахноидальное (под паутинную оболочку мозга) кровоизлияние. Ушиб головного мозга тяжелой степени характеризуется выключением сознания продолжительностью более 6 ч после травмы. Часто выражено двигательное возбуждение. Наблюдаются тяжелые угрожающие нарушения жизненно важных функций: замедленное или учащенное сердцебиение; артериальная гипертензия (см.); расстройства частоты и ритма дыхания, которые могут сопровождаться нарушениями проходимости верхних дыхательных путей. Отмечается высокая температура. Часто преобладает стволовая неврологическая симптоматика (плавающие движения глазных яблок, парез взора, тонический множественный нистагм, нарушения глотания, двусторонний мидриаз или миоз, дивергенция глаз по горизонтальной или вертикальной оси, меняющийся мышечный тонус, децеребрационная ригидность, угнетение, или ирритация, сухожильных рефлексов и рефлексов со слизистых и кожных покровов, двусторонние патологические стопные рефлексы и др.), которая в первые часы и дни после травмы затушевывает очаговые полушарные симптомы. Иногда отмечаются генерализованные судорожные припадки. Общемозговые и в особенности очаговые симптомы пропадают медленно; часты грубые остаточные явления, прежде всего со стороны двигательной и психической сферы. Обычно имеют место переломы свода и основания черепа, массивные внутричерепные кровоизлияния. Диффузное аксональное повреждение головного мозга — сравнительно недавно описанный вид черепно-мозговой травмы. В основе его лежит натяжение и разрыв аксонов (длинных отростков нервных клеток) в белом веществе полушарий и ствола мозга. Данный вид травмы характеризуется длительным многосуточным коматозным состоянием с момента травмы. При этом выражены следующие симптомы: парез рефлекторного взора вверх, разностояние глаз по вертикальной или горизонтальной оси, двустороннее угнетение или выпадение реакции зрачков на свет. Часто наблюдаются грубые нарушения частоты и ритма дыхания. При этом чрезвычайно разнообразны изменения мышечного тонуса, преимущественно в виде диффузной гипотонии. Нередко обнаруживаются пирамидно-экстрапирамидные параличи (см.) конечностей, характерны асимметричные парезы (см.). Ярко выступают вегетативные расстройства: артериальная гипертензия, высокая температура, гипергидроз (потливость), гиперсаливация (повышенное слюноотделение). Отличительной особенностью клинического течения диффузного аксонального повреждения является переход из длительной комы (см.) в стойкое вегетативное состояние, о наступлении которого свидетельствует спонтанное открывание глаз или в ответ на различные раздражения, но при этом нет признаков слежения, фиксации взора или выполнения хотя бы элементарных инструкций. Вегетативное состояние длится от нескольких суток до нескольких месяцев и отличается появлением нового класса неврологических признаков — симптомов функционального или анатомического разобщения больших полушарий и ствола мозга. Сдавление головного мозга характеризуется жизненно опасным нарастанием через различный промежуток времени после травмы или непосредственно после нее общемозговых симптомов. Сдавление мозга характеризуется объемным скоплением жидкой или свернувшейся крови, спинномозговой жидкости или воздуха под оболочками. Это вызывает местное и общее сдавление вещества со смещением срединных структур мозга, деформацией и сжатием желудочков, ущемлением ствола. Сдавление головы — особый вид травмы, возникающий в результате последовательного воздействия динамической (кратковременной) или статической (длительной) механической нагрузки. Он характеризуется повреждениями мягких покровов головы, черепа и мозга. Более точным является термин «длительное сдавление головы» (минуты, часы, сутки) в отличие от менее значимого кратковременного сдавления головы (секунды). Длительное сдавление головы встречается у пострадавших вследствие землетрясений, взрывов и обвалов в шахтах и рудниках. Для адекватной и однозначной оценки клинических форм черепно-мозговых травм необходимо правильно квалифицировать нарушения сознания. Выделяют 4 градации состояния сознания. 1. Ясное сознание с сохранением всех психических функций, полной ориентацией в месте и времени и адекватными реакциями. 2. Оглушение — угнетение сознания при сохранности ограниченного словесного контакта на фоне повышения порога восприятия внешних раздражителей и снижения собственной психической и двигательной активности. 3. Сопор — глубокое угнетение сознания, которое проявляется сонливостью с сохранением координированных защитных реакций на боль, открыванием глаз на резкий звук или боль, сохранностью жизненных функций или умеренным их изменением по одному из параметров. 4. Кома (см.) характеризуется выключением сознания с полной утратой восприятия окружающего мира и самого себя. Открытая черепно-мозговая травма включает в себя ранения мягких тканей черепа с повреждением соединительнотканного апоневроза (оболочки мышечного волокна), не проникающие и проникающие ранения. При данном виде травмы часто наблюдаются переломы костей черепа, что создает опасность инфицирования мозга. Клиника открытого повреждения зависит от характера повреждения головного мозга и стволовых структур. Вместе с разрушением кожи, костей и оболочек имеет значение сотрясение и сдавление мозга. Острый период длится до 3 суток и проявляется развитием сопора или комы (см.), а также нарушениями со стороны сердца и легких. Период ранних реакций характеризуется отеком мозга (см.), в основном вокруг раны. Постепенно восстанавливается сознание, но нарастают параличи рук и ног, нарушаются речь и слух. В этот период наиболее часто происходит развитие менингита (см.) или энцефалита (см.). Через 4 недели начинается период ликвидации ранних осложнений. К 4 месяцам рана заживает, и образуется рубец, не вызывающий последствий. Отдаленные последствия травмы — это развитие эпилептических припадков (см. Эпилепсия) и гидроцефалии (водянки мозга).
Диагностика Объективная оценка тяжести состояния пострадавшего при поступлении является необходимым и важнейшим этапом диагностики клинической формы черепно-мозговой травмы. Оценка тяжести состояния в остром периоде может быть полной лишь при использовании не менее чем трех слагаемых: состояния сознания, витальных (жизненных) функций, очаговых неврологических симптомов. Степень нарушения сознания и прогноз оцениваются по шкале комы Глазго. Регистрацию тяжести нарушения сознания в течение первых суток после травмы следует проводить каждые 2 ч. Черепно-мозговую травму считают тяжелой, если начальная оценка по шкале комы Глазго составляет 8 и менее баллов, среднетяжелой — при оценке 9—12 баллов, легкой — при оценке 13–15 баллов.
Лечение При ушибах легкой степени и сотрясениях головного мозга необходимы охранительный режим, назначение успокоительных средств и холод на голову. При более тяжелых травмах обязателен контроль за внутричерепным давлением. При его повышении показана дегидратационная терапия: осмотические (маннитол или мочевина) и петлевые (лазикс) диуретики. Если регистрируется снижение давления, проводится адекватная инфузионная терапия — изотонический раствор хлорида натрия и глюкоза. При сдавлении экстренно выполняется операция — трепанация черепа. Запоздалое вмешательство не позволяет предотвратить необратимые поражения мозга. При открытой травме без промедления проводится первичная хирургическая обработка раны на фоне реанимационной терапии и поддержания жизненно важных функций.
ЧЕСОТКА
ОпределениеЧесотка — заразное паразитарное заболевание кожи, вызываемое чесоточным клещом.
Этиология и патогенез Чесотку вызывает чесоточный клещ. Самка клеща крупнее самца (соответственно 0,4–0,45 и 0,2 мм в длину, 0,25—0,35 и 0,14—0,19 мм в ширину) и по внешнему виду напоминает черепаху. При рассмотрении невооруженным глазом паразит имеет вид булавочной головки белого или светлосерого цвета. После оплодотворения, которое происходит на поверхности кожи человека, самец погибает, а самка внедряется в поверхностные слои эпидермиса, прокладывая в них ходы. Роговой слой кожи самка пробуравливает крепкими хитиновыми челюстями. Вне кожи самка погибает в течение нескольких дней. За 5–9 недель жизни самка откладывает в чесоточном ходе до 70 яиц. Половозрелые клещи развиваются из яиц в течение 3–7 недель. Экспериментально подсчитано, что за 3 месяца из яиц, отложенных одной самкой, рождается около 150 млн клещей.
Чесоточные клещи
Заболевание несколько чаще встречается в осенне-зимний период, хотя больных регистрируют в течение всего года. Инкубационный период длится от 7—10 дней до 1 месяца и более. Заражение происходит при непосредственном контакте с больным, при пользовании его постельным или нательным бельем, нахождении в одной постели. Среди детей инфекция может передаваться через игрушки, если ими предварительно пользовался больной ребенок. Крайне редко встречается особая форма болезни — так называемая норвежская чесотка (некоторые авторы считают ее запущенной формой обычной чесотки), которая была впервые описана в Норвегии в 1884 г. Даниэльсеном. Эта форма возникает при ослаблении организма (у болеющих лепрой (см.), ВИЧ-инфицированных, больных хроническими вирусными гепатитами (см.), сирингомиелией (поражение спинного мозга с образованием в нем полостей) и подобными заболеваниями), у лиц умственно отсталых.
Клиническая картина На месте проникновения клеща в кожу появляется маленький пузырек. Однако главным симптомом чесотки является сильный зуд (см.), особенно резко выраженный вечером и ночью, начинающийся после того как больной ложится в постель. Кроме характерного зуда, который часто является первым и порой единственным признаком заболевания, отмечают появление парных и рассеянных точечных узелково-пузырьковых высыпаний, чесоточных ходов (штрихообразные пунктирные линии сероватого цвета), ссадин от расчесов кожи. Излюбленной локализацией чесоточного клеща являются межпальцевые складки кистей, боковые поверхности пальцев рук, сгибательная поверхность лучезапястных суставов, разгибательная поверхность предплечий и локтевого сустава, переднебоковые поверхности туловища, область передних стенок подмышечных впадин и молочных желез (окружность соска), живот (особенно в области пупочного кольца), ягодицы, бедра, голени и область полового члена. Иногда на разгибательной поверхности локтевых суставов можно обнаружить сухие корки и чешуйки (симптом Горчакова-Арди), которые покрывают папуловезикулезные элементы. Чесоточные ходы особенно часто можно обнаружить в области лучезапястных суставов и в межпальцевых складках рук. Их длина составляет от 2–3 мм до 0,5 см. Если рассматривать чесоточный ход в лупу, то видно, что он состоит из близко расположенных черных точек-отверстий, которые прорывает клещ для выхода в дальнейшем на поверхность молодых клещей и для обеспечения доступа воздуха. На месте пузырьков образуются кровянистые корочки величиной с булавочную головку. Указанные выше места излюбленной локализации чесотки объясняются тем, что чесоточный клещ предпочитает располагаться на участках с тонким роговым слоем. У маленьких детей отмечают несколько иную локализацию чесотки: она поражает внутренние края стоп, подошвы, ладони, ягодицы, лицо и кожу головы. Сильный зуд (см.), сопровождающий чесотку, приводит к расчесам, куда больные нередко заносят пиококковую инфекцию, вследствие чего чесотка осложняется фолликулитами (см.), фурункулами (см.), лимфаденитом (см.), лимфангитом, импетиго (см.), экземой (см.) и др.
Чесотка. Поражение кожи
Чесотка. Поражение кожи в области живота
Чесотка
Последнее обстоятельство нередко изменяет клиническую картину чесотки и значительно затрудняет диагностику (установлению правильного диагноза помогают характер зуда и локализация процесса). При распространенной и осложненной чесотке обнаруживают наличие эозинофилов в крови и иногда альбуминурию в моче. Чесотка может осложниться и микробной экземой (см.) (у женщин — преимущественно в окружности сосков, у мужчин — на внутренней поверхности бедер). В этих случаях очаги поражения имеют резкие границы, иногда мокнут, покрыты большим количеством гнойничков и корок. В последнее время чаще стали наблюдаться стертые формы чесотки, при которых отсутствуют характерные высыпания (в частности, чесоточные ходы), но имеется сильный зуд. Эта форма чесотки наблюдается у чистоплотных людей или при неправильном лечении. При тщательном осмотре больных и в этих случаях удается обнаружить единичные, парно расположенные папуловезикулы, узелки, мельчайшие пузырьки, уртикоподобные элементы. Чесоточный ход находится в основном в роговом слое. Только его слепой конец достигает мальпигиева слоя (росткового слоя эпидермиса) или проникает в него. В этом участке хода и располагается самка клеща. В мальпигиевом слое развивается внутриклеточный и межклеточный отек, за счет которого образуется небольшой пузырек. В дерме имеется хроническое воспалительное образование, состоящее в основном из лимфоцитов. Оно расположено под чесоточным ходом. При норвежской чесотке кожа в очагах поражения сухая, покрыта толстыми темнозеленого цвета корками, местами напоминающими сплошной панцирь, который ограничивает движения и делает их болезненными. Ногти резко утолщены. Волосы на участках поражения имеют сухой и тусклый вид. Отмечается общее увеличение лимфатических узлов. От больного исходит неприятный запах. Учитывая выраженность клинической симптоматики чесотки, следует отметить при этом незначительность зуда (см.) или его отсутствие. При насильственном удалении корок обнажается покрасневшая кожа, на которой невооруженным глазом можно видеть массу белых точек — чесоточных клещей, которые в большом количестве находятся в чешуйках и корках. Иногда возникают массовые поражения людей пузатым клещом, вызывающим так называемую зерновую чесотку, проявляющуюся небольшими узелками, волдырями и сильным зудом. Этот клещ живет на злаках и зернах и попадает к человеку при погрузке зерна, работе в зерновых складах, спанье на соломе, зараженной клещом. Клещи лошадей, крыс, кур, голубей, попадая на кожу человека, могут наносить укусы (образуются узелки и волдыри), вызывать сильный зуд, но не проникают в эпидермис (верхний слой кожи) и не образуют чесоточных ходов. Этих клещей можно обнаружить в помещении и на белье. Для лечения применяют спиртовые растворы и болтушки. Необходимо проводить дезинсекцию белья и помещения, уничтожение крыс, лечение больных лошадей и т. д. Укусы клопов и блох вызывают образование на коже зудящих уртикарных элементов. В центре укуса блохи образуется характерное центральное кровоизлияние, окруженное красным пятном или волдырем величиной с чечевицу. Кожные проявления специального лечения не требуют. Следует принять меры к уничтожению клопов (дезинфицирующими веществами и растворами) и блох (дезинсекция серными окуриваниями, соблюдение чистоты в помещениях). Личинки лошадиного овода, попадая в кожу человека, вызывают заболевание, носящее название Larva migra. Вначале возникает зудящее пятно, от которого по пути следования личинки образуется петлеобразно извивающаяся красная нить, слегка приподнятая над уровнем кожи, шириной 1–2 мм. За сутки личинка перемещается на 15 см и больше. Гвинейский червь, в среднеазиатских республиках называемый риштой, развивается в подкожной клетчатке преимущественно стоп и голеней, где образуется опухоль. Кожа над опухолью гангренизируется и прорывается, образуя язву, на дне которой и находится паразит.
Укусы блох
Диагностика и дифдиагностика Чесотку иногда можно смешать с почесухой, при которой больных также беспокоит зуд (см.). Однако в последнем случае зуд бывает днем и ночью, болезнь иногда длится годами, характеризуется серым цветом кожи, белым дермографизмом, наличием узелков, часто покрытых кровянистыми корочками, расположенными преимущественно на разгибательных поверхностях конечностей, увеличением лимфатических узлов. Диагностике способствуют: парное расположение папуловезикул на излюбленных для чесотки участках кожи, наличие чесоточных ходов, усиление зуда по ночам, появление зудящих высыпаний у нескольких членов семьи, наличие симптома Горчакова-Арди. Иногда установить диагноз помогает наличие так называемого «признака треугольника»: в области крестца чесоточные высыпания располагаются треугольником, вершина которого направлена в сторону межъягодичной складки. На этом участке, кроме обычных высыпаний, имеются импетигинозные элементы и пигментация с последующим образованием атрофических пятен. При трудностях клинической диагностики чесотки проводят лабораторное исследование с целью обнаружения чесоточного клеща. Его можно извлечь из чесоточного хода иглой. Эффективен метод тонких срезов лезвием безопасной бритвы пузырьков или чесоточных ходов вместе с содержимым. Срезы обрабатывают раствором 20 %-ной едкой щелочи, накрывают покровным стеклом и микроскопируют сухой системой (малое увеличение). В препарате обнаруживаются клещи либо продукты их жизнедеятельности — яйца и экскременты в виде кучек черных точек.
Лечение Применяют средства, которые разрыхляют роговой слой и, проникая в чесоточные ходы, уничтожают клещей. Выбор противопаразитарных средств весьма обширен. Однако эффект терапии часто определяется не характером средства, а правильностью его применения и тщательностью лечения. Перед втиранием противочесоточного средства больному целесообразно принять горячий душ, который способствует механическому удалению с поверхности кожи клещей и разрыхлению рогового слоя. При наличии пиодермии (см.) или экзематозного процесса до начала лечения душ не назначают. Мытье также запрещают во время лечения. Противочесоточные средства втирают в кожу туловища и конечностей, особенно тщательно — в места излюбленной локализации чесоточного клеща. Втирание не производят в кожу головы. Кроме того, при наличии экзематизации или импетигинизации антипаразитарные средства также не втирают, а смазывают ими пораженные участки. Одновременно проводится лечение осложнений. В последнее время появился французский препарат спрегаль в удобной аэрозольной упаковке. Проводится однократная обработка тела пациента. Другой — американский — препарат аракс кроме уничтожения возбудителя чесотки обладает противозудным действием. Из старых методов эффективно втирание в кожу раствора бензилбензоата (бензиловый эфир бензойной кислоты). Используют для взрослых 20 %-ную водно-мыльную эмульсию бензилбензоата, а для маленьких детей — 10 %-ную. Приготовление 20 %-ной эмульсии: в 780 мл теплой кипяченой воды растворяют 20 г измельченного зеленого или другого мыла и добавляют 200 мл бензил-бензоата. Водно-мыльная эмульсия бензилбензоата сохраняет активность в течение 7 дней после приготовления. Эмульсию втирают по 10 мин 2 раза (с 10-минутным перерывом). После этого больной надевает обеззараженную одежду и меняет постельное белье. На другой день втирание повторяют. Через 3 дня производят мытье в бане или под душем и смену белья. Для лечения детей, как указывалось выше, готовят 10 %-ную мыльно-водную эмульсию бензилбензоата или в течение 3 дней применяют 10 %-ную бензилбензоатную мазь, приготовленную на эмульсионной основе. В условиях Крайнего Севера бензилбензоат целесообразно готовить на вазелиновом масле в 10- или 20 %-ной концентрации. Лечение чесотки по методу Демьяновича проводят 60 %-ным раствором натрия тиосульфата (раствор № 1) и 6 %-ным раствором концентрированной или 18 %-ным раствором разбавленной хлористоводородной кислоты (раствор № 2). Вначале дважды в течение 10 мин втирают в каждый участок кожи раствор № 1 (с 10-минутным интервалом), а затем втирают раствор № 2 (по 5 мин с 5-минутным интервалом). Раствор натрия тиосульфата наливают в тарелку и втирают в кожу рукой, смачивая ее раствором. Раствор хлористоводородной кислоты наливают в пригоршню непосредственно из бутылки. После этой процедуры больной надевает чистое белье; постельное белье также меняют. На следующий день лечение повторяют. Мыться разрешается через 2 дня после окончания лечения. Детям натрия тиосульфат назначают в 40 %-ной концентрации, раствор концентрированной хлористоводородной кислоты — в 4 %-ной, а разбавленной — в 12 %-ной. Можно втирать 20–33 %-ную серную мазь (детям — 10 %-ную) или мазь Вилькинсона (по 15 % серы и дегтя, 10 % мела и по 30 % зеленого мыла и вазелина). У детей применяют мазь Вилькинсона пополам с цинковой пастой. Эти мази втирают в кожу 1 раз в день в течение 5 дней. На 6-й день производят мытье в бане или под душем и только после этого меняют нательное и постельное белье. Применение серной мази и мази Вилькинсона ограничено из-за загрязнения белья и возможности развития лекарственного дерматита, который ликвидируют после отмены мази и назначения цинковой болтушки или пасты. Мазь Вилькинсона может обусловить раздражение почечной ткани (нефропатия), поэтому ее нельзя назначать лицам, страдающим заболеванием почек. Для лечения чесотки можно использовать и свежеприготовленную 5 %-ную эмульсию мыла, которую втирают в течение 5 дней (ежедневно), а через 2 дня после окончания лечения назначают ванну или душ. В случае неудачи противочесоточную терапию повторяют через 3–5 дней. Детям, склонным к экссудативному диатезу (см.), а также во избежание развития дерматита (см.) и для профилактики закрепления зуда (по механизму условного патологического рефлекса) рекомендуют во время лечения чесотки назначать десенсибилизирующие и антигистаминные препараты — кальция глюконат, диазолин, супрастин и др. Такое же лечение проводят лицам, у которых чесотка осложняется аллергическим дерматитом (см.). При присоединении к чесотке пиодермии (см.) назначают антибиотики, сульфаниламиды, наружно — серно-дегтярные и борнодегтярные мази, анилиновые красители, 2 %-ный салициловый спирт.
Профилактика На всех выявленных больных чесоткой заполняют специальное извещение. Главным условием успешной борьбы с чесоткой является одновременное лечение всех больных в очаге поражения. Для выявления больных производят осмотр на чесотку в семье или в детских коллективах, если больным является ребенок. Своевременное обнаружение больных, изоляция их от коллектива и лечение — важные условия в профилактике распространения заболевания. При неблагоприятной эпидемиологической обстановке для лечения больных чесоткой и проведения дезинсекционных мероприятий создают специальные учреждения — скабиозории. Важное значение имеет тщательная дезинсекция (опыление инсектицидами, обработка мылом) нательного и постельного белья или дезинфекция их в сухожаровой или влажной камере. Белье больных можно также стирать с кипячением и последующим проглаживанием горячим утюгом. Верхнюю одежду обезвреживают в камере или опыляют инсектицидами.
ЧУМА
ОпределениеЧума — острое инфекционное заболевание из группы карантинных инфекций, проявляющееся тяжелой интоксикацией, поражением кожи, лимфатических узлов, легких и других органов, относится к особо опасным инфекциям, является трансмиссивным зоонозом.Заболевание отличается высокой смертностью, склонностью к рецидивам и частым возникновением осложнений, связанных с присоединением вторичной инфекции и побочным действием антибиотиков.
Этиология, эпидемиология и патогенез Возбудителем чумы является неподвижная бактерия, имеющая вид палочки со вздутой центральной частью. Палочка — факультативный анаэроб (может выживать в бескислородной среде), спор не образует. В природных условиях микроб размножается в R-форме, обладающей большой способностью к заражению. Оптимальная температура роста 29 °C. При температуре 36–38 °C чумной микроб образует капсулу. Передается от грызунов к человеку через переносчика (переносчиком являются блохи) или воздушнокапельным путем (от человека к человеку). Возбудитель чумы имеет сложный набор ферментов. Антигенная структура чумного микроба также сложна. Большую известность получили основной соматический антиген, липополисахарид, мышиный токсин и фракция I — видовой специфический капсульный антиген, играющий важную диагностическую роль. Штаммы чумного микроба, выделенные от грызунов и блох во время интенсивной эпизоотии (эпидемии среди животных) и от больных людей, обладают высокой способностью к заражению. Для заражения восприимчивых организмов бывает достаточно единичных клеток возбудителя. Чумной микроб болезнетворен для многих видов свободноживущих грызунов, зайцеобразных, верблюдов и хищных млекопитающих — ласок, хорьков, кошек, лисиц, некоторых видов обезьян, а также лабораторных животных — морских свинок и белых мышей. Возбудитель чумы очень чувствителен к действию высокой температуры и высушиванию. При температуре 50 °C он гибнет в течение 30–40 мин, при 70 °C — в течение 10 мин, при кипячении — за 1 мин. Прямой солнечный свет убивает микробов в течение 2–3 ч. Низкие температуры микроб переносит хорошо. Плохо выдерживает конкуренцию посторонней микрофлоры. Дезинфицирующие растворы (5 %-ная карболовая кислота, 3–5 %-ный лизол, 1–2 %-ный хлорамин) убивают микроб за 1–5 мин. Возбудители чумы, попав в организм блохи с кровью больного животного, размножаются в пищеварительном тракте и закупоривают просвет преджелудка у насекомого. При укусе блоха отрыгивает бактерии, и возбудители попадают в лимфатические сосуды кожи, а оттуда — в регионарные лимфатические узлы. Последние уплотняются и значительно увеличиваются, образуя так называемые бубоны. При тяжелой форме бубонной чумы лимфатические узлы утрачивают барьерную функцию, а размножившиеся в них возбудители проникают в общий кровоток. Первичная форма легочной чумы обусловлена воздушным заражением от больного человека, но может развиться и при несчастных случаях во время лабораторных исследований. Капли, содержащие огромное число возбудителей заболевания, попадают в легкие, где возбудитель размножается, вызывая пневмонию (см.) и септицемию (проникновение инфекции в кровь), обычно приводящие к смертельному исходу уже в течение первых суток. Реакция тканей на внедрение чумной палочки проявляется их гнойным расплавлением. Очаги омертвения обнаруживаются в лимфатических узлах, селезенке и печени.
Клиническая картина Инкубационный период при чуме колеблется от 3 до 6 суток, как правило, не превышая 3 суток. При отдельных формах заболевания он бывает еще короче. Заболевание чумой, как правило, начинается остро, без продромального периода, с озноба и быстрого повышения температуры тела до 39–40 °C. Повышение температуры сопровождается сильными головными болями, иногда рвотой, покраснением лица и конъюнктив, мышечными болями, нарастающим чувством разбитости. Язык обложен белым налетом, губы сухие. Кожа у больных горячая, сухая, но иногда на конечностях становится холодной и покрывается липким потом. В зависимости от способа заражения чума протекает в виде следующих форм: — преимущественно локальные формы — кожная, кожно-бубонная, бубонная; — генерализованные (распространенные) формы — первично-септическая, вторично-септическая, первично-легочная, вторично-легочная, кишечная.
Кожная форма Кожная форма наблюдается при проникновении чумного микроба в организм через кожные покровы, при этом на месте его внедрения первичной реакции не возникает. Однако в 3–4 % случаев первичное поражение может проявляться в виде покраснения и некоторого уплотнения кожи — папулы. Покрасневший участок довольно болезнен. Очень скоро папула превращается в везикулу (пузырек), а затем в пустулу (гнойный пузырек). На этом развитие процесса может остановиться. Пустула подсыхает, краснота спадает, и все явления затихают. Но чаще воспалительный процесс продолжает прогрессировать, в него вовлекаются окружающие ткани, в результате чего образуется очень болезненный карбункул (см.), который при чуме обычно переходит в язву. Заживление язвы происходит крайне медленно, а на ее месте образуется стойкий рубец. При дальнейшем развитии в процесс вовлекается регионарный лимфатический узел, а заболевание переходит в кожно-бубонную форму.
Кожно-бубонная форма Она возникает при проникновении возбудителя через кожу с наличием в ней четко выраженной местной реакции (первичного аффекта). Из места внедрения возбудитель с током лимфы заносится в регионарный лимфоузел, в котором очень быстро развивается воспалительная реакция, переходящая на окружающие ткани. Формирующийся первичный бубон резко болезнен, вместе с первичным аффектом он составляет первичный чумной комплекс. С момента развития бубона воспалительные явления со стороны кожи становятся менее значимыми, а на первый план выступают клинические симптомы бубонной чумы.
Бубонная форма Особенностью бубонной формы чумы является отсутствие видимых изменений на месте входных ворот чумного возбудителя, а реакция на его внедрение наблюдается в регионарных лимфоузлах. Наиболее частыми по локализации являются бедренные и паховые бубоны. Реже встречаются подмышечные и шейные бубоны. В течение первых двух дней наблюдается резкая болезненность на месте развивающегося бубона. Она отмечается не только при движении, но и в покое. В ранние сроки болезни при прощупывании на месте развивающегося бубона можно прощупать отдельные лимфатические узлы. Затем в воспалительный процесс вовлекается окружающая клетчатка и развивается периаденит. Бубон спаивается с окружающими тканями и теряет свою очерченность. Отсутствие четких контуров является важным диагностическим признаком чумного бубона. При прощупывании сформировавшегося бубона отмечается опухолевидное образование, мягкое по периферии и плотное в центральной части, где находятся пораженные лимфатические узлы. Кожа над бубоном натягивается, краснеет, а в центре приобретает синюшный оттенок. При доброкачественном протекании процесса фаза воспалительных явлений длится 6–8 дней. В этой фазе бубон увеличивается до размеров куриного яйца и более. Следует заметить, что чем доброкачественнее течение болезни, тем больше бывает бубон. При тяжелом течении заболевания бубон обычно не успевает развиться полностью, так как возбудитель чумы быстро преодолевает защитный барьер и током лимфы и крови разносится по организму. При благоприятном течении болезни в первичном бубоне наступает стадия разрешения. Последняя может заканчиваться рассасыванием, нагноением или склерозом бубона. При своевременно начатом лечении антибиотиками развитие бубона большей частью приостанавливается и происходит его рассасывание. Характерным симптомом чумы, имеющим диагностическое значение, является несоответствие температурной реакции и частоты пульса. Обычно пульс достигает 120–140 ударов в минуту и держится на этих цифрах длительное время. Даже в стадии выздоровления при нормальной температуре отмечается тахикардия (см.). Кровяное давление понижается. Клиническим признаком патологических изменений в сердце является приглушение тонов на верхушке с преимущественным ослаблением первого тона. Границы сердца в основном не изменены. В зависимости от тяжести заболевания в прошлом смертность при бубонной форме колебалась от 30 до 100 %, в настоящее время при лечении антибиотиками больные погибают крайне редко.
Первично-септическая форма При первично-септической чуме возбудитель проникает в организм человека через кожу или слизистые оболочки. Возникновение этой формы у людей связывают с высокой способностью к заражению чумного микроба, массивной заражающей дозой или малой сопротивляемостью организма. При этих условиях возбудитель легко проходит все физиологические барьеры и, не вызывая заметных изменений в тканях, быстро проникает в кровь. Заболевание начинается внезапным подъемом температуры. Появляется одышка, пульс частый, слабого наполнения. Отмечается бред (см.) или полное прекращение двигательной активности, переходящее в прострацию. Заболевание длится 2–4 дня и без лечения, как правило, заканчивается смертельным исходом. На коже у больных появляется геморрагическая сыпь (сопровождающаяся кровоизлияниями). Изредка встречается и так называемая молниеносная форма чумы, при которой больные погибают в течение одних суток. Прижизненный диагноз этой формы чумы весьма затруднителен из-за отсутствия характерных клинических признаков.
Легочная чума Легочная чума у людей развивается при воздушно-капельном механизме передачи инфекции. Входными воротами служат органы дыхания. Первичная реакция в организме заболевшего выражается развитием в легких очагов воспаления. При легочной форме различают две стадии болезни. Для первой стадии характерно преобладание общих симптомов, во время второй стадии резко выражены изменения со стороны легких. В течении болезни отмечаются период начального лихорадочного возбуждения, период разгара болезни и сопорозный (конечный) период с прогрессирующей одышкой и иногда комой (см.). В эпидемиологическом отношении наиболее опасен второй период, сопровождающийся интенсивным выделением микробов во внешнюю среду. Клиническая картина легочной чумы, особенно в начальный период болезни, может быть весьма многообразной. Начало болезни обычно бывает внезапным, без продромальных явлений. У больного появляются озноб, сильные головные боли, боли в пояснице и конечностях, слабость, часто отмечаются тошнота и рвота. Лицо становится одутловатым и красным. Температура быстро повышается до 39,5—40,5 °C. Больной беспокоен, жалуется на боли в груди. Пульс частый, иногда аритмичный. Указанные симптомы появляются в первые сутки заболевания. В разгар болезни у больных отмечаются учащенное дыхание и одышка, которые усиливаются с развитием заболевания. Больные жалуются на боли и чувство сжатия в груди, часто ощущают недостаток воздуха и испытывают чувство страха смерти, пытаются вставать и выходить из палаты. В агональном периоде у больных отмечаются поверхностное дыхание и резко выраженное сокращение двигательной активности. Частым симптомом чумной пневмонии (см.) является кашель (см.), обычно слабый, с выделением мокроты или без нее. Мокрота сначала может быть слизистой или слизистогнойной, но вскоре в ней появляются прожилки крови. В типичных случаях мокрота становится пенистой, ярко-красного цвета, приобретает жидкую консистенцию и выделяется в большом количестве. В начале заболевания в мазке из бронхиального смыва чумной микроб может не обнаруживаться или встречаться в небольших количествах. Первичная чумная пневмония (см.) не всегда протекает в типичной форме. Нередко мокрота у больных чумой напоминает таковую при крупозной пневмонии (см.), а ее выделение кратковременно. В редких случаях мокрота отсутствует. Иногда у больных отмечается обильное кровохарканье, что вызывает подозрение на туберкулез (см.). Изменения со стороны легких в начале болезни выражены слабо или совсем отсутствуют. Весьма скудны эти данные и в разгар болезни. Для клиники чумной пневмонии характерным является отсутствие объективных данных у больных, что находится в противоречии с их тяжелым общим состоянием. Даже при обширном и глубоком поражении легких у больных чумой притупления при простукивании часто не наблюдается или оно отмечается на небольших участках. Хрипы также большей частью не прослушиваются. Больные первичной легочной чумой, не подвергавшиеся лечению, погибают в течение 2–3 дней. Заболевание протекает бурно, с высокой контагиозностью и смертельным исходом в 100 % случаев.
Диагностика и дифдиагностика При подозрении на чуму нужно собрать подробный эпидемиологический анамнез (установить возможные пути заражения), обращая внимание на род занятий и образ жизни заболевшего, нахождение его в энзоотичном по чуме районе, общение с остролихорадящими больными, наличие заболеваний со смертельным исходом у родственников или соседей. Лабораторная диагностика основывается на выделении возбудителя чумы или определении антигена в исследуемом материале и обнаружении специфических антител в сыворотке крови. Все исследования проводят в специальных лабораториях. Материалом для исследования служит содержимое бубона, везикул, пустул, карбункулов, отделяемое язв, мокрота и слизь из носоглотки (при легочной форме), кровь при всех формах болезни, кал при наличии диареи (см.). В крови выявляется увеличение количества нейтрофильных лейкоцитов, в период выздоровления могут иметь место снижение их количества и увеличение количества лимфоцитов, снижение количества гемоглобина и эритроцитов. В моче выявляют следы белка, эритроцитов и цилиндров. Для бактериоскопического исследования из выделений больного готовят мазки. Наличие клинических и эпидемиологических данных, обнаружение грамотрицательных овоидных биполярно окрашенных палочек позволяют заподозрить чуму. Окончательный диагноз ставят на основании выделения и идентификации культуры. Чуму следует отличать от некоторых инфекционных болезней, имеющих сходную клинику: туляремии (см.), сибирской язвы (см.), туберкулеза (см.), сыпного тифа (см.), различных пневмоний (см.), лимфаденитов (см.) вульгарной этиологии. Кожные поражения при чуме напоминают таковые при сибирской язве. Однако для кожной формы сибирской язвы характерны преимущественные поражения на открытых частях тела, отсутствие болезненности язвы (карбункула), наличие вокруг язвы отечности и лимфангита, темный цвет струпа и высыпание новых элементов вокруг него. Общая реакция при сибирской язве менее выражена, чем при чуме. Температура у больных поднимается до высоких цифр. Чумные бубоны следует отличать от лимфаденитов (см.) различного происхождения и бубонов туляремийного происхождения. Следует учитывать более четкие контуры туляремийного бубона по сравнению с чумным, сравнительно меньшую болезненность и относительную редкость периаденита. Кроме того, для туляремии характерны более легкое течение и благоприятный исход болезни. Острые лимфадениты (см.) стафилококкового или стрептококкового происхождения могут походить на бубонную чуму острым началом, быстрым подъемом температуры, значительной болезненностью в области развивающегося аденита. Но в то же время при лимфаденитах на месте входных ворот обнаруживают ссадины, раны, порезы. Увеличенные узлы остаются подвижными и обычно не спаяны с окружающими тканями. Общее течение болезни доброкачественное. Наибольшую трудность для диагностики представляет легочная форма чумы, которую необходимо отличать в первую очередь от пневмоний (см.) (крупозной и гриппозной), туберкулеза (см.) и легочной формы сибирской язвы (см.). В типичных случаях мокрота при крупозной пневмонии имеет ржавый цвет, общее суточное количество ее значительно меньше, чем при чуме, и она более вязкая. Герпес (см.), отсутствующий при чуме, часто обнаруживается при крупозной пневмонии. При исследовании больных с крупозной пневмонией у них удается обнаружить значительно больше характерных симптомов. Легочная форма сибирской язвы может быть очень похожа на чумную пневмонию. Отличительными признаками являются катаральные изменения со стороны верхних дыхательных путей и более выраженные объективные данные в легких.
Лечение Лечение чумы должно быть комплексным. Из специфических препаратов для лечения чумы широкое применение нашли антибиотики. Наиболее эффективны антибиотики стрептомицинового ряда: стрептомицин, дигидрострептомицин, пасомицин. Стрептомицин часто заменяется мономицином,рифампицином, препаратами тетрациклинового ряда. Доза зависит от формы заболевания, тяжести течения и времени его начала. Стрептомицин при лечении бубонной формы чумы вводят в дозах 0,5–1 г 3 раза в сутки. Больным с легочной и септической формами антибиотики вводят первые 4–5 дней по 1 г 4 раза в сутки. С 5—6-го дня при улучшении состояния больного можно перейти на 3-разовое введение. При этом разовую дозу препарата можно снизить до 0,75 г. Помимо антибиотиков стрептомицинового ряда, применяют антибиотики тетрациклиновой группы и в первую очередь окситетрациклин, который вводят внутримышечно 6 раз в сутки по 0,2 г. Для лечения больных легочной и септической формами заболевания антибиотики тетрациклинового ряда применяют в сочетании со стрептомицином или мономицином. Курс лечения больных чумой колеблется от 7 до 10 дней. О выздоровлении больных судят по отсутствию клинических симптомов болезни и троекратному отрицательному результату бактериологического исследования пунктата из бубона или мокроты и крови, которое обычно производят на 2–4—6-й день после окончания лечения. При выраженной интоксикации больным вводят внутривенно 40 %-ный раствор глюкозы в количестве 20–40 мл или 500— 1000 мл 5 %-ного раствора глюкозы, физиологический раствор или растворы соды при выраженном ацидозе. Из других жидкостей показаны гемодез, полиглюкин, реополиглюкин. Хороший эффект дает применение сухой или нативной плазмы. Введение жидкости должно производиться под контролем диуреза и состава электролитов крови. В случае задержки в организме больного жидкости показано применение мочегонных средств. При нарушении деятельности сердечно-сосудистой системы больным назначают кордиамин, кофеин, камфору, эфедрин, адреналин. Для улучшения витаминного обеспечения организма назначают витамины — В1, В12, К, аскорбиновую кислоту в больших дозах. Больным чумой устанавливают строгий постельный режим и калорийную легкоусвояемую диету.
Профилактика В целях экстренной профилактики чумы назначают антибиотики лицам, бывшим в контакте с больными. Продолжительность курса профилактического лечения обычно равна 5 суткам. Стрептомицин вводят по 0,5 г 2 раза в сутки. При назначении мономицина его вводят внутримышечно по 0,5 г 2 раза в сутки. Экстренную профилактику можно проводить также антибиотиками тетрациклинового ряда самостоятельно и в комбинации с другими препаратами. Вакцина, приготовленная из убитых нагреванием возбудителей чумы, может создать иммунитет после троекратного введения с промежутком в 2 недели. В последующем для поддержания иммунитета каждые 2 года необходимо проводить ревакцинацию. Живая сухая противочумная вакцина вводится однократно и создает иммунитет длительностью до 6 месяцев. В особо неблагоприятных эпидемических условиях через 6 месяцев проводят повторную вакцинацию.
♦ Ш ♦
ШАНКР МЯГКИЙ
ОпределениеМягкий шанкр (шанкроид) — острое венерическое заболевание, передающееся половым путем и характеризующееся болезненными множественными язвами половых органов, а также воспалительным увеличением лимфатических узлов.
Этиология, эпидемиология ипатогенез Возбудителем мягкого шанкра является бактерия (стрептобактерия Дюкрея-Петерсена), которая представляет собой короткую тонкую палочку длиной 1,5–2 мкм и толщиной 0,4–0,5 мкм с несколько закругленными концами и перетяжкой в середине. Палочки располагаются одиночно или параллельно попарно, в виде характерных цепочек. Возбудитель шанкроида — аэроб, однако растет и при относительном недостатке кислорода. Палочки мягкого шанкра малоустойчивы к высокой температуре (при температуре выше 40 °C культура погибает), но низкие температуры переносят хорошо. В культуре 1 %-ный раствор фенола убивает возбудителя в течение 1 мин, а 0,25 %-ный раствор формалина — через 40 мин; 0,5 %-ный раствор хинозола губительно действует на возбудителя в течение нескольких минут. Заражение происходит, как правило, половым путем, в основном от лиц, занимающихся проституцией. Способствуют инфицированию повреждения кожного покрова или слизистых оболочек. Очень редко встречается внеполовой путь заражения. Шанкроид является кофактором передачи ВИЧ. Около 10 % больных с шанкроидом могут быть одновременно инфицированы возбудителем сифилиса (см.) и вирусом простого герпеса (см.).
Клиническая картина Инкубационный период шанкроида обычно составляет 3–5 дней, а в редких случаях может удлиняться до 7—10 дней. У женщин инкубационный период составляет 2–8 недель. В первые сутки после заражения на месте внедрения возбудителя появляется яркокрасное пятно, которое распространяется по периферии. На следующие сутки в центре его формируется пустула (гнойный пузырек), после вскрытия которой образуется очень болезненная язва, быстро увеличивающаяся в диаметре. На 4—5-й день от начала заболевания язва приобретает неправильную округлую форму, края ее подрыты и окружены отечным воспалительным венчиком. Через 2–3 недели развитие процесса прекращается. В неосложненных случаях заживление наступает через 1–2 месяца после заражения, процесс заканчивается рубцеванием. Стойкий иммунитет после перенесенного мягкого шанкра не развивается. Обычно язвы шанкроида локализуются на половых органах: у мужчин — на внутреннем листке и по краю крайней плоти, в венечной борозде и на уздечке полового члена; у женщин — на малых и больших половых губах и клиторе, реже — на коже лобка, внутренней поверхности бедер, вокруг прямой кишки. Описаны случаи шанкроида полости рта. Язвы имеют неровные подрытые края и глубокое изрытое дно, покрытое желтоватым налетом. Язвы окружены островоспалительным венчиком, но инфильтрация отсутствует, поэтому на ощупь язва представляется мягкой (отсюда и название «мягкий шанкр»). Величина их бывает от размеров булавочной головки до ладони и больше. Язвы имеют склонность к кровотечению, прикосновение к ним вызывает резкую боль. Отделяемое имеет гнойный или кровянисто-гнойный характер и содержит большое количество стрептобацилл. При попадании на окружающие ткани обильное отделяемое обусловливает один из важных признаков заболевания — аутоинфекцию (самозаражение). Вследствие этого, а также одновременного проникновения возбудителя на нескольких участках кожного покрова шанкроид становится множественным. По величине язва обычно не превышает размеров монеты достоинством в 1 рубль. Через 3–4 недели шанкроидная язва начинает очищаться, уменьшается гнойное отделяемое, дно покрывается грануляциями (соединительной тканью), и постепенно (через 1–2 месяца) наступает заживление с образованием рубца. Различают следующие формы шанкроида: — воронкообразный (глубокая язва расположена в шейке головки полового члена); — гангренозный, который характеризуется гангренозным расплавлением тканей на головке полового члена в связи с присоединением фузоспириллеза или анаэробной инфекции; — дифтероидный (язвы покрыты зеленовато-серым фибринозным налетом, обусловленным присоединившимся заражением ложнодифтерийной палочкой); — импетигинозный, клинически сходный с импетиго; — серпингинозный (язва заживает рубцом с одного края и увеличивается с другого); — фолликулярный, когда возникают множественные маленькие язвы со слегка приподнятыми краями и глубоким дном, что обусловлено проникновением возбудителя в протоки сальных желез или в волосяные фолликулы; — смешанный при одновременном заражении сифилисом (см.) и мягким шанкром. Наиболее частыми осложнениями шанкроида являются воспаление лимфатических сосудов (лимфангит и лимфаденит), а также фимоз (см.) и парафимоз (см.). Лимфангит наблюдается на спинке полового члена и на наружной поверхности половых губ. Проявляется в виде уплотненного болезненного тяжа. Кожа над утолщенной поверхностью гиперемирована и отечна, прощупывание болезненно. Наиболее типичным признаком шанкроида является регионарный лимфаденит (бубон), появляющийся через 2–3 недели после заражения. Лимфаденит характеризуется остро возникающим односторонним увеличением одного или нескольких лимфатических узлов, спаянных вследствие развития периаденита между собой и кожей. Над пораженными лимфатическими узлами кожа ярко-красного цвета. Постепенно воспалительные явления стихают, а бубон рассасывается, либо в его центре появляется флюктуация и он вскрывается. Из полости бубона выделяется большое количество густого гноя с примесью крови, а образующаяся язва впоследствии рубцуется. Рубец формируется через 3–4 недели. Когда имеется отек крайней плоти, может развиться фимоз (см.). При этом головку полового члена обнажить не удается, а скапливающийся под крайней плотью гной выделяется через узкое препуциальное отверстие. В гнойном отделяемом обнаруживают возбудителей мягкого шанкра.
Диагностика и дифдиагностика Возбудитель шанкроида можно обнаружить при окрашивании по Романовскому-Гимзе. В препаратах видны мелкие палочки, расположенные в виде «стаи рыб» между лейкоцитами. Современная диагностика мягкого шанкра осуществляется с помощью полимеразной цепной реакции. Шанкроид следует отличать от твердого шанкра (сифилис), простого герпеса (см.), эрозивного и гангренозного баланопостита (см.) или вульвита (см.), дифтерии (см.) половых органов, туберкулезных язв, шанкриформной пиодермии (см.), абсцедирующего пахового лимфаденита (см.), кожно-язвенной формы туляремии (см.), трихомонадных язв. Наиболее затруднена диагностика с первичным периодом сифилиса (см.). Необходимы многократные исследования (10–15 раз) отделяемого язв на бледную трепонему, взятие крови на реакцию Вассермана каждые 5–7 дней, постановка реакции иммунофлюоресценции и привлечение к обследованию всех половых контактов больных за последние 3–6 месяцев. Возможно одновременное заражение мягким шанкром и сифилисом. У больных смешанным (мягким и твердым) шанкром значительно реже выявляется палочка шанкроида. В соскобе из-под края язвы наблюдается картина шанкроида, через 3–4 недели появляются уплотнение дна язвы и регионарный склераденит. Мягкий шанкр задерживает развитие сифилитической инфекции, удлиняет инкубационный период и отдаляет появление вторичных сифилид. Первичная инфекция половых путей вирусом простого герпеса (см.), как и при шанкроиде, вызывает болезненную паховую аденопатию. Вирусная инфекция может быть распознана по особенностям начала заболевания (везикулярные очаги на гиперемированном фоне) или по наличию в анамнезе данных о возможном заражении вирусом герпеса, а также по наличию системных симптомов, таких как лихорадка и мышечные боли. Шанкроид системных симптомов, как правило, не вызывает.
Лечение Сульфаниламиды и препараты тетрациклинового ряда считаются активными при лечении шанкроида, но в ряде случаев лечение оказывается неэффективным вследствие множественной лекарственной устойчивости возбудителя. Первоначальную терапию рекомендуют начинать с сульфаниламидных препаратов, чтобы избежать маскировки сифилиса: котримоксазол (2 таблетки утром и вечером в течение 12–14 дней); бисептол (2 таблетки 2 раза в день в течение 12–14 дней). Применяя при шанкроиде антибиотики, следует учитывать их трепонемоцидное действие. При этом предпочтение отдают препаратам, которые не оказывают действия на бледную трепонему. С этой точки зрения целесообразно лечение аминогликозидами (гентамицин, канамицин, сизомицин, амикацин и др.): канамицин (внутримышечно по 500 тыс. ЕД 2 раза в сутки, на курс — 10–15 млн ЕД); мономицин (внутримышечно по 500 тыс. ЕД 2 раза в день, на курс — до 10 млн ЕД). Доказана высокая эффективность применения при шанкроиде нескольких лекарственных препаратов, применяемых в один прием одновременно: 640 мг триметоприма, 3200 мг сульфаметоксазола, 2 г спектиномицина внутримышечно и 250 мг цефтриаксона внутримышечно. При появлении устойчивых к антибиотикам форм стрептобацилл достаточно принять азитромицин однократно (1 г). Ципрофлоксацин противопоказан беременным и кормящим женщинам, а также лицам моложе 14 лет. Азитромицин и цефтриаксон обладают преимуществом, так как их можно применять однократно. Пациенты должны быть повторно обследованы через 3–7 дней после начала терапии. При успешном лечении состояние язв улучшается симптоматически в течение 3 дней и объективно — в течение 7 дней после начала терапии. Время, необходимое для полного излечения, зависит от размера язвы. Для заживления большой язвы может потребоваться более 2 недель лечения. Кроме того, процесс заживления проходит медленнее у некоторых мужчин, не подвергшихся обрезанию, у которых язва располагается под крайней плотью. Для клинического разрешения флюктуирующих лимфатических узлов требуется больше времени, чем для заживления язвы, и даже при успешном лечении может потребоваться дренирование. Разрез и дренирование бубонов может быть более предпочтительным методом, чем отсасывание содержимого с помощью шприца.
Профилактика Профилактика шанкроида проводится с учетом общих принципов предупреждения заражения болезнями, передаваемыми половым путем. Необходимо наблюдение за больными после окончания лечения в течение 3—12 месяцев с ежемесячным проведением клинико-серологического контроля. Лица, имевшие половые контакты с больным шанкроидом в течение 10 дней до проявления у этих пациентов клинической картины, должны быть обследованы и пролечены, даже при отсутствии симптомов заболевания.
ШЕРЕШЕВСКОГО-ТЕРНЕРА СИНДРОМ
ОпределениеШерешевского-Тернера синдром — хромосомная болезнь, сопровождающаяся характерными аномалиями физического развития, низкорослостью и половым инфантилизмом.Впервые эта болезнь как наследственная была описана в 1925 г. Н. А. Шерешевским, который считал, что она обусловлена недоразвитием половых желез и передней доли гипофиза и сочетается с врожденными пороками внутреннего развития. В 1938 г. Г. Тернер выделил характерную для этого симптомокомплекса триаду симптомов: половой инфантилизм, кожные крыловидные складки на боковых поверхностях шеи и деформацию локтевых суставов. В нашей стране этот синдром принято называть синдромом Шерешевского-Тернера.
Этиология, патогенез и патанатомия Четкой связи возникновения синдрома Тернера с возрастом и какими-либо заболеваниями родителей не выявлено. Однако беременности (см.) обычно осложняются токсикозом (см. Гестозы), угрозой выкидыша, а роды часто бывают преждевременными и патологическими. Особенности беременностей и родов (см.), заканчивающихся рождением ребенка с синдромом Тернера, — следствие хромосомной патологии плода. Нарушение формирования половых желез при синдроме Тернера обусловлено отсутствием или структурными дефектами одной половой хромосомы (Х-хромосомы). У эмбриона первичные герминативные (половые) клетки закладываются почти в нормальном количестве, но во второй половине беременности происходит их быстрая инволюция (обратное развитие), и к моменту рождения ребенка количество фолликулов в яичнике по сравнению с нормой резко уменьшено или они полностью отсутствуют. Это приводит к выраженной недостаточности женских половых гормонов, половому недоразвитию, у большинства больных — к первичной аменорее (отсутствию менструаций) и бесплодию (см.). Возникшие хромосомные нарушения являются причиной возникновения пороков развития (см.). Возможно также, что сопутствующие аутосомные мутации играют определенную роль в появлении пороков развития (см.), поскольку существуют состояния, сходные с синдромом Тернера, но без видимой хромосомной патологии и полового недоразвития. При синдроме Тернера половые железы обычно представляют собой недифференцированные соединительнотканные тяжи, не содержащие элементов гонад. Реже встречаются рудименты яичников и элементы яичек, а также рудименты семявыносящего протока. Другие патологические данные соответствуют особенностям клинических проявлений. Наиболее важны изменения костно-суставной системы — укорочение пястных и плюсневых костей, аплазия (отсутствие) фаланг пальцев, деформация лучезапястного сустава, остеопороз (см.) позвонков. Рентгенологически при синдроме Тернера турецкое седло и кости свода черепа обычно не изменены. Отмечаются пороки развития (см.) сердца и крупных сосудов (коарктация аорты (см.), незаращение боталлова протока, межжелудочковой перегородки, сужение устья аорты), пороки развития почек. Проявляются рецессивные гены дальтонизма (см.) и других заболеваний.
Клиническая картина и диагностика Отставание больных с синдромом Тернера в физическом развитии заметно уже с рождения. Примерно у 15 % больных задержка наблюдается в период полового созревания. Для доношенных новорожденных характерна малая длина (42–48 см) и масса тела (2500–2800 г и менее). Характерными признаками синдрома Тернера при рождении являются избыток кожи на шее и другие пороки развития (см.), особенно костно-суставной и сердечно-сосудистой систем, «лицо сфинкса», лимфостаз (застой лимфы, клинически проявляющийся крупными отеками). Для новорожденного характерны общее беспокойство, нарушение сосательного рефлекса, срыгивание фонтаном, рвота (см.). В раннем возрасте у части больных отмечают задержку психического и речевого развития, что свидетельствует о патологии развития нервной системы. Наиболее характерным признаком является низкорослость. Рост больных не превышает 135–145 см, масса тела часто избыточна. У больных с синдромом Тернера патологические признаки по частоте встречаемости распределяются следующим образом: низкорослость (98 %), общая диспластичность (неправильное телосложение) (92 %), бочкообразная грудная клетка (75 %), укорочение шеи (63 %), низкий рост волос на шее (57 %), высокое «готическое» нёбо (56 %), крыловидные складки кожи в области шеи (46 %), деформация ушных раковин (46 %), укорочение метакарпальных и метатарзальных костей и аплазия фаланг (46 %), деформация локтевых суставов (36 %), множественные пигментные родинки (35 %), лимфостаз (24 %), пороки сердца и крупных сосудов (22 %), повышенное артериальное давление (17 %). Половое недоразвитие при синдроме Тернера отличается определенным своеобразием. Нередкими признаками являются геродермия (патологическая атрофия кожи, напоминающая старческую) и мошонкообразный вид больших половых губ, высокая промежность, недоразвитие малых половых губ, девственной плевы и клитора, воронкообразный вход во влагалище. Молочные железы у большинства больных не развиты, соски низко расположены. Вторичное оволосение появляется спонтанно и бывает скудным. Матка недоразвита. Половые железы не развиты и представлены обычно соединительной тканью. Соматические проявления синдрома Тернера у мужчин такие же, как у женщин, однако проявления гипогонадизма (полового недоразвития) обычно отсутствуют. При синдроме Тернера отмечается склонность к повышению артериального давления у лиц молодого возраста и к ожирению (см.) с нарушением питания тканей. Интеллект у большинства больных с синдромом Тернера практически сохранен, однако частота олигофрении (см.) все же выше. В психическом статусе больных с синдромом Тернера главную роль играет своеобразный психический инфантилизм с эйфорией при хорошей практической приспособляемости и социальной адаптации. Диагноз синдрома Тернера основывается на характерных клинических особенностях, определении полового хроматина (вещества клеточного ядра) и исследовании кариотипа (хромосомного набора). Дифференциальный диагноз проводится с нанизмом (карликовостью), для исключения которого проводится определение содержания гормонов гипофиза в крови, особенно гонадотропинов.
Лечение На первом этапе терапия заключается в стимуляции роста тела анаболическими стероидами и другими анаболическими препаратами. Лечение следует проводить минимальными эффективными дозами анаболических стероидов с перерывами при регулярном гинекологическом контроле. Главным видом терапии больных является эстрогенизация (назначение женских половых гормонов), которую следует проводить с 14–16 лет. Лечение приводит к феминизации телосложения, развитию женских вторичных половых признаков, улучшает трофику (питание) половых путей, уменьшает повышенную активность гипоталамо-гипофизарной системы. Лечение следует проводить в течение всего детородного возраста больных. При синдроме Тернера у мужчин применяется заместительная терапия мужскими половыми гормонами. Прогноз для жизни при синдроме Тернера благоприятный, исключение составляют больные с тяжелыми врожденными пороками сердца (см.) и крупных сосудов и ренальной (почечной) гипертензией. Лечение женскими половыми гормонами делает больных способными к семейной жизни, однако абсолютное большинство из них остаются бесплодными.
ШИЗОФРЕНИЯ
ОпределениеШизофрения — это эндогенное психическое заболевание, характеризующееся постепенно нарастающими изменениями личности (аутизм — погружение в мир личных переживаний с потерей контакта с действительностью), эмоциональное обеднение, появление странностей и чудачеств) и различными психопатологическими симптомами.
Этиология и патогенез Существует множество различных теорий возникновения шизофрении. До недавнего времени наиболее распространенной была теория наследственного происхождения болезни. Между тем многочисленные исследования показали, что наследственная отягощенность в семьях больных шизофренией не выше, чем в семьях здоровых людей. Не переоценивая роли наследственности в возникновении шизофрении, следует все-таки признать, что она создает благоприятную почву для развития этого заболевания. У больных шизофренией обнаруживается немало болезнетворных факторов, которые опосредованно понижают сопротивляемость тканей головного мозга у потомства. Неблагоприятные условия жизни, перенапряжение корковых процессов с последующим изменением ферментативного обмена в ткани мозга у будущих родителей могут наследоваться потомками, снижая защитные способности их организма и тем самым создавая у них предрасположенность к возникновению болезни. Некоторые ученые придерживаются инфекционной теории возникновения заболевания, другие считают шизофрению вирусным заболеванием. Наибольшее признание получила теория аутоинтоксикации (самоотравления), согласно которой шизофрения развивается на основе типологических и онтогенетических (приобретенных в процессе внутриутробного развития) особенностей под влиянием неблагоприятных условий окружающей среды. Ее возникновение обусловливается интоксикацией организма вследствие попадания в него недоокисленных или нерасщепленных продуктов белкового обмена (фенолкрезолов, аммиака и др.), которые угнетают или блокируют окислительно-ферментативные процессы в ткани мозга, вследствие чего последний недостаточно усваивает кислород. Возникающее при этом кислородное голодание является причиной нейродинамических и морфологических изменений в центральной нервной системе. Ряд шизофренических симптомов является следствием именно запредельного торможения в коре головного мозга, фазовых состояний и высвобождения подкорковых структур из-под контроля коры. Но механизм возникновения шизофренического процесса не исчерпывается только запредельным торможением — механизмы возникновения этого процесса еще недостаточно изучены.
Клиническая картина Отличительные признаки шизофренических расстройств — нарушения мышления, восприятия, эмоций и двигательных функций. Нарушения мышления, столь свойственные шизофрении, описывались многократно. При шизофрении мыслительные процессы утрачивают нормальные ассоциативные связи, и больной часто не способен сосредоточиться на решении какой-либо задачи. С одной стороны, посторонние мысли препятствуют концентрации внимания, ведут к расплывчатости мышления и часто образуют поток сугубо личностного и эксцентричного мыслительного материала — источника множества необычных, даже странных мыслей. С другой стороны, у некоторых больных возникают трудности в порождении мыслей вообще, и они жалуются, что их разум пуст и непродуктивен. Существуют и другие варианты нарушений мышления, когда вторгаются мысли, препятствующие нормальному ходу мыслительной активности или полностью блокирующие его. На содержание мышления влияет также характерный для шизофрении феномен бреда (см.). Бред — это совокупность идей и суждений, не соответствующих действительности, полностью овладевающих сознанием больного и не поддающихся коррекции извне в результате разубеждения или разъяснения. Например, страдающий бредом преследования может быть убежден в том, что за ним шпионят, что его дом начинен прослушивающими устройствами, что полиция, ЦРУ или ФБР следят за ним. Разумеется, для оценки таких убеждений важно знать реальную жизненную ситуацию больного, ибо есть люди, которые действительно находятся под таким наблюдением. Однако многие бредовые сюжеты настолько противоестественны, что повседневного опыта достаточно, чтобы развести их с реальностью. Примером служит бредовое убеждение человека в том, что он был перенесен через космос на другую планету, где высшие существа наделили его чудесной силой и озарением. Помимо распространенного бреда преследования, существуют и другие виды шизофренического бреда. В их числе — бред утраты контроля за мыслями и движениями, когда больной убежден, что его мысли и движения контролируются внешними силами, например по проводам, с помощью электроники, телепатии или гипноза. При шизофрении часто возникают нарушения процессов восприятия. Наиболее распространены слуховые галлюцинации (см.) — восприятие несуществующих звуков. Некоторые пациенты слышат голоса почти постоянно, другие — только эпизодически. Голоса могут быть доступны для понимания или нет, но, как правило, они понятны пациенту и повторяют его мысли, комментируют их или же его действия, спорят, угрожают, ругают, проклинают. Некоторые авторитетные специалисты рассматривают непрерывные слуховые галлюцинации как диагностический признак шизофрении, если нет доказанного заболевания мозга или хронической наркомании. Возможны также зрительные или тактильные (осязательные) галлюцинации, хотя они значительно менее распространены. Как правило, галлюцинации сочетаются с другими симптомами и часто включены в бредовые убеждения. Например, галлюцинаторные голоса могут восприниматься как часть электронной подслушивающей системы. Значительно более характерно для шизофрении изменение аффектов (эмоций). Такие изменения включают отсутствие эмоциональной реакции на ситуацию, ранее ее пробуждавшую, либо выражение эмоции, которая не соответствует ни ситуации, ни собственным мыслям больного. В результате у одних больных постоянно «замороженное» или «одеревенелое» лицо, другие же могут смеяться или улыбаться, присутствуя при трагическом событии. Возможны также двигательные нарушения, хотя они менее распространены, чем описанные выше симптомы. Могут быть затронуты двигательные проявления всех видов — поза, походка, жесты, мимика. Движения могут быть неловкими, жесткими, судорожными, неестественными; в течение длительного времени сохраняются позы, кажущиеся неудобными. Такие двигательные аномалии особенно характерны для кататонической формы шизофрении. Существует несколько клинических форм шизофрении. Наиболее распространена параноидная форма, которая характеризуется преимущественно бредом (см.) преследования. Хотя другие симптомы — нарушения мышления и галлюцинации (см.) — тоже присутствуют, бред преследования больше всего бросается в глаза. Обычно ему сопутствует подозрительность и враждебность. Характерен также постоянный страх, порождаемый бредовыми идеями. Бред преследования может присутствовать годами и в значительной мере развиваться. Как правило, у больных параноидной шизофренией не возникает ни заметных изменений в поведении, ни интеллектуальной и социальной деградации, которые отмечаются у больных другими формами. Поведение больного может казаться вполне нормальным, пока не затронуты его бредовые представления. Гебефреническая форма шизофрении отличается от параноидной как по симптоматике, так и по исходу. Преобладающими симптомами служат заметные мыслительные трудности и аффективные расстройства. Мышление может быть настолько дезорганизовано, что утрачивается (или почти утрачивается) способность к осмысленному общению; аффект в большинстве случаев неадекватен, настроение не соответствует содержанию мышления, так что в результате грустные мысли могут сопровождаться веселым настроением. В долгосрочной перспективе большинство этих больных ожидает выраженное расстройство социального поведения, проявляющееся, например, склонностью к конфликтам и неспособностью сохранить работу, семью и близкие человеческие отношения. Эта форма имеет злокачественное течение. Кататоническая шизофрения характеризуется в первую очередь аномалиями в двигательной сфере, присутствующими почти на всем протяжении болезни. Аномальные движения бывают самыми разнообразными; это могут быть нарушения позы и выражения лица или выполнение практически любых движений странным, неестественным образом. Больной может часами находиться в нелепой и неудобной манерной позе, чередуя ее с необычными действиями вроде повторяющихся стереотипных движений или жестов. Выражение лица у многих больных застывшее, мимика отсутствует или очень бедна; возможны какие-то гримасы типа поджимания губ. Кажущиеся нормальными движения иногда внезапно и необъяснимо прерываются, порой сменяясь странным двигательным поведением. Наряду с выраженными моторными аномалиями отмечаются и многие другие симптомы шизофрении — бред и прочие нарушения мышления, галлюцинации и т. д. Течение кататонической формы шизофрении сходно с гебефренической, однако тяжелая социальная деградация, как правило, развивается в более поздний период болезни. Эта форма лучше других поддается лечению. Простая форма шизофрении начинается в любом возрасте, но чаще встречается в детские и (реже) юношеские годы. Ведущими признаками болезни являются прогрессирующая утрата интересов, нарастающая вялость, эмоциональное безразличие, замкнутость и снижение показателей, связанных с интеллектом. Эпизодически возникают галлюцинации и параноидное состояние, сопровождающиеся злобной агрессивностью по отношению к родным и близким людям, которые обычно настойчиво требуют, чтобы ребенок посещал школу. Больные уходят из дома, проводят время в бесцельных скитаниях по улицам, совершают антиобщественные поступки. Близкие начинают отмечать болезненное состояние только тогда, когда оно достигает значительного развития, проявляясь аффективной (эмоциональной) тупостью, немотивированным упрямством и нелепыми рассуждениями. Течение заболевания может быть различным, но чем моложе возраст, в котором начался шизофренический процесс, тем более значительный интеллектуальный ущерб будет нанесен. В лучшем случае больной приспосабливается к несложным трудовым процессам, пользуясь репутацией неполноценного. В большинстве случаев болезнь прогрессирует, приводя к оскудению психики и апатическому слабоумию. В настоящее время встречается редко. Из международной классификации эта форма исключена в связи с недостаточностью объективных критериев диагностики. Привитая форма шизофрении наблюдается у детей и подростков, которые в прошлом перенесли какое-либо органическое поражение головного мозга, вызвавшее задержку в психическом развитии, преимущественно олигофрению (см.). До начала заболевания для личности ребенка характерны были следующие особенности: капризное упрямство, замкнутость, взрывы раздражительности, перенесенные заболевания невыясненной этиологии, диатез (см.), интоксикации, черепномозговые травмы (см.) и т. д. Таким образом, шизофрения прививается уже на биологически измененную почву, что значительно усложняет течение патологического процесса и приводит, особенно при возникновении заболевания в раннем детском возрасте, к остановке в умственном развитии. Диагноз шизофрении может быть поставлен только в случае когда выполнены следующие условия: — наличие перечисленных симптомов: бред, галлюцинации, расстройство мышления, кататоническое поведение, негативные симптомы); — симптомы наблюдаются более одного месяца; — значительные изменения поведения по сравнению с периодом, предшествующим психотическому расстройству. Из методов диагностики информативными являются выявление расширения боковых и III желудочков мозга и атрофические изменения при ядерно-магнитном резонансном обследовании (ЯМР).
Лечение Учитывая разнообразие проявлений болезни, диагноз шизофрении может поставить только врач-психиатр. Своевременная постановка диагноза необходима для правильного и успешного лечения и создания больному щадящих условий труда и быта. Несмотря на то что причина болезни неизвестна, шизофрения поддается лечению. Современная психиатрия располагает широким выбором лечебных методов (медикаментозных, психотерапевтических, трудотерапевтических), позволяющих воздействовать на шизофрению. Сочетание этих методов с системой мер по восстановлению трудоспособности и способности к активной жизни в коллективе дает возможность добиться длительного отсутствия проявлений болезни. Больные шизофренией вне обострений сохраняют трудоспособность, могут жить в семье, находясь под регулярным наблюдением психиатра. О состоянии больного, возможности амбулаторного лечения или необходимости госпитализации и сроках пребывания в больнице может судить только врач. Оценка состояния больного как им самим, так и его родственниками часто ошибочна. Распространены предрассудки в оценке происхождения шизофрении, особенно начавшейся в молодом возрасте. Ее причинами считают половое воздержание и избыточные умственные занятия. Попытки устранить действие этих причин чреваты тяжелыми последствиями для больного и его близких. Самолечение и «домашние средства» часто ведут к обострению процесса. При уклонении от лечения несоответствие поведения ситуации, вероятность импульсивных поступков и действий под влиянием галлюцинаторных переживаний или бредовых убеждений учащаются, а степень опасности больного для самого себя и окружающих увеличивается. В настоящее время имеются большие возможности для лечения больных шизофренией. Большой арсенал психотропных средств с широким спектром действия позволяет проводить дифференцированную терапию с учетом особенностей проявления заболеваний. При выраженных психотических расстройствах с преобладанием бредовых и галлюцинаторных переживаний, состояния возбуждения применяются такие нейролептики, как тиопроперазин, галоперидол и т. д.; с преобладанием кататонических расстройств — этаперазин, френолон и др. Следует остановиться на лечении острых состояний шизофрении, протекающих с повышенной температурой тела, т. е. фебрильных приступов. Для лечения больных с фебрильными приступами применяют аминазин в высоких дозах. Другие нейролептики не рекомендуются. Некоторые больные плохо переносят аминазин; в этих случаях целесообразно вместе с этим препаратом назначать внутривенно сибазон. При неэффективности указанных мер при дальнейшем повышении температуры тела и признаках нарастания отека мозга (см.) необходимо переходить к электросудорожной терапии. В тех случаях, когда в картине заболевания преобладают негативные расстройства, рекомендуется применять нейролептические препараты со стимулирующим действием. Больным с депрессивными и депрессивно-параноидными явлениями следует назначать антидепрессанты. При сложных психопатологических синдромах возможна комбинация препаратов, включающая различные нейролептики, антидепрессанты и другие средства. Хорошие результаты наблюдаются также при применении таких традиционных методов, как инсулино-шоковая и (в крайних случаях) электросудорожная терапия. Инсулино-шоковая терапия показана больным с острыми проявлениями шизофренического процесса и соматически (физически) ослабленным, электросудорожная — больным, устойчивым к терапии другими методами и с хроническими депрессивными состояниями. Важная роль в возвращении больных шизофренией к полноценной жизни отводится социально-трудовой реабилитации. В общей системе организации психиатрической помощи предусмотрены различные формы лечебно-трудового и социального воздействия на больных шизофренией. Среди больных шизофренией около 50 % не имеют инвалидности и работают в условиях обычных предприятий. Остальные преимущественно являются инвалидами II, реже — I и III групп. Больные, имеющие III группу инвалидности, работают в специализированных цехах, а больные II группы — в лечебно-трудовых мастерских при психоневрологических диспансерах. Подбор видов труда для больного проводится врачом-психиатром с учетом его психического состояния и прежней профессиональной подготовки. При невозможности заниматься прежней работой больной может пройти профессиональное обучение и овладеть новой специальностью.
ШИСТОСОМАТОЗЫ
ОпределениеЭто подгруппа трематодозов (гельминтозы, вызываемые плоскими червями класса трематод) с преимущественным поражением мочеполовой системы, склонных к затяжному течению. Включает следующие виды тропических гельминтозов: мочеполовой, кишечный и японский. В нашей стране зарегистрированы случаи мочеполового и кишечного шистосоматозов.
Этиология и эпидемиология Возбудители заболевания относятся к группе плоских червей, классу трематод. Шистосомы являются единственными раздельнополыми представителями этого класса, которые могут вызывать заболевание у человека. Длина самцов колеблется от 4 до 22 мм, ширина — около 1 мм, самки вырастают до 25 мм с шириной до 0,3 мм; на брюшке у самца имеется желобок, или гинекоморфный канал, внутри которого помещается самка. Различные виды шистосом различаются между собой морфологией взрослых особей и по форме яиц и личинок. Яйца этих червей крупные, бесцветные и снабжены шипом. Возбудители шистосоматоза имеют сложный цикл развития со сменой хозяев. Окончательными хозяевами являются многие животные и человек, у которого они паразитируют в крупных венах мочевого пузыря и кишечника. Живут шистосомы до 10 лет, продуцируя до 1000 яиц в сутки, выделяющихся в окружающую среду с калом и мочой. Дальнейшее развитие происходит в воде. Личинки проникают в организм промежуточного хозяина — моллюска, где образуются церкарии (личинки). Церкарии снабжены хвостом и активно двигаются в воде, свободно проникая в организм окончательного хозяина. Молодые особи проходят по сосудам через сердце и легкие в печень, превращаясь там во взрослого паразита. Весь период продолжается от 30 до 50 дней. Источником заражения являются человек, крысы, свиньи, собаки и другие домашние животные спустя 5 недель от момента внедрения возбудителя. Повышенному риску заражения подвержены сельскохозяйственные рабочие и персонал системы орошения.
Патогенез Возбудитель шистосоматоза оказывает различное болезнетворное действие на организм в зависимости от стадии. Личинки способны вызывать тяжелую аллергическую реакцию и травмировать ткани окончательного хозяина во время своей миграции. Взрослые особи не способствуют значительным нарушениям, паразитируя в стенке сосуда. Главные изменения в организме человека возникают при переходе яиц шистосом из вен в кишечник и мочевой пузырь. Со временем в стенке органа развивается соединительная ткань и происходит отложение солей кальция. Это приводит к тому, что яйца с трудом проходят через барьер и легко заносятся в легкие, печень и головной мозг, вызывая в них необратимые изменения.
Клиническая картина и диагностика Выделяют острую и хроническую стадии шистосоматоза. Острая стадия протекает одинаково при всех формах заболевания. Ее симптомы появляются спустя несколько часов после заражения. В месте проникновения личинок на коже возникают признаки дерматита (см.). Это может быть зуд (см.), покраснение, ощущение покалывания иголками. Поражение кожи сопровождается повышением температуры и общим недомоганием. Через неделю кожные изменения проходят, а им на смену приходят симптомы, сопровождающие передвижение личинок. Со стороны легких наблюдается кашель (см.) с густой кровянистой мокротой, развиваются симптомы астматического бронхита (см.), миалгии (см.), боли в суставах и ломота в костях. Почти всегда увеличиваются печень и селезенка. Продолжительность острой стадии — около двух недель. Симптомы хронической стадии зависят от вида шистосоматоза. Мочеполовой шистосоматоз характеризуется появлением крови в конце мочеиспускания. Нередко отмечаются дизурия (расстройства мочеиспускания), тяжесть в паху, боли в пояснице. При поражении женских половых органов возникают нарушения менструального цикла, кровотечения и выкидыши. Кишечный шистосоматоз проявляется болями в животе, нерегулярным стулом с примесью слизи и крови. Больных беспокоят болезненные позывы к дефекации, вздутие живота, иногда выделение крови из прямой кишки. Поражение легких ведет к развитию острой бронхопневмонии (см.) с развитием легочной гипертонии. У больных с патологией сердца и сосудов возникают головокружения, обмороки (см.) и коллапсы (см.). При вовлечении в процесс нервной системы отмечаются симптомы менингизма, головная боль, рвота, нарушения зрения, судороги и припадки. Массированная инвазия (заражение) в детском возрасте ведет к отставанию в развитии. При поражении спинного мозга развиваются парезы (см.), нарушениячувствительности и боли. Диагноз основывается на данных эпидемиологического анамнеза, характерной клинической картине, лабораторных данных — эозинофилия, лейкоцитоз, обнаружение в кале и моче яиц шистосом. С целью обнаружения яиц в моче используют методы фильтрации через мембранные фильтры. Из иммунологических методов используют внутрикожную аллергическую пробу и реакцию иммунофлюоресценции.
Лечение Используют препараты трехвалентной сурьмы, чаще всего фуадин. Он выпускается в виде раствора, высокотоксичен и требует до 15 инъекций. Из других лекарственных препаратов можно назвать празиквантел и метрифонат. Хорошей переносимостью отличается празиквантел в дозе 40 мг на кг веса в течение одного дня. Для терапии кишечного шистосоматоза применяют препараты сурьмы, пиридазол и оксамникин. Последний вводят из расчета 10 мг на кг веса также в течение 1 дня. Основной мерой борьбы с шистосоматозом является охрана почвы и водоемов от загрязнения мочой и калом больных людей. Важное значение имеет обеззараживание выделений от больных в закрытых емкостях сроком до 10 дней. Дорогостоящим средством является уничтожение промежуточных хозяев шистосом (закапывание и утрамбовка старых каналов). Индивидуальная профилактика включает запрещение купания и стирки белья в грязных водах, обязательное ношение обуви при ходьбе по влажной земле.
♦ Э ♦
ЭЗОФАГИТ
ОпределениеЭзофагит — воспалительный процесс слизистой оболочки пищевода. Различаются острый и хронический эзофагит.Хронический эзофагит — воспаление нижних отделов пищевода, обусловленное забросом кислого содержимого из желудка.
Этиология и патогенез Острый эзофагит Острый эзофагит развивается при действии на слизистую оболочку термических, механических и химических раздражителей. У грудных детей может возникать при кормлении очень горячей пищей из бутылочки. Эзофагит могут вызывать различные инфекции: дифтерия (см.), скарлатина (см.), корь (см.). Травмы пищевода, наносимые при зондировании, осуществлении ингаляционного наркоза, являются провоцирующими факторами эзофагита.
Хронический эзофагит Хронический эзофагит встречается при диафрагмальной грыже, резекции желудка, язве желудка и двенадцатиперстной кишки (см. Язвенная болезнь). Причина болезни заключается в ослаблении замыкающей способности нижнего сфинктера пищевода, в результате чего становится возможным желудочно-пищеводный рефлюкс — заброс содержимого желудка в пищевод. Под действием кислого желудочного содержимого на слизистой пищевода развивается воспаление, образуются эрозии и язвы.
Клиническая картина и диагностика Острый эзофагит Основная жалоба больных — боль при глотании, у грудных детей — беспокойство при кормлении. Боль локализуется в области шеи, грудины. В некоторых случаях отмечается рвота при попытке кормления, в рвотных массах — свежая пища, примесь свежей крови. Температура тела обычно повышается незначительно, при прободении пищевода — высокая. Острый эзофагит подтверждается при проведении эндоскопии пищевода. Наиболее часто патологический процесс локализуется в области физиологических сужений пищевода.
Хронический эзофагит Больные жалуются на изжогу, жжение за грудиной, усиливающееся при наклонах туловища, боль в шее и груди. У больных часто возникает отрыжка кислым, срыгивание, при этом желудочное содержимое попадает в дыхательные пути, возникает мучительный кашель. При длительном течении возникают рубцовые изменения, укорочение пищевода, у больных появляется затруднение глотания пищи, ощущение комка в горле. При эндоскопическом исследовании удается увидеть язву в нижнем отделе пищевода, ее диаметр обычно не превышает 1 см, дно покрыто налетом, после заживления остается рубец. Необходимо проводить гистологическое исследование ткани из язвы на предмет возникновения злокачественного новообразования.
Лечение Острый эзофагит Прежде всего необходимо устранение повреждающего фактора в сочетании с щадящей диетой (жидкая пища комнатной температуры), постельным режимом. Применяют также анестезин по 0,5 г внутрь 4 раза в день.
Хронический эзофагит При хронической форме эзофагита, так же как и при острой, необходима щадящая диета. Жидкая пища принимается небольшими порциями 5–6 раз в день, исключаются острые, соленые блюда. Для уменьшения кислотности содержимого желудка — минеральная вода (Смирновская, Ессентуки). Изголовье кровати больного приподнимается на 15–25 см, что предотвращает заброс кислого содержимого в дыхательные пути. Назначаемые препараты: — сукральфат — по 1 г за 30 мин до еды и перед сном, маалокс — по 1–2 пакетика, гастал — по 1 таблетке через 1–2 ч после еды и перед сном; — для уменьшения желудочной секреции: фамотидин — по 40 мг, ранитидин — по 300 мг после еды перед сном, омепра- зол — по 30 мг в сутки; — для нормализации работы пищеводного сфинктера: метоклопрамид (церукал) по 1 таблетке 3–4 раза в день, препульсид по 5—10 мг 2–3 раза в день. При неэффективности консервативного лечения выполняется операция — фундопликация по Ниссену.
ЭКСТРАСИСТОЛИЯ
ОпределениеЭкстрасистолия — преждевременное сокращение сердца в целом или его частей, возникающее под влиянием эктопического импульса, исходящего из любого отрезка проводящей системы.Экстрасистолы делятся на органические и функциональные. Органические экстрасистолы регистрируются при миокардитах, миокардиодистрофии, кардиосклерозе. Функциональные (неврогенные) экстрасистолы возникают у невропатов, больных вегетососудистой дистонией, при наличии очагов инфекции. Различают предсердную, атриовентрикулярную и желудочковую экстрасистолии.
Этиология и патогенез Провоцировать экстрасистолию может психический стресс, интоксикация сердечными гликозидами, аминофиллином, дофамином, никотином, снижение в организме уровня калия.
Клиническая картина Экстрасистолия проявляется внеочередным сокращением сердца, которое ощущает больной. Предсердная экстрасистолия больным не ощущается и обнаруживается только с помощью ЭКГ. Желудочковая экстрасистолия больным ощущается как «замирание» сердца. При выслушивании сердца экстрасистола выглядит как сердечный тон, который выбился из нормального ритма. Основным электрокардиографическим признаком экстрасистолии является преждевременный комплекс QRS. При желудочковой экстрасистолии он деформирован, широкий, более 0,12 с, расщепленный, зубец Р отсутствует, есть полная компенсаторная пауза. При над- желудочковой экстрасистолии зубец Р предшествует комплексу QRS, а сам комплекс более правильный.
Лечение Лечение зависит от наличия или отсутствия патологического процесса в сердце, характера экстрасистол, состояния вегетативной нервной системы. При наличии в сердце патологического очага воспалительного или дистрофического характера, положительный эффект возникает от противовоспалительной терапии, направленной на восстановление метаболических нарушений в миокарде (витамины группы В, препараты калия, кудесан Q10). Специальная терапия предусматривает назначение антиаритмических препаратов: мембраностабилизирующих (хинидин, новакаинамид); адреноблокаторов (обзидан и др.); кордарон; антагонисты кальция и др. При наджелудочковой экстрасистолии: анаприлин — по 20–40 мг в сутки, платифиллина 0,2 %-ный раствор по 1 мл внутримышечно. При желудочковой экстрасистолии: лидокаин (2 мл 2 %-ного раствора развести в 40 мл 5 %-ного раствора глюкозы внутривенно), пропранолол — по 10–30 мг 3–4 раза в сутки. Амиодарон — по 0,8–1,6 г в сутки в течение 1–3 недель до достижения эффекта, после поддерживающая доза — 0,4 мг в сутки. При отсутствии эффекта от лечения используют электрокардиостимуляторы, которые вживляются в подкожную клетчатку подключичной области.
ЭКТИМА
ОпределениеЭктима — глубокое язвенное поражение кожи, вызываемое гноеродной флорой.
Этиология Возбудитель — стрептококк, реже — микст со стафилококком. Заболевание развивается преимущественно у ослабленных детей со сниженной иммунологической реактивностью, при нарушении обмена веществ, витаминной недостаточности (см.), плохом гигиеническом уходе за кожей, тяжелых хронических заболеваниях.
Клиническая картина Воспалительный процесс чаще всего поражает кожу нижних конечностей, реже — туловища.
Эктима
Заболевание начинается с образования пустулы, вокруг которой развивается воспалительный инфильтрат. Через короткое время на месте пустулы образуется плотная корка величиной до 1 см, коричнево-красной окраски. При удалении или самостоятельном отхождении корки под ней обнажается глубокая язва ярко-красного цвета с инфильтрированными краями и гнойным отделяемым. После заживления язвы остается рубец. Болезнь обычно продолжается 1–1,5 месяца.
Язвы и некроз
Лечение и профилактика Лечение заключается в антибиотикотерапии, иммунотерапии, ультрафиолетовом облучении пораженных участков кожи и обработке очагов поражения 10 %-ной синтомициновой, 5 %-ной дерматоловой, 2 %-ной линкомициновой мазью. Профилактика состоит в лечении заболеваний внутренних органов, эндокринной системы, соблюдении правил личной гигиены, избежании травматизации и охлаждения кожи.
ЭКЗЕМА
ОпределениеЭкзема — воспаление поверхностных слоев кожи нервно-аллергического характера, возникающее в ответ на воздействие внешних или внутренних раздражителей, отличающееся многообразием сыпи, зудом и длительным рецидивирующим течением.
Этиология и патогенез Причины, способствующие возникновению экземы, неизвестны. Развивается поливалентная (реже — моновалентная) сенсибилизация кожи, в результате которой она неадекватно реагирует на различные экзогенные и эндогенные воздействия (внешней среды и внутренней среды организма). Сенсибилизации способствуют стрессовые переживания, эндокринопатии, болезни желудочно-кишечного тракта, печени, а также микозы стоп (см.), хронические пиококковые процессы и аллергические заболевания. В детском возрасте экзема патогенетически связана с экссудативным диатезом (см.).
Клиническая картина и диагностика Экзема наблюдается в любом возрасте, на любом участке кожного покрова (чаще — на лице и верхних конечностях). Различают истинную, микробную, себорейную и профессиональную экзему. Истинная экзема протекает остро, подостро и хронически. Острая экзема характеризуется яркой отечной эритемой с множественными мельчайшими пузырьками, при вскрытии которых образуются точечные эрозии с обильным мокнутием, образованием корок и чешуек. Отмечаются жжение и зуд. Продолжительность острой экземы 1,5–2 мес. При подостром течении воспалительные явления менее выражены: окраска очагов становится синюшно-розовой, отечность и мокнутие умеренные, стихают жжение и зуд; присоединяется инфильтрация. Продолжительность процесса — до полугода. При хроническом течении в клинической картине преобладает инфильтрация кожи; пузырьки и мокнущие эрозии обнаруживаются с трудом, отмечается зуд. Течение неопределенно долгое, рецидивирующее. Разновидностью истинной экземы является дисгидротическая экзема, которая локализуется на ладонях и подошвах и проявляется обильными, местами сливающимися в сплошные очаги пузырьками и многокамерными пузырями с плотной покрышкой, при вскрытии которых обнажаются мокнущие участки, окаймленные бахромкой рогового слоя. Микробная экзема, в развитии которой значительную роль играет сенсибилизация к микроорганизмам (обычно пиококкам), отличается асимметричным расположением, чаще на конечностях, округлыми очертаниями, четкими границами отслаивающегося рогового слоя, наличием гнойничков и нередкой приуроченностью к свищам, длительно не заживающим ранам, трофическим язвам (паратравматическая экзема). Себорейная экзема патогенетически связана с себореей. Заболевание встречается в грудном возрасте и после периода полового созревания. Себорейная экзема локализуется на волосистой части головы, за ушными раковинами, на лице, в области грудины и между лопатками. Ее своеобразными особенностями являются: желтоватая окраска, наслоение жирных чешуек, отсутствие выраженного мокнутия, нерезкая инфильтрация, склонность очагов к регрессу в центре с одновременным ростом по периферии. Профессиональная экзема, морфологически сходная с истинной, поражает открытые участки кожи (кисти, предплечья, шею и лицо), которые в первую очередь подвергаются в условиях производства вредному воздействию химических раздражителей, и имеет не столь упорное течение, так как сенсибилизация при ней носит не поливалентный, а моновалентный характер. С диагностической целью используют аллергические кожные пробы.
Дисгидротическая экзема
Лечение Лечение сводится к выявлению и устранению раздражающего фактора, терапии сопутствующих заболеваний. Следует максимально щадить кожу, особенно пораженные участки, от местного раздражения. При обострениях назначается преимущественно молочно-растительная диета. Назначают анти- гистаминные и седативные средства, в том числе транквилизаторы. При острых явлениях, сопровождающихся отечностью и мокнутием, показаны диуретики, препараты кальция, аскорбиновая кислота и рутин. При отечности и мокнутии (местно) — примочки из растворов риванола, фурацилина. По их устранении применяют пасты (2–5 %-ная борно-нафталановая, борно-дегтярная и др.), затем мази (серные, нафталановые, дегтярные); при резкой инфильтрации — тепловые процедуры. На всех этапах широко показаны кортикостероидные мази (при пиококковых осложнениях — комбинированные с антимикробными компонентами). При упорных отграниченных очагах, особенно дисгидроти- ческой экземы — сверхмягкие рентгеновские лучи. Распространенные формы с упорным течением требуют назначения кортикостероидов внутрь. Тяжело протекающие формы подлежат лечению в стационаре с последующей курортотерапией. Для предупреждения развития экземы необходима коррекция нейрогенных отклонений и сопутствующих заболеваний, особенно микозов стоп и пиококковых поражений; своевременное лечение экссудативного диатеза и себорейных состояний; исключение контакта с химическими раздражителями на производстве (трудоустройство) и в быту. Прогноз истинной экземы в отношении полного излечения сомнителен, других форм — более благоприятен.
ЭЛЕКТРОТРАВМА
ОпределениеЭлектротравма — поражение, возникающее при прохождении через тело электрического тока, превышающего допустимые параметры.
Этиология и патогенез Электротравма возникает при непосредственном контакте с электрическим проводом, но может быть следствием удара молнии. Потенциально опасным для человека является ток с напряжением более 36 вольт и силой более 0,15 ампер. Кроме этого, тяжесть электротравмы зависит от того, какой ток проделал путь по организму: если прошел через обе ноги, человек может даже не потерять сознания, а если через левую руку и правую ногу, то возможна остановка сердца. Переменный ток для человека обладает большей поражающей силой.
Клиническая картина Различают 4 степени клинических проявлений: — I степень — больной в сознании, но заторможен или возбужден. Отмечаются бледность, одышка, тахикардия, повышение артериального давления, судорожные сокращения мышц; — II степень — утрата сознания, мраморность кожных покровов, одышка, тахикардия, аритмия, боль, ожог, снижение артериального давления; — III степень — кома (угнетение дыхания, аритмия, падение артериального давления), ожог, болевой шок; — IV степень — клиническая смерть. Поражение электрическим током приводит к ожогам, судорогам, остановке сердца, при этом тяжесть ожога зависит от силы тока, а выраженность судорог — от напряжения. При значительной силе тока возникает обугливание тканей. Легкая электротравма сопровождается возникновением только ожогов и не требует значительной медицинской помощи. В тяжелых случаях возможна потеря сознания, остановка дыхания и сердечной деятельности. Следует помнить: если напряжение превышает 110 вольт, то пострадавший самостоятельно не может отсоединиться от электрической цепи из-за судорог. Это следует сделать с помощью предмета, не проводящего электрический ток.
Лечение Неотложные мероприятия: — прекращение воздействия электрического тока на пострадавшего с помощью деревянной палки или резиновых перчаток; — при снижении диуреза мочегонные препараты (фуросемид, лазикс и др.); — введение противостолбнячного анатоксина, введение антибиотиков. При поражении электрическим током необходима срочная госпитализация в лечебное учреждение, так как у больных в первые сутки возможна остановка дыхания. При отсутствии дыхания и сердечной деятельности требуется проведение искусственного дыхания, массаж сердца. В легком случае лечение ограничивается обработкой ожогов. Ее желательно производить в условиях отделения гнойной хирургии, так как такие ожоги часто нагнаиваются.
Обугливание тканей при электротравме
ЭМБРИОПАТИЯ
ОпределениеЭмбриопатия — патология эмбриона, возникающая между 16-м и 75-м днем беременности, индуцированная воздействием повреждающих факторов. Эмбриопатии характеризуются нарушениями формирования органов, которые в конечном счете заканчиваются или гибелью эмбриона, или врожденными пороками развития. В настоящее время причины, вызывающие большинство пороков развития, неизвестны.К важнейшим порокам развития относятся врожденные пороки сердца, центральной нервной системы, органов пищеварения, пороки развития почек, врожденные пороки лица.
Врожденные пороки сердца Причина возникновения большинства врожденных пороков сердца неизвестна. Возможно, что многие случаи связаны с действием неизвестных тератогенов в первый триместр беременности во время развития сердца. Большинство врожденных пороков сердца не являются наследственными. В некоторых случаях причину можно установить. Внутриутробное инфицирование плода вирусом краснухи в первый триместр беременности является причиной таких пороков сердца, как открытый артериальный проток и стеноз легочной артерии. Хромосомные нарушения во многом определяют развитие. У 20 % больных синдромом Дауна определяются дефекты атриовентрикулярных клапанов, дефекты межпредсердной и межжелудочковой перегородок. При синдроме Тернера в 20 % случаев обнаруживается коарктация аорты. К наиболее частым врожденным порокам сердца относят дефект межпредсердной перегородки, дефекты межжелудочковой перегородки, врожденные пороки сердца с нарушением деления артериального ствола, общий артериальный ствол, открытый артериальный проток (незаращение боталлова протока), коарктацию аорты.
Врожденные пороки центральной нервной системы Врожденные пороки центральной нервной системы встречаются примерно в 30 % случаев пороков развития, выявляемых у новорожденных. Различают следующие основные наиболее тяжелые врожденные пороки центральной нервной системы: — анэнцефалия — отсутствие головного мозга, которое сочетается с акранией — отсутствием костей свода черепа; — микро- и полигирия — большое число мелких и аномально расположенных извилин конечного мозга; — микроцефалия — уменьшение массы, размеров и гистологических структур головного мозга. Кора больших полушарий обычно недоразвита, в ней обнаруживаются как зрелые, так и незрелые нервные клетки; — грыжи спинного мозга, связанные с незаращением задних отделов позвонков; не- закрытие позвоночного канала может встречаться чаще в поясничном и крестцовом и захватывать различное число позвонков; — циклопия — наличие одного глаза или двух глазных яблок в одной глазнице. Прогноз при врожденных пороках центральной нервной системы неблагоприятен, большинство из них несовместимы с жизнью.
Врожденные пороки органов пищеварения Пороки органов пищеварения являются довольно частыми, но их раннее выявление необходимо, так как многие поддаются хирургической коррекции. Механизм развития этих пороков связан с нарушением образования отверстий пищеварительной трубки в периоде от 4-й до 8-й недели внутриутробного развития. Атрезии и стенозы чаще наблюдаются в пищеводе, двенадцатиперстной кишке, проксимальном отрезке тощей и дистальном отрезке подвздошной кишки, в области прямой кишки и анального отверстия. Удвоение кишечника — этот порок чаще наблюдается в толстой кишке и обычно сочетается с врожденными аномалиями органов мочеполовой системы.
Врожденные пороки развития почек Агенезия почек — врожденное отсутствие одной из почек — и арения — врожденное отсутствие обеих почек — часто сочетаются с другими врожденными пороками. Дети с данными пороками нежизнеспособны. Гипоплазия почек — врожденное уменьшение их массы и объема — может быть одно- и двусторонней. Поликистоз почек — двустороннее увеличение почек с формированием кист. Различают крупнокистозные и мелкокистозные типы почки. Крупнокистозные почки характеризуются образованием в корковом слое большого числа крупных кист, между которыми сохраняются участки нормальной почечной ткани. Больные с такими почками при определенных условиях могут жить 40–50 лет. Мелкокистозные почки содержат множество мелких кист, тесно прилежащих друг к другу, нормальная почечная ткань практически отсутствует. Такие новорожденные нежизнеспособны.
Врожденные пороки лица К врожденным порокам лица относятся: — хейлосхиз (заячья губа) — расщепление верхней губы; — палатосхиз (волчья пасть) — расщепление твердого неба; — микрогнатия — гипоплазия нижней челюсти.
ЭМФИЗЕМА ЛЕГКИХ
ОпределениеЭмфизема легких — это хроническое прогрессирующее заболевание, характеризующееся патологическим расширением воздушных пространств дистальнее терминальных бронхиол, которое сопровождается деструктивными изменениями альвеолярных стенок; одна из частых форм хронических неспецифических заболеваний легких.Различают первичную (идиопатическую) эмфизему легких, развивающуюся без предшествовавшего бронхолегочного заболевания, и вторичную (обструктивную) эмфизему — чаще всего осложнение хронического обструктивного бронхита. В зависимости от распространенности эмфизема может быть диффузной или очаговой.
Этиология и патогенез Выделяют две группы причин, приводящих к развитию эмфиземы легких. Первую группу составляют факторы, нарушающие эластичность и прочность легочных структурных элементов: патологическая микроциркуляция, изменение свойств сурфактанта, врожденный дефицит антитрипсина, газообразные вещества (соединения кадмия, окислы азота и др.), а также табачный дым, пылевые частицы во вдыхаемом воздухе. Эти причины могут привести к развитию первичной, всегда диффузной, эмфиземы. В основе ее механизма развития лежит патологическая перестройка всего респираторного отдела легкого. Ослабление эластических свойств легкого приводит к тому, что во время выдоха и, следовательно, повышения внутригрудного давления мелкие бронхи, не имеющие своего хрящевого каркаса и лишенные эластической тяги легкого, пассивно спадаются, увеличивая этим бронхиальное сопротивление на выдохе и повышение давления в альвеолах. Бронхиальная проходимость на вдохе при первичной эмфиземе не нарушается. При первичной эмфиземе имеется равномерное поражение всех альвеол, входящих в состав ацинуса легкого (панацинарная эмфизема), атрофия межальвеолярных перегородок; редукция капиллярного русла. Воспалительные изменения в бронхах, бронхиолах не выражены, и обструкции их, связанной с воспалительным отеком, не возникает. Факторы второй группы способствуют повышению давления в респираторном отделе легких и усиливают растяжение альвеол, альвеолярных ходов и респираторных бронхиол. Наибольшее значение среди них имеет обструкция дыхательных путей, возникающая при хроническом обструктивном бронхите. Это заболевание становится основной причиной развития вторичной, или обструктивной, эмфиземы легких, так как именно при нем создаются условия для формирования клапанного механизма перерастяжения альвеол. Так, понижение внутригрудного давления во время вдоха, вызывая пассивное растяжение бронхиального просвета, уменьшает степень имеющейся бронхиальной обструкции. Положительное внутригрудное давление в период выдоха вызывает дополнительную компрессию бронхиальных ветвей и, усугубляя уже имеющуюся бронхиальную обструкцию, способствует задержке инспирированного воздуха в альвеолах и их перерастяжению. Важное значение имеет распространение воспалительного процесса с бронхиол на прилегающие альвеолы с развитием альвеолита и деструкции межальвеолярных перегородок. Вторичная эмфизема характеризуется вздутием респираторных бронхиол и изменением формы преимущественно тех альвеол, которые лежат вблизи от них (центроацинарная эмфизема). При прогрессировании в патологический процесс может включаться весь ацинус (долька). Альвеолы уплощены, устья расширены, гладкомышечные пучки гипертрофированы, затем дистрофичны. Эластические волокна выпрямлены. Стенки респираторных бронхиол истончены, количество капилляров и клеточных элементов в них уменьшено. В поздних стадиях эмфиземы наблюдаются нарушение и полное исчезновение структурных элементов респираторного отдела легких. Причинами очаговой (локализованной, иррегулярной) эмфиземы легких могут быть: неполная клапанная обтурация бронха воспалительного или опухолевого генеза; ателектаз, или цирроз, участка легкого; врожденная патология (врожденная долевая эмфизема, врожденная односторонняя эмфизема).
Клиническая картина и диагностика Характерны одышка, бочкообразная грудная клетка, уменьшение ее дыхательных экскурсий, расширение межреберных промежутков, выбухание надключичных областей, коробочный перкуторный звук, ослабленное дыхание, уменьшение области относительной тупости сердца, низкое стояние диафрагмы и уменьшение ее подвижности, повышение прозрачности легочных полей на рентгенограмме. Первичной эмфиземе в значительно большей степени, чем вторичной, свойственна тяжелая одышка, с которой (без предшествовавшего кашля) начинается заболевание; у больных уже в покое объем вентиляции предельно велик, поэтому их толерантность к физической нагрузке очень низка. Известный для больных первичной эмфиземой симптом «пыхтения» (прикрывание на выдохе ротовой щели с раздуванием щек) вызван необходимостью повысить внутрибронхиальное давление во время выдоха и тем самым уменьшить экспираторный коллапс мелких бронхов, мешающий увеличению объема вентиляции. При первичной эмфиземе менее, чем при вторичной, нарушен газовый состав крови, мало выражен цианоз («розовый» тип эмфиземы), усиленная вентиляция вплоть до терминальной стадии поддерживает удовлетворительную оксигенацию крови, поэтому у больных не бывает компенсаторной полиглобулии, свойственной вторичной эмфиземе. При первичной эмфиземе в отличие от вторичной не развивается обычно хроническое легочное сердце. Рентгенологически для первичной эмфиземы характерны однородное повышение прозрачности легочных полей и обеднение легочного рисунка, особенно в нижних отделах легких, низкое стояние диафрагмы. При вторичной эмфиземе прозрачность нижних отделов легких уменьшена за счет перибронхиальных изменений, диафрагма может не смещаться, так как общий объем легких изменяется незначительно. При дифференциации этих двух форм диффузной эмфиземы используют методы функционального исследования внешнего дыхания. Диагностика локализованных форм эмфизем обеспечивается применением томографии, томореспираторной пробы, легочной ангиографии, компьютерной томографии, которая выявляет локализацию крупных образований. Применяются также радиоизотопные методы.
Лечение Лечение первичной эмфиземы симптоматическое. Дыхательная гимнастика, направленная на максимальное включение диафрагмы в акт дыхания; курсы кислородотерапии, исключение курения и других вредных воздействий, в том числе профессиональных; ограничение физической нагрузки. Разрабатывается терапия ингибиторами антитрипсина. Присоединение бронхолегочной инфекции требует назначения антибиотиков. При вторичной эмфиземе проводят лечение основного заболевания и терапию, направленную на купирование дыхательной и сердечной недостаточности. Есть попытки хирургического лечения очаговой эмфиземы — резекции пораженных участков легкого. Профилактика вторичной эмфиземы сводится к профилактике хронического обструктивного бронхита.
ЭМПИЕМА ПЛЕВРЫ
ОпределениеЭмпиема плевры — гнойное воспаление плевры, сопровождающееся скоплением гноя в плевральной полости с вторичной компрессией легочной ткани.
Этиология и патогенез Причиной эмпиемы плевры является инфекция. Прямой путь проникновения инфекции — травма легкого, ранения грудной стенки, разрыв пищевода (посттравматическая эмпиема), пневмония, туберкулез, абсцесс или гангрена легкого, бронхоэктазы, резекция легких, пневмоторакс. Наиболее часты пара- и метапневмонические эмпиемы. Непрямой путь проникновения инфекции — поддиафрагмальный абсцесс, острый панкреатит, абсцессы печени, воспаления мягких тканей и костного каркаса грудной стенки. Возбудителями могут быть стафилококки, пневмококки, факультативные и облигатные анаэробы (синегнойная палочка). В результате воспаления возникает гиперемия и лейкоцитарная инфильтрация плевральных листков. Затем происходит отложение фибрина, клинически проявляющееся появлением шума трений плевры и болями, исчезающими при продолжающемся накоплении жидкости в плевральной полости. Постепенно плевральные листки утолщаются, образуются шварты, способствуя организации полости эмпиемы, одно- или двусторонней, ограниченной либо тотальной, чаще расположенной базально, реже — парамедиастинально. Возможны осложнения: перфорация внутрь с образованием бронхоплевральных свищей, реже — наружу, через межреберные промежутки — скопление гноя в мягких тканях грудной стенки, септикопиемия.
Клиническая картина и диагностика Клинические проявления эмпиемы плевры сходны с симптомами пневмонии, поэтому при метапневмонических эмпиемах ее признаки после светлого промежутка распознаются легче, чем при постпневмонических эмпиемах, затушеванных текущей пневмонией. Определяют также укорочение перкуторного звука, исчезновение дыхательных шумов, ослабленное голосовое дрожание. Основными методами исследования при эмпиеме плевры являются полипозиционное рентгенологическое исследование и компьютерная томография. Подтверждает диагноз пункция плевры, экссудат исследуется цитологически и бактериологически с проведением исследования чувствительности флоры на антибиотики. Рентгенологическое исследование стоя выявляет базальное затемнение с горизонтальным уровнем при гнилостной инфекции или бронхоплевральном свище — пиопневмоторакс. Покраснение кожи наблюдается только при прорыве гноя из полости эмпиемы под кожу. Общее состояние прогрессивно ухудшается в результате возникшей гнойно-резорбтивной лихорадки: слабость, потеря аппетита, похудение, гектическая температура, частый пульс, высокий лейкоцитоз со сдвигом формулы влево, гипо- и диспротеинемия.
Лечение Уже в начале лечения больного пневмонией, осложненной плевральным выпотом, следует предвидеть возможность развития гнойного плеврита, поэтому необходим рациональный подбор антибиотиков и своевременное дренирование плевральной полости. Подбор антибиотиков осуществляют путем анализа мокроты с окраской по Граму. По результатам окраски выбирают соответствующие антибиотики, раннее применение которых способствует рассасыванию плеврального выпота. Решение о дренировании плевральной полости принимается на основе оценки вида полученной при плевральной пункции жидкости. Наличие гноя служит императивным показанием к дренированию по ходу пункционной иглы с помощью троакара, через просвет которого вводится дренажная трубка, соединяемая с системой Бюлау. Через дренажную трубку полость эмпиемы промывается антисептиками с последующим введением суточной дозы антибиотиков. Особенно опасна эмпиема плевры у пожилых и лиц, ослабленных затянувшейся пневмонией. Необходима экстренная госпитализация в хирургическое отделение даже при подозрении на эмпиему плевры. Прогноз при своевременном лечении благоприятный.
ЭНДОМЕТРИОЗ
ОпределениеЭндометриоз — перемещение эндометрия в органы и ткани, где его в норме не бывает.
Этиология и патогенез Имплантационная теория эндометриоза является ведущей. Согласно данной теории отторгшиеся участки эндометрия имплантируются в другие ткани и органы; возможен также перенос гематогенным путем (с кровотоком). Эндометриоидные включения могут наблюдаться в толще матки (аденомиоз), в просвете маточных труб, на брюшине малого таза с прорастанием в подлежащие ткани (ректовагинальная перегородка), во влагалище, шейке матки, яичнике с образованием кист («шоколадные» кисты), рубцах после кесарева сечения, редко — в отдаленных от матки органах и тканях. Нередко эндометриоз сопровождается пограничным воспалением. Распространение и развитие эндометриоза тесно связано с функцией яичников. При естественной или искусственной менопаузе очаги эндометриоза подвергаются обратному развитию.
Клиническая картина и диагностика Боль и увеличение образований и органов, пораженных эндометриозом, в дни менструального кровотечения. Затем боль утихает, а образования уменьшаются. Для аденомиоза характерна гиперполименорея. Эти симптомы обусловлены предменструальным набуханием и частичным отторжением эндометриоидных клеток и целиком зависят от циклической деятельности яичника, при наступлении менопаузы исчезают. Диагностика основывается на обнаружении циклических симптомов, соответствующих менструальному циклу, и изменяющихся в объеме образований. Иногда можно выявить аденомиоз при рентгенографии матки с водорастворимым контрастным веществом (диодон, кардиотраст), произведенной на 3—4-й день менструации.
Лечение Консервативное лечение основано на применении гормональных препаратов, вызывающих подавление функции яичников. У молодых женщин применяют комбинированные эстрогеногестагены (бисекурин, ноновлон и др.) по схеме: с 5-го по 26-й день цикла в течение 10–12 месяцев, а затем делают перерыв на полгода и вновь повторяют курсы. Полезны средства, усиливающие иммунную резистентность организма (левамизол по 0,05 г 3 раза в день в течение 3 дней, затем недельный перерыв и еще 2–3 аналогичных курса). У женщин старше 40 лет можно использовать андрогены (метилтестостерон по 5 мг 4 раза в день на протяжении полугода) или рентгенокастрацию. К хирургическому лечению прибегают при образовании кист яичников, при аденомиозе матки, сопровождающемся кровотечениями, или при эндометриозе ректовагинальной клетчатки с прорастанием в кишку. Хирургическому лечению должно предшествовать гормональное, и лишь при отсутствии эффекта при наблюдении в течение 3–4 месяцев производят операцию. Прогноз для жизни при своевременном лечении благоприятный.
ЭНДОМЕТРИТ
ОпределениеЭндометрит — воспаление слизистой матки. Возникает после родов, абортов; может также развиваться при нарушении методики внутриматочной диагностики. 80 из 100 случаев эндометритов сопряжены с операцией кесарева сечения.
Этиология и патогенез Эндометрит — полимикробное заболевание, которое вызывается условно-патогенными бактериями, микоплазмами, хламидиями и вирусами. Основными возбудителями эндометрита являются условно-патогенные аэробные и анаэробные бактерии, составляющие нормальную микрофлору нижних половых путей женщины. В настоящее время ведущее место в этиологии заболевания занимает смешанная вирусно-бактериальная инфекция. Гонорейный эндометрит — поражение слизистой оболочки матки (эндометрия) возбудителем гонореи. Инфекция проникает в полость матки из влагалища через шейку. Особенность гонорейного эндометрита в том, что при тяжелом течении воспаление со слизистой переходит на мышечный слой матки, что способствует возникновению разрывов матки при беременности. Основными путями распространения инфекции при эндометрите являются: восходящий, что связано с наличием условно-патогенных микроорганизмов, обитающих во влагалище женщины, гематогенный, лимфогенный и интраамниальный, связанный с внедрением в акушерскую практику инструментальных методов исследования (амниоскопия, амниоцентез, кордоцентез). Существенная роль в возникновении и течении инфекционного процесса в послеродовом периоде принадлежит снижению иммунологической реактивности. Установлено, что даже у здоровых женщин в ранние сроки послеродового периода наблюдается частичное ослабление иммунитета.
Клиническая картина Заболевание развивается остро, больные жалуются на повышение температуры, боли внизу живота. Через короткое время появляются жидкие гнойные выделения с примесью крови, происходит нарушение менструального цикла. При пальпации нижних отделов живота определяется увеличенная, болезненная матка. При гонорейном эндометрите женщины жалуются на недомогание, головную боль, повышение температуры тела до 38–39 °C. Через некоторое время появляются тупые боли внизу живота и в области крестца, гнойные бели. Менструальный цикл становится нерегулярным, с задержками, сами менструации обильные и длительные.
Лечение и профилактика Антибактериальная терапия: метрогил по 500 мг каждые 12 ч внутривенно + гентамицин по 1,5 мг/кг каждые 12 ч внутримышечно. Метрогил по 500 мг каждые 12 ч внутривенно + ампициллин по 2 г через 6 ч внутримышечно + гентамицин по 1,5 мг/кг каждые 12 ч внутримышечно. Инфузионная терапия: плазмозаменители (реополиглюкин, полиглюкин, гемодез), белковые препараты (альбумин, желатиноль, протеин), солевые растворы (дисоль, хлосоль, трисоль, физиологический раствор). Иммунокорригирующая терапия: кипферон, виферон, нормальный человеческий иммуноглобулин по 25 мл внутривенно капельно через день 3 раза. При тяжелом течении эндометрита рекомендуется применение плазмофереза и лазерного облучения крови. В качестве профилактики необходимо назначение антибактериальных препаратов женщинам с высоким риском развития эндометрита после родов и кесарева сечения. Наиболее обоснованно применение метрогила, амоксиклава, имипенема внутривенно трижды: после пережатия пуповины, через 12 ч и 24 ч после операции.
ЭНТЕРОВИРУСЫ
ОпределениеЭнтеровирус — условно-патогенный вирус, обитающий в кишечнике.Энтеровирусы содержат РНК, имеют малые размеры 20–30 нм, не окружены какой-либо оболочкой, термоустойчивы, устойчивы к эфиру и к кислой среде, благодаря чему вирусы проходят через желудок, устойчивы к желчи и пищеварительным сокам.
Этиология Основной путь распространения энтеровирусов — фекально-оральный. Вирус циркулирует преимущественно в летне-осенний период времени. Среди здоровых людей выявляется большой процент вирусоносителей. Чаще всего болеют дети, преимущественно до 5 лет. В род энтеровирусов входят: возбудители полиомиелита, вирусы Коксаки, вирусы ЕСНО, полиомиелитоподобные вирусы, вирусы гепатита А. Вирус полиомиелита — вирус, поражающий серое вещество спинного мозга. При этом нарушается двигательная иннервация, возникают атрофические параличи конечностей. Существует 3 возбудителя полиомиелита: серотип Брунгинда, серотип Лансинга, серотип Леон, из которых первый наиболее опасен для человека. Вирусы Коксаки вызывают асептический менингит, ангину, лихорадочные заболевания с сыпью, энцефаломиокардит новорожденных. Вирусы ЕСНО вызывают асептический менингит, гастроэнтерит у детей, лихорадочные заболевания с летней сезонностью.
Диагностика Лабораторную диагностику нужно вести одновременно на все вирусы, так как они вызывают однотипные заболевания. Диагностика включает два метода: вирусологический и серологический. Вирусологический метод заключается в заражении мышей вирусом от больного с последующей культивацией его на культуре ткани и электронной микроскопией. Серологический метод основан на определении нарастания титра антител в парных сыворотках больного по отношению к известному вирусу.
ЭНЦЕФАЛИТ
ОпределениеЭнцефалит — воспаление вещества головного мозга. Различают первичный энцефалит, при котором возбудитель первично проникает в мозг и поражает его, и вторичный, прикотором энцефалит является осложнением другого заболевания.
Этиология и патогенез Причиной возникновения энцефалитов служат в основном биологические факторы: вирусы, микробы, риккетсии, грибки, живые паразиты. Играют роль также физические, химические и механические воздействия. Из первичных энцефалитов чаще всего встречаются клещевой, вызываемый арбовирусами, и герпетический, вызванный вирусом простого герпеса. Заболевают клещевым энцефалитом при укусе клещей и мелких грызунов, содержащих вирус, при употреблении сырого молока от зараженных коз и коров. Очаги клещевого энцефалита на территории России существуют на Дальнем Востоке, на Урале и в Сибири. Болеют в основном дети старшего возраста. Вспышки возникают в мае — июне, в сезон размножения иксодовых клещей, от которых вирус попадает к человеку. Вторичный энцефалит может возникнуть как осложнение кори, ветряной оспы, краснухи. Возможно развитие энцефалита как реакция организма на вакцинацию. Страдают нервные клетки и нервные волокна. Процесс может поражать как всю мозговую ткань, так преимущественно серое или белое вещество головного мозга.
Клиническая картина и диагностика Заболевание начинается остро, его развитию может предшествовать период недомогания, проявляющийся повышением температуры тела, тошнотой, жидким стулом, симптомами инфекции верхних дыхательных путей. Для энцефалита характерны головная боль в области глаз и лба, светобоязнь, возможны эпилептические припадки. Нарушается сознание, больной вял и сонлив, на вопросы отвечает односложно, при тяжелом течении впадает в кому. Через некоторое время развиваются параличи и парезы конечностей, ригидность затылочных мышц. В крови — умеренное повышение количества лейкоцитов, повышение СОЭ; в цереброспинальной жидкости наблюдается увеличение количества лимфоцитов до нескольких сот клеток, белка — до 2 %, увеличена концентрация сахара. Герпетический энцефалит протекает очень тяжело, возникает преимущественно у детей. Заболевание протекает с потерей сознания и судорогами. Могут быть герпетические высыпания на различных участках тела. Нередко в течение первых суток наступает летальный исход. При вскрытии в головном мозге обнаруживаются многочисленные некротические изменения. Коревой энцефалит возникает на 3—5-й день болезни. Отмечается повышение температуры тела, возможны судороги, внезапно наступают парезы конечностей, нарушается сознание вплоть до комы. После болезни у части больных остаются необратимые последствия в виде припадков, гемипарезов, психических нарушений. Энцефалиты при ветряной оспе и краснухе встречаются в основном у детей раннего возраста. Первые проявления болезни возникают на 2—8-й день: расстройство сознания, параличи конечностей, нарушение координации. Поствакцинальный энцефалит сопровождается повышением температуры до 39–40 °C, нарушением координации, параличами конечностей. При опросе можно обнаружить связь болезни с недавней вакцинацией. Диагностика проводится на основе эпидемиологического анамнеза, перенесенной инфекции, вакцинации, а также серологических исследований, появления лимфацитарного плеоцитоза в крови и ликворе.
Лечение и профилактика При клещевом энцефалите назначается специфический гамма-глобулин по 3–5 мл внутримышечно ежедневно или через день. В остром периоде для предотвращения отека головного мозга проводится дегидратирующая терапия: маннитол внутривенно по 1–1,5 г/кг массы тела в сутки, лазикс внутривенно или внутримышечно по 1–3 мг/кг массы тела в сутки. Для уменьшения интоксикации организма применяют реополиглюкин, гемодез. С целью уменьшения воспалительной реакции организма: гидрокортизон по 5—10 мг/кг массы тела в сутки, преднизолон — 2–3 мг/кг в сутки, дексаметазон 0,5–1 мг/кг в сутки. При часто повторяющихся судорогах и эпилептическом статусе обычно используется реланиум. Больным могут назначаться витамины группы В, аминалон, пирацетам, лечебная физкультура и массаж. При герметическом энцефалите эффективен цикловир (зовиракс, виролекс). Его вводят капельно внутривенно из расчета 45–95 мг в сутки. Курс лечения составляет от 8 до 20 суток. В качестве профилактики необходима вакцинация людей, проживающих в эндемичных очагах клещевого энцефалита. Профилактика вторичных энцефалитов включает предупреждение основного заболевания.
ЭПИДЕРМОФИТИЯ
ОпределениеЭпидермофития — грибковое заболевание, поражающее крупные кожные складки, стопы. Соответственно различают эпидермофитию крупных складок и стоп.
Этиология Возбудитель относится к роду эпидермофитонов. Заражение происходит в банях, при пользовании общей мочалкой, ванной. Особенностью этого заболевания является то, что оно никогда не поражает волосы.
Клиническая картина При эпидермофитии крупных складок поражение локализуется на бедрах, лобке, в мошоночных складках, подмышечных впадинах. Вначале появляются воспалительные пятна размером с монету. Поверхность пятен шелушится, края приподнятые, отечные. Пятна имеют тенденцию к росту и слиянию, в результате образуются очаги величиной с ладонь. Больных беспокоит зуд. Заболевание длится годами с периодическими обострениями в жаркое время года и при сильном потоотделении. Эпидермофития стоп чаще всего встречается у пловцов, работников душевых, бань, горячих цехов и шахтеров. В области стоп появляется покраснение, кожа на этих участках шелушится. Шелушение может распространяться на всю стопу и межпальцевые промежутки. При прогрессировании заболевания в межпальцевых промежутках образуются трещины, окруженные отслаивающимся роговым слоем кожи.
Эпидермофития стоп
Лечение и профилактика При лечении используют: низорал по 2 таблетки по 0,2 мг 2 раза в день в течение 3 недель; мазь ундецин, нитрофунгин, крем ламизил, клотримазол. Для предупреждения заболевания необходима дезинфекция мест общественной гигиены: бань, душевых, бассейнов. Личная профилактика — использование индивидуальных банных принадлежностей.
ЭПИКОНДИЛИТ
ОпределениеЭпикондилит — асептическое воспаление сухожильно-связочного аппарата и надкостницы плеча с последующим развитием дистрофических процессов. Происходит воспаление сухожилий лучевых разгибателей запястья и плечелучевой мышцы.
Этиология Чаще всего причиной эпикондилита являются однообразные многократно повторяющиеся движения предплечья, физическая нагрузка с микротравматизацией, нарушение трофики тканей при шейном спондилоартрозе.
Клиническая картина и диагностика Основная жалоба больных на тупую ноющую боль постоянного характера в нижней трети плеча, иррадиирующую в предплечье, слабость в руке, неспособность удерживать груз на вытянутой руке. Некоторые больные жалуются на боль при рукопожатии. Со временем уменьшается возможности к ротации, потом и к разгибанию предплечья. При осмотре отмечается уменьшение объема мышц плеча, сама конечность холодная, кожа с синюшным оттенком. На рентгенограммах определяются околосуставные оссификаты, локтевые шпоры, разрежения костной структуры.
Лечение Для лечения необходима иммобилизация плеча гипсовой лонгетой или мягкой повязкой, а также внутрисуставное введение гидрокортизона и дипроспана; фонофорез с гидрокортизоновой мазью, парафиновые или озокеритовые аппликации; При отсутсвии эффекта от консервативного лечения показано оперативное лечение — иссечение воспаленной надкостницы.
ЭПИЛЕПСИЯ
ОпределениеЭпилепсия — хроническое нервно-психическое заболевание, характеризующееся повторными припадками и сопровождающееся разнообразными клиническими и параклиническими симптомами.
Этиология и патогенез В развитии эпилепсии играет роль сочетание предрасположения и органического поражения мозга (нарушение внутриутробного развития, родовая асфикция, механические повреждения при родах, инфекции, черепномозговая травма и др.). В связи с этим нецелесообразно разделение эпилепсии на «генную» (наследственно обусловленную) и «симптоматическую» (результат органического поражения мозга). Эпилептический припадок обусловлен распространением чрезмерных нейронных разрядов из очага эпилептической активности на весь мозг (генерализованный припадок) или его часть (парциальный припадок). Эпилептический очаг может возникать на короткое время при острых заболеваниях мозга, например при нарушениях мозгового кровообращения, менингитах, что сопровождается так называемыми случайными эпилептическими припадками. При хронически текущих мозговых заболеваниях (опухоли, паразитарные заболевания и др.) эпилептический очаг более стойкий, что ведет к появлению повторяющихся припадков (эпилептический синдром). При эпилепсии как болезни повторные припадки обычно являются результатом действия стойкого эпилептического очага в виде склеротически-атрофического фокуса. Важным звеном механизма развития является ослабление функциональной активности структур, оказывающих антиэпилептическое влияние (ретикулярное ядро моста мозга, хвостатое ядро, мозжечок и др.), что и ведет к периодическому «прорыву» эпилептического возбуждения, т. е. к эпилептическим припадкам. Эпилептогенные повреждения особенно часто возникают в медиально-базальных отделах височной доли (височная эпилепсия).
Клиническая картина Генерализованные припадки сопровождаются утратой сознания, вегетативными симптомами (мидриаз, покраснение или побледнение лица, тахикардия и др.), в ряде случаев — судорогами. Судорожный генерализованный припадок проявляется общими тонико-клоническими судорогами (большой судорожный припадок), хотя могут быть только клонические или только тонические судороги. Во время припадка больные падают и нередко получают значительные повреждения, часто прикусывают язык и упускают мочу. Припадок обычно завершается так называемой эпилептической комой, но может наблюдаться и эпилептическое возбуждение с сумеречным помрачением сознания. Бессудорожный генерализованный припадок (малый припадок, или абсанс) характеризуется выключением сознания и вегетативными симптомами (простой абсанс) либо сочетанием этих симптомов с легкими непроизвольными движениями (сложный абсанс). Больные на короткое время прерывают совершаемые ими действия, а затем после припадка продолжают их, при этом воспоминание о припадке отсутствует. Реже во время припадка происходит утрата постурального тонуса, и больной падает (атонический абсанс). При парциальных эпилептических припадках симптоматика может быть элементарной, например очаговые клонические судороги — джексоновский припадок, поворот головы и глаз в сторону — адверсивный припадок и др.; или сложной — пароксизмальные расстройства памяти, приступы навязчивых мыслей, психомоторные припадки, автоматизмы, психосенсорные припадки — сложные расстройства восприятия. В последних случаях имеются галлюцинаторные феномены, явления деперсонализации и дереализации — состояния «уже виденного», «никогда не виденного», ощущение отчуждения внешнего мира, собственного тела и др. Любой парциальный припадок может перейти в генерализованный (вторично генерализованный припадок). К вторично генерализованным припадкам также относятся припадки, которым предшествует аура (предвестник) — моторные, сенсорные, вегетативные или психические феномены, с которых начинается припадок и о которых сохраняет воспоминание больной. Течение эпилепсии в значительной степени зависит от ее формы. Так, у детей существуют абсолютно благоприятные (роландическая эпилепсия, пикноэпилепсия) и неблагоприятные (детский спазм, синдром Леннокса-Гасто) формы эпилепсии. У взрослых течение эпилепсии без лечения в большинстве случаев прогредиентное, что проявляется постепенным учащением припадков, возникновением иных типов пароксизмов (полиморфизм), присоединением к ночным припадкам дневных, склонностью к развитию серий припадков или эпилептического статуса, возникновением характерных изменений личности в виде стереотипности и патологической обстоятельности мышления, сочетания аффективной вязкости с эксплозивностью, назойливости, угодливости, эгоцентризма вплоть до конечных состояний, определяемых как эпилептическое слабоумие.
Диагностика Диагностика эпилепсии основывается на внезапности припадков, их кратковременности (секунды, минуты), глубоком выключении сознания и расширении зрачков при генерализованных припадках, явлениях деперсонализации и дереализации при парциальных припадках. Наиболее полное провоцирующее влияние в отношении эпилептической активности оказывает сон или, наоборот, 24-часовое лишение сна, что позволяет выявлять эпилептические признаки в 85—100 % случаев. Среди методов исследования наибольшее значение имеет ЭЭГ, способствующая также уточнению локализации эпилептического очага и характера эпилептических припадков. Типичные изменения на ЭЭГ (спайки, пик; острые волны, изолированные или в сочетании с последующей медленной волной (так называемые пик-волновые комплексы)), подтверждают эпилептический характер припадков, хотя отсутствие таковых его не исключает. Данные изменения можно вызвать специальными методами провокации — гипервентиляцией, ритмической световой стимуляцией, введением коразола и др. Для диагностики эпилепсии как болезни существенны анамнестические данные: болезнь возникает, как правило, в детском, подростковом и юношеском возрасте, часто встречаются наследственное отягощение в семье, отягощенный акушерский анамнез, перенесенные нейроинфекции и черепномозговые травмы, пароксизмальные состояния в возрасте до 3 лет.
Лечение и профилактика Лечение проводится непрерывно и длительно. Подбор медикаментов и их дозировок должен быть индивидуальным в зависимости от особенностей припадков, их частоты, периодичности, возраста больного и др. Барбитураты могут быть назначены при всех видах припадков: фенобарбитал из расчета 2–3 мг/кг массы тела больного, бензонал — по 7—10 мг/кг, гексамидин — по 10–15 мг/кг в сутки. Максимальное влияние на судорожные формы припадков оказывают барбитураты, а также дифенин в дозе 5–7 мг/кг, карбамазепин (тегретол, стазепин, финлепсин) — по 8—20 мг/кг в сутки. При абсансах применяют этосуксимид (пикнолепсин, суксилеп) и близкий к нему по структуре пуфемид — по 10–30 мг/кг, триметин — по 10–25 мг/кг, клоназепам (антелепсин, ривотрил) — по 0,05—0,15 мг/кг в сутки. При парциальных бессудорожных припадках (психомоторные, психосенсорные) наиболее эффективен карбамазепин и производные бензодиазепина (диазепам, нитразепам) в сочетании с барбитуратами. Производные вальпроевой кислоты (конвулекс, ацедипрол и др.) можно отнести к антиэпилептическим средствам резерва, так как они могут действовать при всех видах припадков, однако максимальный эффект оказывают при абсансах и генерализованных припадках без фокального начала. Дозы варьируют в широких пределах — от 15 до 40 мг/кг и более в сутки. Во избежание токсических эффектов при полипрагмазии необходим пересчет антиэпилептических препаратов на фенобарбиталовый коэффициент. Он составляет для фенобарбитала условную единицу, дифенина — 0,5; бензонала — 0,5; гексамидина — 0,35; карбамазепина — 0,25; этосуксимида — 0,2; триметина — 0,3; вальпроевой кислоты — 0,15. Суммарная доза в условном пересчете на фенобарбитал не должна превышать 0,5–0,6 в сутки. Необходим систематический контроль за состоянием больных (исследование крови и мочи не реже 1 раза в месяц); при появлении признаков интоксикации (головная боль, нарушения сна, головокружение, изменения в крови и др.) дозы лекарств временно уменьшают, дополнительно назначают поливитамины и антигистаминные препараты (тавегил и др.). При появлении осложнений, таких как гемералопия (триметин), гиперпластический гингивит (дифенин), тяжелые диспепсические проявления (этосуксимид), мегалобластическая или апластическая анемия, панцитопения, токсический гепатит (гексамидин, фенобарбитал, дифенин, триздетин, карбамазепин, этосуксимид) и другие, — соответствующие препараты приходится отменять. Всякие изменения в лечении противоэпилептическими препаратами должны проводиться осторожно и постепенно. Наряду с медикаментозной терапией в зависимости от выявленных и лежащих в основе заболевания изменений проводят курсовое лечение средствами рассасывающего, дегидратационного, сосудистого действия. Критерием отмены противоэпилептического лечения является не менее чем трехлетняя ремиссия при благоприятной динамике ЭЭГ. Препараты отменяют постепенно в течение 1–2 лет (нельзя отменять в пубертатном периоде!). Безуспешность длительного консервативного лечения вынуждает решать вопрос о хирургическом лечении эпилепсии. При эпилепсии могут возникать ургентные состояния, требующие немедленных действий в связи с острой угрозой для здоровья и жизни больного или его окружающих. Таковыми являются эпилептический статус (серия припадков, чаще больших судорожных, между которыми сознание полностью не восстанавливается) и острые психотические состояния. При эпилептическом статусе необходимо удалить инородные предметы из полости рта, ввести воздуховод, сделать внутривенно инъекцию 10 мг диазепама в 20 мл 40 %-ного раствора глюкозы или внутримышечно 5—10 мл 10 %-ного раствора тиопентала натрия либо гексенала. Больных направляют в реанимационное отделение многопрофильных больниц, где в случае продолжения припадков им проводят длительный дозированный наркоз. При некупируемом статусе осуществляется сверхдлительный наркоз закисно-азотно-кислородной смесью на мышечных релаксантах и управляемом дыхании, регионарная краниоцеребральная гипотермия. Обязательна коррекция метаболических нарушений. При острых психотических состояниях, протекающих с расстройством сознания или без них (дисфории, сумеречные состояния и др.), следует применить нейролептики — трифтазин внутримышечно по 1–2 мл 0,2 %-ного раствора, левомепромазин (тизерцин) по 1–3 мл 2,5 %-ного раствора внутримышечно с 0,5 %-ным раствором новокаина или с 20–40 %-ным раствором глюкозы внутривенно, галоперидол по 1 мл 0,5 %-ного раствора внутримышечно и др. При тяжелых депрессиях вводят антидепрессанты — мелипрамин по 2 мл 1,25 %-ного раствора внутримышечно, амитриптилин внутримышечно или медленно внутривенно по 2–4 мл 1 %-ного раствора. Инъекции препаратов повторяют при необходимости несколько раз в сутки. Все указанные средства применяют только в сочетании с антиэпилептическими препаратами. Профилактика включает превентивное противоэпилептическое лечение детей, перенесших перинатальные поражения мозга, — при наличии изменений ЭЭГ или характерных клинических данных (ночные страхи, фебрильные припадки и др.), а также лиц с черепно-мозговой травмой в прошлом.
ЭПИСПАДИЯ
ОпределениеЭписпадия — врожденная аномалия мочеполового тракта, представляет собой незаращение части или всей передней стенки мочеиспускательного канала, при этом наружное отверстие мочеиспускательного канала находится на верхней стенке полового члена.У женщин эписпадия сочетается с пороками развития клитора и мочевого пузыря.
Этиология и патогенез Эписпадия встречается с частотой 1 случай на 50 тыс. новорожденных, у мальчиков в 5 раз чаще, чем у девочек. Эписпадия связана с нарушением развития половых органов во время внутриутробного развития, причина неизвестна.
Клиническая картина Характерным для эписпадии является расположение наружного отверстия мочеиспускательного канала у мужчин. У женщин отмечается раздвоенный клитор, широкий мочеиспускательный канал и несформированная шейка мочевого пузыря. Почти у всех девочек и у большинства мальчиков отмечается недержание мочи. Очень часто у больных с эписпадией отмечается недоразвитие мочевого пузыря и пузырно-мочеточниковый рефлюкс — обратный заброс мочи из мочевого пузыря в мочеточники, что способствует развитию пиелонефрита.
Лечение Лечение только хирургическое. У мужчин выполняется пластика мочеиспускательного канала. У женщин производят пластику клитора и реконструкцию шейки мочевого пузыря.
ЭПИТИМПАНИТ
ОпределениеЭпитимпанит — хроническое гнойное воспаление слизистой верхней части барабанной полости.
Этиология Хронический эпитимпанит чаще всего является следствием острого. О переходе острого воспаления барабанной полости в хроническое говорят, если оно продолжается более 6 месяцев. В редких случаях воспаление с самого начала приобретает хронический характер, что свойственно туберкулезу.
Клиническая картина Эпитимпанит характеризуется тяжелым по сравнению с мезотимпанитом течением, что связано с поражением слуховых косточек, стенок барабанной полости, внутреннего уха. Основной признак эпитимпанита — длительно не заживающая перфорация в верхних отделах барабанной перепонки. Кроме этого больные жалуются на боль в теменно-затылочной области, ощущение распирания в ухе, связанное со скоплением гноя в барабанной полости. Если в процесс вовлекаются костные стенки барабанной полости, то гной приобретает зловонный запах. Через некоторое время снижается слух, что связано с разрушением слуховых косточек.
Лечение Необходимо лечение очагов хронической инфекции в организме и хирургическое закрытие перфорации барабанной перепонки в сочетании с тщательным уходом за наружным слуховым проходом: промывание перекисью водорода, борным спиртом, альбуцидом; антибиотики в виде мазей; гидрокортизон, преднизолон, флуцинар в наружный слуховой проход.
ЭРИЗИПЕЛОИД
ОпределениеЭризипелоид — острая инфекционная болезнь, характеризующаяся преимущественным поражением кожи и суставов.
Этиология и эпидемиология Возбудитель относится к семейству коринебактерий и представляет собой короткую палочку, грамположительную, неподвижную; спор и капсул не образует. Возбудитель обладает высокой устойчивостью во внешней среде, в трупах животных сохраняется в течение 3–4 месяцев. Источником и резервуаром инфекции служат свиньи, овцы, крупный рогатый скот, куры, утки, рыбы, раки. Заболевание распространено среди мясников, животноводов, рыбаков, охотников. Заражение происходит через повреждения на коже при контакте с инфицированным мясом. Больные люди не опасны для окружающих.
Патогенез Воротами инфекции служат мелкие повреждения кожи, в воспалительный процесс могут вовлекаться также суставы. У отдельных больных, при пониженной иммунологической реактивности, может наступить диссеминация инфекции с формированием очагов в эндокарде, миокарде, легких. Эндокардит сопровождается разрушением клапанов сердца. Перенесенная инфекция оставляет нестойкий иммунитет.
Клиническая картина и диагностика Различают кожную, суставную, генерализованную (септическую) и ангинозную формы эризипелоида. Кожная форма встречается чаще всего, характеризуется тем, что в месте внедрения инфекции появляется красно-фиолетовая, отечная бляшка, четко отграниченная от окружающей неизмененной кожи. Отечность более выражена по периферии, центр несколько бледнее и менее возвышается над поверхностью кожи. Больные отмечают зуд, жжение, пульсирующую боль. Бляшка быстро увеличиваются, в среднем на 2–3 см в сутки. Кожная форма длится около 10–12 дней, оставляя после себя легкое шелушение кожи. При суставной форме кроме кожи в воспалительный процесс вовлекаются суставы. Чаще всего поражаются суставы пальцев кисти, они отечны и болезненны. Симптомы интоксикации выражены незначительно, больные могут предъявлять жалобы на головную боль, снижение аппетита, температура тела обычно субфебрильная. Эта форма длится в течение нескольких недель и при неблагоприятном течении приводит к деформации суставов. У небольшой части больных болезнь принимает хроническое рецидивирующее течение и продолжается от 6 до 12 месяцев. Генерализованная (септическая) форма возникает у ослабленных людей. Заболевание начинается остро, сопровождается лихорадкой с повышением температуры тела до 40 °C, выраженной интоксикацией, нарушением сознания. На коже появляются эритематозные поля. При обследовании внутренних органов отмечается увеличение печени и селезенки. На этом фоне выявляются многочисленные вторичные очаги в эндокарде, миокарде, головном мозге. Ангинозная форма развивается при употреблении инфицированных пищевых продуктов. Болезнь начинается с повышения температуры тела, озноба, болей в горле. При осмотре отмечается гиперемия небных миндалин, дужек и мягкого неба. Лабораторным подтверждением диагноза служит выделение возбудителя из отечной жидкости, кусочка биопсированной кожи. Для посева используют желчный или слабощелочной мясопептонный бульон.
Лечение и профилактика При лечении используются: — пенициллин — по 300 тыс. ЕД через 4–6 ч в течение 7 дней; — эритромицин — по 15 мг/кг в сутки в течение 5–7 дней. При лечении септических форм и эндокардита дозу пенициллина увеличивают до 12–20 млн ЕД в сутки, лечение продолжают 4–6 недель. При артритах показано наложение гипсовой лонгеты в функционально выгодном положении. Профилактика эризипелоида состоит в выявлении больных домашних животных, вакцинации. Необходимо соблюдение мер личной профилактики при обработке мяса и уходе за животными. Специфическая профилактика эризипелоида у людей не разработана.
ЭХИНОКОККОЗ
ОпределениеЭхинококкоз — это заболевание, возбудителем которого является личиночная стадия цепня эхинококкус гранулеза.
Этиология Половозрелая форма гельминта — цестода длиной 2–7 мм, имеющая головку с 4 присосками и двойной короной из 35–40 крючьев, шейку и 2–6 члеников. Личиночная стадия, растущая в организме человека десятки лет, представлена кистой (см.) круглой или овальной формы, заполненной жидкостью.
Эпидемиология, патогенез и патанатомия Эхинококкоз — заболевание, которое распространено в странах с развитым пастбищным скотоводством (Южная Америка, Северная Африка, Австралия, Новая Зеландия). На территории стран СНГ заболевание чаще регистрируется в Молдавии, республиках Закавказья и Средней Азии, в Киргизии, Украине, Белоруссии. Основной источник заражения — домашние собаки, реже волки и шакалы, в тонкой кишке которых паразитируют половозрелые формы. Зрелые яйца выделяются с фекалиями животных, загрязняя их шерсть и окружающую среду. Промежуточными хозяевами эхинококка являются овца, буйвол, верблюд, лошадь, свинья, заяц, человек. Заражение человека происходит при контакте с зараженными животными, при сборе ягод и трав, питье воды из загрязненных яйцами гельминта источников. В желудочно-кишечном тракте человека онкосферы эхинококка освобождаются от оболочки, а выделившиеся личинки внедряются в кровеносные сосуды и разносятся током крови. Большая часть личинок задерживается в печени, некоторые из них попадают в легкие. Незначительная часть проходит легочный фильтр и попадает в почки, кости и мозг. В печени к концу 5-го месяца вокруг кисты формируется фиброзная (соединительнотканная) капсула. Эхинококковый пузырь имеет сложное строение. Наружная оболочка состоит из множества концентрических пластинок, не содержащих клеток, что важно для диагностики. Внутри первичного (материнского) пузыря нередко формируются вторичные и третичные пузыри. В пораженном органе может развиваться одна киста (см.) или несколько (множественный эхинококкоз), размеры кист значительно варьируют — от 1–5 до 40 см и более в диаметре. Эхинококковая киста растет экспансивно, раздвигая и сдавливая ткани хозяина, которые атрофируются и омертвевают. Паразитарные антигены оказывают сенсибилизирующее действие, особенно выраженное при множественном эхинококкозе. При этом иммунная система хозяина не в состоянии полностью уничтожить гельминт, что связано с наличием у эхинококка ряда приспособительных механизмов. Проявления сенсибилизации (повышенной чувствительности) лежат в основе анафилактического шока (см.), возникающего при разрыве эхинококковой кисты.
Клиническая картина и диагностика Эхинококкоз чаще выявляется у лиц среднего возраста. Болезнь в неосложненных случаях протекает годами и может быть выявлена случайно (при плановой флюорографии) или при целенаправленном обследовании (в очагах) при отсутствии клинических проявлений (доклиническая стадия эхинококкоза). В клинически выраженной стадии течение эхинококкоза зависит от локализации кист (см.), их размеров, скорости развития, осложнений, вариантов сочетанного поражения органов, реактивности организма хозяина.
Частота заболевания эхинококком по органам и тканям
Вид больного с эхинококком печени
Эхинококк легкого
Беременность (см.), тяжелые заболевания, алиментарные нарушения (расстройства пищеварения) способствуют более тяжелому течению болезни, быстрому росту кист, склонности к разрывам и диссеминации (распространению) возбудителя. При локализации кисты в правой доле печени болевой синдром сходен с таковым при холецистите (см.). Отмечаются похудение, снижение аппетита, при локализации в левой доле появляются изжога, отрыжка, рвота. При поверхностной локализации кисты она может пальпироваться. В запущенных случаях нарушается белково-синтетическая функция печени — диспротеинемия со снижением альбуминов, протромбина и ростом гаммаглобулинов. Проявления эхинококкоза легких определяются локализацией кисты. Даже небольшая киста, расположенная вблизи плевры, рано проявляет себя болевым синдромом, а при локализации у бронхиального ствола клинические симптомы проявляются кашлем (см.) и сосудистыми расстройствами. Эхинококкоз почек нередко диагностируется лишь при выделении эхинококков с мочой. Обнаружению обрывков сколексов в осадке мочи могут предшествовать тянущая боль в поясничной области и дизурические расстройства — боль и рези при мочеиспускании. Значительно реже встречаются эхинококкоз головного мозга, средостения, молочной железы, кишечника, крайне редко — костей и подкожной клетчатки. Осложнения при эхинококкозе встречаются часто и иногда являются первым клиническим проявлением заболевания. Нередки нагноения кисты (присоединение вторичной бактериальной флоры при гибели эхинококка), сопровождающиеся усилением боли, лихорадкой, лейкоцитозом. Возможны холангиты, вскрытие кисты в брюшную и плевральную полость с развитием перитонита (см.) и плеврита (см.). Сдавливание желчных протоков приводит к механической желтухе (см.), реже — к билиарному циррозу (см.), амилоидозу (см.). При сдавлении сосудов портальной системы возникают признаки портальной гипертензии (повышенное давление в системе воротной вены). Эхинококкоз легких может осложняться повторными легочными кровотечениями, острой сердечно-сосудистой недостаточностью (см.). Наиболее грозным осложнением является разрыв кисты, который может быть спровоцирован ударом, поднятием тяжестей, грубой пальпацией. Разрыв кисты сопровождается резким болевым синдромом и проявлениями аллергической реакции различной степени выраженности вплоть до развития анафилактического шока (см.). Диагностика эхинококкоза на начальных стадиях затруднена из-за стертости и неспецифичности клинических проявлений и основывается на анализе данных клинических, радиоизотопных, лучевых и иммунологических исследований. Наличие в анамнезе (истории жизни и болезни) операций по поводу эхинококкоза, заболевания эхинококкозом другого члена семьи позволяют предположить вероятный диагноз. Лучевые (рентгенологические), радиоизотопные (сканирование, сцинтиграфия) методы обследования, УЗИ и особенно компьютерная томография и методики с использованием магнитноядерного резонанса (ЯМР) позволяют оценить распространенность процесса. В некоторых случаях показана диагностическая лапароскопия (пунктировать кисту нельзя из-за опасности диссеминации). Дифференцировать эхинококкоз чаще всего приходится с новообразованиями соответствующих органов. Решающая роль принадлежит иммунологическим методам, информативность которых достигает 90–97 %. Внутрикожную пробу с эхинококковым антигеном (реакция Касони) проводить нецелесообразно ввиду частого развития тяжелых аллергических реакций, особенно при повторных исследованиях.
Лечение и профилактика При неосложненном эхинококкозе печени возможно медикаментозное излечение: альбендазол (зентел) в дозе 10 мг/кг в сутки; дозу разделяют на два приема, лечение проводят в течение 3 месяцев. При рецидиве или распространенном процессе показано оперативное лечение. Одиночная киста может быть удалена или дренирована под контролем УЗИ с введением 95 %-ного этилового спирта с мебендазолом. Все больные находятся на диспансерном наблюдении. После операции 1–2 раза в год они проходят обследование, которое включает общий анализ крови и мочи, определение в сыворотке крови билирубина, АлАТ, АсАТ, оценку протеинограммы, серологическое исследование (ИФА), УЗИ (компьютерная томография). При отсутствии признаков рецидива и стойких отрицательных серологических реакций в течение 5 лет больные могут быть сняты с учета. Профилактика эхинококкоза заключается в тщательном соблюдении правил личной гигиены при уходе за животными и сборе ягод, выбраковке и уничтожении туш домашних животных, зараженных эхинококкозом. Ветеринарно-санитарные организации должны вести строгий контроль за убоем скота с уничтожением пораженных эхиннококками органов.
ЭШЕРИХИОЗЫ
ОпределениеЭшерихиозы — группа инфекционных болезней, вызываемых условно-патогенными или патогенными типами кишечной палочки, протекающих с преимущественным поражением желудочно-кишечного тракта, интоксикацией, лихорадкой. У больных со сниженной иммунной реактивностью, страдающих тяжелыми хроническими заболеваниями, патогенные кишечные палочки могут вызывать развитие сепсиса. Эшерихиозы наблюдают чаще всего у детей раннего возраста.
Этиология и патогенез Большинство инфекций вызывает эшерихия коли, реже — эшерихия фергюсони, эшерихия германи и эшерихия вульнерис. Патогенные свойства связаны со способностью эшерихии коли выделять токсины и проникать в клетки слизистой оболочки кишечника. Морфологические различия между патогенными и непатогенными кишечными палочками отсутствуют, их дифференцировка основана на наличии особых поверхностных антигенов. По структуре антигенов выделяют четыре основные группы патогенных эшерихий: — энтеропатогенная группа — основные возбудители диарей у детей; патогенез поражений обусловлен способностью бактерии прикрепляться к эпителию кишечника и повреждать микроворсинки; — энтероинвазивная группа — вызывают развитие воспалительных изменений в слизистой оболочке толстой кишки; по своим свойствам сходны с шигеллами; — энтеротоксигенная группа — возбудители холероподобной диареи; факторы патогенности — устойчивый энтеротоксин, сходный по структуре с холерным; — энтерогеморрагическая группа — вызывают гемморагическую диарею; образуют цитотоксин, аналогичный токсину шигелла дизентериа.
Эпидемиология Основной механизм распространения диареегенных эшерихий — фекально-оральный. Наиболее часто человек заражается при употреблении загрязненной пищи и воды. В стационарах и закрытых коллективах большое значение имеет контактный путь передачи инфекции. В странах с умеренным климатом большинство заражений регистрируется в теплый сезон.
Клиническая картина и диагностика Патогенные кишечные палочки вызывают развитие воспалительного процесса преимущественно в тонкой и толстой кишке — энтероколит. Особенно часто заболевание развивается у новорожденных и детей первого года жизни. Основные клинические проявления инфекции — выраженные боли в животе, рвота, жидкий стул. В среднем заболевание продолжается около 2 недель. Вместе с тем клиническая картина эшерихиоза, вызываемого разными группами, имеет свои особенности. Энтероинвазивные кишечные палочки вызывают поражение преимущественно толстой кишки, характеризующееся выраженными болями в животе и примесью крови. При лабораторном исследовании кала обнаруживается большое количество нейрофилов. Энтеротоксигенные кишечные палочки вызывают развитие холероподобных форм кишечных инфекций с обильным водянистым стулом. Энтерогеморрагические эшерихии вызывают диарею с примесью крови и тромбоцитопеническую пурпуру. При этом в лабораторном анализе стула отсутствуют лейкоциты. Материал для исследования — кал, рвотные массы, промывные воды желудка, при внекишечной локализации — кровь, спинномозговая жидкость, моча, мокрота. Бактериологический анализ основан на определении антигенных свойств.
Лечение и профилактика При лечении необходимы: — восстановление водно-электролитного баланса; при легком течении болезни жидкость вводят перорально, при развитии выраженного обезвоживания — внутривенно; — препараты лакто- и бифидобактерий. При тяжелом течении назначают антибиотики, преимущественно аминогликозиды: мономицин детям по 10–25 тыс. ЕД в сутки 4 раза, взрослым — по 250 тыс. ЕД 4 раза в день. Лечение длится 5–7 дней. Профилактика состоит в выявлении и изоляции больных эшерихиозами, периодическом обследовании персонала больниц на носительство патогенных форм кишечной палочки, соблюдении правил личной гигиены.
♦ Я ♦
ЯЗВЕННАЯ БОЛЕЗНЬ
ОпределениеЯзвенная болезнь — хроническое рецидивирующее заболевание, при котором нарушается регуляция питания и самовосстановления гастродуоденальной зоны, характеризующееся возникновением пептической язвы в желудке или двенадцатиперстной кишке.Язвенная болезнь имеет широкое распространение (7—10 % всего взрослого населения), ею чаще страдают мужчины от подросткового до среднего возраста. Заболевание отличается выраженной сезонностью обострений.
Этиология и патогенез Язвенная болезнь — заболевание многофакториальной природы. В настоящее время его развитие связывают с бактериями Хеликобактер пилори и внутренним нарушением соотношения местных факторов агрессии и защиты. Среди агрессивных факторов выделяют усиление выработки соляной кислоты и пепсина, неадекватную реакцию железистых элементов слизистой оболочки желудка в ответ на нервные и гуморальные влияния, вызывающие повышенное кислотообразование и гипергастринемию и быструю эвакуацию кислого содержимого в луковицу двенадцатиперстной кишки («кислотный удар» по слизистой оболочке). Кроме того, подавлению защитных факторов способствуют желчные кислоты, алкоголь, никотин, лекарственные препараты (нестероидные противовоспалительные средства, глюкокортикоиды), а также хеликобактерная инвазия. Следует отметить, что уровень кислотовыделения не определяет особенности течения и характер осложнений заболевания, но является необходимым условием, на фоне которого реализуются остальные патогенетические (связанные с механизмом развития) факторы. К защитным факторам относят желудочную слизь, секрецию щелочного бикарбоната, интактный кровоток (микроциркуляцию в гастродуоденальной зоне), регенерацию клеточных элементов и синтез некоторых простагландинов. У здорового человека защитные факторы всегда превалируют над факторами агрессии, тогда как снижение pH желудочного содержимого менее 1,5 нарушает равновесие в пользу агрессивных факторов. Хеликобактер пилори является условнопатогенной бактерией, обладающей подвижностью за счет жгутиков и способностью существовать под слизью, которая покрывает слизистую оболочку желудка. Бактерия продуцирует уреазу, способствующую нейтрализации ионов водорода, которая оказывает токсическое действие на эпителий желудка и усиливает воспалительную реакцию слизистой оболочки. Сложная патогенетическая цепочка в конечном итоге приводит к резкому снижению кровотока в сосудах слизистой желудка и нарушению физиологической и репаративной регенерации слизистой. По различным данным, хеликобактерную бактерию выявляют у 60–98 % больных язвенной болезнью двенадцатиперстной кишки и у 40–60 % больных язвенной болезнью желудка. При язвенной болезни наблюдаются различные обменные нарушения, определяющие интенсивность процессов восстановления в зоне желудка и двенадцатиперстной кишки, дисбаланс нуклеиновых кислот, нарушение окислительно-восстановительных процессов, выраженные трофические нарушения, нарушения белкового обмена на разных его стадиях. В качестве факторов возникновения язвенной болезни и механизма ее развития нельзя не учитывать психологические особенности склада личности, ее реакции на стрессорные агенты. В связи с этим полностью обоснован взгляд на язвенную болезнь как на психосоматическое заболевание, чем и объясняются ее своеобразие и неоднородность. Развитие язвенной болезни вскоре приводит к появлению ее «психического обрамления», реакций дезадаптации в ответ на действие стрессорного агента, что формирует психосоматический цикл, сходный с таковым при язвенной болезни.В возникновении язвенной болезни имеет значение и наследственный фактор (среди родственников больных обычно имеются лица, также страдающие язвенной болезнью; у больных чаще определяется 0 группа крови, наследственно обусловленная повышенная продукция соляной кислоты за счет увеличения количества обкладочных клеток и др.). Помимо язвенной болезни, к дефектам слизистой могут приводить заболевания печени и сердечно-сосудистой системы (острый инфаркт миокарда (см.), сердечная недостаточность (см.)), острое нарушение мозгового кровообращения, атеросклероз (см.) сосудов брюшной полости. Медикаментозные язвы развиваются после приема аспирина, стероидных гормонов, нестероидных противовоспалительных средств.
Клиническая картина Единой классификации язвенной болезни в настоящий момент не существует, но в клинической практике выделяют язвенную болезнь желудка и двенадцатиперстной кишки, ассоциированную или неассоциированную с хеликобактерной бактерией; медикаментозные и симптоматические язвы. Симптоматика язвенной болезни зависит от локализации язвенного дефекта. Язвы субкардиального (верхнего) отдела желудка встречаются у лиц старше 50 лет. Боли возникают сразу после еды в районе мечевидного отростка, иногда отдают в область сердца, что требует проведения ЭКГ. Отмечаются упорная изжога, отрыжка пищей, обложенность языка. Именно при такой локализации язва часто осложняется кровотечениями (см.), пенетрацией (см.), плохо поддается медикаментозному лечению. Если в течение 3 месяцев язвенный дефект не исчезает, то прибегают к хирургическому вмешательству. Язвы угла и тела желудка встречаются наиболее часто. Боли возникают через 10–30 мин после еды, иногда отдают в спину, левую половину грудной клетки, за грудину, в левое подреберье. Часты изжога, отрыжка, тошнота, подчас больные сами вызывают у себя рвоту для облегчения самочувствия. Язык обложен густым серовато-белым налетом. Язвы антрального отдела желудка преобладают в молодом возрасте. Беспокоят «голодные» боли, изжога, иногда рвота кислым. Течение благоприятное, язва рубцуется в минимальные сроки. Язвы пилорического отдела желудка протекают тяжело. Боли резкие, в любое время суток, иногда постоянные, могут сопровождаться упорной рвотой, что приводит к отказу больных от пищи и похудению. Специфическим осложнением является сужение пилорического канала с нарушением прохождения пищи из желудка в двенадцатиперстную кишку. Язвы двенадцатиперстной кишки локализуются чаще в ее луковице (90 % случаев). Больных беспокоят изжога, «голодные» боли в ночные часы и спустя 3–4 ч после еды, которые локализуются обычно справа выше пупка, реже отмечаются в правом подреберье и стихают после приема пищи, особенно молока. Отмечаются упорная изжога и отрыжка кислым, часто наблюдается рвота кислым содержимым, приносящая облегчение, характерны запоры (см.). Постбульбарные язвы характеризуются упорными болями в мезогастральной и пилородуоденальной зонах спустя 3–4 ч после еды со смещением в спину, правое и левое подреберье, рвотой на высоте боли, которая не приносит облегчения, изжогой, запорами (см.). Нередко в процесс вовлекаются поджелудочная железа и желчные пути. Возможны кишечные кровотечения. Сочетанные язвы желудка и двенадцатиперстной кишки составляют примерно 20 % всех поражений. Причем первичным является язвенный дефект двенадцатиперстной кишки, а спустя некоторое время к нему присоединяется язва желудка, которая определяет дальнейшую клинику. При легком течении язвенной болезни обострения возникают не чаще 1 раза в 1–3 года, болевой и диспепсический (расстройство пищеварения) синдромы умеренно выражены, заживление язвенной поверхности наступает уже через 4–6 недель от начала лечения. Если рецидивы возникают 2 раза в год, то говорят о среднетяжелом течении, болевой и диспепсический синдромы в этом случае более выражены, заживление язвы наступает через 2,5 месяца. При тяжелом течении обострения возникают 3–4 раза в год, боли прекращаются спустя 10–14 дней от начала терапии, возможно присоединение осложнений.
Осложнения К осложнениям язвенной болезни относятся: кровотечение, перфорпация и пенетрация язвы, развитие перивисцерита, формирование рубцово-язвенного стеноза привратника, малигнизация язвы. Кровотечение (см.) является наиболее частым осложнением язвенной болезни. Иногда так удается диагностировать «немые» язвы. При обильном кровотечении появляется рвота с примесью крови темного цвета или цвета «кофейной гущи», бледность кожи, головокружения, коллапс (см.). Пациент нуждается в экстренной доставке в стационар. Желудочные кровотечения слабой интенсивности могут прекращаться самостоятельно, самочувствие не нарушается; о продолжающемся кровотечении свидетельствует мелена (черный дегтеобразный стул). Перфорация (прободение) язвы (см.) может развиться после употребления алкоголя, переполнения желудка едой, чрезмерного физического напряжения, травмы. Иногда перфорация язвы является первым проявлением язвенной болезни, особенно в молодом возрасте. Боли резкие, «кинжальные», выражена бледность кожных покровов, отмечается похолодание конечностей. Рвота бывает редко. Развивается коллапс (см.). Отмечается защитное напряжение мышц живота. Спустя несколько часов наступает мнимое улучшение самочувствия. Однако затем у больного развивается перитонит (см.), и его состояние начинает быстро ухудшаться. Пациент должен быть доставлен в стационар в первые часы заболевания, от этого зависит исход болезни. Пенетрация язвы (см.) происходит тогда, когда в результате длительного воспаления произошло сращение стенки желудка или двенадцатиперстной кишки с окружающими органами. Язва может пенетрировать (проникать) в поджелудочную железу, сальник. При этом развиваются ночные боли в верхней части живота, часто отдающие в спину. Несмотря на самую энергичную терапию, купировать боль не удается. Стеноз (сужение) привратника возникает в результате рубцевания язвы, расположенной в пилорическом отделе желудка. Незначительная степень стеноза проявляется периодической рвотой съеденной пищей, тяжестью в верхней части живота после еды. По мере его прогрессирования происходит: постоянная задержка части пищи в полости желудка, гниение и брожение, перерастяжение его стенок, определяется «симптом плеска». Пациенты истощены, нередко на поверхности живота можно наблюдать рельеф в форме «песочных часов».
Диагностика Диагностика язвенной болезни основывается как на данных объективного исследования и анамнеза, так и на данных лабораторных и инструментальных методов исследования. Прощупывание и простукивание выявляют болезненность в верхней части живота. Копрологическое исследование (исследование кала) выявляет наличие «скрытой крови». В общем анализе крови определяются иногда эритроцитоз, повышение уровня гемоглобина, замедление СОЭ. Кислотность желудочного сока, определяемая методом pH-метрии, при язве желудка обычно нормальная или слегка снижена, а при язвенной болезни двенадцатиперстной кишки повышена. Рентгенологически при открытой язве определяются симптом «ниши» или «депо» контрастного вещества, а также расстройства сократительной функции желудка в виде спазма привратника, нарушения тонуса и перистальтики желудка. Окончательный диагноз подтверждается гастроскопией. Гастроскопическая картина: язва соответствующей локализации, с высокими ровными краями, выраженным перифокальным воспалением; региональная слизистая оболочка отечна и разрыхлена. Наблюдается заметная гиперемия (покраснение). В биоптате (фрагменте ткани слизистой, взятом на анализ) обнаруживаются некротический детрит, разрушенные нейтрофилы, эритроциты, коллагеновые волокна. Диагностика субкардиальной язвы желудка требует сочетания рентгенографии и гастроскопии в связи с трудностью осмотра данного участка желудка из-за его анатомического расположения. В программу обследования больного обязательно должны входить двукратное исследование на НР (дыхательный тест и клеточное исследование образца ткани слизистой оболочки желудка) — до лечения и после него; ультрасонография печени, желчного пузыря и поджелудочной железы; биохимический анализ крови (печеночные пробы); электрокардиография. При наличии сопутствующей патологии необходимо соответствующее дообследование.
Лечение Лечение больных язвенной болезнью желудка и двенадцатиперстной кишки в фазе обострения заболевания при отсутствии осложнений можно проводить в амбулаторных условиях с освобождением больного от работы или без него, но с обязательным выполнением общих рекомендаций: исключение ульцерогенных препаратов (т. е. способствующих формированию язвы), прекращение курения и злоупотребления алкоголем. При выраженном болевом синдроме питание: в первую неделю назначают диету № 1а и 1б. При легком течении обострения показана диета № 1. Питание дробное, 5–6 раз в сутки. Из пищи исключают все экстрактивные вещества. Супы лучше давать протертые вегетарианские или молочные. Отварное мясо и рыба должны быть в виде паровых котлет, тефтелей, фарша. Через 1–2 недели при улучшении состояния мясо и рыбу можно употреблять куском, но хорошо проваренным. Из других блюд рекомендуются яйца всмятку, овощи протертые в тушеном виде, кисели из сладких ягод, печеные или тертые сырые сладкие яблоки, черствый белый хлеб или сухое галетное печенье, протертые жидкие каши, молоко, сливки, сливочное масло. Комплексная терапия острой язвы желудка и двенадцатиперстной кишки строится в зависимости от локализации, возраста больного, особенностей желудочной секреции, наличия или отсутствия хеликобактерной инфекции, сопутствующих заболеваний. Схема лечения для каждого больного подбирается индивидуально. В целях эрадикации НР применяют три или четыре базисных препарата, сочетание которых может широко варьировать. При дуоденальной (в двенадцатиперстной кишке) локализации язвы предпочтение следует отдавать сочетанию одного-двух антибиотиков и блокаторов «протонной помпы», тогда как при обнаружении язвенного дефекта в желудке лучше использовать антибиотики и Н2-гистаминоблокаторы. Показаниями для профилактики хеликобактерной инфекции, определенными в Маастрихтском консенсусе 2-2000, являются язвенная болезнь в любые периоды обострения или ремиссии, атрофический гастрит (см.), состояние после резекции желудка по поводу рака (см.) желудка, наличие рака желудка у родственников в прошлом. Наиболее эффективными считают амоксициллин в дозе 1 г 2 раза в сутки, кларитромицин — по 500 мг 2 раза в сутки, тетрациклин — по 1 г 2 раза, блокаторы протонной помпы (омепразол, рабепрозол) — по 20 мг 2 раза. Если профилактика уже проводилась ранее, в схему включают не менее 4 препаратов, причем очень эффективны препараты висмута, которые можно назначать и при «тройной» терапии, если назначение двух антибиотиков нежелательно. Предпочтительнее назначать больным Щ-гистаминоблокаторы последних генераций (ранитидин, низатидин, роксатидин), так как циметидин вызывает большое количество побочных эффектов. В качестве симптоматической терапии при наличии болевого синдрома показаны препараты из группы холинолитиков (атропин, платифиллин, метацин) или спазмолитиков (но-шпа, папаверин). Следует помнить, что холинолитики противопоказаны в пожилом возрасте, при глаукоме (см.) и аденоме (см.) простаты. Препараты антацидного и антисекреторного действия показаны при язвенной болезни двенадцатиперстной кишки почти во всех случаях, а при язве желудка — в том случае, если кислотность нормальная или повышена. Среди средств, подавляющих секрецию (выделение) соляной кислоты, в последнее время широко применяют М-холинолитик гастроцепин по 1 таблетке 2 раза в сутки, антацид маалокс по 1–2 таблетки через 1,5 ч после еды. После рубцевания язвы при повышенной или нормальной кислотности для профилактики обострения рекомендуется один из этих препаратов или Н2-гистаминоблокатор в поддерживающих дозах на ночь в течение от нескольких месяцев до года. Назначаются ретаболил, метилурацил, аллантон, актовегил, джефарнил, солкосерил непродолжительными курсами и в зависимости от сопутствующих заболеваний. Так, солкосерил имеет смысл применять при наличии сосудистой патологии. Де-нол и сукральфат (вентер) не рекомендуется сочетать с алмагелем. Препараты, содержащие висмут (викалин, викаин, де-нол), применяют с осторожностью при наличии сопутствующего поражения почек. Поскольку роль психических факторов в возникновении и развитии язвенной болезни надежно доказана, терапевтическое воздействие следует направлять также на стабилизацию психоэмоциональной сферы пациента. Можно рекомендовать посещение психотерапевта, занятия аутотренингом, в тяжелых случаях используются транквилизаторы дневного типа. Среди методов физиотерапевтического воздействия хороший эффект оказывают КВЧ-терапия, озокеритные и парафиновые аппликации. Хирургическое лечение язвенной болезни проводится в случаях рефрактерности язвы к консервативной терапии (отсутствие эффекта от различных комбинаций препаратов в течение 3 месяцев), рецидивах обострений более 2 раз в год и при развитии любых осложнений (за исключением кровотечений незначительного объема, прекращающихся самостоятельно). При язвах желудка выполняют вмешательство в объеме субтотальной (неполной) резекции желудка. При дуоденальной локализации язвы можно применять ваготомию в сочетании с антрэктомией (низкий процент рецидивов, но частые послеоперационные осложнения) или пилоропластикой, а также изолированную ваготомию (проксимальную или селективную), при которой практически не бывает осложнений, но возможны рецидивы. К послеоперационным осложнениям относят болезнь оперированного желудка, синдром мальабсорбции (см.), железо-, фолиево- и В12-дефицитные анемии (см.), остеопороз (см.) и остеомаляцию вследствие недостаточного всасывания кальция и витамина D, а также язвы и карциномы (см.) культи желудка.
ЯЧМЕНЬ
ОпределениеЯчмень — острое гнойное воспаление волосяного мешочка или сальной железы края века, расположенной у корня ресницы. Возбудителем чаще всего является представитель гноеродной флоры, преимущественно стафилококк. Инфицированию способствуют закупорка выводного протока железы секретом, а также снижение общей сопротивляемости организма и сахарный диабет (см.).
Клиническая картина Характеризуется появлением отграниченной, резкой болезненной припухлости вблизи края века, которая сопровождается отеком и покраснением его кожи и (нередко) конъюнктивы. Воспалительное образование довольно быстро увеличивается, а спустя 2–4 дня подвергается гнойному расплавлению, что можно определить по появлению желтой головки на верхушке ячменя. На 3—4-й день его содержимое (гной, омертвевшие ткани) прорывается наружу, после чего болезненность сразу уменьшается, а воспалительные явления стихают. Отечность и покраснения кожи исчезают примерно к концу недели. В некоторых случаях воспалительное образование состоит из нескольких близко расположенных или слившихся головок. В таких случаях ячмень может протекать на фоне явлений интоксикации, высокой температуры, регионарного лимфаденита (см.). Сходная клиническая картина наблюдается при остром гнойном воспалении мейбомиевой железы — мейбомите, однако прорыв гноя происходит обычно со стороны конъюнктивы и хряща, после чего нередко разрастаются грануляции (соединительная ткань). У лиц с пониженной резистентностью организма ячмень склонен к рецидивированию и часто сочетается с фурункулезом (см.). Ячмень может осложниться флегмоной (см.) орбиты, тромбофлебитом (см.) орбитальных век, гнойным менингитом (см.), что чаще всего связано с попытками выдавить из него гной.
Лечение Местно применяют сухое тепло, УВЧ. В конъюнктивальный мешок 2–3 раза в день закапывают 20 %-ный раствор альбуцида, 1 %-ный раствор эритромицина, 0,1 %-ный раствор дексаметазона. Участок инфильтрации (воспаления) на коже века смазывают 1 %-ным спиртовым раствором бриллиантового зеленого. После вскрытия ячменя за веки 2 раза в день закладывают 20 %-ную альбуцидную мазь (сульфацил-натрий), 1 %-ную синтомициновую эмульсию, 1 %-ную тетрациклиновую мазь, 1 %-ную эмульсию гидрокортизона, 1 %-ную желтую ртутную мазь. Если заболевание сопровождается явлениями интоксикации, внутрь назначают сульфаниламидные препараты по 1 г 4 раза в день либо антибиотики тетрациклинового ряда (биомицин по 100 тыс. ЕД 4–6 раз в день, тетрациклин или террамицин по 0,25 г 3–4 раза в день). При рецидивирующих ячменях пациенту показано тщательное обследование (иммунный статус, определение глюкемии, толерантности к глюкозе и др.) для выявления причины заболевания. Назначают курсы антибиотикотерапии, витаминотерапию, иногда повторные переливания консервированной крови и аутогемотерапию (переливание собственной крови).
ЯЩУР
ОпределениеЯщур (рыльно-копытная болезнь) — острое вирусное заболевание из группы зоонозов (инфекционных болезней животных, которыми болеет также и человек), характеризующееся интоксикацией и везикулезноэрозивным (пузырьково-язвенным) поражением слизистых оболочек ротовой и носовой полостей, а также кожи межпальцевых складок и околоногтевого ложа.
Этиология и эпидемиология Возбудителем ящура является РНК-содержащий вирус, его размеры составляют от 8 до 20 нм. Характеризуется высокой степенью болезнетворности и дерматотропностью (сродством по отношению к коже). По антигенной структуре подразделяется на 7 серотипов, в каждом из которых различают несколько антигенных вариантов. На территории СНГ обычно встречаются вирусы типов О и А. Возбудитель ящура устойчив к высушиванию и замораживанию, но быстро погибает при нагревании до 60 °C, действии ультрафиолетовых лучей и обычных дезинфектантов. Вирусы культивируют на тканевых культурах. Ящур довольно широко распространен среди животных. В ряде стран заболевание носит характер эпизоотий (эпидемий среди животных), повторяющихся через определенные промежутки времени. Эпизоотия ящура имела место в 2001 г. в странах Северной Европы (в основном в Великобритании и Голландии). Наиболее подвержены инфекции молодые парнокопытные сельскохозяйственные животные (крупный рогатый скот, свиньи, козы, овцы, олени). От нее могут страдать также лошади, верблюды, собаки, кошки и грызуны. У животных, перенесших заболевание, и некоторых птиц установлено вирусоносительство, проявляющееся выделением возбудителя с испражнениями. Инфекционный процесс у парнокопытных характеризуется тяжелым течением с вирусемией, афтозными высыпаниями и изъязвлениями в области слизистых оболочек полости рта, языка, носоглотки, носа, губ, на коже в межкопытных щелях, на вымени, иногда около рогов. Общая продолжительность болезни у животных — от 10 до 15 дней, продолжительность инкубационного периода — 2–4 дня. При злокачественном течении ящура, особенно у коров, более чем у 50 % заболевших животных наступает смертельный исход в течение 2–3 суток. Основной путь инфицирования людей — через сырое молоко больных животных и продукты его переработки, реже через мясо. У лиц, непосредственно контактирующих с больными животными, возможна прямая передача инфекции (при доении, уходе, лечении, убое), воздушно-капельный путь заражения (при дыхании, кашле животных), а также через предметы, загрязненные их выделениями.
Афтозные высыпания на слизистой рта при ящуре
Описаны случаи внутрилабораторного инфицирования. От человека к человеку инфекция не передается. Дети более восприимчивы к ящуру, чем взрослые. Иммунитет типоспецифичен и зависит от наличия вирус-нейтрализующих антител.
Патогенез Вирус проникает в организм через слизистые оболочки полости рта (реже — пищеварительного и дыхательного тракта) и поврежденную кожу. В месте внедрения возбудителя возникает первичный аффект (очаг поражения) — небольшая везикула (пузырек), где вирус размножается и накапливается. Следующим этапом является вирусемия (проникновение вируса в кровь), приводящая к интоксикации. Выраженная дерматотропность вируса обусловливает его фиксацию в эпителии слизистых оболочек (полость рта, носа и уретры) и кожи (кисти и стопы), где отмечаются вторичные везикулы. С их появлением вирус в крови не обнаруживается.
Клиническая картина Длительность инкубационного периода варьирует от 2 до 12 дней, обычно составляя 3–4 дня. Начало заболевания острое с высокой температурой до 39–40 °C с ознобом, головными и мышечными болями. К концу первых суток возникают симптомы поражения слизистых оболочек: жжение в полости рта, обильное слюнотечение, покраснение конъюнктив, могут встречаться рези при мочеиспускании и легкая диарея (см.). Объективно наблюдаются отечность и покраснение слизистых оболочек щек, мягкого неба, языка, дужек и губ, на фоне которых несколько позже просматриваются мелкие пузырьки — афты, первично заполненные прозрачным, а затем мутным содержимым. Через 1–2 суток афты вскрываются, а на их месте остаются эрозии, обладающие тенденцией к слиянию и образованию обширных очагов изъязвления. При прощупывании регионарных лимфоузлов отмечаются их увеличение и болезненность. Больные не в состоянии разговаривать и глотать, что переносится ими тяжело, возникает обильное слюнотечение (до 2–4 л в сутки). Поражения слизистых оболочек носа, уретры, влагалища и конъюнктив характеризуются соответствующей симптоматикой. Характерным признаком на этом фоне являются везикулезные высыпания в межпальцевых складках рук и ног и около ногтевых лож. При неосложненном течении заращение эрозий наступает к 5-му дню заболевания, общая продолжительность болезни составляет 5–7 дней. В ряде случаев могут встречаться затяжные формы инфекции (до нескольких месяцев) с повторными волнами высыпаний. У детей ящур характеризуется обычно тяжелым течением с явлениями гастроэнтерита (см.). Прогноз обычно благоприятный, но при тяжелом течении — у детей серьезный.
Диагностика и дифдиагностика При типичном течении диагноз не представляет трудностей. При менее четкой симптоматике следует ориентироваться на данные эпиданамнеза (изучение возможных путей заражения) и сведения об эпизоотии ящура. Лабораторные данные: показатели общего анализа крови малоспецифичны — пониженный уровень лейкоцитов и эозинофилия. Вирус выделяют из крови, слюны, афтозных элементов и фекалий. Идентификация вируса осуществляется при помощи РСК и РНГА в парных сыворотках с интервалом в 6–8 дней. В целях диагностики используют биологическую пробу с втиранием содержимого афт в подушечки лапок морских свинок. При наличии вируса ящура у животных возникают типичные для инфекции высыпания. Ящур дифференцируют с афтозным, токсическим и кандидозным стоматитами (см.), герпетической инфекцией (см. Герпес), ветряной оспой (см.), энтеровирусными заболеваниями, пемфигусом.
Лечение и профилактика Больные ящуром подлежат госпитализации на срок не менее 14 дней. Назначается диета, в механическом и химическом отношении максимально щадящая пораженные слизистые (полужидкая легкоусвояемая пища 5–6 раз в день небольшими порциями, перед приемом которой больному дают 0,1 г анестезина), обильное питье. Иногда прибегают к кормлению через зонд. Первостепенное значение имеет уход за полостью рта. С первых дней начинают противовирусную терапию. Для этого применяют 0,25—0,5 %-ную оксолиновую, 0,25—0,5 %-ную флореналевую, 0,25—0,5 %-ную теброфеновую, 4 %-ную гелиомициновую, 0,25 %-ную риодоксолевую, 50 %-ную интерфероновую и другие мази. Используют растворы лейкоцитарного интерферона и 0,1–1 %-ный раствор РНК-азы. Нанесение препаратов на пораженные участки слизистых и кожи осуществляют 3–5 раз в день. Для ускорения процессов заживления можно применять ультрафиолетовое облучение и свет гелиево-неонового лазера, а также аэрозольные препараты «Ливиан», «Левовинизоль», пантенол, «Винизоль» и др. В тяжелых случаях необходимы дезинтоксикационная терапия, сердечно-сосудистые, болеутоляющие, антигистаминные препараты и витамины. Профилактика ящура заключается в соблюдении мер личной предосторожности в очаге и санитарно-ветеринарных мероприятиях. В эндемичных районах обязательны пастеризация и кипячение молока, приготовление масла из обработанных сливок, а также тщательное соблюдение мер безопасности при уходе за больными животными. Важная роль принадлежит регулярной санитарно-просветительной работе среди населения.
СЛОВАРЬ ИСПОЛЬЗУЕМЫХ ТЕРМИНОВ
А
Абазия — неспособность ходить, связанная с нарушением чувства равновесия или с нарушением функционирования нижних конечностей (параличи, мышечные спазмы). См. также Астазия. Абартикуляция — 1. Вывих сустава. 2. Синовиальный сустав (см. Диартроз). Абдуктор — любая мышца, которая отводит одну часть тела от другой или от средней линии туловища. Аберрантный — отклоняющийся от нормы: обычно этот термин используется применительно к кровеносным сосудам или нервам, расположенным не в том месте, где они должны находиться. Абиотрофия — скрытая аномалия органа или системы организма. Дегенерация или потеря функций того или иного органа или системы органов без каких-то явных причин; например, абиотрофия сетчатки (тапсторетинальная дегенерация) — прогрессирующая дегенерация сетчатки, приводящая к ухудшению зрения, возникающая вследствие различных генетических нарушений, например из-за пигментного ретинита (воспаления сетчатки). Аблепсия — вышедший из употребления термин, обозначающий слепоту. Аблефария — врожденное отсутствие или значительное уменьшение размеров век. Абразия — 1. Небольшое повреждение, при котором поверхность кожи или слизистой оболочки удаляется при помощи стирания или соскабливания. 2. Стирание зубов, особенно у их основания, благодаря слишком энергичной их чистке. Часто усиливается за счет эрозии. 3. Любое стирающее или соскабливающее действие, приводящее к удалению того или иного участка поверхности. Абсанс — кратковременная потеря сознания с отсутствием воспоминаний за какой-то период времени. Абсорбция — (в физиологии) поглощение, всасывание жидкости или других веществ тканями человеческого тела. Переваренная пища всасывается пищеварительным трактом и поступает затем в кровь и лимфу. Больше всего питательных веществ всасывается в тонкой кишке — в составляющих ее тощей и подвздошной кишке, однако алкоголь может легко всасываться и из желудка. Тонкая кишка выстлана изнутри мельчайшими пальцевидными выпячиваниями (см. Ворсинка), которые значительно увеличивают площадь ее поверхности, в результате чего всасывание продуктов пищеварения значительно ускоряется. См. также Ассимиляция, Пищеварение. Абсцесс — ограниченное скопление гноя в различных органах и тканях, возникающее при острой или хронической очаговой инфекции и приводящее к тканевой деструкции в очаге. Примером абсцесса может служить гнойничковое поражение кожи — фурункул. Наиболее распространенной причиной возникновения абсцесса является местная бактериальная инфекция, особенно стафилококковая, которая приводит к снижению защитных сил организма. При холодном абсцессе, вызываемом чаще всего туберкулезными бактериями, наблюдается припухлость пораженного участка, но болезненные проявления, а также другие признаки воспаления (характерные для острого абсцесса) практически отсутствуют. Обычными методами лечения абсцесса является использование антибиотиков, а также, в случае необходимости, хирургическое вскрытие гнойника и удаление из него скопления гноя. Головной мозг и его оболочки обладают низкой сопротивляемостью такого рода инфекциям, поэтому в результате действия на него любых микроорганизмов, способствующих развитию абсцесса, у человека может развиться абсцесс мозга. Прогноз этого заболевания является крайне неблагоприятным, если вовремя не произвести аспирацию или хирургический дренаж пораженной области. Абсцесс (легкого) — аномальная полость в каком-либо органе (обычно в легком), содержащая гной. Абсцесс апикальный — абсцесс вокруг верхушки зуба. Острый абсцесс протекает чрезвычайно болезненно, вызывая опухание челюсти, а иногда и части лица. Обычно его развитие связано с отмиранием и инфицированием пульпы зуба. Для лечения проводятся дренаж, лечение корневого канала пульпы зуба или производится удаление зуба. Абсцесс Броди — ограниченный некроз губчатого вещества кости, при котором происходит ее разрушение с образованием полости. Разновидность хронического бактериального остеомиелита, причиной возникновения которого не являются ни туберкулез, ни сифилис. Проводимое лечение требует хирургического дренирования пораженной области и использования антибиотиков. Абсцесс ишиоректальный — абсцесс, развивающийся в седалищно-прямокишечной ямке — пространстве между мышцами тазового дна и тазовой кости. Может развиться самопроизвольно, однако чаще всего является вторичным заболеванием, возникающим в результате имеющихся трещин заднего прохода, тромбированных геморроидальных узлов или каких-либо иных заболеваний, связанных с анусом. Симптомами болезни являются: сильная пульсирующая боль вокруг заднего прохода, сопровождающаяся повышением температуры и болезненной припухлостью в этом месте; в результате может образоваться анальный свищ. Гной из абсцесса обычно удаляется с помощью выполняемого хирургическим путем надреза. Абсцесс перинефральный — скопление гноя вокруг почки, обычно являющееся вторичным по отношению к пионефрозу. Абсцесс периодонтальный — абсцесс, развивающийся в периодонте и свидетельствующий о наличии у человека острого воспаления. Абсцесс перитонзиллярный — появление гноя в перитонзиллярном пространстве между небной миндалиной и стенкой глотки. Человека беспокоят сильные боли, ему бывает трудно открывать рот (тризм) и глотать. В процессе лечения применяются антибиотики. В некоторых случаях возникает необходимость в хирургическом вскрытии абсцесса для удаления из него скопившегося гноя. Медицинское название: перитонзиллярный абсцесс. Абсцесс поддиафрагмальный — скопление гноя в пространстве под диафрагмой, чаще всего с правой стороны — между печенью и диафрагмой. Причиной возникновения поддиафрагмального абсцесса может являться послеоперационная инфекция (особенно после операций на желудке или кишечнике) или прободение какого-либо органа (например, прободение пептической язвы). В некоторых случаях эффективным оказывается срочное назначение больному антибиотиков, однако чаще всего в этой ситуации возникает необходимость в хирургическом дренировании абсцесса. Абсцесс церебральный — см. Абсцесс. Абулия — безволие; утрата или нарушение способности к выполнению самостоятельных действий или к принятию решений. Человек хочет, но не может начать действовать самостоятельно; у него значительно снижена инициативность и энергичность. Данный симптом часто встречается при шизофрении. Аваскулярный — без кровеносных сосудов или имеющий плохое кровоснабжение. Данный термин обычно используется по отношению к хрящам. Авитаминоз — недостаток витаминов в организме человека. См. также Болезнь недостаточности. Автоматизм — поведение человека, которое может иметь место при эпилепсии, когда больной бессознательно выполняет различные движения или задания. Движения могут быть простыми или повторяющимися, такими, например, как хлопанье в ладоши, или, наоборот, достаточно сложными, как, например, подражание обычным осознанным действиям. Автотрофный, литотрофный — применяется для описания организмов (называемых автотрофами), которые синтезируют органические вещества из углекислого газа и нитратов (или аммониевых соединений), используя для этого внешний источник энергии. Фотоавтотрофные организмы, в том числе зеленые растения и некоторые бактерии, получают эту энергию от солнца; хемоавтотрофные или хемосинтетические организмы получают энергию из неорганических химических веществ. Все автотрофные бактерии не являются паразитическими. Для сравнения: Гетеротрофный. Автохтонный — 1. Местный, остающийся в месте образования. Например, сгусток крови, который не переносится с током крови, а остается в месте своего образования, называется автохтонным. 2. Возникающий в каком-либо органе человеческого тела без внешней стимуляции (например, сердцебиение). Авульсия — 1. Также evulsion — отрыв или насильственное отделение части структуры. Например, сухожилие может оторваться от кости, к которой оно обычно прикрепляется, или кожа черепа может оторваться от лежащей под ней ткани и кости. 2. В стоматологии — выбивание зуба вследствие полученной травмы. Выбитый зуб может быть реимплантирован (см. Реимплантация). Агаммаглобулинемия — отсутствие или резкое снижение уровня гаммаглобулина в сыворотке крови. Для сравнения: Гипогаммаглобулинемия. Агглютинация, сращение — процесс слипания таких микрочастиц, как эритроциты или взвешенные бактерии, под действием сывороточных антител, называемых агглютининами, с образованием видимых скоплений. Любое вещество, индуцирующее образование агглютинина, называется агглютиногеном. Агглютинация представляет собой специфическую реакцию; сыворотка крови, содержащая различные агглютинины, помогает в лабораторных условиях идентифицировать большое количество неизвестных бактерий. При смешивании различных групп крови происходящая агглютинация связана с тем, что в сыворотке крови присутствуют естественные антитела (изоагглютинины), которые атакуют эритроциты, содержащиеся в чужеродной группе крови; при этом неважно, сталкивались ли они раньше с ними или нет. Данный процесс заметно отличается от тех, что происходят при свертывании крови. Агглютинин — антитело, вызывающее агглютинацию бактерий, клеток крови, а также некоторых других антигенных частиц. Агглютиноген — любой антиген, вызывающий образование агглютинина в сыворотке крови и таким образом принимающий участие в процессе агглютинации. Агенезия — врожденное отсутствие какого-либо органа, обычно связано с пороком или недоразвитием эмбриона. Аглоссия — врожденное отсутствие языка. Агнатия — врожденное полное или частичное отсутствие нижней челюсти. Агнозия — заболевание головного мозга, при котором больной не может правильно интерпретировать свои ощущения, несмотря на то что органы чувств и нервы, по которым от них к головному мозгу поступают сигналы, функционируют нормально. Данное расстройство связано с нарушениями, возникающими в ассоциативных зонах теменной доли головного мозга. В случае слуховой агнозии у больного сохранен нормальный слух, но он не может правильно интерпретировать слышимые звуки (в том числе и человеческую речь). При тактильной агнозии (астереогнозе) кисти рук сохраняют нормальную чувствительную способность, однако больной не может определить форму объекта на ощупь. При зрительной агнозии у больного сохранено нормальное зрение, однако он не способен понять смысл написанного или напечатанного текста (см. Алексия). Агональный — данный термин используется при описании происходящих в момент смерти явлений, а именно: остановки дыхания или соответствующих изменений ЭКГ и ЭЭГ, позволяющих констатировать факт наступления смерти. Агонизирующий — умирающий. Агонист — 1. Prime mover — мышца, за счет сокращения которой происходит определенное движение той или иной части тела. Сокращение мышцы-агониста сопровождается расслаблением противодействующей ей мышцы-антагониста. 2. Лекарственный препарат или любое другое вещество, действующее как рецептор; инициирует цепь внутриклеточных биохимических процессов в организме человека. К ним относятся, например, холинергическис лекарственные препараты (см. Средства парасимпатомиметические). Агорафобия — патологическая боязнь публичных мест и открытых пространств. См. также Фобия. Агранулоцитоз — состояние, при котором наблюдается значительное уменьшение содержания нейтрофильных гранулоцитов в крови в результате поражения костного мозга химическими веществами или вследствие побочного действия некоторых лекарственных препаратов. Основными симптомами агранулоцитоза являются лихорадка, а также изъязвления полости рта и горла; у больного очень быстро может развиться сильнейшая слабость и наступить смерть. Лечение проводится с помощью антибиотиков. В случае необходимости для сохранения жизни больного показана гемотрансфузия лейкоцитов. Аграфия, дисграфия — состояние умственной и мыслительной деятельности человека, при котором он не может писать правильно, несмотря на то что сила и координация движений кисти руки сохранены в норме. Относится к языковым нарушениям, обычно бывает связана с заболеванием теменной доли головного мозга. См. Синдром Герстмана. Агрегация — вид взаимодействия тел, при котором образуются из более мелких более крупные частицы. Используется при ряде клинических исследований. Агромания — патологически сильное стремление к жизни в одиночестве на лоне природы. Адаптация — явление, при котором постепенно уменьшается ответ органов чувств на длительную или повторяющуюся стимуляцию. Например, обоняние человека может приспособиться (адаптироваться) к стимулирующему воздействию того или иного запаха, так что при длительном его присутствии от органа обоняния (носа) перестают поступать сообщения о наличии такого запаха. Аналогично адаптация органов осязания (рецепторов кожи) приводит к тому, что человек может на какое-то время забыть о недавно надетой на тело одежде, так как не будет ощущать ее прикосновения. Адаптация световая — рефлекс, благодаря которому глаз может либо приспособиться к нормальному освещению после длительного пребывания человека в темноте, либо к очень слабому свету после его пребывания в помещении с нормальным освещением. Благодаря этому рефлексу происходит сужение или расширение зрачка (см. Рефлекс зрачковый), а содержащийся в палочках и колбочках зрительный пигмент под влиянием света меняет свою конфигурацию, что и приводит к возникновению нервного импульса. Для сравнения: Адаптация темновая. Адаптация темновая — изменения в сетчатке глаза и зрачке, которые позволяют человеку приспосабливаться к измененным условиям освещенности и видеть при сумеречном свете (в темноте). Темновая адаптация связана с активизацией деятельности палочек — периферических отростков фоторецепторов сетчатки глаза, которые лучше функционируют в темноте, — и с расширением зрачков (см. Рефлекс зрачковый). Для сравнения: Адаптация световая. Адвентициальный — относящийся к адвентиции. Адвентиция, оболочка адвентициальная — 1. Наружная оболочка стенки вены или артерии. Состоит из соединительной ткани, снабженной сетью малых кровеносных сосудов, питающих ее. 2. Наружная оболочка различных трубчатых органов человека. Адгезия, сцепление — 1. Соединение двух различных поверхностей, например движущихся поверхностей суставов, при помощи волокнистой соединительной ткани, образующейся в воспаленной или травмированной области. После операций на брюшной полости у больных часто возникают спайки между кишечными петлями, но лишь в редких случаях при этом возникает полная непроходимость кишечника. Если спайка возникла в околосердечной сумке, то это может привести к ограничению сокращений сердечной мышцы. 2. Процесс заживления раны, при котором ее края плотно прилегают друг к другу. При первичной адгезии обнаруживается крайне мало грануляционной (зернистой) ткани; при вторичной адгезии края раны соединяются друг с другом при помощи грануляционной ткани. Аддикция — состояние зависимости, развивающееся в результате привыкания к тому или иному лекарственному препарату. Точнее говоря, данный термин заключает в себе состояние физической зависимости, вызванной приемом таких веществ, как морфин, героин или алкоголь; однако он также используется и в случае состояния психологической зависимости, вызванной приемом таких лекарственных препаратов, как барбитураты. Лечение направлено на постепенное уменьшение приема данного вещества и в конечном итоге на то, чтобы добиться полного воздержания больного от него. См. также Алкоголизм, Толерантность. Аддуктор — любая мышца, которая приводит одну часть тела в направлении к другой его части или в направлении к срединной линии туловища. Аддукция — движение конечности или ее части к срединной линии туловища. Аденит — воспаление железы или нескольких желез (или железистоподобных структур). Например, при мезадените поражаются лимфатические узлы (ранее называвшиеся лимфатическими железами) брыжейки — складки брюшины, поддерживающей находящиеся внутри нее петли кишки; при цервикальном адените поражаются преимущественно лимфатические узлы в области шеи. Аденовирус — представитель группы ДНК-вирусов, вызывающий у человека инфекционные заболевания верхних дыхательных путей; их симптомы напоминают те, что имеют место при обычной простуде. Аденогипофиз — передняя доля гипофиза. Аденоз — 1. Чрезмерное разрастание или развитие желез. 2. Любое заболевание желез или железоподобных структур, особенно лимфатических узлов. Аденоиды, миндалины глоточные — непарное скопление лимфоидной ткани в области свода и задней стенки глотки. Гипертрофия аденоидов может затруднять дыхание через нос и нарушать проходимость евстахиевых (слуховых) труб, вызывая у больногоэкссудативный отит. Аденоидэктомия — хирургическое удаление аденоидов у больных, страдающих экссудативным отитом, или тех, у кого затруднено дыхание через нос. Аденокарцинома — злокачественная (эпителиальная) опухоль, состоящая из железистых эпителиальных клеток, входящих в состав большинства внутренних органов человеческого тела. Данный термин также применяется для описания опухолей, затрагивающих в процессе своего роста железы человека. Эти опухоли могут быть дополнительно классифицированы в соответствии с веществами, которые они вырабатывают, например: слизисто-секреторная и серозная аденокарцинома. Также их можно классифицировать по микроскопическому расположению в них клеток, например: сосочковая (папиллярная) и фолликулярная аденокарцинома. Опухоль может быть твердой или содержать цисты (цистаденокарцинома). Каждый внутренний орган человеческого тела может поражаться этой опухолью, при этом наблюдается множество их гистологических типов; например, яичники могут поражаться как муцинозной, так и серозной цистадено-карциномой. Аденолимфома — см. Опухоль Уортина. Аденома — доброкачественная эпителиальная опухоль, происходящая из железистых тканей; в процессе обследования в ней явно определяются железистоподобные структуры. Аденома может перерасти в злокачественную опухоль (см. Аденокарцинома). Иногда нетрудно распознать в ней хорошо известные ткани, например фиброзную (фиброаденома). В других случаях, например при бронхиальной аденоме, в организме человека вырабатываются активные соединения, которые ускоряют рост опухоли (см. Аргентаффинома). Опухоли различных органов человеческого тела, в том числе и гипофиза, часто классифицируются по их гистологической окраске, например: эозинофильная, базофильная или хромофобная аденома. Аденомиоз — см. Эндометриоз. Адиадохокинез — см. Дисдиадохокинез. Адипоз, липоз — избыточное накопление жира в организме человека. Может возникать вследствие переедания, нарушения гормональной регуляции в организме, а также в результате нарушения обмена веществ в нем. Болезненное ожирение встречается чаще у женщин, чем у мужчин, и проявляется болезненными жировыми отложениями, появление которых сопровождается нарушением функционирования нервной системы. См. также Ожирение. Адренергический — для описания нервных волокон, использующих в качестве нейромедиатора норадреналин. Для сравнения: Холинергический. Адренолейкодистрофия — наследственное заболевание, приводящее к различным неврологическим нарушениям как у детей, так и у взрослых. Проявляется в виде прогрессирующего спастического паралича ног и потери их чувствительности, недостаточности функционирования надпочечников и малыми по сравнению с нормой размерами половых желез. Выявление аномального жиро-кислотного метаболизма имеет большое значение для дальнейшего возможного применения лекарственной терапии. Возможна также пренатальная диагностика этого заболевания. Адренолитический — подавляющий активность адренергических нервов. Адреналитическая активность является антагонистом адреналиновой. АДФ (аденозина дифосфат) — соединение, в состав которого входят аденин, рибоза и две фосфатные группы. АДФ присутствует в клетках и участвует в процессах, проходящих с преобразованием энергии (см. АТФ). Азотемия — состояние биоклинических показателей крови, при котором в крови регистрируется избыток азотсодержащих продуктов азотистого обмена. Азотурия — наличие в моче аномально высокой концентрации азотсодержащих соединений, особенно мочевины. Акалькулия — приобретенная неспособность совершать простейшие математические расчеты. Является типичным симптомом заболевания теменной доли головного мозга. См. Синдром Герстмана. Акантамеба — род широко распространенных амеб, некоторые их виды иногда вызывают появление болезненных изъязвлений на роговице глаза человека. Акантоз — увеличение численности шиповатых клеток эпидермиса в его ростковом слое, приводящее к утолщению. Дерматоз, характеризующийся значительными папилломатозными разрастаниями (особенно много их бывает на коже подмышечных впадин), приводящими к гиперпигментации кожи и приобретению ею бархатистого оттенка. По убеждению врачей, часто также сопровождается повышенной толерантностью организма к инсулину. Данное заболевание может носить как доброкачественный, так и злокачественный характер. Однако чаще всего врачам приходится сталкиваться с его доброкачественной формой, зачастую связанной с ожирением. Акапния, гипокапния — отсутствие или значительное уменьшение содержания углекислоты в крови. Данное состояние может развиться вследствие глубокого дыхания или при низкой физической активности человека. Акардия — врожденное отсутствие сердца. Может встречаться у соединенных близнецов; при этом один из них, у которого сердце имеется, контролирует процесс кровообращения у обоих. Акариаз — заболевания, вызываемые клещами, а также симптомы этих заболеваний, возникновение которых наиболее вероятно в результате укуса клещей (например, аллергия и дерматит). Акаталазия — врожденное отсутствие или низкий уровень каталазы крови, приводящее к часто повторяющимся инфекциям и изъязвлению десен (гингивит) и слизистой оболочки полости рта. Данное заболевание наиболее распространено среди японцев (болезнь Тахакары). Акатизия — непроизвольные движения, вызываемые некоторыми антипсихотическими лекарственными препаратами (например, фенотиазоном). Человек проявляет значительную гиперактивность, которая может быть спутана с чувством повышенного волнения, для устранения которого больному было выписано данное лекарство. Акинезия — нарушение нормального тонуса мышц или их чувствительности. В случае акинетической эпилепсии может наступить внезапная потеря мышечного тонуса; при этом больной падает, моментально теряя сознание. При акинетическом мутизме у больного наблюдается состояние полной физической бесчувственности, несмотря на то что глаза его остаются открытыми и он может следить за движениями, совершаемыми вокруг него. Данное заболевание связано с последствиями повреждения основания мозга. Аккомодация — настройка преломляющей силы диоптрического аппарата глаза человека за счет изменения кривизны хрусталика при изменении расстояния от глаза до рассматриваемого предмета. Когда цилиарная (ресничная) мышца находится в расслабленном состоянии, прикрепленный к цидиарному телу ресничный поясок натягивается, и хрусталик уплощается. В таком состоянии глаз может увидеть предметы, расположенные на удаленном от него расстоянии. Чтобы рассмотреть предметы, расположенные вблизи, цилиарная мышца сокращается, а напряжение ресничного пояска ослабевает, так что хрусталик становится более выпуклым. Аклазия — см. Диафизарная аклазия. Аклазия диафизарная — наследственная аномалия роста хрящей и костей, в результате которой на длинных (трубчатых) костях образуется множество хрящевых выступов (экзостозов). Рост самих костей также может замедлиться и даже прекратиться совсем или привести к деформации костей. Акродерматит — воспаление кожи ступней или кистей рук. В случае разлитого хронического акродерматита наблюдаются опухание и покраснение пораженных участков с их дальнейшей атрофией. Причины заболевания неизвестны; соответствующего лечения также пока не найдено. Акродиния — см. Болезнь розовая (полинейропатическая эритродермия). Акромегалия — увеличение размеров кистей рук, стоп и лица вследствие чрезмерной секреции гормона роста (соматотропина), имеющей место при опухоли передней доли гипофиза. Эта опухоль лечится при помощи лучевой терапии или удаляется хирургическим путем. См. также Гигантизм. Акромион — продолговатый отросток в верхней части лопатки (которым заканчивается ость лопатки), одной своей частью соединенный с ключицей и образующий акромиально-ключичный сустав. — Акромиальный. Акропарестезия — чувство онемения, покалывания в ступнях и кистях рук. См. Парестезия. Акросклероз — кожное заболевание, считающееся разновидностью генерализованной склеродермии. Часто также ассоциируется с болезнью Рейно, при которой в основном поражаются кисти рук, лицо и ступни. Акросома — специальная мембранная структура в передней части головки сперматозоида. Разрушается непосредственно перед оплодотворением (акросомная реакция) с образованием ряда ферментов, которые облегчают проникновение сперматозоида в яйцеклетку. Неполное протекание акросомной реакции часто является причиной бесплодия у мужчин (см. также Андрология). Акроцентрический — о хромосоме, в которой центромера расположена у самого ее конца или очень близко к нему. Акроцианоз — синюшная окраска стоп и кистей рук вследствие замедления прохождения крови через мелкие сосуды, расположенные в коже этих участков. Аксон — нервное волокно: единичный отросток, отходящий от тела клетки — нейрона и передающий от него нервные импульсы. В некоторых нейронах аксон может достигать более одного метра в длину. Большинство аксонов покрыты миелиновой оболочкой (миелин — это многократно закрученный двойной слой плазматической мембраны шванновской клетки. — Ред.). На границе между двумя соседними шванновскими клетками образуется узловой перехват Ранвье. Аксон заканчивается телодендроном — множеством концевых разветвлений; они контактируют с другими нервами, мышечными волокнами или клетками. АКТГ (АСТН), гормон адренокортикотропный, адренокортикотропин, кортикотропин — гормон, синтезируемый передней долей гипофиза. Вырабатывается в больших количествах в ответ на любую стрессовую ситуацию. АКТГ контролирует секрецию кортикостероидных гормонов, вырабатываемых надпочечниками. Назначается обычно в виде инъекций для исследования функций надпочечников или для лечения некоторых ревматических заболеваний (особенно у детей) и астмы. Активатор плазминогена тканевый — присутствующий в организме белок, способный разрушать образующиеся тромбы (см. Тромболиз); в настоящее время его получают методами генетической инженерии (см. Альтеплаза). Этот белок требует обязательного присутствия в организме фибрина, который является кофактором; кроме того, он способен активизировать плазминоген на поверхности фибрина, что отличает его от других активаторов плазминогена, таких как стрептокиназа и урокиназа. (Активаторы плазминогена, содержащиеся в тканях, способны непосредственно превращать плазминоген в плазмин. — Ред.) Актиномикоз — хроническое заболевание, вызываемое различными видами актиномицетов, характеризующееся поражением различных органов и тканей. Чаще всего поражается нижняя челюсть, однако болезнь может затрагивать также и легкие, головной мозг или кишечник. Бактерии, вызывающие данное заболевание, обычно присутствуют во рту у человека и могут стать патогенными вследствие апикального абсцесса или после удаления зуба. Заболевание характеризуется образованием множественных свищей, открывающихся на поверхности кожи. Лечение проводится путем отсасывания гноя и длительного курса лечения антибиотиками. Актинотерапия — лечение различных заболеваний инфракрасным или ультрафиолетовым облучением. Актомиозин — белковый комплекс, состоящий из миозина и актина; обнаруживается в мышечной ткани в процессе ее сокращения. См. Мышца поперечнополосатая. Акупунктура — традиционная китайская система исцеления; заключается в прокалывании тонкими металлическими иглами специфических участков кожи с лечебной целью. Иглы дополнительно стимулируются путем их вращения или слабым электрическим током. Существует ряд предположений о том, что такая стимуляция активизирует функционирование глубоких чувствительных нервов, а это, в свою очередь, приводит к тому, что гипофиз и промежуточный мозг начинают вырабатывать большее количество эндорфина — естественного обезболивающего вещества, продуцируемого непосредственно головным мозгом человека. Метод акупунктуры широко распространен в странах Дальнего Востока, где применяется в качестве сильного обезболивающего средства, в том числе в Китае, где довольно часто используется как альтернатива анестезии при проведении различных хирургических вмешательств. В странах Запада, несмотря на это, в настоящее время можно встретить очень мало высококвалифицированных специалистов, занимающихся акупунктурой. Акустический — относящийся к восприятию звука или слуху. Акушерство — раздел медицины, изучающий вопросы беременности, родов и послеродового периода (в течение шести недель после родов), когда происходит восстановление репродуктивных органов. Для сравнения: Гинекология. — Акушерский. — Акушерка. Акцептор — (в биохимии) вещество, облегчающее процесс окисления субстрата с пониженной концентрацией путем принятия дополнительного количества ионов водорода. Алактазия — отсутствие или недостаток в организме фермента лактазы, играющего важную роль в процессе усвоения молочного сахара (лактозы). В кишечнике у всех детей присутствует лактаза, однако в процессе роста ребенка примерно у 10 % жителей стран Северной Европы, у 40 % греков и итальянцев и у 80 % детей из стран Африки и Азии этот фермент исчезает. Алактазия проявляется в виде заболевания лишь в том случае, если в пищу постоянно употребляется сырое молоко; не усваиваемая организмом лактоза вызывает у человека понос и боли в животе. Алейкемический — используется для описания алейкемии — заболевания, при котором в крови содержится недостаточное количество лейкоцитов. Данное состояние обычно развивается вслед за состоянием, при котором в организме человека вырабатывается избыточное количество лейкоцитов, что характерно для лейкемии. Алексин — устаревшее название сывороточного компонента; в настоящее время он называется комплементом. Алекситимия — трудность психологического понимания собственных эмоций и настроений. Некоторые психиатры убеждены в том, что это один из путей развития у людей психосоматических симптомов. Алексия — приобретенная неспособность читать. Связана с заболеванием левого полушария головного мозга у правшей. В случае агностической алексии, иначе называемой слепотой словесной, больной не может читать, так как не способен идентифицировать буквы и слова читаемого текста, однако у него сохраняется способность писать; речь больного также остается нормальной. Данное заболевание является одной из форм агнозии. У больных, страдающих афазической алексией (зрительной асимволией), утрачена как способность читать, так и способность писать, причем данное состояние часто сопровождается и различными нарушениями речи. Это заболевание также является одной из форм афазии. См. также Дислексия. Алиенация (в психиатрии) — 1. Состояние, при котором человек считает, что его мысли контролируются кем-либо другим извне (деперсонализация личности). Является одним из симптомов шизофрении. 2. Психоз. Ализарин, кармин ализариновый — анилиновый краситель красного цвета, получаемый из антрацена (раньше его получали из растения — красильной марены). Ализарин не растворяется в воде, но хорошо растворяется в щелочах, спирте и других подобных веществах. Используется в качестве индикатора рН и как гистохимический реагент для кальция, таллия, титана и циркония. Алкалемия — аномально высокое содержание щелочей в крови. Может быть связано с повышением концентрации щелочей и (или) уменьшением концентрации кислот в крови. См. также Алкалоз. Для сравнения: Ацидемия. Алкалоз — патологическое состояние, характеризующееся аномально высоким содержанием щелочей в жидкостях и тканях человеческого тела. Может развиться вследствие нарушения обменных процессов, отвечающих за поддержание кислотно-щелочного равновесия в крови (см. Равновесие кислотно-щелочное). Иногда алкалоз бывает связан с потерей большого количества кислоты во время рвоты или со злоупотреблением бикарбонатом натрия. Аномально глубокое дыхание по сравнению с выполняемой физической нагрузкой может привести к развитию респираторного алкалоза. Алкалоз у больного часто проявляется в виде мышечной слабости или судорог. Алкалоид — одно из многочисленных веществ растительного происхождения — представитель группы азотсодержащих веществ, которое воздействует на организм человека. Многие алкалоиды являются важными лекарственными веществами, например морфин, хинин, атропин и кодеин. Алкаптонурия — врожденное отсутствие фермента — оксидазы гомогентизиновой кислоты, играющего существенную роль в процессе нормального расщепления аминокислот тирозина и фенилаланина. Накопление гомогентизиновой кислоты в организме человека вызывает потемнение кожи и глаз — они приобретают темно-коричневый оттенок (охроноз), а также приводит к прогрессирующему поражению суставов, особенно позвоночника. Ген, отвечающий за данный фактор, является рецессивным, поэтому у детей данное заболевание может иметь место лишь в случае, если оба родителя являются носителями дефектного гена. Аллантоис — зародышевая оболочка, развивающаяся из задней кишки эмбриона. Ее внешний слой (мезодерма) содержит подходящие к плаценте кровеносные сосуды, образуя таким образом часть пуповины. Данная зародышевая оболочка невелика по размеру и в процессе развития плода продолжает уменьшаться (см. Урахус). — Аллантоисный. Аллерген — любой антиген, вызывающий аллергию у людей с повышенной чувствительностью к нему. Аллергены бывают самыми разными и могут воздействовать на различные ткани и органы человеческого тела. Пыльца растений, шерсть животных, перья птиц или пыль могут привести к развитию сенной лихорадки у человека; клещи, обитающие в домах, являются причиной развития у людей некоторых видов астмы; ряд лекарственных препаратов, красителей, а также косметика и большинство других химических веществ могут привести к появлению сыпи и дерматита; некоторые виды пищевой аллергии способствуют развитию поноса или запора, а также могут проявиться в виде ложного острого пищевого отравления. Когда аллерген выявлен (см. Проба накожная), в ряде случаев можно попытаться осуществить его десенсибилизацию, чтобы смягчить или предотвратить развитие новых приступов аллергии. — Аллергенный. Аллогенный — термин, использующийся для описания трансплантата, полученного от донора того же биологического вида, что и реципиент, но с иной гистосовместимостью. Аллоизолейцин — один из изомеров изолейцина — аминокислоты, присутствующей в большинстве белков. Аллопатия (в гомеопатической медицине) — традиционная система медицины, в которой для лечения используются лекарственные препараты, создающие в организме больного состояние, антагонистичное тому, что было вызвано болезнью; симптомы болезни таким образом ослабляются или полностью проходят. Для сравнения: Гомеопатия. Аллотрансплантат — см. Гомотрансплантат. Алопеция, облысение — отсутствие волос там, где они обычно растут. Нерубцовая алопеция представляет собой облысение у мужчин, чаще всего наблюдающееся сразу у нескольких представителей мужского пола в семье; облысение по мужскому типу у женщин характеризуется выпадением волос с возрастом. Острое выпадение волос, при котором большая часть или все волосы у человека выпали, но потом снова начали расти, может развиться после беременности или перенесенного тяжелого заболевания. В случае гнездной алопеции у больного появляются облысевшие участки, на которых вновь могут начать расти волосы; данная болезнь является разновидностью специфического аутоиммунного заболевания. При рубцовой алопеции выпавшие волосы больше не растут; примерами ее проявления могут служить красный плоский лишай и дисковидная красная волчанка. Альбумин — белок, хорошо растворяется в воде и свертывается при воздействии тепла. Например, сывороточный альбумин присутствует в плазме крови, играя важную роль в сохранении ее объема. Альбумин вырабатывается печенью; неспособность вырабатывать данный белок является типичным симптомом одного из хронических заболеваний печени — цирроза. Альбуминурия, протеинурия — присутствие сывороточного альбумина, сывороточного глобулина или других сывороточных протеинов в моче. Может наблюдаться при некоторых заболеваниях почек или сердечно-сосудистой системы. Однако альбуминурия не всегда бывает связана с заболеванием человека: она может наблюдаться также после значительной физической нагрузки или после слишком длительного стояния (ортостатичсская альбуминурия). Альбумоза — вещество, промежуточное между альбумином и пептонами, вырабатывается в процессе расщепления протеинов пепсином и другими эндопептидазами (см. Пептидаза). Альвеола — 1. В легком — воздушный пузырек неправильной формы микроскопических размеров. Из каждого альвеолярного хода, отходящего от дыхательных, или респираторных, бронхиол открывается примерно 20–30 альвеол. Стенки альвеол снаружи оплетены густой сетью мельчайших кровеносных сосудов — капилляров. Альвеолы разделены межальвеолярными перегородками и выстланы изнутри альвеолоцитами (пневмонитами) двух типов: респираторными (уплощенными), которые образуют вместе с капиллярной стенкой воздушнокровяной (аэрогематический) барьер, через который происходит газообмен между воздухом и кровью; и большими (гранулярными), которые вырабатывают сурфактант. Легкие новорожденного ребенка содержат приблизительно 20 млн альвеол. Примерно к восьми годам число альвеол в легких достигает 600–700 миллионов, оставаясь таким и у взрослого человека (Ред.). 2. Альвеола зубная — участок верхней или нижней челюсти, в которую вколочены корни зубов (см. также Челюсть нижняя, Челюсть верхняя). После удаления зуба большая ее часть абсорбируется. 3. Полость сложной альвеолярной железы (см. также Ацинус). 4. Любая другая небольшая полость, вдавление или сумка. — Альвеолярный. Альвеолит — воспаление любой альвеолы или нескольких альвеол. Хроническое воспаление стенок альвеол в легких обычно бывает связано с вдыханием органической пыли (внешний аллергический альвеолит); см. Легкое любителя птиц, Легкое фермера), но может развиться и самопроизвольно (фиброзный альвеолит неизвестного происхождения). Последний может сопровождаться различными заболеваниями соединительной ткани, такими как ревматоидный артрит, или общим склерозом. Оба типа этого заболевания могут медленно прогрессировать, переходя в фиброз; оба они обычно хорошо поддаются лечению кортикостероидными лекарственными препаратами. Альвеолит луночковый постэкстракционный — болезненное состояние, при котором нарушается нормальное заживление лунки после удаления зуба. Вместо того чтобы заполниться кровяным сгустком, лунка опустевает в результате ее неспецифического инфицирования; лечение паллиативное и занимает обычно 10–14 дней. Альвеус — полость, углубление или канал. Гиппокампов канал представляет собой пучок нервных волокон, расположенных в головном мозге и образующих впадину, в которой и располагается гиппокамп. Альдостерон — стероидный гормон (см. Кортикостероид), синтезируется в коре надпочечников и воздействует на почки, регулируя водно-солевой баланс в организме человека (содержание калия и натрия). Может назначаться в инъекциях в виде заместительной терапии в случае, если кора надпочечников выделяет недостаточное количество этого гормона, а также для выведения больного из шокового состояния. Альдостеронизм — повышенная секреция альдостерона — одного из гормонов, производимых корой надпочечников. В результате в организме человека нарушается водно-солевой баланс (содержание калия, натрия и воды не соответствует норме). Альдостеронизм является одной из причин повышения кровяного давления (гипертензии) у человека. См. также Синдром Конна. Альтеплаза — тканевый плазминогенный активатор, получаемый в результате рекомбинантной ДНК-технологии (генной инженерии). Альтеплаза используется для рассасывания тромбов (см. Средства фибринолитические), особенно в коронарных артериях сердца. Назначается в инъекциях. Возможные побочные эффекты: местное кровотечение, церебральная геморрагия, тошнота и рвота. Торговое название: актилиз. Альфа-блокатор, альфа-адреноблокатор — лекарственное вещество, препятствующее стимуляции альфа-адренергических рецепторов нервных окончаний симпатической нервной системы с помощью адреналиноподобных гормонов. Вследствие этого вызывает расширение кровеносных сосудов (вазодилатацию) и приводит к снижению артериального давления. К альфа-блокаторам относятся следующие лекарственные препараты: доксазоцин, фентоламин, феноксибензамин, тимоксамин, индорамин и празоцин. Передозировка этих лекарств может привести к резкому падению артериального давления, тахикардии, тошноте, рвоте, поносу, сухости во рту, приливу крови к поверхности кожи, судорогам, сонливости и коме. Альфа-фетопротеин (АФП) — протеин, вырабатываемый в печени и желточном мешке плода; присутствует в околоплодных водах и во вторичном виде в крови матери. Содержание АФП может быть определено при помощи анализа крови матери, который делается между 16-й и 18-й неделями беременности для пренатальной диагностики некоторых возможных заболеваний плода. Содержание АФП может быть повышенным по сравнению с нормой в случае открытой нервной трубки или каких-либо дефектов ее развития у плода (например, при расщелине позвоночника), у близнецов и тройняшек, при открытых дефектах развития брюшной стенки (например, при гастросхизисе), а также в случае смерти плода. Содержание АФП бывает пониженным при синдроме Дауна. Следует помнить, что на содержание АФП значительное влияние оказывают такие факторы, как срок беременности и вес матери, поэтому их необходимо обязательно учитывать при интерпретации полученных результатов. Если полученные результаты оказались неожиданно высокими или, наоборот, низкими, то показано проведение дополнительных обследований (например, ультразвуковой диагностики). См. Ультразвук. Альфа-фетопротеин вырабатывается в организме человека также некоторыми видами опухолей (см. Маркер опухолевый). Амавроз — частичная или полная слепота, не связанная с патологией глаза. Например, слепота проходящая — состояние, при котором потеря зрения является временной. — Амавротический. Амбивалентность — (в психологии) сосуществование противоположных тенденций или эмоций (например, любовь и ненависть) по отношению к одному и тому же индивидууму или предмету. Чрезмерная и преобладающая амбивалентность считается, согласно Блейлеру, характерным признаком шизофрении. Амблиопия — ухудшение зрения, не связанное ни с каким заболеванием глаза или зрительной системы. Практически данное строгое определение не всегда выполняется. Например, в случае токсической амблиопии, вызванной воздействием на организм человека никотина, алкоголя и некоторых лекарственных веществ, или при витаминной недостаточности всегда происходит некоторое повреждение зрительного нерва. Наиболее распространенный тип амблиопии тот, при котором поражающими факторами являются косоглазие, катаракта, а также некоторые другие аномалии оптических свойств глаза (см. Рефракция), при которых человек не может нормально видеть с детских лет. Амблиоскоп, ортоптоскоп, синоптофор — прибор для измерения угла сходимости взгляда (косоглазия) и определения бинокулярного зрения у человека. Состоит из двух L-образных трубок и коротких ручек, которые шарнирно стыкуются таким образом, что длинные ручки указывают в противоположном друг от друга направлении. Предмет обращен к короткому концу, и каждый глаз видит благодаря системе линз и зеркал различную картину, появляющуюся на другом конце каждой трубки. Если у больного имеется косоглазие, то трубки могут быть подогнаны таким образом, что короткие ручки совпадут с направлением взгляда каждого глаза. Амеба — простейшее одноклеточное желеобразной консистенции, не имеющее правильной и постоянной формы. Встречаются в воде, почве и других влажных местах; передвигаются и питаются при помощи большого количества выростов на теле (см. Псевдоподия). Некоторые амебы являются патогенными для человека (см. Род Entamoeba). См. также Простейшие. — Амебный. Амебиаз — заболевание, вызываемое простейшими организмами, характеризующееся язвенным поражением толстого кишечника с возможным образованием абсцессов в различных органах. Амебома — опухоль, развивающаяся в прямой или ободочной кишке вследствие паразитирующих простейших, которые внедряются и разрушают стенки кишок. Опухоль может изъязвляться и инфицироваться гнойными (пиогенными) бактериями, которые вызывают активное воспаление стенок кишечника. Опухоль обычно затвердевает и может даже закупорить кишечник. Амебоцит — клетка, способная двигаться благодаря перемещению протоплазмы аналогично амебам. Амелия — врожденное отсутствие рук или ног вследствие дефектов внутриутробного развития. Данная аномалия развития плода часто бывает связана с приемом талидомида на ранних сроках беременности. См. также Фокомелия. Амелобласт — клетка, продуцирующая зубную эмаль; исчезает непосредственно перед прорезыванием зубов. Амелобластома — локальная злокачественная опухоль челюсти. Считается, что амелобластома развивается из амелобластов, хотя клетки опухоли и не содержат в своем составе эмали. Раньше такая опухоль называлась адамантиномой; в настоящее время данный термин больше не используется, так как он предполагает возникновение такого же твердого на ощупь образования, как и эмаль (что неверно!). Амелогенез — образование эмали амелобластами; данный процесс полностью завершается перед прорезыванием зубов. Несовершенный амелогенез представляет собой наследственные дефекты, при которых нарушается образование зубной эмали. Зуб имеет необычную поверхность, но тем не менее не склонен к преждевременному разрушению. Аменорея — отсутствие или ненормальное прекращение менструаций у женщин. Обычно месячных не бывает до наступления половой зрелости; кроме того, они прекращаются во время беременности и секреции молока, а также по окончании репродуктивного периода (см. Менопауза). Первичная аменорея характеризуется тем, что у женщин старше 18 лет при наличии признаков полового созревания отсутствуют месячные. Может возникать при отсутствии у женщины матки или яичников, различных генетических нарушениях (например, синдром Тернера) или гормональном дисбалансе. При вторичной аменорее менструации прекращаются после наступления половой зрелости. Возможные причины развития вторичной аменореи могут быть связаны с заболеваниями гипоталамуса (отдела головного мозга), недостаточностью функционирования яичников, гипофиза или щитовидной железы, психическими нарушениями, депрессией, нервно-психической анорексией, а также со значительными изменениями, происходящими в окружающей обстановке или в личной жизни. Аменция — умственная отсталость. См. Олигофрения. Аметокаин — сильнодействующее местное обезболивающее средство. Применяется для обезболивания поверхности кожи и слизистых оболочек глаза, уха, горла и носа во время хирургических вмешательств; кроме того, иногда применяется для спинальной анестезии. Аметропия — аномалия рефракции глаза, проявляющаяся в затуманивании получающегося на сетчатке изображения. См. Астигматизм, Гиперметропия, Миопия. Для сравнения: Эмметропия. Амилоид — гликопротеин, сходный с крахмалом, выпадающий в осадок во внутренних органах при амилоидозе. Амилоидный протеин обнаружен в головном мозге у пациентов с болезнью Альцгеймера; однако какую роль он играет в развитии данного заболевания, так и остается неясным. Амилоидоз — заболевание с нарушением белкового обмена, при котором внеклеточно откладывается гликопротеид амилоид в различных тканях (печени, селезенке и др. органах). При первичном амилоидозе заболевание возникает без каких-либо видимых причин; вторичный амилоидоз возникает как осложнение таких хронических инфекционных заболеваний, как туберкулез, проказа или болезнь Ходжкина. Амилоидоз очень часто встречается при генетическом нарушении, носящем название средиземноморская лихорадка (см. Полисерозит). Амиодарон — антиаритмический лекарственный препарат; применяется для восстановления сердечного ритма при различных его нарушениях, в том числе при фибрилляции предсердий и учащенном сердцебиении. Назначается в таблетках или в инъекциях. Побочные эффекты неизвестны. Торговое название: кордарон Х. Амиотония врожденная, синдром Оппенгейма — устаревшее название различных врожденных заболеваний, при которых мышцы ребенка являются слабыми и пассивными (гипотоничными). Данные термины практически вышли из употребления, так как в настоящее время более точная диагностика позволяет определить и объяснить причины возникновения этого заболевания у детей. Амиотрофия — это нарушение питания мышц, сопровождающееся дегенеративно-дистрофическими изменениями, истончением волокон и нарушением сократительных функций из-за поражения периферических нервных клеток. Связана с заболеванием нерва, который возбуждает пораженную мышцу. Амиотрофия является характерным симптомом любой хронической невропатии; кроме того, она может быть наиболее очевидным неврологическим проявлением сахарного диабета и менинговаскулярного сифилиса. Сочетание амиотрофии и мышечного спазма может наблюдаться при различных формах заболеваний двигательных нервов. Амитоз — прямое деление клеточных ядер, при котором ядро делится на два (в данный процесс не вовлечен митоз). Амитриптилин — трициклический антидепрессант, обладающий умеренным транквилизирующим действием. К наиболее распространенным побочным эффектам относятся: повышенная сонливость, головокружение, онемение и покалывание в конечностях. Торговые названия: элатрол (Elatrol), триптизол (Tryptizol). Амлодипин — антагонист кальция, используемый для лечения грудной жабы (стенокардии). Принимается внутрь. Возможные побочные эффекты включают: головную боль, головокружение, повышенную утомляемость, тошноту и отеки. Торговое название: истин (Istin). Амнезия — частичная или полная потеря памяти вследствие физической травмы, заболевания, приема некоторых лекарственных препаратов или психологической травмы (см. Конфабуляция, Реакция бегства, Подавление). Антероградная амнезия — амнезия на события, которые последовали после травмы; ретроградная амнезия — амнезия на предшествовавшие травме события. У некоторых больных одновременно могут наблюдаться оба типа амнезии. Амниоскопия — исследование амниотической жидкости внутри амниотического мешка при помощи специального инструмента — амниоскопа, который вводится внутрь через брюшную стенку. Это позволяет непосредственно наблюдать развитие плода внутри данной полости. Цервикальная амниоскопия, выполняемая на более поздних сроках беременности, позволяет с помощью различных инструментов (например, фиброфетоскопа) исследовать содержимое амниотического мешка через шейку матки. Во время такого обследования содержащаяся внутри полости жидкость может быть взята на анализ без пункции амниона; также может быть проведен анализ мекония. АМФ (аденозина монофосфат) — соединение, в состав которого входят аденин, рибоза и одна фосфатная группа. Обнаруживается в клетках человеческого организма; участвует в процессах, требующих превращения энергии (см. АТФ). Амфиартроз — малоподвижное соединение костей, в котором их поверхности отделяются друг от друга хрящом, в котором имеется небольшая щель (см. Симфиз), или гиалиновым хрящом (см. Синхондроз). Амфорные дыхательные звуки — см. Звуки дыхательные. Анаболический — воздействующий на обменные процессы, образование органических веществ, в частности, белка. Анаболические агенты обычно являются синтетическими аналогами мужских половых гормонов (см. Андроген); это этилоэстренол, нандролон, оксиметолон и станозолол. Все они применяются для увеличения массы тела у больных с недостаточным весом (особенно у пожилых, а также у лиц, страдающих серьезными заболеваниями), для стимуляции кроветворения костным мозгом. Некоторые анаболические стероиды могут вызвать вирилизацию у женщин, а также привести к различным нарушениям функций печени. Анальгезия — пониженное болевое восприятие, не сопровождающееся выключением сознания и осязания. Может развиться в результате несчастного случая, если нервы оказываются поврежденными или затронутыми каким-либо заболеванием, или вызываться специально с помощью введения обезболивающих лекарств (см. Анальгетик). Местную анестезию можно по-другому назвать местной анальгезией. См. также Анальгезия относительная. Анальный — имеющий отношение к анусу; например, трещина или свищ заднего прохода. Анамнез — история болезни пациента. Анаплазия — утрата клеткой ее нормальных характеристик или дифференцировки, которая может быть до такой степени сильной, что невозможно бывает даже установить происхождение клетки. Анаплазия часто встречается у быстро растущих злокачественных опухолей. Анасарка — резкий отек ног, туловища и половых органов вследствие задержки жидкости в организме (отека); часто встречается при застойной сердечной недостаточности, а также при некоторых видах почечной недостаточности. Анастомоз — 1. В анатомии — соединение между двумя кровеносными сосудами без капиллярной связи между ними. См. Анастомоз артериовенозный. 2. В хирургии — искусственное соединение между двумя трубчатыми органами или их участками, в частности между двумя различными отделами кишечника. См. также Шунт. Анатоксин — устаревшее название токсоида. Анафилаксия — аномальная реакция на определенный антиген, при которой из тканей организма освобождается гистамин, в результате чего у человека возникает местная или общая аллергическая реакция. Аллергическая реакция (см. Аллергия) является примером локальной анафилаксии. Реже, но в более серьезных случаях, может развиться анафилактический шок: чрезвычайно сильная общая аллергическая реакция организма, при которой освободившийся из клеток гистамин вызывает отеки, сужение бронхиол, сердечную недостаточность, коллапс, а в некоторых случаях может даже закончиться смертельным исходом. — Анафилактический. Анаэроб — любой микроорганизм, особенно микроб, который способен жить, расти и развиваться при отсутствии свободного кислорода. Факультативный анаэроб представляет собой микроорганизм, который лучше растет при наличии в окружающей среде свободного кислорода, однако может расти и в случае его отсутствия. Облигатный анаэроб может расти и развиваться только при отсутствии свободного кислорода в окружающей среде. Для сравнения: Аэроб, Микроаэрофильный. Ангиит, васкулит — воспалительная бляшка на стенках небольших кровеносных сосудов. Может возникать в силу различных причин, в том числе вследствие полиартериита нодозного, острого нефрита или изменения состава сыворотки крови. Основными симптомами заболевания являются: кожные высыпания, артрит, пурпура и почечная недостаточность. В некоторых случаях полезным оказывается лечение препаратами, содержащими кортизон. Ангина Венсана — устаревшее название язвенного гингивита. Ангина лимфоидноклеточная (моноцитарная) — инфекционное заболевание, вызываемое вирусом Эпстайна-Барра; поражает шейные, подмышечные и паховые лимфатические узлы; встречается преимущественно у подростков и молодежи. После инкубационного периода, продолжающегося 5–7 дней, у человека начинают опухать и становятся болезненными лимфатические узлы, повышается температура, появляется головная боль и боль в горле, пропадает аппетит. Иногда болезнь поражает печень, вызывая гепатит; может также увеличиться селезенка. Диагноз ставится на основании выявления наличия большого количества моноцитов в крови. Осложнения этого заболевания встречаются достаточно редко, однако болезнь может длиться в течение нескольких недель до наступления полного выздоровления. Медицинское название: инфекционный мононуклеоз. Ангина Людвига — сильное воспаление горла, вызванное инфекционным поражением обеих сторон дна полости рта и приводящее к значительному опуханию шеи. При отсутствии лечения ангина Людвига может привести к сдавлению дыхательных путей и необходимости осуществления трахеостомии. Ангиография — рентгенологическое обследование кровеносных сосудов. Контрастное для рентгеновских лучей вещество вводится в артерию больного, после чего делается серия рентгенограмм (см. Артериография). Флуоресцентная ангиография является широко распространенным методом обследования больных в офтальмологии. Флуоресцин натрия вводится в локтевую вену, откуда с потоком крови разносится по всему телу человека. В глаз больного направляется свет определенной длины волны, заставляя контрастное вещество светиться в кровеносных сосудах сетчатки. Это позволяет наблюдать состояние кровеносных сосудов сетчатки глаза и фотографировать их. Ангиома — доброкачественная опухоль, развивающаяся из кровеносных и лимфатических сосудов. Старческая ангиома представляет собой небольшое красное пятно на туловище, появляющееся у людей среднего или пожилого возраста. Эти пятна не причиняют человеку никакого беспокойства и представляют собой множественные сосудистые новообразования. Артериовенозная ангиома мозга представляет собой выходящий на поверхность узелок расширенных кровеносныхсосудов, сдавливаемый поверхностью головного мозга. Такая ангиома может привести к развитию у больного эпилепсии, или один из сосудов может лопнуть и привести к субарахноидальному кровоизлиянию. Этот тип ангиом чаще всего удаляется хирургически или с помощью стереотактической радиотерапии. Заболевание может сопровождаться появлением пурпурных родимых пятен на лице (синдром Стерджа-Вебера). См. также Гемангиома, Лимфангиома. Андроген — представитель группы стероидных гормонов, включающей тестостерон и андростерон; стимулирует развитие мужских половых органов и вторичных мужских половых признаков (таких как рост бороды, становление голоса, мышечное развитие). Основным источником этих гормонов являются яички (их выработка клетками Лейдиша стимулируется присутствием лютеинизирующего гормона); кроме того, в небольших количествах они вырабатываются корой надпочечников и яичниками. У женщин избыточная выработка андрогенов может привести к маскулинизации. Аневризма — расширение просвета кровеносного сосуда в результате врожденных аномалий строения или патологических изменений его стенок. Обычно бывает связано с какими-либо дегенеративными изменениями в организме, вызвано заражением сифилисом, при котором поражается мышечная оболочка кровеносных сосудов, или может возникнуть в результате врожденной слабости стенок аорты. Аневризма аорты может развиться в любом месте аорты. Анестезия — потеря чувствительности в одной из частей или во всем теле. Анестезия отдельной части тела может развиваться вследствие травмы или в результате заболевания какого-либо нерва, например при проказе. Однако данный термин обычно применяется для описания приемов снижения или полного устранения болевых ощущений у пациента во время хирургического вмешательства. Анестезия проводится с помощью соответствующих лекарственных препаратов (см. Обезболивающие средства) или путем использования некоторых других приемов, таких как акупунктура или гипноз. Анестезия общая — искусственно вызванное состояние, характеризующееся обратимой утратой сознания и болевой чувствительности; обычно достигается с помощью введения определенной комбинации лекарственных веществ в инъекциях или в виде газов (последние вдыхаются через маску). Местная анестезия устраняет боль в какой-то ограниченной области тела; применяется при проведении небольших оперативных вмешательств, особенно ряда стоматологических процедур. Местная анестезия достигается путем введения в инъекциях таких лекарственных веществ, как лигнокаин (наиболее распространен в стоматологической практике); эти лекарства вводятся вблизи от нерва, обезболивая таким образом ткани, окружающие его. Местная анестезия может сочетаться с внутривенным введением седативных препаратов. Соответствующая инъекция в позвоночный столб вызывает спинномозговую анестезию нижних конечностей или живота. Регионарная анестезия, обычно применяемая при обезболивании конечности, достигается путем кругового введения местных анестезирующих растворов; используется в случаях, когда в силу каких-либо причин общая анестезия противопоказана. Анизоцитоз — значительное различие в размерах эритроцитов у одного и того же человека. Анизоцитоз выявляется с помощью микроскопического исследования мазка крови, в результате чего могут быть выявлены клетки различных размеров. Анизоцитоз является характерным симптомом большинства заболеваний крови. Анкилоз — сращение костей в суставе, либо заращение его костной ткани (костный анкилоз), либо соединительной фиброзной ткани. Анкилоз является осложнением длительно протекающего воспалительного заболевания сустава; он может развиться также в результате некоторых хронических инфекционных (например, туберкулеза) или ревматических (например, анкилозирующего спондилита) заболеваний. Ановуляторный — не сопровождающийся развитием и освобождением женской половой клетки (яйцеклетки) в яичнике, например в случае ановуляторной менструации. Анорексия — потеря аппетита. Анорхизм — врожденное отсутствие одного или обоих яичек. Аносмия — отсутствие обоняния. Часто развивается в результате простуды; кроме того, может возникать вследствие перелома передней черепной ямки или из-за опухоли передних отделов головного мозга. Антагонист — 1. Мышца, действующая противоположно (противодействующая) другой мышце (называемой агонистом). Работа мышц-агонистов и антагонистов позволяет человеку нормально двигаться. 2. Лекарственное или какое-либо другое вещество, оказывающее противоположное другому лекарственному веществу или какому-либо химическому процессу в теле человека действие. В качестве примера здесь можно привести антиметаболиты. — Антагонизм. Антацид — лекарственное вещество, нейтрализующее соляную кислоту, содержащуюся в желудочном соке. Такие антациды, как гидроксид алюминия, карбонат кальция, гидроксид магния и бикарбонат натрия, часто применяются для уменьшения боли и неприятных ощущений в желудке, в том числе и при язве желудка. Антеверсия — смещение органа кпереди, в частности нормальное смещение кпереди матки. Антефлексия — наклон кпереди какого-либо органа. У женщин небольшой наклон матки кпереди считается нормой. Антиген — любое вещество, которое организм человека рассматривает как чужеродное или потенциально опасное и против которого начинает вырабатывать собственные антитела. Обычно в качестве антигенов выступают белки, однако простые вещества, даже металлы, также могут становиться антигенами в сочетании с собственными протеинами человеческого организма и их модификациями. Они называются гаптены. — Антигенный. Антидот — лекарственное вещество, нейтрализующее отравляющее воздействие ядов или передозировку другого лекарственного вещества. Например, димеркапрол является антидотом для мышьяка, ртути и некоторых других тяжелых металлов. Антикоагулянт — вещество, предотвращающее свертывание крови. Природный антикоагулянт гепарин непосредственно воздействует на свертываемость крови, проявляя свою активность как внутри человеческого организма, так и на испытуемых образцах в процессе лабораторных исследований крови. Синтетические лекарственные вещества, такие как фениндион и варфарин, эффективны лишь внутри человеческого организма, так как они воздействуют на свертывающие факторы крови. Антиоксидант — вещество, способное нейтрализовать свободные радикалы кислорода. Обладает высокой химической активностью; способно разрушать атомы и химические группы, образующиеся при различных заболеваниях, вследствие воздействия на организм некоторых ядовитых веществ, радиации, никотина, а также ряда других факторов. Антиперистальтика — обратная волна, возникающая в пищеварительном тракте, которая движется в направлении ко рту (т. е. вверх или в противоположную сторону по сравнению с направлением нормального прохождения пищи) (для сравнения: Перистальтика). Ранее считалось, что это вызывает у человека рвоту, однако проведенные исследования показали, что антиперистальтика у человека не имеет к этому процессу никакого отношения. Антитело — белок крови, синтезируемый лимфоидной тканью в ответ на появление особого антигена; циркулирует в плазме крови, связывается с антигеном и обезвреживает его. Вырабатываемые в ответ на появление антигенов антитела могут быть самыми разнообразными, в зависимости от того, попали ли в организм человека бактерии или у него развилась аллергия на вдыхаемую пыльцу растений. Иммунитет и аллергия у человека в значительной степени определяются функционированием лимфоцитов. Образование антител также может происходить после трансплантации ткани или органа вследствие его отторжения. С химической точки зрения антитела — это глобулярные белки (иммуноглобулины), которые подразделяются в соответствии с их строением и выполняемыми в организме человека функциями (см. Иммуноглобулин). Антропометрия — измерение параметров человеческого тела или его отдельных частей. Сравнение может проводиться между различными людьми или представителями различных полов, возрастов и рас с целью выявления каких-либо отклонений в развитии представителей той или иной группы. — Антропометрический. Анурия — недостаточное образование мочи почками. Может развиться в силу различных условий, приводящих к стойкому падению артериального давления. Срочная помощь больному требуется в случае, если недостаточное образование мочи связано с закупоркой мочевых путей, которое необходимо как можно быстрее устранить для сохранения жизни пациента. Анурия сопровождается нарастающей уремией, в некоторых случаях может потребоваться применение гемодиализа. Анус — отверстие в нижнем конце пищеварительного тракта, через которое удаляются каловые массы. Открывается из заднепроходного канала; его деятельность находится под контролем двух сфинктеров: наружного (произвольного) и внутреннего (непроизвольного). Помимо совершения акта дефекации, анус всегда бывает закрыт. — Анальный. Аорта — главная артерия в теле человека, от которой отходят все остальные артерии. Начинается из левого желудочка сердца (луковица аорты, далее — восходящая аорта), огибает его верхушку (см. Дуга аорты) и спускается вниз перед позвоночником (нисходящая аорта). На этом пути от аорты отходит множество больших и малых ветвей. На уровне IV поясничного позвонка она разделяется на две общие подвздошные артерии — правую и левую. Участок нисходящей аорты от дуги аорты до диафрагмы называется грудной аортой, а участок, расположенный ниже диафрагмы, — брюшной аортой. — Аортальный. Аортит — воспалительное поражение стенок аорты, развивающееся чаще всего как позднее осложнение сифилиса. Главным образом при аортите поражается восходящая аорта; в результате у больного может образоваться аневризма или непроходимость коронарных сосудов. Вследствие давления на прилегающие органы и ткани или из-за недостаточного снабжения сердца кровью больного может беспокоить боль в груди. При обследовании часто выявляется аортальная регургитация. Сифилис достаточно успешно лечится с помощью пенициллина, однако в случае аневризмы аорты или клапанного поражения, чтобы спасти больному жизнь, может потребоваться оперативное вмешательство. Апноэ — асфиксия, временная остановка дыхания в силу различных причин. Приступы апноэ часто встречаются у новорожденных младенцев. К ним следует относиться очень серьезно, хотя они и не всегда связаны с каким-либо серьезным заболеванием у ребенка. Апоневроз — тонкий, но достаточно прочный лепесток плотной оформленной волокнистой соединительной ткани, заменяющий плоские листовидные сухожилия в мышцах, которые прикрепляются к костям на значительном протяжении (например, апоневроз наружной косой мышцы живота). — Апоневротический. Апоплексия — внезапно наступающее повреждение органа, сопровождающееся нарушением его целостности (кровоизлияние, разрыв и др.). Апраксия, диспраксия — неспособность к правильному выполнению целенаправленных движений. Вероятнее всего, связана с заболеванием коры головного мозга, при котором человек не может организовать свои движения, а не с его неловкостью вследствие слабости мышц, потери чувствительности или заболеваний мозжечка. Часто бывает связана с заболеванием теменных долей головного мозга, а в некоторых случаях и с заболеванием его передних долей. Арахнодактилия — аномально длинные и тонкие пальцы рук. Данное состояние обычно сопровождается наличием у больного избыточного веса, а также врожденными пороками сердца и глаз, как при синдроме Марфана. Арахноидит — воспалительный процесс, вызывающий утолщение и рубцевание (фиброз) паутинной оболочки головного или спинного мозга. В результате ущемления нервных окончаний у больного могут развиться слабость, боль и онемение в пораженном участке. Заболевание обычно бывает связано с инфекцией оболочек, кроме того, может возникнуть в результате хирургического вмешательства или в ответ на применение масляных красителей, ранее использовавшихся при проведении миелографии. В настоящее время при выполнении миелографии используют растворимые в воде красящие вещества, что исключает возможность развития арахноидита в качестве реакции на миелографию. Ареола — 1. Округлая коричневатая или розовая область, окружающая сосок груди. 2. Часть радужной оболочки, расположенная вокруг зрачка глаза. 3. Небольшой пигментированный участок ткани. — Ареолярный. Арибофлавиноз — ряд симптомов, возникающих при дефиците рибофлавина (витамина В2) в организме человека. К ним относятся: воспаление языка и губ, а также болезненные изъязвления в углах рта. Аритмия синусовая — нормальное изменение скорости сердечных сокращений, которая немного увеличивается во время вдоха и уменьшается во время выдоха. Синусовая аритмия часто встречается у здоровых людей. Артериит — воспаление стенок артерий. Может развиться в результате заболевания соединительной ткани или вследствие перенесенной инфекции, например сифилиса. Пораженные кровеносные сосуды опухают, становятся болезненными, в ряде случаев может произойти даже их закупорка. Височный или краниальный артериит чаще развивается у людей пожилого возраста и поражает артерии черепа. Больные жалуются на сильную головную боль, а вследствие тромбоза глазных артерий может наступить полная слепота. Данное заболевание успешно лечится лекарственными препаратами, в состав которых входит кортикозон. Артериосклероз — общий термин, используемый для описания поражения артерий. Часто его употребляют как синоним атеросклероза (см. Атерома). Может использоваться для описания дегенерации Мёнкеберга, при которой с возрастом кальций начинает откладываться в стенках артерий, а также при артериолосклерозе, когда стенки артериол с возрастом или вследствие развития у человека гипертензии начинают истончаться. Артралгия — боль в суставе без его опухания или каких-либо иных симптомов артрита. Для сравнения: Артрит. Артрит — заболевание суставов с поражением синовиальной оболочки, суставного хряща, капсулы и других суставных элементов, при этом суставы опухают, становятся горячими на ощупь, кожа над ними краснеет, человек испытывает в них боль и ограничение в движениях. К развитию артрита могут привести свыше 200 различных заболеваний, в том числе ревматоидный артрит, остеоартрит, подагра, туберкулез, а также многие другие. Асистола — состояние, при котором сердце перестает биться; сопровождается отсутствием соответствующих волн на электрокардиограмме. Клинические проявления, причины и лечение аналогичны тем, что применяются при остановке сердца. Астения — состояние физической слабости или аномально низкого мышечного тонуса. Астигматизм — нарушение преломляющей силы глаза, когда в одном глазу сочетаются различные виды аметропии или различные степени одного вида аметропии и происходит искажение изображения предмета (обычно по вертикальной или горизонтальной оси) вследствие того, что лучи света не фокусируются непосредственно на сетчатке глаза. Отдельные участки изображения могут фокусироваться на сетчатке, однако лучи света, исходящие от других его участков, фокусируются либо сзади, либо впереди сетчатки. Астма сердечная — синдром левожелудочковой недостаточности, возникающий внезапно в виде приступа инспираторной одышки с сухим кашлем, часто ночью. Ее следует отличать от бронхиальной астмы, так как лечение в этих двух случаях является совершенно различным. Асцит, гидроперитонеум — скопление жидкости в брюшной полости, вызывающее увеличение живота. Может развиваться в результате какого-либо инфекционного заболевания (например, туберкулеза), сердечной недостаточности, портальной гипертензии, цирроза печени, а также при различных формах рака (особенно при раке печени и яичников). См. также Отек. Атавизм — явление, при котором у человека наблюдается какой-либо признак или заболевание, имевшее место у его отдаленных предков и отсутствовавшее у родителей. Атеросклероз — заболевание, сопровождающееся образованием жировых бляшек на внутренних стенках артерий с постепенной их закупоркой и затруднением кровотока через них. См. Атерома. Атопия — разновидность аллергии, при которой у человека имеется врожденная или конституциональная предрасположенность к развитию аллергических реакций (например, сенной лихорадки, аллергической астмы, атопической экземы) при контакте с аллергеном. — Атопический. Атрезия — врожденное отсутствие или аномальное сужение какого-либо отверстия или канала в теле человека. Атрезия желчных протоков поражает желчные протоки и вызывает у младенцев развитие обтурационной желтухи; если вовремя не сделать ребенку операцию, то болезнь может закончиться смертельным исходом. При атрезии трехстворчатого клапана происходит нарушение внутрисердечного кровотока (нарушается ток крови из правого предсердия в правый желудочек). Атрофия — прекращение нормального развития органа или ткани вследствие дегенеративных изменений их клеток. Может развиться вследствие недостаточного питания, заболевания или в связи с возрастом. Атрофические изменения яичников наблюдаются у женщин во время менопаузы, атрофия желтого тела закономерно наступает во время менструального цикла. Мышечная атрофия наблюдается у человека при различных заболеваниях, например при полиомиелите. Аутоагглютинация — склеивание эритроцитов человека его собственной сывороткой, вызванное наличием в ней специфических аутоантител; часто наблюдается при приобретенной гемолитической анемии (аутоиммунной болезни). Аутоантитело — антитело, образующееся в организме человека против собственных структур при аутоиммунной болезни. Аутолиз — разрушение тканей или клеток под действием их собственных ферментов. См. Лизосома. Афазия, дисфазия — нарушение речи, при котором человек или совершенно не может говорить, или у него нарушаются содержание речи и ее понимание (хотя это и не связано с нарушением артикуляции: см. Дислалия). Афазия связана с заболеванием левой половины головного мозга (доминантного полушария) у правшей. Часто сопровождается затруднениями в чтении и письме. — Афазический. Афферентный — 1. Определенные нервы или нейроны, передающие импульсы от рецепторов к головному или спинному мозгу, т. е. любой чувствительный (центростремительный) нерв или нейрон. 2. Кровеносные сосуды, питающие сеть капилляров в том или ином органе или участке человеческого тела. 3. Приносящие лимфатические сосуды, подходящие к лимфатическому узлу. Для сравнения: Эфферентный. Ахалазия, кардиоспазм — нарушение нормальной проходимости кардиального отдела пищевода (особенно недостаточность сфинктера), связанное с недоразвитием нервно-мышечного аппарата нижнего сфинктера пищевода, в результате чего замедляется прохождение пищи по пищеводу. Ацинус — 1. Небольшая сумка или полость, окруженная секреторными клетками желез. Ряд специалистов считают данный термин синонимом альвеолы, другие различают ацинус по наличию узкого, идущего из сумки протока. 2. В легком — функциональная единица легкого — система разветвлений одной концевой бронхиолы. Эмфизема обычно классифицируется частью ацинуса, вовлеченной в патологический процесс (например, центриацинозная, панацинарная или периацинарная). — Ацинусный. Аэробный — 1. Относящийся к аэробам: требующий присутствия свободного кислорода для нормального роста и развития. 2. Используется для описания клеточного дыхания, при котором углеводы полностью окисляются содержащимся в атмосфере кислородом с освобождением максимального количества химической энергии.Б
Базалиома — эпителиальная опухоль кожи, происходящая из базальных клеток эпидермиса или кожных желез. Базофил — разновидность лейкоцитов, для которых характерно наличие в цитоплазме крупных гранул, которые окрашиваются в пурпурно-черный цвет при воздействии на цитоплазму красителя Романовского. Назначение базофилов пока что до конца не уяснено, однако известно, что они способны поглощать чужеродные частицы и, кроме того, содержат в своем составе гистамин и гепарин. Обычно в норме в одном литре крови содержится 30—150 х 106 базофилов. Бактериемия — присутствие бактерий в крови человека: свидетельствует о наличии инфекционного заболевания. Баллотирование — процедура обследования заполненных жидкостью полостей тела человека с целью определения размеров плавающего в ней объекта. Например, постукивание кончиками пальцев по стенке матки через брюшную стенку или влагалище во время беременности заставляет плод отодвинуться от нее, а затем возвратиться и передать ей ответный удар о руку врача, когда плод занимает свое первоначальное положение. С помощью данной процедуры врач убеждается в том, что увеличение матки связано с наличием в ней плода, а не с ее опухолью или каким-либо заболеванием. Бальнеотерапия — лечение заболеваний путем купаний (обычно в воде из горячих источников, содержащей большое количество минеральных веществ). Ранее было модно говорить о водолечении, однако, как выяснилось позднее, оно оказывает больше психологическое, чем физическое воздействие на человека. Сегодня специализированное лечение путем принятия ванн, проводимое под наблюдением физиотерапевта, применяется для уменьшения боли, а также улучшения кровотока и увеличения подвижности конечности при артрите и различных нервно-мышечных заболеваниях. Баротравма — повреждение уха, слуховой (евстахиевой) трубы или околоносовых пазух, вызываемое изменениями окружающего давления (например, во время воздушных путешествий или опускания глубоко под воду). Барьер гематоэнцефалический — механизм, с помощью которого циркулирующая в теле человека кровь не смешивается с жидкими тканями, окружающими клетки мозга. Гематоэнцефалический барьер является полупроницаемой мембраной, так как обеспечивает прохождение через него жидкостей и задерживает твердые частицы и крупные молекулы. Бери-бери — нарушение питания, связанное с дефицитом в организме человека витамина В1 (тиамина). Часто встречается в странах, где основной пищей является шлифованный рис, с которого снята наружная оболочка, богатая тиамином. Существуют две формы данного заболевания: мокрая бери-бери, при которой происходит скопление жидкости в тканях организма (отек), и сухая бери-бери, при которой у больного наступает сильное истощение. В обоих случаях происходит поражение нервной системы; часто может наступить смерть от сердечной недостаточности. Бета-блокатор — лекарственное вещество, предотвращающее стимуляцию бета-адренергических рецепторов нервных окончаний симпатической нервной системы и вследствие этого ослабляющее активность сердца. К бета-блокаторам относятся: ацебутолол, бетаксолол, бисопролол, окспренолол, пропранолол и соталол; все они применяются для нормализации сердечного ритма, для лечения стенокардии, а также для снижения повышенного кровяного давления при гипертензии. Блокада бета-рецепторов может привести к резкому сужению дыхательных путей, поэтому бета-блокаторы необходимо с большой осторожностью назначать больным, страдающим заболеваниями бронхов. См. также Средство симпатолитическое. Бигеминия — состояние, при котором чередующиеся эктопические систолы (экстрасистолы) сердечных сокращений прослушиваются в пульсе, в результате чего пульс разделяется как бы на две части (пульсовая бигеминия). Является характерным симптомом при отравлении препаратами наперстянки. Билиарный — относящийся или влияющий на желчь или желчный проток. См. также Фистула. Биопсия — взятие небольшого кусочка живой ткани из органа или какой-либо части тела для микроскопического исследования. Биопсия является крайне важным методом, позволяющим диагностировать большинство злокачественных заболеваний с помощью исследования фрагмента опухоли. Выполняется с помощью специальной полой иглы, которая вводится в печень, почку или какой-либо другой орган, не причиняя при этом вреда пациенту. Бифуркация — (в анатомии) точка, в которой происходит разделение на две ветви (например, кровеносных сосудов или трахеи). Блокада сердца — состояние, при котором нарушается проводимость электрических импульсов, генерируемых естественным водителем ритма сердца (синусно-предсердным узлом), в результате чего нарушается способность сердца перекачивать кровь. Брадикардия — замедление частоты сердечных сокращений (менее 50 ударов в минуту). Синусовая брадикардия часто наблюдается у здоровых людей, особенно у спортсменов, однако она может встречаться и при ряде заболеваний, например у больных с пониженной функцией щитовидной железы, желтухой, гипотермией или вазовагальным кризом. Брадикардия также может возникать при аритмии, особенно в случае полной блокады сердца, когда замедление сердечных сокращений выражено очень сильно и часто приводит к потере сознания у больного. Бронхоспазм — сужение бронхов, вызванное сокращением мышц в ответ на действие ряда факторов, например при астме или бронхите. Больной обычно может свободно вдыхать воздух в легкие, однако выдох требует от него значительных мышечных усилий и сопровождается сильным шумом при дыхании, который особенно хорошо прослушивается с помощью стетоскопа (см. Стридор). Состояние, при котором бронхоспазм может быть купирован с помощью бронхолитических средств, называется обратимой закупоркой дыхательных путей; к нему относится, например, астма. Состояние, при котором бронхолитические средства не приносят облегчения, называется необратимой закупоркой дыхательных путей; к нему относится хронический бронхит. Бронхоэктаз — расширение бронхов или их отделов. Может быть врожденным или развиваться в результате инфекции (особенно после перенесенных в детстве коклюша или кори), а также в результате закупорки бронха, связанной с попаданием в дыхательные пути инородных тел или с развитием опухоли (в том числе раковой). В расширенных бронхах может накапливаться гной; при этом отходящая во время кашля у больного гнойная мокрота может быть с примесью крови. Диагноз ставится на основании рентгенологического или ультразвукового обследования. В качестве лечения для устранения инфекции назначаются антибиотики, а для лучшего отхождения мокроты из бронхов — физиотерапия. Хирургическое лечение целесообразно лишь в случаях, когда поражены сразу несколько бронхиальных сегментов. Брыжейка — дупликатура брюшины, которая прикрепляет желудок, тонкую кишку, часть ободочной кишки и ряд других расположенных в брюшной полости органов к задней стенке живота. В брыжейке проходят кровеносные и лимфатические сосуды, а также нервы, иннервирующие органы брюшной полости. — Брыжеечный, Мезентериальный. Брюшина — серозная оболочка, выстилающая брюшную полость. Париетальная брюшина выстилает непосредственно стенки брюшной полости, а висцеральная брюшина покрывает расположенные в брюшной полости внутренние органы. См. также Брыжейка, Сальник. — Перитонеальный. Бубон — опухший и воспаленный лимфатический узел в подмышечной впадине или паховой области, обычно развивающийся при некоторых заболеваниях половых путей (например, при шанкре мягком), бубонной чуме и лейшманиозе.В
Ваготомия — хирургическая операция, заключающаяся в рассечении основного ствола или ветви блуждающего нерва. Обычно данная операция выполняется в процессе лечения пептической язвы желудка для уменьшения секреции соляной кислоты и пепсина в желудке. Стволовая (трункулярная) ваготомия заключается в отсечении основных ветвей блуждающего нерва; при селективной (избирательной) ваготомии оставляются ветви блуждающего нерва, которые иннервируют желчный пузырь и поджелудочную железу. Высокоселективная (или проксимальная) ваготомия заключается в отсечении идущих к желудку ветвей блуждающего нерва; при этом нервы, иннервирующие привратник желудка, сохраняются. Данная операция заменяет резекцию желудка. Ваз-, вaзо- — приставка, обозначающая: 1) сосуды, особенно кровеносные сосуды; 2) семявыносящий проток. Вазоактивный — влияющий на тонус и диаметр просвета кровеносных сосудов, особенно артерий. К вазоактивным относятся такие факторы, как эмоциональное возбуждение, артериальное давление, содержание углекислого газа в атмосфере и температура окружающей среды. Некоторые из них влияют на сосуды непосредственно, другие же первоначально воздействуют на сосудодвигательный центр головного мозга, а уже от него информация поступает к сосудам. Вазовазостомия — хирургическая операция, заключающаяся в наложении анастомоза между двумя участками семявыносящего протока после ранее выполненной вазэктомии: данная операция по своей сущности противоположна вазэктомии и выполняется для восстановления мужской фертильности. Вазовезикулит — воспаление семенных пузырьков и семявыносящего протока. Обычно такое воспаление развивается одновременно с простатитом, вызывая появление боли в промежности, паху и мошонке, а также повышение температуры. При исследовании семявыносяших протоков и семенных пузырьков можно обнаружить их уплотнение и болезненность. Для лечения заболевания применяются антибиотики. Вазодилататор, средство сосудорасширяющее — лекарственное вещество, вызывающее расширение кровеносных сосудов и увеличение кровотока в них. Эти вещества используются для снижения повышенного артериального давления при гипертензии. Такие коронарные вазодилататоры, как тринитрат глицерина и пентаэритритол, способствуют увеличению кровотока в сердечной мышце, поэтому их часто используют для купирования или предотвращения приступов стенокардии. При приеме сосудорасширяющих средств в больших дозах у человека могут развиться такие побочные эффекты, как приливы крови к лицу, сильная головная боль и обморок. Такие периферические вазодилататоры, как альфа-блокаторы и никотинил, воздействуют на кровеносные сосуды конечностей, поэтому они часто применяются для улучшения кровообращения при наличии у больного акроцианоза, отморожения конечностей или болезни Рейно. Вазодилатация — увеличение просвета кровеносных сосудов, особенно артерий. Такая реакция сосудов возникает в ответ на стимуляцию сосудодвигательного центра продолговатого мозга, от которого затем к сосудам поступает сигнал о необходимости расслабления стенок артерий; в результате в организме происходит снижение артериального давления. Вазоконстриктор, средство сосудосуживающее — вещество, вызывающее сужение кровеносных сосудов и уменьшение кровотока в них. К таким веществам относятся метараминол и фенилэфрин. Сосудосуживающие средства применяются для повышения артериального давления при различных нарушениях кровообращения, в случае шока или сильного кровотечения, а также для поддержания определенного уровня артериального давления во время операции. Некоторые сосудосуживающие средства (например, ксилометазолин) оказывают на организм быстрое воздействие при их местном применении, поэтому они часто применяются для устранения чувства заложенности носа. При резком повышении артериального давления у человека могут развиться головная боль и рвота. Сосудосуживающие средства часто добавляются к применяющимся в стоматологической практике растворам местных анестетиков, удлиняя продолжительность действия последних. Вазоконстрикция — сужение просвета кровеносных сосудов, особенно артерий. Такая реакция сосудов возникает в ответ на стимуляцию сосудодвигательного центра продолговатого мозга, от которого затем к сосудам поступает сигнал о необходимости сокращения мышечных стенок артерий, в результате чего повышается артериальное давление. Вазолигатура — хирургическая перевязка семявыносящего протока; выполняется для предотвращения дальнейшего распространения инфекции из мочевых путей, которая может явиться причиной развития рецидивирующего эпидидимита. Иногда данная операция выполняется одновременно с простатэктомией для предотвращения развития эпидидимита в послеоперационный период. Вазомоторика, реакция вазомоторная — изменение просвета кровеносных сосудов, особенно артерий. См. Вазоконстрикция, Вазодилатация. Вазомоторный, сосудодвигательный — контролирующий процесс сокращения и расслабления мышечной оболочки стенок кровеносных сосудов (особенно артерий), а следовательно, и просвета кровеносных сосудов. Вазопрессин, гормон антидиуретический — вырабатываемый гипоталамусом гормон, который увеличивает реабсорбцию воды почками, предотвращая таким образом обезвоживание организма. Кроме того, вазопрессин вызывает сужение кровеносных сосудов. Обычно он применяется либо через нос, либо в инъекциях для лечения несахарного диабета. Внутривенно введение вазопрессина используется также для остановки кровотечения из варикозно расширенных вен пищевода, так как этот гормон уменьшает артериальный кровоток в печени. Вазопрессин синтезируется нейросекреторными клетками гипоталамуса и транспортируется по аксонам в нейрогипофиз, откуда выделяется в кровь. Вазоспазм — ангиотрофоневроз с поражением мелких концевых артерий и артериол с локализацией верхних конечностей. Процесс симметричный и двусторонний. Вазотомия — хирургическая операция, заключающаяся в рассечении стенки семявыносящего протока. Обычно данная операция выполняется для катетеризации протока и введения в него рентгеноконтрастного вещества в процессе рентгенологического исследования состояния протока (вазографии) у пациентов с азооспермией. Вазоэпидидимостомия — хирургическая операция, заключающаяся в создании анастомоза между семявыносящим протоком и протоком придатка яичка для обхода места обструкции, которое затрудняет или делает невозможным нормальный пассаж сперматозоидов. Такая обструкция может быть врожденной или приобретенной; обычно она возникает в средней или хвостовой части придатка яичка. Поэтому чаще всего вазоэпидидимостомия выполняется путем наложения анастомоза между головкой эпидидимиса и примыкающим к ней участком семявыносящего протока. Вазэктомия — хирургическая операция, заключающаяся в иссечении семявыносящего протока. Выполнение данной операции на обоих протоках приводит к стерильности, поэтому она является одним из наиболее популярных методов контроля рождаемости. При этом вазэктомия не влияет на половое влечение и потенцию. Вакуоль — небольшая полость в цитоплазме, ограниченная мембраной, внутри которой находятся поглощенные клеткой вещества. Когда лейкоциты фагоцитируют бактерии и другие чужеродные частички, в их цитоплазме образуются вакуоли. Вакуум-экстрактор — устройство, иногда применяющееся в акушерской практике для облегчения течения родов; оно состоит из специального отсоса, который накладывается на головку плода, после чего медленно осуществляется тракция плода из родовых путей матери. Вакуум-экстрактор был создан в 1954 г. и сравнительно широко использовался до недавнего прошлого, однако в настоящее время предпочтение отдается акушерским щипцам. Вакцина — специальный препарат из антигенного материала, который используется для стимуляции процесса выработки собственных антител в организме и создания иммунитета против какого-либо заболевания или группы заболеваний. Валик мозолистого тела — утолщенный задний округлый отдел мозолистого тела, выступающий над таламусом, шишковидным телом и средним мозгом. Валик прикусной — приспособление, предотвращающее нормальное смыкание зубов в процессе ортодонтического лечения, а также используемое для лечения височнонижнечелюстного синдрома. Валик прикусной — окклюзионное разведение десен для определения правильности смыкания челюстей и регистрации их расположения в этот момент; полученная информация используется в процессе изготовления зубных протезов, мостов и коронок. Валин — основная аминокислота. См. также Аминокислота. Валиум — см. Диазепам. Вальвотомия, вальвулотомия — хирургическая операция, заключающаяся в рассечении сросшихся створок клапана. Данный термин обычно используется для описания операций, целью которых является устранение сужения отверстий, возникающих в результате стеноза клапанов сердца. Вальвулит — воспаление одного или нескольких клапанов, особенно клапанов сердца. Это воспаление может быть острым или хроническим; чаще всего причиной вальвулита является ревматическая лихорадка (см. Эндокардит). Вальгусный — данный термин применяется для описания любой деформации, вызывающей искривление внутрь конечностей (по отношению к средней линии). См. Косолапость (вальгусная косолапость), Вальгусное искривление большого пальца стопы, Колено вальгусное. Варикозный — данный термин используется для описания растянутой, содержащей большое количество узелков варикозно расширенной вены, а также для описания одной из разновидностей опухолей черепа (пещеристой аневризмы), являющейся артериовенозной аневризмой. Варикотомия — иссечение участка варикозной вены (см. Флебэктомия). Варикоцеле — варикозное расширение вен гроздьевидного сплетения семенного канатика; чаще развивается слева. Обычно варикоцеле протекает бессимптомно, за исключением иногда возникающего чувства дискомфорта в области мошонки. В некоторых случаях варикоцеле сопровождается значительным уменьшением количества сперматозоидов в семенной жидкости (см. Олигоспермия) и является причиной развития у мужчины бесплодия. Хирургическая коррекция варикоцеле у таких пациентов (варикоцелеэктомия) обычно приводит к значительному улучшению качества спермы и увеличению подвижности сперматозоидов. Вариолоид — 1. Легкая форма оспы, встречающаяся у лиц, ранее уже перенесших это заболевание, или у тех, кому была сделана профилактическая прививка против данной болезни. 2. Напоминающий натуральную оспу. Варусный — данный термин применяется по отношению к любой деформации, вызывающей смещение внутрь (по отношению к средней линии) кисти руки или стопы. См. Ноги «согнутые», Косолапость (варусная косолапость), Варусное искривление большого пальца стопы. Васкуляризация — формирование новых кровеносных сосудов (обычно капилляров) внутри ткани. Вдох шумный — шумное судорожное втягивание воздуха, которым заканчивается приступ кашля (особенно во время коклюша). Вдыхание — процесс втягивания воздуха в легкие через рот и нос. См. Дыхание. Вегетация — (в патологии) патологическое разрастание ткани, напоминающее присутствующий у растений вырост. При язвенном эндокардите такие состоящие из фибрина, смешанного с клетками крови, разрастания можно обнаружить на эндокарде клапанов сердца. Вегетирующий, вегетационный — 1. Относящийся к росту и питанию, а не к размножению. 2. Функционирующий непроизвольно или бессознательно; автономный. Везикостомия — хирургическая операция, заключающаяся в создании наружного свища мочевого пузыря для временного или постоянного отведения мочи. Иногда одновременно выполняется закрытие уретры. Везикулит — воспаление семенных пузырьков. См. Вазовезикулит. Везикулография — рентгенологическое исследование семенных пузырьков. Обычно такое исследование выполняется после введения рентгеноконтрастного вещества в обследуемые семявыносящие протоки. Кроме того, оно может выполняться с помощью катетера, вводимого через эндоскоп в эякуляторный проток. В настоящее время данное исследование выполняется редко; к нему обычно прибегают для выявления контуров семенных пузырьков. Чаще всего состояние семявыносящих протоков исследуется у пациентов, страдающих азооспермией. Везикулэктомия — хирургическая операция, заключающаяся в удалении семенного пузырька. В настоящее время данная операция выполняется крайне редко — лишь в случае наличия какой-либо опухоли семенных пузырьков. Веко — защитное образование, лежащее впереди глазного яблока и прикрывающее его сверху и снизу, а при смыкании закрывающее глаз. Каждый глаз имеет два века, покрытых тонкой кожей. В толще кожи век залегает плотная соединительнотканная пластинка, придающая твердость и форму краю века, вековая часть круговой мышцы глаза, а также видоизмененные сальные железы (мейбомиевы) хряща век. Каждое веко изнутри выстлано конъюнктивой и по краю окаймлено ресницами. Раздражение болевых рецепторов, расположенных на роговице глаза, заставляет веки рефлекторно закрываться. Воспаление мейбомиевой железы может вызвать развитие халязиона. Анатомическое название: веко. Векторкардиография — см. Электрокардиография. Венепункция — пункция вены, выполняемая в каких-либо терапевтических целях (например, для взятия на анализ крови из вены) или для внутривенного вливания. См. также Флеботомия. Венерология — раздел медицины, занимающийся изучением и лечением заболеваний, передающихся половым путем. Венесекция — см. Флеботомия. Венец — структура, напоминающая корону или венец (например, венечный шов). Венец лучистый — 1. Совокупность радиальных волокон — восходящих проводящих путей, расходящихся в различных направлениях к коре полушария большого мозга; являются частью внутренней капсулы мозга (Ред.). 2. Слой фолликулярных клеток, который окружает только что овулированную яйцеклетку. Клетки обычно вытягиваются радиально по отношению к яйцеклетке, если рассматривать ее сечение. Венечный — относящийся к венцу головы или зуба. Фронтальная плоскость делиттело на дорсальную и вентральную части. Венография, флебография — рентгенографическое исследование, позволяющее установить ход и распределение вен на каком-либо определенном участке тела. При этом в вену больного медленно вводится рентгеноконтрастное вещество, а получаемые рентгенограммы (венограммы) отражают характер распределения вен на исследуемом участке. С помощью венографии могут быть выявлены различные повреждения вен, их обструкция или аномальное соединение с другими сосудами; в этих местах нарушается заполнение вены вводимым в нее рентгеноконтрастным веществом или наблюдается вытекание из нее этого вещества. См. также Ангиография. Вентиляция легких — 1. Прибор для освежения воздуха. 2. Ручное или механическое устройство, применяющееся для искусственной вентиляции легких у пациентов с нарушенной дыхательной функцией. См. также Респиратор. Вентиляция легких искусственная «изо рта в рот» — вид искусственного дыхания, выполняемого методом «изо рта в рот», во время которого в легкие пострадавшего для их расширения вдувается воздух, а выдох осуществляется самопроизвольно. Выполняющий искусственное дыхание человек должен делать примерно 20 вдуваний воздуха в минуту (для детей эта цифра несколько больше). Вентральный, брюшной — относящийся к передней части тела или какого-либо органа или расположенный вблизи от нее. Вентрикул-, вентрикуло-, желудочково- — приставка, обозначающая желудочек (мозга или сердца). Вентрикулит — воспаление желудочков мозга, обычно развивающееся в результате инфекции. Причиной развития вентрикулита может быть также прорыв мозгового абсцесса, в результате чего его содержимое попадает в полость желудочков, или распространение на желудочки менингита из подпаутинного пространства. Вентрикулоатриостомия — хирургическая операция, выполняемая для уменьшения внутричерепного давления, создаваемого спинномозговой жидкостью при гидроцефалии. С помощью нескольких катетеров спинномозговая жидкость отводится в проходящую в шее яремную вену. Эта операция в значительной мере была вытеснена открытыми недавно возможностями, существующими в методах компьютерной томографии и ядерно-магнитного резонанса. Вентрикулография — рентгенологическое исследование желудочков мозга после введения в них воздуха или рентгеноконтрастного вещества. Вентрикулоскопия — исследование желудочков мозга с помощью волоконно-оптических приборов. См. Эндоскоп, Оптика волоконная. Вентрикулостомия — хирургическая операция, заключающаяся во введении полой иглы (канюли) в один из боковых желудочков (в одну из полостей) головного мозга. Данная операция выполняется для уменьшения повышенного внутричерепного давления, для получения из желудочков спинномозговой жидкости и ее последующего исследования или для введения антибиотиков или контрастного вещества в процессе рентгенологического обследования. Вентрофиксация — хирургическая фиксация смещенной матки к передней брюшной стенке путем укорочения круглых связок в месте их прикрепления к матке или к брюшной стенке. Венула — мелкий кровеносный сосуд, являющийся продолжением сети капилляров. Множество венул, сливаясь между собой, образуют вену. Веретенообразный — напоминающий по своему внешнему виду веретено; сужающийся с обоих концов. Вертел — один из двух отростков, располагающихся под шейкой бедренной кости. Вертиго — испытываемое больным чувство, что либо он, либо окружающие его предметы находятся в постоянном движении. Чаще всего данное состояние сопровождается ощущением вращения окружающих предметов, однако иногда человеку может казаться, что под ногами у него начинает вращаться земля. Вертиго является одним из симптомов какого-либо заболевания лабиринта внутреннего уха, нерва преддверия или расположенного в стволе мозга его ядра, которое отвечает за сохранение у человека чувства равновесия. Верхний, расположенный выше — (в анатомии) расположенный выше какой-либо другой структуры или поверхности в теле человека. Ветрогонное — лекарственный препарат, способствующий уменьшению метеоризма; применяется для лечения желудочно-кишечного дискомфорта и колик. Ветрянка — легкое, но очень заразное инфекционное заболевание, вызываемое вирусом герпеса, который передается воздушно-капельным путем. После инкубационного периода, длящегося 11–18 дней, у человека наблюдается небольшое повышение температуры, затем в течение суток на теле появляются зудящие темно-красные пятна. Эти пятна распространяются на кожу лица, головы и конечностей; вскоре они превращаются в волдыри, которые затем покрываются корочкой. Вещество белое — вещество центральной нервной системы, которое окрашено менее интенсивно, чем серое вещество. Белое вещество сформировано отростками нейронов, большинство из которых миелинизированы, и клеток глии. В головном мозге белое вещество находится внутри расположенного в коре мозговых полушарий слоя серого вещества; в спинном мозге оно расположено по периферии. Виремия — наличие вирусов в крови. Вирилизация — проявление избыточного образования андрогена (гиперандрогенизма) в организме женщины. При этом у женщины отмечается выпадение волос на коже височных областей, увеличение мышечной массы и клитора, развитие гирсутизма; голос становится более грубым и низким, а по внешнему виду фигура женщины начинает напоминать мужскую. Причиной вирилизации у мальчиков препубертатного возраста может быть развитие какой-либо опухоли (см. Опухоль Лейдига). Вирулентность — степень патогенности; способность микроорганизма вызывать то или иное заболевание. См. также Аттенуация. Висцеральный, внутренностный — относящийся к внутренним органам, например висцеральная мезодерма. Для сравнения: Соматический. Витилиго — распространенное заболевание, характеризующееся образованием на коже белых или бесцветных пятен. Встречается у представителей всех рас, однако наиболее восприимчивыми к нему являются темнокожие люди. Витилиго является аутоиммунным заболеванием и может сопровождаться развитием других аналогичных процессов (например, болезнями щитовидной железы или пернициозной анемией). Обычно болезнь постепенно прогрессирует, хотя в некоторых случаях возможна и самостоятельная репигментация пораженных участков кожи. В процессе лечения витилиго темнокожим людям иногда помогает фотохемотерапия; людям со светлой кожей лучше всего пользоваться сильными защитными кремами от солнца или другими косметическими средствами, скрывающими эти пятна. Витрэктомия — удаление всего стекловидного тела глаза или какой-либо его части, включая место, где произошло кровоизлияние. Необходимость в выполнении витрэктомии часто возникает во время проведения операции по поводу отслойки сетчатки. ВИЧ (HIV), вирус иммунодефицита человека — ретровирус, вызывающий развитие у человека СПИДа. См. также Вирус Т-клеточной лимфомы человека. Вкусовой — относящийся ко вкусу или вкусовым органам. Влагалище — нижний отдел женской репродуктивной системы — непарная полая трубка, расположенная в полости малого таза, простирающаяся от матки до половой щели и прободающая мочеполовую диафрагму. Стенка влагалища состоит из трех оболочек, в которых отсутствуют железы: толстой внутренней — слизистой, задней мышечной и наружной адвентициальной. Водопровод церебральный, водопровод Сильвиев — узкий канал, соединяющий третий и четвертый желудочки головного мозга, содержащий спинномозговую жидкость. ВОЗ — см. Организация здравоохранения Всемирная. Возбуждение — 1. Состояние настороженности и повышенного отклика на внешнее раздражение. Вызывается сильным возбуждением, тревогой или располагающей к этому окружающей обстановкой. 2. Физиологическая активация коры головного мозга такими его центрами, как активирующая ретикулярная система; возникает вследствие бессонницы и повышенной настороженности. В настоящее время считается, что сильные колебания возбуждения приводят к возникновению нервно-психических расстройств у человека, таких как нарколепсия и мания. Волокна Пуркинье — разветвления ножек пучка Гиса под эндокардом и в толще миокарда желудочков (Ред.). Волокна ретикулярные — тонкие, практически нерастяжимые разветвляющиеся волокна соединительной ткани, которые, соединяясь вместе, образуют мелкопетлистую тонкую сеть, окружающую кровеносные сосуды, мышечные волокна, железы, нервы и другие структуры, а также присутствующие в строме несколько вытянутыми у своего основания, образуя луковицу. Вуайеризм — получение сексуального удовлетворения от наблюдения за обнаженными телами других людей или половым сношением между ними. См. также Извращение половое. — Скопофил. Вульва — наружные женские половые органы, в состав которых входят лобок, большие половые губы и малые половые губы, преддверие влагалища и клитор. См. также Железы преддверные. Вульвит — воспаление вульвы, часто сопровождающееся сильным зудом (см. Зуд). Вульвовагинит — воспаление вульвы и влагалища (см. Зуд, Вагинит). Вульвэктомия — хирургическая операция, заключающаяся в удалении у женщины наружных гениталий (см. Вульва). В случае простой вульвэктомии, которая выполняется при наличии у женщины доброкачественных новообразований наружных половых органов, удаляются большие и малые половые губы, а также клитор. Радикальная вульвэктомия является более обширной операцией; она выполняется при наличии у женщины злокачественных новообразований, например рака вульвы. При этом, помимо удаления больших и малых половых губ и клитора, производится полное удаление всех близлежащих лимфатических узлов. Покрывающая эти участки кожа также удаляется, а место операции постепенно заживает с образованием грануляции. Выпот — 1. Появление гноя, экссудата, крови, лимфы или какой-либо иной жидкости в полости тела в результате воспаления или наличия избытка крови или жидкости в каком-либо органе или ткани. 2. Жидкость, которая выделяется в полости тела. Вытяжение — ортопедический прием, заключающийся в вытяжении части конечности, в то время как остальная ее часть удерживается в устойчивом неподвижном положении; применяется главным образом для лечения перелома бедренной кости.Г
Галактоза — простой сахар, составляющая молочного сахара лактозы. Процесс превращения галактозы в глюкозу происходит в печени. У младенцев с редким наследственным заболеванием обмена веществ, называемым галактоземией, отсутствует фермент, необходимый для осуществления этого превращения. Галактоземия — врожденная неспособность организма усваивать сахар галактозу, который начинает накапливаться в крови. Без лечения у больных детей отмечается задержка физического и умственного развития, однако, если исключить потребление галактозы с пищей, рост и развитие ребенка могут проходить нормально. Галакторея — самопроизвольное истечение грудного молока вне процесса нормальной лактации. Галитоз — дурной запах изо рта. Причиной временного галитоза может быть недавно съеденная пища с сильным запахом (например, лук или чеснок) или прием некоторых лекарственных веществ, таких как паральдегид. Кроме того, галитоз может возникать при дыхании человека через рот, периодонтальной болезни, а также при наличии инфекционных заболеваний носа, горла и легких (особенно в случае бронхоэктатической болезни). Запор, нарушение процесса пищеварения, а также некоторые заболевания печени также могут вносить свой вклад в появление неприятного запаха изо рта человека. Гамартома — чрезмерное разрастание зрелой ткани, в которой присутствуют аномальные элементы, свидетельствующие о наличии у человека какого-либо заболевания. Гамартома обычно является доброкачественной, однако в любом из входящих в состав ее ткани элементов могут развиться злокачественные изменения. Гамета — зрелая половая клетка: яйцеклетка у женщин или сперматозоид у мужчин. Гаметы являются гаплоидными, так как содержат половину нормального числа хромосом. Гаметогенез — процесс образования сперматозоидов и яйцеклеток. У представителей обоих полов клетки — предшественницы гамет проходят мейоз, во время которого число хромосом в них делится пополам. Однако время деления, размер и число образующихся гамет сильно отличаются у мужчин и женщин. См. Оогенез, Сперматогенез. Гаметоцит — любая клетка, которая в процессе своего развития превращается в гамету. Гаммаглобулин — любой белок, присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическом поле (см. Электрофорез). Почти все гаммаглобулины являются иммуноглобулинами. Инъекция гаммаглобулина обеспечивает человеку временную защиту от гепатита А; кроме того, недавно было установлено, что в результате этих инъекций уменьшается вероятность поражения венечных артерий болезнью Кавасаки. См. также Глобулин. Ганглии базальные, ядра базальные — несколько крупных скоплений серого вещества, расположенного в толще белого вещества большого мозга. В их состав входят хвостатое и чечевицеобразное ядра (они образуют полосатое тело), а также миндалевидные тела и ограду. Ганглий, узел — 1. Любая структура (в неврологии, анатомии. — Ред.), содержащая скопление тел нервных клеток, а также и ряд синапсов. В симпатической нервной системе цепи ганглиев образуют симпатические стволы (и узлы крупных вегетативных сплетений в брюшной полости. — Ред.), расположенные по бокам от позвоночника, в то время как в парасимпатической нервной системе ганглии располагаются внутри иннервируемых ими органов или вблизи от них. Гангрена — отмирание и разложение какой-либо части тела в результате дефицита или полного прекращения ее кровоснабжения. Причинами гангрены могут быть: травма, какое-либо заболевание, наличие атеромы в крупных кровеносных сосудах, отморожение или глубокие ожоги, а также такие болезни, как сахарный диабет и болезнь Рейно. Гангрена газовая — субфасциальная анаэробная инфекция, проявляющаяся некрозом тканей с отмиранием и разложением поврежденной ткани вследствие ее заражения бактериями. Ядовитые вещества, выделяемые этими бактериями, вызывают гниение соединительной ткани с образованием газа. Лечение обычно связано с хирургическим удалением пораженной конечности (ампутацией). Гаптоглобин — белок, присутствующий в плазме крови; связывается со свободным гемоглобином, образуя комплекс, который быстро удаляется из крови в печени. Уменьшение содержания гаптоглобина в плазме крови является характерным симптомом анемии, при которой происходит разрушение эритроцитов внутри кровеносного русла с выделением гемоглобина в плазму и его потерей с мочой. Гастрин — гормон, вырабатываемый слизистой оболочкой привратниковой области желудка (см. G-клетка). Стимулом для его секреции является наличие пищи в желудке. Этот гормон циркулирует в крови и стимулирует выделение желудочного сока (кроме того, гастрин усиливает моторику кишечника. — Ред.). Гастринома — редкая опухоль, производящая чрезмерное количество гормона гастрина, вызывая у человека развитие синдрома Золлингера-Эллисона. Эти опухоли чаще всего образуются в поджелудочной железе; примерно половина их являются злокачественными. Гастродуоденоскопия — метод обследования полости желудка и двенадцатиперстной кишки с помощью эндоскопа. См. также Дуоденоскоп. Гастродуоденостомия — хирургическая операция, заключающаяся в соединении двенадцатиперстной кишки (обычно ее горизонтальной или восходящей части) с отверстием, сделанным в желудке, для обхода места его непроходимости (например, стеноза привратника) или для облегчения выхода пищи из желудка после ваготомии. См. также Дуоденостомия. Гастроеюностомия — хирургическая операция, заключающаяся в соединении тощей кишки с отверстием, сделанным в желудке. Выполняется вместо гастродуоденостомии, если последняя операция сопряжена с техническими трудностями, или как самостоятельная операция для устранения обратного оттока желчи в желудок. Гастроптоз — опущение желудка. Несмотря на то что ранее гастроптоз считался основной причиной различных заболеваний органов брюшной полости, в настоящее время доказано, что желудок может принимать разные анатомические положения. Гастроэзофагостомия — хирургическая операция, заключающаяся в соединении пищевода с желудком; выполняется для создания обхода естественного соединения между ними, когда наблюдается его непроходимость в результате ахалазии, стриктуры (сужения) пищевода или рака. Данная операция выполняется редко, так как желудочный сок, попадающий в пищевод через такое искусственное соединение, вызывает воспаление и стриктуру последнего. Гебефрения — форма шизофрении. Обычно гебефрения представляет собой хроническое заболевание, причем наиболее заметным проявлением ее является нарушение процесса мышления: несоответствующие окружающей обстановке эмоции сопровождаются бездумной веселостью, апатией или ворчливостью, а также глупым поведением. Чаще всего гебефрения развивается в юности или в начале зрелости. Гельминтоз — заболевание, развивающееся в результате инвазии организма паразитирующими червями (гельминтами). Гемагглютинация — склеивание эритроцитов (см. Агглютинация). Связана с реакцией антитело — антиген или присутствием в организме некоторых вирусов или веществ. Гемартроз — боль в суставе и его опухание, вызванные внутрисуставным кровотечением. Он может развиться в результате травмы или самопроизвольно при некоторых заболеваниях крови (например, при гемофилии). В процессе лечения больной сустав должен находиться в неподвижном положении; также применяются холодные компрессы и устраняется заболевание крови (если оно присутствует). Гематокрит — общий объем эритроцитов в крови. Гематурия — наличие крови в моче. Эта кровь может выходить из почек, одного или обоих мочеточников, мочевого пузыря или мочеиспускательного канала в результате их травмы или при различных заболеваниях. Гемералопия — см. Слепота дневная. Гемианопия — выпадение одной из двух половин нормального поля зрения. Чаще всего у людей встречается гомонимная гемианопия, при которой одна и та же половина поля зрения (правая или левая) выпадает в обоих глазах. Иногда у человека могут выпадать внутренние половины поля зрения в обоих глазах, вызывая биназальную гемианопию, или наружные половины, что приводит к развитию битемпоральной гемианопии. Крайне редко могут выпадать обе верхние или обе нижние половины поля зрения, вызывая развитие верхней гемианопии. Гемикрания, мигрень — 1. Головная боль, развивающаяся только в одной половине головы (обычно такая головная боль называется мигренью). 2. Аномалия развития: отсутствие половины черепа у развивающегося плода. Гемипарез — см. Гемиплегия. Гемиплегия, гемипарез — паралич одной половины тела. Лицо и одна из рук часто поражаются сильнее, чем нога. Гемиплегия возникает в результате заболевания, поражающего противоположное полушарие головного мозга. Гемограмма — запись результатов обычного анализа крови, включая содержание в ней гемоглобина, общий объем и количество эритроцитов и число лейкоцитов (см. Анализ крови). Также регистрируются любые отклонения от нормы, выявляемые в ходе микроскопического исследования полученного образца крови. Гемодиализ — удаление продуктов жизнедеятельности или ядовитых веществ из крови с помощью диализа. Гемодиализ обычно выполняется больным, у которых резко нарушена функция почек; он осуществляется с помощью аппарата «искусственная почка» или диализатора. Забираемая из артерии больного кровь пропускается через диализатор и находится с одной стороны от полупроницаемой мембраны, в то время как раствор, по своему электролитному составу аналогичный циркулирующей крови, накапливается с другой стороны от нее. Гемолиз — разрушение эритроцитов. В организме человека гемолиз может развиваться в результате приобретенного дефекта самих эритроцитов или вследствие отравления, инфекционного заболевания, действия антител; часто он наблюдается также после переливания крови, если кровь была подобрана неправильно. Обычно гемолиз приводит к развитию у человека анемии. Гемолиз образцов крови может быть результатом ее неправильного сбора или хранения или может вызываться искусственно, являясь частью специального лабораторного исследования (см. Гемолизация). Гемолитический — вызывающий, сопровождающийся или приводящий к разрушению эритроцитов. Например, гемолитическое антитело является одной из причин, приводящих к разрушению эритроцитов; гемолитическая анемия развивается в результате такого разрушения (см. Анемия). Гемоперитонеум — наличие крови в брюшине — полости между париетальным и висцеральным листками брюшины. Гемопневмоторакс — наличие воздуха и крови в плевральной полости, возникающее обычно в результате травмы. Как воздух, так и кровь должны быть удалены из нее путем дренирования, чтобы легкие могли нормально расправляться. См. также Гемоторакс. Гемопоэз, кроветворение — процесс образования клеток крови и тромбоцитов, протекающий в течение всей жизни человека и приводящий к замене старых клеток новыми (при этом старые клетки удаляются из кровообращения). У здоровых взрослых людей гемопоэз осуществляется в красном костном мозге, а во время эмбрионального развития и в раннем детстве, так же как и в случае некоторых заболеваний, он может проходить в каких-либо других местах (внемедуллярный гемопоэз). См. также Эритропоэз, Лейкопоэз, Тромбопоэз. — Гемопоэтический. Геморрагический — сопровождающийся или возникающий в результате сильной потери крови (см. Кровоизлияние). Например, в этом случае у человека может развиться геморрагическая анемия (см. Анемия). Генитальный — относящийся к органам размножения или к процессу размножения. Гепарин — антикоагулянт, вырабатываемый клетками печени, базофильными лейкоцитами, а также тучными клетками; гепарин подавляет действие фермента тромбина на заключительном этапе процесса свертывания крови. Экстрагируемая очищенная форма гепарина широко используется для предотвращения свертывания крови у больных, страдающих тромбозом или аналогичными заболеваниями, а также добавляется в образцы крови, взятые для анализа. Гепарин обычно назначается больным в виде инъекций; основным побочным эффектом является кровотечение. См. также Гепарин с низкомолекулярным весом. Гериатрия — раздел медицины, занимающийся диагностикой и лечением заболеваний, развивающихся в пожилом возрасте, а также общим лечением пожилых людей. См. также Геронтология. Гермафродит — организм, у которого имеются как мужские, так и женские половые органы или у которого половые органы содержат как клетки, присущие яичникам, так и клетки, характерные для яичек. У людей истинные гермафродиты встречаются крайне редко. — Гермафродитизм. Гигантизм — аномальное увеличение размеров, приводящее к приобретению чрезмерного веса; чаще всего причиной гигантизма является повышенная секреция гипофизом гормона роста (соматотропина), наблюдающаяся в детстве. При евнухоидном гигантизме высокий рост человека сопровождается задержкой полового развития, в результате чего у человека наблюдается интенсивный рост длинных трубчатых костей с задержкой развития и слияния их концов (эпифизов). Гидрартроз — увеличение объема сустава, возникающее в результате избыточного скопления в его суставной полости синовиальной жидкости. Чаще всего гидрартроз возникает в коленных суставах, причем нередко наблюдаются его рецидивы. Установить причину гидрартроза удается не всегда; иногда позднее у больного развивается ревматоидный артрит. Гидронефроз — заболевание почек, развивающееся вследствие нарушения оттока мочи и характеризующееся расширением чашечно-лоханочной системы, патологическими изменениями ткани почки и ее атрофией. Препятствие оттоку мочи, которое может располагаться в шейке мочевого пузыря или чуть ниже ее, приводит к развитию гидронефроза обеих почек. Гинекомастия — увеличение молочных желез у мужчин, вызванное либо нарушением гормонального состава в организме, либо возникающее в результате применения гормональной терапии. Гиперволемия — аномальное увеличение объема циркулирующей в организме крови. Гипергидроз — избыточное выделение пота, которое может наблюдаться при различных заболеваниях (например, при тиреотоксикозе или лихорадочных состояниях) или развиваться в результате приема некоторых лекарственных веществ. Гиперкапния — аномально высокое содержание в крови углекислого газа. Гиперкератоз — утолщение наружного рогового слоя кожи. Часто является наследственным нарушением, при котором поражаются ладони и подошвы. Гиперметропия, дальнозоркость — состояние глаза, при котором параллельные лучи света фокусируются позади сетчатки, что приводит к ослаблению аккомодации глаза. Гиперплазия — повышенное образование и рост нормальных клеток в какой-либо ткани или органе. Пораженный участок увеличивается в размерах, однако форма его обычно не изменяется. Во время беременности таким образом у женщины увеличивается грудь. Для сравнения: Гипертрофия, Неоплазма. Гипертрихоз — чрезмерный рост волос (см. Гирсутизм). Гипогонадизм — сниженная функция половых желез (яичек или яичников), приводящая к отсутствию или недоразвитию вторичных половых признаков. Гипоксемия — уменьшение содержания кислорода в артериальной крови; клинически проявляется по наличию у человека центрального и периферического цианоза. Когда частичное давление кислорода (Р02) падает ниже 8,0 кПа (60 мм рт. ст.), у человека развивается дыхательная недостаточность. Гипоксия — недостаточное содержание кислорода в тканях организма (кислородное голодание). Гликоген — сложный углевод, в состав которого входят разветвленные цепи глюкозных единиц. Гликоген является основной формой хранения углеводов в организме, являясь точной копией крахмала, содержащегося в растениях. Гликоген накапливается в печени и мышцах и может легко расщепляться с образованием глюкозы. Глюкагон — гормон, вырабатываемый поджелудочной железой; повышает содержание сахара в крови, оказывая таким образом действие, противоположное действию инсулина. Глюкагон применяется в инъекциях для устранения диабетической гипогликемии у больных сахарным диабетом. Гомеостаз — физиологический процесс поддержания постоянства внутренней среды организма (Ред.), при котором различные параметры организма (например, кровяное давление, температура тела, кислотно-щелочное равновесие) поддерживаются в равновесии, несмотря на изменение условий окружающей среды. — Гомеостатический. Гомотрансплантат, аллотрансплантат — трансплантат живой ткани или органа, пересаживаемый от донора реципиенту (и донор, и реципиент принадлежат к одному и тому же виду); например, трансплантат сердца может быть пересажен от одного человека другому. Эти трансплантаты не приживаются, если у реципиента с помощью специальных лекарственных веществ не подавить автоматически возникающую реакцию отторжения чужеродной ткани. См. также Трансплантация. Гранулопоэз — процесс образования гранулоцитов, который обычно проходит в кроветворной ткани красного костного мозга. Гранулоциты на последнем этапе своего развития образуются из кроветворной стволовой клетки; однако их ранним предшественником, который может быть идентифицирован при микроскопическом исследовании, является миелобласт. Он делится и проходит через ряд этапов созревания, которые, соответственно, называются промиелоцит, миелоцит и метамиелоцит, перед тем как превратиться в зрелый гранулоцит. См. также Гемопоэз. Гумма — небольшая мягкая опухоль, появление которой характерно для третичной стадии сифилиса; образуется в соединительной ткани, печени, головном мозге, яичках, сердце или костях. Гуморальный — циркулирующий в крови; гуморальный иммунитет обусловлен наличием в крови специальных антител.Д
Делирий — острое нарушение психики, возникающее при органическом заболевании головного мозга. Может проявляться иллюзиями, дезориентацией, галлюцинациями или чрезмерным возбуждением; нередко возникает при нарушении обмена веществ, интоксикации, болезнях недостаточности и инфекционных заболеваниях. Деменция, слабоумие — хроническое или стойкое нарушение психики вследствие органического заболевания головного мозга. У больного отмечаются расстройства памяти, изменение личности, ослабление внимания к себе, снижение умственных способностей и дезориентация. Пресенильная деменция развивается у молодых людей или лиц среднего возраста. Данный термин иногда служит для обозначения болезни Альцгеймера и болезни Пика, однако важно отличать эти заболевания от тех заболеваний головного мозга, при которых состояние больного может улучшиться после соответствующего лечения. Деменция старческая — утрата старым человеком интеллектуальных способностей, часто сопровождающаяся изменением его поведения. См. также Деменция. Дентин — твердая ткань, образующая большую часть зуба. Дентин коронки зуба покрыт эмалью, а у корня — цементом зуба. Дентин пронизан множеством мельчайших канальцев (дентинных трубочек), которые ближе к полости зуба содержат клетки (дентинобласты. — Ред.) пульпы зуба. Обнаженный дентин крайне чувствителен к прикосновению, воздействию тепла и холода. Дерматоз — заболевание кожи, не связанное с ее воспалением. В случае юношеского подошвенного дерматоза, поражающего преимущественно детей в возрасте до 14 лет, кожа на передней части подошв краснеет, лоснится и симметрично трескается. Заболевание проходит само через несколько лет; считается, что его возникновение связано с постоянным ношением кроссовок или иной спортивной обуви. Дерматомиозит — воспалительное заболевание кожи и расположенных под ней тканей, включая мышцы. Является одной из разновидностей коллагеноза. На коже лица, головы, шеи, плеч и суставов пальцев появляется сине-красная сыпь; позднее эти участки начинают сильно опухать. Дерматомиозит у взрослых часто сопровождается каким-либо злокачественным новообразованием, однако у детей этого не наблюдается. Дермографизм — местная реакция, возникающая при надавливании на кожу. Люди с такой повышенной чувствительностью кожи могут «писать» на ней собственным пальцем или каким-либо тупым предметом, в результате чего от оказываемого на кожу давления на ней остаются полосы. Десенсибилизация (гипосенсибилизация) — 1. Метод снижения чувствительности к известному аллергену путем его введения через определенный период времени с постепенным увеличением дозы аллергена, пока в организме не разовьется сопротивляемость к нему. См. Аллергия. 2. Прием, используемый в поведенческой терапии для лечения состояния фобии. Предмет, который пациент считает опасным, очень медленно приводится в контакт с ним (сначала лишь мысленно, а затем — в действительности). Дефибрилляция — применение контролируемого электрического разряда для восстановления нормального сердечного ритма в случае остановки сердца вследствие желудочковой фибрилляции. Для проведения дефибрилляции используется дефибриллятор; его электроды размещаются либо на груди над областью сердца, либо непосредственно на самом сердце после торакотомии. Дефибринизация — удаление из крови фибрина, одного из белков плазмы крови, вызывающего ее свертывание. Обычно производится с помощью нескольких тонких проволочек, на которые накручиваются нити фибрина, прилипая к ним. Диапедез — миграция клеток через стенки кровеносных сосудов в ткани. Диапедез является важной составной частью реакции тканей на травму (см. Воспаление). Диартроз, сустав синовиальный — непрерывное соединение костей, в котором осуществляются свободные движения. Суставные концы покрыты тонким слоем гиалинового хряща, а сами кости соединены между собой связкой (капсулой). Внутренний слой суставной капсулы образован тонкой синовиальной мембраной, которая вырабатывает синовиальную жидкость. Диафиз — центральная часть (тело) длинной (трубчатой) кости. Для сравнения: Эпифиз. Дизурия — затрудненное или болезненное мочеиспускание. Обычно сопровождается учащением позывов к мочеиспусканию и чаще всего бывает связано с циститом или уретритом. Боль и жжение уменьшаются после лечения и устранения основной причины, вызвавшей развитие дизурии. Нередко состояние больных облегчается, если они потребляют большое количество жидкости. Дилатация — увеличение или расширение какого-либо полого органа (например, кровеносного сосуда) или полости. Дисменорея — болезненные менструации, которые могут проявляться в двух формах. Первичная (спазматическая) дисменорея наблюдается у молодых женщин обычно в самом начале менструации и характеризуется спазматическими болями внизу живота, начинающимися непосредственно перед началом или в самом начале менструации и продолжающимися во время ее течения. Часто у женщин в это время также отмечаются тошнота, рвота, головная боль, слабость и периферическая вазодилатация. Дисплазия, аллоплазия, гетероплазия — аномалии в развитии кожи, костей или других тканей человеческого тела. См. также Дисплазия фиброзная. — Диспластический. Дистальный. В анатомии — расположенный в стороне от места происхождения, точки прикрепления или средней линии туловища. Например, данный термин часто применяется по отношению к наиболее удаленной от средней линии туловища части конечности; к кровеносному сосуду, расположенному вдали от сердца, или к нерву, достаточно удаленному от центральной нервной системы. Дистония — постуральное (зависящее от положения тела) расстройство, вызванное заболеванием базальных ганглиев головного мозга. Дистония проявляется обычно спазмами в мышцах плеч, шеи, туловища и конечностей. Одна рука нередко удерживается больным в полусогнутом положении, а голова склонена в одну сторону. Состояние больных с дистоническими расстройствами (например, при блефароспазме) может быть несколько улучшено с помощью инъекций ботулинического токсина. — Дистонический. Дистрофия — нарушение развития органа или ткани (чаще всего мышцы) вследствие ее недостаточного питания. Данный термин применяется по отношению к нескольким заболеваниям: например мышечная дистрофия и адипозогенитальная дистрофия (см. Синдром Фрехлиха). Дисфагия — состояние, при котором процесс проглатывания пищи затруднен, крайне болезнен (см. Одинофагия) или человеку кажется, что пища застревает у него в пищеводе, перед тем как попасть в желудок. Дисфагия может развиться при различных заболеваниях полости рта и горла, закупорке глотки или пищевода, в результате болезненного поражения стенок глотки и пищевода или вследствие оказываемого на них давления извне, а также при нарушении функционирования мышц глотки или пищевода. Дисфония — нарушение голосообразования. Может возникать в результате различных заболеваний гортани, глотки, языка или полости рта, а также вследствие психогенных расстройств. Для сравнения: Дизартрия, Афазия. Диурез — повышенная секреция мочи почками. Обычно наблюдается после приема большего, чем требуется организму, количества жидкости, однако может развиваться и в результате приема мочегонных средств.Е
Еюностомия — хирургическая операция, заключающаяся в выведении тощей кишки наружу через брюшную стенку и ее вскрытии. Иногда эта операция выполняется для введения катетера в тощую кишку для кратковременного вливания через него питательных или лекарственных веществ. Еюнотомия — хирургическая операция наложения наружного свища на тонкую кишку. Еюнэктомия — хирургическая операция, заключающаяся в удалении тощей кишки или какой-либо ее части.Ж
Живот острый — синдром, который характеризуется травмой брюшной полости, или острое заболевание брюшной полости, угрожающее жизни больного. Пациент испытывает сильную боль и часто находится в шоковом состоянии. Прободение язвы желудка, тяжелое воспаление аппендикса, разрыв печени или селезенки в результате травмы — все это приводит к развитию у больного критического состояния, требующего неотложного хирургического вмешательства. Жировик — ограниченная доброкачественная опухоль из жировой ткани. Он бывает различной плотности и величины. Развивается в подкожной клетчатке спины, шеи, передней брюшной стенки. Не вызывает нарушений функций организма. Чаще удаляется с косметической целью.З
Заеда, стоматит ангулярный — заболевание слизистой полости рта, характеризующееся сухостью и образованием трещин в углах рта, нередко сопровождающееся инфицированием пораженных участков кожи. Причиной заболевания может быть постоянное облизывание губ или недостаточное содержание витаминов в организме.И
Иллюзия — неверное восприятие, связанное с нарушением интерпретации стимулов, исходящих от какого-либо объекта. Например, человек может неверно интерпретировать разговоры других людей, расценивая их как недружелюбные и ставящие своей целью уничтожить его. Иллюзии могут возникать и у психически абсолютно нормальных людей, но в этом случае они обычно самостоятельно корректируются и устраняются. Также они могут наблюдаться практически при любом психическом заболевании, особенно при депрессии. Для сравнения: Галлюцинация. Иммунизация — процесс создания иммунитета с помощью искусственных мер. Пассивный иммунитет, являющийся временным, может быть создан путем введения иммунной сыворотки. Создание активного иммунитета требует использования подвергнутых специальной обработке антигенов, чтобы стимулировать образование собственных антител в организме: эта процедура называется вакцинацией (или по-другому — прививкой). Вещество, которое применяется для проведения иммунизации (вакцина), может содержать живые бактерии или вирусы, обработанные таким образом, что они не могут причинить вреда, пока остаются антигенными; абсолютно мертвые организмы или продукты их жизнедеятельности (например, токсины), специально обработанные химически или физически таким образом, чтобы они могли производить аналогичный эффект. Иммунодепрессант, иммуносупрессант — лекарственное вещество (например, азатиоприн или циклофосфамид), снижающее сопротивляемость организма инфекциям и другим чужеродным организмам за счет подавления действия иммунной системы. Инвазия — внедрение в организм паразитов (простейших, гельминтов, членистоногих) с последующим развитием различных форм их взаимодействия. Ингибитор — вещество, предотвращающее протекание какого-либо процесса или реакции в организме. Инсулиназа — фермент, присутствующий в печени и почках; отвечает за расщепление инсулина в организме. Инсулинома — инсулинопроизводящая опухоль бета-клеток островков Лангерганса поджелудочной железы. Симптомами развития инсулиномы являются: повышенная потливость, обмороки, эпизодическая потеря сознания, а также другие симптомы гипогликемии (см. Триада Уиппла). Единичные опухоли могут быть удалены хирургическим путем. Множественные очень маленькие опухоли, рассеянные по поджелудочной железе, не могут быть удалены хирургическим путем, однако хорошо поддаются лечению лекарственными веществами, которые уничтожают бета-клетки (например, диазоксид). Истерия — 1. Заболевание, вызванное психической травмой, в результате которой возникает так называемый механизм бегства в болезнь, или условной желательностью болезненного симптома. Ранее так назывался невроз, характеризующийся эмоциональной неустойчивостью, подавленностью, диссоциацией, а также рядом физических симптомов (см. Истерический) и уязвимостью к внушению. Известны два типа истерии: конверсивная истерия, в настоящее время называемая конверсивным нарушением, и диссоциативная истерия, объединяющая группу заболеваний, которые в настоящее время обобщенно называются диссоциативными расстройствами. См. также Невроз. 2. Состояние сильного эмоционального возбуждения. Ихтиоз — врожденная группа заболеваний, чаще всего наследственных, для которых характерно изменение эпидермиса, при котором он становится похожим на рыбью чешую. Заболевание не связано с воспалительным процессом в организме. Ишемия — снижение кровоснабжения какой-либо части тела, ткани или органа, вызванное сужением или непроходимостью снабжающих ее кровеносных сосудов. Ишемия сердечной мышцы приводит к развитию стенокардии. Ишемия икроножных мышц во время физической нагрузки (вызывает перемежающуюся хромоту) или в состоянии покоя (вызывает боль, возникающую в состоянии покоя) часто встречается у пожилых людей, страдающих атеросклерозом периферических сосудов конечностей, удаленных от места, где аорта разветвляется на подвздошные артерии.К
Карбункул — острое гнойное некротическое воспаление нескольких волосяных мешочков и сальных желез, распространяющееся на подкожную клетчатку и кожу. Инфекция обычно развивается вследствие попадания в организм золотистого стафилококка и может привести к значительному некрозу кожи. В процессе лечениябольному назначаются антибиотики; иногда требуется хирургическое вмешательство. Кардиальный — 1. Относящийся к сердцу или воздействующий на него. 2. Относящийся к верхней части желудка (см. Кардия) или воздействующий на нее. Кардиоплегия — прием в медицине, при котором производится остановка сердца с помощью впрыскивания в него солевых растворов при помощи гипотермии или электростимуляции. Это позволяет производить сложные хирургические операции на сердце и безопасно выполнять его пересадку. Кардиоспазм — см. Ахалазия. Карункула, сосочек — небольшое мясистое возвышение ткани, чаще всего красного цвета. Слезное мясцо представляет собой небольшое возвышение красного цвета, расположенное у внутреннего края глаза. Края девственной плевы окружают наружное отверстие влагалища. Катаболизм — химическая реакция разложения сложных веществ в организме на простые, сопровождающаяся выделением энергии. К сложным веществам, подвергающимся разложению на простые, относятся питательные вещества, содержащиеся в пищевых продуктах (например, жиры, углеводы, белки и т. д.), а также вещества, образующиеся непосредственно в организме (такие как гликоген). См. также Метаболизм. — Катаболический. Каузалгия — стойкое неприятное ощущение жжения в конечности после частичного повреждения в ней симпатических и соматических сенсорных нервов. Кахексия — вызванное хронической болезнью состояние, при котором наблюдается резкое уменьшение массы тела, слабость и общее недомогание. Часто встречается при раке, туберкулезе легких и малярии. Кератоз — чрезмерное ороговение кожи. Старческий кератоз характеризуется появлением на поверхности кожи красных чешуйчатых пятен; особенно подвержены этому виду кератоза люди со светлой кожей (блондины), которые постоянно и подолгу загорают на солнце. Пятна со временем могут перерождаться в злокачественные новообразования. Кератоконъюнктивит — одновременное воспаление роговицы и конъюнктивы глаза. Кератомаляция — прогрессирующее заболевание глаза, связанное с нарушением питания и дефицитом витамина А в организме. Роговица глаза при этом размягчается и может разорваться. Заболевание является очень серьезным, и в результате почти неизбежно наступает слепота. См. также Ксерофтальмия. Кифоз — локализованная в одном месте деформация позвоночника, приводящая к его выпячиванию назад и образованию в этом месте горба. Данная деформация возникает в результате коллапса передней части позвонка и чаще всего является следствием остеопороза, вторичного злокачественного нароста или туберкулеза. Койлонихия — образование тонкой (хрупкой) вогнутости на ногтях (напоминающей по внешнему виду углубление в ложке). Койлонихия часто встречается у больных железодефицитной анемией, хотя точная причина ее развития неизвестна. Для ее устранения необходимо лечить все выявленные у человека сопутствующие заболевания. Колика абдоминальная — приступообразная боль в животе, обычно носящая периодический характер, когда сильная боль, длящаяся несколько секунд, затем на несколько минут проходит, а после этого возобновляется. Колика достаточно часто встречается у маленьких детей вследствие скопления газов в кишечнике из-за погрешностей в питании. Кишечная колика возникает в результате частичной или полной закупорки кишечника, а также в случае запора. В случае колики, возникшей в тонкой кишке, боль ощущается в верхней половине живота, а в случае колики, возникшей в ободочной кишке, — внизу живота. Комплемент — группа из девяти плазменных факторов, присутствующих в крови в виде неактивных проферментов, в определенной последовательности активирующих друг друга. Комплемент участвует в реакциях связывания антителами вторгшихся в организм антигенов; способствует разрушению (лизис), агглютинации и опсонизации чужеродных клеток. В ходе сопровождающей его реакции антиген — антитело может также происходить накопление фагоцитов, очищающих организм от чужеродных ему клеток. См. также Иммунитет. Констриктор — мышца, которая сжимает какой-либо орган или заставляет полый орган или какую-либо его часть сокращаться. Копролит — скопление затвердевших каловых масс внутри ободочной или прямой кишки, возникающее в результате хронического запора. Может наблюдаться их кальцификация. Копростаз — см. Запор, Закупоренный. Корень, корешок — 1. В анатомии, неврологии — пучок нервных волокон в месте его выхода из спинного мозга. 31 пара спинномозговых нервов имеет по два корешка с каждой стороны: передний корешок содержит двигательные волокна, а задний — сенсорные волокна. Эти корешки, выйдя из спинного мозга, объединяются с образованием смешанных нервов. 2. В стоматологии — часть зуба, лишенная эмали, которая расположена в зубной альвеоле и прикрепляется к ее стенкам с помощью периодонта. 3. Начальный участок какой-либо структуры (т. е. точка, в которой она отходит от другой структуры). Анатомическое название: корень. Кореподобный — данный термин применяется для описания кожной сыпи, напоминающей по внешнему виду сыпь при кори. Кормление принудительное — любые меры, применяемые к больному, который не желает или не может самостоятельно принимать пищу через рот (особенно принудительное кормление через вставляемый в желудок зонд). Коронка — 1. Покрытая эмалью часть зуба, обычно хорошо видимая в полости рта. 2. Заменитель зуба (искусственный зуб), который заменяет или покрывает большую часть или всю естественную коронку зуба. Может изготавливаться из фарфора, золота, их сочетания или, реже, из других материалов. Большинство коронок напоминают по своему внешнему виду наперсток и просто надеваются на зуб. Штифтовый зуб с наружным кольцом используется для восстановления всего зуба, когда оставшаяся часть естественной коронки зуба является недостаточной. Штифт вставляется в корень, а затем на него наращивается недостающая часть зуба. Перед тем как ставится штифтовый зуб с наружным кольцом, обязательно проводится лечение корневого канала и пульпы зуба. Коронка фарфоровая — наружное покрытие из композиционной пластмассы или фарфора, которое наносится на поверхность зуба для улучшения его формы и (или) цвета. При этом поверхность зуба требует минимальной подготовки. Первое нанесенное покрытие фиксируется на поверхности зуба с помощью эмали, которая была нанесена на зуб методом кислотного травления. Фарфоровые коронки являются менее прогрессивным способом восстановления нормального цвета зубов, чем обычные коронки. Корсет гипсовый Сайра — гипсовый корсет, предназначенный для иммобилизации и поддержания позвоночника. Он применяется в случае сильного повреждения позвоночника в результате различных заболеваний (например, туберкулеза). Кортизол — см. Гидрокортизон. Кортизон — синтезируемый непосредственно в организме кортикостероид, применяемый главным образом для лечения дефицита кортикостероидных гормонов, наблюдающегося при болезни Аддисона или после хирургического удаления надпочечников. Назначается внутрь или в инъекциях; может вызвать развитие серьезных побочных эффектов, таких как язва желудка, желудочное кровотечение, нервные и гормональные нарушения, повреждение мышц и костей, поражение глаз. Кортикостероид, кортикоид — стероидный гормон, синтезируемый корой надпочечников. Существуют две основные группы кортикостероидов. Глюкокортикоиды (например, гидрокортизон (кортизол), кортизон и кортикостерон) играют важную роль в процессе усвоения организмом углеводов, жиров и белков, стимулируют глюконеогенез в печени, а также обеспечивают нормальную реакцию организма на стресс. Естественно вырабатываемые и синтетические глюкокортикоиды обладают очень мощным противовоспалительным действием, поэтому их часто используют для лечения различных воспалительных заболеваний. Минералокортикоиды (например, альдостерона) участвуют в регуляции в организме водно-солевого баланса. Кортикостерон — стероидный гормон (см. Кортикостероид), вырабатываемый в небольших количествах корой надпочечников. Кортикотропин — см. АКТГ. Корэктопия — смещение зрачка в сторону по сравнению с его нормальным положением в центре радужной оболочки. При врожденной корэктопии зрачок обычно смещен в направлении к носу. Рубцовые изменения, возникающие после воспаления, могут также привести к смещению зрачка. Кост-, косто — приставка, указывающая на связь с ребрами. Например: костэктомия — резекция ребра. Косталгия — боль, локализующаяся в ребрах. Данный термин в настоящее время используется редко. Кости клиновидные — три кости; лежат кпереди от ладьевидной кости, занимают медиальную часть предплюсны и сочленяются с основаниями плюсневых костей: наиболее крупная медиальная клиновидная кость — с первой плюсневой костью, промежуточная — со второй, латеральная — с третьей; сзади соединяются с ладьевидной костью, с латеральной стороны — с кубовидной костью. Костный — данный термин применяется по отношению к различным участкам внутреннего уха (улитке, костным полукружным каналам и лабиринту). Косточка — небольшая кость. Например, расположенные в среднем ухе три мелкие слуховые косточки (наковальня, молоточек и стремя). Через них звуки передаются из наружного уха к лабиринту внутреннего уха. Кость — орган, образованный разновидностью соединительной ткани — костной тканью. Кости формируют скелет. Кость состоит из костных клеток, замурованных в костное основное вещество, содержащее коллагеновые волокна и пропитанное кристаллами гидроксиапатита и аморфным фосфатом кальция. Скелет человека построен в основном из пластинчатой костной ткани, которая образована костными пластинками, состоящими из костных клеток (остеоцитов) и костного основного вещества. В зависимости от расположения костных пластинок различают компактное и губчатое костное вещество. Компактное вещество кости образует ее внешний слой; костные пластинки располагаются в определенном порядке, образуя остеоны, состоящие из 5—20 цилиндрических пластинок, вставленных одна в другую (гаверсовы системы). Губчатое вещество кости, расположенное под компактным, состоит из тонких костных перекладин (трабекул), перекрещивающихся между собой и образующих множество ячеек; в них находится костный мозг. Кости подразделяются на: трубчатые (длинные и короткие), губчатые, плоские, смешанные и воздухоносные. Снаружи кости покрыты надкостницей. Костномозговая полость, в которой находится костный мозг, выстлана изнутри эндостом. Кости не только образуют скелет тела, но и участвуют в минеральном обмене, являются депо кальция, фосфора и других веществ, содержат витамины; в костномозговых полостях находится костный мозг. Кость бедренная — длинная трубчатая кость. Головка бедренной кости сочленяется с вертлужной впадиной тазовой кости, образуя тазобедренный сустав. Большой и малый вертелы представляют выступы, к которым соответственно прикрепляются средняя и малая ягодичные и большая поясничная мышцы. На нижнем эпифизе имеются два мыщелка: латеральный и медиальный, которые соединены с большеберцовой костью, образуя коленный сустав, а площадка на передней поверхности нижнего эпифиза — надколенниковая поверхность приспособлена к форме надколенника и сочленяется с ним. Шейка бедра, соединяющая головку бедренной кости с его телом, является наиболее часто встречающимся местом перелома бедра у пожилых женщин. Частичное смещение эпифиза бедренной кости в зоне роста (метаэпифиз. — Ред.), располагающейся в верхнем конце кости, приводит к деформации головки бедренной кости и преждевременным дегенеративным изменениям в тазобедренном суставе. Кость безымянная — см. Кость тазовая. Кость большеберцовая — более крупная, расположенная медиально кость голени. Ее верхний эпифиз сочленяется с бедренной костью, образуя коленный сустав, нижний — с таранной костью. Большеберцовая кость соединяется с малоберцовой межберцовым суставом, межкостной перепонкой голени и межберцовым синдесмозом (Ред.). Нижний эпифиз большеберцовой кости переходит в медиальную лодыжку; суставные поверхности медиальной лодыжки и нижнего эпифиза большеберцовой кости сочленяются с таранной костью. Кость височная — парная кость мозгового черепа. Ее чешуйчатая часть образует боковую поверхность черепа (от нижней части снаружи отходит скуловой отросток, у основания которого расположена нижнечелюстная ямка, куда входит мыщелковый отросток нижней челюсти, образуя височно-нижнечелюстной сустав. От нижней поверхности пирамиды отходит шиловидный отросток. — Ред.), каменистая часть, имеющая форму трехгранной пирамиды, располагается в основании черепа; внутри пирамиды залегают барабанная полость (среднее ухо) и костный лабиринт, содержащий органы слуха и равновесия (внутреннее ухо). От наружной поверхности пирамиды отходит сосцевидный отросток, воздухоносные ячейки которого сообщаются с барабанной полостью. Самая маленькая барабанная часть ограничивает наружное слуховое отверстие, которое переходит в наружный слуховой проход (Ред.). См. также Череп. Кость головчатая — самая большая кость запястья (см. Запястье). Сзади соединяется с ладьевидной и полулунной костями, спереди — со второй, третьей и четвертой пястными костями и по бокам — с трапециевидной и крючковидной костями. Кость гороховидная — самая мелкая кость запястья (сесамовидная. — Ред.), по своему внешнему виду напоминающая горошину; соединяется с трехгранной костью. Кость затылочная — блюдцеобразная кость мозгового отдела черепа, которая входит в состав задней стенки и основания черепа. Она состоит из четырех частей, расположенных вокруг большого (затылочного) отверстия, через которое проходит спинной мозг: базиллярной части спереди, двух латеральных и чешуи сзади (Ред.). На наружной поверхности латеральных частей по краям большого (затылочного) отверстия расположены два затылочных мыщелка, которые сочленяются с первым шейным позвонком (атлантом). Кость клиновидная — кость мозгового черепа, расположенная в центре основания черепа. Она состоит из тела, содержащего воздухоносную полость, которая сообщается с полостью носа (см. Пазухи носа придаточные); двух пар крыльев (больших и малых), которые участвуют в образовании стенок глазниц, и двух крыловидных отростков, отходящих вниз от тела кости. На верхней поверхности тела находится гипофизарная ямка, в которой залегает гипофиз. См. Череп. Кость крючковидная — крючковидная кость запястья (см. Запястье). По бокам она соединяется с головчатой и трехгранной костями, сзади — с полулунной костью, а спереди — с четвертой и пятой пястными костями. Кость кубовидная — кость, занимающая латеральный край предплюсны, которая соединяется с четвертой и пятой плюсневыми костями спереди и сзади пяточной костью. Кость ладьевидная — похожая на ладью кость предплюсны; соединяется спереди с тремя клиновидными костями, сзади — с таранной костью, а с латеральной стороны — с кубовидной костью. Кость ладьевидная — напоминающая по внешнему виду ладью кость запястья. Внизу ладьевидная кость сочленяется с костью-трапецией, головчатой и трапециевидной костями, вверху — с лучевой, сбоку — с полулунной костью. Эта кость чаще всего травмируется при опоре во время падения на запястье. Кость лобковая — кость, образующая нижнюю и переднюю часть тазовой кости (см. также Таз). Обе лобковые кости соединяются спереди, образуя лобковый симфиз. См. также Лобок. Кость лобная — кость, образующая лоб и верхние стенки глазниц; содержит несколько воздухоносных полостей (лобные пазухи) (см. Придаточные пазухи носа). В момент рождения ребенка его лобная кость состоит из правой и левой половин, соединенных швом, который обычно зарастает в течение первого года жизни ребенка. См. Череп. Кость локтевая — медиальная, большая из костей предплечья. Ее верхний эпифиз соединяется с плечевой и лучевой костями, а нижний — непосредственно с костями запястья. На верхнем эпифизе локтевой кости расположены локтевой и венечный отростки, а нижний переходит в конический шиловидный от росток. — Локтевой. Кость лучевая — длинная трубчатая кость предплечья (для сравнения: Кость локтевая). Она частично вращается вокруг локтевой кости, обеспечивая пронацию и супинацию кисти руки. Головка лучевой кости сочленяется с плечевой костью, образуя плечелучевой сустав, и с локтевой, образуя лучелоктевой сустав (Ред.). Нижний эпифиз этой кости сочленяется с ладьевидной, полулунной и трехгранной костями, образуя лучезапястный сустав, а также с локтевой костью (посредством локтевой вырезки на боковой поверхности этой кости). — Лучевой. Кость малоберцовая — длинная тонкая трубчатая кость, меньшая из двух костей голени. Головка малоберцовой кости чуть ниже коленного сустава сочленяется с большеберцовой костью; нижний дистальный утолщенный конец, называемый латеральной лодыжкой, соединяется с одной стороны с таранной костью. Кость межтеменная, кость инков — кость, расположенная в крыше черепа между теменными костями. Кость небная — парная кость лицевого черепа, участвующая в образовании твердого неба, полости носа и глазницы. См. Череп. Кость носовая — парная узкая, продолговатой формы кость лицевого черепа. Обе кости, соединяясь между собой, образуют спинку носа. См. Череп. Кость плечевая — кость, образующая скелет верхнего сегмента руки. Головка плечевой кости сочленяется с суставной впадиной лопатки, образуя плечевой сустав. Внизу блок плечевой кости сочленяется с блоковидной вырезкой локтевой кости, а головка мыщелка плечевой кости — с суставной ямкой головки лучевой кости. Лучевая кость, кроме того, сочленяется с локтевой, образуя проксимальный лучелоктевой сустав (Ред.). Кость подвздошная — одна из трех костей, составляющих тазовую кость: широкая кость, образующая с каждой стороны верхнюю часть тазовой кости (см. также Таз). На внутренней поверхности она имеет вогнутость (подвздошную ямку). — Подвздошный. Кость подъязычная — небольшая отдельная U-образная кость лицевого черепа, расположенная на шее; служит местом прикрепления мышц. Кость удерживается в одном положении с помощью мышц и связок, которые соединяют ее с шиловидным отростком височной кости. Кость полулунная — кость запястья (см. Запястье). Спереди соединяется с головчатой и крючковидной костями, сзади — с лучевой костью, а с боков — с трехгранной и ладьевидной костями. Кость пяточная — крупная кость предплюсны, заканчивающаяся сзади пяточным бугром. Спереди соединяется с кубовидной костью, а сверху — с таранной костью. Кость решетчатая — кость мозгового отдела черепа, которая входит в состав переднего отдела основания черепа и главным образом лицевого черепа, участвуя в образовании стенок глазниц и носовой полости. Решетчатая пластинка решетчатой кости — пронизана множеством маленьких отверстий, через которые проходят обонятельные нервы. См. также Гребень решетчатый, Череп. Кость седалищная — кость, образующая с каждой стороны нижнюю часть тазовой кости (см. также Таз). — Седалищный. Кость сесамовидная — овальная кость, расположенная в толще сухожилия и обычно лежащая на поверхности другой кости. Надколенник и гороховидная кость запястья являются сесамовидными костями. Кость скуловая — парная кость лицевого черепа, образующая его рельеф; скуловая кость участвует в образовании глазницы. См. Череп. Кость слезная — самая мелкая парная кость лицевого черепа: участвует в образовании медиальной стенки прямоугольной формы глазницы. См. Череп. Кость тазовая — кость, образованная в результате сращения подвздошной, седалищной и лобковой костей. Вертлужная впадина сочленяется с бедренной костью (головка бедренной кости входит в углубление вертлужной впадины) (см. Сустав тазобедренный). Лобковая и седалищная кости ограничивают запирательное отверстие, расположенное чуть ниже и немного впереди вертлужной впадины. Правая и левая бедренные кости образуют часть области таза. Кость таранная — кость предплюсны; блок таранной кости сверху сочленяется с большеберцовой костью, сбоку — с обеими лодыжками и снизу — с пяточной костью. Кость теменная — парная четырехугольная плоская кость, образующая верхнебоковой отдел свода черепа. См. Череп. Кость трапециевидная — кость запястья (см. Запястье). Внизу она соединяется со второй пястной костью, наверху — с ладьевидной костью, а с боков — с костью-трапецией и головчатой костью. Кость трехгранная — кость запястья (см. Запястье). Сверху она соединяется с локтевой костью, а также с гороховидной, крючковидной и полулунной костями запястья. Кость эндесмальная, кость, развившаяся из мезенхимы — кость, развивающаяся (из мезенхимы. — Ред.) в соединительной ткани путем ее непосредственной оссификации, без первоначального образования хрящевой ткани. Примером таких костей являются кости лицевого и мозгового отделов черепа. Кость-трапеция — одна из костей запястья (см. Запястье). Сверху она соединяется с ладьевидной костью, снизу — с первой пястной костью, образуя седловидный запястно-пястный сустав первого пальца (Ред.), а с боков — с трапециевидной костью. Котиледон — структурно-функциональная единица сформированной плаценты, представляющая собой чашеобразные пространства, разделенные децидуальными сектами (Ред.). Каждый котиледон содержит главную ветвь, состоящую из пупочных кровеносных сосудов плода, которая разветвляется далее в множестве ворсинок хориона, образующих поверхность котиледона. Котримоксазол — антибактериальное лекарственное вещество, в состав которого входят сульфаметоксазол и триметоприм. Котримоксазол принимается внутрь в таблетках, так как оба эти препарата хорошо усваиваются в организме человека и быстро выводятся из него, причем каждое из составляющих усиливает действие другого; особенно эффективен при лечении инфекций мочевыводящих путей (например, при лечении цистита). Побочные эффекты такие же, как и у сульфаниламидов. Торговые названия: бактрим (Bactrim), септрин (Septrin). Кофактор — небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия). Кофеин — алкалоид, присутствующий в чае и кофе; оказывает стимулирующее действие на организм человека, особенно на центральную нервную систему. Применяется для поддержания бодрствования и повышения умственной активности; кроме того, обладает мочегонными свойствами; в некоторых случаях уменьшает головную боль. Часто входит в состав анальгетиков вместе с аспирином или кодеином. Кофермент — небелковое органическое соединение, присутствующее в ферменте и играющее важную роль в протекании реакций, которые катализируются этим ферментом. К коферментам, часто содержащим витамины группы В в своей молекулярной структуре, относятся кофермент А, ФАД, НАД и др. Кофермент А — нуклеотид, в состав которого входит пантотеновая кислота, являющаяся важнейшим коферментом в цикле Кребса, а также в реакциях метаболизма жирных кислот. Коэффициент внутрибольничной смертности — см. Коэффициент смертности. Коэффициент выписки из больницы — число случаев выписки из больницы после лечения по поводу какого-либо определенного заболевания по отношению к населению охватываемой области (обычно выражается по регионам в отношении к 10 000 человек). Коэффициент дыхательный — отношение объема углекислого газа, поступающего из крови в альвеолы легких, к объему кислорода, поглощаемого альвеолами. Обычно этот коэффициент равен примерно 0,8, так как по сравнению с выделяющимся углекислым газом потребляется большая часть кислорода. Коэффициент заболеваемости — определение заболеваемости по числу новых случаев возникновения болезни в данной популяции за рассматриваемый период времени. Данный коэффициент может быть выражен через количество заболевших человек или число случаев развития заболевания, приходящихся на 1000 человек. Для сравнения: Коэффициент распространенности болезни. Коэффициент интеллекта — показатель умственного развития. Этот коэффициент отражает интеллектуальные способности детей и взрослых по отношению к другим людям; у детей он также отражает скорость их развития (психический возраст по отношению к хронологическому возрасту). Большинство тестов на интеллектуальное развитие разрабатывается таким образом, чтобы результирующий коэффициент интеллекта имел среднее значение 100, а стандартное отклонение составляло примерно 15. Коэффициент материнской смертности — число смертельных исходов, развившихся в результате осложнений во время беременности, родов и в послеродовой период, по отношению к общему числу родов (т. е. включая мертворожденных детей). Ранее этот коэффициент представлял число смертельных исходов, приходящееся на 1000 родов, однако так как в таком выражении он является очень низким, в настоящее время обычно он отражает число смертельных исходов, приходящееся на 100 000 родов. Коэффициент общий — общее число случаев (например, заболевания раком легких), выраженное в процентах (или в пересчете на 1000 человек и т. д.), по отношению к населению в целом. Когда такие факторы, как возраст или пол населения, могут сильно повлиять на эти коэффициенты (например, на коэффициент смертности или коэффициент заболеваемости), необходимо сравнить отдельные половозрастные коэффициенты в нескольких возрастных группах желаемого пола (например, раком легких чаще заболевают мужчины в возрасте от 55 до 64 лет). Более сложные расчеты, учитывающие возрастной уклон населения в целом, требуют введения стандартизированных коэффициентов. В них коэффициенты в подгруппах выражаются в процентах по отношению к желаемым или стандартным группам населения; особенно часто эти коэффициенты используются в возрастном диапазоне от 15 до 64 лет. Коэффициент перинатальной детской смертности — см. Коэффициент смертности среди младенцев. Коэффициент репродукции — см. Рождаемость. Коэффициент смертности — число смертельных исходов какого-либо заболевания за данный период времени, приходящееся на 100 случаев возникновения данного заболевания за тот же период времени. Если все эти смертные случаи не связаны с какой-либо эпидемией (например, холеры), когда практически в одно и то же время умирает большое количество людей, они чаще всего могут явиться результатом заболевания, начавшегося несколько раньше (поэтому здесь лучше говорить о коэффициенте, чем о скорости). Ежегодное сравнение количества поступивших в данную больницу с каким-либо конкретным заболеванием и умерших от него больных называется определением коэффициента внутрибольничной смертности. Коэффициент смертности среди младенцев — число смертных случаев среди младенцев в возрасте до года, приходящихся на 1000 живых детей, родившихся в течение данного года. В состав этого коэффициента входит смертность среди новорожденных, характеризующаяся числом смертных случаев среди новорожденных в течение первого месяца жизни, и смертность среди новорожденных после первого месяца жизни, характеризующаяся числом смертных случаев среди детей в возрасте от одного месяца до года. В состав коэффициента смертности среди новорожденных, в свою очередь, входит ранняя детская смертность (в течение первой недели жизни) и более поздняя детская смертность (на второй, третьей и четвертой неделях жизни). В развитых странах смертность среди новорожденных составляет примерно две трети от общего числа случаев детской смертности, причем большая часть смертных случаев возникает в течение первой недели жизни ребенка. Коэффициент смертности среди младенцев обычно считается больше мерой социального благополучия, нежели мерой качества дородового наблюдения и (или) акушерского мастерства; последнее лучше всего отражается с помощью коэффициента перинатальной детской смертности, который является суммой мертворожденных и умерших в течение первой недели жизни детей, приходящихся на 1000 случаев родов. См. также Коэффициент мертворождаемости. Коэффициент смертности среди новорожденных — см. Коэффициент смертности среди младенцев. Крани-, кранио- — приставка, указывающая на связь с черепом. Например: краниопластика — хирургическое восстановление дефектов или деформации черепа. Краниально — по направлению к голове. Краниальный — относящийся к голове. Краниокласт — хирургический инструмент, применяемый для отделения черепа плода от его туловища. Данная редкая процедура выполняется в случае мертвого плода для обеспечения возможности его естественного прохождения через родовые пути матери. Краниометрия — раздел медицины, занимающийся определением различий в размерах и форме черепа. Краниосиностоз — преждевременное сращение некоторых костей черепа, происходящее обычно еще до рождения ребенка, в результате которого череп не может расшириться в отдельных направлениях и принять нормальную форму, необходимую для растущего мозга. В зависимости от того, какие черепные швы срастаются раньше, череп может иметь удлиненную спереди назад форму, быть широким и коротким, остроконечным (акроцефалия) или асимметричным. Для сравнения: Краниостеноз. Краниостеноз — преждевременное заращение швов между костями черепа ребенка, в результате чего череп остается аномально маленьким. Для сравнения: Краниосиностоз. Краниотомия — 1. Трепанация черепа — хирургическое удаление части крыши черепа для исследования или биопсии головного мозга и его оболочек или для уменьшения избыточного внутричерепного давления (например, при субдуральной гематоме). 2. Хирургическая перфорация черепа мертвого плода во время трудных родов, что способствует возможности продолжения родов. В обоих случаях для проведения краниотомии используется трепан. Краниофарингиома — опухоль головного мозга, происходящая из остатков кармана Ратке — эмбриональной структуры, из которой впоследствии развивается гипофиз. Вследствие уменьшения секреции гормона вазопрессина больного могут беспокоить повышенное внутричерепное давление и несахарный диабет. На рентгенограмме черепа обычно проявляются кальцинированные участки, окружающие опухоль; кроме того, вокруг гипофиза кости черепа утрачивают свою нормальную структуру. Крапивница — аллергическое заболевание, являющееся результатом реакции гиперчувствительности немедленно-замедленного типа на аутогенные и экзогенные факторы, характеризующиеся образованием на коже и слизистой оболочке волдырей. При этом у человека очень быстро (в течение нескольких часов) развивается отек какой-либо части тела. Наиболее часто встречается острая крапивница, которая является ответом организма на такие, например, аллергены, как клубника или морепродукты. Хроническая крапивница не связана с аллергией и может постоянно наблюдаться у человека в течение нескольких лет. Ангиоэдема представляет собой аллергический отек губ, глаз или языка; иногда этот отек может быть столь сильным, что человек нуждается в срочной медицинской помощи. Для предотвращения развития крапивницы предрасположенным к ней людям необходимо регулярно принимать антигистаминные препараты. Красители Романовского — группа красителей, которые применяются для микроскопического исследования клеток крови; к этой группе принадлежат различные смеси тиазиновых красителей (например, азура В) с эозином. Красители Романовского дают характерную окраску исследуемых клеток крови, на основании которой производится их классификация. К этой группе красителей относятся красители Лейшманна, Райта, Мэй-Грюнвальда, Гимзы и др. Красители Судановые — группа азокрасителей, используемых для окрашивания жиров. В состав этой группы входят: судан I, судан II, судан III, судан IV и судан черный. Краситель Бисмарка коричневый — основной анилиновый краситель, применяемый для окрашивания гистологических и бактериальных образцов. Краситель Гимза — смесь метиленового синего и эозина, применяемая для распознавания различных типов белых клеток крови и для выявления паразитических микроорганизмов в мазках крови. Является одной из разновидностей красителей Романовского. Краситель трехвалентный Маллори — гистологический краситель, в состав которого входят растворимый в воде анилиновый синий или метиловый синий, оранжевый G и щавелевая кислота. Перед окрашиванием производится травление ткани, затем она обрабатывается кислым фуксином и фосфомолибденовой кислотой. В процессе окрашивания ядра клеток приобретают красный цвет, мышцы — красный или оранжевый, нервная ткань — сиреневый, коллаген — темно-синий, а слизистая оболочка и соединительная ткань окрашиваются в синий цвет. Краситель, окрашивание — 1. Краситель, используемый для окрашивания тканей и других образцов в процессе их микроскопического исследования. В кислых красителях необходимый цвет достигается путем действия на вещество кислотного радикала, причем окрашиваются те части образца, которые имеют основную (щелочную) реакцию. В основных красителях необходимый цвет достигается за счет действия на вещество основного радикала, причем окрашиваются те части образца, которые имеют кислую реакцию. Нейтральные красители не имеют сродства ни с кислотами, ни со щелочами. Контрастные красители применяются для окрашивания тех участков ткани, которые не были окрашены после действия на эту ткань первичного красителя. Дифференциальное окрашивание позволяет распознавать присутствующие в ткани элементы, которые после окрашивания можно различить по цвету. 2. Окрашивание образца для его последующего изучения под микроскопом. Краснуха — острое вирусное заболевание, возбудителем которого является неустойчивый во внешней среде вирус, проникающий в организм через слизистые оболочки верхних дыхательных путей. Необходимо оберегать от контакта с больными беременных женщин, не болевших краснухой. Профилактика: вакцинация в 1, 6 или 13 лет. У беременных, контактирующих с больным краснухой, определяют антитела класса М (Ig М), их наличие говорит об отсутствии иммунитета. При отсутствии антител решают вопрос о прерывании беременности. Крауроз — атрофия какой-либо части тела, обычно вульвы у пожилых женщин (крауроз вульвы). Заболевание связано со снижением выработки половых гормонов у женщин. Крахмал — сложный углевод, в виде которого углеводы накапливаются в большинстве растений; основная составляющая продуктов питания. Крахмал содержит связанные мономеры глюкозы и встречается в двух формах: амилоза и амилопектин. В амилозе входящие в ее состав молекулы глюкозы образуют длинную неразветвленную цепь; в амилопектине они образуют разветвленную цепь. Наличие крахмала может быть выявлено с помощью йода: он окрашивает амилозу в синий цвет, а амилопектин — в красный. Переваривание крахмала в организме происходит под действием фермента амилазы. См. также Декстрин. Краш-синдром, токсикоз травматический — почечная недостаточность, развивающаяся в результате обширной травмы и некроза мышечной ткани. Краш-синдром развивается вследствие острого некроза почечных канальцев, сопровождающегося наличием в крови миогемоглобина, который высвобождается из поврежденной мышечной ткани. Креатин — продукт белкового обмена веществ в мышцах. Его фосфат — креатинфосфат, фосфокреатин, фосфаген — является высокоэнергетическим фосфатом в мышцах и необходим для образования АТФ (источника энергии, обеспечивающего мышечное сокращение) из АДФ. Креатиназа, креатинкиназа — фермент, участвующий в метаболическом разложении креатина до креатинина. Креатинин — один из природных метаболитов, образующихся в мышцах из креатина и фосфата креатина. Креатинин выводится из организма почками. Креатинурия — избыточное содержание в моче азотистого соединения креатина. Креаторея — повышенное содержание азота в каловых массах вследствие нарушения пищеварения или процесса всасывания в тонкой кишке. Встречается главным образом при недостаточности функции поджелудочной железы. См. Дегенерация фибрознокистозная, Панкреатит. Крезол — сильнодействующий антисептик; эффективен против многих микроорганизмов. Применяется главным образом в мыльных растворах для проведения общей дезинфекции. Иногда в небольших концентрациях применяется в качестве консерванта растворов для инъекций. Растворы крезола раздражают кожу, а при попадании в рот разъедают все поверхности, с которыми они соприкасаются, вызывая у человека боль, тошноту и рвоту. Крем защитный — крем, используемый для защиты кожи от растворимых в воде веществ, которые могут вызвать ее раздражение (например, различных чистящих средств или продуктов распада мочи). Обычно применяется в виде крема или мази, часто с добавлением силикона (например, диметикона). Защитные кремы часто приносят человеку значительное облегчение, смягчая кожу при различных кожных раздражениях, в том числе при опрелостях и пролежнях. Крем обезболивающий — крем, содержащий смесь местноанестезирующих средств. Наносимый на кожу толстым слоем, он оказывает местное обезболивающее действие, позволяя взять на анализ образцы крови и облегчить выполнение биопсии у маленьких детей. Крепитация, хрип — хорошо прослушиваемый в легких с помощью стетоскопа звук, напоминающий треск. Этот звук возникает либо в дыхательных путях и альвеолах во время их раскрытия при вдохе, либо в результате прохождения воздушных пузырьков через жидкость. В здоровых легких такие звуки обычно не прослушиваются. Крепитация — 1. Щелчок или шум, возникающий в результате трения кости о кость или о поверхность хряща в суставе, пораженном артритом. Крепитация в коленном суставе является характерным симптомом хондромаляции надколенника у молодых и остеоартрита у пожилых людей. 2. Аналогичный звук, прослушиваемый в стетоскоп при дыхании больного воспалением легких, если стетоскоп поместить над пораженным участком. Кресло стоматологическое — кресло, на котором лежит больной во время лечения зубов. С помощью электрических переключателей можно менять положение пациента в кресле; часто кресло подсоединено к стоматологической установке. Крестец — массивная закругленная треугольная структура, входящая в состав позвоночника, образованная пятью сросшимися между собой крестцовыми позвонками. Вверху крестец соединяется с пятым поясничным позвонком, внизу — с копчиком, а ушковидные поверхности сочленяются с тазовыми костями, образуя крестцовоподвздошные суставы. См. также Позвонок. — Крестцовый. Кретинизм — эндокринное заболевание, связанное с врожденной гипофункцией щитовидной железы, характеризующееся задержкой физического и психического развития. Кри-, крио- — приставка, указывающая на связь с холодом. Кривая Ланге — вышедший из употребления метод определения избыточного содержания глобулинов в белке, присутствующем в спинномозговой жидкости. Ранее этот метод применялся для диагностики нейросифилиса и рассеянного склероза, однако в настоящее время его заменили более совершенные диагностические тесты. Кривошея — наклон головы в пораженную сторону с ее одновременным поворотом в противоположную сторону, обусловленный укорочением грудино-ключично-сосцевидной мышцы (чаще врожденным). Причиной кривошеи может быть родовая травма грудино-ключично-сосцевидной мышцы (см. Опухоль грудино-ключично-сосцевидной мышцы). Консервативное лечение (корригирующие упражнения) следует выполнять начиная с 2-недельного возраста. Оперативное лечение заключается в миотомии и пластическом удлинении мышцы. Уменьшение боли может быть достигнуто путем рассечения двигательных спинномозговых нервов, иннервирующих мышцу, или путем введения в пораженные мышцы ботулинического токсина. Криз вазовагальный — состояние, характеризующееся чрезмерной активностью блуждающего нерва, в результате чего у человека замедляется сердцебиение и снижает ся артериальное давление, что приводит к обмороку. См. Синкопе, Обморок. Криз Дитля — острая закупорка верхнего отдела мочеточника, вызывающая сильную боль в пояснице. Закупорка может возникнуть в месте соединения почечной лоханки с мочеточником, вызывая ее растяжение скопившейся мочой (см. Гидронефроз). Иногда моча отходит самопроизвольно, что приводит к уменьшению боли, однако острая декомпрессия почки может потребовать хирургического устранения закупорки (пиелопластика). Кризис — 1. Переломная точка в ходе заболевания, после которой у больного наступает или улучшение, или ухудшение состояния. Со времени открытия антибиотиков при инфекционных заболеваниях кризис наступает очень редко. 2. Внезапное возникновение сильной боли при некоторых заболеваниях. См. также Криз Дитля. Кризотерапия — лечение заболевания при помощи золота или соединений, в состав которых оно входит. Инъекции или применение солей золота внутрь чрезвычайно эффективны при лечении артрита у некоторых больных. Несмотря на это, у других пациентов могут развиться сильные побочные эффекты от их приема, например нарушения состава крови и функции почек, а также дерматит. Криоглобулин — аномальный белок — иммуноглобулин (см. Парапротеин), — который может присутствовать в крови при ряде заболеваний. Криоглобулины становятся нерастворимыми при низкой температуре, приводя к закупорке небольших кровеносных сосудов, расположенных в пальцах рук и ног, в холоднуюпогоду и вызывая появление характерной сыпи. Наличие криоглобулинов (криоглобулинемия) может являться симптомом различных заболеваний, в том числе макроглобулинемии, системной красной волчанки, а также ряда инфекционных заболеваний. Криозонд — см. Криохирургия. Криоконсервация — консервация тканей путем их замораживания. Криоконсервация эмбриона может использоваться как часть процесса искусственного оплодотворения вне организма матери, например в случае, если зачатие ребенка в организме матери невозможно в силу каких-либо медицинских причин. Криопреципитат — осадок, образующийся при замораживании и последующем оттаивании при определенных условиях. Примером криопреципитата может служить осадок, получаемый из свежезамороженной плазмы крови, которая затем оттаивает при температуре 4 °C. Этот осадок чрезвычайно богат свертывающим фактором, фактором VIII (антигемофилическим фактором), и используется для остановки кровотечений при гемофилии. Криостат — 1. Камера, в которой производят срезы замороженной ткани с помощью микротома. 2. Прибор, служащий для поддержания необходимой низкой температуры. Криотерапия — использование холода для лечения различных заболеваний. См. Криохирургия, Гипотермия. Для сравнения: Термотерапия. Криохирургия — использование очень низких температур в локализованном участке тела для замораживания и разрушения тканей. Основным инструментом в криохирургии является криозонд, который имеет тонкий конец, охлаждаемый с помощью углекислого газа или закисно-кислородной смеси, расширяющейся внутри него. Криохирургия часто применяется для лечения отслойки сетчатки, разрушения некоторых костных опухолей, а также для удаления некоторых пятен с кожи. Крипт-, крипто- — приставка, указывающая на скрытое протекание чего-либо. Например: криптогенный — имеющий неизвестное происхождение. Крипта — небольшая ямка, мешочек или полость, например либеркюновы крипты (см. Либеркюновы железы), являющиеся трубчатыми углублениями в собственной пластинке слизистой оболочки кишечника. Криптококкоз, торулез — широко распространенное в мире заболевание, особенно часто встречающееся в США, вызываемое грибком. Грибок поражает легкие, вызывая образование в них опухолевидной массы (торуломы), однако не приводит к появлению никаких других симптомов, по которым можно было бы заподозрить у человека заболевание легких. Болезнь может распространиться на головной мозг и вызвать менингит. Криптококкоз хорошо лечится амфотерицином В. Криптоменорея — отсутствие кровяных выделений у женщин во время менструации, несмотря на присутствие всех остальных симптомов ее наступления. Криптоменорея может развиться из-за очень маленького наружного отверстия влагалища (вследствие заращения девственной плевы) или в результате какого-либо иного препятствия оттоку крови. Криптон-81М — радиоактивный газ — короткоживущий изотоп, используемый в медицине (время его полураспада составляет 13 с). Этот изотоп применяется для исследования функции легких. Пациент вдыхает небольшое количество газа, поступление которого в различные участки легких регистрируется с помощью гамма-камеры. См. также Рубидий-81. Крипторхидизм, крипторхизм — неполное опущение яичек в мошонку, когда они остаются в брюшной полости или в паховом канале. Иногда возникает необходимость в проведении операции орхидопексии для низведения яичек в мошонку до момента наступления полового созревания, чтобы обеспечить их последующее нормальное развитие; считается, что более высокая температура брюшной полости отрицательно влияет на образование сперматозоидов. — Крипторхичный. Криптофтальмоз — кажущееся отсутствие глаз вследствие недоразвития век во время эмбрионального развития, проявляющееся в отсутствии щели между верхним и нижним веком. Кристаллы Шарко-Лейдена — тонкие бесцветные остроконечные кристаллы, присутствующие в мокроте больных астмой. Кровать воздушная — кровать с матрасом, в верхней поверхности которого сделано множество отверстий, через которые под давлением подается воздух. Пациент, таким образом, лежит на воздушной подушке. Данный тип кровати незаменим для лечения ожоговых больных с большой площадью поражения. Крове-, крово- — приставка, обозначающая кровь. Кроветворный, гематогенный — 1. Имеющий отношение к образованию крови или ее компонентов; гемопоэтический. 2. Производимый кровью, происходящий из крови или переносимый с кровью. Кровоизлияние внутримозговое — кровотечение из мозговой артерии в ткань головного мозга. Чаще всего возникает при различных дегенеративных изменениях кровеносных сосудов или в результате повышения кровяного давления, однако может развиться и из-за врожденных аномалий развития кровеносных сосудов. Характер симптомов и сила поражения зависят от места кровотечения и его интенсивности: проявления внутримозгового кровоизлияния могут варьироваться от быстропроходящей слабости или онемения конечностей до глубокой комы и смерти человека. См. также Атерома, Гипертензия, Удар. Кровоизлияние у основания ногтей — кровоизлияние под ногтями, обычно возникающее в результате травмы; иногда его причиной может быть также подострый бактериальный эндокардит или сильный ревматоидный артрит. Кровоизлияние, кровотечение — вытекание крови из лопнувшего кровеносного сосуда (может быть внешним и внутренним). Артериальная кровь имеет ярко-красный цвет и выходит пульсирующими толчками; венозная кровь — темно-красного цвета и вытекает равномерно, а повреждение мелких кровеносных сосудов может привести лишь к незначительному кровотечению. Разрыв крупного кровеносного сосуда, такого, например, как бедренная артерия, может привести к потере нескольких литров крови в течение нескольких минут; в этом случае, если сразу же не оказать человеку помощь, может развиться шок, коллапс и наступить смерть. См. также Гематемезис, Гематурия, Кровохарканье. Кровообращение коллатеральное — 1. Альтернативный путь прохождения крови по боковым кровеносным сосудам при закупорке основных. 2. Артерии, соединяющие между собой снабжающие сердце ветви коронарных артерий. У верхушки сердца они образуют очень сложные анастомозы. Кровообращение экстракорпоральное — замена сердца в кардиохирургии работой аппарата искусственного кровообращения на время вынужденной остановки сердца во время проведения операции. До восстановления естественного кровообращения функции сердца и легких выполняет насос-оксигенатор (см. Машина сердечно-легочная). Кровосмешение, инбридинг — скрещивание близкородственных или генетически сходных особей, индивидуумов (например, двоюродного брата с сестрой). Наличие инбридинга в популяции в значительной степени контролируется существующими традициями и культурными устоями. Для сравнения: Скрещивание генетически различных особей. Кровотечение из слизистой оболочки желудка капиллярное — вышедший из употребления термин, обозначающий гематемез (кровотечение из желудка). Кровотечение маточное профузное — сильное маточное кровотечение, сходное с кровотечением при меноррагии или выкидыше. Кровотечение носовое — кровотечение из носа, которое может развиться в результате какой-либо травмы или вследствие наличия у человека высокой температуры, высокого артериального давления или при различных заболеваниях крови. Кровотечение из кровеносного сосуда, расположенного непосредственно в преддверии носа, может быть остановлено простым зажатием ноздри. В иных случаях для остановки кровотечения применяется марлевый тампон. Медицинское название: эпистаксис. Кровохарканье — отхаркивание крови, выделяющейся из легких или бронхов. К данному симптому всегда следует относиться крайне серьезно, сколь бы незначительным ни было выделение крови. У некоторых больных, однако, отхаркивание крови не имеет какой-либо серьезной причины, а у других установить эту причину не удается вообще. Однако в любом случае о появлении этого симптома необходимо сообщить врачу. Кровь — жидкая ткань организма, циркулирующая по всему телу. Кровь проходит по артериям и венам, обеспечивая связь огромного количества различных веществ, переносимых к различным органам и тканям тела. Кровь состоит из клеток крови, которые находятся во взвешенном состоянии в жидкой среде, плазме крови. В среднем в организме человека на один килограмм веса тела приходится 70 мл крови (около 5 л для среднего взрослого мужчины). Кровяной — 1. Окрашенный в цвет крови, содержащий кровь или покрытый ею. 2. (По отношению к тканям) содержащий аномально большое (по сравнению с нормой) количество крови. Кромолин натрия — лекарственное вещество, применяемое для предотвращения и лечения приступов астмы и аллергического бронхита. Назначается в ингаляциях; иногда вызывает раздражение слизистой оболочки глотки и гортани. Торговое название: интал. Кротамитон — лекарственное вещество, которое уничтожает клещей; применяется для лечения струпьев и аналогичных кожных инфекционных заболеваний, а также для уменьшения зуда. Наносится на поверхность кожи в виде лосьона или мази; иногда может вызвать покраснение кожи и аллергические реакции. Торговое название: эуракс. Круг Виллизиев — артериальный круг большого мозга, расположенный в основании головного мозга. Образуется благодаря соединению ряда артерий, снабжающих головной мозг: задних мозговых, передних мозговых и задних соединительных. Виллизиев круг обеспечивает нормальное кровоснабжение мозга в случае закупорки какого-либо питающего мозг сосуда. Большинство аневризм артерий головного мозга развивается непосредственно в сосудах Виллизиева круга. Круг кровообращения большой — совокупность кровеносных сосудов, которые снабжают кровью все части тела, за исключением сосудов (малого круга кровообращения) легких, в которых осуществляется газообмен. Большой круг кровообращения образован аортой и ее ветвями, по которым обогащенная кислородом кровь распределяется по всему организму, а также все вены, по которым обедненная кислородом кровь поступает в полые вены. Для сравнения: Круг кровообращения малый. Круг кровообращения малый — система кровеносных сосудов, которая начинается в правом желудочке и направляется в легкие, где происходит газообмен, и заканчивается в левом предсердии (Ред.). Обедненная кислородом кровь из правого желудочка сердца поступает в легочную артерию, откуда переносится во все расположенные в легких капиллярные сети, оплетающие альвеолы. В них происходит газообмен, в процессе которого из крови удаляется углекислый газ и происходит ее обогащение кислородом. Обогащенная кислородом кровь затем поступает в вены, которые, соединившись в четыре легочные вены, возвращают кровь в левое предсердие. Эта обогащенная кислородом кровь по большому кругу кровообращения циркулирует по всему телу человека. Круп — острое воспаление и непроходимость дыхательных путей, в том числе гортани, трахеи и бронхов у маленьких детей (чаще всего наблюдается в возрасте от шести месяцев до трех лет). Причиной крупа обычно является вирусная инфекция, однако нередко может развиться и вторичная бактериальная инфекция. Симптомы крупа такие же, как и при ларингите, однако они сопровождаются симптомами непроходимости воздуха в дыхательные пути — резким затруднением дыхания (см. Стридор), учащением пульса, беспокойством и цианозом. Лечение направлено на то, чтобы успокоить ребенка и увлажнить вдыхаемый воздух, — обычно это устраняет угрожающие жизни симптомы крупа. В очень тяжелых случаях непроходимости дыхательных путей может потребоваться проведение интубации или трахеостомии. См. также Эпиглоттит. Крыло — (в анатомии) любая крыловидная структура, например крылья носа или крыло подвздошной кости. Крыша — анатомическая структура, покрывающая какой-либо орган или часть органа. Например, крыша барабанной полости представляет собой тонкую костную пластинку, отделяющую барабанную полость от полости черепа. Крыша среднего мозга — структура среднего мозга, в которой различают пластинку крыши (четверохолмие), состоящую из четырех беловатых холмиков: двух верхних (подкорковые центры зрительного анализатора) и двух нижних (подкорковые центры слухового анализатора). Крючок I — 1. В анатомии — передний, загнутый конец парагиппокампальной извилины (Ред.). 2. Хирургический инструмент с загнутым или искривленным концом, который используется для удержания, поднятия или оттягивания назад ткани во время операции. Крючок II — любая крючкообразная структура, например, изогнутый конец парагиппокампальной извилины на нижней поверхности полушария мозга. Крючок зубной — инструмент для удаления зубного камня. Может быть ручным или приводиться в действие с помощью ультразвуковых колебаний. Ксамотерол — лекарственное вещество, стимулирующее бета-рецепторы сердца (см. Средство симпатомиметическое); применяется для длительного лечения умеренной сердечной недостаточности. Назначается внутрь. Возможные побочные эффекты: головные боли, головокружение, мышечные спазмы, учащение сердцебиения и появление сыпи на коже. Торговое название: корвин. Ксантелазма — желтые бляшки, образующиеся симметрично вокруг век. У пожилых людей они образуются очень часто, причем представляют собой косметический дефект; лишь в некоторых случаях образование таких бляшек может быть проявлением нарушения обмена жиров в организме (гиперлипидемии). Ксантин — азотсодержащий продукт окисления пуринов (аденозина и гуанина). Ксантин является промежуточным продуктом расщепления нуклеиновых кислот до мочевой кислоты. Ксантинурия — выделение с мочой аномально большого количества производной пурина ксантина; обычно развивается в результате врожденного нарушения обмена веществ. Данное заболевание встречается крайне редко и протекает практически бессимптомно. Ксанто- — приставка, обозначающая желтый цвет. Ксантома — образование желтых пятен на коже, вызванное нарушением липидного обмена в организме. Существует несколько видов ксантом. Туберозные ксантомы обычно образуются на коже коленных и локтевых областей; сухожильные ксантомы — на сухожилиях разгибателей кистей и стоп, а также на ахилловом сухожилии. Гроздья из небольших желтых папул, которые могут появиться на любом участке тела, называются высыпающими ксантомами, в то время как более плоские образования называются плоскими ксантомами. Ксантоматоз — образование множественных ксантом на поверхности кожи. См. Ксантома. Ксантопсия — желтое зрение: нарушение цветового зрения, при котором все предметы кажутся желтыми. Иногда ксантопсия развивается в результате отравления организма наперстянкой. Ксантофилл — желтый пигмент, присутствующий в зеленых листьях растений. Одним из примеров ксантофилла является лютеин. Ксантохромия — желтая окраска кожи (например, во время желтухи) или спинномозговой жидкости (если она содержит продукты расщепления гемоглобина, попавшие в нее из красных клеток крови (эритроцитов). Ксено- — приставка, обозначающая отличие; чужеродность по отношению к чему-либо; чуждость чему-либо. Ксеногенный — данный термин применяется для описания тканевого трансплантата, полученного от представителя иного, чем реципиент, вида. Ксенодиагностика — метод диагностики инфекций, передающихся через насекомых. Неинфицированные насекомые, являющиеся переносчиками какого-либо инфекционного заболевания, высасывают кровь у пациента, подозреваемого в наличии у него этой болезни. Диагноз подтверждается, если после этого в организме насекомых появляются болезнетворные паразиты. Данный метод широко используется для диагностики болезни Чагаса; в этом случае для диагностики заболевания применяются клопы-редувиды (переносчики этой болезни), так как в анализе крови не всегда удается выявить паразитов. Ксенотрансплантат — см. Гетеротрансплантат. Ксенофобия — болезненный страх всего чужого и незнакомого. См. Фобия. Ксеро- — приставка, обозначающая сухость чего-либо. Ксеродермия — слабо выраженная форма ихтиоза — наследственное заболевание, характеризующееся значительной сухостью кожи и образованием на ней отрубевидных рубцов. Чаще всего встречается у людей пожилого возраста. Ксероз — аномальная сухость конъюнктивы, кожи или слизистых оболочек. Ксероз конъюнктивы глаза не приводит к уменьшению образования слез, а лишь вызывает изменения в самой мембране, которая утолщается и приобретает серый оттенок в месте поражения; эти изменения можно заметить, когда глаз человека бывает открыт. Ксерорадиография — метод рентгенографии, при котором рентгеновское изображение получается на фотобумаге. Данный метод обычно применяется для выявления рака молочной железы (ксеромаммография). Ксеростомия — см. Синдром сухого рта. Для сравнения: Птиализм. Ксерофтальмия — прогрессирующее заболевание глаз, связанное с дефицитом витамина А в организме. Основными его симптомами являются сухость, утолщение и сморщивание роговицы и конъюнктивы. Заболевание может осложниться кератомаляцией и в конце концов привести к слепоте. Ксилен, диметилбензен — жидкость, которая применяется для увеличения прозрачности тканей в процессе их подготовки к микроскопическому исследованию после дегидратации. См. Просветление. Ксилоза — сахар — пентоза (т. е. в состав этого соединения входят пять атомов углерода); участвует в процессах взаимных превращений углеводов. Применяется в диагностических целях при исследовании функционирования кишечника. Ксилометазолин — лекарственное вещество, вызывающее сужение кровеносных сосудов (см. Средство сосудосуживающее). Действие его наступает быстро и продолжается в течение длительного времени. Применяется местно для уменьшения отечности и заложенности носа при простудах и синусите. Побочные эффекты встречаются редко. Торговое название: отривин. Кулицид — вещество, убивающее москитов и комаров. Кулон — единица количества электричества в системе СИ, равная количеству электричества, передаваемому за 1 с при токе, равном 1 А. Обозначение: К. Кульдоскоп — полый прибор, снабженный линзами и лампочкой; применяется для непосредственного осмотра матки, яичников и фаллопиевых труб (кульдоскопия). Кульдоскоп проводится через стенку влагалища позади шейки матки. В настоящее время его практически полностью заменил лапароскоп. Кульдоцентез — см. Кольпотомия. Культура — 1. Популяция микроорганизмов (обычно бактерий), выращенных в твердой или жидкой питательной среде; такой средой чаще всего являются агар, питательный бульон или желатин. Монокультура содержит один вид бактерий. Культивирование с введением материала осуществляется путем прокалывания плотной питательной среды и представляет собой бактериальную культуру, выращенную в твердой пробке внутри бутылки (или пробирки); среда инокулируется путем прокалывания ее тонкой проволочкой, на конце которой находятся данные бактерии. Запасная культура является неизменной бактериальной культурой, из которой начинают развиваться подкультуры. См. также Культура тканевая. 2. Культивирование (выращивание) бактерий или других микроорганизмов. Культура запасная — см. Культура. Культура тканевая — культура живых тканей, взятых из организма и помещенных в соответствующую среду, где обеспечивается их необходимое питание и снабжение кислородом. Кумарин — лекарственное вещество, используемое для предотвращения свертывания крови в процессе лечения тромбофлебита и эмболии легких. Основным побочным эффектом является возникновение кровотечений. Купол — 1. Небольшое возвышение в конце улитки внутреннего уха. 2. Любое возвышение куполообразной формы в анатомических структурах. Купол — небольшая, желатинообразная, напоминающая купол структура, лежащая на волосковых клетках ампулярных гребешков перепончатых ампул полукружных каналов внутреннего уха. В купол погружены реснички волосковых клеток. Кураре — экстракт из коры южноамериканских деревьев (виды Strychnos и Chondodendron); нарушает проведение нервно-мышечного возбуждения (Ред.) и вызывает расслабление и паралич скелетной мускулатуры. На протяжении многих веков использовался южноамериканскими индейцами для отравления наконечников стрел; также ранее применялся для устранения мышечных спазмов при столбняке, использовался во время проведения хирургических операций в качестве мышечного релаксанта. В настоящее время вместо него во время операций применяют тубокурарин. Куру — заболевание, поражающее исключительно представителей одного из племен Новой Гвинеи. Оно характеризуется прогрессирующей дегенерацией нервных клеток центральной нервной системы, особенно в той области головного мозга, которая контролирует осуществляемые человеком движения. В результате происходит нарушение контроля мышечных движений и развивается тремор туловища, конечностей и головы. Это заболевание встречается преимущественно у женщин и детей и обычно считается неизлечимым — через 9—12 месяцев оно заканчивается смертельным исходом. Причиной его возникновения считается прион, а передается оно при каннибализме. См. также Энцефалопатия губчатая. Кусачки костные — мощные щипцы, предназначенные для откусывания ткани (особенно костной). Кутикула — 1. Эпидермис кожи. 2. Слой твердого или полутвердого вещества, покрывающий эпителий; секретируется клетками кожи (особенно развит в покровах беспозвоночных животных — Ред.). 3. Наружный слой клеток, покрывающий кору волоса. Кюретаж — выскабливание кожи или внутренней поверхности какого-либо органа или полости тела при помощи похожего на ложку инструмента — кюретки; производится обычно для удаления пораженной болезнью ткани или для получения образцов ткани в диагностических целях (см. также Дилатация). Кюретаж кожи сочетается с каутеризацией; производится для удаления базальноклеточной карциномы, себорейного кератоза и т. д.; обычно после него на коже остаются небольшие рубцы. Кюретка — похожий на ложку инструмент для выскабливания ткани из полости (см. Кюретаж, Дилатация). Кюри — практически вышедшая из употребления единица радиоактивности. В настоящее время она заменена на беккерель. Обозначение: Ки. Кюри-терапия дистанционная — вид лучевой терапии, при которой источник воздействующего на организм человека излучения находится на некотором расстоянии от больного. Первоначально в качестве источника излучения использовался радий; в настоящее время для этой цели применяются искусственные радиоактивные изотопы (например, кобальт-60).Л
Лабеталол — лекарственное вещество, в состав которого входят альфа- и бета-блокаторы (см. Вещество лекарственное симпатолитическое), иногда оно оказывается более эффективным при лечении повышенного кровяного давления, чем простые бета-блокаторы. Назначается внутрь или внутривенно. Возможные побочные эффекты: обморок во время изменения положения тела с горизонтального на вертикальное, покалывание кожи головы, а также затрудненные мочеиспускание и эякуляция. Торговые названия: лаброкол (Labrocol), трандат (Trandate) Лабиальный, губной — 1. Имеющий отношение к губе или губам. 2. Данный термин применяется по отношению к прилегающей к губам поверхности зубов. Лабио — приставка, обозначающая губу (губы). Лабиомансия — распознавание речи человека по губам. Лабиопластика, хейлопластика — хирургическое восстановление губ после травмы или их деформации. Лабиринт (внутреннего уха) — система, состоящая из полостей и протоков, образующая органы слуха и равновесия. Перепончатый лабиринт представляет собой комплекс связанных между собой мембранных каналов и камер: полукружные каналы, маточка, мешочек (орган равновесия) и улитка (орган слуха). Внутри лабиринт заполнен специальной жидкостью — эндолимфой. Костный лабиринт представляет собой систему костных каналов и камер, которая снаружи окружает перепончатый лабиринт. Он находится в пирамиде височной кости и также заполнен жидкостью (перилимфой). Лабиринт костный — см. Лабиринт. Лабиринт перепончатый — см. Лабиринт (внутреннего уха). Лабиринтит, отит внутренний — воспаление лабиринта внутреннего уха. См. Отит. Лаваж — промывание какой-либо полости тела (например, ободочной кишки или желудка) водой или лекарственным раствором. Лаваж бронхоальвеолярный — метод получения клеточного материала из легких; применяется главным образом при обследовании легких и мониторинге легочных заболеваний, а также при исследовании легочных инфильтратов у больных с пониженной функцией иммунной системы. Исследование клеток в жидкости лаважа часто способствует установлению причины заболевания легких. В сочетании с цитологическими и микробиологическими исследованиями оно позволяет значительно повысить точность постановки диагноза при таких заболеваниях, как пневмония, вызванная микроорганизмом Pneumocystis carinii. Лагена — закрытый конец спирали улитки внутреннего уха. Данный термин чаще применяется для описания гомологичных улитке внутреннего уха образований у примитивных позвоночных. Лагофтальм — состояние, при котором человек не может полностью закрыть глаза. В результате из-за чрезмерного освещения глаз это может привести к повреждению роговицы. Лаетрил — цианидсодержащее соединение, получаемое из персиковых косточек. Применяется в альтернативной медицине для лечения различных видов рака. Лазер — прибор, позволяющий получить очень тонкий пучок света с высокой концентрацией энергии в нем. В хирургической практике лазер применяется для проведения операций, затрагивающих небольшие участки ткани, с минимальным повреждением окружающих тканей. Например, лазер широко применяется для устранения закупорки коронарных артерий, вызванной их атеромой, а также для удаления некоторых видов родимых пятен с кожи (см. Невус). В хирургии глаза применяются различные виды лазеров, которые позволяют выполнять операции на роговице, капсуле хрусталика и сетчатке глаза (см. Лазер аргоновый. Лазер диодный, Лазер эксимерный, АИГ-лазер). Кроме того, лазеры используются в процессе лечения цервикальной интраэпителиальной неоплазии, а специальный лазер (AHr: Nd-laser (Nd: YAG laser)) — для удаления слоя эндометрия. Лазер аргоновый — тип лазера, создающего мощный световой поток; применяется в хирургии глаза для лечения заболеваний сетчатки (например, диабетической ретинопатии). См. также Фотокоагуляция. Лазер диодный — портативный лазер; применяется для лечения заболеваний сетчатки глаза путем ее небольшого прижигания (см. Фотокоагуляция). Лазер эксимерный — лазер, применяющийся для удаления очень тонких слоев ткани с поверхности роговицы глаза. Данная операция может производиться с целью изменения кривизны поверхности роговицы, например в процессе лечения миопии (фото- рефракционная кератэктомия) или для удаления пораженной болезнью ткани (например, обезызвествленной) с поверхности роговицы (фототерапевтическая кератэктомия). Лазикс — см. Фуросемид. Лакриматор — вещество, которое раздражает глаза и приводит к сильному слезотечению. Лакт-, лакти-, лакто- — приставка, обозначающая: 1. Молоко. 2. Молочную кислоту. Лактаза — фермент, секретируемый железами тонкой кишки; катализирует превращение лактозы (молочного сахара) в глюкозу и галактозу в процессе переваривания пищи. Лактальбумин — молочный белок, присутствующий в молоке в меньшей концентрации, чем казеин. В отличие от казеина, он не осаждается из молока при воздействии на него кислой среды; поэтому обычно он входит в состав сыра в большем количестве, чем в состав творога. Лактация — секреция молока молочными железами, которая обычно возникает в конце беременности. До образования молока отмечается выделение особой жидкости, называемой молозивом; стимулом для секреции молока и молозива является воздействие, оказываемое ребенком во время сосания материнского соска. Процесс лактации контролируется с помощью специальных гормонов (см. Пролактин, Окситоцин) и прекращается после отнятия ребенка от груди и полного прекращения его кормления грудью. Лактоген — вещество, стимулирующее секрецию молока или увеличивающее его отделение. Лактоза — сахар, в состав которого входят одна молекула глюкозы и одна молекула галактозы; его присутствие обнаруживается исключительно в молоке. Под действием фермента лактазы, который секретируется в тонкой кишке человека, лактоза расщепляется на составляющие ее сахара. Однако в организме некоторых людей, особенно живущих на Дальнем Востоке и в Африке, этот фермент отсутствует или обладает крайне низкой активностью, что приводит к неспособности этих людей усваивать лактозу (к непереносимости лактозы). Лактозурия — присутствие молочного сахара (лактозы) в моче. Лактозурия часто наблюдается у женщин во время беременности и кормления грудью, а также в случае подавления секреции молока. Лактулоза — сахар, дисахарид, действующий как слабое, но достаточно эффективное слабительное средство. Назначается внутрь, но не усваивается и не расщепляется в организме человека, а остается в нетронутом виде, пока не достигнет ободочной кишки. Там под действием бактерий он расщепляется на входящие в его состав простые сахара, способствуя задержке в кишечнике некоторого количества воды и смягчая таким образом затвердевшие каловые массы. Торговые названия: дуфалак (Duphalac), лактулоза (Lactulose). Лакуна — (в анатомии) небольшая полость или углубление; например, одно из пространств компактного слоя кости, в котором располагаются костные клетки. — лалия — суффикс, указывающий на связь с речью. Лалляция — 1. Неразборчивое, отдаленно напоминающее человеческую речь лепетание младенцев. 2. Неправильная замена одного согласного звука другим во время речи. Ламелла — тонкий желатиновый диск, используемый для введения в глаз лекарственных веществ. Этот диск помещается в конъюнктивальный мешок; его желатиновая основа растворяется, и лекарство начинает впитываться в ткани глаза. Ламинэктомия, рахиотомия — хирургическая операция, заключающаяся в рассечении дуги позвонка для обеспечения доступа к спинному мозгу. Хирург обычно удаляет дугу одного или нескольких позвонков. Операция выполняется для удаления опухолей, в ходе лечения некоторых травм позвоночника (например, выпадающего межпозвоночного диска) — в этом случае производится удаление пораженного болезнью диска, или для уменьшения давления на спинномозговой нерв. Ламотригин — противосудорожный лекарственный препарат, применяемый при эпилепсии для уменьшения частоты припадков. Назначается внутрь. Возможные побочные эффекты: тошнота, головная боль, двойное зрение, головокружение, атаксия и появление кожной сыпи. Торговое название: ламиктал (Lamictal). Лампа щелевая — лампа, позволяющая получить узкий луч света; применяется вместе со специальным микроскопом. Может использоваться для исследования мелких структур внутри глаза. Ланатозид — лекарственное вещество, сходное по своему действию с наперстянкой; применяется для лечения сердечной недостаточности. Назначается внутрь или в инъекциях. Применение ланатозида в больших дозах может привести к развитию таких побочных явлений, как потеря аппетита, тошнота, рвота, головная боль, нарушение зрения и сердечной деятельности. Торговое название: цедиланид. Лануго — тонкие волоски, покрывающие тельце и конечности человеческого плода. Большинство их появляется примерно на 28-й неделе и выпадает на 40-й неделе беременности. Ланцет — широкий хирургический нож с острым концом и двумя лезвиями. Лапаро- — приставка, обозначающая поясницу или живот. Лапароскоп, перитонеоскоп — хирургический инструмент (разновидность эндоскопа), снабженный освещаемой зрительной трубой, которая вводится через прокол брюшной стенки в брюшную полость; с помощью этого инструмента врач может произвести осмотр расположенных в брюшной полости органов (см. Лапароскопия). Лапароскопия, абдоминоскопия, перитонеоскопия — обследование расположенных в брюшной полости органов с помощью освещенного полого трубчатого инструмента (лапароскопа). Через небольшой разрез в брюшной стенке, который выполняется после введения в брюшную полость углекислого газа (пневмоперитонеум), лапароскоп вводится в брюшную полость. Помимо диагностических целей, лапароскопия применяется также для взятия материала на биопсию, аспирации кист и разделения спаек. В хирургической практике лапароскоп используется в процессе выполнения холецистэктомии, фундопликации, колэктомии, гемиколэктомии, а также для устранения непроходимости фаллопиевых труб, являющейся одной из причин женского бесплодия; для быстрой остановки кровотечения во всех этих случаях применяется либо лазерное воздействие, либо диатермия (см. также Операция хирургическая минимально инвазивная). Лапароскоп применяется для взятия яйцеклетки у женщины в процессе искусственного оплодотворения вне организма матери, а также в ходе выполнения различных гинекологических операций с использованием лазера (лазерная лапароскопия). — Лапароскопический. Лапароскопия лазерная — см. Лапароскопия. Лапаротомия — хирургическая операция, заключающаяся в рассечении брюшной стенки. Выполняется в ходе обследования расположенных в ней органов для окончательной постановки диагноза какого-либо заболевания (например, для установления степени распространения опухоли (эксплораторная лапаротомия) или в качестве подготовки к проведению основной операции. Ларинг-, ларинго- — приставка, обозначающая гортань. Ларингит — воспаление гортани и голосовых связок, вызываемое бактериальной или вирусной инфекцией или возникающее в результате их раздражения газами, химическими веществами и т. д. Голосовые связки теряют свою способность к осуществлению вибрации (из-за их сильного отека), голос у человека становится хриплым или теряется совершенно. Дыхание становится затрудненным и свистящим (см. Стридор), и появляется болезненный «лающий» кашель. Закупорка дыхательных путей иногда может быть очень серьезной, особенно у детей (см. Круп). Больной должен беречь свой голос, некоторое время не разговаривать и стараться, чтобы вдыхаемый воздух был теплым и влажным; обычно в этом случае рекомендуются паровые ингаляции, которые необходимо делать по 15–20 мин через каждые 2–3 ч. Также следует избегать находиться на холодном воздухе или в прокуренном помещении и выходить на улицу во время тумана. Ларингология — наука, изучающая болезни гортани и голосовых связок. Ларингомаляция — состояние, характеризующееся пароксизмальными приступами нарушения дыхания и стридором. Ларингомаляция часто встречается у маленьких детей в результате слабости гортани у них. Обычно исчезает самостоятельно примерно в возрасте двух лет. Ларингоскоп — прибор (разновидность эндоскопа) для обследования гортани. См. Ларингоскопия. Ларингоскопия — обследование гортани. Может выполняться косвенно с помощью небольшого зеркала или непосредственно с помощью ларингоскопа. Ларингоспазм — закрытие голосовой щели в результате внезапного сокращения мышц гортани, приводящее к появлению шумного затрудненного дыхания. Ларингоспазм часто наблюдается у маленьких детей; нередко он развивается у больных рахитом. В настоящее время ларингоспазм часто встречается при раздражении гортани анестетиками, в случае попадания каких-либо инородных тел, а также при крупе. Ларинготомия — хирургическое рассечение гортани. Нижняя ларинготомия (при которой разрезается перстнещитовидная связка) является операцией, позволяющей спасти жизнь больным с закупоркой дыхательных путей, если место этой закупорки расположено выше. См. Трахеостомия. Ларинготрахеобронхит — вирусная инфекция дыхательных путей (особенно у маленьких детей), при которой может развиться опасная для жизни закупорка гортани (см. Круп) или основных дыхательных путей (бронхов) густой и вязкой жидкостью (мокротой), секретируемой воспаленными тканями. Симптомы заболевания обычно начинают проявляться ночью. Лечение аналогично ларингиту, с проведением в случае необходимости эндотрахеальной интубации или трахеостомии, а также дополнительной бронхоскопии, во время которой врач удаляет скопившуюся мокроту с помощью бронхиального лаважа или путем ее отсасывания. Через некоторое время больной полностью выздоравливает. Ларингофаринкс, гипофаринкс — гортанная часть глотки, расположенная ниже подъязычной кости. Ларингофиссура — хирургическая операция, заключающаяся в рассечении гортани для дальнейшего проведения каких-либо других процедур. Ларингоцеле — дефект развития, при котором воздушный мешок соединяется с гортанью. В результате на шее образуется характерная припухлость, которая увеличивается во время кашля или напряжения человека. Ларингэктомия — хирургическое удаление всей гортани или какой-либо ее части в процессе лечения злокачественной опухоли гортани. У большинства пациентов наблюдается частичное восстановление речи, которое достигается с помощью использования специальных приспособлений. Лата — тип поведения, присущий представителям некоторых культур (например, в Малайзии). После перенесенного психологического шока человек становится очень беспокойным, легко подвергается различным внушениям, проявляет крайнюю покорность и патологическое подражание действиям других людей (эхопраксия). Латамоксеф — разновидность антибиотика, в состав которого входит цефалоспорин; эффективен против многих грамотрицательных палочек (см. Окрашивание по Грому). Торговое название: моксалактам (Мохаlactam). Латеральный — 1. Расположенный сбоку или относящийся к боковой поверхности какого-либо органа или организма. 2. В анатомии — относящийся к участкам или частям тела, наиболее удаленным от срединной сагиттальной линии. 3. В радиологии — расположенный в сагиттальной плоскости. Латиризм — заболевание, характеризующееся ослаблением и параличом мышц; встречается среди людей, пища которых содержит большое количество мелкого «турецкого» горошка и (или) сходных с ним других стручковых. За исключением слабых проявлений болезни, во всех остальных случаях полного выздоровления от нее не наблюдается, несмотря на применение хорошо сбалансированной диеты и физиотерапии. ЛГ — см. Гормон лютеинизирующий. Леваллорфан — лекарственное вещество, препятствующее угнетению дыхательной функции, которое может развиться в результате применения таких наркотических анальгетиков, как морфин, без уменьшения их болеутоляющего действия. Назначается в инъекциях, обычно непосредственно перед или одновременно с введением анальгетика. Торговое название: лорфан (Lorfan). Левамизол — антигельминтное средство; применяется для выведения из организма круглых червей (аскарид). Кроме того, обнаружено, что это лекарственное вещество оказывает стимулирующее действие на иммунную систему за счет увеличения чувствительности Т-клеток и активизации фагоцитов. Часто оно применяется для лечения ревматоидного артрита. Левамизол назначается внутрь; возможные побочные эффекты: боль в суставах и влияние на процесс кроветворения, что значительно ограничивает его применение. Леватор — любая мышца, поднимающая кость, к которой она прикрепляется; например мышца, поднимающая лопатку, поднимает верхний угол лопатки. Лево- — приставка, обозначающая: 1) левую сторону; 2) в химии — левовращение. Леводопа, ЩОПА, ДОФА — естественно образующаяся в организме аминокислота (см. Дофа); назначается внутрь для лечения паркинсонизма. Возможные побочные эффекты: тошнота, рвота, потеря аппетита и непроизвольные движения лицевых мышц; применение больших доз этого препарата может вызвать у больного слабость, обморок и головокружение. Торговые названия: брокадопа (Brocadopa), лародопа (Larodopa). См. также Бенсеразид. Левокардия — нормальное расположение сердца, при котором его верхушка направлена в левую сторону. Для сравнения: Декстрокардия. Левоноргестрел — синтетический женский половой гормон — прогестоген; применяется в основном в оральных контрацептивах, в сочетании с эстрогеном или в качестве только прогестогенсодержащего лекарственного препарата. Леворукость — преимущественное использование человеком левой руки в процессе выполнения различных видов деятельности. Леворфанол — сходный с морфином наркотический анальгетик; применяется для уменьшения сильной боли. Назначается внутрь или в инъекциях и может вызвать у больного тошноту, рвоту, потерю аппетита, запор и спутанность сознания. Также в результате его длительного приема у человека может развиться зависимость к нему. Торговое название: дроморан (Dromoran). Левулезурия — см. Фруктозурия. Легкое — окруженный серозной оболочкой (см. Плевра) парный орган дыхательной системы, расположенный в грудной полости с обеих сторон от сердца. Легкие представляют собой эластичные воздухоносные органы, которые могут расширяться и сжиматься под действием движений ребер и диафрагмы во время дыхания. Атмосферный воздух попадает в легкие через воздухоносные пути: носовую полость, глотку, гортань и трахею, которая, в свою очередь, делится на два бронха (см. Бронх), а последние разветвляются в легких до мельчайших бронхиол. Бронхиолы также делятся наеще более мелкие веточки, которые оканчиваются в воздушных пузырьках (см. Альвеола), где в организме человека происходит газообмен. Поглощенный из атмосферы кислород диффундирует в кровь, а поступающий из кровеносного русла через легочные капилляры углекислый газ — в альвеолы; в каждом случае в процессе газообмена концентрация одного компонента, участвующего в процессе дыхания, уменьшается, а другого — увеличивается (см. Малый круг кровообращения). Общая емкость легких у взрослого мужчины составляет примерно 5,5 л, однако во время нормального дыхания обменивается только 500 мл воздуха (см. также Объем легких остаточный). К другим функциям, выполняемым легкими, относится выведение воды из организма, что имеет важное значение для поддержания в норме водного баланса в организме и его теплорегуляции. Легкое искусственное — см. Респиратор. Легкое «любителя птиц» — проявление внешнего аллергического альвеолита, развивающегося при вдыхании птичьих белков, которые присутствуют в помете и перьях некоторых птиц, особенно голубей и птиц, живущих в клетках. Как и в случае заболевания, носящего название «легкое фермера», данное заболевание имеет острую и хроническую формы течения. «Легкое фермера» — профессиональное заболевание легких, возникающее в результате аллергии; вызывается грибковыми спорами, которые начинают расти в оставленном на хранение, но плохо высушенном сене, соломе или хлебных злаках, в результате чего быстро плесневеют. Данное заболевание является разновидностью аллергического альвеолита, который может развиться также в результате повышенной чувствительности организма и ко многим другим аллергенам. Острая обратимая форма его может развиться в течение нескольких часов после контакта с аллергеном; хроническая форма, проявляющаяся постепенным развитием необратимой одышки, возникает после нескольких острых приступов, однако может появиться и самостоятельно. Избегание контакта с аллергеном является основным принципом лечения, однако большая часть работников сельского хозяйства может продолжать трудиться на своем прежнем месте при условии выполнения ими соответствующих мер предосторожности. Легочный — относящийся к легким, связанный с ними или поражающий их. Лейк-, лейко- — приставка, обозначающая: 1) бесцветный, белый; 2) лейкоциты. Лейкемия — любое злокачественное поражение костного мозга и других кроветворных органов, в результате чего в организме человека значительно повышается число некоторых видов лейкоцитов. Избыточное образование этих клеток, чаще всего незрелых или имеющих неправильную форму, подавляет образование нормальных лейкоцитов, эритроцитов и тромбоцитов в крови. В результате у человека значительно повышается чувствительность к инфекционным заболеваниям (вследствие нейтропении), развивается анемия и может наступить кровотечение (вследствие тромбоцитопении). Другими симптомами заболевания являются: увеличение печени, селезенки и лимфатических узлов. Лейкемия подразделяется на острую и хроническую в зависимости от скорости развития заболевания. Кроме того, лейкемия может быть классифицирована по типу белых клеток крови, аномальное разрастание которых наблюдается в организме; например, острая лимфобластическая лейкемия (см. Лимфобласт) и острая миелобластическая лейкемия (см. Миелобласт). (См. также Лейкемия миелоидная.) Для лечения лейкемии используются лучевая терапия или цитотоксические лекарственные вещества, которые подавляют образование аномальных клеток. Лейкемия миелоидная — разновидность лейкемии, при которой отмечается аномально быстрое размножение миелопоэтических клеток крови в кроветворной (миелоидной) ткани красного костного мозга. Миелоидная лейкемия бывает острой или хронической; заболевание может поражать любые клетки, вырабатываемые в костном мозге. Лейкодерма — исчезновение пигментации на отдельных участках кожи, в результате чего на них появляются белые пятна или полосы. Лейколизин — см. Лизин. Лейкома — белое пятно на роговице глаза. Большинство лейком образуются в результате рубцовых изменений роговицы после ее воспаления или изъязвления. Наличие врожденной лейкомы может сопровождаться и другими дефектами развития глаза. Лейконихия — обесцвечивание ногтей (может быть полным или частичным). Причина лейконихии неизвестна. Лейкопения — уменьшение содержания в крови количества лейкоцитов. См. Эозинопения, Лимфопения, Нейтропения. Лейкоплакия — появление толстых белых полос на слизистой оболочке полости рта или вульвы; эти полосы не удается удалить с помощью стирания. Лейкоплакия не является каким-либо специфическим заболеванием и наблюдается примерно у 1 % пожилых людей. В редких случаях лейкоплакия может перерождаться в злокачественную опухоль или являться одним из первых симптомов СПИДа. См. также Кат. Лейкопоэз — образование лейкоцитов; обычно протекает в кроветворной ткани костного мозга. См. также Гранулопоэз, Гемопоэз, Лимфопоэз, Монобласт. Лейкорея — слизистые выделения из влагалища белого или желтоватого цвета. Обычно они всегда присутствуют у женщины, причем их количество несколько увеличивается непосредственно перед менструацией и после нее. Аномально обильные выделения могут возникать в случае попадания инфекции в нижние женские половые органы (например, простейших вида Trichomonas vaginalis) (см. Вагинит). Лейкотаксин — химическое соединение, присутствующее в воспалительном экссудате, которое притягивает лейкоциты (хемотаксис) и способствует увеличению проницаемости кровяных капилляров. Существует мнение, что лейкотаксин вырабатывается поврежденными клетками. Лейкотомия — хирургическая операция, заключающаяся в рассечении нервных волокон, проходящих внутри головного мозга: данная операция часто выполняется в психохирургии. Ранее, в своей прежней форме — префронтальной лейкотомии (или лоботомии), операция заключалась в пересечении нервных волокон, соединяющих лобную долю со зрительным бугром (таламусом), а также в рассечении ассоциативных волокон лобных долей. Часто в этом случае удавалось уменьшить сильное эмоциональное напряжение у больного. Однако после осуществления префронтальной лейкотомии у человека могут развиться серьезные побочные эффекты, поэтому в настоящее время от проведения этой операции отказались. В современных условиях благодаря применению стереотаксии удается осуществлять избирательное рассечение значительно более мелких участков головного мозга. Побочные эффекты при этом наблюдаются крайне редко. Эти операции обычно проводятся для избавления человека от неустранимой никакими другими методами боли, в случае сильной депрессии, обессивного невроза и хронического беспокойства, когда очень сильное эмоциональное напряжение не снижается после применения различных методов лечения. Лейкоцидин — бактериальный экзотоксин, который избирательно поражает лейкоциты. Лейкоцит, клетка крови белая — любая ядросодержащая клетка крови, обладающая амебоидной подвижностью. В здоровом организме существуют три основных вида этих клеток: гранулоциты, лимфоциты (в настоящее время лимфоцит признается основной иммунокомпетентной клеткой. — Ред.) и моноциты; они защищают организм от попадания в него чужеродных веществ и вырабатывают различные антитела. При заболеваниях в крови могут появиться и другие виды лейкоцитов, преимущественно незрелые формы. Лейкоцитоз — увеличение в крови количества лейкоцитов. См. Базофилия, Эозинофилия, Лимфоцитоз, Моноцитоз. Лейо- — приставка, обозначающая «ровный, гладкий». Например: лейодермия — аномальная гладкость кожи. Лейомиома — доброкачественная опухоль гладких мышц. Чаще всего эти опухоли развиваются в матке (см. Фиброид), однако они могут также возникать в пищеварительном тракте, в стенках кровеносных сосудов и т. д. Со временем они могут перерождаться в злокачественные опухоли (см. Лейомиосаркома). Лейомиосаркома — злокачественная опухоль гладких мышц, чаще всего развивающаяся в матке, желудке, тонкой кишке и в дне мочевого пузыря. Эта опухоль является вторым наиболее распространенным видом саркомы мягких тканей. У детей она встречается сравнительно редко и поражает в основном мочевой пузырь, предстательную железу и желудок. Лейпрорелин — см. Аналог лютеинизирующего гормона. Лейцин — основная аминокислота. См. также Аминокислота. Лейшманиоз — заболевание, распространенное в тропических и субтропических странах; вызывается паразитирующими простейшими рода Leishmania, которые передаются человеку через укусы песчаных москитов. Существуют две основные формы этого заболевания: висцеральный лейшманиоз, при котором поражаются клетки различных внутренних органов (см. Калаазар), и кожный лейшманиоз, при котором поражаются кожа и подкожные ткани. Кожный лейшманиоз, в свою очередь, также имеет несколько различных форм, в зависимости от места поражения и вида простейших, которые вызвали развитие болезни. В странах Азии он чаще всего проявляется в виде фурункулов. В Америке существуют несколько разновидностей кожного лейшманиоза (см. Язва каучуковая, Эспундия). Для лечения кожного лейшманиоза применяются лекарственные вещества, содержащие сурьму. Лейшманиоз кожный, фурункул багдадский, фурункул делийский, фурункул аллепский — кожное заболевание, распространенное в тропических и субтропических районах Африки и Азии; вызывается простейшими паразитами вида Leishmania tropica (см. Лейшманиоз). Болезнь обычно развивается у детей и протекает с образованием плохо заживающих открытых фурункулов или язв, которые иногда могут вторично инфицироваться различными бактериями. Для борьбы с инфекцией используются антибиотики. Лекарства, отпускаемые без рецепта врача — лекарственные вещества, которые можно приобрести в аптеке без рецепта врача. В настоящее время перечень таких лекарственных веществ постоянно расширяется. Лекарственный — содержащий в своем составе лекарственное вещество: данный термин применяется по отношению к лосьонам, мылу, леденцам и т. д. Лента, полоска — любая плоская лентовидная анатомическая структура. Например, продольные лентовидные мышцы ободочной кишки называются, соответственно, брыжеечной, свободной и сальниковой лентами. Лентиго — плоское темно-коричневое пятнышко, появляющееся на коже пожилых людей, если она часто подвергается солнечному облучению. Лентиго характеризуется повышенным скоплением меланоцитов в базальном слое эпидермиса (в отличие от лентиго в веснушках не наблюдается увеличения числа меланоцитов в этих клетках). При злокачественном лентиго (или лентиго Гетчинсона), которое чаще всего образуется на щеках у пожилых людей, пятна увеличиваются до 2 см в диаметре и могут изменять свою пигментацию; этот вид лентиго является одной из разновидностей злокачественной меланомы и не распространяется на другие участки кожи. Лентиконус — состояние глаза, при котором центральная часть передней (иногда задней) поверхности хрусталика глаза имеет более сильное искривление, чем обычно, и выпячивается вперед, образуя тупой угол в вершине возникающего конуса. Обычно лентиконус является врожденным. Леонтиаз — чрезмерное разрастание костей черепа, в результате чего голова человека начинает напоминать голову льва; леонтиаз является редким симптомом нелеченной болезни Педжета. Медицинское название: леонтиаз (leontiasis ossca). Лепра, болезнь Хансена — хроническое заболевание, вызываемое бактериями вида Mycobacterium leprae; эти бактерии поражают кожу, слизистые оболочки и нервы в организме человека. Чаще всего данное заболевание встречается в тропиках; передается оно при непосредственном контакте между больными и здоровыми людьми. После инкубационного периода, продолжающегося от 1 до 30 лет, у человека начинают постепенно развиваться симптомы болезни; первоначально она поражает в основном кожу и нервы. Лепроматозная лепра является высокозаразной, постоянно прогрессирующей формой этого заболевания; она характеризуется образованием распространенных по всей коже лепрозных бугорков, утолщением кожи и нервов, а также (в тяжелых случаях) отсутствием общей кожной чувствительности, мышечной слабостью и параличом мышц, в результате чего тело человека уродуется и деформируется. Характерным осложнением лепры является туберкулез. Туберкулоидная лепра является доброкачественной, часто самоограничивающейся разновидностью лепры; проявляется она обесцвечиванием и обезображиванием отдельных (редко расположенных) участков кожи, а также их локализованным онемением. Недифференцированная лепра представляет собой одну из разновидностей заболевания, при которой кожные проявления болезни могут быть двух видов; туберкулоидная и недифференцированная лепра, называемая олигобациллярной лепрой. Аналогично туберкулезу, лечить лепру необходимо с помощью нескольких антибактериальных препаратов, чтобы преодолеть развитие устойчивости к отдельным лекарственным веществам. Всемирная организация здравоохранения усиленно рекомендует для лечения олигобациллярной лепры применять в течение шести месяцев сочетание рифампицина и дапсона; в случае лепроматозной лепры — в сочетании с клофазимином, причем такое комплексное лечение должно проводиться по крайней мере в течение двух лет. В настоящее время Всемирная организация здравоохранения испытывает для лечения лепры сочетание офлоксацина с другими лекарственными веществами; это позволяет уменьшить длительность лечения и быстрее достигнуть полного выздоровления. С помощью методов реконструктивной хирургии можно устранить часть уродств, которые возникают при этом заболевании. В настоящее время также создается и проходит клинические испытания вакцина, применение которой позволит предотвратить возникновение у человека этой болезни. Лепрома — образование на коже бугорков, характерных для лепры. Лепромин — экстракт тканей, приготовленный из кожных поражений больных лепроматозной лепрой. Лепт-, лепто- — приставка, обозначающая: 1) тонкий; 2) маленький; 3) незначительный, слабый. Лептоменингит — воспаление паутинной и мягкой мозговых оболочек головного и спинного мозга. См. также Менингит. Лептоменинкс — две мозговые оболочки: паутинная и мягкая мозговая оболочка. Лептоспироз, болезнь Вейля — инфекционное заболевание, вызываемое бактериями рода Leptospira (особенно бактериями вида L. icterohaemorrhagiae), которые присутствуют в организме грызунов, собак и других млекопитающих; они могут передаваться человеку при тесном контакте с этими животными. Болезнь начинается с повышения температуры и может поражать печень (вызывая у человека появление желтухи) или мозговые оболочки (приводя к развитию менингита); в некоторых случаях поражаются также почки. Лептотена — первая стадия первой профазы мейоза, при которой хромосомы становятся видимыми как отдельные тонкие и длинные нити. Лептофония — ослабление голоса. Лептоцит — аномально узкий эритроцит. Появление лептоцитов в крови характерно для некоторых видов анемии. Лерез — бессвязная речь, незрелая как в произношении, так и в синтаксисе. Является одним из признаков деменции. Лесбиянство — женский гомосексуализм; состояние, при котором женщину привлекает и возбуждает сексуальное поведение другой женщины, и осуществляются сексуальные контакты между двумя женщинами. Лесбиянство не является каким-либо заболеванием. — Лесбиянка. Лестница — один из спиральных каналов в улитке внутреннего уха. Средняя лестница (или улитковый проток) представляет собой центральный перепончатый канал, содержащий чувствительный слуховой орган улитки внутреннего уха; лестница преддверия и барабанная лестница представляют собой два костных канала улитки внутреннего уха. Летаргия — психическая и физическая вялость; болезненный сон, длящийся от нескольких часов до нескольких недель с почти не ощутимыми в тяжелых случаях пульсом и дыханием; степень утраты активности в этом случае близка к полной потере сознания. Данное состояние наблюдается при различных заболеваниях человека (например, при сонной болезни) или во время гипноза. Лецитин — представитель группы фосфолипидов, который является важной составной частью клеточных мембран и участвует в процессах метаболизма жиров в печени (например, фосфатидилхолин). Лецитины также присутствуют в сурфактанте, который образуется в альвеолах. Для определения степени созревания легочной ткани плода используется коэффициент лецитин/сфингомиелин: если его величина оказывается меньше 2, то у ребенка увеличивается риск развития синдрома респираторного дистресса новорожденных. В этих случаях для ускорения процесса созревания легких у плода может назначаться кортизон, который уменьшает вероятность развития указанного синдрома. Лецитиназа — фермент тонкой кишки, под действием которого лецитин расщепляется на глицерол, жирные кислоты, фосфорную кислоту и холин. Лечение комбинированное — сочетание нескольких методов лечения, при котором один вид лечения (например, хирургическая операция) проводится между какими-либо другими его видами (например, между дои послеоперационной лучевой терапией). Лечение консервативное — лечение, направленное на предотвращение ухудшения состояния здоровья человека в случае какого-либо заболевания; при этом считается, что у больного либо наступит естественное выздоровление, либо прогрессирование болезни удается замедлить настолько, что ему не потребуется никакого дополнительного оперативного лечения. Для сравнения: Лечение радикальное. Лечение корневого канала пульпы зуба — (в эндодонтии) процедура, заключающаяся в удалении остатков пульпы зуба, очищении и формировании канала внутри зуба с его последующим заполнением (см. Пломба корневая). Этот вид лечения применяется для устранения зубной боли, а также в ходе лечения периодонтальных абсцессов. Лечение радикальное — интенсивное лечение, целью которого является достижение полного выздоровления больного, а не простое ослабление симптомов его заболевания. Для сравнения: Лечение консервативное. Лечение суггестивное, лечение внушением — лечение различных заболеваний путем убеждения пациента в том, что он сможет быстро поправиться и его состояние заметно улучшится. Симптомы заболеваний, которые исчезают в результате такого лечения, относятся к проявлениям различных психологических нарушений у человека и классифицируются как истерические симптомы. Лечение сухим или влажным теплом — см. Припарка. Лиаза — фермент, удаляющий радикалы негидролитическим путем с образованием двойных связей. Либидо — половое влечение: данный термин часто используется для обозначения силы полового влечения. В теории психоанализа либидо (аналогично инстинкту смерти) считается одним из основных источников энергии всей психической жизни. Нормальное развитие (см. Развитие психосексуальное) может быть изменено с помощью фиксации на определенном уровне и регрессии. Либриум — см. Хлордиазепоксид. Лигатура — любой материал (например, нейлон, шелк, кетгут или проволока), который прочно обвязывается вокруг кровеносного сосуда для остановки кровотечения или вокруг ножки какого-либо образования (например, вокруг ножки опухоли) для ее перевязки и последующего удаления. Лигирование, перевязка — наложение лигатуры. Лигнокаин — широко применяющийся местный анестетик; используется в хирургии при проведении небольших операций, а также при осуществлении стоматологических процедур. Кроме того, может использоваться в процессе лечения заболеваний глаз, глотки и полости рта, так как при его непосредственном применении он хорошо всасывается слизистыми оболочками этих участков. Лигнокаин также применяется в инъекциях для лечения нарушений сердечного ритма, особенно во время инфаркта миокарда. При его использовании в качестве местного анестетика побочные эффекты практически не наблюдаются. Торговые названия: ксилокаин (Xylocaine), ксилокард (Xylocard). Лиен-, лиено- — приставка, обозначающая селезенку. Например: лиенопатия — какое-либо заболевание, при котором поражается селезенка. Лиз-, лизи-, лизо- — приставка, обозначающая лизис; растворение. — лиз — суффикс, обозначающий: 1) лизис; растворение; 2) ослабление, уменьшение симптомов болезни. Лизин — белковый компонент крови, который способен вызывать разрушение (лизис) различных клеток. Названия этим компонентам даются в зависимости от того, разрушение каких клеток они вызывают. Например, гемолизин поражает красные клетки крови; лейколизин поражает белые клетки, а бактериолизин — бактериальные клетки. Лизин — основная аминокислота. См. также Аминокислота. Лизис — разрушение клеток в результате повреждения или разрыва их оболочек, что приводит к вытеканию плазмы и содержимого клеток наружу. См. также Аутолиз, Лизоцим. Лизогения — взаимодействие между бактериофагом и клеткой-хозяином, при котором внутри бактериальной клетки существует скрытая, неразрушасмая форма фага (профаг). При определенных условиях (например, во время облучения бактерии) фаг может перейти в свою активную форму, которая способна воспроизводить сама себя и которая в конечном итоге разрушает бактериальную клетку. Лизогенный — вызывающий лизис. Лизосома — ограниченная мембраной органелла, в которой присутствуют гидролитические ферменты, осуществляющие расщепление веществ в клетке. Особенно много лизосом находится в клетках печени и почек. Попадающие в клетку чужеродные частицы (например, бактерии) расщепляются под действием содержащихся в лизосомах ферментов. Когда клетка погибает, эти ферменты высвобождаются и расщепляют ее содержимое. Лизоцим — фермент, присутствующий в слезе и яичном белке. Лизоцим катализирует разрушение клеточных стенок у некоторых бактерий. Бактериальные клетки, подвергшиеся воздействию лизоцима, называются лизированными. Ликантропия — редко встречающийся симптом психического расстройства, при котором человек верит, что может превратиться в волка. Лимб — (в анатомии) край или граница. Например, лимб склеры глаза представляет собой место соединения роговицы и склеры глаза. Лимфа — прозрачная жидкость, текущая в сосудах лимфатической системы. Она образуется из тканевой жидкости. С лимфой из интерстициального пространства удаляются белки и другие вещества. Лимфа проходит через несколько фильтров (лимфатических узлов) и в конечном итоге возвращается в кровеносное русло через грудной проток. По своему составу она напоминает плазму крови, однако в ней содержится меньше белков, а клетки в основном представлены лимфоцитами. Лимфаден-, лимфадено- — приставка, обозначающая лимфатический узел (лимфатические узлы). Лимфаденит — воспаление лимфатических узлов. Пораженные узлы опухают, становятся уплотненными и болезненными. В некоторых случаях заболевание может переходить в хроническую форму (например, туберкулезный лимфаденит), однако чаще всего оно протекает остро и поражает узлы, расположенные поблизости от места локализации инфекции. Обычно в результате имеющегося у человека тонзиллита поражаются шейные (подчелюстные. — Ред.) лимфатические узлы, так как именно в лимфатических узлах происходит борьба организма с инфекцией. Иногда после какого-либо перенесенного вирусного инфекционного заболевания может развиться генерализованный лимфаденит. Лечение заболевания зависит от вызвавшей его причины. Лимфаденома — устаревшее название лимфомы. Лимфаденэктомия — хирургическая операция, заключающаяся в иссечении лимфатических узлов; обычно она выполняется в случае поражения лимфатических узлов злокачественными клетками в результате образования в организме человека метастазов. Лимфанги-, лимфангио- — приставка, обозначающая лимфатический сосуд. Лимфангиография — рентгенологическое исследование лимфатических сосудов и лимфатических узлов после введения в них контрастного вещества (см. Ангиография). Данный метод обследования применяется в основном для определения степени и распространенности злокачественных опухолей в лимфатической системе, а также для выявления наличия у человека лимфедемы. Лимфангиома — локализованное скопление расширенных лимфатических сосудов, в результате которого в области шеи или подмышечной впадины может образовываться большая киста (кистозная гигрома). Обычно она удаляется хирургическим путем. Лимфангиосаркома — крайне редко встречающаяся злокачественная опухоль лимфатических сосудов. Обычно она развивается у женщин, перенесших мастэктомию по поводу рака молочной железы, и проявляется в виде постоянной припухлости подмышечных впадин. Лимфангит — воспаление лимфатических сосудов, при котором на коже вблизи места, пораженного стрептококковой инфекцией, появляются характерные красные полосы. В случае перехода заболевания в хроническую форму у человека может развиться лимфедема. Пораженная болезнью часть тела должна находиться в покое, а для борьбы с инфекцией человеку обычно назначаются антибиотики (например, пенициллин). Лимфангиэктазия — расширение лимфатических сосудов; обычно оно является врожденным и приводит к увеличению различных участков человеческого тела (например, ног в случае болезни Милроя). Лимфангиэктазия может быть связана также с нарушением проходимости лимфатических сосудов. См. Лимфедема. Лимфатический — 1. Лимфатический сосуд. См. Система лимфатическая. 2. Относящийся к лимфе или разносящий лимфу по организму. Лимфедема, лимфодема — скопление лимфы в тканях, приводящее к их отеку; чаще всего в этом случае поражаются ноги. Лимфедема может быть связана с врожденной аномалией лимфатических сосудов (как, например, в случае болезни Милроя) или развиваться в результате нарушения проходимости лимфатических сосудов из-за наличия в них опухоли, паразитов, а также из-за их воспаления или травмы. Для лечения лимфедемы конечности бинтуются эластичными бинтами или используются эластичные чулки; больному также назначаются мочегонные препараты. В последнее время было опробовано несколько хирургических методов лечения лимфедемы, однако ни один из них не имел такого успеха, благодаря которому его можно было бы рекомендовать для массового применения. Лимфо- — часть слова, обозначающая лимфу или лимфатическую систему. Лимфобласт — аномальная клетка, появляющаяся в крови и кроветворных органах в случае развития у человека лимфобластической лейкемии. Эта клетка имеет крупное ядро и содержит очень мало цитоплазмы; считается, что она является предшественницей лимфоцитов. — Лимфобластический. Лимфогранулема венерическая — заболевание, передающееся половым путем; чаще всего встречается в тропиках. Причиной болезни являются хламидии. Вначале на коже половых органов появляется небольшая припухлость и отмечается воспаление паховых лимфатических узлов; по мере развития заболевания у человека может нарушиться проходимость лимфатических узлов, расположенных в этой области, в результате чего образуется характерное утолщение кожи. Обычно эффективным оказывается как можно более раннее лечение сульфамидами или лекарственными веществами, в состав которых входит тетрациклин. Лимфография — метод введения рентгеноконтрастного вещества в лимфатическую систему для рентгенологического исследования лимфатических сосудов и узлов, расположенных в какой-либо ее части. Лимфография помогает выявить наличие опухолей в лимфатической системе. Лимфокин — вещество, вырабатываемое лимфоцитами; влияет на другие клетки иммунной системы. Примером лимфокина является интерлейкин 2. Лимфома — злокачественная опухоль лимфатических узлов, включая болезнь Ходжкина. Существует множество видов этих опухолей; прогнозируемая продолжительность жизни человека при некоторых из них составляет лишь несколько месяцев, в то время как при других она может насчитывать несколько лет. У больного обычно наблюдаются множественное увеличение лимфатических узлов, общая потеря веса, повышение температуры и сильная потливость. Болезнь может распространиться, поражая несколько групп лимфатических узлов, или может ограничиться лишь каким-либо одним органом, например миндалиной. Для лечения применяются такие лекарственные вещества, как хлорамбуцил, или сочетание циклофосфамида, винкристина и преднизона (иногда к ним добавляется доксорубицин и (или) блеомицин); однако реакция на эти препараты часто оказывается очень сильной. Для лечения локализованной лимфомы может применяться лучевая терапия, к помощи которой прибегают после проведения больному курса медикаментозной терапии. Состояние пациентов с неходжкинскими лимфомами, которые плохо поддаются лечению с помощью химиотерапии, может быть значительно улучшено с помощью пересадки костного мозга. Лимфома Беркитта, опухоль Беркитта — злокачественная опухоль лимфатической системы, часто встречаемая у детей африканских тропических стран, которые расположены на 15° севернее и южнее экватора. Представляет собой быстрорастущее злокачественное образование, увеличивающееся примерно в два раза за каждые пять дней. Может возникать в различных областях человеческого тела, однако чаще всего поражает челюсти и живот. В образовании и развитии опухоли важную роль играет вирус Эпстайна-Барра. Примерно в 50 % случаев наблюдаются осложнения со стороны нервной системы. В последнее время все чаще стала встречаться также и лимфома Беркитта неафриканского происхождения. Все формы этого заболевания очень чувствительны к применению цитотоксических лекарственных средств, однако единого подхода в лечении этой болезни не существует. Лимфопения, лимфоцитопения — уменьшение количества лимфоцитов в крови; наблюдается при различных заболеваниях. Лимфопоэз — процесс образования лимфоцитов, протекающий в костном мозге, лимфатических узлах, селезенке, тимусе (вилочковой железе) и стенках кишечника. Клетки — предшественники образующихся лимфоцитов — пока что не идентифицированы. Лимфоррагия — истечение лимфы из поврежденных лимфатических сосудов. Лимфосаркома — устаревшее название неходжкинской лимфомы. Лимфоцит — разновидность белых клеток крови (лейкоцитов) (лимфоциты являются структурными элементами иммунной системы, которые постоянно присутствуют в крови. — Ред.); эти клетки находятся в лимфатических узлах, селезенке, тимусе (вилочковой железе), лимфоидной ткани стенок кишечника и костном мозге. Наблюдать их можно при окраске красителем Романовского: эти клетки имеют плотное ядро и прозрачную, бледно-голубую цитоплазму. Лимфоциты, содержащие небольшое количество цитоплазмы, называются малыми лимфоцитами; лимфоциты, в состав которых входит большое количество цитоплазмы, называются большими лимфоцитами. Обычно в норме в литре крови содержится 1,5–4 х 109 лимфоцитов. Они принимают участие в иммунных реакциях и подразделяются на вырабатывающие специальные циркулирующие в крови антитела В-лимфоциты и Т-лимфоциты, которые отвечают главным образом за клеточно-опосредованный иммунитет. Т-лимфоциты подразделяются на клетки-хелперы, клетки-киллеры и Т-супрессоры. — Лимфоцитарный. Лимфоцит, проникающий в опухолевые ткани, — лимфоидная клетка, которая может проникать в плотные опухолевые ткани. Эти клетки могут быть выращены в искусственных условиях в присутствии интерлейкина 2; они были использованы в качестве проводника некротического опухолевого фактора в экспериментальных генетических исследованиях, связанных с изучением рака. Лимфоцитоз — повышение содержания лимфоцитов в крови. Лимфоцитоз может развиваться при различных заболеваниях, в том числе при хронической лимфоцитарной лейкемии и вирусных инфекциях. Лимфоцитопения — см. Лимфопения. Лимфурия — присутствие лимфы в моче. Линдан — инсектицид; применяется в виде лосьона или крема для уничтожения вшей и чесоточного клеща вида Sarcoptes scabei. Возможные побочные эффекты включают раздражение кожи и появление на ней сыпи, однако наблюдаются крайне редко. Торговые названия: эзодерм (Esoderm), лорексан (Lorexane). Линза — (в оптике) изделие из стекла, применяемое для преломления световых лучей в каком-либо одном направлении. Выпуклые линзы сводят световые лучи в одну точку, в то время как вогнутые линзы, наоборот, рассеивают их; эти линзы применяются для коррекции различных нарушений зрения. См. также Линзы бифокальные. Линзы контактные. Линзы трифокальные. Линзы ахроматические — специальные линзы, предназначенные для использования в окулярах микроскопов и других научных приборах. Они позволяют получить четкое изображение, не затуманенное цветными разводами, наблюдающимися при использовании обычных линз (данное явление связано с разложением белого света на различные составляющие спектра в соответствии с длиной их волн). Линзы бифокальные — очки, в которых верхняя часть стекол позволяет получить четкое изображение удаленных предметов, а нижняя часть стекол позволяет получить четкое изображение предметов вблизи, например четко видеть текст во время чтения. См. также Линзы трифокальные, Линзы мультифокальные. Линзы контактные — линзы, надеваемые непосредственно на глаз и отделенные от него лишь тонкой пленкой слезной жидкости. Роговичные микролинзы закрывают лишь роговицу глаза, в то время как тактильные линзы закрывают также и некоторую часть окружающей ее склеры. Контактные линзы используются главным образом вместо очков для коррекции дальнозоркости или близорукости, а также других нарушений рефракции глаза; кроме того, их можно использовать и в качестве защитного средства при некоторых заболеваниях роговицы. Контактные линзы изготавливаются из жесткого или мягкого материала, обладающего различными свойствами. Жесткие линзы в настоящее время частично заменяются новыми воздухопроницаемыми линзами, которые позволяют кислороду воздуха проникать к роговице глаза. Линзы многофокальные — линзы, преломляющая сила которых (см. Диоптрия) постепенно увеличивается в направлении снизу вверх. В этих линзах не существует никакой разграничительной линии, разделяющей ее верхний и нижний сегменты, как в бифокальных линзах. Человек, носящий очки с такими линзами, может четко видеть предметы, находящиеся на любом расстоянии от его глаз; он должен лишь немного приподнять или опустить глаза, в зависимости от того, на каком расстоянии находятся рассматриваемые им предметы. Линзы трифокальные — линзы, состоящие из трех сегментов. Верхний сегмент позволяет четко видеть удаленные от глаз предметы; нижний используется во время чтения и работы вблизи, а средний — для рассмотрения предметов, находящихся на среднем от глаз расстоянии. Музыканты иногда пользуются средним сегментом линз для чтения партитуры во время концерта. Линии Бо — поперечные углубления на ногтях пальцев рук, возникающие через несколько недель после тяжелой болезни (например, пневмонии или сердечного приступа). Линимент — медицинский препарат, который втирается в кожу больного или наносится на одежду хирургов. Часто в состав линимента входит камфора. Линия — (в анатомии) линия, узкая полоса. Белая линия живота образована перекрещивающимися волокнами апоневрозов наружной и внутренней косых мышц живота; представляет собой сухожильный тяж, идущий от мечевидного отростка до лобкового симфиза. Линкомицин — антибиотик; применяется для лечения инфекционных заболеваний, вызываемых узким спектром бактерий (например, для лечения остеомиелита). Назначается внутрь или в инъекциях; иногда может вызывать у человека понос, тошноту и боли в желудке. Торговое название: линкоцин (Lincocin). Линт — материал, используемый для изготовления хирургической одежды; в его состав входят нити расчесанного льна или хлопкового суррогата. Обычно с одной стороны этот материал имеет пушистую, а с другой — гладкую поверхность. Лиотиронин — сходный с тироксином гормон, вырабатываемый щитовидной железой; применяется для лечения заболеваний, сопровождающихся недостаточной функцией щитовидной железы. Назначается внутрь или в инъекциях; оказывает быстрое, но кратковременное воздействие на организм. Торговое название: тертроксин (Tertroxin). Лиофилизация — метод фиксации гистологических образцов, приводящий к минимальным химическим и физическим изменениям в них. Образцы погружают в охлажденный в жидком воздухе до -190 °C раствор изопентана. Это приводит к немедленной фиксации ткани без образования больших кристалликов льда (в противном случае в ткани произошли бы структурные изменения). Затем ткань обезвоживается в вакууме в течение 72 ч при температуре примерно -32,5 °C. Лип-, липо- — часть слова, обозначающая: 1) жир; 2) липид. Липаза, стеапсин — фермент, секретируемый поджелудочной железой и железами тонкой кишки; способствует расщеплению жира на глицерол и жирные кислоты в процессе пищеварения. Липемия — повышенное по сравнению с нормой содержание жира в крови. Липид — одно из ряда естественно образующихся в организме соединений, растворимых в хлороформе или спирте и нерастворимых в воде. Липиды являются важной составной частью продуктов питания не только из-за их большой энергетической ценности, но также и потому, что в них содержится много витаминов и основных жирных кислот. К лилидам относятся жиры, стероиды, фосфолипиды и гликолипиды. Липидоз, липоидоз — нарушение внутриклеточного липидного обмена в организме. Церебральный липидоз (см. Болезнь Гоше, Синдром Гунтера, Синдром Гурлера, Болезнь Тэя-Сакса) является врожденным нарушением внутриклеточного липидного метаболизма, приводящим к накоплению липидов в клетках головного мозга. Липогенез — процесс, при котором глюкоза и другие вещества из содержащихся в пище углеводов превращаются в организме в жирные кислоты. Липогранулематоз — нарушение липидного обмена, приводящее к образованию на коже узелков желтого цвета. Липодистрофия — нарушенный обмен липидов или нарушенное распределение жиров в организме. В случае липодистрофии нижних конечностей у человека отсутствуют жировые отложения в ногах; при инсулиновой липодистрофии, иногда встречающейся у больных сахарным диабетом, отсутствие жировых отложений наблюдается в местах введения инсулина. Липоидоз — см. Липидоз. Липолиз — процесс расщепления липидов (особенно содержащихся в жире триглицеридов) на составляющие их жирные кислоты под действием присутствующего в организме фермента липазы. — Липолитический. Липома — распространенная доброкачественная опухоль, образующаяся из дифференцированных жировых клеток. Липоматоз — 1. Повышенное по сравнению с нормой содержание жира в тканях. 2. Наличие в организме множественных липом. Липоотсасывание — метод удаления нежелательных скоплений подкожной жировой клетчатки с помощью мощного отсоса. Отсос представляет собой трубку, которая может вводиться под кожу в различных участках. Липополисахарид — сложная молекула, которая состоит из липидной и полисахаридной составляющей. Липополисахариды являются составной частью клеточных стенок грамотрицательных бактерий и играют важную роль в процессе определения антигенных свойств этих бактерий. Липопротеин — представитель группы сложных белков, присутствующих в лимфе и плазме крови, которые представляют собой соединения белков с липидами. Липопротеины играют важную роль в процессе переноса липидов с кровью и лимфой. Так, холестерин переносится с кровью в виде одного из липопротеинов низкой плотности. Холестерин удаляется из крови, связываясь со специальными LDL-рецепторами, присутствующими в клеточных мембранах, которые затем поглощаются клетками. Другой разновидностью липопротеинов являются липопротеины высокой плотности и липопротеины очень низкой плотности. Липопротеин низкой плотности — см. Липопротеин. Липосаркома — редко встречающаяся злокачественная опухоль жировых клеток. Обычно поражаются ткани бедра, причем эта опухоль редко образуется у людей моложе 30 лет. Существуют четыре основных гистологических вида липосаркомы: хорошо дифференцированная, миксоидная, плеоморфная и круглоклеточная. Первые два вида этих опухолей лечатся успешнее, чем два других (обычно путем их хирургического удаления). Липосома — микроскопический сферический мембранный пузырек (диаметром 2030 нм). Получается искусственно в лабораторных условиях путем добавления водного раствора к фосфолипидному гелю. Защитная оболочка этого пузырька напоминает клеточную мембрану, а весь пузырек в целом похож на клеточную органеллу. Липосомы могут проникать в живые клетки, поэтому они используются для введения относительно токсичных лекарственных веществ в пораженные болезнью участки организма, где оказывают максимальное лечебное воздействие. Например, содержащие метотрексат липосомы могут быть введены в кровь больного. Ткани, в которых присутствуют злокачественные клетки, имеют повышенную по сравнению с нормальной температуру, поэтому, когда липосомы проходят через кровеносные сосуды этих органов, их оболочка реагирует на такое повышение температуры, а содержащееся внутри липосом лекарственное вещество проникает в пораженные участки. В настоящее время проводятся исследования по применению липосом в качестве наполнителей в генной терапии. Липотропин — гормоноподобное вещество, секретируемое передней долей гипофиза; стимулирует поступление жира из жировой ткани в кровь. Липотропный — данный термин применяется по отношению квеществу, которое стимулирует поступление жирных кислот из печени в различные ткани организма или ускоряет процесс утилизации жира в самой печени. Одним из таких веществ является аминокислота метионин. Липофусцин — гранулы коричневого пигмента, содержащие липидные продукты лизосомного переваривания. Часто встречается в клетках сердечной мышцы, нервной ткани и печени, причем обычно находится внутри лизосом. Липохондродистрофия — множественные врожденные дефекты, связанные с врожденными нарушениями липидного (жирового) обмена, поражением хрящевой и костной ткани, кожи, а также различных внутренних органов и приводящие к задержке умственного развития, карликовости и деформациям костей у человека. Липохром — растворимый в жире пигмент, придающий характерную окраску жирным веществам. Примером липохрома является каротин — пигмент, придающий характерную окраску маслу и яичным желткам. Липурия — наличие в моче жира. Лист ожидания — перечень фамилий пациентов, ожидающих помещения в больницу. Листок — тонкая, напоминающая листок структура, например складка на поверхности мозжечка. Лит-, лито- — часть слова, обозначающая конкремент (камень). Например: литогенез — процесс образования камней. Литиаз — образование камней (см. Конкремент) в каком-либо внутреннем органе, например в желчном пузыре (см. Конкремент желчный), мочевыводящих путях, поджелудочной железе или аппендиксе. Литий, карбонат лития — лекарственное вещество; назначается внутрь для предотвращения обострений маниакально-депрессивного психоза или для лечения мании. Возможные побочные эффекты: тремор, слабость, тошнота, жажда и повышенное мочевыделение. Иногда может влиять на функцию щитовидной железы; длительное применение лития приводит к появлению изменений в почках. Передозировка этого лекарственного вещества может вызвать у человека развитие энцефалопатии, а в некоторых случаях даже заканчивается смертельным исходом. Поэтому при длительном применении лития необходимо постоянно контролировать его содержание в крови больного. Торговые названия: камколит (Camcolit), литарекс (Litarex), приадел (Priadel). Литолапаксия, литотрипсия — хирургическая операция, заключающаяся в разрушении камней в мочевом пузыре с помощью специального инструмента — литотриптора. Мелкие осколки камней затем могут быть удалены из мочевого пузыря путем его промывания или отсасывания. Литонефротомия — хирургическая операция, заключающаяся в удалении камней из почки. См. Нефролитотомия, Пиелолитотомия. Литопедион — умерший в матке или брюшной полости плод, который после этого подвергся обызвествлению. Литотомия — хирургическая операция, заключающаяся в удалении камней (конкрементов) из мочевыводящих путей. См. Нефролитотомия, Пиелолитотомия, Уретеролитотомия. Литотрипсия — 1. Разрушение конкрементов (камней) с помощью специальных волн, которые приводят к раздроблению имеющихся в мочевом пузыре камней. В случае экстракорпоральной волновой литотрипсии, применяемой для дробления камней в верхнем отделе мочевыводящих путей и желчном пузыре, волны генерируются внешним источником энергии и передаются от него к месту проведения операции. Специальный прибор (литотриптор) состоит из сложной рентгеновской установки, позволяющей точно выявить местоположение камня с помощью бипланарного рентгеновского луча или ультразвуковых волн и специальной головки или датчика, в котором генерируются и фокусируются разрушающие камень волны. В приборах старого образца пациенту должна быть проведена предварительная анестезия, а его тело погружено в ванну с водой. В приборах нового образца этого не требуется, и процесс дробления камней в организме человека значительно упрощается. В случае электрогидравлической литотрипсии, которая применяется для дробления камней в мочевыводящих путях, генерируемые с помощью электрического тока волны передаются к камню через контактный зонд; он подводится к камню через нефроскоп. 2. См. Литолапаксия. Литотриптор — хирургический инструмент, применяемый для раздробления камней в мочевом пузыре. См. Литолапаксия. Литотрофный — см. Автотрофный. Литр — единица объема, равная объему, занимаемому 1 килограммом чистой воды при температуре 4 °C и нормальном атмосферном давлении (760 мм рт. ст.). В системе СИ литр носит специальное название кубического дециметра, причем эта величина не используется, если требуется высокая степень точности (1 л = 1,0000028 дм3). В приближенных вычислениях 1 л считается равным 1000 см3, а 1 мл берется равным 1 см3. В настоящее время данный подход встречает определенный протест со стороны ученых. Литурез — выведение небольших камней или мочевого песка с мочой. Литурия — см. Гиперурикурия. Лихен (лишай) простой хронический — см. Нейродермит. Лихенификация — утолщение эпидермиса кожи с образованием на ней большого количества складок. Причиной лихенификации является сильное расчесывание или растирание кожи. Лихеноидный — данный термин применяется для описания кожных заболеваний, течение которых напоминает красный плоский лишай. Лихорадка, пирексия — повышение температуры тела по сравнению с нормальной (т. е. выше оральной температуры, равной 37 °C, или выше ректальной температуры, равной 37,2 °C). Лихорадка обычно сопровождается ознобом, головной болью, тошнотой, запором или поносом. Повышение температуры тела выше 40,5 °C может привести к развитию делирия и судорогам (особенно у маленьких детей). Обычно причиной лихорадки являются различные бактериальные и вирусные инфекции или инфекционные заболевания, начиная с обычной простуды и кончая малярией. Перемежающаяся лихорадка характеризуется периодическим повышением температуры тела и ее падением до нормальной в течение дня и максимальным повышением ночью (это имеет место, например, при малярии). Ремиттирующая лихорадка также характеризуется периодическими колебаниями температуры тела, однако при этом она никогда не снижается до нормальной. См. также Тиф эпидемический возвратный. Лихорадка Денге — заболевание, вызываемое арбовирусами; передается человеку в основном через комаров вида Aedes aegypti. Симптомы болезни длятся несколько дней и включают в себя сильную боль в суставах и мышцах, головную боль и боль в горле, лихорадку, слезотечение и раздражение кожи в виде сыпи. Обычно эти же симптомы возникают у человека вновь через два-три дня, но выражены более слабо. Смерть от этого заболевания наступает редко, однако больной продолжает оставаться ослабленным, и для его выздоровления требуется значительное время. Более сильная форма этой болезни, геморрагическая лихорадка Денге, характеризуется нарушениями механизма свертывания крови и внутренними кровотечениями (болезнь может развиться и у детей). Лихорадка Денге чаще всего встречается в странах с тропическим и субтропическим климатом. Основными лекарственными средствами являются аспирин и кодеин, так как они позволяют уменьшить боль, а также каламиновый лосьон, уменьшающий раздражение кожи. Лихорадка Дум-дум — см. Кала-азар. Лихорадка желтая — инфекционное заболевание, вызываемое арбовирусом; распространено в странах Тропической Африки и в северных районах Южной Америки. Заражение человека происходит через укусы комаров, особенно вида Aedes aegypti. Попавший в организм вирус вызывает дегенеративные изменения в тканях печени и почек. Симптомы заболевания зависят от степени инфицирования организма; к ним относятся: озноб, головные боли, боли в спине и конечностях, повышение температуры, рвота, запор, затруднение мочеиспускания (выделяющаяся моча содержит большое количество альбумина) и желтуха. В наиболее тяжелых случаях заболевания оно может закончиться смертью больного; у выздоровевших людей в дальнейшем вырабатывается стойкий иммунитет к этой инфекции. В процессе лечения желтой лихорадки применяется замещение содержащихся в организме жидкостей; предотвратить ее развитие можно с помощью вакцинации. Лихорадка кишечная — см. Лихорадка паратифозная, Тиф брюшной. Лихорадка клещевая — инфекционное заболевание, передающееся через укусы клещей (особенно пятнистая лихорадка Скалистых гор). Лихорадка «кошачьих царапин» — инфекционное заболевание, вероятнее всего, вирусного происхождения, передающееся человеку через ранки на коже от кошачьих царапин, заноз или уколов острыми предметами. Травмированная поверхность кожи воспаляется, а примерно через неделю у человека поднимается температура и опухают лимфатические узлы (обычно расположенные вблизи от поврежденного участка кожи). В некоторых случаях может развиться абсцесс, однако чаще всего наступает полное выздоровление. Лихорадка Ласса — тяжелое вирусное заболевание, встречающееся исключительно в Центральной и Западной Африке. После инкубационного периода, длящегося от 3 до 21 дней, у человека развивается сильная головная и мышечная боль, резко повышается температура; нередко наблюдается затрудненное глотание. Примерно в 50 % случаев у больных наступает смерть от сердечной или почечной недостаточности. Наболее эффективным методом лечения этого заболевания является замещение плазмы; вызывающий эту болезнь вирус чувствителен к рибавирину. Лихорадка мальтийская — см. Бруцеллез. Лихорадка москитная, лихорадка Паппатачи — вирусное заболевание, передающееся человеку через укусы песчаных москитов вида Phlebotomus papatasii. Эти москиты обитают в основном в странах, расположенных вблизи Персидского залива, а также в странах Средиземноморья с тропическим климатом; обычно москитная лихорадка развивается в теплое время года, протекает в течение очень непродолжительного времени и никогда не заканчивается смертельным исходом. Ее симптомы во многом похожи на симптомы гриппа. Никакого специального лечения этого заболевания не существует; для уменьшения проявлений болезни обычно назначаются аспирин и кодеин. Лихорадка Ороя — см. Бартонеллез. Лихорадка Паппатачи — см. Лихорадка москитная. Лихорадка паратифозная — инфекционное заболевание, вызываемое бактериями видов Salmonella paratyphi А, В или С. Распространение болезни происходит через зараженные каловые массы больных или носителей этих бактерий; вспышки заболевания отмечаются в местах с плохими санитарными условиями или после употребления в пищу продуктов, приготовленных в антигигиенических условиях. После инкубационного периода, составляющего от 1 до 10 дней, появляются первые симптомы болезни: понос, незначительное повышение температуры и появление розовой сыпи на груди. Продолжительность болезни составляет обычно около недели. Для лечения весьма эффективен хлорамфеникол. Вакцинация тифозно-паратифозной АВ вакциной позволяет создать временный иммунитет против паратифа А и В. Лихорадка перемежающаяся — лихорадка, течение которой сопровождается периодическими резкими скачками температуры. См. Малярия. Лихорадка попугайная — см. Пситтакоз. Лихорадка послеродовая — повышение температуры до 38 °C и выше, которое может наблюдаться у женщины в течение первых двух недель после родов или выкидыша; обычно такая высокая температура держится недолго и примерно через два дня возвращается к норме. Лихорадка пятнистая — см. Менингит, Лихорадка пятнистая Скалистых гор, Тиф сыпной. Лихорадка пятнистая Скалистых гор, лихорадка пятнистая, лихорадка клещевая — болезнь грызунов и других встречающихся в США мелких млекопитающих, которая вызывается микроорганизмом Rickettsia rickettsii и может передаваться человеку через укусы клещей. Основными симптомами заболевания являются: повышение температуры, боли в мышцах и появление красноватой сыпи, напоминающей коревую. При отсутствии необходимого лечения больной может умереть; в процессе лечения данного заболевания высокоэффективным является применение тетрациклина или хлорамфеникола. См. также Тиф сыпной. Лихорадка ревматическая, ревматизм острый — заболевание, поражающее преимущественно детей и молодых людей; обычно оно является осложнением инфекционных процессов верхних дыхательных путей в результате их поражения гемолитическим стрептококком (см. Стрептококк). Основными симптомами болезни являются: повышение температуры; артрит, переходящий от одного сустава к другому; появление красных округлых пятен на коже; незначительная болезненность узелков, образующихся над некоторыми отростками костей, например, локтевым отростком одноименной кости; возникновение аномальных непроизвольных движений конечностями и головой (хорея Сиденгама), миокардит и воспаление сердечных клапанов и окружающего сердце перикарда. Данное заболевание может переходить в хроническое ревматическое поражение сердца, сопровождающееся образованием характерных рубцов в миокарде и хроническим воспалением сердца и его клапанов, что приводит к развитию у человека сердечной недостаточности, появлению шумов в сердце и повреждению его клапанов. Первичная инфекция лечится с помощью антибиотиков (например, пенициллина); больному необходимо соблюдать постельный режим и принимать аспирин для уменьшения боли в суставах. После перенесенного острого приступа болезни для предотвращения ее рецидивов обычно таким больным рекомендуется проводить долговременную поддерживающую терапию пенициллином. В настоящее время острый ревматизм все реже встречается в развитых странах; видимо, это связано с применением антибиотиков для лечения различных инфекций. Лихорадка ремиттирующая — см. Лихорадка. Лихорадка Рифт-Валли — распространенное в странах Восточной Африки вирусное заболевание, передающееся от животных человеку через комаров; симптомы этой болезни сходны с симптомами гриппа. Лихорадка св. Антония — устаревшее разговорное название кожного воспаления, которое развивается при отравлении человека спорыньей. См. Эрготизм. Лихорадка сенная — разновидность аллергии, возникновение которой связано с воздействием на организм человека пыльцы растений; основным проявлением этого вида аллергии является воспаление слизистой оболочки носа и иногда конъюнктивы (весенний конъюнктивит). Симптомами сенной лихорадки являются: частое чиханье, водянистые выделения из носа или его заложенность, а также слезотечение из глаз вследствие освобождения гистамина; часто в этом случае больным помогает прием антигистаминных лекарственных препаратов. Если удается установить аллерген, то существует возможность осуществления десенсибилизации. Медицинское название: аллергический ринит. Лихорадка средиземноморская — 1. См. Бруцеллез. 2. См. Полисерозит. Лихорадка травматическая — лихорадка, развивающаяся в результате полученной человеком серьезной травмы. Лихорадка укуса крысы, содокоз — заболевание, возникающее после укуса крысы при попадании в организм человека бактерий вида Spirillum minus, вызывающих изъязвление кожи и возвратную лихорадку, или грибков вида Streptobacillus moniliformis, которые вызывают воспаление кожи, мышечные боли и рвоту. Для лечения этих инфекционных заболеваний применяется пенициллин. Лихорадка ундулирующая — см. Бруцеллез. Лихорадка цереброспинальная, лихорадка пятнистая — см. Менингит. Лихорадка черной воды — редкое, но серьезное осложнение молниеносной трехдневной малярии, связанное с обширным внутрисосудистым разрушением эритроцитов, приводящее к появлению гемоглобина в моче. Предполагается, что данное осложнение возникает вследствие неправильного лечения хинином: у больного развиваются лихорадка, зевота, рвота, увеличиваются печень и селезенка, выделяемая моча содержит примесь крови, нарастает анемия, истощение, и в наиболее тяжелых случаях, заканчивающихся, как правило, смертью больного, резко уменьшается выделение мочи вследствие закупорки почечных канальцев. Лечение требует обеспечения больному полного покоя, назначения щелочного питья, внутривенного введения глюкозы, а также переливания крови. Лихорадка чукунгунская — распространенное в странах Азии и Африки заболевание, вызываемое арбовирусом и передающееся человеку через комаров вида Aedes. Симптомы болезни напоминают лихорадку Денге. К ним относятся: повышение температуры, головная боль, генерализованная боль во всем теле и зудящая сыпь. Больным обычно назначаются обезболивающие и снижающие температуру лекарства. Лихорадочный — имеющий отношение к лихорадке или больному лихорадкой. Лицо, заменяющее функции матери, — женщина, забеременевшая (путем искусственного оплодотворения или введения эмбриона в матку) в результате достигнутого соглашения с другой стороной (обычно с семейной парой, которая по каким-либо причинам не может иметь детей), согласно которому она обязуется передать ребенка этой стороне после его рождения. Личинка I — предшествующая взрослой стадия развития некоторых видов животных, заключающаяся в выведении из яиц незрелых особей, например насекомых или нематод. Они сильно отличаются от зрелых половых представителей своего вида и имеют отличный от них способ обитания. Например, личинки некоторых видов мух паразитируют в организме животных и могут вызывать различные заболевания у человека и животных, в то время как взрослые особи являются свободно живущими представителями своего вида. — Личиночный. Личинка II — личинка насекомого или любая червеобразная личинка, которая иногда может поражать ткани человеческого организма (см. Миаз). Раньше в некоторых случаях личинки использовались в медицинской практике для очищения и ускорения процесса заживления глубоких инфицированных ран, так как источником их питания являлись омертвевшие и разлагающиеся ткани раны. Личинка III — 1. Незрелая стадия развития некоторых насекомых, например кузнечиков и клопов-редувидов. Они вылупляются из яиц, будучи похожими на взрослых насекомых, но только несколько меньше их по размеру, имеют недоразвитые крылья и не достигли еще половой зрелости. 2. Поздняя личиночная стадия развития клещей. Личность — (в психологии) индивидуум с особыми личностными качествами, которые отличают его от других людей. Наиболее распространенные среди людей модели поведения иногда относят к различным категориям (см. Изменение личности, Экстравертированность, Состояние невротическое). Личность шизоидная — человек, для которого характерны замкнутость, эмоциональная холодность по отношению к окружающим людям, неспособность выражать удовольствие, отсутствие реакции на похвалу или критику, уход в мир собственных фантазий, усиленный самоанализ и эксцентричное поведение. У некоторых больных шизофренией до развития заболевания отмечаются многие из этих черт; несмотря на это, далеко не у всех шизоидных личностей впоследствии развивается шизофрения. См. Изменение личности. Лишай красный плоский — кожное заболевание, сопровождающееся очень сильным зудом; причина его развития неизвестна. Характеризуется появлением на коже лоснящихся плоских розовато-лиловатых пятен; чаще всего они образуются на внутренней поверхности запястий. Иногда у больного может возникнуть кружевной налет на слизистой оболочке полости рта; в этом случае болезнь протекает бессимптомно. Линейная форма заболевания обычно развивается вследствие различных травм, например расчесов (см. Феномен Кебнера). Лишай опоясывающий — герпес опоясывающий (см. Герпес). Лишай склеротический атрофический — хроническое кожное заболевание, поражающее аногенитальную область (особенно у женщин) и характеризующееся появлением на коже тонких полос цвета слоновой кости. У 20 % больных иногда могут поражаться также и другие участки кожи. Лоаоз — заболевание, распространенное в Западной и Центральной Африке; вызывается глазным червем вида Loa loa. Взрослые черви обитают и мигрируют в подкожной клетчатке, вызывая появление быстро проходящих калабарских опухолей. Они, возможно, являются проявлением аллергической реакции, возникающей в ответ на присутствие в организме продуктов жизнедеятельности этих червей, и иногда могут вызывать повышение температуры и зуд кожи. Черви часто мигрируют вдоль глазного яблока под конъюнктивой глаза и скапливаются там, вызывая у человека характерное раздражение этих участков. Для лечения лоаоза применяется диэтилкарбамазин, так как он убивает как взрослых червей, так и их личинки. Лобный — имеющий отношение ко лбу (см. Кость лобная). Лобок — 1. Поверхность тела, расположенная над лобковой костью в передней части таза. Обычно лобок бывает покрыт лобковыми волосами. 2.См. Кость лобковая. — Лобковый. Лоботомия, лейкотомия префронтальная — см. Лейкотомия. Лобэктомия — хирургическая операция, заключающаяся в удалении доли какого-либо органа или железы (например, доли легкого, щитовидной железы или головного мозга). Лобэктомия легкого обычно выполняется в случае злокачественного новообразования или какого-либо другого серьезного заболевания легких. Ловастатин — лекарственное вещество, влияющее на синтез холестерина в печени; применяется для снижения повышенного уровня холестерина в организме человека. Возможные побочные эффекты: мышечная боль и слабость, поражение печени, бессонница, головная боль, тошнота, диспепсия, понос и спазмы живота. Лог-, лого- — часть слова, обозначающая слова; речь. — логия, — ология — часть слова, обозначающая отрасль изучения. Например: цитология — изучение строения и функционирования клеток. Логопедия — раздел медицины, занимающийся изучением дефектов речи и разработкой методов их исправления; речевая терапия. Логопедия — реабилитация пациентов с нарушениями речи, развившимися у них в силу каких-либо имеющихся врожденных отклонений, из-за несчастного случая или в результате заболевания (например, после инсульта). Логопеды имеют специальную подготовку в данной области, но могут не иметь диплома врача. Логорея — неудержимая, часто бессвязная речь, нередко наблюдающаяся у больных манией. Лодыжка — один из двух отростков, участвующих в формировании голеностопного сустава: латеральная лодыжка — отходит от нижнего эпифиза малоберцовой кости, а медиальная лодыжка — от нижнего эпифиза большеберцовой кости. Локоть теннисный — болезненное воспаление сухожилия локтевой мышцы, возникающее в результате ее перенапряжения. Для лечения воспаления необходимо обеспечить покой больной конечности и вводить местно кортикостероиды. См. также Тендинит. Локтевой — относящийся к локтю или предплечью; например, локтевая ямка представляет собой углубление на передней поверхности локтевого сустава. Локус, место — 1. В анатомии — область или место расположения чего-либо. Так, голубоватое место представляет собой небольшую парную пигментированную область в верхних отделах ромбовидной ямки. 2. В генетике — местоположение гена в хромосоме. Ломотил — см. Дифеноксилат. Лопатка — треугольная кость плечевого пояса. Ость лопатки, расположенная на ее дорсальной (задней) поверхности, оканчивается акромиальным отростком, расположенным в верхней части лопатки. Этот закругленный отросток сочленяется с ключицей, образуя акромиально-ключичный сустав; он нависает над суставной впадиной, в которую входит головка плечевой кости. Верхний край лопатки переходит в клювовидный отросток, у основания которого имеется глубокая вырезка лопатки; к отростку прикрепляются связки и мышцы. — Лопаточный. Лоперамид — лекарственное вещество; применяется для лечения поноса. Лоперамид уменьшает перистальтику пищеварительного тракта; назначается внутрь. Побочные эффекты наблюдаются редко, однако иногда человека могут беспокоить вздутие живота, сонливость и кожные высыпания. Торговое название: имодий (Imodium). Лопразолам — лекарственное вещество — бензодиазепин длительного действия; назначается внутрь. Возможные побочные эффекты: аддикция и явления бессонницы. Торговое название: лопразолам (Loprazolam). Лоразепам — лекарственное вещество — бензодиазепин; применяется для уменьшения умеренного или сильного беспокойства и напряжения, а также для лечения бессонницы. Назначается внутрь; возможные побочные эффекты: сонливость, головокружение, нарушение зрения и тошнота. Торговое название: ативан (Ativan). Лордоз — изгиб позвоночника в сагиттальной плоскости, обращенный выпуклостью вперед. Небольшие лордозы в поясничном и шейном отделах позвоночника являются для человека нормой: их отсутствие — признак анкилозирующего спондилита. Выраженные проявления лордоза могут развиться в юности в результате нарушения осанки или вследствие какого-либо заболевания позвоночника и мышц спины. Для сравнения: Кифоз. Лоскут — 1. В хирургии полоска ткани, отсеченная от расположенных под ней структур, но продолжающая оставаться прикрепленной к ним одним концом (при этом сохраняются питающие сосуды и нервы. — Ред.), так что кровь и нервные импульсы продолжают поступать в нее через оставленную ножку. Затем этот лоскут используется для устранения дефектов в какой-либо другой части тела. Свободный конец лоскута пришивается к восстанавливаемому участку, а по прошествии трех недель, когда лоскут приживается на новом месте, другой его конец отделяется и также пришивается на этом, новом для него, восстанавливаемом участке. Лоскуты обычно применяются во время выполнения пластических операций при лечении больных со значительной утратой кожи и ткани вследствие калечащих операций (например, мастэктомии) или после ожогов и травм, в случае если пораженные ткани не поддаются восстановлению с помощью кожной трансплантации (см. Трансплантат кожный). Лоскуты кожи также могут быть использованы для закрытия оставшегося костного конца ампутированной конечности. 2. В стоматологии — часть слизистой оболочки и надкостницы, прикрепленная к широкому основанию. Она приподнимается и отводится для обнажения расположенной под ней кости и осуществления таких процедур, как, например, удаление зуба. Затем эти ткани возвращаются на прежнее место. Лоскут Боари — хирургическая операция, при которой для замещения нижней трети мочеточника используется трубка из ткани мочевого пузыря. Проводится при повреждении или опухоли мочеточника. См. также Уретеропластика. Лосьон — медицинский раствор для промывания наружных участков тела. Лосьоны обычно оказывают на обрабатываемую поверхность кожи охлаждающее, успокаивающее или антисептическое действие. Лофепрамин — трициклический антидепрессант; назначается внутрь или в инъекциях. Возможные побочные эффекты: приливы крови к лицу, повышенная потливость, сухость во рту, нарушение зрения, затрудненное мочеиспускание и сонливость. Торговое название: гаманил (Gamanil). Лохии — послеродовые маточные выделения из влагалища. Первичные выделения, красные лохии, в основном состоят из крови. Появляющиеся после них серозные лохии представляют собой выделения коричневатого цвета, состоящие из смеси крови и слизи. После этого появляются белые лохии — выделения желтого или белого цвета, состоящие из микроорганизмов и клеточных фрагментов. Длительность каждого вида лохии может составлять несколько дней. — Лохиальный. ЛСД — см. Диэтиламид лизергиновой кислоты. Луковица — (в анатомии) любая шарообразная структура или округлое расширение на конце органа или части тела. Лунатизм, снохождение — см. Сомнамбулизм. Луночка — серповидный участок белого цвета, расположенный в основании ногтя. Лупа — небольшое увеличительное стекло; применяется для исследования передней части глаза. Обычно лупа связана с небольшим фонариком, создающим необходимое освещение исследуемого объекта. В современной медицинской практике вместо лупы часто используется щелевой микроскоп. Лучевой — относящийся к лучевой кости (кости предплечья) или связанный с ней. Лучепреломление двойное — свойство некоторых веществ (например, клеточных мембран), характеризующееся двойным преломлением световых лучей; имеет место при их отклонении в двух различных направлениях. Обладающий свойством двойного лучепреломления. Лучи рентгеновские — электромагнитное излучение с очень короткой длиной волны (чуть большей, чем в ультрафиолетовом излучении), способное легко проникать внутрь светонепроницаемых веществ. Рентгеновское излучение образуется при действии на вещество потока электронов, которые обладают значительной энергией. Эти лучи используются в диагностических и терапевтических целях в рентгенографии и лучевой терапии. При этом необходимо стараться максимально избегать нежелательного облучения, так как радиация оказывает вредное воздействие на все живые ткани. См. Болезнь лучевая. Лучи ультрафиолетовые — невидимое коротковолновое излучение, занимающее спектральную область между видимым и рентгеновским излучением. В состав солнечных лучей входят ультрафиолетовые лучи, вызывающие образование загара или (при их передозировке) солнечного ожога. Содержащиеся в земной атмосфере пыль и газы поглощают большую часть идущих от солнца ультрафиолетовых лучей (см. Озон). Если бы этого не происходило, то идущее от Солнца сильное ультрафиолетовое излучение привело бы к гибели многих живых организмов. Люкс — единица освещенности в системе СИ, равная 1 люмену на квадратный метр. Ранее данная единица называлась канделой на квадратный метр. Обозначение: лк. Люмбаго — боль в нижней части спины независимо от причин ее возникновения и характера проявления. Причиной сильного люмбаго, которое развивается у человека внезапно во время наклона или поднятия тяжести, может быть либо выпадение межпозвоночного диска, либо значительное напряжение мышц и связок спины. Если люмбаго сопровождается ишиалгией, то, скорее всего, причиной его возникновения является выпадение межпозвоночного диска. Люмбо- — приставка, обозначающая поясницу, поясничную область. Люмен — единица светового потока в системе СИ, равная световому потоку, испускаемому за одну секунду точечным источником в телесном угле 1 стерадиан при силе света 1 кандела. Обозначение: лм. Лютеин — 1. См. Ксантофилл. 2. Желтый пигмент желтого тела. Лютео- — часть слова, обозначающая: 1) желтый цвет; 2) желтое тело. Люэс — серьезное инфекционное заболевание (например, сифилис). Лямбда — точка на черепе, где сходятся лямбдовидный и сагиттальный швы. Лямблиоз — см. Гиардиоз. Лярдациоз — напоминающий свиное сало (лярд): данный термин часто применяется по отношению к ткани, содержащей инфильтраты крахмалоподобного вещества амилоида (см. Амилоидоз).М
Магента — см. Фуксин. Магний — металлический элемент, играющий важную роль для нормальной жизнедеятельности человеческого организма. Организм взрослого человека содержит примерно 25 г магния, который скапливается в основном в костях. Магний необходим для нормального функционирования мышечной и нервной ткани; он входит в состав кофактора около 90 содержащихся в организме человека ферментов. Особенно богаты магнием зеленые листья овощей. Обозначение: Mg. Магния гидроксид — магниевая соль, по своему применению и оказываемому на организм человека воздействию сходная с карбонатом магния. Торговое название: магниевое молочко (Milk of Magnesia). Магния карбонат — слабый антацид (противокислотное средство. — Ред.); применяется для уменьшения симптомов диспепсии, а также для снятия боли, вызванной язвой желудка или двенадцатиперстной кишки; иногда используется в качестве легкого слабительного средства. Обычно назначается вместе с другими лекарственными веществами в микстурах, порошках или таблетках. Магния сульфат — соль магния; применяется в микстурах или клизмах для лечения запора (см. Средство слабительное). Иногда инъекции сульфата магния используются для устранения дефицита этого элемента в организме человека. Магния трисиликат — соединение магния, обладающее антацидными и абсорбирующими свойствами; используется для лечения пептических язв и других нарушений процесса пищеварения. Мадароз — 1. Врожденное недоразвитие ресниц и бровей (иногда может наблюдаться их полное отсутствие). 2. Выпадение ресниц, вызванное хроническим блефаритом. Мадопар — см. Бенсеразид. Мадуромикоз — см. Стопа мадурская. Мазиндол — лекарственное вещество, снижающее аппетит; применяется для лечения ожирения. Назначается внутрь. Возможные побочные эффекты: запор, сухость во рту и бессонница. Торговое название: теронак (Теrоnас). Мазок — образец ткани или другого материала, взятый из какой-либо части тела и нанесенный на предметное стекло микроскопа для изучения. См. Мазок цервикальный. Мазок цервикальный, Тест Папаниколау (ПАП) — соскоб клеток, выстилающих канал шейки матки, который исследуется под микроскопом для выявления возможных изменений, свидетельствующих о развитии у женщины рака. Трансформированный участок шейки матки, если он есть, вероятнее всего, свидетельствует о цервикальной интраэпителиальной неоплазии. Обычный цервикальный мазок позволяет выявить наличие у женщины предракового состояния или развитие раковой опухоли на самой ранней стадии. Мазохизм — получение сексуального удовлетворения от испытываемой боли. Данный термин иногда применяется более свободно для обозначения всех форм поведения, которые сопровождаются болью и унижением. См. Половое извращение. — Мазохист. — Мазохистский. Мазь — жирное вещество, в состав которого обычно входит какое-либо лекарство; наносится на кожу или слизистые оболочки тела. Мазь — (в фармации) лекарственное вещество в полужидком виде. Макро-, makro- — приставка, обозначающая большой размер чего-либо. Например: макроэнцефалия — аномальное увеличение головного мозга. Макрогамета — неподвижная женская половая клетка малярийного плазмодия и других одноклеточных организмов (см. Простейшие). Макрогамета во многом сходна с яйцеклеткой высших животных; по размеру она несколько больше, чем мужская половая клетка (см. Микрогамета). Макрогаметоцит — клетка, из которой в процессе мейоза образуются зрелые женские половые клетки (макрогаметы) малярийного плазмодия. Макрогаметоциты присутствуют в крови человека, однако их превращение в макрогаметы происходит в организме комаров. Макрогенитосома — преждевременное половое созревание организма с заметным увеличением половых органов. Ранняя половая зрелость является одной из разновидностей преждевременного полового созревания; она обычно наступает в раннем детстве ребенка. Макроглия — один из двух основных типов глий (не-нервных клеток центральной нервной системы), в состав которого входят эпендимоциты (Ред.), астроциты и олигодендроциты. Для сравнения: Микроглия. Макроглобулин — 1. Иммуноглобулин М — присутствующий в крови белок глобулин; выполняет в организме функции антитела, образуя эффективную первоначальную защиту от попадающих в кровеносное русло бактерий. См. также Иммуноглобулин. 2. Аномальная форма IgM (см. Парапротеин). Макроглобулинемия — повышенное содержание в крови макроглобулина, вырабатываемого злокачественным разрастанием лимфоцитов. Макроглоссия I — аномально большой язык. Макроглоссия может быть врожденным дефектом развития, как, например, в случае недостаточной функции щитовидной железы (кретинизма); она также может развиваться в результате инфильтрации языка амилоидом, опухоли или возникать вследствие нарушения проходимости лимфатических сосудов. Макроглоссия II — аномальное утолщение языка. Макрогнатия — заметное увеличение размеров одной челюсти (обычно нижней) по сравнению с другой (верхней). Макродактилия — аномальное увеличение размеров одного или нескольких пальцев кистей или стоп. Макродентия — необычно крупные зубы. Макромелия — аномальное увеличение размеров конечностей. Для сравнения: Микромелия. Макронормобласт — клетка (нормобласт) неправильной формы; нормобласт является одним из предшественников эритроцитов. Макронормобласты имеют необычно большие размеры, но нормальное ядро (для сравнения: Мегалобласт); их можно выявить в организме человека при некоторых видах анемий, когда нарушается процесс эритропоэза. Макропсия — состояние, при котором окружающие предметы кажутся по размеру большими, чем они есть в действительности. Обычно макропсия развивается вследствие какого-либо заболевания сетчатки глаза, при котором поражается желтое пятно сетчатки, или из-за спазма аккомодации. Макроскопический — хорошо различимый невооруженным глазом. Для сравнения: Микроскопический. Макросомия — аномально большие размеры чего-либо. В случае макросомии плода из-за плохо поддающегося лечению диабета у женщины может развиться очень крупный ребенок. Увеличение его размеров и веса происходит благодаря выработке в организме плода избыточного количества инсулина, который способствует отложению в его тканях избытка гликогена. Макрофаг, клазмоцит — крупная клетка (фагоцит). Основные функции макрофагов — участие в естественном, специфическом, противоопухолевом иммунитете (Ред.). Макрофаги присутствуют в соединительной ткани, большинстве тканей и органов, в том числе в костном мозге, селезенке, лимфатических узлах, печени (см. Клетки Купфера) и центральной нервной системе (см. Микроглия). Эти клетки тесно связаны с моноцитами (имеют моноцитарное происхождение и относятся к системе мононуклеарных фагоцитов. — Ред.). Фиксированные макрофаги (или гистиоциты) постоянно находятся в соединительной ткани в нсподвижном состоянии; свободные макрофаги блуждают между клетками и скапливаются в местах проникновения в организм возбудителя инфекции, где способствуют удалению из крови и тканей бактерий или других чужеродных частиц. См. также Система ретикулоэндотелиальная. Макрохейлия — гипертрофия губ: врожденный порок развития, при котором отмечается аномальное увеличение размеров губ. Для сравнения: Микрохейлия. Макроцефалия, мегалоцефалия — аномальное увеличение размеров головы по отношению ко всему остальному туловищу человека. Для сравнения: Микроцефалия. Макроцит, мегалоцит — аномальное увеличение размеров эритроцитов, которое наблюдается при некоторых видах анемии. См. также Макроцитоз. — Макроцитарный. Макроцитоз — наличие в крови аномально больших по размеру эритроцитов (макроцитов). Макроцитоз является одним из симптомов некоторых видов анемий (макроцитарных анемий), в том числе тех, которые вызваны недостаточным содержанием в организме человека витамина В12 или фолиевой кислоты, а также тех, при которых наблюдается увеличение скорости образования красных клеток крови. Максвелл — единица магнитного потока, равная магнитной индукции 1 Гаусс на квадратный сантиметр. Малатион — фосфорорганическое соединение — инсектицид; используется для выведения головных и лобковых вшей, а также для лечения чесотки. Применяется наружно в виде лосьона; возможными побочными эффектами являются раздражение кожи и аллергические реакции. Торговые названия: дербак-М (Derbac-M), приодерм (Prioderm), солео-М (Soleo-M). Маль- — часть слова, обозначающая болезнь, нарушение или какое-либо отклонение от нормы. Мальабсорбция — состояние, при котором у человека нарушается всасывание одного или нескольких веществ в тонкой кишке. Чаще всего нарушается всасывание жиров (вызывая стеаторею), некоторых витаминов (таких как В12, фолиевая кислота, витамины D и К), электролитов (например, кальция или калия), железа и аминокислот. Основными симптомами (в зависимости от того, всасывание каких веществ нарушено) являются: потеря веса, понос, анемия, отеки и дефицит различных витаминов в организме человека. Причиной развития мальабсорбции чаще всего являются чревная болезнь, панкреатит, фиброзно-кистозная дегенерация, синдром слепой петли или хирургическое удаление части тонкого кишечника. Мальт — смесь углеводов (состоящая в основном из мальтозы), образующаяся в процессе разложения содержащегося в зернах ячменя и пшеницы крахмала. Зернам этих злаковых дают прорасти, а затем получают мальт путем их обработки горячей водой. Он используется в процессе варки пива и в чистом виде, так как является хорошим источником питательных веществ при различных заболеваниях, сопровождающихся истощением больного. Мальтаза — фермент, присутствующий в слюне и соке, вырабатываемом поджелудочной железой; способствует расщеплению мальтозы в глюкозу в процессе пищеварения. Мальтоза — сахар, в состав которого входят две молекулы глюкозы. Мальтоза образуется в организме человека в процессе переваривания крахмала и гликогена; также она присутствует в проросших зернах злаков. Мальформация — любое отклонение от нормального физического развития; может быть врожденным или приобретенным дефектом развития, а также возникать в результате какого-либо заболевания или травмы. Мальформация артериовенозная — см. Ангиома. Малярия, агью — инфекционное заболевание, развивающееся при попадании простейших из рода Plasmodium (P. falciparum, Р. malariae, P. ovale или Р. vivax) в эритроциты крови человека. Болезнь передается через комаров рода Anopheles, причем чаще всего встречается в странах с тропическим и субтропическим климатом. Малярия непрерывная, малярия с ежедневными приступами — см. Малярия. Малярия трехдневная — см. Малярия. Малярия четырехдневная — см. Малярия. Маляция — аномальное размягчение какой-либо части органа или ткани, например кости(см. Остеомаляция). — маляция — часть слова, обозначающая аномальное размягчение какой-либо ткани. Например: кератомаляция — размягчение роговицы глаза. Маммография — рентгенография молочной железы или получение ее изображения с помощью инфракрасных лучей. Применяется для раннего обнаружения опухолей молочной железы. См. также Рентгенография, Термография. Маммопластика — пластическая операция на молочной железе, заключающаяся в изменении ее формы или увеличении (уменьшении) ее размера. При отвисании железы удаляются кожа и расположенная под ней железистая ткань, а оставшиеся ткани закрепляются в нормальном положении. После перенесенной мастэктомии, а также при ее очень маленьких размерах для коррекции под кожу может быть имплантирован специальный протез (см. Имплантат груди). Маммотермография — метод исследования молочных желез на наличие в них опухолей или каких-либо других образований с помощью термографии. М-АМСА, амсакрин — цитотоксический лекарственный препарат, проходящий в настоящее время клинические испытания для решения вопроса о возможности его применения для лечения злокачественных новообразований. Побочные эффекты включают подавление функций костного мозга. Манипуляция — выполнение желаемых действий или достижение лечебного эффекта при воздействии рук на какую-либо часть тела человека. Как физиотерапевты, так и остеопаты используют различные манипуляции для восстановления нормальной работоспособности тугоподвижных суставов. Мания — состояние психики, характеризующееся чрезмерной веселостью, повышенной активностью человека, часто состоянием эйфории, причем настроение может быстро изменяться, приводя к повышенной раздражительности. Мышление и речь больного стремительны и бессвязны, так что бывает очень сложно установить связь между высказываемыми им мыслями. Поведение больного также отличается чрезмерной активностью, экстравагантностью, подавленностью; иногда эти люди склонны к проявлению насилия. Суждения их не адекватны реальности, поэтому иногда действия больного могут противоречить его собственным интересам. Нередко отмечается бред. Для лечения обычно применяются литий или фенотиазины; кроме того, часто возникает необходимость в помещении больного в специализированное медицинское учреждение. См. также Расстройство аффективное, Психоз маниакально-депрессивный. — Маниакальный. — мания — часть слова, обозначающая обсессию, компульсивность или преувеличенное проявление какого-либо чувства. Например: пиромания — болезненное стремление к поджигательству. Маннитол — диуретик; назначается в инъекциях вместе с другими диуретиками для лечения отеков, некоторых заболеваний почек, а также для снижения внутричерепного давления при травмах головного мозга. Возможные побочные эффекты: головная боль, боль в груди и сухость во рту. Манометр — прибор для измерения давления в жидкости или газе. В состав манометра часто входит U-образная трубка, заполненная ртутью, водой или какой-либо другой жидкостью; эта трубка открыта с одного конца, а другой ее конец опущен в жидкость, находящуюся под некоторым давлением. Измеряемое давление может быть легко определено по имеющейся на манометре градуированной шкале. См. также Сфигмоманометр. Манометрия — измерение давления внутри имеющихся в теле человека органов. В основе данного метода лежит регистрация изменений давления внутри заполненных жидкостью камер (например, желудочков мозга) или определение мышечной активности в таких подвижных трубках, как пищевод, прямая кишка или желчный проток. Мантия — см. Поле. МАО — см. Моноамин оксидазы. МАО-ингибитор — лекарственное вещество, уменьшающее активность фермента моноамина оксидазы (МАО), который содержится в тканях головного мозга, и таким образом влияющее на настроение человека. К МАО-ингибиторам относятся: изокарбоксазид, фенелзин и транилкипромин. Все эти лекарственные вещества являются антидепрессантами, однако в настоящее время их применение ограничено вследствие серьезных побочных эффектов, которыми они обладают. Они могут взаимодействовать с другими лекарственными веществами (например, с эфедрином или амфетамином) и пищевыми продуктами, в состав которых входит тирамин (например, с сыром), приводя к внезапному резкому повышению кровяного давления у человека. См. также Моклобемид, Селегилин. Мапротилин — лекарственное вещество; применяется для лечения всех видов депрессии, в том числе и тех, которые сопровождаются повышенным беспокойством больного (см. Антидепрессант). Назначается внутрь. Возможные побочные эффекты: сонливость, головокружение и тремор. Торговое название: людиомил (Ludiomil). Маразм — сильное истощение младенцев, приводящее к снижению их веса ниже 75 % от того, который должен быть у них по возрасту. Ребенок выглядит постаревшим, бледным, апатичным, у него отсутствует подкожная жировая клетчатка, нарушена терморегуляция. Такое состояние у ребенка может развиться в результате мальабсорбции, неправильного питания, нарушения обмена веществ, частой рвоты, поноса, какого-либо серьезного заболевания сердца, легких, почек или мочевыводящих путей или вследствие хронической бактериальной или паразитарной инфекции (особенно в странах с тропическим климатом). Отказ матери от кормления ребенка грудью может вызвать развитие маразма вследствие недостаточного питания ребенка. Острая инфекция может привести к скорой смерти ребенка. Лечение маразма зависит от вызвавшей его причины, однако в любом случае больному младенцу нужен тщательный уход и обеспечение необходимого ему по возрасту питания и поступления в организм требуемого количества жидкости, однако добиться этого можно лишь постепенно, постоянно расширяя рацион его питания. Марганец — металлический элемент серого цвета. При вдыхании его окиси шахтерами, находящимися в плохо вентилируемых шахтах под землей, он может вызвать повреждение головного мозга и симптомы, сходные с паркинсонизмом. В небольших количествах марганец необходим организму человека для поддержания его нормальной жизнедеятельности (см. Микроэлемент). Обозначение: Мn. Марихуана — см. Каннабис. Маркер опухолевый — вырабатываемое опухолевыми клетками вещество, по которому можно судить о размерах опухоли и эффективности проводимого лечения. Примером такого вещества является альфа-фетопротеин, по которому оценивается эффективность проводимого лечения при тератоме яичка. Маркер ультразвуковой — выявление какой-либо аномалии развития плода на определенной стадии его развития в процессе ультразвукового исследования беременной женщины. Такие маркеры предполагают наличие характерных хромосомных аномалий или явных дефектов развития у плода. Например, выйный маркер, представляющий собой расположенный в области шеи плода темный участок, является одним из признаков наличия у развивающегося плода синдрома Дауна. Марля — тонкий хлопчатобумажный материал, используемый для приготовления повязок и тампонов (обычно применяется в несколько слоев). Марсупиализация — оперативный метод лечения кисты. Киста вскрывается, ее содержимое удаляется, а края стенки вскрытой кисты затем пришиваются к краям операционной раны с образованием искусственного кармана. Рана оставляется открытой до тех пор, пока она не заживет благодаря образованию в ней грануляционной ткани. Маскулинизация — появление на теле и лице женщины избыточного количества волос, огрубение голоса и увеличение мышечной массы (развитие вторичных мужских половых признаков), возникающее в результате какого-либо гормонального нарушения или вследствие гормональной терапии. См. также Вирилизм, Вирилизация. Масло касторовое — см. Средство слабительное. Масло эссенциальное — летучее масло, получаемое из некоторых благовонных растений. Эти масла применяются в различных фармацевтических препаратах. Массаж — система приемов механических манипуляций (растирание, поглаживание, поколачивание. — Ред.) с мягкими тканями человеческого тела, осуществляемая при помощи рук. Массаж применяется для улучшения кровообращения, уменьшения отечности, предотвращения адгезии тканей после перенесенной травмы, уменьшения мышечных спазмов и улучшения тонуса мышц. См. также Поглаживание, Разминание, Поколачивание. Массаж точечный — вид массажа, при котором массажист осуществляет манипуляции кончиками пальцев. Этот вид массажа применяется для оказания воздействия на расположенные под кожей органы и ткани, а также для разрушения спаек, которые образуются у больного в результате травмы. Массирование — см. Разминание. Массы рвотные — содержимое желудка, удаляющееся через рот во время рвоты. Медицинское название: рвота. Маст-, masto- — часть слова, обозначающая грудь. Масталгия — боль в груди. Мастика — (в стоматологии) тонкий слой цемента, вставляемый в небольшую полость между зубом и коронкой для его постоянного удержания на одном месте. Мастикациограф — (в стоматологии) инструмент для переноса положения челюстей больного на артикулятор для воспроизведения боковых и передне-задних движений нижней челюсти. Мастит — воспаление молочной железы, причиной которого обычно является проникновение бактериальной инфекции через травмированный сосок. Чаще всего во время кормления грудью, примерно через месяц после родов, у женщины развивается острый послеродовой мастит; иногда заболевание может сопровождаться появлением обильных гнойных выделений из молочной железы. Причины развития хронической фибрознокистозной мастопатии различны и не имеют никакого отношения к воспалению. В этом случае грудь как бы опухает из-за наличия в ней кист; считается, что развитие этого заболевания связано с нарушением гормонального баланса в организме женщины. Мастоидит — воспаление сосцевидного отростка височной кости и воздухоносных ячеек, в том числе сосцевидной пещеры, которая сообщается с полостью среднего уха. Причиной воспаления, как правило, является бактериальная инфекция, распространяющаяся из среднего уха (см. Отит (средний)). Обычно лечение проводится с помощью антибиотиков, однако в запущенных случаях иногда возникает необходимость в проведении хирургического вмешательства (см. Мастоидэктомия). Мастоидэктомия — хирургическая операция, заключающаяся в частичном или полном удалении всех воздухоносных ячеек, расположенных в сосцевидном отростке височной кости, при их воспалении (см. Мастоидит) или инвазии в них холестеатомы. См. также Аттикотомия. Мастурбация — физическая стимуляция человеком (это может быть как мужчина, так и женщина) собственных наружных половых органов для достижения сексуального удовлетворения, которая нередко заканчивается оргазмом. Мастэктомия — хирургическая операция, заключающаяся в удалении молочной железы. Простая мастэктомия, выполняемая при обширных, но не распространившихся в другие ткани опухолях, заключается в простом удалении груди; кожа и, если это возможно, сосок могут быть оставлены, а под кожу вводится специальный протез (см. Имплантат груди), который придает ей нормальную форму. Если опухоль распространяется на близлежащие лимфатические узлы, то выполняется радикальная мастэктомия. Она заключается в удалении железы вместе с кожей, всеми расположенными под ней грудными мышцами и всеми лимфатическими узлами подмышечной впадины. После хирургического лечения проводится курс лучевой терапии и (или) химиотерапии. В современной хирургической практике обычно применяется модифицированная радикальная мастэктомия, при которой грудные мышцы оставляются. См. также Тилэктомия. Материал шовный — шелк, кетгут, нейлон или тонкая леска — используемые для зашивания раны. Матка — внутренний женский половой орган, предназначенный для имплантации эмбриона и развития плода. В обычном состоянии матка женщины представляет собой орган грушевидной формы, длина которого составляет примерно 7,5 см. Она удерживается в полости таза в определенном положении при помощи широких связок, являющихся складками брюшины. В полость матки открываются фаллопиевы трубы, а ее шейка охватывается передним и задним сводами влагалища. Стенка матки состоит из трех слоев: внутреннего эндометрия (слизистой оболочки), богатого маточными железами; среднего — миометрия (мышечной оболочки) и наружного — серозной оболочки, или периметрия. Во время родов миометрий сокращается, изгоняя плод из матки через шейку матки и влагалище. При отсутствии у женщины беременности эндометрий претерпевает периодические изменения (см. Цикл менструальный). — Маточный. Матка двойная — см. Матка удвоенная. Матка удвоенная, матка двойная — врожденный дефект развития матки, характеризующийся удвоением матки или ее тела в связи с неполным слиянием двух парамезонефрических (мюдлеровых) протоков на этапе раннего эмбрионального развития. В результате у женщины с двойной маткой может быть одна или две шейки (матки) и одно влагалище. При полном неслиянии этих протоков могут развиться две матки с двумя ее шейками и двумя влагалищами. Маточка, мешочек эллиптический — 1. Наибольший из двух мешочков преддверной части перепончатого лабиринта внутреннего уха. Он заполнен эндолимфой, а на его внутренней поверхности находится пятно, содержащее рецепторные клетки, улавливающие изменения положения тела в пространстве. Эта информация направляется в головной мозг. 2. Небольшая полость (предстательная маточка), расположенная в предстательной железе и открывающаяся в простатическую часть мужского мочеиспускательного канала. Маточный — связанный с маткой или относящийся к ней. Матрац гидростатический; матрац резиновый, заполненный водой — кровать с гибким гидростатическим матрацем. Поверхность матраца легко принимает форму тела больного, так что ему удобно лежать на кровати, и у него не образуются пролежни. Матрикс — основное (межклеточное) вещество ткани или органа, которое содержит другие, более специализированные структуры. Например, основное вещество соединительной ткани. Матрица — гибкая полоска из металла или пластмассы, содержащая пломбировочный материал для подготовленной полости; закрепляется вокруг коронки зуба. Мацерация — 1. Размягчение твердого вещества путем его погружения в жидкость. 2. В акушерстве — естественное разложение умершего плода внутри матки. Mea-, meato- — часть слова, обозначающая проход. Например: меатотомия — рассечение наружного отверстия мочеиспускательного канала с целью его расширения. Мебгидролин — антигистаминный препарат; применяется для лечений аллергических реакций, в том числе сенной лихорадки и крапивницы. Торговое название: фабагистин (Fabahistin). Мебендазол — антигельминтное средство, используемое для выведения из организма аскарид, анкилостом, остриц и власоглавов. К побочным эффектам от его применения относится расстройство желудка. Торговое название: верннокс (Vennox). См. также Имидазол. Мега-, mega- — часть слова, обозначающая: 1) большой размер; аномальное увеличение или растяжение чего-либо. Например: megacaecum — аномальное увеличение слепой кишки; 2) миллион. Например: мегавольт (megavolt) — миллион вольт. Мегакариобласт — клетка, являющаяся предшественником тромбоцитообразующей клетки — мегакариоцита; присутствует в кроветворной ткани костного мозга. Мегакариобласт образуется из кроветворной стволовой клетки и в процессе своего созревания, минуя промежуточную стадию (промегакариоцит), превращается в мегакариоцит. Мегакариоцит — клетка костного мозга, из которой в дальнейшем образуются тромбоциты. Мегакариоцит отличается большими размерами (диаметр этой клетки составляет 35—160 мкм) и имеет неправильное, разделенное на множество долей ядро; содержащееся в ней большое количество цитоплазмы окрашивается с помощью красителя Романовского в бледно-голубой цвет, на котором хорошо видны гранулы красного цвета. См. также Тромбопоэз. Мегаколон — значительное расширение, а иногда и удлинение, ободочной кишки. Причиной образования мегаколона может являться нарушение проходимости ободочной кишки, болезнь Гиршпрунга или длительный запор; мегаколон может развиться также в результате осложнения язвенного колита (токсический мегаколон). Мегал-, мегало- — приставка, обозначающая аномальное увеличение чего-либо. Например: макромелия — аномальное увеличение конечностей. — мегалия — часть слова, обозначающая аномальное увеличение чего-либо. Например: спленомегалия — аномальное увеличение селезенки. Мегалобласт — клетки, имеющие аномальную форму; являются предшественниками эритроцитов (см. Эритробласт). Мегалобласты являются необычно крупными клетками и содержат незрелые ядра; они присутствуют в костном мозге человека при наличии у него некоторых видов анемий (мегалобластических анемий), вызванных дефицитом в организме витамина В12 или фолиевой кислоты. — Мегалобластический. Мегаломания — мания величия, во время которой человек представляет себя богом, членом королевской семьи или кем-либо еще. Мегаломания может быть одним из проявлений шизофрении, маниакального заболевания или церебрального сифилиса. Мегалоцефалия — 1. См. Макроцефалия. 2. Чрезмерное разрастание и искажение костей черепа (см. Леонтиаз). Мегалоцит — см. Макроцит. Мегауретер — значительное расширение мочеточника. Образуется непосредственно над местом длительного нарушения проходимости мочеточника, в результате чего в этом месте затруднен свободный отток мочи из почечной лоханки. Наиболее характерной причиной образования мегауретера является рефлюкс мочи из мочевого пузыря обратно в мочеточники (см. Рефлюкс везикоуретеральный), однако наряду с этой причиной существуют поразительные примеры образования так называемого идиопатического мегауретера. В этом случае могут поражаться как один, так и оба мочеточника; при этом в самом низу мочевого пузыря располагается сегмент нормального мочеточника, который может быть различной длины, а расположенный над ним мочеточник значительно расширяется. В обоих случаях (как при рефлюксе мочи, так и при идиопатическом мегауретере) состояние больного усугубляется, приводя к развитию инфекционных заболеваний мочевыводящих путей и (или) почечной недостаточности. В процессе лечения выполняется корректирующая операция. Мегестрол — синтетический женский половой гормон (см. Прогестоген); применяется для лечения метастазов рака молочной железы или рака матки у женщин. Торговое название: мегас (Megace). Медиальный — срединный; относящийся или расположенный ближе к срединной плоскости тела. Медиастинит — воспаление клетчатки средостения; обычно является осложнением, возникающим после разрыва пищевода. Склерозирующий медиастинит часто приводит к развитию у человека фиброза, в результате чего может произойти сдавление других органов, расположенных в грудной клетке (например, верхней полой вены, бронхиального дерева или пищевода). Медиатор — нейрогормон или нейромедиатор. Медикохирургический — данный термин применяется для описания заболеваний, для лечения которых используются как консервативные, так и хирургические методы. Медицина — 1. Наука и практика диагностики, лечения и предотвращения различных заболеваний. 2. Наука и практика консервативных (нехирургических) методов лечения заболеваний. Медицина альтернативная — различные системы исцеления, включая гомеопатию, фитотерапию, гипноз и психотерапию. Все эти системы не относятся к традиционным методам лечения, особенно в случае, если их практикуют специалисты, не имеющие необходимого сертификата, подтверждающего право на данный вид деятельности. Польза большинства этих видов лечения научно до сих пор не доказана, однако больные хроническими или не поддающимися никакому другому лечению заболеваниями часто прибегают к помощи таких специалистов. Многие альтернативные методы лечения до сих пор остаются непризнанными врачами, однако акупунктура и остеопатия пользуются сравнительно широкой популярностью благодаря той пользе, которую они могут оказать в ряде случаев. Существует множество причин, по которым можно принимать или отвергать альтернативные методы лечения, но всегда необходимо при этом руководствоваться основным принципом, которому в ряде случаев не уделяется должного внимания (этот принцип установлен общемедицинской службой): лечение больных может проводиться лишь в том случае, если действия практикующего специалиста могут быть проконтролированы представителями медицинской службы; часто это оказывается неприемлемым для специалистов, практикующих альтернативные методы лечения. См. также Хиропрактика. Подход холистический, Натуропатия. Медицина государственная — см. Здравоохранение народное. Медицина клиническая — раздел медицины, занимающийся непосредственно диагностикой и лечением больных, в отличие от раздела медицины, занимающегося изучением изменений в различных органах и тканях при различных заболеваниях (патологическая анатомия), а также от лабораторных исследований (лабораторная диагностика). Медицина общественная — 1. См. Народное здравоохранение. 2. В разговорной речи — народное здравоохранение в сочетании с общей медицинской практикой, особенно в областях, где проявляется заметная нехватка медицинского персонала и один врач может выполнять одновременно различные функции, работая с широкими слоями населения. Медицина подростковая — раздел медицины, занимающийся изучением заболеваний детей пубертатного и юношеского возраста. Для сравнения: Педиатрия. Медицина профилактическая — раздел медицины, занимающийся предотвращением развития заболеваний. К нему относятся различные стороны врачебной деятельности, начиная от массовой иммунизации населения против различных инфекционных заболеваний (таких, например, как дифтерия или коклюш) до разработки методов уничтожения переносчиков заболеваний (например, комаров, являющихся переносчиками малярийных паразитов). См. также Всемирная организация здравоохранения. Медицина судебная — 1. (Forensic medicine) — раздел медицины, занимающийся установлением причин травмы или смерти, происшедшей при невыясненных обстоятельствах, особенно если они произошли предположительно в ходе преступления. Такие исследования проводятся патологоанатомами по запросу коронера совместно с другими экспертами и представителями полиции. 2. (Мedical certificate) — изучение или практическое применение юридических аспектов в медицине. Медицина тропическая — раздел медицины, изучающий заболевания, которые наиболее распространены в регионах с тропическим климатом; к ним относятся, например, малярия, лепра, трипаносомоз, шистосомоз и лейшманиоз. Медицинский — 1. Имеющий отношение к медицине, диагностике, лечению и профилактике различных заболеваний. 2. Терапевтический. Данный термин используется для описания таких заболеваний, которые хорошо поддаются консервативному лечению без применения хирургических методов лечения. Так, этот признак обязательно учитывается в процессе формирования медицинских палат в больницах. Медия — 1. Средняя оболочка стенки вены или аретрии. Является самой толстой из трех оболочек; образована чередующимися слоями, состоящими из эластических волокон и гладких мышц. 2. Средняя оболочка любых других органов или частей тела человека. Медленно заживающий — данный термин применяется для описания длительно текущего, медленно проходящего заболевания. Особенно часто используется он по отношению к язвам кожи или слизистых оболочек. Медроксипрогестерон — синтетический женский половой гормон (см. Прогестоген); используется для лечения нарушений менструального цикла (в том числе аменореи), для предотвращения выкидыша и (в сочетании с эстрогеном) в оральных контрацептивах. Назначается внутрь или в инъекциях. Торговые названия: фарлутал (Farlutal), провера (Provera). Медсестра — лицо, получившее специальное медицинское образование и принимающее участие в диагностике и лечении имеющихся или возможных заболеваний под руководством врача. Медуллобластома — опухоль головного мозга, которая обычно развивается в детском возрасте. Она происходит из клеток, которые потенциально могут созреть до такой степени, что превратятся в нейроны. Медуллобластома обычно развивается в черве мозжечка, примыкающем к четвертому желудочку мозга. В результате ее образования у ребенка возникают неустойчивая походка и трясущиеся движения конечностей. Нарушение оттока спинномозговой жидкости приводит к развитию гидроцефалии. Лечение состоит в хирургическом удалении опухоли и восстановлении нормального оттока спинномозговой жидкости, после которого проводится курс лучевой терапии. Примерно 40 % детей, у которых имелась медуллобластома, смогли прожить еще в течение пяти лет после перенесенной операции. Меж- — приставка, указывающая на расположение между чем-либо. Например: межреберный — расположенный между ребрами; межвертельный — расположенный между вертелами. Межклеточный — расположенный или образующийся между клетками. Мез-, мезо- — часть слова, обозначающая середину или медиальное расположение чего-либо. Мезаортит — воспаление средней (медиальной) оболочки стенки аорты, обычно развивающееся на поздней стадии сифилиса. Может привести к образованию аневризмы на пораженном участке аорты. Для лечения инфекции применяется пенициллин. Мезартериит — воспаление средней (медиальной) оболочки артерии, которое нередко сопровождается воспалением всех слоев стенки артерии. Мезартериит обычно развивается при сифилисе, полиартериите, височном артериите и болезни Бюргера. Мезенхима — эмбриональный зачаток соединительной ткани, образованный из мезодермы. Мезенхимные клетки образуют скопления в различных участках эмбриона, где на их основе формируется большая часть скелетных и гладких мышц, соединительной ткани, крови и кровеносных сосудов. Мезиальный — 1. Медиальный. 2. Относящийся к срединной (центральной) линии или плоскости или расположенный в ней. 3. Кривизна зубной дуги, идущая по направлению к срединной линии. Мезовариум — брыжейка яичников. Мезодерма — средний зародышевый листок эмбриона на ранних стадиях развития. Он служит источником развития хрящей, мышц, костей, крови, почек, половых желез и их протоков и соединительной ткани. Мезодерма разделяется на два слоя: наружную соматическую и глубокую, внутренностную, разделенные полостью — целомом, который становится полостью тела. Дорсальная соматическая мезодерма становится сегментированной на ряд сомитов. См. также Мезенхима. — Мезодермальный. Мезоколон, брыжейка ободочной кишки — дупликатура брюшины, при помощи которой ободочная кишка прикрепляется к задней брюшной стенке. Обычно у взрослого человека существуют только брыжейка поперечной и сигмовидной кишки, которые прикрепляются соответственно к поперечной и сигмовидной ободочной кишке. Мезометрий, брыжейка матки — широкая связка матки: два листка брюшины, прикрепляющиеся к брюшной стенке; через мезометрий к матке подходят кровеносные сосуды. Мезоморфный — данный термин используется для описания типа телосложения человека, которое характеризуется хорошо развитыми мышцами и скелетом, а также прямой и правильной осанкой (при мезоморфном типе анатомические особенности приближаются к усредненным параметрам нормы. — Ред.). — Мезоморф. — Мезоморфия. Мезонефрос, тело вольфово — парная первичная почка, которая образуется у зародыша. Мезонефрос функционирует в качестве органа выделения лишь в течение очень короткого времени, а затем происходит его дегенерация. Однако отдельные участки мезонефроса становятся частью мужской репродуктивной системы. Его проток — мезонефральный (или вольфов проток) превращается у мужчин в придаток яичка и семявыносяший проток, по которому из яичек выделяются сперматозоиды. — Мезонефральный. Мезосальпинкс — дупликатура брюшины; участок широкой связки матки, прилежащий к маточной (фаллопиевой) трубе. Мезосома — структура, образующаяся у некоторых бактериальных клеток за счет наличия складок в клеточной мембране. Мезосомы обычно соединяются с ДНК и принимают участие в процессе деления клетки. Мезотелий — однослойный плоский эпителий, выстилающий серозные оболочки. Мезотелий образуется из эмбриональной мезодермы. Для сравнения: Эпителий. Мезотелиома — редкая опухоль, развивающаяся в плевре, брюшине или внутри перикарда, исходящая из мезотелия. Развитие плевральной мезотелиомы очень часто бывает связано с вдыханием человеком асбестовой пыли (см. Асбестоз), поэтому работникам предприятий, деятельность которых связана с асбестом и у которых имеется такая опухоль, полагается специальная финансовая компенсация предприятия за причиненный их здоровью ущерб. Во всех других случаях, если больной сам непосредственно не контактирует с асбестом на своем рабочем месте, асбестовая пыль может попасть в его организм через одежду близких родственников, работающих на асбестовом предприятии, или же он может жить вблизи от такого предприятия. Специального лечения этих опухолей пока что не существует, однако хорошие результаты в некоторых случаях могут быть получены после проведения радикального хирургического вмешательства, которое позволяет ограничить распространение болезни, лучевой терапии и химиотерапии. Мезотендон, брыжейка сухожилия — два листка синовиального слоя, соединяющих наружный и внутренний листки синовиального влагалища. Содержит кровеносные сосуды и нервы, снабжающие сухожилие (Ред.). Мезофильный — данный термин применяется для описания организмов, особенно бактерий, которые лучше всего растут и развиваются при температуре 25–45 °C. Для сравнения: Психофильный, Термофильный. Мейоз, деление редукционное — вид клеточного деления, при котором из одной материнской образуются четыре дочерние клетки, каждая из которых имеет половину хромосомного набора соматической клетки. В результате этого деления образуются сперматозоиды и яйцеклетки, а после оплодотворения восстанавливается нормальный (диплоидный) набор хромосом. Во время мейоза в дочерних клетках происходят определенные генетические изменения, вызванные образованием перекреста. Процесс мейоза состоит из двух последовательных делений клетки, причем каждое деление проходит через четыре стадии (см. Профаза, Метафаза, Анафаза, Телофаза). Для сравнения: Митоз. — Мейотический. Меклозин — антигистаминный препарат; используется в основном для предотвращения и лечения тошноты и рвоты, особенно при укачивании, а также для уменьшения проявлений аллергических реакций. Назначается внутрь. Меконизм — отравление, возникающее в результате употребления внутрь или курения опиума или получаемых из него продуктов, особенно морфина. Меконий — первые кишечные выделения новорожденного, имеющие темно-зеленый цвет и состоящие из слущенных эпителиальных клеток слизистой оболочки кишечника, слизи и желчных пигментов. Наличие мекония в околоплодных водах во время родов свидетельствует о дистрессе плода. См. также Непроходимость кишечника (мекониевая). Мексилетин — противоаритмическое лекарственное вещество; применяется для предотвращения или лечения сильной аритмии, возникающей в желудочках сердца. Назначается внутрь. Возможные побочные эффекты: тошнота, рвота, головокружение и двоение зрения. Торговое название: мекситил (Mexitil). Мелан-, мелано- — часть слова, обозначающая: 1) темную (черную) окраску; 2) меланин. Например: меланемия — наличие в крови меланина. Меланизм, меланоз — необычная, ярко выраженная пигментация тканей тела, вызванная избыточной выработкой в них пигмента меланина. Так, например, меланизму могут быть подвержены волосы, кожа (после солнечного ожога, во время беременности или при болезни Аддисона) и глаза. Меланин — темно-коричневый или черный пигмент, содержащийся в волосах, коже, а также в сосудистой (в том числе в радужке) и сетчатой оболочках глаза. Кроме того, меланин присутствует в некоторых клетках (они называются хроматофорами или меланофорами), где вырабатываются в процессе метаболизма аминокислоты тирозина. Образование меланина в меланоцитах эпидермиса кожи увеличивается под действием солнечных лучей (при этом на коже человека появляется характерный загар), что способствует защите внутренних слоев кожи от попадания на них солнца. Меланодермия — см. Хлоазма. Меланоз — 1. См. Меланизм. 2. Нарушение процесса нормального образования в организме человека пигмента меланина. 3. Кахексия, сопровождающая распространение рака кожи — меланомы на другие участки тела человека. — Меланотический. Меланома, меланома злокачественная — злокачественная опухоль клеток, способных вырабатывать меланин, — меланоцитов. Эти опухоли обычно развиваются в коже (чаще всего из-за чрезмерного увлечения загоранием на солнце); иногда они могут поражать глаза и слизистые оболочки. Меланомы могут содержать меланин, или этот пигмент может отсутствовать в них (амеланотические (беспигментные) меланомы). Опухоль обычно быстро распространяется на другие участки тела человека, поражая преимущественно лимфатические узлы и печень. В этих случаях меланин или его предшественники (меланогены) могут выводиться из организма с мочой, а кожа приобретает характерную сильно пигментированную окраску. Прогноз заболевания обратно пропорционален толщине пораженного опухолью слоя кожи; практически все пациенты, у которых размер опухоли не превышал 0,76 мм, выжили после ее хирургического удаления. Меланонихия — черная пигментация ногтей, возникающая из-за наличия в них пигмента меланина. Меланоплакия — появление пигментированных участков на слизистой оболочке внутренней поверхности щек из-за наличия в них пигмента меланина. Меланофор — см. Меланин. Меланоцит — клетка, расположенная в базальном слое эпидермиса кожи, которая вырабатывает темно-коричневый пигмент меланин. Меланурия — наличие в моче темного пигмента. Это может быть меланин или его предшественники, что наблюдается при некоторых видах меланом, или же наличие в моче темного пигмента может быть связано с нарушением обмена веществ в организме человека, например при порфирии. Меланхолия — см. Депрессия, Меланхолия инволюционная. Меланхолия инволюционная — сильная депрессия, обычно связанная с каким-либо нарушением психики, впервые появляющаяся во время инволюционного периода у взрослых людей (примерно в 40–55 лет у женщин и в 50–65 лет у мужчин). Данное заболевание имеет такие характерные симптомы, как тревожное возбуждение, бред о наличии у человека мнимых заболеваний, отсутствие каких-либо других выраженных симптомов болезни и отрешенность от окружающего мира; больше всего больной озабочен собственными утратами и близящейся смертью. Однако болезнь не всегда может иметь эти классические симптомы, поэтому обычно врачи считают нецелесообразным выделять это заболевание из группы депрессивных психозов. См. Психоз маниакальнодепрессивный. Мелатонин — гормон, секретируемый в темноте (но не на свету) шишковидным телом. Находящиеся в головном мозге мелатониновые рецепторы, расположенные в клетках ядер гипоталамуса, расположенных над зрительным перекрестом, реагируют на появление этого гормона и синхронизируют функции этих ядер в соответствии с 24-часовыми периодическими сменами дня и ночи, посылая в головной мозг сообщения о том, когда наступает день и когда — ночь. Мелатонин является одним из производных серотонина, совместно с которым осуществляет регуляцию цикла сна и бодрствования; в настоящее время проводятся экспериментальные исследования относительно возможности его применения для лечения расстройств нормального циркадианного ритма, возникающего в результате быстрого перемещения между часовыми поясами Земли, синдрома сезонных аффективных расстройств и бессонницы, развивающейся у рабочих, вынужденных работать в разные смены, а также у пожилых людей. Мелена — темные, дегтеобразные каловые массы, имеющие такой цвет из-за наличия в них частично переваренной крови из вышележащих отделов пищеварительного тракта. Появление мелены становится заметным только при попадании более 500 мл крови в кишечник. Нередко мелена возникает после кровавой рвоты (см. Гематемезис), вызванной теми же самыми причинами, однако она также может быть связана и с наличием какого-либо заболевания тонкой кишки или верхних отделов ободочной кишки у человека, например карциномы или ангиодисплазии. См. также Болезнь новорожденных геморрагическая. Мелиоидоз — болезнь диких грызунов, вызываемая бактериями вида Pseudomonas pseudomallei. Мелиоидоз может передаваться человеку через укусы обитающих на крысах блох, приводя к развитию у него пневмонии, множественных абсцессов и септицемии. Нередко заболевание заканчивается смертью больного. Мелфалан — лекарственное вещество; применяется для лечения различных видов злокачественных опухолей, в том числе злокачественной меланомы, опухолей молочной железы и яичников, а также болезни Ходжкина. Назначается внутрь или в инъекциях. Возможные побочные эффекты: нарушение пищеварения, изъязвление слизистой оболочки полости рта и временное выпадение волос. Торговое название: алкеран (Alkeran). Мембрана — 1. Тонкий слой волокнистой ткани, служащий в качестве оболочки какого-либо органа или ткани, выстилки полости, перегородки или скрепляющей структуры. См. также Мембрана базальная, Оболочка слизистая, Оболочка серозная. 2. Окружающая клетку липопротеиновая оболочка (плазматическая или клеточная мембрана). — Мембранозный. Мембрана базальная — тонкий межклеточный слой, подстилающий эпителий, окружающий отдельные мышечные волокна и шванновские клетки, отделяя их от подлежащей соединительной ткани. Образована коллагеном, протеогликанами и гликопротеинами. Мембрана базилярная — мембрана в улитке внутреннего уха, разделяющая два из трех каналов (лестниц), которые тянутся вдоль всей длины спирали улитки (улитковый проток и барабанную лестницу). Спиральный (кортиев) орган, осуществляющий восприятие звуков, расположен на базилярной мембране внутри средней лестницы (улиткового протока). Мембрана периодонтальная, связка периодонтальная — расположенная вокруг зуба связка, при помощи которой он прикрепляется к кости. Мембрана полупроницаемая — мембрана, которая пропускает молекулы одних веществ и препятствует прохождению через нее молекул других веществ. Клеточные мембраны являются полупроницаемыми. Полупроницаемые мембраны применяются в клинических условиях в процессе проведения гемодиализа у больных с почечной недостаточностью. Мембрана Рейсснера — мембрана, разделяющая лестницу преддверия и среднюю лестницу (улитковый проток), расположенные в улитке внутреннего уха. Мембрана с пишущим устройством регистрирующего прибора — барабан для записи, который состоит из эластичной мембраны, прикрепленной к одному из концов цилиндра. Данное устройство применяется в различных инструментах, регистрирующих изменения атмосферного давления. Мембрана синовиальная, оболочка синовиальная — внутренний слой суставной капсулы, имеющий множество обращенных в полость сустава синовиальных ворсинок, богатых кровеносными сосудами. Синовиальная мембрана покрыта слоем синовицитов (Ред.), которые секретируют синовиальную жидкость, смазывающую и питающую суставные хрящи. Мембрана стекловидная — прозрачная оболочка, окружающая стекловидное тело глаза, отделяя его от сетчатки. Мен-, мено- — часть слова, обозначающая менструацию. Менархе — становление менструальной функции; время наступления первой менструации, когда в организме происходят глубокие физические и психические изменения, связанные с половым созреванием. Наступление менархе сопровождается повышением функциональной активности репродуктивных органов и проходит обычно в возрасте от 10 до 18 лет. Менделизм — теория о наследственной передаче признаков, в основе которой лежат законы Менделя. Менинг-, менинго- — приставка, обозначающая оболочки мозга. Менингизм — состояние раздражения головного или спинного мозга, при котором имеются симптомы менингита (например, ригидность шейных мышц), но реальное воспаление отсутствует. Данное состояние часто встречается у детей и обычно является симптомом инфекционного поражения органов грудной клетки или воспаления верхних дыхательных путей. Исследование спинномозговой жидкости в этом случае не показывает никаких аномалий в ее составе. Менингиома — опухоль, образующаяся из соединительной ткани мозговых оболочек головного и спинного мозга. Рост этих опухолей обычно является замедленным, однако их развитие может привести к возникновению у человека симптомов, свидетельствующих о сдавлении расположенных под мозговыми оболочками структур мозга. Развивающаяся в головном мозге опухоль может явиться причиной возникновения у человека фокальной эпилепсии и постепенно прогрессирующих неврологических нарушений. Опухоль спинного мозга вызывает развитие у человека параплегии и синдрома Броун-Секара. Некоторые менингиомы (их называют менингеальными саркомами) являются злокачественными и могут инвазировать соседние ткани. Чаще всего, если только это возможно, производится хирургическое удаление менингиомы. Злокачественные опухоли, кроме того, могут требовать дополнительного применения лучевойтерапии. Известны случаи, когда больные довольно долго, порой до 30 лет, испытывали вышеуказанные симптомы, прежде чем у них была выявлена данная опухоль. Менингит — воспаление оболочек мозга, вызванное вирусной или бактериальной инфекцией. Симптомами менингита являются сильная головная боль, повышение температуры, потеря аппетита, непереносимость световых и звуковых раздражителей, ригидность мышц, особенно шейных (см. также Симптом Кернига), а в очень тяжелых случаях судороги, рвота и бред, в результате чего может наступить смерть. Чаще всего причиной развития бактериального менингита у маленьких детей являются бактерии видов Haemophilus influenzae и Neisseria meningitidis (относящиеся к менингококкам); в настоящее время имеется возможность проведения иммунизации против менингита, вызываемого бактериями рода Haemophilus. При менингококковом менингите (также по-другому он называется цереброспинальным менингитом или пятнистой лихорадкой) симптомы болезни проявляются внезапно, а попавшие в организм бактерии могут вызвать обширную менингококковую инфекцию, достигающую своей высшей точки во время менингококковой септицемии, для которой характерно появление геморрагической сыпи на любом участке тела человека. Если своевременно не поставлен диагноз и не начато лечение, то в течение недели заболевание может закончиться смертью больного. При бактериальном менингите назначаются большие дозы антибиотиков, причем чем раньше это происходит, тем лучше для больного. За исключением простого герпетического энцефалита (который лечится с помощью ацикловира), вирусный менингит не поддается лечению лекарственными препаратами. См. также Лептоменингит, Пахименингит. Менингококк — бактерия вида Neisseria meningitidis, которая может вызвать развитие серьезной формы септицемии и является одной из наиболее распространенных причин менингита. — Менингококковый. Менингококцемия — наличие менингококков (бактерий вида Neisseria meningitidis) в крови человека. См. Менингит. Менингомиелит — см. Менингоэнцефалит. Менингомиелоцеле — см. Дефекты развития нервной трубки. Менингососудистый — относящийся к оболочкам, закрывающим головной и спинной мозг, и проходящим в них кровеносным сосудам, которые снабжают кровью расположенные под ними ткани мозга. Данный термин применяется также для описания вторичной сифилитической инфекции нервной системы. Менингоцеле — см. Дефекты развития нервной трубки. Менингоэнцефалит — воспаление головного мозга и его оболочек, вызванное бактериальной или вирусной инфекцией. Болезнь может затрагивать также и спинной мозг, вызывая развитие миелита с параличом обеих ног (иногда данное заболевание называют менингомиелитом). Мениск — (в анатомии) несплошная хрящевая или соединительнотканная (Ред.) серповидная пластинка, расположенная между суставными поверхностями и разделяющая на части полость сустава. Мениск суставной — парное фибрознохрящевое образование коленного сустава, имеющее вид полумесяца и расположенное между бедренной и большеберцовой костями. Менискэктомия — хирургическое удаление суставного мениска (чаще всего в коленном суставе). Данная операция выполняется при разрыве или поражении мениска для уменьшения боли в коленном суставе и увеличения его подвижности. В настоящее время операция выполняется с помощью артроскопа. Менопауза, климакс — период в жизни женщины, когда ее яичники прекращают вырабатывать яйцеклетки через каждые четыре недели: в результате прекращаются менструации, после чего она оказывается не способной к рождению детей. Менопауза может наступать в любом возрасте, начиная от 35 и кончая 55 годами, однако чаще всего она наступает в возрасте между 45 и 55 годами. При этом менструации могут постепенно ослабляться, несмотря на то что они проходят последовательно в положенные им сроки, или же интервалы между ними значительно удлиняются; также иногда отмечается внезапное и полное прекращение менструаций. Во время менопаузы в организме женщины происходят значительные изменения в соотношении половых гормонов, что иногда приводит к появлению у нее приливов крови к лицу, сердцебиения и сухости слизистой оболочки влагалища. У некоторых женщин также наблюдаются эмоциональные расстройства. Проявления всех этих симптомов могут быть значительно уменьшены с помощью применения гормонозаместительной терапии. — Менопаузный. Меноррагия, эпименоррагия, кровотечение дисфункциональное — аномально сильное кровотечение во время менструации, которое может сопровождаться или не сопровождаться увеличением длительности менструальной фазы. Меноррагия может быть связана с нарушением гормонального баланса в организме женщины, наличием у нее какого-либо воспалительного процесса или опухоли (например, фибромы) в полости таза и также обычно сопровождается развитием анемии. В некоторых случаях не удается установить никакой явной причины появления меноррагии. Менструация — циклическое отторжение утолщенного функционального слоя эндометрия и выделение крови из матки, происходящее ежемесячно у женщин детородного возраста (см. Менархе, Менопауза). Менструация представляет собой один из этапов менструального цикла, который наступает, если не произошло оплодотворения яйцеклетки. Обычно длительность менструации может колебаться от трех до семи дней. В случае ановуляторной менструации менструальное кровотечение проходит без предварительного выхода яйцеклетки из яичника. При викарной менструации у женщины наблюдаются циклически возникающие кровотечения, соответствующие срокам менструации, из слизистых оболочек носа, десен, желудка, полости рта, а не из матки. При ретроградной менструации у женщины отмечается обратный ток менструальной крови и фрагментов эндометрия через фаллопиевы трубы (см. Эндометриоз). См. также Аменорея, Дисменорея, Эпименорея, Гипоменорея, Меноррагия, Олигоменорея. Менструация нормальная — регулярный менструальный цикл. Это не всегда означает регулярное протекание овуляций. Мепакрин — лекарственное вещество; применяется для лечения различных инвазий, особенно при гиардиозе и тениозе; ранее широко использовалось для лечения малярии, однако в настоящее время заменено более безопасными лекарственными веществами. Назначается внутрь. К возможным побочным эффектам от его применения относятся: нарушения пищеварения, головная боль и окрашивание кожи в желтый цвет. Меперидин — см. Петидин. Мепробамат — слабый транквилизатор; применяется для снятия беспокойства и нервного напряжения. Назначается внутрь или в инъекциях; возможные побочные эффекты: нарушения пищеварения, головная боль и сонливость. Торговое название: экванил (Equanil). Мералгия парестезическая — чувство болезненного покалывания и онемения, испытываемое на наружной поверхности бедра при ущемлении латерального кожного нерва по ходу его между фиброзной и мышечной тканью бедра. Меркаптопурин — лекарственное вещество, угнетающее рост злокачественных клеток; назначается внутрь в основном для лечения некоторых видов лейкемии (см. Антиметаболит). Прием этого препарата обычно приводит к уменьшению числа лейкоцитов в крови; кроме того, у человека могут появиться различные нарушения пищеварения и образоваться изъязвления слизистой оболочки полости рта. Торговое название: пуринетол (Purinethol). Меркуриализм, гидраргирия — отравление ртутью. Металлическая ртуть хорошо поглощается кожей и стенками пищеварительного тракта, а ее пары легко могут проникать в организм человека через легкие. Симптомами острого отравления ртутью являются: рвота, сильные боли в животе, понос, сопровождающийся выделением крови с каловыми массами, и поражение почек, приводящее к нарушению процесса образования мочи. Для лечения отравления применяется димеркапрол. При хроническом отравлении ртутью у человека изъязвляется слизистая оболочка полости рта, выпадают зубы, отмечаются потеря аппетита, кишечные и почечные заболевания, сопровождающиеся развитием анемии и повышенной нервной раздражимости. Лечение хронического отравления связано с удалением человека из мест его возможного контакта с ртутью. Мерозоит — стадия жизненного цикла малярийного паразита (Plasmodium). Обычно мерозоиты образуются во время бесполого размножения шизонта (см. Шизогония). Появившиеся мерозоиты могут поражать молодые эритроциты или клетки печени; при этом у них продолжается бесполая стадия развития, во время которой образуется еще большее количество мерозоитов, которые, распространяясь по организму, разносят инфекцию. В других случаях мерозоиты поражают красные клетки крови и начинают половой цикл размножения с образованием мужских и женских половых клеток (см. Микрогаметоцит, Макрогаметоцит). Мерокринный, эккринный — данный термин используется для описания одного из видов секреции, при котором железистые клетки в процессе секреции не повреждаются. Мертворождение, мертворожденность — рождение ребенка, не проявляющего никаких признаков жизни (у него отсутствуют сердцебиение, дыхание и самостоятельные движения тела) на любом сроке после 24 недель беременности. В соответствии с принятым в 1992 г. Положением о мертворождаемости необходимо уведомлять обо всех случаях рождения мертвых детей соответствующие организации. Число таких родов, приходящихся на 1000 случаев родов (живых или мертвых детей), называется коэффициентом мертворождаемости. Плод, родившийся после 24-й недели беременности, считается жизнеспособным, а плод, появившийся на свет мертвым до этого срока, является результатом аборта или выкидыша. Однако иногда плод может выжить и в случае, если он родился на сроке до 24-й недели беременности; такая возможность появилась благодаря значительно возросшему в последнее время качеству выхаживания недоношенных младенцев. Мескалин — алкалоид, присутствующий в кактусах (сухой верхней части мексиканского кактуса вида Lophophora williamsii), который при проглатывании вызывает у человека опьянение и яркие цветные галлюцинации. Месмеризм — гипноз, в основе которого лежат идеи, предложенные в XVIII в. немецким врачом Францем Месмером, о пользе применения магнитов и некоторых других приспособлений в процессе воздействия на организм человека. Mесна — лекарственное вещество, вводимое больному внутривенно в инъекциях или вливаниях для предотвращения токсического влияния таких лекарственных веществ, как ифосфамид или циклофосфамид, на его мочевой пузырь. Месна связывается с токсическим метаболитом акролеином и выводится вместе с ним с мочой. Мессенджер вторичный — биологическая молекула, которая функционирует внутри клетки, инициируя ее отклик на сигналы, поступающие от химических посредников (например, гормонов); сами они не могут проникнуть внутрь клетки. Примерами таких вторичных мессенджеров являются трифосфат инозитола и циклический АМФ (аденозинамонофосфат). Местный — локальный; данный термин используется по отношению к способу применения какого-либо лекарственного вещества, которое наносится непосредственно на больное место (например, на поверхность кожи или глаза). Местранол — синтетический женский половой гормон (см. Эстроген); применяется в сочетании с прогестогеном для лечения симптомов менопаузы (см. Терапия гормонозаместительная), а также в качестве одной из составляющих в оральных контрацептивах. Торговые названия: менофаза (Menophase), норинил-1 (Norin_yl-1). Mет-, — мета приставка, обозначающая: 1) удаленный от чего-либо; расположенный позади чего-либо; 2) изменение; преобразование. Метаболизм — 1. Совокупность всех химических и физических изменений, происходящих в организме человека, которые способствуют его нормальному росту и развитию. Метаболизм включает процесс расщепления сложных органических соединений в организме, который проходит с выделением энергии, необходимой для протекания других процессов и реакций (см. Катаболизм), и процесс образования сложных веществ, являющихся основой большинства тканей и органов человеческого тела, из простых (см. Анаболизм). См. также Метаболизм базальный. 2. Совокупность биохимических изменений, проходящих в организме (например, метаболизм белков (белковый обмен)). — Метаболический. Метаболизм базальный, обмен основной — минимальное количество энергии, расходуемое человеческим организмом для поддержания собственной жизни в покое (эта энергия тратится на дыхание, кровообращение и переваривание пищи). Определяется количеством тепла, приходящимся на единицу массы человеческого тела в сутки, и представляет собой скорость основного обмена. В среднем для человека она составляет 4,2 кДж/кг/ч (1,2 Вт); для человека, весящего 70 кг, показатель основного обмена составляет примерно 7100 кДж/сутки (84 Вт). Скорость основного обмена определяется с помощью прямых измерений (человек помещается в дыхательную камеру и измеряется количество расходуемого им тепла) или (что выполняется чаще) косвенно, на основании дыхательного коэффициента. Данные измерения лучше всего проводить в период наименьшей физической активности человека, утром, в покое, натощак в условиях температурного комфорта. Различные факторы, такие как возраст, пол и особенно уровень функционирования щитовидной железы, могут заметно влиять на величину скорости основного обмена. Метаболит — вещество, образующееся в процессе метаболизма. Метаболиты являются либо продуктами реакций, проходящих во время метаболизма, либо составной частью пищи, которую употребляет человек. Метадон — эффективный анальгетик, обладающий наркотическими свойствами; назначается внутрь или в инъекциях для снятия сильной боли, а также в виде сиропа для подавления приступов кашля. Кроме того, метадон применяется для лечения героиновой зависимости. Возможные побочные эффекты от его применения: расстройства пищеварения, сонливость и головокружение; длительное применение метадона может привести к развитию зависимости от него. Торговое название: физептон (Physеptonе). Метамиелоцит — незрелый гранулоцит, имеющий почкообразное ядро (для сравнения: Миелоцит) и цитоплазму, в которой присутствуют нейтрофильные, эозинофильные или базофильные гранулы. Обычно метамиелоциты можно обнаружить в кроветворной ткани костного мозга, однако они могут исчезать из нее при различных заболеваниях, в том числе и при острых инфекциях. См. также Гранулопоэз. Метаморфопсия — состояние, при котором окружающие предметы кажутся человеку искаженными. Обычно метаморфопсия возникает в результате какого-либо заболевания сетчатки, при котором поражается ее наиболее чувствительная область — пятно. Метанефрос, почка вторичная — возникающий у зародыша человека на втором месяце эмбрионального развития (Ред.) орган выделения, из которого в дальнейшем формируется почка; сам метанефрос образуется из двух источников: метанефрогенной ткани и проксимального конца мочеточникового выроста протока первичной почки. До самого рождения ребенка он не функционирует, так как мочевина удаляется из организма плода, проходя через окружающую его плаценту. Метание в бреду — сильное беспокойство человека во время серьезного заболевания, сопровождающегося очень высокой температурой. Метанол — см. Спирт метиловый. Метаплазия — стойкая трансформация одного вида дифференцированной зрелой ткани в другую. Например, выстилающий бронхи столбчатый эпителий может трансформироваться в чешуйчатый (плоскоклеточная метаплазия); такое изменение строения клеток может свидетельствовать о начале развития в этом участке злокачественной опухоли. Миелоидная метаплазия представляет собой появление клеточных элементов костного мозга, обычно присутствующих только в красном костном мозге, в селезенке и печени. Этот вид метаплазии может развиваться в результате недостаточной функции костного мозга. Метараминол — симпатомиметическое лекарственное вещество, стимулирующее альфа-рецепторы; применяется для лечения сильного анафилактического шока (см. Анафилаксия). Назначается в инъекциях. Торговое название: арамин (Aramim). Метастазирование — появление новообразований в органах тела, удаленных от места возникновения первичной злокачественной опухоли. Метастазирование может проходить тремя путями: через кровеносное русло; через лимфатическую систему и через различные полости тела, например через брюшину. Высокозлокачественные опухоли имеют большую вероятность метастазирования. Опухоли могут распространяться по организму человека как с помощью какого-либо одного, так и с помощью всех вышеперечисленных путей, хотя считается, что метастазирование карцином обычно происходит через лимфатическую систему, а метастазирование сарком — через кровеносное русло. — Метастатический. Метастазировать — (применяется по отношению к злокачественной опухоли) распространяться с помощью образования метастазов. Метаталамус — часть промежуточного мозга, образованная парными медиальным и латеральным коленчатыми телами. Ядра коленчатых тел связаны с корковыми центрами зрительного и слухового анализаторов. Метатарзалгия — выраженная боль в плюсневых костях стопы. Повторное травмирование и деформация стопы являются наиболее частыми причинами возникновения метатарзалгии, для устранения которой иногда требуется ношение специальной ортопедической обуви. Метатарзальный — 1. Относящийся к костям стопы (к плюсне). 2. Любая из костей, образующих плюсну. Метафаза — вторая стадия митоза и каждого деления при мейозе, во время которой хромосомы выстраиваются в ряд по экватору веретена, а их центромеры прикрепляются к микротрубочкам веретена. Метафиз — участок длинной трубчатой кости, расположенный между эпифизом и диафизом. За счет метафиза кость растет в длину в детском и юношеском возрасте (Ред.). Метахромазия — 1. Свойство красителя окрашивать различные ткани и клетки в цвет, отличный от цвета самого красителя. 2. Изменение цвета, возникающее в различных элементах ткани при ее окрашивании красителем того же цвета. 3. Аномальное окрашивание ткани, которое возникает при использовании некоторых красителей. — Метахроматический. Метацентрический — данный термин применяется для описания хромосомы, в которой центромера располагается в центре хромосомы или поблизости от него. Метацеркарий — стадия развития зрелой личинки трематод, возникающая после церкария. Метацеркарии печеночных трематод находятся внутри тонких цист и могут существовать в них на различных этапах своего развития. Метгемальбумин — химическое соединение части пигмента гемоглобина (гема) с белком плазмы альбумином. Данное химическое соединение образуется в крови людей, страдающих анемией, при которой происходит разрушение эритроцитов, в результате чего освобождающийся гемоглобин попадает в плазму. В этом случае метгемальбумин может быть обнаружен как в крови, так и в моче больного. Метгемоглобин — вещество, образующееся в случае, когда присутствующие в пигменте крови гемоглобине атомы железа окисляются с образованием окиси железа (для сравнения: Оксигемоглобин). Метгемоглобин не может соединяться с молекулярным кислородом и, следовательно, не может переносить кислород в организме. Наличие метгемоглобина в крови (метгемоглобинемия) может быть связано с приемом кислородсодержащих лекарственных веществ или с каким-либо наследственным нарушением состава молекулы гемоглобина. Симптомами метгемоглобинемии являются повышенная утомляемость, головная боль, головокружение и цианоз. Метенамин — см. Гексамин. Метеоризм — 1. Изгнание газов или воздуха из желудка черед рот; отрыжка. 2. Чувство вздутия живота. 3. Газ, образующийся в кишечнике и состоящий частично из проглоченного воздуха и частично из газов, выделяющихся в результате бактериальной ферментации содержимого кишечника. В состав этого газа входят в основном водород, углекислый газ и метан в различных пропорциях. Неусвоенные организмом углеводы, которые попали в организм человека с пищей (например, в результате употребления в пищу бобов), вызывают усиление процесса газообразования. — Относящийся к метеоризму. 4. Вздутие живота вследствие скопления в нем воздуха или газов; при перкуссии живота четко различается характерный резонирующий звук (напоминающий барабанную дробь). Причиной развития метеоризма могут быть непроходимость кишечника, синдром раздражения кишечника или аэрофагия. Метизергид — лекарственное вещество; применяется для предотвращения сильных приступов мигрени и прекращения поноса, который наблюдается при различных опухолях пищеварительной системы. Назначается внутрь. Возможные побочные эффекты: нарушение процесса пищеварения, головокружение и сонливость. Торговое название: дезерил (Deseril). Метиклотиазид — диуретик, в состав которого входит тиазид; применяется для снижения повышенного кровяного давления (при гипертензии) и уменьшения отеков, возникающих при застойной сердечной недостаточности, циррозе печени, применении некоторых лекарственных веществ и дисфункции почек. Данное лекарственное вещество ограничивает реабсорбцию ионов натрия, хлора и, в меньшей степени, калия. Назначается внутрь. Возможные побочные эффекты: потеря аппетита, головокружение и гипотензия. Торговое название: эндурон (Enduron). Метиксен — лекарственное вещество, оказывающее на организм человека действие, подобное атропину; применяется для устранения тремора и других симптомов, наблюдающихся при паркинсонизме, а также для снятия спазмов гладкой мускулатуры при расстройствах пищеварения. Назначается внутрь; возможные побочные эффекты: сухость во рту, нарушение зрения, приливы крови к лицу и головокружение. Торговое название: тремонил (Tremonil). Метиламфетамин — лекарственное вещество, по своему действию и оказываемым побочным эффектам сходное с аналогичными веществами, в состав которых входит амфетамин. Назначается внутрь для лечения нарколепсии, паркинсонизма, некоторых депрессивных состояний, а также для снижения аппетита. Также может назначаться в инъекциях для лечения различных психических заболеваний, для нормализации кровяного давления во время проведения хирургических операций и для устранения симптомов, вызванных передозировкой каких-либо лекарственных веществ. Обычно метиламфетамин применяется только в больничных условиях. Метилдофа — лекарственное вещество, снижающее кровяное давление (см. Симпатолитическое лекарственное вещество). Назначается внутрь или в инъекциях. Иногда в первые дни лечения у больного может появиться сонливость. Торговые названия: альдомет (Aldomet), допамет (Dopamet), гидромет (Hydromet), медомет (Medomet). Метиленовый синий — краситель синего цвета; применяется для окрашивания бактериальных клеток в ходе их микроскопического изучения. Метиловый зеленый — основной краситель, используемый для окрашивания хроматина и — совместно с пиронином — для дифференцированного окрашивания молекул РНК и ДНК, которые соответственно приобретают красный и зеленый цвета. Метиловый фиолетовый, генциановый фиолетовый — краситель; применяется главным образом для окрашивания простейших. Метилпреднизолон — глюкокортикоидный лекарственный препарат (см. Кортикостероид); применяется для лечения различных воспалительных заболеваний, таких как ревматоидный артрит и ревматизм; для уменьшения аллергических проявлений и при недостаточности коры надпочечников. Назначается внутрь, внутривенно или внутримышечно в инъекциях. Возможные побочные эффекты: нарушение баланса электролитов в организме, мышечная слабость и вздутие живота. Торговые названия: депомедрон (Depo-Medrone), медрон (Medrone), солюмедрон (SoluMedrone). Метилтестостерон — синтетический мужской половой гормон (см. Андроген); назначается внутрь для лечения задержки полового развития у мужчин. Применяется для подавления лактации, лечения менструальных и менопаузных нарушений, а также рака груди у женщин. Побочные эффекты те же, что и у тестостерона. Метилтиоурацил — лекарственное вещество, подавляющее активность щитовидной железы; ранее применялось внутрь для уменьшения гиперактивности щитовидной железы (см. Тиреотоксикоз). Возможные побочные эффекты: кожные высыпания, расстройства пищеварения и головная боль; в настоящее время вместо метилтиоурацила обычно используется карбимазол. Метилфенидат — симпатомиметическое лекарственное вещество, оказывающее стимулирующее воздействие на центральную нервную систему. Применяется для лечения гиперкинетического синдрома у детей, для улучшения умственной деятельности у выздоравливающих больных и у пациентов с отдельными видами депрессии, а также для избавления человека от летаргии, которая может развиваться после приема некоторых лекарственных веществ. Назначается внутрь или в инъекциях; иногда могут возникать такие побочные эффекты, как нервозность и бессонница. Торговое название: риталин (Ritalin). Метилцеллюлоза — хорошо поглощающее воду соединение; применяется в качестве объемного слабительного средства для лечения запора, прекращения поноса, а также у пациентов с колостомией. Назначается внутрь и обычно не вызывает никаких побочных эффектов. Торговое название: целевак (Celevac). Метионин — основная аминокислота, в состав которой входит сера. См. также Аминокислота. Метирапон — лекарственное вещество, влияющее на выработку в организме человека гормона альдостерона; применяется для лечения синдрома Кушинга. Назначается внутрь. Возможные побочные эффекты: тошнота, рвота, снижение кровяного давления и аллергические реакции. Торговое название: метопирон (Metopirone). Метод Биллинга — метод планирования беременности (в настоящее время используется редко), заключающийся в ежедневном исследовании цервикальных слизистых выделений из влагалища, которые изменяют свою консистенцию и цвет на протяжении всего менструального цикла. С помощью специальной таблицы Биллинга можно определить (точность определения составляет 50 %), какой характер выделений бывает у женщины за шесть дней до наступления овуляции. Данный метод недостаточно надежен. Метод Брандта Андреуса — метод извлечения плаценты из матки. На матку оказывается давление в направлении снизу вверх через брюшную стенку, в то время как пуповина туго натягивается. Когда матка таким образом несколько приподнимается, плацента оказывается внутри шейки или в верхней части влагалища и легко извлекается с помощью давления, оказываемого на основание матки. Метод Гомори — метод окрашивания гистологических образцов, применяемый для выявления в них некоторых ферментов, особенно фосфатазы и липазы. Метод Доплера — диагностический метод, в котором определение консистенции и структуры тканей основано на изменении частоты ультразвуковых волн, исходящих из тканей различной плотности. Данный метод широко применяется для диагностики опухолей и других поражений мягких тканей, а также для исследования функции сердца (см. Эхокардиография) и кровотока в периферических артериях, так как в зависимости от изменения относительной скорости кровотока частота звуковых волн меняется. Последнее свойство также используется для исследования маточного и плацентарного кровообращения во время беременности в процессе пренатальной диагностики для определения состояния здоровья плода и его возможных аномалий. Полученные в ходе такого исследования результаты могут потребовать применения дальнейших (инвазивных) диагностических процедур, например хордоцентеза. Метод «звонка и подушки» — метод психологического лечения энуреза у детей и взрослых. Состояние, когда больной начинает мочиться, определяется с помощью специальной подушки и сочетается со звонком. Современные приборы имеют небольшой электронный датчик, который прикрепляется к телу человека под одеждой и в необходимых случаях производит громкий сигнал. Цель этого предупредительного сигнала — разбудить человека, чтобы он пошел в туалет. В результате, когда человек привыкает, он перестает мочиться в постель. Данный метод эффективен примерно в 80 % случаев. Метод кислотного травления — метод фиксации зубопротезных материалов из пластмассы на эмали зубов; применяется для удержания и изоляции зубной пломбы, удержания и фиксации ортодонтической назубной скобы, а также для фиксации изолирующего покрытия зубных фиссур и адгезивного мостовидного зубного протеза. Пористая поверхность создается путем применения примерно в течение одной минуты фосфорной кислоты. Метод Креде — метод извлечения плаценты из матки. Во время сокращения матки врач надавливает на брюшную стенку сверху вниз, по направлению к родовому каналу. Данный метод в настоящее время в значительной степени вытеснен методом Брандта Андреуса. Метод Ловсета — поворот и тракция туловища плода при его ягодичном предлежании во время родов для облегчения выведения ручек и плеч из родового отверстия. Метод ритмический — метод контрацепции, при котором половые сношения ограничиваются безопасным периодом в начале и конце менструального цикла. Безопасный период определяется либо исходя из длительности менструального цикла, либо по изменению температуры тела, которое наблюдается во время овуляции яйцеклетки. Третьим возможным индикатором безопасного периода (см. Метод Биллинга) является изменение вязкости слизи, выделяющейся из шейки матки, которое наблюдается во время овуляции. Точность использования данного метода зависит от того, насколько постоянно и регулярно у женщины проходят менструации; вероятность неудачи в этом случае несколько выше, чем при использовании механических средств контрацепции (при использовании данного метода на 100 женщин в год приходится примерно 25 беременностей). Метод Стамея — хирургическая операция, разработанная для лечения недержания мочи у женщин во время физической нагрузки; в этом случае шейка мочевого пузыря приподнимается или подтягивается и прикрепляется к передней брюшной стенке с помощью нерассасываемого шовного материала. См. также Кольпосуспензия. Метод Страссмана — хирургическая операция, выполняемая для коррекции двойной матки (см. Матка удвоенная). В настоящее время данная операция в значительной мере заменена методами, в которых используется гистероскоп. Метоклопрамид — лекарственное вещество, которое по своему действию является антагонистом дофамина; применяется для уменьшения тошноты, рвоты, диспепсии, изжоги и метеоризма. Назначается внутрь или в инъекциях; применение больших доз данного лекарственного вещества может вызвать у человека сонливость и мышечные спазмы. Торговые названия: гастромакс (Gastromax), максолон (Маxolon). Метоксамин — симпатомиметическое лекарственное вещество, вызывающее сужение кровеносных сосудов и, следовательно, способствующее повышению кровяного давления. Назначается в инъекциях для поддержания в норме кровяного давления во время проведения хирургических операций. Применение метоксамина в больших дозах может привести к развитию у человека головной боли и рвоты. Торговое название: вазоксин (Vasoxine). Метолазон — диуретик; применяется для лечения отеков и нормализации повышенного кровяного давления. Назначается внутрь. Возможные побочные эффекты: головная боль, потеря аппетита, нарушение процесса пищеварения, а также снижение содержания ионов калия в крови. Торговые названия: метеникс (Metenix), ксурет (Xuret). Метопролол — лекарственное вещество, контролирующее активность сердечной мышцы (см. Бета-блокатор); применяется для нормализации повышенного кровяного давления и для лечения стенокардии. Назначается внутрь. Возможные побочные эффекты: повышенная утомляемость и нарушения процесса пищеварения. Торговые названия: беталок (Betaloc), лопресор (Lopresor). Метосерпидин — лекарственное вещество, снижающее кровяное давление. Назначается внутрь. Наиболее характерные побочные эффекты: летаргия, сонливость и расстройства пищеварения. Торговое название: декасерпил (Decaserpyl). Метотрексат — лекарственное вещество, влияющее на рост клеток; применяется для лечения различных видов рака, в том числе лейкемии (см. Антиметаболит). Назначается внутрь или в инъекциях. Возможные побочные эффекты: воспаление полости рта, расстройства пищеварения, появление сыпи на коже и выпадение волос. Торговое название: макстрекс (Maxtrex). Метотримепразин — лекарственное вещество, обладающее транквилизирующими, седативными и болеутоляющими свойствами; применяется для снятия беспокойства, напряжения и возбуждения у больного, а также для уменьшения умеренной или сильной боли. Назначается внутрь или в инъекциях; основными побочными эффектами являются сонливость и слабость. Торговое название: нозинан (Nozinan). — метр — суффикс, обозначающий прибор для измерения какой-либо величины. Например: периметр (perimeter) — прибор для измерения поля зрения. Метр-, метро- — главная составляющая слов, относящихся к матке. Метр — единица длины в СИ, равная 39,37 дюйма. Ранее метр определялся как длина пути, проходимого светом в вакууме за время, равное 1/299 792 458 доли секунды. Обозначение: м. Метрит — воспаление матки. См. также Эндометрит, Миометрит. — метрия — суффикс, обозначающий измерение какого-либо параметра. Метрография, гистерография — рентгенография матки. Метронидазол — лекарственное вещество; применяется для лечения инфекций мочеполовой системы (таких как трихомониаз, амебиаз и гиардиоз) и острого язвенного гингивита. Назначается внутрь или в суппозиториях. Побочные эффекты встречаются редко, однако могут проявляться в виде расстройств пищеварения, сонливости и головной боли. Торговые названия: флагил (Flagyl), метрозол (Metrozol). Метропатия геморрагическая — нерегулярное эпизодическое маточное кровотечение, возникающее независимо от овуляции благодаря чрезмерной активности гормона эстрогена в организме женщины. Обычно геморрагическая метропатия сопровождается эндометриальной гиперплазией и образованием фолликулярных кист яичника. Метроррагия — маточное кровотечение, отличающееся от обычно протекающих у женщины менструаций. Метроррагия может свидетельствовать о наличии у женщины какого-либо серьезного заболевания, поэтому необходимо установить причину ее возникновения. Метформин — лекарственное вещество — бигуанид; применяется для снижения уровня сахара в организме человека и лечения инсулиннезависимого сахарного диабета. Назначается внутрь. Возможные побочные эффекты: потеря аппетита и незначительные нарушения процесса пищеварения. Торговое название: глюкофаг (Glucophage). См. также Вещество лекарственное оральное гипогликемическое. Мефлокин — лекарственное вещество; применяется для лечения малярии, устойчивой к другим лекарственным препаратам. Назначается внутрь; данный препарат не следует применять во время беременности, одновременно с бета-блокаторами, а также назначать пациентам, страдающим какими-либо психическими расстройствами. Торговое название: лариам (Lariam). Мефрусид — тиазидоподобный диуретик; применяется для снижения повышенного кровяного давления и выведения избытка жидкости из организма. Назначается внутрь. Возможные побочные эффекты: тошнота и расстройство пищеварения. Торговое название: байкарон (Ваусагоп). Механизм защитный — действующий в организме механизм, помогающий избежать или ограничить внешнее нежелательное воздействие. В данном словаре описывается множество защитных механизмов, в том числе: подавление, проецирование, реакция образования, сублимация и расщепление. В результате частичного нарушения действия этих механизмов у человека могут развиться, в частности, тик, заикание и фобия. Механорецептор — чувствительное нервное окончание, воспринимающее механические смещения, возникающие в результате растяжения или сжатия ткани, что приводит к генерации нервного импульса, который передается по чувствительному нерву (см. Рецептор). К механорецепторам относятся рецепторы прикосновения и проприоцепторы; рецепторы слуха и равновесия не относятся к механорецепторам (Ред.). Механотерапия — использование механического оборудования во время проведения физиотерапии для осуществления периодически повторяющихся движений в какой-либо части тела человека. Это способствует улучшению функции соответствующих мышц и суставов. Мече- — часть слова, обозначающая мечевидный отросток грудины. Например: относящийся к мечевидному отростку грудины и ребрам (xiphocostal). Мешок — сумка или карман. Например, эндолимфатический мешок (saccus cndolymphaticus) представляет собой небольшой карман, лежащий в толще твердой мозговой оболочки, соединенный с мешочком и маточкой внутреннего уха с помощью эндолимфатического протока. Мешок амниотический — наполненная жидкостью полость между эмбрионом и амнионом. Первоначально образует внутренний слой клеток бластоцисты; позднее расширяется, проходя над областью спины эмбриона и равномерно закрывая его со всех сторон. См. также Жидкость амниотическая. Мешок желточный — внезародышевый орган — мешок, образованный слоем мезодермы, выстланным эндодермой; расположен вблизи пупочной области развивающегося зародыша. Вначале тесно связан с эмбриональной кишкой, однако со временем эта связь сохраняется лишь в виде узкого желточного стебелька. На ранних стадиях эмбрионального развития желточный мешок принимает участие в питании и дыхании. До 7—8-й недели он функционирует в качестве кроветворного органа. В стенке желточного мешка формируются первичные половые клетки, которые мигрируют из него с кровью в зачатки половых желез. Мешок эндолимфатический — расширение на конце эндолимфатического протока. Мешочек сферический — меньший из двух мешочков преддверия внутреннего перепончатого лабиринта уха. Этот мешочек заполнен жидкостью (эндолимфой); внутри него расположено пятно, содержащее рецепторные волосковые клетки, улавливающие изменения положения тела и головы в пространстве. Ми-, мио- — часть слова, обозначающая мышцу. Миаз — инвазия какого-либо органа или ткани личинками двукрылых насекомых. Обычно эти насекомые (мухи) питаются начавшими разлагаться веществами животного и растительного происхождения; миаз поэтому обычно возникает исключительно в местах с плохими санитарно-гигиеническими условиями; в большинстве случаев заражение происходит в результате случайной небрежности человека. У человека болезнь могут вызывать различные виды этих насекомых. Так, представители рода Gastcrophilus, Hypo derma, Dermatobia и Cordylobia поражают кожу; представители рода Fannia поражают пищеварительный тракт и мочевую систему; представители рода Phonnia и Wohlfahrtia могут заражать открытые раны и язвы; представители рода Oestrus поражают глаза; а представители рода Cochliomyia проникают в носовые ходы и осуществляют их инвазию. Лечение наружного миаза заключается в уничтожении и удалении личинок с помощью антибиотиков путем обработки ран и имеющихся поражений кожи. Миалгия — боль в мышцах, возникающая при пальпации, в покое, пассивном или активном растяжении. — Миалгический. Мианзерин — лекарственное вещество; применяется для уменьшения средней или сильной депрессии и беспокойства у больного. Назначается внутрь. Побочные эффекты обычно выражены слабее, чем у других сильнодействующих антидепрессантов; основным побочным эффектом является сонливость. Торговые названия: больвидон (Bolvidon), норвал (Norval). Миастения тяжелая псевдопаралитическая — хроническое заболевание, проявляющееся в повышенной утомляемости человека и слабости отдельных групп мышц, которая уменьшается в покое или после приема лекарственных веществ, содержащих антихолинэстеразу. Усталость в этом случае является такой сильной, что иногда даже может наступить временный паралич отдельных мышц. Другими симптомами заболевания являются: опущение верхнего века (птоз), двоение зрения и дизартрия. Причины болезни до сих пор не установлены, однако известно, что она развивается в результате нарушения способности нейромедиатора ацетилхолина вызывать мышечные сокращения. Заболевание возникает преимущественно у подростков и молодежи (чаще у женщин), а также у взрослых людей после 40 лет. Медикаментозная терапия и хирургическое удаление тимуса способствуют уменьшению проявлений симптомов болезни. Тяжелобольным людям в процессе лечения может назначаться стероидная терапия или переливание плазмы крови. Мигрень — периодически возникающая пульсирующая головная боль, обычно поражающая какую-либо одну половину головы. Иногда незадолго до начала приступа у человека возникают его предвестники (аура), заключающиеся в зрительных нарушениях и (или) слабости конечностей; во время приступа они постепенно проходят. Приступ мигрени нередко может сопровождаться прострацией и рвотой. В настоящее время существуют эффективные способы предотвращения развития этих приступов, а такие лекарственные вещества, как суматриптан, могут использоваться для купирования острой боли во время приступа мигрени. Мидазолам — лекарственное вещество, в состав которого входит бензодиазепин; применяется в качестве седативного средства в ходе выполнения небольших операций, а также для премедикации и усиления действия общей анестезии. Назначается в инъекциях. Возможные побочные эффекты: головная боль, головокружение и затрудненное дыхание. Торговое название: гипновел (Hypnovel). Мидриаз — расширение зрачка, возникающее при поражении глазодвигательного или шейного симпатического нерва и параличе мышцы, суживающий зрачок, либо в результате спазма мышцы, расширяющей зрачок. Наиболее распространеннымипричинами длительного мидриаза являются лекарственная терапия (см. Средство мидриатическое) или травма глаза. См. также Циклоплегия. Для сравнения: Миоз. Миел-, миело- — часть слова, обозначающая: 1) спинной мозг; 2) костный мозг; 3) миелин. Миелин — вещество липидной природы, в состав которого входят белки и фосфолипиды; образует миелиновую оболочку аксонов ряда нейронов, называемых миелинизированными нервными волокнами (или мякотными нервными волокнами). Миелиновая оболочка образована шванновскими клетками и располагается по ходу нервного волокна. Эта оболочка прерывается через регулярные промежутки вдоль волокон перехватами Ранвье. По миелинизированным нервным волокнам импульсы проходят быстрее, чем по немиелинизированным. Миелинизация — процесс образования миелина вокруг аксонов ряда нервных волокон. Миелинизация нервных волокон центральной нервной системы обычно полностью завершается к концу второго года жизни ребенка. Миелит — 1. Воспалительное заболевание спинного мозга. Наиболее распространенным видом этого заболевания является поперечный миелит; часто он развивается одновременно с рассеянным склерозом, однако иногда может явиться одним из симптомов энцефаломиелита, если возникает как отдельный приступ. Воспаление в большей или меньшей степени поражает спинной мозг, приводя к утрате его нормальных функций, связанных с передачей нервных импульсов. Спинной мозг как бы разрубается пополам: у человека развивается паралич нижних конечностей и туловища ниже места наиболее выраженного поражения спинного мозга. 2. Воспаление костного мозга. См. Остеомиелит. Миелобласт — клетка-предшественница гранулоцита; миелобласт имеет большое ядро и малое количество цитоплазмы. Обычно миелобласты присутствуют в кроветворной ткани костного мозга, но могут обнаруживаться и в крови при некоторых заболеваниях; особенно заметным их появление в крови становится в случае развития у человека острой миелобластической лейкемии. См. также Гранулопоэз. — Миелобластический. Миелография — специальный метод рентгенологического исследования, позволяющий наблюдать спинномозговой канал; он заключается во введении рентгеноконтрастного вещества в подпаутинное пространство. Получаемое с помощью рентгеновских лучей изображение называется миелограммой. Миелография имеет важное значение для распознавания опухолей спинного мозга и других аномалий, приводящих к сдавлению спинного мозга или его корешков. Ранее в процессе выполнения миелографии использовались масляные красители, что иногда приводило к развитию у больных арахноидита. В настоящее время этого осложнения удается избежать с помощью использования водного раствора рентгеноконтрастного вещества. Миелоидный — 1. Относящийся к костному мозгу, происходящий из костного мозга, проявляющий характеристики костного мозга. 2. Напоминающий по внешнему виду миелоцит. 3. Относящийся к спинному мозгу. Миелома, миелома множественная, миеломатоз — злокачественное поражение клеток красного костного мозга, которое характеризуется следующими основными признаками: 1) наличием в костном мозге аномально большого количества плазматических клеток; 2) характерными изменениями костей, которые становятся заметными во время рентгенологического обследования и имеют вид небольших углублений; 3) наличие в сыворотке крови аномально большого количества гамма-глобулина, обычно иммуноглобулина (см. Парапротеин). В сыворотке крови или в моче больного также может присутствовать белок Бенс-Джонса. Больной жалуется на повышенную утомляемость, вызванную наличием у него анемии, и боли в костях; нередко могут развиваться патологические переломы костей конечностей. В процессе лечения обычно используются мелфалан или циклофосфамид, а также применяется локальная лучевая терапия. В ходе первичного лечения миеломы также проводится лучевая терапия всего тела. См. также Плазмоцитома. Миеломаляция — размягчение тканей спинного мозга, возникающее в результате нарушения его нормального кровоснабжения. Миеломатоз — см. Миелома. Миеломенингоцеле — см. Дефекты развития нервной трубки. Миелосупрессия — уменьшение количества образующихся в костном мозге клеток крови. Обычно миелосупрессия может развиться у человека после курса химиотерапии или в результате анемии, инфекции или какого-либо аномального кровотечения (см. Тромбоцитопения, Нейтропения). — Миелосупрессивный. Миелофиброз — хроническое прогрессирующее заболевание, характеризующееся наличием у человека фиброза костного мозга, что приводит к развитию у него анемии и появлению незрелых эритроцитов и лейкоцитов в циркулирующей крови. Другими проявлениями миелофиброза являются увеличение селезенки и наличие кроветворной (миелоидной) ткани в местах, где обычно ее не бывает (например, в печени и селезенке). Причины заболевания неизвестны. Миелоцеле — спинномозговая грыжа, при которой в грыжевом мешке содержатся частично покрытый оболочками измененный спинной мозг и цереброспинальная жидкость. Миелоцит — незрелая форма гранулоцита, имеющая округлое ядро (для сравнения: Метамиелоцит) и гранулы (нейтрофильные, эозинофильные или базофильные) в цитоплазме (для сравнения: Промиелоцит). Миелоциты обычно присутствуют в кроветворной ткани костного мозга, однако в случае развития у человека некоторых заболеваний (например, инфекций, инфильтратов костного мозга или ряда лейкемий) они могут быть обнаружены и в крови. См. также Гранулопоэз. Мизо- — часть слова, обозначающая ненависть по отношению к кому-либо или чему-либо. Например: мизопедия — ненависть по отношению к детям. Мизопростол — лекарственное вещество, в состав которого входит простагландин; применяется для предотвращения и лечения пептических язв, образовавшихся в результате приема нестероидных противовоспалительных лекарственных веществ. Назначается внутрь. Возможные побочные эффекты: тошнота, рвота, понос и боли в животе. Торговые названия: цитотек (Cytotec), напратек (Napratec). Мик-, мико-, мицето- — часть слова, обозначающая гриб. Микобактерии — род палочкообразных грамположительных аэробных бактерий, которые могут образовывать волокнистые, сильно разветвленные структуры. Некоторые виды этих бактерий являются патогенными для животных и человека: М. leprae (палочки Ганзена) вызывают у человека лепру; М. tuberculosis (палочки Коха) могут привести к развитию туберкулеза. Вид М. bovis вызывает туберкулез у крупного рогатого скота, но может также поражать легкие, суставы и кишечник человека. Микоз — любое заболевание, вызываемое грибками, включая актиномикоз, аспергиллез, криптококкоз, риноспоридиоз, дерматомикоз и споротрихоз. Микоз грибовидный — кожное заболевание, являющееся разновидностью ретикулеза; характеризуется появлением на коже бляшек, а позднее узелков с инфильтратами Т-лимфоцитов в них. Болезнь прогрессирует медленно и на ранней стадии может быть излечена с помощью местного применения кортикостероидов; на более поздних стадиях для выздоровления больного необходимо использовать фотохемотерапию и электроннолучевую терапию; химиотерапия обычно не позволяет добиться желаемого эффекта. Микология — наука о грибах. См. также Микробиология. — Миколог. Миконазол — лекарственное вещество; применяется для лечения грибковых инфекций, таких как дерматомикоз кожи головы, тела и стоп или кандидоз. Назначается внутривенно, внутривлагалищно или наружно; возможные побочные эффекты: зуд кожи, появление на коже сыпи, тошнота и рвота. Торговые названия: дактарин (Daktarin), гинодактарин (Gynodaktarin). Микоплазма — представитель группы мелких неподвижных микроорганизмов, клетки которых не имеют достаточной жесткой клеточной стенки и поэтому могут менять свою форму. Некоторые специалисты относят микоплазму к примитивным бактериям. В эту группу входят некоторые виды, которые могут вызывать сильные респираторные заболевания у крупного рогатого скота, овец и коз; один из них, Mycoplasma pneumoniae, может вызывать у человека атипичную пневмонию. В эту группу также входят микроорганизмы, сходные с возбудителями плевропневмонии. Микота — см. Кислота ундеценовая. Микр-, микро- —часть слова, обозначающая: 1) малый размер чего-либо; 2) одну миллионную часть. Микроангиопатия — поражение стенок мельчайших кровеносных сосудов. Может наблюдаться при различных заболеваниях, в том числе при сахарном диабете, поражениях соединительной ткани, инфекционных заболеваниях, а также при злокачественных новообразованиях. Некоторыми наиболее общими проявлениями микроангиопатии являются почечная недостаточность, гемолиз (повреждение красных клеток крови) и пурпура (подкожные кровоизлияния). Лечение микроангиопатии зависит от причины ее возникновения. Микроаневризма — небольшое локальное расширение капилляров сетчатки глаза, встречающееся у больных с диабетической ретинопатией. Распознать микроаневризму можно по наличию у человека небольшого красного пятнышка при обследовании внутренней поверхности глаза с помощью офтальмоскопа. Микроаэрофильный — данный термин используется для описания микроорганизмов, которые лучше растут и развиваются в среде с очень низким содержанием кислорода (т. е. ниже его содержания в атмосферном воздухе). Микроб — см. Микроорганизм. Микробиология — наука, изучающая микроорганизмы. Задача медицинской микробиологии заключается главным образом в том, чтобы правильно идентифицировать и быстро уничтожить болезнетворные микроорганизмы. — Микробиологический. — Микробиолог. Микроблефарон — аномально маленький размер век. Микроворсинка — один из множества микроскопических, напоминающих по внешнему виду волос, выростов — клетки, лишенные органелл, примерно 5 мкм длиной (1–2 мкм — Ред.) на поверхности эпителиальных клеток (см. Эпителии). Микроворсинки увеличивают площадь поверхности клетки. Множество микроворсинок можно различить также на поверхности абсорбирующих и секреторных клеток. Особенно много их на апикальной поверхности кишечных эпителиоцитов; они называются щеточной каемкой эпителиальной ткани. Микрогамета — подвижная жгутикообразная мужская половая клетка малярийного паразита (Plasmodium) и других одноклеточных животных (см. Простейшие). Микрогаметы во многом напоминают клетки сперматозоидов, имеющиеся у животных — представителей высших групп; по размеру они несколько меньше, чем женские половые клетки (см. Макрогамета). Микрогаметоцит — клетка, из которой после мейоза образуются 6–8 зрелых мужских половых клеток (микрогамет) малярийного паразита (см. Plasmodium). Микрогаметоциты можно обнаружить в крови человека, но их превращение в микрогаметы происходит исключительно в организме комаров. Микрогематокрит — определение количества эритроцитов, содержащихся в циркулирующем объеме крови. Это определение производится с помощью помещения образца крови пациента в тонкую пробирку и ее раскручивания в центрифуге до полного выпадения осадка. См. Общий объем эритроцитов. Микрогирия — дефект развития головного мозга, при котором его извилины являются очень маленькими, а в коре головного мозга отмечаются заметные структурные нарушения. Данный дефект развития мозга сопровождается выраженной задержкой физического и психического развития человека. Микроглия — один из двух основных видов глии (клетки, отличающиеся от нейронов центральной нервной системы), очищающий организм от всех ненужных ему веществ (см. Макрофаг). (Клетки микроглии не являются макрофагами. — Ред.) Для сравнения: Макроглия. Микроглоссия — аномально маленький язык. Микрогнатия — состояние, при котором одна из челюстей (обычно верхняя) имеет необычно маленький размер. Микрограмм — одна миллионная часть грамма. Обозначение: мкг. Микрограф, фотомикрограф — фотоснимок наблюдаемого через микроскоп изображения предмета. В случае электронного микрографа получается фотоснимок изображения предмета, наблюдаемого в электронный микроскоп, а в случае светового микрографа — в световой микроскоп. Микродактилия — необычно маленькие или короткие пальцы. Микродентия — необычно маленькие зубы. Микродискэктомия — хирургическое удаление всей или части пролабирующего межпозвоночного диска с помощью операционного микроскопа. Для этого через очень короткий разрез в тканях в образовавшееся пространство между позвонками вводятся очень тонкие инструменты. Данная операция выполняется с целью уменьшения давления на корешки спинномозговых нервов и спинной мозг, которое возникает за счет выпячивания студенистого ядра, и является одним из видов минимально инвазивной хирургии. Микродиссекция, микропрепаровка — процесс разделения мелких структур при их микроскопическом изучении. С помощью миниатюрных хирургических инструментов, например стеклянных скальпелей, выполняются различные перемещения механических соединений, благодаря чему уменьшается относительная неточность движений рук оператора во время осуществления им микродвижений. Таким образом обеспечивается возможность рассечения клеточных ядер и даже отдельных хромосом. См. также Микрохирургия. Микродуктэктомия — диагностическая операция на млечных протоках, выполняемая с целью выявления (или исключения) наличия у женщины опухоли. Микроманипуляция — выполняемая под микроскопом манипуляция с очень мелкими структурами, как, например, при микродиссекции или в микрохирургии. Микромелия — аномально маленький размер конечностей. Для сравнения: Макромелия. Микрометастаз — вторичная опухоль, которая не поддается диагностике при обычном клиническом обследовании или с помощью имеющихся в распоряжении диагностических тестов. Микрометр — 1. (Micrometer) — прибор для выполнения чрезвычайно точных измерений, связанных с определением длины или толщины; обычно его действие основано на движении намотанной на специальный винт нити, которое происходит по принципу верньера. 2. (Micrometre) — одна миллионная часть метра. Обозначение: мкм. Микроорганизм, микроб — любой организм, имеющий слишком малые размеры для того, чтобы его можно было различить невооруженным глазом. К микроорганизмам относятся бактерии, некоторые виды грибков, микоплазмы, простейшие, риккетсии и вирусы. Микропипетка — очень тонкая трубочка, из которой может вытекать (капать) небольшой объем жидкости. Микропипетки также используются для взятия небольших количеств жидкости из организма больного для обследования. С помощью микропипетки можно также добавлять или удалять какие-либо вещества из клеток, подвергающихся микроскопическому изучению. Микропсия — состояние, при котором окружающие предметы кажутся по размеру меньшими, чем они есть в действительности. Обычно микропсия развивается в связи с каким-либо заболеванием сетчатки глаза, при котором поражается его желтое пятно, однако иногда она может быть связана с параличом аккомодации. Микроскоп — прибор для получения сильно увеличенного изображения рассматриваемого предмета, который может быть настолько маленьким, что его невозможно бывает увидеть невооруженным глазом. Световые или оптические микроскопы используют в качестве источника излучения для рассмотрения образца световые лучи, а с помощью комбинации имеющихся в микроскопе линз можно получить его увеличенное изображение; обычно они представляют собой объектив и окуляр. См. такжеМикроскоп электронный, Микроскоп операционный, Ультрамикроскоп. — Микроскопический. — Микроскопия. Микроскоп операционный — бинокулярный микроскоп, часто применяющийся в микрохирургии. Операционное поле освещается с помощью специального источника света, расположенного внутри микроскопа; свет от него проходит через линзы объектива. Во многих моделях этих микроскопов объединены устройства для расщепления луча и второй набор окуляров; это позволяет ассистенту хирурга также следить за ходом операции. Микроскоп электронный — микроскоп, в котором для наблюдения в качестве источника излучения используется поток электронов. Разрешающая способность этого микроскопа (способность точно различать отдельные детали) в тысячу раз превышает разрешающую способность обычного светового микроскопа. Образцы должны исследоваться в вакууме, что требует специфических приемов подготовки к проведению исследования, а электроны обычно фокусируются на флуоресцирующем экране (при непосредственном наблюдении) или на фотопластинке (при фотографировании образцов или проведении электронной микрографии). Трансмиссионный электронный микроскоп применяется обычно для изучения тонких срезов тканей при большом увеличении. Сканирующий электронный микроскоп позволяет наблюдать поверхности различных изучаемых объектов с различным увеличением; его основным преимуществом является возможность очень хорошей фокусировки (и объемность изображения. — Ред.). Микроскопический — 1. Имеющий слишком маленькие размеры для того, чтобы быть различимым без использования микроскопа. 2. Имеющий отношение к микроскопу или используемый в нем. Микросома — небольшая частица, в состав которой входит эндоплазматический ретикулум, к которому прикрепляются рибосомы. Микросомы образуются при центрифугировании гомогенизированных клеток. — Микросомный. Микросонация — использование генерируемых внутри человеческого тела от чрезвычайно слабого источника (например, от конца иглы или введенной внутрь ткани капсулы) ультразвуковых волн. Данный метод используется для получения четкого изображения структуры соседних тканей. Является разновидностью ультрасонографии. Микротом — инструмент для отрезания очень тонких слоев какого-либо материала для их дальнейшего микроскопического изучения. Данный материал помещается в какую-либо подходящую для него среду, чаще всего в парафиновый воск. Обычно в качестве микротома используется стальной нож. Микрофилярия — подвижный зародыш некоторых нематод (см. Филярия). Тонкие нити микрофилярий (длиной 150–300 мкм) обычно можно обнаружить в циркулирующей крови или лимфе больного, зараженного филяриями, например рода Wuchereria. Там эти зародыши созревают и превращаются в личинки, которые способствуют распространению инфекции с помощью кровососущих насекомых (например, комаров). Микрофотография — 1. Фотоснимок микрообъекта, полученный с помощью микрофотосъемки. 2. В широком понимании — фотомикрограф. Микрохейлия — аномально маленький размер губ. Для сравнения: Макрохейлия. Микрохирургия — направление в хирургии, в котором оперативные вмешательства производятся с помощью операционных микроскопов с высокой степенью разрешения и миниатюрных хирургических инструментов (зажимов, ножниц, игл и т. д.). Применение методов микрохирургии позволяет выполнять ранее недоступные операции на глазах, внутреннем ухе, спинном и головном мозге (например, удалять опухоли или устранять церебральные аневризмы), пришивать ампутированные в результате травмы пальцы (позволяет соединять мельчайшие нервы и кровеносные сосуды), а также выполнять пластические операции после вазэктомии. Микроцефалия — чрезвычайно малый размер головы по сравнению с остальным туловищем; данное состояние является врожденным, причем головной мозг в этом случае остается недоразвитым. Для сравнения: Макроцефалия. Микроцит — аномально маленький эритроцит. См. также Микроцитоз. — Микроцитарный. Микроцитоз — наличие аномально маленьких по размеру эритроцитов (микроцитов) в крови. Микроцитоз является характерным признаком некоторых анемий (микроцитарных анемий), в том числе железодефицитных анемий; ряда гемоглобинопатий; анемий, возникающих при различных хронических инфекционных заболеваниях, и т. д. Микроэлектрод — чрезвычайно тонкая проволочка, используемая в качестве электрода для измерения электрической активности небольших участков ткани. Микроэлектроды также могут применяться для регистрации электрических изменений, которые возникают в мембранах нервных или мышечных клеток. Микроэлемент — элемент, который необходим организму в минимальной концентрации для его нормального роста и развития. К микроэлементам относятся: фтор (см. Соединения фтора), марганец, цинк, медь, йод, кобальт, селен, молибден, хром и кремний. Они могут являться кофакторами или составными частями сложных биологических молекул (например, кобальт присутствует в молекулах витамина В12). Микс-, миксо- — часть слова, обозначающая слизь. Микседема — 1. Сухая, плотная, воскового цвета опухоль кожи и подкожных тканей, встречающаяся у больных с пониженной активностью щитовидной железы (см. Гипотиреоидизм). 2. Клинический синдром, наблюдающийся у страдающих гипотиреоидизмом взрослых людей; основными его проявлениями являются: огрубение кожи, непереносимость холода, значительная прибавка в весе и замедление умственной деятельности. Все эти симптомы проходят после назначения больному тироксина. Миксовирус — представитель группы РНК-содержащих вирусов, которые могут вызывать грипп у животных и человека. К относящимся к этой группе парамиксовирусам относятся респираторно-синтициальный вирус, а также агенты, вызывающие корь, эпидемический паротит и парагрипп. Миксома — доброкачественная желатинообразная опухоль соединительной ткани. Миксома предсердия представляет собой опухоль сердца, обычно его левой половины; она развивается из межпредсердной перегородки. Симптомами образующейся миксомы являются: повышение температуры, повышенная утомляемость, боль в суставах, а также внезапная потеря сознания, вызванная нарушением кровообращения в организме. Миксома может быть ошибочно диагностирована как стеноз митрального клапана, так как она вызывает появление аналогичного шума в сердце. Лечение опухоли требует ее хирургического удаления. — Миксоматозный. Миксосаркома — саркома, в состав которой входит мукоидное вещество. Пока что остается неясным, является ли эта опухоль самостоятельным образованием или простым видоизменением других сарком, например липосаркомы или фибросаркомы. Миксофиброма — доброкачественная опухоль фиброзной ткани, содержащая миксоматозные элементы (см. Миксома) или претерпевшая в ходе своего развития мукоидную дегенерацию. Микстура — лекарственное вещество в смеси с сиропом; применяется обычно для лечения раздражающего горло кашля. Милиарный, просовидный — данный термин используется для описания мелких узелков или пятен на коже, которые по своему внешнему виду напоминают просо. Милиум, угри белые — появление на коже (особенно на коже лица) белых узелков. Эти узелки представляют собой крошечные кератиновые кисты диаметром не более 4 мм, которые образуются непосредственно под эпидермисом кожи. Белые угри нередко можно обнаружить вокруг носа у новорожденных младенцев; вскоре они проходят без какого-либо активного лечения. Милли- — часть слова, обозначающая одну тысячную часть чего-либо. Миллиампер — одна тысячная ампера. Обозначение: мА. Миллиграмм — одна тысячная грамма. Обозначение: мг. Миллилитр — одна тысячная доля литра. Обозначение: мл. См. Литр Миллиметр — одна тысячная метра. Обозначение: мм. Миллиметр ртутного столба — единица давления, в результате которого ртуть в столбике поднимается на 1 мм. 1 мм рт. ст. = = 133,3224 Па. Миндалина, тело миндалевидное — один из базальных ганглиев: округлое скопление серого вещества миндалевидной формы внутри каждого полушария большого мозга. Большая часть ее волокон соединена с органами обоняния, ряд нервных волокон также подходит к гипоталамусу; функции миндалины, очевидно, имеют отношение к настроению человека, его чувствам, инстинктам, а возможно, и к памяти о недавних событиях. Миндалина — скопление лимфоидной ткани, расположенное в области зева, корня языка и носоглотки. К ним относятся парные небные и трубные и непарные язычная и глоточная миндалины. Они защищают организм от различных инфекций. См. также Аденоиды (носоглоточная миндалина). Минералокортикоид — см. Кортикостероид. Миним — единица объема, используемая в фармации; один миним равен одной шестидесятой части жидкой драхмы. Минитрахеостомия — временная трахеостомия, выполняемая с помощью вводимой через кожу иглы или тонкой трубочки. Миноксидил — периферический вазодилататор; применяется для лечения повышенного артериального давления (гипертензии) в случае, если все другие лекарственные вещества не оказывают необходимого эффекта; назначается перорально вместе с диуретиками. Также может наноситься на кожу головы в виде лосьона для восстановления нормального роста волос. Возможные побочные эффекты: изменения на ЭКГ и быстро проходящие отеки. Торговое название: лонитен (Loniten), регаин (Rеgaine). Миноциклин — антибиотик, в состав которого входит тетрациклин; активен против многих бактерий и инфекций, вызванных наличием в организме человека риккетсий, при микоплазменной пневмонии и возвратной лихорадке. Назначается внутрь или во внутривенных инъекциях; возможные побочные эффекты включают: потерю аппетита, кожные высыпания и головокружение. Торговое название: миноцин (Minocin). Мио- — часть слова, обозначающая: 1) уменьшение или сокращение чего-либо; 2) рудиментарность, зачаточность. Миобласт — мышечная клетка, потенциально способная к развитию в мышечное волокно. — Миобластический. Миогемоглобин, миоглобин — присутствующий в мышечных клетках растворимый железосодержащий пигментный белок, который по своему химическому строению очень близок к гемоглобину. Подобно гемоглобину, он содержит гем, который обратимо связывается с кислородом, выполняя таким образом функции кислородного резервуара в мышечных волокнах. Миогемоглобинурия, миоглобинурия — наличие в моче пигмента миогемоглобина. Миоглобин — см. Миогемоглобин. Миоглобинурия — см. Миогемоглобинурия. Миограмма — запись, полученная в результате регистрации мышечных сокращений. См. Электромиография. Миограф — прибор для регистрации мышечных сокращений. См. Электромиография. Миодиния — боль в мышцах. Миоз — сужение зрачков. Обычно наблюдается при ярком свете, однако постоянный миоз иногда развивается в результате действия некоторых глазных капель, которые применяются для лечения глаукомы. См. также Средство миозическое. Для сравнения: Мидриаз. Миозин — самый распространенный белок в мышечных волокнах, благодаря наличию которого мышцы обладают важными свойствами эластичности и способности к сокращениям. Вместе с актином он является основной сократительной единицей мышц. См. Мышца поперечно-полосатая. Миозит — группа заболеваний, характеризующихся воспалением мышц и развитием в них дегенеративных изменений. Чаще всего из этих заболеваний встречается полимиозит; миозит может развиться одновременно с каким-либо поражающим организм человека общим коллагенозом, или (реже) причиной его развития может являться бактериальная или паразитарная инфекция. Миозит оссифицирующий — особая форма миозита, при которой наблюдаются отложение в соединительной ткани солей кальция и образование кости на месте гематомы; часто такая оссификация возникает после переломов, особенно вокруг локтевого сустава. Миокард — средний из трех слоев, образующих стенку сердца (см. также Эндокард, Эпикард). Миокард образует сердечную мышцу, которая несколько толще в желудочках, чем в предсердиях. Миокард сформирован кардиомиоцитами (Ред.). — Миокардиальный. Миокардит — острое или хроническое воспаление сердечной мышцы. Миокардит может протекать у человека отдельно или в сочетании с панкардитом (см. Эндомиокардит). Миокимия — заметное трепетание некоторых мышечных волокон при отсутствии любых других аномалий в организме человека. Данное состояние обычно является преходящим. См. также Фасцикуляция. Миоклонус — внезапный мышечный спазм, обычно развивающийся при поднимании и сгибании рук. Иногда миоклонические подергивания возникают у больных в промежутках между приступами идиопатической эпилепсии; кроме того, миоклонус является характерным симптомом некоторых прогрессирующих нервных заболеваний, сопровождающихся обширной дегенерацией нейронов мозга (включая губчатую энцефалопатию). Миоклонические подергивания иногда наблюдаются у совершенно здоровых людей при засыпании (ночной миоклонус). — Миоклонический. Миология — наука, изучающая структуру, функции и заболевания мышц. Миома — доброкачественная опухоль мышечной ткани. Миома может развиваться из гладких (см. Лечомиома) или из поперечнополосатых мышц (см. Рабдомиома). Миометрий — мышечная стенка матки, которая изнутри выстлана слоем эндометрия. Миометрий образован переплетающимися между собой пучками гладких миоцитов, в которых постоянно возникают небольшие самопроизвольные сокращения. Частота и амплитуда этих сокращений меняется в зависимости от наличия в организме таких гормонов, как эстроген, прогестерон и окситоцин, которые появляются в организме женщины в определенные моменты менструального цикла и во время беременности. Миометрит — воспаление мышечной стенки матки (миометрия). Миомэктомия — хирургическая операция, заключающаяся в удалении из мышечной стенки матки доброкачественной опухоли (фиброида). Миопатия — различное по происхождению системное поражение скелетных мышц с нарушением их трофики, уменьшением массы активных элементов и развитием мышечной атрофии. Миопатии обычно подразделяются на наследуемые (см. Дистрофия мышечная) и приобретенные. К приобретенным миопатиям относятся полимиозит и мышечные заболевания, осложненные какими-либо эндокринными нарушениями или развитием карциномы. Все они характеризуются заметным ослаблением и истощением мышц, которое может сопровождаться их болезненностью и напряженностью. Миопатия Дюшенна — см. Дистрофия мышечная. Миопия, близорукость — аномалия рефракции, при которой параллельные световые лучи фокусируются перед сетчаткой глаза, а не на ней. В этом случае человек видит удаленные предметы нечетко, расплывчато, так как не может с помощью аккомодации добиться их более четкого изображения. Миопия корректируется ношением специальных очков с вогнутыми линзами; в настоящее время она может быть устранена также и хирургическим путем (см. Лазер эксимерный, Кератомшеоз интрастромальный, Кератотомия радиальная). Для сравнения: Эмметропия, Гиперметропия. — Миопический. Миоплазма — см. Саркоплазма. Миопластика — пластическое восстановление мышцы, во время которого производится отделение какого-либо ее участка, который в дальнейшем используется для устранения различных дефектов ткани или расположенной вблизи мышцы деформации. Миосаркома — злокачественная опухоль мышечной ткани. См. также Лейомиосаркома, Рабдомиосаркома. Миотактический — относящийся к мышечному чувству. Миотом — часть сомита — участка мезодермы на ранней стадии эмбрионального развития, из которого в дальнейшем развиваются все скелетные мышцы. Развитие гладких мышц происходит из несегментированой мезодермы (см. Мезензима). См. также Сомит. Миотомия — рассечение или хирургическое разделение мышцы. Миотонический — относящийся к мышечному тонусу. Миотония — заболевание, поражающее скелетные мышцы и проявляющееся в аномально длительных их сокращениях. Больному трудно расслабить мышцы (например, разжать руку) после выполнения какого-либо усилия. Миотония является наследственным заболеванием, развивающимся обычно в младенчестве или раннем детстве (врожденная миотония); кроме того, она может являться одним из проявлений мышечной дистрофии (миотоническая дистрофия). Миотонус — 1. Тонический мышечный спазм. 2. Мышечный тонус. Миофибрилла — сократительная органелла, присутствующая в цитоплазме поперечно-полосатых мышечных волокон. Миофибриллы отличаются поперечной исчерченностью, в них можно обнаружить чередующиеся участки с разным коэффициентом светопреломления (темные анизотропные диски А чередуются со светлыми изотропными дисками J. — Ред.), что придает поперечно-полосатым мышцам характерный для них внешний вид. Миофибрилла — специальная сократительная органелла поперечно-полосатого мышечного волокна. Миофибриллы состоят из актиновых и миозиновых филаментов (Ред.). Миоцит — мышечная клетка. Миоэпителиоцит — клетка эпителиального происхождения, сходная с гладким миоцитом. Эти клетки окружают секреторные альвеолы экзокринных желез. В отростках миоэпителиальных клеток хорошо выражены сократительные филаменты (Ред.). Эти клетки играют важную роль в процессе выделения секретируемых веществ в протоки желез. Мирацидия — первый этап развития личинки паразитирующих трематод. Мирацидии выводятся из яиц, которые попадают в воду вместе с испражнениями «хозяина». К этому времени они уже имеют на теле реснички и могут передвигаться в воде до тех пор, пока не встретятся с улиткой. Во время такой встречи мирацидии внедряются в мягкие ткани улитки и там продолжают свое развитие в качестве спороцистов. Мирингит — воспаление барабанной перепонки. См. Отит (средний). Мирингопластика, тимпанопластика — хирургическая операция, заключающаяся в закрытии дефекта барабанной перепонки путем ее трансплантации. Миринготомия — выполнение разреза в барабанной перепонке для создания в ней искусственного отверстия либо для оттока инфицированной жидкости из среднего уха в случае острого среднего отита, либо для удаления жидкости в случае экссудативного отита и введения через этот разрез специальной трубки для дренирования среднего уха. Митоген — любое вещество, которое может стимулировать начало клеточного деления (процесс митоза). Митоз — вид клеточного деления, при котором из одной клетки образуются две генетически идентичные дочерние клетки. В ходе митоза происходит образование новых клеток в процессе роста организма и регенерации. Деление ядра (кариокинез) происходит на первых четырех стадиях (см. Профаза, Метафаза, Анафаза, Телофаза), после чего начинается деление цитоплазмы (цитокинез), в результате которого образуются две дочерние клетки. Для сравнения: Метоз. — Митотический. Митоксантрон — лекарственное вещество; применяется для лечения некоторых видов злокачественных опухолей, в том числе рака молочной железы, лейкемии и лимфом. Побочные эффекты обычно бывают выражены слабо. Торговое название: новантрон (Novantrone). Митомицин — антибиотик, подавляющий рост злокачественных клеток. Его применение может вызвать резкое угнетение функций костного мозга, однако он продолжает использоваться для лечения рака желудка и молочной железы. Торговое название: мутамицин (Mutamycin). Митохондрия, хондриосома — органелла, присутствующая в различном количестве в клеточной цитоплазме; митохондрии участвуют в процессах клеточного дыхания и преобразования энергии в клетках. В митохондриях образуются АТФ и ферменты, участвующие в процессах клеточного метаболизма; каждая митохондрия окружена двойной мембраной, внутренняя из них образует складчатую структуру, выступы которой (гребешки) обращены внутрь. — Митохондриальный. Митрамицин, пликамицин — антибиотик; предотвращает рост злокачественных клеток. Ранее применялся для лечения некоторых видов злокачественных новообразований, однако в настоящее время используется только для уменьшения повышенного содержания ионов кальция в крови. Возможные побочные эффекты: нарушения пищеварения, изъязвление полости рта, а также более серьезные побочные эффекты, такие как носовые кровотечения и кровавая рвота. Мифепристон — лекарственное вещество, стимулирующее аборт в течение первых 63 дней беременности путем блокирования действия прогестерона (основного гормона, ответственного за сохранение беременности). Если в течение 48 ч женщина принимает какое-либо второе лекарственное вещество, в состав которого входит простагландин (например, гемефрост), то с 95 %-ной вероятностью оплодотворенная яйцеклетка будет изгнана из матки. Мицелий — скопление тонких разветвленных нитей, которые составляют основу питательной и растущей части гриба. Мицелла — одна из микрочастиц, в которой находятся в кишечнике продукты переваривания жиров (т. е. жирные кислоты и моноглицериды); под действием желчных солей эти частицы дробятся на еще более мелкие. Жировые вещества в своей окончательной мелкодисперсной форме легче всасываются в тонкой кишке. Мицетома — хроническое воспаление тканей, вызванное наличием в них грибка. См. Стопа мадурская. Миэктомия — хирургическая операция, заключающаяся в удалении части мышцы. Мл — (сокращ.) миллилитр. См. Литр. Младенец — недавно родившийся ребенок, еще не способный к самостоятельному, независимому от матери существованию: ребенок в течение первого года жизни, особенно недоношенный или новорожденный. Согласно существующему закону (в Англии. — Ред.) данный термин может применяться по отношению к детям в возрасте до семи лет. МЛД — минимальная летальная доза: минимальное количество токсичного соединения, которое может вызвать у человека смерть. См. также LD50. Млечный — переносящий или секретирующий молоко (например, млечные протоки груди). Многофакторный — данный термин применяется для описания состояний, которые возникают в результате взаимодействия нескольких генетических факторов, обычно полигенов, с фактором (или факторами) окружающей среды. Многие заболевания (например, расщелина позвоночника или анэнцефалия) являются многофакторными. Могадон — см. Нитразепам. Модд — см. Число среднее. Модальность — разновидность ощущений, например обонятельных, слуховых, вкусовых или позволяющих человеку определять окружающую температуру. Существование разных видов ощущений связано не с различной структурой нервов, а с различиями в функционировании их рецепторов и центров коры больших полушарий головного мозга, которые получают от них информацию. Модекат — см. Флюфеназин. Моделирование — применяемый в модификации поведения метод, с помощью которого человек привыкает к какому-либо поведению, наблюдая за другим человеком. Совместно с побуждением он очень полезен для освоения человеком новых правил поведения. Модификатор биологического отклика — терапевтический агент (например, интерферон или интерлейкин), который воздействует на защитные механизмы человеческого организма, заставляя их противодействовать образованию злокачественных клеток. В норме эти вещества в небольших количествах вырабатываются в организме человека; сравнительно большие дозы их используются для лечения злокачественных новообразований. Модификация поведения — использование методов поведенческой психологии (см. Бихевиоризм) — особенно оперантного кондиционирования — для изменения поведения людей. Модификация поведения имеет более широкое применение по сравнению с поведенческой терапией, так как она может использоваться и в ситуациях, когда пациент совершенно здоров (например, в процессе обучения). См. также Привязывание, Побуждение. Модуретик — см. Амилорид. Мозаицизм — состояние, при котором не все клетки человека содержат одинаковые хромосомы и в его организме могут присутствовать две или более генетически различные клеточные популяции. Часто одна из таких клеточных популяций является нормальной, а в состав другой входит дефектная хромосома (например, при синдроме Дауна или синдроме Тернера). В этом случае у больных людей дефектная хромосома обычно бывает выражена не полностью. — Мозаичный. Мозг большой — самый крупный и наиболее развитый отдел головного мозга, образованный двумя полушариями большого мозга, отделенными друг от друга продольной щелью, в глубине которой залегает мозолистое тело, образованное многочисленными волокнами, соединяющими оба полушария. По периферии каждого полушария лежит слой серого вещества, кора головного мозга, под которым находится белое вещество, содержащее базальные ганглии. Внутри каждого полушария находится серповидная, заполненная жидкостью полость (боковой желудочек), соединяющаяся с полостью третьего желудочка через межжелудочковое отверстие. Большой мозг отвечает за инициацию и координацию всех сознательных действий человека, а также контролирует функции низших отделов нервной системы. Кора головного мозга отвечает за совершение человеком разумных действий. — Церебральный. Мозг головной — часть центральной нервной системы; расположен в полости черепа; переходит в спинной мозг. В среднем мозг взрослого человека весит 1400 г (примерно 2 % от общей массы тела); Головной мозг покрыт тремя оболочками, образованными соединительной тканью (менинги). Головной мозг состоит из следующих отделов: ромбовидный мозг, в состав которого входят продолговатый и задний мозг (последний включает варолиев мост и мозжечок); средний мозг и передний мозг, подразделяющийся на большой (конечный) и промежуточный мозг (включая таламус и гипоталамус). Анатомическое название: encephalon. Мозг задний — отдел мозга, в состав которого входят мост и мозжечок; располагается над продолговатым мозгом. См. Мозг головной. Мозг костный — ткань, расположенная в костномозговых полостях. У новорожденного ребенка этиполости целиком заполнены кроветворной миелоидной тканью (красный костный мозг), однако впоследствии с возрастом красный костный мозг в диафизах трубчатых костей конечностей заменяется жировой тканью (желтый костный мозг). Красный костный мозг у взрослого человека располагается в ячейках губчатого вещества плоских и губчатых костей, эпифизов длинных трубчатых костей. Исследование костного мозга проводится путем его аспирации с помощью толстой иглы или путем трефинационной биопсии. См. также Гемопоэз. Мозг обонятельный — структуры головного мозга, которые на ранних этапах эволюции были связаны с обонятельным анализатором. В состав обонятельного мозга входят обонятельная луковица, обонятельный тракт, обонятельный треугольник, переднее продырявленное вещество, сводчатая извилина, гиппокамп, зубчатая извилина (Ред.). В настоящее время эти отделы мозга относятся к лимбической системе. Мозг передний — передний отдел головного мозга, в состав которого входят конечный мозг (два полушария большого мозга) и промежуточный. Мозг продолговатый — является продолжением спинного мозга, образуя самый нижний отдел ствола мозга. Продолговатый мозг образован пучками восходящих и нисходящих нервных волокон и скоплениями серого вещества, которые образуют специальные центры дыхания и кровообращения, ядра IX–XII пар черепных нервов, олив и ретикулярную формацию. Мозг промежуточный — отдел переднего мозга, в состав которого входят эпиталамус, таламус, гипоталамус, метаталамус и субталамус. Таламус является подкорковым центром всех видов общей чувствительности. Гипоталамус управляет функцией внутренней среды организма и обеспечивает гомеостаз. Мозг ромбовидный — часть головного мозга, в состав которой входят мозжечок, мост и продолговатый мозг. В составе моста и продолговатого мозга находятся ядра многих черепных нервов, которые отходят от их поверхностей, а также ретикулярная формация. Полостью ромбовидного мозга является четвертый желудочек мозга, который книзу продолжается в центральный канал спинного мозга. Мозг спинной — часть центральной нервной системы, заключенная в позвоночном канале; состоит из нервных клеток и пучков нервных волокон и переходит в головной мозг. Спинной мозг образован расположенным в центре серым веществом (в котором различают симметричные передние и задние столбы, а на участке от I грудного до II поясничного сегментов — и боковые столбы. — Ред.), окруженным со всех сторон белым веществом. Он окружен тремя оболочками мозга и проходит от расположенного внутри черепа продолговатого мозга до уровня второго поясничного позвонка, где оканчивается мозговым конусом. От спинного мозга отходит 31 пара спинномозговых нервов. Мозг средний — небольшой участок ствола мозга, за исключением моста и мозгового вещества, который соединяет передний мозг с ромбовидным мозгом. Включает ножки мозга и крышу среднего мозга (Ред.). Мозговидный — напоминающий мозговую ткань: данный термин применяется по отношению к некоторым опухолям, например мозговидной карциноме молочной железы. Мозжечок — самая большая часть заднего отдела головного мозга; располагается в задней черепной ямке кзади от варолиева моста и продолговатого мозга под затылочными долями большого мозга. Как и в большом мозге, в мозжечке снаружи расположено серое вещество (кора), а внутри — белое вещество. Три пары широких пучков нервных волокон — нижняя, средняя и верхняя ножки мозга — соединяют мозжечок, соответственно, с продолговатым мозгом, варолиевым мостом и средним мозгом. Мозжечок состоит из двух полушарий и непарной срединной части — червя мозжечка. Поверхность полушарий и червя разделяют поперечные параллельные борозды, между которыми залегают узкие длинные листки мозжечка. В толще белого вещества располагаются четыре пары ядер (зубчатое, пробковидное, шаровидное и ядро шатра). Основными функциями мозжечка являются: поддержание позы и мышечного тонуса, сохранение равновесия и синхронизация деятельности различных групп мышц на подсознательном уровне путем преобразования мышечных сокращений в плавные, хорошо скоординированные движения. Несмотря на это, мозжечок не инициирует выполняемые движения и не участвует в сознательном восприятии человеком его чувств или в развитии у него интеллектуальных способностей. — Мозжечковый. Мозжечок новый, неоцеребеллум — отделы мозжечка, включающие его полушария и участки червя, которые расположены каудальнее первой борозды. С эволюционной точки зрения неоцеребеллум является новейшим участком, который возникает у млекопитающих. (К неоцеребеллуму поступает афферентная импульсация от обширных областей коры больших полушарий по трактам, переключающимся в ядрах варолиева моста.) Мозоль — гиперкератоз на месте длительного давления или в результате плоскостопия и неправильно подобранной обуви. На коже пяточных областей и ладоней мозоли образуются чаще всего, причем они могут быть крайне болезненными, если занимают большую площадь поверхности кожи. Потертость является одним из видов мозолей. Мозоль костная — 1. Структура, образующаяся в ходе регенерации костной ткани после нарушения целости кости. Вначале образуется соединительнотканная провизорная мозоль, к концу 1-й недели образуется остеоидная ткань, которая превращается либо непосредственно в костную, либо вначале в хрящевую, а затем в костную. Мозоль возникает из костеобразующих клеток надкостницы и эндоста. Образование костной мозоли играет важную роль в процессе срастания поврежденной кости. Костная мозоль, представляющая на рентгенограмме слегка затемненную область, в конце концов кальцифицируется и моделируется. 2. См. Мозоль. Моклобемид — антидепрессант, обратимо угнетающий действие фермента моноамина оксидазы. Отрицательное воздействие на существование МАО-ингибиторов, проявляющееся в сильных аллергических реакциях на сыр и другие тираминсодержащис продукты питания, употребляемые в пищу больным, принимающим моклобемид, маловероятно. Мокрота — откашливаемое из дыхательных путей вещество. Это выделяемый при отхаркивании трахеобронхиальный секрет, к которому в носовой части глотки и полости рта примешивается слюна и секрет слизистой оболочки придаточных пазух носа. Некоторые признаки мокроты (такие, как цвет, консистенция, количество, запах и наличие каких-либо иных твердых веществ внутри ее) часто могут являться важной информацией для врача, позволяя ему диагностировать заболевания дыхательных путей. Исследование мокроты на содержание в ней микроорганизмов и аномальных клеток может дать врачу дополнительную информацию. Моксибустион — вид излюбленного в Японии лечения, в ходе которого мякоть подсолнуха или листья растения Artemisia moxa приклеиваются к коже и поджигаются. Исходящее от тлеющих листьев тепло способствует уменьшению раздражения и широко используется в процессе лечения различных заболеваний. Моллюск контагиозный — распространенное кожное заболевание, особенно часто встречающееся у детей. Характеризуется появлением на коже папул диаметром менее 5 мм, каждая из которых имеет в центре небольшое углубление; болезнь вызывается поксвирусом и передается от человека человеку при непосредственном контакте. Безо всякого лечения эти папулы проходят в течение 6–9 месяцев. Молозиво — первичные выделения из молочных желез, возникающие сразу после, а иногда и перед родами до того, как у женщины начинает вырабатываться настоящее молоко для кормления ребенка. Молозиво представляет собой относительно прозрачную жидкость, содержащую сыворотку крови, белые кровяные клетки (лейкоциты) и защитные антитела. Молоко — секретируемая молочными железами женщин и самок млекопитающих белая жидкость, которая является единственным источником пищи для их потомства в течение некоторого времени после рождения. Молоко является ценным продуктом, так как в нем содержится большинство необходимых для жизни питательных веществ (белки, углеводы, жиры, минеральные вещества и витамины). Состав молока может сильно изменяться у представителей различных видов млекопитающих. Так, коровье молоко содержит практически все основные питательные вещества, однако витамины С и D присутствуют в нем в очень малом количестве. В женском молоке содержится больше сахара (лактозы) и меньше белков, чем в коровьем молоке. Молоточек — (в анатомии) напоминающая молоточек кость среднего уха, которая соединяется с наковальней и прикрепляется к барабанной перепонке. См. Косточка. Молоточек перкуссионный, плексор — небольшой молочек, который применяется для исследования нервных рефлексов, а также используется при перкуссии. Молочница — см. Кандидоз. Моль — единица количества вещества в системе СИ, равная такому его количеству, в котором содержится столько же основных структурных элементов этого вещества, сколько атомов содержится в 0,012 г углерода. В качестве основных структурных элементов могут выступать атомы, молекулы, ионы, электроны и т. д. или какие-либо их специфические группы. Один моль любого соединения имеет массу, равную его молекулярной массе, выраженной в граммах. Обозначение: моль. Моляр — шестые, седьмые и восьмые зубы постоянного зубного ряда с каждой стороны обеих челюстей (см. также Зуб мудрости). В молочном ряду зубов моляры — это четвертые и пятые зубы с каждой стороны обеих челюстей. Молярность — концентрация раствора, выраженная через массу (в граммах) растворенного вещества, содержащуюся в литре раствора, в отношении к его молекулярной массе (по-другому молярность — это число молей, содержащееся в одном литре раствора). Обозначается молярность как 0,1 М, 1 М, Мон-, моно- — часть слова, обозначающая что-либо в единственном числе, единичное или уединенное. Монилиоз — устаревшее название кандидоза. Моноамин оксидаза (МАО) — фермент, катализирующий окисление большого количества различных моноаминов, в том числе адреналина, норадреналина и серотонина. Моноамин оксидазы присутствует в большинстве тканей живого организма, особенно в печени и нервной системе. Поэтому для лечения депрессии широко применяются лекарственные вещества, которые угнетают активность этого фермента (см. МАО-ингибитор). Моноартрит — см. Артрит. Монобласт — самая ранняя идентифицируемая клетка, из которой образуется моноцит (клетка — предшественник моноцита). Монобласт, вероятно, можно считать идентичным миелобласту; он созревает, минуя промежуточную стадию (промоноцит). Обычно монобласты присутствуют в кроветворной ткани красного костного мозга, однако при наличии у человека некоторых заболеваний могут появляться и в крови; особенно заметно их присутствие в крови при наличии у человека острой монобластической лейкемии. Монодактилизм — наличие только по одному пальцу на руках и ногах и врожденное отсутствие всех остальных пальцев. Монойодотирозин — йодсодержащее вещество, секретируемое щитовидной железой в процессе выработки в ней гормонов. Монокулярный — относящийся к одному глазу, поражающий только один глаз. Для сравнения: Бинокулярный. Мономания — навязчивая или чрезмерная увлеченность одной идеей или субъектом. См. также Паранойя. Мононеврит — заболевание, при котором поражается какой-либо один периферический нерв. Сдавление нерва или нарушение его кровоснабжения являются наиболее часто встречающимися причинами развития мононеврита. Множественный мононеврит представляет собой воспаление нескольких отдельных нервов в разных частях тела. Для сравнения: Полиневропатия. Мононуклеоз — наличие аномально большого количества моноцитов в циркулирующей крови. См. Ангина лимфоидно-клеточная (моноцитарная) (мононуклеоз инфекционный). Мононуклеоз инфекционный — см. Ангина лимфоидно-клеточная (моноцитарная). Моноплегия — паралич одной конечности. — Моноплегический. Моноплоидный — см. Гаплоидный. Монорхизм — отсутствие одного яичка. Обычно монорхизм бывает связан с неполным опусканием яичка в мошонку перед рождением ребенка. Данный термин иногда применяется также в случае, если одно яичко было удалено хирургически или повреждено в результате травмы или какого-либо заболевания. Если имеющееся у мужчины одно яичко является совершенно нормальным, то никаких отрицательных последствий от отсутствия второго яичка обычно не возникает. Моносахарид — простой сахар, имеющий общую формулу (СН2О)n. Моносахариды могут иметь от трех до девяти атомов углерода, однако чаще всего количество этих атомов бывает равно пяти или шести. Моносахариды классифицируются в соответствии с числом имеющихся в них атомов углерода. Так, триозы имеют три углеродных атома, тетрозы — четыре, пентозы — пять и гексозы — шесть. Одним из самых распространенных моносахаридов является глюкоза (она принадлежит к классу гексоз). Моносомия — отсутствие одной хромосомы в нормальном (диплоидном) наборе хромосом. Для сравнения: Трисомия. — Моносомический. Монофилетический — данный термин используется для описания людей, животных и т. д., имеющих единое происхождение (из одной линии предшественников). Для сравнения: Полифилетический. Монофобия — панический страх нахождения в одиночестве. Монохромат — человек, у которого полностью отсутствует цветовое восприятие. Существуют два типа таких людей. У палочковых монохроматов полностью поражены колбочки сетчатки глаза: у этих людей бывает резко снижена острота зрения, и они не могут различать цвета окружающих их предметов. У колбочковых монохроматов острота зрения соответствует норме; колбочки сетчатки глаза у этих людей могут нормально реагировать на свет, однако эти люди совершенно не могут различать цвета окружающих их предметов. В данном случае дефект зрения может быть связан не с каким-либо поражением колбочек, а с нарушенной интеграцией нервных импульсов во время их прохождения из колбочек в головной мозг. Оба типа нарушения цветового восприятия чаще всего являются наследственными. Моноцит — один из представителей лейкоцитов (агранулоцит. — Ред.), диаметр которого составляет 16–20 мкм; моноциты имеют почкообразное ядро и голубоватую цитоплазму (такой цвет она приобретает после ее обработки красителем Романовского); в ней присутствуют мелкие азурофильные гранулы. Функции моноцитов заключаются в устранении из организма чужеродных частиц, таких как бактерий и омертвевшие ткани (фагоцитоз). Обычно в норме в одном литре крови содержится 0,2–0,8 х 109 моноцитов. — Моноцитарный. Моноцитоз — увеличение числа моноцитов в крови. Может наблюдаться при различных заболеваниях, в том числе при некоторых видах лейкемий (моноцитарных лейкемий) и инфекциях, вызванных отдельными бактериями и простейшими. Моргание — открывание и закрывание глазных век, при котором передняя часть глазного яблока равномерно смачивается слезой. Моргательный рефлекс может быть искусственно вызван при резком приближении предмета к глазам; при этом веки непроизвольно закрываются, чтобы обеспечить защиту глазу. Морицизин — лекарственное вещество; назначается внутрь для лечения угрожающих жизни состояний нарушения сердечного ритма (аритмии). Возможные побочные эффекты: усиление аритмии и развитие сердечной недостаточности; поэтому препарат применяется только в случаях, когда развитие этих побочных эффектов считается оправданным. Морула — ранняя стадия эмбрионального развития, возникающая в результате деления оплодотворенной яйцеклетки. На этой стадии эмбрион представляет собой скопление (наподобие ягоды тутового дерева. — Ред.) клеток; морула является промежуточной стадией между зиготой и бластоцистой. Морфин — сильный анальгетик и наркотик; применяется главным образом для уменьшения непроходящей сильной боли. Назначается внутрь или в инъекциях; возможные побочные эффекты: потеря аппетита, тошнота, запор и спутанность сознания. Морфин может вызывать чувство эйфории; у больного также может быстро развиться толерантность к этому лекарственному веществу и зависимость от него. — морфный — часть слова, обозначающая форму или структуру (какого-либо специфического вида). Морфо- — часть слова, обозначающая форму или структуру чего-либо. Морфогенез — дифференцирование клеток и тканей, в результате которого определяется форма и структура различных органов и частей тела. Морфология — см. Анатомия. Москит — небольшое двукрылое кровососущее насекомое, принадлежащее к большому отряду Diptera (двукрылых насекомых). У этих насекомых имеется длинный хоботок, с помощью которого они могут прокалывать кожу и высасывать кровь. Самки москитов являются переносчиками паразитов, которые могут вызвать у человека ряд тяжелых инфекционных заболеваний (например, малярию). См. Anopheles, Aedes, Culex. Москит песчаный — мелкий, покрытый ворсинками москит, принадлежащий к широко распространенному роду Phlebotomus. Взрослые особи редко бывают более 3 мм длиной; они обладают длинными тонкими лапками. Самки некоторых видов этих москитов являются кровососущими насекомыми, переносящими различные заболевания, включая лейшманиоз, москитную лихорадку и бартонеллез. Мост — 1. См. Мост варолиев. 2. Любой участок, соединяющий две части какого-либо органа. Мост варолиев, мост — часть ствола мозга (структура заднего мозга. — Ред.), в виде поперечного утолщенного валика. Задняя поверхность, покрытая мозжечком, участвует в образовании ромбовидной ямки, передняя граничит с продолговатым мозгом внизу и ножками мозга вверху (Ред.). Внутри варолиева моста проходит множество проводящих путей, связывающих кору головного мозга со спинным мозгом и с корой полушарий мозжечка; кроме того, внутри него находится несколько ядер серого вещества (V, VI, VII, VIII пара черепных нервов, ретикулярная формация. — Ред.). От его передней поверхности отходят тройничные нервы. Моча — выводимая почками из организма жидкость, которая содержит большое количество продуктов его жизнедеятельности. С мочой из организма удаляются конечные продукты азотистого обмена: мочевина, мочевая кислота и креатинин. Важной составляющей мочи является также хлорид натрия. В моче присутствуют следы свыше 100 различных веществ. Для облегчения диагностики различных заболеваний обычно производится биохимический анализ мочи (например, повышенное содержание сахара в моче свидетельствует о наличии у больного сахарного диабета, а повышенное содержание кетоновых тел — о наличии у него кетонурии); иммунологический анализ мочи является основой большинства тестов на наличие у женщины беременности. Мочевина — основной продукт распада в процессе метаболизма белков. Мочевина является той химической формой, в которой ненужный организму азот удаляется с мочой. Мочевина образуется в печени из аммиака и углекислого газа при участии ферментов, являясь конечным продуктом ряда реакций (так называемого цикла мочевины). Накопление мочевины и других азотсодержащих соединений в крови вследствие почечной недостаточности приводит к развитию уремии. Мочеиспускание — периодическое опорожнение мочевого пузыря, при котором моча выводится через уретру. Растяжение стенки мочевого пузыря мочой приводит к возбуждению рецепторов, которое вызывает активацию парасимпатических нейронов, иннервирующих детрузор (мышцу, изгоняющую мочу). Ее сокращение с одновременным расслаблением произвольного наружного сфинктера мочеиспускательного канала приводит к опорожнению мочевого пузыря (Ред.). Мочеточник — парная цилиндрическая трубочка длиной 25–30 см, по которым моча поступает из почечных лоханок в мочевой пузырь. Сокращения гладких мышц стенки мочеточников, которые располагаются между наружной адвентициальной и внутренней слизистой оболочкой, способствуют продвижению мочи в мочевой пузырь. — Мочеточниковый. Мошонка — отвисающий книзу кожнофасциальный мешок, в котором находятся яички и их придатки (вне брюшной полости). Ее функции заключаются в обеспечении нормального образования и хранения сперматозоидов, так как данный процесс протекает при более низкой температуре, чем температура брюшной полости. Регуляция температуры осуществляется за счет сокращения или расслабления мышц мошонки. — Скротальный. Муко- — часть слова, обозначающая: 1. Слизь. 2. Слизистую оболочку. Муковисцидоз — см. Дегенерация фиброзно-кистозная. Мукополисахарид — представитель группы сложных углеводов, являющийся главной структурной составляющей соединительной ткани. Молекулы мукополисахаридов обычно образуются из двух повторяющихся сахарных групп, одна из которых является аминосахаром. Одним из примеров мукополисахарида является образующийся в хрящевой ткани хондроитин. Мукополисахаридоз — группа наследственных болезней соединительной ткани, обусловленных нарушением обмена углеводов, называемых гликозаминогликанами или мукополисахаридами. К этим заболеваниям относятся липохондродистрофия, множественный дизостоз, гаргоилизм и др. Мукопротеид, мукоид — представитель группы сложных белков, присутствующий в глобулиновой фракции плазмы крови. Мукопротеиды представляют собой глобулины, в которых присутствует углеводная группа (аминосахар). Они во многом сходны с гликопротеинами, однако в них содержится большее количество углевода. Мукоцеле — слизистая киста. Она может развиться, например, в желчном пузыре в случае нарушения проходимости его протока, что приводит к задержке слизи в желчном пузыре и расширению его полости. Мукоцеле мягких тканей развивается из слюнной железы в случае нарушения проходимости или разрыва ее протока. Мультисистемный — данный термин применяется для описания заболеваний, при которых поражаются многие органы и системы человеческого тела. Мумификация — 1. Высыхание трупа или мертвой ткани с ее последующим превращением в твердую сморщенную массу (главным образом за счет обезвоживания) при отсутствии условий для гниения. 2. В стоматологии — наложение фиксатора на пульпу зуба для предотвращения ее распада. Мустин, аналог горчичного газа (иприта) азотный — лекарственное вещество, применяемое для лечения различных видов злокачественных опухолей, в том числе болезни Ходжкина и некоторых видов лейкемии. Назначается в инъекциях; возможные побочные эффекты включают тошноту, рвоту, поражение костного мозга и серьезные заболевания крови. Мутаген — внешний агент, который вызывает мутации. Мутагены обычно только увеличивают число образующихся мутантов, однако не являются причиной их мутации и не присутствуют в естественных условиях. В качестве мутагенов могут выступать некоторые виды излучения, многие химические вещества и различные вирусы. Для сравнения: Антимутаген. Мутант — 1. Человек, в организме которого произошла мутация, особенно если ее проявления сразу же становятся заметными. 2. Признак, свидетельствующий о происшедшей в данном организме мутации. — Мутантный. Мутация — изменение количества или структуры ДНК данного организма. При точечной мутации (или генной мутации) такому изменению подвергается какой-либо один ген; при хромосомной мутации изменяется структура или количество хромосом. Все виды мутаций являются достаточно редким явлением и могут возникать самопроизвольно или под действием каких-либо внешних агентов (мутагенов). Если мутация возникает в развивающихся половых клетках (гаметах), то она может передаваться по наследству. Мутации в каких-либо других клетках (соматические мутации) по наследству обычно не передаются. Мутизм — органическое или функциональное отсутствие способности говорить; полная немота при сохранении письменной речи. Врожденное отсутствие способности говорить чаще всего наблюдается у совершенно глухих с рождения людей (глухонемота). Утрата способности говорить также может быть связана с каким-либо повреждением мозга (см. Афазия). Иногда причиной мутизма является депрессия или психическая травма, после чего больной либо вовсе не может произнести ни слова, либо ведет разговор только с избранным кругом лиц и только в определенных ситуациях. Последнее состояние называется избирательным мутизмом. Лечение мутизма, вызванного какими-либо психологическими причинами, в настоящее время имеет различные подходы, например, с помощью модификации поведения (особенно с помощью побуждения): люди, к которым больной не хочет обращаться, медленно вводятся в те ситуации, в которых пациент ведет разговор. Данный метод может применяться в одиночку или в сочетании с традиционными методами психотерапии. — Немой. — Немота. Мутуализм — внутренняя, но не обязательная связь между двумя различными видами организмов, взаимовыгодная и полезная для них обоих. Для сравнения: Симбиоз. Муха — двукрылое насекомое, принадлежащее к большому классу Diptera. Область рта у этих мух приспособлена для высасывания крови, а иногда также для прокалывания поверхности кожи и нанесения укусов. Личинки мух могут проникать в ткани человеческого организма и вызывать заболевания (см. Миаз). Муха тумбу — крупная некровососущая муха вида Cordylobia anthropophaga, широко распространенная в странах Тропической Африки. Самки этих мух могут откладывать яйца в почве, загрязненной мочой или экскрементами, а также на одежде, пропитанной потом или мочой. Обычно личинки этих мух паразитируют в организме крыс, однако при их непосредственном контакте с человеком они могут проникать под кожу, вызывая образование фурункулов (см. также Миаз). После нанесения масла на образовавшиеся на коже припухлости эти личинки легко удаляются. Муха черная — небольшое широко распространенное кровососущее насекомое из рода Sunulium. Черных мух также по-другому называют бычьими комарами за их горбатую внешность. Самки этих мух наносят болезненные укусы и очень мешают человеку в теплое время года. S. damnosum в Африке и S. ochraceum в Центральной Америке и Венесуэле являются переносчиками паразитов, вызывающих у человека онхоцеркоз. Муцин — основной компонент, входящий в состав слизи. Муцин является гликопротеином. Мушка шпанская — водяной жук вида Lytta vesicatoria; является источником раздражающего токсичного химического соединения кантаридина. «Мушки летающие» — утрата стекловидным телом глаза прозрачности, в результате чего на сетчатку отбрасывается тень и человек видит темные точки на ярком фоне при хорошем освещении. «Летающие мушки» являются разновидностью энтоптического феномена. Мыс — (в анатомии) выступающая часть какого-либо органа или другой структуры в теле (например, мыс крестца. — Ред.). Мышечный — мышечный слой стенки полого органа (например, желудка) или какой-либо трубчатой структуры (такой как кишечник или мочеточник). Мышечная пластинка слизистой оболочки представляет собой несколько слоев гладких миоцитов. Мышление — процесс обдумывания чего-либо, создание образа или возникновение идей. Мышца — орган, образованный мышечной тканью, клетки которой обладают способностью сокращаться и производить различные движения. Мышцы обладают способностью превращать энергию протекающих в организме химических реакций в механическую энергию. Основными функциями мышц являются: осуществление различных движений человеческого тела, сохранение правильной осанки под воздействием на тело человека силы гравитации, обеспечение различных движений расположенных внутри тела органов и структур, а также изменение давления или напряжения, приходящегося на эти органы и структуры. Существуют три типа мышц: поперечно-полосатые мышцы, которые прикрепляются к костям скелета; гладкие мышцы, которые входят в состав стенок кровеносных сосудов и внутренних органов; и сердечная мышца, которая образует стенки сердца. (Сердечная мышца образована поперечно-полосатой (исчерченной) сердечной мышечной тканью. — Ред.) Мышца бедра четырехглавая — одна из самых крупных мышц бедра. Является разгибателем голени (играет важную роль в прямохождении и вертикальном положении тела человека. — Ред.). Эта мышца состоит из четырех отдельных мышц: прямой мышцы бедра (она также сгибает бедро в тазобедренном суставе), латеральной широкой мышцы, медиальной широкой мышцы и промежуточной широкой мышцы. Мышца большеберцовая — одна из двух мышц голени, начинающаяся от большеберцовой кости и проходящая к костям предплюсны. Передняя большеберцовая мышца разгибает и супинирует стопу. Задняя большеберцовая мышца сгибает, приводит и супинирует стопу. Мышца височная — жевательная веерообразная мышца, начинающаяся от височной ямки поверхности теменной и чешуи височной кости и прикрепляющаяся к нижней челюсти. Эта мышца поднимает нижнюю челюсть, способствуя закрыванию рта. Мышца внутренняя — мышца, целиком расположенная внутри какого-либо органа или той его части, которой она управляет. Например, сокращения мышц, расположенных внутри языка, приводят к изменению его формы. Мышца гладкая, мышца непроизвольная — мышца, в которой возникают медленные, длительные сокращения, которые не подконтрольны сознанию. Гладкие мышцы находятся в стенках полых органов (желудка, кишечника, кровеносных сосудов, мочевого пузыря, бронхов и др.). Они образованы удлиненными веретенообразными клетками, которые располагаются группами, окруженными прослойками соединительной ткани; клетка содержит одно ядро и продольно ориентированные микрофиламенты. Изнутри к плазмалемме прилежат прикрепительные тельца. Они располагаются и в цитоплазме. В цитоплазме находятся актиновые, миозиновые и промежуточные филаменты (Ред.). Деятельность этих мышц находится под контролем вегетативной нервной системы. Для сравнения: Мышца поперечно-полосатая. Мышца грудино-ключично-сосцевидная — длинная поверхностная мышца шеи, которая начинается от рукоятки грудины и ключицы и прикрепляется к сосцевидному отростку височной кости. При одностороннем сокращении она наклоняет голову, при двустороннем запрокидывает голову. Мышца грудино-подъязычная — одна из подподъязычных мышц шеи, которая начинается от рукоятки грудины и прикрепляется к подъязычной кости. Она способствует опусканию этой кости. Мышца дельтовидная — толстая треугольная мышца, покрывающая плечевой сустав, образуя округлость плеча. Отводит руку от туловища до горизонтального уровня; разгибает плечо. Мышца жевательная — толстая жевательная мышца, начинающаяся от скуловой дуги и прикрепляющаяся к наружному углу нижней челюсти. Она играет важную роль в процессе жевания пищи, осуществляя смыкание челюстей. Мышца запирательная — одна из двух мышц, расположенных на наружной поверхности запирательной перепонки (наружная запирательная и внутренней поверхности запирательной перепонки — внутренняя запирательная мышца); обе мышцы поворачивают бедро кнаружи. Мышца зубчатая — мышца, начинающаяся несколькими зубцами, напоминающими зубья пилы. Например, передняя зубчатая мышца — мышца, начинающаяся крупными зубцами от верхних восьми-девяти ребер и прикрепляющаяся к лопатке, прилежит сбоку к грудной клетке. Это основная мышца, осуществляющая энергичные движения лопатки. Мышца икроножная — мышца, составляющая большую часть икроножной мышцы голени. Она сгибает колено и стопу (подошвенное сгибание). Мышца камбаловидная — широкая плоская толстая мышца голени, проходящая под (впереди) икроножной мышцей. Она сгибает стопу (подошвенное сгибание). Мышца квадратная — любая мышца, по форме напоминающая квадрат. Квадратная мышца бедра представляет собой плоскую четырехугольную мышцу, начинающуюся от седалищного бугра, проходящую вблизи головки бедренной кости и прикрепляющуюся к межвертельному гребню бедренной кости (Ред.). Эта мышца поворачивает бедро кнаружи. Мышца круглая — одна из двух мышц плечевого пояса (большая и малая), начинающаяся от лопатки и прикрепляющаяся к плечевой кости. Большая круглая мышца разгибает плечо и поворачивает его кнутри; малая круглая мышца вращает плечо кнаружи. Мышца круговая — одна из круговых мышц лица. Круговая мышца рта окружает ротовую щель и смыкает ротовую щель. Круговая мышца глаза, расположенная вокруг каждой глазницы, суживает глазную. Мышца лестничная — одна из четырех парных мышц шеи (передняя, средняя, наименьшая и задняя); эти мышцы начинаются от поперечных отростков шейных позвонков и прикрепляются к первому и второму ребрам. Они поднимают эти ребра во время дыхания; кроме того, они сгибают шейный отдел позвоночника кпереди, а при одностороннем сокращении наклоняют его в свою сторону. Мышца локтевая — плоская короткая мышца, расположенная под кожей верхнего отдела задней поверхности предплечья; разгибает предплечье. Мышца малоберцовая — одна из мышц латеральной группы мышц голени, которая начинается от малоберцовой кости. Длинная малоберцовая и короткая малоберцовая мышцы проходят по латеральной поверхности голени и прикрепляются к основанию 1—11 плюсневых костей стопы (большая) и бугристости плюсневой кости (малая). Эти мышцы сгибают стопу и поднимают ее латеральный край. Мышца надчерепная — широкий мышечно-апоневротический пласт, расположенный на своде черепа. Ее лобное брюшко, расположенное надо лбом, поднимает бровь и сморщивает лоб; затылочное брюшко, расположенное в затылочной области, тянет кожу волосистой части головы назад и вниз. Мышца непроизвольная — мышца, сокращения которой не могут происходить осознанно (к этим мышцам относятся мышцы кишечника, желудка, кровеносных сосудов и сердца). См. также Мышца сердечная, Мышца гладкая. Мышца плечевая — мышца, расположенная в нижних двух третях передней области плеча; прикрепляется к бугристости локтевой кости; сгибает предплечье. Является антагонистом трехглавой мышцы плеча. Мышца подвздошная — плоская треугольная мышца, расположенная в паховой области. Эта мышца совместно с поясничной мышцей осуществляет сгибание ноги в бедре. Мышца подвздошно-поясничная — сложная мышца, образующаяся из подвздошной и поясничной мышц, которые имеют общее сухожилие. Мышца подколенная — плоская треугольная мышца, проходящая в подколенной ямке между латеральным мыщелком бедра и задней поверхностью большеберцовой кости; участвует в сгибании голени. — Подколенный. Мышца подъязычно-язычная — мышца, опускающая язык; начинается от тела и большого рога подъязычной кости и заканчивается в языке. Мышца поперечно-полосатая, мышца исчерченная — мышца, образованная поперечно-полосатой мышечной тканью, из которой построена скелетная мускулатура человека. Скелетные мышцы прикрепляются к костям скелета и осуществляют движения костей. Эти мышцы произвольные, так как их действия сознательно контролируются. В состав поперечно-полосатой мышцы входят параллельные пучки многоядерных волокон (миосимпластов), каждое из которых содержит множество миофибрилл; при их рассмотрении под микроскопом можно обнаружить поперечные полосы. Их наличие связано с чередованием анизотропных (диск А) и изотропных (диск I) дисков. Миофибриллы состоят из актиновых и миозиновых белковых филаментов. Во время сокращения мышцы актиновые филаменты скользят относительно миозиновых, при этом длина каждой сократительной единицы (саркомер) уменьшается. Такое скольжение вызывается рядом циклических реакций, приводящих к изменению ориентации головок миозина. Благодаря наличию в молекуле миозина двух «шарнирных» устройств головки миозина могут сгибаться, прикрепляясь к актину и подтягивая актиновые филаменты. Это возможно благодаря тому, что белок актинин, расположенный в Z-линии, закрепляет концы актиновых филаментов. Затем головки миозина отделяются от актина, после чего цикл повторяется (Ред.). Мышца портняжная — узкая лентовидная мышца, проходящая по передней поверхности бедра от верхней передней подвздошной кости к бугристости большеберцовой кости. Эта мышца — одна из самых длинных в теле человека; она сгибает бедро и голень и поворачивает бедро кнаружи. Мышца поясничная большая — толстая длинная веретенообразная мышца, расположенная на задней брюшной стенке; совместно с подвздошной мышцей образует подвздошно-поясничную мышцу (Ред.), сгибающую бедро в тазобедренном суставе. Малая поясничная мышца выполняет те же функции, что и большая поясничная мышца, однако часто она может отсутствовать. Мышца произвольная — см. Мышца поперечно-полосатая, Мышца исчерченная. Мышца противопоставляющая — одна из нескольких мышц кисти, которая противопоставляет один палец всем остальным. Например, мышца, противопоставляющая большой палец кисти, является основной мышцей, противопоставляющей большой палец всем остальным пальцам кисти руки. Мышца прямая — любая прямая мышца человека. Например, четыре прямые мышцы глазного яблока осуществляют его движения. Прямая мышца живота — это длинная лентовидная плоская мышца, которая проходит с обеих сторон по передней стенке живота. При двустороннем сокращении прямые мышцы наклоняют туловище вперед и уменьшают размеры брюшной полости; действуя по отдельности, они наклоняют туловище в свою сторону. Прямая мышца бедра является частью четырехглавой мышцы. Мышца ромбовидная — одна из двух мышц, относящихся к поверхностным мышцам спины (большая ромбовидная и малая ромбовидная), проходящих в верхнем отделе спины под трапециевидной мышцей между позвоночником и лопаткой. Эти мышцы обеспечивают движение лопатки к позвоночнику и вверх. Мышца сердечная, миокард, слой средний — мышца стенки сердца. Сердечная мышца образована исчерченной поперечнополосатой мышечной тканью, состоящей из кардиомиоцитов, которые, нерегулярно соединяясь между собой, формируют сеть; кардиомиоциты соединяются между собой при помощи контактов, называемых по-другому вставочными дисками; по ним возбуждение передается от клетки к клетке. Мышца скелетная — см. Мышца поперечно-полосатая. Мышца трапециевидная — плоская треугольная мышца, расположенная поверхностно в верхней части спины и задней области шеи. Участвует в движениях лопатки, отклоняет голову назад и в стороны. Мышца трехглавая — мышца, имеющая три головки: например, трехглавая мышца плеча; ее сокращение вызывает разгибание предплечья. Данная мышца является антагонистом двуглавой мышцы плеча. Мышца челюстно-подъязычная — мышца, расположенная в основании полости рта; один ее конец прикрепляется к нижней челюсти, а другой — к подъязычной кости. Мышца шеи подкожная — широкая тонкая мышца, проходящая по переднебоковой поверхности шеи от грудной фасции ниже ключицы к краю нижней челюсти и углу рта. Способствует опусканию нижней челюсти, тянет угол рта вниз. Мышца шилоподъязычная — одна из надподъязычных мышц; начинается от шиловидного отростка височной кости и прикрепляется к подъязычной кости. Эта мышца поднимает подъязычную кость и оттягивает ее немного кзади. Мышца шилоязычная — одна из скелетных мышц языка; начинается от шиловидного отростка височной кости и входит в толщу языка. Она тянет язык кверху и кзади. Мышца широкая — одна из трех мышц (промежуточная, латеральная и медиальная), которые являются частями четырехглавой мышцы бедра. Мышца щечная — мышца щеки; начинается от наружной поверхности альвеолярной дуги верхней челюсти и ветви нижней челюсти. Напрягает щеку; кроме того, играет важную роль в процессе пережевывания пищи. Мышца, выталкивающая мочу — гладкая (Ред.) мышца стенки мочевого пузыря. Функция ее и внутреннего сфинктера выявляется с помощью уродинамического исследования (см. Уродинамика). Оно применяется для диагностики дисфункции этой мышцы, отсутствия или, наоборот, наличия избыточных рефлексов в ней, а также ее неустойчивости и недостаточной координации между мышцей и сфинктером (диссинергия мочевой пузырь/сфинктер). Мышцы груди — мышцы, расположенные на передней поверхности груди. Подразделяются на поверхностные (большая и малая грудные, подключичная и передняя зубчатая) и глубокие (наружные и внутренние межреберные, подреберные и поперечная мышца груди) — Ред. Большая грудная мышца представляет собой плоскую веерообразную мышцу, которая занимает большую часть передней грудной стенки. Ее пучки конвергируют в латеральном направлении и прикрепляются к гребню большого бугорка плечевой кости (Ред.); эта мышца приводит плечо и опускает поднятое плечо, одновременно поворачивая его вовнутрь. Под ней находится малая грудная мышца, которая оттягивает лопатку вперед и вниз. Мышцы межреберные — мышцы, расположенные в промежутках между ребрами; контролируют различные движения ребер. Поверхностные наружные межреберные мышцы поднимают ребра во время вдоха; расположенные более глубоко внутренние межреберные мышцы опускают ребра во время выдоха. Мышцы постуральные — мышцы (главным образом разгибающие), которые служат для поддержания вертикального положения тела и преодоления силы тяжести. Мышцы ягодичные — наружные мышцы таза (Ред.) — три парные ягодичные мышцы (большая ягодичная, средняя ягодичная и малая ягодичная). Они осуществляют движения бедра. — Ягодичный. Мышь, лишенная волосяного покрова — мышь, у которой с рождения отсутствует вилочковая железа и поэтому в ее организме не вырабатываются Т-лимфоциты. У таких мышей часто образуются опухоли, характерные для человека. В силу неизвестных причин у этих мышей отсутствует волосяной покров, из-за чего они и получили такое название. Мышьяк — ядовитый химический элемент — металл серого цвета; отравление мышьяком вызывает у человека тошноту, рвоту, понос, мышечные спазмы, судороги и кому (в случае попадания в организм в большихдозах). К лекарственным веществам, являющимся антидотом для мышьяка, относится димеркапрол. Раньше человек мог легко отравиться мышьяком, так как он содержался в крысином яде и входил в состав липкой бумаги от мух. Впервые он был признан ядовитым веществом в XIX в., после чего с ним стали обращаться с крайней осторожностью, однако его присутствие в организме человека было трудно определить. Сегодня наличие мышьяка в организме человека определяется достаточно просто. Ранее мышьяк широко использовался в медицине. Наиболее важными лекарственными препаратами, в состав которых входил мышьяк, были арсфенамин (сальварсан) и неоарсфенамин, применявшиеся для лечения сифилиса и опасных паразитических заболеваний. Обозначение: As. Мыщелок — округлый или овальный выступ на эпифизах некоторых костей, например затылочной кости, который участвует в образовании сочленения с другой костьюН
Невралгия — синдром, характеризующийся приступообразными, часто обостряющимися болями, распространяющимися по ходу нерва или его ветвей (чаще тройничного, реже языкоглоточного, блуждающего и др.). Неврастения — заболевание центральной нервной системы, относящееся к неврозам; вызывается переутомлением или длительно действующими психотравмирующими факторами; характеризуется повышенной возбудимостью, быстрой истощаемостью, расстройством сна, вегетативными нарушениями. Неврит — заболевание периферической нервной системы воспалительного характера (инфекционного, токсического и травматического). Неврозы — заболевания центральной нервной системы, обусловленные воздействием психотравмирующих факторов. Неврозы отличаются от психозов отсутствием грубой психопатологической (продуктивной) симптоматики (галлюцинации, бред, помрачение сознания и т. п.) и сохранностью осознания больным факта своего заболевания. Основными клиническими формами являются неврастения, истерический невроз, невроз навязчивого состояния. Нейрогуморальная регуляция — регулирующее и координирующее действие нервной системы и находящихся в крови и лимфе биологически активных веществ на процессы жизнедеятельности человека. Нейродермит — хроническое кожное заболевание, характеризующееся зудом кожи и сыпью. Нейролейкемия — осложнение острого лейкоза, проявляющееся метастазированием лейкозных клеток в оболочки мозга, вещество мозга и нервные стволы. Нейролептики — психотропные средства, оказывающие преимущественно угнетающее действие на высшую нервную деятельность, эмоциональное состояние, поведение и не нарушающие при этом сознание. Купируют бред, галлюцинации, применяются при лечении психозов. Нейролингвистическое программирование — один из методов психотерапии. Нейромедиаторы (синоним: нейропептиды) — биологически активные вещества, участвующие в передаче нервных импульсов, например норадреналин, адреналин, ацетилхолин, серотонин и др. Нейрон — нервная клетка. Является структурной единицей нервной ткани. Нейротоксикоз — проявления токсического воздействия бактериальных токсинов и вирусов на организм человека, как правило, ребенка, выражающиеся в лихорадке, которая не снижается обычными жаропонижающими средствами, а также судорогах, менингеальном синдроме, токсической одышке, резком сниженим давления (коллапсе). Нейроциркуляторные дистонии — состояния, связанные с нарушением регуляции артериального давления, т. е. его повышением или понижением. Часто встречаются при неврозах. Нейтрофильный лейкоцитоз со сдвигом влево — изменение в гемограмме (см.), связанное с увеличением количества нейтрофильных лейкоцитов и появлением в крови молодых форм (миелоцитов (см.)), является показателем выраженного воспаления. Некроз — омертвение клеток или тканей в живом организме, сопровождающееся необратимым прекращением их функций. Неокортикальные образования — см. Кора головного мозга. Нервный ганглий — нервный узел, в котором происходит процесс передачи нервного импульса от одного нейрона другому. Неспецифические гуморальные факторы иммунитета — разнообразные белки плазмы крови, обладающие антимикробными свойствами или свойствами активировать другие механизмы иммунитета. К ним относят белки системы комплемента, лизоцим, трансферрин, С-реактивный белок и др. Нефробиопсия — биопсия почек. Нефролитиаз — наличие камней (конкрементов) в чашечно-лоханочной системе почки. Основными факторами, ведущими к образованию камней, являются: метаболические нарушения (генетически обусловленные), анатомические аномалии, приводящие к появлению хронического инфекционного процесса и застоя мочи, гормональный дисбаланс, факторы окружающей среды, диетические факторы. Основные типы камней: калийсодержащие (оксалат кальция, фосфаты кальция, смешанные — 70 %), инфекционные камни (струвитные, фосфатно-аммониево-магниевые — 15–20 %), камни из мочевой кислоты — 5—10 %. См. также Оксалатный уролитиаз, Мочекислый уролитиаз, Струвитный уролитиаз, Цистиновый уролитиаз. Нефрон — структурная единица почки, представлен капсулой клубочка и канальцами. Выполняет функцию фильтрации крови и мочеобразования. Нефропатия — поражение почек при различных нарушениях обмена, чаще водносолевого. Отдельно выделяют нефропатию беременных, когда при тяжелом гестозе появляются белок в моче, выраженные отеки и повышение артериального давления. Нефротоксичность — способность химических и фармакологических веществ токсически воздействовать на почечную ткань. Нистагм — непроизвольное движение глазных яблок в горизонтальной или вертикальной плоскости. Нозология — от греч. nosos — болезнь, учение о причинах развития болезней. Нормобласты — клетки кроветворной ткани, предшественники эритроцитов. Нутриенты — питательные вещества (белки, углеводы, и др.).О
Облитерация — заращение соединительной тканью полости внутреннего органа, канала, кровеносного сосуда. Обсессия — навязчивость. Обстипация — запор. Обструктивный, обструкция — сужение просвета полого органа из-за закупорки, сдавления извне, спазма мышечной стенки. Обтурация — закрытие просвета полого органа, в том числе бронхов, кровеносного или лимфатического сосуда, обусловливающее нарушение его проходимости. Обтурация бронхов может быть инородными телами, слизью. Общемозговая симптоматика — головная боль, повышение внутричерепного давления, рвота, не связанная с приемом пищи, судороги, застойные диски зрительного нерва. Овуляция — выход зрелой, способной к оплодотворению яйцеклетки из фолликула яичника в брюшную полость у женщины детородного возраста. Однослойный цилиндрический эпителий — один из видов эпителиальной ткани, выстилающий слизистые оболочки желудка, трахеи, бронхов. Одонтогенный — связанный с первичным поражением зуба (одонтогенный гайморит, например, развивается при наличии кариеса зубов верхней челюсти). Окклюзия — закупорка просвета сосуда. Оксигенотерапия — дополнительное введение кислорода в лечебных целях. Олигоменорея — скудные и (или) редкие менструации. Олигофрения (врожденное слабоумие, умственная отсталость) — наследственная или приобретенная в раннем детстве до 3 лет умственная недостаточность. Олигурия — уменьшение выделения мочи. Она может быть физиологической (у новорожденных, при повышенном потоотделении и др.) и патологической (при почечной недостаточности, при шоке, гемолизе и др.). Онкотическое давление плазмы — давление, обусловленное нахождением в плазме высокомолекулярных белков. Препятствует выходу жидкой части плазмы в ткани. Оофорит — воспаление яичников. Опистотонус — судорожная поза, при которой больной лежит с выгнутой спиной, опираясь только на затылок и пятки. Возникает при столбняке, у детей при гнойных менингитах. Оральная регидратация — лечебное мероприятие, позволяющее ввести жидкость больному через рот при ее дефиците. При этом жидкость (как правило, соляной раствор) дают по чайной ложке через каждые 5 минут. Существуют специальные растворы для оральной регидратации — оралит, регидрон и др. Орбита — глазница. Органелла — постоянный устойчивый участок цитоплазмы клетки, имеющий постоянные свойства и строение. К ним относят: рибосомы, лизосомы, митохондрии и др. Орган Гольджи сухожильный — расположенный внутри сухожилия вблизи мышц рецептор, который воспринимает натяжение сухожилия, посылая в центральную нервную систему соответствующие импульсы. Подобно находящимся в мышцах рецепторам растяжения, сухожильное веретено является проприорецептором. Органическое заболевание — заболевание, при котором нарушение функции органа или ткани носит постоянный, стойкий характер, в отличие от функциональных нарушений, которые являются быстропреходящими и не затрагивают тканевых структур. Ортостатический — возникающий при переходе из горизонтального положения в вертикальное. Осевой цилиндр — отросток нейрона, нервное волокно, окруженное миелиновой оболочкой. Осмотическая активность — способность поддерживать осмотическое давление. Выраженной осмотической активностью обладают, например, ионы натрия. Основной обмен — совокупность всех обменных процессов в организме человека, происходящих в покое, натощак. Оссификация — процесс костеобразования. Остеодистрофия — патологические изменения в костной ткани, проявляющиеся перестройкой костной ткани с образованием характерных деформаций костей — искривления, сплющивания, патологических переломов. Остеоид — новобразованная костная субстанция, не подвергающаяся обызвествлению. Появляется в тех случаях, когда процесс оссификации идет при нехватке витамина D. Остеоидная гиперплазия — усиленное разрастание остеоидной ткани, возникающее при рахите. Проявляется «рахитическими четками» — утолщением ребер в местах их прикрепления к грудине, «браслетами» — при разрастании остеоида на запястьях. Остеолизис — разрушение костной ткани. Остеомаляция — размягчение костной ткани, выявляется при тяжелых случаях рахита. Остеомиелит — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу. Остеопороз (разрежение кости) — изменение костной ткани в виде уменьшения числа костных перекладин, их истончения, искривления и частичного полного рассасывания. Остеофиты — различные костные разрастания. Остеофолликулит — воспаление волосяного мешочка. Остеохондрит — заболевание, характеризующееся воспалительным процессом в костной и хрящевой ткани. Острая надпочечниковая недостаточность — тяжелое патологическое состояние, возникающее при кровоизлиянии, инфаркте надпочечника, характеризующееся резким падением давления, неукротимой рвотой, жидким многократным стулом, нарушениями электролитного баланса. Островки Лангерганса — см. Инсулярный аппарат. Острый живот — клинический термин, обозначающий тяжелое состояние больного при острых заболеваниях органов брюшной полости (кишечная непроходимость, перитонит, острый аппендицит, острый аднексит и др.), требующих срочного хирургического вмешательства. Термин может быть употреблен только в рамках предварительного диагноза при направлении в стационар. Открытая репозиция — сопоставление костных отломков при различных переломах, производимое методом хирургической операции. Офтальмогипертензия — повышение внутриглазного давления. Офтальмоплегический — офтальмоплегия — паралич нескольких наружных мышц глаза, иногда в сочетании с параличом сфинктера зрачка. Проявляется нарушением подвижности глазного яблока, двоением в глазах, нарушением зрачковых реакций. Офтальмотонус — внутриглазное давление. Очаговые неврологические симптомы — симптомы, позволяющие определить очаг поражения центральной нервной системы.П
Паллиативное лечение — поддержание жизнедеятельности организма неизлечимых больных. Палочкоядерные нейтрофилы — молодые формы нейтрофильных лейкоцитов, определяющиеся в норме в периферической крови. Пальпация — метод обследования тела или органов с помощью осязания. Панкреонекроз — омертвение части или всей поджелудочной железы в результате самопереваривания собственными ферментами. Панцитопения — резкое снижение количества всех клеток системы крови — эритроцитов, лейкоцитов, тромбоцитов. Возникает при аплазии костного мозга, лучевой болезни. Папула — элемент сыпи, представляющий собой бесполостное, поверхностно расположенное образование, выступающее над уровнем кожи, обычно более яркого цвета. Папулезно-геморрагическая сыпь — сочетание геморрагий и папул на коже. Парадоксальный пульс — уменьшение пульсовых волн на вдохе. При сужении дыхательных путей и слабости миокарда этот феномен выражен наиболее ярко. Пародонтоз — медленно текущий дистрофический процесс, сопровождающийся рассасыванием костной ткани в зубных лунках, расшатыванием зубов, образованием патологических зубодесневых карманов. Параклинические исследования — лабораторные методы исследования. Параличи (парезы) — полное отсутствие (паралич) или ослабление (парез) двигательных функций с отсутствием или снижением силы мышц в результате различных патологических процессов в нервной системе, вызывающих нарушение структуры и функции двигательного анализатора. Парапарез — парез обеих рук (верхний парапарез) или обеих ног (нижний парапарез). Парапроктит — воспаление околопрямокишечной клетчатки. Парасимпатико-миметический эффект — эффект усиления парасимпатической части вегетативной нервной системы. Парасимпатическая нервная система — функциональная часть вегетативной нервной системы. При повышении ее тонуса отмечается снижение силы и частоты сердечных сокращений, снижение артериального давления, усиление секреторной и моторной функции желудочно-кишечного тракта. Паратгормон — гормон паращитовидной железы, регулирует кальциевый обмен. Парацентез — разрез, прокол. Лечебно-диагностическое мероприятие с целью получения содержимого поверхностно расположенной полости (например, прокол передней брюшной стенки при асците). Паренхима — совокупность клеточных элементов органа, выполняющих его специфическую функцию. Парентеральный — внекишечный. Как правило, этим термином обозначают способ введения лекарственных веществ — внутривенный, внутримышечный и подкожный. Парестезия — нарушение кожной чувствительности. Париетальный — пристеночный. Паркинсонизм — неврологический синдром, обычно обусловленный атеросклеротическими изменениями в базальных ганглиях и характеризующийся ритмическим мышечным тремором, ригидностью движений, семенящей походкой, согбенным положением тела, маскообразным лицом; часто сочетание с дисфункцией обонятельного анализатора, возможно постепенное развитие умственной недостаточности. Паркинсонизм также может возникать как побочный эффект приема антипсихотических лекарств. Пародонт — комплекс тканей, окружающих зуб: десна, альвеолярный отросток челюсти. Пароксизмальная тахикардия — приступ учащения сердечного ритма (140–240 ударов в минуту), характеризующийся внезапным началом и окончанием. Пастозность — незначительно выраженная отечность. Патогенез — процесс развития биологических механизмов заболевания. Патогенность — болезнетворность микроорганизмов, их способность вызывать инфекционные заболевания. Патогномоничность — свойство именно этого заболевания. Патологоанатомическое исследование — посмертное исследование трупа умершего. Пер вагинум — вагинальный, т. е. через влагалище. Перекисное окисление липидов — свободнорадикальное окисление, ведущий механизм повреждения мембран клеток. Свободные радикалы вступают во взаимодействие с липидами мембран и разрушают их. Периартикулярный — околосуставной. Перикардит — воспаление перикарда, сердечной сумки. Перинеотомия — рассечение промежности женщины во время родов с целью профилактики разрывов (при родах крупным плодом, например). Периостит — воспаление надкостницы. Перистальтика кишечника — ритмичное сокращение гладких мышц кишечной стенки, обеспечивающее продвижение содержимого кишечника. Перитонзиллярная ткань — ткань, окружающая миндалины. Перитонзиллярный абсцесс — осложнение ангины, характеризуется переходом гнойного воспаления с миндалины на перитонзиллярную ткань. Перитубарный — околотрубный. Периферическая кровь — термин, обозначающий кровь, находящуюся в сосудистом русле. Периферический полиневрит — множественное поражение нервных стволов, складывающееся из дефектов чувствительности и вялых парезов стоп и (или) кистей. Перихолецистит — воспаление клетчатки, расположенной вокруг желчного пузыря. Перкуссия — метод обследования, заключающийся в постукивании по телу человека и выслушивании специфических перкуторных звуков. Пернициозная анемия — заболевание, развивающееся при дефиците витамина В12, характеризуется поражением кроветворной системы, пищеварительного тракта и нервной системы. Перорально — через рот. Пер ректум — ректальный, т. е. через прямую кишку. Персистирование — как правило, микроорганизмов — при слабости иммунного ответа некоторые микробы способны выживать в организме человека и оставаться в нем до момента резкого ослабления защитных сил — персистировать, после чего вновь начинают размножаться и вызывают новое заболевание. Перфорация — прободение. Петехия — мелкое кровоизлияние под кожу. Пиелит — воспаление почечной лоханки. Пиелоэктазия — значительное расширение почечной лоханки. Пиовар — гнойное воспаление яичника. Синоним: пиосальпинкс. Пиодермия — общее название дерматозов, вызываемых стрептококками, стафилококками, реже другими возбудителями, и характеризующихся гнойным воспалением кожи. Пирамидные знаки — симптомы поражения пирамидного пути — нейронов двигательного анализатора. Проявляются центральными параличами и парезами на стороне, противоположной поражению. Пиурия — выделение гноя с мочой. Плазмоферез — взятие цельной крови из организма, отделение от нее клеточных элементов центрифугированием, обратная их инфузия в солевом растворе или другой плазмозамещающей жидкости. Используется для уменьшения количества токсинов, токсических веществ в крови при различных заболеваниях. Плевральный выпот — скопление жидкости (экссудата или транссудата) в плевральной полости. Плеврит — воспаление плевры. Плечелопаточный периартрит — реактивное травматическое воспаление плечевого сустава, характеризующееся резкими болями и ограничением движений в пораженном суставе. Плюс-ткань — термин, обозначающий ограниченный участок, возвышающийся над общей поверхностью ткани. Пневмосклероз — разрастание рубцовой соединительной ткани в легких, что ведет к нарушению их функции. Пневмоторакс — скопление воздуха в плевральной полости. Пневмоэнцефалография — метод контрастного исследования желудочков мозга путем введения воздуха при спинномозговой пункции. Подагра — хроническое заболевание, обусловленное нарушением обмена пуринов, характеризующееся отложением солей мочевой кислоты в тканях с развитием воспалительных и склеротических изменений; проявляется острым рецидивирующим артритом, образованием подкожных узелков, симптомами мочекаменной болезни. Поднадкостничный перелом — перелом кости с сохранением целостности надкостницы. Проколлаген — белок, предшественник коллагена (см.). Полиаллергия — аллергическая настроенность организма против многих аллергенов. Полиартрит — воспалительное повреждение многих суставов одновременно. Полинаркомания — психическая и физическая зависимость от нескольких наркотических веществ. Полинейропатия — см. Периферический полиневрит. Полипы — тканевые выросты, выступающие над поверхностью ткани и связанные с ней длинной или короткой ножкой. Полирадикулоневропатия — см. Периферический полиневрит. Полисерозит — множественное воспаление серозных оболочек — перикарда, плевры и др., обычно встречается при системной красной волчанке. Поллакиурия — учащенное, болезненное мочеиспускание. Полиурия — увеличение объема выделяемой за сутки мочи свыше 1800 мл. Полостное кровотечение — кровотечение в одну из полостей организма — брюшную, плевральную и др. Поля зрения — совокупность всех точек пространства, одновременно воспринимаемых неподвижным, фиксированным взглядом. Портальная гипертензия — повышение давления крови в воротной вене, возникающее при затруднении оттока из нее крови. Это состояние возникает когда в воротной вене формируется препятствие оттоку крови. Порфирия — термин, обозначающий нарушение порфиринового обмена Порфирин — природный пигмент, входящий в состав гемоглобина. Преморбидное состояние — состояние, предшествующее возникновению болезни. Пренатальный период — развитие плода в утробе матери от момента зачатия до родов. Преовуляторный период — время от конца прошедшей менструации до овуляции. Препателлярная гематома — кровоизлияние в область надколенника. Препуциальный мешок — полость крайней плоти, закрывающая головку полового члена. Преципитация — реакция осаждения комплекса антигена и антитела. Преэклампсия — патологическое состояние, осложняющее течение беременности, развивается на фоне позднего гестоза, когда к отекам, протеинурии и повышенному давлению присоединяются жалобы на сильную головную боль, расстройство зрения, боли в подложечной области. Необходима немедленная госпитализация беременной в родильный дом. Продрома — период от начала заболевания до появления развернутой клинической картины, как правило, проявляется слабостью, разбитостью, ознобом, субфебрильной температурой. Характерен для многих инфекционных заболеваний. Прозеринотерапия — лечение прозерином — антихолинэстеразным средством (см.). Применяется для восстановительной терапии после менингита, энцефалита, при атонии кишечника и мочевого пузыря. Проксимальный — специальный термин для описания той части конечности, которая находится ближе к туловищу. Проктит — воспаление прямой кишки. Пролактин — гормон гипофиза, стимулирующий лактацию. Пролонгированный — продленный. Промиелоциты — клетки лейкоцитарного ряда, предшественники нейтрофильных лейкоцитов, молодые формы — в норме в периферической крови не определяются. Пронаторная контрактура — нарушение двигательной функции сустава с фиксацией в положении пронации (поворота кнутри). Простагландины — физиологически активные вещества, присутствующие во многих тканях; действуют как сосудорасширяющие, стимуляторы гладкой мускулатуры, мускулатуры матки, антагонисты гормонов, регулирующих липидный обмен. Простатит — воспаление предстательной железы. Протеинотерапия — лечение белковыми веществами, введенными в организм парентерально; применяют кровь, сыворотки, вакцины, коровье молоко. Повышает неспецифическую резистентность организма. Протеолитические ферменты — ферменты, обладающие способностью расщеплять белок. Протозойный — простейший, вызванный простейшим организмом. К типу простейших относятся: дизентерийная амеба, трихомонада, лямблия, малярийный плазмодий и многие другие. Протромбин — неактивный предшественник фермента тромбина, находящийся в плазме крови. Необходим для процесса свертывания крови. Псевдостриктура — ложная стриктура (см. Стриктура). Псевдотуморозный — протекающий под маской опухолевого процесса. Психогения — заболевание, вызванное первичным нарушением психики (неврозом). Психастения — невроз, проявляющийся чувством неполноценности, страхом, нерешительностью, безволием, навязчивыми состояниями; человек отличается тревожномнительным характером. Психоз — расстройство психики, проявляющееся нарушением мышления, поведения, эмоций, не свойственными нормальной психике явлениями (галлюцинации, бред, аффективные расстройства и др.). Психомоторное возбуждение — патологическое состояние, характеризующееся выраженным усилением психической и двигательной активности. Может сопровождаться галлюцинациями, бредом, спутанностью сознания. Психомоторное возбуждение требует неотложной медицинской помощи, так как больной представляет опасность для себя и окружающих. Психопатизация личности — дисгармоничное развитие личности в эмоционально-волевой сфере при сохранности интеллекта. Приводит к развитию определенных характерологических особенностей личности, мешающих ей приспосабливаться к внешней среде безболезненно для себя и окружающих. Психостимуляторы — лекарственные вещества, стимулирующие головной мозг и активирующие физическую и психическую деятельность организма. К ним относят кофеин, фенамин и др. Психотерапия — планомерное использование психических воздействий для лечения больного. Это лечение информацией, при котором большую роль играет эмоциональное воздействие, определяющееся информацией, исходящей от врача, его речи, его личности. Психотропные средства — группа лекарственных веществ, оказывающих влияние на психические функции, эмоциональное состояние и поведение. К ним относят нейролептики (см.) и транквилизаторы (см.). Птиализм — слюнотечение. Пульмонология — раздел медицины, изучающий болезни дыхательной системы. Пульпидное ядро — центральная часть межпозвоночного диска (см.). Пупартова связка — паховая связка, натянутая между передней верхней подвздошной остью и лонным бугорком. Пуриновый обмен — обмен пуриновых оснований, являющихся составной частью нуклеиновых кислот (ДНК, РНК), которые содержатся в каждой клетке. В состав нуклеиновых кислот входят в основном аденин (6-аминопурин) и гуанин (2-амино-6-оксипурин). Конечным продуктом окисления аденина и гуанина и всех пуриновых оснований является мочевая кислота. Избыток мочевой кислоты приводит к подагре. Пурпура — геморрагическая крупнопятнистая сыпь, представляет собой кровоизлияния в кожу, чаще встречается при нарушениях свертываемости крови. Пустула — кожный патологический элемент, представляет собой пузырек, заполненный гноем.Р
Радиальный — край предплечья со стороны лучевой кости. Радикальная операция — операция, приводящая к полному излечению (как правило, опухолевых заболеваний, поэтому особое значение придается удалению всех измененных тканей и регионарных лимфоузлов). Реабсорбция — процесс повторного всасывания некоторых веществ из почечных канальцев обратно в кровь, например глюкозы. Реактивность организма — свойство организма реагировать на факторы внешней среды, изменяя процессы своей жизнедеятельности, что обеспечивает приспособляемость организма к внешней среде. Реакция Сулковича — определение в моче гиперкальциурии, возникающей при передозировке витамина D. Регургитация — обратный заброс содержимого желудка и (или) пищевода в полость рта (срыгивание). Резекция — хирургическое удаление целого органа или его части (полная и неполная резекция). Резистентность — устойчивость организма к действию патогенных факторов, т. е. физических, химических, биологических агентов, способных вызвать патологическое состояние. Резорбция — рассасывание. Реинфекция — повторное инфицирование тем же вирусом или микроорганизмом. Реконвалесценция — выздоровление. Ректороманоскопия — осмотр слизистой оболочки прямой и сигмовидной кишки при помощи ректороманоскопа — прибора световолоконной оптики. Релизинг-гормоны — гормоны, вырабатываемые гипоталамусом, регулирующие гормонпродуцирующую функцию гипофиза. Ремиссия — стабильное улучшение состояния больного хроническим заболеванием. Ренин-ангиотензинная система — группа биологически активных веществ, взаимодействие между которыми приводит к образованию факторов, влияющих на тонус сосудов и, как следствие, на артериальное давление. Репликация вируса — самовоспроизведение вирусной частицы в клетке организма хозяина. Реснитчатый эпителий — один из видов эпителиальной ткани, покрывающий трахею, бронхи и др. Ретенция — ретенционная киста — образуется вследствие закупорки выводного протока какой-либо железы. Ретикулоэндотелиальная система — совокупность тканей и органов, участвующих в процессах кроветворения и кроверазрушения, клетки которых обладают способностью к фагоцитозу. К ним относят селезенку, красный костный мозг, лимфатические узлы и др. Ретикулярная формация — функциональное анатомическое образование головного и спинного мозга, играет важную роль в выполнении различных подкорковых функций, формирует восходящие импульсы к коре головного мозга, которые являются непременным условием поддержания бодрствующего состояния мозга. Ретинопатия — заболевание (изменение) сетчатой оболочки глаза невоспалительного характера, например при сахарном диабете — диабетическая ретинопатия. Рефлексотерапия — лечебная система, основанная на использовании с лечебной целью рефлекторных соотношений, имеющихся в организме человека. К методам рефлексотерапии относят иглоукалывание, акупрессуру, аурикулопунктуру, шиа-цу и др. Рефрактерность — невозбудимость, резкое снижение возбудимости. Рефракция — преломляющая сила линзы (хрусталика глаза). Ригидность мышц затылка — один из симптомов поражения мозговых оболочек, характеризуется невозможностью нагнуть голову и коснуться груди подбородком. Риноскопия — метод осмотра носовой полости. Розеола — элемент сыпи, представляет собой пятно розового цвета, не возвышающееся над поверхностью кожи. Рожистое воспаление — острое инфекционное заболевание, вызываемое стрептококком, с высокой температурой при болезненности кожи с резко ограниченной краснотой.С
Сагиттальный — анатомический термин, обозначающий направление спереди назад. Сакральный — крестцовый. Салицилаты — жаропонижающие средства, производные салициловой кислоты. Широко известный представитель — аспирин. Сальник — анатомическое образование в брюшной полости, являющееся удвоением листков брюшины, между которыми находится небольшое количество жировой клетчатки. Седативные средства — лекарственные вещества, оказывающие успокаивающее действие. Не вызывают привыкания, зависимости, сонливости. К ним относятся препараты брома, валерианы, пустырника и других лекарственных растений. Секвестрация — процесс отторжения омертвевшего участка ткани (чаще — костной). Сенестопатия — расстройство психики, характеризующееся возникновением неприятных, тягостных ощущений в различных частях тела и уверенностью больного в том, что эти ощущения ему навязаны извне. Сенсибилизация — приобретение организмом повышенной чувствительности к чужеродным веществам, чаще белковой природы (антигенам). Септикопиемия — одна из форм сепсиса, характеризующаяся наличием возбудителя в крови и вторичных очагов гнойного воспаления в тканях. Септицемия — одна из форм сепсиса, характеризующаяся выраженным токсикозом, повышенной реактивностью организма и отсутствием гнойных метастазов. Серовар — серологический вариант микроба или вируса. Серозная оболочка — наружная оболочка внутренних органов, представленная однослойным плоским эпителием. Серозная полость — полость тела, выстланная серозной оболочкой, например брюшная полость — брюшиной, плевральная — плеврой. Серологические реакции — реакции, возникающие между антигеном и антителом. Используются для диагностики инфекционных и аутоиммунных заболеваний, определения групп крови и др. Серотерапия — лечение иммунными сыворотками. Симпатикотония — преобладание тонуса симпатической нервной системы над парасимпатическим отделом. Симпатическая нервная система — функциональный отдел вегетативной нервной системы. При повышении ее тонуса усиливаются сердечные сокращения и учащается их ритм, повышается артериальное давление, расширяются бронхи, зрачки, усиливается секреторная деятельность коры надпочечников, снижается тонус желудочно-кишечного тракта. Симптом — признак болезни. Симптом Пастернацкого — резкая болезненность при поколачивании в поясничной области, отмечается при поражении почек. Синапс — место функционального контакта двух нервных клеток или нервной и эффекторной (рабочей) клетки. Синдактилия — деформация, характеризующаяся полным или неполным сращением пальцев между собой в результате задержки нормального расщепления сегментов во время эмбриогенеза. Различают кожную, перепончатую, костную, концевую формы синдактилии. Синдесмофит — участок окостенения суставной связки. Синдром — совокупность симптомов, объединенных общим механизмом возникновения и характеризующих определенное патологическое состояние организма. Синехии — спайки, сращения. Синовектомия — удаление всей или части синовиальной оболочки сустава. Синовиальная оболочка, жидкость — внутренняя оболочка капсулы сустава, сухожильного влагалища; жидкость, находящаяся в синовиальной полости, называется синовиальной. Систолический шум — шум, выслушиваемый во время сокращения желудочков сердца (систолы). Скелетное вытяжение — метод лечения повреждений и заболеваний опорно-двигательного аппарата и их последствий, заключающийся в приложении силы по оси конечности, туловища или головы. Цель — устранить смещение костных отломков, суставных поверхностей; удлинить конечность и др. Склера — плотная непрозрачная белочная оболочка глаза. Склерокистозные яичники — поражение яичников, характеризующееся аменореей, избыточным оволосением, ожирением и бесплодием. Лечение — хирургическое. Сколиоз позвоночника — боковое искривление позвоночного столба, развивается в детском возрасте. Скотома — ограниченный слепой участок в поле зрения, не связанный с его границами. Соединительная ткань — разновидность тканей внутренней среды организма, характеризующаяся наличием клеток и межклеточного вещества, представленного коллагеновыми, эластическими, ретикулярными волокнами и основным веществом. Различают рыхлую и плотную соединительную ткань. Она выполняет множество различных функций, главными из которых являются защитная, опорная, трофическая и заместительная. Соматовегетативные расстройства — расстройства в работе внутренних органов, связанные с нарушениями регулирующей функции вегетативной нервной системы. Сосудисто-нервный пучок — анатомическое образование, объединяющее сосуды и нервы, питающие и иннервирующие отдельный орган или анатомическую область. СОЭ — скорость оседания эритроцитов. Ускорение СОЭ отмечается при различных воспалительных процессах. Спазмолитический — снижающий спазм и понижающий тонус сосудов и гладкомышечных органов. Спелеотерапия — использование в лечебных целях природных пещер. Специфическая гипосенсибилизация — снижение чувствительности организма к аллергену путем введения этого аллергена в малых дозах. Используется при лечении бронхиальной астмы, крапивницы, поллинозе, аллергическом риносинусите и др. Специфическая этиология — принято считать специфическими заболевания, вызванные: гонококками, трихомонадами, кандидами, микоплазмами, хламидиями, а также туберкулез и сифилис. Спирометрия — метод измерения жизненной емкости легких. Спленомегалия — увеличение селезенки. Спленэктомия — хирургическое удаление селезенки. Спондилит — воспаление одного или более компонентов позвоночника (суставов, дисков, тел позвонков). Спондилоартроз — дистрофическое поражение межпозвоночных суставов при остеохондрозе. С-реактивный белок — белок сыворотки крови, неспецифический признак воспаления. Средостение — пространство, расположенное посередине грудной полости между правым и левым легкими, грудиной и грудным отделом позвоночника; содержит различные жизненно важные органы, крупные сосуды и нервы. Сроки гестации — сроки беременности. Стекловидное тело — прозрачная бесцветная студенистая масса, составляющая большую часть содержимого глазного яблока. Стенотическое дыхание — нарушение процесса внешнего дыхания, связанное с сужением верхних дыхательных путей или их закупоркой (дифтерийной пленкой, инородными телами). Приводит к дыхательной недостаточности вплоть до асфиксии. Стернальный пунктат — проба костного мозга, взятая для исследования костномозгового кроветворения при помощи пункции грудины. Стриктура — органическое сужение трубчатого органа, например желчного протока, мочеточника, мочеиспускательного канала. Ступор — состояние оглушенности и неподвижности. Субатрофия — умеренное снижение объема органа, ткани и клетки, сопровождающееся снижением их функций. Субдуральный — находящийся под твердой мозговой оболочкой. Сублингвально — под язык Субфебрилитет — постоянное повышение температуры тела в пределах от +37,1 до +38,0 °C, отмечаемое длительно, от двух недель до нескольких месяцев или лет. Субхондральный — подхрящевой. Суггестивная терапия — лечение при помощи внушения в состоянии гипнотического сна. Сульфаниламиды — лекарственные вещества, производные сульфаниловой кислоты, применяемые при лечении бактериальных, некоторых протозойных инфекций. Супинация — поворот кнаружи какой-либо конечности. Сурдомутизм — глухонемота. Отсутствие восприятия обращенной речи и невозможность говорить. Сфинктер — мышечный жом, регулирует выделение содержимого полого органа (например, пилорический сфинктер регулирует поступление содержимого желудка в двенадцатиперстную кишку).Т
Тампонада — заполнение ран или кровоточащих полостей стерильными ватно-марлевыми шариками, тампонами. Тахикардия — частота сердечных сокращений более 100 ударов в минуту. Телеангиоэктазия — локальное расширение капилляров и мелких концевых артерий. Встречается при гиперэстрогении (повышенном содержании эстрогенов), патологии сосудов. Темпоральная область — височная область (черепа или головного мозга). Тенезмы — болезненные, ложные позывы на дефекацию. Тератогенность — способность различных физических, химических, биологических, фармакологических веществ нарушать внутриутробное развитие плода и приводить к появлению различных пороков развития. Термография — метод регистрации спонтанного теплового излучения поверхности тела с получением термографического изображения исследуемой области. Терморегуляция — физиологическая функция, обеспечивающая постоянство температуры внутренней среды организма путем регуляции теплообмена между организмом и внешней средой. Тестикулярная феминизация — врожденное нарушение полового развития, когда при наличии мужского генетического пола (набор хромосом 46 ХУ) отмечается строение наружных гениталий по женскому типу. Причина — дефицит мужских половых гормонов и полная нечувствительность к ним тканей. Тимоаналептическое действие — эффект от лечения, приводящий к улучшению настроения и активации психики. Тимолептические вещества — лекарственные средства из группы антидепрессантов, способные улучшать настроение, снимать депрессию и оказывать седативный эффект. Тимпанический звук — звук, определяемый посредством перкуссии (см.), характеризует повышенную воздушность легких при эмфиземе. Тимпанопластика — комплекс хирургических вмешательств, целью которых являются ликвидация воспалительных процессов в среднем ухе и улучшение слуха при тугоухости. Тиреоидин — лекарственное вещество, представляющее собой гормональный препарат щитовидной железы. Тиреоидные гормоны — гормоны щитовидной железы. Т-лимфоциты, Т-хелперы, Т-супрессоры — иммунокомпетентные клетки лимфоцитарной системы, выполняющие различные защитные функции клеточного иммунитета. Токсемия — наличие токсинов в крови. Токсический гипервитаминоз — избыточное содержание витаминов в организме, приводящее к тяжелым нарушениям обмена веществ и развитию специфической интоксикации. Толерантность — устойчивость. Тонзиллэктомия — удаление миндалин. Тонзиллогенный — связанный с миндалинами. Тонография — графический метод исследования уровня и регуляции внутриглазного давления. Торакобрахиальная повязка — повязка, наложенная на область груди и руку, фиксирующая их в определенномположении. Торакоскопия — метод эндоскопического осмотра плевры, легкого и всей плевральной полости. Торпидность — неблагоприятное течение заболевания, устойчивость к лечению. Трабекулярная кость — кость, представленная трабекулярным или губчатым веществом — такие кости расположены в тех местах, где прочность необходимо сочетать с подвижностью (кости запястья, предплюсны). Транскапиллярный обмен — перенос газов (кислорода и углекислого газа), воды, микро- и макромолекул через стенку капилляра (из крови в ткани и наооборот). Трансмиссивный — передающийся через переносчика (например, трансмиссивным заболеванием является малярия, так как передается при укусе комара). Трансплацентарный путь передачи — путь передачи возбудителя инфекционной болезни через плаценту от матери к плоду. Транссудат — прозрачная жидкость бледно-желтого цвета, скапливающаяся в тканевых щелях и полостях тела вследствие нарушения крово- и лимфообращения. Процесс пропотевания этой жидкости из сосудов носит название транссудации. Трахеостомия — вскрытие дыхательного горла, является неотложной операцией при закупорке верхних дыхательных путей любого происхождения (травма, опухоль, отек, инородное тело). Тремор — дрожь, дрожание. Тромбопластин — важный фактор свертываемости крови, фермент, превращающий протромбин в тромбин, который, в свою очередь, действует на фибриноген, из которого образуется фибрин — белок, образующий кровяной сгусток. Тромбоцитопения — снижение содержания тромбоцитов в периферической крови (менее 150 000 в мл3). Тропные гормоны — гормоны гипофиза, оказывающие непосредственное регулирующее влияние на функцию периферических эндокринных желез: надпочечников, щитовидной железы, половых желез. Трофика — процессы клеточного питания, входящие в непрерывный обмен веществ. Трофические нарушения — нарушения в питании клеток, тканей и органов, приводящие к снижению их функции и последующей гибели. Тубоовариальные образования — термин, обозначающий возникновение новообразований в придатках матки (кисты, опухоли и др.) Туннельная невропатия — См. Компрессионно-ишемическая невропатия. Тургор кожи — упругость кожи. Тучные клетки — специфические клетки, содержащие в себе большое количество микрогранул с биологически активными веществами — медиаторами аллергии (гистамин, кинины и др.). При их высвобождении в тканях нарушается обмен веществ, возникают отек и спазм гладких мышц.У
Узурация — процесс образования щели, отверстия в кости, через которое выделяются продукты гнойного расплавления кости и секвестры (см.). Ульнарный — локтевой, в анатомии обозначает локтевой край предплечья. Уролитиаз — образование камней мочевого пузыря и мочевыводящих путей. Уртикарная сыпь — узелковая сыпь.Ф
Фагоцит — клетка, поглощающая микроорганизмы, чужеродные частицы, другие клетки; фагоциты подразделяют на два класса: микрофаги и макрофаги. Фагоцитарная реакция, фагоцитоз — процесс поглощения и переваривания фагоцитами микроорганизмов, других клеток, фрагментов некротизированной ткани, чужеродных частиц. Фарингоскопическая картина — внешний вид глотки, определяемый при осмотре ее слизистой. Фасцикуляция — мышечное подергивание, возникает непроизвольно. Фекально-оральный механизм передачи — способ передачи возбудителей инфекционных болезней, при котором микробы попадают в организм человека через его рот с загрязненными выделениями больного продуктами, водой, грязными руками. Фермент — вещество белковой природы, играющее в организме роль катализатора биохимических реакций. Фетоплацентарная недостаточность — нарушение кровообращения в системе «плацента — плод», приводящее к развитию хронического кислородного голодания в организме плода. Фибринозные наложения — пленки фибрина, пропотевающего через стенки сосудов в ткани под воздействием различных инфекционных и токсических агентов. Фибринолиз — процесс разрушения сгустков фибрина под воздействием ферментов противосвертывающей системы крови. Фиброзное кольцо — периферическая часть межпозвоночного диска (см.). Фиброзный процесс (см. Фиброз) — замещение соединительной тканью нефункционирующих клеток или тканей. Фиброколоноскопия — эндоскопическое обследование слизистой оболочки толстой кишки. Фимбрии — бахромки. Фитонцид — вещество, выделяемое растениями, губительно действующее на вирусы и бактерии. Фобия — патологический, необоснованный страх. Фолликулиновая фаза — период менструального цикла, во время которого доминирует гормон эстроген, в яичниках созревает яйцеклетка. Начинается эта фаза с момента окончания менструации и длится до момента овуляции. Фосфатаза — фермент, отщепляющий неорганический фосфат от фосфорных эфиров. Активность щелочной фосфатазы повышается при механической желтухе. Фонофорез — лечебная процедура, позволяющая доставлять лекарственные вещества непосредственно в ткани с помощью ультразвука. Фосфатурия — выделение нейтральных фосфатов с мочой. ФСГ — фолликулостимулирующий гормон гипофиза. Регулирует рост и развитие фолликула в яичнике и созревание яйцеклетки. Фунгистатический — обладающий свойством подавлять развитие грибков. Фунгицидный — обладающий свойством уничтожать грибки.Х
Хиломикрон — представитель класса липопротеидов, образуется в клетках кишечника, транспортирует жиры пищи, соотношение количества белка к количеству жира в хиломикроне 1:99. Период полужизни их составляет около часа. Химиотерапия — лечение болезни при помощи химических веществ, в том числе лекарственных. Адъювантная химиотерапия — химиотерапия после полного удаления первичной опухоли, проводимая для устранения возможных метастазов опухоли. Холекинетики — лекарственные вещества различного происхождения, стимулирующие выделение желчи. Холелитиаз — наличие конкрементов (камней) в желчном пузыре или желчных протоках. Холеретики — лекарственные вещества, повышающие секрецию желчи. Холецистография — метод рентгенологического исследования желчного пузыря путем введения рентгеноконтрастного вещества. Холецистэктомия — хирургическое удаление желчного пузыря. Холинергического действия препараты — лекарственные препараты, воздействующие на холинергические синапсы (см.), активируя тонус кишечника, урежая число сердечных сокращений, снижая давление, сужая зрачок и бронхи. Их воздействие подобно действию парасимпатической нервной системы, так как все парасимпатические синапсы холинергические. Холинолитики — большая группа лекарственных препаратов, основным свойством которых является способность подавлять или ослаблять действие ацетилхолина и холинергических средств. К ним относятся: атропин, скополамин, красавка, а также ганглиоблокаторы (см.) и миорелаксанты.Ц
Центральные механизмы регуляции — регулирующее влияние центральной нервной системы. Цервицит — воспаление слизистой оболочки шейки матки. Церебральный — относящийся к головному мозгу. Цилиарное тело — часть сосудистого тракта глаза, в который входит радужная оболочка и сосудистая оболочка — хориоидея. Составной частью цилиарного тела является цилиарная мышца, от функции которой зависит аккомодация глаза (см.). Цилиндрурия — выделение с мочой так называемых цилиндров, являющихся слепками с почечных канальцев. Возникает при тяжелом поражении почек, например при гломерулонефрите. Цитолиз — разрушение клетки. Цитология — 1. Учение о клетке. 2. Метод исследования прижизненно взятых или самостоятельно отторгшихся клеток организма. Цитопатогенное действие — неблагоприятное действие на клетку различных физических, химических, биологических агентов внешней и внутренней среды организма. Цитопения — снижение количества клеток (как правило, форменных элементов крови). Цитохром — железосодержащий белок, входящий в состав гемоглобина и миоглобина. Физиологическая функция его заключается в переносе электронов и осуществляется в процессе тканевого дыхания путем обратимого изменения валентности атома железа.Ч
Чашечно-лоханочный аппарат почки — анатомо-функциональное образование, включающее в себя малые и большие почечные чашки и почечную лоханку, которые совместно с мочеточником составляют мочевыводящие пути.Ш
Шванновская оболочка — оболочка нервного волокна, образованная специальными клетками, получившими название шванновских. Шлеммов канал — анатомическое образование глазного яблока, круговой венозный сосуд в толще склеры, через который происходит отток внутриглазной жидкости. Штамм — дифференцированный вариант конкретного вида микроорганизмов, определяется при микробиологическом исследовании с целью выявления источника заражения и путей распространения инфекции.Щ
Щеткина симптом — симптом раздражения брюшины, встречается при остром аппендиците, перитоните и других заболеваниях.Э
Эзофагогастродуоденальная система — отдел пищеварительного тракта, включающий в себя пищевод, желудок и двенадцатиперстную кишку. Экзантема — кожная сыпь. Экзема — воспаление поверхностных слоев кожи нервно-аллергического характера, возникающее в ответ на воздействие внешних или внутренних раздражителей, отличающееся разнообразной сыпью, кожным зудом и длительным рецидивирующим течением. Экзогенный — внешний, возникший извне. Экзотоксин — токсин, который продуцируют бактерии, с последующей секрецией его во внешнюю (для бактерий) среду. Эксдуральный — находящийся над твердой оболочкой головного или спинного мозга. Эксикоз — острое обезвоживание организма. Экскреторная урография — метод исследования почек с применением рентгеноконтрастного вещества. Экссудат — жидкость, накапливающаяся в тканях или полостях при воспалении. Возникает в результате выпота из сосудов жидкой части крови вследствие повышения проницаемости их стенок. Экстирпация — удаление матки с придатками. Экстрагенитальные заболевания — термин, применяемый гинекологами для обозначения заболеваний женщины любой локализации, кроме гинекологических. Экстракорпоральная детоксикация — метод очищения крови или плазмы от токсинов, производимого вне организма человека. Экстракорпоральное оплодотворение — процесс оплодотворения сперматозоидом яйцеклетки, произведенного вне организма женщины («в пробирке»). Оплодотворенная яйцеклетка затем подсаживается в матку, и в дальнейшем развивается физиологическая беременность. Экстрапирамидные расстройства — см. Паркинсонизм. Экстрацеребральный — внемозговой. Эктопия — расположение ткани или органа не на своем месте. Электрокаустика — метод диатермокоагуляции (см.). Электроэнцефалография — метод исследования деятельности головного мозга на основании изучения его биоэлектрической активности. Элиминация — выведение. Эмбриогенез — внутриутробное развитие. ЭМГ — электромиография — метод регистрации биоэлектрических потенциалов скелетных мышц. Эмметропия — нормальная, физиологическая рефракция (преломляющая сила) глаза. Эндемичность — длительное многолетнее присутствие в данной местности возбудителя инфекционной болезни, обусловленное природными факторами (природный очаг). Эндогенный — внутренний, возникший изнутри. Эндокардит — воспаление эндокарда. Эндокринно-вегетативный криз — патологическое состояние, связанное с нарушением вегетативно-гуморальной регуляции деятельности внутренних органов, возникшим как результат длительно действующих психотравмирующих факторов. Эндометрий — слизистая оболочка матки. Эндометриоз — появление в различных органах участков ткани, сходных по строению со слизистой оболочкой матки и подвергающихся циклическим изменениям соответственно менструальному циклу. Эндоскопия — визуальный осмотр полостей и стенок внутренних органов (пищевод, желудок, кишечник, брюшина) при помощи световолоконной оптики. В настоящее время все большее распространение получают эндоскопические операции, не требующие полостных разрезов. Эндотоксин — продукт распада бактерий в организме, вызывающий различные нарушения в организме при попадании его в кровь. Эндохондральное окостенение — процесс образования кости внутри разрушающегося хряща. Эндоцервикс — слизистая оболочка канала шейки матки. Энзимодиагностика — метод диагностики различных заболеваний, основанный на определении в сыворотке крови ферментов и их активности. Энзимопатия — недостаточность или низкая активность каких-либо ферментов. Эозинофилия — увеличение в крови числа эозинофильных лейкоцитов, часто связано с аллергическими процессами или гель минтозами. Эпигастрий — надчревье, область живота выше пупка. Эпидермис — поверхностный ороговевающий слой кожи. Эпидуральная жировая ткань — рыхлая жировая клетчатка, расположенная между твердой оболочкой спинного мозга и костными стенками спинномозгового канала. Эпизиотомия — хирургическое рассечение промежности при родах крупным плодом. Эпикард — наружная оболочка сердца (сердечная сумка). Эритема — ограниченная гиперемия кожи. Эритропоэз — термин, обозначающий процесс кроветворения — образования в костном мозге красных кровяных клеток (эритроцитов). Эритроцит — красная клетка крови, является переносчиком кислорода в организме, так как содержит гемоглобин. Эстрогенгестагеновая терапия — заместительное лечение аналогами женских половых гормонов с целью получения менструальноподобной реакции. Эстрогены — женские половые гормоны, вырабатываются яичниками под воздействием фолликулостимулирующего гормона гипофиза. Этиология — причина возникновения того или иного заболевания. Например, причиной возникновения вирусного гепатита является вирус гепатита (А, В и т. д.). Этиотропное лечение — лечение, направленное на устранение причины заболевания. Эхоэнцефалография — метод исследования головного мозга с помощью ультразвука, позволяет определить наличие объемных образований (опухолей) и, у детей первого года жизни, других изменений мозговой структуры.Я
Ядерная желтуха — токсическое поражение подкорковых узлов головного мозга с развитием специфических неврологических проявлений при выраженном повышении уровня билирубина у новорожденных. Ятрогения — заболевание, обусловленное неосторожными поступками врача (или другого лица из числа медицинского персонала).Другие издания
Актуализированные и дополненные издания медицинских бестселлеров
В этом справочнике собраны все необходимые сведения об оказании первой медицинской помощи. Благодаря этой книге каждый может быть уверен, что в любой экстренной ситуации сделает все возможное, чтобы помочь близким или даже посторонним людям. Необходимые сведения по неотложной помощи, рекомендации по составу домашней аптечки, оказание экстренной помощи детям, алгоритм действий до приезда скорой — это и многое другое вы найдете в этом справочнике.
Каждому человеку время от времени приходится прибегать к использованию медикаментов, будь то головная боль, изжога или заболевания посерьезнее. В этом справочнике вы найдете описания всех самых необходимых лекарственных средств, рекомендации по их приему, исчерпывающую информацию по контролю их качества и совместимости друг с другом. Он станет незаменимым помощником при любом недомогании для вас и ваших близких.
Возьмите с собой "SOS". Походный справочник первой помощи, и вы будете защищены
Отдых на море, на даче или просто туристический поход кроме удовольствия влечет за собой и многие опасности. «SOS. Походный справочник первой помощи» — это руководство, которое подходит для любых экспедиций, от трансарктических переходов до семейных пикников. В нем рассмотрены все проблемы со здоровьем, которые могут возникнуть у членов команды любого возраста: от самых юных до пожилых, сохранивших страсть к приключениям. Основное внимание в книге уделено незначительным проблемам, возникновение которых наиболее вероятно. При этом даются практические советы, сопровождаемые простыми и понятными иллюстрациями. Представлены также рекомендации на случай более серьезных болезней и травм, с указаниями, когда помощь пострадавшему может быть оказана на месте, а когда он нуждается в эвакуации.
Новое издание бестселлера
В этом справочнике вы найдете исчерпывающую информацию о множестве лекарственных средств. По всем препаратам даны: химическое название и структура, механизмы действия, показания к применению, способы применения и дозы, возможные побочные эффекты, взаимодействия с другими лекарственными средствами, противопоказания и меры предосторожности, формы выпуска, условия хранения и пр. Книга предназначена для врачей, фармацевтов, иных специалистов медицинской службы, для учащихся высших медицинских и фармацевтических учебных заведений, для специалистов, занимающихся созданием новых лекарственных средств, а так же для массового читателя, интересующегося вопросами здоровья и лечения заболеваний.
Справочник, написанный специалистами, для врачей и всех, кто заботится о своем здоровье
В этом справочнике максимально полно представлена информация об основных заболеваниях и синдромах для врачей общего профиля, к которым в первую очередь обращается больной. С учетом современных достижений медицины и фармакологии рассматриваются клинические проявления, методы диагностики, терапия и профилактика сердечно-сосудистых, инфекционных, ревматических, детских, гинекологических, онкологических и многих других групп заболеваний. В подготовке издания принимали участие специалисты, имеющие большой практический опыт. Четкое изложение материала, наличие предметного указателя значительно облегчают пользование книгой, а широта круга рассматриваемых вопросов делает ее весьма полезной в ежедневной работе практикующего врача.
В этом справочнике собрано более 1500 статей, которые помогут каждому фельдшеру
Здесь изложены вопросы диагностики и лечения внутренних, хирургических, инфекционных, детских и других заболеваний. Большое внимание уделено диагностике, лечению неотложных состояний, немедикаментозным методам лечения, уходу за больными, описанию различных лечебных и диагностических процедур, вопросам организации и планирования работы фельдшера на участке. Материал излагается с учетом самых современных на момент издания достижений отечественной и зарубежной медицины. В создании справочника приняли участие самые авторитетные специалисты в своих областях, их многолетний опыт, несомненно поможет фельдшеру, а также широкому кругу читателей, заботящихся о своем здоровье.* * *
Последние комментарии
1 день 22 часов назад
2 дней 3 часов назад
2 дней 4 часов назад
2 дней 6 часов назад
2 дней 7 часов назад
2 дней 8 часов назад