Оповідання з хімії [Юрій Якович Фіалков] (fb2) читать онлайн
- Оповідання з хімії 467 Кб скачать: (fb2) - (исправленную) читать: (полностью) - (постранично) - Юрій Якович Фіалков
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Юрій Яковлевич Фіалков Оповідання з хімії
ПЕРЕДМОВА
Думка написати цю книгу в мене виникла після бесіди з школярами в республіканському таборі юних техніків у сосновому борі мальовничого київського передмістя Святошино. По закінченні бесіди мене оточила група хлопчиків, і між нами зав’язалась та невимушена розмова, заради якої я так люблю зустрічатися з школярами. Мова зайшла про те, як народжуються проблеми, розв’язанням яких займаються в своїх лабораторіях хіміки. — Не видумують же їх ось так, — сказав один з моїх юних співбесідників, приставивши пальця до лоба і явно передражнюючи одного з комедійних персонажів фільму «Весна», який твердив, що варто лише вченому задуматись «ось так» — і відкриття готове. Я сказав моїм юним друзям, що в роботі вченого буває набагато більше буднів, ніж свят. Зате ці будні заповнені захоплюючою працею. Романтика відкрить захоплює не тільки обвітреного і засмаглого капітана, не тільки бувалого геолога й безстрашного мандрівника. Повсякденна праця хіміка, хоч вона й виявляється більше в безперервних і одноманітних аналізах, теж сповнена романтики — романтики зустрічі з невідомим, з тим, що ти взнав перший. Кожне відкриття в хімії — це цікава історія, сповнена великого драматизму — радості й гіркоти, знахідок і втрат, розчарувань і тріумфу. Пам’ятна розмова в республіканському таборі юних техніків примусила мене в нарисах, пропонованих увазі читача, наголосити на одному моменті. Група моїх співрозмовників, очевидно тих, хто вирішив присвятити себе хімії, схвильовано допитувалась, чи не трапиться така прикрість, що їм після закінчення школи й інституту вже нічого буде робити, бо, судячи з темпів розвитку цієї науки, всі великі відкриття вже будуть зроблені. Таке запитання здалося мені спочатку смішним, та пізніше я пригадав, як мене самого приблизно в такому ж віці мучили подібні сумніви. Тому я й вирішив докладно спинитись на проблемах, ще не розв’язаних сучасною хімічною наукою і над якими працюватимуть ще, коли сьогоднішні школярі вступлять в армію науковців. Ці нариси не претендують на повний виклад сучасного стану хімії. Для цього потрібна була б не одна, а, може, десять таких книжок. Та деякі актуальні проблеми знайшли тут своє відображення. Книга може бути корисною для позакласного читання з хімії, а також для вчителів та студентів.ЩО КРИЄТЬСЯ ЗА КОМОЮ…
Коли я вперше прочитав замітку Бейкера, яка загубилася серед інших статей товстелезної книги «Журналу англійського хімічного товариства» за 1922 рік, вона дуже вразила мене своєю незвичайністю. Та я й не думав тоді, що бажання глибше розібратись у суті описаних там явищ приведе мене до таких далеких один від одного і таких не схожих між собою фактів. І ось тепер цих фактів так багато, що я не знаю, з чого почати… Найкраще, очевидно, буде почати з того, що відбувалось у великому будинку на берлінській вулиці Дінгельштрассе в жаркі серпневі дні 1933 року. В імперському митному суді був великий день. Слухалася справа про американську платину. На лаві підсудних сиділи вісім власників найбільших берлінських ювелірних магазинів. На комерційні операції панів ювелірів поліцейське управління завжди дивилося крізь пальці. Коли ж анонімні доноси вже стали надто настирливими, довелося зробити обшук. І в усіх магазинах були виявлені великі запаси платини. На допиті ювеліри давали плутані відповіді, а за митними книгами такої кількості металу з-за кордону не було завезено. Почався судовий процес, в результаті якого на найбільших ювелірних магазинах Берліна вже три місяці сумно висіли замки. Пани ювеліри твердили, що платина — німецького походження і сплавлена з різних платинових виробів. Поліцейське управління настоювало на своєму: платина завезена потай з Південної Америки і відлита в невеличкі злитки майже стопроцентного металу. Нескінченні дебати сторін встигли досить-таки набриднути публіці, а тому, коли голова суду надав слово вченому-експерту, професору Ноддаку, рівномірний гул в залі нітрохи не зменшився. Серед людей, які розкриють суть справи, публіка називала імена судді, прокурора, адвокатів. Ніхто й подумати не міг, що вирішальну роль тут відіграє висновок скромного експерта Вальтера Ноддака. Не часто в урочисто-казенному залі імперського суду вимовляли фізичні й хімічні терміни. Голова суду морщив лоба, слухаючи професора і намагаючись пригадати мізерні відомості з хімії, здобуті ним у правовому училищі. — Сучасна аналітична хімія, — говорив експерт, — має величезні можливості, які часто не використовуються дослідниками. За допомогою різноманітних хімічних реакцій ми можемо в 1 г речовини виявити до 0,001 мг домішок, що складають одну десятитисячну частку процента. Навіть найчистіша речовина має певну кількість домішок. Коли ж користуватись методами рентгенівського або спектрального аналізів, то можна визначити кількість речовини в 10–9г. Це вже одна десятимільйонна частка процента. Застосовані нами методи аналізу показують, що в будь-якій речовині є як домішки майже всі елементи періодичної системи. — Чи не може пан експерт, — перебив Ноддака в’їдливий адвокат одного з ювелірів, — сказати, скільки в мені міститься, наприклад, золота? — Якщо тіло пана адвоката особливо не відрізняється за своїм складом від тіла сірих щурів, над якими ми проводили експерименти, то три десятимільйонні частки вашої поважної ваги варто віднести за рахунок золота, — спокійно відказав експерт. — Я продовжуватиму, пане голово. Характер домішок до даної основної речовини різний залежно від того, яким способом і де одержано цю речовину. Ось перед вами два злитки. Обидва вони характеризуються однаковим ступенем чистоти: 99,999 %. Та співвідношення різних елементів з числа домішок, тобто відношення до кількості основної речовини, позначеної п’ятьма дев’ятками, різне. Нам пощастило встановити, що характер домішок платини американського походження істотно відрізняється від домішок платини з інших рудників. Платина, запропонована мені для дослідження, безсумнівно американського походження. Про це свідчить як велика кількість міді в ній, так і мала кількість миш’яку. Не маючи наміру більше втомлювати високий суд доведенням очевидного, дозвольте на цьому вважати свою місію закінченою. Цей висновок експерта і зумовив вирок суду. А втім, вирок не був занадто суворим. Підсудні — дуже багаті люди, а з такими новонароджений райх волів зберігати добрі стосунки. Ось яке несподіване практичне застосування дістала так звана проблема малих кількостей речовині А виникла ця проблема давно…Терези створюють хімію
Назва, яку Петро І дав будинку, що виходить своїми вузькими і високими вікнами на Неву, — Кунсткамера — збереглася й досі. Тепер там не демонструють заспиртованих потвор. У цьому музеї серед інших експонатів зберігаються дорогі для історії нашої вітчизняної науки реліквії — прилади, якими користувався Ломоносов. Урочисто застиг у ніші телескоп, тьмяно відсвічує потемнілий від часу глобус, під стелею висить складний прилад для добування атмосферної електрики. Зовсім непомітно у віддаленому кутку стоять під скляним ковпаком терези ломоносівської лабораторії. Якби не були такими строгими традиції академічного музею, ці терези слід було б освітити яскравим світлом і прикріпити урочистий напис «Прилад, що поклав початок сучасній хімії». Відкривши закон збереження ваги речовин, експериментально доведений на цих самих терезах, Ломоносов тим самим утвердив хімію як точну науку. З тих пір терези стали головним знаряддям досліджень хімії. Чим би хімік не займався в своїй лабораторії: чи добуванням нової речовини, чи детальним дослідженням уже відкритих сполук, чи вивченням якоїсь реакції, завжди його роботу вінчає хімічний аналіз. Лише аналіз може дати відповідь на запитання, яку саме сполуку добув учений, чи правильно він вів процес, чи досяг бажаного результату. Не минуло й 100 років після впровадження Ломоносовим терезів у практику наукових досліджень, як вчені вже мали прилади, з допомогою яких можна було зважувати з точністю до 0,001 г. А ще через якихось 40–50 років у кожній хімічній лабораторії стояли терези з чутливістю до 0,0002 г. Для того щоб результати аналізу були достовірними, потрібно, визначаючи процентний вміст елементів у досліджуваній речовині, бути впевненим, що цифри, які відповідають сотим часткам процента, визначені правильно. Якщо для дослідження складу сполуки брати кількість речовини в 1 г, то неважко підрахувати, що десятитисячні частки грама якраз і складатимуть ті необхідні соті частки процента, щоб з певністю судити про склад сполуки. Минуло небагато часу, і вже 1 г, який хіміки брали звичайно для аналізу, стало забагато. Справді, при виготовленні якоїсь речовини доводиться провадити багатостадійний синтез протягом двох-трьох тижнів, а часом і довше, в результаті чого дістаєш кілька грамів речовини. Нелегко зважитись на те, щоб майже половину цієї кількості витратити на аналіз. А при хімічному аналізі речовина втрачається безповоротно: її розкладають на складові частини. На проведення аналізу дослідники могли відпустити щонайбільше десяті частки грама. Але тоді потрібно в 10 раз підвищити точність зважування. Так у хімію увійшов п’ятий десятковий знак… Терези, на яких можна зважувати з такою точністю, тепер в хімічних лабораторіях вже не рідкість. Вони помітно відрізняються від своїх «чотиризначних» товаришів. Стоять вони, як правило, в окремій кімнаті на спеціальній підставці, укріпленій в стіні, температура в приміщенні повинна бути сталою. Один зайвий десятковий знак — і які ускладнення! Та й п’ятий десятковий знак — не межа для хіміків. Минуло ще 35 років, і хімікам довелося зіткнутися з визначенням таких мізерних кількостей речовини, що, якби такі маніпуляції приснилися дослідникові кінця минулого століття, це здалося б йому маренням. На початку 40-х років нашого століття з’явились перші праці з хімії зауранових елементів — елементів, які в періодичній системі стоять після урану. Вчені їх добули штучно, за допомогою ядерних реакцій. Дослідники бюретками відміряли не мілілітри, як у звичайних хімічних лабораторіях, а одну стотисячну мілілітра. Найбільші хімічні стакани, якими маніпулювали автори цих статей, мали в діаметрі 1 мм; доводилось зважувати кількість речовини в 0,001 г, причому це робилося з точністю до 0,000001 г. Уявіть собі, як доводиться вести роботу з такими кількостями речовини! Її обережно переливають з однієї посудини в іншу, слідкуючи, щоб не пролилась жодна крапля. А втім, яка там крапля! Про краплю тут не може бути й мови, бо крапля в тисячу раз більша від усього розчину. Ну, а терези, який вигляд мають вони? Коромисло зроблено з чистого кварцу, завтовшки з людську волосину. Більшість частин цього приладу взагалі невидима для неозброєного ока. Ось які вони тонкі й невагомі! Такі терези в звичайній кімнаті не поставиш. Навіть на абсолютно нерухомій підставці вони зазнають коливань. Пройде вулицею біля будинку, де міститься лабораторія, людина — і коромисло вже коливається, зважувати не можна. Проїде за три квартали вантажна машина — знову терези «хвилюються». Стоять ці терези в глибокому підвалі. Наближаються до них з більшою обережністю, ніж лікар до тяжко хворого. В цій кімнаті не можна голосно розмовляти, сильно розмахувати руками. І все це для того, щоб зважувати з точністю до 0,000001 г. Ось що таке шостий десятковий знак і чого він коштує дослідникам. Чому в хімії з’явилася потреба в шостому десятковому? Для чого вся ця хитромудрість? Перші штучні елементи спочатку були добуті в надзвичайно малих кількостях — у десятитисячних, а в деяких випадках навіть у мільйонних частках грама. А знати, причому абсолютно точно, властивості цих елементів було вкрай необхідно. Хоч вченим довелось оперувати мізерними кількостями речовини, вони дістали вичерпні дані про хімічні і фізичні властивості сполук. А в тому, наскільки малими були ці кількості, можна пересвідчитись хоча б з рисунку, де зображена вся наявна кількість гідроокису америцію до 1945 року. Так через двісті років після Ломоносова хіміки досягли, здавалось, межі можливого. Хто знав, що не мине й кілька років, як промисловість вимагатиме від хіміків уміння визначати такі кількості речовин, які в порівнянні з описаними вище були такими, як піщинка в порівнянні з великою горою? Ось тут і довелося згадати одну історію, яку майже всі вчені називали науковою сенсацією.Проблеми виникають так…
Так само, як і інші сенсації, це відкриття в 20-х роках нашого століття наробило багато галасу в наукових і білянаукових колах, а потім з незбагненною швидкістю забулось і протягом якихось двадцяти років не згадувалось. Чому? Може тому, що надто неймовірними здалися хімікам 20-х років факти, які були описані в кількох невеликих статтях, уміщених у наукових журналах. І, як часто буває, люди визнали за краще не шукати розгадки цих дивовижних явищ, а просто забути про них. А було це так… Певно, слід почати з хіміка Кольрауша, який протягом кількох років одну й ту саму порцію води переганяв з однієї посудини в іншу. На відміну від вчених острова Лапути, так блискуче описаних Свіфтом в його «Подорожі Гуллівера», Кольрауш мав істинно наукові цілі. Він намагався очистити воду. Та невже очищення води є такою складною справою, що вимагає багато років роботи? Авжеж так. Ось хімік прийшов у лабораторію. Йому потрібна вода, щоб приготувати розчин, по можливості вільний від домішок. З водопровідного крана він наливає її в колбу. На погляд хіміка, ця вода страшенно «брудна». У ній багато солей натрію, кальцію, калію, магнію. Коли вода текла по трубах, у неї перейшло залізо в кількості, достатній для того, щоб виявити його з допомогою роданіду калію. На водоочисній станції воду хлорували, і при цьому в ній залишилась така кількість хлору, що додача до неї кількох крапель азотнокислого срібла робить її схожою на молоко: це випало хлористе срібло. Крім того, у воді є значна, з точки зору хіміка, кількість органічних речовин: найдрібніші частки рослин, бактерії тощо. У водопровідній воді розчинено дуже багато повітря. Це видно хоч би з того, що, коли холодна водопровідна вода постоїть у кімнаті, на стінках склянки з’явиться велика кількість повітряних бульбашок. А вуглекислий газ, розчинений у воді? А сірчистий газ, який поглинули води Дніпра, протікаючи повз завод, опалюваний вугіллям? А фенол, що його десь у верхів’ї випустив у Дніпро недбайливий директор хімічного заводу? Словом, у водопровідній воді, крім водню й кисню, є ще добра третина елементів періодичної системи Менделєєва. Нехай ці домішки і не шкідливі для спраглої людини, але хіміку вони дуже заважають. Щоб видалити домішки, воду кип’ятять спочатку з лужним розчином перманганату калію. При цьому окислюється більшість органічних речовин, що знаходиться у воді. Потім повторно кип’ятять воду з підкисленим розчином перманганату. Ця операція повинна привести до остаточного зруйнування всіх органічних речовин. Після цього воду переганяють і звільняються від основної кількості домішок: солей металів, значної частини повітря. Добута дистильована вода далеко ще не чиста. В ній залишилось порівняно багато повітря, залишився майже весь вуглекислий газ. Всі операції проводились у скляній посудині, значить, вода містить багато їдкого натру та кремнійової кислоти, які перейшли до її складу з посуду. Словом, до чистої води ще далеко. Дистильовану воду знову кип’ятять кілька годин, щоб виділити якомога більше газів, у тому числі й хлор, а потім переливають у перегінну колбу, виготовлену з платини. Холодильник, де конденсується водяна пара, відлитий з олова, прийомна колба теж виготовлена з платини. Адже ці метали майже не розчиняються у воді. При перегонці треба стежити, щоб вода ніде не стикалась з повітрям, бо вона знову натягне кисень, азот і вуглекислий газ. Тепер вода вже називається бідистилатом. З цією водою вже можна працювати. Бідистилат — не абсолютно чиста вода. Встановити це легко. Досить опустити у воду електроди, сполучені з джерелом електричного струму, і стрілка приладу покаже, що вода проводить електрику. Але ж вода — не електроліт, отже, не повинна проводити струм. Очевидно, з неї не повністю видалено домішки. Електропровідність цієї води невелика і має порядок 10–6 зворотних омів. Кольрауш значно старанніше очистив воду і одержав електропровідність у 100 раз меншу; вода у нього була набагато чистішою. Та досить було йому потримати цю воду кілька хвилин у відкритій посудині — в контакті з повітрям, як електропровідність почала швидко збільшуватись. Те, що я розповів про воду, можна з успіхом віднести до будь-якої іншої речовини. Тільки очищати інші речовини здебільшого доводиться ще довше. Важко приготувати очищену речовину, а ще важче зберегти її в чистому стані. Особливо важко уберегти чисті речовини від домішок повітря і вологи, якими насичена атмосфера. Ось чому очищені речовини часто запаюють у скляні або виготовлені з іншого матеріалу посудини. Так зробив одного разу англійський хімік Бейкер, запаявши у скляній трубці азотистий ангідрид. Правда, нін запаяв цю речовину у контакті з п’ятиокисом фосфору, бо випадково домішав до азотистого ангідриду деяку кількість води. А п’ятиокис фосфору, як відомо, є одною з найжадібніших до води речовин; майже жодна з відомих нам сполук так сильно не притягує воду, як цей білий порошок. У викладеному вище нема нічого дивного, що могло б послужити матеріалом для сенсації. Минуло п’ять років. І ось Бейкер згадав, що в його лабораторії зберігається трубка з запаяним азотистим ангідридом, потрібним йому для якогось експерименту. Хіміки всього світу звичайно очищають рідини перегонкою. Щоб відокремити азотистий ангідрид від кусочків п’ятиокису фосфору, Бейкер налив рідину в перегінну колбу і приступив до діла. Почалася перегонка як завжди: ангідрид налили в охолоджену колбу, бо він кипить вже при температурі +3,5°. Прийомник, де мала збиратися перегнана рідина, теж помістили в лід. Бейкер почав чекати, коли ангідрид, попільно нагріваючись при кімнатній температурі, почне переганятись. Минуло десять хвилин, двадцять, а перегонка не починалась. Розмовляючи з своїм співробітником, Бейкер машинально глянув на термометр, занурений в рідину, і замовк на півслові. Термометр показував 20°, тобто температуру навколишнього повітря. Азотистий ангідрид повинен був уже давно кипіти, а рідина в колбі залишалась нерухомою. Знизавши плечима у відповідь на німе запитання асистента, Бейкер почав обережно підігрівати колбу. Ніякого ефекту: синя рідина лишалась зовні спокійною. 30°… 35°… 40°… і тільки при 43° почалась перегонка. «Можливо, це не та рідина, за яку я її вважаю?» — майнула в Бейкера думка. Негайно був зроблений аналіз — чистий азотистий ангідриді Знову повторили перегонку при 43°. За сусіднім столом асистент Бейкера, озираючись на загадкову колбу, гарячково готував з азотної кислоти азотний ангідрид. Ось вона, синя рідина, яка зовнішнім виглядом нічим не відрізняється від своєї сусідки. Яка ж буде її температура кипіння? Термометр показав 3,5°. Знову почали переганяти першу рідину. І знову 43°! Бейкер наказав запаяти обидві рідини, одягнувся і вийшов. Залишатись в лабораторії віч-на-віч з цією загадкою він більше не міг. Що ж так вразило англійського хіміка? Невже якихось сорок градусів могли бути причиною такого сильного хвилювання?! Могли.Чи постійні «постійні величини»?
Справа в тому, що кожна речовина, кожна хімічна сполука мають цілком визначені фізичні й хімічні властивості. Можна брати, наприклад, воду з Індійського океану, з запліснявілого болота, з полярної крижини, з калюжі на дорозі — яке б не було її походження, завжди вона замерзатиме при 0°, а кипітиме при 100°. Бензол, добутий шляхом переробки кам’яного вугілля, і бензол, добутий синтетично з ацетилену, не відрізняються один від одного ні на йоту. Отже, кожній хімічній сполуці відповідає цілком певна температура кипіння, температура плавління, густина і т. д. Це правило лежить в основі процесів добування очищених речовин. Якщо хочуть, наприклад, одержати чисту оцтову кислоту, то виділяють з неї домішки доти, поки температура плавлення її не дорівнюватиме 16,6°. І дослідник може бути впевненим, що він тримає в руках чистий препарат оцтової кислоти. Якщо хімік, переганяючи якусь речовину, бачить, що при нормальному атмосферному тискові вона кипить, скажімо, при температурі 110,8°, то він впевнено може сказати, що в колбі толуол. Але тепер те, що кожній речовині відповідають тільки її притаманні властивості, треба було ще довести. Є речовини, з якими хіміки мають справу майже щодня. Для цих речовин температури кипіння і плавлення були визначені особливо старанно. З них і вирішив Бейкер почати чергову серію дослідів. Читач вже знає, як важко хімікові добути чисту речовину. Очевидно, чим вища ступінь очистки речовини, тим важче її приготувати. Можна старанно очистити якусь органічну речовину від домішок неорганічних речовин. Значно важче, але також можливо очистити цю сполуку від домішок сторонніх органічних речовин. Та як уберегтися речовині від повітря, від водяної пари, що міститься в ньому? Ось чому, приступаючи до очистки бензолу, брому, сірковуглецю, спирту та інших речовин, Бейкер вже знав, що від води, найменших часток її, врятуватись йому не пощастить. Звідси основна передумова досліду така: всі описані досі хімічні сполуки, якими б чистими вони не вважались, завжди мають в собі деякі домішки води. Завдання досліду — добути цілком чисті, вільні навіть від слідів води, речовини. Для цього в скляні трубки разом з п’ятиокисом фосфору були запаяні старанно очищені речовини і покладені в шухляду лабораторного стола. В робочому журналі з’явився запис: «27 листопада 1913 року». Далі стояли нові дати: «січень… березень… червень 1914 року». На цьому записи обірвались. Почалася перша світова війна. До своїх трубок Бейкер повернувся аж через 9 років (у 1922 році). Трубки він відкривав в умовах, які виключали присутність вологи: посудини старанно просушувались, кінці трубок відламували під ртуттю і т. п. Результати перевершили всі сподівання. Першим переганяли бензол. «Звичайний» бензол, як показують всі довідники, має температуру кипіння 80°, а цей закипів при 106°. Далі Бейкер із співробітниками ледве встигали записувати в лабораторні журнали нові дивовижні факти: діетиловий ефір кипів при 83°, тоді як звичайна температура кипіння його 35°, бром починав переганятись при 118° (звичайно бром починав кипіти при 59°), ртуть кипіла при 459° замість 357°, сірковуглець — при 80° (звичайна температура кипіння 46°). Перші ознаки кипіння спирту з’явились при 138°, а не при 78,4°. Так само «поводили себе» й інші речовини, всього було — 11. Коли Бейкер через кілька днів повідомив про всі ці факти вчених колег, ті зустріли це по-різному: одні одверто реготали, такими неправдоподібними здалися їм його слова; інші глибокодумно закочували очі, а коли Бейкер відходив, здивовано знизували плечима; треті, найбільш далекоглядні, гаряче переконували вченого: — Дивуюсь, дорогий колего! Невже ви не бачите, що маєте справу з звичайнісіньким явищем перегрівання, коли дуже чиста рідина може деякий час залишатись в рідкому стані трохи вище температури кипіння? — Перегрівання, панове, — починав сперечатися Бейкер, — тут абсолютно виключене. По-перше, на дні колби, з якої велась перегонка, лежали кусочки пористого фарфору, а це, як відомо, виключає можливість перегрівання. По-друге, як починається кипіння при перегріванні? Рідина лишається зовні спокійною, поки температура не підніметься на кілька градусів вище температури кипіння, а потім раптово і дуже бурхливо закипає. Весь вміст колби стає пінистим. А в даному разі кипіння починалось цілком спокійно, так само проходила й перегонка. Крім того, не слід забувати, що перегрівання буває завжди не більшим, ніж на три-чотири, найбільше — на 10 градусів, а тут 70–80 градусів! Ні, колеги, це не перегрівання. Колеги вже й самі бачили, що в цих дослідах нема нічого спільного з явищем перегрівання. Це клало кінець науковим суперечкам, і далі розмова вже входила в сферу ненаукову: — Ну, знаєте, все може бути… — і співрозмовники розводили руками так, ніби вони були не шанованими членами Королівського товариства, а звичайнісінькими школярами. Отже, в наявності — наукове відкриття. Все було б добре, якби Бейкер сам хоч в якійсь мірі догадувався, яким чином тривале осушування речовини може привести до таких разючих результатів. До того ж, через кілька днів з’ясувались нові факти: речовини, піддані тривалому осушуванню, змінювали також температуру плавлення. Ромбічна сірка плавилась при 117,5° замість 112,8°, йод — при 116° замість 114°. У бік збільшення змінилася й температура замерзання рідин: бром замерзав при температурі на 2,8° вище звичайної, а бензол — на 0,6°. Що ж це за явище? Поки що зрозуміло дуже й дуже небагато. Нема сумніву, що «винна» у всьому волога, сліди якої видалені з осушуваних речовин при багаторічному контакті з п’ятиокисом фосфору. Доказом цього може бути хоч би й те, що, коли ці рідини залишити на повітрі, температура їх кипіння починає швидко знижуватись і за якихось 5–6 хвилин досягає звичайної. Очевидно, це пов’язано з поглинанням води з повітря. Крім того, можна було догадатись, чому для досягнення цього ефекту, названого Бейкером «ефектом осушування», треба було піддавати речовини такому тривалому осушуванню. Один з дуже важливих хімічних законів — закон діючих мас, відкритий видатним російським вченим М. М. Бекетовим, говорить: швидкість хімічних реакцій пропорційнальна добутку концентрацій взаємодіючих речовин. Якою ж могла бути початкова концентрація води в бензолі, старанно очищеному Бейкером перед тим, як запаяти його разом з п’ятиокисом фосфору? Важко сказати. Та навряд чи більше однієї стотисячної частки процента. Після того як процес осушування почався, ця кількість спочатку швидко, а потім все повільніше й повільніше зменшувалась: мільйонна частка процента, десятимільйонна, стомільйонна… Якщо підставити цю концентрацію в добуток, яким визначається швидкість реакції, то неважко буде уявити, якою мізерною виявиться ця швидкість. Ось чому для абсолютного осушення бензолу та інших речовин потрібні роки. Деякі сторони явищ, спостережених Бейкером, можна було пояснити, а от найголовніше питання, найголовнішу проблему: яким чином мільйонні частки води так сильно впливають на властивості речовин, розв’язати не вдавалось. Не дивно, що результати дослідів Бейкера викликали полеміку серед вчених того часу. Адже й тепер, майже через 40 років після цього відкриття, читач, очевидно, здивований: у чому ж суть такого дивовижного впливу мізерних домішок води? Зрозуміло й те, чому це відкриття стало сенсацією в повному розумінні цього слова, тобто про нього дуже швидко забули. Мало хто з дослідників наважувався повторити ці експерименти. У кого вистачить терпіння провадити дев’ятирічний дослід! Однак армія хіміків на землі велика, знайшлося кілька чоловік, які спокійно, без полемічного запалу взялися перевірити дослідні дані англійського вченого.Нові факти, нові запитання
Через кілька років почали з’являтися окремі праці, присвячені питанню «ефекту осушування». З’ясувались деякі подробиці, а для науки ніщо так не важливо, як подробиці. Амстердамський хімік Смітс вирішив по можливості зменшити час, необхідний для одержання цього «ефекту». Він встановив, що основна кількість води потрапляє в осушувану речовину головним чином з мікроскопічних капілярів у склі посудини, де зберігається рідина. Звичайне нагрівання не може видалити воду з капілярів. Смітс створив досить складний прилад, з допомогою якого можна сплавляти капіляри, одночасно відкачуючи з них повітря, а отже, і водяну пару. Такий прилад дав можливість значно зменшити початкову кількість води в осушуваній речовині. Смітсу вдалося досяіти «ефекту осушування» за один рік, а в деяких випадках навіть за дев’ять місяців. Інший фізико-хімік — Мейлі довів, що час осушування можна значно скоротити, якщо посуд з запаяними в ньому в контакті з п’ятиокисом фосфору речовинами зберігати при високій температурі. Це була правильна ідея, бо з підвищенням температури швидкість хімічних реакцій значно прискорюється. Такі тривалі експерименти, певно, набридли навіть ентузіастам. Настала кількарічна пауза, і лише в 1927 році знову з’явилася стаття про «надчисті». Автор її — той самий Смітс. Він розглядає питання, чи підвищується температура кипіння осушуваних рідин раптово, стрибком чи поступово, в міру видалення вологи. Смітс взяв старанно очищений бензол, який спочатку мав температуру кипіння 80,1°. 2 червня 1924 року дослідник запаяв бензол разом з п’ятиокисом фосфору у спеціальний прилад, де рідину можна було переганяти з одної посудини в іншу без контакту з повітрям. 25 серпня бензол уже мав температуру кипіння 81,5°. 23 лютого 1925 року він кипів при температурі 87°. У цей день експериментатора спіткало лихо: на колбу з бензолом упав металевий предмет, і вона дала тріщину. Тріщинка була ледь помітною, і її майже одразу запаяли, однак і цих кількох хвилин виявилось досить, щоб у колбу проникла з повітря якась кількість вологи. Дослід був зіпсований: термометр знову показував 80°. Довелося все починати з початку. Через місяць після злополучного випадку бензол кипів при 81,5°. Ще через місяць температура кипіння досягла 83°, і, нарешті, через рік весь бензол переганявся в інтервалі 86,6–87,7°. На цьому дослід був припинений. Хоча, продовжуючи далі осушування бензолу, можна довести температуру його кипіння до величини, досягнутої Бейкером — 106°, а може й вище. Тим часом Бейкера і його нечисленних послідовників мучило питання: в чому ж річ, чому тгкі мізерні домішки води так разюче впливають на властивість речовин? Минали роки, а до розв’язання цього питання було так само далеко, як і в 1913 році, коли вперше був відкритий цей «ефект». Та коли вчені піднялись ще на кілька східців, коли з’явилось ще кілька праць, над деякими незрозумілими явищами замерехтіло світло розгадки. Один з наступних дослідів показав, що старанно осушені речовини під час перегонки «поводяться» не так, як «звичайні». При перегонці «звичайних» речовин температура всього об’єму рідини повільно підвищується і потім, при певній температурі, що має назву температури кипіння, рідина починає переганятись, причому кипіння проходить строго при цій температурі до кінця досліду. Коли ж уважно вивчили процес перегонки старанно осушеного гексану (вуглеводень С6Н14), то виявилась зовсім інша картина. Звичайний гексан кипів при температурі 69°. Внаслідок кількарічного осушування температура його кипіння досягла 82°. Одержавши «гексан-82» (читач уже розуміє, що може бути «гексан-69», або гексан звичайний, «гексан-72» і «гексан-75» і т. д. — в залежності від того, скільки часу осушувалася ця речовина), дослідники почали вивчати процес його перегонки. Сподівання не обманули вчених. Перегонка відбулася справді незвичайно. Перші ознаки кипіння з’явились при температурі 79°. З цього моменту температура кипіння почала рівномірно підвищуватись, поки не досягла 82°. При цій температурі і перегналась більша частина гексану. Та перегонка, подібна вищеописаній, спостерігається лише для суміші кількох речовин. А тим часом у колбі міститься тільки гексан, причому надзвичайно чистий. І цей гексан кипить при кількох температурах! Кілька гексанів в одній речовині! Неймовірно, але факт! Попутно виявилось ще кілька цікавих фактів. Речовини, піддані тривалому осушуванню, змінюють не тільки температуру кипіння, а майже всі свої фізичні властивості: показник заломлення, поверхневий натяг, теплоту випаровування і т. д. Ці нові факти додали чимало знаків запитання до тих, які вже стояли біля цієї проблеми. Чергова стаття Бейкера поставила все на свої місця.) Була визначена густина пари речовин, підданих тривалому осушуванню. А знаючи густину пари, можна визначити молекулярну вагу речовини в паровидному стані. Ці вимірювання показали, що молекулярні ваги вивчених речовин у всіх випадках перевищують визначені. Так, молекулярна вага діетилового ефіру (С2Н5)20, як виявилось, дорівнює 170. Коли ж скласти вагу всіх атомів, що входять в молекулу діетилового ефіру, то вийде величина 12∙4 + 10 + 16 = 74. Виходить, що молекули ефіру, підданого тривалому осушуванню, збираються в агрегати, по двоє-троє. До такого висновку можна прийти тому, що виявлена молекулярна вага в два-три рази перевищує розраховану. Подібні результати показали й інші речовини. Так, молекулярна вага метилового спирту перевищувала визначену майже втроє, молекулярні ваги брому, бензолу та чотирихлористого вуглецю збільшились у півтора раза, гексану — вдвоє, сірковуглецю — в 2,7 раза і т. д. Отже, всі висушені і дуже чисті речовини знаходяться в парах у вигляді агрегатів молекул, або, як кажуть, в асоційованому стані. В рідинному стані величина цих агрегатів, або ступінь асоціації, повинна бути ще більшою. Тепер зрозуміло, чому температура кипіння цих рідин так відрізняється від температури кипіння рідин звичайних. Природно, що енергія, потрібна для відриву одної від одної молекул з меншою молекулярною вагою, повинна бути меншою, ніж для молекул з більшою молекулярною вагою. А звідси — і підвищення температури кипіння. Здавалось, тепер вже можна полегшено зітхнути, бо знайдено ключ до всіх знаків запитання: молекули дуже чистих речовин збираються в агрегати, і цим вони відрізняються від молекул речовин просто чистих. Все інше — наслідок цього явища. Взяти хоча б перегонку гексану, про яку ми вже говорили. Спочатку в газоподібний стан переходять прості молекули, а потім складні, які зв’язані по двоє-троє і т. д. Ось чому перегонка гексану йде не при одній температурі, а в деякому інтервалі. Однак тільки тепер починаються найнезрозуміліші речі. Явище асоціації само по собі не викликає здивовання. Хімікам відома величезна кількість речовин, які в рідкому та газоподібному стані асоційовані. Якщо ми визначимо молекулярну вагу пари, наприклад, оцтової кислоти, то знайдемо, що вона дорівнює 120, тоді як теоретично молекулярна вага цієї речовини — СН3СООН — дорівнює 60. Отже, в оцтовій кислоті молекули тримаються попарно. Таких прикладів можна навести ще багато. Усі речовини, здатні до асоціації, мають спільну властивість: позитивний заряд їхньої молекули зосереджений в одній частині, а негативний — в іншій. Молекули оцтової кислоти побудовані саме так і це пояснює, чому молекули оцтової кислоти намагаються об’єднатися. Позитивний полюс однієї молекули притягує негативний полюс іншої. У рідинному стані, коли віддалі між молекулами значно зменшуються порівняно з паровидним, агрегати молекул більші: вони можуть об’єднуватись по четверо, по шестеро і Т. д. Наскільки зрозуміла причина асоціації речовин, у молекул яких розділений електричний заряд, або, як кажуть вчені, молекули яких мають дипольний момент, настільки ж повинно бути очевидно й те, що речовини, які не мають його, не можуть асоціюватися. У більшості речовин, з якими експериментували Бейкер та Смітс, дипольний момент дорівнює нулю. Тому вони й не можуть асоціюватись. Так на місце одного розв’язаного питання прийшло принаймні два. Перше: чому саме вода має такі чудові властивості, що найменші домішки її мають такий величезний вплив на властивості речовин? Друге: що примушує молекули речовин, які не мають дипольного моменту, асоціюватися всупереч законам фізики й хімії?. Така вже доля вчених. Ніколи їм не досягти того рубежу, де можна було б сказати: «Все, більше в цій галузі вивчати нічого. Можна спокійно відпочивати». Одне розв’язане питання тягне за собою десятки інших.Чому вода?
Чому саме вода має такі виключні властивості? Очевидно, вона чимось дуже відрізняється від інших неорганічних і органічних речовин. Тоді якою своєю властивістю? Може, густиною і в’язкістю? Ні, сотні речовин мають такі ж величини цих властивостей, як вода. Може, поверхневим натягом, показником заломлення, температурою кипіння або плавлення? Ні, і ці властивості води не показові. Може, електропровідність, дипольний момент або діелектрична стала? Так. Здається, вона. Справді, діелектрична стала води дуже відрізняється від діелектричних сталих інших речовин. Діелектричною константою у фізиці називають величину, яка показує, в скільки разів ослаблюється електрична взаємодія в даному середовищі в порівнянні з пустотою. Для води ця величина дорівнює 81. Для бензолу, наприклад, вона становить 2,2, для гексану — 1,9.
Погляньмо на таблицю, де зведено дані діелектричних сталих речовин. Жодна речовина не може зрівнятися в цьому відношенні з водою. Найближча до води — мурашина кислота, але і в неї діелектрична стала у 1,5 раза менша. Може, саме в надзвичайно великій діелектричній константі полягає гідна подиву дія домішок води? Припустимо, що молекули всіх речовин, Навіть тих, у яких молекули мають дипольний момент, який дорівнює нулеві, притягуються одна до одної якимись силами, природа яких нам ще невідома. А втім, якими б не були ці сили, вони повинні бути електричними, отже, повинні підлягати законам електричного притягання — законам Кулона. Якщо є якась чиста речовина, то що міститься між двома молекулами цієї речовини? Нічого, пустота! Отже, сили електростатичного притягання в даному випадку, в пустоті, найбільші. Що ж станеться, коли між двома цими молекулами опиниться молекула якоїсь сторонньої речовини? Звичайно, сила взаємодії між цими двома молекулами значно ослабне. А якщо ця стороння молекула, до того ж молекула такої речовини, як вода, з найбільшою діелектричною сталою, тобто в середовищі якої сили електростатичної взаємодії ослаблюються найбільше, то легко припустити, що ніякого притягання між молекулами основної речовини вже не буде. Такі міркування треба було підтвердити дослідами. І підтвердження не забарились.

Чистий бензол, осушений звичайним методом для лабораторної практики, помістили в спеціальний посуд між двома платиновими електродами. Посуд нагрівали повільно, поки не закипів бензрл. Термометр показував 80°. Іншими словами, бензол «поводився» так, як і належить «нормальному» бензолові. Та ось до електродів підвели струм високої напруги. На перший погляд це — безглузда витівка: адже бензол не проводить струму. Але як тільки включили рубильник, кипіння бензолу зразу ж припинилось. Довелося нагріти рідину ще на вісім градусів, щоб знову почалось кипіння. Бензол «поводився» так, як «надчистий», підданий багаторічному осушуванню. Як тільки струм вимкнули, температура кипіння зразу знизилась до нормальної. Підвели напругу — знову 88°. Чому ж цей дослід підтверджує вплив води на асоціацію бензолу? У «звичайному» бензолі порівняно багато води: одну з 50–60 молекул можна вважати оточеною тонесеньким шаром — в одну молекулу — води. Молекули води, як це можна бачити з рисунка на стор. 23, дуже подібні до магнітиків. Маленькі атоми водню, з сильним електропозитивним полем, зосереджені в одному кінці молекули, а атом кисню з двома негативними зарядами — на іншому. Чим не магніт! А поруч зображена молекула бензолу. Досить тільки глянути на неї, і зразу ж стане зрозумілим, чому бензол не має дипольного моменту: шість симетрично розташованих атомів вуглецю і стільки ж атомів водню урівноважують заряди один одного. При утворенні поля струму високої напруги «магнітики» води відриваються від молекул бензолу, водяна оболонка руйнується, і молекула бензолу дістає можливість асоціюватись. Ось чому зразу підвищується температура кипіння рідини. Отже, на запитання «чому вода?» ми відповіли. А ось друге питання: що примушує бездипольні молекули дуже чистих речовин збиратися в агрегати — досі залишається нез’ясованим. І далі. Про яку водну оболонку може йти мова, коли навіть у просто чистому бензолі одна молекула води припадає на 50–60 молекул бензолу? А якщо бензол піддається спеціальному осушуванню, то частка води в ньому падає до одної десятитисячної або навіть одної стотисячної процента. Це значить, що одна молекула води припадає приблизно на один мільйон молекул основної речовини. Яким же чином це мізерне співвідношення «сил» може виконувати таку руйнівну дію? Ось вони, проблеми, які, можливо, розв’яжеш ти, читачу. Загадка «надчистих» рідин досі лишається нерозгаданою. Та ми ще далеко не повністю зичерпали коло питань, які доведеться розв’язувати майбутньому дослідникові цієї проблеми. Тепер перейдемо до подій, які, власне, і примусили вчений світ згадати цю історію, яку й досі називають науковою сенсацією.
Голка в сіні
Хто позаздрить людині, яка мусить темної ночі знайти в копиці сіна загублену голку? Скажете, ніхто? Помиляєтесь! Є немало таких хіміків, які сказали б, що ця (звичайно, вигадана мною) людина займається грою в бирюльки. І у відповідь негайно проаргументували б своє твердження ясною мовою арифметики. Справді, скільки може важити копиця сіна? Кілограмів 400. А голка? Приблизно одну десяту грама, або 10–4 кг. Якщо 400 кг прийняти за 100 %, то скільки процентів становитиме 0,1 г?
Отже, в голці 25 мільйонних часток процента від ваги копиці сіна. Хімік сказав би, що оперує в межах п’ятого десяткового знака. Але для хімії робота з визначенням такої кількості домішок, яка криється в п’ятому десятковому, давно пройдений етап. Ось, скажімо, шостий або сьомий десятковий знак — тут треба попрацювати. Та якби хімія обмежувалась тільки шостим і сьомим знаками! Вже в середині п’ятдесятих років техніка почала вимагати від хіміків не тільки визначення кількостей домішок, але й видалення їх. А це далеко не одне й те ж. Одна справа знайти, скільки до основної речовинидомішано того чи іншого елемента, а зовсім інша — видалити домішки, причому так, щоб не внести нових. І це друге завдання набагато складніше від першого. Та якщо техніка, промисловість кажуть «треба», хімія повинна відповісти «є»! Навіщо потрібні речовини такої надприродної чистоти? Наше покоління було свідком створення одної з чудових галузей фізики — науки про напівпровідники. Більшість напівпровідників виявляє свої властивості в стані дуже високої чистоти. Ось, наприклад, метал германій. Сучасна напівпровідникова техніка вимагає для нього чистоти 99,9999999999 %, тобто на один атом домішок тисячі мільярдів атомів германію. Два атоми домішок на цю кількість — і напівпровідник вже непридатний. Так перед хіміками у всій величі постала вершина десятого десяткового знака. Йдеться про одержання не якихось унікальних двох-трьох грамів речовини надвисокої чистоти, а про заводи, де ці речовини виробляють сотнями й тисячами кілограмів. Читач пам’ятає, якими труднощами супроводжувалось завоювання «вершин» шостого і сьомого десяткових знаків. Тепер же треба було взяти десятий. А подібно до того, як кожний метр на великій висоті дається альпіністові важче, ніж кілометр по рівній дорозі, так само кожна послідовна дев’ятка в числі, що виражає чистоту препарата, дається хімікові з дедалі наростаючим зусиллям. Одержання речовини з ступенем чистоти 99,99 %, або речовини «чотири дев’ятки», не являє тепер труднощів. Але чи давно це так? Ось три статті, вміщені в різних хімічних журналах. В першій із них читаємо: «Нам вдалося одержати надзвичайно чисту речовину чистотою 99,99 %». В другій написано: «Вміст основної речовини в продукті — 99,999 %. Таким чином, одержаний продукт можна вважати відносно чистим». В третій статті говориться таке: «Одержаний зразок був досить брудним: вміст основного металу в ньому становить лише 99,9999 %». В чому ж річ? Висловлювання в цих статтях повністю виключають одне одного. Просто перша праця написана на початку 20 століття, друга — в двадцяті роки, а третя з’явилася в наші дні. Речовина, яка шістдесят років тому вважалася чистою, в наш час не може зберегти свою колишню репутацію. Цікаво хоча б коротенько розглянути, як хімікам вдається добувати речовини такої надзвичайної чистоти. Одержання таких «надчистих» речовин стало можливим завдяки величезним успіхам аналітичної хімії, бо при очищенні речовини треба насамперед знати, від яких домішок слід її очищати, а потім — скільки їх міститься в основній речовині. На всі ці запитання відповідь дає аналітична хімія. І чим вищий ступінь очищення, тим досконалішими повинні бути прийоми цієї науки. З усього арсеналу засобів, які є в розпорядженні аналітиків, ми виберемо для ілюстрації декілька, однак і їх досить, щоб показати можливості цієї науки. Ось один з наймолодших методів аналізу — радіоактиваційний. Метал, який мають очистити, вміщують у ядерний реактор або циклотрон. При опромінюванні металу нейтронами або іншими елементарними частками його атоми — не всі, звичайно, — стають радіоактивними. Набувають радіоактивності і всі атоми домішок. Однак характер випромінювання одного штучного радіоактивного елемента різко відрізняється від характеру випромінювання іншого. Визначаючи характер та інтенсивність кожного типу випромінювання, можна легко визначити кількість і характер домішок у металі. Цей метод дає можливість визначати домішки в кількості до 10–13 г. Спробуйте прочитати цю величину у виразах, прийнятих для десяткових дробів! Електропровідність напівпровідникових матеріалів дуже залежить від домішок — цим, власне, й зумовлена вимога виняткової чистоти напівпровідників. Очищаючи напівпровідник, кожного разу випробовують його електропровідність. Чим чистіша речовина, тим менша її провідність. Варто спинитися на дуже цікавих способах одержання речовин «дев’ять» або «десять дев’яток». Насамперед про лабораторії та людей, де провадяться такі роботи. У цих лабораторіях ходять повільно, розмовляють тихо, уникають різких рухів, щоб з одежі не виділялись залишки пилу, який не встиг висмоктати пилосос, що стоїть біля входу. Стіни і стелі цих лабораторій гладенькі й блискучі, і на них смітинці ніде зачепитися. Всі маніпуляції там виконують за допомогою особливих приладів, що нагадують пінцети з довгою ручкою, причому роблять це знову-таки поволі, обережно… Складається враження, що працювати в таких лабораторіях досить-таки нудно. Та це враження зразу ж розвіється, як тільки ми докладно ознайомимося з тим, як люди в прозорих пластмасових халатах, виконуючи свою буденну і ніби нудну роботу, сходять на одну з найвеличніших і найтрудніших вершин сучасної науки — на вершину «десяти дев’яток». Ось одна з поширених установок для одержання надчистих речовин. У ній здійснюється процес відокремлення домішок, так звана «зонна плавка». Трубчаста електрична піч повільно рухається вздовж кварцевої трубки. У цій трубці на спеціальній підставці лежить невеличкий розтягнутий злиток германію. Зовні нема нічого цікавого. Ми бачимо, як розплавлена зона переміщається вздовж злитка металу. У тому місці, де над ним проходить піч, він розплавляється і перетворюється у в’язку рідину. Піч проходить далі, і метал повільно остигає. Для чого це робиться? А ось для чого. Домішка, яка міститься в германії, при розплавлянні металу залишається в рідкій зоні, бо атоми розплавленого металу, з’єднуючись при застиганні, виштовхують «чужаків» з кристалевої гратки. Рідка зона, переміщуючись вздовж злитка, захоплює значну частину домішок. Коли, нарешті, рідка зона доходить до кінця злитка й остигає, її відрізають, і перед нами — германій, значно чистіший, ніж той, який ми мали на початку роботи. Хоч метод зонної плавки найуніверсальніший, однак і він не завжди придатний для одержання надчистих речовин. Ось, наприклад, інший напівпровідник — сусід германію по періодичній системі Д. І. Менделєєва — кремній. Він плавиться при температурі значно вищій, ніж германій, — при 1400°. При такій високій температурі майже всі атоми інших речовин, що його оточують, намагаються вступити з ним у хімічну сполуку. Звідки беруться ці атоми? З повітря, яке оточує злиток, з тигля, де кремній плавиться. Повітря можна викачати, але чим замінити тигель, де відбувається плавлення? З елементами (металами), що піддаються впливу магнітного поля, обійшлися дуже оригінально: почали плавити їх без будь-якого посуду. Вміщують кусочок металу в середину круглого електромагніту, вмикають струм і… метал повисає в повітрі, а вірніше — в пустоті, бо повітря відкачане. Там же, в пустоті, його плавлять і проводять інші маніпуляції. Так метал проходить всі стадії, що ведуть до його очищення, і жодного разу при цьому не дотикається до стінок посуду. А як бути з кремнієм, який не піддається впливу магнітного поля? На допомогу тут прийшов сам кремній. Розплавлений кремній має дуже високий поверхневий натяг. Тому розплавлена маса його вдержується зовнішньою плівкою рідини. Кремній, як бачимо, плавиться у власному посуді. Кожний новий напівпровідниковий матеріал при його очищенні висуває нові проблеми, нові ускладнення. Але вже з цих кількох прикладів читачеві ясно, наскільки складна проблема одержання надчистих речовин. Тепер наука розвивається такими темпами, що той зміст, який я вкладаю в слово «складний», говорячи про проблему надчистих, зміниться в бік полегшення навіть за кілька місяців, які минуть з часу написання цих рядків до виходу книги в світ. Адже ступінь чистоти, доступний тепер промисловості, років десять тому не міг навіть приснитися вченому з найбагатшою фантазією.
Нова хімія
У підручнику з хімії сказано: «Цинк при звичайних умовах досить крихкий і при невеликому нагріванні може бути легко, без зусиль розтертий у порошок у звичайній ступці». «Цинк легко розчиняється у розведених сірчаній і соляній кислотах». «Марганець, хром і титан дуже важко піддаються обробці через свою крихкість. Перший з цих елементів енергійно розчиняється в кислотах». А ось уривок із статті, опублікованої недавно в одному з хімічних журналів: «Метали цинк, титан, марганець і особливо хром — дуже пластичні і чудово куються. Цинк і марганець, хоч і стоять в ряді напруг значно вище від водню, не виділяють останній з кислот навіть при великому нагріванні». Читач заперечить мені: — Годі вигадувати! Не знаю, як там марганець, а з цинком я особисто провадив спробу і не раз. Подивилися б, як виділяється водень! Я все це знаю, бо й сам добував водень, розчиняючи цинк у сірчаній кислоті. Проте в наведеній цитаті все правильно. — Дозвольте, — скажете ви, — але ж тоді всі підручники хімії неправильні! Ні, і підручники правильні. Просто в першому випадку йдеться про «брудний» цинк, про цинк чистоти, що застосовується в лабораторіях: 99,9 %, а в другому — про «надчисті» метали, які мають не менше «п’яти дев’яток». З металами надвисокої чистоти трапилась ось яка історія. Звичайно хіміки вивчають властивості якогось елемента і тільки після того одержують його в більш-менш чистому вигляді. Тут же були спочатку одержані надчисті елементи, а потім стало можливим вивчення їх фізичних і хімічних властивостей. Саме тоді й згадали про досліди по одержанню надчистих рідин, згадали про дивовижні зміни властивостей рідин при виділенні з них десятитисячних і мільйонних часток домішок, згадали і… не здивувались. Не здивувались, бо з металами відбувалось щось подібне. Ось цинк «дві дев’ятки». Він, як і належить цинку, розчиняється в кислотах, дуже крихкий і т. д. Цинк «чотири дев’ятки» — теж прекрасно розчиняється в кислотах, дуже крихкий і т. д. Цинк «п’ять дев’яток» не розчиняється в кислотах навіть при нагріванні, може витягуватись у тонкі нитки, дуже ковкий. Варто цинку змінити свої «чотири дев’ятки» на «п’ять» — і властивості речовини дивовижно змінюються. Що ж виходить? Забрали домішки, що були в третій дев’ятці, — нічого, в четвертій — те ж саме, і лише тоді, коли звільнились від домішок, які становили одну тисячну від першої «порції» домішок, властивості цинку зразу ж змінились! При цьому в міру очищення цинку розчинність його в кислотах не зменшувалась, а пластичність не збільшувалась. Тільки при переході через межу «п’яти дев’яток» властивості металу змінювались раптово, стрибком. Те ж саме і з іншими надчистими металами: якась чергова «дев’ятка» несподівано різко змінює властивості елемента. І знову виникає питання, яким чином мізерні частки домішок можуть так впливати на властивості речовини, що надчисті речовини стають нічим не подібні до своїх «предків». Хімія поки що не може відповісти на це запитання. Очевидно, у фізичних і хімічних властивостях речовини величезну роль відіграють однорідність і неоднорідність її хімічного складу. Коли метали передають струм, електрони біжать не абияк, а пересуваються по ланцюжках атомів, з яких складається кристалічна гратка. Це уявлення не пояснює ще, яким чином один атом домішок на тисячу мільярдів атомів іншої речовини може змінити властивості цієї речовини, але дозволяє догадуватись. Справді, лінія телефонного зв’язку між Москвою і, скажімо, Владивостоком має довжину в 10 тисяч кілометрів. Досить десь на відстані цих 10 тисяч кілометрів вирізати 1 мм провода, як зв’язок зразу ж перерветься. Так само один атом стороннього елемента порушує нормальний біг електронів. — Добре, — скаже читач, — нехай це вірно у відношенні фізичних властивостей, але як один атом домішок на 10 тисяч мільярдів основних атомів може вплинути на хімічні властивості речовини? Один на 10 тисяч мільярдів! Коли ми кладемо звичайний (тобто три-чотири «дев’ятки») цинк у кислоту, то зараз же починає виділятись водень. Як розчиняється цинк у кислотах? Уявно збільшимо поверхню розчиненого цинку в мільярди разів, так щоб видно було окремі атоми, з яких складається гратка цинку. Серед атомів цинку ви помітите порівняно багато атомів домішок. Біля них кристалічна гратка деформована, і тут же ви звернете увагу на те, що молекули кислоти відривають атоми цинку саме в тих місцях, де сталося порушення однорідності кристалічної гратки через сусідство з атомами домішок. Отже, наявність останніх створює сприятливі умови для перебігу реакції. А якщо речовина дуже чиста і склад її можна вважати однорідним, що відбувається тоді? Маючи перед собою однорідну в хімічному розумінні поверхню, молекули кислоти «не знають», з якого кінця почати руйнування кристалічної гратки металу. Для того щоб альпініст міг здертися на стрімку стіну, йому потрібно спочатку знайти в ній якусь розколину або виступ, за який він зміг би зачепитись. Такої розколини на поверхні надчистої речовини нема, тому ця речовина інертна в хімічному відношенні. Очевидно, ідеально чисті речовини взагалі не можуть взаємодіяти. Відомо, що хлор і водень дуже активно взаємодіють один з одним. Якщо змішати ці два гази при світлі, то станеться сильний вибух. У темноті реакція проходить дещо повільніше. Коли ж обидва гази старанно висушити (багато разів пропустити через фосфорний ангідрид), то після змішання така реакція не відбудеться. Більш того, скільки б ми не освітлювали суміш, скільки б її не підігрівали, не буде навіть ознаки реакції Н2 + Сl2 = 2НСl. Ось рівняння реакції водню й хлору. При чому тут вода? Її не видно ні справа, ні зліва. Але вода відіграє велику роль у початку реакції і в її перебігу, порушуючи хімічну однорідність згаданої суміші. Звичайно, цікаво знати про властивості дуже чистих речовин, але спочатку треба твердо і точно знати, як «поводять себе» речовини звичайного ступеню чистоти. І далі. Як бути з константами для надчистих рідин? Може, з довідників треба викинути дані про температури кипіння, оскільки вони відповідають рідинам, що містять деяку кількість вологи? Ну, закреслимо, а що вписати на місце закресленого? Яку, наприклад, температуру кипіння має бензол? Писати 80° чи 88°, чи 106°. І тут треба відповісти: викреслювати нічого не потрібно. На практиці майже завжди доводиться мати справу з таким бензолом, який кипить при температурі 80°. Це ж саме можна сказати про всі інші речовини.Світ нескінченно малих
Після сказаного вище доречно навести кілька фактів, які покажуть читачеві, що проблема малих кількостей речовин і тісно пов’язана з нею проблема надчистих речовин являють собою не приватний інтерес хімії, а мають велике значення для багатьох галузей знань. Найбільше прикладів впливу надзвичайно малої кількості речовин на властивості сполук дають нам явища каталізу. Ми вже вказували на каталітичну дію мізерних домішок води на реакцію взаємодії водню з хлором. Наведемо ще один приклад каталітичної дії малої кількості речовини. Перекис водню (Н2O2) — речовина в звичайних умовах досить стабільна. Та варто внести в перекис водню платину концентрацією в три мільярдні частки грама, як зразу ж починається бурхливий розклад Н2O2 = Н2O + О. А втім, це розкладання можна припинити в одну мить, отруївши каталізатор. Для платини-каталізатора найсильнішою отрутою є синильна кислота. Досить створити в розчині концентрацію синильної кислоти в одну мільярдну грама на один мілілітр, як розкладання перекису припиняється. У старовину, а інколи і в наш час, монастирі спекулюють «святою» водою, яка нібито «зціляє» від багатьох хвороб. Цікаво, що при деяких хворобах, особливо шлункових, вона дійсно виявляє цілющу дію. Але вся справа в тому, що під виглядом «святої» ченці продають воду, настояну на срібних монетах або предметах. Під час настоювання у воду переходять мізерні кількості срібла, але й їх досить, щоб згубно вплинути на велику кількість бактерій. Адже в середовищі, яке містить одну мільярдну грама срібла в мілілітрі, гине багато бактерій. Ось чому в старовину дуже цінували срібний посуд: люди давно примітили, що їжа, приготовлена в такому посуді, вигідно відрізняється від будь-якої іншої. Ми оперуємо зараз величинами: одна мільярдна, три мільярдних і т. п. Знаючи з власного досвіду, як важко уявити собі такі мізерні величини, я ще раз дозволю собі вдатися до порівняння. Отже, що таке одна мільярдна грама? Припустимо, нам вдалося грудочку цукру-рафінаду поділити порівну між усіма мешканцями нашої планети. Скільки тоді дісталося б кожному? У п’ять раз більше, ніж одна мільярдна грама: 5∙10–9 г. Тепер уявіть собі цю грудочку цукру, кількість людей на земній кулі і тоді, можливо, збагнете, якими мізерними величинами оперує сучасна хімія. Ще дивовижніші приклади дає нам біологія. Зараз доведено, що в рості рослинних клітин активну участь бере речовина ауксин. Якщо з допомогою шприца ввести ауксин у стебло рослини, то в цьому місці починається інтенсивний ріст клітин, який призводить до викривлення стебла. За одиницю ауксина приймають таку кількість ного, яка дає відхилення стебла вівса на 10°. У грамах ця одиниця дорівнює 2∙10–11, тобто двом стомільярдним грама. Людський нюх дає дивовижні приклади реєстрації мізерної кількості речовини. Органічну сполуку меркаптан, який має неприємний запах, людина може виявити навіть тоді, коли одна частина його припадає на п’ять мільярдів частин повітря. Якщо перевести ці числа в грами, то вийде, що людський нюх реєструє 2∙10–12г. Цю властивість меркаптану використовують, домішуючи невагомі кількості його до природного газу. Тимчасом відомо, що людський нюх малочутливий в порівнянні з нюхом багатьох тварин і комах. Тут природа дійсно проявляє дива. Швейцарські натуралісти Фабр і Форель повідомляють про такий дослід. У Цюріху була вирощена гусениця метелика, що перетворилась з лялечки в кокон. Наступної весни з кокона з’явилась самка метелика. Її помістили в кімнаті з відчиненими вікнами, і за кілька днів сюди злетілося понад сто метеликів-самців цієї породи, пролетівши кілька кілометрів з навколишніх лук. Дослід показав, що метелики знаходять один одного по запаху. Уявляєте, як розвинений нюх у комах і яка мала кількість речовини потрібна для збудження їхніх нюхових центрів?! Всі ці приклади показують, що світ дуже малих кількостей речовини відіграє величезну роль у визначенні властивостей багатьох речовин. Іноді кілька атомів домішок на багато мільйонів атомів основної речовини докорінно змінюють властивості останньої. Наша розмова про «надчисті» була б не завершена, якби ми не спинилися докладніше на практичній важливості цієї проблеми, хоч сказане вже повинно було показати читачеві, що без розв’язання її сучасна наука і техніка не змогли б просуватися вперед такими величезними кроками.Великі справи малих домішок
У сільському господарстві тепер широко застосовують так звані мікроелементи для підвищення врожайності багатьох культур. Навіть дуже малі кількості деяких хімічних елементів (кобальту, цинку, марганцю), коли їх внести в грунт разом з добривами, дуже впливають на розвиток рослин. Досить, наприклад, внести в добриво 1,5 кг сполук бору на гектар, як врожай люцерни збільшиться вдвоє Лише 0,1 грама солі марганцю на кущ синіх баклажанів дає чудові результати: визрівання плодів прискорюється на 10 днів, кількість плодів та їх вага значно збільшуються і т. д. Між мікроелементами є так звані ультрамікроелементи Якщо створити в грунті концентрацію радію в кількості одної стомільярдної частки на кілограм грунту, то врожай гороху підвищиться на 182 %. Така ж доза радію значно прискорює ріст і цвітіння троянд. Знову мільярдні і навіть стомільярдні частки грама — і знову величезний ефект. Як бачимо, не тільки в хімії а й в біології мізерні зміни в мікросвіті викликають дуже значні зміни в макросвіті. Говорячи про практичне застосування проблеми «надчистих» і «надмалих», слід було б спинитися ще на явищі корозії. Відомо, що для багатьох металевих виробів корозія — страшенне лихо. Люди важкою працею добувають руду, виплавляють метал, виготовляють різні деталі, складають з них машини. Та як тільки машину пустили в дію, до неї зразу ж підкрадається невидимий підступний ворог — корозія. Близько 30 мільйонів тонн металу щороку перетворюється в рудувату іржу. І хоч з корозією ведеться невпинна і небезуспішна війна, все-таки доводиться визнати: втрати металу дуже значні. На одній з площ Делі стоїть залізна колона. Вона є предметом поклоніння і паломництва релігійних індусів. Колона дуже давня: їй понад дві тисячі років. Вона безперервно зазнає впливу жаркого й вологого клімату, однак на ній не помітно найменших слідів корозії. Інші залізні речі в таких же умовах починають іржавіти вже в перший рік і за кілька років стають буквально непридатними. Загадкова колона привертала увагу багатьох учених. Лише в останні роки встановлено, що вона виготовлена з чистого заліза. Навіть такий точний метод аналізу, як спектральний, не виявляє в матеріалі цієї колони нічого, крім заліза. Тепер ми знаємо, чому дуже чисте залізо таке стійке до атмосферної вологи: як і всі надчисті речовини, воно хімічно інертне. Загадкою є інше: як могли люди 2 тисячі років тому виготовити надчисте залізо, добувати яке ще й досі в лабораторіях, оснащених найдосконалішим сучасним устаткуванням, дуже важко. Вчені припускають, що ця колона зроблена з гігантського метеорита, який упав колись на землю, і що цей метеорит складався з чистого заліза. Отже, найдійовішим засобом боротьби з корозією є виготовлення предметів з надчистих металів. Не за горами той час, коли з явищем корозії можна буде ознайомитись тільки з літератури. Ще одне важливе застосування проблеми надчистих: передача струму на велику відстань. Читачеві, певно, відомо, що найважливішою з обставин, які іноді примушують відмовлятись від проектування лінії далекої передачі електроенергії, є велика втрата струму при проходженні його по проводах — значна частина електроенергії втрачається внаслідок опору металів, з яких зроблені проводи. Питомий опір срібла лише на 6 % нижчий, ніж міді, і все ж уряди деяких країн пішли на проведення ліній електропередач, поки що, правда, на невеликі відстані, не з мідного, як це роблять звичайно, а з срібного дроту. Як показали дослідження, надчисті метали і особливо мідь дуже знижують опір електричному струмові. Виявляється, щонайменші домішки і тут відіграють значну роль. У цій галузі застосування надчистих нині ведуться наполегливі роботи, і через небагато років промисловість одержить сильне джерело збільшення ресурсів електроенергії. Та хоч як багато зроблено в цій галузі, набагато більше треба ще зробити. Основні проблеми, які хвилювали вчених років тридцять тому, ще лишилися нерозгаданими. І досі ще не з’ясовано, чому видалення мізерних домішок вологи так сильно змінює властивості рідин? Чому зміна властивостей рідин при видаленні з них вологи йде не поступово, а стрибком? Чому мізерні домішки до металів так впливають на властивості останніх, що при видаленні їх ми одержуємо начебто зовсім інші речовини? Яким чином один атом домішок, який припадає на два мільярди атомів основної речовини, може зробити таку колосальну дію на фізичні та хімічні властивості цієї речовини?АЛХІМІЯ XX СТОЛІТТЯ
Біскайська історія
Одного разу, ще в студентські роки, я наткнувся на цікаву книжку, написану німецькою мовою. Називалась вона «Про струмочки і ріки, які злились і дали славну науку — хімію». Це була історія хімії, написана більш як півтораста років тому. На товстих і ломких від часу сторінках цієї книги я вичитав історію, яку мені хочеться переказати, бо вона має деяке відношення до теми цього нарису. …Теплий вітер гнав рвані хмари до затоки. Тонкі і гострі цівочки піску, здіймаючись у повітря з прибережних дюн, виводили пронизливу пісню, що нагадувала стогони грішних душ у пеклі. Коли це порівняння спало на думку отцю-настоятелю бенедиктинського монастиря святого Назера, то він, незважаючи на трагічність становища, не міг втаїти посмішки. Монастир стояв за кілька льє від берега Біскайської затоки на високому березі Луари, і його було добре видно в промінні західного сонця. Від цього монастиря, супроводжувані тужливим співом двох захриплих хлопчиків-служок, в’язнучи в густому піску і важко дихаючи, повзли навколішках брати-бенедиктинці. Першим повз брат Лоренцо Піка, який, власне, і був винуватцем цієї незвичайної процесії. Приватна записка папи Климента V наказувала монастирю св. Назера зайнятися «шуканням чудових речовин, які перетворюють неблагородні метали в золото, таке необхідне нам зараз в ці тяжкі часи, коли наші брати во Христі відмовились від нас настільки, що керівники богопротивного ордена тамплієрів, володіючи секретом філософського каменю, відмовляються нам його повідомити». Отец-настоятель, читаючи цю записку, не сміявся, ні, а лише посміхався, що, правду кажучи, теж було порядною крамолою. Настоятель знав, що папа не випадково вибрав його монастир серед багатьох, яким він вирішив зізнатися в своєму безсиллі. Монастир св. Назера ось уже 20 років славився своєю вченістю. В цьому була заслуга Лоренцо Піка, який зараз першим повз по піску, допомагаючи собі руками і дихаючи важче за інших. Вільні звичаї в монастирі св. Назера були, можна сказати, освячені традицією десятиліть. Навіть невихід до ранньої обідні не вважався там за тяжку провину. Ось чому Лоренцо Піка, вступивши сюди в 1387 p., міг вільно займатися природничими дослідженнями і досяг у цій справі неабияких успіхів. Автор книги повідомляє, хоч я ні трохи не ручаюсь за достовірність його повідомлення, що Лоренцо Піка навіть винайшов телескоп за двісті років до Галілея! і спостерігав Місяць. Він залишив твір про чудові властивості речовини, що тепер називається окисом ртуті, який без кінця можна перетворювати в блискучу ртуть і навпаки. Останнє відкриття, між іншим, задовго до Лоренцо зробили араби, але можливо, що він цього не знав. Безтурботно йшло життя Лоренцо Піка в монастирі св. Назера серед братів-бенедиктинців на рідкість доброї і веселої вдачі. Та все це тривало доти, поки не прибув лист від Климента. Строк на відшукання рецепта одержання золота був дуже короткий, бо папа не сумнівався в існуванні такого рецепта. Хвастливі декларації ордена тамплієрів про можливість одержання будь-якої кількості золота тільки підігрівали нетерпіння Климента V. Лоренцо Піка висловив здогад, що тамплієри добувають золото не стільки за допомогою філософського каменю, скільки за допомогою шахрайств і вбивств. Та коли папський посланець сказав, що він уперше зустрічається з таким нешанобливим ставленням до священного документа, яким є папір, підписаний самим папою, і при цьому так виразно подивився на отця-настоятеля, що той, простерши руки до зображення святого Назера, поспішно запевнив високого гостя, що зі здібностями Лоренцо скоро можна буде вивозити золото з монастиря возами. З цим посланець і поїхав, наказавши під кінець дати на допомогу Лоренцо стільки монахів, скільки він забажає, бо аліхімічні досліди суть багатотрудні і суєтні. Після від’їзду папського посланця Лоренцо Піка почав навчати братів-бенедиктинців алхімічної майстерності. В монастирі настали гарячкові дні. Виноград осипався і гнив без догляду, а з вузеньких вікон трапезної, перетвореної в лабораторію, виривався їдкий дим, супроводжуваний словами, які ясно свідчили, що знайомство з алхімією відвертає думки і душі бенедиктинців від бога. Сам Лоренцо Піка не мав сумніву в тому, що всякі рецепти філософського каменю, які наводились у численних творах, суть шарлатанство. Ці твори являлись, здебільшого, набором слів, які були чи то шифрованим текстом, чи то просто нісенітницею. Двох місяців виявилось досить, щоб зайвий раз переконатися: жодний з рецептів одержання золота не приводить ні до чого, крім марної витрати вихідних речовин, виготовлених з такими труднощами. Раптом сталося щось дивовижне. Доливаючи до розчину ртуті, розбавленої в азотній кислоті, до якої було домішано трохи йоду, розчин срібла в тій же кислоті, Лоренцо одержав жовтий осад. Відокремивши осад від розчину, він почав його сушити. І порошок з жовтого почав перетворюватись в яскраво-червоний. Піка швидко зняв жаровню з вогню, і порошок знову перетворився в жовтий. Поставив жаровню на вогонь — порошок почервонів, погасив вогонь — колір порошку знову став жовтим. Якби тепер хтось із хіміків зіткнувся з таким явищем, він ніскільки не здивувався б, знаючи, що має справу із звичайнісінькою термофарбою. Лоренцо Піка добув срібну сіль тетрайодортутної кислоти, яка є термофарбою. Та шістсот років тому це відкриття могло приголомшити будь-кого. Ченці, скупчившись за спиною Лоренцо, затаївши дух, дивились на чудові перетворення. І навіть сам настоятель, прибігши в трапезну, замість того щоб вознести молитву богсродиці за дароване диво, стояв як стовп і дивувався разом з іншими. Згодом Лоренцо сказав бенедиктинцям, що золото не можна добути штучним способом і що всі спроби зробити це приречені на невдачу. А ще через кілька днів ченці заявили папському посланцеві, який прибув до монастиря і з нетерпінням чекав результатів дослідів, що вони відмовляються шукати рецепт виготовлення золота, бо з цього нічого не вийде. Високий гість скочив на коня і помчав геть з монастиря. А через деякий час прибуло повеління папи: замолити нечувану непокору особисто перед папою в Авіньйоні, причому від Сент-Назера до Авіньйона повзти на колінах. Виняток було зроблено лише для отця-настоятеля. Ось чому від монастиря св. Назера, який стояв на високому березі Луари, по дюнах Біскайської затоки навколішках повзли сімнадцять ченців…Загадкові клітинки
Чекаю запитання: чому це в книзі про найновіші проблеми сучасної хімії автор починає нарис з аліхімічної історії? Кого зараз може цікавити алхімія? Шістсот-сімсот років тому люди почали мріяти про можливість перетворення одних металів на інші. У марних шуканнях таких рецептів постаріло або загинуло не одне покоління алхіміків. І тільки XX ст. перетворило мрію середньовічних алхіміків у реальну програму наукових досліджень. Отже, про перетворення елементів… Безсумнівно, цю розповідь треба починати з Д. І. Менделєєва. …Це було дуже важко — привести в якусь систему хаос відомостей про властивості хімічних елементів та їх сполук. Адже більше третини хімічних елементів не було відомо зовсім і ніхто не міг сказати, скільки їх повинно бути. Але поки що ніякого закону нема, і Менделєєв терпляче перетасовує свої картки. Нічні вартові не дивуються, що ночами одне вікно в професорському корпусі технологічного інституту завжди освітлене. Та ось перший варіант періодичної системи створений. Елементи розміщені по своїх клітинках. Вже можна впевнено сказати, які елементи і де саме треба ще відкрити. Більш того, можна з певністю визначити наперед властивості цих елементів. Описав Менделєєв невідкриті ще елементи: екабор, екаалюміній, екакремній. Минає кілька років і ці елементи відкривають дослідники, давши їм назви скандій, галлій, германій. Відкриття нових елементів перестало бути випадковим, а стало справою науки. Тому не слід дивуватися, що за дві тисячі років існування хімії відкрито 63 елементи, а за якихось п’ятдесят років після створення періодичної системи елементів додали до цієї кількості ще близько тридцяти. Давно минули часи, коли відкриття хімічного елемента було справою сліпого випадку або казкової удачі. Тепер шукання нових елементів проводиться впевнено, виходячи з положення їх у періодичній системі. У 1925 р. в молібденових рудах виявили елемент реній — аналог марганцю в VII групі періодичної системи. В таблиці лишилось ще чотири порожніх клітини з порядковими номерами 43, 61, 85, 87. Розшуки в різних рудах і хімічних сполуках не приводили поки що ні до яких результатів, а шукання ці велись дуже енергійно, бо відкриття нового хімічного елемента — це наукове досягнення. Багато хто з хіміків усвідомлював, що лише чотирьом за всю майбутню історію хімії призначено буде зазнати вищої насолоди вченого — першому тримати в руках сполуки елемента, якого до тебе ще ніхто не бачив, і, як наслідок цього, право дати назву цьому елементу. Проте у багатьох підхід до цієї проблеми був інший. «Дозвольте, — говорили вони, — хто сказав, що періодична система елементів Менделєєва повинна кінчатися номером 92? Чому не можуть існувати елементи з порядковими номерами 93, 94 і т. д.?» І цих, останніх, хіміків було немало. Ще більше було дослідників, які в лабораторіях мовчки шукали елементів з порядковими номерами вище 92. Шукання трансуранових елементів — так назвали гіпотетичні метали, розташовані за ураном, — проводилось ще впертіше, ще наполегливіше, ніж тих невідомих чотирьох «серединних» елементів, які кінець кінцем будуть відкриті. Відкриття трансуранового елемента являло для науки принциповий інтерес. У всій своїй гостроті проблема трансуранових стала перед дослідниками з кінця 20-х і на початку 30-х років. Можливо, це сталось тому, що надто тісно стало допитливим дослідникам у вузьких рамках незаповнених чотирьох клітин періодичної системи, і вони почали обережно, а далі наполегливіше рватися за її межі. У всякому разі саме в цей час на сторінках наукових і науково-популярних журналів починає з’являтися багато праць, присвячених проблемі зауранових елементів, припущення, де слід шукати, і повідомлення про відкриття елемента з порядковим номером 93. У журналі «Наука и жизнь» за той період не менше трьох разів на рік друкувались сенсаційні замітки (взяті з хімічних журналів) про відкриття 93 елемента. І щоразу через два-три місяці неминуче публікувалося спростування. Виходить те, що знаходиться за якоюсь граничною лінією, завжди вабить особливо гостро. Ось чому невідкритих ще серединних елементів шукали невідступно, але спокійно. Помилялись, ввічливо поправляли один одного, доброзичливо докоряли, поблажливо підхвалювали. Елементів за граничною лінією — трансуранових елементів — шукали гарячково. Сперечались і погоджувались, підносили і спростовували, вихваляли і лаяли. Щороку науковий світ буває вражений численними повідомленнями про елемент 93, яким навіть не дуже йняли віри. Загадкові елементи 43, 61, 85 та 87 і вже зовсім таємничі зауранові елементи не давались у руки дослідникам, як не давався їх середньовічним попередникам секрет «філософського каменя». Дальші події показали, що остання фраза — це не просто красиве порівняння. …Тридцяті роки нашого століття. На таблиці елементів Д. І. Менделєєва, яка висить і в шкільному класі, і в лабораторії хіміка, яка вміщена і в науковому журналі, і в студентському підручнику — скрізь чотири знаки запитання на вільних клітинах — 43, 61, 85 і 87.Снаряди, мішені і… алхімія
Коли у 1919 році Резерфорд проводив свій дослід, він і гадки не мав, що його експерименти викличуть до життя слово «алхімія», яке в той час пов’язувалось з таємничими кабалістичними знаками, з напівтемними лабораторіями, заклинаннями й іншими атрибутами середньовічної науки. Справді, що алхімічного в установці, зображеній на рисунку? (стор. 44). На штативі встановлено джерело α-частинок (ізотоп радіоактивного елемента полонію), α-частинки потрапляють на екран, покритий сірчистим цинком. При співударі α-частинок з сірчистим цинком виникають дуже слабкі світлові спалахи, добре видимі в збільшувач. Якщо між полонієм і екраном вмістити дуже тонку металеву пластинку, то спалахи зразу ж припиняться, бо α-частинки затримуються цією перешкодою. Та коли камеру, в якій містились всі ці частини приладу, заповнили воднем, то хоч між джерелом і екраном стояла металева пластинка, знову з’явилися спалахи. Причина цього ясна: α-частинки — ядра гелію, зштовхуючись з ядрами водню — протонами, передають їм свою енергію. Оскільки протони мають удвічі менший заряд, ніж α-частинки, і вчетверо меншу масу, вони можуть проникати крізь металеву перешкоду, неприступну для ядер гелію. Отже, тут дивуватись нема чого. Але тим більш разючим було те, що, коли водень в камері замінили азотом, на екрані почали спалахувати маленькі мерехтливі вогники, які свідчили, що на нього потрапляють якісь частинки.
«Справді, що алхімічного в установці, зображеній на рисунку?»
У чому ж справа? Адже атоми азоту, ядра яких майже вчетверо важчі за α-частинки, не могли проникнути через перешкоду, доступну лише протонам — маленьким і в’юнким ядрам атомів водню. А звідки тут взятися водню? Можливо, прилад був недосить очищений від слідів цього газу? Дослід повторили ще, а потім ще раз — і все одно екран вперто спалахував, хоч для цього начебто не було ніяких причин. І раптом, коли вже, здавалось, все безнадійно заплуталось, фотознімок, що реєструє сліди ядерних співударів частинок, усе пояснив: у камері утворився кисень. Кисень з гелію та азоту І Це вже не хімічна реакція, а щось інше. Подібні перетворення згодом дістали назву «ядерні реакції». В описаному приладі була здійснена перша з відомих науці ядерних реакцій. Ось як вона проходить: Заряд ядра гелію дорівнює двом, азоту — семи. При співударі α-частинки, які вилітають з полонію, що розпадається, з ядром атома азоту, утворювався атом кисню, і при цьому вилітав один протон — ядро водню з атомною вагою 1. Ось арифметика цього процесу: 2 + 7 = 8 + 1. Два — це заряд гелію, сім — азоту, вісім — кисню, а один, як вже відомо, — водню. Цю ядерну реакцію можна записати так: N7 + Не2 = O8 + Н1. Дослід Резерфорда показав, що, по-перше, один елемент можна перетворювати в інший, а по-друге, вказав на засоби, за допомогою яких можна досягти цих перетворень. Цими засобами є елементарні частинки, сумірні за розмірами з атомними ядрами. Так були знайдені «снаряди», якими можна обстрілювати атомні ядра. Тепер треба було сконструювати «гармати» для «вистрілювання» цих снарядів. Природні радіоактивні елементи в даному випадку виявились малопридатними, бо вони випускають надто малу кількість елементарних частинок та ще порівняно невеликої енергії. Ми б дуже відхилилися від основної теми, якби почали докладно розповідати історію створення «гармат», за допомогою яких можна «стріляти» елементарними частинками. Варто лише сказати, що більшість таких установок основана на здатності ядерних частинок прискорюватись у постійному електричному полі. Причому швидкість, до якої можна розігнати ядерну частинку, тим більша, чим більша напруга цього поля. Таким насамперед е циклотрон. У циклотронах вдається одержувати протони з енергією до дев’яти мільйонів електрон-вольт (поле, в якому існує різниця потенціалів з такою енергією), дейтерони (ядра ізотопу водню з атомною вагою 2) з енергією до вісімнадцяти мільйонів електрон-вольт і α-частинки з енергією до 35 мільйонів електрон-вольт. В останньому випадку така енергія означає потік часток у кількості приблизно ста тисяч мільярдів на секунду. Щоб одержати таку кількість α-частинок від природних радіоактивних джерел, довелося б взяти з кілограм радію, тобто таку кількість елемента, яку навряд чи можна набрати в лабораторіях усього світу. Отже, на озброєнні науки стало одне з чудових відкрить нашого століття — ядерна артилерія. Обстріл ядер дав можливість лише за кілька років зробити багато відкрить. Перше з них було зроблене в 1934 році знаменитим французьким вченим Фредеріком Жоліо-Кюрі спільно з Ірен Жоліо-Кюрі. При опроміненні α-частинками вони виявили в алюмінійовій фользі, яка зазнала обстрілу, утворення деякої кількості фосфору. Це явище супроводилось виділенням нейтронів. Цю ядерну реакцію можна записати так:
 Цифри зверху означають атомну вагу елемента, знизу — заряд ядра; нейтрон не має ніякого заряду, тому знизу біля нього стоїть нуль. Однак не в цьому полягала, як кажуть, сіль відкриття подружжя Жоліо-Кюрі. Якщо подивитись на таблицю атомних ваг елементів, то побачимо, що фосфор має вагу 31. Ізотоп же фосфору, добутий в цій ядерній реакції, мав атомну вагу 30. Виявилось, що цей ізотоп фосфору радіоактивний. За порівняно короткий час він розпадається з виділенням позитрону (елементарна частинка з масою електрона, яка має заряд +1) і перетворюється в ізотоп кремнію з атомною вагою 30. Так було відкрито явище штучної радіоактивності і разом з тим одержано широку можливість перетворювати атоми одних елементів у інші.
Ось коли здійснилась мрія середньовічних алхіміків, яка, здавалось, була навіки похована разом з хибами їхніх алхімічних методів.
Після цього відкриття дуже скоро були добуті штучні радіоактивні ізотопи багатьох хімічних елементів. І зразу ж перед фізиками і хіміками постало питання: чи не простіше добути штучно загадкові елементи з порядковими номерами 43, 61, 85 і 87, ніж безуспішно шукати їх у гірських породах? Чи не можна перейти межу «92», спробувавши добути зауранов і елементи за допомогою ядерних реакцій? Що й казати: завдання незвичне, але тим воно цікавіше!
Цифри зверху означають атомну вагу елемента, знизу — заряд ядра; нейтрон не має ніякого заряду, тому знизу біля нього стоїть нуль. Однак не в цьому полягала, як кажуть, сіль відкриття подружжя Жоліо-Кюрі. Якщо подивитись на таблицю атомних ваг елементів, то побачимо, що фосфор має вагу 31. Ізотоп же фосфору, добутий в цій ядерній реакції, мав атомну вагу 30. Виявилось, що цей ізотоп фосфору радіоактивний. За порівняно короткий час він розпадається з виділенням позитрону (елементарна частинка з масою електрона, яка має заряд +1) і перетворюється в ізотоп кремнію з атомною вагою 30. Так було відкрито явище штучної радіоактивності і разом з тим одержано широку можливість перетворювати атоми одних елементів у інші.
Ось коли здійснилась мрія середньовічних алхіміків, яка, здавалось, була навіки похована разом з хибами їхніх алхімічних методів.
Після цього відкриття дуже скоро були добуті штучні радіоактивні ізотопи багатьох хімічних елементів. І зразу ж перед фізиками і хіміками постало питання: чи не простіше добути штучно загадкові елементи з порядковими номерами 43, 61, 85 і 87, ніж безуспішно шукати їх у гірських породах? Чи не можна перейти межу «92», спробувавши добути зауранов і елементи за допомогою ядерних реакцій? Що й казати: завдання незвичне, але тим воно цікавіше!
Хіміки знімають знаки запитання
Першим штучним судилося бути елементу 43. У 1937 році італійці Сегре і Пелье піддали бомбардуванню дейтеронами ядра молібдену. При цьому молібденова мішень почала випромінювати потік нейтронів. Вивчення матеріалу мішені показало, що там відбулась ядерна реакція:
Елемент номер 43 назвали технецієм, на знак того, що це перший елемент, добутий штучним, технічним, способом. У наступні роки було добуто ще кілька ізотопів технеція за допомогою різних ядерних реакцій. Всі ці ізотопи виявились радіоактивними. Навіть найтривкіший з них має час піврозпаду (тобто час, за який розпадається половина атомів даного радіоактивного елемента) близько двохсот тисяч років. Звідси зрозуміло, що за час існування нашої планети, визначений вченими в 5–6 мільярдів років, весь первісний елемент 43 встиг розпастись. Ось чому спроби відшукати цей елемент у земній корі виявились безуспішними. Технецій відповідно до його положення в періодичній системі елементів Д. І. Менделєєва є аналогом елементів марганцю і ренію. Властивості його закономірно вкладаються в цей ряд. Після тогояк була пробита бреш у так званій «загадці чотирьох», дальші досліди пішли упевненіше. Через рік добули елемент з порядковим номером 61. Його синтезували, бомбардуючи елемент неодим дейтеронами. Та тільки через дев’ять років — у 1947 році — цей елемент виділили з опромінених мішеней у вагомих кількостях. Так само, як і в попередньому випадку, всі ізотопи 61-го елемента виявились радіоактивними — ось чому марно було шукати цей елемент у природі. Так ще в одній клітинці періодичної системи елементів замість знака запитання з’явився хімічний символ. Елемент дістав назву прометій, на честь міфологічного бога Прометея, який украв з неба вогонь і передав його людям. Як відомо, за це Зевс звелів прикувати Прометея до скелі, на якій
«…Споконвіку Прометея
Там орел карає,
Що день божий довбе ребра
Й серце розбиває».
Елементи створюються в лабораторіях
Наприкінці 30-х років з’ясувалось, що найбільш перспективними для добування атомної енергії е важкі елементи періодичної системи. Стало очевидним, що виділення енергії атомного ядра повинно супроводитись його розщепленням. Тому почались активні досліди по опроміненню різними елементарними частинками атомів важких елементів і серед них, насамперед, найважчого відомого на той час елемента урану. Улюблений снаряд атомних «артилеристів» — елементарна частинка нейтрон, бо нейтрон не має ніякого заряду. Заряджені частинки виконують ці функції набагато гірше: якщо частинка заряджена негативно, то при підході до атома вона зазнає сильної відштовхувальної дії електронної оболонки атома, а якщо заряд частинки позитивний, то її намагається відштовхнути позитивно заряджене ядро атома. Так ось, при опромінюванні урану нейтронами було виявлено, що його атоми розпадаються на два осколки. Які ж це осколки? Уран має атомну вагу 238. Якщо це число поділити навпіл, то буде 119. Ядро урану під впливом нейтронів ділиться по-різному: іноді осколки однакові — тоді це елемент з атомною вагою 119, тобто олово, а часто-густо осколки бувають різні. В останньому випадку переважають елементи з атомними вагами 138–139, тобто барій і лантан. Дійсно, при опромінюванні урану нейтронами в продуктах ділення можна виявити ці елементи. Елементи середини періодичної системи, які утворюються при діленні урану, мають штучну радіоактивність, і характер опромінювання кожного осколка добре вивчено, бо кожний радіоактивний елемент випускає притаманні тільки йому віпромінювання. Власне природа радіоактивних променів однакова: це — α-, β- і γ-частинки, але енергія випромінювання кожного ізотопу різна. У 1939 р. американський вчений Макміллан відкрив у продуктах поділу урану якийсь радіоактивний ізотоп з періодом піврозпаду 2–3 дні. Серед осколків урану такий ізотоп раніше не був відомий. Уважне вивчення його показало, що випромінювання належить елементу, який своїми властивостями не схожий на жодний елемент, що міг би утворитися при розпаді ядер урану під впливом бомбардування нейтронами. Цей елемент виділили і… через кілька тижнів вся фізична і хімічна преса повідомляла: знайдено елемент 93! Вийшло, що при обстрілі урану нейтронами, крім розпаду урану, відбувається ще один процес: деяка частина урану замість того, щоб розлетітися при зіткненні з нейтроном, захоплює його. При цьому утворюється ізотоп урану з атомною вагою на одиницю більше. Ось вона, ця реакція: Однак ізотоп урану з атомною вагою 239 нестійкий і за дуже короткий час зазнає радіоактивного розпаду: атом цього ізотопу випускає одну (3-частинку. Що ж при цьому відбувається? Як відомо, β-частинка — ніщо інше, як електрон, який має заряд –1. Заряд ядра атома урану дорівнює 92. Якщо від 92 відняти (-1), то неважко підрахувати, що матимемо 93. Отже, утворився ізотоп елемента з порядковим номером 93 і атомною вагою 239, оскільки втрата одного електрона не позначається на масі атома.
Новий елемент дістав назву нептуній, бо в сонячній системі за планетою Уран іде планета Нептун.
Тепер читач скаже, що він догадався, як має називатись наступний заурановий елемент — плутоній, бо за планетою Нептун іде планета Плутон. Правильної Наступний, 94-й, елемент був названий саме так. Відкриття, або, вірніше, одержання його, не примусило себе довго чекати. Нептуній виявився недовговічним елементом. Період його піврозпаду — приблизно дві з половиною доби. Він теж розпадається з виділенням однієї β-частинки. При цьому утворюється елемент з порядковим номером 94.
Навряд чи яке-небудь наукове відкриття 30–40-х років так вплинуло на долю людства, як одержання елемента плутонію. Це відкриття — десятки тисяч жертв Хіросіми і Нагасакі, це відкриття — могутній рух народів нашої планети за заборону атомної зброї, це відкриття — перша в світі атомна електростанція і атомний криголам «Ленін».
Справа в тому, що плутоній виявився найбільш придатною речовиною для одержання атомної енергії. Саме цей елемент був у тій атомній бомбі, яка ясного серпневого ранку 1945 р. розгорнула свій зловісний гриб над японським містом Нагасакі. Це плутонієм заряджені атомні бомби, вибухи яких потрясли землю атомних полігонів у Неваді і води атола Бікіні. Це продукти його розпаду заражають зараз атмосферу Америки і води японських морів.
Але це також той елемент, який у недалекому майбутньому — і ти, читачу, будеш творцем цього майбутнього! — стане однією з основ енергетики народного господарства нашої Батьківщини.
Численні атомні реактори збудовані в різних країнах. Вони служать для перетворення урану в плутоній. Тепер цей елемент можна добувати кілограмами.
Одержання нептунію і плутонію стало торжеством фізики та хімії, так би мовити, вершиною нинішньої алхімії, та, як показало найближче майбутнє, не найвищою. Не минуло й трьох років з того славного 1941 p., як були виділені перші мікрограми плутонію, а хімікам довелося докреслювати нові клітини в періодичній системі елементів. Винуватцями торжества були елементи з порядковими номерами 95 і 96.
При бомбардуванні урану α-частинками утворюється; як виявилось, ізотоп плутонію з атомною вагою 241. Цей ізотоп, як і всі трансуранові елементи, радіоактивний і при своєму розпаді він виділяє одну β-частинку. Ми вже знаємо, до чого це призводить: утворюється елемент з порядковим номером на одиницю більше, ніж у «батька». Так був вперше добутий елемент 95. Сталась ця подія в 1944 р. Назвали елемент америцієм.
Майже одночасно з америцієм виділили його сусіда — елемент номер 96, добутий при β-розпаді америцію. Цей елемент назвали кюрієм на честь знаменитих дослідників радіоактивності Марії та П’єра Кюрі. Згодом кюрій добули кількома способами, бо ядерна фізика мала вже в своєму розпорядженні досить методів «виготовлення» нових елементів.
Після одержання цих елементів настала деяка пауза. Декілька років кюрій замикав шеренгу відомих нам хімічних елементів. Тільки в 1949 р. з’явились повідомлення про одержання елементів — 97 і 98. Обидва ці елементи добув відомий хімік Г. Сіборг в американському місті Берклі в штаті Каліфорнія. Звідси й назва елементів: 97-го — берклій, а 98-го — каліфорній. Перший з цих двох елементів добуто опромінюванням америцію α-частинками, другий — тим же способом, тільки за мішень був взятий кюрій.
Відомо, що під час вибуху атомної бомби утворюється надзвичайно сильний потік нейтронів. Цю обставину вчені використали для одержання наступних зауранових елементів. У безпосередній близькості від епіцентра вибуху атомної бомби поставили уранову мішень і в ній після опромінювання виявили два елементи, кожний з яких випускав α-промені з різною енергією. Одному з цих елементів був приписаний номер 99, другому — 100. Сталося це в 1952 p., хоч повідомлення про відкриття з’явились значно пізніше — у 1955 p., коли елементи 99 і 100 добули вже й іншими методами.
Роком раніше елемент 99 синтезували при бомбардуванні урану ядрами атомів азоту (уран має порядковий номер 92, азот — 7; 92 + 7 = 99). Цей елемент назвали ейнштейнієм на честь видатного вченого XX ст. Альберта Ейнштейна.
Наступний елемент, який стоїть в періодичній системі під номером 100, синтезований одночасно в США і Швеції. Американці добули цей елемент в ядерному реакторі, опромінюючи плутоній, шведи — в циклотроні, бомбардуючи уран ядрами атомів кисню (92 + 8 = 100). Він був названий фермієм на честь відомого італійського фізика-атомщика Фермі.
Всі елементи, що йдуть за кюрієм, ще не виділені в індивідуальному стані з мішеней, з яких їх одержали. Причин цього багато, а головна та, що їх одержано в надто малих кількостях.
У 1954 р. група дослідників під керівництвом Сіборга одержала елемент з порядковим номером 101. Цей елемент вони назвали менделевієм «на знак визнання провідної ролі великого російського хіміка Дмитра Менделєєва, який першим створив періодичну систему елементів для завбачення хімічних властивостей ще невідкритих елементів — принцип, який був ключем до відкриття останніх семи трансуранових елементів». Вивчення властивостей менделевію стало вершиною сучасної вимірювальної хімічної техніки.
Нарешті в 1957 р. було повідомлено, що добуто останній з відомих хімічних елементів — елемент 102. Синтезували цей елемент у Швеції на циклотроні Нобелівського інституту, чому і запропонували назвати його нобелієм. Нобелій утворився при обстрілі кюрію ядрами атомів вуглецю (96 + 6 = 102).
Експерименти проводились і в Радянському Союзі. Того ж 1957 р. група працівників Інституту атомної енергії Академії Наук СРСР при опромінюванні плутонію ядрами кисню (94 + 8 = 102) виявила утворення якогось α-активного елемента. Характер випромінювання його слід приписати елементу 102.
Нобелій може бути добрим прикладом того, що науці не властиво тупцювати на місці. З цієї причини нам довелося тричі переробляти виклад матеріалу про нобелій.
Спочатку досліди шведів були спростовані американськими дослідниками. З’явились праці радянських вчених. Але й вони були взяті під сумнів! Та як не сумніватися, коли ідентифіковано лише два-три атоми елемента! Потім результати експериментів радянських вчених підтвердили ще американці. Виявилось, що елемент 102 дійсно утворюється. Піврозпад його триває лише три секунди. Через кілька місяців вчені добули ще з десяток атомів цього елемента. У порівнянні з первісним це вже «кількість»! Тепер перестали сумніватися в існуванні 102 елемента. Не знаю, чи залишиться за ним назва нобелій, бо це ім’я дали йому шведи, які, по суті, його не відкрили.
Як бачимо, за якихось 20 років періодична система збагатилась цілим сімейством нових елементів, які не тільки не були відомі, але й не існували в природі. Ось який вигляд має періодична система елементів Д. І. Менделєєва зараз: жодної порожньої клітини в середині її і довгий ряд елементів за ураном.
Добування елементів — не самоціль, хоч, зрозуміло, кожний факт такого відкриття вже сам по собі значно збагачує науку. Нарешті, кожний елемент досліджують або добувають (як зауранові елементи) для того, щоб можна було поставити його на службу людині.
Дослідження фізичних і хімічних властивостей зауранових елементів несподівано стало новим і дуже великим розділом сучасної хімії. Виявилось, що ці елементи розташовуються в клітинах періодичної системи не довільно, що вони тісно пов’язані між собою. На цьому варто спинитися докладніше.
Однак ізотоп урану з атомною вагою 239 нестійкий і за дуже короткий час зазнає радіоактивного розпаду: атом цього ізотопу випускає одну (3-частинку. Що ж при цьому відбувається? Як відомо, β-частинка — ніщо інше, як електрон, який має заряд –1. Заряд ядра атома урану дорівнює 92. Якщо від 92 відняти (-1), то неважко підрахувати, що матимемо 93. Отже, утворився ізотоп елемента з порядковим номером 93 і атомною вагою 239, оскільки втрата одного електрона не позначається на масі атома.
Новий елемент дістав назву нептуній, бо в сонячній системі за планетою Уран іде планета Нептун.
Тепер читач скаже, що він догадався, як має називатись наступний заурановий елемент — плутоній, бо за планетою Нептун іде планета Плутон. Правильної Наступний, 94-й, елемент був названий саме так. Відкриття, або, вірніше, одержання його, не примусило себе довго чекати. Нептуній виявився недовговічним елементом. Період його піврозпаду — приблизно дві з половиною доби. Він теж розпадається з виділенням однієї β-частинки. При цьому утворюється елемент з порядковим номером 94.
Навряд чи яке-небудь наукове відкриття 30–40-х років так вплинуло на долю людства, як одержання елемента плутонію. Це відкриття — десятки тисяч жертв Хіросіми і Нагасакі, це відкриття — могутній рух народів нашої планети за заборону атомної зброї, це відкриття — перша в світі атомна електростанція і атомний криголам «Ленін».
Справа в тому, що плутоній виявився найбільш придатною речовиною для одержання атомної енергії. Саме цей елемент був у тій атомній бомбі, яка ясного серпневого ранку 1945 р. розгорнула свій зловісний гриб над японським містом Нагасакі. Це плутонієм заряджені атомні бомби, вибухи яких потрясли землю атомних полігонів у Неваді і води атола Бікіні. Це продукти його розпаду заражають зараз атмосферу Америки і води японських морів.
Але це також той елемент, який у недалекому майбутньому — і ти, читачу, будеш творцем цього майбутнього! — стане однією з основ енергетики народного господарства нашої Батьківщини.
Численні атомні реактори збудовані в різних країнах. Вони служать для перетворення урану в плутоній. Тепер цей елемент можна добувати кілограмами.
Одержання нептунію і плутонію стало торжеством фізики та хімії, так би мовити, вершиною нинішньої алхімії, та, як показало найближче майбутнє, не найвищою. Не минуло й трьох років з того славного 1941 p., як були виділені перші мікрограми плутонію, а хімікам довелося докреслювати нові клітини в періодичній системі елементів. Винуватцями торжества були елементи з порядковими номерами 95 і 96.
При бомбардуванні урану α-частинками утворюється; як виявилось, ізотоп плутонію з атомною вагою 241. Цей ізотоп, як і всі трансуранові елементи, радіоактивний і при своєму розпаді він виділяє одну β-частинку. Ми вже знаємо, до чого це призводить: утворюється елемент з порядковим номером на одиницю більше, ніж у «батька». Так був вперше добутий елемент 95. Сталась ця подія в 1944 р. Назвали елемент америцієм.
Майже одночасно з америцієм виділили його сусіда — елемент номер 96, добутий при β-розпаді америцію. Цей елемент назвали кюрієм на честь знаменитих дослідників радіоактивності Марії та П’єра Кюрі. Згодом кюрій добули кількома способами, бо ядерна фізика мала вже в своєму розпорядженні досить методів «виготовлення» нових елементів.
Після одержання цих елементів настала деяка пауза. Декілька років кюрій замикав шеренгу відомих нам хімічних елементів. Тільки в 1949 р. з’явились повідомлення про одержання елементів — 97 і 98. Обидва ці елементи добув відомий хімік Г. Сіборг в американському місті Берклі в штаті Каліфорнія. Звідси й назва елементів: 97-го — берклій, а 98-го — каліфорній. Перший з цих двох елементів добуто опромінюванням америцію α-частинками, другий — тим же способом, тільки за мішень був взятий кюрій.
Відомо, що під час вибуху атомної бомби утворюється надзвичайно сильний потік нейтронів. Цю обставину вчені використали для одержання наступних зауранових елементів. У безпосередній близькості від епіцентра вибуху атомної бомби поставили уранову мішень і в ній після опромінювання виявили два елементи, кожний з яких випускав α-промені з різною енергією. Одному з цих елементів був приписаний номер 99, другому — 100. Сталося це в 1952 p., хоч повідомлення про відкриття з’явились значно пізніше — у 1955 p., коли елементи 99 і 100 добули вже й іншими методами.
Роком раніше елемент 99 синтезували при бомбардуванні урану ядрами атомів азоту (уран має порядковий номер 92, азот — 7; 92 + 7 = 99). Цей елемент назвали ейнштейнієм на честь видатного вченого XX ст. Альберта Ейнштейна.
Наступний елемент, який стоїть в періодичній системі під номером 100, синтезований одночасно в США і Швеції. Американці добули цей елемент в ядерному реакторі, опромінюючи плутоній, шведи — в циклотроні, бомбардуючи уран ядрами атомів кисню (92 + 8 = 100). Він був названий фермієм на честь відомого італійського фізика-атомщика Фермі.
Всі елементи, що йдуть за кюрієм, ще не виділені в індивідуальному стані з мішеней, з яких їх одержали. Причин цього багато, а головна та, що їх одержано в надто малих кількостях.
У 1954 р. група дослідників під керівництвом Сіборга одержала елемент з порядковим номером 101. Цей елемент вони назвали менделевієм «на знак визнання провідної ролі великого російського хіміка Дмитра Менделєєва, який першим створив періодичну систему елементів для завбачення хімічних властивостей ще невідкритих елементів — принцип, який був ключем до відкриття останніх семи трансуранових елементів». Вивчення властивостей менделевію стало вершиною сучасної вимірювальної хімічної техніки.
Нарешті в 1957 р. було повідомлено, що добуто останній з відомих хімічних елементів — елемент 102. Синтезували цей елемент у Швеції на циклотроні Нобелівського інституту, чому і запропонували назвати його нобелієм. Нобелій утворився при обстрілі кюрію ядрами атомів вуглецю (96 + 6 = 102).
Експерименти проводились і в Радянському Союзі. Того ж 1957 р. група працівників Інституту атомної енергії Академії Наук СРСР при опромінюванні плутонію ядрами кисню (94 + 8 = 102) виявила утворення якогось α-активного елемента. Характер випромінювання його слід приписати елементу 102.
Нобелій може бути добрим прикладом того, що науці не властиво тупцювати на місці. З цієї причини нам довелося тричі переробляти виклад матеріалу про нобелій.
Спочатку досліди шведів були спростовані американськими дослідниками. З’явились праці радянських вчених. Але й вони були взяті під сумнів! Та як не сумніватися, коли ідентифіковано лише два-три атоми елемента! Потім результати експериментів радянських вчених підтвердили ще американці. Виявилось, що елемент 102 дійсно утворюється. Піврозпад його триває лише три секунди. Через кілька місяців вчені добули ще з десяток атомів цього елемента. У порівнянні з первісним це вже «кількість»! Тепер перестали сумніватися в існуванні 102 елемента. Не знаю, чи залишиться за ним назва нобелій, бо це ім’я дали йому шведи, які, по суті, його не відкрили.
Як бачимо, за якихось 20 років періодична система збагатилась цілим сімейством нових елементів, які не тільки не були відомі, але й не існували в природі. Ось який вигляд має періодична система елементів Д. І. Менделєєва зараз: жодної порожньої клітини в середині її і довгий ряд елементів за ураном.
Добування елементів — не самоціль, хоч, зрозуміло, кожний факт такого відкриття вже сам по собі значно збагачує науку. Нарешті, кожний елемент досліджують або добувають (як зауранові елементи) для того, щоб можна було поставити його на службу людині.
Дослідження фізичних і хімічних властивостей зауранових елементів несподівано стало новим і дуже великим розділом сучасної хімії. Виявилось, що ці елементи розташовуються в клітинах періодичної системи не довільно, що вони тісно пов’язані між собою. На цьому варто спинитися докладніше.
Нове сімейство
У ряді авторитетних посібників з хімії можна зустріти вказівки, що найбільш вивченим елементом тепер є… плутоній. — Як? — спитає читач. — Елемент, відомий лише років з двадцять, вивчений краще, ніж, скажімо, залізо, з яким люди ознайомились ще на зорі свого розвитку? Плутоній, якого після його відкриття навряд чи добули більше однієї тонни, вивчений краще, ніж, скажімо, кремній, запаси якого на поверхні Землі обчислюються астрономічним числом тонн? Справді так. Що й казати: факт надто цікавий. Цікавий, але не такий вже дивний. Я вже згадував, що плутоній є основним вихідним матеріалом для виготовлення термоядерної зброї. Проблема одержання плутонію в свій час була така гостра, що нею займались сотні лабораторій в різних країнах, займались гарячково. Щоб виділити плутоній з матеріалів атомних котлів, треба всебічно вивчити його властивості, а також властивості численних його сполук. Над одними і тими ж проблемами працювали різні лабораторії. Після розсекречення цих робіт виявилось, що багато вчених приходили до однакових результатів, ідучи до них різними шляхами. Через це не лишилось буквально жодної ділянки хімії плутонію, куди не заглянуло б допитливе око вченого-дослідника. Для більшості зауранових елементів одержано по декілька ізотопів. Для нептунію їх відомо 11, для плутонію — 14. Дуже старанно вивчені властивості кожного з ізотопів зауранових елементів у відношенні здатності випускати радіоактивні промені, бо у переважній більшості випадків, за винятком плутонію, всі ці елементи добувають у дуже малих кількостях. Тому їх виявляють не хімічним аналізом, як це роблять із звичайними елементами, а способом визначення типу й енергії випромінювання. Сучасні методи дослідження дозволяють виявити розпад навіть одного окремого атома. Вивчення хімічних властивостей зауранових елементів дало, на перший погляд, дуже дивні результати. Виявилось, що всі ці елементи за своїми хімічними властивостями схожі один на одного. Так, всі вони у водних розчинах можуть давати солі з валентністю металу +3. В свою чергу трансуранові елементи дуже нагадують уран. Властивості аналогічних сполук цих елементів виявились навдивовижу подібними. Що ж у цій подібності могло здивувати хіміків? Спробуємо відповісти. Закрийте рукою чи аркушем паперу групу елементів на таблиці періодичної системи, позначену як сімейство актиноїдів, і уявіть собі хіміка сорокових років, який розглядає цю таблицю. Тоді вона мала саме такий вигляд. Що міг сказати цей вчений про властивості не вивченого, але відкритого вже елемента 93? Насамперед те, що цей елемент за своїми властивостями подібний до елемента ренію, бо клітина 93 припадає на сьому групу періодичної системи і елемент, який стоїть у цій клітині, мусить знаходитись під ренієм. З такою ж упевненістю він міг сказати, що 94 елемент буде подібний до осмію, бо мусить знаходитись саме під ним. Але насправді все було не так. Зауранові елементи зовсім не були схожі на своїх імовірних аналогів, зате були схожі один на одного, як рідні брати. Ці елементи справді є рідними братами, але не з народження, а з глибших причин. Читач, певно, вже звернув увагу на те, що в періодичній системі після елемента з порядковим номером 56 іде клітина, в якій стоять номери 57–71. 15 елементів у одній клітині! Або, правильніше, 15 клітин в одній! У чому ж річ? Відомо, що зовнішня електронна оболонка атома кожного елемента періодичної системи Менделєєва відрізняється від зовнішньої оболонки атомів сусідніх елементів. Так, наприклад, літій має на зовнішній оболонці 1 електрон, берилій — 2, бор — 3 і т. д. Саме це число електронів на зовнішній електронній оболонці визначає хімічні властивості елементів. Ось елемент лантан — перший член сімейства під назвою лантаноїдів, тобто лантаноподібних. У нього на зовнішній електронній оболонці три електрони, тому він тривалентний. Ми повинні були б припустити, що наступний за лантаном елемент — церій — матиме на зовнішній електронній оболонці чотири електрони. Однак на зовнішній електронній оболонці церію, як і в лантана, три електрони. Куди дівся ще один електрон? Виявляється, він заповнює одну з внутрішніх електронних оболонок. Те ж саме спостерігається і в інших лантаноїдів. Всі вони — і празеодим, і прометій, і неодим аж по елемент 71 — мають на зовнішньому електронному шарі три електрони, зате заповнюються в них внутрішні електронні рівні. Ось чому всі ці 15 елементів своїми хімічними та фізичними властивостями надзвичайно подібні один до одного. Недаром проблема відокремлення одного від одного лантаноїдів, або, як ще їх називають, рідкісноземельних елементів, була до останніх років одним з найважчих завдань хімії. Така сама картина і з елементами, які в періодичній системі йдуть за актинієм. У торію — сусіда актинію — також заповнюється не зовнішня електронна оболонка, а одна з внутрішніх. Те саме слід сказати про протактиній, уран і всі добуті досі зауранові елементи. Через це зауранові елементи разом з ураном, протактинієм і актинієм подібно до лантаноїдів виділяються в окреме сімейство актиноїдів. Таким чином у періодичній системі з’явилась ще одна «багатокімнатна» клітина.Нові проблеми — нові труднощі
Майже ніде в сучасній хімії так не даються взнаки труднощі експерименту, як у проблемі трансуранових елементів. Що було раніше основним у проблемі вивчення властивостей нового елемента? Виділити більш-менш значні кількості сполук цього елемента, з тим щоб провести експеримент. З викладеного ми вже знаємо, як мало тепер потрібно хімікам, щоб визначати абсолютну величину цих «більш-менш» значних кількостей. Для трансуранових елементів проблема виділення стоїть на другому плані. Перш ніж виділити, треба ці елементи добути. Якщо перші зауранові елементи — нептуній, плутоній і почасти америцій і кюрій — вдалося добути порівняно (але тільки порівняно!) легко, то наступні за ними елементи дались в руки дослідникам значно важче. Справа тут насамперед у тому, що із збільшенням порядкового номера зауранових елементів швидко зменшується період їх піврозпаду. Якщо у елементів від нептунію до кюрію період піврозпаду досягає порядку мільйона років (а в найдовговічнішого ізотопа плутонію досягає навіть 80 млн. років), то у берклію він становить вже кілька тисяч років, у каліфорнію — 400 років, у ейнштейнію — 272 дні, а у 101 і 102 елементів — лише кілька секунд. Спробуйте за кілька секунд виділити елемент і вивчити його властивості! Для виділення 102 елемента вдались до дуже складних засобів. Опромінювана мішень містилась на рухомій стрічці. Утворені атоми 102 елемента внаслідок енергії, одержаної при співударі з «снарядом», вилітали з мішені і притягувались негативно зарядженою фольгою. Ця фольга зразу ж подавалась на лічильник радіоактивних частинок. Читач вже, мабуть, звернув увагу на те, що багато зауранових елементів добувають бомбардуванням не елементарними частинками, а ядрами атомів азоту і навіть кисню. Мішені повинні бути дуже тонкими, бо інакше ці «великокаліброві снаряди» не зможуть проникати в опромінюваний матеріал. Мішень готують розпиленням опромінюваного металу на яку-небудь пластинку. Звичайно товщина цього шару становить п’ять десятитисячних грама на 1 кв. см. Часто при опромінюванні змінюється структура металу і він осипається.
Маніпулятор.
Є ще одна причина, яка утруднює роботу з радіоактивними речовинами — це їх сильна радіоактивність. Відомо, що радіоактивні промені дуже шкідливо впливають на людський організм. Сильне опромінювання радіоактивними променями може призвести до смерті — в цьому одна з особливостей смертоносної дії атомної бомби. Навіть незначне, але систематичне опромінювання радіоактивними препаратами призводить до дуже тяжкого і часто невиліковного захворювання. Невипадково перші дослідники радіоактивних явищ, які ще не знали цих неприємних властивостей радіоактивних променів, захворіли на рак. Все це примушує з сполуками трансуранових елементів працювати дуже обережно. Зокрема користуються так званими маніпуляторами — інструментами, які дозволяють провадити всі хімічні операції, не наближаючись до посуду, де знаходяться трансуранові елементи. З речовинами, від яких сильно розходяться радіоактивні промені, всі маніпуляції проводять у спеціальних шафах. Такий маніпулятор для роботи з дуже радіоактивними елементами можна побачити на рисунку (стор. 60). Велика радіоактивність зауранових елементів викликає ще одне утруднення при роботі з ними. Плутоній, наприклад, випускає таку кількість α-частинок, що коли у воді розчинити яку-небудь його сіль, то в розчині зразу ж утворюється перекис водню, який відновлює сполуку плутонію. Ось чому, якої б валентності не взяли плутоній, коли розчини стоять, плутоній обов’язково переходить у сполуки нижчої валентності. Розчини сполук кюрію у воді відсильного випромінювання закипають. Уявіть собі таку картину: розчиняють у воді яку-небудь сіль цього елемента і розчин сам по собі спочатку слабо, а потім дуже бурхливо кипить, розбризкуючи краплі рідини! Більшість трансуранових елементів добувають у мізерних кількостях. В цьому відношенні хіміки роблять чудеса. Останній з трансуранових елементів — менделевій спочатку добули в кількості 17 атомів! І цього виявилось достатньо, щоб ізолювати елемент і визначити всі особливості його випромінювання. Подумайте тільки: 17 атомів! Тоді ви зрозумієте, чого коштує хімікам кожний рядок у повідомленнях про властивості елементів, які на відміну від всіх інших доводилося одержувати штучно.
Чи є трансурани в природі?
Тепер вже зрозуміло, чому шукання трансуранових елементів у природі не увінчались успіхом. Періоди піврозпаду, навіть найдовговічніших з них, такі невеликі порівняно з часом існування нашої планети, що ці елементи встигли повністю розпастись. А втім, багатьом з них вчені відводять істотну роль у природі. Вважають, що в свій час плутоній зробив великий вплив на тепловий баланс нашої планети, й що тепер внутрішнє тепло Землі зумовлене процесами радіоактивного розпаду в її надрах. Сучасні спектроскопічні методи дослідження дають можливість встановити, з яких елементів складаються Сонце і зорі. Але й за допомогою цих методів не виявлено ще де-небудь у Всесвіті слідів плутонію або інших зауранових елементів, за винятком одного — каліфорнію. Про це треба розповісти докладніше… Понад 900 років тому в ніч на 4 липня 1054 р. астроном китайської обсерваторії Великого Дракона Ма Туан-лін, як і завжди вийшов спостерігати небо. Майже над головою він помітив дуже яскраву зірку, якої вчора в цьому місці неба не було. Не писалось про неї нічого і в тих старовинних книгах, зміст яких астроном знав досконало. Наступного дня зірка з’явилась на небі ще до заходу сонця. На вулицях товпились сотні людей і дивувалися з цього дива. Завдяки Ма Туан-ліну ми знаємо всі подробиці цього чудового явища. Зірка сяяла на небосхилі майже два місяці, а потім почала швидко гаснути. Незабаром її зовсім не стало. Записи китайського астронома дійшли до наших днів. Вважають, що він спостерігав явище, яке тепер називається «новою зіркою». Утворення таких нових зірок порівняно часто можна спостерігати на небосхилі. Правда, «нова зірка», описана Ма Туан-ліном, була надзвичайно яскравою. Але при вивченні неба в телескоп такі явища — не рідкість. Для нас тут цікаве одне — всі «нові зірки» подібно до зірки, описаної Ма Туан-ліном, сяють завжди однаковий час — 55 днів. Зовсім недавно звернули увагу на те, що 55 днів — це точний час піврозпаду одного з ізотопів зауранового елемента — каліфорнію (254). Очевидно, ядерні процеси, які приводять до спалаху речовини «нових зірок», е процесами утворення каліфорнію. Після того як зауранові елементи були добуті в лабораторіях, шукання їх на поверхні Землі в гірських породах все-таки не припинились. Це диктувалось такими міркуваннями: по-перше, шукання можна було вже проводити не наосліп, бо властивості, наприклад, плутонію, нептунію, були вивчені добре; по-друге, цікаво знати, чи можуть на Землі скластися умови, за яких з урану утворювався б нептуній або плутоній? Останнє припущення здається абсурдом, а тимчасом воно скоро підтвердилось. Вже за кілька років до відкриття плутонію стало відомо, що деяка частина урану замість того, щоб піддатися звичайному радіоактивному розпаду (випускання α-, β- або γ-частинок), розпадається в повному розумінні цього слова на дві частини, при цьому утворюються осколки у вигляді нейтронів. Правда, на один такий розпад припадає кілька мільйонів розпадів звичайного радіоактивного типу, але разом з тим він завжди має місце. Отже, нейтрони, необхідні для перетворення урану в нептуній, а потім у плутоній, беруться з … самого урану. Ця обставина і стала приводом до шукання природного плутонію в уранових рудах. Коли для переробки взяли кілограми і навіть тонни уранової руди, дістали цілком точну відповідь: так, у природному урані плутоній є, але в дуже мізерній кількості. Відношення ваги плутонію до ваги уранової руди становить 10–14. Відношення кількості учнів у будь-якому класі до кількості людей на земній кулі має порядок — 10–8 у мільйон разів більший, ніж співвідношення плутонію і урану в урановій руді. У 1952 р. уранову смоляну руду з Бельгійського Конго піддали дослідженню на вміст у ній нептунію. І нептуній був, звичайно, виявлений. «Звичайно», бо проміжною ланкою при утворенні плутонію з урану є нептуній. Нептунію виявилось в урані навіть більше, ніж плутонію: одна частина на 2000 мільярдів частин урану. Отже, нептуній і плутоній знаходяться в уранових рудах у таких кількостях, що не доводиться говорити про можливості одержання їх природним шляхом. Можливо, що інші зауранові елементи теж є в зникаюче малих кількостях у гірських породах. Наприклад, припускають, що кюрій-247 завдяки своєму порівняно великому періоду піврозпаду (приблизно сто мільйонів років) у мізерних кількостях може ще існувати на Землі. При цьому дуже ймовірно, що він знаходиться разом з рідкісноземельними елементами — лантаноїдами, бо властивості актиноїдів, до яких належить кюрій, дуже подібні до рідкісноземельних елементів. Однак, оскільки кюрій супроводжує рідкісноземельні елементи, один атом його може припадати не менш як на 1015 атомів лантаноїдів. Це таке співвідношення, що ніякого порівняння вже не підбереш.Чи є межа числу елементів?
Глянемо ще раз на періодичну систему елементів Д. І. Менделєєва (стор. 56–57). Ми бачимо, що система тепер складається з семи періодів. До першого періоду входять лише два елементи, до другого й третього по вісім, потім ідуть два періоди по 18 елементів. У шостому періоді налічується вже 32 елементи, і стільки ж може бути в сьомому, незакінченому періоді системи, куди входять зауранові елементи. Отже, цей період повинен закінчуватися 118-м елементом. Актиноїдів, до речі, так само, як і лантаноїдів, повинно бути 15, тому елемент 103 повинен належати ще до актиноїдів, а 104 — вже буде аналогом гафнію — елемента IV групи періодичної системи. Отже, може бути ще один актиноїд і ще 16 елементів VII періоду. Однак «може» ще не означає «повинно». Ми вже доводили, що із збільшенням атомних номерів у елементів, які йдуть за ураном, швидко зменшується період піврозпаду. Елементи з порядковими номерами 102 і 103 мають періоди піврозпаду, вимірювані секундами. Та, крім радіоактивного розпаду, в зауранових елементів у міру віддалення від урану все чіткіше проявляється ефект так званого спонтанного ділення ядер. Ми вже спинялись на суті цього ефекту: ядро замість того, щоб випустити α- або β-частинки, розпадається на дві частини. Якщо для торію (порядковий номер 90) період піврозпаду спонтанного типу дорівнює 1021 рокам, то для фермію (порядковий номер 100) він дорівнює 12 годинам. Однак розрахунки показують, що для деяких елементів після елемента 102 період піврозпаду спонтанного типу буде не більший від періоду звичайного радіоактивного типу. Тому, якщо можливі роботи з 101 і 102 елементами, то чому ж не можна працювати над одержанням сусідніх з ними елементів? Можна! Як побудовані атоми всіх елементів, про які ми весь час вели мову і з якими весь час маємо справу в навколишній природі? — Смішне запитання, — відповість дехто з читачів. — Кожний знає, що всі атоми побудовані з позитивно зарядженого ядра, яке складається з протонів і нейтронів і негативних електронів, що обертаються навколо цього ядра. Так, але хіба ця комбінація є єдиною? Уявімо собі такий атом, в ядрі якого позитивно заряджені протони замінено на негативні антипротони, а електрони на позитивні частинки з такою ж, як у електронів, масою — позитрони. Такі частинки вже відомі. Перед нами — атом антиелемента. Хто може сказати, які властивості матиме такий елемент? А втім, теоретично створити такий елемент можливо. А що буде, коли в «звичайних» елементах з позитивно зарядженим ядром замінити один або кілька електронів на інші, негативно заряджені частинки, важчі, ніж електрони? Такі елементарні частинки теж відомі. А які властивості матиме елемент, в ядрі якого один або кілька протонів замінено на інші позитивно заряджені більш-менш важкі елементарні частинки? За останні роки ці проблеми стали предметом теоретичних і навіть експериментальних досліджень, однак до цього часу зроблено занадто мало, щоб можна було говорити про результати. Перед кожним, хто побажає присвятити себе проблемі добуття нових елементів, — буквально неосяжне поле діяльності.ОДИН ІЗ СТА ДВОХ
Кремнійовий світ
Початок становлення людини на нашій планеті — кам’яний вік — завжди пов’язують з появою кам’яних знарядь. У краєзнавчих музеях виставлені безформні осколки каменів, на яких тільки після уважного огляду можна помітити сліди обробки. Кремінь був першим матеріалом, який людина використовувала в своїй свідомій трудовій діяльності. Оскільки кремінь (двоокис кремнію) в основному складається з двох елементів — кисню й кремнію, — то можна сказати, що це були два елементи, з якими вперше ознайомилась людина. Навряд чи можна вважати це випадковістю. Саме ці два елементи й повинні були першими «потрапити до рук» людини. Кисень і кремній дістали назву елементів-гігантів. Три чверті земної кори, тобто всього, що входить до складу гірських порід, морів, океанів і атмосфери, складається з цих двох елементів: 49,13 % припадає на кисень, 26 % — на кремній. Вміст переважної більшості інших хімічних елементів виражається числами, де попереду стоять нулі. Кожний шостий атом тієї матерії, з якої складається навколишній світ, є атом кремнію. Чи варто дивуватися, що саме кремній був елементом, «впровадженим у виробництво» ще первісною людиною? Всі типи житла, за винятком куренів первісних людей і наметів сучасних туристів, завжди споруджували з матеріалів, в основі яких лежали сполуки кремнію. Піраміда Хеопса і собор Василія Блаженного, палаци царя Дарія і нові будинки на Хрещатику — всі вони в основному складаються з двоокису кремнію — тієї комбінації кисню і кремнію, в якій переважно зустрічаються на поверхні нашої планети ці два елементи-гіганти. Людина навчилася варити скло, опанувавши при цьому ще одну величезну галузь застосування кремнію. Скляні вироби в побуті, так само як витончена фарфорова статуетка на полиці і внутрішнє облицювання домни — це знову-таки сполуки кремнію, різноманітності яких можна дивуватись. Певно, нема якогось іншого елемента, що відіграв би таку велику роль у житті людини, як кремній. Тому серед 102 відомих нам елементів періодичної системи можна було б назвати дуже мало таких, які були б вивчені краще, ніж кремній. Тільки в нашій країні виходить кілька журналів, спеціально присвячених сполукам кремнію. Можна уявити собі, скільки стало відомо про цей елемент за весь час існування фізики й хімії! Систематичне вивчення хімії кремнію почалося на початку минулого століття. Природно, що з часом у цій галузі важливі відкриття з’являлися все рідше й рідше, і тому деякі вчені почали дивитись на цей розділ хімії дещо скептично. Почали ширитись заклики припинити вивчення хімії кремнію заради вивчення властивостей малодосліджених елементів. Один видатний закордонний хімік так прямо й писав у 1935 p.: «Хімія кремнію нагадує мені шахту, де вугілля поступово вичерпується: і кидати таку шахту шкода, і експлуатація стає нерентабельною. Чи не краще залишити в ній невелику бригаду «шахтарів», а всім іншим піти на розшуки менш досліджених родовищ?» І багато хто з хіміків відгукнувся на цю пораду. Що ж, звинувачувати їх не слід, бо романтика незвіданого принадна сивому хімікові не менше, ніж підліткові. І ось у тематиці багатьох лабораторій поступово слово «кремній» замінили назвами інших елементів. Те саме сталося і з галогенами, натрієм та ін., хімія яких була вивчена в достатній мірі. Повторюю, не слід вбачати тут щось погане: завдяки цьому за останні десятиліття дуже пішло вперед вивчення елементів, про які раніше знали дуже мало. А все же поговоримо зараз про дослідників «старих шахт».Кремній — вуглець
Якщо взяти кілька підручників неорганічної або загальної хімії 20-х — початку 30-х років, то у викладі цілого ряду розділів, і в тому числі хімії кремнію, можна помітити деякий шаблон. Йде опис його сполук: силіцидів — сполук елементів з кремнієм, потім галогенидів — сполук кремнію з фтором, хлором, бромом і йодом, далі силанів — сполук з воднем, нарешті — силікатів, тобто похідних кремнійової кислоти. І все. Тільки в небагатьох книгах після викладу всіх цих розділів ішло кілька рядків під заголовком «Кремнійорганічні сполуки». Тут у «двох словах» говорилось, що кремній може утворювати органічні сполуки, в яких він виступає як аналог вуглецю. І навряд чи тоді можна було сказати про ці сполуки більше. А говорити про них варто було хоч би тому, що в кремнійорганічних сполуках проявляється чудова властивість. Хтось із літературознавців сказав, що існує 16 різновидностей сюжетів усіх науково-фантастичних повістей і оповідань. Не знаю, чи це так, але одне можу підтвердити — приблизно з тридцятих років почала з’являтися велика кількість фантастичних творів, де головним героєм був… кремній. Причина цього досить проста: кожному, хто хоч у загальних рисах обізнаний з хімією, впадає в очі таке, здавалося б, ненормальне становище: неорганічних сполук, тобто сполук всіх елементів, за винятком вуглецю, відомо в наш час трохи більше п’ятдесяти тисяч, а органічних, вуглецевих, сполук хіміки одержали більше трьох мільйонів. Один елемент дає сполук у 60 раз більше, ніж усі інші! Ця виключна властивість вуглецю пояснюється його здатністю утворювати сполуки, які містять практично необмежену кількість атомів вуглецю в молекулі. Справді, візьмемо будь-яку неорганічну сполуку, ну скажімо, сірчану кислоту (H2S04). Атомів водню в ній 2, кисню 4, а центральних, тобто сірки, які організують, цементують цю молекулу, лише 1. У неорганічній природі можна знайти дуже мало прикладів, коли атоми одного й того ж елемента сполучаються один з одним у ланцюжок. У кращому разі такий ланцюжок налічує 2–3 атоми і сполуки, які містять його, дуже нестійкі. Прикладом цього можуть бути водень і кисень. Сполука Н — О — Н — вода — дуже стійка, а перекис водню Н — О — О — Н з мінімальним ланцюжком у два атоми кисню часто вибухає навіть при кімнатній температурі. Тільки вуглець може утворювати сполуки з дуже довгим ланцюжком вуглецевих атомів. Вуглеводень етан СН3—СН3 дуже стійкий навіть при високій температурі. Вуглеводень гектан СН3—(СН2)98—СН3, з ланцюжком із 100 атомів вуглецю, не набагато менш стійкий. Атоми вуглецю можуть сполучатися не тільки рівним ланцюжком. Можливі сполуки зовсім однакового складу, але різної будови, а це значить — з іншими властивостями. Так, для вуглеводню С4Н10 можливе існування двох ізомерів: У сполуки С5Н12 є вже три ізомери, для вуглеводню складу С14Н30 можливі 1858 ізомерів, для сполуки С20Н42 — 366319. Для наступних — вже мільйони. Вуглеводні — прості сполуки і складаються лише з двох елементів. Коли ж ми переходимо до сполук, які складаються з більшої кількості елементів, то різноманітність їх збільшується безмірно.
Хіміки ще в середині минулого століття, а автори науково-фантастичних творів років на 80 пізніше задумались над таким питанням: чи може який-небудь елемент, крім вуглецю, мати такі властивості? Увага вчених і письменників спрямувалась на кремній. Хід їхніх думок очевидний: саме цей елемент — найближчий аналог вуглецю за періодичною системою елементів і саме від нього слід чекати виявлення властивостей, подібних до властивостей вуглецю. А якщо так, то… уява літераторів-фантастів нестримно рвонулася вперед. З’явилися цілі світи, де все побудовано так само, як і в нас, лише в органічній природі всі атоми вуглецю замінені кремнієм. У результаті такої заміни тіла живих організмів складалися з білка, який своєю міцністю не поступався земній броні, рослини нагадували собою каміння, а розумні істоти… Правда, жоден з авторів цих творів чомусь не вказав, що в цих розумних істот при диханні з рота повинна сипатись весь час пилюка — двоокис кремнію, бо замість вуглекислого газу вони видихали б саме цю сполуку.
Загальній кремнійовій спокусі піддався навіть видатний наш письменник-фантаст І. О. Єфремов у повісті «Зоряні кораблі», змалювавши чужинця з кремнійового світу.
Захоплення хіміків-експериментаторів були далеко не гарячими. Кремній виявив всі властивості, які він повинен був мати як елемент IV групи, наступний за вуглецем. Але в здатності утворювати ланцюжки він був мало подібним до вуглецю.
Сполуки кремнію з воднем, кремневодні, або силани, — аналоги вуглеводнів, виявились дуже нестійкими сполуками, що легко спалахують на повітрі. Найбільший ланцюжок, який вдалося реалізувати, це сполука з 6 атомами кремнію: Si6H14. У складніших сполуках, наприклад, силанах, де атоми водню замінені на вуглеводневий радикал, зовсім не вдалося одержати сполук із зв’язком кремній — кремній Si — Si. Крім того, виявилось, що кремній майже не може утворювати сполук, де дваатоми кремнію були б зв’язані подвійно (Si = Si), двома одиницями валентності, в той час як для вуглецю такі сполуки зустрічаються чи не частіше, ніж сполуки з одинарним зв’язком. І все-таки кремній більше, ніж будь-який інший елемент, подібний до вуглецю! Подібність ця виражена насамперед здатністю утворювати сполуки, в яких атоми його зв’язані з атомами вуглецю. Це не повністю «кремнійові сполуки», а так звані кремнійорганічні. Ось про них і поведемо розповідь.
У сполуки С5Н12 є вже три ізомери, для вуглеводню складу С14Н30 можливі 1858 ізомерів, для сполуки С20Н42 — 366319. Для наступних — вже мільйони. Вуглеводні — прості сполуки і складаються лише з двох елементів. Коли ж ми переходимо до сполук, які складаються з більшої кількості елементів, то різноманітність їх збільшується безмірно.
Хіміки ще в середині минулого століття, а автори науково-фантастичних творів років на 80 пізніше задумались над таким питанням: чи може який-небудь елемент, крім вуглецю, мати такі властивості? Увага вчених і письменників спрямувалась на кремній. Хід їхніх думок очевидний: саме цей елемент — найближчий аналог вуглецю за періодичною системою елементів і саме від нього слід чекати виявлення властивостей, подібних до властивостей вуглецю. А якщо так, то… уява літераторів-фантастів нестримно рвонулася вперед. З’явилися цілі світи, де все побудовано так само, як і в нас, лише в органічній природі всі атоми вуглецю замінені кремнієм. У результаті такої заміни тіла живих організмів складалися з білка, який своєю міцністю не поступався земній броні, рослини нагадували собою каміння, а розумні істоти… Правда, жоден з авторів цих творів чомусь не вказав, що в цих розумних істот при диханні з рота повинна сипатись весь час пилюка — двоокис кремнію, бо замість вуглекислого газу вони видихали б саме цю сполуку.
Загальній кремнійовій спокусі піддався навіть видатний наш письменник-фантаст І. О. Єфремов у повісті «Зоряні кораблі», змалювавши чужинця з кремнійового світу.
Захоплення хіміків-експериментаторів були далеко не гарячими. Кремній виявив всі властивості, які він повинен був мати як елемент IV групи, наступний за вуглецем. Але в здатності утворювати ланцюжки він був мало подібним до вуглецю.
Сполуки кремнію з воднем, кремневодні, або силани, — аналоги вуглеводнів, виявились дуже нестійкими сполуками, що легко спалахують на повітрі. Найбільший ланцюжок, який вдалося реалізувати, це сполука з 6 атомами кремнію: Si6H14. У складніших сполуках, наприклад, силанах, де атоми водню замінені на вуглеводневий радикал, зовсім не вдалося одержати сполук із зв’язком кремній — кремній Si — Si. Крім того, виявилось, що кремній майже не може утворювати сполук, де дваатоми кремнію були б зв’язані подвійно (Si = Si), двома одиницями валентності, в той час як для вуглецю такі сполуки зустрічаються чи не частіше, ніж сполуки з одинарним зв’язком. І все-таки кремній більше, ніж будь-який інший елемент, подібний до вуглецю! Подібність ця виражена насамперед здатністю утворювати сполуки, в яких атоми його зв’язані з атомами вуглецю. Це не повністю «кремнійові сполуки», а так звані кремнійорганічні. Ось про них і поведемо розповідь.

Мрії матеріалізуються в колбах
Письменники-фантасти з усіма подробицями описали кремнійовий світ, у всіх речовинах якого елемент вуглець замінений кремнієм. Це дивовижні й захоплюючі описи. Хіміки теж дуже добре уявляли собі, яким має бути кремнійовий світ. Правда, при цьому вони не переносились в уяві на інші планети або галактики. Ні, вони керувались вимогами сучасної техніки, вимогами сучасного життя. Хіміки, як і автори науково-фантастичних творів, знали — кремнійові сполуки повинні мати багато цінних властивостей і найважливішу з них — міцність, тому до їх одержання варто докласти зусиль. Нема потреби розглядати всі способи, застосовувані сучасною хімією для одержання різних кремнійорганічних сполук. Це привело б нас до вузькоспеціальних термінів і визначень, які в даному разі мають для нас другорядне значення. Скажемо тільки, що і в лабораторіях, і на заводах основною вихідною речовиною для одержання кремнійорганічних сполук є чотири хлористий кремній — речовина, названа так тому, що кожна молекула її містить 1 атом кремнію і 4 атоми хлору. Ця речовина на повітрі дуже димить, бо атоми хлору легко відщеплюються під дією води або подібних їй речовин. Під впливом вологи повітря чотирихлористий кремній відщеплює хлористий водень; він і утворює ДИМ. Ось ця властивість чотирихлористого кремнію — легке відщеплювання атомів хлору — і використовується для синтезу кремнійорганічних сполук. Так, наприклад, при взаємодії чотирихлористого кремнію з етиловим спиртом С2Н5ОН (етиловий спирт подібний до води; він відрізняються від неї тільки тим, що у нього замість атома водню стоїть вуглеводний радикал С2Н5) утворюється кремнійоргапічна сполука (C2H6O)4Si — етиловий ефір ортокремнійової кислоти, або тетраетоксисилан. Це, звичайно, найпростіший приклад. Переважну більшість кремнійорганічних сполук добувати значно складніше. Вперше систематичні дослідження методів одержання різних кремнійорганічних сполук стали проводити у нас, в Радянському Союзі. Піонерами цих досліджень були вчені Б. М. Долгов, К. А. Андріанов і О. П. Крєшков. Завдяки їм синтезовано багато кремнійорганічних сполук з найрізноманітнішими властивостями. Професор Б. М. Долгов у 1933 р. писав: «При існуючому розмахові соціалістичного будівництва та гнучкості індустрії СРСР кремнійорганічний препарат знайде широке застосування». А за кордоном навіть через чотири роки після опублікування в пресі наведеного вислову Б. М. Долгова писали: «Оскільки незначна кількість відомих кремнійорганічних сполук дуже обмежена в своїх реакціях, то перспектива якогось швидкого і значного просування в цій галузі хімії не здається дуже надійною». Так писав відомий англійський хімік Кіппінг. Саме в цей час у Радянському Союзі видали ряд патентів на відкриття, присвячені різним застосуванням кремнійорганічних сполук у техніці. Тепер, через 20 років після того, як почались систематичні й широкі дослідження щодо застосування кремнійорганічних сполук у техніці, важко навіть перелічити всі галузі їх застосування.Ворог води
У вересні 1958 р. в будинку Академії наук СРСР в Ленінграді проводилась нарада з хімії кремнійорганічних сполук. Піднімаючись широкими сходами до знаменитої мозаїки Ломоносова «Полтавський бій», я почув незвичну для наукових установ голосну розмову і веселий сміх. Причиною такого збудження було те, що в залі, де відбувались засідання і експонувалась виставка, присвячена різним галузям застосування кремнійорганічних сполук, один молодий чоловік зняв з манекена та надів на себе пальто, став ногами в таз, а на нього з відра лили воду. Після чергового відра води учасники наради мацали полите пальто. Помацав його і я. Матеріал був абсолютно сухим. Пальто не вбирало аніскільки вологи, що потрапляла на нього. Прекрасний експонат, але скільки затрачено напруженої роботи. Почалося, здається, з дрібниці. У багатьох лабораторіях, де займалися синтезом кремнійорганічних сполук, часто можна було спостерігати, як лаборант лаявся, старанно миючи колби. При зіткненні з деякими кремнійорганічними сполуками скляний посуд ставав майже непридатним для роботи, бо вода й інші рідини не змочували скло. Вода на поверхні скла збиралась у краплини і взагалі поводила себе дуже незвично з точки зору хіміків. Знищення плівки досягалося з великими труднощами і вимагало великої затрати часу, протягом якого можна було вволю відпускати непохвальні епітети на адресу не до речі забруднених колб. Та хімікам треба було не гніватись, а радіти. Життєва мудрість «Не знаєш, де загубиш, а де знайдеш» виявилася справедливою і цього разу. Хіміки «загубили» час на митті посуду, зате «знайшли» новий універсальний засіб боротьби з водою. Адже дощ, який докучає туристам, густий туман, що осідає додатковою вагою на сірих солдатських шинелях, водяні патьоки на вітровому склі автомашини, що примушують шофера до краю напружувати зір, проводи, які рвуться під вагою льодяних бурульок, брудні розводи на фасадах будинків, бурі плями іржі на металевих предметах — все це вода, з якою треба боротися. Ось тут і стали в пригоді сполуки кремнію. Багато речовин, підданих обробці кремнійорганічними сполуками, ставляться до води різко вороже. Досить на поверхню скла, будівельних матеріалів, тканин нанести плівку кремнійорганічних сполук і вони не намокатимуть. Вода не тільки не вбиратиметься ними, а навіть не затримуватиметься ні на хвилинку, бо поверхня відштовхує воду. Плівка ця дуже тонка. В поперечному перетині її міститься від однієї до кількох десятків молекул речовин, з якої вона складається. Такої мізерної кількості виявляється цілком досить, щоб зробити матеріал несприйнятливим до води. Так, наприклад, 1 г диметилдихлорсилану може захистити тисячу квадратних метрів оброблюваного матеріалу. Кожному, хто більш-менш докладно знайомий з хімією, відомий такий дослід: скло, розтерте на порошок, декілька хвилин кип’ятять у звичайній воді; вода, злита після досліду, показує лужну реакцію, бо при кип’ятінні скла з нього вимились сполуки натрію. Отже, скло тільки зовні стійке до води. Така властивість скла для тих, кому доводиться мати справу з скляними приладами, дуже неприємна. Очевидно, багатьом із вас доводилось бачити, як скляні деталі в оптичних приладах — лінзи, призми — мутнішають, жорсткішають і чудові мікроскопи стають непридатними для роботи. Незначна кремнійорганічна плівка на поверхні скла цілком ліквідує цю вікову ваду скляних виробів. Покриття оптичного скла плівкою кремнійорганічних сполук привело до дуже важливого відкриття. Академік І. В. Гребенщиков, досліджуючи захисні властивості кремнійорганічних плівок, виявив, що більшість із них має дуже важливу для оптичних приладів особливість — зменшує кількість відбитого склом світла. Як відомо, будь-яка фізична поверхня, в тому числі і найпрозоріше скло, відбиває більшу або меншу частину променів, які попадають на неї. Непрозора поверхня відбиває багато, прозоре скло порівняно малу кількість — до 4 %. Але в тих оптичних приладах, де кількість лінз велика, ці 4 % для кожної з них плюсуються і перетворюються в чимале число, яке дуже обмежує теле- і мікроскопію. Наприклад, перископ втрачає до 3/4 світла, яке потрапляє в нього.
«…якщо пробірку нахилити, то й тоді вміст її не виллється».
Відкриття І. В. Гребенщикова дозволяло створити так звану «просвітлену» оптику. Тепер майже всі мікроскопи і фотоапарати випускаються нашою промисловістю з «просвітленими» лінзами. Покриття скла кремнійорганічною плівкою дозволяє простежити ряд дуже важливих явищ. На рисунку зображена гідрофобна скляна пластинка. Ми бачимо, що вода не розтікається по цій пластинці, а збирається в краплини-кульки. Те ж саме можна спостерігати в експериментах з іншими речовинами, які не змочують звичайне скло, наприклад, з ртуттю. Якщо налити води в пробірку, гідрофобізовану кремнійорганічними сполуками, то утворюється не увігнутий, як звичайно, а випуклий меніск. Якщо таку пробірку з стінками, що не змочуються, покласти горизонтально на стіл, вода з неї не виллється, бо ненамокаюча поверхня її чинить сильний опір рухові води. Більш того, якщо пробірку нахилити на 10–15°, як це показано на рисунку, то й тоді вміст її не виллється. Гідрофобний скляний посуд стали застосовувати в медицині. Виявилось, у цьому посуді кров для переливання хворим зберігається значно довше, ніж у звичайному скляному. У пресі з’явились повідомлення, що деякі іноземні фірми використали властивість кремнійорганічних плівок давати незмочувані водою поверхні для виготовлення столового і чайного фарфорового та фаянсового посуду. Витирати рушником після миття цей посуд не потрібно: зразу ж після споліскування його водою він стає сухим, бо волога на ньому не затримується. Правда, перший час користуватися таким посудом неприємно. Уявіть собі, борщ у тарілці випинається горбом; щоб випити весь чай із склянки, її треба перевернути вверх дном. Скло знайшло вірного захисника в особі своїх родичів — кремнійорганічних сполук. Я називаю їх родичами, бо і скло, і кремнійорганічні сполуки в своїй основі мають елемент кремній. У вересні 1953 р. один з будинків по вулиці Воїнова в Ленінграді став об’єктом тривалого дослідження, що закінчилось тільки через 4 роки. Фасад цього будинку при фарбуванні покрили 4–5-процентним розчином кремнійорганічної сполуки метилтрихлорсилану. Тепер цей будинок став привертати загальну увагу. Після дощу, — а в в Ленінграді, як відомо, опадів багато, — фасад цього будинку відрізняється від сусідніх. У той час як з сусідніх будинків ще довго стікає вода і облицьовка залишається вологою, згаданий будинок через кілька хвилин після дощу такий же сухий, як і в жаркий безхмарний день. Через 4 роки фарба на ділянках фасаду, покритих кремнійорганічною плівкою, була наче нанесена тільки вчора, а на непокритих ділянках її повністю змило. Покриття фасадів будинків захисною гідрофобною плівкою вперше запроваджене в Радянському Союзі групою вчених під керівництвом Б. М. Долгова і М. Г. Воронкова. Після дослідів, тільки що описаних нами, перейшли до експериментів широкого масштабу. Кремнійорганічною плівкою покрили ряд історичних будинків Ленінграда: Мармуровий палац, де тепер міститься філіал центрального музею В. І. Леніна, Російський музей та ін. Найважливіша властивість водозахисних плівок — міцність. Такі плівки руйнуються тільки від сильних хімічних агентів — сильних кислот або концентрованих лугів. Але ж вони безумовно не загрожують стінам міських будинків. Ось чому метод захисних покрить застосовується дедалі більше. Кремнійорганічні сполуки дозволяють будівельникам внести в практику новий будівельний матеріал. Природний гіпсовий камінь — дуже красивий оздоблювальний матеріал. Він легко піддається обробці, легко фарбується і значно дешевший від інших облицювальних матеріалів, таких, як граніт і мармур. Природний гіпс зустрічається у великих кількостях у багатьох місцях нашої країни. Виникає запитання: чому ж гіпс не застосовується замість граніту і мармуру? Справа в тому, що сірчанокислий кальцій, з якого в основному складається гіпс, з точки зору хіміків мало розчиняється у воді — лише два грами на один літр. Але те, що для хіміків визначається словом «мало», для будівельників у даному разі означає «дуже багато». — Два грами на літр води! — обурюються вони. — Та це ж приведе до того, що облицьовку розмиє за один дощовий сезон! Досліди показали, що обробка природного гіпсу 5-процентним розчином метилхлорсилану робить його практично вологостійким. Завдяки цьому гіпс стає облицювальним матеріалом нарівні з гранітом і мармуром. Не можна обминути і гідрофобізацію цегли. Всім відомо, скільки прикростей завдають будівельникам грунтові води. А втім, якщо «дивитись у корінь», то вода тут ні при чому. Скоріш тут винна сама цегла, бо вона вкрита численними порами, які жадібно вбирають воду. Якщо цеглу піддати обробці 1-процентним розчином кремнійорганічної сполуки, «схильність» її до води перетвориться в глибоку «ненависть». Досліди показали, що оброблена таким чином цегла навіть через два роки лишається байдужою до води. Ми розглянули тільки одну галузь застосування кремнійорганічних сполук — будівництво, а скільки дізналися нового й цікавого. Таких галузей ще є чимало. Патентні бюро багатьох країн зберігають у своїх архівах сотні пропозицій на непромокальний одяг, який можна було б носити і в хорошу погоду. Але виготовлені за цими рецептами непромокальні плаття і пальта були важкими, непроникними для повітря, більшість з них мала їдкий і неприємний запах. Застосування кремнійорганічних сполук кладе край пануванню парасольки. Я вже згадував про чудове пальто, експоноване на виставці кремнійорганічних сполук. Просочене кремнійорганічною речовиною, воно, не змінивши свого зовнішнього вигляду, стало зовсім непроникним для води. У той же час повітря через таку плівку проходить вільно. Непромокальний одяг — це лише незначна частина застосування кремнійорганічних сполук. Паруси на яхтах, безсило звисаючі в дощ, тепер пружно випинатимуться під час найсильнішої зливи. Взуття, насичене кремнійорганічним складом, служитиме в будь-яку погоду, залишаючись красивим і легким. Якщо вода неприємна для тканини, то для паперу вона просто згубна. Скільки дорогоцінних рукописів і книг загинуло під час повеней і інших стихійних лих! Так само й афіші за 10 хвилин перебування під дощем набувають плачевного вигляду. І тут кремнійорганічні сполуки виступають як рятівний засіб. Ось аркуш фільтрувального паперу, підданий обробці протягом 10 хвилин 3-процентним розчином поліметал-діамінсилану. Цей аркуш тепер витримує стовп води висотою в 3 метри! А звичайний фільтрувальний папір, як відомо, дуже швидко вбирає воду (за що й дістав свою назву). Міцність паперу, підданого обробці кремнійорганічними сполуками, значно збільшується. Можна обробляти цими речовинами списаний вже папір. При цьому написане закріплюється, можна сказати, навічно. Важко переоцінити значення цього засобу для збереження документів і інших паперів історичної цінності. Ми ще не розповіли про паперові плащі, які за 10–15 копійок можна буде купити на випадок дощу в кожному газетному кіоску, про паперові пляшки, які не битимуться, про паперові тарілки, які не шкода буде викинути після одноразового вживання. Та цими випадками навряд чи ми вичерпали хоч чверть можливого застосування кремнійорганічних сполук у техніці й промисловості.
Краще природи
Щоб розповісти про всі галузі застосування кремнійорганічних сполук, довелося б у багато разів збільшити обсяг цих нарисів. Тому ми наведемо лише кілька прикладів. Візьмемо таку галузь техніки, як ізоляція проводів і інших електричних матеріалів. В одній східній казці розповідається, як вередливий шах послав своїх візирів шукати йому наречену. Кожному з них вручили докладний список тих якостей, які повинна була мати майбутня дружина шаха. Список цей був такий довгий, що візирі, почавши читати його вранці, закінчували, «коли надвечірнє сонце вже золотило лише вершини мінаретів». Список вимог, пред’явлених сучасною технікою до електроізоляційних матеріалів, не набагато менший від пам’ятної записки вередливого шаха. Електроізоляційні матеріали повинні витримувати різкі зміни температури (від –70 до +350°), значне перевантаження, тривалий вплив високих температур, тривалий холод. Вони повинні мати високий опір, малу вагу, стійкість до води і бактерій, а в умовах тропічного клімату і до мікрофлори, яка роз’їдає майже все. Електроізоляційні матеріали повинні мати також високу механічну стійкість, стійкість до різних масел і органічних розчинників (бензин, гас) добре прилипати до металів і кераміки, бути еластичними, вібростійкими, незаймистими, повітронепроникними, не змінюватись при тривалому зберіганні. Ці матеріали повинні бути виготовлені з дешевої сировини, технологія їх виготовлення повинна бути простою і не трудомісткою. Матеріалів для ізоляції проводів знайдено дуже багато, але кожний чимось не задовольняв вимоги: одні були міцні при звичайних умовах, але не витримували найменшого підвищення температури, другі пропускали вологу, треті були дуже важкі, четверті — крихкі і т. д. Єдиними матеріалами, в «анкеті» яких після кожного пункту стоїть слово «придатний», є кремнійорганічні полімерні сполуки. Матеріали, добуті на їхній основі, добре почувають себе при високій температурі. Вони можуть служити дуже довго при температурі 400–500°; тимчасово вони можуть бути розігріті навіть до температури 3500°. В Антарктиді вони себе почувають, як пінгвіни, а в тропіках, як крокодили. При покритті металу вони зчеплюються з ним «намертво». Сировина для виготовлення їх коштує копійки, а технологія дуже проста. Тому можна з повним правом говорити про революцію в електроізоляційній промисловості, революцію, яка закінчиться неподільним пануванням кремнійорганічних полімерів. Поступово кремнійорганічні сполуки увійдуть і в металургію; завдяки стійкості до високих температур плівки з цих речовин можуть витримувати тривалий контакт з розплавленими металами. Отже, з них можна виготовляти дуже добрі ливарні форми. Дрібні металеві деталі до недавнього часу не можна було відливати: вони виходили дуже нерівними, тому їх виготовляли тільки на механічних верстатах. При цьому до 50 % металу непродуктивно переводилося в стружку. А при використанні ливарних форм з кремнійорганічної маси 1 т деталей обходиться на 3500–4000 крб. дешевше, ніж при звичайній механічній технології. На кожних 500 тисяч тонн відливок заощаджується 75 тисяч тонн металу. Крім того, спрощення технології виготовлення малогабаритних деталей вивільнило б для інших робіт до 20 тисяч робітників і 5 тисяч верстатів. А на це потрібно всього 35 тисяч тонн порівняно недорогого етилсилікату. Кремнекислим натрієм, або сіллю кремнійової кислоти (побутова назва — розчинене скло) просочують театральні декорації, щоб зробити їх негорючими. І завдяки застосуванню цього нескладного засобу пожежі в театрах припинились. Для того щоб надати дерев’яним і паперовим матеріалам негорючості, потрібно багато цього неорганічного похідного кремнію. Ось чому, як тільки розсувається оксамитна завіса, зі сцени в залу пливе «запах куліс». Цей запах зникне, коли розчинене скло буде замінене кремнійорганічними сполуками. До речі, кремнійорганічних сполук потрібно набагато менше, ніж їх неорганічних «родичів». Звичайно, це стосується не тільки театрів. Треба зауважити, що й шпали, просочені цими речовинами, стають довговічнішими від звичайних. Говорячи про майбутнє кремнію, треба згадати і про кремнійорганічні мастила. Автомашинам у кліматичних умовах більшості областей нашої країни доводиться працювати при різних температурах. Влітку спека досягає 30–35°, а взимку морози 30–40°. Звичайні мастила можна використовувати тільки у вузькому інтервалі температур: ті з них, які добре поводять себе влітку, тверднуть на морозі, і навпаки, мастила, придатні взимку, влітку настільки розріджуються, що витікають з підшипників. Кремнійорганічні мастила в’язкі, і в’язкість їх мало змінюється в дуже широкому інтервалі температур: від –70 до +200°. З таким мастилом можна їздити і по Сахарі, і по льодах Антарктиди. Застосування цього мастила дозволяє майже вдвічі зменшити вагу гідравлічної рідини і відповідно зменшити діаметр трубопроводів. Можна було б розповісти і про нові трансформаторні мастила, і про застосування кремнійорганіки в харчовій промисловості, і про те, як ці сполуки полегшать працю шахтарів, але треба переходити до інших питань.Передвісник майбутнього
Тільки-но я вивів заголовок цього розділу, а тут листоноша приніс свіжий номер «Правды». На першій сторінці заголовок: «8 тисяч обертів навколо Землі». У повідомленні ТАРС говорилось: «27 листопада 1959 року третій радянський штучний супутник Землі здійснив свій восьмитисячний оберт навколо земної кулі. 289 днів триває політ третього радянського супутника навколо Землі. Радіопередавач «Маяк» продовжує стійко працювати. Основним джерелом його живлення є сонячні батареї». Сонячні батареї… За цими двома словами для багатьох фізиків і хіміків стоять роки напруженої праці. Але ці батареї означають також початок чудової епохи відкрить, яку майбутні історики науки назвуть ерою кремнію. Читач, певно, вже знає, що майже всі види енергії, якими користується людство — це перероблена, або акумульована, енергія Сонця. Ми спалюємо в топці вугілля — це залишки рослин, які росли завдяки сонячній енергії. Бензин, що приводить у рух двигуни повітряних кораблів, добутий з нафти, яка утворилася з залишків тваринних і рослинних організмів, а вони могли існувати тільки завдяки Сонцю. Енергія рік — це теж сонячна енергія, бо переміщення води на нашій планеті відбувається в результаті процесів випаровування, зміни пір року. Ми самі теж існуємо тільки за рахунок енергії сонячного світила: адже енергію для підтримання наших життєвих процесів ми одержуємо, харчуючись рослинами, які виросли завдяки асиміляції вуглецю під дією сонячних променів. Тільки енергія атомної електростанції і криголама «Ленін» добута людиною незалежно від дії Сонця, добута з надр атомного ядра силою розуму. Однак треба сказати, що рослини — дуже погані акумулятори сонячної енергії. Вони використовують продуктивно лише 1 % енергії сонячних променів, що потрапляють на них. А та енергія, яка падає на неродючу пустиню, мовчазні гори чи море, втрачається марно. Якби вдалося використати тільки 1 % енергії сонячних променів, які падають на сушу, то людство одержало б стільки енергії, скільки дають 1700 тисяч електростанцій потужністю в 1000 кіловат кожна. За літо на 1 квадратний метр поверхні в Середній Азії припадає стільки енергії, скільки дає при згорянні 1,5 ц вугілля. Ось чому люди давно намагалися створити установки, які б концентрували тепло сонячного променя і віддавали його для корисної роботи. Та практичне втілення ідей далі малогабаритних печей і установок для домашнього душу не пішло. Причина цього насамперед полягає в тому, що такі установки можна використати лише в сонячних районах і тільки вдень. Коефіцієнт використання ними сонячної енергії не набагато перевищував би коефіцієнт використання її рослинами. Ще кілька років тому найпродуктивнішим акумулятором сонячних променів була, мабуть, лупа в руках хлопчика, який за допомогою цього нехитрого інструмента випалював на дерев’яній дощечці візерунки. І раптом все змінилось. Винуватцем цієї зміни є кремній. Правда, не «простий», а надчистий. Пластинки надчистого кремнію, вкриті дуже тонким (у 2,5 мікрона) шаром бору, виявились чудовими напівпровідниковими елементами — батареями. Як тільки на таку батарею потрапить сонячний промінь, вона зразу ж починає давати електричний струм. Само по собі це явище не таке вже й дивне. Прилади, які при попаданні на них світла починають давати електричний струм, тепер вже не рідкість не тільки в наукових закладах, але і в побуті. Основою фотоекспонометра, яким визначають величину витримки, є селеновий фотоелемент. При попаданні на нього світла він починає випускати електричний струм. Чим яскравіше освітлення, тим сильніший струм. Але коефіцієнт корисної дії таких фотоелементів дуже низький. Тільки декілька десятитисячних часток енергії сонячних променів, що попадають на цей фотоелемент, перетворюється в електричний струм. Цієї енергії вистачає тільки на те, щоб відхилити тонесеньку стрілку фотоекспонометра. Кремнійові батареї мають дуже високий коефіцієнт корисної дії. Вже є батареї, які перетворюють в електричний струм до 11 % енергії сонячних променів. Теоретично можна створити батареї з коефіцієнтом корисної дії до 22 %. Для порівняння вкажемо, що коефіцієнт корисної дії паровоза не перевищує 5 %. Кремнійова батарея нічим не примітна. Сірувато-темні пластинки покладені поруч. Оце і все. В опису третього радянського штучного супутника Землі про кремнійові батареї сказано: «Ці кремнійові батареї перетворюють енергію радіації Сонця безпосередньо в електричну енергію. Сонячні батареї складаються з ряду елементів, які являють собою тонкі пластинки з чистого монокристалічного кремнію з заздалегідь заданою електронною провідністю. Напруга, утворювана окремими кремнійовими елементами, дорівнює 0,5 вольта, а коефіцієнт перетворення сонячної енергії 9–11 %». 11 процентів!.. Це означає, що 1 квадратний метр батареї може дати до 120 в електроенергії. Дах триповерхового будинку, вистелений такою сонячною батареєю, забезпечить всі енергетичні потреби мешканців: і опалення, і роботу електроприладів, і приготування їжі, і холодильник, і все інше, на що тепер витрачається енергія від спалювання вугілля або нафти. Може виникнути запитання: а що робити увечері або вночі, коли на небі нема сонця? Це утруднення перебороти дуже легко: вдень, коли сонячного світла достатньо, кремнійові батареї заряджатимуть акумулятори, від яких вечорами можна буде забирати струм. Цікаво, що сонячні батареї зовсім не вимагають для своєї роботи прямого сонячного світла. У похмурні, дощові дні вони працюватимуть не набагато гірше, ніж у сонячну погоду. Чудові властивості кремнійових батарей дають підстави трохи помріяти… Матеріалу, щоб зробити такі батареї, скільки завгодно. У кожному місці земної кулі сполук кремнію більш ніж досить. Приймачі не залежатимуть від електричної мережі. Для радіоприйому і радіопередачі не треба буде користуватися громіздкими і важкими батареями. Невелика пластинка кремнійового елемента на поверхні приймача може живити його практично вічно. Коли спрацюються частини приймача, кремнійовий елемент можна буде пристосувати до іншого апарата. Кожний будинок матиме власну електростанцію. Зникне потреба в громіздких і дорогих лініях електропередач. Геолог у глухій тайзі буде забезпечений електроенергією в такій же мірі, як і столичний житель, причому «електростанція» його матиме вагу не більше 1 кг. А найголовніше те, що ці «електростанції» для своєї роботи не вимагають нічого, крім денного світла, а його ніколи не бракуватиме. Хіба що на полюсі в полярну ніч. Шофер, у якого несподівано кінчився бензин далеко від бензоколонки, не чекатиме зустрічної машини, яка наділила б його пальним. Один рух рукою — і живлення двигуна перемкнуто на сонячні батареї, розташовані на даху машини. Звичайно, великої швидкості ці батареї не забезпечать, але машина зможе доїхати до місця заправки. Сонячні батареї зможуть заряджати акумулятори в той час, як машина стоїть або йде на бензині. «Сонцемобіль» — вже не фантазія. Ще в 1955 р. був сконструйований автомобіль, який приводився в рух енергією 12 фотоелементів… Хай цей «сонцемобіль» рухався з швидкістю візника, але цієї енергії цілком вистачило б, щоб надати достатньої швидкості, скажімо, моторолеру. Мрії… Хіба можуть бути безплідними мрії в науці? Мине якийсь час, і все, підведене нами під поняття «мрія», втілиться в життя. Хіба можна сумніватися в цьому, коли третій радянський супутник Землі служить джерелом сигналів, які з гордістю за геній людини слухає весь світ. Майбутнє починає жити сьогодні! Основна складність впровадження кремнійових батарей у побут полягає в тому, що кремній мусить бути виготовлений в дуже чистому стані, а одержати надчистий кремній дуже важко. Кожний грам надчистого кремнію обходиться ще дуже дорого. Тому треба наполегливо працювати, щоб його добувати доступними і простими засобами. Ось воістину неозоре поле діяльності для тих, хто захоче присвятити себе цій вдячній проблемі. В історії хімії відомо немало прикладів, коли який-небудь елемент або речовина на початку відкриття були дуже дорогі, а поступово, в міру удосконалення способів їх добування, ставали доступними. У 1889 р. Д. І. Менделєєву під час перебування в Лондоні як дорогоцінний подарунок піднесли терези, зроблені з алюмінію. Не минуло й півстоліття, і алюміній став таким же звичайним матеріалом, як дерево. Коли я починав вивчати хімію в університеті, наш старий і статечний професор казав, що він ніколи не бачив сполуки ренію. З того часу минуло років з 10 і солі ренію можна зустріти в будь-якій лабораторії. Так само зараз мало хто бачив кремнійові батареї чи взагалі надчистий кремній. Але разом з тим я майже впевнений, що читач, який прочитає ці рядки років через 10, глянувши на радіоприймач з кремнійовим живленням, задоволено посміхнеться і скаже: «Якими колосальними темпами розвивається наука». Ми розглянули більш-менш докладно нові відкриття в галузі хімії тільки одного з ста двох елементів періодичної системи — кремнію. А тимчасом про кожний з них можна розповісти стільки ж нового й цікавого. Ось воно поле діяльності хімії сьогоднішнього і завтрашнього дня!БІЛІ ПЛЯМИ
На столі переді мною лежить географічна карта. Вигляд у неї досить незвичайний. Ось начебто і знайомий чобіток Італії. Але чому Сіцілія так неприродно сплющена? Та й сама Італія схожа на глибоку хатню пантофлю, а не на витягнутий чобіт. А це, мабуть, Греція? А чому вона така? Чому вона врізалась так далеко в море? Нема сумніву, що вона вклиниться в африканське узбережжя. Це — карта Землі, складена стародавніми греками. Такою уявляли собі нашу планету елліни дві тисячі років тому. Всі їх відомості про навколишній світ обмежувались берегами Середземного моря. На географічних картах середньовіччя вже проступають контури віддалених областей Азії й Африки. В XIV столітті на них з’явилась назва «Індія». Туди, в ті далекі землі, названі пізніше Америкою, потяглись каравели завойовників, запалених жадобою наживи. Ще пізніше на географічних картах з’явилися обриси полярних земель. І вже, можна сказати, на наших очах на картах почала вимальовуватись загадкова Антарктида. Тільки останнє століття дало нам повну картину Землі. Хай не всі області нашої планети детально обстежені, але ми твердо знаємо, куди потрібно направляти експедиції для їх докладного вивчення. Для географії часи мандрувань навмання, за принципом «а може щось зустрінеться, може на щось цікаве наткнусь», минули ще років 500 тому. Зовсім інше становище в хімії. Там «мандрували» без карт ще якихось років 100 тому… Читач спитає: «Дозвольте, які ж карти можуть бути у хімії»? Виходить, можуть. У давнину в своїй практичній діяльності люди застосовували сполуки лише 19 елементів. Та й це застосування було, так би мовити, несвідоме. Якщо на хвилинку уявити собі, що ми запитали якогось староримського вченого, скільки хімічних елементів йому відомо, то він навряд чи зміг би назвати більше п’яти-шести: золото, срібло, мідь, залізо і сірка. Як бачимо, хімічний світ у давнину був такий же обмежений, як і географічний. На жаль, розширення хімічних горизонтів ішло значно повільніше, ніж географічних. Дванадцять століть нашої ери додало до цих п’яти тільки шість назв і всього стало одинадцять. XIX ст. принесло великі відкриття. На початку минулого століття був відомий тільки 31 елемент, а в середині XIX ст. хімік міг назвати вже 60 елементів. Шістдесят… А скільки їх повинно бути всіх? Сто? Двісті? — А може відкриті вже всі? Відповів на ці запитання геніальний російський вчений Д. І. Менделєєв. Він впевнено позначив у періодичній системі, які елементи ще не відкриті, скільки їх може бути відкрито взагалі, де слід шукати ці елементи і ще багато дечого, що й зробило періодичний закон міцним фундаментом грандіозної споруди сучасної хімії. Періодична система елементів Д. І. Менделєєва була по суті першою «хімічною картою». Менделєєв цілком точно вказав, які елементи і з якими властивостями ще слід відкрити. Всі знають приклад з елементом екасиліцієм, тобто германієм, властивості якого Менделєєв визначив за кілька років до його відкриття з точністю, гідною подиву. Тепер, дивлячись на свою карту, хіміки, точно знають, де лишились «білі плями» і куди «вирушати», шукаючи нових елементів, бо періодичний закон дав можливість створити одне з основних положень науки, що називається геохімією, тобто хімією Землі, а саме: елементи, схожі за своїми властивостями, завжди супроводжують у земній корі один одного. Якщо, наприклад, не був відомий елемент з порядковим номером 75, то в таблиці Менделєєва виразно видно, що цей елемент міститься в VII групі періодичної системи і мусить зустрічатися в молібденових рудах. І дійсно, вперше елемент 75 — реній знайшли там. Історія відкриття кожного нового елемента сповнена захоплюючих моментів і ще більше — копіткої праці. Для нас важливо інше: якщо за весь час розвитку людства відкрито 60 елементів, то за 90 років з часу відкриття періодичного закону науці стало відомо ще понад 40. Та цим не вичерпується аналогія періодичної системи елементів з географічною картою. Якби комусь спало на думку розмалювати таблицю Менделєєва так, як це роблять картографи, то вийшла б дуже цікава картина. «Білих плям» на карті не було б. Та цілий ряд клітин таблиці Менделєєва виявився б, як Антарктида на географічній карті, лише злегенька проконтурований тоненькою смужкою зеленої фарби (так географи позначають малодосліджені області нашої планети). На хімічній карті це означало б, що даний хімічний елемент вивчений недостатньо, а то й зовсім не досліджений. Очевидно, не доведеться довго шукати причину, внаслідок якої одні елементи вивчені краще, а інші — гірше. Звичайно, хімія заліза, відомого людям з давніх-давен, розроблена краще, ніж хімія гафнію, відкритого кілька десятиліть тому. Але це тільки половина пояснення. Щоб відшукати другу його половину, треба переглянути таблицю. Якщо подивитись на таблицю, де наведені дати відкрить кожного елемента, то тільки-но висловлена думка буде далеко не беззаперечною. Справді, елемент ітрій став відомий вже у XVIII ст., а проте ми знаємо про нього менше, ніж, наприклад, про натрій, магній, або алюміній, відкриті в XIX ст. Отже, не тільки «вік» елемента визначає ступінь знання його. Що ж тоді ще? Відповідь на це нам знову-таки дадуть таблиці…Вміст елементів у земній корі
Під час перерви в роботі однієї з нарад хіміків, яка відбулась кілька років тому, мою увагу привернула жвава розмова. Кілька поважних вчених обговорювали щось і поспішно підраховували на клаптиках паперу. Мова, як виявилось, йшла про те, скільки хімічних елементів бачив за своє життя кожний з них. Першість випала одному професорові, який вже тримав у руках сполуки 60 елементів. Символами цих 60 елементів був густо списаний весь папірець, і по обличчях співрозмовників професора можна було не сумніватися, що вони вважають це число більш ніж значним. Шістдесят елементів… Адже це тільки трошки більше, ніж половина відомих нам тепер «цеглинок всесвіту»! Секрет того, що багато хімічних елементів сховано від людини за сімома замками, стане зразу ж зрозумілим, як тільки глянемо на таблицю, де вказано вміст елементів у земній оболонці (до земної оболонки відносять літосферу — материки і ложа морів та океанів на глибину до 16 кілометрів, гідросферу — ріки, моря та океани, атмосферу — повітряну оболонку нашої планети).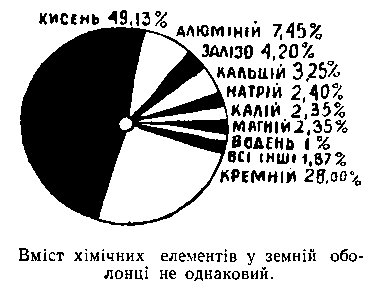 Виявляється, вміст хімічних елементів у земній оболонці не однаковий. Так, вміст кисню перевищує вміст полонію, наприклад, у 1015 або в мільйон мільярдів раз! Ця нерівномірність розподілу елементів у земній корі стане ще очевиднішою, коли розташувати хімічні елементи в один ряд у міру зменшення їх вмісту.
Перші три члени цього ряду — кисень, кремній, і алюміній — складають 82,6 % ваги земної оболонки. Якщо до цих трьох елементів додати вміст ще шістьох — заліза, кальцію, натрію, магнію, калію і водню, то вони складатимуть вже 98,13 % ваги земної оболонки. А на частку всіх інших 79 елементів (я не беру до уваги елементи, добуті штучно) припадає лише 1,87 % ваги земної кори.
Отже, причиною неодноразового ступеня вивчення тих чи інших елементів є не тільки час їх відкриття, а й наявність їх у земній корі. Не випадково вагові проценти елементів, відкритих останніми, — гафнія і ренія — становлять відповідно 4∙10–4 і 10–7%. Такий перший і, безсумнівно, правильний висновок з розгляду таблиці вмісту елементів у земній корі.
Хтось сказав, що вся наука складається з «але». Це — перебільшення, але не неправда. Таке «але» є і в даному разі. Гляньте на таблицю розподілу елементів уважніше.
Цікаво, який вміст елемента скандія, що дуже рідко зустрічається? Лише кілька десятитисячних часток процента. Справді, мало хто з хіміків може похвалитися тим, що бачив хоч одну із сполук цього елемента. Та ось сусідній в алфавітному списку елемент — срібло. Як відомо, його вважають дорогоцінним металом, але ніхто ке скаже, що срібло надто рідкісне. Мабуть, не знайдеться такої сім’ї, де б не було хоч малесенької дрібнички із срібла. А в хімічних лабораторіях азотнокисла сіль срібла — один з поширених реактивів. Солі срібла часто зустрічаються і в побуті, зокрема поверхня фотопаперу вкрита галоїдними сполуками цього металу. І все-таки срібла в земній корі вдвічі менше, ніж скандію, який вважається дуже рідкісним металом.
Елемент галій — дуже рідкісний. Тільки останнім часом у деяких лабораторіях стали з’являтися сполуки цього елемента в кількостях, які рідко перебільшують десяток — другий грамів. А звичайнісінький для хіміків елемент кадмій, солі якого кілограмами можна знайти навіть у шкільному кабінеті, зустрічається в земній корі в кількостях майже в 100 раз менших, ніж галій. Рідкісного металу германію в земній корі міститься майже в 40 раз більше, ніж такого звичайного в побуті елемента, як йод, і вдесятеро більше, ніж сурми і вісмуту.
Можна навести ще багато подібних прикладів, але й з цих вже ясно, що ваговий вміст елемента в земній корі ще не визначає його «доступність». А саме від «доступності» залежить, чи елемент рідкісний, чи звичайний.
Елементи зустрічаються в земній корі по-різному: одні сконцентровані у вигляді руд або значних домішок до мінералів, а інші знаходяться в «розмазаному» стані. Олова і ітрію в земній корі приблизно однакова кількість (відповідно 0,004 і 0,003 %). Але олово зустрічається в досить концентрованих рудах (наприклад, у мінералі каситериту), а ітрій не має своїх руд, він зустрічається у вигляді незначних домішок до різноманітних мінералів.
Можна сказати, що у вивченні того чи іншого елемента значну роль відіграє не тільки його вміст — «положення», а й легкість «підходу» до нього — характер залягання в земній корі. Справді, практика показала, що легше дістатися до віддалених берегів Антарктиди, ніж піднятися на вершину Джомолунгми, яка знаходиться порівняно недалеко від густонаселених місць Азії.
Ми з’ясували питання, яке спочатку здавалося навіть несерйозним: чому різні елементи неоднаково вивчені. І зразу ж напрошується друге запитання: навіщо, власне, знати однаково детально властивості всіх хімічних елементів? Хіба й так не видно, що елемент залізо для нас значно важливіший, ніж, скажімо, той же ітрій?
Відповім одразу: мало вивчені елементи періодичної системи криють у собі такі можливості, які можуть здивувати навіть багатих на уяву авторів науково-фантастичних романів.
Виявляється, вміст хімічних елементів у земній оболонці не однаковий. Так, вміст кисню перевищує вміст полонію, наприклад, у 1015 або в мільйон мільярдів раз! Ця нерівномірність розподілу елементів у земній корі стане ще очевиднішою, коли розташувати хімічні елементи в один ряд у міру зменшення їх вмісту.
Перші три члени цього ряду — кисень, кремній, і алюміній — складають 82,6 % ваги земної оболонки. Якщо до цих трьох елементів додати вміст ще шістьох — заліза, кальцію, натрію, магнію, калію і водню, то вони складатимуть вже 98,13 % ваги земної оболонки. А на частку всіх інших 79 елементів (я не беру до уваги елементи, добуті штучно) припадає лише 1,87 % ваги земної кори.
Отже, причиною неодноразового ступеня вивчення тих чи інших елементів є не тільки час їх відкриття, а й наявність їх у земній корі. Не випадково вагові проценти елементів, відкритих останніми, — гафнія і ренія — становлять відповідно 4∙10–4 і 10–7%. Такий перший і, безсумнівно, правильний висновок з розгляду таблиці вмісту елементів у земній корі.
Хтось сказав, що вся наука складається з «але». Це — перебільшення, але не неправда. Таке «але» є і в даному разі. Гляньте на таблицю розподілу елементів уважніше.
Цікаво, який вміст елемента скандія, що дуже рідко зустрічається? Лише кілька десятитисячних часток процента. Справді, мало хто з хіміків може похвалитися тим, що бачив хоч одну із сполук цього елемента. Та ось сусідній в алфавітному списку елемент — срібло. Як відомо, його вважають дорогоцінним металом, але ніхто ке скаже, що срібло надто рідкісне. Мабуть, не знайдеться такої сім’ї, де б не було хоч малесенької дрібнички із срібла. А в хімічних лабораторіях азотнокисла сіль срібла — один з поширених реактивів. Солі срібла часто зустрічаються і в побуті, зокрема поверхня фотопаперу вкрита галоїдними сполуками цього металу. І все-таки срібла в земній корі вдвічі менше, ніж скандію, який вважається дуже рідкісним металом.
Елемент галій — дуже рідкісний. Тільки останнім часом у деяких лабораторіях стали з’являтися сполуки цього елемента в кількостях, які рідко перебільшують десяток — другий грамів. А звичайнісінький для хіміків елемент кадмій, солі якого кілограмами можна знайти навіть у шкільному кабінеті, зустрічається в земній корі в кількостях майже в 100 раз менших, ніж галій. Рідкісного металу германію в земній корі міститься майже в 40 раз більше, ніж такого звичайного в побуті елемента, як йод, і вдесятеро більше, ніж сурми і вісмуту.
Можна навести ще багато подібних прикладів, але й з цих вже ясно, що ваговий вміст елемента в земній корі ще не визначає його «доступність». А саме від «доступності» залежить, чи елемент рідкісний, чи звичайний.
Елементи зустрічаються в земній корі по-різному: одні сконцентровані у вигляді руд або значних домішок до мінералів, а інші знаходяться в «розмазаному» стані. Олова і ітрію в земній корі приблизно однакова кількість (відповідно 0,004 і 0,003 %). Але олово зустрічається в досить концентрованих рудах (наприклад, у мінералі каситериту), а ітрій не має своїх руд, він зустрічається у вигляді незначних домішок до різноманітних мінералів.
Можна сказати, що у вивченні того чи іншого елемента значну роль відіграє не тільки його вміст — «положення», а й легкість «підходу» до нього — характер залягання в земній корі. Справді, практика показала, що легше дістатися до віддалених берегів Антарктиди, ніж піднятися на вершину Джомолунгми, яка знаходиться порівняно недалеко від густонаселених місць Азії.
Ми з’ясували питання, яке спочатку здавалося навіть несерйозним: чому різні елементи неоднаково вивчені. І зразу ж напрошується друге запитання: навіщо, власне, знати однаково детально властивості всіх хімічних елементів? Хіба й так не видно, що елемент залізо для нас значно важливіший, ніж, скажімо, той же ітрій?
Відповім одразу: мало вивчені елементи періодичної системи криють у собі такі можливості, які можуть здивувати навіть багатих на уяву авторів науково-фантастичних романів.
Уран та лантаноїди
Коротко розглянемо деякі властивості рідкісних елементів і те, що може дати народному господарству докладне вивчення їх. Почнемо з урану, одного з останніх елементів періодичної системи. Цей елемент, відкритий ще в XVIII ст., понад 100 років не викликав ніякого інтересу вчених. Дещо збільшився інтерес до урану наприкінці минулого століття, коли відкрили явище радіоактивності. Та й після цього інтерес до сполук урану був чисто академічний. І коли в старих підручниках повідомляли, що уран іноді застосовується в керамічній промисловості і у виробництві фарби «уранова жовта», то робили це насамперед тому, що про застосування такого елемента більше нічого не могли сказати. Та й фарби цієї у всьому світі приготували, можливо, одну-дві тонни. Значення уранових родовищ зросло, коли з’ясувалось, що з цих руд можна добувати радій, але оскільки після відкриття радію він кілька десятиліть ще застосовувався виключно для наукових цілей, то й виходить, що про практичне використання урану та його сполук до початку 40-х років не могло бути й мови. Та ось над Хіросімою і Нагасакі навис зловісний гриб атомного вибуху, і все зразу змінилось. Уран з звичайного хімічного елемента перетворився в один з найважливіших стратегічних матеріалів. З урану виділяють ізотоп з атомною вагою 235, з нього ж таки добувають елемент плутоній. Ці два елементи і є вибуховою речовиною в атомних, водневих та подібних до них бомбах. У Канаді є так зване Ведмеже озеро. Колись на його берегах виявили поклади урану. Ні одна газета не присвятила цьому відкриттю жодного рядка. Але як тільки з’ясувалась роль урану у виробництві атомної зброї, американські монополії кинулись в Канаду. Одна за одною лопались різні компанії, а на їхнє місце з’являлись інші. Виникали організації по закупці «пшениці», хоч жодна зернина й не покинула землю Канади завдяки зусиллям цих американських компаній. Всіх хвилювало одне: уран. Довго велася б ця, дуже характерна для капіталістичного світу боротьба, якби уряд Канади не зрозумів важливості атомної проблеми і не прибрав цю справу до своїх рук. Уранова гарячка й не думала вщухати. Роздувши історію одного ірландця, який за допомогою сконструйованого ним радіометра відкрив невеличке уранове родовище, компанії почали наживати шалені гроші напродажу таких радіометрів. Тисячі людей кинулись у гори, у віддалені райони капіталістичного світу аби тільки знайти уран і розбагатіти. Почалася «уранова лихоманка»… Ця лихоманка не вщухла і досі. Урановий «вірус» проник навіть на сторінки серйозних наукових журналів. Вони пропагують тепер різні типи радіометрів для людей, які прагнуть до наживи. Тільки одного не пишуть ці журнали, а саме: що цей уран перетвориться в ядерні вибухи, в мільйони радіоактивних осколків, які заражатимуть повітря і воду. Не пишуть вони також, для якої мети виготовляються сотні і сотні нових атомних бомб. Тим часом повідомлення про досягнення радянської науки й техніки у мирному використанні атомної енергії зустрічаються зарубіжною капіталістичною пресою недоброзичливо. Неважко уявити собі, з якою злобою зустріли вони повідомлення про пуск першої в світі атомної електростанції під Москвою, про атомний криголам «Ленін». Чи варто говорити, що практична потреба застосування урану примусила докладно розробити хімію цього елемента. І якщо в минулому всі відомості про хімічні властивості 92-го елемента вільно вміщались на 3–4 сторінках середнього формату, то зараз ці відомості не вмістяться в десяток товстенних томів. Так була стерта одна з білих плям на хімічній карті. Тільки одна назва, а скільки нового й цікавого внесено в науку і техніку, скільки змінилося в житті людини! Таких маловивчених ділянок ще багато на хімічній карті. Поглянемо на одну з них. Це сімейство III групи періодичної системи — сімейство лантаноїдів. Ці 15 елементів дуже подібні за своїми властивостями один до одного, тому їх і розташували в одній клітині періодичної системи елементів, проставивши їх порядкові номери: 57–71. Власне кажучи, вони подібні один до одного не тому, що містяться в одній клітині менделєєвської таблиці, а тому, що зовнішня електронна оболонка у всіх побудована однаково. П’ятнадцять «близнят» нерозлучні не тільки в періодичній системі, а і в природі. їх неможливо зустріти окремо одно від одного. Та хіміків ця зворушлива дружба не дуже тішить. Навпаки, вона завдає їм багато прикростей, бо подібність цих елементів утруднює їх розрізнення і поділ. Довгий час — аж до створення електронної теорії атома — не знали навіть, скільки їх повинно бути, бо ніхто ніколи не був упевненим, чи не є який-небудь елемент із сімейства лантаноїдів сумішшю кількох елементів. А з лантаноїдами, або, як їх називали хіміки минулого століття, рідкісними землями, такі помилки вже траплялись. Довгий час у хімічній літературі минулого століття зустрічались вказівки на елемент діодим. Тільки в 1880 р. з’ясувалось, що це суміш кількох рідкісноземельних елементів, з якої пощастило виділити елементи неодим і празеодим. Ще в останньому виданні знаменитої книги Д. І. Менделєєва «Основи хімії» висловлювалось припущення, що при уважному дослідженні з цих елементів можна буде виділити нові рідкісноземельні елементи. Рідкісноземельні елементи дістали таку назву, бо вважалось, що вони дуже рідко зустрічаються в покладах. Однак в останні роки було доведено, що це не зовсім так. Таблиця вмісту елементів у земній корі свідчить, що деякі рідкісноземельні елементи зустрічаються в значно більших кількостях, ніж елементи, які прийнято вважати поширеними. Неодиму в земних надрах міститься приблизно стільки ж, скільки й кобальту, і поклади цих елементів не така вже й рідкість. У Радянському Союзі, наприклад, на Кольському півострові, відкрито великі поклади апатитів, які містять рідкісноземельні елементи. Проте виділити їх так важко, що до останнього часу хімія цих елементів являла собою, образно кажучи, цілину. Ось елемент тулій. Якщо його помістити в ядерний реактор, то в результаті опромінення утвориться радіоактивний ізотоп тулію з атомною вагою 170. Він випускає γ-промені, які майже тотожні з рентгенівськими. Отже, майже невидимий для ока кристалик радіоактивного тулію може замінити громіздке рентгенівське устаткування, для якого потрібні велике приміщення і багато електроенергії. Рентгенівські апарати, які будуть створені на основі тулію, легко вміщуватимуться в портфелі середньої величини. Ці апарати стануть такими ж кишеньковими приладами для лікарів, як і стетоскопи, якими вислуховують серце. Незамінними будуть прилади з радіоактивним тулієм для працівників, контролюючих якість виробів з металу. Промені, які випускає цей елемент, дозволяють заглянути в глибину металу. Найменша тріщинка, пустота всередині деталі не пройдуть повз увагу всюдипроникаючих γ-променів тулію. Цей прилад називається γ-дефектоскоп, він може вміститися в невеличкому чемоданчику контролера. Або рідкісноземельний елемент церій. Сплави з цим елементом мають дуже важливу в практичному відношенні властивість: при незначному співударі з твердим предметом з них вилітає сніп іскор. Завдяки цій властивості церій — мабуть єдиний з рідкісноземельних елементів, з яким знайомі майже всі, бо він лежить в основі «камінців» у запальничках. Дедалі більше використовуються рідкісноземельні елементи у виробництві скла і кераміки. Завдяки тому, що лантаноїди добре вбирають нейтрони, скло, до складу якого введені ці метали, не змінюється під дією радіоактивного рентгенівського випромінювання. Оскільки приладів, де застосовуються радіоактивні ізотопи, стає чимраз більше, то перспективу лантаноїдів у даному випадку переоцінити неможливо. Важливе застосування рідкісноземельні елементи знайдуть у металургії. Введення церію в магнійові і алюмінійові сплави значно підвищує їх міцність, а це дуже важливо, бо сплави цих металів досить м’які, і тому застосування їх у промисловості обмежене. Додача рідкісноземельних елементів до чавуну дуже зменшує його крихкість і в такій же мірі збільшує міцність. Такий чавун можна навіть обточувати на токарних верстатах. Цікаво, що домішувати лантаноїди треба всього в кількості від 1/3 до 2 кг на 1 т чавуну. Рідкісноземельні елементи для цього не треба відокремлювати один від одного, — їх застосовують у вигляді «мішметалу», тобто сплаву кількох лантаноїдів. Велике майбутнє належить також елементу прометію. Ми вже згадували про мініатюрні атомні батарейки, виготовлені на основі цього елемента. Підрахунок того, що може дати прометійова батарейка розміром хоча б з куряче яйце, є тільки арифметичною вправою. Тут читач може дати повну волю фантазії. Можна не сумніватися, що років через 15 у поясненні до набору дитячого «конструктора» буде текст: «Джерело живлення двигуна — прометійова батарея». Питання практичного застосування рідкісноземельних елементів стали предметом багатьох досліджень. Протягом найближчого десятиліття буде створена повна картина хімії цих елементів. Хочеться думати, що в ліквідації цієї «білої плями» на хімічній карті візьмуть участь і читачі нашої книги.Реній
На хімічній карті ще багато «білих плям». Чимало доведеться ще зробити нинішнім і майбутнім дослідникам, поки більшість малодосліджених елементів стане на службу людині. Не будемо спинятись докладно на характеристиці кожної «білої плями», та про деякі з них просто необхідно згадати. До таких малодосліджених областей хімічної карти належить 75-а клітина періодичної системи — елемент реній. З усіх елементів, які існують у земній корі, реній найпізніше відкрив своє обличчя. Тільки у 1925 р. в клітині № 75 замість знака запитання з’явився символ Re. Всі елементи періодичної системи, які стали відомі науці після відкриття ренію, добуті штучно. Можливо, через це й історія відкриття ренію незвичайна. Жоден з природних хімічних елементів стільки часу не був загадкою для хіміків, як цей тьмяно-сріблястий метал, який на перший погляд нічим особливим не виділявся серед інших, хіба що великою питомою вагою. Багато разів, коли вже ось-ось його мали відкрити, реній «тікав» з рук дослідників: то не підтверджувались початкові дані, то не відтворювались досліди, то бракувало терпіння, яке навіть у хіміків може увірватись. У 1869 р. цей елемент добув дослідник Гіяр; він дав йому назву уралій, але згодом спростував власні дані. Цим самим він уник сумної долі хіміка Розе, радісне повідомлення якого про відкриття ним у 1846 р. елемента «пелопію» було спростоване зразу ж кількома дослідниками. Така ж доля спіткала і елемент ніпоній, описаний у 1906 р. Огавою, і люцій Барр’єра (1896 р.) та ін. Помилки не було лише в одному випадку. 27 червня 1877 р. з’явилось повідомлення російського хіміка С. Керна про те, що в залишках після переробки платинових руд він виявив новий елемент, який запропонував назвати на честь знаменитого англійського хіміка девієм. Визначення атомної ваги та властивостей девію показали, що він має зайняти в періодичній системі місце, уготоване Д. І. Менделєєвим для елемента двімарганцю. Років через 20 американський хімік Мале повторив досліди Керна, але з платинових залишків не зміг одержати виділений російським вченим елемент. Чи тут відіграло роль те, що платинова руда була іншого походження, чи те, що Мале був малодосвідченим хіміком, але відкриття не підтвердилось — в клітині знову стояв знак запитання. Тільки тоді, коли існування елемента 75 — ренію беззаперечно довели Ноддак, Таке і Борг, хіміки звернули увагу на те, що всі реакції, описані Керном для девію, тотожні з реакціями ренію. Майже на 50 років критика несправедливо відсунула час такого чудового відкриття. І тепер, через 35 років після відкриття ренію, про цей елемент, як і раніше, відомо дуже мало. Причина цього: реній — надзвичайно рідкісний і до того ж розсіяний елемент. Вміст ренію в земній корі — одна десятимільйонна частка процента. До того ж майже не зустрічаються мінерали, які б хоч у незначній мірі були збагачені ренієм. У свій час Ноддак із співробітниками, шукаючи елемента 75, детально вивчив склад майже 1800 мінералів. У жодному з них реній не виявлено. Тільки знайдена недавно руда молібденіт порівняно багата на реній. А втім, слово «багата» тут явно відносне. Щоб добути 1 ке ренію — кусок металу, який займає півдолоні —, доводиться переробити таку кількість цієї «багатої» руди, на яку потрібно кілька сот залізничних вагонів. І все ж реній — один з металів майбутнього. Не біда, що зараз його добувають тільки тоннами, — в 40-х роках його добували лише кілограмами, а наприкінці 20-х років — грамами. Реній — один з найтугоплавкіших металів. Тепер, коли з високими температурами доводиться мати справу в багатьох галузях техніки, ця властивість надзвичайно цінна. Друга дуже цінна властивість ренію — хімічна інертність. Навіть при 1600° він не сполучається з киснем повітря. При звичайних температурах він зовсім незмінний. Блискуча пластинка з ренію не потьмяніє ніколи. Більшість кислот, навіть гаряча плавикова кислота, прославлена своєю агресивністю, на нього не діє. Невеликий додаток ренію до сплавів робить їх кислотостійкими. Хімічна апаратура, виготовлена із сплавів ренію, служить на десятки років довше, ніж та, що з звичайних сплавів. У майбутньому реній замінить вольфрам у багатьох галузях техніки, бо при високих температурах реній міцніший. Вже тепер у найбільш цінних машинах поверхні деталей, які швидко спрацьовуються від тертя при високих температурах, покривають ренієм. Крім того, реній дуже легко і добре утворює електролітичні покриття, а це теж цінна властивість. Отже, одна галузь застосування ренію полягає у використанні його прекрасних механічних якостей і хімічної інертності. Але наскільки реній інертний в реакціях з одними речовинами, настільки він активний до реакцій інших речовин, тобто він виявився чудовим каталізатором багатьох важливих хімічних реакцій. Реній-каталізатор — друга велика галузь застосування цього металу майбутнього. Через кілька років після відкриття ренію довідались, що він каталізує реакцію взаємодії вуглекислого газу з воднем. Продуктом реакції при цьому є метан. Важко переоцінити значення такої реакції. Метан — чудове висококалорійне пальне, яке легко транспортується, не коптить, не димить. Найголовніша цінність метану та, що він може бути сировиною для одержання багатьох хімічних продуктів. Вуглекислий газ і водень — побічні продукти багатьох виробництв. При згорянні вугілля і нафти в повітря за добу виділяється сотні тисяч тонн вуглекислоти. Водень теж утворюється як побічний і до того ж шкідливий продукт при електролізі цинку і багатьох інших металів. Реній дозволяє легко і просто перетворювати ці відходи виробництва в цінний продукт для народного господарства. Окиси ренію, як виявилось, прекрасно каталізують такий важливий для хімічної технології процес, як окислення киснем повітря сірчистого газу, а саме на цій реакції оснований процес добування сірчаної кислоти. Тепер вже ясно — майбутнє за ренієм. Основне завдання — вишукати методи швидкого й дешевого видобування його з руд. Над цим варто потрудитись.Титан
Якщо від відкриття до практичного застосування ренію минуло не більше десятка років, то протилежна доля спіткала інший елемент періодичної системи — титан. Його відкрили в 1795 р. Німецький хімік Клапрот назвав його так на честь Титана, міфологічного сина Землі. Навряд чи вчений пророкував цією назвою своєму «хрещенику» велике майбутнє, — просто в той час була мода на еллінську міфологію. Та зовсім несподівано назва ця згодом стала пророчою. Титан ніяк не можна зарахувати до рідкісних елементів, бо тільки 8 елементів є в земній корі в більших кількостях. Проте майже до кінця минулого століття він «ходив» у безумовно рідкісних металах. Та і тепер дехто з хіміків і особливо металурги дивляться на цифру вагового вмісту титану в земній корі просто як на цифру, а нишком кладуть мінерал на полицю рідкісних. Та як не вважати його рідкісним, коли добувати його у вільному стані навчились лише півсотні років тому? Певно, тоді ж склалась думка, що титан належить до розсіяних металів, тобто до таких елементів, які хоч і зустрічаються в земній корі в значній кількості, але не мають концентрованих руд і мінералів. Склалась така думка, мабуть, тому, що ні в кого не виникло особливого бажання шукати поклади титану, бо зразу ж після виділення перших порцій йому був винесений суворий вирок: цей метал за своїми якостями безперспективний, бо неміцний, крихкий, погано піддається механічній обробці. Видобувати титан і виділяти його в чистому вигляді важко. А коли так, то чи не краще зовсім відмовитись від спроб застосування його в промислових цілях? Подумали і… відмовились. Ось чому ще років 25 тому металевий титан можна було побачити хіба що в демонстраційних колекціях на лекціях з неорганічної хімії. Та й то професор, виймаючи з жилетної кишені запаяну пробірку з непоказним темним порошком, не пускав її по руках, щоб бува не розбили, а лише вдавався у спогади, як йому дістався цей зразок. У міру наближення до сорокових років хімікам з кожним роком ставала все більш очевидною ідея, що некорисних хімічних елементів нема і бути не може. В числі інших елементів титан почали докладно досліджувати, і результати не забарились. У 1947 р. одержали перші дві тонни відносно чистого металевого титану. За якихось вісім років ця цифра виросла в десять тисяч разів. Десять тисяч! Для цього гігантського стрибка були поважні причини. Почати з того, що титан має найбільшу серед усіх металів питому міцність (питома міцність — це міцність, віднесена до одиниці ваги). Питома вага титану лише в 1,7 раза більша, ніж алюмінію, але міцність його втричі більша. Ось і виходить, що титанова деталь може мати вдвічі меншу вагу і в той же час не поступатися міцністю перед алюмінієм. Як тільки про це дізнались авіаконструктори, вони зразу ж насторожились. Для них це дуже цінна властивість. Адже більшого ворога, ніж вага різних частин повітряного корабля, нема. Святом для конструктора є той день, коли йому вдається знайти спосіб зменшити вагу якогось вузла літака хоча б на кілька сот грамів. У наш час загального поширення набула реактивна авіація. З’явились літаки різних конструкцій і різноманітних призначень. Головним «героєм», який зумовив такий прогрес у літакобудуванні, є титан, той самий титан, якому ще 50 років тому не надавали ніякого значення. Обшивка літаків, що летять із швидкістю звуку, нагрівається при терті об повітря до температури вище 300°. Алюмінійові сплави при такій високій температурі втрачають свою міцність, стають дуже м’якими. Титану ж таке нагрівання не страшне. Навіть при нагріванні ще на 100° він лишається таким самим міцним і твердим. Титан — найтугоплавкіший з так званих «легких» металів. Мабуть жодний елемент періодичної системи не має такої величини відношення температури плавлення до питомої ваги, як титан. Велике майбутнє титану пророкується не тільки через його виключну міцність або високу тугоплавкість, а ще й через те, що цей метал один з найінертніших у відношенні до різноманітних хімічних впливів. Більшість металів добре розчиняється в соляній або сірчаній кислотах. Майже всі метали розчиняються в азотній кислоті. Для стійких металів до цих кислот існує спеціальний розчин — «царська водка» — суміш соляної та азотної кислот. «Царською» ця суміш називається через те, що вона розчиняє «царя» всіх металів — золото. Титан же стійкий навіть до цієї агресивної суміші. Відполірована пластинка титану в розчині кислоти майже не тьмяніє. Титан не піддається корозії. Вироби з титану зовсім не змінюються, навіть коли перебувають в умовах, в яких залізні вироби через кілька місяців перетворюються в бурий порошок. Підводні частини кораблів, зроблені з титану, не бояться морської води, яка є активним руйнівником інших металів. Не менш чудові властивості мають сполуки і сплави, до яких входить титан. Досить домішати до сталі лише 0,1 % титану, щоб вона стала твердою і еластичною. Кербід титану — сполука титану з вуглецем — надтверда речовина, яка входить до складу багатьох сплавів. Вони використовуються для виготовлення різців. Такі ж властивості має нітрид титану — сполука його з азотом. Дуже чистий титан добре кується, легко витягається в дріт і може розкачуватись в фольгу завтовшки в тисячні частки міліметра. Чудові властивості титану, здається, розкриті повністю. Залишилось тепер тільки одне — дати цьому елементу широку дорогу у промисловість. Та це не легко, бо виробництво титану у всьому світі нараховується десятками тисяч тонн, а для того, щоб повністю задовольнити промисловість, його необхідно добувати в сотні разів більше. Поклади титану тепер розвідані в достатній мірі, але все ще лишається проблемою виділення металів з його руд. Наскільки метал титан інертний до впливу різних хімічних агентів, настільки він, будучи сполучений з різними хімічними елементами — киснем, хлором та ін., не хоче з ними розлучатися. Вилучення титану з руд — дуже важка справа. Титан інертний при низьких температурах, а при високих стає дуже хімічно активним. Ця активність така велика, що він сполучається навіть з матеріалом посудини, де відбувається плавка. Ось чому добувати металічний титан важко і чому вартість його, хоч і зменшується з кожним днем, все ще порівняно висока. Розв’язання проблеми дешевого й ефективного методу добування титану — програма найближчого часу. Майбутньому дослідникові є над чим попрацювати! Ми заглянули ще в одну область «хімічної карти». Тільки одна клітина періодичної системи, тільки один елемент, про який ще зовсім недавно знали дуже мало і в майбутнє якого ніхто не вірив, стає однією з основ техніки нашого комуністичного завтра.Найлегші
Перші два елементи періодичної системи Д. І. Менделєєва — водень і гелій — гази. Третій елемент — літій — наймолодший серед великої сім’ї відомих нам металів. Якби комусь заманулося серед металів виявити рекордсменів, то літій зайняв би одно з перших місць. По-перше, він серед усіх відомих нам металів має найменшу атомну вагу. Через це він стоїть на початку періодичної системи. По-друге, він легший від будь-якого іншого металу: в 15 раз легший від заліза і має вдвоє меншу густину, ніж дерево. Літій добре плавав би на воді, якби він тільки не взаємодіяв з нею. Зроблений з літію автомобіль легко міг би штовхати навіть підліток, якби тільки… літій енергійно не сполучався з киснем і навіть з азотом повітря. По-третє, у літію величезна різниця між температурою плавлення і температурою кипіння — майже 1200°. Порівняйте цю цифру з аналогічною величиною для води, тобто 100°. По-четверте, літій має феноменальну здатність сполучатися з багатьма газами, в тому числі й азотом, який взагалі неохоче реагує з іншими речовинами. По-п’яте, а втім, досить і переліченого, щоб стало ясно — літій в усіх відношеннях посідає видатне місце серед інших елементів періодичної системи. А тим часом у земній корі літію більше, ніж олова чи ртуті. І мінерали, які містять в собі літій, зустрічаються не дуже рідко. Причиною недостатнього застосування цього металу є те, що властивості його недостатньо вивчені. Давно відомо, що літій може сполучатися з воднем, утворюючи гідрид літію. Ця сполука цікава тим, що 1 кг її містить 1500 л водню, який легко виділяється, коли гідрид літію облити водою. Хто міг знати, що ця сполука, яку хіміки нічим не виділяли серед інших десятків тисяч неорганічних сполук, стане в наш час такою популярною? Власне кажучи, мова йде не про гідрид, а про дейтерид літію — сполуку цього металу з ізотопом водню дейтерієм. З хімічної точки зору різниці між ними нема ніякої. Ця речовина є основним зарядом так званих водневих бомб. Під впливом нейтронного випромінювання «запалу» цих бомб частина дейтерію перетворюється в тритій, а потім уже при температурі вибуху уранового або плутонійового заряду (300 000°) атоми тритію і дейтерію сполучаються один з одним, утворюючи елемент гелій. Ця реакція має такий вигляд:
При цьому виділяється колосальна кількість енергії. Енергія ця звільняється в результаті явища, яке дістало назву «дефект маси». Якщо зважити гази, які, вступили в цю ядерну реакцію, і продукти реакції, то виявиться, що вага останніх на 0,7 % менша. За відомим співвідношенням Ейнштейна, цей дефект маси відповідає величезній енергії. Неважко підрахувати, що дефект маси в 1 г — лише в 1 г! — дасть 25 млн. кіловат-годин енергії. Підрахуйте, скільком Дніпрогесам відповідає ця кількість енергії! Між іншим, дефект маси під час вибуху атомної бомби над Хіросімою був саме такої величини. Тепер можна собі уявити, скільки енергії виділиться при вибусі термоядерної бомби, якщо взяти 20–30 кг дейтериду літію. Найцікавіше те, що така реакція перетворення водню в гелій є джерелом енергії Сонця. Щосекунди на Сонці 570 млн. т водню перетворюється в 566 млн. т гелію. Отже, щосекунди Сонце зменшується в своїй масі на 4 млн. т. А коли врахувати, що маса нашого світила становить приблизно 2∙1027 т, то стає очевидним, що сонячна «піч» працюватиме при нинішньому режимі ще багато мільярдів років. Завдяки літію цю реакцію, яка по суті є джерелом життя на Землі, пощастило відтворити штучно. Неважко уявити собі значення цього відкриття. Ми вже згадували, що літій має властивість сполучатися з азотом повітря, утворюючи сполуку нітрид літію: 6Li + N2 = 2Li3N. Нітрид літію розкладається водою з виділенням аміаку: Li3N + ЗНаО = 3Li(OH) + NH3. Аміак є одним з найважливіших продуктів хімічної промисловості. Аміак — це дуже цінне добриво, сотні штучних матеріалів, сода, вибухові речовини, азотна кислота. Проект синтезу аміаку з азоту повітря давно вже привертав увагу вчених. Це й зрозуміло, бо повітря на 80 % складається з азоту і тому є його невичерпним джерелом. Перший здійснив цей синтез у промисловому масштабі німецький хімік Габер. Це відкриття дало можливість кайзерівській Німеччині відтягнути свою поразку в Першій світовій війні на кілька років. За це відкриті Габер був проголошений національним героєм, що, одінак, не завадило фашистам, які прийшли до влади, вислати його за межі Німеччини як неарійця. Згодом з’явились нові проекти зв’язування атмосферного азоту, але всі вони потребують надто багато енергії. Розрахунки показали, що в енергетичному відношенні синтез аміаку з нітриду літію з використанням і наступною регенерацією цього металу вимагає значно меншої затрати енергії, ніж існуючі методи. Слід також зазначити, що літій знаходить широке застосування в різноманітних сплавах. Додача лише 0,012 % літію до міді значно підвищує її електропровідність; незначна кількість цього металу в чавуні сильно підвищує його текучість у рідинному стані. Інтерес до літію зростає з кожним днем і, безсумнівно, ще чимало доведеться зробити майбутньому хімікові. Не можна обминути ще один чудовий елемент, про який до недавнього часу знали дуже небагато, про сусіда літія в періодичній системі елементів — берилій. Мабуть, жодний інший метал періодичної системи елементів не має такого розриву між часом його відкриття і виділення в чистому вигляді і часом, коли він почав запроваджуватись у промисловість, як цей елемент з порядковим номером 4 — берилій. …Важко сказати, що спонукало французького вченого Вокелена в бурхливі для Франції часи кінця XVIII ст. зайнятися хімічними дослідами. Є всі підстави гадати, що причиною були гроші. Він вирішив дослідити властивості і склад чудового каменю берилу, який, як відомо, лежить в основі ізумруду. Знаючи склад берилу, може, і пощастить добути його в лабораторії? Вокелен почав досліди над потовченим у ступці ізумрудом. Скоро йому вдалося виділити речовину, яку він назвав за її солодкий смак «солодкою землею», або гліциною від грецького слова «глікос» — солодкий (землями в той час хіміки називали більшість окисів). Гліцина була відкрита ним в 1798 році. Рівно через 20 років з гліцини був виділений сірий блискучий метал, який дістав назву гліциній. Згодом харківський професор Ф. І. Гізе запропонував назвати цей елемент берилієм. Назва прижилась. Та навіть через 40 років властивості берилію були вивчені так мало, що Д. І. Менделєєв довго вагався, в яку саме клітину помістити цей елемент. Якби не геніальна інтуїція Д. І. Менделєєва, хто знає, скільки б ще тинявся берилій по періодичній системі, поки не знайшов би своєї законної комірки № 4. Повторюю, біографія берилію дуже оригінальна. Не менш незвична і його «анкета». Рік народження на ній зазначено — 1798. Рік вступу на «роботу» — 1932. Саме в цьому році вперше були застосовані в промисловості деякі сплави берилію. І, подібно до Іллі Муромця, який «тридцять три роки сидьма сидів» і тільки потім розвернувся «на всю свою молодецьку силу», берилій зразу ж після того, як «увійшов у життя», став показувати чудеса. Найважливіша властивість, що забезпечує берилію велике майбутнє — це його мала питома вага. Хоч міцність берилію значно менша, ніж сталі, але різниця в їх питомих вагах така велика, що конструкція певної ваги з берилію в багато разів міцніша, ніж із сталі. Відомо, що застосування алюмінію зробило переворот у літакобудуванні. Нескладні розрахунки показують, що дальність польоту літака, зробленого з берилію, була б на 40 % більша від дальності алюмінійового. Значне застосування знаходить берилій у виготовленні рентгенівських трубок. Берилій на відміну від багатьох інших матеріалів дуже добре пропускає рентгенівські промені, тому в рентгенівських трубках, виготовлених із скла, «віконце» для променів роблять з берилію. Цей метал пропускає промені, але непроникний для повітря, а це дозволяє зберігати у трубці вакуум. Особливий інтерес становлять сплави берилію. Лише 2 % домішок до міді — і сплав, або так звана берилійова бронза, після гартування стає вдвоє твердішою від нержавіючої сталі. А окремо і мідь, і берилій дуже м’які метали. Інструменти, зроблені з берилійової бронзи, не іскрять при ударі об камінь, тому цей сплав незамінний для роботи в шахтах, млинах, на порохових заводах і скрізь, де розжарена іскра становить небезпеку. Все більше визнання завойовує обробка сталі, яка називається берилізацією. Цей процес полягає в тому, що стальну деталь, нагріту до 1000°, вміщують у порошок берилію, який у дуже незначній кількості проникає в поверхневий шар металу. Ця нескладна операція різко підвищує міцність стального виробу. Крім того, берилізована сталь дуже стійка до окислювачів. Навіть при нагріванні до 800° ця сталь не окислюється на повітрі. Положення берилію в періодичній системі робить його незамінним і в виробництві атомної енергії. Легкі елементи періодичної системи добре затримують нейтрони. Для того щоб в урановому котлі здійснювалась ланцюгова реакція ділення ядер і утворення плутонію, необхідно, щоб швидкість нейтронів, які виділяються при спонтанному діленні урану, була значно знижена. Для цього в котел поміщають берилійові стержні або стержні із сплавів берилію. Це дозволяє регулювати швидкість ланцюгової реакції. З кожним роком методи дослідження, зв’язані з впливом елементарних частинок на речовину, набувають все більшого значення. Якщо йдеться про елементарні частинки невеликої енергії, то такі дослідник легко може мати в своєму розпорядженні, користуючись яким-небудь природним або штучним радіоактивним елементом. Однак радіоактивні елементи випускають тільки електрони або ядра атомів гелію, а при різноманітних експериментальних дослідженнях найважливіше буває вплинути на речовини нейтронами, бо вони, не маючи ніякого заряду, найглибше проникають в опромінювану речовину. Можливість зіткнення з ядром у нейтрона набагато більша, ніж у якоїсь зарядженої частинки. Сплав берилію з радієм є прекрасним і порівняно сильним джерелом нейтронів. Найменшої кількості цього сплаву досить, щоб одержати в лабораторії (без будь-яких інших пристосувань) штучні радіоактивні ізотопи багатьох елементів. Нейтронні берилійові джерела зробили науці величезну послугу і довго ще сприятимуть застосуванню радіоактивних ізотопів для різноманітних досліджень. Уран, лантоноїди, реній, титан, літій, берилій… Це все, що ми встигли тут коротко розглянути. Назви всіх елементів, про які ми вели мову на багатьох сторінках, вміщуються в одному рядку. І всі ці елементи навряд чи становлять більше 1/10 тих елементів, які об’єднуються під назвою «рідкісні». З наведених прикладів читач бачить, що елементи не можна ділити на корисні і некорисні, на перспективні і безперспективні, застосовні і незастосовні. Всі без винятку елементи періодичної системи Д. І. Менделєєва можуть і повинні бути поставлені на службу людині. Від елементів, які вивчені менше від інших і добуваються в меншій кількості, слід чекати такого самого обширного застосування, як і від тих, що зараз вважаються основними. Все це — завдання хімії найближчого майбутнього, того майбутнього, коли багатотисячна армія хіміків нашої країни об’єднаними зусиллями поставить на службу комуністичному суспільству всі 102 та ще стільки, скільки їх буде відкрито, елементів періодичної системи, яка названа ім’ям великого вченого Д. І. Менделєєва. Розвиток хімії став тепер заповітною справою радянського народу. Розвиток хімічної індустрії — одна з неодмінних умов побудови комуністичного суспільства в нашій країні, бо хімія — це наука достатку, наука прогресу.
ЛІТЕРАТУРА
Андрианов К. А., «Синтетические полимеры в электроэнергетике», «Знание», 1959. Андрианов К. А. и Петрашко А. И., «Кремнийоргаиические полимеры в народном хозяйстве», AH СССР, 1959. Анфилов Г., «Что такое полупроводник», Детгиз, 1957. Бреслер С. Е., «Радиоактивнне элементы», ГИНТЛ, 1957. Лаврухина А. К., Золотов Ю. А., «Трансурановые злементы», AH СССР, 1958. Гольданский В. И., «Новые злементы в Периодической системе Д. И. Менделеева», АН СССР, 1958. Голуб А. М., Дмитрик С. Я., «Рідкісні і розсіяні елементи та їх значення в народному господарстві», Київ, 1958. Каданер Л. І., «Нові метали сучасної техніки», Держ. вид. техніч. літ., 1958. Парфенов В. А., «Металлы прогресса», «Знание», 1958. «Применение атомной знергии в мирных целях», АН СССР, 1956. Руденко Е., Таубе П., «Сто один»… Астрахань, 1958. Савченко Вл., «Полупроводники на старте», Детгиз, 1958. «Химия больших молекул», АН СССР, 1958. Фіалков Ю. Я., «Властивості дуже чистих речовин», «Наука і життя», № 7 за 1957 р. Ю. Я. Фиалков Рассказы по химии (на украинском языке). Государственное учебно-педагогическое издательство «Радянська школа»Редактор О. М. Трофімова. Художн. редактор В. Ф. Монжеран. Художник Є. В. Саренко Технічний редактор Л. І. Шевченко. Коректор С. М. Супрун
Здано до набору 29/111 1960 р. Підписано до друку 25/VIІ 1960 р. Папір 84x1081/32. Друк. арк. 3,5, Умовн. друк. арк. 5,74. Видавн. арк. 5,35. Тираж 4.300 БФ 19552. Державне учбово-педагогічне видавництво «Радянська школа» Київ, Ново-Павлівська, 5. Видави. № 11505 Ціна 1 крб. 60 коп. (З 1/I 1961 р. — 16 коп.). Надруковано з матриць Книжкової фабрики їм. Фрунзе Головполіграфвидаву Міністерства культури УРСР. Харків, Донець-Захаржевська, 6/8, в друкарні «Комуніст» Головполіграфвидаву Міністерства культури УРСР. Харків. Пушкінська, 29. Зам. 610.
Книга є збіркою тематично поєднаних нарисів, присвячених найважливішим проблемам сучасної хімії. В цих нарисах, написаних науково-популярною мовою, висвітлюється значення сучасної хімії для народного господарства, для поліпшення добробуту радянських людей. В кожному нарисі докладно розглядаються перспективи розвитку даної галузі хімії в найближчі десятиріччя. Книга розрахована на учнів старших класів.
Последние комментарии
14 часов 35 минут назад
14 часов 45 минут назад
3 дней 10 часов назад
4 дней 2 часов назад
4 дней 11 часов назад
4 дней 11 часов назад